Індоли для лікування хвороб, пов’язаних з андроген-рецепторами
Номер патенту: 79504
Опубліковано: 25.06.2007
Автори: Терхейс Нелтє Міранда, Ломмерсе Йоханнес Петрус Марія, Сток Херман Тайс, Хермкенс Педро Харолд Хан, ван дер Лаув Яп
Формула / Реферат
1. Сполука формули
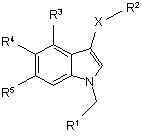 ,
,
де
X представляє S, SO або SO2;
R1 представляє 5- або 6-членну моноциклічну, гетеро- або гомоциклічну, насичену або ненасичену кільцеву структуру, як варіант, заміщену одним або більше замісниками, вибраними з групи: галоген, CN, (1С-4С)флуоралкіл, нітро, (1С-4С)алкіл, (1С-4С)алкоксил або (1С-4С)флуоралкоксил;
R2 представляє 2-нітрофеніл, 2-ціанофеніл, 2-гідрометилфеніл, піридин-2-іл, піридин-2-іл-N-оксид, 2-бензамід, 2-бензойної кислоти метиловий естер або 2-метоксифеніл;
R3 представляє Н, галоген або (1С-4С)алкіл;
R4 представляє Н, ОН, (1С-4С)алкокси або галоген;
R5 представляє Н, ОН, (1С-4С)алкоксил, NH2, CN, галоген, (1С-4С)флуоралкіл, NO2, гідроксі(1С-4С)алкіл, СО2Н, СО2(1С-6С)алкіл, або
R5 представляє NHR6, де R6 представляє (1С-6С)ацил, як варіант, заміщений одним або більше галогенами, S(О)2(1С-4С)алкіл або S(O)2aліл, як варіант, заміщений (1С-4С)алкілом або одним чи більше галогенами, або
R5 представляє C(O)N(R8,R9), де R8 та R9, кожний незалежно, представляють Н, (3С-6С)циклоалкіл або CH2R10, де R10 представляє Н, (1С-5С)алкіл, (1С-5С)алкеніл, гідроксі(1С-3С)алкіл, (1С-4С)алкілестер карбоксі(1С-4С)алкілу, (1С-3С)алкоксі(1С-3С)алкіл, (моно- або ді(1С-4С)алкіл)амінометил, (моно- або ді(1С-4С)алкіл)амінокарбоніл, або 3-, 4-, 5- або 6-членне моноциклічне, гомо- або гетероциклічне, ароматичне або неароматичне кільце, або R8 та R9 утворюють разом з N гетероциклічне 5- або 6-членне насичене або ненасичене кільце, як варіант, заміщене (1С-4С)алкілом;
або її сіль чи гідрат.
2. Сполука за п. 1, яка відрізняється тим, що
R1 представляє 5- або 6-членну моноциклічну, гетеро- або гомоциклічну, насичену або ненасичену кільцеву структуру, як варіант, заміщену одним або більше замісниками, вибраними з групи: галоген, CN, CF3, нітро, метоксил, трифлуорметоксил або метил;
R2 представляє 2-нітрофеніл, 2-ціанофеніл, 2-гідроксиметилфеніл, піридин-2-іл, піридин-2-іл-N-оксид, 2-бензамід, 2-бензойної кислоти метиловий естер або 2-метоксифеніл;
R3 представляє Н, галоген або (1С-2С)алкіл;
R4 представляє Н або F.
3. Сполука за п. 2, яка відрізняється тим, що
R5 представляє Н, ОН, (1С-4С)алкоксил, CN, галоген, (1С-4С)флуоралкіл, NO2, гідроксі(1С-4С)алкіл, СО2(1С-6С)алкіл, або
R5 представляє NHR6, де R6 представляє (1С-6С)ацил, як варіант, заміщений одним або більше галогенами, S(О)2(1С-4С)алкіл або S(О)2арил, як варіант, заміщений (1С-4С)алкілом або одним чи більше галогенами, або
R5 представляє C(O)N(R8,R9), де R8 та R9, кожний незалежно, представляють Н, (3С-6С)циклоалкіл або CH2R10, де R10 представляє Н, (1С-5С)алкіл, (1С-5С)алкеніл, гідроксі(1С-3С)алкіл, (1С-4С)алкілестер карбоксі(1С-4С)алкілу, (1С-3С)алкоксі(1С-3С)алкіл, (моно- або ді(1С-4С)алкіл)амінометил, (моно- або ді(1С-4С)алкіл)амінокарбоніл, або 3-, 4-, 5- або 6-членне моноциклічне, гомо- або гетероциклічне, ароматичне або неароматичне кільце, або R8 та R9 утворюють разом з N гетероциклічне 5-або 6-членне насичене або ненасичене кільце, як варіант, заміщене (1С-4С)алкілом.
4. Сполука за п. 3, яка відрізняється тим, що R3 представляє Н або галоген;
R4 представляє Н;
R5 представляє Н, ОН, (1С-4С)алкоксил, CN, F, Сl, CF3, NO2, гідроксі(1С-4С)алкіл, СО2(1С-6С)алкіл, або
R5 представляє NHR6, де R6 представляє (1С-3С)ацил, як варіант, заміщений одним або більше галогенами, або
R5 представляє C(O)N(R8,R9), де R8 та R9, кожний незалежно, представляють Н, (3С-5С)циклоалкіл або CH2R10, де R10 представляє Н, (1С-5С)алкіл, (1С-5С)алкеніл, гідроксі(1С-3С)алкіл, (1С-2С)алкілестер карбоксі(1С-2С)алкілу, (1С-3С)алкоксі(1С-3С)алкіл, (моно- або ді(1С-4С)алкіл)амінометил, (моно- або ді(1С-4С)алкіл)амінокарбоніл, (3С-5С)циклоалкіл або 5-членне гетероциклічне кільце.
5. Сполука за п. 4, яка відрізняється тим, що X представляє S або SO2;
R2 представляє 2-нітрофеніл, 2-гідроксиметилфеніл, 2-бензамід, 2-метоксифеніл, 2-ціанофеніл або піридин-2-іл;
R3 представляє Н чи F;
R5 представляє Н, ОН, (1С-2С)алкоксил, CN, F, Сl, CF3, NO2, гідроксі(1С-4С)алкіл, СО2(1С-4С)алкіл, або
R5 представляє NHR6, де R6 представляє форміл, ацетил, флуорацетил, дифлуорацетил або трифлуорацетил, або
R5 представляє C(O)N(R8,R9), де R8 представляє Н, a R9 представляє Н, циклопропіл, або
R9 представляє CH2R10, де R10 представляє Н, (1С-2С)алкіл, гідроксі(1С-2С)алкіл, метоксі(1С-2С)алкіл, циклопропіл.
6. Сполука за п. 5, яка відрізняється тим, що
X представляє S;
R1 представляє 3,5-дифлуорфеніл, піридин-2-іл, піридин-3-іл, піримідин-5-іл, піримідин-4-іл, піразин-2-іл, 3-флуорфеніл, 3-ціанофеніл або 3-нітрофеніл;
R2 представляє 2-нітрофеніл, 2-гідроксиметилфеніл, 2-метоксифеніл, 2-ціанофеніл або піридин-2-іл;
R3 представляє Н;
R5 представляє ОН, (1С-2С)алкоксил, CN, CF3, NO2, гідроксі(1С-4С)алкіл, СО2(1С-4С)алкіл або NHR6, де R6 представляє форміл, ацетил, флуорацетил, дифлуорацетил або трифлуорацетил.
7. Сполука за п. 6, яка відрізняється тим, що
R1 представляє 3,5-дифлуорфеніл, піридин-2-іл, піридин-3-іл, піримідин-5-іл, піримідин-4-іл або піразин-2-іл;
R2 представляє 2-нітрофеніл або 2-гідроксиметилфеніл;
R5 представляє ОН, (1С-2С)алкоксил, CN, гідроксі(1С-4С)алкіл або NHR6, де R6 представляє форміл, ацетил, флуорацетил, дифлуорацетил або трифлуорацетил.
8. Сполука за п. 7, яка відрізняється тим, що
R1 представляє 3,5-дифлуорфеніл, піридин-2-іл, піридин-3-іл, піримідин-5-іл або піримідин-4-іл;
R2 представляє 2-нітрофеніл;
R5 представляє ОН, (1С-2С)алкоксил, CN або NHR6, де R6 представляє форміл, ацетил, флуорацетил, дифлуорацетил або трифлуорацетил.
9. Сполука за п. 8, яку вибрано з групи:
6-метокси-3-(2-нітрофенілсульфаніл)-1-піримідин-5-ілметил-1Н-індол,
3-(2-нітрофенілсульфаніл)-1-піридин-2-ілметил-1Н-індол-6-карбонітрил,
3-(2-нітрофенілсульфаніл)-1-піридин-2-ілметил-1Н-індол-6-карбонітрилгідрохлорид,
3-(2-нітрофенілсульфаніл)-1-піримідин-5-ілметил-1Н-індол-6-карбонітрил,
3-(2-нітрофенілсульфаніл)-1-піримідин-4-ілметил-1Н-індол-6-карбонітрил,
N-[1-(3,5-дифлуорбензил)-3-(2-нітрофенілсульфаніл)-1Н-індол-6-іл]-2-флуорацетамід та
N-[3-(2-нітрофенілсульфаніл)-1-піримідин-5-ілметил-1Н-індол-6-іл]-формамід.
10. Сполука за п. 5, яка відрізняється тим, що
X представляє S;
R1 представляє 3,5-дифлуорфеніл, піридин-2-іл, піридин-3-іл, 3-флуорфеніл, 3-ціанофеніл або 3-нітрофеніл;
R2 представляє 2-нітрофеніл, 2-гідроксиметилфеніл, 2-метоксифеніл, 2-ціанофеніл або піридин-2-іл;
R3 представляє Н;
R5 представляє C(O)N(R8,R9), де R8 представляє Н, a R9 представляє Н або CH2R10, де R10 представляє Н, (1С-2С)алкіл, гідроксі(1С-2С)алкіл чи метоксі(1С-2С)алкіл.
11. Сполука за п. 10, яка відрізняється тим, що
R1 представляє 3,5-дифлуорфеніл, піридин-2-іл або піридин-3-іл;
R2 представляє 2-нітрофеніл або 2-гідроксиметилфеніл;
R5 представляє C(O)N(R8,R9),де R8 представляє Н, a R9 представляє CH2R10, де R10 представляє Н або (1С-2С)алкіл.
12. Сполука за п. 11, котрою є 1-(3,5-дифлуорбензил)-3-(2-нітрофенілсульфаніл)-1Н-індол-6-карбонової кислоти метиламід.
13. Сполука за п. 4, яка відрізняється тим, що
X представляє S;
R1 представляє 3,5-дифлуорфеніл, піридин-2-іл, піридин-3-іл, 3-флуорфеніл, 3-ціанофеніл, або 3-нітрофеніл;
R2 представляє 2-нітрофеніл, 2-гідроксиметилфеніл, 2-метоксифеніл, 2-ціанофеніл або піридин-2-іл;
R3 представляє Н;
R5 представляє C(O)N(R8,R9), де R8 та R9, кожний незалежно, представляють Н або CH2R10, де R10 представляє Н, (1C-5С)алкіл, (1С-5С)алкеніл, гідроксі(1С-3С)алкіл, (1С-3С)алкоксі(1С-3С)алкіл або (моно- чи ді(1С-4С)алкіл)амінометил.
14. Сполука за п. 13, яка відрізняється тим, що
R1 представляє 3,5-дифлуорфеніл, піридин-2-іл або піридин-3-іл;
R2 представляє 2-нітрофеніл або 2-гідроксиметилфеніл;
R5 представляє C(O)N(R8,R9), де R8 та R9, кожний незалежно, представляють Н або CH2R10, де R10 представляє Н, (1С-5С)алкіл, гідроксі(1С-3С)алкіл або (1С-3С)алкоксі(1С-3С)алкіл.
15. Сполука за п. 14, котрою є 1-(3,5-дифлуорбензил)-3-(2-нітрофенілсульфаніл)-1Н-індол-6-карбонової кислоти диметиламід.
Текст
1. Сполука формули 2 (19) 1 3 79504 4 ну кільцеву стр уктуру, як варіант, заміщену одним R9 представляє CH2R10, де R10 представляє Н, або більше замісниками, вибраними з групи: гало(1С-2С)алкіл, гідроксі(1С-2С)алкіл, метоксі(1Сген, CN, CF3, нітро, метоксил, трифлуорметоксил 2С)алкіл, циклопропіл. або метил; 6. Сполука за п. 5, яка відрізняється тим, що R2 представляє 2-нітрофеніл, 2-ціанофеніл, 2X представляє S; гідроксиметилфеніл, піридин-2-іл, піридин-2-іл-NR1 представляє 3,5-дифлуорфеніл, піридин-2-іл, оксид, 2-бензамід, 2-бензойної кислоти метиловий піридин-3-іл, піримідин-5-іл, піримідин-4-іл, піраестер або 2-метоксифеніл; зин-2-іл, 3-флуорфеніл, 3-ціанофеніл або 3R3 представляє Н, галоген або (1С-2С)алкіл; нітрофеніл; R4 представляє Н або F. R2 представляє 2-нітрофеніл, 23. Сполука за п. 2, яка відрізняється тим, що гідроксиметилфеніл, 2-метоксифеніл, 2R5 представляє Н, ОН, (1С-4С)алкоксил, CN, галоціанофеніл або піридин-2-іл; ген, (1С-4С)флуоралкіл, NO2, гідроксі(1С-4С)алкіл, R3 представляє Н; СО2(1С-6С)алкіл, або R5 представляє ОН, (1С-2С)алкоксил, CN, CF3, R5 представляє NHR6, де R6 представляє (1СNO2, гідроксі(1С-4С)алкіл, СО2(1С-4С)алкіл або 6С)ацил, як варіант, заміщений одним або більше NHR6, де R6 представляє форміл, ацетил, флуогалогенами, S(О)2(1С-4С)алкіл або S(О)2арил, як рацетил, дифлуорацетил або трифлуорацетил. варіант, заміщений (1С-4С)алкілом або одним чи 7. Сполука за п. 6, яка відрізняється тим, що більше галогенами, або R1 представляє 3,5-дифлуорфеніл, піридин-2-іл, R5 представляє C(O)N(R8,R9), де R8 та R9, кожний піридин-3-іл, піримідин-5-іл, піримідин-4-іл або незалежно, представляють Н, (3С-6С)циклоалкіл піразин-2-іл; або CH2R10, де R10 представляє Н, (1С-5С)алкіл, R2 представляє 2-нітрофеніл або 2(1С-5С)алкеніл, гідроксі(1С-3С)алкіл, (1Сгідроксиметилфеніл; 4С)алкілестер карбоксі(1С-4С)алкілу, (1СR5 представляє ОН, (1С-2С)алкоксил, CN, гідро3С)алкоксі(1С-3С)алкіл, (моноабо ді(1Сксі(1С-4С)алкіл або NHR6, де R6 представляє фо4С)алкіл)амінометил, (моноабо ді(1Срміл, ацетил, флуорацетил, дифлуорацетил або 4С)алкіл)амінокарбоніл, або 3-, 4-, 5- або 6-членне трифлуорацетил. моноциклічне, гомо- або гетероциклічне, аромати8. Сполука за п. 7, яка відрізняється тим, що 8 9 чне або неароматичне кільце, або R та R утвоR1 представляє 3,5-дифлуорфеніл, піридин-2-іл, рюють разом з N гетероциклічне 5-або 6-членне піридин-3-іл, піримідин-5-іл або піримідин-4-іл; насичене або ненасичене кільце, як варіант, заміR2 представляє 2-нітрофеніл; щене (1С-4С)алкілом. R5 представляє ОН, (1С-2С)алкоксил, CN або 3 4. Сполука за п. 3, яка відрізняється тим, що R NHR6, де R6 представляє форміл, ацетил, флуопредставляє Н або галоген; рацетил, дифлуорацетил або трифлуорацетил. R4 представляє Н; 9. Сполука за п. 8, яку вибрано з групи: R5 представляє Н, ОН, (1С-4С)алкоксил, CN, F, Сl, 6-метокси-3-(2-нітрофенілсульфаніл)-1-піримідинCF3, NO2 , гідроксі(1С-4С)алкіл, СО2(1С-6С)алкіл, 5-ілметил-1Н-індол, або 3-(2-нітрофенілсульфаніл)-1-піридин-2-ілметилR5 представляє NHR6, де R6 представляє (1С1Н-індол-6-карбонітрил, 3С)ацил, як варіант, заміщений одним або більше 3-(2-нітрофенілсульфаніл)-1-піридин-2-ілметилгалогенами, або 1Н-індол-6-карбонітрилгідрохлорид, R5 представляє C(O)N(R8,R9), де R8 та R9, кожний 3-(2-нітрофенілсульфаніл)-1-піримідин-5-ілметилнезалежно, представляють Н, (3С-5С)циклоалкіл 1Н-індол-6-карбонітрил, або CH2R10, де R10 представляє Н, (1С-5С)алкіл, 3-(2-нітрофенілсульфаніл)-1-піримідин-4-ілметил(1С-5С)алкеніл, гідроксі(1С-3С)алкіл, (1С1Н-індол-6-карбонітрил, 2С)алкілестер карбоксі(1С-2С)алкілу, (1СN-[1-(3,5-дифлуорбензил)-3-(23С)алкоксі(1С-3С)алкіл, (моноабо ді(1Снітрофенілсульфаніл)-1Н-індол-6-іл]-24С)алкіл)амінометил, (моноабо ді(1Сфлуорацетамід та 4С)алкіл)амінокарбоніл, (3С-5С)циклоалкіл або 5N-[3-(2-нітрофенілсульфаніл)-1-піримідин-5членне гетероциклічне кільце. ілметил-1Н-індол-6-іл]-формамід. 5. Сполука за п. 4, яка відрізняє ться тим, що X 10. Сполука за п. 5, яка відрізняється тим, що представляє S або SO2; X представляє S; R2 представляє 2-нітрофеніл, 2R1 представляє 3,5-дифлуорфеніл, піридин-2-іл, гідроксиметилфеніл, 2-бензамід, 2-метоксифеніл, піридин-3-іл, 3-флуорфеніл, 3-ціанофеніл або 32-ціанофеніл або піридин-2-іл; нітрофеніл; R3 представляє Н чи F; R2 представляє 2-нітрофеніл, 25 R представляє Н, ОН, (1С-2С)алкоксил, CN, F, Сl, гідроксиметилфеніл, 2-метоксифеніл, 2CF3, NO2 , гідроксі(1С-4С)алкіл, СО2(1С-4С)алкіл, ціанофеніл або піридин-2-іл; або R3 представляє Н; 5 6 6 R представляє NHR , де R представляє форміл, R5 представляє C(O)N(R8,R9), де R8 представляє ацетил, флуорацетил, дифлуорацетил або трифН, a R9 представляє Н або CH2R10, де R10 предсталуорацетил, або вляє Н, (1С-2С)алкіл, гідроксі(1С-2С)алкіл чи метоR5 представляє C(O)N(R8,R9), де R8 представляє ксі(1С-2С)алкіл. Н, a R9 представляє Н, циклопропіл, або 11. Сполука за п. 10, яка відрізняється тим, що R1 представляє 3,5-дифлуорфеніл, піридин-2-іл або піридин-3-іл; 5 79504 6 R2 представляє 2-нітрофеніл або 2R5 представляє C(O)N(R8,R9), де R8 та R9, кожний гідроксиметилфеніл; незалежно, представляють Н або CH2R10, де R10 R5 представляє C(O)N(R8,R9), де R8 представляє представляє Н, (1C-5С)алкіл, (1С-5С)алкеніл, гідН, a R9 представляє CH2R10, де R10 представляє Н роксі(1С-3С)алкіл, (1С-3С)алкоксі(1С-3С)алкіл або або (1С-2С)алкіл. (моно- чи ді(1С-4С)алкіл)амінометил. 12. Сполука за п. 11, котрою є 1-(3,514. Сполука за п. 13, яка відрізняється тим, що дифлуорбензил)-3-(2-нітрофенілсульфаніл)-1НR1 представляє 3,5-дифлуорфеніл, піридин-2-іл індол-6-карбонової кислоти метиламід. або піридин-3-іл; 13. Сполука за п. 4, яка відрізняється тим, що R2 представляє 2-нітрофеніл або 2X представляє S; гідроксиметилфеніл; R1 представляє 3,5-дифлуорфеніл, піридин-2-іл, R5 представляє C(O)N(R8,R9), де R8 та R9, кожний піридин-3-іл, 3-флуорфеніл, 3-ціанофеніл, або 3незалежно, представляють Н або CH2R10, де R10 нітрофеніл; представляє Н, (1С-5С)алкіл, гідроксі(1С-3С)алкіл R2 представляє 2-нітрофеніл, 2або (1С-3С)алкоксі(1С-3С)алкіл. гідроксиметилфеніл, 2-метоксифеніл, 215. Сполука за п. 14, котрою є 1-(3,5ціанофеніл або піридин-2-іл; дифлуорбензил)-3-(2-нітрофенілсульфаніл)-1НR3 представляє Н; індол-6-карбонової кислоти диметиламід. Винахід стосується похідних індолу, їх отримання та їх застосування для лікування пов'язаних з рецепторами андрогенів станів, розладів чи хвороб та інших пов'язаних з андрогенами лікувань. Сполуки, що мають андрогенну активність, корисні у лікуванні людей з низькими ендогенними рівнями циркулюючих андрогенних гормонів, або людей з пригніченною андрогенною дією. Таке лікування прийнято для старіючих людей, гіпогонадних людей або людей, яких лікують прогестагенами для контрацепції чоловіків. На додаток, сильнодіючі андрогени пригнічують сперматогенез та їх можна вживати як контрацептиви для чоловіків. Таким чином важливо отримувати сполуки з високою афінністю стосовно андрогенного рецептору. Нестероїдні сполуки з високою афінністю стосовно андрогенного рецептору є особливо корисними, оскільки вони можуть мати відмінні від стероїдних андрогенів характеристики розподілу у тканинах та можуть бути пристосованими вірним вибором замісників для більшої або меншої селективності для певних тканин. Наприклад, дія у мозку звичайно запобігається, коли сполуки є сильно гідрофільними або несуть іонний заряд. Мета представленого винаходу стосується нестероїдних сполук з афінністю стосовно андрогенного рецептору. Ці сполуки є потенційно корисними для лікування пов'язаних з рецепторами андрогенів розладів чи розладів, котрі можна лікувати андрогенами. Сполуки цього винаходу мають структур у згідно з формулою l: де X представляє S, SO або SO2 ; R1 представляє 5- або 6-членну моноциклічну, гетеро- або гомоциклічну, насичену або ненасичену кільцеву стр уктуру, як варіант, заміщену одним або більше замісниками, вибраними з групи: галоген, CN, (1С-4С)флуоралкіл, нітро, (1С-4С)алкіл, (1С-4С)алкоксил або (1С-4С)флуоралкоксил; R2 представляє 2-нітрофеніл, 2-ціанофеніл, 2гідрометил-феніл, піридин-2-іл, піридин-2-iл-Nоксид, 2-бензамід, 2-бензойної кислоти метиловий естер або 2-метоксифеніл; R3 представляє Н, галоген або (1С-4С)алкіл; R4 представляє Н, ОН, (1С-4С)алкокси, або галоген; R5 представляє Н, ОН, (1С-4С)алкоксил, NH2, CN, галоген, (1С-4С)флуоралкіл, NO2, гідрокси(1С4С)алкіл, СО2Н, СО2(1С-6С)алкіл, або R5 представляє NHR6, де R6 представляє (1С6С)ацил, як варіант, заміщений одним або більше галогенами, S(О)2(1С-4С)алкіл, або S(O)2алкіл, як варіант, заміщений (1С-4С)алкілом або одним чи більше галогенами, або R5 представляє C(O)N(R8,R9), де R8 та R9, кожний незалежно, представляють Н, (3С6С)циклоалкіл, або CH2R10, де R10 представляє Н, (1С-5С)алкіл, (1С-5С)алкеніл, гідрокси(1С3С)алкіл, (1С-4С)алкілестер карбокси(1С4С)алкілу, (1С-3С)алкокси(1С-3С)алкіл, (моно-або ди(1С-4С)алкіл)амінометил, (моно- або ди(1С4С)алкіл)амінокарбоніл, або 3-, 4-, 5-або б-членне моноцикпічне, гомо- або гетероциклічне, ароматичне або неароматичне кільце, або R8 та R9 утворюють разом з N гетероциклічне 5-або 6-членне насичене або ненасичене кільце, як варіант, заміщене (1С-4С)алкілом; або її сіль чи гідрат. В одному втіленні R1 представляє 5- або 6членну моноциклічну, гетеро- або гомоциклічну, насичену або ненасичену кільцеву стр уктуру, як варіант, заміщену одним або більше замісниками, вибраними з групи: галоген, CN, CF3, нітро, метокси, трифлуорметокси або метил; R2 представляє 2-нітрофеніл, 2-ціанофеніл, 2-гідроксиметилфеніл, піридин-2-іл, піридин-2-іл-N-оксид, 2бензамід, 2-бензойної кислоти метиловий естер 7 79504 8 або 2-метоксифеніл; R3 представляє Н, галоген R5 представляє ОН, (1С-2С)алкокси, CN, гідроабо (1С-2С)алкіл; R4 представляє Η або F. кси(1С-4С)алкіл, або NHR6, де R6 представляє У ще одному втіленні R5 представляє Н, ОН, форміл, ацетил, флуорацетил, дифлуорацетил, (1С-4С)алкокси, CN, галоген, (1С-4С)флуоралкіл, або трифлуорацетил. ΝΟ2, гідрокси(1С-4С)алкіл, СО2(1С-6С)алкіл, або У наступному втіленні R1 представляє 3,55 6 6 R представляє NHR , де R представляє (1Сдифлуорфеніл, піридин-2-іл, піридин-3-іл, піримі6С)ацил, як варіант, заміщений одним або більше дин-5-іл, або піримідин-4-іл; R2 представляє 2галогенами, S(О)2(1С-4С)алкіл, або S(O)2арил, як нітрофеніл; R5 представляє ОН, (1С-2С)алкокси, варіант, заміщений (1С-4С)алкілом або одним чи CN, або NHR6, де R6 представляє форміл, ацетил, більше галогенами, або R5 представляє флуорацетил, дифлуорацетил, або трифлуорацеC(O)N(R8,R9), де R8 та R9, кожний незалежно, тил. представляють Н, (3С-6С)циклоалкіл, або CH2R10, В особливому втіленні мета представленого де R10 представляє Н, (1С-5С)алкіл, (1Свинаходу стосується сполук 6-Метокси-3-(2-нітро5С)алкеніл, гідрокси(1С-3С)алкіл, (1Сфенілсульфаніл)-1-піримідин-5-ілметил-1Н-індол, 4С)алкілестер карбокси(1С-4С)алкілу, (1С3-(2-Нітро-фенілсульфаніл)-1-піридин-2-ілметил3С)алкокси(1С-3С)алкіл, (моноабо ди(1С1Н-індол-6-карбонітрил, 3-(2-Нітро4С)алкіл)амінометил, (моно- або ди(1С-4С)алкіл)фенілсульфаніл)-1-піридин-2-ілметил-1Н-індол-6амінокарбоніл, або 3-, 4-, 5-або 6-членне моноциккарбонітрил-гідрохлорид, 3-(2-Нітропічне, гомо- або гетероциклічне, ароматичне або фенілсульфаніл)-1-піримідин-5-ілметил-1Н-індолнеароматичне кільце, або R8 та R9 утворюють ра6-карбонітрил, 3-(2-Нітро-фенілсульфаніл)-1зом з N гетероциклічне 5-або 6-членне насичене піримідин-4-ілметил-1Н-індол-6-карбонітрил, N-[1або ненасичене кільце, як варіант, заміщене (1С(3,5-Дифлуор-бензил)-3-(2-нітро-фенілсульфаніл)4С)алкілом. 1Н-індол-6-іл]-2-флуор-ацетамід, та N-[3-(2-НітроУ наступному втіленні R3 представляє Η або фенілсульфаніл)-1-піримідин-5-ілметил-1Н-індолгалоген; R4 представляє Н; R5 представляє Н, ОН, 6-іл]-формамід. (1С-4С)алкокси, CN, F, СІ, CF 3, NO 2, гідрокси(1СУ ще одному втіленні X представляє S; R1 5 4С)алкіл, СО2(1С-6С)алкіл, або R представляє представляє 3,5-дифлуорфеніл, піридин-2-іл, піNHR6, де R6 представляє (1С-3С)ацил, як варіант, ридин-3-іл, 3-флуорфеніл, 3-ціанофеніл, або 35 заміщений одним або більше галогенами або R нітрофеніл; R2 представляє 2-нітрофеніл, 28 9 8 9 представляє C(O)N(R ,R ), де R та R , кожний гідроксиметил-феніл, 2-метоксифеніл, 2незалежно, представляють Н, (3С-5С)циклоалкіл, ціанофеніл або піридин-2-іл; R3 представляє Н; R5 або CH2R10, де R10 представляє Н, (1С-5С)алкіл, представляє C(O)N(R8,R9), де R8 представляє Н, a (1С-5С)алкеніл, гідрокси(1С-3С)алкіл, (1СR9 представляє Н, або CH2R10, де R10 представляє 2С)алкілестер карбокси(1С-2С)алкілу, (1СН, (1С-2С)алкіл, гідрокси(1С-2С)алкіл, або меток3С)алкокси(1С-3С)алкіл, (моноабо ди(1Сси(1С-2С)алкіл. 4С)алкіл)амінометил, (моноабо ди(1СУ наступному втіленні R1 представляє 3,54С)алкіл)амінокарбоніл, (3С-5С)циклоалкіл, або 5дифлуорфеніл, піридин-2-іл, або піридин-3-іл; R2 членне гетероциклічне кільце. представляє 2-нітрофеніл, або 2-гідроксигпетилУ наступному втіленні X представляє S або феніл; R5 представляє C(O)N(R8,R9), де R8 пред2 SO2; R представляє 2-нітрофеніл, 2ставляє Н, та R9 представляє CH2R10, де R10 предгідроксиметил-феніл, 2-бензамід, 2-метоксифеніл, ставляє Н, або (1С-2С)алкіл. 2-ціанофеніл або піридин-2-іл; R3 представляє Η В особливому втіленні мета представленого або F; R5 представляє Н, ОН, (1С-2С)алкокси, CN, винаходу стосується сполуки 1-(3,5-ДифлуорF, СІ, CF 3, NO 2, гідрокси(1С-4С)алкіл, СО2(1Сбензил)-3-(2-нітро-фенілсульфаніл)-1Н-індол-64С)алкіл, або R5 представляє NHR6, де R6 предкарбонової кислоти метиламід. ставляє форміл, ацетил, флуорацетил, дифлуораУ наступному втіленні X представляє S; R1 цетил, або трифлуорацетил, або R5 представляє представляє 3,5-дифлуорфеніл, піридин-2-іл, піC(O)N(R8,R9), де R8 представляє Н, a R9 представридин-3-іл, 3-флуорфеніл, 3-ціанофеніл. або 3ляє Н, циклопропіл, або R9 представляє CH2R10, нітрофеніл; R2 представляє 2-нітрофеніл, 210 де R представляє Н, (1С-2С)алкіл, гідрокси(1Сгідроксиметил-феніл, 2-метоксифеніл, 22С)алкіл, метокси(1С-2С)алкіл, циклопропіл. ціанофеніл або піридин-2-іл; R3 представляє Н; R5 У наступному втіленні X представляє S; R1 представляє C(O)N(R8,R9), де R8 та R9, кожний представляє 3,5-дифлуорфеніл, піридин-2-іл, пінезалежно, представляють Η або CH2R10, де R10 ридин-3-іл, піримідіп-5-іл, піримідіп-4-іл, піразин-2представляє Н, (1С-5С)алкіл, (1С-5С)алкеніл, гіділ, 3-флуор феніл, 3-ціанофеніл, або 3-нітрофеніл; рокси(1С-3С)алкіл, (1С-3С)алкокси(1С-3С)алкіл, R2 представляє 2-нітрофеніл, 2-гідроксиметилабо (моно-або ди(1С-4С)алкіл)амінометил. феніл, 2-метоксифеніл, 2-ціанофеніл або піридинУ наступному втіленні R1 представляє 3,53 5 2-іл; R представляє Н; R представляє ОН, (1Сдифлуорфеніл. піридин-2-іл, або піридин-3-іл; R2 2С)алкокси, CN, CF3, NO2, гідрокси(1С-4С)алкіл, представляє 2-нітрофеніл, або 2-гідроксиметилСО2(1С-4С)алкіл, або NHR6, де R6 представляє феніл; R5 представляє C(O)N(R8,R9), де R8 та R9, форміл, ацетил, флуорацетил, дифлуорацетил, кожний незалежно, представляють Н, або CH2R10, або трифлуорацетил. де R10 представляє Н, (1С-5С)алкіл, гідрокси(1С1 У наступному втіленні R представляє 3,53С)алкіл, або (1С-3С)алкокси(1С-3С)алкіл. дифлуорфеніл, піридин-2-іл, піридин-3-іл, піриміВ особливому втіленні мета представленого діп-5-іл, піримідіп-4-іл, або піразин-2-іл; R2 предвинаходу стосується сполуки 1-(3,5-Дифлуорставляє 2-нітрофеніл, або 2-гідроксиметил-феніл; 9 79504 10 бензил)-3-(2-нітро-фенілсульфаніл)-1Н-індол-6ню тестостерону, як-то у гіпогонадних чоловіків карбонової кислоти диметиламід. або хлопчаків. Зокрема, нестача андрогенів, яку У випадках, коли сполука винаходу має основлікують сполукою винаходу є зменшення рівню ну амінну функціональну гр упу, сполук у можна тестостерону, котре чоловік отримує як результат застосовувати як вільну основу або як фармацеввіку (сполуку винаходу тоді застосовують для тетично прийнятну сіль, як-то хлорид, ацетат, оксарапії заміщення гормону самців), або, коли він є лат, тартрат, цитрат, фосфа т, малеат або фумаоб'єктом контрацепції чоловіків. У контексті контрат. рацепції чоловіків, сполук винаходу особливо слуСполукою згідно з винаходом є сполука, яку гує для нейтралізації ефекту режиму контрацепції визначено вище, її сіль, гідрат або проліки. чоловічим гормоном, у котрій стерилізатор, як-то Терміни, застосовані у цьому описі, мають напрогестаген або LHRH (гормон вивільнення лютеїступні значення: нізованого гормону) застосовують регулярно, наалкілом є розгалужений або нерозгапужений приклад, кожної доби, або застосовують як одиниалкіл, наприклад метил, етил, пропіл, ізопропіл, чну речовину контрацептиву для чоловіків. бутил, втор-бутил, трет-бутил, гексил, тощо; флуВідтак, мета представленого винаходу стосуоралкіл є алкілом, заміщеним одним або більше ється будь-якої сполуки цього винаходу для застоатомами флуор у; циклоалкіл є циклізованим несування у терапії. розгалуженим алкілом, як-то циклопропіл, циклоВинахід крім того охоплює фармацевтичну бутил, циклопентил тощо; композицію, що містить сполуку цього винаходу та алкенілом є розгалужений або нерозгалужефармацевтично прийнятний носій. У втіленні цього ний алкеніл, як-то етеніл, 2-бутеніл, тощо; алкоквинаходу, фармацевтична композиція призначена силом є розгалужений або нерозгалужений алкілодля лікування розладу, вибраного з групи, що ксил, наприклад метилоксил, етилоксил, складається з пов'язаного з рецепторами андрогепропілоксил, ізопропілоксил, бутилоксил, вторнів розладу, пов'язаного з андрогеном розладу та бутилоксил, трет-бутилоксил тощо; флуоралкокнестачі андрогенів. силом є алкоксил, заміщений одним або більше Винахід крім того стосується застосування атомами флуору; сполуки винаходу для виробництва медикаменту арилом є моно- або поліциклічна, гомо- або для лікування пов'язаних з рецепторами андрогегетероциклічна ароматична кільцева система, якнів розладів, пов'язаних з андрогеном та нестачі то феніл, нафтил або піридил; моноцикпічне кільандрогенів. це з 6 атомами є кращим для застосування; Винахід крім того стосується способу лікуванацил представляє групу (замісник-)карбоніл, ня розладу, вибраного з групи, що складається з як-то ароїл або алканоїл; пов'язаного з рецепторами андрогенів розладу, ароїлом є арилкарбоніл як-то бензоїл; пов'язаного з андрогеном розладу та нестачі андалканоїл означає форміл або алкілкарбоніл, рогенів, що містить застосування фармацевтично як-то форміл, ацетил та пропаноїл; ефективної кількості сполуки згідно з винаходом карбоксилом є замісник -СООН, що утворює до суб'єкту, що цього потребує. сполуку органічної кислоти; карбоксилат є сіллю Сполуки винаходу можуть крім того бути корикарбоксилу. сними для лікування остеопорозу, а також інших Префікси (1С-4С), (2С-4С) тощо мають звирозладів кісток, відновлення фракцій кісток, саркочайні значення, обмежуючи значення вказаних пенії, крихкості, старіння шкіри, гіпогонадизму самгруп 1-4, 2-4 то що атомами карбону; ців, жіночої сексуальної дисфункції, постменопаузгалоген стосується флуор у, хлору, брому та них симптомів, атеросклерозу, апластичної анемії, йоду. атрофії м'язів, ліподистрофії, зменшеної сили та Афінність стосовно андрогенного рецептору та функції м'язів, побічних ефектів хемотерапії, синдефективність сполук згідно з винаходом роблять їх ром хронічної втоми, доброякісної гіперплазії пропридатними для застосування у лікуванні пов'язастати (ВРН), кахексії, хронічного катаболітичного них з рецепторами андрогенів розладів, розладів, стану, нестачі пізнавальної здатності, контрацепції котрі можна лікувати андрогенами, та у способах чоловіків, та іншого. діагностики, сфокусованих на кількості та/або розСполуки винаходу можна вживати у сполученміщенні андрогенних рецепторів у різних тканинах. ні з естрогенами, прогестогеном та іншими андроДля останньої мети може бути кращим виробляти генами. мічені варіанти сполук згідно з винаходом. ТипоСполуки винаходу можна виробляти різними вими лікуваннями, пов'язаними з андрогенними способами, відомими у рівні техніки органічної хімії рецепторами є лікування для контрацепції чоловізагалом. Більш конкретно можна застосовувати ків та самців або терапія заміщення жіночого горшляхи синтезу, які ілюстровано у наступних схемону. Відтак винахід також стосується способу мах та прикладах. У наступних схемах та приклалікування нестачі андрогенів застосуванням до дах застосовано скорочення: самців або самиць людини або тварин ефективної ДМФ = диметилформамід кількості будь-якої сполуки цього винаходу. ВинаМХГІБК = мета-хлорпербензойна кислота хід також стосується застосування будь-якої з його ΤΓΦ = тетрагідрофуран сполук для отримання медикаменту для лікування ВТТУ = 2-(1Н-бензотриазол-1-іл)-1,1,3,3нестачі андрогенів. У контексті винаходу, термін тетраметилуроній тетрафлуорборат "нестача андрогенів", як слід розуміти, стосується ДІПЕА = діізопропілетиламін усі х хвороб, розладів та симптомів, у котрій саЕДХ = 1-(3-диметиламінопропіл)-3мець або самиця потерпає від такого низького ріветилкарбодіімід гідрохлорид 11 79504 12 ГОБт= 1-гідроксибензотриазол цією, наприклад, з 3 еквівалентами мХПБК (Схема N-MM = N-метилморфолін II). ТФЕ = твердо-фазна екстракція ЗФ-ТФЕ = зворотно-фазова твердо-фазна екстракція ДМСО = диметилсульфоксид ДХМ = ди хлорметан ДГТ = 5a-дигідротестостерон Ν-ΜΠ = 1-метил-2-піролідинон ДМС = диметилсульфід. З огляду на номенклатуру наступні звичайні Схема III описує синтез сполуки структури 3, у назви застосовано почергово для замісників R1 та котрій R2 представляє феніл, заміщений на 2R2: позиції СО2Ме (Структура 7), СН2ОН (Стр уктура 8), Звичайна назва Офіційна назва СО2Н (Структура 9), CONHMe (Структура 10), 2-піридил піридин-2-іл CONH2 (Структура 11), CN (Структура 12). 3-піридил піридил-3-іл 4-піридил піридил-4-іл 3,5-піримідил піримідин-5-іл 2,4-піримідил піримідин-4-іл 2,5-піразил піразин-2-іл тощо У кожній зі Схем I-VII значення символів відповідають раніше представленим визначенням. Заміщені індольні сполуки структури 3 отримують у два етапи з коректно заміщених індолів структури 1 двома відмінними шляхами. У першому шляху коректно заміщений індол структури 1 Nалкілують галогенідом типу R1CH2Y, де Υ представляє галоген, мезилат або тозилат, NaH або цезій карбонатом як основою у ДМФ або Ν-ΜΠ при температурі від 0°С до кімнатної температури, отримуючи сполуку структури 2. Стр уктур у 2 тоді сульфанілують на С-3 позиції індольного кільця реакцією з сульфенілхлорид у СН 2СІ2 або діетиловому етері при кімнатній температурі, отримуючи структур у 3. У др угому шляху два етапи першого шляху міняють: коректно заміщений індол структури 1 спершу сульфанілують на С-3 позиції індолу, отримуючи структур у 4, а потім N-алкілують R1CH2Y, отримуючи структуру 3 (Схема І). Сульфоксиди структури 5 можна отримувати окисненням відповідного сульфіду (С труктура 3) реакцією, наприклад, з 0,9 еквівалентами мХПБК. Сульфони структури 6 можна отримувати окисненням відповідного сульфіду (Структура 3) реак На першому етапі заміщений індол структури 6 сульфанілують на 3-позиції 2-(карбоксиметил)фенілсульфенілхлоридом, котрий отримують з метилтіосаліцилату та газуватого хлор у, отримуючи сполуку стр уктури 7. Відновлення метилестерної групи сполуки структури 7 LiAIH4 дає відповідні гідроксиметильні сполуки структури 8. Омилення метилестерної групи сполук структури 7 літій гідроксидом дає відповідні карбоновокислотні сполуки структури 9. Карбоновокислотну груп у сполуки структури 9 можна перетворити у відповідний карбоксамід реакцією з аміном, ВТТУ та ДІПЕА у ДМФ при кімнатній температурі. Цим способом отримують структуру 10, коли як амін застосовано метиламін та отримують структуру 11, коли як амін застосовано аміак. Дегідрування бензамідної групи структури 11 Tf2O та триетиламіном у СН 2СІ2 дає відповідну бензонітрильну сполуку стр уктури 12 (Схема III). 13 79504 14 У Схемі VI описано, як метилові етери структури 24 можуть бути розщеплені, наприклад, з BF3·ДMC у ТГФ при кімнатній температурі до гідроксисполуки структури 25. Схема IV описує синтез сполуки структури 3, у котрій індольне кільце заміщено на 6-позиції СО2Ме (Стр уктура 13), СО2Н (Структура 14), CONR8R9 (Структура 15), CONH2 (Структура 16) або CN (Структура 17). Омилення метилестерної групи структури 13 літій гідроксидом дає відповідні карбоновокислотні структури 14. Карбоновокислотну гр упу структури 14 можна перетворити у відповідні карбоксаміди 15 та 16 реакцією з аміном або сіллю аміну, у присутності ЕДХ та ГОБт у суміші NMM та ДМФ або у присутності ВТТУ та ДІПЕА у СН2СІ2 при кімнатній температурі. Дегідрування бензамідної групи структури 16 Tf2 O та триетиламіном у СН 2СІ2 дає відповідну бензонґгрильну сполуку стр уктури 17 (Схема IV). Схема V описує синтез сполуки структури 22, що містить ациловану амінну функціональну групу на 6-позиції індольного кільця. Ці сполуки можна синтезувати з 6-нітроіндолів структури 18 у 4 етапи. На першому етапі індол структури 18 алкілують на атомі нітрогену реакцією галогеніду типу R1CH2Y, у котрому Υ представляє галоген, мезилат або тозилат, з NaH як основою у ДМФ, отримуючи сполуки структури 19. На другому етапі нітрогрупу стр уктури 19 відновлюють до аміногрупи SnCI2, отримуючи стр уктуру 20. Наступне ацилування аміногрупи хлорангідридом типу ZCOCI дає структур у 21, котру тоді сульфанілують на 3позиції індольного кільця реакцією з а.сульфенілхлоридом у СН 2СІ2 або Et2O як розчиннику, при кімнатній температурі, отримуючи сполуки структури 22. Безпосереднє сульфанілування сполуки структури 20 сульфенілхлоридом дає структур у 23. Схема VII описує синтез сполук, що містять ациловану амінну функціональну групу (структура 28) або сульфонамідну функціональну групу (структура 29) на 6-позиції індольного кільця. Ці сполуки можна отримувати з 6-нітроіндолів структури 18 у 6 етапів. На першому етапі індол структури 18 алкілують на N-1 реакцією галогеніду типу R1CH2 Y, у котрому Υ представляє галоген, мезилат або тозилат, з NaH або цезій карбонатом як основою у ΝΜΠ або ДМФ, отримуючи сполуки структури 19. На другому етапі нітрогрупу стр уктури 19 відновлюють до аміногрупи залізом та розчином амоній хлориду у суміші етанол/вода, отримуючи стр уктуру 20. Наступне ацилування аміногрупи ди-третбутил дикарбонатом дає структур у 26, котру тоді сульфанілують на 3-позиції індольного кільця реакцією з сульфенілхлорид у СН 2СІ2 або діетиловому етері, отримуючи сполуки структури 27. Тоді амідну функціональну гр уп на 6-позиції індолу розщеплюють трифлуороцтовою кислотою або НСООН, отримуючи аміни структури 23. Ці аміни можна перетворити у аміди структури 28 реакцією з триетиламіном та хлорангідридом у СН 2СІ2 (спосіб а), або кислотою, ВТТУ та ДІПЕА у СН 2СІ2 (спосіб b). Сульфонаміди структури 29 можна отримувати реакцією амінів структури 23 з сульфонілхлоридами (спосіб с). 15 79504 16 3 схеми І. де R1 = 3,5-дифлуорфеніл, R2 = 2нітроФеніл R3=R4=H. R 5 = ОМе) Представлений винахід також стосується фармацевтичної композиції, що містить не-стероїдну сполуку згідно з винаходом, змішану з фармацевтично, прийнятним допоміжником, як-то описано у стандартному посиланні [Gennaro et al,. Remmington: The Science and Practice of Pharmacy, (20th ed, Lippincott Williams & Wilkins, 2000, дивись особливо Part 5: Pharmaceutical Manufacturing)]. Придатні допоміжники описано, наприклад, у [Handbook of Pharmaceutical Excipients (2nd Edition, Editors A. Wade та P. J. Weller; Амернаn Pharmaceutical Association; Washington; The Pharmaceutical Press; London, 1994)]. Суміш сполуки згідно з винаходом та фармацевтично прийнятного допоміжнику можна пресувати у тверді одиничні дози, як-то пілюлі, таблетки, або перетворювати у капсули або супозиторії. Як фармацевтично придатні рідини сполуки можна також застосовувати як ін'єкції у формі розчину, суспензії, емульсії, або як спрей, наприклад, назальний спрей. Для створення одиничних доз, наприклад, таблеток, можна застосовувати звичайні адитиви як-то наповнювачі, барвники, полімерні зв'язуючі тощо. Загалом можна застосовувати будь-який фармацевтично прийнятний адитив, котрий не взаємодіє з функціональною групою активної сполуки. Сполуки винаходу можна також уводити у імплантат, вагінальне кільце, пластир, гель, та будь-як інший препарат для безперервного вивільнення. Придатні носії, з котрими можна вживати композиції залучають лактозу, крохмаль, похідні целюлози тощо, або їх суміші, застосовані у придатних кількостях. Кількості дозування представлених сполук матимуть звичайний порядок для фармацевтично активної сполуки, наприклад, порядку 0,00150мг/кг маси тіла реципієнта на застосування. Реципієнт може бути людиною або твариною, що потребує лікування, пов'язаного з андрогенними рецепторами, або лікування андрогенами. Винахід ілюстровано наступними прикладами. Приклади Приклад 1 1-(3,5-Дифлуор-бензил)-6-метокси-3-(2-нітрофенілсульфаніл)-1Н-індол (Сполука 63. Структура Загальний спосіб 1: N-алкілування (не)заміщеного індолу структури 1, о тримуючи Nалкілований індол структури 2, а потім 3сульфанілують, отримуючи заміщені індоли структури 3 (Схема І). (а) 1-(3,5-Дифлуор-бензил)-6-метокси-1Ніндол (Структура 2 схеми І. де R1 = 3,5дифлуорофеніл R3=R4=H. R 5=OMe) В атмосфері азоту до охолодженого (0°С) розчину 6-метоксііндолу (863мг, 5,86ммоль) у ДМФ (40мл) додають NaH (60% у маслі; 281мг, 7,03ммоль) невеликими порціями протягом 3 хвилин. Утворену зелену суспензію перемішують при 0°С протягом 10 хвилин. Тоді додають 3,5дифлуорбензилбромід (0,91мл, 7,03ммоль). Суміш перемішують при 0°С протягом 1 години та тоді при кімнатній температурі ще 21 годину. Етилацетат (50мл) додають та суміш промивають 3% водною лимонною кислотою (3x50мл) та розсолом (50мл). Органічну фазу сушать (MgSO 4) та концентрують під вакуумом, отримуючи зелене масло (1,43г). Сирий продукт очищають 20г оксиду силіцію ТФЕ-патрон (етилацетат/гептан 1:9), отримуючи заголовну сполуку як безбарвне масло (1,23 & вихід = 77%). РХ-МС: 4,01 хвилин (96,3%, МН+ = 274); ТШХ (етилацетат/гептан 1:4): Rf = 0,46; 1H ЯМР (CDCI3): d 3,80 (s, 3H, OСН3), 5,24 (s, 2Н, NCH 2Ar), 6,51 (dd, 1H, J1=3,5Гц, J2=0,8Гц), 6,57-6,60 (m, 2Н), 6,65 (d, 1Н, J=3,1Гц), 6,66-6,72 (m, 1Н), 6,81 (dd, 1H, J1=8,6Гц, J2=3,1Гц), 7,01 (d, 1H, J=3,5Гц), 7,53 (d, 1H, J=8,6Гц). (b) 1-[3,5-Дифлуор-бензил)-6-метокси-3-(2нітро-aенілсульфаніл)-1Н-індол (Сполука 63. Структура 3 схеми І. де R1 = 3,5дифлуорфеніл, R2 = 2-нітрофеніл R3=R4=H. R5 ОMe) = До розчину 1-(3,5-Дифлуор-бензил)-6-метокси1Н-індолу (900мг, 3,29ммоль) у діетиловому етері (20мл) додають краплями при кімнатній температурі суспензію 2-нітробензенсульфенілхлориду (627мг, 3,31ммоль) у діетиловому етері (10мл) протягом 2 хвилин. Після перемішування при кімнатній температурі протягом 1 години додають етилацетат (50мл) та суміш промивають насиченим розчином натрій гідрогенкарбонату (2x50мл) та розсолом (50мл). Органічну фазу сушать магній сульфатом та концентрують під вакуумом, отримуючи оранжево-червоне масло (1,54г). Сирий продукт кристалізують з суміші толуєн/ацетон, отримуючи заголовну сполуку як оранжево 17 79504 18 червоний кристалічний твердий продукт (900мг, Загальним способом 1 отримують наступні вихід = 64%). сполуки: РХ-МС: 4,25 хвилин (100%, МН+ = 427); ВЕРХ: 4,86 хвилин (98,7%); 1Н ЯМР (CDCI3): d 3,82 (s, 3Н, ОСН3), 5,32 (s, 2Н, NCH2Ar), 6,63-6,69 (m, 2Н), 6,72-6,79 (m, 1Н), 6,75 (d, 1Η, J=2,7Гц), 6,85 (dd, 1H, J1=8,2Гц, J2=2,7Гц), 6,98 (dd, 1H, J1=6,7Гц, J2=1,2Гц), 7,16-7,20 (m, 1Н), 7,26-7,30 (m, 1Н), 7,34 (s, 1H), 7,39 (d, 1H, J=8,2Гц), 8,27 (dd, 1H, J1=8,2Гц, J2=1,6Гц). Таблиця 1 Сполуки, синтезовані загальним способом 1 Сполука X 21 22 23 24 25 50 51 52 53 54 55 56 60 61 63 66 90 91 92 S S S S S S S S S S S S S S S S S S S R1 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл феніл феніл феніл R2 2-метоксифеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-піридил N-оксид 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл R3 Н Н Н Н Н Н F Н Н Сl Me Н Н Н Н Н Н Н Н R4 R5 Μ Η Η Η Η Η Н Η Н F Η Н ОН Η Н Η Η Н ОМ Η Оме Вr CF3 СН2О Сl F Н Н Н Η Н Н ΝΟ2 ОН ОМе ОМе Н Н ОМе 411,47 475,32 464,41 426,44 430,86 414,40 414,40 396,41 414,40 430,86 410,44 412,41 441,41 412,41 426,45 398,43 360,43 390,46 390,46 РХ-МС РХ-МС час (МН+) затр. (хвилин) 446 5,14b 476 4,89 465 5,34b Nd 3,88b 431 4,89 415 4,79 415 4,72 397 4,22 415 4,75 431 5,14b 411 5,24b 413 4,50b 442 4,7 413 4,54b 274d 4,01 399 3,96 361 4,19 391 4,14 391 4,12 a) 7 хвилин РХ-МС спосіб застосовано, якщо не визначено інше, b) 10 хвилин РХ-МС спосіб застосовано, c) М+СІ. nd = не визначено, d) =[M-S(PhNO 2)]H+. Приклад 2 1-[3,5-Дифлуор-бензил)-3-[2-нітрофенілсульфаніл)-1Н-індол-6-карбонової кислоти метиловий естер (Сполука 31, Структура 3 схеми І, де R1 - 3,5дифлуорфеніл R2 = 2- нтроофеніл R3=R4=H, R1=CO2 Me) (a) 1Н-Індол-6-карбонової кислоти метиловий естер (Структура 1 схеми І. де R3=R 4=H. R 5=CОz Me) До розчину 1Н-Індол-6-карбонової кислоти (1,500г, 9,31ммоль) у метанолі (50мл) додають концентровану сульфатн у кислоту (550мкл, 10,24ммоль). Суміш перемішують протягом ночі при температурі кипіння під зворотним холодильником. Суміш тоді нейтралізують до рН 7 додаванням насиченого водного розчину натрій гідрогенкарбонату та суміш екстрагують двічі етилацетатом. Комбіновані органічні шари сушать безводним натрій сульфатом та концентрують під вакуумом, отримуючи жовтий порошок. Продукт перекристалізовують з суміші гептан/етилацетат, отримуючи заголовну сполуку як зелено-жовті кристали (688мг, вихід = 53%) 1 Н ЯМР (CDCI3): d 3,94 (s, 3Н, СН3ОСО), 6,60 (m, 1Н), 7,37 (t, 1Н, J=4,7Гц), 7,66 (d, 1H, J=8,2Гц), 7,82 (dd, 1H, J1=8,2Гц, J2=1,0Гц), 8,18 (s, 1H), 8,73 (s, 1H, NH) (b) 1-(3,5-Дифлуор-бензил)-1Н-індол-6карбонової кислоти метиловий естер (Структура 2 схеми І, де R1 = 3,5дисрлуорсЬєніл. R3=R4=H. R s=CO2Me) В атмосфері азоту до розчину 1Н-індол-6карбонової кислоти метилового естеру (367мг, 2,09ммоль) у ДМФ (10мл) додають NaH (60% у 19 79504 20 маслі, 101мг, 2,52ммоль) при кімнатній температують протягом ночі при 60°С. Суміш тоді підкислюрі. Після перемішування протягом 15 хвилин доють до рН 4 додаванням 15% водного розчину дають 1-бромметил-3,5-дифлуорбензен (325мкл, хлоридної кислоти та суміш екстрагують двічі е ти2,51ммоль) та суміш перемішують при кімнатній лацетатом. Комбіновані органічні шари сушать температурі протягом 4 годин. Реакцію гасять 3% безводним натрій сульфатом та концентрують під водною лимонною кислотою (10мл) та додають вакуумом, отримуючи жовтий порошок. Продукт етилацетат (30мл). Суміш промивають 3% водною перекристалізовують з суміші гептан/етилацетат, лимонною кислотою (3x20мл) та розсолом (20мл). отримуючи заголовну сполуку як жовто-оранжеві Органічну фаз у сушать магній сульфатом та конкристали (129,3мг, у = 89%) 1 центрують під вакуумом, отримуючи блідо-жовте Н MMR PMSO): d 5,62 (s, 2Н, СН2Аr), 6,85 (dd, масло (702мг). Сирий продукт очищають 20г окси1H, JT=8,6Гц, J2=br), 7,05 (m, 2H, br), 7,20 (m, 1H, ду силіцію ТФЕ-патрон (етилацетат/гептан 1:9), br), 7,32-7,38 (m, 1H), 7,40 (d, 1H, J=8,2Гц), 7,44отримуючи заголовну сполуку як безбарвне масло, 7,50 (m, 1H), 7,68 (dd, 1H, J1=8,6Гц, J2=br), 7,97 (s, котре повільно кристалізується при стоянні (530мг, 1H, COOH), 8,20 (s, 1H), 8,26 (s, 1H), 8,28 (d, 1H, вихід = 84%). J=8,2) РХ-МС: 4,08 хвилин (99%, МН+ = 302); 1Н ЯМР Приклад 4 (CDCI3): d 3,92 (3, 3Н, СО2СН3), 5,37 (s, 2Н, 1-(3-5-Дифлуор-бензил)-3-(2-нітроNCH2Ar), 6,54-6,60 (m, 2Н), 6,64 (d, 1Н, J=3,1Гц), фенілсульфаніл)-1Н-індол-6-карбонової кислоти 6,67-6,74 (m, 1H), 7,27 (d, 1H, J=3,1Гц), 7,68 (d, 1H, метиламід J=8,6Гц), 7,83 (d, 1H, J=8,6Гц), 8,01 (s, 1H). (Сполука 47, Структура 15 схеми IV, де R 1 = (с) 1-(3.5-Дифлуор-бензил)-3-(2-нітро3,5-дифлуор феніл R2 = 2-нітрофеніл R3=R4=R8=H, фенілсульфаніл)-1Н-індол-6-карбонової кислоти R9=Me) метиловий естер (Сполука 31. Структура 3 схеми І. де R1 = 3,5дифлуорфеніл. R2 = 2-нітрофеніл R3=R4=H. Rs=CO2Me) До розчину 1-(3,5-Дифлуор-бензил)-1Н-індол6-карбонової кислоти метиловий естер (330мг, 1,10ммоль) у дихлорметані (30мл) додають при кімнатній температурі розчин 2нітробензенсульфенілхлориду (210мг, 1,11ммоль) у ди хлорметані (10мл). Суміш перемішують при кімнатній температурі 4 доби. Реакційну суміш концентрують та сирий продукт очищають 20г окЗагальний спосіб 2: амідування 6сиду силіцію ТФЕ-патрон (етилацетат/гептан 1:5 карбоксііндолів структури 14, отримуючи 6до 1:2), отримуючи заголовну сполуку як жовтий карбоксамідіндоли структури 15 (Схема IV). твердий продукт (392мг, вихід = 78%). В атмосфері азоту до розчину 1-(3,5-ДифлуорВЕРХ: 4,60 хвилин (97,8%); 1H ЯМР (CDCI3): d бензил)-3-(2-нітро-фенілсульфаніл)-1Н-індол-63,93 (s, 3Н, СО2СН3), 5,45 (s, 2H, NCH2Ar), 6,63карбонової кислоти (25,1мг, 57,0мкмоль) у сухому 6,69 (m, 2Н), 6,74-6,80 (m, 1Н), 6,88 (dd, 1Н, ДМП (10мл) додають N-MM (1мл), ГОБт (9,60мг, J1=8,2Гц, J2=1,2Гц), 7,18-7,23 (m, 1H), 7,26-7,30 62,7мкмоль), ЕДХ (12,1мг, 62,7мкмоль), та метил(m, 1H), 7,57 (d, 1H, J=7,8Гц), 7,58 (s, 1H), 7,89 (dd, амоній хлорид (19,2мг, 285мкмоль). Реакційну су1H, J1=7,8Гц, J2=1,2Гц), 8,12 (s, 1H), 8,28 (dd, 1H, міш перемішують протягом ночі при кімнатній темJ1=7,8Гц, J2=1,2Гц). пературі та тоді виливають на лід вод. Утворений Приклад 3 осад фільтрують та залишок промивають надли1-(3,5-Дифлуор-бензил)-3-(2-нітрошок водою, а потім трохи гептаном. Продукт суфенілсульфаніл)-1Н-індол-6-карбонова кислота шать під вакуумом при 40°С, отримуючи заголовну (Сполука 30, Структура 14 схеми IV. де R 1 = сполуку як жовтий твердий продукт (15,2мг, у = 3,5-диФлуорФєніл. R2 = 2 нітрофеніл. R3=R4=H) 60%). РХ-МС:4,31 хвилин(100,0%, [МН+ = 454]; 1H ЯМР (ДМСО): d 2,80 (d, 3К, J=4,3 , -CH 2NHCO), 5,63 (s, 2Н, СН2Аr), 6М (dd, IK, J1=3,2Гц, J2=1,0Гц), 7,04 (m, 2H), 7,20 (m, 1H), 7,33-7,37 (m, 1H), 7,41 (d, 1H, 8,6Гц), 7,46-7,50 (m, 1H), 7,64 (dd, 1H, J1=8,2Гц, J2=1,0Гц), 8,15 (s, IK), 8,25 (s, 1H), 8,27 (dd, 1H, J1=8,6Гц, J2=1,0Гц), 8,40 (m, 1H, MeNHCO). Загальним способом 2 отримують наступні сполуки: До розчину 1-(3-5-Дифлуор-бензил)-3-{2-нітрофенілсульфаніл)-1Н-індол-6-карбонової кислоти метиловий естер (150,0мг, 0,33ммоль) у діоксан (20мл) та вод (15мл) додають LiOH·H2O (83,1мг, 2,0ммоль) у 5мл вод. Реакційну суміш перемішу 21 79504 22 Таблиця 2 Сполуки, синтезовані загальним способом 2 Сполука X R1 R2 R3 R4 27 28 S S 3,5-дифлуор феніл 3,5-дифлуор феніл 2-нітрофеніл Н 2-нітрофеніл Н Н Н 29 S 3,5-дифлуор феніл 2-нітрофеніл Н Н 32 S 3,5-дифлуор феніл 2-нітрофеніл Н Н 34 S 3,5-дифлуор феніл 2-нітрофеніл Н Η 35 S 3,5-дифлуор феніл 2-нітрофеніл Н Η 36 37 38 39 40 41 42 43 44 45 46 47 48 49 S S S S S S S S S S S S S S 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 3,5-дифлуор феніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл Η Η Η Н Η Н Η Η Η Η Н Н Η Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н R5 M СО(1-піролідиніл) СО(4-морфолініл) СО[1-(4етилпіперазиніл) CONEt2 CONHCH2-(2фураніл) CONHCH2(3піридил) CONHCH2CH2NMe2 CONHCH2CH2OH CONHCH2CH2OMe CONHCH2CO2Me CONHCH2CONMe2 CONHCH2cPr CONHCH2iPr CONHCH2Ph CONHcPr CONHEt CONHiPr CONHMe CONHnPr CONMe2 493,53 509,53 РХМС час затр. (МН+) (хвилин) 494 4,66 510 4,50 522,57 523 3,81 495,55 496 4,82 519,53 520 4,74 530,55 531 3,94 510,56 483,49 497,52 511,50 524,55 493,53 495,55 529,56 479,50 467,49 481,52 453,47 481,52 467,45 511 484 498 512 525 494 496 530 480 3,90 421 4,48 4,51 4,33 4,75 4,85 4,90 4,57 4,56 4,71 4,31 4,75 !4,30b 482 454 482 468 a) 7 хвилин РХ-МС спосіб застосовано, якщо не визначено інше, b) 10 хвилин РХ-МС спосіб застосовано. Приклад 5 1-[3,5-Дифлуор-бензил)-3-(2-нітрофенілсульфаніл)-1Н-індол-6-карбонової кислоти амід (Сполука 33. Структура 16 схеми IV, де R 1 = 3,5-дифлуор феніл, R2 = 2- нітрофеніл. R3=R4=HT Заголовну сполук у отримують загальним способом 2, застосуванням 51,1мг (116мкмоль) карбонової кислоти, 19,5мг (128мкмоль) ГОБт, 24,6мг (128мкмоль) ЕДХ та 31,1мг (581мкмоль) амоній хлориду. Заголовну сполук отримують як жовтий твердий продукт (9,0мг, 18%). РХ-МС: 4,16 хвилин (100,0%, МН+ = 440); 1Н ЯМР (CDCI3): d 5,46 (s, 2H, С СН2Аr), 6,65 (m, 2H), 6,77 (m, 1H), 6,88 (dd, 1H, J1=8,2Гц, J2=1,0Гц), 7,21 (m, 1H), 7,29 (m, 1H), 7,51 (dd, 1H, J1=7,8Гц, J2=1,0Гц), 7,57 (d, 1H, J=7,7Гц), 7,58 (s, 1H), 8,05 (s, 1H), 8,29 (dd, 1H, J1=8,2Гц, J2=1,0Гц). Приклад 6 6-Метокси-3-(2-нітро-фенілсульфаніл)-1піридин-2-ілметил-1Η-індол (Сполука 9, Структура 3 схеми І. де R1 = 2піридил. R2 = 2-нітрофеніл, R3=R4=H, R 5=OMe) Загальний спосіб 3: 3-сульфанілування (не)заміщеного індолу структури 1, отримуючи заміщені індоли структури 4, а потім індол Nалкілують, отримуючи N-алкілований індол структури 3 (Схема І). (a) 6-Метокси-3-(2-нітро-фенілсульфаніл)-1Ніндол (Структура 4 схеми І, де R2 = 2-нітрофеніл. R1= 3 R =R4=H, R 5=OMe) До розчину 6-метоксііндолу (1,5г, 10,2ммоль) у діетиловому етері (100мл) додають краплями розчин 2-нітробензенсульфенілхлориду (1,93г, 10,2ммоль) у 50мл діетилового гетеру, протягом 4 хвилин. Утворений жовтий розчин перемішують при кімнатній температурі протягом 1 години. Розчинник випарюють та сирий продукт очищають на колонці з оксидом силіцію (гептан/етилацетат 9:1), 23 79504 24 отримуючи заголовну сполуку (3,054г, вихід = суміш промивають 2% водною лимонною кисло97%). тою (2x100мл) та водою (100мл). Органічну фазу ВЕРХ: 3,72 хвилин, чистота 96,7%, ТШХ (гепсушать магній сульфатом та розчинник випарютан/етилацетат 1:1): Rf = 0,6; ють. Сирий продукт очищають кристалізацією 1 (етилацетат/гептан), отримуючи заголовну сполуку Н ЯМР (CDCI3): d 3,87 (s, 3Н, GCH3), 6,84 (dd, (1,437г, вихід = 74%). 1H, J1=7,8Гц, J2=3,13Гц), 6,97, (m, 2H), 7,16 (t, 1H, ВЕРХ: 10,3 хвилин, чистота 99,6%, ТШХ (гепJ=7,8Гц), 7,25 (t, 1H, J=7,8Гц), 7,36 (d, 1H, J=7,8Гц), 7,44 (d, 1H, J=2,0Гц), 8,26 (d, 1H, J=7,8Гц), 8,45 (s, тан/етилацетат 1:1): Rf = 0,3; 1 1H, NH). Н ЯМР (CDCI3): d 3,80 (s, 3Н, ОСН3), 5,47 (s, (b) 6-Метокси-3-(2-нітро-фенілсульфаніл)-12Η, NCH2), 6,82 (m, 2H), 6,88 (d, 1H, J=7,8Гц), 7,01 піридин-2-ілметгил-1Η-індол (dd, 1Н, J1=7,8Гц, J2=1,6Гц), 7,15-7,19 (m, 1Н), 7,25 (Сполука 9. Структура 3 схеми І. де R1 = 2(m, 2Н), 7,37 (d, 1H, J=8,6Гц), 7,60-7,64 (m, 1H), піридил R2 = 2-нітрофеніл. R3=R4=H. R 5-OMe) 8,26 (dd, 1H, J1=7,8Гц, J2=1,6Гц), 8,63 (d, 1H, До розчину 6-Ме токси-3-(2-нітроJ=5,88Гц). фенілсульфаніл)-1Н-індолу (1,5г, 5ммоль) у ДМФ Загальним способом 3 отримують наступні (150мл) додають NaH (60% у маслі; 500мг, сполуки: 12,5ммоль) невеликими порціями, протягом 4 хвилин. Утворений темний розчин перемішують протягом 5 хвилин, при кімнатній температурі. Тоді 2піколілхлорид гідрохлорид (984мг, 6ммоль) додають невеликими порціями протягом 2 хвилин. Протягом перемішування при кімнатній температурі (2 години) колір розчину слабко змінюється від темного до жовтого. Етилацетат (100мл) додають та Таблиця 3 Сполуки, синтезовані загальним способом 3 Сполука X 1 2 3 4 5 6 7 8 9 11 12 13 14 15 67 68 S S S S S S S S S S S S S S S S 69 S 70 S 71 72 73 74 75 S S S S S 76 S 77 S 78 79 S S 80 S R3 R4 R5 РХ-Мс РХ-МС час (МН+) затр. (хвилин) 427 4,07 423 4,23 425 4,17 416 3,97 409 4,10 450 4,10 405 4,16 436 4,08 1030b 399 4,68 459 4,29 396 4,66 459 4,33 459 4,36 425 4,34 416 3,92 R1 R2 2,5-дифлуор феніл 2,флуор, 3-метил-феніл 2-хлор-феніл 2-ціано-феніл 2-флуор-феніл 2-метил, 3-нітро-феніл 2-метил-феніл 2-нітро-феніл 2-піридил 2-тетрагідропіраніл 2-трифлуор-метил-феніл 3-(5-метилізоксазоліл) 3,4-дихлор-феніл 3,5-дихлор-феніл 3-хлор-феніл 3-ціано-феніл 3-флуор, 5трифлуорметил-феніл 3-флуор, 6трифлуорметил-феніл 3-флуор-феніл 3-метокси-феніл 3-метил-феніл 3-нітро-феніл 3-піридил 3-трифлуор-метил, 4хлорфеніл 3-трифлуорметилоксифеніл 3-трифлуор-метил-феніл 4-(2-метилтіазоліл) 4-(3,5-диметилзоксазоліл) 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2- нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл Н Η Н Η Н Η Н Н Η Н Н Н Н Н Н Η Н Н Н Н Н Н Н Н Н Н Н Η Η Η Η Η ОМе ОМе ОМе ОМе ОМе ОМе ОМе ОМе ОМе ОМе ОМе ОМе ОМе ОМе ОМе ОМе 426,44 422,48 424,91 415,47 408,45 449,48 404,49 435,46 391,45 398,48 458,46 395,44 459,35 459,35 424,91 415,47 2-нітрофеніл Η Η ОМе 476,45 477 4,42 2-нітрофеніл Η Η ОМе 476,45 477 4,27 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл Η Η Η Η Η Η Η Η Η Η ОМе ОМе ОМе ОМе ОМе 408,45 420,49 404,49 435,46 391,45 409 421 405 436 392 4,22 4,04 4,16 4,00 3,28 2-нітрофеніл Η Η ОМе 492,90 493 4,33 2-нітрофеніл Η Η ОМе 474,46 475 4,43 2 нітрофеніл 2-нітрофеніл Η Η Η Η ОМе ОМе 458,46 411,50 459 412 4,21 4,39 2-нітрофеніл Η Η ОМе 409,46 410 4,49 М 81 82 83 84 85 86 87 88 89 S S S S S S S S S 25 4-хлор-феніл 4-ціано-феніл 4-флуор-феніл 4-метоксифеніл 4-метил-феніл 4-морфолініл 5-(2-хлор-тіазоліл) 5-(2-хлортіофеніл) циклогексил 79504 2-нітрофеніл Η 2-нітрофеніл Η 2-нітрофеніл Η 2-нітрофеніл Η 2-нітрофеніл Η 2-нітрофеніл Η 2-нітрофеніл Η 2-нітрофеніл Η 2-нітрофеніл Η 26 Η Η Η Η Η Η Η Η Η ОМе ОМе ОМе ОМе ОМе ОМе ОМе ОМе ОМе 424,91 415,47 408,45 420,49 404,49 413,50 431,92 430,93 396,51 425 416 409 421 405 414 432 431 397 4,22 3,93 4,07 4,03 4,19 3,54 4,61 4,92 5,11 a) 7 хвилин РХ-МС спосіб застосовано якщо не визначено інше, b) застосовано 20 хвилин перебігу на ВЕРХ-системі. Приклад 7 1-(3,5-Дифлуор-бензил)-6-метокси-3-[піридин2-ілсульфаніл)-1Η-індол (Сполука 65 Структура 3 схеми І. де R1 = 3,5дифлуорфеніл. R2 = 2-піридил R3=R4=H. R 6= ОМе В атмосфері азоту до охолодженого (-10°С) розчину 2-меркаптопіридину (25мг, 0,22ммоль) у ССl4 (2мл) пропускають СІ2-газ протягом 1 хвилини. Розчинник випарюють та додають краплями розчин 1-(3,5-Дифлуор-бензил)-6-метокси-1Ніндолу (25мг, 0,09ммоль) у діетиловому етері (2мл). Реакційну суміш концентрують та сирий продукт очищають препаративною РХ-МС, отримуючи заголовну сполуку (7,77мг, вихід = 23%). РХ-МС: 3,95 хвилин (100%, МН+ 383); ТШХ (гептан/етилацетат 1:1): Rf = 0,6; 1 Н-ЯМР (CDCI3): d 2,23 (s, 1Н, NH), 3,82 (s, 1H, OCH3), 6,65 (у, 2Н), 6,73 (d, 1H, J=2,7Гц), 6,73-6,78 (m, 1Н), 6,80 (d, 1Н, J=7,8Гц), 6,87 (dd, 1H, J1=7,8Гц, J2=1,6Гц), 7,00 (ddd, 1Н, J1=9,8Гц, J2=4,7Гц, J3=0,8Гц), 7,35 (s, 1Η), 7,42 (ddd, 1H, J1=J2=7,8Гц, J3=1,6Гц), 7,50 (d, 1H, 8,6Гц), 8,46 (d, 1H, J=4,7Гц). Приклад 8 {2-[1-[3,5-Дифлуор-бензил)-6-метокси-1Ніндол-3-ілсульфаніл]-феніл}-метанол (Сполука 16, Структура 8 схеми III, де R 1 =3,5дифлуорфеніл R3=R4=H. R 5=OMe) а) {2-[1-[3,5-Дифлуор-бензил)-6-метокси-1Ніндол-3-ілсульфаніл]-феніл}-бензойної кислоти метиловий естер (Сполука 19, Структура 7 схеми III, де R 1 =3,5дифлуорфеніл R3=R4=H. R 5=OMe) СІггаз пропускають у ССI4 (5мл) протягом 3 хвилин. Далі додають розчин метилтіосаліцилату (91мкл, 0,66ммоль) у ССI4 (2мл). Суміш перемішують при -10°С протягом 5хв. та далі при кімнатній температурі протягом 15хв. Суміш концентрують та знов розчиняють у дихлорметані (5мл). До цього розчину додають краплями розчин 1-[3,5Дифлуор-бензил)-6-метокси-1Η-індолу (121мг, 0,443ммоль) у ди хлорметані Суміш перемішують при кімнатній температурі протягом 2 годин та концентрують. Сирий продукт очищають хроматографією на колонці (гептан/етилацетат 9:1), отримуючи заголовну сполук у як білий твердий продукт (161мг, вихід = 83%). РХ-МС: 4,72 хвилини (100,0%, МН+ = 440); 1Н ЯМР (CDCI3): d 3,82 (s, 3Н, АrOСН3), 3,99 (s, 3Н, СО2СН3), 5,30 (s, 2Н, СН2Аr), 6,62-6,69 (m, 2H), 6,71-6,77 (m, 2H), 6,83 (dd, 1H, J1=8,6Гц, J2=1,0Гц)), 6,87 (dd, 1H, J1=8,4Гц, J2=1,2Гц)), 7,067,11 (m, 1H), 7,15-7,20 (m, 1Н), 7,30 (s, 1H), 7,44 (d, 1H, J1=8,6Гц), 7,57 (d, 1H, J=7,7Гц), 8,02 (dd, 1H, J1=8,0Гц, J2=1,2Гц). b) {2-[1-[3,5-Дифлуор-бенэил)-6-метокси-1Ніндол-3-ілсульфаніл]-феніл}метанол (Сполука 16, Структура 8 схеми III, де R 1 =3,5дифлуорфеніл R3=R4=H. R 5=OMe) В атмосфері азоту до розчину {2-[1-[3,5Дифлуор-бензил)-6-метокси-1Н-індол-3ілсульфаніл]-феніл}-бензойної кислоти метилового естеру (13,5мг, 0,031ммоль) у ТГФ (2мл) додають LiAIH 4 (1Μ у ТГФ, 0,40мл, 0,40ммоль). Суміш перемішують при кімнатній температурі протягом 3 годин. Далі додають етилацетат (25мл) та суміш промивають 3% лимонною кислотою(2х25мл) та розсолом (25мл). Органічну фазу сушать магній сульфатом та концентрують, отримуючи безбарвне масло (15мг) Сирий продукт очищають препаративною ВЕРХ, отримуючи заголовну сполуку як безбарвне масло (5,6мг, 44% виходу). РХ-МС: 4,47 хвилин (95,6%, МН+ = 412); 1НЯМР (CDCI3): d 3,49 (s, 1Н, ОН), 3,81 (3, 3Н, ОСН3), 4,92 (s, 2Н, СН2ОН), 5,28 (s, 2Н, СН2Аr), 6,62-6,66 (m, 2Н), 6,70-6,77 (m, 2Н), 6,83 (dd, 1Н, J1=8,8Гц, J2=2,4Гц), 6,89-(dd, 1Н, J1=8,0Гц, J2=1,2Гц), 7,027,07 (m, 1Н), 7,08-7,13 (m, 1Н), 7,29 (s, 1H), 7,38 (dd, 1H, J1=8,0Гц, J2=1,2Гц), 7,44 (d, 1H, J=8,8Гц). Приклад 9 27 79504 28 2-[1-[3,5-Дифлуор-бензил)-6-метокси-1Н-індолРХ-МС: 4,20 хвилин (МН+ = 425); 1Н-ЯМР 3-ілсульфаніл]-бензамід (CDCI3): d 3,81 (s, 3Н, ОСН3), 5,39 (s, 2H, СН2Аr), (Сполука 18. Структура 11 схеми III, де R 1 = 6,05 (s, br, 1Н, NH), 6,28 (s, br, 1Н, NH), 6,61-6,67 3,5-дифлуор феніл R3=R4=H, R 5=OMe) (m, 2Н), 6,70-6,72 (m, У), 6,73-6,77 (m, 1Н), 6,83 (dd, IK. J1=8,8Гц, J2=2,0Гц), 6,92 (dd, 1H, J1=8,0Гц, J2=1,2Гц), 7,07-7,17 (m, 2H), 7,31 (s, 1H), 7,45 (d, 1H, J=8,8Гц), 7,60 (dd, 1H, J1=8,0Гц, J2=1,2Гц). Приклад 10 Приклад 11 2-[1-[3,5-Дифлуор-бензил)-6-метокси-1Н-індол3-ілсульфаніл)1-бензонітрил (Сполука 20. Структура 12 схеми НІ, де R1 = 3,5-дифлуор фeніл R3=R4=H, R 5=OMe) а) 2-[1-[З,5-Дифлуор-бензил)-6-метокси-1Ніндол-3-ілсульфанілі-бензойна кислота (Структура 9 схеми III, де R1 = 3,5дифлуорфеніл R3=R4=H, R 5=OMe) До розчину 2-[1-(3,5-Дифлуор-бензил)-6метокси-1Н-індол-3-ілсульфаніл]-бензойної кислоти метилового естеру (97мг, 0,221ммоль) у ТГФ (10мл) додають розчин LiOH-H2O (71мг, 1,69ммоль) у воді (10мл). Суміш перемішують при кімнатній температурі протягом 17 годин та тоді при 60°С протягом 24 годин та тоді підкислюють 3% водною лимонною кислотою. Етилацетат (50мл) додають та суміш промивають 3% водною лимонною кислотою (2x50мл) та розсолом (50мл). Органічну фаз у сушать магній сульфатом та концентрують, отримуючи жовтий твердий продукт (104мг). Сирий продукт перекристалізовують з суміші етилацетат/гептан, отримуючи заголовну сполуку як жовтий порошок (49мг, 52% виходу). РХ-МС: 4,37 хвилин (МН+ = 426); 1Н-ЯМР (CDCI3): d 3,77 (s, 3Н, ОСН3), 5,51 (s, 2Н, СН2Аr), 6,69 (d, 1Н, J=8,0Гц), 6,76 (dd, 1Н, J1=8,4Гц, J2=2,4Гц), 6,98-7,04 (m, 2H), 7,11-7,15 (m, 1H), 7,16-7,25 (m, 4H), 7,83 (s, 1Η), 7,92 (dd, 1H, J1=8,0Гц, J2=1,6Гц). Загальний спосіб 4: Реакція аміну з карбоновими кислотами структури 9 з ВТТУ та ДІПЕА дає аміди структури 3, у котрій R2 = феніл-2карбоксамід, представлені сполуками структури 10 та 11 (Схема III). b) 2-[1-(3,5-Дифлуор-бензил)-6-метокси-1Ніндол-3-ілсульфаніл)1-бензамід (Сполука 18. Структура 11 схеми III, де R 1 = 3,5-дифлуор феніл. R3=R4=R R 5=OMe) Через розчин 2-[1-(3,5-Дифлуор-бензил)-6метокси-1Н-індол-3-ілсульфаніл]-бензойної кислоти (36мг, 0,085ммоль), ВТТУ (28мг, 0,087ммоль) та ДІПЕА (30мкл, 0,172ммоль) у ДМФ (1мл) продувають газ аміаку протягом 10 хвилин. Суміш тоді перемішують при кімнатній температурі протягом 3 діб. Тоді додають 3% водну лимонну кислоту (0,4мл) та сир реакційну суміш очищають через ЗФ-ТФЕ-патрон (2г сорбенту; 25% водний метанол до 100% метанолу), отримуючи білий твердий продукт (34мг). Сирий продукт очищають хроматографією на колонці (етилацетат), отримуючи заголовну сполуку як безбарвне масло, котре стверджується при стоянні (31мг, вихід: 86%). 2-[1-(3,5-Дифлуор-бензил)-6-метокси-1Ніндол-3-ілсульфаніл)-N-метил-бензамід (Сполука 17. Структура 10 схеми III, де R 1 = 3,5-дифлуор фeніл. R3=R4=H, До охолодженого (0°С) розчину 2-[1-(3,5дифлуор-бензил)-6-метокси-1Н-індол-3ілсульфанілі-бензамід (8мг, 0,019ммоль) та Et3N (10мкл, 0,072ммоль) у СН2СІ2 (1,5мл) додають Tf2O (6мкл, 0,036ммоль). Суміш перемішують при 0°С протягом 2 годин та тоді при кімнатній температурі протягом 22 годин. Воду (25мл) додають та суміш екстрагують СН 2СІ2 (2 x25мл). Комбіновані органічні фази сушать натрій сульфатом та концентрують, о тримуючи коричневе масло (25мг). Сирий продукт очищають хроматографією на колонці (етилацетат/гептан 1:2), отримуючи заголовну сполуку як блідо-рожеве масло (3мг, ви хід: 39%). РХ-МС: 4,57 хвилин (МН+ = 407); 1Н-ЯМР (CDCI3): d 3,82 (s, 3Н. ОСН3), 5,30 (s, 2H, СН2Аr), 6,62-6,67 (m, 2Н), 6,71-6,73 (m, 1Н), 6,74-6,78 (m, 1Н), 6.S6 (dd, 1Н, J1=8,8Гц, J2=2,0Гц), 6,91 (d, 1Н, J=8,4Гц), 7,11-7,15 (m, 1Н), 7,26-7,30 (m, 1Н), 7,37 (s, 1H), 7,46 (d, 1H, J=8,8Гц), 7,57-7,60 (m, 1Н). Приклад 12 1-[3,5-Дифлуор-бензил)-3-(2-нітрофенілсульфаніл)-1Н-індол-6-карбонітрил (Сполука 26. Структура 17 схеми IV. де R 1 = 3,5-дифлуор феніл R2 -2-нітрофеніл. R3=R4=H) 29 79504 30 До охолодженої (0°С) суспензії 1-(3,5До розчину 1-(3,5-Дифлуор-бензил)-6-метоксиДифлуор-бензил)-3-(2-нітро-фенілсульфаніл)-1Н3-(2-нітро-фенілсульфаніл)-1Η-індолу (40мг, індол-6-карбонової кислоти аміду (15мг, 0,09ммоль) у СН 2СІ2 (4мл) додають мета0,034ммоль) та Et3N (10мкл, 0,072ммоль) у СН 2СІ2 хлорпербензойну кислоту (46,5мг, 0,27ммоль). (1-5мл) додають Tf2O (13мкл, 0,077ммоль). Суміш Розчин перемішують при кімнатній температурі перемішують при 0°С протягом 2 годин та тоді при протягом 6 годин. Розчинник випарюють та сирий кімнатній температурі протягом 20 годин. Воду продукт очищають РХ-МС, отримуючи заголовну (25мл) додають та суміш екстрагують СН 2СІ2 сполуку (14,5мг, ви хід = 34%). (2x25мл). Комбіновані органічні фази сушать наВЕРХ: 4,38хвил. чистота 100%; ТШХ (гептрій сульфатом та концентрують, отримуючи заготан/етилацетат 1:1): Rf = 0,6; ловну сполуку як жовтий твердий продукт (13мг, ЯМР (CDCI3): d 3,71 (s, 3H, OCH 3), 5,25 (s, 2Н), вихід: 91%).: 6,58 (d, 1Н, J=3,1), 6,62 (m, 1H), 6,07-6,11 (m, 1H), РХ-МС: 4,55 хвилин (МН+ = не визначається); 6,88 (dd, 1H, J1=7,8Гц, J2=3,1Гц), 7,63 (m, 4H), 7,72 1 Н-ЯМР (CDCI3): d 5,42 (s,2Н, CH2Ar), 6,63-6,69 (m, (d, 1H, J=7,8Гц), 7,83 (s, 1H), 8,37 (dd, 1H, 2H), 6,78-6,85 (m, 2H), 7,21-7,25 (m, 1H), 7,28-7,33 J1=7,8Гц, J2=1,9Гц). (m, 1H), 7,44 (dd, 1H, J1=8,4Гц, J2=1,2Гц), 7,62 (d, Приклад 15 1H, J=8,4Гц), 7,66 (s, 1H), 8,29 (dd, 1H, J1=8,4Гц, 6-Метокси-3-(2-нітро-фенілсульфаніл)-1J2=1,6Гц). піридин-2-ілметил-1Η-індол моногідрохлорид Приклад 13 (Сполука 10). 1-(3,5-Дифлуор-бензил)-6-метокси-3-[2-нітробензенсульфініл)-1Η-індол (Сполука 64, Структура 5 схеми Н, де R1 = 3,5дифлуорфеніл. R2 = 2-нітроФеніл. R3=R4=H, R5=OMe) До розчину 1-(3,5-Дифлуор-бензил)-6-метокси3-(2-нітро-фенілсульфаніл)-1Н-індолу (40мг, 0,09ммоль) у СН 2СІ2 (4мл) додають метахлорпербензойну кислоту (14,5, 0,08ммоль). Розчин перемішують при кімнатній температурі протягом 2 годин. Розчинник випарюють та сирий продукт очищають препаративною РХ-МС, отримуючи заголовну сполуку (14,3мг, ви хід = 34%). ВЕРХ: 4,13 хвилин, чистота 100%; ТШХ (гептан/етилацетат 1:1): Rf = 0,4; 1Н ЯМР (CDCI3): d 3,66 (s, 3Н, ОСН3), 5,12 (s, 2Н), 6,57 (m, 3Н), 6,75 (m, 2Н), 7,47 (d, 1Н, J=7,8J2), 7,52 (s, 1Н), 7,66-7,70 (m, 1Н), 8,28-8,32 (m, 1Н), 8,23 (dd, 1Н, J1=7,8Гц, J2=1,9Гц), 8,80 (dd, 1H, J1=7,8Гц, J2=3,1Гц). Приклад 14 1-(3,5-дифлуор-бензип)-6-метокси-3-[2-нітробензенсульфоніл))-1Η-індол (Сполука 62. Структура 6 схеми Н, де R1 = 3,5дифлуорфеніл. R2 = 2-нітрофеніл. R3=R4=H. R5=OMe) До розчину 6-Ме токси-3-(2-нітрофенілсульфаніл)-1-піридин-2-ілметил-1Н-індолу у метиленхлориді пропускають НСІ-газ, доки не кристалізується органічна сіль. Заголовну сполуку виділяють фільтруванням. РХ-МС: 4,04 хвилин (МН+ = 392); 1Н Я МР (ДМСО): d 3,78 (s, 3Н, ОСН3), 5,78 (s, 2H, NCH2), 6,77 (dd, 1H, J3=7,8Гц, J2=2,0Гц), 6,93 (dd, 1H, J1=7,8Гц, J2=0,8Гц), 7,22 (d, 1H, J=7,8Гц), 7,26 (d, 1H, J=2,0Гц), 7,34 (m, 2H), 7,48-7,52 (m, 3H), 7,59 (t, 1H, J=7,0Гц), 7,96 (s, 1H), 8,08 (t, 1H, J=7,0Гц), 8,27 (dd, 1H, J1=7,8Гц, J2=1,6Гц), 8,74 (d, 1H, J=6,7Гц). Приклад 16 1-(3,5-Дифлуор-бензил)-3-(2-нітрофенілсульфаніл))-1Н-індол-6-іламін (Сполука 57. Структура 23 схеми V, де R 1 = 3,5-диФлуорфеніл. R2 = 2-нітрофеніл, R3=R4=H) a) 1-(2-5-Дифлуор-бензил)-6-нітро-1Н-індол (Структура 19 схеми V, де R1 = 3,5дифлуорфеніл R3=R4=H) До розчину 6-нітроіндолу (162мг, 1,0ммоль) у ДМФ (4мл) додають NaH (60% дисперсія у маслі; 80мг, 2,0ммоль). Утворений темний розчин перемішують при кімнатній температурі протягом 15 хвилин. 3,5-дифлуорбензилбромід (129мкл, 1,1ммоль) додають. Реакційну суміш перемішують 31 79504 32 протягом ночі, виливають у підкислену воду та екстрагують двічі етилацетатом. Комбіновані органічні шари сушать безводним натрій сульфатом та концентрують під вакуумом. Продукт очищають на колонці SiO2 (гептан/етилацетат 9:1), отримуючи заголовну сполуку як жовтий твердий продукт (270мг, вихід = 94%). РХ-МС: 5,54 хвилин (100,0%, МН+= 289); 1Н ЯМР (CDCI3): d 5,40 (s, 2Н, СН2Аr), 6,58 (m, 2Н), 6,71 (d, 1Н, J=3,5Гц), 6,75 (m, 1H), 7,26 (s, 1H), 7,41 (d, 1H, J=3,5Гц), 7,71 (d, 1H, J=8,3Гц), 8,05 (dd, 1H, Загальний спосіб 5: Реакція ангідриду кислоти J1=8,3Гц, J2=2,0Гц), 8,21 (d, 1H ,J=2,0Гц). з 6-аміноіндолом структури 20 дає сполуки струкb) 1-(3,5-ДиФлуор-бензил)-1Н-індол-6-іламін тури 21, а потім сульфанілують індол у 3-позиції, (Структура 20 схеми V, де R1 = 3,53 4 отримуючи сполуки структури 22 (Схема V). дифлуорфеніл. R =R =H) а) N-[1-(3,5-Дифлуор-бензил)-1Н-індол-6-іл)До розчину 1-(3,5-Дифлуор-бензил)-6-нітроацетамід 1Н-індолу (144мг, 0,5ммоль) в етанолі (20мл) до(Структура 21 схеми V, де R1 = 3,5дають хлоридну кислоту 37% (80мкл) та. дифлуорфеніл. R3=R4=R Z = метил) SnCI2,2H2O (600мг). Реакційну суміш перемішують До розчину 1-(3,5-Дифлуор-бензил)-1Н-індолпри 60°С протягом 40 годин та тоді концентрують 6-іламіну (25мг, 0,1ммоль) у ДХМ (4мл) додають під вакуумом. Залишок виливають у етилацетат та піридин (25мкл) та оцтовий ангідрид (9,8мкл, додають концентрований розчин натрій гідроген0,11ммоль) та перемішують протягом ночі при кімкарбонату. Дво шарову систему фільтрують через натній температурі. Реакційну суміш виливають у декаліт для позбавлення від солі стануму та нітрат 10мл води та нейтралізують натрій гідрогенкарбодвічі екстрагують етилацетатом. Комбіновані органатом та екстрагують двічі ДХМ. Комбіновані органічні шари сушать безводним натрій сульфатом та нічні шари сушать безводним натрій сульфатом та концентрують під вакуумом. Продукт очищають на концентрують під вакуумом, отримуючи сиру споколонці з оксидом силіцію (гептан/етилацетат 9:1), луку як білуватий твердий продукт (23,3мг, вихід = отримуючи заголовну сполуку як безбарвне масло 84%). Продукт застосовують без наступної очист(89мг, вихід = 69%). + 1 ки. РХ-МС: 3,20 хвилин (97,7%, МН = 259); H РХ-МС: 4,10 хвилин (97,4%, МН+ = 301); 1Н ЯМР (CDCI3): d 5,12 (s, 2H, CH2Ar), 6,52 (m, 2H), ЯМР (CDCI3): d 2,18 (s, 3Н, CH3CON), 5,28 (s, 2H, С 6,56 (d, 1H, J=3,5Гц), 6,63 (m, 1H), 7,97 (dd, 1H, CH2Ar), 6,53 (d, 1Н, J=3,1), 6,58 (m, 2H), 6,68 (m, J1=8,3Гц, J2=2,0Гц), 7,13 (d, 1H, J=3,5Гц), 7,17 (d, 1H), 6,87 (dd, 1H, J1=8,3Гц, J2=1,6Гц), 7,07 (d, 1H, 1H, J=2,0Гц), 7,55 (d, 1H, J=8,3Гц). J=3,1Гц), 7,55 (d, 1H, J=8,3Гц), 7,90 (s, 1H). с) 1-(3.5-Дифлуор-бензил)-3-(2-нітроb) N-[1-(3,5-Дифлуор-бензил)-3-(2-нітрофенілсульфаніл)-1Н-індол-6-іламін фенілсульфаніл)-1Н-індол-6-ілі-ацетамід (Сполука 57. Структура 23 схеми V, де Rs = (Сполука 58, Структура 22 схеми V, де R 1 = 3.5-дифлуор феніл. R2 = 2- нітрофеніл, R3=R4=H) 3,5-дифлуор феніл. R2 = 2-нітрофеніл, R3=R4=H, Z До розчину 1-(3,5-Дифлуор-бензил)-1Н-індол= метил) 6-іламіну (25мг, 0,1ммоль) у ДХМ (4мл) додають 2До розчину N-[1-(3,5-Дифлуор-бензил)-1Ннітробензенсульфенілхлорид. Утворений жовтий індол-6-іл]-ацетаміду (23,3мг, 0,08ммоль) у діетирозчин перемішують при кімнатній температурі ловому етері (4мл) додають 2протягом 1 години. Суміш концентрують під вакуунітробензенсульфенілхлорид (14,7мг, 0,09ммоль). мом та очищають на колонці з оксидом силіцію Утворений жовтий розчин перемішують протягом (гептан/етилацетат 9:1), отримуючи заголовну ночі при кімнатній температурі. Суміш концентрусполуку як оранжевий твердий продукт (11,6мг, ють під вакуумом та очищають на колонці з оксивихід = 28%). + 1 дом силіцію (гептан/етилацетат 9:1), отримуючи РХ-МС: 5,11 хвилин (100,0%, МН = 412); Н заголовну сполуку як жовтий твердий продукт ЯМР (CDCI3): d 5,22 (s, 2H, CH2Ar), 6,56 (m, 2H), (35,0мг, вихід = 96%). 6,65 (m, 1H), 6,84 (dd, 1H, J1=8,2Гц, J2=1,2Гц), 7,00 РХ-МС: 4,26 хвилин (98,6%, МН+ = 454); 1Н (dd, 1H, J1=8,2Гц, J2=1,2Гц), 7,19 (m, 1Н), 7,30 (d, ЯМР (ДМСО): d 2,03 (s, 3Н, CHACON), 5,51 (s, 2Н, 1Н, J=1,2Гц), 7,31 (s, 1Н), 7,37 (d, 1Н, J=8,2Гц) 7,49 С СН2Аr), 6,89 (dd, 1H, J=8,3Гц, J2=1,2Гц), 6,95 (m, (m, 1Н), 8,27 (dd, 1H, J1=8,2Гц, J2=1,2Гц). 2H), 7,17 (dd, 1H, J1=~83Гц, J2=2,0Гц), 7,19 (m, Приклад 17 1Н), 7,27 (d, 1Н, J=8,3Гц), 7,34 (m, 1Н), 7,49 (m, N-[1-(3,5-Дифлуор-бeнзил)-3-(2-нітро1Н), 7,97 (d, 1H, J=1,2Гц), 8,02 (s, 1H), 8,27 (dd, 1H, фенілсульфаніл))-1Н-індол-6-іл]-ацетамід J1=8,3Гц, J2=1,2Гц). (Сполука 58, Структура 22 схеми V, де R 1 = 2 3 4 Приклад 18 3,5-дифлуор феніл. R = 2-нітрофеніл, R =R =H, Ζ N-[1-[3,5-Дифлуор-бензил)-3-[2-нітро= метил) фенілсульфаніл)-1Н-індол-6-іл]-2,2,2-трифлуорацетамід (Сполука 59, Структура 22 схеми V, де R 1 = 3,5-дифлуор феніл, R2 = 2-нітрофеніл R3=R4=H. Ζ = трифлуорметил) 33 79504 34 екстрагують етилацетатом (2´500мл). Комбіновані органічні шари промивають водою (2´500мл) та розсолом (500мл) та сушать натрій сульфатом і концентрують, отримуючи заголовну сполуку (65г, жовтий твердий продукт), котрий застосовують без наступної очистки. b) 1-[3,5-Дифлуор-бензиліл-1Н-індол-6-іламін. структура 20 схеми VII, де R10 = 3,5дифлуорфеніл. R2=R3=R4=H. EtOH 96% (1л) додають до 1-(3,5-дифлуорбензил)-6-нітро-1Н-індолу та суміш перемішують Загальним способом 5, етап а): N-[1-(3,5при 60°С, доки не розчиняється увесь матеріал. Дифлуор-бензил)-1Н-індол-6-іл]-2,2,2-трифлуор37% розчин хлоридної кислоти (37мл) додають а ацетамід отримують застосуванням 1-(3,5потім станум(ІІ)хлорид дигідрат (268г, 1,19моль) та Дифлуор-бензил)-1Н-індол-6-іламіну (17,7мг, перемішування продовжують при 60°С протягом 69мкмоль), піридину (17мкл) та трифлуороцтового 18 годин. Після суміш охолоджують до кімнатної ангідриду (9,68 мкл, 70мкмоль). Сполуку очищають температури та розчинник видаляють під зменшена колонці з оксидом силіцію (гептан/етилацетат ним тиском. Етилацетат (800мл) додають та суміш 9:1), отримуючи заголовну сполуку як білий твервиливають у насичений водний розчин натрій гіддий продукт(10,9мг, вихід = 61%). РХ-МС: 4,41 рогенкарбонату (1л) та фільтрують через кізель+ хвилин (82,1%, МН = 355) гур. Шари відокремлюють та органічний шар проЗагальним способом 5, етап b): N-[1-(3,5мивають водою (2´500мл) та розсолом (500мл), Дифлуор-бензил)-3-(2-нітро-фенілсульфаніл)-1Нсушать натрій сульфатом та концентрують, отриіндол-6-іл]-2,2,2-трифлуор-ацетамід отримують муючи заголовну сполуку (54г, коричневе масзастосуванням N-[1-(3,5-Дифлуор-бензил)-1Нло/твердий продукт), котрий застосовують без наіндол-6-іл]-2,2,2-трифлуор-ацетаміду (10,9мг, ступної очистки. 31мкмоль) та 2-нітробензенсульфенілхлориду c) [1-[3,5-Дифлуор-бензил)-1Н-індол-6-іл](5,7мг, 37мкмоль). Сполуку очищають через ВЕРХкарбамінової кислоти трет-бутиловий естер, струкколонку (MeCN/вода), отримуючи заголовну спотура 26 схеми VII, де R1 = 3,5-дифлуорфеніл. луку як жовтий твердий продукт (10,2мг, вихід = R2=R3=R4=H. 65%). 1-(3,5-Дифлуор-бензил)-1Н-індол-6-іламін розРХ-МС: 4,65 хвилин (89,0%, МН+ = 508); 1Н чиняють у Ν-ΜΠ (1л) та додають триетиламін ЯМР (ДМСО): d 5,56 (s, 2Η, CH2Ar), 6,87 (dd, 1Н, (34мл, 242ммоль) а потім ди-трет-бутил дикарбоJ=8,3Гц, J2=1,2Гц), 7,01 (m, 2H), 7,20 (m, 1H), 7,35 нат (53г, 242ммоль) та суміш перемішують при (m, 1H), 7,37 (dd, 1H, J1=8,3Гц, J2=2,0Гц), 7,39 (d, кімнатній температурі протягом 18 годин. Суміш 1H, J=8,3Гц), 7,49 (m, 1H), 7,50 (d, 1H, J=2,0Гц), виливають у насичений водний розчин натрій гід8,15 (s, 1H), 8,28 (dd, 1H, J1=8,3Гц, J2=2,0Гц). рогенкарбонату (1,5л) та екстрагують етилацетаПриклад 19 том (3´750мл). Комбіновані органічні шари промиСполука 97: N-[1-(3,5-Дифлуор-бензил)-3-(2вають водою (1л) та розсолом (1л), сушать натрій нітрофенілсульфаніл)-1Н-індол-6-іл-1-2сульфатом та концентрують. Сирий продукт очифлуорацетамід. щають застосуванням хроматографії на колонці структура 28 схеми VII, де R1 = 3 M5(гептан/етилацетат 4:1), отримуючи заголовну 2 3 4 1 дифлуорфеніл R = 2-нітрофеніл. R =R =H. Z = сполуку (39г, 109ммоль, 91% (три етапи), білий монофлуорметил. твердий продукт).. d) [1-[3,5-Дифлуор-бензил)-3-[2-нітрофенілсульфаніл)-1Н-індол-6-іл)-карбамінової кислоти трет-бутиловий естер, структура 27 схеми VEL, де R1 = 3,5дифлуорфеніл, R2 = 2-нітрофеніл R3=R4=H. До розчину [1-(3,5-дифлуор-бензил)-1Н-індол6-іл]-карбамінової кислоти трет-бутилового естеру (39г, 109ммоль) у діетиловому етері (750мл) додають 2-нітробензенсульфенілхлорид (20,4г, 109ммоль) та реакційну суміш перемішують при кімнатній температурі протягом 18 годин. Суміш а) 1-[3,5-Дифлуор-бензил)-6-нітро-1Н-індол. виливають у насичений водний розчин натрій гідструктура 19 схеми VII, де R1 = 3,5рогенкарбонату (1л) та екстрагують етилацетатом 2 3 4 дифлуорфеніл. R =R =R =H. (2´300мл). Комбіновані органічні шари промиваДо розчину 6-нiтро-1Н-індолу (19,5г, ють водою (400мл) та розсолом (400мл), сушать 120ммоль) у Ν-ΜΠ (500мл) додають при 0°С цезій та концентрують, отримуючи заголовну сполуку карбонат (39,1г, 120ммоль). Після перемішування (56г, жовтий твердий продукт), котрий застосовупротягом 30 хвилин при 0°С додають 3,5ють без наступної очистки. дифлуорбензилбромід (30,0г, 144ммоль) та суміші e) 1-(3,5-Дифлуор-бензил)-3-(2-нітродають нагрітися до кімнатної температури та пефенілсульфаніл)-1Н-індол-6-іламін, ремішують протягом 18 годин. Суміш виливають у структура 23 схеми VTJL, де R1 = 3,5насичений водний розчин амоній хлориду (1л) та дифлуорфeніл, R2 = 2-нітрофеніл. R3=R4=H. 35 79504 [1-(3,5-Дифлуор-бензил)-3-(2-нітрофенілсульфаніл)-1Н-індол-6-іл]-карбамінової кислоти трет-бутиловий естер розчиняють у СН 2СІ2 (1л) та в атмосфері азоту додають краплями трифлуороцтову кислоту (48мл, 624ммоль) при кімнатній температурі. Після перемішування протягом 1 години ще додають порцію трифлуороцтової кислоти (48мл, 624ммоль) та реакційну суміш перемішують протягом ще години. Суміш розбавляють СН2СІ2 (500мл) та водою (1л) і додають 3Η розчин гідроксиду натрію до рН суміші 11-12. Шари відокремлюють та органічний шар промивають водою (500мл) та розсолом (500мл), сушать натрій сульфатом та концентрують, отримуючи сирий продукт. Загальним способом 6 отримують наступні сполуки: 36 37 79504 38 Приклад 20 Загальним способом 3 отримують наступні сполуки: Приклад 21 Сполука 61: 1-(3,5-Дифлуор-бензил)-3-(2нітро-фенілсульфаніл)-1Н-індол-6-ол, структура 25 схеми VI, де R1 = 3,5дифлуорфеніл R2 = 2-нітрофеніл, R3=R4=H, R5=OH. До розчину сполуки 63 (240мг, 0,56ммоль) у СН2СІ2 (10мл) додають при 0°С комплекс бор трифлуорид-метил сульфід (2,37мл, 22,5ммоль). Після перемішування протягом 2 годин при 0°С реакційній суміші дають нагрітися до кімнатної температури та перемішування продовжують ще 4 години. Реакційну суміш виливають у суміш лідвода (20мл) та після додавання етилацетату (10мл) шари відокремлюють. Органічний шар промивають насиченим розчином натрій гідрогенкарбонату (20мл) та розсолом (20мл) та сушать безводним натрій сульфатом. Концентрування дає сирий продукт, котрий очищають застосуванням флеш-хроматографії (гептан/етилацетат 3:2), отримуючи сполуку 61 як жовте масло (87мг, 0,21ммоль, 38%). 1 Н ЯМР (CDCI3) d 4,75 (2, 1Н), 5,29 (s, 2Н), 4,66 (m, 1Н), 6,72-6,79 (m, 3Н), 6,98 (dd, 1Н, J1=8,4Гц, J2=1,5Гц), 7,17-7,21 (m, 1H), 7,27-7,31 (m, 1H), 7,35-7,37 (m, 3Н), 8,27 (dd, 1H, J1=8,4Гц, J2=1,5Гц). Приклад 22 Сполука 109: 3-(2-Нітро-фенілсульфаніл)-1піридин-2-ілметил-1Н-індол-6-карбонової кислоти диметиламід, структура 15 схеми ТV, де R1 = 2-піридил. R2 = 2-нітрофеніл R3=R4=H. R 8=R9=Me. a) 1-піридин-2-ілметил-1Н-індол-6-карбонової кислоти метиловий естер. 39 79504 40 В атмосфері азоту до розчину 1Н-індол-6отримуючи сполуку 109 (540мг, 1,25ммоль, 72%, карбонової кислоти метилового естеру (для синтежовтий твердий продукт). 1 зу дивись приклад 2а), 2,47г, 14,1ммоль) у Ν-ΜΠ Н-ЯМР (CDCI3): d 2,97 (s, 3Н), 3,11 (s, 3Н), (140мл) додають цезій карбонат (10,1мг, 31ммоль) 5,53 (s, 2Н), 6,90 (dd, 1Н, J1=7,6Гц, J2=1,5Гц), 6,95 при 0°С. Після перемішування протягом 15 хвилин (d, 1H, J=7,6Гц), 7,17-7,28 (m, 4H), 7,51 (d, 1H, 2-піколілхлорид гідрохлорид (2,77г, 16,9ммоль) J=7,6Гц), 7,54 (s, 1H), 7,61-7,66 (m, 2H), 8,28 (dd, додають та суміш перемішують при кімнатній тем1H, J1=8,4Гц, J2=1,5Гц), 8,61 (d, 1H, J=4,6Гц). пературі протягом 18 годин. Етилацетат (200мл) Отримують застосуванням загального способу додають та суміш промивають насиченим водним 7 наступні сполуки: розчином амоній хлориду (3´150мл) та розсолом (200мл). Органічну фазу сушать натрій сульфатом та концентрують. Сирий продукт очищають застосуванням хроматографії на колонці (етилацетат/гептан 1:3), отримуючи заголовну сполуку як безбарвне масло, котре повільно кристалізується при стоянні (2,72г, 10,2ммоль, 72%). b) 3-[2-Нітро-фенілсульфаніл)-1-піридин-2ілметил-1Н-індол-6-карбонової кислоти метиловий естер, структура 13 схеми IV, де R1 = 2-піридил. R2 = 2-нітрофеніл, R3=R4=H. До розчину 1-піридин-2-ілметил-1Н-індол-6карбонової кислоти метилового естеру (2,72г, 10,2ммоль) у дихлорметані (75мл) додають при кімнатній температурі розчин 2нітробензенсульфенілхлориду (1,93г, 10,2ммоль) у дихлорметані (75мл). Суміш перемішують при кімнатній температурі протягом 24 годин. Реакційну суміш концентрують та сирий продукт очищають застосуванням хроматографії на колонці (етилацетат/гептан 1:5 до 1:2), отримуючи заголовну сполуку як жовтий твердий продукт (3,21г, 7,65ммоль, 75%). c) 3-[2-нітро-фенілсульфаніл)-1-піридин-2ілметил-1Н-індол-6-карбонова кислота, структура 14 схеми IV, де R1 = 2-піридил. R2 = 2-нітрофеніл. R3=R4=H. До суспензії 3-(2-нітро-фенілсульфаніл)-1піридин-2-ілметил-1Н-індол-6-карбонової кислоти метилового естеру (3,0г, 6,58ммоль) у діоксані (65мл) додають розчин LiOH.H2O (1,66г, 39,6ммоль) у воді (65мл). Реакційну суміш перемішують протягом ночі при 60°С. Суміш тоді підкислюють до рН 6 додаванням 15% водного розчину хлоридної кислоти та суміш екстрагують етилацетатом (2´100мл). Комбіновані органічні шари сушать сульфатом натрію та концентрують, отримуючи жовтий порошок. Продукт перекристалізовують з суміші гептан/етилацетат, отримуючи заголовну сполуку як жовто-оранжеві кристали (2,47г, 6,09ммоль, 93%). Загальний спосіб 7: амідування 6карбоксиіндолів структури 14, отримуючи 6карбоксамідіндоли структури 15 (Схема IV). В атмосфері азоту до розчину 3-(2-нітрофенілсульфаніл)-1-піридин-2-ілметил-1Н-індол-6карбонової кислоти (700мг, 1,73ммоль) у сухому СН2СІ2 (70мл) додають ДІПЕА (0,9мл, 5,2ммоль), ВТТУ (840мг, 2,6ммоль) та диметиламін хлорид (420мг, 5,1ммоль). Реакційну суміш перемішують протягом ночі при кімнатній температурі та тоді виливають у насичений водний розчин натрій гідПриклад 23 рогенкарбонату (100мл). Органічний шар промиСполука 118: N-[3-(2-нітрофенілсульфаніл)-1вають розсолом (50мл), сушать натрій сульфатом піримідин-5-ілметил-1Н-індол-6-іл)формамід, та концентрують. Сирий продукт очищають хроматографією на колонці (етилацетат/МеОН 95:5), 41 79504 42 структура 28 схеми VII, де R1 = 3,5-піримідил, тан/етилацетат (1:1), що дає заголовну сполуку як R2 = 2-нітрофеніл. R3=R4=R Ζ = Η жовтий твердий продукт (3,8г, 83%). e) N-[3-[2-нітро-фенілсульфаніл)-1-піримідин5-ілметил-1Н-індол-6-іл]-формамід [3-(2-нітро-фенілсульфаніл)-1-піримідин-5ілметил-1Н-індол-6-іл]-карбамінової кислоти третбутиловий естер (3,8г, 8,0ммоль) розчиняють у 150мл мурашиної кислоти та перемішують протягом 4 годин. Розчин концентрують під вакуумом. Додають насичений розчин натрій гідрогенкарбонату та суміш екстрагують СН 2СІ2 (2х) Комбіновані органічні шари промивають розсолом та сушать a) 6-нітро-1-піримідин-5-ілметил-1Η-індол сульфатом натрію. Розчину дають стояти протя5-(Гідроксиметил)піримідин (16,2г, 147ммоль) гом ночі Утворений твердий продукт фільтрують, розчиняють у 500мл СН 2СІ2 та о холоджують до отримуючи суміш сполуки 118 та структури 23 40°С. MsCI (16,0г, 140ммоль) додають при -40°С. схеми VII, де R1 = 3,5-піримідил, R2=2-нітрофеніп, Суміш перемішують протягом 1 години, даючи R3=R4=H (2,4г). Сполука 118: 1Н ЯМР (CDCI3 + досягти -20°С. Розчин застосовано як такий. крапля MeOD) d 5,47 (s, 2Н), 6,91 (dd, 1Н, 6-нітроіндол-1Н-індол (35,6г, 220ммоль) розJ1=8,4Гц, J2=1,1Гц), 6,99 (dd, 1H, J1=8,4Гц, чиняють у 750мл ДМФ та додають порціями NaH J2=1,9Гц), 7,19-7,23 (m, 1Н), 7,27-7,31 (m, 1Н), 7,33 (50%, 12г, 250ммоль) та суміш перемішують про(s, 1H), 7,42 (d, 1H, J=8,4Гц), 7,49 (s, 1Н), 8,22 (d тягом 1 години. Суміш охолоджують до -40°С та 1H, J=1,9Гц), 8,27 (dd, 1H, J1=8,4Гц, J2=1,1Гц), розчин мезилату додають краплями. Суміші дають 8,66 (s, 2H), 9,16 (s, 1H). досягти кімнатної температури протягом ночі. СуПриклад 24 міш гасять водою та екстрагують етилацетатом Сполука 119: 3-[2-нітро-фeнілсульфоніл))-1(2х). Комбіновані органічні шари промивають вопіридин-2-ілметил-1Н-індол-6-карбонітрил, дою (2х) та розсолом та сушать безводним натрій структура 3 схеми І, де R1 =2-піридил R2 = 2сульфатом. Після концентрування під вакуумом нітрофеніл, R3 = R4 - Η. R6 = CN. матеріал очищають хроматографією на колонці з оксидом силіцію, гептан/етилацетат (3:1)-(1:4)). отримуючи заголовну сполуку як жовтий твердий продукт (14г, 55ммоль, 39%). b) 3-Піримідин-5-ілметил-1Н-індол-6-іламін. 6-нітро-1-піримідин-5-ілметил-1Н-індол (4,1г, 16,1ммоль) розчиняють у 100мл ТГФ та додають 100мл ізопропанолу. Pd/C (2г) та суміш перемішують у Н2-атмосфері (балон) протягом 2 годин. Суміш фільтрують через броунмілерит та промиваa) До розчину 1Н-індол-6-карбонітрилу (1,00г, ють етилацетатом, отримуючи заголовну сполуку 7,04ммоль) у діетиловому етері (50мл) додають після концентрування (3,5г, 15,6ммоль, 97%). при кімнатній температурі 2c) 1-піримідин-5-ілметил-1Н-індол-6-іл)нітробензенсульфенілхлорид (1,34г, 7,04ммоль) та карбамінової кислоти трет-бутиловий естер реакційну суміш перемішують протягом 18 годин. 1-піримідин-5-ілметил-1Н-індол-6-іламін (5,5г, Суміш концентрують та сирий продукт очищають 24,6ммоль) розчиняють у 100мл N-МП та додають застосуванням хроматографії на колонці (етилатриетиламін (3,5г, 35ммоль) та ди-трет-бутил дицетат/гептан 1:4®4:1), отримуючи 3-(2-нітрокарбонат (7,0г, 32ммоль). Суміш перемішують фенілсульфаніл)-1Н-індол-6-карбонітрил (1,62г, протягом ночі, гасять насиченим розчином натрій 5,49ммоль, 78%). гідрогенкарбонату та екстрагують толуєном (3х). b) До розчину 3-(2-нітро-фенілсульфаніл)-1НКомбіновані органічні шари промивають водою індол-6-карбонітрилу (200мг, 0,68ммоль) у ДМА (4х) та розсолом та суша ть безводним натрій су(5мл) додають при 0°С цезій карбонат (442мг, льфатом. Концентрування шарів дає заголовну 1,36ммоль) та суміш перемішують протягом 20 сполуку (3,1г, 39%). хвилин. Тоді додають 2-піколілхлорид гідрохлорид d) [3-(2-нітро-фенілсульфаніл)-1-піримідин-5(112мг, 0,68ммоль) та суміш перемішують протяілметил-1Н-індол-6-ілі-карбамінової кислоти третгом 18 годин при кімнатній температурі. Додають бутиловий естер. насичений водний розчин натрій гідрогенкарбона1-піримідин-5-ілметил-1Н-індол-6-іл)ту та суміш екстрагують етилацетатом (2х). Комбікарбамінової кислоти трет-бутиловий естер (3,1г, новані органічні шари промивають розсолом, су9,6ммоль) розчиняють у 150мл СН 2СІ2 та додають шать натрій сульфатом та концентрують. Сирий 2-нітробензенсульфенілхлорид (1,86г, 9,8ммоль). продукт очищають застосуванням хроматографії Суміш перемішують протягом 18 годин та гасять на колонці, отримуючи сполуку 119 (223мг, насиченим розчином натрій гідрогенкарбонату та 0,58ммоль, 85%). екстрагують етилацетатом (2х). Комбіновані органічні шари промивають розсолом та сушать безЯМР (CDCI3) d 5,54 (s, 2Н), 6,86 (dd, 1Н, водним натрій сульфатом. Продукт очищають J1=8,4Гц, J2=1,1Гц), 7,04 (d, 1H, J=8,4Гц), 7,19хроматографії на колонці з оксидом силіцію, геп7,23 (m, 1H), 7,26-7,31 (m, 2H), 7,40 (dd, 1H, J1=8,4Гц, J2=1,1Гц), 7,59 (d, 1H, J=8,4Гц), 7,70 (td, 43 79504 44 1H, J1=8,4Гц, J2=1,9Гц), 7,76 (s, 1H), 7,78 (s, 1Н), Сполука 120: 3-(2-нітро-фенілсульфаніл)-1 8,29 (dd, 1Н, J1=8,4Гц, J2=1,1Гц), 8,63 (d, 1Н, J=3,0 піридин-2-ілметил-1Н-індол-6-карбонітрил моногіН2). дрохлорид Загальним способом 3 отримують наступні сполуки: Концентровану хлоридну кислоту (0,0225мл) додають до розчину сполуки 119 (0,093г) у діоксані. Суміш перемішують протягом 20 хвилин, та тоді концентрують під зменшеним тиском, отримуючи сполуку 120 (0,096г). 1 Н ЯМР (MeOD) d 6,01 (s, 2Н), 6,98 (dd, 1Н, J1=7,6Гц, J2=1,1Гц), 7,28-7,32 (m, 1Н), 7,36-7,41 (m, 1H), 7,48 (dd, 1H, J1=7,6Гц, J2=1,1Гц), 7,53 (d, 1H, J=8,4Гц), 7,60 (d, 1H, J=8,4Гц), 7,93 (t, 1H, J=6,1Гц), 8,08 (s, 1H), 8,10 (s, 1H), 8,27 (dd, 1H, J1=8,4Гц, J2=1,1Гц), 8,44 (td, 1H, J1=8,4Гц, J2=1,1Гц), 8,85 (dd, 1H, J1=6,1Гц, J2=1,9Гц). Сполуки досліджено на їх активність стосовно андрогенних рецепторів у трансактиваційному дослідженні та у дослідженні зв'язування. (Анти-)андрогенну активність тест-сполук (ЕК50 та власну активність) визначено у in vitro біодослідженні клітин яєчнику китайського хом'яка (СНО) стабільно трансфекто-ваних експресійною плазмідою андрогенного рецептору людини та репортерною плазмідою, у котрій MMTV-промотер приєднано до репортерного гена люциферази. Лінію клітин CHO-AR-pMMTV-LUC 1G12-A5-CA описано у [Schoonen et al. (2000), Journal of Steroid Biochemistry and Molecular Biology 74(4):213-222]. Антиандрогенну активність тест-сполуки визначено інгібуванням трансактивації андрогенним рецептором ферменту люциферази у присутності 1нМ ДГТ(5a-дигідротестостерон, 17b-гідрокси-5aандростан-3-он). Власну активність антиандрогенної активності визначено у присутності контрольного антиандрогену 2-Гідрокси-2-метил-N-(4-нітро3-трифлуорметил-феніл)-пропіонаміду (Гідроксифлутамід), та прийнято за 100%. Стосовно антиандрогенної активності, максимальну власну активність у присутності 100нМ ДГТ прийнято за 100%. Результати представлено у таблиці 4. Приклад 25 Таблиця 4 Активність стосовно андрогенних рецепторів Сп. X 1 S 2 S 3 4 5 S S S 6 S R1 2,5дифлуорфеніл 2,флуорметилфеніл 2-хлор-феніл 2-ціанофеніл 2-флуор-феніл 2-метил, 3-ніт рофеніл R2 R3 R4 R5 аго ЕК 50 аго ефективність ант ЕК 50 ант ефектив ність 2-нітрофеніл Η Η ОМе ++ + 2-нітрофеніл Η Η ОМе + + 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл Η Η Η Η Η Η ОМе ОМе ОМе + + + + ± + ++ ± 2-нітрофеніл Η Η ОМе + + 45 7 8 9 S S S 10 S 11 S 12 S 13 S 14 15 S S 16 S 17 S 18 S 19 S 20 S 21 S 22 S 23 S 24 S 25 S 26 S 27 S 28 S 29 S 30 S 31 S 32 S 33 S 34 S 35 S 36 S 37 S 38 S 39 S 40 S 41 S 42 S 43 S 2-метилфеніл 2-нітро-феніл 2-піридил 2-піридил Гідрогенхлорид 2-тетрагідропіраніл 2-трифлуорметилфеніл 3-(5металізоксазоліл) 3,4-дихлор-феніл 3,5-дихлор-феніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 79504 46 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл Η Η Η Η Η Η ОМе ОМе ОМе + + +++ ++ + + +++ ± 2-нітрофеніл Η Η ОМе ++ + 2-нітрофеніл н Η ОМе ++ + 2-нітрофеніл Η Η ОМе + + 2-нітрофеніл Η Η ОМе + ± 2-нітрофеніл 2-нітрофеніл 2-(гідроксиметилфеніл) 2-(N-мeтилбензамід) Η Η Η Η ОМе ОМе + ++ + ++ Η Η ОМе ++ + ++ ± Η Η ОМе + + 2-бензамід Η Η ОМе ++ + ++ ± 2-бензойної кислоти ме- Η тил-естер Η ОМе + + 2-ціанофеніл Η ОМе ++ ++ 2-метоксифеніл Η Η ОМе ++ 2-нітрофеніл Η Η Вr ++ ++ 2-нітрофеніл Η Η CF3 +++ ++ 2-нітрофеніл Η Η СН2ОН ++ ++ 2-нітрофеніл Η Η +++ ++ 2-нітрофеніл Η Η CN +++ ++ 2-нітрофеніл Η Η СО(1-піролідиніл) ++ + 2-нітрофеніл Η Η СО(4-морфолініл) ++ + 2-нітрофеніл Η Η СО-[1-(4метилпіперазиніл ++ ++ 2-нітрофеніл Η Η СО2Н + + 2-нітрофеніл Η Η СО2 Ме +++ + 2-нітрофеніл Η Η COHEt2 ++ + ++ ± 2-нітрофеніл Η Η СОНН2 ++ + ++ 2-нітрофеніл Η Η СОМНСН2(2-фураніл) +++ + 2-нітрофеніл Η Η СОМНСН2(3-піридил) +++ + 2-нітрофеніл Η Η tCONHCH2CH2Nme2 ++ + 2-нітрофеніл Η Η CONHCH2CH2OH +++ ++ 2-нітрофеніл Η Η CONHCH2CH2OMe +++ ++ 2-нітрофеніл Η Η СОNСН2 СО2Ме ++ ++ 2-нітрофеніл Η Η CONHCH2CONMe2 ++ + 2-нітрофеніл Η Η CONHCH2cPr +++ + 2-нітрофеніл Η Η CONHCH2iPr ++ + 2-нітрофеніл Η Η CONHCH2 Ph ++ ± + ± 47 44 S 45 S 46 S 47 S 48 S 49 S 50 S 51 S 52 S 53 S 54 S 55 S 56 S 57 S 58 S 59 S 60 S 61 S 62 SО2 63 S 64 SO 65 S 66 S 67 68 S S 69 S 70 S 71 72 73 74 75 S S S S S 76 S 77 S 78 S 79 S 80 S 81 S 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3,5-дифлуорфеніл 3-хлор-феніл 3-ціанофеніл 3-флуор, 5трифлуор-метил феніл 3-флуор, 6дифлуорметилфеніл 3-флуор-феніл 3-метокси-феніл 3-метилфеніл 3-нітро-феніл 3-піридил 3-трифлуорметил, 4-хлорфеніл 3-трифлуорметилокси-феніл 3-трифлуорметилфеніл 4-(2-метилтіазоліл) 4-{3,5-диметилізоксазоліл) 4-хлор-феніл 79504 48 2-нітрофеніл Η Η CONHc Pr +++ + 2-нітрофеніл Η Η CONHEt +++ ++ 2-нітрофеніл Η Η CONHiPr ++ + ++ ± 2-нітрофеніл Η Η CONHMe +++ + 2-нітрофеніл Η Η CONHNPr ++ + + ± 2-нітрофеніл Η Η CONMe2 +++ + 2-нітрофеніл Η Η F ++ ++ 2-нітрофеніл F Η Η +++ ++ 2-нітрофеніл Η Η Η ++ ++ 2-нітрофеніл Η F Η ++ ++ 2-нітрофеніл СІ Η Η ++ ++ 2-нітрофеніл Me Η Η ++ + 2-нітрофеніл Η Η Η +++ 2-нітрофеніл Η Η ΝΗ2 2-нітрофеніл Н Η 2-нітрофеніл Η 2-нітрофеніл 2-нітрофеніл + + NHAc +++ ++ Η NHCOCF3 +++ + Η Η ΝΟ2 +++ ++ Η Η ОН +++ ОМе +++ ++ +++ ++ 2-нітрофеніл 2-нітрофеніл Η Η 2-нітрофеніл Η Η ОМе ± + + 2-піридил Η Η ОМе ++ ++ 2-піридил-Nоксид 2-нітрофеніл 2-нітрофеніл Η Η ОМе + + ++ ± Η Η Η Η ОМе ОМе ++ +++ ++ ++ 2-нітрофеніл Η Η ОМе ++ ++ 2-нітрофеніл Η Η ОМе ++ + 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл Η Η Η Η Η Η Η Η Η Η ОМе ОМе ОМе ОМе ОМе +++ ++ ++ +++ +++ ++ + ++ ++ ++ 2-нітрофеніл Η Η ОМе + + 2-нітрофеніл Η Η ++ ++ 2-нітрофеніл Η Η ++ ++ 2-нітрофеніл Η Η ++ + 2-нітрофеніл Η Η ОМе + ± + ± 2-нітрофеніл Η Η ОМе + + +++ + ОМе 49 82 83 84 85 86 S S S S S 87 4-ціанофеніл 4-флуор-феніл 4-метокси-феніл 4-метилфеніл 4-морфолініл 5-(2-хлортіазоліл) 5-(2-хлортіофеніл) Циклогексил Феніл Феніл Феніл S 88 89 90 91 92 S S S S 79504 50 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл Η Η Η Η Η Η Η Η Η Η ОМе ОМе ОМе ОМе ОМе ++ ++ + + ± + ++ ± + ± ± + ++ ± + 2-нітрофеніл Η Η ОМе ++ + 2-нітрофеніл Η Η ОМе ++ ++ 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл 2-нітрофеніл Η Η Η Η Η Η ОМе Η ОМе Η Η ОМе ++ + ++ +++ + + ++ +++ ± ± ++ заув аження 1: шкала ЕК 50: +++
ДивитисяДодаткова інформація
Назва патенту англійськоюIndols for treating diseases associated with androgen receptors
Автори англійськоюVan Der Louw Jaap
Назва патенту російськоюИндолы для лечения болезней, связанных с рецепторами андрогена
Автори російськоюван дер Лаув Яп
МПК / Мітки
МПК: C07D 401/06, C07D 413/06, C07D 403/06, C07D 417/06, C07D 401/12, C07D 409/12, C07D 209/30, A61P 5/24, C07D 403/12, C07D 405/12, C07D 405/06
Мітки: андроген-рецепторами, хвороб, індоли, лікування, пов'язаних
Код посилання
<a href="https://ua.patents.su/26-79504-indoli-dlya-likuvannya-khvorob-povyazanikh-z-androgen-receptorami.html" target="_blank" rel="follow" title="База патентів України">Індоли для лікування хвороб, пов’язаних з андроген-рецепторами</a>
Попередній патент: Канатна дорога
Наступний патент: Спосіб цифрового аерофотознімання
Випадковий патент: Комбінований літальний апарат












