Заміщені індоли, спосіб їх одержання та спосіб лікування хвороби, опосередкованої простагландином d2
Номер патенту: 79464
Опубліковано: 25.06.2007
Автори: Расул Рухсана, Боннерт Роджер, Санґані Гітеш, Тіґ Саймон, Дікінсон Марк, Браф Стівен, Кук Тоні
Формула / Реферат
1. Сполука формули (І) або її фармацевтично прийнятна сіль:
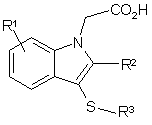 , (I)
, (I)
у якій
R1 - гідроген, галоген, CN, нітрогрупа, SO2R4, OH, OR4, S(O)xR4, SO2NR5R6, CONR5R6, NR5R6, арил (як варіант, заміщений хлором або флуором), С2-С6алкеніл, С2-С6алкініл або С1-6алкіл, причому останні три групи, як варіант, заміщені одним або більше замісниками, незалежно вибраними з галогену, OR8 і NR5R6, S(O)xR7, де х дорівнює 0, 1 або 2;
R2 - гідроген, галоген, CN, SO2R4 або CONR5R6, CH2OH, CH2OR4 або С1-7алкіл, причому остання група, як варіант, заміщена одним або більше замісниками, незалежно вибраними з атомів галогену, OR8 і NR5R6, S(O)xR7, де х дорівнює 0, 1 або 2;
R3 - арил або гетероарил, кожний з яких, як варіант, заміщений одним або більше замісниками, незалежно вибраними з гідрогену, галогену, CN, нітрогрупи, ОН, SO2R4, OR4, SR4, SOR4, SO2NR5R6, CONR5R6, NR5R6, NHCOR4, NHSO2R4, NHCO2R4, NR7SO2R4, NR7CO2R4, С2-С6алкенілу, С2-С6алкінілу, С1-6алкілу, причому останні три групи, як варіант, заміщені одним або більше замісниками, незалежно вибраними з атомів галогену, OR8 і NR5R6, S(O)xR7, де х дорівнює 0,1 або 2;
R4 - арил, гетероарил або С1-6алкіл, які, як варіант, можуть бути заміщені одним або більше замісниками, незалежно вибраними з атомів галогену, арилу, гетероарилу, OR10, ОН, NR11R12, S(O)xR13 (де х дорівнює 0, 1 або 2), CONR14R15, NR14COR15, SO2NR14R15, NR14SO2R15, CN, нітрогрупи;
R5 і R6 є незалежно атомом гідрогену, С1-6алкільною групою або арилом, або гетероарилом, причому останні три, як варіант, можуть бути заміщені одним або більше замісниками, незалежно вибраними з атомів галогену, арилу, OR8 і NR14R15, CONR14R15, NR14COR15, SO2NR14R15, NR14SO2R15, CN, нітрогрупи, або
R5 і R6 разом з атомом нітрогену, до якого вони приєднані, можуть утворювати 3-8-членне насичене гетероциклічне кільце, яке, як варіант, містить один або більше атомів, вибраних з О, S(O)x, де х дорівнює 0, 1 або 2, NR16, і яке саме, як варіант, заміщене С1-3алкілом;
R7 і R13 незалежно є С1-С6алкілом, арильною або гетероарильною групою, які можуть бути, як варіант, заміщені атомами галогену;
R8 - атом гідрогену, C(O)R9, С1-С6алкіл (як варіант, заміщений атомами галогену або арилом), арильна або гетероарильна група (як варіант, заміщена галогеном);
кожна з R9, R10, R11, R12, R14, R15 незалежно є атомом гідрогену, С1-С6алкілом, арильною або гетероарильною групою; i
R16 - гідроген, С1-4алкіл, -СОС1-C4алкіл, СОYС1-C4алкіл, де Y є О або NR7,
кожна з R9, R10, R11, R12, R14, R15 незалежно є атомом гідрогену, С1-С6алкілом, арильною або гетероарильною групою (які можуть бути, як варіант, заміщені атомами галогену); і
R16 - гідроген, С1-4алкіл, -СОС1-C4алкіл, СОYС1-C4алкіл, де Y є О або NR7,
причому у цьому контексті, якщо не вказано інше, алкільна або алкенільна група або алкільний або алкенільний компонент у групі замісника можуть бути лінійними, розгалуженими або циклічними.
2. Сполука за п. 1, яка відрізняється тим, що у ній R1 - арил, гідроген, метил, хлор, флуор, нітрил, нітрогрупа, бром, йод, SO2Me, SO2Et, NR4R5, SO2N-алкіл2.
3. Сполука за п. 1 або п. 2, яка відрізняється тим, що у ній R2 є С1-6алкілом.
4. Сполука за п. 3, яка відрізняється тим, у ній R3 - хіноліл, феніл або тіазол, заміщений одним або більше флуором, хлором, метилом, етилом, ізопропілом, метокси, SO2Me, трифлуорметильною або арильною групами.
5. Сполука за п. 1, яка відрізняється тим, що її вибрано з таких сполук:
3-[(4-хлорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота;
3-[(2-хлор-4-флуорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота;
3-[(3-хлор-4-флуорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота;
3-[(2-метоксифеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота;
3-[(3-флуорфеніл)тіо]-2,5-диметил-1 Н-індол-1-оцтова кислота;
3-[(4-етилфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота;
3-[(2-хлорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота;
3-[(2,5-дихлорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота;
3-[(4-флуорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота;
3-[(4-хлор-2-метилфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота;
3-[(4-хлорфеніл)тіо]-4-ціано-2,5-диметил-1Н-індол-1-оцтова кислота;
5-хлор-3-[(4-хлорфеніл)тіо]-6-ціано-2-метил-1Н-індол-1-оцтова кислота;
3-[(4-хлорфеніл)тіо]-4-(етилсульфоніл)-7-метокси-2-метил-1Н-індол-1-оцтова кислота;
3-[(4-хлорфеніл)тіо]-4-[(діетиламіно)сульфоніл]-7-метокси-2-метил-1Н-індол-1-оцтова кислота;
4-хлор-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота;
5-хлор-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота;
6-хлор-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота;
7-хлор-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота;
3-[(4-хлорфеніл)тіо]-2-метил-5-(метилсульфоніл)-1Н-індол-1-оцтова кислота;
2-метил-3-[(4-метилфеніл)тіо]-6-(метилсульфоніл)-1Н-індол-1-оцтова кислота;
4-бром-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота;
3-[(4-хлорфеніл)тіо]-4-[4-[(1,1-диметилетокси)карбоніл]-1-піперазиніл]-2-метил-1Н-індол-1-оцтова кислота;
3-[(4-хлорфеніл)тіо]-2-метил-4-(1-піперазиніл)-1Н-індол-1-оцтова кислота;
5-бром-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота;
3-[(4-хлорфеніл)тіо]-2-метил-5-феніл-1Н-індол-1-оцтова кислота;
3-[(4-хлорфеніл)тіо]-5-ціано-2-метил-1Н-індол-1-оцтова кислота;
3-[(4-ціанофеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота,
3-[(3-метоксифеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота;
3-[(4-метоксифеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота,
3-[(3-етилфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота;
2,5-диметил-3-[(2-метилфеніл)тіо]-1Н-індол-1-оцтова кислота;
3-[(3-хлорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота,
3-[(2-флуорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота,
3-[(2,6-дихлорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота;
3-(1Н-імідазол-2-ілтіо)-2,5-диметил-1Н-індол-1-оцтова кислота,
2,5-диметил-3-(1Н-1,2,4-триазол-3-ілтіо)-1Н-індол-1-оцтова кислота;
2,5-диметил-3-[(4-метил-4Н-1,2,4-триазол-3-іл)тіо]-1Н-індол-1-оцтова кислота;
2,5-диметил-3-[(4-метил-2-оксазоліл)тіо]-1Н-індол-1-оцтова кислота;
2,5-диметил-3-[(1-метил-1Н-імідазол-2-іл)тіо]-1Н-індол-1-оцтова кислота;
2,5-диметил-3-[[4-(метилсульфоніл)феніл]тіо]-1Н-індол-1-оцтова кислота,
2,5-диметил-3-(8-хінолінілтіо)-1Н-індол-1-оцтова кислота,
3-[(4-хлорфеніл)тіо]-5-флуор-2,4-диметил-1Н-індол-1-оцтова кислота;
3-[(4-ціанофеніл)тіо]-5-флуор-2,4-диметил-1Н-індол-1-оцтова кислота;
3-[(2-хлорфеніл)тіо]-5-флуор-2,4-диметил-1Н-індол-1-оцтова кислота;
5-флуор-3-[(2-метоксифеніл)тіо]-2,4-диметил-1Н-індол-1-оцтова кислота;
5-флуор-3-[(2-етилфеніл)тіо]-2,4-диметил-1Н-індол-1-оцтова кислота;
5-флуор-2,4-диметил-3-[[2-(1-метилетил)феніл]тіо]-1Н-індол-1-оцтова кислота;
5-флуор-2,4-диметил-3-[[2-(трифлуорметил)феніл]тіо]-1Н-індол-1-оцтова кислота;
2,5-диметил-4-(метилсульфоніл)-3-[(4-феніл-2-тіазоліл)тіо]-1Н-індол-1-оцтова кислота;
3-[(3-хлорфеніл)тіо]-2,5-диметил-4-(метилсульфоніл)-1Н-індол-1-оцтова кислота;
3-[(2-хлорфеніл)тіо]-2,5-диметил-4-(метилсульфоніл)-1Н-індол-1-оцтова кислота;
3-[(4-хлорфеніл)тіо]-5-(метоксикарбоніл)-2-метил-1Н-індол-1-оцтова кислота;
5-карбокси-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота;
3-[(4-хлорфеніл)тіо]-2-метил-4-нітро-1Н-індол-1-оцтова кислота;
4-аміно-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота;
3-[(4-хлорфеніл)тіо]-4-(етиламіно)-2-метил-1Н-індол-1-оцтова кислота;
3-[(4-хлорфеніл)тіо]-4-йод-2-метил-1Н-індол-1-оцтова кислота;
3-[(4-хлорфеніл)тіо]-2-метил-4-феніл-1Н-індол-1-оцтова кислота;
і їх фармацевтично прийнятні солі.
6. Сполука формули (I) за будь-яким з пп. 1-5, яка відрізняється тим, що вона призначена для використання у терапії.
7. Спосіб лікування хвороби, опосередкованої простагландином D2, який включає введення пацієнту терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі за пп. 1-6.
8. Спосіб за п. 7, який відрізняється тим, що хворобою є астма або риніт.
9. Спосіб одержання сполуки формули (І), який включає введення сполуки формули (II):
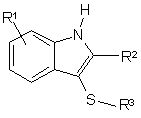 , (II)
, (II)
у якій R1, R2 і R3 є такими, як визначено для формули (І), або є їх захищеними похідними,
у реакцію зі сполукою формули (А):
L-CH2CO2R17, (А)
де R17 - естероутворююча група, і L - відщеплювальна група, у присутності основи, і як варіант, після цього у будь-якій послідовності:
видалення будь-якої захисної групи,
гідроліз естерної групи R17 до відповідної кислоти,
утворення фармацевтично прийнятної солі.
Текст
Винахід стосується замішених індолів, корисних як фармацевтичні сполуки для лікування респіраторних розладів, фармацевтичних композицій, що містять їх, і способів їх приготування. [У ЕРА 1 170 594] описано способи ідентифікації сполук, які можуть бути використані для лікування хворобливих станів, опосередкованих простагландином D2, лігандом для рецептора CRTh2, що не має підтримки. У GB 1356834] описано групу сполук, які, як вважають, мають протизапальну, анальгетичну і жарознижуючу активність. Несподівано було виявлено, що певні індол-оцтові кислоти є активними на рецепторі CRTK2, і тому можна сподіватись, що вони будуть потенційно корисними для лікування різних респіраторних захворювань, включаючи астму і обструктивну хворобу легеневих шляхів. Першим аспектом винаходу є сполука формули (І) або її фармацевтично прийнятні сіль або сольват: (I) у якій R1 - гідроген, галоген, CN, нітрогрупа, SO2R4, OH, OR4, S(O)xR4, SO2NR5R6, CONR5R6, NR5R6, арил (як варіант, заміщений хлором або флуором), С2-С6алкеніл, С2-С6алкініл або С1-6алкіл, причому останні три групи, як варіант, заміщені одним або більше замісниками, незалежно вибраними серед галогену, OR8 і NR5R6, S(O)хR7, де х дорівнює 0,1 або 2; R2 - гідроген, галоген, CN, SO2R4 або CONR5R6, CH2OH, CH2OR4 або С1-7алкіл, причому остання група, як варіант, заміщена одним або більше замісниками, незалежно вибраними серед атомів галогену, OR8 і NR5R6, S(O)хR7, де х дорівнює 0, 1 або 2; R3 - арил або гетероарил, кожний з яких, як варіант, заміщений одним або більше замісниками, незалежно вибраними серед гідрогену, галогену, CN, нітрогрупи, ОН, SO2R4, OR4, SR4, SOR4, SO2NR5R6, CONR5R6, NR5R6, NHCOR4, NHSO2R4, NHCO2R4, NR7SO2R4, NR7CO2R4, С2-С6алкенілу, С2-С6алкінілу, С1-6алкілу, причому останні три групи як варіант, заміщені одним або більше замісниками, незалежно вибраними серед атомів галогену, OR8 і NR5R6, S(O)хR7, де х дорівнює 0,1 або 2; R4 - арил, гетероарил, або С 1-6алкіл, які, як варіант, можуть бути заміщені одним або більше замісниками, незалежно вибраними серед атомів галогену, арилу, гетероарилу, OR10, OH, NR11R12, S(O)xR13 (де х дорівнює 0, 1 або 2), CONR14R15, NR14COR15, SO2NR14R15, NR14SO2R15, CN, нітрогрупи; R5 і R6 є незалежно атомом гідрогену, С1-6алкільною групою або арилом, або гетероарилом, останні три з яких, як варіант, можуть бути заміщені одним або більше замісниками, незалежно вибраними серед атомів галогену, арилу, OR8 і NR14R15, CONR14R15, NR14COR15, SO2NR14R15, NR14SO2R15; CN, нгтрогрупи, або R5 і R6 разом з атомом нітрогену, до якого вони приєднані, можуть утворювати 3-8-членне насичене гетероциклічне кільце, яке, як варіант, містить один або більше атомів, вибраних серед О, S(O)х, де χ дорівнює 0, 1 або 2, NR16, і яке саме, як варіант, заміщене С1-3алкілом; R7 і R13 незалежно є С1-С6алкілом, арильною або гетероарильною групою, які можуть бути, як варіант, заміщені атомами галогену; R8 - атом гідрогену, C(O)R9, С1-С6алкіл (як варіант, заміщений атомами галогену або арилом), арильна або гетероарильна група (як варіант, заміщена галогеном); кожна з R9, R10, R11, R12, R14, R15 незалежно є атомом гідрогену, С1-С6алкілом, арильною або гетероарильною групою (які можуть бути, як варіант, заміщені атомами галогену); і R16 - гідроген, С1-4алкіл, -СОС1-С4алкіл, СОYС1-С4алкіл, де Υ є О або NR7. Тут, якщо не вказано інше, алкільна або алкенільна група або алкільний або алкенільний компонент у групі замісника можуть бути лінійними, розгалуженими або циклічними. Арилом є феніл або нафтил. Гетероарил визначають як 5-7-членне ароматичне кільце або як 6,6- або 6,5-злитий біцикл, де кожне кільце містить один або більше гетероатомів, вибраних серед N, S і О. Приклади включають піридин, піримідин, тіазол, оксазол, піразол, імідазол, фуран, ізоксазол, пірол, ізотіазол і азулен, нафтил, інден, хінолін, ізохінолін, індол, індолізин, бензо[b]фуран, бенз[b]тіопен, 1Н-індазол, бензімідазол, бензтіазол, 1,2бензізотіазол, бензоксазол, пурин, 4Н-хінолізин, цинолін, фталазин, хіназолін, хіноксалін, 1,8-нафтиридин, піперидин, хінолон. Гетероциклічні кільця R5 і R6 є насиченими гетероциклами, приклади яких включають морфолін, тіоморфолін, азетидин, імідазолідин, піролідин, піперидин і піперазин. Термін алкіл, взятий окремо або як частина іншої групи, включає прямоланцюговий, розгалужений або циклічний алкіл. Бажано, коли R1 - гідроген, галоген, нітрогрупа, NR4R5, нітрил, SO2R4, SO2NR5R6, ОМе, арил, CO2R8 або С16апкіл, які можуть бути, як варіант, заміщені одним або більше замісниками, незалежно вибраними серед атомів галогену, OR8, NR8R9, S(O)хR7, де χ дорівнює 0, 1 або 2. Замісників R1 (однакових або різних) може бути декілька. Більш бажано, коли R1 - арил, гідроген, метил, хлор, флуор, нітрил, нітрогрупа, бром, йод, SO2Me, SO2Et, NR4R5, SO2N-алкіл2 , алкіл (як варіант, заміщений атомами флуору). Найкраще, коли R1 - гідроген, метил, феніл, хлор, флуор, йод, нітрил, SO2Me, CF3, нітрил. Група або групи R1 можуть бути у будь-якій позиції на індольному кільці, бажано на 4-й або 5-й позиції. Бажана кількість замісників R1, відмінних від гідрогену, становить 1 або 2. Бажано, коли R2 є С1-С6алкілом, найкраще, метилом. R3 - феніл або гетероарил. Бажані гетероарильні групи включають 6,6- або 6,5-злиті біциклічні ароматичні кільцеві системи, які, як варіант, містять 1-3 гетероатоми, вибрані серед нітрогену, оксигену або сульфуру, або 5-7-членне гетероциклічне кільце, яке містить 1-3 гетероатоми, вибрані серед нітрогену, оксигену або сульфуру. Прикладами гетероарильних груп можуть бути піридин, піримідин, тіазол, оксазол, піразол, імідазол, фуран, ізоксазол, пірол, ізотіазол і азулен, нафтил, інден, хінолін, ізохінолін, індол, індолізин, бензо[b]фуран, бензо[b]тіофен, 1Н-індазол, бензімідазол, бензтіазол, бензоксазол, пурин, 4Н-хінодізин, цинолін, фталазин, хіназолін, хіноксалін, 1,8-нафтирідин, птеридин, індол, 1,2-бензізотіазол і хінолон. Бажано, коли R3 - хіноліл, феніл або тіазол, кожний з яких може бути заміщений, як це було визначено вище. Більш бажано, коли R3 - феніл або хіноліл, кожний з яких може бути заміщений, як це було визначено вище. Група R3 може бути заміщена одним або більше замісниками, вибраними серед галогену, метокси, алкілу, CF3, SO2алкілу, арилу або ціаногрупи. Більш бажано, коли замісниками на R3 є флуор, хлор, метил, етил, ізопропіл, метокси, SO2Me, трифлуорметил або арил. Замісники можу бути присутні у будь-якій позиції у групі R3, бажано, у 4-й позиції. Коли R3 є гетероцикпом, гетероатоми можуть знаходитись у будь-якій позиції на кільці. Бажані сполуки винаходу включають: 3-[(4-хлорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота; 3-[(2-хлор-4-флуорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота; 3-[(3-хлор-4-флуорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота; 3-[(2-метоксифеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота; 3-[(3-флуорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота; 3-[(4-етилфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота; 3-[(2-хлорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота; 3-[(2,5-diхлорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота; 3-[(4-флуорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота; 3-[(4-хлор-2-метилфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота; 3-[(4-хлорфеніл)тіо]-4-ціано-2,5-диметил-1Н-індол-1-оцтова кислота; 5-хлор-3-[(4-хлорфеніл)тіо]-6-ціано-2-метил-1Н-індол-1-оцтова кислота; 3-[(4-хлорфеніл)тіо]-4-(етилсульфоніл)-7-метокси-2-метил-1Н-індол-1-оцтова кислота; 3-[(4-хлорфеніл)тіо]-4-[(діетиламіно)сульфоніл]-7-метокси-2-метил-1Н-індол-1-оцтова кислота; 4-хлор-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота; 5-хлор-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота; 6-хлор-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота; 7-хлор-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота; 3-[(4-хлорфеніл)тіо]-2-метил-5-(метилсульфоніл)-1Н-індол-1-оцтова кислота; 2-метил-3-[(4-метилфеніл)тіо]-6-(метилсульфоніл)-1Н-індол-1-оцтова кислота; 4-бром-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота; 3-[(4-хлорфеніл)тіо]-4-[4-[(1,1-диметилетокси)карбоніл]-1-піперазиніл]-2-метил-1Н-індол-1-оцтова кислота; 3-[(4-хлорфеніл)тіо]-2-метил-4-(1-піперазиніл)-1Н-індол-1-оцтова кислота; 5-бром-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота; 3-[(4-хлорфеніл)тіо]-2-метил-5-феніл-1Н-індол-1-оцтова кислота; 3-[(4-хлорфеніл)тіо]-5-ціано-2-метил-1Н-індол-1-оцтова кислота; 3-[(4-ціанофеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота; 3-[(3-метоксифеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота; 3-[(4-метоксифеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота; 3-[(3-етилфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота; 2,5-диметил-3-[(2-метилфеніл)тіо]-1Н-індол-1-оцтова кислота; 3-[(3-хлорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота; 3-[(2-флуорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота; 3-[(2,6-дихлорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота; 3-(1Н-імідазол-2-ілтіо)-2,5-диметил-1Н-індол-1-оцтова кислота; 2,5-диметил-3-(1Н-1,2,4-триазол-3-іл)тіо]-1Н-індол-1-оцтова кислота; 2,5-диметил-3-[(4-метил-4Н-1,2,4-триазол-3-іл)тіо]-1Н-індол-1-оцтова кислота; 2,5-диметил-3-[(4-метил-2-оксазоліл)тіо]-1Н-індол-1-оцтова кислота; 2,5-диметил-3-[(1-метил-1Н-імідазол-2-іл)тіо]-1Н-індол-1-оцтова кислота; 2,5-диметил-3-[[4-(метилсульфоніл)феніл]тіо]-1Н-індол-1-оцтова кислота, 2,5-диметил-3-(8-хінолінілтіо)-1Н-індол-1-оцтова кислота, 3-[(4-хлорфеніл)тіо]-5-флуор-2,4-диметил-1Н-індол-1-оцтова кислота; 3-[(4-ціанофеніл)тіо]-5-флуор-2,4-диметил-1Н-індол-1-оцтова кислота; 3-[(2-хлорфеніл)тіо]-5-флуор-2,4-диметил-1Н-індол-1-оцтова кислота; 5-флуор-3-[(2-метоксифеніл)тіо]-2,4-диметил-1Н-індол-1-оцтова кислота; 5-флуор-3-[(2-етилфеніл)тіо]-2,4-диметил-1Н-індол-1-оцтова кислота; 5-флуор-2,4-диметил-3-[[2-(1-метилетил)феніл]тіо]-1Н-індол-1-оцтова кислота; 5-флуор-2,4-диметил-3-[[2-(трифлуорметил)феніл]тіо]-1Н-індол-1-оцтова кислота; 2,5-диметил-4-(метилсульфоніл)-3-[(4-феніл-2-тіазоліл)тіо]-1Н-індол-1-оцтова кислота; 3-[(3-хлорфеніл)тіо]-2,5-диметил-4-(метилсульфоніл)-1Н-індол-1-оцтова кислота; 3-[(2-хлорфеніл)тіо]-2,5-диметил-4-(метилсульфоніл)-1Н-індол-1-оцтова кислота; 3-[(4-хлорфеніл)тіо]-5-(метоксикарбоніл)-2-метил-1Н-індол-1-оцтова кислота; 5-карбокси-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота; 3-[(4-хлорфеніл)тіо]-2-метил-4-нітро-1Н-індол-1-оцтова кислота; 4-аміно-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота; 3-[(4-хлорфеніл)тіо]-4-(етиламіно)-2-метил-1Н-індол-1-оцтова кислота; 3-[(4-хлорфеніл)тіо]-4-йод-2-метил-1Н-індол-1-оцтова кислота; 3-[(4-хлорфеніл)тіо]-2-метил-4-феніл-1Н-індол-1-оцтова кислота; і їх фармацевтично прийнятні солі. Певні сполуки формули (І) можуть існувати у стереоізомерних формах. Зрозуміло, що винахід охоплює всі геометричні і оптичні ізомери сполук формули (І) і їх суміші, включаючи рацемати. Таутомери і їх суміші також входять в об'єм винаходу. Сполука формули (І) може бути перетворена у її фармацевтично прийнятну сіль або сольват, бажано, в основну сіль приєднання, наприклад, сіль амонію, натрію, калію, кальцію, алюмінію, літію, магнію, цинку, бензатину, хлорпрокаїну, холіну, діетаноламіну, етаноламіну, етилдіаміну, меглуміну, трометаміну або прокаїну, або у кислотну сіль приєднання, наприклад, гідрохлорид, гідробромід, фосфат, ацетат, фумарат, малеат, тартрат, цитрат, оксалат, метансульфонат або р-толуолсульфонат. Бажаними є солі натрію і амонію. Сполуки формули (І) можуть бути перетворені у фармацевтично прийнятну сіль або сольват. Бажаними є солі натрію. Подальшим аспектом винаходу є спосіб приготування сполук формули (І), який включає реакцію сполуки формули (II): (II) у якій R1, R2 і R3 є такими, що визначені для формули (І), або є їх захищеними похідними, з сполукою формули (А): L-CH2CO2R17 (A) де R17 - групоутворюючий естер і L - відщеплювальна група, у присутності основи, і, як варіант, після цього у будь-якому порядку: - видалення будь-якої захисної групи - гідроліз естерної групи R1 до відповідної кислоти - утворення фармацевтично прийнятної солі. Реакцію можна проводити у придатному придатному розчиннику, наприклад, ТГФ з використанням основи, наприклад, гідриду натрію тощо. Придатні групи R17 включають C1-6алкільні групи, наприклад, метил, етил або третичний бутил. Придатною відщеплювальною групою може бути галоген, зокрема, бром. Бажаними сполуками формули (А) є етил, метил або трет-бутилбромацетат. Гідроліз естерної групи R17 можна провести, виконуючи звичайні процедури, наприклад, перемішуванням з водним гідроксидом натрію або трифлуороцтовою кислотою. Зрозуміло, що певні функціональні групи потребують захисту стандартними захисними групами. Введення і усунення захисту функціональних груп, описані, [наприклад, у "Protective Groups in Organic Chemistry", ed. by J. W. F. McOmie, Plenum Press (1973), і "Protective Groups in Organic Synthesis", 3rd ed., T. W. Greene & P. G. M. Wuts, Wiley-lnterscience (1999)]. Сполуки формули (II) можна приготувати реакцією сполуки формули (III) з сполукою формули (IV): у якій R1, R2 і R3 є такими, що визначені для формули (І). Реакцію бажано проводити в оцтовій кислоті з нагріванням. Сполуки формули (II) можна також приготувати реакцією сполуки формули (V) з сполукою формули (IV): у якій R1, R2 і R3 є такими, що визначені для формули (І). Реакцію бажано проводити у придатному розчиннику, наприклад, ДХМ або ТГФ, використовуючи хлоруючий агент, наприклад, сульфонілхлорид або трет-бутилгіпохлорит. Сполуки формул (III), (IV) і (V) є комерційно доступними або можуть бути приготовлені з використанням стандартної хімії. Сполуки формули (І) можна також приготувати з сполук формули (VI). Реакцію проводять з сполукою формули (В) у присутності галогенуючого агента, наприклад, йоду, у придатному органічному розчиннику, наприклад, ДМФ: де R1, R2, R3 і R17 є такими, що визначені для формул (І) і (А), або є їх захищеними похідними. Сполуки формули (І) отримують гідролізом в стандартних умовах: Сполуки формули (VI) можна також приготувати з сполук формули (VII) реакцією з сполукою формули (А), як це було описано. Деякі сполуки формули (VII) є комерційно доступними або можуть бути приготовлені з сполук формули (VIII) реакцією з сполукою формули (В). Реакцію проводять у присутності тіолу, бажано, тіосаліцилової кислоти, у трифлуороцтовій кислоті. Сполуки формули (VIII) можна приготувати реакцією сполуки формули (IV) з сполукою (IX), як це було описано для приготування сполук формули (II), у яких R1, R2 і R3 є такими, що визначені для формули (II), або є їх захищеними похідними. R18 є С1-С6 алкілом (наприклад, метилом) або єеквівалентною R3. Сполуки формули (VII) можна також перетворити у сполуки формули (І) реакцією з сполукою формули (В). Реакцію проводять у присутності йоду, у придатному органічному розчиннику, наприклад, ДМФ. Іноді реакцію проводять у присутності основи, наприклад, гідриду натрію, після перемішування реакційну суміш обробляють сполукою формули (А) і потім гідролізують. У іншому варіанті інтермедіат формули (VIII) може бути ізольований і потім введений у реакцію з сполукою формули (А) з подальшим гідролізом. Сполуки формули (І) можна також приготувати з сполук формули (X) реакцією з сполуками формули (XI): де R1, R2, R3, R5 і R6 є такими, що визначені для формули (І), a R17 - як у формулі (А), або є їх захищеними похідними. Υ - галоген, бажано, бром або йод. Реакцію бажано . проводити в умовах реакції Бухвальда з використанням каталізу паладієм. Бажано використовувати Pd2(dba)3 з BINAP як лігандом. Реакцію проводять у толуолі у присутності основи, наприклад, третичному бутоксиді натрію при 110°С. Естерну групу R17 потім гідролізують, як це було описано. Сполуки формули (І) можна також приготувати з сполук формули (X) реакцією з сполукою формули (XII): де R1, R2, R3, R5, і R6 є такими, що визначені для формули (І), a R17 - для формули (А) або є їх захищеними похідними. Υ - галоген, бажано, бром або йод. Реакцію бажано проводити в умовах реакції з'єднання Сузуки, з використанням каталізу паладієм, а саме Pd(PPh3)4. Реакцію проводять в етанолі і толуолі у присутності основи, наприклад, гідрокарбонаті натрію під зворотним холодильником. Естерну групу R17 потім гідролізують, як це було описано. Сполуки формули (X) отримують з сполук формули (II) реакцією з сполукою формули (А), як це було описано. Сполуки формули (XI) і (XII) є комерційно доступними або можуть бути приготовлені відомими методами. Певні сполуки формул (II), (VI), (VIII) і (X) можна вважати новими, які утворюють подальший аспект винаходу. Ще одним аспектом винаходу є сполука формули (ІА), яка є підкласом формули (І): (IA) де R1 і R2 є незалежно гідрогеном, галогеном, CN, аміногрупою, нітрогрупою, Сі. 6алкілом, C1-6алкоксилом, SO2C1-6алкілом, CONR4R5, де R4 і R5 є незалежно гідрогеном або C1-6алкілом; і R3 - феніл або гетероарил і кожна з цих груп, як варіант, заміщена одним або більше замісниками, вибраними серед галогену, C1-6алкілу, C1-6алкокси, SO2C1-6алкілу, CN, аміногрупи або CONR4R5, де R4 і R5 є незалежно гідрогеном або C1-6алкілом, і їх фармацевтично прийнятні солі. Подальшим аспектом винаходу є використання сполуки формули (І), її проліків, фармацевтично прийнятної солі або сольвату у терапії. Сполуки формули (І) є активними фармацевтичними препаратами, зокрема, модуляторами активності рецептора CRTh2, і можуть бути використані у лікуванні (терапевтичному або профілактичному) станів/захворювань людини і інших тварин, з ускладненнями або таких, що спричинені надмірним або неконтрольованим продукуванням PGDa і його метаболітами. Приклади таких станів/захворювань включають: (1) (респіраторні шляхи) Обструктивні хвороби дихальних шляхів, включаючи: астму (зокрема, бронхіальну, алергічну, внутрішню, зовнішню і пилову, хронічну або стійку (наприклад, застарілу астму і надчутливість дихальних шляхів)); хронічну обструктивну легеневу хворобу (ХОЛХ) (наприклад, незворотну ХОЛХ); бронхіт (включаючи еозинофільний); гострий, алергічний, атрофічний риніт або хронічний риніт (наприклад, творожистий риніт, гіпертрофічний риніт, гнійний риніт, сикативний риніт), медикаментозний риніт, мембранний риніт (включаючи крупозний, фібринозний і псевдомембранний риніт), золотушний риніт, постійний алергічний риніт, еозонофільний риніт (включаючи нервовий риніт (сінна пропасниця) і вазомоторний риніт); носові поліпи; саркоїдоз; хвороби, пов'язані з фермерськими легенями; фіброїдні легені; ідіопатичну внутрішньотканинну пневмонію; фіброз яєчника; протикашлеву активність; лікування хронічного кашлю, викликаного запаленням або ятрогенного; (2) (кістки і суглоби) артрити, включаючи ревматичний, інфекційний, аутоімунний, серонегативний, спондилоартропатії (наприклад, анкілозний спондиліт, псоріазний артрит і хвороба Рейтера), хвороба Бесе, синдром Сйоргена і системний склероз; (3) (шкіра і очі) псоріаз, атопікальний дерматит, контактний дерматит, інші екзематичні дерматити, себорейний дерматит, Lichen planus, пемфігус, бульйозний пемфігус, бульйозний епідермолізис, кропивниця, ангіодерми, васкуліти, еритеми, шкірні еозинофілії, хронічні шкірні виразки, увеліт, виразкове ареатакомне облисіння і весінній кон'юнктивіт; (4) (шлунково-кишечний такт) коеліатична хвороба, проктит, еозинофільний гастроентерит, мастоцитоз, хвороба Крона, виразковий коліт, хвороба подразненого кишечнику; харчові алергії з дією, віддаленою від кишечнику (наприклад, мігрень, риніт і екзема); (5) (центральна і периферійна нервові системи) нейродегенеративні хвороби і розлади слабоумства (наприклад, хвороба Альцгеймера, аміотропічний латеральний склероз і інші нейромоторні хвороби, хвороба Кройцфельда-Якоба і інші пріонні хвороби, викликана ВІЛ енцефалопатія (комплекс слабоумства СНІД), хвороба Хантингтона, лобно-скронне слабоумство, тілесне слабоумство Леві і васкулярне слабоумство), полінейропатії (наприклад, синдром Плена-Бара, хронічна запальна демієлінативна полірадикулонейропатія, мультифокальна моторна нейропатія), плексопатії, деміелінація ЦНС (наприклад, множинний склероз, гострий розсіяний/геморагічний енцефаломієліт і субгострий склеротичний паненцефаліт), нейром'язові розлади (наприклад, міастенія і синдром Ламберта-Ітона), спінальні розлади (наприклад, тропічний спазматичний парапарез і синдром гордовитості), паранеопластичні синдроми (наприклад, мозочкова дегенерація і енцефаломієліт), травма ЦНС, мігрень і інсульт. (6) (інші тканинні і системні хвороби) набутий атеросклероз, СНІД, еритематозна волчанка; системна волчанка, еритематоз; тироїдит Хашімото, діабет типу І, нефротичний синдром, еозинофілія fascitis, синдром гіпер-lgE, лепроматозна проказа, ідіопатична тромбоцитопенія pupura; післяопераційні адгезії, сепсис і ішемічно-реперфузійна травма серця, мозку, периферичний гепатит (алкоголічний гепатит, стеатогепатит і хронічна вірусна хвороба), гломерулонефрит, ниркова недостатність, хронічна ниркова недостатність і і хвороби інших органів. (7) (відторгнення аллотрансплантату) гостре і хронічне, після, наприклад, трансплантації нирки, серця, печінки, легені, кісткового мозку, шкіри і роговиці; і хронічна хвороба несприяття трансплантату; (8) хвороби, пов'язані з підвищеним рівнем PGDi або його метаболітів. Отже, винахід пропонує сполуку формули (І) або її фармацевтично прийнятну сіль або сольват для використання у терапії. Бажано використовувати сполуки винаходу для лікування хвороб, при яких рецептор хемокіну належить до субродини рецептора CRTh2. Конкретними станами, які можуть лікувати сполуки винаходу, є астма, риніт і інші хвороби, пов'язані з підвищеним рівнем PGDa або його метаболітів. Сполуки винаходу бажано використовувати для лікування астми. Згідно з подальшим аспектом, винахід пропонує визначену вище сполуку формули (І) або її фармацевтично прийнятну сіль або сольват, для виготовлення медикаменту, призначеного для терапії. Згідно з іншим аспектом, винахід пропонує визначену вище сполуку формули (І) або її фармацевтично прийнятну сіль або сольват, для виготовлення медикаменту, призначеного для терапії у комбінації з ліками, що використовується для лікування астми і риніту (наприклад, інгаляційними і оральними стероїдами, інгаляційними агоністами β2-рецептора і оральними антагоністами рецептора лейкотрієну). Згідно з іншим аспектом, винахід пропонує визначену вище сполуку формули (І) або її фармацевтично прийнятну сіль або сольват, для виготовлення медикаменту, призначеного для лікування людських хвороб або станів, при яких сприятливою є модуляція активності рецептора CRTh2. У цьому описі термін "терапія" включає також "профілактику" якщо не зазначено протилежне. Терміни "терапевтичний" і "терапевтично" визначаються відповідним чином. Винахід також включає спосіб лікування хвороб, опосередкованих PGD2 або його метаболітами, коли простаноїд зв'язується з його (зокрема, CRTh2) рецептором, який включає введення пацієнту терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, сольвату або проліків, як це було визначено вище. Винахід також включає спосіб лікування запальних хвороб, зокрема, псоріазу, у пацієнтів, що страждають від нього або ризикують захворіти цією хворобою, який включає введення пацієнту терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, сольвату або проліків, як це було визначено вище. При такому терапевтичному використанні доза, що має бути введена, варіюється залежно від використаної сполуки, способу введення, бажаного лікування і розладу. Сполуки формули (І) її фармацевтично прийнятні солі, сольвати і проліки можна використовувати як такі, але звичайно їх краще вводити у формі фармацевтичної композиції, в якій сполука формули (І)/сіль/сольват (активний інгредієнт) знаходиться разом з фармацевтично прийнятними наповнювачем, розріджувачем або носієм. Залежно від способу введення пацієнту фармацевтична композиція, бажано, включає від 0,05 до 99% (за масою), більш бажано, від 0,05 до 80% (за масою), краще від 0,10 до 70% (за масою), найкраще від 0,10 до 50% (за масою) активного інгредієнта (від повної маси композиції). Винахід також включає фармацевтичну композицію, яка містить сполуку формули (І) або її фармацевтично прийнятну сіль або сольват, як це було визначено вище, разом з фармацевтично прийнятними наповнювачем, розріджувачем або носієм. Фармацевтичні композиції можна вводити локально (наприклад, у легені і/або легеневі шляхи або у шкіру) у формі розчинів, суспензій, гептафлуоралканових аерозольних і сухих порошкових композицій; або системно, наприклад, оральним введенням у вигляді таблеток, капсул, сиропів, порошків і гранул, або парентеральним введенням у формі розчинів або суспензій, або підшкірним введенням або ректальним введення супозиторіями або трансдермально. Бажаним способом введення сполук винаходу є оральний. Винахід також включає фармацевтичну композицію, яка містить сполуку формули (І) або її фармацевтично прийнятну сіль або сольват, як це було визначено вище, разом з фармацевтично прийнятним наповнювачем, розріджувачем або носієм. Далі винахід ілюструється необмежуючими прикладами, в яких (якщо не зазначено інше): (і) назви і субназви сполук у прикладах узгоджені з програмою LAb./Name ACD (версія 6,0) від Advanced Chemical Development Inc, Canada; (ii) якщо не зазначено інше, зворотно-фазова РХВР (рідинна хроматографія високого розрізнення) виконується з використанням зворотно-фазової кремнеземної колонки Symmetry, NovaPak або Ex-Terra; (ііі) колонна флеш-хроматографія є нормально-фазовою кремнеземною хроматографією; (iv) розчинники висушують з МnSO2 або Na2SO4 (ν) випарювання виконують роторним випарюванням у вакуумі з завершуючими процедурами після видалення залишкової твердої речовини, наприклад, висушуючих агентів, фільтруванням; (vi) якщо не зазначено інше, операції проводять при зовнішній температурі, тобто при 18-25°C і в атмосфері інертного газу, наприклад, аргону або нітрогену; (vii) вихід реакції наведений лише для ілюстрації і не обов'язково є максимально можливим; (viii) структури кінцевих продуктів формули (1) підтверджуються ЯМР (звичайно протонним) і масспектрографією; значення хімічних зсувів протонного магнітного резонансу виміряють згідно з дельта-шкалою і множинність піків позначеною - синглет; d - дублет; t - триплет; m - мультиплет; br - широкий; q - квартет, quin квінтет; (іх) інтермедіатам не надається повна характеризація і їх чистоту оцінюють тонкошаровою хроматографією (ТШХ), РХВР, мас-спектрометрією (MS), інфрачервоним (IR) або ЯМР-аналізом; (x) мас-спектр (MS): надаються лише іони, які вказують основну масу, дані 1Н ЯМР наведено у формі дельта-значень для головних діагностичних протонів, у 1/млн (часток на млн) відносно тетраметилсилану (ТМС) як внутрішнього стандарту; (хі) абревіатури: ЕtOАс ДМФ NMP ТГФ RT етилацетат Ν,Ν-диметилформамід N-метилпіролідон тетрагідрофуран кімнатна температура ТФК трифлуороцтова кислота Приклад 1.3-[(4-хлорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота і) етиловий естер 3-[(4-хлорфеніл)тіо1-2,5-диметил-1Н-індол-1-оцтової кислоти З перемішуванням 3-[(4-хлорфеніл)тіо]-2,5-диметил-1Н-індолу (300мг) у сухому ДМФ (15мл) обробляють гідридом натрію (42мг 60%-ї дисперсії у мінеральному маслі). Через 10хвил. реакцію обробляють етилбромацетатом (116мкл) і перемішування продовжують ще 24год. Реакцію вливають у дистильовану воду (200мл) і екстрагують діетилетером (3´100мл). Екстракти сушать (MgSO4), випарюють in vacua і залишок очищають колонною флеш-хроматографією з елюентом 10% етилацетату у ізогексані. Проміжну сполуку отримують як жовту тверду речовину (вихід 130мг). 1 Н ЯМР CDCI 3: δ (1Н, m), 7,17-7,03 (4Н, m), 6,94 (2Н, m), 4,85 (2Н, s), 4,22 (2Н, q), 2,46 (3Н, s), 2,40 (3H, s), 1,26 (3H,t). іі) 3-[(4-хлорфеніл)тіо]-2,5-диметил-1Η-індол-1-оцтова кислота Розчин сполуки з операції (і) (120мг) в етанолі (5мл) обробляють водою (5мл) і 2.5N розчином гідроксиду натрію (1мл). Одержану суспензію перемішують при 70°С протягом 1год. і етанол видаляють in vacua. Водний залишок підкислюють 2N гідрохлорною кислотою і осад відфільтровують і концентрують in vacua, одержуючи бажану сполуку як білувату тверду речовину (вихід 102мг). 1 Н ЯМР d6-DMSO: δ 13,12 (1Н, br s), 7,41 (1H, d), 7,27 (1H, m), 7,24 (1H, m), 7,15 (1H, m), 7,01-6,94 (3Н, m), 5,08 (2H, s), 2,39 (3H, s), 2,34 (3H, s). Точка плавл. 219-221°С Приклади 2-10 є прикладами сполук формули (І) і виконуються згідно з такою загальною процедурою: До розчину відповідного арилтіолу (1г) у ДХМ (15мл) додають триетиламін (1 молярний еквівалент) і потім 1-хлорацетон (1 молярний еквівалент). Реакцію перемішують 2год., потім промивають водою, сушать (MgSO4), фільтрують, і випарюють. До цього продукту додають 1-(4-метилфеніл)гідразингідрохлорид (1 молярний еквівалент) і оцтову кислоту (15мл). Реакцію підігрівають при 70°С протягом 5год.. Випарювання розчинника і очищення зворотно-фазовою РХВР (з градієнтною елюентною системою (25% ΜeCN/NH3(водн.) (0,1%) до 95% ΜeCN/NH3(водн.) (0,1%)) дає такі інтермедіати: Таблиця 1 Інтермедіат (і) (іі) (ііі) (iv) (v) (vi) (vii) (viii) (іх) Назва 3-[(2-хлор-4-флуорфеніл)тіо]-2,5-диметил-1Н-індол 3-[(3-хлор-4-флуорфеніл)тіо]-2,5-диметил-1Н-індол 3-[(2-метоксифеніл)тіо]-2,5-диметил-1Н-індол 3-[(3-флуорфеніл)тіо]-2,5-диметил-1Н-індол 3-[(4-етилфеніл)тіо]-2,5-диметил-1Н-індол 3-[(2-хлорфеніл)тіо]-2,5-диметил-1Н-індол 3-[(2,5-дихлорфеніл)тіо]-2,5-диметил-1Н-індол 3-[(4-флуорфеніл)тіо]-2,5-диметил-1Н-індол 3-[(4-хлор-2-метилфеніл)тіо]-2,5-диметил-1Н-індол MS: ES(-ve)(M-H) 304 304 282 270 280 286 320 270 300 Ці інтермедіати потім N-алкілюють і естер гідролізують, як у Прикладі 1. Це дає Приклади 2-10. Таблиця 2 Приклад 2 3 4 5 6 7 8 9 10 Назва 3-[(2-хлор-4-флуорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота 3-[(3-хлор-4-флуорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота 3-[(2-метоксифеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота 3-[(3-флуорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота 3-[(4-етилфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота 3-[(2-хлорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота 3-[(2,5-дихлорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота 3-[(4-флуорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота 3-[(4-хлор-2-метилфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтова кислота MS: ES(-ve)(M-H) 362 362 340 328 338 344 378 328 358 Приклад 11. 3-[(4-хлорфеніл)тіо]-4-ціано-2,5-диметил-1H-індол-1-оцтова кислота і) 3-[(4-хлорфеніл)тіо]-2.5-диметил-1Н-індол-4-карбонітрил З перемішуванням розчин 1-[(4-хлорфеніл)тіо]-ацетону (6,14г) у сухому ДХМ (150мл) при -78°С обробляють сульфурилхлоридом (2,25мл). Через 30хвил. протягом 30хвил. краплями додають розчин N,N,N',N'-тетраметил-1,8-нафталіндіаміну (6,01г) і 5-аміно-2-хлорбензонітрилу (3,89г) у сухому ДХМ (80мл). Суміш перемішують ще 2год., після чого . додають триетиламін (4,26мл) і реакцію залишають досягти кімнатної температури. Реакційну суміш розбавляють ДХМ (200мл), промивають водою, 1N НСІ і розсолом. Органічну фазу сушать (MgSO4), випарюють in vacua і залишок очищають колонною флеш-хроматографією з елюентом ізогексан і етилацетат (1: 1), і одержують проміжну сполуку (1г), 1 Н ЯМР CDCI 3: δ 12,52 (s,1H), 7,74 (d, 1H), 7,38 (dd, 1H), 7,29 (m, 2H), 6,97 (m, 2H), 3,29 (s,3H). Був також отриманий регіоізомер, 5-хлор-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-6-карбонітрил (600мг). 1 Н ЯМР CDCI 3: δ 8,68 (1Н, s), 7,69 (1Н, s), 7,61 (1Н, s), 7,15 (2Н, dt), 6,91 (2Н, dt), 2,57 (3H, s). іі) метиловий естер 3-[(4-хлорфеніл)тіо]-4-ціано-2,5-диметил-1Н-індол-1-оцтової кислоти З перемішуванням до розчину гідриду натрію (96,1мг, 60%-на дисперсія у мінеральному маслі) у сухому ТГФ (15мл) додають 3-[(4-хлорфеніл)тіо]-2,5-диметил-1Н-індол-4-карбонітрил (400мг) у сухому ТГФ (5мл). Через 30хвил. реакцію обробляють метилбромацетатом (177мкл) і перемішування продовжують ще 4год. Розчинник видаляють in vacua, залишок розчиняють в етилацетаті, промивають водою, розсолом, сушать (MgSO4), випарюють in vacua і залишок очищають колонною флеш-хроматографією з елюентом суміш 1: 1 етилацетат/ізогексан. Проміжну сполуку отримують як жовту тверду речовину (360мг). 1 Н ЯМР CDCI 3: δ 7,37 (1Н, d), 7,30 (1Н, d), 7,18-7,13 (2Н, m), 7,00-6,96 (2Н, m), 4,92 (2Н, s), 3,80 (3Н, s), 2,55 (3Н, s). ііі) 3-[(4-хлорфеніл)тіо]-4-ціано-2.5-диметил-1Н-індол-1-оцтова кислота Продукт операції іі) (0,1г) розчиняють у ТГФ (5мл) і NaOH (200мкл, розчин 1,25М). Через 3год. додають ще NaOH (200мкл, розчин 1.25М) і реакційну суміш перемішують протягом ночі при кімнатній температурі. Реакційну суміш концентрують in vacua і залишок розчиняють у воді. Розчин підкислюють розбавленою НСІ. Осад фільтрують і одержують бажану сполуку як білу тверду речовину (86мг). 1 Н ЯМР DMSO: δ 7,99 (1Н, d), 7,47 (1Н, d), 7,38 (2Н. dt), 7,3 (2Н, dt), 6,98 (2Н, dt), 5,25 (2H, s), 2,49 (3H, s). MS: APCI+[M+H] 390 Точка плавл. 237-238°С Приклад 12.5-хлор-3-[(4-хлорфеніл)тіо]-6-ціано-2-метил-1Н-індол-1-оцтова кислота і) метиловий естер 5-хлор-3-[(4-хлорфеніл)тіо]-6-ціано-2-метил-1Н-індол-1-оцтової кислоти Цю сполуку приготовляють, як у Прикладі 11, іі), використовуючи продукт Прикладу 11, і). іі) 5-хлор-3-[(4-хлорфеніл)тіо]-6-ціано-2-метил-1Н-індол-1-оцтова кислота Цю сполуку приготовляють, як у Прикладі 11, ііі), використовуючи продукт і). 1 Н ЯМР DMSO: δ 8,42 (1Н, s), 7,59 (1Н, s), 7,3 (2Н, dt), 6,99 (2Н, dt), 5,24 (2Н, s), 2,46 (3Н, s). Приклад 13. 3-[(4-хлорфеніл)тіол-4-(етилсульфоніл)-7-метокси-2-метил-1Н-індол-1-оцтова кислота і) 3-[(4-хлорфеніл)тіо]-4-(етилсульфоніл)-7-метокси-2-метил-1Н-індол Цю сполуку приготовляють, як у Прикладі 11, і), з 3-аміно-4-метоксифенілетил-сульфону. 1 Н ЯМР CDCI 3: δ 9,00 (1Н, s), 7,91 (1Н, d), 7,12 (2Н, dd), 6,86 (2Н, m), 6,73 (1Н, d), 4,05 (3Н, s), 4,05 (3Н, s), 3,46 (2Н, q), 2,46 (3Н, s) і 1,16 (3Н, t). іі) метиловий естер 3-[(4-хлорфеніл)тіо]-4-(етилсульФоніл)-7-метокси-2-метил-1Н-індол-1-оцтової кислоти Цю сполуку приготовляють, як у Прикладі 11, іі), з продукту операції і). 1 Н ЯМР CDCI 3: δ 7,92 (1Н, d), 7,13 (2Н. dt), 6,85 (2Н, dt), 6,73 (1Н, d), 5,27 (2Н, s), 3,98 (3Н, s), 3,79 (3Н, s), 3,48 (2Н, q), 2,38 (3Н, s) і 1,18 (3Н, t). ііі) 3-[(4-хлорфеніл)тіо]-4-(етилсульфоніл)-7-метокси-2-метил-1Н-індол-1-оцтова кислота Цю сполуку приготовляють, як у Прикладі 11, ііі), з продукту операції іі). 1 Н ЯМР DMSO: δ 7,72 (1Н, d), 7,24 (2Н, m), 6,96 (1Н, d), 6,86 (2Н, dt), 5,29 (2Н, s), 5,27 (2Н, s), 3,97 (3Н, s), 3,41 (2Н, q), 2,34 (3Н, s) і 1,01 (3Н, t). Приклад 14. 3-[(4-хлорфеніл)тіо]-4-[(діетиламіно)сульфоніл]-7-метокси-2-метил-1Н-індол-1-оцтова кислота і) 3-[(4-хлорфеніл)тіо]-N,N-діетил-7-метокси-2-метил-1Н-індол-4-сульфонамід Цю сполуку приготовляють, як у Прикладі 11, і), з 3-аміно-N,N-діетил-4-метокси-бензолсульфонамід. 1 Н ЯМР CDCI 3: δ 7,80 (1Н, d), 7,88 (1Н, s), 7,08 (2Н, d), 6,85 (2Н, d), 6,66 (1Н, d), 4,04 (3Н, s), 3,25 (4Н, q), 3,79 (3Н, s), 2,43 (3Н, s) і 0,98 (6Н, t). іі) метиловий естер 3-[(4-хлорфеніл)тіо]-4-[(діетиламіно)сульфоніл]-7-метокси-2-метил-1Н-індол-1-оцтової кислоти Цю сполуку приготовляють, як у Прикладі 11, іі), з продукту операції і) і використовують без очищення. ііі) 3-[(4-хлорфеніл)тіо]-4-[(діетиламіно)сульфонал]-7-метокси-2-метил-1Н-індол-1-оцтова кислота Цю сполуку приготовляють, як у Прикладі 11, ііі), з продукту операції іі). Точка плавл. 247-249°С 1 Н ЯМР DMSO: δ 7,56 (1Н, d), 7,18 (2Н, dt), 6,85-6,79 (3Н, m), 5,13 (2Н, s), 3,94 (3Н, s), 3,14 (4Н, q), 2,29 (3Н, s) і 0,88 (6Н, t). Приклад 15. 4-хлор-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота і) 4-хлор-3-[4(-хлорфеніл)тіо]-2-метил-1Н-індол До суспензії (3-хлорфеніл)-гідразингідрохлориду (2г) в оцтовій кислоті (30мл) додають 1-[(4-хлорфеніл)тіо]ацетон (2,24г), ацетонітрил (20мл) і воду (10мл). Суміш перемішують при кімнатній температурі протягом ночі. Реакційну суміш концентрують in vacuo і залишок суспендують в ЕtOАс, промивають розчином гідрокарбонату натрію, розсолом, сушать (MgSO4) і концентрують in vacuo. Залишок розчиняють в оцтовій кислоті (20мл) і підігрівають при 80°С протягом ночі. Реакційну суміш вливають у воду, підлужують доданням NaOH і органіку екстрагують в ЕtOАс. ЕtOАс промивають розсолом, сушать (MgSO4) і концентрують in vacuo. Очищення колонною флеш-хроматографією (елюент 10% ЕtOАс/гексан) дає проміжну сполуку (0,816г). 1 Н ЯМР CDCI 3: δ 8,38 (s, 1H), 7,27-7,23 (m, 1H), 7,14-7,07 (m, 4H), 6,96 (dt, 2H), 2,52 (s, 3H). іі) метиловий естер 4-хлор-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтової кислоти До розчину продукту і) (0,2г) у ТГФ (5мл) додають 1,0М розчин біс(триметилсиліл)аміду натрію у ТГФ (0,65мл). Суміш перемішують 30хвил. і потім додають метилбромацетат (62мкл), реакцію перемішують при кімнатній температурі протягом ночі. До суміші додають ще 0,3мл 1,0М розчину біс(триметилсиліл)аміду натрію у ТГФ і 30мкл метилбромацетату і перемішують ще 3год.. Суміш очищають колонною флешхроматографією (елюент 14% ЕtOАс/гексан) і одержують проміжну сполуку (0,21г). 1 Н ЯМР CDCI 3: δ 7,17-7,11 (m, 5Н), 6,95 (dt, 2Н), 4,89 (s, 2Н), 3,78 (s, 3Н), 2,49 (s, 3Н). ііі) 4-хлор-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота До розчину продукту (іі) (0,11г) у ТГФ (5мл) додають 1.25М розчин NaOH (водн.) (0,25мл). Реакцію перемішують протягом ночі при кімнатній температурі. Реакційну суміш концентрують in vacuo і залишок розчиняють/суспендують у воді. рН доводять до 2 доданням розбавленої НСІ (водн.) і органіку екстрагують в ЕtOАс, промивають розсолом, сушать над MgSO4 і концентрують in vacuo. Залишок очищають екстрагуванням твердої фази, використовуючи розчинник NH2 (2г), з елюентом ацетонітрилом і потім 10% трифлуороцтової кислоти/ацетонітрил, і одержують бажану сполуку (0,06г). 1 Н ЯМР CDCI 3: δ 7,54 (dd, 1H), 7,27 (dt, 2H), 7,14 (d, 1H), 7,08 (dd, 1H), 6,95 (dt, 2H), 5,16 (s, 2H),2,43 (s, 3H) MS: APCI-[M-H] 364 Точка плавл. 184-187°С Приклад 16. 5-хлор-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота і) 5-хлор-3-[4(-хлорфеніл)тіо]-2-метил-1Н-індол Цю сполуку приготовляють, як у Прикладі 15, (i), використовуючи (4-хлорфеніл)-гідразингідрохлорид. Продукт очищають колонною флеш-хроматографією (20% EtOAc/гексан як елюент). 1 Н ЯМР CDCI 3: δ 8,31 (s, 1Н), 7,48 (d, 1Н), 7,26 (m, 2Н), 7,13 (m, 3Н), 6,93 (m, 2H), 2,51 (s, 3H). іі) метиловий естер 5-хлор-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтової кислоти Цю сполуку приготовляють, як у Прикладі 15, (іі), використовуючи продукт (і). 1 Н ЯМР CDCI 3: δ 7,52 (d,1H), 7,27 (d, 1H), 7,20-7,10 (m, 3Н), 6,97-6,89 (m, 2H), 4,80 (d, 2H), 3,79 (d, 3Н), 2,47 (d, 3Н). iii) 5-хлор-3-[(4-хлорфеніл)тіо]-2-метил-1Η-індол-1-оцтова кислота До розчину продукту (іі) (0,11г) у ТГФ (5мл) додають 1,25Μ розчин NaOH (водн.) (0,25мл). Реакцію перемішують протягом ночі при кімнатній температурі. Реакційну суміш концентрують in vacua і залишок розчиняють/suspended у воді. рН коригують до 2 використовуючи розбавлену НСІ (водн.), твердий осад ізолюють фільмуванням і сушать у вакуумі при 40°С, одержуючи бажану сполуку . 1 Н ЯМР CDCI 3: δ 7,60 (d, 1Н), 7,32-7,26 (m, 3Н), 7,19 (dd, 1Н), 6,98 (dt, 2Н), 5,15 (s, 2Н), 2,42 (s, 3Н). MS: APCI-[M-H] 364 Точка плавл. (розкл.) >211°С Приклад 17. 6-хлор-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота і) 6-хлор-3-[4(-хлорфеніл)тіо]-2-метил-1Н-індол Цю сполуку приготовляють, як у Прикладі 15, (і). 1 Н ЯМР CDCI 3: δ 8,27 (s, 2Н), 7,39 (d, 1Н), 7,34 (d, 1Н), 7,10 (m, 3Н), 6,92 (m, 2H), 2,50 (s, 3Н). іі) метиловий естер 6-хлор-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтової кислоти Цю сполуку приготовляють, як у Прикладі 15, (іі), використовуючи продукт (і). 1 Н ЯМР CDCI 3: δ 7,43 (d, 1Н), 7,27-7,25 (m, 1 Η), 7,14-7,09 (m, 3Н), 6,92 (dd, 2H), 4,85 (s, 2Н), 3,80 (d, 3Н), 2,46 (d, 3Н). iii) 6-хлор-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота Цю сполуку приготовляють, як у Прикладі 16, (ііі), використовуючи продукт (іі). 1 Н ЯМР CDCI 3: δ 7,71 (d, 1H), 7,33 (d, 1H), 7,26 (dt, 2H), 7,09 (dd, 1H), 6,96 (dt, 2H), 5,08 (s, 2Н), 2,40 (s, 3Н). MS: APCI-[M-H] 364 Точка плавл. (розкл.) >189°С Приклад 18. 7-хлор-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота і) 7-хлор-3-[4(-хлорфеніл)тіо]-2-метил-1Н-індол Цю сполуку приготовляють, як у Прикладі 15 (і), використовуючи (2-хлорфеніл)-гідразингідрохлорид. Продукт очищають колонною флеш-хроматографією (14% ЕtOАс/гексан як елюент). 1 Н ЯМР CDCI 3: δ 8,48 (s 1H) 7,40 (d, 1H), 7,19 (m, 1H) 7,13-7,11 (m, 2Н), 7,06 (t, 1H), 6,96-6,92 (m, 2Н), 2,55 (s, 3Н). іі) метиловий естер 7-хлор-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтової кислоти Цю сполуку приготовляють, як у Прикладі 15 (іі), використовуючи продукт (і). 1 Н ЯМР CDCI 3: δ 7,44 (d, 1Н), 7,18-7,09 (m, 3Н), 7,03 (td, 1Н), 6,92 (dd, 2Н), 5,37 (2Н, d), 3,81 (3Н, d), 2,46 (3Н, d) ііі) 7-хлор-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота Цю сполуку приготовляють, як у Прикладі 16 (ііі), використовуючи продукт (іі). 1 Н ЯМР DMSO δ 7,35 (dd, 1Н), 7,28 (dt, 2Н), 7,20 (dd, 1Н), 7,07 (t, 1Н). 6,98 (dt, 2Н), 5,36 (s, 2Н), 2,45 (s, 3Н). MS: АРСІ- [М-Н] 364 Точка плавл. (розкл.) >207°С Приклад 19. 3-[(4-хлорфеніл)тіо]-2-метил-5-(метилсульфоніл)-1Н-індол-1-оцтова кислота і) 3-[(4-хлорфеніл)тіо]-2-метил-5-(метилсульфоніл)-1Н-індол Цю сполуку приготовляють, як у Прикладі 11 і), з 4-метилсульфоніланілінгідрохлориду. 1 Н ЯМР CDCI 3: δ 8.1S (1Н, s), 8,16 (1H,d), 7,74 (1Н, dd), 7,47 (1Н, d), 7,13 (2Н, dt), 6,92 (2Н, dt), 3,06 (3Н, s), 2,55 (3Н, s). іі) метиловий естер 3-[(4-хлорфеніл)тіо]-2-метил-5-(метилсульфоніл)-1Н-індол-1-оцтової кислоти Цю сполуку приготовляють, як у Прикладі 11 іі), з продукту операції і). 1 Н ЯМР CDCI3: δ 8,20 (1Н, d), 7,79 (1Н, dd), 7,38 (1Н, d), 7,14 (1Н, dd), 6,92 (2Н, dd), 4,96 (2H, s), 3,79 (3Н, d), 2,52 (3Н, s). ііі) 3-[(4-хлорфеніл)тіо]-2-метил-5-(метилсульфоніл)-1Н-індол-1-оцтова кислота Продукт іі) (190мг) обробляють метанолом (10мл), LiOH (18,9мг) і водою (2мл). Реакційну суміш перемішують 4год., концентрують in vacua, залишок розчиняють у воді, підкислюють НСІ і одержують бажану сполуку як білу тверду речовину, 44мг. 1 Н ЯМР CDCI3: δ 8,19 (1Н, d), 7,79 (1Н, dd), 7,39 (1Н, d), 7,13 (1Н, dd), 6,91 (2Н, dd), 4,98 (2H, s), 3,04 (3Н, s), 2,53 (3Н, s). Точка плавл. 185-187°С. Приклад 20. 2,5-диметил-3-[[4-(метилсульфоніл)феніл]тіо]-1Н-індол-1-оцтова кислота і) 3-[(4-хлорфеніл)тіо]-2-метил-4-(метилсульфоніл)-1Н-індол і 3-[(4-хлорфеніл)тіо]-2-метил-6-(метилсульфоніл)-1Н-індол Цю сполуку приготовляють, як у Прикладі 19 і) з 3-(метилсульфоніл)анілінгідрохлориду і отримують суміш 3-[(4-хлорфеніл)тіо]-2-метил-6-(метилсульфоніл)-1Η-індолу і 3-[(4-хлорфеніл)тіо]-2-метил-4-(метилсульфоніл)1Н-індолу, яку очищають кремнеземною флеш-хроматографією з 50% ЕtOАс/гексан як елюентом. Це дає бажаний продукт: 1 Н ЯМР DMSO: δ 7,77 (2Н, ddd), 7,33 (2Н, t), 7,24 (2Н, dt), 6,87 (2Н, dt), 3,32 (3Н, s), 2,40 (3Н, s). Крім того, ізольовано 3-[(4-хлорфеніл)тіо]-2-метил-6-(метилсульфоніл)-1Н-індол. Цей ізомер використано у Прикладі 2, step і). 1 Н ЯМР DMSO: δ 12,30 (1Η, s), 7,93 (1 Η, d), 7,50-7,59 (2H, m), 7,27 (2H, dd), 6,95-7 (2H, m), 3,19 (3H, s), 2,52 (3H, s). іі) 2,5-диметил-3-[[4-(метилсульфоніл)феніл]тіо]-1Н-індол-1-оцтова кислота До продукту Прикладу 21 і) (0,28г) розчиненого у ТГФ (5мл), додають NaH (63мг, 60%-а дисперсія у маслі) і реакцію залишають перемішуватись на 10хвил. Додають етилбромацетат (0,13мл) і реакцію залишають перемішуватись на 3год. Додають ЕtOН (2мл) і NaOH (2мл, 10% водн.) і реакцію залишають перемішуватись на 30хвил. Випарювання ЕtOН з подальшим доданням НСІ (1М) дає білий осад, який фільтрують і промивають діетилетером, одержуючи бажаний продукт як тверду речовину (0,351г). 1 Н ЯМР DMSO: δ 13,33 (1Н, s), 8,02 (1Н, dd), 7,81 (1Н, dd), 7,40 (1Н, t), 7,24 (2Н, dt), 6,89 (2Н, dt), 5,29 (2Н, s), 3,32 (3Н, s), 2,39 (3Н, s). MS: APCI+ [M+DMSO] 488 Приклад 21. 2-метил-3-[(4-метилФеніл)тіо]-6-(метилсульфоніл)-1Н-індол-1-оцтова кислота і) етиловий естер 2-метил-3-[(4-метилфеніл)тіо]-6-(метилсульфоніл)-1Н-індол-1-оцтової кислоти З перемішуванням до розчину гідриду натрію (45мг 60%-ї дисперсії у мінеральному маслі) у сухому ТГФ (10мл) додають 3-[(4-хлорфеніл)тіо]-2-метил-6-(метилсульфоніл)-1Н-індол (160мг) (продукт Прикладу 20, і). Через 30хвил. реакцію обробляють етилбромацетатом (78мкл) і перемішування продовжують 1год. Реакцію гасять етанолом, розчинник видаляють in vacua, залишок розчиняють в етилацетаті, промивають водою, сушать (MgSO4) і випарюють in vacua, залишок очищають колонною флеш-хроматографією з елюентом 30% етилацетату і ізогексан у суміші. Проміжну сполуку отримуютьяк білу тверду речовину (180мг). MS: ES+[M+H] 438. іі) 2-метил-3-[(4-метилфеніл)тіо]-6-(метилсульФоніл)-1Н-індол-1-оцтова кислота Продукт операції іі) (180мг), розчиняють в етанолі (5мл) і додають NaOH (1мл 10%-го розчину). Через 1год. реакційну суміш концентрують in vacua і залишок розчиняють у воді. Розчин підкислюють водною НСІ (1М) і екстрагують етилацетатом, промивають водою, сушать (MgSO4) і випарюють in vacua. Продукт очищають використовуючи NН2-смолу (0,5г) у MeCN і вивільняють 5%-ю оцтовою кислотою/MeCN, одержуючи 30мг продукту у вигляді білої твердої речовини. 1 Н ЯМР DMSO: δ 8,11 (1Н, s), 7,50-7,62 (2Н, m), 7,24-7,29 (2Н, m), 6,98 (2Н, dd), 4,96 . (2Н, s), 3,21 (3Н, s), 2,48 (3Н, s). MS: APCI+[M+DMSO] 488. Приклад 22. 4-бром-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота і) 4-бром-3-[4(-хлорфеніл)тіо]-2-метил-1Н-індол Цю сполуку приготовляють, як у Прикладі 15 (і), використовуючи (3-бромфеніл)-гідразингідрохлорид. Продукт очищають колонною флеш-хроматографією (10% ЕtOАс/гексан як елюент). 1 Н ЯМР CDCI 3 δ 7,31 (1Н, s), 7,30 (2Н, d), 7,13 (2Н, dt), 7,02 (1Н, t), 6,94 (2Н, dt), 2,52 (3Н, s). іі) 1,1-диметилетиловий естер 4-бром-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтової кислоти Цю сполук приготовляють, як у Прикладі 11 (іі), використовуючи продукт (і) і 1-бутилбромацетат. Продукт очищають колонною флеш-хроматографією (10% ЕtOАс/гексан як елюент). 1 Н ЯМР CDCI 3: δ 7,31 (dd, 1H), 7,21 ( dd, 1H), 7,14-7,10 (m, 2H), 7,05 (t, 1H), 6,94-6,91 (m, 2Н), 4,77 (s, 2Н), 2,49 (s, 3Н), 1,43 (s, 9H). iiі) 4-бром-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота До розчину продукт (іі) (0,09г) у ДХМ (2мл) додають трифлуороцтову кислоту (0,1мл). Реакцію перемішують протягом ночі при кімнатній температурі. Твердий осад ізолюють фільтруванням, промивають гексаном, сушать протягом ночі під вакуумом при 40°С і одержують бажану сполуку (0,025г). 1 Н ЯМР (DMSO) δ 7,59 (dd, 1Н), 7,29-7,25 (m, 3Н), 7,08 (t, 1Н), 6,94 (dt, 2Н), 5,16 (s, 2Н), 2,43 (s, 3Н). MS: APCI+[M+H] 411 Точка плавл. (розкл.) >213°С Приклад 23. 3-[(4-хлорфеніл)тіо]-4-[4-[(1,1-диметилетокси)карбоніл]-1-1-піперазиніл]-2-метил-1Н-індол-1оцтова кислота У суху колбу вносять продукт Прикладу 22, (іі) (1г), N-трет-бутоксикарбонілпіперазин (0,48г), Pd2(dba)3 (3мг), 2,2'-біс(дифенілфосфіно)-1,1'-бінаптил Віnар (10мг) і толуол (5мл). Реакцію підігрівають при 110°С 1год., потім залишають охолонути. Суміш розбавляють ЕtOАс, промивають водою, сушать над MgSO4 і концентрують in vacua. Залишок очищають колонною флеш-хроматографією (елюент 25% ЕtOАс/гексан, потім 50% ЕtOАс/гексан/1%-на оцтова кислота). Для подальшого очищення використовують зворотно-фазову препаративну РХВР (елюент MeCN/NH3 (водн.) ) і одержують бажану сполуку (0,021г). 1 Н ЯМР (DMSO) δ 7,22 (dt, 2H), 7,12 (d, 1H), 7,02 (t, 1H), 6,93 (dt, 2H), 6,66 (d, 1H), 4,57 (s, 2H), 3,33 (s, 4H), 2,79 (s, 4H), 2,36 (s, 3H), 1,39 (s, 9H). MS: APCI+[M+H] 516 Точка плавл. 173°С Приклад 24. 3-[(4-хлорфеніл)тіо]-2-метил-4-(1-піперазиніл)-1Н-індол-1-оцтова кислота і) 1,1-диметилетиловий естер 3-[(4-хлорфеніл)тіо]-4-[4-[(1,1-диметилетокси)карбоніл]-1-піперазиніл]-2метил-1Н-індол-1-оцтової кислоти Цю сполуку приготовляють, як у Прикладі 23. Продукт очищають колонною флеш-хроматографією (елюент 25% ЕtOАс/гексан). 1 Н ЯМР (DMSO) 90°С δ 7,21-7,15 (m, 3Н), 7,08 (t, 1H), 6,92 (d, 2H), 6,72 (d, 1H), 4,99 (s, 2Н), 3,26 (s, 4H), 2,81 (t, 4H), 2,40 (s, 3Н), 1,40 (s, 18H). іі) 3-[(4-хлорфеніл)тіо]-2-метил-4-(1-піперазиніл)-1Н-індол-1-оцтова кислота До розчин продукту (і) (0,34г) у ДХМ (5мл) додають 4М НСІ у діоксані (1,3мл), суміш перемішують при кімнатній температурі протягом ночі. Твердий осад ізолюють фільтруванням, суспендують у ДХМ (20мл) і додають трифлуороцтову кислоту (6мл), і реакцію перемішують ще 18год. Суміш концентрують in vacuo i залишок перетирають з етером, одержуючи тверду речовину, яку сушать протягом ночі при 40°С у вакуумі і одержують бажану сполуку (0,2г). 1 Н ЯМР (DMSO) 90°С δ 7,28-7,20 (m, 3Н), 7,12 (t, 1H), 6,95 (d, 2H), 6,77 (d, 1H), 5,02 (S, 2H), 3,08 (d, 4H), 3,00 (d, 4H), 2,42 (s, 3Н). MS: APCI-[M-H] 414 Точка плавл. (розкл.) >249°С Приклад 25. 5-бром-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота і) 5-бром-3-[4(-хлорфеніл)тіо]-2-метил-1Н-індол Цю сполуку приготовляють, як у Прикладі 15 (і), використовуючи (4-бромфеніл)-гідразингідрохлорид. Продукт очищають колонною флеш-хроматографією (елюент 10% ЕtOАс/гексан). 1 Н ЯМР (CDCI 3) δ 8,31 (s, 1H), 7,64 (d, 1H), 7,28 (dd, 2H), 7,22 (d, 2H), 7,13 (m, 2H), 6,93 (dt, 2H), 2,51 (s, 3Н). MS: APCI+[M+H] 352 іі) 1,1-диметилетиловий естер 5-бром-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтової кислоти Цю сполуку приготовляють, як у Прикладі 11 (іі), використовуючи продукт (і) і t-бутилбромацетат. Продукт очищають колонною флеш-хроматографією (10% ЕtOАс/гексан як елюент). 1 Н ЯМР (DMSO) δ 7,54 (d, 1H), 7,45 (d, 1Н), 7,34-7,25 (m, 3Н), 6,97 (m, 2Н), 5,15 (s, 2Н), 2,41 (s, 3H), 1,41 (s, 9H). Додання етанолу до залишку після випарювання і дає побічний продукт: етиловий естер 5-бром-3-[(4хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтової кислоти після хроматографії. 1 Н ЯМР (DMSO) δ 7,56 (d, 1Н), 7,46 (d, 1Н), 7,34-7,27 (m, 3Н), 6,97 (dd, 2Н), 5,27 (s, 2Н), 4,17 (q, 2Н), 2,41 (s, 3Н), 1,21 (t, 3Н). ііі) натрієва сіль 5-бром-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтової кислоти До розчину побічного продукту (іі) (0,2г) в етанолі (10мл) додають 1М розчин NaOH (водн.) (0,5мл). Реакцію перемішують протягом ночі при кімнатній температурі, потім концентрують у вакуумі і залишок рекристалізують з киплячої води. Тверду речовину ізолюють фільтруванням, сушать протягом ночі при 40°С у вакуумі і одержують бажану сполуку (0,13г). 1 Н ЯМР (DMSO) δ 7,39 (d, 1H), 7,37 (d, 1H), 7,26 (d, 2H), 7,21 (dd, 1H), 6,97 (dt, 2H), 4,47 (s, 2H), 2,38 (s, 3H). Приклад 26. 3-[(4-хлорфеніл)тіо]-2-метил-5-феніл-1Н-індол-1-оцтова кислота і) етиловий естер 3-[(4-хлорфеніл)тіо]-2-метил-5-феніл-1Н-індол-1-оцтової кислоти До розчину продукту Прикладу 25 (іі) (0,5г) в етанолі (0,8мл) і толуолі (3мл) додають 2М розчин карбонату натрію у воді (1,4мл), фенілборну кислоту (0,131г) і тетракіс(трифенілфосфін)паладій(0) (1,2г). Реакцію підігрівають під зворотним холодильником 2год., охолоджують і концентрують in vacuo. Залишок очищають колонною флеш-хроматографією і одержують проміжну сполуку (0,4г), яку використовують в операції (іі) без характеризації. іі) 3-[(4-хлорфеніл)тіо]-2-метил-5-феніл-1Н-індол-1-оцтова кислота Цю сполуку приготовляють, як у Прикладі 26 (ііі). Очищення зворотно-фазовою препаративною РХВР дає бажану сполуку. 1 Н ЯМР (DMSO) δ 7,61-7,53 (4Н, m,), 7,46-7,38 (3Н, m), 7,31-7,22 (3Н, m), 7,01 (2Н, dd), 4,91 (2H, s), 2,42 (3H, s). MS: APCI- [M-H] 406 Приклад 27. 3-[(4-хлорфеніл)тіо]-5-ціано-2-метил-1Н-індол-1-оцтова кислота і) 3-[(4-хлорфеніл)тіо]-5-ціано-2-метил-1Н-індол З перемішуванням до розчину 4-амінобензонітрилу (5г) у ДХМ (150мл), охолодженого до -70°С, краплями протягом 5хвил. додають t-бутилгіпохлорит (4,6г). Реакцію перемішують 10хвил. і потім додають розчин 1-[4хлорфеніл)тіо]-2-пропанону (8,49г) у ДХМ (20мл). Через 1год. додають триетиламін (5,9мл) і реакцію залишають нагрітись до кімнатної температури. Реакцію розбавляють ДХМ, промивають НСІ (водн.), розсолом, сушать над MgSO4 і концентрують у вакуумі, одержуючи коричневу тверду речовину. Очищення рекристалізацією з метанолу дає проміжну сполуку (7,5г). 1 Н ЯМР (CDCI 3) 6 8,61 (s, 1Н), 7,84 (s, 1Н), 7,44 (dd, 1Н), 7,41 (d, 1 Η), 7,19-7,08 (m, 2Η), 6,93 (dd, 2Н), 2,56 (s, 3Н). іі) етиловий естер 3-[(4-хлорфеніл)тіо]-5-ціано-2-метил-1Н-індол-оцтової кислоти Цю сполуку приготовляють, як у Прикладі 11 (іі), використовуючи продукт (і), і використовують без подальшої характеризації в опер. (ііі). ііі) 3-[(4-хлорфеніл Угіо1-5-ціано-2-метил-1Н-індол-1-оцтова кислота Цю сполуку приготовляють, як у Прикладі 16 (ііі), використовуючи продукт (іі). 1 Н ЯМР (DMSO) δ 13,34 (s, 1H), 7,82-7,77 (m, 2H), 7,57 (dd, 1H), 7,29 (dt, 2H), 7,02-6,98 (m, 2Н), 5,23 (s, 2Н), 2,46 (s, 3Н). MS: APCI-[M-H] 355. Приклад 28. Амонієва сіль 3-[(4-ціанофеніл)тіо]-2,5-диметил-1Н-індол-1-іл-оцтової кислоти і) (2,5-диметил-1Н-індол-1-іл)оцтова кислота 60%-й гідрид натрію/масло (0,64г) додають до розчину 2,5-диметил-1Н-індолу (2,0г) у ДМФ (15мл). Через 15хвил. швидко додають етилбромацетат (2,7мл) і реакцію перемішують 20хвил. Реакційну суміш гасять 1%-ю (водн.) оцтовою кислотою (100мл), екстрагують етилацетатом (2´100мл) і промивають водою (2´50мл) і розсолом (20мл). Екстракти сушать (MgSO4), фільтрують і випарюють in vacuo, одержуючи коричневу тверду речовину, яку розчиняють в ЕtOН (20мл) і додають водний гідроксид натрію (1М, 10мл). Через 1год. розчин коригують до рН6 гідрохлорною кислотою (1М, прибл. 10мл) і потім випарюють in vacuo. Залишок очищають колонною флеш-хроматографією (градієнт 1-10% метанолу у ДХМ) і одержують проміжну сполуку як червонокоричневу тверду речовину (1,3г). MS (APCI+) 204 [М+Н]+ 1 Н ЯМР DMSO-d6: δ 7,22-7,17 (2Н, m), 6,85 (1Н, d), 6,11 (1Н, s), 4,87 (2Н, s), 2,34 (3Н, s), 2,30 (3Н, s). іі) амонієва сіль (3-[(4-ціанофеніл)тіо]-2,5-диметил-1Н-індол-1-іл) оцтової кислоти Йод (0,51г) додають до розчину 4-ціанобензолтіолу (0,27г) і продукту Прикладу 28, і) (0,2г) у ДМФ (5мл). Через 1год. розчин очищають зворотно-фазовою РХВР. Розчинник випарюють in vacua, маслянистий залишок обробляють етером одержують тверду речовину, яку відфільтровують, сушать і одержують бажану сполуку як білу тверду речовину (0,25г). MS: АРСІ- [(M-NH4)-H] - 334 1 Н ЯМР DMSO-d6: δ 7,62 (2Н, d), 7,35 (1Н, d), 7,10 (1Н, s), 7,08 (2Н, d), 6,97 (1Н, d), 4,80 (2Н, s), 2,36 (3Н, s), 2,32 (3Н, s). Приклад 29. 3-[(3-метоксифеніл]-2,5-диметил-1Н-індол-1-оцтова кислота Йод (0,51г) додають до розчину 3-метоксилбензолтіоле (0,25г) і продукту Прикладу 28 і) (0,2г) у ДМФ (5мл). Через 1год. розчин очищають зворотно-фазовою РХВР. Розчинник випарюють in vacua, маслянистий залишок обробляють етером і одержують тверду речовину, яку відфільтровують, сушать і одержують бажану сполуку як білу тверду речовину (0,22г). MS: АРСІ-[(М-Н]- 340 1 H ЯМР DMSO-d6: δ 7,40 (1Н, d), 7,16 (1Н, s), 7,11 (1Н, t), 6,98 (1Н, d), 6,63 (1Н, d), 6,55 (1Н, d), 6,45 (1Н, s), 5,08 (2Н, s), 3,61 (3Н, s), 2,39 (3Н, s), 2,34 (3Н, s). Приклад 30. Амонієва сіль 3-[(4-метокси(реніл)тіо]-2,5-диметил-1Н-індол-1-оцтовоїкислоти Йод (0,51г) додають до розчину 4-метоксилбензолтіолу (0,25г) і продукту Приклад 28 і) (0,2г) у ДМФ (5мл). Через 1год. розчин очищають зворотно-фазовою РХВР. Розчинник випарюють in vacua, маслянистий залишок обробляють етером і одержують тверду речовину, яку відфільтровують, сушать і одержують бажану сполук як білу тверду речовину (0,27г). MS: АРСІ-[(М-Н]- 340 1 Н ЯМР DMSO-d6: δ 7,24 (1Н, d), 7,15 (1Н, s), 6,95 (2Н, d), 6,90 (1Н, d), 6,78 (2Н, d), 4,60 (2Н, s), 3,66 (3Н, s), 2,38 (3Н, s) і 2,33 (3Н, s). Приклад 31. Амонієва сіль 3-[(3-етилфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтової кислоти Йод (0,44г) додають до розчину 2-етилбензолтіолу (0,32г) і продукту Приклад 28 і) (0,2г) у ДМФ (5мл). Через 1год. розчин очищають зворотно-фазовою РХВР. Розчинник випарюють in vacuo, маслянистий залишок обробляють етером і одержують тверду речовину, яку відфільтровують, сушать і одержують бажану сполук як білу тверду речовину (0,18г). MS: APCI-[(M-NH4)-H]- 338 1 Н ЯМР DMSO-d6: δ 7,26 (1Н, d), 7,16 (1Н, d), 7,08 (1Н, s), 7,01-6,85 (3Н, m), 6,48 (1Н, d), 4,57 (2Н, s), 2,83 (2Н, q), 2,34 (3Н, s), 2,31 (3Н, s), 1,31 (3Н, t). Приклад 32. 2,5-диметил-3-[(2-метилфеніл)тіо]-1Н-індол-1-оцтова кислота Йод (0,29г) додають до розчину 2-метилбензолтіолу (0,16г) і продукту Прикладу 28 і) (0,2г) у ДМФ (5мл). Через 1год. розчин очищають зворотно-фазовою РХВР. Розчинник випарюють in vacuo, маслянистий залишок обробляють етером і одержують, тверду речовину, яку відфільтровують, сушать і одержують бажану сполуку як білу тверду речовину (0,16г). MS: APCI-[(M-H]- 324 1 Н ЯМР DMSO-d6: δ 7,24 (1Н, d), 7,15 (1Н, d), 7,07 (1Н, s), 6,97-6,86 (3Н, m), 6,47 (1Н, d), 4,49 (2Н, s), 2,42 (3Н, s), 2,33 (3Н, s), 2,31 (3Н, s) Приклад 33. Натрієва сіль 3-[(3-хлорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтової кислоти Йод (0,29г) додають до розчину 3-хлорбензолтіолу (0,175г) і продукту Прикладу 28 і) (0,2г) в ЕtOН (5мл). Через 1год. розчин очищають зворотно-фазовою РХВР. Розчинник випарюють in vacuo і одержують продукт у вигляді безбарвного масла, яке розчиняють у метанолі (10мл), обробляють водним гідроксидом натрію (1М, 0,52мл) і випарюють in vacuo, одержуючи натрієву сіль як білу тверду речовину (0,19г). MS: APCI-[(M-Na)-H]- 344 1 Н ЯМР DMSO-d6: δ 7,28-7,15 (2Н, m), 7,13-7,06 (2Н, m), 6,97-6,88 (3Н, m), 4,42 (2Н, s), 2,36 (3Н, s), 2,33 (3Н, s). Приклад 34. Натрієва сіль 3-[(2-флуорфеніл)тіо]-2,5-диметил-1Н-індол-1-оцтової кислоти Йод (0,51г) додають до розчину 2-флуорбензолтіолу (0,26г) і продукту Прикладу 28 і) (0,2г) у ДМФ (5мл). Через 1год. розчин очищають зворотно-фазовою РХВР. Розчинник випарюють in vacua, одержуючи продукт у вигляді безбарвного масла, яке розчиняють у МеОН (10мл), обробляють водним гідроксидом натрію (1М, 0,52мл), випарюють in vacua і одержують натрієву сіль як білу тверду речовину (0,08г). MS APCI-[(M-Na)-H]- 328 1 Н ЯМР DMSO-d6: δ 7,24 (1Н, d), 7,18 (1Н, m), 7,10 (1Н, s), 7,09 (1Н, m), 6,91 (1Н, d), 6,56 (1Н, m), 6,56 (1Н, m), 4,42 (2Н, s), 2,35 (3Н, s), 2,33 (3Н, s). Приклад 35. 3-[(2,6-дихлорфеніл)тіо]-2.5-диметил-1Н-індол-1-оцтова кислота Йод (0,51г) додають до розчину 2,6-дихлорбензолтіолу (0,36г) і продукту Прикладу 28 і) (0,2г) у ДМФ (5мл). Через 1год. розчин очищають зворотно-фазовою РХВР. Розчинник випарюють in vacua, маслянистий залишок обробляють етером і одержують тверду речовину, яку відфільтровують, сушать і одержують бажану сполуку як білу тверду речовину (0,22г). MS: АРСІ-[М-Н] - 378 1 Н ЯМР DMSO-d6: δ 7,49 (2Н, d), 7,29 (1Н, m), 7,24 (1Н, d), 7,13 (1Н, s), 6,88 (1Н, d), 4,81 (2Н, s), 2,44 (3Н, s), 2,29 (3Н, s). Приклад 36. Амонієва сіль –(1Н-iмідазол-2-ілтіо)-2,5-диметил-1Н-індол-1-оцтової кислоти Йод (0,51г) додають до розчину 1Н-імідазол-2-тіолу (0,20г) і продукту Прикладу 28 і) (0,2г) у ДМФ (5мл). Через 1год. розчин очищають зворотно-фазовою РХВР. Розчинник випарюють in vacua, маслянистий залишок обробляють етером і одержують тверду речовину, яку відфільтровують, сушать і одержують бажану сполук як білу тверду речовину (0,23г). MS АРСІ-[М-Н]- 300 1 Н ЯМР DMSO-d6: δ 8,15 (1Н, s), 7,21 (1Н, d), 7,21 (2Н, s), 6,90 (1Н, d), 4,51 (2Н, s), 2,40 (3Н, s), 2,35 (3Н, s) Приклад 37. 2,5-диметил-3-(1Н-1,2,4-триазол-3-ілтіо)-1Н-індол-1-оцтова кислота Йод (0,51г) додають до розчину 1Н-1,2,4-триазол-3-тіолу (0,20г) і продукту Прикладу 28 і) (0,2г) у ДМФ (5мл). Через 1год. розчин очищають зворотно-фазовою РХВР. Розчинник випарюють in vacua, маслянистий залишок обробляють етером і одержують тверду речовину, яку відфільтровують, сушать і одержують бажану сполук як білу тверду речовину (0,24г). MS APCI-[M-H]- 301 1 Н ЯМР DMSO-d6: δ 8,15 (1Н, s), 7,21 (1Н, d), 7,20 (1Н, s), 6,90 (1Н, d), 4,49 (2Н, s), 2,40 (3Н, s),2,35 (3H, s) Приклад 38. 2,5-диметил-3-[(4-метил-4Н-1,2,4-триазол-3-іл)тіо]-1Н-індол-1-оцтова кислота Йод (0,51г) додають до розчину 4-метил-4Н-1,2,4-триазол-3-тіолу (0,20г) і продукту Прикладу 28 і) (0,2г) у ДМФ (5мл). Через 1год. розчин очищають зворотно-фазовою РХВР. Розчинник випарюють in vacua, маслянистий залишок обробляють етером і одержують тверду речовину, яку відфільтровують, сушать і одержують бажану сполук як білу тверду речовину (0,21г). MSAPCI-[M-H]- 315 1 Н ЯМР DMSO-d6: δ 8,44 (1Н, s), 7,29 (1Н, s), 7,19 (1Н, d), 6,90 (1Н, d), 4,46 (2Н, s), 3,52 (3Н, s), 2,46 (3Н, s), 2,35 (3Н, s). Приклад 39. 2,5-диметил-3-[(4-метил-2-оксазоліл)тіо]-1Н-індол-1-оцтова кислота Йод (0,51г) додають до розчину 4-метил-2-оксазолтіолу (0,23г) і продукту Прикладу 28 і) (0,2д) у ДМФ (5мл). Через 1год. розчин очищають зворотно-фазовою РХВР. Розчинник випарюють in vacua, маслянистий залишок обробляють етером і одержують тверду речовину, яку відфільтровують, сушать і одержують бажану сполуку як білу тверду речовину (0,23г). MSAPCI-[M-H]- 315 1 H ЯМР DMSO-d6: δ 7,69 (1Η, s), 7,29 (1H, d), 7,22 (1H, s), 6,95 (1H, d), 4,78 (2H, s), 2,42 (3H, s), 2,36 (3H, s), 1,99 (3H, s). Приклад 40. 2,5-диметил-3-[(1-метил-1Н-імідазол-2-іл)тіо]-1Н-індол-1-оцтова кислота Йод (0,51г) додають до розчину 1-метил-1Н-імідазол-2-тіолу (0,23г) і продукту Прикладу 28 і) (0,2г) у ДМФ (5мл). Через 1год. розчин очищають зворотно-фазовою РХВР. Розчинник випарюють in vacua, маслянистий залишок обробляють етер і одержують тверду речовину, яку відфільтровують і сушать, одержуючи бажану сполук як білу тверду речовину (0,21г). MS АРСІ- [М-Н] - 314 1 Н ЯМР DMSO-d6: δ 7,37 (1Н, s), 7,29 (1Н, d), 7,15 (1Н, s), 6,93 (1Н, d), 6,84 (1Н, s), 4,97 (2Н, s), 3,60 (3Н, s), 2,49 (3Н, s), 2,36 (3Н, s). Приклад 41. Амонієва сіль 2,5-диметил-3-[[(4-(метилсульфоніл)фенілітіо]-тіо]-1Н-індол-1-оцтової кислоти і) 4-(метилсульфоніл)-бензолтіол 1-флуор-4-(метилсульфоніл)-бензол (1,74г) і гідрат гідросульфіду натрію (0,67г) розчиняють у ДМФ (10мл) і перемішують при кімнатній температурі 24год. Реакцію гасять водою, підкислюють 2М гідрохлорною кислотою (20мл) і екстрагують етилацетатом (2´50мл). Об'єднані екстракт промивають водою (2´25мл) і розсолом (20мл). Органічний розчин сушать (MgSO4), фільтрують, випарюють in vacua, одержуючи проміжну сполуку як білу тверду речовину (1,8г). MS: ESI+[M+H] 188 1 Н ЯМР CDCI 3: δ 7,99 (2Н, d), 7,27 (2Н, d), 3,05 (3Н, s). іі) Амонієва сіль 2,5-диметил-3-[[4-(метилсульфоніл)феніл]тіо]-1Н-індол-1-оцтової кислоти Йод (0,51г) додають до розчину продукту Прикладу 41 і) (0,565г) і продукту Прикладу 28 і) (0,2г) у ДМФ (5мл). Через 1год. розчин очищають зворотно-фазовою РХВР. Розчинник випарюють in vacua, маслянистий залишок обробляють етером і одержують тверду речовину, яку фільтрують і сушать, одержуючи бажану сполуку як білу тверду речовину (0,25г) MS: APCI-[M-H] 388 1 Н ЯМР DMSO-d6: δ 7,69 (2Н, d), 7,31 (1Н, d), 7,15 (2Н, d), 7,11 (1Н, s), 6,95 (1Н, d), 4,62 (2Н, s), 3,13 (3Н, s), 2,36 (3Н, s), 2,33 (3Н, s). Приклад 42. Геміамоніева сіль 2,5-диметил-3-(8-хінолінілтіо)-1Н-індол-1-оцтової кислоти Йод (0,25г) додають до розчину 8-хінолінтіолу (0,16г) і продукту Прикладу 28 і) (0,1г) у ДМФ (5мл). Через 1год. розчин очищають зворотно-фазовою РХВР. Розчинник випарюють in vacua, маслянистий залишок обробляють етером і одержують тверду речовину, яку фільтрують і сушать, одержуючи бажану сполук як білу тверду речовину (0,08г). MS: APCI-[M-H] 361 1 Н ЯМР DMSO-d6: δ 8,97 (1Н, s), 8,37 (1Н, d), 7,62 (2Н, m), 7,32 (1Н, d), 7,27 (1Н, t), 7,08 (1Н, s), 6,94 (1Н, d), 6,71 (1Н, d), 4,69 (2Н, s), 2,36 (3Н, s), 2,30 (3Н, s). Приклад 43. 3-[(4-хлорфеніл)тіо]-5-флуор-2,4-диметил-1Н-індол-1-оцтова кислота і) 7-хлор-5-флуор-2,4-диметил-3-метилтіо-1Н-індол З перемішуванням розчин 2-хлор-4-флуор-5-метилаланіну (1,65г) у метиленхлориді (100мл) під нітрогеном обробляють при -65°С розчином t-бутилгіпохлориту (1,13г) у метиленхлориді (5мл), перемішують при -65°С 10хвил., обробляють при -65°С розчином метилтіоацетону (1,080г) у метиленхлориді (5мл) і перемішують при -65°С протягом 1год., обробляють при -65°С триетиламіном (1,05г) і залишають досягти зовнішньої температури. Розчин промивають, сушать (MgSO4) і випарюють. Залишок очищають кремнеземною хроматографією, використовуючи 25% ацетону у ізогексані як елюент, і одержують бажану сполуку (1,7г). MS: АРСІ-[М-Н] 242 1 Н ЯМР DMSO-d6: δ 11,67 (1Н, s), 7,07 (1Н, d), 2,71 (3Н, d), 2,48 (3Н, s), 2,19 (3Н, s). іі) 7-хлор-5-флуор-2,4-димeтил-1Н-індол Розчин продукту і) (1,13г) і тіосаліцилову кислоту (1,43г) у ТФК (50мл) перемішують при 60°С 2год. і випарюють. Залишок вносять у метиленхлорид, промивають водним розчином гідроксиду натрію, потім водою, сушать (MgSO4) і випарюють. Залишок очищають кремнеземною хроматографією, використовуючи 10% етилацетату у ізогексані як елюент, і одержують бажану сполуку (0,82г). MS: ESI 197 [М+Н] 1 Н ЯМР DMSO-d6: δ 11,25 (1Η, s), 6,97 (1Η, d), 6,28 (1Η, q), 2,40 (3Н, d), 2,30 (3Н, d) iii) 5-флуор-2,4-диметил-1Н-індол Перемішуючи, суспензію 10% паладію на карбоні (200мг) в етанолі (50мл) обробляють розчином формату амонію (2,3г) у воді (2мл), перемішують 1хвил., обробляють розчином продукту іі) (721мг) в етанолі (10мл), перемішують протягом 2 днів, обробляють ще 10% паладієм на карбоні (500мг), перемішують при 40°С протягом 2год. і фільтрують. Тверду речовину промивають етанолом і об'єднані фільтрати випарюють. Залишок вносять в етер, промивають, сушать (MgSO4), випарюють і одержують бажану сполуку. MS: ESI+[M+H] 163 1 H ЯМР CDCI 3: δ 7,82 (1Η, s), 7,04-7,01 (1H, m), 6,82 (1H, dd), 6,21-6,21 (1H, m), 2,45 (3H, s), 2,40-2,40 (3H, m). iv) метил 5-флуор-2,4-диметил-1Н-індол-1-іл]ацетат. З перемішуванням суспензію продукту ііі) (2г) і карбонат цезію (4,8г) у ацетоні (100мл) обробляють метилбромацетатом (4,22г), підігрівають під зворотним холодильником протягом ночі, обробляють карбонатом цезію (2,4г) і метилбромацетатом (1,3мл), підігрівають під зворотним холодильником 2год. і випарюють. Залишок вносять в етилацетат, промивають розсолом (3 х), сушать (MgSO4) і випарюють. Залишок очищають кремнеземною хроматографією, використовуючи 20% ацетону у ізогексані як елюент, і одержують бажану сполуку як білу тверду речовину (2,57г). MS: APCI-[M-H] 253 Точка плавл. 176°С. 1 Н ЯМР DMSO-d6: δ 6,92-6,83 (2Н, m), 6,30 (1Н, s), 4,76 (2Н, s), 3,74 (3Н, s), 2,40-2,39 (6H,m). ν) 5-флуор-2,4-диметил-1Н-індол-1-іл]оцтова кислота З перемішуванням розчин продукту iv) (2,51г) у ТГФ (50мл) обробляють розчином гідроксиду літію (894мг) у воді (10мл), перемішують протягом ночі і концентрують-для видалення ТГФ. Залишок підкислюють 1N гідрохлорною кислотою і екстрагують метиленхлоридом, потім промивають і сушать (MgSO4), екстракт випарюють і одержують бажану сполуку як білу тверду речовину (2,33г). 1 Н ЯМР DMSO-d6: δ 12,98 (1Н, s), 7,16 (1Н, dd), 6,83 (1Н, dd), 6,27 (1Н, s), 4,92 (2H,s), 2,32-2,32 (6Н, m). MS: APCI-[M-H] 220 vi) 3-[(4-хлорфеніл)тіо]-5-флуор-2,4-диметил-1Н-індол-1-оцтова кислота. З перемішуванням розчин продукту ν) (221мг) і йод (508мг) у ДМФ (2мл) обробляють розчином 4хлортіофенолу (288мг) і перемішують протягом ночі. Розчин очищають зворотно-фазовою препаративною РХВР і одержують бажану сполуку (50мг). MS: APCI-[M-H] 362 1 Н ЯМР DMSO-d6: δ 7,30-7,25 (3Н, m), 6,97-6,89 (3Н, m), 4,74 (2Н, s), 2,44 (3Н, d), 2,36 (3Н, s) Приклад 44. 3-[(4-ціаноФеніл)тіо]-5-флуор-2.4-диметил-1Н-індол-1-оцтова кислота Бажану сполуку приготовляють з продукту Прикладу 49), ν) (221мг), йоду (508мг) і 4-тіобензонітрилу (270мг), як у Прикладі 49, vi). MS: APCI-[M-H] 353 1 Н ЯМР DMS0-d6: δ 7,68-7,63 (2Н, m), 7,33-7,29 (1Н, m), 7,12-7,08 (2Н, m), 6,98 -6,92 (1Н, m),4,78-(2H, s), 2,40 (3H, d), 2,35 (3H, s). Приклад 45. 3-[(2-хлорфеніл)тіо]-5-флуор-2,4-диметил-1Н-індол-1-оцтова кислота Бажану сполук приготовляють з продукту Прикладу 49), ν) (221мг), йоду (508мг) і 2-хлортіофенолу (289мг), як у Прикладі 49), vi). MS: APCl-[M-H] 362 1 Н ЯМР DMSO-d6: δ 7,45-7,42 (1Н, m), 7,25-7,21 (1Н, m), 7,13-7,06 (2Н, m), 6,94 -6,87 (1Н, m), 6,53-6,50 (1Н, m), 4,53 (2Н, s), 2,39 (3Н, d), 2,33 (3Н, s). Приклад 46. 5-флуор-3-[(2-метоксифеніл)тіо]-2,4-диметил-1Н-індол-1-оцтова кислота Бажану сполук приготовляють з продукту Прикладу 49, ν) (221мг), йоду (508мг) і 2-метокситіофенолу (280мг), як у Прикладі 49), vi). MS: APCI-[M-H] 358 1 Н ЯМР DMSO-d6: δ 7,39-7,34 (1Н, m), 7,08-6,93 (3Н, m), 6,74-6,69 (1Н, m), 6,33 (1Н, dd), 5,09 (2Н, s), 3,89 (3Н, s), 2,40 (3Н, d), 2,34 (3Н, s). Приклад 47. 5-флуор-3-[(2-етилфеніл)тіо]-2,4-диметил-1Н-індол-1-оцтова кислота Бажану сполуку приготовляють з продукту Прикладу 49, ν) (221мг), йоду (508мг) і 2-етилтіофенолу (276мг), як у Прикладі 49, vi). MS: APCI-[M-H] 356 1 Н ЯМР DMSO-d6: δ 7,28-7,23 (1Н, m), 7,18 (1Н, dd), 7,03-6,87 (3Н, m), 6,47 (1Н, dd), 4,71 (2Н, s), 2,80 (2Н, q), 2,40 (3Н, d), 2,35 (3Н, s), 1,29 (3H, t) Приклад 48. 5-флуор-2,4-диметил-3-[[2-(1-метилетил)феніл]тіо]-1Н-індол-1-оцтова кислота Бажану сполук приготовляють з продукту Прикладу 49, ν) (221мг), йоду (508мг) і 2-ізопропілтіофенолу (304мг), як у Прикладі 49, vi). MS: APCI-[M-H] 370 1 Н ЯМР DMSO-d6: δ 7,29-7,25 (2Н, m), 7,03 (1Н, td), 6,95-6,88 (2Н, m), 6,47 (1Н, dd), 4,78 (2Н, s), 3,44 (1Н, quintet), 2,40 (3Н, d), 2,35 (3Н, s), 1,30 (6Н, d). Приклад 49. 5-флуор-2,4-диметил-3-[[2-(трифлуорметил)феніл]тіо]-1Н-індол-1-оцтова кислота Бажану сполуку приготовляють з продукту Прикладу 49, ν) (221мг), йоду (508мг) і 2трифлуорметилтіофенолу (356мг), як у Прикладі 49, vi). MS: APCI-[M-H] 396 1 Η ЯМР DMSO-d6: δ 7,70 (1Η, d), 7,38 (1Η, t), 7,27-7,23 (2Η, m), 6,91 (1Η, t), 6,76 (1Η, d), 4,57 (2Η, s), 2,38 (3Н, d) і 2,35 (3Н, s). Приклад 50. 2.5-диметил-4-(метилсульфоніл)-3-[(4-феніл-2-тіазоліл)тіо]-1Н-індол-1-оцтова кислота і) 2,5-диметил-4-(метилсульфоніл)-3-(метилтіо)-1Н-індол Бажану сполуку отримують, як у Прикладі 43 і) використовуючи 4-метил-3-(метилсульфоніл)-бензоламін. 1 Н ЯМР DMSO-d6: δ 11,94 (1Н, s), 7,49 (1Н, d), 7,01 (1Н, d), 3,51 (3Н, s), 2,69 (3Н, s), 2,55 (3H, s),2,19 (3H, d). b) 2,5-диметил-4-(метилсульфоніл)-1Η-індол Розчин продукту а) (1,00г) і тіосаліцилову кислоту (1,15г) у ТФК (20мл) перемішують при 60°С 2год. і потім концентрують in vacua. Залишок вносять у метиленхлорид, промивають 1N водним розчином гідроксиду натрію, потім водою, сушать (MgSO4), випарюють і одержують бажану сполуку (0,47г). 1 Н ЯМР DMSO-d6: δ 11,36 (1Н, s), 7,46 (1Н, d), 6,99 (1Н, d), 6,64 (1Н, d), 3,33 (3Н, s), 3,10 (3Н, s),2,66 (3H, s). c) 2,5-диметил-4-(метилсульфоніл)-3-[(4-феніл-2-тіазоліл)тіо]-1Η-індол-1-оцтова кислота З перемішуванням розчин продукту операції b) (200мг) і йоду (210мг) у ДМФ (2мл) обробляють 2тіазолтіолом, 4-феніл- (300мг) і перемішують 1год. Розчин обробляють 60%-м гідридом натрію (4,0 молярні еквіваленти) і перемішують протягом ночі. Додають метилбромацетат (0,30г) і після 30-хвилинного перемішування воду (2мл), ТГФ (2мл) і гідроксид літію (0,20г). Після перемішування протягом ще 30хвил. реакційну суміш підкислюють (2М НСІ, 5мл) і екстрагують в етилацетат (3´10мл). Об'єднану органіку промивають насиченим розсолом (3´10мл), сушать (MgSO4) і випарюють. Залишок очищають зворотнофазовою препаративною РХВР і одержують бажану сполуку (172мг). MS: APCI-[M-H] 471 1 Н ЯМР DMSO-d6: δ 7,94-7,69 (4Н, m), 7,49-7,24 (3Н, m), 7,19 (1Н, d), 5,05 (2Н, s), 3,57 (3Н, s), 3,34 (3Н, s), 2,80 (3Н, s). Приклад 51. 3-[(3-хлорфеніл)тіол-2,5-диметил-4-(метилсульфоніл]-1Н-індол-1-оцтова кислота Бажану сполук отримують за процедурою Прикладу 50 ііі), використовуючи продукт операції іі) (200мг) і 3хлорбензолтіол (0,3г). Сполуку очищають зворотно-фазовою препаративною РХВР і одержують бажану сполуку (40мг). MS: АРСІ-[М-Н] 422 1 Н ЯМР DMSO-d6: δ 7,83-7,69 (1Н, m), 7,26-6,97 (3Н, m), 6,88-6,73 (2Н, m), 5,01 (2Н, d), 3,57 (3Н, s), 3,32 (3Н, s), 2,69 (3Н, s). Приклад 52. 3-[(2-хлорфеніл)тіо]-2,5-диметил-4-(метилсульфоніл)-1Н-індол-1-оцтова кислота Бажану сполуку (55мг) приготовляють, як у Прикладі 57 ііі), використовуючи продукт операції іі) (200мг) і 2хлорбензолтіол (0,3г). MS: APCI-[M-H] 422 1 Н ЯМР DMSO-d6: δ 7,76 (1Н, d), 7,39 (1Н, m), 7,21-6,95 (3Н, m), 6,34 (1Н, m), 4,93 (2Н, s), 3,64 (3Н, s), 3,29 (3Н, s), 2,69 (3Н, s). Приклад 53 3-[(4-хлорфеніл)тіо]-5-(метоксикарбоніл)-2-метил-1Н-індол-1-оцтова кислота (і) 3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-5-карбонова кислота До розчину продукту Прикладу 27 (і) (2г) в етанолі (20мл) додають 12.5М розчин гідроксиду натрію (5мл). Суміш підігрівають під зворотним холодильником протягом 4 днів. Після охолодження суміш вливають у воду і рН коригують 2, використовуючи концентр. НСІ (водн.). Твердий осад ізолюють фільтруванням і потім рекристалізують з киплячого метанолу, одержуючи проміжну сполуку (2г). 1 Н ЯМР DMSO-d6: δ 12,51 (1Н, s), 12,05 (1Н, s), 7,96 (1Н, d), 7,75 (1Н, dd), 7,46 (1Н, dd), 7,27 (2Н, dd), 6,97 (2Н, dd), 2,47 (3Н, s). (іі) метиловий естер 3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-5-карбонової кислоти До розчину/суспензії продукту (і) (1г) у метанолі (50мл) додають триметилсилілхлорид (12,6мл). Після перемішування при кімнатній температурі протягом ночі суміш концентрують in vacua і одержують проміжну сполуку. 1 Н ЯМР DMSO-d6: δ 12,12 (1Η, s), 7,97 (1H, d), 7,77 (1H, dd), 7,49 (1H, dd), 7,27 (2H, dt), 6,97 (2H, dt), 3,80 (3H, s), 2,47 (3H, s). (ііі) 1,1-диметилетиловий естер 3-[(4-хлорфеніл)тіо]-5-(метоксикарбоніл)-2-метил-1Н-індол-1-оцтової кислоти. Цю сполуку приготовляють, як у Прикладі 11 (іі), використовуючи продукт (іі) і t-бутилбромацетат. Продукт очищають колонною флеш-хроматографією (14% ЕtOАс/гексан як елюент). 1 Н ЯМР DMSO-d6: δ 8,01 (1Н, d), 7,82 (1Н, dd), 7,67 (1Н, d), 7,28 (2Н, m), 6,97 (2Н, dt), 5,20 (2Н, s), 3,81 (3Н, s), 2,44 (3Н, s), 1,42 (9Н, s). (iv) 3-[(4-хлорфеніл)тіо]-5-(метоксикарбоніл)-2-метил-1Н-індол-1-оцтова кислота Бажану сполук приготовляють, як у Прикладі 22 (ііі), використовуючи продукт (ііі). 1 Н ЯМР DMSO-d6: δ 13,28 (1Н, s), 8,01 (1Н, d), 7,81 (1Н, dd), 7,68 (1Н, d), 7,28 (2Н, d), 6,98 (2Н, d), 5,20 (2Н, s), 3,82 (3Н, s), 2,45 (3Н, s). MS: АРСІ-[М-Н] 388 Точка плавл. 221-223°С Приклад 54. 5-карбокси-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота (і) 5-карбокси-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота Суспензію продукту Прикладу 53 (0,5г) у 1М гідроксиді натрію (водн.) (3мл) підігрівають у герметичній трубці при 100°С у мікрохвильовій печі протягом 10хвил. Суміш вливають у воду і рН коригують до 2, використовуючи 2М НСІ (водн.). Твердий осад ізолюють фільтруванням, сушать протягом ночі у вакуумі при 50°С і одержують бажану сполуку (0,1г). 1 Н ЯМР DMSO-d6: δ 7,99 (1Н, d), 7,79 (1Н, dd), 7,64 (1Н, d), 7,28 (2Н, dd), 6,99 (2Н, dt), 5,19(2H, s), 2,45(3H, s). MS: APCI-[M-H] 374 Точка плавл. (розкл.) >302°С Приклад 55. 3-[(4-хлорфеніл)тіо]-2-метил-4-нітро-1Н-індол-1-оцтова кислота і) 3-[(4-хлорфеніл)тіо]-2-метил-4нітро-1Н-індол З перемішуванням розчин 3-нітроаніліну (8г) у ТГФ (700мл) охолоджують до -78°С і додають tбутилгіпохлорит (6,3г) протягом 5хвил. краплями. Реакцію залишають нагрітись до -65°С протягом 20хвил. і потім додають розчин 1-[4-хлорфеніл)тіо]-2-пропанону (11,6г) у ТГФ (20мл). Через 2год. додають триетиламін (8,1мл) і реакцію залишають нагрітись до кімнатної температури. До реакційної суміші додають 2М НСІ (водн.) і потім концентрують in vacua. Залишок перемішують у метанол і твердий осад ізолюють фільтруванням, одержуючи проміжну сполуку (5,8г). 1 Н ЯМР DMSO-d6: δ 12,55 (s, 1Н), 7,76 (dd, 1Н), 7,63 (dd, 1Н), 7,31-7,22 (m, 3Н), 6,91 (dd, 2H), 2,47 (s, 3H). ii) етиловий естер 3-[4-хлорфеніл)тіо]-2-метил-4нітро-1Н-індол-оцтової кислоти З перемішуванням до суспензії гідриду натрію (60%-а дісперсія у мінеральному маслі, 0,85г) у ТГФ (100мл) додають розчин продукту операції (і) (5,6г) у ТГФ (50мл). Після перемішування при кімнатній температурі протягом 30хвил. краплями протягом 10хвил додають етилбромацетат (2,3мл). Через 2год. реакцію концентрують in vacua, залишок розчиняють в етилацетаті, промивають водою, розсолом, сушать (MgSO4) і концентрують in vacua. Рекристалізація з киплячого етанолу дає проміжну сполуку (5г). 1 Н ЯМР DMSO-d6: δ 7,97 (dd, 1H), 7,65 (dd, 1H), 7,35 (t, 1H), 7,26 (dt, 2H), 6,92 (dt, 2H), 5,40 (S, 2H), 4,19 (q, 2H), 2,45 (S, 3Н), 1,22 (t, 3Н). iії) 3-[(4-хлорфенілУгіо1-2-метил-4нітро-1Н-індол-оцтова кислота До розчину продукту (іі) (0,1г) у ТГФ (5мл) додають 1М розчин NaOH (водн.) (0,25мл). Реакцію перемішують протягом ночі при кімнатній температурі. Реакційну суміш концентрують in vacua і залишок розчиняють/суспендують у воді. рН коригують до 2, використовуючи розбавлену НСІ (водн.) і твердий осад ізолюють фільтруванням, сушать під вакуумом при 50°С і одержують бажану сполуку (0,07г). 1 Н ЯМР DMSO-d6: δ 13,37 (s, 1H), 7,97 (d, 1H), 7,64 (d, 1H), 7,34 (t, 1H), 7,25 (dt, 2H), 6,92 (dt, 2H), 5,28 (s, 2H), 2,45 (s, 3H). MS: APCI- [M-H] 375 Точка плавл. (розкл.) >198°С Приклад 56. 4-аміно-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота і) етиловий естер 4-аміно-3-[4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтової кислоти Суспензію продукту Прикладу 55 (іі) (2,25г) в етанолі (170мл) перемішують у присутності 5% Pt/C (0,5г) у Н2 під тиском 2бар. Після перемішування протягом ночі каталізатор видаляють фільтруванням і фільтрати концентрують in vacua. Очищення колонною флеш-хроматографією (14% ЕtOАс/гексан як елюент) дає проміжну сполуку (1,4г). 1 Н ЯМР (DMSO) δ 7,30 (dd, 2H), 7,00 (dt, 2H), 6,85 (t, 1H), 6,68 (dd, 1H), 6,23 (dd, H), 5,33 (s, 2H), 5,09 (s, 2H), 4,16 (q, 2H), 2,33 (s, 3Н), 1,21 (t, 3Н). Також ізольовано етиловий естер 3-[(4-хлорфеніл)тіо]-4-(етиламіно)-2-метил-1Н-індол-1-оцтової кислоти як побічний продукт реакції (0,33г). 1 Н ЯМР DMSO-d6: δ 7,32 (dd, 2Н), 7,01 (dd, 2Н), 6,95 (t, 1H), 6,73 (d, 1H), 6,16 (d, 1H), 5,70 (t, 1H), 5,11 (s, 2H), 4,16 (q, 2H), 3,05 (dt, 2H), 2,34 (s, 3H), 1,21 (t, 3H), 1,02 (t, 3H). іі) 4-аміно-3-[(4-хлорфеніл)тіо]-2-метил-1Н-індол-1-оцтова кислота Бажану сполуку приготовляють, як у Прикладі 1 (ііі) (0,03г). 1 Н ЯМР (DMSO) δ 7,29 (dt, 2H), 7,01 (dt, 2H), 6,88 (t, 1H), 6,76 (d, 1H), 6,30 (d, 1H), 4,99 (s, 2Н), 2,33 (s, 3Н). MS: APCI- [M-H] 345 Точка плавл.(розкл.) >235°С Приклад 57. 3-[(4-хлорфеніл)тіо]-4-(етиламіно)-2-метил-1Н-індол-1-оцтова кислота Сполуку приготовляють, як у Прикладі 55 (іі), використовуючи побічний продукт Прикладу 2 (і). Очищеннязворотно-фазовою препаративною РХВР. 1 Н ЯМР DMSO-d6: δ 7,29 (dt, 2H), 7,02 (m, 2H), 6,88 (t, 1H) 6,64 (d, 1H), 6,11 (d, 1H), 5,66 (t, 1Н), 4,51 (s, 2Н), 3,04 (dt, 2Н), 2,31 (s, 3Н), 1,01 (t, 3Н). MS: APCI+ [M+H] 375. Приклад 58. 3-[(4-хлорфеніл)тіо]-4-йод-2-метил-1Н-індол-1-оцтова кислота (і) 3-[(4-хлорфеніл)тіо]-4-йод-2-метил-1Н-індол Цю сполуку приготовляють, як у Прикладі 27 (і), використовуючи 3-йоданілін. Продукт очищають колонною флеш-хроматографією (14% ЕtOАс/гексан як елюент). 1 Н ЯМР DMSO-d6: δ 11,99 (1Н, s), 7,50 (1Н, dd), 7,44 (1Н, dd), 7,26 (2Н, m), 6,92 -6,84 (3Н, m), 2,43 (3Н, s) (іі) 3-[(4-хлорфеніл)тіо]-4-йод-2-метил-1Н-індол-1-оцтова кислота Цю сполуку приготовляють, як у Прикладі 11, (іі) і (ііі), використовуючи продукт (і). 1 Н ЯМР DMSO-d6: δ 7,52 (2Н, d), 7,25 (2Н, dt), 6,93-6,86 (3Н, m), 4,86 (2Н, s), 2,40 (3Н, s). MS: APCI-[M-H] 456 Приклад 59. 3-[(4-хлорфеніл)тіо]-2-метил-4-феніл-1Н-індол-1-оцтова кислота і) 1,1-диметилетиловий естер 3-[(4-хлорфеніл)тіо]-2-метил-4-феніл-1Н-індол-1-оцтової кислоти До розчину продукту Прикладу 22, (іі) (0,5г) в етанолі (0,8мл) і толуолі (3мл) додають 2М розчин карбонату натрію у воді (1,4мл), фенілборну кислоту (0,131г) і тетракіс(трифенілфосфін)паладій(0) (1,2г). Реакцію підігрівають під зворотним холодильником 2год., охолоджують і концентрують in vacua. Залишок очищають колонною флеш-хроматографією і одержують проміжну сполуку (0,4г), яку використовують в операції (іі) без характеризації. іі) 3-[(4-хлорфеніл)тіо]-2-метил-4-феніл-1Н-індол-1-оцтова кислота До розчину продукту (і) (0,4г) у ДХМ (10мл) додають ТФК (2мл), реакцію перемішують при кімнатній температурі протягом ночі, потім концентрують in vacua і залишок розчиняють/суспендують у воді. рН коригують 2, використовуючи 2М НСІ (водн.) і твердий осад ізолюють фільтруванням. Очищення проводять зворотно-фазовою препаративною РХВР (MeCN/NH3 (водн.) як елюент) і одержують тверду речовину, яку суспендують у воді і рН коригують до 2 використовуючи 2М НСІ (водн.), тверду речовину ізолюють фільтруванням, перетирають з гексаном, сушать протягом ночі при 40°С у вакуумі одержують бажану сполуку (0,15г). 1 Н ЯМР DMSO-d6: δ 7,55 (d, 1H), 7,26-7,07 (m, 8H), 6,87 (d, 1H), 6,56 (m, 2H), 5,18 (s, 2Н), 2,40 (s, 3Н). MS: APCI+[M+H] 408 Фармакологічні дані Аналіз на зв'язування ліганду [3H]PGD2 був придбаний від Perkin Elmer Life Sciences і мав питому активність 100-210Сі/ммоль. Всі інші хімічні реактиви були рівня придатності для аналізу. Клітини, що експресують rhCRTh2/Gal6 були у звичайний спосіб підтримані у DMEM з вмістом 10% Foetal Bovine Serum (HyClone), 1мг/мл генецитину, 2мМ L-глутаміну і 1% несуттєвих амінокислот. Для приготування мембран були вирощені зв'язуючі трансфектовані клітини НЕК для утворення центрів продукування двошарових тканевих культур [Fisher, № у каталозі ТКТ-170-070Е]. Максимальні рівні експресії рецептора були індуковані доданням до культури 500мМ бутирату натрію протягом останніх 18год. Зв'язуючі клітини промивали одноразово розсолом, буферованим фосфатом (PBS, 50мл на центр продукування) і відокремлювали доданням на кожний центр продукування 50мл льодяного гомогенізуючого мембрану буфера [20мМ HEPES (рН7,4), 0,1мМ дитіотреїтолу, 1мМ EDTA, 0,1мМ фенілметилсульфонілфлуориду і 100мкг/мл бацитрацину]. Клітини були гранульовані на центрифузі при 220хg протягом 10хвил. при 4°С, ресуспендовані у половині первісного об'єму свіжого гомогенізуючого мембрану буфера і були подрібнені з використанням гомогенізатора Polytron серіями 2´20сек. з утриманням посудини у льоді протягом всього часу. Незруйновані клітини були видалені центрифугою при 220хд протягом 10хвил. при 4°С і мембранну фракцію гранулювали на центрифузі при 9000хg протягом 30хвил. при 4°С. Останню гранулу ресуспендували у 4мл свіжого гомогенізуючого мембрану буфера на кожний центр продукування клітин і визначали вміст протеїну. Мембрани зберігали при -80°С відповідними аліквотами. Всі дослідження проводили у білих 96-[ніздових платах NBS (Fisher) з прозорим -дном (Corning). Перед аналізом мембрани клітин НЕК, які містили CRTh2, були нанесені на бусини SPA PVT WGA (Amersham). Для цього мембрани інкубували з бусинами у розрахунку 25мкг протеїну мембрани на бусину при 4°С з постійним перемішуванням протягом ночі. (Оптимальну концентрацію покриття визначали для кожної партії мембран). Бусини гранулювали на центрифузі (800хg 7хвил. при 4°С), промивали один раз аналітичним буфером (50мМ HEPES, рН7,4 з 5мМ хлориду магнію) і ресуспендували у аналітичному буфері з концентрацією бусин 10мг/мл. Кожний аналіз містив 20мкл 6,25нМ [3H]PGD2, 20мкл насичених мембраною бусин SPA як у аналітичному буфері, так і у 10мкл розчину сполуки, або 13,14-дигідро-15-кетопростагландину D2 (DK-PGD2, для визначення неспецифічного зв'язування, Cayman chemical company). Сполуки і DK-PGDa розчиняли у ДМСО і розбавляли у тому ж розчиннику до 100х бажаної кінцевої концентрації. Після додання аналітичного буфера одержували кінцеву концентрацію 10% DMSO (сполуки тепер мали 10х бажаної кінцевої концентрації) і цей розчин додавали до аналітичної плати. Цю плату інкубували при кімнатній температурі 2год. і вели підрахунок на рідинному сцинтиляційному лічильнику Wallac Microbeta (1хвил. на гніздо). Сполуки формули (І) мають значення IK50 менше 10мкМ, зокрема, у Прикладі 23 рІК50=6,05, у Прикладі 50 рІК50=7,2 і у Прикладі 29 рІК50=8,35.
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted indoles, methods for their production and method for treating disorders mediated by prostaglandin d2
Автори англійськоюBonnert Roger, Brough Stephen, Dickinson Mark, Rasul Rukhsana
Назва патенту російськоюЗамещенные индолы, способы их получения и способ лечения заболевания, опосредованного простагландином d2
Автори російськоюБоннерт Роджер, Браф Стивен, Дикинсон Марк, Расул Рухсана
МПК / Мітки
МПК: C07D 209/30, C07D 413/12, A61P 11/06, A61K 31/4196, C07D 417/12, A61K 31/404, A61K 31/422, A61K 31/496, A61P 11/02, A61P 43/00, A61K 31/4178, A61K 31/4709, C07D 401/12, C07D 403/12
Мітки: хвороби, лікування, заміщені, спосіб, простагландином, одержання, опосередкованої, індоли
Код посилання
<a href="https://ua.patents.su/17-79464-zamishheni-indoli-sposib-kh-oderzhannya-ta-sposib-likuvannya-khvorobi-oposeredkovano-prostaglandinom-d2.html" target="_blank" rel="follow" title="База патентів України">Заміщені індоли, спосіб їх одержання та спосіб лікування хвороби, опосередкованої простагландином d2</a>
Попередній патент: Сіль периндоприлу і фармацевтична композиція, що її містить
Наступний патент: Упаковка зі звуковідтворенням
Випадковий патент: Спосіб транспортування зелені












