19-нор-стероїдні похідні з 15a,16a-метиленовою групою й насиченим 17,17-спіролактоновим кільцем, їх застосування й лікарський засіб, який містить ці похідні
Номер патенту: 98834
Опубліковано: 25.06.2012
Автори: Рінг Свен, Менгес Фредерік, Кунке Йоахім, Френцель Томас, Мун Ханс-Петер, Прелле Катя, Хюбнер Ян, Больманн Рольф, Клар Ульріх, Борден Штеффен
Формула / Реферат
1. g-Лактонові похідні 15a,16a-метилен-17-гідрокси-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти загальної формули І
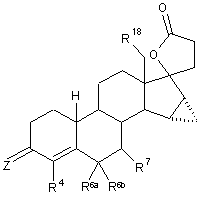 , (I)
, (I)
у якій
Z являє собою кисень, два атоми водню, групу =NOR1 або =NNHSO2R1,
R1 являє собою водень, С1-С10-алкіл, арил, С7-С20-аралкіл,
R4 являє собою водень або галоген,
R6a, R6b, які можуть бути однаковими або різними, являють собою водень, С1-С10-алкіл, С2-С10-алкеніл, С2-С10-алкініл або разом являють собою метилен або 1,2-етандіїл,
R7 являє собою водень, С1-С10-алкіл, С3-С6-циклоалкіл, С2-С10-алкеніл, С2-С10-алкініл,
R6a, R7 разом являють собою зв'язок, кисень або метиленову групу,
R18 являє собою водень, С1-С3-алкіл,
та їх сольвати, гідрати, стереоізомери й солі.
2. g-Лактонові похідні 15a,16a-метилен-17-гідрокси-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, як заявлено у пункті 1, які відрізняються тим, що Z вибирають з групи, яка включає кисень, NOR1 та NNHSO2R1.
3. g-Лактонові похідні 15a,16a-метилен-17-гідрокси-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, як заявлено у пункті 1, які відрізняються тим, що Z являє собою кисень.
4. g-Лактонові похідні 15a,16a-метилен-17-гідрокси-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, як заявлено у пункті 1, які відрізняються тим, що R4 являє собою водень або хлор.
5. g-Лактонові похідні 15a,16a-метилен-17-гідрокси-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, як заявлено у пункті 1, які відрізняються тим, що R6a, R6b разом утворюють 1,2-етандіїл або кожен являє собою водень.
6. g-Лактонові похідні 15a,16a-метилен-17-гідрокси-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, як заявлено у пункті 1, які відрізняються тим, що R7 являє собою водень або метил, або етил, або вініл.
7. g-Лактонові похідні 15a,16a-метилен-17-гідрокси-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, як заявлено у пункті 1, які відрізняються тим, що R6a та R7 разом утворюють метиленову групу.
8. g-Лактонові похідні 15a,16a-метилен-17-гідрокси-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, як заявлено у пункті 1, які відрізняються тим, що R6a та R7 разом являють собою зв'язок.
9. g-Лактонові похідні 15a,16a-метилен-17-гідрокси-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, як заявлено у пункті 1, які відрізняються тим, що R18 являє собою водень або метил.
10. g-Лактонові похідні 15a,16a-метилен-17-гідрокси-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, як заявлено у пункті 1, вибрані з групи
g-лактон 17b-гідрокси-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідрокси-7a-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідрокси-7b-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідроксі-7a-етил-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідроксі-7b-етил-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідрокси-7a-вініл-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідрокси-7b-вініл-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідрокси-7a-циклопропіл-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідрокси-7b-циклопропіл-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідрокси-6-метилен-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідрокси-6a-гідроксиметил-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідрокси-6b-гідроксиметил-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 6,6-(1,2-етандіїл)-17b-гідрокси-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідрокси-6a,7a,15a,16a-бісметилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідрокси-6b,7b,15a,16a-бісметилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідрокси-15a,16a-метилен-19-нор-17a-прегна-4,6-дієн-3-он-21-карбонової кислоти
g-лактон (Е/Z)-3-(гідроксііміно)-17b-гідрокси-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (E/Z)-3-(гідроксііміно)-17b-гідрокси-7a-метил-15a,16a-метилен-19-нор-17α-прегна-4-єн-21-карбонової кислоти,
g-лактон (Е/Z)-3-(гідроксііміно)-17b-гідрокси-7b-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (Е/Z)-3-(гідроксііміно)-17b-гідроксі-7a-етил-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (Е/Z)-3-(гідроксііміно)-17b-гідроксі-7b-етил-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (Е/Z)-3-(гідроксііміно)-17b-гідрокси-7a-вініл-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (Е/Z)-3-(гідроксііміно)-17b-гідрокси-7b-вініл-15a,16a-метилен-19-нор-17α-прегна-4-єн-21-карбонової кислоти,
g-лактон (Е/Z)-3-(гідроксііміно)-17b-гідрокси-7a-циклопропіл-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (E/Z)-3-(гідроксііміно)-17b-гідрокси-7b-циклопропіл-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (Е/Z)-3-(гідроксііміно)-17b-гідрокси-6-метилен-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (E/Z)-3-(гідроксііміно)-17b-гідрокси-6α-гідроксиметил-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (Е/Z)-3-(гідроксііміно)-17b-гідрокси-6b-гідроксиметил-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (Е/Z)-3-(гідроксііміно)-6,6-(1,2-етандіїл)-17b-гідрокси-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (E/Z)-3-(гідроксііміно)-17b-гідрокси-6a,7a,15a,16a-бісметилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (Е/Z)-3-(гідроксііміно)-17b-гідрокси-6b,7b,15a,16a-бісметилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (Е/Z)-3-(гідроксііміно)-17b-гідрокси-15a,16a-метилен-19-нор-17a-прегна-4,6-дієн-21-карбонової кислоти,
g-лактон 17b-гідрокси-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідрокси-7a-метил-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідрокси-7b-метил-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідроксі-7a-етил-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідроксі-7b-етил-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідрокси-7a-вініл-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідрокси-7b-вініл-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідрокси-7a-циклопропіл-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідрокси-7b-циклопропіл-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідрокси-6-метилен-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідрокси-6a-гідроксиметил-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17β-гідрокси-6β-гідроксиметил-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 6,6-(1,2-етандіїл)-17b-гідрокси-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідрокси-6a,7a,15a,16a-бісметилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідрокси-6b,7b,15a,16a-бісметилен-19-нор-17a-прегна-4-єн-3-он-21-карбонової кислоти,
g-лактон 17b-гідрокси-18-метил-15a,16a-метилен-19-нор-17a-прегна-4,6-дієн-3-он-21-карбонової кислоти,
g-лактон (Е/Z)-3-(гідроксііміно)-17b-гідрокси-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (Е/Z)-3-(гідроксііміно)-17b-гідрокси-7a-метил-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (E/Z)-3-(гідроксііміно)-17b-гідрокси-7b-метил-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (E/Z)-3-(гідроксііміно)-17b-гідроксі-7a-етил-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (Е/Z)-3-(гідроксііміно)-17b-гідроксі-7b-етил-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (Е/Z)-3-(гідроксііміно)-17b-гідрокси-7a-вініл-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (Е/Z)-3-(гідроксііміно)-17b-гідрокси-7b-вініл-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (Е/Z)-3-(гідроксііміно)-17b-гідрокси-7a-циклопропіл-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (E/Z)-3-(гідроксііміно)-17b-гідрокси-7b-циклопропіл-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (Е/Z)-3-(гідроксііміно)-17b-гідрокси-6-метилен-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (E/Z)-3-(гідроксііміно)-17b-гідрокси-6a-гідроксиметил-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (Е/Z)-3-(гідроксііміно)-17b-гідрокси-6b-гідроксиметил-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (Е/Z)-3-(гідроксііміно)-6,6-(1,2-етандіїл)-17b-гідрокси-18-метил-15a,16a-метилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (Е/Z)-3-(гідроксііміно)-17b-гідрокси-6a,7a,15a,16a-бісметилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (Е/Z)-3-(гідроксііміно)-17b-гідрокси-6b,7b,15a,16a-бісметилен-19-нор-17a-прегна-4-єн-21-карбонової кислоти,
g-лактон (E/Z)-3-(гідроксііміно)-17b-гідрокси-18-метил-15a,16a-метилен-19-нор-17a-прегна-4,6-дієн-21-карбонової кислоти.
11. g-Лактонові похідні 15a,16a-метилен-17-гідрокси-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, як заявлено в одному з пунктів 1-10, для пероральної контрацепції та для лікування перед-, пери- та постклімактеричних розладів.
Текст
Реферат: -Лактонові похідні 15, 16-метилен-17-гідрокси-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти згідно із даним винаходом мають прогестаційну ефективність. Вони мають загальну хімічну формулу І, у якій Z вибирають із групи, яка включає атом кисню, два атоми водню, NOR і 4 NNHSO2R, де R являє собою водень, C1-С10 алкіл, арил або С7-С20-аралкіл, R являє собою 6а 6b 6а водень або галоген, і крім того, або R , R разом утворюють метилен або 1,2-етандіїл, або R 6b являє собою водень, і R вибирають із групи, яка включає водень, C1-С10-алкіл, C2-С10-алкеніл 7 або C2-С10-алкініл, і R вибирають із групи, яка включає водень, C1-С10-алкіл, C3-С6-циклоалкіл, 6a 6b 7 C2-С10-алкеніл або C2-С10-алкініл, або R являє собою водень, і R i R разом являють собою 18 зв'язок, кисень або утворюють метилен, R являє собою водень або C1-С3-алкіл, і додатково включає їх сольвати, гідрати, стереоізомери й солі. UA 98834 C2 (12) UA 98834 C2 O R 18 O H Z R R 4 R6a R6b 7 . (I) UA 98834 C2 5 10 15 20 25 30 35 Винахід стосується γ-лактонових похідних 15α, 16α-метилен-17-гідрокси-19-нор-17-прегна-4єн-3-он-21-карбонової кислоти із прогестаційною дією, їх застосування й лікарських засобів, що містять похідні, наприклад для лікування перед-, пери- і постклімактеричних і передменструальних розладів. Сполуки із прогестаційною, антимінералокортикоїдною, антиандрогенною або антиестрогенною дією на основі стероїдної структури відомі з літератури, які є похідними, наприклад, з 19-нор-андрост-4-ен-3-ону або його похідного (нумерація стероїдної структури представлена, наприклад, в Fresenius/Gorlitzer 3-те вид., 1991 "Organic-Chemical Nomenclature" стор. 60 наст.). Таким чином, в WO 2006072467 А1 описана сполука 6β, 7β; 15β, 16β-диметилен-3-оксо-17прегн-4-ен-21,17β-карболактон (дроспіренон), що має прогестаційну дію й може застосовуватися, наприклад, для пероральної контрацепції й у препараті для лікування постклімактеричних розладів. Завдяки його відносно низькій спорідненості до рецептора прогестогену і його відносно високій дозі для інгібування овуляції, дроспіренон міститься в протизаплідних засобах, однак, у відносно високій добовій дозі 3 мг. Більш того, дроспіренон також відрізняється тим, що, додатково до прогестаційної дії, він також має альдостеронантагоністичну (антимінералокортикоїдну) і антиандрогенну дію. Ці дві властивості роблять дроспіренон дуже схожим за його фармакологічним профілем на природний прогестоген, прогестерон, який, однак, на відміну від дроспіренону, не має достатньої біодоступності при пероральному введенні. Для зниження введеної дози в WO 2006072467 А1 надалі запропонований 18-метил-19-нор-17-прегн-4-ен-21,17-карболактон і фармацевтичні препарати, що містять таку сполуку, які мають більшу прогестаційну ефективність в порівнянні із дроспіреноном. Додатково, наприклад, в US-A 3,705,179 описані стероїди, які мають антиандрогенну активність й придатні для лікування захворювань, які зв'язані з андрогенами. Задачею даного винаходу є надання сполук, які мають сильне зв'язування, переважно більш сильне у порівнянні із дроспіреноном, з рецептором прогестогену. Крім того, сполуки переважно повинні також мати антимінералокортикоїдну дію й, по відношенню до рецептора андрогену, від нейтральної до слабкої андрогенну дію. Іншою важливою задачею даного винаходу є досягнення збалансованого профілю дії по відношенню до прогестаційної дії й антимінералокортикоїдної дії, таким чином, щоб співвідношення прогестаційної дії до антимінералокортикоїдної дії було меншим, ніж у дроспіренону. Ця задача вирішується за допомогою γ-лактонових похідних 15α, 16α-метилен-17-гідрокси19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти відповідно до винаходу відповідно до пункту 1, застосування похідних відповідно до винаходу відповідно до пункту 12 і лікарського продукту, що містить принаймні одне похідне відповідно до винаходу відповідно до пункту 14. Сприятливі варіанти здійснення винаходу представлені в залежних пунктах формули винаходу. Уданому винаході описані нові γ-лактонові похідні 15,16-метилен-17-гідрокси-19-нор-17прегна-4,20(Z)-діен-3-он-21-карбонової кислоти загальної формули І, 40 ,I 45 у якій 1 1 Z представляє собою кисень, два атоми водню, групу =NOR або =NNHSO2R , 1 R представляє собою водень, С1-С10-алкіл, арил, С7-С20-аралкіл, R4 представляє собою водень або галоген, 6a 6b R , R які можуть бути однаковими або різними, являють собою водень, 1 UA 98834 C2 5 10 15 20 25 30 35 40 45 50 55 60 С1-С10-алкіл, С2-С-10-алкеніл, С2-С10-алкініл або разом являють собою метилен або 1,2етандіїл, 7 R представляє собою водень, С1-С10-алкіл, С3-С6-циклоалкіл, С2-С-10-алкеніл, С2-С10-алкініл, 6a 7 R , R разом, являють собою зв'язок, кисень або метиленову групу, R18 представляє собою водень, С1-С3-алкіл. 6a 6b 7 Залишки R , R і R і тричленне кільце кожний (e) може знаходитися в α або β положенні. Переважними є сполуки формули І, у якій 1 Z представляє собою кисень, групу =NOR , 1 R представляє собою водень, C1-C6-алкіл, арил, С7-С12-аралкіл, 4 R представляє собою водень або галоген, 6a 6b R , R , які можуть бути однаковими або різними, являють собою водень, С 1-С6-алкіл, С2-С6алкеніл, С2-С6-алкініл або разом являють собою метилен або 1,2-етандіїл, 7 R представляє собою водень, С1-С6-алкіл, С3-С6-циклоалкіл, С2-С6-алкеніл, С2-С6-алкініл, 6a 6b R , R разом, являють собою зв'язок, або метиленову групу, 18 R представляє собою водень, С1-С2-алкіл. Особливо переважними є сполуки формули І, у якій Z представляє собою кисень, групу =NOR1, 1 R представляє собою водень, С1-С3-алкіл, 4 R представляє собою водень, хлор або бром, 6a 6b R , R , які можуть бути однаковими або різними, являють собою водень, С1-С3-алкіл, С2-С4-алкеніл, або разом являють собою метилен або 7 разом являють собою 1,2-етандіїл, R представляє собою водень, С1-С4-алкіл, С3-С4циклоалкіл, С2-С4-алкеніл, 6a 7 R , R разом, являють собою зв'язок, або метиленову групу, R18 представляє собою водень, метил. Нумерацію вуглецевого скелету похідного відповідно до винаходу, що має загальну хімічну формулу І, здійснюють відповідно до звичайної нумерації стероїдної структури, наприклад, як описано в Fresenius, у вищенаведеному джерелі. Нумерація залишків, вказаних у пунктах формули винаходу, аналогічно відповідає їх положенню зв'язування у вуглецевому скелеті 4 6 7 18 4 4 похідного, що стосується R , R , R і R . Наприклад, залишок R зв'язаний з С - положенням похідного відповідно до винаходу. По відношенню до груп, визначених для Z, групи NOR' і NNHSO 2R' кожна зв'язана подвійним зв'язком за допомогою N з вуглецевим скелетом похідного відповідно до =NOR' або =NNHSO2R'. OR' в NOR' і NHSO2R' в NNHSO2R' може знаходитися в син- або анти-положенні. 1 6a 6b 7 18 19 20 21a 21b 22 Алкільні групи R , R , R , R , R , R , R , R , R і R являють собою лінійні або розгалужені алкільні групи з 1-10 атомами вуглецю, наприклад, метил, етил, пропіл, ізопропіл, бутил, ізобутил, трет.-бутил, пентил, ізопентил, неопентил, гептил, гексил, децил. 1 6a 6b 7 18 19 20 21a 21b 22 Алкільні групи R , R , R , R , R , R , R , R , R і R можуть бути перфторованими або можуть бути заміщені 1-5 атомами галогену, гідроксильними групами, С1-С4-алкокси групами, С6-С-12-арильними групами (які можуть бути заміщені 1-3 атомами галогену). 6a 6b Алкенільні групи R і R являють собою лінійні або розгалужені алкенові групи з 2-10 атомами вуглецю, такі як, наприклад, вініл, пропеніл, бутеніл, пентеніл, ізобутеніл, ізопентеніл. 6a 6b Алкінільні групи R і R являють собою лінійні або розгалужені алкінові групи з 2-10 атомами вуглецю, такі як, наприклад, етиніл, пропініл, бутиніл, пентиніл, ізобутиніл, ізопентиніл. 6a 6b Алкенільні й алкінільні групи R і R можуть бути заміщені 1-5 атомами галогену, гідроксильними групами, С1-С3-алкокси групами, С6-С12-арильними групами (які можуть бути заміщені 1-3 атомами галогену). 7 Як циклоалкільні груп R , можна розглядати циклопропіл, циклобутил, циклопентил, циклогексил. 7 Циклоалкільні групи R можуть бути заміщені галогеновими, ОН, О-алкілом, СО2Н, СО2алкілом, -NH2, -NO2, -N3-CN, С1-С10-алкільними, С1-С10-ацильними, С1-С10-ацилокси групами. 1 6a 6b 7 Як арильний залишок R , R , R і R можна розглядати заміщені й незаміщені карбоциклічні або гетероциклічні залишки з одним або декількома гетероатомами, наприклад, феніл, нафтил, фурил, тієніл, піридил, піразоліл, піримідиніл, оксазоліл, піридазиніл, піразиніл, хіноліл, тіазоліл, що може бути однократно або багатократно заміщений галогеном, ОН, О-алкілом, СО2Н, СО2алкілом, -NH2, -NO2, -N3, -CN, C1-C10-алкільними, C1-C10-ацильними, C1-C10-ацилокси групами. 1 7 Аралкільні групи в R і R можуть містити аж до 14, переважно від 6 до 10, атомів вуглецю в кільці й від 1 до 8, переважно від 1 до 4, атомів в алкільному ланцюзі. Як аралкільні залишки, можна розглядати, наприклад, бензил, фенілетил, нафтилметил, нафтилетил, фурилметил, тієнілетил, піридилпропіл. Кільця можуть бути однократно або багатократно заміщені 2 UA 98834 C2 5 10 15 20 галогеном, ОН, О-алкілом, СО2Н, СО2-алкілом, -NO2, -N3, -CN, С1-С20-алкільними, С1-С20ацильними, С1-С20-ацилокси групами. Галоген означає фтор, хлор або бром. Похідні із загальної хімічної формули І включають всі стереоізомери і їх суміші. Похідні відповідно до винаходу також можуть знаходитися у формі сольватів, зокрема гідратів, і сполуки відповідно до винаходу, отже, містять полярні розчинники, зокрема воду, як структурний елемент кристалічної ґратки сполук відповідно до винаходу. Полярний розчинник, зокрема вода, може бути присутній у стехіометричних співвідношеннях або навіть у нестехіометричних співвідношеннях. Стехіометричні сольвати й гідрати також називаються гемі, (семі-), моно-, півтора-, ди-, три-, тетра-, пента-, і т.д. сольвати або гідрати. Було виявлено, що сполуки або похідні відповідно до винаходу мають гарну прогестаційну дію. Крім того, деякі сполуки, які представляють інтерес, відповідно до винаходу взаємодіють із мінералокортикоїдним рецептором і здатні виявляти антагоністичну дію. Крім того, сполуки відповідно до винаходу мають від нейтральної до слабкої андрогенну дію по відношенню до рецептора андрогену. Іншою властивістю сполук є той факт, що зв'язування цих сполук з рецептором прогестерону й з мінералокортикоїдним рецептором збалансовано відносно один одного, а саме таким чином, що співвідношення їх здатності зв'язуватися з рецептором прогестерону відносно здатності зв'язуватися з мінералокортикоїдним рецептором є меншим, ніж такі у випадку дроспіренону. Отже, антимінералокортикоїдна дія цих сполук при даній прогестаційній дії є меншою, ніж така в дроспіренону. Якщо дозування даної сполуки відповідно до винаходу ґрунтується на її прогестаційній дії, то, отже, антимінералокортикоїдна дія цієї сполуки при цьому дозуванні є меншою, ніж у дроспіренону. Сполуки, перераховані нижче, переважні відповідно до винаходу: γ-лактон 17β-гідрокси-15α, карбонової кислоти 16α-метилен-19-нор-17α-прегна-4-єн-3-он-21 γ-лактон 17β-гідрокси-7α-метил-15α, 16а-метилен-19-нор-17α-прегна-4-єн-3он-21-карбонової кислоти γ-лактон 17β-гідрокси-7β-метил-15α, 16α-метилен-19-нор-17α-прегна-4-єн-3он-21-карбонової кислоти γ-лактон 17β-гідрокси-7α-етил-15α, 16α-метилен-19-нор-17α-прегна-4-єн-3-он21-карбонової кислоти γ-лактон 17β-гідрокси-7β-етил-15α, 16α-метилен-19-нор-17α-прегна-4-єн-3-он21-карбонової кислоти γ-лактон 17β-гідрокси-7α-вініл-15α, 16α-метилен-19-нор-17α-прегна-4-єн-3-он21-карбонової кислоти γ-лактон 17β-гідрокси-7β-вініл-15α, 16α-метилен-19-нор-17α-прегна-4-єн-3-он21-карбонової кислоти γ-лактон 17β-гідрокси-7α-циклопропіл-15α, 16α-метилен-19-нор-17α-прегна-4єн-3-он-21-карбонової кислоти γ-лактон 17β-гідрокси-7β-циклопропіл-15α, 16α-метилен-19-нор-17α-прегна-4єн-3-он-21-карбонової кислоти γ-лактон 17β-гідрокси-6-метилен-15α, 16α-метилен-19-нор-17α-прегна-4-єн-3он-21-карбонової кислоти 3 UA 98834 C2 γ-лактон 17β-гідрокси-6α-гідроксиметил-1 5а, 16а-метилен-19-нор-17α-прегна4-єн-3-он-21-карбонової кислоти γ-лактон 17β-гідрокси-6β-гідроксиметил-15α, 16α-метилен-19-нор-17α-прегна4-єн-3-он-21-карбонової кислоти γ-лактон 6,б-(1,2-етандіїл)-17β-гідрокси-15α, 16α-метилен-19-нор-17α-прегна4-єн-3-он-21-карбонової кислоти γ-лактон 17β-гідрокси-6α, 7α, 15α, 16α-бісметилен-19-нор-17α-прегна-4-єн-3он-21-карбонової кислоти γ-лактон 17β-гідрокси-6β, 7β, 15α, 16α-бісметилен-19-нор-17α-прегна-4-єн-3он-21-карбонової кислоти γ-лактон 17β-гідрокси-15α, 16α-метилен-19-нор-17α-прегна-4,6-дієн-3-он-21карбонової кислоти γ-лактон 4-хлор-17β-гідрокси-15α, 16α-метилен-19-нор-17α-прегна-4-єн-3-он21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-15α, прегна-4-єн-21-карбонової кислоти 16а-метилєн-19-нор-17α γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-7α-метил-15α, 16α-метилен-19нор-17α-прегна-4-єн-21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-7β-метил-15α, 16α-метилен-19нор-17α-прегна-4-єн-21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-7α-етил-15α, 16α-метилен-19-нор17α-прегна-4-єн-21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-7β-етил-15α, 16α-метилен-19-нор17α-прегна-4-єн-21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-7α-вініл-15α, 16α-метилен-19-нор17α-прегна-4-єн-21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-7β-вініл-15α, 16α-метилен-19-нор17α-прегна-4-ані-21-карбонової кислоти 4 UA 98834 C2 γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-7α-циклопропіл-15α, метилен-19-нор-17α-прегна-4-єн-21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-7β-циклопропіл-15α, метилен-19-нор-17α-прегна-4-єн-21-карбонової кислоти 16α16α γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-6-метилен-15α, 16α-метилен-19нор-17α-прегна-4-єн-21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-6α-гідроксиметил-15α, метилен-19-нор-17α-прегна-4-єн-21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-6β-гідроксиметил-15α, метилен-19-нор-17α-прегна-4-єн-21-карбонової кислоти 16α γ-лактон (E/Z)-3-(гідроксііміно)-6,6-(1,2-етандіїл)-17β-гідрокси-15α, метилен-19-нор-17α-прегна-4-єн-21-карбонової кислоти 16α 16α γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-6α, 7α, 15α, 16α-бісметилен-19нор-17α-прегна-4-єн-21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-6β, 7β, 15α, 16α-бісметилен-19нор-17α-прегна-4-єн-21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-15α, прегна-4,6-дієн-21-карбонової кислоти 16α-метилен-19-нор-17α γ-лактон (E/Z)-3-(гідроксііміно)-4-хлор-17β-гідрокси-15α, 16α-метилен-19-нор17α-прегна-4-єн-21-карбонової кислоти γ-лактон 17β-гідрокси-18-метил-15α, 16α-метилен-19-нор-17α-прегна-4-єн-3он-21-карбонової кислоти γ-лактон 17β-гідрокси-7α-метил-18-метил-15α, прегна-4-єн-3-он-21-карбонової кислоти γ-лактон 17β-гідрокси-7β-метил-18-метил-15α, прегна-4-єн-3-он-21-карбонової кислоти 16α-метилен-19-нор-17α16α-метилен-19-нор-17α γ-лактон 17β-гідрокси-7α-етил-18-метил-15α, 16α-метилен-19-нор-17α-прегна4-єн-3-он-21-карбонової кислоти γ-лактон 17β-гідрокси-7β-етил-18-метил-15α, 16α-метилен-19-нор-17α-прегна4-єн-3-он-21-карбонової кислоти γ-лактон 17β-гідрокси-7α-вініл-18-метил-15α, 16α-метилен-19-нор-17α-прегна4-єн-3-он-21-карбонової кислоти γ-лактон 17β-гідрокси-7β-вініл-18-метил-15α, 16α-метилен-19-нор-17α-прегна4-єн-3-он-21-карбонової кислоти 5 UA 98834 C2 γ-лактон 17β-гідрокси-7α-циклопропіл-18-метил-15α, 16α-метилен-19-нор-17αпрегна-4-єн-3-он-21-карбонової кислоти γ-лактон 17β-гідрокси-7β-циклопропіл-18-метил-15α, 16α-метилен-19-нор-17αпрегна-4-єн-3-он-21-карбонової кислоти γ-лактон 17β-гідрокси-6-метилен-18-метил-15α, прегна-4-єн-3-он-21-карбонової кислоти 16α-метилен-19-нор-17α γ-лактон 17β-гідрокси-6α-гідроксиметил-18-метил-15α, 16α-метилен-19-нор17α-прегна-4-єн-3-он-21-карбонової кислоти γ-лактон 17β-гідрокси-6β-гідроксиметил-18-метил-15α, 16α-метилен-19-нор17α-прегна-4-єн-3-он-21-карбонової кислоти γ-лактон 6,6-(1,2-етандіїл)-17β-гідрокси-18-метил-15α, 16α-метилен-19-нор17α-прегна-4-єн-3-он-21-карбонової кислоти γ-лактон 17β-гідрокси-6α, 7α, 15α, 16α-бісметилен-19-нор-17α-прегна-4-ен-3он-21-карбонової кислоти γ-лактон 17β-гідрокси-6β, 7β, 15α, 16а-бісметилен-19-нор-17α-прегна-4-ен-3он-21-карбонової кислоти γ-лактон 17β-гідрокси-18-метил-15α, 16α-метилен-19-нор-17α-прегна-4,6-дієн3-он-21-карбонової кислоти γ-лактон 4-хлор-17β-гідрокси-15α, 16α-метилен-19-нор-17α-прегна-4-єн-3-он21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-17|3-гідрокси-18-метил-15α, 16α-метилен-19нор-17α-прегна-4-єн-21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-7α-метил-18-метил-15α, 16αметилен-19-нор-17α-прегна-4-єн-21-карбонової кислоти γ-лактон (Е/Z)-3(гідроксііміно)-17β-гідрокси-7β-метил-18-метил-15α, 16α-метилен-19-нор-17αпрегна-4-єн-21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-7α-етил-18-метил-15α, метилен-19-нор-17α-прегна-4-єн-21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-7β-етил-18-метил-15α, метилен-19-нор-17α-прегна-4-єн-21-карбонової кислоти 6 16α16α UA 98834 C2 γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-7α-вініл-18-метил-15α, метилен-19-нор-17α-прегна-4-єн-21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-7β-вініл-18-метил-15α, метилен-19-нор-17α-прегна-4-єн-21-карбонової кислоти 16α16α γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-7α-циклопропіл-18-метил-15α, 16α-метилен-19-нор-17α-прегна-4-єн-21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-7β-циклопропіл-18-метил-15α, 16α-метилен-19-нор-17α-прегна-4-єн-21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-6-метилен-18-метил-15α, метилен-19-нор-17α-прегна-4-єн-21-карбонової кислоти 16α γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-6α-гідроксиметил-18-метил-15α, 16α-метилен-19-нор-17α-прегна-4-єн-21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-6β-гідроксиметил-18-метил-15α, 16α-метилен-19-нор-17α-прегна-4-єн-21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-6,6-(1,2-етандіїл)-17β-гідрокси-18-метил-15α, 16α-метилен-19-нор-17α-прегна-4-єн-21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-6α, 7α, 15α, 16α-бісметилен-19нор-17α-прегна-4-єн-21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-6β, 7β, 15α, 16а-бісметилен-19нор-17α-прегна-4-єн-21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-17β-гідрокси-18-метил-15α, 16α-метилен-19нор-17α-прегна-4,6-дієн-21-карбонової кислоти γ-лактон (E/Z)-3-(гідроксііміно)-4-хлор-17β-гідрокси-18-метил-15α, метилен-19-нор-17α-прегна-4-єн-21-карбонової кислоти 5 10 15 16α У зв'язку з їх прогестаційною ефективністю, нові сполуки, що мають загальну хімічну формулу І, можуть застосовуватися окремо або в комбінації з естрогеном у лікарських засобах для контрацепції. Отже, похідні відповідно до винаходу придатні, зокрема, для одержання лікарського засобу для пероральної контрацепції й для лікування перед-, пери- і постклімактеричних розладів, включаючи застосування в препаратах для гормоно-замісної терапії (HRT). Завдяки сприятливому профілю їх дії, похідні відповідно до винаходу, крім того, особливо придатні для лікування передменструальних розладів, таких як головні болі, депресивні розлади, утримання води й мастодинія. Особливо переважним є застосування похідних відповідно до винаходу для одержання лікарського засобу із прогестаційною, і переважно також антимінералокортикоїдною і від нейтральної до слабкої андрогенною дією. Лікування за допомогою похідних відповідно до винаходу переважно здійснюють на людях, але також можна здійснювати на споріднених видах ссавців, наприклад, собаках і котах. Для застосування похідних за винаходом як лікарських засобів, їх об'єднують із принаймні однією підходящою фармацевтично безпечною допоміжною речовиною, наприклад, носієм. Допоміжна речовина придатна, наприклад, для парентерального, переважно перорального, 7 UA 98834 C2 5 10 15 20 25 30 35 40 45 50 55 60 введення. Прикладами таких речовин є фармацевтично прийнятні органічні або неорганічні допоміжні речовини, такі як, наприклад, вода, желатин, гуміарабік, лактоза, крохмаль, стеарат магнію, тальк, рослинні олії, поліалкіленгліколі та ін. Лікарські засоби можуть знаходитися у твердій формі, наприклад, у вигляді таблеток, таблеток з покриттям, супозиторіїв, капсул, або в рідкій формі, наприклад, у вигляді розчинів, суспензій або емульсій. Необов'язково, вони додатково можуть містити ексципієнти, такі як консерванти, стабілізатори, змочувальні речовини або емульсифікатори, солі для зміни осмотичного тиску або буфери. Для парентерального введення особливо придатні масляні розчини, такі як, наприклад, розчини в кунжутній олії, рициновій олії й бавовняній олії. Для підвищення розчинності можна додавати солюбілізатори, такі як, наприклад, бензилбензоат або бензиловий спирт. Також можливо вводити похідні за винаходом в трансдермальну систему й таким чином вводити їх трансдермально. Для перорального введення особливо придатні таблетки, таблетки з покриттям, капсули, пігулки, суспензії або розчини. Подальшими прикладами шляхів введення є внутрішньовагінальне або внутрішньоматкове введення. Це можна здійснювати у фізіологічно переносимих розчинах, таких як, наприклад, водний або масляний розчин з або без підходящих солюбілізаторів, диспергаторів або емульсифікаторів. Прикладами підходящих масел є арахісова олія, бавовняна олія, рицинова олія або кунжутна олія. Вибір не обмежується тільки вказаними компонентами. Для внутрішньовагінального або внутрішньоматкового введення представляється можливим застосовувати спеціальні системи, такі як внутрішньовагінальна система (наприклад, вагінальне кільце, VRS) або внутрішньоматкова система (IUS), які вивільняють активну речовину згідно із даним винаходом з резервуара протягом тривалого періоду (наприклад, 1, 2, 3, 4 або 5 років). Типовим прикладом внутрішньоматкової системи, що може бути згадана, є MIRENA®. Вона представляє собою Т-подібну внутрішньоматкову систему, що вивільняє левоноргестрел, що випускається Bayer Schering Pharma AG. Введення також можна здійснювати за допомогою імплантованої депо-системи, що складається з інертної речовини-носія, такої як, наприклад, біорозкладний полімер або синтетичний силіконовий полімер. Ці депо-системи вивільняють активний компонент контрольованим чином протягом тривалого періоду (наприклад, від 3 місяців до 3 років) і імплантують підшкірно. Доза похідних за винаходом в препаратах для контрацепції повинна становити від 0,01 до 10 мг на добу. Добова доза для лікування передменструальних розладів становить приблизно від 0,1 до 20 мг. Прогестаційні похідні за винаходом переважно вводять перорально в складі препаратів для контрацепції й лікарських засобів для лікування передменструальних розладів. Добову дозу переважно вводять у вигляді однократної дози. Вищевказані дозування стосуються форм для перорального введення. При застосуванні депо-препарату, підходяща доза, еквівалентна до вищевказаних пероральних доз, вивільняється безперервно щодня з депо-систем, описаних вище, і застосовується протягом тривалого часу. Депо-препарат, наприклад, IUS, вивільняє за добу кількість від 0,005 до 10 мг сполуки загальної формули 1. Прогестаційно- і естрогенно-активні компоненти переважно застосовують спільно перорально в контрацептивних препаратах. Добову дозу переважно вводять у вигляді однократної дози. Як естрогени, можна згадати синтетичні естрогени, переважно етинілестрадіол, але також местранол, і природні естрогени, включаючи фітоестрогени. Естроген вводять у добовій кількості, що відповідає фармакологічній дії від 0,01 до 0,04 мг етинілестрадіолу. Ця кількість відповідає формі для перорального введення. Якщо вибирають інший шлях введення, то використовують підходящу дозу, еквівалентну до вищевказаної пероральної дози. Як естрогени у лікарських засобах для лікування перед-, пери- і постклімактеричних розладів і для гормоно-замісної терапії, головним чином використовують природні естрогени, зокрема естрадіол, але також складні ефіри естрадіолу, наприклад, естрадіол валерат, або також кон'юговані естрогени (СЕЕ = кон'юговані кінські естрогени). Прогестаційну, антимінералокортикоїдну й андрогенну або антиандрогенну дію сполук відповідно до винаходу досліджували за допомогою наступних методів: 1. Тест зв'язування рецептора прогестерону: Використовуючи цитозоль із клітин комах, які експресують рецептор прогестерону (Ні5), визначали конкурентне зв'язування з рецептором прогестерону за допомогою здатності 3 витісняти Н-прогестерон як еталонну речовину з рецептора. Якщо сполука має спорідненість, 8 UA 98834 C2 5 10 15 20 25 30 35 40 45 50 55 60 що відповідає прогестерону, то це відповідає конкурентному фактору (CF) 1. Значення CF більше 1 характеризують більш низьку спорідненість до рецептора прогестерону, і значення CF менше 1 характеризують більш високу спорідненість. 2. Тест зв'язування мінералокортикоїдного рецептора: Тест здійснювали, як описано в 1., з наступними модифікаціями: використовували цитозоль із клітин комах, які експресують мінералокортикоїдний рецептор (Ні5), і порівняльною 3 речовиною був Н-альдостерон. 3. Тест зв'язування рецептора андрогену: Тест здійснювали, як описано в 1., з наступними модифікаціями: використовували цитозоль 3 із клітин комах, які експресують рецептор андрогену (Ні5), і порівняльною речовиною був Нтестостерон. Результати тестів зв'язування й співвідношення конкурентних факторів CF(PR) і CR(MR) представлено в таблиці 1, де для порівняння також представлені значення зв'язування з рецептором дроспіренону як еталонної речовини А. 4. Визначення прогестаційної дії шляхом трансактиваційних тестів: Культуральним середовищем, яке використовували для культивування клітин, використовуваних для дослідження, було DMEM (модифіковане Дульбеко середовище Ігла: 4500 мг/мл глюкози; РАА, № Е15-009) з 10 % FCS (Biochrom, S0115, партія № 615В), 4 мМ Lглутамін, 1 % пеніцилін/стрептоміцин, 1 мг/мл G418 і 0,5 мкг/мл пуроміцину. Репортерні клітинні лінії (СНО K1 клітини, стабільно трансфектовані за допомогою злитого білка з домену, що зв'язує PR-ліганд і Gal4-трансактиваційного домену й репортерної конструкції, що містить люциферазу під контролем GаІ4-чутливого промотору) висівали при 4 щільності 4×10 клітин у білі, непрозорі планшети для культивування тканин кожний на 96 лунок (PerkinElmer, № Р12-106-017) і витримували в культуральному середовищі з 3 % DCC-FCS (сироватка, оброблена активованим вугіллям для видалення інтерферуючих компонентів, що містяться в сироватці). Через вісім годин додавали тестовані сполуки, і клітини інкубували зі сполуками протягом 16 годин. Тести здійснювали в трьох повторах. Після закінчення інкубування середовище, що містить ефектор, видаляли й замінювали буфером для лізису. Потім додавали субстрат для люциферазного аналізу (Promega, № Е1501), потім планшети на 96 лунок поміщали в люмінометр для аналізу мікропланшет (Pherastar, BMG labtech), і вимірювали люмінесценцію. Розраховували значення ІС 50, використовуючи програмне забезпечення для розрахунку залежностей доза-ефект. У таблиці 1 представлені результати тестів і (для порівняння, що відповідають результати для дроспіренону як еталонної речовини А. Якщо приготування вихідних сполук не описано в даній заявці, то вони відомі фахівцеві в даній галузі техніки або можуть бути отримані аналогічно до відомих сполук або способів, описаних у даній заявці. Ізомерні суміші можуть бути розділені на окремі сполуки за допомогою загальноприйнятих способів, наприклад, кристалізації, хроматографії або утворення солі. Солі одержують загальноприйнятим способом, шляхом додавання, до розчину сполуки, що має загальну хімічну формулу І, еквівалентної кількості або надлишку основи або кислоти, яка необов'язково знаходиться в розчині, при необхідності, розділення осаду або обробки розчину звичайним способом. Сполуки загальної формули І одержують, використовуючи як вихідні речовини сполуки 4 6a 6b загальної формули 1 (Схема 2), відповідно до методів, представлених на схемі 1, де R , R R 7 18 7 R R і Z мають значення, вказані раніше, і R6, R в 5 і 6, разом являють собою кисень або метиленову групу, 19 U представляє собою атом кисню, дві алкокси групи OR , С2-С10-алкілен-αω-діокси групу, яка може бути лінійною або розгалуженою, і 19 R представляє собою С1-С20-алкільний залишок, 20 R представляє собою С1-С20-алкільний залишок, 21a 21b 22 X представляє собою NR R групу, алкокси групу OR 21a 21b R R як (можуть бути однаковими або різними, являють собою водень, С1-С10-алкіл або разом С4-С10-αω-алкіленову групу, яка може бути лінійною або розгалуженою, 22 R представляє собою С1-С20-алкільний залишок. Сполуки 2 і 3 на схемі 1 кожна має подвійний зв'язок між С5 і С6 або С5 і С10 і інший подвійний зв'язок між С2 і С3 або С3 і С4. Сполуки 7-9 на схемі 1 кожна має подвійний зв'язок між С4 і С5 або С5 і С6 або С5 і С10. Для фахівця в даній галузі техніки очевидно, що в описах синтетичних перетворень завжди передбачається, що, при необхідності, інші функціональні групи, які присутні на стероїдній структурі, підходящим чином захищені. Введення 6,7-подвійного зв'язку з утворенням сполук, 9 UA 98834 C2 5 10 15 20 25 30 35 40 45 50 55 60 що мають загальні хімічні формули 4, 13 або 18, здійснюють шляхом бромування відповідних 3,5-дієнольних простих ефірів 3, 12 або 17 з наступним видаленням бромистого водню (див., наприклад, J. Fried, J.A. Edwards, Organic Reactions in Steroid Chemistry, Van Nostrand Reinhold Company 1972, стор. 265-374). Бромування дієнольного простого ефіру сполук 3, 12 або 17 можна здійснювати, наприклад, як описано в Steroids 1, 233 (1963). Видалення бромистого водню з утворенням сполук, що мають загальні хімічні формули 4, 13 або 18, здійснюють шляхом нагрівання 6-бром сполуки з лужними реагентами, наприклад, з LiBr або Li 2CO3, в апротонних розчинниках, таких як диметилформамід, при температурах 50-120 °C або альтернативно шляхом нагрівання 6-бром сполуки в розчиннику, такому як колідин або лутидин. 4 Введення замісника R можна здійснювати, наприклад, використовуючи як вихідну речовину сполуку формули 6, 11, 13, 14, 16 або 18, шляхом епоксидування 4,5-подвійного зв'язку з перекисом водню в лужних умовах і взаємодії отриманих епоксидів у підходящому розчиннику з 4 4 кислотами, що мають загальну формулу H-R , де R може являти собою атом галогену, 4 переважно хлор або бром. Сполуки, у яких R представляє собою бром, можна піддавати реакції, наприклад, з 2,2-дифтор-2-(фторсульфоніл)метил ацетатом у диметилформаміді в 4 присутності йодиду міді (І), одержуючи сполуки, у яких R представляє собою фтор. Альтернативно, використовуючи як вихідну речовину сполуку формули 6, 11, 13, 14, 16 або 18, галоген може бути введений безпосередньо шляхом взаємодії із сульфурил хлоридом або 4 сульфурил бромідом у присутності підходящої основи, наприклад, піридину, де R представляє собою хлор або бром. Сполуку 4 перетворюють шляхом метенілування 6,7-подвійної суміші за допомогою відомих методів, наприклад, з метилідом диметилсульфоксонію (див., наприклад, DE-A 11 83 500, DE-A 6 29 22 500, ЕР-А 0 019 690, US-A 4,291,029; J. Am. Chem. Soc. 84, 867 (1962)) до сполуки 5 (R , 7 R разом утворюють метиленову групу), одержуючи суміш α- і β-ізомерів, які можна розділити на окремі ізомери, наприклад, шляхом хроматографії. Сполуки типу 5 можуть бути отримані, як описано в прикладах, або аналогічно до цих описів, використовуючи реагенти, аналогічні до 6a 6b вказаних у цих описах. Синтез спіроциклічної сполуки 18 (R , R разом утворюють 1,2-етандіїл) здійснюють, використовуючи як вихідні речовини сполуки 11 або 14, які спочатку перетворюють 21a 21b у похідне 3-аміно-3,5-дієну 15 (Х=NR R ). Шляхом взаємодії з формаліном у спиртовому 6 розчині, одержують похідне 6-гідроксиметилену 16 (R = гідроксиметилен). Після перетворення гідроксильної групи в групу, яка вилучається, таку як мезилат, тозилат або навіть бензоат, сполуку 18 можна одержувати шляхом взаємодії з йодидом триметилсульфоксонію, використовуючи основи, такі як гідроксиди лужних металів, алкоголяти лужних металів, у підходящих розчинниках, таких як диметилсульфоксид. 6 Для введення 6-метиленової групи, сполука 16 (R = гідроксиметилен) може бути 6a 6b дегідрована, наприклад, із соляною кислотою в діоксані/воді. Сполука 18 (R , R разом утворюють метилен) також може бути отримана після перетворення гідроксильної групи в групу, яка вилучається, таку як мезилат, тозилат або навіть бензоат (див. DE-A 34 02 3291, ЕР-А. 0 150 157, US-A 4,584,288; J. Med. Chem. 34, 2464 (1991)). Іншою можливістю одержання 6-метиленових сполук 18 є пряма реакція 4(5) - ненасичених 6 3-кетонів, таких як сполука 16 (R = водень), з ацеталями формальдегіду в присутності ацетату натрію, наприклад, з оксихлоридом фосфору або пентахлоридом фосфору в підходящих розчинниках, таких як хлороформ (див., наприклад, К. Annen, Η. Hofmeister, Η. Laurent і R. Wiechert, Synthesis 34 (1982)). 6-метиленові сполуки можна використовувати для одержання сполук загальної формули 18, 6a 6b 7 де R представляє собою метил і R і R разом утворюють додатковий зв'язок. Для цього представляється можливим використовувати, наприклад, метод, описаний в Tetrahedron 21, 1619 (1965), у якому ізомеризацію подвійного зв'язку здійснюють шляхом нагрівання 6-метиленових сполук в етанолі з каталізатором 5 % паладій/активоване вугілля, попередньо обробленим або воднем або шляхом нагрівання з невеликою кількістю циклогексену. Ізомеризацію також можна здійснювати з каталізатором, який не піддавали попередній обробці, якщо до реакційної суміші додавали невелику кількість циклогексену. Утворенню невеликих порцій гідрованих продуктів можна запобігати шляхом додавання надлишку ацетату натрію. 22 Альтернативно, сполуку 17 (Х=OR ) можна використовувати як попередник. Описано пряме одержання похідних 6-метил-4,6-дієн-3-ону (див. К. Annen, Η. Hofmeister, H. Laurent i R. Wiechert, Lieb. Ann, 712 (1983)). 6b Сполуки 18, у яких R представляє собою α-метильну функціональну групу, можуть бути 6a 6b отримані в підходящих умовах з 6-метиленових сполук (18: R , R разом утворюють метилен) шляхом гідрування в підходящих умовах. Найкращі результати (селективне гідрування екзо 10 UA 98834 C2 5 10 15 20 25 30 35 40 45 50 метиленової функціональної групи) одержують шляхом трансферного гідрування (J. Chem. Soc. 3578 (1954)). Якщо 6-метиленові похідні 18 нагрівають у підходящому розчиннику, наприклад, етанолі, у присутності донора гідриду, наприклад, циклогексену, то при цьому одержують 6αметильні похідні в дуже хороших виходах. Невеликі кількості 6β-метильної сполуки можуть ізомеризуватися в кислих умовах (Tetrahedron 1619 (1965)). Також можна здійснювати селективне приготування 6β-метильних сполук. Для цього, 4-ен-3они, такі як сполука 16, піддають реакції, наприклад, з етиленгліколем, триметил ортоформіатом у дихлорметані в присутності каталітичних кількостей кислоти, наприклад, птолуолсульфокислоти, одержуючи відповідні 3-кеталі. При здійсненні такої кеталізації 5 відбувається ізомеризація подвійного зв'язку в положенні С . Селективне епоксидування цього 5-подвійного зв'язку здійснюють, наприклад, за допомогою органічних перкислот, наприклад, мхлорпербензойної кислоти, у підходящому розчиннику, такому як дихлорметан. Як альтернатива, епоксидування також можна здійснювати з перекисом водню в присутності, наприклад, гексахлорацетону або 3-нітротрифторацетофенону. Потім утворені 5,6α-епоксиди можуть бути розкриті аксіально, використовуючи підходящі галогеніди алкілмагнію або алкіллітієві сполуки. У такий спосіб одержують 5α-гідрокси-6β-алкільні сполуки. 3-кето захисна група може бути відщеплена, одержуючи 5α-гідрокси функціональну групу, шляхом обробки в м'яких кислих умовах (оцтова кислота або 4 н. соляна кислота при 0 °C). При лужному видаленні 5α-гідрокси функціональної групи, наприклад, з розведеним водним розчином гідроксиду натрію, одержують 3-кето-4-єн сполуки з 6-алкільною групою в β положенні. Альтернативно, при відщепленні кеталю в більш жорстких умовах (водна соляна кислота або інша сильна кислота) одержують відповідні 6α-алкільні сполуки. Введення 7-алкільної, 7-алкенільної або 7-алкінільної групи з утворенням сполук загальної формули 14, здійснюють шляхом 1,6-приєднання відповідної металоорганічної сполуки до попередника загальної формули 13, під впливом солі міді. Переважними є двовалентні метали, такі як магній і цинк; як протиіон переважними є хлор, бром і йод. Підходящими солями міді є одновалентні або двовалентні сполуки міді, наприклад, хлорид міді, бромід міді або ацетат міді. Реакцію здійснюють в інертному розчиннику, наприклад, тетрагідрофурані, простому діетиловому ефірі або дихлорметані. Отримані сполуки 6, 11, 13, 14, 16, 18 або 20, у яких Ζ представляє собою атом кисню, можуть бути перетворені шляхом реакції з гідрохлоридом гідроксиламіну, гідрохлоридами алкілоксіаміну або сульфонілгідразинами в присутності третинного аміну при температурах від 20 до +40 °C у їх відповідні оксими в E/Z-конфігурації або сульфонілгідразони (загальної 1 1 формули І, де Ζ представляє собою NOR , NNHSO2R )). Підходящими третинними основами є, наприклад, триметиламін, триетиламін, піридин, Ν,Ν-диметиламінопіридин, 1,5діазабіцикло[4,3,0]нон-5-ен (DBN) і 1,5-діазабіцикло[5,4,0]ундец-5-ен (DBU), переважним є піридин. Аналогічний метод описаний, наприклад, в WO 98/24801 для одержання відповідних 3оксііміно похідних дроспіренону. Для одержання кінцевого продукту, що має загальну хімічну формулу І, де Ζ представляє собою два атоми водню, 3-оксо група може бути вилучена, наприклад, відповідно до інструкцій, представлених в DE-A 28 05 490, шляхом відновного розщеплення тіокеталю 3-кето сполуки на підходящому попереднику, наприклад, сполуках загальних формул 6, 11, 13, 14, 16, 18 або 20. Утворення спіролактонів сполук загальних формул 6 або 11 здійснюють, використовують як вихідні речовини відповідні 17гідроксипропенільні сполуки 5 або 10, шляхом окислення. Окисними процесами, які можуть бути згадані, є, наприклад, окислення Джонса, окислення з перманганатом калію, наприклад, у водній системі трет-бутанолу й дигідрофосфату натрію, окислення із хлоритом натрію у водному трет-бутанолі, необов'язково в присутності пастки для хлору, наприклад, 2-метил-2бутену, або шляхом окислення з діоксидом марганцю. Альтернативно, спіролактон може бути введений безпосередньо з кетонів загальних формул 1 або 7 необов'язково також після відщеплення простих єнольних ефірів в 1 або кеталів в 7 відповідно до способу, описаного в Georges Sturtz і ін., в Tetrahedron Letters 47 (1976). 11 UA 98834 C2 5 Сполука 1 на схемі 2 у кожному випадку має подвійний зв'язок між С5 і С6 або С5 і С10 і інший подвійний зв'язок між С2 і С3 або С3 і С4. 12 UA 98834 C2 5 Наступні приклади призначені для подальшого пояснення винаходу, без обмеження представленими прикладами: Приклад 1: (17-спіролактонізація з діоксидом марганцю) γ-Лактон 17β-гідрокси-15α, 16α-метилен-19-нор-17α-прегна-4-єн-3-онкарбонової кислоти 10 15 1,14 г діоксид марганцю додавали до розчину 150 мг сполуки, приготовленої відповідно до прикладу 1а, в 7 мл дихлорметані й перемішували приблизно протягом 16 годин при 23 °C. Його фільтрували через целіт і після концентрування шляхом упарювання й хроматографії, виділяли 125 мг вказаної в заголовку сполуки. 1 Н-ЯМР (CDCI3): δ=0,52 (1Н), 0,57 (1Н), 0,75 (1Н), 1,03 (1Н), 1,15 (1Н), 1,22 (3Н), 1,23-134 (3Н), 1,43-1,65 (3Н), 1,76-1,86 (2Н), 1,97-2,56 (11Н), 5,84 (1Н) част, на млн. Приклад 1а: (розщеплення 3-кеталю) 17α(Z)-(3'-Пдроксипроп-1'-іл)-15α, 16α-метилен-17β-гідроксіестра-4-єн-3-он 20 30 1,8 мкл 4 н. соляної кислоти додавали до розчину 880 мг сполук, приготовлених відповідно до прикладу 1b, в 35 мл ацетону і його перемішували протягом 1 години при 23 °C. Його вливали насичений розчин гідрокарбонату натрію, декілька разів екстрагували етилацетатом, об'єднані органічні екстракти промивали насиченим розчином хлориду натрію й висушували над сульфатом натрію. Залишок, отриманий після фільтрації й упарювання розчинника, очищали шляхом хроматографії. Виділяли 580 мг вказаної в заголовку сполуки. Приклад 1b: (гідроборування) 17α(Z)-(3'-Гідроксипроп-1'-іл)-15α, 16α-метилен-17β-гідроксіестра-5-єн-3-он-3-етилен кеталь і 17α(Z)-(3'-гідроксипроп-1'-іл)-15α, 16α-метилен-17β-гідроксіестра-5(10)-єн-3-он-3-етилен кеталь 35 10,5 мл 0,5-молярного розчину 9-борабіциклононану в тетрагідрофурані додавали до розчину 643 мг сполуки, приготовленої відповідно до прикладу 1с, в 7,5 мл тетрагідрофурану і 25 13 UA 98834 C2 5 його перемішували протягом 4 годин при 23 °C. Його охолоджували до 4 °C, додавали 4,6 мл 5 % розчину гідроксиду натрію й 1,2 мл 30 % розчину перекису водню і його перемішували додатково протягом 15 годин при 23 °C. Його екстрагували етилацетатом, об'єднані органічні екстракти промивали водою, насиченим розчином тіосульфату натрію, і насиченим розчином хлориду натрію й висушували над сульфатом натрію. Після фільтрації й видалення розчинника, виділяли 880 мг вказаної в заголовку сполуки, і піддавали подальшій реакції без очищення. Приклад 1с: (приєднання 17-алілу) 17α-(2'-Пропен-1'-іл)-15α, 16α-метилен-17β-гідроксіестра-5-єн-3-он-3-етилен кеталь і 17α-(2'пропен 1'-іл)-15α, 16а-метилен-17β-гідроксіестра-5(10)-єн-3-он-3-етилен кеталь 10 15 20 4,38 мл 1-молярного розчину броміду алілмагнію в простому діетиловому ефірі додавали при 4 °C до розчину 600 мг сполуки, приготовленої відповідно до прикладу 1d, в 10 мл дихлорметану, перемішували протягом 1 хвилини й вливали в насичений розчин хлориду амонію. Його екстрагували етилацетатом, об'єднані органічні екстракти промивали насиченим розчином хлориду натрію й висушували над сульфатом натрію. Після фільтрації й видалення розчинника, виділяли 690 мг вказаної в заголовку сполуки, і піддавали подальшій реакції без очищення. Приклад 1d: (окислення 17-ОН) 15α, 16α-Метилен-естра-5-ен-3,17-діон-3-етилен кеталь і 15α, 16α-метилен-естра-5(10)-ен3,17-діон-3-етилен кеталь 25 30 На кінчику шпателя молекулярного сита 4Å, 700 мг N-метилморфоліно-N-оксида, і 90 мг перрутенату тетрабутиламонію додавали до розчину 1,06 г сполуки, приготовленої відповідно до прикладу 1е, в 32 мл дихлорметану і його перемішували при 23 °C приблизно протягом 16 годин. Його концентрували шляхом упарювання й залишок очищали шляхом хроматографії. Виділяли 878 мг вказаних у заголовку сполук. Приклад 1е: (3-єнольний простий ефір в етилен кеталь) 15α, 16α-Метилен-17α-гідроксіестра-5-єн-3-он-3-етилен кеталь і 15α, 16α-метилен-17αгідроксіестра-5(10)-єн-3-он-3-етилен кеталь 35 40 10 мл етиленгліколю й 4,4 мг гідрати п-толуолсульфонової кислоти додавали до розчину 500 мг сполуки, приготовленої відповідно до прикладу 1f, в 10 мл тетрагідрофурану і його перемішували при 23 °C протягом 2 годин. Його вливали насичений розчин гідрокарбонату натрію, декілька разів екстрагували етилацетатом, об'єднані органічні екстракти промивали насиченим розчином хлориду натрію й висушували над сульфатом натрію. Залишок, отриманий після фільтрації й упарювання розчинника, очищали шляхом хроматографії. Виділяли 359 мг вказаної в заголовку сполуки. Приклад 1f: (Бірх) α, 16α-метилен-17α-гідроксіестра-2,5(10)-дієн 45 14 UA 98834 C2 5 10 15 20 25 30 35 40 45 9,91 г літію додавали до 597 мл аміаку при -75 °C і протягом 1 години по краплях додавали розчин 24,6 г сполуки, приготовленої відповідно до прикладу 1д, в 1,2 л тетрагідрофурану. Додавали 720 мл етанолу, через 1 годину йому дозволяли нагрітися аж до -50 °C і його перемішували додатково протягом 2 годин. Потім додавали 600 мл води, суміші дозволяли нагрітися аж до 23 °C, її декілька разів екстрагували етилацетатом, об'єднані органічні екстракти промивали насиченим розчином хлориду натрію й висушували над сульфатом натрію. Після фільтрації й видалення розчинника, виділяли 27,1 г вказаної в заголовку сполуки, і піддавали подальшій реакції без очищення. Приклад 1g: (Симмонс Сміт) 3-метокси-15α, 16α-метилен-17α-гідроксіестра-1,3,5(10)-триєн 86,6 г цинкового пилу додавали до суспензії 1,5 г ацетату міді (II) в 900 мл простого діетилового ефіру й її нагрівали в колбі зі зворотним холодильником протягом 10 хвилин. Потім додавали 11,7мл дийодметану, і суміш нагрівали в колбі зі зворотним холодильником додатково протягом 30 хвилин. Додавали розчин 37,6 г сполуки, приготовленої відповідно до прикладу 1h, в 100 мл тетрагідрофурану й, розпорошували протягом усього 40 годин, додатково додавали 35 мл дийодметану. Охолоджену суміш фільтрували через целіт, фільтрат промивали насиченим розчином хлориду натрію й висушували над сульфатом натрію. Залишок, отриманий після фільтрації й упарювання розчинника, очищали шляхом перекристалізації. Виділяли 24,6 г вказаної в заголовку сполуки. Приклад 1h: (омилення бензоату) 3-метокси-17α-гідроксіестра-1,3,5(10), 15-тетраєн 75,5 г карбонату калію додавали до розчину 96,3 г сполуки, приготовленої відповідно до прикладу 1і, в 1,1 л метанолу і його перемішували при 50 °C протягом 2 годин. Його концентрували шляхом упарювання, додавали воду, його декілька разів екстрагували етилацетатом, об'єднані органічні екстракти промивали водою й висушували над сульфатом натрію. Залишок, отриманий після фільтрації й упарювання розчинника, очищали шляхом перекристалізації. Виділяли 46 г вказаної в заголовку сполуки. Приклад 1і: (Міцунобу) 3-метокси-естра-1,3,5(10),15-тетраен-17-іловий ефір 4-нітробензойної кислоти 121 г трифенілфосфіну, 27,1 г 4-нітробензойної кислоти, і 30,9 мл діізопропілового ефіру азодикарбонової кислоти додавали до розчину 43,9 г 3-метокси-17β-гідроксіестра-1,3,5(10),15тетраєну в 1,6 л тетрагідрофурану і його перемішували протягом 23 °C протягом 2 годин. Додавали насичений розчин хлориду натрію, його екстрагували етилацетатом, об'єднані органічні екстракти промивали насиченим розчином хлориду натрію й висушували над сульфатом натрію. Залишок, отриманий після фільтрації й упарювання розчинника, ресуспендували в 1,2 л ацетону, додавали 80 мл 30 % розчину перекису водню при охолодженні, і через 20 хвилин його вливали, при охолодженні, в 600 мл напівконцентрованого розчину тіосульфату натрію. Його екстрагували етилацетатом, об'єднані органічні екстракти промивали насиченим розчином хлориду натрію й висушували над сульфатом натрію. Залишок, 15 UA 98834 C2 5 10 15 20 25 30 отриманий після фільтрації й упарювання розчинника, очищали шляхом перекристалізації. Виділяли 52,5 г вказаної в заголовку сполуки. Приклад 2: (утворення дієнону із простого дієнольного ефіру) γ-лактон 17β-гідрокси-15α, 16α-метилен-19-нор-17α-прегна-4,6-дієн-3-он-21-карбонової кислоти 119 мг ацетату натрію, 1,2 мл води й, порціями, усього 460 г дибромгідантоїну додавали при -10 °C до розчину 1,14 г c полуки, приготовленої відповідно до прикладу 2а, в 2,1 мл Nметилпіролідону. Через 30 хвилин, додавали 447 мг броміду літію й 392 мг карбонату літію і його нагрівали протягом 2,5 годин при температурі бані 100 °C. Його вливали в суміш льоду й розчину хлориду натрію й осаджений продукт відфільтровували з відсмоктуванням. Виділяли 910 мг вказаної в заголовку сполуки у вигляді кристалічного вихідного продукту, які можна безпосередньо піддавати подальшої реакції. 1 Н-ЯМР (CDCI3): δ=0,59 (1Н), 0,72 (1Н), 1,00 (1Н), 1,10 (1Н), 1,19-1,59 (5Н), 1,24 (3Н), 1,79 (1Н), 1,87 (1Н), 1,99-2,59 (9Н), 5,80 (1Н), 6,24 (1Н), 6,38 (1Н) част. на млн. Приклад 2а: (утворення простого дієнольного ефіру) γ-лактон 17β-гідрокси-3-метокси-15α, 16α-метилен-19-нор-17α-прегна-3,5-дієн-21-карбонової кислоти 221 мг п-толуолсульфонату піридинію додавали до розчину 2г сполуки, приготовленої відповідно до прикладу 1, в 29 мл 2,2-диметоксипропану і його нагрівали в колбі зі зворотним холодильником протягом 4 годин. Його вливали насичений розчин гідрокарбонату натрію, декілька разів екстрагували етилацетатом, об'єднані органічні екстракти промивали насиченим розчином хлориду натрію й висушували над сульфатом натрію. Залишок, отриманий після фільтрації й упарювання розчинника, очищали шляхом кристалізації. Виділяли 1,15 г вказаної в заголовку сполуки. Приклад 3: (1,6-приєднання (метил)) γ-лактон 17β-гідрокси-7α-метил-15α, 16α-метилен-19-нор-17α-прегна-4-єн-3-он-21карбонової кислоти (А) і γ-лактон 17β-гідрокси-7β-метил-15α, 16α-метилен-19-нор-17α-прегна-4єн-3-он-21-карбонової кислоти (В) 35 40 45 250 мкл 3-молярного розчину хлориду метилмагнію в тетрагідрофурані по краплях додавали до суспензії 7 мг хлориду міді (І) в 1,2 мл тетрагідрофурану, охолодженого до -30 °C, і його перемішували додатково протягом 10 хвилин. Його охолоджували до -25 °C і розчин додавали по краплях до 100 мг сполуки, приготовленої відповідно до прикладу 2, в 5 мл тетрагідрофурану. Через 2 хвилин його вливали він. соляну кислоту, декілька разів екстрагували етилацетатом, об'єднані органічні екстракти промивали насиченим розчином хлориду натрію й висушували над сульфатом натрію. Залишок, отриманий після фільтрації й упарювання розчинника, очищали шляхом хроматографії. 23 мг вказаної в заголовку сполуки А 16 UA 98834 C2 5 виділяли разом з усе ще забрудненою сумішшю, що містила пропорції вказаної в заголовку сполуки В. 1 Н-ЯМР (CDCI3) А: δ=0,51 (1Н), 0,66 (1Н), 0,81 (3Н), 0,94-1,10 (2Н), 1,22 (3Н), 1,18-1,60 (6Н), 1,74-1,91 (3Н), 2,00-2,58 (10Н), 5,85 (1Н) част. на млн. Приклад 4: γ-лактон 17β-гідрокси-7α-етил-15α, 16α-метилен-19-нор-17α-прегна-4-єн-3-он-21-карбонової кислоти (А) і γ-лактон 17β-гідрокси-7β-етил-15α, 16α-метилен-19-нор-17α-прегна-4-єн-3-он-21карбонової кислоти (В) 10 15 20 Аналогічно до прикладу 3, піддавали реакції 200 мг сполуки, приготовленої відповідно до прикладу 2, використовуючи хлорид етилмагнію, і, після обробки й очищення, 81 мг вказаної в заголовку сполуки А виділяли разом з усе ще забрудненою сумішшю, що містила пропорції вказаної в заголовку сполуки В. 1 Н-ЯМР (CDCI3) А: δ=0,51 (1Н), 0,75 (1Н), 0,90 (3Н), 0,95-1,10 (3Н), 1,18-1,38 (4Н), 1,22 (3Н), 1,44 (1Н), 1,50 (1Н), 1,77-1,96 (4Н), 2,01-2,10 (2Н), 2,15 (1Н), 2,22-2,54 (6Н), 2,60 (1Н), 5,86 (1Н) част. на млн. Приклад 5: γ-лактон 17β-гідрокси-7α-вініл-15α, 16α-метилен-19-нор-17α-прегна-4-єн-3-он-21-карбонової кислоти (А) і γ-лактон 17β-гідрокси-7β-вініл-15α, 16α-метилен-19-нор-17α-прегна-4-єн-3-он-21карбонової кислоти (В) 25 30 35 40 45 Аналогічно до прикладу 3, піддавали реакції 210 мг сполуки, приготовленої відповідно до прикладу 2, використовуючи хлорид вінілмагнію, і, після обробки й очищення, 16 мг вказаної в заголовку сполуки А виділяли разом з усе ще забрудненою сумішшю, що містила пропорції вказаної в заголовку сполуки В. 1 Н-ЯМР (CDCI3) А: δ=0,45 (1Н), 0,63 (1Н), 0,97-1,10 (2Н), 1,16-1,36 (4Н), 1,23 (3Н), 1,40-1,57 (2Н), 1,78-2,17 (5Н), 2,22-2,54 (6Н), 2,60 (1Н), 2,79 (1Н), 5,10 (1Н), 5,18 (1Н), 5,69 (1Н), 5,88 (1Н) част. на млн. Приклад 6: γ-лактон 17β-гідрокси-7α-циклопропіл-15α, 16α-метилен-19-нор-17α-прегна-4-єн-3-он-21карбонової кислоти (А) і γ-лактон 17β-гідрокси-7β-циклопропіл-15α, 16α-метилен-19-нор-17αпрегна-4-єн-3-он-21-карбонової кислоти (В) Аналогічно до прикладу 3, піддавали реакції 200 мг сполуки, приготовленої відповідно до прикладу 2, використовуючи бромід циклопропілмагнію, і, після обробки й очищення, 71 мг вказаної в заголовку сполуки А виділяли разом з усе ще забрудненою сумішшю, що містила пропорції вказаної в заголовку сполуки В. 1 Н-ЯМР (CDCI3) А: δ=-0,05 (1Н), 0,41-0,53 (4Н), 0,56 (1Н), 0,99 (1Н), 1,12 (1Н), 1,16-1,32 (5Н), 1,23 (3Н), 1,43-1,57 (2Н), 1,81-1,93 (3Н), 2,02-2,21 (3Н), 2,24-2,34 (2Н), 2,38-2,57 (5Н), 5,90 (1Н) част. на млн. 17 UA 98834 C2 Приклад 7: (6-гідроксиметил) γ-лактон 17β-гідрокси-6β-гідроксиметил-15α, 16α-метилен-19-нор-17α-прегна-4-єн-3-он-21карбонової кислоти 5 10 15 20 25 30 35 40 400 мкл 37 % водного розчину формальдегіду додавали до розчину 400 мг сполуки, приготовленої відповідно до прикладу 7а, у суміші 4 мл толуолу й 8 мл етанолу і його перемішували протягом 3 годин при 23 °C. Його концентрували шляхом упарювання й залишок очищали шляхом хроматографії. Виділяли 180 мг вказаної в заголовку сполуки. 1 Н-ЯМР (CDCI3): δ=0,52 (2Н), 0,75 (1Н), 1,03 (1Н), 1,21 (3Н), 1,17-1,86 (10Н), 1,97-2,56 (9Н), 2,68 (1Н), 3,73 (2Н), 5,93 (1Н) част. на млн. Приклад 7а: (дієнамін для 6-алкілування) γ-лактон 17β-гідрокси-3-піролідиніл-15α, 16α-метилен-19-нор-17α-прегна-3,5-дієн-21карбонової кислоти 280 мкл піролідину додавали до розчину 500 мг сполуки, приготовленої відповідно до прикладу 1, в 5,3 мл метанолу і його нагрівали в колбі зі зворотним холодильником протягом 2 годин. Його охолоджували, осад відфільтровували з відсмоктуванням, промивали невеликою кількістю холодного метанолу й одержували 406 мг вказаної в заголовку сполуки, і яку піддавали подальшій реакції без додаткового очищення. Приклад 8: (6-спіроциклопропанування (Кору)) γ-лактон 6,6-(1,2-етандіїл)-17β-гідрокси-15α, 16α-метилен-19-нор-17α-прегна-4-єн-3-он-21карбонової кислоти 100 мг йодиду триметилсульфоксонію розчиняли в 1,0 мл диметилсульфоксиду, додавали 18,5 мг 60 % дисперсії гідриду натрію й суміш перемішували протягом 2 годин при 23 °C. Потім по краплях додавали розчин 58 мг сполуки, приготовленої відповідно до прикладу 8а, в 2,5 мл диметилсульфоксиду і його перемішували додатково протягом 3,5 годин при 23 °C. Його вливали у воду, декілька разів екстрагували етилацетатом, об'єднані органічні екстракти промивали водою й насиченим розчином хлориду натрію й висушували над сульфатом натрію. Залишок, отриманий після фільтрації й упарювання розчинника, очищали шляхом хроматографії. Виділяли 20 мг вказаної в заголовку сполуки. 1 Н-ЯМР (CDCI3): δ=0,43 (1Н), 0,50 (1Н), 0,53-0,62 (2Н), 0,74 (1Н), 0,85 (1Н), 1,00 (1Н), 1,171,37 (5Н), 1,24 (3Н), 1,42-1,53 (2Н), 1,66 (1Н), 1,78-1,88 (3Н), 2,02 (1Н), 2,09-2,32 (4Н), 2,37-2,54 (3Н), 5,70 (1Н) част. на млн. Приклад 8а: (6-тозилоксиметил) γ-лактон 17β-гідрокси-6β-(п-толілсульфонілоксиметил)-15α, 16α-метилен-19-нор-17α-прегна4-єн-3-он-21-карбонової кислоти 18 UA 98834 C2 5 10 665 мкл триетиламіну й 190 мг хлориду п-толуолсульфонової кислоти додавали до розчину 150 мг сполуки, приготовленої відповідно до прикладу 7, в 7,5 мл дихлорметану і його перемішували протягом 37 годин при 23 °C. Його вливали в насичений розчин карбонату натрію, декілька разів екстрагували етилацетатом, об'єднані органічні екстракти промивали водою й насиченим розчином хлориду натрію й висушували над сульфатом натрію. Залишок, отриманий після фільтрації й упарювання розчинника, очищали шляхом хроматографії. Виділяли 131 мг вказаної в заголовку сполуки. Приклад 9: γ-лактон 17β-гідрокси-6β, 7β-15α, 16α-бісметилен-19-нор-17α-прегна-4-єн-3-он-21карбонової кислоти (А) і γ-лактон 17β-гідрокси-6α, 7α-15α, 16α-бісметилен-19-нор-17α-прегна-4єн-3-он-21-карбонової кислоти (В) 15 20 25 30 35 40 Аналогічно до прикладу 8, піддавали реакції 1,13 г сполуки, приготовленої відповідно до прикладу 2, і, після обробки й очищення, виділяли 46 мг вказаної в заголовку сполуки А і 222 мг вказаної в заголовку сполуки В. 1 Н-ЯМР (CDCI3) А: δ=0,58-0,68 (2Н), 0,80-0,97 (2Н), 1,09-1,37 (4Н), 1,24 (3Н), 1,43-1,96 (8Н), 2,05-2,60 (8Н), 6,15 (1Н) част. на млн. 1 Н-ЯМР (CDCI3) В: δ=0,60 (1Н), 0,64-0,74 (2Н), 0,95 (1Н), 1,08 (1Н), 1,14-1,51 (5Н), 1,25 (3Н), 1,66 (1Н), 1,73-1,90 (3Н), 1,98-2,58 (10Н), 6,04 (1Н) част. на млн. Приклад 10: Інертні депо-системи, що підлягають внутрішньоматковій імплантації й складаються з біорозкладного полімеру або синтетичного силіконового полімеру, що включають ядро, яке містить активний компонент у підходящому співвідношенні компонентів полімер-активна речовина, оточена полімерною мембраною, що забезпечує бажану добову швидкість вивільнення, вводили в порожнину матки щурів. Самок тварин перед цим кастрували й попередньо лікували естрадіолом протягом трьох днів. Імпланти різної довжини (5-20 мм) і обмеженого діаметра (1,1-2 мм) залишали протягом періоду від 4 до 14 днів у матці щурів для дослідження місцевого й системного прогестаційного впливу активного компонента, що вивільняється, виходячи з різних параметрів у різних тканинах. Визначали наступні параметри: 1) місцевий прогестаційний вплив на матку, виходячи з ваги матки, висоти епітелію, що визначається гістологічно, й експресії маркерних генів, регульованих прогестогеном (наприклад, IGFBP-1); 2) системний прогестаційний вплив на молочну залозу, виходячи з експресії маркерних генів, регульованих прогестогеном (наприклад, RankL), 3) системний прогестаційний вплив на гіпофіз, виходячи з рівня LH (зменшення індукованого естрогеном підвищення рівня LH). Сполуки згідно із даним винаходом проявляють істотний прогестаційний вплив на матку, який порівняний з відповідним лікуванням із застосуванням депо-5 системи, що містить левоноргестрел, такої як MIRENA®. 19 UA 98834 C2 20 UA 98834 C2 5 Сполуки із прикладів 1, 3-6 і 8-9 мають поліпшену селективність по відношенню до рецептора прогестерону (PR) у порівнянні з мінералокортикоїдним рецептором (MR), вираженим за допомогою співвідношення конкурентних факторів CF-PR/CF-MR. Співвідношення знаходяться в інтервалі від 0,41 до 2,46 і, отже, значно нижче, ніж такі в DRSP (5,4). ФОРМУЛА ВИНАХОДУ 10 1. -Лактонові похідні 15,16-метилен-17-гідрокси-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти загальної формули І O R 18 O H Z R R 15 20 25 30 4 7 R6a R6b , (I) у якій 1 1 Z являє собою кисень, два атоми водню, групу =NOR або =NNHSO2R , 1 R являє собою водень, С1-С10-алкіл, арил, С7-С20-аралкіл, 4 R являє собою водень або галоген, 6a 6b R , R , які можуть бути однаковими або різними, являють собою водень,С 1-С10-алкіл, С2-С10алкеніл, С2-С10-алкініл або разом являють собою метилен або 1,2-етандіїл, 7 R являє собою водень, С1-С10-алкіл, С3-С6-циклоалкіл, С2-С10-алкеніл, С2-С10-алкініл, 6a 7 R , R разом являють собою зв'язок, кисень або метиленову групу, 18 R являє собою водень, С1-С3-алкіл, та їх сольвати, гідрати, стереоізомери й солі. 2. -Лактонові похідні 15,16-метилен-17-гідрокси-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, як заявлено у пункті 1, які відрізняються тим, що Z вибирають з групи, яка включає 1 1 кисень, NOR та NNHSO2R . 3. -Лактонові похідні 15,16-метилен-17-гідрокси-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, як заявлено у пункті 1, які відрізняються тим, що Z являє собою кисень. 4. -Лактонові похідні 15,16-метилен-17-гідрокси-19-нор-17-прегна-4-єн-3-он-21-карбонової 4 кислоти, як заявлено у пункті 1, які відрізняються тим, що R являє собою водень або хлор. 21 UA 98834 C2 5 10 15 20 25 30 35 40 45 50 55 5. -Лактонові похідні 15,16-метилен-17-гідрокси-19-нор-17-прегна-4-єн-3-он-21-карбонової 6a 6b кислоти, як заявлено у пункті 1, які відрізняються тим, що R , R разом утворюють 1,2етандіїл або кожен являє собою водень. 6. -Лактонові похідні 15,16-метилен-17-гідрокси-19-нор-17-прегна-4-єн-3-он-21-карбонової 7 кислоти, як заявлено у пункті 1, які відрізняються тим, що R являє собою водень або метил, або етил, або вініл. 7. -Лактонові похідні 15,16-метилен-17-гідрокси-19-нор-17-прегна-4-єн-3-он-21-карбонової 6a 7 кислоти, як заявлено у пункті 1, які відрізняються тим, що R та R разом утворюють метиленову групу. 8. -Лактонові похідні 15,16-метилен-17-гідрокси-19-нор-17-прегна-4-єн-3-он-21-карбонової 6a 7 кислоти, як заявлено у пункті 1, які відрізняються тим, що R та R разом являють собою зв'язок. 9. -Лактонові похідні 15,16-метилен-17-гідрокси-19-нор-17-прегна-4-єн-3-он-21-карбонової 18 кислоти, як заявлено у пункті 1, які відрізняються тим, що R являє собою водень або метил. 10. -Лактонові похідні 15,16-метилен-17-гідрокси-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, як заявлено у пункті 1, вибрані з групи -лактон 17-гідрокси-15,16-метилен-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, -лактон 17-гідрокси-7-метил-15,16-метилен-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, -лактон 17-гідрокси-7-метил-15,16-метилен-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, -лактон 17-гідроксі-7-етил-15,16-метилен-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, -лактон 17-гідроксі-7-етил-15,16-метилен-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, -лактон 17-гідрокси-7-вініл-15,16-метилен-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, -лактон 17-гідрокси-7-вініл-15,16-метилен-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, -лактон 17-гідрокси-7-циклопропіл-15,16-метилен-19-нор-17-прегна-4-єн-3-он-21карбонової кислоти, -лактон 17-гідрокси-7-циклопропіл-15,16-метилен-19-нор-17-прегна-4-єн-3-он-21карбонової кислоти, -лактон 17-гідрокси-6-метилен-15,16-метилен-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, -лактон 17-гідрокси-6-гідроксиметил-15,16-метилен-19-нор-17-прегна-4-єн-3-он-21карбонової кислоти, -лактон 17-гідрокси-6-гідроксиметил-15,16-метилен-19-нор-17-прегна-4-єн-3-он-21карбонової кислоти, -лактон 6,6-(1,2-етандіїл)-17-гідрокси-15,16-метилен-19-нор-17-прегна-4-єн-3-он-21карбонової кислоти, -лактон 17-гідрокси-6,7,15,16-бісметилен-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, -лактон 17-гідрокси-6,7,15,16-бісметилен-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, -лактон 17-гідрокси-15,16-метилен-19-нор-17-прегна-4,6-дієн-3-он-21-карбонової кислоти -лактон (Е/Z)-3-(гідроксііміно)-17-гідрокси-15,16-метилен-19-нор-17-прегна-4-єн-21карбонової кислоти, -лактон (E/Z)-3-(гідроксііміно)-17-гідрокси-7-метил-15,16-метилен-19-нор-17α-прегна-4-єн21-карбонової кислоти, -лактон (Е/Z)-3-(гідроксііміно)-17-гідрокси-7-метил-15,16-метилен-19-нор-17-прегна-4-єн21-карбонової кислоти, -лактон (Е/Z)-3-(гідроксііміно)-17-гідроксі-7-етил-15,16-метилен-19-нор-17-прегна-4-єн-21карбонової кислоти, -лактон (Е/Z)-3-(гідроксііміно)-17-гідроксі-7-етил-15,16-метилен-19-нор-17-прегна-4-єн-21карбонової кислоти, -лактон (Е/Z)-3-(гідроксііміно)-17-гідрокси-7-вініл-15,16-метилен-19-нор-17-прегна-4-єн21-карбонової кислоти, 22 UA 98834 C2 5 10 15 20 25 30 35 40 45 50 55 -лактон (Е/Z)-3-(гідроксііміно)-17-гідрокси-7-вініл-15,16-метилен-19-нор-17α-прегна-4-єн21-карбонової кислоти, -лактон (Е/Z)-3-(гідроксііміно)-17-гідрокси-7-циклопропіл-15,16-метилен-19-нор-17прегна-4-єн-21-карбонової кислоти, -лактон (E/Z)-3-(гідроксііміно)-17-гідрокси-7-циклопропіл-15,16-метилен-19-нор-17прегна-4-єн-21-карбонової кислоти, -лактон (Е/Z)-3-(гідроксііміно)-17-гідрокси-6-метилен-15,16-метилен-19-нор-17-прегна-4єн-21-карбонової кислоти, -лактон (E/Z)-3-(гідроксііміно)-17-гідрокси-6α-гідроксиметил-15,16-метилен-19-нор-17прегна-4-єн-21-карбонової кислоти, -лактон (Е/Z)-3-(гідроксііміно)-17-гідрокси-6-гідроксиметил-15,16-метилен-19-нор-17прегна-4-єн-21-карбонової кислоти, -лактон (Е/Z)-3-(гідроксііміно)-6,6-(1,2-етандіїл)-17-гідрокси-15,16-метилен-19-нор-17прегна-4-єн-21-карбонової кислоти, -лактон (E/Z)-3-(гідроксііміно)-17-гідрокси-6,7,15,16-бісметилен-19-нор-17-прегна-4-єн21-карбонової кислоти, -лактон (Е/Z)-3-(гідроксііміно)-17-гідрокси-6,7,15,16-бісметилен-19-нор-17-прегна-4-єн21-карбонової кислоти, -лактон (Е/Z)-3-(гідроксііміно)-17-гідрокси-15,16-метилен-19-нор-17-прегна-4,6-дієн-21карбонової кислоти, -лактон 17-гідрокси-18-метил-15,16-метилен-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, -лактон 17-гідрокси-7-метил-18-метил-15,16-метилен-19-нор-17-прегна-4-єн-3-он-21карбонової кислоти, -лактон 17-гідрокси-7-метил-18-метил-15,16-метилен-19-нор-17-прегна-4-єн-3-он-21карбонової кислоти, -лактон 17-гідроксі-7-етил-18-метил-15,16-метилен-19-нор-17-прегна-4-єн-3-он-21карбонової кислоти, -лактон 17-гідроксі-7-етил-18-метил-15,16-метилен-19-нор-17-прегна-4-єн-3-он-21карбонової кислоти, -лактон 17-гідрокси-7-вініл-18-метил-15,16-метилен-19-нор-17-прегна-4-єн-3-он-21карбонової кислоти, -лактон 17-гідрокси-7-вініл-18-метил-15,16-метилен-19-нор-17-прегна-4-єн-3-он-21карбонової кислоти, -лактон 17-гідрокси-7-циклопропіл-18-метил-15,16-метилен-19-нор-17-прегна-4-єн-3-он21-карбонової кислоти, -лактон 17-гідрокси-7-циклопропіл-18-метил-15,16-метилен-19-нор-17-прегна-4-єн-3-он21-карбонової кислоти, -лактон 17-гідрокси-6-метилен-18-метил-15,16-метилен-19-нор-17-прегна-4-єн-3-он-21карбонової кислоти, -лактон 17-гідрокси-6-гідроксиметил-18-метил-15,16-метилен-19-нор-17-прегна-4-єн-3он-21-карбонової кислоти, -лактон 17β-гідрокси-6β-гідроксиметил-18-метил-15,16-метилен-19-нор-17-прегна-4-єн-3он-21-карбонової кислоти, -лактон 6,6-(1,2-етандіїл)-17-гідрокси-18-метил-15,16-метилен-19-нор-17-прегна-4-єн-3-он21-карбонової кислоти, -лактон 17-гідрокси-6,7,15,16-бісметилен-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, -лактон 17-гідрокси-6,7,15,16-бісметилен-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, -лактон 17-гідрокси-18-метил-15,16-метилен-19-нор-17-прегна-4,6-дієн-3-он-21-карбонової кислоти, -лактон (Е/Z)-3-(гідроксііміно)-17-гідрокси-18-метил-15,16-метилен-19-нор-17-прегна-4-єн21-карбонової кислоти, -лактон (Е/Z)-3-(гідроксііміно)-17-гідрокси-7-метил-18-метил-15,16-метилен-19-нор-17прегна-4-єн-21-карбонової кислоти, -лактон (E/Z)-3-(гідроксііміно)-17-гідрокси-7-метил-18-метил-15,16-метилен-19-нор-17прегна-4-єн-21-карбонової кислоти, 23 UA 98834 C2 5 10 15 20 25 -лактон (E/Z)-3-(гідроксііміно)-17-гідроксі-7-етил-18-метил-15,16-метилен-19-нор-17прегна-4-єн-21-карбонової кислоти, -лактон (Е/Z)-3-(гідроксііміно)-17-гідроксі-7-етил-18-метил-15,16-метилен-19-нор-17прегна-4-єн-21-карбонової кислоти, -лактон (Е/Z)-3-(гідроксііміно)-17-гідрокси-7-вініл-18-метил-15,16-метилен-19-нор-17прегна-4-єн-21-карбонової кислоти, -лактон (Е/Z)-3-(гідроксііміно)-17-гідрокси-7-вініл-18-метил-15,16-метилен-19-нор-17прегна-4-єн-21-карбонової кислоти, -лактон (Е/Z)-3-(гідроксііміно)-17-гідрокси-7-циклопропіл-18-метил-15,16-метилен-19-нор17-прегна-4-єн-21-карбонової кислоти, -лактон (E/Z)-3-(гідроксііміно)-17-гідрокси-7-циклопропіл-18-метил-15,16-метилен-19-нор17-прегна-4-єн-21-карбонової кислоти, -лактон (Е/Z)-3-(гідроксііміно)-17-гідрокси-6-метилен-18-метил-15,16-метилен-19-нор-17прегна-4-єн-21-карбонової кислоти, -лактон (E/Z)-3-(гідроксііміно)-17-гідрокси-6-гідроксиметил-18-метил-15,16-метилен-19нор-17-прегна-4-єн-21-карбонової кислоти, -лактон (Е/Z)-3-(гідроксііміно)-17-гідрокси-6-гідроксиметил-18-метил-15,16-метилен-19нор-17-прегна-4-єн-21-карбонової кислоти, -лактон (Е/Z)-3-(гідроксііміно)-6,6-(1,2-етандіїл)-17-гідрокси-18-метил-15,16-метилен-19-нор17-прегна-4-єн-21-карбонової кислоти, -лактон (Е/Z)-3-(гідроксііміно)-17-гідрокси-6,7,15,16-бісметилен-19-нор-17-прегна-4-єн21-карбонової кислоти, -лактон (Е/Z)-3-(гідроксііміно)-17-гідрокси-6,7,15,16-бісметилен-19-нор-17-прегна-4-єн21-карбонової кислоти, -лактон (E/Z)-3-(гідроксііміно)-17-гідрокси-18-метил-15,16-метилен-19-нор-17-прегна-4,6дієн-21-карбонової кислоти. 11. -Лактонові похідні 15,16-метилен-17-гідрокси-19-нор-17-прегна-4-єн-3-он-21-карбонової кислоти, як заявлено в одному з пунктів 1-10, для пероральної контрацепції та для лікування перед-, пери- та постклімактеричних розладів. 30 Комп’ютерна верстка Л. Купенко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 24
ДивитисяДодаткова інформація
Назва патенту англійською19-nor-steroid derivatives with a 15,16-methylene group and a saturated 17,17-spirolactone ring, use thereof, and medicaments containing said derivative
Автори англійськоюKlar, Ulrich, Kuhnke Joachim, Bohlmann, Rolf, Huebner Jan, Ring, Sven, Frenzel, Thomas, Menges Frederik, Borden Steffen, Muhn, Hans, Peter, Prelle, Katja
Назва патенту російською19-нор-стероидные производные с 15a,16a-метиленовой группой и насыщенным 17,17-спиролактоновым кольцом, их применение и лекарственное средство, которое содержит эти производные
Автори російськоюКлар Ульрих, Кунке Йоахим, Больманн Рольф, Хюбнер Ян, Ринг Свен, Френцель Томас, Менгес Фредерик, Борден Штеффен, Мун Ханс-Петер, Прелле Катя
МПК / Мітки
МПК: A61P 5/34, A61K 31/585, C07J 53/00
Мітки: містить, 17,17-спіролактоновим, насиченим, застосування, групою, лікарський, 19-нор-стероїдні, 15a,16a-метиленовою, похідні, кільцем, засіб
Код посилання
<a href="https://ua.patents.su/26-98834-19-nor-sterodni-pokhidni-z-15a16a-metilenovoyu-grupoyu-jj-nasichenim-1717-spirolaktonovim-kilcem-kh-zastosuvannya-jj-likarskijj-zasib-yakijj-mistit-ci-pokhidni.html" target="_blank" rel="follow" title="База патентів України">19-нор-стероїдні похідні з 15a,16a-метиленовою групою й насиченим 17,17-спіролактоновим кільцем, їх застосування й лікарський засіб, який містить ці похідні</a>
Попередній патент: Спосіб синтезу пористого вуглецевого матеріалу з органічної сировини рослинного походження
Наступний патент: Курильний виріб
Випадковий патент: Передача повідомлень у режимі сторінок