2-оксо-1,2-дигідрохінолінові модулятори імунної функції
Формула / Реферат
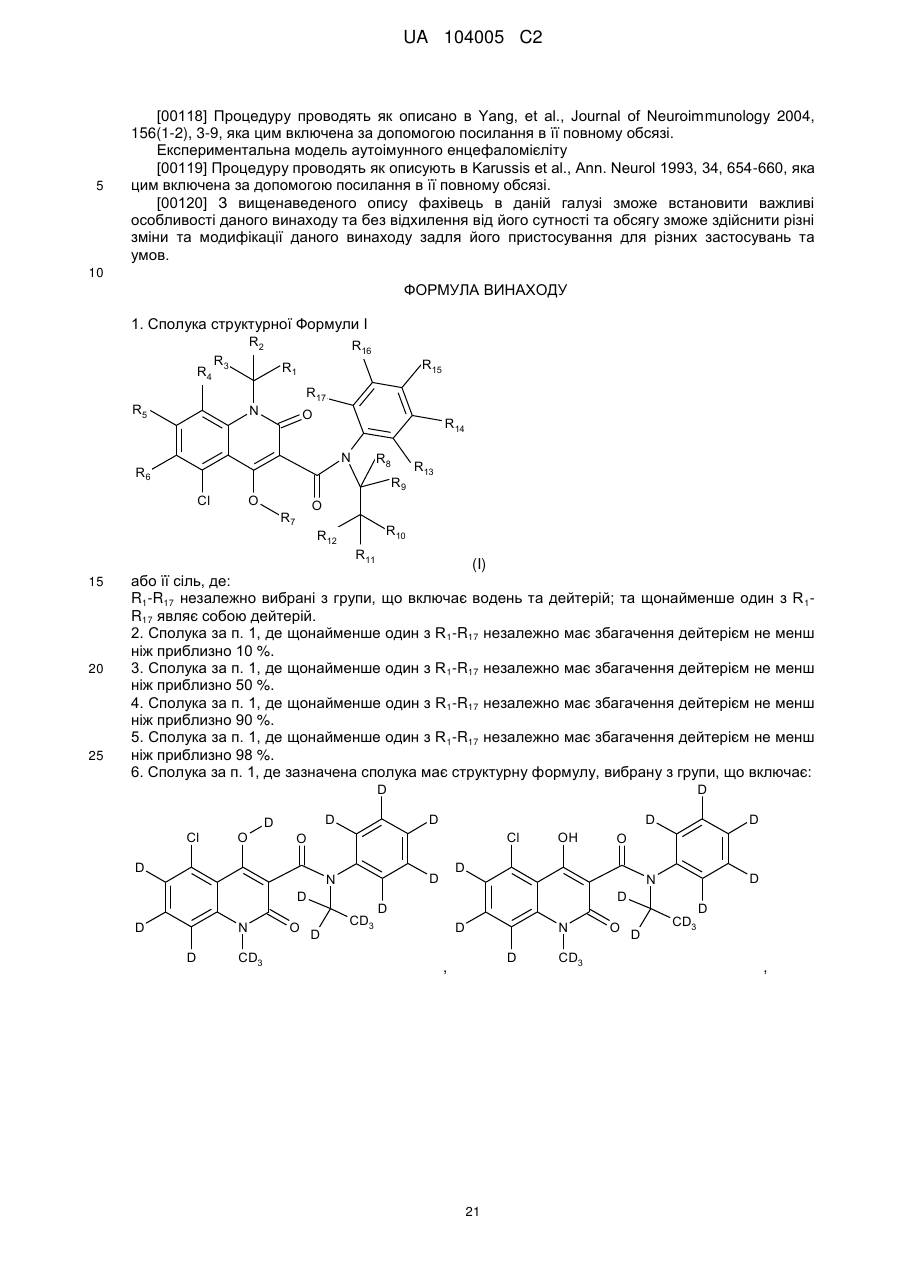
1. Сполука структурної Формули І
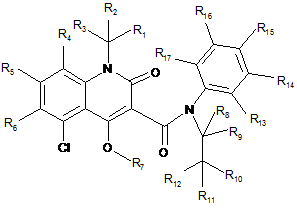 (I)
(I)
або її сіль, де:
R1-R17 незалежно вибрані з групи, що включає водень та дейтерій; та щонайменше один з R1-R17 являє собою дейтерій.
2. Сполука за п. 1, де щонайменше один з R1-R17 незалежно має збагачення дейтерієм не менш ніж приблизно 10 %.
3. Сполука за п. 1, де щонайменше один з R1-R17 незалежно має збагачення дейтерієм не менш ніж приблизно 50 %.
4. Сполука за п. 1, де щонайменше один з R1-R17 незалежно має збагачення дейтерієм не менш ніж приблизно 90 %.
5. Сполука за п. 1, де щонайменше один з R1-R17 незалежно має збагачення дейтерієм не менш ніж приблизно 98 %.
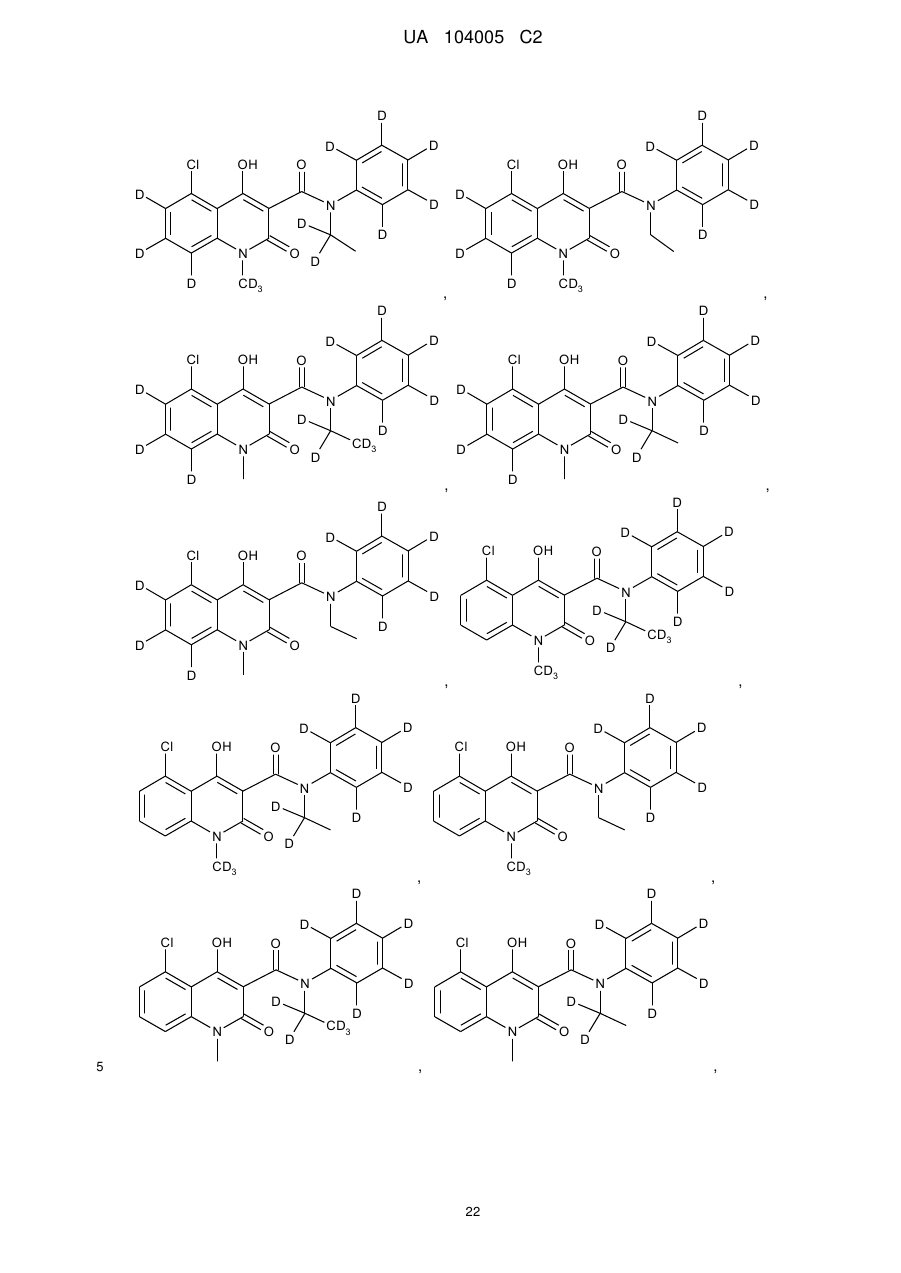
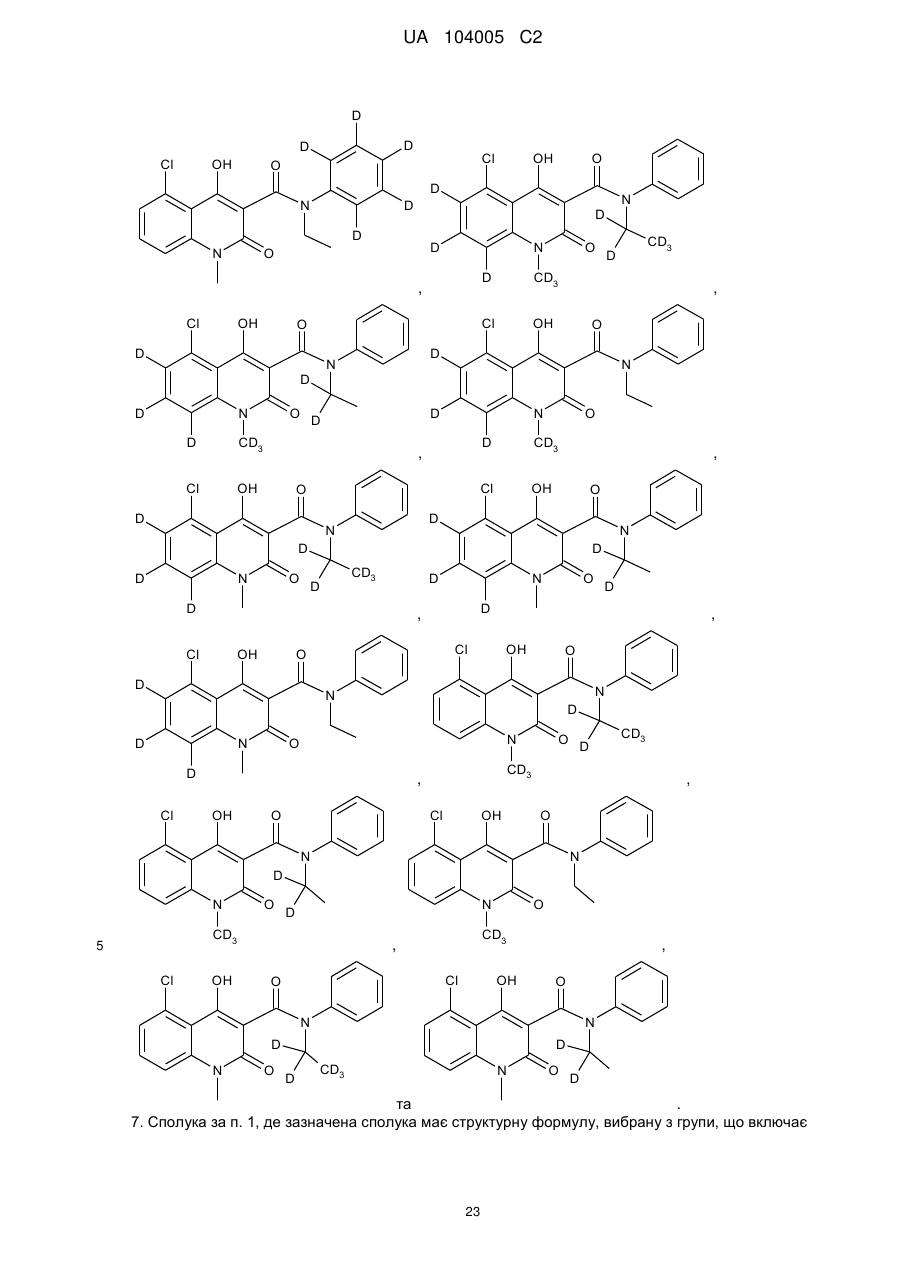
6. Сполука за п. 1, де зазначена сполука має структурну формулу, вибрану з групи, що включає:
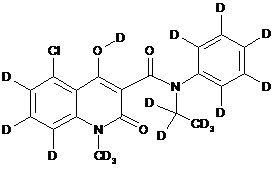 ,
, 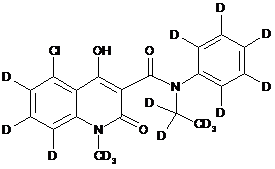 ,
,
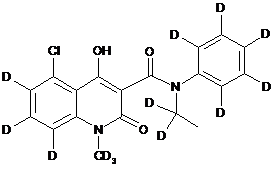 ,
, 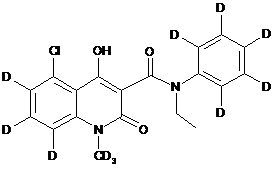 ,
,
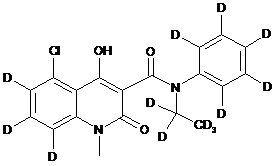 ,
, 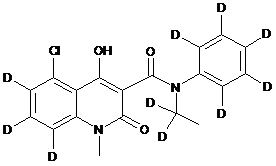 ,
,
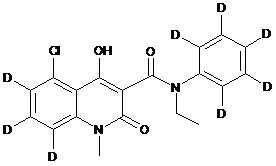 ,
, 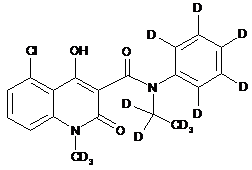 ,
,
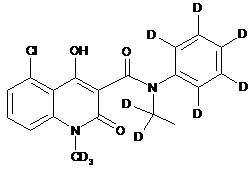 ,
, 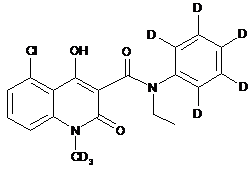 ,
,
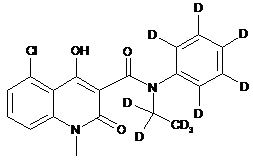 ,
, 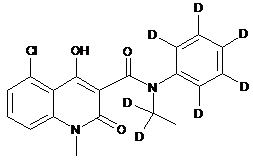 ,
,
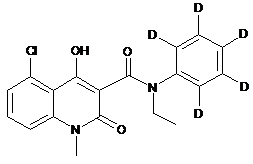 ,
, 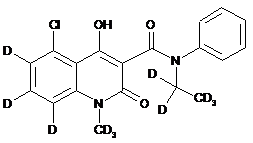 ,
,
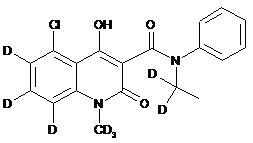 ,
, 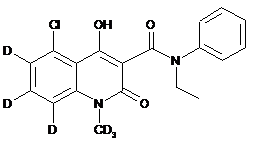 ,
,
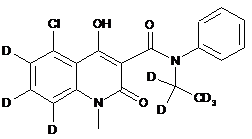 ,
, 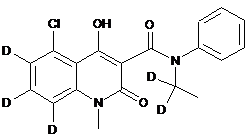 ,
,
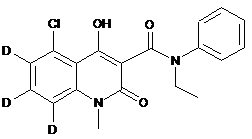 ,
, 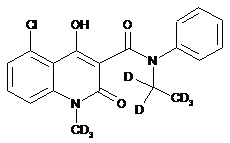 ,
,
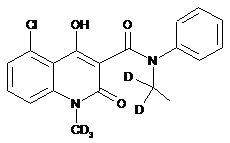 ,
, 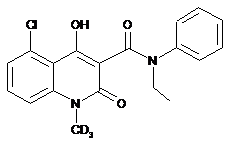 ,
,
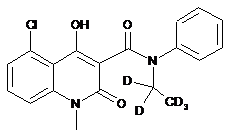 та
та 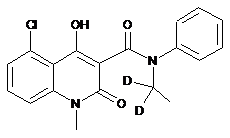 .
.
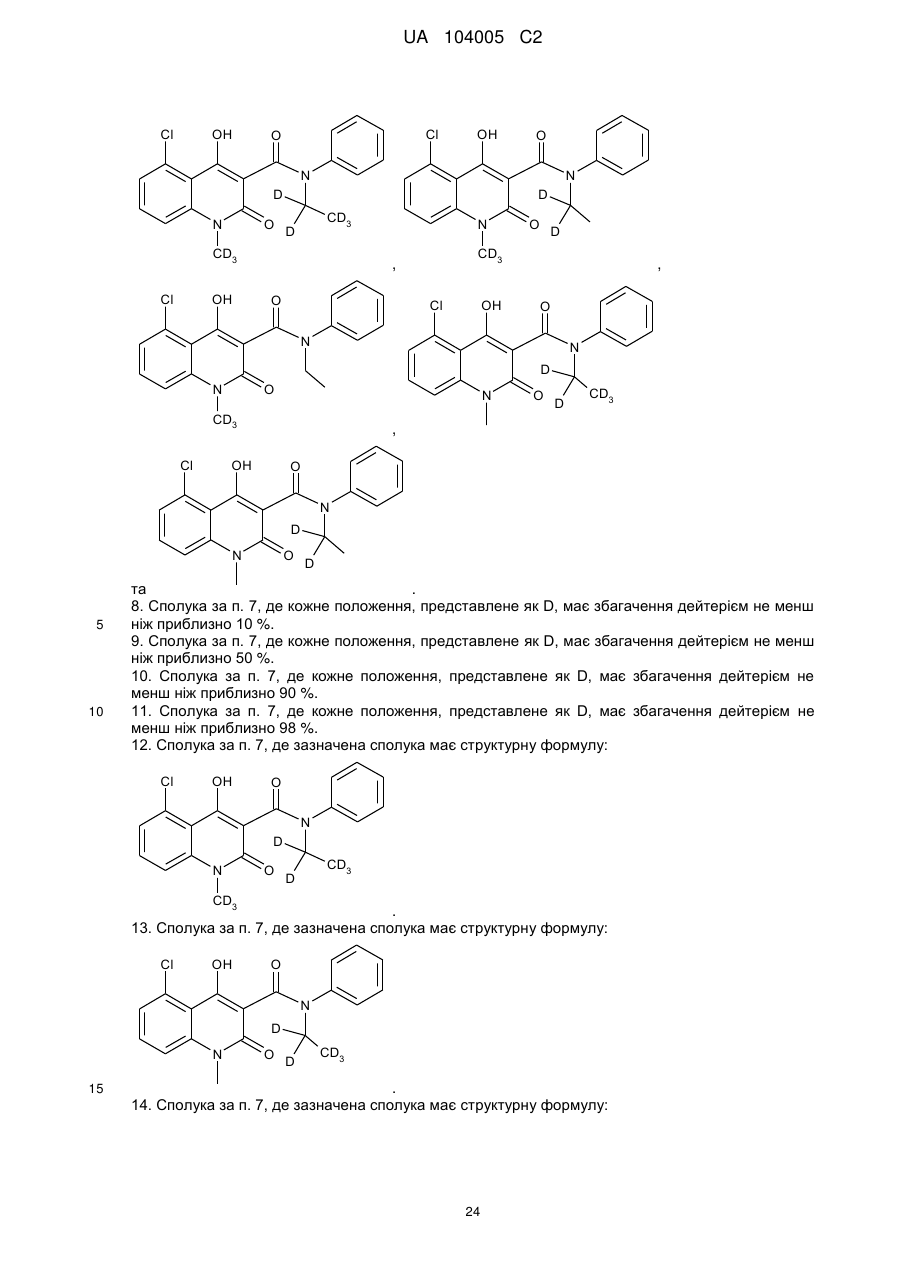
7. Сполука за п. 1, де зазначена сполука має структурну формулу, вибрану з групи, що включає
 ,
, ,
,  ,
, 
та  .
.
8. Сполука за п. 7, де кожне положення, представлене як D, має збагачення дейтерієм не менш ніж приблизно 10 %.
9. Сполука за п. 7, де кожне положення, представлене як D, має збагачення дейтерієм не менш ніж приблизно 50 %.
10. Сполука за п. 7, де кожне положення, представлене як D, має збагачення дейтерієм не менш ніж приблизно 90 %.
11. Сполука за п. 7, де кожне положення, представлене як D, має збагачення дейтерієм не менш ніж приблизно 98 %.
12. Сполука за п. 7, де зазначена сполука має структурну формулу:
 .
.
13. Сполука за п. 7, де зазначена сполука має структурну формулу:
 .
.
14. Сполука за п. 7, де зазначена сполука має структурну формулу:
 .
.
15. Фармацевтична композиція, що містить сполуку за п. 1 разом з фармацевтично прийнятним носієм.
16. Спосіб лікування опосередкованого імунною функцією розладу, що включає етапи, на яких вводять терапевтично ефективну кількість сполуки за п. 1 пацієнту у разі потреби.
17. Спосіб за п. 16, де зазначений розлад являє собою розсіяний склероз та аутоімунні розлади.
18. Спосіб за п. 16, що додатково включає етапи, на яких вводять додатковий терапевтичний засіб.
19. Спосіб за п. 18, де зазначений додатковий терапевтичний засіб вибирають з групи, що включає імуномодулятори та циклоспорини.
20. Спосіб за п. 19, де зазначений імуномодулятор вибирають з групи, що включає філграстим, молграмостим, сарграмостим, ленограстим, анцестим, пегфілграстим, гамма-інтерферон, інтерферон альфа-2а, інтерферон альфа-2b, інтерферон альфа-n1, інтерферон бета-1а, інтерферон бета-1b, інтерферон альфакон-1, пегінтерферон альфа-2b, пегінтерферон альфа-2а, інтерферон омега, альдеслейкін, опрелвекін, лентинан, роквінімекс, вакцину БЦЖ, пегадемазу, підотимод, Poly I:C, Poly ICLC, тимопентин, імуноціанін, тазонермін, вакцину від меланоми, глатирамеру ацетат, гістаміну дигідрохлорид, міфамуртид, плериксафор, муромонаб-СD3, антилімфоцитарний імуноглобулін (конячий), антитимоцитарний імуноглобулін (кролячий), мікофенолову кислоту, сиролімус, лефлуномід, алефацепт, еверолімус, гусперимус, ефалізумаб, абетимус, наталізумаб, абатацепт, екулізумаб, етанерцепт, інфліксимаб, афелімомаб, адалімумаб, цертолізумаб пегол, даклізумаб, базиліксимаб, анакінру, циклоспорин, такролімус, азатіоприн, талідомід, метотрексат та леналідомід.
Текст
Реферат: Даний винахід стосується нових 2-оксо-1,2-дигідрохінолінових модуляторів імунної функції, їх фармацевтичних композицій та їх застосування. UA 104005 C2 (12) UA 104005 C2 UA 104005 C2 5 10 15 20 25 30 35 40 45 50 [0001] Дана заявка заявляє пріоритет попередньої заявки на патент США № 61/093943, поданої 3 вересня 2008, розкриття якої цим включається за посиланням, як якщо б була приведена письмово в даному документі в її повному обсязі. [0002] В даному документі розкриваються нові заміщені 2-оксо-1,2-дигідро-хінолінові сполуки, фармацевтичні композиції, виготовлені з них, та також передбачаються способи модуляції імунної функціональної активності у суб'єкта для лікування розладів, таких як розсіяний склероз та аутоімунні розлади. [0003] Лаквінімод (ABR 215062; SAIK-MS; ABR-215062; SAIKMS; CAS # 248281-84-7), етилфеніл-амід 5-хлор-4-гідрокси-1-метил-2-оксо-1,2-дигідро-хінолін-3-карбонової кислоти, являє собою модулятор імунної функції. Лаквінімод в даний час досліджується для лікування розсіяного склерозу (Burton et al., Curr. Neurol. & Neurosc. Reports 2007, 7(3), 223-30; Tuvesson et al., Xenobiotica 2005, 35(3), 293-304; Cohen et al., Int. J. Clin. Pract. 2007, 61(11), 1922-30). Лаквінімод також продемонстрував перспективу у лікуванні аутоімунного розладу (Tuvesson et al, Xenobiotica 2005, 35(3), 293-304). Лаквінімод [0004] Лаквінімод піддається екстенсивному окислювальному метаболізуванню цитохромними ферментами P450, зокрема CYP3A4 (Tuvesson et al., Drug Metab. & Disp. 2005, 33(6), 866-72). Первісні метаболіти включають утворені гідроксилюванням хіноліну в різних положеннях, деметилюванням хіноліну, деетилюванням аніліну та гідроксилюванням аніліну у пара-положенні (Tuvesson et al, Xenobiotica 2005, 35(3), 293-304). Кінетичний ізотопний ефект дейтерію [0005] Для усунення сторонніх речовин, таких як терапевтичні засоби, тваринний організм експресує різні ферменти, такі як цитохромні ферменти Р450 (CYP), естерази, протеази, редуктази, дегідрогенази та моноаміноксидази, щоб прореагувати та перетворити ці сторонні речовини у більш полярні проміжні сполуки або метаболіти для виведення з сечею. Такі метаболічні реакції часто включають окиснення зв'язку вуглець-водень (C-H) до або вуглецькисень (C-O), або вуглець-вуглець (C-C) -зв'язку. Отримані в результаті метаболіти можуть бути стабільними або нестабільними в фізіологічних умовах та можуть мати значно відмінні фармакокінетичні, фармакодинамічні профілі та профілі гострої і довготривалої токсичності відносно вихідних сполук. Для більшості лікарських засобів, такі окиснення звичайно є швидкими та зрештою приводять до введення множинних або високих щоденних доз. [0006] Відношення між енергією активації та швидкістю реакції можна визначити кількісно за -Eact/RT рівнянням Арреніуса, k=Ae . Рівняння Арреніуса виражає, що при даній температурі швидкість хімічної реакції експоненціально залежить від енергії активації (E act). [0007] Перехідний стан в реакції являє собою короткотривалий стан протягом ходу реакції, під час якого вихідні зв'язки розтягнулися до їх границі. За визначенням енергія активації Eact для реакції являє собою енергію, що необхідна для досягнення перехідного стану такої реакції. Як тільки досягнуто перехідний стан, молекули можуть або повернутися до вихідних реагентів, або сформувати нові зв'язки, які будуть джерелом продуктів реакції. Каталізатор сприяє реакційному процесу знижуючи енергію активації, що приводить до перехідного стану. Ферменти являють собою приклади біологічних каталізаторів. [0008] Міцність зв'язку вуглець-водень є прямо пропорційною до абсолютної величини енергії коливань основного стану зв'язку. Ця енергія коливань залежить від маси атомів, що утворюють зв'язок, та зростає по мірі зростання маси одного або обох атомів, що утворюють 1 зв'язок. Через те, що дейтерий (D) має подвійну масу протію ( H), зв'язок C-D є більш міцним, 1 1 ніж відповідний зв'язок C- H. Якщо руйнується зв'язок C- H під час етапу, що визначає швидкість, в хімічний реакції (тобто етапу з найвищою енергією перехідного стану), то заміщення такого протію на дейтерий приведе до зменшення швидкості реакції. Це явище відоме як кінетичний ізотопний ефект дейтерію (DKIE). Величину DKIE можна виразити як 1 співвідношення між швидкостями даної реакції, в якій руйнується зв'язок C- H, та тієї ж реакції, де протій заміщений на дейтерий. DKIE може змінюватися в діапазоні від приблизно 1 (ізотопний ефект відсутній) до дуже великих чисел, таких як 50 або більше. Заміщення водню на 1 UA 104005 C2 5 10 15 20 25 30 35 40 45 50 55 60 тритій приводить до ще більш міцного зв'язку, ніж дейтерий, та дає значно більші ізотопні ефекти. 2 [0009] Дейтерий ( H або D) являє собою стабільний та нерадіоактивний ізотоп водню, який1 має приблизно подвійну масу протію ( H), найбільш поширеного ізотопу водню. Оксид дейтерію (D2O або "важка вода") на вигляд та смак подібний до H2О, але має відмінні фізичні властивості. [0010] Якщо чисту D2O дати гризунам, вона легко всмоктується. Кількість дейтерію, потрібна для індукції токсичності, є надзвичайно високою. Якщо приблизно 0-15 % води тіла заміщено D2O, тварини здорові, але нездатні набирати вагу так швидко, як контрольна (необроблена) група. Якщо приблизно 15-20 % води тіла заміщено D2O, тварини стають збудливими. Якщо приблизно 20-25 % води тіла заміщено D2O, тварини стають настільки збудливими, що вони впадають в часті конвульсії при збудженні. З'являються пошкодження шкіри, виразки на лапах та мордах та некрози хвостів. Тварини стають дуже агресивними. Якщо більше 30 % води тіла заміщено D2О, тварини відмовляються їсти та впадають в кому. Їх вага тіла різко падає, та їх швидкості метаболізму падають набагато нижче нормальних зі смертельними випадками при від приблизно 30 % до приблизно 35 % заміщенні D2О. Ефекти є оборотними, якщо через D2О не втрачено більш ніж тридцять відсотків попередньої ваги тіла. Також дослідження показали, що застосування D2О може уповільнювати ріст ракових клітин та підвищити цитотоксичність окремих протипухлинних засобів. [0011] Дейтеризація лікарських препаратів для покращення фармакокінетики (PK), фармакодинаміки (PD) та профілів токсичності була продемонстрована з декількома класами лікарських засобів. Наприклад, DKIE застосовували для зниження гепатотоксичності галотану, можливо шляхом обмеження утворення реакційноздатних частинок, таких як трифторацетилхлорид. Проте, цей спосіб не може бути застосовним до всіх класів лікарських засобів. Наприклад, включення дейтерію може викликати метаболічне перемикання. Метаболічне перемикання трапляється, якщо ксеногени, секвестровані ферментами Фази І, тимчасово зв'язуються та повторно зв'язуються в різноманітних конформаціях перед хімічною реакцією (наприклад, окиснення). Метаболічне перемикання включається через відносно велику за розміром зв'язуючу "кишеню" у багатьох ферментів Фази I та різноманітну природу багатьох метаболічних реакцій. Метаболічне перемикання може призвести до різних пропорцій відомих метаболітів, а також зовсім нових метаболітів. Цей новий метаболічний профіль може спричинювати більшу або меншу токсичність. Такі труднощі є незвичайними і непередбачуваними a priori для будь-якого класу лікарського засобу. [0012] Лаквінімод являє собою модулятор імунної функції. Зв'язки вуглець-водень 1 лаквінімоду містять розподіл ізотопів водню, що зустрічається в природі, зокрема H або протій 2 3 (приблизно 99,9844 %), H або дейтерий (приблизно 0,0156 %) та H або тритій (у діапазоні від 18 приблизно 0,5 до 67 атомів тритію на 10 атомів протію). Підвищені рівні включення дейтерію можуть давати кінетичний ізотопний ефект дейтерію (DKIE), що може бути виявлений, який може впливати на фармакокінетичний, фармакологічний та/або токсикологічний профілі лаквінімоду порівняно з лаквінімодом, що має природні рівні дейтерію. [0013] На основі відкриттів, зроблених в нашій лабораторії, а також тих, що розглядаються в літературі, лаквінімод метаболізується у людей в хіноліновому кільці, N-метильній групі, Nетильній групі та фенільному кільці. Сучасний підхід має потенціал для запобігання метаболізування в цих ділянках. Інші ділянки на молекулі можуть також піддаватися трансформаціям, що ведуть до метаболітів з поки що невідомою фармакологією/токсикологією. Обмеження утворення цих метаболітів має потенціал до зменшення небезпеки введення цих лікарських засобів та може навіть зробити можливим підвищене дозування та/або підвищену ефективність. Всі ці трансформації можуть відбуватися завдяки поліморфно-експресованим ферментам, що посилює варіабельність між пацієнтами. Крім того, деякі розлади найкраще піддаються лікуванню, якщо пацієнт отримує ліки цілодобово або протягом тривалого періоду часу. Згідно всіх вищевикладених причин, лікарський препарат з більш довгим періодом напіввиведення може приводити до більшої ефективності та економії коштів. Різні схеми дейтеризації можуть бути використані для (a) зменшення або уникнення небажаних метаболітів, (b) подовження періоду напіввиведення вихідного лікарського засобу, (c) зменшення кількості доз, необхідних для досягнення бажаного ефекту, (d) зменшення кількості дози, необхідної для досягнення бажаного ефекту, (e) підвищення утворення активних метаболітів у випадку їх утворення, (f) зменшення продукування шкідливих метаболітів в окремих тканинах та/або (g) створення більш ефективного лікарського засобу та/або більш безпечного лікарського засобу для надлишкового застосування лікарських засобів незалежно від того, або було надлишкове застосування лікарських засобів навмисним, або ні. Підхід дейтеризації має потужний потенціал для уповільнення метаболізування лаквінімоду та пом'якшення варіабельності між пацієнтами. 2 UA 104005 C2 5 [0014] Нові сполуки та фармацевтичні композиції, деякі з яких, як виявилось, модулюють імунну функцію, були відкриті разом зі способами синтезу та застосуванням даних сполук, включаючи способи лікування розладу, опосередкованого імунною функцію, у пацієнта шляхом введення даних сполук. [0015] У певних варіантах здійснення даного винаходу, сполуки мають структурну формулу I: (I) 10 15 20 25 30 35 40 45 50 або його сіль, сольват або проліки, де: R1-R17 є незалежно вибраними з групи, що включає водень та дейтерий; та щонайменше, один з R1-R17 являє собою дейтерий. [0016] Деякі сполуки, розкриті в даному документі, можуть мати придатну модулюючу активність імунної функції та можуть бути застосовані при лікуванні або профілактиці розладу, в якому імунна функція відіграє активну роль. Таким чином, деякі варіанти здійснення також надають фармацевтичні композиції, що містять одну або більше сполук, розкритих в даному документі, разом з фармацевтично прийнятним носієм, а також способи виготовлення та застосування даних сполук та композицій. Деякі варіанти здійснення надають способи модулювання імунної функції. Інші варіанти здійснення надають способи лікування розладу, опосередкованого імунною функцією, у пацієнта у разі потреби такого лікування, що включає етапи, на яких вводять зазначеному пацієнту терапевтично ефективну кількість сполуки або композиції за даним винаходом. Також надається застосування певних сполук, розкритих в даному документі, для застосування при виробництві лікарського препарату для попередження або лікування розладу, який послабляється модуляцією імунної функції. [0017] Сполуки, як розкрито в даному документі, можуть також містити менш поширені 13 14 33 34 ізотопи інших елементів, включаючи, але не обмежуючись, C або C для вуглецю, S, S або 36 15 17 18 S для сірки, N для азоту та О або О для кисню. [0018] У певних варіантах здійснення сполука, розкрита в даному документі, може впливати на пацієнта максимально до приблизно 0,000005 % D2О або приблизно 0,00001 % DHO, припускаючи, що всі C-D зв'язки в сполуці, як розкрито в даному документі, метаболізуються та вивільняються як D2О або DHO. У певних варіантах здійснення рівні D 2O, які, як показано, викликають токсичність у тварин, є значно вищими, ніж навіть максимальна границя впливу, спричиненого введенням збагаченої дейтерієм сполуки, як описано в даному документі. Таким чином, у певних варіантах здійснення збагачена дейтерієм сполука, розкрита в даному документі, не повинна призводити до будь-якої додаткової токсичності, обумовленої утворенням D2О або DHO при метаболізуванні лікарського засобу. [0019] У певних варіантах здійснення дейтеризовані сполуки, розкриті в даному документі, зберігають позитивні аспекти відповідних незбагачених ізотопами молекул, у той же час значно підвищуючи максимальну стерпну дозу, зменшуючи токсичність, підвищуючи період напіввиведення (T1/2), знижуючи максимальну концентрацію в плазмі (Cmax) мінімальної діючої дози (MED), зменшуючи діючу дозу та, таким чином, знижуючи не пов'язану з механізмом токсичність та/або зменшуючи можливість взаємодій лікарський засіб-лікарський засіб. [0020] Всі публікації та посилання, що цитуються в даному документі, безумовно включені в їх повному обсязі. Проте, що стосується будь-яких подібних або ідентичних виразів, знайдених як у включених публікаціях і посиланнях, так і явно застосовуваних або визначених в даному документі, то такі вирази, визначення або значення, явно застосовувані в даному документі, будуть переважними в усіх відношеннях. [0021] Як застосовують у даному документі, вирази, наведені нижче, мають вказані значення. [0022] Форми однини можуть відповідати формам множини, якщо ясно не вказано інше. [0023] Вираз "приблизно", як застосовують у даному документі, призначений для пом'якшення кількісних значень, які він визначає, вказуючи на таке значення, як змінне в межах похибки. Якщо конкретна межа похибки, така як стандартне відхилення від середнього 3 UA 104005 C2 5 10 15 20 25 30 35 40 45 50 55 60 значення, даного в діаграмі або таблиці даних, не наведена, вираз "приблизно" слід розуміти як середнє, що змінюється в діапазоні, який буде охоплювати наведене значення, а також діапазон, що буде включатися заокруглюванням в більшу або меншу сторону до такої цифри, беручи до уваги значущі цифри. [0024] Якщо розкривають діапазони значень, та застосовують запис “від n 1 … до n2“ або “n1n2”, де n1 та n2 є числами, тоді, якщо не зазначено інше, цей запис призначений, як такий, що включає власне числа та діапазон між ними. Цей діапазон може бути цілим числом або безперервним між кінцевими значеннями та включати їх. [0025] Вираз "збагачення дейтерієм" стосується відсоткового співвідношення включення дейтерію у даному положенні в молекулі замість водню. Наприклад, збагачення дейтерієм у розмірі 1 % у даному положенні означає, що 1 % молекул в даному зразку містить дейтерий у зазначеному положенні. Через те, що природне розповсюдження дейтерію складає приблизно 0,0156 %, збагачення дейтерієм у будь-якому положенні в сполуці, синтезованій з застосуванням незбагачених початкових матеріалів, складає приблизно 0,0156 %. Збагачення дейтерієм можна визначити з застосуванням загальноприйнятих аналітичних способів, відомих фахівцю в даній галузі, включаючи мас-спектрометрію та ядерну магнітно-резонансну спектроскопію. [0026] Вираз "являє/являють собою дейтерий", якщо застосовується для опису даного положення в молекулі, такого як R1-R17, або символ "D", якщо застосовується для представлення даного положення в графічному зображенні молекулярної структури, означає, що зазначене положення є збагаченим дейтерієм вище розповсюдження дейтерію, що трапляється в природі. В одному варіанті здійснення збагачення дейтерієм складає не менш ніж приблизно 1 %, в іншому - не менш ніж приблизно 5 %, в іншому - не менш ніж приблизно 10 %, в іншому - не менш ніж приблизно 20 %, в іншому - не менш ніж приблизно 50 %, в іншому - не менш ніж приблизно 70 %, в іншому - не менш ніж приблизно 80 %, в іншому - не менш ніж приблизно 90 % або в іншому - не менш ніж приблизно 98 % дейтерію у зазначеному положенні. [0027] Вираз "ізотопне збагачення" стосується відсоткового співвідношення включення менш поширеного ізотопу елемента у даному положенні в молекулі замість більш поширеного ізотопу елемента. [0028] Вираз "ізотопно незбагачений" стосується молекули, в якій відсоткові вмісти різних ізотопів по суті такі ж, що й природні відсоткові вмісти. [0029] В розкритих в даному документі сполуках існують асиметричні центри. Ці центри позначають символами "R" або "S" залежно від розташування замісників навколо хірального вуглецевого атому. Слід розуміти, що даний винахід охоплює всі стереохімічні ізомерні форми, включаючи діастереомерні, енантіомерні та епімерні форми, а також D-ізомери та L-ізомери, та їх суміші. Окремі стереоізомери сполук можна отримати синтезом з комерційно доступних початкових матеріалів, що містять хіральні центри, або шляхом отримання сумішей енантіомерних продуктів з наступним відділенням, таким як перетворення у суміш діастереомерів з наступним відділенням або рекристалізацією, хроматографічними техніками, безпосереднім відділенням енантіомерів на хіральних хроматографічних колонках або будьяким іншим придатним способом, відомим в даному рівні техніки. Початкові сполуки з конкретною стереохімією є або комерційно доступними, або можуть бути виготовленими та розділеними за допомогою методик, відомих в даному рівні техніки. Додатково, розкриті в даному документі сполуки можуть існувати як геометричні ізомери. Даний винахід включає всі цис, транс, син, анти, E- (від німецького "entgegen") та Z- (від німецького "zusammen") ізомери, а також їх відповідні суміші. Додатково, сполуки можуть існувати як таутомери; всі таутомерні ізомери надаються даним винаходом. Додатково, розкриті в даному документі сполуки можуть існувати у несольватованих, а також сольватованих формах з фармацевтично прийнятними розчинниками, такими як вода, етанол та подібні. Загалом, сольватовані форми розглядаються як еквівалентні несольватованим формам. [0030] Вираз "зв'язок" стосується ковалентного зв'язку між двома атомами або двома частинами, якщо з'єднані зв'язком атоми розглядають як частину більшої структури. Зв'язок може бути одинарним, подвійним або потрійним, якщо не зазначено інше. Пунктирна лінія між двома атомами у графічному зображенні молекули позначає, що в такому положенні може бути присутній або відсутній додатковий зв'язок. [0031] Вираз "розлад", як застосовують у даному документі, призначений як такий, що є в цілому синонімічним та застосовується взаємозамінно з виразами "захворювання" та "стан" (як в медичному стані), в тому, що все відображає ненормальний стан тіла людини або тварини, або однієї з його частин, що погіршує нормальне функціонування, як правило виявляється за відмінними ознаками та симптомами. 4 UA 104005 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0032] Вирази "лікувати", "лікувальний" та "лікування" призначені для включення полегшення або позбавлення від розладу або одного або більше симптомів, пов'язаних з розладом; або послаблення або усунення причини(причин) власне розладу. Як застосовують у даному документі, посилання на "лікування" розладу призначене для включення попередження. Вирази "попереджувати", "попереджуючий" та "попередження" стосуються способу затримки або запобігання прояву розладу; та/або симптомів, що його супроводжують, не допускаючи набуття суб'єктом розладу або зменшуючи у суб'єкта ризик набуття розладу. [0033] Вираз "терапевтично ефективна кількість" стосується кількості сполуки, що при введенні є достатньою для попередження розвитку або полегшення до деякого ступеня одного або більше з симптомів розладу, що піддають лікуванню. Вираз "терапевтично ефективна кількість" також стосується кількості сполуки, що є достатньою для того, щоб викликати біологічну або медичну відповідь клітини, тканини, системи, тварини або людини, якої прагне дослідник, ветеринар, лікар або клініцист. [0034] Вираз "суб'єкт" стосується тварини, включаючи, але без обмежень, примата (наприклад, людина, мавпа, шимпанзе, горила та подібні), гризунів (наприклад, пацюки, миші, піщанки, хом'яки, африканські тхори та подібні), зайцеподібних, свиню (наприклад, свиня, мініатюрна свиня), конячих, собачих, котячих та подібних. Вирази "суб'єкт" та "пацієнт" застосовуються взаємозамінно в даному документі відносно, наприклад, суб'єкта-ссавця, такого як пацієнт-людина. [0035] Вираз "комбінована терапія" позначає введення двох або більше терапевтичних засобів для лікування терапевтичного розладу, описаного в даному розкритті. Таке введення охоплює сумісне введення таких терапевтичних засобів головним чином одночасно, наприклад, в одній капсулі з незмінним співвідношенням активних інгредієнтів або в декількох окремих капсулах для кожного активного інгредієнта. До того ж таке введення також охоплює застосування кожного типу терапевтичного засобу в послідовному порядку. В будь-якому випадку схема лікування буде давати позитивні ефекти комбінації лікарських засобів при лікуванні розладу, описаного в даному документі. [0036] Вираз "імунна функція" стосується сукупності механізмів в організмі, що захищає від захворювання. Такі механізми включають макрофаги, T-лімфоцити та B- лімфоцити та їх відповідні активності. [0037] Вираз "опосередкований імунною функцією розлад" стосується розладу, який характеризується ненормальною імунною функцією. Опосередкований імунною функцією розлад може бути повністю або частково опосередкований модулюванням імунної функції у суб'єкта. Зокрема, опосередкований імунною функцією розлад являє собою такий, в якому модуляція імунної функції приводить до деякого впливу на розлад, що лежить в основі, наприклад, введення модулятора імунної функції приводить до деякого покращення у, принаймні, декількох пацієнтів, яких піддають лікуванню. [0038] Вираз "модулятор імунної функції" стосується здатності сполуки, розкритої в даному документі, змінювати активність імунної функції. Модулятор імунної функції може стимулювати активність імунної функції, може активувати або інгібувати активність імунної функції залежно від концентрації сполуки, якою впливають на суб'єкта, або може інгібувати активність імунної функції. Такі активація або інгібування можуть бути залежними від виникнення специфічної події, такої як активація шляху сигнальної трансдукції, та/або можуть виявлятися лише в конкретних типах клітин. Наприклад, сполуки, розкриті в даному документі, можуть модулювати + імунну функцію завдяки інгібуванню інфільтрації як CD4 T-клітин, так і макрофагів в тканини центральної нервової системи та зміні популяції T-лімфоцитів на користь клітин, що експресують Th2/Th3 цитокіни, інтерлейкін (IL)-4, IL-10 та трансформуючий фактор росту бета. В деяких варіантах здійснення модуляцію імунної функції можна оцінити з застосуванням способу, що описано в Karussis et al., Ann. Neurol. 1993, (34), 654-660; Yang, et al., Journal of Neuroimmunology 2004, 156(1-2), 3-9; Brunmarket al., J. Neuroimmunol. 2002, 130, 163-172; та Jonsson et al., J. Med. Chem. 2004, 47, 2075-88. [0039] Вираз "терапевтично прийнятний" стосується таких сполук (або солей, проліків, таутомерів, цвітеріонних форм і т.д.), які є придатними для застосування в контакті з тканинами пацієнтів безнадлишкової токсичності, подразнення, алергічної реакції, імуногенності, є порівнянними з прийнятним співвідношенням корисність/ризик та є ефективними задля їх призначеного застосування. [0040] Вираз "фармацевтично прийнятний носій", "фармацевтично прийнятний наповнювач", "фізіологічно прийнятний носій" або "фізіологічно прийнятний наповнювач" стосується фармацевтично-прийнятного матеріалу, композиції або середовища для ліків, такого як рідкий або твердий заповнювач, розріджувач, наповнювач, розчинник або інкапсулюючий матеріал. 5 UA 104005 C2 5 10 15 20 25 30 35 40 45 50 55 60 Кожен компонент має бути "фармацевтично прийнятним" в сенсі сумісності з іншими інгредієнтами фармацевтичного складу. Він також має бути придатним для застосування в контакті з тканиною або органом людей та тварин без надмірної токсичності, подразнення, алергічної реакції, імуногенності або інших труднощів або ускладнень, порівнянним з прийнятним співвідношенням корисність/ризик. Дивись, Remington: The Science and Practice of Pharmacy, 21st Edition; Lippincott Williams & Wilkins: Philadelphia, PA, 2005; Handbook of Pharmaceutical Excipients, 5th Edition; Rowe et al., Eds., The Pharmaceutical Press and the American Pharmaceutical Association: 2005; та Handbook of Pharmaceutical Additives, 3rd Edition; Ash and Ash Eds., Gower Publishing Company: 2007; Pharmaceutical Preformulation and Formulation, Gibson Ed., CRC Press LLC: Boca Raton, FL, 2004). [0041] Вирази "активний інгредієнт", "активна сполука" та "активна речовина" стосуються сполуки, яку вводять окремо або в комбінації з одним або більше фармацевтично прийнятними наповнювачами або носіями суб'єкту для лікування, попередження або послаблення одного або більше симптомів розладу. [0042] Вирази "лікарський засіб", "терапевтичний засіб" та "хіміотерапевтичний засіб" стосуються сполуки або її фармацевтичної композиції, яку вводять суб'єкту для лікування, попередження або послаблення одного або більше симптомів розладу. [0043] Вираз "контролюючий вивільнення наповнювач" стосується наповнювача, основною функцією якого є модифікація тривалості або місця вивільнення активної речовини з лікарської форми у порівнянні з традиційною лікарською формою негайного вивільнення. [0044] Вираз "не контролюючий вивільнення наповнювач" стосується наповнювача, основна функція якого не включає модифікування тривалості або місця вивільнення активної речовини з лікарської форми у порівнянні з традиційною лікарською формою негайного вивільнення. [0045] Вираз "проліки" стосується складної функціональної похідної сполуки, як розкрито в даному документі, та яка легко перетворюється in vivo у вихідну сполуку. Проліки часто є придатними через те, що в деяких ситуаціях їх можна ввести легше, ніж вихідну сполуку. Вони можуть бути, наприклад, біодоступними пероральним введенням, у той час як вихідна сполука ні. Проліки можуть також мати підвищену розчинність в фармацевтичних композиціях, ніж вихідна сполука. Проліки можна перетворити у вихідний лікарський засіб за допомогою різних механізмів, включаючи ферментативні процеси та метаболічний гідроліз. Дивись Harper, Progress in Drug Research 1962, 4, 221-294; Morozowich et al. в "Design of Biopharmaceutical Properties through Prodrugs and Analogs, " Roche Ed., APHA Acad. Pharm. Sci. 1977; "Bioreversible Carriers in Drug in Drug Design, Theory and Application, " Roche Ed., APHA Acad. Pharm. Sci. 1987; "Design of Prodrugs, " Bundgaard, Elsevier, 1985; Wang et al., Curr. Pharm. Design 1999, 5, 265287; Pauletti et al., Adv. Drug. Delivery Rev. 1997, 27, 235-256; Mizen et al., Pharm. Biotech. 1998, 11, 345-365; Gaignault et al, Pract. Med. Chem. 1996, 671-696; Asgharnejad в "Transport Processes in Pharmaceutical Systems, " Amidon et al., Ed., Marcell Dekker, 185-218, 2000; Balant et al., Eur. J. DrugMetab. Pharmacokinet. 1990, 15, 143-53; Balimane and Sinko, Adv. Drug Delivery Rev. 1999, 39, 183-209; Browne, Clin. Neuropharmacol. 1997, 20, 1-12; Bundgaard, Arch. Pharm. Chem. 1979, 86, 1-39; Bundgaard, Controlled Drug Delivery 1987, 17, 179-96; Bundgaard, Adv. Drug Delivery Rev.1992, 8, 1-38; Fleisher et al, Adv. Drug Delivery Rev. 1996, 19, 115-130; Fleisher etal., Methods Enzymol. 1985, 112, 360-381; Farquhar et al., J. Pharm. Sci. 1983, 72, 324-325; Freeman et al., J. Chem. Soc, Chem. Commun. 1991, 875-877; Friis and Bundgaard, Eur. J. Pharm. Sci. 1996, 4, 4959; Gangwar et al., Des. Biopharm. Prop. Prodrugs Analogs, 1977, 409-421; Nathwani and Wood, Drugs 1993, 45, 866-94; Sinhababu and Thakker, Adv. Drug Delivery Rev. 1996, 19, 241-273; Stella et al., Drugs 1985, 29, 455-73; Tan et al., Adv. Drug Delivery Rev. 1999, 39, 117-151; Taylor, Adv. Drug Delivery Rev. 1996, 19, 131-148; Valentino and Borchardt, Drug Discovery Today 1997, 2, 148155; Wiebe and Knaus, Adv. Drug Delivery Rev. 1999, 39, 63-80; Waller et al., Br. J. Clin. Pharmac. 1989, 28, 497-507. [0046] Сполуки, розкриті в даному документі, можуть існувати як терапевтично прийнятні солі. Вираз "терапевтично прийнятна сіль", як застосовують у даному документі, представляє собою солі або цвітеріонні форми сполук, розкритих у даному документі, які є терапевтично прийнятними, як визначено в даному документі. Солі можна отримати під час остаточного виділення та очищення сполук або окремо шляхом реакції відповідної сполуки з придатною кислотою або основою. Терапевтично прийнятні солі включають кислотні та основні адитивні солі. Для більш повного обговорення отримання та вибору солей зверніться до "Handbook of Pharmaceutical Salts, Properties, and Use, " Stah and Wermuth, Ed.; (Wiley-VCH and VHCA, Zurich, 2002) та Berge et al., J. Pharm. Sci. 1977, 66, 1-19. [0047] Придатні кислоти для застосування при отриманні фармацевтично прийнятних солей включають, але без обмежень, оцтову кислоту, 2,2-дихлороцтову кислоту, ацильовані 6 UA 104005 C2 5 10 15 20 25 30 35 40 45 50 55 60 амінокислоти, адипінову кислоту, альгінову кислоту, аскорбінову кислоту, L-аспарагінову кислоту, бензолсульфонову кислоту, бензойну кислоту, 4-ацетамідобензойну кислоту, борну кислоту, (+)-камфорну кислоту, камфорсульфонову кислоту, (+)-(1S)-камфор-10-сульфонову кислоту, капринову кислоту, капронову кислоту, каприлову кислоту, коричну кислоту, лимонну кислоту, цикламову кислоту, циклогексансульфамінову кислоту, додецилсірчану кислоту, етан1,2-дисульфонову кислоту, етансульфонову кислоту, 2-гідроксі-етансульфонову кислоту, мурашину кислоту, фумарову кислоту, галактарову кислоту, гентизинову кислоту, глюкогептонову кислоту, D-глюконову кислоту, D-глюкуронову кислоту, L-глутамінову кислоту, αоксо-глутарову кислоту, гліколеву кислоту, гіпурову кислоту, бромоводневу кислоту, соляну кислоту, йодистоводневу кислоту, (+)-L-молочну кислоту, (±)-DL-молочну кислоту, лактобіонову кислоту, лауринову кислоту, малеїнову кислоту, (-)-L-яблучну кислоту, малонову кислоту, (±)DL-мигдальну кислоту, метансульфонову кислоту, нафталін-2-сульфонову кислоту, нафталін1,5-дисульфонову кислоту, l-гідрокси-2-нафтойну кислоту, нікотинову кислоту, азотну кислоту, олеїнову кислоту, оротову кислоту, щавлеву кислоту, пальмітинову кислоту, памову кислоту, перхлорну кислоту, фосфорну кислоту, L-піроглутамінову кислоту, цукрову кислоту, саліцилову кислоту, 4-аміно-саліцилову кислоту, себацинову кислоту, стеаринову кислоту, бурштинову кислоту, сірчану кислоту, дубильну кислоту, (+)-L-винну кислоту, тіоціанову кислоту, pтолуолсульфонову кислоту, ундециленову кислоту та валеріанову кислоту. [0048] Придатні основи для застосування при отриманні фармацевтично прийнятних солей включають, але без обмежень, неорганічні основи, такі як магнію гідроксид, кальцію гідроксид, калію гідроксид, цинку гідроксид або натрію гідроксид; та органічні основи, такі як первинні, вторинні, третинні та четвертинні аліфатичні та ароматичні аміни, включаючи L-аргінін, бенетамін, бензатин, холін, деанол, діетаноламін, діетиламін, диметиламін, дипропіламін, діізопропіламін, 2-(діетиламін)-етанол, етаноламін, етиламін, етилендіамін, ізопропіламін, Nметил-глюкамін, гідрабамін, 1H-імідазол, L-лізин, морфолін, 4-(2-гідроксіетил)-морфолін, метиламін, піперидин, піперазин, пропіламін, піролідин, 1-(2-гідроксіетил)-піролідин, піридин, хінуклідин, хінолін, ізохінолін, вторинні аміни, триетаноламін, триметиламін, триетиламін, Nметил-D-глюкамін, 2-аміно-2-(гідроксиметил)-1,3-пропандіол та трометамін. [0049] У той час як може бути можливим для сполук даного винаходу вживання у вигляді сирої хімічної речовини, також можливим є представлення їх у вигляді фармацевтичної композиції. Відповідно, в даному документі надаються фармацевтичні композиції, які містять одну або більше певних сполук, розкритих в даному документі, або одну або більше фармацевтично прийнятних солей, проліків або їх сольватів разом з одним або більше їх фармацевтично прийнятними носіями та факультативно одним або більше іншими терапевтичними інгредієнтами. Належний склад є залежним від вибраного шляху введення. Будь які з добре відомих методик, носіїв та наповнювачів можна застосовувати як придатні, та як зрозуміло з відомого рівня техніки; наприклад, в Remington's Pharmaceutical Sciences. Фармацевтичні композиції, розкриті в даному документі можна виготовляти будь-яким відомим в даній галузі техніки способом, наприклад, за допомогою загальноприйнятих процесів змішування, розчинення, гранулювання, виготовлення драже, розтирання в порошок, емульгування, включення в желатинову капсулу, захоплювання або пресування. Фармацевтичні композиції можна також скласти як лікарську форму з модифікованим вивільненням, включаючи лікарські форми з уповільненим, подовженим, пролонгованим, безперервним, ударним, контрольованим, прискореним та швидким, націленим, програмованим вивільненням та лікарські форми, що утримуються в шлунку. Ці лікарські форми можна виготовити відповідно до загальноприйнятих способів та методик, відомих фахівцям даної галузі техніки (див. Remington: The Science and Practice of Pharmacy, раніше; Modified-Release Drug Deliver Technology, Rathbone et al., Eds., Drugs and the Pharmaceutical Science, Marcel Dekker, Inc.: New York, NY, 2002; Vol. 126). [0050] Композиції включають такі, що придатні для перорального, парентерального (включаючи підшкірне, внутрішньошкірне, внутрішньом'язове, внутрішньовенне, внутрішньосуглобове та інтрамедулярне), інтраперитонеального, трансмукозального, трансдермального, ректального та місцевого (включаючи дермальне, букальне, сублінгвальне та внутрішньоочне) введення, хоча найбільш придатний шлях може залежати від, наприклад, стану та розладу реципієнта. Композиції можуть традиційно бути представлені в стандартній лікарській формі та можуть бути виготовлені з застосуванням будь-якого зі способів, добре відомих в даному рівні техніки фармації. Взагалі, ці способи включають етап приведення до поєднання сполуки даного винаходу або її фармацевтичної солі, проліків або сольвату ("активний інгредієнт") з носієм, який являє собою один або більше супутніх інгредієнтів. Взагалі, композиції виготовляють шляхом рівномірного та тісного приведення до поєднання 7 UA 104005 C2 5 10 15 20 25 30 35 40 45 50 55 60 активного інгредієнта з рідкими носіями або дрібнодисперсними твердими носіями або і тим, і іншим у разі потреби, формуючи продукт у необхідний склад. [0051] Склади сполук, розкритих в даному документі, придатні для перорального введення, можуть бути представлені як окремі одиниці, такі як капсули, крохмальні облатки або таблетки, при цьому кожна містить попередньо визначену кількість активного інгредієнта; у вигляді порошку або гранул; у вигляді розчину або суспензії у водній рідині або неводній рідині; або у вигляді рідкої емульсії масло-у-воді або рідкої емульсії вода-у-маслі. Активний інгредієнт може також бути представлений у вигляді болюсу, електуарію або пасти. [0052] Фармацевтичні препарати, які можуть використовуватися перорально, включають таблетки, тверді капсули з двох частин, зроблені з желатину, а також м'які, запечатані капсули, зроблені з желатину та пластифікатору, такого як гліцерин або сорбіт. Таблетки можуть бути виготовлені пресуванням або формуванням, факультативно з одним або більше супутніх інгредієнтів. Пресовані таблетки можна отримати пресуванням у придатному приладі активного інгредієнта у вільно-сипкій формі, такій як порошок або гранули, факультативно змішаній зі сполучними, інертними розріджувачами або змащуючими, поверхнево-активними або диспергуючими засобами. Сформовані таблетки можна виготовити формуванням у придатному приладі суміші подрібненої в порошок сполуки, зволоженої інертним рідким розріджувачем. Таблетки можна факультативно вкрити або нанести насічку та можна скласти так, щоб забезпечити в ній повільне або контрольоване вивільнення активного інгредієнта. Всі склади для перорального введення повинні бути в дозуваннях, придатних для такого введення. Тверді капсули з двох частин можуть містити активні інгредієнти з домішкою заповнювача, такого як лактоза, сполучних, таких як крохмалі, та/або змащуючих речовин, таких як тальк або стеарат магнію, та, факультативно, стабілізаторів. У м'яких капсулах активні сполуки можна розчинити або суспендувати в придатних рідинах, таких як жирні масла, рідкий парафін або рідкі поліетиленгліколі. Додатково можна додати стабілізатори. Ядра драже забезпечують придатними покриттями. Задля цього можна застосовувати концентровані цукрові розчини, які можуть факультативно містити ґуміарабік, тальк, полівінілпіролідон, карбополовий гель, поліетиленгліколь та/або діоксид титану, розчини глазурі та придатні органічні розчинники або суміші розчинників. Барвники або пігменти можна додати в покриття таблеток або драже для ідентифікації або для розрізнення різних комбінацій доз активних сполук. [0053] Сполуки можна скласти для парентерального введення ін'єкцією, наприклад, ін'єкцією ударної дози речовини або безперервною інфузією. Склади для ін'єкції можуть бути представлені в стандартній лікарській формі, наприклад, в ампулах або в контейнерах з множинними дозами з доданим консервантом. Композиції можуть приймати такі форми, як суспензії, розчини або емульсії в масляному або водному середовищах для ліків та можуть містити допоміжні засоби, такі як суспендуючі, стабілізуючі та/або диспергуючі засоби. Склади можуть бути представлені в контейнерах зі стандартною дозою або з множинними дозами, наприклад, запечатані ампули та флакони, та можуть зберігатися в порошковій формі або в ліофілізованому (сублімованому) стані, що потребує лише додавання стерильного рідкого носія, наприклад, сольового розчину або стерильної апірогенної води, безпосередньо перед застосуванням. Ін'єкційні розчини та суспензії для негайного прийому можна отримати зі стерильних порошків, гранул та таблеток раніше описаних видів. [0054] Склади для парентерального введення включають водні та неводні (масляні) стерильні ін'єкційні розчини активних сполук, які можуть містити антиоксиданти, буфери, бактеріостатичні фактори та розчинені речовини, які приводять склад в ізотонічний стан з кров'ю призначеного реципієнта; та водні та неводні стерильні суспензії, які можуть включати суспендуючі засоби та загусники. Придатні ліпофільні розчинники або середовища для ліків включають жирні масла, такі як сезамова олія, або синтетичні естери жирних кислот, такі як етилолеат або тригліцериди, або ліпосоми. Водні ін'єкційні суспензії можуть містити речовини, які підвищують в'язкість суспензії, такі як натрію карбоксиметилцелюлоза, сорбіт або декстран. Факультативно, суспензія може також містити придатні стабілізатори або засоби, які підвищують розчинність сполук, щоб забезпечити приготування висококонцентрованих розчинів. [0055] Додатково до попередньо описаних складів сполуки можна також скласти у вигляді депо-препаратів. Такі довгодіючі склади можна вводити імплантацією (наприклад, підшкірно або внутрішньом'язово) або внутрішньом'язовою ін'єкцією. Таким чином, наприклад, сполуки можна скласти з придатними полімерними або гідрофобними матеріалами (наприклад, як емульсію в прийнятному маслі) або іонообмінними смолами, або як помірно розчинні похідні, наприклад, як помірно розчинні солі. [0056] Для букального або сублінгвального введення композиції можуть приймати форму таблеток, коржиків, пастилок або гелів, складених традиційним способом. Такі композиції 8 UA 104005 C2 5 10 15 20 25 30 35 40 45 50 55 можуть містити активний інгредієнт в ароматизованій основі, такій як цукроза та камедь або трагакант. [0057] Сполуки можна скласти в ректальні композиції, такі як супозиторії або утримуюча клізма, наприклад, що містить традиційні супозиторні основи, такі як масло-какао, поліетиленгліколь або інші гліцериди. [0058] Деякі розкриті в даному документі сполуки можна застосовувати місцево, тобто несистемним введенням. Воно включає нанесення розкритої в даному документі сполуки зовнішньо на епідерміс або в щічну кишеню та закапування такої сполуки у вухо, око та ніс так, щоб сполука значно не входила у кровотік. На відміну від цього, системне введення стосується перорального, внутрішньовенного, внутрішньоперитонеального та внутрішньом'язового введення. [0059] Склади, придатні для місцевого застосування включають рідкі або напіврідкі препарати, придатні для проникнення крізь шкіру до місця запалення, такі як гелі, лініменти, лосьйони, креми, мазі або пасти та краплі, придатні для введення в око, вухо або ніс. [0060] Для введення інгаляцією сполуки можна доставляти інсуфлятором, аерозольними балонами під тиском або іншими традиційними засобами доставки аерозолю. Балони під тиском можуть містити придатний газ-витискувач, такий як дихлордифторметан, трихлорфторметан, дихлортетрафторетан, діоксид вуглецю або інший придатний газ. У випадку аерозолю під тиском одиницю дозування можна визначити, забезпечуючи клапан для доставки відміряної кількості. Альтернативно, для введення інгаляцією або інсуфляцією сполуки за даним винаходом можуть приймати форму сухої порошкової композиції, наприклад, порошкової суміші сполуки та придатної порошкової основи, такої як лактоза або крохмаль. Порошкова композиція може бути представлена в стандартній лікарській формі, в, наприклад, капсулах, патронах, желатинових або блістерних пакунках, з яких можна вводити порошок за допомогою інгалятору або інсуфлятору. [0061] Переважні склади стандартної лікарської форми являють собою такі, що містять ефективну дозу активного інгредієнта, як наведено нижче в даному документі, або її відповідну долю. [0062] Сполуки можна вводити перорально або ін'єкцією дозою від 0,1 до 500 мг/кг на добу. Діапазон доз для дорослих людей складає як правило від 5 мг до 2 г/добу. Таблетки або інші форми подання, наведені в дискретних одиницях, можуть традиційно містити кількість однієї або більше сполук, які ефективні в такому дозуванні або множинність таких, наприклад, одиниці, що містять від 5 мг до 500 мг, звичайно близько від 10 мг до 200 мг. [0063] Кількість активного інгредієнта, яку можна поєднати з матеріалами-носіями для отримання лікарської форми для однократного введення, буде варіювати в залежності від реципієнта, якого піддають лікуванню, та конкретного способу введення. [0064] Сполуки можна вводити різними способами, наприклад, перорально, місцево або ін'єкцією. Точна кількість сполуки, що вводять пацієнту, буде відповідальністю лікуючого лікаря. Рівень питомої дози для будь-якого конкретного пацієнта буде залежати від різноманітних факторів, включаючи активність конкретної застосовуваної сполуки, вік, вагу тіла, загальний стан здоров'я, стать, харчові раціони, час введення, шлях введення, швидкість виведення, поєднання лікарських засобів, певний розлад, від якого лікують, та тяжкість розладу, від якого лікують. Також, шлях введення може змінюватися залежно від розладу та його тяжкості. [0065] У випадку, при якому стан пацієнта не покращується, на розсуд лікаря введення сполук можна проводити постійно, тобто, протягом подовженого періоду часу, включаючи протягом всього життя пацієнта задля покращення або, в іншому випадку, контролю, або обмеження симптомів розладу пацієнта. [0066] У випадку, при якому становище пацієнта покращується, на розсуд лікаря введення сполук можна давати безперервно або тимчасово не давати протягом певного проміжку часу (тобто, "лікарські канікули"). [0067] Як тільки відбулося покращення станів пацієнта, у разі потреби вводять підтримуючу дозу. Далі, дозування або частоту ведення або і те, і інше можна зменшувати, залежно від симптомів, до рівня, на якому зберігається послаблений розлад. Проте, пацієнти можуть потребувати переривчастого лікування на довгостроковій основі після поновлення симптомів. [0068] В даному документі розкривають способи лікування опосередкованого імунною функцією розладу, що включає етап, на якому вводять суб'єкту, що має такий розлад або в якого підозрюють такий розлад, терапевтично ефективну кількість сполуки, як розкрито в даному документі, або її фармацевтично прийнятної солі, сольвату або проліків. 9 UA 104005 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0069] Опосередковані імунною функцією розлади включають, але без обмежень, розсіяний склероз та аутоімунний розлад, та/або будь-який розлад, який можна полегшити, пом'якшити або попередити введенням модулятора імунної функції. [0070] У певних варіантах здійснення спосіб лікування опосередкованого імунною функцією розладу включає етап, на якому вводять суб'єкту терапевтично ефективну кількість сполуки, яку розкрито в даному документі, або її фармацевтично прийнятної солі, сольвату або проліків таку, щоб викликати: (1) знижену міжособову варіацію в рівнях сполуки або її метаболітів в плазмі; (2) підвищені середні рівні сполуки в плазмі або знижені середні рівні в плазмі, щонайменше, одного метаболіту сполуки на одиницю дозування; (3) знижене інгібування та/або метаболізування, щонайменше, однією ізоформою цитохрому P450 або моноаміноксидази у суб'єкта; (4) знижене метаболізування, щонайменше, однією ізоформою цитохрому P450, що поліморфно експресується, у суб'єкта; (5) щонайменше, одну статистично значущу кінцеву точку покращеного контролю розладу та/або ліквідації розладу; (6) покращений клінічний ефект під час лікування розладу, (7) попередження поновлення або затримку погіршення або прояву ненормальних травних або печінкових параметрів як основну клінічну сприятливу дію, або (8) зменшення або уникнення шкідливих змін у будь-яких діагностичних кінцевих точках гепатобіліарної функції у порівнянні з відповідною ізотопно незбагаченою сполукою. [0071] У певних варіантах здійснення зменшують міжособову варіацію в рівнях сполук в плазмі, як розкрито в даному документі, або їх метаболітів; підвищують середні рівні сполуки в плазмі, як розкрито в даному документі; знижують середні рівні метаболіту сполуки в плазмі, як розкрито в даному документі; знижують інгібування ізоформи цитохрому P 450 або моноаміноксидази сполукою, як розкрито в даному документі; або знижують метаболізування сполуки, як розкрито в даному документі, щонайменше однією ізоформою цитохрому P450, що поліморфно експресується; на більш ніж близько 5 %, більш ніж близько 10 %, більш ніж близько 20 %, більш ніж близько 30 %, більш ніж близько 40 % або на більш ніж близько 50 % у порівнянні з відповідною ізотопно незбагаченою сполукою. [0072] Рівні сполуки в плазмі, як розкрито в даному документі, або її метаболітів, можна виміряти з застосуванням способів, описаних Li et al. Rapid Communications in Mass Spectrometry 2005, 19, 1943-1950; Sennbro, et al., Rapid Communications in Mass Spectrometry 2006, 20(22), 3313-3318; Edman, et al., Journal of Chromatography, B: Analytical Technologies in the Biomedical and Life Sciences 2003, 785(2); та будь-якими посиланнями, що наведені в цих документах, та їх модифікаціями. [0073] Приклади ізоформ цитохрому P450 у суб'єкта-ссавця включають, але не обмежуючись, CYP1A1, CYP1A2, CYP1B1, CYP2A6, CYP2A13, CYP2B6, CYP2C8, CYP2C9, CYP2C18, CYP2C19, CYP2D6, CYP2E1, CYP2G1, CYP2J2, CYP2R1, CYP2S1, CYP3A4, CYP3A5, CYP3A5P1, CYP3A5P2, CYP3A7, CYP4A11, CYP4B1, CYP4F2, CYP4F3, CYP4F8, CYP4F11, CYP4F12, CYP4 X1, CYP4Z1, CYP5A1, CYP7A1, CYP7B1, CYP8A1, CYP8B1, CYP11A1, CYP11B1, CYP11B2, CYP17, CYP19, CYP21, CYP24, CYP26A1, CYP26B1, CYP27A1, CYP27B1, CYP39, CYP46 та CYP51. [0074] Приклади ізоформ моноаміноксидази у суб'єкта-ссавця включають, але не обмежуючись, MAOА та MAOB. [0075] Інгібування ізоформи цитохрому P450 вимірюють способом Ko et al., British Journal of Clinical Pharmacology, 2000, 49, 343-351. Інгібування ізоформи MAOА вимірюють способом Weyler et al., J. Biol Chem. 1985, 260, 13199-13207. Інгібування ізоформи MAOB вимірюють способом Uebelhack et al. Pharmacopsychiatry, 1998, 31, 187-192. [0076] Приклади ізоформ цитохрому P450, що поліморфно експресуються, у суб'єкта-ссавця включають, але не обмежуючись, CYP2C8, CYP2C9, CYP2C19 та CYP2D6. [0077] Метаболічні активності печінкових мікросом, ізоформ цитохрому P 450 та ізоформ моноаміноксидази вимірюють способами, описаними в даному документі. [0078] Приклади покращених кінцевих точок контролю та/або ліквідації розладу або покращені клінічні ефекти включають, але не обмежуючись, сукупну кількість активних уражень на тиждень 24, сукупну та активну кількість активних та посилених гадолінієм уражень на MRI (магнітна резонансна томографія) кожні 8 тижнів, частоту рецидивів, комплексну функціональну оцінку при розсіяному склерозі, коротку форму 36 оцінки якості життя (Burton et al., Curr. Neurol. & Neurosc. Reports 2007, 7(3), 223-30). [0079] Приклади діагностичних кінцевих точок гепатобіліарної функції включають, але не обмежуючись, аланінамінотрансферазу ("ALT"), сироваткову глутамат-піруваттрансаміназу ("SGPT"), аспартат-амінотрансферазу ("AST" або "SGOT"), співвідношення ALT/AST, сироваткову альдолазу, лужну фосфатазу ("ALP"), рівні аміаку, білірубін, гамаглутамілтранспептидазу ("GGTP", “γ-GTP", або "GGT"), лейцинамінопептидазу ("LAP"), біопсію 10 UA 104005 C2 5 10 15 20 25 30 35 40 45 50 55 60 печінки, ультразвукову ехографію печінки, печінкове ядерне сканування, 5'-нуклеотидазу та білок крові. Гепатобіліарні кінцеві точки порівнюють зі встановленими нормальними рівнями, як th дано в "Diagnostic and Laboratory Test Reference", 4 edition, Mosby, 1999. Ці аналізи проводяться акредитованими лабораторіями відповідно до стандартних протоколів. [0080] Окрім придатності для лікування людей, деякі сполуки та склади, розкриті в даному документі, можуть також бути придатними для ветеринарного лікування домашніх тварин, екзотичних тварин та сільськогосподарських тварин, включаючи ссавців, гризунів та подібних. Більш переважні тварини включають коней, собак та котів. Комбінована терапія [0081] Сполуки, розкриті в даному документі, можна також поєднувати або застосовувати у поєднанні з іншими засобами, придатними в лікуванні опосередкованого імунною функцією розладу. Або, тільки в якості прикладу, терапевтична ефективність однієї зі сполук, описаних в даному документі, можна посилити введенням допоміжного засобу (тобто, сам по собі допоміжний засіб може мати лише мінімальну терапевтичну користь, але у поєднанні з іншим терапевтичним засобом, підвищується загальна терапевтична користь для пацієнта). [0082] Такі інші засоби, допоміжні засоби або лікарські засоби можна вводити, шляхом та в кількості, що звичайно застосовуються для них, одночасно або послідовно зі сполукою, розкритою в даному документі. Якщо сполуку, як описано в даному документі, застосовують одночасно з одним або більше іншими лікарськими засобами, фармацевтичну композицію, що містить такі інші лікарські засоби додатково до сполуки, розкритої в даному документі, можна використовувати, але не обов'язково. [0083] У певних варіантах здійснення сполуки, розкриті в даному документі, можна поєднати з одним або більше імуномодуляторами, стероїдними лікарськими засобами або циклоспоринами. [0084] У певних варіантах здійснення сполуки, надані в даному документі, можна поєднати з одним або більше імуномодуляторами, відомими в даному рівні техніки, включаючи, але без обмежень, філграстим, молграмостим, сарграмостим, ленограстим, анцестим, пегфілграстим, гама-інтерферон, інтерферон альфа-2а, інтерферон альфа-2b, інтерферон альфа-n1, інтерферон бета-1a, інтерферон бета-1b, інтерферон альфакон-1, пегінтерферон альфа-2b, пегінтерферон альфа-2а, інтерферон омега, альдеслейкін, опрелвекін, лентинан, роквінімекс, вакцину БЦЖ, пегадемазу, підотимод, Poly I:C, Poly ICLC, тимопентин, імуноціанін, тазонермін, вакцину від меланоми, глатирамеру ацетат, гістаміну дигідрохлорид, міфамуртид, плериксафор, муромонаб-CD3, антилімфоцитарний імуноглобулін (конячий), антитимоцитарний імуноглобулін (кролячий), мікофенолову кислоту, сиролімус, лефлуномід, алефацепт, еверолімус, гусперимус, ефалізумаб, абетимус, наталізумаб, абатацепт, екулізумаб, етанерцепт, інфліксимаб, афелімомаб, адалімумаб, цертолізумаб пегол, даклізумаб, базиліксимаб, анакінру, циклоспорин, такролімус, азатіоприн, талідомід, метотрексат та леналідомід. [0085] Сполуки, розкриті в даному документі, можна також вводити в поєднанні з іншими класами сполук, включаючи, але без обмежень, інгібітори зворотного захоплення норепінефрину (NRI), такі як атомексин; інгібітори зворотного захоплення допаміну (DARI), такі як метилфенідат; інгібітори зворотного захоплення серотоніну та норепінефрину (SNRI), такі як мілнаципран; заспокійливі засоби, такі як diazepham; інгібітори зворотного захоплення норепінефрину та допаміну (NDRI), такі як бупропіон; інгібітори зворотного захоплення серотоніну, норепінефрину та допаміну (SNDRI), такі як венлафаксин; інгібітори моноаміноксидази, такі як селегілін; гіпоталамічні фосфоліпіди; інгібітори ендотелінперетворюючого ферменту (ECE), такі як фосфорамідон; синтетичні наркотичні препарати, такі як трамадол; антагоністи тромбоксанового рецептора, такі як іфетробан; відкривачі калієвих каналів; інгібітори тромбіну, такі як гірудин; гіпоталамічні фосфоліпіди; інгібітори фактору росту, такі як модулятори активності PDGF (фактор росту тромбоцитів); антагоністи тромбоцитактивуючого фактору (PAF); протитромбоцитні засоби, такі як блокатори GPIIb/IIIa (наприклад, абдксимаб, ептифібатид та тирофібан), антагоністи P2Y(AC) (наприклад, клопідогрель, тиклопідин та CS-747) та аспірин; антикоагулянти, такі як варфарин; низькомолекулярні гепарини, такі як еноксапарин; інгібітори фактору VIIa та інгібітори фактору Xa; інгібітори реніну; інгібітори нейтральної ендопептидази (NEP); інгібітори вазопепсидази (подвійні інгібітори NEPACE (ACE – ангіотензин-перетворюючий фермент)), такі як омапатрилат та гемопатрилат; інгібітори HMG CoA-редуктази, такі як правастатин, ловастатин, аторвастатин, симвастатин, NK104 (також відомий як ітавастатин, нісвастатин або нісбастатин) та ZD-4522 (також відомий як розувастатин або атавастатин, або візастатин); інгібітори скваленсинтетази; фібрати; речовини, що посилюють екскрецію жовчних кислот, такі як квестран; ніацин; протиатеросклеротичні засоби, такі як інгібітори ACAT (ацил–коензим A:холестерол ацилтрансфераза); інгібітори MTP 11 UA 104005 C2 5 10 15 20 25 30 35 40 45 50 55 60 (мікросомальний білок перенесення тригліцеридів); блокатори кальцієвих каналів, такі як амлодипіну безилат; активатори калієвих каналів; альфа-мускаринові засоби; бета-мускаринові засоби, такі як карведілол та метопролол; протиаритмічні засоби; діуретики, такі як хлоротіазид, гідрохлоротіазид, флуметіазид, гідрофлуметіазид, бендрофлуметіазид, метилхлортіазид, трихлорметіазид, політіазид, бензотіазид, етакринову кислоту, трикринафен, хлорталідон, фуроземід, музолімін, буметанід, триамтерен, амілорид та спіронолактон; тромболітичні засоби, такі як тканинний плазміногенний активатор (tPA), рекомбінантний tPA, стрептокіназа, урокіназа, проурокіназа та анізоільований плазміногено-стрептокіназний активаторний комплекс (APSAC); протидіабетичні засоби, такі як бігуаніди (наприклад, метформін), інгібітори глюкозидази (наприклад, акарбоза), інсуліни, меглітиніди (наприклад, репаглініди), сульфонілсечовини (наприклад, глімепірид, глібурид та гліпізид), тіозолідиндіони (наприклад, троглітазон, розіглітазон та піоглітазон) та агоністи PPAR-гама (рецептор, що активує проліферацію пероксисом); антагоністи мінералокортикоїдних рецепторів, такі як спіронолактон та еплеренон; засоби, що підвищують секрецію гормону росту; інгібітори aP2 (адипоцитний білок 2); інгібітори фосфодіестерази, такі як інгібітори ФДЕ III (наприклад, цилостазол) та інгібітор ФДЕ V (наприклад, силденафіл, тадалафіл, варденафіл); інгібітори протеїнтирозинкінази; протизапальні засоби; антипроліферативні засоби, такі як метотрексат, FK506 (такролімус, Prograf), мікофенолату мофетил; хіміотерапевтичні засоби; імунодепресанти; протиракові засоби та цитотоксичні засоби (наприклад, алкілуючі засоби, такі як азотисті іприти, алкілсульфонати, нітрозосечовини, етиленіміни та триазени); антиметаболіти, такі як фолатні антагоністи, пуринові аналоги та аналоги піридину; антибіотики, такі як антрацикліни, блеоміцини, мітоміцин, дактиноміцин та плікаміцин; ферменти, такі як L-аспарагіназа; інгібітори фарнезил-протеїнтрансферази; гормональні засоби, такі як глюкокортикоїди (наприклад, кортизон), естрогени/антиестрогени, андрогени/антиандрогени, прогестини та антагоністи рилізинг-фактору лютеїнізуючого гормону, та октреотиду ацетат; засоби-дезінтегратори мікротрубочок, такі як ектеїнасцидини; засоби, стабілізуючі мікротрубочки, такі як пацитаксел, доцетаксел та епотилони A-F; продукти рослинного походження, такі як алкалоїди барвінка, епіподофілотоксини та таксани; та інгібітори топоізомерази; інгібітори пренілпротеїнтрансферази; та циклоспорини; стероїди, такі як преднізон та дексаметазон; цитотоксичні лікарські засоби, такі як азатиприн та циклофосфамід; інгібітори TNF-альфа (фактор некрозу пухлини), такі як тенідап; антитіла до TNF або розчинний рецептор TNF, такі як етанерцепт, рапаміцин та лефлунімід; та інгібітори циклооксигенази-2 (COX-2), такі як целекоксиб та рофекоксиб; та різні засоби, такі як, гідроксисечовина, прокарбазин, мітотан, гексаметилмеламін, сполуки золота, платинові координаційні комплекси, такі як цисплатин, сатраплатин та карбоплатин. [0086] Таким чином, в іншому аспекті окремі варіанти здійснення надають способи лікування опосередкованих імунною функцією розладів у суб'єкта-людини або суб'єкта-тварини у разі необхідності такого лікування, що включає етапи, на яких вводять зазначеному суб'єкту кількість сполуки, розкритої в даному документі, ефективну для полегшення або попередження зазначеного розладу у суб'єкта, у поєднанні з, щонайменше, одним додатковим засобом для лікування зазначеного розладу, що відомий в даній галузі техніки. У пов'язаному аспекті окремі варіанти здійснення надають терапевтичні композиції, що містять, щонайменше, одну сполуку, розкриту в даному документі, у поєднанні з одним або більше додатковими засобами для лікування опосередкованих імунною функцією розладів. Загальні синтетичні способи отримання сполук [0087] Ізотопний водень можна ввести в сполуку, як розкрито в даному документі, за допомогою синтетичних методик, що задіюють дейтеризовані реагенти, таким чином заздалегідь визначають ступені включення; та/або методиками обміну, де ступені включення визначаються за умовами рівноваги та можуть бути високомінливими залежно від реакційних умов. Синтетичні методики, де тритій або дейтерий безпосередньо та специфічно включають за допомогою насичених тритієм або дейтеризованих реагентів з відомим вмістом ізотопів, можуть дати високий відносний вміст тритію або дейтерію, але можуть бути обмежені необхідною хімією. Техніки обміну, з іншого боку, можуть давати більш низьке включення тритію або дейтерію, при цьому часто з розповсюдженням ізотопу в багатьох ділянках молекули. [0088] Сполуки, як розкрито в даному документі, можна отримати способами, відомими фахівцю в даній галузі, та їх стандартними модифікаціями, та/або згідно процедур, подібних до описаних в розділі Приклади в даному документі та їх стандартних модифікацій, та/або процедурами, що знаходяться в Wennerberg et al., Org. Proc. Res. & Dev. 2007, 11(4), 674-80; Wang et al., Bioorganic & Medicinal Chemistry Letters 2007, 17(10), 2817-2822; Jansson et al., J. Org. Chem. 2006, 71(4), 1658-67; Joensson et al., J. Med. Chem. 2004, 47(8), 2075-88; патентних 12 UA 104005 C2 5 10 15 20 25 30 35 документів US 2007/088050; US 2005/215586; US 2005/192315; US 2004/034227; WO 2005/74899; WO 2003106424; та WO 1999/55678, які цим включені в їх повному обсязі, та посиланнями, наведеними в них, та їх стандартними модифікаціями. Сполуки, як розкрито в даному документі, можна також отримати, як показано в будь-якій з наступних схем та їх простих модифікацій. [0089] Наступні схеми можна застосовувати для здійснення на практиці даного винаходу. Будь-які положення, показані як водень, можна факультативно замістити дейтерієм. Схема I [0090] Сполуку 1 піддають реакції з відповідним хлорформіатом або фосгеновим еквівалентом, таким як ізопропілкарбонхлоридат, в присутності придатного дегідратуючого засобу, такого як ацетилхлорид, в придатному розчиннику, такому як 1,4-діоксан, при підвищеній температурі до даної сполуки 2. Сполуку 2 піддають реакції зі сполукою 3 в присутності відповідної основи, такої як натрію гідрид, в придатному розчиннику, такому як диметилформамід, в умовах інертної атмосфери, такої як азот, до даної сполуки 4. Сполуку 4 піддають реакції з придатним похідним малонату, таким як діетилмалонат, у присутності придатної основи, такої як натрію гідрид, у придатному розчиннику, такому як диметилформамід, при підвищеній температурі до даної сполуки 5. Сполуку 5 піддають реакції зі сполукою 6 у придатному розчиннику, такому як n-гептан, при підвищеній температурі до даної сполуки 7 Формули I. [0091] Дейтерий можна синтетично включити в різні положення відповідно до синтетичних процедур, як показано на Схемі I, з застосуванням придатних дейтеризованих проміжних сполук. Наприклад, для введення дейтерію в одне або більше положень R4-R6 можна використовувати сполуку 1 з відповідними дейтерієвими заміщеннями. Для введення дейтерію в одне або більше положень R1-R3 можна використовувати сполуку 3 з відповідними дейтерієвими заміщеннями. Для введення дейтерію в одне або більше положень R8-R17 можна використовувати сполуку 6 з відповідними дейтерієвими заміщеннями. [0092] Дейтерий можна включити в різні положення, що мають протон, здатний до обміну, такі як гідроксил O-H, завдяки протон-дейтерієвому рівноважному обміну. Наприклад, для введення дейтерію в R7 цей протон можна вибірково або невибірково замістити дейтерієм протон-дейтерієвим обмінним способом, відомим в даній галузі техніки. [0093] Даний винахід далі проілюстровано наступними прикладами. Всі назви IUPAC утворили з застосуванням ChemDraw 10.0 від CambridgeSoft. ПРИКЛАД 1 Натрію 5-хлор-3-(етил(феніл)карбамоїл)-1-метил-2-оксо-1,2-дигідрохінолін-4-олат Етап 1 13 UA 104005 C2 5 [0094] 5-Хлор-1Н-бензо[d][1,3]оксазин-2,4-діон: В атмосфері азоту краплинно додали ізопропілкарбонохлоридат (50 мл, 4,50 еквів.) у суспензію 2-аміно-6-хлорбензойної кислоти (20 г, 116,56 ммоль, 1,00 еквів.) в 1,4-діоксані (150 мл). Отриманий розчин витримали при приблизно 90 °C протягом 30 хвилин та потім охолодили до приблизно 50 °C. Ацетилхлорид (50 мл, 6,00 еквів.) додали однією порцією, та розчин витримали при приблизно 50 °C протягом приблизно 30 хвилин. Отримані тверді речовини зібрали фільтруванням та очистили хроматографією з силікагелем (етилацетат/петролейний ефір 10:1) задля отримання названого продукту у вигляді сіро-білої твердої речовини (17,6 г, вихід: 76 %). Етап 2 10 15 [0095] 5-Хлор-1-метил-1Н-бензо[d][1,3]оксазин-2,4-діон: В атмосфері азоту, 5-хлор-1Нбензо[d][1,3]оксазин-2,4-діон (10 г, 50,61 ммоль, 1,00 еквів.) розчинили у N, N-диметилформаміді (100 мл) при приблизно 5 °C. Потім додали натрію гідрид (2,8 г, 121,5 ммоль, 2,4 еквів.) та метилйодид (5,7 мл, 2 еквів.) та отриману суміш помішували при кімнатній температурі протягом приблизно 16 годин. Суміш продували азотом протягом приблизно 1 годину для отримання названого продукту у вигляді жовтої твердої речовини, яку застосовували безпосередньо в наступному етапі без будь-якого очищення. Етап 3 20 25 30 35 40 [0096] Етил-5-хлор-4-гідрокси-1-метил-2-оксо-1,2-дигідрохінолін-3-карбоксилат: Натрію гідрид (1,9 г, 79,17 ммоль, 1,60 еквів.) додали декількома порціями до суміші 5-хлор-1-метил-1Нбензо[d][1,3]оксазин-2,4-діону в N, N-диметилформаміді з Етапу 2. Потім діетилмалонат (7,7 г, 48,07 ммоль, 1,00 еквів.) краплинно додавали до суміші при помішуванні протягом періоду приблизно 30 хвилин. Отриманий розчин помішували при приблизно 85 °C протягом приблизно 1 години, додали воду (800 мл) та pH розчину довели до 2 розчином соляної кислоти (5 моль/л). Отриманий сирий продукт зібрали фільтруванням та потім перекристалізували в етанолі для отримання названого продукту у вигляді світло-жовтої твердої речовини (2,5 г, вихід: 18 % 2 етапи). Етап 4 [0097] 5-Хлор-N-етил-4-гідрокси-1-метил-2-оксо-N-феніл-1,2-дигідрохінолін-3-карбоксамід: Nетилбензоламін (430 мг, 3,55 ммоль, 2,00 еквів.) краплинно додали до етил-5-хлор-4-гідрокси-1метил-2-оксо-1,2-дигідрохінолін-3-карбоксилату (500 мг, 1,78 ммоль, 1,00 еквів.), розчиненого в гептані (10 мл). Отриману суміш нагріли до приблизно 100 °C та леткі компоненти видалили перегонкою протягом періоду приблизно 7 годин. Після охолодження до кімнатної температури отримані кристали зібрали фільтруванням, промили гептаном та очистили хроматографією з силікагелем (етилацетат/петролейний ефір 1:3) для отримання названого продукту у вигляді білої твердої речовини (0,38 г, вихід: 60 %). Етап 5 14 UA 104005 C2 5 10 [0098] Натрію 5-хлор-3-(етил(феніл)карбамоїл)-1-метил-2-оксо-1,2-дигідрохінолін-4-олат: Значення pH розчину 5-хлор-N-етил-4-гідрокси-1-метил-2-оксо-N-феніл-1,2-дигідрохінолін-3карбоксаміду (170 мг, 0,48 ммоль, 1,00 еквів.) в етанолі (5 мл) довели до 9-10 розчином 5 молярного натрію гідроксиду. Потім суміш помішували протягом приблизно 30 хвилин при кімнатній температурі. Отримані тверді речовини зібрали фільтруванням та промили етанолом 1 для отримання названої сполуки у вигляді білої твердої речовини (70 мг, вихід: 39 %). H NMR (ядерний магнітний резонанс) (300 МГц, DMSO (диметилсульфоксид)) δ: 6,84~7,31(m, 8H), 3,68(q, 2H), 3,34(s, 3H), 1,02(t, 3H). LC-MS (рідинна хроматографія-мас-спектрометрія): m/z=357 + + (M-Na 2H) ПРИКЛАД 2 Натрію 5-хлор-3-(етил(феніл)карбамоїл)-1-d3-метил-2-оксо-1,2-дигідрохінолін-4-олат Етап 1 15 20 25 [0099] d3-Етил-5-хлор-4-гідрокси-1-метил-2-оксо-1,2-дигідрохінолін-3-карбоксилат: Слідували процедурі Прикладу 1, Етапу 2, але замінюючи метилйодид на d3-метилйодид. Отриманий продукт, жовту тверду речовину, застосовували безпосередньо в наступному етапі без будьякого очищення. Етап 3 [00100] d3-Етил-5-хлор-4-гідрокси-1-метил-2-оксо-1,2-дигідрохінолін-3-карбоксилат: Слідували процедурі Прикладу 1, Етапу 3, але замінюючи етил-5-хлор-4-гідрокси-1-метил-2оксо-1,2-дигідрохінолін-3-карбоксилат на d3-етил-5-хлор-4-гідрокси-1-метил-2-оксо-1,2дигідрохінолін-3-карбоксилат. Названий продукт виділили у вигляді жовтої твердої речовини (5,8 г, вихід: 57 % 2 етапи). Етап 4 30 35 [00101] d3-5-Хлор-N-етил-4-гідрокси-1-метил-2-оксо-N-феніл-1,2-дигідрохінолін-3карбоксамід: Слідували процедурі Прикладу 1, Етапу 4, але замінюючи етил-5-хлор-4-гідрокси1-метил-2-оксо-1,2-дигідрохінолін-3-карбоксилат на d3-етил-5-хлор-4-гідрокси-1-метил-2-оксо1,2-дигідрохінолін-3-карбоксилат. Названий продукт виділили у вигляді білої твердої речовини (1,0 г, вихід: 79 %). Етап 5 15 UA 104005 C2 5 10 [00102] Натрію 5-хлор-3-(етил(феніл)карбамоїл)-1-d3-метил-2-оксо-1,2-дигідрохінолін-4-олат: Слідували процедурі Прикладу 1, Етапу 5, але замінюючи 5-хлор-N-етил-4-гідрокси-1-метил-2оксо-N-феніл-1,2-дигідрохінолін-3-карбоксамід на d3-5-хлор-N-етил-4-гідрокси-1-метил-2-оксо-Nфеніл-1,2-дигідрохінолін-3-карбоксамід. Названий продукт виділили у вигляді білої твердої 1 речовини (0,17 г, вихід: 80 %). H NMR (ядерний магнітний резонанс) (300 МГц, DMSO (диметилсульфоксид)) δ: 6,83~7,32(m, 8H), 3,68(q, 2H), 1.03(t, 3H). LC-MS (рідинна + + хроматографія-мас-спектрометрія): m/z=360 (M-Na 2H) . ПРИКЛАД 3 Натрію 5-хлор-3-(d5-етил(феніл)карбамоїл)-1-метил-2-оксо-1,2-дигідрохінолін-4-олат Етап 1 15 20 [00103] трет-бутилфенілкарбамат: Анілін (2,3 г, 25 ммоль, 1 еквів.) розчинили в тетрагідрофурані (25 мл) при приблизно 5 °C. До розчину додали розчин ди-третбутилдикарбонату (6,0 г, 27,5 ммоль) в тетрагідрофурані (10 мл) та отриману суміш нагрівали у колбі зі зворотним холодильником протягом приблизно 2 годин. Розчинник видалили in vacuo та отриманий залишок розчинили в етилацетаті (50 мл). Отриманий розчин промили 1 молярним розчином лимонної кислоти (2×50мл) та сольовим розчином (1×50мл). Органічну фазу висушили над сульфатом натрію та випарили in vacuo задля отримання названого продукту у вигляді білої твердої речовини (4,3 г, вихід: 83 %). Етап 2 25 30 35 [00104] Трет-бутиловий естер d5-етил-феніл-карбамінової кислоти: Калію 2-метилпропан-2олат (790 мг, 7,05 ммоль, 2,50 еквів.) та d5-йодетан (500 мг, 3,11 ммоль, 1,10 еквів.) додали до трет-бутилфенілкарбамату (540 мг, 2,80 ммоль, 1,00 еквів.), розчиненого у N, Nдиметилформаміді (100 мл). Отриману суміш помішували при приблизно 55 °C протягом приблизно 16 годин та потім додали оксид дейтерію (10 мл). pH суміші довели до приблизно 6-7 1 молярною соляною кислотою. Стандартна екстракційна обробка етилацетатом дала названий продукт у вигляді неочищеного залишку, який застосовували в наступному етапі без додаткового очищення. Етап 3 16 UA 104005 C2 5 [00105] N-d5-етилбензоламін: Протягом періоду 1 години, та підтримуючи температуру при близько 25 °C, хлористоводневий газ вводили в трет-бутиловий естер d5-етил-фенілкарбамінової кислоти, розчинений в етилацетаті (5 мл). pH розчину потім довели до 6-7 розчином натрію гідроксиду (10 моль/л). Стандартна екстракційна обробка етилацетатом дала названий продукт у вигляді жовтого масла (0,33 г, вихід: 93 %). Етап 4 10 15 20 25 [00106] 5-Хлор-N-d5-етил-4-гідрокси-1-метил-2-оксо-N-феніл-1,2-дигідрохінолін-3карбоксамід: Слідували процедурі Прикладу 1, Етапу 4, але замінюючи N-етилбензоламін на Nd5-етилбензоламін. Названий продукт виділили у вигляді білої твердої речовини (0,4 г, вихід: 58 %). Етап 5 [00107] Натрію 5-хлор-3-(d5-етил(феніл)карбамоїл)-1-метил-2-оксо-1,2-дигідрохінолін-4-олат: Слідували процедурі Прикладу 1, Етапу 5, але замінюючи 5-хлор-N-етил-4-гідрокси-1-метил-2оксо-N-феніл-1,2-дигідрохінолін-3-карбоксамід на 5-хлор-N-d5-етил-4-гідрокси-1-метил-2-оксо-Nфеніл-1,2-дигідрохінолін-3-карбоксамід. Названий продукт виділили у вигляді білої твердої 1 речовини (90 мг, вихід: 40,5 %). H NMR (ядерний магнітний резонанс) (300 МГц, DMSO (диметилсульфоксид)) δ: 6,84~7,32(m, 8H), 3,34(s, 3H)_LC-MS (рідинна хроматографія-мас+ спектрометрія): m/z=362 (M-Na+2H) . ПРИКЛАД 4 Натрію 5-хлор-3-(d5-етил(феніл)карбамоїл)-1-d3-метил-2-оксо-1,2-дигідрохінолін-4-олат Етап 1 30 17 UA 104005 C2 [00108] 5-хлор-N-d8-етил-4-гідрокси-1-метил-2-оксо-N-феніл-1,2-дигідрохінолін-3карбоксамід: Слідували процедурі Прикладу 2, Етапу 4, але замінюючи N-етилбензоламін на Nd5-етилбензоламін. Названий продукт виділили у вигляді білої твердої речовини. Етап 2 5 10 [00109] Натрію 5-хлор-3-(d8-етил(феніл)карбамоїл)-1-d3-метил-2-оксо-1,2-дигідрохінолін-4олат: Слідували процедурі Прикладу 2, Етапу 5, але замінюючи N-етилбензоламін на N-d5етилбензоламін. Названий продукт виділили у вигляді білої твердої речовини (0,1 г, вихід: 1 70 %). H NMR (ядерний магнітний резонанс) (300 МГц, DMSO (диметилсульфоксид)) δ: 6,83+ + 7,31 (m, 8H). LC-MS (рідинна хроматографія-мас-спектрометрія): m/z=365 (M-Na 2H) . [00110] Наступні сполуки звичайно можна утворити з застосуванням способів, описаних вище. Очікується, що ці сполуки після утворення матимуть активність, подібну до описаних в вищенаведених прикладах. 15 18 UA 104005 C2 5 10 15 20 25 [00111] Зміни в метаболічних властивостях сполук, розкритих в даному документі, у порівнянні з їх ізотопно незбагаченими аналогами можна показати з застосуванням наступних аналізів. Сполуки, перелічені вище, які ще не були утворені та/або протестовані, як передбачається, мають змінені метаболічні властивості, як також показано одним або більше з цих аналізів. Аналізи біологічної активності In vitro аналіз печінкової мікросомальної стабільності [00112] Аналіз печінкової мікросомальної стабільності проводять з розрахунку 2 мг на мл білка печінкових мікросом з NADPH(нікотинамідаденіндинуклеотидфосфат)-утворюючою системою в 2 % бікарбонаті натрію (2,2 ммоль NADPH, 25,6 ммоль глюкозо-6-фосфат, 6 одиниць на мл глюкозо-6-фосфатдегідрогенази та 3,3 ммоль магнію хлориду). Аналізовані сполуки отримують у вигляді розчинів в 20 % ацетонітрил-воді та додають до суміші аналізу (кінцева концентрація аналізу 5 мікрограм на мл), та інкубують при 37 °C. Кінцева концентрація ацетонітрилу в аналізі має бути менше 1 %. Аліквоти (50 мкл) забирають в періоди часу 0, 30, 60, 90 та 120 хвилин та розчиняють льодяним ацетонітрилом (200 мкл) для зупинення реакцій. Зразки центрифугують при 12000 обертів на хвилину протягом 10 хвилин задля осадження білків. Супернатанти переносять до мікроцентрифужних пробірок та зберігають для аналізу LC/MS/MS (рідинна хроматографія/тандемна мас-спектрометрія) періоду напіврозпаду тестових сполук. Періоди напіврозпаду Прикладів 1-4 (лаквінімод та ізотопно збагачені лікарські засоби) показані в Таблиці 1. 19 UA 104005 C2 Результати аналізу in vitro людської печінкової мікросомальної (HLM) стабільності Приклад 1 Приклад 2 Приклад 3 Приклад 4 -20 % - 0 % + % подовження HLM періоду напіврозпаду 0 % - 20 % 20 %-100 % >100 % + + + Таблиця 1 5 10 15 Метаболізування in vitro з застосуванням ферментів цитохрому P450 людини [00113] Ферменти цитохрому P450 експресують з відповідних людських кДНК із застосуванням бакуловірусної експресуючої системи (BD Biosciences, Сан-Хосе, Каліфорнія). 0,25 мілілітра реакційної суміші, що містить 0,8 міліграм на мілілітр білка, 1,3 мілімолярний + НАДФ , 3,3 мілімолярний глюкоза-6-фосфат, 0,4 одиниць/мл глюкоза-6-фосфатдегідрогенази, 3,3 мілімолярний магнію хлорид та 0,2 мілімоль сполуки Формули I, відповідну ізотопно незбагачену сполуку або стандарту, або контролю в 100 мілімолярному калію фосфаті (pH 7,4) інкубують при 37 °C протягом 20 хвилин. Після інкубації реакцію зупиняють додаванням придатного розчинника (наприклад, ацетонітрил, 20 % трихлороцтова кислота, 94 % ацетонітрил/6 % льодяна оцтова кислота, 70 % перхлорна кислота, 94 % ацетонітрил/6 % льодяна оцтова кислота) та центрифугують (10000 g) протягом 3 хвилин. Супернатант аналізують за допомогою HPLC/MS/MS (високоефективна рідинна хроматографія/тандемна мас-спектрометрія). Цитохром P450 CYP1A2 CYP2A6 CYP2B6 CYP2C8 CYP2C9 CYP2C19 CYP2D6 CYP2E1 CYP3A4 CYP4A Стандарт Фенацетин Кумарин 13 [ C]-(S)-мефенітоїн Паклітаксел Диклофенак 13 [ C]-(S)-мефенітоїн (+/-)-Буфуралол Хлорзоксазон Тестостерон 13 [ C]-лауринова кислота 20 25 30 35 40 Інгібування моноаміноксидази А та окислювальне перетворення [00114] Процедуру проводять із застосуванням способів, описаних Weyler, Journal of Biological Chemistry 1985, 260, 13199-13207, що цим включена за допомогою посилання у її повному обсязі. Активність моноаміноксидази A вимірюють спектрофотометрично, спостерігаючи підвищення в поглинанні при 314 нм після окиснення кінураміну з утворенням 4гідроксихіноліну. Вимірювання проводять при 30 °C в 50 ммолярному натрійфосфатному буфері, pH 7,2, що містить 0,2 % Тритон X-100 (буфер для аналізу моноаміноксидази), плюс 1 ммолярний кінурамін та необхідну кількість ферменту в 1 мл загального об'єму. Інгібування моноаміноксидази B та окислювальне перетворення [00115] Процедуру проводять як описано в Uebelhack, Pharmacopsychiatry 1998, 31(5), 187192, яка цим включена за допомогою посилання в її повному обсязі. Визначення лаквінімоду в плазмі з застосуванням рідинної хроматографії на двох послідовно з'єднаних колонках з детектуванням за поглинанням УФ-області спектра [00116] Процедуру проводять як описано в Edman, et al, Journal of Chromatography, B: Analytical Technologies in the Biomedical and Life Sciences 2003, 785(2), яка цим включена за допомогою посилання в її повному обсязі. Визначення лаквінімоду в плазмі людини рідинною хроматографією/тандемною масспектрометрією [00117] Процедуру проводять як описано в Sennbro, et al., Rapid Communications in Mass Spectrometry 2006, 20(22), 3313-3318, яка цим включена за допомогою посилання в її повному обсязі. Вимірювання впливу лаквінімоду на баланс Th1/Th2 та продукування цитокіну Th3 та цитокіну TGF-β у щурів Lewis. 20 UA 104005 C2 5 [00118] Процедуру проводять як описано в Yang, et al., Journal of Neuroimmunology 2004, 156(1-2), 3-9, яка цим включена за допомогою посилання в її повному обсязі. Експериментальна модель аутоімунного енцефаломієліту [00119] Процедуру проводять як описують в Karussis et al., Ann. Neurol 1993, 34, 654-660, яка цим включена за допомогою посилання в її повному обсязі. [00120] З вищенаведеного опису фахівець в даній галузі зможе встановити важливі особливості даного винаходу та без відхилення від його сутності та обсягу зможе здійснити різні зміни та модифікації даного винаходу задля його пристосування для різних застосувань та умов. 10 ФОРМУЛА ВИНАХОДУ 1. Сполука структурної Формули І R2 R4 R16 R3 R15 R1 R5 R17 N O R14 N R6 R8 R9 Cl O R13 O R7 R10 R12 R11 15 20 25 (I) або її сіль, де: R1-R17 незалежно вибрані з групи, що включає водень та дейтерій; та щонайменше один з R 1R17 являє собою дейтерій. 2. Сполука за п. 1, де щонайменше один з R 1-R17 незалежно має збагачення дейтерієм не менш ніж приблизно 10 %. 3. Сполука за п. 1, де щонайменше один з R 1-R17 незалежно має збагачення дейтерієм не менш ніж приблизно 50 %. 4. Сполука за п. 1, де щонайменше один з R1-R17 незалежно має збагачення дейтерієм не менш ніж приблизно 90 %. 5. Сполука за п. 1, де щонайменше один з R 1-R17 незалежно має збагачення дейтерієм не менш ніж приблизно 98 %. 6. Сполука за п. 1, де зазначена сполука має структурну формулу, вибрану з групи, що включає: D Cl O D D D D D CD3 O D CD3 D N OH D O D D N N D Cl O D D D D D N D D , 21 CD3 O D CD3 D , UA 104005 C2 D D D D Cl OH D N D O D O D D N OH D N O D D D Cl D D N D D CD3 D , O CD3 , D D D D Cl OH D D N O CD3 D D N OH D O D D N D D Cl O D D N D D O D D D , , D D D N Cl OH D D Cl O D OH N N O D O D , O D N OH D O D N N D Cl O D D D N D CD3 O CD3 , , D OH O D CD3 N , D O D D D N OH D N 5 D Cl O D N D D D Cl D D D D OH CD3 CD3 , D Cl D O D D D D N D O D D , 22 UA 104005 C2 D D OH D N Cl D Cl O OH O D D N N D O OH N D OH O N N D D CD3 Cl O O D CD3 Cl OH , O D , D N D OH , O D N N D N D O D CD3 D N D D OH OH O N N N D D N O D Cl Cl O O D CD3 CD3 , OH D , Cl O D O D , Cl CD3 D CD3 Cl O D D O D , Cl N D OH , O N N D N O N D CD3 5 Cl OH CD3 , Cl O O OH , O N N D N O D D CD3 N O D та . 7. Сполука за п. 1, де зазначена сполука має структурну формулу, вибрану з групи, що включає 23 UA 104005 C2 Cl OH Cl O OH O N N D N O D CD3 D CD3 Cl OH N D CD3 , O O Cl OH , O N N D N O N CD3 Cl O D CD3 , OH O N D N 5 10 O D та . 8. Сполука за п. 7, де кожне положення, представлене як D, має збагачення дейтерієм не менш ніж приблизно 10 %. 9. Сполука за п. 7, де кожне положення, представлене як D, має збагачення дейтерієм не менш ніж приблизно 50 %. 10. Сполука за п. 7, де кожне положення, представлене як D, має збагачення дейтерієм не менш ніж приблизно 90 %. 11. Сполука за п. 7, де кожне положення, представлене як D, має збагачення дейтерієм не менш ніж приблизно 98 %. 12. Сполука за п. 7, де зазначена сполука має структурну формулу: Cl OH O N D N O CD3 D CD3 . 13. Сполука за п. 7, де зазначена сполука має структурну формулу: Cl OH O N D N 15 O D CD3 . 14. Сполука за п. 7, де зазначена сполука має структурну формулу: 24 UA 104005 C2 Cl OH O N N O CD3 5 10 15 20 . 15. Фармацевтична композиція, що містить сполуку за п. 1 разом з фармацевтично прийнятним носієм. 16. Спосіб лікування опосередкованого імунною функцією розладу, що включає етапи, на яких вводять терапевтично ефективну кількість сполуки за п. 1 пацієнту у разі потреби. 17. Спосіб за п. 16, де зазначений розлад являє собою розсіяний склероз та аутоімунні розлади. 18. Спосіб за п. 16, що додатково включає етапи, на яких вводять додатковий терапевтичний засіб. 19. Спосіб за п. 18, де зазначений додатковий терапевтичний засіб вибирають з групи, що включає імуномодулятори та циклоспорини. 20. Спосіб за п. 19, де зазначений імуномодулятор вибирають з групи, що включає філграстим, молграмостим, сарграмостим, ленограстим, анцестим, пегфілграстим, гамма-інтерферон, інтерферон альфа-2а, інтерферон альфа-2b, інтерферон альфа-n1, інтерферон бета-1а, інтерферон бета-1b, інтерферон альфакон-1, пегінтерферон альфа-2b, пегінтерферон альфа2а, інтерферон омега, альдеслейкін, опрелвекін, лентинан, роквінімекс, вакцину БЦЖ, пегадемазу, підотимод, Poly I:C, Poly ICLC, тимопентин, імуноціанін, тазонермін, вакцину від меланоми, глатирамеру ацетат, гістаміну дигідрохлорид, міфамуртид, плериксафор, муромонаб-СD3, антилімфоцитарний імуноглобулін (конячий), антитимоцитарний імуноглобулін (кролячий), мікофенолову кислоту, сиролімус, лефлуномід, алефацепт, еверолімус, гусперимус, ефалізумаб, абетимус, наталізумаб, абатацепт, екулізумаб, етанерцепт, інфліксимаб, афелімомаб, адалімумаб, цертолізумаб пегол, даклізумаб, базиліксимаб, анакінру, циклоспорин, такролімус, азатіоприн, талідомід, метотрексат та леналідомід. Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 25
ДивитисяДодаткова інформація
Назва патенту англійською2-oxo-1,2-dihydro-quinoline modulators of immune function
Автори російськоюGant, Thomas, G., Shahbaz, Manjuchehr, M.
МПК / Мітки
МПК: A61P 37/08, C07D 215/58, A61K 31/47, A61K 31/198, C07D 215/227
Мітки: 2-оксо-1,2-дигідрохінолінові, модулятори, функції, імунної
Код посилання
<a href="https://ua.patents.su/27-104005-2-okso-12-digidrokhinolinovi-modulyatori-imunno-funkci.html" target="_blank" rel="follow" title="База патентів України">2-оксо-1,2-дигідрохінолінові модулятори імунної функції</a>
Попередній патент: Аналоги бупренорфіну
Наступний патент: Спосіб боротьби з хворобою рослин
Випадковий патент: Пристрій для виймання і укладання пляшок в тару