a-кристалічна форма карбабензпіриду
Номер патенту: 104102
Опубліковано: 25.12.2013
Автори: Жебровська Філя, Ванат Михайло, Сяркевич Олег, Маргітич Віктор, Костюк Григорій
Формула / Реферат
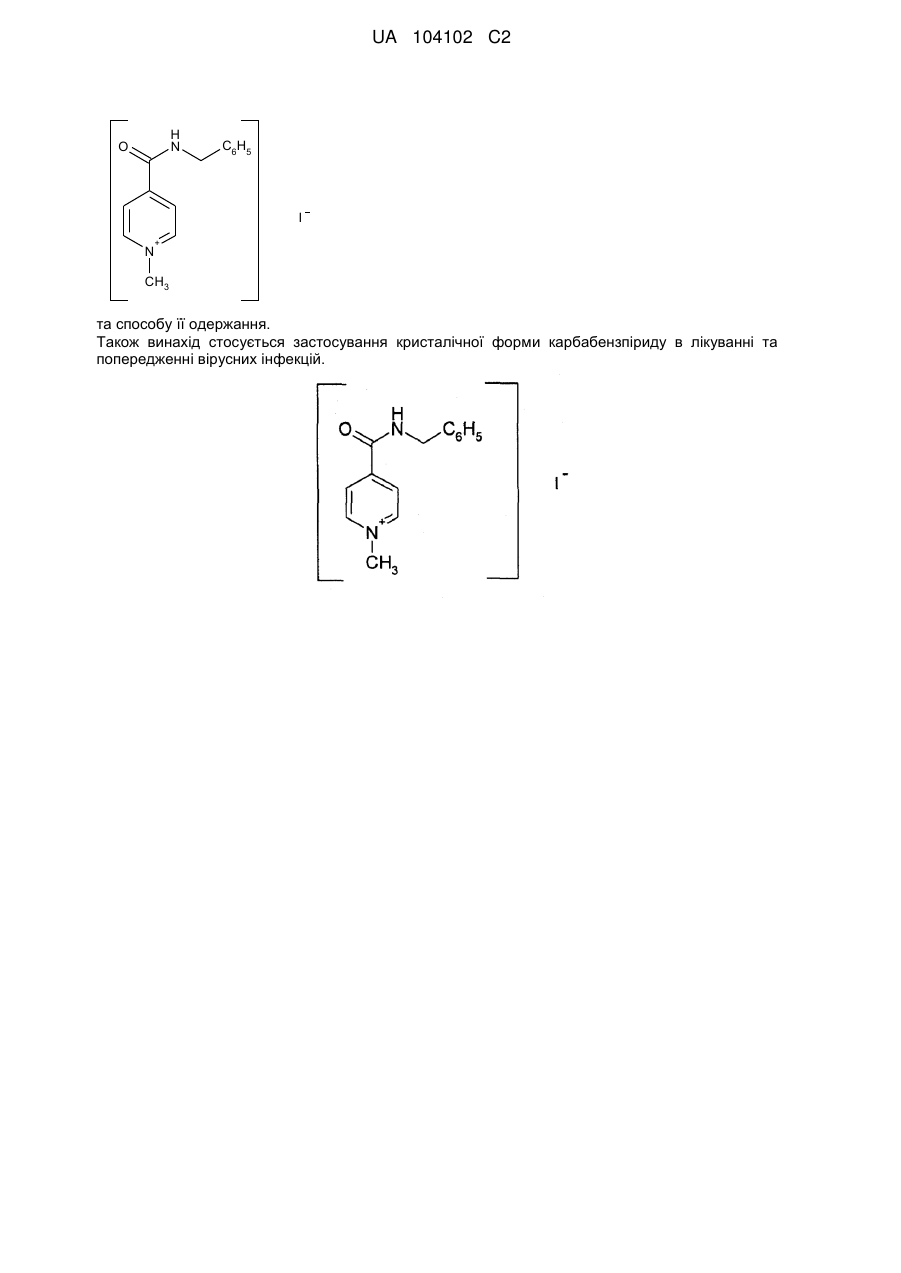
1. α-Кристалічна форма карбабензпіриду формули (І):
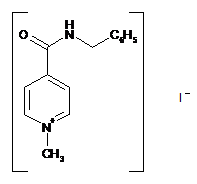 ,
,
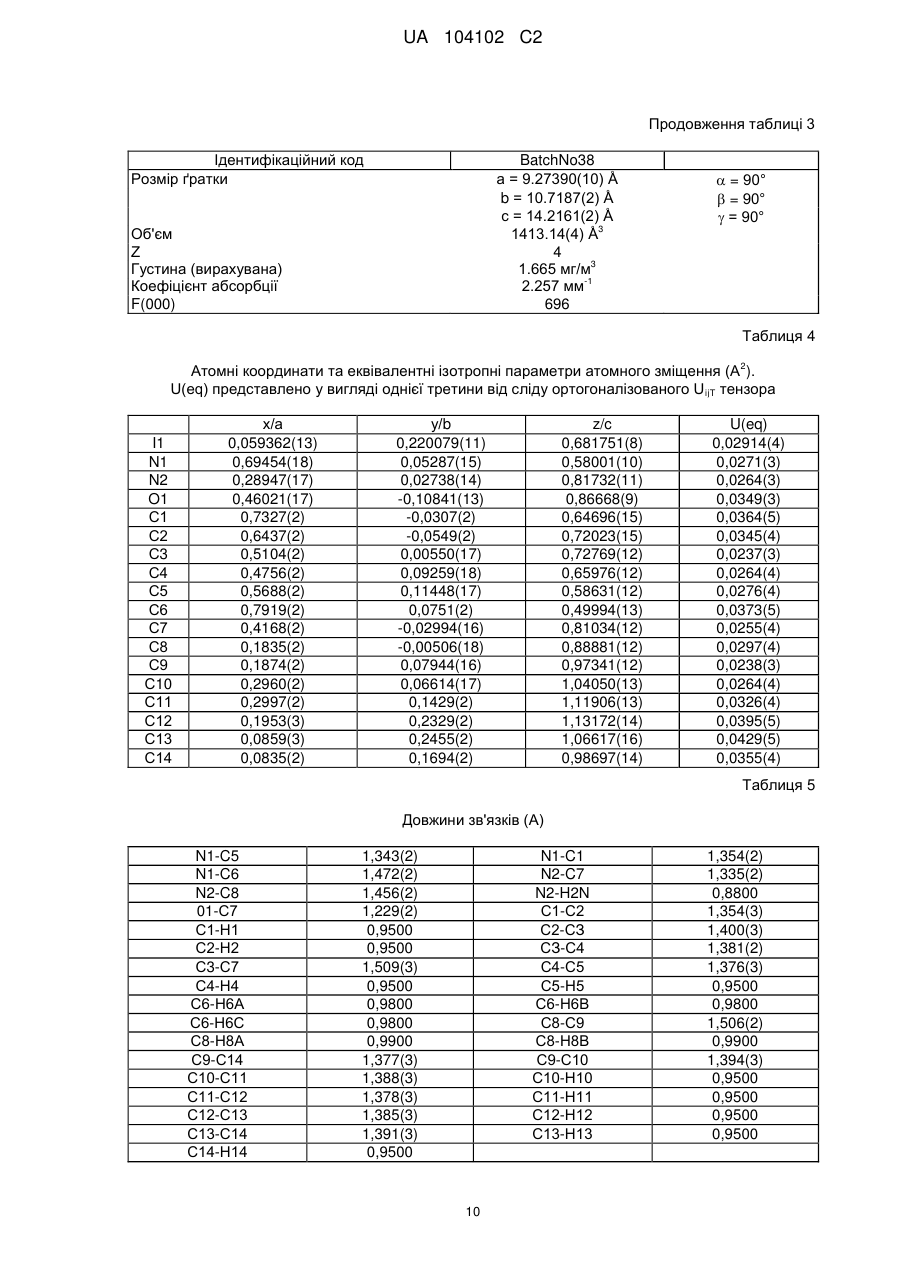
яка має, головним чином, наступні параметри, визначені за допомогою методу порошкової рентгенівської дифракції з застосуванням для вимірювання дифрактометра (мідний антикатод), виражені відносно міжплощинної відстані d, кута Брега 2 тета та відносної інтенсивності (виражається у відсотках до найбільш інтенсивного променя), що зазначені у нижченаведеній таблиці з переліком наступних кутів відхилення високої та середньої інтенсивності:
№
Кут 2 тета (°)
Міжплощинна відстань d (Å)
Відносна інтенсивність
1
2,3925
36,92687
5,23
2
10,2105
8,66366
5,95
3
11,3179
7,81828
5,70
4
12,3706
7,15527
10,86
5
13,9617
6,34318
3,67
6
16,2837
5,44354
6,62
7
17,4171
5,09177
8,45
8
17,6238
5,03251
66,93
9
19,8858
4,46489
100,00
10
20,3088
4,37284
7,36
2. α-Кристалічна форма карбабензпіриду за пунктом 1, яка має ступінь чистоти щонайменше 99,5 %, визначений із застосуванням методу ВЕРХ.
3. α-Кристалічна форма карбабензпіриду за пунктом 2, яка має ступінь чистоти щонайменше 99,9 %, визначений із застосуванням методу ВЕРХ.
4. α-Кристалічна форма карбабензпіриду за пунктом 1, яка має єдиний ендотермічний максимум на ДСК-кривій в межах від 187 до 193 °C.
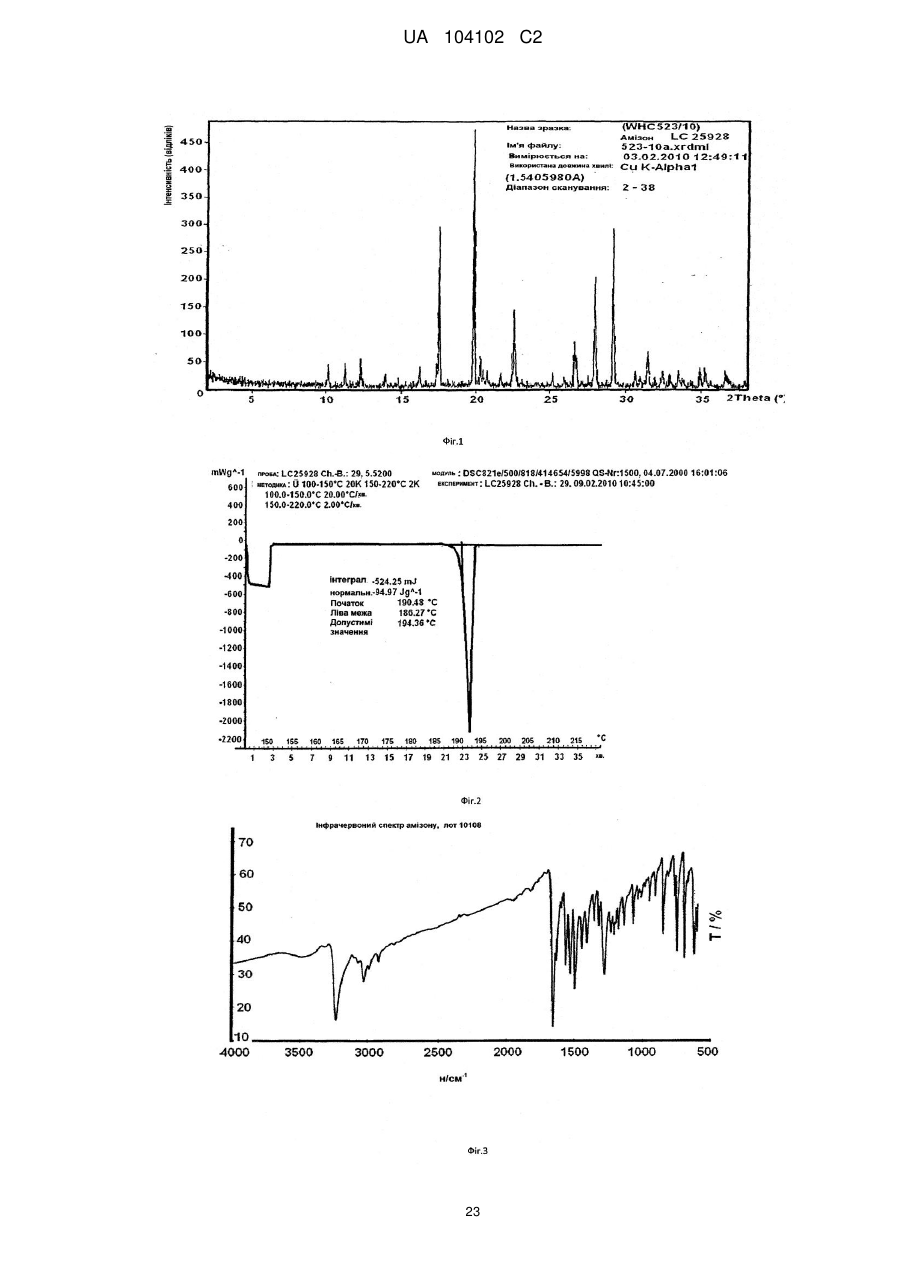
5. α-Кристалічна форма карбабензпіриду за пунктом 1, яка має ІЧ-спектр з характерними піками, показаними у нижченаведеній таблиці:
Хвильове число [см-1]
коливання
3236
N-H
3040
С-Н
2934
С-Н
1622
С=О
1600/1502
С=С
760/704
С-Н
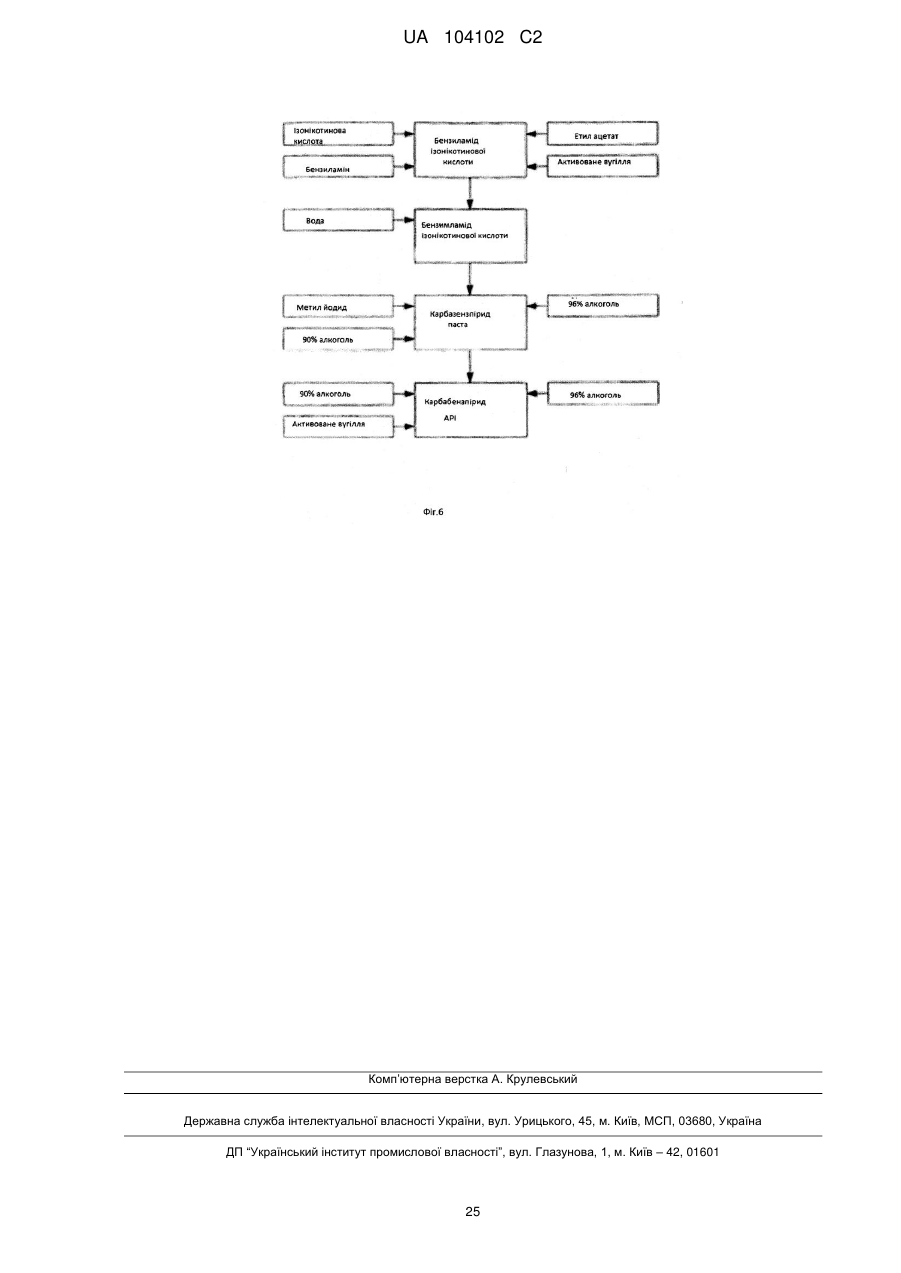
6. Спосіб одержання α-кристалічної форми карбабензпіриду за пунктом 1, за яким здійснюють наступні стадії:
(і) конденсацію ізонікотинової кислоти з бензиламіном при підвищених температурах,
(іі) кристалізацію та виділення конденсованого продукту, одержаного на вищевказаному етапі (і),
(ііі) реакцію кристалічного продукту, одержаного на вищевказаному етапі (іі), з метилйодидом та
(iv) перекристалізацію неочищеного продукту, одержаного на етапі (ііі), з водного розчину спирту.
7. Спосіб за пунктом 6, у якому реакцію конденсації між ізонікотиновою кислотою та бензиламіном відповідно до етапу (і) здійснюють із застосуванням надлишку бензиламіну в межах від 10 до 25 %.
8. Спосіб за пунктом 6, у якому продукт реакції конденсації між ізонікотиновою кислотою та бензиламіном, тобто бензиламід ізонікотинової кислоти (БАІНК), кристалізують з реакційної суміші з застосуванням розчинника, який вибирають із групи, що включає етилацетат, ацетонітрил та ізопропанол.
9. Спосіб за пунктом 8, що додатково включає застосування активованого вугілля.
10. Спосіб за будь-яким з пунктів 6, 8 або 9, у якому продукт, одержаний на етапі (іі), тобто БАІНК, обробляють водою.
11. Спосіб за пунктом 6, у якому на етапі (ііі) реакцію кватернізації бензиламіду ізонікотинової кислоти та метилйодиду здійснюють із застосуванням надлишку метилйодиду в межах від 5 до 15 %.
12. Спосіб за пунктом 11, у якому реакцію кватернізації здійснюють у водному розчині спирту.
13. Спосіб за пунктом 12, у якому водний розчин спирту являє собою 90 % етанол.
14. Спосіб за пунктом 6, в якому додатково здійснюють етап промивання неочищеного продукту, одержаного на етапі (ііі), водним розчином спирту.
15. Спосіб за пунктом 14, у якому водний розчин спирту являє собою 96 % етанол.
16. Спосіб за пунктом 6, у якому водний розчин спирту, що застосовують на етапі (iv), являє собою етанол, що містить воду у кількості від 5 до 15 % об/об.
17. Спосіб за пунктом 16, у якому водний розчин спирту являє собою 90 % етанол.
18. Спосіб за пунктом 6, у якому співвідношення неочищеного продукту та водного розчину етанолу, що застосовують на етапі (iv), знаходиться в межах від 1:2 до 1:4.
19. Спосіб за пунктом 18, у якому співвідношення неочищеного продукту та водного розчину етанолу, що застосовують на етапі (iv), становить 1:3.
20. Спосіб за пунктом 6, у якому перекристалізацію на етапі (iv) здійснюють при спонтанному охолодженні киплячого розчину неочищеного продукту в водному етанолі до температури в межах від 30 до 40 °C з подальшим охолодженням розчину до температури в межах від 10 до 15 °C з наступним перемішуванням протягом періоду від 1 до 3 годин.
21. Фармацевтична композиція, що містить α-кристалічну форму карбабензпіриду формули (І) відповідно до будь-якого з пунктів 1-5 та фармацевтично прийнятний носій.
22. α-Кристалічна форма карбабензпіриду формули (І) відповідно до будь-якого з пунктів 1-5 для застосування в лікуванні та попередженні вірусних інфекцій.
23. α-Кристалічна форма карбабензпіриду за пунктом 22, де вірусні інфекції являють собою інфекції, спричинені вірусами грипу типу А.
24. α-Кристалічна форма карбабензпіриду за пунктом 23, де вірусні інфекції являють собою інфекції, спричинені вірусом типу A [H3N2 (Каліфорнія та Вікторія/3/75), H1N1 (Нова Каледонія 20/99)].
25. α-Кристалічна форма карбабензпіриду за пунктом 22, де вірусні інфекції являють собою інфекції, спричинені аденовірусами, вірусом Коксакі, еховірусом, цитомегаловірусом, метапневмовірусом та ентеровірусом.
26. α-Кристалічна форма карбабензпіриду формули (І) відповідно до будь-якого з пунктів 1-5 для застосування в лікуванні гострих респіраторних захворювань.
Текст
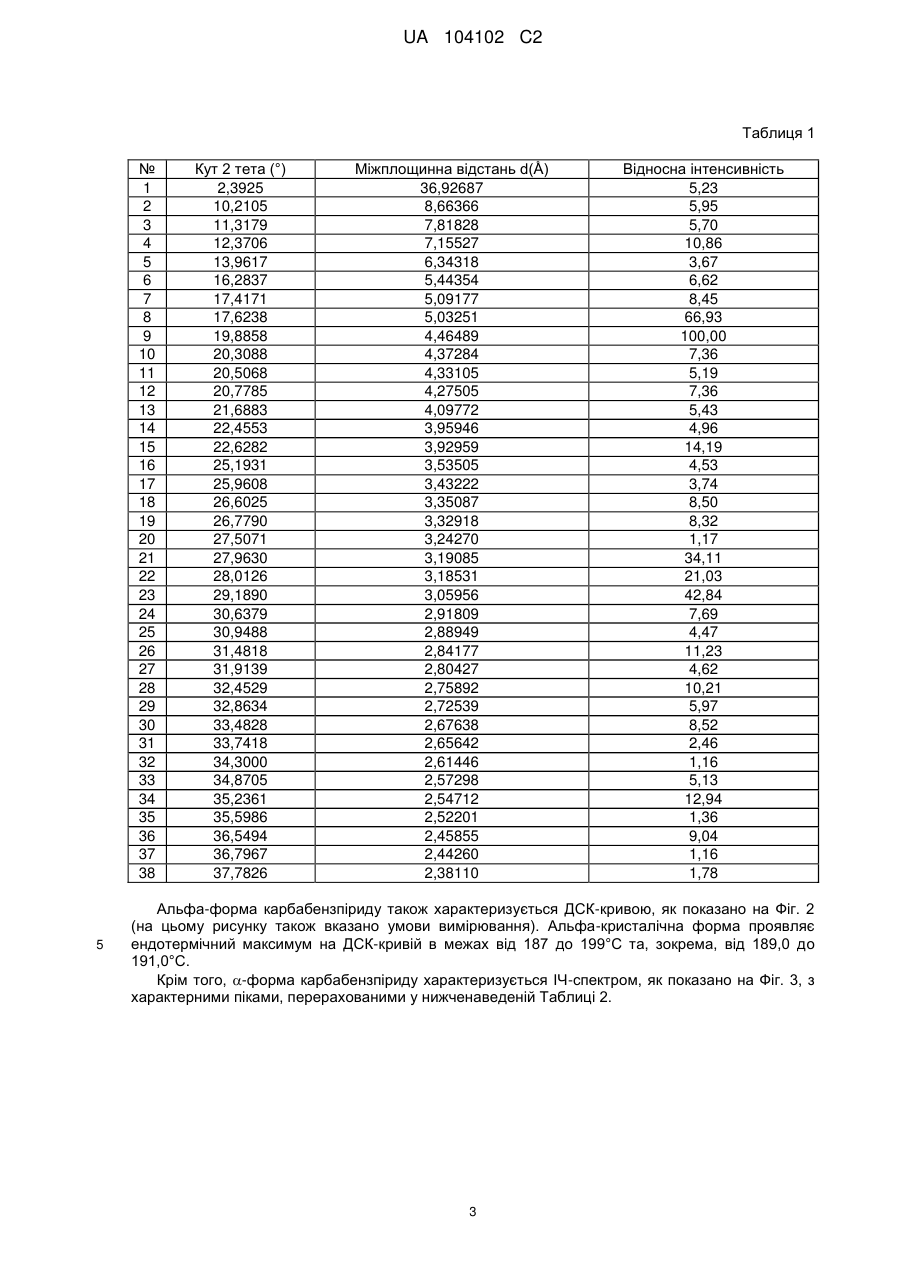
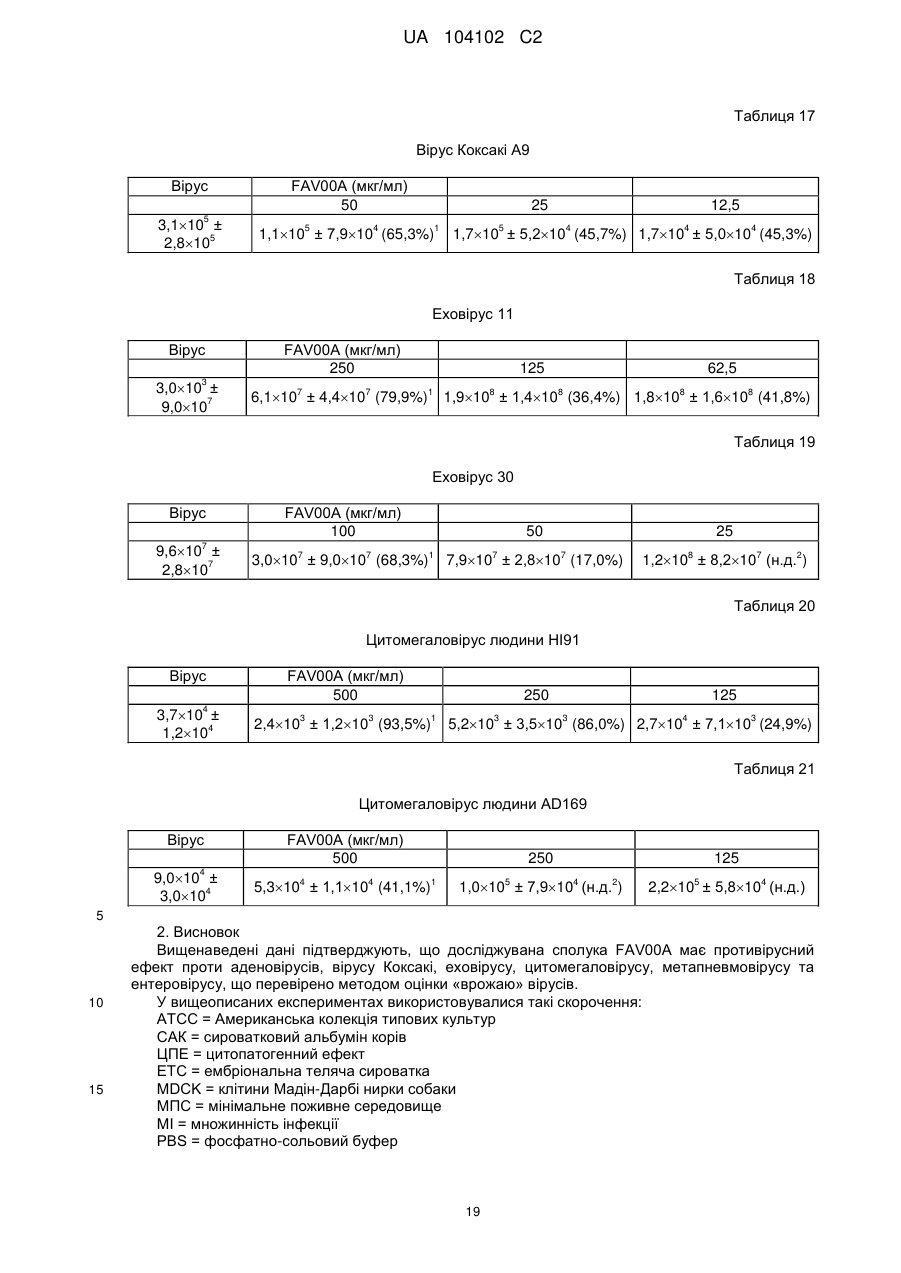
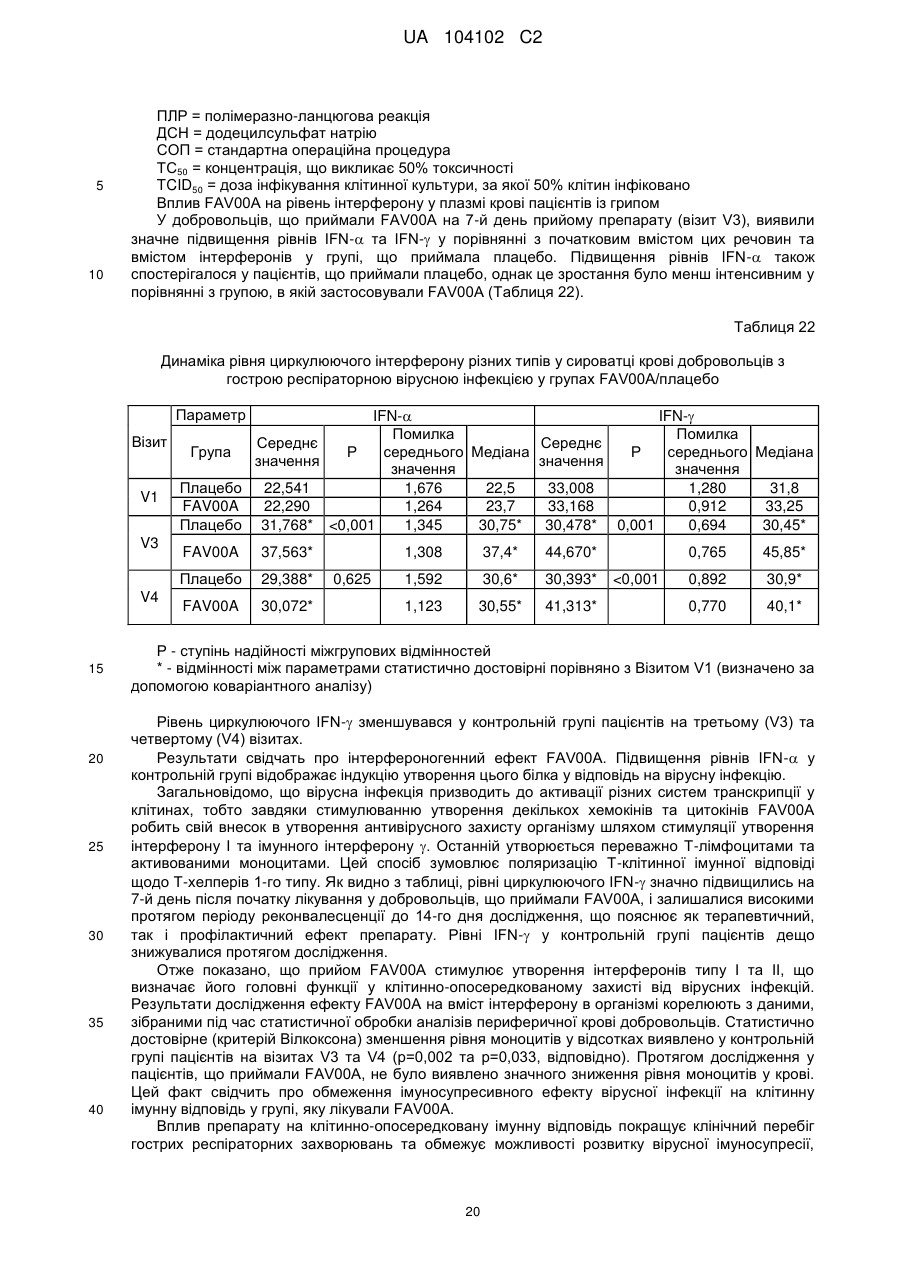
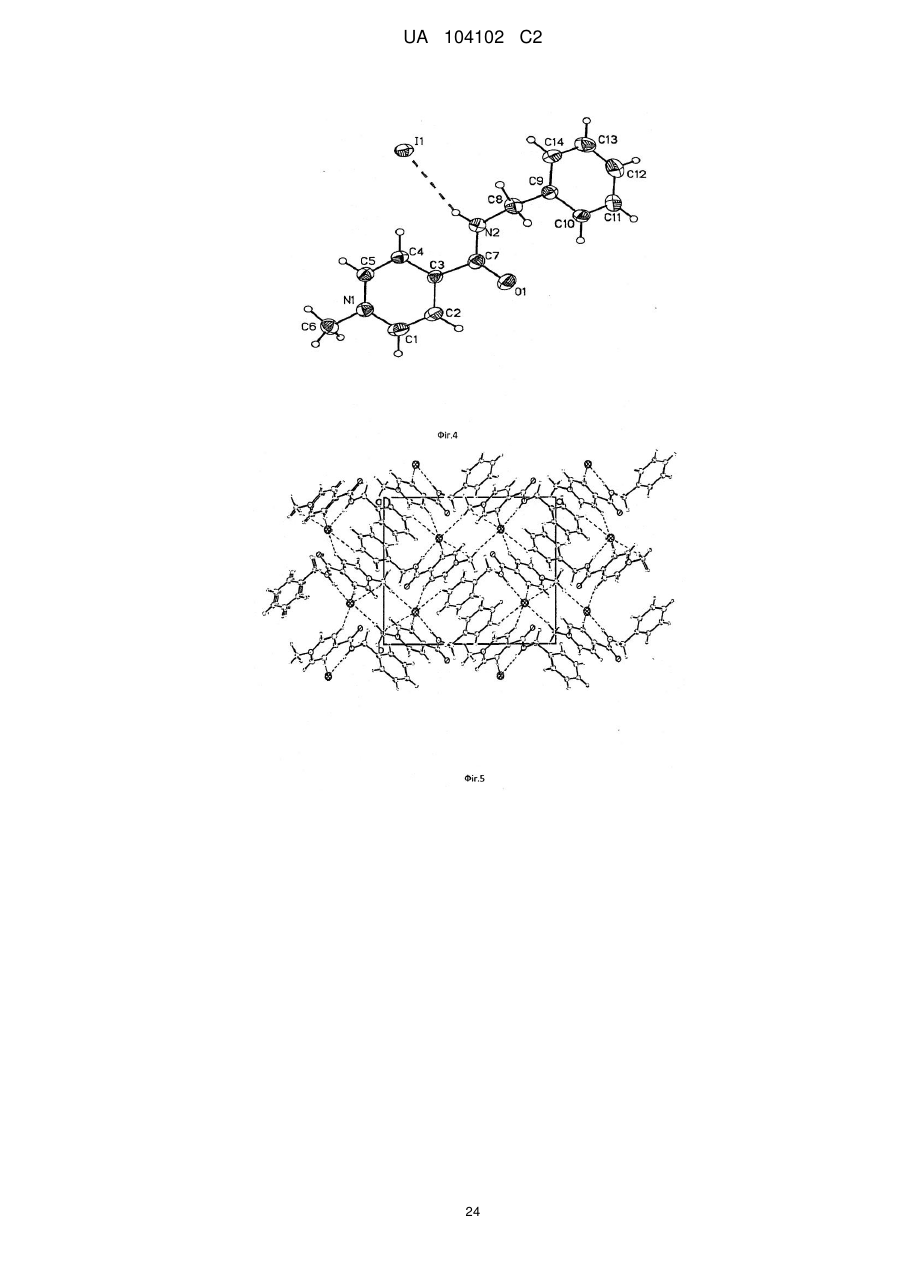
Реферат: Цей винахід стосується кристалічної форми карбабензпіриду формули (І): UA 104102 C2 (12) UA 104102 C2 H N O C6H5 I + N CH3 та способу її одержання. Також винахід стосується застосування кристалічної форми карбабензпіриду в лікуванні та попередженні вірусних інфекцій. UA 104102 C2 5 10 15 20 25 30 Галузь застосування винаходу Цей винахід стосується нової кристалічної форми карбабензпіриду та методу його приготування. Також винахід стосується лікарського препарату, що містить нову кристалічну форму, тобто -кристалічну форму карбабензпіриду. Нарешті, винахід стосується застосування -кристалічної форми карбабензпіриду для виготовлення лікарських засобів для лікування та запобігання вірусним інфекціям. Карбабензпірид має таку формулу (І): та також відомий як Амізон. Передумови створення винаходу Фармакологічно прийнятні солі карбабензпіриду мають цінні фармакологічні властивості. Їх головною характеристикою є здатність лікувати та запобігати вірусним інфекціям, особливо викликаним вірусами грипу А. Для фармакологічного застосування особливий інтерес становить речовина з високим ступенем чистоти. Крім того, бажано використовувати стабільний, добре налагоджений та масштабований виробничий спосіб, у результаті якого одержують продукт відповідної якості, який придатний для виготовлення лікарських засобів. Опис прототипу SU 583612 (1975) описує синтез карбабензпіриду для застосування у фармакологічних цілях, проте відсутній належний опис одержання активної речовини відтворюваним способом. Отже, існувала потреба для методу синтезу, який би забезпечував одержання матеріалу з високим ступенем чистоти, що відповідає вимогам для фармакологічного застосування. Формула винаходу Цей винахід стосується -кристалічної форми карбабензпіриду формули (І): якому притаманні зазначені нижче параметри, визначені за допомогою методу порошкової рентгенівської дифракції з застосуванням для вимірювання дифрактометра (мідний антикатод), виражені відносно міжплощинної відстані d, кута Брега 2 тета і відносної інтенсивності (виражається у відсотках найбільш інтенсивного променя), що наведені у таблиці нижче з переліком кутів відхилення високої та середньої інтенсивності: 1 UA 104102 C2 № 1 2 3 4 5 6 7 8 9 10 5 10 15 20 25 30 35 Кут 2 тета (°) 2,3925 10,2105 11,3179 12,3706 13,9617 16,2837 17,4171 17,6238 19,8858 20,3088 Міжплощинна відстань d(Å) 36,92687 8,66366 7,81828 7,15527 6,34318 5,44354 5,09177 5,03251 4,46489 4,37284 Відносна інтенсивність 5,23 5,95 5,70 10,86 3,67 6,62 8,45 66,93 100,00 7,36 Цю нову -кристалічну форму карбабензпіриду одержано в результаті способу, що відповідно до цього винаходу складається з таких етапів: (і) конденсація ізонікотинової кислоти з бензиламіном за підвищених температур, (іі) кристалізація та виділення конденсованого продукту, одержаного на вищеописаному етапі (і), (ііі) реакція кристалічного продукту, одержаного на вищевказаному етапі (іі), з метилйодидом (iv) перекристалізація неочищеного продукту, одержаної на етапі (ііі), з водного розчину спирту. Стислий опис креслень Фіг. 1 представляє діаграму порошкової рентгенівської дифракції -кристалічної форми карбабензпіриду відповідно до цього винаходу. Фіг. 2 представляє криву диференційної сканувальної калориметрії -форми. Фіг. 3 представляє інфрачервоний спектр -форми. Фіг. 4 представляє вигляд молекули карбабензпіриду з кристалічною структурою, що показує застосовану схему нумерації. Показані еліпсоїди анізотропного зміщення для атомів, крім атомів водню з рівнем ймовірності 50%. Зміщення атомів водню відбувається з як завгодно малим радіусом. Фіг. 5 показує вигляд молекулярної упаковки для -кристалічної форми карбабензпіриду, одержаної із структури кристалу. (Кінцеві константи комірки: а = 9.27390(10)Å, b = 10.7187(2)Å, с 3 = 14.2161(2)Å, = 90°, = 90°, = 90°, об'єм = 1413.14(4)Å . Кінцеві домішки: R1 [для 4152 І> 4(Ι)] = 1.87 % wR2 [всі дані - 4309 ] = 4.40 %). Фіг. 6 схематично показує переважний варіант способу для підготовки -кристалічної форми карбабензпіриду відповідно до цього винаходу. Детальний опис винаходу Відповідно до способів цього винаходу можна одержати нову кристалічну форму карбабензпіриду (Амізону), яка має високий ступінь чистоти. Як показано у нижченаведеній експериментальній частині, відповідно до цього винаходу, нова кристалічна форма, яка має ступінь чистоти щонайменше 99,5% та переважний - щонайменше 99.9%, визначений із застосуванням методу ВЕРХ. Ця нова кристалічна форма карбабензпіриду, тобто -форма, характеризується спектром рентгенівського випромінювання як визначено у пункті 1, що містить перелік кутів відхилення високої та середньої інтенсивності. Заради повноти даних нижченаведена Таблиця 1 також містить інші піки у спектрі рентгенівських променів відповідно до Фіг. 1. 2 UA 104102 C2 Таблиця 1 № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 5 Кут 2 тета (°) 2,3925 10,2105 11,3179 12,3706 13,9617 16,2837 17,4171 17,6238 19,8858 20,3088 20,5068 20,7785 21,6883 22,4553 22,6282 25,1931 25,9608 26,6025 26,7790 27,5071 27,9630 28,0126 29,1890 30,6379 30,9488 31,4818 31,9139 32,4529 32,8634 33,4828 33,7418 34,3000 34,8705 35,2361 35,5986 36,5494 36,7967 37,7826 Міжплощинна відстань d(Å) 36,92687 8,66366 7,81828 7,15527 6,34318 5,44354 5,09177 5,03251 4,46489 4,37284 4,33105 4,27505 4,09772 3,95946 3,92959 3,53505 3,43222 3,35087 3,32918 3,24270 3,19085 3,18531 3,05956 2,91809 2,88949 2,84177 2,80427 2,75892 2,72539 2,67638 2,65642 2,61446 2,57298 2,54712 2,52201 2,45855 2,44260 2,38110 Відносна інтенсивність 5,23 5,95 5,70 10,86 3,67 6,62 8,45 66,93 100,00 7,36 5,19 7,36 5,43 4,96 14,19 4,53 3,74 8,50 8,32 1,17 34,11 21,03 42,84 7,69 4,47 11,23 4,62 10,21 5,97 8,52 2,46 1,16 5,13 12,94 1,36 9,04 1,16 1,78 Альфа-форма карбабензпіриду також характеризується ДСК-кривою, як показано на Фіг. 2 (на цьому рисунку також вказано умови вимірювання). Альфа-кристалічна форма проявляє ендотермічний максимум на ДСК-кривій в межах від 187 до 199°С та, зокрема, від 189,0 до 191,0°С. Крім того, -форма карбабензпіриду характеризується ІЧ-спектром, як показано на Фіг. 3, з характерними піками, перерахованими у нижченаведеній Таблиці 2. 3 UA 104102 C2 Таблиця 2 -1 Хвильове число [см ] 3236 3040 2934 1622 1600/1502 760 / 704 5 10 15 20 25 коливання N-H С-Н С-Н С=О С=С С-Н Як було згадано, -кристалічна форма, яка має ступінь чистоти щонайменше 99,5% та переважний - щонайменше 99.9%, визначений із застосуванням методу ВЕРХ. Такого високого ступеня чистоти не вдалося одержати у прототипі. Зокрема, це стало можливим завдяки використанню відповідно до цього винаходу способу значного зменшення вмісту у готовому препараті метилйодиду, відомої генотоксичної речовини. Як вже було згадано, відповідно до цього винаходу спосіб складається із чотирьох основних етапів, а саме: (і) конденсація ізонікотинової кислоти з бензиламіном за підвищених температур, (іі) кристалізація та виділення конденсованого продукту, одержаного на вищеописаному етапі (і), (ііі) реакція кристалічного продукту, одержаного на вищевказаному етапі (іі), з метилйодидом та (iv) перекристалізація неочищеного продукту, одержаної на етапі (ііі), з водного розчину спирту. Цей спосіб проілюстровано на нижченаведеній схемі: де ізонікотинова кислота позначена ІНК, бензиламін - БА, а БАІНК означає бензиламід ізонікотинової кислоти. Конденсація ізонікотинової кислоти із бензиламіном відбувається за підвищених температур, тобто в межах від 160 до 220°С. Найбільшу перевагу надають температурному діапазону від 200 до 210°С. Мольне співвідношення ізонікотинової кислоти та бензиламіну знаходиться в межах 1: (1,11,25). Найбільша перевага надається співвідношенню приблизно 1:1,23. У результаті реакції ізонікотинової кислоти та бензиламіну утворюється вода, яку видаляють за допомогою дистиляції з надлишком бензиламіну. 4 UA 104102 C2 5 10 15 20 25 30 35 40 45 50 55 60 Продукт конденсації, а саме бензиламід ізонікотинової кислоти (БАІНК) виділяється з реакційної суміші при додаванні розчинника, який вибирають із групи розчинників, а саме етилацетату, ацетонітрилу та ізопропанолу. Найбільшу перевагу як розчиннику надають етилацетату. Відповідно до переважного варіанту способу згідно з цим винаходом, розчин БАІНК, що містить вищезазначений розчинник, переважно етилацетат, обробляють активованим вугіллям. Активоване вугілля використовують у кількості від 0,5% до 1,5% від об'єму розчинника, переважно приблизно 1%. Час обробки активованим вугіллям становить від 20 до 40 хвилин, переважно близько 30 хвилин. Температура, за якої здійснюють обробку активованим вугіллям, змінюється в межах від 65 до 75°С, переважно близько 70°С. Далі активоване вугілля або деревне вугілля відфільтровують, а фільтрат спонтанно охолоджують до температури в межах від 25 до 35°С, переважно близько 30°С. Спонтанне охолодження означає, що розчин просто залишають стояти, поки він не досягне бажаної температури. При цьому не застосовують жодних додаткових засобів або заходів для пришвидшення способу охолодження. Після такого спонтанного охолодження до вищезгаданої температури застосовують охолоджуючий агент, що знижує температуру приблизно до рівня від 0 до 5°С. Після перемішування збирають одержаний неочищений продукт. Його одержують у формі пасти, яку обробляють водою. Масове співвідношення пасти БАІНК та води може бути від 1:2 до 1:3, переважно приблизно 1:2. Цю водну систему нагрівають до температури в межах від 30 до 40°С, переважно від 32 до 35°С. Час перемішування становить від 1,5 до 2,5 годин, переважно близько 2 годин. Після фільтрації преципітат двічі промивають холодною водою, а потім сушать, наприклад, за 25°С протягом 18 годин. У результаті вищезгаданих етапів способу одержують БАІНК, який є гомогенним кристалічним порошком від жовтого до жовто-зеленого забарвлення та містить не більше ніж 0,5% домішок. Такий високий ступінь чистоти дає можливість точно вирахувати кількість метилйодиду, який використовують на третьому етапі способу відповідно до цього винаходу. Зазвичай реакція кватернізації БАІНК та метилйодиду проводиться з застосуванням надлишку останнього в межах від 5 до 15%, переважно від 8 до 12%. Найбільшу перевагу надають надлишку метилйодиду, що становить приблизно 10%. Відповідно до переважного варіанту способу згідно з цим винаходом, реакція кватернізації відбувається у водному розчині спирту. Вміст води у спирті зазвичай становить від 5 до 15%, переважно від 8 до 12%. Найбільшу перевагу надають вмісту води близько 10%, а спиртом є етанол. Неочищений продукт реакції кватернізації можуть виділяти із застосуванням фільтрації та промивати переважно водним розчином спирту. Переважно використовують 96% етанол. Чисту -форму карбабензпіриду відповідно до цього винаходу одержують завдяки рекристалізації неочищеного продукту, одержаного на етапі (ііі), з водного розчину етанолу. Зазвичай кількість води, наявної в етанолі становить від 5 до 15%, переважно від 7 до 13%. Найбільшу перевагу для застосування на етапі (iv) надають 90% етанолу. Відповідно до переважного варіанту заявленого способу співвідношення розчинника до неочищеного продукту, що застосовується на етапі (iv), знаходиться в межах від 1:2 до 1:4. Найбільш переважним є співвідношення близько 1:3. Після розчинення неочищеного продукту у розчиннику, переважно у 90% етанолі, розчин спонтанно (тобто без застосування охолоджуючих агентів) охолоджують від температури розчинника до рівня від 30 до 40°С. Найбільшу перевагу надають спонтанному охолодженню гарячого розчину (тобто без застосування охолоджуючих агентів) до температури приблизно 30°С. Після цього температуру знижують до рівня від 10 до 15°С. Після перемішування протягом періоду від 1 до 3 годин чистий продукт можна відфільтрувати та промити, наприклад, 2 рази, холодним 96% спиртом. Відповідно до переважного варіанту способу рекристалізації до розчину неочищеного продукту додають активоване деревне вугілля. Винахід також стосується фармацевтичних препаратів, що містять як активна речовина кристалічну форму сполуки (І) із одним або кількома фармацевтично прийнятними, інертними компонентами. Лікарська форма може застосовуватися перорально, назально, ректально або 5 UA 104102 C2 5 10 15 20 25 30 35 40 45 парентерально у формі таблеток, таблеток, вкритих оболонкою, желатинових капсул, пастилок, розчинів для перорального застосування, назальних спреїв, розчинів для ін'єкцій, супозиторіїв, розчинів для інгаляції або порошків, тощо. Ефективне дозування може змінюватися від 125 мг до 2500 мг на день в один або 4 окремі прийоми. Фармацевтичні препарати відповідно до цього винаходу можуть використовуватися у лікуванні або запобіганні вірусних інфекцій. Зокрема, їх використовують при інфекціях, спричинених такими вірусами грипу (А), як віруси штамів типу A [H3N2 (Каліфорнія та Вікторія/3/75), H1N1 (Нова Каледонія 20/99)]. Крім того, нова -кристалічна форма карбабензпіриду відповідно до цього винаходу, а також лікарські засоби, що містять цю сполуку, виявляють противірусну активність щодо аденовірусів, вірусів Коксакі, еховірусів, цитомегаловірусу, метапневмовірусу та ентеровірусу, визначених за результатами аналізу відтворення вірусів. І, врешті решт, виявлено, що нова -кристалічна форма має вплив на вміст інтерферону у плазмі крові пацієнтів із грипом. Відповідно до цього винаходу вплив -кристалічної форми карбабензпіриду сполуки (І) на клітинно-опосередковану імунну відповідь приводить до покращення клінічного перебігу гострих респіраторних захворювань та обмежує можливості розвитку вірусної імуносупресії, ускладнень та переходу інфекції у хронічну форму. Збільшення утворення інтерферону-гамма (IFN-) має особливо важливе значення, оскільки крім противірусної активності він виявляє різні ефекти на клітини імунної системи, мієломоноцитарні клітини та вважається ключовим цитокіном, що супроводжує спосіб антигенної стимуляції лімфоцитів. Наступні приклади ілюструють винахід, проте жодним способом не обмежують його. Експериментальна частина Приготування БАІНК Приклад 1 Суміш 91,4 г (0,7424 Μ) ізонікотинової кислоти та 97,9 г (0,9136 Μ) бензи-ламіну (1:1,23) нагрівають до температури180°С з застосуванням зворотного конденсатора та перемішують протягом 1 год. При цьому температура реакції зменшується до 160°С. Тоді реакційну масу нагрівають до температури 210°С протягом 2 год з застосуванням прямого конденсатора для відгонки водного бензиламіну. Реакційну масу нагрівають до температури 220°С протягом 1,5 год з застосуванням прямого конденсатора для відгонки надлишку бензиламіну. Вміст реактора охолоджують до температури 100°С, додають 240 мл етилацетату, потім реакційну масу перемішують протягом 20 хв та додають 2,4 г деревного вугілля, після чого реакційну масу перемішують при температури 70-75° С протягом 30 хв, фільтрують від деревного вугілля, а одержаний розчин спонтанно охолоджують до 30°С, а потім до 0-+5°С із застосуванням охолоджуючого агента, протягом 1 год перемішують та фільтрують. Пасту БАІНК змішують з 180 мл води, нагрівають до температури 32-35°С та перемішують протягом 2 год. Реакційну масу фільтрують, а преципітат у фільтрі промивають двічі 50 мл охолодженої води. Продукт висушують при температурі 25°С протягом 18 год. Кількість БАІНК: 136,5 г (86.6 %). Аналітичний контроль: Вміст: 101,44% Вміст супутніх домішок: БА, % 0,1 50 55 ІΗК, % відсутня Всі домішки (разом), % 0,1 Приклад 2 Цей приклад відрізняється від Прикладу 1 тим, що: 1. Суміш 294 г (2,39 Μ) ізонікотинової кислоти та 316,0 г (2,95 Μ) бензиламіну нагрівають. 2. Додають 772 мл етилацетату. 3. Пасту БАІНК змішують з 500 мл води. Кількість БАІНК: 413,6 г (81,6 %). Приклад 3 Цей приклад відрізняється від Прикладу 1 тим, що : 1. Суміш 45,7 г (0,3715 Μ) ізонікотинової кислоти та 49,1 г (0,4589 Μ) бензиламіну нагрівають. 2. Додають 120 мл етилацетату. 6 UA 104102 C2 5 10 15 20 3. Пасту БАІНК змішують з 80 мл води. Кількість БАІНК: 65,1 г (82,6 %). Приготування неочищеного карбабензпіриду Приклад 4 106,1 г (0,5 Μ) БАІНК поміщують у реактор, обладнаний мішалкою, зворотнім конденсатором та крапельною лійкою, додають 230 мл 90 % спирту, реакційну масу нагрівають до 38-40°С та перемішують протягом 30 хв до одержання розчину. Додають 2,3 г деревного вугілля і нагрівають реакційну масу до температури 60-70°С на 30 хв, після чого реакційну масу фільтрують, а деревне вугілля у фільтрі двічі промивають 5 мл 90% спирту. Одержаний розчин нагрівають до температури 40-41 °С і по краплях додають 78,1 г (0,55 Μ) метилйодиду. Реакційну масу перемішують при температурі 40-41 °С протягом 1 год, нагрівають до кипіння та кип'ятять протягом 1 год. Реакційну масу спонтанно охолоджують до температури 40°С, а тоді на водяній бані до температури 10-15°С, при цій температурі суміш перемішують протягом 1,5 год (без затравки кристалів). Реакційну масу фільтрують, а преципітат на фільтрі двічі промивають 55 мл охолодженого 96% спирту. Продукт висушують при 25° С протягом 18 год та зважують. Кількість неочищеного карбабензпіриду (пасти): 164,6 г (92,9 %) Аналітичний контроль: Вміст: 102,05% Вміст супутніх домішок: БА, % відсутній 25 30 35 40 БАІНК, % 0,3 ІНК, % відсутня Інші домішки, % 0,05 Приклад 5 Цей приклад відрізняється від Прикладу 4 тим, що для реакції кватернізації використовують 398 г БАІНК (1,88 М), 868 мл 90 % спирту та 292,0 г (2,06 Μ) метилйодиду. Кількість неочищеного карбабензпіриду (пасти): 586.8 г Приклад 6 Цей приклад відрізняється від Прикладу 4 тим, що для реакції кватернізації використовують 30 г (0,14 Μ) БАІНК, 63,5 мл 90 % спирту, 21,42 г (0,15 Μ) метилйодиду. Кількість неочищеного карбабензпіриду (пасти): 42,9 г Приготування очищеної -кристалічної форми карбабензпіриду Приклад 7 580 г неочищеного карбабензпіриду розчиняють у 1744 мл 90 % спирту (1:3) (m/V), та додають 17 г активованого деревного вугілля. Реакційну масу нагрівають до температури кипіння, перемішують та кип'ятять протягом 30 хв і фільтрують. Одержаний розчин спонтанно охолоджують до температури 30°С, а тоді на охолоджуючій водяній бані до температури 1015°С, після цього за такої температури перемішують протягом 1 год (без затравки кристалів). Реакційну масу фільтрують, а преципітат на фільтрі двічі промивають 105 мл охолодженого 96 % спирту. Продукт висушують при температурі 25° С протягом 18 год та зважують. Кількість очищеного карбабензпіриду: 502,8 г (62,5 % на основі ізонікотинової кислоти). Аналітичний контроль: Вміст: 100,97% Вміст супутніх домішок: 45 БА, % відсутній 50 БАІНК, % 0,01 Загальна кількість домішок, % 0,01 Приклад 8 Цей приклад відрізняється від Прикладу 7 тим, що для реакції рекристалізації використовують 30 г неочищеного карбабензпіриду, 90 мл 90% спирту та 0,1 г активованого деревного вугілля. Кількість очищеного карбабензпіриду. 25,6 г (60,3% на основі ізонікотинової кислоти). Аналітичний контроль: Вміст: 100,58% Вміст супутніх домішок: 55 7 UA 104102 C2 БА, % 0,005 5 БАІНК, % відсутній Загальна кількість домішок, % 0,005 Приклад 9 Цей приклад відрізняється від Прикладу 7 тим, що для рекристалізації використовують 500 г неочищеного карбабензпіриду, 1500 мл 90 % спирту та 15 г активованого деревного вугілля. Кількість очищеного карбабензпіриду. 425,79 г (75,4% на основі ізонікотинової кислоти). Аналітичний контроль: Вміст: 99,48% Вміст супутніх домішок: 10 БА, % 0,01 15 20 БАІНК, % 0,015 Загальна кількість домішок, % 0,03 Приклад 10 50 г неочищеного карбабензпіриду розчиняють у 150 мл 90% алкоголю (1:3) (m/V), додають 1,5 г активованого деревного вугілля, реакційну масу нагрівають до температури кипіння, помішують і кип'ятять протягом 30 хв та фільтрують. Одержаний розчин спонтанно охолоджують до температури 30°С, а тоді на охолоджуючій водяній бані до температури 1015°С, при цій температурі перемішують протягом 1 год (без затравки кристалів), фільтрують для одержання розчину, а фільтр двічі промивають 20 мл охолодженого 96% спирту. Продукт висушують при 25°С протягом 18 год та зважують. Кількість очищеного карбабензпіриду. 44 г (70,8% на основі ізонікотинової кислоти). Аналітичний контроль: Температура плавлення: 191,3°С Вміст: 99,81% Вміст супутніх домішок: 25 БА, % відсутній 30 БАІНК, % 0,01 Загальна кількість домішок, % 0,03 Приклад 11 Цей приклад відрізняється від Прикладу 10 тим, що як розчинник використовують 70% спирт. Кількість очищеного карбабензпіриду. 33 г (53,1% на основі ізонікотинової кислоти). Аналітичний контроль: Температура плавлення: 191,5°С Вміст: 101,01% Вміст супутніх домішок: 35 БА, % відсутній 40 БАІНК, % 0,03 Загальна кількість домішок, % 0,05 Приклад 12 Цей приклад відрізняється від Прикладу 10 тим, що як розчинник використовують воду. Кількість очищеного карбабензпіриду. 40,6 г (65,4 % на основі ізонікотинової кислоти). Аналітичний контроль: Температура плавлення: 191,4°С Вміст: 100,19% Вміст супутніх домішок: БА, % відсутній БАІНК, % 0,14 Загальна кількість домішок, % 0,2 45 Приклад 13 Цей приклад відрізняється від Прикладу 10 тим, що неочищений карбабензпірид очищують, і карбабензпірид піддають другій рекристалізації з застосуванням як розчинник води. 40 г очищеного карбабензпіриду розчиняють у 460 мл води при температурі 30-35°С, перемішують 8 UA 104102 C2 5 протягом 20 хв, а тоді спонтанно охолоджують до температури 22-25°С, далі перемішують протягом 1 год, а тоді охолоджують протягом 2 год до температури 7-10°С та фільтрують. Кількість очищеного карбабензпіриду. 29,5 г (73,8%, на основі очищеного карбабензпіриду) Аналітичний контроль: Температура плавлення: 191,1 °С Вміст: 99,11 % Вміст супутніх домішок: БА, % відсутній 10 15 20 25 30 35 40 БАІНК, % 0,007 Загальна кількість домішок, % 0,04 Інформація про структуру кристалу (-кристалічна форма карбабензпіриду) Для кристалографічного аналізу з застосуванням рентгенівських променів використовували жовту призму C14H15IN2O, з приблизними розмірами 0,26 мм 0,34 мм 0,40 мм. Дані щодо інтенсивності рентгенівського випромінювання визначалися при 173(2) K на системі Bruker SMART APEX II, обладнаній графітовим монохроматором та МоK запаяною трубкою з ультратонким фокусом ( = 0,71073Å), що працює за потужності 1250 Вт (50 кВ, 25 мА). Детектор був розташований на відстані 60 мм від кристалу. Було одержано 458 зображень з шириною сканування 1.5° у та 211 додаткових зображень з шириною сканування 1.5° у . Всі зображення були одержані з витримкою 20 с/зображення. Загальний час одержання даних становив 5 годин. Зображення були інтегровані за допомогою пакета програмного забезпечення Bruker SAINT з застосуванням алгоритму інтеграції вузьких зображень. Інтеграцію даних виконували з застосуванням ромбічної елементарної комірки, що дало загалом 18403 відбиттів до максимального кута падіння = 30,54° (розділення - 0,7 Å), з яких 4309 були незалежними (надлишковість 4,27, повнота = 99,7%, Rint = 2,67%, Rsig = 2,29%) і 4152 (96,4 %) перевищували 4 2 (F ). Остаточні параметри елементарної комірки (а = 9,27390(10)Å, b = 10,7187(2)Å, с = 3 14,2161(2)Å, = 90°, = 90°, = 90°, об'єм = 1413,14(4)Å ) ґрунтуються на уточненні центрів мас ΧΥΖ 9894 відбиттів понад 20 (Ι) з 2,38° < 2 < 30,54°. Аналіз даних показав незначний розпад під час збору даних. Дані були відкориговані з урахуванням ефекту поглинання з застосуванням чисельного методу (SADABS). Співвідношення мінімального до максимального очевидного пропускання становило 0,79. Підраховані коефіцієнти мінімального та максимального пропускання (на основі розміру кристалу) становлять 0,4625 та 0,5872. Структура була визначена та уточнена за допомогою пакета програмного забезпечення Bruker SHELXTL (версія 6.1) з застосуванням просторової групи Р2(1)2(1)2(1), із Ζ = 4 для складу елементарної комірки C14H15IN20. Остаточне уточнення з застосуванням анізотропного 2 наближення повноматричного метода найменших квадратів за F з 164 змінними зійшлося при R1 = 1.87% для даних, що спостерігались, і при wR2 = 4.40% - для всіх даних. Ступінь відповідності був 1,117. Найбільший пік при остаточному диференційному відтворенні - 3 - 3 електронної густини був 0,260 е /Å , а дірка - 0,752 е /Å із середньоквадратичним відхиленням - 3 3 0,093 е /А . Густина, розрахована на основі остаточної моделі, склала 1.665 г/см і F(000), 696 e . Результати рентгеноструктурного графічного аналізу кристалу підсумовані у наступних таблицях: Таблиця 3 Цифрові дані про кристал Ідентифікаційний код Назва сполуки Емпірична формула Молекулярна формула Молекулярна маса за формулою Температура Довжина хвилі Розмір кристалу Кристалічна форма Кристалічна система Просторова група BatchNo38 BatchNo38 15 C14H IN20 C14H15IN20 354,18 173(2) K 0,71073 Å 0,40 0,34 0,26 жовта призма орторомбічна Р2(1)2(1)2(1) 9 мм UA 104102 C2 Продовження таблиці 3 Ідентифікаційний код Розмір ґратки BatchNo38 а = 9.27390(10) Å b = 10.7187(2) Å с = 14.2161(2) Å 3 1413.14(4) Å 4 3 1.665 мг/м -1 2.257 мм 696 Об'єм Ζ Густина (вирахувана) Коефіцієнт абсорбції F(000) = 90° = 90° = 90° Таблиця 4 2 Атомні координати та еквівалентні ізотропні параметри атомного зміщення (А ). U(eq) представлено у вигляді однієї третини від сліду ортогоналізованого U ijT тензора I1 N1 N2 O1 С1 С2 С3 С4 С5 С6 С7 С8 С9 С10 С11 С12 С13 С14 х/а 0,059362(13) 0,69454(18) 0,28947(17) 0,46021(17) 0,7327(2) 0,6437(2) 0,5104(2) 0,4756(2) 0,5688(2) 0,7919(2) 0,4168(2) 0,1835(2) 0,1874(2) 0,2960(2) 0,2997(2) 0,1953(3) 0,0859(3) 0,0835(2) у/b 0,220079(11) 0,05287(15) 0,02738(14) -0,10841(13) -0,0307(2) -0,0549(2) 0,00550(17) 0,09259(18) 0,11448(17) 0,0751(2) -0,02994(16) -0,00506(18) 0,07944(16) 0,06614(17) 0,1429(2) 0,2329(2) 0,2455(2) 0,1694(2) z/c 0,681751(8) 0,58001(10) 0,81732(11) 0,86668(9) 0,64696(15) 0,72023(15) 0,72769(12) 0,65976(12) 0,58631(12) 0,49994(13) 0,81034(12) 0,88881(12) 0,97341(12) 1,04050(13) 1,11906(13) 1,13172(14) 1,06617(16) 0,98697(14) U(eq) 0,02914(4) 0,0271(3) 0,0264(3) 0,0349(3) 0,0364(5) 0,0345(4) 0,0237(3) 0,0264(4) 0,0276(4) 0,0373(5) 0,0255(4) 0,0297(4) 0,0238(3) 0,0264(4) 0,0326(4) 0,0395(5) 0,0429(5) 0,0355(4) Таблиця 5 Довжини зв'язків (А) N1-C5 N1-C6 N2-C8 01-С7 С1-Н1 С2-Н2 С3-С7 С4-Н4 С6-Н6А С6-Н6С С8-Н8А С9-С14 С10-С11 С11-С12 С12-С13 С13-С14 С14-Н14 1,343(2) 1,472(2) 1,456(2) 1,229(2) 0,9500 0,9500 1,509(3) 0,9500 0,9800 0,9800 0,9900 1,377(3) 1,388(3) 1,378(3) 1,385(3) 1,391(3) 0,9500 N1-C1 N2-C7 N2-H2N С1-С2 С2-СЗ СЗ-С4 С4-С5 С5-Н5 С6-Н6В С8-С9 С8-Н8В С9-С10 С10-Н10 С11-Н11 С12-Н12 С13-Н13 10 1,354(2) 1,335(2) 0,8800 1,354(3) 1,400(3) 1,381(2) 1,376(3) 0,9500 0,9800 1,506(2) 0,9900 1,394(3) 0,9500 0,9500 0,9500 0,9500 UA 104102 C2 Таблиця 6 Кути зв'язків (°) C5-N1-C1 C1-N1-C6 C7-N2-H2N C2-C1-N1 N1-C1-H1 С1-С2-Н2 С4-СЗ-С2 С2-СЗ-С7 С5-С4-Н4 N1-C5-C4 С4-С5-Н5 N1-C6-H6B N1-C6-H6C Н6В-С6-Н6С О1-С7-СЗ N2-C8-C9 С9-С8-Н8А С9-С8-Н8В С14-С9-С10 С10-С9-С8 С11-С10-Н10 С12-С11-С10 С10-С11-Н11 С11-С12-Н12 С12-С13-С14 С14-С13-Н13 С9-С14-Н14 120,36(17) 119,35(17) 118,7 120,51(19) 119,7 119,7 117,77(18) 116,78(16) 120,0 120,82(16) 119,6 109,5 109,5 109,5 119,43(17) 113,40(15) 108,9 108,9 118,77(17) 120,18(17) 119,7 120,17(19) 119,9 120,1 119,9(2) 120,0 119,6 C5-N1-C6 C7-N2-C8 C8-N2-H2N С2-С1-Н1 С1-С2-СЗ СЗ-С2-Н2 С4-СЗ-С7 С5-С4-СЗ СЗ-С4-Н4 N1-C5-H5 N1-C6-H6A Н6А-С6-Н6В Н6А-С6-Н6С O1-C7-N2 N2-C7-C3 N2-C8-H8A N2-C8-H8B Н8А-С8-Н8В С14-С9-С8 С11-С10-С9 С9-С10-Н10 С12-С11-Н11 С11-С12-С13 С13-С12-Н12 С12-С13-Н13 С9-С14-С13 С13-С14-Н14 120,29(16) 122,64(16) 118,7 119,7 120,56(18) 119,7 125,45(17) 119,93(17) 120,0 119,6 109,5 109,5 109,5 123,79(18) 116,79(16) 108,9 108,9 107,7 121,04(17) 120,54(18) 119,7 119,9 119,71(19) 120,1 120,0 120,87(19) 119,6 Таблиця 7 Торсійні кути (°) C5-N1-C1-C2 N1-C1-C2-C3 С1-С2-С3-С7 С7-С3-С4-С5 C6-N1-C5-C4 C8-N2-C7-O1 С4-С3-С7-О1 C4-C3-C7-N2 C7-N2-C8-C9 N2-C8-C9-C10 С8-С9-С10-С11 С10-С11-С12-С13 С10-С9-С14-С13 С12-С13-С14-С9 5 10 1,1(3) 0,4(3) 178,4(2) -178,38(17) 178,63(18) -5,2(3) -179,47(19) 0,6(3) 97,4(2) -76,5(2) -179,44(17) 0,6(3) -0,2(3) 1,2(3) C6-N1-C1-C2 С1-С2-С3-С4 С2-С3-С4-С5 C1-N1-C5-C4 C3-C4-C5-N1 C8-N2-C7-C3 С2-С3-С7-О1 C2-C3-C7-N2 N2-C8-C9-C14 С14-С9-С10-С11 С9-С10-С11-С12 С11-С12-С13-С14 С8-С9-С14-С13 -178,5(2) -2,0(3) 2,0(3) -1,0(3) -0,6(3) 174,76(15) 0,1(2) -179,81(18) 104,6(2) -0,5(3) 0,3(3) -1,4(3) 178,67(19) Антивірусна активність проти штамів вірусу грипу типу A [H3N2 (Каліфорнія та Вікторія/3/75), H1N1 (Нова Каледонія 20/99)] Метою нижчеописаного дослідження було перевірити антивірусну активність -кристалічної форми карбабензпіриду, що має кодову назву "FAV00A" проти різних штамів вірусів грипу типу А. Пригнічення вірусної інфекції у культурі клітин MDCK (NBL-2) (клітини Мадін-Дарбі нирки собаки) перевіряли, визначаючи зменшення титрів вірусів за допомогою методу оцінки 11 UA 104102 C2 5 10 15 20 25 30 35 40 45 50 55 60 зменшення «врожаю» вірусів. Як контроль ефективності FAV00A використали речовину порівняння (Занамівір - інгібітор нейрамінідази) з відомим противірусним ефектом до вірусів грипу. 1. Матеріали та методи Система для проведення досліджень Клітини: Лінія клітин Мадін-Дарбі нирки собаки (MDCK, NBL-2) була одержана з Американської колекції типових культур (АТСС), Рок-вілл, Меріленд, АТСС-номер CCL-34. Культуру клітин зберігали у рідкому азоті. Робочий запас клітин NBL-2 вирощували у мінімальному поживному середовищі, доповненому 5% ембріональної телячої сироватки (ETC) протягом не більше 20 циклів відповідно до стандартної операційної процедури (СОП). Клітини 2 NBL-2 вирощували у колбах для культури клітин з площею поверхні 25 см на мінімальному поживному середовищі (МПС) при 37°С та переносили у розведення 1:10 або 1:20 двічі на тиждень. У кожну лунку 96-лункового планшета вносили 100 мкл клітинної суспензії, що містила 4 8 10 клітин. Відповідно до СОП, клітини в плановому порядку перевіряли на наявність мікоплазм за допомогою набору Venor®GeM для традиційної полімеразної ланцюгової реакції, (виробництва «Мінерва Біолабс ГмбХ» (Minerva Biolabs GmbH), Берлін, Німеччина). Клітини, які використовували у дослідженні, не були контаміновані. Віруси: До вірусів грипу, що використовувалися для перевірки антивірусної активності, належали: вірус грипу типу A H1N1 (штам Нова Каледонія 20/99), вірус грипу типу A H3N2 (штами Вікторія/3/75 та Каліфорнія), вірус грипу типу В (штами Тайвань 2/62 та Цзянсу). Запас вірусів був одержаний при розмноженні вірусів грипу на безсироватковому МПС з додаванням 2 мкг/мл трипсину з застосуванням клітин NBL-2 як господаря. Для гарантування стабільності вірусу до зараженої вірусом культури клітин NBL-2 після 2-3 днів інкубації при 37°С, додали 1% сироваткового альбуміну корів (САК), перед заморожуванням на ніч при температурі -80°С. З очищених супернатантів культури клітин, використовуючи низькошвидкісне центрифугування, приготували маточні розчини з вірусами, а тоді поділили на аліквоти по 500 мкл. Цей вихідний матеріал з вірусами зберігали при -80°С до моменту застосування. Відповідні титри інфекційності вірусів у вихідних розчинах визначали титруванням на моношарі NBL-2 клітин у 96-лункових планшетах та оцінювали дозу зараження 50% культури тканин (TCID 50). Інфекційний титр визначали методом Спірмена-Кербера (Spearman C (1908). The method of "right and wrong cases" ("constantstimuli") without Gauss's formulae. British Journal of Psychology 2: 227-242; Karber G (1931). Beitrag zur kollektiven Behandlung pharmakologischer Reihenversuche [A contribution to the collective treatment of a pharmacological experimental series]. Archiv fur experimentelle Pathologie und Pharmakologie 162: 480-483.) Середовище для культури клітин: МПС (MEM), Номер за каталогом. Τ 031-10, «Біохром» (Biochrom) ETC (FCS), Номер за каталогом F-7524, «Сігма» (Sigma) Фосфатно-сольовий буферний розчин (PBS) 10х: Фосфатно-сольовий буферний розчин Номер за каталогом L 182-10, «Дульбекко Біохром» (Dulbecco Biochrom) додати до 1 л води для ін'єкцій, Номер за каталогом 0370-3452, «Браун» (Braun). Автоклавують та зберігають за кімнатної температури, термін придатності 1 рік; два місяці в разі застосування. PBS 1х: 450 мл води для ін'єкцій + 50 мл 10х PBS Зберігати за кімнатної температури, термін придатності один рік; два місяці в разі застосування. NaHCO3, 7.5%: 75 г NaHCO3, Номер за каталогом S-4019, «Сігма» (Sigma) Розчиняють у 1 л води (Millipore-Н2О). Зберігати за температури 2-8°С, термін придатності один рік; два місяці в разі застосування. Hepes (N-2-гідрокси-етилпіперазин N'-2-етансульфонова кислота), 1 М: 238,31 г Hepes, Номер за каталогом S-4019, «Сігма» (Sigma) 33,75 мл NaOH 32% Розчинити в 1 л води (Millipore-Н2О). Зберігати за температури 2-8°С, термін придатності один рік; чотири місяці в разі застосування. L-глютамін, 0.2 М: 29,2 г L-глютаміну, Номер за каталогом G-5763, «Сігма» (Sigma) Розчинити в 1 л води (Millipore-Н2О). 12 UA 104102 C2 5 10 15 20 25 30 35 40 45 50 55 Зберігати за температури -18°С протягом одного року; два місяці за температури 2-8°С в разі застосування. Пеніцилін/Стрептоміцин: 10 ΜΕΓ Пеніцилін (пеніцилін), «Грюненталь» (Grunenthal) 10 г Стрептоміцин-сульфат, Номер за каталогом S-6501, «Сігма» (Sigma) Розчинити в 1 л води (Millipore-Н2О). Зберігати за температури -18°С протягом одного року; два тижні за температури 2-8°С в разі застосування. Трипсин/ЕДТК розчин: 2,0 г трипсину 1:250 ВАЕЕ 1570 одиниць/мл, Номер за каталогом Т-4799, «Сігма» (Sigma) 0,6 g ЕДТК-Na (Tritriplex III), Номер за каталогом 8418.0100, «Мерк» (Merck) Розчинити в 1 л 1х PBS. Зберігати за температури -18°С протягом одного року; один місяць за температури 2-8°С в разі застосування. Як підтримуюче середовище використовували безсироваткове МПС з додаванням 2% hepes, 2% NaНСО3, 1% пеніциліну/стрептоміцину, яке містить 2 мкг/мл трипсину. 2. Визначення антивірусної активності (метод оцінки зменшення «врожаю» вірусів) Метод оцінки зменшення «врожаю» вірусів - потужний метод для оцінки ефективності противірусних сполук. Цей метод дає можливість виконати кількісний аналіз утворення інфекційних вібріонів у обробленій препаратом культурі порівняно з «врожаєм» вірусів у необробленому контрольному зразку. Під час цієї процедури інфіковані вірусом культури інкубують з противірусними сполуками протягом достатнього для реплікації періоду, а тоді оцінюють на наявність нового потомства вірусів методом титрування на окремому моношарі культури клітин (Shipman С Jr, Smith SH, Carlson RH, Drach JC (1976). Antiviral activity of arabinosyladenine and arabinosylhypoxanthine in herpes simplex virus-infected KB cells: selective inhibition of viral deoxyribonucleic acid synthesis in synchronized suspension cultures. Antimicrob Agents Chemother. 9: 120-127; Collins P, Bauer DJ (1977). Relative potencies of anti-herpes compounds. Ann Ν Υ Acad Sci. 284: 49-59; Prichard MN, Turk SR, Coleman LA, Engelhardt SL, Shipman С Jr, Drach JC (1990). A microtiter virus yield reduction assay for the evaluation of antiviral compounds against human cytomegalovirus and herpes simplex virus. J Virol Methods. 28: 101-106). 2.1 Принцип дослідження: Дослідження виконувалося у колбах для культури клітин у трьох паралелях. Були проведені два незалежні експерименти. Концентрації випробовуваної та референтної сполуки попередньо визначалися під час вимірювань цитотоксичності, що описано вище. Найвища використана концентрація не повинна була виявляти жодного токсичного ефекту на клітини. Попередні експерименти були спершу проведені у двох різних варіантах з застосуванням 400 мкг випробовуваної речовини FAV00A та 10 нг Занамівіру як референтної сполуки. Експеримент проводився з застосуванням вірусу грипу типу В штаму Тайвань 2/62 та вірусу грипу типу А штаму Нова Каледонія. При першому варіанті дослідження клітини NBL-2 висівали у колби для 2 культури клітин з площею поверхні 25 см на МПС за 37°С у розведенні 1:10. Клітини підраховували, а тоді заражали після промивання фосфатно-сольовим буферним розчином при множинності інфікування 0,01 для обох штамів вірусу грипу. До одного ряду (у трьох паралелях) інфікованих клітин одночасно додали 400 мкг FAV00A (одночасно з вірусом). Клітини інкубували протягом 45 хвилин при 37°С, щоб дозволити вірусу здійснити адсорбцію, а тоді тричі промивали фосфатно-сольовим буферним розчином для видалення неадсорбованих вірусів. Після цього групу інфікованих клітин, попередньо інкубованих із 400 мкг FAV00A, знову обробили 400 мкг FAV00A. Другу групу інфікованих клітин обробили 10 нг Занамівіру. Також у дослідження був включений вірусний контроль без додавання випробовуваної або референтної сполуки. Другий варіант дослідження виконували подібно до першого, але без етапу попередньої інкубації з 400 мкг FAV00A (одночасне додавання FAV00A). При цьому клітини спершу інфікували вірусами, після чого інкубували протягом 45 хвилин для того, щоб дозволити вірусу адсорбуватися. Після триразового промивання фосфатно-сольовим буферним розчином культуру інфікованих клітин обробляли 400 мкг FAV00A або 10 нг Занамівіру. Колби з культурою інкубували за 37°С у інкубаторі з 5% СО2 протягом 24 годин, а тоді заморожували на ніч, а наступного дня розморожували. Етапи заморожування та розморожування зумовлювали дезінтеграцію клітин та вивільнення вірусів, які вони містили. Таким чином, можна було визначити загальну кількість вірусу. Після низькошвидкісного центрифугування у кожній експериментальній моделі (контроль вірусу, а також випробовувана та референтна сполуки) визначали кількість вірусу використовуючи "титрування до кінцевої точки" у 96-лунковому 13 UA 104102 C2 5 10 15 20 25 30 планшеті, при цьому одержували титр вірусу/кількість, за якої 50% клітин є інфікованими або неінфікованими (ТСID50/мл). Усі подальші експерименти з усіма випробовуваними вірусами грипу проводили за другим варіантом. Для цього виконували підрахунок клітин, які потім інфікували після промивання фосфатно-сольовим буферним розчином при множинності інфікування 0,01 для всіх використаних типів вірусу грипу, крім H3N2 (Каліфорнія), який використовували для інфікування клітин при множинності інфікування 0,001. Були випробувані дві різні концентрації (400 мкг та 800 мкг FAV00A; 100 нг та 1000 нг Занамівіру). Титрування до кінцевої точки. Відповідно до СОП підготували один 96-лунковий планшет (для кожної експериментальної моделі) з чутливою культурою клітин. У кожну лунку засіяли 50 мкл суспензії клітин. Клітини вирощували за 37°С в атмосфері із 5% СО2 протягом трьох або чотирьох днів для утворення суцільного моношару. Після низькошвидкісного центрифугування здійснювали 10-разове -9 серійне розведення (до 10 ) одержаних вірусів з застосуванням підтримуючого середовища. На кожній пластина 1-й та 2-й ряди (у кожному по 8 лунок) використовували для контролю культури клітин, а з 3-го по 12-й - для 10-разово серійно розведених вірусів, починаючи з нерозведеного -9 матричного зразка та закінчуючи розведенням 10 . У відповідні ряди внесли по 50 мкл розведення вірусів, тоді як у лунки контрольних рядів вносили по 50 мкл підтримуючого середовища. Планшети інкубували протягом 2-3 днів за температури 37°С у інкубаторі із СО2. Після завершення інкубаційного періоду планшети вивчали мікроскопічно на наявність цитопатогенного ефекту (ЦПЕ). Дослідження проводили незалежно двома лаборантами. Титр вірусів був підрахований за методом Спірмена-Кербера. Після цього вираховували відсоток зменшення титру при додаванні випробовуваної або референтної сполуки порівняно з контролем (взято за 100%). 2.2 Одержані результати Зменшення «врожаю» вірусів виражали як ТСID50/мл, показаний також % вірусного інфікування, а також у скільки разів спостерігалося зменшення в разі обробки випробовуваною або референтною сполукою по відношенню до вірусного контролю (100 %). Оскільки проводили два експерименти з випробовуваною та референтною сполукою, у таблицях наведено середні величини: Таблиця 8 Вірус грипу типу А, штам Нова Каледонія (H1N1) Титр (ТСID50/мл) Контроль вірусу FAV00A 400 мкг (із 45 хв попередньої інкубації) FAV00A 400 мкг (без попередньої інкубації) Занамівір 10 нг 6 2,1110 % «врожаю» вірусів відносно контролю 100 Кратність зменшення 6 52 1,92 5 31 3,23 5 23 4,35 1,1010 6,5610 4,8510 Таблиця 9 Вірус грипу типу А, штам Каліфорнія (H3N2) Контроль вірусу FAV00A 400 мкг FAV00A 800 мкг Занамівір 10 нг Титр (ТСID50/мл) % «врожаю» вірусів відносно контролю Кратність зменшення 4 100 2,9510 4 76 1,32 2,2510 4 61 1,64 1,8010 2 0,4 250 1,1810 14 UA 104102 C2 Таблиця 10 Вірус грипу типу А, штам Вікторія (H3N2) Титр (ТСID50/мл) Контроль вірусу FAV00A 400 мкг FAV00A 800 мкг Занамівір 10 нг 6 2,9010 6 1,2010 5 7,7510 2 7,0510 % «врожаю» вірусів відносно контролю 100 41 27 0,02 Кратність зменшення 2,44 3,70 5000 Таблиця 11a Вірус грипу типу А, штам Нова Каледонія (H1N1) Контроль вірусу FAV00A 400 мкг Занамівір 100 нг Титр (ТСID50/мл) % «врожаю» вірусів відносно контролю Кратність зменшення 6 100 2,1110 5 32 3,13 6,8110 4 3 33,33 7,0010 Таблиця 12b Вірус грипу типу А, штам Нова Каледонія (Н1N1) Контроль вірусу FAV00A 800 мкг Занамівір 100 нг 5 10 15 Титр (ТСID50/мл) % «врожаю» вірусів відносно контролю Кратність зменшення 6 100 9,7010 6 28 3,57 2,7010 6 15 6,67 1,4210 3. Висновки Вищенаведені дані підтверджують, що FAV00A має противірусний ефект проти вірусів грипу типу А, перевірений зменшенням «врожаю» вірусів у культурі клітин NBL-2. Час додавання в експерименті дає змогу припустити, що FAV00A впливає на етапи адсорбції вірусу до специфічних рецепторів на мембрані клітин. До цих етапів належить розпакування вірусів та реплікація. Антивірусна активність проти аденовірусів, вірусу Коксакі, еховірусу, цитомегаловірусу, метапневмовірусу та ентеровірусу, визначена методом оцінки «врожаю» вірусів Метою дослідження було дослідити вплив випробовуваної речовини FAV00A на реплікацію аденовірусів, метапневмовірусу людини, еховірусу, вірусу Коксакі А9, ентеровірусу 71 та цитомегаловірусу людини, визначаючи титр вірусу. Титри вірусів визначалися за методом оцінки зменшення «врожаю» вірусів. 1. Матеріали та методи 1.1 Матеріали та методи дослідження 1.1.1 План дослідження 20 15 UA 104102 C2 Вірус Коксакі А9 Культура клітин для Підтримуюче Множинність Джерело, звідки взято вірус розмноження середовище інфікування* вірусу Hygienish-bakteriologisches landesuntersuchungsamt HFF МПС + 2% ETC 0,005 "Westfalen" ATCC (ATCC No: VR-847) А549 МПС + 2% ETC 0,05 ATCC (ATCC No: VR-5) А549 МПС + 2% ETC 0,05 Аденовірус 3 Аденовірус 5 Цитомегаловірус людини, штам AD- ATCC (ATCC No: VR-538) 169 Цитомегаловірус Власний ізолят 9 людини, штам НІ91 Метапневмовірус Ентеровірус 71 0,02 МПС + 2% ETC 0,02 HFF МПС + 2 мкг/мл трипсину МПС + 2% ETC 0,005 HFF МПС + 2% ETC 0,01 HFF Власний ізолят Hygienish-bakteriologisches landesuntersuchungsamt "Westfalen" Власний ізолят Еховірус 30 МПС + 2% ETC HFF ATCC (ATCC No: VR-92) Еховірус 11 HFF МПС + 2% ETC 0,1 МК2 клітини 0,1 * - множинність інфікування - співвідношення інфекційних агентів (наприклад, фагів або вірусів) до їхніх мішеней (наприклад, клітин) 5 10 15 20 25 30 35 1.1.2 Система для проведення досліджень Клітини: Для культивації цитомегаловірусу, ентеровірусу, еховірусу та вірусу Коксакі А9 використали культуру препуціальних фібробластів людини (HFF). Клітини HFF визначали відповідно до вищенаведеного опису [1]. Клітини LLC-MK2 (МК2) одержані з Американської колекції типових культур (АТСС, Роквілл, Меріленд) були використані для культивації метапневмовірусу. Клітини А549 були одержані з АТСС та використані для культивації аденовірусу. Робочий запас клітин вирощували у мінімальному поживному середовищі (МПС), доповненому 5% ембріональної телячої сироватки (ETC) протягом не більше 20 циклів відповідно до стандартної операційної процедури (СОП). Клітини вирощували у колбах для 2 культури клітин з площею поверхні 25 см на МПС при 37°С. Для культивування у кожну лунку 96-лункового планшета вносили 100 мкл клітинної суспензії, клітини росли до досягнення конфлюентності. Клітини в плановому порядку перевіряли на наявність мікоплазм за допомогою набору Venor®GeM для традиційної полімеразної ланцюгової реакції, (виробництва «Мінерва лабс ГмбХ» (Minerva labs GmbH), Берлін, Німеччина). Клітини, які використовували у дослідженні, не були контаміновані. Середовище для культури клітин: МПС (MEM), Номер за каталогом. Τ 031-10, «Біохром» (Biochrom) ETC (FCS), Номер за каталогом F-7524, «Сігма» (Sigma) Фосфатно-сольовий буферний розчин (PBS) 10х: Фосфатно-сольовий буферний розчин Номер за каталогом L 182-10, «Дульбекко Біохром» (Dulbecco Biochrom) додати до 1 л води для ін'єкцій, Номер за каталогом 0370-3452, «Браун» (Braun). Автоклавують та зберігають за кімнатної температури, термін придатності 1 рік; два місяці в разі застосування. PBS 1х: 450 мл води для ін'єкцій + 50 мл 10х PBS Зберігати за кімнатної температури, термін придатності один рік; два місяці в разі застосування. NaHCO3, 7,5%: 75 г NaHCO3, Номер за каталогом. S-4019, «Сігма» (Sigma) Розчиняють в 1 л води (Millipore-Н2О). Зберігати за температури 2-8°С, термін придатності один рік; два місяці в разі застосування. 16 UA 104102 C2 5 10 15 20 25 30 35 40 45 50 55 60 Hepes, (N-2-гідрокси-етилпіперазин N'-2-етансульфонова кислота), 1М: 238,31 г Hepes, Номер за каталогом S-4019, «Сігма» (Sigma) 33,75 мл NaOH 32% Розчинити в 1 л води (Millipore-Н2О). Зберігати за температури 2-8°С, термін придатності один рік; чотири місяці в разі застосування. L-глютамін, 0,2 М: 29,2 г L-глютаміну, Номер за каталогом G-5763, «Сігма» (Sigma) Розчинити в 1 л води (Millipore-Н2О). Зберігати за температури -18°С протягом одного року; два місяці за температури 2-8°С в разі застосування. Пеніцилін/Стрептоміцин: 10 ΜΕΓ Пеніцилін (пеніцилін), «Грюненталь» (Grunenthal) 10 г Стрептоміцин-сульфат, Номер за каталогом S-6501, «Сігма» (Sigma) Розчинити в 1 л води (Millipore-Н2О). Зберігати за температури -18°С протягом одного року; два тижні за температури 2-8°С в разі застосування. Трипсин/ЕДТК розчин: 2,0 г трипсину 1:250 ВАЕЕ 1570 одиниць/мл, Номер за каталогом Т-4799, «Сігма» (Sigma) 0,6 г ЕДТК-Na (Tritriplex III), Номер за каталогом 8418.0100, «Мерк» (Merck) Розчинити в 1 л 1х PBS. Зберігати за температури -18°С протягом одного року; один місяць за температури 2-8°С в разі застосування. Як підтримуюче середовище використовували безсироваткове МПС з додаванням 2% hepes, 2% NaHCO3, 1% пеніциліну/стрептоміцину, яке містить 2 мкг/мл трипсину. 1.2 Визначення антивірусної активності (метод оцінки зменшення «врожаю» вірусів) Метод оцінки зменшення «врожаю» вірусів - потужний метод для оцінки ефективності противірусних сполук. Цей метод дає можливість виконати кількісний аналіз утворення інфекційних вібріонів у обробленій препаратом культурі порівняно з «врожаєм» вірусів у необробленому контрольному зразку. Під час цієї процедури інфіковані вірусом культури інкубують з противірусними сполуками протягом достатнього для реплікації періоду, а тоді оцінюють на наявність нового потомства вірусів методом титрування на окремому моношарі культури клітин (Shipman С Jr, Smith SH, Carlson RH, Drach JC (1976). Antiviral activity of arabinosyladenine and arabinosylhypoxanthine in herpes simplex virus-infected KB cells: selective inhibition of viral deoxyribonucleic acid synthesis in synchronized suspension cultures. Antimicrob Agents Chemother. 9: 120-127; Collins P, Bauer DJ (1977). Relative potencies of anti-herpes compounds. Ann Ν Υ Acad Sci. 284: 49-59; Prichard MN, Turk SR, Coleman LA, Engelhardt SL, Shipman С Jr, Drach JC (1990). A microtiter virus yield reduction assay for the evaluation of antiviral compounds against human cytomegalovirus and herpes simplex virus. J Virol Methods. 28: 101-106). 1.2.1 Принцип дослідження: Дослідження виконували у колбах для культури клітин у трьох паралелях. Було проведено два незалежні експерименти. Клітини підраховували, а тоді заражали після промивання фосфатно-сольовим буферним розчином при множинності інфікування, зазначеній у 4.1.1. До культури клітин одночасно додали FAV00A (разом із вірусом). Тоді клітини інкубували протягом 45 хвилин при 37 °С, щоб дозволити вірусу здійснити адсорбцію, а тоді тричі промивали фосфатно-сольовим буферним розчином для видалення неадсорбованих вірусів. Після цього групу інфікованих клітин, попередньо інкубованих з FAV00A, знову обробили FAV00A. Також у дослідження був включений вірусний контроль без додавання випробовуваної або референтної сполуки. Колби з культурою інкубували при 37 °С у інкубаторі з СО 2. Після 3 днів (еховірус, ентеровірус, вірус Коксакі), 4 днів (аденовірус), 5 днів (цитомегаловірус) або 8 днів (метапневмовірус) клітини заморожували на ніч, а наступного дня розморожували. Етапи заморожування та розморожування зумовлювали дезінтеграцію клітин та вивільнення вірусів, які вони містили. У такий спосіб можна було визначити загальну кількість вірусів. Після низькошвидкісного центрифугування у кожній експериментальній моделі (контроль вірусів, а також випробовувана та референтна сполуки) проводили визначення кількості вірусів з застосуванням "титрування до кінцевої точки" у 96-лунковому планшеті - при цьому одержували титр вірусу/кількість, за якої 50% клітин є інфікованими або неінфікованими (ТСID50/мл). Титрування до кінцевої точки Відповідно до СОП підготували один 96-лунковий планшет (для кожної експериментальної моделі) з чутливою культурою клітин. У кожну лунку засіяли 50 мкл суспензії клітин. Клітини 17 UA 104102 C2 5 10 15 20 вирощували при 37 °С в атмосфері із 5% СО2 протягом трьох або чотирьох днів для утворення суцільного моношару. Після низькошвидкісного центрифугування здійснювали 10-разове -9 серійне розведення (до 10 ) одержаних вірусів з застосуванням підтримувального середовища. На кожній пластина 1- та 2-й ряди (у кожному по 8 лунок) використовувались для контролю культури клітин, а з 3-го по 12-й (у кожному по 8 лунок) - для 10-разово серійно розведених -9 вірусів, починаючи з нерозведеного матричного зразка та закінчуючи розведенням 10 . У відповідні ряди внесли по 50 мкл розведення вірусів, тоді як у лунки контрольних рядів вносили по 50 мкл підтримувального середовища. Планшети інкубували протягом 2-3 днів при температурі 37 °С в інкубаторі з СО2. Після завершення інкубаційного періоду планшети вивчали мікроскопічно на наявність цитопатогенного ефекту (ЦПЕ). Дослідження проводились незалежно двома лаборантами. Титр вірусів був визначений за методом Спірмена-Кербера (Spearman C (1908). The method of "right and wrong cases" ("constantstimuli") without Gauss's formulae. British Journal of Psychology 2: 227-242; Karber G (1931). Beitrag zur kollektiven Behandlung pharmakologischer Reihenversuche [A contribution to the collective treatment of a pharmacological experimental series]. Archiv fur experimentelle Pathologie und Pharmakologie 162: 480-483.). Після цього вираховували відсоток зменшення титру при додаванні випробовуваної або референтної сполуки порівняно з контролем (взято за 100%). 1.3 Одержані результати Зменшення «врожаю» вірусів виражали як TCID50/мл, показаний також % вірусного інфікування, а також у скільки разів спостерігалося зменшення після обробки випробовуваною або референтною сполукою по відношенню до вірусного контролю (100 %). Оскільки проводились два експерименти з випробовуваною та референтною сполукою, у таблицях наведено середні величини: Таблиця 13 Аденовірус 3 Вірус 7 FAV00A (мкг/мл) 50 7 6 3,410 ± 2,510 (43,5%) 6 6,110 ± 4,010 25 7 5,410 ± 1,610 (11,3%) 12,5 7 7 7 2 7,210 ± 4,210 (н.д. ) 25 Таблиця 14 Аденовірус 5 Вірус FAV00A (мкг/мл) 50 25 12,5 8 5,410 ± 8 1,610 8 7 1,710 ± 5,110 (68,4%) 8 7 3,010 ± 9,010 (43,7%) 8 8 7,010 ± 3,910 (н.д.) Таблиця 15 Метапневмовірус людини Вірус FAV00A (мкг/мл) 500 250 125 4 4,510 ± 4 1,610 3 3 2,010 ± 1,610 (95,6%) 4 4 2 5,410 ± 1,610 (н.д. ) 4 4 4,010 ± 2,210 (88,5%) Таблиця 16 Ентеровірус 71 Вірус 3 3 4,010 ± 2,210 FAV00A (мкг/мл) 500 250 1 1 1 2 2 9,610 ± 2,810 (97,6%) 6,510 ± 4,610 (83,6%) 18 125 3 3 2 5,410 ± 1,610 (н.д. ) UA 104102 C2 Таблиця 17 Вірус Коксакі А9 Вірус FAV00A (мкг/мл) 50 25 12,5 5 3,110 ± 5 2,810 5 4 1,110 ± 7,910 (65,3%) 1 5 4 4 4 1,710 ± 5,210 (45,7%) 1,710 ± 5,010 (45,3%) Таблиця 18 Еховірус 11 Вірус FAV00A (мкг/мл) 250 125 62,5 3 3,010 ± 7 9,010 7 7 6,110 ± 4,410 (79,9%) 1 8 8 8 8 1,910 ± 1,410 (36,4%) 1,810 ± 1,610 (41,8%) Таблиця 19 Еховірус 30 Вірус FAV00A (мкг/мл) 100 50 25 7 9,610 ± 7 2,810 7 7 3,010 ± 9,010 (68,3%) 1 7 7 7,910 ± 2,810 (17,0%) 8 7 2 1,210 ± 8,210 (н.д. ) Таблиця 20 Цитомегаловірус людини НІ91 Вірус FAV00A (мкг/мл) 500 250 125 4 3,710 ± 4 1,210 3 3 2,410 ± 1,210 (93,5%) 1 3 3 4 3 5,210 ± 3,510 (86,0%) 2,710 ± 7,110 (24,9%) Таблиця 21 Цитомегаловірус людини AD169 Вірус FAV00A (мкг/мл) 500 250 125 4 9,010 ± 4 3,010 4 4 5,310 ± 1,110 (41,1%) 1 5 4 2 1,010 ± 7,910 (н.д. ) 5 4 2,210 ± 5,810 (н.д.) 5 10 15 2. Висновок Вищенаведені дані підтверджують, що досліджувана сполука FAV00A має противірусний ефект проти аденовірусів, вірусу Коксакі, еховірусу, цитомегаловірусу, метапневмовірусу та ентеровірусу, що перевірено методом оцінки «врожаю» вірусів. У вищеописаних експериментах використовувалися такі скорочення: АТСС = Американська колекція типових культур САК = сироватковий альбумін корів ЦПЕ = цитопатогенний ефект ETC = ембріональна теляча сироватка MDCK = клітини Мадін-Дарбі нирки собаки МПС = мінімальне поживне середовище МІ = множинність інфекції PBS = фосфатно-сольовий буфер 19 UA 104102 C2 5 10 ПЛР = полімеразно-ланцюгова реакція ДСН = додецилсульфат натрію СОП = стандартна операційна процедура ТС50 = концентрація, що викликає 50% токсичності TCID50 = доза інфікування клітинної культури, за якої 50% клітин інфіковано Вплив FAV00A на рівень інтерферону у плазмі крові пацієнтів із грипом У добровольців, що приймали FAV00A на 7-й день прийому препарату (візит V3), виявили значне підвищення рівнів IFN- та IFN- у порівнянні з початковим вмістом цих речовин та вмістом інтерферонів у групі, що приймала плацебо. Підвищення рівнів IFN- також спостерігалося у пацієнтів, що приймали плацебо, однак це зростання було менш інтенсивним у порівнянні з групою, в якій застосовували FAV00A (Таблиця 22). Таблиця 22 Динаміка рівня циркулюючого інтерферону різних типів у сироватці крові добровольців з гострою респіраторною вірусною інфекцією у групах FAV00A/плацебо Параметр IFN- IFN- Помилка Помилка Візит Середнє Середнє Група Ρ середнього Медіана Ρ середнього Медіана значення значення значення значення Плацебо 22,541 1,676 22,5 33,008 1,280 31,8 V1 FAV00A 22,290 1,264 23,7 33,168 0,912 33,25 Плацебо 31,768*
ДивитисяДодаткова інформація
Назва патенту англійськоюAlpha-crystalline form of carbabenzpyride
Автори англійськоюZhebrovska, Filya, Margitych, Viktor, Kostiuk, Grygorii, Syarkevych, Oleh, Vanat, Mykhailo
Автори російськоюЖебровска Филя, Маргитич Виктор, Костюк Григорий, Сяркевич Олег, Ванат Михайло
МПК / Мітки
МПК: C07D 213/81, A61K 31/4425, A61P 31/16
Мітки: карбабензпіриду, форма, a-кристалічна
Код посилання
<a href="https://ua.patents.su/27-104102-a-kristalichna-forma-karbabenzpiridu.html" target="_blank" rel="follow" title="База патентів України">a-кристалічна форма карбабензпіриду</a>
Попередній патент: Спосіб керування компресорним елементом гвинтового компресора
Наступний патент: Спосіб очищення стічних вод від фенолу, формальдегіду і метанолу
Випадковий патент: Пристрій для отримання покриттів із хімічних сполук