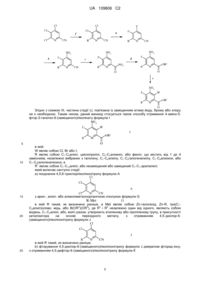
Спосіб отримання 4-аміно-5-фтор-3-галоген-6-(заміщених)піколінатів
Номер патенту: 109806
Опубліковано: 12.10.2015
Автори: Рот Гарі Алан, Арндт Кім Е., Чжу Юаньмін, Подхорес Девід Е., Уайтекер Грегорі Т., Вест Скотт П., Ренга Джеймс М.
Формула / Реферат
1. Спосіб отримання 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули І:
 , I
, I
в якій
W являє собою Сl, Вr або І;
R являє собою С1-С4алкіл, циклопропіл, С2-С4алкеніл або феніл, що містить від 1 до 4 замісників, незалежно вибраних з галогену, С1-С4алкілу, С1-С4галогеналкілу, С1-С4алкокси або С1-С4галогеналкокси; а
R1 являє собою С1-С12алкіл або незаміщений або заміщений С7-С11арилалкіл;
який включає наступні стадії:
а) фторування 4,5,6-трихлорпіколінонітрилу (формула А)
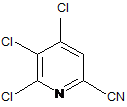 , A
, A
джерелом фторид-іону, з отриманням 4,5,6-трифторпіколінонітрилу (формула В)
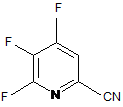 , B
, B
b) амінування 4,5,6-трифторпіколінонітрилу (формула В) аміаком, з отриманням 4-аміно-5,6-дифторпіколінонітрилу (формула С)
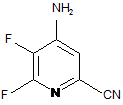 , C
, C
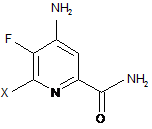
с) гідроліз нітрильного замісника і заміщення фтор-замісника в 6-положенні 4-аміно-5,6-дифторпіколінонітрилу (формула С) на йод-, бром- або хлор-замісник обробкою джерелом йоду, брому або хлору, з отриманням 4-аміно-5-фтор-6-галогенпіколінаміду формули D:
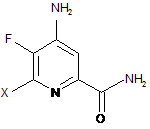 , D
, D
в якій X являє собою Сl, Вr або І;
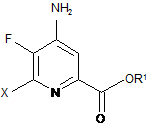
d) етерифікацію 4-аміно-5-фтор-6-галогенпіколінаміду формули D дією спирту (R1OH) і кислоти Бренстеда або Льюїса, з отриманням 4-аміно-5-фтор-6-галогенпіколінату формули Ε:
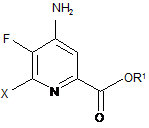 , E
, E
в якій R1 являє собою С1-С12алкіл або незаміщений або заміщений С7-С11арилалкіл;
e) галогенування 4-аміно-5-фтор-6-галогенпіколінату формули Ε джерелом галогену, з отриманням 4-аміно-5-фтор-3,6-дигалогенпіколінату формули F:
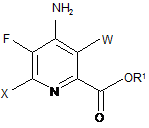 , F
, F
в якій W і X незалежно являють собою Сl, Вr або І,
a R1 такий, як визначено раніше, і
f) поєднання 4-аміно-5-фтор-3,6-дигалогенпіколінату формули F з арил-, алкіл- або алкенілметалоорганічною сполукою формули G:
R-Met, G
в якій R такий, як визначено раніше, a Met являє собою Zn-галогенід, Zn-R, три(С1-С4алкіл)олово, мідь або B(OR2)(OR3), де R2 і R3, незалежно один від одного, являють собою водень, С1-С4алкіл, або, взяті разом, утворюють етиленову або пропіленову групу, в присутності каталізатора на основі перехідного металу, з отриманням 4-аміно-3-галоген-5-фтор-6-(заміщеного)піколінату формули І.
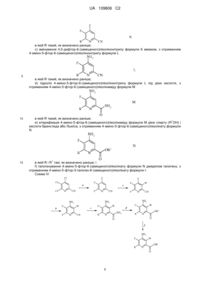
2. Спосіб отримання 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули І
 , I
, I
в якій
W являє собою Сl, Вr або І;
R являє собою С1-С4алкіл, циклопропіл, С2-С4алкеніл або феніл, що містить від 1 до 4 замісників, незалежно вибраних з галогену, С1-С4алкілу, С1-С4галогеналкілу, С1-С4алкокси або С1-С4галогеналкокси; а
R1 являє собою С1-С12алкіл або незаміщений або заміщений С7-С11арилалкіл;
який включає наступні стадії:
а) фторування 4,5,6-трихлорпіколінонітрилу (формула А)
 , A
, A
джерелом фторид-іону, з отриманням 4,5,6-трифторпіколінонітрилу (формула В)
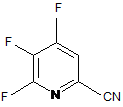 , B
, B
b) амінування 4,5,6-трифторпіколінонітрилу (формула В) аміаком, з отриманням 4-аміно-5,6-дифторпіколінонітрилу (формула С)
 , C
, C
с) гідроліз нітрильного замісника і заміщення фтор-замісника в 6-положенні 4-аміно-5,6-дифторпіколінонітрилу (формула С) на йод-, бром- або хлор-замісник обробкою джерелом йоду, брому або хлору, з отриманням 4-аміно-5-фтор-6-галогенпіколінаміду формули D:
 , D
, D
в якій X являє собою Сl, Вr або І;
d) етерифікацію 4-аміно-5-фтор-6-галогенпіколінаміду формули D дією спирту (R1OH) і кислоти Бренстеда або Льюїса, з отриманням 4-аміно-5-фтор-6-галогенпіколінату формули Ε:
 , E
, E
в якій X являє собою Сl, Вr або І; а
R1 являє собою С1-С12алкіл або незаміщений або заміщений С7-С11арилалкіл;
е) поєднання 4-аміно-5-фтор-6-галогенпіколінату формули E з арил-, алкіл- або алкенілметалоорганічною сполукою формули G:
R-Met, G
в якій R такий, як визначено раніше, a Met являє собою Zn-галогенід, Zn-R, три(С1-С4алкіл)олово, мідь або B(OR2)(OR3), де R2 і R3, незалежно один від одного, являють собою водень, С1-С4алкіл, або, взяті разом, утворюють етиленову або пропіленову групу, в присутності каталізатора на основі перехідного металу, з отриманням 4-аміно-5-фтор-6-(заміщеного)піколінату формули Η:
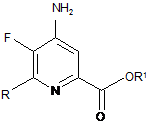 , H
, H
в якій R і R1 такі, як визначено раніше; і
f) галогенування 4-аміно-5-фтор-6-(заміщеного)піколінату формули Η джерелом галогену, з отриманням 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули І.
3. Спосіб отримання 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули І:
 , I
, I
в якій
W являє собою Сl, Вr або І;
R являє собою С1-С4алкіл, циклопропіл, С2-С4алкеніл або феніл, що містить від 1 до 4 замісників, незалежно вибраних з галогену, С1-С4алкілу, С1-С4галогеналкілу, С1-С4алкокси або С1-С4галогеналкокси; а
R1 являє собою С1-С12алкіл або незаміщений або заміщений С7-С11арилалкіл;
який включає наступні стадії:
а) поєднання 4,5,6-трихлорпіколінонітрилу формули А
 , A
, A
з арил-, алкіл- або алкенілметалоорганічною сполукою формули G:
R-Met, G
в якій R такий, як визначено раніше, a Met являє собою Zn-галогенід, Zn-R, три(С1-С4алкіл)олово, мідь або B(OR2)(OR3), де R2 і R3, незалежно один від одного, являють собою водень, С1-С4алкіл, або, взяті разом, утворюють етиленову або пропіленову групу, в присутності каталізатора на основі перехідного металу, з отриманням 4,5-дихлор-6-(заміщеного)піколінонітрилу формули J:
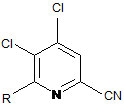 , J
, J
в якій R такий, як визначено раніше;
b) фторування 4,5-дихлор-6-(заміщеного)піколінонітрилу формули J джерелом фторид-іону, з отриманням 4,5-дифтор-6-(заміщеного)піколінонітрилу формули K:
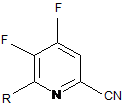 , K
, K
в якій R такий, як визначено раніше;
с) амінування 4,5-дифтор-6-(заміщеного)піколінонітрилу формули K аміаком, з отриманням 4-аміно-5-фтор-6-(заміщеного)піколінонітрилу формули L:
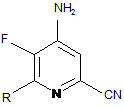 , L
, L
в якій R такий, як визначено раніше;
d) гідроліз 4-аміно-5-фтор-6-(заміщеного)піколінонітрилу формули L під дією кислоти, з отриманням 4-аміно-5-фтор-6-(заміщеного)піколінаміду формули Μ:
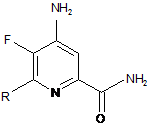 , M
, M
в якій R такий, як визначено раніше;
e) етерифікацію 4-аміно-5-фтор-6-(заміщеного)піколінаміду формули Μ дією спирту (R1OH) і кислоти Бренстеда або Льюїса, з отриманням 4-аміно-5-фтор-6-(заміщеного)піколінату формули N:
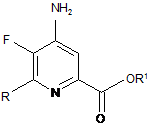 , N
, N
в якій R і R1 такі, як визначено раніше; і
f) галогенування 4-аміно-5-фтор-6-(заміщеного)піколінату формули N джерелом галогену, з отриманням 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули І.
4. Спосіб отримання 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули І:
 , I
, I
в якій
W являє собою Сl, Вr або І;
R являє собою С1-С4алкіл, циклопропіл, С2-С4алкеніл або феніл, що містить від 1 до 4 замісників, незалежно вибраних з галогену, С1-С4алкілу, С1-С4галогеналкілу, С1-С4алкокси або С1-С4галогеналкокси; а
R1 являє собою С1-С12алкіл або незаміщений або заміщений С7-С11арилалкіл;
який включає наступні стадії:
а) фторування 4,5,6-трихлорпіколінонітрилу (формула А)
 , A
, A
джерелом фторид-іону, з отриманням 4,5,6-трифторпіколінонітрилу (формула В)
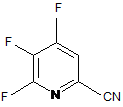 , B
, B
b) галогенування 4,5,6-трифторпіколінонітрилу (формула В) джерелом галогену, з отриманням 4,5,6-трифтор-3-галогенпіколінонітрилу формули О:
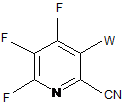 , O
, O
в якій
W являє собою Сl, Вr або І;
с) амінування 4,5,6-трифтор-3-галогенпіколінонітрилу формули О аміаком, з отриманням 4-аміно-5,6-дифтор-3-галогенпіколінонітрилу формули Ρ:
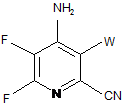 , P
, P
в якій
W являє собою Сl, Вr або І;
d) гідроліз нітрильного замісника і заміщення фтор-замісника в 6-положенні 4-аміно-5,6-дифтор-3-галогенпіколінонітрилу формули Ρ на йод-, бром- або хлор-замісник шляхом обробки джерелом йоду, брому або хлору, з отриманням 4-аміно-5-фтор-3,6-дигалогенпіколінаміду формули Q:
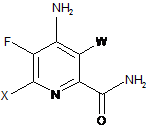 , Q
, Q
в якій W і X незалежно являють собою Сl, Вr або І;
e) етерифікацію 4-аміно-5-фтор-3,6-дигалогенпіколінаміду формули Q дією спирту (R1OH) і кислоти Бренстеда або Льюїса, з отриманням 4-аміно-5-фтор-3,6-дигалогенпіколінату формули F:
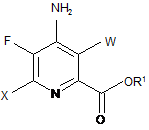 , F
, F
в якій W і X незалежно являють собою Сl, Вr або І; а
R1 являє собою С1-С12алкіл або незаміщений або заміщений С7-С11арилалкіл;
і
f) поєднання 4-аміно-5-фтор-3,6-дигалогенпіколінату формули F з арил-, алкіл- або алкенілметалоорганічною сполукою формули G:
R-Met, G
в якій R такий, як визначено раніше, a Met являє собою Zn-галогенід, Zn-R, три(С1-С4алкіл)олово, мідь або B(OR2)(OR3), де R2 і R3, незалежно один від одного, являють собою водень, С1-С4алкіл, або, взяті разом, утворюють етиленову або пропіленову групу, в присутності каталізатора на основі перехідного металу, з отриманням 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули І.
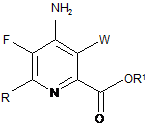
5. Сполука, яка представлена формулою:
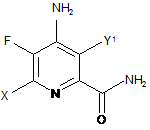 ,
,
в якій X являє собою І, Вr, Сl або F, a Y1 являє собою Н, Сl, Вr або І.
Текст
Реферат: 4-Аміно-5-фтор-3-галоген-6-(заміщені)піколінати зручно отримувати з 4,5,6трихлорпіколінонітрилу за допомогою ряду стадій, що включають заміщення атома фтору, амінування, заміщення галогену, галогенування, гідроліз нітрильної групи, етерифікацію і поєднання в присутності перехідного металу. UA 109806 C2 (12) UA 109806 C2 UA 109806 C2 5 10 15 20 25 Даний винахід стосується способу отримання 4-аміно-5-фтор-3-галоген-6(заміщених)піколінатів. Більш конкретно, даний винахід стосується способу отримання 4-аміно5-фтор-3-галоген-6-(заміщених)піколінатів, в яких 5-фторзамісник вводять шляхом обміну галогену на ранній стадії схеми способу. У патенті США 6297197 В1, крім іншого, описані деякі сполуки 4-аміно-3-хлор-5-фтор-6(алкокси або арилокси)піколінатів, і їх застосування як гербіцидів. У патентах США 6784137 В2 і 7314849 В2, крім іншого, описані деякі сполуки 4-аміно-3-хлор-5-фтор-6-(арил)піколінатів, і їх застосування як гербіцидів. У патенті США 7432227 В2, крім іншого, описані деякі сполуки 4аміно-3-хлор-5-фтор-6-(алкіл)піколінатів, і їх застосування як гербіцидів. У кожному з цих патентів описане отримання вихідних речовин на основі 4-аміно-3-хлор-5-фторпіколінату фторуванням відповідних 5-незаміщених піридинів біс(тетрафторборатом) 1-(хлорметил)-4фтор-1,4-діазоніабіцикло[2.2.2]октану. Було б переважно отримувати 4-аміно-5-фтор-3-галоген6-(заміщені)піколінати, не вдаючись до прямого фторування 5-положення піридинового циклу за допомогою фторуючого агента, на зразок біс(тетрафторборату) 1-(хлорметил)-4-фтор-1,4діазоніабіцикло[2.2.2]октану, що дорого коштує. Даний винахід стосується способу отримання 4-аміно-5-фтор-3-галоген-6(заміщених)піколінатів з 4,5,6-трихлорпіколінонітрилу. Більш конкретно, даний винахід стосується способу отримання 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули I в якій W являє собою Cl, Br або I; R являє собою С1-С4алкіл, циклопропіл, С2-С4алкеніл, або феніл, що містить від 1 до 4 замісників, незалежно вибраних з галогену, С1-С4алкілу, С1-С4галогеналкілу, С1-С4алкокси, або С1-С4галогеналкокси; а 1 R являє собою С1-С12алкіл, або незаміщений або заміщений С7-С11арилалкіл; який включає наступні стадії: а) фторування 4,5,6-трихлорпіколінонітрилу (формула А) джерелом фторид-іону, з отриманням 4,5,6-трифторпіколінонітрилу (формула В) 30 35 b) амінування 4,5,6-трифторпіколінонітрилу (формула В) аміаком, з отриманням 4-аміно-5,6дифторпіколінонітрилу (формула С) с) гідроліз нітрильного замісника і заміну фтор-замісника в 6-положенні 4-аміно-5,6дифторпіколінонітрилу (формула С) на йод-, бром- або хлор-замісник обробкою джерелом йоду, брому або хлору, з отриманням 4-аміно-5-фтор-6-галогенпіколінаміду формули D 1 UA 109806 C2 в якій Х являє собою Cl, Br або I; 1 d) етерифікацію 4-аміно-5-фтор-6-галогенпіколінаміду формули D дією спирту (R OH) і кислоти Бренстеда або Льюїса, з отриманням 4-аміно-5-фтор-6-галогенпіколінату формули Е 5 1 в якій R являє собою С1-С12алкіл, або незаміщений або заміщений С7-С11арилалкіл; е) галогенування 4-аміно-5-фтор-6-галогенпіколінату формули Е джерелом галогену, з отриманням 4-аміно-5-фтор-3,6-дигалогенпіколінату формули F 10 в якій W і Х незалежно являють собою Cl, Br або I; 1 а R такий, як визначено раніше, і f) поєднання 4-аміно-5-фтор-3,6-дигалогенпіколінату формули F з арил-, алкіл- або алкенілметалоорганічною сполукою формули G 15 в якій R такий, як визначено раніше, а Met являє собою Zn-галогенід, Zn-R, три(С12 3 2 3 С4алкіл)олово, мідь, або В(ОR )(ОR ), де R і R незалежно один від одного, являють собою водень, С1-С4алкіл, або, взяті разом, утворюють етиленову або пропіленову групу, в присутності каталізатора на основі перехідного металу, з отриманням 4-аміно-3-галоген-5-фтор-6(заміщеного)піколінату формули I. Стадії (а) (f) можна здійснити в перерахованому порядку, як показано на схемі I. Схема I 20 2 UA 109806 C2 Альтернативним чином, порядок здійснення стадій можна змінити, як показано, наприклад, на схемах II, III і IV. Схема II 5 10 15 Згідно з схемою II, даний винахід стосується способу отримання 4-аміно-5-фтор-3-галоген-6(заміщеного)піколінату формули I в якій W являє собою Cl, Br або I; R являє собою С1-С4алкіл, циклопропіл, С2-С4алкеніл, або феніл, що містить від 1 до 4 замісників, незалежно вибраних з галогену, С1-С4алкілу, С1-С4галогеналкілу, С1-С4алкокси, або С1-С4галогеналкокси; а 1 R являє собою С1-С12алкіл, або незаміщений або заміщений С7-С11арилалкіл; який включає наступні стадії: а) фторування 4,5,6-трихлорпіколінонітрилу (формула А) джерелом фторид-іону, з отриманням 4,5,6-трифторпіколінонітрилу (формула В) 20 b) амінування 4,5,6-трифторпіколінонітрилу (формула В) аміаком, з отриманням 4-аміно-5,6дифторпіколінонітрилу (формула С) 3 UA 109806 C2 с) гідроліз нітрильного замісника і заміну фтор-замісника в 6-положенні 4-аміно-5,6дифторпіколінонітрилу (формула С) на йод-, бром- або хлор-замісник обробкою джерелом йоду, брому або хлору, з отриманням 4-аміно-5-фтор-6-галогенпіколінаміду формули D 5 10 15 20 в якій Х являє собою Cl, Br або I; 1 d) етерифікацію 4-аміно-5-фтор-6-галогенпіколінаміду формули D дією спирту (R OH) і кислоти Бренстеда або Льюїса, з отриманням 4-аміно-5-фтор-6-галогенпіколінату формули Е в якій Х являє собою Cl, Br або I; а 1 R являє собою С1-С12алкіл, або незаміщений або заміщений С7-С11арилалкіл; е) поєднання 4-аміно-5-фтор-6-галогенпіколінату формули F з арил-, алкенілметалоорганічною сполукою формули G алкіл або в якій R такий, як визначено раніше, а Met являє собою Zn-галогенід, Zn-R, три(С12 3 2 3 С4алкіл)олово, мідь, або В(ОR )(ОR ), де R і R незалежно один від одного, являють собою водень, С1-С4алкіл, або, взяті разом, утворюють етиленову або пропіленову групу, в присутності каталізатора на основі перехідного металу, з отриманням 4-аміно-5-фтор-6(заміщеного)піколінату формули Н 1 в якій R і R такі, як визначено раніше; і f) галогенування 4-аміно-5-фтор-6-(заміщеного)піколінату формули Н джерелом галогену, з отриманням 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули I. Схема III 4 UA 109806 C2 Згідно з схемою III, частина стадії с), пов'язана із заміщенням атома йоду, брому або хлору не є необхідною. Таким чином, даний винахід стосується також способу отримання 4-аміно-5фтор-3-галоген-6-(заміщеного)піколінату формули I 5 10 15 20 25 в якій W являє собою Cl, Br або I; R являє собою С1-С4алкіл, циклопропіл, С2-С4алкеніл, або феніл, що містить від 1 до 4 замісників, незалежно вибраних з галогену, С1-С4алкілу, С1-С4галогеналкілу, С1-С4алкокси, або С1-С4галогеналкокси; а 1 R являє собою С1-С12алкіл, або незаміщений або заміщений С7-С11арилалкіл; який включає наступні стадії: а) поєднання 4,5,6-трихлорпіколінонітрилу формули А з арил-, алкіл- або алкенілметалоорганічною сполукою формули G в якій R такий, як визначено раніше, а Met являє собою Zn-галогенід, Zn-R, три(С12 3 2 3 С4алкіл)олово, мідь, або В(ОR )(ОR ), де R і R незалежно один від одного, являють собою водень, С1-С4алкіл, або, взяті разом, утворюють етиленову або пропіленову групу, в присутності каталізатора на основі перехідного металу, з отриманням 4,5-дихлор-6(заміщеного)піколінонітрилу формули J в якій R такий, як визначено раніше; b) фторування 4,5-дихлор-6-(заміщеного)піколінонітрилу формули J джерелом фторид-іону, з отриманням 4,5-дифтор-6-(заміщеного)піколінонітрилу формули К 5 UA 109806 C2 в якій R такий, як визначено раніше; с) амінування 4,5-дифтор-6-(заміщеного)піколінонітрилу формули К аміаком, з отриманням 4-аміно-5-фтор-6-(заміщеного)піколінонітрилу формули L 5 в якій R такий, як визначено раніше; d) гідроліз 4-аміно-5-фтор-6-(заміщеного)піколінонітрилу формули L під дією кислоти, з отриманням 4-аміно-5-фтор-6-(заміщеного)піколінаміду формули М 10 в якій R такий, як визначено раніше; 1 е) етерифікація 4-аміно-5-фтор-6-(заміщеного)піколінаміду формули М дією спирту (R OH) і кислоти Бренстеда або Льюїса, з отриманням 4-аміно-5-фтор-6-(заміщеного)піколінату формули N 15 в якій R і R такі, як визначено раніше; і f) галогенування 4-аміно-5-фтор-6-(заміщеного)піколінату формули N джерелом галогену, з отриманням 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули I. Схема IV 1 6 UA 109806 C2 Згідно з схемою IV, даний винахід стосується способу отримання 4-аміно-5-фтор-3-галоген6-(заміщеного)піколінату формули I 5 10 в якій W являє собою Cl, Br або I; R являє собою С1-С4алкіл, циклопропіл, С2-С4алкеніл, або феніл, що містить від 1 до 4 замісників, незалежно вибраних з галогену, С1-С4алкілу, С1-С4галогеналкілу, С1-С4алкокси, або С1-С4галогеналкокси; а 1 R являє собою С1-С12алкіл, або незаміщений або заміщений С7-С11арилалкіл; який включає наступні стадії: а) фторування 4,5,6-трихлорпіколінонітрилу (формула А) джерелом фторид-іону, з отриманням 4,5,6-трифторпіколінонітрилу (формула В) 15 20 25 30 b) галогенування 4,5,6-трифторпіколінонітрилу (формула отриманням 4,5,6-трифтор-3-галогенпіколінонітрилу формули О В) джерелом галогену, з в якій W являє собою Cl, Br або I; с) амінування 4,5,6-трифтор-3-галогенпіколінонітрилу формули О аміаком, з отриманням 4аміно-5,6-дифтор-3-галогенпіколінонітрилу формули Р в якій W являє собою Cl, Br або I; d) гідроліз нітрильного замісника і заміну фтор-замісника в 6-положенні 4-аміно-5,6-дифтор3-галогенпіколінонітрилу формули Р на йод-, бром- або хлор-замісник шляхом обробки джерелом йоду, брому або хлору, з отриманням 4-аміно-5-фтор-3,6-дигалогенпіколінаміду формули Q в якій W і Х незалежно являють собою Cl, Br або I; 7 UA 109806 C2 1 е) етерифікацію 4-аміно-5-фтор-3,6-дигалогенпіколінаміду формули Q дією спирту (R OH) і кислоти Бренстеда або Льюїса, з отриманням 4-аміно-5-фтор-3,6-дигалогенпіколінату формули F 5 10 15 20 25 в якій W і Х незалежно являють собою Cl, Br або I; а 1 R являє собою С1-С12алкіл, або незаміщений або заміщений С7-С11арилалкіл; і f) поєднання 4-аміно-5-фтор-3,6-дигалогенпіколінату формули F з арил-, алкіл- або алкенілметалоорганічною сполукою формули G в якій R такий, як визначено раніше, а Met являє собою Zn-галогенід, Zn-R, три(С12 3 2 3 С4алкіл)олово, мідь, або В(ОR )(ОR ), де R і R незалежно один від одного, являють собою водень, С1-С4алкіл, або, взяті разом, утворюють етиленову або пропіленову групу, в присутності каталізатора на основі перехідного металу, з отриманням 4-аміно-5-фтор-3-галоген-6(заміщеного)піколінату формули I. Наступний аспект даного винаходу складають нові проміжні сполуки, отримані в процесі даного способу, а саме сполуки, вибрані з групи, що включає: а) в якій R являє собою С1-С4алкіл, циклопропіл, С2-С4алкеніл, або феніл, що містить від 1 до 4 замісників, незалежно вибраних з галогену, С1-С4алкілу, С1-С4галогеналкілу, С1-С4алкокси, або С1-С4галогеналкокси; b) 1 в якій Х являє собою I, Br, Cl або F, а Y являє собою Н, Cl, Br, або I; с) 1 в якій Х являє собою I, Br, Cl або F, а Y являє собою Н, Cl, Br, або I; d) 30 в якій R являє собою С1-С4алкіл, циклопропіл, С2-С4алкеніл, або феніл, що містить від 1 до 4 замісників, незалежно вибраних з галогену, С1-С4алкілу, С1-С4галогеналкілу, С1-С4алкокси, або С1-С4галогеналкокси; е) 8 UA 109806 C2 в якій W являє собою Cl, Br, або I; і f) 5 10 15 20 25 30 35 40 45 в якій W являє собою Cl, Br, або I. Докладний опис винаходу Використані в даному описі терміни "алкіл", "алкеніл" і "алкініл", а також похідні терміни, такі як "алкокси", "ацил", "алкілтіо" і "алкілсульфоніл", включають в свої рамки групи з лінійним ланцюгом, розгалуженим ланцюгом, і циклічні групи. Якщо спеціально не вказано інакше, кожний з них може бути не заміщений, або заміщений одним або більше замісниками, вибраними з числа, але не обмеженими, галогеном, гідрокси, алкокси, алкілтіо, С1-С6ацилом, формілом, ціано, арилокси або арилом, при умові, що дані замісники стерично сумісні і задовольняються правила хімічного зв'язування і енергії деформації. Мається на увазі, що терміни "алкеніл" і "алкініл" включають в себе один або більше ненасичених зв'язків. Використаний в даному описі термін "арилалкіл" стосується фенілу, заміщеному алкільною групою, що містить загалом від 7 до 11 атомів вуглецю, такому як бензил (-СН2С6Н5), 2метилнафтил (-СН2С10Н7), і 1- або 2-фенетил (-СН2СН2С6Н5 або -СН(СН3)С6Н5). Сама фенільна група може бути не заміщена або заміщена одним або більше замісниками, незалежно вибраними з числа галогену, нітро, ціано, С1-С6алкілу, С1-С6алкокси, галогензаміщеного С1С6алкілу, галогензаміщеного С1-С6алкокси, С1-С6алкілтіо, С(О)ОС1-С6алкілу, або випадку, коли два сусідніх замісники взяті разом у вигляді -О(СН2)nО-, де n=1 або 2, при умові, що дані замісники стерично сумісні і задовольняються правила хімічного зв'язування і енергії деформації. Якщо спеціально не вказано інакше, термін "галоген", а також похідні терміни, такі як "галоїд", стосуються фтору, хлору, брому і йоду. Фенільні групи, що містять від 1 до 4 замісників, незалежно вибраних з числа галогену, С1С4алкілу, С1-С4галогеналкілу, С1-С4алкокси, або С1-С4галогеналкокси, можуть мати будь-яку орієнтацію, але переважними є 4-заміщений фенільний, 2,4-дизаміщений фенільний, 2,3,4тризаміщений фенільний, 2,4,5-тризаміщений фенільний, і 2,3,4,6-тетразаміщений фенільний ізомери. 4-Аміно-5-фтор-3-галоген-6-(заміщені)піколінати отримують з 4,5,6-трихлорпіколінонітрилу за допомогою ряду стадій, що включають заміщення фтору, амінування, заміщення галогену, галогенування, гідроліз нітрильної групи, етерифікацію і поєднання під дією перехідного металу. Окремі стадії можна провести в різній послідовності. Вихідна речовина 4,5,6-трихлорпіколінонітрил є відомою сполукою; дивись, наприклад, приклад 15 в патенті США 6784137 В2. У реакції заміщення атома фтору, фторований піколінонітрил отримують, вводячи у взаємодію відповідний хлорований піколінонітрил, щонайменше, з одним еквівалентом джерела фторид-іону на кожний підлягаючий обміну хлор-замісник циклу. Стандартними джерелами фторид-іону є фториди лужних металів, які включають в себе фторид натрію (NaF), фторид калію (KF) і фторид цезію (CsF), при цьому переважними є KF і CsF. Крім того, можна застосовувати фторидні солі, такі як фторид тетрабутиламонію (н-Bu4NF). Переважно, реакцію проводять в полярному апротонному розчиннику або реакційному середовищі, такому як диметилсульфоксид (ДМСО), N-метилпіролідон (NMP), N, Nдиметилформамід (ДМФА), гексаметилфосфорамід (ГМФТА), або сульфолан. Крім того, можна 9 UA 109806 C2 5 10 15 20 25 30 35 40 45 застосовувати добавки, такі як краун-ефіри або агенти міжфазного перенесення, які, як відомо, підвищують швидкість обміну фтору. Температура проведення реакції не є вирішальною, але звичайно складає від близько 70 °C до близько 180 °C, а переважно, від близько 80 °C до близько 120 °C. Оптимальна температура буде змінюватися в залежності від того, який розчинник використовують в даній конкретній реакції. Взагалі кажучи, чим нижче температура, тим повільніше буде протікати реакція. Дану реакцію звичайно проводять при енергійному перемішуванні, достатньому для підтримки, по суті, рівномірно розподіленій суміші реагуючих речовин. При проведенні реакції фторування ні швидкість, ні порядок додавання реагентів не є вирішальними. Як правило, розчинник і фторид лужного металу змішують перед додаванням хлорованого піколінонітрилу до реакційної суміші. Стандартна реакція звичайно займає від близько 4 до близько 100 годин, і звичайно проводиться при атмосферному тиску навколишнього середовища. Незважаючи на те, що точна кількість реагентів не вирішальною, переважно використати таку кількість фториду лужного металу, яка забезпечить, щонайменше, еквімолярну кількість атомів фтору, виходячи з кількості атомів хлору, які треба замінити у вихідній речовині, тобто, щонайменше, близько одного еквівалента фториду лужного металу. По завершенні реакції, необхідний продукт виділяють, використовуючи стандартні методики виділення і очищення. У випадку амінування, 4-фторпіколінонітрил вводять у взаємодію з аміаком для заміни атома фтору на аміногрупу. Незважаючи на те, що необхідна лише стехіометрична кількість аміаку, часто зручно застосовувати великий надлишок аміаку. Реакцію проводять в інертному розчиннику, переважно, полярному апротонному розчиннику або реакційному середовищі, такому як ДМСО, NMP, ДМФА, ГМФТА або сульфолан. Альтернативним чином, можна застосовувати водний гідроксид амонію (NH4OH), з використанням, або без використання органічного розчинника. Температура проведення реакції не вирішальною, але звичайно складає від близько 0 °C до близько 45 °C, а переважно, від близько 10 °C до близько 30 °C. При проведенні реакції амінування, 4-фторпіколінонітрил розчиняють в розчиннику і додають до реакційної суміші аміак при охолоджуванні. Звичайно надлишок газоподібного аміаку барботують в реакційну суміш. Як правило, стандартна реакція займає від близько 0,5 до близько 5 годин, і звичайно проводиться при атмосферному тиску навколишнього середовища. У випадку реакції заміщення галогену і гідролізу, 6-галогенпіколінамід отримують, вводячи у взаємодію відповідний 6-фторпіколінамід, щонайменше, з двома еквівалентами галогеноводню (гідройодиду (HI), гідроброміду (HBr), або гідрохлориду (HCl)). Незважаючи на те, що необхідно лише два еквіваленти галогеноводню, часто зручно застосовувати великий надлишок галогеноводню. Реакцію проводять в інертному органічному розчиннику, при цьому особливо переважними є С1-С4алканові кислоти. Температура проведення реакції не є вирішальною, але звичайно складає від близько 75 °C до близько 150 °C, а переважно, від близько 100 °C до близько 130 °C. Заміщення галогену звичайно проводять під тиском в герметизованій посудині. При проведенні реакцій галогенування і гідролізу, 6-фторпіколінонітрил можна нагрівати з галогеноводнем і розчинником на основі алканової кислоти в герметизованому реакторі. Стандартна реакція звичайно займає від близько 0,5 до близько 24 годин. Необхідний продукт 6-галогенпіколінамід виділяють з використанням стандартних методик виділення і очищення. У випадку реакції етерифікації, піколінамід вводять у взаємодію зі спиртом в присутності кислоти Бренстеда або Льюїса. 10 UA 109806 C2 5 10 15 20 25 30 35 40 45 Сильні протонні кислоти Бренстеда на зразок сірчаної кислоти і фосфорної кислоти звичайно застосовують в стехіометричних кількостях. Можна також використати кислоти Льюїса на зразок ізопропілату титану(IV). Реакцію проводять при використанні С1-С12алкілового або незаміщеного або заміщеного С7-С11арилалкілового спирту для необхідного складного ефіру як розчинник. Реакцію звичайно проводять в герметизованому реакторі, як правило, при температурі, що перевищує температуру кипіння спиртового розчинника. При проведенні етерифікації, піколінамід або піколінонітрил додають до суміші спирту і кислоти. Незважаючи на те, що температура реакції не є вирішальною, часто здійснюють нагрівання до температури від близько 80 °C до близько 140 °C протягом від близько 2 до близько 24 годин, переважно, від 100 °C до 120 °C протягом від 6 до 8 годин. Необхідний продукт виділяють з використанням стандартних методик розділення і очищення. Іноді зручно провести стадію етерифікації в комбінації з обробкою на стадії заміщення галогену. У реакції галогенування, атом хлору, брому або йоду вводять в 3-положення або піколінату, або піколінонітрилу реакцією з джерелом галогену в інертному розчиннику. У випадку, коли атомом галогену в 3-положенні є Cl, джерело хлору може являти собою власне хлор (Cl2), або такі реагенти, як хлористий сульфурил, N-хлорсукцинімід або 1,3-дихлор5,5-диметилгідантоїн. При використанні хлору або хлористого сульфурилу застосовують великий надлишок хлоруючого агента. При використанні газоподібного хлору реакцію проводять в інертному розчиннику, переважно, такому розчиннику, як дихлорметан, суміш дихлорметанвода, чотирьоххлористий вуглець, або оцтова кислота. При використанні хлористого сульфурилу реакцію можна провести в інертному розчиннику, такому як дихлорметан, або в чистому хлористому сульфурилі. Температура проведення реакції не є вирішальною, але звичайно складає від близько 0 °C до близько 45 °C, а переважно, від близько 10 °C до близько 30 °C. Стандартна реакція, як правило, займає від близько 0,5 до близько 5 годин. Реакцію хлорування звичайно проводять при атмосферному тиску навколишнього середовища. У деяких випадках хлорування не протікає в даних умовах. Замість цього можна використати хлорування в газовій фазі в трубчастому реакторі з використанням газоподібного хлору. Температура, при якій проводять дану реакцію, звичайно складає від близько 350 °C до близько 600 °C, а переважно, від близько 500 °C до близько 600 °C. Реакцію хлорування звичайно проводять при атмосферному тиску навколишнього середовища. У випадку, коли хлоруючий агент, що застосовується, являє собою N-хлорсукцинімід або 1,3-дихлор-5,5-диметилгідантоїн, реакцію можна провести з використанням стехіометричної кількості хлоруючого реагенту. У випадку реакцій хлорування із застосуванням 1,3-дихлор-5,5диметилгідантоїну як хлоруючого агента було знайдено, що у взаємодії беруть участь обидва атоми хлору гідантоїну. Реакцію проводять в інертному полярному розчиннику, такому як ДМФА або ацетонітрил. Температура проведення реакції не є вирішальною, але звичайно складає від близько 20 °C до близько 85 °C, а переважно, від близько 50 °C до близько 80 °C. При використанні ацетонітрилу як розчинника, зручно провести дану реакцію при температурі кипіння. Стандартна реакція звичайно займає від близько 0,5 до близько 5 годин. Реакцію хлорування звичайно проводять при атмосферному тиску навколишнього середовища. У випадку, коли атомом галогену в 3-положенні є Br, джерело брому може являти собою власне бром (BR2), або такі реагенти, як бромистий сульфурил, N-бромсукцинімід або 1,3дибром-5,5-диметилгідантоїн. При використанні BR2 як бромуючого агента можна застосовувати великий надлишок, а реакцію проводять в інертному розчиннику, переважно, такому розчиннику, як дихлорметан, суміш дихлорметан-вода, або оцтова кислота. Температура 11 UA 109806 C2 5 10 15 20 25 30 35 40 45 50 55 проведення реакції не є вирішальною, але звичайно складає від близько 0 °C до близько 45 °C, а переважно, від близько 10 °C до близько 30 °C. Стандартна реакція, як правило, займає від близько 0,5 до близько 5 годин. Реакцію бромування звичайно проводять при атмосферному тиску навколишнього середовища. У випадку, коли бромуючий агент, що застосовується, являє собою N-бромсукцинімід або 1,3-дибром-5,5-диметилгідантоїн, реакцію проводять з використанням стехіометричної кількості бромуючого реагенту. Реакцію проводять в інертному полярному розчиннику, такому як ДМФА або ацетонітрил. Температура проведення реакції не є вирішальною, але звичайно складає від близько 20 °C до близько 85 °C, а переважно, від близько 50 °C до близько 80 °C. При використанні ацетонітрилу як розчинника, зручно провести дану реакцію при температурі кипіння. Стандартна реакція звичайно займає від близько 0,5 до близько 5 годин. Реакцію бромування звичайно проводять при атмосферному тиску навколишнього середовища. У випадку, коли атомом галогену в 3-положенні є I, джерело йоду може являти собою власне йод (I2), або такі реагенти, як монохлорид йоду або N-йодсукцинімід. Йодна кислота може бути використана спільно з I2. При використанні I2 як йодуючого агента можна застосовувати великий надлишок, а реакцію проводять в інертному розчиннику, переважно, такому розчиннику, як дихлорметан, суміш дихлорметан-вода, або оцтова кислота. Температура проведення реакції не є вирішальною, але звичайно складає від близько 0 °C до близько 45 °C, а переважно, від близько 10 °C до близько 30 °C. Стандартна реакція, як правило, займає від близько 0,5 до близько 5 годин. Реакцію йодування звичайно проводять при атмосферному тиску навколишнього середовища. У реакції поєднання, 6-йод-, бром- або хлорпіколінату або піколінонітрилу дають можливість взаємодіяти з арил-, алкіл- або алкенілметалоорганічною сполукою, в якій метал являє собою 2 3 2 3 Zn-галогенід, Zn-R, три(С1-С4алкіл)олово, мідь, або В(OR )(OR ), де R і R незалежно один від одного, водень, С1-С4алкіл, або, взяті разом, утворюють етиленову або пропіленову групу, в присутності каталізатора на основі перехідного металу. "Каталізатор" являє собою каталізатор на основі перехідного металу, зокрема, паладієвий каталізатор, такий як ацетат паладію(II) або дихлорид біс(трифенілфосфін)паладію(II), або нікелевий каталізатор, такий як ацетилацетонат нікелю(II) або дихлорид біс(трифенілфосфін)нікелю(II). Крім того, каталізатори можна отримувати in situ з солей металів і лігандів, таких як ацетат паладію(II) і трифенілфосфін, або хлорид нікелю(II) і трифенілфосфін. Дані отримані in situ каталізатори можна отримувати попередньою реакцією солі металу і ліганду, з подальшим додаванням до реакційної суміші, або шляхом окремого додавання солі металу і ліганду безпосередньо до реакційної суміші. Звичайно реакцію поєднання можна здійснювати за відсутністю кисню при використанні інертного газу, такого як азот або аргон. Методи, що застосовуються для видалення кисню з реакційних сумішей для проведення поєднання, такі як барботування інертного газу, добре відомі фахівцям в даній галузі техніки. Приклади таких методик описані в The Manipulation of AirSensitive Compounds, 2nd ed., D.F. Shriver, M.A. Drezdzon, Eds.; Wiley-Interscience, 1986. Застосовують субстехіометричні кількості каталізатора, звичайно від близько 0,0001 еквівалента до 0,1 еквівалента. Необов'язково можна додавати додаткові кількості ліганду для підвищення стабільності і активності каталізатора. Крім того, в реакцію поєднання звичайно вводять такі добавки, як карбонат натрію (Na2CO3), карбонат калію (К2CO3), KF, CsF і NaF. Для реакції поєднання звичайно потрібно від близько 1 до близько 5 еквівалентів подібної добавки, переважно, від 1 до 2 еквівалентів. Необов'язково, в реакцію поєднання можна додати воду для підвищення розчинності добавок. Для реакції поєднання звичайно потрібно від 1 до близько 3 еквівалентів арил-, алкіл- або алкенілметалоорганічної сполуки, переважно, від 1 до 1,5 еквівалента. Реакцію проводять в інертному розчиннику, такому як толуол, тетрагідрофуран (ТГФ), діоксан або ацетонітрил. Температура, при якій проводять реакцію, не є вирішальною, але звичайно складає від близько 25 °C до близько 150 °C, а переважно, від близько 50 °C до близько 125 °C. Стандартна реакція звичайно займає від близько 0,5 до близько 24 годин. Звичайно не потрібно певного порядку додавання реагентів. Часто буває препаративно простіше з'єднати всі реагенти, за винятком каталізатора, а потім дегазувати реакційний розчин. Після видалення кисню, для початку реакції поєднання можна додати каталізатор. 12 UA 109806 C2 5 10 15 20 25 30 35 40 45 У випадку, коли Met частину арил-, алкіл- або алкенілметалоорганічної сполуки являє собою Zn-галогенід, Zn-R або мідь, може бути потрібен захист реакційноздатних функціональних груп. Наприклад, при наявності аміно-замісника (-NHR або -NH2), може бути потрібен захист даних реакційноздатних груп. Для захисту аміногруп від взаємодії з металоорганічними реагентами в даній галузі відома безліч груп. Приклади таких захисних груп описані в Protective Groups in Organic Synthesis, 3nd ed.; Greene, T.W.; Wuts, P.G.M. Eds.; Wiley-Interscience, 1999. На вибір металу для застосування в R-Met впливає ряд чинників, таких як вартість, стійкість, реакційна здатність і необхідність в захисті реакційноздатних функціональних груп. Продукти, отримані будь-яким з даних способів, можна виділити звичайними способами, такими як випарювання або екстракція, і можна очистити стандартними методами, такими як перекристалізація або хроматографія. Для ілюстрації даного винаходу надані наступні приклади. Приклади Заміщення атома фтору Приклад 1а 4,5,6-Трифторпіколінонітрил У тригорлу колбу на 100 мілілітрів (мл), забезпечену механічною мішалкою, термопарою і насадкою для перегонки у вакуумі, вміщували безводний ДМСО (50 мл) і CsF (8,71 грам (г), 57,4 мілімоль (ммоль)) в атмосфері азоту. Прилад вакуумували і нагрівали до 60 °C при перемішуванні, щоб було можна осушити систему шляхом відгонки ДМСО (15 мл) і слідових кількостей води. Додавали 4,5,6-трихлорпіколінонітрил (3,4 г, 16,3 ммоль). Реакційну суміш нагрівали до 75 °C (20,5 годин (год.)), а потім при 110 °C (2,5 год.). Додавали ще CsF (2,23 г) і продовжували нагрівання при 110 °C ще протягом години. Після охолоджування реакційну суміш виливали в холодний насичений (насич.) водний (водн.) розчин гідрокарбонату натрію (NaHCO3) при перемішуванні і екстрагували ефіром (Et2O). Об'єднані органічні екстракти промивали концентрованим розчином NaСl, сушили над сульфатом натрію (Na 2SO4), фільтрували і концентрували у вакуумі, отримуючи масло коричневого кольору (2,51 г): EIMS m/z 158. Приклад 1b 4,5,6-Трифторпіколінонітрил В автоклав на 45 мл з неіржавіючої сталі вміщували 4,5,6-трихлорпіколінонітрил (1,0 г, 4,8 ммоль), сухий KF (1,3 г, 22,4 ммоль), 18-краун-6 (180 мг, 0,7 ммоль) і сухий ацетонітрил (10 мл). Автоклав герметизували і нагрівали при 135 °C протягом 10 год. Після охолоджування з автоклава відбирали пробу, при цьому за даними аналізу методом газової хроматографії (ГХ) в суміші містилося 70 % 4,5,6-трифторпіколінонітрилу і 30 % 5-хлор-4,6-дифторпіколінонітрилу: + + + EIMS (70 еВ) m/z 158 (М , 100 %), 131 (20 %), 176 (М , 30 %), 174 (М , 100 %). Приклад 1с 6-(4-Хлорфеніл)-4,5-дифторпіколінонітрил Тригорлу колбу на 1000 мл забезпечували насадкою для перегонки, введенням азоту, механічною мішалкою і термопарою. У колбу вміщували CsF (93,6 г, 0,616 моль). Додавали безводний ДМСО (500 мл) і суспензію вакуумували/знов заповнювали азотом. Суспензію нагрівали при 80 °C протягом 30 хв. ДМСО (100 мл) відганяли у вакуумі для видалення залишкової води. Додавали 4,5-дихлор-6-(4-хлорфеніл)піколінонітрил (50 г, 0,1763 моль) і розчин вакуумували/знов заповнювали азотом. Реакційну суміш нагрівали при 105 °C в атмосфері азоту. Через 4 год. при 105 °C, за даними аналізу методом ГХ, реакція завершувалася. Реакційну суміш залишали остигати до кімнатної температури. ДМСО 13 UA 109806 C2 5 10 15 20 25 30 35 40 45 видаляли перегонкою у вакуумі. Залишок виливали в крижану воду (500 г) і екстрагували етилацетатом (EtOAc; 3×200 мл). Об'єднані органічні екстракти промивали водою (2×200 мл), а потім концентрованим розчином NaСl (100 мл). Екстракти сушили над безводним Na 2SO4, фільтрували і концентрували у вакуумі, отримуючи масло коричневого кольору, яке закристалізовувалося при стоянні. Внаслідок очищення колонковою хроматографією (силікагель 60-120 меш; елюювання при градієнті 0-20 % EtOAc-гексан) отримували тверду речовину білого 1 кольору (17 г, 39 %): т.пл. 89,0-90,8ºС; H ЯМР (400 MГц, ДМСО-d6) δ 8,51-8,47 (м, 1H), 7,92 (д, 13 JH-H=8,6 Гц, 2H), 7,64 (д, JH-H=8,6 Гц, 2H); C ЯМР (100 MГц, ДМСО-d6) δ 156,04 (дд, JF-C=262, 13 Гц), 148,16 (дд, JF-C=9, 2 Гц), 147,99 (дд, JF-C=267, 10 Гц), 135,72, 131,17 (дд, JF-C=15, 3 Гц), 130,4 19 (д, JF-C=6 Гц), 129,08 (дд, JF-C=11, 7 Гц), 128,91, 118,93 (д, JF-C=19 Гц), 115,96 (д, JF-C=3 Гц); F ЯМР (376,5 MГц, ДМСО-d6) δ -123,25 (д, JF-F=18,82 Гц),-141,07 (д, JF-F=18,82 Гц); ESIMS m/z 251 + ([M] ). Аналіз вир. для C12H5ClF2N2: C, 57,51; H, 2,01; N, 11,18. Знайдено: C, 57,97; H, 2,15; N, 10,77. Амінування Приклад 2а 4-Аміно-5,6-дифторпіколінонітрил До сирого 4,5,6-трифторпіколінонітрилу (2,5 г, 15,8 ммоль) додавали гідроксид амонію (NH4OH) і перемішували при кімнатній температурі протягом 2 год. Осад коричневого кольору, що випав, фільтрували, промивали водою і сушили, отримуючи 0,72 г. За даними аналізу методом хроматографії-мас-спектрометрії (ГХ-МС), було два ізомерних продукти. Водний фільтрат екстрагували EtOAc. Об'єднані органічні екстракти промивали концентрованим розчином NaСl, сушили над Na2SO4, і упарювали, отримуючи додаткову кількість твердої речовини коричневого кольору. Дві цих порції об'єднували і очищали колонковою 1 хроматографією, отримуючи 4-аміно-5,6-дифторпіколінонітрил (0,60 г, 24,4 %): H ЯМР (400 13 MГц, CDCl3) δ 7,13 (д, J=5,3 Гц, 1H, ароматичний), 6,62 (с, 2H, NH2); C ЯМР (101 MГц, CDCl3) δ 157,0 (дд, J=235, 12 Гц), 151,7 (дд, J=10, 7 Гц), 139,5 (дд, J=254, 29 Гц), 128,8 (д, J=19 Гц), 121,2 19 (с), 121,0 (с); F ЯМР (376 MГц, CDCl3) δ -85,29 (д, J=24,5 Гц), -156,98 (дд, J=24,5, 5,2 Гц). Приклад 2b 4-Аміно-3-хлор-5,6-дифторпіколінонітрил Розчин 3-хлор-4,5,6-трифторпіколінонітрилу (200 г) в EtOAc (3 л) охолоджували до 10 °C. До нього повільно додавали 14 %-ний водн. NH4OH (1296 г), підтримуючи температуру в інтервалі 18-23 °C. Водний розчин відділяли від органічного розчину. Органічну фазу послідовно промивали 50/50 розчином водного насиченого NaCl і водою (500 мл) і насич. розчином NaCl (250 мл). Як тільки органічну фазу концентрували у вакуумі при 50 °C до об'єму приблизно 500 мл, продукт викристалізовувався. До даної суспензії додавали гептан (1 л) і концентрували суміш у вакуумі. Осад виділяли фільтруванням. Даний осад промивали пентаном і сушили у вакуумі, отримуючи 4-аміно-3-хлор-5,6-дифторпіколінонітрил (173,8 г, 90 %, чистота 99,6 %) у 13 вигляді кристалічної речовини білого кольору: т.пл. 190-191,5 °C; C ЯМР (101 MГц, ДМСО-d6) δ 150,03 (дд, J=232,4, 12,5 Гц, C6), 144,29 (дд, J=11,4, 6,9 Гц, C4), 133,72 (дд, J=257,9, 30,8 Гц, 19 C5), 122,14 (дд, J=19,6, 4,9 Гц, C2), 119,31 (с, C3), 114,25 (с, CN); F ЯМР (376 MГц, ДМСО-d6) δ + -91,24 (д, J=24,2 Гц),-154,97 (д, J=24,2 Гц); EIMS m/z 189 ([M] ). Аналіз вир. для C6H2ClF2N3: C, 38,02; H, 1,06; N, 22,17. Знайдено: C, 37,91; H, 1,00; N, 22,02. Приклад 2с 4-Аміно-6-(4-хлорфеніл)-5-фторпіколінонітрил 6-(4-Хлорфеніл)-4,5-дифторпіколінонітрил (60 г, 0,24 моль) розчиняли в ДМСО (1200 мл). Через розчин періодично барботували аміак загалом протягом 24 год. за період часу 48 год. Реакційну суміш виливали в крижану воду (2000 г). Продукт екстрагували EtOAc (3×500 мл). 14 UA 109806 C2 5 10 15 20 25 30 35 40 45 Об'єднані органічні шари промивали водою (5×500 мл), а потім концентрованим розчином NaСl (100 мл). Екстракти сушили над безводним Na2SO4, фільтрували і концентрували у вакуумі, 1 отримуючи тверду речовину білого кольору (50 г, 84 %): т.пл. 185,3-187,8 °C; H ЯМР (400 MГц, ДМСО-d6) δ 7,85 (д, JН-H=8,5 Гц, 2H), 7,58 (д, JН-H=8,5 Гц, 2H), 7,21 (д, JН-H=6,0 Гц, 1H), 6,96 13 (ушир.с, 2H); C ЯМР (100 MГц, ДМСО-d6) δ 141,86 (д, JF-C=256 Гц), 144,81 (д, JF-C=14 Гц), 143,80 (д, JF-C=10 Гц), 134,34, 132,87 (д, JF-C=5 Гц), 130,3 (д, JF-C=6 Гц), 128,56, 128,38 (д, JF-C=5 19 + Гц), 117,43, 115,08 (д, JF-C=5 Гц); F ЯМР (376,5 MГц, ДМСО-d6) δ -142,71; ESIMS m/z 248 ([M] ). Аналіз вир. для C12H7ClFN3: C, 58,20; H, 2,85; N, 16,97. Знайдено: C, 57,82; H, 3,022; N, 16,10. Заміщення галогену, гідроліз і етерифікація Приклад 3а Метил 4-аміно-6-бром-5-фторпіколінат 4-Аміно-5,6-дифторпіколінонітрил (4,5 г, 6,45 ммоль) розчиняли в 30 %-ному розчині HBr в оцтовій кислоті (40 мл). Розчин нагрівали при 120 °C в реакторі системи Parr протягом 3,0 год. Після охолоджування розчин концентрували у вакуумі. Залишок розчиняли в метиловому спирті (СН3ОН; 40 мл) і переносили зворотно в реактор системи Parr. Додавали концентровану сірчану кислоту (632 мг, 6,45 ммоль) і нагрівали реактор при 110 °C протягом 7 год. Після охолоджування розчинник випарювали у вакуумі. Залишок розчиняли в EtOAc і нейтралізували насич. водн. розчином NaHCO3. Органічну фазу відділяли, промивали концентрованим розчином NaСl, сушили (Na2SO4) і упарювали. Сирий продукт очищали колонковою хроматографією на силікагелі (10-100 % EtOAc в гексані), отримуючи тверду речовину жовтого 1 кольору (2,87 г, 40 %): т.пл. 187-190 °C; H ЯМР (400 MГц, ДМСО-d6) δ 7,46 (д, J=6,2 Гц, 1H, 13 ароматичний), 6,88 (с, 2H, NH2), 3,83 (с, 3H, CH3); C ЯМР (101 MГц, ДМСО-d6) δ 163,8 (с), 144,7 (д, J=252 Гц), 144,3 (д, J=13 Гц), 143,1 (д, J=5 Гц), 127,7 (д, J=21 Гц), 113,1 (д, J=5 Гц), 52,4 (с); 19 F ЯМР (376 MГц, ДМСО-d6) δ -133,77 (с). Приклад 3b 4-Аміно-6-бром-5-фторпіколінамід і метил 4-аміно-6-бром-3-хлор-5фторпіколінат Суміш 4-аміно-3-хлор-5,6-дифторпіколінонітрилу (70 г, 0,37 моль) і 33 %-ного HBr в оцтовій кислоті (700 мл) нагрівали до 120 °C в герметизованій реакційній посудині при перемішуванні протягом 2 год. Після охолоджування до кімнатної температури надосадову рідину відділяли від великої кількості твердої речовини жовтувато-коричневого кольору, і концентрували у вакуумі, отримуючи клейкий темний залишок. Даний залишок розчиняли в СН3ОН (600 мл) і знову додавали до осаду жовтувато-коричневого кольору, що залишався в автоклаві. До цієї суміші повільно додавали концентровану сірчану кислоту (H2SO4; 40 г, 0,41 моль), і реактор знову герметизували і нагрівали до 110 °C протягом 6 год. Охолоджену реакційну суміш повільно виливали в насич. водн. розчин карбонату натрію (Na2CO3; 2 л) і Et2O (1 л). Ефірний екстракт сушили над MgSO4, фільтрували і концентрували до стану твердої речовини жовтуватокоричневого кольору. Дану тверду речовину очищали колонковою хроматографією, отримуючи метил 4-аміно-6-бром-3-хлор-5-фторпіколінат (78 г, 75 %) у вигляді дрібних кристалів білого 1 13 кольору: т.пл. 119-120 °C; H ЯМР (400 MГц, ДМСО-d6) δ 7,28 (с, 2H), 3,87 (с, 3H); C ЯМР (101 MГц, ДМСО-d6) δ 163,54 (с, C=O), 144,63 (д, J=256,3 Гц, C5), 142,60 (д, J=4,9 Гц, C2), 140,55 (д, 19 J=13,6 Гц, C4), 125,61 (д, J=21,0 Гц, C6), 116,65 (с, C3), 53,2 (с, OMe); F ЯМР (376 MГц, CDCl3) + δ -128,86; EIMS m/z 284 ([M] ). Аналіз вир. для C7H5BrClFN2O2: C, 29,66; H, 1,78; N, 9,88. Знайдено: C, 30,03; H, 1,80; N, 9,91. Крім того, методом колонкової хроматографії виділяли 4-аміно-6-бром-3-хлор-5фторпіколінамід (200 мг) у вигляді твердої речовини світло-жовтувато-коричневого кольору: 13 т.пл. 215 °C розкл.; C ЯМР (101 MГц, ДМСО-d6) δ 165,64 (с, C=O), 148,02 (д, J=4,8 Гц, C2), 142,31 (д, J=233,2 Гц, C5), 141,86 (д, J=14,0 Гц, C4), 124,13 (д, J=19,9 Гц, C6), 112,55 (д, J=2,1 15 UA 109806 C2 19 + Гц, C3); F ЯМР (376 MГц, ДМСО-d6) δ -131,56; EIMS m/z 269 ([M] ). Аналіз вир. для C6H4BrClFN3O: C, 26,84; H, 1,50; N, 15,65. Знайдено: C, 26,95; H, 1,52; N, 15,16. Гідроліз і етерифікація Приклад 4а Метил 4-аміно-6-(4-хлорфеніл)-5-фторпіколінат 5 10 15 20 25 30 35 У запаяну трубку на 1000 мл вміщували 4-аміно-6-(4-хлорфеніл)-5-фторпіколінонітрил (30 г, 0,1211 моль) і 90 %-ну H2SO4 (30 мл) в СН3ОН (500 мл). Розчин нагрівали при 110 °C протягом 7 днів. При охолоджуванні до кімнатної температури випадав осад білого кольору. Реакційну суміш виливали в крижану воду (300 г), нейтралізовували насич. розчином NaHCO 3, а потім екстрагували EtOAc (3×200 мл). Об'єднані органічні екстракти промивали водою (3×100 мл), а потім концентрованим розчином NaСl. Екстракти сушили над безводним Na 2SO4, фільтрували і концентрували у вакуумі, отримуючи тверду речовину білого кольору. Внаслідок очищення колонковою хроматографією (силікагель 60-120 меш; елюювання при градієнті 0-20 % EtOAc1 гексан) отримували тверду речовину білого кольору (25 г, 44 %): т.пл. 176,8-178,9 °C; H ЯМР (400 MГц, ДМСО-d6) δ 7,87 (д, JН-H=8,6 Гц, 2H), 7,56 (д, 8,6 Гц, 2H), 7,46 (д, JН-F=6,3 Гц, 1H), 6,64 13 (ушир.с, 2H), 3,38 (с, 3H); C ЯМР (100 MГц, ДМСО-d6) δ 165,44, 147,69 (д, JF-C=254 Гц), 144,82 (д, JF-C=13 Гц), 143,72 (д, JF-C=5 Гц), 142,56 (д, JF-C=11 Гц), 133,34 (д, JF-C=7 Гц), 130,75 (д, JF-C=6 19 Гц), 128,88, 112,44 (д, JF-C=5 Гц), 52,73; F ЯМР (376,5 MГц, ДМСО-d6) δ -145,01; ESIMS m/z 281 + ([M] ). Аналіз вир. для C13H10ClFN2O2: C, 55,63; H, 3,59; N, 9,98. Знайдено: C, 55,59; H, 3,61; N, 9,98. Поєднання Приклад 5а Метил 4-аміно-5-фтор-6-(4-хлор-2-фтор-3-метоксифеніл)піколінат У круглодонну колбу на 50 мл, забезпечену зворотним холодильником, вміщували твердий метил 4-аміно-6-бром-5-фторпіколінат (1,0 г, 4,02 ммоль), 2-(4-хлор-2-фтор-3-метоксифеніл)1,3,2-діоксаборинан (1,227 г, 5,02 ммоль), дихлорид біс(трифенілфосфін)паладію(II) (Pd(PPh3)2Cl2:) (0,141 г, 0,201 ммоль) і KF (0,467 г, 8,03 ммоль). Реакційну суміш продували азотом, а потім додавали розчинник (3:1 ацетонітрил-вода, 24 мл). Реакційну суміш нагрівали при кипінні в атмосфері азоту протягом 2 год. Після охолоджування до кімнатної температури продукт фільтрували, промивали ацетонітрилом, після чого водою, і сушили у вакуумній печі протягом ночі, отримуючи продукт (0,89 г) у вигляді твердої речовини майже білого кольору: 1 т.пл. 204-206 °C. З фільтрату виділяли ще 0,29 г продукту із загальним виходом 89 %. H ЯМР (400 MГц, ДМСО-d6) δ 7,54 (д, J=6,6 Гц, 1H), 7,46 (дд, J=8,5, 1,4 Гц, 1H), 7,30 (дд, J=8,4, 7,2 Гц, 13 1H), 6,71 (с, 2H), 3,93 (с, 3H), 3,83 (с, 3H), 3,31 (с, 4H); C ЯМР (101 MГц, ДМСО-d6) δ 164,82 (с), 153,17 (д, J=249,5 Гц), 146,87 (д, J=254,3 Гц), 143,83 (дд, J=13,4, 3,8 Гц), 143,69 (д, J=4,3 Гц), 139,05 (д, J=10,6 Гц), 128,20 (д, J=3,2 Гц), 125,96 (д, J=3,4 Гц), 125,42 (д, J=3,6 Гц), 123,83 (дд, 19 J=14,3, 3,1 Гц), 112,54 (с), 61,56 (с), 52,25 (с); F ЯМР (376 MГц, ДМСО-d6) δ -129,37 (д, J=26,0 Гц), -142,56 (д, J=26,3 Гц). Приклад 5b Метил 4-аміно-3-хлор-5-фтор-6-(4-хлор-2-фтор-3-метоксифеніл)піколінат 40 16 UA 109806 C2 5 10 15 20 25 30 35 40 45 У тригорлу колбу на 250 мл, забезпечену зворотним холодильником, вводом азоту і термопарою, вміщували метил 4-аміно-3,6-дихлор-5-фторпіколінат (9,965 г, 41,7 ммоль), 2-(4хлор-2-фтор-3-метоксифеніл)-1,3,2-діоксаборинан (12,74 г, 52,1 ммоль), і KF (4,84 г, 83 ммоль). Додавали ацетонітрил (78 мл) і воду (26 мл). Реакційну суміш продували азотом. Додавали Pd(PPh3)2Cl2 (1,477 г, 2,10 ммоль, 5 мол. %), і нагрівали розчин при 70 °C в атмосфері азоту протягом 2 год. При охолоджуванні до кімнатної температури випадав осад, який фільтрували і промивали водою. Осад розчиняли в EtOAc (прибл. 500 мл) і промивали водою, а потім насиченим розчином солі. Органічний шар сушили (MgSO 4) і видаляли розчинник на роторному випарнику, отримуючи тверду речовину оранжевого кольору, яку сушили у вакуумній печі при 1 50 °C (11,46 г, вихід 76 %): т.пл. 169-170,5 °C. H ЯМР (400 MГц, ДМСО-d6) δ 7,48 (д, J=8,4 Гц, 13 1H), 7,32 (т, J=7,7 Гц, 1H), 7,15 (с, 2H), 3,96 (с, 3H), 3,90 (с, 3H); C ЯМР (101 MГц, ДМСО-d6) δ 164,85 (с), 153,11 (д, J=252,5 Гц), 146,29 (с), 144,52 (д, J=4,3 Гц), 143,74 (с), 142,75 (дд, J=227,1, 14,0 Гц), 136,38 (д, J=13,4 Гц), 128,58 (д, J=3,2 Гц), 125,87 (с), 125,54 (д, J=3,5 Гц), 122,89 (дд, + J=13,8, 4,0 Гц), 113,01 (д, J=3,0 Гц), 61,61 (д, J=4,2 Гц), 52,70 (с); ESIMS m/z 364 ([M+Н] ). Аналіз вир. для C14H10Cl2F2N2O3: C, 46,30; H, 2,78; N, 7,71. Знайдено: C, 46,60; H, 2,68; N, 7,51. Приклад 5с 4-Аміно-3-хлор-5-фтор-6-(4-хлор-2-фтор-3-метоксифеніл)піколінат Суміш 4-аміно-3,6-дихлор-5-фторпіколінонітрилу (0,37 г, 1,80 ммоль), 2-(4-хлор-2-фтор-3метоксифеніл)-1,3,2-діоксаборинану (0,549 г, 2,24 ммоль) і KF (0,209 г, 3,59 ммоль) розчиняли в ацетонітрилі (6,75 мл) і воді (2,25 мл). Суміш перемішували і барботували через неї азот. Додавали Pd(PPh3)2Cl2 (63 мг, 0,1 ммоль), і знов барботували через суміш азоту. Після цього розчин нагрівали при 75 °C в атмосфері азоту протягом 2 год. При охолоджуванні випадав осад, який виділяли фільтруванням, промивали водою і сушили у вакуумі, отримуючи продукт (0,34 г) у вигляді твердої речовини майже білого кольору. Водну фазу екстрагували EtOAc (3х), а об'єднані органічні екстракти промивали концентрованим розчином NaСl, сушили і концентрували. У результаті очищення колонковою хроматографією отримували додаткову 1 кількість продукту (0,12 г) у вигляді твердої речовини білого кольору. Загальний вихід 78 %. H ЯМР (400 MГц, ДМСО-d6) δ 7,50 (дд, J=8,5, 1,4 Гц, 1H), 7,45 (с, 2H), 7,33 (дд, J=8,5, 7,2 Гц, 1H), 13 3,94 (с, 3H); C ЯМР (101 MГц, ДМСО-d6) δ 152,97 (д, J=253,2 Гц), 145,73 (д, J=260,8 Гц), 143,82 (д, J=13,7 Гц), 141,83 (д, J=14,7 Гц), 138,45 (д, J=14,8 Гц), 133,93-132,79 (м), 128,93 (д, J=3,3 Гц), 127,74 (с), 126,37-125,10 (м), 122,08 (дд, J=13,6, 3,9 Гц), 119,34 (д, J=4,5 Гц), 114,99 (с), 61,61 (с); 19 F ЯМР (376 MГц, ДМСО-d6) δ -129,00 (дд, J=28,2, 7,0 Гц, 1F),-133,76 (д, J=28,2 Гц, 1F); ESIMS + m/z 330,1 ([M+Н] ). Приклад 5d 4,5-Дихлор-6-(4-хлорфеніл)піколінонітрил У круглодонну колбу на 3000 мл вміщували 4,5,6-трифторпіколінонітрил (100 г, 0,482 моль), (4-хлорфеніл)боронову кислоту (106 г, 0,6797 моль), трифенілфосфін (11,4 г, 0,0433 моль) і гідрофосфат калію (К2НРО4; 252 г, 1,4462 моль). Додавали ацетонітрил (900 мл) і воду (300 мл). Реакційну суміш вакуумували/знов заповнювали азотом. Додавали дихлорид біс(ціанофеніл)паладію(II) (Pd(PhCN)2Cl2; 9,2 г, 0,0241 моль). Розчин вакуумували/знов заповнювали азотом, а потім перемішували при кипінні протягом 5 год. При охолоджуванні до кімнатної температури випадав осад білого кольору. Реакційну суміш виливали в крижану воду (1000 г) і екстрагували EtOAc (3×500 мл). Об'єднані органічні шари послідовно промивали водою (3×500 мл) і концентрованим розчином NaСl (100 мл). Екстракти сушили над безводним Na2SO4, фільтрували і концентрували у вакуумі, отримуючи тверду речовину білого кольору (83 1 г, 61 %): т.пл. 142,2-144,6 °C. H ЯМР (400 MГц, ДМСО-d6) δ 8,58 (с, 1H), 7,71 (д, J=8,56 Гц, 2H), 13 7,61 (д, J=8,56 Гц, 2H); C ЯМР (75 MГц, ДМСО-d6) δ 158,52, 144,49, 135,64, 135,26, 133,20, 17 UA 109806 C2 131,64, 131,16, 129,84, 128,81, 116,5. Аналіз вир. для C12H5Cl3N2: C, 50,83; H, 1,78; N, 9,88. Знайдено: C, 51,54; H, 1,90; N, 9,19. Галогенування Приклад 6а Метил 4-Аміно-3-хлор-5-фтор-6-(4-хлор-2-фтор-3-метоксифеніл)піколінат 5 10 15 20 25 30 35 40 45 Суміш метил 4-аміно-5-фтор-6-(4-хлор-2-фтор-3-метоксифеніл)піколінату (0,5 г, 1,52 ммоль) і 1,3-дихлор-5,5-диметилімідазолідин-2,4-діону (0,30 г, 1,52 ммоль) в ацетонітрилі (10 мл) нагрівали при кипінні протягом 1,5 год. Після охолоджування до кімнатної температури реакційну суміш концентрували у вакуумі, а потім очищали колонковою хроматографією на силікагелі (градієнт від 100 % гексану до 100 % EtOAс), отримуючи тверду речовину ясно1 коричневого кольору (0,53 г, 100 %): т.пл. 169-170,5 °C. H ЯМР (400 MГц, ДМСО-d6) δ 7,48 (д, 13 J=8,4 Гц, 1H), 7,32 (т, J=7,7 Гц, 1H), 7,15 (с, 2H), 3,96 (с, 3H), 3,90 (с, 3H);, C ЯМР (101 MГц, ДМСО-d6) δ 164,8 (с), 153,1 (д, J=253 Гц), 146,3 (с), 144,5 (д, J=4 Гц), 143,7 (с), 142,8 (дд, J=227, 14 Гц), 136,4 (д, J=13 Гц), 128,6 (д, J=3 Гц), 125,9 (с), 125,5 (д, J=4 Гц), 122,9 (дд, J=14, 4 Гц), 113,0 (д, J=3 Гц), 61,6 (д, J=4 Гц), 52,7 (с). Аналіз вир. для C14H10Cl2F2N2О3: C, 46,30; H, 2,78; N, 7,71. Знайдено: C, 46,60; H, 2,68; N, 7,51. Приклад 6b 3-Хлор-4,5,6-трифторпіколінонітрил Використали трубчастий реактор, що складається з вертикальної трубки Hastelloy-C-276 із зоною змішування (довжина = 48,26 сантиметрів (см), ID=1,58 см, Т=290 °C) і реакційною зоною, що нагрівається окремо, довжина = 24,13 см, ID=1,58 см, Т=550 °C). До вихідного отвору трубчастого реактора приєднували зону випаровування, що нагрівається (180 °C), що складається з 4-футової секції труби з 1/8-дюймової нержавіючої сталі. Безпосередньо в зону змішування відмірювали газоподібний хлор (5 об. % Cl2 в N2) з швидкістю 101 мл/хв. 4,5,6Трифторпіколінонітрил (1,013 г, 79 %, зважений в твердому стані в гексані), розчиняли в чьотирьохлористому вуглеці (39,2 г). Даний розчин відмірювали за допомогою насоса Гілсона з швидкістю 0,1 мл/хв. в зону випарювання, щоб гарантувати наявність реагентів в газовій фазі до їх змішування з газоподібним хлором в зоні змішування. Конденсат з вихідного потоку реактора збирали в резервуар-пастку, яку встановлювали приблизно на 6 дюймів нижче реакційної зони. Рідку реакційну суміш вивантажували з резервуара-пастки після завершення реакції. Зразок аналізували методами ГХ, ЯМР-спектроскопії і ГХ-МС. За даними ГХ-аналізу (система Agilent 6890, колонка: 15 м × 0,32 мм J&W DB-5, 0,25 мкм; програма температури: 80 °C витримували 2 хв., лінійне зростання 20°/хв. до 280 °C, витримували 5 хв.), співвідношення площ піків вихідної речовини (4,5,6-трифторпіколінонітрилу) і продукту (3-хлор-4,5,6-трифторпіколінонітрилу) 13 становило приблизно 1:1,4. За результатами кількісного ЯМР С, вихідна речовина (4,5,6трифторпіколінонітрил) і продукт (3-хлор-4,5,6-трифторпіколінонітрил) були основними компонентами суміші. Молярне співвідношення вихідної речовини і продукту становило приблизно 1,0:1,8. Дані ГХ-МС підтверджували ідентичність продукту з 3-хлор-4,5,6трифторпіколінонітрилом. Вихід продукту хлорування (3-хлор-4,5,6-трифторпіколінонітрилу) істотно зростав, коли суміш з описаної вище реакції вміщували в реакційну систему ще один раз. Застосування хлорування в два прийоми приводило до підвищеної конверсії з співвідношенням продукту (3хлор-4,5,6-трифторпіколінонітрилу) і вихідної речовини (4,5,6-трифторпіколінонітрилу), що складає 2,5:1,0. Приклад 6с Метил 4-аміно-6-(4-хлорфеніл)-5-фтор-3-йодпіколінат 18 UA 109806 C2 5 10 15 У круглодонну колбу на 250 мл вміщували метил 4-аміно-6-(4-хлорфеніл)-5-фторпіколінат (25 г, 0,08906 моль), йод (18 г, 0,07125 моль) і йодну кислоту (H 5IO6, 7,3 г, 0,03206 моль). Додавали СН3ОН (100 мл). Реакційну суміш перемішували при кипінні протягом 16 год. Реакційну суміш концентрували у вакуумі, а потім розчиняли в Et 2O (500 мл). Ефірний розчин промивали 10 %-ним тіосульфатом натрію (3×100 мл), водою (3×100 мл), а потім насиченим розчином солі. Органічні екстракти сушили над безводним Na 2SO4, фільтрували і концентрували у вакуумі, отримуючи тверду речовину оранжевого кольору. Внаслідок кристалізації з суміші EtOAc-гексан (3:7) отримували тверду речовину ясно-оранжевого кольору 1 (30,5 г, 83 %): т.пл. 113,7-115,2 °C. H ЯМР (400 MГц, ДМСО-d6) δ 7,84 (д, J=8,4 Гц, 2H), 7,55 (д, 13 J=8,4 Гц, 2H), 6,73 (ушир.с, 2H), 3,87 (с, 3H); C ЯМР (100 MГц, ДМСО-d6) δ 167,50, 151,48 (д, JFC=5 Гц), 145,95 (д, JF-C=13 Гц), 144,05 (д, JF-C=257 Гц), 140,75 (д, JF-C=9 Гц), 134,56, 133,42 (д, JF19 F ЯМР (376,5 MГц, C=5 Гц), 130,63 (д, JF-C=6 Гц), 129,02, 112,44 (д, JF-C=5 Гц), 77,52, 53,05; + ДМСО-d6) δ -140,62; ESIMS m/z 407 ([M] ). Аналіз вир. для C13H9ClFIN2O2: C, 38,40; H, 2,23; N, 6,89. Знайдено: C, 38,40; H, 2,31; N, 6,85. ФОРМУЛА ВИНАХОДУ 1. Спосіб отримання 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули І: NH2 F W OR1 R N O 20 25 ,I в якій W являє собою Сl, Вr або І; R являє собою С1-С4алкіл, циклопропіл, С2-С4алкеніл або феніл, що містить від 1 до 4 замісників, незалежно вибраних з галогену, С1-С4алкілу, С1-С4галогеналкілу, С1-С4алкокси або С1-С4галогеналкокси; а 1 R являє собою С1-С12алкіл або незаміщений або заміщений С7-С11арилалкіл; який включає наступні стадії: а) фторування 4,5,6-трихлорпіколінонітрилу (формула А) Cl Cl 30 Cl N CN , A джерелом фторид-іону, з отриманням 4,5,6-трифторпіколінонітрилу (формула В) F F F N CN ,B 19 UA 109806 C2 b) амінування 4,5,6-трифторпіколінонітрилу (формула В) аміаком, з отриманням 4-аміно-5,6дифторпіколінонітрилу (формула С) NH2 F F 5 N CN ,C с) гідроліз нітрильного замісника і заміщення фтор-замісника в 6-положенні 4-аміно-5,6дифторпіколінонітрилу (формула С) на йод-, бром- або хлор-замісник обробкою джерелом йоду, брому або хлору, з отриманням 4-аміно-5-фтор-6-галогенпіколінаміду формули D: NH2 F X NH2 N O 10 ,D в якій X являє собою Сl, Вr або І; 1 d) етерифікацію 4-аміно-5-фтор-6-галогенпіколінаміду формули D дією спирту (R OH) і кислоти Бренстеда або Льюїса, з отриманням 4-аміно-5-фтор-6-галогенпіколінату формули Ε: NH2 F OR1 X N O ,E в якій R являє собою С1-С12алкіл або незаміщений або заміщений С7-С11арилалкіл; e) галогенування 4-аміно-5-фтор-6-галогенпіколінату формули Ε джерелом галогену, з отриманням 4-аміно-5-фтор-3,6-дигалогенпіколінату формули F: 1 15 NH2 F W OR1 X N O 20 25 ,F в якій W і X незалежно являють собою Сl, Вr або І, 1 a R такий, як визначено раніше, і f) поєднання 4-аміно-5-фтор-3,6-дигалогенпіколінату формули F з арил-, алкіл- або алкенілметалоорганічною сполукою формули G: R-Met, G в якій R такий, як визначено раніше, a Met являє собою Zn-галогенід, Zn-R, три(С12 3 2 3 С4алкіл)олово, мідь або B(OR )(OR ), де R і R , незалежно один від одного, являють собою водень, С1-С4алкіл, або, взяті разом, утворюють етиленову або пропіленову групу, в присутності каталізатора на основі перехідного металу, з отриманням 4-аміно-3-галоген-5-фтор-6(заміщеного)піколінату формули І. 2. Спосіб отримання 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули І 20 UA 109806 C2 NH2 F W OR1 R N O 5 10 ,I в якій W являє собою Сl, Вr або І; R являє собою С1-С4алкіл, циклопропіл, С2-С4алкеніл або феніл, що містить від 1 до 4 замісників, незалежно вибраних з галогену, С1-С4алкілу, С1-С4галогеналкілу, С1-С4алкокси або С1-С4галогеналкокси; а 1 R являє собою С1-С12алкіл або незаміщений або заміщений С7-С11арилалкіл; який включає наступні стадії: а) фторування 4,5,6-трихлорпіколінонітрилу (формула А) Cl Cl Cl N CN , A джерелом фторид-іону, з отриманням 4,5,6-трифторпіколінонітрилу (формула В) F F F N CN ,B 15 b) амінування 4,5,6-трифторпіколінонітрилу (формула В) аміаком, з отриманням 4-аміно-5,6дифторпіколінонітрилу (формула С) NH2 F F 20 N CN ,C с) гідроліз нітрильного замісника і заміщення фтор-замісника в 6-положенні 4-аміно-5,6дифторпіколінонітрилу (формула С) на йод-, бром- або хлор-замісник обробкою джерелом йоду, брому або хлору, з отриманням 4-аміно-5-фтор-6-галогенпіколінаміду формули D: NH2 F X NH2 N O 25 ,D в якій X являє собою Сl, Вr або І; 1 d) етерифікацію 4-аміно-5-фтор-6-галогенпіколінаміду формули D дією спирту (R OH) і кислоти Бренстеда або Льюїса, з отриманням 4-аміно-5-фтор-6-галогенпіколінату формули Ε: 21 UA 109806 C2 NH2 F OR1 X N O 5 10 ,E в якій X являє собою Сl, Вr або І; а 1 R являє собою С1-С12алкіл або незаміщений або заміщений С7-С11арилалкіл; е) поєднання 4-аміно-5-фтор-6-галогенпіколінату формули E з арил-, алкіл- або алкенілметалоорганічною сполукою формули G: R-Met, G в якій R такий, як визначено раніше, a Met являє собою Zn-галогенід, Zn-R, три(С12 3 2 3 С4алкіл)олово, мідь або B(OR )(OR ), де R і R , незалежно один від одного, являють собою водень, С1-С4алкіл, або, взяті разом, утворюють етиленову або пропіленову групу, в присутності каталізатора на основі перехідного металу, з отриманням 4-аміно-5-фтор-6(заміщеного)піколінату формули Η: NH2 F OR1 R 15 N O ,H 1 в якій R і R такі, як визначено раніше; і f) галогенування 4-аміно-5-фтор-6-(заміщеного)піколінату формули Η джерелом галогену, з отриманням 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули І. 3. Спосіб отримання 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули І: NH2 F W OR1 R N O 20 25 ,I в якій W являє собою Сl, Вr або І; R являє собою С1-С4алкіл, циклопропіл, С2-С4алкеніл або феніл, що містить від 1 до 4 замісників, незалежно вибраних з галогену, С1-С4алкілу, С1-С4галогеналкілу, С1-С4алкокси або С1-С4галогеналкокси; а 1 R являє собою С1-С12алкіл або незаміщений або заміщений С7-С11арилалкіл; який включає наступні стадії: а) поєднання 4,5,6-трихлорпіколінонітрилу формули А Cl Cl Cl 30 N CN ,A з арил-, алкіл- або алкенілметалоорганічною сполукою формули G: R-Met, G в якій R такий, як визначено раніше, a Met являє собою Zn-галогенід, Zn-R, три(С12 3 2 3 С4алкіл)олово, мідь або B(OR )(OR ), де R і R , незалежно один від одного, являють собою 22 UA 109806 C2 водень, С1-С4алкіл, або, взяті разом, утворюють етиленову або пропіленову групу, в присутності каталізатора на основі перехідного металу, з отриманням 4,5-дихлор-6(заміщеного)піколінонітрилу формули J: Cl Cl R 5 N CN ,J в якій R такий, як визначено раніше; b) фторування 4,5-дихлор-6-(заміщеного)піколінонітрилу формули J джерелом фторид-іону, з отриманням 4,5-дифтор-6-(заміщеного)піколінонітрилу формули K: F F R 10 N CN ,K в якій R такий, як визначено раніше; с) амінування 4,5-дифтор-6-(заміщеного)піколінонітрилу формули K аміаком, з отриманням 4аміно-5-фтор-6-(заміщеного)піколінонітрилу формули L: NH2 F R 15 N CN ,L в якій R такий, як визначено раніше; d) гідроліз 4-аміно-5-фтор-6-(заміщеного)піколінонітрилу формули L під дією кислоти, з отриманням 4-аміно-5-фтор-6-(заміщеного)піколінаміду формули Μ: NH2 F R 20 NH2 N O ,M в якій R такий, як визначено раніше; 1 e) етерифікацію 4-аміно-5-фтор-6-(заміщеного)піколінаміду формули Μ дією спирту (R OH) і кислоти Бренстеда або Льюїса, з отриманням 4-аміно-5-фтор-6-(заміщеного)піколінату формули N: NH2 F OR1 R N O ,N в якій R і R такі, як визначено раніше; і f) галогенування 4-аміно-5-фтор-6-(заміщеного)піколінату формули N джерелом галогену, з отриманням 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули І. 4. Спосіб отримання 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули І: 1 25 23 UA 109806 C2 NH2 F W OR1 R N O 5 10 ,I в якій W являє собою Сl, Вr або І; R являє собою С1-С4алкіл, циклопропіл, С2-С4алкеніл або феніл, що містить від 1 до 4 замісників, незалежно вибраних з галогену, С1-С4алкілу, С1-С4галогеналкілу, С1-С4алкокси або С1-С4галогеналкокси; а 1 R являє собою С1-С12алкіл або незаміщений або заміщений С7-С11арилалкіл; який включає наступні стадії: а) фторування 4,5,6-трихлорпіколінонітрилу (формула А) Cl Cl Cl N CN , A джерелом фторид-іону, з отриманням 4,5,6-трифторпіколінонітрилу (формула В) F F F N CN ,B 15 b) галогенування 4,5,6-трифторпіколінонітрилу (формула В) джерелом галогену, з отриманням 4,5,6-трифтор-3-галогенпіколінонітрилу формули О: F F F 20 W N CN ,O в якій W являє собою Сl, Вr або І; с) амінування 4,5,6-трифтор-3-галогенпіколінонітрилу формули О аміаком, з отриманням 4аміно-5,6-дифтор-3-галогенпіколінонітрилу формули Ρ: NH2 F F 25 W N CN ,P в якій W являє собою Сl, Вr або І; d) гідроліз нітрильного замісника і заміщення фтор-замісника в 6-положенні 4-аміно-5,6-дифтор3-галогенпіколінонітрилу формули Ρ на йод-, бром- або хлор-замісник шляхом обробки 24 UA 109806 C2 джерелом йоду, брому або хлору, з отриманням 4-аміно-5-фтор-3,6-дигалогенпіколінаміду формули Q: NH2 F X 5 W NH2 N O ,Q в якій W і X незалежно являють собою Сl, Вr або І; 1 e) етерифікацію 4-аміно-5-фтор-3,6-дигалогенпіколінаміду формули Q дією спирту (R OH) і кислоти Бренстеда або Льюїса, з отриманням 4-аміно-5-фтор-3,6-дигалогенпіколінату формули F: NH2 F X W OR1 N O 10 15 20 ,F в якій W і X незалежно являють собою Сl, Вr або І; а 1 R являє собою С1-С12алкіл або незаміщений або заміщений С7-С11арилалкіл; і f) поєднання 4-аміно-5-фтор-3,6-дигалогенпіколінату формули F з арил-, алкіл- або алкенілметалоорганічною сполукою формули G: R-Met, G в якій R такий, як визначено раніше, a Met являє собою Zn-галогенід, Zn-R, три(С12 3 2 3 С4алкіл)олово, мідь або B(OR )(OR ), де R і R , незалежно один від одного, являють собою водень, С1-С4алкіл, або, взяті разом, утворюють етиленову або пропіленову групу, в присутності каталізатора на основі перехідного металу, з отриманням 4-аміно-5-фтор-3-галоген-6(заміщеного)піколінату формули І. 5. Сполука, яка представлена формулою: NH2 Y1 F X NH2 N O , 1 в якій X являє собою І, Вr, Сl або F, a Y являє собою Н, Сl, Вr або І. Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 25
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 4-amino-5-fluoro-3-halo-6-(substituted)picolinates
Автори англійськоюZhu, Yuanming, Whiteker, Gregory, T., Renga, James, M., Arndt, Kim, E., Roth, Gary Alan, Podhorez, David, E., West, Scott, P.
Автори російськоюЧжу Юаньмин, Уайтекер Грегори Т., Ренга Джэймс М., Арндт Ким Э., Рот Гари Алан, Подхорес Дэвид Э., Вест Скотт П.
МПК / Мітки
МПК: A01N 43/40, C07D 213/04
Мітки: 4-аміно-5-фтор-3-галоген-6-(заміщених)піколінатів, отримання, спосіб
Код посилання
<a href="https://ua.patents.su/27-109806-sposib-otrimannya-4-amino-5-ftor-3-galogen-6-zamishhenikhpikolinativ.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання 4-аміно-5-фтор-3-галоген-6-(заміщених)піколінатів</a>
Попередній патент: Спосіб вимірювання морфометричних показників інтактних ядерних еритроцитів риб
Наступний патент: Похідні піридиніл- та піразинілметилоксіарилу як інгібітори тирозинкінази селезінки (syk)
Випадковий патент: Пристрій для вимірювання густини природного газу