Похідні піридиніл- та піразинілметилоксіарилу як інгібітори тирозинкінази селезінки (syk)
Номер патенту: 109807
Опубліковано: 12.10.2015
Автори: Ліддлі Джон, Баркер Майкл Девід, Аткінсон Френсіс Луіс, Вілсон Девід Метт'ю
Формула / Реферат
1. Сполука формули (І):
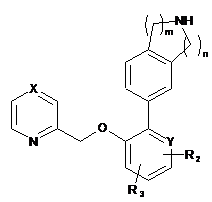 , (I)
, (I)
де:
Х - CR1 або N;
Y - СН, С або N;
R1 - гідроген, С1-6алкоксил або С1-6алкіл;
R2 - гідроген, С1-6алкоксил, галоген, -С(О)С1-6алкіл, CN, галоген-С1-6алкіл або C(O)NR4R5;
R3 - гідроген або С1-6aлкоксил;
R4 - гідроген або С1-6алкіл:
R5 - гідроген або С1-6алкіл, та
m та n - цілі числа, незалежно вибрані з 1 та 2;
або її сіль.
2. Сполука за п. 1, яка є сполукою формули (Іа):
 , (Ia)
, (Ia)
де:
X - CR1 або N;
Y - CH, С або N;
R1 - гідроген, С1-6алкоксил або С1-6алкіл;
R2 - гідроген, С1-6алкоксил, галоген або-С(O)С1-6алкіл; та
m та n - цілі числа, незалежно вибрані з 1 та 2;
або її сіль.
3. Сполука або її сіль за п. 1 або за п. 2, де X - CR1.
4. Сполука або її сіль за п. 3, де R1 - метил, метоксил або гідроген.
5. Сполука або її сіль за будь-яким із пп. 1-4, де Y - С.
6. Сполука або її сіль за будь-яким із пп. 1-5, де R2 - гідроген, етоксил або -С(О)СН3.
7. Сполука або її сіль за будь-яким із пп. 1-6, де R3 - гідроген або метоксил.
8. Сполука або її сіль за будь-яким із пп. 1-7, де m та n дорівнюють 2.
9. Сполука, вибрана з групи, що включає:
7-(3-{[(4-метил-2-піридиніл)метил]окси}-2-піридиніл)-2,3,4,5-тетрагідро-1Н-3-бензазепін;
7-(2-(метилокси)-6-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1Н-3-бензазепін;
7-(4-(метилокси)-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1Н-3-бензазепін;
1-[4-{[(4-метил-2-піридиніл)метил]окси}-3-(2,3,4,5-тетрагідро-1Н-3-бензазепін-7-іл)феніл]етанон;
1-[4-[(2-піразинілметил)окси]-3-(2,3,4,5-тетрагідро-1Н-3-бензазепін-7-іл)феніл]етанон;
7-(5-флуор-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-1,2,3,4-тетрагідроізохінолін;
7-[2-({[4-(метилокси)-2-піридиніл]метил}окси)феніл]-2,3,4,5-тетрагідро-1Н-3-бензазепін;
1-[4-[(2-піридинілметил)окси]-3-(2,3,4,5-тетрагідро-1Н-3-бензазепін-7-іл)феніл]етанон;
7-(6-метил-3-{[(4-метил-2-піридиніл)метил]окси}-2-піридиніл)-2,3,4,5-тетрагідро-1Н-3-бензазепін;
7-(5-метил-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-1,2,3,4-тетрагідроізохінолін;
7-(2-(метилокси)-6-{[(4-метил-2-піридиніл)метил]окси}феніл)-1,2,3,4-тетрагідроізохінолін;
7-(5-(етилокси-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-1,2,3,4-тетрагідроізохінолін;
7-{2-(метилокси)-6-[(2-піразинілметил)окси]феніл}-2,3,4,5-тетрагідро-1Н-3-бензазепін;
4-{[(4-метил-2-піридиніл)метил]окси}-3-(1,2,3,4-тетрагідро-7-ізохінолініл)бензонітрил;
7-[2-{[(4-метил-2-піридиніл)метил]окси}-5-(трифлуорометил)феніл]-1,2,3,4-тетрагідроізохінолін;
7-(5-(метилокси)-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-1,2,3,4-тетрагідроізохінолін;
7-(5-(1,1-диметилетил)-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-1,2,3,4-тетрагідроізохінолін;
7-{6-метил-3-[(2-піразинілметил)окси]-2-піридиніл}-2,3,4,5-тетрагідро-1Н-3-бензазепін;
7-(6-метил-3-{[(4-метил-2-піридиніл)метил]окси}-2-піридиніл)-2,3,4,5-тетрагідро-1Н-3-бензазепін;
7-{5-(метилокси)-2-[(2-піразинілметил)окси]феніл}-2,3,4,5-тетрагідро-1Н-3-бензазепін;
7-[5-(метилокси)-2-({[4-(метилокси)-2-піридиніл]метил}окси)феніл]-2,3,4,5-тетрагідро-1Н-3-бензазепін;
1-[4-({[4-(метилокси)-2-піридиніл]метил}окси)-3-(2,3,4,5-тетрагідро-1Н-3-бензазепін-7-іл)феніл]етанон;
7-[2-({[4-(метилокси)-2-піридиніл]метил}окси)феніл]-2,3,4,5-тетрагідро-1Н-3-бензазепін;
7-(5-флуоро-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1Н-3-бензазепін;
7-(5-метил-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1Н-3-бензазепін;
7-(5-(етилокси-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1Н-3-бензазепін;
7-(5-(метилокси)-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1Н-3-бензазепін;
4-{[(4-метил-2-піридиніл)метил]окси}-3-(2,3,4,5-тетрагідро-1Н-3-бензазепін-7-іл)бензонітрил;
7-[2-{[(4-метил-2-піридиніл)метил]окси}-5-(трифлуорометил)феніл]-2,3,4,5-тетрагідро-1Н-3-бензазепін;
7-(5-(1,1-диметилетил)-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1Н-3-бензазепін;
7-(3-{[(4-етил-2-піридиніл)метил]окси}-6-метил-2-піридиніл)-2,3,4,5-тетрагідро-1Н-3-бензазепін;
7-(6-(1,1-диметилетил)-3-{[(4-метил-2-піридиніл)метил]окси}-2-піридиніл)-2,3,4,5-тетрагідро-1Н-3-бензазепін;
1-[4-{[(4-етил-2-піридиніл)метил]окси}-3-(2,3,4,5-тетрагідро-1Н-3-бензазепін-7-іл)феніл]етанон;
1-[4-({[4-(етилокси-2-піридиніл]метил}окси)-3-(2,3,4,5-тетрагідро-1Н-3-бензазепін-7-іл)феніл]етанон;
7-{5-(метилокси)-2-[(2-піридинілметил)окси]феніл}-2,3,4,5-тетрагідро-1Н-3-бензазепін;
1-[4-[(2-піридинілметил)окси]-3-(1,2,3,4-тетрагідро-7-ізохінолініл)феніл]етанон;
N-мeтил-4-{[(4-мeтил-2-пipидинiл)мeтил]oкcи}-3-(2,3,4,5-тeтpaгiдpo-1H-3-бензазепін-7-іл)бензамід;
4-{[(4-метил-2-піридиніл)метил]окси}-3-(2,3,4,5-тетрагідро-1Н-3-бензазепін-7-іл)бензамід;
N,N-диметил-4-{[(4-метил-2-піридиніл)метил]окси}-3-(1,2,3,4-тетрагідро-7-ізохінолініл)бензамід;
4-{[(4-метил-2-піридиніл)метил]окси}-3-(1,2,3,4-тетрагідро-7-ізохінолініл)бензамід;
7-(2,3-біс(метилокси)-6-{[(4-метил-2-піридиніл)метил]окси}феніл)-1,2,3,4-тетрагідроізохінолін;
7-(2,3-біс(метилокси)-6-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1Н-3-бензазепін;
7-(5-хлоро-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1Н-3-бензазепін;
7-{5-хлоро-2-[(2-піридинілметил)окси]феніл}-1,2,3,4-тетрагідроізохінолін;
7-[6-метил-3-({[4-(метилокси)-2-піридиніл]метил}окси)-2-піридиніл]-2,3,4,5-тетрагідро-1Н-3-бензазепін;
7-(6-хлоро-3-{[(4-метил-2-піридиніл)метил]окси}-2-піридиніл)-2,3,4,5-тетрагідро-1Н-3-бензазепін;
7-(6-хлоро-3-{[(4-метил-2-піридиніл)метил]окси}-2-піридиніл)-1,2,3,4-тетрагідроізохінолін;
1-[4-{[(4-{[2-(метилоксі)етил]окси}-2-піридиніл)метил]окси}-3-(2,3,4,5-тетрагідро-1Н-3-бензазепін-7-іл)феніл]етанон;
1-{3-(2,3-дигідро-1Н-ізоіндол-5-іл)-4-[(2-піридинілметил)окси]феніл}етанон та
1-[4-[(2-піридинілметил)окси]-3-(1,2,3,4-тетрагідро-6-ізохінолініл)феніл]етанон;
або її сіль.
10. Сполука, вибрана з групи, що включає:
7-(3-{[(4-метил-2-піридиніл)метил]окси}-2-піридиніл)-2,3,4,5-тетрагідро-1Н-3-бензазепін;
7-(2-(метилокси)-6-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1Н-3-бензазепін;
7-(4-(метилокси)-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1Н-3-бензазепін;
1-[4-{[(4-метил-2-піридиніл)метил]окси}-3-(2,3,4,5-тетрагідро-1Н-3-бензазепін-7-іл)феніл]етанон;
1-[4-[(2-піразинілметил)окси]-3-(2,3,4,5-тетрагідро-1Н-3-бензазепін-7-іл)феніл]етанон;
7-(5-флуоро-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-1,2,3,4-тетрагідроізохінолін;
7-[2-({[4-(метилокси)-2-піридиніл]метил}окси)феніл]-2,3,4,5-тетрагідро-1Н-3-бензазепін та
1-[4-[(2-піридинілметил)окси]-3-(2,3,4,5-тетрагідро-1Н-3-бензазепін-7-іл)феніл]етанон;
або її сіль.
11. Сполука, яка є 7-(2-(метилокси)-6-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1Н-3-бензазепіном, або її сіль.
12. Сполука або її сіль за будь-яким із пп. 1-11, де сіль є фармацевтично прийнятною сіллю.
13. Фармацевтична композиція, яка містить сполуку формули (І) або її фармацевтично прийнятну сіль за п. 12 та один або більше фармацевтично прийнятних носіїв, розріджувачів або наповнювачів.
14. Фармацевтична композиція за п. 13, де композицію адаптовано для місцевого дермального застосування.
15. Композиція, яка містить сполуку формули (І) або її фармацевтично прийнятну сіль за п. 12 разом з одним або більше іншими терапевтично активними засобами.
16. Сполука формули (І) або її фармацевтично прийнятна сіль за п. 12 для застосування в терапії.
17. Сполука формули (І) або її фармацевтично прийнятна сіль за п. 12 для застосування в інгібуванні тирозинкінази селезінки.
18. Сполука або її фармацевтично прийнятна сіль за п. 12 для застосування в лікуванні аутоімунного стану.
19. Сполука або її фармацевтично прийнятна сіль для застосування за п. 18, де аутоімунний стан - хронічна ідіопатична кропив'янка з та без статусу аутоантитіла.
20. Застосування сполуки або її фармацевтично прийнятної солі за п. 12 для виготовлення медикаменту для лікування аутоімунного стану.
Текст
Реферат: Сполука формули (І) m NH n X N O Y R3 або її сіль; R2 (I) UA 109807 C2 (12) UA 109807 C2 яка є інгібітором тирозинкінази селезінки (SYK) та потенційно може застосовуватись в лікуванні хвороб, що виникають в результаті невідповідної активації тучних клітин, макрофагів та Вклітин, та стосуються запальних відповідей та пошкодження тканини, наприклад запальних хвороб та/або алергічних станів, у лікуванні раку, конкретно злоякісного новоутворення гему, та аутоімунних станів. UA 109807 C2 5 10 15 20 25 30 35 40 45 50 55 60 Заявлений винахід стосується нових хімічних сполук, які мають активність проти тирозинкінази селезінки (Syk), способів їх отримання, фармацевтично прийнятних композицій, які їх містять, та їх застосування в терапії. Syk − нерецепторна тирозинкіназа, яку залучено до зв'язування активованих імунорецепторів для прояв нижчого сигналу, які опосередковують відмінні клітинні відгуки, охоплюючи проліферацію, диференціацію та фагоцитоз. Syk широко експресовано в кровотворні клітини. Інгібітори Syk мають потенційні протизапальні та імуномделювальні активності. Вони інгібують Syk-опосередкований сигнальний IgG Fc епсилон та гама-рецептор, та BCR-рецептор, що призводить до інгібування активації тучних клітин, макрофагів та B-клітин, та пов'язаних запальних відгуків та пошкодження тканини. Тучні клітини грають головну роль в алергічних реакціях типу I та залучені до кропив'янки, бронхіальної астми, анафілаксії та інших алергічних станів. Отже, Інгібітори Syk приваблюють інтерес у численних терапевтичних областях, охоплюючи лікування наступного: ревматоїдний артрит, лімфома B-клітини, астма, риніт та шкірні розлади, як-то гостра та хронічна кропив'янка, мастоцитоз, вовчак шкіри, атопічний дерматит, автоімунні бульозні стани, охоплюючи пемфігус та пемфігоід та інші опосередковані тучною клітиною хвороби шкіри. Гостра та хронічна кропив'янка є загальними хворобами шкіри, які вражають близько 25 % загального населення США. Хоча кропив'янку можуть спонукати алергічні реакції, багато випадків мають неясну етіологію. Хронічну кропив'янку встановлено, коли широко розповсюджені пухирі наявні більше 6 тижнів. Існує багато патологічних подібностей у пацієнтів із хронічною кропив'янкою на базі об'єму пухирів на шкірі з індукованими алергеном реакціями дегрануляції тучної та базофільної клітини через активацію IgE. Близько 40 % пацієнтів із хронічною кропив'янкою, які містять у собі авто-антитіла IgG сироватки, які націлено на IgE або рецептор IgE (епсилон-рецептор Fc), та існує міркування, щодо залучення гістаміну та іншого посередника вивільнення через тучну та базофільну дегрануляцію. Інгібіторам Syk слід інгібувати відгук, створений IgE, опосередкований активацією Епсилон Fc, та інгібувати секрецію медіатору, відому як така, що пов'язана із хронічною сверблячкою в множинних хворобах. Мастоцитоз шкіри визначено як надмірну акумуляцію тучних клітин у шкірі, звичайно спостережену в дитячого та дорослого населення. Це − рідкісна хвороба, обумовлена дерегулюванням проліферативної здатності тучних клітин. Надмірне продукування тучних клітин у шкірі призводить до збільшеної секреції цитокінів та гістамінів, що призводить до сверблячки, вражень шкіри, та в деяких випадках, де є системне залучення, до анафілактичного шоку або зниженого тиску. Вовчак шкіри є станом шкіри, знайденим у деяких пацієнтів із дискоїдною формою червоного вовчаку. Розлад охарактеризовано підвищеним червоним висипом на обличчі або шкірі голови та інших областях тіла, та відомо, що тучні клітини та відкладення антитіла охоплено в ураженнях. Інгібітор Syk, нанесений місцево, повинен зменшувати продукування цитокінів, гістамінів та інших медіаторів, що потенційно призводить до зменшення свербежу та запальної інфільтрації в шкірі. Атопічний дерматит є дуже загальним та інколи довготривалим запальним розладом шкіри, охарактеризованим почервонінням та свербежем. Хворобу, яка часто трапляється з іншими алергічними станами, як-то сінна гарячка або астма, знайдено переважно в юних дітей, та її загострено контактом з алергенами. Зрозуміло, що залучення тучної клітини призводить до характерного свербежу та надмірного дряпання, яке може призводити до збільшення бактеріальних інфекцій у шкірі. Місцеве застосування інгібітору Syk могло б зменшити ці симптоми. Автоімунні бульозні стани, охоплюючи пемфігус та пемфігоід, є гострими та хронічними хворобами шкіри, які охоплюють утворення пухирів. Бульозний пемфігоід (BP) є хронічним, автоімунним, субепідермальним, пухирчатим розладом шкіри (не таким, як пемфігус, де пухирчатість є інтраепідермальною). Ці рідкісні хвороби звичайно вражають людей віком понад 70. Автоантитіла генеровано проти базових шарів мембрани шкіри, що призводить до активації комплементу та інших запальних медіаторів. Запальні процеси ініціюють вивільнення ферментів, які порушують білки в гемідесмосомальних шарах, що, зрештою, призводить до пухирів як нашарувань порушеної шкіри. Уртикарний висип та свербіж звичайно виникає до появи пухирів, отже, інгібування дегрануляції тучної клітини та продукування цитокіну після активації антитіла IgG в макрофагах інгібітором Syk може бути цілющим при цих хворобах. Ревматоїдний артрит (RA) є автоімунною хворобою, яка вражає, приблизно, 1 % населення. Відмітною ознакою є запалення суглобових зчленувань, що призводить до деструкції кістки та хряща. Сучасні клінічні дослідження з ритуксимабом, який спричиняє зворотне виснаження B 1 UA 109807 C2 5 10 15 20 25 30 35 40 45 50 55 60 клітин, (J.C.W. Edwards et al 2004, New Eng. J. Med. 350: 2572-2581), показали, що цільовою функцією B-клітин є відповідна терапевтична стратегія при автоімунних хворобах, як-то RA. Клінічна перевага корелює зі зменшенням автореактивних антитіл (або ревматоідним фактором), та ці дослідження означають, що функція B-клітин та продукування автоантитіла дійсно є центральною щодо діючої у хворобі патології Дослідження, у яких застосовано клітини мишей із недостатньою Syk, показали незайву роль цієї кінази у функції B-клітини. Недостатність Syk охарактеризовано блокадою розвитку Bклітини (M. Turner et al 1995 Nature 379: 298-302 та Cheng et al 1995, Nature 378: 303-306). Ці дослідження, разом із дослідженнями недостатності зрілих B-клітин у Syk (Kurasaki et al 2000, Immunol. Rev. 176:19-29), показали, що Syk є необхідною для диференціації та активації Bклітин. Отже, інгібування Syk в RA-пацієнтів є вірогідним для блокади функції B-клітини, та, отже, це зменшує продукування ревматоідного фактору. Додатковою до ролі Syk у функції Bклітини щодо важливості лікування RA, є потреба активності Syk у сигнальному рецепторі Fc (FcR). Уважають, що активація FcR імунними комплексами в RA сприяє вивільненню множинних прозапальних медіаторів. Внесок залежних від Syk процесів до патології RA розглянуто Wong et al (2004, ibid). Опубліковано результати 12-тижневої перевірки клінічного дослідження інгібітору Syk R788 (динатрієвий фостаматиніб, Rigel): Лікування ревматоїдного артриту інгібітором Syk: дванадцяти-тижневе, рандомізоване, контрольоване плацебо випробовування, Arthritis & Rheumatis, 58(11), 2008, 3309-3318. Інгібітори Syk також можуть бути корисними в лікуванні раку, конкретно злоякісностей гему, конкретно неходжкінових лімфом, охоплюючи фолікулярні лімфоми (FL), клітини тканини, лімфоми Burkitt та великої дифузної B-клітини (DLBCL). Дослідження показало, що Syk дерегульовано надекспресією та/або складною активацією в різновидах первісних пухлин B-лімфоми та також у лініях клітини B-лімфоми. Syk, через шляхи PI3K / AKT, шляхи PLD та незалежний сигнальний AKT, активує mTOR (ссавцеву мішень рапаміцину), яка у свою чергу збільшує виживання B-клітин та проліферацію. Інгібування Syk in vitro має результатом зменшення активації mTOR та зниження стану клонуса в клітинах FL. Інгібування Syk циркуміном лімфоми B (BKS-2) у моделі на мишах дало значне зменшення важкості пухлини, що визначено загальною кількістю спленоциту. (Leseux L. et al. Blood 15 Dec 2006, Vol 108, No 13 pp 4156-4162 та Gururajan M. et al. Journal of Immunology, 2007, 178 pp 111121). Результати клінічного дослідження Phase 2 R788 (двонатрієвого фостаматинібу) у пацієнтів із рецидивною або важко виліковною неходжкіновою лімфомою B-клітини (NHL) показали, що пацієнти добре витримували сполуку, а також показали терапевтичну перевагу для пацієнтів, які потерпають від великої дифузної лімфоми B-клітини (DLBCL) та хронічної лимфоцитарної лейкемії/малої лимфоцитарної лімфоми (CLL/SLL). Незважаючи на факт, що пацієнти, які приймали участь у цьому випробовуванні, мали розвинуту хворобу та мали невдале лікування ліками, які є в продажу, значна їх кількість була чутливою конкретно до інгібування Syk за допомогою R788 (Chen et al Blood 2008 Vol 111 pp 2230-2237, www.Rigel.com). Інгібітори Syk також можуть бути корисними в лікуванні астми та алергічного риніту, бо вони є важливими в перетворенні нижчих клітинних сигналів, асоційованих із перехресно-зв'язаним FcεR1 та або рецепторами FcγR1, та Syk є завчасно розташованою в сигнальному каскаді. Наприклад, у тучних клітинах рання послідовність FcεR1, яка сигналізує про наступне поперечне зв'язування алергену комплексів рецептору-IgE, залучає спочатку Lyn (тирозинкіназу Src-сімейства), а потім − Syk. Алергічний риніт та астма є хворобами, пов'язаними з алергічними реакціями та запальними наслідками, які охоплюють велику кількість типів клітин, охоплюючи тучні клітини, еозинофіли, T-клітини та дендритні клітини. При наступному контакті з алергеном рецептори високої спорідненості до імуноглобуліну для IgE (FcεRI) та IgG (FcγRI) стають перехресно-зв'язаними та активують розташовані нижче процеси в тучних клітинах та інших типах клітин, що призводить до вивільнення прозапальних медіаторів та спазмогенів дихальних шляхів. У тучній клітині, наприклад, перехресне зв'язування рецептора IgE алергеном призводить до вивільнення медіаторів, охоплюючи гістамін, з попередньо сформованих гранул, а також синтезу та вивільнення знову синтезованих медіаторів ліпіду, охоплюючи простагландини та лейкотриєни. Показано, що інгібітор Syk R112 (Rigel), дозований інтраназально в I/II стадії для лікування алергічного риніту, дозволяє статистично важливо зменшувати це в PGD2, ключовому імунному медіаторі, що високо корелює з покращеннями при алергічній ринореї, а також є безпечним в діапазоні показників, отже, забезпечує перший доказ клінічної безпечності та ефективності місцевого інгібітору Syk (дивись Meltzer, Eli O.; Berkowitz, Robert B.; Grossbard, Elliott B. 2 UA 109807 C2 5 10 15 20 25 30 35 40 Інтраназальний інгібітор Syk (R112) поліпшує симптоми сезонного алергічного риніту в навколишньому середовищі. Journal of Allergy та Clinical Immunology (2005), 115(4), 791-796). Однак, у подальшій II стадії клінічного випробовування щодо алергічного риніту R112 показав нестачу ефективності стосовно плацебо (Clinical Trials.gov Identifier NCT0015089). У WO 03/057695 (Boehringer Ingelheim Pharmaceuticals, Inc) описано 1,6 нафтиридини, які мають Syk-інгібіторну активність. Далі це описано в "Discovery and SAR of Novel [1,6] Naphthyridines as Potent Inhibitors of Spleen Tyrosine Kinase (SYK) (Bioorganic & Medicinal Chemistry Letters 13 (2003) 1415 – 1418). Це випливало із двох заявок на патент с більш пізньою датою, WO 2010/015518 та WO 2010/015529 (Boehringer Ingelheim Pharmaceuticals, Inc), де описано 4-диметиламіно-феніл-заміщені нафтиридини та заміщені нафтиридини, відповідно. WO 04/035604 розкриває структурні координати Syk-білку людини. Проте залишається потреба ідентифікувати подальші сполуки, які є інгібіторами Syk. На фігурі 1 показано рентгенограму дифракційних смуг XRPD (рентгенівська дифракція на порошку) для ФОРМИ 1. На фігурі 2 показано ПФ-Раман-спектр для ФОРМИ 1. На фігурі 3 показано ДСК-термограма ФОРМИ 1. На фігурі 4 показано рентгенограму дифракційних смуг XRPD для ФОРМИ 2. На фігурі 5 показано ПФ-Раман-спектр для ФОРМИ 2. На фігурі 6 показано ДСК-термограму ФОРМИ 2. Отже, в одному втіленні заявленого винаходу запропоновано сполуку формули (I): (I) де: X − CR1 або N; Y − CH, C або N; R1 − гідроген, C1-6алкоксил або C1-6алкіл; R2 − гідроген, C1-6алкоксил, галоген, -C(O)C1-6алкіл, CN, галоген-С1-6алкіл або C(O)NR4R5; R3 − гідроген або C1-6алкоксил; R4 − гідроген або C1-6алкіл: R5 − гідроген або C1-6алкіл та m та n − ціле число, незалежно вибране з 1 та 2; або її сіль. В одному втіленні винаходу запропоновано сполуку формули (Ia); (Ia) де: X − CR1 або N; Y − CH, C або N; R1 − гідроген, C1-6алкоксил або C1-6алкіл; R2 − гідроген, C1-6алкоксил, галоген або -C(O)C1-6алкіл; та m та n − ціле число, незалежно вибране з 1 та 2; або її сіль. В одному втіленні X − CR1 або N. У ще одному втіленні X − CR1. 3 UA 109807 C2 5 10 15 20 25 30 35 40 45 50 55 60 В одному втіленні Y − CH, C або N. У ще одному втіленні Y − CH. У ще одному втіленні Y − C. У подальшому втіленні Y − N. В одному втіленні R1 − гідроген, C1-6алкоксил або C1-6алкіл. У ще одному втіленні R1− метил, метоксил або гідроген. В одному втіленні R2 − гідроген, C1-6алкоксил, галоген, -C(O)C1-6алкіл, CN, галоген-С1-6алкіл або C(O)NR4R5. В одному втіленні R2 − гідроген, C1-6алкоксил, галоген або -C(O)C1-6алкіл. У ще одному втіленні R2 − гідроген, метоксил, флуор, -C(O)CH3 або трифлуорметил. У ще одному втіленні R2 − гідроген, метоксил, флуор або -C(O)CH3. У подальшому втіленні R2 − гідроген, метоксил або -C(O)CH3. В одному втіленні R3 − гідроген або C1-6алкоксил. В одному втіленні R3 − гідроген, або метоксил. В одному втіленні R4 − гідроген або C1-6алкіл. У ще одному втіленні R4 − гідроген або C14алкіл. У подальшому втіленні R4 − гідроген або метил. В одному втіленні R5 − гідроген або C1-6алкіл. У ще одному втіленні R5 − гідроген або C14алкіл. У подальшому втіленні R5 − гідроген або метил. В одному втіленні m та n − ціле число, незалежно вибране з 1 та 2. У ще одному втіленні m дорівнює 2 та n дорівнює 1 або 2. У ще одному втіленні n дорівнює 1 та m дорівнює 1 або 2. У подальшому втіленні m та n дорівнюють 2. В одному втіленні X − CR1, та R1− метил. У ще одному втіленні X − CR1, R1− метил та Y − C. У подальшому втіленні, X − CR1, R1− метил, Y − C та R2 − метоксил. Ще в подальшому втіленні, X − CR1, R1− метил, Y − C, R2 − метоксил та R3 − гідроген. Ще в подальшому втіленні X − CR1, R1− метил, Y − C, R2 −метоксил, R3 − гідроген, m дорівнює 2 та n дорівнює 2. В одному втіленні сполуку формули (I) вибрано з наступного: 7-(3-{[(4-метил-2-піридиніл)метил]окси}-2-піридиніл)-2,3,4,5-тетрагідро-1H-3-бензазепін; 7-(2-(метилокси)-6-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1H-3бензазепін; 7-(4-(метилокси)-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1H-3бензазепін; 1-[4-{[(4-метил-2-піридиніл)метил]окси}-3-(2,3,4,5-тетрагідро-1H-3-бензазепін-7іл)феніл]етанон; 7-(6-метил-3-{[(4-метил-2-піридиніл)метил]окси}-2-піридиніл)-2,3,4,5-тетрагідро-1H-3бензазепін; 1-[4-[(2-піразинілметил)окси]-3-(2,3,4,5-тетрагідро-1H-3-бензазепін-7-іл)феніл]етанон; 7-(5-флуор-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-1,2,3,4-тетрагідроізохінолін; 7-(5-метил-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-1,2,3,4-тетрагідроізохінолін; 7-(2-(метилокси)-6-{[(4-метил-2-піридиніл)метил]окси}феніл)-1,2,3,4-тетрагідроізохінолін; 7-(5-(етилокси-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-1,2,3,4-тетрагідроізохінолін; 7-(4-(метилокси)-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-1,2,3,4-тетрагідроізохінолін; 4-{[(4-метил-2-піридиніл)метил]окси}-3-(1,2,3,4-тетрагідро-7-ізохінолініл)бензонітрил; 7-[2-{[(4-метил-2-піридиніл)метил]окси}-5-(трифлуорметил)феніл]-1,2,3,4тетрагідроізохінолін; 7-(5-(метилокси)-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-1,2,3,4-тетрагідроізохінолін; 7-(5-(1,1-диметилетил)-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-1,2,3,4тетрагідроізохінолін; N-метил-4-{[(4-метил-2-піридиніл)метил]окси}-3-(2,3,4,5-тетрагідро-1H-3-бензазепін-7іл)бензамід; 4-{[(4-метил-2-піридиніл)метил]окси}-3-(2,3,4,5-тетрагідро-1H-3-бензазепін-7-іл)бензамід; N, N-диметил-4-{[(4-метил-2-піридиніл)метил]окси}-3-(1,2,3,4-тетрагідро-7ізохінолініл)бензамід; 4-{[(4-метил-2-піридиніл)метил]окси}-3-(1,2,3,4-тетрагідро-7-ізохінолініл)бензамід; 7-(2,3-біс(метилокси)-6-{[(4-метил-2-піридиніл)метил]окси}феніл)-1,2,3,4-тетрагідроізохінолін; 7-(2,3-біс(метилокси)-6-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1H-3бензазепін; 7-[2-({[4-(метилокси)-2-піридиніл]метил}окси)феніл]-2,3,4,5-тетрагідро-1H-3-бензазепін; 1-[4-[(2-піридинілметил)окси]-3-(2,3,4,5-тетрагідро-1H-3-бензазепін-7-іл)феніл]етанон, трифлуорацетат; 7-{6-метил-3-[(2-піразинілметил)окси]-2-піридиніл}-2,3,4,5-тетрагідро-1H-3-бензазепін, трифлуорацетат; 7-(6-метил-3-{[(4-метил-2-піридиніл)метил]окси}-2-піридиніл)-2,3,4,5-тетрагідро-1H-3бензазепін, трифлуорацетат; 4 UA 109807 C2 5 10 15 20 25 30 35 40 45 50 55 60 7-{5-(метилокси)-2-[(2-піразинілметил)окси]феніл}-2,3,4,5-тетрагідро-1H-3-бензазепін, трифлуорацетат; 7-[5-(метилокси)-2-({[4-(метилокси)-2-піридиніл]метил}окси)феніл]-2,3,4,5-тетрагідро-1H-3бензазепін; 7-(5-(метилокси)-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1H-3бензазепін, трифлуорацетат; 1-[4-({[4-(метилокси)-2-піридиніл]метил}окси)-3-(2,3,4,5-тетрагідро-1H-3-бензазепін-7іл)феніл]етанон; 1-[4-{[(4-метил-2-піридиніл)метил]окси}-3-(2,3,4,5-тетрагідро-1H-3-бензазепін-7іл)феніл]етанон, трифлуорацетат; 7-[2-({[4-(метилокси)-2-піридиніл]метил}окси)феніл]-2,3,4,5-тетрагідро-1H-3-бензазепін, трифлуорацетат; 1,1-диметилетил 7-[6-метил-3-({[4-(метилокси)-2-піридиніл]метил}окси)-2-піридиніл]-1,2,4,5тетрагідро-3H-3-бензазепін-3-кабоксилат; 7-(5-флуор-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1H-3-бензазепін; 7-(5-метил-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1H-3-бензазепін; 7-(5-(етилокси-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1H-3бензазепін; 7-(5-(метилокси)-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1H-3бензазепін; 4-{[(4-метил-2-піридиніл)метил]окси}-3-(2,3,4,5-тетрагідро-1H-3-бензазепін-7-іл)бензонітрил 7-[2-{[(4-метил-2-піридиніл)метил]окси}-5-(трифлуорметил)феніл]-2,3,4,5-тетрагідро-1H-3бензазепін; 7-(5-(1,1-диметилетил)-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1H-3бензазепін; 7-(5-хлор-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1H-3-бензазепін; 7-(3-{[(4-етил-2-піридиніл)метил]окси}-6-метил-2-піридиніл)-2,3,4,5-тетрагідро-1H-3бензазепін 7-(6-(1,1-диметилетил)-3-{[(4-метил-2-піридиніл)метил]окси}-2-піридиніл)-2,3,4,5-тетрагідро1H-3-бензазепін; 1-[4-{[(4-етил-2-піридиніл)метил]окси}-3-(2,3,4,5-тетрагідро-1H-3-бензазепін-7іл)феніл]етанон; 1-[4-({[4-(етилокси-2-піридиніл]метил}окси)-3-(2,3,4,5-тетрагідро-1H-3-бензазепін-7іл)феніл]етанон; 1-[4-{[(4-{[2-(метилокси)етил]окси}-2-піридиніл)метил]окси}-3-(2,3,4,5-тетрагідро-1H-3бензазепін-7-іл)феніл]етанон; 7-{5-(метилокси)-2-[(2-піридинілметил)окси]феніл}-2,3,4,5-тетрагідро-1H-3-бензазепін; 1-[4-[(2-піридинілметил)окси]-3-(1,2,3,4-тетрагідро-7-ізохінолініл)феніл]етанон; 7-{5-хлор-2-[(2-піридинілметил)окси]феніл}-1,2,3,4-тетрагідроізохінолін; 7-(6-хлор-3-{[(4-метил-2-піридиніл)метил]окси}-2-піридиніл)-2,3,4,5-тетрагідро-1H-3бензазепін; 7-(6-хлор-3-{[(4-метил-2-піридиніл)метил]окси}-2-піридиніл)-1,2,3,4-тетрагідроізохінолін; 1,1-диметилетил 5-{5-acetyl-2-[(2-піридинілметил)окси]феніл}-1,3-дигідро-2H-ізоіндол-2кабоксилат; 1-[4-[(2-піридинілметил)окси]-3-(1,2,3,4-тетрагідро-6-ізохінолініл)феніл]етанон; та 7-{2-(метилокси)-6-[(2-піразинілметил)окси]феніл}-2,3,4,5-тетрагідро-1H-3-бензазепін, гідрогенхлорид; або її сіль. В одному втіленні сполуку формули (I) вибрано з наступного: 7-(3-{[(4-метил-2-піридиніл)метил]окси}-2-піридиніл)-2,3,4,5-тетрагідро-1H-3-бензазепін; 7-(2-(метилокси)-6-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1H-3бензазепін; 7-(4-(метилокси)-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1H-3бензазепін; 1-[4-{[(4-метил-2-піридиніл)метил]окси}-3-(2,3,4,5-тетрагідро-1H-3-бензазепін-7іл)феніл]етанон; 1-[4-[(2-піразинілметил)окси]-3-(2,3,4,5-тетрагідро-1H-3-бензазепін-7-іл)феніл]етанон; 7-(5-флуор-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-1,2,3,4-тетрагідроізохінолін; 7-[2-({[4-(метилокси)-2-піридиніл]метил}окси)феніл]-2,3,4,5-тетрагідро-1H-3-бензазепін; та 1-[4-[(2-піридинілметил)окси]-3-(2,3,4,5-тетрагідро-1H-3-бензазепін-7-іл)феніл]етанон; або її сіль. 5 UA 109807 C2 5 10 15 20 25 30 35 40 45 50 55 60 В одному втіленні сполукою формули (I) є: 7-(3-{[(4-метил-2-піридиніл)метил]окси}-2-піридиніл)-2,3,4,5-тетрагідро-1H-3-бензазепін; або її сіль. У ще одному втіленні сполукою формули (I) є: 7-(2-(метилокси)-6-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1H-3бензазепін; або її сіль. У ще одному втіленні сполукою формули (I) є: 7-(4-(метилокси)-2-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1H-3бензазепін; або її сіль. У подальшому втіленні сполукою формули (I) є: 1-[4-{[(4-метил-2-піридиніл)метил]окси}-3-(2,3,4,5-тетрагідро-1H-3-бензазепін-7іл)феніл]етанон; або її сіль. Далі слід брати до уваги, що вираз "сполука формули (I)” охоплює сполуку формули (Ia). Слід брати до уваги, що сполуки формули (I) та їх солі можуть існувати в сольватованих формах. У ще одному втіленні заявленого винаходу запропоновано сполуки формули (I) та їх солі. У ще одному втіленні заявленого винаходу запропоновано сполуки формули (I) та їх фармацевтично прийнятні солі. У ще одному втіленні заявленого винаходу запропоновано сполуки формули (I) та їх сольвати. У подальшому втіленні заявленого винаходу запропоновано сполуку формули (I) як вільну основу. Сполуки заявленого винаходу є корисними як інгібітори Syk. Як тут застосовано, термін "алкіл" стосується прямого або розгалуженого насиченого вуглеводневого ланцюгу, який містить конкретне число атомів карбону. Наприклад, C 1-6алкіл означає пряму або розгалужену групу алкілу, яка містить, принаймні, 1, та максимум 6 атомів карбону. Приклади "алкілу", які тут застосовано, охоплюють, але без обмеження, метил, етил, нпропіл, н-бутил, н-пентил, н-гексил, ізобутил, ізопропіл, т-бутил та 1,1-диметилпропіл. Як тут застосовано, термін "алкоксил" стосується прямого або розгалуженого насиченого ланцюгу алкоксилу, який містить конкретне число атомів карбону. Наприклад, C 1-6алкоксил означає пряму або розгалужену групу алкоксилу, яка містить, принаймні, 1, та максимум 6 атомів карбону. Приклади "алкоксилу", які тут застосовано, охоплюють, але без обмеження, метоксил, етоксил, пропоксил, проп-2-оксил, бутоксил, бут-2-оксил, 2-метилпроп-1-оксил, 2метилпроп-2-оксил, пентоксил або гексилоксил. Як тут застосовано, термін "гало" або, альтернативно, "галоген" стосується флуор, хлор або бром. Як тут застосовано, термін "галогеналкіл" стосується прямого або розгалуженого насиченого вуглеводневого ланцюгу, який містить конкретне число атомів карбону, заміщених атомами галогену. Наприклад, галоген-С1-6алкіл означає пряму або розгалужену групу алкілу, як містить, принаймні, 1, та максимум 6 атомів карбону, заміщених 1 − 3 атомами галогену на атом карбону. Приклади "галогеналкілу", який тут застосовано, охоплюють, але без обмеження, флуорметил, ди-флуорметил, та три-флуорметил. Як тут застосовано, термін "фармацевтично прийнятна" стосується сполук, речовин, композицій, та форм дозування, які є в межах дійсного медичного передбачення, придатних для застосування в контакті із тканинами людей та тварин без надмірної токсичності, подразнення або інших проблем, або ускладнень, розмірних відповідно співвідношенням переваги/ризику. Кваліфікованому спеціалісту зрозуміло, що фармацевтично прийнятні солі сполуки формули (I) можна отримувати. Як тут застосовано, термін "фармацевтично прийнятні солі" стосується солей, які зберігають бажану біологічну активність обговорюваної сполуки та проявляють мінімальні небажані токсикологічні дії. Ці фармацевтично прийнятні солі можна отримувати на місці протягом кінцевого виділення та очищення сполуки, або окремою реакцією очищеної сполуки у формі вільної кислоти або вільної основи із придатною основою або кислотою, відповідно. Дійсно, у деяких утіленнях винаходу фармацевтично прийнятні солі можуть бути кращими ніж відповідна вільна основа або вільна кислота, оскільки такі солі надають більшу стабільність або розчинність молекулі, що полегшує створення форми дозування. Сполуки формули (I) є лужними та, отже, звичайно здатні до створення фармацевтично прийнятних кислотно-адитивних солей обробкою придатною кислотою. Придатні кислоти охоплюють фармацевтично прийнятні неорганічні кислоти та фармацевтично прийнятні органічні кислоти. Характерні фармацевтично прийнятні кислотно-адитивні солі охоплюють 6 UA 109807 C2 5 10 15 20 25 30 35 40 45 50 55 наступне: гідрогенхлорид, гідрогенбромід, нітрат, метилнітрат, сульфат, бісульфат, сульфамат, фосфат, ацетат, гідроксиацетат, фенілацетат, пропіонат, бутират, ізобутират, валерат, малеат, гідроксималеат, акрилат, фумарат, малат, тартрат, цитрат, саліцилат, п-аміносаліцилат, гліколят, лактат, гептаноат, фталат, оксалат, сукцинат, бензоат, o-ацетоксибензоат, хлорбензоат, метилбензоат, динітробензоат, гідроксибензоат, метоксибензоат, мигдалат, танат, форміат, стеарат, аскорбат, пальмітат, олеат, піруват, памоат, малонат, лаурат, глутарат, глутамат, естолат, метансульфонат (мезилат), етансульфонат (езилат), 2гідроксиетансульфонат, бензолсульфонат (безилат), п-амінобензолсульфонат, птолуолсульфонат (тозилат), нафталін-2-сульфонат, етандисульфонат, та 2,5дигідроксибензоат, . В одному втіленні заявленого винаходу запропоновано фармацевтично прийнятну сіль сполуки формули (I), яка є сіллю гідрогенхлориду, мезилатом, фумаратом або фосфатом. В одному втіленні заявленого винаходу запропоновано фармацевтично прийнятну сіль сполуки формули (I), яка є мезилатом. Сполука формули (I) може існувати у твердій або рідинній формі. У твердому стані сполука формули (I) може існувати в кристалічній або некристалічній (аморфній) формі, або як їх суміш. Кваліфікованому спеціалісту слід розуміти, що сольвати кристалічної форми сполук формули (I), як-то фармацевтично прийнятні сольвати, можуть утворюватися там, де молекули розчиннику введено в кристалічну решітку протягом кристалізації. Сольвати можуть містити неводні розчинники, як-то, але без обмеження, етанол, ізопропанол, н-бутанол, i-бутанол, ацетон, тетрагідрофуран, діоксан, ДМСО, оцтова кислота, етаноламін, та етилацетат, або вони можуть містити воду, як розчинник, уведений у кристалічну решітку. Сольвати, де вода є розчинником, уведеним у кристалічну решітку, типово віднесено до "гідратів". Гідрати охоплюють стехіометричні гідрати а також композиції, які містять різні кількості води. Кваліфікованому спеціалісту далі слід розуміти, що сполука формули (I), яка існує в кристалічній формі, охоплюючи різні їх сольвати, може виявляти поліморфізм (тобто здатність зустрічатися в різних кристалічних структурах). Ці різні кристалічні форми типово відомі як "поліморфи." У винаході охоплено всі такі поліморфи. Поліморфи мають однакову хімічну композицію, але відрізняються компоновкою, геометричним упорядкуванням та іншими дескриптивними властивостями твердого кристалічного стану. Отже, поліморфи можуть мати відмінні фізичні властивості, як-то конфігурація, щільність, твердість, здатність до деформації, стабільність та властивості розчинення. Поліморфи типово мають різні точки плавлення, ІЧ спектр, та рентгенівські порошкові дифрактограми, які можна застосовувати для ідентифікації. Кваліфікованому спеціалісту слід розуміти, що різні поліморфи можна отримувати, наприклад, зміною або регулюванням умов реакції, або реагентів, застосованих у отриманні сполуки. Наприклад, зміни температури, тиску, або розчиннику може призводити до створення поліморфів. Крім того, у певних умовах один поліморф може спонтанно перетворюватися до іншого поліморфу. У подальшому аспекті згідно із заявленим винаходом запропоновано кристалічну форму 7(2-(метилокси)-6-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1H-3-бензазепіну (ФОРМА 1), ґрунтовно описану рентгенівською порошковою дифрактограмою (XRPD), яку показано на фігурі 1, де дифрактограму XRPD надано в термінах 2тета-кутів та отримано на дифрактометрі при застосуванні Kα-радіації міді, застосовуючи описані тут процедури. На XRPD ФОРМИ 1 показано характерні піки 2-тета-куту при 11,7, 12,7, 13,7 та 16,0. Альтернативно або додатково, ФОРМУ 1 7-(2-(метилокси)-6-{[(4-метил-2піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1H-3-бензазепіну можна охарактеризувати -1 раманівською спектроскопією, яку показано на фігурі 2, де спектр надано в термінах cm та отримано, застосовуючи процедури, які тут описано. Раманівський спектр ФОРМИ 1 має характерні піки при 2945, 2832, 1610, 1363, 994 та 784. Альтернативно або додатково, ФОРМУ 1 7-(2-(метилокси)-6-{[(4-метил-2піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1H-3-бензазепіну можна охарактеризувати термограмами диференціальної сканувальної калориметрії (ДСК), яку показано на фігурі 3, де ДСК виконували, застосовуючи описані тут процедури. У подальшому аспекті, згідно із заявленим винаходом запропоновано кристалічну форму 7(2-(метилокси)-6-{[(4-метил-2-піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1H-3-бензазепіну (ФОРМ 2), ґрунтовно описану рентгенівською порошковою дифрактограмою (XRPD), яку показано, яку показано на фігурі 4, де дифрактограму XRPD надано в термінах 2 тета-кутів та отримано на дифрактометрі при застосуванні Kα-радіації міді, застосовуючи описані тут процедури. На XRPD ФОРМИ 1 показано характерні піки 2-тета-куту при 8,9, 9,9, 13,3, 15,2, 16,7. 7 UA 109807 C2 5 10 Альтернативно або додатково, ФОРМУ 2 7-(2-(метилокси)-6-{[(4-метил-2піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1H-3-бензазепіну можна охарактеризувати -1 раманівською спектроскопією, яку показано на фігурі 5, де спектр надано в термінах cм та отримано, застосовуючи процедури, які тут описано. Раманівський спектр ФОРМИ 1 має характерні піки при 2934, 1614, 1371, 1005 та 777. Альтернативно або додатково, ФОРМУ 2 7-(2-(метилокси)-6-{[(4-метил-2піридиніл)метил]окси}феніл)-2,3,4,5-тетрагідро-1H-3-бензазепіну можна охарактеризувати термограмами диференціальної сканувальної калориметрії (ДСК), яку показано на фігурі 6, де ДСК виконували, застосовуючи описані тут процедури. Сполук формули (I) можна отримувати за схемами синтезу, описаними нижче. Схема 1: Схема 2: 15 20 де Y, R1 та R2 розкрито вище. Етап A: Калій карбонат / ДМФ Етап B: PdCl2.dppf / цезій карбонат / водн. діоксан / нагрівання; або тетракіс / натрій карбонат / водн ДМЕ / нагрівання Етап C: HCl в діоксані; або трифлуороцтова кислота в дихлорметані Схема 3: 8 UA 109807 C2 5 10 Етап A: Калій карбонат / ДМФ Етап B: Тетракіс / натрій карбонат / водн ДМЕ / нагрівання Етап C: HCl в діоксані; або трифлуороцтова кислота в дихлорметані Схема 4: Етап A: Калій карбонат / ДМФ Етап B: PdCl2.dppf / цезій карбонат / водн. діоксан / нагрівання Етап C: HCl в діоксані; або трифлуороцтова кислота в дихлорметані Схема 5: 9 UA 109807 C2 5 Етап A: Калій карбонат / ДМФ / бензил бромід Етап B: Cu(I)CN / ТГФ / трет-бутилмагній хлорид (в ТГФ) Етап C: 20 % Pd(OH)2 / H2 / EtOH Етап D: Бром / піридин Схема 6: Етап A: DEAD / PPh3 / ТГФ Схема 7: 10 15 Етап A: Амоній пероксидисульфат / конц. Сульфатна кислота / водн. метанол Схема 8: Етап A: EDC / HOBT / TEA / ДХМ / RR2NH Схема 9: Етап A: (i) ДХМ / ДМФ / оксаліл хлорид. (ii) NH 3 10 UA 109807 C2 Схема 10: 5 Етап A: хлорметил метил-етер / DIPEA / ДХМ Етап B: (i) TMEDA / трет-BuLi / Et2O (ii) Бром Етап C: Конц. хлоридна кислота / метанол Схема 11 Етап A: бром / піридин Схема 12 10 Етап A: Бром / хлорформ Схема 13 t 15 Етап A: KO Bu / ROH / 110 °C Схема 14 Альтернативний синтез щодо прикладу 2, сіль мезилату 11 UA 109807 C2 Отже, у подальшому аспекті згідно із заявленим винаходом запропоновано спосіб отримання сполуки формули (I), який полягає в реакції сполуки формули (II): (II) 5 де X, Y та R2 розкрито вище; з боро-естером або кислотою формули (III): 10 15 20 25 (III) де R6 та R7, які можуть бути такими ж або відмінними, кожна − гідроген, C 1-6алкіл, або R6 та R7 можуть бути об'єднаними для створення C 1-3алкілену, необов'язково заміщеного навіть чотирма групами метилу, наприклад, –C(Me)2C(Me)2-; P − захисна група; та m та n розкрито вище; у присутності каталізатору, в умовах, типово застосовуваних для сполучення борестеру/кислоти; та відповідно, видалення будь-якої захисної групи. Умови, типово застосовані для сполучення бор-естеру/кислоти, охоплюють застосування Pd(PPh3)4 як каталізатору із цезій карбонатом у розчиннику, як-то водн. 1,4-діоксан. TM Альтернативно умови, які можна застосовувати, охоплюють застосування PEPPSI як каталізатору з калій гідроксидом у розчиннику, як-то водн. диметоксиетан (ДМЕ) з етанолом. Приклади захисних груп та способів їх видалення можна знайти в T. W. Greene "Protective Groups in Organic Synthesis" (J. Wiley and Sons, 1991). Придатні захисні групи аміну охоплюють, але без обмеження, сульфоніл (як-то тозил), ацил (як-то бензилоксикарбоніл або тбутоксикарбоніл) та арилалкіл (як-то бензил), які можна видаляти гідролізом або гідрогенoлізом. Інші придатні захисні групи аміну охоплюють трифлуорацетил (-C(O)CF3), які можна видаляти каталізованим основою гідролізом, або групу бензилу, зв'язану в твердофазовому полімері, як 12 UA 109807 C2 5 10 15 20 25 30 35 40 45 50 55 60 то полімер-зв'язана група 2,6-диметоксибензилу Merrifield (лінкер Ellman), яку можна видаляти гідролізом, каталізованим кислотою (застосовуючи, наприклад, трифлуороцтову кислоту). В одному втіленні заявленого винаходу захисну групу (P) вибрано із третбутилоксикарбонілу "BOC" та 9-флуоренілметилоксикарбонілу "FmoC". Сполуки формули (I) є корисними як інгібітори Syk та, отже, потенційно застосовуваними в лікуванні деяких видів раку, зокрема, злоякісностей гему, а також запальних станів, як охоплюють B-клітини, і також хвороб внаслідок невідповідної активації тучної клітини, наприклад, алергічних та запальних хвороб, наприклад, тучної клітини шкіри, опосередкованих хворобами, охоплюючи наступне: гостра та хронічна кропив'янка, мастоцитоз, атопічний дерматит та автоімунні хвороби, як-то вовчак шкіри та автоімунні бульозні стани, охоплюючи пемфігус та пемфігоід. Згідно з одним аспектом заявленого винаходу запропоновано сполуку формули (I) або її фармацевтично прийнятну сіль для застосування в терапії. Згідно із ще одним аспектом заявленого винаходу запропоновано сполуку формули (I) або її фармацевтично прийнятну сіль для застосування в інгібуванні тирозинкінази селезінки (Syk). У подальшому аспекті, згідно із заявленим винаходом запропоновано спосіб, який полягає в застосуванні до суб'єкта, конкретно людини, яка цього потребує, ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі для інгібування тирозинкінази селезінки (Syk). Інгібітори Syk можуть бути корисними в лікуванні раку, конкретно злоякісності гему, конкретно лімфоми неходжкінової, охоплюючи наступні: лімфома фолікулярна (FL), лімфома клітини тканини, мала лімфоцитарна лімфома/хронічна лімфоцитарна лімфома (SLL/CLL), Burkitt та велика дифузна лімфома B-клітини (DLBCL). Інгібітори Syk також можуть бути корисними в лікуванні гострої мієлоїдної лейкемії та ретинобластоми. Згідно з одним аспектом заявленого винаходу запропоновано сполуку формули (I) або її фармацевтично прийнятну сіль для застосування в лікуванні раку, наприклад, наступного: гостра мієлоїдна лейкемія, ретинобластома, злоякісність гему, конкретно, неходжкінова лімфома, охоплюючи наступну: лімфома фолікулярна (FL), лімфома клітини тканини, мала лімфоцитарна лімфома/хронічна лімфоцитарна лімфома (SLL/CLL), Burkitt та велика дифузна лімфома B-клітини (DLBCL). Згідно із ще одним аспектом заявленого винаходу запропоновано спосіб лікування раку, наприклад, наступного: гостра мієлоїдна лейкемія, ретинобластома, злоякісність гему, конкретно неходжкінова лімфома, охоплюючи наступне: лімфома фолікулярна (FL), лімфома клітини тканини, мала лімфоцитарна лімфома/хронічна лімфоцитарна лімфома (SLL/CLL), лімфома Burkitt та велика дифузна лімфома B-клітини (DLBCL), цей спосіб полягає в застосуванні до суб'єкта, конкретно людини, яка цього потребує, терапевтично ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі. Згідно з подальшим аспектом заявленого винаходу запропоновано застосування сполуки формули (I) або її фармацевтично прийнятної солі, для виготовлення медикаменту для лікування раку, наприклад, наступного: гостра мієлоїдна лейкемія, ретинобластома, злоякісність гему, конкретно неходжкінова лімфома, охоплюючи наступну: лімфома фолікулярна (FL), лімфома клітини тканини, мала лімфоцитарна лімфома/хронічна лімфоцитарна лімфома (SLL/CLL), лімфома Burkitt та велика дифузна лімфома B-клітини (DLBCL). Сполуки формули (I) також можна застосовувати в хіміотерапії раку в композиції із засобами хіміотерапії інших типів раку, які відомі в рівні техніки. Характерними класами засобів для застосування в таких композиціях щодо неходжкінової лімфоми охоплюють наступне: ритуксимаб, BEXXAR (тоситумомаб та йод I 131 тоситумомаб) та піксантрон. Сполуки формули (I) також можна застосовувати в композиції з режимом ліків CHOP (циклофосфамід, адріаміцин, вінкристин, преднізон) або CHOP плюс ритуксимаб (CHOP+R). Сполуки формули (I) є потенційно застосовуваними в лікуванні автоімунних станів, які охоплюють активацію B-клітин та/або макрофагу, наприклад, у наступних: системний червоний вовчак (SLE), дискоїдальний (шкірний) вовчак, синдром Сьоргена, гранулематоз Вегнера та інші васкулітиди, бульозний пемфігоід і пемфігус, ідіопатична тромбоцитопенічна пурпура (ITP), артеріоз гігантської клітини, хронічна ідіопатична кропив'янка з та без статусу автоантитіла (хронічна автоімунна кропив'янка (Нові концепції в хронічній кропив'янці, Current Opinions in Immunology 2008 20:709-716)), гломерулонефрит, хронічне відторгнення трансплантату та ревматоїдний артрит. Згідно з одним аспектом заявленого винаходу запропоновано сполуку формули (I) або її фармацевтично прийнятну сіль для застосування в лікуванні автоімунного стану, наприклад, наступного: системний червоний вовчак (SLE), дискоїдальний (шкірний) вовчак, синдром 13 UA 109807 C2 5 10 15 20 25 30 35 40 45 50 55 Сьоргена, гранулематоз Вегнера та інші васкулітиди, бульозний пемфігоід та пемфігус, ідіопатична тромбоцитопенічна пурпура (ITP), артеріоз гігантської клітини, хронічна ідіопатична кропив'янка з та без статусу автоантитіла (хронічна автоімунна кропив'янка (Нові концепції в хронічній кропив'янці, Current Opinions in Immunology 2008 20:709-716)), гломерулонефрит, хронічне відторгнення трансплантату та ревматоїдний артрит. В одному втіленні заявленого винаходу запропоновано сполуку формули (I) або її фармацевтично прийнятну сіль для застосування в лікуванні автоімунного стану, яким є хронічна ідіопатична кропив'янка з та без статусу автоантитіла. У ще одному втіленні заявленого винаходу запропоновано сполуку формули (I) або її фармацевтично прийнятну сіль для застосування в лікуванні автоімунного стану, яким є дискоїдальний (шкірний) вовчак. Згідно із ще одним аспектом заявленого винаходу запропоновано спосіб лікування автоімунного стану, наприклад, наступного: системний червоний вовчак (SLE), дискоїдальний (шкірний) вовчак, синдром Сьоргена, гранулематоз Вегнера та інші васкулітиди, бульозний пемфігоід та пемфігус, ідіопатична тромбоцитопенічна пурпура (ITP), артеріоз гігантської клітини, хронічна ідіопатична кропив'янка з та без статусу автоантитіла, гломерулонефрит, хронічне відторгнення трансплантату та ревматоїдний артрит, цей спосіб полягає в застосуванні до суб'єкта, конкретно людини, яка цього потребує, терапевтично ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі. В одному втіленні заявленого винаходу запропоновано спосіб лікування автоімунної хвороби, яка є хронічною ідіопатичною кропив'янкою з та без статусу автоантитіла, цей спосіб полягає в застосуванні до суб'єкта, конкретно людини, яка цього потребує, терапевтично ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі. У ще одному втіленні заявленого винаходу запропоновано спосіб лікування автоімунної хвороби, яка є дискоїдальним (шкірним) вовчаком, цей спосіб полягає в застосуванні до суб'єкта, конкретно до людини, яка цього потребує, терапевтично ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі. У подальшому аспекті згідно із заявленим винаходом запропоновано застосування сполуки формули (I) або її фармацевтично прийнятної солі для виготовлення медикаменту для лікування автоімунного стану, наприклад, наступного: системний червоний вовчак (SLE), дискоїдальний (шкірний) вовчак, синдром Сьоргена, гранулематоз Вегнера та інші васкулітиди, бульозний пемфігоід та пемфігус, ідіопатична тромбоцитопенічна пурпура (ITP), артеріоз гігантської клітини, хронічна ідіопатична кропив'янка з та без статусу автоантитіла, гломерулонефрит, хронічне відторгнення трансплантату та ревматоїдний артрит. В одному втіленні заявленого винаходу запропоновано застосування сполуки формули (I) або її фармацевтично прийнятної солі для виготовлення медикаменту для лікування автоімунного стану, яким є хронічна ідіопатична кропив'янка з та без статусу автоантитіла. У ще одному втіленні заявленого винаходу запропоновано застосування сполуки формули (I) або її фармацевтично прийнятної солі для виготовлення медикаменту для лікування автоімунного стану, яким є дискоїдальний (шкірний) вовчак. Згідно з одним аспектом заявленого винаходу запропоновано сполуку формули (I) або її фармацевтично прийнятну сіль для застосування в лікуванні запальної хвороби, яка охоплює Bклітини. Згідно із ще одним аспектом заявленого винаходу запропоновано спосіб лікування запальної хвороби, яка охоплює B-клітини. Цей спосіб полягає в застосуванні до суб'єкта, конкретно людини, яка цього потребує, терапевтично ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі. Згідно з подальшим аспектом заявленого винаходу запропоновано застосування сполуки формули (I) або її фармацевтично прийнятної солі для виготовлення медикаменту для лікування запальної хвороби, яка охоплює B-клітини. Сполуки формули (I) є потенційно застосовуваними в лікуванні хвороби, яка є наслідком невідповідної активації тучної клітини, наприклад, алергічних та запальних хвороб, конкретно − з проявами на шкірі. Згідно з одним аспектом заявленого винаходу запропоновано сполуку формули (I) або її фармацевтично прийнятну сіль для застосування в лікуванні хвороби, пов'язаним із невідповідною активацією тучної клітини. Згідно із ще одним аспектом заявленого винаходу запропоновано спосіб лікування хвороби, пов'язаний із невідповідною активацією тучної клітини. Цей спосіб полягає в застосуванні до суб'єкта, конкретно людини, яка цього потребує, терапевтично ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі. 14 UA 109807 C2 5 10 15 20 25 30 35 40 45 50 55 60 Згідно з подальшим аспектом заявленого винаходу запропоновано застосування сполуки формули (I) або її фармацевтично прийнятної солі для виготовлення медикаменту для лікування хвороби, пов'язаної з невідповідною активацією тучної клітини. Згідно з одним аспектом заявленого винаходу запропоновано сполуку формули (I) або її фармацевтично прийнятну сіль для застосування в лікуванні запальної хвороби та/або алергічного розладу, наприклад, наступного: хронічна обструктивна легенева хвороба (COPD), синдром розладу зовнішнього подиху дорослого (ARDS), астма, тяжка астма, виразковий коліт, хвороба Крона, бронхіт, кон'юнктивіт, псоріаз, склеродерма, дерматит, алергія, риніт, вовчак шкіри, автоімунні бульозні стани, охоплюючи пемфігус та пемфігоід, мастоцитоз та анафілаксію. Згідно із ще одним аспектом заявленого винаходу запропоновано спосіб лікування запальної хвороби та/або алергічного розладу, наприклад, наступного: хронічна обструктивна легенева хвороба (COPD), синдром розладу зовнішнього подиху дорослого (ARDS), астма, тяжка астма, виразковий коліт, хвороба Крона, бронхіт, кон'юнктивіт, псоріаз, склеродерма, дерматит, алергія, риніт, вовчак шкіри, автоімунні бульозні стани, охоплюючи пемфігус та пемфігоід, мастоцитоз та анафілаксію, цей спосіб полягає в застосуванні до суб'єкта, конкретно людини, яка цього потребує, терапевтично ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі. Згідно з подальшим аспектом заявленого винаходу запропоновано застосування сполуки формули (I) або її фармацевтично прийнятної солі для виготовлення медикаменту для лікування запальної хвороби та/або алергічного розладу, наприклад, наступного: хронічна обструктивна легенева хвороба (COPD), синдром розладу зовнішнього подиху дорослого (ARDS), астма, тяжка астма, виразковий коліт, хвороба Крона, бронхіт, кон'юнктивіт, псоріаз, склеродерма, дерматит, алергія, риніт, вовчак шкіри, автоімунні бульозні стани, охоплюючи пемфігус та пемфігоід, мастоцитоз та анафілаксія. Сполуки формули (I) також можна застосовувати в композиції з іншими класами терапевтичних засобів, наприклад, вибраних із наступного: протизапальні засоби, антихолінергічні засоби (конкретно, антагоніст рецептору M1/M2/M3), агоністи 2адренорецептору, протиінфекційні засоби, як-то антибіотики або антивірусні, або антигістаминні препарати. У ще одному втіленні сполуки формули (I) можна застосовувати в композиції з іншими класами терапевтичних засобів, які відомі в рівні техніки, для лікування автоімунних хвороб, наприклад, ліки, які корегують антиревматичні хвороби, охоплюючи циклоспорин, метотрексат, сульфасалазин, преднізон, лефлуномід, та хлорквін/гідрохлорквін а також біофармацевтичні засоби, як-то пом'якшені моноклональні антитіла (mabs), наприклад, охоплюючи альфаблокатори анти-TNF, як-то ремікад, енбрел та хуміра, лікування виснаження B-клітини, як-то ритумаб та офатумумаб, та mabs анти-Blys, як-то белілумаб. Отже, згідно з винаходом запропоновано композицію, яка містить сполук формули (I) або її фармацевтично прийнятну сіль разом з одним або більше іншими терапевтично активними засобами, наприклад, вибраними з наступного: протизапальний засіб, як-то адреностероїд або NSAID, антихолінергічний засіб, агоніст 2-адренорецептору, протиінфекційний засіб, як-то антибіотик або антивірусний, антигістамінний, ліки, які корегують антиревматичну хворобу, та біофармацевтичний засіб, як-то пом'якшені моноклональні антитіла (mabs), лікування виснаження B-клітини та mabs анти-Blys. Згідно з одним утіленням винаходу охоплено композиції, які містять сполуку формули (I) або її фармацевтично прийнятну сіль разом із наступним: агоніст β2-адренорецептору, та/або антихолінергічний засіб, та/або інгібітор PDE-4, та/або антигістамінний засію, та/або ліки, які корегують антиревматичну хворобу, та/або біофармацевтичний засіб. Згідно з одним утіленням винаходу охоплено композиції, які містять один або два інші терапевтично активні засоби. Спеціалісту слід розуміти в рівні техніки, що інші придатні терапевтичні інгредієнти можна застосовувати у формі солей, наприклад як солі лужного метал або аміну, або як кислотноадитивні солі, або проліки, або як естери, наприклад естери нижчого алкілу, або як сольвати, наприклад, гідрати, для оптимізації активності та/або стабільності, та/або фізичних характеристик, як-то розчинність терапевтичного інгредієнту. Також слід розуміти, що придатні терапевтичні інгредієнти можна застосовувати в оптично чистій формі. Приклади агоністів 2-адренорецептору охоплюють салметерол (який може бути рацематом або єдиним енантіомером, як-то R-енантіомер), салбутамол (який може бути рацематом або єдиним енантіомером, як-то R-енантіомер), формотерол (який може бути рацематом або єдиним діастереомером, як-то R, R-діастереомер), салмефамол, фенотерол, кармотерол, етантерол, намінтерол, кленбутерол, пірбутерол, флербутерол, репротерол, бамбутерол, 15 UA 109807 C2 5 10 15 20 25 30 35 40 45 50 55 індакатерол, тербуталін та їх солі, наприклад ксинофоат (1-гідрокси-2-нафталінкабоксилат) сіль салметеролу, сульфатна сіль або вільна основа салбутамолу або фумаратна сіль формотеролу. В одному втіленні агоністами 2-адренорецептору є агоністи 2-адренорецептору, які діють довго, наприклад, сполуки, які надають ефективну бронходилатацію протягом, приблизно, 12 годин або довше. Інші агоністи 2-адренорецептору охоплюють описане в WO02/066422, WO02/070490, WO02/076933, WO03/024439, WO03/072539, WO03/091204, WO04/016578, WO04/022547, WO04/037807, WO04/037773, WO04/037768, WO04/039762, WO04/039766, WO01/42193 та WO03/042160. Приклади агоністів 2-адренорецептору охоплюють: 3-(4-{[6-({(2R)-2-гідрокси-2-[4-гідрокси-3-(гідроксиметил)феніл]етил}аміно)гексил] окси} бутил)бензолсульфонамід; 3-(3-{[7-({(2R)-2-гідрокси-2-[4-гідрокси-3-гідроксиметил)феніл]етил}аміно)гептил]окси}пропіл)бензолсульфонамід; 4-{(1R)-2-[(6-{2-[(2,6-дихлорбензил)окси]етокси}гексил)аміно]-1-гідроксиетил}-2(гідроксиметил)фенол; 4-{(1R)-2-[(6-{4-[3-(цтклопентилсульфоніл)феніл]бутокси}гексил)аміно]-1-гідроксиетил}-2(гідроксиметил)фенол; N-[2-гідроксил-5-[(1R)-1-гідрокси-2-[[2-4-[[(2R)-2-гідрокси-2фенілетил]аміно]феніл]етил]аміно]етил]феніл]формамід; N-2{2-[4-(3-феніл-4-метоксифеніл)амінофеніл]етил}-2-гідрокси-2-(8-гідрокси-2(1H)-хінолінон5-іл)етиламін; та 5-[(R)-2-(2-{4-[4-(2-аміно-2-метил-пропокси)-феніламіно]-феніл}-етиламіно)-1-гідрокси-етил]8-гідрокси-1H-хінолін-2-он. Агоніст β2-адренорецептора може бути в формі солі, утвореної з фармацевтично прийнятної кислоти, вибраної з наступного: сульфатна, хлоридна, фумарова, гідроксинафтойна (наприклад 1- або 3-гідрокси-2-нафтойна), корична, заміщена корична, трифенілоцтова, сульфамінова, сульфанілова, нафталінакрилова, бензойна, 4-метоксибензойна, 2- або 4-гідроксибензойна, 4хлорбензойна та 4-фенілбензойна кислота. Приклади адреностероїдів можуть охоплювати описане в WO02/088167, WO02/100879, WO02/12265, WO02/12266, WO05/005451, WO05/005452, WO06/072599 та WO06/072600. Протизапальні адреностероїди добре відомі в рівні техніки. Показові приклади охоплюють наступне: флутіказон пропіонат (наприклад, дивись US patent 4,335,121), флутіказон фуроат (наприклад, дивись US patent 7,101,866), беклометазон 17-пропіонат-естер, беклометазон 17,21-дипропіонат-естер, дексаметазон або його естер, мометазон або його естер (наприклад, мометазон фуроат), циклезонід, будезонід, флунісолід, метил преднізолон, преднізолон, дексаметазон та 6, 9-дифлуор-11-гідрокси-16-метил-3-оксо-17-(2,2,3,3тетраметициклопропілкарбоніл)окси-андроста-1,4-дієн-17-карботіонової кислоти Sцианометил-естер. Подальші приклади протизапальних адреностероїдів описано в WO02/088167, WO02/100879, WO02/12265, WO02/12266, WO05/005451, WO05/005452, WO06/072599 та WO06/072600. Нестероідальні сполуки, які мають глюкокортикоідний агонізм, які можуть сприяти селективності для транспридушення через трансактивацію та які можуть бути корисними в композиційній терапії, охоплюють охоплене в наступних опублікованих заявках на патент та патентах: WO03/082827, WO98/54159, WO04/005229, WO04/009017, WO04/018429, WO03/104195, WO03/082787, WO03/082280, WO03/059899, WO03/101932, WO02/02565, WO01/16128, WO00/66590, WO03/086294, WO04/026248, WO03/061651, WO03/08277, WO06/000401, WO06/000398, WO06/015870, WO06/108699, WO07/000334 та WO07/054294. Приклади протизапальних засобів охоплюють нестероїдні протизапальні ліки (NSAID). Приклади NSAID охоплюють наступне: натрій хромоглікат, натрій недохроміл, інгібітори фосфодіестерази (PDE) (наприклад, теофілін, інгібітори PDE4 або змішані інгібітори PDE3/PDE4), антагоністи лейкотриєну, інгібітор синтезу лейкотриєну (наприклад монтелукаст), інгібітор iNOS, інгібітори триптази та еластази, антагоністи бета-2 інтегрину та агоністи або антагоністи рецептору аденозину (наприклад, аденозин 2a-агоністи), антагоністи цитокіну (наприклад антагоністи хемокіну, як-то антагоніст CCR3) або інгібітори синтезу цитокіну, або інгібітори 5-ліпоксигенази. iNOS (індукований інгібітор нітроген оксид-синтази) є переважним для перорального застосування. Приклади інгібіторів iNOS охоплюють розкрите в WO93/13055, WO98/30537, WO02/50021, WO95/34534 та WO99/62875. Приклади інгібіторів CCR3 охоплюють розкрите в WO02/26722. 16 UA 109807 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад інгібіторів PDE4 охоплюють наступне: цис-4-циано-4-(3-цтклопентилокси-4метоксифеніл)циклогексан-1-карбонова кислота, 2-карбометокси-4-циано-4-(3циклопропілметокси-4-дифлуорметоксифеніл)циклогексан-1-он та цис-[4-циано-4-(3циклопропілметокси-4-дифлуорметоксифеніл)циклогексан-1-ол]. Також, цис-4-циано-4-[3(цтклопентилокси)-4-метоксифеніл]циклогексан-1-карбонова кислота (також відома як циломіласт) та її солі, естери, проліки або фізичні форми (наприклад, дивись U.S. patent 5,552,438). Інші сполуки охоплюють AWD-12-281 від Elbion (Hofgen, N. et al. 15th EFMC Int Symp Med Chem (Sept 6-10, Edinburgh) 1998, Abst P, 98; CAS reference No. 247584020-9); похідне 9бензиладеніну, номіноване NCS-613 (INSERM); D-4418 від Chiroscience та Schering-Plough; інгібітор бензодіазепіну PDE4, ідентифікований як CI-1018 (PD-168787) та віднесений до Pfizer; похідне бензодіоксолу, розкрите Kyowa Hakko в WO99/16766; K-34 від Kyowa Hakko; V-11294A від Napp (Landells, L.J. et al. Eur Resp J [Annu Cong Eur Resp Soc (Sept 19-23, Geneva) 1998] 1998, 12 (Suppl. 28): Abst P2393); рофлуміласт (CAS reference No 162401-32-3) та фталазинон (наприклад, дивись WO99/47505) від Byk-Gulden; пумафентрин, (-)-п-[(4aR*,10bS*)-9-етоксил1,2,3,4,4a, 10b-гексагідро-8-метокси-2-метилбензо[c][1,6]нафтиридин-6-іл]-N, Nдіізопропілбензамід, який є змішаним інгібітором PDE3/PDE4, який отримано та опубліковано Byk-Gulden, тепер Altana; арофілін, який є під розробкою в Almirall-Prodesfarma; VM554/UM565 від Vernalis; або T-440 (Tanabe Seiyaku; Fuji, K. et al. J Pharmacol Exp Ther, 1998, 284(1): 162), та T2585. Наступні сполуки розкрито в опублікованій міжнародній заявці на патент WO04/024728 (Glaxo Group Ltd), WO04/056823 (Glaxo Group Ltd) та WO04/103998 (Glaxo Group Ltd). Прикладами антихолінергічних засобів є сполуки, які діють як антагоністи при мускаринових рецепторах, зокрема, ці сполуки, які є антагоністами рецепторів M 1 або M3, подвійні антагоністами M1/M3 або M2/M3, рецепторами або панантагоністами рецепторів M1/M2/M3. Типові сполуки для застосування через інгаляцію охоплюють іпратропіум (наприклад, як бромід, CAS 22254-24-6, у продажу під назвою атровент), окситропіум (наприклад, як бромід, CAS 30286-750) та тіотропіум (наприклад, як бромід, CAS 136310-93-5, у продажу під назвою спірива). Також цікавим є реватропат (наприклад, як гідрогенбромід, CAS 262586-79-8) та LAS-34273, який розкрито в WO01/04118. Типові сполуки для перорального застосування охоплюють пірензепін (CAS 28797-61-7), дарфенацин (CAS 133099-04-4, або CAS 133099-07-7 як гідрогенбромід, у продажу під назвою енаблекс), оксибутинін (CAS 5633-20-5, у продажу під назвою дитропан), теродилін (CAS 15793-40-5), толтеродин (CAS 124937-51-5, або CAS 124937-52-6 для тартрату, у продажу під назвою детрол), отилоніум (наприклад, як бромід, CAS 26095-59-0, у продажу під назвою спазмомен), троспіум хлорид (CAS 10405-02-4) та соліфенацин (CAS 242478-37-1, або CAS 242478-38-2 для сукцинату, також відомий як YM-905, та у продажу під назвою весикар). Інші антихолінергічні засоби охоплюють сполуки, які розкрито в заявці на патент US patent application 60/487981 охоплюючи, наприклад, наступне: (3-ендо)-3-(2,2-ди-2-тієнілетеніл)-8,8-диметил-8-азоніабіцикло[3,2,1]октан бромід; (3-ендо)-3-(2,2-дифенілетеніл)-8,8-диметил-8-азоніабіцикло[3,2,1]октан бромід; (3-ендо)-3-(2,2-дифенілетеніл)-8,8-диметил-8-азоніабіцикло[3,2,1]октан 4метилбензолсульфонат; (3-ендо)-8,8-диметил-3-[2-феніл-2-(2-тієніл)етеніл]-8-азоніабіцикло[3,2,1]октан бромід; та (3-ендо)-8,8-диметил-3-[2-феніл-2-(2-піридиніл)етеніл]-8-азоніабіцикло[3,2,1]октан бромід. Наступні антихолінергічні засоби охоплюють сполуки, які розкрито в заявці на патент US patent application 60/511009 охоплюючи, наприклад: (ендо)-3-(2-метокси-2,2-ди-тіофен-2-іл-етил)-8,8-диметил-8-азоніа-біцикло[3,2,1]октан йодид; 3-((ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3-іл)-2,2-дифеніл-пропіонітрил; (ендо)-8-метил-3-(2,2,2-трифеніл-етил)-8-аза-біцикло[3,2,1]октан; 3-((ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3-іл)-2,2-дифеніл-пропіонамід; 3-((ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3-іл)-2,2-дифеніл-пропіонова кислота; (ендо)-3-(2-циано-2,2-дифеніл-етил)-8,8-диметил-8-азоніа-біцикло[3,2,1]октан йодид; (ендо)-3-(2-циано-2,2-дифеніл-етил)-8,8-диметил-8-азоніа-біцикло[3,2,1]октан бромід; 3-((ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3-іл)-2,2-дифеніл-пропан-1-ол; N-бензил-3-((ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3-іл)-2,2-дифеніл-пропіонамід; (ендо)-3-(2-карбамоіл-2,2-дифеніл-етил)-8,8-диметил-8-азоніа-біцикло[3,2,1]октан йодид; 1-бензил-3-[3-((ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3-іл)-2,2-дифеніл-пропіл]-сечовина; 1-етил-3-[3-((ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3-іл)-2,2-дифеніл-пропіл]-сечовина; N-[3-((ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3-іл)-2,2-дифеніл-пропіл]-ацетамід; N-[3-((ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3-іл)-2,2-дифеніл-пропіл]-бензамід; 17 UA 109807 C2 5 10 15 20 25 30 35 40 45 50 55 3-((ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3-іл)-2,2-ди-тіофен-2-іл-пропіонітрил; (ендо)-3-(2-циано-2,2-ди-тіофен-2-іл-етил)-8,8-диметил-8-азоніа-біцикло[3,2,1]октан йодид; N-[3-((ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3-іл)-2,2-дифеніл-пропіл]-бензолсульфонамід; [3-((ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3-іл)-2,2-дифеніл-пропіл]-сечовина; N-[3-((ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3-іл)-2,2-дифеніл-пропіл]-метансульфонамід; та (ендо)-3-{2,2-дифеніл-3-[(1-феніл-метаноіл)-аміно]-пропіл}-8,8-диметил-8-азоніабіцикло[3,2,1]октан бромід. Наступні сполуки охоплюють: (ендо)-3-(2-метокси-2,2-ди-тіофен-2-іл-етил)-8,8-диметил-8-азоніа-біцикло[3,2,1]октан йодид; (ендо)-3-(2-циано-2,2-дифеніл-етил)-8,8-диметил-8-азоніа-біцикло[3,2,1]октан йодид; (ендо)-3-(2-циано-2,2-дифеніл-етил)-8,8-диметил-8-азоніа-біцикло[3,2,1]октан бромід; (ендо)-3-(2-карбамоіл-2,2-дифеніл-етил)-8,8-диметил-8-азоніа-біцикло[3,2,1]октан йодид; (ендо)-3-(2-циано-2,2-ди-тіофен-2-іл-етил)-8,8-диметил-8-азоніа-біцикло[3,2,1]октан йодид; та (ендо)-3-{2,2-дифеніл-3-[(1-феніл-метаноіл)-аміно]-пропіл}-8,8-диметил-8-азоніабіцикло[3,2,1]октан бромід. В одному втіленні винаходу запропоновано композицію, яка містить сполуку формули (I), або її фармацевтично прийнятну сіль, разом з антагоністом H1. Приклади антагоністів H1 охоплюють, без обмеження, метапірилен, деслоратадин, амелексанокс, астемізол, азатадин, азеластин, акривастин, бромфенірамін, цетиризин, левоцетиризин, ефлетиризин, хлорфенірамін, клемастин, циклізин, каребастин, ципрогептадин, карбіноксамін, дескарбоетоксилопатадин, доксиламін, диметинден, ебастин, епінастин, ефлетиризин, фексофенадин, гідроксизин, кетотифен, лопатадин, левокабастин, мізоластин, меквітазин, міансерин, ноберастин, меклізин, норастемізол, олопатадин, пікумаст, піриламін, прометазин, терфенадин, трипеленамін, термеластин, тримепразин та трипролідин, конкретно ceтиризин, левоцетиризин, ефлетиризин та фексофенадин. У подальшому втіленні винаходу запропоновано композицію, яка містить сполуку формули (I), або її фармацевтично прийнятну сіль, разом із антагоністом H3 (та/або зворотним агоністом). Приклад антагоністів H3 охоплюють, наприклад, сполуки, які розкрито в WO2004/035556 та в WO2006/045416. Інші антагоністи рецептору гістаміну, які можна застосовувати в композиції зі сполуками формули (I) або їх фармацевтично прийнятною сіллю, охоплюють антагоністи (та/або зворотні агоністи) рецептору H4, наприклад, сполуки, розкриті в Jablonowski et al., J. Med. Chem. 46:3957-3960 (2003). В одному втіленні запропоновано композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль разом з адреностероїдом. У ще одному втіленні запропоновано композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль разом з NSAID. У ще одному втіленні запропоновано композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль разом з антихолінергічним засобом. У ще одному втіленні запропоновано композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль разом з агоністом β2-адренорецептору. У ще одному втіленні запропоновано композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль разом із протиінфекційним засобом. У ще одному втіленні запропоновано композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль разом з антигістаміном. У ще одному втіленні запропоновано композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль разом із ліками, які корегують антиревматичну хворобу. У подальшому втіленні запропоновано композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль разом із біофармацевтичним засобом. Сполуку формули (I) звичайно слід, але необов'язково, уводити у фармацевтичні композиції для застосування до пацієнта. Отже, ще один аспект винаходу стосується фармацевтичних композицій, які містять сполуку формули (I) або її фармацевтично прийнятну сіль, та один або більше фармацевтично прийнятних носіїв, розріджувачів або наповнювачів. Фармацевтичні композиції сполук формули (I) можна отримувати та пакувати у форму маси, де безпечну та ефективну кількість сполуки формули (I) можна вилучати та потім надавати пацієнту, як-то порошки або сиропи. Альтернативно, фармацевтичні композиції сполук формули (I) можна отримувати та пакувати в одиничній формі дозування, де кожна фізично окрема одиниця містить безпечну та ефективну кількість сполуки формули (I). Фармацевтичні композиції сполук формули (I) також можна отримувати та пакувати в субодиничній формі дозування, де дві або більше субодиничні форми дозування надають одиничну форму дозування. При виготовленні в одиничній формі дозування фармацевтичні композиції сполук 18 UA 109807 C2 5 10 15 20 25 30 35 40 45 50 55 60 формули (I) типово містять, приблизно, 0,1 − 99,9 мас. % сполуки формули (I), залежно від природи композиції. Крім того, далі фармацевтичнікомпозиції сполук формули (I) необов'язково можуть містити одну або більше додаткових терапевтично активних сполук. Як тут застосовано, "фармацевтично прийнятний наповнювач" означає фармацевтично прийнятну речовину, композицію або наповнювач, уведені в надану форму, або сумісні щодо фармацевтичної композиції. Кожному наповнювачу слід бути сумісним з іншими інгредієнтами фармацевтичної композиції при об'єднанні, за умови уникнути взаємодій, які могли б значною мірою зменшити ефективність сполуки формули (I) при застосуванні до пацієнта та могли б призводити до фармацевтично неприйнятних композицій. Крім того, кожному наповнювачеві звичайно слід бути достатньо високої чистоти, щоб робити її фармацевтично прийнятною. Для композицій, які містять сполуку формули (I) або її фармацевтично прийнятну сіль та один або більше фармацевтично прийнятних носіїв, розріджувачів або наповнювачів, звичайно слід передбачати форму дозування, адаптовану для застосування до пацієнта бажаним шляхом. Наприклад, форми дозування охоплюють пристосованість до наступного застосування: (1) пероральне застосування, як-то таблетки, капсули, таблетки у вигляді капсули, гранули, пігулки, порошки, сиропи, еліксири, суспензії, розчини, емульсії, саше, та капсули; (2) місцеве дермальне застосування, як-то креми, мазі, лосьйони, розчини, пасти, спреї, піни, та гелі, (3) інгаляція, як-то аерозолі та розчини; (4) інтраназальне застосування, як-то розчини або спреї; (5) парентеральне застосування, як-то стерильні розчини, суспензії, та порошки для розбавлення та (6) застосування склоподібного тіла. В одному втіленні запропоновано форму дозування, адаптоване для місцевого дермального застосування. Слід брати до уваги, що форми дозування, адаптовані для перорального застосування звичайно застосовують для лікування автоімунної хвороби, охоплюючи ревматоїдний артрит та системний червоний вовчак, хронічну ідіопатичну кропів'янку та злоякісність гему. Форми дозування, адаптовані для місцевого застосування до шкіри, звичайно застосовують для лікування атопічного дерматиту, псоріазу й станів хронічної та гострої кропив'янки, та автоімунних бульозних станів, охоплюючи пемфігус та пемфігоід. Форми дозування, адаптовані для інгаляції або перорального застосування, звичайно застосовують для лікування COPD; поки форми дозування, адаптовані для інтраназального застосування звичайно застосовують для лікування алергічного риніту. Придатним фармацевтично прийнятним наповнювачам слід чітко залежати від вибраної конкретної форми дозування. Крім того, придатні фармацевтично прийнятні наповнювачі можна вибирати для конкретної функції, для якої вони можуть бути корисними в композиції. Наприклад, певні фармацевтично прийнятні наповнювачі можна вибирати по їх здатності полегшувати продукування постійних форм дозування. Певні фармацевтично прийнятні наповнювачі можна вибирати по їх здатності полегшувати продукування стійких форм дозування. Певні фармацевтично прийнятні наповнювачі можна вибирати по їх здатності полегшувати при одному застосуванні до пацієнта перенесення або транспортування сполуки формули (I) від одного органу, або частини організму до іншого органу, або частини організму. Певні фармацевтично прийнятні наповнювачі можна вибирати по їх здатності посилювати податливість пацієнта. Придатні фармацевтично прийнятні наповнювачі охоплюють наступні типи наповнювачів: розріджувачі, наповнювачі, зв'язувачі, дезінтегранти, змащувачі, ковзні засоби, засоби гранулювання, засоби покриття, засоби зволоження, розчинники, співрозчинники, засоби суспендування, емульгатори, підсолоджувачі, ароматизатори, засоби маскування аромату, засоби запобігання злежуванню, зволожувачі, засоби хелатування, пластифікатори, засоби підвищення в'язкості, антиоксиданти, консерванти, стабілізатори, поверхнево-активні речовини та засоби буферування. Кваліфікованому спеціалісту слід розуміти, що певні фармацевтично прийнятні наповнювачі можуть бути корисними для більш ніж одної функції та можуть бути корисними для альтернативних функцій залежно від того, скільки наповнювачу є присутнім у композиції та які інші інгредієнти є присутніми в композиції. Кваліфіковані спеціалісти володіють знанням та розуміють у рівні техніки, що дає можливість вибирати придатні фармацевтично прийнятні наповнювачі в придатній кількості для застосування у винаході. Крім того, існує ряд засобів, відомих кваліфікованому спеціалісту, який описує фармацевтично прийнятнінаповнювачі, які можуть бути корисними у виборі придатних фармацевтично прийнятних наповнювачів. У прикладах охоплено Remington's Pharmaceutical Sciences (Mack Publishing Company), Remington: The Science та Practice of Pharmacy, (Lippincott Williams & Wilkins), The Handbook of Pharmaceutical Additives (Gower Publishing Limited), та The 19 UA 109807 C2 5 10 15 20 25 30 35 40 45 50 55 60 Handbook of Pharmaceutical Excipients (the American Excipients Association та Pharmaceutical Press). Фармацевтичні композиції сполук формули (I) отримано із застосуванням технологій та способів, відомих спеціалісту в рівні техніки Деякі способи звичайно застосовувані в рівні техніки описано в Remington's Pharmaceutical Sciences (Mack Publishing Company). Пероральні тверді форми дозування, як-то таблетки, типово містять один або більше фармацевтично прийнятних наповнювачів, які можуть, наприклад, допомагати надавати прийнятний спосіб та характеристики щільності, або забезпечувати таблеткам додаткові бажані фізичні характеристики. Такі фармацевтично прийнятні наповнювачі можна вибирати з наступного: розріджувачі, зв'язувачі, ковзні засоби, змащувачі, дезінтегратори, барвники, ароматизатори, зволожувачі, полімери, воски або інші речовини, які регулюють розчинність. Форми дозування для місцевого застосування до шкіри, наприклад, можуть бути в наступних формах: мазі, креми, лосьйони, очні мазі, очні каплі, вушні краплі, просочені пов'язки та аерозолі, та можуть містити придатні звичайні допоміжні речовини, охоплюючи, наприклад, консерванти, розчинники, які сприяють проникненню ліків, та пом'якшувачі в мазях та кремах. Такі місцеві композиції також можуть містити звичайні сумісні носії, наприклад, базові крем або мазь, та етанол або олеіловий спирт для лосьйонів. Такі носії можуть складати, приблизно, 1 % − 98 % за масою композиції; у більшості випадків вони складають, приблизно, 80 % за масою композиції. Форми дозування для парентерального застосування звичайно містять рідини, конкретно внутрішньовенні рідини, тобто, стерильні розчини простих хімікатів, як-то цукри, амінокислоти або електроліти, які легко переносить система кровообігу та які легко засвоюються. Такі рідини типово готують із води для ін'єкції USP. Рідини, звичайно застосовувані для внутрішньовенного (IV) застосування, розкрито в Remington, The Science та Practice of Pharmacy [ibid]. У такій IV рідині pH може варіювати, та типово йому слід дорівнювати 3,5 − 8 pH, як відомо в рівні техніки. Форми дозування для назального або дихального застосування можна легко скомпонувати як аерозолі, розчини, краплі, гелі або сухі порошки. Форми дозування для місцевого застосування носової порожнин (назальне застосування) охоплюють аерозолеві композиції та водні композиції під тиском, застосовані до носа насосом під тиском. Композиції, як не є під тиском та адаптовані для назального застосування, складають конкретний інтерес. Придатні для цієї мети композиції містять воду як розріджувач або носій. Водні композиції для застосування до носа можна забезпечувати звичайними наповнювачами, як-то буферувальними засобами, засобами, які модифікують тонус, та подібним. Водні композиції також можна застосовувати до носа розпилюванням. Форми дозування для назального застосування запропоновано в приладі з контрольованою дозою. Форму дозування можна забезпечити як рідинну композицію для постачання з рідинного дозатора, який має носик для розподілення або отвір для розподілення, через який виміряну дозу рідинної композиції розподілено після застосування користувачем механізму насоса рідинного розподілювача для інтенсивності нанесення. Такі рідинні розподілювачі звичайно забезпечено резервуаром множинних виміряних доз рідинної композиції, доз, які є незначними щодо наступних спрацьовувань насосу. Патрубок розподілення або сопло можна створити придатним для введення в ніздрі споживача для розподілення потоку рідинної композиції в назальну порожнину. В одному втіленні рідинний розподілювач є розподілювачем загального типу, описаного та ілюстрованого в WO2005/044354A1. Розподілювач має футляр, який уміщує механізм вивільнення рідини, який має компресор, закріплений на резервуарі для втримування рідинної композиції. Футляр має, принаймні, одну бічну рукоятку для пальця, яка є внутрішньо пересувною стосовно футляру, щоб піднімати контейнер уверх у футлярі, щоб спричинити стискання та накачку виміряної дози композиції зі стовбуру насосу через назальне сопло футляру. Конкретно кращим рідинним розподілювачем є загальний тип, ілюстрований на фігурах 30-40 у WO2005/044354A1. Композиції аерозолю, наприклад, для застосування вдиханням можуть містити розчин або чисту суспензію активної речовини у фармацевтично прийнятному водному або неводному розчиннику. Композиції аерозолю можна надавати в одиничній або багатодозових кількостях у стерильній формі в герметичному контейнері, який може мати форму патрону або змінного балончику для застосування з пульверизатором або інгалятором. Альтернативно герметичний контейнер може бути засобом одиничного розподілення, як-то інгалятор одиничної назальної дози, або розподілювачем аерозолю, оснащеним дозатором (інгалятор виміряної дози), який призначено для розміщення одноразових умістів, які слід випускати. Якщо форма дозування містить розподілювач аерозолю, він переважно має придатний газвитискувач під тиском, як-то стиснене повітря, карбон діоксид або органічний газ-витискувач, як 20 UA 109807 C2 5 10 15 20 25 30 35 40 45 50 55 60 то гідрогенфлуоркарбон (HFC). Придатні гази-витискувачі HFC охоплюють 1,1,1,2,3,3,3гептафлуорпропан та 1,1,1,2-тетрафлуоретан. Форми дозування аерозолю також можуть форму насоса-розпилювача. Стиснутий аерозоль може містити розчин або суспензію активної сполуки. Це може потребувати введення додаткових наповнювачів, наприклад, співрозчинників та/або поверхнево-активних речовин для поліпшення властивостей дисперсії та гомогенності суспензії композиції. Розчин композиції також може потребувати додаткових співрозчинників, як-то етанол. Інші модифікатори наповнювача також можна вводити для поліпшення, наприклад, стабільності та/або смаку, та/або характеристик тонких часточок маси композиції (кількості та/або контуру). Для фармацевтичних композицій, придатних та/або адаптованих для застосування вдиханням, переважним є те, що фармацевтична композиція є сухою порошковою дихальною композицією. Така композиція може містити порошкову основу, як-то лактоза, глюкоза, трегалоза, манітол або крохмаль, сполуку формули (I) (переважно у формі часточки зменшеного розміру, наприклад, у тонко подрібненій формі), та необов'язково модифікатор дії, як-то L-лейцин або друга амінокислота, целюлоза октаацетат та/або солі металів стеаринової кислоти, як-то магній або кальцій стеарат. Переважно дихальна композиція сухого порошку містить суміш сухого порошку лактози та сполуки формули (I). Переважною лактозою є лактоза гідрат, наприклад, лактоза моногідрат, та/або переважним є сорт лактози для інгаляції та/або лактоз високого сорту. Визначено, що переважним розміром частки лактози є такий, коли 90 % або більше (за масою або за об'ємом) часток лактози мають розмір менший 1000 мікронів (мікрометрів) (наприклад, 10-1000 мікронів наприклад, 30-1000 мікронів) у діаметрі, та/або 50 % або більше часток лактози мають розмір менший 500 мікронів (наприклад, 10-500 мікронів) у діаметрі. Визначено, що кращим, розміром частки лактози є такий, коли 90 % або більше часток лактози мають розмір менший 300 мікронів (наприклад, 10-300 мікронів наприклад, 50-300 мікронів) у діаметрі, та/або 50 % або більше часток лактози мають розмір менший 100 мікронів у діаметрі. Визначено, що необов'язково розміром частки лактози є такий, коли 90 % або більше часток лактози мають розмір менший 100-200 мікронів у діаметрі, та/або 50 % або більше часток лактози мають розмір менший 40-70 мікронів у діаметрі. Найважливіше, це є найкращим, що, приблизно, 3 − 30 % (наприклад, приблизно, 10 %) (за масою або за об'ємом) часток є меншими 50 мікронів або меншими 20 мікронів у діаметрі. Наприклад, без обмеження, придатним сортом лактози для інгаляції є лактоза E9334 (10 % дрібний наповнювач) (Borculo Domo Ingredients, Hanzeplein 25, 8017 JD Zwolle, Netherlands). Зокрема, для сухих порошкових дихальних композицій необов'язково фармацевтичну композицію для застосування вдиханням можна вводити в множинні герметизовані контейнери для дози (наприклад, які містять композицію сухого порошку), змонтованої вздовж смужки або в середини смужки, придатних для способу інгаляції. Контейнер є здатним до розриву або лущіння при потребі, та дозу, наприклад, композиції сухого порошку можна застосовувати ® інгаляцією через пристрій, як-то DISKUS device, який є в продажу в GlaxoSmithKline. Пристрій ® для інгаляції DISKUS описано, наприклад, у GB 2242134 A, та в такому пристрої, принаймні, один контейнер для фармацевтичної композиції у формі порошку (контейнер або контейнери, які переважно є множинними контейнерами герметизованої дози, змонтованої вздовж смужки або в середини смужки) установлено між двома елементами, закріпленими один до другого; пристрій містить: способи визначення місця встановлення отвору згаданого контейнера або контейнерів; способи відшаровування елементів на місці отвору щоб відкрити контейнер; та отвір, суміжний з відкритим контейнером, через який споживач може вдихати фармацевтичну композицію в формі порошку з відкритого контейнеру. Композицію винаходу сполуки формули (I) для інтраназального застосування також можна адаптувати для дозування вдуванням як суху порошкову композицію. Для форми дозування при застосуванні вдиханням, де сполука формули (I) присутня як сухий порошок або в суспензії, переважним є те, що, вона є у формі частки зменшеного розміру. Переважно форму зменшеного розміру отримують або вона є досяжною тонким подрібненням. Переважний розмір частки зменшеного розміру (наприклад, тонко подрібненні) сполуки або соли визначено величиною D50, приблизно, 0,5 − 10 мікронів (наприклад, яку визначено лазерною дифракцією). Слід брати до уваги, якщо сполуки формули (I) застосовано в композиції з іншими терапевтичними засобами звичайно застосованими вдиханням, внутрішньовенним, пероральним, місцевим або інтраназальним шляхом, то фармацевтичну композицію можна застосовувати такими ж шляхами. Композиція може містити 0,1 % − 100 % за масою, наприклад, 10 − 60 % за масою активної речовини залежно від способу застосування. Композиція може містити 0 % − 99 % за масою, 21 UA 109807 C2 5 10 15 20 25 30 35 40 45 50 55 60 наприклад, 40 % − 90 % за масою носія, залежно від способу застосування. Сполуки формули (I) можна легко застосовувати в кількості, наприклад, 1 мкг − 2 г. Точній дозі, звичайно, слід залежати від віку та стану пацієнта та конкретного вибраного шляху застосування. Способи біологічного тесту Активність сполуки можна тестувати in vitro відповідно наступним аналізам: 1. Активність лужного ферменту SYK Лізат SYK 3 мкл, розбавлений 16-кратно в буфері для аналізу (20 мМ TRIS pH 7,4, 0,01 % BSA 0,1 % Pluronic F-68), додавали до лунок 384-лункового чорного планшету малого об'єму Greiner, які містять 0,1 мкл сполуки різних концентрацій або наповнювач ДМСО (остаточно 1,7 %). Наступні 15 хвилин преінкубували при кімнатній температурі, реакцію ініціювали додаванням 3 мкл реагенту субстрату, який містить пептид Y7 Sox, (Invitrogen Cat. # KNZ3071, остаточно 5 мкМ), ATP (остаточно 35 мкМ) та MgCl2 (остаточно 10 мМ) у буфері для аналізу. Реакцію інкубували при кімнатній температурі перед вимірюванням інтенсивності флуоресценції (λex 360/λem 485) на зчитувачеві планшету Envision (Perkin Elmer Life Sciences, Waltham, MA, US) при 15 хвилинах та 55 хвилинах після додавання субстрату. Сполуки прикладів тестували, по суті, як описано вище, та знаходили pКІ50, яка дорівнює 5,5 − 7,5. Сполуки прикладів 1 − 8 тестували, по суті, як описано вище та в цьому аналізі знаходили середню величину pКІ50 ≥ 6,0. Сполуку прикладу 2 тестували, по суті, як описано вище та знаходили pКІ50, яка дорівнює 7,1. Спеціалісту в рівні техніки слід розуміти, що аналізи зв'язування in vitro та аналізи, базовані на функціональній активності клітини, піддані мінливості. Отже, слід розуміти, що вказані вище величини pКІ50 є тільки типовими. Виготовлення лізату SYK i. Виготовлення лізатів клітини Ramos B-клітини Ramos (B-клітини людини лімфома Burkitt, клону 296,4C10, ATCC) культивували в суспензії середовища для вирощування (RPMI-1640, Sigma; доповненого 2 мМ L-глутаміну, Gibco; 10 мМ Hepes, Sigma; 1 мМ натрій пірувату, Sigma; 10 об'єм. % термоінактивованого FCS, 2 Gibco). Клітини вирощували в Corning Cellstacks (6360 см ) в об'ємі 1 літр, життєздатність та густину клітини контролювали щодобово. Клітини підтримували при 92 % Режими укрупненого масштабу продукування створили з аліквот інтермедіату укрупненого масштабу (LSIA's) заморожених клітин Ramos, як тут знайдено, щоб надавати більшу відтворюваність ніж продукування від культури тривалого зростання клітин Ramos. Режим укрупненого масштабу продукування клітин отримано за чотири етапи: 1. Відтавання LSIA в 1 x Cellstack (набор клітини); 2. Поширення культури в 4 x Cellstack; 3. Поширення від 4 до 12 x Cellstacks; 4. Збирання всіх 12 Cellstacks Cellstack збирали в 2 л посудини для центрифугування, застосовуючи центрифугу Sorvall 6 9 Mistral centrifuge, 2000 оберт/хвил, 10 хвилин, 4 °C. (2 л x 2 × 10 клітин/мл = 4 × 10 сукупних клітин) (Примітки для укрупненого масштабу клітини: якщо густина клітини перевершувала 1,8 × 10e6/мл або життєздатність падала нижче 90 %, препарат Syk, отриманий після стимулювання, вірогідно був нижчої активності). Також, повторний пасаж клітин Ramos здавалось має шкідливий вплив на активність Syk, коли зростання клітини зроблено при масштабі (не слід уявляти, що це стан культур малого масштабу) – це завжди рекомендовано для застосування LSIA та модульного укрупненого масштабу для приготувань укрупненого масштабу. ii. Стимулювання клітин Ramos анти-IgM Ab для продукування лізатів препарату Syk & 6 Клітини стимулювали при 20 × 10 клітинах/мл, застосовуючи антитіло анти-IgM 15 мкг/мл 9(остаточна концентрація). Наступний збір клітин (як описано вище), повний − 4 × 10 клітин, суспендували в 180 мл попередньо нагрітого (37 °C) DPBS в 500 мл посудині для центрифугування Corning. Антитіло анти-IgM 20 мл при 150 мкг/мл додавали до кожної 500 мл посудини для центрифугування. (робочі матеріали виготовляли в попередньо нагрітому до 37 °C DPBS). Клітин інкубували точно протягом 5 хвилин при 37 °C, а потім − додавання антитіла анти-IgM. Після 5 хвилин стимулювання до кожної посудини додавали 300 мл охолодженого льодом DPBS для зупинки стимулювання (температура краплі, приблизно 12 °C), потім клітини центрифугували при 2000 оберт/хвил. (Sorvall Legend RT+ центрифуга – попередньо охолоджені до 4 °C). Клітини промивали ресуспендуванням в охолодженому льодом DPBS та центрифугували, як указано вище. Потім осад клітин після центрифугування 22 UA 109807 C2 5 10 15 20 25 30 35 40 45 50 55 піддавали лізису в охолодженому льодом буфері для лізису, який містить 1 % тритон-x-100 при 7 співвідношення 150 мкл/1 × 10 клітин (тобто 48 мл буферу для лізису). Після додавання буферу для лізису клітини продовжували наносити піпеткою & вниз & на лід протягом 15 хвилин. Прозорий лізат потім отримували центрифугуванням (Sorvall Evolution RC (SLA-1500 ротор, приблизно 20,000 г (приблизно 14500 оберт/хвил), 45 хвил., 4 °C). Лізат аліквотували, швидко заморожували на сухому льоді та зберігали при -80 °C до аналізу. Матеріали Клітини Ramos: B-клітини людини лімфоми Burkitt, клону 296,4C10 (ATCC). Середовище для вирощування: 500 мл RPMI, 10 % теплий інактивований FCS, 2 мМ Lглутамін, 2 мМ HEPES, 1 мМ натрій піруват. RPMI: Sigma R0883, запас CT5652 Ембріональна сироватка теляти: Gibco 10099-141, запас CT2509 L-Глутамін: 200 мМ, Gibco 25030, запас CT3005 HEPES: 1M, Sigma H0887, запас CT5637 Натрій піруват: 100 мМ, Sigma S8636, запас CT7741 Анти-IgM Ab: кози, анти-людський IgM ((Fab")2 фрагменти) в PBS. Інвітроген, виготовлений на замовлення (азид-вільний та низькі рівні ендотоксину). Каталог №. NON0687, Lot 1411913. 2,74 мг/мл. D-PBS: забуферений фосфатом Дульбекко фізрозчин Sigma D8537 Буфер для лізису: 50 мМ TRIS pH 7,5+150 мМ NaCl+1 % Тритон-X-100+2 мМ EGTA + коктейлі 1:100 розведеного інгібітору (коктейль набору II інгібітору фосфатази, калбіохім кат. № 524625 та коктейль набору V інгібітору протеази, калбіохім кат. № 539137) Тритон-X-100: Roche 10 789 704 001 (GI 198233X, SC/159824). Виготовляють як 20 % запас у воді. EGTA: Sigma E4378. Тверду речовину додано безпосередньо до буферу. 2. Аналізи активності B-клітини 2,1. аналіз Ramos pErk Принцип аналізу B-клітини Ramos (B-клітини лімфоми Burkitt людини) стимулювали, застосовуючи анти-IgM. Результатом є поповнення SYK до рецептора B-клітини. Наступне автофосфорилування Syk призводить до ініціювання сигнального каскаду, що має результатом активацію B-клітини через Erk MAP-шлях кінази. Результатом є фосфоритування Erk, та подальший лізис клітини виявляли аналізом імунного захоплення. Стимулювання клітини Ramos анти-IgM Клітини розміщували в 96-v-лункові поліпропіленові планшети при щільності середовища 5 для аналізу 2,5 × 10 /лунку в об'єм 25 мкл (RPMI, який містить 10 % інактивованої нагріванням ембріональної сироватки теляти, 1 % L-глутамін). Додавали 25 мкл відповідно розбавленого розчину сполуки, та планшет інкубували протягом 30 хвил. при 37 °C з 5 % CO2. Клітини стимулювали 5 мкл Fab’2 фрагментами козла анти-людини IgM (5 мкг/мл остаточно) протягом 7 хвил. при 37 °C. Клітини піддали лізису додаванням 55 мкл 2x RIPA-буферу для лізису протягом 2 год. при 4 °C. Лізат можна заморожувати на цій стадії при -80 °C. Аналіз pErk MSD 50 мкл лізат клітин переносили до 96-лункового планшету MSD, покритого іммобілізованим антитілом анти-pErk1/2 (Thr/Tyr: 202/204; 185/187), та інкубували протягом 16 годин при 4 °C або 3 годин при кімнатній температурі. Планшет промивали та додавали антитіло визначення антиpErk (25 мкл/лунку) протягом 1 год. при кімнатній температурі. Це видаляли, додавали 150 мкл MSD-буферу зчитування, та визначали отриманий у результаті сигнал електохемілюмінісценції. Виготовлення сполуки Сполуку отримували як 10 мМ запас у ДМСО, та отримували серії розбавлень у ДМСО, застосовуючи 9 послідовних 5-кратних розбавлень. Ці серії розбавлень потім розбавляли 1:100 середовищем для аналізу для остаточного діапазону концентрації -5 -11 для тестування 5 × 10 − 2,56 × 10 M. Розчини сполуки отримували, застосовуючи автоматичні роботизовані системи додавання піпеткою Biomek 2000 та Biomek Nx. Сполуки прикладів 1-4, 6, 7, 9, 10-12, 15-17, 19, 20, 22, 24, 26-39, 41, 45, 46, 48 та 49 тестували, по суті, як описано вище, та знаходили, що вони мають середні величини pКІ 50 5,2 − 6,8. Сполуки прикладів 1, 2, 3 та 4 тестували, по суті, як описано вище, та знаходили, що вони мають у цьому аналізі середні величини pКІ50 ≥ 6,0. 23 UA 109807 C2 5 10 15 20 25 30 35 40 45 50 55 Спеціалісту в рівні техніки слід розуміти, що аналізи зв'язування in vitro та базовані на клітині аналізи функціональної активності піддаються змінності. Отже, слід розуміти, що величини pКІ 50 надано вище тільки як приклади. Інтермедіати та приклади Загальне Усі температури − в°C. BOC − трет-бутоксикарбоніл BOC2O − Ди-трет-бутил гідрогенкарбонат BuOH − бутанол Cs2CO3 − цезій карбонат ДХМ / CH2Cl2 − дихлорметан DEAD − діетилазодикабоксилат Діоксан − 1,4-діоксан DIPE− N, N-діізопропілетиламін ДМСО − диметилсульфоксид ДМЕ − 1, 2-диметоксиетан ДМФ − N, N-диметилформамід Dppf − 1,1’-біс(дифенілpфосфіно)фероцен EА − етилацетат EDC − N-(3-диметиламінопропіл)-N’-етилкарбодіімід Et3N − триетиламін Етер − діетилетер EA / EtOAc − етилацетат h − години HCl − гідроген хлорид HOBT − 1-гідроксибензотриазол ВЕРХ − високоефективна рідинна хроматографія K2CO3 − калій карбонат KOH − калій гідроксид РХМС − рідинна хроматографія − мас- спектрометрія MDAP − мас-спрямована автоматизована препаративна хроматографія хвил. − хвилини NaHCO3 − натрій гадрогенкарбрнат NH4Cl − амоній хлорид NMP − N-метилпіролідон PEPPSI − піридин-підсилене попередньо каталізоване отримання стабілізації та ініціювання Pd/C − паладій на вуглецю PdCl2.dppf − [1, 1’- біс(дифенілpфосфіно)фероцен] дихлорпаладій Pd(PPh3)4 або Тетракіс − тетракіс(трифенілфосфін)паладій (0) Пінакон диборан− 4,4,4',4',5,5,5',5'-октаметил-2,2'-бі-1,3,2-діоксоборолан к.т. − кімнатна температура Rt − час утримання SiO2 − діоксид силіцію TEA− триетиламін Tf − трифлуорметансульфоніл ТФОК− трифлуороцтова кислота ТГФ − тетрагідрофуран ТШХ/тшх− тонкошарова хроматографія 1 Спектри H ЯМР реєстрували, застосовуючи Bruker DPX 400 МГц, відносно тетраметилсилану. Мас-спектри реєстрували на спектрометрі SHIMADZU LCMS 2010 EV, застосовуючи позитивне/негативне електоророзпилювання. Виготовлення зразку робили в 100 % метанолі, та зразки інжектували прямо через отвір для інжектування Способи хроматографії на діоксиді силіцію охоплюють автоматизовані способи (Flashmaster, Biotage SP4) або ручну хроматографію на розфасованих у патронах (SPE) або вручну впакованих флеш-колонках. Коли ім'я торгівельного постачальника надано після назви сполуки або реагенту, наприклад, "сполука X (Aldrich)” або "сполука X / eg Aldrich", це означає, що сполуку X отримано від торгівельного постачальника, тобто названого торгівельного постачальника. 24 UA 109807 C2 5 10 Подібно, коли посилання на літературу або патент надано після назви сполуки, наприклад, сполука Y (EP 0 123 456), це означає, що сполуку можна отримувати як описано в назві посилання. Назви у вищеназваних прикладах можна отримувати, застосовуючи програму назви сполуки "ACD Name Pro 6,02". Загальний спосіб ВЕРХ: ВЕРХ виконували, застосовуючи колонку X-Bridge C18 250 × 4,6 мм, 5 мікронів при 267 нм. Потік у колонці був 1 мл / хвил., та застосовані розчинники − 0,1 % ТФОК у воді якості ВЕРХ способу (A) та 0,1 % ТФОК в MeCN градієнту якості способу (B), з об'ємом ін'єкції 10 мкл. -1 Виготовлення разку при 250 млн у воді:MeCN. Спосіб описано нижче. Час (хвил.) 0,01 9,00 11,00 20,00 20,01 25,00 15 20 A 90 10 0 0 90 90 Загальні способи РХ-МС: Спосіб-A РХ-МС виконували, застосовуючи колонку X-bridge C18 150 × 4,6 мм, 5 мікронів. Визначення УФ робили при довжині хвилі максимуму абсорбції (вказано на окремих спектрах). Мас-спектри реєстрували на спектрометрі SHIMADZU LCMS 2010EV, застосовуючи позитивне/негативне електророзпилювання. Потік у колонці був 1 мл / хвил., та застосовані розчинники − 0,1 % мурашина кислота у воді якості ВЕРХ способу (A) і 0,1 % мурашиної кислоти в MeCN якості -1 ВЕРХ способу (B), з об'ємом ін'єкції 10 мкл. Виготовлення зразку при 250 млн в MeCN + вода. Спосіб описано нижче. Час (хвил.) 0,01 5,00 6,00 10,00 10,01 12,00 25 30 A 90 10 0 0 90 90 B% 10 90 100 100 10 10 Спосіб-B РХ-МС виконували, застосовуючи колонку X-bridge C18 150 × 4,6 мм, 5 мікронів. Визначення УФ робили при довжин хвилі максимуму абсорбції (вказано на окремих спектрах). Мас-спектри реєстрували на спектрометрі SHIMADZU РХМС 2010 EV, застосовуючи позитивне/негативне електророзпилювання. Потік у колонці був 1 мл / хвил., та застосовані розчинники − 0,05 % амоній ацетат у воді якості ВЕРХ способу (A) та 0,05 % амоній ацетат в метанолі якості ВЕРХ -1 способу (B) з ін'єкційним об'ємом 10 мкл. Виготовлення зразку при 250 млн у MeOH + воді. Спосіб описано нижче. Час (хвил.) 0,01 5,00 6,00 10,00 10,01 12,00 35 B% 10 90 100 100 10 10 A 90 10 0 0 90 90 B% 10 90 100 100 10 10 Спосіб C РХ/МС (Aglient) виконували на колонці HALO C18, (50 мм x 4,6 мм, діаметр пакування 2,7 мкм) при 40 градусах за Цельсієм, елюючи розчином мурашиної кислоти у воді 0,1 об'єм. % (розчинник A) та розчином мурашиної кислоти в ацетонітрилі 0,1 об'єм. % (розчинник B), 25 UA 109807 C2 5 10 застосовуючи наступний градієнт елюювання 0-1 хвил. 5 % B, 1-2,01 хвил. 95 % B, 2,01 – 2,5 хвил. 5 % B при швидкості потоку 1,8 мл/ хвил… Визначене УФ − сумарний сигнал при довжин хвилі: 214 нм та 254 нм. МС: джерело іонів: ESI; потік сушильного газу: 10 л/хвил.; тиск у розпилювачі: 45 фунт/кв.дюйм; температура сушильного газу: 330 °C; капілярна напруга: 4000 вольт. Спосіб препаративної ВЕРХ, застосований для очищення сполуки прикладу 5: Препаративну ВЕРХ виконували на Waters Delta 600, застосовуючи колонку Gemini C18 150 × 21,2 мм, 5 мікронів, з визначенням УФ при 251 нм на детекторі УФ. Потік у колонці був 21 мл/хвил., та застосовані розчинники − 0,1 % ТФОК у воді якості ВЕРХ способу (A) та 0,1 % ТФОК в ацетонітрилі якості ВЕРХ способу (B). Зразок отримували у воді & ацетонітрилі 1:1. Спосіб описано нижче. Час (хвил.) 0,01 5,5 5,51 9,0 9,01 11 15 B% 25 55 100 100 25 25 Спосіб препаративної ВЕРХ, застосований для очищення сполуки прикладу 6: Препаративну ВЕРХ виконували, застосовуючи колонку ACE C 18 250 × 21,2 мм, 5 мікронів, з визначенням УФ при 249 нм на детекторі PDA. Потік у колонці був 21 мл/хвил., та застосовані розчинники − 0,1 % ТФОК у воді якості ВЕРХ способу (A) та 0,1 % ТФОК в MeCN градієнту якості способу (B). Зразок отримували в суміш води та ацтонітрилу. Спосіб описано нижче. 20 Час (хвил.) 0,01 7,00 8,00 12,00 12,01 14,00 25 B% 30 50 100 100 30 30 Інші сполуки, очищені препаративною ВЕРХ, очищували способами, подібними описаним вище, наприклад, 5 та 6 Інтермедіат 1: 1,1-диметилетил 7-(4,4,5,5-тетрaметил-1,3,2-діоксаборолан-2-іл)-1,2,4,5тетрагідро-3H-3-бензазепін-3-кабоксилат O O B O N O 30 35 До дегазованої суміші 1,1-диметилетил 7-{[(трифлуорметил)сульфоніл]окси}-1,2,4,5тетрагідро-3H-3-бензазепін-3-кабоксилату (9,9 г) (який можна отримувати згідно з J. Med Chem. 2007, 50(21) 5076-5089), 4,4,4',4',5,5,5',5'-октаметил-2,2'-бі-1,3,2-діоксоборолану (7,6 г), калій ацетату (7,3 г) та dppf (0,833 г) в діоксані (165 мл) додавали PdCl 2dppf.CH2Cl2 (1,2 г). Реакційну суміш знов дегазували циклами − азот/вакуум. Її нагрівали при 100 °C протягом 18 год. Її розбавляли етилацетатом та фільтрували через целіт. Фільтрат концентрували, що дало сирий продукт. Його очищали хроматографією на колонці, елюючи 0-6 % градієнтом етилацетату в гексані, що дало бажану сполуку як білу тверду речовину (6,2 г) РХМС (спосіб B): Rt=8,00 хвил., [MH]+-100=274 (втрата групи BOC − як артефакт умов на мас- спектрометрі) Інтермедіат 18, 2-бром-6-метил-3-піридинол 26 UA 109807 C2 Br HO 5 10 N До розчину 5-гідрокси-2-метилпіридину (є в продажу, eg Aldrich, 44,5 г) у піридині (400 мл) додавали краплями протягом 30 хвил. при кімнатній температурі розчин брому (71,64 г) у піридині (550 мл). Реакційну суміш перемішували протягом додаткових 1,5 год. Реакційну суміш заливали у воду (4 літри), перемішували протягом кількох хвилин та екстрагували діетилетером (4 × 300 мл). Комбіновані органічні фази сушили над натрій сульфатом та концентрували у вакуумі, що дало коричневу тверду речовину, яку очищали через діоксид силіцію, застосовуючи систему 0-30 % етилацетату в гексані, що дало бажану сполуку як бежеву тверду речовину, 37 г. 1 -1 -1 ЯМР H ЯМР (400 МГц, ДМСО-d6) δ млн 10,43 (1H, s, OH), 7,16 млн (1H, d, CH), 7,06 (1H, d, CH), 2,31 (3H, s, CH3) Інтермедіат 19, (4-етил-2-піридиніл)метанол OH N 15 20 Розчин 4-етилпіридину (є в продажу, наприклад, Sigma-Aldrich) (10,7 г), амоній пероксидисульфату (45,6 г) та концентрованої сульфатної кислоти (4,5 мл) у метанолі (150 мл)/воді (70 мл) нагрівали зі зворотним холодильником протягом 24 год. Реакційну суміш повільно додавали у водний натрій гадрогенкарбрнат та екстрагували хлорформом (4 × 500 мл). Її сушили над натрій сульфатом, концентрували у вакуумі та очищали через діоксид силіцію, застосовуючи 0-60 % етилацетат у гексані, що дало бажану сполуку, 1,16 г Мас-спектрометрія: [MH]+ = 138,0 Інтермедіат 20, 2-бром-4-(етилоксифенол Br HO 25 O До розчину 4-(етилоксифенолу (є в продажу, eg Aldrich) (1,0 г) у хлорформі (5 мл) охолодженого до 0ºC краплями додавали бром (1,26 г) протягом 20 хвил. Отриману суміш перемішували при 25 °C протягом 2 год. до послідовного промивання водним натрій бікарбонатом та розсолом. Органічні фази сушили над натрій сульфатом, фільтрували та концентрували у вакуумі, що дало бажану сполуку, 1,8 г РХМС (спосіб A): Rt=6,52 хвил., [MH]+= 215, 217 Інтермедіат 65, 3-бром-4-гідрокси-N-метилбензамід Br HO H N 30 35 O До перемішуваного розчину 3-бром-4-гідроксибензойної кислоти (є в продажу) (2,0 г), EDC (2,65 г), HOBT (1,41 г) та TEA (6,2 мл) у ДХМ (60 мл) додавали метиламін гідрогенхлорид (1,87 г). Його перемішували при 25-30 °C протягом 16 год. Розчинник видаляли під зниженим тиском. Залишок розчиняли у воді та екстрагували етилацетатом. Органічні фази сушили (натрій сульфат) та концентрували у вакуумі, що дало бажану сполуку, 0,57 г РХМС (спосіб B): Rt=4,76 хвил. 27 UA 109807 C2 Інтермедіат 66 отримували подібно, застосовуючи відмінний амін. Інтермедіат 66 3-бром-4-гідрокси-N, Nдиметилбензамід Амін Кількість Диметиламін, гідрогенхлорид 0,52 г Визначення характеристик РХМС (спосіб B): Rt=5,21 хвил., [MH]+= 244, 266 Інтермедіат 67, 3-бром-4-гідроксибензамід Br HO NH2 5 10 O До перемішуваного розчину 3-бром-4-гідроксибензойної кислоти (0,5 г) та ДМФ (0,1 мл) у ДХМ (10 мл) додавали краплями оксаліл хлорид (0,6 мл). Після перемішування протягом 2 год. через розчин продували газ аміак. Після завершення реакції згідно ТШХ розчинник видаляли під зниженим тиском. Залишок розчиняли у воді та екстрагували етилацетатом. Органічні фази сушили над натрій сульфатом та концентрували у вакуумі, що дало бажану сполуку, 0,18 г + РХМС (спосіб A): Rt=4,33 хвил., [MH] = 216, 218 Інтермедіат 68 1,2-біс(метилокси)-4-{[(метилокси)метил]окси}бензол O O O O 15 20 До перемішуваного розчину 3,4-біс(метилокси)фенолу (є в продажу, Alfa Aesar) (1,0 г) та DIPEA (2,28 мл) у ДХМ (15 мл) додавали хлорметил метил-етер (0,74 мл) при 0 °C. Після перемішування при 25-30 °C протягом 17 год., реакційну суміш промивали розбавленою хлоридною кислотою та насиченим водним натрій бікарбонатом. Її сушили над натрій сульфатом та очищали через діоксид силіцію, елюючи 0-5 % етилацетатом у гексані, що дало бажану сполуку, 0,80 г + РХМС (спосіб A): Rt=5,99 хвил., [MH] = 199 Інтермедіат 69 2-бром-3,4-біс(метилокси)-1-{[(метилокси)метил]окси}бензол Br O O O O 25 30 До перемішуваного розчину 1,2-біс(метилокси)-4-{[(метилокси)метил]окси}бензолу (4,0 г) та TMEDA (3,93 мл) у сухому діетилетері (50 мл) додавали трет-бутиллітій (1,7M у пентані, 23,76 мл) при -70 °C. Реакційну суміш перемішували при цій температурі протягом 1 год. до додавання брому (0,15 мл). Реакційну суміш перемішували 0 °C протягом 3 год. Реакційну суміш гасили додаванням 20 % водного натрій дитіоніту та екстрагували етилацетатом. Органічні фази промивали розбавленою хлоридною кислотою, водним натрій бікарбонатом, розсолом та сушили над натрій сульфатом, що дало сирий продукт. Його очищали через діоксид силіцію, елюючи 0-10 % етилацетатом у гексані, що дало бажану сполуку, 1,4 г Мас-спектрометрія: [MH]+= 277, 279 Інтермедіат 70, 2-бром-3,4-біс(метилокси)фенол Br HO O O 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPyridinyl- and pyrazinyl-methyloxy-aryl derivatives useful as inhibitors of spleen tyrosine kinase (syk)
Автори англійськоюAtkinson, Francis Louis, Barker, Michael David, Liddle, Johm, Wilson, David Matthew
Автори російськоюАткинсон Френсис Луис, Баркер Майкл Дэвид, Лиддли Джон, Вилсон Дэвид Мэттью
МПК / Мітки
МПК: A61P 37/00, C07D 401/12, C07D 403/12, A61K 31/47
Мітки: syk, селезінки, піридиніл, інгібітори, похідні, піразинілметилоксіарилу, тирозинкінази
Код посилання
<a href="https://ua.patents.su/65-109807-pokhidni-piridinil-ta-pirazinilmetiloksiarilu-yak-ingibitori-tirozinkinazi-selezinki-syk.html" target="_blank" rel="follow" title="База патентів України">Похідні піридиніл- та піразинілметилоксіарилу як інгібітори тирозинкінази селезінки (syk)</a>
Попередній патент: Спосіб отримання 4-аміно-5-фтор-3-галоген-6-(заміщених)піколінатів
Наступний патент: Елемент, стійкий до повітропереносу та тепло- і гідропереносу в галузі будівництва, зокрема для полегшених стін або полегшених фасадів
Випадковий патент: Збивні цукерки