Спосіб отримання 1-заміщених 6-аміно-3-ціанопіридонів-2
Номер патенту: 78653
Опубліковано: 10.04.2007
Автори: Кондратюк Костянтин Михайлович, Трофимчук Сергій Андрійович, Воловенко Юліан Михайлович
Формула / Реферат
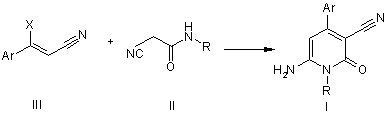
1. Спосіб отримання 1-заміщених 6-аміно-3-ціанопіридонів-2 загальної формули І
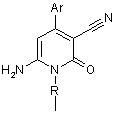 ,
,
де
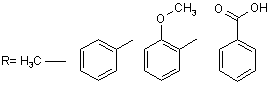 ,
,
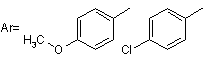
 ,
,
який відрізняється тим, що аміди ціаноцтової кислоти загальної формули II піддають взаємодії з ![]() -заміщеними нітрилами коричних кислот загальної формули III в присутності основ
-заміщеними нітрилами коричних кислот загальної формули III в присутності основ
 ,
,
 ,
,
де R та Аr мають значення, як визначено вище.
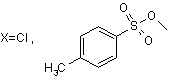
2. Спосіб за п. 1, який відрізняється тим, що як р-заміщені нітрили коричних кислот використовують ![]() -хлоркоричні нітрили та
-хлоркоричні нітрили та ![]() -тозилоксикоричні нітрили.
-тозилоксикоричні нітрили.
3. Спосіб за пп. 1, 2, який відрізняється тим, що як основу використовують водно-диметилсульфоксидний розчин лугу або етанольний розчин етилату натрію.
Текст
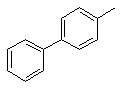
Даний винахід стосується галузі органічної хімії, зокрема хімії гетероциклічних сполук, а саме способу отримання 1-заміщених 6-аміно-З-ціанопіридонів-2 загальної формули І, Ar H2N N N O R O CH3 O OH R= H3 C Ar= H3C O Cl які можуть бути застосовані як фізіологічно активні речовини в медицині або проміжні продукти при їх синтезі. Відомі такі способи отримання 1-заміщених 6-аміно-3-ціанопіридонів-2. Отримання 6-окси-1,4-диметил-3-ціанопіридону-2 конденсацією етилціаноацетату та N-бутилацетоацетаміду в присутності етилату натрію, перетворення його на 1,4-диметил-6-хлор-3-ціанопіридон-2 реакцією з хлорокисом фосфор у та взаємодія останнього з рідким аміаком в автоклаві [Katritzky, Alan R., Rachwald, Stanislaw. II Regioselective conversion оf 3-cyano-6-hydroxy-2-p yridones into З-суапо-6-аmіпо-2-pyridones // J.Heterocycl. Chem. 1995. - Vol. 32(3). - P.1007-1010.], як зображено на схемі 1 Схема 1 CH3 O O H3 C O n-Bu + CN N H N CH3 HO O N O n-Bu CH3 CH3 N CH3 N POCl 3 N O Cl n-Bu N O O N n-Bu CH3 Cl Cl N Cl n-Bu CH3 N N + + HO CH3 N N NH3 Cl N O H2 N n-Bu N O n-Bu Недоліком цього способу є необхідність контактува ти з токсичними оксихлоридом фосфору та рідким аміаком. А також необхідність проведення амінування в автоклаві при високому тиску та необхідність розділяти суміш продуктів на другій стадії. Основним недоліком є те, що таким способом була отримана лише одна сполука. Інший спосіб полягає в деструкції 7-аміно-6-етоксикарбоніл-1,4-диметил-2-оксо-3-ціано[1,8]нафтирідину при кип'ятінні в морфоліні [Mekheimer, Ramadan Ahmed // A New Approach to the Synthesis ofPolyfunctionally Substituted 1,8-Naphthyridin-2-one Derivatives from 6-Azidopyridones: A Novel Thermal Decomposition to 6-Aminopyridones.// Synthesis - 2001. - Vol. 1. - P.103-107.]: N CH3 O O N O O N N CH3 CH3 N H NH2 O CH3 N NH2 CH3 Недоліком цього способу є тр удоємкість та складність отримання вихідної речовини шість стадій, а також обмежений перелік цільових сполук, обумовлений вузькою базою вихідних сполук. Найбільш близьким за технічним результатом є наступний спосіб отримання 1-заміщених 6-аміно-3ціанопіридонів-2. Взаємодія фенілізотіоціанату з ацетилацетоном та метилйодидом веде до утворення проміжної сполуки, нагрівання якої з етилціаноацетатом, оцтовою кислотою та ацетатом амонію дає цільовий продукт [AlAfaleq, Eljazi // A facile method for the synthesis of novel pyridinone derivatives via ketene N, S-acetals // Synth. Commun. - 2001. - Vol. 31(22). - P.3557-3568.], як зображено на схемі 2 Схема 2 H3 C S N O H N O + CH3I + H3 C O S CH3 H3 C O CH3 H 3C O H N O + CH 3 S O CH 3 CH 3 NH 4OAc N NC O AcO H H 3C H 2N N O Недоліком цього способу є необхідність контактувати з токсичним фенілізотіоціанатом, який є сильним алергентом, в процесі реакції виділяється леткий та токсичний метил меркаптан і обмежений перелік цільових сполук, обумовлений вузькою базою вихідних речовин. В основу винаходу поставлено задачу створити новий більш зручний спосіб отримання 1-заміщених 6-аміно3-ціанопіридонів-2 шляхом циклізації N-монозаміщених ціанацетамідів з b-заміщеними нітрилами коричних кислот під дією основ, за рахунок чого забезпечити розширення асортименту сполук типу І без суттєви х ускладнень процедури їх отримання. Поставлена задача вирішується при здійснені способу отримання 1-заміщених 6-аміно-3-ціанопіридонів-2 загальної формули І, який полягає в тому, що N-монозаміщені ціанацетаміди загальної формули II та (3-заміщені нітрили коричних кислот III, де R та Аг мають наведені вище значення, обробляють основою, як основу використовують гідроксид калію або етилат натрію, як зображено на схемі 3. Схема 3 Ar X N Ar + H N NC O III II O S X=Cl , N R H 2N N O R I O O H3C Винахід підтверджується нижченаведеними прикладами. Методики синтезу 1-заміщених 6-аміно-3-ціанопіридонів-2. Приклад 1 Методика А 0,02моль b-заміщеного нітрилу коричної кислоти та 0,02моль N-монозаміщеного ціанацетаміду розчиняють у 15мл диметилсульфоксиду. До отриманого розчину при інтенсивному перемішуванні по краплях додають розчин 0,04моль гідроксиду калію в 3-5мл води. Отриману суміш залишають на дві доби, потім виливають на воду, осад, що утворився, відфільтровують, перекристалізовують з відповідного розчинника. Методика В 0,042моль натрію розчиняють в 50мл безводного етилового спирту. До розчину етилату натрію присипають суміш 0,02моль (3-заміщеного нітрилу коричної кислоти та 0,02моль N-монозаміщеного ціанацетаміду. Реакційну суміш кип'ятять протягом трьох годин, виливають на воду, осад, що утворився, відфільтровують, перекристалізовують з відповідного розчинника. Приклад 2 6-Аміно-1-метил-4-(4-хлорофеніл)-3-ціанопіридон-2. С13Н10N3ClO (Mr=259,5). Методика В. Вихід 64%, Т.топл. 251°С (з оцтової кислоти). 14 спектр (таблетки з KBr), n, см-1: 2221 (CºN). Mac-спектр (високоефективний рідинний хроматограф "Agilent 1100 Series", оснащений мас-селективним детектором "Agilent LC/MSD SL"), m/z: 262; 260. ЯМР 1Н (у ДМСО-d6, Varian Mercury 400 з робочою частотою 400МГц), d, м.ч: 3,4 (3Н, с), 5,6 (1Н, с), 7,6 (2Н, д), 7,8 (2Н, д), 7,8 (2Н, ш. с). Приклад 3 6-Аміно-1-метил-4-(4-метоксифеніл)-3-ціанопіридон-2. C14H13N3O2 (Mr=255). Методика В. Ви хід 61%, Т.топл. 270-272°С (з оцтової кислоти). 14 спектр (таблетки з KBr), n, см-1: 2204 (CºN). Mac-спектр, m/z: 256; 255. ЯМР 1Н (у ДМСО-d6), d, м.ч: 3,4 (3Н, с), 3,8 (3Н, с), 5,6 (1Н, с), 7,1 (2Н, д), 7,4 (2Н, д), 7,3 (2Н, ш. с). Приклад 4 6-Аміно-1-метил-4-(4-фенілфеніл)-3-ціанопіридон-2. С19H15N3О (Mr=301). Методика В. Ви хід 62%, Т.топл. 310-311°С (з оцтової кислоти). 14 спектр (таблетки з KBr), n, см-1: 2211 (CºN). Mac-спектр, m/z: 302; 301. ЯМР 1H(у ДМСО-d6), d, м.ч: 3,4 (3Н, с), 5,7 (1Н, с), 7,4 (1Н, т), 7,5 (2Н, т). 7,6 (2Н, д), 7,7 (2Н, ш. с), 7,72 (2Н, д), 7,8 (2Н, д). Приклад 5 6-Аміно-4-(4-метоксифеніл)-1-феніл-3-ціанопіридон-2. С19Н15N3 O2 (Mr=317). Методика А. Вихід 50%, Т.топл. >310°С (з диметилформаміду). 14 спектр (таблетки з KBr), n, см-1: 2204 (CºN). Mac-спектр, m/z: 318; 317. ЯМР 1H(у ДМСО-d6,), d, м.ч: 3,8 (3Н, с), 5,7 (1Н, с), 6,7 (2Н, ш. с), 7 (2Н, д), 7,3 (2Н, д), 7,6 (5Н, м). Приклад 6 6-Аміно-1-феніл-4-(4-хлорофеніл)-3-ціанопіридон-2. C18H12ClN3O (Mr=321,5). Методика А. Вихід 60%, Т.топл. >310°С (з диметилформаміду). 14 спектр (таблетки з KBr), n, см-1: 2204 (CºN). Mac-спектр, m/z; 324; 323; 322. ЯМР 1H(у ДМСО-d6), 8, м.ч: 5,6 (1Н, с), 7, 35 (2Н, д), 7,6 (7Н, м). Приклад 7 6-Аміно-4-(4-фенілфеніл)-1-феніл-3-ціанопіридон-2. C24H17N3 O (M=363). Методика А. Ви хід 66%, Т.топл. >310°С (з оцтової кислоти). 14 спектр (таблетки з KBr), n, см-1: 2204 (CºN). Mac-спектр, m/z: 364; 363. ЯМР 1Н (у ДМСО-d6), d, м.ч: 5,6 (1Н, с), 7,34 (2Н, д), 7,42 (1Н, т), 7,54 (3Н, м), 7,6 (2Н, т), 7,66 (2Н, д), 7,75 (2Н, д), 7,84 (2Н, д). Приклад 8 6-Аміно-4-(4-метоксифеніл)-1-(2-метоксифеніл)-3-ціанопіридон-2. С20Н17N3О 3 (Mr=347). Методика А. Ви хід 56%, Т.топл. >310°С (з оцтової кислоти). 14 спектр (таблетки з KBr), n, см-1: 2204 (CºN). Mac-спектр, m/z: 348; 347. ЯМР 1Н (у ДМСО-d6), d, м.ч: 3,8 (3Н, с), 3,85 (3Н, с), 5,6 (1Н, с), 6,75 (2Н, ш. с), 7,1 (2Н, д), 7,18 (3Н, м), 7,49 (1Н, т) 7,55 (2Н, д). Приклад 9 6-Аміно-1-(2-метоксифеніл)-4-(4-хлорофеніл)-3-ціано-піридон-2. С19Н14СlN3O2 (Mr=351,5). Методика А. Ви хід 67%, Т.топл. >310°С (з оцтової кислоти). 14 спектр (таблетки з KBr), n, см-1: 2211 (CºN). Mac -спектр, m/z: 354; 352. ЯМР 1Н (у ДМСО-d6), d, м.ч: 3,85 (3Н, с), 5,6 (1Н, с), 6,8 (2Н, ш. с), 7,2 (3Н, м), 7,6 (2Н, д), 7,45 (3Н, м). Приклад 10 6-Аміно-1-(2-метоксифеніл)-4-(4-фенілфеніл)-3-ціанопіридон-2. С25Н17N3O 2 (Mr=393). Методика А. Ви хід 66%, Т.топл. >310°С (з оцтової кислоти). 14 спектр (таблетки з KBr), n, см-1: 2219 (CºN). Mac -спектр, m/z: 394; 393. ЯМР 1H(у ДМСО-d6), d, м.ч: 3,8 (3Н, с), 5,7 (1Н, с), 7,12 (1Н, т), 7,28 (2Н, м), 7,42 (1Н, т), 7,52 (3Н, т), 7,66 (2Н, д), 7,76 (2Н, д), 7,82 (2Н, д). Приклад 11 6-Аміно-1-(2-карбоксифеніл)-4-(4-хлорофеніл)-3-ціанопіридон-2. С19H12ClN3О3 (Mr=365,5). Методика А. Вихід 76%, Т.топл. >310°С (з диметилформаміду). 14 спектр (таблетки з KBr), n, см-1: 2204 (CºN). Мас - спектр, m/z: 368; 366. ЯМР 1H(у ДМСО-d6), d, м.ч: 5,7 (1Н, с), 7,25 (2Н, ш. с), 7,39 (1Н, д), 7.68 (1Н, т), 7,79 (1Н, т), 7,58 (4Н, дд), 8,12 (1Н, д). Таким чином, результатом винаходу є спрощення синтезу 6-аміно-З-ціанопіридонів-2 загальної формули І, внаслідок зменшення стадій та усунення токсичних реагентів.
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for synthesis of 1-substituted 6-amino-3-cyanopiridon-2
Автори англійськоюVolovenko Yulian Mykhailovych, Volovenko Yulian Mykchaylovich, Trofymchuk Serhii Andriiovych
Назва патенту російськоюСпособ получения 1-замещенных 6-амино-3-цианопиридонов-2
Автори російськоюВоловенко Юлиан Михайлович, Трофимчук Сергей Андреевич
МПК / Мітки
МПК: A61K 31/395, C07D 213/24, C07D 213/00, C07D 213/26
Мітки: спосіб, отримання, 1-заміщених, 6-аміно-3-ціанопіридонів-2
Код посилання
<a href="https://ua.patents.su/3-78653-sposib-otrimannya-1-zamishhenikh-6-amino-3-cianopiridoniv-2.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання 1-заміщених 6-аміно-3-ціанопіридонів-2</a>
Попередній патент: Спосіб повітроплавання
Наступний патент: Пристрій для регулювання потоку
Випадковий патент: Спосіб спікання виробів з металевого порошку







