Ферментативне безгліцеринове продукування етанолу
Номер патенту: 107467
Опубліковано: 12.01.2015
Автори: ван Маріс Антоніус Джероен Адріан, Пронк Якобус Томас, Гвадалупе Медіна Віктор Габріель
Формула / Реферат
1. Рекомбінантна дріжджова клітина, зокрема, трансгенна дріжджова клітина, яка включає одну чи декілька рекомбінантних, зокрема гетерологічних, послідовностей нуклеїнової кислоти, що кодують активність NAD+-залежної ацетилюючої ацетальдегіддегідрогенази (EC 1.2.1.10), де зазначена клітина або не має ферментативної активності, потрібної для NADH-залежного синтезу гліцерину, або має знижену ферментативну активність по відношенню до NADH-залежного синтезу гліцерину у порівнянні з відповідною дріжджовою клітиною дикого типу.
2. Клітина за п. 1, яка включає одну чи декілька гетерологічних послідовностей нуклеїнової кислоти, що кодують NAD-залежну ацетилюючу ацетальдегіддегідрогеназу, представлену SEQ ID NO: 2 чи SEQ ID: 29, або функціональний гомолог SEQ ID NO: 2 чи SEQ ID NO: 29, де зазначений гомолог краще має ідентичність послідовності, що дорівнює щонайменше 60 %, зокрема щонайменше 70 %, конкретніше щонайменше 80 %, щонайменше 90 %, щонайменше 95 %, щонайменше 97 %, щонайменше 98 % або щонайменше 99 %, з SEQ ID NO: 2 або SEQ ID NO: 29.
3. Клітина за п. 2, яка включає послідовність нуклеїнової кислоти, що кодує зазначену дегідрогеназу, де послідовність нуклеїнової кислоти включає послідовність, що відповідає SEQ ID NO: 1, SEQ ID NO: 28 чи SEQ ID NO: 32, або функціональний гомолог SEQ ID NO: 1, SEQ ID NO:28 чи SEQ ID NO: 32, причому зазначений гомолог краще має ідентичність послідовності, що дорівнює щонайменше 60 %, зокрема щонайменше 70 %, конкретніше щонайменше 80 %, щонайменше 90 %, щонайменше 95 %, щонайменше 97 %, щонайменше 98 % або щонайменше 99 %, з SEQ ID NO: 1.
4. Клітина за будь-яким з попередніх пунктів формули, яка або не має активності NAD-залежної гліцерин-3-фосфатдегідрогенази, або має знижену активність NAD-залежної гліцерин-3-фосфатдегідрогенази у порівнянні з відповідною клітиною дикого типу, та/або яка або не має активності гліцеринфосфатфосфатази, або має знижену активність гліцеринфосфатфосфатази у порівнянні з відповідною клітиною дикого типу.
5. Клітина за п. 4, у якій геном клітини включає мутацію у щонайменше одному гені, вибраному з групи GPD1, GPD2, GPP1 та GPP2, де мутація може бути нокаут-мутацією, причому нокаут-мутація може бути повною делецією щонайменше одного із зазначених генів у порівнянні з геном відповідної дріжджової клітини дикого типу.
6. Клітина за п. 4 або 5, яка не має генів, що кодують NAD+-зaлeжнi гліцерин-3-фосфатдегідрогенази (EC 1.1.1.8).
7. Клітина за будь-яким з попередніх пунктів формули, яка включає одну чи декілька послідовностей нуклеїнової кислоти, що кодують активність ацетил-кофермент А-синтетази (EC 6.2.1.1), та одну чи декілька послідовностей нуклеїнової кислоти, що кодують активність NAD+-залежної алкогольдегідрогенази (ЕС 1.1.1.1).
8. Клітина за будь-яким з попередніх пунктів формули, яка є дріжджовою клітиною, вибраною з Saccharomycetaceae, зокрема, з групи Saccharomyces, такою як Saccharomyces cerevisiae; Kluyveromyces, такою як Kluyveromyces marxianus; Pichia, такою як Pichia stipitis або Pichia angusta; Zygosaccharomyces, такою як Zygosaccharomyces bailii; та Brettanomyces, такою як Brettanomyces intermedius.
9. Клітина за будь-яким з попередніх пунктів формули, яка належить до штаму S. cerevisiae, депонованого 16 липня 2009 р. у Centraal Bureau voor Schimmelcultures за номером CBS 125049.
10. Застосування клітини за будь-яким з попередніх пунктів формули для одержання етанолу.
11. Спосіб одержання етанолу, який включає одержання етанолу з ацетату та зі зброджуваного вуглеводу, зокрема вуглеводу, вибраного з групи глюкози, фруктози, сахарози, мальтози, ксилози, арабінози, галактози та занози, причому одержання проводиться в анаеробних умовах з використанням дріжджової клітини, яка включає активність ацетил-кофермент А-синтетази та активність NAD+-залежної ацетилюючої ацетальдегіддегідрогенази, де зазначена клітина краще є клітиною, вибраною з групи клітин, що не мають ферментативної активності, потрібної для NADH-залежного синтезу гліцерину, та клітин, що мають знижену ферментативну активність по відношенню до NADH-залежного синтезу гліцерину у порівнянні з відповідною дріжджовою клітиною дикого типу.
12. Спосіб за п. 11, у якому одержання проводиться у середовищі ферментації, що включає ацетат та вуглевод у молярному співвідношенні 0,7 чи менше, зокрема щонайменше від 0,004 до 0,5, конкретніше від 0,05 до 0,3.
13. Спосіб за п. 11 або 12, у якому щонайменше частину вуглеводу та щонайменше частину ацетату одержують шляхом гідролізу полісахариду, вибраного з групи лігноцелюлоз, целюлоз, геміцелюлоз та пектинів.
14. Спосіб за п. 13, у якому лігноцелюлозну біомасу гідролізують, одержуючи при цьому зброджуваний вуглевод та ацетат.
Текст
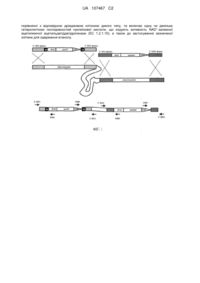
Реферат: Винахід належить до рекомбінантної дріжджової клітини, яка не має ферментативної або має знижену ферментативну активність по відношенню до NADH-залежного синтезу гліцерину у UA 107467 C2 (12) UA 107467 C2 порівнянні з відповідною дріжджовою клітиною дикого типу, та включає одну чи декілька + гетерологічних послідовностей нуклеїнової кислоти, що кодують активність NAD -залежної ацетилюючої ацетальдегіддегідрогенази (EC 1.2.1.10), а також до застосування зазначеної клітини для одержання етанолу. UA 107467 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується рекомбінантної дріжджової клітини, яка є здатною продукувати бажаний продукт ферментації, конструювання зазначеної дріжджової клітини шляхом генетичної модифікації, та способу виробництва продукту ферментації, у якому використовується зазначена дріжджова клітина. Продукування етанолу за допомогою Saccharomyces cerevisiae на сьогодні, за об’ємом, є найбільшим окремим ферментаційним процесом промислової біотехнології. В усьому світі проводяться дослідження, спрямовані на поширення спектра субстратів S. cerevisiae із включенням до нього лігноцелюлозних гідролізатів, зокрема гідролізованої лігноцелюлозної біомаси з нехарчової сировини (наприклад, енергетичні культури та сільськогосподарські відходи, відходи лісоматеріалів або промислові/побутові відходи з високим вмістом целюлози, геміцелюлози та/або пектину), та на підвищення продуктивності, надійності та виходу продукту. Лігноцелюлозна біомаса є широко розповсюдженою, однак звичайно погано ферментується етанолпродукуючими мікроорганізмами дикого типу, такими як S. cerevisiae. Біомаса має бути гідролізована. Одержаний гідролізат часто є сумішшю різних моносахаридів та олігосахаридів, не усі з яких можуть бути придатними субстратами для мікроорганізмів дикого типу. Крім того, гідролізати типово включають оцтову кислоту, що утворюється як побічний продукт, зокрема при гідролізі пектину або геміцелюлози, і - в залежності від типу гідролізу – один чи декілька інших побічних продуктів або залишкових реагентів, які можуть негативно впливати на ферментацію. Зокрема, повідомлялося, що оцтова кислота негативно впливає на кінетику та/або стехіометрію ферментації цукру штамами дикого типу та генетично модифікованими S. cerevisiae, а її токсичність значно збільшується при низьких pH культури (Helle et al. Enzyme Microb Technol 33 (2003) 786-792; Bellissimi et al. FEMS Yeast Res 9 (2009) 358-364). Були запропоновані різні підходи для поліпшення ферментативних властивостей етанолпродукуючих організмів шляхом генетичної модифікації, та удосконалення процесу гідролізу біомаси. Наприклад, огляд досягнень у ферментативному продукуванні етанолу з гідролізатів біомаси наведений A. van Maris et al. (Antonie van Leeuwenhoek (2006) 90:391-418). Наведені посилання на різні способи, якими можуть бути модифіковані S. cerevisiae, та на різні методики гідролізу лігноцелюлозної біомаси. Велика проблема, пов’язана зі стехіометрією продукування етанолу на основі дріжджів, полягає в тому, що неминуче утворюється значна кількість гліцерину як побічний продукт. За оцінкою, у типових промислових процесах виробництва етанолу, приблизно до 4 % мас. цукрової сировини перетворюється на гліцерин (Nissen et al. Yeast 16 (2000) 463-474). В умовах, ідеальних для анаеробного росту, перетворення на гліцерин може бути навіть вище, до приблизно 10 %. Продукування гліцерину в анаеробних умовах переважно пов’язане з редокс-метаболізмом. Під час анаеробнго росту S. cerevisiae, дисиміляція цукру відбувається шляхом спиртового бродіння. В цьому процесі, NADH (нікотинамідаденіндинуклеотид, відновлений), який утворюється в результаті гліколітичної реакції гліцеральдегід-3-фосфатдегідрогенази, повторно окислюється шляхом перетворення ацетальдегіду, утворюваного при декарбоксилюванні + пірувату до етанолу, за участі NAD -залежної алкогольдегідрогенази. Постійна стехіометрія цього редокс-нейтрального дисиміляційного шляху спричинює проблеми, коли де-небудь у + метаболізмі відбувається загальне відновлення NAD до NADH. В анаеробних умовах, повторне окиснення NADH у S. cerevisiae знаходиться у чіткій залежності від відновлення цукру до гліцерину. Утворення гліцерину ініціюється відновленням гліколітичної проміжної сполуки + дигідроксіацетонфосфату до гліцерин-3-фосфату, причому ця реакція каталізується NAD залежною гліцерин-3-фосфатдегідрогеназою. Згодом, гліцерин-3-фосфат, утворюваний в цій реакції, гідролізується гліцерин-3-фосфатазою з утворенням гліцерину та неорганічного фосфату. Внаслідок цього, гліцерин є головним побічним продуктом при анаеробному продукуванні етанолу S. cerevisiae, який є небажаним, оскільки він зменшує загальний ступінь перетворення цукру на етанол. Крім того, присутність гліцерину у стоках установок продукування етанолу може вимагати витрат на очищення стічних вод. Метою винаходу є створення нової рекомбінантної клітини, яка є придатною для анаеробного ферментативного продукування етанолу з вуглеводу, зокрема вуглеводу, одержаного з лігноцелюлозної біомаси, і яка характеризується зниженим продукуванням гліцерину у порівнянні з відповідним організмом дикого типу, або не продукує гліцерин, якщо ця клітина використовується для ферментативного одержання етанолу. Наступною метою є створення нового способу ферментативного одержання етанолу в анаеробних дріжджових культурах, у якому гліцерин не утворюється, або, принаймні, в якому утворюється менше гліцерину, ніж у способі з використанням відомих штамів S. cerevisiae. Одна чи декілька додаткових цілей, що можуть бути досягнуті, будуть зрозумілі з опису 1 UA 107467 C2 5 10 15 20 25 30 35 40 45 50 55 60 та/або формули винаходу. Автори винаходу зрозуміли, що однієї чи декількох з цих цілей можна досягти шляхом забезпечення певної рекомбінантної клітини, до якої буде включено певну іншу ферментативну активність, що дозволяла б здійснювати повторне окиснення NADH, утворюваного при ферментації вуглеводу, а також за відсутності ферментативної активності, необхідної для NADH-залежного синтезу гліцерину. Відповідно, даний винахід стосується рекомбінантної дріжджової клітини, яка включає одну чи декілька рекомбінантних, зокрема, одну чи декілька гетерологічних послідовностей + нуклеїнової кислоти, що кодують активність NAD -залежної ацетилюючої ацетальдегіддегідрогенази (EC 1.2.1.10). Автори винаходу, зокрема, зрозуміли, що буде зручним забезпечити клітину без ферментативної активності, потрібної для NADH-залежного синтезу гліцерину, або клітину зі зниженою ферментативною активністю, потрібною для NADH-залежного синтезу гліцерину. Відповідно, винахід стосується, зокрема, рекомбінантної дріжджової клітини, яка включає одну чи декілька гетерологічних послідовностей нуклеїнової кислоти, що кодують активність + NAD -залежної ацетилюючої ацетальдегіддегідрогенази, де клітина не має ферментативної активності, потрібної для NADH-залежного синтезу гліцерину (тобто, є вільною від такої активності), або де клітина має знижену ферментативну активність по відношенню до NADHзалежного синтезу гліцерину у порівнянні з відповідною дріжджовою клітиною дикого типу. Винахід далі стосується використання клітини відповідно до винаходу для одержання етанолу. Зокрема, винахід додатково стосується способу одержання етанолу, включаючи одержання етанолу зі зброджуваного вуглеводу та з ацетату, який проводять в анаеробних умовах ферментації з використанням дріжджової клітини, де зазначена клітина експресує активність + ацетил-кофермент A-синтетази та активність NAD -залежної ацетилюючої ацетальдегіддегідрогенази, причому зазначена клітина краще позбавлена ферментативної активності, потрібної для біохімічного шляху синтезу гліцерину з вуглеводу, або має знижену ферментативну активність по відношенню до біохімічного шляху синтезу гліцерину з вуглеводу у порівнянні з клітиною S. cerevisiae дикого типу. Краще, відповідно до винаходу, етанол продукується у молярному співвідношенні гліцерин:етанол менш ніж 0,04:1, зокрема, менш ніж 0,02:1, краще, менш ніж 0,01:1. Продукування гліцерину може бути відсутнім (недетектованим), хоча принаймні в деяких варіантах втілення (у яких NADH-залежний синтез гліцерину зменшується, але повністю не зупиняється), певна кількість гліцерину може продукуватися як побічний продукт, наприклад, із співвідношенням гліцерину до етанолу 0,001:1 чи більше. Фігура 1 схематично зображує процедуру генетичної модифікації, яка може бути проведена як частина продукування клітини відповідно до винаходу. Фігура 2 зображує концентрації біомаси та продуктів в анаеробних періодичних культурах -1 -1 різних штамів S. cerevisiae на глюкозі (20 г л ). Оцтова кислота (2,0 г л ) була присутньою на початку ферментації (панелі A, B) або додавалась в момент часу, вказаний стрілкою (панелі C, D). Умови вирощування: T = 30 °C, pH 5,0. Символи: ▲, оптична густина при 660 нм; λ, глюкоза; , етанол; ν, ацетат; ο, гліцерин. На кожному графіку представлені результати одного з двох незалежних паралельних експериментів, які дали дані, що відрізняються менш ніж на 5%. Панель A: S. cerevisiae IME076 (GPD1 GPD2). Панель B: S. cerevisiae IMZ132 (gpd1Δ gpd2Δ з надекспресією гена mhpF E. coli). Панель C: S. cerevisiae IMZ132 (gpd1Δ gpd2Δ з надекспресією гена mhpF E. coli). Панель D: S. cerevisiae IMZ127 (gpd1Δ gpd2Δ), вирощуваний на глюкозі (20 г -1 л ). Даний винахід дозволяє повністю усунути продукування гліцерину, або щонайменше значно зменшити його, шляхом забезпечення рекомбінантної дріжджової клітини, зокрема S. cerevisiae, так щоб вона могла повторно окислювати NADH шляхом відновлення оцтової кислоти до етанолу згідно з NADH-залежними реакціями. Усунення або щонайменше зниження продукування гліцерину не лише є бажаним, але, оскільки продукт, утворюваний при повторному окисненні NADH, також є бажаним продуктом, а саме етанолом, спосіб за винаходом може також забезпечити підвищений вихід продукту (що визначається як % мас. від перетворюваної сировини, тобто, вуглеводу плюс оцтової кислоти, що перетворюються на етанол). Оскільки оцтова кислота звичайно є присутньою у значній кількості в лігноцелюлозних гідролізатах, це робить даний винахід особливо кращим для одержання етанолу з використанням лігноцелюлозної біомаси як джерела зброджуваного вуглеводу. Крім цього, джерела вуглеводу, що можуть містити значну кількість ацетату, включають бурякоцукрові 2 UA 107467 C2 5 10 15 20 25 30 35 40 45 50 55 60 меляси (гідролізати) та крохмальвмісні матеріали (наприклад, відходи процесів сухого помелу кукурудзи, процесів мокрого помелу кукурудзи; відходи процесів крохмало-патокового виробництва, наприклад, з продуктами рециркуляції барди). Винахід сприяє зниженню рівнів інгібуючої сполуки оцтової кислоти, і більша частка гідролізату насправді робиться субстратом для продукування етанолу. Гарні результати були одержані для дріжджової клітини без помітної ферментативної активності, потрібної для NADH-залежного синтезу гліцерину, як продемонстровано у прикладі. Однак, автори винаходу передбачають, що дріжджова клітина відповідно до винаходу, яка виявляє активність NADH-залежного синтезу гліцерину, також може бути краще використана, наприклад, для продукування етанолу. Передбачається, що така клітина може використовувати ацетат для повторного окиснення щонайменше частини NADH. Отже, ацетат може конкурувати зі шляхом NADH-залежного синтезу гліцерину і тим самим потенційно знижувати синтез гліцерину. Більш того, ацетат, присутній у сировині, використовуваній для продукування етанолу, такій як лігноцелюлозний гідролізат, може бути перетворений на етанол, тим самим збільшуючи вихід продукту. Використовувані тут терміни в однині (англійською мовою - з артиклями “a” або “an”) означають “щонайменше один”, якщо не зазначене інше. При посиланні на іменник (наприклад, сполука, домішка і т.д.) в однині розуміється, що він включає форми множини. Отже, при посиланні на конкретний об’єкт, наприклад, "сполука", це означає "щонайменше один" даний об’єкт, наприклад, "щонайменше одну сполуку", якщо не зазначене інше. Термін "або" у використовуваному тут значенні слід розуміти як "та/або". При посиланні тут на карбоксилат, наприклад, ацетат, розуміється, що він включає відповідну карбонову кислоту (спряжену з ним кислоту), а також її сіль, і навпаки. При посиланні на сполуку, для якої існує декілька ізомерів (наприклад, D- та L-енантіомери), сполука в принципі включає усі енантіомери, діастереомери та цис/транс-ізомери цієї сполуки, які можуть бути використані у конкретному способі за винаходом; зокрема, при посиланні на таку сполуку, вона включає природний ізомер (ізомери). Терміни "ферментація", "ферментативний" тощо використовуються тут у класичному значенні, тобто, для зазначення, що процес проводиться або був проведений в анаеробних умовах. Анаеробні умови визначаються тут як умови відсутності кисню, або такі, в яких кисень по суті не споживається дріжджовою клітиною, зокрема, дріжджовою клітиною, і звичайно відповідають споживанню кисню менш ніж 5 ммоль/(л·год), зокрема, споживанню кисню менш ніж 2,5 ммоль/(л·год), або менш ніж 1 ммоль/(л·год). Це звичайно відповідає концентрації розчиненого кисню у культуральному бульйоні менш ніж 5 % насичення повітрям, зокрема, концентрації розчиненого кисню менш ніж 1 % насичення повітрям, або менш ніж 0,2 % насичення повітрям. Термін “дріжджі” або “дріжджова клітина” стосується філогенетично різноманітної групи одноклітинних грибів, більшість яких належать до розділів Ascomycota та Basidiomycota. Брунькотвірні дріжджі ("справжні дріжджі") належать до ряду Saccharomycetales, найкраще відомим видом якого є Saccharomyces cerevisiae. Термін “рекомбінантна (клітина)” у використовуваному тут значенні, стосується штаму (клітин), що містить нуклеїнову кислоту, яка є результатом однієї чи декількох генетичних модифікацій з використанням методики (методик) рекомбінантної ДНК та/або іншої мутагенної методики (методик). Зокрема, рекомбінантна клітина може включати нуклеїнову кислоту, відсутню у відповідній клітині дикого типу, причому нуклеїнова кислота вводиться в цей штам (клітину) з використанням методик рекомбінантної ДНК (трансгенна клітина), або нуклеїнова кислота, відсутня в зазначеному дикому типі, є результатом однієї чи декількох мутацій – наприклад, з використанням методик рекомбінантної ДНК або іншої методики мутагенезу, такої як УФ-опромінювання – в послідовності нуклеїнової кислоти, присутньої у зазначеному дикому типі (такої як ген, що кодує поліпептид дикого типу), або де послідовність нуклеїнової кислоти гена була модифікована так, щоб спрямувати (кодований нею) поліпептидний продукт до іншого клітинного компартмента. Крім того, термін “рекомбінантна (клітина)” стосується, зокрема, штаму (клітини), з якого послідовності ДНК були видалені за допомогою методик рекомбінантної ДНК. Термін “трансгенна (дріжджова) клітина”, у використовуваному тут значенні, стосується штаму (клітини), що містить нуклеїнову кислоту, у природі відсутню в цьому штамі (клітині), яка була введена в даний штам (клітину) за допомогою методик рекомбінантної ДНК, тобто, рекомбінантної клітини. Термін "мутований", у використовуваному тут значенні, по відношенню до білків або 3 UA 107467 C2 5 10 15 20 25 30 35 40 45 50 55 60 поліпептидів означає, що щонайменше одна амінокислота у білковій або поліпептидній послідовності дикого типу або природній була заміщена на іншу амінокислоту, вставлена до або делетована з послідовності шляхом мутагенезу нуклеїнових кислот, що кодують ці амінокислоти. Мутагенез є добре відомим фахівцям способом та включає, наприклад, сайтспрямований мутагенез методом ПЛР або шляхом олігонуклеотид-медійованого мутагенезу, як описано Sambrook et al., Molecular Cloning - A Laboratory Manual, 2nd ed., Vol. 1-3 (1989). Термін "мутований" у використовуваному тут значенні по відношенню до генів означає, що щонайменше один нуклеотид у послідовності нуклеїнової кислоти даного гена або його регуляторній послідовності був заміщений на інший нуклеотид, або був делетований з послідовності шляхом мутагенезу, призводячи до транскрипції білкової послідовності з якісно чи кількісно зміненою функцією або нокауту даного гена. Термін “ген”, у використовуваному тут значенні, стосується послідовності нуклеїнової кислоти, що містить матрицю полімерази нуклеїнової кислоти, в еукаріотах - РНК-полімерази II. Гени транкрибуються в мРНК, яка потім транслюється в білок. Термін "нуклеїнова кислота", у використовуваному тут значенні, включає посилання на дезоксирибонуклеотидний або рибонуклеотидний полімер, тобто, полінуклеотид, в одно- або дволанцюговій формі та, якщо не буде зазначено інше, охоплює відомі аналоги, які виявляють істотні властивості природних нуклеотидів, а саме, гібридизуються з одноланцюговими нуклеїновими кислотами у спосіб, подібний до природних нуклеотидів (наприклад, пептидні нуклеїнові кислоти). Полінуклеотид може мати повну довжину або бути субпослідовністю нативного чи гетерологічного структурного чи регуляторного гена. Якщо не зазначене інше, термін включає посилання на зазначену послідовність, а також її комплементарну послідовність. Таким чином, ДНК або РНК з основними ланцюгами, модифікованими для забезпечення стабільності або з інших причин, є "полінуклеотидами" в тому значенні, що передбачається тут. Крім того, ДНК або РНК, що включають незвичні основи, такі як інозин, або модифіковані основи, такі як тритиловані основи, як лише два приклади, є полінуклеотидами у використовуваному тут значенні терміну. Слід розуміти, що кваліфікованим фахівцям відомі різноманітні модифікації ДНК та РНК, що служать різним корисним цілям. Термін полінуклеотид, як він використовується тут, охоплює такі хімічно, ферментативно або метаболічно модифіковані форми полінуклеотидів, а також хімічні форми ДНК та РНК, характерні для вірусів та клітин, включаючи, поміж іншого, прості та складні клітини. Терміни "поліпептид", "пептид" та "білок" використовуються тут взаємозамінно для позначення полімеру амінокислотних залишків. Терміни стосуються амінокислотних полімерів, у яких один чи декілька амінокислотних залишків є штучними хімічними аналогами відповідної природної амінокислоти, а також природних амінокислотних полімерів. Важливою ознакою таких аналогів природних амінокислот є те, що при їх включенні в білок, цей білок буде специфічно реакційноздатним по відношенню до антитіл, індукованих до такого саме білка, але який складається цілком з природних амінокислот. Терміни "поліпептид", "пептид" та "білок" також охоплюють модифікації, включаючи, без обмеження, глікозилювання, приєднання ліпіду, сульфування, гамма-карбоксилювання залишків глутамінової кислоти, гідроксилювання та АДФрибозилювання. У випадках, коли згадується фермент із посиланням на клас ферменту (EC), клас ферменту є класом, до якого цей фермент належить або може бути віднесений на основі Номенклатури ферментів, розробленої Номенклатурним комітетом (Nomenclature Committee) Міжнародної спілки біохімії та молекулярної біології (International Union of Biochemistry та Molecular Biology, NC-IUBMB), яка розміщена за адресою http://www.chem.qmul.ac.uk/iubmb/enzyme/. Інші придатні ферменти, які не були (ще) віднесені до зазначеного класу, але можуть бути віднесені до нього, важаються включеними до обсягу винаходу. При згадуванні тут білка або послідовності нуклеїнової кислоти, такої як ген, з посиланням на номер доступу, цей номер використовується, зокрема, для позначення білка або послідовності нуклеїнової кислоти (гена), що мають послідовність, яка може бути знайдена за допомогою сайта www.ncbi.nlm.nih.gov/, (станом на 13 червня 2009 р.), якщо не зазначене інше. Будь-яка послідовність нуклеїнової кислоти за даним винаходом, що кодує поліпептид, з посиланням на генетичний код, описує також усі можливі мовчазні варіанти нуклеїнової кислоти. Термін "консервативно модифіковані варіанти" стосується як амінокислоти, так і послідовності нуклеїнової кислоти. По відношенню до конкретної послідовності нуклеїнової кислоти, консервативно модифіковані варіанти стосуються таких нуклеїнових кислот, які кодують ідентичні або консервативно модифіковані варіанти амінокислотних послідовностей внаслідок виродженості генетичного коду. Термін "виродженість генетичного коду" стосується того факту, що велике число функціонально ідентичних нуклеїнових кислот кодують будь-який даний білок. 4 UA 107467 C2 5 10 15 20 25 30 35 40 45 50 55 60 Наприклад, кодони GCA, GCC, GCG та GCU усі кодують амінокислоту аланін. Таким чином, в кожному положенні, у якому кодон позначає аланін, цей кодон може бути змінений на будь-який з описаних відповідних кодонів без зміни кодованого поліпептиду. Такі варіанти нуклеїнової кислоти є "мовчазними варіантами" та належать до одного типу консервативно модифікованих варіантів. Термін “функціональний гомолог” (або скорочено “гомолог”) поліпептиду, що має конкретну послідовність (наприклад, SEQ ID NO: 2), у використовуваному тут значенні, стосується поліпептиду, який включає зазначену конкретну послідовність, за умови, що одна чи декілька амінокислот є заміщеними, делетованими, доданими та/або вставленими, і який має (якісно) таку саме ферментативну функціональність щодо перетворення субстрату, наприклад, гомолог + активності NAD -залежної ацетилюючої ацетальдегіддегідрогенази (EC 1.2.1.10) є здатним перетворювати ацетальдегід на етанол. Випробування цієї функціональності можна провести шляхом використання системи аналізу, яка включає рекомбінантну дріжджову клітину, що містить експресійний вектор для експресії гомолога у дріжджах, причому зазначений експресійний вектор включає гетерологічну послідовність нуклеїнової кислоти, функціонально з’єднану з промотором, який є функціональним у дріжджах, і зазначену гетерологічну послідовність нуклеїнової кислоти, що кодує гомологічний поліпептид, випробування ферментативної активності якого у перетворенні ацетил-коферменту A на ацетальдегід у дріжджовій клітині треба провести, та оцінки, чи відбувається зазначене перетворення у зазначених клітинах. Сполуки-кандидати у гомологи можуть бути ідентифіковані з використанням комп’ютерних (in silico) аналізів подібності. Детальний приклад такого аналізу описаний у Прикладі 2 WO2009/013159. Кваліфікований фахівець буде здатним зрозуміти звідти, яким чином можуть бути визначені придатні сполуки-кандидати гомологів і, необов’язково, після оптимізації кодонів (пар), буде здатним провести випробування необхідної функціональності такої сполуки-кандидата гомолога з використанням придатної системи аналізу, як описано вище. Придатний гомолог є поліпептидом, який має амінокислотну послідовність зі ступенем подібності до конкретного поліпептиду більш ніж 50%, краще, 60 % чи більше, зокрема, щонайменше 70 %, краще, щонайменше 80 %, щонайменше 90 %, щонайменше 95 %, щонайменше 97 %, щонайменше 98 % або щонайменше 99 %, наприклад, має такий ступінь подібності амінокислотної послідовності до SEQ ID NO: 2, і має потрібну ферментативну функціональність перетворення ацетил-коферменту A на ацетальдегід. Що стосується послідовностей нуклеїнової кислоти, термін функціональний гомолог повинен включати послідовності нуклеїнової кислоти, які відрізняються від іншої послідовності нуклеїнової кислоти внаслідок виродженості генетичного коду і кодують таку саме поліпептидну послідовність. Ідентичність послідовності визначається тут як співвідношення між двома чи більше амінокислотними (поліпептидними або білковими) послідовностями або двома чи більше послідовностями нуклеїнової кислоти (полінуклеотиду), визначене шляхом порівняння послідовностей. Звичайно, ідентичності або подібності послідовностей порівнюють по усій довжині порівнюваних послідовностей. У технічній літературі, "ідентичність" також означає ступінь спорідненості амінокислотних послідовностей або послідовностей нуклеїнової кислоти, у відповідиних випадках, визначений шляхом порівняння вирівнюванням ланцюгів таких послідовностей. Кращі способи визначення ідентичності розроблені у такий спосіб, щоб забезпечити найбільший збіг порівнюваних послідовностей. Способи визначення ідентичності та подібності кодифіковані у вигляді загальнодоступних комп’ютерних програм. Кращі способи визначення ідентичності та подібності двох послідовностей за допомогою комп’ютерних програм включають, наприклад, BestFit, BLASTP, BLASTN та FASTA (Altschul, S. F. et al., J. Mol. Biol. 215:403-410 (1990), загальнодоступні від NCBI та з інших джерел (BLAST Manual, Altschul, S., et al., NCBI NLM NIH Bethesda, MD 20894). Кращими параметрами порівняння амінокислотних послідовностй з використанням BLASTP є штраф за відкриття гепу 11,0, штраф за подовження гепу 1, матриця Blosum 62. "Експресія" стосується транскрипції гена в структурну РНК (рРНК, тРНК) або матричну РНК (мРНК) з подальшою трансляцією у білок. У використовуваному тут значенні, "гетерологічний" у посиланні на нуклеїнову кислоту або білок позначає нуклеїнову кислоту або білок, які були одержані від чужорідного виду, або, якщо вони походять від того самого виду, є істотно модифікованими порівняно з їх нативною формою за складом та/або в геномному локусі, внаслідок цілеспрямованого втручання з боку людини. Наприклад, промотор, функціонально з’єднаний з гетерологічним структурним геном, походить від виду, що відрізняється від того, з якого був отриманий структурний ген, або, якщо вони 5 UA 107467 C2 5 10 15 20 25 30 35 40 45 50 55 60 походять від одного виду, то один чи обидва з них є істотно модифікованими порівняно з вихідною формою. Гетерологічний білок може походити від чужорідного виду або, якщо він узятий від того самого виду, бути істотно модифікованим порівняно з його вихідною формою внаслідок цілеспрямованого втручання з боку людини. Термін “гетерологічна експресія” стосується експресії гетерологічної нуклеїнової кислоти у клітині-хазяїні. Експресія гетерологічних білків в системах еукаріотичних клітин-хазяїв, таких як дріжджі, є добре відомою кваліфікованим фахівцям. Полінуклеотид, який включає послідовність нуклеїнової кислоти гена, що кодує фермент з певною активністю, може бути експресований у такій еукаріотичній системі. В деяких варіантах втілення, трансформовані/трансфековані дріжджові клітини можуть бути використані як системи для експресії ферментів. Експресія гетерологічних білків у дріжджах є добре відомою. Sherman, F., et al., Methods in Yeast Genetics, Cold Spring Harbor Laboratory (1982) є добре відомою працею, у якій описуються різні способи, доступні для експресії білків у дріжджах. Двома широко використовуваними дріжджами є Saccharomyces cerevisiae та Pichia pastoris. Вектори, штами та протоколи експресії в Saccharomyces та Pichia є відомими фахівцям та доступними від комерційних постачальників (наприклад, Invitrogen). Придатні вектори звичайно мають контрольні послідовності експресії, такі як промотори, включаючи 3-фосфогліцераткіназу або алкогольоксидазу, та послідовності початку реплікації, термінації і т.ін., за бажанням. У використовуваному тут значенні "промотор" є ДНК-послідовністю, яка керує транскрипцією (структурного) гена. Типово, промотор розташований у 5'-області гена, проксимальній до сайта початку транскрипції (структурного) гена. Промотор послідовності може бути конститутивним, індукованим або репресованим. Якщо промотор є індукованим промотором, то швидкість транскрипції зростає у відповідь на індукуючий агент. Термін “вектор”, у використовуваному тут значенні, включає посилання на аутосомний експресійний вектор та на вектор інтеграції, використовуваний для інтеграції в хромосому.Термін "експресійний вектор" стосується молекули ДНК, лінійної або кільцевої, яка включає сегмент, що кодує потрібний поліпептид під контролем (тобто, функціонально з’єднаним) додаткових сегментів нуклеїнової кислоти, які забезпечують його транскрипцію. Такі додаткові сегменти можуть включати послідовності промотора та термінатора, і можуть необов’язково включати один чи декілька початків реплікації, один чи декілька селектованих маркерів, енхансер, сигнал поліаденілюваня і т.ін. Експресійні вектори звичайно одержують з плазмідної або вірусної ДНК, або вони можуть містити елементи з обох джерел. Зокрема, експресійний вектор включає послідовність нуклеїнової кислоти, яка включає в напрямку від 5'- до 3'-кінця функціонально з’єднані: (a) ділянку ініціації транскрипції та трансляції, що розпізнається дріжджами, (b) кодуючу послідовність потрібного поліпептиду, та (c) ділянку термінації транскрипції та трансляції, що розпізнається дріжджами. “Плазміда" стосується автономно реплікованої екстрахромосомальної ДНК, яка не інтегрована в геном мікроорганізму та звичайно є кільцевою. “Вектор інтеграції” стосується молекули ДНК, лінійної чи кільцевої, яка може бути включена в геном мікроорганізму та забезпечує стабільне успадковування гена, що кодує потрібний поліпептид. Вектор інтеграції звичайно включає один чи декілька сегментв, які включають послідовність гена, що кодує потрібний поліпептид, під контролем (тобто, функціонально з’єднану) додаткових сегментів нуклеїнової кислоти, які забезпечують його транскрипцію. Такі додаткові сегменти можуть включати послідовності промотора та термінатора, і один чи декілька сегментів, які забезпечують включення потрібного гена в геном клітини-мішені, звичайно, шляхом процесу гомологічної рекомбінації. Типово, вектор інтеграції буде таким, який може бути трансфекований у клітину-мішень, але який має реплікон, нефункціональний в цьому організмі. Інтеграція сегмента, що включає потрібний ген, може бути вибрана, якщо цей сегмент буде включати відповідний маркер. У використовуваному тут значенні, термін "функціонально з’єднаний" стосується суміжного розміщення, при якому описувані компоненти перебувають у співвідношенні, що дозволяє їм функціонувати у належний спосіб. Контрольна послідовність, "функціонально з’єднана" з іншою контрольною послідовністю та/або кодуючою послідовністю, є лігованою у такий спосіб, щоб транскрипція та/або експресія кодуючої послідовності досягалася в умовах, сумісних з контрольною послідовністю. Звичайно, функціонально з’єднаний означає, що з’єднані послідовності нуклеїнової кислоти є суміжними і, при необхідності з’єднання двох кодуючих ділянок білка, суміжними та такими, що належать до однієї рамки зчитування. "Клітина-хазяїн" означає клітину, яка містить вектор та підтримує реплікацію та/або експресію вектора. Клітини-хазяїни можуть бути прокаріотичними клітинами, такими як E. coli, або еукаріотичними клітинами, такими як клітини дріжджів, комах, земноводних або ссавців. 6 UA 107467 C2 5 10 15 20 25 30 35 40 45 50 55 60 Краще, клітини-хазяїни є клітинами ряду Actinomycetales, найкраще, дріжджовими клітинами, найкраще, клітинами Saccharomyces cerevisiae. "Трансформація" та "трансформуючий", у використовуваному тут значенні, стосується вставлення екзогенного полінуклеотиду в клітину-хазяїна, незалежно від способу, використовуваного для вставляння, наприклад, прямого поглинання, трансдукції, f-спарювання або електропорації. Екзогенний полінуклеотид може мати вигляд неінтегрованого вектора, наприклад, плазміди, або, альтернативно, може бути інтегрованим в геном клітини-хазяїна. Клітину відповідно до винаходу краще вибирають з групи Saccharomycetaceae, ще краще, з групи клітин Saccharomyces, Zygosaccharomyces та клітин Kluyveromyces. Зокрема, гарні результати були одержані для клітини-хазяїна Saccharomyces cerevisiae. Іншою особливо кращою клітиною є Zygosaccharomyces baillii, зокрема, через її високу толерантність до ацетату та її високу толерантність до етанолу. Крім того, клітина відповідно до винаходу може бути дріжджовою клітиною, вибраною з групи ксилоза-ферментуючих дріжджів, ще краще, видів Pichia, наприклад, Pichia stipitis або Pichia angusta (також відомий як Hansenula polymorpha). В наступному варіанті втілення, клітина-хазяїн відповідно до винаходу є клітиною-хазяїном, яка від природи не має ферментативної активності, потрібної для NADH-залежного синтезу гліцерину, наприклад, дріжджовими клітинами, що належать до виду Brettanomyces intermedius. Краща клітина відповідно до винаходу не має ферментативної активності, потрібної для NADH-залежного синтезу гліцерину або має знижену ферментативну активність по відношенню до NADH-залежного біохімічного шляху синтезу гліцерину з вуглеводу у порівнянні з відповідною дріжджовою клітиною дикого типу. Знижена ферментативна активність може бути досягнута шляхом модифікації одного чи декількох генів, що кодують активність NAD-залежної гліцерин-3-фосфатдегідрогенази (GPD) або одного чи декількох генів, що кодують активність гліцеринфосфатфосфатази (GPP), так щоб фермент експресувався в меншому ступені, ніж у дикого типу, або так, щоб ген кодував поліпептид зі зниженою активністю. Такі модифікації можуть бути здійснені за допомогою загальновідомих біотехнологічних методик, і можуть зокрема включати одну чи декілька нокаутмутацій або сайт-спрямований мутагенез промоторих ділянок чи кодуючих ділянок структурних генів, що кодують GPD та/або GPP. Альтернативно, штами дріжджів з дефектами продукування гліцерину можуть бути одержані шляхом випадкового мутагенезу з подальшим селектуванням штамів зі зниженою або відсутньою активністю GPD та/або GPP. Гени GDP1, GDP2, GPP1 та GPP2 S. cerevisiae наведені у SEQ ID NO: 24-27. Краще, щонайменше один ген, що кодує GPD, або щонайменше один ген, що кодує GPP, є повністю видаленим, або принаймні є делетованою частина гена, що кодує частину ферменту, суттєву для його активності. Зокрема, гарні результати були досягнуті з клітинами S. cerevisiae, у яких були інактивовані відкриті рамки зчитування гена GPD1 ген та гена GPD2. Інактивація структурного гена (гена-мішені) може бути здійснена кваліфікованим фахівцем шляхом штучного синтезу або іншого методу конструювання фрагмента ДНК, який складається з гена селектованого маркера, фланкованого ДНК-послідовностями, ідентичними послідовностям, що фланкують ділянку геному клітини-хазяїна, яка має бути видалена. Зокрема, гарні результати були одержані при інактивації генів GPD1 та GPD2 у Saccharomyces cerevisiae шляхом інтеграції маркерних генів kanMX та hphMX4. Потім цей фрагмент ДНК трансформують в клітину-хазяїна. Трансформовані клітини, які експресують домінантний маркерний ген, перевіряють на точність заміни ділянки, яку планувалося видалити, наприклад, методом діагностичної полімеразної ланцюгової реакції або саузерн-гібридизації. Як було вказано вище, клітина відповідно до винаходу включає гетерологічну послідовність + нуклеїнової кислоти, що кодує NAD -залежну ацетилюючу ацетальдегіддегідрогеназу (EC 1.2.1.10). Цей фермент каталізує перетворення ацетил-коферменту A на ацетальдегід. Таке перетворення може бути представлене рівнянням рівноваги реакції: + + ацетил-кофермент A + NADH + H ↔ ацетальдегід + NAD + кофермент A Таким чином, цей фермент забезпечує можливість повторного окиснення NADH, коли ацетил-кофермент A генерується з ацетату, присутнього у живильному середовищі, і тим самим синтез гліцерину робиться вже не потрібним для врівноважування редокс-кофактора. + Послідовність нуклеїнової кислоти, що кодує NAD -залежну ацетилюючу ацетальдегіддегідрогеназу, може в принципі походити з будь-якого організму, що включає послідовність нуклеїнової кислоти, яка кодує зазначену дегідрогеназу. + Відомі NAD -залежні ацетилюючі ацетальдегіддегідрогенази, які можуть каталізувати NADHзалежне відновлення ацетил-коферменту A до ацетальдегіду, можуть загалом бути поділені на + три типи функціональних гомологів NAD -залежної ацетилюючої ацетальдегіддегідрогенази: 7 UA 107467 C2 5 10 15 20 25 30 35 40 45 50 55 60 1) Біфункціональні білки, які каталізують оборотне перетворення ацетил-коферменту A на ацетальдегід, та подальше оборотне перетворення ацетальдегіду на етанол. Прикладом цього типу білків є білок AdhE в E. coli (Gen Bank No: NP_415757). AdhE, очевидно, є еволюційним продуктом генного злиття. NH2-кінцева ділянка білка AdhE є у високому ступені гомологічною + альдегід:NAD оксидоредуктазам, у той час як COOH-кінцева ділянка є гомологічною сімейству 2+ + Fe -залежних етанол:NAD оксидоредуктаз (Membrillo-Hernandez et al., (2000) J. Biol. Chem. 275: 33869-33875). AdhE E. coli зазнає метал-каталізованого окиснення і тому є чутливою до кисню (Tamarit et al. (1998) J. Biol. Chem. 273:3027-32). 2) Білки, що каталізують оборотне перетворення ацетил-коферменту A на ацетальдегід у суворих або факультативних анаеробних мікроорганізмах, але не виявляють алкогольдегідрогеназної активності. Приклад цього типу білків був описаний для Clostridium kluyveri (Smith et al. (1980) Arch. Biochem. Biophys. 203: 663-675). Ацетилююча ацетальдегіддегідрогеназа була описана у геномі Clostridium kluyveri DSM 555 (GenBank No: EDK33116). Гомологічний білок AcdH ідентифікований у геномі Lactobacillus plantarum (GenBank No: NP_784141). Іншим прикладом цього типу білків є згаданий генний продукту Clostridium beijerinckii NRRL B593 (Toth et al. (1999) Appl. Environ. Microbiol. 65: 4973-4980, GenBank No: AAD31841). 3) Білки, що є частиною біфункціонального комплексу альдолаза-дегідрогеназа, який бере участь в катаболізмі 4-гідрокси-2-кетовалерату. Такі біфункціональні ферменти каталізують дві останні стадії шляху мета-розщеплення катехіну, який у багатьох видах бактерій є проміжним продуктом деградації фенолів, толуатів, нафталіну, біфенілів та інших ароматичних сполук (Powlowski and Shingler (1994) Biodegradation 5, 219-236). 4-Гідрокси-2-кетовалерат спочатку перетворюється 4-гідрокси-2-кетовалератальдолазою на піруват і ацетальдегід, після чого ацетальдегід перетворюється ацетилюючою ацетальдегіддегідрогеназою на ацетил-CoA. Прикладом цього типу ацетилюючої ацетальдегіддегідрогенази є білок DmpF у Pseudomonas sp. CF600 (GenBank No: CAA43226) (Shingler et al. (1992) J. Bacteriol. 174:71 1-24). Білок MphF E. coli (Ferrandez et al. (1997) J. Bacteriol. 179: 2573-2581, GenBank No: NP_414885) є гомологічним білку DmpF Pseudomonas sp. CF600. Придатна послідовність нуклеїнової кислоти може бути знайдена, зокрема, в організмі, вибраному з групи Escherichia, зокрема, E. coli; Mycobacterium, зокрема, Mycobacterium marinum, Mycobacterium ulcerans, Mycobacterium tuberculosis; Carboxydothermus, зокрема, Carboxydothermus hydrogenoformans; Entamoeba, зокрема, Entamoeba histolytica; Shigella, зокрема, Shigella sonnei; Burkholderia, зокрема, Burkholderia pseudomallei, Klebsiella, зокрема, Klebsiella pneumoniae; Azotobacter, зокрема, Azotobacter vinelandii; Azoarcus sp.; Cupriavidus, зокрема, Cupriavidus taiwanensis; Pseudomonas, зокрема, Pseudomonas sp. CF600; Pelomaculum, зокрема, Pelotomaculum thermopropionicum. Краще, послідовність нуклеїнової кислоти, що кодує + NAD -залежну ацетилюючу ацетальдегіддегідрогеназу, походить від Escherichia, ще краще, від E. coli. Особливо придатним є ген mhpF E. coli, або його функціональний гомолог. Цей ген описаний Ferrández et al. (1997) J. Bacteriol. 179:2573-2581. Гарні результати були одержані для S. cerevisiae, до яких був включений ген mhpF E. coli. В наступному кращому варіанті втілення послідовність нуклеїнової кислоти, що кодує (ацетилюючу) ацетальдегіддегідрогеназу, походить з Pseudomonas, зокрема, dmpF з Pseudomonas sp. CF600. + У принципі, послідовність нуклеїнової кислоти, що кодує NAD -залежну ацетилюючу ацетальдегіддегідрогеназу, може бути послідовністю нуклеїнової кислоти дикого типу. + Краща послідовність нуклеїнової кислоти кодує NAD -залежну ацетилюючу ацетальдегіддегідрогеназу, представлену SEQ ID NO: 2, SEQ ID NO: 29, або функціональним гомологом SEQ ID NO: 2 чи SEQ ID NO: 29. Зокрема, послідовність нуклеїнової кислоти включає послідовність, що відповідає SEQ ID NO: 1, SEQ ID NO: 28 або функціональному гомологу SEQ ID NO: 1 чи SEQ ID NO: 28. Крім того, ацетилююча ацетальдегіддегідрогеназа (або послідовність нуклеїнової кислоти, що кодує таку активність) може, наприклад, бути вибраною з групи adhE Escherichia coli, adh2 Entamoeba histolytica, adhE Staphylococcus aureus, E2 adhE Piromyces sp., EDK33116 Clostridium kluyveri, acdH Lactobacillus plantarum, та YP 001268189 Pseudomonas putida. Стосовно послідовностей цих ферментів, послідовностей нуклеїнової кислоти, що кодують ці ферменти, та методик включення послідовності нуклеїнової кислоти у клітину-хазяїна, робиться посилання на WO 2009/013159, зокрема, Приклад 3, Таблиця 1 (сторінка 26) та згадані там ідентифікаційні номери (ID numbers) послідовностей, і Таблиця 1 цієї публікації та послідовності, представлені ідентифікаційними номерами послідовностей, вказаними у зазначеній Таблиці, включені сюди 8 UA 107467 C2 5 10 15 20 25 30 35 40 45 50 55 60 шляхом посилання. Звичайно, клітина відповідно до винаходу також включає ацетил-кофермент A-синтетазу, де цей фермент каталізує утворення ацетил-коферменту A з ацетату. Цей фермент можу бути присутнім у клітині дикого типу, наприклад, у випадку S. cerevisiae, що містить два ізоферменти ацетил-кофермент A-синтетази, кодовані генами ACS1 [SEQ ID NO: 17] та ACS2 [SEQ ID NO: 18] (van den Berg et al (1996) J. Biol. Chem. 271:28953-28959), або клітина-хазяїн може бути забезпечена одним чи декількома гетерологічним геном (генами), що кодують цю активність, наприклад, ген ACS1 та/або ACS2 S. cerevisiae або його функціональний гомолог можуть бути включені у клітину, позбавлену активності ізоферменту ацетил-кофермент A-синтетази. Крім того, зокрема, з погляду ефективного продукування етанолу, але також для + ефективного окиснення NADH, краще, щоб клітина включала NAD -залежну алкогольдегідрогеназу (EC 1.1.1.1). Цей фермент каталізує перетворення ацетальдегіду на етанол. Клітина може від природи включати ген, який кодує таку дегідрогеназу, як у випадку S. cerevisiae (ADH1-5) [SEQ ID NO: 19-23], див. ‘Lutstorf and Megnet. 1968 Arch. Biochem. Biophys. 126:933-944’, або ‘Ciriacy, 1975, Mutat. Res. 29:315-326’), або клітина-хазяїн може бути забезпечена одним чи декількома гетерологічним геном (генами), що кодують цю активність, наприклад, будь-який з або усі гени ADH1-5 S. cerevisiae або їх функціональні гомологи можуть + бути включені у клітину, позбавлену активності NAD -залежної алкогольдегідрогенази. Конкретніше, кращими клітинами відповідно до винаходу є клітини штаму S. cerevisiae, депонованого 16 липня 2009 р. у Centraalbureau voor Schimmelcultures (Utrecht, the Netherlands) за номером CBS125049. В конкретному аспекті, даний винахід спрямований на спосіб одержання рекомбінантної дріжджової клітини відповідно до винаходу. Генетична модифікація клітини, що включає введення однієї чи декількох гетерологічних послідовностей нуклеїнової кислоти у клітину-хазяїна, і звичайно включає мутування (включаючи повну делецію) гена, що кодує ферментативну активність, потрібну для NADHзалежного синтезу гліцерину, може бути основана на звичайному рівні техніки, наприклад, за допомогою стандартних методів генетики та молекулярної біології, загальновідомих фахівцям і описаних раніше (наприклад, Maniatis et al. 1982 “Molecular cloning: a laboratory manual”. Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y.; Miller 1972 “Experiments in molecular genetics”, Cold Spring Harbor Laboratory, Cold Spring Harbor; Sambrook and Russell 2001 "Molecular cloning: a laboratory manual” (3rd edition), Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press; F. Ausubel et al., eds., "Current protocols in molecular biology", Green Publishing and Wiley Interscience, New York 1987). Спосіб за винаходом одержання рекомбінантної дріжджової клітини відповідно до винаходу включає: (a) забезпечення дріжджової клітини, краще, дріжджової клітини, вибраної з групи дріжджових клітин, позбавлених ферментативної активності, потрібної для NADH-залежного синтезу гліцерину, та дріжджової клітини, яка має знижену ферментативну активність по відношенню до синтезу гліцерину у порівнянні з відповідною дріжджовою клітиною дикого типу; (b) одержання сегмента нуклеїнової кислоти, що включає ген, який є гетерологічним по + відношенню до зазначеної дріжджової клітини та кодує фермент з NAD -залежною ацетилюючою ацетальдегіддегідрогеназною активністю, і де зазначений ген є функціонально з’єднаним з промотором, який є функціональним у зазначеній дріжджовій клітині; (c) якщо бажано (наприклад, якщо дріжджова клітина позбавлена активності ацетилкофермент A-синтетази, або активність ацетил-коферменту A-синтетази (синтетаз) у цій клітині обмежує загальну in vivo активність шляху перетворення ацетату на етанол, або вона експресує ацетил-кофермент A-синтетазу у клітинному компартменті, несумісному з її використанням за винаходом), одержання сегмента нуклеїнової кислоти, який включає ген, що є гетерологічним по відношенню до зазначеної дріжджової клітини та кодує фермент, який має активність ацетилкофермент A-синтетази, і де зазначений ген є функціонально з’єднаним з промотором, який є функціональним у зазначеній дріжджовій клітині; + (d) якщо бажано (наприклад, якщо дріжджова клітина не виявляє активності NAD -залежної + алкогольдегідрогенази або активність NAD -залежної алкогольдегідрогенази у такій клітині + обмежує in vivo активність шляху перетворення ацетату на етанол, або експресує NAD залежну алкогольдегідрогеназу в клітинному компартменті, що є несумісним з її використанням за винаходом), одержання сегмента нуклеїнової кислоти, що включає ген, який є гетерологічним + по відношенню до зазначеної дріжджової клітини та кодує фермент, що має активність NAD залежної алкогольдегідрогенази, і де зазначений ген є функціонально з’єднаним з промотором, який є функціональним у зазначеній дріжджовій клітині; та 9 UA 107467 C2 5 10 15 20 25 30 35 40 45 50 55 60 (e) трансформування дріжджової клітини зазначеним сегментом або сегментами нуклеїнової кислоти з одержанням рекомбінантної дріжджової клітини, яка експресує зазначений гетерологічний ген і де зазначена рекомбінантна дріжджова клітина демонструє знижений NADH-залежний синтез гліцерину в умовах ферментації у порівнянні з відповідною нерекомбінантною дріжджовою клітиною, або де у зазначеній дріжджовій клітині NADHзалежний синтез гліцерину в умовах ферментації є відсутнім. Промотори для дріжджових клітин є відомимими фахівцям і можуть бути, наприклад, промоторами TPI1 тріозофосфатдегідрогенази, промоторами TDH3 гліцеральдегід-3фосфатдегідрогенази, промоторами TEF1 фактора елонгації трансляції EF-1 альфа, промоторами ADH1 алкогольдегідрогенази, промоторами gpdA та ZWF1 глюкоза-6фосфатдегідрогенази, промоторами протеази, такими як pepA, pepB, pepC, промоторами glaA глюкоамілази, промоторами амілази amyA, amyB, промоторами catR або catA каталази, промотором goxC глюкозооксидази, промотором lacA бета-галактозидази, промотором aglA альфа-глюкозидази, промотором tefA фактора елонгації трансляції, промоторами ксиланази, такими як xlnA, xlnB, xlnC, xlnD, промоторами целлюлази, такими як eglA, eglB, cbhA, промоторами регуляторів транскрипції, такими як areA, creA, xlnR, pacC, prtT тощо, або будьякими іншими, і можуть бути знайдені, поміж іншого, на веб-сайті NCBI (http://www.ncbi.nlm.nih.gov/entrez/). В кращому варіанті втілення, гетерологічна послідовність нуклеїнової кислоти призначена для введення у дріжджову клітину при одержанні рекомбінантної дріжджової клітини за винаходом, включається у вектор, і трансформація клітини здійснюється за допомогою вектора. Якщо має бути введено декілька гетерологічних послідовностей нуклеїнової кислоти (які кодують різні ферментативні активності або разом кодують одну ферментативну активність), то ці послідовності нуклеїнової кислоти можуть бути присутніми в одному векторі, або ці послідовності нуклеїнової кислоти можуть бути включені як частини різних векторів. Відповідно, винахід додатково стосується вектора для експресії гетерологічного поліпептиду в дріжджовій клітині, зокрема, дріжджовій клітині, причому зазначений експресійний вектор включає одну чи декілька гетерологічних послідовностей нуклеїнової кислоти, функціонально з’єднаних з промотором, який є функціональним у дріжджовій клітині, і зазначеною гетерологічною послідовністю (послідовностями) нуклеїнової кислоти, що кодують поліпептид, який має ферментативну активність перетворення ацетил-коферменту A на ацетальдегід у (цитозолі) зазначеної дріжджової клітини, де зазначений поліпептид краще включає послідовність, що відповідає SEQ ID NO: 2 або її функціональному гомологу. Вектор (використовуваний у способі) за винаходом може бути фаговим вектором, бактеріальним вектором, центромерним, епісомальним або інтегруючим плазмідним вектором або вірусним вектором. В кращому варіанті втілення вектор є вектором для експресії у Saccharomyces, зокрема, S. cerevisiae. В такому варіанті втілення, гетерологічна послідовність нуклеїнової кислоти, що + кодує активність NAD -залежної ацетилюючої ацетальдегіддегідрогенази, може бути оптимізована за частотою використання кодонів (кодонових пар) для експресії у Saccharomyces, зокрема, S. cerevisiae, хоча гарні результати були досягнуті для кодуючої послідовності нуклеїнової кислоти дикого типу. Для досягнення оптимальної експресії у конкретній клітині (такій як S. cerevisiae), частота використання кодонів (пар) гетерологічного гена може бути оптимізована шляхом використання будь-якого з різноманітних пакетів программ для розробки схем синтезу генів, наприклад, ® GeneOptimizer фірми Geneart AG (Regensburg, Germany) для оптимізації частоти використання кодонів або оптимізації частоти використання кодонових пар, як описано у PCT/EP2007/05594. Така адаптація використання кодонів забезпечує, щоб гетерологічні гени, які мають, наприклад, бактеріальне походження, ефективно оброблялися механізмами транскрипції та трансляції дріжджів. Оптимізація частоти використання кодонових пар приведе до підвищеної експресії білка у дріжджовій клітині. Оптимізовані послідовності можуть, наприклад, бути клоновані в мультикопійну плазміду для експресії у дріжджах, функціонально з’єднану з (краще, конститутивним) промотором, функціональним у грибах (дріжджах). Як зазначено вище, винахід додатково стосується одержання етанолу. Для способу одержання етанолу використовується клітина відповідно до винаходу, яка в анаеробних умовах ферментує цукор, утворюючи при цьому етанол. Придатні дріжджові клітини для ферментації цукру є загальновідомими та включають, поміж інших, S. cerevisiae. У способі + за винаходом використовується дріжджова клітина, яка також продукує NAD -залежну ацетилюючу ацетальдегіддегідрогеназу (EC 1.2.1.10). Ця клітина може бути одержана, як описано вище та проілюстровано у наведених далі прикладах. При використанні для одержання 10 UA 107467 C2 5 10 15 20 25 30 35 40 45 50 55 60 етанолу, клітина краще також включає активність ацетил-кофермент A-синтетази. При + використанні для одержання етанолу, клітина краще також включає активність NAD -залежної алкогольдегідрогенази. Ці активності можуть бути присутніми від природи, як у S. cerevisiae, або забезпечені шляхом генетичної модифікації (також див. вище). Умови ферментації можуть, у принципі, бути основані на загальновідомих умовах, наприклад, як описано в огляді Van Maris, згаданому вище, або в наведених у ньому посиланнях, за умови, що середовище, у якому проводять ферментацію, типово включає ацетат на додаток до зброджуваного вуглеводу (вуглеводів). Молярне співвідношення ацетату до вуглеводів, споживаних анаеробними культурами дріжджових клітин, модифікованих відповідно до винаходу, звичайно становить щонайменше 0,004, зокрема, щонайменше 0,01, щонайменше 0,03, щонайменше 0,1, або щонайменше 0,2. Молярне співвідношення ацетату до вуглеводів, присутніх у гідролізатах лігноцелюлозної біомаси, звичайно становить менш ніж 0,70, зокрема, 0,5 чи менше, конкретніше, 0,3 чи менше, або 0,2 чи менше. В даному описі число молей вуглеводу основано на моносахаридних ланках, тобто, один моль оліго/полісахариду, що містить n моносахаридних ланок, враховується як n моль. В абсолютних величинах, концентрація зброджуваного вуглеводу звичайно має значення в інтервалі від 65 до 400 г/л, зокрема, в інтервалі значень від 100 до 250 г/л. В абсолютних величинах, концентрація ацетату звичайно має значення в інтервалі від 0,5 до 20 г/л, зокрема, в інтервалі значень 1-15 г/л, конкретніше, в інтервалі значень від 2 до 12 г/л. Величина pH може бути вибрана в залежності від прийнятної для використовуваного організму, на основі відомого рівня техніки, або може бути визначена звичайними методами. Звичайно, ферментація проводиться при нейтральному або кислотному pH, зокрема, при величині pH в інтервалі значень 2-7, конкретніше, при pH 3-6, ще конкретніше, 3,5-5,5 (видимий pH, виміряний у середовищі ферментації при температурі, за якої відбувається ферментація). Температура може бути вибрана в залежності від прийнятної для організму, що використовується. Звичайно, температура має значення в інтервалі 15-50 °C, зокрема, в інтервалі значень 25-45 °C. Як зброджуваний вуглевод у принципі може бути використаний будь-який вуглевод, що зазнає метаболізму у конкретній рекомбінантній клітині, з утворенням етанолу як продукту метаболізму. Клітина може від природи включати потрібну систему метаболічних ферментів або клітина може бути генетично модифікована з цією метою, наприклад, як описано в огляді Van Maris, наведених в ньому посиланнях, або як описано в даному документі. Краще, зброджувані вуглеводи у гідролізаті включають щонайменше один вуглевод, вибраний з групи гексоз, пентоз та олігосахаридів, що включають один чи декілька гексозних та/або пентозних ланок. Зокрема, у випадку рекомбінантної клітини, що належить до групи Saccharomyces, краще, S. cerevisiae, використовується щонайменше один вуглевод, вибраний з глюкози, фруктози, сахарози, мальтози, галактози, ксилози, арабінози та манози. Гарні результати були одержані для глюкози. Спосіб відповідно до винаходу, зокрема, є придатним для одержання етанолу з використанням гідролізату щонайменше одного полімеру, вибраного з целюлози, геміцелюлози та пектину, краще, щонайменше одного полімеру, вибраного з геміцелюлози та пектину, тому що при гідролізі цих полімерів ацетат типово вивільняється в результаті гідролізу або утворюється як продукт розкладу. Зокрема, гідролізат може бути гідролізованим лігноцелюлозним матеріалом, таким як лігноцелюлозна біомаса. Наприклад, лігноцелюлозний матеріал може бути вибраний з сільськогосподарського лігноцелюлозного матеріалу, наприклад, бавовни, соломи, (слонової) трави, багаси, кукурудзяної соломи, лігноцелюлозного матеріалу водяних рослин, вижимок цукрового буряку, шкірок цитрусових, лігноцелюлозних матеріалів лісового господарства, таких як лігноцелюлозні відходи дерев чи кущів (матеріали обрізання/обрубування/підрізання рослин, тирса тощо), або дерев чи кущів, спеціально вирощуваних як джерело лігноцелюлозних матеріалів, наприклад, тополь, (лігно)целюлозних відходів промисловості, наприклад, деревної маси, макулатури. Краще, лігноцелюлозний гідролізат включає один чи декілька зброджуваних цукрів (зокрема, глюкозу, ксилозу та арабінозу) і ацетат, що утворився під час гідролізу. Таким чином, в кращому варіанті втілення винаходу, одержання етанолу включає стадію, на якій лігноцелюлозний матеріал гідролізують, з утворенням при цьому гідролізату, який містить один чи декілька зброджуваних вуглеводів, зокрема, глюкозу та, необов’язково, одну чи декілька інших гексоз та пентоз, і ацетат, і цей гідролізат потім вводять в контакт з рекомбінантною клітиною за винаходом. Відносні концентрації ацетату та зброджуваних вуглеводів у субстраті, який вводять в контакт з рекомбінантною клітиною за винаходом, можуть бути модифіковані шляхом 11 UA 107467 C2 5 10 15 оптимізації умов гідролізу, шляхом змішування різних гідролізатів та/або змішування з (частково) очищеними джерелами вуглеводів та/або оцтовою кислотою. Придатна методика гідролізу може бути основана на зазначеному вище огляді Van Maris, або на згадуваних в ньому посиланнях, та включає ферментативний гідроліз, термічний гідроліз, хімічний гідроліз та їх комбінації. Полімери звичайно гідролізують до ступеня. який відповідає деградації щонайменше 50 %, краще, щонайменше 90 %, зокрема, щонайменше 95 %, ланцюгів до моносахаридних ланок або до моносахаридних ланок та дисахаридних ланок. Винахід буде далі проілюстрований такими прикладами: ПРИКЛАДИ ПРИКЛАД 1 Матеріали та способи Конструювання та підтримування штаму Використовувані штами Saccharomyces cerevisiae (Таблиця 1) походять з сімейства CEN.PK, яке було раніше ідентифіковане як придатний вихідний матеріал для комбінованих генетичних та фізіологічних досліджень (van Dijken et al. (2000) Enzyme Microb. Technol. 26:706-714). Таблиця 1 Використовувані штами Saccharomyces cerevisiae Штам Відповідіний генотип CEN.PK113-5D MATa ura3 GPD1 GPD2 IME076 (еталон) Джерело/посилання Колекція штамів EUROSCARF, Frankfurt, Germany MATa ura3 GPD1 GPD2 p426_GPD(URA3) Колекція штамів EUROSCARF, Frankfurt, Germany MATa ura3 leu2 gpd1(-1,1133):loxP-KanMX-loxP BIRD Engineering, RWB0094 gpd2(-2,1281):hphMX4 Rotterdam MATa ura3 leu2 gpd1(-1,1133):loxP gpd2(IMZ008 2,1281):hphMX4 YEplac181(LEU2) Депонований у MATa ura3 leu2 gpd1(-1,1133):loxP gpd2(Centraalbureau voor IMZ132 (CBS125049) 2,1281):hphMX4 YEplac181(LEU2) Schimmelcultures 16 липня pUDE43(URA3 pTHD3:mhpF (E.coli):CYC1t) 2009 р. MATa ura3 leu2 gpd1(-1,1133):loxP gpd2Δ(IMZ127 2,1281):hphMX4 YEplac181(LEU2) p426_GPD(URA3) CEN.PK102-3A 20 25 MATa ura3 leu2 GPD1 GPD2 Для розриву гена GPD1 (YDL022W), касета розриву loxP-KanMX-loxP може бути ампліфікована методом ПЛР згідно з Güldener et al. (1996, Nucleic Acids Res. 24:2519-2524), з використанням набору праймерів, що містить 45-нуклеотидні фланкуючі ділянки, гомологічні послідовностям, що містяться у гені GPD1, та приблизно 20-нуклеотидну ділянку, гомологічну послідовностям модуля розриву pUG6 (Güldener et al. (1996) Nucleic Acids Res. 24:2519-2524) (Фігура 2, Аналогічно, плазміда pAG32 ((Goldstein та McCusker (1999) Yeast 15:1541-1553) може бути використана як матриця для ПЛР-ампліфікації модуля розриву hphMX4. Для конструювання касети розриву GPD2 (YOL059W) може бути використаний набір праймерів, що містить 45-нуклеотидні фланкуючі ділянки, гомологічні послідовностям, що входять до гена GPD2, та послідовність 20 нуклеїнових кислот, гомологічну послідовностям модуля розриву pAG32 (Таблиця 2). 12 UA 107467 C2 Таблиця 2 Олігонуклеотиди для інактивації генів GPD1 та GPD2 і для верифікації точності розриву методом діагностичної ПЛР. Олігонуклеотиди розриву гена; нуклеотиди, гомологічні послідовності, розташованій зліва (5’-бік) або справа (3’-бік) від генів, що мають бути видалені, вказані великими літерами; маленькі літери позначають нуклеотиди, гомологічні послідовності касет розриву. Ген-мішень GPD2/YOL059W fw fw (прямий) 5’TCAATTCTCTTTCCCTTTCCTTTTCCT 5’TTGTACACCCCCCCCCTCCAC TCGCTCCCCTTCCTTATC AAACACAAATATTGATAATATAAA ccaggctgaagcttcgtacg cagctgaagcttcgtacgc [SEQ ID NO: 7] Праймери [SEQ ID NO: 5] rv розриву гена rv (зворотний) 5’GTGTCTATTCGT 5’AATCTAATCTTCATGTA CATCGATGTCTAGCTCT GATCTAATTCTTCAAT TCAATCATCTCCGGTAG CATGTCCGGCGgcataggccactagtggatctg gcataggccactagtggatc [SEQ ID NO: 6] [SEQ ID NO: 8] fw 5’ GPD1 fw 5’ GPD2 Праймери 5’ CCCACCCACACCACCAATAC 5’ GTTCAGCAGCTCTTCTCTAC верифікації - [SEQ ID NO: 9] [SEQ ID NO: 11] специфічні до rv 3’ GPD1 rv 3’ GPD2 гена-мішені 5’CGGACGCCAGATGCTAGAAG 5’ CCAAATGCGACATGAGTCAC [SEQ ID NO: 10] [SEQ ID NO: 12] fw KANB Fw KANB Праймери 5’CGCACGTCAAGACTGTCAAG 5’CGCACGTCAAGACTGTCAAG верифікації [SEQ ID NO: 13] [SEQ ID NO: 15] специфічні до rv KANA rv KANA касети 5’ TCGTATGTGAATGCTGGTCG 5’ TCGTATGTGAATGCTGGTCG розриву [SEQ ID NO: 14] [SEQ ID NO: 16] 5 10 15 20 25 GPD1/YDL022W Трансформація ампліфікованих методом ПЛР касет розриву GPD1 та GPD2 в штам Saccharomyces cerevisiae CEN.PK102-3A (Таблиця 1) може бути здійснена згідно з протоколами, описаними Güldener et al. (Nucleic Acids Res. (1996) 24:2519-2524), з подальшою селекцією трансформантів на комплексному середовищі YPD (Burke et al. (2000) Methods in yeast genetics. Cold Spring Harbour Press Plainview, NY), з 200 мг/л G-418 для штамів, трансформованих касетою розриву KanMX та 300 мг/л гігроміцину B для штамів, трансформованих касетою розриву hphMX4. Підтвердження точності інтеграції касети розриву гена GPD1 можна перевірити методом ПЛР колоній, з використанням комбінацій наборів праймерів 5’GPD1\KANA та 3’GPD1\KANB (Таблиця 2). Точність інактивації GPD2 може бути аналогічно верифікована з набором праймерів 5’ GPD2\KANA та 3’GPD2\KANB (Таблиця 2). Штам RWB0094, який несе делеції у відкритих рамках зчитування генів GPD1 та GPD2 штаму CEN.PK102-3A (MATa ura3 leu2), що були заміщені на касету loxP-KanMX-loxP та касету hphMX4, відповідно, був придбаний у фірми BIRD Engineering, Rotterdam, The Netherlands. Маркер KanMX штаму RWB0094 був видалений шляхом експресії Cre-рекомбінази (Güldener et al. (1996) Nucleic Acids Res. 24:2519-2524), а його лейцинова ауксотрофія була доповнена трансформацією плазмідою YEPlac181, що несе LEU2 (Gietz, R.D. and S. Akio. (1988) Gene 74:527-534), з утворенням штаму IMZ008. Фігура 1 2 схематично зображує процедуру розриву гена, заміщення ORF (відкритої рамки зчитування) GPD1 на KanMX та ORF GPD2 на hphMX4. Стрілки вказують олігонуклеотидні праймери для верифікації методом діагностичної ПЛР точності інактивації гена. Трансформація штаму IMZ008 mhpF експресійною плазмідою pUDE43, що несе URA3bearing (див. нижче) дала прототрофний mhpF-експресуючий штам IMZ132, трансформація "пустим" вектором p426_GPD, що несе URA3, дала штам IMZ127. Зрештою, трансформація штаму CEN.PK113-5D (ura3) за допомогою p426_GPD дала прототрофний GPD1 GPD2 референс-штам IME076. Культури, трансформовані за допомогою касет делеції, висіювали на -1 -1 комплексне середовище YPD, що містить G418 (200 мг л ) або гігроміцин (200 мг л ). Успішну 13 UA 107467 C2 5 10 15 20 25 30 35 40 45 50 55 60 інтеграцію касет делеції підтверджували методом діагностичної ПЛР. Маточні культури усіх штамів вирощували в струшуваних колбах, що містять 100 мл -1 синтетичного середовища (див. нижче) з 20 г л глюкози як джерелом вуглецю. Після додавання 30 % (об./об.) гліцерину, 1-мл аліквоти стаціонарної фази культури зберігають при 80 °C. Конструювання плазміди Ген mhpF E. coli (номер доступу EMBL Y09555.7) піддають ПЛР-ампліфікації з геномної ДНК штаму JM109 E. coli K12 з використанням пар праймерів mhpF-FW (5’-GGGGACAAGTTTGTACAAAAAAGCAGGCTATGAGTAAGCGTAAAGTCGCCATT-ATCGG-3’ [SEQ ID NO: 3]) та mhpF-RV (5’-GGGGACCACTTTGTACAAGAAAGCTGGGTGTTCATGCCGCTTCTCCTGCCTTGC-3’, [SEQ ID NO: 4]), які містять послідовності attB1 та attB2, відповідно. Полімеразну ланцюгову реакцію (ПЛР) проводять з використанням ® ДНК-полімерази Phusion Hot Start High-Fidelity (Finnzymes Oy, Espoo, Finland) згідно з інструкціями виробника в термоциклері Biometra TGradient (Biometra, Göttingen, Germany) з такими параметрами: 25 циклів по 10 с денатурації при 98 °C та 30 с відпалу та подовження при 72 °C. Продукт ПЛР розміром 1011 п.о. був клонований з використанням технології клонування ® Gateway (Invitrogen, Carlsbad, CA, USA). Плазміда pDONR221, шляхом проведення BP-реакції, була використана для створення вихідного вектора (entry clone), позначеного як плазміда pUD64. З цього вихідного вектора та мультикопійної плазміди pAG426GPD-ccdB (Addgene, Cambridge, MA, USA) була сконструйована дріжджова експресійна плазміда pUDE43 шляхом проведення LR-реакції. Трансформації продуктів реакції рекомбінації в компетентний штам TM JM109 E. coli K12 здійснювали за допомогою набору для трансформації E. coli Z-Competent (Zymoresearch Corporation, Orange, USA) та висіювали на середовище LB, що містить ампіцилін -1 -1 (100 мг л ) або канаміцин (50 мг л ). Трансформації дріжджів проводять згідно з Burke et al. (Methods in yeast genetics (2000) Cold Spring Harbor Laboratory Press Plainview, NY). Після трансформації дріжджовою експресійною плазмідою, клітини висіювали на синтетичні середовища. Успішну інсерцію мультикопійної плазміди pUDE43 підтверджували методом діагностичної ПЛР з використанням пар праймерів для клонування. Культивація та середовища Культивацію у струшуваних колбах проводили при 30 °C у синтетичному середовищі (46). Величину pH середовища доводили до 6,0 за допомогою 2M KOH перед стерилізацією. -1 Попередні культури готували шляхом інокуляції 100 мл середовища, що містить 20 г л глюкози, в струшуваній колбі на 500 мл з використанням (1 мл) замороженої маточної культури. ® Після 24 год. інкубації при 30 °C в інкубаторі-струшувачі Innova (200 об/хв, New Brunswick Scientific, NJ, USA), культури переносили в біореактори. Анаеробну періодичну ферментацію проводили при 30 °C в 2-літрових лабораторних біореакторах (Applikon, Schiedam, The Netherlands) з робочим об’ємом 1 літр. Для усіх -1 ферментацій використовували синтетичне середовище з 20 г л глюкози (46) та з додаванням -1 100 мкл л силіконового антиспінювача (Silcolapse 5020, Caldic Belgium, Bleustar Silicones), а -1 -1 також з анаеробними факторами росту, ергостеролом (0,01 г л ) та Tween 80 (0,42 г л ), розчиненими в етанолі. Це давало 11-13 мМ етанолу у середовищі. Де зазначено, оцтову -1 кислоту додавали у концентрації 2 г л і pH доводили до 5,0 перед інокуляцією. Значення pH культури підтримували рівним 5,0 шляхом автоматичного додавання 2M KOH. Культури -1 -1 перемішували при 800 об/хв та продували 0,5 л хв азоту (
ДивитисяДодаткова інформація
Назва патенту англійськоюFermentative glycerol-free ethanol production
Автори англійськоюPronk, Jacobus Thomas, van Maris, Antonius Jeroen Adriaan, Guadalupe Medina, Victor Gabriel
Автори російськоюПронк Якобус Томас, ван Марис Антониус Джероен Адриан, Гвадалупе Медина Виктор Габриель
МПК / Мітки
МПК: C12N 9/02, C12N 1/18, C12P 7/10, C12N 15/53, C12P 7/06
Мітки: продукування, безгліцеринове, ферментативне, етанолу
Код посилання
<a href="https://ua.patents.su/28-107467-fermentativne-bezglicerinove-produkuvannya-etanolu.html" target="_blank" rel="follow" title="База патентів України">Ферментативне безгліцеринове продукування етанолу</a>
Попередній патент: Спосіб покращення біодоступності латанопросту
Наступний патент: Нова дельта-9-елонгаза для одержання олій, збагачених поліненасиченими жирними кислотами
Випадковий патент: Система динамічного захисту лобових частин башти бойової машини