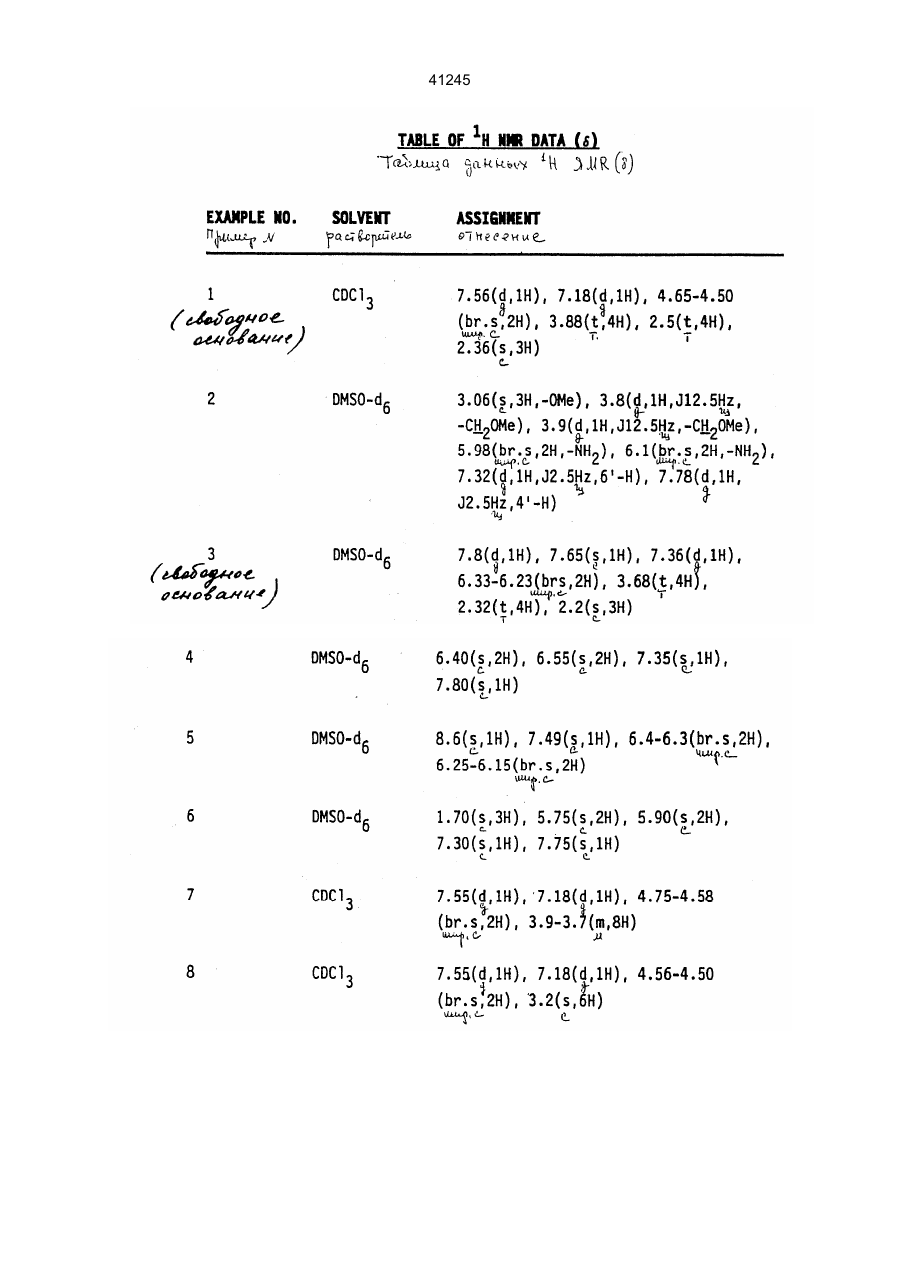
Похідні піримідину, спосіб їх одержання та фармацевтична композиція на їх основі
Номер патенту: 41245
Опубліковано: 17.09.2001
Автори: Річард Мартін Гайд, Елістейр Ейнслі Міллер, Малькольм Стюарт Ноббз, Майкл Джон Ліч
Формула / Реферат
1. Производные пиримидина общей формулы (I):
где R представляет собой NH2, N-алкиламино, N, N -диалкиламино,
R2 представляет собой NH2
R3 представляет собой трифторметил или СН2Х, в котором Х представляет собой (С1-С6)алкокси, фенокси, бензилокси, гидрокси или галоген,
R4 и R5 каждый означает галоген,
R6-R8 каждый представляет водород, и их фармацевтические приемлемые кислотно-аддитивные соли.
2. Соединение по п. 1, в котором R3 представляет собой фторметил.
3. Соединение по п. 1, в котором R4 и R5 каждый представляет собой хлор.
4. Соединение по п. 1, в котором
R1 представляет собой NH2, N-этиламино или N, N -диметиламино, R2 представляет собой NH2,
R3 выбирают из группы, включающей трифторметил, бензилоксиметил и метоксиметил,
R4 и R5 каждый представляет собой хлор.
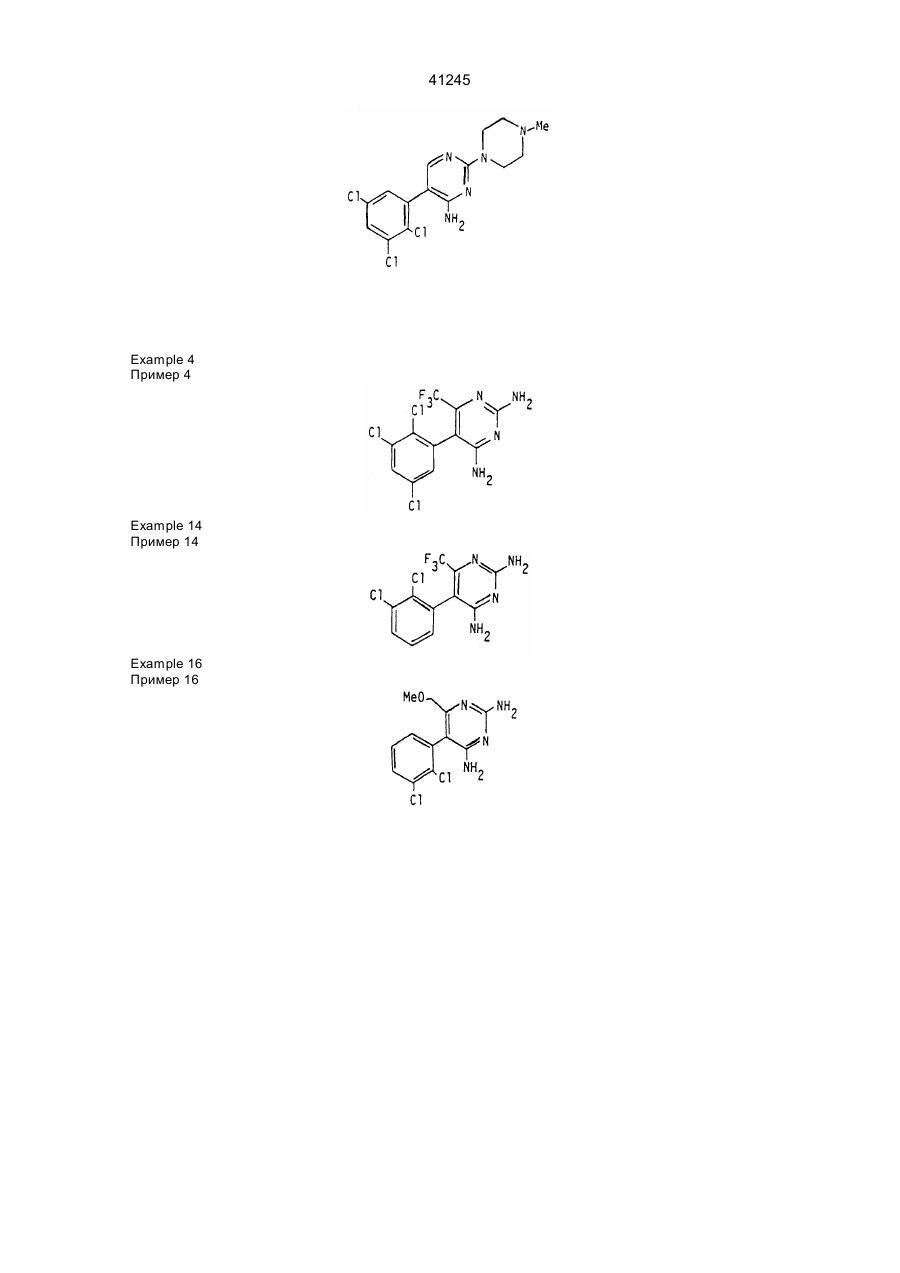
5. Соединение по п. 1, выбранное из группы, включающей
2,4-диамино-5-(2,3-дихлорфенил)-6-трифторметилпиримидин,
2,4-диамино-5-(2,3-дихлорфенил)-б-метоксиметилпиримидин,
2,4-диамино-5-(2,3-дихлорфенил)-б-фторметилпиримидин,
2,4-диамино-5-(2,3-дихлорфенил)-6-феноксиметилпиримидин,
2,4-диамино-5-(2,3-дихлорфенил)-б-гидроксиметилпиримидин и их
фармацевтически приемлемые кислотно-аддитивные соли.
6. Способ получения производных пиримидина общей формулы (I),
значение которой определено в п. 1, или их фармацевтически приемлемых
кислотно-аддитивных солей, отличающийся тем, что осуществляют
взаимодействие соединения формулы (II) или (V):
где R3-R8 принимают значения, определенные в п. 1,
R10 и R11 оба представляют собой алкил или вместе образуют группу -(C(R)2)n-, в которой R представляет собой водород или алкил и n принимает значение целого числа от 2 до 4,
L представляет собой уходящую группу,
Y представляет собой цианогруппу, с соединением формулы (III):
где R1 принимает значения, определенные в п. 1, выделяют образующееся производное пиримидина формулы (І) в виде свободного основания или в виде его кислотно-аддитивной соли и необязательно превращают основание в его кислотно-аддитивную соль или в другое производное пиримидина формулы (I) или его фармацевтически приемлемую кислотно-аддитивную соль.
7. Способ по п. 6, отличающийся тем, что L означает (С1-С4)алкокси.
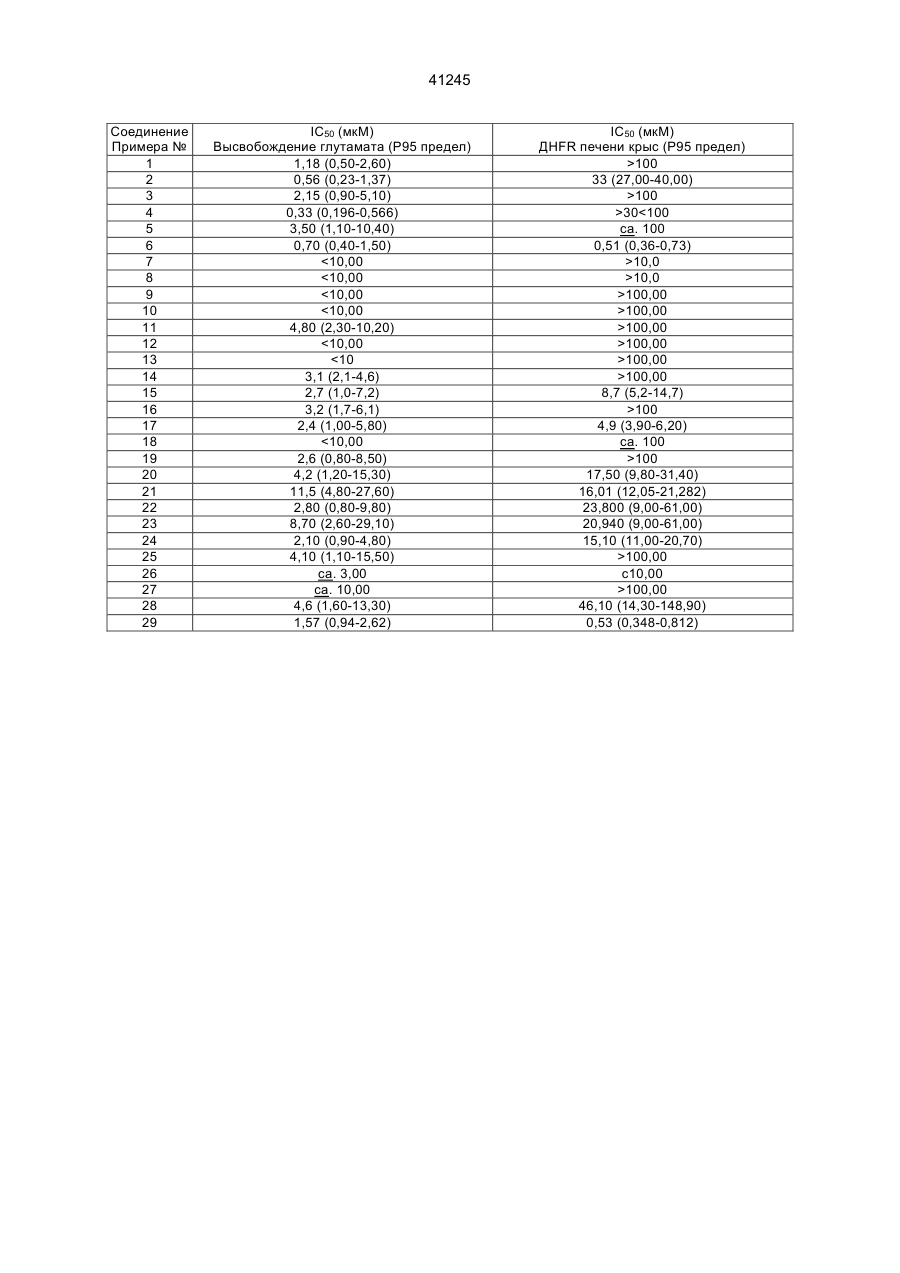
8. Фармацевтическая композиция, обладающая активностью в качестве ингибитора высвобождения глутамата и включающая активный ингредиент и его фармацевтически приемлемый носитель, отличающаяся тем, что в качестве активного ингредиента содержит эффективное количество производного пиримидина формулы (I) или его фармацевтически приемлемой кислотно-аддитивной соли, как определено в любом из п.п. 1-5.
9. Соединение по любому из п.п. 1 - 5, обладающее ингибирующей высвобождение глутамата активностью.
Приоритет по признакам и пунктам:
07.12.88- по п. 1, где производное пиримидина формулы (I) имеет значение R3, представляющее собой трифторметил, и по п. 3.
18.08.89-по п. 2.
07.12.88 - по п. 4, где пиримидин формулы (I) имеет значение R1 = NH2 и R3 - трифторметил.
14.04.89 - если значение R1 = NH2 и R3 - метоксиметил.
07.12.88 - по п. 5 - 2,4-диамино-5-(2,3-дихлорфенил)-6-трифторметилпиридин.
14.04.89 - по п. 5 - 2,4-диамино-5-(2,3-дихлорфенил)-6-метоксиметилпиримидин.
18.08.89 - по п. 5 - 2,4-диамино-5-(2,3-дихлорфенил)-6-фторметилпиридин и 2,4-диамино-5-(2,3-дихлорфенил)-6-гидроксиметилпиримидин.
07.12.88 - по п. б - при использовании соединений формулы (II).
14.04.89, 18.08.89 - в зависимости от приоритета получаемых соединений формулы (I) по п.п. 1 - 5.
Текст
41245 Настоящее изобретение относится к классу соединений пиримидина, которые пригодны для лечения заболеваний и расстройств центральной нервной системы (ЦНС), например, для предот-вращения церебральных ишемических поражений, к содержащим их фармацевтическим композициям, к их применению при лечении таких рас-стройств и к способам их получения. Глутамат является возбуждающей аминокис-лотой, которая действует как нейротрансмиттер. Однако, если его внеклеточная концентрация дос-таточно высока, глутамат действует как сильный нейротоксин, способный убивать нейроны в цен-тральной нервной системе (Rothman and Olney, 1968, Prog. Brain. Res. 63, 69). Нейротическое дей-ствие глутамата включено в ряд заболеваний и расстройств центральной нервной системы, вклю-чая церебральное ишемическое поражение, эпи-лепсию и такие хронические нейродегенератив-ные расстройства, как болезнь Алцмейера, рас-стройства двигательной системы и хорея Хантинг-тона (Meldrum Clinical Science, 1985, 68, 113-122). Кроме того, глутамат был включен в другие ней-рологические расстройства, такие как маниакаль-ная депрессия, депрессия, шизофрения, невроло-гический синдром высокого давления, хрониче-ская боль, тригеминальная невралгия и мигрень. В Европейской патентной заявке № 21121 раскрыта группа 3,5-диамино-6-(замещенный фе-нил)-1,2,4триазинов, которые активны при лечении ЦНС заболеваний, например, при лечении эпилепсии. Одно из соединений, описанных в этой заявке, 3,5-диамино-6-(2,3-дихлорфенил)-1,2,4-триазин-(ламотригин), как было показано, ингиби-рует высвобождение возбуждающих аминокислот, глутамата и аспартата (Zeach et. Al. Epilepsia 27, 490-497 1986, A. A. Miller et. al. New anticonvulsant drugs. Ed. Meldrum and Porter, 1965-177, 1987). Авторы настоящего изобретения обнаружили, что ряд замещенных соединений пиримидина, как определено в формуле І, являются потенциаль-ными ингибиторами высвобождения глутамата; эти соединения полезны при лечении вышеука-занных ранее заболеваний и расстройств цен-тральной нервной системы. Соединения пирими-дина формулы І также являются ингибиторами высвобождения аспартата. Таким образом, в первом аспекте настоящего изобретения предложено использование соединения формулы І или его соли присоединения кис-лоты при изготовлении медикаментов для лече-ния или предотвращения заболеваний или рас-стройств ЦНС у млекопитающихся, где (І) в форме 1 R1 и R2 одинаковы или различны и выбраны из водорода, галоида гидрокси, акокси алкила, ал-килтио и группы NR1R11, где R1 и R11 одинаковы или различны и выбраны из водорода, алкила, арила и аралкила или вместе с атомом азота, к которому они присоединены, образуют циклическое кольцо необязательно замещенное одной или более ал-кильными группами и необязательно содержит другие гетероатомы; R3 является водородом, алкилом необязательно замещенным одним или более алкильными радикалами, или является амино, алкиламино, диал-киламино, циано, нитро, галоид, карбамоил, гидр-окси, карбокси, алкокси, алкилтио, алкилтиоалкил, S(O)n алкил, ди(алкилокcи)алкил, -C(R):NOH или -COR или -CO2R, где R является водородом или алкилом, или группой СН2Х, где Х является гидр-окси, алкокси, арилокси, арилалкокси, галоид, циано, -NR1R11, где R1 и R11 имеют указанные ранее значения, S(O)n -алкил, где n равно 1 или 2, или SO2NR1R11; каждый из R1 до R8 одинаковы или различны и каждый выбирают из водорода, галоида, алкила, пергалоидалкила, циано, карбамоил-карбокси, СОR, нитро, амино, алкилсульфониламино, алкок-си, S(O)nалкила, где n равно 1 или 2, или SO2NR1R11 или R4 и R5 или R5 и R6 вместе являются группой -CН=С HCH=CH- или группой -CH2-СH2-CH2-CH2-, и в этом случае оба R7 и R8 являются водородом; и необязательно один из атомов азота в пиримидиновом кольце может быть N ал-килирован или не обязательно может быть N-оксидом; причем вышеуказанные алкильные группы или фрагменты алкилсодержащих групп имеют от 1 до 6 атомов углерода, а арильные группы или арильные фрагменты арилсодержащих групп имеют 6 или 10 атомов углерода. Некоторые соединения формулы І являются хиральными, и следует учитывать, что в этих слу-чаях формула I включает как рацемическую смесь, так и индивидуальные энантиомеры таких соединений. Следует также учитывать, что если один или более из R1, R2 и R3 являются гидрокси, они могут также существовать в их таутомерных формах. Предпочтительным классом соединений фор-мулы І, которые являются потенциальными ингибиторами глутамата, являются те, в которых один из R1 и R2 является амино, а другой выбирают из амино, гидрокси, галоид, морфолино, пиперази-нил, N-алкил-пиперазинил, N,N-диалкиламино, N-алкиламино или алкилтио; R3 является алкилом, необязательно замещенным одним или более из галоидных радикалов, или является алкилом, ал-килтио, водородом, гидрокси, алкокси, галоидом, карбокси, карбамоилом или группой СН2Х, где Х является гидрокси, фенокси, бензилокси, алкокси или алкилтио; один из R4 и R5 является галоидом, а другой вы-бирают из галоида или водорода; R6 является галоидом, водородом, нитро или аминогруппой; R7 является водородом, галоидом, циано, ал-килтио, SO2NR1R11 алкилом, нитро или амино или метансульфонамидо; и 41245 R8 является водородом или галоидом. В настоящем изобретении R1 предпочтительно является гидрокси, амино, N-алкиламино, N,N-диалкиламино, морфолино, пиперазинилом, N-алкилпиперазинилом; R2 предпочтительно является хлором, амином, N,N-диалкиламином или пиперидином; R3 предпочтительно является водородом, алки-лом, метоксиметилом, трифторметилом, бензилоксиметилом, феноксиметилом или метилтиоме-тилом; R4 до R8 предпочтительно выбирают из водорода и хлора. Предпочтительно, чтобы алкильный фрагмент содержал от 1 до 4 атомов углерода. Выгодно, чтобы в формуле I, по крайней мере, один R1 и R2 был амином, а другой был амином, пиперазинилом, или N-метилпиперазинилом, N-алкиламино, N,N-диалкиламином, и R3 является водородом, метилом, трифторметилом или метоксиметилом. Предпочтительной особенность формулы I яв-ляется то, что два из R4, R5 и R7 являются хлором, в частности, предпочтительно, чтобы вcе R4, R5 и R7 были хлором. Такие соединения являются вы-соко потентными ингибиторами высвобождения глутамата. Предпочтительные примеры групп NR1R11- являются амино, N-метиламино, N-этил-амино, N,N-диметиламино, пиперазинилом, N-метилпиперазинилом, пиперидинилом и морфо-лином. Наиболее предпочтительным классом соединений формулы I являются те, в которых R1 выбирают из амино, пиперазинила, N-метилпиперазинила, N-морфолино, N,N-диметиламино и Nэтиламино; R2 является аминогруппой; R3 выбирают из трифторметила, водорода, ме-тила, бензилоксиметила, метоксиметила и метилтиометила; R4 является хлором; и по крайней море, один из R5, R6 и R7 является хлором, а остальные выбирают из водорода, хло-ра и нитрогруппы; и R8 является водородом или R4 и R8 оба являются водородом, R5 и R7 оба являются хлором, а R6 выбирают из водорода, хлора и нитрогруппы. В настоящем изобретении предложен также подкласс соединений формулы I, которые хотя и являются потенциальными ингибиторами высвобождения глутамата, демонстрируют лишь слабые (то есть ИК50 менее 20 мкм) или незначительные ингибирующие эффекты на фермент дигидрофо-латредуктазу. Соответственно, в предпочтительном варианте настоящего изобретения предложены соединения формулы I, в которых R1 до R8 имеют указанные ранее значения, при условии, что если R7 является галоидом, тогда R3 является водородом, пергалоидалкилом, ме-тилом или метоксиметилом и/или R6 является нитрогруппой и/или R1 является N-алкилпиперазинилом, морфоли-но, N,N-диметиламино, пиперазинил или N-этиламиногруппой; или при условии, что если R6 является хлором, тогда R4 является галоидом, и R3 является водородом, пергалоидалкилом, метоксиметилом, метилом или галоидом и/или R1 является N-метилпиперази-нилом, пиперазинилом, морфолино или N,N-диме-тиламино или N-этиламиногруппой. Соединения формулы І можно использовать при лечении или профилактике острых и хронических нарушений центральной нервной системы млекопитающихся. Острые состояния включают церебральную ишемию, которая может возникать по разным причинам из различных случаев, вклю-чая удары, остановку сердца, послеоперационные состояния, неонатальную гипоксию и гипоглике-мию; и также физические поражения или травмы позвоночника или мозга. Хронические нейродеге-неративные расстройства, которые можно лечить, включают болезнь Алцхеймера, хорею Хантингто-на, оливопонтоцеребральную атропию, расстройства двигательной системы. Другие неврологические состояния, которые можно лечить соединениями формулы I, включают депрессии, маниа-кальные депрессии, шизофрению, хронические боли, эпилепсию, тригеминальную невралгию и мигрени. В дальнейшем аспекте настоящее изобретение обеспечивает способ лечения или предот-вращения расстройств или заболеваний ЦНС у млекопитающихся, включая человека, при кото-ром вводят млекопитающемуся нетоксичное эф-фективное количество соединения формулы І или его соли присоединения кислоты. В частности, в настоящем изобретении пред-ложен способ лечения млекопитающихся, предрасположенных к или имеющих нейротоксичные уровни внеклеточного глутамата в центральной нервной системе, включающий введение млеко-питающимся нетоксичного эффективного количе-ства соединения формулы І или его соли присое-динения кислоты. Некоторые замещенные фенилпиримидины настоящего изобретения известны специалистам как обладающие противомалярийной активно-стью; см., например, Brit. J. РhаrmасоІ. 6, 185-200, 1951; JACS 73, 3763-70, 1951. Другие фенилпири-мидины известны из Chem. Biol. Рteridines 463-468, 1982, и Рhаrmасоthеrар. Вudesinsky p. 129-141, 1963, ео. Oldrich Hanc. Тем не менее, некоторые соединения настоящего изобретения являются новыми, и соответственно, в настоящем изобретении предложены со-единения формулы І или их соли присоединения кислот, в которых 41245 R1 до R8 имеют указанные ранее значения, при условии, что по крайней мере, один из R4-R8 отличается от водорода, и далее, при ус-ловии, что если R1 и R2 оба являются аминогруп-пой, или если R1 является гидрокси, и R2 является аминогруппой, а R3 является алкилом или водо-родом, а R7 является водородом, тогда R4 и R5 оба являются аминогруппой. Другими новыми соединениями настоящего изобретения являются соединения, в которых R1 до R3 и R8 имеют указанные ранее значения, а один из R4 или R5 отличен от водорода, и R7 явля-ется галоидом, алкилом, пергалоидалкилом, циа-но, нитро, амино, алкилтио, S(O)n-алкилом или SO2NR1R11. Третьим классом новых соединений нестоящего изобретения являются те соединения фор-мулы I, в которых R1 является морфолино, пипе-разинил, N-алкилпипоразинил, N,N-диалкиламино, N-алкиламино или алкилтио, а R2-R8 имеют ука-занные ранее значения. Четвертым классом новых соединений на-стоящего изобретения являются соединения фор-мулы I, в которых R1 и R2 имеют указанные ранее значения, a R3 является алкокси, алкилтио или ал-килом, замещенным одним или более алкильными радикалами, или является группой СН2Х, где Х является алкилтио, арилокси, арилалкилокси, ал-килокси или гидрокси; R4-R6 одинаковы или различны и каждый вы-бран из водорода, галоида, пергалоидалкила, циано, нитро, амино или алкилтио; R7 является галоидом, алкилом, поргалоидал-килом, циано, нитро, амино или группа SO2N(RIII)2, где RIII является алкилом; а R8 является водородом или галоидом. Пятым классом новых соединений настоящего изобретения являются соединения формулы I, в которых R1 и R2 и R4-R8 имеют указанные ранее значения, а R3 является алкокси, aрилокси, арилалкилокси или алкилтио. Предпочтительные новые соединения на-стоящего изобретения включают нижеследующие, причем номера соответствуют номерам примеров, в которых они появляются: Пример №: 1. 4-амино-2-(4-метилпиперазин-1-ил)-5-(2,3,5-трихлорфенил)-6-трифторметилпиримидин. 2. 2,4-диамино-5-(2,3,5-трихлорфенил)-6-мет-оксиметилпиримидин. 3. 4-амино-2-(4-метилпиперазин-1-ил)-5-(2,3,5-трихлорфенил)-пиримидин. 4. 2,4-диамино-5-(2,3,5-трихлорфенил)-6-три-фторметилпирииидин. 5. 2,4-диамино-5-(4-нитро-2,3,5-трихлорфе-нил)пиримидин. 6. 2,4-диамино-5-(2,3,5-трихлорфенил)-6-мет-илпиримидин. 7. 4-амино-2-N-морфолино-5-(2,3,5-трихлор-фенил)-6-трифторметилпиримидин. 8. 4-амино-2-N,N-диметиламино-5-(2,3,5-три-хлорфенил)-6-трифторметилпиримидин. 9. 4-амино-2-N-морфолино-5-(2,3,5-трихлор-фенил)пиримидин. 10. 4-aмино-2-N,N-диметиламино-5-(2,3,5-три-хлорфeнил)пиримидин. 11. 4-амино-6-метил-2-(4-метилпиперазин-1-ил)-5-(2,3,5-трихлорфенил)пиримидин. 14. 2,4-диамино-5-(2,3-дихлорфенил)-6-три-фторметилпиримидин. 15. 2,4-диамино-5-(2,3-дихлорфенил)-6-метил-пиримидин. 16. 2,4-диамино-5-(2,3-дихлорфенил)-6-меток-симетилпиримидин. 25. 2,4-диамино-5-(2,4-дихлорфенил)-6-три-фторметилпиримидин. 26. 6-бензилоксиметил-2,4-диамино-5-(2,4-ди-хлорфенил)пиримидин. 27. 2-(4-метилпиперазин-1-ил)-4-амино-5-(2,4-дихлорфенил)пиримидин. 28. 2,4-диамино-5-(2,5-дихлорфенил)-6-три-фторметилпиримидин. 29. 2,4-диамино-5-(2,3,5-трихлорфенил)пири-мидин. 36. 4-амино-5-(3,5-дихлорфенил)-6-метил-2-(4-метилпиперазин-1-ил)пиримидин. 58. 4-амино-2-N-1-этиламино-5-(2,3,5-трихлор-фенил)пиримидин. 79. 4-амино-2-N-метиламино-5-(2,3,5-трихлор-фенил)пиримидин или их соли присоединения ки-слоты. Подходящие соли присоединения кислот со-единений формулы I включают те, которые обра-зуются как с органическими, так и с неорганиче-скими кислотами. Обычно такие соли присоедине-ния кислот фармацевтическиприемлемы. Так, предпочтительные соли включают те, которые по-лучены из соляной, бромистоводородной, серной, лимонной, винной, фосфорной, молочной, пиро-виноградной, уксусной, янтарной, щавелевой, фу-маровой, малеиновой, оксалоуксусной, метан-сульфокислоты, этансуотфокислоты, пара-толуол-сульфокислоты, бонзолсульфокислоты и изетио-новой кислот. Эти соли можно получить при взаи-модействии соединений в виде свободных осно-ваний с соответствующими кислотами. Хотя соединений формулы I можно вводить в виде чистых химических соединений, предпочти-тельно включать их в фармацевтические компози-ции. Композиции настоящего изобретения вклю-чают новые соединения формулы I определенной ранее, или их фармацевтичеcкиприемлемые соли вместе с одним или более носителями, и необязательно другими терапевтическими ингредиентами. Носитель (носители) должны быть "приемлемы" в том смысле, что они должны быть совместимы с другими ингредиентами композиции и не должны причинять вред тому, кто их принимает. Эти композиции включают такие, которые при-годны для орального, парэнтерального (включая подкожные, внутримышечные и внутривенные инъекции), ректального и поверхностного (вклю-чая нанесение на кожу, через нос или под язык) введения, хотя наиболее подходящий способ бу-дет зависеть от вида, состояния и степени забо-левания пациента. Композиции обычно можно из-готовить в единичной дозированной форме, и их можно получить любыми способами, известными фармацевтам. Все способы включают стадию со-единения формулы I или его фармацевтически-приемлемой соли присоединения кислоты ("актив-ного ингредиента") с носителем, который состоит из одного или более вспомогательных 41245 ингредиен-тов. Обычно композиции приготавливают, тща-тельно перемешивая активный ингредиент с жидкими носителями, или тонко измельченными твер-дыми носителями, или обоими, а затем, при необходимости придавая композиции нужную форму. Композиции настоящего изобретения пригодные для орального введения могут быть пред-ставлены в дискретном виде, например, в виде капсул, лепешек или таблеток, причем каждая со-держит определенное количество активного ин-гредиента; в виде порошка или гранул; в виде рас-твора или суспензии в водном разбавителе или в неводной жидкости; или в виде жидкой эмульсии типа масло в воде, или вода в масле; активный ингредиент может быть также представлен в виде шариков, электуария или пасты. Таблетки можно изготавливать прессованием или из расплава, необязательно с одним или бо-лее из вспомогательных ингредиентов. Прессо-ванные таблетки можно получить прессованием в подходящем устройстве активного ингредиента в свободнопересыпающейся форме, например, в виде порошка или гранул, необязательно в смеси со связующим, смазывающим агентом, инертным разбавителем, поверхностноактивным иди дис-пергирующим агентом. Таблетки из расплава можно получить, расплавляя в соответствующем устройстве смесь порошкообразного соединения смоченного инертным жидким разбавителем. Таб-летки могут быть необязательно с нанесенным по-крытием, а композиции могут быть такими, чтобы обеспечить медленное и контролируемое высво-бождение из него активного ингредиента. Композиции для парантерального введения включают водные и неводные стерильные раство-ры для инъекций, которые могут содержать анти-оксиданты, буферирующие агенты, бактериостаты и растворенные вещества, которые придают ком-позициям изотоничность с кровью пациента; и водные и неводные стерильные суспензии, кото-рые могут включать суспендирующие и загущаю-щие агенты. Такие композиции могут существовать в виде единичных доз или в упаковках для многих доз, например, в запаянных ампулах и пробирках, и могут храниться в лиофилизирован-ных состояниях, которые требуют только добавления стерильного жидкого носителя, например, воды для инъекций, непосредственно перед ис-пользованием. Произвольные растворы для инъекций и сус-пензии можно приготовить из стерильных порош-ков, гранул и таблеток описанных ранее типов. Композиции для ректального введения можно приготовить в виде суппозиториев с такими обыч-ными носителями как масло какао или полиэти-ленгликоль. Композиции для поверхностного нанесения, например, в рот или под язык, включают лепешки, содержащие активный ингредиент с такими вкусовыми добавками, как сахароза и акация или трага-кант, и пастилки, содержащие активный ингредиент на базе желатина и глицерина или сахарозы и акации. Предпочтительные композиции единичных доз, содержат эффективную дозу, как будет указано далее, или соответствующую ее часть, ак-тивного ингредиента. Следует учитывать, что в дополнении к ука-занным конкретно ранее ингредиентам, компози-ции настоящего изобретения могут включать и другие агенты обычные для практики и касающие-ся рассматриваемого типа композиции, например, композиции для орального введения могут вклю-чать вкусовые агенты или отдушки. Таблетки или другие формы, предложенные в дискретном виде, могут содержать такие количе-ства соединения формулы I, которые эффективны в таких дозах или в кратных им дозах, так, например, единичные дозы могут составлять от 5 до 500 мг, и обычно от 10 до 250 мг. Соединения формулы I предпочтительно ис-пользуют для лечения расстройств и заболеваний ЦНС путем орального приема или путем инъекций (интрапарэнтеральных или подкожных). Точные количества вводимого соединения зависят от ле-чащего врача. Однако, прописываемая доза дол-жна зависеть от ряда факторов, включая возраст и пол пациента, точный диагноз и степень заболевания подлежащего лечению. Так, например, при лечении больного эпилепсией интервал доз дол-жен быть, по-видимому, существенно ниже, чем при лечении пациента после удара для снятия це-ребральных ишемических поражений. Точно также и способ введения, по-видимому, должен зависеть от состояния и его тяжести. Соединения формулы I можно вводить ораль-но или путем инъекций в дозах от 0,1 до 30 мг/кг в день. Интервал доз для взрослых обычно от 8 до 2400 мг/день и предпочтительно от 35 до 1050 мг/день. Некоторые соединения формулы I являются соединениями длительного действия, и может оказаться важным принять в первый день начальную дозу от 70 до 2400 мг, а затем снизить дозу в последующие дни до 20-1200 мг. Примера-ми таких соединений длительного действия явля-ются: 2,4-диамино-5-(2,3,5трихлорфенил)-6-три-фторметилпиримидин; 4-амино-2-(4-метилпипера-зин-1-ил)-5-(2,3,5-трихлорфенил)6-трифторметил-пиримидин; и 4-амино-2-(4-метилпиперазин-1-ил)-5-(2,3,5-трихлорфенил)-пиримидин. Соединения с длительным действием особенно важны клинически, так как с ними легче работать. При хронических ситуациях их можно вво-дить без вливаний, и таким образом свести к ми-нимуму медицинское вмешательство; также и в острых состояниях успокоить больного снижая дневную дозу. Напротив, такие быстродействующие соединения как 2,4-диамино-5-(2,3,5-три-хлорфенил)-6-метоксиметилпиримидин позволяют обеспечивать клинический контроль за фармако-логическим действием соединения с высокой точ-ностью, так как такие соединения удаляются из центральной нервной системы быстро. Соединения настоящего изобретения можно получить любым способом, известным для анало-гичных соединений (см. JACS, vol. 73, 1951, 3763-70). В настоящем изобретении предложен также способ получения соединения формулы I или его соли присоединения кислоты, который включает осуществление взаимодействия соединения фор-мулы II: 41245 ІІ где R3 и R8 имеют указанные ранее значения, L является отщепляемой группой, а y является циа-но или карбокси, карбонил, или алкилоксикарбо-нильной группой, с соединением формулы III или его солью III где R1 имеет указанные ранее значения, и выделяя соединение формулы I в виде свободного ос-нования или его соли присоединения кислоты, и необязательно превращая основание в его соль присоединения кислоты или в другую соль при-соединения кислоты, или в другое соединение формулы I или его соль присоединения кислоты. Следует учитывать, что некоторые соедине-ния формулы III, например, те, в которых R1 озна-чает гидрокси, могут существовать в соответствующих таутомерных формах (например, моче-вина). В качестве примеров взаимопревращений со-единений формулы I, если в продукте описанного выше способа один из R1, R2 или R3 является гид-рокси, соединение можно галоидировать, напри-мер, используя реагент Vilsmeier Haack или окси-хлорид фосфора (POCI3), до соответствующего галоидного соединения. Это соединение можно далее превратить в соединение формулы I, где R1, R2 или R3 является алкилтиогруппой, путем взаимодействия с соответствующим алкилтиола-том, или в соответствующее аминосоединениe (R1, R2 или R3 являются при этом NR1R11) при вза-имодействии с соответствующим аминосоeдине-нием в таком подходящем растворителе как алка-нол, например, этанол, или превращая в соедине-ние, где R1, R2 или R3 являются алкоксигруппой, при взаимодействии с соответствующим алкоксидом. Если необходимо получить соединение фор-мулы I, в котором R4-R8 является нитрогруппой, его можно получить из соответствующего соеди-нения формулы I, где один из R4-R8 является во-дородом, используя стандартные условия нитро-вания, например, серную кислоту и нитрат калия, а затем превращая далее стандартным восста-новлением в соответствующие аминосоединения, например, используя РтO2, АсОН, Н2. Следует учитывать, что амино или галоид со-единения можно далее превратить в R4-R8, как определено ранее, стандартным взаимопревра-щением, например, через диазониевые соли. Если R3 является алкилом, его можно превратить в пер-галоидалкил или галоидированный алкильный фрагмент при взаимодействии с соответствующим галоидом или - N-галоидсукцинимидом (NХS) в та-ком подходящем растворителе как уксусная ки-слота. Соединения, в которых R3 является СН(ОEт)2 можно превратить в соответствующие альдегиды гидролизом разбавленной кислотой (кислотами) и после этого восстановить до соответствующего спирта стандартным восстанавливающим агентом (например, боргидридом натрия NaBH4), или их превращают в соответствующий оксим (гидрохло-ридгидроксиламина в этанололе), который, в свою очередь, можно превратить в соответствующее цианосоадинение, используя, например, трифтор-уксусный ангидрид (ТFАА), а затем в соответст-вующее амидосоединение, используя концентри-рованную серную кислоту. В другом варианте, альдегид можно окислить KMnО4 (перманганатом калия) до получения соответствующей кислоты, которую можно, в свою очередь, подвергнуть взаимодействию со спиртом до получения соответствующего сложного эфира. Если в продукте вышеуказанного процесса R3 является группой СН2ОR, где R является алкилом или арилалкилом, этот продукт можно превратить в СН2Х при взаимодействии с HX (X = галоид) в, например, уксусной кислоте, и его далее превращают в соответствующее цианосоединение, на-пример, в результата обработки цианидом натрия и ДМФ, или во фторметил в результате обработки, например, фторидом цезия (CSF), или в группу CH2NR1R11 при взаимодействии с соответствующим амином. В другом варианте, группу СН2OP можно дeалкилировать до получения соответст-вующего спирта, например, Me3SiI, а его далее превратить во фторметил с помощью трифторида диэтиламиносеры (ДАSТ). Если R3-R8 содержат алкилтиофрагмент, eго можно окислить до соответствующего сульфок-сидa и сульфона, используя, например, МСРВА (метахлорпербензойную кислоту). Следует учитывать, что можно провести и другие взаимопревращения, как ясно специалистам, в соответствии со стандартной методо-логией. Примеры подходящих отщепляемых групп (L) включают С1-4-алкокси, галоид, NR1R11 как опре-делено ранее, например, анилино, морфолино, С1-4 алкиламино, бензиламино или алкилтио. Предпочтительно, чтобы в формуле III R1 был гид-рокси, алкокси, алкилтио или группой NR1R11 как определено ранее. Выгодно, чтобы R1 был амино, алкиламино, диалкиламино, пиперазинил или N-метилпиперазинилгруппой. Предпочтительно реакцию соединения фор-мулы I и II вести в неводных растворителях, на-пример, в алканоле, например, в этаноле при по-вышенных температурах (например, между 50 и 110°C) в основании, предпочтительно, алкон-оксидe. 41245 В другом варианте соединение формулы I, или его соль присоединения кислоты можно также получить при взаимодействии соединения форму-лы III с соединением формулы IV IV где R3-R4 и y имеют указанные ранее значения. Реакцию обычно ведут в неводном растворителе, например, в алканолах, таких как этанол, и при повышенных температурах, предпочтительно при кипячении с холодильником. Соединения формулы IV можно получить спо-собами известными специалистам (JACS, 1951, 73, 37633770). Соединения формулы II можно получить спо-собами известными специалистам (JACS см. ра-нее), например, при взаимодействии соединения формулы IV с диазометаном или с алкилортоэфи-ром (JACS, 1952, 74, 1310-1313) или при конде-нcации с амином. В формуле III, если R1 является пиперазинилом или алкилпиперазинилом, их можно получить стандартными способами, например, при взаимодействии известного соединения формулы III, где R1 является алкилтио, с соответствующим ами-ном, например, N-метилпиперазином. Эта реакция преимущественно протекает при комнатной тем-пературе в воде. Соединения формулы I можно также получить при взаимодействии соединения формулы V V где y и R3 имеют указанные ранее значения, a R10 и R11 являются алкилом, или вместо образуют группу (СR2)n, где n имеет значения от 2 до 4, а R является Н или алкилом, с соединением форму-лы III. Более предпочтительно, чтобы R1 был ами-но, пиперазинил или метилпиперазинилгруппой. Предпочтительно, чтобы реакцию вели в невод-ном растворителе, например, этаноле при кипячении с обратным холодильником, используя в качестве основания этилат натрия. Соединения формулы I можно также получить из соответствующих дигидропиримидинов, ис-пользуя стандартные условия дегидрирования (например, JCS 1956, 1019). Такие дигидропиримидины можно получить при взаимодействии соединения формулы II, где R3-R8 имеют указанные ранее значения, а L является водородом, с соединением формулы III. В приводимых далее примерах настоящего изобретения сокращения и обозначения химических соединений соответствуют общепринятым у специалистов, и имеют следующие значения: NаВН4 боргидрид натрия СНСl3 хлороформ NаНСО3 бикарбонат натрия МgSО4 сульфат магния РВr3 трибромид фосфора ДМF диметилформамид КСN цианид калия Ет2О диэтиловый эфир NаОЕт этилат натрия ЕтОН этанол H2SO4 серная кислота AcOH уксусная кислота MeOH метанол N2 азот HCl соляная кислота NaOH гидроксид натрия SiO2 двуокись кремния ДМSO диметилсульфоксид Na натрий 41245 ДМE MeI ЕтOAc CH2Cl2 Ет3N MeNH2 NH4OH SOCl2 THF NaH CCl4 DHFR PtO2 NX X2 TFAA CsF Me3SiI DAST MCPBA AIBN диметоксиэтан метилиодид (иодметан) этилацетат дихлорметан триэтиламин метиламин гидроксид аммония тионилхлорид тетрагидрофуран гидрид натрия четыреххлористый углерод дигидрофолатредуктаза окись платины (катализатор Адамса) N-галоидсукцинимид галоид трифторуксусный ангидрид фторид цезия триметилсилилиодид трифтори диэтиламиносеры метахлорпербензойная кислота a,a'-азоизобутиронитрил (2,2'-азобис)2-метилпропионитрил) Пример 1 Получение 4-амино-2-(4-метилпиперазин-1-ил)-5-(2,3,5-трихлорфенил)-6-трифторметил-пиримидина 1. Получение гидроиодида N-метилпиперазин-формамидина 10,8 г тиомочевины растворяют в ацетоне (250 мл) при 50°С. Добавляют 10 мл иодометана, и реакционную смесь перемешивают при 50°С в течение 4 часов. После охлаждения раствор раз-бавляют эфиром (1 л) и отфильтровывают соль метилиодида, промывают эфиром и сушат в ва-кууме, получают 29,2 г, т. пл. 113-115°С. 5 г соли метилиодида растворяют в воде, добавляют 30 мл N-метилпиперазина. Полученный раствор пере-мешивают, барботируя азот при комнатной тем-пературе в течение 24 часов. Раствор концентрируют в вакууме. Остаток перемешивают с этано-лом, фильтруют и сушат в вакууме. Получают 4,98 г, т. пл. 230-242°С. 2. Получение 2,3,5-трихлорбензилового спирта К раствору 2,3,5-трихлорбензильдегида (Aldrich, 50 г) в этанолe (1,0 л) при комнатной тем-пературе добавляет NaBH4 (7,0 г) и полученную смесь перемешивают в течение 3,5 часов. Реак-цию гасят водой, и растворитель выпаривают в вакууме перед тем, как разделить остаток между СHСІ3 и насыщенным раствором NаНСО3. Орга-ническую фазу промывают рассолом, сушат над MgSO4, фильтруют и растворитель выпаривают в вакуумe до получения твердой части. Получают 43,0 г. Т. пл. 90-93°С. 3. Получение 2,3,5-трихлорбензилбромида К раствору спирта в бензоле (400 мл) в атмо-сфере азота добавляют РBr3 (126,58 г), и полу-ченную смесь перемешивают при 55-60°С в тече-ние 3,5 часа. После охлаждения смесь выливают на измельченный лед (2 л) и выделяют бензольный слой. Водную фазу промывают бензолом (x3) и объединенные бензольные экстракты промывают насыщенным NaHCO3 раствором в воде, сушат над МgSО4, фильтруют и растворитель выпаривают до получения коричневатой жидкости, кото-рая отверждается при стоянии 37,5 г, т. пл. 40-42°С. 4. Получение 2,3,5-трихлорфенилацето-нитрила Бромид суспендируют в ДМF (130 мл) / вода (86,67 мл) при 0°С и порциями добавляют KCN (12,99 г). После перемешивания при 30-35°С в те-чение 3 часов суспензию разбавляют водой, и экс-трагируют Eт2О. Объединенные эфирные экстрак-ты промывают водой, сушат над МgSО4, фильт-руют, и растворитель выпаривают в вакууме. По-сле хроматографичeской обработки на силика-гeле, используя в качестве элюента гексан до 20% эфир-гeксан, получают целевой продукт в виде белого твердого вещества, 18,52 г. Т. пл. 60-62°C. 5. Получение 2(2,3,5-трихлорфенил)-4,4,4-трифтор-3-оксобутиронитрила К раствору NaОEт (из 1,04 г Nа) в EтОН (60 мл) при комнатной температуре в атмосфере азота добавляют 8,40 г нитрила, а затем 6,57 г этилтрифторацетата, и полученную смесь пере-мешивают при кипении с обратным холодильником в течение 5 часов. После охлаждения раство-ритель удаляют в вакууме, а остаток растворяют в водe. Водную фазу промывают Ет2О (отработанным), подкисляют H2SO4 и экстрагируют Ет2О. Объединенные экстракты Ет2О промывают водой, сушат над МgSO4, фильтруют, и растворитель вы-паривают в вакууме до масла. Его тщательно растирают с петролейным эфиром, и твердую часть отфильтровывают и сушат. Твердую часть азеотропнo перегоняют с толуолом (х5). Получают 4,89 г, т. пл. 160-163°С. 6. Получение 2-(2,3,5-трихлорфeнил)-4,4,4-трифтор-3-метоксибут-2-енонитрила К раствору трифторметилкетона в ЕТ2О (39,62 мл) при комнатной температуре добавляют диазомeтан (из 8,55 г Diazald) в 79,62 мл Ет2О, и полученную смесь оставляют выстаиваться при комнатной 41245 температуре в течение ночи. Избыток диазометана удаляют в вакууме в АсОН, и остаток растворяют в Ет2О, сушат над МgSО4, фильтруют, и растворитель выпаривают в вакууме до получения коричневого масла, 5,20 г. 7. Получение 4-aмино-2-(4-метилпиперазин-1-ил)-5-(2,3,5-трихлорфенил)-6-трифтормeтилпири-мидина К раствору NaOEт (из 0,144 г Nа) в ЕтОН (12,5 мл) добавляют N-метилпиперазиноформамидингидроиодид (1,39 г). После перемешивания в течение 10 минут при комнатной температуре, раствор вышеуказанного промежуточного соединения (0,85 г) в ЕтОН (2,5 мл) добавляют, и полученную смесь перемешивают при кипячении с об-ратным холодильником в течение 4,5 часа. После охлаждения суспензию фильтруют, полученный фильтрат выпаривают досуха в вакууме. В ре-зультате хроматографической обработки на сили-кагеле при элюировании смесью СНСl3 – 4% МeОH/СHСІ3, получают целевой продукт, который тщательно растирают с петролейным эфиром (т. кипения 40-60°С) и сушат в вакууме, получают 0,56 г. Т. пл. 127-129°С. 8. 4-амино-2-(4-метилпиперазин-1-ил)-5-(2,3,5-трихлорфенил)-6-трифторметилпиримидин метансульфонат 9,6 г основания фенилпиримидина растворяют в абсолютированном этаноле, охлаждают при 0°С, добавляют метансульфокислоту (2,14 г, 1,62 мл). После перемешивания при комнатной температура в течение 2 часов, полученный раствор выпа-ривают досуха и остаток тщательно растирают с Ет2О, фильтруют и сушат в вакууме, получая твердый продукт бежевого цвета. Его растворяют в воде (500 мл) и сушат вымораживанием, полу-чая 10,7 г твердого продукта желто-коричневого цвета. Метансульфонатную соль можно далее очистить, тщательно растирая с TBUОН (30 мл), фильтруя, растворяя в воде и снова высушивая вымораживанием досуха, получая указанное в за-главии соединение в виде грязно-белого твердого продукта. 8,33 г. Т. пл. 145-7°С. Пример 2 Получение 2,4-диамино-5-(2,3,5-трихлорфе-нил)-6-метоксиметилпиримидина А. 2-(2,3,5-трихлорфенил)-4-метокси-3-оксо-бутиронитрил К перемешиваемому при кипении с обратным холодильником раствору этоксида натрия (из 1,38 г натрия) в 25 мл этанола добавляют за 5 ми-нут смесь 2,3,5-трихлорфенилацетонитрила (11 г) и 8,85 г этилметоксиацетата в сухом ДMF (25 мл). Спустя 4 часа полученную смесь охлаждают на льду и подкисляют по каплям уксусной кислотой (примерно 6 мл), разбавляют ледяной водой (150 мл) и экстрагируют дихлормeтаном (2х100 мл). Экстракт дихлорметана промывают водой, сушат над сульфатом магния и концентри-руют, получая твердое вещество желтого цвета, которое тщательно растирают с небольшим коли-чеством эфира и фильтруют. Получают 8,6 г гомо-генного по данным ТСX (19:1 СН2Сl2:МeОH). В. Получение 2,4-диамино-5-(2,3,5-трихлор-фенил)-6-мотоксиметилпиримидина Суспензию неочищенного ацетонитрила (8,5 г) в 100 мл эфира, охлажденную на льду, обрабатывают избытком не содержащего спирт раствора диазометана в эфире (0,035 М). Через час ТСХ (19:1 СН2Сl2:МеОН) указывает на отсутствие ис-ходного вещества. Полученный раствор концен-трируют до получения коричневого воскообразно-го твердого продукта, который используют без дальнейшей очистки. К раствору этоксида натрия (из 0,76 г натрия) в этаноле (30 мл) добавляют гуанидингидрохло-рид (2,9 г). Спустя 15 мин. добавляют раствор не-очищенного енола в этаноле (25 мл), и полученную смесь кипятят с обратным холодильником в течение 4 часов, охлаждают и концентрируют. Ос-таток встряхивают с 2М NaOH (150 мл) и темный твердый продукт отфильтровывают, промывают водой, сушат на воздухе и пeрeкристаллизо-вывают из этанола (150 мл). 5 г. Т. пл. 214-216°С. ТСХ (1:9 МeОH:СНСl3) Rs примерно 0,35. С. 2,4-диамино-5-(2,3,5-трихлорменил)-6-мети-оксиметилпиримидинэтансульфат К перемешиваемой суспензии фенилпирими-дина (2 г) в 75 мл этанола добавляют по каплям этансульфокислоту (0,67 г) в этаноле (10 мл). Спустя примерно 30 минут раствор мутнеет. Перемешивание продолжают еще 1,5 часа, а затем раствор концентрируют до примерно 20 мл. До-бавляют эфир, твердую часть отфильтровывают и промывают Ет2О перед сушкой в вакууме. Полу-чают 2,17 г, т. пл. 265-268°С. Пример 3 Получение 4-амино-2-(4-метилпиперазин-1-ил)-5-(2,3,5-трихлорфенил)пиримидинмезилата 1. Получение 2-/2,3,5-трихлорфенил-3-оксо-пропионитрила, натриевой соли К раствору NаОЕт (из 0,803 г натрия) в этано-ле (55 мл) охлажденному льдом в атмосфере азо-та добавляют 1,3,5-трихлорфенилацетонитрил (см. пример 1.4). Добавляют этилформат (5,1 мл), и полученную смесь перемешивают при комнатной температуре в течение ночи. После переме-шивания еще в течение 2,5 часа при 50°С полу-ченную смесь охлаждают и фильтруют. Получен-ный фильтрат выпаривают, а остаток тщательно растирают с диэтиловым эфиром, фильтруют и сушат (6,82 г). 2. Получение 2-(2,3,5-трихлорфенил)-3-метокси-акрилонитрила Вышеуказанный твердый продукт растворяют в ДМF (36 мл) и добавляют 2 мл метилиодида. Ре-актор герметизируют перед тем, как его содержание перемешивают в течение 3 часов при 40°С. Затем растворитель выпаривают. Остаток разде-ляют между водой и этилацетатом. Органическую фазу промывают водой, сушат над сульфатом магния и растворитель выпаривают по получении неочищенного продукта в виде красно-коричнево-го масла, которое отверждается при стоянии (5,04 г). 3. Получение 4-амино-2-(4-метилпиперазин-1-ил)-5-(2,3,5-трихлорфенил)пиримидина К раствору NаОEт (из 0,21 г натрия) в этаноле (20 мл) добавляют N-метилпиперазинформ-амидина гидроиодид (2,06 г) (см. пример 1.1). По-сле перемешивания в течение еще 10 минут до-бавляют 41245 соединение примера 3,2 (1 г), и полученную смесь перемешивают при кипячении с обратным холодильником в точение 4 часов. Получен-ную смесь оставляют выстаиваться при комнатной температуре в течение ночи, а затем фильтруют. Полученный фильтрат концентрируют, а остаток очищают хроматогрaфически на SiО2, элюируя СНСІ3 до 4% MeOH/CHCl3 до получения указанного в заглавии соединения в виде свободного осно-вания. 0,89 г, т. пл. 162-164°С. Затем 0,805 г свободного основания растворяют в этаноле (35 мл) и охлаждают на ледяной бане. Добавляют метансульфокислоту (0,21 г), и реакционную смeсь перемешивают при комнатной температуре в точение 2 часов. Затем раствори-тель выпаривают, а остаток тщательно растирают с диэтиловым эфиром, фильтруют, растворяют в холодной воде и сушат вымораживанием до полу-чения указанной в заглавии соли в виде твердого продукта бледно-зеленого цвета, 0,98 г, т. пл. 143-146°С. Пример 4 Синтез 2,4-диамино-5-(2,3,5-трихлорфенил)-6-трифторметилпиримидина К раствору NaOEт (из 0,88 г Nа) в EтОН (82 мл) добавляют 2,98 г гуанидингидрохлорида. Полученную белую суспензию перемешивают при комнатной температуре в течение 10 минут. До-бавляют раствор енольного эфира (пример 1,6) в 27 мл этанола, и полученную смесь перемешивает при кипячении с обратным холодильником в те-чение 4,25 часов. После охлаждения, суспензию фильтруют, и полученный фильтрат выпаривают досуха в вакууме. Хроматография на силикагеле при элюировании СНСІ3 до МeОН:СНСl3 дает це-левой продукт, который тщательно растирают с Ет2О и сушат в вакууме, получают 1,78 г, т. пл. 226-227°С. Пример 5 Получение 2,4-диамино-5-(4-нитро-2,3,5-три-хлорфенил)-пиримидина Соединение примера 29 растворяют в концен-трированной серной кислоте (2,5 мл), добавляют нитрат калия (25,8 мг), и полученный раствор пе-ремешивают в течение 3 часов. Затем раствор вы-ливают на лед и подкисляют 10н NаОН. Получен-ный продукт экстрагируют етилацетатом (х3), су-шат над МgSО4, фильтруют и растворитель выпа-ривают. После хроматографирования на силика-геле при элюировании этилацетатом дополучают целевой продукт, 40,7 мг, т. пл. 293-295°С. Пример 6 Получение 2,4-диамино-5-(2,3,5-трихлорфе-нил)-6-метилпиримидина 1. Получение 2-(2,3,5-трихлорфенил)-3-оксо-бутиронитрила К раствору NаОEт (из 0,68 г натрия) в этаноле (20 мл) добавляют 2,3,5-трихлорфенилацето-нитрил (5 г) и этилацетат – (4,43 мл). Полученную смесь нагревают при кипячении с обратным холо-дильником в атмосфере азота в течение 2,5 часа. Полученную смесь оставляют выстаиваться при комнатной температуре в течение ночи. Затем по-лученную смесь концентрируют, а остаток раство-ряют в воде. Водную фазу промывают эфиром, подкисляют концентрированной серной кислотой и экстрагируют эфиром. Полученные экстракты сме-шивают, сушат над сульфатом магния и выпари-вают, получают 2,59 г. Т. плавления 134-135°С. 2. Получение 2-(2,3,5-трихлорфенил)-3-меток-сибут-2-енонитрила К раствору кетона в эфире (100 мл) при ком-натной температуре добавляют диазометан (из 5,43 г, Diazald) в эфире (50 мл) и полученную смесь оставляют выстаиваться при комнатной температуре в течение ночи. Затем полученный эфир отгоняют, получают целевой продукт, 2,45 г. 3. Получение 2,4-диамино-5-(2,3,5-трихлор-фенил)-6-метилпиримидина Гуанидингидрохлорид (3,87 г) добавляют к раствору этоксида натрия (из 1,01 г натрия) в эта-ноле (80 мл). Полученную белую суспензию пере-мешивают при комнатной температуре в течение 10 минут, а затем добавляют к раствору енольно-го эфира (пример 6.2), (5,60 г) в этаноле (20 мл). Полученную смесь перемешивают при кипячении с обратным холодильником в течение 8 часов в атмосфере азота. После охлаждения суспензию фильтруют, и полученный фильтрат выпаривают досуха в вакууме. При хроматографировании на силикагеле, элюируя СHСІ3 до 2% MeOH-СHСІ3 получают целевой продукт, который тщaтeльно растирают с эфиром и сушат в вакууме. Выход 1,70 г, т. пл. 236-238°С. Пример 7 Получение 4-амино-2-N-морфолино-5-(2,3,5-трихлорфенил)-6-трифторметилпиримидина К раствору NаОЕт (из 0,144 г Nа) в 12,5 мл EтОН добавляют морфолиноформамидингидро-бромид (1,08 г) Синтез Ланкастера. Полученную белую суспензию перемешивают при комнатной температуре в течение 10 минут. Добавляют рас-твор енольного эфира (0,85 г) (пример 1.6) в 2,5 мл ЕтОН, и полученную смесь перемешивают при кипячении с обратным холодильником в тече-ние 4,5 часов. После охлаждения суспензию фильтруют, и полученный фильтрат выпаривают досуха. После хроматографирования на силикаге-ле с элюированием СНСІ3 получают целевой про-дукт, который тщательно растирают с петролейным эфиром (т. кипения 40-60°С) и сушат в вакуу-ме, 0,47 г, т. плавления 177-181°С. Пример 8 Получение 4-амино-2-N,N-диметилатно-5-(2,3,5-трихлорфенил)-6-трифторметилпиримидина К раствору NаОЕт (из 0,144 г NA) в EтОH (12,5 мл) добавляют 1,4 г 1,1-диметилгуанидин-сульфата (Aldrich). Полученную белую суспензию перемешивают при комнатной температуре в те-чение 10 минут. Добавляют раствор 2-(2,3,5-трихлорфенил)-4,4,4-трифтор-3-метоксибут-2-ено-нитрила (см. пример 1.6) (0,85 г) в ЕтОН (2,5 мл), и полученную смесь перемешивают при кипячении с обратным холодильником в течение 4,5 часа. По-сле охлаждения суспензию фильтруют, и полу-ченный фильтрат выпаривают досуха в вакууме. После хроматографирования на силикагеле при элюировании СНСІ3 получают целевой продукт, 0,61 г, т. пл. 124-126°С. Пример 9 41245 Синтез 4-амино-2-N-морфолино-5-(2,3,5-три-хлорфенил)пиримидина К раствору NаОЕт (из 0,21 г натрия) в 20 мл этанола добавляют морфолиноформамидингидроборомид (1,6 г), и полученную смесь перемешивают при кипячении с обратным холодильником в течение 4 часов. Полученную смесь оставляют выстаиваться при комнатной температуре в тече-ние ночи, а затем фильтруют. Полученный фильт-рат концентрируют, и полученный остаток очища-ют хроматогрaфически на силикагеле, элюируя СНСІ3 до получения целевого продукта, 0,73 г, т. пл. 168-170°С. Пример 10 Получение 4-амино-2-N,N-диметиламино-5-(2,3,5-трихлорфенил)-пиримидина К раствору NаОEт (из 0,21 г натрия) в этаноле (20 мл) добавляют 1,1-диметилгуанидинсульфат (2,07 г). После перемешивания в течение 10 минут добавляют аддукт примера 3.2 (1 г), и полученную смесь перемешивают при кипячении с обратным холодильником в течение 4 часов. Эту смесь ос-тавляют выстаиваться при комнатной температуре в течeние ночи, а затем фильтруют. Получен-ный фильтрат концентрируют, а остаток очищают хроматографичeски на силикагелe, элюируя СНСІ3 до получения целевого продукта, 0,69 г, т. пл. 145-147°С. Примеp 11 Получение 4-амино-6-метил-2-(4-метилпипе-разинил-1-ил)-5-(2,3,5-трихлорфенил)пиримидина К раствору NаОЕт (из 0,16 г натрия) в этаноле (15 мл) добавляют 1,6 г N-мeтилпипeразинформамидингидрохлорида. После перемешивания в течение 10 минут добавляют енольный эфир примера 6.2 (0,82 г) в этаноле (5 мл), и полученную смесь перемешивают при кипячении с обратным холодильником в течение 5 часов. Полученную смесь оставляют выстаиваться при комнатной температуре в течение ночи, а затем фильтруют. Полученный фильтрат концентрируют, а остаток очищают хроматографически на силикагеле, элюируя СНСІ3 до 4% MeOH/CHCl3 до получения целевого продукта, 0,31 г, т. пл. 156-159°С. Пример 12 Получение 2,4-диамино-6-метил-5-(2,3,5-три-хлор-4-нитрофенил)-пиримидина 2,4-диамино-6-метил-5-(2,3,5-трихлорфенил) пиримидина (0,152 г) (пример 6) растворяют в концентрированной серной кислоте и добавляют нит-рат калия (50 мл). Полученный раствор перемешивают при комнатной температуре в течение но-чи, а затем выливают на лед и подкисляют 0,880 аммиака. Этот продукт экстрагируют этил-ацетатом, высыпают, сушат над сульфатом маг-ния и выпаривают. Полученный остаток обрабаты-вают хроматографически на силикагеле, элюируя ЕтОАс до 8% МеОН/ЕтОАс до получения целевого продукта, 0,13 г, т. пл. 313-315°С. Пример 13 Получение 4-амино-2-(N,N-диметиламино)-6-метил-5-(2,3,5-трихлорфeнил)пиримидина К раствору NаОЕт (из 0,16 г натрия) в 15 мл этанола добавляют 1,1-диметилгуанидинсульфат (1,6 г). После перемешивания в течение 10 минут добавляют енольный эфир примера 6.2 (0,82 г) в 5 мл этанола, и полученную смесь перемешивают при кипячении с обратным холодильником в тече-ние 5 часов. Полученную смесь оставляют вы-стаиваться при комнатной температуре в течение ночи, а затем фильтруют. Полученный фильтрат концентрируют, а остаток очищают хроматогра-фически на силикагеле, элюируя СНСІ3 до получения целевого продукта, 54 мг, т. пл. 151-153°С. Пример 14 Получение 2,4-диамино-5-(2,3-дихлорфенил)-6-трифторметилпиримидина 1. Получение 2,3-дихлорбензилового спирта К раствору 2,3-дихлорбонзильдегида (Aldrich: 50 г) в 800 мл спирта при комнатной температуре добавляют NaBH4 (8,54 г), и полученную смесь перемешивают в течение 1,5 часа. Реакцию гасят водой, а растворитель выпаривают в вакууме до разделения остатка между СНСІ3 и насыщенным раствором NaHCO3. Органическую фазу промывают рассолом, сушат над сульфатом магния, фильтруют, и растворитель выпаривают в вакууме до получения белого твердого продукта, 48,38 г, т. пл. 87-87,5°С. 2. Получение 2,3-дихлорбензилбромида К раствору спирта в бензоле (500 мл) в атмо-сфере азота добавляют РВr3 (167,8 г) и полученную смесь перемешивают при 55-60°C в течение 3,5 часа. После охлаждения полученную смесь выливают на измельченный лед (2 л), и выделяют бензольный слой. Водную фазу промывают бен-золом (х3) и объединенные бензольные экстракты промывают насыщенным NaНCO3 раствором в водой, сушат над МgSO4, фильтруют и растворитель выпаривают, оставляя коричневатую жид-кость, которая отверждаeтся при стоянии. Полу-чают 37,53 г, т. пл. 31-32°С. 3. Получение 2,3-дихлорфенилацетонитрила Бромид суспeнзируют в ДМСО (155 мл) / вода (105 мл) при 0°С и КСN (20,24 г) добавляют пор-циями. После перемешивания при 30-35°C в тече-ние 2 часов, суспензию разбавляют водой и экст-рагируют Ет2О. Объединенные эфирные экстрак-ты промывают водой, сушат над сульфатом маг-ния, фильтруют, и растворитель выпаривают в ва-кууме до получения твердого продукта белого цвета. 27,52 г, т. пл. 64-67°C. 4. Получение 2-(2,3-дихлорфенил)-4,4,4-три-фтор-3-оксо-бутиронитрила К раствору NaOEт (из 1,48 г Na) в ЕтОН (25 мл) при комнатной температуре в атмосфере азота добавляют 10,0 г нитрила а затем 9,3 г этилтрифторацетата, и полученную смесь переме-шивают при кипячении с обратным холодильником в течение 5 часов. После охлаждения раствори-тель удаляют в вакууме, а остаток растворяют в воде. Водную фазу промывают Ет2О /сливают, подкисляют серной кислотой и экстрагируют Ет2О. Объединенные экстракты Ет2О промывают водой, сушат над сульфатом магния, фильтруют, и рас-творитель выпаривают в вакууме до получения масла. Его тщательно растирают с петролейным эфиром, отфильтровывают твердую часть и су-шат. Получают 9,56 г, т. пл. 74-75°С. 5. Получение 2-(2,3-дихлорфенил)-4,4,4,-три-фтор-3-метокси-бут-2-енонитрила 41245 К раствору трифторметилкетона в Ет2О (90 мл) при комнатной температуре добавляют диазометан (из 19,35 г Diazald) в Ет2О (180 мл), и полученную смесь оставляют выстаиваться при комнатной температуре в течение ночи. Затем из-быток диазометана удаляют в вакууме в АсОН, и остаток растворяют в Ет2О, сушат над сульфатом магния, фильтруют, и растворитель выпаривают в вакууме до получения коричневатого твердого вещества, 6,44 г. 6. Получение 2,4-диамино-5-(2,3-дихлор-фенил)-6-трифтор-метилпиримидина К раствору вышеуказанного енольного эфира в этаноле (37 мл) добавляют гуанидингидрохло-рид (1,92 г), а затем раствор NаОЕт (из 540 мг Nа) в ЕтОН (90 мл), и полученную смесь перемешивают при кипячении с обратным холодильником в течение 3 часов. После охлаждения суспензию фильтруют, и полученный фильтрат выпаривают досуха в вакууме. После хроматографирования на силикагеле при элюировании СHСІ3 до 2% Мe-ОН-СHСІ3 получают целевой продукт, который тща-тельно растирают с EТ2О и сушат в вакууме до получения 673 мг, т. пл. 218-9°С. 7. 2,4-диамино-5-(2,3-дихлорфенил)-6-три-фторметилпиримидинметансульфонат К суспензии свободного основания (100 мг) в этаноле добавляют метансульфокислоту (30 мг), и полученный прозрачный раствор перемешивают при комнатной температуре в течение 2 часов. Этот раствор выпаривают досуха, а оставшуюся твердую часть тщательно растирают с эфиром, фильтруют и сушат в вакууме, 107 мг, т. пл. 253-256°С. 8. 2,4-диамино-5-(2,3-дихлорфенил)-6-три-фторметилпиримидингидрохлорид К раствору свободного основания (150 мг) в метаноле добавляют эфирный раствор хлористого водорода. После перемешивания, растворитель выпаривают досуха, и полученный твердый про-дукт тщательно растирают с эфиром, фильтруют и сушат в вакууме, 160 мг, т. пл. 233-236°С. Пример 15 Получение 2,4-диамино-5-(2,3-дихлорфенил)-6-метилпиримидина Это соединение получают аналогично соединению примера 6 из 2,3-дихлорфенилацето-нитрила, т. пл. 245-247°С. Пример 16 Получение 2,4-диамино-5-(2,3-дихлорфенил)-6-метокоиметил-пиримидина 1. Получение 2-(2,3-дихлорфенил)-4-метокси-3-оксобутиронитрила К перемешиваемому кипящему с обратным холодильником раствору NaОЕт (из 1,38 г Nа) в EтОН (25 мл) добавляют смесь этилметоксиаце-тата (8,85 г) и 2,3-дихлорфенилацетоцитрил (при-мер 14.3) (9,3 г) растворенный в 20 мл ДМЕ за 5 минут. Спустя 5 часов появляется осадок (на-триевая соль продукта). Полученную смесь охла-ждают и фильтруют, полученный фильтрат выпаривают досуха в вакууме, и остаток разделяют между эфиром и водой (эфирную фазу сливают). Водный остаток подкисляют 2н H2SO4 и экстраги-руют эфиром (х2). Объединенные экстракты Ет2О промывают водой, сушат над сульфатом магния, фильтруют и выпаривают в вакууме до получения желтого твердого вещества (а). Нижеуказанную натриевую соль растворяют в воде, и раствор экс-трагирует эфиром и сливают. Водный раствор подкисляют 2н H2SO4 и экстрагируют эфиром. Эфирные растворы промывают водой, сушат над сульфатом магния, фильтруют и выпаривают в вакууме до получения твердого продукта белого цвета (b). Вышеуказанные продукты (а) и (b) объединя-ют до получения 10,4 г, которые используют без дальнейшей очистки. На ТСХ одно пятно (19:1 CH2CI2:МеОН) Rf 0,35. 2. Получение 2-(2,3-дихлорфенил)-3,4-димет-оксибут-2-енонитрила К перемешиваемому раствору вышеуказанно-го нитрила (9,4 г) в эфире добавляют порциями диазометан (0,4-0,45 М) в эфире. Вначале наблю-дается интенсивное вспeнивание, и после дополнительного добавления немедленной реакции не происходит. Полученную смесь оставляют выстаиваться при перемешивании при комнатной температуре в течение 3 часов, и выпаривают в вакууме в АсOН до получения енольного эфира. 3. Получение 2,4-диамино-5-(2,3-дихлор-фенил)-6-метокси-метилпиримидина К раствору NaOEт (из 0,92 г Na) в ЕтОН (40 мл) добавляют гуанидингидрохлорид (3,44 г). Добавляют вышеуказанный раствор енольного эфира в ЕтОН (30 мл), и полученную смесь кипя-тят с обратным холодильником приблизительно 3 часа. После охлаждения растворитель выпаривают в вакууме и остаток обрабатывают 5н NаОН (примерно 50 мл). Красный раствор фильтруют, растворяют в АсОН (примерно 20 мл), разбавляют 40 мл воды, обрабатывают древесным углем и фильтруют. Полученный фильтрат (желтый рас-твор) подщелачивают 2н NаОН и белый осадок отфильтровывают, сушат и пeрекристаллизовы-вают из ЕтОН. Получают 4,39 г, т. пл. 237-240°С. Пример 17 Получение 2,4-диамино-5-(1-нафтил)пир-мидина К раствору NaOEт (из 1,45 г Na) в этаноле (60 мл) при комнатной температуре в атмосфере азота добавляют 1-нафтилацетонитрил (Aldrich, 10,02 г). После перемешивания в течение 10 ми-нут добавляют этилформат (8,88 г), и полученную смесь перемешивают при кипячении с обратным холодильником в течение 5 часов. Полученную смесь охлаждают, растворитель выпаривают, a остаток тщательно растирают c Ет2O перед тем, как фильтруют и сушат твердую часть в вакууме (6,86 г). Полученную твердую часть растворяют в ДMF (45 мл), добавляют метилиодид, и реактор герметизируют перед перемешиванием содержания при 40°C в течение 4 часов. Затем растворитель уда-ляют в вакууме, а остаток разделяют мeжду ЕтОАс и водой. Органическую фазу промывают водой, сушат над сульфатом магния, и растворитель выпаривают в вакууме до получения неочи-щенного продукта в виде вязкого красноватого масла (5,4 г). 41245 К раствору NaOЕт (из 1,19 г Nа) в этаноле (80 мл) добавляют гуанидингидрохлорид (4,94 г). После перемешивания в течение еще 5 минут, вышеуказанное промежуточное соединение в эта-ноле добавляют, и полученную реакционную смесь перемешивают при кипячении с обратным холодильником в течение 3,5 часа. После охлаж-дения растворитель удаляют в вакууме, и полу-ченный остаток разделяют между СНСІ3 и водой. Органическую фазу промывают водой, сушат над сульфатом магния, фильтруют и растворитель выпаривают до получения твердого продукта бледно-желтого цвета. После хроматографирова-ния на силикагеле при элюировании СНСІ3 до 4% СНСІ3:МеОН, с последующей перекристаллизаци-ей из этанола получают целевой продукт в виде белого твердого вещества, 2,82 г, т. пл. 171-173°С. Пример 18 Получение 2,4-диамино-5-(2,3-дихлорфенил)-6-фторметилпиримидина 1. 2,4-диамино-5-(2,3-дихлорфенил)-6-(диэток-симетил)-пиримидин К перемешиваемому при кипячении с обрат-ным холодильником раствору NaOEт (из 1,38 г на-трия) в 25 мл этанола добавляют за 5 минут смесь этилдиэтоксиацетата (13; 21 г, 75 ммолей) и (при-мер 14.3) 2,3дихлорфенилацетонитрил (9,3 г, 50 ммолей) в сухом диметоксиэтане (20 мл). Спус-тя 4 часа охлаждают и выпаривают в вакууме. Ос-таток разделяют между содой (100 мл) и эфиром (100 мл) и эфирную фазу сливают, а водный оста-ток подкисляют 1н серной кислотой. После экстра-гирования CH2CI2 получают ацилацетонитрил (13,47 г), который используют без дальнейшей очистки. К перемешиваемому раствору вышеуказанно-го ацетонитрила в эфире (100 мл) охлажденному на льду добавляют порциями раствор диазомета-на (примерно 3 г) в эфире. Спустя 2 часа этот рас-твор выпаривают в вакууме до получения целево-го енольного эфира в виде масла, которое ис-пользуют без дальнейшей очистки. К раствору NаОЕт (из 1,4 г натрия) в этаноле (50 мл) добавляют гуанидингидрохлорид (4,8 г, 50 ммолей). Добавляют раствор вышеуказанного енольного эфира в этаноле (20 мл) и полученную смесь кипятят с обратным холодильником в тече-ние 4 часов, охлаждают, и концентрируют в ва-кууме до приблизительно 30 мл, и разбавляют во-дой до получения темно-пурпурного твердого ве-щества, которое фильтруют, растворяют в CH2Cl2, промывают водой, сушат над сульфатом магния и выпаривают в вакууме. Остаток тщательно расти-рают с 50 мл этанола и отфильтровывают, полу-чая целевой продукт (8,4 г), который используют без дальнейшей очистки (т. пл. 214-217°С). 2. 2,4-диамино-5-(2,3-дихлорфенил)пирими-дин-6-карбоксальдегид Смесь вышеуказанного ацеталя (7 г) и 0,4 М НСl (150 мл) кипятят c обратным холодильником при перемешивании в течение 1 часа, охлаждают на льду и нейтрализуют 2 М NaOH. Полученную смесь фильтруют, промывают водой и сушат на воздухе до получения целевого продукта (6,2 г), который используют без дальнейшей очистки. 3. 2,4-диамино-5-(2,3-дихлорфенил)-6-гидрок-симетилпиримидин К перемешиваемому раствору вышеуказанно-го альдегида (2,8 г, 10 ммолей) в смеси диметок-сиэтана (15 мл) и этанола (15 мл) добавляют пор-циями боргидрид натрия (110 мг, 3 ммоля). Спустя 30 минут раствор обрабатывают водой (50 мл) и добавляет несколько капель уксусной кислоты для разрушения остатков боргидрида. После экстраги-рования дихлорметаном (2х50 мл), промывают водой и экстракт сушат над сульфатом магния. После выпаривания растворителя получают твер-дое вещество розового цвета, которое тщательно растирают с эфиром, фильтруют и сушат (1,6 г). После перекристаллизации из метанола (50 мл) получают целевой продукт в виде тонких бесцвет-ных кристаллов; 0,65 г. Т. пл. 173176°С. 4. 2,4-диамино-5-(2,3-дихлорфенил)-6-фтор-метилпиримидин К перемешиваемой суспензии 2,4-диамино-5-(2,3-дихлорфенил)-6-гидроксиметилпиримидина (185 мг, 1 ммоль) в сухом дихлорметане (25 мл) в атмосфере азота при -70°С, добавляют по каплям трифторид диэтиламиносеры (263 мкл, 2 ммоля). Полученной смеси дают нагреться до 0°С, и под-держивают эту температуру в течение 4 часов. После охлаждения до -70°С смесь гасят водным бикарбонатом натрия, экстрагируют дихлормета-ном (2х50 мл), промывают насыщенным рассолом и сушат над сульфатом магния. После концентри-рования получают бесцветную смолу (0,2 г). По-сле хроматографирования на силикагеле при элюировании 0,01:1:19 Ет3N:МеОН:СН2Сl2 полу-чают целевой продукт, который тщательно расти-рают с ССI4 и сушат в вакууме; получают 111 мг, т. плавления 224-226°С. Пример 19 2,4-диамино-5-(2,3-дихлорфенил)-6-фенокси-метилпиримидин К перемешиваемому раствору NаОEт (из 1,38 г натрия) в этанолe (70 мл) при кипении с об-ратным холодильником добавляют за 10 минут смесь 2,3-дихлорфенилацетонитрила (9,3 г) и этилфеноксиацетат (13,5 г) в сухом диметоксиэта-не (50 мл). После перемешивания при кипячении с обратным холодильником в течение 3 часов полу-ченную смесь охлаждают, фильтруют и раствори-тель выпаривают в вакууме. Остаток растворяют в воде, промывают эфиром (сливают), подкисляют 2н соляной кислотой и экстрагируют дихлормета-ном. Объединенные экстракты промывают рассо-лом, сушат над сульфатом магния и выпаривают в вакууме, получая желто-коричневый твердый про-дукт (8 г), который используют без дальнейшей очистки. К суспензии неочищенного ацилацетонитрила (8 г) в 150 мл эфира добавляют порциями избыток раствора диазометана в эфире. После перемешивания в течение 1 часа при комнатной температуре раствор концентрируют в вакууме до получения енольного эфира, который используют без даль-нейшей очистки. К раствору этоксида натрия (из 0,63 г натрия) в этаноле (25 мл) при комнатной температуре добавляют гуанидингидрохлорид (2,39 г). Спустя 15 минут добавляют раствор вышеуказанного енольного 41245 эфира в этаноле (25 мл), и полученную смесь перемешивают при кипячении с обратным холодильником в течение 4 часов. После охлаж-дения, растворитель выпаривают в вакууме. Оста-ток суспендируют в 2 н NаОН (75 мл), фильтруют, промывают водой, сушат на воздухе и перекрис-таллизовывают из этанола до получения целевого продукта в виде бесцветного белого твердого продукта. 3,82 г, т. пл. 211-213°С. Пример 20 2,4-диамино-5-(2,3-дихлорфенил)-6-метилтио-метилпиримидин К перемешиваемому раствору NаОЕт (из 1,38 г натрия) в 25 мл этанола при кипячении с об-ратным холодильником добавляют за 5 минут смесь 2,3-дихлорфенилацетонитрила (9,3 г) и 10,07 г этилметилтиоацетата в 20 мл сухого ди-метоксиэтана. После перемешивания при кипяче-нии с обратным холодильником в течение 5 часов смесь охлаждают на льду, подкисляют уксусной кислотой (5 мл), выливают в холодную воду и экс-трагируют дихлорметаном. Объединенные экс-тракты промывают водой, сушат над сульфатом магния и концентрируют до получения желтого масла, которое используют без дальнейшей очистки. Неочищенный ацилацетонитрил нагревают в атмосфере азота с триэтилортоформатом (40 мл) при 140-150°С в течение 4 часов, отгоняют легко-кипящую часть. После охлаждения полученную смесь концентрируют в вакууме до получения темного масла (15,2 г). Это масло растворяют в этаноле (20 мл) и добавляют к смеси гуанидин-гидрохлорида (4,8 г) и этоксида натрия (из 1,38 г натрия) в 50 мл этанола. После перемешивания при кипячении с обратным холодильником в тече-ние 4 часов полученную смесь охлаждают и кон-центрируют в вакууме. Остаток встряхивают с 5М NаОН до получения темного масла, которое экст-рагируют дихлорметаном, промывают водой, су-шат над сульфатом магния. Концентрируют в ва-кууме, и получают темную смолу. Целевой про-дукт кристаллизуют из этанола (20 мл) в виде светлокоричневого твердого продукта, 0,57 г, т. пл. 205-207°С. Пример 21А Получение 2,4-диамино-5-(2,3-дихлорфенил) пиримидина а. 2-(2,3-дихлорфенил)-3-оксо-пропионитрил К раствору NаОEт (из 3,63 г Nа) в 500 мл эта-нола добавляют 2,3-дихлорфенилацетонитрил (пример 14.5) в 150 мл этанола. Добавляют этил-формат (16,67 г), и полученную смесь перемеши-вают при 80°С в течение 45 минут, перед добав-лением дополнительной порции этилформата (2,78 г). После перемешивания при 80°С в течение еще 1,5 часа, осадок отфильтровывают и сушат в вакууме. Твердый продукт растворяют в воде, фильтруют, подкисляют концентрированной соля-ной кислотой и осадок отфильтровывают и сушат в вакууме. 14,35 г, 45% выход. b. раствор вышеуказанного продукта, 9,19 г этиленгликоля и 8,9 г паратолуолсульфокислоты в 100 мл толуола перемешивают при кипячении с обратным холодильником, причем воду собирают в ловушку ДинаСтарка. После охлаждения рас-твор промывают водой, 1н NаOН и водной перед сушкой над сульфатом магния. После выпарива-ния растворителя получают масло (20,17 г), кото-рое растворяют в ЕтOH (70 мл). После выстаивания в течение 1 часа кремообразный осадок от-фильтровывают и сушат в вакууме. Получают 10,44 г. с. К раствору NaOMe (5,1 г) в этаноле (75 мл) добавляют 8,2 г гуанидингидрохлорида. После перемешивания в течение 30 минут NaCI отфильт-ровывают, добавляют вышеуказанный ацеталь, и полученную смесь перемешивают при кипячении с обратным холодильником в течение 1 часа. Затем растворитель концентрируют, а полученный про-дукт отфильтровывают. После перекристаллиза-ции из этанола получают продукт в виде белого твердого продукта, 7,67 г выход 70%, т. плавления 212,5-214°С. Диаминопиримидин (6,12 г) растворяют в эта-ноле (250 мл), добавляют концентрированную со-ляную кислоту (2,07 мл) и суспензию охлаждают в течение 2 часов. Осадок отфильтровывают и су-шат до получения гидрохлоридной соли, 5,52 г. Пример 21В а. 2,3-дихлорфенилуксусная кислота 100 мл концентрированной соляной кислоты выливают на измельченный лед, этот раствор до-бавляют к 2,3-дихлорфенилацетонитрилу (30,6 г), и полученную смесь кипятят с обратным холодильником в течение 5 часов. После охлаждения смесь разбавляют водой (500 мл), экстрагируют ЕтОАс (600 мл), и органическую фазу промывают рассолом перед тем, как сушат над сульфатом магния. После выпаривания растворителя полу-чают белый твердый продукт, 31,3 г. b. Этил-2,3-дихлорфенилацетат К суспензии кислоты в этаноле (200 мл) до-бавляют концентрированную серную кислоту (1 мл), и полученную смесь перемешивают при кипении с обратным холодильником в течение 3 часов. После охлаждения растворитель выпаривают, а остаток обрабатывают концентрированной NН4OH (3 мл) в 50 мл воды. Органическую фазу экстрагируют в CH2CI2, сушат над сульфатом маг-ния, и растворитель выпаривают, получая про-зрачную жидкость, 19,88 г. с. Этил-2-(2,3-дихлорфенил)-3-N-морфолино-акрилат К смеси сложного эфира, морфолина (40,7 г) и этилортоформата (69,24 г) добавляют уксусный ангидрид (0,5 мл), и полученный бледно-желтый раствор перемешивают при кипячении с обратным холодильником в течение 3 часов. После охлаж-дения смесь концентрируют в вакууме. Начинает образовываться белый осадок, и его отфильтро-вывают перед дальнейшим концентрированием фильтрата до получения коричневого прозрачного масла. После выстаивания в вакууме в течение ночи получают желтый твердый продукт, 34,34 г. d. 5-(2,3-дихлорфенил)изоцитозин 41245 К вышеуказанному сложному эфиру добавля-ют гуанидингидрохлорид (26,6 г), суспендирован-ный в 2метоксиэтокоиде натрия (из 6,6 г Nа) в 2-метоксиэтаноле (150 мл), и полученную смесь пе-ремешивают при кипячении с обратным холо-дильником в течение ночи. После охлаждения по-лученную смесь концентрируют в вакууме, раз-бавляют водой (100 мл), а затем промывают Ет2O (200 мл). Водную фазу подкисляют АсОН, и оса-док фильтруют и промывают ЕтОН, а затем Eт2О перед сушкой в вакууме. Получают 13,48 г. е. N1-(4-хлор-5-)2,3-дихлорфенил(-2-пирими-динил)-N2,N2-диметилформамидин К смеси указанного изоцитозина (14,4 г) в CH2CI2 (200 мл) добавляют по каплям за 30 минут свежий реагент Вилсмейера-Хаака (из 2,75 экви-валентов SOCI2 и 2,58 эквивалентов ДМF), а за-тем полученную смесь кипятят с обратным холо-дильником в течение 6 часов. После охлаждения медленно добавляют 1н NaOH (250 мл). Водную фазу промывают CH2CI2 и объединенные органи-ческие экстракты промывают рассолом перед тем, как их сушат над сульфатом магния. После выпа-ривания растворителя и хроматографической об-работки на силикагеле при элюировании ЕтОАс получают 13,6 г, т. пл. 113-115°С. f. 2-амино-4-хлор-5-(2,3-дихлoрфенил)пири-мидин К формамидину в ЕтОН (50 мл) добавляют этанольный МеNН4 (8 эквивалентов) в ЕтОН (50 мл) и полученную смесь герметизируют в ре-акторе Парра перед тем как перемешивают при комнатной температуре в течение 5 часов. Затем реакционную смесь концентрируют в вакууме, ос-таток смешивают с 1н NаОН (75 мл), фильтруют, промывают водой и сушат в вакууме. Получают 11,2 г, т. пл. 228-230°C. g. 2,4-диамино-5-(2,3-дихлорфенил)пири-мидин К 2-амино-4-хлор-5-(2,3-дихлорфенил)пирими-дину (6,73 г) добавляют этанольный аммиак (30 экв. в 50 мл ЕтОН) и полученную смесь герме-тизируют в реакторе Парра и нагревают до 125°С в течение 38 часов. После охлаждения смесь кон-центрируют в вакууме, а остаток смешивают с 1н NaOH (75 мл), фильтруют, промывают водой и сушат в вакууме. 6,14 г. Т. пл. 208-211°С. Пример 22 Получение 2,4-диамино-5-(2-хлорфенил)-6-метилпиримидина Это соединение получают по способу JACS, 1951, 73, 3763-70, т. пл. 225°C. Пример 23 Получение 2,4-диамино-5-(2-хлорфенил)пири-мидина Это соединение получают по способу JACS, 1951, 73, 3763-70, т. пл. 125-8°С. Пример 24 Получение 2,4-диамино-5-(2-хлорфенил)-6-этилпиримидина Получают по способу примера 22, за исключением того, что этилпропионат заменяют на этил-ацетат. Т. пл. 197-8°С. Пример 25 Получение 2,4-диамино-5-(2,4-дихлорфенил)-6-трифторметилпиримидина Это соединение получают способом анало-гичным получению соединения примера 14 из 2,4дихлорфенилацетонитрила (Aldrich). Т. пл. 220,5-221°С. Пример 26 Получение 6-бензилоксиметил-2,4-диамино-5-(2,4-дихлорфенил)-пиримидина Это соединение получают способом анало-гичным получению соединения примера 16 из 2,4дихлорфенилацетонитрила и этилбензилоксиаце-тата, 3,77 г, 171-172°C. Пример 27 2-(4-мeтилпиперазин-1-ил)-4-амино-5-(2,4-дихлорфенил)пиримидин А) Раствор 55,7 г (0,4 экв.) сульфата S-метилизотиомочeвины в 280 мл воды приготавливают и осторожно нагревают на паровой бане при перемешивании. Затем медленно прикапывaют 40 г (0,4 моля) N-мeтилпипeразина к раствору, продувая колбу азотом. Выделяющиеся газы со-бирают в несколько порций раствора 132 г хлори-да ртути в 400 мл этанола, который заставляет мeтилмеркаптан оседать в виде хлорида метил-ртути. После завершения добавления N-метилпиперазина реакцию продолжает до тех пор, пока не прекращается осаждение хлорида метил-ртути. Затем реакционную смесь концентрируют в вакууме и охлаждают, что приводит к кристалли-зации N-метил-N'-аминопипeразинсульфата, по-лучают 50,79 г. В) Смесь 76,3 г (0,356 моля) a-формил-2,4-дихлорфенилацетонитрила, 63,7 г изоамилового спирта, 0,36 г пара-толуолсульфокислоты, 895 мл толуола и 10 капель концентрированной серной кислоты нагревают при кипячении с обратным хо-лодильником в течение 20 часов в присутствии ловушки ДинаСтарка для удаления воды, обра-зующейся в процессе реакции, затем добавляют равную порцию изоамилового спирта и несколько капель серной кислоты, и реакционную смесь на-гревают еще 20 часов до тех пор, пока не собира-ют теоретическое количество воды. Раствор ох-лаждают. С) Порцию 8,2 г натрия растворяют в 500 мл абсолютированного этанола, добавляют 50 г N-метил-N'аминопиперазинсульфата. Полученную смесь перемешивают еще 10 минут. Добавляют раствор В. Смесь кипятят при перемешивании еще 6 часов, оставляют выстаиваться в течение ночи, и растворитель удаляют в вакууме. Остаток экстрагируют разбавленной соляной кислотой, ко-торая растворяет большую часть продукта. Рас-твор трижды экстрагируют эфиром, затем нейтра-лизуют водную фракцию, которая оседает в виде смолы, которая отвeрждается при стоянии в тече-ние ночи; вес 30 г. Продукт повторно кристалли-зуют из 50% этанола с обесцвечивающим древес-ным углем. Для того, чтобы прошла кристаллиза-ция, необходимо очень медленное охлаждение; т. пл. 137°С. Рассчитано для C15H17CI2N5: С 58,27 Н 5,07 N 20,71 41245 Найдено: С 53,58 Н 5,14 N 20,40 Пример 28 Получение 2,4-диамино-5-(2,5-дихлорфенил)-6-трифторметилпиримидина Это соединение получают по способу для со-единения примера 14 из 2,5-дихлорфензилового спирта (Синтез Ланкастера, 48,26 г) до получения указанного в заглавии соединения в количестве 3,85 г. Т. плавления 215-217°С. Пример 29 Получение 2,4-диамино-5-(2,3,5-трихлорфе-нил)пиримидина 3,20 г гуанидинхлорида добавляют к раствору этоксида натрия (из 848 мг натрия) в 52 мл этано-ла. Полученную белую суспензию перемешивают при комнатной температуре в течение 10 минут. Добавляют енольный эфир из примера 3.2 (4,40 г), и полученную смесь перемешивают при кипячении с обратным холодильником в течение 3,5 часа. После охлаждения суспензию фильтруют, и полу-ченный фильтрат выпаривают досуха в вакууме. После хроматографической обработки на силика-геле при элюировании CНCI3 до 3% МеОН-СHСІ3 получают целевой продукт, который тщательно растирают с эфиром и сушат в вакууме. Выход 2,01 г. Т. плавления 246-249°С. Пример 30 Получение 4-амино-5-(3-бромфенил)-6-метил-2-(4-метилпиперазин-1-ил)пиримидина К раствору NаОEт (из 0,92 г натрия) в 75 мл этaнола добавляют 3-бромфенилацетонитрил (Aldrich, 7,85 г) и этилацетат (3,52 г). Полученную смесь нагревают при кипячении с обратным холо-дильником в течение 6 часов. После охлаждения смесь концентрируют и остаток растворяют в во-де. Водную фазу промывают эфиром, подкисляют 2н НСl и экстрагируют эфиром. Полученные экс-тракты сливают, сушат над сульфатом магния и выпаривают 3,6 г. Т. плавления 97-103°С. Полученный кетон (3,7 г), этилtнгликоль (5 мл) и паратолуольсульфокислоту (100 мг) нагревают при кипячении с обратным холодильником в то-луоле (100 мл) в аппарате Дина-Старка в течение 3,5 часа. Полученную смесь охлаждают, концен-трируют и к остатку добавляют воду. Полученный продукт экстрагируют эфиром, и полученные экс-тракты сливают, сушат над сульфатом магния и выпаривают, 4,03 г, т. пл. 68-7У°С. К раствору NaOEт (из 0,28 г натрия) в этаноле (30 мл) добавляют N-метилпиперазино-формамидингидроиодид (2,7 г). После перемешивания в течение 10 минут добавляют кeталь (1,41 г), и полученную смесь перемешивают при кипячении с обратным холодильником в течение 4 часов. По-сле охлаждения суспензии ее фильтруют, и полу-ченный фильтрат концентрируют. Остаток очища-ют хроматографически на силикагеле, элюируют 10% МеОН/СНСІ3 до получения целевого продукта, 0,48 г. Т. плавления 120-122°С. Пример 31 Получение 2,4-диамино-5-(1-нафтил)-6-три-фторметилпиримидина Это соединение получают способом анало-гичным получению соединения 14 из 1нафтилацетонитрила (Aldrich, 10 г), до получения указанного в заглавии соединения с выходом 0,69 г, т. пл. 224-226°С. Пример 32 Получение 2-амино-5-(2,4-дихлорфенил)-4,6-дихлорпиримидина 1. Этил-2,4-дихлорфенилацетат 2,4-дихлорфенилацетонитрил (27,9 г, 150 ммоля) суспендируют в 2н NаОН (400 мл), и полученную смесь кипятят с обратным холодильником в течение 4 часов. Охлажденную реакционную смесь экстрагируют эфиром (2х200 мл), под-кисляют до рН 3, и твердый продукт фильтруют и сушат (22 г, 70%). 20 г продукта растворяют в ЕтОН (300 мл) и концентрированную серную кислоту (5 мл) осто-рожно добавляют. Полученную смесь кипятят с обратным холодильником в течение 7 часов. Ох-лажденную реакционную смесь выпаривают при пониженном давлении, и остаток разделяют меж-ду CH2CI2 и водой (по 30 мл каждого). Органический слой экстрагируют насыщенным раствором бикарбоната натрия (200 мл), промывают водой (100 мл), сушат и выпаривают в вакууме до полу-чения этил-2,4-дихлорфенилацетата в виде масла (22,2 г, 89,5%). 2. Диэтил-2,4-дихлорфенилмалонат Натрий (1,86 г,081 М) добавляют порциями в абсолютированный этанол (150 мл) при переме-шивании. После того, как весь натрий растворится, прикапывают раствор этил-2,4-дихлор-фенилацетата (20 г) в диэтилкарбонате (50 мл). Реакционную смесь нагревают до тех пор, пока не отгонится ЕтОН. Скорость добавления контролируют таким образом, чтобы скорость разгонки бы-ла равномерной. После завершения добавления реакционную смесь нагревают и перегоняют еще 4 часа. Охлажденную реакционную смесь разде-ляют между водой (300 мл) и ЕтОАс (300 мл) и ор-ганический слой сушат и выпаривают в вакууме до получения масла желтого цвета (21 г, 85%). 3. 2-амино-5-(2,4-дихлорфенил)-4,6-дигидрок-сипиримидин Натрий (4,52 г, 0,196 М) добавляют порциями к этанолу (150 мл). После того, как растворяется весь натрий, добавляют гуанидингидрохлорид (12,44 г, 0,13М), а затем диэтил-2,4"-дихлорфенилмалонат (20 г, 0,0655 М). Получен-ную смесь кипятят с обратным холодильником в течение 6 часов, ЕтОН удаляют при пониженном давлении, а остаток разделяют между 2н NаОН (400 мл) и ЕтОАс (400 мл). Водный слой подкис-ляют концентрированной соляной кислотой при охлаждении и осадок отфильтровывают и сушат (11 г, 62%). 4. 2-амино-5-(2,4-дихлорфенил)-4,6-дихлорфе-нилпиримидин 41245 Смесь 2-амино-5-(2,4-дихлорфенил)-4,6-дигидроксипиримидина (10 г), фосфорилхлорида (100 мл) и диметиланилина (1,5 мл) кипятят с об-ратным холодильником в течение 6 часов. Охлаж-денную реакционную смесь осторожно добавляют к измельченному льду и нерастворимую твердую часть фильтруют и промывают 2н HCl, а затем во-дой. Твердую часть повторно суспендируют в воде, нейтрализуют (0,88 NН4ОН) при охлаждении, и полученную смесь оставляют на ночь при комнатной температуре. Нерастворимую твердую часть отфильтровывают, сушат и очищают с помощью хроматографии с мгновенным испарением до по-лучения указанного в заглавии соединения (2,5 г, 22%), т. плавления 211-213°С. Результаты микроанализа: Рассчитано: C 38,83 H 1,6 N 13,59 Найдено: C 38,59 H 1,53 N 13,40 Пример 33 Получение 2,4-диамино-6-хлор-5-(2,4-дихлор-фенил)-пиримидина Смесь 2-амино-5-(2,4-дихлорфенил)-4,6-дихлорпиримидина (0,5 г) (пример 32) ЕтОН на-сыщенного аммиаком (20 мл) и порошка меди (0,05 г) нагревают в автоклаве при 180°С в тече-ние 18 часов. Охлажденную реакционную смесь фильтруют, выпаривают и остаток очищают на хроматографической колонке с мгновенным испа-рением до получения указанного в заглавии со-единения (0,12 г, 25%). Т. плавления 219°С. Мик-роанализ: Рассчитано C 40,82 Найдено: C 41,27 H 2,55 H 2,46 N 19,05 N 18,74 Пример 34 Получение 2-амино-4-хлор-5-(2,4-дихлорфе-нил)-6-метилтиопиримидина Смесь 2-амино-5-(2,4-дихлорфенил)-4,6-дихлорпиримидина (0,5 г) (пример 32), ТНF (15 мл), натриевой соли метантиола (0,113 г), по-рошка меди (0,05 г) и трис/2-/2-метоксиэтоиси/-этил/амина (0,1 г) нагревают в автоклаве при 180°С в течение 18 часов. Охлажденную реакци-онную смесь фильтруют, выпаривают и остаток очищают хроматографически с мгновенным испа-рением до получения указанного в заглавии соединения (0,262 г, 5%). Т. плавления 201-202°С (размягчается при 196°С). Микроанализ: Рассчитано: C 41,19 H 2,50 N 13,10 Найдено: C 41,10 H 2,52 N 12,77 Пример 35 Получение 2,4-диамино-5-(2,4-дихлорфенил)-6-метилтиопиримидина Смесь 2-амино-4-хлор-5-(2,4-дихлорфенил)-6-метилтиопиримидина (0,5 г) (пример 32) ЕтОН насыщенный аммиаком (20 мл), порошка меди (0,05 г) и трис/2-/2-метоксиэтокси/этил/амина (0,01 г) нагревают в автоклаве при 180°С в тече-ние 18 часов. Охлажденную реакционную смесь фильтруют, выпаривают и остаток очищают хро-матографически с мгновенным испарением до по-лучения указанного в заглавии соединения (0,11 г, 20,5%), т. плавления 191-192°С. Микроанализ: Рассчитано для 0,2 гидрата: C 43,33 H 3,41 N 18,38 Найдено: C 43,37 H 3,23 N 18,33 Пример 36 2-амино-5-(3,5-дихлорфенил)-6-метил-2-(4-метилпиперазин-1-ил)-пиримидин а. 3,5-дихлорфенилацетонитрил Смесь 3,5-дихлорбензилового спирта (Aldrich, 25 г), тионилхлорида (100 мл) и ДМГ (0,5 мл) перемешивают и кипятят с обратным холодильником в течение 4 часов. После охлаждения смесь концентрируют в вакууме, остаток помещают в эфир, промывают насыщенным водным NаНСО3 и рас-солом, сушат над сульфатом магния и концентри-руют в вакууме до получения 3,5-дихлор-бензилхлорида в виде светло-желтого твердого вещества, которое используют без дальнейшей очистки, 28 г, т. пл. 32-36°С. К интенсивно перемешиваемому раствору 3,5-дихлорбензилхлорида (28 г) в 150 мл дихлорме-тана добавляют смесь КСN (27,5 г) и кислого сульфата тетрабутиламмония (2,38 г) в воде (110 мл). После перемешивания при комнатной температуре в течение 22 часов смесь разбавля-ют дихлорметаном, органическую фазу промывают водой и концентрируют в вакууме до получения масла. После фильтрования через силикагель с толуолом, концентрирования и тщательного рас-тирания с гексаном получают целевой продукт в виде бесцветного твердого вещества, 15,8 г, т. плавления 31-32°С. b. 4-амино-5-(3,5-дихлорфенил)-6-метил-2-(4-метилпиперазин-1-ил)-пиримидин К перемешиваемому раствору NаОЕт (из 0,69 г натрия) в этаноле (25 мл) при кипячении с обратным холодильником, добавляют за 5 минут смесь 3,5-дихлорфенилацетонитрила (9,3 г) и этилацетата (3,3 г) в сухом диметоксиметане (10 мл). После перемешивания при кипячении с обратным холодильником в течение 4 часов, по-лученную смесь охлаждают на льду, подкисляют уксусной кислотой, выливают в холодную воду и экстрагируют дихлорметаном. Объединенные экс-тракты промывают водой и концентрируют до по-лучения масла. После тщательного растирания с гексаном получают 2-(3,5дихлорфенил)-3-оксо-бутиронитрил в виде бесцветного твердого про-дукта (4,15 г). К раствору ацилацетонитрила (4,1 г) в 100 мл эфира добавляют порциями избыток раствора диазометана в эфире. После перемешивания в точение 2 часов при комнатной температуре рас-твор концентрируют в вакууме до получения енольного эфира. 41245 К перемешиваемому раствору NаОЕт (из 0,72 г натрия) в этанолe (25 мл) добавляют Nметилпиперазиноформамидингидриодид (7,29 г). Спустя 10 минут добавляют раствор вышеуказан-ного енольного эфира в этаноле (25 мл) и затем перемешивают при кипячении с обратным холо-дильником в течение 4,5 часа. После охлаждения растворитель выпаривают в вакууме, а остаток встряхивают с 2н NaOH (50 мл). Твердую часть фильтруют, промывают водой, сушат на воздухе и обрабатывают хроматографически (двуокись кремния 1:9 МеОН:СНСl3) до получения целевого продукта в виде бесцветного твердого продукта, 1,6 г. Т. плавления 164-166°С. Пример 37 Получение 2,4-диамино-5-(2,5-дихлорфенил)-6-метилпиримидина Это соединение получают способом, анало-гичным способу получения примера 6 из 2,5дихлорбензилового спирта (синтез Ланкастера). Т. плавления 226-228°С. ТСХ /SiO2:СНСІ3/МеОН, 9:1/ Rf=0,24. Пример 38 Получение 2,4-диамино-5-(3,4-дихлорфенил)-6-трифторметилпиримидина Это соединение получают способом анало-гичным способу получения соединения примера 4, из 3,4дихлорфенилацетонитрила (Aldrich), т. плавления 252-254°С: ТСХ /SiO2;метанол/хлороформ, 1:9) Rf=0,38. Пример 39 Получение 2,4-диамино-5-(2,3-дихлорфенил-4-нитрофенил)пиримидина Это соединение получают способом анало-гичным способу получения соединения примера 5 из 2,4диамино-5-(2,3-дихлорфенил)пиримидина (пример 21). В результате реакции получают смесь 4-нитро и 5нитропроизводных, из которых выделяют указанное в заглавии соединение на хроматографической колонке (SiO2, EтОАс) т. пл. 237-9°С. Таким же образом выделяют 2,4-диамино-5-(2,3-дихлор-5нитрофенил)пиримидин, т. плавления 264-6°С. Пример 40 Получение 2,4-диамино-5-(2,4-дихлорфенил)-6-(диэтоксиметил)пиримидина Это соединение получают способом анало-гичным способу получения 2,4-диамино-5-(2,3дихлорфенил)-6-(диэтоксиметил)-пиримидина (пример 18.1) из 2,4-дихлорфенилацетонитрила, т. плавления 225°С. Пример 41 Получение 2,4-диамино-5-(3,5-дихлорфенил)-6-метилпиримидина Это соединение получают способом анало-гичным способу получения соединения примера 6 из 3,5дихлорфенилацетонитрила (Aldrich), т. плавления 242-244°С. Пример 42 Получение 2,4-диамино-5-(2,3-дихлорфенил)-6-трифторметилпиримидин-N-оксида Это соединение получают из соединения примера 14 при взаимодействии с МСРВА в CНCI3 при комнатной температуре. Т. плавления 275-278°С. Пример 43 Получение 2,4-диамино-5-(2,3-дихлорфенил)-6-трибромметилпиримидина Это соединение получают из соединения при-мера 15 при взаимодействии с избытком брома и ацетата натрия в уксусной кислоте при кипячении с обратным холодильником. Указанное в заглавии соединении выделяют из смеси с соединением примера 75 на хроматографической колонке. Т. плавления 210°С (с разл.). Пример 44 Получение 2,4-диамино-5-(2,4-дихлорфенил)-6-метоксиметилпиримидина Это соединение получают способом анало-гичным способу примера 2, из 2,4-дихлорфенилацетонитрила, т. плавления 183-185°С. На ТСХ одно пятно. Пример 45 Получение 2,4-диамино-5-(2,6-дихлорфeнил)-6-метилпиримидина Это соединение получают по способу анало-гичному способу примера 6 из 2,6-дихлорфенилацетонитрила (Aldrich). Т. плавления 250°С. Пример 46 Получение 2,4-диамино-5-(2,4-дихлорфенил)-пиримидин-6-карбоксальдегида Это соединение получают из соединения при-мера 40 способом аналогичным способу приме-ра 18.2. Т. плавления более 350°С. Пример 47 Получение 2,4-диамино-5-(2,3-дихлор-4-нитро-фенил)-6-метилпиримидина Это соединение получают из соединения при-мера 15 способом, аналогичным способу получе-ния соединения 39, т. плавления 265°С. Также в результате реакции получают 2,4-диамино-5-(2,3-дихлор-5нитрофенил)-6-метилпиримидин. Пример 48 Получение 2,4-диамино-5-(2,4-дихлорфенил)-6-гидроксииминометилпиримидина Это соединение получают из соединения при-мера 46 при взаимодействии с гидроксиламингидрохлоридом в этаноле, т. плавления 260-265°С. Пример 49 Получение 2,4-диамино-5-(2,4-дихлорфенил)-6-гидроксиметилпиримидина 41245 Это соединение получают из соединения при-мера 46 способом аналогичным способу получе-ния соединения в примере 18.3, т. пл. 169-171°С. Пример 50 Получение 2,4-диамино-5-(2,3,4-трихлор-фенил)-6-метилпиримидина Это соединение получают из соединения при-мера 47 при восстановлении амина (РтО2, Н2, AcOH), получения диазониевой соли (NаNО2, H2SO4 и взаимодействия ее с СCl (как в приме-ре 57). Возгоняется при 275°С. По данным ТСХ го-могенно (метанол/хлороформ, 1:9) Rf=0,36. Пример 51 2,4-диамино-5-(2,6-дихллорфенил)-6-метокси-метил-пиримидин Это соединение получают способом анало-гичным способу получения соединения примера 2 из 2,6дихлорфенилацетонитрила (Aldrich), т. пл. 204-207°С. Пример 52 Получение 2,4-диамино-5-(2,3,5-трихлор-фенил)-6-трихлорметилпиримидина Это соединение получают из соединения при-мера 6 при взаимодействии с NСS в AcOH при 100°С (катализатора AIBN), т. плавления 226-227°С. Пример 53 2,4-диамино-5-(2,4-дихлорфенил)-6-фторме-тилпиримидин 1. 2,4-диамино-6-бромметил-5-(2,4-дихлор-фенил)пиримидин 2,4-диамино-6-бензилоксиметил-5-(2,4-ди-хлорфенил)-пиримидин (пример 26) (6,5 г) раство-ряют в 47% растворе бромистоводородной кисло-ты в уксусной кислоте (75 мл) и полученную смесь перемешивают при 100°С в течение 6 часов. По-сле выстаивания при комнатной температуре в течение ночи дигидробромидную соль отфиль-тровывают, промывают эфиром и сушат в вакуу-ме, 6 г. К перемешиваемому раствору дигидробро-мидной соли (0,43 г) в диметилсульфоксиде (4 мл) прикапывают раствор бикарбоната натрия (0,84 г) в 10 мл воды. Спустя 30 минут осадок отфильтровывают, промывают водой, затем эфиром и сушат в вакууме, 0,26 г, т. пл. более 270°С (с разложе-нием). 2. 2,4-диамино-5-(2,4-дихлорфенил)-6-фтор-метилпиримидин К раствору 2,4-диамино-6-бромметил-5-(2,4-дихлорфенил)пиримидина (1,04 г) в тетраметиленсульфоне (4,5 мл) добавляют фторид цези (1 г). Полученную смесь перемешивают и нагре-вают при 100°С в течение 4 часов, разбавляют во-дой и экстрагируют хлороформом. Объединенные экстракты промывают водой, сушат над сульфа-том магния и концентрируют в вакууме. Остаток обрабатывают хроматографически /двуокись кремния 19:1,0,1 дихлорметан/менаол/триэтил-амин) до получения указанного в заглавии соеди-нения, которое перекристаллизовывают из этано-ла 0,19 г, т. плавления 210211°С. Пример 54 Получение 2,4-диамино-5-/2-хлор-5-/N,N-диме-тилсульфамоил/-фенил/-6-метилпиримидина 1. 2,4-диамино-5-(2-хлор-5-нитрофенил)-6-метилпиримидин К раствору 2,4-диамино-5-(2-хлорфенил)-6-метилпиримидина (11,84 г) (пример 22) в концентрированной серной кислоте (100 мл), добавляют нитрат калия (5,1 г). После перемешивания при комнатной температуре в течение 90 минут рас-твор выливают на лед и подщелачивают 10н NaOH. Полученный продукт экстрагируют этил-ацетатом, сливают, сушат над сульфатом магния и выпаривают, 13,9 г, 236-240°С. 2. 2,4-диамино-5-(5-амино-2-хлорфенил)-6-метилпиримидин Раствор 2,4-диамино-5-(2-хлор-5-нитрофе-нил)-6-метилпиримидина (13,9 г) в уксусной кисло-те (500 мл) восстанавливают в атмосфере водо-рода в присутствии РтО2 (0,28 г). Полученную смесь фильтруют через hyflo, и полученный филь-трат концентрируют. Остаток нейтрализуют насы-щенным раствором бикарбоната натрия и полу-ченный продукт экстрагируют этилацетатом, сли-вают, сушат над сульфатом магния и выпаривают. После хроматографирования на силикагеле при элюировании СНСl3 до 40% MeOH/СHСІ3 получа-ют целевой продукт, К г, т. пл. 117-121°С. 3. 2,4-диамино-5-(2-хлор-5-N,N-диметилсуль-фамоилфенил)-6-метилпиримидин 2,4-диамино-5-(5-амино-2-хлорфенил)-6-ме-тилпиримидин (0,25 г) растворяют в воде (0,8 мл) и концентрированной НСІ (0,5 мл). К охлажденно-му раствору (ниже 10°С) добавляют раствор нит-рита натрия (0,07 г) в воде (0,5 мл). После пере-мешивания при комнатной температуре в течение 2 часов, раствор охлаждают до 5°С Добавляют хлорид меди (0,05 г) и 5,14М О2 в уксусной кисло-те (0,97 мл) и реакционную смесь перемешивают при 5°С в течение ночи. Смесь фильтруют и про-мывают водой до получения сульфонилхлорида, 0,23 г. Полученный сульфонилхлорид (0,16 г) рас-творяют в ТНF (2 мл), добавляют 2 мл диэтилами-на. После перемешивания в течение ночи раствор разбавляют водой, экстрагируют этилацетатом, сливают, сушат над сульфатом магния и выпаривают. После хроматографирования на силикагеле при элюировании 2% MeOH/СHСІ3 получают це-левой продукт 0,047 г, т. плавления 283-285°С. Пример 55 Получение 2,4-диамино-5-(3,5-дихлорфенил)-6-метоксиметилпиримидина Это соединение получают способом аналогич-ным способу примера 2 из 3,5-дихлорфенилацетонитрила, т. пл. 228-230°С. Пример 56 Получение 2,4-диамино-5-(2,3-дихлорфенил)-6-гидроксипиридидина 1. Этил-2-циано-2-(2,3-дихлорфенил)ацетат 41245 1,2 г натрия порциями добавляют к 50 мл эта-нола при перемешивании. После растворения на-трия прикапывают раствор 2,3-дихлорфенил-ацетонитрила (9,4 г) в 25 мл диэтилкарбоната. Ре-акционную смесь нагревают до тех пор, пока не отгоняется ЕтОН. Скорость добавления регулиру-ют таким образом, чтобы она была равна скорости отгонки. После завершения добавления реакци-онную смесь нагревают и отгоняют еще в течение 4 часов. Холодную реакционную смесь разделяют между водой и ЕтОАс (300 мл каждого). Органиче-ский слой сушат и выпаривают в вакууме, а оста-ток очищают хроматографически с мгновенным испарением до получения указанного в заглавии соединения (5 г, 39%). 2. 2,4-диамино-5-(2,3-дихлорфенил)-6-гидрок-сипиримидин Натрий (1,2 г, 0,052 моля) добавляют порция-ми к 50 мл абсолютированного этанола при перемешивании. После того, как натрий растворяется, добавляют гуанидингидрохлорид (3,69 г, 0,039 моля) а затем этил-2-циано-2(2,3-дихлор-фенил)ацетат (5 г, 0,0195 моля). Полученную смесь кипятят с обратным холодильником в тече-ние 8 часов, ЕтОН удаляют при пониженном дав-лении, а остаток разделяют между ЕтОАс и водой. ЕтОАс слой экстрагируют 2н NaOH, и полученный экстракт нейтрализуют 2н НСl при охлаждении. Твердый осадок отфильтровывают и сушат до по-лучения указанного в заглавии соединения (0,22 г). Т. плавления 275°C (с разложением). Мик-роанализ: Рассчитано для 0,25 гидрата: C 43,56 H 3,09 N 20,33 Найдено: C 43,76 H 3,09 N 20,03 Пример 57 Получение 2,4-диамино-5-(2,4-трихлорфенил)-6-метилпиримидина а. Получение 2-(2,4-дихлорфенил)-3-оксо-бутиронитрила Раствор 2,4-дихлорфонилацетонитрила (30,0 г, 161 ммоля) (Aldrich) в сухом этилацетате (36 мл) прикапывают к этанольному раствору этоксида натрия, полученному in situ из металли-ческого натрия (4,90 г, 213 ммоля) и сухого этано-ла (60 мл). Эту реакционную смесь кипятят с об-ратным холодильником в течение двух часов, ос-тавляют выстаиваться в течение ночи при комнат-ной температуре и этанол выпаривают. Получен-ное твердое вещество растворяют в воде, а полу-ченный раствор экстрагируют дважды эфиром. Водный слой охлаждают и подкисляют соляной кислотой. Неочищенный продукт экстрагируют эфиром до получения 23,31 г белого твердого продукта. b. Получение 2,4-диамино-5-(2,4-дихлор-фенил)-6-метилпиримидина Раствор неочищенного 2-(2,4-дихлорфенил)-3-оксо-бутиронитрила (23,24 г) в сухом толуоле (400 мл) кипятят с обратным холодильником c этиленгликолем (280 мл) и паратолуолсульфокис-лотой (8,00 г, 42 ммоля) в течение четырех часов с использованием ловушки Дина-Старка. После охлаждения органическую фазу промывает насы-щенным раствором NaНСО3, сушат над МgSO4, и растворитель выпаривают до получения твердого продукта (24,0 г). Тонкоизмельченный гуанидингидрохлорид (19,1 г, 200 ммолей) добавляют к этанольному раствору этоксида натрия, полученному in situ из металлического натрия (5,0 г, 218 ммолей) в сухом этаноле (500 мл). К раствору гуанидина добавля-ют раствор кеталя (25,0 г, 92 ммоля) в сухом эта-ноле (10 мл). Полученную смесь кипятят с обрат-ным холодильником в течение двух часов и ос-тавляют выстаиваться в течение ночи при комнат-ной температуре. Этанол выпаривают, а неочи-щенный продукт порекристаллизовывают из горя-чего ацетона до получения 17,23 г продукта, т. плавления 222-222,5°С. с. Получение 2,4-диамино-5-(2,4-дихлор-5-нитрофенил)-6-метилпиримидина Тонкоизмельченный нитрат калия (6,5 г, 64 ммоля) добавляют к раствору 2,4-диамино-5-(2,4дихлорфенил)-6-метилпиримидина (17,23 г, 64 ммоля) в концентрированной серной кислоте (150 мл). Полученную смесь перемешивают при комнатной температуре в течение 90 минут. Реак-ционную смесь добавляют затем к бикарбонату натрия и льду. Полученный продукт экстрагируют этилацетатом. После удаления этилацетата полу-чают желтый твердый продукт (30,85 г). Часть это-го неочищенного продукта (7,0 г) пропускают че-рез хроматографическую колонку с силикагелем с мгновенным испарением и элюируя этилацетатом получают неочищенный продукт (4,81 г). d. Получение 2,4-диамино-5-(5-амино-2,4-дихлорфенил)-6-метилпиримидина 2,4-диамино-5-(2,4-дихлор-5-нитрофенил)-6-метилпиримидин (4,80 г, 15 ммолей) растворяют в ледяной уксусной кислоте (18 мл). Этот раствор и 10 мг катализатора Адамса перемешивают в ат-мосфере водорода при комнатной температуре в течение 4 часов. Катализатор отфильтровывают, и уксусную кислоту выпаривают. Получают бес-цветную жидкость, которую растворяют в этилаце-тате и промывают трижды водой. После выпари-вания этилацетата получают твердый белый про-дукт (2,64 г, 9 ммолей). е. Получение 2,4-диамино-5-(2,4,5-три-хлорфенил)-6-метилпиримидина 2,4-диамино-5-(5-амино-2,4-дихлорфенил)-6-метилпиримидин (1,95 г, 7 ммолей) растворяют в смеси концентрированной соляной кислоты (3,6 мл) и воды (6 мл). Температуру снижают до 10°С. Полученную смесь перемешивают при ком-натной температуре в течение 2 часов, затем ох-лаждают перед прикапыванием холодного раство-ра хлорида меди (1,7 г, 17 ммолей) в концентри-рованной соляной кислоте (50 мл). Образуется серый осадок, который отфильтровывают и сушат. Неочищенный продукт (2,30 г) растворяют в этил-ацетате и дважды промывают раствором гидро-ксида аммония и один раз рассолом. После выпа-ривания этилацетата получают грязно-белое вещество (2,04 г). После перекристаллизации из 10% метанола в хлороформ получают чистый продукт (0,55 г, 2 ммоля), т. плавления 262°С (с разложением). Пример 58 Получение 4-эмино-2-N-этиламино-5-(2,3,5-трихлорфенил)-пиримидина 41245 К раствору NаОЕт (из 0,1 г натрия) в 10 мл этанола добавляют этилгуанидинсульфат (1 г) (Aldrich). После перемешивания в течение 10 ми-нут, енольный эфир (пример 3.2) (0,486 г) добав-ляют, и полученную смесь перемешивают при ки-пячении с обратным холодильником в течение 4 часов. Реакционную смесь оставляют выстаи-ваться при комнатной температуре на ночь, а за-тем фильтруют. Полученный фильтрат концен-трируют, и остаток очищают на хроматографиче-ской колонке с силикагелем, элюируя СНСІ3 до получения целевого продукта, 0,11 г, т. плавления 149-152°С. Пример 59 2,4-диамино-5-(2,4-дихлорфенил)-6-цианоме-тилпиримидин Это соединение получают из 2,4-диамино-5-(2,4-дихлорфенил)-6-бромметилпиримидина (при-мер 53) при взаимодействии с цианидом натрия в ДМГ при комнатной температуре, т. плавления 249-251°С. Пример 60 2,4-диамино-5-(2,4-дихлорфенил)-6-диметил-аминометилпиримидин Это соединение получают из 2,4-диамино-5-(2,4-дихлорфенил)-6-бромметилпиримидина (при-мер 53) при взаимодействии с диметиламином в этаноле при комнатной температуре, т. плавления 170-172°С. Пример 61 2,4-диамино-5-(2,4-дихлорфенил)-6-циано-пиримидин Это соединение получают из соединения при-мера 48 при взаимодействии с трифторуксусным ангидридом в пиридине, т. плавления 249°С. Пример 62 2,4-диамино-5-(2-хлор-4-фторфенил)-6-метил-пиримидин Это соединение получают способом аналогич-ным способу примера 15 из 2-хлор-4-фторфенилацетонитрила, который сам получают из 2-хлор-4-фтортолуола (Aldrich), т. плавления 238°C. Пример 63 2,4-диамино-5-(3,4-дихлорфенил)-6-метокси-метилпиримидин Это соединение получают способом аналогич-ным способу получения примера 2 из 3,4-дихлорфенилацетонитрила (Aldrich), т. плавления 204-206°C. Пример 64 2,4-диамино-5-(2,3-дихлорфенил)-6-этил-пиримидин Это соединение получают способом аналогич-ным способу получения соединения примера 15 из этилпропионата, т. плавления 228-230°С. Пример 65 2,4-диамино-5-(2,4-дифторфонил)-6-метил-пиримидин Это соединение получают способом аналогич-ным способу получения соединения примера 6 из 2,4дифторфенилацетонитрила (Aldrich), т. плав-ления 291-296°С. Пример 66 2,4-диамино-5-(2-нафтил)-6-метилпиримидин Это соединение получают способом аналогич-ным способу получения соединения примера 6 из 2нафтилацетонитрила (Aldrich). Т. плавления 221-222°С. Пример 67 2,4-диамино-5-(1-нафтил)-6-метилпиримидин Это соединение получают способом получе-ния соединения примера 6 из 1-нафтилацето-нитрила (Aldrich). Т. плавления 224-225°С. Пример 68 2-гидрокси-4-амино-5-(2,3-дихлорфенил)пири-мидин Это соединение получают из соединения при-мера 21 при взаимодействии с нитритом натрия в 1н Н2SО4 при кипячении с обратным холодильни-ком до получения смеси указанного в заглавии со-единения и соединения примера 21B.d. Указанное в заглавии соединение выделяют на хроматогра-фической колонке. Т. плавления 330-334°С. Пример 69 2-амино-4-этокси-5-(2,4-дихлорфенил)-6-метилтиопиримидин Это соединение получают из соединения при-мера 32.4 при взаимодействии с натриевой солью метантиола в этаноле. Т. плавления 123-124°С. Пример 70 2,4-диамино-5-(2,3,5-трихлорфенил)-6-гидроксиметилпиримидин Это соединение получают из соединения при-мера 2 при взаимодействии с триметилсилилио-дидом в сульфолане при 80°С. Т. плавления 101-105°С. Пример 71 2,4-диамино-5-(2,3,5-трихлорфенил)-6-фтор-метилпиримидин Это соединение получают способом аналогич-ным способу получения соединения примера 18 из 2,4диамино-5-(2,3,5-трихлорфенил)-6-гидрокси-метилпиримидина. Т. плавления 215-217°С. Пример 72 2,4-диамино-5-(2,4-дихлорфенил)-6-карбамо-илпиримидин Это соединение получают из соединения при-мера 61 при взаимодействии с концентрированной серной кислотой при комнатной температуре. Т. плавления 298-199°С. Пример 73 2,4-диамино-5-(2,4-дихлорфенил)пиримидин-6-карбоновая кислота 41245 Это соединение получают из соединения при-мера 46 при взаимодействии с перманганатом ка-лия, т. плавления 227°С. Пример 74 Этил-2,4-диамино-5-(2,4-дихлорфенил)пири-мидин-6-карбоксилат Это соединение получают из соединения при-мера 73 при кипячении с обратным холодильни-ком в присутствии концентрированной серной ки-слоты, т. плавления 177,5°С. Пример 75 2,4-диамино-5-(2,3-дихлорфенил)-6-дибром-метилпиримидин Это соединение получают из соединения при-мера 15 при взаимодействии с 2н эквивалентами NBS в CCI4 а АІВN в качестве инициатора. Ука-занное в заглавии соединение выделяет из смеси соединения примера 43 на хроматографической колонке. Т. плавления 270°С (с разложением). Пример 76 2-диметиламино-4-амино-5-(2,4-дихлорфе-нил)пиримидин Это соединение получают способом аналогич-ным способу получения соединения примера 10 из 2,4дихлорфенилацотонитрила (Aldrich). Т. плав-ления 151°С. Пример 77 4-амино-2-диметиламино-5-(3,4-дихлорфе-нил)-6-метилпиридимин Это соединение получают способом аналогич-ным способу получения соединения примера 13 из 3,4дихлорфенилацетонитрила. Пример 78 2-N-пиперидил-4-амино-5-(2,4-дихлорфе-нил)пиримидин Это соединение получают способом аналогич-ным способу получении соединения 76 из 1пиперидинилкарбоксамидинсульфата (Bader), т. плавления 169°С. Пример 79 2-метиламино-4-амино-5-(2,3,5-трихлорфe-нил)пиримидин Это соединение получают способом аналогич-ным способу получения соидиения примера 58 из 1метилгуанидингидрохлорида (Aldrich), т. плав-ления 155-157°С. Пример 80 2,4-диамино-5-(2-хлор-5-бромфенил)-6-метил-пиримидин Это соединение получают способом аналогич-ным способу получения соединения примера 54 при взаимодействии диазониевой соли с броми-дом меди, т. плавления 212-216°С. Пример 81 2,4-диамино-5-(2-хлор-5-иодофенил)-6-метил-пиримидин Это соединие получают способом аналогич-ным способу получения соединения примера 54 при взаимодействии диазониевой соли с иодидом калия, т. плавления 232-234°С. Пример 82 2,4-диамино-5-(2-хлор-5-цианофенил)-6-метилпиримидин Это соединение получают способом аналогич-ным способу получения соединения примера 54 при взаимодействии диазониевой соли с циани-дом меди, т. плавления 239-241°С. Пример 83 2,4-диамино-5-(2-хлор-5-фторфенил)-6-метил-пиримидин Это соединение получают способом аналогич-ным способу получения соединения примера 54 через диазониевую соль тетрафторбората, т. плавления 195-197°C. Пример 84 2,4-диамино-5-(2-хлор-5-метилтиофенил)-6-метилпиримидин Это соединение получают способом аналогич-ным способу получения соединения примера 54 при взаимодействии диазониевой соли с матан-тиолом в присутствии порошка меди, т. плавления 194-198°C. Пример 85 2-амино-4,6-ди(метилтио)-5-(2,4-дихлорфе-нил)пиримидин Это соединение получают из соединения при-мера 32.4 при взаимодействии с натриевой солью метантиола в метаноле в присутствии трис/2-/2-метоксиэтил/этил/амина и порошка меди, т. плав-ления 164-165°С. Пример 86 2,4-диамино-5-(2-хлор-5-метансульфонилами-нофенил)-6-метилпиримидин Это соединение получают из 2,4-диамино-5-(2-хлор-5-аминофенил)-6-метилпиримидина из примера 54 при взаимодействии с метансульфо-нилхлоридом в пиридине, т. плавления 234-240°С. Пример 87 2,4-диамино-5-(2,3-дихлорфенил)-1-метилпи-римидиний иодид Это соединение получают из соединения при-мера 21 и метилиодида, т. плавления 280-284°С. Пример 88 2-амино-4-мeтиламино-5-(2,3-дихлорфе-нил)пиримидин Это соединение получают способом аналогич-ным способу получения соединения приме-ра 21В.g при взаимодействии с метиламином в этаноле, т. плавления 233-237°С. 41245 Пример 89 2-амино-4-диметиламино-5-(2,3-дихлорфе-нил)пиримидингидрохлорид Это соединение получают способом аналогич-ным способу получения соединения приме-ра 21В.g при взаимодействии с диметиламином в этаноле с последующим превращением в хлорис-товодородную соль, т. плавления 295-300°С. Пример 90 2-амино-4-хлор-5-(2,4-дихлорфенил)пири-мидин Это соединение получают способом аналогич-ным способу получения соединения приме-ра 21В.f. из 5(2,4-дихлорфенил)изоцитозина, т. плавления 215-216°С. Пример 91 2-амино-4-метиламино-5-(2,4-дихлорфе-нил)пиримидин Это соединение получают из соединения при-мера 90 при взаимодействии с метиламином в этаноле, т. плавления 189-90°С. Пример 92 2-амино-4-диметиламино-5-(2,4-дихлорфе-нил)пиримидин гидрохлорид Это соединение получают из соединения при-мера 90 при взаимодействии с диметиламином в этаноле и последовательном превращении в гид-рохлоридную соль, т. плавления 297-301°С. Пример 93 2-амино-4-пиперидино-5-(2,4-дихлорфенил)пи-римидингидрохлорид Это соединение получают из соединения при-мера 90 при взаимодействии с пиперидином в этаноле и последующем превращении в гидро-хлоридную соль, т. плавления 303°С (с разложе-нием). Предпочтительным среди соединений форму-лы (І) являются пиримидиным вышеприведенных примеров 1, 2, 3, 4, 14 и 16 наряду с их солями (в частности, фармацевтически приемлемыми солями). Эти соединения имеют следующую двумерную структуру: Example 1 Пример 1 Example 2 Пример 2 Example 3 Пример 3 41245 Example 4 Пример 4 Example 14 Пример 14 Example 16 Пример 16 41245 41245 41245 41245 In the foregoing, the signals have been abbreviated as follows: s = singlet; d = doublet; dd = doublet of doublets; t = triplet; q = quadruplet; m = multiplet; br.s = broad singlet; br.t = broad triplet. В вышеприведенной таблице сокращения имеют следующие значения: s = синглет, d = дублет, dd = дублет дублетов, t = триплет, q = квадруплет, m = мультиплет, br.s = шир. синглет, br. t = широкий триплет. Фармакологические активности Ингибирование высвобождения глутамата и ингибирование ДНFR печени крыс Соединения формулы (І) тестировали на предмет их эффективности на вызванное верат-рином высвобождении глутамата из срезов мозга крыс по протоколу, описанному в Ерilepsia 27/5:490-497, 1986. Протокол для тестирования ингибирования активности ДНFR является моди-фикацией способа, описанного в Pharmacology vоl. 20, рр. 561-574, 1971. Полученные результаты приведены в табл. 1, причем IC50 является концентрацией соединения, вызывающей 50% ингибирования (а) вызванного вератрином высвобождения глутамата, и (о) ак-тивности фермента ДНFR. Таблица 1 41245 Соединение Примера № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 IC50 (мкМ) Высвобождение глутамата (Р95 предел) 1,18 (0,50-2,60) 0,56 (0,23-1,37) 2,15 (0,90-5,10) 0,33 (0,196-0,566) 3,50 (1,10-10,40) 0,70 (0,40-1,50) 100,00 >100,00 >100,00 >100,00 8,7 (5,2-14,7) >100 4,9 (3,90-6,20) са. 100 >100 17,50 (9,80-31,40) 16,01 (12,05-21,282) 23,800 (9,00-61,00) 20,940 (9,00-61,00) 15,10 (11,00-20,70) >100,00 с10,00 >100,00 46,10 (14,30-148,90) 0,53 (0,348-0,812) 41245 Пример на токсичность Соединение примера 1 вводят внутривенно группе из 6 самцов и 6 самок крыс штамма Вистар раз в день при уровне доз вплоть до 15 мг/кг/день. Дозой, при которой не наблюдалось эффекта, бы-ла 2,5 мг/кг/день. Соединение примера 2 тестировали как на крысах, так и на собаках. Для крыс дозой, при ко-торой не наблюдался эффект, была доза 2,5 мг/кг/день, а для собак она составляла 14 мг/кг/день. Пример фармацевтической композиции Таблетки Ингредиенты А. Соединение примера 1 Лактоза Кукурузный крахмал Поливинилпирролидон Стеарат магния 150 мг 200 мг 50 мг 4 мг 4 мг (Содержание на таблетку) Препарат смешивают с лактозой и крахмалом и гранулируют с раствором поливинилпирролидо-на в воде. Полученные гранулы сушат, смешивают со стеаратом магния и прессуют до получения таблеток. В. Инъекции (I) Соль соединении формулы І растворяют в стерильной воде для инъекций. Композиция для внутривенных инъекций (II) Активный ингредиент 0,20 г Стерильный безпирогенный до 10 мл фосфатный буфер (рН 0) Соединение примера 1 в виде соли растворяют в большей части фосфатного буфера при 35-40°С, затем доходят до нужного объема, и фильт-руют через стерильный микропористый фильтр в стерипьные 10 мл стеклянные ампулы (тип 1), ко-торые закрывает стерильными пробками и герме-тизируют. В нижеследующих примерах в качестве активного соединения можно использовать любое со-единение формулы (І) или его фармацевтической соли. С: Композиции для капсул Композиция для капсул А Композицию А можно получить смешивая ин-гредиенты и заполняя состоящие из двух частей твердые желатиновые капсулы полученной смесью. (а) (b) (с) (d) Активный ингредиент Лактоза В.Р. Натрийкрахмалгликоллят Cтeapат магния мг/капсулу 250 143 25 2 420
ДивитисяДодаткова інформація
Автори англійськоюAlistair Ainslie Miller, Richard Martin Hyde, Michael John Leach
Автори російськоюЭлистейр Ейнсли Миллер, Ричард Мартин Гайд, Майкл Джон Лич
МПК / Мітки
МПК: A61P 25/18, A61P 25/28, A61P 25/02, C07D 239/42, C07D 239/48, A61P 9/00, C07D 239/56, A61P 25/24, A61P 25/08, A61K 31/535, A61K 31/506, A61P 25/04, C07C 255/56, A61K 31/5377, C07D 239/46, C07C 255/54, C07D 239/47, A61K 31/505, C07D 239/50, A61P 25/26, C07D 239/58
Мітки: піримідину, спосіб, композиція, основі, одержання, похідні, фармацевтична
Код посилання
<a href="https://ua.patents.su/29-41245-pokhidni-pirimidinu-sposib-kh-oderzhannya-ta-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Похідні піримідину, спосіб їх одержання та фармацевтична композиція на їх основі</a>
Попередній патент: Похідні пропенової кислоти, що мають фунгіцидну активність
Наступний патент: Похідні мільбеміцину, що мають пестицидну активність, спосіб лікування ендо- та ектопаразитних інфекцій, спосіб боротьби з комахами та кліщами
Випадковий патент: Спосіб наноструктурування поверхні скла в повітрі атмосферного тиску