Дигідроптеридинони, спосіб їх одержання і їхнє застосування як лікарського засобу
Номер патенту: 76512
Опубліковано: 15.08.2006
Автори: Айкмайер Крістіан, Штегмайер Мартін, Квант Йенс Юрген, Поль Геральд, Шнапп Гізела, Редеманн Норберт, Грауерт Маттіас, Хоффманн Маттіас, Бауер Екхарт, Брайтфельдер Штеффен, Леманн-Лінц Торстен
Формула / Реферат
1. Сполуки загальної формули (І)
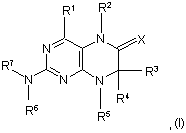
у якій
R1 являє собою залишок, вибраний із групи, яка включає водень, NH2, ХН, галоген та необов'язково заміщену одним або декількома атомами галогену С1-С3алкільну групу,
R2 являє собою залишок, вибраний із групи, яка включає водень, СНО, ХН, -Х-С1-С2алкіл та необов'язково заміщену С1-С3алкільну групу,
R3 та R4 мають ідентичні або різні значення та являють собою залишок, вибраний із групи, яка включає необов'язково заміщений С1-С10алкіл, С2-С10алкеніл, С2-С10алкiніл, арил, гетероарил, С3-С8циклоалкіл, С3-С8гетероциклоалкіл, -Х-арил, -Х-гетероарил, -Х-циклоалкіл, -Х-гетероциклоалкіл, -NR8-арил, -NR8-гетероарил, -NR8-циклоалкіл та -NR8-гетероциклоалкіл, або являють собою залишок, вибраний із групи, яка включає водень, галоген, COXR8, CON(R8)2, COR8 та XR8,
або R3 та R4 разом утворюють 2-5-членний алкільний місток, який може містити 1-2 гетероатоми,
R5 являє собою водень або залишок, вибраний із групи, яка включає необов'язково заміщений С1-С10алкіл, С2-С10алкеніл, С2-С10алкініл, арил, гетероарил та С3-С6циклоалкіл, або
R3 та R5 або R4 та R5 разом утворюють насичений або ненасичений С3-С4алкільний місток, який може містити 1-2 гетероатоми,
R6 являє собою необов'язково заміщений арил або гетероарил,
R7 являє собою водень або –С-O-Х-С1-С4алкіл, і
Х означає в кожному випадку незалежно від інших його значень О або S,
R8 являє собою в кожному випадку незалежно від інших його значень водень або залишок, вибраний із групи, яка включає необов'язково заміщений С1-С4алкіл, С2-С4алкеніл, С2-С4алкініл та феніл,
необов'язково у вигляді їх таутомерів, їхніх рацематів, їх енантіомерів, їх діастереомерів та їх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей.
2. Сполуки за п. 1, які відрізняються тим, що
Х та R6 мають зазначені вище значення, а
R1 являє собою водень,
R2 являє собою залишок, вибраний із групи, яка включає групу СНО, ОН та СН3,
R3 та R4 мають ідентичні або різні значення та являють собою залишок, вибраний із групи, яка включає водень, необов'язково заміщений С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл та С3-С7циклоалкіл, або
R3 та R4 разом утворюють С2-С5алкільний місток,
R5 являє собою залишок, вибраний із групи, яка включає необов'язково заміщений С1-С10алкіл, С2-С10алкеніл, С2-С10алкініл та С3-С6циклоалкіл, або
R3 та R5 або R4 та R5 разом утворюють насичений або ненасичений С3-С4алкільний місток, який може містити 1-2 гетероатоми, і
R7 являє собою водень,
необов'язково у вигляді їх таутомерів, їх рацематів, їх енантіомерів, їх діастереомерів та їх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей.
3. Сполуки за п. 1 або 2, які відрізняються тим, що
R1- R5, R7, R8 та Х мають зазначені вище значення, а
R6 являє собою залишок загальної формули
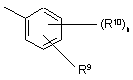 ,
,
де
n означає 1, 2, 3 або 4,
R9 являє собою залишок, вибраний із групи, яка включає необов'язково заміщений С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, -CONH-С1-С10алкілен, -O-арил, -O-гетероарил, -O-циклоалкіл, -O-гетероциклоалкіл, арил, гетероарил, циклоалкіл та гетероциклоалкіл, або являє собою залишок, вибраний із групи, яка включає -O-С1-С6алкіл-Q1, -CONR8-С1-С10алкіл-Q1, -СОNR8-С2-С10алкеніл-Q1, -CONR8-Q2, галоген, ОН, -SO2R8, -SO2N(R8)2, -COR8, -COOR8, -N(R8)2, -NHCOR8, CONR8O-С1-С10алкіл-Q1 та CONR8O-Q2, де
Q1 означає водень, -NHCOR8 або залишок, вибраний із групи, яка включає необов'язково заміщену -NH-арильну, -NН-гетероарильну, арильну, гетероарильну, С3-С8циклоалкільну та гетероциклоалкільну групу, а
Q2 означає водень або залишок, вибраний із групи, яка включає необов'язково заміщену арильну, гетероарильну, С3-С8гетероциклоалкільну, С3-С8циклоалкільну та С1-С4алкіл-С3-С8циклоалкільну групу,
R10 має ідентичні або різні значення та являє собою залишок, вибраний із групи, яка включає необов'язково заміщений С1-С6алкіл, С2-С6алкеніл та С2-С6алкініл, -O-С1-С6алкіл, -O-С2-С6алкеніл, -O-С2-С6алкініл, С3-С6гетероциклоалкіл та С3-С6циклоалкіл, або являє собою залишок, вибраний із групи, яка включає водень, -CONH2, -COOR8, -OCON(R8)2, -N(R8)2, -NHCOR8, -NHCON(R8)2, -NO2 та галоген, або
розташовані поруч один з одним залишки R9 та R10 разом утворюють місток загальної формули
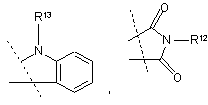 ,
,
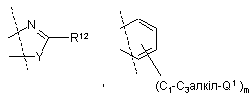 ,
,
де
Y означає О, S або NR11,
m означає 0, 1 або 2, а
R11 являє собою водень або С1-С2алкіл, і
R12 являє собою водень або залишок, вибраний із групи, яка включає необов'язково заміщений феніл, піридил, піразиніл, піримідиніл, піридазиніл, -С1-С3алкілфеніл, -С1-С3алкілпіридил, -С1-С3алкілпіразиніл, -С1-С3алкілпіримідиніл та -С1-С3алкілпіридазиніл,
R13 являє собою С1-С6алкіл,
необов'язково у вигляді їх таутомерів, їх рацематів, їх енантіомерів, їх діастереомерів та їх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей.
4. Сполуки за будь-яким одним з пп. 1-3, які відрізняються тим, що
R3-R6, R8 та Х мають зазначені вище значення, а
R1 являє собою водень,
R2 являє собою СН3, і
R7 являє собою водень,
необов'язково у вигляді їх таутомерів, їх рацематів, їх енантіомерів, їх діастереомерів та їх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей.
5. Сполука формули (І) за будь-яким одним з пп. 1-4, яка відрізняється тим, що призначена для застосування як лікарський засіб.
6. Сполука формули (І) за будь-яким одним з пп. 1-4, яка відрізняється тим, що призначена для застосування як лікарський засіб, який має антипроліферативну дію.
7. Фармацевтична композиція, яка містить як діючу речовину одну або кілька сполук загальної формули (І) за будь-яким одним з пп. 1-4 або її (їх) фізіологічнo прийнятну сіль, при необхідності разом зі звичайними допоміжними речовинами та/або носіями.
8. Спосіб одержання сполуки загальної формули (І)
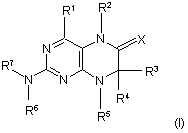 ,
,
де R1-R7 та Х мають значення, зазначені у пп. 1-4, який відрізняється тим, що сполуку загальної формули (II)
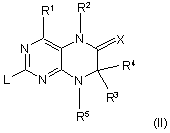 ,
,
де R1-R5 та Х мають значення, зазначені у пп. 1-4, a L означає відхідну групу, піддають взаємодії з необов'язково заміщеною сполукою загальної формули (III)
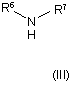 ,
,
де R6 та R7 мають значення, зазначені у пп. 1-4.
Текст
1. Сполуки загальної формули (І) C2 2 (19) 1 3 76512 4 необов'язково у вигляді їх таутомерів, їх рацемаR12 являє собою водень або залишок, вибраний із тів, їх енантіомерів, їх діастереомерів та їх сумігрупи, яка включає необов'язково заміщений фешей, а також необов'язково у вигляді їх фармаконіл, піридил, піразиніл, піримідиніл, піридазиніл, логічно прийнятних кислотно-адитивних солей. С1-С3алкілфеніл, -С1-С3алкілпіридил, -С13. Сполуки за п. 1 або 2, які відрізняються тим, С3алкілпіразиніл, -С1-С3алкілпіримідиніл та -С1що С3алкілпіридазиніл, R1- R5, R7, R8 та Х мають зазначені вище значення, R13 являє собою С1-С6алкіл, а необов'язково у вигляді їх таутомерів, їх рацемаR6 являє собою залишок загальної формули тів, їх енантіомерів, їх діастереомерів та їх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей. (R10)n 4. Сполуки за будь-яким одним з пп. 1-3, які відрізняються тим, що R9 R3-R6, R8 та Х мають зазначені вище значення, а , R1 являє собою водень, де R2 являє собою СН3, і n означає 1, 2, 3 або 4, R7 являє собою водень, R9 являє собою залишок, вибраний із групи, яка необов'язково у вигляді їх таутомерів, їх рацемавключає необов'язково заміщений С1-С6алкіл, С2тів, їх енантіомерів, їх діастереомерів та їх суміС6алкеніл, С2-С6алкініл, -CONH-С1-С10алкілен, -Oшей, а також необов'язково у вигляді їх фармакоарил, -O-гетероарил, -O-циклоалкіл, -Oлогічно прийнятних кислотно-адитивних солей. гетероциклоалкіл, арил, гетероарил, циклоалкіл та 5. Сполука формули (І) за будь-яким одним з пп. 1гетероциклоалкіл, або являє собою залишок, виб4, яка відрізняється тим, що призначена для зараний із групи, яка включає -O-С1-С6алкіл-Q1, 8 1 8 1 стосування як лікарський засіб. CONR -С1-С10алкіл-Q , -СОNR -С2-С10алкеніл-Q , 8 2 8 8 6. Сполука формули (І) за будь-яким одним з пп. 1CONR -Q , галоген, ОН, -SO2R , -SO2N(R )2, 8 8 8 8 8 4, яка відрізняється тим, що призначена для заCOR , -COOR , -N(R )2, -NHCOR , CONR O-С11 8 2 стосування як лікарський засіб, який має антипроС10алкіл-Q та CONR O-Q , де ліферативну дію. Q1 означає водень, -NHCOR8 або залишок, вибра7. Фармацевтична композиція, яка містить як діючу ний із групи, яка включає необов'язково заміщену речовину одну або кілька сполук загальної формуNH-арильну, -NН-гетероарильну, арильну, гетероли (І) за будь-яким одним з пп. 1-4 або її (їх) фізіоарильну, С3-С8циклоалкільну та гетероциклоалкілогічнo прийнятну сіль, при необхідності разом зі льну групу, а звичайними допоміжними речовинами та/або носіQ2 означає водень або залишок, вибраний із груями. пи, яка включає необов'язково заміщену арильну, 8. Спосіб одержання сполуки загальної формули гетероарильну, С3-С8гетероциклоалкільну, С3(І) С циклоалкільну та С -С алкіл-С -С циклоалкільну 8 1 4 3 8 групу, R10 має ідентичні або різні значення та являє собою залишок, вибраний із групи, яка включає необов'язково заміщений С1-С6алкіл, С2-С6алкеніл та С2-С6алкініл, -O-С1-С6алкіл, -O-С2-С6алкеніл, -OС2-С6алкініл, С3-С6гетероциклоалкіл та С3С6циклоалкіл, або являє собою залишок, вибраний із групи, яка включає водень, -CONH2, -COOR8, OCON(R8)2, -N(R8)2, -NHCOR8, -NHCON(R8)2, -NO2 та галоген, або розташовані поруч один з одним залишки R9 та R10 разом утворюють місток загальної формули R1 X R7 N N (I), R3 N R4 R6 1 R5 (I) 7 де R -R та Х мають значення, зазначені у пп. 1-4, який відрізняється тим, що сполуку загальної формули (II) R1 R2 N N R12 N N N N O R13 R2 X R4 L O , N (II) N R3 , R5 (II) де R1-R5 та Х мають значення, зазначені у пп. 1-4, a L означає відхідну групу, піддають взаємодії з необов'язково заміщеною сполукою загальної формули (III) N R12 Y , (C1-C3алкіл-Q1 )m , де Y означає О, S або NR11, m означає 0, 1 або 2, а R11 являє собою водень або С1-С2алкіл, і R6 R7 N H (III) де R6 та R7 мають значення, зазначені у пп. 1-4. (III) 5 Даний винахід відноситься до нових дигідроптеридинонів загальної формули (І) у якій залишки X, R1, R2, R3, R4, R5, R6 і R7 мають зазначені у формулі винаходу й в описі значення, до їх ізомерів, до способів одержання цих дигідроптеридинонів, а також до їх застосування як лікарських засобів. Похідні птеридинонів відомі з рівня техніки як діючі речовини, які мають антипроліферативну дією. Так, зокрема, у заявці WO 01/019825 описується застосування похідних птеридинонів для лікування онкологічних та вірусних захворювань. Стійкість багатьох видів пухлин обумовлює необхідність розробки і створення нових високоефективних протипухлинних лікарських засобів. З урахуванням вищевикладеного, в основу даного винаходу була покладена задача одержати нові сполуки, які мають протизапальну та антипроліферативну дію. При створенні винаходу було встановлено, що сполуки загальної формули (І), де залишки X та R1-R7 мають зазначені нижче значення, несподівано виявляють ефективність як інгібітори особливих кіназ, які беруть участь у регуляції клітинного циклу. Завдяки цьому запропоновані у винаході сполуки можуть застосовуватися, наприклад, для лікування захворювань, що так чи інакше пов'язані з активністю специфічних кіназ, які беруть участь у регуляції клітинного циклу, і при яких характерна надлишкова чи аномальна проліферація клітин. Відповідно до цього даний винахід відноситься до сполук загальної формули (І) у якій R1 являє собою залишок, обраний із групи, яка включає водень, NH2, ХН, галоген та необов'язково заміщену одним або декількома атомами галогену С1-С3алкільну групу, R2 являє собою залишок, обраний із групи, яка включає водень, СНО, ХН, -Х-С1-С2алкіл і необов'язково заміщену С1-С3алкільну групу, R3 та R4 мають ідентичні або різні значення і являють собою залишок, обраний із групи, яка включає необов'язково заміщений С1-С10алкіл, С2С10алкеніл, С2-С10алкініл, арил, гетероарил, С3С8циклоалкіл, С3-С8гетероциклоалкіл, -Х-арил, -Х 76512 6 гетероарил, -Х-циклоалкіл, -Х-гетероциклоалкіл, NR8-арил, -NR8-гетероарил, -NR8-циклоалкіл та 8 NR -гетероциклоалкіл, або являють собою залишок, обраний із групи, яка включає водень, галоген, COXR8, CON(R8)2, COR8 та XR8, або R3 та R4 разом утворюють 2-5-членний алкільний місток, який може містити 1-2 гетероатоми, R5 являє собою водень або залишок, обраний із групи, яка включає необов'язково заміщений С1С10алкіл, С2-С10алкеніл, С2-С10алкініл, арил, гетероарил та С3-С6циклоалкіл, або R3 та R5 або R4 та R5 разом утворюють насичений чи ненасичений С3-С4алкільньій місток, який може містити 1-2 гетероатоми, R6 являє собою необов'язково заміщений арил або гетероарил, R7 являє собою водень або -СО-Х-С1-С4алкіл і X позначає у кожному випадку незалежно від інших його значень О або S, R8 являє собою в кожному випадку незалежно від інших його значень водень або залишок, обраний із групи, яка включає необов'язково заміщений С1-С4алкіл, С2-С4алкеніл, С2-С4алкініл та феніл, необов'язково у вигляді їх таутомеріє, їхніх рацематів, їх енантіомерів, їх діастереомерів та їхніх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей. Кращими є ті сполуки формули (І), де X та R6 мають зазначені вище значення, а R1 являє собою водень, R2 являє собою залишок, обраний із групи, яка включає групу СНО, ОН та СН3, R3 та R4 мають ідентичні або різні значення та являють собою залишок, обраний із групи, яка включає водень, необов'язково заміщений С1С6алкіл, С2-С6алкеніл, С2-С6алкініл та С3С7циклоалкіл, чи R3 та R4 разом утворюють С2-С5алкільний місток, R5 являє собою залишок, обраний із групи, яка включає необов'язково заміщений С1-С10алкіл, С2С10алкеніл, С2-С10алкініл, С3-С6циклоалкіл та С3С6циклоалкеніл, чи R3 та R5 або R4 та R5 разом утворюють насичений або ненасичений С3-С4алкільньій місток, який може містити 1-2 гетероатоми, і R7 являє собою водень, необов'язково у вигляді їх таутомерів, їхніх рацематів, їх енантіомерів, їх діастереомерів та їхніх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей. До особливо кращих відносяться ті сполуки формули (І), де R1-R5, R7, R8 та X мають зазначені вище значення, а R6 являє собою залишок загальної формули 7 де n позначає 1, 2, 3 або 4, R9 являє собою залишок, обраний із групи, яка включає необов'язково заміщений С1-С6алкіл, С2С6алкеніл, С2-С6алкініл, -CONH-С1-С10алкілен, -Оарил, -О-гетероарил, -О-циклоалкіл, -Огетероциклоалкіл, арил, гетероарил, циклоалкіл та гетероциклоалкіл, або являє собою залишок, обраний із групи, яка включає -О-С1-С6алкіл-Q1, CONR8-С1-С10алкіл-Q1, -CONR8-C2-С10алкеніл-Q1, CONR8-Q2, галоген, ОН, -SO2R8, -SO2N(R8)2, COR8, -COOR8, -N(R8)2, -NHCOR8, CONR8O-С1С10алкіл-Q1 та CONR8O-Q2, де Q1 позначає водень, -NHCOR8 або залишок, обраний із групи, яка включає необов'язково заміщену -NH-арильну, -NH-гетероарильну, арильну, гетероарильну, С3-С8циклоалкільну та гетероциклоалкільну групу, а Q2 позначає водень або залишок, обраний із групи, яка включає необов'язково заміщену арильну, гетероарильну, С3-С8гетероциклоалкільну, С3С8циклоалкільну та С1-С4алкіл-С3-С8циклоалкільну групу, R10 має ідентичні або різні значення та являє собою залишок, обраний із групи, яка включає необов'язково заміщений С1-С6алкіл, С2-С6алкеніл та С2-С6алкініл, -О-С1-С6алкіл, -О-С2-С6алкеніл, -ОС2-С6алкініл, С3-С6Гетероциклоалкіл та С 3С6циклоалкіл, або являє собою залишок, обраний із групи, яка включає водень, -CONH2, -COOR8, OCON(R8)2, -N(R8)2, -NHCOR8, -NHCON(R8)2, -NO2 та галоген, або розташовані поруч один з одним залишки R9 та R10 разом утворюють місток загальної формули де Υ позначає О, S або NR11, m позначає 0, 1 або 2, а R11 являє собою водень або С1-С2алкіл і R12 являє собою водень або залишок, обраний із групи, яка включає необов'язково заміщений феніл, піридил, піразиніл, піримідиніл, піридазиніл, -С1-С3алкілфеніл, -С1-С3алкілпіридил, -С1С3алкілпіразиніл, -С1-С3алкілпіримідиніл та -С1С3алкілпіридазиніл, R13 являє собою С1-С6алкіл, необов'язково у вигляді їх таутомерів, їхніх рацематів, їх енантіомерів, їх діастереомерів та їхніх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей. Найбільш кращі ті сполуки формули (І), де R3-R6, R8 та X мають зазначені вище значення, а R1 являє собою водень, R2 являє собою СН3 і 76512 8 R7 являє собою водень, необов'язково у вигляді їх таутомерів, їхніх рацематів, їх енантіомерів, їх діастереомерів та їхніх сумішей, а також необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей. Ще одним об'єктом винаходу є сполуки формули (І), де X та R1-R7 мають зазначені вище значення, для застосування як лікарські засоби. Особливе значення надається відповідно до винаходу сполукам формули (І), де X та R1-R7 мають зазначені вище значення, для їхнього застосування як лікарські засоби з антипроліферативною дією. Ще одним об'єктом винаходу є застосування сполуки формули (І), де X та R1-R7 мають зазначені вище значення, для одержання лікарського засобу, призначеного для лікування та/або попередження раку, інфекційних, запальних та аутоімунних захворювань. Ще одним об'єктом винаходу є спосіб лікування та/або попередження раку, інфекційних, запальних та аутоімунних захворювань, який відрізняється тим, що пацієнту вводять ефективну кількість сполуки формули (І), де X та R1-R7 мають зазначені вище значення. Ще одним об'єктом винаходу є фармацевтичні композиції, які містять як діючу речовину одну або кілька сполук загальної формули (І), де X та R1-R7 мають зазначені вище значення, або її(їх) фізіологічно прийнятні солі, при необхідності разом зі звичайними допоміжними речовинами та/або носіями. Ще одним об'єктом винаходу є спосіб одержання сполуки загальної формули (І) де X та R1-R7 мають зазначені вище значення, який відрізняється тим, що сполуку загальної формули (II) де R1-R5 та X мають зазначені вище значення, a L позначає групу, яка видаляється, піддають взаємодії із необов'язково заміщеною сполукою загальної формули (III) 9 76512 10 спиртом з одержанням відповідного складного ефіру. Під алкільними групами як такими, так само як й під алкільними групами, які є компонентами інших залишків, маються на увазі розгалужені та нерозгалужені алкільні групи, які містять від 1 до 10 атомів вуглецю, переважно 1-6, особливо переважно 1-4 атома вуглецю; як приклади можна наде R6 та R7 мають зазначені вище значення. звати метил, етил, пропіл, бутил, пентил, гексил, Ще одним об'єктом винаходу є сполука форгептил, октил, ноніл та децил. При цьому, якщо не мули (II) зазначене інше, з числа вищезгаданих сполук пропіл, бутил, пентил, гексил, гептил, октил, ноніл та децил включають також усі можливі ізомерні форми. Так, наприклад, поняття "пропіл" включає обидва ізомерних залишки н-пропіл та ізопропіл, поняття "бутил" включає н-бутил, ізобутил, вторбутил та терт-бутил, поняття "пентил" включає ізопентил, неопентил та т.д. У вищезгаданих алкільних групах один або кілька атомів водню за певних умов можуть бути замінені на інші залишки. Так, наприклад, ці алкіде R1-R5 та X мають зазначені вище значення. льні групи можуть бути заміщені атомами галогеСполуки формули (II) являють собою важливі дону: фтору, хлору, брому або йоду. Кращими як поміжні продукти для одержання запропонованих замісники є фтор та хлор, особливо кращий з них у винаході сполук загальної формули (І). хлор. За певних умов можлива також заміна всіх Ще одним об'єктом винаходу є спосіб одератомів водню алкільної групи. жання сполуки загальної формули (І) В однаковій мірі у вищезгаданих алкільних групах, якщо не зазначене інше, можлива за певних умов заміна одного або декількох атомів водню, наприклад на необов'язково заміщений залишок, обраний із групи, яка включає CN, ОСОСН3, арил, переважно феніл, гетероарил, переважно тієніл, тіазоліл, імідазоліл, піридил, піримідил або піразиніл, насичений або ненасичений гетероциклоалкіл, переважно піразоліл, піролідиніл, піперидиніл, піперазиніл або тетрагідрооксазиніл, амінде ний залишок, переважно метиламін, бензиламин, 6 R являє собою залишок загальної формули феніламин або гетероариламин, насичені або ненасичені біциклічні кільцеві системи, переважно бензімідазоліл, та циклоалкіл, переважно циклогексил або циклопропіл. Поняттям "алкільний місток" позначаються, якщо не зазначене інше, розгалужені або нерозгалужені алкільні групи, які містять 2-5 атомів вуглеR9 являє собою необов'язково заміщений зацю, наприклад пропіленові, ізопропіленові, нлишок -CONH-С1-С10алкілен або залишок, обраний бутиленові, ізобутильні, втор-бутильні, трет8 1 із групи, яка включає -CONR -С1-С10алкіл-Q , бутильні та тому подібні містки. Особливо кращи8 1 8 2 8 CONR -C2-C10алкеніл-Q , -CONR -Q та -COOR , а ми є пропіленові та бутиленові містки. У названих R1-R5, R7, R10, n та X мають зазначені вище алкільних містках 1-2 С-атоми за певних умов мозначення, який відрізняється тим, що сполуку зажуть бути замінені на один або кілька гетероатогальної формули (ІА) мів, обраних із групи, яка включає кисень, азот та сірку. Під алкенільними групами (включаючи й ті випадки, коли ці групи є фрагментом інших залишків) маються на увазі розгалужені або нерозгалужені алкенільні групи, які містять від 2 до 10 атомів вуглецю, переважно від 2 до 6, особливо переважно 2-3 атоми вуглецю, за умови, що вони мають щонайменше один подвійний зв'язок. Як приклад можна назвати етеніл, пропеніл, бутеніл, пентеніл та т.п. Якщо не зазначене інше, то у число вищезгаданих понять пропеніл, бутеніл та т.п. входять усі можливі ізомерні форми. Так, наприклад, поняття де R1-R5, R7, R10 та n мають зазначені вище "бутилен" включає н-бутеніл, 1-метилпропеніл, 2значення, a L позначає групу, яка видаляється, метилпропеніл, 1,1-диметилетеніл, 1,2піддають взаємодії із первинним або вторинним диметилетеніл та т.д. аміном з одержанням відповідного аміду або зі 11 76512 12 У вищезгаданих алкенільних групах, якщо не сень, азот та сірку, можна назвати, наприклад, зазначене інше, один або кілька атомів водню за фуран, тіофен, пірол, піразол, імідазол, триазол, певних умов можуть бути замінені на інші залишки. тетразол, піридин, піридазин, піримідин, піразин, Так, наприклад, ці алкенільні групи можуть бути триазин, оксазол, ізоксазол, тіазол, тіадіазол та заміщені атомами галогену: фтору, хлору, брому оксадіазол, при цьому кожний з вищезгаданих геабо йоду. Кращими як замісники є фтор та хлор, тероциклів може бути у свою чергу за певних умов особливо кращий з них хлор. За певних умов можанельований з бензольним кільцем, переважно лива також заміна всіх атомів водню алкенільної бензімідазолом, і, крім того, ці гетероцикли, якщо групи. не зазначене інше, можуть нести, наприклад, один Під алкінільними групами (включаючи й ті виабо кілька наступних замісників: групу ОН, NO2, падки, коли ці групи є компонентами інших залишCN, -OCHF2, -OCF3, -NH2, галоген, переважно ків) маються на увазі розгалужені або нерозгалуфтор або хлор, С1-С10алкіл, переважно С1-С5алкіл, жені алкінільні групи, які містять від 2 до 10 атомів більш переважно С1-С3алкіл, особливо переважно вуглецю, за умови, що вони мають щонайменше метил або етил, -О-С1-С3алкіл, переважно -Оодин потрійний зв'язок, як приклад можна назвати метил або -О-етил, -N-метилтетрагідрооксазиніл, етиніл, пропаргіл, бутиніл, пентиніл, гексиніл та групу -СООН, -СОО-С1-С4алкіл, переважно -СООт.п., кращі з них етиніл та пропиніл. С(СНз)3 або -СООСН3, групу -CONH2, необов'язкоУ вищезгаданих алкінільних групах, якщо не во заміщений феніл, необов'язково заміщений зазначене інше, один або кілька атомів водню за гетероарил, переважно необов'язково заміщений певних умов можуть бути замінені на інші залишки. піридил або піразиніл, -CONH-С1-С10алкіл, причоТак, наприклад, ці алкінільні групи можуть бути му цей алкіл у свою чергу за певних умов може заміщені атомами галогену, такого як фтор, хлор, бути заміщений, необов'язково заміщений -CONHбром або йод. Кращими як замісники є фтор та С3-С6циклоалкіл, переважно необов'язково заміхлор, особливо кращий з них хлор. За певних умов щений -CONH-циклопентил, необов'язково заміможлива також заміна всіх атомів водню алкінільщений -CONH-гетероарил, переважно необов'язної групи. ково заміщений -CONH-піридил, необов'язково Поняттям "арил" позначається ароматична цизаміщений -CONH-арил, переважно необов'язково клічна система, яка містить від 6 до 14 атомів вугзаміщений -CONH-феніл, -CONMeC1-С3алкіл, прилецю, переважно 6 або 10 атомів вуглецю, перечому цей алкіл у свою чергу за певних умов може важно феніл, який, якщо не зазначене інше, може бути заміщений, переважно -СОNМеСН2-піридил, нести, наприклад, один або кілька наступних замібензімідазол або залишок формули сників: групу ОН, NO2, CN, -OCHF2, -OCF3, -NH2, галоген, наприклад фтор, хлор, бром або йод, переважно фтор або хлор, С1-С10алкіл, переважно С1-С5алкіл, більш переважно С1-С3алкіл, особливо переважно метил або етил, -О-С1-С3алкіл, переважно -О-метил або -О-етил, -Nметилтетрагідрооксазиніл, групу -СООН, -СОО-С1С4алкіл, переважно -СООСН2СН3, -СОО-С(СН3)3 або -СООСН3, групу -CONH2, -CONH-С1-С10алкіл, Під циклоалкільними залишками маються на причому цей алкіл у свою чергу за певних умов увазі насичені або ненасичені циклоалкільні залиможе бути заміщений, необов'язково заміщений шки, які містять від 3 до 8 атомів вуглецю, напри-CONH-С3-С6циклоалкіл, переважно необов'яклад циклопропіл, циклобутил, циклопентил, цикзково заміщений -CONH-циклопентил, необов'язлопентеніл, циклогексил, циклогексеніл, ково заміщений -CONH-гетероциклоалкіл, перевациклогептил або циклооктил, переважно циклопжно піперидиніл, піролідиніл або піперазиніл, ропіл, циклопентил або циклогексил, при цьому необов'язково заміщений -CONH-гетероарил, пекожний з вищезгаданих циклоалкільних залишків у реважно необов'язково заміщений -CONH-піридил, свою чергу може нести за певних умов один або необов'язково заміщений -CONH-арил, переважно кілька замісників, переважно =O, або може бути необов'язково заміщений -CONH-феніл, анельований з яким-небудь бензольним кільцем. СОNМеС1-С3алкіл, причому цей алкіл у свою чергу "=O" позначає приєднаний подвійним зв'язком за певних умов може бути заміщений, переважно атом кисню. СОNМеСН2-піридил, бензімідазол або залишок Під гетероциклоалкільними залишками маформули ються на увазі, якщо не зазначене інше, 5-, 6- або 7-членні насичені або ненасичені гетероцикли, яки можуть містити в якості гетероатомів азот, кисень або сірку, наприклад тетрагідрофуран, тетрагідрофуранон, -бутиролактон, -піран, -піран, діоксолан, тетрагідропіран, діоксан, дигідротіофен, тіолан, дитіолан, піролін, піролідин, піразолін, піразолідин, імідазолін, імідазолідин, тетразол, піперидин, піридазин, піримідин, піразин, пеперазин, У якості 5-10-членних моно- або біциклічних триазин, тетразин, морфолін, тіоморфолін, діазегетероарильних кілець, у яких аж до трьох Спан, оксазин, тетрагідрооксазиніл, ізотіазол та піатомів можуть бути замінені на один або кілька разолідин, переважно піразоліл, піролідиніл, піпегетероатомів, обраних із групи, яка включає киридиніл, піперазиніл або тетрагідрооксазиніл, при 13 76512 14 цьому такий гетероцикл у свою чергу може бути за R4, за певних умов можуть бути заміщені. певних умов заміщений. Замісник R5 може являти собою водень або Поняттям "галоген" позначається, як правило, залишок, обраний із групи, яка включає необов'язфтор, хлор, бром або йод. ково заміщений С1-С10алкіл, наприклад С1Під групою L, яка видаляється, яка має ідентиС6алкіларил або С1-С6алкілгетероарил, переважно чні або різні значення, мається на увазі така група, С1-С6алкіл, насамперед С1-С6алкіл, особливо пеяка видаляється, як, наприклад, хлор, бром, йод, реважно пропіл, бутил, пентил, гексил, -СН2метансульфоніл, трифторметансульфоніл або nциклогексил, (СН2)1-2-циклопропіл або (СН2)4толуолсульфоніл, переважно хлор. ОСОСН3, С2-С10алкеніл, переважно пропеніл, буЗапропоновані у винаході сполуки можуть бути теніл, пентеніл або гексеніл, насамперед пропеніл представлені у вигляді окремих оптичних ізомерів, або гексеніл, С2-С10алкініл, переважно пропиніл, сумішей окремих енантіомерів, діастереомерів або бутиніл або пентиніл, переважно пропиніл, арил, рацематів, у вигляді таутомеріє, а також у вигляді переважно феніл, гетероарил, С3-С6циклоалкіл, вільних основ або відповідних кислотно-адитивних переважно циклопропіл, циклобутил, циклопентил солей, утворених з фармакологічно прийнятними або циклогексил, та С3-С6циклоалкеніл, переважно кислотами, наприклад кислотно-адитивних солей з циклогексеніл або циклопентеніл, або замісники R3 галогеноводневими кислотами, такими як хлориста R5 або R4 та R5 спільно утворюють насичений то- або бромистоводнева кислота, або з органічабо ненасичений С3-С4алкільний місток, який може ними кислотами, такими як щавлева, фумарова, містити 1-2 гетероатома, переважно кисень, сірку дигліколева або метансульфонова кислота. або азот. Замісник R1 може являти собою залишок, обУсі залишки, зазначені як значення замісника раний із групи, яка включає водень, групу NH2, XH, R5, за певних умов можуть бути заміщені. переважно групу ОН, галоген, переважно фтор Замісник R6 може являти собою необов'язково або хлор, та необов'язково заміщену одним або заміщений арил або гетероарил, переважно арил, декількома, переважно одним, двома або трьома, насамперед феніл. Найбільш кращий як замісник атомами галогену, переважно атомами фтору або R6 є фенільний залишок, який може бути заміщехлору, С1-С3алкільну групу, переважно метил або ний одним з описаних нижче залишків R9 та R10, етил. Найбільш кращим як замісник R1 є водень. при цьому фенільне кільце може нести один із Замісник R2 може являти собою залишок, обзалишків R9, переважно в пара-положенні, та раний із групи, яка включає водень, групу СНО, один, два, три або чотири, переважно один або ХН, переважно групу ОН, -Х-С1-С2алкіл, переваждва, залишки R10, переважно в орто- або метано -О-СН3 або -О-СН2СН3, та необов'язково заміположенні. 7 щену С1-С3алкільну групу, причому ця алкільна Замісник R може являти собою водень або група містить переважно 1-2 атоми вуглецю, наСО-Х-С1-С4алкіл, переважно водень. самперед один атом вуглецю, та за певних умов X у кожному випадку незалежно від інших знаможе бути заміщена, переважно атомами галогечень позначає О або S, переважно О. ну, насамперед атомами фтору. Найбільш кращим Залишки R8, зазначені при розкритті значень 2 як замісник R є метил. замісників R3 та R4, являють собою кожен незале3 4 Замісники R та R можуть бути ідентичними жно один від одного водень або залишок, обраний або різними та являти собою залишок, обраний із із групи, яка включає необов'язково заміщений С1групи, яка включає необов'язково заміщений С1С4алкіл, С2-С4алкеніл, С2-С4алкініл та феніл, переС10алкіл, переважно С1-С6алкіл, насамперед С1важно водень та С1-С2алкіл. С4алкіл, особливо переважно метил, етил або Замісник R9 може являти собою залишок, обпропіл, насамперед метил або етил, С2раний із групи, яка включає необов'язково заміщеС10алкеніл, переважно етеніл або пропеніл, більш ний С1-С6алкіл, переважно С1-С4алкіл, насамперед переважно етеніл, С2-С10алкініл, переважно етиніл метил, етил або пропіл, особливо переважно меабо пропиніл, арил, переважно необов'язково затил, С2-С6алкеніл, С2-С6алкініл, -CONH-C1міщений феніл, гетероарил, С3-С8циклоалкіл, пеС10алкілен, переважно -CONH-С1-С3алкілен, нареважно циклопропіл та циклобутил, С 3самперед -СОNН-С1-С2алкілен, -О-арил, переважС8гетероциклоалкіл, -X-арил, -Х-гетероарил, -Хно О-С6-С10арил, особливо переважно О-феніл, циклоалкіл, -Х-гетероциклоалкіл, -NR8-арил, -NR8О-гетероарил, -О-циклоалкіл, насамперед О-С3гетероарил, -NR8-циклоалкіл та -NR8-гетероцикліл, С6циклоалкіл, особливо переважно О-циклопропіл, або можуть являти собою залишок, обраний із -О-гетероциклоалкіл, арил, переважно С6-С10арил, групи, яка включає водень, галоген, COXR8, особливо переважно феніл, гетероарил, циклоалCON(R8)2, COR8 та XR8, переважно водень, або R3 кіл, насамперед С3-С6циклоалкіл, найбільше перета R4 можуть спільно утворювати 2-5-членний алважно циклопропіл, та гетероциклоалкіл, або може кільний місток, переважно етиленовий, пропіленоявляти собою залишок, обраний із групи, яка вий або бутиленовий місток, при цьому пропіленовключає -О-С1-С6алкіл-Q1, -СОNR8-С1-С10алкіл-QІ1, вий, відповідно бутиленовий місток можуть містити -CONR8-C1-C10aлкeнiл-Q1, -CONR8-Q2, галоген, 1-2 гетероатоми, переважно кисень, азот або сірнаприклад фтор, хлор, бром або йод, групу ОН, ку, особливо кращий з названих етиленовий місSO2R8, -SO2N(R8)2, -COR8, -COOR8, -N(R8)2, ток. Найбільш кращим як замісник R3 є метил або NHCOR8, CONR8OC1-C10aлкiл-Q1 та CONR8O-Q2, 4 етил, а як замісник R найбільш кращий є водень при цьому Q1 та Q2 мають зазначені вище значенабо метил. До особливо кращих відносяться такі ня. Переважно R9 являє собою один з наступних 3 4 сполуки, у яких R та R позначають метил. Усі залишків: -CONH-С1-С10алкіл, насамперед -CONHзалишки, зазначені як значення замісників R3 та C1-С3алкіл, особливо переважно -CONH-С1 15 76512 16 С2алкіл, причому цей алкіл у свою чергу за певних де умов може бути заміщений групою CN, необов'язΥ позначає О, S або NR11, переважно NR11, ково заміщений арил, переважно необов'язково m позначає 0, 1 або 2, переважно 1, заміщений феніл, гетероарил, переважно тієніл, R11 являє собою водень або С1-С2алкіл, перетіазоліл, імідазоліл, піридил, піримідил або піразиважно водень або метил, особливо переважно ніл, насичений або ненасичений гетероциклоалкіл, водень, переважно піразоліл, піролідиніл, піперидиніл, R12 являє собою водень або залишок, обраний піперазиніл або тетрагідрооксазиніл, амінний заіз групи, яка включає необов'язково заміщений лишок, переважно метиламін, бензиламін, феніфеніл, піридил, піразиніл, піримідиніл, піридазиніл, ламін або гетероариламін, насичені або ненасиче-С1-С3алкілфеніл, -С1-С3алкілпіридил, -С1ні біциклічні кільцеві системи, переважно С3алкілпіразиніл, -С1-С3алкілпіримідиніл та -С1бензімідазоліл та циклоалкіл, насамперед циклоС3алкілпіридазиніл, переважно феніл, піридил та гексил. піразиніл, а Крім того, R9 являє собою переважно -CONHR13 являє собою С1-С6алкіл, переважно метил гетероарил, переважно -CONH-піридил, -CONHабо етил. С3-С10циклоалкіл, переважно -CONH-циклопропіл, Запропоновані у винаході сполуки можна син-CONH-циклобутил або -CONH-циклопентил, найтезувати за допомогою описаних нижче способів більш переважно -CONH-циклопропіл; -CONH-С3синтезу А та Б, при цьому замісники у загальних С10гетероциклоалкіл, -CONH-С6-С10арил, переваформулах (А1)-(А6) мають зазначені вище значенжно -CONH-феніл, СОО-С1-С3алкіл, особливо пеня. Представлені способи служать лише для більш реважно СООСН3, СООН, галоген, переважно F докладного пояснення винаходу, не обмежуючи або хлор, групу ОН або залишок формули при цьому його обсяг. Спосіб А Стадія 1А Сполуку формули (А1) взаємодією зі сполукою формули (А2) перетворюють у сполуку формули (A3) (схема 1А). Дану реакцію можна проводити згідно із WO 00/43369 або WO 00/43372. Сполука (A1) є комерційно доступним продуктом та поставляється, зокрема, фірмою City Chemical LLC, розташованої за адресою: 139 Allings Crossing Road, Усі залишки, зазначені при розкритті значень West Haven, CT, 06516, USA. Сполуку (А2) можна замісника R9, за певних умов можуть бути заміщеодержувати за відомою з літератури методикою: a) ні, переважно одним або декількома залишками, F. Effenberger, U. Burkhart, J. Willfahrt, Liebigs Ann. обраними з групи, яка включає ОН, ОСН3, СІ, F, Chem. (1986), cc.314-333; б) Т. Fukuyama, C.-K. СН3, СООН, CONHCH2Ph та СОМНСН2-піразинілJow, M. Cheung, Tetrahedron Lett. (1995), 36, СН3. cc.6373-6374; в) R.K. Olsen, J. Org. Chem. (1970), Замісник R10 може мати відповідно ідентичні 35, cc.1912-1915; r) F.E. Dutton, B.H. Byung, або різні значення та може являти собою залишок, Tetrahedron Lett. (1998), 30, cc.5313-5316; д) J.M. обраний із групи, яка включає необов'язково заміRanajuhi, M.M. Joullie, Synth. Commun. (1996), 26, щений С1-С6алкіл, переважно С1-С3алкіл, С2cc.1379-1384. С6алкеніл, переважно С2-С3алкеніл, та С2С6алкініл, переважно С2-С3алкініл, -О-С1-С6алкіл, переважно -О-С1-С3алкіл, -О-С2-С6алкеніл, -О-С2С6алкініл, С3-С6гетероциклоалкіл та С 3С6циклоалкіл, або може являти собою залишок, обраний із групи, яка включає водень, -CONH2, COOR8, -OCON(R8)2, -N(R8)2, -NHCOR8, NHCON(R8)2, -NO2 та галоген, наприклад фтор, хлор, бром або йод. Кращими як замісник R9 є водень, метил, метоксигрупа, фтор або хлор, особливо переважно водень або метоксигрупа, насамНа стадії 1А 1 еквівалент сполуки (А1) та 1-1,5 перед метоксигрупа. еквівалента, переважно 1,1 еквівалента, що відпоРозташовані поруч один з одним залишки R9 відає основі, переважно карбонату калію, гідроката R10 спільно можуть утворювати місток загальної рбонату калію, карбонату натрію або гідрокарбоформули нату натрію, карбонату кальцію, особливо переважно карбонату калію, перемішують у розріджувачі, наприклад у ацетоні, водяному ацетоні, тетрагідрофурані, діетиловому ефірі або діоксані, переважно у ацетоні або діетиловому ефірі, особливо переважно у ацетоні. Далі при температурі в інтервалі від 0 до 15°С, переважно від 5 до 10°С, по краплях додають 1 еквівалент амінокислоти формули (А2), розчинений у органічному розчиннику, наприклад в ацетоні, тетрагідрофурані, діетиловому ефірі або діоксані, переважно у ацетоні. 17 76512 18 Реакційну суміш нагрівають при перемішуванні до ку, наприклад у диметилформаміді або диметилатемператури в інтервалі від 18 до 30°С, переважно цетаміді, переважно в диметилацетаміді, та оходо приблизно 22°С, та потім продовжують перемілоджують до температури в інтервалі від приблизшування протягом наступних 10-24год., переважно но -5 до +5°С, переважно до 0°С. Потім додають приблизно протягом 12год. Після цього розріджу0,9-1,3 еквіваленти гідриду натрію та 0,9-1,3 еквівач відганяють, залишок змішують з водою та суваленти алкілгалогеніду, наприклад метилйодиду. міш двічі або тричі екстрагують за допомогою орРеакційну суміш протягом 0,1-3год., переважно ганічного розчинника, наприклад діетилового протягом 1год., перемішують при 0-10°С, переваефіру або етилацетату, переважно етилацетату. жно при температурі порядку 5°С, після чого в разі Об'єднані органічні екстракти сушать, а розчинник потреби її можна витримувати в зазначеному інтевідганяють. Залишок (сполука (A3)) можна без рвалі температур протягом наступних 12год. Потім попереднього очищення використовувати на стадії реакційну суміш концентрують та екстрагують во2. дою й органічним розчинником, переважно дихлоСтадія 2А рметаном або етилацетатом. Органічні фази конОтриману на стадії 1А сполуку (A3) відновлюцентрують, залишок (сполука (А5)) можна очищати ють по нітрогрупі та циклізують з утворенням споза допомогою хроматографії, переважно на силікалуки (А4) (схема 2А) гелі. Стадія 4А Амінування отриманої на стадії 3А сполуки (А5) з одержанням сполуки формули (А7) (схема 4А) можна здійснювати за відомими з літератури методами, а саме, у відповідності з наступними варіантами: 4.1А (a) M.P.V. Boarland, J.F.W. McOmie, J. Chem. Soc. (1951), cc.1218-1221; 6) F.H.S. Curd, F.C. Rose, J. Chem. Soc. (1946), cc. 343-348, 4.2A (a) Banks, J. Am. Chem. Soc. (1944), 66, cc. 1131; б) Ghosh and Dolly, J. Indian Chem. Soc. (1981), 58, cc.512-513. На стадії 2А1 еквівалент нітросполуки (A3) розчиняють у відповідній кислоті, переважно у крижаній оцтовій кислоті, мурашиній кислоті або соляній кислоті, насамперед у крижаній оцтовій кислоті, та нагрівають до 50-70°С, переважно до приблизно 60°С. Потім аж до завершення екзотермічної реакції додають відновлювач, наприклад цинк, олово або залізо, переважно залізний порошок, та протягом 0,2-2год., переважно протягом 0,5год., перемішують при температурі в інтервалі від 100 до 125°С, переважно при температурі поНаприклад, відповідно до варіанта 4.1А 1 еквірядку 117°С. Після охолодження до кімнатної темвалент сполуки (А5) та 1-3 еквіваленти, переважно ператури сіль заліза відфільтровують, а розчинник 2 еквіваленти, сполуки (А6) без використання розвідганяють. Залишок розчиняють у відповідному чинника або у відповідному органічному розчиннирозчиннику або у суміші розчинників, наприклад у ку, такому, наприклад, як сульфолан, диметилфоетилацетаті або у суміші дихлорметану/метанолу, рмамід, диметилацетамід, толуол, Nвзятих у співвідношенні 9:1, та напівнасиченого метилпіролідон, диметилсульфоксид або діоксан, розчину NaCI, та фільтрують, наприклад, через переважно в сульфолані, нагрівають до 100кізельгур. Органічну фазу сушать та концентрують. 220°С, переважно до приблизно 160°С, витримуюЗалишок (сполука (А4)) можна очищати за допомочи при цій температурі протягом 0,1-4год., перегою хроматографії або шляхом кристалізації, або важно протягом 1год. Після охолодження додавикористовувати його як сирий продукт на стадії ванням органічних розчинників або сумішей 3А синтезу. розчинників, наприклад діетилового ефіСтадія 3А ру/метанолу, етилацетату, метиленхлориду або Отриману на стадії 2А сполуку (А4) можна діетилового ефіру, переважно суміші діетилового шляхом електрофільного заміщення відповідно до ефіру/метанолу в співвідношенні 9:1, продукт (А7) схеми 3А перетворювати на сполуку формули (А5) кристалізують або очищують його за допомогою хроматографії. Відповідно до варіанта 4.2А 1 еквівалент сполуки (А5) та 1-3 еквіваленти сполуки (А6) перемішують зі зворотнім холодильником протягом 148год., переважно протягом приблизно 5год., разом з відповідною кислотою, наприклад з 1-10 еквівалентами 10-38%-вої соляної кислоти, та/або з відповідним спиртом, наприклад етанолом, пропанолом, бутанолом, переважно з етанолом. ПроНа стадії 3А 1 еквівалент аміду формули (А4) дукт, що випав у осад, (А7) відфільтровують, при розчиняють у відповідному органічному розчинни 19 76512 необхідності промивають водою, сушать та кристалізують з відповідного органічного розчинника. У тому випадку, коли R6 являє собою необов'язково заміщений бензімідазол, сполуки (А6) можна одержувати за методами, які відомі з літератури, наприклад відповідно до наступної схеми: Відповідно до цього, наприклад, 33ммоля сполуки (Z1), 49ммолей сполуки (Z2) та 49ммолей 1етоксикарбоніл-2-етоксидигідрохіноліну (ЕЕДХ) перемішують у 50мл органічного розчинника, переважно диметилформаміді, при температурі в інтервалі від 100 до 130°С, переважно порядку 115°С, протягом 1-4год., переважно протягом приблизно 3год. Потім охолоджений реакційний розчин зливають у 50-400мл, переважно в приблизно 200мл, суміші води та етилацетату (їхнє співвідношення у суміші приблизно 1:1). Кристали (Z3), які утворюються, видаляють вакуум-фільтрацією та промивають. Після цього 4,2ммоля сполуки (Z3) перемішують з 12,5ммоля хлориду олова(ІІ) та 30ммолями карбонату калію у приблизно 50мл органічного розріджувача, переважно етилацетату, при температурі порядку 22°С протягом 4-48год., переважно протягом приблизно 24год. Після додавання 22г кізельгуру екстрагують органічним розріджувачем або сумішшю розріджувачів, переважно сумішшю дихлорметану та метанолу (при їх співвідношенні 9:1), об'єднані екстракти концентрують та осад, що утворився, (Z4) або кристали, які утворилися, (Z4) виділяють. Стадія 5А У тому випадку, коли R9 являє собою -CONR8C1-C10алкіл-Q1, -СОNН-С1-С5алкілен або -CONR8Q2, при цьому замісники мають зазначені вище значення, запропоновані у винаході сполуки можна одержувати за методами, які відомі з літератури, наприклад відповідно до схеми 5А. Отриману на стадії 4А сполуку (А7) можна або шляхом омилення та наступного амінування перетворювати на амід загальної формули (А10) (схема (5А), варіант 5.1А), або перетворювати шляхом омилення з наступним переведенням у хлорангідрид кислоти (А9) та завершальним амінуванням (схема (5А), варіант 5.2А). 20 Варіант 5.1А Відповідно до варіанта 5.1А, наприклад 20ммолей складного ефіру (А7') у приблизно 100мл основи, переважно 1н. розчині гідроксиду натрію або розчині гідроксиду літію, та приблизно 500мл спирту, наприклад етанолу, діоксану або метанолу, переважно метанолу, нагрівають до моменту повного перетворення зазначеного ефіру. Потім спирт відганяють. Залишок розчиняють у приблизно 200мл води та при охолодженні підкисляють відповідною кислотою, наприклад соляною кислотою, переважно 2н. соляною кислотою. Після цього продукт (А8) відфільтровують та сушать. Далі, наприклад, приблизно 0,5ммоля сполуки (А8) розчиняють разом із приблизно 0,5ммоля тетрафторборату О-бензотриазол-Ν,Ν,Ν',Ν'тетраметилуронію (ТБТУ) та приблизно 1,4ммоля діізопропілетиламіну (ДІПЕА) у приблизно 5мл органічного розчинника, такого, наприклад, як тетрагідрофуран, диметилформамід, Nметилпіролідон або диметилацетамід. Після додавання приблизно 0,75ммоля аміну, який утворює замісник R9, реакційну суміш протягом 0,1-24год., переважно протягом приблизно 12год., перемішують при температурі в інтервалі від 20 до 100°С. У результаті, наприклад, кристалізації або хроматографічного очищення одержують продукт формули (А10). Варіант 5.2А Відповідно до варіанта 5.2А, наприклад, приблизно 1ммоль кислоти (А8) суспендують у приблизно 2,7 мл тіонілхлориду. Потім суміш нагрівають до 40-80°С, переважно до порядку 50°С, і, підтримуючи температуру на цьому рівні, до реакційної суміші при перемішуванні додають від 2 до 10 крапель, переважно 3 краплі, диметилформаміду. Далі суміш до завершення реакції перемішують при 90°С. Надлишковий тіонілхлорид відганяють. Потім приблизно 1ммоль хлорангідриду кислоти (А9), що утворився розчиняють у приблизно 30мл органічного розріджувача, наприклад у дихлорметані. Після додавання аміну, який утворює замісник R9, перемішують при температурі порядку 22°С. Осад, який утворився, відфільтровують та промивають водою. Залишок промивають органічним розріджувачем, наприклад метанолом. Матковий розчин очищають, наприклад, хроматографією та концентрують. У результаті одержують продукт 21 76512 22 (А10). Вихід: 54,3г сполуки 1 (олія червоного кольоСпосіб Б ру). На відміну від вищеописаного способу можна, 54,3г сполуки 1, розчинених у 400мл ацетону, як це показано на схемі Б, за відомими з літератута 30,7г (0,222молів) карбонату калію охолоджувари методами після стадії 1А спочатку здійснювати ли при перемішуванні до 8°С, змішували з 43,1г амінування сполуки (A3), а потім циклізацію проду(0,222молів) 2,4-дихлор-5-нітропіримідину у 250мл кту (Б1) з одержанням сполуки (Б2). Наступне заацетону, після чого перемішували протягом 24год. міщення сполуки (Б2) з одержанням сполуки (А7) при кімнатній температурі. Суспензію, яка утвориможна здійснювати, наприклад, аналогічно стадії лася, упарювали, залишок екстрагували водою та 3А. етилацетатом, органічну фазу промивали водою та розчином NaCI, сушили над MgSo4 та упарювали досуха. Вихід: 87,3г сполуки 2 (олія коричневого кольору). 44,1г сполуки 2 розчиняли у 800мл крижаної оцтової кислоти, нагрівали до 65°С та змішували порціями з 36г залізного порошку. Після цього протягом 3год. перемішували при 70°С, осад відфільтровували та фільтрат упарювали. Залишок екстрагували сумішшю дихлорметану та метанолу (у їхньому співвідношенні 90:10) з використанням силікагелю, упарювали й очищали хроматографією на колонці (елюент: етилацетат/циклогексан у співвідношенні 1:1). залишок осаджували із суміші етилацетату та петролейного ефіру. Вихід: 16,1г сполуки 3 (порошок бежевого кольору). 16,1г сполуки 3 розчиняли у 75мл диметилацетаміду та у атмосфері азоту охолоджували при перемішуванні до 5°С. Потім додавали 2,51г (0,063молів) NaH, 60%-ва дисперсія у мінеральній олії, при цьому температура тимчасово зростала до 16°С. Після закінчення 30хв. додавали 3,94мл (0,063молів) метилйодиду, розчинених у 75мл диметилацетаміду та перемішували протягом 24год. при 22°С. Потім розчинник випарювали, до суміші домішували 200мл води, осад, який утворився, відокремлювали вакуум-фільтрацією та на завершення виділяли розмішуванням з петролейним Нові сполуки загальної формули (І) можна сиефіром. нтезувати аналогічно представленим нижче прикВихід: 15,1г сполуки 4 (порошок жовтого коладам. Ці приклади служать лише для більш дольору). 1 кладного пояснення винаходу, не обмежуючи при Н-ЯМР (250МГц): 7,80 (1Н, s), 4,35 (m, 1Н), цьому його обсяг. 3,92 (m, 1Н), 3,22 (s, 3Н), 3,14 (m, 1Н), 1,81 (m, 2Н), Приклад 63 та приклад 109 1,60-1,40 (m, 3Н), 0,90 (m, 6H), 0,70 (t, 3Н). Для синтезу сполук 63 та 109 спочатку одерСинтез сполуки з приклада 63 жують описаним нижче шляхом проміжну сполу2,5г сполуки 4, 1,43г 4-аміно-3ку 4 метоксибензойної кислоти, 1,25мл концентрованої соляної кислоти, 150мл дистильованої води та 37,5мл етанолу кип'ятили протягом 10год. зі зворотнім холодильником. Осад відфільтровували, промивали водою та виділяли розмішуванням у метанолі. Потім осад перекристалізовували за допомогою петролейного ефіру та діетилового ефіру. Вихід: 1,6г сполуки 5 (порошок білого кольору). 0,2г сполуки 5, 5мл бензиламіну, 0,16 ТБТУ та 38,9мл (0,263молів) етилового ефіру 20,17г ДІПЕА розчиняли у 2мл диметилформаміду броммасляної кислоти та 36,4г (0,263молі) карбо(ДМФ) та перемішували протягом 48год. при кімнату калію попередньо поміщали у 350мл етиланатній температурі. Потім реакційну суміш розчицетату, а потім швидко додавали по краплях няли в метиленхлориді, промивали водою та орга46,7мл (0,402молі) ізоаміламіну, розчинених у нічну фазу концентрували. При додаванні 70мл етилацетату. Далі протягом 20год. кип'ятили петролейного ефіру/етилацетату (у співвідношенні зі зворотнім холодильником. Сіль, що утворилася, 9:1) продукт випадав у осад у вигляді кристалів відфільтровували, фільтрат упарювали, змішували світло-бежевого кольору. з 50мл толуолу та повторно упарювали досуха. Вихід: 0,18г, tпл.: 178°С. Синтез сполуки з прик 23 76512 24 лада 109 лювали, сушили над MgSO4 та упарювали досуха. 5г 2-аміно-5-нітроаніліну, 6,03г 4Вихід: 79,2г сполуки 9 (смола жовтого кольопіридилкарбонової кислоти та 12,1г ЕЕДХ розчиру). няють у 50мл ДМФ та перемішують при 115°С про79,0г сполуки 9 розчиняли у 1000 мл крижаної тягом 1,75год., після чого ДМФ відганяють у вакуоцтової кислоти та нагрівали до 70°С. Після видаумі та реакційну суміш нагрівають потім до 180°С, лення джерела нагрівання порціями додавали 52г витримуючи її при цій температурі протягом 1год. заліза. Температура при цьому піднімалася до Залишок розчиняють у 30мл ДМФ та змішують з приблизно 110°С та при такій температурі перемі200мл води та 100мл етилацетату. Кристалічну шували протягом 1год. Суспензію фільтрували в кашоподібну масу, яка утворилася, відфільтровугарячому стані та фільтрат упарювали, залишок ють та промивають водою, етилацетатом та просрозчиняли у етилацетаті та змішували з 150мл тим ефіром. концентрованої НСІ, потім органічну фазу відоВихід: 5,8г сполуки 6. кремлювали, а водну фазу кілька разів екстрагу2г сполуки 6 змішують з 0,2г 5%-вого Pd/C в вали дихлорметаном. Об'єднані органічні фази 30мл етанолу та гідрують у присутності водню. упарювали, екстрагували з використанням силікаПотім концентрують та кристалізують з етанолу та гелю та очищали хроматографією на колонці толуолу. (елюент: петролейний ефір/етилацетат у співвідВихід: 1,75г сполуки 7 у вигляді порошку білого ношенні 1:1). кольору. Оскільки, однак, виділена речовина містила 0,2г сполуки 5, 0,28г сполуки 7, 0,001г третще значну кількість домішок, її повторно очищали бутилату натрію, 2,5мл диметилового ефіру етиза допомогою силікагелю. Необхідна сполука виленгліколю, 0,006г ацетату паладію(ІІ) та 0,22г 2падала у вигляді кристалів та ці кристали відокре(ди-трет-бутилфосфін)біфенілу розчиняють у млювали вакуум-фільтрацією. Матковий розчин 1,5мл N-метилпіролідону (Ν-ΜΠ). Потім розчин упарювали та перекристалізовували із суміші етинагрівають до 160°С з витримуванням при цій темлацетату та діетилового ефіру. пературі протягом 0,5год. Після цього реакційну Вихід: 17,63г сполуки 10. суміш очищають за допомогою 20г силікагелю та 7,6г сполуки 10 та 6,4мл метилйодиду поперецільовий продукт кристалізують із простого ефіру, дньо поміщали у 75мл диметилацетаміду (ДМА) та етилацетату та петролейного ефіру. охолоджували до -15°С. Потім порціями додавали Вихід: 0,04г кристалів жовтого кольору, tпл.: 1,25г NaH, 60%-ва дисперсія у мінеральній олії, та 180сС. протягом 30хв. перемішували при температурі в Приклади 218, 58 та 4 інтервалі від -10 до -5°С. Далі додавали 150мл Для синтезу сполук 218, 58 та 4 спочатку одесуміші води з льодом, кристали, які утворилися, ржують описаним нижче шляхом проміжну сполуку відокремлювали вакуум-фільтрацією та промива11 ли водою та петролейним ефіром. Потім кристали розчиняли у дихлорметані, фільтрували через кізельгур та фільтрат упарювали досуха. На завершення перекристалізовували з петролейного ефіру. Вихід: 6,3г сполуки 11 (кристали бежевого кольору). 1 Н-ЯМР (250МГц): 7,73 (1Н, s), 4,35 (d, 1Н), 4,25 (m, 1Н), 3,35 (s, 3Н), 2,55 (d, 1Н), 1,31 (d, 3Н), 0,95 (s, 9H). Синтез сполуки з приклада 218 55,8г гідрохлориду метилового ефіру DL0,2г сполуки 11, 3,5-дифтор-4-гідроксіанілін та аланіну розчиняли у 500мл метанолу, після чого 0,75мл сульфолану нагрівали протягом 15хв. до додавали 76,1мл 30%-вого розчину метилату на130°С, протягом 15хв. до 140°С та протягом 10хв. трію та сіль відфільтровували. До фільтрату додадо 170°С. Потім змішували з простим ефіром, навали 37,8г триметилацетальдегіду та потім залидосадовий розчин декантирували, а залишок крисшали стояти на 22год. Далі додавали 9,5г 10%талізували з метанолу/простого ефіру та повторно вого Pd/C та протягом 3,1год. гідрували при тиску перекристалізовували з метанолу. 0,5бар та 20°С. Реакційну суміш відфільтровували Вихід: 0,15г кристалів білого кольору, tпл.: через кізельгур вакуум-фільтрацією та упарювали. >250°С. Залишок розчиняли у діетиловому ефірі, солі фіСинтез сполуки з приклада 4 льтрували через кізельгур та фільтрат упарювали. 6,3г сполуки 11 розчиняли у 25мл сульфолану Вихід: 55,8г сполуки 8 (прозора рідина). при 100°С, після чого змішували з 4,0г етилового 48,5г 2,4-дихлор-5-нітропіримідину попередньо ефіру 4-амінобензойної кислоти та нагрівали пропоміщали у 400мл діетилового ефіру, потім додатягом 1год. до 170°С. Потім до суміші домішували вали 41,0г гідрокарбонату калію у 400мл води та 50мл простого ефіру. Після кристалізації, що поохолоджували до -5°С. Далі 43,3г сполуки 8 розчичалася, додавали ще 50мл простого ефіру та 50мл няли у 400мл діетилового ефіру та по краплях дометанолу. Кристали, які утворилися, перекристалідавали при -5°С до першої суміші. Спочатку прозовували з метанолу. тягом 1год. перемішували при -5°С, а потім Вихід: 6,6г сполуки 12 (кристали жовтуватого протягом 2год. при 0°С. Після цього реакційну сукольору), tпл.: вище 65°С починається розкладання. міш нагрівали до кімнатної температури та зали3,55г сполуки 12 суспендували у 250мл меташали стояти на 24год. Органічну фазу відокрем 25 76512 26 нолу та змішували при 60°С з 25мл 4н. їдкого на40,0г сполуки 16 розчиняли у 300мл крижаної тру. Після закінчення 6год. додавали 15мл крижаоцтової кислоти та нагрівали до 70°С. Після виданої оцтової кислоти, кристали, які утворилися, вілення джерела нагрівання порціями додавали 30г дфільтровували та промивали сумішшю метанолу заліза. Температура при цьому піднімалася до та простого ефіру. 110°С. Далі реакційну суміш охолоджували до Вихід: 1,2г сполуки 13 (кристали білого кольо90°С та протягом 20хв. перемішували при цій темру). пературі. Потім суміш фільтрували у гарячому 1,5г сполуки 13 розчиняли у 7,5мл тіонілхлостані та фільтрат упарювали. Залишок розмішувариду та нагрівали протягом 1год. до 80°С. Потім ли у 300мл води та 300мл дихлорметану та фільтвідганяли від тіонілхлориду, залишок розмішували рували через кізельгур. Фази розділяли. Органічну з простим ефіром, кристали відокремлювали вакуфазу промивали водою, сушили над MgSO4 та ум-фільтрацією та промивали простим ефіром. упарювали досуха. На завершення продукт видіВихід: 1,7г сполуки 14 (кристали жовтого коляли шляхом перемішування з петролейного льору). ефіру. 0,18г 3-амінопіридину розчиняли у 10мл тетраВихід: 26,7г сполуки 17. гідрофурану (ТГФ) та змішували з 0,4мл триети15,0г сполуки 17 попередньо поміщали у ламіну. Після цього додавали 0,22г сполуки 14 та 100мл ДМА, після чого додавали 4,13мл метилйопротягом 16год. перемішували при кімнатній темдиду та охолоджували до 5°С. Далі порціями допературі. Потім суміш упарювали досуха, розчинядавали 2,60г NaH у вигляді 60%-вої дисперсії у ли у етилацетаті, екстрагували водою, повторно мінеральній олії. Температура при цьому піднімаупарювали та продукт кристалізували з етилацелася до 13°С. Після закінчення 30хв. додавали тату. 300мл суміші води з льодом, кристали, які випали Вихід: 0,07г (кристали бежевого кольору), tпл.: у осад, відокремлювали вакуум-фільтрацією та 215-216°C. промивали петролейним ефіром. Синтез сполуки з приклада 58 Вихід: 13,9г сполуки 18. 1 0,05г сполуки 13 суспендували у 10мл дихлоН-ЯМР (250МГц): 7,95 (1Н, s), 4,30 (m, 1H), рметану та потім змішували з 0,15мл ДІПЕА та 3,95 (m, 1H), 3,24 (s, 3Н), 2,95 (m, 1Н), 2,05 (m, 1Н), 0,05г ТБТУ. Далі розчин перемішували протягом 1,30 (d, 3Н), 0,96 (d, 3Н), 0,92 (d, 3Н). 30хв. та змішували з 0,01мл 4-піколіламіну. Після Синтез сполуки з приклада 65 закінчення 18год. суміш змішували з 20мл води, 2,1г сполуки 18 змішували у 10мл сульфолану органічну фазу відокремлювали та продукт очиз етиловим ефіром 4-амінобензойної кислоти та щали хроматографією на силікагелі, на завершенперемішували протягом 2год. при 160°С. Потім ня перекристалізовували його з етилацетазмішували з простим ефіром та кристали, яки виту/петролейного ефіру. пали в осад, промивали простим ефіром. Вихід: 0,044г (кристали білого кольору), tпл.: Вихід: 3,0г сполуки 19. 238-240°С. 3г сполуки 19 змішували з 200мл метанолу та Приклади 65 та 125 25мл 4н. NaOH та протягом 4год. перемішували Для синтезу сполук 65 та 125 спочатку одерпри 60°С. Потім домішували крижану оцтову кисжують описаним нижче шляхом проміжну сполулоту, кристали, що випали у осад, відфільтровуку 18 вали та промивали простим ефіром. Вихід: 2,3г сполуки 20 (кристали білого кольору). 0,1г сполуки 20 суспендували у 3мл дихлорметану та 3мл ДМФ та потім змішували з 0,13г ДІПЕА, 0,095г ТБТУ та 0,045г гідроксибензотриазолу (ГОБТ). Далі розчин перемішували протягом 30хв. та змішували з 0,035г N-метил-3-піколіламіну. Після закінчення 0,5год. до суміші домішували воду та 1г карбонату калію, водну фазу двічі екстрагували етилацетатом, додаючи його порціями по 28,3г ізобутиламіну, 36г етилового ефіру R,S50мл, та продукт очищали хроматографією на си2-бромпропіонової кислоти та 28г карбонату калію лікагелі, на завершення перекристалізовували з кип'ятили в 150мл етилацетату протягом 6год. зі етанолу/ацетону. зворотнім холодильником. Після охолодження сіль Вихід: 0,08г. відокремлювали вакуум-фільтрацією, а матковий Синтез сполуки з приклада 125 розчин упарювали. Залишок змішували з 100мл 3,7г сполуки 20, 3,8г ТБТУ, 1,6г ГОБТ та 5мл толуолу й упарювали досуха. ДІПЕА розчиняли у 40мл ДМФ та протягом 4год. Вихід: 37,2г сполуки 15 (олія жовтого кольору). перемішували при кімнатній температурі. Потім 38,4г 2,4-дихлор-5-нітропіримідину попередньо суміш концентрували, розчиняли у 200мл етилапоміщали у 300мл діетилового ефіру, додавали цетату та двічі екстрагували 5%-вим розчином 30г гідрокарбонату калію в 300мл води та охолокарбонату калію, додаючи його порціями по 5мл. джували до 0°С. Далі 37,0г сполуки 15 розчиняли у Органічну фазу концентрували, кристали, яки ви300мл діетилового ефіру та при 0-3°С додавали по пали у осад відфільтровували та промивали етикраплях до першої суміші. Після закінчення 3год. лацетатом та простим ефіром. фази розділяли, органічну фазу сушили й упарюВихід: 1,65г сполуки 21 (кристали жовтуватого вали досуха. кольору). Вихід: 71,6г сполуки 16. 27 76512 28 0,486г сполуки 21 разом із 0,33г 1,2змішували з 20,0г (0,103молів) 2,4-дихлор-5фенілендіаміну кип'ятили у 10мл толуолу протягом нітропіримідину у 400мл діетилового ефіру. Після 0,5год. зі зворотнім холодильником, після чого охолодження реакційної суміші до -10°С порціями суміш концентрували. Залишок змішували з 100мл додавали 50,0г (0,499молів) карбонату калію. Далі етилацетату та органічну фазу двічі екстрагували протягом 1год. перемішували при -5°С та протягом водою. Потім органічну фазу концентрували, крис1год. при 0°С та потім нагрівали до кімнатної темтали, яки випали у осад відокремлювали вакуумператури. Водну фазу відокремлювали, а органічфільтрацією та промивали невеликою кількістю ну фазу промивали водою, сушили та упарювали етилацетату. досуха. Вихід: 0,25г сполуки 22 (кристали білого коВихід: 36,9г сполуки 25. льору). 20,0г сполуки 25 розчиняли у 280мл крижаної 0,22г сполуки 22 перемішували у 20г поліфосоцтової кислоти та нагрівали до 70°С. Після видафорної кислоти протягом 0,5год. при 150°С, після лення джерела нагрівання додавали 17г заліза. чого зливали на лід та змішували з аміаком. Потім Температура при цьому піднімалася до 100°С, двічі екстрагували етилацетатом, додаючи його потім протягом 30хв. перемішували при цій темпепорціями по 100мл, органічну фазу промивали ратурі. Далі суміш фільтрували в гарячому стані та водою та концентрували. Продукт, який випав у фільтрат упарювали. Залишок змішували з 300мл осад, (кристали) відокремлювали вакуумдихлорметану та 30мл 32%-вої НСІ, фази розділяфільтрацією та промивали етилацетатом та просли, водну фазу екстрагували дихлорметаном, тим ефіром. об'єднані органічні фази промивали водою та водВихід: 0,115г кристалів жовтуватого кольору, ним розчином аміаку, сушили та упарювали досуtпл.: 287°С (розкладання). ха. Залишок виділяли шляхом перемішування з Приклад 171 діетиловим ефіром. Для синтезу сполуки 171 спочатку одержують Вихід: 10,5г сполуки 26, tпл.: 182-185°С. описаним нижче шляхом проміжну сполуку 27 2,7г сполуки 26 та 2,5мл метилйодиду попередньо поміщали у 27мл ДМА та охолоджували до 10°С. Далі додавали 0,45г NaH, 60%-ва дисперсія в мінеральній олії, та протягом 30хв. перемішували при -5°С. Потім додавали 10г льоду та 5мл 2н. НСІ та упарювали. Залишок екстрагували етилацетатом та водою, органічну фазу сушили, упарювали досуха та фільтрували через силікагель. Вихід: 3,0г сполуки 27 (олія). 1 Н-ЯМР (250МГц): 7,67 (1Н, s), 4,32-4,07 (m, 2H), 3,32 (s, 3Н), 3,08 (m, 1Н), 1,70-1,50 (m, 3Н), 34,4г N-ізопентилбензиламіну, 36,2г етилового 1,42 (d, 3Н), 0,95 (m, 6H). ефіру 2-бромпропіонової кислоти та 42,0г карбоСинтез сполуки з приклада 171 нату калію попередньо поміщали у 250мл ДМФ та 0,28г сполуки 27, 0,9мл сульфолану та 0,22г перемішували протягом 3год. при 110°С. Після бензиламіду n-амінобензойної кислоти перемішуохолодження неорганічні солі відфільтровували та вали протягом 0,5год. при 170°С, потім суміш зміфільтрат упарювали. Залишок екстрагували вошували з простим ефіром та кристали, якi випали дою та діетиловим ефіром, органічнуфазу промиу осад, відфільтровували. На завершення продукт вали водою, сушили та упарювали досуха. перекристалізовували з етанолу. Вихід: 55,5г сполуки 23. Вихід: 0,15г (кристали жовтуватого кольору), 55,5г сполуки 23 попередньо поміщали у tпл.: 228-240°С. 600мл етанолу та протягом 20хв. гідрували за доАналогічно вищеописаній методиці одержують помогою 20мл 32%-вої НСІ та 6г 10%-вого Pd/C серед інших також сполуки формули (І), представпри 20°С та тиску 5бар. Потім фільтрували через лені у таблиці. У цій таблиці для позначення посилікагель та упарювали. Залишок змішували з ложення, у якому відповідний залишок R2, R3, R4, 400мл діетилового ефіру, осад відокремлювали R5 та R6 приєднаний до іншої частини молекули вакуум-фільтрацією та промивали діетиловим приведеної перед таблицею загальної формули, ефіром. використовуються символи Х2, Х3, Χ4, X5 та Х6 відВихід: 23,5г сполуки 24, tпл.: 105°С. повідно. 23,5г сполуки 24 розчиняли у 200мл води та 29 76512 30 31 76512 32 33 76512 34 35 76512 36 37 76512 38 39 76512 40 41 76512 42 43 76512 44 45 76512 46 47 76512 48 49 76512 50 51 76512 52 Сполуки загальної формули (І) володіють, як було встановлено, широкими можливостями для застосування в терапевтичних цілях, відповідно володіють високим терапевтичним потенціалом. Особливо при цьому слід зазначити можливість їхнього застосування в тих випадках, коли важливу роль грає інгібування специфічних кіназ, які беруть участь у регуляції клітинного циклу, насамперед інгібувальна дія, яка впливає на проліферацію пухлинних клітин людини, яки культивуються, а також на проліферацію інших клітин, таких, наприклад, як ендотеліальні клітини. За результатами FACS-аналізу (сортування клітин методом збудженої флуоресценції) вдалося встановити, що викликане запропонованими у винаході сполуками інгібування проліферації клітин опосередковується затримкою клітин головним чином у G2/М-періоді клітинного циклу. Клітини в залежності від їх конкретного типу, який використовують у аналізі, затримуються в цій фазі клітинного циклу протягом визначеного проміжку часу, після чого настає запрограмована загибель клітин. Затримка клітин у G2/М-періоді клітинного циклу ініціюється, наприклад, інгібуванням специфічних кіназ, яки беруть участь у регуляції клітинного циклу. Дослідження, що проводилися на організмахмоделях, таких як Schizosaccharomyces pombe або Xenopus, або ж дослідження, яки проводилися на людських клітинах, свідчать про те, що перехід від G2-періоду до мітозу регулюється кіназою CDK1/циклін В (Nurse, 1990). Ця кіназа, названа також "фактором стимуляції мітозу" (MPF від англ. "mitosis promoting factor"), фосфорилює та регулює тим самим безліч різних білків, таких, наприклад, як ядерні пластинки, кінезинподібні моторні білки, конденсини та матриксні протеїни комплексу Гольджі, що відіграють важливу роль у руйнуванні оболонки клітинного ядра, у поділі центросом, у формуванні мітотичного веретена розподілу, у конденсації хромосом та у руйнуванні комплексу Гольджі (Nigg. Ε., 2001). В однієї з мишачих клітинних ліній з чуттєвим до температури мутантом кінази CDK1 після підвищення температури спостерігається швидке руйнування кінази CDK1 та наступна за ним затримка клітин у G2/М-періоді клітинного циклу (Th'ng та ін., 1990). Обробка людських пухлинних клітин інгібіторами зі спрямованою проти CDK1/цикліна В дією, такими, наприклад, як бутиролактон, також призводить до затримки клітин у G2/M-періоді та наступному їх апоптозу (Nishio та ін., 1996). Іншою кіназою, яка відіграє визначену роль у G2-періоді та мітозі, є Polo-подібна кіназа 1 ("Polo-like kinase 1", Plk1), яка 53 76512 54 відповідальна за дозрівання центросом, за актиз використанням клітин НеLа3 значення EC50 вацію фосфатази Cdc25C, a також за активацію складало менше 5мкмолей, як правило, навіть стимулюючого анафазу комплексу ("anaphase менше 1мкмоля. promoting complex") (Glover та ін., 1998, Qian та ін., Визначення цитотоксичності на людських пух2001). Ін'єкція антитіл до Plk1 приводить до затрилинних клітинах, які культивуються мки у G2-періоді нетрансформованих клітин, на Для визначення цитотоксичності на людських відміну від яких затримка пухлинних клітин відбупухлинних клітинах, які культивуються, пухлинні вається у мітозі (Lane та Nigg, 1996). Крім цього клітини рака шийки матки лінії НеLа3 (отримані з відповідно до літературних джерел істотну функАмериканської колекції типових культур (АТСС)) цію при входженні в мітоз виконує й протеїнкіназа культивували у F12-середовищі Хема (фірма Life aurora В. Ця кіназа aurora В фосфорилює гістон Н3 Technologies) та 10%-вій фетальний телячій сирона Ser11 та тим самим ініціює конденсацію хромоватці (фірма Life Technologies) та збирали у фазі сом (Hsu J.Y. та ін., 2000). Однак специфічна зупилогарифмічного росту. Потім клітини HeLa3 внонка клітинного циклу у G2/М-періоді може також сили у 96-лункові планшети (фірма Costar) із щільініціюватися, наприклад, у результаті інгібування ністю 1000 клітин на лунку та інкубували протягом особливих фосфатаз, таких, наприклад, як Cdc25C ночі в інкубаторі (при 37°С у атмосфері з 5%-вим (Russell та Nurse, 1986). Дріжджі з дефектним гевмістом СО2), при цьому по 6 лунок на кожнім ном cdc25 затримуються у G2-періоді, у той час як планшеті заповнювали тільки культуральним сепонадекспресія cdc25 призводить до передчасного редовищем (по 3 лунки використовували як контвходження у мітоз (Russell та Nurse, 1987). Разом роль з культуральним середовищем та по 3 лунки із тим затримка клітин, відповідно зупинка клітинвикористовували для інкубації з відновленим барного циклу у G2/М-періоді може також ініціюватися вником блакитного кольору AlamarBlue). Діючі рев результаті інгібування визначених моторних білчовини додавали до клітин у різних концентраціях ків, тобто так званих кінезинів, як, наприклад, Eg5 (у розчиненому у ДМСО вигляді, кінцева концент(Mayer та ін., 1999), чи стабілізуючими або дестарація 1%) (досліди з діючими речовинами у кожній білізуючими мікротрубочки агентами (наприклад з досліджуваних концентрацій проводили в трьох колхіцином, таксолом, етопозидом, вінбластином, повторностях). Після інкубації протягом 72год. у вінкристином) (Schiff та Horwitz, 1980). кожну лунку додавали по 20мкл барвника Запропоновані у винаході сполуки загальної AlamarBlue (фірма AccuMed International) та клітиформули І, їхні ізомери та їх фізіологічно сумісні ни інкубували ще протягом 7год. Для контролю в 3 солі з урахуванням їхніх біологічних властивостей лунки додавали по 20мкл відновленого барвника придатні для лікування захворювань, при яких хаAlamarBlue (реактив AlamarBlue, автоклавований рактерна надлишкова або аномальна проліферапротягом 30хв.). Після інкубації протягом 7год. ція клітин. визначали зміну кольору реактиву AlamarBlue в До подібних до захворювань відносяться, наокремих лунках у флуоресцентному спектрофотоприклад, вірусні інфекції (наприклад ВІЛ та саркометрі фірми PerkinElmer (довжина хвилі збудливома Капоши), запальні процеси й аутоімунні захвого випромінювання 530нм, довжина хвилі випусрювання (наприклад, коліт, артрит, хвороба каючого випромінювання 590нм, 15 щілин, час Альцгеймера, гломерулонефрит та процеси, яки інтегрування 0,1с). Кількість реактиву AlamarBlue, відбуваються при загоєнні ран), бактеріальні, грибяка прореагувала (змінила колір), є мірою метабокові та/або паразитарні інфекції, різні типи лейкелічної активності клітин. Відносну активність клітин мії, лімфома, солідні пухлини, шкірні захворюванрозраховували у відсотковому відношенні до контня (наприклад псоріаз), захворювання кісток, а ролю (клітини НеLа3 без інгібітору) та за отриматакож серцево-судинні захворювання (наприклад, ним значенням визначали концентрацію діючої рестеноз та гіпертрофія). Крім цього запропоноваречовини, при якій активність клітин інгібується на ні у винаході сполуки ефективні як захист клітин, 50% (IC50)- При цьому відповідні величини обчисщо проліферують (наприклад, волоскових клітин, лювали на основі середнього значення за резульентероцитів, гемоцитів та клітин-попередників) від татами трьох окремих дослідів з поправкою на ушкодження їх ДНК під впливом радіації, під вплизначення, отримане у досліді без інгібітору (контвом УФ-випромінювання та/або при цитостатичній роль з культуральним середовищем). терапії (Davis та ін., 2001). FACS-аналіз Запропоновані у винаході нові сполуки можуть Пропідіййодид (ПЙ) стехіометрично зв'язуєтьвикористовуватися для попередження, короткося з дволанковою ДНК та завдяки цій його властистрокового або довгострокового лікування зазнавості придатний для визначення кількості клітин, чених вище захворювань, у тому числі й у поєдяка виражається у відсотках, які знаходяться у G1-, нанні з іншими діючими речовинами, які S- та G2/M-nepioflax клітинного циклу, на основі застосовують при тих же показаннях, наприклад з вмісту ДНК у клітині. Клітини, які знаходяться у G0цитостатиками. та G1-періоді, містять диплоїдну ДНК (2N), а клітиДію запропонованих у винаході сполук визнани, що знаходяться у G-періоді або у мітозі, місчали, наприклад, на клітинах НеLа3 у досліді на тять 4N ДНК. цитотоксичність з використанням людських пухДля фарбування пропідіййодидом, наприклад, линних клітин, які культивували, та/або шляхом 0,4млн. клітин HeLa3 висівали у колбу для культиFACS-аналізу. Запропоновані у винаході сполуки вування об'ємом 75см2 та через 24год. до клітин при їх дослідженні обома цими методами виявили додавали 1%-вий ДМСО як контроль, відповідно ефективність від доброї до дуже доброї, тобто, досліджувану речовина в різних концентраціях (у наприклад, отримане в досліді на цитотоксичність 1%-вому ДМСО). Потім клітини протягом 24год. 55 76512 56 інкубували в присутності досліджуваної речовини, жуть також складатися з декількох шарів. відповідно ДМСО, після чого клітини промивали Відповідним чином можна виготовляти драже, дворазовим забуференим фосфатом фізіологічшляхом нанесення на отримані аналогічно таблетним розчином (ЗФР) та відокремлювали за допокам ядра покриття зі звичайно застосовуваних у могою трипсину/ЕДТК. Далі клітини центрифугувацих цілях матеріалів, наприклад колідона або шели (1000об./хв., 5хв., 4°С) та осад у пробірці, який лаку, гуміарабіка, тальку, діоксида або титана цукмістив клітини, після центрифугування двічі прору. Ядра драже для забезпечення ефекту або щоб мивали ЗФР, а потім клітини ресуспендували у уникнути несумісності можна також виготовляти 0,1мл ЗФР. Після цього клітини фіксували 80%багатошаровими. Так само й оболонка драже тавим етанолом протягом 16год. при 4°С або ж прокож може складатися для забезпечення депотягом 2год. при -20°С. Фіксовані клітини (106 кліефекту з декількох шарів, при цьому можна викотин) центрифугували (1000об./хв., 5хв., 4°С), прористовувати допоміжні речовини, зазначені вище мивали ЗФР та потім знову центрифугували. Осад для таблеток. у пробірці, якій містив клітини, після центрифугуДо складу мікстур на основі запропонованих у вання ресуспендували у 2мл тритона Х-100 у винаході діючих речовин, відповідно їхніх комбіна0,25%-вому ЗФР та інкубували протягом 5хв. на цій додатково можуть входити також підсолоджульоді, після чого додавали 5мл ЗФР та повторно вальна речовина, така як сахарин, цикламат, гліцентрифугували. Осад у пробірці, якій містив кліцерин або цукор, а також поліпшувач смаку, тини, після центрифугування ресуспендували у наприклад ароматизатор, такий як ванілін або 350мкл розчину барвника ПЙ (0,1мг/мл РНКази А, апельсиновий екстракт. Крім цього мікстури мо10мкг/мл пропідіййодиду в однократному ЗФР). жуть містити суспендувальні допоміжні речовини Потім клітини протягом 20хв. інкубували у темряві або ті, що згущують, такі як натрійкарбоксиметилв присутності буферного розчину барвника, після целюлоза, змочувальні агенти, наприклад продукчого їх переносили у ємності для FACS-аналізу ти конденсації жирних спиртів з етиленоксидом, зразків. Вміст ДНК у клітинах визначали у FACSабо консерванти (захисні речовини), такі як nаналізаторі фірми Becton Dickinson з використангідроксибензоати. ням аргонового лазера (потужність 500мвт, довРозчини для ін'єкцій або інфузії одержують за жина хвилі випромінювання 488нм) та програми відомою технологією, наприклад з додаванням DNA Cell Quest (фірми BD). Логарифмічну флуоагентів, яки додають ізотонічність, консервантів, ресценцію ПЙ визначали за допомогою смугового таких як n-гідроксибензоати, або стабілізаторів, фільтра (ВР 585/42). Для кількісної оцінки популятаких як лужнометалічні солі етилендіамінтетроццій клітин, що знаходяться в окремих періодах тової кислоти, та при необхідності з застосуванням клітинного циклу, використовували програму емульгаторів та/або диспергаторів, при цьому, ModFit LT, розроблену фірмою Becton Dickinson. наприклад, при застосуванні води як розріджувач Сполуки загальної формули (І) можна застопри необхідності можна використовувати органічні совувати індивідуально або в сполученні з іншими розчинники в якості гідротропних солюбілізаторів запропонованими у винаході діючими речовинами, або допоміжних розчинників, та потім розливають а за певних умов - й в сполученні з іншими фармапо пляшках або ампулах для ін'єкцій, відповідно по кологічно активними діючими речовинами. Як припляшках для інфузії. клад прийнятних лікарських форм можна назвати Капсули, які містять одну або кілька діючих ретаблетки, капсули, супозиторії, розчини, зокрема човин, відповідно комбінації діючих речовин, можрозчини для ін'єкцій (підшкірних, внутрішньовенна виготовляти, наприклад, змішуванням діючих них, внутрішньом'язових) та інфузії, мікстури, емуречовин з інертними носіями, такими як лактоза льсії або порошки, яки диспергуються. На частку або сорбіт, та розфасовуванням отриманої суміші фармацевтично активних(-ої) сполук(-и) у таких в желатинові капсули. лікарських формах повинно приходитися в кожноВідповідні супозиторії можна виготовляти, наму випадку від 0,1 до 90мас.%, переважно від 0,5 приклад, змішуванням з передбаченими для цієї до 50мас.%, від загальної маси препарату, тобто мети носіями, такими як нейтральні жири або повміст фармацевтично активних(-ої) сполук(-и) у ліетиленгліколь, відповідно їхні похідні. лікарських формах повинний бути достатнім для Як приклад допоміжних речовин, які викорисвведення лікарської речовини в організм у дозутовують при приготуванні лікарських форм, можна ваннях, інтервали яких зазначені нижче. Такі дози назвати воду, фармацевтично прийнятні (нешкідпри необхідності можна розподіляти на кілька приливі) органічні розчинники, такі як парафіни (найомів удень. приклад, фракції мінеральної олії), олії рослинного Відповідні таблетки можна виготовляти, напоходження (наприклад, арахісова або кунжутна приклад, змішуванням діючої речовини або діючих олія), моно- або поліфункціональні спирти (наприречовин з відомими допоміжними речовинами, клад, етанол або гліцерин), носії, такі як природне наприклад інертними розріджувачами, такими як борошно гірських порід (наприклад, каолін, глинокарбонат кальцію, фосфат кальцію або лактоза, земи, тальк, крейда), синтетичне борошно гірських розпушувачами, такими як кукурудзяний крохмаль порід (наприклад, високодисперсна кремнієва кисабо альгінова кислота, зв'язувальними агентами, лота та силікати), цукри (наприклад, очеретяний, такими як крохмаль або желатин, змащувальними молочний та виноградний цукор), емульгатори речовинами, такими як стеарат магнію або тальк, (наприклад, лігнін, відпрацьований сульфітний та/або засобами для забезпечення депо-ефекту, щелок, метилцелюлоза, крохмаль та полівінилпітакими як карбоксиметилцеллюлоза, ацетатфтаролідон) та речовини, що змащують, (наприклад лат або целюлози полівінілацетат. Таблетки мостеарат магнію, тальк, стеаринова кислота та лау 57 76512 58 рилсульфат натрію). лактоза 140мг Отримані на основі відповідних діючих речокукурудзяний крохмаль 240мг вин препарати вводять в організм звичайними полівінилпіролідон 15мг методами, переважно перорально або трансдерстеарат магнію 5мг мально, переважно перорально. У випадку перо500мг рального введення відповідні таблетки можуть, як Тонкоподрібнену діючу речовину змішують з очевидно, крім вищевказаних носіїв містити також лактозою та з частиною від всієї передбаченої добавки, такі, наприклад, як цитрат натрію, карбокількості кукурудзяного крохмалю. Отриману суміш нат кальцію та дикальційфосфат, разом з різного просівають, після чого її зволожують розчином роду наповнювачами, такими як крохмаль, переполівінилпіролідону у воді, місять, гранулюють у важно картопляний крохмаль, желатин та т.і. Крім вологому стані та сушать. Отриманий гранулят цього при виробництві таблеток можуть викорисразом із іншою кількістю кукурудзяного крохмалю товуватися також змащувальні речовини, такі як та стеаратом магнію просівають та змішують між стеарат магнію, лаурилсульфат натрію та тальк. У собою. З отриманої суміші пресують таблетки невипадку водних суспензій діючі речовини крім виобхідної форми та розмірів. щеописаних допоміжних речовин можна також Б) Таблетки змішувати з різного роду покращувачами смаку Вміст із розраабо барвниками. Для парентерального введення Компонент хунку на одну можна використовувати розчини діючих речовин із таблетку придатними для цієї мети рідкими носіями. діюча речовина 80мг При внутрішньовенному введенні доза, яка лактоза 55мг вводиться в організм, складає від 1 до 1000мг на кукурудзяний крохмаль 190мг годину, переважно від 5 до 500мг на годину. мікрокристалічна целюлоза 35мг Однак у деяких випадках, а саме, у залежності полівінилпіролідон 15мг від ваги тіла пацієнта, відповідно шляху введення, натрійкарбоксиметилкрохмаль 23мг індивідуальної реакції організму на лікарський застеарат магнію 2мг сіб, типу фармацевтичної композиції та її природи 400мг та від моменту введення лікарського засобу, відТонкоподрібнену діючу речовину змішують з повідно періоду часу, протягом якого вводиться частиною від усієї передбаченої кількості кукурулікарський засіб, доза, яка вводиться в організм, дзяного крохмалю, лактозою, мікрокристалічною може відрізнятися від зазначених вище кількостей. целюлозою та полівінилпіролідоном, отриману Так, зокрема, іноді може виявитися достатнім висуміш просівають та разом з іншою кількістю кукукористовувати діючу речовину або діючі речовини рудзяного крохмалю та водою переробляють у у дозуванні, меншому, ніж зазначена вище нижня гранулят, який сушать та просівають. Далі додамежа, тоді як в інших випадках може знадобитися ють натрійкарбоксиметилкрохмаль та стеарат мавикористовувати діючу речовину або діючі речогнію, перемішують та з отриманої суміші пресують вини в дозуванні, яке перевищує вищевказану таблетки необхідних розмірів. верхню межу. При необхідності введення діючої В) Розчин в ампулах речовини або діючих речовин у більшій дозі (додіюча речовина 50мг зах) може виявитися доцільним дробити її на кільхлорид натрію 50мг ка більш дрібних доз з розрахунку на кілька привода для ін'єкцій 5мл йомів на день. Діючу речовина при її власному значенні рН Нижче винахід проілюстрований на прикладах, або при необхідності при рН від 5,5 до 6,5 розчиу яких представлені сполуки деяких лікарських няють у воді та змішують із хлоридом натрію, який форм та які не обмежують його обсяг. використовують як агент, що додає ізотонічність. Приклади фармацевтичних композицій Отриманий розчин фільтрують у непірогенних А) Таблетки умовах та фільтрат в асептичних умовах розфасоВміст із розрахунку вують у ампули, які потім стерилізують та запаюКомпонент на одну таблетку ють. Такі ампули можуть містити 5мг, 25мг або діюча речовина 100мг 50мг діючої речовини. Комп’ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюDihydropteridinones, a method for producing thereof and use thereof as medicament
Автори англійськоюHoffmann Matthias, Grauert Matthias, Breitfelder Steffen, Eickmeier Christian, Schnapp Gisela, BAUER ECKHART, Quant Jens Juergen
Назва патенту російськоюДигидроптеридиноны, способ их получения и их применение в качестве лекарственного средства
Автори російськоюХоффманн Маттиас, Грауэрт Маттиас, Брайтфельдер Штеффен, Айкмайер Кристиан, Шнапп Гизела, Бауэр Экхарт, Квант Йенс Юрген
МПК / Мітки
МПК: A61P 31/18, C07D 475/00, A61K 31/505, A61P 35/00
Мітки: дигідроптеридинони, лікарського, засобу, спосіб, одержання, застосування, їхнє
Код посилання
<a href="https://ua.patents.su/29-76512-digidropteridinoni-sposib-kh-oderzhannya-i-khneh-zastosuvannya-yak-likarskogo-zasobu.html" target="_blank" rel="follow" title="База патентів України">Дигідроптеридинони, спосіб їх одержання і їхнє застосування як лікарського засобу</a>
Попередній патент: Засіб та спосіб боротьби з небажаними рослинами
Наступний патент: Спосіб виробництва торта “київський дарунок”
Випадковий патент: Пристрій для вимірювання тиску високотемпературних газів












