Похідні імідазолу як інгібітори tafia
Номер патенту: 87306
Опубліковано: 10.07.2009
Автори: Сіллат Хауке, Грюнеберг Свен, Хайч Хольгер, Лінденшмідт Андреас, Каллус Крістофер
Формула / Реферат
1. Сполука формули (Iа):
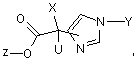 (Іа)
(Іа)
і/або всі стереоізомерні форми сполуки формули (Iа), і/або суміші цих форм у будь-якому співвідношенні, і/або фізіологічно прийнятна сіль сполуки формули (Iа), причому
U означає атом водню;
Х означає залишок формули (II):
-(А1)m-А2, (II)
де
m означає 1;
А1 означає -СН2-,
А2 означає амінопіридил, де амінопіридил незаміщений або, незалежно один від одного, одно- дво- або трикратно заміщений галогеном або СН3;
Y означає -(С3-С8)-циклоалкіл, де циклоалкіл незаміщений або, незалежно один від одного, одно-, дво- або трикратно заміщений за допомогою R1,
причому R1 означає:
а) феніл, причому феніл незаміщений або одно-, дво- або трикратно, незалежно один від одного, заміщений -(С1-С4)-алкілом,
b) триазоліл або піридиніл,
с) -(С1-С4)-алкіл,
d) -(С3-С6)-циклоалкіл,
е) -CF3,
f) -O-CF3,
g) фтор або
h) хлор; і
Z означає:
1) атом водню,
2) -(С1-С6)-алкіл,
3) -(С1-С6)-алкіл-ОН,
4) -(С0-С4)-алкіл-(С3-С6)-циклоалкіл,
5) -(С1-С10)-алкіл-О-С(О)-О-(С3-С6)-циклоалкіл.
2. Сполука за п.1 формули (Ia), де
U означає атом водню;
Х означає залишок формули (II), де
m означає ціле число 1;
А1 означає -СН2-;
А2 означає залишок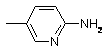 ,
,
який незаміщений або, незалежно один від одного, одно-, дво- або трикратно заміщений за допомогою F, Cl, Br, J або -CH3;
Y означає -(С3-С8)-циклоалкіл, де циклоалкіл незаміщений або, незалежно один від одного, одно-, дво- або трикратно заміщений за допомогою R1,причому R1 означає:
а) феніл, причому феніл незаміщений або одно-, дво- або трикратно, незалежно один від одного, заміщений -(С1-С4)-алкілом,
b) піридил або тетразоліл,
с) -(С1-С4)-алкіл,
d) -(С3-С6)циклоалкіл,
е) -CF3,
f) -O-CF3,
g) фтор або
h) хлор; і
Z означає атом водню.
3. Сполука за п. 1 або 2 формули (Iа), яка відрізняється тим, що вона являє собою сполуку:
3-(6-амінопіридин-3-іл)-2-(1-циклогексил-1Н-імідазол-4-іл)пропіонова кислота;
метиловий ефір 3-(6-амінопіридин-3-іл)-2-(1-циклогексил-1Н-імідазол-4-іл)пропіонової кислоти;
ізопропіловий ефір 3-(6-амінопіридин-3-іл)-2-(1-циклогексил-1Н-імідазол-4-іл)пропіонової кислоти;
циклопропілметиловий ефір 3-(6-амінопіридин-3-іл)-2-(1-циклогексил-1Н-імідазол-4-іл)пропіонової кислоти;
2-гідроксіетиловий ефір 3-(6-амінопіридин-3-іл)-2-(1-циклогексил-1Н-імідазол-4-іл)пропіонової кислоти;
1-циклогексилоксикарбонілоксіетиловий ефір 3-(6-амінопіридин-3-іл)-2-(1-циклогексил-1Н-імідазол-4-іл)-пропіонової кислоти;
3-(6-амінопіридин-3-іл)-2-[1-(4,4-диметилциклогексил)-1Н-імідазол-4-іл]пропіонова кислота;
етиловий ефір 3-(6-амінопіридин-3-іл)-2-(1-циклогексил-1Н-імідазол-4-іл)пропіонової кислоти.
4. Спосіб отримання сполуки формули (Iа) за одним або декількома з пп. 1-3, який відрізняється тим, що
а) сполуку формули (VII):

де РG1 означає карбоксилзахисну групу,
перетворюють на сполуку формули (Iа) за п. 1;
b) отриману за способом а) сполуку формули (Iа), або придатний попередник формули (Iа), яка(ий) на основі своєї хімічної структури утворюється в енантіомерних формах, розділяють на чисті енантіомери шляхом солеутворення з енантіомерно чистими кислотами або основами, шляхом хроматографії при використанні хіральних нерухомих фаз або шляхом дериватизації за допомогою хіральних енантіомерно чистих сполук, таких як амінокислоти, з подальшим розділенням отриманих таким чином діастереомерів і відщепленням хіральних допоміжних груп; або
с) отриману за способом а) або b) сполуку формули (Iа) або виділяють у вільній формі, або, у разі наявності кислотних або основних груп, перетворюють на фізіологічно прийнятні солі.
5. Лікарський засіб, який відрізняється тим, що містить ефективну кількість щонайменше однієї сполуки формули (Iа) за будь-яким з пп. 1-3 разом з фармацевтично придатним і фізіологічно прийнятним носієм, домішкою і/або іншими біологічно активними і допоміжними речовинами.
Текст
1. Сполука формули (Iа): X O N Y 2 (19) 1 3 87306 4 е) -CF3, а) сполуку формули (VII): O f) -O-CF3, g) фтор або NH h) хлор; і PG1 O N , (VII) Z означає атом водню. де РG1 означає карбоксилзахисну групу, 3. Сполука за п. 1 або 2 формули (Iа), яка відрізперетворюють на сполуку формули (Iа) за п. 1; няється тим, що вона являє собою сполуку: b) отриману за способом а) сполуку формули (Iа), 3-(6-амінопіридин-3-іл)-2-(1-циклогексил-1Набо придатний попередник формули (Iа), яка(ий) імідазол-4-іл)пропіонова кислота; на основі своєї хімічної структури утворюється в метиловий ефір 3-(6-амінопіридин-3-іл)-2-(1енантіомерних формах, розділяють на чисті енанциклогексил-1Н-імідазол-4-іл)пропіонової кислоти; тіомери шляхом солеутворення з енантіомерно ізопропіловий ефір 3-(6-амінопіридин-3-іл)-2-(1чистими кислотами або основами, шляхом хромациклогексил-1Н-імідазол-4-іл)пропіонової кислоти; тографії при використанні хіральних нерухомих циклопропілметиловий ефір 3-(6-амінопіридин-3фаз або шляхом дериватизації за допомогою хіраіл)-2-(1-циклогексил-1Н-імідазол-4-іл)пропіонової льних енантіомерно чистих сполук, таких як амінокислоти; кислоти, з подальшим розділенням отриманих 2-гідроксіетиловий ефір 3-(6-амінопіридин-3-іл)-2таким чином діастереомерів і відщепленням хіра(1-циклогексил-1Н-імідазол-4-іл)пропіонової кислольних допоміжних груп; або ти; с) отриману за способом а) або b) сполуку форму1-циклогексилоксикарбонілоксіетиловий ефір 3-(6ли (Iа) або виділяють у вільній формі, або, у разі амінопіридин-3-іл)-2-(1-циклогексил-1Н-імідазол-4наявності кислотних або основних груп, перетвоіл)-пропіонової кислоти; рюють на фізіологічно прийнятні солі. 3-(6-амінопіридин-3-іл)-2-[1-(4,45. Лікарський засіб, який відрізняється тим, що диметилциклогексил)-1Н-імідазол-4-іл]пропіонова містить ефективну кількість щонайменше однієї кислота; сполуки формули (Iа) за будь-яким з пп. 1-3 разом етиловий ефір 3-(6-амінопіридин-3-іл)-2-(1з фармацевтично придатним і фізіологічно прийнциклогексил-1Н-імідазол-4-іл)пропіонової кислоти. ятним носієм, домішкою і/або іншими біологічно 4. Спосіб отримання сполуки формули (Iа) за одактивними і допоміжними речовинами. ним або декількома з пп. 1-3, який відрізняється тим, що Винахід стосується нових сполук формули (І), які інгібують фермент TAFIa (активований інгібітор фібринолізу, що активується тромбіном), способу їх отримання і застосування як лікарського засобу. Фермент TAFIa утворюється, наприклад, за рахунок активування тромбіну з зимогену інгібітора фібринолізу, що активується тромбіном (TAFI). Фермент TAFI називають також прокарбоксипептидазою В, прокарбоксипептидазою U або прокарбоксипептидазою R плазми і він являє собою подібний до карбоксипептидази В профермент [L. Bajzar, Arterioscler. Thromb. Vase. Biol., 25112518(2000)]. Під час утворення згустка тромбін генерується як кінцевий продукт каскаду коагуляцій та індукує перетворення розчинного фібрриногену плазми у нерозчинний фібриновий матрикс. Одночасно тромбін активує ендогенний інгібітор фібринолізу TAFI. Активований TAFI (TAFIa), отже, утворюється під час утворення тромбу та лізису з зимогену TAFI під впливом тромбіну, тромбомодулін у комплексі з тромбіном посилює цей ефект приблизно у 1250 разів. TAFIa розщеплює основні С-кінцеві амінокислоти фібринових фрагментів. Втрата Скінцевих лізинів як сайтів зв'язування плазміногену призводить тоді до інгібування фібринолізу. Ефективні інгібітори TAFIa запобігають втраті цих високоафінних лізинових сайтів зв'язування плазміногену і, таким чином, сприяють ендогенному фібринолізу за рахунок плазміну: інгібітори TAFIa діють профібринолітично. Для підтримання гемостазу у крові виникають механізми, які призводять до згортання крові і розчинення згустків; вони знаходяться у рівновазі. Коли порушена рівновага сприяє коагуляції, утворюється фібрин у набагато більших кількостях, так що патологічні процеси тромбоутворення у людини можуть призводити до важких картин хвороби. Точно так само, як надмірна коагуляція може призводити до серйозних, тромботично зумовлених картин хвороби, антитромботична обробка пов'язана з ризиком небажаних кровотеч за рахунок порушення утворення необхідної гемостатичної пробки. Інгібування TAFIa посилює, не впливаючи на коагуляцію і агрегацію тромбоцитів, ендогенний фібриноліз, тобто, порушена рівновага зсувається на користь фібринолізу. Таким чином, можна як протидіяти утворенню клінічно істотного тромбу, так і посилювати лізис вже існуючого згустка. З іншого боку, не погіршується утворення гемостатичної пробки, так що більше не можна очікувати на діатез кровотечі [Воumа та ін., J. Thrombosis and Haemostasis, 1, 1566-1574(2003)]. Інгібітори TAFIa вже описані у Міжнародних заявках WO-03/013526 і WO-03/061653. Інгібітори TAFIa, що пропонуються згідно з винаходом, придатні для профілактичного, а також терапевтичного застосування відносно людини, яка страждає на захворювання, що протікають з тромбозами, емболіями, гіперкоагульованістю або фіброзними змінами. Вони придатні як для екстреної, так і також для довготривалої терапії. 5 87306 6 Винахід відноситься, отже, до сполуки формуd) A3 означає -(СН2)q-(С6-C14)-арил, де арил ли (І): незаміщений або, незалежно один від одного, одно-, дво- або трикратно заміщений за допомогою R1, А4 і А5 мають вказане у п. b) значення, о означає ціле число нуль або 1, p означає ціле число 1 і q означає ціле число нуль, 1, 2 або 3; і/або усіх стереоізомерних форм сполуки фоe) A3 означає -(CH2)r-Het, де Het означає 4-15рмули (І) і/або сумішей цих форм у будь-якому членний гетероцикл і гетероцикл незаміщений співвідношенні і/або фізіологічно прийнятної солі або, незалежно один від одного, одно, дво- або сполуки формули (І), причому трикратно заміщений за допомогою =O або R1, U означає 1) атом водню; 2) -(С1-С6)-алкіл; 3) А4 і А5 мають вказане у п. b) значення, (С3-С6)-циклоалкіл; 4) фтор; 5) -O-CF3 або 6) -CF3; о означає ціле число нуль або 1, X означає залишок формули (II): p означає ціле число 1 і r означає ціле число нуль, 1, 2 або 3; f) A3 означає -(СН2)q-(С6-C14)-арил, де арил незаміщений або, незалежно один від одного, одде но-, дво- або трикратно заміщений за допомогою m означає ціле число нуль або 1; R1, А1 означає 1) -(СН2)n-, де n означає ціле число А4 означає -О-, 1, 2 або 3; або 2) -О-(СН2)n-, де n означає ціле чиА5 означає -(С6-С14)-арил, де арил незаміщесло нуль, 1, 2 або 3; ний або, незалежно один від одного, одно-, двоА2 означає або трикратно заміщений за допомогою R1, 1) 4-15-членний гетероцикл, де гетероцикл міо і p означають ціле число 1 і стить щонайменше один N-атом і заміщений аміq означає ціле число нуль, 1, 2 або 3; ногрупою і додатково, незалежно один від одного, g) -СН(-(С6-С14)-арил)-(С6-C14)-арил; може бути одно-, дво- або трикратно заміщений причому R1 означає (С1-С3)-алкілом, галогеном, -CF3 або O-CF3; a) -(С6-C14)-арил, причому арил незаміщений 2) -(С1-С6)-алкіл-NН2 або або одно-, дво- або трикратно, незалежно один від 3) -(С3-С8)-циклоалкіл-NН2; одного, заміщений -(С1-С6)-алкілом, -(С0-С4)-алкілΥ означає 1) залишок формули (III): (С3-С8)-циклоалкілом, -CF3, =O, -O-CF3 або галогеном, b) 4-15-членний гетероцикл, c) -(С1-С6)-алкіл, причому d) -(С0-С4)-алкіл-(С3-С8)-циклоалкіл, a) A3 означає -(С3-С8)-циклоалкіл або -(С2-С6)e) -CF3, алкінілен, де циклоалкіл або алкінілен незаміщеf) -O-CF3 або ний або, незалежно один від одного, одно-, двоg) галоген; або трикратно заміщений за допомогою -O-R10 причому R2 означає: або R1, a) -(С6-С14)-арил, де арил незаміщений або А4 означає -N(R2)2-, де R2 має нижчевказане одно-, дво- або трикратно, незалежно один від значення і значення обох залишків R2 є незалежодного, заміщений за допомогою R1, ним один від одного, b) -(С1-С6)-алкіл, де алкіл незаміщений або, А5 відсутній, о означає ціле число нуль або 1 і незалежно один від одного, одно-, дво- або триR10 означає атом водню, -(С1-С6)-алкіл або -(С6кратно заміщений за допомогою R1, С14)-арил; c) -(С3-С8)-циклоалкіл, де циклоалкіл незаміb) A3 означає -(С3-С8)-циклоалкіл, де циклоалщений або. незалежно один від одного, одно-, двокіл незаміщений або, незалежно один від одного, або трикратно заміщений за допомогою R1, одно-, дво- або трикратно заміщений за допомоd) -CF3 або гою -O-R10 або R1, e) атом водню; А4 означає -N(R2)- і причому R3, R6 і R7 є однаковими або різними А5 означає а)1) -C(O)-R3; а)2) -C(O)-N(R4)-R5; і, a)3) -(SO2)-R6 або а)4) -С(О)-O-R7; незалежно один від одного, означають: о означає ціле число 1 і p означає ціле число a) -(С1-С6)-алкіл, де алкіл незаміщений або, 1; незалежно один від одного, одно-, дво- або триc) A3 означає циклічний амін з 3-8 атомами у кратно заміщений за допомогою R1, циклі, де циклічний амін незаміщений або, незаb) -(С6-С14)-арил, де арил незаміщений або, лежно один від одного, одно-, дво- або трикратно незалежно один від одного, одно-, дво- або тризаміщений за допомогою R1, кратно заміщений за допомогою R1, А4 і А5 мають вказане у п. b) значення, причоc) 4-15-членний гетероцикл, де гетероцикл нему заміщений або, незалежно один від одного, одно-, А5 зв'язаний з N-атомом A3, дво- або трикратно заміщений за допомогою R1, о означає ціле число нуль і d) -(С3-С8)- циклоалкіл, де циклоалкіл незаміp означає ціле число нуль або 1; або щений або, незалежно один від одного, одно-, двоабо трикратно заміщений за допомогою R1, 7 87306 8 e) атом водню; 4) -(С0-С3)-алкіл-Неt, де Het незаміщений або, причому R4 і R5 є однаковими або різними і, незалежно один від одного, одно-, дво- або тринезалежно один від одного, означають: кратно заміщений за допомогою R1; і a) -(С1-С6)-алкіл або -(С2-С10)-алкеніл, де алкіл R13 означає 1) -(С0-С3)-алкіл-(С6-С14)-арил, де алкіл і арил, або алкеніл незаміщений або, незалежно один від відповідно, незаміщені або, незалежно один від одного, одно-, дво- або трикратно заміщений за одного, одно-, дво- або трикратно заміщені за додопомогою R1, помогою R1, або b) -(С6-С14)-арил, де арил незаміщений або, 2) -(С0-С3)-алкіл-Неt, де алкіл і Het, відповідно, незалежно один від одного, одно-, дво- або тринезаміщені або, незалежно один від одного, одно-, кратно заміщений за допомогою R1, дво- або трикратно заміщені за допомогою R1; c) 4-15-членний гетероцикл, де гетероцикл непричому у випадку b): заміщений або, незалежно один від одного, одно-, R12 означає дво- або трикратно заміщений за допомогою R1, 1) атом водню, d) -(С3-С8)-циклоалкіл, де циклоалкіл незамі2) -(С1-С6)-алкіл, де алкіл незаміщений або, щений або, незалежно один від одного, одно-, двонезалежно один від одного, одно-, дво- або триабо трикратно заміщений за допомогою R1, або кратно заміщений за допомогою R1, e) атом водню, або 3) -(С0-С3)-алкіл-(С6-С14)-арил, де арил незаR4 і R5 разом з атомом азоту, з яким вони зв'язані, утворюють 3-8-членний цикл, який додатміщений або, незалежно один від одного, одно-, ково до атома азоту може містити ще аж до двох дво- або трикратно заміщений за допомогою R1, додаткових гетероатомів з ряду, що включає киабо сень, сірку або азот; 4) -(С0-С3)-алкіл-Het, де Het незаміщений або, Υ означає 2) залишок формули (IV): незалежно один від одного, одно-, дво- або трикратно заміщений за допомогою R1; і R13 означає CH(R8)-R9, причому R8 і R9, незалежно один від одного, означають -(С6-С14)-арил або Het, де Het і арил, відповідно, незаміщені або, незалежно один від одного, одно-, дво- або трикратно заміщені -О-(С1-С4)-алкілом або R1, і R16, R17, R18 і R19 є однаковими або різними причому R8 означає і, незалежно один від одного, означають а) -(С1-С6)-алкіл, де алкіл незаміщений або, 1) атом водню, незалежно один від одного, одно-, дво- або три2) -(С1-С6)-алкіл, де алкіл незаміщений або, кратно заміщений за допомогою R1, незалежно один від одного, одно-або двократно b) -(C6-C14)- арил, де арил незаміщений або, заміщений за допомогою R1, незалежно один від одного, одно-, дво- або три3) галоген, кратно заміщений за допомогою R1, 4) -ОН, c) 4-15-членний гетероцикл, де гетероцикл не5) -NH2, заміщений або, незалежно один від одного, одно-, 6) -(С0-С3)-алкіл-(С6-С14)-арил, де алкіл і арил, дво- або трикратно заміщений за допомогою R1, відповідно, незаміщені або, незалежно один від d) -(С3-С8)-циклоалкіл, де циклоалкіл незаміодного, одно-, дво- або трикратно заміщені за дощений або, незалежно один від одного, одно-, двопомогою R1, або або трикратно заміщений за допомогою R1, або 7) -(С0-С3)-алкіл-Het, де алкіл і Het, відповідно, e) атом водню; незаміщені або, незалежно один від одного, одно-, Υ означає 3) залишок формули (V): дво- або трикратно заміщені за допомогою R1, або R16 і R17 або R18 і R19 разом з атомом вуглецю, з яким вони, відповідно, зв'язані, утворюють 3-8-членний цикл; або Υ означає 4) залишок формули (VI): причому у випадку а): R12 означає 1) -(С1-С6)-алкіл, де алкіл незаміщений або, незалежно один від одного, одно-, дво- або трикратно заміщений за допомогою R1, 2) -(С0-С3)-алкіл-(С3-С6)-циклоалкіл, де циклоалкіл незаміщений або, незалежно один від одного, одно-, дво- або трикратно заміщений за допомогою R1, 3) -(С0-С3)-алкіл-(С6-С14)-арил, де арил незаміщений або, незалежно один від одного, одно-, дво- або трикратно заміщений за допомогою R1, або причому R24 і R25 є однаковими або різними і, незалежно один від одного, означають 1) атом водню, 2) -(С1-С6)-алкіл, де алкіл незаміщений або, незалежно один від одного, одноабо двократно заміщений за допомогою R1, 3) -(С0-С3)-алкіл-(С6-С14)-арил, де алкіл і арил, відповідно, незаміщені або, незалежно один від 9 87306 10 одного, одно-, дво- або трикратно заміщені за дозолілу, 1Н-індазолілу, індолінілу, індолізинілу, помогою R1, або індолілу, 3H-індолілу, ізобензофуранілу, ізохрома4) -(С0-С3)-алкіл-Het, де алкіл і Het, відповідно, нілу, ізоіндазолілу, ізоіндолінілу, ізоіндолілу, ізохінезаміщені або, незалежно один від одного, одно-, нолінілу (бензімідазоліл), ізотіазолідинілу, 2дво- або трикратно заміщені за допомогою R1, або ізотіазолінілу, ізотіазолілу, ізоксазолілу, ізоксазо5) -(С0-С3)-алкіл-(С3-С6)-циклоалкіл, або лідинілу, 2-ізоксазолінілу, морфолінілу, нафтириR24 і R25 разом з атомом азоту, з яким вони динілу, октагідроізохінолінілу, оксадіазолілу, 1,2,3зв'язані, утворюють 3-8-членний цикл, який додатоксадіазолілу, 1,2,4-оксадіазолілу, 1,2,5ково до атома азоту може містити ще аж до двох оксадіазолілу, 1,3,4-оксадіазолілу, оксазолідинілу, додаткових гетероатомів з ряду, що включає киоксазолілу, піримідинілу, фенантридинілу, фенансень, сірку або азот; тролінілу, феназинілу, фенотіазинілу, феноксатііR26, R27, R28 і R29 є однаковими або різними нілу, феноксазинілу, фталазинілу, піперазинілу, і, незалежно один від одного, означають піперидинілу, птеридинілу, пуринілу, піранілу, пі1) атом водню, разинілу, піроазолідинілу, піразолінілу, піразолілу, 2) -(С1-С6)-алкіл, де алкіл незаміщений або піридазинілу, піридооксазолілу, піридоімідазолілу, одно- або двократно заміщений за допомогою R1, піридотіазолілу, піридотіофенілу, піридинілу, піри3) галоген, дилу, піримідинілу, піролідинілу, піролінілу, 2Н4) -ОН, піролілу, піролілу, тетрагідроізохінолінілу, тетрагі5) -NH2, дрохінолінілу, тетрагідропіридинілу, 6Н-1,2,56) -(С0-С3)-алкіл-(С6-С14)-арил, де алкіл і арил, тіадазинілу, 1,2,4-тіадіазолілу, 1,2,5-тіадіазолілу, відповідно, незаміщені або, незалежно один від 1,3,4-тіадіазолілу, тіантренілу, тіазолілу, тієнотіаодного, одно-, дво- або трикратно заміщені за дозолілу, тієнооксазолілу, тієноімідазолілу, тіоморпомогою R1, або фолінілу, триазинілу, 1,2,3-триазолілу, 1,2,47) -(С0-С3)-алкіл-Het, де алкіл і Het, відповідно, триазолілу, 1,2,5-триазолілу, 1,3,4-триазолілу і незаміщені або, незалежно один від одного, одно-, ксантенілу, і де гетероцикл заміщений аміногрудво- або трикратно заміщені за допомогою R1, або пою і, незалежно один від одного, може бути доR26 і R27 або R28 і R29 разом з атомом вугдатково одно-, дво- або трикратно заміщений -(С1С3)-алкілом, галогеном, -CF3 або -O-CF3; лецю, з яким вони, відповідно, зв'язані, утворюють 3-8-членний цикл; Ζ означає 2) -(С1-С6)-алкіл-NH2 або 3) -(С3-С8)-циклоалкіл-NH2; 1) атом водню, 2) -(С1-С6)-алкіл, Υ означає 1) залишок формули (III), причому 3)-(С1-С6)-алкіл-ОН, a) A3 означає -(С3-С8)-циклоалкіл або -(С2-С6)4) -(С0-С4)-алкіл-(С3-С6)-циклоалкіл, алкінілен, де циклоалкіл або алкінілен незаміще5) -(С1-С10)-алкіл-О-С(О)-О-R1, ний або, незалежно один від одного, одно-, дво6) -(СН2)r-алкіл-(С6-С14)-арил, де арил незаміабо трикратно заміщений за допомогою R1, щений або, незалежно один від одного, одно-, двоА4 означає -N(R2)2-, де R2 має нижчевказане значення і значення обох залишків R2 є незалежабо трикратно заміщений за допомогою R1 і r ним одне від одного, означає ціле число нуль, 1, 2 або 3, або А5 відсутній і 7) -(CH2)s-Het, де Het незаміщений або, незао означає ціле число нуль або 1; лежно один від одного, одно-, дво- або трикратно b) A3 означає -(С3-С8)-циклоалкіл, де циклоалзаміщений за допомогою R1 і s означає ціле число кіл незаміщений або, незалежно один від одного, нуль, 1, 2 або 3. одно-, дво- або трикратно заміщений за допомоПодальшим об'єктом винаходу є сполука фогою R1, рмули (Іа): А4 означає -N(R2)- і А5 означає а)1) -C(O)-R3; а)2) -C(O)-N(R4)-R5; a)3) -(SO2)-R6 або а)4) -С(О)-O-R7; о означає ціле число 1 і p означає ціле число 1; c) A3 означає циклічний амін з групи, яка склапричому дається з пропіламіну, азетидину, піролідину, піU означає 1) атом водню; 2) -(С1-С6)-алкіл; 3) перидину, азепану або азокану, де циклічний амін (С3-С6)-циклоалкіл; 4) фтор; 5) -O-CF3 або 6) CF3; незаміщений або, незалежно один від одного, одX означає залишок формули (II), де но-, дво- або трикратно заміщений за допомогою Μ означає ціле число нуль або 1; R1, А1 означає 1) -(СН2)n-, де n означає ціле число А4 і А5 мають вказане у п. b) значення, причо1, 2 або 3; або 2) -(СН2)n-, де n означає ціле число му нуль, 1, 2 або 3; А5 зв'язаний з N-атомом A3, А2 означає о означає ціле число нуль і 1) 4-15-членний гетероцикл, де гетероцикл виp означає ціле число нуль або 1; або бирають з групи, яка складається з акридинілу, d) A3 означає -(СН2)q-(С6-C14)-арил, де арил азепінілу, азетидинілу, азиридинілу, бензімідазалівибирають з групи, яка складається з фенілу, нафнілу, бензімідазолілу, карболінілу, хіназолінілу, тилу, антрилу або флуоренілу, і незаміщений або, хінолінілу, 4Н-хінолізинілу, хіноксалинілу, хінуклінезалежно один від одного, одно-, дво- або тридинілу, хроманілу, хроменілу, цинолінілу, декагідкратно заміщений за допомогою R1, рохінолінілу, імідазолідинілу, імідазолінілу, імідаА4 і А5 мають вказане у п. b) значення, 11 87306 12 о означає ціле число нуль або 1, причому R4 і R5 є однаковими або різними і, p означає ціле число 1 і незалежно один від одного, означають: q означає ціле число нуль, 1, 2 або 3; a) -(С1-С6)-алкіл або -(С2-С10)-алкеніл, де алкіл e) A3 означає -(CH2)r-Het, де Het має вищезгаабо алкеніл незаміщений або, незалежно один від одного, одно-, дво- або трикратно заміщений за дане значення і незаміщений або, незалежно один допомогою R1, від одного, одно, дво- або трикратно заміщений за b) -(С6-С14)-арил, де арил має вищезгадане допомогою =O або R1, значення і незаміщений або, незалежно один від А4 і А5 мають вказане у п. b) значення, одного, одно-, дво- або трикратно заміщений за о означає ціле число нуль або 1, допомогою R1, p означає ціле число 1 і c) 4-15-членний гетероцикл, де гетероцикл має r означає ціле число нуль, 1, 2 або 3; вищезгадане значення і незаміщений або, незаf) A3 означає -(СН2)q-(С6-C14)-арил, де арил лежно один від одного, одно-, дво- або трикратно незаміщений або, незалежно один від одного, одзаміщений за допомогою R1, но-, дво- або трикратно заміщений за допомогою d) -(С3-С8)-циклоалкіл, де циклоалкіл незаміR1, щений або, незалежно один від одного, одно-, двоА4 означає -О-, або трикратно заміщений за допомогою R1, або А5 означає -(С6-С14)-арил, де арил незаміщеe) атом водню, або ний або, незалежно один від одного, одно-, двоабо трикратно заміщений за допомогою R1, R4 і R5 разом з атомом азоту, з яким вони о і p означають ціле число 1 і зв'язані, утворюють 3-8-членний цикл, вибираний з групи, яка складається з пропіламіну, азетидину, q означає ціле число нуль, 1, 2 або 3; піролідину, піперидину, азепану, азокану, азепіну, g) -СН(феніл)феніл; 1,2діоксазолу, діоксазину, 1,4-діазепану, причому R1 означає діазепуну, 1,3-діазепіну, 1,4-діазепіну, імідазолу, a) -(С6-С14)-арил, де арил має вищезгадане імідазоліну, імідазолідину, ізотіазолу, ізотіазолідизначення і причому арил незаміщений або одно-, ну, ізотіазоліну, ізоксазолу, ізоксазоліну, ізоксазодво- або трикратно, незалежно один від одного, лідину, 2-ізоксазоліну, кетопіперазину, морфоліну, заміщений -(С1-С6)-алкілом, -(С0-С4)-алкіл-(С3-С8)циклоалкілом, -CF3, =O, -O-CF3 або галогеном, [1,4]оксазепану, оксазолу, піперазину, піразину, піразолу, піразоліну, піразолідину, піридазину, піb) 4-15-членний гетероцикл, де гетероцикл ридину, піримідину, піролу, піролідинону, піроліну, має вищезгадане значення, тетрагідропіридину, тіазолу, тіадіазолу, тіазолідиc) -(С1-С6)-алкіл, d) -(С3-С8)-циклоалкіл, ну, тіазоліну, тіоморфоліну, 1,2,3-триазину, 1,2,4триазину, 1,3,5-триазину, 1,2,3-триазолу або 1,2,4e) -CF3, f) -O-CF3 або триазолу; Υ означає 2) залишок формули (IV), причому g)галоген; формулі (IV) відповідає сполука, вибрана з групи, причому R2 означає: яка складається з азетидин-2-ону, піролідин-2-ону, a) -(С6-C14)-арил, де арил має вищезгадане піперидин-2-ону, азепан-2-ону та азокан-2-ону, і значення і незаміщений або одно-, дво- або трияке у атома азоту, відповідно, заміщено за допократно, незалежно один від одного, заміщений за могою R8, допомогою R1, причому R8 означає b) -(С1-С6)-алкіл, де алкіл незаміщений або, a) -(С1-С6)-алкіл, де алкіл незаміщений або, незалежно один від одного, одно-, дво- або тринезалежно один від одного, одно-, дво- або трикратно заміщений за допомогою R1, кратно заміщений за допомогою R1, c) -(С3-С8)-циклоалкіл, де циклоалкіл незаміb) -(С6-С14)-арил, де арил має вищезгадане щений або, незалежно один від одного, одно-, двоабо трикратно заміщений за допомогою R1, значення і незаміщений або, незалежно один від d) -CF3 або одного, одно-, дво- або трикратно заміщений за e) атом водню; допомогою R1, причому R3, R6 і R7 є однаковими або різними c) 4-15-членний гетероцикл, де гетероцикл має і, вищезгадане значення і незаміщений або, незанезалежно один від одного, означають: лежно один від одного, одно-, дво- або трикратно a) -(С1-С6)-алкіл, де алкіл незаміщений або, заміщений за допомогою R1, незалежно один від одного, одно-, дво- або триd) -(С3-С8)-циклоалкіл, де циклоалкіл незамікратно заміщений за допомогою R1, щений або, незалежно один від одного, одно-, двоb) -(С6-С14)-арил, де арил має вищезгадане або трикратно заміщений за допомогою R1, або значення і незаміщений або, незалежно один від e) атом водню; Υ означає 3) залишок формули (V), одного, одно-, дво- або трикратно заміщений за причому у випадку а): допомогою R1, c) 4-15-членний гетероцикл, де гетероцикл має R12 означає вищезгадане значення і незаміщений або, неза1) -(С1-С6)-алкіл, де алкіл незаміщений або, незалежно один від одного, одно-, дво- або трилежно один від одного, одно-, дво- або трикратно кратно заміщений за допомогою R1, заміщений за допомогою R1, 2) -(С0-С3)-алкіл-(С3-С6)-циклоалкіл, де циклоd) -(С3-С8)-циклоалкіл, де циклоалкіл незаміщений або, незалежно один від одного, одно-, двоалкіл незаміщений або, незалежно один від одноабо трикратно заміщений за допомогою R1, або го, одно-, дво- або трикратно заміщений за допоe) атом водню; могою R1, 13 87306 14 щені або, незалежно один від одного, одно-, дво3) -(С0-С3)-алкіл-(С6-С14)-арил, де арил має або трикратно заміщені за допомогою R1, або вищезгадане значення і незаміщений або, неза4) -(С0-С3)-алкіл-Het, де алкіл і Het мають вилежно один від одного, одно-, дво- або трикратно заміщений за допомогою R1, або щезгадані значення і, відповідно, незаміщені або, незалежно один від одного, одно-, дво- або три4) -(С0-С3)-алкіл-Het, де Het має вищезгадане кратно заміщені за допомогою R1, або значення і незаміщений або, незалежно один від одного, одно-, дво- або трикратно заміщений за 5) -(С0-С3)-алкіл-(С3-С6)-циклоалкіл, або допомогою R1; і R24 і R25 разом з атомом азоту, з яким вони R13 означає зв'язані, утворюють 3-8-членний цикл, вибираний з 1) -(С0-С3)-алкіл-(С6-С14)-арил, де алкіл і арил групи, яка складається з пропіламіну, азетидину, піролідину, піперидину, азепану, азокану, азепіну, мають вищезгадані значення і, відповідно, незамідіоксазолу, діоксазину, 1,4-діазепану, 1,2щені або, незалежно один від одного, одно-, дводіазепіну, 1,3-діазепіну, 1,4-діазепіну, імідазолу, або трикратно заміщені за допомогою R1, або імідазоліну, імідазолідину, ізотіазолу, ізотіазоліди2) -(С0-С3)-алкіл-Het, де алкіл і Het мають вину, ізотіазоліну, ізоксазолу, ізоксазоліну, ізоксазощезгадані значення і, відповідно, незаміщені або, лідину, 2-ізоксазоліну, кетопіперазину, морфоліну, незалежно один від одного, одно-, дво- або три[1,4]оксазепану, оксазолу, піперазину, піразину, кратно заміщені за допомогою R1; або піразолу, піразоліну, піразолідину, піридазину, піу випадку b): ридину, піримідину, піролу, піролідинону, піроліну, R12 означає тетрагідропіридину, тіазолу, тіадіазолу, тіазоліди1) атом водню, 2) -(С1-С6)-алкіл, де алкіл незаміщений або, ну, тіазоліну, тіоморфоліну, 1,2,3-триазину, 1,2,4незалежно один від одного, одно-, дво- або тритриазину, 1,3,5-триазину, 1,2,3-триазолу або 1,2,4кратно заміщений за допомогою R1, триазолу; 3) -(С0-С3)-алкіл-(С6-С14)-арил, де арил незаR26, R27, R28 і R29 є однаковими або різними і, незалежно один від одного, означають міщений або, незалежно один від одного, одно-, 1) атом водню, дво- або трикратно заміщений за допомогою R1, 2) -(С1-С6)-алкіл, де алкіл незаміщений або або одно- або двократно заміщений за допомогою R1, 4) -(С0-С3)-алкіл-Het, де Het незаміщений або, 3) галоген, незалежно один від одного, одно-, дво- або три4) -ОН, кратно заміщений за допомогою R1; і 5) -NH2, R13 означає CH(R8)-R9, причому R8 і R9, не6) -(С0-С3)-алкіл-(С6-С14)-арил, де алкіл і арил залежно один від одного, означають -(С6-С14)-арил або Het, де Het і арил, відповідно, мають вищезгамають вищезгадані значення і, відповідно, незамідані значення і незаміщені або, незалежно один щені або, незалежно один від одного, одно-, двовід одного, одно-, дво- або трикратно заміщені -Оабо трикратно заміщені за допомогою R1, або 7) -(С0-С3)-алкіл-Het, де алкіл і Het мають ви(С1-С4)-алкілом або R1, і R16, R17, R18 і R19 є однаковими або різними щезгадані значення і, відповідно, незаміщені або, незалежно один від одного, одно-, дво- або триі, незалежно один від одного, означають кратно заміщені за допомогою R1, або 1) атом водню, 2) -(С1-С6)-алкіл, де алкіл незаміщений або R26 і R27 або R28 і R29 разом з атомом вугодно- або двократно заміщений за допомогою R1, лецю, з яким вони, відповідно, зв'язані, утворюють 3-6-членний цикл, вибираний з групи, яка склада3) галоген, ється з циклопропілу, циклобутилу, циклопентилу 4) -ОН, 5) -NH2, або циклогексану; 6) -(С0-С3)-алкіл-(С6-С14)-арил, де алкіл і арил Ζ означає 1) атом водню, мають вищезгадані значення і, відповідно, незамі2) -(С1-С6)-алкіл, щені або, незалежно один від одного, одно-, дво3) -(С3-С6)-циклоалкіл, або трикратно заміщені за допомогою R1, або 4) -(С1-С10)-алкіл-О-С(О)-О-R1, 7) -(С0-С3)-алкіл-Het, де алкіл і Het мають ви5) -(СН2)r-алкіл-(С6-С14)-арил, де арил має вищезгадані значення і, відповідно, незаміщені або, щезгадане значення і незаміщений або, незалежнезалежно один від одного, одно-, дво- або трино один від одного, одно-, дво- або трикратно закратно заміщені за допомогою R1, або міщений за допомогою R1 і r означає ціле число R16 і R17 або R18 і R19 разом з атомом вугнуль, 1, 2 або 3, або лецю, з яким вони, відповідно, зв'язані, утворюють 6) -(CH2)s-Het, де Het має вищезгадане зна3-6-членний цикл, вибираний з групи, яка складачення і незаміщений або, незалежно один від одється з циклопропілу, циклобутилу, циклопентилу або циклогексилу; або ного, одно-, дво- або трикратно заміщений за доΥ означає 4) залишок формули (VI), причому помогою R1 і s означає ціле число нуль, 1, 2 або 3. R24 і R25 є однаковими або різними і, незалеПодальшим об'єктом винаходу є сполука фожно один від одного, означають рмули (Іа), причому 1) атом водню, U означає атом водню, CF3, фтор або СН3; 2) -(С1-С6)-алкіл, де алкіл незаміщений або X означає залишок формули (II), де одно- або двократно заміщений за допомогою R1, Μ означає ціле число 1; 3) -(С0-С3)-алкіл-(С6-С14)-арил, де алкіл і арил А1 означає 1) -(СН2)-, 2) -О-(СН2)n-, де n ознамають вищезгадані значення і, відповідно, незамічає ціле число нуль або 1, або 3) ковалентний зв'язок; 15 87306 16 причому R1 означає А2 означає 1) амінопіридил, де амінопіридил незаміщений a) феніл, причому феніл незаміщений або одабо, незалежно один від одного, одно-, дво- або но-, дво- або трикратно, незалежно один від однотрикратно заміщений -(С1-С3)-алкілом, галогеном го, заміщений -(С1-С4)-алкілом, b) триазоліл або піридиніл, або -СН3; 2) амінотіазоліл, де амінотіазоліл незаміщений c) -(С1-С4)-алкіл, або, незалежно один від одного, одно-, дво- або d) -(С3-С6)-циклоалкіл, e) -CF3, трикратно заміщений -(С1-С3)-алкілом, галогеном f) -O-CF3, або СН3; 3) -(С1-С3)-алкіл-NH2, або g) фтор або h) хлор; 4) -(С3-Са)-циклоалкіл-NH2; Υ означає 1) залишок формули (III), причому причому R2 означає: a) A3 означає -(С3-С8)-циклоалкіл або -(С2-С6)a) феніл, де феніл незаміщений або одно-, алкінілен, де циклоалкіл або алкінілен незаміщедво- або трикратно, незалежно один від одного, ний або, незалежно один від одного, одно-, двозаміщений за допомогою R1, або трикратно заміщений за допомогою O-R10 або b) -(С1-С3)-алкіл, де алкіл незаміщений або, R1, незалежно один від одного, одно-, дво- або триА4 означає -N(R2)2-, де R2 має нижчевказане кратно заміщений за допомогою R1, c) -(С3-С8)-циклоалкіл, де циклоалкіл незамізначення і значення обох залишків R2 є незалежщений або, незалежно один від одного, одно-, двоним один від одного, або трикратно заміщений за допомогою R1, А5 відсутній, о означає ціле число нуль або 1 і d) -CF3 або R10 означає атом водню, -(С1-С6)-алкіл або феніл; b) A3 означає -(С3-С6)-циклоалкіл, де циклоалe) атом водню; кіл незаміщений або, незалежно один від одного, причому R3, R6 і R7 є однаковими або різними одно-, дво- або трикратно заміщений за допомоі, гою -O-R10 або R1, незалежно один від одного, означають: А4 означає -N(R2)- і a) -(С1-С6)-алкіл, де алкіл незаміщений або, А5 означає а)1) -C(O)-R3; a)2) -C(O)-N(R4)-R5; незалежно один від одного, одно-, дво- або трикратно заміщений за допомогою R1, a)3) -(SO2)-R6 або а)4) -С(О)-O-R7; о означає ціле число 1 і b) -(С6-C14)-арил, де арил незаміщений або, p означає ціле число 1; незалежно один від одного, одно-, дво- або триc) A3 означає циклічний амін з 3-8 атомами у кратно заміщений за допомогою R1, циклі, де циклічний амін незаміщений або, незаc) 4-15-членний гетероцикл, де гетероцикл нележно один від одного, одно-, дво- або трикратно заміщений або, незалежно один від одного, одно-, заміщений за допомогою R1, дво- або трикратно заміщений за допомогою R1, А4 і А5 мають вказане у п. b) значення, причоd) -(С3-С8)-циклоалкіл, де циклоалкіл незаміщений або, незалежно один від одного, одно-, двому або трикратно заміщений за допомогою R1, або А5 зв'язаний з N-атомом A3, о означає ціле число нуль і e) атом водню; p означає ціле число нуль або 1; або причому R4 і R5 є однаковими або різними і, d) A3 означає -(СН2)q-(С6-Н14)-арил, де арил незалежно один від одного, означають: a) -(С1-С6)-алкіл або -(С2-С10)-алкеніл, де алкіл незаміщений або, незалежно один від одного, одабо алкеніл незаміщений або, незалежно один від но-, дво- або трикратно заміщений за допомогою одного, одно-, дво- або трикратно заміщений за R1, допомогою R1, А4 і А5 мають вказане у п. b) значення, b) -(С6-С14)-арил, де арил незаміщений або, о означає ціле число нуль або 1, незалежно один від одного, одно-, дво- або триp означає ціле число 1 і кратно заміщений за допомогою R1, q означає ціле число нуль, 1, 2 або 3; c) 4-15-членний гетероцикл, де гетероцикл неe) A3 означає -(CH2)r-Het, де Het означає пірозаміщений або, незалежно один від одного, одно-, лідин, бензотіофен або піперидин, який незаміщедво- або трикратно заміщений за допомогою R1, ний або, незалежно один від одного, одно-, двоd) -(С3-С8)-циклоалкіл, де циклоалкіл незаміабо трикратно заміщений за допомогою =O або щений або, незалежно один від одного, одно-, двоR1, або трикратно заміщений за допомогою R1, або А4 і А5 мають вказане у п. b) значення, e) атом водню, або о означає ціле число нуль або 1, R4 і R5 разом з атомом азоту, з яким вони p означає ціле число 1 і зв'язані, утворюють цикл, що походить від азетиr означає ціле число нуль, 1, 2 або 3; дину. піролідину, піперидину, азепану, азокану, f) A3 означає -(СН2)q-феніл, де феніл незаміщений або, незалежно один від одного, одно-, двоазепіну, діоксазолу, діоксазину, 1,4-діазепану, 1,2або трикратно заміщений за допомогою R1, діазепіну, 1,3-діазепіну, 1,4-діазепіну, імідазолу, імідазоліну, імідазолідину, ізотіазолу, ізотіазолідиА4 означає -О-, А5 означає феніл, де феніл незаміщений або, ну, ізотіазоліну, ізоксазолу, ізоксазоліну, ізоксазонезалежно один від одного, одно-, дво- або трилідину, 2-ізоксазоліну, кетопіперазину, морфоліну, кратно заміщений за допомогою R1, [1,4]оксазепану, оксазолу, піперазину, піразину, о і p означають ціле число 1 і піразолу, піразоліну, піразолідину, піридазину, піридину, піримідину, піролу, піролідинону, піроліну, q означає ціле число 1 або 2; 17 87306 18 тетрагідропіридину, тіазолу, тіадіазолу, тіазоліди3) фтор, ну, тіазоліну, тіоморфоліну, 1,2,3-триазину, 1,2,44) -ОН, триазину, 1,3,5-триазину, 1,2,3-триазолу або 1,2,45) -NH2 або триазолу; 6) -(С0-С3)-алкілфеніл, де алкіл і феніл, відпоΥ означає 2) залишок формули (IV), вибираний відно, незаміщені або, незалежно один від одного, з групи, яка складається з азетидин-2-ону, піроліодно-, дво- або трикратно заміщені за допомогою дин-2-ону або піперидин-2-ону, причому залишок R1; може бути заміщений біля атома азоту за допомоабо гою R8, Υ означає 4) залишок формули (VI), причому причому R8 означає R24 і R25 є однаковими або різними і, незалеa) -(С1-С6)-алкіл, де алкіл незаміщений або, жно один від одного, означають незалежно один від одного, одно-, дво- або три1) атом водню, кратно заміщений за допомогою R1, 2) -(С1-С6)-алкіл, де алкіл незаміщений або b) феніл, де феніл незаміщений або, незалежодно- або двократно заміщений за допомогою R1, 3) -(С0-С3)-алкілфеніл, де алкіл і феніл, відпоно один від одного, одно-, дво-або трикратно завідно, незаміщені або, незалежно один від одного, міщений за допомогою R1, одно-, дво- або трикратно заміщені за допомогою c) атом водню, або R1, або d) -(С3-С8)-циклоалкіл, де циклоалкіл незамі4) -(С0-С3)-алкіл-(С3-С6)-циклоалкіл, або щений або, незалежно один від одного, одно-, двоR26, R27, R28 і R29 є однаковими або різними або трикратно заміщений за допомогою R1; і, незалежно один від одного, означають Υ означає 3) залишок формули (V), 1) атом водню, причому у випадку а): 2) -(С1-С3)-алкіл, де алкіл незаміщений або R12 означає одно- або двократно заміщений за допомогою R1, 1) -(С1-Сб)-алкіл, де алкіл незаміщений або, 3) фтор, незалежно один від одного, одно-, дво- або три4) -ОН, кратно заміщений за допомогою R1, 5) -NH2 або 2) -(С0-С3)-алкіл-(С3-С6)-циклоалкіл, де цикло6) -(С0-С3)-алкілфеніл, де алкіл і феніл, відпоалкіл незаміщений або, незалежно один від одного, одно-, дво- або трикратно заміщений за доповідно, незаміщені або, незалежно один від одного, могою R1, одно-, дво- або трикратно заміщені за допомогою 3) -(С0-С3)-алкілфеніл, де феніл незаміщений R1; або, незалежно один від одного, одно-, дво- або і трикратно заміщений за допомогою R1; і Ζ означає атом водню або -(С1-С4)-алкіл. Подальшим об'єктом винаходу є сполука фоR13 означає рмули (Іа), причому 1) -(С0-С3)-алкілфеніл, де алкіл і феніл, відпоU означає атом водню; відно, незаміщені або, незалежно один від одного, X означає залишок формули (II), де одно-, дво- або трикратно заміщені за допомогою m означає ціле число 1; R1, або 2) -(С0-С3)-алкілпіридил, де алкіл і піридил, А1 означає -СН2-; А2 означає амінопіридил, де амінопіридил невідповідно, незаміщені або, незалежно один від заміщений або, одного, одно-, дво- або трикратно заміщені за донезалежно один від одного, одно-, дво- або помогою R1; або у випадку b): трикратно заміщений галогеном або -СН3; Υ означає 1) залишок формули (III), причому R12 означає a) A3 означає -(С3-С8)-циклоалкіл, де циклоал1) атом водню, кіл незаміщений або, незалежно один від одного, 2) -(С1-С6)-алкіл, де алкіл незаміщений або, незалежно один від одного, одно-, дво- або триодно-, дво- або трикратно заміщений за допомократно заміщений за допомогою R1, гою R1, і 3) -(С0-С3)-алкілфеніл, де феніл незаміщений А4 і А5 відсутні; або, незалежно один від одного, одно-, дво- або b) A3 означає -(С2-С4)-алкінілен, де алкінілен незаміщений або, незалежно один від одного, одтрикратно заміщений за допомогою R1, або но-, дво- або трикратно заміщений за допомогою 4) -(С0-С3)-алкілпіридил, де алкіл і піридил, R1, і відповідно, незаміщені або, незалежно один від одного, одно-, дво- або трикратно заміщені за доА4 і А5 відсутні; помогою R1; і c) A3 означає циклічний амін з 3-8 атомами у R13 означає -CH(R8)-R9, причому R8 і R9, нециклі, де циклічний амін незаміщений або, незазалежно один від одного, означають феніл або лежно один від одного, одно-, дво- або трикратно піридил, де феніл або піридил, відповідно, незазаміщений за допомогою R1, і міщені або, незалежно один від одного, одно-, двоА4 і А5 відсутні; або трикратно заміщені -О-(С1-С4)-алкілом або R1, d) A3 означає -(СН2)q-фешл, де феніл незаміі щений або, незалежно один від одного, одно-, двоабо трикратно заміщений за допомогою R1, R16, R17, R18 і R19 є однаковими або різними А4 означає -N(R2)-, де R2 має нижчевказане і, незалежно один від одного, означають 1) атом водню, значення, 2) -(С1-С3)-алкіл, де алкіл незаміщений або А5 означає а)1) -C(O)-R3; a)2) -C(O)-N(R4)-R5; a)3) -(SO2)-R6; або а)4) -С(О)-O-R7; одно- або двократно заміщений за допомогою R1, 19 87306 20 b) феніл, де феніл незаміщений або, незалежо означає ціле число 1, p означає ціле число 1 і но один від одного, одно-, дво-або трикратно заміщений за допомогою R1, або q означає ціле число нуль, 1 або 2; c) -(С3-С6)-циклоалкіл, де циклоалкіл незаміe) A3 означає -(CH2)r-Het, де Het означає піролідин або піперидин, який незаміщений або, незащений або, незалежно один від одного, одно-, дволежно одинвід одного, одно-, дво- або трикратно або трикратно заміщений за допомогою R1; Υ означає 3) залишок формули (V), причому заміщений за допомогою R1, А4 відсутній і А5 має вказане у п. d) значення, R12 означає атом водню або -(С1-С6)-алкіл, де алкіл незаміщений або, незалежно один від однопричому А5 зв'язаний з атомом азоту A3, о означає ціле число 1 і го, одно-, дво- або трикратно заміщений за допоr означає ціле число нуль, 1, 2 або 3; могою R1, і R13 означає -CH(R8)-R9, причому R8 і R9, неf) A3 означає -СН2-феніл, причому феніл незаміщений або, незалежно один від одного, одно-, залежно один від одного, означають феніл або дво- або трикратно заміщений за допомогою R1, піридил, де піридил і феніл, відповідно, незаміщені А4 означає -О-, або, незалежно один від одного, одно-, дво- або А5 означає феніл, причому феніл незаміщетрикратно заміщені за допомогою R1, і R16, R17, R18 і R19 є однаковими або різними ний або, незалежно один від одного, одно-, двоі, незалежно один від одного, означають або трикратно заміщений за допомогою R1, 1) атом водню, причому R1 означає 2) -(С1-С3)-алкіл, де алкіл незаміщений або a) феніл, причому феніл незаміщений або ододно- або двократно заміщений за допомогою R1, но-, дво- або трикратно, незалежно один від одного, заміщений -(С1-С4)-алкілом, або b) триазоліл або піридиніл, 3) -(С0-С3)-алкілфеніл, де алкіл і феніл, відповідно, незаміщені або, незалежно один від одного, c) -(С1-С4)-алкіл, одно-, дво- або трикратно заміщені за допомогою d) -(С3-С6)-циклоалкіл, R1; і e) -CF3, Ζ означає f) -O-CF3, g) фтор або 1) атом водню, h) хлор; 2) -(С1-С6)-алкіл, 3) -(С1-С6)-алкіл-ОН, причому R2 означає атом водню або -(С1-С3)4) -(С0-С4)-алкіл-(С3-С6)-циклоалкіл, алкіл, де алкіл незаміщений або, незалежно один 5) -(С1-С10)-алкіл-О-С(О)-О-(С3-С6)-циклоалкіл. від одного, одно-, дво- або трикратно заміщений Подальшим об'єктом винаходу є сполука фоза допомогою R1; причому R3, R6 і R7 є однаковими або різними рмули (Іа), причому U означає атом водню; і, X означає залишок формули (II), де незалежно один від одного, означають: Μ означає ціле число 1; a) -(С1-С6)-алкіл, де алкіл незаміщений або, незалежно один від одного, одно-, дво- або триА1 означає -СН2-; А2 означає залишок (відсутня формула, с.35), кратно заміщений за допомогою R1, який незаміщений або, незалежно один від одного, b) феніл, де феніл незаміщений або, незалежодно-, дво- або трикратно заміщений за допомоно один від одного, одно-, дво-або трикратно загою F, СІ, Br, J або -СН3; міщений за допомогою R1, Υ означає 1) залишок формули (III). причому c) атом водню, або a) A3 означає -(С3-С8)-циклоалкіл, де циклоалd) -(С3-С6)-циклоалкіл, де циклоалкіл незаміщений або, незалежно один від одного, одно-, двокіл незаміщений або, незалежно один від одного, або трикратно заміщений за допомогою R1; одно-, дво- або трикратно заміщений за допомогою R1, і причому R4 і R5 є однаковими або різними і, А4 і А5 відсутні; незалежно один від одного, означають: a) -(С1-С6)-алкіл або -(С2-С10)-алкеніл, де алкіл b) A3 означає -(С2-С4)-алкінілен, де алкінілєн або алкеніл незаміщений або, незалежно один від незаміщений або, незалежно один від одного, ододного, одно-, дво- або трикратно заміщений за но-, дво- або трикратно заміщений за допомогою допомогою R1, R1, b) феніл, де феніл незаміщений або, незалежА4 і А5 відсутні; c) A3 означає циклічний амін з 3-6 атомами у но один від одного, одно-, дво-або трикратно зациклі, де циклічний амін незаміщений або, незаміщений за допомогою R1, лежно один від одного, одно-, дво- або трикратно c) атом водню, або заміщений за допомогою R1, d) -(С3-С6)-циклоалкіл, де циклоалкіл незаміщений або, незалежно один від одного, одно-, двоA4 і А5 відсутні; d) A3 означає -(СН2)q-феніл, де феніл незаміабо трикратно заміщений за допомогою R1; щений або, незалежно один від одного, одно-, двоΥ означає 2) залишок піролідин-2-ону, причому або трикратно заміщений за допомогою R1, залишок заміщений біля атома азоту, відповідно, А4 означає -N(R2)-, де R2 має нижчевказане за допомогою R8, значення, причому R8 означає А5 означає а)1) -C(O)-R3; a)2) -C(O)-N(R4)-R5; a) -(С1-С6)-алкіл, де алкіл незаміщений або, незалежно один від одного, одно-, дво- або триa)3) -(SO2)-R6 або а)4) -С(О)-O-R7; кратно заміщений за допомогою R1, о означає ціле число 1, 21 87306 22 p означає ціле число 1 і R13 означає -CH(R8)-R9, причому R8 і R9, неq означає ціле число нуль, 1 або 2; залежно один від одного, означають феніл або e) A3 означає -(CH2)r-Het, де Het означає піропіридил, де піридил і феніл, відповідно, незаміщені або, незалежно один від одного, одно-, дво- або лідин або піперидин, який незаміщений або, незалежно один від одного, одно-, дво- або трикратно трикратно заміщені за допомогою R1; заміщений за допомогою R1, R16, R17, R18 і R19 є однаковими або різними А4 відсутній і А5 має вказане у п. d) значення, і, незалежно один від одного, означають причому А5 сполучений з атомом азоту A3, 1) атом водню, p означає ціле число 1 і 2) -(С1-С3)-алкіл, де алкіл незаміщений або r означає ціле число нуль, 1, 2 або 3; одно- або двократно заміщений за допомогою R1, або f) A3 означає -СН2-феніл, причому феніл незаміщений або, незалежно один від одного, одно-, 3) -(С0-С3)-алкілфеніл, де алкіл і феніл, відподво- або трикратно заміщений за допомогою R1, відно, незаміщені або, незалежно один від одного, А4 означає -О-, одно-, дво- або трикратно заміщені за допомогою А5 означає феніл, причому феніл незаміщеR1; і ний або, незалежно один від одного, одно-, двоΖ означає атом водню. або трикратно заміщений за допомогою R1; Подальшим об'єктом винаходу є сполуки фопричому R1 означає рмули (Іа) з ряду: a) феніл, причому феніл незаміщений або од3-(6-амінопіридин-3-іл)-2-(1-циклогексил-1Нно-, дво- або трикратно, незалежно один від одноімідазол-4-іл)пропіонова кислота; го, заміщений -(С1-С4)-алкілом, метиловий ефір 3-(6-амінопіридин-3-іл)-2-(1b) піридил або тетразоліл. циклoreксил-1Н-імідазол-4-іл)пропіонової кислоти; c) -(С1-С4)-алкіл, ізопропіловий ефір 3-(6-амінопіридин-3-іл)-2d) -(С3-С6)-циклоалкіл, (1-циклогексил-1Н-імідазол-4-іл)пропіонової кислоe) -CF3, ти; f) -O-CF3, циклопропілметиловий ефір 3-(6g) фтор або амінопіридин-3-іл)-2-(1-циклогексил-1Н-імідазол-4h) хлор; іл)пропіонової кислоти; причому R2 означає атом водню або -(С1-С3)2-гідроксіетиловий ефір 3-(6-амінопіридин-3алкіл, де алкіл незаміщений або, незалежно один іл)-2-(1-циклогексил-1Н-імідазол-4-іл)пропіонової від одного, одно-, дво- або трикратно заміщений кислоти; за допомогою R1; 1-циклогексилоксикарбонілоксіетиловий ефір причому R3, R6 і R7 є однаковими або різними 3-(6-амінопіридин-3-іл)-2-(1-циклогексил-1Ні, незалежно один від одного, означають імідазол-4-іл)-пропіонової кислоти; a) -(С1-С6)-алкіл, де алкіл незаміщений або, 3-(6-амінопіридин-3-іл)-2-(1-циклопентил-1Німідазол-4-іл)пропіонова кислота; незалежно один від одного, одно-, дво- або три3-(6-амінопіридин-3-іл)-2-(1-піперидин-4-іл-1Нкратно заміщений за допомогою R1, b) феніл, де феніл незаміщений або, незалежімідазол-4-іл)пропіонова кислота; 3-(6-амінопіридин-3-іл)-2-[1-(2-оксо-1но один від одного, одно-, дво-або трикратно заміщений за допомогою R1, фенілпіролідин-3-іл)-1Н-імідазол-4-іл]пропіонова d) -(С3-С6)-циклоалкіл, де циклоалкіл незамікислота; щений або, незалежно один від одного, одно-, дво3-(6-амінопіридин-3-іл)-2-{1або трикратно заміщений за допомогою R1; [(бензгідрилкарбамоїл)метил]-1Н-імідазол-4іл}пропіонова кислота; причому R4 і R5 є однаковими або різними і, незалежно один від одного, означають: ізопропіловий ефір 3-(6-амінопіридин-3-іл)-2a) -(С1-С6)-алкіл, де алкіл незаміщений або, {1-[(бензгідрилкарбамоїл)метил]-1Н-імідазол-4незалежно один від одного, одно-, дво- або триіл}пропіонової кислоти; кратно заміщений за допомогою R1, 3-(6-амінопіридин-3-іл)-2-{1-[4-(3b) феніл, де феніл незаміщений або, незалежфенілуреїдо)феніл]-1Н-імідазол-4-іл}пропіонова но один від одного, одно-, дво-або трикратно закислота; 3-(6-амінопіридин-3-іл)-2-{1-[2-(1міщений за допомогою R1, c) атом водню, або дифенілацетилпіперидин-4-іл)етил]-1Н-імідазол-4d) -(С3-С8)-циклоалкіл, де циклоалкіл незамііл}пропіонова кислота; 3-(6-амінопіридин-3-іл)-2-{1-[2-(1щений або, незалежно один від одного, одно-, двобензоїлпіперидин-4-іл)етил]-1Н-імідазол-4або трикратно заміщений за допомогою R1; іл}пропіонова кислота; Υ означає 2) залишок піролідин-2-ону, причому 3-(6-амінопіридин-3-іл)-2-[1-(1залишок біля атома азоту, відповідно, заміщений бензоїлпіперидин-2-ілметил)-1Н-імідазол-4за допомогою R8, іл]пропіонова кислота; причому R8 означає феніл, де феніл незамі3-(6-амінопіридин-3-іл)-2-(1-{2-[1-(3щений або, незалежно один від одного, одно-, двофенілпропіоніл)-піперидин-3-іл]етил}-1Н-імідазолабо трикратно заміщений за допомогою R1; Υ означає 3) залишок формули (V), причому 4-іл)пропіонова кислота; R12 означає атом водню або -(С1-С6)-алкіл, де 3-(6-амінопіридин-3-іл)-2-[1-(1дифенілацетилпіперидин-3-ілметил)-1Н-імідазолалкіл незаміщений або, незалежно один від одно4-іл]пропіонова кислота; го, одно-, дво- або трикратно заміщений за допомогою R1; і 23 87306 24 3-(6-амінопіридин-3-іл)-2-(1-{2-[1-(33-(6-амінопіридин-3-іл)-2-{1-[3-(3фенілиропіоніл)-піперидин-4-іл]етил}-1Н-імідазолбензилуреїдо)бензил]-1Н-імідазол-4-іл}пропіонова 4-іл)пропіонова кислота; кислота; 3-(6-амінопіридин-3-іл)-2-{1-[2-(13-(6-амінопіридин-3-іл)-2-{1-[3-(3фенілацетилпіперидин-3-іл)етил]-1Н-імідазол-4вінілуреїдо)бензил]-1Н-імідазол-4-іл}пропіонова іл}пропіонова кислота; кислота; 3-(6-амінопіридин-3-іл)-2-{1-[2-(13-(2-амінотіазол-4-іл)-2-{1фенілацетилпіперидин-4-іл)етил]-1Н-імідазол-4[(бензгідрилкарбамоїл)метил]-1Н-імідазол-4іл}пропіонова кислота; іл}пропіонова кислота; 3-(6-амінопіридин-3-іл)-2-{1-[1-(4'3-(2-амінотіазол-4-іл)-2-[1-({[(4метилбіфеніл-3-карбоніл)піперидин-4-ілметил]-1Нхлорфеніл)фенілметил]-карбамоїл}метил)-1Німідазол-4-іл}пропіонова кислота; імідазол-4-іл]пропіонова кислота; 3-(6-амінопіридин-3-іл)-2-[13-(6-амінопіридин-3-іл)-2-{1-[4-(3-трет(1бензоїлпіперидин-4-ілметил)-1Н-імідазол-4бутилуреїдо)-феніл]-1Н-імідазол-4-іл}пропіонова іл]пропіонова кислота; кислота; 3-(6-амінопіридин-3-іл)-2-(1-бензгідрил-1Н3-(6-амінопіридин-3-іл)-2-{1-[4-(3імідазол-4-іл)пропіонова кислота; бензилуреїдо)феніл]-1Н-імідазол-4-іл}пропіонова 3-(6-амінопіридин-3-іл)-2-[1-(4-[1,2,4]триазол-1кислота; або ілбензил)-1Н-імідазол-4-іл]пропіонова кислота; етиловий ефір 3-(6-амінопіридин-3-іл)-2-(13-(6-амінопіридин-3-іл)-2-[1-(4циклогексил-1Н-імідазол-4-іл)пропіонової кислоти. трифторметоксибензил)-1Н-імідазол-4Під поняттям «(С1-С6)-алкіл» або «(С1-С10)алкіл» розуміють вуглеводневі залишки, вуглецеіл]пропіонова кислота; вий ланцюг яких є лінійним або розгалуженим і 3-(6-амінопіридин-3-іл)-2-[1-(1,1-діоксо-1Н-1,6містить 1-6 атомів вуглецю або 1-10 атомів вуглебензо-[b]тіофен-2-ілметил)-1Н-імідазол-4цю, наприклад, метил, етил, пропіл, ізопропіл, буіл]пропіонова кислота; тил, ізобутил, трет-бутил, пентил, ізопентил, не3-(6-амінопіридин-3-іл)-2-[1-(5опентил, гексил, 2,3-диметилбутан, неогексил, хлорбензо[b]тіофен-3-ілметил)-1Н-імідазол-4іл]пропіонова кислота; гептил, октаніл, нонаніл або деканіл. 3-(6-амінопіридин-3-іл)-2-{1-[3-(4Під поняттям «-(С0-С4)-алкілен» розуміють вуглеводневі залишки, вуглецевий ланцюг яких є фторфенокси)бензил]-1Н-імідазол-4-іл} пропіонова лінійним або розгалуженим і містить 1-4 атоми кислота; вуглецю, наприклад, метилен, етилен, пропілен, 3-(6-амінопіридин-3-іл)-2-[1-(2ізопропілен, ізобутилен, бутилен або трет-бутилен. феноксибензил)-1Н-імідазол-4-іл]пропіонова кис«С0-алкілен» означає ковалентний зв'язок. лота; 3-(6-амінопіридин-3-іл)-2-[1-(4Під поняттям «(С1-С10)-алкіл» також розуміють вуглеводневі залишки, як «-(С2-С10)-алкенілен», феноксибензил)-1Н-імідазол-4-іл]пропіонова кисвуглецевий ланцюг яких є лінійним або розгалужелота; ним і містить 2-10 атомів вуглецю і в яких, залежно 3-(6-амінопіридин-3-іл)-2-(1-проп-2-ініл-1Нвід довжини ланцюга, є 1, 2 або 3 подвійні зв'язки, імідазол-4-іл)пропіонова кислота; як, наприклад, етенилен, пропенілен, ізопропені3-(6-амінопіридин-3-іл)-2-(1-бут-2-ініл-1Нлен, ізобутенілен або бутенілен; замісники у поімідазол-4-іл)пропіонова кислота; двійного зв'язку, якщо існує принципова можли3-(6-амінопіридин-3-іл)-2-[1-(4,4вість, можуть бути розташовані у Е- або Zдиметилциклогексил)-1Н-імідазол-4-іл]пропіонова кислота; положенні. Під поняттям «(С1-С10)-алкіл» також розуміють 3-(6-амінопіридин-3-іл)-2-{1вуглеводневі залишки, як «-(С2-С10)-алкінілен», [(бензгідрилметилкарбамоїл)-метил]-1Н-імідазолвуглецевий ланцюг яких є лінійним або розгалуже4-іл}пропіонова кислота; ним і містить 2-10 атомів вуглецю і в яких, залежно 3-(6-амінопіридин-3-іл)-2-[1-({[(4від довжини ланцюга, є 1, 2 або 3 подвійні зв'язки, хлорфеніл)фенілметил]-карбамоїл}метил)-1Няк, наприклад, етинилен, пропінілен, ізопропінілен, імідазол-4-іл]пропіонова кислота; ізобутинілен, бутинілен, пентинілен або ізомери 3-(6-амінопіридин-3-іл)-2-[1-({[біс(4пентинілену або гексинілену або ізомери гексиніметоксифеніл)метил]-карбамоїл}метил)-1Нлену. імідазол-4-іл]пропіонова кислота; Під поняттям «(С3-С8)-циклоалкіл» розуміють 3-(6-амінопіридин-3-іл)-2-{1-[4-(3залишки, як такі, що походять від 3-8-членних мопропілуреїдо)феніл]-1Н-імідазол-4-іл}пропіонова ноциклів, як циклопропіл, циклобутил, циклопенкислота; тил, циклогексил, циклогептил або циклооктаніл. 3-(6-амінопіридин-3-іл)-2-{1-[4-(толуол-4Під поняттям «циклічний амін з 3-8 атомами у сульфоніламіно)-феніл]-1Н-імідазол-4циклі» розуміють залишки, які походять від пропііл}пропіонова кислота; ламіну, азетидину, піролідину, піперидину, азепану 3-(6-амінопіридин-3-іл)-2-{1-[3-(3або азокану. пропілуреїдо)бензил]-1Н-імідазол-4-іл}пропіонова Під поняттям «-(СН2)n-, -(CH2)q-, -(СН2)r-, де n, кислота; q або r означає ціле число нуль, 1, 2 або 3» розу3-(6-амінопіридин-3-іл)-2-{1-[3-(3міють залишки, як метилен, етилен або пропілен. фенетилуреїдо)бензил]-1Н-імідазол-4У випадку, в якому n, q або r означає ціле число іл}пропіонова кислота; нуль, залишок має значення ковалентного зв'язку. 25 87306 26 нолініл, дибензофураніл, дибензотіофеніл, Під поняттям «R16 і R17 або R18 і R19 разом з дигідрофуран[2,3-b]тетрагідрофураніл, дигідрофуатомом вуглецю, з яким вони зв'язані, утворюють раніл, діоксоліл, діоксаніл, 2Н,6Н-1,5,2-дитіазиніл, 3-6-членний цикл» розуміють залишки, які похофураніл, фуразаніл, імідазолідиніл, імідазолініл, дять від циклопропілу, циклобутилу, циклопентилу імідазоліл, 1Н-індазоліл, індолініл, індолізиніл, або циклогексилу. індоліл, 3H-індоліл, ізобензофураніл, ізохроманіл, Під поняттями «R4 і R5 разом з атомом азоту, ізоіндазоліл, ізоіндолініл, ізоіндоліл, ізохінолініл з яким вони зв'язані, утворюють 3-8-членний цикл, (бензімідазоліл), ізотіазолідиніл, 2-ізотіазолініл, який додатково до атома азоту може містити ще ізотіазоліл, ізоксазоліл, ізоксазолідиніл, 2аж до двох додаткових гетероатомів з ряду, що ізоксазолініл, морфолініл, нафтиридиніл, октагідвключає кисень, сірку або азот» або «R24 і R25 роізохінолініл, оксадіазоліл, 1,2,3-оксадіазоліл, разом з атомом азоту, з яким вони зв'язані, утво1,2,4-оксадіазоліл, 1,2,5-оксадіазоліл, 1,3,4рюють 3-8-членний цикл, який додатково до атома оксадіазоліл, оксазолідиніл, оксазоліл, оксотіолаазоту може містити ще аж до двох додаткових геніл, піримидиніл, фенантридиніл, фенантролініл, тероатомів з ряду, що включає кисень, сірку або феназиніл, фенотіазиніл, феноксатилініл, феноказот» розуміють залишки, які походять від пропісазиніл, фталазиніл, піперазиніл, піперидиніл, ламіну, азетидину, піролідину, піперидину, азепану, азокану, азепіну, діоксазину, 1,4-діазепану, 1,2птеридиніл, пуриніл, піраніл, піразиніл, піроазолідіазепіну, 1,3-діазепіну, 1,4-діазепіну, імідазолу, диніл, піразолініл, піразоліл, піридазиніл, піридооксазоліл, піридоімідазоліл, піридотіазоліл, піридоімідазоліну, імідазолідину, ізотіазолідину, ізотіазотіофеніл, піридиніл, піридил, піримідиніл, ліну, ізоксазоліну, ізоксазолідину, 2-ізоксазоліну, піролідиніл, піролініл, 2Н-піроліл, піроліл, тетрагідкетопіперазину, морфоліну, [1,4]оксазепану, піперофураніл, тетрагідроізохінолініл, тетрагідрохіноразину, піразину, піразоліну, піразолідину, піридалініл, тетрагідропіридиніл, 6Н-1,2,5-тіадазиніл, зину, піролідинону, піроліну, тетрагідропіридину, 1,2,3-тіадіазоліл, 1,2,4-тіадіазоліл, 1,2,5тіазолідину, тіазоліну або тіоморфоліну. тіадіазоліл, 1,3,4-тіадіазоліл, тіантреніл, тіазоліл, Під поняттям «залишок формули (IV)» розумітієніл, тієнотіазоліл, тієнооксазоліл, тієноімідазоють замісники, які походять від азетидин-2-ону, ліл, тіоморфолініл, тіофеніл, триазиніл, 1,2,3піролідин-2-ону, піперидин-2-ону, азепан-2-ону і триазоліл, 1,2,4-триазоліл, 1,2,5-триазоліл, 1,3,4азокан-2-ону і заміщені біля атома азоту, відповідтриазоліл і ксантеніл. но, за допомогою R8. Переважними гетероциклами є залишки: бенПід фрагментом (відсутня формула, с.44) з зофураніл, бензімідазоліл, бензоксазоліл, бензотіформули (V) у випадку, коли одно-, дво- або триазоліл, бензотіофеніл, 1,3-бензодіоксоліл, хіназократно є місце розгалуження, розуміють залишки, лініл, хінолініл, хіноксалініл, хроманіл, цинолініл, як метилен, етилен або пропілен, які, відповідно, заміщені залишками R18 і R19. У випадку, коли фураніл, як 2-фураніл і 3-фураніл; імідазоліл, індоліл, індазоліл. ізохінолініл, ізохроманіл, ізоіндонемає місця розгалуження, є ковалентний зв'язок. ліл, ізотіазоліл, ізоксазоліл, оксазоліл, фталазиніл, Під фрагментом (відсутня формула, с.44) з птеридиніл, піразиніл, піразоліл, піридазиніл, піриформули (VI) у випадку, коли одно-, дво- або тридоімідазоліл, піридопіридиніл, піридопіримідиніл, кратно є місце розгалуження, розуміють залишки, піридил, як 2-піридил, 3-піридил або 4-піридил; як метилен, етилен або пропілен, які, відповідно, піримідиніл, піроліл, як 2-піроліл і 3-піроліл; пуризаміщені залишками R28 і R29. У випадку, коли ніл, тіазоліл, тетразоліл або тієніл, як 2-тієніл і 3немає місця розгалуження, є ковалентний зв'язок. тієніл. Відносно фрагмента (III) треба брати до уваги, що зв'язування з 1Н-імідазолом відбувається чеПід поняттям «галоген» розуміють фтор, хлор, рез A3, а не через А5. бром або йод. Під поняттям «-(С6-C14)-арил» розуміють ароПід поняттям «=О» розуміють оксо-залишок або карбоніл(-С(О)-) або нітрозо-залишок (-N=O). матичні вуглеводневі залишки з 6-14 атомами вугСполуки, що пропонуються згідно з винахолецю у циклі. -(С6-С14)-арильними залишками є, наприклад, феніл, нафтил, як, наприклад, 1дом, можна отримувати загальновідомими спосонафтил, 2-нафтил, антрил або флуореніл. Перебами або описаними у даному контексті способаважними арильними залишками є нафтильні зами. Функціональні групи проміжних продуктів, що лишки і, особливо, фенільні залишки. Під поняттям «4-15-членний гетероцикл» або використовуються, наприклад, аміногрупи або ка«Het» розуміють циклічні системи з 4-15 атомами рбоксильні групи, при цьому можна захищати за вуглецю, які знаходяться у вигляді однієї, двох або допомогою придатних захисних груп. Придатними трьох, зв'язаних одна з одною циклічних систем і захисними групами для аміногруп є, наприклад, які містять один, два, три або чотири однакових трет-бутоксикарбонільна група, бензилоксикарбоабо різних гетероатомів з ряду, що включає кинільна група або фталоїльна група, а також тритисень, азот або сірку. Прикладами цих циклічних льна або тозильна захисна група. Придатними систем є залишки: акридиніл, азепініл, азетидиніл, захисними групами для карбоксильної групи с, азиридиніл, бензімідазалініл, бензімідазоліл, беннаприклад, складний алкільний, арильний або зофураніл, бензотіофураніл, бензотіофеніл, бенарилалкільний ефір. Захисні групи можна вводити зоксазоліл, бензтіазоліл, бензтриазоліл, бензтеті видаляти загальновідомими або описаними у разоліл, бензизоксазоліл, бензизотіазоліл, даному контексті способами [див. Green T.W., карбазоліл, 4аН-карбазоліл, карболініл, хіназоліWutz P.G.M., "Protective Groups in Organic ніл, хінолініл, 4Н-хінолізиніл, хіноксалініл, хінукліSynthesis" (1991), друге видання, Wileyдиніл, хроманіл, хроменіл, цинолініл, декагідрохі 27 87306 28 Interscience, або Kocienski P., "Protecting Groups" но активні сполуки, що пропонуються згідно з ви(1994), Thieme]. находом. Поняття «захисна група» може включати таВинахід відноситься, далі, до способу отрикож відповідні полімерзв'язані захисні групи. Такомання сполуки формули (І) і/або стереоізомерної го роду захищені сполуки формули (Іа), де функціформи сполуки формули (І) і/або фізіологічно приональні групи залишку X, у разі необхідності, також йнятної солі сполуки формули (І), яка відрізняється можуть бути захищені, можуть бути, хоча, у разі тим, що необхідності, навіть фармакологічно неактивно, у а) сполуку формули (І) отримують згідно зі разі необхідності, після введення ссавцям шляхом схемою 1, причому X і Υ мають, відповідно, вказані метаболізації перетворюватися на фармакологічвище значення: Сполуки формули (VII) можна отримувати звичайними способами, наприклад, з гідрохлориду 4імідазолоцтової кислоти шляхом перетворення у нижчих спиртах в присутності тіонілхлориду, причому PG1 означає придатну карбоксилзахисну групу. На стадії способу (А) згідно зі стандартними способами вводять придатну захисну групу PG2. Отримувані сполуки формули (VIII) на стадії способу (В) у присутності основи і в інертному розчиннику при температурах від -90°С до 50°С вводять у взаємодію зі сполукою формули (XIII): з отриманням сполук формули (IX), причому PG1' означає придатну карбоксилзахисну групу. Зі сполук формули (IX) на стадії способу (С) у присутності сильної основи в інертному розчиннику при температурах від -90°С до +50°С шляхом введення у взаємодію зі сполуками формули (XIV): X-LG (XIV) отримують сполуки формули (X), причому ті, що містяться у (X) функціональні групи можуть бути захищені придатними захисними групами і LG означає придатну активуючу групу, як, наприклад, хлор, бром, йод, мезилат, тозилат або трифлат. На стадії способу (D) сполуки формули (X) перетворюють на сполуки формули (XI) тим, що згідно зі стандартними способами видаляють захисні групи PG1, PG1' і PG2, а також, у разі необхідності, захисну групу, що міститься в (X), і обробляють, у разі необхідності, у водно-кислотних умовах при температурах від кімнатної температури до 100°С. Сполуки формули (XII) можна отримувати зі сполук формули (XI) на стадії (Е) шляхом введення у стандартних умовах придатної карбоксилзахисної групи PG1". На стадії (F) можна отримувати сполуки формули (Іа) шляхом взаємодії сполук формули (XII) у присутності основи при температурах від -90°С до +60°С в інертному розчиннику зі сполуками формули (XV): Υ-LG (XV) причому LG означає придатну активуючу групу, як хлор, бром, йод, мезилат, тозилат або трифлат, і Υ має вищезгадані значення. Альтернативно, сполуки формули (Іа) можна отримувати шляхом взаємодії сполук формули (XII) в умовах реакції Міцонобу зі сполуками формули (XVI): 29 87306 30 алкілсульфоксиди, як диметилсульфоксид, аліфаΥ-ОН (XVI) тичні нітрили, як ацетонітрил, складний ефір, як етиловий ефір бензойної кислоти, або інші розде Υ має вищезгадані значення. чинники, як N-метилпіролідинон. Також можна виАльтернативно, сполуки формули (Іа) можна користовувати суміші вказаних розчинників. отримувати тим, що сполуки формули (XII) у приЗвичайними додавальними реагентами для сутності основи при температурах від -90°С до реакції Міцонобу є, наприклад, трифенілфосфін, +60°С в інертному розчиннику вводять у взаємодифеніл(2-піридил)фосфін або (4дію з шестичленними 2-фторнітроароматичними диметиламінофеніл)дифенілфосфін. сполуками або шестичленними 4Азодикарбоксилатами є, наприклад, діетилафторнітроароматичними сполуками. Потім нітрозодикарбоксилат, диметилазодикарбоксилат, діігрупу відновлюють до аміногрупи згідно зі стандазопропілазодикарбоксилат або ди-третртними способами, наприклад, при кімнатній тембутилазодикарбоксилат. пературі у нижчих спиртах за допомогою водню в Отримана згідно зі схемою 1 сполука формули присутності каталізатора на основі перехідного (І), або придатний попередник формули (І), яка(ий) металу або в інертних розчинниках у присутності на основі своєї хімічної структури утворюється в дигідрату хлориду олова-(II), і ацилюють згідно зі енантіомерних формах, шляхом солеутворення з стандартними способами. енантіомерно чистими кислотами або основами, Сполуки формули (Іb) отримують на стадії (G) хроматографії при використанні хіральних нерушляхом видалення у стандартних умовах захисної хомих фаз або дериватизації за допомогою хірагрупи PG1" і, у разі необхідності, захисної групи, льних енантіомерно чистих сполук, як амінокислощо міститься в (X). ти, розділення таким чином отриманих Сполуки формул (XIII), (XIV), (XV) і (XVI) комедіастереомерів та відщеплення хіральних допомірційно доступні, відомі з літератури або можуть жних груп розділяють на чисті енангіомери (спосіб бути отримані відомими з літератури способами. b), або отримана згідно зі схемою 1 сполука форПеретворення можна здійснювати при нормамули (І) або виділяють у чистій формі, або, у разі льному, підвищеному або при пониженому тиску. наявності кислотних або основних груп, перетвоЗагалом, працюють при нормальному тиску. рюють на фізіологічно прийнятні солі (спосіб с). Як розчинники для стадій способу (В), (С) і (F) На стадії способу b), сполука формули (І), якпридатні інертні органічні розчинники. До них відщо вона утворюється у вигляді суміші діастереомерів або енантіомерів або при вибраному синтезі носяться, наприклад, простий ефір, як діоксан, утворюється у вигляді їх сумішей, розділяють на тетрагідрофуран або 1,2-диметоксіетан; вуглеводні, як циклогексан, бензол, толуол або ксилол; нітчисті стереоізомери або шляхом хроматографії роароматичні сполуки, як нітробензол; аміди карпри використанні, у разі необхідності, хірального бонових кислот, як диметилформамід або носія, або, якщо рацемічна сполука формули (І) здатна до солеутворення, шляхом фракційної кридиметилацетамід; алкілсульфоксиди, як диметилсталізації отримуюваних з оптично активною осносульфоксид; аліфатичні нітрили, як ацетонітрил, вою або кислотою як допоміжної речовини діастеабо інші розчинники, як N-метилпіролідинон. Також можна використовувати суміші вказаних розчинниреомерних солей. Як хіральні нерухомі фази для розділення енантіомерів шляхом тонкошарової ків. або колонкової хроматографії придатні, наприЯк основи для стадій способу (В), (С) і (F) приклад, модифіковані силікагелі (так звані Pirkleдатні звичайні неорганічні і органічні основи. До фази), а також високомолекулярні вуглеводи, як них відносяться переважно карбонати лужних і триацетилцелюлоза. Для аналітичних цілей, після лужноземельних металів, як карбонат натрію, кавідповідної, відомої фахівцеві дериватизації, також лію або кальцію; гідриди лужних металів, як гідрид застосовні газохромагографічні методи при виконатрію; аміди, як біс(триметилсиліл)амід літію або ристанні хіральних нерухомих фаз. Для розділендіізопропіламід літію; органічні аміни, як піридин, 4-N,N-диметиламінопіридин, триетиламін, етилдііня на енантіомери рацемічних карбонових кислот, зопропіламін, N-метилморфолін, Nза допомогою оптично активної, як правило, комеметилпіперидин, 1,5-діазабіцикло[4,3,0]нон-5-ен рційно доступної основи, як (-)-нікотин, (+)- і (-)(DBU) або 1,8-діазабіиикло[5,4,0]ундец-7-ен (DBU); фенілетиламін, хінінові основи, L-лізин або L- і Dабо металоорганічні сполуки, як бутилітій або феагрінін, отримують по-різному розчинні діастереонілітій. Особливо переважні гідрид натрію, мерні солі, важче розчинний компонент виділяють біс(триметилсиліл)амід літію і триетилахв. у вигляді твердої речовини, легше розчинний діасПід умовами реакції Міцонобу, загалом, розутереомер осаджують з маточного розчину і з таким міють використання інертних розчинників у присучином отриманих діастереомерних солей отримутності азодикарбоксилату, у разі необхідності, в ють чисті енантіомери. У принципі, таким же чином присутності додаткового реагенту, переважно в рацемічні сполуки формули (І), що містять основну області температур від 0°С до кімнатної темперагрупу, як аміногрупа, за допомогою оптично активтури при нормальному тиску. Інертними розчинниних кислот, як (+)-камфор-10-сульфокислота, D- і ками є, наприклад, галогенвуглеводні, як дихлорL-винна кислота, D- і L-молочна кислота, а також (+)- і (-)-мигдалева кислота, переводять у чисті метан, простий ефір, як діоксан, тетрагідрофуран або 1,2-диметоксіетан, вуглеводні, як бензол, тоенантіомери. Хіральні сполуки, що містять спиртолуол або ксилол, нітроароматичні сполуки, як нітві функціональні групи або аміногрупи, за допоморобензол, аміди карбонових кислот, як диметилгою відповідно активованих або, у разі необхідносформамід або диметилацетамід, ті, N-захищених енантіомерно чистих амінокислот 31 87306 32 також можна переводити у відповідний складний гліцерофосфорна кислота, молочна кислота, ябефір або аміди, або, навпаки, хіральні карбонові лучна кислота, адипінова кислота, лимонна кислокислоти за допомогою карбоксизахищених енантіта, фумарова кислота, малеїнова кислота, глюкоомерно-чистих амінокислот можна переводити в нова кислота, глюкуронова кислота, пальмітинова аміди або за допомогою енантіомерно-чистих гідкислота або трифтороцтова кислота. роксикарбонових кислот, як молочна кислота, моВинахід відноситься також до лікарського зажна переводити у відповідні хіральні складні ефісобу, який відрізняється ефективним вмістом щори. Потім хіральність амінокислотного або найменше однієї сполуки формули (І) і/або фізіоспиртового залишку, введеного в енантіомернологічно прийнятної солі сполуки формули (І) і/або, чистій формі, можна використовувати для роздіу разі необхідності, стереоізомерної форми сполуки формули (І) разом з фармацевтично придатним лення ізомерів тим, що розділення діастереомерів, і фізіологічно сумісним носієм, домішкою і/або інщо тепер наявні, здійснюють шляхом кристалізації шими біологічно активними і допоміжними речовиабо хроматографії при використанні придатних нами. нерухомих фаз і після цього за допомогою придатЗавдяки фармакологічним властивостям, споних способів знов відщеплюють введену хіральну луки, що пропонуються згідно з винаходом, придачастину молекули. тні для профілактики і лікування таких захворюДалі, у випадку деяких із сполук, що пропонувань, які піддаються лікуванню за рахунок ються згідно з винаходом, існує можливість викоінгібування TAFIa. Так, інгібітори TAFIa придатні як ристання діастереоізомерно- або енантіомернодля профілактичного, так і також терапевтичного чистих вихідних продуктів для отримання скелетзастосування відносно людини. Вони придатні як них структур. Завдяки цьому, у разі необхідності, для екстреного лікування, так і також для довгоможна використовувати також інші або спрощені тривалої терапії. Інгібітори TAFIa можна викорисспособи для очищення кінцевих продуктів. Ці вихітовувати у випадку пацієнтів, які страждають на дні продукти раніше отримують енантіомерно- або порушення хорошого самопочуття або захворюдіастереомерно-чистими згідно з відомими з літеваннями, які протікають з тромбозами, емболіями, ратури способами. Це, особливо, може означати, гіперкоагулльованістю або фібротичними змінами. що при синтезі основних скелетних структур викоДо них відносяться інфаркт міокарда, стенокардиія ристовують або енантіоселективні способи, або, та всі інші форми гострого коронарного синдрому, однак, розділення енантіомерів (або діастереомеінсульт, приферичні васкулярні захворювання, рів) здійснюють на більш ранній стадії синтезу, а глибокий венозний тромбоз, емболія легеневої не тільки на стадії кінцевих продуктів. Спрощення артерії, емболічні або тромботичні явища, зумоврозділень також можна досягати завдяки тому, що лені кардіальними аритміями, серцево-судинні здійснюють дві або більше стадій. явища, як рестеноз після реваскуляризації, ангіопКислі або основні продукти сполук формули (І) можуть знаходитися у формі їх солей або у чистій ластики та подібних втручань, як стент-імплантації формі. Переважні фармакологічно прийнятні солі, та операцій шунтування. Далі, інгібітори TAFIa наприклад, солі лужних або лужноземельних меможна використовувати у випадку всіх втручань, які призводять до контакту крові з чужорідними талів, відповідно, гідрохлориди, гідроброміди, суповерхнями, як, наприклад, у випадку пацієнтів, льфати, напівсульфати, всі можливі фосфати, а що піддаються діалізу, і пацієнтів з постійними також солі амінокислот, природних основ або каркатетерами. Інгібітори TAFIa можна використовубонових кислот. вати для зменшення небезпеки тромбозу після Отримання фізіологічно прийнятних солей зі здатних до солеутворення сполук формули (І), хірургічних втручань, як при операціях колінного включаючи їх стереоізомерні форми, згідно зі стасуглоба і тазобедренного суглоба. дією способу с), здійснюють саме за собі відомим Інгібітори TAFIa придатні для лікування пацієчином. Сполуки формули (І) з основними реагеннтів з дисемінованою інтраваскулярною коагуляцітами, як гідроксиди, карбонати, гідрокарбонати, єю, сепсисом та іншими інтраваскулярними явиалкоголяти, а також аміак, або органічними оснощами, які протікають із запаленням. Далі, вами, як, наприклад, триметил- або триетиламін, інгібітори TAFIa придатні для профілактики і лікуетаноламін, діетаноламін або триетаноламін, тровання пацієнтів з атеросклерозом, діабетом і меметамол, або також основними амінокислотами, таболічним синдромом і його наслідками. Порушення гемостатичної системи (наприклад, як, наприклад, лізин, орнітин або агрінін, утворювідкладання фібрину) полягають у механізмах, які ють стабільні солі лужних металів, лужноземельних металів або у разі необхідності заміщені амведуть до росту пухлини і метастазування пухлимонієві солі. Якщо сплуки формули (І) включають ни; інгібітори TAFIa придатні для сповільнення або основні групи, за допомогою сильних кислот також запобігання таким процесам. можна отримувати стабільні адитивні солі кислот. Подальшими свідченнями до використання інДля цього використовують як неорганічні, так і тагібіторов TAFIa є фіброзні зміни легень, як хронічкож органічні кислоти, як соляна кислота, бромвоне обструктивне захворювання легень, респіратоднева кислота, сірчана кислота, гемісірчана кислорний дистрес-синдром дорослих (ARDS) і дистреста, фосфорна кислота, метансульфокислота, синдром ока, як відкладання фібрину після очних бензолсульфокислота, п-толуолсульфокислота, 4операцій. Інгібітори TAFIa придатні також для забромбензолсульфокислота, циклогексиламідосупобігання і/або лікування при рубцюванні. льфокислота, трифторметилсульфокислота, 2Введення лікарських засобів, що пропонуються згідно з винаходом, можна здійснювати шляхом гідроксіетансульфокислота, оцтова кислота, щаворального, за допомогою інгаляції, ректального лева кислота, винна кислота, бурштинова кислота, 33 87306 34 або трансдермального введення або шляхом підзасобами, що знижують рівень линідів і антиаритшкірної, внутрішньосуглобинної, інтраперитонеамічними засобами. льної або внутрішньовенної ін'єкції. Переважне Приклади оральне введення. Можливе покривання інгібітоКінцеві продукти, як правило, визначають мерами TAFIa стента та інших поверхонь, які в оргатодами мас-спектрометрії (FAB-МС (маснізмі вступають у контакт з кров'ю. спектрометрія з іонізацією шляхом бомбардування Винахід відноситься також до способу отришвидкими атомами) або ESI-MC (масмання лікарського засобу, який відрізняється тим, спектрометрія з іонізацією електронним розпилен1 що щонайменше одна сполука формули (І) разом з ням)) і H-ЯМР вказуються, відповідно, основний фармацевтично придатним і фізіологічно прийнятпік або обидва основних піки. Температури вказані у градусах Цельсия, RT означає кімнатну темпеним носієм і, у разі необхідності, іншими придатратуру (від 21°С до 24°С). Скорочення, що викориними біологічно активними речовинами, домішкастовуються, або пояснені, або відповідають звими або допоміжними речовинами доводять до чайним конвенціям. придатної для введення форми. Придатними твердими або галеновими готоЯкщо не вказано нічого іншого, аналізи шлявими формами є, наприклад, грануляти, порошки, хом рідинної хроматографії з мас-спектрометрією драже, таблетки, (мікро)капсули, супозиторії, сиздійснюють у наступних умовах: ропи, соки, суспензії, емульсії, краплі або ін'єктовні Спосіб А: колонка: YMC Jsphere 33×2,1мм; розчини, а також препарати з пролонгованим вивіущільнювальний матеріал: 4мкм; розчинник: льненням біологічно активної речовини, при пригоCH3CN+0,05% трифтороцтової кислоти (ТФОК): туванні яких знаходять застосування звичайні доН2О+0,05% ТФОК, градієнт: від 5:95 (0хв.) до 95:5 поміжні кошти, як носії, порофори, зв'язуючі, (3,4хв.), витрата: 1мл/хв., температура: 30°С; засоби для покриття, засоби, що сприяють набуСпосіб В: колонка: YMC Jsphere ODS H80 ханню, засоби або мастила, що додають ковзкості, 20×2,1мм; ущільнювальний матеріал: 4мкм; розсмакові речовини, підсолоджувачі та речовини, що чинник: CH3CN+0,05% трифтороцтової кислоти сприяють розчиненню. Як допоміжні речовини, що (ТФОК): Н2О+0,05% ТФОК, градієнт: від 4:96 (0хв.) часто використовуються, потрібно назвати карбодо 95:5 (2,0хв.), витрата: 1мл/хв., температура: нат магнію, діоксид титану, лактозу, манії та інший 30°С; цукор, тальк, молочний білок, желатин, крохмаль, Спосіб С: колонка: YMC Jsphere 33×2,1мм; целюлозу та її похідні, тваринні і рослинніолії, як ущільнювальний матеріал: 4мкм; розчинник: риб'ячий жир, соняшникова олія, арахісова олія CH3CN+0,05% трифтороцтової кислоти (ТФОК): або кунжутна олія, поліетиленгліколь і розчинники, Н2О+0,05% ТФОК, градієнт: від 5:95 (0хв.) до 95:5 як, наприклад, стерильна вода і одно- або багато(2,5хв.), витрата: 1,3мл/хв., температура: 30°С. атомні спирти, як гліцерин. Якщо не вказано нічого іншого, розділення Переважно, фармацевтичні препарати готують шляхом хроматографії здійснюють на силікагелі і вводять у разових дозах, причому кожна разова при використанні сумішей етилацетат/гептан як доза як активний компонент містить певну кількість розчинника, а також препаративні розділення просполуки формули (І), що пропонується згідно з водять шляхом високоефективної рідинної хромавинаходом. У випадку твердих разових форм, як тографії (ВЕРХ) з оберненою фазою (ОФ) на силітаблетки, капсули, драже або супозиторії, ця кількагелі при використанні сумішей води, що містять кість може складати аж до 1000мг, переважно, трифтороцтову кислоту, з ацетонітрилом як розоднак, від приблизно 50мг до 300мг, а у випадку чинником. розчинів для ін'єкції в ампульній формі аж до приВипарювання розчинників здійснюють, як праблизно 300мг, переважно, однак, від приблизно вило, при зниженому тиску при температурі від 10мг до 100мг. 35°С до 45°С. Для лікування дорослих, масою приблизно Приклад 1 70кг пацієнтів, залежно від ефективності сполуки 3-(6-Амінопіридин-3-іл)-2-(1-циклогексил-1Нформули (І), показані добові дози від приблизно імідазол-4-іл)пропіонова кислота 2мг до 1000мг біологічно активної речовини, переПриклад 1а важно, від приблизно 50мг до 500мг. Дивлячись по трет-Бутиловий ефір (5-метилпіридин-2обставинам, однак, також можна вводити більш іл)карбамінової кислоти високі або більш низькі добові дози. Введення доДо розчину 30,00г (277ммоль) 5-метилпіридинбової дози можна здійснювати як шляхом однора2-іламіну і 3,39 г (28ммоль) 4зового введення у формі окремої разової дози диметиламінопіридину в 150мл дихлорметану доабо, однак, у вигляді декількох більш маленьких дають розчин 60,54г (277ммоль) ди-третразових доз, як також шляхом багаторазового бутилдикарбонату в 50мл дихлорметану. Отримавведення розділених доз у певні інтервали. ний розчин перемішують протягом 16 годин при Інгібітори TAFIa можна вводити як у вигляді кімнатній температурі і потім концентрують досуха. монотерапії, так і також у комбінації або спільно з Очищення хроматографією на силікагелі призвобудь-якими антитромботичними засобами (антидить до 15,4г продукту у вигляді безбарвної тверкоагулянти та інгібітори агрегації тромбоцитів), дої речовини. тромболітичними засобами (плазміногенні активаМС (ЕS+)[мас-спектрометрія з іонізацією електори будь-якого роду), іншими профібринолітично тронним розпиленням при утворенні позитивних активними речовинами, засобами, що знижують іонів]=209 [М+Н]+ кров'яний тиск, регуляторами вмісту цукру в крові, Приклад 1b 35 87306 36 Розчин 14,9г (72ммоль) сполуки, отриманої Приклад 1f згідно з прикладом 1а, в 700мл ССІ4 нагрівають до Диметиловий ефір 2-(6-третбутилоксикарбоніламінопіридин-3-ілметил)-2-[1кипіння. Після додавання суміші з 12,8г (72ммоль) (толіл-4-сульфоніл)-1Н-імідазол-4-іл]малонової N-бромсукциніміду і 1,2г (7ммоль) 2,2'кислоти азобіс(ізобутиронітрилу) кип'ятять зі зворотним Охолоджений до температури 0°С розчин з холодильником протягом 2,5 годин. Реакційну су2,2г (6,24ммоль) сполуки, отриманої згідно з приміш фільтрують в гарячому стані, залишок на фікладом 1е, в 40мл абсолютного Ν,Ν'льтрі промивають додатково за допомогою ССІ4 і з диметилформаміду (ДМФА) змішують з 150мл об'єднаних фільтратів видаляють розчинник. За(6,26ммоль) NaH (50%-ний) і перемішують протялишок перекристалізовують з ацетонітрилу, відфігом 1 години при кімнатній температурі. Після охольтровують під вакуумом, промивають ацетонітлоджування до температури 0°С додають 1,8г рилом і сумішшю ацетонітрилу і метилом-трет(6,24ммоль) 2-(6-трет-бутилоксикарбоніламінобутилового ефіру (1:1) і висушують при зниженому піридинін-3-іл)метилброміду і отриманий розчин тиску. Отримують 6,94г бажаної сполуки у вигляді перемішують протягом 30 хвилин при температурі твердої речовини кремового кольору. 1 0°С. Потім додають 50мл води і багато разів екстH-ЯМР (500МГц, ДМСО-d6): δ = 1,48 (с, 9Н); рагують етилацетатом. Об'єднані етилацетатні 4,71 (с, 2Н); 7,78 (д, 1Н); 7,82 (д, 1Н); 8,32 (с, 1Н). екстракти сушать над Na2SO4, фільтрують і концеПриклад 1с нтрують досуха. Очищення залишку хроматограГідрохлорид метилового ефіру 4фією на силікагелі призводить до 2,9г бажаної імідазолоцтової кислоти сполуки. 5,0г (30,75ммоль) 4-Імідазолоцтової кислоти + Rt (спосіб А)=2,10хв.; MC (ES+)=559 [М+Н] розчиняють у 50мл метанолу і потім змішують з Приклад 1g 5,6мл (76,87ммоль) тіонілхлориду. Отриманий Етиловий ефір 3-(6-амінопіридин-3-іл)-2-(1Нрозчин кип'ятять зі зворотним холодильником проімідазол-4-іл)-пропіонової кислоти тягом 4 годин і після охолоджування концентрують 400,0мг (0,72ммоль) сполуки, отриманої згідно досуха. Після висушування при зниженому тиску з прикладом 1f, суспендують у розчині з 5мл 37%отримують 5,3г бажаного продукту у вигляді тверної соляної кислоти і 5мл води. Отриману суспендої речовини блідо-жовтого кольору. + зію нагрівають протягом 20 хвилин при температуMC (ES+)=141 [M+H] рі 180°С у мікрохвильовій установці. Потім реакПриклад 1d ційний розчин концентрують, отриманий залишок Метиловий ефір [1-(толіл-4-сульфоніл)-1Нобробляють за допомогою 50мл етанолу і знов імідазол-4-іл]-оцтової кислоти концентрують. Залишок, що залишається, розчиРозчин з 5,0г (28,31ммоль) сполуки, отриманої няють в 50мл етанолу і розчин, після додавання згідно з прикладом 1с, і 9,8мл триетиламіну 40мл насиченого розчину газоподібного НCl у діе(70,72ммоль) в 350мл СН2СІ2, після охолоджувантиловому ефірі, перемішують протягом 3 годин. ня до температури 0°С, змішують з 7,04г Концентрують досуха, залишок обробляють за (36,90ммоль) п-толуолсульфонілхлориду. Розчин допомогою 20мл суміші з етилацетату і насиченого перемішують протягом 15 хвилин при температурі розчину NaHCO3 і реакційний розчин багато разів 0°С і 15 хвилин при кімнатній температурі, конценекстрагують етилацетатом. Об'єднані етилацетаті трують і потім промивають розчином хлориду екстракти сушать над Na2SO4, фільтрують і концеамонію та водою. Органічну фазу сушать над сунтрують. Очищення залишку хроматографією на льфатом натрію і після відфільтровування конценсилікагелі призводить до 134мг бажаної сполуки. трують досуха. Очищення хроматографією на сиRt (спосіб А)=0,20хв.; MC (ES+)=261 [М+H]+ лікагелі приводить до 7,2г бажаного продукту. Приклад 1h Rt (спосіб А)=1,71хв.; МС (ES+)=295 [М+Н]+ Етиловий ефір 3-(6-амінопіридин-3-іл)-2-(1Приклад 1е циклогексил-1Н-імідазол-4-іл)пропіонової кислоти Диметиловий ефір 2-(1-толіл-4-сульфоніл)-1НСпосіб 1: імідазол-4-іл]-малонової кислоти Розчин з 60,1мг (0,23ммоль) сполуки, отримаДо охолодженого до температури 0°С розчину ної згідно з прикладом 1g, 37,7мг (0,23ммоль) з 3,0г (10,19ммоль) сполуки, отриманої згідно з бромциклогексану і 100мкл триетиламіну в 1мл прикладом 1d, в 50мл абсолютного тетрагідрофуабсолютного тетрагідрофурану обробляють протярану (ТГФ) повільно докрапують 9,3мл гом 40 хвилин при температурі 170°С у мікрохви(11,1ммоль) 20%-ного розчину льовій установці. Потім реакційний розчин оброббіс(триметилсиліл)аміду літію у тетрагідрофурані. ляють невеликою кількістю суміші етилацетату і Після перемішування протягом 30 хвилин при теводи (1:1), фази розділяють, органічну фазу сумпературі 0°С додають 0,89мл метилціаноформіашать над Na2SO4, фільтрують і концентрують доту і отриманий розчин протягом проміжку часу 1,5 суха. Очищення хроматографією зі зверненою години повільно нагрівають до кімнатної темперафазою на силікагелі при використанні суміші тури. Реакційний розчин потім виливають приблиСН3СN/вода/0,1% ТФОК як розчинника і сушіння зно у 300мл насиченого розчину хлориду амонію. виморожуванням об'єднаних фракцій, що мають Багато разів екстрагують етилацетатом і об'єднані значення, призводить до 18,0мг бажаної сполуки у етилацетатні екстракти після промивання водою і вигляді бістрифторацетату у формі аморфної твевисушування над Na2SO4 концентрують досуха. рдої речовини. Очищення хроматографією на силікагелі призводить до 2,2г вказаної у заголовку сполуки. + Rt (спосіб A)=1,89хв.; MC (ES+)=353 [М+Н] 37 87306 38 Альтернативно до способу 1, вказану у загоефірі і перемішують протягом 6 годин при кімнатловку сполуку також отримують згідно з нижчеопиній температурі. Потім розчин концентрують досусаним способом 2. ха і отриманий залишок висушують у високому Спосіб 2 вакуумі. Отримують 51мг вказаної у заголовку Розчин з 200,0мг (0,77ммоль) сполуки, отрисполуки у вигляді бісгідрохлориду у формі аморфманої згідно з прикладом 1е, і 39,0мг (0,77ммоль, ної твердої речовини. + 60%-ний) NaH у 5мл абсолютного ДМФА переміRt (спосіб А)=0,90хв.; МС (ES+)=329 [М+Н] ; 1 шують протягом 1 години при кімнатній темпераH-ЯМР (500МГц, ДМСО-d6): δ = 1,20 (м, 1Н), турі і потім змішують з 123,7мг (0,77ммоль) 31,37 (м, 2Н), 1,65 (м, 3H), 1,82 (м, 2Н), 2,0 (м, 2Н). бромциклогексану. Отриманий розчин перемішу3,10 (дд, 1Н), 3,18 (дд, 1Н), 3,65 (с, 3H), 4,22 (м, ють протягом 1 години при кімнатній температурі. 2Н), 6,95 (д, 1Н), 7,72 (м, 3H), 8,05 (с, 2Н). Після додавання 2мл води багато разів екстрагуОбидва енантіомери сполуки розділяють шляють діетиловим ефіром і об'єднані екстракти у діехом препаративної хроматографії при використантиловому ефірі сушать над MgSO4. Після концентні хіральної фази; фаза: Chiracel OD/H-61; розчинрування, очищення залишку хроматографією зі ник: гептан:пропанол:метанол=15:1:1 плюс 0,1% зверненою фазою на силікагелі при використанні діетиламіну (в ізократичному режимі); витрата: суміші вода/ацетонітрил (5:95) і концентрування 1мл/хв.; температура: 30°С: фракцій, що мають значення, отримують 152мг енантіомер 1: Rt=14,05хв.; енантіомер 2: етилового ефіру 3-(6-амінопіридин-3-іл)-2-(1Rt=17,15хв. циклогекс-2-ен-1Н-імідазол-4-іл)пропіонової кислоПриклад 3 ти. Цю сполуку потім гідрують в 15мл метанолу в Ізопропіловий ефір 3-(6-амінопіридин-3-іл)-2присутності Pd/активне вугілля (10%) протягом 2 (1-циклогексил-1Н-імідазол-4-іл)пропіонової кислогодин при кімнатній температурі. Після концентрути вання і висушування при зниженому тиску отриРозчин з 38,0мг (0,12ммоль) сполуки, отримамують 127мг бажаної, вказаної у заголовку сполуної згідно з прикладом 1і, в 5мл ізопропанолу зміки у вигляді аморфної твердої речовини. шують з 2мл насиченого розчину НCl в діетиловоRt (спосіб А)=0,89хв.; МС (ES+)=343 [М+Н]+; му ефірі і перемішують протягом 4 годин при 1 кімнатній температурі. Потім розчин концентрують H-ЯМР (500МГц, ДМСО-d6): δ = 1,12 (т, 3H), досуха і отриманий залишок висушують у високо1,18 (м, 1Н), 1,38 (м, 2Н), 1,68, (м, 3H), 1,80 (м, 2Н), му вакуумі. Отримують 25мг вказаної у заголовку 2,03 (м, 2Н), 3,08 (дд, 1Н), 3,15 (дд, 1Н), 3,42 (кв, сполуки у вигляді бісгідрохлориду у формі аморф2Н), 4,10 (дт, 1Н), 4,24 (м, 1Н), 6,95 (д, 1Н), 7,75 (м, ної твердої речовини. 3H), 8,10 (с, 2Н). + Rt (спосіб А)=0,92хв.; МС (ES+)=357 [М+H] ; Приклад 1i 1 Гідрохлорид 3-(6-амінопіридин-3-іл)-2-(1H-ЯМР (500МГц, ДМСО-d6): δ = 1,02 (д, 6Н), циклогексил-1Н-імідазол-4-іл)пропіонової кислоти 1,15 (м, 3H), 1,38 (м, 2Н). 1,68 (м, 3H), 1,85 (м, 1Н), Розчин з 13,7мг (0,03ммоль) сполуки, отрима2,03 (м, 1Н), 3,05 (дд, 1Н), 3,14 (дд, 1Н), 3,78 (дт, ної згідно з прикладом 1h, в 0,5мл води і 0,5мл 1Н), 4,20 (м, 2Н), 4,90 (м, 1Н), 6,90 (м, 1Н), 7,74 (м, 37%-ної соляної кислоти обробляють протягом 5 3H), 8,00 (м, 1Н). хвилин при температурі 180°С у мікрохвильовій Приклад 4 установці. Потім концентрують досуха при знижеЦиклопропілметиловий ефір 3-(6ному тиску, залишок обробляють невеликою кільамінопіридин-3-іл)-2-(1-циклогексил-1Н-імідазол-4кістю води і розчин піддають сушінню виморожуіл)пропіонової кислоти ванням. При цьому отримують 8,0мг вказаної у Розчин з 50,0мг (0,16ммоль) сполуки, отримазаголовку сполуки у вигляді бісгідрохлориду у фоної згідно з прикладом 1і, в 2мл циклопропілкарбірмі аморфної твердої речовини. нолу змішують з 1мл насиченого розчину НCl в Rt (спосіб А)=0,80хв.; МС (ES+)=315 [М+Н]+; діетиловому ефірі і перемішують протягом 12 го1 H-ЯМР (400МГц, ДМСО-d6): δ = 0,86 (м, 1Н), дин при кімнатній температурі. Потім розчин кон1,28 (м, 5Н), 1,60 (м, 3H), 1,78 (м, 2Н), 1,92 (м, 2Н), центрують досуха і отриманий залишок висушують 2,77 (дд, 1Н), 2,95 (дд, 1Н), 3,55 (дт, 1Н), 3,95 (м, у високому вакуумі. Очищення шляхом хроматог1Н), 5,60 (с, 2Н), 6,34 (д, 1Н), 7,00 (с, 1Н), 7,14 (дд, рафії на силікагелі при використанні суміші 1Н), 7,58 (с. 1Н), 7,68 (с, 1Н). СН2СІ2/метанол як розчинника призводить до 29мг вказаної у заголовку сполуки у вигляді аморфної Обидва енантіомери сполуки, отриманої згідно твердої речовини. з прикладом 1g, розділяють шляхом препаративRt (спосіб А)=0,91хв.; МС (ES+)=369 [M+Н]+; ної хроматографії при використанні хіральної фа1 зи; фаза: Chiralpak ADH40; розмір колонки: H-ЯМР (500МГц, ДМСО-d6): δ = 0,18 (м, 2Н), 0,42 (м, 2Н), 0,98 (м, 1Н), 1,18 (м, 1Н), 1,34 (м, 2Н), 250×4мм: розчинник: гептан:етанол:метанол=8:1:1 1,60 (м, 3H), 1,75 (д, 2Н), 1,94 (д, 2Н), 2,90 (м, 2Н), плюс 0,1% ацетату амонію (в ізократичному режи3,70 (м, 1Н), 3,78 (д, 2H), 3,97 (м, 1Н), 5,70 (с, 2Н), мі); витрата: 1мл/хв.; температура: 30°С: 6,34 (д, 1Н), 7,05 (с, 1Н), 7,13 (д, 1Н), 7,55 (с, 1Н), енантіомер 1: Rt=6,13хв.; енантіомер 2: Rt=46,32хв. 7,70 (с, 1Н). Приклад 5 Приклад 2 2-Гідроксіетиловий ефір 3-(6-амінопіридин-3Метиловий ефір 3-(6-амінопіридин-3-іл)-2-(1іл)-2-(1-циклогексил-1Н-імідазол-4-іл)пропіонової циклогексил-1Н-імідазол-4-іл)пропіонової кислоти кислоти Розчин з 50,0мг (0,16ммоль) сполуки, отримаРозчин з 50,0мг (0,16ммоль) сполуки, отриманої згідно з прикладом 1і, в 8мл метанола змішуної згідно з прикладом 1і, в 1мл етиленгліколю ють з 3мл насиченого розчину НCl у діетиловому 39 87306 40 змішують з 0,4мл насиченого розчину НCl у діетиЦиклопентиловий ефір (1-циклопентил-1Нловому ефірі і перемішують протягом 1 години при імідазол-4-іл)-оцтової кислоти (2,00г; 7,60ммоль) кімнатній температурі. Потім розчин концентрують розчиняють у тетрагідрофурані (ТГФ; 45мл). Після досуха, залишок обробляють насиченим розчином охолоджування реакційного розчину до темпераNaHCO3 і багато разів екстрагують етилацетатом. тури 0°С докрапують літійгексаметилдисилазан (20%-ний у тетрагідрофурані; 6,33мл; 7,60ммоль). Об'єднані етилацетатні екстракти сушать, фільтрують і концентрують. Отриманий залишок висуПеремішують протягом наступної години при темшують у високому вакуумі, причому отримують 33 пературі 0°С. Потім додають метилціаноформіат мг вказаної у заголовку сполуки у вигляді масла (0,66мл; 8,36ммоль). Перемішують протягом 10 світло-жовтого кольору. хвилин при температурі 0°С і потім 7 годин при + Rt (спосіб А)=0,85хв.; МС (ES+)=359 [М+Н] ; кімнатній температурі. Реакційний розчин після 1 цього додають до насиченого розчину NH4Cl. ЕксH-ЯМР (500МГц, ДМСО-d6): δ = 0,85 (м, 1Н), трагують етилацетатом, органічну фазу промива1,15-1,35 (м, 5Н), 1,60 (м, 3H), 1,78 (д, 1Н), 1,95 (м, ють водою і сушать над Na2SO4. Розчинник вида1Н), 2,90 (м, 1Н), 3,48 (м, 1Н), 4,00 (м, 2Н), 5,68 (с, ляють при зниженому тиску. Після очищення 2Н), 6,32 (д, 1Н), 7,05 (с, 1Н), 7,13 (д, 1Н), 7,55 (с, сирого продукту шляхом колонкової хроматографії 1Н), 7,65 (д, 1Н). (120г силікагелю; етилацетат/н-гептан=2:1) отриПриклад 6 мують 0,46г метилового ефіру циклопентилового 1-Циклогексилоксикарбонілоксіетиловий ефір ефіру 2-(1-циклопентил-1Н-імідазол-43-(6-амінопіридин-3-іл)-2-(1-циклогексил-1Ніл)малонової кислоти. імідазол-4-іл)пропіонової кислоти + Rt (спосіб В)=1,01хв.; МС (ES+)=321 [М+Н] Розчин з 50,0мг (0,16ммоль) сполуки, отримаПриклад 7с ної згідно з прикладом 1і, і 39мг (0,19ммоль) 1Метиловий ефір циклопентилового ефіру 2-(6циклогексилоксикарбонілоксі-1-етилхлориду, 13мг амінопіридин-3-ілметил)-2-(1-циклопентил-1Н(0,08ммоль) KІ і 26мг (0,19ммоль) К2СО3 в 2мл імідазол-4-іл)малонової кислоти диметилформаміду перемішують протягом 12 гоМетиловий ефір циклопентилового ефіру 2-(1дин при температурі 60°С. Потім змішують з 5мл циклопентил-1Н-імідазол-4-іл)малонової кислоти води і реакційний розчин багато разів екстрагують (0,46г; 1,44ммоль) розчиняють в абсолютному диетилацетатом. Об'єднані етилацетатні екстракти метилформаміді (5мл). При температурі 0°С досушать, фільтрують і концентрують досуха. Отридають гідрид натрію (50%-ний; 0,07г; 1,44ммоль). маний залишок очищають при використанні силікаПеремішують протягом 1 години при кімнатній тегелю за допомогою суміші СН2Сl2/метанол як розмпературі і потім знов охолоджують до температучинника, причому отримують вказану у заголовку ри 0°С. Після цього додають (5сполуку у вигляді аморфної твердої речовини. бромметилпіридин-2-іл)-трет-бутилкарбамат Rt (спосіб А)=0,81хв.; МС (ES+)=485 [М+Н]+; 1 (0,41г; 1,44ммоль) і перемішують протягом 2 годин H-ЯМР (500МГц, ДМСО-d6): δ = 0,86 (м, 4Н), при кімнатній температурі. При охолоджуванні 1,20-1,40 (м, 8Н), 1,63 (м, 2Н), 1,70 (м, 2Н), 1,95 (м, льодом реакцію гасять водою і потім екстрагують 1Н), 2,90 (м, 1Н), 3,45 (м, 1Н), 3,52 (с, 3H), 3,70 (м, двічі етилацетатом. Органічну фазу відділяють, 1Н), 3,94 (м, 1H), 4,13 (м, 2Η), 4,52 (м, 1Η), 5,68 (д, сушать над Na2SO4 і розчинник видаляють при 1Η), 6,30 (т, 1Н), 6,55 (м, 1Н), 7,00 (с, 1Н), 7,13 (м, зниженому тиску. Після очищення сирого продукту 1Н), 7,72 (м, 2Н). при використанні фільтруючого елемента (50г сиПриклад 7 лікагелю) отримують 0,31г метилового ефіру цик3-(6-Амінопіридин-3-іл)-2-(1-циклопентил-1Нлопентилового ефіру 2-(6-амінопіридин-3імідазол-4-іл)-пропіонова кислота ілметил)-2-(1-циклопентил-1Н-імідазол-4Приклад 7а іл)малонової кислоти. Циклопентиловий ефір (1-циклопентил-1Н+ Rt (спосіб С)=1,47хв.; МС (ES+)=527 [М+Н] імідазол-4-іл)оцтової кислоти Приклад 7d Гідрохлорид імідазол-4-оцтової кислоти (5,30г; 3-(6-Амінопіридин-3-іл)-2-(1-циклопентил-1Н32,60ммоль) і карбонат цезію (31,90г, 97,80ммоль) імідазол-4-іл)-пропіонова кислота вносять в абсолютний диметилформамід. Туди Метиловий ефір циклопентилового ефіру 2-(6додають циклопентилбромід (10,5мл; амінопіридин-3-ілметил)-2-(1-циклопентил-1Н97,80ммоль). Перемішують протягом 3 годин при імідазол-4-іл)малонової кислоти (0,30г; 0,57ммоль) температурі 110°С, потім фільтрують крізь освітрозчиняють в абсолютному етанолі (5мл). При лювальний шар, залишок промивають за допомотемпературі 0°С додають етанольний розчин НCl. гою СН2Сl2 і фільтрат концентрують при зниженоРеакційний розчин витримують протягом 48 годин му тиску. Залишок обробляють етилацетатом і при температурі 10°С. Потім концентрують при розчин промивають водою і 0,5н соляною кислозниженому тиску і залишок обробляють 2н солятою. Органічну фазу сушать над Na2SO4 і розчинною кислотою. Нагрівають у мікрохвильовій устаник потім видаляють при зниженому тиску. Після новці (3×4хв.; 180°С). Після цього промивають очищення сирою продукту при використанні фільетилацетатом і водну фазу нейтралізують за дотруючого елемента (70г силікагелю) отримують помогою 1н розчину NaOH і потім піддають сушін2,65г циклопентилового ефіру (1-циклопентил-1Нню виморожуванням. Залишок обробляють метаімідазол-4-іл)оцтової кислоти. + нолом і фільтрують двічі крізь фільтруючий Rt (спосіб В)=0,89хв.; МС (ES+)=263 [М+Н] елемент (С18). Після концентрування фільтрату Приклад 7b при зниженому тиску отримують 3-(6Метиловий ефір циклопентилового ефіру 2-(1циклопентил-1Н-імідазол-4-іл)малонової кислоти 41 87306 42 амінопіридин-3-іл)-2-(1-циклопентил-1Н-імідазолму ефірі сушать над Na2SO4. фільтрують і 4-іл)-пропионову кислоту. концентрують. Очищення отриманого залишку Rt (спосіб С)=0,64хв.; МС (ES+)=301 [М+Н]+; шляхом хроматографії на силікагелі при викорис1 танні суміші СН2Сl2/метанол (від 92:8 до 85:15 за H-ЯМР (ДМСО-d6): δ = 1,60 (м, 2Н); 1,73 (м, 35 хвилин) як розчинника призводить до 52,2г вка4Н); 2,18 (м, 2Н), 2,87 (ддд, 1Н); 3,58 (т, 1Н); 3,78 заної у заголовку сполуки. (квт, 2Н); 4,45 (т, 1Н); 5,52 (с, 2Н); 6,29 (д, 1Н); 6,95 + Rt (спосіб А)=0,93хв.; МС (ES+)=420 [М+Н] (с, 1Н); 7,11 (дд; 1Н); 7,55 (с, 1Н); 7,65 8 (с, 1Н). Приклад 9b Приклад 8 Бисгідрохлорид 3-(6-амінопіридин-3-іл)-2-[1-(23-(6-Амінопіридин-3-іл)-2-(1-піперидин-4-іл-1Ноксо-1-фенілпіролідин-3-іл)-1Н-імідазол-4імідазол-4-іл)пропіонова кислота іл]пропіонової кислоти Приклад 8а Розчин з 23,1мг (0,06ммоль) сполуки, отримаЕтиловий ефір 3-(6-амінопіридин-3-іл)-2-(1ної згідно з прикладом 9а, в 0,5мл води і 0,5 мл (бензилокси-карбоніл)піперидин-4-іл-1Н-імідазол37%-ної соляної кислоти обробляють протягом 3 4-іл)пропіонової кислоти хвилин при температурі 180°С у мікрохвильовій Розчин з 60,1мг (0,23ммоль) сполуки, отримаустановці. Реакційний розчин багатократно обробної згідно з прикладом 1g, 68,9мг (0,23ммоль) 4ляють етанолом і концентрують при зниженому бром-1-бензилоксикарбонілпіперидину, 97мкл тиску. Сушіння виморожуванням розчиненого у (0,69ммоль) триетиламіну в 1мл абсолютного тетводі залишку призводить до 19,0мг бажаної сполурагідрофурану обробляють протягом 2 годин при ки у вигляді аморфної твердої речовини. температурі 180°С у мікрохвильовій установці. + Rt (спосіб А)=0,73хв.; МС (ES+)=392 [М+Н] ; Потім реакційний розчин змішують з 2мл суміші 1 H-ЯМР (500МГц, ДМСО-d6): δ = 2,74 (м, 1Н), діетиловий ефір/вода (1:1), фазу діетилового ефі3,00 (дд, 1Н), 3,12 (дд, 1Н), 4,91 (м, 1Н), 4,02 (м, ру відділяють і сушать над Na2SO4. Фільтрація, видалення розчинника і хроматографічне очищен3H), 5,48 (дд, 1Н), 6,85 (д, 1Н), 7,20 (г, 1Н), 7,38 (м, ня залишку, що залишився, шляхом препаративної 2Н), 7,70 (м, 5Н), 7,95 (уш.с, 2Н). ВЕРХ при використанні СН3СN/вода/0,1% ТФОК як Приклад 10 розчинника призводять до 33мг вказаної у заголо3-(6-Амінопіридин-3-іл)-2-{1вку сполуки у вигляді біс-трифторацетату. [(бензгідрилкарбамоїл)метил]-1Н-імідазол-4+ іл}пропіонова кислота Rt (спосіб А)=1,18хв.; МС (ES+)=478 [М+Н] Приклад 8b Приклад 10а Бісгідрохлорид 3-(6-амінопіридин-3-іл)-2-(1N-Бензгiдрил-2-бромацетамiд піперидин-4-іл-1Н-імідазол-4-іл)пропіонової кислоОхолоджений до температури 0°С розчин з ти 2,91г (14,39ммоль) бромацетилброміду в 40мл тетрагідрофурану послідовно змішують з 2,1мл Розчин з 17,7мг (0,03ммоль) сполуки, отрима(14,39ммоль) триетиламіну і 2,64г (14,39ммоль) ної згідно з прикладом 2а, в 0,5мл води і 0,5 мл бензгідриламіну. Потім реакційний розчин концен37%-ної соляної килоти обробляють протягом 5 трують досуха при зниженому тиску і отриманий хвилин при температурі 180°С у мікрохвильовій залишок очищають на силікагелі при використанні установці. Потім концентрують досуха при знижеетилацетату як розчинника. Продукт, що викрисному тиску, залишок розчиняють у невеликій кількості води і розчин піддають сушінню виморожуталізувався з фракцій, які мають значення, відфіванням. При цьому отримують 11,0мг вказаної у льтровують під вакуумом, промивають невеликою заголовку сполуки у вигляді аморфної твердої рекількістю холодного діетилового ефіру і висушують човини. при зниженому тиску, причому отримують 0,85г Rt (спосіб А)=0,18хв.; МС (ES+)=316 [М+H]+; вказаної у заголовку сполуки. + 1 МС (ES+)=305 [М+Н] H-ЯМР (500МГц, ДМСО-d6): δ = 1,27 (м, 2Н), Приклад 10b 2,20 (м, 4Н), 2,28 (м, 2Н), 3,08 (дд, 1Н), 3,17 (дд, Етиловий ефір 3-(6-амінопіридин-3-іл)-2-{11Н), 4,15 (м, 2Н), 4,52 (м, 1Н), 6,85 (д, 1Н), 7,52 (д, [(бензгідрил-карбамоїл)метил]-1Н-імідазол-41Н), 7,75 (м, 2Н). іл}пропіонової кислоти Приклад 9 Розчин з 60,1мг (0,23ммоль) сполуки, отрима3-(6-Амінопіридин-3-іл)-2-[1-(2-оксо-1ної згідно з прикладом 1g, в 1мл абсолютного дифенілпіролідин-3-іл)-1Н-імідазол-4-іл]пропіонова метилформаміду змішують з 11мг (0,23ммоль) кислота гідриду натрію (50%-ний) і перемішують протягом Приклад 9а 1 години при кімнатній температурі. Потім додають Етиловий ефір-3-(6-амінопіридин-3-іл)-2-[1-(270,3мг (0,23ммоль) сполуки, отриманої згідно з оксо-1-фенілпіролідин-3-іл)-1Н-імідазол-4прикладом 10а, і перемішують протягом 1 години іл]пропіонової кислоти при кімнатній температурі. Реакційний розчин зміРозчин з 60,1мг (0,23ммоль) сполуки, отримашують з 1мл води і багато разів екстрагують етиної згідно з прикладом 1g, в 1мл абсолютного дилацетатом. Об'єднані етилацетатні екстракти суметилформаміду змішують з 11мг (0,23ммоль) шать над Na2SO4, фільтрують і концентрують. гідриду натрію (50%-ний) і перемішують протягом Очищення шляхом хроматографії отриманого за1 години при кімнатній температурі. Потім додають лишку на силікагелі при використанні суміші 55,5мг (0,23ммоль) (+/-)-3-бром-1-феніл-2СН2Сl2/метанол (9:1) як розчинника призводить до піролідинону і перемішують протягом 45 хвилин 71,4мг вказаної у заголовку сполуки. при кімнатній температурі. Реакційний розчин зміRt (спосіб А)=1,24хв.; МС (ES+)=484 [М+Н]+ шують з 1мл води і багато разів екстрагують діеПриклад 10с тиловим ефіром. Об'єднані екстракти у діетилово 43 87306 44 Бістрифторацетат 3-(6-амінопіридин-3-іл)-2Фільтрат тричі екстрагують етилацетатом. Об'єд{[(бензгідрил-карбамоїл)метил]-1Н-імідазол-4нані органічні фази сушать над Na2SO4, фільтруіл}пропіонової кислоти ють і концентрують. Масло жовтого кольору, що Розчин з 14мг (0,03ммоль) сполуки, отриманої виділилося при цьому, і осад об'єднують, і хромазгідно з прикладом 10b, в 1мл тетрагідрофурану тографують на силікагелі. Отримують 4,2г бажаної змішують з 147мкл 1н розчину гідроксиду літію і сполуки. 1 перемішують протягом 30 хвилин при кімнатній H-ЯМР (400МГц, CDCl3): δ = 3,62 (с, 2Н), 3,69 температурі. Після додавання ще раз 100мкл 1н (с, 3H), 6,78 (с, 1Н), 7,10-7,18 (м, 6Н), 7,30-7,36 (м, розчину гідроксиду літію перемішують протягом 9Н), 7,38 (с, 1Н). ночі при кімнатній температурі. Потім значення рН Приклад 12b розчину встановлюють нейтральним за рахунок Диметиловий ефір 2-(1-тритил-1Н-імідазол-4додавання 1н соляної кислоти і випарюють досуха іл)малонової кислоти при зниженому тиску. Хроматографічне очищення 3,50г (9,15ммоль) сполуки, отриманої згідно з отриманого залишку шляхом препаративної ВЕРХ прикладом 12а, розчиняють у 50мл безводного при використанні суміші (0,1% TOOК)/CH3CN тетрагідрофурану і охолоджують до температури (5:100) як розчинника призводить до 16мг бажаної 0°С. До цього розчину при перемішуванні докрасполуки. пують 1,67г (9,96ммоль) біс(триметилсиліл)аміду Rt (спосіб А)=1,13хв.; МС (ES+)=456 [М+Н]+; літію у вигляді 20%-ного розчину у тетрагідрофу1 H-ЯМР (500МГц, ДМСО-d6): δ = 2,98 (дд, 1Н), рані. Суміш, що утворилася, перемішують протя3,14 (дд, 1Н), 4,08 (дд, 1Н), 5,00 (с, 2Н), 6,08 (д, гом 30 хвилин при температурі 0°С і потім змішу1Н), 6,87 (д, 1Н), 7,27 (м, 6Н), 7,35 (м, 4Н), 7,50 ють з 0,86г (10,07моль) метилціанформіату. (уш.с, 1Н), 7,72 (м, 2Н), 7,95 (уш.с, 2Н), 9,38 (д, Реакційну суміш нагрівають до кімнатної темпера1Н). тури і перемішують протягом подальших 2 годин, Обидва енантіомери сполуки, отриманої згідно після чого виливають у 400мл насиченого водного з прикладом 10с, розділяють шляхом препаративрозчину NH4Cl і двічі екстрагують етилацетатом. Об'єднані органічні фази промивають водою, суної хроматографії при використанні хіральної фашать над Na2SO4, фільтрують і концентрують. зи; фаза: Chiralpak ADH40; розмір колонки: Хроматографія залишку на силікагелі призводить 250×4мм; розчинник: гептан:етанол:метанол=1:1:1 до 1,92г вказаної у заголовку сполуки. Здійснюваплюс 0,1% ацетату амонію (в ізократичному режина ще раз хроматографія змішаної фракції, що мі); витрата: 1мл/хв.; температура: 30°С: утворилася, призводить до подальших 40мг бажаенантіомер 1: Rt=3,42хв.; енантіомер 2: ної сполуки. Rt=12,35хв. + Rt (спосіб С)=2,17хв.; МС (ES+)=498 [М+Н] ; Приклад 11 1 H-ЯМР (400МГц, CDCl3): δ = 3,76 (с, 6Η), 4,78 Ізопропіловий ефір 3-(6-амінопіридин-3-іл)-2(с, 1Н), 6,98 (с, 1Н) 7,10-7,18 (м, 6Н), 7,28-7,33 (м, {1-[(бензгідрил-карбамоїл)метил]-1Н-імідазол-49Н), 7,38 (с, 1Н). іл}пропіонової кислоти Приклад 12с Розчин з 50мг (87,8мкмоль) сполуки, отримаДиметиловий ефір 2-(6-третної згідно з прикладом 10с, в 5мл ізопропанолу бутоксикарбоніламінопіридин-3-ілметил)-2-(1змішують з 3мл насиченого розчину НCl у діетилотритил-1Н-імідазол-4-іл)малонової кислоти вому ефірі і перемішують протягом 12 годин при Розчин 2,25г (5,11ммоль) сполуки, отриманої кімнатній температурі. Потім розчин концентрують згідно з прикладом 12b, у 40мл безводного димедосуха і отриманий залишок висушують у високотилформаміду при температурі 0°С змішують з му вакуумі. Отримують 39мг вказаної у заголовку 0,12г (5,12ммоль; 50%-ний) гідриду натрію і пересполуки у вигляді бісгідрохлориду у формі аморфмішують протягом 5 хвилин при цій температурі. ної твердої речовини. Rt (спосіб А)=1,31хв.; МС (ES+)=498 [М+Н]+; Потім витримують для підвищення температури до 1 кімнатної, перемішують протягом 1 години, знов H-ЯМР (500МГц, ДМСО-d6): δ = 1,15 (д, 6Н), охолоджують до температури 0°С і потім у вигляді 3,13 (м, 2Н), 4,25 (дд, 1Н), 4,92 (дт, 1Н), 5,10 (с, однієї порції додають 1,47г (5,11ммоль) сполуки, 2Н), 6,15 (д, 1Н), 6,94 (д, 1Н), 7.28 (м, 2Н), 7,33 (м, отриманої згідно з прикладом 1b. При цій темпера8Н), 7,53 (с, 1Н), 7,75 (м, 2Н), 8,05 (уш.с, 1Н), 9,50 турі продовжують перемішування протягом 30 (д, 1Н). хвилин, після чого при охолоджуванні льодом зміПриклад 12 шують з 50мл води і тричі екстрагують дихлорме3-(6-Амінопіридин-3-іл)-2-{1-[4-(3таном. Об'єднані органічні фази сушать над фенілуреїдо)феніл]-1Н-імідазол-4-іл}пропіонова Na2SO4, фільтрують і концентрують. Залишок кислота очищають хроматографією на силікагелі. ОтримуПриклад 12а ють 3,15г вказаної у заголовку сполуки. Метиловий ефір (1-тритил-1Н-імідазол-41 іл)оцтової кислоти H-ЯМР (400МГц, CDCl3): δ = 1,53 (с, 9Н), 3,63 Розчин 2,78г (19,80ммоль) сполуки, отриманої (с, 2Н), 3,72 (с, 6Н), 7,01-7,05 (м, 2Н), 7,06-7,11 (м, згідно з прикладом 1с, 5,52г (19,80ммоль) трифе6Н), 7,28-7,37 (м, 10Н), 7,42 (с, 1Н), 7,70-7,77 (м, нілметилхлориду і 2,00г (19,80ммоль) триетиламі2Н). ну в 5мл диметилформаміду перемішують протяПриклад 12d гом ночі при кімнатній температурі, потім Диметиловий ефір 2-(6-третвиливають у 200мл води і додатково перемішують бутоксикарбоніламінопіридин-3-ілметил)-2-(1Німідазол-4-іл)малонової кислоти протягом однієї години при кімнатній температурі. Осад, що випав, відфільтровують під вакуумом. 45 87306 46 До охолодженого льодом розчину 1,00г Rt (спосіб В)=1,28хв.; МС (ES+)=615 [М-+Н]+ (1,55ммоль) сполуки, отриманої згідно з приклаПриклад 12h дом 12с, в 15мл СН2СІ2 при перемішуванні дода3-(6-Амінопіридин-3-іл)-2-{1[4-(3ють 0,20г (1,70ммоль, 272 мкл) триетилсілану і фенілуреїдо)феніл]-1Н-імідазол-4-іл}пропіонова 1,76г (15,46ммоль, 1,19мл) трифтороцтової кислокислота ти і перемішують далі при температурі 0°С. Через 47мг (75 мкмоль) сполуки, отриманої згідно з 5 годин при охолоджуванні льодом змішують з прикладом 12g, в 4мл напівконцентрованої соля10мл води і встановлюють значення рН=9 за доної кислоти нагрівають до температури 100°С. помогою 2н розчину NaOH. Осад, що випав, відфіЧерез 1,5 години суміш розбавляють водою і реальтровують під вакуумом, розтирають у порошок кційну суміш піддають сушінню виморожуванням. Препаративна ВЕРХ залишку призводить до 19мг приблизно в 20мл СН2Сl2, відфільтровують під вакуумом і висушують. Отримують 0,55г бажаної вказаної у заголовку сполуки у вигляді бістрифтосполуки. рацетату. + 1 Rt (спосіб В)=0,85хв.; МС (ES+)=443 [М+Н] ; H-ЯМР (400МГц, CDCl3): δ = 1,49 (с, 9Н), 3,58 1 H-ЯМР (400МГц, ДМСО-d6): δ = 3,07 (дд, 1Н), (с, 2Н), 3,77 (с, 6Н), 6,99 (д, 1H), 7,06 (с, 1Н), 7,21 3,20 (дд, 1Н), 4,00 (м, 1Н), 6,90 (д, 1Н), 6,98 (т, 1Н), (с, 1Н), 7,60-7,69 (м, 3H). 7,30 (т, 2Н), 7,43 (д, 2Н), 7,61 (м, 4Н), 7,78 (с, 1Н), Приклад 12е 7,80 (дд, 2Н), 7,90 (с, 2Н, уш.), 8,82 (с, 1Н, уш.), Диметиловий ефір 2-(6-трет8,98 (с, 1Н), 9,16 (с, 1Н). бутоксикарбоніламінопіридин-3-іл-метил)-2-[1-(4Приклад 13 нітрофеніл)-1Н-імідазол-4-іл]малонової кислоти 3-(6-Амінопіридин-3-іл)-2-{1-[2-(1Розчин 404мг (1,00ммоль) сполуки, отриманої дифенілацетилпіперидин-4-іл)етил]-1Н-імідазол-4згідно з прикладом 12d, в 10мл диметилформамііл}пропіонова кислота ду охолоджують до температури 0°С і при переміПриклад 13а шуванні порціями змішують з 80мг (2,00ммоль, 1-[4-(2-Гідроксіетіл)піперидин-1-іл]-2,260%-ний) гідриду натрію. Перемішують протягом 1 дифенілетанон години при температурі 0°С, потім додають 423мг 2-Піперидін-4-ілетанол (1,12г; 8,65ммоль) вно(3ммоль) 4-фторнітробензолу і перемішують при сять у диметилформамід (ДМФА, 10мл). Потім кімнатній температурі аж до повного перетворендодають гідроксибензотриазол (НОВТ, 1,46г, ня. Суміш змішують з насиченим водним розчином 9,51ммоль), 1-етил-3-(3NaHCO3 і екстрагують діетиловим ефіром. Органідиметиламінопропіл)карбодіімідгідрохлорид чну фазу сушать над Na2SO4, фільтрують і концентрують. Залишок очищають хроматографією на (EDC·НCl, 1,83г; 9,51ммоль) і дифенілоцтову киссилікагелі. Отримують 394мг вказаної у заголовку лоту (2,02г; 9,51ммоль) у вказаній послідовності. сполуки. Після цього реакційну суміш змішують з Ν,Ν+ Rt (спосіб В)=1,30хв.; МС (ES+)=526 [М+Н] діізопропілетиламіном (DIEA: 1,67мл; 9,51ммоль) і Приклад 12f перемішують при кімнатній температурі протягом 16 годин. Реакційний розчин концентрують при Диметиловий ефір 2-[1-(4-амінофеніл)-1Нзниженому тиску. Залишок обробляють діетилоімідазол-4-іл]-2-(6-третбутоксикарбоніламінопіридин-3-ілметил)малонової вим ефіром і органічний розчин промивають покислоти слідовно насиченим розчином NaHCO3, 2н НCl і насиченим розчином NaCl. Органічну фазу віддіРозчин 384мг (0,73ммоль) сполуки, отриманої ляють, сушать над Na2SO4, фільтрують і концентзгідно з прикладом 12е, у 10мл диметилформаміду змішують з 824мг (3,66ммоль) дигідрату хлориду рують. Таким чином отриманий 1-[4-(2олова-(ll) і перемішують протягом ночі при кімнатгідроксіетил)піперидин-1-іл]-2,2-дифенілетанон ній температурі. Потім розчинник випарюють і за(2,39г; 8,11ммоль) вводять у взаємодію далі без лишок розподіляють між діетиловим ефіром і наподальшого очищення. + сиченим водним розчином NaHCO3. Водну фазу Rt (спосіб В)=1,33хв.; МС (ES+)=324 [М+Н] екстрагують двічі діетиловим ефіром. Об'єднані Приклад 13b органічні фази сушать над Na2SO4, фільтрують і 1-[4-(2-Брометил)піперидин-1-іл]-2,2концентрують. Отримують 103мг бажаної сполуки. дифенілетанон + Rt (спосіб В)=0,93хв.; МС (ES+)=496 [М+Н] 1-[4-(2-Гідроксіетил)піперидин-1-іл]-2,2Приклад 12g дифенілетанон (2,39г; 8,11ммоль) розчиняють у дихлорметані (20мл). При кімнатній температурі Диметиловий ефір 2-(6-третповільно докрапують трибромід фосфору (1,6мл; бутоксикарбоніламінопіридин-3-ілметил)-2-{ 1-[48,92ммоль). Реакційну суміш кип'ятять зі зворот(3-фенілуреїдо)феніл]-1Н-імідазол-4-іл}-малонової ним холодильником протягом 4 годин. Після охокислоти лоджування промивають насиченим розчином 50мг (0,10ммоль) сполуки, отриманої згідно з NaHCO3, 2н НCl і насиченим розчином NaCl, оргаприкладом 12f, розчиняють в 10мл ацетонітрилу. нічну фазу відділяють і сушать над Na2SO4. РозОтриманий розчин охолоджують до температури чинник видаляють при зниженому тиску. Після 0°С і змішують з 14мг (0,12ммоль, 13,2мкл) феніліочищення залишку при використанні фільтруючого зоціанату і 20мг (0,20ммоль, 28мкл) три-етиламіну. елемента (силікагель) отримують 1-[4-(2Нагрівають до кімнатної температури і додають на кінчику шпателя 4-диметиламінопіридин. Після брометил)піперидин-1-іл]-2,2-дифенілетанон витримування протягом ночі реакційну суміш ви(0,75г; 2,13ммоль). + парюють і залишок хроматографують на силікагеRt (спосіб В)=1,79хв.; МС (ES+)=386 [М+Н] Приклад 13с лі. Отримують 47мг вказаної у заголовку сполуки. 47 87306 48 3-(6-Амінопіридин-3-іл)-2-[1-(1Етиловий ефір 3-(6-амінопіридин-3-іл)-2-{1-[2бензоїлпіперидин-2-ілметил)-1Н-імідазол-4(1-дифенілацетилпіперидин-4-іл)етил]-1Ніл]пропіонова кислота імідазол-4-іл}проніонової кислоти Вказану у заголовку сполуку (41мг; 0,09ммоль) Етиловий ефір 3-(6-амінопіридин-3-іл)-2-(1Німідазол-4-іл)пропіонової кислоти (100мг; синтезують аналогічно вказаній у прикладі 13. + 0,38ммоль) розчиняють в абсолютному диметилRt (спосіб С)=0,81хв.; МС (ES+)=434 [М+Н] ; 1 формаміді (2мл). Додають гідрид натрію (50%-ний; H-ЯМР (500МГц, ДМСО-d6): δ = 1,12 (м, 2Н); 19мг; 0,38ммоль) і реакційну суміш перемішують 1,39 (м, 1Н); 1,61 (м, 1Н); 1,92 (м, 1Н); 2,80 (м, 4Н); протягом 1 години при кімнатній температурі. По3,48 (м, 5Н); 4,20 (м, 1Н); 5,60 (с, 2Н); 6,28 (д, 1Н); тім додають розчинений в абсолютному диметил6,90 (м, 1Н); 7,10 (д, 1Н); 7,35 (м, 6Н); 7,61 (с, 1Н). формаміді (1мл) 1-[4-(2-брометил)піперидин-1-іл]Приклад 16 2,2-дифенілетанон (148мг; 0,38ммоль). Реакційну 3-(6-Амінопіридин-3-іл)-2-(1-{2-[1-(3суміш перемішують при кімнатній температурі профенілпропіоніл)піперидин-3-іл]етил}-1Н-імідазол-4тягом 1 години і потім концентрують при зниженоіл}пропіонова кислота му тиску. Залишок обробляють 1н НCl і промиваВказану у заголовку сполуку (15мг; 0,03ммоль) ють дихлорметаном (СН2Сl2; 2 рази). Водну фазу синтезують аналогічно вказаній у прикладі 13. підлужнюють за допомогою 1н розчину NaOH і 3 Rt (спосіб С)=1,04хв.; МС (ES+)=476 [М+Н]+; 1 рази екстрагують дихлорметаном. Об'єднані оргаH-ЯМР (500МГц, ДМСО-d6): δ = 1,15 (м, 3H); нічні фази сушать над Na2SO4. Після видалення 1,55 (м, 3H); 1,75 (м, 1Н); 2,59 (м, 2Н); 2,77 (м, 2Н); розчинника при зниженому тиску отримують ети2,92 (м, 2Н); 3,40 (м, 4Н); 3,65 (м, 1Н); 3,89 (т, 2Н), ловий ефір 3-(6-амінопіридин-3-іл)-2-{1-[2-(14,15 (м, 1Н); 5,55 (с, 2Н); 6,28 (д, 1Н); 6,89 (м, 1Н); дифенілацетилпіперидин-4-іл)-етил]-1Н-імідазол7,13 (м, 2Н); 7,22 (м, 4Н); 7,45 (с, 1Н); 7,63 (м, 1Н). 4-іл}пропіонової кислоти (71мг; 0,12ммоль). Приклад 17 Rt (спосіб В)=0,98хв.; МС (ES+)=566 [М+H]+ 3-(6-Амінопіридин-3-іл)-2-[1-(1Приклад 13d дифенілацетилпіперидин-3-іл-метил)-1Н-імідазол3-(6-Амінопіридин-3-іл)-2-{1-[2-(14-іл]пропіонова кислота дифенілацетилпіперидин-4-іл)етил]-1Н-імідазол-4Вказану у заголовку сполуку (19мг; 0,03ммоль) іл}пропіонова кислота синтезують аналогічно вказаній у прикладі 13. + Етиловий ефір 3-(6-амінопіридин-3-іл)-2-{1-[2Rt (спосіб С)=1,13хв.; МС (ES+)=524 [М+Н] ; 1 (1-дифенілацетилпіперидин-4-іл)етил]-1НH-ЯМР (500МГц, ДМСО-d6): δ = 0,85-1,75 (м, імідазол-4-іл}пропіонової кислоти (71мг; 5Н); 2,55-3,07 (м, 4Н); 3,07-3,83 (м, 6Н); 4,09 (м, 0,12ммоль) розчиняють в абсолютному етанолі 1Н); 5,62 (м, 2Н); 6,29 (м, 1Н); 6,89 (м, 1Н); 7,23 (м, (600мкл). До отриманого розчину додають 1н роз12Н); 7,65 (м, 1Н). чин NaOH (128мкл; 0,12ммоль). Реакційну суміш Приклад 18 перемішують при кімнатній температурі протягом 3-(6-Амінопіридин-3-іл)-2-(1-{2-[1-(316 годин. Потім нейтралізують за допомогою 1н фенілпропіоніл)піперилин-4-іл]етил}-1Н-імідазол-4НCl (128мкл; 0,12ммоль) і концентрують при зниіл)пропіонова кислота женому тиску. Обробляють метанолом і фільтруВказану у заголовку сполуку (81мг; 0.17ммоль) ють через С із-колонку. Метанол видаляють і досинтезують аналогічно вказаній у прикладі 13. + дають ацетонітрил і двічі декантують і залишок Rt (спосіб С)=1,00хв.; МС (ES+)=476 [М+Н] ; 1 потім розтирають на порошок у діетиловому ефірі. H-ЯМР (500МГц, ДМСО-d6): δ = 0,92 (м, 2Н); Осад відфільтровують і висушують у високому 1,32 (м, 1Н); 1,55 (м, 4Н); 2,55 (м, 2Н); 2,85 (м, 4Н); вакуумі при температурі 40°С. Отримують 3-(63,40 (м. 4Н); 3,79 (м, 1Н); 3,88 (т, 2Н), 4,33 (д, 1Н); амінопіридин-3-іл)-2-{1-[2-(1-дифенілацетил5,65 (с, 2Н); 6,29 (д, 1Н); 6,89 (с, 1Н); 7,13 (м, 2Н); піперидин-4-іл)етил]-1Н-імідазол-4-іл}пропионову 7,22 (м, 4Н); 7,45 (с, 1Н); 7,63 (м, 1Н). кислоту (50мг; 0,09ммоль) у вигляді безбарвної Приклад 19 твердої речовини. 3-(6-Амінопіридин-3-іл)-2-{1-[2-(1+ Rt (спосіб С)=1,20хв.; МС (ES+)=538 [М+Н] ; фенілацетилпіперидин-3-іл)етил]-1Н-імідазол-41 H-ЯМР (500МГц, ДМСО-d6): δ = 0,90 (м, 1Н); іл}пропіонова кислота 1,02-1,51 (м, 5Н); 1,61 (м, 2Н); 2,67 (м, 2Н); 2,94 (м, Вказану у заголовку сполуку (28мг; 0,06ммоль) 1Н); 3,11 (м, 1Н); 3,18-3,56 (м, 3H), 3,65 (м, 1Н); синтезують аналогічно вказаній у прикладі 13. + 3,90 (м, 1Н); 4,09 (т; 1Н); 5,54 (м; 2Н); 6,29 (д, 1Н); Rt (спосіб С)=0,93хв.; МС (ES+)=462 [М+H] ; 1 6,89 (с, 1Н); 7,23 (м, 12Н); 7,65 (м, 1Н). H-ЯМР (500МГц, ДМСО-d6): δ = 0,90 (м, 2Н); Приклад 14 1,35 (м, 1Н); 1,58 (м, 4Н); 2,80 (м, 2Н); 2,95 (м, 2Н); 3-(6-Амінопіридин-3-іл)-2-{1-[2-(13,40 (м, 4Н); 3,69 (с, 1Н); 3,85 (т, 2Н), 4,33 (д, 1Н); бензоїлпіперидин-4-іл)-етил]-1Н-імідазол-45,60 (с, 2Н); 6,29 (д, 1Н); 6,90 (с, 1Н); 7,10 (дд, 1Н); іл}пропіонова кислота 7,19 (м, 3H); 7,27 (м, 2Н); 7,48 (с, 1Н); 7,61 (м, 1Н). Вказану у заголовку сполуку (54мг; 0,12ммоль) Приклад 20 синтезують аналогічно вказаній у прикладі 13. 3-(6-Амінопіридин-3-іл)-2-{1-[2-(1+ Rt (спосіб С)=0,88хв.; МС (ES+)=448 [М+Н] ; фенілацетилпіперидин-4-іл)етил]-1Н-імідазол-41 H-ЯМР (500МГц, ДМСО-d6): δ = 1,10 (м, 2Н); іл}пропіонова кислота 1,41 (м, 1Н); 1,60 (м, 3H); 1,72 (м, 1Н); 2,71 (м, 2Н); Вказану у заголовку сполуку (41мг; 0,08ммоль) 2,95 (м, 2Н); 3,48 (м, 3H); 3,92 (т, 2Н); 4,45 (м, 1Н); синтезують аналогічно вказаній у прикладі 13. + 5,57 (с; 2Н); 6,28 (д, 1Н); 6,90 (с, 1Н); 7,11 (д, 1Н); Rt (спосіб С)=0,91хв.; МС (ES+)=462 [М+Н] ; 1 7,32 (м, 2Н); 7,43 (м, 3H); 7.49 (с, 1Н); 7,61 (с, 1Н). H-ЯМР (500МГц, ДМСО-d6): δ = 0,92 (м, 2Н); Приклад 15 1,25 (м, 1Н); 1,58 (м, 4Н); 2,65-4,20 (м, 12Н); 5,65 49 87306 50 (м, 2Н); 6,29 (м, 1Н); 6,90 (м, 1Н); 7,20 (6Н); 7,60 (м, (0,23ммоль) 1-[4-(бромметил)феніл]-1Н-1,2,42Н). триазолу і перемішують протягом 3 годин при кімПриклад 21 натній температурі. Після цього додають 1мл во3-(6-Амінопіридйн-3-іл)-2-{1-[1-(4'ди, екстрагують етилацетатом, органічну фазу метилбіфеніл-3-карбоніл)піперидин-4-ілметил]-1Нсушать над Na2SO4, фільтрують і концентрують. імідазол-4-іл}пропіонова кислота Шляхом хроматографії на силікагелі отримують Вказану у заголовку сполуку (33мг; 0,06ммоль) етиловий ефір 3-(6-амінопіридин-3-іл)-2-[1-(4синтезують аналогічно вказаній у прикладі 13. [1,2,4]триазол-1-ілбензил)-1Н-імідазол-4-іл]Rt (спосіб С)=1,21хв.; МС (ES+)=524 [М+Н]+; пропіонової кислоти. Таким чином отриманий про1 дукт обробляють за допомогою 0,4мл напівконцеH-ЯМР (500МГц, ДМСО-d6): δ = 1,12 (м, 2Н); нтрованої соляної кислоти і протягом 3мін при те1,45 (м, 2Н); 1,95 (м, 1Н); 2,36 (с, 3H); 2,80-3,60 (м, мпературі 180°С обробляють у мікрохвильовій 6Н); 3,71 (т, 1Н); 3,85 (д, 2Н); 4,45 (м, 1Н); 6,49 (д, установці. Шляхом сушіння виморожуванням, піс1Н); 6,60 (м, 2Н); 6,87 (с, 1Н); 7,29 (м, 4Н); 7,58 (м, ля охолоджування реакційної суміші отримують 4Н); 7,65 (м, 1Н); 7,72 (м, 2Н). 5мг вказаної у заголовку сполуки у вигляді бісгідПриклад 22 рохлориду. 3-(6-Амінопіридин-3-іл)-2-[1-(1+ Rt (спосіб А)=0,16хв.; МС (ES+)=390 [M+H] ; бензоїлпіперидин-4-ілметил)-1Н-імідазол-41 іл]пропіонова кислота H-ЯМР (500МГц, ДМСО-d6): δ = 3,03 (дд, 1Η); 3,21 (дд, 1H); 4,21 (м, 1Н); 5,45 (с, 2H); 6,91 (д, 1Н); Вказану у заголовку сполуку (46мг; 0,10ммоль) 7,50 (д, 2Н); 7,60 (с, 1Н); 7,70-7,78 (м, 2Н); 7,86 (д, синтезують аналогічно вказаній у прикладі 13. + Rt (спосіб С)=0,81хв.; МС (ES+)=434 [М+Н] ; 1Н); 7,95 (д, 2Н); 8,08.(с, уш, 2Н); 8,26 (с, 1Н); 9,28 1 (с, 1Н), 9,38 (с, 1Н). H-ЯМР (500МГц, ДМСО-d6): δ = 1,10 (м, 2Н); Приклад 25 1,45 (м, 2Н); 1,95 (м, 1Н); 2,80-3,10 (м, 4Н); 3,50 (м, 3-(6-Амінопіридин-3-іл)-2-[1-(42Н) 3,62 (т, 1Н); 3,82 (д, 2Н); 4,48 (м, 1Н); 6,03 (м, трифторметоксибензил)-1Н-імідазол-42Н); 6,48 (д, 1Н); 6,90 (д, 1Н); 7,19 (д, 1Н); 7,35 (м, іл]пропіонова кислота 2Н); 7,42 (м, 3H); 7,55 (с, 1Н); 7,61 (с, 1Н). Вказану у заголовку сполуку отримують аналоПриклад 23 гічно вказаному в прикладі 24. 3-(6-Амінопіридин-3-іл)-2-(1-бензгідрил-1Н+ Rt (спосіб А)=1,04хв.; МС (ES+)=407 [М+Н] ; імідазол-4-іл)-пропіонова кислота 1 H-ЯМР (500МГц, ДМСО-d6): δ = 2,98 (дд, 1Н); Розчин 50мг (0,19ммоль) етилового ефіру 3-(63,12 (дд, 1Н); 4,02 (м, 1Н); 5,33 (с, 2Н); 6,84 (д, 1Н); амінопіридин-3-іл)-2-(1Н-імідазол-4-іл)пропіонової 7,30 (дд, 1Н); 7,35-7,46 (м, 4Н); 7,68 (м, 2Н); 7,93 кислоти (приклад 1g) в 0,5мл диметилформаміду (с, br, 2Н), 8,75 (с, уш, 1Н). при кімнатній температурі змішують з 11мг Приклад 26 (0,23ммоль, 50%-ний) гідриду натрію і перемішу3-(6-Амінопіридин-3-іл)-2-[1-(1,1-діоксо-1Н-1,6ють протягом 1 години. Потім додають 48мг бензо[b]тіофен-2-ілметил)-1Н-імідазол-4(0,19ммоль) бромдифенілметану і перемішують іл]пропіонова кислота 3,5 години при кімнатній температурі. Після цього Вказану у заголовку сполуку отримують аналонагрівають ще протягом 2 годин при температурі гічно вказаній у прикладі 24. 60°С, після охолоджування додають 1мл води, + екстрагують етилацетатом, органічну фазу сушать Rt (спосіб А)=0,88хв.; МС (ES+)=411 [М+Н] ; 1 над Na2SO4, фільтрують і концентрують. ХроматоH-ЯМР (500МГц, ДМСО-d6): δ = 2,10 (с, 2Н); графія на силікагелі призводить до етилового ефі3,06 (дд, 1Н); 3,18 (дд, 1Н); 3,99 (м, 1Н); 7,40 (д, ру 3-(6-амінопіридин-3-іл)-2-(1-бензгідрил-1Н1Н); 7,22 (д, 1Н); 7,60 (с, 1Н); 7,70-7.82 (м, 5Н); імідазол-4-іл)пропіонової кислоти. 7,98 (с, уш, 2Н); 7,99 (с, 1Н); 8,46 (с, 1Н). Таким чином, отриманий продукт обробляють Приклад 27 за допомогою 0,4мл напівконцентрованої соляної 3-(6-Амінопіридин-3-іл)-2-[1-(5кислоти і протягом 3 хвилин при температурі хлорбензо[b]тіофен-3-ілметил)-1Н-імідазол-4180°С обробляють у мікрохвильовій установці. іл]пропіонова кислота Шляхом сушіння виморожуванням, після охолоВказану у заголовку сполуку отримують аналоджування реакційної суміші отримують 5мг вказагічно вказаній у прикладі 24; її отримують у вигляді ної у заголовку сполуки у вигляді бісгідрохлориду. бістрифторацетату при використанні препаратив+ Rt (спосіб А)=1,04хв.; МС (ES+)=399 [М+Н] ; ної ВЕРХ. 1 H-ЯМР (500МГц, ДМСО-d6): δ = 3,05 (дд, 1Н); Rt (спосіб А)=0,98хв.; МС (ES+)=413 [М+Н]+; 1 3,11 (дд, 1Н); 3,70 (м, 1Н); 4,12 (м, 1Н); 6,38 (дд, H-ЯМР (500МГц, ДМСО-d6): δ = 2,98 (дд, 1Н); 1Н); 7,02 (с, 1Н), 7,12 (дд, 1Н), 7,23-7,51 (м, 6Н), 3,13 (дд, 1Н); 4,06 (м, 1Н); 5,61 (с, 2Н); 6,78 (д, 1Н); 7,67 (д, 1Н), 7,72 (м, 1Н); 8,02 (с, уш, 2Н), 9,03 (с, 7,42-7,53 (м, 2Н); 7,63 (д, 1Н); 7,70 (с, 1Н); 7,841Н). 7,98 (м, 3H); 8,02 (с, 1Н); 8,09 (д, 1Н); 8,92 (с, уш, Приклад 24 1Н). 3-(6-Амінопіридин-3-іл)-2-[1-(4-[1,2,4]триазолПриклад 28 1-ілбензил)-1Н-імідазол-4-іл]пропіонова кислота 3-(6-Амінопіридин-3-іл)-2-{1-[3-(4Розчин 60мг (0,23ммоль) етилового ефіру 3-(6фторфенокси)бензил]-1Н-імідазол-4-іл}пропіонова амінопіридин-3-іл)-2-(1Н-імідазол-4-іл)пропіонової кислота кислоти (приклад 1g) у 0,5мл диметилформаміду Вказану у заголовку сполуку отримують аналопри кімнатній температурі змішують з 11мг гічно вказаній у прикладі 24; її отримують у вигляді (0,23ммоль, 50%-ний) гідриду натрію і перемішубістрифторацетату при використанні препаративють протягом 1 години. Потім додають 55мг ної ВЕРХ. 51 87306 52 1 Rt (спосіб А)=1,09хв.; МС (ES+)=433 [М+Н]+; H-ЯМР (500МГц, ДМСО-d6): δ = 3,11 (дд, 1Н); 1 3,20 (дд, 1Н); 3,78 (с, 1Н); 4,21 (т, 1Н); 5,12 (д, 2Н); H-ЯМР (500МГц, ДМСО-d6): δ = 2,98 (дд, 1Н); 6,92 (д, 1Н); 7,54 (с, 1Н); 7,75 (м, 2Н); 8,04 (с, уш, 3,13 (дд, 1Н); 4,08 (м, 1Н); 5,30 (с, 2Н); 6,81 (д, 1Н); 2Н); 9,03 (с, 1Н). 6,95 (дд, 2Н); 7,07 (м. 3H); 7,23 (дд, 2Н); 7,40 (дд, Приклад 32 1Н); 7,44 (м, 1Н); 7,69 (м, 2Н); 7,93 (с, уш, 2Н); 8,87 3-(6-Амінопіридин-3-іл)-2-(1-бут-2-иніл-1Н(с, уш, 1Н). імідазол-4-іл)-пропіонова кислота Приклад 29 Приклад 32а 3-(6-Амінопіридин-3-іл)-2-[1-(2Етиловий ефір 3-(6-амінопіридин-3-іл)-2-(1феноксибензил)-1Н-імідазол-4-іл]пропіонова кисбут-2-иніл-1Н-імідазол-4-іл)пропіонової кислоти лота Розчин 60мг (0,23ммоль) етилового ефіру 3-(6Вказану у заголовку сполуку отримують аналогічно вказаній у прикладі 24, її отримують у вигляді амінопіридин-3-іл)-2-(1Н-імідазол-4-іл)пропіонової бістрифторацетату при використанні препаративкислоти (приклад 1g) в 0,5мл диметилформаміду ної ВЕРХ. при кімнатній температурі змішують з 11мг Rt (спосіб А)=1,05хв.; МС (ES+)=415 [М+Н]+; (0,23ммоль, 50%-ний) гідриду натрію і перемішу1 ють протягом 1 години. Потім додають 31мг H-ЯМР (500МГц, ДМСО-d6): δ = 2,97 (дд, 1Н); (37мкл, 0,23ммоль) 1-бром-2-бутину і перемішують 3,13 (дд, 1Н); 4,03 (м, 1Н); 5,37 (с, 2Н); 6,82 (м, 2Н); протягом 1 години при кімнатній температурі. Змі6,90 (д, 2Н); 7,17 (м, 2Н); 7,30 (д, 1Н); 7,32-7,43 (м, шують потім з 1мл води і екстрагують діетиловим 4Н); 7,69 (м, 2Н); 7,92 (с, уш, 2Н); 8,82 (с, уш, 1Н). ефіром. Органічну фазу сушать над Na2SO4, фільПриклад 30 трують і концентрують. Шляхом хроматографії 3-(6-Амінопіридин-3-іл)-2-[1-(4залишку на силікагелі отримують 28мг вказаної у феноксибензил)-1Н-імідазол-4-іл]пропіонова кисзаголовку сполуки. лота + Rt (спосіб А)=0,69хв.; МС (ES+)=313 [М+Н] Вказану у заголовку сполуку отримують аналоПриклад 32b гічно вказаній у прикладі 24, її отримують у вигляді 3-(6-Амінопіридин-3-іл)-2-(1-бут-2-иніл-1Нбістрифторацетату при використанні препаративімідазол-4-іл)-пропіонова кислота ної ВЕРХ. + Розчин 25мг (0,08ммоль) сполуки, отриманої Rt (спосіб A)=1,08хв.; MC (ES+)=415 [М+Н] ; 1 згідно з прикладом 32а, в 2мл тетрагідрофурану H-ЯМР (500МГц, ДМСО-d6): δ = 2,99 (дд, 1Н); змішують з 88мкл 1н розчину NaOH і перемішують 3,13 (дд, 1Н); 4,07 (м, 1Н); 5,28 (с, 2Н); 6,84 (д, 1Н); протягом 4 годин при кімнатній температурі. Потім 7,01 (м, 3H); 7,17 (дд, 1Н); 7,32 (д, 2Н); 7,40 (м, і ще раз після перемішування протягом ночі дода3H); 7,48 (м, 1Н); 7,68 (м, 2Н); 7,90 (с, уш, 2Н); 8,88 ють по 40мкл 1н розчину NaOH. Після подальшого (с, уш, 1Н). перемішування протягом 24 годин нейтралізують з Приклад 31 допомогою 2н НCl і реакційну суміш піддають су3-(6-Амінопіридин-3-іл)-2-(1-проп-2-ініл-1Ншінню виморожуванням. Шляхом препаративної імідазол-4-іл)-пропіонова кислота ВЕРХ отримують 5мг вказаної у заголовку сполуки Приклад 31а у вигляді бістрифторацетату. Диметиловий ефір 2-(6-трет+ Rt (спосіб А)=0,23хв.; МС (ES+)=285 [М+Н] ; бутоксикарбоніламінопіридин-3-ілметил)-2-(11 H-ЯМР (500МГц, ДМСО-d6): δ = 1,88 (с, 3H); проп-2-ініл-1Н-імідазол-4-іл)малонової кислоти 3,12 (м, 2Н); 4,18 (м, 1Н); 5,02 (с, 2Н); 6,93 (д, 1Н); Розчин 100мг (0,25ммоль) диметилового ефіру 7,56 (с, 1Н); 7,78 (м, 2Н); 8,04 (с, уш, 2Н); 8,97 (с, 2-(6-трет-бутоксикарбоніламінопіридин-3-ілметил)уш, 1Н). 2-(1Н-імідазол-4-іл)-малонової кислоти (приклад Наступні сполуки отримують аналогічно вказа12d) у 2мл диметилформаміду послідовно змішуній у прикладі 1: ють з 322мг (0,99ммоль) карбонату цезію, а також Приклад 33 з 20мкл (0,27ммоль, 80%-ний у толуолі) пропаргіл3-(6-Амінопіридин-3-іл)-2-[1-(4,4броміду. Суміш перемішують протягом 3 годин при диметилциклогексил)-1Н-імідазол-4-іл]пропіонова кімнатній температурі, потім виливають у воду і кислота у вигляді бісгідрохлориду екстрагують діетиловим ефіром. Шляхом хромато+ Rt (спосіб С)=0,93хв.; МС (ES+)=343 [М+Н] ; графічного очищення на силікагелі отримують 1 H-ЯМР (500МГц, ДМСО-d6): δ = 0,93 (с, 3H); 27мг вказаної у заголовку сполуки. 1 1,00 (с, 3H); 1,33 (м, 2Н); 1,48 (м, 2Н); 1,85 (м, 4Н); H-ЯМР (400МГц, CDCl3): δ = 1,49 (с, 9Н); 1,52 3,04 (дд, 1Н); 3,20 (дд, 1Н); 4,11 (т, 1Н); 4,16 (м, (д, 1Н); 2,52 (м, 1Н); 3,60 (с, 2Н); 4,67 (д, 2Н); 6,98 1Н); 6,90 (д, 1Н); 7,73 (д, 2Н); 7,81 (с, 1Н); 8,02 (с, (д, 1Н); 7,12 (с, 1Н); 7,21 (с, 1Н); 7,60 (с, 1Н); 7,68 2Н, уш); 9,14 (с, 1Н). (д, 1Н). Аналогічно вказаній у прикладі 10 отримують Приклад 31b нижченаведені сполуки: 3-(6-Амінопіридин-3-іл)-2-(1-проп-2-ініл-1НПриклади 34-36 імідазол-4-іл)-пропіонова кислота 3-(6-Амінопіридин-3-іл)-2-{1Розчин 40мг (0,09ммоль) сполуки, отриманої [(бензгідрилметилкарбамоїл)-метил]-1H-імідазолзгідно з прикладом 31а, в 1,4мл напівконцентрова4-іл}пропіонова кислота у вигляді бістрифтораценої соляної кислоти нагрівають протягом 9 годин тату. при температурі 95°С. Шляхом сушіння виморожу+ Rt (спосіб С)=1,18хв.; МС (ES+)=470 [М+Н] ванням, після охолоджування, отримують 21мг 3-(6-Амінопіридин-3-іл)-2-[1-({[(4вказаної у заголовку сполуки у вигляді бісгідроххлорфеніл)фенілметил]-карбамоїл}метил)-1Нлориду. 53 87306 54 імідазол-4-іл]пропіонова кислота у вигляді бістриВказану у заголовку сполуку отримують шляфторацетату. хом перетворення сполуки, отриманої згідно з приRt (спосіб С)=1,22хв.; МС (ES+)=490 [М+Н]+ кладом 37b, аналогічно вказаній у прикладах 12e12g і подальшого, відомого з літератури звичайноабо го відщеплення захисної групи у суміші 3-(6-Амінопіридин-3-іл)-2-[1-({[біс(4СН2СІ2/ТФОК (1:1). Потім здійснюють заміщення як метоксифеніл)метил]-карбамоїл}метил)-1Німідазол-4-іл]пропіонова кислота у вигляді бістривказується у прикладі 10с. Шляхом препаративної фторацетату. ВЕРХ отримують 8мг вказаної у заголовку сполуки + Rt (спосіб В)=0,92хв.; МС (ES+)=516 [М+Н] у вигляді бістрифторацетату. + Приклад 37 Rt (спосіб В)=0,73хв.; МС (ES+)=409 [М+Н] ; 1 3-(6-Амінопіридин-3-іл)-2-{1-[4-(3H-ЯМР (400МГц, ДМСО-d6): δ = 0,88 (т, 3H); пропілуреїдо)феніл]-1Н-імідазол-4-іл}пропіонова 1,45 (дт, 2Н); 3,07 (м, 3H); 3,18 (м, 1Н); 3,97 (т, 1Н); кислота 6,28 (т, 1Н); 6,89 (д, 1Н); 7,51 (м, 4Н); 7.21 (д, 2Н); Приклад 37а 7,31 (д, 1Н): 7,86 (с, 2Н, уш);8,19(с, 1Н). Метиловий ефір 3-(6-третПриклад 38 бутоксикарбоніламінопіридин-3-іл)-2-[1-(толуол-43-(6-Амінопіридин-3-іл)-2-{1-[4-(толуол-4сульфоніл)-1Н-імідазол-4-іл]пропіонової кислоти сульфоніламіно)-феніл]-1Н-імідазол-4Розчин 1,00г (3,39ммоль) метилового ефіру (1іл}пропіонова кислота бензолсульфоніл-1Н-імідазол-4-іл)оцтової кислоти Приклад 38а (приклад 1d) у 100мл тетрагідрофурану охолоМетиловий ефір 3-(6-третджують до температури -78°С і протягом 3 хвилин бутоксикарбоніламінопіридин-3-іл)-2-{1-[біс(4змішують, у три порції, з 3,74мл (3,74ммоль. 1Μ (толуол-4-сульфоніл)аміно)феніл]-1Н-імідазол-4розчин у тетрагідрофурані) іл}-пропіонової кислоти біс(триметилсиліл)аміду літію. Перемішують проГотують розчин 115мг (0,26ммоль) метилового тягом 5 хвилин при цій температурі і потім змішуефіру 2-[1-(4-амінофеніл)-1Н-імідазол-4-іл]-3-(6ють, в одну порцію, з 0,65г (2,26ммоль) треттрет-бутоксикарбоніламіно-піридин-3бутилового ефіру (5-бромметилпіридин-2іл)пропіонової кислоти (отримують згідно з приіл)карбамінової кислоти (приклад 1b). Залишають кладом 37b) в 20мл CH3CN. Розчин охолоджують перемішуватися протягом 1 години при темперадо температури 0°С, потім додають 60мг турі -78°С і потім доводять до кімнатної темпера(0,32ммоль) п-толуолсульфонілхлориду, 73мкл тури. Суміш вносять до суміші з етилацетату і на(53мг, 0,53ммоль) триетиламіну і 0,3мг (2,6мкмоль) сиченого розчину NaHCO3. Після струшування 4-диметиламінопіридину. Суміш нагрівають до органічну фазу відділяють, сушать над Na2SO4, кімнатної температури і витримують протягом ночі. фільтрують і концентрують досуха. Залишок переШляхом колонкової хроматографії на силікагелі кристалізовують з суміші етилацетат/гептан. Крисотримують 112мг вказаної у заголовку сполуки. + тали, що утворилися, відфільтровують під вакууRt (спосіб В)=1,45хв.; МС (ES+)=746 [М+Н] мом, промивають невеликою кількістю Приклад 38b етилацетату і гептану і висушують. Отримують 3-(6-Амінопіридин-3-іл)-2-{1-[4-(толуол-40,66г вказаної у заголовку сполуки. сульфоніламіно)-феніл]-1Н-імідазол-4+ Rt (спосіб В)=1,30хв.; МС (ES+)=501 [М+Н] іл}пропіонова кислота Приклад 37b Розчин 109мг (0,146ммоль) сполуки, отримаМетиловий ефір 3-(6-третної згідно з прикладом 38а,в 1мл тетрагідрофурабутоксикарбоніламінопіридин-3-іл)-2-(1Н-імідазолну змішують з 190мкл (0,190ммоль) 1н водного 4-іл)пропіонової кислоти розчину LiOH. Суміш нагрівають до температури До розчину 0,65г (1,29ммоль) метилового ефі40°С і протягом 2 днів перемішують при цій темперу 3-(6-трет-бутоксикарбоніламінопіридин-3-іл)-2ратурі. Після нагрівання при температурі 60°С [1-(толуол-4-сульфоніл)-1Н-імідазол-4протягом декількох годин розчин охолоджують до іл]пропіонової кислоти (приклад 37а) в 25мл метакімнатної температури, нейтралізують з допомонолу додають 0,80г (5,24ммоль) 1гою 1н НCl і тетрагідрофуран видаляють при знигідроксибензотриазолгідрату і суміш перемішують женому тиску. Отриманий водний розчин очищапротягом 2 годин при кімнатній температурі. Розють шляхом препаративної ВЕРХ і отримують чинник випарюють при зниженому тиску і залишок чисту 3-(6-трет-бутоксикарбоніламінопіридин-3-іл)очищають на силікагелі при використанні суміші 2-{1-[4-(толуол-4-сульфоніламіно)феніл]-1Нрозчинників з СН2СІ2 і 10%-ного розчину аміаку в імідазол-4-іл}пропіонову кислоту. Сполуку розчиметанолі. Шляхом другої колонкової хроматографії няють в 1мл ТФОК і перемішують при кімнатній на силікагелі отримують 341мг вказаної у заголовтемпературі. Через 30 хвилин ТФОК видаляють ку сполуки. при зниженому тиску, залишок розчиняють у воді і + Rt (спосіб В)=0,78хв.; МС (ES+)=347 [М+Н] ; ліофілізують. Отримують 24мг вказаної у заголов1 H-ЯМР (400МГц, ДМСО-d6): δ = 1,46 (с, 9Н), ку сполуки у вигляді бістрифторацетату. + 3,08 (м, 2Н); 3,52 (с, 3H); 3,87 (т, 1Н); 6,92 (с, 1Н); Rt (спосіб В)=0,84хв.; МС (ES+)=487 [М+Н] ; 1 6,98 (д, 1Н); 7,55 (с, 1Н); 7,63 (д, 1Н); 7,98 (с, 1Н). H-ЯМР (400МГц, ДМСО-d6): δ = 1,22 (с, 3H); Спосіб 37с 3,02 (дд, 1Н); 3,13 (дд, 1Н); 3,92 (т, 1Н); 6,87 (д, 3-(6-Амінопіридин-3-іл)-2-{1-[4-(31Н); 7,21 (д, 2Н); 7,88 (д, 2Н); 7,53 (д, 2Н); 7,62 (с, пропілуреїдо)феніл]-1Н-імідазол-4-іл}пропіонова 1Н); 7,68 (д, 2Н); 7,72 (с, 1Н);.7.77 (д, 1Н); 7,88 (с, кислота 2Н, уш); 8,44 (с, 1Н, уш). Приклад 39 55 87306 56 3-(2-Амінотіазол-4-іл)-2-{13-(6-Амінопіридин-3-іл)-2-{1-[3-(3[(бензгідрилкарбамоїл)метил]-1Н-імідазол-4пропілуреїдо)бензил]-1Н-імідазол-4-іл}пропіонова іл}пропіонова кислота кислота Сполуку отримують аналогічно вказаній у приВказану у заголовку сполуку отримують аналокладах 37а-37b і 10b. Відщеплення захисної групи гічно вказаній у прикладі 38. Тільки омилення проміжного продукту - ефіру карбонової кислоти здійснюють як описано. + здійснюють іншим чином: Rt (спосіб С)=1,13хв.; МС (ES+)=462 [М+Н] ; 1 Метиловий ефір 3-(6-амінопіридин-3-іл)2-{1-[3H-ЯМР (500МГц, ДМСО-d6): δ = 2,75 (м, 1Н), (3-пропілуреїдо)бензил]-1Н-імідазол-43,10 (м, 1Н); 3,50 (с, 2Н); 3,75 (м, 1Н); 3,98 (д, 2Н); іл}пропіонової кислоти (120мг, 0,275ммоль) розчи6,07 (с, 1Н); 6,10 (д, 1Н); 6,65 (с, 1Н); 7,20-7,35 (м, няють у тетрагідрофурані. Додають водний роз9Н); 7,39 (с, 1Н); 7,40 (т, 1Н); 8,78 (д, 1H). чин, що містить LiOH (1н, 275мкл) і водний розчин Приклад 44 пероксиду водню (30%, 27мкл). Розчин перемішу3-(2-Амінотіазол-4-іл)-2-[1-({[(4ють протягом ночі при кімнатній температурі і похлорфеніл)фенілметил]-карбамоїл}метил)-1Нтім протягом 4 годин при температурі 50°С. Реакімідазол-4-іл]пропіонова кислота ційний розчин нейтралізують за допомогою Сполуку отримують аналогічно вказаній у приводного розчину НCl (1н) і потім розчинник видакладах 37а-37b і 10b. Відщеплення захисної групи ляють. Залишок обробляють невеликою кількістю здійснюють як описано. + метанолу і фільтрують через С18-колонку (500мг). Rt (спосіб С)=1,26хв.; МС (ES+)=496 [М+Н] ; 1 Метанол видаляють і отриманий продукт кристаліH-ЯМР (500МГц, ДМСО-d6): δ = 2,78 (м, 1Н), зують з діетилового ефіру (100мг, 0,237ммоль). 3,10 (м, 1Н); 3,50 (с, 2Н); 3,75 (м, 1Н); 3,95 (д, 2Н); Rt (спосіб С)=0,93хв.; МС (ES+)=423 [М+Н]+; 6,08 (с, 1Н); 6,11 (д, 1Н); 6,65 (с, 1Н); 7,20-7,41 (м, 1 H-ЯМР (500МГц, ДМСО-d6): δ = 0,85 (т, 3H), 9Н); 7,60 (т, 1Н); 8,85 (д, 1Н). 1,42 (кв, 2Н); 2,65 (м, 1Н), 2,92 (м, 1Н); 3,02 (м, 2Н); Сполуку згідно з прикладами 45 і 46 отриму3,45 (м, 2Н); 5,00 (с, 2Н); 5,50 (с, 2Н); 6,25 (д, 1Н); ють аналогічно тому, як описується вище. 6,60 (д, 1Н); 6,73 (с, 1Н); 7,05 (д, 1Н); 7,21 (т, 1Н); Приклад 45 7,23 (с, 1Н); 7,33 (д, 1Н); 7,50 (м, 1Н); 7,62 (с, 3-(6-Амінопіридин-3-іл)-2-{1-[4-(3-трет1Н);9,12(с,1Н).· бутилуреїдо)феніл]-1Н-імідазол-4-іл}пропіонова Приклад 40 кислота у вигляді бістрифторацетату + 3-(6-Амінопіридин-3-іл)-2-{1-[3-(3Rt (спосіб В)=0,75хв.; МС (ES+)=423 [М-+Н] ; 1 фенетилуреїдо)бензил]-1Н-імідазол-4H-ЯМР (400МГц, ДМСО-d6): δ = 1,29 (с, 9Н); іл}пропіонова кислота 3,10 (дд, 1Н); 3,28 (дд, 1Н); 4,09 (т, 1Н); 6,72 (д, Сполуку отримують аналогічно вказаній у при2Н); 7,28 (д, 1Н); 7,33 (д, 2Н); 7,56 (д, 1Н); 7,85 (с, кладі 39. 1Н); 7,92 (с, 1Н); 7,99 (с, 1Н); 9,03 (с, 1Н); 9,28 (с, + Rt (спосіб В)=0,86хв.; МС (ES+)=485 [М+H] ; 1Н). 1 H-ЯМР (500МГц, ДМСО-d6): δ = 2,72 (м, 2Н); Приклад 46 2,85 (м, 1Н), 2,95 (м, 1Н); 3,25 (м, 2Н); 3,50 (с, 2Н); 3-(6-Амінопіридин-3-іл)-2-{1-[4-(34,95 (с, 1Н); 5,05 (с, 1Н); 5,45 (с, 1Н); 5,55 (с, 1Н); бензилуреїдо)феніл]-1Н-імідазол-4-іл}пропіонова 6,28 (дд, 1Н); 6,65 (т, 1Н); 6.92 (с, 1Н); 7,08-7,31 (м, кислота у вигляді бістрифторацетату + 9Н); 7,62 (м, 2Н); 9,15 (с, 1Н). Rt (спосіб В)=0,81хв.; МС (ES+)=457 [М+Н] ; 1Приклад 41 H-ЯМР (400МГц, ДМСО-d6): δ = 3,03 (дд, 1Н); 3-(6-Амінопіридин-3-іл)-2-{1-[3-(33,18 (дд, 1Н); 3,99 (т, 1Η); 4,32 (д, 2Н); 6,79.(т, 1Н); бензилуреїдо)бензил]-1Н-імідазол-4-іл}пропіонова 6,90 (д, 1Н); 7,22 (м, 1Н); 7,32 (м, 4Н); 7,49 (д, 2Н); кислота 7,53 (д, 2Н); 7,72 (с, 2Н); 7,28 (д, 1Н); 7,88 (с, 2Н, Сполуку отримують аналогічно вказаній у приуш); 8,71 (с, 1Н, упі); 8,86 (с, 1Н). кладі 39. Приклад 47 + Rt (спосіб В)=0,84хв.; МС (ES+)=471 [М+Н] ; Етиловий ефір 3-(6-амінопіридин-3-іл)-2-(11 H-ЯМР (500МГц, ДМСО-d6): δ = 2,65 (м, 1Н); циклогексил-1Н-імідазол-4-іл)пропіонової кислоти 2,92 (м, 1Н), 3,45 (м, 2Н); 3,75 (м, 1Н); 4,25 (д, 2Н); Вказану у заголовку сполуку синтезують у ви5,00 (с, 2Н); 5,50 (с, 2Н); 6,25 (м, 1Н); 6,65 (м, 1Н); гляді гідрохлориду аналогічно вказаній у прикладі 6,78 (с, 1Н); 7,08-7,40 (м, 9Н); 7,62 (м, 2Н); 9,45 (с, 2. + 1Н). Rt (спосіб С)=0,87хв.; МС (ES+)=343 [М+Н] ; 1 Приклад 42 H-ЯМР (500МГц, ДМСО-d6): δ = 1,12 (т, 3H), 3-(6-Амінотридин-3-іл)-2-{1-[3-(31,13-1,27 (м, 1Н), 1,31-1,41 (м, 2Н), 1,61-1,73 (м, вінілуреїдо)бензил]-1Н-імідазол-4-іл}пропіонова 3H), 1,80-1,86 (м, 2Н), 1,98-2,05 (м, 2Н). 3,12 (дд, кислота 1Н), 3,18 (дд, 1Н), 4,12 (м, 2Н), 4,21-4,27 (м, 2Н), Сполуку отримують аналогічно вказаній у при6,93 (д, 1Н), 7,72-7,78 (м, 3H), 8,08 (с, 2Н), 9,12 (с, кладі 39. 1Н). + Rt (спосіб В)=0,60хв.; МС (ES+)=407 [М+Н] ; Фармакологічні приклади 1 H-ЯМР (500МГц, ДМСО-d6): δ = 2,68 (м, 1Н); Отримані речовини тестували на інгібування 2,92 (м, 1Н), 3,45 (м, 2Н); 3,82 (м, 1Н); 4,18 (м, 2Н); TAFIa при використанні набору «Actichrome 5,00 (с, 2Н); 5,50 (с, 2Н); 6,25 (д, 1Н); 6,62-6,77 (м, Plasma TAFI Activity», що випускається фірмою 3H); 7,09 (м, 1Н); 7,25 (м, 2Н); 7,45 (м, 1Н); 7,62 (м, American Diagnostica (реєстраційний номер 874). 2Н). При цьому до 1мкл 5мМ розчину речовини в димеПриклад 43 тилсульфоксиді додавали 29мкл буферу для тесту (20мМ Гепес, 150мМ NaCl, pH 7,4) і 10мкл TAFIa 57 87306 (American Diagnostica; реєстраційний номер 874TAFIa; 2,5/мл) і протягом 15 хвилин інкубували при кімнатній температурі в 96-ямковому титраційному мікропланшеті. Ферментативну реакцію ініціСполука з ювали шляхом додавання 10мкл TAFIa Приклад 1 «Developer» (заздалегідь при розведенні водою у Приклад 7 співвідношенні 1:2). За протіканням реакції у часі Приклад 8 спостерігали протягом 15 хвилин при 420нм, викоПриклад 9 ристовуючи апарат для прочитування титраційних Приклад 10 мікропланшетів (SpectraMax plus 384; фірма Приклад 12 Molecular Devices). Приклад 13 Значення ІК50 (концентрація, що викликає Приклад 15 50%-не інгібування) розраховували з середніх знаПриклад 16 чень (подвійне визначення) ряду розведення реПриклад 17 човини за допомогою програмного забезпечення Приклад 18 Graft 4 (Erithacus Software, UK). Приклад 25 Результати представлені у таблиці. Приклад 27 Приклад 28 Приклад 31 Приклад 33 Приклад 37 Приклад 38 Комп’ютерна верстка О. Гапоненко Підписне 58 Таблиця Аналіз на фермент TAFI ІК50 [мМ] 0,030 0,016 1,13 0,439 0,023 0,015 0,012 0,012 0,038 0,011 0,021 10,51 1,11 1,44 0,87 0,003 0,049 0,050 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюImidazole derivatives used as tafia inhibitors
Автори англійськоюKallus, Christopher, Heitsch Holger, Lindenschmidt Andreas, Grueneberg Sven, Szillat Hauke
Назва патенту російськоюПроизводные имидазола как ингибиторы tafia
Автори російськоюКаллус Кристофер, Хайч Хольгер, Линденшмидт Андреас, Грюнеберг Свен, Силлат Хауке
МПК / Мітки
МПК: A61K 31/435, A61P 7/00, C07D 401/06, C07D 417/06, C07D 401/14, A61K 31/41, C07D 409/14
Мітки: tafia, інгібітори, імідазолу, похідні
Код посилання
<a href="https://ua.patents.su/29-87306-pokhidni-imidazolu-yak-ingibitori-tafia.html" target="_blank" rel="follow" title="База патентів України">Похідні імідазолу як інгібітори tafia</a>
Попередній патент: Штампований скребок дволанцюгового скребкового конвеєра
Наступний патент: Стільниковий телефонний апарат, його sim-карта і спосіб активування телефонного апарата
Випадковий патент: Укриття вагонне












