Спосіб одержання фенілперфторалкілсульфідів
Номер патенту: 1404
Опубліковано: 25.03.1994
Автори: Кошечко Вячеслав Григорович, Бойко Володимир Миколайович, Кіпріанова Лідія Андріївна, Філєлєєва Людмила Іванівна
Формула / Реферат
Способ получения фенилперфторалкил-сульфидов общей формулы 1:
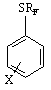
где rf = СF3, С3F7,
Х = Н, 4 - CI, 4 – NНСООСН3, путем взаимодействия замещенных тиофенолов с перфторалкилиодидами в среде полярного апротонного растворителя, отличающийся тем, что процесс ведут при комнатной температуре в присутствии в качестве гомогенного катализатора метилвиологена, в количестве 6-7% от массы тиофенола.
Текст
Изобретение относится к усовершенствованному перфторалкилсульфидов общей формулы 1: SRF способу получения ароматических X где RF = СF3, С3F 7, Х = Н, 4 - CI, 4 – NНСООСН3, которые являются ценными исходными веществами для синтеза фотосенсибилизаторов, биологически активных веществ, синтетических красителей. Известны способы получения арилфтор-метилсульфидов путем хлорирования арил-метилсульфидов и последующим фторированием образующихся арилтрихлорметилсульфидов трехфтористой сурьмой или безводным фтористым водородом [1-2]: Cl HF или BF3 RC6H4SCH3 ¾¾2 ® RC6H4 SCCl3 ¾¾¾¾ ¾ ® RC6H4SCF3 ¾ ¾ Существенными недостатками этого метода являются его двустадийность, необходимость применения элементарного хлора, образование в значительных количествах побочных продуктов: во второй стадии для фторирования трихлорметилсульфидов используется автоклавное оборудование с применением агрессивного и токсичного безводного фтористого водорода или дорогостоящей трехфтористой сурьмы. Известен также метод прямого введения трифторметилсульфидной группы в ароматическое ядро, основанный на использовании трифторметилмеркаптидов меди или ртути и арилиодидов. При взаимодействии арилиодидов с трифторметилмеркаптидом одновалентной меди в среде N метилпирролидона: хинолина или диметилформамида образуются соответствующие тиоэфиры [3]: RC6H4I + CuSCF3 ® RC6H4SCF3 Такой метод позволяет синтезировать с достаточно высоким выходом арилтрифторметилсульфиды лишь с электроноакцепторными заместителями в кольце; при синтезе тиоэфиров из арилиодидов с электронодонорными заместителями выход целевых продуктов составляет 20-40%. Кроме того недостатком этого метода служит также необходимость предварительного получения CuSCF3 из AgSCF3; синтез последнего из солей серебра с избытком CS2 в автоклаве при 140° - взрывоопасный, дорогостоящий и трудоемкий процесс. Более усовершенствованный аналогичный способ включает образование трифторметилмеркаптида меди непосредственно в реакционном растворе из трифтормеркаптида ртути [4]: Cu RC6H4I + Hg( SCF3 )2 ¾¾ ® RC6H4SCF3 + Hg ¾ Однако, этот метод целый ряд недостатков - необходимость работать с высокотоксичными соединениями ртути, образование в результате реакции металлической ртути, использование для синтеза Нg(SСF3)2 фторида ртути, получаемого с участием агрессивного элементарного фтора. Известен способ введения в конденсацию с тиофенолами перфторалкилбромидов при УФ-облучении и низких температурах (-70° + -80°С) в присутствии катализатора-йодистых солей [5] или без облучения, но при высоком давлении [6]. Недостатком этого метода, помимо необходимости применения специальной аппаратуры для УФ-облучения (а соответственно, и методов защиты персонала) или высокого давления, является возможность достижения высоких выходов целевых продуктов при использовании тиолов только с электронодонорными заместителями. Немаловажным фактором является также и то, что в условия х УФоблучения разветвленные перфторалкилиодиды претерпевают гомолитическую деструкцию, что снижает выход перфторалкилсульфидов. По сущности и достигаемому результату наиболее близким к заявленному способу является выбранный в качестве прототипа способ ион-радикального перфторалкилирования тиолов перфторалкилиодидами. инициированного УФ-облучением в среде жидкого аммиака или органического растворителя [7]. RC6H4SH + RFI ® RRC6H4SRF Суть этого способа заключается а том, что в пирексовую колбу, снабженную холодильником глубокого охлаждения со смесью сухого льда, помещают навеску тиофенола, конденсируют при температуре до (-30°С) жидкий аммиак и трифторметилиодид. Колбу с реакционной смесью освещают ртутной лампой ПРК-4 в 20-30 см от сосуда в течение от 0,5 часов до 18 часов. После удаления аммиака к смеси добавляют NaOH и выделяют целевой продукт. Выходы n-ClC 6H4SCF3 и C6Н5SCF 3 при этом достигают 72 и 76%, соответственно. Взаимодействие тиофенола с трифторметилиодидом может быть осуществлено при УФ-облучении и в полярном органическом растворителе в присутствии щелочи. Указанный способ, однако, имеет ряд существенных недостатков: 1. Усложнение технологии получения целевых продуктов вследствие необходимости использования УФоблучения, требующего ртутны х ламп, пирексовой или кварцевой посуды, защиты рабочего персонала и т.п. 2. Усложнение технологии, связанное с необходимостью работы при весьма низких температурах. 3. В случае применения органического растворителя - двустадийность процесса за счет предварительного синтеза тиолата металла на первой стадии. 4. Выход целевых продуктов по исходному тиофенолу в большинстве случаев не достигает количественного. Задачей изобретения является разработка способа получения фенилперфторалкилсульфидов, который за счет введения в реакционную смесь гомогенного катализатора обеспечивает повышение выхода целевого продукта и упрощение технологического процесса. Поставленная задача решается тем, что фенилперфторалкилсульфиды общей формулы Х - C6H4SRF (X = Н, 4-Сl, n – NНСООСН3; RF – СF3 , С3 F7), получают путем взаимодействия замещенных тиофенолов с перфторалкилиодидами в среде полярного апротонного растворителя в присутствии катализатора метилвиологена, причем катализатор используют в количестве 6-7% от массы тиофенола. Используемый в качестве гомогенного катализатора дикатион метилвиологена (MV2+) описывается формулой: CH3 + + CH 3 2A-, (MV 2+) где А- - СI-, СlO4-, ВF4- и др. Предлагаемый процесс основан на обнаруженном эффекте активации катионрадикалом метилвиологена (MV+) распада перфторалкилгалогенида на активный перфторалкильный радикал RF и ион галогена. Для проведения перфторалкилирования в раствор тиофенола в апротонном органическом растворителе, содержащем триэтиламин или другое основание и перфторалкилиодид, добавляют катализатор MV2+ Ниже представлено описание технической реализации заявляемого способа. Взаимодействие RFI с тиофенолом проводят в стеклянной колбе с вводом и выводом для барботирования инертного газа. В качестве среды для проведения процесса целесообразно использовать, апротонные органические растворители, поскольку растворители, содержащие подвижный протон, могут приводить к протонированию как тио-фенолйта, так и образующихся в стадиях анион-радикалов, что, в свою очередь, будет приводить к образованию побочных продуктов. Среди апротонных растворителей (ди-метоксиэтан, пропилен карбонат, диметилформамид, ацетонитрил и др.) предпочтительно использовать диметилформамид (ДМФА). Способ осуществляют следующим образом. В колбу с 10-15 мл ДМФА помещают 1·10-3-1·10-2 молей тиофенола и 1-2 мл свежеперегнанного трйэтиламина и барботируют в течение 20-30 мин. инертный газ, Затем в колбу добавляют 3·10-5 + 3·10-4 молей метилвиологена (6-7% от количества взятого в реакцию тиофенола). Раствор при этом приобретает синюю окраску, характерную для МV+. К нему добавляют 3·10-3 – 2·10-2 моль перфторалкилиодида и оставляют стоять 20-40 минут. Затем содержимое колбы выливают в 100 мл воды, экстрагируют несколькими порциями эфира, эфирные вытяжки высушивают и отгоняют. Остаток перегоняют, собирая фракцию соответствующего тиоэфира. Ниже на примерах 1-5 продемонстрирована конкретная сущность и практическая реализация предлагаемого способа получения арилперфторалкилсульфидов. Пример 1. Получение фенилтрифторметилсульфи-да (С6Н3SCF3). В колбе с магнитной мешалкой, вводом и выводом для барботирования газов растворяют 0,495 г (0,0045 моль) тиофенола в смеси 15 мл диметилформамида и 1 мл триэтиламина. Раствор продувают в течение 20 мин инертным газом (аргон или азот) и добавляют 0,0751 г (0,00029 моль) хлорида метилвиологена (6,5% от количества взятого тиофенола). Раствор окрашивают в синий цвет. Затем, отключив инертный газ, в раствор с помощью перистальтического насоса пропускают 2,67 г (0,0136 моль) трифторметилиодида. Синяя окраска раствора изменяется на желто-коричневую. Оставляют раствор при перемешивании на 0,5 часа, затем выливают раствор в 100 мл холодной воды (~10° С) и экстрагируют диэтиловым эфиром (4×20 мл). Соединенные фракции эфира промывают дистиллированной водой и суша т над прокаленным Na2SO4; эфир отгоняют и образующиеся в результате реакции продукты анализируют методом ЯМР-19F. В спектре ЯМР-19 F в диметилформамиде наблюдают синглет при 118,87 м.д. (отн. С6F6), соответствующий фенилтрифторметилсульфиду. др уги х фторсодержащих продуктов при этом не наблюдалось. Количественный анализ по спектру ЯМР- 19 F (отн. С6 F6) показывает, что вы ход фенилтрифор-метилсульфида составляет 94% относительно взятого в реакцию тиофенола. Остаток перегоняют: выход выделенного фенилтрифторметилсульфида составляет 0,713г. (89%), т.кип. = 141°С, h D20 = 1,4623 . Пример 2. Получение п-карбомаилфенилтрифтор-метилсульфида(СН3СООNНС6Н4SCF3). п-Карбомаилфенилтрифторметилсульфид получают по методике, аналогичной описанной в примере 1. При этом вместо тиофенола берут 0,238 г (0,0013 моль) п-карбомаилтиофенола. Количество метилвиологена составляет 0,0234 г (0,000091 моль, 7% от количества тиосоединения), а трифторметилиодида - 0,891 г (0,00455 моль). Выделение продукта проводят экстрагированием эфиром, как описано в примере 1. После отгонки эфира продукт анализируют методом ЯМР-19F. В спектре ЯМР-19 F в диметилформамиде наблюдается синглет при 118,24 м.д: (отн. C6F6), соответствующий пкарбомаилфенилтрифторметилсульфиду. Вы ход последнего составляет 93% относительно взятого в реакцию тиофенола. Продукт очищают пропусканием его через колонку с силикагелем (элюент - бензол). Бензол отгоняют, получают п-карбомаилфенилтрифторметилсульфид с т. пл. 130°С, который не дает депрессии температуры плавления в пробе смешения с заведомым образцом. Выход 0,29 г (88,5%). Примерз. Получение п-хлорфенилтрифторметил-сульфида (СlС6Н4SСF3). Методика получения и выделения проодукта аналогична описанной в примере 1, при этом количества исходных компонентов составляют: п-хлортиофенола - 0,374 г (0,00259 моль); метилвиологена - 0,0399 г (0,000155 моль; 6,0% от количества п-хлортиофенола); трифторметилиодида 1,84 г (0,0094 моль). Выход пхлорфенилтрифторметилсульфида, рассчитанный по спектру ЯМР-19F ( d = 118,6 м.д. отн. С 6F6) составляет 0,550 г (100%). После перегонки в вакууме при 74°С/19 мм рт.ст. выход сульфида составляет 0,517 г (94%), т. кип. - 73°С/19 мм рт.ст. ПРИМЕР 4 (негативный). Получение п-хлорфеиилтрифторметил-сульфида (CIC6H4SCF3). Методика получения и выделения продукта аналогична приведенной в примере 3, но количество исходных компонентов составляет: п-хлортиофенола 0,367 г (0,00254 моль); метилвиологена 0.0036 г (0.000140 моль; 5.5% от количества п-хлортиофенола); трифторметилиодида 1,99 г (0,0101 моль). Выход п хлорфенилтрифторметилсульфида, рассчитанный по спектру ЯМР- 19 F ( d = 188,6 м.д. отн. C6F 6), составляет 0,458 г (85%). Пример 5. Получение п-хлорфенилгептафторпро-пилсульфида (CIС6Н4SС3F7) Методика получения продукта аналогична приведенной в примере 1. При этом количества исходных реагентов составляют: п-хлортиофенола 0,413 г (0,00286 моль); метилвиологена 0,0442 г (0,000172 моль; 6,0% от количества п-хлортиофенола). Вместо трифторметилиодида добавляют 2,80 г (0.0095 моль) перфторпропилиодида С 3F7I. Выделение продукта проводят экстрагированием эфиром, как описано в примере 1. Количественный анализ по спектру ЯМР- 19 F относительно С 6F6 ( d1 = 82,73 м.д. триплет; d 2 = 79,96 м.д., мультиплет; d= 39,13 ° м.д., синглет) показывает, что выход п3 хлорфенилгептафторпропилсульфата составляет 100% относительно взятого в реакцию п-хлортиофенола. Как видно из данных, представленных в таблице, а также в примерах 1-3,5, заявляемый способ по сравнению с известным имеет значительные преимущества. Он позволяет получать арилперфторалкилсульфи-ды при комнатной температуре без получения с количественным выходом. Высокая селективность способа позволяет практически избежать побочных процессов и благодаря этому получить чистый продукт. Использование катализатора (метилвиологена) в количествах, меньших 6% нижнего заявляемого предела (пример 4), приводит к снижению выхода целевого продукта. Использование катализатора в количествах, превышающи х вер хний заявляемый предел (7%), нецелесообразно, поскольку уже при 7% достигается количественный выход, и увеличение концентрации катализатора приведет к его бесполезному расходованию.
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparation of phenylperfluoralkylsulphides
Автори англійськоюKoshechko Viacheslav Hryhorovych, Kiprianova Lidiia Andriivna, Philielieeva Liudmyla Ivanivna, Boiko Volodymyr Mykolaiovych
Назва патенту російськоюСпособ получения фенилперфторалкилсульфидов
Автори російськоюКошечко Вячеслав Григорьевич, Киприанова Лидия Андреевна, Филелеева Людмила Ивановна, Бойко Владимир Николаевич
МПК / Мітки
МПК: C07C 323/29, C07C 319/00, C07C 15/02, C07C 323/09
Мітки: одержання, фенілперфторалкілсульфідів, спосіб
Код посилання
<a href="https://ua.patents.su/3-1404-sposib-oderzhannya-fenilperftoralkilsulfidiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання фенілперфторалкілсульфідів</a>
Попередній патент: Пристрій для збудження синхронної машини
Наступний патент: Спосіб одержання відливок
Випадковий патент: Пристрій для усунення міофункціональних порушень







