Спосіб одержання нових похідних піридо[1,2-а][1,3,5]триазину
Номер патенту: 59695
Опубліковано: 25.05.2011
Автори: Кривоколиско Сергій Геннадійович, Фролов Костянтин Олександрович, Доценко Віктор Вікторович
Формула / Реферат
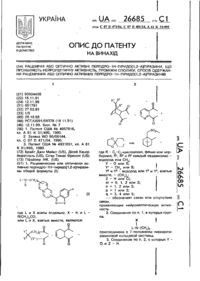
Спосіб одержання нових похідних піридо[1,2-а][1,3,5]триазину, який відрізняється тим, що до 6-аміно-3,5-дицианопіридин-2(1Н)-тіонів та -селенонів (II), у етанолі, додають первинні аміни та формальдегід, у м'яких умовах реакції Манніха, та нагрівають до повного розчинення, вихід цільових продуктів (І) знаходиться в межах 46-72 %.
Текст
Спосіб одержання нових похідних піридо[1,2а][1,3,5]триазину, який відрізняється тим, що до 6-аміно-3,5-дицианопіридин-2(1Н)-тіонів та селенонів (II), у етанолі, додають первинні аміни та формальдегід, у м'яких умовах реакції Манніха, та нагрівають до повного розчинення, вихід цільових продуктів (І) знаходиться в межах 46-72 %. (19) (21) u201013366 (22) 10.11.2010 (24) 25.05.2011 (46) 25.05.2011, Бюл.№ 10, 2011 р. (72) КРИВОКОЛИСКО СЕРГІЙ ГЕННАДІЙОВИЧ, ДОЦЕНКО ВІКТОР ВІКТОРОВИЧ, ФРОЛОВ КОСТЯНТИН ОЛЕКСАНДРОВИЧ (73) СХІДНОУКРАЇНСЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ ІМЕНІ ВОЛОДИМИРА ДАЛЯ 3 Одержані продукти мають достатню чистоту для аналізу та для подальшого використання, їх 1 будова доведена за допомогою ІЧ- і ЯМР Нспектроскопії, елементного аналізу. Корисна модель підтверджується наступними прикладами, які ілюструють, але не обмежують її об'єм. Приклад 1. Суспензію 2 ммоля тіона (II, R = 4-СlС6Н4, X = S) в 20 мл етанола нагрівають до повного розчинення, відфільтровують через паперовий фільтр, до фільтрату добавляють первинний амін (R1 = 4МеС6Н4) та надлишок (3.5 мл) 37 %-ного водного СН2О (формаліну). Суміш кип'ятять 2-3 хвилини при інтенсивному перемішуванні. Осад, що утворився, відділяють та перекристалізовують з суміші ДМФА-ЕtOН (1:1). Вихід сполуки (І, R = 4-СlС6Н4, R1 = 4-МеС6Н4, X = S) – 48 %, т. пл. 238-240 °С. Елементний аналіз, знайдено (%): С, 62.94; Н, 3.87; N, 16.80. C22H16ClN5S. Розраховано (%): С, -1 63.23; Н, 3.86; N,16.76. ІЧ-спектр, v/см : 3200 (NH), 1 2206, 2225 (2CN). Спектр ЯМР H (300 МГц, ДМСО-d6, , м.д., J, Гц): 9.61 (1Н, розш. с, NH); 3 3 7.56 (4Н, кв, J = 8.4, 4-СlС6Н4); 7.05 (4Н, кв, J = 8.3, 4-МеС6Н4); 6.04 (2Н, розш. псевдо-с, Н-4); 5.06 (2Н, розш. псевдо-с, Н-2); 2.21 (3Н, с, СН3). Приклад 2. Аналогічно прикладу 1 з тіона (II, R = фур-2-ил, X = S) та аміна (R1 = CH2Ph) отримано сполуку (I, R = фур-2-ил, R1 = CH2Ph, X = S), вихід – 64 %, т. пл. > 300 °С. Елементний аналіз, знайдено (%): С, 63.89; Н, 4.06; N, 18.80. C20H15N3OS. Розраховано -1 (%): С, 64.33; Н, 4.05; N,18.75. ІЧ-спектр, v/cм : 1 3210 (NH), 2203, 2215 (2CN). Спектр ЯМР Н (300 МГц, ДМСО-d6, , м.д.): 9.16 (1Н, розш. с, NH); 8.10 (1Н, м, Н-5фурил); 7.38 (1Н, м, Н-3фурил); 7.32 (5Н, м, С6Н5); 6.82 (1Н, м, Н-4фурил); 5.36 (2Н, розш. псевдо-с, Н-2); 3.85 (2Н, розш. с, СH2С6Н5). Джерело інформації: [1] R. J. Bochis, GB Pat. 1503046 (1978). Avail. URL: http://espacenet.com/. [2] Y. Watanabe, H. Usui, S. Kobayashi, H. Yoshiwara, T. Shibano, T. Tanaka, Y. Morishima, M. Yasuoka, M. Kanao, J. Med Chem., 35, 189 (1992). [3] Z. Wang, Haoxin Shi, Haijian Shi, Synth Commun., 31, 2841 (2001). [4] S. Yadav Lai Dhar, A. Vaish, S. Sharma, J. Agric. Food Chem., 42, 811 (1994). [5] K. A. Фролов, B. B. Доценко, С. Г. Кривоколыско, В. П. Литвинов, Изв. АН, Сер. хим., 2158 (2005). [6] Z. A. Hozcin, J. Chem. Res. (S), 3, 99 (2000). [7] A. A. O. Sarhan, S. H. Abdel-Hafez, H. ElSherief, T. Abdel-Fadl, Synth Commun., 36, 987 (2006). [8] B. B. Доценко, С. Г. Кривоколыско, А. Н. Чернега, В. П. Литвинов, ДАН, 389, 763 (2003). 59695 4 [9] В. В. Доценко, С. Г. Кривоколыско, В. П. Литвинов, ХГС, 1695 (2005). [Chem. Heterocycl. Сотр., 41, 1428 (2005)]. [10] В. В. Доценко, С. Г. Кривоколыско, В. П. Литвинов, Изв. АН, Сер. хим., 2605 (2005). [11] Shestopalov A. M., Sharanin Yu. A., Litvinov V. P., Mortikov V. Yu., Nesterov V. N. // J. Gen. Chem. USSR. 1987. 57. 959. [12] Dyachenko V. D., Nesterov V. N., Struchkov Yu. T., Sharanin Yu. A., Shklover V. E. // J. Gen. Chem. USSR. 1989. 59. 881. [13] Sharanin Yu. A., Dyachenko V. D. // J. Gen. Chem. USSR.1987. 57. 1662. [14] Sharanin Yu. A., Dyachenko V. D., Turov A. V. // J. Gen. Chem. USSR. 1990. 60. 2750. [15] Sharanin Yu. A., Shestopalov A. M., Litvinov V. P., Klokol G. V., Mortikov V. Yu., Demerkov A. S. // Zhurnal Organic. Khim. 1988. 24. 854. [16] Sharanin Yu. A., Promonenkov V. K., Shestopalov A. M., Nesterov V. N., Melenchuk S. N. // Zhurnal Organic. Khim. 1989. 25. 622. [17] May B. C.H., Zorn J. A., Witkop J., Sherrill J., Wallace A. C., Legname G., Prusiner S. B., Cohen F. E. // J. Med. Chem. 2007. 50. 65. [18] Пат. WO 2005/34950 (2005). [19] Пат. US2001/27196 (2001). [20] Frolova N. G., Zav'yalova V. K., Litvinov V. P. // Russ. Chem. Bull. 1996. 45. 893. [21] Dyachenko V. D., Krivokolysko S. G., Nesterov V. N., Litvinov V. P. // Chem. Heterocycl. Сотр. 1997. 33. 1430. [22] Elnagdi M. H., Ghozlan S. A. S., Abdelrazek F. M., Selim M. A. // J. Chem. Res. 1991.5. 1021. [23] Elkholy Y. M. // Chem. Heterocycl. Соmр. 2002. 38. 1342. [24] Elnagdi M. H., Erian A. W. // Bull. Soc. Chim. France. 1995.132. 920. [25] Issac Y. A., Ali M. S., Erian A. W. // Scientia Pharm. 2000. 68. 389. [26] Hussein A. M., Hafez I. S. A., Elnagdi M. H. // J. Chinese Chem. Soc. 2000. 47. 347. [27] Sharanin Yu. A., Shestopalov A. M., Nesterov V. N., Melenchuk S. N., Promonenkov V. K.; et al. // Zhurnal Organic. Khim. 1989. 25. 1323. [28] Dyachenko V. D., Krivokolysko S. G., Nesterov V. N., Litvinov V. P. // Chem. Heterocycl. Соmр. 1997. 33. 1430. [29] Dyachenko V. D., Krivokolysko S. G., Sharanin Yu. A., Litvinov V. P. // Russ. J. Org. Chem. 1997.55. 1014. [30] Attia A.M. E., Ismail A. E.-H.A.A. // Tetrahedron. 2003. 59. 1749. [31] El-Torgoman A. M., El-Kousy S. M., Kandeel Z. E.-Sh. // Z. Naturforsh. B: Chem. Sc. 1987.42. 107. [32] Elnagdi M. H., Harb A. F. A., Elghandour A. H. H., Hussien A. H. M., Metwally S. A. M. // Gazzetta Chim. Ital. 1992.122. 299. [33] Dyachenko V. D., Litvinov V. P. // Chem. Heterocycl. Соmр. 1998. 34. 188. 5 Комп’ютерна верстка І.Скворцова 59695 6 Підписне Тираж 24 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of novel pyrido[1,2-a][1,3,5]triazine derivatives
Автори англійськоюKryvokolysko Serhii Hennadiiovych, Dotsenko Viktor Viktorovych, Frolov Kostiantyn Oleksandrovych
Назва патенту російськоюСпособ получения новых производных пиридо[1, 2-а][1,3,5]триазина
Автори російськоюКривоколиско Сергей Геннадиевич, Доценко Виктор Викторович, Фролов Константин Александрович
МПК / Мітки
МПК: C07D 251/08, C07D 251/72, C07D 251/14
Мітки: одержання, нових, спосіб, похідних, піридо[1,2-а][1,3,5]триазину
Код посилання
<a href="https://ua.patents.su/3-59695-sposib-oderzhannya-novikh-pokhidnikh-pirido12-a135triazinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання нових похідних піридо[1,2-а][1,3,5]триазину</a>
Попередній патент: Спосіб лікування тютюнової залежності – спосіб в.п. ботвіна
Наступний патент: Спосіб отримання похідних 3-гідроксі-5-оксо-2,3,4,5,6,7-гексагідротіазоло[3,2-a]піридинів
Випадковий патент: Спосіб лікування соматизованих депресивних розладів у підлітків