Проліки амінохіназолінового інгібітору кінази
Номер патенту: 113892
Опубліковано: 27.03.2017
Автори: Хейль Памела А., Маркіс Роберт В. Дж., Кейсіллас Лінда Н., Ван Грен
Формула / Реферат
1. Сполука, яка відповідає формулі:
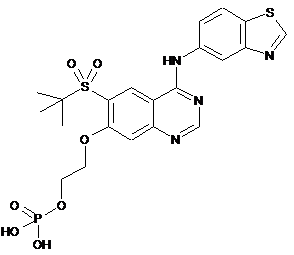 ,
,
або її фармацевтично прийнятна сіль або гідрат.
2. Сполука, яка являє собою 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)оксі)етилдигідрофосфат або його фармацевтично прийнятну сіль.
3. Сполука або її фармацевтично прийнятна сіль за п. 2, яка являє собою 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)оксі)етилдигідрофосфат.
4. Сполука або її фармацевтично прийнятна сіль або гідрат за п. 1, яка являє собою фармацевтично прийнятну сіль зазначеної сполуки.
5. Сполука або її фармацевтично прийнятна сіль або гідрат за п. 4, де фармацевтично прийнятна сіль є натрієвою сіллю.
6. Сполука або її фармацевтично прийнятна сіль або гідрат за п. 4, де фармацевтично прийнятна сіль є хлоргідратною сіллю.
7. Сполука або її фармацевтично прийнятна сіль або гідрат за п. 1, яка є гідратом хлоргідратної солі зазначеної сполуки.
8. Сполука або її фармацевтично прийнятна сіль або гідрат за п. 1, яка являє собою моногідрат гідрохлориду 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)оксі)етилдигідрофосфату.
9. Сполука або її фармацевтично прийнятна сіль або гідрат за п. 1, яка являє собою кристалічний моногідрат гідрохлориду 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)оксі)етилдигідрофосфату, який має дифрактограму порошкової рентгенівської дифракції (PXRD) відповідно до Фіг. 2.
10. Сполука або її фармацевтично прийнятна сіль або гідрат за п. 4, де фармацевтично прийнятна сіль є кальцієвою сіллю.
11. Сполука або її фармацевтично прийнятна сіль або гідрат за п. 1, яка являє собою гідрат кальцієвої солі зазначеної сполуки.
12. Сполука або її фармацевтично прийнятна сіль або гідрат за п. 1, яка являє собою гідрат гемікальцієвої солі зазначеної сполуки.
13. Сполука за п. 1, яка відповідає формулі
 ,
,
або її фармацевтично прийнятна сіль або гідрат, яка являє собою тригідрат гемікальцієвої солі зазначеної сполуки.
14. Тригідрат гемікальцієвої солі сполуки за п. 13, який являє собою кристалічний тригідрат 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)-хіназолін-7-іл)оксі)етилгідрофосфату кальцію (І), що має порошкову рентгенівську дифрактограму (PXRD) за Фіг. 1.
15. Фармацевтична композиція, що включає сполуку або її фармацевтично прийнятну сіль або гідрат за п. 1 та фармацевтично прийнятний ексципієнт.
16. Фармацевтична композиція, що містить тригідрат гемікальцієвої солі сполуки за п. 13 та фармацевтично прийнятний ексципієнт.
17. Застосування сполуки або її фармацевтично прийнятної солі або гідрату за п. 1 в терапії.
18. Застосування сполуки за п. 13 в терапії.
19. Застосування сполуки або її фармацевтично прийнятної солі або гідрату за п. 17, де терапія передбачає лікування захворювання, опосередкованого інгібуванням RІР2-кінази, де захворювання вибране з увеїту, дерматиту, гострого пошкодження легенів, цукрового діабету 2 типу, артриту, ревматоїдного артриту, виразкового коліту, хвороби Крона, запального захворювання кишечнику з раннім початком, позакишкового запального захворювання кишечнику, запобігання ішемічно-реперфузійному пошкодженню у трансплантатах твердих органів, неалкогольного стеатогепатиту, аутоімунного гепатиту, астми, системного червоного вовчака, розсіяного склерозу, саркоїдозу, синдрому Блау/саркоїдозу з раннім початком, гранулематозу Вегенера та інтерстиціальної хвороби легенів.
20. Застосування сполуки або її фармацевтично прийнятної солі або гідрату за п. 19, де захворювання вибране з увеїту, синдрому Блау/саркоїдозу з раннім початком, виразкового коліту, хвороби Крона, гранулематозу Вегенера та саркоїдозу.
21. Застосування сполуки або її фармацевтично прийнятної солі або гідрату за п. 19, де захворювання вибране з хвороби Крона, виразкового коліту, синдрому Блау або ревматоїдного артриту.
22. Застосування сполуки за п. 18, де терапія передбачає лікування захворювання, опосередкованого інгібуванням RІР2-кінази, де захворювання вибране з увеїту, дерматиту, гострого пошкодження легенів, цукрового діабету 2 типу, артриту, ревматоїдного артриту, виразкового коліту, хвороби Крона, запального захворювання кишечнику з раннім початком, позакишкового запального захворювання кишечнику, запобігання ішемічно-реперфузійному пошкодженню в трансплантатах твердих органів, неалкогольного стеатогепатиту, аутоімунного гепатиту, астми, системного червоного вовчака, розсіяного склерозу, саркоїдозу, синдрому Блау/саркоїдозу з раннім початком, гранулематозу Вегенера та інтерстиціальної хвороби легенів.
23. Застосування сполуки або її фармацевтично прийнятної солі або гідрату за п. 22, де захворювання вибране з увеїту, синдрому Блау/саркоїдозу з раннім початком, виразкового коліту, хвороби Крона, гранулематозу Вегенера та саркоїдозу.
24. Застосування сполуки або її фармацевтично прийнятної солі або гідрату за п. 22, де захворювання вибране з хвороби Крона, виразкового коліту, синдрому Блау або ревматоїдного артриту.
25. Спосіб лікування захворювання, опосередкованого інгібуванням RIP2-кінази, що включає введення терапевтично ефективної кількості сполуки або її фармацевтично прийнятної солі або гідрату за п. 1 людині, яка потребує цього лікування, де захворювання вибирають з увеїту, дерматиту, гострого пошкодження легенів, цукрового діабету 2 типу, артриту, ревматоїдного артриту, виразкового коліту, хвороби Крона, запального захворювання кишечнику з раннім початком, позакишкового запального захворювання кишечнику, запобігання ішемічно-реперфузійному пошкодженню в трансплантатах твердих органів, неалкогольного стеатогепатиту, аутоімунного гепатиту, астми, системного червоного вовчака, розсіяного склерозу, саркоїдозу, синдрому Блау/саркоїдозу з раннім початком, гранулематозу Вегенера та інтерстиціальної хвороби легенів.
26. Спосіб лікування захворювання, опосередкованого інгібуванням RIP2-кінази, за п. 25, де захворювання вибирають з увеїту, синдрому Блау/саркоїдозу з раннім початком, виразкового коліту, хвороби Крона, гранулематозу Вегенера та саркоїдозу.
27. Спосіб лікування захворювання, опосередкованого інгібуванням RIP2-кінази, за п. 25, де захворювання вибирають з хвороби Крона, виразкового коліту, синдрому Блау або ревматоїдного артриту.
28. Спосіб лікування захворювання, опосередкованого інгібуванням RIP2-кінази, що включає введення терапевтично ефективної кількості сполуки за п. 13 людині, яка потребує цього лікування, де захворювання вибирають з увеїту, дерматиту, гострого пошкодження легенів, цукрового діабету 2 типу, артриту, ревматоїдного артриту, виразкового коліту, хвороби Крона, запального захворювання кишечнику з раннім початком, позакишкового запального захворювання кишечнику, запобігання ішемічно-реперфузійному пошкодженню в трансплантатах твердих органів, неалкогольного стеатогепатиту, аутоімунного гепатиту, астми, системного червоного вовчака, розсіяного склерозу, саркоїдозу, синдрому Блау/саркоїдозу з раннім початком, гранулематозу Вегенера та інтерстиціальної хвороби легенів.
29. Спосіб лікування захворювання, опосередкованого інгібуванням RIP2-кінази, за п. 28, де захворювання вибирають з увеїту, синдрому Блау/саркоїдозу з раннім початком, виразкового коліту, хвороби Крона, гранулематозу Вегенера та саркоїдозу.
30. Спосіб лікування захворювання, опосередкованого інгібуванням RIP2-кінази, за п. 28, де захворювання вибирають з хвороби Крона, виразкового коліту, синдрому Блау або ревматоїдного артриту.
Текст
Реферат: Розкриті сполуки, що мають Формулу (І); де X є таким, як визначено у цьому описі, і способи одержання та застосування цих сполук. S O O N HN S N O X N O (I) UA 113892 C2 (12) UA 113892 C2 (I) UA 113892 C2 5 10 15 20 25 30 35 40 45 50 55 РІВЕНЬ ТЕХНІКИ Галузь техніки Цей винахід відноситься до нових проліків хіназоліламіну, які інгібують RIP2-кіназу, і способам його одержання й застосування. Конкретно, цей винахід відноситься до нових проліків 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етанолу. Рівень техніки Кіназа білка-2 (RIP2), що взаємодіє з рецептором, яку також називають CARD3, RICK, CARDIAK або RIPK2 є сериновою/треоніновою протеїнкіназою сімейства TKL, включену у природжену імунну сигнальну систему. RIP2-кіназа складена з N-кінцевого домена кінази і Cкінцевого домена рекрутування каспази (CARD), зв'язаних через проміжну (IM) ділянку ((1998) J. Biol. Chem. 273, 12296-12300; (1998) Current Biology 8, 885-889; і (1998) J. Biol. Chem. 273, 16968-16975). CARD-домен RIP2-кінази опосередковує взаємодію з іншими білками, що містять CARD, такими як NOD1 і NOD2 ((2000) J. Biol. Chem. 275, 27823-27831 і (2001) EMBO reports 2, 736-742). NOD1 і NOD2 є цитоплазматичними рецепторами, які відіграють ключову роль у природженому імунному нагляді. Вони розпізнають як грампозитивні, так і грамнегативні бактеріальні патогени і активуються специфічними пептидоглікановими мотивами, діамінопімеліновою кислотою (тобто, DAP) і мурамілдипептидом (MDP), відповідно ((2007) J Immunol 178, 2380-2386). Після активації, RIP2-кіназа асоціюється з NOD1 або NOD2 і, мабуть, функціонує головним чином як молекулярний каркас, щоб звести разом інші кінази (TAK1 ΙΚΚ//γ), залучені в NF-κ і активацію протеїнкінази, що активується митогеном ((2006) Nature Reviews Immunology 6, 9-20). RIP2-кіназа піддається K63-зв'язаному поліубіквітинуванню на лізині-209, яке полегшує рекрутинг TAK1 ((2008) EMBO Journal 27, 373-383). Ця пост-трансляційна модифікація потрібна для сигнального шляху, оскільки мутація цього залишку перешкоджає опосередкованій NOD 1/2 активації NF-кВ. RIP2-кіназа також піддається аутофосфорилуванню на серині-176, і, можливо, інших залишках ((2006) Cellular Signalling 18, 2223-2229). Дослідження з використанням мертвих мутантів кінази (K47A) і неселективних низькомолекулярних інгібіторів продемонстрували, що активність RIP2-кінази є важливою для регуляції стабільності експресії RIP2-кінази і передачі сигналу ((2007) Biochem J 404, 179-190 і (2009) J. Biol. Chem. 284, 19183-19188). Дисрегуляція RIP2-залежної передачі сигналу була пов'язана з аутозапальними захворюваннями. Мутації із надбанням функції в NACHT-домені NOD2 викликають синдром Блау, саркоїдоз із раннім початком, дитячі гранулематозні захворювання, що характеризуються увеїтом, дерматитом і артритом ((2001) Nature Genetics 29, 19-20; (2005) Journal of Rheumatology 32, 373-375; (2005) Current Rheumatology Reports 7, 427-433; (2005) Blood 105, 1195-1197; (2005) European Journal of Human Genetics 13, 742-747; (2006) American Journal of Ophthalmology 142, 1089-1092; (2006) Arthritis & Rheumatism 54, 3337-3344; (2009) Arthritis & Rheumatism 60, 1797-1803; і (2010) Rheumatology 49, 194-196). Мутації в LRR-домені NOD2 були у значній мірі пов'язані зі схильністю до хвороби Крону ((2002) Am. J. Hum. Genet. 70, 845-857; (2004) European Journal of Human Genetics 12, 206-212; (2008) Mucosal Immunology (2008) I (Suppl 1), S5-S9. 1, S5-S9; (2008) Inflammatory Bowel Diseases 14, 295-302; (2008) Experimental Dermatology 17, 1057-1058; (2008) British Medical Bulletin 87, 17-30; (2009) Inflammatory Bowel Diseases 15, 1145-1154 і (2009) Microbes and Infection 11, 912-918). Мутації в NOD1 були асоційовані з астмою ((2005) Hum. Mol. Genet. 14, 935-941) і позакишковим запальним захворюванням кишечника з раннім початком ((2005) Hum. Mol. Genet. 14, 1245-1250). Генетичні і функціональні дослідження дозволили передбачити роль для RIP2-залежної передачі сигналу при різних інших гранулематозних розладах, таких як саркоїдоз ((2009) Journal of Clinical Immunology 29, 78-89 і (2006) Sarcoidosis Vasculitis and Diffuse Lung Diseases 23, 23-29) і гранулематоз Вегенера ((2009) Diagnostic Pathology 4, 23). Активний, селективний, низькомолекулярний інгібітор активності RIP2-кінази міг би блокувати RIP2-залежну прозапальну передачу сигналу і за допомогою цього забезпечувати терапевтичний сприятливий ефект при аутозапальних захворюваннях, що характеризується збільшеною та/або дисрегульованою активністю RIP2-кінази. Міжнародна патентна заявка PCT/US2012/051247 (WO2013/025958) описує ряд сполук хіназоліламіну, які вказані як інгібітори RIP2-кінази. Конкретно розкритим у цій заявці є сполука 2-((4-(бензо[d]тіазол-5-іламіно)-6-(третбутилсульфоніл)хіназолін-7-іл)окси)етанол. Як відомо у цій галузі, біодоступність сполук у межах структурного класу важко передбачити. Відносно мінорні структурні модифікації часто надають велику дію на всмоктування сполуки, її рівень концентрацій у крові та/або її час напівжиття. Як наслідок, структурно родинні сполуки, що мають дуже хорошу активність in vitro, можуть розрізнятися за терапевтичною ефективністю. 1 UA 113892 C2 5 10 15 Життєздатність гіпотетичного медичного засобу може бути послаблена низькою пероральною біодоступністю. Проліки є біооборотними похідними лікарських молекул, які піддаються ферментативному та/або хімічному перетворенню in vivo, щоб вивільнити активний батьківський лікарський засіб, який може потім проявляти бажаний фармакологічний ефект. Як при відкритті, так і при розробці лікарських засобів, проліки стали встановленим інструментом для покращення фізикохімічних, біофармацевтичних або фармакокінетичних властивостей фармакологічно активних засобів. У деяких випадках, ідентифікація відповідних проліків може бути необхідною, щоб одержати ефективний терапевтичний засіб, що вводиться перорально. СУТЬ ВИНАХОДУ Цей винахід відноситься до сполуки хіназоліламіну відповідно до Формули (I): (I) де: X вибирають з групи, що складається з: 1a 20 25 30 35 40 1b R і R кожен незалежно є Н, (C1-C4) алкіл, або -CH2OCО2(C1-C4)алкіл; 1a 1b або R і R разом є -(CH2)2- або -(CH2)3-; 2a 2b 3a 3b R , R , R і R кожен незалежно є Н або (C1-C4)алкілом, де вказаний (C1-C4)алкіл є необов'язково заміщеним -CО2(C1-C4)алкілом; 2a 2b або R і R разом є -(CH2)4-, -(CH2)5-, -(CH2)2О(CH2)2-, -(CH2)2NH(CH2)2- або (CH2)2N(CH3)(CH2)2-; 3a 3b або R і R разом є -(CH2)4-, -(CH2)5-, -(CH2)2О(CH2)2-, -(CH2)2NH(CH2)2- або (CH2)2N(CH3)(CH2)2-; 2b 3b або R і R разом є -(CH2)2- або -(CH2)3-; 4 R є -OH або -NH2; 5 6 7 R є (C1-C6)алкілом, -О(C1-C4)алкілом, -NR R , або 5- або 6-членним гетероциклоалкілом, де вказаний (C1-C6)алкіл є заміщеним -OH, -OP(=О)(ОН)2, -NH2, або -NHCO(C1-C4)алкілом, де (C1-C4)алкільна група вказаного -NHCO(C1-C4) алкілу є необов'язково заміщеною -NH2, і, де вказаний 5- або 6-членний гетероциклоалкіл є необов'язково заміщеним, один раз або двічі незалежно, (C1-C4)алкілом, оксо або додатковим 5або 6-членним гетероциклоалкілом; і 6 7 R і R кожен незалежно є Н або (C1-C4)алкілом; або його сіль. Сполуки відповідно до Формули (I), або їх солі, зокрема, фармацевтично прийнятні солі при введенні в організм-господар, перетворюються на інгібітор RIP2-кінази. Цей винахід, зокрема, відноситься до сполуки хіназоліламіну відповідно до Формули (I), або їх солі, зокрема, їх фармацевтично прийнятні солі або їх гідрати, які, при введенні в організм-господар, перетворюються на інгібітор RIP2-кінази. Відповідно, цей винахід також відноситься до способу інгібування RIP2-кінази, причому спосіб включає введення в організм-господар сполуки відповідно до Формули (I), або її солі, зокрема, фармацевтично прийнятної солі. 2 UA 113892 C2 5 10 15 20 25 30 35 40 45 50 55 Цей винахід додатково відноситься до способу лікування захворювання або розладу, опосередкованого RIP2-кіназою, який включає введення терапевтично ефективної кількості сполуки відповідно до Формули (I), або її солі, зокрема, її фармацевтично прийнятній солі, пацієнтові (людині або іншому ссавцеві, зокрема, людині), який потребує цього. Приклади захворювань або розладів, опосередкованих RIP2-кіназою, охоплюють увеїт, хворобу Крону, виразковий коліт, з раннім початком і позакишкове запальне захворювання кишечнику і гранулематозні розлади, такі як саркоїдоз, синдром Блау, саркоїдоз з раннім початком і гранулематоз Вегенера. Цей винахід додатково відноситься до фармацевтичної композиції, що містить сполуку відповідно до Формули (I), або її сіль, зокрема, фармацевтично прийнятну сіль, і фармацевтично прийнятний ексципієнт. Зокрема, цей винахід стосується фармацевтичної композиції для лікування захворювання або розладу, опосередкованого RIP2-кіназою, де композиція включає сполуку відповідно до Формули (I), або її сіль, зокрема, її фармацевтично прийнятну сіль, і фармацевтично прийнятний ексципієнт. КОРОТКИЙ ОПИС ГРАФІЧНИХ МАТЕРІАЛІВ Фігура 1 ілюструє порошкову рентгенівську (PXRD) дифрактограму порошку кристалічної форми тригідрату 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)окси)етилгідрофосфату кальцію (I). Фігура 2 ілюструє дифрактограму порошкової рентгенівської дифракції кристалічної форми моногідрату гідрохлориду 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)окси)етилдигідрофосфату. Фігура 3 ілюструє комбіновану цитокінову відповідь у зразках цілісної крові щурів, одержану після попереднього дозованого введення щурам сполуки 2-((4-(бензо[d]тіазол-5-іламіно)-6(трет-бутилсульфоніл)хіназолін-7-іл)окси)етанолу або преднізолону, з подальшим дозованим введенням L18-MDP. Фігура 4 ілюструє профіль 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін7-іл)окси)етанолу після перорального введення 2-((4-(бензо[d]тіазол-5-іламіно)-6-(третбутилсульфоніл)хіназолін-7-іл)окси)етилдигідрофосфату в крові у щурів, собак і мінісвиней. ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ Альтернативні визначення для різних груп і груп-замісників Формули (I), надані за всім обсягом опису, призначені для того, щоб конкретно описати кожен вид сполуки, розкритої у цьому описі, індивідуально, а також груп одного або декількох видів сполук. Обсяг домагань цього винаходу охоплює будь-яку комбінацію цих визначень групи і групи-замісника. Сполуки за винаходом є лише тими сполуками, що розглядаються як такі, що є "хімічно стійкими", як зможуть оцінити фахівці у цій галузі. На додаток, фахівці у цій галузі зможуть оцінити, що сполуки за цим винаходом, залежно від додаткового заміщення, можуть існувати в інших таутомерних формах. Мають на увазі, що всі таутомерні форми сполук, описаних у цьому описі, охоплені межами обсягу цього винаходу. Слід розуміти, що будь-яке посилання на названу сполуку за цим винаходом призначене для того, щоб охопити всі таутомери названої сполуки і будь-які суміші таутомерів названої сполуки. Як використовують у цьому описі, термін "алкіл" позначає насичений, прямоланцюжковий або розгалужений вуглеводневий фрагмент. Ілюстративні алкіли охоплюють, але не обмежені ними, метил (Me), етил (Et), н-пропіл, ізопропіл, н-бутил, втор-бутил, ізобутил, трет-бутил і пентил. Термін "C1-C4алкіл" відноситься до алкільної групи або фрагменту, що містить від 1 до 4 атомів вуглецю. "5- або 6-членний гетероциклоалкіл" позначає групу або фрагмент, що містять неароматичний, моноциклічний радикал, який є насиченим або частково ненасиченим, таким, що містить від 5 до 6 кільцевих атомів, який охоплює від 1 до 4 гетероатомів, вибраних з азоту, кисню і сірки. Ілюстративні приклади гетероциклоалкілів охоплюють, але не обмежені ними, піролідил (або піролідиніл), піперидиніл, піперазиніл, морфолініл, тетрагідро-2H-1,4-тіазиніл, тетрагідрофурил (або тетрагідрофураніл), дигідрофурил, оксазолініл, тіазолініл, піразолініл, тетрагідропіраніл, дигідропіраніл, 1,3-діоксоланіл, 1,3-діоксаніл, 1,4-діоксаніл, 1,3-оксатіоланіл, 1,3-оксатіаніл і 1,3-дитіаніл. Гетероциклоалкільні групи охоплюють 5-членні гетероциклоалкільні групи, що містять один гетероатом, вибраний з азоту, кисню і сірки, і що необов'язково містять один або два додаткові атоми азоту, або такі, що необов'язково містять один додатковий атом кисню або сірки, такі як піролідил (або піролідиніл), тетрагідрофурил (або тетрагідрофураніл), тетрагідротієніл, дигідрофурил, оксазолініл, тіазолініл, імідазолініл, піразолініл, 1,3-діоксоланіл, і 1,3-оксатіолан2-он-іл. 3 UA 113892 C2 5 10 15 20 25 30 35 Гетероциклоалкільні групи є 6-членними гетероциклоалкільними групами, що містять один гетероатом, вибраний з азоту, кисню і сірки, і що необов'язково містять один або два додаткові атоми азоту або один додатковий атом кисню або сірки, такі як піперидил (або піперидиніл), піперазиніл, морфолініл, тіоморфолініл, 1,1-діоксоїдо-тіоморфолін-4-іл, тетрагідропіраніл, дигідропіраніл, тетрагідро-2H-1,4-тіазиніл, 1,4-діоксаніл, 1,3-оксатіаніл і 1,3-дитіаніл. Слід розуміти, що термін "гетероциклоалкіл" призначений для того, щоб охоплювати стійкі гетероциклічні групи, де кільцевий гетероатом азоту є необов'язково окисленим (наприклад, гетероциклічні групи, що містять N-оксид), або, де кільцевий гетероатом сірки є необов'язково окисленим (наприклад, гетероциклічні групи, що містять фрагменти сульфонів або сульфоксиду, такі як тетрагідротієніл-1-оксид (тетрагідротієнілсульфоксид) або тетрагідротієніл1,1-діоксид (тетрагідротієнілсульфон)). "Оксо" є кисневим фрагментом з подвійними зв'язками; наприклад, якщо атом кисню приєднаний безпосередньо до атома вуглецю, то він утворює карбонільний фрагмент (C=О). Як використовують у цьому описі, терміни "сполука(сполука) за винаходом" або "сполука(сполуки) за цим винаходом" означають сполуку Формули (I), як визначено вище, у будь-якій формі, тобто, будь-яку сольову або несольову форму (наприклад, у вигляді вільної кислоти або основної форми або у вигляді солі, зокрема, її фармацевтично прийнятній солі), і її будь-яку фізичну форму (наприклад, таку, що містить нетверді форми (наприклад, рідкі або напівтверді форми), і тверді форми (наприклад, аморфні або кристалічні форми, конкретні поліморфні форми, сольватні форми, у тому числі гідратні форми (наприклад, моно-, ди-, три- і гемі-гідрати)), і суміші різних форм (різні гідрати сольової форми). Як використовують у цьому описі, термін "необов'язково заміщена" вказує на те, що група (така як алкільна або гетероциклоалкільна група) або кільце або фрагмент можуть бути незаміщеними, або група, кільце або фрагмент можуть бути заміщені одним або декількома замісником(замісниками), як визначено. У випадку, де групи можуть бути вибрані з числа альтернативних груп, вибрані групи можуть бути однаковими або різними. Термін "незалежно" позначає, що там, де більше одного замісника вибирають із числа можливих замісників, ці замісники можуть бути однаковими або різними. На додаток, фахівці у цій галузі зможуть оцінити, що сполуки за цим винаходом, залежно від додаткового заміщення, можуть існувати в інших таутомерних формах. Мають на увазі, що всі таутомерні форми сполук, описані в цьому описі, охоплюються обсягом цього винаходу. Слід розуміти, що будь-яке посилання на названу сполуку за цим винаходом призначене для того, щоб охопити всі таутомери названої сполуки і будь-які суміші таутомерів названої сполука. У одному варіанті реалізації сполук Формули (I) за цим винаходом, X є R кожен незалежно є Н, (C1-C4)алкілом, або -CH2OCО2(C1-C4)алкілом. 1b У ще одному варіанті реалізації, X є метилом. і R 1a і R 1b іR 1a і кожен незалежно є Н або 5 40 У ще одному варіанті реалізації, X є і R є (C1-C6)алкілом, заміщеним -OH, OP(=О)(ОН)2, -NH2 або -NHCO(C1-C4)алкілом, де (C1-C4)алкільна група вказаного -NHCO(C1C4)алкілу є необов'язково заміщеною -NH2. 5 У ще одному варіанті реалізації, Х є і R є (C1-C6)алкілом, заміщеним -OH або -NH2. У ще одному варіанті реалізації, Х є і R є (C1-C6)алкілом, заміщеним -NH2. 5 4 UA 113892 C2 5 У ще одному варіанті реалізації, Х є і R є -CH(NH2)(C1-C4)алкілом. У переважному варіанті реалізації Х є його фармацевтично прийнятною сіллю. 5 іR 1a іR 15 20 25 30 35 40 45 кожен незалежно є Н, або У ще одному переважному варіанті реалізації, Х є іR Н, або його фармацевтично прийнятною сіллю, або його гідратом. 5 10 1b 1a іR 1b кожен незалежно є У ще одному переважному варіанті реалізації, Х є і R є (C1-C4)алкілом, заміщеним -NH2. Типові сполуки за цим винаходом охоплюють: 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)окси)етилдигідрофосфат, (S)-2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2-аміно3-метилбутаноат, (R)-2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2-аміно3-метилбутаноат, і (2S,3S)-2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2аміно-3-метилпентаноат або його сіль. У ще одному варіанті реалізації, типові сполуки за цим винаходом охоплюють сполуки Прикладів 1-7, конкретно: 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)окси)етилдигідрофосфат, 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)окси)етилдинатрійфосфат, тригідрат 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)окси)етилгідрофосфату кальцію (I), моногідрат гідрохлориду 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)окси)етилдигідрофосфату, (S)-2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2-аміно3-метилбутаноата, дигідрохлорид, (R)-2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2-аміно3-метилбутаноата, дигідрохлорид, і (2S,3S)-2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2аміно-3-метилпентаноат. У ще одному варіанті реалізації типові сполуки за цим винаходом охоплюють: 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)окси)етилдигідрофосфат, 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)окси)етилдинатрійфосфат, і (S)-2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2-аміно3-метилбутаноат, дигідрохлорид. Слід розуміти, що цей винахід охоплює сполуки Формули (I) у вигляді вільної основи або вільної кислоти і у вигляді їх солей, наприклад, у вигляді їх фармацевтично прийнятних солей. В одному варіанті реалізації винахід відноситься до сполук Формули (I) у формі вільної основи або вільної кислоти. У ще одному варіанті реалізації винахід відноситься до сполук Формули (I) або їх фармацевтично прийнятним солям. Додатково слід розуміти, що сполуки Формули (I) і їх солі можуть існувати в гідратованій формі, такій як моногідрат або тригідрат. 5 UA 113892 C2 5 10 15 20 25 30 35 40 45 50 55 У одному варіанті реалізації, сполука за винаходом є 2-((4-(бензо[d]тіазол-5-іламіно)-6-(третбутилсульфоніл)хіназолін-7-іл)окси)етилдигідрофосфатом у вигляді вільної кислоти. У ще одному варіанті реалізації, сполука за винаходом є 2-((4-(бензо[d]тіазол-5-іламіно)-6-(третбутилсульфоніл)хіназолін-7-іл)окси)етилдигідрофосфатом або його сіллю. У ще одному варіанті реалізації, сполука за винаходом є 2-((4-(бензо[d]тіазол-5-іламіно)-6-(третбутилсульфоніл)хіназолін-7-іл)окси)етилдигідрофосфатом або його фармацевтично прийнятною сіллю. У ще одному варіанті реалізації, сполука за винаходом є 2-((4(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етилдигідрофосфатом або його гідратом. У ще одному варіанті реалізації, сполука за винаходом є фармацевтично прийнятною сіллю 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутил-сульфоніл)хіназолін-7іл)окси)етилдигідрофосфату або її гідратом. У ще одному іншому варіанті реалізації, сполука за винаходом є натрієвою, кальцієвою або гідрохлоридною сіллю 2-((4-(бензо[d]тіазол-5-іламіно)-6(трет-бутилсульфоніл)-хіназолін-7-іл)окси)етилдигідрофосфату або її гідратом. У конкретному варіанті реалізації, сполука за винаходом є 2-((4-(бензо[d]тіазол-5-іламіно)-6(трет-бутилсульфоніл)хіназолін-7-іл)окси)етилдинатрійфосфатом. У ще одному конкретному варіанті реалізації, сполука за винаходом є тригідратом 2-((4(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етилгідрофосфату кальцію (I). У додатковому конкретному варіанті реалізації, сполука за винаходом є тригідратом 2-((4(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етилгідрофосфату кальцію (I), що має PXRD згідно з Фігурою 1. У ще одному другом конкретному варіанті реалізації, сполука за винаходом є моногідратом гідрохлориду 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)окси)етилдигідрофосфату. У ще додатковому конкретному варіанті реалізації, сполука за винаходом є моногідратом гідрохлориду 2-((4-(бензо[d]тіазол-5-іламіно)-6-(третбутилсульфоніл)хіназолін-7-іл)окси)етилдигідрофосфату, що має PXRD згідно Фігури 2. У ще одному варіанті реалізації сполука за винаходом є (S)-2-((4-(бензо[d]тіазол-5-іламіно)6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2-аміно-3-метилбутаноатом у вигляді вільної основи. У ще одному варіанті реалізації сполука за винаходом є (S)-2-((4-(бензо[d]тіазол-5іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2-аміно-3-метилбутаноатом або його сіллю. У ще одному варіанті реалізації сполука за винаходом є (S)-2-((4-(бензо[d]тіазол-5іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2-аміно-3-метилбутаноатом або його фармацевтично прийнятною сіллю. У ще одному варіанті реалізації сполука за винаходом є (R)-2-((4-(бензо[d]тіазол-5-іламіно)6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2-аміно-3-метилбутаноатом у вигляді вільної основи. У ще одному варіанті реалізації сполука за винаходом є (R)-2-((4-(бензо[d]тіазол-5іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2-аміно-3-метилбутаноатом або його сіллю. У ще одному варіанті реалізації сполука за винаходом є (R)-2-((4-(бензо[d]тіазол-5іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2-аміно-3-метилбутаноатом або його фармацевтично прийнятною сіллю. У додатковому варіанті реалізації сполука за винаходом є (2S,3S)-2-((4-(бензо[d]тіазол-5іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2-аміно-3-метилпентаноатом у вигляді вільної основи. У додатковому варіанті реалізації сполука за винаходом є (2S,3S)-2-((4(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2-аміно-3метилпентаноатом або його сіллю. У додатковому варіанті реалізації сполука за винаходом є (2S,3S)-2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2-аміно3-метилпентаноатом або його фармацевтично прийнятною сіллю. Відповідно, сполука за винаходом охоплює сполуку Формули (I), зокрема, конкретні сполуки, описані у цьому описі, або її сіль, зокрема, її фармацевтично прийнятну сіль. Конкретно, сполука за винаходом охоплює сполуку Формули (I), або її фармацевтично прийнятну сіль або її гідрат або гідрат фармацевтично прийнятної солі сполуки Формули (I) і, зокрема, конкретні сполуки, описані у цьому описі. В одному варіанті реалізації винахід направлений на спосіб інгібування RIP2-кінази, що включає введення в організм-господар сполуки за винаходом. У ще одному варіанті реалізації винахід направлений на спосіб лікування захворювання або розладу, опосередкованого RIP2-кіназою, що включає введення терапевтично ефективної кількості сполуки за винаходом людині, яка потребує цього. Цей винахід направлений на спосіб лікування захворювання або розладу, опосередкованого інгібуванням RIP2-кінази, що включає введення терапевтично ефективної кількості сполуки за винаходом людині, яка потребує цього. Цей винахід, зокрема, направлений на спосіб лікування захворювання або розладу, опосередкованого інгібуванням RIP2-кінази, що включає введення 6 UA 113892 C2 5 10 15 20 25 30 35 40 45 50 55 60 терапевтично ефективної кількості сполуки відповідно до Формули (I) або її фармацевтично прийнятної солі людині, яка потребує цього. Винахід ще додатково відноситься застосування сполуки за винаходом або фармацевтичної композиції, що містить сполуку за винаходом, для того, щоб інгібувати RIP2-кіназу та/або лікувати захворювання або розлад, опосередковане RIP2-кіназою. Сполуки відповідно до Формули (I) можуть містити один або декілька асиметричних центрів (що також називаються хіральними центрами) і можуть, отже, існувати у вигляді індивідуальних енантіомерів, діастереомерів або інших стереоізомерних форм або у вигляді їх сумішей. Там, де стереохімія хірального центру, присутнього у сполуці за цим винаходом (наприклад, у назві сполуки) або у будь-якій хімічній структурі, що ілюструється у цьому описі, не встановлена, мають на увазі, що сполука, назва сполуки або структура охоплюють усі індивідуальні стереоізомери і всі їх суміші. Таким чином, сполуки відповідно до Формули (I), що містять один або декілька хіральних центрів, можуть бути присутніми у вигляді рацемічних сумішей, енантіомерно збагачених сумішей або як енантіомерно чисті індивідуальні стереоізомери. Індивідуальні стереоізомери сполуки відповідно до Формули (I), які містять один або декілька асиметричних центрів, можуть бути розділені за допомогою методів, відомих фахівцям у цій галузі. Наприклад, таке розділення може виконуватися (1) за допомогою утворення діастереоізомерних солей, комплексів або інших похідних; (2) за допомогою селективної реакції із стереоізомер- специфічним реагентом, наприклад, за допомогою ферментативного окислення або відновлення; або (3) за допомогою газорідинної або рідинної хроматографії у хіральному оточенні, наприклад, на хіральному носієві, такому як оксид кремнію із зв'язаним хіральним лігандом, або у присутності хірального розчинника. Кваліфікований фахівець у цій галузі зможе зрозуміти, що там, де бажаний стереоізомер перетворюється на ще один хімічний об'єкт за допомогою однієї з методик розділення, описаних вище, потрібна додаткова стадія для вивільнення бажаної форми. Альтернативно, конкретні стереоізомери можуть бути синтезовані за допомогою асиметричного синтезу з використанням оптично активних реагентів, субстратів, каталізаторів або розчинників, або за допомогою перетворення одного енантіомера на іншій за допомогою асиметричного перетворення. Слід розуміти, що тверда форма сполуки за винаходом може існувати в кристалічних формах, некристалічних формах або їх сумішах. Такі кристалічні форми можуть також проявляти поліморфізм (тобто здатність існувати у різних кристалічних формах). Ці різні кристалічні форми зазвичай відомі як "поліморфи." Поліморфи мають однаковий хімічний склад, але розрізняються за пакуванням, геометричним розташуванням, та іншими описовими властивостями кристалічного твердого стану. Поліморфи, отже, можуть мати різні фізичні властивості, такі як форма, щільність, твердість, деформованість, стійкість і властивості розчинення. Поліморфи зазвичай проявляють різні температури плавлення, ІЧ-спектри і рентгенівські порошкові дифрактограми, які можуть використовуватися для ідентифікації. Рядовий фахівець у цій галузі зможе зрозуміти, що різні поліморфи можуть бути одержані, наприклад, за допомогою зміни або регулювання умов, що використовуються при кристалізації/перекристалізації сполуки. Коли сполука за винаходом є основою, (містить основний фрагмент), бажана сольова форма може бути одержана будь-яким прийнятним способом, відомим у цій галузі, включаючи обробку вільної основи неорганічною кислотою, такою як хлористоводнева кислота, бромистоводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота і тому подібні, або органічною кислотою, такою як оцтова кислота, трифтороцтова кислота, малеїнова кислота, бурштинова кислота, мигдалева кислота, фумарова кислота, малонова кислота, піровиноградна кислота, щавлева кислота, гліколева кислота, саліцилова кислота, і тому подібні, або піранозильною кислотою, такою як глюкуронова кислота або галактуронова кислота, або альфагідроксикислотою, такою як лимонна кислота або винна кислота, або амінокислотою, такою як аспарагінова кислота або глутамінова кислота, або ароматичною кислотою, такою як бензойна кислота або корична кислота, або сульфоновою кислотою, такою як п-толуолсульфонова кислота, метансульфонова кислота, етансульфонова кислота або тому подібні. Прийнятні адитивні солі охоплюють ацетат, п-амінобензоат, аскорбат, аспартат, бензолсульфонат, бензоат, бікарбонат, бісметиленсаліцилат, бісульфат, бітартрат, борат, кальцію едетат, камзилат, карбонат, клавуланат, цитрат, циклогексилсульфамат, едетат, едизилат, естолат, езилат, етандисульфонат, етансульфонат, форміат, фумарат, глюцептат, глюконат, глутамат, гліколят, гліколіларсанілат, гексилрезорцинат, гідрабамін, гідробромід, гідрохлорид, дигідрохлорид, гідрофумарат, гідрофосфат, гідройодид, гідромалеат, гідросукцинат, гідроксинафтоат, ізетіонат, ітаконат, лактат, лактобіонат, лаурат, малат, малеат, манделат, мезилат, метилсульфат, монокалію малеат, мукат, напсилат, нітрат, N 7 UA 113892 C2 5 10 15 20 25 30 35 40 45 50 55 60 метилглюкамін, оксалат, оксалоацетат, памоат (ембонат), пальмат, пальмітат, пантотенат, фосфат/дифосфат, піруват, полігалактуронат, пропіонат, сахарат, саліцилат, стеарат, субацетат, сукцинат, сульфат, танат, тартрат, теоклат, тозилат, триетйодид, трифторацетат і валерат. Інші ілюстративні кислотно-адитивні солі охоплюють піросульфат, сульфіт, бісульфіт, деканоат, каприлат, акрилат, ізобутират, капроат, гептаноат, пропіолат, оксалат, малонат, суберат, себацат, бутин-1,4-діоат, гексин-1,6-діоат, хлорбензоат, метилбензоат, динітробензоат, гідроксибензоат, метоксибензоат, фталат, фенілацетат, фенілпропіонат, фенілбутират, лактат γ-гідроксибутират, манделат і сульфонати, такі як ксилолсульфонат, пропансульфонат, нафталін-1-сульфонат і нафталін-2-сульфонат. Якщо основну сполуку за винаходом виділяють у вигляді солі, то відповідна форма вільної основи такої сполуки може бути одержана за будь-яким відповідним способом, відомим у цій галузі, у тому числі обробкою солі неорганічною або органічною основою, прийнятним чином неорганічною або органічною основою, що має вищий pKa, ніж форма вільної основи сполуки. Коли сполука за винаходом є кислотою (містить кислотний фрагмент), бажану сіль можна одержати за будь-яким прийнятним способом, відомим у цій галузі, у тому числі обробкою вільної кислоти неорганічною або органічною основою, такою як амін (первинний, вторинний або третинний), гідроксидом лужного металу або лужноземельного металу або т.п. Ілюстративні приклади прийнятних солей охоплюють органічні солі, похідні від амінокислот, таких як гліцин і аргінін, солі амонію, первинних, вторинних і третинних амінів і циклічних амінів, таких як Nметил-D-глюкамін, діетиламін, ізопропіламін, триметиламін, етилендіамін, дициклогексиламін, етаноламін, піперидин, морфолін і піперазин, а також неорганічні солі, похідні від натрію, кальцію, калію, магнію, марганцю, заліза, міді, цинку, алюмінію і літію. Внаслідок їх потенційного застосування у медицині, солі сполук Формули (I) є переважно фармацевтично прийнятними солями. Прийнятні фармацевтично прийнятні солі охоплюють кислотно- або основно-адитивні солі, такі як солі, описані Berge, Bighley і Monkhouse J. Pharm. Sci (1977) 66, pp. 1-19 і "Pharmaceutical Salts: Properties, Selection, and Use, 2nd Revised Edition", P.H. Stahl і C.G. Wermuth (eds.), Wiley, Hoboken, NJ, US (2011). Термін "фармацевтично прийнятні" відноситься до тих сполук, речовин, композицій, і дозованим формам, які є, в межах обсягу ретельної медичної оцінки, прийнятними для застосування у контакті з тканинами людей і тварин без надлишкової токсичності, дратівливості або іншої проблеми або ускладнення, відповідно до обґрунтованого співвідношення сприятливий ефект/ризик. "Фармацевтично прийнятні сіль(солі)" відноситься до сполуки, яка є прийнятною для фармацевтичного застосування. Сольові і сольватні (наприклад, гідрати й гідрати солей) форми сполук Формули (I), які є прийнятними для застосування у медицині, є такими, де протиіон або асоційований розчинник є фармацевтично прийнятними. Проте, солі і сольвати, що мають фармацевтично неприйнятні протиіони або асоційовані розчинники, знаходяться у межах обсягу цього винаходу, наприклад, для застосування як проміжних сполук при одержанні інших сполук за винаходом і їх солей і сольватів. Приклади фармацевтично прийнятних кислотно-адитивних солей охоплюють ацетат, адипат, аскорбат, аспартат, бензолсульфонат, бензоат, камфорат, камфор-сульфонат (камзилат), капрат (деканоат), капроат (гексаноат), каприлат (октаноат), карбонат, бікарбонат, цинамат, цитрат, цикламат, додецилсульфат (естолат), етан-1,2-дисульфонат (едизилат), етансульфонат (езилат), форміат, фумарат, галактарат (мукат), гентизат (2,5дигідроксибензоат), глюкогептонат (глюцептат), глюконат, глюкуронат, глутамат, глутарат, гліцерофосфат, гліколат, гіпурат, гідробромід, гідрохлорид, гідройодид, ізобутират, лактат, лактобіонат, лаурат, малеат, малат, малонат, манделат, метансульфонат (мезилат), нафталін1,5-дисульфонат (нападизилат), нафталін-сульфонат (напсилат), нікотинат, нітрат, олеат, оксалат, пальмітат, памоат, фосфат, дифосфат, пропіонат, піроглутамат, саліцилат, себацат, стеарат, сукцинат, сульфат, тартрат, тіоціанат, тозилат, ундециленат, 1-гідрокси-2-нафтоат, 2,2дихлорацетат, 2-гідроксіетансульфонат (ізетіонат), 2-оксоглутарат, 4-ацетамідобензоат і 4аміносаліцилат. У одному варіанті реалізації винаходу фармацевтично прийнятна кислотноадитивна сіль є гідрохлоридом (наприклад, моногідрохлоридною або дигідрохлоридною сіллю). Фармацевтично неприйнятні солі, наприклад трифторацетат, можуть застосовуватися, наприклад, при виділенні сполука Формули (I), і включені в межі обсягу цього винаходу. Приклади фармацевтично прийнятних основно-адитивних солей охоплюють солі амонію, літію, натрію, калію, кальцію, магнію, алюмінію, солі цинку, триметиламіну, триетиламіну, морфоліна, піридину, піперидину, піколіну, дициклогексиламіну, N,N'-дибензилетилeндіаміну, 2гідроксіетиламіну, біс-(2-гідроксіетил)аміну, три-(2-гідроксіетил)аміну, прокаїну, дибензилпіперидину, дегідроабіетиламіну, глюкаміну, N-метилглюкаміну, коллідину, хініну, 8 UA 113892 C2 5 10 15 20 25 30 35 40 45 50 55 60 хіноліну, лізину й аргініну. В одному варіанті реалізації винаходу фармацевтично прийнятною основно-адитивною сіллю є сіль натрію або кальцію. У ще одному варіанті реалізації фармацевтично прийнятною основно-адитивною сіллю є сіль натрію. У ще одному варіанті реалізації винаходу фармацевтично прийнятною основно-адитивною сіллю є сіль кальцію. Деякі сполуки за винаходом можуть утворювати солі з одним або декількома еквівалентами кислоти (якщо сполука містить основний фрагмент) або основи (якщо сполука містить кислотний фрагмент). Цей винахід охоплює у межах його обсягу всі можливі стехіометричні і нестехіометричні сольові форми. Сполуки за винаходом, що мають як основний, так і кислотний фрагмент, можуть знаходитися у формі цвіттеріонів, кислотно-адитивної солі основного фрагменту або основних солей кислотного фрагменту. Цей винахід також подає перетворення однієї фармацевтично прийнятної солі сполуки за цим винаходом на ще одну фармацевтично прийнятну сіль сполуки за цим винаходом. Якщо основну сполуку за винаходом виділяють у вигляді солі, то відповідна форма вільної кислоти або форма вільної основи такої сполуки може бути одержана за будь-яким прийнятним способом, відомим у цій галузі. Для сольватів сполук Формули (I), що охоплюють сольвати солей сполук Формули (I), які знаходяться у кристалічній формі, кваліфікований фахівець у цій галузі зрозуміє, що можуть бути утворені фармацевтично прийнятні сольвати, де молекули розчинника включаються у кристалічну решітку під час кристалізації. Сольвати можуть містити неводні розчинники, такі як етанол, ізопропанол, ДМСО, оцтова кислота, етаноламін і EtOAc, або вони можуть містити воду як розчинник, яка включена в кристалічну решітку. Сольвати, в яких вода є розчинником, яка включається в кристалічну решітку, зазвичай називають "гідратами". Гідрати охоплюють стехіометричні гідрати, а також композиції, що містять змінні кількості води. Винахід охоплює усі такі сольвати, зокрема, гідрати, наприклад, моногідрат або тригідрат. Відповідно, сполука за цим винаходом охоплює сполуку Формули (I) або її сіль, зокрема, її фармацевтично прийнятну сіль, або її гідрат, гідрат фармацевтично прийнятної солі сполуки Формули (I) і, зокрема, охоплює кожну сполуку, описану в Прикладах. Таким чином, винахід надає сполуку Формули (I) або її сіль, особливо, її фармацевтично прийнятну сіль, у вигляді сольвату, зокрема у вигляді гідрату, такого як моногідрат або тригідрат. Оскільки сполуки Формули (I) призначені для застосування у фармацевтичних композиціях, буде легко зрозуміти, що кожна з них переважно надана в по суті чистій формі, наприклад, щонайменше зі 60 % чистотою, більш прийнятним чином щонайменше зі 75 % чистотою, і переважно щонайменше зі 85 %, особливо щонайменше з 98 % чистотою (% наводяться у розрахунку маса від маси). Забруднені препарати сполук можуть застосовуватися для одержання чистіших форм, що застосовуються у фармацевтичних композиціях. Сполуки за винаходом можуть бути особливо застосовними для лікування захворювань або розладів, опосередкованих RIP2-кіназою, зокрема, захворювань або розладів, опосередкованих інгібуванням RIP2-кінази, таких як увеїт, гарячковий синдром (лихоманка ICE), що асоціюється з інтерлейкін-1-перетворюючим ферментом (ICE, також відомим як Каспаза-1), дерматит, гостре пошкодження легенів, цукровий діабет другого типу, артрит (особливо, ревматоїдний артрит), запальні захворювання кишечника (такі як виразковий коліт і хвороба Крону), запальне захворювання кишечника із раннім початком, позакишкове запальне захворювання кишечника, запобігання ішемічно-реперфузійного пошкодження в твердих органах (особливо, у нирці) у відповідь на ішемію, що індукується операціями на серці, трансплантація органів, сепсис та інші дії, захворювання печінки (неалкогольний стеатогепатит, алкогольний стеатогепатит і аутоімунний гепатит), алергічні захворювання (такі як астма), реакції на трансплантати (такі як криз відторгнення трансплантата), аутоімунні захворювання (такі як системний червоний вовчак і розсіяний склероз) і гранулематозні розлади (такі як саркоїдоз, синдром Блау, саркоїдоз із раннім початком, гранулематоз Вегенера і інтерстиціальна хвороба легенів). Сполуки за цим винаходом можуть бути особливо застосовними при лікуванні увеїту, лихоманки ICE, синдрому Блау, саркоїдозу з раннім початком, виразкового коліту, хвороби Крону, гранулематозу Вегенера і саркоїдозу. В одному варіанті реалізації винахід направлений на спосіб лікування увеїту, що включає введення терапевтично ефективної кількості сполуки відповідно до Формули (I) або її фармацевтично прийнятної солі людині, яка потребує цього. У ще одному варіанті реалізації винахід направлений на спосіб лікування гарячкового синдрому, що асоціюється з інтерлейкін-1перетворюючим ферментом, що включає введення терапевтично ефективної кількості сполуки відповідно до Формули (I) або її фармацевтично прийнятної солі людині, яка потребує цього. У ще одному варіанті реалізації винахід направлений на спосіб лікування синдрому Блау, що 9 UA 113892 C2 5 10 15 20 25 30 35 40 45 50 55 60 включає введення терапевтично ефективної кількості сполуки відповідно до Формули (I) або її фармацевтично прийнятної солі людині, яка потребує цього. У ще одному варіанті реалізації винахід направлений на спосіб лікування саркоїдозу з раннім початком, що включає введення терапевтично ефективної кількості сполуки відповідно до Формули (I) або її фармацевтично прийнятної солі людині, яка потребує цього. У ще одному варіанті реалізації винахід направлений на спосіб лікування виразкового коліту, що включає введення терапевтично ефективної кількості сполуки відповідно до Формули (I) або її фармацевтично прийнятної солі людині, яка потребує цього. У ще одному варіанті реалізації винахід направлений на спосіб лікування хвороби Крону, що включає введення терапевтично ефективної кількості сполуки відповідно до Формули (I) або її фармацевтично прийнятної солі людині, яка потребує цього. У ще одному варіанті реалізації винахід направлений на спосіб лікування гранулематозу Вегенера, що включає введення терапевтично ефективної кількості сполуки відповідно до Формули (I) або її фармацевтично прийнятної солі людині, яка потребує цього. У додатковому варіанті реалізації винахід направлений на спосіб лікування саркоїдозу, що включає введення терапевтично ефективної кількості сполуки відповідно до Формули (I) або її фармацевтично прийнятної солі людині, яка потребує цього. Лікування захворювань або розладів, опосередкованих RIP2-кіназою, або ширше, лікування імуно-опосередкованих захворювань, що охоплюють, але не обмежених ними, алергічні захворювання, аутоімунні захворювання, запобігання відторгненню трансплантата і тому подібне може досягатися із застосуванням сполуки за цим винаходом у вигляді монотерапії, або при подвійній або множинній комбінаційній терапії, особливо, для лікування рефракторних випадків, таким чином, як у комбінації з іншими протизапальними та/або анти-TNF засобами, які можуть вводитися у терапевтично ефективних кількостях, як відомо у цій галузі. Сполуки Формули (I) і їх фармацевтично прийнятні солі можуть використовуватися окремо або в комбінації з іншими терапевтичними засобами. Комбіновані терапії відповідно до цього винаходу, таким чином, включають уведення щонайменше однієї сполуки Формули (I) або її фармацевтично прийнятної солі і застосування щонайменше одного іншого терапевтично активного засобу. Переважно, комбіновані терапії відповідно до цього винаходу включають введення щонайменше однієї сполука Формули (I) або її фармацевтично прийнятної солі і щонайменше одного іншого терапевтично активного засобу. Сполука(сполуки) Формули (I) і їх фармацевтично прийнятні солі і інший терапевтично активний засіб(засоби) можуть вводитися разом в одиночній фармацевтичній композиції або окремо і, коли їх вводять окремо, введення може відбуватися одночасно або послідовно у будь-якому порядку. Кількості сполуки(сполук) Формули (I) і їх фармацевтично прийнятних солейі іншого терапевтично активного засобу(засобів) і відносні часові режими введення вибиратимуться для того, щоб досягти бажаного комбінованого терапевтичного ефекту. Таким чином, у додатковому аспекті, надана комбінація, що містить сполуку Формули (I) або її фармацевтично прийнятну сіль разом із одним або декількома іншими терапевтично активними засобами. Таким чином, в одному аспекті, сполука Формули (I) або її фармацевтично прийнятна сіль і фармацевтичні композиції, що містять сполуку Формули (I) або її фармацевтично прийнятну сіль відповідно до винаходу, можуть застосовуватися в комбінації з або містити один або декілька інших терапевтичних засобів, наприклад, протизапальний засіб та/або анти-TNF засіб. Сполуки за цим винаходом можуть вводитися в комбінації з кортикостероїдами та/або антиTNF засобами для лікування синдрому Блау, саркоїдозу з раннім початком; або у комбінації з анти-TNF біологічними препаратами або іншими протизапальними біологічними препаратами для лікування хвороби Крону; або в комбінації з 5-ASA (мезаламіном) або сульфасалазином для лікування виразкового коліту; або в комбінації з кортикостероїдами у малих дозах та/або метотрексатом для лікування гранулематозу Вегенера або саркоїдозу або інтерстиціальної хвороби легенів; або у комбінації з біологічним препаратом (наприклад, анти-TNF, анти-IL-6, і так далі) для лікування ревматоїдного артриту; або у комбінації з анти-IL6 та/або метотрексатом для лікування лихоманки ICE. Приклади прийнятних протизапальних засобів охоплюють 5-аміносаліцилову кислоту і препарати мезаламіну, сульфасалазин, гідроксихлорохін, тіопурини (азатіоприн, меркаптопурин), метотрексат, циклофосфамід, циклоспорин, інгібітори JAK (тофацитиніб), ® кортикостероїди, особливо, кортикостероїди у малих дозах (такі як преднізон (Deltasone ) і будесонід) і протизапальні біологічні препарати, такі як анти-IL6R моноклональні антитіла ® (Actemra (тоцилізумаб)), анти-IL6 біологічні препарати, анти-IL1 або IL12 або IL23 біологічні ® ® препарати (устекінумаб (Stelara )), анти-інтегринові засоби (наталізумаб (Tysabri )), анти-CD20 ® ® моноклональні антитіла (ритуксимаб (Rituxan ) і офатумумаб (Arzerra )) і інші засоби, такі як ® ® ® абатацепт (Orencia ), анакінра (Kineret ), і белімумаб (Benlysta ), CD4 біологічні препарати і інші 10 UA 113892 C2 5 10 15 20 25 30 35 40 45 50 55 60 цитокінові інгібітори або біологічні препарати до рецепторів T-клітин або B-клітин або інтерлейкіни. Приклади відповідних анти-TNF засобів охоплюють анти-TNF біологічні препарати, ® ® ® ® такі як Enbrel (етанерцепт), Humira (адалімумаб), Remicade (інфліксимаб), Cimzia ® (цертолізумаб) і Simponi (голімумаб). Цей винахід надає сполуку за винаходом для застосування у терапії. Цей винахід також надає сполуку Формули (I), або її фармацевтично прийнятну сіль для застосування у терапії. Конкретно, цей винахід надає сполуки, описані у цьому описі для застосування в терапії. У ще одному варіанті реалізації цей винахід надає сполуку за винаходом для застосування при лікуванні захворювання або розладу, опосередкованого інгібуванням RIP2-кінази. У ще одному варіанті реалізації цей винахід надає сполуку Формули (I), або її фармацевтично прийнятну сіль для застосування при лікуванні захворювання або розладу, опосередкованого інгібуванням RIP2-кінази. Особливо, цей винахід надає сполуки, описані у цьому описі, для застосування при лікуванні захворювання або розладу, опосередкованого інгібуванням RIP2кінази. У ще одному варіанті реалізації цей винахід надає сполуку Формули (I), або її фармацевтично прийнятну сіль для застосування при лікуванні увеїту, гарячкового синдрому, що асоціюється з інтерлейкін-1-перетворюючим ферментом, дерматиту, гострого пошкодження легенів, цукрового діабету другого типу, артриту, ревматоїдного артриту, виразкового коліту, хвороби Крону, запального захворювання кишечнику з раннім початком, позакишкового запального захворювання кишечнику, запобігання ішемічно-реперфузійному пошкодженню в трансплантатах твердих органів, неалкогольного стеатогепатиту, алкогольного стеатогепатиту, аутоімунного гепатиту, астми, кризу відторгнення трансплантата, системного червоного вовчаку, розсіяного склерозу, саркоїдозу, синдрому Блау/саркоїдоза з раннім початком, гранулематозу Вегенера або інтерстиціальній хворобі легенів. У ще одному варіанті реалізації цей винахід надає сполуку Формули (I) або її фармацевтично прийнятну сіль для застосування при лікуванні увеїту. У ще одному варіанті реалізації цей винахід надає сполуку Формули (I) або її фармацевтично прийнятну сіль для застосування при лікуванні гарячкового синдрому, що асоціюється з інтерлейкін-1-перетворюючим ферментом. У ще одному варіанті реалізації цей винахід надає сполуку Формули (I) або її фармацевтично прийнятну сіль для застосування при лікуванні синдрому Блау. У ще одному варіанті реалізації цей винахід надає сполуку Формули (I) або її фармацевтично прийнятну сіль для застосування при лікуванні саркоїдозу з раннім початком. У ще одному варіанті реалізації цей винахід надає сполуку Формули (I) або її фармацевтично прийнятну сіль для застосування при лікуванні виразкового коліту. У ще одному варіанті реалізації цей винахід надає сполуку Формули (I), або її фармацевтично прийнятну сіль для застосування при лікуванні хвороби Крону. У ще одному варіанті реалізації цей винахід надає сполуку Формули (I) або її фармацевтично прийнятну сіль для застосування при лікуванні запального захворювання кишечника з раннім початком. У ще одному варіанті реалізації цей винахід надає сполуку Формули (I) або її фармацевтично прийнятну сіль для застосування при лікуванні позакишкового запального захворювання кишечника. У ще одному варіанті реалізації цей винахід надає сполуку Формули (I) або її фармацевтично прийнятну сіль для застосування при лікуванні гранулематозу Вегенера. У ще одному варіанті реалізації цей винахід надає сполуку Формули (I) або її фармацевтично прийнятну сіль для застосування при лікуванні саркоїдозу. Цей винахід конкретно надає застосування сполуки Формули (I) або її фармацевтично прийнятної солі як активної терапевтичної речовини при лікуванні захворювання або розладу, опосередкованого RIP2-кіназою, наприклад, захворювань і розладів, перерахованих у цьому описі. Конкретніше, цей винахід надає застосування сполуки Формули (I) або її фармацевтично прийнятної солі для лікування захворювання або розладу, опосередкованого інгібуванням RIP2кінази. Цей винахід конкретно надає застосування сполук, описаних у цьому описі, для лікування захворювання або розладу, опосередкованого інгібуванням RIP2-кінази. Відповідно, винахід надає застосування сполуки Формули (I), або її фармацевтично прийнятної солі як активної терапевтичної речовини при лікуванні у людини, яка потребує цього лікування, захворювання, опосередкованого інгібуванням RIP2-кінази. Цей винахід також надає застосування сполуки Формули (I) або її фармацевтично прийнятної солі у виробництві лікарського засобу для застосування при лікуванні захворювання або розладу, опосередкованого RIP2-кіназою, наприклад, захворювань і розладів, перерахованих у цьому описі. Конкретніше, цей винахід надає застосування сполуки Формули (I) або її фармацевтично прийнятної солі у виробництві лікарського засобу для лікування захворювання або розладу, опосередкованого інгібуванням RIP2-кінази. Відповідно, винахід надає застосування сполуки Формули (I) або її фармацевтично прийнятної солі у виробництві лікарського засобу для застосування при лікуванні у людини, яка потребує цього лікування, 11 UA 113892 C2 5 10 15 20 25 30 35 40 45 50 55 захворювання або розладу, опосередкованого інгібуванням RIP2-кінази. В одному варіанті реалізації цей винахід надає застосування сполуки Формули (I) або її фармацевтично прийнятної солі у виробництві лікарського засобу для застосування при лікуванні увеїту, гарячкового синдрому, що асоціюється з інтерлейкін-1-перетворюючим ферментом, дерматиту, гострого пошкодження легенів, цукрового діабету другого типу, артриту, ревматоїдного артриту, виразкового коліту, хвороби Крону, запального захворювання кишечнику з раннім початком, позакишкового запального захворювання кишечнику, запобігання ішемічно-реперфузійному пошкодженню в трансплантаті твердого органу, неалкогольного стеатогепатита, алкогольного стеатогепатиту, аутоімунного гепатиту, астми, кризу відторгнення трансплантата, системного червоного вовчаку, розсіяного склерозу, саркоїдозу, синдрому Блау/саркоїдозу з раннім початком, гранулематозу Вегенера або інтерстиціальній хворобі легенів. У ще одному варіанті реалізації цей винахід надає застосування сполуки Формули (I) або її фармацевтично прийнятної солі у виробництві лікарського засобу для застосування при лікуванні увеїту. У ще одному варіанті реалізації цей винахід надає застосування сполуки Формули (I) або її фармацевтично прийнятної солі у виробництві лікарського засобу для застосування при лікуванні гарячкового синдрому, що асоціюється з інтерлейкін-1-перетворюючим ферментом. У ще одному варіанті реалізації цей винахід надає застосування сполукиФормули (I) або її фармацевтично прийнятної солі у виробництві лікарського засобу для застосування при лікуванні саркоїдозу з раннім початком. У ще одному варіанті реалізації цей винахід надає застосування сполуки Формули (I) або її фармацевтично прийнятної солі у виробництві лікарського засобу для застосування при лікуванні виразкового коліту. У ще одному варіанті реалізації цей винахід надає застосування сполуки Формули (I) або її фармацевтично прийнятної солі у виробництві лікарського засобу для застосування при лікуванні хвороби Крону. У ще одному варіанті реалізації цей винахід надає застосування сполуки Формули (I) або її фармацевтично прийнятної солі у виробництві лікарського засобу для застосування при лікуванні гранулематозу Вегенера. У ще одному варіанті реалізації цей винахід надає застосування сполуки Формули (I) або її фармацевтично прийнятній солі у виробництві лікарського засобу для застосування при лікуванні саркоїдозу. У ще одному варіанті реалізації цей винахід надає застосування сполуки Формули (I) або її фармацевтично прийнятної солі у виробництві лікарського засобу для застосування при лікуванні запального захворювання кишечника з раннім початком. У ще одному варіанті реалізації цей винахід надає застосування сполуки Формули (I) або її фармацевтично прийнятної солі у виробництві лікарського засобу для застосування при лікуванні позакишкового запального захворювання кишечнику. У додатковому варіанті реалізації цей винахід надає застосування сполуки Формули (I) або її фармацевтично прийнятній солі у виробництві лікарського засобу для застосування при лікуванні синдрому Блау. Термін терапевтично "ефективна кількість" призначений для позначення того, що кількість сполуки, яка, коли його вводять пацієнтові, який потребує такого лікування, є достатньою, щоб надавати дію на лікування, як визначено у цьому описі. Таким чином, наприклад, терапевтично ефективна кількість сполуки Формули (I) або її фармацевтично прийнятної солі або її гідрату, є кількістю засобу за винаходом, яка, коли її вводять людині, яка потребує цього, є достатньою, щоб модулювати або інгібувати активність RIP2-кінази, таким чином, що хворобливий стан, який є опосередкованим такою активністю, зменшується, полегшується або йому запобігають. Кількість цієї сполуки, яка відповідатиме такій кількості, змінюватиметься залежно від чинників, таких як конкретна сполука (наприклад, активність (pIC50), ефективність дії (EC50) і біологічний час напівжиття конкретної сполуки), хворобливий стан і його важкість, ідентичність (наприклад, вік, розмір і маса тіла) пацієнта, який потребує лікування, але які, проте, можуть бути визначені стандартним чином фахівцем у цій галузі. Аналогічно, тривалість лікування і період часу введення (період між дозуваннями і часовий режим дозувань, наприклад, перед/разом з/після прийомів їжи) сполуки змінюватимуться відповідно до ідентичності ссавця, який потребує лікування (наприклад, масою тіла), конкретної сполуки і її властивостей (наприклад, фармацевтичними характеристиками), захворюванням або розладом і його важкістю і конкретними композицією і способом, що використовуються, але які, проте, можуть бути визначені стандартним чином фахівцем у цій галузі. Термін "вилікування" або "лікування" призначений для позначення щонайменше пом'якшення протікання захворювання або розладу у пацієнта. Способи лікування для пом'якшення захворювання або розладу включають застосування сполук у цьому винаході будь-яким загальноприйнятим прийнятним чином, наприклад, для запобігання, затримки, профілактики, терапії або вилікування опосередкованого захворювання або розладу. Конкретні 12 UA 113892 C2 5 10 15 20 25 30 35 40 45 50 55 60 захворювання і розлади, які, зокрема, можуть бути особливо сприйнятливими до лікування із використанням сполуки за цим винаходом, описані у цьому описі. Сполуки за винаходом можуть вводитися за допомогою будь-якого прийнятного шляху введення, що включає як системне введення, так і місцеве введення. Системне введення включає пероральне введення, парентеральне введення, черезшкірне введення, ректальне введення і введення за допомогою інгаляції. Парентеральне введення відноситься до шляхів введення, відмінних від ентерального, черезшкірного введення або введення за допомогою інгаляції, і здійснюється зазвичай за допомогою ін'єкції або інфузії. Парентеральне введення включає внутрішньовенну, внутрішньом'язову і підшкірну ін'єкцію або інфузію. Інгаляція відноситься до введення у легені пацієнта або до вдихання через рот або через носові проходи. Місцеве введення включає застосування на шкірі. Сполуки за винаходом можуть вводитися однократно або відповідно до режиму дозування, де число доз вводять при інтервалах часу, що змінюються, протягом даного періоду часу. Наприклад, дози можуть вводитися один, два, три або чотири рази на день. Дози можуть вводитися до досягнення бажаного терапевтичного ефекту або невизначено для підтримки бажаного терапевтичного ефекту. Прийнятні режими дозування для сполуки за винаходом залежать від фармакокінетичних властивостей такої сполуки, таких як всмоктування, розподіл і час напівжиття, які можуть бути визначені кваліфікованим фахівцем у цій галузі. На додаток, прийнятні режими дозування, що охоплюють тривалість введення таких режимів для сполуки за винаходом, залежать від захворювання або розладу, що виліковується, важкості захворювання або розладу, що виліковується, віку і фізичного стану пацієнта, який проходить лікування, історії хвороби пацієнта, який проходить лікування, природи супутньої терапії, бажаного терапевтичного ефекту і подібних чинників, що знаходяться у межах обсягу знань і компетентності кваліфікованого фахівця у цій галузі. Такі кваліфіковані фахівці у цій галузі зможуть додатково зрозуміти, що прийнятні режими дозування можуть вимагати регулювання з урахуванням відповіді індивідуального пацієнта на режим дозування або з часом, оскільки для індивідуального пацієнта необхідні зміни. Для застосування в терапії, сполуки за винаходом будуть зазвичай, але не обов'язково, складені у фармацевтичну композицію перед введенням пацієнтові. Відповідно, винахід також направлений на фармацевтичні композиції, що містять сполуку за винаходом і один або декілька фармацевтично прийнятних ексципієнтів. У одному варіанті реалізації винаходу надана фармацевтична композиція, що містить 2-((4(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етилдигідрофосфат у вигляді вільної кислоти і один або декілька фармацевтично прийнятних ексципієнтів. У ще одному варіанті реалізації, надана фармацевтична композиція, що містить 2-((4-(бензо[d]тіазол5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етилдигідрофосфат або його фармацевтично прийнятну сіль і один або декілька фармацевтично прийнятних ексципієнтів. У ще одному варіанті реалізації, надана фармацевтична композиція, що містить 2-((4(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси) етилдигідрофосфат або його гідрат і один або декілька фармацевтично прийнятних ексципієнтів. У ще одному варіанті реалізації, надана фармацевтична композиція, що містить фармацевтично прийнятну сіль 2-((4(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етилдигідрофосфату або його гідрат і один або декілька фармацевтично прийнятних ексципієнтів. У ще одному іншому варіанті реалізації винаходу, надана фармацевтична композиція, що містить натрієву, кальцієву або гідрохлоридну сіль 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)окси)етилдигідрофосфату або її гідрат, і один або декілька фармацевтично прийнятних ексципієнтів. У конкретному варіанті реалізації винаходу надана фармацевтична композиція, що містить 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етилдинатрійфосфат і один або декілька фармацевтично прийнятних ексципієнтів. У ще одному конкретному варіанті реалізації винаходу надана фармацевтична композиція, що містить тригідрат 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)окси)етилгідрофосфату кальцію (I) і один або декілька фармацевтично прийнятних ексципієнтів. У додатковому конкретному варіанті реалізації винаходу надана фармацевтична композиція, що містить тригідрат 2-((4-(бензо[d]тіазол-5-іламіно)-6-(третбутилсульфоніл)хіназолін-7-іл)окси) етилгідрофосфату кальцію (I), що має PXRD згідно Фігури 1, і один або декілька фармацевтично прийнятних ексципієнтів. У ще одному іншому конкретному варіанті реалізації винаходу надана фармацевтична композиція, що містить моногідрат гідрохлориду 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет 13 UA 113892 C2 5 10 15 20 25 30 35 40 45 50 55 60 бутилсульфоніл)хіназолін-7-іл)окси) етилдигідрофосфату і один або декілька фармацевтично прийнятних ексципієнтів. У ще додатковому конкретному варіанті реалізації винаходу надана фармацевтична композиція, що містить моногідрат гідрохлориду 2-((4-(бензо[d]тіазол-5іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси) етилдигідрофосфату, що має PXRD згідно з Фігурою 2, і один або декілька фармацевтично прийнятних ексципієнтів. У ще одному варіанті реалізації винаходу надана фармацевтична композиція, що містить (S)-2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2-аміно-3метилбутаноат у вигляді вільної основи і один або декілька фармацевтично прийнятних ексципієнтів. У ще одному варіанті реалізації винаходу надана фармацевтична композиція, що містить (S)-2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2аміно-3-метилбутаноат або його фармацевтично прийнятну сіль і один або декілька фармацевтично прийнятних ексципієнтів. У ще одному варіанті реалізації винаходу надана фармацевтична композиція, що містить (R)-2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2-аміно-3метилбутаноат у вигляді вільної основи і один або декілька фармацевтично прийнятних ексципієнтів. У ще одному варіанті реалізації винаходу надана фармацевтична композиція, що містить (R)-2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2аміно-3-метилбутаноат або його фармацевтично прийнятну сіль і один або декілька фармацевтично прийнятних ексципієнтів. У додатковому варіанті реалізації винаходу надана фармацевтична композиція, що містить (2S,3S)-2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2-аміно3-метилпентаноат у вигляді вільної основи і один або декілька фармацевтично прийнятних ексципієнтів. У додатковому варіанті реалізації надана фармацевтична композиція, що містить (2S,3S)-2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2-аміно3-метилпентаноат або його фармацевтично прийнятну сіль і один або декілька фармацевтично прийнятних ексципієнтів. Фармацевтичні композиції за винаходом можуть бути одержані й упаковані в насипній формі, де ефективна кількість сполуки за винаходом може бути екстрагована і потім видана пацієнтові, такій як з порошками, сиропами і розчинами для ін'єкції. Альтернативно, фармацевтичні композиції за винаходом можуть бути одержані і упаковані в одиничній стандартній лікарській формі. Для перорального застосування можуть вводитися, наприклад, одна або декілька пігулок або капсул. Доза фармацевтичної композиції містить щонайменше терапевтично ефективну кількість сполуки за цим винаходом (тобто, сполуку Формули (I) або сіль, особливо, її фармацевтично прийнятну сіль). При одержанні в одиничній стандартній лікарській формі фармацевтичні композиції можуть містити від 1 мг до 1000 мг сполуки за цим винаходом. Як надано у цьому описі, одиничні стандартні лікарські форми (фармацевтичні композиції), що містять від 1 мг до 1000 мг сполуки за винаходом, можуть вводитися один, два, три або чотири рази на день, переважно один, два або три рази на день, і переважніше, один раз або двічі на день, для надання дії на лікування захворювання або розладу, опосередкованого RIP2. Фармацевтичні композиції за винаходом зазвичай містять одну сполуку за винаходом. Проте, у деяких варіантах реалізації винаходу фармацевтичні композиції за винаходом містять більше однієї сполуки за винаходом. На додаток, фармацевтичні композиції за винаходом можуть необов'язково додатково містити одну або декілька додаткових фармацевтично активних сполук. Як використовують у цьому описі, "фармацевтично прийнятний ексципієнт" позначає речовину, композицію або середовище, залучені в надання форми або консистенції композиції. Кожен ексципієнт має бути сумісним із іншими інгредієнтами фармацевтичної композиції, коли його змішують, таким чином, щоб уникнути взаємодій, які могли б істотно знизити ефективність дії сполуки за винаходом при введенні пацієнтові, і взаємодій, які могли б призвести у результаті до фармацевтичних композицій, які не є фармацевтично прийнятними. На додаток, кожен ексципієнт повинен поза сумнівом мати досить високу чистоту, щоб бути фармацевтично прийнятним. Сполуки за винаходом і фармацевтично прийнятний ексципієнт або ексципієнти типовим чином будуть складені у дозовану лікарську форму, адаптовану для введення пацієнтові за допомогою бажаного шляху введення. Загальноприйняті дозовані лікарські форми охоплюють дозовані форми, пристосовані для (1) перорального введення, такі як пігулки, капсули, капсуловидні пігулки, пілюлі, пастилки, порошки, сиропи, еліксири, суспензії, розчини, емульсії, саше і облатки; (2) парентерального введення, такі як стерильні розчини, суспензії і порошки для розчинення; (3) черезшкірного введення, такі як трансдермальні пластири; (4) ректального 14 UA 113892 C2 5 10 15 20 25 30 35 40 45 50 55 60 введення, такі як супозиторії; (5) інгаляції, такі як аерозолі і розчини; і (6) місцевого введення, такі як креми, мазі, лосьйони, розчини, пасти, спреї, піни і гелі. Прийнятні фармацевтично прийнятні ексципієнти змінюватимуться залежно від конкретної вибраної дозованої форми. На додаток, прийнятні фармацевтично прийнятні ексципієнти можуть бути вибрані для конкретної функції, яку вони можуть виконувати у композиції. Наприклад, деякі фармацевтично прийнятні ексципієнти можуть бути вибрані через їх здатності полегшувати одержання однорідних дозованих форм. Деякі фармацевтично прийнятні ексципієнти можуть бути вибрані через їх здатності полегшувати одержання стійких дозованих форм. Деякі фармацевтично прийнятні ексципієнти можуть бути вибрані через їх здатності сприяти перенесенню або транспортуванню сполуки або сполук за винаходом одразу після введення пацієнтові від одного органу або частини тіла до ще одного органу або ще однієї іншої частини тіла. Деякі фармацевтично прийнятні ексципієнти можуть бути вибрані через їх здатності покращувати дотримання пацієнтом схеми і режиму лікування. Прийнятні фармацевтично прийнятні ексципієнти охоплюють наступні типи ексципієнтів: розчинники, наповнювачі, зв'язуючі речовини, розпушувачі, змащуючі речовини, гліданти, гранулюючі засоби, покривні речовини, змочуючі засоби, розчинники, спів-розчинники, суспендуючі засоби, емульгатори, підсолоджувачі, ароматизатори, засоби, що маскують запах, забарвлюючі засоби, засоби проти грудкування, зволожувачі, хелатуючі агенти, пластифікатори, засоби, що збільшують в'язкість, антиоксиданти, консерванти, стабілізатори, поверхнево-активні речовини і буферні агенти. Кваліфікований фахівець у цій галузі зрозуміє, що деякі фармацевтично прийнятні ексципієнти можуть виконувати більше однієї функції і можуть виконувати альтернативні функції залежно від того, наскільки багато ексципієнту міститься у готовій лікарській формі і які інші інгредієнти присутні в готовій лікарській формі. Кваліфіковані фахівці у цій галузі мають знання і кваліфікацію у цій галузі, щоб зробити можливим вибір відповідних фармацевтично прийнятних ексципієнтів у відповідних кількостях для застосування у винаході. На додаток, існує ряд ресурсів, які є доступними кваліфікованому фахівцеві у цій галузі, які описують фармацевтично прийнятні ексципієнти і можуть бути корисними при виборі прийнятних фармацевтично прийнятних ексципієнтів. Приклади охоплюють Remington's Pharmaceutical Sciences (Mack Publishing Company), The Handbook of Pharmaceutical Additives (Gower Publishing Limited), і The Handbook of Pharmaceutical Excipients (the American Pharmaceutical Association and the Pharmaceutical Press). Фармацевтичні композиції за винаходом одержують із використанням технологій і способів, відомих фахівцям у цій галузі. Деякі із способів, що зазвичай використовуються у цій галузі, описані у Remington's Pharmaceutical Sciences (Mack Publishing Company). В одному аспекті, винахід направлений на тверду пероральну дозовану лікарську форму, таку як пігулку або капсулу, що містить ефективну кількість сполуки за винаходом і розчинник або наповнювач. Прийнятні розчинники і наповнювачі охоплюють лактозу, сахарозу, декстрозу, маніт, сорбіт, крохмаль (наприклад, кукурудзяний крохмаль, картопляний крохмаль і прежелатований крохмаль), целюлозу і її похідні (наприклад, мікрокристалічну целюлозу), сульфат кальцію, і двоосновний фосфат кальцію. Пероральна тверда дозована лікарська форма може додатково містити зв'язуючу речовину. Прийнятні зв'язуючі речовини охоплюють крохмаль (наприклад, кукурудзяний крохмаль, картопляний крохмаль і прежелатований крохмаль), желатин, камедь акації, альгінат натрію, альгінову кислоту, трагакант, гуарову камедь, повідон і целюлозу та її похідні (наприклад, мікрокристалічну целюлозу). Пероральна тверда дозована лікарська форма може додатково містити розпушувач. Прийнятні розпушувачі охоплюють кросповідон, гліколат натрію крохмалю, кроскармелозу, альгінову кислоту і карбоксиметилцелюлозу натрію. Пероральна тверда дозована лікарська форма може додатково містити змащуючу речовину. Прийнятні змащуючі речовини охоплюють стеаринову кислоту, стеарат магнію, стеарат кальцію і тальк. ПРИКЛАДИ Наступні приклади ілюструють винахід. Ці приклади не призначені для обмеження обсягу цього винаходу, але здебільшого для того, щоб забезпечити керівництво для кваліфікованого фахівця у цій галузі для одержання і застосування сполук, композицій і способів за цим винаходом. У той час як описані конкретні варіанти реалізації цього винаходу, кваліфікований фахівець у цій галузі зрозуміє, що можуть бути виконані різні зміни і модифікації без відступу від суті і обсягу винаходу. Найменування для проміжних і кінцевих сполук, описаних у цьому описі, генерували з використанням програми найменувань програмного забезпечення ACD/Name Pro V6.02, доступного від Advanced Chemistry Development, Inc., 110 Yonge Street, 14th Floor, Toronto, Ontario, Canada, M5C 1T4 (http://www.acdlabs.com/) або програми найменувань ChemDraw, 15 UA 113892 C2 5 Struct=Name Pro 12.0, як частини ChemBioDraw Ultra, доступній від CambridgeSoft. 100 CambridgePark Drive, Cambridge, MA 02140 USA (www.cambridgesoft.com). Фахівці у цій галузі зрозуміють, що у деяких випадках ця програма називатиме структурно зображену сполуку як таутомер такої сполуки. Слід розуміти, що будь-яке посилання на названу сполука або структурно зображену сполуку призначене для того, щоб охопити всі таутомери такої сполуки і будь-які суміші її таутомерів. У наступних експериментальних описах можуть застосовуватися наступні скорочення: Скорочення AcOH водн. brine СН2Сl2 або ДХМ CH3CN або MeCN СH3NH2 д DCE DMAP ДМФА ДМСО EDC еквів. Et Et3N або TEA Et2O EtOAc г., год.(и) HATU Значення оцтова кислота водний насичений водний хлорид натрію метиленхлорид ацетонітрил Метиламін день 1,2-дихлоретан 4-диметиламінопіридин N,N-диметилформамід диметилсульфоксид 1-етил-3-(3-диметиламінопропіл)карбодіімід еквіваленти етил триетиламін діетиловий ефір етилацетат година(години) Гексафторфосфат О-(7-азабензотриазол-1іл)-N,N,N',N'-тетраметилуронію хлористоводнева кислота монохлорид йоду N',N'-діізопропілетиламін трет-бутоксид калію рідинна хроматографія-мас-спектроскопія гексаметилдисилазид літію Метил Метанол сульфат магнію хвилина(хвилини) мас-спектр Мікрохвилі карбонат натрію бікарбонат натрію гідроксид натрію сульфат натрію Гідразин хлорид амонію гексагідрат хлориду нікелю (II) N-метил-2-піролідон Феніл фосфорилхлорид кімнатна температура Насичений твердофазова екстракція трифтороцтова кислота тетрагідрофуран час утримування HCl ICl i-Pr2NEt KOt-Bu LCMC LIHDMS Me MeOH або СН3ОН MgSO4 хв. МС µw Na2CO3 NaHCO3 NaOH Na2SO4 N2H2 NH4Cl NiCl2•6H2O NMP Ph POCl3 кт насич. SPE ТФУ ТГФ tR 16 UA 113892 C2 Одержання 1 N-(6-(трет-бутилтіо)-7-метоксихіназолін-4-іл)бензо[d]тіазол-5-амін 5 10 15 20 25 30 35 Стадія 1. Метил 2-аміно-4-метоксибензоат: До розчину 2-аміно-4-(метилокси)бензойної кислоти (5 г, 30 ммоль) у MeOH (30 мл) і толуолі (60 мл) додавали триметилсилілдіазометан (30 мл, 60 ммоль). Реакційну суміш перемішували при 0 °C протягом 1 год. Реакційній суміші дозволяли нагрітися до кімнатної температури і розчинник видаляли під вакуумом. Неочищену речовину очищали за допомогою колонкової хроматографії (від 0 до 15 % EtOAc/гексани) із + одержанням 4,2 г вказаної в заголовку сполуки (74 %). МС: m/z: 182 [M+H] . Стадія 2. Метил-2-аміно-5-йодо-4-метоксибензоат: Метил-2-аміно-4-(метилокси)бензоат (3,78 г, 20,86 ммоль) розчиняли у 25 мл води, 15 мл етанолу і 2,2 мл концентрованої HCl. Розчин ICl (1,1 мл, 21,9 ммоль) у 3,8 мл концентрованої HCl і 14 мл води при 5 °C додавали до розчину аніліну. Реакційну суміш перемішували протягом ночі і потім фільтрували із + одержанням 6,9 г світло-коричневої твердої речовини. МС: m/z: 308 [M+H] . Стадія 3. 6-йодо-7-метоксихіназолін-4(1H)-он: Розчин метил-2-аміно-5-йодо-4(метилокси)бензоату (2 г, 6,5 ммоль) і імідоформаміда (2,0 г, 19,5 ммоль) у 2-метоксиетанолі (15 мл) перемішували при 125 °C протягом 6 год. Розчинник видаляли під вакуумом, і залишок суспендували у воді і тверду речовину збирали за допомогою фільтрації, промивали водою і сушили під вакуумом (50 °C) із одержанням 2,1 г вказаної в заголовку сполуки (96 % чистоти). + МС: m/z: 303 [M+H] . Стадія 4. 4-хлор-6-йодо-7-(метилокси)хіназолін: 6-йодо-7-(метилокси)-4(1H)-хіназолінон (2,0 г, 6,6 ммоль), POCl3 (3,1 мл, 33,1 ммоль) і DIPEA (6,9 мл, 40 ммоль) об'єднували в DCE (50 мл) у круглодонній колбі. Реакційну суміш нагрівали при 80 °C протягом 5 год., з подальшим нагрівом при 70 °C протягом ночі. Реакційній суміші дозволяли охолодитися до кімнатної температури. Жовта тверда речовина випадала в осад. Тверду речовину фільтрували. Розчин концентрували і нейтралізували насич. NaHCО3, екстрагували CH2Cl2 і сушили над Na2SО4. Суміш фільтрували, і розчинник видаляли під вакуумом. Тверді частини об'єднували із одержанням 2,0 г вказаної в + заголовку сполуки (88 %, 93 % чистоти)). МС: m/z: 321 [M+H] . Стадія 5. N-1,3-бензотіазол-5-іл-6-йодо-7-(метилокси)-4-хіназолінамін: До розчину 4-хлор-6йодо-7-(метилокси) хіназоліну (2,0 г, 5,4 ммоль) в 1-пропанолі (30 мл) додавали 1,3-бензотіазол5-амін (1,2 г, 8,1 ммоль). Суспензію нагрівали на масляній бані при 90 °C (заздалегідь нагрітою). Реакційну суміш перемішували при цій температурі протягом 30 хв. Жовта тверда речовина випадала в осад, у міру того, як реакційній суміші давали охолодитися до кімнатної температури. Тверду речовину відфільтровували, промивали толуолом і сушили із одержанням + 1,3 г вказаної в заголовку сполуки (55,2 %, 99 % чистоти). МС: m/z: 435 [M+H] . Стадія 6. N-(6-(трет-бутилтіо)-7-метоксихіназолін-4-іл)бензо[d]тіазол-5-амін: До розчину N1,3-бензотіазол-5-іл-6-йодо-7-(метилокси)-4-хіназолінаміну (2,1 г, 4,5 ммоль), 2-метил-2 17 UA 113892 C2 5 10 15 20 25 30 35 40 пропантіола (483 мг, 5,35 ммоль), Et3N (1,9 мл, 13,4 ммоль) у ДМФА (5 мл) додавали Pd(Ph 3P)4 (516 мг, 0,45 ммоль). Реакційну суміш перемішували при 90-100 °C протягом 1 год. Більшу частину ДМФА видаляли під вакуумом. Неочищену речовину розтирали з MeOH. Червону тверду речовину фільтрували і промивали Et 2О із одержанням 1,7 г вказаної в заголовку + сполуки у вигляді білястої твердої речовини (92 %, 96 % чистоти). МС: m/z: 397 [M+H] . Одержання 2 N-(6-(трет-бутилсульфоніл)-7-метоксихіназолін-4-іл)бензо[d]тіазол-5-амін До розчину N-(6-(трет-бутилтіо)-7-метоксихіназолін-4-іл)бензо[d]тіазол-5-аміну (1,0 г, 2,5 ммоль) у ТГФ (20 мл) і воді (2 мл) додавали оксон (3,1 г, 5,0 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 8 год. Насичений водний NaHCО 3 додавали до реакційної суміші, щоб довести її до pH~7. Суміш екстрагували EtOAc (100 мл×2) і CH 2Cl2 (100 мл×2), сушили над Na2SО4 і фільтрували. Розчинник видаляли під вакуумом, і неочищену речовину очищали за допомогою колонкової хроматографії (від 0 до 8 % MeOH/CH2Cl2) із + одержанням 530 мг вказаної в заголовку сполуки (43,6 %, 89 % чистоти). МС: m/z: 429 [M+H] . 1 H ЯМР N-(6-(трет-бутилсульфоніл)- 7-метоксихіназолін-4-іл)бензо[d]тіазол-5-аміна: (400 Мгц, ДМСО-d6) δ 1,34 (с, 9H), 4,01 (с, 3H), 7,40 (с, 1H), 7,89 (дд, J=8,80, 1,78 Гц, 1H), 8,17 (д, J=8,80 Гц, 1H), 8,59 (д, J=1,78 Гц, 1H), 8,64 (с, 1H), 9,14 (с, 1H), 9,42 (с, 1H), 10,55 (с, 1H). Одержання 3 4-(Бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-ол До розчину N-(6-(трет-бутилсульфоніл)-7-метоксихіназолін-4-іл) бензо[d]тіазол-5-аміну (2,0 г, 4,7 ммоль) у ДМФА (30 мл) додавали ізопропілтіолат натрію (2,7 г, 28,0 ммоль), і розчин перемішували при 150 °C протягом 1 год. Розчинник видаляли під вакуумом. 1N водн. HCl додавали до реакційної суміші, щоб нейтралізувати до pH=6. Жовта тверда речовина випадала в осад, який відфільтровували і очищали за допомогою колонкової хроматографії (від 0 до 5 % MeOH/CH2Cl2), із одержанням 1,5 г вказаної в заголовку сполуки (65,9 %, 85 % чистоти). МС: + m/z: 415 [M+H] . 1 H ЯМР 4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-ола: (400 Мгц, ДМСО-d6) δ 1,15-1,46 (с, 9H), 7,21 (с, 1H), 7,89 (дд, J=8,72, 1,78 Гц, 1H), 8,16 (д, J=8,72 Гц, 1H), 8,55 (с, 1H), 8,58 (д, J=1,78 Гц, 1H), 9,07 (с, 1H), 9,42 (с, 1H), 10,47 (с, 1H), 11,45 (шир. с, 1H). Одержання 4 2-((4-(Бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етанол 4-(Бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-ол (8,0 г, 19,3 ммоль) і K2CO3 (5,9 г, 42,5 ммоль) розчиняли в 98 мл ДМФА і перемішували 2 хв. перед додаванням 2брометанолу (5,1 мл, 72,4 ммоль). Суміш нагрівали протягом 3 год. при 70 °C, і потім охолоджували до кімнатної температури і перемішували протягом 18 год. Додавали воду (300 мл), і одержану в результаті тверду речовину відфільтровували і промивали водою. Вологий корж знову суспендували у воді і відфільтровували із одержанням рудувато-коричневої твердої 18 UA 113892 C2 5 10 15 20 25 30 35 речовини. Тверду речовину розчиняли в гарячому EtOAc/MeOH (150 мл/50 мл) і охолоджували до кімнатної температури із одержанням осаду білої твердої речовини, яку відфільтровували і сушили під вакуумом із одержанням продукту у вигляді білої твердої речовини (2,4 г). Одержаний у результаті фільтрат упарювали насухо, розтирали з EtOAc, фільтрували, і сушили з одержанням світло-коричневої твердої речовини (3,1 г). Тверді речовини об'єднували (5,5 г, 62 % вихід). Декілька завантажень цієї речовини об'єднували з одержанням 15 г сировинної речовини. До цієї твердої речовини додавали воду (150 мл). Суміш обробляли ультразвуком і перемішували протягом 15 хв. при кімнатній температурі. Тверду речовину фільтрували і сушили під вакуумом при 70 °C протягом 3 днів із одержанням сполуки, вказаної в заголовку, у + 1 вигляді твердої речовини (14,8 г, 98 % витягання). МС: m/z: 459 [M+H] ; H ЯМР (400 Мгц, ДМСО-d6) δ 1,36 (с, 9H), 3,81 (кв., J=4,80 Гц, 2H), 4,28 (т, J=4,80 Гц, 2H), 4,81 (т, J=4,80 Гц, 1H), 7,41 (с, 1H), 7,89 (д, J=8,40 Гц, 1H), 8,17 (д, J=8,40 Гц, 1H), 8,58 (с, 1H), 8,63 (с, 1H), 9,14 (с, 1H), 9,42 (с, 1H), 10,55 (с, 1H). Приклад 1 2-((4-(Бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)окси)етилдигідрофосфат 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етанол (4 г, 8,72 ммоль) і Et3N (1,824 мл, 13,08 ммоль) суспендували (за допомогою технічного фену для нагріву, щоб розчинити якомога більше речовини, що є не повністю розчинною при даній концентрації) у триетилфосфаті (40 мл) і 0 °C. POCl3 (1,220 мл, 13,08 ммоль) додавали повільно по краплях при 0 °C при енергійному перемішуванні. Реакційну суміш перемішували при 0 °C протягом 1 години до завершення реакції. Реакцію гасили водою (4 мл) при 0 °C протягом 10 хв., реакційну суміш суспендували у суміші ДМСО-CH3CN-50 мМ фосфат натрію-амонію (pH=7) (співвідношення 1:1:8), потім доводили pH до 7 за допомогою NH4OH із одержанням повного розчину, і очищали за допомогою препаративної C18 ВЕРХ (Luna C18, 10 мкм, колонка 101×250 мм, 500 мл/хв.) із використанням градієнта 15-21 % CH3CN у буфері 50 мМ фосфату натрію-амонію (pH=7). Фракції, що містять бажаний продукт (від множини очищень) об'єднували, доводили pH до 3,6 за допомогою мурашиної кислоти і концентрували до 300 мл із одержанням жовтої суспензії. pH суспензії повторно доводили до 3,6, суспензію охолоджували протягом 2 год. у бані з льодом; відфільтрований продукт промивали 50 мл холодної води і сушили при 40 °C протягом 18 год. в умовах високого вакууму із одержанням жовтої твердої речовини, 2-((4-(бензо[d]тіазол-5іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етилдигідрофосфату (76 % сумарний вихід). 1 H ЯМР (400 Мгц, ДМСО-d6) δ м.д. 1,36 (с, 9H), 4,16-4,28 (м, 3H), 4,45 (т, J=4,55 Гц, 2H), 7,43 (с, 1H), 7,89 (дд, J=8,72, 1,64 Гц, 1H), 8,17 (д, J=8,59 Гц, 1H), 8,58 (д, J=1,52 Гц, 1H), 8,64 (с, 1H), + 9,15 (с, 1H), 9,42 (с, 1H), 10,58 (шир. с, 1H); MС (m/z) 539 (M+H ). Приклад 2 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)окси)етилдинатрійфосфат 40 2-((4-(Бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)окси)етилдигідрофосфат (95 мг, 0,176 ммоль) суспендували в CH3CN (2 мл) і воді (2 мл), 19 UA 113892 C2 5 10 15 20 25 30 35 40 додавали розчин бікарбонату натрію (29,6 мг, 0,353 ммоль) у воді (1 мл) із одержанням прозорого розчину, який концентрували насухо на роторному випарнику. Одержаний у результаті залишок розтирали з CH3CN і упарювали насухо на роторному випарнику із одержанням білої твердої речовини, 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет1 бутилсульфоніл)хіназолін-7-іл)окси) етилдинатрійфосфату (103 мг, 100 %). H ЯМР (400 Мгц, D2O) δ м.д. 1,15 (с, 9H), 3,94 (д, J=18,95 Гц, 4H), 6,31 (с, 1H), 6,82-7,02 (м, 2H), 7,37 (шир. с, 1H), + + 7,76 (с, 1H), 7,90 (с, 1H), 8,70 (с, 1H); МС (m/z) 539 (M-2Na +3H ). Приклад 3 Тригідрат 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)окси)етилгідрофосфату кальцію (I) Ацетонітріл (11,0 мл) додавали до 2-((4-(бензо[d]тіазол-5-іламіно)-6-(третбутилсульфоніл)хіназолін-7-іл)окси)етилдигідрофосфату (407,1 мг). Суспензію нагрівали до 40 °C і Ca(OAc)2 (0,5M розчин у воді, 0,5 еквівалентів) додавали 3 рівними порціями (з інтервалом 10 хвилин) з подальшим засіванням затравковими кристалами. Температуру суспензії потім циклічно змінювали між 40 °C і 5 °C протягом ~20 год. Кристалічні тверді речовини виділяли за допомогою вакуум-фільтрації під завісою азоту. Вихід відфільтрованих твердих речовин дорівнював 90,1 % (411,5 мг). Дифрактограму порошкової рентгенівської дифракції Фігури 1 одержували після вакуумного сушіння твердих речовин при 40 °C протягом 4 годин. Стехіометрію гемі-кальцієвої солі підтверджували, як 1:0,5 (API:CI) за допомогою ICP-AES (3,8 %, теоретичне значення для гемі-Ca солі: 3,3 %). Затравкові кристали цієї гідратованої форми геми-кальцієвої солі одержували за аналогічною методикою, що проводиться у невеликому масштабі, за відсутності засівання. Приклад 4 Моногідрат гідрохлориду 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)окси)етилдигідрофосфату. ТГФ (11,0 мл) додавали до 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін7-іл)окси)етилдигідрофосфату (401,0 мг). Суспензію нагрівали до 40 °C і кислоту HCl (5M розчин у воді, 1,0 еквівалент) додавали 3 рівними порціями (з інтервалом 10 хвилин) із подальшим засіванням. Температуру суспензії потім циклічно змінювали між 40 °C і 5 °C протягом ~20 год. Кристалічні тверді речовини виділяли за допомогою вакуум-фільтрації під завісою азоту. Вихід відфільтрованих твердих речовин дорівнював 85,9 % (379,4 мг). Дифрактограму порошкової рентгенівської дифракції Фігури 2 одержували після вакуумного сушіння твердих речовин при 40 °C протягом 4 годин. Стехіометрію цієї HCl солі підтверджували, як рівну 1:1 (API:CI) за допомогою іонної хроматографії на вміст хлориду (5,990,42 %, теоретичне значення для HClсолі: 6,15 %). Затравкові кристали цієї гідратованої форми HCl-солі одержували за аналогічною методикою, що проводиться у невеликому масштабі, за відсутності засівання. Приклад 5 Дігідрохлорід (S)-2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)окси)етил-2-аміно-3-метилбутаноата a) (S)-2-((4-(бензо[(d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2((трет-бутоксикарбоніл)аміно)-3-метилбутаноат 20 UA 113892 C2 5 10 15 20 25 30 (S)-2-((трет-бутоксикарбоніл)аміно)-3-метилбутанову кислоту (171 мг, 0,785 ммоль) і HATU (498 мг, 1,308 ммоль) розчиняли у ДМФА (4 мл) при кімнатній температурі, додавали ізо-Pr2NEt (0,229 мл, 1,308 ммоль), перемішування продовжували протягом 15 хв. із подальшим додаванням 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етанолу (300 мг, 0,654 ммоль) і DMAP (15,99 мг, 0,13 ммоль). Реакційну суміш перемішували протягом 16 годин при кімнатній температурі, розбавляли EtOAc (100 мл), промивали водою, насиченим сольовим розчином, сушили над MgSO4 і концентрували. Залишок очищали на силікагелі (40 г, 5% MeOH/ДХМ) із одержанням (S)-2-((4-(бензо[d]тіазол-5-іламіно)-6-(третбутилсульфоніл)хіназолін-7-іл)окси)етил-2-трет-бутоксикарбоніл)аміно)-3-метилбутаноата (387 1 мг, 90 %). H ЯМР (400 Мгц, ДМСО-d6) δ м.д. 0,87 (т, 6H), 1,36 (с, 9H), 1,38 (с, 9H), 2,03-2,14 (м, 1H, 3,92 (дд, J=8,08, 6,06 Гц, 1H), 4,47 (д, J=10,86 Гц, 4H), 7,14 (д, J=8,34 Гц, 1H), 7,44 (с, 1H), 7,89 (дд, J=8,59, 2,02 Гц, 1H), 8,17 (д, J=8,59 Гц, 1H, 8,58 (д, J=2,02 Гц, 1H), 8,64 (с, 1H), 9,16 (с, + 1H), 9,43 (с, 1H), 10,57 (с, 1H); MС (m/z) 658 (M+H ). b) Дігідрохлорід (S)-2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)окси)етил-2-аміно-3-метилбутаноата HCl у 1,4-діоксані (4,33 мл, 17,33 ммоль) додавали у флакон, що містить (S)-2-((4(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2-((третбутоксикарбоніл)аміно)-3-метилбутаноат (380 мг, 0,578 ммоль), суспензію перемішували при кімнатній температурі протягом 1 години, концентрували, тверду речовину збирали за допомогою фільтрації, промивали EtOAc, і сушили в умовах високого вакууму протягом 16 годин із одержанням білястої твердої речовини, дигідрохлориду (S)-2-((4-(бензо[d]тіазол-5-іламіно)-61 (трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2-аміно-3-метилбутаноата (326 мг, 89 %). H ЯМР (400 Мгц, ДМСО-d6) δ м.д. 0,99 (д, J=7,07 Гц, 6H) 1,37 (с, 9H) 2,26 (дд, 1H) 3,91 (д, J=5,31 Гц, 1H) 4,60 (д, J=11,87 Гц, 4H) 7,71 (с, 1H) 7,78 (дд, J=8,72, 1,64 Гц, 1H) 8,30 (д, J=8,59 Гц, 1H) 8,44 (д, J=1,77 Гц, 1H) 8,56 (шир. с, 3H) 8,95 (с, 1H) 9,34 (с, 1H) 9,50 (с, 1H) 12,09 (шир. с, 1H); МС (m/z) + 558 (M+H ). Наступна сполука була одержана аналогічним чином із використанням (R)-2-((третбутоксикарбоніл)аміно)-3-метилбутанової кислоти. Приклад 6: (R)-2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)окси)етил-2-аміно-3-метилбутаноат, дигідрохлорид 21 UA 113892 C2 1 5 10 15 20 25 30 35 40 H ЯМР (400 Мгц, ДМСО-d6) δ м.д. 0,99 (д, 6H), 1,37 (с, 9H), 2,21-2,32 (м, 1H), 3,90 (д, J=4,80 Гц, 1H), 4,48-4,69 (м, 4H), 7,69 (с, 1H), 7,80 (дд, J=8,72, 1,89 Гц, 1H), 8,28 (д, J=8,59 Гц, 1H), 8,46 (д, J=2,02 Гц, 1H), 8,58 (д, J=3,79 Гц, 3H), 8,91 (с, 1H, 9,32 (с, 1H), 9,49 (с, 1H), 11,88 (шир. с, 2H); + МС (m/z) 558 (M+H ). Приклад 7 (2S,3S)-2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2аміно-3-метилпентаноат (2S,3S)-2-((трет-бутоксикарбоніл)аміно)-3-метилпентанову кислоту (60,5 мг, 0,262 ммоль) і HATU (166 мг, 0,436 ммоль) розчиняли у ДМФА (2 мл) і охолоджували при 23 °C, додавали DIEA (0,076 мл, 0,436 ммоль) і DMAP (5,33 мг, 0,044 ммоль), перемішування продовжували протягом 30 хв. із подальшим додаванням 2-((4-(бензо[d]тіазол-5-іламіно)-6-(третбутилсульфоніл)хіназолін-7-іл)окси)етанолу (100 мг, 0,218 ммоль). Реакційну суміш перемішували протягом 3 днів при кімнатній температурі, потім нагрівали при 50 °C протягом 20 годин, реакція проходила не повністю. Розчин (2S,3S)-2-((трет-бутоксикарбоніл)аміно)-3-метилпентанової кислоти (121 мг, 0,52 ммоль) і HATU (332 мг, 0,87 ммоль) і DIEA (0,15 мл, 0,87 ммоль) у ДМФА (1 мл) готували і перемішували протягом 15 хв. перед його додаванням до вказаної вище реакційної суміші. Одержану у результаті реакційну суміш нагрівали при 50 °C протягом 4 годин, очищали на ВЕРХ Gilson (100×150 мм ОФ колонка Sunfire), використовуючи 20-70 % ACN/вода/ТФУ (0,05 %). Фракції, що містять бажаний продукт, об'єднували, концентрували на роторному випарнику. Залишок розчиняли в діоксані (1 мл), потім HCl (1 мл, 4M у діоксані) додавали при кімнатній температурі, і одержану в результаті суміш перемішували протягом 1 години до перетворення всієї первинної речовини на бажаний продукт. Реакційну суміш концентрували, розподіляли між EtOAc і водним бікарбонатом натрію, органічний шар відділяли, промивали насиченим сольовим розчином, сушили (MgSО4), і концентрували із одержанням білої твердої речовини (2S,3S)-2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етил-2-аміно3-метилпентаноата (74 мг, 0,126 ммоль, 57,6 % вихід). 1 H ЯМР (400 Мгц, ДМСОd6) δ м.д. 0,78-0,83 (м, 3H), 0,85 (д, J=6,82 Гц, 3H), 1,05-1,21 (м, 1H), 1,35 (с, 9H), 1,43 (ддд, J=13,45, 7,52, 4,29 Гц, 1H), 1,57-1,70 (м, 1H), 3,15-3,23 (м, 1H), 4,34-4,57 (м, 4H, 7,44 (с, 1H), 7,89 (дд, J=8,72, 1,89 Гц, 1H), 8,17 (д, J=8,59 Гц, 1H), 8,58 (д, J=1,77 Гц, 1H), + 8,64 (с, 1H), 9,15 (с, 1H), 9,42 (с, 1H, 10,56 (с, 1H); МС (m/z) 572 (M+H ). Приклад 8 Біологічні аналітичні тести Аналітичний тест in vivo (I) Ефективність дії інгібіторів RIP2 можна оцінити in vivo на гризунах. Було показано, що внутрішньочеревне (в.ч.) або внутрішньовенне (в.в.) введення L18-MDP у мишей індукує запальну відповідь через активацію сигнального шляху NOD2 (Rosenweig, H. L., et al. 2008. Journal of Leukocyte Biology 84:529-536). Рівень запальної відповіді в оброблених L18-MDP мишей/щурів безперервно реєструють, використовуючи загальноприйняті способи, за допомогою вимірів збільшення рівнів цитокінів (IL8, TNF, IL6 і IL-І) у сироватці та/або 22 UA 113892 C2 5 10 15 20 25 30 35 40 перитонеальній промивній рідині і за допомогою вимірювання інфлюкса нейтрофілів у черевну порожнину (коли L18-MDP дають дозами в.ч.). Інгібування індукованої L18-MDP запальної відповіді в оброблених гризунів може бути продемонстроване за допомогою перорального попереднього прийому доз тестованих сполук, потім вимірювання і порівняння рівнів цитокінів (IL8, TNF, IL6 і IL-І) у сироватці та/або перитонеальній промивній рідині і інфлюкса нейтрофілів у черевну порожнину (коли L18-MDP дають дозами в.ч.) із використанням загальноприйнятих способів. Щури перорально одержували попередню дозу сполуки, 2-((4-(бензо[d]тіазол-5-іламіно)-6(трет-бутилсульфоніл)хіназолін-7-іл)окси)етанолу, при дозі, рівній 2 мг/кг (8 щурів) і преднізолону (8 щурів, використовували як позитивний контроль), із подальшим одержанням дози L18-MDP (50 мкг/щура) 0,25 год./хв. після попереднього дозування. Комбіновані рівні цитокінів (IL8, TNF, IL6 і IL-І) у зразках цілісної крові, взятих у щурів у цьому дослідженні, вимірювали, використовуючи виявлення на основі антитіл (платформа виявлення Meso-Scale). Комбіновану цитокінову відповідь розраховували як усереднену відповідь для 4 цитокінів, виміряну відносно відповіді, що спостерігалася у мишей, оброблених середовищем, і відображували на Фігурі 3 як середнє значення ± стандартна похибка середнього (n=8 щурів/групу). Аналітичний тест in vivo (II) 2-((4-(Бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)окси)етилдигідрофосфат перорально вводили при еквіваленті дози до 2 мг/кг 2-((4(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етанолу ряду тестованих тварин. Щурам (n=2) і собакам (n=3) вводили 2-((4-(бензо[d]тіазол-5-іламіно)-6-(третбутилсульфоніл)хіназолін-7-іл)окси) етилдигідрофосфат, тоді як мінісвиням (самцям Геттингенських мінісвиней (n=3)) вводили 2-((4-(бензо[d]тіазол-5-іламіно)-6-(третбутилсульфоніл)хіназолін-7-іл)окси)етилдинатрійфосфат. Зразки крові брали від кожної тестованої тварини при інтервалах між 0 і 24 годинами (25 годин у собак) після введення. Концентрацію 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)окси)етанолу у кожному зразку визначали за допомогою РХ/МС. Середні концентрації у крові 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)окси)етанолу у кожного тестованого виду, після перорального введення 2-((4-(бензо[d]тіазол-5-іламіно)-6-(третбутилсульфоніл)хіназолін-7-іл)окси)етилдигідрофосфату або динатрійфосфату проілюстровані на Фігурі 4. Було визначено, що час напівжиття (T 1/2) 2-((4-(бензо[d]тіазол-5-іламіно)-6-(третбутилсульфоніл)хіназолін-7-іл)окси)етилдигідрофосфату складає 15 хв. у щурів і 5 хв. у собак. Було визначено, що час напівжиття (T 1/2) 2-((4-(бензо[d]тіазол-5-іламіно)-6-(третбутилсульфоніл)хіназолін-7-іл)окси)етилдинатрійфосфату складає 26 хв. у мінісвиней. Фармацевтичні композиції Приклад A Пігулки одержують із використанням загальноприйнятих способів і складають таким чином: Інгредієнт Кількість на пігулку Сполука 5 мг Мікрокристалічна целюлоза 100 мг Лактоза 100 мг Гліколят крохмалю натрію 30 мг Стеарат магнію 2 мг Усього 237 мг Приклад B Капсули одержують із використанням загальноприйнятих способів і складають таким чином: Інгредієнт Кількість на пігулку Сполука 15 мг Сухий крохмаль 178 мг Стеарат магнію 2 мг Загалом 195 мг 23 UA 113892 C2 ФОРМУЛА ВИНАХОДУ 5 1. Сполука, яка відповідає формулі: S O O N HN S N O O HO 10 15 20 25 30 P N O OH , або її фармацевтично прийнятна сіль або гідрат. 2. Сполука, яка являє собою 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)оксі)етилдигідрофосфат або його фармацевтично прийнятну сіль. 3. Сполука або її фармацевтично прийнятна сіль за п. 2, яка являє собою 2-((4-(бензо[d]тіазол5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7-іл)оксі)етилдигідрофосфат. 4. Сполука або її фармацевтично прийнятна сіль або гідрат за п. 1, яка являє собою фармацевтично прийнятну сіль зазначеної сполуки. 5. Сполука або її фармацевтично прийнятна сіль або гідрат за п. 4, де фармацевтично прийнятна сіль є натрієвою сіллю. 6. Сполука або її фармацевтично прийнятна сіль або гідрат за п. 4, де фармацевтично прийнятна сіль є хлоргідратною сіллю. 7. Сполука або її фармацевтично прийнятна сіль або гідрат за п. 1, яка є гідратом хлоргідратної солі зазначеної сполуки. 8. Сполука або її фармацевтично прийнятна сіль або гідрат за п. 1, яка являє собою моногідрат гідрохлориду 2-((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)хіназолін-7іл)оксі)етилдигідрофосфату. 9. Сполука або її фармацевтично прийнятна сіль або гідрат за п. 1, яка являє собою кристалічний моногідрат гідрохлориду 2-((4-(бензо[d]тіазол-5-іламіно)-6-(третбутилсульфоніл)хіназолін-7-іл)оксі)етилдигідрофосфату, який має дифрактограму порошкової рентгенівської дифракції (PXRD) відповідно до Фіг. 2. 10. Сполука або її фармацевтично прийнятна сіль або гідрат за п. 4, де фармацевтично прийнятна сіль є кальцієвою сіллю. 11. Сполука або її фармацевтично прийнятна сіль або гідрат за п. 1, яка являє собою гідрат кальцієвої солі зазначеної сполуки. 12. Сполука або її фармацевтично прийнятна сіль або гідрат за п. 1, яка являє собою гідрат гемікальцієвої солі зазначеної сполуки. 13. Сполука за п. 1, яка відповідає формулі 24 UA 113892 C2 S O O N HN S N O O HO 5 10 15 20 25 30 35 40 45 P N O OH , або її фармацевтично прийнятна сіль або гідрат, яка являє собою тригідрат гемікальцієвої солі зазначеної сполуки. 14. Тригідрат гемікальцієвої солі сполуки за п. 13, який являє собою кристалічний тригідрат 2((4-(бензо[d]тіазол-5-іламіно)-6-(трет-бутилсульфоніл)-хіназолін-7-іл)оксі)етилгідрофосфату кальцію (І), що має порошкову рентгенівську дифрактограму (PXRD) за Фіг. 1. 15. Фармацевтична композиція, що включає сполуку або її фармацевтично прийнятну сіль або гідрат за п. 1 та фармацевтично прийнятний ексципієнт. 16. Фармацевтична композиція, що містить тригідрат гемікальцієвої солі сполуки за п. 13 та фармацевтично прийнятний ексципієнт. 17. Застосування сполуки або її фармацевтично прийнятної солі або гідрату за п. 1 в терапії. 18. Застосування сполуки за п. 13 в терапії. 19. Застосування сполуки або її фармацевтично прийнятної солі або гідрату за п. 17, де терапія передбачає лікування захворювання, опосередкованого інгібуванням RІР2-кінази, де захворювання вибране з увеїту, дерматиту, гострого пошкодження легенів, цукрового діабету 2 типу, артриту, ревматоїдного артриту, виразкового коліту, хвороби Крона, запального захворювання кишечнику з раннім початком, позакишкового запального захворювання кишечнику, запобігання ішемічно-реперфузійному пошкодженню у трансплантатах твердих органів, неалкогольного стеатогепатиту, аутоімунного гепатиту, астми, системного червоного вовчака, розсіяного склерозу, саркоїдозу, синдрому Блау/саркоїдозу з раннім початком, гранулематозу Вегенера та інтерстиціальної хвороби легенів. 20. Застосування сполуки або її фармацевтично прийнятної солі або гідрату за п. 19, де захворювання вибране з увеїту, синдрому Блау/саркоїдозу з раннім початком, виразкового коліту, хвороби Крона, гранулематозу Вегенера та саркоїдозу. 21. Застосування сполуки або її фармацевтично прийнятної солі або гідрату за п. 19, де захворювання вибране з хвороби Крона, виразкового коліту, синдрому Блау або ревматоїдного артриту. 22. Застосування сполуки за п. 18, де терапія передбачає лікування захворювання, опосередкованого інгібуванням RІР2-кінази, де захворювання вибране з увеїту, дерматиту, гострого пошкодження легенів, цукрового діабету 2 типу, артриту, ревматоїдного артриту, виразкового коліту, хвороби Крона, запального захворювання кишечнику з раннім початком, позакишкового запального захворювання кишечнику, запобігання ішемічно-реперфузійному пошкодженню в трансплантатах твердих органів, неалкогольного стеатогепатиту, аутоімунного гепатиту, астми, системного червоного вовчака, розсіяного склерозу, саркоїдозу, синдрому Блау/саркоїдозу з раннім початком, гранулематозу Вегенера та інтерстиціальної хвороби легенів. 23. Застосування сполуки або її фармацевтично прийнятної солі або гідрату за п. 22, де захворювання вибране з увеїту, синдрому Блау/саркоїдозу з раннім початком, виразкового коліту, хвороби Крона, гранулематозу Вегенера та саркоїдозу. 24. Застосування сполуки або її фармацевтично прийнятної солі або гідрату за п. 22, де захворювання вибране з хвороби Крона, виразкового коліту, синдрому Блау або ревматоїдного артриту. 25. Спосіб лікування захворювання, опосередкованого інгібуванням RIP2-кінази, що включає введення терапевтично ефективної кількості сполуки або її фармацевтично прийнятної солі або гідрату за п. 1 людині, яка потребує цього лікування, де захворювання вибирають з увеїту, 25 UA 113892 C2 5 10 15 20 25 дерматиту, гострого пошкодження легенів, цукрового діабету 2 типу, артриту, ревматоїдного артриту, виразкового коліту, хвороби Крона, запального захворювання кишечнику з раннім початком, позакишкового запального захворювання кишечнику, запобігання ішемічнореперфузійному пошкодженню в трансплантатах твердих органів, неалкогольного стеатогепатиту, аутоімунного гепатиту, астми, системного червоного вовчака, розсіяного склерозу, саркоїдозу, синдрому Блау/саркоїдозу з раннім початком, гранулематозу Вегенера та інтерстиціальної хвороби легенів. 26. Спосіб лікування захворювання, опосередкованого інгібуванням RIP2-кінази, за п. 25, де захворювання вибирають з увеїту, синдрому Блау/саркоїдозу з раннім початком, виразкового коліту, хвороби Крона, гранулематозу Вегенера та саркоїдозу. 27. Спосіб лікування захворювання, опосередкованого інгібуванням RIP2-кінази, за п. 25, де захворювання вибирають з хвороби Крона, виразкового коліту, синдрому Блау або ревматоїдного артриту. 28. Спосіб лікування захворювання, опосередкованого інгібуванням RIP2-кінази, що включає введення терапевтично ефективної кількості сполуки за п. 13 людині, яка потребує цього лікування, де захворювання вибирають з увеїту, дерматиту, гострого пошкодження легенів, цукрового діабету 2 типу, артриту, ревматоїдного артриту, виразкового коліту, хвороби Крона, запального захворювання кишечнику з раннім початком, позакишкового запального захворювання кишечнику, запобігання ішемічно-реперфузійному пошкодженню в трансплантатах твердих органів, неалкогольного стеатогепатиту, аутоімунного гепатиту, астми, системного червоного вовчака, розсіяного склерозу, саркоїдозу, синдрому Блау/саркоїдозу з раннім початком, гранулематозу Вегенера та інтерстиціальної хвороби легенів. 29. Спосіб лікування захворювання, опосередкованого інгібуванням RIP2-кінази, за п. 28, де захворювання вибирають з увеїту, синдрому Блау/саркоїдозу з раннім початком, виразкового коліту, хвороби Крона, гранулематозу Вегенера та саркоїдозу. 30. Спосіб лікування захворювання, опосередкованого інгібуванням RIP2-кінази, за п. 28, де захворювання вибирають з хвороби Крона, виразкового коліту, синдрому Блау або ревматоїдного артриту. 26 UA 113892 C2 27 UA 113892 C2 Комп’ютерна верстка О. Гергіль Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 28
ДивитисяДодаткова інформація
Назва патенту англійськоюProdrugs of amino quinazoline kinase inhibitor
Автори англійськоюCasillas, Linda, N., Haile, Pamela, A., Marquis, Robert, W., Jr., Wang, Gren
Автори російськоюКэйсиллас Линда Н., Хэйль Памела А., Маркис Роберт В. Дж., Ван Грэн
МПК / Мітки
МПК: A61K 31/535
Мітки: кінази, амінохіназолінового, інгібітору, проліки
Код посилання
<a href="https://ua.patents.su/30-113892-proliki-aminokhinazolinovogo-ingibitoru-kinazi.html" target="_blank" rel="follow" title="База патентів України">Проліки амінохіназолінового інгібітору кінази</a>
Попередній патент: Спосіб локальної ізоляції елементів пористим прооксидованим кремнієм в субмікронних структурах великих інтегральних схем
Наступний патент: Попередньо наповнений шприц
Випадковий патент: N-[6-метоксі-5-(перфторалкін)-1-нафтоіл]-n-метілгліцин чи його тіонафтоільні аналоги як інгібітори албдозоредуктази