Похідні піримідинону як терапевтичні агенти проти гострого і хронічного запалення, ішемічних і реконструкційних процесів
Номер патенту: 82074
Опубліковано: 11.03.2008
Автори: Мойрер Дірк, Альбрехт Барбара, Телан Лейла, Розентретер Ульріх, Берфаккер Ларс, Аллерхайліген Свен, Шлеммер Карл-Хайнц, Кельденіх Йорг, Фітцджеральд Мері Ф., Мін-Джіан Лі Фолькхарт, Гілен-Хертвіг Хайке, Неш Кевін
Формула / Реферат
1. Похідні піримідинону загальної формули (І)
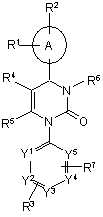 , (І)
, (І)
де
А представляє арил або гетероарил,
R1, R2 і R3 незалежно один від одного представляють водень, галоген, нітро, ціано, С1-С6-алкіл, гідрокси або С1-С6-алкокси, де С1-С6-алкіл і С1-С6-алкокси можуть бути в подальшому заміщені одним - трьома ідентичними або різними радикалами, що вибирають з групи, яка містить галоген, гідрокси і С1-С4-алкокси,
R4 представляє трифторметилкарбоніл, C1-C6-алкілкарбоніл, C1-C6-алкоксикарбоніл, С1-С6-алкеноксикарбоніл, гідроксикарбоніл, амінокарбоніл, моно- або ді-С1-С4-алкіламінокарбоніл, С6-С10-ариламінокарбоніл, арилкарбоніл, гетероарилкарбоніл, гетероциклілкарбоніл, гетероарил, гетероцикліл або ціано, де С1-С6-алкілкарбоніл, С1-С6-алкоксикарбоніл, моно- і ді-С1-С4-алкіламінокарбоніл можуть бути в подальшому заміщені одним - трьома ідентичними або різними радикалами, що вибирають з групи, яка містить С3-С8-циклоалкіл, гідрокси, С1-С4-алкокси, С1-С4-алкоксикарбоніл, гідроксикарбоніл, амінокарбоніл, моно- і ді-С1-С4-алкіламінокарбоніл, С1-С4-алкілкарбоніламіно, (С1-С4-алкілкарбоніл)-С1-С4-алкіламіно, ціано, аміно, моно- і ді-С1-С4-алкіламіно, гетероарил, гетероцикліл і три-(С1-С6-алкіл)силіл, і де гетероарилкарбоніл, гетероциклілкарбоніл, гетероарил і гетероцикліл можуть бути в подальшому заміщені С1-С4-алкілом,
R5 представляє С1-С4-алкіл, який може бути заміщений одним - трьома ідентичними або різними радикалами, що вибирають з групи, яка містить галоген, гідрокси, С1-С6-алкокси, С1-С6-алкенокси, С1-С6-алкілтіо, аміно, моно- і ді-С1-С6-алкіламіно, ариламіно, гідроксикарбоніл, С1-C6-алкоксикарбоніл і радикал -О-С1-С4-алкіл-О-С1-С4-алкіл,
або
R5 представляє аміно,
R6 представляє водень, С1-С6-алкіл, форміл, амінокарбоніл, моно- або ді-С1-С4-алкіламінокарбоніл, С3-С8-циклоалкілкарбоніл, С1-С6-алкілкарбоніл, С1-С6-алкоксикарбоніл, N-(С1-С4-алкілсульфоніл)амінокарбоніл, N-(С1-С4-алкілсульфоніл)-N-(С1-С4-алкіл)амінокарбоніл, гетероарил, гетероцикліл, гетероарилкарбоніл або гетероциклілкарбоніл, де С1-С6-алкіл, моно- і ді-С1-С4-алкіламінокарбоніл, С1-С6-алкілкарбоніл, С1-С6-алкоксикарбоніл, гетероарил і гетероцикліл можуть бути заміщеними одним - трьома ідентичними або різними радикалами, що вибирають з групи, яка містить арил, гетероарил, гідрокси, С1-С4-алкокси, гідроксикарбоніл, С1-С6-алкоксикарбоніл, амінокарбоніл, моно- і ді-С1-С4-алкіламінокарбоніл, аміно, моно- і ді-С1-С4-алкіламіно, С1-С4-алкілкарбоніламіно, три-(С1-С6-алкіл)силіл, ціано, моно- і ді-С1-С4-алкіламіно-С1-С4-алкіламінокарбоніл, С1-С4-алкоксі-С1-С4-алкіламінокарбоніл і галоген,
або
R6 представляє замісник формули
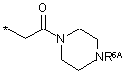 ,
, 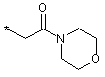 або
або 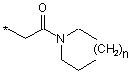 ,
,
де
R6A вибирають з групи, що містить водень і С1-С6-алкіл, і
n представляє ціле число 1 або 2,
R7 представляє галоген, нітро, ціано, C1-C6-алкіл, гідрокси або С1-С6-алкокси, де C1-C6-алкіл і C1-C6-алкокси можуть бути в подальшому заміщені одним – трьома ідентичними або різними радикалами, що вибирають з групи, яка містить галоген, гідрокси і С1-С4-алкокси,
і
Y1, Y2, Y3, Y4 і Y5 незалежно один від одного представляють СН або N, де кільце містить 0, 1 або 2 атоми азоту,
і їх солі, гідрати і/або сольвати і їх таутомерні форми.
2. Похідні піримідинону загальної формули (І) згідно з пунктом 1, де
А представляє арил або гетероарил,
R1, R2 і R3 незалежно один від одного представляють водень, галоген, нітро, ціано, С1-С6-алкіл, гідрокси або С1-С6-алкокси, де С1-C6-алкіл і C1-C6-алкокси можуть бути в подальшому заміщені одним - трьома ідентичними або різними радикалами, що вибирають з групи, яка містить галоген, гідрокси і С1-С4-алкокси,
R4 представляє С1-С6-алкілкарбоніл, С1-С6-алкоксикарбоніл, С1-С6-алкеноксикарбоніл, гідроксикарбоніл, амінокарбоніл, моно- або ді-С1-С4-алкіламінокарбоніл, С6-С10-ариламінокарбоніл, гетероарилкарбоніл, гетероциклілкарбоніл, гетероарил, гетероцикліл або ціано, де С1-С6-алкілкарбоніл, С1-С6-алкоксикарбоніл, моно- і ді-С1-С4-алкіламінокарбоніл можуть бути в подальшому заміщені одним - трьома ідентичними або різними радикалами, що вибирають з групи, яка містить С3-С8-циклоалкіл, гідрокси, С1-С4-алкокси, С1-С4-алкоксикарбоніл, гідроксикарбоніл, амінокарбоніл, моно- і ді-С1-С4-алкіламінокарбоніл, С1-С4-алкілкарбоніламіно, аміно, моно- і ді-С1-С4-алкіламіно, гетероарил, гетероцикліл і три-(С1-С6-алкіл)силіл,
R5 представляє С1-С4-алкіл, який може бути заміщений одним - трьома ідентичними або різними радикалами, що вибирають з групи, яка містить галоген, гідрокси, С1-С6-алкокси, С1-С6-алкенокси, С1-С6-алкілтіо, аміно, моно- і ді-С1-С6-алкіламіно, ариламіно, гідроксикарбоніл, C1-C6-алкоксикарбоніл і радикал -O-С1-С4-алкіл-O-С1-С4-алкіл,
або
R5 представляє аміно,
R6 представляє водень, С1-C6-алкіл, форміл, амінокарбоніл, моно- або ді-С1-С4-алкіламінокарбоніл, С3-С8-циклоалкілкарбоніл, C1-C6-алкілкарбоніл, C1-C6-алкоксикарбоніл, N-(С1-С4-алкілсульфоніл)амінокарбоніл, N-(С1-С4-алкілсульфоніл)-N-(С1-С4-алкіл)амінокарбоніл, гетероарил, гетероцикліл, гетероарилкарбоніл або гетероциклілкарбоніл, де С1-С6-алкіл, моно- і ді-С1-С4-алкіламінокарбоніл, С1-С6-алкілкарбоніл, С1-С6-алкоксикарбоніл, гетероарил і гетероцикліл можуть бути заміщеними одним - трьома ідентичними або різними радикалами, що вибирають з групи, яка містить арил, гетероарил, гідрокси, С1-С4-алкокси, гідроксикарбоніл, С1-С6-алкоксикарбоніл, амінокарбоніл, моно- і ді-С1-С4-алкіламінокарбоніл, аміно, моно- і ді-С1-С4-алкіламіно, С1-С4-алкілкарбоніламіно, три-(С1-С6-алкіл)силіл, ціано, моно- і ді-С1-С4-алкіламіно-С1-С4-алкіламінокарбоніл, С1-С4-алкоксі-С1-С4-алкіламінокарбоніл і галоген,
або
R6 представляє замісник формули
 ,
,  або
або  ,
,
де
R6A вибирають з групи, що містить водень і C1-C6-алкіл, і
n представляє ціле число 1 або 2,
R7 представляє галоген, нітро, ціано, C1-C6-алкіл, гідрокси або C1-C6-алкокси,
де С1-С6-алкіл і С1-С6-алкокси можуть бути в подальшому заміщені одним – трьома ідентичними або різними радикалами, що вибирають з групи, яка містить галоген, гідрокси і С1-С4-алкокси,
Y1, Y2, Y3, Y4 і Y5 незалежно один від одного представляють СН або N, де кільце містить 0, 1 або 2 атоми азоту.
3. Похідні піримідинону загальної формули (І) згідно з пунктом 1 або 2, де
А представляє феніл, нафтил або піридил,
R1, R2 і R3 незалежно один від одного представляють водень, фтор, хлор, бром, нітро, ціано, метил, етил, трифторметил або трифторметокси,
R4 представляє C1-C6-алкілкарбоніл, C1-C6-алкоксикарбоніл, гідроксикарбоніл, амінокарбоніл, моно-С1-С4-алкіламінокарбоніл або ціано, де С1-С6-алкілкарбоніл, С1-С6-алкоксикарбоніл і моно-С1-С4-алкіламінокарбоніл можуть бути заміщеними одним -трьома ідентичними або різними радикалами, що вибирають з групи, яка містить С3-С8-циклоалкіл, гідрокси, С1-С4-алкокси, С1-С4-алкоксикарбоніл, аміно, моно- або ді-С1-С4-алкіламіно, гетероарил і гетероцикліл,
R5 представляє метил або етил,
R6 представляє водень, С1-С6-алкіл, моно- або ді-С1-С4-алкіламінокарбоніл, С1-С6-алкілкарбоніл, С1-С6-алкоксикарбоніл або гетероциклілкарбоніл, де С1-С6-алкіл і С1-С6- алкоксикарбоніл можуть бути заміщеними одним - трьома ідентичними або різними радикалами, що вибирають з групи, яка містить гетероарил, гідрокси, С1-С4-алкокси, гідроксикарбоніл, С1-С6-алкоксикарбоніл, амінокарбоніл, моно- і ді-С1-С4-алкіламінокарбоніл, ціано, аміно, моно- і ді-С1-С4-алкіламіно, або R6 представляє замісник формули
 ,
,  або
або  ,
,
де
R6A вибирають з групи, що містить водень і С1-С4-алкіл, і
n представляє ціле число 1 або 2,
R7 представляє галоген, нітро, ціано, трифторметил, трифторметокси, метил або етил,
i
Y1, Y2, Y3, Y4 і Y5 кожен представляє СН.
4. Похідні піримідинону загальної формули (І) згідно з пунктом 1, 2 або 3, де
А представляє феніл або піридил,
R1 і R3 кожен представляє водень,
R2 представляє фтор, хлор, бром, нітро або ціано,
R4 представляє ціано, С1-С4-алкілкарбоніл або С1-С4-алкоксикарбоніл, де С1-С4-алкоксикарбоніл може бути заміщений радикалом, що вибирають з групи, яка містить гідрокси, С1-С4-алкокси, С1-С4-алкоксикарбоніл, моно- і ді-С1-С4-алкіламіно, гетероарил і гетероцикліл,
R5 представляє метил,
R6 представляє водень, С1-С4-алкіл, моно- або ді-С1-С4-алкіламінокарбоніл, С1-С4-алкілкарбоніл або С1-С4-алкоксикарбоніл, де С1-С4-алкіл і С1-С4-алкоксикарбоніл може бути заміщений радикалом, що вибирають з групи, яка містить гетероарил, гідрокси, С1-С4-алкокси, гідроксикарбоніл, амінокарбоніл, моно- і ді-С1-С4-алкіламінокарбоніл, аміно, моно- і ді-С1-С4-алкіламіно,
або
R6 представляє замісник формули
 або
або  ,
,
де
R6A вибирають з групи, що містить водень і метил,
R7 представляє трифторметил або нітро,
i
Y1, Y2, Y3, Y4 і Y5 кожен представляє СН.
5. Похідні піримідинону загальної формули (І) згідно з будь-яким з пунктів 1-4, де А є фенілом або піридилом.
6. Похідні піримідинону загальної формули (І) згідно з будь-яким з пунктів 1-5, де R1 є воднем.
7. Похідні піримідинону загальної формули (І) згідно з будь-яким з пунктів 1-6, де R2 є ціано.
8. Похідні піримідинону загальної формули (І) згідно з будь-яким з пунктів 1-7, де R3 є воднем.
9. Похідні піримідинону загальної формули (І) згідно з будь-яким з пунктів 1-8, де R4 є С1-С4-алкоксикарбонілом, необов'язково, заміщеним гідрокси, або де R4 є С1-С4-алкілкарбонілом.
10. Похідні піримідинону загальної формули (І) згідно з будь-яким з пунктів 1-9, де R5 є метилом.
11. Похідні піримідинону загальної формули (І) згідно з будь-яким з пунктів 1-10, де R6 є воднем.
12. Похідні піримідинону загальної формули (І) згідно з будь-яким з пунктів 1-11, де R7 є трифторметилом або нітро.
13. Похідні піримідинону загальної формули (І) згідно з будь-яким з пунктів 1-12, де радикал
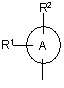 означає групу
означає групу 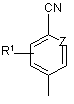 ,
,
де
Z представляє CН або N, і
R1 представляє значення, вказані в пункті 1,
R3, R4 і R6 мають значення, вказані в пункті 1,
R5 представляє метил,
Y1-Y4 кожен представляє СН-групу, а R7 представляє трифторметил в положенні 3 фенільного радикала.
14. Фармацевтична композиція, що має властивості інгібітора нейтрофільної еластази людини, що містить принаймні одну сполуку загальної формули (І) за будь-яким з пунктів 1-13 і фармацевтично прийнятний розріджувач.
Текст
1. Похідні піримідинону загальної формули (І) R2 (19) (21) a200503292 (22) 28.08.2003 (24) 11.03.2008 (86) PCT/EP2003/009525, 28.08.2003 (31) 0220962.5 (32) 10.09.2002 (33) GB (31) 0226609.6 (32) 14.11.2002 (33) GB (31) 0315870.6 (32) 07.07.2003 (33) GB (72) ГІЛЕН-ХЕРТВІГ ХАЙКЕ, МІН-ДЖІАН ЛІ ФОЛЬКХАРТ, РОЗЕНТРЕТЕР УЛЬРІХ, ШЛЕММЕР КАРЛ-ХАЙНЦ, АЛЛЕРХАЙЛІГЕН СВЕН, ТЕЛАН ЛЕЙЛА, US/DE, БЕРФАККЕР ЛАРС, КЕЛЬДЕНІХ ЙОРГ, ФІТЦДЖЕРАЛЬД МЕРІ Ф., НЕШ КЕВІН, АЛЬБРЕХТ БАРБАРА, МОЙРЕР ДІРК (73) БАЄР ХЕЛСКЕР АГ (56) FRECHET J M J ET AL: "A Combinatorial Approach to Recognition of Chirality: Preparation of Highly Enantioselective Aryl-Dihydropyrimidine Selectors for Chiral HPLC" JOURNAL OF COMBINATORIAL CHEMISTRY, AMERICAN CHEMICAL SOCIETY, WASHINGTON, US, vol. 1, no. 1, 1999, pages 105-112, XP002267474 ISSN: 1520-4766 WO0137837 A 31.05.2001 EP0528633 A 24.02.1993 US5532366 A 02.07.1996 2 3 82074 арилкарбоніл, гетероарилкарбоніл, гетероциклілкарбоніл, гетероарил, гетероцикліл або ціано, де С1-С6-алкілкарбоніл, С1-С6алкоксикарбоніл, моноі ді-С1-С4алкіламінокарбоніл можуть бути в подальшому заміщені одним - трьома ідентичними або різними радикалами, що вибирають з групи, яка містить С3С8-циклоалкіл, гідрокси, С1-С4-алкокси, С1-С4алкоксикарбоніл, гідроксикарбоніл, амінокарбоніл, моноі ді-С1-С4-алкіламінокарбоніл, С1-С4алкілкарбоніламіно, (С1-С4-алкілкарбоніл)-С1-С4алкіламіно, ціано, аміно, моно- і ді-С1-С4алкіламіно, гетероарил, гетероцикліл і три-(С1-С6алкіл)силіл, і де гетероарилкарбоніл, гетероциклілкарбоніл, гетероарил і гетероцикліл можуть бути в подальшому заміщені С1-С4алкілом, R5 представляє С1-С4-алкіл, який може бути заміщений одним - трьома ідентичними або різними радикалами, що вибирають з групи, яка містить галоген, гідрокси, С1-С6-алкокси, С1-С6алкенокси, С1-С6-алкілтіо, аміно, моно- і ді-С1-С6алкіламіно, ариламіно, гідроксикарбоніл, С1-C6алкоксикарбоніл і радикал -О-С1-С4-алкіл-О-С1-С4алкіл, або R5 представляє аміно, R6 представляє водень, С1-С6-алкіл, форміл, амінокарбоніл, моноабо ді-С1-С4алкіламінокарбоніл, С3-С8-циклоалкілкарбоніл, С1С6-алкілкарбоніл, С1-С6-алкоксикарбоніл, N-(С1-С4алкілсульфоніл)амінокарбоніл, N-(С1-С4алкілсульфоніл)-N-(С1-С4-алкіл)амінокарбоніл, гетероарил, гетероцикліл, гетероарилкарбоніл або гетероциклілкарбоніл, де С 1-С6-алкіл, моно- і ді-С1С4-алкіламінокарбоніл, С1-С6-алкілкарбоніл, С1-С6алкоксикарбоніл, гетероарил і гетероцикліл можуть бути заміщеними одним - трьома ідентичними або різними радикалами, що вибирають з групи, яка містить арил, гетероарил, гідрокси, С1-С4-алкокси, гідроксикарбоніл, С1-С6алкоксикарбоніл, амінокарбоніл, моно- і ді-С1-С4алкіламінокарбоніл, аміно, моно- і ді-С1-С4алкіламіно, С1-С4-алкілкарбоніламіно, три-(С1-С6алкіл)силіл, ціано, моно- і ді-С1-С4-алкіламіно-С1С4-алкіламінокарбоніл, С1-С4-алкоксі-С1-С4алкіламінокарбоніл і галоген, або R6 представляє замісник формули O O * * N NR6A , N O або O * N (CH2)n , де R6A вибирають з групи, що містить водень і С1-С6алкіл, і n представляє ціле число 1 або 2, 4 R7 представляє галоген, нітро, ціано, C1-C6-алкіл, гідрокси або С1-С6-алкокси, де C1-C6-алкіл і C1-C6алкокси можуть бути в подальшому заміщені одним – трьома ідентичними або різними радикалами, що вибирають з групи, яка містить галоген, гідрокси і С1-С4-алкокси, і Y1, Y2 , Y3 , Y4 і Y5 незалежно один від одного представляють СН або N, де кільце містить 0, 1 або 2 атоми азоту, і їх солі, гідрати і/або сольвати і їх таутомерні форми. 2. Похідні піримідинону загальної формули (І) згідно з пунктом 1, де А представляє арил або гетероарил, R1, R2 і R3 незалежно один від одного представляють водень, галоген, нітро, ціано, С1С6-алкіл, гідрокси або С1-С6-алкокси, де С1-C6алкіл і C1-C6-алкокси можуть бути в подальшому заміщені одним - трьома ідентичними або різними радикалами, що вибирають з групи, яка містить галоген, гідрокси і С1-С4-алкокси, R4 представляє С1-С6-алкілкарбоніл, С1-С6алкоксикарбоніл, С1-С6-алкеноксикарбоніл, гідроксикарбоніл, амінокарбоніл, моно- або ді-С1С4-алкіламінокарбоніл, С6-С10-ариламінокарбоніл, гетероарилкарбоніл, гетероциклілкарбоніл, гетероарил, гетероцикліл або ціано, де С1-С6алкілкарбоніл, С1-С6-алкоксикарбоніл, моно- і діС1-С4-алкіламінокарбоніл можуть бути в подальшому заміщені одним - трьома ідентичними або різними радикалами, що вибирають з групи, яка містить С3-С8-циклоалкіл, гідрокси, С1-С4алкокси, С1-С4-алкоксикарбоніл, гідроксикарбоніл, амінокарбоніл, моно- і ді-С1-С4-алкіламінокарбоніл, С1-С4-алкілкарбоніламіно, аміно, моно- і ді-С1-С4алкіламіно, гетероарил, гетероцикліл і три-(С1-С6алкіл)силіл, R5 представляє С1-С4-алкіл, який може бути заміщений одним - трьома ідентичними або різними радикалами, що вибирають з групи, яка містить галоген, гідрокси, С1-С6-алкокси, С1-С6алкенокси, С1-С6-алкілтіо, аміно, моно- і ді-С1-С6алкіламіно, ариламіно, гідроксикарбоніл, C1-C6алкоксикарбоніл і радикал -O-С1-С4-алкіл-O-С1-С4алкіл, або R5 представляє аміно, R6 представляє водень, С1-C6-алкіл, форміл, амінокарбоніл, моноабо ді-С1-С4алкіламінокарбоніл, С3-С8-циклоалкілкарбоніл, C1C6-алкілкарбоніл, C1-C6-алкоксикарбоніл, N-(С1-С4алкілсульфоніл)амінокарбоніл, N-(С1-С4алкілсульфоніл)-N-(С1-С4-алкіл)амінокарбоніл, гетероарил, гетероцикліл, гетероарилкарбоніл або гетероциклілкарбоніл, де С 1-С6-алкіл, моно- і ді-С1С4-алкіламінокарбоніл, С1-С6-алкілкарбоніл, С1-С6алкоксикарбоніл, гетероарил і гетероцикліл можуть бути заміщеними одним - трьома ідентичними або різними радикалами, що вибирають з групи, яка містить арил, гетероарил, гідрокси, С1-С4-алкокси, гідроксикарбоніл, С1-С6алкоксикарбоніл, амінокарбоніл, моно- і ді-С1-С4алкіламінокарбоніл, аміно, моно- і ді-С1-С4алкіламіно, С1-С4-алкілкарбоніламіно, три-(С1-С6 5 82074 алкіл)силіл, ціано, моно- і ді-С1-С4-алкіламіно-С1С4-алкіламінокарбоніл, С1-С4-алкоксі-С1-С4алкіламінокарбоніл і галоген, або R6 представляє замісник формули O O * * N NR6A , N N O * або (CH2)n , де R6A вибирають з групи, що містить водень і C1-C6алкіл, і n представляє ціле число 1 або 2, R7 представляє галоген, нітро, ціано, C1-C6-алкіл, гідрокси або C1-C6-алкокси, де С1-С6-алкіл і С1-С6-алкокси можуть бути в подальшому заміщені одним – трьома ідентичними або різними радикалами, що вибирають з групи, яка містить галоген, гідрокси і С1-С4-алкокси, Y1, Y2 , Y3 , Y4 і Y5 незалежно один від одного представляють СН або N, де кільце містить 0, 1 або 2 атоми азоту. 3. Похідні піримідинону загальної формули (І) згідно з пунктом 1 або 2, де А представляє феніл, нафтил або піридил, R1, R2 і R3 незалежно один від одного представляють водень, фтор, хлор, бром, нітро, ціано, метил, етил, трифторметил або трифторметокси, R4 представляє C1-C6-алкілкарбоніл, C1-C6алкоксикарбоніл, гідроксикарбоніл, амінокарбоніл, моно-С1-С4-алкіламінокарбоніл або ціано, де С1С6-алкілкарбоніл, С1-С6-алкоксикарбоніл і моно-С1С4-алкіламінокарбоніл можуть бути заміщеними одним -трьома ідентичними або різними радикалами, що вибирають з групи, яка містить С3С8-циклоалкіл, гідрокси, С1-С4-алкокси, С1-С4алкоксикарбоніл, аміно, моно- або ді-С1-С4алкіламіно, гетероарил і гетероцикліл, R5 представляє метил або етил, R6 представляє водень, С1-С6-алкіл, моно- або діС1-С4-алкіламінокарбоніл, С1-С6-алкілкарбоніл, С1С6-алкоксикарбоніл або гетероциклілкарбоніл, де С1-С6-алкіл і С1-С6- алкоксикарбоніл можуть бути заміщеними одним - трьома ідентичними або різними радикалами, що вибирають з групи, яка містить гетероарил, гідрокси, С1-С4-алкокси, гідроксикарбоніл, С1-С6-алкоксикарбоніл, амінокарбоніл, моно- і ді-С1-С4-алкіламінокарбоніл, ціано, аміно, моно- і ді-С1-С4-алкіламіно, або R6 представляє замісник формули O * N N NR6A O , або O * O O * 6 N (CH2)n , де R6A вибирають з групи, що містить водень і С1-С4алкіл, і n представляє ціле число 1 або 2, R7 представляє галоген, нітро, ціано, трифторметил, трифторметокси, метил або етил, i Y1, Y2 , Y3, Y4 і Y5 кожен представляє СН. 4. Похідні піримідинону загальної формули (І) згідно з пунктом 1, 2 або 3, де А представляє феніл або піридил, R1 і R3 кожен представляє водень, R2 представляє фтор, хлор, бром, нітро або ціано, R4 представляє ціано, С1-С4-алкілкарбоніл або С1С4-алкоксикарбоніл, де С1-С4-алкоксикарбоніл може бути заміщений радикалом, що вибирають з групи, яка містить гідрокси, С1-С4-алкокси, С1-С4алкоксикарбоніл, моно- і ді-С1-С4-алкіламіно, гетероарил і гетероцикліл, R5 представляє метил, R6 представляє водень, С1-С4-алкіл, моно- або діС1-С4-алкіламінокарбоніл, С1-С4-алкілкарбоніл або С1-С4-алкоксикарбоніл, де С1-С4-алкіл і С1-С4алкоксикарбоніл може бути заміщений радикалом, що вибирають з групи, яка містить гетероарил, гідрокси, С1-С4-алкокси, гідроксикарбоніл, амінокарбоніл, моно- і ді-С1-С4-алкіламінокарбоніл, аміно, моно- і ді-С1-С4-алкіламіно, або R6 представляє замісник формули O O * * N NR6A або N O , де R6A вибирають з групи, що містить водень і метил, R7 представляє трифторметил або нітро, i Y1, Y2 , Y3, Y4 і Y5 кожен представляє СН. 5. Похідні піримідинону загальної формули (І) згідно з будь-яким з пунктів 1-4, де А є фенілом або піридилом. 6. Похідні піримідинону загальної формули (І) згідно з будь-яким з пунктів 1-5, де R1 є воднем. 7. Похідні піримідинону загальної формули (І) згідно з будь-яким з пунктів 1-6, де R2 є ціано. 8. Похідні піримідинону загальної формули (І) згідно з будь-яким з пунктів 1-7, де R3 є воднем. 9. Похідні піримідинону загальної формули (І) згідно з будь-яким з пунктів 1-8, де R4 є С1-С4алкоксикарбонілом, необов'язково, заміщеним гідрокси, або де R4 є С1-С4-алкілкарбонілом. 7 82074 10. Похідні піримідинону загальної формули (І) згідно з будь-яким з пунктів 1-9, де R5 є метилом. 11. Похідні піримідинону загальної формули (І) згідно з будь-яким з пунктів 1-10, де R6 є воднем. 12. Похідні піримідинону загальної формули (І) згідно з будь-яким з пунктів 1-11, де R7 є трифторметилом або нітро. 13. Похідні піримідинону загальної формули (І) згідно з будь-яким з пунктів 1-12, де радикал CN R2 R1 R1 A означає групу Z 8 де Z представляє CН або N, і R1 представляє значення, вказані в пункті 1, R3, R4 і R6 мають значення, вказані в пункті 1, R5 представляє метил, Y1-Y4 кожен представляє СН-групу, а R7 представляє трифторметил в положенні 3 фенільного радикала. 14. Фармацевтична композиція, що має властивості інгібітора нейтрофільної еластази людини, що містить принаймні одну сполуку загальної формули (І) за будь-яким з пунктів 1-13 і фармацевтично прийнятний розріджувач. , Представлений винахід стосується нових гетероциклічних похідних, способів їх одержання і їх використання в медикаментах, особливо для лікування хронічних обструктивних захворювань легень, гострого коронарного синдрому, гострого інфаркту міокарда і прогресуючої серцевої недостатності. Фібрилярний протеїн еластин, який складає значний відсоток всіх протеїнів, що містяться в тканинах, таких як артерії, деякі сполучні тканини, легені і серце, може гідролізуватись або руйнуватись іншим чином по певним групам ферментами, що відносяться до класу еластаз. Лейкоцитарна еластаза людини (HLE, EC 3.4.21.37), також відома як нейтрофільна еластаза людини (HNE), є глікозильованою сильноосновною сериновою протеазою і зустрічається в азурофільних гранулах поліморфоядерних лейкоцитів людини (PMN). HNE вивільнюється з активованих PMN і втягнуті в патогенез гострих і хронічних запальних захворювань. HNE здатна деградувати широкий перелік матриксних протеїнів включаючи еластин і колаген і на додаток до цієї дії на сполучну тканину HNE має широкий спектр запальної дії включаючи зворотну регуляцію експресії IL-8 гену, утворення набряку, гіперплазії слизових гланд і гіперсекрецм слизу. Вона також діє як медіатор пошкодження тканини завдяки гідролізу структури колагену, наприклад, в серці після гострого інфаркту міокарда або під час прогресуючої серцевої недостатності, таким чином пошкоджуючи ендотеліальні клітини, промотуючи екстравазію прилипання нейтрофілів до ендотелію і вплив на процес адгезії. Легеневі захворювання, де HNE, як припускають, відіграє роль, яка включає фіброз легені, пневмонію, гострий респіраторний дистрессиндром (ARDS), легеневу емфізему, включаючи викликану курінням емфізему, хронічні обструктивні легеневі захворювання (COPD) і кістозний фіброз. При кардіоваскулярних захворюваннях, HNE включена в збільшення генерування ішемічного ушкодження тканини внаслідок дисфункції міокарду після гострого інфаркту міокарда і реконструкційних процесах, що зустрічаються під час прогресуючої серцевої недостатності. HNE також є причиною ревматоїдного артриту, атеросклерозу, травми мозку, раку і залежних станів, і в які втягнуті нейтрофіли. Таким чином, інгібітори активності HLE можуть бути потенційно корисними при лікуванні ряду запальних захворювань, особливо хронічних обструктивних захворювань легень [R.A. Stockley, Neutrophils and protease/antiprotease imbalance, Am. J. Respir. Crit. Care 160, S49-S52 (1999)]. Інгібітори активності HLE можуть бути потенційно корисними при лікуванні гострого синдрому міокарду, нестабільної стенокардії, гострого інфаркту міокарда і шунтування коронарної артерії (CABG) [С.Р. Tiefenbacher et al., Inhibition of elastase improves myocardial function after repetitive ischaemia and myocardial infarction in the rat heart, Eur. J. Physiol. 433, S563-S570 (1997); Dinerman et al., Increased neutrophil elastase release in unstable angina pectoris and acute myocardial infarction, J. Am. Coll. Cardiol. 15, 1559-1563 (1990)], прогресуючої серцевої недостатності [S.J. Gilbert et al., Increased expression ofpromatrix metalloproteinase-9 and neutrophil elastase in canine dilated cardiomyopathy, Cardiov. Res. 34, S377-S383 (1997)] і атеросклерозу [Dollery et al., Neutrophil elastase in human atherosclerotic plaque, Circulation 107, 2829-2836 (2003)]. Синтез 5-етоксикарбоніл-1-феніл-6-метил-4(3-нітрофеніл)-3,4-дигідропіримідин-2(1Н)-ону описується в [J. Heterocyclic Спем. 38, 1051 (2001)]. Фармакологічна активність цієї сполуки не згадувалась. Представлений винахід стосується сполук загальної формули (І) 9 82074 (І) де А представляє арил або гетероарил, R1, R2 і R3 незалежно один від одного представляють водень, галоген, нітро, ціано, С1С6-алкіл, гідрокси або С1-С6-алкокси, де С1-С6алкіл і С1-С6-алкокси можуть бути в подальшому заміщені одним-трьома ідентичними або різними радикалами, що вибирають з групи, яка містить галоген, гідрокси і С1-С6-алкокси, R4 представляє трифторметилкарбоніл, С1-С6алкілкарбоніл, С1-С6-алкокси-карбоніл, С1-С6алкеноксикарбоніл, гідроксикарбоніл, амінокарбоніл, моноабо ди-С1-С4алкіламінокарбоніл, С6-С10-ариламінокарбоніл, арилкарбоніл, гетероарилкарбоніл, гетероциклілкарбоніл, гетероарил, гетероцикліл або ціано, де С1-С6-алкіл карбоніл, С1-С6алкоксикарбоніл, моноі ди-С1-С4алкіламінокарбоніл можуть бути в подальшому заміщені одним-трьома ідентичними або різними радикалами, що вибирають з групи, яка містить С3С8-циклоалкіл, гідрокси, С1-С4-алкокси, С1-С4алкоксикарбоніл, гідроксикарбоніл, амінокарбоніл, моноі ди-С1-С4-алкіламінокарбоніл, С1-С4алкілкарбоніламіно, (С1-С4-алкілкарбоніл)-С1-С4алкіламіно, ціано, аміно, моно- і ди-С1-С4алкіламіно, гетероарил, гетероцикліл і три-(С1-С6алкіл)силіл, і де гетероарилкарбоніл, гетероциклілкарбоніл, гетероарил і гетероцикліл можуть бути в подальшому заміщені С1-С4алкілом, R5 представляє С1-С4-алкіл, який може бути заміщений одним-трьома ідентичними або різними радикалами, що вибирають з групи, яка містить галоген, гідрокси, С1-С6-алкокси, С1-С6-алкенокси, С1-С6-алкілтіо, аміно, моно- і ди-С1-С6-алкіламіно, ариламіно, гідроксикарбоніл, С1-С6алкоксикарбоніл і радикал -О-С1-С4-алкіл-О-С1-С4алкіл, або R5 представляє аміно, R6 представляє водень, С1-С6-алкіл, форміл, амінокарбоніл, моноабо ди-С1-С4алкіламінокарбоніл, С3-С8-циклоалкілкарбоніл, С1С6-алкілкарбоніл, С1-С6-алкоксикарбоніл, N-(С1-С4алкілсульфоніл)амінокарбоніл, N-(С1-С4алкілсульфоніл)-N-(С1-С4-алкіл)амінокарбоніл, гетероарил, гетероцикліл, гетероарилкарбоніл або гетероциклілкарбоніл, де С1-С6-алкіл, моно- і диС1-С6-алкіламінокарбоніл, С1-С6-алкілкарбоніл, С1С6-алкоксикарбоніл, гетероарил і гетероцикліл можуть бути заміщеними одним-трьома ідентичними або різними радикалами, що вибирають з групи, яка містить арил, гетероарил, 10 гідрокси, С1-С6-алкокси, гідроксикарбоніл, С1-С6алкоксикарбоніл, аміно-карбоніл, моно- і ди-С1-С4алюламінокарбоніл, аміно, моно- і ди-С1-С4алкіламіно, С1-С4-алкілкарбоніламіно, три-(С1-С6алкіл)силіл, ціано, N-(моно- і ди-С1-С6-алкіламіноС1-С4-алкіл)амінокарбоніл, N-(С1-С4-алкокси-С1-С4алкіл)амінокарбоніл і галоген, або R6 представляє замісник формули де R6A вибирають з групи, що містить водень і С1С6-алкіл, і n представляє ціле число 1 або 2, R представляє галоген, нітро, ціано, С1-С6алкіл, гідрокси або С 1-С6-алкоксил де С1-С6-алкіл і С1-С6-алкокси можуть бути в подальшому заміщені одним – трьома ідентичними або різними радикалами, що вибирають з групи, яка містить галоген, гідрокси і С1-С4-алкокси, і Υ1, Υ2, Υ3, Υ4 і Υ5 незалежно один від одного представляють СН або Ν, де кільце містить або 0,1 або 2 атоми азоту. Сполуки згідно з цим винаходом також можуть існувати у формі їх солей, гідратів і/або сольватів. Фізіологічно прийнятні солі є переважними в контексті цього винаходу. Фізіологічно прийнятними солями згідно з винаходом є нетоксичні солі, які зазвичай одержують за допомогою реакції сполук (І) з неорганічною або органічною основою або кислотою, що зазвичай використовуються для цих цілей. Необмежуючими прикладами фармацевтично прийнятних солей сполук (І) є солі лужних металів, наприклад, солі літію, калію і натрію, солі лужноземельних металів, такі як солі магнію і кальцію, четвертинні амонієві солі, такі як, наприклад, триетиламонієві солі, ацетати, бензолсульфонати, бензоати, дикарбонати, дисульфати, дитартрати, борати, броміди, карбонати, хлориди, цитрати, дигідрохлориди, фумарати, глюконати, глутамати, гексилрезорцинати, гідроброміди, гідрохлориди, гідроксинафтоати, йодати, ізотіонати, лактати, лаурати, малати, малеати, манделати, мезилати, метилброміди, метилнітрати, метилсульфати, нітрати, олеати, оксалати, пальмітати, пантотенати, фосфати, дифосфати, полігалукторонати, саліцилати, стеарати, сульфати, сукцинати, тартрати, тозилати, валерати і інші солі, що використовуються в медичних цілях. Гідрати сполук винаходу або їх солей є стехіометричними композиціями сполук з водою, такими як, наприклад, гемі-, моно- або дигідрати. Сольвати сполук винаходу або їх солей є стехіометричними композиціями сполук з розчинниками. Представлений винахід включає і окремі енантіомери, і діастереомери і відповідні рацемати або діастереомерні суміші сполук згідно з 11 винаходом і їх відповідних солей. Крім того, включають всі можливі таутомерні форми сполук описаних вище згідно з представленим винаходом. Діастереомерні суміші можуть бути розділені на окремі ізомери за допомогою хроматографічних методик. Рацемати можуть бути розділені на відповідні енантіомери або за допомогою хроматографічних методик на хіральній фазі, або шляхом розділення. В контексті представленого винаходу, замісники, якщо не вказано інше, зазвичай мають наступні значення: Алкіл зазвичай представляє нерозгалужений або розгалужений вуглеводневий радикал, що має від 1до 6, переважно від 1 до 4 атомів вуглецю. Необмежуючими прикладами є метил, етил, нпропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил, пентил, ізопентил, гексил, ізогексил. Те ж саме стосується радикалів, таких як алкокси, алкіламіно, алкоксикарбоніл і алкоксикарбоніламіно. Алкокси ілюстративно і переважно представляє метокси, етокси, н-пропокси, ізопропокси, трет-бутокси, н-пентокси і н-гексокси. Алкілкарбоніл зазвичай представляє нерозгалужений або розгалужений вуглеводневий радикал, що має від 1 до 6, переважно від 1 до 4 атомів вуглецю, який має карбонільну функцію в місці приєднання. Необмежуючими прикладами є форміл, ацетил, н-пропіоніл, н-бутирил, ізобутирил, півалоїл, н-гексаноїл. Алкоксикарбоніл ілюстративно і переважно представляє метоксикарбоніл, етоксикарбоніл, нпропоксикарбоніл, ізопропоксикарбоніл, третбутоксикарбоніл, н-пентоксикарбоніл і нгексоксикарбоніл. Алкіламіно представляє алкіламінорадикал, що має один або два (вибрані незалежно) алкільні замісники, ілюстративно і переважно представляє метиламіно, етиламіно, н-пропіламіно, ізопропіламіно, трет-бутиламіно, н-пентиламіно, нгексиламіно, Ν,Ν-диметиламіно, Ν,Ν-діетиламіно, N-етил-N-метиламіно, N-метил-N-н-пропіламіно, Νізопропіл-N-н-пропіламіно, N-трет-бутил-Nметиламіно, N-етил-М-н-пентиламіно і N-н-гексилN-метиламіно. Алкіламінокарбоніл представляє алкіламінокарбонільний радикал, що має один або два (вибрані незалежно) алкільні замісники, ілюстративно і переважно представляє метиламінокарбоніл, етиламінокарбоніл, нпропіламінокарбоніл, ізопропіламінокарбоніл, третбутиламінокарбоніл, н-пентиламінокарбоніл, нгексиламінокарбоніл, Ν,Ν-диметил-амінокарбоніл, Ν,Ν-діетиламінокарбоніл, N-етил-Мметиламінокарбоніл, N-метил-N-нпропіламінокарбоніл, N-ізопропіл-N-нпропіламінокарбоніл, N-трет-бутил-Nметиламінокарбоніл, N-етил-N-н-пентиламінокарбоніл і N-н-гексил-N-метил-амінокарбоніл. АлкілсульФоніл зазвичай представляє нерозгалужений або розгалужений вуглеводневий радикал, що має від 1 до 6, переважно від 1 до 4 атомів вуглецю, який має сульфонільну групу в місці приєднання. Необмежуючими прикладами є 82074 12 метилсульфоніл, етилсульфоніл, нпропілсульфоніл, ізопропілсульфоніл, нбутилсульфоніл, трет-бутилсульфоніл. Циклоалкіл зазвичай представляє циклічний насичений вуглеводневий радикал, що має від 3 до 8, переважно від 3 до 6 атомів вуглецю. Необмежуючими прикладами є циклопропіл, циклобутил, циклопентил, циклогексил і циклогептил. Арил per se і в арилкарбонілі представляє моно- - трициклічний ароматичний карбоциклічний радикал, що зазвичай має від 6 до 14 атомів вуглецю, ілюстративно і переважно представляє феніл, нафтил і фенантреніл. Арилкарбоніл ілюстративно і переважно представляє бензоїл і нафтоїл. Гетероарил per se і в гетероарилкарбонілі представляє ароматичний моно- або біциклічний радикал, що зазвичай має від 5 до 10 і переважно 5 або 6 кільцевих атомів i до 5 і переважно до 4 гетероатомів, що вибирають з групи, яка містить S, О і N, ілюстративно і переважно представляє тієніл, фурил, піроліл, тіазоліл, оксазоліл, імідазоліл, оксадіазоліл, тіадіазоліл, піридил, піримідил, піридазиніл, індоліл, індазоліл, бензофураніл, бензотіофеніл, бензотіазоліл, хінолініл, ізохінолініл. Гетероарилкарбоніл ілюстративно і переважно представляє тієнілкарбоніл, урилкарбоніл, піроліл карбоніл, тіазолілкарбоніл, оксазолілкарбоніл, імідазолілкарбоніл, піридилкарбоніл, піримідилкарбоніл, піридазинілкарбоніл, індолілкарбоніл, індазолілкарбоніл, бензофуранілкарбоніл, бензотіофеніл карбоніл, хінолінілкарбоніл, ізохінолініл карбоніл. Гетероиикліл per se і в гетероииклілкарбонілі представляє моно- або поліциклічний, переважно моноабо біциклічний, неароматичний гетероциклічний радикал, що зазвичай має від 4 до 10 і переважно від 5 до 8 кільцевих атомів і до 3 і переважно до 2 гетероатомів і/або гетерогруп, що вибирають з групи, яка містить N, О, S, SO і SO2. Гетероциклільні радикали можуть бути насиченими або частково насиченими. Перевага віддається 5- - 8-членним моноциклічним насиченим гетероциклільним радикалам, що мають до двох гетероатомів, що вибирають з групи, що містить О, N і S, таким як, ілюстративно і переважно, тетрагідрофуран-2-іл, піролідин-1-іл, піролідин-2-іл, піролідин-3-іл, піролініл, піперидиніл, морфолініл, пергідроазепініл. Гетероциклілкарбоніл ілюстративно і переважно представляє тетрагідрофуран-2карбоніл, піролідин-1-карбоніл, піролідин-2карбоніл, піролідин-3-карбоніл, піролінкарбоніл, піперидинкарбоніл, морфолінкарбоніл, пергідроазепінкарбоніл. Галоген представляє фтор, хлор, бром і йод. Коли зазначено, що Υ1. Υ2. Υ3. Υ4 і Y5 представляють СН або N, QH також повинен ставати кільцевим атомом вуглецю, який заміщений замісником R3 або R7. * символ після зв'язку означає точку приєднання до молекули. 13 В іншому втіленні, представлений винахід стосується сполук загальної формули (І), де А представляє арил або гетероарил, R1, R2 і R3 незалежно один від одного представляють водень, галоген, нітро, ціано, С1С6-алкіл, гідрокси або С1-С6-алкокси, де С1-С6алкіл і С1-С6-алкокси можуть бути в подальшому заміщені одним-трьома ідентичними або різними радикалами, що вибирають з групи, яка містить галоген, гідрокси і С1-С4-алкокси, R4 представляє С1-С6-алкілкарбоніл, С1-С6алкоксикарбоніл, С1-С6-алкенокси-карбоніл, гідроксикарбоніл, амінокарбоніл, моно- або ди-С1С4-алкіламінокарбоніл, С6-С10-ариламінокарбоніл, гетероарилкарбоніл, гетероциклілкарбоніл, гетероарил, гетероцикліл або ціано, де С1-С6алкілкарбоніл, С1-С6-алкоксикарбоніл, моно- і диС1-С4-алкіламінокарбоніл можуть бути в подальшому заміщені одним-трьома ідентичними або різними радикалами, що вибирають з групи, яка містить С3-С8-циклоалкіл, гідрокси, С1-С4алкокси, С1-С4-алкоксикарбоніл, гідроксикарбоніл, амінокарбоніл, моноі ди-С1-С4алкіламінокарбоніл, С1-С4-алкілкарбоніл аміно, аміно, моно- і ди-С1-С4-алкіламіно, гетероарил, гетероцикліл і три-(С1-С6-алкіл)силіл, R5 представляє С1-С4-алкіл, який може бути заміщений одним-трьома ідентичними або різними радикалами, що вибирають з групи, яка містить галоген, гідрокси, С1-С6-алкокси, С1-С6-алкенокси, С1-С6-алкілтіо, аміно, моно- і ди-С1-С6-алкіламіно, ариламіно, гідроксикарбоніл, С1-С6алкоксикарбоніл і радикал -О-С1-С4-алкіл-О-С1-С4алкіл, або R5 представляє аміно, R6 представляє водень, С1-С6-алкіл, форміл, амінокарбоніл, моноабо ди-С1-С4алкіламінокарбоніл, С3-С8-циклоалкілкарбоніл, С1С6-алкілкарбоніл, С1-С6-алкоксикарбоніл, N-(С1-С4алюлсульфонт)амiнокарбонiл, N-(С1-С4алкілсульфоніл)-N-(С1-С4-алкіл)амінокарбоніл, гетероарил, гетероцикліл, гетероарилкарбоніл або гетероциклілкарбоніл, де С1-С6-алкіл, моно- і диС1-С6-алкіламінокарбоніл, С1-С6-алкілкарбоніл, С1С6-алкоксикарбоніл, гетероарил і гетероцикліл можуть бути заміщеними одним-трьома ідентичними або різними радикалами, що вибирають з групи, яка містить арил, гетероарил, гідрокси, С1-С4-алкокси, гідроксикарбоніл, С1-С6алкоксикарбоніл, аміно-карбоніл, моно- і ди-С1-С4алкіламінокарбоніл, аміно, моно- і ди-С1-С4алкіламіно, С1-С4-алкілкарбоніламіно, три-(С1-С6алкіл)силіл, ціано, N-(моно- і ди-С1-С4-алкіламіноС1-С4-алкіл)амінокарбоніл, N-(С1-С4-алкокси-С1-С4алкіл)амінокарбоніл і галоген, або R6 представляє замісник формули де R6A вибирають з групи, що містить водень і С1С6-алкіл, і 82074 14 n представляє ціле число 1 або 2, R7 представляє галоген, нітро, ціано, С1-С6алкіл, гідрокси або С1-С6-алкокси, де С1-С6-алкіл і С1-С6-алкокси можуть бути в подальшому заміщені одним-трьома ідентичними або різними радикалами, що вибирають з групи, яка містить галоген, пдроксиж і С1-С4-алкокси, Υ1, Υ2, Υ3, Υ4 і Υ5 незалежно один від одного представляють СН або Ν, де кільце містить 0,1 або 2 атоми азоту. В іншому втіленні, представлений винахід стосується сполук загальної формули (І), де А представляє феніл, нафтил або піридил, R1, R2 і R3 незалежно один від одного представляють водень, фтор, хлор, бром, нітро, ціано, метил, етил, трифторметил або трифторметокси, R4 представляє С1-С6-ал кіл карбоніл, С1-С6алкоксикарбоніл, гідроксикарбоніл, амінокарбоніл, моно-С1-С4-алкіламінокарбоніл або ціано, де С1С6-алкілкарбоніл, С1-С6-алкоксикарбоніл і моно-С1С4-алкіламінокарбоніл можуть бути заміщеними одним-трьома ідентичними або різними радикалами, що вибирають з групи, яка містить С3С8-циклоалкіл, гідрокси, С1-С4-алкокси, С1-С4алкоксикарбоніл, аміно, моно- або ди-С1-С4алкіламіно, гетероарил і гетероцикліл, R5 представляє метил або етил, R6 представляє водень, С1-С6-апкіл, моно- або ди-С1-С4-алкіламінокарбоніл, С1-С6-алкілкарбоніл, С1-С6-алкоксикарбоніл або гетероциклілкарбоніл, де С1-С6-алкіл і С1-С6-алкоксикарбоніл можуть бути заміщеними одним-трьома ідентичними або різними радикалами, що вибирають з групи, яка містить гетероарил, гідрокси, С1-С4-алкокси, гідроксикарбоніл, С1-С6-алкоксикарбоніл, амінокарбоніл, моноі ди-С1-С4алкіламінокарбоніл, ціано, аміно, моно- і ди-С1-С4алкіламіно, або R6 представляє замісник формули де R6A вибирають з групи, що містить водень і С1С4-алкіл, і n представляє ціле число 1 або 2, R7 представляє галоген, нітро, ціано, трифторметил, трифторметокси, метил або етил, Υ1, Υ2 , Υ3, Υ4 і Υ5 кожен представляє СН. В іншому втіленні, представлений винахід стосується сполук загальної формули (І), де А представляє феніл або піридил, R1 і R3 кожен представляє водень, R2 представляє фтор, хлор, бром, нітро або ціано, R4 представляє ціано, С1-С4-алкілкарбоніл або С1-С4-алкоксикарбоніл, де С1-С4-алкоксикарбоніл може бути заміщений радикалом, що вибирають з групи, яка містить гідрокси, С1-С4-алкокси, С1-С4алкоксикарбоніл, моно- і ди-С1-С4-алкіламіно, гетероарил і гетероцикліл, 15 R5 представляє метил, R6 представляє водень, С1-С4-апкіл, моно- або ди-С1-С4-алкіламінокарбоніл, С1-С4-алкілкарбоніл або С1-С4-алкоксикарбоніл, де С1-С4-алкіл і С1-С4алкоксикарбоніл може бути заміщений радикалом, що вибирають з групи, яка містить гетероарил, гідрокси, С1-С4-алкокси, гідроксикарбоніл, амінокарбоніл, моноі ди-С1-С4алкіламінокарбоніл, аміно, моно- і ди-С1-С4алкіламіно, Або R6 представляє замісник формули де R6А вибирають з групи, що містить водень і метил, R7 представляє трифторметил або нітро, і Υ1, Υ2 , Υ3, Υ4 і Y5 кожен представляє СН. В іншому втіленні, представлений винахід стосується сполук згідно з загальною формулою (І), де А є феніл або піридил. В іншому втіленні, представлений винахід стосується сполук згідно з загальною формулою (І), де R1 є водень. В іншому втіленні, представлений винахід стосується сполук згідно з загальною формулою (І), де R2 є ціано, особливо, де А є феніл або піридил і R2 є ціано, що розташоване в параположенні відносно центрального дигідропіримідинонового кільця. В іншому втіленні, представлений винахід стосується сполук згідно з загальною формулою (І), де R3 є водень. В іншому втіленні, представлений винахід стосується сполук згідно з загальною формулою (І), де R4 є С1-С4-алкоксикарбоніл, необов'язково, заміщений гідрокси, а особливо 2гідроксиетоксикарбоніл, або де R4 є С1-С4-алкіл карбоніл, особливої метилкарбоніл. В іншому втіленні, представлений винахід стосується сполук згідно з загальною формулою (І), де R5 є метил. В іншому втіленні, представлений винахід стосується сполук згідно з загальною формулою (І), де R6 є водень. В іншому втіленні, представлений винахід стосується сполук згідно з загальною формулою (І), де R7 є трифторметил або нітро, особливо, де R7 є трифторметил, що розташований в метаположенні відносно центрального дигідропіримідинонового кільця. В іншому втіленні, представлений винахід стосується сполук загальної формули (ІА) 82074 16 (ІА) де Ζ представляє СН або Ν, і R1, R3, R4 і R6 мають значення вказані вище. Сполуки представленого винаходу, де R6 є водень, можуть енолізувати у відповідні гідроксиамідини: Сполуки загальної формули (І) синтезувати шляхом конденсування загальної формули (II) можна сполук (ІІ) де A, R1 і R2 мають значення вказані вище, з сполуками загальної формули (III) (ІІІ) де R4 і R5 мають значення вказані вище, і сполуками загальної формули (IV) (ІV) де R3, R7 і Υ1 - Υ5 мають значення вказані вище, в присутності кислоти або в трикомпонентно/одностадійній реакції, або послідовно одержуючи сполуки загальної формули (IB) 17 82074 (ІB) де A, R1 - R5, R7 і Y1 - Y5 мають значення вказані вище, необов'язково, з наступною реакцією сполук загальної формули (IB) з сполуками загальної формули (V) R6*-X (V) де R6* має значення R6, як вказано вище, але не представляє собою водень, і X представляє групу, що відходить, таку як галоген, тозилат, мезилат або сульфат, в присутності основи. Сполуки загальної формули (І), де R4 представляє ціано, R5 представляє аміно і R6 представляє водень, можна, альтернативно, одержати шляхом конденсування сполук загальної формули (II) з сполуками загальної формули (IV) і сполукою формули (VI) NC-CH2-CN (VІ) в присутності кислоти або в трикомпонентній/одностадійній реакції, або послідовно. Придатними розчинниками для процесу (II)+(III)/(VI)+(IV)®(IB) зазвичай є звичайні органічні розчинники, які не змінюються під дією умов реакції. Розчинниками є етери, такі як діетиловий етер, діізопропіловий етер, 1,2-диметоксиетан, діоксан або тетрагідрофуран, етилацетат, ацетон, ацетонітрил, диметилсульфоксид, диметилформамід або спирти, такі як метанол, етанол, н-пропанол, ізопропанол, н-бутанол або тбутанол, або вуглеводні, такі як пентан, гексан, циклогексан, бензол, толуол або ксилен або галогеновуглеводні, такі як дихлорметан, дихлоретан, трихлорметан або хлорбензол. Також можливе використання сумішей згаданих вище розчинників. Переважним для процесу є тетрагідрофуран. Придатними кислотами для процесу (II)+(III)/(VI)+(IV)®(IB) зазвичай є неорганічні або органічні кислоти. Кислотами переважно є карбонові кислоти, такі як, наприклад, оцтова кислота або трифтороцтова кислота, сульфонові кислоти, такі як, наприклад, метансульфонова кислота або п-толуолсульфонова кислота, хлорводнева кислота або фосфорні кислоти, такі як поліфосфорні кислоти. Перевага віддається етиловому естеру проліфосфорної кислоти. Кислоту використовують в кількості від приблизно 0,25моль до 100моль, відносно 1моль сполуки загальної формули (III). 18 Процес зазвичай проводять при температурі в інтервалі від +20°С до +150°С, переважно від +60°С до +100°С. Процес зазвичай проводять при нормальному тиску. Однак, також можливо проводити його при підвищеному тиску або при пониженому тиску (наприклад, в інтервалі від 0,5 до 5бар). Придатними розчинниками для процесу (IB)+(V)®(І) зазвичай є звичайні органічні розчинники, які не змінюються під дією умов реакції. Розчинниками є етери, такі як діетиловий етер, діізопропіловий етер, 1,2-диметоксиетан, діоксан або тетрагідрофуран, етилацетат, ацетон, ацетонітрил, диметилсульфоксид, диметилформамід або вуглеводні, такі як пентан, гексан, циклогексан, бензол, толуол або ксилен або галогеновуглеводні, такі як дихлорметан, дихлоретан, трихлорметан або хлорбензол. Також можливе використання сумішей згаданих вище розчинників. Переважним для процесу є тетрагідрофуран. Придатними основами для процесу (IB)+(V)®(І) є звичайні неорганічні або органічні основи. Основами переважно є циклічні аміни, такі як, наприклад, піперидин або 4-N,Nдиметиламінопіридин або (С1-С4)-триалкіламін, такі як, наприклад, триетиламін або діізопропілетиламін, або гідриди, такі як гідрид натрію. Перевага віддається гідриду натрію. Основу використовують в кількості від приблизно 0,1моль до 10моль, переважно, від 1моль до 3моль, відносно 1моль сполуки загальної формули (IV). Процес зазвичай проводять при температурі в інтервалі від 0°С до +150°С, переважно, від +20°С до +80°С, особливо, при кімнатній температурі. Процес зазвичай проводять при нормальному тиску. Однак, також можливо проводити при підвищеному тиску або при пониженому тиску (наприклад, в інтервалі від 0,5 до 5бар). Сполуки загальних формул (II), (III), (IV), (V) і (VI) відомі per se, або вони можуть бути одержані за допомогою звичайних способів. Згаданий вище спосіб можна проілюструвати за допомогою наступної схеми: Сполуки згідно з винаходом проявляють непередбачуваний спектр корисної фармакологічної і фармакокінетичної активності. Тому вони є придатними як медикаменти для 19 лікування і/або профілактики розладів у людей і тварин. Неочікувано, сполуки представленого винаходу інгібують активність нейтрофільної елестази людини (HNE) і тому придатні для одержання медикаментів для лікування захворювань пов'язаних з активністю HNE. Вони можуть забезпечувати ефективне лікування гострих і хронічних запальних процесів, таких як ревматоїдний артрит, атеросклероз, і особливо гострих і хронічних легеневих захворювань, таких як легеневий фіброз, кістозний фіброз, пневмонія, гострий респіраторний дистрессиндром (ARDS), зокрема, легенева емфізема, включаючи викликану курінням емфізему, і хронічні обструктивні легеневі захворювання (COPD), хронічний бронхіт і бронхоектазія. Сполуки представленого винаходу також можуть забезпечувати ефективне лікування кардіоваскулярних ішемічних захворювань, таких як гострий коронарний синдром, гострий інфаркт міокарда, нестабільна і стабільна стенокардія, шунтування коронарної артерії (CABG) і прогресуючої серцевої недостатності, атеросклерозу, морального пороку серця, дефектів міжпредсердной перегородки, при крізьшкірній транслюмінальній коронарній ангіопластиці (РТСА), запалення після відкритої операції на серці і легеневої гіпертензії. Вони також можуть бути корисними для ефективного лікування ревматоїдного артриту, гострого запального артриту, раку, гострого панкреатиту, виразкового коліту, періодонтального захворювання, синдрому Чурі-Страусса, гострого і хронічного атопічного дерматиту, псоріазу, системного ериматозного вовчаку, бульозного пемфігусу, сепсису, алкогольного гепатиту, фіброзу печінки, хвороби Бехцета, алергічного грибкового синуситу, алергічного синуситу, хвороби Крона, хвороби Кавасакі, гломерулонефриту, гострого пієлонефриту, колоректальних захворювань, хронічного гнійного отиту, хронічних венозних виразок ніг, запального захворювання кишечнику, бактеріальних і вірусних інфекцій, травми мозку, інсульту і інших станів, в які втягнуті нейтрофіли. Представлений винахід також забезпечує медикаменти, що містять, принаймні, одну сполуку згідно з винаходом, переважно, разом з одним або більшою кількістю фармакологічно безпечних екціпієнтів або речовин носіїв, а також їх застосування для згаданих вище цілей. Активний компонент може діяти системно і/або локально. Для цієї цілі, він може бути використаний прийнятним чином, наприклад, перорально, парентерально, пульмонарно, назально, сублінгвально, лінгвально, букально, ректально, трансдермально, коньюнктивально, отикально або як імплантат. Для цих шляхів застосування, активний компонент може вводитись у вигляді придатних для застосування форм. Корисні для перорального застосування форми, які вивільнюють активний компонент швидко і/або в модифікованій формі, такі як, 82074 20 наприклад, таблетки (непокриті таблетки або таблетки з покриттям, наприклад, з кишковим покриттям), капсули, таблетки покриті цукром, гранули, драже, порошки, емульсії, суспензії, розчини і аерозолі. Парентеральне застосування може проводитись з уникнення стадії абсорбції (внутрішньовенно, внутрішньоартеріально, внутрішньосерцево, внутрішньохребтово або внутрішньополітично) або з включенням абсорбції (внутрішньом'язово, підшкірно, внутрішньошкірно, крізьшкірно або внутрішньоочеревенно). Корисними для парентерального застосування формами є ін'єкційні рецептури і рецептури для вливання у формі розчинів, суспензій, емульсій, ліофілізатів і стерильних порошків. Формами придатними для інших шляхів застосування є, наприклад, фармацевтичні форми для інгаляції (включаючи, порошки для інгаляторів, розпилювачів), назальні краплі/розчини, спреї; таблетки або капсули для введення лінгвально, сублінгвально або букально, супозиторії, рецептури для вух і очей, вагінальні капсули, водні суспензії (лосьйони, змішані суміші), ліпофільні суспензії, мазі, креми, молочко, пасти, порошки для обпудрювання або імплантати. Активні компоненти можна перетворити у згадані препаративні форми за способами відомими per se. Це здійснюють використовуючи інертні нетоксичні фармацевтично придатні екціпієнти. Такими екціпієнтами є inter alia носії (наприклад мікрокристалічна целюлоза), розчинники (наприклад, рідкі поліетиленгліколі), емульсифікатори (наприклад, додецилсульфат натрію), диспергувальні агенти (наприклад, полівінілпіролідони), синтетичні і природні біополімери (наприклад, альбумін), стабілізатори (наприклад, антиоксиданти, такі як аскорбінова кислота), барвники (наприклад, неорганічні пігменти, такі як оксиди заліза) або коригувачи смаку і/або запаху. Для застосування людьми, у випадку перорального застосування, рекомендовані для введення дози знаходяться в інтервалі від 0,001 до 50мг/кг, переважно, 0,01мг/кг - 20мг/кг. У випадку парентерального застосування, такого як, наприклад, внутрішньовенного або назально, букально або за допомогою інгаляції через слизову оболонку, рекомендованими до застосування дози складають від 0,001мг/кг до 0,5мг/кг. Не дивлячись на це, може бути необхідно в деяких випадках відмовитись від згаданих кількостей, а саме беручи до уваги вагу тіла, використовуваний шлях введення, індивідуальну відповідь на активний компонент, спосіб одержання і час або інтервал, при якому має місце застосування. Наприклад, в деяких випадках, може бути достатньо використати меншу, ніж згадана вище мінімальну кількість, в той час як в інших випадках згадана верхня межа буде перевищуватись. У випадку використання великих кількостей, може бути бажано розділити дозу на декілька окремих доз для вживання протягом дня. 21 Відсотки в тестах і прикладах, які приведені далі є, якщо не вказано інше, ваговими; частки також є ваговими. Співвідношення розчинників, розріджувачів і концентрації приведені для розчинів рідина/рідина є об'ємними. А. Оцінка Фізіологічної активності Активність сполук винаходу по інгібуванню активності нейтрофільної еластази можна продемонструвати, наприклад, використовуючи наступні дослідження: І. In vitro дослідження Ферменту нейтрофільної еластази людини (HNE) Компоненти дослідження буфер дослідження: 0,1Μ HEPES-NaOH буфер рН7,4, 0,5Μ NaCI, 0,1% (в/о) бичачий сироватковий альбумін; придатна концентрація (дивіться нижче) HNE (18О/мг ліофіл., #20927,01, SERVA Electrophoresis GmbH, Heidelberg, Germany) в буфері дослідження; придатна концентрація (дивіться нижче) субстрату в буфері дослідження; придатна концентрація сполуки, що тестується, розведена буфером дослідження з 10мМ готового розчину в ДМСО. Приклад А In vitro інгібування HNE використовуючи флуорогенний пептидний субстрат (постійне зчитування сигналу, 384 МТР формат дослідження): В цьому протоколі, використовують субстрат еластази MeOSuc-Ala-Ala-Pro-Val-АМС (#324740, Calbiochem-Novabiochem Corporation, Merck KGaA, Darmstadt, Germany). Розчин тесту одержують шляхом змішування 10мкл розведеної тестованої сполуки, 20мкл HNE розведеного ферменту (кінцева концентрація 8 - 0,4мкО/мл, звичайно 2,1мкО/мл) і 20мкл розведеного субстрату (кінцева концентрація 1мМ - 1мкМ, звичайно 20мкМ), відповідно. Розчин інкубують протягом 0 - 2 годин при 37°С (зазвичай одну годину). Вимірюють флуоресценцію, що вивільнюється АМС завдяки ферментній реакції при 37°С (зчитувач планшетів TECAN spectra fluor plus). Швидкість збільшення флуоресценції (екс. 395нм, ем. 460нм) є пропорційною активності еластази. Значення ІС 50 визначають за допомогою графіку RFU-дo-[I]. Значення Km і Κm(app) визначають за допомогою графіків Ліневеавера-Бурка і перетворюючи у значення Ki за допомогою графіків Діксона. Препаративні приклади в цьому дослідженні мали значення IC50 в інтервалі 5нМ - 5мкМ. Зразкові дані приведені в Таблиці 1: 82074 22 Приклад Б In vitro інгібування HNE використовуючи флуорогенний нерозчинний субстрат еластину (постійне зчитування сигналу, 96 МТР формат дослідження): В цьому протоколі використовували субстрат еластази - еластин-флуоресцеїн (#100620, ICN Biomedicals GmbH, Eschwege, Germany). Розчин для тестування одержують шляхом змішування 3мкл розведеної сполуки, що тестується, 77мкл HNE розведеного ферменту (кінцева концентрація 0,22О/мл - 2,2мО/мл, звичайно 21,7мкО/мл) і 80мкл суспензії субстрату (кінцева концентрація 2мг/мл). Суспензію інкубують протягом 0-16 годин при 37°С (звичайно чотири години) при легкому перемішуванні. Для зупинки ферментної реакції, до розчину, що тестується, додають 160мкл 0,1Μ оцтової кислоти (кінцева концентрація 50мМ). Полімерний еластин-флуоресцин осаджують центрифугуванням (центрифуга Eppendorf 5804, 3000об/хв., 10хв.). Надосадкову рідину переносять в новий МТР і вимірюють флуоресценцію виділеного пептидом флуоресцеїну внаслідок ферментної реакції (зчитувач планшету BMG Fluostar). Коефіцієнт флуоресценції (екс. 490нм, ем. 520нм) є пропорційним активності еластази. Значення ІС50 визначають за графіками RFU-дo-[l]. II. In vitro дослідження на нейтрофілах людини Приклад А In vitro дослідження PMN еластолізу: Це дослідження використовують для визначення еластолітичної активності поліморфоядерних клітин людини (PMN) і оцінки частини деградації завдяки нейтрофільної 23 еластази [див. Z.W. She et al., Am. J. Respir. Cell. Мої. ВіоІ. 9, 386-392 (1993)]. Тритійований еластин, в суспензії, наносять на 96 луночний планшет в кількості 10мкг на лунку. До лунок в прийнятних концентраціях додають сполуку, що тестується, і контрольну сполуку [ZD0892 (J. Med. CheM. 40, 1876-1885, 3173-3181 (1997), WO 95/21855) і інгібітор α1 протеази (α1ΡΙ)]. ΡΜΝ людини виділяють з периферійної венозної крові здорових донорів і ресуспендують в культуральному середовищі. Нейтрофіли додають до заповнених лунок в концентраціях від 1´106 до 1´105 клітин на лунку. Як позитивний контроль для дослідження використовують панкреатичну еластазу свиней (1,3мкМ) і α1РІ (1,2мкМ) використовують як позитивний інгібітор нейтрофільної еластази. Клітинним контролем є ΡΜΝ без сполуки при кожній прийнятній густині клітин. Клітини плюс сполуки інкубують у вологому інкубаторі при 37°С протягом 4 годин. Планшети центрифугують осаджуючи тільки надосадкової рідини. Надосадкову рідину переносять в 75мкл відповідні лунки 96 луночного Lumaplate™ (тверді сцинтилятвмісні планшети). Планшети сушать до відсутності рідини у лунках і зчитують в беталічильнку протягом 3 хвилин на лунку. Еластоліз призводить до збільшення кількості 3 Н-еластину в надосадковій рідині. Інгібування цього еластолізу проявляється у зменшенні, порівняно з клітинним контролем, тритію у надосадковій рідині. α1РІ дає 83,46±3,97% (значення ±с.к.п.) інгібування при 1,2мкМ (n=3 різні донори при 3,6´105 клітин на лунку). ІС50 значення одержували виходячи з контрольної сполуки ZD0892 45,50±7,75нМ (значення ±с.к.п.) (n=2 різні донори при 3,6´105 клітин на лунку). Виходячи з того, що ZD-0892 є селективним інгібітором PMN еластази, разом з даними з інгібування α1РІ, ці результати вказують, що основна деградація еластину PMN відбувається завдяки вивільненню нейтрофільної еластази, а не іншого еластолітичного ферменту, такого як метриксна металопротеїназа (ММП). Сполуки цього винаходу оцінювали за їх інгібувальною активністю в цій HNE-залежній моделі нейтрофільного еластолізу. 19 Приклад Б In vitro інгібування мембранзв'язаної еластази: Вимірювання інгібування еластази зв'язаної з мембранами нейтрофілів проводили використовуючи дослідження на нейтрофілах людини. Нейтрофіли стимулюють LPS при 37°С протягом 35хв. і потім осаджують при 1600об/хв. Після цього, мембранзв'язану еластазу фіксують на нейтрофілах використовуючи 3% параформальденгід і 0,25% глутаральдегід протягом 3хв. при 4°С. Нейтрофіли потім осаджують і додають розчинник і сполуку, що досліджують, після чого додають субстрат MeOSuc-Ala-Ala-Pro-Val-AMC (#324740, Calbiochem-Novabiochem Corporation, Merck KGaA, Darmstadt, Germany) в кількості 200мкМ. Після 25хв. інкування при 37°С, реакцію зупиняють додаючи PMCF (фторид фенілтетансульфонілу), і 82074 24 визначають флуоресценцію при екс: 400нм і ем: 505нм. Визначають значення IC50 шляхом інтерполяції на графіках відносної флуоресценції до концентрації інгібування. III. In vivo моделі Приклад А In vivo модель гострого пошкодження легені у щура: Вдування нейтрофільної еластази людини (HNE) в легені щурів викликає пошкодження легені. Ступінь цього пошкодження може бути оцінена шляхом вимірювання легеневого крововиливу. Щурів анестезіювали Гіпнорм/Гіпновел/вода і вводили в легені HNE або салін використовуючи мікророзпилювач. Сполуки, що тестуються, вводять за допомогою внутрішньовенного ін'єктування, перорального введення або за допомогою інгаляції безпосередньо перед введенням HNE. Через шістдесят хвилин після введення тваринам еластази їх умертвляли шляхом введення надмірної дози анестетика (пентобарабітон натрію) і легені промивали 2мл гепаринізованого забуференого фосфатом саліну (PBS). Вимірюють об'єм бронхоальвеолярних рідин (BAL) і зразки зберігають на льоду. Кожен зразок BAL центрифугують при 900об/хв. протягом 10 хвилин при 4-10°С. Надосадкову рідину відкидають і залишок клітин ресуспендують в PBS і зразок знову центрифугують. Надосадкову рідину знову відкидають і залишок клітин ресуспендують в 1мл 0,1% цетилтриметил-бромід амонію (CTAB)/PBS для лікування клітин. Зразки заморожують до аналізу вмісту крові. Перед аналізом крововиливу зразки розморожують і змішують. 100мкл кожного зразку поміщають в окрему лунку 96 луночного пласкодонного планшету. Всі зразки тестують двічі. 100мкл 0,1% СТАВ/PBS включають як контроль. Вимірюють абсорбцію вмісту лунок при 415нм використовуючи спектрофотометр. Стандарту криву будують шляхом вимірювання OD при 415нм при різних концентраціях крові в 0,1% СТАВ/PBS. Розраховують значення вмісту в крові шляхом порівняння з стандартною кривою (включена в кожний планшет) і нормалізують для об'єму BAL вилученої рідини. Сполуки цього винаходу оцінюють при внутрішньовенному, пероральному введенні або за допомогою інгаляції за їх інгібувальною активністю в цій моделі HNE-індукованого крововиливу у щурів. Приклад Б In vivo модель гострого інфаркту міокарда у щурів: Інгібітори еластази тестують у щурах моделі інфаркту. Самці щурів Вістар (вага >300г) одержують 10мг/кг аспірину за 30хв. до операції. їх анестезіюють ізофлураном і вентилюють (120130ударів/хв., об'єм удару 200-250мкл; MiniVent Type 845, Hugo Sachs Elektronik, Germany) протягом всієї операції. Після лівої торакотомії в четвертому міжреберному проміжку, відкривають перикардій і серце швидко виводять. Нитку обводять навколо лівої коронарної артерії (LAD) 25 без затягування артерії. Нитку виводять на поверхню шкіри до шиї тварини. Грудну клітку закривають і тварину залишають відновлюватись протягом 4 днів. На п'ятий день, щурів анестезують ефіром протягом 3хв. і нитку затягують і закривають LAD під контролем ECG. Сполуки, що тестуються, вводять перед і після закриття LAD per os, внуктрішньоочеревенно або внутрішньовенно (болюс або постійне вливання). Після 1г оклюзії, нитку відпускають дозволяють реперфузію. Серця вирізають і визначають розміри інфаркту через 48 годин після забарвлювання реоклюдованих сердець Еванс блакитним, з наступним витримуванням з ТТС (хлорид трифенілтетразолію) 2 мм шматочків серця. Нормоксичні (не оклюдована тканина) зони забарвлюються блакитним, ішемічні (оклюдовані, але живі тканини) зони забарвлюються червоним і некротичні (оклюдована мертва тканина) зони залишаються білими. Кожний шматочок тканини сканували і визначали розміри інфарктування використовуючи комп'ютерну планіметрію. Б. Приклади Абревіатури: вод. конц. ДМФА ДМСО ЕІ ЕСІ ВЕРХ РХ-МС Тпл. МС ЯМР від тео. Чу ТГФ водний концентрований Ν,Ν-диметилформамід диметилсульфоксид іонізація електронним ударом (для МС) електро-спрей іонізація (для МС) високоефективна рідинна хроматографія рідинна хроматографія з мас-спектроскопією температура плавлення мас-спектроскопія ядерний магнітний резонанс Теоретичний (вихід) час утримання (для ВЕРХ) тетрагідрофуран Загальні методики: Всі реакції проводять в атмосфері аргону, як що не вказано інше. Розчиннику використовують утому вигляді як було придбано в Aldrich, без додаткового очищення. 'Силігагель' стосується силікагелю 60 (0,040мм-0,063мм) від компанії Merck KGaA. Температури плавлення знімали на Buchi 512 або подібному пристрої для вимірювання температури плавлення і не коригували. Сполуки очищені за допомогою препаративної ВЕРХ очищали на RP18-колонці використовуючи ацетонітрил і воду як елюент, і використовуючи градієнт 1:9 - 9:1. РХ-МС/ВЕРХ способи: РХ-МС спосіб 1 Прилад: MicroMaca Quattro LCZ, HP1100; колонка: Uptisphere HDO, 50мм´2,0мм, 3мкм; елюент А: вода +0,05% мурашина кислота, елюент В: ацетонітрил +0,05% мурашина кислота; градієнт: 0,0хв. 100% А®0,2хв. 100% А®2,9хв. 30% А®3,1хв. 10% А®4,5хв. 10% А; піч: 55°С; потік: 0,8мл/хв.; УФ-детектування: 208-400нм. РХ-МС спосіб 2 Прилад: Waters Alliance 2790 LC; колонка: Symmetry C18, 50мм´2,1мм, 3,5мкм; елюент А: 82074 26 вода +0,1% мурашина кислота, елюент В: ацетонітрил +0,1% мурашина кислота; градієнт: 0,0хв. 5% В®5,0хв. 10% В®6,0хв. 10% В; температура: 50°С; потік: 1,0мл/хв.; УФдетектування: 210нм. РХ-МС спосіб 3 Прилад: MicroMaca Platform LCZ, HP1100; колонка: Aquasil C-18, 50мм´2,0мм, 3 мкм; елюент А: вода +0,05% мурашина кислота, елюент В: ацетонітрил +0,05% мурашина кислота; градієнт: 0,0хв. 100% А®0,2хв. 100% А®2,9хв. 30% А®3,1хв. 10% А®4,5хв. 10% А; піч: 55°С; потік: 0,8мл/хв.; УФ-детектування: 208-400нм. ВЕРХ спосіб 4 Прилад: HP 1100 з DAD-детектуванням; колонка: Kromasil RP-18, 60мм´2мм, 3,5мкм; елюент: А=5мл НСlO4/л Н2О, В= ацетонітрил; градієнт: 0хв. 2% В, 0,5хв. 2% В, 4,5хв. 90% В, 6,5хв. 90% В; потік: 0,75мл/хв.; температура: 30°С; УФ-детектування: 210нм. РХ-МС спосіб 5 Прилад: MicroMaca TOF-MUX-lnterface 4кратне паралельне ін'єктування, з ВЕРХ Waters 600; колонка: Uptisphere HDO, 50мм´2,0мм, 3,0 мкм; елюент А: 1л води +1мл 50% мурашиної кислоти, елюент В: 1л ацетонітрилу +1мл 50% мурашиної кислоти; градієнт: 0,0хв. 100% А®0,2хв. 100% А®2,9хв. 30% А®3,1хв. 10% А®4,5хв. 10% А®4,6хв. 100% А®6,5хв. 100% А; піч: кімнатна температура; потік: 0,8мл/хв.; УФдетектування: 210нм. РХ-МС спосіб 6 Прилад: MicroMaca Platform LCZ з ВЕРХ Agilent Serie 1100; колонка: Grom-SIL120 ODS-4 HE, 50мм´2,0мм, 3мкм; елюент А: 1л води +1мл 50% мурашиної кислоти, елюент В: 1л ацетонітрилк +1мл 50% мурашиної кислоти; градієнт: 0,0хв. 100% А®0,2хв. 100% А®2,9хв. 30% А®3,1хв. 10% А®4,5хв. 10% А; піч: 55°С; потік: 0,8мл/хв.; УФ-детектування: 208-400нм. РХ-МС спосіб 7 Прилад: MicroMaca Quattro LCZ з ВЕРХ Agilent Serie 1100; колонка: Uptisphere HDO, 50мм´2,0мм, 3мкм; елюент А: 1л води +1мл 50% мурашиної кислоти, елюент В: 1л ацетонітрилу +1мл 50% мурашиної кислоти; градієнт: 0,0хв. 100% А®0,2хв. 100% А®2,9хв. 30% А®3,1хв. 10% А®4,5хв. 10% А; пічь: 55°С; потік: 0,8мл/хв.; УФдетектування: 208-400нм. Вихідні матеріали: Приклад 1А 2-Бром-5-(1,3-діоксалан-2-іл)піридин 6-Бром-3-піридинкарбальдегід (500мг, 2,7ммоль) і 1,2-етандіол (200мг, 3,2ммоль) розчиняють в толуолі (50мл) разом з Amberlyst 15 (100мг) в круглодонній колбі спорядженій зворотнім холодильником і насадкою Діна-Старка. 27 Розчин перемішують при кип'ятінні із зворотнім холодильником протягом ночі, потім охолоджують до кімнатної температури, фільтрують і концентрують у вакуумі. Неочищений продукт хроматографують на силікагелі використовуючи циклогексан і етилацетат як елюент одержуючи вказану в заголовку сполуку як безбарвне масло. Вихід: 0,489г (79% від теор.) ВЕРХ (спосіб 4): 3,46хв. МС (ЕСІпоз): m/z=231 (М+Н)+ 1 Н-ЯМР (300МГц, CDCI 3): δ=8,46 (д, 1Н), 7,64 (м, 1Н), 7,49 (м, 1Н), 4,15-4,00 (м, 4Н) м.ч. Приклад 2А 5-(1,3-Діоксалан-2-іл)-2-піридинкарбонітрил Приклад 1А (2,8г, 12,5ммоль), ціанід цинку (1,6г, 13,8ммоль) і тетракіс(трифенілфосфін)паладію (0) (1,4г, 1,3ммоль) розчиняють в диметилформаміді (100мл) і перемішують протягом ночі (18г) при 80°С. Додають ще тетракіс(трифенілфосфін)паладію (0) (0,1г) і реакцію знову перемішують протягом ночі (18г) при 80°С, потім залишають стояти при кімнатній температурі протягом 2 днів (48 годин). Розчинник видаляють у вакуумі, до залишку додають воду (100мл) і продукт екстрагують етилацетатом (1л). Органічну фазу промивають насиченим водним розчином хлориду натрію (200мл), сушать моногідратом сульфату магнію, фільтрують і концентрують у вакуумі. Неочищений продукт хроматографують на силікагелі використовуючи циклогексан і етилацетат, як елюент, одержуючи вказану в заголовку сполуку як білу аморфну тверду речовину. Вихід: 0,94г (42% від теор.) ВЕРХ (спосіб 4): 3,21хв. МС (ЕСІпоз): m/z=177 (М+Н)+ 1 Н-ЯМР (400МГц, ДMCO-d6): δ=8,81 (с, 1Н), 8,09 (с, 2Н), 5,95 (с, 1Н), 4,13-3,94 (м, 4Н) м.ч. Приклад 3А 5-Форміл-2-піридинкарбонітрил Спосіб а): Одержували по аналогії з методикою Dodd, D. et al. [J.Org.CheM. 1992, 57, 7226-7234]: До розчину, що перемішується, 5-(1,3-діоксалан-2-іл)2-піридинкарбонітрилу (Приклад 2А; 850мг, 4,8ммоль) в ацетон/вода 85:15 (59,5мл) додають п-толуолсульфонову кислоту (102мг, 0,59ммоль). Реакцію перемішують при кип'ятінні із зворотнім холодильником протягом ночі (18г), потім додають ще п-толуолсульфонову кислоту (50мг) і воду (5мл). Реакцію перемішують при кип'ятінні із 82074 28 зворотнім холодильником протягом ще 48г. Розчин охолоджують до кімнатної температури і гасять насиченим розчином бікарбонату натрію. Продукт екстрагують етилацетатом (3´100мл), сушать моногідратом сульфату магнію, фільтрують і концентрують у вакуумі. Неочищений продукт очищають за допомогою препаративної ВЕРХ одержуючи блідо-жовту тверду речовину. Вихід: 0,66г (93% від теор.) Тпл.: 80-82°С ВЕРХ (спосіб 4): 2,13хв. МС (ЕСІпоз): m/z=133 (М+Н)+ 1 Н-ЯМР (400МГц, ДMCO-d6): δ=10,18 (с, 1Н), 9,21 (м, 1Н), 8,49 (м, 1Н), 8,27 (м, 1Н) м.ч. Спосіб б): 1,04г (8,2ммоль) оксалілхлориду розчиняють в 8мл дихлорметану. При -78°С по краплям додають 1,28г (16,4ммоль) диметилсульфоксиду. Розчин перемішують при -78°С протягом 20 хвилин, потім додають 1г (7,46ммоль) сполуки Прикладу 5А, розчиненої в 7мл дихлорметану, і перемішують при -78°С протягом наступних 2 годин. Потім по краплям додають 3,4г (33,6ммоль) триетиламіну і після нагрівання до кімнатної температури, суміш очищають за допомогою колонкової хроматографії (силікагель, елюент циклогексан до циклогексан/етилацетат 2:1). Вихід: 0,76г (77% від теор.) Аналітичні дані: дивіться вище. Приклад 4А 5-Метил-2-піридинкарбонітрил 36г (209ммоль) 2-бром-5-метилпіридину і 37,5г (418ммоль) ціаніду міді кип'ятять із зворотнім холодильником протягом двох годин в 500мл диметилформаміду. Після охолодження до 50°С, при перемішуванні додають 10% водний розчин аміаку (500мл). Продукт екстрагують дихлорметаном, органічну фазу сушать над сульфатом магнію і розчинник видаляють у вакуумі. Продукт очищають за допомогою колонкової хроматографії (силікагель, елюент циклогексан/етилацетат 9:1). Вихід: 18г (73% від теор.) 1 Н-ЯМР (300МГц, CDCI 3): δ=2,4 (с, 3Н), 7,6 (м, 2Н), 8,6 (с, 1Н) м.ч. Приклад 5А 5-(Гідроксиметил)-2-піридинкарбонітрил Сполуку Прикладу 4А (13г, 110ммоль) розчиняють в 400мл тетрахлорметану і додають 29,4г (165ммоль) N-бромсукциніміду і 0,4г (1,6ммоль) дибензоїлпероксиду. Реакційну суміш кип'ятять із зворотнім холодильником протягом 29 трьох годин, охолоджують до кімнатної температури і фільтрують. Розчин промивають водним тіосульфатом натрію, сушать над сульфатом магнію і розчинник видаляють у вакуумі. Залишок розчиняють в 200мл діоксану і 200мл води, додають карбонат кальцію (44г, 440ммоль) і суміш перемішують при кип'ятінні із зворотнім холодильником протягом 2 годин. Після охолодження до кімнатної температури, суміш фільтрують і додають дихлорметан. Після розділення фаз, органічну фазу сушать над сульфатом магнію і розчинник видаляють у вакуумі. Продукт очищають за допомогою хроматографії (силікагель, елюент циклогексан/етилацетат 2:1). Вихід: 5,2г (35% від теор.) 1 Н-ЯМР (300МГц, ДМСО-d6): δ=4,7 (д, 2Н), 5,6 (т, 1Н), 8,0 (м, 2Н), 8,7 (с, 1Н) м.ч. Одержання Прикладів: Приклад 1 Етил 4-(4-ціанофеніл)-6-метил-2-оксо-1-[3(трифторметил)феніл]-1,2,3,4-тетрагідро-5піримідинкарбоксилат 7,0г (34,29ммоль) N-[3(трифторметил)феніл]сечовини, 8,99г (68,58ммоль) 4-ціанобензальдегіду, 8,92г (68,58ммоль) етил 3-оксобутаноату і 20г етилового естеру поліфосфорної кислоти суспендують в 250мл ТГФ. Суміш перемішують при кип'ятінні із зворотнім холодильником протягом 18 годин. Після охолодження до кімнатної температури, розчинник видаляють у вакуумі і залишок очищають за допомогою колонкової хроматографії на силікагелі використовуючи циклогексан/етилацетат як елюент. Вихід: 13,4г (91%) 1 Н-ЯМР (200МГц, ДМСО-d6): δ=1,1 (т, 3Н); 2,0 (с, 3Н); 4,0 (к, 2Н); 5,4 (д, 1Н); 7,6 (м, 3Н); 7,7 (м, 3Н); 7,9 (м, 2Н); 8,4 (д, 1Н) м.ч. Приклад 2 4-{5-Ацетил-6-метил-2-оксо-1-[3(трифторметил)феніл]-1,2,3,4-тетрагідро-4піримідиніл}бензонітрил 82074 30 265мг (1,3ммоль) N-[3(трифторметил)фент]сечовини, 131мг (1,0ммоль) 4-ціанобензальдегіду і 100мг (1,0ммоль) 2,4пентандіону суспендують в 2мл ТГФ і додають каталітичну кількість концентрованої хлорводневої кислоти. Суміш перемішують при кип'ятінні із зворотнім холодильником протягом 18 годин. Після охолодження до кімнатної температури, розчинник видаляють у вакуумі і залишок очищають за допомогою колонкової хроматографії на силікагелі використовуючи циклогексан/етилацетат як елюент. Вихід: 29мг (7%) 1 Н-ЯМР (200МГц, ДМСО-d6): δ=2,0 (с, 3Н); 2,2 (с, 3Н); 5,5 (д, 1Н); 7,5 (м, 1Н); 7,6 (м, 3Н); 7,7 (м, 1Н); 7,8 (м, 1Н); 7,9 (м, 2Н); 8,5 (д, 1Н) м.ч. Приклад 3 Етил 4-(4-бромфеніл)-6-метил-2-оксо-1-[3(трифторметил)феніл]-1,2,3,4-тетрагідро-5піримідинкарбоксилат 204мг (1,0ммоль) N-[3(трифторметил)фент]сечовина, 142мг (0,77ммоль) 4-бромбензальдегіду і 100мг (0,77ммоль) етил 3оксобутаноату суспендують в 2мл ТГФ і додають каталітичну кількість концентрованої хлорводневої кислоти. Суміш перемішують при кип'ятінні із зворотнім холодильником протягом 18 годин. Після охолодження до кімнатної температури, розчинник видаляють у вакуумі і залишок очищають за допомогою колонкової хроматографії на силікагелі використовуючи циклогексан/етилацетат як елюент. Вихід: 23мг (6%) 1 Н-ЯМР (200МГц, ДМСО-d6): δ=1,1 (т, 3Н); 2,0 (с, 3Н); 4,0 (к, 2Н); 5,3 (д, 1Н); 7,4 (м, 2Н); 7,6 (м, 3Н); 7,7 (м, 3Н); 8,3 (д, 1Н) м.ч. Приклад 4 Етил 4-(4-ціанофеніл)-6-метил-2-оксо-1-[4фторфеніл]-1,2,3,4-тетрагідро-5піримідинкарбоксилат 154мг (1,0ммоль) N-[4-фторфеніл]сечовини, 101мг (0,77ммоль) 4-ціано-бензальдегіду і 100мг (0,77ммоль) етил 3-оксобутаноату суспендують в 2мл ТГФ і додають каталітичну кількість 31 концентрованої хлорводневої кислоти. Суміш перемішують при кип'ятінні із зворотнім холодильником протягом 18 годин. Після охолодження до кімнатної температури, розчинник видаляють у вакуумі і залишок очищають за допомогою колонкової хроматографії на силікагелі використовуючи циклогексан/етилацетат як елюент. Вихід: 40мг (14%) 1 Н-ЯМР (200МГц, ДМСО-d6): δ=1,1 (т, 3Н); 2,0 (с, 3Н); 4,0 (к, 2Н); 5,3 (д, 1Н); 7,3 (м, 4Н); 7,5 (м, 2Н); 7,9 (м, 2Н); 8,3 (д, 1Н) м.ч. Приклад 5 Етил 4-(4-ціанофеніл)-6-метил-2-оксо-1-[3хлорфеніл]-1,2,3,4-тетрагідро-5піримідинкарбоксилат 170мг (1,0ммоль) N-[3-хлорфент]сечовини, 100мг (0,77ммоль) 4-ціано-бензальдегіду і 100мг (0,77ммоль) етил 3-оксобутаноату суспендують в 2мл ТГФ і додають каталітичну кількість концентрованої хлорводневої кислоти. Суміш перемішують при кип'ятінні із зворотнім холодильником протягом 18 годин. Після охолодження до кімнатної температури, розчинник видаляють у вакуумі і залишок очищають за допомогою колонкової хроматографії на силікагелі використовуючи циклогексан/етилацетат як елюент. Вихід: 13мг (4%) 1 Н-ЯМР (200МГц, ДMCO-d6): δ=1,1 (т, 3Н); 2,1 (с, 3Н); 4,0 (к, 2Н); 5,3 (д, 1Н); 7,2 (м, 1Н); 7,4 (м, 3Н); 7,5 (м, 2Н); 7,9 (м, 2Н); 8,3 (д, 1Н) м.ч. Приклад 6 (1S)-2-Метокси-1-метил-2-оксоетил 4-(4ціанофеніл)-6-метил-2-оксо-1-[3-(трифторметил)феніл]-1,2,3,4-тетрагідро-5піримідинкарбоксилат 200мг (0,98ммоль) N-[3(трифторметил)феніл]сечовини, 129мг (0,98ммоль) 4-ціанобензальдегіду, 92мг (0,49ммоль) (1S)-2-метокси-1-метил-2-оксоетил 3оксобутаноату і 295мг етилового естеру поліфосфорної кислоти суспендують в 3мл ТГФ. Суміш перемішують при кип'ятінні із зворотнім 82074 32 холодильником протягом 18 годин. Після охолодження до кімнатної температури, розчинник видаляють у вакуумі і залишок очищають за допомогою колонкової хроматографії на силікагелі використовуючи циклогексан/етилацетат як елюент. Одержують суміш діастереомерів. Вихід: 96мг (40%) 1 Н-ЯМР (200МГц, ДMCO-d6): δ=1,3 (д, 3Н); 1,4 (д, 3Н); 2,0 (с, 3Н+3Н); 3,6 (с, 3Н); 3,6 (с, 3Н); 5,0 (м, 1Н+1Н); 5,4 (м, 1Н+1Н); 7,6-7,9 (м, 8Н+8Н); 8,4 (м, 1Н+1Н) м.ч. 4-{6-Метил-5-(4-морфолінілкарбоніл)-2-оксо-1[3-(трифторметил)феніл]-1,2,3,4-тетрагідро-4піримідиніл}бензонітрил 150мг (0,73ммоль) N-[3(трифторметил)феніл]сечовини, 96мг (0,73ммоль) 4-ціанобензальдегіду, 63мг (0,37ммоль) 4-(4морфолініл)-4-оксо-2-бутанону і 220мг етилового естеру поліфосфорної кислоти суспендують в 3мл ТГФ. Суміш перемішують при кип'ятінні із зворотнім холодильником протягом 18 годин. Після охолодження до кімнатної температури, розчинник видаляють у вакуумі і залишок очищають за допомогою колонкової хроматографії на силікагелі використовуючи дихлорметан/метанол як елюент. Вихід: 28мг (16%) 1 Н-ЯМР (300МГц, ДМСО-d6): δ=1,5 (с, 3Н); 3,1 (м, 4Н); 3,6 (м, 4Н); 5,3 (ш с, 1Н); 7,6 (м, 2Н); 7,7 (м, 1Н); 7,8 (м, 2Н); 7,9 (м, 2Н); 8,0 (ш с, 1Н) м.ч. Приклад 8 4-(4-Ціанофеніл)-N,N-діетил-6-метил-2-оксо-1[3-(трифторметил)феніл]-1,2,3,4-тетрагідро-5піримідинкарбоксамід 200мг (0,98ммоль) N-[3(трифторметил)фент]сечовини, 128мг (0,98ммоль) 4-ціанобензальдегіду, 77мг (0,49ммоль) 4-(4діетиламіно)-4-оксо-2-бутанону і 295мг етилового естеру поліфосфорної кислоти суспендують в 3мл ТГФ. Суміш перемішують при кип'ятінні із зворотнім холодильником протягом 18 годин. Після охолодження до кімнатної температури, розчинник видаляють у вакуумі і залишок очищають за допомогою колонкової хроматографії 33 82074 34 на силікагелі використовуючи дихлорметан/метанол як елюент. Вихід: 106мг (47%) 1 Н-ЯМР (300МГц, ДMCO-d6): δ=0,9 (м, 6Н); 3,1 (м, 4Н); 5,2 (ш с, 1Н); 7,6 (м, 2Н); 7,7 (м, 1Н); 7,8 (м, 2Н); 7,9 (м, 2Н); 8,0 (ш с, 1Н) м.ч. Приклад 9 6-Аміно-4-(4-ціанофеніл)-2-оксо-1-[3(трифторметил)феніл]-1,2,3,4-тетрагідро-5піримідинкарбонітрил 400мг (1,97ммоль) N-[3(трифторметил)феніл]сечовини, 199мг (1,51ммоль) 4-ціанобензальдегіду і 100мг (1,51ммоль) малононітрилу суспендують в 2мл ТГФ і додають каталітичну кількість концентрованої хлорводневої кислоти. Суміш перемішують при кип'ятінні із зворотнім холодильником протягом 18 годин. Після охолодження до кімнатної температури, розчинник видаляють у вакуумі і залишок очищають за допомогою колонкової хроматографії на силікагелі використовуючи дихлорметан/метанол як елюент. Вихід:4мг(1%) 1 Н-ЯМР (400МГц, ДМСО-d6): δ=5,2 (д, 1Н); 6,0 (с, 2Н); 7,6 (м, 3Н); 7,7 (м, 2Н); 7,8 (м, 1Н); 7,9 (м, 2Н) 8,4 (д, 1Н) м.ч. Приклад 10 Етил 4-(4-ціанофеніл)-3-форміл-6-метил-2оксо-1-[3-(трифторметил)феніл]-1,2,3,4-тетрагідро5-піримідинкарбоксилат 100мг (0,23ммоль) Прикладу 1 розчиняють в 1мл диметилформаміду і додають 35,7мг (0,23ммоль) фосфорилхлориду. Реакційну суміш перемішують при 70°С протягом двох годин. Після охолодження до кімнатної температури, продукт виділяють за допомогою препаративної ВЕРХ. Вихід: 43мг (41%) 1 Н-ЯМР (300МГц, ДMCO-d6): δ=1,1 (т, 3H); 2,1 (с, 3Н); 4,1 (к, 2Н); 6,4(с, 1Н); 7,6 (м, 2Н); 7,7 (м, 1Н); 7,8 (м, 1Н); 7,9 (м, 4Н); 9,2 (с, 1Н) м.ч. Приклад 11 4-(4-Ціанофеніл)-6-метил-2-оксо-1-[3(трифторметил)феніл]-1,2,3,4-тетрагідро-5піримідинкарбонова кислота 3г (7ммоль) Прикладу 1 розчиняють в суміші 50мл води і 100мл 5% КОН в етанолі. Реакційну суміш перемішують при кімнатній температурі протягом 18 годин. Розчинник видаляють у вакуумі і залишок очищають за допомогою колонкової хроматографії на силікагелі використовуючи дихлорметан/метанол як елюент. Вихід: 1,27г (45%) 1 Н-ЯМР (300МГц, ДMCO-d6): δ=2,0 (с, 3Н); 5,4 (д, 1Н); 7,6 (м, 1Н); 7,6 (м, 2Н); 7,7 (м, 1Н); 7,8 (м, 1Н); 7,9 (м, 3Н); 8,3 (д, 1Н); 12,5 (с, 1Н) м.ч. Приклад 12 4-(4-Ціанофеніл)-6-метил-2-оксо-N-пропіл-1-[3(трифторметил)феніл]-1,2,3,4-тетрагідро-5піримідинкарбоксамід 40мг (0,1ммоль) Прикладу 11 розчиняють в 2мл диметилформаміду, додають 7мг (0,11ммоль) н-пропіламіну, 15мг (0,11ммоль) гідрату 1-гідрокси1Н-бензотриазолу і 12мг (0,1ммоль) 4диметиламінопіридину. Реакційну суміш перемішують при 0°С, потім додають 21мг (0,11ммоль) гідрохлориду 1-(3диметиламінопропіл)-3-етилкарбодііміду. Реакційну суміш перемішують при кімнатній температурі протягом 18 годин, потім додають воду і етилацетат. Органічну фазу промивають насиченим водним KHSO4, водою і насиченим водним розчином хлориду натрію, сушать над сульфатом натрію і упарюють до суха у вакуумі. Якщо необхідно, продукт надалі очищають за допомогою колонкової хроматографії або препаративної ВЕРХ. Вихід: 29мг (66%) 1 Н-ЯМР (300МГц, ДMCO-d6): δ=0,7 (т, 3Н); 1,3 (секс, 2Н); 1,7 (с, 3Н); 3,0 (к, 2Н); 5,4 (д, 1 N); 7,6 (м, 3Н); 7,7 (м, 2Н); 7,8 (м, 2Н); 7,9 (м, 1Н); 8,1 (д, 1Н) м.ч. Приклад 13 4-(4-Ціанофеніл)-N-(2-метоксиетил)-6-метил-2оксо-1-[3-(трифторметил)феніл]-1,2,3,4-тетрагідро5-піримідинкарбоксамід 35 82074 36 Етил 3-ацетил-4-(4-ціанофеніл)-6-метил-2оксо-1-[3-(трифторметил)феніл]-1,2,3,4-тетрагідро5-піримідинкарбоксилат 48мг (0,12ммоль) Прикладу 11 розчиняють в 2мл диметилформаміду, додають 10мг (0,13ммоль) 2-метоксиетиламіну, 18мг (0,13ммоль) гідрату 1-гідрокси-1Н-бензотриазолу і 15мг (0,12ммоль) 4-диметиламінопіридину. Реакційну суміш перемішують при 0°С, потім додають 25мг (0,13ммоль) гідрохлориду 1-(3диметиламінопропіл)-3-етилкарбодііміду. Реакційну суміш перемішують при кімнатній температурі протягом 18 годин, потім додають воду і етилацетат. Органічну фазу промивають насиченим водним KHSO4, водою і насиченим водним розчином хлориду натрію, сушать над сульфатом натрію і упарюють до суха у вакуумі. Якщо необхідно, продукт надалі очищають за допомогою колонкової хроматографії або препаративної ВЕРХ. Вихід: 22мг (40%) 1 Н-ЯМР (300МГц, ДМСО-d6): δ=1,7 (с, 3Н); 3,2 (с, 3Н); 3,3 (м, 4Н); 5,4 (д, 1Н); 7,6 (м, 3Н); 7,7 (м, 3Н); 7,9 (м, 2Н); 8,1 (м, 1Н) м.ч. Приклад 14 Етил 4-(4-ціанофеніл)-3,6-диметил-2-оксо-1-[3(трифторметил)феніл]-1,2,3,4-тетрагідро-5піримідинкарбоксилат 100мг (0,23ммоль) Прикладу 1 додають до суспензії 12мг (0,28ммоль) 60% гідриду натрію (в мінеральному маслі) в 2мл ТГФ. Суміш перемішують при кімнатній температурі протягом двох годин. Потім додають 91мг (1,16ммоль) ацетилхлориду і суміш перемішують при кімнатній температурі протягом ще 2 годин. Потім додають воду і етилацетат і органічну фазу промивають водою і насиченим водним розчином хлориду натрію, сушать над сульфатом натрію і упарюють до суха у вакуумі. Якщо необхідно, продукт надалі очищають за допомогою колонкової хроматографії або препаративної ВЕРХ. Вихід: 93мг (85%) 1 Н-ЯМР (200МГц, ДMCO-d6): δ=1,2 (т, 3Н); 2,1 (с, 3Н); 2,5 (с, 3Н); 4,2 (м, 2Н); 6,7 (с, 1Н); 7,4 (м, 1Н); 7,5 (м, 2Н); 7,6 (м, 1Н); 7,7 (м, 1Н); 7,8 (м, 1Н); 7,9 (м, 2Н) м.ч. Приклад 16 Діетил 6-(4-ціанофеніл)-4-метил-2-оксо-3-[3(трифторметил)феніл]-3,6-дигідро-1,5 (2Н)піримідиндикарбоксилат 89мг (0,21ммоль) Прикладу 1 додають до суспензії 12,4мг (0,31ммоль) 60% гідриду натрію (в мінеральному маслі) в 2мл ТГФ. Суміш перемішують при кімнатній температурі протягом двох годин. Потім додають 26мг (0,21ммоль) диметилсульфату і суміш перемішують при кімнатній температурі протягом ще 2 годин. Потім додають воду і етилацетат і органічну фазу промивають водою і насиченим водним розчином хлориду натрію, сушать над сульфатом натрію і упарюють до суха у вакуумі. Якщо необхідно, продукт надалі очищають за допомогою колонкової хроматографії або препаративної ВЕРХ. Вихід: 85мг (93%) 1 Н-ЯМР (200МГц, ДMCO-d6): δ=1,1 (т, 3Н); 2,0 (с, 3Н); 2,8 (с, 3Н); 4,0 (к, 2Н); 5,5 (с, 1Н); 7,6 (м, 3Н); 7,7 (м, 1Н); 7,8 (м, 2Н); 7,9 (м, 2Н) м.ч. Приклад 15 100мг (0,23ммоль) Прикладу 1 додають до суспензії 12мг (0,28ммоль) 60% гідриду натрію (в мінеральному маслі) в 2мл ТГФ. Суміш перемішують при кімнатній температурі протягом двох годин. Потім додають 126мг (1,16ммоль) етил хлоридокарбонату і суміш перемішують при кімнатній температурі протягом ще 2 годин. Потім додають воду і етилацетат і органічну фазу промивають водою і насиченим водним розчином хлориду натрію, сушать над сульфатом натрію іупарюють до суха у вакуумі. Якщо необхідно, продукт надалі очищають за допомогою колонкової хроматографії або препаративної ВЕРХ. Вихід: 92мг (79%) 1 Н-ЯМР (200МГц, ДМСО-d6): δ=1,2 (т, ЗН; т, 3Н); 2,1 (с, 3Н); 4,2 (м, 2Н); 4,3 (к, 2Н); 6,4 (с, 1Н); 7,4 (м, 1Н); 7,5 (м, 3Н); 7,7 (м, 1Н); 7,8 (м, 1Н); 7,9 (м, 2Н) м.ч. 37 82074 38 Приклад 17 Етил 4-(4-ціанофеніл)-6-метил-1-(3метилфеніл)-2-оксо-1,2,3,4-тетрагідро-5піримідинкарбоксилат 150мг (1,0ммоль) N-[3-метилфеніл]сечовини, 101мг (0,77ммоль) 4-ціано-бензальдегіду і 100мг (0,77ммоль) етил 3-оксобутаноату суспендують в 2мл ТГФ і додають каталітичну кількість концентрованої хлорводневої кислоти. Суміш перемішують при кип'ятінні із зворотнім холодильником протягом 18 годин. Після охолодження до кімнатної температури, розчинник видаляють у вакуумі і залишок очищають за допомогою колонкової хроматографії на силікагелі використовуючи циклогексан/етилацетат як елюент. Вихід: 8мг (3%) 1 Н-ЯМР (200МГц, ДМСО-d6): δ=1,1 (т, 3Н); 2,0 (с, 3Н); 2,3 (с, 3Н); 4,0 (к, 2Н); 5,3 (д, 1Н); 7,0 (м, 2Н); 7,2 (м, 1Н); 7,3 (м, 1Н); 7,6 (м, 2Н); 7,9 (м, 2Н); 8,2 (д, 1Н) м.ч. Приклад 18 Етил 4-(4-хлорфеніл)-6-метил-2-оксо-1-[3(трифторметил)феніл]-1,2,3,4-тетрагідро-5піримідинкарбоксилат 204мг (1,0ммоль) N-[3(трифторметил)фент]сечовини, 108мг (0,77ммоль) 4-хлорбензальдегіду і 100мг (0,77ммоль) етил 3оксобутаноату суспендують в 2мл ТГФ і додають каталітичну кількість концентрованої хлорводневої кислоти. Суміш перемішують при кип'ятінні із зворотнім холодильником протягом 18 годин. Після охолодження до кімнатної температури, розчинник видаляють у вакуумі і залишок очищають за допомогою колонкової хроматографії на силікагелі використовуючи циклогексан/етилацетат як елюент. Вихід: 29мг (9%) 1 Н-ЯМР (200МГц, ДМСО-d6): δ=1,1 (т, 3Н); 2,0 (с, 3Н); 4,0 (к, 2Н); 5,3 (д, 1Н); 7,5 (м, 5Н); 7,6 (м, 1Н); 7,7 (м, 2Н); 8,3 (д, 1Н) м.ч. Приклад 19 Етил 6-(бромметил)-4-(4-ціанофеніл)-2-оксо-1[3-(трифторметил)феніл]-1,2,3,4-тетрагідро-5піримідинкарбоксилат 3г (7ммоль) Прикладу 1 розчиняють в 100мл хлороформу. При 0°С, по краплям додають 558мг (3,48ммоль) брому. Суміш перемішують при кімнатній температурі протягом двох годин, потім розчинник видаляють у вакуумі. Залишок очищають за допомогою колонкової хроматографії на силікагелі використовуючи циклогексан/етилацетат як елюент. Вихід: 3,2г (90%) 1 Н-ЯМР (200МГц, ДMCO-d6): δ=1,1 (т, 3Н); 4,0 (к, 2Н, д, 1Н); 4,6 (ш д, 1Н); 5,4 (д, 1Н); 7,6 (м, 3Н); 7,7 (м, 2Н); 7,8 (м, 1Н); 7,9 (м, 2Н); 8,6 (д, 1Н) м.ч. Приклад 20 Етил 4-(4-ціанофеніл)-6-[(діетиламіно)метил]2-оксо-1-[3-(трифторметил)феніл]-1,2,3,4тетрагідро-5-піримідинкарбоксилат 20мг (0,04ммоль) Прикладу 19 розчиняють в 2мл ацетону і додають 8мг (0,10ммоль) діетиламіну. Суміш перемішують при кімнатній температурі протягом 18 годин, потім розчинник видаляють у вакуумі. Залишок очищають за допомогою препаративної ВЕРХ. Вихід: 15мг(75%) 1 Н-ЯМР (300МГц, ДМСО-d6): δ=0,6 (т, 6Н); 1,1 (т, 3Н); 2,0 (м, 2Н); 2,2 (м, 2Н); 3,1 (ш д, 1Н); 3,9 (ш д, 1Н); 4,1 (к, 2Н); 5,4 (д, 1Н); 7,5 (м, 1Н); 7,6 (м, 4Н); 7,7 (м, 1Н); 7,9 (м, 2Н) м.ч. Приклад 21 Етил 6-(анілінометил)-4-(4-ціанофеніл)-2-оксо1-[3-(трифторметил)феніл]-1,2,3,4-тетрагідро-5піримідинкарбоксилат 50мг (0,10ммоль) Прикладу 19 розчиняють в 2мл ацетону і додають 18мг (0,20ммоль) аніліну. Суміш перемішують при кімнатній температурі протягом 18 годин, потім розчинник видаляють у 39 вакуумі. Залишок очищають за допомогою препаративної ВЕРХ. Вихід: 28мг (55%) 1 Н-ЯМР (300МГц, ДMCO-d6): δ=1,1 (т, 3Н); 3,6 (д/д, 1Н); 4,1 (к, 2Н); 4,4 (д/д, 1Н); 5,4 (м, 2Н); 6,2 (м, 2Н); 6,5 (м, 1Н); 6,9 (м, 2Н); 7,6 (м, 6Н); 7,9 (м, 2Н); 8,4 (д, 1Н) м.ч. Приклад 22 (+)-Етил 4-(4-ціанофеніл)-6-метил-2-оксо-1-[3(трифторметил)феніл]-1,2,3,4-тетрагідро-5піриіиідинкарбоксилат Енантіомери Прикладу 1 розділяють за допомогою препаративної ВЕРХ на хіральній фазі: 100мг сполуки розчиненої в 1,5мл етилацетату, колонка KBD 8361 (хіральний силікагелевий селектор на основі мономеру N-метакрилоїл-Lлейцин-1-ментиламіду, [див. ЕР-А-379 917]), 250мм´20мм, елюент етилацетат, потік 25мл/хв., температура 23°С, ін'єкційний об'єм 2500мкл, детектування 254нм. 1 Н-ЯМР (300МГц, ДMCO-d6): δ=1,1 (т, 3Н); 2,0 (с, 3Н); 4,0 (к, 2Н); 5,4 (д, 1Н); 7,6 (м, 3Н); 7,7 (м, 2Н); 7,8 (м, 1Н); 7,9 (м, 2Н); 8,4 (д, 1Н) м.ч. [α]20=+3,3° (l=589нм, дихлорметан, с=535,0мг/100мл) Приклад 23 (-)-Етил 4-(4-ціанофеніл)-3,6-диметил-2-оксо1-[3-(трифторметил)феніл]-1,2,3,4-тетрагідро-5піримідинкарбоксилат 100мг (0,23ммоль) Прикладу 22 додають до суспензії 14мг (0,35ммоль) 60% гідриду натрію (в мінеральному маслі) в 2мл ТГФ. Суміш перемішують при кімнатній температурі протягом двох годин. Потім додають 29мг (0,23ммоль) диметилсульфату і суміш перемішують при кімнатній температурі протягом ще 2 годин. Потім додають воду і етилацетат, органічну фазу промивають водою і насиченим водним розчином хлориду натрію, сушать над сульфатом натрію і упарюють до суха у вакуумі. Продукт очищають за допомогою колонкової хроматографії на силікагелі використовуючи циклогексан/етилацетат як елюент. Вихід: 76мг (74%)82074 40 1 Н-ЯМР (200МГц, ДМСО-d6): δ=1,1 (т, 3Н); 2,0 (с, 3Н); 2,8 (с, 3Н); 4,0 (к, 2Н); 5,5 (с, 1Н); 7,6 (м, 3Н); 7,7 (м, 1Н); 7,8 (м, 2Н); 7,9 (м, 2Н) м.ч. [α]20=-18,1° (l=589нм, дихлорметан, с=530,0мг/100мл) Приклад 24 Етил 4-(6-ціано-3-піридиніл)-6-метил-2-оксо-1[3-(трифторметил)феніл]-1,2,3,4-тетрагідро-5піримідинкарбоксилат До розчину, що перемішується, Прикладу 3А (76мг, 0,58ммоль) в тетрагідрофурані (5мл) додають етил 3-оксобутаноат (75мг, 0,58ммоль), N-[3-(трифторметил)феніл]сечовину (118мг, 0,58ммоль) і етиловий естер поліфосфорної кислоти (200мг; свіжоодержаний згідно з методикою [Cava et al., J. Org. Спем. 1969, 34, 2665]). Реакційну суміш кип'ятять із зворотнім холодильником протягом двох днів (48 годин) після чого розчин розводять ДМСО (2мл) і очищають за допомогою препаративної ВЕРХ. Фракції з продуктом концентрують у вакуумі і знову хроматографують на силікагелі використовуючи циклогексан і етилацетат як елюент. Вихід: 92мг (35% від теор.) МС (ЕСІпоз): m/z=431 (М+Н)+ ВЕРХ (спосіб 4)=4,63хв. 1 Н-ЯМР (300МГц, ДMCO-d6): δ=8,76 (с, 1Н), 8,36 (д, 1Н), 8,16-8,00 (м, 2Н), 7,83-7-74 (м, 2Н), 7,75-7,58 (м, 2Н), 5,47 (д, 1Н), 4,03 (квартет, 2Н), 2,06 (с, 3Н), 1,08 (т, 3Н) м.ч. Приклад 25 4-{5-(1Н-Імідазол-1-ілкарбоніл)-6-метил-2оксо-1-[3-(трифторметил)феніл]-1,2,3,4-тетрагідро4-піримідиніл}бензонітрил До розчину 501мг (1,25ммоль) сполуки Прикладу 11 в 5мл сухого диметилформаміду додають 567мг (3,5ммоль) Ν,Νкарбонілдіімідазолу. Після чого реакційну суміш залишають стояти протягом ночі, розчинник упарюють у вакуумі. Залишок переносять в етилацетат і промивають водою і насиченим водним розчином хлориду натрію. Після 41 висушування над сульфатом магнію розчинник упарюють у вакуумі. Вихід: 500мг (88,6% від теор.) МС (El): m/z=452 (М+Н)+ 1 Н-ЯМР (200МГц, ДМСО-d6): δ=1,40 (д, 3Н), 5,5 (д, 1Н), 7,0 (с, 1Н), 7,55-8,0 (м, 9Н), 8,4 (с, 1Н), 8,45 (д, 1Н) м.ч. Приклад 26 2-Гідроксиетил 4-(4-ціанофеніл)-6-метил-2оксо-1-[3-(трифторметил)феніл]-1,2,3,4-тетрагідро5-піримідинкарбоксилат 45,1мг (0,1ммоль) сполуки Прикладу 25 додають до 0,5мл етиленгліколю. Реакційну суміш перемішують приблизно при 100°С протягом 1 години. Після охолодження, реакційну суміш очищають за допомогою препаративної ВЕРХ (колонка: Agilent Zorbax Extend C18 20мм´50мм, 5мкм; розчинник А: ацетонітрил, розчинник В: вода +0,1% конц. аміаку; градієнт: 0хв. 10% А, 2хв. 10% А, 6хв. 90% А, 7хв. 90% А, 7,1хв. 10% А, 8хв. 10% А; довжина хвилі: 220нм; ін'єкційний об'єм: приблизно 500мкл; кількість ін'єктувань: 1). Фракції, що містять продукт, об'єднують і концентрують у вакуумі. Вихід: 22мг (49,4% від теор.) MC(EI):m/z=446(M+H)+ 1 Н-ЯМР (300МГц, ДМСО-d6): δ=2,05 (д, 3Н), 3,5 (квартет, 2Н), 3,95-4,15 (м, 2Н), 4,75 (т, 1Н), 5,45 (д, 1Н), 7,55-7,75 (м, 5Н), 7,75 (д, 1Н), 7,85 (д, 2Н), 8,35 (д, 1Н) м.ч. Приклад 27 2-(Диметиламіно)етил 4-(4-ціанофеніл)-6метил-2-оксо-1-[3-(трифторметил)феніл]-1,2,3,4тетрагідро-5-піримідинкарбоксилат s 45,1мг (0,1ммоль) сполуки Прикладу 25 додають до 0,5мл 2-(диметиламіно)етанолу. Реакційну суміш перемішують приблизно при 100°С протягом 1 години. Після охолодження, реакційну суміш очищають за допомогою препаративної ВЕРХ (колонка: Agilent Zorbax Extend С18 20мм´50мм, 5мкм; розчинник А: ацетонітрил, розчинник В: вода +0,1% конц. аміаку; градієнт: 0хв. 10% А, 2хв. 10% А, 6хв. 90% А, 7хв. 90% А, 7,1хв. 10% А, 8хв. 10% А; довжина 82074 42 хвилі: 220нм; ін'єкційний об'єм: приблизно; 500мкл; кількість ін'єктувань: 1). Фракції, що містять продукт, об'єднують і концентрують у вакуумі. Вихід: 24мг (50,8% від теор.) МС (El): m/z=473 (М+Н)+ 1 Н-ЯМР (300МГц, ДМСО-d6): δ=2,05 (д, 3Н), 2,1 (с, 6Н), 2,4 (м, 2Н), 4,1 (м, 2Н), 5,35 (д, 1Н), 7,55 (д, 1Н), 7,6 (д, 2Н), 7,7 (м, 2Н), 7,8 (д, 1Н), 7,85 (д, 2Н), 8,35 (д, 1Н) м.ч. Приклад 28 2-(4-Піридиніл)етил 4-(4-ціанофеніл)-6-метил2-оксо-1-[3-(трифторметил)феніл]-1,2,3,4тетрагідро-5-піримідинкарбоксилат 45,1мг (0,1ммоль) сполуки Прикладу 25 додають до 0,5мл 2-(4-піридиніл)етанолу. Реакційну суміш перемішують приблизно при 100°С протягом 1 години. Після + охолодження, реакційну суміш очищають за допомогою препаративної ВЕРХ (колонка: Agilent Zorbax Extend C18 20мм´50мм, 5мкм; розчинник А: ацетонітрил, розчинник В: вода +0,1% конц. аміаку; градієнт: 0хв. 10% А, 2хв. 10% А, 6хв. 90% А, 7хв. 90% А, 7,1хв. 10% А, 8хв. 10% А; довжина хвилі: 220нм; ін'єкційний об'єм: приблизно 500мкл; кількість ін'єктувань: 1). Фракції, що містять продукт, об'єднують і концентрують у вакуумі. Вихід: 17мг (33,5% від теор.) МС (El): m/z=507 (М+Н)+ 1 Н-ЯМР (300МГц, ДMCO-d6): δ=2,0 (д, 3Н), 2,9 (т, 2N), 4,3 (т, 2N), 5,25 (д, 1Н), 7,15 (д, 2Н), 7,45 (д, 2Н), 7,5 (д, 1Н), 7,65 (т, 2Н), 7,8 (м, 3Н), 8,35 (д, 1Н), 8,4 (д, 2Н) м.ч. Приклад 29 2-(2-Піридиніл)етил 4-(4-ціанофеніл)-6-метил2-оксо-1-[3-(трифторметил)феніл]-1,2,3,4тетрагідро-5-піримідинкарбоксилат 45,1мг (0,1ммоль) сполуки Прикладу 25 додають до 0,5мл 2-(2-піридиніл)етанолу. Реакційну суміш перемішують приблизно при 100°С протягом 1 години. Після охолодження, реакційну суміш очищають за допомогою препаративної ВЕРХ (колонка: Agilent Zorbax Extend C18 20мм´50мм, 5мкм; розчинник А: 43 ацетонітрил, розчинник В: вода +0,1% конц. аміаку; градієнт: 0хв. 10% А, 2хв. 10% А, 6хв. 90% А, 7хв. 90% А, 7,1хв. 10% А, 8хв. 10% А; довжина хвилі: 220нм; ін'єкційний об'єм: приблизно 500мкл; кількість ін'єктувань: 1). Фракції, що містять продукт, об'єднують і концентрують у вакуумі. Вихід: 22мг (43,4% від теор.) МС (El): m/z=507 (М+Н)+ 1 Н-ЯМР (300МГц, ДМСО-d6): δ=2,0 (д, 3Н), 3,0 (т, 2Н), 4,4 (т, 2Н), 5,25 (д, 1Н), 7,15-7,25 (м, 2Н), 7,4 (д, 2Н), 7,5 (д, 1Н), 7,6-7,75 (м, 3Н), 7,8 (м, 3Н), 8,3 (д, 1Н), 8,45 (д, 1Н) м.ч. Приклад 30 2-(2-Оксо-1-піролідиніл)етил 4-(4-ціанофеніл)6-метил-2-оксо-1-[З-(трифторметил)-феніл]1,2,3,4-тетрагідро-5-піримідинкарбоксилат 45,1мг (0,1ммоль) сполуки Прикладу 25 додають до 0,5мл 1-(2-гідроксиетил)-2піролідинону. Реакційну суміш перемішують приблизно при 100°С протягом 1 години. Після охолодження, реакційну суміш очищають за допомогою препаративної ВЕРХ. (колонка: Agilent Zorbax Extend C18 20мм´50мм, 5мкм; розчинник А: ацетонітрил, розчинник В: вода +0,1% конц. аміаку; градієнт: 0хв. 10% А, 2хв. 10% А, 6хв. 90% А, 7хв. 90% А, 7,1хв. 10% А, 8хв. 10% А; довжина хвилі: 220нм; ін'єкційний об'єм: приблизно 500мкл; кількість ін'єктувань: 1). Фракції, що містять продукт, об'єднують і концентрують у вакуумі. Вихід: 25мг (48,8% від теор.) MC (EI): m/z=513 (M+H)+ 1 Н-ЯМР (300МГц, ДМСО-d6): δ=1,8 (квінтет, 2Н), 2,0 (д, 3Н), 2,1 (т, 2N), 3,2 (т, 2N), 3,4 (т, 2Н), 4,0-4,2 (м, 2Н), 5,35 (д, 1Н), 7,55 (д, 1Н), 7,6 (д, 2Н), 7,7 (т, 2Н), 7,8 (д, 1Н), 7,9 (д, 2Н), 8,4 (д, 1Н) м.ч. Аналогічно методикам для Прикладів 14-16, одержують наступні сполуки: 82074 44 45 82074 46 Аналогічно методикам для Прикладів 6-8, одержують наступні сполуки: 47 82074 48 допомогою колонкової хроматографії або препаративної ВЕРХ. Вихід: 78мг (85%) 1 Н-ЯМР (300МГц, ДMCO-d6): δ=1,1 (т, 3Н); 2,0 (с, 3Н); 3,4 (м, 4Н); 3,6 (м, 4Н); 3,7 (д, 1Н); 4,1 (м, 2Н); 4,5 (д, 1Н); 5,5 (с, 1Н); 7,6 (м, 5Н); 7,8 (м, 1Н); 7,9 (м, 2Н) м.ч. Аналогічно методикам для Прикладу 59, одержують наступні сполуки: Аналогічно методикам для Прикладів 5-8, одержують наступні сполуки: Приклад 59 Етил 4-(4-ціанофеніл)-6-метил-3-[2-(4морфолініл)-2-оксоетил]-2-оксо-1-[3(трифторметил)феніл]-1,2,3,4-тетрагідро-5піримідинкарбоксилат 80мг (0,16ммоль) Прикладу 44 розчиняють в 2мл диметилформаміду, додають 16мг (0,18ммоль) морфоліну, 24мг (0,18ммоль) гідрату 1-гідрокси-1Н-бензотриазолу і 20мг (0,16ммоль) 4диметиламінопіридину. Реакційну суміш перемішують при 0°С, потім додають 35мг (0,18ммоль) гідрохлориду 1-(3диметиламінопропіл)-3-етилкарбодііміду. Реакційну суміш перемішують при кімнатній температурі протягом 18 годин, потім додають воду і етилацетат. Органічну фазу сушать над сульфатом натрію і упарюють до суха у вакуумі. Якщо необхідно, продукт надалі очищають за 49 82074 50 години, потім додають воду і етилацетат. Органічну фазу сушать над сульфатом натрію і упарюють до суха у вакуумі. Продукт надалі очищають за допомогою препаративної ВЕРХ. Вихід: 55мг (28% від теор.) 1 Н-ЯМР (200МГц, ДMCO-d6): δ=1,8 (с, 3Н); 5,4 (д, 1Н); 7,2 (ш с, 1Н); 7,4 (ш с, 1Н); 7,6 (м, 5Н); 7,7 (м, 1Н); 7,9 (м, 2Н); 8,1 (д, 1Н) м.ч. Приклад 71 (+)-4-(4-Ціанофеніл)-6-метил-2-оксо-1-[3(трифторметил)феніл]-1,2,3,4-тетрагідро-5піримідинкарбонова кислота Приклад 70 4-(4-Ціанофеніл)-6-метил-2-оксо-1-[3(трифторметил)феніл]-1,2,3,4-тетрагідро-5піримідинкарбоксамід 200мг (0,5ммоль) Прикладу 11 розчиняють в 5мл тетрагідрофурану і додають 6мг (0,05ммоль) 4-N,N-диметиламінопіридину, 77мг (0,6ммоль) Ν,Ν-діізопропілетиламіну і 115мг (0,6ммоль) гексафторфосфату бензотриазол-1-ілокситрис(піролідино)фосфонію. Реакційну суміш перемішують при кімнатній температурі протягом 15 хвилин, потім додають 5мл (2,5ммоль) аміаку (як 0,5Μ розчин в діоксані). Реакційну суміш перемішують при кімнатній температурі протягом 1 Енантіомери Прикладу 11 розділяють за допомогою препаративної ВЕРХ на хіральній фазі [колонка KBD 8361 (хіральний силікагелевий селектор на основі мономеру N-метакрилоїл-Lлейцин-1-ментиламіду, [див. ЕР-А-379 917]), 250мм´20мм, елюент: етилацетат ® метанол ® етилацетат, потік 25мл/хв., температура 23°С, детектування 254нм]. 1 Н-ЯМР (300МГц, ДМСО-d6): δ=2,0 (с, 3Н); 5,4 (д, 1Н); 7,6 (м, 1Н); 7,6 (м, 2Н); 7,7 (м, 1Н); 7,8 (м, 1Н); 7,9 (м, 3Н); 8,3 (д, 1Н); 12,5 (с, 1Н) м.ч. [α]20=+2,5° (l=589нм, метанол, с=505мг/100мл). Приклад 72 (+)-2-Гідроксиетил 4-(4-ціанофеніл)-6-метил-2оксо-1-[3-(трифторметил)феніл]-1,2,3,4-тетрагідро5-піримідинкарбоксилат Під аргоном, 1560мг (3,89ммоль) сполуки Прикладу 71 додають до 19,6мл ДМФА. Після додавання 1,095мл (7,86ммоль) триетиламіну і 1,11мл (15,7ммоль) 2-брометанолу, реакційну суміш перемішують приблизно при 70°С протягом 8 годин. Після охолодження, реакційну суміш концентрують у вакуумі. Залишок переносять в етилацетат і промивають водою. Після висушування над сульфатом магнію, органічну фазу упарюють у вакуумі. Залишок переносять в 8мл метанолу і очищають за допомогою 51 препаративної ВЕРХ (колонка: Nucleosil 100-5 С 18 Nautilus, 20´50мм, 5мкм; розчинник А: ацетонітрил, розчинник В: вода +0,3% мурашиної кислоти; градієнт: 0хв. 10% А, 2хв. 10% А, 6хв. 90% А, 7хв. 90% А, 7,1хв. 10% А, 8хв. 10% А; довжина хвилі: 220нм; ін'єкційний об'єм: приблизно 500мкл; кількість ін'єктувань:18). Фракції, що містять продукт, об'єднують і ліофілізують. Вихід: 1290мг (74,5% від теор.) MC (EI): m/z=446(M+H)+ 1 Н-ЯМР (300МГц, ДМСО-d6): δ=2,05 (д, 3Н); 3,5 (квартет, 2Н); 3,95-4,15 (м, 2Н); 4,75 (т, 1Н); 5,45 (д, 1Н); 7,55-7,75 (м, 5Н); 7,75 (д, 1Н); 7,85 (д, 2Н); 8,35 (д, 1Н) м.ч. [α]20=+14,3° (l=589нм, метанол, с=455мг /100мл). Приклад 73 5-{5-Ацетил-6-метил-2-оксо-1-[3(трифторметил)феніл]-1,2,3,4-тетрагідро-4піримідиніл}-2-піридинкарбонітрил До розчину, що перемішується, Прикладу 3А (75мг, 0,57ммоль) в тетрагідрофурані (5мл) додають 2,4-пентандіон (57мг, 0,57ммоль), N-[3(трифторметил)феніл]сечовину (116мг, 0,57ммоль) і етиловий естер поліфосфорної кислоти (200мг) [свіжоодержаний згідно з методикою Cava et al., J. Org. Спем. 34, 2665 (1969)]. Реакційну суміш кип'ятять із зворотнім холодильником протягом 24 годин після чого розчин розводять ДМСО (2мл) і очищають за допомогою препаративної ВЕРХ. Вихід: 101мг (44% від теор.) 1 Н-ЯМР (200МГц, ДMCO-d6): δ=2,02 (с, 3Н); 2,24 (с, 3Н); 5,54 (д, 1Н); 7,52-7,90 (м, 4Н); 8,08 (д, 2Н); 8,50 (д, 1Н); 8,81 (с, 1Н) м.ч. Приклад 74 (+)-5-{5-Ацетил-6-метил-2-оксо-1-[3(трифторметил)феніл]-1,2,3,4-тетрагідро-4піримідиніл}-2-піридинкарбонітрил 82074 52 Енантіомери Прикладу 73 розділяють за допомогою препаративної ВЕРХ на хірапьній фазі [колонка KBD 8361 (хіральний силікагелевий селектор на основі мономеру N-метакрилоїл-Lлейцин-1-ментиламіду, [див. ЕР-А-379 917]), 250мм´20мм, елюент: етилацетат ® метанол ® етилацетат, потік 25мл/хв, температура 23°С, детектування 254нм]. 1 Н-ЯМР (300МГц, CDCI 3): δ=2,06 (с, 3Н); 2,35 (с, 3Н); 5,69 (д, 1Н); 6,02 (д, 1Н); 7,29-7,50 (м, 2Н); 7,57-7,75 (м, 3Н); 7,83 (дд, 1Н); 8,74 (д, 1Н) м.ч. МС (ЕСІпоз): m/z=401 (М+Н)+ [α]20=+25,1° (δ=589нм, метанол, с=505мг /100мл). 2-(2-Піридиніл)метил 4-(4-ціанофеніл)-6метил-2-оксо-1-[3-(трифторметил)феніл]-1,2,3,4тетрагідро-5-піримідинкарбоксилат До розчину 40,1мг (0,1ммоль) сполуки Прикладу 11 в 0,4мл сухого диметилформаміду додають 48,6мг (0,3ммоль) Ν,Νкарбонілдіімідазолу. Після стояння реакційної суміші протягом години, реакційну суміш розводять водою і екстрагують ди-хлорметаном. Після висушування над сульфатом магнію, розчинник упарюють у вакуумі. До залишку додають 0,5мл (2-піридиніл)метанолу. Реакційну суміш перемішують приблизно при 100°С протягом 1 години. Після охолодження, реакційну суміш очищають за допомогою препаративної ВЕРХ (колонка: Nucleosil 100-5 С 18 Nautilus 20мм´ 50мм, 5мкм; розчинник А: ацетонітрил, розчинник В: вода + 0,1% мурашиної кислоти; градієнт: 0хв. 10% А, 2хв. 10% А, 6хв. 90% А, 7хв. 90% А, 7,1хв. 10% А, 8хв. 10% А; швидкість потоку 25мл/хв; довжина хвилі: 220нм; ін'єкційний об'єм: приблизно 550мкл; кількість ін'єктувань: 1). Фракції, що містять продукт, об'єднують і концентрують у вакуумі. Вихід: 17мг (34,5% від теор.) МС (El): m/z=493 (М+Н)+ 1 Н-ЯМР (300МГц, ДМСО-d6): δ=2,1 (д, 3Н); 5,15 (дд, 2Н); 5,45 (д, 1Н); 7,05 (д, 1Н); 7,3 (дд, 1Н); 7,57,85 (м, 9Н); 8,35 (д, 1Н); 8,5 (д, 2Н) м.ч. Приклад 76 2-(3-Піридиніл)етил 4-(4-ціанофеніл)-6-метил2-оксо-1-[3-(трифторметил)феніл]-1,2,3,4тетрагідро-5-піримідинкарбоксилат 53 82074 54 етилацетатом. Цей останній екстракт сушать над сульфатом магнію і упарюють у вакуумі. Залишок очищають за допомогою колонкової хроматографії на силікагелі використовуючи циклогексан/етилацетат як елюент. Вихід: 1,5г (39% від теор.) MC(EI):m/z=416 (M+H)+ 1 Н-ЯМР (300МГц, ДМСО-d6): δ=2,0 (с, 3Н); 2,8 (с, 3Н); 5,5 (д, 1Н); 7,6-7,8 (м, 6Н); 7,9 (д, 2Н); 12,6 (с, 1Н) м.ч. Аналогічно з методикою для Прикладу 76, одержують наступні сполуки: До розчину 60,2мг (0,15ммоль) сполуки Прикладу 11 в 0,57мл сухого диметилформаміду додають 72,9мг (0,45ммоль) Ν,Νкарбонілдіімідазолу. Після стояння реакційної суміші протягом години, реакційну суміш розводять водою і екстрагують етилацетатом. Після висушування над сульфатом магнію, розчинник упарюють у вакуумі. До залишку додають 185мг (1,5ммоль) 2-(3-піридил)етанолу і 20мкл (0,27ммоль) триетиламіну. Реакційну суміш перемішують протягом години при 100°С. Потім реакційну суміш розводять 0,4мл метанолу, фільтрують і очищають за допомогою препаративної . ВЕРХ (колонка: Nucleosil 100-5 С 18 Nautilus 20мм´50мм, 5мкм; розчинник А: ацетонітрил, розчинник В: вода +0,1% мурашиної кислоти; градієнт: 0хв. 10% А, 2хв. 10% А, 6хв. 90% А, 7хв. 90% А, 7,1хв. 10% А, 8хв. 10% А; швидкість потоку 25мл/хв.; довжина хвилі: 220нм; ін'єкційний об'єм: приблизно 550 мкл; кількість ін'єктувань: 1). Фракції, що містять продукт, об'єднують і концентрують у вакуумі. Вихід: 44мг (57,9% від теор.) РХ-МС (ЕІ, Спосіб 5): m/z=507 (М+Н)+, Чу=3,19хв. Приклад 77 4-(4-Ціанофеніл)-3,6-диметил-2-оксо-1-[3(трифторметил)феніл]-1,2,3,4-тетрагідро-5піримідинкарбонова кислота 4,1г (9,25ммоль) Прикладу 14 розчиняють в 100мл етанолу. До цього розчину додають 6,2мл (27,6ммоль) розчину гідроксиду калію у воді (25ваг.%). Реакційну суміш залишають стояти при кімнатній температурі протягом 18 годин. Потім додають ще 12,4мл (55,2ммоль) розчину гідроксиду калію у воді (25ваг.%) і реакційну суміш перемішують протягом 2 годин. Реакційну суміш розводять водою і екстрагують три рази етилацетатом. Водну фазу підкислюють 1N хлорводневою кислотою і екстрагують 55 82074 56 57 Приклад 102 Етил 4-(4-ціанофеніл)-1-(3,5-дихлорфеніл)-бметил-2-оксо-1,2,3,4-тетрагідро-5піримідинкарбоксилат 82074 58 30,6мг (0,15ммоль) N-[3(трифторметил)фенш]сечовини збовтують разом з 45,3мг (0,3ммоль) 3-нітробензальдегіду, 39мг (0,3ммоль) етил 3-оксобутаноату і 90мг етилового естеру поліфосфорної кислоти [свіжоодержаний згідно з методикою Cava et al., J. Org. Сhем. 34, 2665 (1969)] в 0,5мл діоксану і 0,1мл ДМФА при 80°С протягом 18 годин. Після додавання 200мкл ДМФА, реакційну суміш фільтрують і очищають за допомогою препаративної ВЕРХ (колонка: Nucleosil 100-5 С 18 Nautilus 20мм´50мм, 5мкм; розчинник А: ацетонітрил, розчинник В: вода + 0,1% мурашиної кислоти; градієнт: 0хв. 10% А, 2хв. 10% А, 6хв. 90% А, 7хв. 90% А, 7,1хв. 10% А, 8хв. 10% А; швидкість потоку 25мл/хв; довжина хвилі: 220нм; ін'єкційний об'єм: приблизно 800 мкл; кількість ін'єктувань: 1). Фракції, що містять продукт, об'єднують і концентрують у вакуумі. Вихід: 34мг (50,4% від теор.) РХ-МС (ЕІ, Спосіб 6): m/z=450 (М+Н)+, Чу=3,94хв. Аналогічно з методикою для Прикладу 102, одержують наступні сполуки: Під аргоном, 30,8мг (0,15ммоль) N-(3,5дихлорфент)сечовини перемішують разом з 39,3мг (0,3ммоль) 4-формілбензонітрилу, 39мг (0,3ммоль) етил 3-оксо-бутаноату і 90мг триметилсилілполіфосфату в 0,5мл діоксану при 80°С протягом 4 годин. Після додавання малої кількості ДМСО, реакційну суміш фільтрують і очищають за допомогою препаративної ВЕРХ (колонка: Agilent Zorbax Extend С18 20мм´50мм, 5мкм; розчинник А: ацетонітрил, розчинник В: вода +0,1% конц. вод. аміаку; градієнт: 0хв. 10% А, 2хв. 10% А, 6хв. 90% А, 7хв. 90% А, 7,1хв. 10% А, 8хв. 10% А; швидкість потоку 25мл/хв.; довжина хвилі: 220нм; ін'єкційний об'єм: приблизно 500 мкл; кількість ін'єктувань: 1). Фракції, що містять продукт, об'єднують і концентрують у вакуумі. Вихід: 38,1мг (59% від теор.) РХ-МС (ЕІ, Спосіб 7): m/z=431 (М+Н)+, Чу=4,14хв. Приклад 103 Етил 6-метил-4-(3-нітрофеніл)-2-оксо-1 -[3(трифторметил)феніл]-1,2,3,4-тетрагідро-5пїримідинкарбоксилат Приклад 108 4-(4-Ціанофеніл)-6-метил-2-оксо-1-[3(трифторметил)феніл]-1,2,3,4-тетрагідро 59 82074 60 піримідин-5-карбонової кислоти 2-ціаноетиловий естер 9,87г (48,3ммоль) N-[3(трифторметил)феніл]сечовини, 12,68г (96,68ммоль) 4-ціанобензальдегіду, 15г (96,68ммоль) (2-ціаноетил) 3-оксобутаноату і 37,5г етилового естеру поліфосфорної кислоти суспендують в 250мл ТГФ. Суміш перемішують при кип'ятінні із зворотнім холодильником протягом 18 годин. Після охолодження до кімнатної температури, розчинник видаляють у вакуумі і залишок очищають за допомогою колонкової хроматографії на силікагелі використовуючи циклогексан/етилацетат як елюент. Вихід: 25г (100% від теор.) 1 Н-ЯМР (200МГц, ДМСО-d6): δ=2,1 (с, 3Н); 2,8 (м, 2Н); 4,2 (м, 2Н); 5,4 (д, 1Н); 7,6 (м, 4Н); 7,7 (м, 2Н); 7,9 (м, 2Н); 8,5 (д, 1Н) м.ч. Приклад 109 4-(4-Ціанофеніл)-6-метил-2-оксо-1-[3(трифторметил)феніл]-1,2,3,4-тетрагідропіримідин-5-карбонітрил 0,609г (1,52ммоль) Прикладу 70 розчиняють в 60мл ТГФ і додають 1,24г (12,93ммоль) (метоксикарбонілсульфамоТл)триетиламоній-Мбетаїну. Реакційну суміш перемішують при кімнатній температурі протягом 1 години, розчинник видаляють у вакуумі і залишок очищають за допомогою колонкової хроматографії на силікагелі використовуючи суміш дихлорметан/метанол як елюент. Вихід: 249мг (43% від теор.) 1 Н-ЯМР (300МГц, ДMCO-d6): δ=1,8 (с, 3Н); 5,4 (д, 1Н); 7,7 (м, 4Н); 7,8 (м, 2Н); 8,0 (м, 2Н), 8,4 (д, 1Н) м.ч. Приклад 110 Етил 6-метил-4-(4-нітрофеніл)-2-оксо-1-[3(трифторметил)феніл]-1,2,3,4-тетрагідропіримідин5-карбоксилат 7,84г (38,4ммоль) N-[3(трифторметил)феніл]сечовини, 5,81г (38,4ммоль) 4-нітробензальдегіду, 5,0г (38,4ммоль) етил 3оксобутаноату і 15г етилового естеру поліфосфорної кислоти суспендують в 100мл ТГФ. Суміш перемішують при кип'ятінні із зворотнім холодильником протягом 18 годин. Після охолодження до кімнатної температури, розчинник видаляють у вакуумі і залишок очищають за допомогою колонкової хроматографії на силікагелі використовуючи толуол/етилацетат як елюент. Вихід: 8,75г (51 % від теор.) 1 Н-ЯМР (200МГц, ДМСО-d6): δ=1,1 (т, 3Н); 2,1 (с, 3Н); 4,0 (м, 2Н); 5,4 (д, 1Н); 7,5-7,8 (м, 6Н); 8,3 (м, 2Н); 8,5 (д, 1Н) м.ч. Приклад 111 5-Ацетил-6-метил-4-(4-нітрофеніл)-2-оксо-1-[3(трифторметил)феніл]-1,2,3,4-тетрагідропіримідин 0,407г (2,0ммоль) N-[3(трифторметил)феніл]сечовини, 0,302г (2,0ммоль) 4-нітробензальдегіду, 0,2г (2,0ммоль) 2,4пентандіону і 0,4г етилового естеру поліфосфорної кислоти суспендують в 20мл ТГФ. Суміш перемішують при кип'ятінні із зворотнім холодильником протягом 18 годин. Після охолодження до кімнатної температури, розчинник видаляють у вакуумі і залишок очищають за допомогою колонкової хроматографії на силікагелі використовуючи циклогексан/етилацетат як елюент. Вихід: 0,302г (36% від теор.) 1 Н-ЯМР (200МГц, ДMCO-d6): δ=2,0 (с, 3Н); 2,2 (с, 3Н); 5,5 (д, 1Н); 7,5-7,8 (м, 6Н); 8,3 (м, 2Н); 8,5 (д, 1Н)м.ч. В. Оперативні приклади стосовно Фармацевтичних композицій Сполуки згідно з винаходом можуть бути перетворені у фармацевтичні рецептури наступним чином: Таблетка Склад 100мг сполуки Прикладу 1, 50мг лактози (моногідрат), 50мг кукурудзяного крохмалю (природний), 10мг полівінілпіролідону (ПВП 25)
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrimidinone derivatives as therapeutic agents against acute and chronic inflammatory, ischaemic and remodelling processes
Автори англійськоюMin-Jian Li Volkhart, Schlemmer, Karl-Heinz, Allerheiligen Swen, Telan Leila, Baerfacker Lars, Keldenich, Jorg, Fitzgerald Mary F., Nash Kevin, Meurer Dirk
Назва патенту російськоюПроизводные пиримидинона как терапевтические агенты против острого и хронического воспаления, ишемических и реконструкционных процессов
Автори російськоюМин-Джиан Ли Фолькхарт, Аллерхайлиген Свен, Телан Лейла, Берфаккер Ларс, Фитцджеральд Мери Ф., Неш Кевин, Мойрер Дирк
МПК / Мітки
МПК: C07D 405/06, C07D 417/04, C07D 417/12, C07D 413/04, C07D 401/12, C07D 401/04, C07D 403/06, C07D 401/06, C07D 403/12, C07D 413/12, C07D 405/12, A61P 9/00, C07D 239/22
Мітки: ішемічних, гострого, агенти, процесів, терапевтичні, запалення, похідні, піримідинону, хронічного, реконструкційних
Код посилання
<a href="https://ua.patents.su/31-82074-pokhidni-pirimidinonu-yak-terapevtichni-agenti-proti-gostrogo-i-khronichnogo-zapalennya-ishemichnikh-i-rekonstrukcijjnikh-procesiv.html" target="_blank" rel="follow" title="База патентів України">Похідні піримідинону як терапевтичні агенти проти гострого і хронічного запалення, ішемічних і реконструкційних процесів</a>
Попередній патент: Гетероциклічні ароматичні сполуки
Наступний патент: Спосіб підготовки газоподібного теплоносія
Випадковий патент: Торцеве ущільнення












