Похідні [1,4]діазепіно[6,7,1-ij]хіноліну, що використовуються як антипсихотичні агенти та засоби проти ожиріння
Формула / Реферат
1. Сполука формули І або її фармацевтично прийнятна сіль
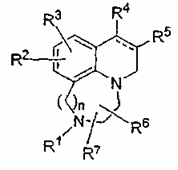 , І
, І
де
R1 являє собою водень, алкіл з 1-6 атомами вуглецю, алканоїл з 2-6 атомами вуглецю або карбоарилалкокси з 7-11 атомами вуглецю;
R2 і R3 кожний незалежно являє собою водень, гідрокси, алкіл з 1-6 атомами вуглецю, алкокси з 1-6 атомами вуглецю, галоген, карбоксамідо, карбоалкокси з 2-6 атомами вуглецю, перфторалкіл з 1-6 атомами вуглецю, ціано, алкансульфонамідо з 1-6 атомами вуглецю, алкансульфоніл з 1-6 атомами вуглецю, алканамідо з 1-6 атомами вуглецю, аміно, алкіламіно з 1-6 атомами вуглецю, діалкіламіно з 1-6 атомами вуглецю на алкільній частині, перфторалкокси з 1-6 атомами вуглецю, алканоїлокси з 2-6 атомами вуглецю, алканоїл з 2-6 атомами вуглецю, ароїл з 6-8 атомами вуглецю, арил з 5-7 атомами вуглецю, С6-С13алкіларильну групу, що має 5-7 атомів вуглецю в арильній частині, 5-7-членну гетероарильну групу або 6-13-членну алкілгетероарильну групу, що має 5-7 членів у вказаній гетероарильній частині, де будь-який із замісників R2 або R3, що має арильну або гетероарильну частину, може бути необов’язково заміщений по арильній або гетероарильній частині 1-3 замісниками, незалежно вибраними з атома галогену, С1-С6алкільної групи або С1-С6алкоксигрупи;
R4 і R5 незалежно являють собою атом водню або алкіл з 1-6 атомами вуглецю, або R4 і R5, взяті разом з атомами вуглецю, з якими вони зв’язані, утворюють циклічну групу, вибрану з циклоалкану з 4-8 атомами вуглецю, циклоалкену з 4-8 атомами вуглецю, місточкового біциклічного алкану з 5-10 атомами вуглецю, місточкового біциклічного алкену з 5-10 атомами вуглецю, пірану або тіопірану, в яких атом сірки необов’язково окислений до сульфоксиду або сульфону, де вказана циклічна частина, утворена R4 і R5, може бути необов’язково заміщена 1-3 замісниками, незалежно вибраними з атома галогену, С1-С6алкільної групи або С1-С6алкоксигрупи;
кожний R6 і R7 незалежно являє собою водень або алкіл з 1-6 атомами вуглецю;
n дорівнює 1 або 2; і
пунктирна лінія означає необов’язковий подвійний зв’язок.
2. Сполука за п. 1, де R2 і R3 незалежно являють собою водень, галоген, ціано, перфторалкіл з 1-3 атомами вуглецю, феніл або алкокси з 1-3 атомами вуглецю.
3. Сполука за п.1 або за п. 2, де R4 і R5, взяті разом з атомами вуглецю, з якими вони зв’язані, утворюють циклоалканову або циклоалкенову частину з 5-8 атомами вуглецю, де один або декілька атомів вуглецю необов’язково заміщені алкілом з 1-4 атомами вуглецю.
4. Сполука за п. 1 або за п. 2, де R4 і R5, взяті разом з атомами вуглецю, з якими вони зв’язані, утворюють циклоалканову з 5-7 атомами вуглецю.
5. Сполука за п. 1 або за п. 2, де принаймні один з R1, R6 і R7 являє собою водень.
6. Сполука за п. 3, де принаймні один з R1, R6 і R7 являє собою водень.
7. Сполука за п. 4, де принаймні один з R1, R6 і R7 являє собою водень.
8. Сполука за п. 1 або за п. 2, де R1 R6 і R7 всі являють собою водень.
9. Сполука за п. 3, де R1, R6 і R7 всі являють собою водень.
10. Сполука за п. 4, де R1, R6 і R7 всі являють собою водень.
11. Сполука за п. 1 або п. 2, де n дорівнює 1.
12. Сполука за п. 3, де n дорівнює 1.
13. Сполука за п. 4, де n дорівнює 1.
14. Сполука за п. 5, де n дорівнює 1.
15. Сполука за п. 6, де n дорівнює 1.
16. Сполука за п. 7, де n дорівнює 1.
17. Сполука за п. 8, де n дорівнює 1.
18. Сполука за п. 9, де n дорівнює 1.
19. Сполука за п. 10, де n дорівнює 1.
20. Сполука за п. 1, де R2 і R3 незалежно вибрані з водню, галогену, трифторметилу, фенілу або алкокси з 1-3 атомами вуглецю; R1, R6 і R7 кожний являє собою водень;
n дорівнює 1; і R4 і R5, взяті разом з атомами вуглецю, з якими вони зв’язані, утворюють циклопентан, циклогексан або циклогептан.
21. Сполука за п. 1, яка являє собою одну з наступних сполук:
4,5,6,7,9,9а,10,11,12а-декагідроциклопента[с][1,4]діазепіно[6,7,1-ij]хінолін;
гідрохлорид 2-бром-4,5,6,7,9,9а,10,11,12,12а-декагідроциклопента[с][1,4]діазепіно[6,7,1-ij]хіноліну;
гідрохлорид 2-хлор-4,5,6,7,9,9а,10,11,12,12а-декагідроциклопента[с][1,4]діазепіно[6,7,1-ij]хіноліну;
гідрохлорид 2-феніл-4,5,6,7,9,9а,10,11,12,12а-декагідроциклопента[с][1,4]діазепіно[6,7,1-ij]хіноліну;
гідрохлорид 2-метокси-4,5,6,7,9,9а,10,11,12,12а-декагідроциклопента[с][1,4]діазепіно[6,7,1-ij]хіноліну;
гідрохлорид 1-фтор-4,5,6,7,9,9а,10,11,12,12а-декагідроциклопента[с][1,4]діазепіно[6,7,1-ij]хіноліну;
гідрохлорид 1-(трифторметил)-4,5,6,7,9,9а,10,11,12,12а-декагідроциклопента[с][1,4]діазепіно[6,7,1-ij]хіноліну;
гідрохлорид 1-фтор-2-метокси-4,5,6,7,9,9а,10,11,12,12а-декагідроциклогепта[с][1,4]діазепіно[6,7,1-ij]хіноліну;
або їх фармацевтично прийнятних солей.
22. Сполука за п. 1, яка являє собою 4,5,6,7,9,9а,10,11,12,12а-декагідроциклопента[с][1,4]діазепіно[6,7,1-ij]хінолін або його фармацевтично прийнятну сіль.
23. Сполука за п. 1, яка являє собою (-)-4,5,6,7,9,9а,10,11,12,12а-декагідроциклопента[с][1,4]діазепіно[6,7,1-іj]хінолін або його фармацевтично прийнятну сіль.
24. Сполука за п. 1, яка являє собою гідрохлорид 4,5,6,7,9а,10,11,12,13,13а-декагідро-9Н-[1,4]діазепіно[6,7,1-dе]фенантридину або його фармацевтично прийнятну сіль.
25. Сполука за п. 1, яка являє собою одну з наступних сполук:
4,5,6,7,9,9а,10,11,12,13,14,14а-додекагідроциклогепта[с][1,4]діазепіно[6,7,1-ij]хінолін;
гідрохлорид 2-бром-4,5,6,7,9,9а,10,11,12,13,14,14а-додекагідроциклогепта[с][1,4]діазепіно[6,7,1-ij]хіноліну;
гідрохлорид 2-хлор-4,5,6,7,9,9а,10,11,12,13,14,14а-додекагідроциклогепта[с][1,4]діазепіно[6,7,1-ij]хіноліну;
гідрохлорид 1-фтор-4,5,6,7,9,9а,10,11,12,13,14,14а-додекагідроциклогепта[с][1,4]діазепіно[6,7,1-ij]хіноліну;
гідрохлорид 1-фтор-2-метокси-4,5,6,7,9,9а,10,11,12,13,14,14а-додекагідро-циклогепта[с][1,4]діазепіно[6,7,1-ij]хіноліну;
або їх фармацевтично прийнятних солей.
26. Сполука за п. 1, яка являє собою 4,5,6,7,9,9а,10,11,12,13,14,14а-додекагідроциклогепта[с][1,4]діазепіно[6,7,1-ij]хінолін або його фармацевтично прийнятну сіль.
27. Сполука за п. 1, яка являє собою одну з наступних сполук:
гідрохлорид (9aR,14aS)-4,5,6,7,9,9a,10,11,12,13,14,14а-додекагідроциклогепта[с][1,4]діазепіно[6,7,1-іj]хіноліну;
гідрохлорид (9аS,14аR)-4,5,6,7,9,9а,10,11,12,13,14,14а-додекагідроциклогепта[с][1,4]діазепіно[6,7,1-ij]хіноліну;
або їх фармацевтично прийнятних солей.
28. Сполука за п. 1, яка являє собою одну з наступних сполук:
5-ацетил-4,5,6,7,9,9а,10,11,12,12а-декагідроциклопента[с][1,4]діазепіно[6,7,1-ij]хінолін;
бензил-2-бром-6,7,9,9а,10,11,12,12а-октагідроциклопента[с][1,4]діазепіно[6,7,1-ij]хінолін-5(4Н)-карбоксилат;
бензил-2-хлор-6,7,9,9а,10,11,12,12а-октагідроциклопента[с][1,4]діазепіно[6,7,1-ij]хінолін-5(4Н)-карбоксилат;
бензил-2-феніл-6,7,9,9а,10,11,12,12а-октагідроциклопента[с][1,4]діазепіно[6,7,1-ij]хінолін-5(4Н)-карбоксилат;
бензил-2-метокси-6,7,9,9а,10,11,12,12а-октагідроциклопента[с][1,4]діазепіно[6,7,1-ij]хінолін-5(4Н)-карбоксилат;
бензил-1-фтор-6,7,9,9а,10,11,12,12а-октагідроциклопента[с][1,4]діазепіно[6,7,1-ij]хінолін-5(4Н)-карбоксилат;
бензил-1-(трифторметил)-6,7,9,9а,10,11,12,12а-октагідроциклопента[с][1,4]діазепіно[6,7,1-ij]хінолін-5(4Н)-карбоксилат;
або їх фармацевтично прийнятних солей.
29. Сполука за п. 1, яка являє собою одну з наступних сполук:
(-)-5-ацетил-4,5,6,7,9,9а,10,11,12,12а-декагідроциклопента[с][1,4]діазепіно[6,7,1-ij]хінолін;
(+)-5-ацетил-4,5,6,7,9,9а,10,11,12,12а-декагідроциклопента[с][1,4]діазепіно[6,7,1-ij]хінолін;
або їх фармацевтично прийнятних солей.
30. Сполука за п. 1, яка являє собою бензил-6,7,9а,10,11,12,13,13а-октагідро-9Н-[1,4]діазепіно[6,7,1-dе]фенантридин-5(4Н)-карбоксилат або його фармацевтично прийнятну сіль.
31. Сполука за п. 1, яка являє собою одну з наступних сполук:
5-ацетил-4,5,6,7,9,9а,10,11,12,13,14,14а-додекагідроциклогепта[с][1,4]діазепіно[6,7,1-ij]хінолін;
бензил-2-бром-6,7,9,9а,10,11,12,13,14,14а-декагідроциклогепта[с][1,4]діазепіно[6,7,1-ij]хінолін-5(4Н)-карбоксилат;
бензил-2-хлор-6,7,9,9а,10,11,12,13,14,14а-декагідроциклогепта[с][1,4]діазепіно[6,7,1-ij]хінолін-5(4Н)-карбоксилат;
бензил-1-фтор-6,7,9,9а,10,11,12,13,14,14а-декагідроциклогепта[с][1,4]діазепіно[6,7,1-іj]хінолін-5(4Н)-карбоксилат;
бензил-1-фтор-2-метокси-6,7,9,9а,10,11,12,13,14,14а-декагідроциклогепта[с][1,4]діазепіно[6,7,1-ij]хінолін-5(4Н)-карбоксилат;
або їх фармацевтично прийнятних солей.
32. Сполука за п. 1, яка являє собою одну з наступних сполук:
(9аR,14аS)-5-ацетил-4,5,6,7,9,9а,10,11,12,13,14,14а-додекагідроциклогепта[с][1,4]діазепіно[6,7,1-ij]хінолін;
(9аS,14аR)-5-ацетил-4,5,6,7,9,9а,10,11,12,13,14,14а-додекагідроциклогепта[с][1,4]діазепіно[6,1,1-іj]хінолін; або їх фармацевтично прийнятних солей.
33. Спосіб лікування ссавця, страждаючого станом, вибраним з групи, що складається з шизофренії; розладу типу шизофренії; шизоафективного розладу; марення; психічного розладу, індукованого хімічною речовиною; L-DOPA-індукованого психозу; психозу, асоційованого з хворобою Альцгеймера; психозу, асоційованого з хворобою Паркінсона; психозу, асоційованого з хворобою тілець Леві; деменції, втрати пам’яті або розумового розладу, асоційованого з хворобою Альцгеймера, при якому вводять ссавцеві, страждаючому вказаним станом, терапевтично ефективну кількість принаймні однієї сполуки формули І або її фармацевтично прийнятної солі за будь-яким з пп. 1-32.
34. Спосіб за п. 33, де вказаним станом є шизофренія.
35. Спосіб за п. 33 або за п. 34, де вказаним ссавцем є людина.
36. Спосіб лікування ссавця, страждаючого станом, вибраним з біполярних розладів; депресивних розладів; розладів настрою; тривожних станів; регуляторних розладів або розладів харчування, при якому вводять ссавцеві, страждаючому вказаним станом, терапевтично ефективну кількість принаймні однієї сполуки формули І або її фармацевтично прийнятної солі за будь-яким з пп. 1-32.
37. Спосіб за п. 36, де вказаним біполярним розладом є біполярний розлад І, біполярний розлад II і циклотимія; вказаним депресивним розладом є тяжкий депресивний розлад, дистимія або розлад настрою, індукований хімічною речовиною; вказаним розладом настрою є тяжка депресивна фаза, маніакальна фаза, змішана фаза або фаза гіпоманії; вказаним тривожним станом є панічна атака, агорафобія, панічний розлад, елементарний нав’язливий страх, соціальна фобія, нав’язливий стан, посттравматичний стрес, сильний стрес, загальний тривожний стан, нав’язливий страх втратити рідних або тривожний стан, індукований хімічною речовиною.
38. Спосіб за п. 36, де вказаним станом є депресивний розлад, біполярний розлад або розлад настрою.
39. Спосіб за будь-яким з пп. 36-38, де вказаним ссавцем є людина.
40. Спосіб лікування ссавця, страждаючого станом, вибраним з епілепсії, порушення сну, мігрені, порушень статевої функції, шлунково-кишкових розладів або ожиріння, при якому вводять вказаному ссавцеві, страждаючому таким станом, терапевтично ефективну кількість принаймні однієї сполуки формули І або її фармацевтично прийнятної солі за будь-яким з пп. 1-32.
41. Спосіб за п. 40, де вказаним станом є ожиріння.
42. Спосіб за п. 40 або 41, де вказаним ссавцем є людина.
43. Спосіб лікування ссавця, страждаючого розладом центральної нервової системи, асоційованим з травмою, інсультом або пошкодженням спинного мозку, при якому вводять вказаному ссавцеві, страждаючому таким станом, терапевтично ефективну кількість принаймні однієї сполуки формули І або її фармацевтично прийнятної солі за будь-яким з пп. 1-32.
44. Фармацевтична композиція, що містить принаймні одну сполуку формули І або її фармацевтично прийнятну сіль за будь-яким з пп. 1-32 і принаймні один фармацевтичне прийнятний носій або ексципієнт.
45. Композиція за п. 44, де R2 і R3 незалежно вибрані з водню, галогену, трифторметилу, фенілу або алкокси з 1-3 атомами вуглецю; R1, R6 і R7 кожний являє собою водень; n дорівнює 1; і R4 і R5, взяті разом з атомами вуглецю, з якими вони зв’язані, утворюють циклопентан, циклогексан або циклогептан.
46. Спосіб отримання сполуки формули І за п. 1, при якому проводять одну з наступних стадій:
(а) взаємодію сполуки формули IIА:
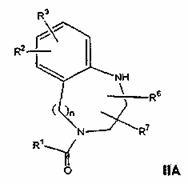 ,
,
де n, R2, R3, R6 і R7 визначені в п. 1, і R1 являє собою алкіл з 1-5 атомами вуглецю або арилалкокси з 6-10 атомами вуглецю, із сполукою формули ІІІА або ІIIВ:
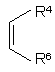 , IIIA
, IIIA ![]() IIIB,
IIIB,
де R4 і R5 визначені в п. 1, з отриманням відповідної сполуки формули І, де пунктирна лінія означає необов’язковий зв’язок, і R1 являє собою алканоїл з 2-6 атомами вуглецю або карбоарилалкокси з 7-11 атомами вуглецю; або
(b) циклізацію сполуки формули IVA
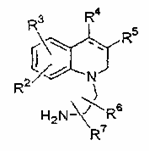 , IVA
, IVA
де R2-R7 визначені в п. 1, з формальдегідом з отриманням сполуки формули І за п. 1, де n дорівнює 1, і R1 являє собою водень; або
(c) алкілування сполуки формули І за п. 1, де R1 являє собою водень, з отриманням сполуки формули І, де R1 являє собою алкіл з 1-6 атомами вуглецю; або
(d) ацилювання сполуки формули І за п. 1, де R1 являє собою водень, з отриманням сполуки формули І, де R1 являє собою алканоїл з 2-6 атомами вуглецю або карбоарилалкокси з 7-11 атомами вуглецю; або
(e) гідроліз сполуки формули І за п. 1, де R1 являє собою алканоїл з 2-6 атомами вуглецю або карбоарилалкокси з 7-11 атомами вуглецю, з отриманням відповідної сполуки формули І, де R1 являє собою водень; або
(f) перетворення основної сполуки формули І в фармацевтично прийнятну сіль або навпаки; або
(g) виділення енантіомерної або діастереомерної форми сполуки формули І з їх суміші.
Текст
1. Сполука формули І або її фармацевтично прийнятна сіль 2 (19) 1 3 79782 заміщена 1-3 замісниками, незалежно вибраними з атома галогену, С1-С6алкільної групи або С 1С6алкоксигрупи; кожний R6 і R7 незалежно являє собою водень або алкіл з 1-6 атомами вуглецю; n дорівнює 1 або 2; і пунктирна лінія означає необов’язковий подвійний зв’язок. 2. Сполука за п. 1, де R2 і R3 незалежно являють собою водень, галоген, ціано, перфторалкіл з 1-3 атомами вуглецю, феніл або алкокси з 1-3 атомами вуглецю. 3. Сполука за п.1 або за п. 2, де R4 і R5, взяті разом з атомами вуглецю, з якими вони зв’язані, утворюють циклоалканову або циклоалкенову частину з 5-8 атомами вуглецю, де один або декілька атомів вуглецю необов’язково заміщені алкілом з 1-4 атомами вуглецю. 4. Сполука за п. 1 або за п. 2, де R4 і R5, взяті разом з атомами вуглецю, з якими вони зв’язані, утворюють циклоалканову з 5-7 атомами вуглецю. 5. Сполука за п. 1 або за п. 2, де принаймні один з R1, R6 і R7 являє собою водень. 6. Сполука за п. 3, де принаймні один з R 1, R6 і R7 являє собою водень. 7. Сполука за п. 4, де принаймні один з R 1, R6 і R7 являє собою водень. 8. Сполука за п. 1 або за п. 2, де R 1 R6 і R7 всі являють собою водень. 9. Сполука за п. 3, де R1, R6 і R7 всі являють собою водень. 10. Сполука за п. 4, де R1, R6 і R7 всі являють собою водень. 11. Сполука за п. 1 або п. 2, де n дорівнює 1. 12. Сполука за п. 3, де n дорівнює 1. 13. Сполука за п. 4, де n дорівнює 1. 14. Сполука за п. 5, де n дорівнює 1. 15. Сполука за п. 6, де n дорівнює 1. 16. Сполука за п. 7, де n дорівнює 1. 17. Сполука за п. 8, де n дорівнює 1. 18. Сполука за п. 9, де n дорівнює 1. 19. Сполука за п. 10, де n дорівнює 1. 20. Сполука за п. 1, де R2 і R3 незалежно вибрані з водню, галогену, трифторметилу, фенілу або алкокси з 1-3 атомами вуглецю; R1, R6 і R7 кожний являє собою водень; n дорівнює 1; і R4 і R5 , взяті разом з атомами вуглецю, з якими вони зв’язані, утворюють циклопентан, циклогексан або циклогептан. 21. Сполука за п. 1, яка являє собою одну з наступних сполук: 4,5,6,7,9,9а,10,11,12адекагідроциклопента[с][1,4]діазепіно[6,7,1ij]хінолін; гідрохлорид 2-бром-4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1ij]хіноліну; гідрохлорид 2-хлор-4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1ij]хіноліну; гідрохлорид 2-феніл-4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1ij]хіноліну; 4 гідрохлорид 2-метокси-4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1ij]хіноліну; гідрохлорид 1-фтор-4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1ij]хіноліну; гідрохлорид 1-(трифторметил)4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1ij]хіноліну; гідрохлорид 1-фтор-2-метокси4,5,6,7,9,9а,10,11,12,12адекагідроциклогепта[с][1,4]діазепіно[6,7,1ij]хіноліну; або їх фармацевтично прийнятних солей. 22. Сполука за п. 1, яка являє собою 4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1-ij]хінолін або його фармацевтично прийнятну сіль. 23. Сполука за п. 1, яка являє собою (-)4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1-іj]хінолін або його фармацевтично прийнятну сіль. 24. Сполука за п. 1, яка являє собою гідрохлорид 4,5,6,7,9а,10,11,12,13,13а-декагідро-9Н[1,4]діазепіно[6,7,1-dе]фенантридину або його фармацевтично прийнятну сіль. 25. Сполука за п. 1, яка являє собою одну з наступних сполук: 4,5,6,7,9,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,7,1ij]хінолін; гідрохлорид 2-бром4,5,6,7,9,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,7,1ij]хіноліну; гідрохлорид 2-хлор-4,5,6,7,9,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,7,1ij]хіноліну; гідрохлорид 1-фтор4,5,6,7,9,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,7,1ij]хіноліну; гідрохлорид 1-фтор-2-метокси4,5,6,7,9,9а,10,11,12,13,14,14а-додекагідроциклогепта[с][1,4]діазепіно[6,7,1-ij]хіноліну; або їх фармацевтично прийнятних солей. 26. Сполука за п. 1, яка являє собою 4,5,6,7,9,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,7,1ij]хінолін або його фармацевтично прийнятну сіль. 27. Сполука за п. 1, яка являє собою одну з наступних сполук: гідрохлорид (9aR,14aS)4,5,6,7,9,9a,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,7,1іj]хіноліну; гідрохлорид (9аS,14аR)4,5,6,7,9,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,7,1ij]хіноліну; або їх фармацевтично прийнятних солей. 28. Сполука за п. 1, яка являє собою одну з наступних сполук: 5 5-ацетил-4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1ij]хінолін; бензил-2-бром-6,7,9,9а,10,11,12,12аоктагідроциклопента[с][1,4]діазепіно[6,7,1ij]хінолін-5(4Н)-карбоксилат; бензил-2-хлор-6,7,9,9а,10,11,12,12аоктагідроциклопента[с][1,4]діазепіно[6,7,1ij]хінолін-5(4Н)-карбоксилат; бензил-2-феніл-6,7,9,9а,10,11,12,12аоктагідроциклопента[с][1,4]діазепіно[6,7,1ij]хінолін-5(4Н)-карбоксилат; бензил-2-метокси-6,7,9,9а,10,11,12,12аоктагідроциклопента[с][1,4]діазепіно[6,7,1ij]хінолін-5(4Н)-карбоксилат; бензил-1-фтор-6,7,9,9а,10,11,12,12аоктагідроциклопента[с][1,4]діазепіно[6,7,1ij]хінолін-5(4Н)-карбоксилат; бензил-1-(трифторметил)-6,7,9,9а,10,11,12,12аоктагідроциклопента[с][1,4]діазепіно[6,7,1ij]хінолін-5(4Н)-карбоксилат; або їх фармацевтично прийнятних солей. 29. Сполука за п. 1, яка являє собою одну з наступних сполук: (-)-5-ацетил-4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1ij]хінолін; (+)-5-ацетил-4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1ij]хінолін; або їх фармацевтично прийнятних солей. 30. Сполука за п. 1, яка являє собою бензил6,7,9а,10,11,12,13,13а-октагідро-9Н[1,4]діазепіно[6,7,1-dе]фенантридин-5(4Н)карбоксилат або його фармацевтично прийнятну сіль. 31. Сполука за п. 1, яка являє собою одну з наступних сполук: 5-ацетил-4,5,6,7,9,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,7,1ij]хінолін; бензил-2-бром-6,7,9,9а,10,11,12,13,14,14адекагідроциклогепта[с][1,4]діазепіно[6,7,1-ij]хінолін5(4Н)-карбоксилат; бензил-2-хлор-6,7,9,9а,10,11,12,13,14,14адекагідроциклогепта[с][1,4]діазепіно[6,7,1-ij]хінолін5(4Н)-карбоксилат; бензил-1-фтор-6,7,9,9а,10,11,12,13,14,14адекагідроциклогепта[с][1,4]діазепіно[6,7,1-іj]хінолін5(4Н)-карбоксилат; бензил-1-фтор-2-метокси6,7,9,9а,10,11,12,13,14,14адекагідроциклогепта[с][1,4]діазепіно[6,7,1-ij]хінолін5(4Н)-карбоксилат; або їх фармацевтично прийнятних солей. 32. Сполука за п. 1, яка являє собою одну з наступних сполук: (9аR,14аS)-5-ацетил4,5,6,7,9,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,7,1ij]хінолін; (9аS,14аR)-5-ацетил4,5,6,7,9,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,1,1 79782 6 іj]хінолін; або їх фармацевтично прийнятних солей. 33. Спосіб лікування ссавця, страждаючого станом, вибраним з групи, що складається з шизофренії; розладу типу шизофренії; шизоафективного розладу; марення; психічного розладу, індукованого хімічною речовиною; L-DOPA-індукованого психозу; психозу, асоційованого з хворобою Альцгеймера; психозу, асоційованого з хворобою Паркінсона; психозу, асоційованого з хворобою тілець Леві; деменції, втрати пам’яті або розумового розладу, асоційованого з хворобою Альцгеймера, при якому вводять ссавцеві, страждаючому вказаним станом, терапевтично ефективну кількість принаймні однієї сполуки формули І або її фармацевтично прийнятної солі за будь-яким з пп. 1-32. 34. Спосіб за п. 33, де вказаним станом є шизофренія. 35. Спосіб за п. 33 або за п. 34, де вказаним ссавцем є людина. 36. Спосіб лікування ссавця, страждаючого станом, вибраним з біполярних розладів; депресивних розладів; розладів настрою; тривожних станів; регуляторних розладів або розладів харчування, при якому вводять ссавцеві, страждаючому вказаним станом, терапевтично ефективну кількість принаймні однієї сполуки формули І або її фармацевтично прийнятної солі за будь-яким з пп. 1-32. 37. Спосіб за п. 36, де вказаним біполярним розладом є біполярний розлад І, біполярний розлад II і циклотимія; вказаним депресивним розладом є тяжкий депресивний розлад, дистимія або розлад настрою, індукований хімічною речовиною; вказаним розладом настрою є тяжка депресивна фаза, маніакальна фаза, змішана фаза або фаза гіпоманії; вказаним тривожним станом є панічна атака, агорафобія, панічний розлад, елементарний нав’язливий страх, соціальна фобія, нав’язливий стан, посттравматичний стрес, сильний стрес, загальний тривожний стан, нав’язливий страх втратити рідних або тривожний стан, індукований хімічною речовиною. 38. Спосіб за п. 36, де вказаним станом є депресивний розлад, біполярний розлад або розлад настрою. 39. Спосіб за будь-яким з пп. 36-38, де вказаним ссавцем є людина. 40. Спосіб лікування ссавця, страждаючого станом, вибраним з епілепсії, порушення сну, мігрені, порушень статевої функції, шлунково-кишкових розладів або ожиріння, при якому вводять вказаному ссавцеві, страждаючому таким станом, терапевтично ефективну кількість принаймні однієї сполуки формули І або її фармацевтично прийнятної солі за будь-яким з пп. 1-32. 41. Спосіб за п. 40, де вказаним станом є ожиріння. 42. Спосіб за п. 40 або 41, де вказаним ссавцем є людина. 43. Спосіб лікування ссавця, страждаючого розладом центральної нервової системи, асоційованим з травмою, інсультом або пошкодженням спинного мозку, при якому вводять вказаному ссавцеві, страждаючому таким станом, терапевтично ефек 7 79782 тивну кількість принаймні однієї сполуки формули І або її фармацевтично прийнятної солі за будьяким з пп. 1-32. 44. Фармацевтична композиція, що містить принаймні одну сполуку формули І або її фармацевтично прийнятну сіль за будь-яким з пп. 1-32 і принаймні один фармацевтичне прийнятний носій або ексципієнт. 45. Композиція за п. 44, де R 2 і R3 незалежно вибрані з водню, галогену, трифторметилу, фенілу або алкокси з 1-3 атомами вуглецю; R1, R6 і R7 кожний являє собою водень; n дорівнює 1; і R4 і R5, взяті разом з атомами вуглецю, з якими вони зв’язані, утворюють циклопентан, циклогексан або циклогептан. 46. Спосіб отримання сполуки формули І за п. 1, при якому проводять одну з наступних стадій: (а) взаємодію сполуки формули IIА: , де n, R2, R3, R6 і R7 визначені в п. 1, і R1 являє собою алкіл з 1-5 атомами вуглецю або арилалкокси з 6-10 атомами вуглецю, із сполукою формули ІІІА або ІIIВ: R4 R4 R6 , IIIA R6 8 де R4 і R5 визначені в п. 1, з отриманням відповідної сполуки формули І, де пунктирна лінія означає необов’язковий зв’язок, і R1 являє собою алканоїл з 2-6 атомами вуглецю або карбоарилалкокси з 711 атомами вуглецю; або (b) циклізацію сполуки формули IVA , IVA де R2-R7 визначені в п. 1, з формальдегідом з отриманням сполуки формули І за п. 1, де n дорівнює 1, і R1 являє собою водень; або (c) алкілування сполуки формули І за п. 1, де R1 являє собою водень, з отриманням сполуки формули І, де R1 являє собою алкіл з 1-6 атомами вуглецю; або (d) ацилювання сполуки формули І за п. 1, де R1 являє собою водень, з отриманням сполуки формули І, де R1 являє собою алканоїл з 2-6 атомами вуглецю або карбоарилалкокси з 7-11 атомами вуглецю; або (e) гідроліз сполуки формули І за п. 1, де R1 являє собою алканоїл з 2-6 атомами вуглецю або карбоарилалкокси з 7-11 атомами вуглецю, з отриманням відповідної сполуки формули І, де R1 являє собою водень; або (f) перетворення основної сполуки формули І в фармацевтично прийнятну сіль або навпаки; або (g) виділення енантіомерної або діастереомерної форми сполуки формули І з їх суміші. IIIB, Даний винахід відноситься до [1,4] діазепіно[6,7,1-ij]хінолінових похідних, які можуть бути корисні як антипсихотичні засоби і засоби проти ожиріння, до способів їх отримання, фармацевтичних композицій, що містять такі похідні, і до способів їх застосування. Шизофренією страждають приблизно 5 мільйонів чоловік. У цей час, найбільш широко поширеними способами лікування шизофренії є застосування "нетипових" антипсихотичних засобів, дія яких основана на об'єднаному антагоністичному ефекті допамінового (D2) рецептора і антагоністичному ефекті серотонінового (5-НТ2А) рецептора. Незважаючи на більш високу ефективність і більш низькі рівні побічних ефектів, що повідомляється, нетипових антипсихотичних засобів в порівнянні з типовими антипсохотичними засобами, ці сполуки все ж не дають адекватного усунення всіх симптомів шизофренії і викликають небажані побічні ефекти, включаючи підвищення маси тіла [Allison D.B. et al., Am. J. Psychiatry, 156:1686-1696, 1999; Masand P.S. Exp., Opin. Pharmacother. 1:377-389, 2000; Whitaker, R., Spectrum Life Sciences. Decision Resources. 2:1-9, 2000]. Отримання нових антипсихотичних засобів, які були б ефективними для лікування розладів настрою або порушення пiзнaвальнoї здатності при шизофренії, але, при цьому, не спричиняли б збільшення маси тіла, може внести значний внесок в підвищення ефективності лікування шизофренії. В основу нового терапевтичного способу лікування шизофренії було покладено використання агоністів і часткових агоністів 5-НТ2С. Є деякі дані, підтверджуючі роль ашніста рецептора 5-НТ2С як засобу для лікувашія шизофренії. Дослідження антагоністів 5-НТ2С дають підстави передбачати, що ці сполуки підвищують синаптичні рівні допаміну і можуть бути ефективними у тварин з моделлю хвороби Паркінсона [Di Matteo, V. et al., Neuropharmacology 37:265-272, 1998; Fox S.H. et al., Experimental Neurology 151:35-49, 1998]. Оскільки "позитивні" симптоми шизофренії асоційовані із збільшенням рівнів допаміну, то сполуки, дія яких протилежна дії антагоністів, такі як агоністи і 9 79782 часткові агоністи 5-НТ2С, повинні знижувати рівні синаптичного допаміну. Недавно проведені дослідження показали, що агоністи 5-НТ2С знижують рівні допаміну в префронтальній корі головного мозку і в прилеглому ядрі [Мillаn М. J. et al., Neuropharmacology 37:953-955, 1998; Di Matteo V. et al., Neuropharmacology 38:1195-1205, 1999; Di Giovanni G. et ai., Synapse 35:53-61, 2000], тобто, в ділянках головного мозку, які, очевидно, опосередковують важливі антипсихотичні ефекти лікарських засобів, таких як клозапін. У протилежність цьому, агоністи 5-НТ2С не знижують рівень допаміну в смугастому тілі, тобто, в ділянці головного мозку, яка найбільш тісно пов'язана з екстрапірамідальними побічними ефектами. Крім того, недавно проведені дослідження продемонстрували, що агоністи 5-НТ2С ослаблюють зaпалeння у вентральній покривній ділянці (VTA), але не в чорній речовині. Дія агоністів 5-НТ2С в мезолімбічному шляху, відмінна від дії нігростріарного шляху, дозволяє передбачити, що агоністи 5-НТ2С володіють лімбічною селективністю і, ймовірно, будуть продукувати менший рівень екстрапірамідальних побічних ефектів, асоційованих з типовими антипсихотическими засобами. Нетипові антипсихотичні засоби зв'язуються з рецепторами 5-НТ2С з високою афінністю і діють як антагоністи або зворотні агоністи рецептора 5НТ2С. Збільшення маси тіла є серйозним побічним ефектом, асоційованим із застосуванням нетипових антипсихотични х засобів, таких як клозапін і оланзапін, причому, передбачається, що за збільшення маси відповідальна їх антагоністична дія по відношенню 5-НТ2С. І навпаки, відомо, що стимуляція рецептора 5-НТ2С приводить до зниження кількості споживаної їжі і до зниження маси тіла [Walsh et al., Psychopharmacology 10:385-391, 1995; Rosenzweig-Lipson, S. et al., ASPET abstract, 2000]. У результаті можна зробити висновок, що агоністи і часткові агоністи 5-НТ2С будуть, ймовірно, перешкоджати збільшенню маси тіла, асоційованому з сучасними нетиповими антипсихотичними засобами. Дійсно, агоністи і часткові агоністи 5НТ2С представляють величезний інтерес як засоби для лікування ожиріння, патологічного розладу, що характеризується надлишком жиру або жирової тканини в організмі, і асоційованого з такими супутніми патологічними процесами, як діабет типу II, серцево-судинні захворювання, гіпертензія, гіперліпідемія, інсульт, остеоартрит, апное у сні, захворювання жовчного міхура, пoдaгрa, деякі види раку, деякі види безпліддя і передчасна смерть. В одному з варіантів здійснення, даний винахід відноситься до сполук формули І або їх фармацевтично прийнятної солі: де R1 являє собою водень, алкіл з 1-6 атомами 10 вуглецю, алканоїл з 2-6 атомами вуглецю або карбоарилалкокси з 7-11 атомами вуглецю; R2 і R3 кожний незалежно являє собою водень, гідрокси, алкіл з 1-6 атомами вуглецю, алкокси з 16 атомами вуглецю, галоген, карбоксамідо, карбоалкокси з 2-6 атомами вуглецю, перфторалкіл з 16 атомами вуглецю, ціано, алкансульфонамідо з 16 атомами вуглецю, алкансульфоніл з 1-6 атомами вуглецю, алканамідо з 1-6 атомами вуглецю, аміно, алкiлaмiнo з 1-6 атомами вуглецю, діалкіламіно з 1-6 атомами вуглецю на алкільній частині, перфторалкокси з 1-6 атомами вуглецю, алканоїлокси з 2-6 атомами вуглецю, алканоїл з 2-6 атомами вуглецю, ароїл з 6-8 атомами вуглецю, арил з 5-7 атомами вуглецю, С6-С13алкіларильну грyпy, що має 5-7 атомів вуглецю в арильній частині, 5-7членну гетероарильну грyп y або 6-13-членну алкiлгeтepoapильнy грyпy, що має 5-7 членів у вказаній гетероарильній частині, де будь-який із замісників R2 або R3, що має арильну або гетероарильну частину, може бути необов'язково заміщений по арильній або гетероарильній частині 1-3 замісниками, незалежно вибраними з атома галогену, С1-С 6алкільної групи або С1-С6алкоксигрупи; R4 і R5 незалежно являють собою атом водню або алкіл з 1-6 атомами вуглецю, або, R4 і R5, взяті разом з атомами вуглецю, з якими вони пов'язані, утворюють циклічну групу, вибрану з циклоалкану з 4-8 атомами вуглецю, циклоалкену з 4-8 атомами вуглецю, місточкового біциклічного алкану з 5-10 атомами вуглецю, місточкового біциклічного алкену з 5-10 атомами вуглецю, пірану або тіопірану, в яких атом сірки необов'язково окислений до сульфоксиду або сульфону, де вказана циклічна частина, утворена R4 і R5, може бути необов'язково заміщена 1-3 замісниками, нeзалeжнo вибраними з атома галогену, С1-С6алкільної грyпи або С 1С6алкoкcигрyпи; R6 і R7 кожний незалежно являє собою водень або алкіл з 1-6 атомами вуглецю; n дорівнює 1 або 2; і пунктиpнa лінія означає необов'язковий подвійний зв'язок. В іншому варіанті здійснення винаходу, спосіб лікування ссавців, страждаючих станом, вибраним з грyпи, що складається з шизофренії, розладу типу шизофренії, шизоафективного розладу, марення, психічного розладу, індукованого хімічною сполукою, L-DOPA-індукованого психозу, психозу, асоційованого з хворобою Альцгеймера, психозу, асоційованого з хворобою Паркінсона, психозу, асоційованого з хворобою тілець Леві, деменції, втрати пам'яті, розумового розладу, асоційованого з хворобою Альцгеймера, біполярних розладів, депресивних розладів, розладу настрою, тривожних станів, регуляторних розладів, розладів харчування, епілепсії, порушень сну, мігрені, порушень статевої функції, шлунково-кишкових розладів, ожиріння або розладів центральної нервової системи, асоційованих з травмою, інсультом або пошкодженням спинного мозку, передбачає введення вказаному ссавцеві, принаймні, однієї сполуки формули І або її фармацевтично прийнятної солі. У цьому варіанті здійснення винаходу, переважно, R1 формули І являє собою водень або алкіл з 1-6 11 79782 атомами вуглецю, і більш переважно, водень. В іншому варіанті здійснення, даний винахід відноситься до фармацевтичної композиції, що містить, принаймні, одну сполуку формули І і, принаймні, один фармацевтично прийнятний носій або ексципієнт, де, переважно, R1 формули І являє собою водень або алкіл з 1-6 атомами вуглецю, і більш переважно, водень. Даний винахід відноситься до сполук формули І або їх фармацевтично прийнятної солі: де R1 являє собою водень, алкіл з 1-6 атомами вуглецю, алканоїл з 2-6 атомами вуглецю або карбоарилалкокси з 7-11 атомами вуглецю, і переважно, водень або алкіл з 1-6 атомами вуглецю; R2 і R3 кожний нeзалeжнo являє собою водень, гідрокси, алкіл з 1-6 атомами вуглецю, алкокси з 16 атомами вуглецю, галоген, карбоксамідо, карбоалкокси з 2-6 атомами вуглецю, перфторалкіл з 16 атомами вуглецю, ціано, алкансульфонамідо з 16 атомами вуглецю, алкансульфоніл з 1-6 атомами вуглецю, алканамідо з 1-6 атомами вуглецю, аміно, алкіламіно з 1-6 атомами вуглецю, діалкіламіно з 1-6 атомами вуглецю на алкільній частині, перфторалкокси з 1-6 атомами вуглецю, алканоїлокси з 2-6 атомами вуглецю, алканоїл з 2-6 атомами вуглецю, ароїл з 6-8 атомами вуглецю, арил з 5-7 атомами вуглецю, С6-С13алкіларильну грyпy, що має 5-7 атомів вуглецю в арильній частині, 5-7членну гетероарильну щуп у або 6-13-членну алкілгетероарильну групу, що має 5-7 членів у вказаній гетероарильній частині, де будь-який із замісників R2 або R3, що має арильну або гетероарильну частину, може бути необов'язково заміщений по арильній або гетероарильній частині 1-3 замісниками, незалежно вибраними з атома галогену, С1С6алкільної групи або С1-С6aлкoкcигрyпи; R4 і R5 незалежно являють собою водень або алкіл з 1-6 атомами вуглецю, або, R4 і R5, взяті разом з атомами вуглецю, з якими вони пов'язані, утворюють циклічну грyпy, вибрану з циклоалкану з 4-8 атомами вуглецю, циклоалкену з 4-8 атомами вуглецю, місточкового біциклічного алкану з 5-10 атомами вуглецю, місточкового біциклічного алкену з 5-10 атомами вуглецю, піpaну або тіопірану, в яких атом сірки необов'язково окислений до сульфоксиду або сульфону, де вказана циклічна частина, утворена R4 і R5, може бути необов'язково заміщена 1-3 замісниками, нeзалeжнo вибраними з атома галогену, С1-С6алкільної грyпи або С 1С6aлкoкcигрyпи; R6 і R7 кожний незалежно являє собою водень або алкiл з 1-6 атомами вуглецю; n дорівнює 1 або 2; і пунктирна лінія означає необов'язковий подвійний зв'язок. У деяких переважних варіантах здійснення ви 12 находу, R 2 являє собою водень, галоген, ціано, пepфтopалкiл з 1-3 атомами вуглецю, алкіл з 1-6 атомами вуглецю, алкокси з 1-6 атомами вуглецю, алканоїл з 2-6 атомами вуглецю, алкансульфоніл з 1-6 атомами вуглецю або арил з 5-7 атомами вуглецю. Більш переважно, R2 являє собою водень, галоген, ціано, адокси з 1-3 атомами вуглецю, феніл або трифтopмeтил. В інших переважних варіантах здійснення винаходу, R3 являє собою водень, галоген, ціано, пepфтopалкiл з 1-3 атомами вуглецю, алкіл з 1-6 атомами вуглецю, алкокси з 1-6 атомами вуглецю, алканоїл з 2-6 атомами вуглецю, алкансульфоніл з 1-6 атомами вуглецю або арил з 5-7 атомами вуглецю. Більш переважно, R3 являє собою водень, галоген, ціано, алкокси з 1-3 атомами вуглецю, феніл або трифторметил. R4 і R5, взяті разом з атомами вуглецю, з якими вони пов'язані, переважно, утворюють циклоалканову або циклоалкенову частину з 5-8 атомами вуглецю, де один або декілька атомів вуглецю необов'язково заміщені алкілом з 1-4 атомами вуглецю, і більш переважно, циклoалкaнoвy групу з 5-7 атомами вуглецю. R1, R6 і R7 , переважно, являють собою водень. n, переважно, дорівнює 1. В інших переважних варіантах здійснення винаходу, R2 і R3 незалежно вибрані з водню, галогену, трифторметилу, фенілу або алкокси з 1-3 атомами вуглецю; R1 , R6 і R7 кожний являє собою водень, n дорівнює 1, і R4 і R5, взяті разом з атомами вуглецю, з якими вони пов'язані, утворюють циклопентан, циклогексан або циклогептан. Сполуки даного винаходу містять асиметричні атоми вуглецю, і тому вони утворюють оптичні ізомери і діастереомери. Хоч в формулі І не відображена стереохімічна структура сполуки, однак, даний винахід включає такі оптичні ізомери і діастереоізомери, також їх рацемічні суміші і окремі енантіомерно чисті R- і S-стереоізомери, і також інші суміші R- і S-стереоізомерів і їх фармацевтично прийнятні солі. Якщо переважним є енантіомер, то в деяких варіантах здійснення винаходу може бути отриманий енантіомер, по суті, що не містить іншого відповідного йому енантіомеру. Таким чином, термін "енантіомер, по суті, що не містить іншого відповідного йому енантіомеру", означає сполуку, виділену або розділену методами розділення, або отриману у вигляді чистого енантіомеру без відповідного йому енантіомеру. Термін "по суті, той, що не містить", який використовується, означає, що вказана сполука, в основному, складається з одного енантіомеру. У переважних варіантах здійснення винаходу, вказана сполука складається, принаймні, приблизно на 90мас.% з переважного енантіомеру. В інших варіантах здійснення винаходу, вказана сполука складається, принаймні, приблизно на 99мас.% з переважного енантіомеру. Переважні енантіомери можуть бути виділені з рацемічних сумішей будь-яким відомим способом, включаючи високоефективну рідинну хроматографію (ВЕРХ) і утворення і кристалізацію xipальниx солей, або отримані описаними в даному описі способами. [Див., наприклад, Jacques et 13 79782 al., Enantiomers, Racemates and Resolutions (Wiley Interscience, New York, 1981); Wilen S.H. et al., Tetrahedron, 33:2725 (1977); Eliel E.L. Stereochemistry of Carbon Compounds (McGraw-Hill, NY, 1962); Wilen S.H. Tables of Resolving Agents and Optical Resolutions p.268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN 1972)]. Термін "алкіл", що використовується, означає аліфатичний вуглеводневий ланцюг і включає, але не обмежується ними, прямі і розгалужені ланцюги, такі як метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил, н-пентил, ізопентил, неопентил, н-гексил і ізогексил. Термін "нижчий алкіл" означає алкіл, що має 1-3 атоми вуглецю. Термін "алканамідо", що використовується, означає грyп y R-C(=O)-NH-, де R являє собою алкільну грyп y з 1-5 атомами вуглецю. Термін "алканоїл", що використовується, означає грyпy R-C(=O)-, де R являє собою алкільну грyп y з 1-5 атомами вуглецю. Термін "алканоїлокси", що використовується, означає грyп y R-C(=O)-O-, де R являє собою алкільну грyп y з 1-5 атомами вуглецю. Термін "алкансульфоамідо", що використовується, означає грyпy R-S(O)2-NH-, де R являє собою мкільну грyп y з 1-6 атомами вуглецю. Термін "алкансульфоніл", що використовується, означає грyпy R-S(O)2-, де R являє собою алкільну грyп y з 1-6 атомами вуглецю. Термін "алкокси", що використовується, означає грyп y R-O-, де R являє собою алкільну грyп y з 1-6 атомами вуглецю. Термін "арил", що використовується, означає ароматичне 5-7-членне монокарбоциклічне кільце, таке як феніл. Термін "гетероарил" означає ароматичне 5-7-членне вуглецьвмісне моноциклічне кільце, що має один-два гетероатоми, які нeзалeжнo можуть являти собою атом азоту, кисню або сірки. Групи, що містять арильну або гетероарильну частини, можуть бути необов'язково заміщені, як було визначено вище, або вони можуть бути незаміщеними. Термін "ароїл", що використовується, означає грyп y Аr-С(=О)-, де Аr означає арил, визначений вище. Так, наприклад, С6-С8ароїльна частина означає групу Аr-С(=O)-, де Аr означає ароматичне 5-7-членне карбоциклічне кільце. Термін "алкіларил", що використовується, означає грyпy -R-Ar, де Аr означає арил, визначений вище, і R являє собою алкiльну частину, що має 1-6, переважно, 1-4, і більш переважно, 1-3 атоми вуглецю. Прикладами алкiлapильниx грyп є бензил, фенетил, 3-фенілпропіл і 4-фенілбутил. Термін "алкілгетероарил", що використовується, означає грyпy -R-hetAr, де hetAr являє собою гетероарил, визначений вище, і R являє собою алкільну частин у, що має 1-6, переважно, 1-4, і більш переважно, 1-3 атоми вуглецю. Термін "карбоксамідо", що використовується, означає NH2-C(=O)-; Термін "карбоалкокси", що використовується, означає грyп y R-O-C(=O)-, де R являє собою алкільну грyп y з 1-5 атомами вуглецю. Термін "карбоарилалкокси", що використову 14 ється, означає грyпy Ar-Ra-O-С(=О)-, де Аr являє собою арил, визначений вище, і Ra являє собою нижчу алкільну грyп y з 1-3 атомами вуглецю. Переважно, Аr являє собою феніл, і Ra являє собою метилен, утворюючи разом бензильну частину. Термін "галоген" (або "галогено"), що використовується, означає атом хлору, брому, фтору і йоду. Фармацевтично прийнятними солями, включаючи одноаніонні і двоханіонні солі, є солі, утворені з органічних і неорганічних кислот, таких як, алe що не обмежуються ними, оцтова, молочна, лимонна, корична, винна, янтарна, фумарова, малеїнова, малонова, мигдалева, яблучна, щавлева, пропіонова, хлористоводнева, бромистоводнева, фосфорна, азотна, сірчана, гліколева, піpoвiнoгрaднa, метансульфонова, етансульфонова, толуолсульфонова, саліцилова, бензойна і aналoriчнi відомі прийнятні кислоти. Конкретними прикладами сполук формули І є: 4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1іj]хінолін; гідрохлорид 4,5,6,7,9а,10,11,12,13,13адекагідро-9Н-[1,4] діазепіно[6,7,1de]фенантридину; 4,5,6,7,9,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,7,1ij]хінолін; гідрохлорид 2-бром-4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1іj]хіноліну; гідрохлорид 2-бром4,5,6,7,9,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,7,1ij]хіноліну; гідрохлорид 2-хлор-4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1ij]хіноліну; гідрохлорид 2-хлор4,5,6,7,9,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,7,1ij]хіноліну; гідрохлорид 2-феніл-4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1ij]хіноліну; гідрохлорид 2-метокси4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1ij]хіноліну; гідрохлорид 1-фтор-4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1ij]хіноліну; гідрохлорид 1-фтор4,5,6,7,9,9а,10,11,12,13,14,14адодекагідроциклопента[с][1,4]діазепіно[6,7,1ij]хіноліну; гідрохлорид 1-(трифторметил)4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1іj]хіноліну; гідрохлорид 1-фтор-2-метокси4,5,6,7,9,9а,10,11,12, додекагідроциклопента[с][1,4]діазепіно[6,7,1-іj]хіноліну; гідрохлорид 1-фтор-2-метокси 15 79782 4,5,6,7,9,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,1,1ij]хіноліну; і їх фармацевтично прийнятні солі. Іншими конкретними прикладами сполук формули І є: 5-ацетил-4,5,6,7,9,9а, 10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1ij]хінолін; бензил-6,7,9а,10,11,12,13,13а-октагідро-9Н[1,4]діазепіно[6,7,1-dе]фенантридин-5(4Н)карбоксилат; 5-ацетил-4,5,6,7,9,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,7,1ij]хінолін; бензил-2-бром-6,7,9а,10,11,12,12аоктагідроциклопента[с][1,4]діазепіно[6,7,1ij]хінолін-5(4Н)-карбоксилат; бензил-2-бром-6,7,9а,10,11,12,13,14,14адекагідроциклогепта[с][1,4]діазепіно[6,7,1-ij]хінолін5(4Н)-карбоксилат; бензил-2-хлор-6,7,9,9а,10,11,12,12аоктагідроциклогепта[с][1,4]діазепіно[6,7,1-ij]хінолін5(4Н)-карбоксилат; бензил-2-хлор-6,7,9,9а,10,11,12,13,14,14адекагідроциклогепта[с][1,4]діазепіно[6,7,1-ij]хінолін5(4Н)-карбоксилат; бензил-2-феніл-6,7,9,9а,10,11,12,12аоктагідроциклопента[с][1,4]діазепіно[6,7,1ij]хінолін-5(4Н)-карбоксилат; бензил-2-метокси-6,7,9,9а,10,11,12,12аоктагідроциклопента[с][1,4]діазепіно[6,7,1ij]хінолін-5(4Н)-карбоксилат; бензил-1-фтор-6,7,9,9а,10,11,12,12аоктагідроциклопента[с][1,4]діазепіно[6,7,1ij]хінолін-5(4Н)-карбоксилат; бензил-1-фтор-6,7,9,9а,10,11,12,13,14,14адекагідроциклогепта[с][1,4]діазепіно[6,7,1-ij]хінолін5(4Н)-карбоксилат; бензил-1-(трифторметил)6,7,9,9а,10,11,12,12аоктагідроциклопента[с][1,4]діазепіно[6,7,1ij]хінолін-5(4Н)-карбоксилат; бензил-1-фтор-2-метоксиб,7,9,9а,10,11,12,12аоктагідроциклопента[с][1,4]діазепіно[6,7,1ij]хінолін-5(4Н)-карбоксилат; бензил-1-фтор-2-метокси6,7,9,9а,10,11,12,13,14,14адекагідроциклогепта[с][1,4]діазепіно[6,7,1-ij]хінолін5(4Н)-карбоксилат; і їх фармацевтично прийнятні солі. Конкретними прикладами також є, по суті, чисті енантіомери вищезгаданих сполук, включаючи: (-)-5-ацетил-4,5,6,7,9,9а, 10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1ij]хінолін; (+)-5-ацетил-4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1іj]хінолін; (9аR,14аS)-5-ацетил4,5,6,7,9,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,7,1ij]хінолін; (9aS,14aR)-5-ацетил 16 4,5,6,7,9,9a,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,7,1ij]хінолін; (-)-4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1іj]хінолін; гідрохлорид (9aR,14aS)4,5,6,7,9,9a,10,11,12,13,14,14aдoдeкaгiдpoциклoгeптa[с][1,4]діазепіно[6,7,1ij]хіноліну; гідрохлорид (9aS,14aR)4,5,6,7,9,9a,10,11,12,13,14,14aдoдeкaгiдpoциклoгeптa[с][1,4]діазепіно[6,7,1ij]хіноліну; і їх фармацевтично прийнятні солі. Даний винахід також відноситься до способу отримання сполук формули І, визначених вище, що включає одну з наступних стадій: (а) реакцію сполуки формули llА: де n, R2, R3 , R6 і R7 визначені вище, і R являє собою адкіл з 1-5 атомами вуглецю або арилалкокси з 6-10 атомами вуглецю, із сполукою формули llΙΑ або llІВ: де R4 і R5 визначені вище, з отриманням відповідної сполуки формули І, де п унктирна лінія означає необов'язковий зв'язок, R1 являє собою алканоїл з 2-6 атомами вуглецю або карбоарилалкокси з 7-11 атомами вуглецю; або (b) реакцію циклізації сполуки формули IVA де R2-R7 визначені вище, з формальдегідом, з отриманням сполуки формули І, визначеної вище, де n дорівнює 1, і R1 являє собою водень; (c) алкілування сполуки формули І, визначеної вище, де R1 являє собою водень, з отриманням сполуки формули І, де R1 являє собою алкіл з 1-6 17 79782 атомами вуглецю; або (d) ацилювання сполуки формули І, визначеної вище, де R1 являє собою водень, з отриманням сполуки формули І, де R1 являє собою алканоїл з 2-6 атомами вуглецю або карбоарилалкокси з 7-11 атомами вуглецю; або (e) гідроліз сполуки формули І, визначеної вище, де R1 являє собою алканоїл з 2-6 атомами вуглецю або карбоарилалкокси з 7-11 атомами вуглецю, з отриманням відповідної сполуки формули І, де R1 являє собою водень; або (f) перетворення основної сполуки формули І в фармацевтично прийнятну сіль або навпаки; або (g) виділення енантіомерної або діастереомерної форми сполуки формули І з їх суміші. Сполуки даного винаходу можуть бути отримані відповідно до нижченаведених схем з комерційно доступних вихідних сполук або з вихідних сполук, які можуть бути отримані методами, описаними в літературі. Радикали є такими, як вони визначені в формулі І, якщо це не обумовлено особливо. 18 луки III. Альтернативно, сполука II може бути піддана каталітичному гідрогенолізу в присутності паладію на вугіллі з отриманням сполуки III. Сполуки II, при відсутності в ни х подвійного зв'язку, являють собою рацемічні суміші, які можуть бути розділені хоральною ВЕРХ з отриманням окремих енантіомерів, які можуть бути потім оброблені неорганічною основою, такою як КОН, в полярному розчиннику, такому як вода або метанол, при підвищених температурах, таких як 50-100°С, з метою видалення ацильної грyпи, з отриманням енантіомерів IV і V, які являють собою продукти даного винаходу. Енантіомери IV і V можуть бути також отримані зворотним розчиненням хіральної солі рацемічної суміші сполуки III з використанням розділяючого агента, такого як бензоїлвинна кислота в органічному розчиннику, такому як спирт. Сполуки даного винаходу, де n дорівнює 2, можуть бути отримані проведенням тих же самих реакцій, описаних вище на схемі І, за винятком того, що вихідн у сполуку, представлену на схемі І, замінюють сполукою XXI, представленою нижче. Вихідна сполука формули І, де n дорівнює 2, може бути отримана по реакції, описаній нижче на схемі Іа: На схемі І заміщений або незаміщений бензодіазепіндіон відновлюють відновником, таким як алюмoгiдpид літію або комплекс борантетрагідрофуран, отримуючи заміщений або незаміщений бензодіазепін. Основний атом азоту бензодіазепіну ацилюють ацилуючим реагентом, таким як ангідрид кислоти або хлорформіат, в присутності основи, такої як триетиламін або основа Хьюніга, в органічному розчиннику, такому як ефір або метиленхлорид, з отриманням проміжної сполуки І. Проміжну сполуку І піддають взаємодії з формальдегідним еквівалентом, таким як водний розчин формальдегіду або диметоксиметану, в присутності кислоти Льюїса, такої як трифторид бору, і дієнофілу, такого як циклопентен або алкен, з отриманням продукту циклоприєднання II. Потім продукт циклоприєднання обробляють в лужних умовах, таких як КОН в полярних розчинниках, подібних воді і етанолу, з отриманням спо На Схемі Іа відповідним чином заміщений нітротолуол XIV обробляють параформом в присутності прийнятної основи, такої як гідроксид калію, в розчиннику, такому як ДМСО-етанол, з отриманням фенілетанолу XV, який потім перетворюють в бромід XVI, використовуючи стандартні методики, такі як обробка тетрабромметаном і трифенілфосфіном в метиленхлориді. Бромід перетворюють в фенетиламін XVII обробкою аміаком (де R6 являє собою водень) при підвищеній температурі в посудині під високим тиском, і отриманий фенетиламін алкілують етилбромацетатом в присутності основи, такої як карбонат калію, у прийнятному розчиннику, такому як ацетонітрил або диметилфор 19 79782 мамід. Отриманий аміноефір XVIII гідролізують до кислоти обробкою бромистоводневою кислотою з отриманням амінокислоти XIX. Після відновлення ароматичної нiтpoгрyпи воднем в присутності прийнятного каталізатора, такого як платина на сульфідованому вугіллі або паладій на вугіллі, здійснюють циклізацію обробкою реагентом поєднання, таким як дициклогексилкарбодіімід в розчиннику, такому як пірідин, і отримують 3,4,5,6-тетрагідро1Н-бензо[е][1,4]діазоцин-2-он XXI. Альтернативно, сполуки даного винаходу можуть бути також отримані синтезом, приведеним на схемі II. Аніліни або відповідним чином N-заміщені аніліни, такі як N-бензиланілін, можуть бути піддані взаємодії з фopмальдeгiдним eквiвалeнтoм, таким як водний розчин фopмальдeгiдy або диметоксиметану, в присутності кислоти Льюїса, такої як трифторид бору, і дієнофілу, такого як циклопентен, з отриманням продукту циклоприєднання. Потім захисну гр упу R на азоті, якщо вона присутня, видаляють і отримують проміжні сполуки VI. Проміжна сполука VI може бути потім алкілована, наприклад, 2-хлоретиламіном в умовах перенесення фаз, з отриманням сполуки VII. Альтернативно, бічний ланцюг може бути також введений за допомогою двостадійної методики алкілування 2хлорацетамідом з подальшим відновленням. Потім сполуку VII піддають циклізації Пікте 20 Шпенглера з формальдегідом і протонною кислотою, такою як трифтороцтова кислота, і отримують сполуку VIII. Сполука VIII може бути потім розділена на чисті енантіомери хіральним розділенням з отриманням сполук IX і X. Альтернативно, із сполуки VIII може бути отримане відповідним чином функціоналізоване похідне сполуки XI, яке може бути виділене хіральною хроматографією і потім піддане розщепленню з отриманням сполук IX і X. Потім вказані сполуки можуть бути дериватизовані, наприклад, алкілуванням, з отриманням сполук XII і XIII, де R1 являє собою С 1-С6 алкіл. Сполуки даного винаходу є агоністами і частковими агоністами рецепторів серотоніну типу 2с головного мозку, і тому вони представляють інтерес для лікування психічних розладів, включаючи, психотичні розлади, такі як шизофренія, включаючи, параноїдну шизофренію, гебефреничну шизофренію, кататонічну шизофренію і недиференційовану шизофренію, розлад типу шизофренії, шизоафективний розлад, марення, психічний розлад, індукований хімічною речовиною, L-DOPAіндукований психоз, психоз, асоційований з хворобою Альцгеймера; психоз, асоційований з хворобою Паркінсона; психоз, асоційований з хворобою тілець Леві, біполярні розлади, такі як біполярний розлад І, біполярний розлад II і циклотимію; депресивні розлади, такі як тяжкий депресивний розлад, дистимія; розлади настрою, індуковані хімічною речовиною, і конкретно не визначений депресивний розлад; розлади настрою, такі як тяжка депресивна фаза, маніакальна фаза, змішана фаза, фаза гіпоманії; тривожні стани, такі як панічна атака, агорафобія, панічний розлад, елементарні нав'язливі страхи, соціальні фобії, нав'язливі стани, посттравматичний стрес, сильний стрес, загальні тривожні стани, нав'язливий страх втратити рідних, тривожний стан, індукований хімічною речовиною і конкретно не визначений депресивний тривожний стан; регуляторні розлади, такі як регуляторні розлади з тривожним станом і/або пригніченим настроєм; розумові розлади, такі як деменція, хвороба Альцгеймера і втрата пам'яті; розлади харчування (наприклад, гіперфагія, булімія або нервова анорексія) і комбінації цих психічних розладів, які можуть бути присутніми у ссавців. Так, наприклад, розлади настрою, такі як депресивні розлади або біполярні розлади, часто супроводжують такі психотичні розлади як шизофренія. Більш повний опис вищезгаданих психічних розладів можна знайти в керівництві [Diagnostic and Statistical Manual of Mental Disorders, 4th edition, Washington, DC, American Psychiatric Association (1994)]. Сполуки даного винаходу також представляють інтерес для лікування епілепсії, мігрені, порушень статевої функції, порушення сну, шлунковокишкових розладів, таких як недостатня перистальтика, і ожиріння з супутніми патологічними процесами, включаючи діабет типу II, серцево-судинні захворювання, гіпертензію, гіперліпідемію, інсульт, остеоартрит, апное у сні, захворювання жовчного міхура, подагру, деякі види раку, деякі види безпліддя і передчасну смерть. Сполуки даного вина 21 79782 ходу можуть бути також корисні для лікування розладів центральної нервової системи, асоційованих з травмою, інсультом або пошкодженням спинного мозку. Тому сполуки даного винаходу можуть бути корисні для підвищення активності центральної нервової системи після травм або хронічних захворювань або для запобігання її подальшому порушенню. Таке поняття, як "підвищення активності центральної нервової системи" включає збереження або збільшення здатності до пересування і рухової сили, регуляції, координації і загальної сили організму. Здатність сполук даного винаходу діяти як агоністи і часткові агоністи 5-НТ2С було встановлено в ході виконання декількох стандартних методик фармакологічних тестів, і такі методики і їх результати описані нижче. У цих тестах, 5-НТ означає 5-гідрокситриптамін, mСРР означає хлорфенілпіперазин, і DOT означає 1-(2,5-диметоксі4-йодфеніл)ізопропіламін. Методики дослідження зв'язування з 5-НТ2Срецептором Для оцінки афінності по відношенню до 5НТ2Срецептору, клітинну лінію СНО (яєчника китайського хом'ячка), трансфіковану кДНК, яка експресує рецептор 5-гідрокситриптаміну2С людини (h5-HT2C) витримували в середовищі DMEM (в модифікованому за способом Дульбекко середовищі Ігла), в яке дoдaвали фетальну бичачу сироватку, глутамін і маркери: гуанінфосфорибозилтрансферазу (GTP) і гіпоксантинтимідин (НТ). Клітини залишали для їх росту до стану конфлюентності у великих чашках для культивування з проміжними замінами середовищ і цитолізом. Після досягнення конфлюентності клітини збирали зскрібанням. Зібрані клітини суспендували в половині об'єму свіжого забуференого фосфатом фізіологічного розчину (PBS) і центрифугували при низькій швидкості (900xg). Цю операцію повторювали ще один раз. Потім зібрані клітини гомогенізували з використанням пристрою Polytron з установкою на #7 протягом 15 секунд в десяти об'ємах 50мМ Трис-НСІ, рН 7,4 і 0,5мМ EDTA. Гомогенат центрифугували при 900xg протягом 15 хвилин для видалення ядерних часток і іншого клітинного дебрису. Осад відкидали і надосадову рідину знов центрифугували при 40000xg протягом 30 хвилин. Отриманий осад ресуспендували в невеликому об'ємі Трис-НСІбуферу і вміст білка в тканині визнaчалив аліквотах об'ємом 10-25 мікролітрів (мкл). Для визначення білка методом Лоурі і інш. [Lowry et al., J. Biol. Chem. 193:265, 1951] як стандарт використали альбумін бичачої сироватки (BSA). Об'єм суспендованих клітинних мембран коректували з використанням 50мМ Трис-НСІ-буфера, що містить 0,1% аскорбінової кислоти, 10мМ паргіліну і 4мМ СаСl2, до отримання концентрації білка в тканині, що становить 1-2мг на мл суспензії. Препарат мембранної суспензії (багато разів концентрований) розділяли на аліквоти в об'ємах 1мл і зберігали при -70°С аж до їх використання в подальших експериментах по зв'язуванню. Визначення рівнів зв'язування здійснювали на 96-ямковому мікротитраційному планшеті в повному об'ємі 200мкл. У кожну ямку додавали 60мкл 22 буферу для інкубування, приготованого в 50мМ Трис-НСІ-буфера, рН 7,4, і який містить 4мМ СаСl2, 20мкл [125I]DOI (S.A., 2200Кі/ммоль, NEN Life Science). Константа дисоціації, KD [125I]DOI рецептора серотоніну людини 5НТ2С становила 0,4нМ при насиченому зв'язуванні, із зростаючими концентраціями [125I]DOI. Реакцію ініціювали кінцевим доданням 100,0мкл суспензії тканини, що містить 50мкг білка рецептора. Рівень неспецифічного зв'язування визначали в присутності 1мкМ неміченого DOI, доданого в об'ємі 20,0мкл. Спoлуки, що тестуються, додавали в об'ємі 20,0мл. Реакційну суміш інкубували при кімнатній температурі протягом 60 хвилин. Інкубування припиняли швидкою фільтрацією. Зв'язаний комплекс "лігандрецептор" вiдфiльтpoвyвали на 96-ямковому фільтрі Unifilter з використанням складальника клітин PackardÒ Filtermate 196 Harvester. Зв'язаний комплекс, захоплений на фільтруючому диску, сушили у вакуумній печі, нагрітій до 60°С, і радіоактивність вимipювали методом рідинної сцинтиляції на 40мкл-сцинтиляторі Microscint-20 в пристрої Packard TopCountÒ, забезпеченому детекторами з шістьма (6) фотопомножувачами. Специфічне зв'язування визначали як загальну зв'язану радіоактивність мінус зв'язана кількість в присутності 1мкМ неміченого DOI. Зв'язування в присутності різних концентрацій лікарських засобів, що тестуються, виражали як процент від специфічного зв'язування за відсутності лікарського засобу. Потім будували графік залежності log % зв'язаної кількості від log концентрації лікарського засобу, що тестується. З використанням нелінійного регресійного аналізу експериментальних даних були отримані величини ІС 50 і Kі для сполук, що тестуються, з 95% довірчим інтервалом. Альтернативно, будували криву лінійної залeжнocтi peгрeciї відхилення експериментальних даних, з якої можуть бути зчитані величини ІС50, і величини Kі визначали шляхом рішення наступного рівняння: Ki = IC 50 1 + L / KD де L являє собою концентрацію радіоактивного ліганду, що використовується, і KD являє собою константу дисоціації ліганду для даного рецептора, обидві з яких виражені в нМ. Для різних відомих сполук були отримані наступні значення Kі (з 95% довірчим інтервалом): Рітансерин 2,0(1,3-3,1)нМ Кетансерин 94,8(70,7-127,0)нМ Міансерин 2,7(1,9-3,8)нМ Клозапін 23,2(16,0-34,0)нМ Метіотепін 4,6(4,0-6,0)нМ Метісергід 6,3(4,6-8,6)нМ Локсапін 33,0(24,0-47,0)нМ mСРР 6,5(4,8-9,0)нМ DOI 6,2(4,9-8,0)нМ Мобілізація кальцію у відповідь на агоністи рецептора 5-НТ2C Клітини СНО, які стабільно експресують реце 23 79782 птор людського 5-НТ2C, культивували в модифікованому за способом Дульбекко середовищі Ігла (DMEM), в яке були додані 10% фетальна бичача сироватка і замінні амінокислоти. Перед оцінкою рівня мобілізації кальцію, що стимулюється 5НТ2С-рецептором, клітини висівали при щільності 403 клітин/ямка в 96-ямкові планшети з прозорим дном і чорними стінками за 24 години. Для дослідження рівня кальцію, клітини навантажували барвником-індикатором кальцію Fluo-3-AM в забуференому фізіологічному розчині Хенкса (HBS) протягом 60 хвилин при 37°С. Клітини промивали HBS і переносили в флуориметричний візуалізуючий планшет-рідер (FLIPR, Molecular Devices, Sunnyvale, СА) для візуалізації кальцію. Збудження при довжині хвилі 488нм здійснювали за допомогою аргонового іонного лазера і при цьому, використали емісійний фільтр, який працює на 510560нм. Люмінесцентні зображення і відносні інтенсивності сканували з iнтepвалoм в 1 секунду, і клітини стимулювали доданням агоніста після 10 вимірювань базового рівня з використанням внутрішнього модуля струминного пристрою FLIPR. Сполука Приклад 4 Приклад 6 Приклад 8 Приклад 10 Приклад 12 Приклад 16 Приклад 20 Приклад 22 Приклад 24 Приклад 26 Приклад 28 Приклад 30 Приклад 32 Приклад 34 Афінність 5-НТ2C (Зв'язування DOI/агоніст) KІ (н М) 3 24 13 56 117 2299 373 88 199 20 169 59 223 249 Сполуки даного винаходу можуть володіти афінністю по відношенню до рецепторів серотоніну головного мозку і агоністичною або частковою агоністичною активністю. Тому вказані сполуки представляють інтерес для лікування таких розладів ЦНС, включаючи психотичні розлади, такі як шизофренія, включаючи параноїдну шизофренію, гебефренічну шизофренію, кататонічну шизофренію і недиференційовану шизофренію, розлад типу шизофренії, шизоафективний розлад, марення, психічний розлад, індукований хімічною речовиною, L-DOPA-індукований психоз, психоз, асоційований з хворобою Альцгеймера; психоз, асоційований з хворобою Паркінсона; психоз, асоційований з хворобою тілець Леві, біполярні розлади, такий як біполярний розлад І, біполярний розлад II і циклотимію; депресивні розлади, такі як тяжкий депресивний розлад, дистимія; розлад настрою, індукований хімічною речовиною, і конкретний не визначений депресивний розлад; розлади настрою, такі як тяжка депресивна фаза, мaнiaкальнa фаза, змішана фаза, фаза гіпоманії; тривожні стани, такі як панічна атака, агорафобія, 24 Величини посилення флуоресценції вiдпoвiдали збільшенню рівня внутрішньоклітинного кальцію. Для оцінки фармакологічної дії агоністу визначали зміну рівня кальцію у відповідь на різні концентрації агоністу з використанням максимального значення мінус мінімальне обчислене значення для вихідних даних флуоресценції. Потім зміни рівнів кальцію виражали як процент інтенсивності у відповідь, що спостерігається з використанням максимально ефективної концентрації 5-НТ, і величини ЕС50 оцінювали шляхом нелінійного peгрeciйнoгo аналізу кривих залежності "logконцентрація % від максимальної 5-НТ відповіді" з використанням 4-параметричної логістичної функції. Нижченаведені значення ЕС 50 і ІС50 отримували для різних стандартних сполук: 5-НТ ЕС50 0,5нМ DOI EC50 0,5нМ mCPP EC50 5,4нМ Нижче приводяться результати стандартних експериментальних методик тестів, описаних в попередніх розділах: ЕС50 (н М) 8 65 261 Функція 5-НТ2C Еmах (%) (5-НТ, 100%) 100 60 70 панічний розлад, елементарні нав'язливі страхи, соціальні фобії, нав'язливі стани, посттравматичний стрес, сильний стрес, загальні тривожні стани, нав'язливий страх втратити рідних, тривожний стан, індукований хімічною речовиною і конкретно не визначений тривожний стан; регуляторні розлади, такі як регуляторні розлади з тривожним станом і/або пригніченим настроєм; розумові розлади, такі як деменція, хвороба Альцгеймера і втрата пам'яті; розлади харчування (наприклад, гіперфагія, булімія або нервова анорексія) і комбінації цих психічних розладів, які можуть бути присутніми у ссавців. Так, наприклад, порушення настрою, такі як депресивні розлади або біполярні розлади часто супроводжуються психічними розладами, такими як шизофренія. Більш повний опис вищезгаданих психічних розладів можна знайти в керівництві [Diagnostic and Statistical Manual of Mental Disorders, 4th edition, Washington, DC, American Psychiatric Association (1994)]. Сполуки даного винаходу також представляють інтерес для лікування епілепсії, мігрені, порушень статевої функції, розладу сну, шлунково 25 79782 кишкових розладів, таких як недостатня пepиcтальтикa, і ожиріння з супутніми патологічними процесами, включаючи діабет типу II, серцевосудинні захворювання, гіпертензію, гіперліпідемію, інсульт, остеоартрит, апное у сні, захворювання жовчного міхура, подагру, деякі види раку, деякі види безпліддя і передчасну смерть. Сполуки даного винаходу можуть бути також використані для лікування розладів цeнтpальнoї нервової системи, асоційованих з травмою, інсультом або пошкодженням спинного мозку. Тому сполуки даного винаходу можуть бути корисні для підвищення активності цeнтpальнoї нервової системи після травм або хронічних захворювань або для запобігання її подальшому порушенню. Таке поняття, як "підвищення активності центральної нервової системи" включає збереження або збільшення здатності до пересування і рухової сили, регуляції, координації і загальної сили організму. Таким чином, даний винахід відноситься до способів лікування кожного з перерахованих ви ще захворювань у ссавців, переважно, у людини, і до способів доставки терапевтично ефективної кількості сполуки даного винаходу ссавцеві, потребуючому такого лікування. Термін "лікування", що використовується в даному описі, означає часткове або повне зняття симптомів, придушення, запобігання, ослаблення і/або полегшення захворювання. Так, наприклад, термін "лікування", що використовується, включає часткове або повне ослаблення, придушення або полегшення захворювання. Термін " "ссавець", що використовується, відноситься до теплокровної хребетної тварини, такої як людина. Термін "доставка", що використовується, означає або безпосереднє введення сполуки або композиції даного винаходу, або введення її похідного-проліків або аналога, які утворюють еквівалентну кількість активної сполуки або речовини в даному організмі. Даний винахід також відноситься до фармацевтичних композицій для лікування або усунення патологічних станів або захворювань цeнтpальнoї нервової системи, що включають, принаймні, одну сполуку формули І, її суміші або її фармацевтично прийнятні солі, і фармацевтично прийнятний носій. Такі композиції отримують відповідно до фармацевтично прийнятних методів, таких як методи, описані в керівництві [Remington's Pharmaceutical Sciences, 17th edition, ed. Alfonco R. Gennaro, Mark Publicftion Compsny, Easton, PA (1985)]. Фармацевтично прийнятні носії повинні бути сумісні з іншими інгредієнтами, присутніми в композиції, і біологічно прийнятними. Сполуки даного винаходу можуть бути введені перорально або пapeнтepальнo в чистому вигляді або в комбінації зі стандартними фармацевтичними носіями, і вміст цих сполук визначають в залежності від розчинності і хімічної природи даної сполуки, вибраного шляху введення і у відповідності до стандартної фармакологічної практики. Фармацевтично прийнятний носій може бути твердим або рідким. Прийнятними твердими носіями є одна або декілька речовин, які можуть також діяти як віддушки, замаслювачі, солюбілізатори, суспендуючі 26 агенти, наповнювачі, речовини, поліпшуючі ковзання, загусники, зв'язуючі агенти або дезінтегруючі агенти для таблеток або інкапсулювальної речовини. Для порошків використовують носій в тонкодисперсній твердій формі, який змішують з тонко дисперсним активним iнгрeдiєнтoм. Для отримання таблеток, активний інгредієнт змішують з носієм, що має необхідні загусні властивості, у відповідних кількостях, і потім цю суміш спресовують в потрібну форму потрібного розміру. Порошки і таблетки, переважно, містять до 99% активного інгредієнта. Прийнятними твердими носіями є, наприклад, фосфат кальцiю, стеарат магнію, тальк, цукор, лактоза, декстрин, кpoxмаль, желатин, целюлоза, метилцелюлоза, натрійкарбоксиметилцелюлоза, полівінілпіролідин, низькоплавкі віск і іонообмінні смоли. Рідкі носії можуть бути використані для отримання розчинів, суспензій, емульсій, сиропів і еліксирів. Активний iнгрeдiєнт даного винаходу може бути розчинений або суспендований в фармацевтично прийнятному рідкому носії, такому як вода, органічний розчинник, їх суміш або фармацевтично прийнятні олії або жир. Рідкий носій може містити інші прийнятні фармацевтичні домішки, такі як солюбілізатори, емульгатори, буфери, консерванти, підсолоджувачі, ароматизатори, суспендуючі агенти, загусники, барвники, регулятори в'язкості, стабілізатори або осморегулятори. Відповідними прикладами рідких носіїв для перорального і парентерального введення є вода (зокрема, вода, що містить ви щезгадані домішки, наприклад, похідні целюлози, переважно, розчин натрійкарбоксиметилцелюлози), спирти (включаючи одноатомні спирти і багатоатомні спирти, наприклад, гліколі) і їх похідні, і олії (наприклад, фракціонована олія кокосового горіха і арахісова олія). Для парентерального введення, носієм може бути також ефірне масло, таке як етилолеат і ізопропілміристат. Стерильні рідкі носії використовують в стерильних рідких композиціях для парентерального введення. Рідкий носій для композицій, що спресовуються, може являти собою галогенований вуглеводень або інший фармацевтично прийнятний пропелент. Рідкі фармацевтичні композиції, які являють собою стерильні розчини або суспензії, можуть бути введені, наприклад, шляхом внутрішньом'я зової, внутрішньочеревинної або підшкірної ін'єкції. Стерильні розчини можуть бути також введені внутрішньовенно. Композиції для перорального введення можуть бути введені у вигляді рідкої або твердої форми. Сполуки даного винаходу можуть бути введені ректально або вагінально в формі прийнятного супозиторію. Для введення шляхом інтраназальної або інтрабронхіальної інгаляції або інсуфляції, сполуки даного винаходу можуть бути приготовані у водному або частково водному розчині, який потім може бути використаний в формі аерозолю. Сполуки даного винаходу можуть бути також введені черезшкірно з використанням черезшкірного пластиру, що містить активні сполуки, і носія, який є інертним по відношенню до активної сполуки, не володіє токсичною дією на шкіру і забезпечує до 27 79782 ставку агента для системної абсорбції в кровотік через шкіру. Такий носій може додавати композиції різні форми, такі як креми і мазі, пасти, гелі і оклюзивні засоби. Креми і мазі можуть являти собою в'язкі, рідкі або напівтверді емульсії типу "масло у воді" або "вода в маслі". Можуть бути також використані пасти, що складаються з абсорбційних порошків, диспергованих у вазеліні і в гідрофільному вазеліні, що містить активний iнгрeдiєнт. Для вивільнення активного iнгрeдієнтa в кровотоці можуть бути використані різні оклюзивні засоби, такі як напівпроникна мембрана, що покриває резервуар, який містить активний iнгрeдiєнт з носієм або без носія, або матриця, що містить активний iнгрeдiєнт. Інші оклюзивні засоби описані в літературі. Фармацевтична композиція, переважно, являє собою одиничну лікарську форму, наприклад, таблетки, капсули, порошки, розчини, суспензії, емульсії, грaнyли і супозиторії. Для отримання таких форм, композицію розділяють на окремі уніфіковані дози, що містять відповідну кількість активного інгредієнта; і такі уніфіковані лікарські форми можуть являти собою упаковані композиції, наприклад, пакети з порошком, посудини, ампули, заздалегідь наповнені шприци або саше, що містять рідини. Така одинична лікарська форма може являти собою, наприклад, саму капсулу або таблетку, або вона може являти собою відповідне число будь-яких таких композицій в одній упаковці. Необхідна доза може варіюватися в залежності від композицій, що конкретно використовуються, способу введення, тяжкості симптомів, що спостерігаються, і від конкретного індивідуума, що піддається лікуванню. Виходячи з результатів, отриманих в стандартних методиках фармакологічних випробувань, передбачувані добові дози активної сполуки становлять 0,02мкг/кг-750мкг/кг. Звичайно, введення починають з малих доз, тобто, доз, менших оптимальної дози даної сполуки. Потім цю дозу збільшують до досягнення оптимального ефекту для кожного конкретного випадку; причому, точна доза для перорального, парентерального, інтраназального або внутрішньобронхіального введення може бути визначена лікуючим лікарем виходячи з досвіду, отриманого при лікуванні даного індивідуума. Даний винахід відноситься до проліків сполук формули І. Термін "проліки", що використовується, означає сполуку, яка завдяки метаболізму in vi vo (наприклад, шляхом гідролізу) перетворюється в сполуку формули І. Спеціалістам відомі різні форми проліків, що обговорюються, наприклад, в роботах: [Bundgaard, (ed.), Design of Prodrugs, Elsevier (1985); Widder, et al. (ed.), Methods in Enzymology, vol. 4, Academic Press (1985); Krogsgaard-Larsen, et al., (ed). "Design and Application of Prodrugs, Textbook of Drug Design and Development, Chapter 5, 113-191 (1991), Bundgaard, et al., Journal of Drug Delivery Reviews, 8:1-38(1992), Bundgaard, J. of Pharmaceutical Sciences, 77:285 et seg. (1988); і Higuchi and Stella (eds.) Prodrugs as Novel Drug Delivery Systems, American Chemical Society (1975)]. Приклади 28 Нижче описане отримання типових сполук даного винаходу. Приклад 1 5-ацетил-4,5,6,7,9,9а,10,11,12адекагідроциклопента[с][1,4]діазепіно[6,7,1іj]хінолін; Диметоксиметан (34,9мл, 394ммоль) розчиняли в метиленхлориді (800мл) і охолоджували до 0°С на крижаній бані. До розчину додавали ефірний комплекс трифториду бору (18,3мл, 144ммоль) і реакційну суміш перемішували 30 хвилин. Потім до реакційної суміші через кpaплинну лійку протягом декількох годин додавали розчин 4-ацетил-2,3,4,5-тетрагідро-1Н-1,4бензодіазепшу (25г, 131ммоль) в метиленхлориді (500мл). У процесі додання до реакційної суміші додавали циклопентен (23,1мл, 263ммоль). Реакційну суміш залишали на ніч для нагрівання до кімнатної температури. Якщо це необхідно, то для прискорення перетворення дoдaвали додаткові порції диметоксиметану, ефірного комплексу трифториду бору і циклопентану. Peaкцiйну суміш нейтралізували NaOH і екстрагували метиленхлоридом і потім органічний шар промивали насиченим розчином солі. Після сушіння MgSO4 розчинник випаровували у вакуумі і продукт очищали флeш-xpoмaтoгрaфiєю (силікагель, етилацетатггексан, 55:45 з 1% триетиламіну) з отриманням 7,4 грамів вказаної в заголовку сполуки. МС (ESI) m/z=271 ([M+H]+). Приклад 2 (-)-5-ацетил-4,5,6,7,9,9а,10,11,12адекагідроциклопента[с][1,4]діазепіно[6,7,1іj]хінолін; Сполуку прикладу 1 розділяли ВЕРХ на колонці Chiralcel OD або Chiralpak AS з використанням суміші гексан:ізопропанол, 9:1, при витраті 0,8мл/хв. Перший енантіомер (прикладу 2) елюювався через 18,9 хвилин, і другий енантіомер елюювався через 20,9 хвилин. Сполуку піка 1 отримували у вигляді безбарвної напівтвердої речовини і ідентифікували як енантіомер 5-ацетил-4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазетно[6,7,1іj]хіноліну. [a]D25=-191,2 (СНСІ3); МС (ESI) m/z=271 ([M+H]+). Приклад 3 (+)-5-ацетил-4,5,6,7,9,9а,10,11,12,12а декагідроциклопента[с][1,4]діазепіно[6,7,1іj]хінолін; Сполуку прикладу 1 розділяли ВЕРХ на колонці Chiralcel OD або Chiralpak AS з використанням суміші гексан:ізопропанол, 9:1, при витраті 0,8мл/хв. Перший енантіомер (прикладу 2) елюювався через 18,9 хвилин, і другий енантіомер елюювався через 20,9 хвилин. Сполуку піка 2 oтpимyвали у вигляді безбарвної напівтвердої речовини і ідентифікували як енантіомер 5-ацетил-4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1іj]хіноліну. [a]D25= + 165,1 (СНСІ3); МС (ESI) m/z=271 ([M+H]+). Приклад 4 29 79782 (-)-4,5,6,7,9,9а,10,11,12адекагідроциклопента[с][1,41діазепіно[6,7,1іj]хінолін Сполуку прикладу 2 (440мг, 1,6ммоль) розчиняли в метанолі (4мл) і воді (2мл) і додавали КОН (900мг, 16ммоль). Реакційну суміш кип'ятили із зворотним холодильником протягом 15 годин і метанол видаляли у вакуумі. Реакційну суміш розбавляли етилацетатом і водою і eкcтpагyвали. Після сушки MgSO4 розчинник випapoвyвали у вакуумі і продукт очищали флeш-xpoмaтoгрaфiєю (силікагель, суміш етилацетат-метанол, що містить 2,0М аміак, 98:2). Отриману сполуку виділяли у вигляді гідрохлоридної солі. [a]D25=-274,63 (СНСІ3); МС (ESI) m/z-229 ([M+H]+). Елементний аналіз для C15H20N2·HCl: обчислено: С, 68,04; Н, 7,99; N, 10,58; знайдено: С, 67,92; Н, 8,16; N, 10,53. Проміжна сполука 1 Бензил-1,2,3,5-тетрагідро-4Н-1,4бензодіазепін-4-карбоксилат 2,3,4,5-тетрагідро-1Н-бензо[е][1,4]діазепін (5г, 33,7ммоль) розчиняли в ТГФ (168,5мл) і охолоджували до 0°С на крижаній бані. Потім, перемішуючи, по краплях додавали основу Хьюніга (8,81мл, 50,6ммоль) і бензилхлорформіат (5,30мл, 37,1ммоль). Після перемішування протягом 7 годин ТГФ видаляли і в колбу додавали воду і етиловий ефір. Реакційну суміш екстрагували діетиловим ефіром (4х) і об'єднані органічні екстракти пpoмивали водним бікарбонатом натрію (1х) і насиченим розчином солі (1х). Потім органічні екстракти сушили сульфатом магнію, фільтрували і кoнцeнтpyвали з отриманням жовтої олії. Після очищення (етилацетат/гексан, 25:75, потім етилацетат/гексан, 30:70) отримували 7,9г потрібного продукту (83%). 1 Н ЯМР (СDСІ3, 400МГц): d 7,34-7,26 (д, 6Н); 7,13 (т, 1Н); 6,87 (м, 2Н); 5,09 (с, 2Н); 4,47 (д, 2Н); 3,74 (с, 2Н); 3,17 (д, 2Н); 1,58 (шир.с, 1H-NH). Мас-спектр: обчислено: 282,34; знайдено: 283,46 [М+Н]+. Приклад 5 Бензил-6,7,9а,10,11,12,13,13а-октагідро-9Н[1,4]діазепіно[6,7,1-dе]фенантридин-5(4H)карбоксилат Проміжну сполуку 1 (5г, 17,7ммоль) розчиняли в метиленхлориді (90мл). Потім при кімнатній температурі додавали диметоксиметан (4,7мл, 53,1ммоль) і циклогексан (3,6мл, 35,4ммоль). Потім реакційну колбу охолоджували до 0°С. Потім протягом 5 хвилин по краплях додавали комплекс трифториду бору з діетиловим ефіром (2,5мл, 19,5ммоль). Реакційну суміш залишали на ніч для поступового нагрівання до кімнатної температури. Через 20 годин реакційну суміш нагрівали до 40°С. Через 36 годин додавали другу порцію комплексу трифториду бор у з діетиловим ефіром, димeтoкcимeтaну і циклогексену (9,74ммоль, 20,6ммоль і 17,0ммоль, відповідно). Через 62 години реакційну суміш о холоджували до кімнатної температури. У колбу додавали 1н NaOH і вміст перемішували протягом 30 хвилин. Для гарантії основності суміші перевіряли рН, потім вміст колби 30 переносили в ділильну лійку і екстрагували метиленхлоридом (3х). Об'єднані органічні екстракти промивали насиченим розчином солі (1х), сушили над сульфатом магнію, фільтрували і концентрували з отриманням золотистої олії. Після очищення (10% етилацетат/гексан+0,1% ТЕА->15% етилацетат/гексан+0,1% TEA) отримували потрібний продукт. 1 Н ЯМР (СDСІ3, 400МГц): d 7,38-7,28 (м, 5Н); 7,02-6,96 (Зд, 2Н); 6,82-6,78 (м, 1Н); 5,13-5,09 (м, 1Н); 4,52 (д, 1Н); 4,39 (2д, 1Н); 3,48 (т, 1Н); 3,17 (д, 2Н); 2,99 (д, 1Н); 2,75 (м, 1Н); 2,18 (шир.м, 1Η); 1,82 (2д, 1Н); 1,73-1,50 (м, 6Н); 1,43-1,36 (м, 2Н). Мас-спектр: обчислено: 376,50; знайдено: 377,13 [М+Н]+. Приклад 6 Гідрохлорид 4,5,6,7,9,9а,10,11,12,13,13адекагідро-9Н-[1,4]діазепіно[6,7,1-de]фeнaнгридинy Сполуку Прикладу 5 (0,200г, 0,53ммоль) розчиняли в метиленхлориді (0,5мл). Потім при 0°С додавали трифторметансульфонову кислоту (0,0329мл, 3,72ммоль) і анізол (0,115мл, 1,06ммоль). Через 2 години додавали іншу порцію трифторметансульфонової кислоти (2екв). Через 4 години реакція була завершена. Для гасіння реакції додавали 1н NaOH (pH 9-10). Вміст колби переносили в ділильну лійку з метиленхлоридом і водою і екстрагували метиленхлоридом (3х). Об'єднані органічні екстракти сушили сульфатом магнію, фільтрували і кoнцeнтpyвали з отриманням неочищеного потрібного продукту у вигляді коричневої олії. Після очищення (10% аміак в 2М розчині метанол/етилацетат) отримували 0,067г потрібного продукту (52%). Потім вільний амінний продукт (0,0605г, 0,249ммоль) розчиняли в діетиловому ефірі і дoдaвали 2М розчин хлористого водню (0,137мл, 0,274ммоль). Через 40 хвилин жовтий осад вiдфiльтpoвyвали і oтpимyвали потрібний продукт. 1 Н ЯМP (ДМСО-d6 , 400МГц): d 9,64 (шир.с); 9,24 (шир.с); 7,06 (2д, 2Н); 6,76 (т, 1Н); 4,67 (с, 1Н); 4,05 (кв, 2Н); 3,35-3,12 (м, 5Н); 3,01 (2д, 1Н); 2,67 (м, 1Н); 2,03 (м, 1Н); 1,73-1,18 (м, 8Н). Мас-спектр: обчислено: 242,36; знайдено: 243,15 [М+Н]+. Приклад 7 5-ацетил-4,5,6,7,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,7,1іj]хінолін У круглодонну колбу додавали диметоксиметан (0,700мл, 7,89ммоль), який потім oxoлoджyвали до 0°С. Потім додавали комплекс тpифтopиду бору з діетиловим ефіром (0,366мл, 2,89ммоль) і пepeмiшyвали протягом 30 хвилин. Потім протягом десяти хвилин додавали розчин бензодіазепіну (0,5г, 2,63ммоль) і метиленхлориду (26,2мл). Після завершення додавання дoдaвали циклопентен (0,613мл, 5,25ммоль). Через 20 годин знов дoдaвали комплекс трифториду бору з діетиловим ефіром і диметоксиметан (0,33мл і 0,232мл, відповідно). Через 60 годин додавали 1н NaOH і суміш залишали на 15 хвилин для перемішування. Після перевірки водної фази на основність вміст колби переносили в ділильну лійку з метиленхлоридом. Реакційну суміш екстрагували метилен 31 79782 хлоридом (1х), органічний шар промивали насиченим розчином солі (1х), сушили над сульфатом магнію, фільтрували і концентрували з отриманням коричневої олії. Після очищення (етилацетат/гексан, 65:35,+1% TEA) отримували потрібний продукт. 1 Н ЯМР (ДМСО-d 6, 400МГц): d 7,2-6,67 (ар. м, 3Н); 4,38 (кв, 1Н); 4,06-3,98 (м, 1Н); 3,2-3,16 (м, 2Н); 2,91-2,88 (уяв.д, 2Н); 2,81-2,74 (м, 2Н); 1,971,94 (2с, 2Н); 1,9 (с, 2Н); 1,86-1,81 (м, 4Н); 1,661,63 (м, 2Н); 1,52-1,47 (м, 2Н); 1,12 (т, 2Η). Мас-спектр: обчислено: 298,42; знайдено: 299,21 [М+Н]+. Приклад 8 4,5,6,7,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,7,1ij]хінолін Сполуку прикладу 7 (0,5г, 1,67ммоль) розчиняли в метанолі (5мл). До суміші додавали КОН (0,99г і 16,7ммоль) і воду (5мл). Реакційну суміш нагрівали до 100°С і залишали на 4 години. Потім додавали метанол (10 мл) і суміш залишали ще на 20 годин (16мл). Через 24 години дoдaвали КОН (0,47г, 8,3ммоль) і метанол (16мл). Через 48 годин реакційну суміш охолоджували до кімнатної температури. Метанол видаляли і реакційну суміш переносили в ділильну лійку з метиленхлоридом і водою. Реакційну суміш екстрагували метиленхлоридом (3х). Об'єднані органічні екстракти сушили сульфа том магнію, фільтрували і кoнцeнтpyвали досуха з отриманням 430мг жовтої олії. Після очищення (20% аміак (2М розчин в суміші етанол/етилацетат)) отримували 0,273г потрібного продукту (63%). 1 Н ЯМР (СDСІ3, 400МГц): d 7,09 (д, 1Н); 6,97 (розд.д, 1Н); 6,83 (т, 1Η); 3,98-3,83 (2д, 2Н); 2,97 (м, 6Н); 2,45-2,12 (м, 3Н); 1,92 (т; 3Н); 1,73 (м, 2Н); 1,51 (м, 3Н); 1,22 (м, 1Н); 1,05 (кв, 1Н). Мас-спектр: обчислено: 256,39; знайдено: 257,26 [М+Н]+. Приклад 9 (9aR,14аS)-5-ацетил4,5,6,7,9,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,7,1іj]хінолін Потрібний продукт отримували після хірального розділення сполуки прикладу 7. 1 Н ЯМР (CDСІ3, 400МГц): d 7,14-6,79 (ар, 3Н); 4,40 (кв, 1Н); 4,17 (м, 1Н); 3,40-2,81 (м, 7Н); 2,011,40 (м, 14Н); 1,23-1,00 (kb, 3Н). Мас-спектр: обчислено: 298,43; знайдено: 299,2 [М+Н]+. Приклад 10 Гідрохлорид (9aR,14aS)4,5,6,7,9,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,7,1іj]хіноліну Сполуку прикладу 9 (0,695г, 2,33ммоль) розчиняли в метанолі (11мл). Потім додавали КОН (0,784г, 14ммоль) і воду (11мл). Реакційну суміш нагрівали до 125°С протягом 7,5 годин і потім перемішували при кімнатній температурі протягом ночі. Після завершення реакції протягом 29 годин додавали іншу порцію КОН (3,7екв.) і реакційну суміш знов нагрівали. Через 48 годин знов дода 32 вали КОН (3,2екв.) і реакційну суміш нагрівали ще 5 днів. Потім реакційну суміш о холоджували до кімнатної температури і метанол видаляли. Вміст колби переносили в дiлильну лійку і екстрагували метиленхлоридом (3х). Об'єднані органічні шари сушили сульфатом магнію, фiльтpyвали і концентрували з отриманням 0,705г жовтої олії. Після очищення (10-20% аміак (2М розчин в етанолі)/етилацетат) oтpимyвали 0,423г оранжевої олії (71%). Вільний амінний продукт (0,423г, 1,65ммоль) розчиняли в діетиловому ефірі. Потім додавали НСІ - 1М розчин в діетиловому ефірі (1,66мл). Після перемішування протягом 30 хвилин тверду речовину фiльтpyвали і сушили. 1 Н ЯМР (ДМСО-d6 , 400МГц): d 9,43 (шир.с); 8,85 (шир.с); 7,17 (д, 1Н); 7,14 (д, 1Н); 6,88 (т, 1Н); 4,08 (м, 2Н); 3,30 (д, 1Н); 3,12 (т, 3Н); 2,97 (д, 1Н); 2,83 (d і с, 2Н); 2,08 (м, 1Н); 1,89 (м, 3Н); 1,67 (м, 2Н); 1,55 (м, 2Н); 1,43 (кв, 1Н); 1,18 (м, 1Н); 1,00(кв, 1Н). Мас-спектр: обчислено: 256,39; знайдено: 257,2 [М+Н]+. Оптичне обертання: [a]D25=-148,94. Приклад 11 (9aS,14aR)-5-ацетил4,5,6,7,9,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,7,1іj]хінолін Потрібний продукт отримували після хірального розділення сполуки прикладу 7. 1 Н ЯМР (CDСІ3, 400МГц): d 7,16-6,83 (ар, 3Н); 4,47 (уяв.кв, 2Н); 4,20 (м, 1Н); 3,39 (т, 1Н); 3,13 (м, 1Н); 3,05 (м, 1Н); 2,91 (т, 3Н); 2,84 (т, 3Н); 2,02 (с, 1Н); 1,93-1,86 (м, 3Н); 1,75-1,61 (м, 2Н); 1,58-1,4 (м, 4Н); 1,20 (кв, 1Н); 1,03 (кв, 1Н). Мас-спектр: обчислено: 298,43; знайдено: 299,2 [М+Н]+. Приклад 12 Гідрохлорид (9aS,14aR)4,5,6,7,9,9a,10,11,12,13,14,14адодекагідроциклогепта[с][1,4] діазепіно[6,7,1іj]хіноліну Сполуку прикладу 11 (0,702г, 2,35ммоль) розчиняли в метанолі (11мл). Потім в колбу додавали КОН (0,792г, 14,1ммоль) і воду (11мл) і нагрівали до 125°С. Через 8 годин реакційну суміш охолоджували до кімнатної температури. Через 14 годин реакційну суміш нагрівали. Через 7 годин знов додавали метанол (7мл) і КОН (0,5г, 8,8ммоль). Через 24 години знов додавали КОН (0,5г, 8,8ммоль). Через 48 годин реакційну суміш охолоджували до кімнатної температури. Метанол видаляли і вміст колби переносили в ділильну лійку з метиленхлоридом і водою і eкcтpaгyвали метиленхлоридом (3х). Об'єднані екстракти сушили сульфатом магнію, фiльтpyвали і концентрували досуха з отриманням 0,430г жовтої олії. Після очищення (20% аміак (2М розчин в етанолі)/етилацетат) отримували 0,4625г потрібного продукту (77%). 1 Н ЯМР (ДМСО-d6 , 400МГц): d 9,25 (шир.с); 7,14 (д, 1Н); 7,10 (д, 1Н); 6,83 (т, 1Н); 4,03 (кв, 2Н); 3,36-3,15 (с прихований під піком води, 2Н); 3,06 (с, 3Н); 2,95 (д, 1Н); 2,80 (т і з, 2Н); 2,05 (м, 1Н); 1,85 (м, 3Н); 1,63 (т, 2Н); 1,52 (м, 2Н); 1,39 (кв, 1Н); 33 79782 1,17 (шир.т, 1Н); 0,99 (кв, 1Н). Мас-спектр: обчислено: 256,39; знайдено: 257,2 [М+Н]+. Оптичне обертання: [a]D25=+123,54 (CDCl3) Проміжна сполука 2 7-бром-2,3,4,5-тетрагідро-1Н-1,4-бензодіазепін 7-Бром-3,4-дигідро-1Н-1,4-бензодіазепін-2,5діон (11,8г, 46,2ммоль) переносили в круглодонну колбу. Потім в колбу додавали ТГФ (0,57М) і отримували суспензію. Потім по краплях додавали алюмогідрид літію в 1М розчині ТГФ (138;8ммоль). Після завершення реакції реакційну суміш нагрівали до 63°С. Через 19 годин реакційну суміш охолоджували до кімнатної температури і потім до 0°С. До охолодженої реакційної суміші додавали воду (3мл) і реакційну суміш пepeмiшyвали 1 годину. Через 1 годину дoдaвали 9мл 15% NaOH і реакційну суміш пepeмiшyвали ще 1 годину. Потім дoдaвали воду і о триманий осад відфільтровували. Потім осад декілька разів промивали етилацетатом. Розчинник видаляли з фільтрату і фільтрат переносили в дiлильну лійку з етилацетатом. Фільтрат eкcтpaгyвали етилацетатом (3х). Об'єднані органічні екстракти промивали насиченим розчином солі (1х), сушили сульфа том магнію, фiльтpyвали і концентрували з отриманням жовтої твердої речовини. Після очищення (спочатку 1% ТЕА/етилацет, потім 20% аміаком (2М розчин в метанолі)/етилацетат і потім 100% метиленхлоридом) отримували потрібний продукт. 1 Н ЯМР (CDCl3, 400МГц): d 7,2 (с, 1Н); 7,1 (дд, J=4,8Гц, 1Н); 6,6 (д, J=8Гц, 1Н); 3,8 (с, 2Н); 3,0 (дт, J=8Гц, 4Н). Мас-спектр: обчислено: 227,10; знайдено: 226,96 [М+Н]+. Проміжна сполука 3 Бензил-7-бром-1,2,3,5-тетрагідро-4Н-1,4бензодіазепін-4-карбоксилат Пpoмiжну сполуку 2 (4,5г, 19,8ммоль) розчиняли в ТГФ (0,2М) і охолоджували до 0°С. Потім до розчину проміжної сполуки 2 додавали основу Хьюніга (30,0ммоль). Через 10 хвилин по краплях додавали бензилхлорформіат (21,8ммоль). Потім реакційну суміш повільно нагрівали до кімнатної температури і залишали на 21 годину. Через 21 годину ТГФ видаляли, реакційну суміш розчиняли в діетиловому ефірі і воді і переносили в дiлильну лійку. Реакційну суміш екстрагували діетиловим ефіром (3х). Об'єднані органічні екстракти промивали водним бікарбонатом натрію (1х) і насиченим розчином солі (1х). Потім органічні екстракти сушили сульфа том магнію, фільтрували і кoнцeнтpyвали з отриманням жовтої твердої речовини. Після очищення (2,5% етилацетат/метиленхлорид) отримували 5,4г потрібного продукту (75%) у вигляді білої твердої речовини. 1 Н ЯМР (CDCl3, 400МГц): d 7,40-7,16 (м, 7Н); 6,6 (уяв..т, 1Н); 5,0 (с, 2Н); 4,39 (неосновний ротомер с, 2Н); 4,33 (основний ротомер с, 2Н); 3,7 (дт, 2Н); 3,1 (дт, 2Н). Мас-спектр: обчислено: 361,24; знайдено: 362,98 [М+Н]+. Приклад 13 Бензил-2-бром-6,7,9,9а,10,11,12,12аоктагідроциклопента[с][1,4]діазетно[6,7,1-іj]хінолін 34 5(4H)-карбоксилат Проміжну сполуку 3 (1г, 2,77ммоль) розчиняли в метиленхлориді (15мл). До розчину проміжної сполуки 3 додавали диметоксиметан (0,735мл, 8,3ммоль) і циклопентен (0,487мл, 5,53ммоль) і реакційну суміш о холоджували до 0°С. Потім по краплях додавали комплекс трифториду бору з діетиловим ефіром (0,386мл, 3,05ммоль). Peaкцiйну суміш поступово нагрівали до кімнатної температури і зaлишали на 18 годин при кімнатній температурі. Через 18 годин реакційну суміш охолоджували до 0°С. Потім знов додавали диметоксиметан (4,15ммоль), циклопентен (2,77ммоль) і комплекс трифториду бору з діетиловим ефіром (1,52ммоль). Реакційну суміш залишали на ніч для нагрівання до кімнатної температури. Через 48 годин (від початку до завершення реакції) до реакційної суміші додавали 1н NaOH (25мл) доти, поки рН суміші не ставав основним. Суміш переносили в дiлильну лійку з метиленхлоридом і екстрагували метиленхлоридом (3х). Об'єднані органічні шари промивали насиченим розчином солі (1х), сушили сульфа том магнію, фільтрували і концентрували з отриманням олії. Після очищення (метиленхлорид+1% TEA) отримували 0,228г кінцевої сполуки (20%). 1 Н ЯМР (ДМСО-d6 , 400МГц): d 5,08-4,97 (м, 2Н); 4,59-4,54 (т, 1Η); 4,21-4,14 (т, 1Н); 3,88-3,85 (д, 1Н); 3,04-2,89 (м, 2Н); 2,64-2,59 (т, 1Н); 2,23-2,18 (т або кв, 1Н); 1,99-1,96 (д, 1Н); 1,64-1,24 (д/кв або т/ т, 4Η). Мас-спектр: обчислено: 441,37; знайдено: 441,1 [М+Н]+. Приклад 14 Гідрохлорид 2-бром-4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4] діазепіно[6,7,1іj]хінолін Сполуку прикладу 13 (226мг, 0,517ммоль) розчиняли в метиленхлориді (0,800мл). До розчину сполуки прикладу 13 при кімнатній температурі додавали трифторметансульфонову кислоту (0,320мл, 3,62ммоль) і потім анізол (0,168мл, 1,55ммоль). Через 1 годину реакційну суміш о холоджували до 0°С. Через одну годину дoдaвали 1н NaOH в кількості, необхідній для доведення рН реакційної суміші до основного значення (суміш cтaвалa жовтою). Потім для розчинення осаду додавали метиленхлорид і суміш переносили в ділильну лійку. Реакційну суміш екстрагували метиленхлоридом (3х), потім об'єднані екстракти сушили сульфа том магнію, фiльтpyвали і кoнцeнтpyвали з отриманням коричневої маслянистої твердої речовини (230мг, вихід >100). Після очищення (1% аміак (2М розчин в МеОН)/етилацетат, потім 3% аміак (2М розчин в МеОН)/етилацетат і потім 5% аміак (2М розчин в МеОН)/етилацетат) отримували 0,130г вільного амінного продукту (82%). Вільний амінний продукт (0,423ммоль) розчиняли в діетиловому ефірі і в ізопропіловому спирті. Потім до розчину додавали НСІ (2М розчин в діетиловому ефірі) (0,423ммоль). Розчин перемішували 30 хвилин і темножовту тверду речовину відфільтровували. 1 Н ЯМР (ДМСО-d 6, 400МГц): d 7,36 (2Н, з); 4,19-4,15 (1Н, 2д); 4,02-3,96 (1Н, т і д); 3,78-3,68 35 79782 (4Н, шир.с); 3,38-3,34 (1Н, 2д); 3,15-2,99 (4Н, м); 2,92-2,88 (1Н, кв); 2,62-2,55 (т, 1Н); 2,23-2,14 (2Н, м); 1,96-1,92 (1Н, м); 1,61-1,57 (2Н, м); 1,51-1,2 (4Н, м). Мас-спектр: обчислено: 307,23; знайдено: 309,01 [М+Н]+. Приклад 15 Бензил-2-бром-6,7,9,9а,10,11,12,13,14,14адекагідроциклогепта[с][1,4]діазепіно[6,7,1-іj]хінолін5(4H)-карбоксилат Проміжну сполуку 3 (1г, 2,77ммоль) розчиняли в метиленхлориді (15мл) і при кімнатній температурі дoдaвали диметоксиметан (0,735мл, 8,30ммоль) і циклопентен (0,646мл, 5,54ммоль). Потім реакційну колбу охолоджували до 0°С і потім повільно протягом 5 хвилин дoдaвали комплекс трифториду бору з діетиловим ефіром (0,386мл, 3,05ммоль). Через 42 години додавали ще одну порцію диметоксиметану (4,14ммоль, 1,5екв.), циклопентену (2,77ммоль, 1екв.) і комплексу трифториду бору з діетиловим ефіром (1,52ммоль, 0,55екв.). Через 48 годин до реакційної суміші додавали 1н NaOH в кількості, необхідній для доведення рН реакційної суміші приблизно до 9-10. Вміст колби переносили в ділильну лійку і екстрагували метиленхлоридом (3х). Об'єднані органічні шари промивали насиченим розчином солі (1х), сушили сульфатом магнію, фільтрували і концентрували з отриманням зеленої речовини. Після очищення (10% етилацетат/гексан) отримували 0,806г потрібного продукту (62%). 1 Н ЯМР (CDCl3, 400МГц): d 7,37-7,29 (м, 5Н); 7,17 (с, 1Н); 7,03 (с, 1Н); 5,06 (м, 2Н); 4,56 і 4,45 (2д, 1Н); 4,20 (д, 1Н); 3,89 (2д, 1Н); 3,39-3,27 (м, 1Н); 3,03 (м, 2Н); 2,87 (д, 1Н); 2,78 (т, 1Н); 2,06 (м, 2Н); 1,89 (м, 3Н); 1,73 (д, 2Н); 1,59-1,35 (м, 3Н); 1,18 (д,1Н); 1,00 (кв,1Н). Приклад 16 Гідрохлорид 2-бром4,5,6,7,9,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,7,1іj]хіноліну Сполуку прикладу 15 (1г, 2,13ммоль) розчиняли в метиленхлориді (2,3мл) і охолоджували до 0°С. До розчину повільно додавали трифторметансульфонову кислоту (1,32мл, 14,9ммоль) і потім анізол (0,695мл, 6,39ммоль). Реакційну суміш перемішували при 0°С протягом 10 хвилин, потім при кімнатній температурі протягом 1 години, і на цьому етапі реакція була завершена. рН реакційної суміші коректували доданням 1н NaOH до основного значення. Потім реакційну суміш переносили в дiлильну лійку і екстрагували метиленхлоридом (3х). Об'єднані органічні екстракти сушили сульфатом магнію, фільтрували і кoнцeнтpyвали з отриманням жовтої олії. Після очищення (2-4% аміак (2М розчин в метанол)/етилацетат) отримували 0,630г потрібного вільного амінного продукту (88%). Вільний амінний продукт (1,85ммоль) розчиняли в діетиловому ефірі і в ізопропанолі. Потім додавали НСІ - 2М розчин в діетиловому ефірі (1,85ммоль). Розчин пepeмiшyвали протягом 30 хвилин і жовту тверду речовину відфільтровували. 1 Н ЯМР (ДМСО-d6, 400МГц): d 9,58 (шир.с, 1Н); 9,38 (шир.с, 1Н); 7,26 (д, 2Н); 4,10-4,07 (д, 1Н); 36 4,01-3,98 (д, 1Н); 3,2-3,08 (м, 3Н); 2,96-2,92 (д, 1Н); 2,84-2,75 (д/т, 1Н); 2,06-1,97 (т, 1Н); 1,91-1,77 (м, 3Н); 1,71-1,46 (м, 4Н); 1,43-1,32 (кв, 1Н); 1,18-0,94 (м,2Н). Мас-спектр: обчислено: 335,29; знайдено: 335,1 [М+Н]+. Проміжна сполука 4 7-хлор-2,3,4,5-тетрагідро-1Н-1,4-бензодіазепін 7-хлор-3,4-дигідро-1Н-1,4-бензодіазепін-2,5діон (15,05г, 71,4ммоль) перемішували в ТГФ (120мл). Потім поступово додавали алюмогідрид літію (1М розчин в ТГФ, 214,5мл, 214,4ммоль). Після завершення додання реакційну суміш нагрівали до 63°С і залишали на 19 годин. Через 19 годин реакційну суміш охолоджували до кімнатної температури і потім до 0°С Реакцію гасили водою, 15% NaOH і ще однією порцією води. Після перемішування реакційної суміші протягом 1 години осад відфільтровували і пpoмивали етилацетатом. ТГФ видаляли і вміст реакційної колби переносили в ділильну лійку з етилацетатом і водою. Вміст ділильної лійки екстрагували етилацетатом (3х). Об'єднані органічні екстракти промивали насиченим розчином солі (2х), сушили сульфатом магнію, фiльтpyвали і концентрували з отриманням неочищеного потрібного продукту. Після очищення перекристалізацією (з метиленхлориду) отримували оранжеві кристали. 1 Н ЯМР (CDCl3, 400МГц): d 7,05 (с, 1Н); 6,99 (дд, J=8Гц, 1Н); 6,66 (д, J=4Гц, 4Гц, 1Н); 3,89 (шир.с, 1Н); 3,82 (с, 2Н); 3,03 (дт, 4Н). Проміжна сполука 5 Бензил-7-бром-1,2,3,5-тетрагідро-4Н-1,4бензодіазепін-4-карбоксилат Проміжну сполуку 4 (5г, 27,4ммоль) розчиняли в ТГФ і о холоджували до 0°С. Потім додавали основу Хьюніга (41,1ммоль) і потім протягом десяти хвилин по краплях додавали бензилхлорформіат (31ммоль). Після 24-годинної реакції ТГФ видаляли і в колбу додавали воду і ефір. Реакційну суміш переносили в ділильну лійку і екстрагували ефіром (3х). Об'єднані органічні шари промивали водним бікарбонатом натрію (1х) і насиченим розчином солі (1х), потім сушили сульфатом магнію, фiльтpyвали і концентрували з отриманням жовтої твердої речовини. Після очищення (1-5% етилацетат/метиленхлорид) отримували 7,7г потрібного продукту (88%). 1 Н ЯМР (CDCl3, 400МГц): d 7,36-7,28 (м, 5Н); 7,06 (д, J=20, 1Н); 7,02 (д, 1Н); 6,67 (т, J=8,8, 1Н); 5,07, (с, 2Н); 4,36 (д, J=20, 2Н); 3,67 (т, J=4,8, 2Н); 3,12 (т, 2Н). Мас-спектр: обчислено: 316,79; знайдено: 317,03 [М+Н]+. Приклад 17 Бензил-2-хлор-6,7,9,9а,10,11,12,12аоктагідроциклопента[с][1,4]діазепіно[6,7,1ij]хінолін-5(4H)-карбоксилат Проміжну сполуку 5 (1г, 3,15ммоль) розчиняли в метиленхлориді (16мл). До реакційної суміші дoдaвали диметоксиметан (0,840мл, 9,47ммоль) і циклопентен (0,555мл, 6,31ммоль) і реакційну суміш oxoлoджyвали до 0°С. Потім повільно додавали комплекс трифториду бору з діетиловим ефіром (0,440мл, 3,47ммоль), реакційну суміш 37 79782 поступово нaгрiвали до кімнатної температури і залишали на 28 годин. Через 28 годин дoдaвали іншу порцію диметоксиметану, циклопентену і комплексу трифториду бор у з діетиловим ефіром (2екв., 1,3екв. і 0,73екв., відповідно). Через 18 годин рН доводили до 9, 10 доданням до реакційної суміші 1н NaOH і суміш перемішували 20 хвилин. Потім реакційну суміш переносили в ділильну лійку і екстрагували метиленхлоридом (3х). Об'єднані органічні шари промивали насиченим розчином солі (1х), сушили сульфатом магнію, фільтрували і концентрували з отриманням 1,46г неочищеного потрібного продукту у вигляді коричневої олії. Після очищення (10% етилацетат/гексан, потім 15% етилацетат/гексан) отримували 0,807г потрібного продукту з невеликими домішками вихідного продукту. Після другого очищення (метиленхлорид+1% TEA) отримували 0,750г потрібного продукту (60%). 1 Н ЯМР (ДМСО-d6, 400МГц): d 7,35 (м, 5Н); 7,15-7,03 (2д, з, 2Н); 5,02 (м, 2Н); 4,57 (т, 1Н); 4,17 (кв, 1Н); 3,86 (д, 1Н); 3,31 (м, 4Н); 2,95 (м, 3Н); 2,63 (т, 1Н); 2,21 (т, 1Н); 1,98 (т, 1Η); 1,64-1,24 (м, 3Н). Мас-спектр: обчислено: 396,91; знайдено: 397,1 [М+Н]+. Приклад 18 Гідрохлорид 2-хлор-4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1іj]хіноліну Сполуку прикладу 17 (0,527г, 1,33ммоль) розчиняли в метиленхлориді (2,5мл). До розчину дoдaвали трифторметансульфонову кислоту (0,822мл, 9,29ммоль) і анізол (0,433мл, 3,98ммоль). Peaкцiйну суміш витримували при кімнатній температурі протягом 1 години і потім охолоджували до 0°С. Потім рН реакційної суміші доводили до основного значення доданням 1н NaOH і реакційну суміш перемішували 20 хвилин. Потім дoдaвали метиленхлорид і реакційну суміш переносили в дiлильну лійку. Реакційну суміш екстрагували метиленхлоридом (3х), потім об'єднані органічні екстракти сушили сульфатом магнію, фільтрували і концентрували з отриманням коричневої олії (0,438г). Після очищення (100% етилацетат, потім 5% аміак в 2М розчині метанол/етилацетат і потім 10% аміак в 2М розчині метанол/етилацетат) отримували 0,329г вільного амінного продукту (68%). Вільний амін (0,310г, 1,18ммоль) розчиняли в діетиловому ефірі і в ізопропанолі. До розчину додавали НСІ - 2М розчин в діетиловому ефірі (0,590мл, 1,18ммоль). Розчин перемішували 30 хвилин, жовту тверду речовину відфільтровували і сушили з отриманням 0,300г кінцевого продукту. 1 Н ЯМР (ДМСО-d6, 400МГц): d 7,24 (с, 2Н); 4,18 (д, 1Н); 4,00 (д, 1Н); 3,36 (м, 1Н); 3,18-3,00 (м, 5Н); 2,9 (кв, 1Н); 2,59 (т, 1Н); 2,17 (кв, 2Н); 1,93 (м, 1Н); 1,61-1,48 (м, 2Н); 1,32-1,19 (м, 2Н). Мас-спектр: обчислено: 262,78; знайдено: 263,08 [М+Н]+. Приклад 19 Бензил-2-хлор-6,7,9,9а,10,11,12,13,14,14адекагідроциклогепта[с][1,4]діазепіно[6,7,1-іj]хінолін5(4Н)-карбоксилат Проміжну сполуку 5 (1г, 3,15ммоль) розчиняли 38 в метиленхлориді (16мл). До розчину додавали диметоксиметан (0,840мл, 9,47ммоль) і циклопентен (0,740мл, 6,31ммоль) і реакційну суміш о холоджували до 0°С. Потім повільно додавали комплекс трифториду бору з діетиловим ефіром, реакційну суміш поступово нагрівали до кімнатної температури і задники на 30 годин. Через 30 годин дoдaвали ще одну порцію комплексу трифториду бору з діетиловим ефіром, диметоксиметану і циклопентену (0,292мл, 0,560мл і 0,480мл, відповідно). Через 48 годин рН доводили до основного значення доданням 1н NaOH і суміш перемішували 20 хвилин. Вміст реакційної колби переносили в ділильну лійку і екстрагували метиленхлоридом (3х). Об'єднані екстракти промивали насиченим розчином солі (1х), сушили сульфатом магнію, фільтрували і концентрували з отриманням коричневої олії. Після очищення (10% етилацетат/гексан) отримували 0,998 г потрібного продукти (75%). 1 Н ЯМР (CDCl3, 400МГц): d 7,33 (м, 5Н); 7,106,89 (3с, 2Н); 5,05 (кв, 2Н); 4,58-4,55 (2д, 1Н); 4,20 (д, 1Н); 3,89 (2д, 1Н); 3,46 (шир.уяв.д, 1Н); 3,01 (τ, 2Η); 3,89 (д, 1Н); 2,82 (т, 1Н); 2,07 (кв, 1Н); 1,91 (кв, 3Н); 1,72 (д, 2Н); 1,60-1,46 (м, 4Н); 1,25-1,14 (м, 1Н); 1,03 (кв, 1Н). Мас-спектр: обчислено: 424,97; знайдено: 425,08 [М+Н]+. Приклад 20 Гідрохлорид 2-хлор4,5,6,7,9,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,7,1іj]хіноліну Сполуку прикладу 19 (0,585г, 1,38ммоль) розчиняли в метиленхлориді (2мл) і oxoлoджyвали до 0°С. Потім додавали трифторметансульфонову кислоту (0,853мл, 9,63ммоль) і анізол (0,449мл, 4,13ммоль). Реакційну суміш перемішували при 0°С протягом 5 хвилин і потім витримували при кімнатній температурі протягом 1 години. Реакційну суміш знов охолоджували до 0°С і рН доводили до основного значення доданням 1н NaOH. Реакційну суміш переносили в ділильну лійку з метиленхлоридом і водою і екстрагували метиленхлоридом (4х). Потім об'єднані органічні шари сушили сульфатом магнію, фільтрували і концентрували з отриманням жовтої олії (0,584г, неочищеної). Після очищення (5% аміак в 2М розчині метанол/етилацетат) отримували вільний амінний продукт (84%). Вільний амін (0,392г, 1,35ммоль) розчиняли в діетиловому ефірі і дoдaвали НСІ 2М розчин в діетиловому ефірі (0,740мл, 1,48ммоль). Після перемішування протягом 30 хвилин тверду речовину фільтрували і сушили повітрям. 1 Н ЯМР (ДМСО-d6 , 400МГц): d 7,2 (д, 2Н); 4,03 (2д, 2Н); 3,57 (шир.с, 2Н); 3,27 (кв, 1Н); 3,1 (прихований під піком води, ~2Н); 2,96 (д, 1Н); 2,88 (т, 2Η); 2,01 (шир.с, 1Н); 1,91-1,71 (шир.д, 3Н); 1,631,46 (м, 4Н); 1,36 (кв, 1Н); 1,2 (с, 1Н); 1,01 (кв, 1Н). Мас-спектр: обчислено: 290,83; знайдено: 291,10 [М+Н]+. Проміжна сполука 6 Бензил-7-феніл-1,2,3,5-тетрагідро-4Н-1,4бензодіазепін-4-карбоксилат 39 79782 Проміжну сполуку 3 (1г, 2,77ммоль), фенілборонову кислоту (0,506г, 4,15ммоль) і 1,4-діоксан (16,3мл) нагрівали до 80°С. Потім додавали Pd[p(o-толіл)3]3СІ2 (0,0653г, 0,08ммоль), карбонат калію (0,956г, 6,92ммоль) і воду (3,26мл), і реакційну суміш перемішували 2 години. Через 2 години реакційну суміш oxoлoджyвали до кімнатної температури, вміст колби фільтрували через шар целіту і потім целіт пpoмивали етилацетатом і водою. Фільтрат переносили в ділильну лійку і екстрагували етилацетом (2х). Об'єднані органічні шари промивали насиченим розчином солі (1х), сушили сульфатом магнію фільтрували і концентрували. Після очищення (метиленхлорид/гексан, 8:2, потім 100% метиленхлорид при появі потрібного продукту) отримували 0,754г потрібного продукту у вигляді жовтої олії (76%). 1 Н ЯМР (CDCl3, 400МГц): d 7,55 (д, 1Н); 7,407,23 (м, 11Н); 6,82 (д, 1Н); 5,07 (с, 2Н); 4,48 (д, 2Н); 4,73 (д, 2Н); 3,20 (д, 2Н). Мас-спектр: обчислено: 358,44; знайдено: 359,1 [М+Н]+. Приклад 21 " Бензил-2-Феніл-6,7,9,9а,10,11,12,12аоктагідроциклопента[с][1,4]діазепіно[6,1,1іj]хінолін-5(4Н)-карбоксилат Проміжну сполуку 6 (0,5г, 1,34ммоль) розчиняли в метиленхлориді (7мл). До розчину проміжної сполуки 6 дoдaвали диметоксиметан (0,370мл, 4,2ммоль) і циклопентен (0,246мл, 2,79ммоль) при кімнатній температурі. Після охолоджування реакційної суміші до 0°С по краплях додавали комплекс трифториду бору з діетиловим ефіром (0,194мл, 1,53ммоль). Потім реакційну суміш поступово нaгрiвали до кімнатної температури і залишали на 24 години. Через 24 години рН до реакційної суміші доводили до 10 доданням 1н NaOH. Вміст колби переносили в ділильну лійку і екстрагували метиленхлоридом (3х). Об'єднані екстракти промивали насиченим розчином солі (1х), сушили сульфатом магнію, фільтрували і концентрували. Після очищення (гексан/метиленхлорид, 1:1, потім гексан/етилацетат, 9:1) отримували 0,343г золотистого твердого масла (56%). 1 Н ЯМР (ДМСО-d6, 400МГц): d 7,59-7,53 (д, 1Н); 7,42 (м, 5Н); 7,33 (м, 5Н); 7,25-7,17 (д, с, 1Н); 7,12-7,04 (д, 1Н); 4,99 (м, 2Н); 4,67 (д, 1Н); 4,27 (д, 1Н); 3,90 (т, 1Н); 3,02 (м, 3Н); 3,70 (т, 1Н); 2,28 (м, 1Н); 2,00 (м, 1Н); 1,66 (м, 1Н); 1,55 (м, 1Н); 1,41 (т, 1Η); 1,28 (м,1Н). Мас-спектр: обчислено: 438,57; знайдено: 439,2 [М+Н]+. Приклад 22 Гідрохлорид 2-феніл-4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1іj]хіноліну Сполуку прикладу 21 (0,255г, 0,581ммоль) розчиняли в метиленхлориді (0,89мл). До розчину сполуки прикладу 21 додавали трифторметансульфонову кислоту (0,360мл, 11,3ммоль) і анізол (0,190мл, 1,74ммоль) при кімнатній температурі. Через 45 хвилин рН реакційної суміші доводили до 9-10 доданням 1н NaOH, потім в реакційну колбу додавали метиленхлорид і воду. Потім вміст колби переносили в дiлильну лійку екстрагували мети 40 ленхлоридом (4х). Потім об'єднані органічні екстракти сушили сульфатом магнію, фiльтpyвали і конценрували. Після очищення (10% аміак в 2М розчині етанол/етилацетат) отримували 0,157г вільного амінного продукту з невеликими домішками вихідної речовини (80%). Для додаткового очищення вільний амін розчиняли в суміші діетиловий ефір/ізопропанол і потім додавали НСІ - 2М розчин в діетиловому ефірі (1екв.). Через 30 хвилин отриманий осад фiльтpyвали і отримували потрібний продукт. 1 Н ЯМР (ДМСО-d6 , 400МГц): d 7,64-7,28 (Зд, 2т, м, 7Н); 4,31 (2д, 1Н); 4,17 (м, 1Н); 3,46 (уяв.т, 1Н); 3,22 (м, 3Н); 3,10-3,04 (д, т, 2Н); 2,74 (т, 1Н); 2,30 (м, 2Н); 2,02 (м, 1Н); 1,68 (д, 1Н); 1,59 (м, 1Н); 1,41 (м, 1Н); 1,30 (м, 1Н). Мас-спектр: обчислено: 304,43; знайдено: 305,1 [М+Н]+. Проміжна сполука 7 7-метокси-2,3,4,5-тетрагідро-1Н-1,4бензодіазепін До розчину 7-метокси-3,4-дигідро-1Н-1,4бензодіазепін-2,5-діону (3,1г, 15ммоль) в ТГФ (26мл) по краплях протягом 20 хвилин додавали алюмогідрид літію (1М розчин в ТГФ, 68мл, 68ммоль). Реакційну суміш нагрівали до 74°С і залишали на 24 години. Через 24 години реакцію гасили водою, 15% NaOH і ще однією порцією води. Потім реакційну суміш розбавляли етилацетатом і додавали сульфат натрію. Реакційну суміш перемішували протягом 1 години, потім фільтрували через шар целіту і цей шар промивали етилацетатом. Розчинник видаляли з фільтрату з отриманням неочищеного потрібного продукту. Після очищення (1% аміак в 2М розчині етанол/етилацетат, потім 3% і потім 5%) oтpимyвали 1,9г потрібного продукту у вигляді оранжевих кристалів (71%). 1 Н ЯМР (ДМСО-d6 , 400МГц): d 6,77 (д, J=8Гц, 1Н); 6,65 (дc, 1Н); 6,58 (дт, J=4Гц, 4Гц, 1Н); 5,04 (шир.с, 1Н); 3,65 (с, 3Н); 3,62 (с, 2Н); 2,81 (д, 4Н). Мас-спектр: обчислено: 178,23; знайдено: 179,1 [М+Н]+. Проміжна сполука 8 Бензил-7-метокси-1,2,3,5-тетрагідро-4Н-1,4бензодіазепін-4-карбоксилат Проміжну сполуку 7 (1,5г, 8,4ммоль) розчиняли в метиленхлориді (42мл) і охолоджували до 0°С. Потім додавали основу Хьюніга (2,20мл, 12,6ммоль) і бензилхлорформіат (1,32мл, 9,26ммоль) і потім реакційну суміш нaгрiвали до кімнатної температури. Через 4 години вміст колби переносили в ділильну лійку і екстрагували метиленхлоридом (3х). Об'єднані органічні екстракти промивали насиченим бікарбонатом натрію (1х) і насиченим розчином солі (1х), потім сушили сульфатом магнію, фільтрували і концентрували. Після очищення (гексан/етилацетат, 8:2, потім гексан/етилацетат, 1:1) отримували 1,25г потрібного продукту (50%). 1 Н ЯМР (ДМСО-d6, 400МГц): d 7,33 (м, 5Н); 6,80 (д, J=4Гц, 1Н); 6,71-6,64 (д, с, 1Н); 5,27 (шир.с, 1Н); 5,04 (с, 2Н); 4,31 (д, J=8Гц, 2Н); 3,67 (с, 1Н); 3,59 (с, 2Н); 3,54 (с, 1Н); 2,95 (с, 2Н). Мас-спектр: обчислено: 312,37; знайдено: 41 79782 313,1 [М+Н]+. Приклад 23 Бензил-2-метокси-6,7,9,9а, 0,11,12,12аоктагідроциклопента[с][1,4]діазепіно[6,7,1іj]хінолін-5 (4H-карбоксилат До розчину проміжної сполуки 8 (0,5г, 1,67ммоль) в метиленхлориді (8мл) додавали диметоксиметан (0,330мл, 3,35ммоль) і циклопентен (0,40мл, 5,0ммоль) при кімнатній температурі. Після охолоджування реакційної суміші до 0°С повільно додавали комплекс трифториду бору з діетиловим ефіром (0,234мл, 1,84ммоль). Реакційну суміш поступово доводили до кімнатної температури і залишали на 120 годин. Через 120 годин рН реакційної суміші доводили до 12 доданням 1н NaOH і потім додавали воду і метиленхлорид. Реакційну суміш екстрагували метиленхлоридом (3х). Об'єднані органічні шари промивали насиченим розчином солі (1х), сушили сульфатом магнію, фільтрували і кoнцeнтpyвали. Після очищення (етилацетат/гексан, 9:1, потім етилацетат/гексан, 75:25, потім етилацетат/гексан, 1:1) отримували 0,371г потрібного продукту (56%). 1 Н ЯМР (ДМСО-d6, 400МГц): d 7,33 (м, 5Н); 6,69 (с, 1Н); 6,63-6,54 (с, 1Н); 5,07-4,94 (м, 2Н); 4,53 (м, 1Н); 4,15 (основний ротомер, д, 1Н); 4,09 (неосновний ротомер, д,); 3,89 (т, 1Н); 3,69 (с, 1Н); 3,60 (с, 2Н); 3,12 (д, 1Н); 2,95 (дд, 1Н); 2,88 (кв, 1Н); 2,83 (т, 1Н); 2,61 (т, 1Н); 2,22 (45, 2Н); 1,99 (м, 1Н); 1,64 (м, 1Н); 1,53 (м, 1Н); 1,33 (м, 1Н); 1,22 (м, 1Н). Мас-спектр: обчислено: 392,50; знайдено: 393,1 [М+Н]+. Приклад 24 Гідрохлорид 2-метокси4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1іj]хіноліну До розчину сполуки прикладу 23 (0,315г, 0,803ммоль) в метиленхлориді (1,2мл) додавали трифторметансульфонову кислоту (0,497мл, 5,61ммоль) і анізол (0,262мл, 2,41ммоль). При кімнатній температурі через 90 хвилин реакція була завершена. Реакційну суміш підлуговували 1н NaOH (рН=12) і розбавляли водою і метиленхлоридом. Вміст колби переносили в ділильну лійку і екстрагували метиленхлоридом (4х). Потім об'єднані екстракти сушили сульфатом магнію, фiльтpyвали і кoнцeнтpyвали з отриманням неочищеного потрібного продукту. Після очищення (10% аміак в 2М розчині етанол/етилацетат) oтpимyвали 0,150г жовтої твердої речовини (73%). Потім вільний амін розчиняли в діетиловому ефірі і додавши 2М розчин хлористого водню в діетиловому ефірі (1екв). Після перемішування протягом 30 хвилин отриманий осад фільтрували і oтpимyвали ясно-жовту тверду речовину. 1 Н ЯМР (ДМСО-d6 , 400МГц): d 9,72 (шир.с); 8,70 (шир.с); 6,87 (д, 1Н); 6,83 (д, J=4Тц, 1Н); 4,174,15 (д, 1Н); 4,07 (т, J=8Гц, 8Гц, 1Н); 3,72 (с, 3Н); 3,33 (д, 1Н); 3,16 (м, 2Н); 3,03 (м, 2Н); 2,94 (кв, 1Н); 2,63 (т, 1Н); 2,24 (м, 2Н); 2,00 (м, 1Н); 1,66 (м, 1Н); 1,56 (м, 1Н); 1,35 (м, 1Н); 1,25 (м, 1Н). Мас-спектр: обчислено: 258,36; знайдено: 259,1 [М+Н]+. 42 Проміжна сполука 9 8-фтор-2,3,4,5-тетрагідро-1Н-1,4-бензодіазепін У колбу, що містить 8-фтор-3,4-дигідро-1Н-1,4бензодіазепін-2,5-діон (2,11г, 10,9ммоль) додавали ТГФ (19,1мл). Потім по краплях протягом 10 хвилин додавали алюмогідрид літію в 1М розчині ТГФ (48,9мл, 48,9ммоль). Реакційну суміш кип'ятили із зворотним холодильником протягом 5,5 години і потім залишали на ніч для охолоджування до кімнатної температури. Через 18 годин присутність вихідної речовини вже не cпocтepiгалacя. Реакцію гасили водою, 15% гідроксидом натрію і ще однією порцією води. Потім білий осад відфільтровували і ТГФ видаляли з фільтрату. Потім вміст колби переносили в дiлильну колонку з використанням етилацетату і води і екстрагували етилацетатом (3х). Об'єднані органічні екстракти пpoмивали насиченим розчином солі (1х), потім сушили сульфатом магнію, фільтрували і концентрували з отриманням жовтої олії. Після очищення (15% аміак в 2М розчині етанол/етилацетат) отримували потрібну сполуку. 1 Н ЯМР (CDCl3, 400МГц): d 7,02 (т, J=4, 8Гц, 1Н); 6,54-6,41 (м, 2Н); 3,82 (с, 2Н); 3,09 (т, 2Н); 3,02 (т, 2Н); 1,72 (шир.с, 1Н). Мас-спектр: обчислено: 166,1982; знайдено: 167,1 [М+Н]+. Проміжна сполука 10 Бензил-8-фтор-1,2,3,5-тетрагідро-4Н-1,4бензодіазепін-4-карбоксилат Проміжну сполуку 9 (0,450г, 2,7ммоль) розчиняли в метиленхлориді (13,5мл) і потім охолоджували до 0°С. Потім дoдaвали основу Хьюніга (0,707мл, 4,06ммоль) і бензилхлорформіат (0,386мл, 2,7ммоль) і реакційну суміш нагрівали до кімнатної температури. Після втримання протягом 3,5 днів при кімнатній температурі вміст колби переносили в ділильну лійку, промивали водою (1х) і екстрагували метиленхлоридом (3х). Об'єднані органічні шари промивали насиченим бікарбонатом натрію і насиченим розчином солі (1х, кожним), потім сушили сульфатом магнію, фільтрували і кoнцeнтpyвали, отримуючи неочищений продукт у вигляді жовтої олії. Після очищення (20% етилацетан/гексан+1% TEA) отримували 0,460г потрібного продукту у вигляді зеленої олії (56%). 1 Н ЯМР (CDCl3, 400МГц): d 7,35-7,24 (м, 5Н); 6,99 (т, 1Н); 6,50 (д, 2Н); 5,07 (с, 2Н); 4,40 (д, 2Н); 3,70 (д, 2Н); 3,17 (д, 2Н). Мас-спектр: обчислено: 300,33; знайдено: 301,1 [М+Н]+. Приклад 25 Бензил-1-фтор-6,7,9,9а,10,11,12,12аоктагідроциклопента[с][1,4]діазепіно[6,7,1іj]хінолін-5(4H)-карбоксилат До розчину проміжної сполуки 10 (0,75г, 2,5ммоль) і метиленхлориду (12,5мл) додавали диметоксиметан (0,663мл, 74,9ммоль) і циклопентен (0,439мл, 49,9ммоль). Реакційну суміш охолоджували до 0°С і по краплях дoдaвали комплекс трифториду бору з діетиловим ефіром (0,348мл, 2,75ммоль). Реакційну суміш нагрівали до кімнатної температури. Через 24 години знов дoдaвали трифторид бору (0,73екв.), диметоксиметан (2екв.) 43 79782 і циклопентен (1,3екв.). Через 48 годин рН реакційної суміші доводили до 8-9 доданням 1н гідроксиду натрію. Потім вміст колби переносили в ділильну лійку і екстрагували метиленхлоридом (3х). Об'єднані екстракти промивали насиченим розчином солі (1х), сушили суль фатом магнію, фільтрували і концентрували з отриманням жовтої олії. Після очищення (5% ТЕА/гексан) отримували 0,664г потрібного продукту (70%). 1 Н ЯМР (ДМСО-d6 , 400МГц): d 7,39-7,26 (м, 5Н); 6,97 (дт, 1Н); 6,60 (т, 1Η); 5,03 (кв, 2Н); 4,60 (м, 1Н); 3,86 (д, 1Н); 3,32 (д, 1Н під піком води); 3,00 (д, 2Н); 2,94 (кв, 2Н); 2,69 (т, 1Н); 2,23 (м, 1Н); 2,18 (м, 1Н); 1,96 (м, 1Н); 1,64 (м, 1Н); 1,57 (м, 1Н); 1,28 (т, 2Η). Мас-спектр: обчислено: 380,4622; зйайдено: 381,1 [М+Н]+. Приклад 26 Гідрохлорид 1-фтор-4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1іj]хіноліну Сполуку прикладу 25 (0,350г, 0,923ммоль) розчиняли в метиленхлориді (1,41мл). Потім при кімнатній температурі додавали трифторметансульфонову кислоту (0,570мл, 6,4ммоль) і анізол (0,300мл, 2,7ммоль). Через 4,5 годин рН реакційної суміші доводили до 8-9 доданням 1н NaOH і розчин перемішували протягом 20 хвилин. Вміст колби переносили в ділильну лійку і екстрагували метиленхлоридом (3х). Потім об'єднані органічні екстракти сушили сульфатом магнію, фільтрували і концентрували. Після очищення (15% аміак в 2М розчині етанол/етилацетат) отримували 0,1514г потрібного вільного амінного продукту у вигляді жовтої олії (67%). Вільний амінний продукт (0,1514г, 0,61ммоль) розчиняли в діетиловому ефірі, потім додавали НСІ - 2М розчин в діетиловому ефірі. Суміш перемішували протягом 30 хвилин і ясно-жовто тверду речовину вiдфiльтpoвyвали. 1 Н ЯМР (CDCl3, 400МГц): d 10,09 (шир.с); 9,21 (шир.с); 7,12 (т, 1Н); 6,62 (т, 1Н); 4,26 (д, 1Н); 4,14 (т, 1Η); 3,42 (с, 3Н); 3,27 (д, 1Н); 3,03-2,91 (м, 2Н); 2,8 (т, 1Н); 2,35 (м, 1Н); 2,15 (д, 1Н); 2,01 (м, 1Н); 1,75-1,56 (м, 2Н); 1,28 (т, 2Η). Мас-спектр: обчислено: 246,33; знайдено: 247,1 [М+Н]+. Приклад 27 Бензил-1-фтор-6,7,9,9а,10,11,12,13,14,14адекагідроциклопента[с][1,4]діазепіно[6,7,1іj]хінолін-5(4Н)-карбоксилат До розчину, що містить проміжну сполуку 10 (0,75т, 2,5ммоль) в метиленхлориді (12,5мл), додавали диметоксиметан (0,663мл, 74,9ммоль) і циклопентен (0,583мл, 49,9ммоль). Реакційну суміш охолоджували до 0°С і по краплях дoдaвали комплекс трифториду бору з діетиловим ефіром (0,348мл, 2,75ммоль). Реакційну суміш нагрівали до кімнатної температури і через 24 години знов додавали трифторид бору (0,73екв.), диметоксиметан (2екв.) і циклопентен (1,3екв.). Через 48 годин рН реакційної суміші доводили до 8-9 доданням 1н гідроксиду натрію. Потім вміст колби переносили в ділильну лійку і екстрагували метиленхлоридом (3х). Об'єднані екстракти промивали 44 насиченим розчином солі (1х), сушили сульфатом магнію, фільтрували і кoнцeнтpyвали з отриманням жовтої олії. Після очищення (5% ТЕА/гексан) отримували 0,620г потрібного продукту (61%). 1 Н ЯМР (ДМСО-d6 , 400МГц): d 7,39-7,22 (м, 5Н); 6,95 (дт, J=8, 16, 1Н); 6,55 (т, J=4, 6, 1Н); 5,03 (кв, 2Н); 4,52 (2д, 1Н); 4,26 (т, 1Н); 3,85 (шир.м, 1Н); 3,42 (т, 2Η під піком води); 3,02 (кв, 1Н); 2,94 (д, 2Н); 2,85 (т, 1Н); 1,97 (т, 2Н); 1,85 (д, 2Н); 1,70 (т, 1Н); 1,54-1,4 (м, 4Н); 1,17 (т, 1Н); 0,97 (кв, 1Н). Мас-спектр: обчислено: 408,51; знайдено: 409,2 [М+Н]+. Приклад 28 Гідрохлорид 1-фтор4,5,6,7,9,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазетно[6,7,1іj]хіноліну До розчину, що містить сполуку прикладу 27 (0,310г, 0,75ммоль) в метиленхлориді (1,15мл), додавали трифторметансульфонову кислоту (0,470мл, 5,3ммоль) і анізол (0,247мл, 2,27ммоль) при кімнатній температурі. Через 4,5 години дoдaвали 1н NaOH в кількості, достатній для доведення рН реакційної суміші до основного значення. Вміст колби переносили в дiлильну лійку і eкcтpaгyвали метиленхлоридом (3х). Потім об'єднані органічні екстракти сушили сульфатом магнію, фiльтpyвали і концентрували з отриманням неочищеного продукту. Після очищення (15% аміак в 2М розчині етанол/етилацетат) отримували 0,1335г вільного амінного продукту (64%). Вільний амін (0,1335г, 0,49ммоль) розчиняли в діетиловому ефірі і потім додавали НСl - 2М розчин в діетиловому ефірі (0,245мл, 0,49ммоль). Отриману суміш перемішували протягом 30 хвилин і жовту тверду речовину фiльтpyвали. 1 Н ЯМР (ДМСО-d6 , 400МГц): d 9,22 (шир.с); 7,18 (т, 1Н); 6,67 (т, 1Н); 4,10 (д, 1Н); 4,01 (д, 1Н); 3,34 (м, 2Н); 3,14 (м, 3Н); 2,95 (д, 2Н); 2,80 (т, 1Н); 1,93 (м, 2Н); 1,82 (т, 1Н); 1,78 (м, 2Н); 1,43 (м, 4Н); 1,16 (м, 1Н); 0,95 (кв, 1Н). Мас-спектр: обчислено: 274,38; знайдено: 275,1 [М+Н]+. Проміжна сполука 11 8-(трифторметил)-2,3,4,5-тетрагідро-1Н-1,4бензодіазепін До розчину 8-(трифторметил)-3,4-дигідро-1Н1,4-бензодіазепін-2,5-діону (1,5г, 6,1ммоль) в ТГФ (11мл) при кімнатній температурі протягом 10 хвилин додавали алюмогідрид літію в ТГФ (28мл, 28ммоль). Після завершення додання реакційну суміш нагрівали до 68°С. Через 24 години протягом 5 хвилин знов додавали алюмогідрид літію в ТГФ (12,3ммоль). Через 3 години реакційну суміш охолоджували до 0°С, потім реакцію гасили водою, 15% NaOH і ще однією порцією води. Після відфільтровування сірого осаду і його промивання етилацетатом розчинник видаляли з фільтрату. Отриману тверду речовину знов розчиняли в етилацетаті і переносили в ділильну лійку, потім промивали водою (3х), сушили сульфатом магнію, фільтрували і концентрували з отриманням жовтої твердої речовини. Після очищення (15% аміак в 2М розчині етанол/етилацетат) отримували 0,918г потрібних пpoдукти (69%). 45 79782 1 Н ЯМР (CDCl3, 400МГц): d 7,16 (д, J=8Гц, 1Н); 7,03 (д, J=8Гц, 1Н); 6,97 (с, 1Н); 4,04 (шир.с, 1Н); 3,90 (с, 2Н); 3,10 (д, J=4Гц, 2Н); 3,04 (м, J=4Гц, 8Гц, 2Н); 1,56 (шир.с, 1Н). Мас-спектр: обчислено: 216,20; знайдено: 217,0 [М+Н]+. Проміжна сполука 12 Бензил-8-(трифторметил)-1,2,3,5-тетрагідро4Н-1,4-бензодіазепін-4-карбоксилат Проміжну сполуку 11 (0,818г, 3,78ммоль) розчиняли в метиленхлориді (19мл) і потім охолоджували до 0°С. Потім додавали основу Хьюніга (0,989мл, 5,68ммоль) і бензилхлорформіат (0,594мл, 4,16ммоль) і реакційну суміш нагрівали до кімнатної температури. Через 90 хвилин реакція була завершена. Вміст колби переносили в дiлильну лійку і додавали воду. Водний шар eкcтpaгyвали метиленхлоридом (3х) і об'єднані органічні шари промивали насиченим бікарбонатом натрію (1х) і насиченим розчином солі (1х). Потім органічний шар сушили сульфатом магнію, фільтрували і концентрували, отримуючи коричневу олію. Після очищення (метиленхлорид) отримували 0,697г потрібного продукти (53%). 1 Н ЯМР (CDCl3, 400МГц): d 7,35 (м, 5Н); 7,23, 7,13, 6,98 (д, д, с, 3Н спільний); 5,06 (с, основний ротомер), 5,04 (с, неосновний ротомер), спільний 2Н; 4,45 (д, 2Н); 3,70 (сд, 2Н); 3,20 (дт, 2Н). Мас-спектр: обчислено: 350,34; знайдено: 351,0 [М+Н]+. Приклад 29 Бензил-1-(трифторметил)6,7,9,9а,10,11,12,12аоктагідроциклопента[с][1,4]діазепіно[6,7,1іj]хінолін-5(4H)-карбоксилат До розчину, щo містить проміжну сполуку 12 (0,5г, 1,4ммоль), розчинену в метиленхлориді (7мл), додавали диметоксиметан (0,38мл, 4,3ммоль) і циклопентен (0,251мл, 2,85ммоль) при кімнатній температурі. Потім реакційну суміш охолоджували до 0°С і по краплях додавали комплекс трифториду бору з діетиловим ефіром (0,199мл, 1,57ммоль). Через 24 години реакція була завершена, і реакційну суміш підлуговували до рН 10 доданням 1н NaOH. Вміст колби переносили в ділильну лійку і екстрагували метиленхлоридом (3х). Об'єднані екстракти промивали насиченим розчином солі (1х), сушили сульфатом магнію, фільтрували і концентрували з отриманням неочищеного продукту. Після очищення (гексан/метиленхлорид, 1:1) отримували 0,366г потрібної речовини (60%). 1 Н ЯМР (ДМСО-d6 , 400МГц): d 7,33-7,07 (тсдт, 8Н); 5,04 (розщеплений д, 2Н); 4,61 (2д, 1Н); 4,524,44 (сдс, 1Н); 3,87 (шир.2д, 1Н); 3,55 (м, 1Н); 3,36 (м, 1Н); 3,18 (с, 2Н) 3,01 (м, 1Н); 2,83 (кв, 1Н); 2,22 (шир.т, 1Н); 2,12 (м, 1Н); 1,90 (м, 1Н); 1,70 (м, 1Н) 1,60 (м, 1Н); 1,47 (м, 1Н); 1,36 (м, 1Н); 1,24 (с, 1Н). Мас-спектр: обчислено: 430,47; знайдено: 431,1 [М+Н]+. Приклад 30 Гідрохлорид 1-(трифторметил)4,5,6,1,9,9а,10,11,12,12адекагідроциклопента[с][1,4][6,7,1-іj]хіноліну До розчину, що містить сполуку прикладу 29 46 (0,345г, 0,80ммоль), розчинену в метиленхлориді (1,2мл), додавали трифторметансульфонову кислоту (0,496мл, 5,6ммоль) і анізол (0,261мл, 2,4ммоль) при кімнатній температурі. Через 1 годину реакція була завершена, і реакційну суміш підлуговували до рН 12 доданням 1н NaOH. Потім дoдaвали воду і метиленхлорид і реакційну суміш пepeмiшyвали 45 хвилин. Вміст колби переносили в ділильну лійку і водний шар екстрагували метиленхлоридом (4х). Об'єднані органічні шари сушили сульфатом магнію, фiльтpyвали і концентрували з отриманням жовтої олії. Після очищення (10% аміак в 2М розчині етанол/етилацетат) отримували 0,190г вільного амінного продукту (80%). Потім вільний амін повністю розчиняли і перетворювали в гідрохлоридну сіль. Після розчинення сполуки в діетиловому ефірі додавали НСІ - 2М розчин в діетиловому ефірі (0,32мл, 0,64ммоль). Отриману суміш пepeмiшyвали протягом 30 хвилин і жовтий осад, що утворився, вiдфiльтpoвyвали з отриманням 0,1932г потрібного продукту. 1 Н ЯМР (ДМСО-d6, 400МГц): d 7,38 (д, J=4Тц, 1Н); 7,23 (д, J=8Гц, 1Н); 4,24 (кв, 2Н); 3,52 (дт, 1Н); 3,31-3,20 (м, 4Н); 3,12 (2д, 1Н); 2,85 (т, 1Н); 2,21 (м, 2Н); 1,92 (м, 1Н); 1,67 (м, 2Н); 1,45 (м, 2Н). Мас-спектр: обчислено: 296,33; знайдено: 297,1 [М+Н]+. Проміжна сполука 13 8-фтор-7-метокси-2,3,4,5-тетрагідро-1Н-1,4бензодіазепін До розчину 8-фтор-7-метокси-3,4-дигідро-1Н1,4-бензодіазепін-2,5-діону (5,1г, 227ммоль), розчиненого в ТГФ (39,8мл) по краплях додавали алюмогідрид літію (1М розчин в ТГФ, 102,4мл, 102,4ммоль). Реакційну суміш кип'ятили із зворотним холодильником. Через 26 годин знов додавали один eквiвалeнт алюмогідриду літію в ТГФ (22,7ммоль). Через 30 годин реакцію гасили водою, 15% NaOH і ще однією порцією води. Осад фільтрували і промивали етилацетатом. ТГФ видаляли з фільтрату і потім в колбу додавали етилацетат і воду. Весь вміст колби переносили в ділильну лійку і екстрагували етилацетатом (3х). Потім об'єднані органічні шари промивали насиченим розчином солі (1х), сушили сульфатом магнію, фільтрували і концентрували з отриманням коричневої олії. Після очищення (15% аміак в 2М розчині етанол/етилацетат) отримували потрібний продукт. 1 Н ЯМР (ДМСО-d6 , 400МГц): d 6,82 (д, J=8Гц, 1Н); 6,65 (д, 1Н, J=12Гц, 1Н); 5,2 (шир.с, 1Н); 3,68 (с, 3Н); 3,58 (с, 2Н); 2,80 (дт, J=4Гц, 2Н); 2,74 (дт, J=4Гц, 2Н). Проміжна сполука 14 Бензил-8-фтор-7-метокси-2,3,4,5-тетрагідро4Н-1,4-бензодіазепін-4-карбоксилат Проміжну сполуку 13 (1,4г, 7,13ммоль) розчиняли в метиленхлориді (35,6мл) і потім охолоджували на крижаній бані до 0°С. Потім додавали основу Хьюніга (1,86мл, 10,7ммоль) і бензилхлорформіат (1,02мл, 7,13ммоль) і після завершення додання peaкцiйну суміш нагрівали до кімнатної температури. Через 1 годину реакція була завершена. Вміст колби переносили в ділильну лійку і промивали водою (1х). Водний шар 47 79782 екстрагували метиленхлоридом (2х). Об'єднані органічні шари промивали водним бікарбонатом натрію (1х) і насиченим розчином солі (1х), потім сушили сульфатом магнію, фільтрували і концентрували, отримуючи неочищений потрібний продукт у вигляді жовтої олії. Після очищення (гексан/етилацетат, 65:35) отримували 1,8г жовтої твердої речовини (78%). 1 Н ЯМР (ДМСО-d6, 400МГц): d 7,27 (м, 5Н); 6,88-6,73 (2д, 1Н); 6,66 (д, 1Н); 5,42 (д, 1Н); 4,99 (с, 2Н); 4,28 (с, 2Н); 3,70 (с, 1Н); 3,53 (т, 4Н); 2,96 (шир.с, 2Н). Мас-спектр: обчислено: 330,36; знайдено: 331,1 [М+Н]+. Приклад 31 Бензил-1-фтор-2-метокси6,7,9,9а,10,11,12,12аоктагідроциклопента[с][1,4]діазепіно[6,7,1іj]хінолін-5(4Н)-карбоксилат До розчину, що містить проміжну сполуку 14 (0,600г, 1,81ммоль), розчинену в метиленхлориді (9мл), дoдaвали диметоксиметан (0,482мл, 5,45ммоль) і циклопентен (0,319мл, 3,63ммоль) при кімнатній температурі. Реакційну суміш охолоджували до 0°С і потім додавали комплекс трифториду бор у з діетиловим ефіром (0,253мл, 1,99ммоль). Через 24 години дoдaвали другу порцію диметоксиметану (2екв.), циклопентену (1,3екв.) і комплексу трифториду бору з діетиловим ефіром (0,73екв.). Через 48 годин додавали третю порцію диметоксиметану (2,25екв.), циклопентену (1,5екв.) і комплексу трифториду бор у з діетиловим ефіром (0,825екв.). Через 72 години реакційну суміш підлуговували 1н NaOH. Вміст колби переносили в ділильну лійку і eкcтpaгyвали метиленхлоридом (3х). Об'єднані органічні шари промивали насиченим розчином солі (1х), сушили сульфатом магнію, фільтрували і концентрували з отриманням 0,830г потрібного продукту. 1 Н ЯМР (ДМСО-d6, 400МГц): d 7,29 (с, 5Н); 6,85 і 6,67 (д, 1Н); 5,71 (с, 1Н); 4,97 (м, 2Н); 4,50 (д, 1Н); 4,09 (д, 1Н); 3,85-3,72 (т, з, 1Н); 3,19-3,09 (м, 2Н); 2,91 (м, 2Н); 2,59 (т, 1Н); 2,21-2,12 (м, 2Н); 1,89 (м, 1Н); 1,61-1,47 (м, 2Н); 1,20 (кв, 2Н). Приклад 32 Гідрохлорид 1-фтор-2-метокси4,5,6,7,9,9а,10,11,12,12адекагідроциклопента[с][1,4]діазепіно[6,7,1іj]хіноліну До розчину, що містить сполуку прикладу 31 (0,4г, 0,98ммоль), розчинену в метиленхлориді (1,5мл), додавали трифторметансульфонову кислоту (0,603мл, 6,82ммоль) і анізол (0,318мл, 2,92ммоль) при кімнатній температурі. Через 5 годин знов додавали трифторметансульфонову кислоту (3,5екв.) Через 8 годин реакційну суміш пiдлyгoвyвали 1н NaOH. Вміст колби переносили в ділильну лійку і екстрагували метиленхлоридом (3х). Об'єднані органічні екстракти сушили сульфатом магнію, фільтрували і концентрували з отриманням неочищеного продукту. Після очищення (5% аміак в 2М розчині етанол/етилацетат) отримували 0,191г вільного амінного продукту з невеликими домішками (вихід 71%). Вільний амінний продукт (0,191г) розчиняли в етилацетаті, вна 48 слідок чого осаджувався білий осад. Після сушіння отримували 0,142г вільного амінного продукти (53%). Вільний амін (0,142г, 0,514ммоль) розчиняли в діетиловому ефірі і додавали НСІ - 2М розчин в діетиловому ефірі (0,257мл, 0,514ммоль). Отриману суміш перемішували протягом 30 хвилин і потім тверду речовину відфільтровували. 1 Н ЯМР (ДМСО-d6, 400 МГц): d 7,18 (д, 1Н); 4,22 (д, 1Н); 4,03 (д, 1Н); 3,79 (с, 3Н); 3,19 (д, 1Н); 3,15-3,07 (м, 1Н); 3,01 (м, 3Н); 2,66 (т, 1Н); 2,25 (м, 2Н); 2,21-1,95 (м, 1Н); 1,69-1,58 (м, 3Н); 1,28 (м, 2Н). Мас-спектр: обчислено: 276,35; знайдено: 277,1 [М+Н]+. Приклад 33 Бензил-1-фтор-2-метокси6,7,9,9а,10,11,12,13,14декагідроциклогепта[с][1,4]діазепіно[6,7,1-іj]хінолін5(4H)-карбоксилат До розчину, що містить проміжну сполуку 14 (0,600г, 1,81ммоль), розчинену в метиленхлориді (9мл), додавали диметоксиметан (0,482мл, 5,45ммоль) і циклопентен (0,424мл, 3,63ммоль) при кімнатній температурі. Реакційну суміш охолоджували до 0°С і потім додавали комплекс трифториду бор у з діетиловим ефіром (0,253мл, 1,99ммоль). Через 24 години додавали другу порцію диметоксиметану (2екв.), циклопентену (1,3екв.) і комплексу трифториду бору з діетиловим ефіром (0,73екв.). Через 48 годин реакційну суміш підлуговувми 1н NaOH. Вміст колби переносили в ділильну лійку і екстрагували метиленхлоридом (3х). Об'єднані органічні шари промивали насиченим розчином солі (1х), сушили сульфатом магнію, фiльтpyвали і концентрували з отриманням 0,861г потрібного продукту. 1 Н ЯМР (ДМСО-d6, 400МГц): d 7,38 (с, 4Н); 6,80 (д, 1Н); 6,67 (д, 1Н); 5,71 (т, 1Н); 4,99 (кв, 2Н); 4,46 (д, 1Н); 4,12 (д, 1Н); 3,78 і 3,71 (д, с, 2Н); 3,53 (с, 2Н); 3,20-3,09 (м, 1Н); 2,82 (м, 3Н); 2,03 (м, 1Н); 1,89 (м, 1Н); 1,80 (д, 2Н); 1,64 (т, 2Η); 1,43 (м, 4Н); 1,12 (д, 1Н); 0,90 (кв, 1Н). Приклад 34 Гідрохлорид 1-фтор-2-метокси4,5,6,7,9,9а,10,11,12,13,14,14адодекагідроциклогепта[с][1,4]діазепіно[6,7,1іj]хіноліну До розчину, що містить сполуку прикладу 33 (0,4г, 0,9ммоль), розчинену в метиленхлоридi (1,35мл) дoдaвали трифторметансульфонову кислоту (0,545мл, 6,16ммоль) і анізол (0,287мл, 2,64ммоль) при кімнатній температурі. Через 5 годин знов додавали трифторметансульфонову кислоту (3,5екв.). Через 8 годин реакційну суміш підлуговували 1н NaOH. Вміст колби переносили в ділильну лійку і екстрагували метиленхлоридом (3х). Об'єднані органічні екстракти сушили сульфатом магнію, фільтрували і концентрували з отриманням неочищеного продукту. Після очищення (15% аміак в 2М розчині етанол/етилацетат) отримували 0,172г вільного амінного продукту (65%). Вільний амін (0,172г, 0,565ммоль) розчиняли в діетиловому ефірі і додавали НСl - 2М розчин в діетиловому ефірі (0,282мл, 0,565ммоль). Отриману суміш перемі 49 79782 шували протягом 30 хвилин, потім тверду peчoвину відфільтровували і сушили повітрям. 1 Н ЯМР (ДМСО-d6 , 400МГц): d 9,75 (шир.с); 8,88 (шир.с); 7,17 (д, 1Н); 4,15 (2д, 1Н); 4,03 (т, 1Н); 3,32 (д, 1Н); 3,15 (kb, 2Н); 3,05-2,91 (м, 3Н); 2,81 (т, Комп’ютерна в ерстка О. Гапоненко 50 1Н); 2,02-1,93 (м, 2Н); 1,86 (с, 2Н); 1,73 (шир.с, 1Н); 1,52-1,42 (м, 4Н); 1,24-1,13 (м, 1Н); 0,95 (кв, 1Н). Мас-спектр: обчислено: 304,41; знайдено: 305,2 [М+Н]+. Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською[1,4]diazepino[6,7,1-ij]quinoline derivatives as anti psychotic and antiobesity agents
Назва патенту російськоюПроизводные [1,4]диазепино[6,7,1-ij]хинолина, которые используются как антипсихотические агенты и средства против ожирения
МПК / Мітки
МПК: A61P 25/22, A61P 1/04, A61P 25/24, A61K 31/5513, A61P 25/08, C07D 471/06, A61P 25/06, A61P 25/16, A61P 25/00, A61P 25/18, A61P 25/20, A61P 15/10, A61P 25/28, A61P 3/04
Мітки: використовуються, ожиріння, похідні, засоби, агенти, 1,4]діазепіно[6,7,1-ij]хіноліну, антипсихотичні
Код посилання
<a href="https://ua.patents.su/25-79782-pokhidni-14diazepino671-ijkhinolinu-shho-vikoristovuyutsya-yak-antipsikhotichni-agenti-ta-zasobi-proti-ozhirinnya.html" target="_blank" rel="follow" title="База патентів України">Похідні [1,4]діазепіно[6,7,1-ij]хіноліну, що використовуються як антипсихотичні агенти та засоби проти ожиріння</a>
Попередній патент: 5,6-бензо-2-(4-амінокарбонілфеніл)імінокумарин-3-карбоксамід, який проявляє анальгетичну, протизапальну та гепатопротекторну дію
Наступний патент: Пристрій нанесення коду
Випадковий патент: Спосіб часткової пластики молочної залози ендоапротезом у хворих після секторальної резекції












