Бензоконденсовані п’ятичленні гетероцикли і їх застосування
Номер патенту: 98608
Опубліковано: 11.06.2012
Автори: Бякстрем Рейо, Алмарк Марко, Луйро Анне, Пюстюнен Ярмо, Тіайнен Ейя
Формула / Реферат
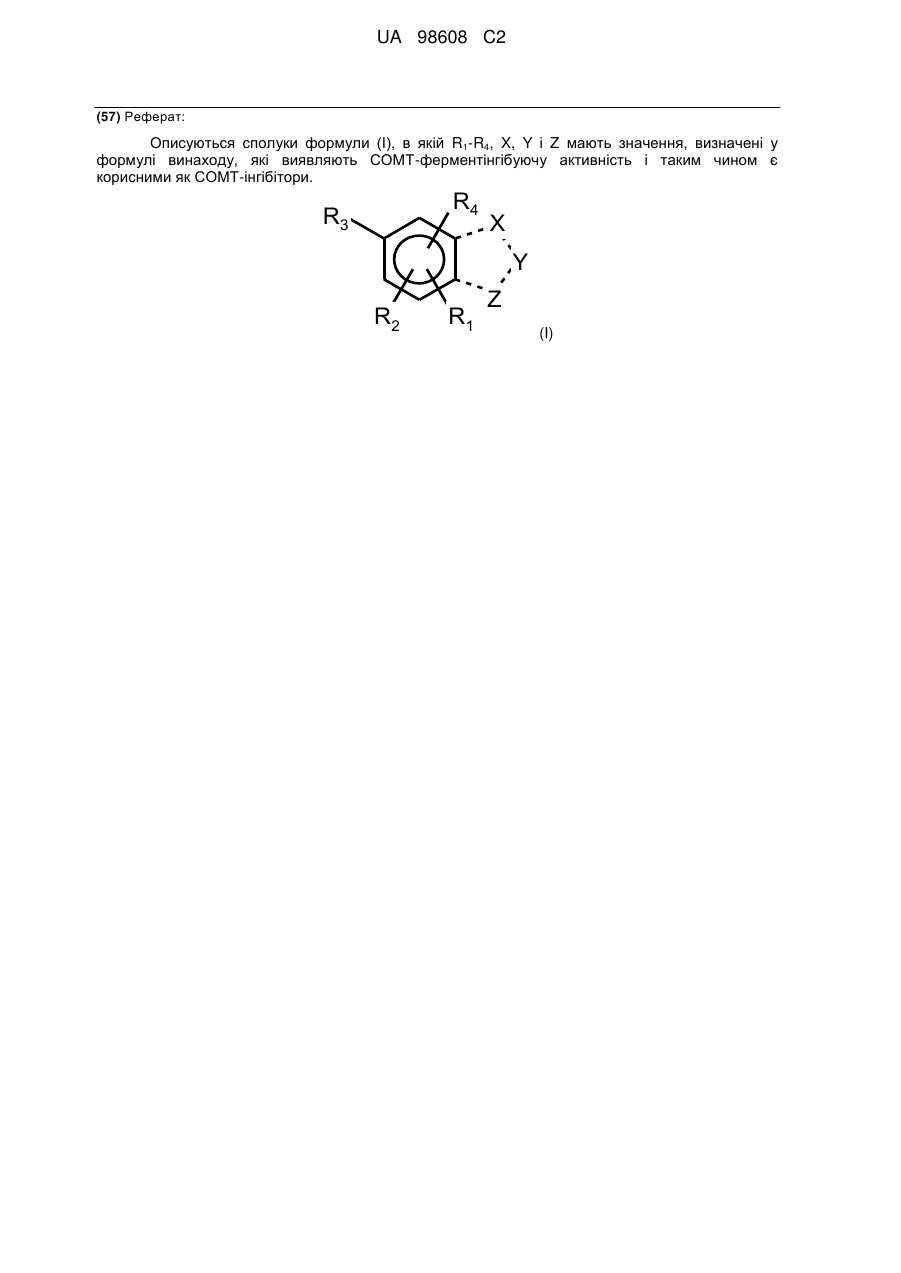
1. Сполука формули І
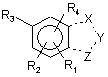 , І
, І
в якій
R2 знаходиться в орто-положенні до R3, і R1 знаходиться в орто-положенні до R2; або
R1 знаходиться в орто-положенні до R3, і R4 знаходиться в орто-положенні до R1;
R1 являє ціано або нітро;
R2 являє гідрокси;
R3 являє гідрокси;
R4 являє Н, (С1-С6)алкіл, галоген(С1-С6)алкіл, ціано, форміл, (С1-С6)алкіл-(С=О)-, галоген або нітро;
пунктирна лінія являє собою одинарний або подвійний зв'язок;
два з X, Y або Z являють собою CR5(R6)m, і один з X, Y або Z являє собою N(R7)n, О або S;
або один з X, Y або Z являє собою CR5(R6)m, і один з X, Y або Z являє собою N(R7)n, і один з X, Y або Z являє S;
m являє незалежно в кожному випадку 0 або 1;
n являє незалежно в кожному випадку 0, 1 або 2;
R5 являє собою незалежно в кожному випадку Н, (С1-С6)алкіл, галоген, галоген(С1-С6)алкіл, (С1-С8)алкокси-(С=O)-, карбокси, арил, гетероарил, гетероцикліл-(С=О)-, (R8)2N-(C=O)-,
де вказаний гетероцикліл, як такий або як частина якої-небудь іншої групи, належать до 5-, 6- або 7-членної насиченої циклічної групи, що містить 1 або 2 гетероатоми, кожен з яких незалежно вибраний з N, О і S; вказаний арил, як такий або як частина якої-небудь іншої групи, належить до моно- або біциклічної ароматичної карбоциклічної групи, яка містить 6 або 10 атомів вуглецю; вказаний гетероарил належить до 5-, 6- або 7-членної ароматичної групи, яка містить 1, 2, 3 або 4 гетероатоми, кожен з який незалежно вибраний з N, О і S, і
де вказані гетероцикліл, арил або гетероарил, як самі по собі або як частина ще якої-небудь групи, є незаміщеними або заміщеними 1 або 2 замісниками, кожний з яких незалежно являє собою (С1-С6)алкіл або гідрокси;
R6 являє собою незалежно в кожному випадку Н;
або R5 і R6, приєднані, обидва, до одного і того ж кільцевого атома вуглецю, утворюють разом із кільцевим атомом вуглецю, до якого вони приєднані, -(С=О)-групу;
R7 являє собою незалежно в кожному випадку (С1-С6)алкіл або арил, де вказаний арил належить до моно- або біциклічної ароматичної карбоциклічної групи, яка містить 6 або 10 атомів вуглецю;
де вказаний арил є заміщеним 1 замісником, який являє собою галоген; або
R8 являє собою незалежно в кожному випадку Н, (С1-С6)алкіл, (С1-С6)алкокси, арил або арил(С1-С6)алкіл, де вказаний арил, як такий або як частина якої-небудь іншої групи, належить до моно- або біциклічної ароматичної карбоциклічної групи, яка містить 6 або 10 атомів вуглецю;
де вказаний арил, як сам по собі або як частина ще якої-небудь групи, є незаміщеним або заміщеним 1 або 2 замісниками, кожний з яких незалежно являє собою (С1-С6)алкіл, галоген, гідрокси, карбокси або (С1-С6)алкокси;
або її фармацевтично прийнятна сіль або ефір.
2. Сполука за п. 1, яка відрізняється тим, що R2 знаходиться в орто-положенні до R3, і R1 знаходиться в орто-положенні до R2.
3. Сполука за п. 1, яка відрізняється тим, що R1 знаходиться в орто-положенні до R3, і R4 знаходиться в орто-положенні до R1.
4. Сполука за будь-яким із пп. 1-3, яка відрізняється тим, що R4 являє собою Н, галоген або нітро.
5. Сполука за п. 4, яка відрізняється тим, що R4 являє собою Н.
6. Сполука за будь-яким із пп. 1-5, яка відрізняється тим, що R1 являє собою ціано.
7. Сполука за будь-яким із пп. 1-5, яка відрізняється тим, що R1 являє собою нітро.
8. Сполука за будь-яким із пп. 1-7, яка відрізняється тим, що одна з пунктирних ліній являє собою подвійний зв'язок.
9. Сполука за будь-яким із пп. 1-8, яка відрізняється тим, що два з X, Y або Z являють собою CR5(R6)m, і один із X, Y або Z являє собою N(R7)n.
10. Сполука за будь-яким із пп. 1-8, яка відрізняється тим, що один із X, Y або Z являє собою CR5(R6)m, один із X, Y або Z являє собою N(R7)n, і один із X, Y або Z являє собою S.
11. Сполука за будь-яким із пп. 1-8, яка відрізняється тим, що два з X, Y або Z являють собою CR5(R6)m, і один із X, Y або Z являє собою О.
12. Сполука за будь-яким із пп. 1-8, яка відрізняється тим, що два з X, Y або Z являють собою CR5(R6)m, і один із X, Y або Z являє собою S.
13. Сполука за будь-яким із пп. 1-12, яка відрізняється тим, що R5 являє собою незалежно в кожному випадку Н, (С1-С6)алкіл, галоген, галоген(С1-С6)алкіл, (С1-С8)алкокси-(С=О)-, карбокси, арил, гетероарил, гетероцикліл-(С=О)- або (R8)2N-(С=O)-, де вказаний арил належить до моно- або біциклічної ароматичної карбоциклічної групи, яка містить 6 або 10 атомів вуглецю; вказаний гетероарил належить до 5-, 6- або 7-членної ароматичної групи, яка містить 1, 2, 3 або 4 гетероатоми, кожен з яких незалежно вибраний з N, О і S, і
вказаний гетероцикл як такий або як частина якої-небудь іншої групи, належить до 5-, 6- або 7-членної насиченої циклічної групи, яка містить 1 або 2 гетероатоми, кожен з яких незалежно вибраний з N, О і S і
де вказаний гетероцикліл, арил або гетероарил, як сам по собі або як частина ще якої-небудь групи, є незаміщеним або заміщеним 1, 2 або 3 замісниками, які являють, кожен незалежно, (С1-С6)алкіл або гідрокси,
R6 являє собою незалежно в кожному випадку Н,
або R5 і R6, приєднані, обидва, до одного і того ж кільцевого атома вуглецю, утворюють разом із кільцевим атомом вуглецю, до якого вони приєднані, -(С=О)-групу;
R8 являє собою незалежно в кожному випадку (С1-С6)алкіл або арил, де вказаний арил належить до моно- або біциклічної ароматичної карбоциклічної групи, яка містить 6 або 10 атомів вуглецю;
де вказаний арил є незаміщеним або заміщеним 1 або 2 замісниками, які являють, кожен незалежно, карбокси або (С1-С6)алкокси.
14. Сполука за п. 13, яка відрізняється тим, що
m являє собою незалежно в кожному випадку 0,
R5 являє незалежно в кожному випадку Н, галоген, (С1-С8)алкокси-(С=О)-, карбокси, гетероцикліл-(С=О)- або (R8)2N-(C=O)-, де вказаний гетероцикліл, як такий або як частина якої-небудь іншої групи, належить до 5-, 6- або 7-членної насиченої циклічної групи, яка містить 1 або 2 гетероатоми, кожен з яких незалежно вибраний з N, О і S, і
де вказаний гетероцикліл як частина ще якої-небудь групи є незаміщеним або заміщеним 1, 2 або 3 замісниками, які являють собою, кожен незалежно, (С1-С6)алкіл або гідрокси;
R8 являє незалежно в кожному випадку (С1-С6)алкіл або арил, де вказаний арил належить до моно- або біциклічної ароматичної карбоциклічної групи, яка містить 6 або 10 атомів вуглецю; і
де вказаний арил є незаміщеним або заміщеним 1 замісником, що являє собою карбокси або (С1-С6)алкокси.
15. Сполука за п. 1, вибрана з групи:
2-(4-хлорфеніл)-5,6-дигідрокси-4-нітро-2,3-дигідроізоіндол-1-он, 5,6-дигідрокси-7-нітро-3Н-ізобензофуран-1-он, 7-нітро-2-піридин-4-ілбензотіазол-5,6-діолу метансульфонат, 3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонова кислота, етиловий ефір 3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонової кислоти, 3-хлор-5,6-дигідрокси-4-нітробензо[b]тіофен-2-карбонова кислота, 3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен, (3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-іл)морфолін-4-ілметанон, діетиламід 3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонової кислоти, (3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-іл)піперидин-1-ілметанон, феніламід 3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонової кислоти, 3-[(3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбоніл)аміно]бензойна кислота, 4-[(3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбоніл)аміно]бензойна кислота, (4-метоксифеніл)амід 3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонової кислоти, 2-метил-7-нітробензотіазол-5,6-діол, (5,6-дигідрокси-7-нітробензо[b]тіофен-2-іл)морфолін-4-ілметанон, 5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонова кислота, 5,6-дигідрокси-7-нітробензофуран-2-карбонова кислота, 5,6-дигідрокси-2-метил-7-нітробензо[d]ізотіазол-3-он, (5,6-дигідрокси-3-метил-7-нітробензо[b]тіофен-2-іл)морфолін-4-ілметанон, етиловий ефір 5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонової кислоти, 5,6-дигідрокси-4-нітроізобензофуран-1,3-діон, 5,6-дигідрокси-4-нітро-3Н-ізобензофуран-1-он, 5,6-дигідрокси-4,7-динітро-3Н-ізобензофуран-1-он, 7-нітро-2-фенілбензотіазол-5,6-діол, метиловий ефір 6,7-дигідрокси-5-нітробензо[b]тіофен-2-карбонової кислоти, 1-(5,6-диметокси-7-нітробензо[b]тіофен-2-іл)нонан-1-он, (3-хлор-5,6-дигідрокси-4,7-динітробензо[b]тіофен-2-іл)морфолін-4-ілметанон, (3,4-дихлор-5,6-дигідрокси-7-динітробензо[b]тіофен-2-іл)морфолін-4-ілметанон, (3-хлор-5,6-дигідрокси-4-нітробензо[b]тіофен-2-іл)морфолін-4-ілметанон, (3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-іл)-(2,6-диметилморфолін-4-іл)метанон, (3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-іл)-(4-гідроксипіперидин-1-іл)метанон, (3-бромметил-5,6-дигідрокси-7-нітробензо[b]тіофен-2-іл)морфолін-4-ілметанон, 5,6-дигідрокси-3-метил-2-(морфолін-4-карбоніл)бензо[b]тіофен-4-карбонітрил або (3-хлор-5,6-дигідрокси-7-ціанобензо[b]тіофен-2-іл)морфолін-4-ілметанон.
16. Сполука за п. 1, яка відрізняється тим, що сполукою є (3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-іл)морфолін-4-ілметанон.
17. Сполука за п. 1, яка відрізняється тим, що сполукою є діетиламід 3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонової кислоти.
18. Сполука за п. 1, яка відрізняється тим, що сполукою є (3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-іл)піперидин-1-ілметанон.
19. Сполука за п. 1, яка відрізняється тим, що сполукою є феніламід 3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонової кислоти.
20. Сполука за п. 1, яка відрізняється тим, що сполукою є 3-[(3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбоніл)аміно]бензойна кислота.
21. Сполука за п. 1, яка відрізняється тим, що сполукою є 4-[(3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбоніл)аміно]бензойна кислота.
22. Сполука за п. 1, яка відрізняється тим, що сполукою є (4-метоксифеніл)амід 3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонової кислоти.
23. Сполука за п. 1, яка відрізняється тіш, що сполукою є (3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-іл)-(2,6-диметилморфолін-4-іл)метанон.
24. Сполука за п. 1, яка відрізняється тим, що сполукою є (3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-іл)-(4-гідроксипіперидин-1-іл)метанон.
25. Сполука за будь-яким із пп. 1-24 для застосування як лікарського засобу.
26. Застосування сполуки за будь-яким із пп. 1-24 або її фармацевтично прийнятної солі або ефіру для виробництва лікарського засобу для лікування захворювання або стану, при якому показаний агент, що інгібує СОМТ.
27. Застосування за п. 26, при якому захворюванням є хвороба Паркінсона.
28. Спосіб лікування захворювання або стану, при якому показаний агент, що інгібує СОМТ, при якому вводять ссавцю, що потребує такого лікування, ефективну кількість, принаймні, однієї сполуки за будь-яким із пп. 1-24.
29. Спосіб за п. 28, який відрізняється тим, що захворюванням є хвороба Паркінсона.
30. Фармацевтична композиція, що містить як активний інгредієнт щонайменше одну сполуку за будь-яким із пп. 1-24 або її фармацевтично прийнятну сіль або ефір і фармацевтично прийнятний носій, розріджувач і/або наповнювач.
Текст
Реферат: Описуються сполуки формули (І), в якій R1-R4, X, Y і Z мають значення, визначені у формулі винаходу, які виявляють СОМТ-ферментінгібуючу активність і таким чином є корисними як СОМТ-інгібітори. R4 R3 X Y R2 R1 Z (I) UA 98608 C2 5 10 15 20 25 30 35 40 45 50 Даний винахід стосується фармакологічно активних бензоконденсованих п'ятичленних гетероциклів або їхніх фармацевтично прийнятних солей і ефірів, а також фармацевтичних композицій, що їх містять, та їхнього застосування як інгібіторів ферменту катехол-Ометилтрансферази (СОМТ). У рівні техніки загальновідомо і прийнято, що інгібітори СОМТ корисні в лікуванні хвороби Паркінсона. Було показано, що інгібітори СОМТ є ефективними при клінічному використанні для лікування хвороби Паркінсона в доповнення до терапії за допомогою леводопи. Для того, щоб досягнути постійної концентрації леводопи в плазмі, бажано, щоб інгібітор СОМТ мав хорошу біодоступність і тривалу тривалість дії. Однак промислово доступні інгібітори СОМТ асоціюються з досить короткою тривалістю дії, і їхня оральна біодоступність обмежена. Було показано також, що інгібітори СОМТ корисні при лікуванні, наприклад, гіпертензії, серцевої недостатності і депресії [див., наприклад, патент США 5446194], а також у ролі інгібіторів для профілактики діабетичних судинних дисфункцій [див. патент США 6207706]. Інгібітори СОМТ описані також як корисні для лікування або контролювання болю (див. патент США 6723754), а також для лікування синдрому неспокійних ніг (RLS), який відомий також як синдром Ekbom [див. WO 2006/051154]. RLS характеризується непереборним спонуканням рухати ногами, що супроводжується іншими неприємними відчуттями глибоко в ногах. У рівні техніки відомі деякі сполуки з інгібуючою СОМТ активністю. Наприклад, похідні катехолу як інгібітори СОМТ описані, наприклад, у патентах США 5389653; 5446194; 6150412; 6512136; WO 01/98250; WO 01/98251; WO 02/02548; патенті США 6903114, WO 2004/112729 і WO 2005/058228. Ізофлавонові похідні як інгібітори СОМТ описані в патенті США 3973608. Що стосується відомих бензоконденсованих п'ятичленних гетероциклів, у праці Любчинської зі співробітниками в Хіміко-фармацевтичному журналі, 23 (1989), 843, описаний 2-бензил-7бром-6-нітробензофуран-4,5-діол. Завданням даного винаходу є створення додаткових інгібіторів ферменту катехол-Ометилтрансферази, які можуть використовуватися для лікування захворювань або станів, при яких показані корисними інгібітори СОМТ. Відповідно, завданням даного винаходу є створення додаткових сполук, корисних як агентів, що інгібують СОМТ, при лікуванні ссавців, включаючи людей і тварин. Крім того, даний винахід стосується фармацевтичних композицій, що містять дані сполуки. Завдяки повільному елімінуванню за допомогою глюкуронідування, інгібітори СОМТ даного винаходу мають поліпшену біодоступність і/або пролонговану дію. У доповнення до сказаного, сполуки даного винаходу мають вищі первинні фармакологічні властивості, тобто СОМТ інгібуючу активність. Крім того, дані сполуки не роз'єднують окисне фосфорилування і, таким чином, мають бажаний профіль безпеки. Даний винахід стосується нових інгібіторів СОМТ, що мають загальну формулу І, ,І в якій R2 знаходиться в орто-положенні до R3, і R1 знаходиться в орто-положенні до R2; або R1 знаходиться в орто-положенні до R3, і R4 знаходиться в орто-положенні до R1; R1 являє ціано або нітро; R2 являє гідрокси; R3 являє гідрокси; R4 являє Н, (С1-С6)алкіл, галоген(С1-С6)алкіл, ціано, форміл, (С1-С6)алкіл-(С=О)-, галоген або нітро; пунктирна лінія являє одинарний або подвійний зв'язок; два з X, Y або Z являють незалежно CR5(R6)m, N(R7)n, О або S, і один із X, Y або Z являє N(R7)n, О або S; m являє незалежно в кожному випадку 0 або 1; n являє незалежно в кожному випадку 0, 1 або 2; R5 являє незалежно в кожному випадку Н, (С1-С6)алкіл, (С2-С6)алкеніл, галоген, гідрокси, (С1С6)алкокси, галоген(С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкіл-(С=О)-, (С1-С8)алкокси-(С=О)-, ціано, форміл, (С1-С6)алкіл-(С=S)-, (R8)2N-(C=S)-, R8-(C=NR8)-, карбокси, (С3-С7)циклоалкіл, 1 UA 98608 C2 5 10 15 20 25 30 35 40 45 50 55 60 гетероцикліл, арил, гетероарил, гетероцикліл-(С=О)-, арил(С1-С6)алкіл, (R8)2N-, (R8)2N-(C1C6)aлкiл, (R8)2N-(C=O)-, (С1-С6)алкіл-S-, R9-(S=O)-, R9-(O=S=O)-, (С1-С6)алкоксі(С1-С6)алкіл, (С1С6)алкокси-(С=О)-(С1-С6)алкіл, (С1-С6)алкіл-(С=О)-О-, (С1-С6)алкіл-(С=О)-О-(С1-С6)алкіл, гідроксі(С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкіл-S-(С1-С6)алкіл, (С1-С6)алкіл-S-(С=О)-, (С3С7)циклоалкіл(С1-С6)алкіл, арилокси, арилоксі(С1-С6)алкіл, арил(С1-С6)алкокси, арил(С1С6)алкоксі(С1-С6)алкіл або гетероцикліл-(С=S)-, де зазначений (С3-С7)циклоалкіл, гетероцикліл, арил або гетероарил, як самі по собі, або, як частина ще будь-якої групи, є незаміщеним або заміщеним 1, 2 або 3 замісниками,кожен з яких незалежно являє (С1-С6)алкіл, галоген, гідрокси, карбокси, (С1-С6)алкокси або (R8)2N-; R6 являє незалежно в кожному випадку Н, (С1-С6)алкіл, галоген, гідрокси, гідроксі(С1-С6)алкіл або (С1-С6)алкокси; або R5 і R6, приєднані, обидва, до одного і того ж кільцевого атома вуглецю, утворюють разом із кільцевим атомом вуглецю, до якого вони приєднані, -(С=О)-групу;або R5 і R6, приєднані, обидва, до одного і того ж кільцевого атома вуглецю, утворюють разом із кільцевим атомом вуглецю, до якого вони приєднані, C=C(R8)2; або R5 і R6, приєднані, обидва, до одного і того ж кільцевого атома вуглецю, утворюють разом із кільцевим атомом вуглецю, до якого вони приєднані, 5-, 6- або 7-членне насичене або ненасичене карбоциклічне кільце, яке є незаміщеним або заміщеним 1 або 2 замісниками, кожен з яких незалежно являє (С1-С6)алкіл, галоген, гідрокси, (С1-С6)алкокси або карбокси; R7 являє незалежно в кожному випадку Н, (С1-С6)алкіл, (С3-С7)циклоалкіл, (С1-С6)алкокси, арил або О , де зазначений (С3-С7)циклоалкіл або арил є незаміщеним або заміщеним 1, 2 або 3 замісниками, кожен з яких незалежно являє (С1-С6)алкіл, галоген, гідрокси, (С1-С6)алкокси або карбокси; або R5 і R5, R5 і R7, або R7 і R7, приєднані до суміжних кільцевих атомів, утворюють разом із кільцевими атомами, до яких вони приєднані, сконденсоване 5-, 6- або 7-членне насичене або ненасичене карбоциклічне кільце або сконденсоване 5-, 6- або 7-членне насичене або ненасичене гетероциклічне кільце, що містить 1 або 2 гетероатоми, вибрані з N, О і S, де зазначене карбо- або гетероциклічне кільце є незаміщеним або заміщеним 1 або 2 замісниками, кожен з яких незалежно являє (С1-С6)алкіл, галоген, гідрокси, (С1-С6)алкокси, карбокси або оксо; R8 являє незалежно в кожному випадку Н, (С1-С6)алкіл, (С1-С6)алкокси, арил або арил(С1С6)алкіл, де зазначений арил, як сам по собі або як частина ще будь-якої групи, є незаміщеним або заміщеним 1 або 2 замісниками, кожен з яких незалежно являє (С 1-С6)алкіл, галоген, гідрокси, карбокси або (С1-С6)алкокси; R9 являє незалежно в кожному випадку (С1-С6)алкіл, (R8)2N-, гідрокси або (С1-С6)алкокси; або їхніх фармацевтично прийнятних солей або ефіру; за умови, що сполука не є 2-бензил-7-бром-6-нітробензофуран-4,5-діолом. У можливій підгрупі сполук формули І R2 знаходиться в орто-положенні до R3, і R4 знаходиться в орто-положенні до R2. У ще одній можливій підгрупі сполук формули І R1 знаходиться в орто-положенні до R3, і R4 знаходиться в орто-положенні до R1. У ще одній можливій підгрупі сполук формули І R4 являє Н, галоген або нітро, наприклад, Н. У ще одній можливій підгрупі сполук формули І R1 являє ціано. У ще одній можливій підгрупі сполук формули І R1 являє нітро. У ще одній можливій підгрупі сполук формули І одна з пунктирних ліній являє подвійний зв'язок. У додатковій можливій підгрупі сполук формули І два з X, Y або Z являють CR5(R6)m, і один із X, Y або Z являє N. У додатковій можливій підгрупі сполук формули І один із X, Y або Z являє CR5(R6)m, oдин із Х, Y або Z являє N(R7)n, і один із X, Y або Z являє S. У додатковій можливій підгрупі сполук формули І два з X, Y або Z являють CR5(R6)m, і один із X, Y або Z являє О. У додатковій можливій підгрупі сполук формули І два з X, Y або Z являють CR5(R6)m, і один із X, Y або Z являє S. У ще одній можливій підгрупі сполук формули І R7 являє незалежно в кожному випадку Н, (С1-С6)алкіл або арил, де зазначений арил є незаміщеним або заміщеним 1, 2 або 3 замісниками, кожен з яких являє незалежно галоген. У ще одній можливій підгрупі сполук формули І R5 являє незалежно в кожному випадку Н, (С1-С6)алкіл, галоген, галоген(С1-С6)алкіл, (С1-С8)алкокси-(С=О)-, карбокси, арил, гетероарил, гетероцикліл-(С=О)- або (R8)2N-(C=O)-, де зазначений гетероцикліл, арил або гетероарил, як сам по собі або як частина ще будь-якої групи, є незаміщеним або заміщеним 1, 2 або 3 2 UA 98608 C2 5 10 15 20 25 30 35 40 45 50 55 60 замісниками, кожен з яких незалежно являє (С1-С6)алкіл або гідрокси, R6 являє незалежно в кожному випадку Н, або R5 і R6, приєднані, обидва, до одного і того ж кільцевого атома вуглецю, утворюють разом із кільцевим атомом вуглецю, до якого вони приєднані, -(C=О)-групу, і R8 являє незалежно в кожному випадку (С1-С6)алкіл або арил, де зазначений арил є незаміщеним або заміщеним 1 або 2 замісниками, кожен з яких незалежно являє карбокси або (С1-С6)алкокси, наприклад, m являє незалежно в кожному випадку 0, R5 являє незалежно в кожному випадку Н, галоген, (С1-С8)алкокси-(C=O)-, карбокси, гетероцикліл-(С=О)- або (R8)2N-(C=O)-, де зазначений гетероцикліл як частина ще будь-якої групи є незаміщеним або заміщеним 1, 2 або 3 замісниками, кожен з яких незалежно являє (С1-С6)алкіл або гідрокси, і R8 являє незалежно в кожному випадку (С1-С6)алкіл або арил, де зазначений арил є незаміщеним або заміщеним 1 замісником, що являє карбокси або (С1-С6)алкокси. У додатковій можливій підгрупі сполук формули І сполукою є 2-(4-хлорфеніл)-5,6-дигідрокси4-нітро-2,3-дигідроізоіндол-1-он, 5,6-дигідрокси-7-нітро-3Н-ізобензофуран-1-он, 7-нітро-2піридин-4-ілбензотіазол-5,6-діол, метансульфонат, 3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен2-карбонова кислота, етиловий ефір 3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонової кислоти, 3-хлор-5,6-дигідрокси-4-нітробензо[b]тіофен-2-карбонова кислота, 3-хлор-5,6дигідрокси-7-нітробензо[b]тіофен, (3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-іл)морфолін-4ілметанон, діетиламід 3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонової кислоти, (3хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-іл)піперидин-1-ілметанон, феніламід 3-хлор-5,6дигідрокси-7-нітробензо[b]тіофен-2-карбонової кислоти, 3-[(3-хлор-5,6-дигідрокси-7нітробензо[b]тіофен-2-карбоніл)аміно]бензойна кислота, 4-[(3-хлор-5,6-дигідрокси-7нітробензо[b]тіофен-2-карбоніл)аміно]бензойна кислота, (4-метоксифеніл)амід 3-хлор-5,6дигідрокси-7-нітробензо[b]тіофен-2-карбонової кислоти, 2-метил-7-нітробензотіазол-5,6-діол, (5,6-дигідрокси-7-нітробензо[b]тіофен-2-іл)морфолін-4-ілметанон, 5,6-дигідрокси-7нітробензо[b]тіофен-2-карбонова кислота, 5,6-дигідрокси-7-нітробензофуран-2-карбонова кислота, 5,6-дигідрокси-2-метил-7-нітробензо[d]ізотіазол-3-он, (5,6-дигідрокси-3-метил-7нітробензо[b]тіофен-2-іл)морфолін-4-ілметанон, етиловий ефір 5,6-дигідрокси-7нітробензо[b]тіофен-2-карбонової кислоти, 5,6-дигідрокси-4-нітроізобензофуран-1,3-діон, 5,6дигідрокси-4-нітро-3Н-ізобензофуран-1-он, 5,6-дигідрокси-4,7-динітро-3Н-ізобензофуран-1-он, 7нітро-2-фенілбензотіазол-5,6-діол, метиловий ефір 6,7-дигідрокси-5-нітробензо[b]тіофен-2карбонової кислоти, 1-(5,6-диметокси-7-нітробензо[b]тіофен-2-іл)нонан-1-он, (3-хлор-5,6дигідрокси-4,7-динітробензо[b]тіофен-2-іл)морфолін-4-ілметанон, (3,4-дихлор-5,6-дигідрокси-7динітробензо[b]тіофен-2-іл)морфолін-4-ілметанон, (3-дихлор-5,6-дигідрокси-4нітробензо[b]тіофен-2-іл)морфолін-4-ілметанон, (3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2іл)-(2,6-диметилморфолін-4-іл)метанон, (3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-іл)-(4гідроксипіперидин-1-іл)метанон, (3-бромметил-5,6-дигідрокси-7-нітробензо[b]тіофен-2іл)морфолін-4-ілметанон, 5,6-дигідрокси-3-метил-2-(морфолін-4-карбоніл)бензо[b]тіофен-4карбонітрил або (3-хлор-5,6-дигідрокси-7-ціанобензо[b]тіофен-2-іл)морфолін-4-ілметанон. Фахівцеві в даній галузі техніки очевидно, що в сполуках формули (І), принаймні, один із двох зв'язків, які зображені пунктирною лінією і мають загальний атом, представлений символом X, Y або Z, являє собою одинарний зв'язок, і що зберігається ароматичний характер шестичленного кільця. Аналогічним чином, фахівцеві очевидно, що в сполуках формули І, коли R7 являє О , атом азоту, до якого приєднаний зазначений замісник, являє позитивно заряджений четвертинний атом азоту. Терміни, що застосовуються в описі, мають такі значення: Термін "ціано", що застосовується в описі, стосується -CN групи. Термін "нітро", що застосовується в описі, стосується -NO2 групи. Термін "(С1-С6)алкіл", що застосовується в описі, як такий або як частина будь-якої іншої групи, стосується насиченої вуглеводневої групи з прямим або розгалуженим ланцюгом, що має 1, 2, 3, 4, 5 або 6 атомів вуглецю. Характерні приклади (С 1-С6)алкілу включають, але не обмежуються ними, метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил, н-пентил, ізопентил і н-гексил. Термін "галоїд" або "галоген", що застосовується в описі, як такий або як частина будь-якої іншої групи, стосується фтору, хлору, брому або йоду. Термін "галоген(С1-С6)алкіл", що застосовується в описі, стосується, принаймні, одного галогену, визначеного в описі, приєднаного до початкового або основного молекулярного фрагмента через (С1-С6)алкільну групу, визначену в описі. Характерні приклади галоген(С1С6)алкілу включають, але не обмежуються ними, фторметил, хлорметил, дифторметил, трифторметил, 2-хлоретил, 3-бромпропіл і 2-хлорпропіл. 3 UA 98608 C2 5 10 15 20 25 30 35 40 45 50 55 Термін "форміл", що застосовується в описі, стосується -СНО групи. Термін "гідрокси", що застосовується в описі, як такий або як частина будь-якої іншої групи, стосується -ОН групи. Термін "(С1-С6)алкокси", що застосовується в описі, як такий або як частина будь-якої іншої групи, стосується (С1-С6)алкільної групи, визначеної в описі, приєднаної до основного молекулярного фрагмента через атом кисню. Характерні приклади (С 1-С6)алкокси включають, але не обмежуються ними, метокси, етокси, н-пропокси, н-бутокси, ізобутокси, втор-бутокси і трет-бутокси. Термін "(С1-С8)алкокси", що застосовується в описі, як такий абояк частина будь-якої іншої групи, стосується насиченої вуглеводневої групи з прямим або розгалуженим ланцюгом, що має 1, 2, 3, 4, 5, 6, 7 або 8 атомів вуглецю, приєднаної до початкового молекулярного фрагмента через атом кисню. Характерні приклади (С1-С8)алкокси включають, але не обмежуються ними, метокси, етокси, н-пропокси, н-бутокси, ізобутокси, втор-бутокси, трет-бутокси і н-октокси. Термін "гідроксі(С1-С6)алкокси", що застосовується в описі, як такий або як частина будь-якої іншої групи, стосується визначеної в описі принаймні однієї гідроксигрупи, приєднаної до початкового молекулярного фрагмента через (С1-С6)алкоксигрупу, визначену в описі. Характерні приклади гідроксі(С 1-С6)алкокси включають, але не обмежуються ними, гідроксиметокси, дигідроксиметокси, 2-гідроксіетокси, 2-гідроксипропокси і 2-гідрокси-1метилетокси. Термін "(С3-С7)циклоалкіл", що застосовується в описі, як такий або як частина будь-якої іншої групи, стосується насиченої циклічної вуглеводневої групи, що має 3, 4, 5, 6 або 7 атомів вуглецю. Характерні приклади (С 3-С7)циклоалкілу включають, але не обмежуються ними, циклопропіл, циклопентил і циклогексил. Термін "(С2-С6)алкеніл", що застосовується в описі стосується вуглеводневої групи з прямим або розгалуженим ланцюгом, що має 2, 3, 4, 5 або 6 атомів вуглецю і що містить, принаймні, один вуглець-вуглецевий подвійний зв'язок. Характерні приклади (С 2-С6)алкенілу включають, але не обмежуються ними, етеніл і 2-пропеніл. Термін "арил", що застосовується в описі, як такий або як частина будь-якої іншої групи, стосується моно- або біциклічної ароматичної карбоциклічної групи, що містить 6 або 10 атомів вуглецю. Термін "арил(С1-С6)алкіл", що застосовується в описі, стосується арильної групи, визначеної в описі, приєднаної до початкового або основного молекулярного фрагмента через (С1С6)алкільну групу, визначену в описі. Характерні приклади арил(С 1-С6)алкілу включають, але не обмежуються ними, фенілметил і нафт-1-илметил. Термін "гідроксі(С1-С6)алкіл", що застосовується в описі, стосується, принаймні, однієї гідроксигрупи, визначеної в описі, приєднаної до початкового молекулярного фрагмента через (С1-С6)алкільну групу, визначену в описі. Характерні приклади гідроксі(С 1-С6)алкілу включають, але не обмежуються ними, гідроксиметил, 1-гідроксіетил, 2,2-дигідроксіетил, 1-гідроксипропіл, 3-гідроксипропіл, 1-гідрокси-1-метилетил і 1-гідрокси-1-метилпропіл. Термін "гетероцикліл", що застосовується в описі, як такий або як частина будь-якої іншої групи, стосується 5-, 6- або 7-членної насиченої циклічної групи, що містить 1 або 2 гетероатоми, кожен з яких незалежно вибраний з N, О і S. Характерні приклади гетероциклілу включають, але не обмежуються ними, піролідиніл, піперидиніл, піперазиніл, морфолініл і азепаніл. Термін "карбокси", що застосовується в описі, стосується -СООН групи. Термін "гетероарил", що застосовується в описі стосується 5-, 6- або 7-членної ароматичної групи, що містить 1, 2, 3 або 4 гетероатоми, кожен з яких незалежно вибраний із N, О і S. Характерні приклади гетероарилу включають, але не обмежуються ними, піроліл, фураніл, тіофеніл, імідазоліл, оксазоліл, тіазоліл, триазоліл, тетразоліл, піразоліл, піридиніл, піримідиніл, піразиніл, піридазиніл, піраніл і азепініл. Термін "(С1-С6)алкоксі(С1-С6)алкіл", що застосовується в описі, як такий або як частина будьякої іншої групи, стосується, принаймні, однієї (С1-С6)алкоксигрупи, визначеної в описі, приєднаної до початкового молекулярного фрагмента через (С1-С6)алкільну групу, визначену в описі. Характерні приклади (С1-С6)алкоксі(С1-С6)алкілу включають, але не обмежуються ними, метоксиметил, пропоксиметил, 2-етоксіетил, 2,2-диметоксіетил, 1-метил-2-пропоксіетил і 4метоксибутил. Термін "арил(С1-С6)алкокси", що застосовується в описі, як такий або як частина будь-якої іншої групи, стосується арильної групи, визначеної в описі, приєднаної до початкового молекулярного фрагмента через (С1-С6)алкоксигрупу, визначену в описі. Характерні приклади 4 UA 98608 C2 5 10 15 20 25 арил(С1-С6)алкокси включають, але не обмежуються ними, фенілметокси, 2-фенілетокси і 2нафт-2-илетокси. Термін "оксо", що застосовується в описі, стосується =O групи. Фармацевтично прийнятні солі, наприклад, солі металів і кислотно-адитивні солі, як з органічними, так і неорганічними кислотами добре відомі в галузі фармацевтичних продуктів. Характерні приклади фармацевтично прийнятних солей металів включають, але не обмежуються ними, солі літію, натрію, калію, кальцію, магнію, алюмінію і цинку. Характерні приклади фармацевтично прийнятних кислотно-адитивних солей включають, але не обмежуються ними, хлориди, броміди, сульфати, нітрати, фосфати, сульфонати, метансульфонати, форміати, тартрати, малеати, цитрати, бензоати, саліцилати та аскорбати. Фармацевтично прийнятні складні ефіри, коли вони є застосовними, можна одержувати за допомогою відомих методів із використанням фармацевтично прийнятних кислот, які є загальноприйнятими в галузі фармацевтичних продуктів і які зберігають фармакологічні властивості у вільній формі. Необмежуючі приклади даного ефіру включають ефір аліфатичних або ароматичних спиртів, наприклад, метилові, етилові, н-пропілові, ізопропілові, н-бутилові, ізобутилові, втор-бутилові і трет-бутилові складні ефіри. Винахід включає в свій обсяг всі можливі геометричні ізомери, наприклад, Z-і Е-ізомери (цис- і транс-ізомери), сполук, також як і всі можливі оптичні ізомери, наприклад, діастереомери та енантіомери, сполук. Крім того, винахід включає в свій обсяг як індивідуальні ізомери, так і будь-які їхні суміші, наприклад, рацемічні суміші. Індивідуальні ізомери можуть бути одержані з використанням відповідних ізомерних форм вихідних матеріалів, або вони можуть бути виділені після одержання кінцевої сполуки відповідно до загальноприйнятих способів розділення. Для відділення оптичних ізомерів, наприклад, енантіомерів, із суміші їх можуть використовуватися загальноприйняті методи розщеплення, наприклад, фракційна кристалізація. Сполуки формули І можуть бути одержані за допомогою безлічі шляхів синтезу аналогічно або відповідно до методів, відомих у літературі, із використанням придатних вихідних матеріалів. Похідні бензофурану можуть бути одержані, наприклад, відповідно до реакційної схеми 1: 30 35 40 45 На схемі 1 метоксизамісники знаходяться в положенні орто стосовно один одного, R4 має значення, визначені вище, і в положенні орто стосовно або ацильного замісника, або гідроксизамісника у формулі II, і R5 має значення, визначені вище. Ацилфенольна сполука алкілується функціоналізованим галоїдпохідним при кімнатній температурі в присутності придатної основи у придатному розчиннику, наприклад, карбонату калію в N, Nдиметилформаміді або гідриду натрію в тетрагідрофурані. Активована метиленова група конденсується з карбонілом із використанням придатної основи, наприклад, етаноляту натрію. У доповнення до карбетоксигрупи, метиленова група може активуватися будь-якою активуючою метиленгрупою, такою як нітро, ціано, ацил, арил, арилокси, алкілтіо або арилтіо. Карбетоксигрупа може потім перетворюватися при бажанні в інші функціональні групи. Одержання бензофуранових похідних додатково ілюструється в прикладі 18. 2,3-Дигідроізоіндол-1-онові похідні можуть бути одержані, наприклад, відповідно до реакційної схеми 2: 5 UA 98608 C2 5 На схемі 2 метоксизамісники знаходяться в положенні орто стосовно один одного, R4 має значення, визначені вище, і в положенні орто стосовно або метоксикарбонільного замісника, або СВrR5R6-замісника у формулі V, і R5, R6 і R7 мають значення, визначені вище. Кільце утворюється шляхом нагрівання зі зворотним холодильником сполуки формули V з аміном у придатному розчиннику, наприклад, толуолі. Одержання 2,3-дигідроізоіндол-1-онових похідних додатково ілюструється в прикладі 1. Похідні бензотіазолу можна одержувати, наприклад, відповідно до схеми 3: 10 15 На схемі 3 метоксизамісники знаходяться в положенні орто стосовно один одного, R4 має значення, визначені вище, і в 4- або 7-положенні у формулі VIII, і R5 являє, наприклад, арил або гетероарил. Кільце утворюється шляхом нагрівання зі зворотним холодильником аніліну з альдегідом і елементарною сіркою у придатному розчиннику, наприклад, диметилацетаміді. Одержання похідних бензотіазолу додатково ілюструється в прикладах 3, 15 і 25. Похідні бензо[b]тіофену можна одержати, наприклад, відповідно до схеми реакції 4: 20 25 На схемі 4 метоксизамісники знаходяться в положенні орто стосовно один одного, R4 має значення, визначені вище, і в 4- або 7-положенні у формулі XI, і R5' являє, наприклад, (С1С8)алкокси, N-умісний гетероцикліл або (R8)2N-, де R8 має значення, визначені вище. Бензальдегід конденсується з малоновою кислотою у придатному розчиннику, наприклад, піридині, даючи в результаті похідну акрилової кислоти. Кільце утворюється за допомогою реакції кислоти з тіонілхлоридом у придатному розчиннику, наприклад, хлорбензолі або толуолі. Ще один шлях одержання похідних бензо[b]тіофену ілюструється на схемі 5: 6 UA 98608 C2 5 10 15 20 25 30 35 40 45 На схемі 5 метоксизамісники знаходяться в положенні орто стосовно один одного. Бензальдегід конденсується з роданіном XII у придатному розчиннику, наприклад, карбоновій кислоті, такій як оцтова кислота, даючи в результаті проміжну сполуку XIII. За допомогою придатної основи, наприклад, гідроксиду натрію, проміжну сполуку перетворюють у похідну 2меркаптоакрилової кислоти. Кільце утворюється за допомогою обробки меркаптосполуки, наприклад, йодом, у придатному розчиннику, наприклад, тетрагідрофурані. Карбоксигрупу при бажанні можна потім перетворювати в інші функціональні групи. Одержання похідних бензо[b]тіофену додатково ілюструється в прикладах 4-14, 16-17, 20-21 і 26-35. Деалкілування одержуваних у результаті діалкоксипроміжних сполук, також як і включення замісника R1, що являє ціано або нітро, описується в прикладах одержання конкретних сполук. Фахівцям у даній галузі техніки буде очевидно, що будь-який вихідний матеріал або проміжна сполука в описаних вище реакціях може за необхідності захищатися способом, добре відомим у галузі хімії. Захист будь-якої функціональної групи може згодом зніматися за способом, відомим у техніці. Описані вище способи синтезу призначені для ілюстрації одержання сполук формули І, і дане одержання ніяким чином не обмежується ними, тобто є також інші можливі методи синтезу, які знаходяться в обсязі загальних знань фахівців у даній галузі. Сполуки формули І при бажанні можна перетворювати у форму їхніх фармацевтично прийнятних солей або ефіру з використанням добре відомих у техніці способів. Даний винахід буде пояснений детальніше за допомогою наступних прикладів. Дані приклади призначені тільки для цілей ілюстрації і не обмежують обсяг винаходу, визначений у пунктах формули винаходу. Приклад 1 2-(4-Хлорфеніл)-5,6-дигідрокси-4-нітро-2,3-дигідроізоіндол-1-он 2-(4-Хлорфеніл)-5,6-диметокси-2,3-дигідроізоіндол-1-он Розчин метилового ефіру 2-бромметил-4,5-диметоксибензойної кислоти (2,9 г), 4хлораніліну (1,28 г) і триетиламіну (1,4 мл) нагрівали зі зворотним холодильником у толуолі протягом шести годин. Потім реакційну суміш перемішували на льодяній бані, відфільтровували і промивали 1M соляною кислотою і водою. Вихід: 0,74 г 1 Н ЯМР (ДМСО-d6): =3,85 (с, 3Н, СН3О), 3,88 (с, 3Н, СН3О), 4,89 (с, 2Н, СН2), 7,23 (с, 1Н, АrН), 7,24 (с, 1H, АrН), 7,48 (д, 2Н, J=8,9 Гц), 7,91 (д, 2Н, J=8,9 Гц). 2-(4-Хлорфеніл)-5,6-дигідрокси-2,3-дигідроізоіндол-1-он 2-(4-Хлорфеніл)-5,6-диметокси-2,3-дигідроізоіндол-1-он (0,74 г) диметилювали 4 екв. триброміду бору, як описано в прикладі 8. Вихід: 0,79 г (сирий матеріал використовували як такий у наступній стадії) 1 Н ЯМР (ДМСО-d6): =4,80 (с, 2Н, СН2), 6,77 (с, 1Н, АrН), 6,82 (с, 1Н, АrН), 7,48 (д, 2Н, J=9,1 Гц), 7,91 (д, 2Н, J=9,1 Гц). 6-Ацетокси-2-(4-хлорфеніл)-3-оксо-2,3-дигідро-1Н-ізоіндол-5-іловий ефір оцтової кислоти 2-(4-Хлорфеніл)-5,6-дигідрокси-2,3-дигідроізоіндол-1-он (0,79 г сирого матеріалу) і оцтовий ангідрид (10 мл) перемішували при 80 °C з однією краплею сірчаної кислоти у ролі каталізатора протягом однієї години. Суміш виливали в льодяну воду, відфільтровували і перекристалізовували з оцтової кислоти. Вихід: 0,5 г 7 UA 98608 C2 Н ЯМР (ДМСО-d6): =2,29 (с, 3Н, СН3СОО), 2,34 (с, 3Н, СН3СОО), 5,04 (с, 2Н, СН2), 7,51 (д, 2Н, J=8,8 Гц), 7,62 (с, 1Н, ArH), 7,70 (с, 1Н, ArH), 7,92 (д, 2Н, J=8,8 Гц). 2-(4-Хлорфеніл)-6~гідрокси-3-оксо-2,3-дигідро-1H-ізоіндол-5-іловий ефір оцтової кислоти Розчин 6-ацетокси-2-(4-хлорфеніл)-3-оксо-2,3-дигідро-1Н-ізоіндол-5-ілового ефіру оцтової кислоти (0,5 г) у сухому N, N-диметилформаміді (15 мл) обробляли морфоліном (0,13 мл) при 05 °C і потім перемішували протягом 1 години при кімнатній температурі. Реакційну суміш виливали в льодяну воду і відфільтровували. Вихід: 0,34 г 1 Н ЯМР (ДМСО-d6): =2,29 (с, 3Н, СН3СОО), 4,92 (с, 2H, СН2), 7,14 (с, 1Н, ArH), 7,43 (с, 1H, ArH), 7,48 (д, 2Н, J=8,9 Гц), 7,90 (д, 2Н, J=8,9 Гц). 2-(4-Хлорфеніл)-6-гідрокси-7-нітро-3-оксо-2>3-дигідро-1Н-ізоіндол-5-іловий ефір оцтової кислоти Суспензію 2-(4-хлорфеніл)-6-гідрокси-3-оксо-2,3-дигідро-1Н-ізоіндол-5-ілового ефіру оцтової кислоти (0,34 г) в оцтовій кислоті (7 мл) обробляли 2М азотною кислотою в дихлорметані (0,6 мл). Через 1 годину реакційну суміш відфільтровували. Вихід: 0,24 г (сирий матеріал використовували як такий у наступній стадії) 1 Н ЯМР (ДМСО-d6): =2,35 (с, 3Н, СН3СОО), 5,25 (с, 2Н, СН2), 7,50 (д, 2Н, J=8,8 Гц), 7,89 (с, 1Н, ArH), 7,93 (д, 2Н, J=8,8 Гц). 2-(4-Хлорфеніл)-5,6-дигідрокси-4-нітро-2,3-дигідроізоіндол-1-он 2-(4-Хлорфеніл)-6-гідрокси-7-нітро-3-оксо-2,3-дигідро-1Н-ізоіндол-5-іловий ефір оцтової кислоти (0,24 г сирого матеріалу) нагрівали зі зворотним холодильником у метанолі (15 мл) з трьома краплями концентрованої хлористоводневої кислоти протягом шести годин. Потім реакційну суміш охолоджували і відфільтровували. Вихід: 80 мг 1 Н ЯМР (ДМСО-d6): =5,13 (с, 2Н, СН2), 7,34 (с, 1Н, АrН), 7,48 (д, 2Н, J=8,7 Гц), 7,91 (д, 2Н, J=8,7 Гц), 10,4-11,5 (ушир., 2Н, ОН). Приклад 2 5,6-Дигідрокси-7-нітро-3Н-ізобензофуран-1-он 5,6-Дигідрокси-7-нітро-3Н-iзобензофуран-1-он До розчину 5,6-дигідрокси-3Н-ізобензофуран-1-ону (0,4 г) у сірчаній кислоті при -30 °C додавали розчин 5М азотної кислоти в сірчаній кислоті (0,55 мл). Реакційній суміші давали можливість нагрітися до кімнатної температури і потім виливали в льодяну воду. Продукт відфільтровували і перекристалізовували з оцтової кислоти. Вихід: 0,2 г 1 Н ЯМР (ДМСО-d6): =5,26 (с, 2Н, СН2), 7,14 (с, 1H, АrН), 10,6 (ушир., 1H, ОН), 11,75 (ушир., 1H, ОН). Приклад 3 Метансульфонат 7-нітро-2-піридин-4-ілбензотіазол-5,6-діолу 5,6-Диметокси-2-піридин-4-ілбензотіазол Розчин 3,4-диметоксіаніліну (6 г) і сірки (5 г) нагрівали зі зворотним холодильником у 4піколіні (15 мл) протягом п'яти годин. Холодну реакційну суміш виливали в метанол, тримали в умовах льодяної бані протягом 30 хвилин і відфільтровували. Продукт промивали метанолом і дисульфідом вуглецю. Вихід: 6,14 г 1 Н ЯМР (ДМСО-d6): =3,88 (с, 3Н, СН3О), 3,89 (с, 3Н, СН3О), 7,67 (с, 1Н, АrН), 7,76 (с, 1Н, АrН), 7,94 (д, 2Н, J=6,4 Гц), 8,75 (д, 2Н, J=6,4 Гц). 5,6-Диметокси-4-нітро-2-піридин-4-ілбензотіазол До розчину 5,6-диметокси-2-піридин-4-ілбензотіазолу (1,1 г) у сірчаній кислоті (10 мл) додавали нітрат калію (0,5 г). Через 60 хвилин витримування при кімнатній температурі суміш виливали в льодяну воду і відфільтровували. Перекристалізація з ацетону давала чистий продукт. Вихід: 0,8 г 1 Н ЯМР (ДМСО-d6): =4,05 (с, 3Н, СН3О), 4,07 (с, 3Н, СН3О), 8,07 (д, 2Н, J=6 Гц), 8,25 (с, 1H, АrН), 8,81 (д, 2Н, J=6 Гц). Метансульфонат 7-нітро-2-піридин-4-ілбензотіазол-5,6-діолу Розчин 5,6-диметокси-4-нітро-2-піридин-4-ілбензотіазолу (0,4 г) нагрівали зі зворотним холодильником у 48 % розчині НВr (14,5 мл) протягом 2 годин. Кристали фільтрували, брали в метансульфонову кислоту (2 мл), нагрівали при цьому, і розводили метанолом. Після перемішування в льодяній бані сіль відфільтровували. Вихід: 0,44 г 1 5 10 15 20 25 30 35 40 45 50 55 60 8 UA 98608 C2 5 10 15 20 25 30 35 40 45 50 55 60 Точка плавлення: >350 °C 1 Н ЯМР (ДМСО-d6): =2,37 (с, 3Н, CH3SO3-), 7,83 (с, 1H, АrН), 8,42 (д, 2Н, J=6,3 Гц), 8,94 (д, 2Н, J=6,3 Гц). Приклад 4 3-Хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонова кислота 3-(3,4-Диметоксифеніл)акрилова кислота 3,4-Диметоксибензальдегід (5 г), малонову кислоту (4,7 г), піперидин (0,5 мл) і піридин (15 мл) нагрівали зі зворотним холодильником протягом 6 годин. Реакційну суміш виливали в льодяну воду і підкисляли 6М хлористоводневою (соляною) кислотою. Одержану в результаті тверду речовину відфільтровували, промивали водою і сушили у вакуумі. 1 Н ЯМР (ДМСО-d6): =3,80 (д, 6Н), 6,44 (д, 1H), 7,20 (кв., 1H), 7,31 (д, 1H), 7,4 (д, 1Н), 12 (ушир., 1H). Метиловий ефір 3-хлор-5,6-диметоксибензо[b]тіофен-2-карбонової кислоти 3-(3,4-Диметоксифеніл)акрилову кислоту (1,0 г) суспендували в хлорбензолі (25 мл) і потім додавали тіонілхлорид (1,5 мл). Суспензію перемішували при кімнатній температурі і через 30 хвилин додавали піридин (0,1 мл). Реакційну суміш нагрівали зі зворотним холодильником протягом 24 годин. Одержану в результаті тверду речовину відфільтровували і розчиняли в хлорбензолі (20 мл) і метанолі (20 мл). Реакційну суміш нагрівали зі зворотним холодильником протягом 1 години і потім охолоджували. Тверду речовину відфільтровували, промивали метанолом і сушили у вакуумі. 1 Н ЯМР (ДМСО-d6): =3,88 (с, 3Н), 3,89 (с, 3Н), 3,90 (с, 3Н), 7,29 (с, 1Н), 7,29 (с, 1Н), 7,68 (с, 1Н). 3-Хлор-5,6-дигідроксибензо[b]тіофен-2-карбонова кислота Метиловий ефір 3-хлор-5,6-диметоксибензо[b]тіофен-2-карбонової кислоти (0,2 г) суспендували в дихлорметані (10 мл) в атмосфері азоту, охолоджували до -20 °C і додавали трибромистий бор (0,4 мл). Одержану в результаті суміш перемішували при -20 °C протягом 30 хвилин і потім у холодному стані протягом ночі. Суміш виливали в льодяну воду, екстрагували в етилацетаті і випарювали досуха. Продукт використовували на наступній стадії без будь-якого очищення. 3-Хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонова кислота 3-Хлор-5,6-дигідроксибензо[b]тіофен-2-карбонову кислоту розчиняли в етилацетаті і при 20 °C поступово додавали розчин азотної кислоти в дихлорметані (2М, 0,38 мл). Розчин перемішували протягом 10 хвилин при кімнатній температурі, а потім виливали в льодяну воду та екстрагували етилацетатом. Органічні екстракти об'єднували, сушили і випарювали досуха. Залишок перекристалізовували з оцтової кислоти. Вихід: 94 мг Точка плавлення: 298-300 C 1 Н ЯМР (ДМСО-d6): =7,49 (с, 1Н), 13-14 (ушир., 1H). Приклад 5 Етиловий ефір 3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонової кислоти Етиловий ефір 3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонової кислоти 3-Хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонову кислоту (70 мг) із прикладу 4, етанол (2 мл) і тіонілхлорид (0,16 мл) нагрівали зі зворотним холодильником протягом 4 годин. Етанол випарювали. Залишок нагрівали з чистим етанолом і гарячусуміш відфільтровували. Продукт сушили у вакуумі. Вихід: 34 мг Точка плавлення: 215 °C 1 Н ЯМР (ДМСО-d6): =1,36 (т, 3Н), 4,36 (кв., 2Н) 7,50 (с, 1Н). Приклад 6 3-Хлор-5,6-дигідрокси-4-нітробензо[b]тіофен-2-карбонова кислота Метиловий ефір 3-хлор-5-бензилокси-6-метоксибензо[b]тіофен-2-карбонової кислоти 3-(3-Бензилокси-4-метоксифеніл)акрилову кислоту перетворювали в метиловий ефір 3хлор-5-бензилокси-6-метоксибензо[b]тіофен-2-карбонової кислоти шляхом повторення способу з прикладу 4, за винятком використання 3-(3-бензилокси-4-метоксифеніл)акрилової кислоти замість 3-(3,4-диметоксифеніл)акрилової кислоти. Продукт являв собою суміш двох сполук, і його використовували в наступній стадії без будь-якого очищення. Метиловий ефір 3-хлор-5-гідрокси-6-метоксибензо[b]тіофен-2-карбонової кислоти Метиловий ефір 3-хлор-5-бензилокси-6-метоксибензо[b]тіофен-2-карбонової кислоти (0,7 г), оцтову кислоту (17,5 мл) і концентровану хлористоводневу кислоту (2,1 мл) нагрівали зі зворотним холодильником протягом 6 годин. Суміш охолоджували і випарювали досуха. 9 UA 98608 C2 5 10 15 20 25 30 35 40 45 50 55 60 Одержану в результаті суміш спочатку екстрагували в діетиловий ефір, а потім у розчин 1М гідроксиду натрію. Водну фазу підкисляли 6М хлористоводневою кислотою. Розчин перемішували в холоді протягом 2 годин і потім відфільтровували. Тверду речовину промивали водою і сушили у вакуумі. Продукт являв собою суміш двох сполук, і його використовували в наступній стадії без будь-якого очищення, 3-Хлор-5-гідрокси-6-метоксибензо[b]тіофен~2-карбонова кислота Метиловий ефір 3-хлор-5-гідрокси-6-метоксибензо[b]тіофен-2-карбонової кислоти (0,5 г) розчиняли в метанолі (10 мл) і додавали 5М гідроксид натрію (10 мл). Розчин нагрівали зі зворотним холодильником протягом 2 годин. Метанол випарювали та одержаний у результаті розчин підкисляли 2М хлористоводневою кислотою. Одержану в результаті тверду речовину сушили у вакуумі. Продукт використовували на наступній стадії без будь-якого очищення. 3-Хлор-5-гідрокси-6-метокси-4-нітробензо[b]тіофен-2-карбонова кислота 3-Хлор-5-гідрокси-6-метоксибензо[b]тіофен-2-карбонову кислоту (0,28 г) розчиняли в етилацетаті і при 20 °C поступово додавали розчин азотної кислоти в дихлорметані (2М, 0,75 мл). Розчин перемішували при кімнатній температурі протягом 10 хвилин і потім виливали в льодяну воду та екстрагували етилацетатом і випарювали досуха. 1 Н ЯМР (ДМСО-d6): =3,98 (с, 3Н), 7,90 (с, 1Н), 10,9 (ушир., 1Н), 13,4-14,4 (ушир., 1Н). 3-Хлор-5,6-дигідрокси-4-нітробензо[b]тіофен-2-карбонова кислота До розчину 3-хлор-5-гідрокси-6-метокси-4-нітробензо[b]тіофен-2-карбонової кислоти (0,2 г), піридин (6,3 мл) в етилацетаті (5 мл) поступово додавали трихлористий алюміній (0,32 г). Реакційну суміш нагрівали зі зворотним холодильником при 90 °C протягом 2 годин. До теплого (60 °C) реакційного розчину додавали суміш концентрованої хлористоводневої кислоти і льоду (1:1). Продукт екстрагували в етилацетат, сушили і випарювали. Залишок обробляли діетиловим ефіром і одержану в результаті тверду речовину відфільтровували. Вихід: 32 мг Точка плавлення: 215-219 °C 1 Н ЯМР (ДМСО-d6): =7,54 (с, 1Н), 10-12 (ушир., 2Н), 13,5-14 (ушир., 1Н). Приклад 7 3-Хлор-5,6-дигідрокси-7-нітробензо[b]тіофен Метиловий ефір 3-хлор-6-бензилокси-5-метоксибензо[b]тіофен-2-карбонової кислоти 3-(4-Бензилокси-3-метоксифеніл)акрилову кислоту перетворювали в метиловий ефір 3хлор-6-бензилокси-5-метоксибензо[b]тіофен-2-карбонової кислоти шляхом повторення способу прикладу 4, за винятком використання 3-(4-бензилокси-3-метоксифеніл)акрилової кислоти замість 3-(3,4-диметоксифеніл)акрилової кислоти. 1 Н ЯМР (ДМСО-d6): =3,88 (с, 3Н), 3,90 (с, 3Н), 5,20 (с, 2Н), 7,32-7,50 (м, 5Н),7,81 (с, 1Н). 3-Хлор-6-гідрокси-5-метоксибензо[b]тіофен Метиловий ефір 3-хлор-6-бензилокси-5-метоксибензо[b]тіофен-2-карбонової кислоти (1,33 г), метанол (27 мл) і 5М гідроксид натрію (27 мл) нагрівали зі зворотним холодильником протягом 2,5 годин. Метанол випарювали та одержану в результаті тверду речовину відфільтровували. Тверду речовину розчиняли у воді і підкисляли концентрованою хлористоводневою кислотою. Суміш перемішували у водно-льодяній бані, відфільтровували і сушили у вакуумі. Одержану в результаті тверду речовину, мідь (0,17 г) і хінолін (10,6 мл) нагрівали при 210 °C протягом 1 години. До охолодженої суміші додавали 10 % хлористоводневу кислоту (26 мл) і розчиняли в етилацетаті. Розчин промивали 10 % карбонатом натрію і 1М хлористоводневою кислотою, а потім випарювали досуха. Одержаний залишок, оцтову кислоту (24 мл) і концентровану хлористоводневу кислоту (3,2 мл) нагрівали зі зворотним холодильником протягом 5 годин. Розчин випарювали досуха. Залишок розчиняли в діетиловому ефірі і потім екстрагували 1М гідроксидом натрію. Водну фазу підкисляли 6М хлористоводневою кислотою та екстрагували в етилацетат. Розчин сушили, випарювали досуха і потім розтирали з діетиловим ефіром і відфільтровували. 1 Н ЯМР (ДМСО-d6): =3,89 (с, 3Н), 7,17 (с, 1Н), 7,35 (с, 1Н) 7,56 (с, 1Н), 9,52 (с, 1Н). 3-Хлор-6-гідрокси-5-метокси-7-нітробензо[b]тіофен 3-Хлор-6-гідрокси-5-метоксибензо[b]тіофен (0,39 г) розчиняли в етилацетаті (26 мл). До розчину поступово додавали розчин азотної кислоти в дихлорметані (2М, 0,9 мл) при кімнатній температурі. Розчин перемішували при кімнатній температурі протягом 10 хвилин, а потім виливали в льодяну воду та екстрагували етилацетатом, і випарювали досуха. Продукт очищали колонковою хроматографією з використанням суміші толуол-етилацетат-оцтова кислота 8:1:1 як елюент. 1 Н ЯМР (ДМСО-d6): =4,02 (с, 3Н), 7,58 (с, 1H), 7,87 (с, 1H). 3-Хлор-5,6-дигідрокси-7-нітробензо[b]тіофен 10 UA 98608 C2 5 10 15 20 25 30 35 40 45 50 55 60 До розчину 3-хлор-6-гідрокси-3-метокси-7-нітробензо[b]тіофену (0,13 г) і піридину (3,3 мл) поступово додавали трихлористий алюміній (0,09 г). Реакційну суміш нагрівали при 90 °C протягом 2 годин. До теплої (60 °C) реакційної суміші додавали суміш льоду і концентрованої хлористоводневої кислоти (1:1). Продукт відфільтровували, промивали 1М хлористоводневою кислотою і водою і сушили у вакуумі. Вихід: 110 мг Точка плавлення: 182-184 °C 1 Н ЯМР (ДМСО-d6): =7,49 (с, 1Н), 7,83 (с, 1Н) 10-12 (ушир., 2Н). Приклад 8 (3-Хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-іл)морфолін-4-ілметанон (3-Хлор-5,6-диметоксибензо[b]тіофен-2-іл)морфолін-4-ілметанон 3-(3,4-Диметоксифеніл)акрилову кислоту перетворювали в (3-хлор-5,6диметоксибензо[b]тіофен-2-іл)морфолін-4-іл метанон шляхом повторення способу з прикладу 4, за винятком використання морфоліну замість метанолу. 1 Н ЯМР (ДМСО-d6): =3,53 (м, 4Н), 3,64 (м, 4Н), 3,85 (с, 3Н), 3,88 (с, 3Н), 7,21 (с, 1Н), 7,67 (с, 1Н). (3-Хлор-5,6-дигідроксибензо[b]тіофен-2-іл)морфолін-4-ілметанон (3-Хлор-5,6-диметоксибензо[b]тіофен-2-іл)морфолін-4-ілметанон (8,6 г) суспендували в дихлорметані (50 мл) в атмосфері азоту, охолоджували до -20 °C і по краплях обробляли розчином 1М триброміду бору (100 мл) у дихлорметані. Одержану в результаті суспензію перемішували при -20 °C протягом 30 хвилин і потім в охолодженому стані протягом ночі. Суміш виливали в льодяну воду і перемішували протягом 30 хвилин при кімнатній температурі. Продукт відфільтровували і промивали водою. 1 Н ЯМР (ДМСО-d6): =3,40 (ушир., 4Н), 3,62 (ушир., 4Н), 7,11 (с, 1H), 7,32 (с, 1Н), 9,5-10,0 (ушир., 2Н). (3-Хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-іл)морфолін-4-ілметанон (3-Хлор-5,6-дигідроксибензо[b]тіофен-2-іл)морфолін-4-ілметанон (7,7 г) розчиняли в етилацетаті (500 мл) і при 20 °C поступово додавали розчин азотної кислоти в дихлорметані (2М, 13,6 мл). Розчин перемішували протягом 30 хвилин при кімнатній температурі, а потім виливали в льодяну воду, і одержану в результаті тверду речовину відфільтровували і сушили у вакуумі. Продукт перекристалізовували з оцтової кислоти. Вихід: 4,8 г Точка плавлення: 259 °C 1 Н ЯМР (ДМСО-d6): =3,53 (ушир., 4Н), 3,62 (ушир., 4Н), 7,51 (с, 1Н), 10-11 (ушир., 2Н). Приклад 9 Діетиламід 3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонової кислоти 5,6-Діацетокси-3-хлор-7-нітробензо[b]тіофен-2-карбонова кислота 3-Хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонову кислоту (0,32 г) з прикладу 4, оцтовий ангідрид (1,6 мл) і концентровану сірчану кислоту (2 краплі) нагрівали при 50-60 °C протягом 1 години. Реакційну суміш виливали у воду і перемішували в холоді. Продукт відфільтровували, промивали холодною водою і сушили у вакуумі. 1 Н ЯМР (ДМСО-d6): =2,41 (с, 3Н), 2,48 (с, 3Н), 13,5-14,5 (ушир., 1Н). Діeтиламід 5,6-діацетокси-3-хлор-7-нітробензо[b]тіофен-2-карбонової кислоти До розчину 5,6-діацетокси-3-хлор-7-нітробензо[b]тіофен-2-карбонової кислоти (0,39 г) у толуолі (3,9 мл) додавали тіонілхлорид (0,11 мл) і N, N-диметилформамід (одну краплю). Розчин нагрівали при 80 °C протягом 1 години, а потім випарювали досуха і сушили у вакуумі. Залишок розчиняли в дихлорметані (3,9 мл) і додавали розчин діетиламіну (0,12 мл) і N, Nдіізопропіламіну (0,5 мл) у дихлорметані (3,9 мл). Реакційний розчин перемішували при кімнатній температурі протягом 3 годин. Його випарювали досуха і до залишку додавали метанол (5 мл) і концентровану хлористоводневу кислоту (1 мл). Продукт екстрагували дихлорметаном, потім промивали водою і розчином бікарбонату натрію. Розчин сушили і випарювали. Продукт використовували на наступній стадії без будь-якого очищення. Діетиламід 3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонової кислоти Діетиламід 5,6-діацетокси-3-хлор-7-нітробензо[b]тіофен-2~карбонової кислоти (0,32 г) розчиняли в метанолі (16 мл) і до реакційного розчину додавали розчин карбонату калію (0,61 г) у воді (3 мл). Суміш перемішували при кімнатній температурі протягом 1 години. Метанол випарювали і залишок тримали в холоді і відфільтровували. Тверду речовину промивали водою і перекристалізовували з метанолу. Вихід: 138 мг Точка плавлення: 202-205 °C 11 UA 98608 C2 Н ЯМР (ДМСО-d6): =1,14 (ушир., 6Н), 3,41 (ушир., 4Н), 7,49 (с, 1Н), 10-12 (ушир., 2Н). Приклад 10 (3-Хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-іл)піперидин-1-ілметанон (3-Хлор-5,6-дигідрокси-7-нітробензо[b]тІофен-2-іл)піперидин-1-ілметанон Зазначену в заголовку сполуку одержували з продукту прикладу 4 шляхом повторення способу прикладу 9 за винятком використання піперидину замість діетиламіну. Вихід: 192 мг Точка плавлення: 254-256 °C 1 Н ЯМР (ДМСО-d6): =1,55-1,62 (м, 10Н), 7,48 (с, 1Н), 10-11 (ушир., 2Н). Приклад 11 Феніламід 3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонової кислоти Феніламід 3-хлор-5,6-дигідрокси- 7-нітробензо[b]тіофен-2-карбонової кислоти Зазначену в заголовку сполуку одержували з продукту прикладу 4 шляхом повторення способу прикладу 9 за винятком використання аніліну замість діетиламіну. Вихід: 100 мг Точка плавлення: 288 °C 1 Н ЯМР (ДМСО-d6): =7,15 (т, 1Н), 7,38 (т, 2Н), 7,52 (с, 1H), 7,70 (д, 1Н), 10,37 (с, 1H). Приклад 12 3-[(3-Хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбоніл)аміно]бензойна кислота 3-[(3-Хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбоніл)аміно]бензойна кислота Зазначену в заголовку сполуку одержували з продукту прикладу 4 шляхом повторення способу прикладу 9 за винятком використання 3-амінобензойної кислоти замість діетиламіну. Вихід: 53 мг Точка плавлення: 293-294 °C 1 Н ЯМР (ДМСО-d6): =7,50 (д, 1Н), 7,53 (д, 1Н), 7,72 (д, 1Н), 7,95 (д, 1Н), 8,36 (с, 1H), 10,58 (с, 1Н). Приклад 13 4-[(3-Хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбоніл)аміно]бензойна кислота 4-[(3-Хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбоніл)аміно]бензойна кислота Зазначену в заголовку сполуку одержували з продукту прикладу 4 шляхом повторення способу прикладу 9 за винятком використання 4-амінобензойної кислоти замість діетиламіну. Вихід: 110 мг Точка плавлення: 298-300 °C 1 Н ЯМР (ДМСО-d6): =7,55 (с, 1Н), 7,84 (д, 2Н), 7,96 (д, 2Н), 10,70 (с, 1Н). Приклад 14 (4-Метоксифеніл)амід 3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонової кислоти (4-Метоксифеніл) амід 3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонової кислоти Зазначену в заголовку сполуку одержували з продукту прикладу 4 шляхом повторення способу прикладу 9 за винятком використання 4-метоксіаніліну замість діетиламіну. Вихід: 94 мг Точка плавлення: >350 °C 1 Н ЯМР (ДМСО-d6): =3,74 (с, 3Н), 6,88 (с, 1H), 6,92 (д, 2Н), 7,62 (д, 2Н), 8,46 (ушир., 2Н), 9,82 (ушир., 1Н). Приклад 15 2-Метил-7-нітробензотіазол-5,6-діол 1-Бром-4,5-диметокси-2-нітробензол До розчину 4-бромвератролу (20 г) в оцтовій кислоті (50 мл) додавали 2М азотну кислоту (48 мл). Все перемішували при кімнатній температурі протягом 30 хвилин, а потім реакційний розчин виливали у воду. Одержану в результаті тверду речовину відфільтровували, промивали водою і сушили у вакуумі. 1 Н ЯМР (ДМСО-d6): =3,85 (с, 3Н), 3,90 (с, 3Н), 7,38 (с, 1H), 7,67 (с, 1Н). 5,6-Диметокси-2-метилбензотіазол 1-Бром-4,5-диметокси-2-нітробензол (10 г) суспендували в етанолі (50 мл). До реакційної суміші додавали суспензію сульфіду натрію (5 г) і сірки (0,65 г) в етанолі (12 мл). Реакційну суміш нагрівали зі зворотним холодильником протягом 1,5 годин і потім одержану в результаті тверду речовину відфільтровували і промивали гарячою водою та етанолом. Суху тверду речовину суспендували з оцтовою кислотою (60 мл) і ацетангідридом (35 мл). До суспензії поступово додавали цинк (16,6 г) і суспензію перемішували при кімнатній температурі протягом 15 хвилин перед фільтрацією. Залишок випарювали досуха. Продукт очищали колонковою хроматографією з використанням суміші толуол-етилацетат-оцтова кислота 8:1:1 як елюенту. 1 5 10 15 20 25 30 35 40 45 50 55 60 12 UA 98608 C2 Н ЯМР (ДМСО-d6): =2,72 (с, 3Н), 3,81 (с, 3Н), 3,82 (с, 3Н), 7,44 (с, 1Н), 7,56 (с, 1H). 2-Метилбензотіазол-5,6-діол 5,6-Диметокси-2-метилбензотіазол (3,9 г) нагрівали зі зворотним холодильником із 47 % бромистоводневою кислотою (40 мл) протягом 4 годин. Тверду речовину відфільтровували і сушили у вакуумі. 1 Н ЯМР (ДМСО-d6): =2,66 (с, 3Н), 7,21 (с, 1Н), 7,33 (с, 1Н), 9,23 (с, 2Н). 2-Метил-7-нітробензотіазол-5,6-діол 2-Метилбензотіазол-5,6-діол розчиняли в етилацетаті і при 20 °C поступово додавали розчин азотної кислоти в дихлорметані (2М, 0,38 мл). Розчин перемішували 10 хвилин при кімнатній температурі, а потім виливали в льодяну воду, екстрагували в етилацетат і випарювали. Продукт очищали колонковою хроматографією з використанням суміші толуолетилацетат-оцтова кислота 8:1:1 як елюенту. Вихід: 75 мг Точка плавлення: 219 °C 1 Н ЯМР (ДМСО-d6): =2,73 (с, 3Н), 7,63 (с, 1H), 10,1-10,9 (ушир., 2Н). Приклад 16 (5,6-Дигідрокси-7-нітробензо[b]тіофен-2-іл)морфолін-4-ілметанон 5-[1-(4-Бензилокси-3-метоксифеніл)мет-(Z)-иліден]-2-тіоксотіазолідин-4-он 4-Бензилокси-3-метоксибензальдегід (29 г) розчиняли в оцтовій кислоті (16 г) і потім додавали роданін (16 г) і ацетат натрію (36 г). Розчин нагрівали зі зворотним холодильником протягом 1 години. Реакційний розчин виливали у воду. Тверду речовину відфільтровували, промивали водою і сушили у вакуумі. 1 Н ЯМР (ДМСО-d6): =3,83 (с, 3Н), 5,17 (с, 2Н), 7,15-7,22 (кв, 3Н), 7,33-7,46 (м, 5Н), 7,60 (с, 1Н), 13,0-14,0 (ушир., 1H). (Z)-3-(4-Бензилокси-3-метоксифеніл)-2-меркаптоакрилова кислота 5-[1-(4-Бeнзилoкcи-3-мeтoкcифeнiл)мeт-(Z)-илiдeн]-2-тioкcoтiaзoлiдин-4-oн (38 г) і 2,5 М NaOH нагрівали при 80 °C протягом 1 години. Потім розчин охолоджували до 10 °C і повільно вливали в 6М розчин НСl (200 мл). Реакційну суміш перемішували при кімнатній температурі протягом 1 години. Тверду речовину відфільтровували, промивали водою і сушили у вакуумі. 1 Н ЯМР (ДМСО-d6): =3,80 (с, 3Н), 5,14 (с, 2Н), 7,14-7,16 (д, 1H), 7,26-7,46 (м, 6Н), 7,70 (с, 1Н). 6-Гiдрокси-5-метоксибензо[b]тіофен-2-карбонова кислота Суміш (Z)-3-(4-бензилокси-3-метоксифеніл)-2-меркаптоакрилової кислоти (21 г) і йоду (21 г) у тетрагідрофурані (300 мл) перемішували при 60 °C протягом 15 годин. Потім виливали у воду (1 л) і додавали 120 г бісульфіту натрію. Продукт екстрагували етилацетатом, а потім його екстрагували в бікарбонат натрію. Водну фазу підкисляли концентрованою хлористоводневою кислотою і перемішували при кімнатній температурі протягом 1 години. Тверду речовину відфільтровували, промивали водою і сушили у вакуумі. 1 Н ЯМР (ДМСО-d6): 5=3,83 (с, 3Н), 7,29 (с, 1Н), 7,45 (с, 1Н), 7,89 (с, 1Н), 9,70 (ушир., 1H), 12,8-13,3 (ушир., 1Н). 6-Гідрокси-5-метокси-7-нітробензо[b]тіофен-2-карбонова кислота 6-Гідрокси-5-метоксибензо[b]тіофен-2-карбонову кислоту (3,2 г) розчиняли в етилацетаті (200 мл) і при 0 °C до них поступово додавали розчин азотної кислоти в дихлорметані (2М, 7,7 мл). Розчин перемішували при кімнатній температурі протягом 30 хвилин, а потім виливали в охолоджену льодом воду і відфільтровували. Тверду речовину промивали етилацетатом і сушили у вакуумі. 1 Н ЯМР (ДМСО-d6): =3,96 (с, 3Н), 7,95 (с, 1Н), 8,05 (с, 1H), 11,5-12,0 (ушир, 1Н), 12,8-13,6 (ушир, 1Н). (6-Гідрокси-5-метокси-7-нітробензо[b]тiофен-2-іл)морфолін-4-ілметанон 6-Гідрокси-5-метокси-7-нітробензо[b]тіофен-2-карбонову кислоту (2,7 г) розчиняли у толуолі (45 мл). Додавали тіонілхлорид (1,2 мл) і N, N-диметилформамід (4 краплі). Розчин перемішували при 80 °C протягом 2 годин і після цього випарювали. Залишок розчиняли в дихлорметані (45 мл) і додавали морфолін (1,4 мл) і триетиламін (1,2 мл). Реакційний розчин перемішували при кімнатній температурі протягом ночі. До розчину додавали розчин води і 2М НСl. Тверду речовину промивали водою і сушили у вакуумі. 1 Н ЯМР (ДМСО-d6): =3,67 (ушир., 4Н), 3,69 (ушир, 4Н), 3,95 (с, 3Н), 7,73 (с, 1Н), 7,87 (с, 1Н), 11,0-11,8 (ушир, 1Н). (5,6-Дигідрокси-7-нітробензо[b]тіофен-2-іл)морфолін-4-ілметанон (6-Гідрокси-5-метокси-7-нітробензо[b]тіофен-2-іл)морфолін-4-ілметанон (1,0 г) розчиняли в етилацетаті (11 мл) і додавали піридин (14 мл). Потім до розчину поступово додавали 1 5 10 15 20 25 30 35 40 45 50 55 60 13 UA 98608 C2 5 10 15 20 25 30 35 40 45 50 55 трихлористий алюміній (0,47 г). Реакційну суміш нагрівали протягом 2 годин при 110 °C. До теплого (60 °C) реакційного розчину додавали суміш льоду і концентрованої хлористоводневої кислоти (1:1), перемішували його при кімнатній температурі протягом 1 години. Тверду речовину відфільтровували, промивали водою та обробляли діетиловим ефіром. Вихід: 114 мг Точка плавлення: 266 °C 1 Н ЯМР (ДМСО-d6): =3,65 (ушир, 4Н), 3,68 (ушир, 4Н), 7,64 (с, 1Н), 7,72 (с, 1Н), 10-11 (ушир, 2Н). Приклад 17 5,6-Дигідрокси-7-нітробензо[b]тіофен-2-карбонова кислота 4-Бензилокси-3-етоксибензальдегід До розчину 3-етокси-4-гідроксибензальдегіду (83 г) у N, N-диметилформаміді (400 мл) поступово додавали 10М гідроксид натрію (55 мл), а потім при температурі до 40 °C додавали бензилхлорид (60 мл). Суміш перемішували при кімнатній температурі на протязі півгодини і протягом 2 годин при 60 °C. Розчин виливали в охолоджену льодом воду (2 л) і екстрагували діетиловим ефіром. Органічну фазу промивали водою і 5М гідроксидом натрію, а потім сушили і випарювали. Продукт перекристалізовували з суміші толуол-гептан. 1 Н ЯМР (ДМСО-d6): =1,34 (т, 3Н), 4,12 (кв, 2Н), 5,24 (с, 2Н), 7,26 (д, 1Н), 7,34-7,53 (м, 7Н), 9,83 (с, 1Н). 4-Бензилокси-5-етокси-2-нітробензальдегід 4-Бензилокси-3-етоксибензальдегід (20 г) розчиняли в дихлорметані (100 мл) і при температурі до 30 °C поступово додавали розчин азотної кислоти в дихлорметані (2М, 200 мл). Розчин перемішували при кімнатній температурі протягом 10 хвилин і потім виливали в охолоджену льодом воду. Органічну фазу промивали 1М гідроксидом натрію і водою, а потім сушили і випарювали. 1 Н ЯМР (ДМСО-d6): =1,37 (т, 3Н), 4,25 (кв, 2Н), 5,34 (с, 2Н), 7,36-7,49 (м, 5Н),7,82(с, 1H), 10,19 (с, 1Н). 5-Етокси-4-гідрокси-2-нітробензальдегід 4-Бензилокси-5-етокси-2-нітробензальдегід (23 г) розчиняли в оцтовій кислоті (93 мл) і концентрованій хлористоводневій кислоті (10 мл). Реакційну суміш нагрівали зі зворотним холодильником протягом 24 годин. Потім розчин випарювали досуха, і залишок розчиняли в діетиловому ефірі. Продукт екстрагували 1М гідроксидом натрію і підкисляли 6М хлористоводневою кислотою. Одержану в результаті тверду речовину відфільтровували і сушили у вакуумі. 1 Н ЯМР (ДМСО-d6): =1,37 (т, 3Н), 4,20 (кв, 2Н), 7,33 (с, 1Н), 7,57 (с, 1Н), 10,15 (с, 1H), 10,611,2 (ушир., 1Н). 5-Етокси-4-гідрокси-2,3-динітробензальдегід 5-Етокси-4-гідрокси-2-нітробензальдегід (1,6 г) розчиняли в дихлорметані (30 мл) і при температурі до 30 °C поступово додавали розчин азотної кислоти в дихлорметані (2М, 13 мл). Розчин перемішували при кімнатній температурі протягом 10 хвилин і потім виливали в охолоджену льодом воду. Органічну фазу промивали водою, а потім сушили і випарювали. 1 Н ЯМР (ДМСО-d6): =1,41 (т, 3Н), 4,32 (кв, 2Н), 7,56 (с, 1Н), 9,93 (с, 1H). 4,5-Діетокси-2,3-динітробензальдегід 5-Етокси-4-гідрокси-2,3-динітробензальдегід (3,77 г), N, N-диметилформамід (35 мл), К2СО3 (3,877 г) і етилбромід (50 мл) нагрівали зі зворотним холодильником протягом 24 годин. До реакційного розчину додавали діетиловий ефір (100 мл) і потім промивали водою і 1М гідроксидом натрію. Розчин сушили і випарювали. 1 Н ЯМР (ДМСО-d6): =1,26 (т, 3Н), 1,43 (т, 3Н), 4,36 (м, 6Н), 7,70 (с, 1Н), 10,05 (с, 1H). Метиловий ефір 5,6-діетокси- 7-нітробензо[b]тіофен-2-карбонової кислоти 4,5-Діетокси-2,3-динітробензальдегід (1,53 г) розчиняли в N, N-диметилформаміді (6 мл) і потім додавали метилтіогліколят (1,36 мл). До реакційного розчину на холоді додавали триетиламін (2,6 мл). Суміш перемішували протягом ночі. Тверду речовину відфільтровували і промивали N, N-диметилформамідом. 1 Н ЯМР (ДМСО-d6): =1,39 (т, 3Н), 1,44 (т, 3Н), 4,24 (т, 3Н), 4,28 (кв, 3Н), 8,08 (с, 1H), 8,19 (с, 1Н). 5,6-Дигідрокси-7-нітробензо[b]тіофен-2-карбонова кислота Метиловий ефір 5,6-діетокси-7-нітробензо[b]тіофен-2-карбонової кислоти (160 мг), бромистоводневу кислоту (8 мл) і оцтову кислоту (8 мл) нагрівали зі зворотним холодильником протягом 6 годин і перемішували при кімнатній температурі протягом ночі. Тверду речовину 14 UA 98608 C2 5 10 15 20 25 30 35 40 45 50 55 відфільтровували і промивали розчином оцтової кислоти і бромистоводневої кислоти (1:1) і водою. Продукт перекристалізовували з ацетонітрилу. Вихід: 90 мг 1 Н ЯМР (ДМСО-d6): =7,71 (с, 1Н), 8,05 (с, 1Н), 10-11 (ушир., 2Н), 13-13,5 (ушир., 1Н). Приклад 18 5,6-Дигідрокси-7-нітробензофуран-2-карбонова кислота 2,4-Дигідрокси-5-метоксибензальдегід 2,4,5-Триметоксибензальдегід (20 г) розчиняли в дихлорметані (20 мл) і невеликими порціями додавали хлорид алюмінію (34,1 г). Одержану в результаті суміш перемішували при кімнатній температурі протягом 5 годин, а потім виливали в підкислену льодяну воду. Дихлорметановий шар відділяли і водну фазу екстрагували етилацетатом. Об'єднані органічні шари екстрагували 1н NaOH. Водну фазу підкисляли НСl і осад відфільтровували. Продукт перекристалізовували з толуолу. 1 Н ЯМР (400 МГц, ДМСО-d6): =3,74 (с, 3Н), 6,41 (с, 1Н), 7,12 (с, 1Н), 9,96 (с, 1H), 10,4 (ушир, 1Н), 10,52 (ушир., 1Н). 4-Бензилокси-2-гідрокси-5-метоксибензальдегід 2,4-Дигідрокси-5-метоксибензальдегід (6,0 г), бензилбромід (9,7 г) і 1,8діазабіцикло[5.4.0]ундец-7-ен (8,6 г) у N, N-диметилформаміді (30 мл) нагрівали при 100 °C в атмосфері азоту протягом 5 годин. Після охолодження до кімнатної температури додавали 1н NaOH і суміш промивали етилацетатом. Водну фазу підкисляли НСl і осад відфільтровували. 1 Н ЯМР (400 МГц, ДМСО-d6): =3,74 (с, 3Н), 5,16 (с, 2Н), 6,65 (с, 1Н), 7,17 (с, 1Н), 7,36-7,47 (м, 5Н), 10,02 (с, 1Н), 10,68 (с, 1Н). Етиловий ефір (5-бензилокси-2-форміл-4-метоксифенокси)оцтової кислоти 4-Бензилокси-2-гідрокси-5-метоксибензальдегід (2,9 г), етилбромацетат (2,3 г) і 1,8діазабіцикло[5.4.0]ундец-7-ен (2,1 г) у N, N-диметилформаміді (30 мл) нагрівали при 100 °C в атмосфері азоту протягом 5 годин. Після охолодження до кімнатної температури додавали воду і суміш екстрагували етилацетатом. Етилацетатну фазу промивали 1н NaOH і 1н НСl, сушили Na2SO4 і випарювали досуха. 1 Н ЯМР (400 МГц, ДМСО-d6): =1,20 (т, 3Н, J=7,2 Гц), 3,76 (с, 3Н), 4,15 (кв, 2Н, J=7,2 Гц), 4,98 (с, 2Н), 5,21 (с, 2Н), 6,97 (с, 1Н), 7,19 (с, 1H), 7,36-7,47 (м, 5Н), 10,29 (с, 1Н). Етиловий ефір 6-бензилокси-5-метоксибензофуран-2-карбонової кислоти Етиловий ефір (5-бензилокси-2-форміл-4-метоксифенокси)оцтової кислоти (1,5 г), 1,8діазабіцикло[5.4.0]ундец-7-ен (0,33 г) і оцтову кислоту (0,026 г) у N, N-диметилформаміді (8 мл) перемішували при 100 °C в атмосфері азоту протягом 5 годин. Після охолодження до кімнатної температури суміш виливали в льодяну воду й осад відфільтровували. 1 Н ЯМР (400 МГц, ДМСО-d6): =1,32 (т, 3Н, J=7,l Гц), 3,82 (с, 3Н), 4,37 (кв, 2Н, J=7,1 Гц), 5,18 (с, 2Н), 7,25 (с, 1Н), 7,33-7,50 (м, 6H), 7,62 (д, 1Н, J=0,8 Гц). Етиловий ефір 6-гідрокси-5-метоксибензофуран-2-карбонової кислоти Етиловий ефір 6-бензилокси-5-метоксибензофуран-2-карбонової кислоти (7,3 г), оцтову кислоту (45 мл) і концентровану НСl (24 мл) перемішували при 50 °C протягом 0,5 години. Додавали воду і показник рН доводили до 3 за допомогою NaOH. Суміш екстрагували етилацетатом. Етилацетатну фазу сушили сульфатом натрію і випарювали досуха. Продукт перекристалізовували з толуолу. 1 Н ЯМР (400 МГц, ДМСО-d6): =1,32 (т, 3Н, J=7,l Гц), 3,82 (с, 3Н), 4,31 (кв, 2Н, J=7,1 Гц), 7,07 (д, 1H, J=0,9 Гц), 7,20 (с, 1H), 7,58 (д, 1H, J=0,9 Гц). Етиловий ефір 6-гідрокси-5-метокси-7-нітробензофуран-2-карбонової кислоти Етиловий ефір 6-гідрокси-5-метоксибензофуран-2-карбонової кислоти (1,5 г) розчиняли в дихлорметані (30 мл) і розчин охолоджували до -20 °C. Додавали 1М HNO3 у дихлорметані (6,4 мл) і через 10 хвилин суміш виливали в льодяну воду. Дихлорметановий шар відділяли і водну фазу екстрагували етилацетатом. Об'єднані органічні фази сушили сульфатом натрію і випарювали досуха. 1 Н ЯМР (400 МГц, ДМСО-d6): =1,33 (т, 3Н, J=7,1 Гц), 3,94 (с, 3Н), 4,35 (кв, 2Н, J=7,1 Гц), 7,57 (с, 1Н), 7,74 (с, 1Н), 11,3 (ушир., 1Н). 5,6-Дигідрокси- 7-нітробензофуран-2-карбонова кислота Етиловий ефір 6-гідрокси-3-метокси-7-нітробензофуран-2-карбонової кислоти (0,25 г) розчиняли в дихлорметані та охолоджували до -5 °C. Додавали розчин 1М трибромистого бору в дихлорметані (4,5 мл) і суміш перемішували при 0 °C протягом 24 годин. Суміш виливали в льодяну воду і дихлорметановий шар відділяли. Водну фазу екстрагували етилацетатом. Об'єднані органічні фази сушили сульфатом натрію і випарювали досуха. Продукт очищали 15 UA 98608 C2 5 10 15 20 25 30 35 40 45 50 55 60 колонковою хроматографією зі зворотною фазою з використанням (1 %) метанолу в дихлорметані як елюент. 1 Н ЯМР (400 МГц, CD3OD): =7,37 (с, 1H), 7,53 (с, 1H). Приклад 19 5,6-Дигідрокси-2-метил-7-нітробензо[d]ізотіазол-3-он 2-Меркапто-4,5-диметоксибензойна кислота До розчину 2-аміно-4,5-диметоксибензойної кислоти (10,2 г) у НСl (9 мл концентрованої НСl і 30 мл води) при 5 °C додавали розчин NaNO2 (3,6 г у 20 мл води) і перемішували протягом 2 годин. Діазонієвий розчин фільтрували і фільтрат додавали до холодного розчину Na2S2, одержаного з моногідрату сульфіду натрію (11,6 г у 20 мл води) і сірки (1,5 г) у розчині NaOH (1,8 г у 20 мл води). Суміш перемішували при кімнатній температурі протягом ночі, відфільтровували і підкисляли концентрованою НСl. Осад відфільтровували. Продукт являв собою суміш 2-меркапто-4,5-диметоксибензойної кислоти і димеризованого продукту 4,4',5,5'тетраметокси-2,2'-дитіобіс(бензойної кислоти) і використовували для наступної стадії без очищення. 1 Н ЯМР (400 МГц, ДМСО-d6): = мономер 3,65 (с, 3Н), 3,72 (с, 3Н), 7,29 (с, 1Н), 7,36 (с, 1H), димеризований продукт 3,59 (с, 6Н), 3,78 (с, 6Н), 7,24 (с, 2Н), 7,48 (с, 2Н). 2-Хлорсульфеніл-4,5-диметоксибензоїлхлорид 2-Меркапто-4,5-диметоксибензойну кислоту (12,8 г), толуол (50 мл) і тіонілхлорид (100 мл) нагрівали при 80 °C протягом 3 годин. Розчинник і надлишок SOCl2 випарювали. До залишку додавали толуол і суміш знову випарювали досуха. Залишок суспендували у толуолі (50 мл), додавали хлорид сірки (14,3 мл) і суміш нагрівали при 65 °C протягом 2 годин. Суміш випарювали досуха і залишок використовували для наступної стадії без очищення. 1 Н ЯМР (400 МГц, ДМСО-d6): =3,84 (с, 3Н), 3,89 (с, 3Н), 7,32 (с, 1Н), 7,79 (с, 1Н). 5,6-Диметокси-2-метилбензо[d]ізотіазол-3-он 2-Хлорсульфеніл-4,5-диметоксибензоїлхлорид (5,0 г) розчиняли в піридині (30 мл) і додавали гідрохлорид метиламіну (6,0 г). Суміш перемішували при кімнатній температурі протягом 2 днів. Додавали етилацетат і суміш промивали 1н НСl і водою. Етилацетат сушили сульфатом натрію і випарювали досуха. Неочищений продукт очищали флеш-хроматографією з елююванням сумішшю гептан-етилацетат (1:9). 1 Н ЯМР (400 МГц, ДМСО-d6): =3,30 (с, 3Н), 3,83 (с, 3Н), 3,85 (с, 3Н), 7,26 (с, 1Н), 7,53 (с, 1Н). 5,6-Дигідрокси-2-метилбензо[d]ізотіазол-3-он До суспензії 5,6-диметокси-2-метилбензо[d]ізотіазол-3-ону (0,35 г) у дихлорметані (30 мл) при -40 °C додавали трибромистий бор (3,1 мл, 1М розчин у дихлорметані). Суміші давали можливість нагрітися до -10 °C. На наступний день додавали метанол (30 мл) і суміш випарювали досуха. До залишку додавали розчин сульфіту натрію (9 мл, 5 % у воді) і сольовий розчин (9 мл). Після перемішування при 0 °C осад відфільтровували. 1 Н ЯМР (400 МГц, ДМСО-d6): =3,24 (с, 3Н), 7,13 (с, 1H), 7,20 (с, 3Н), 9,53 (ушир., 1Н), 10,0 (ушир., 1H). 6-Ацетокси-2-метил-3-оксо-2,3-дигідробензо[d]ізотіазол-5-іловий ефір оцтової кислоти 5,6-Дигідрокси-2-метилбензо[d]ізотіазол-3-он (0,23 г) суспендували в N, Nдиметилформаміді і при 0 °C додавали триетиламін (0,47 г) і ангідрид оцтової кислоти (0,24 г). Після перемішування при кімнатній температурі протягом 1 години суміш виливали в льодяну воду й осад відфільтровували. 1 Н ЯМР (400 МГц, ДМСО-d6): =2,31 (с, 3Н), 2,34 (с, 3Н), 3,35 (с, 3Н), 7,76 (с, 1Н), 7,94 (с, 1Н). 6-Гідрокси-2-метил-3-оксо-2,3-дигідробензо[й]ізотіазол-5-іловий ефір оцтової кислоти До розчину 6-ацетокси-2-метил-3-оксо-2,3-дигідробензо[d]ізотіазол-5-ілового ефіру оцтової кислоти (0,21 г) у диметилформаміді при 0 °C додавали морфолін (0,070 г). Суміш перемішували при 0 °C протягом 1 години, а потім виливали в льодяну воду. Осаджений продукт відфільтровували. 1 Н ЯМР (400 МГц, ДМСО-d6): =2,27 (с, 3Н), 3,27 (с, 3Н), 7,44 (с, 1Н), 7,47 (с, 1Н), 10,72 (с, 1Н). 6-Гідрокси-2-метил-7-нітро-3-оксо-2,3-дигідробензо[d]iзотіазол-5-іловий ефір оцтової кислоти До розчину 6-гідрокси-2-метил-3-оксо-2,3-дигідробензо[d]ізотіазол-5-ілового ефіру оцтової кислоти (0,055 г) в оцтовій кислоті при 10 °C додавали азотну кислоту (100 % 0,015 г) і перемішували при кімнатній температурі протягом 15 хвилин. Суміш виливали в льодяну воду та екстрагували етилацетатом. Етилацетат сушили і випарювали досуха. 1 Н ЯМР (400 МГц, ДМСО-d6): =2,29 (с, 3Н), 3,29 (с, 3Н), 7,73 (с, 1Н). 5,6-Дигідрокси-2-метил-7-нітробеюо[d]ізотіазол-3-он 16 UA 98608 C2 5 10 15 20 25 30 35 40 45 50 55 60 6-Гідрокси-2-метил-7-нітро-3-оксо-2,3-дигідробензо[d]ізотіазол-5-іловий ефір оцтової кислоти (0,046 г) у суміші метанол-НСІ (14:1, 7 мл) нагрівали при 60 °C протягом 3 годин. Суміш випарювали досуха. Неочищений продукт очищали флеш-хроматографією з використанням етилацетату як елюент з подальшою кристалізацією з суміші ізопропанол-метанол. 1 Н ЯМР (400 МГц, ДМСО-d6): =3,30 (с, 3Н), 7,49 (с, 1Н). Приклад 20 (5,6-Дигідрокси-3-метил-7-нітробензо[b]тіофен-2-іл)морфолін-4-ілметанон (5,6-Диметокси-3-метилбензо[b]тіофен-2-іл)морфолін-4-ілметанон (3-Хлор-5,6-диметоксибензо[b]тіофен-2-іл)морфолін-4-ілметанон (3,0 г) з прикладу 8, триметилалюміній (3,2 г) і [1,3-біс(дифенілфосфіно)пропан]дихлорнікель(ІІ) (1,2 г) в 1,2диметоксіетані (100 мл) нагрівали зі зворотним холодильником в атмосфері аргону протягом 10 годин. До холодної суміші відповідно додавали етанол (50 мл), воду і НСl і суміш екстрагували етилацетатом. Етилацетат сушили і випарювали досуха. Неочищений продукт очищали флешхроматографією з елююванням сумішшю гептан-етилацетат(5:5). 1 Н ЯМР (400 МГц, ДМСО-d6): =2,34 (с, 3Н), 3,52 (ушир., 4Н), 3,61 (ушир., 4Н), 3,83 (с, 3Н), 3,85 (с, 3Н), 7,26 (с, 1H), 7,54 (с, 1Н). (5,6-Дигідрокси-3-метилбензо[b]тіофен-2-іл)морфолін-4-ілметанон До розчину (5,6-диметокси-3-метилбензо[b]тіофен-2-іл)морфолін-4-ілметанону (0,80 г) у дихлорметані (8 мл) при 0 °C додавали трибромистий бор (5,2 мл, 2М розчин у дихлорметані). Суміші давали можливість нагрітися до кімнатної температури. Через 2 години при кімнатній температурі додавали метанол (16 мл) і розчинники випарювали. До залишку додавали розчин сульфіту натрію (16 мл, 5 % у воді) і після перемішування протягом 0,5 години осад відфільтровували. 1 Н ЯМР (400 МГц, ДМСО-d6): =2,24 (с, 3Н), 3,51 (ушир, 4Н), 3,59 (ушир., 4Н), 7,07 (с, 1H), 7,21 (с, 1Н), 9,20 (с, 1Н), 9,42 (с, 1H). (5,6-Дигідрокси-3-метил-7-нітробензо[b]тіофен-2-іл)морфолін-4-ілметанон (5,6-Дигідрокси-3-метилбензо[b]тіофен-2-іл)морфолін-4-ілметанон (0,10 г) розчиняли в етилацетаті (60 мл). Невеликими порціями при 55 °C додавали азотну кислоту (2 екв, 2М розчин у дихлорметані). Через 15 хвилин після останнього додавання суміш охолоджували, промивали водою, сушили сульфатом натрію і концентрували до меншого об'єму. Осаджений продукт відфільтровували. 1 Н ЯМР (400 МГц, ДМСО-d6): =2,31 (с, 3Н), 3,53 (ушир., 4Н), 3,61 (ушир., 4Н), 7,54 (с, 1H), 10,5 (ушир, 2Н). Приклад 21 Етиловий ефір 5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонової кислоти Етиловий ефір 5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонової кислоти 5,6-Дигідрокси-7-нітробензо[b]тіофен-2-карбонову кислоту (50 мг, 0,20 ммоль) із прикладу 17 і тіонілхлорид (130 мкл) в етанолі (2 мл) нагрівали зі зворотним холодильником протягом 1,5 годин, випарювали досуха і перекристалізовували з етанолу. Вихід: 46 мг 1 Н ЯМР (ДМСО-d6): =8,13 (1Н, с), 7,72 (1Н, с), 4,34 (2Н, кв), 1,34 (3Н, т). Приклад 22 5,6-Дігідрокси-4-нітроізобензофуран-1,3-діон 5,6-Диметокси-3Н-ізобензофуран-1-он Суміш 3,4-диметоксибензойної кислоти (10 г) у 37 % НСl (150 мл) і формальдегіду (25 мл, 37 % мас. розчин у воді) нагрівали до 90 °C протягом 4¾ години і потім матеріал, що не розчинився, видаляли фільтруванням. Фільтрат гасили водою (200 мл) і екстрагували три рази етилацетатом (200 мл). Об'єднані органічні шари промивали водним NaOH (40 мл, 2,5 М) і водою (100 мл). Органічний розчинник сушили над безводним сульфатом натрію, відфільтровували і випарювали досуха. Вихід: 8,9 г 1 Н ЯМР (ДМСО-d6): =7,27 (1Н, с), 7,24 (1H, с), 5,28 (2Н, с), 3,88 (3Н, с), 3,84 (3Н, с). 4,5-Диметоксифталева кислота До суміші 5,6-диметокси-3Н-ізобензофуран-1-ону (4,5 г) і 7 % водного NaOH (47 мл) додавали КМnО4 (4,0 г), розведений у воді (125 мл). Суміш перемішували при кімнатній температурі протягом 4 днів. Матеріал, що не розчинився, видаляли фільтруванням. Фільтрат охолоджували за допомогою водно-льодяної бані і підкисляли концентрованою НСl. Кислий розчин екстрагували три рази етилацетатом (300 мл). Об'єднані органічні шари сушили безводним сульфатом натрію і випарювали. Вихід: 4,8 г 17 UA 98608 C2 Н ЯМР (ДМСО-d6): =7,19 (2Н, с), 3,83 (6Н, с). 5,6-Диметокси-4-нітроізобензофуран-1,3-діон 4,5-Диметоксифталеву кислоту (1,0 г) охолоджували у водно-льодяній бані. По краплях додавали холодну суміш сірчаної кислоти (3,0 мл) і димлячої азотної кислоти (3,0 мл). Суміш перемішували протягом 10 хвилин і залишали стояти протягом 10 хвилин. Додавали суміш сольового розчину і льоду (1:1). Тверду речовину відфільтровували, промивали водою і перекристалізовували з етанолу. Вихід: 0,46 г 1 Н ЯМР (ДМСО-d6): =8,19 (1H, с), 4,11 (3Н, с), 4,05 (3Н, с). 5-Гідрокси-6-метокси-4-нітроізобензофуран-1,3-діон 5,6-Диметокси-4-нітроізобензофуран-1,3-діон (346 мг), 48 % бромистий водень (1,5 мл), оцтову кислоту (15 мл) і бензилтриетиламмонійбромід (37 мг) нагрівали при 140 °C протягом 3 годин. Оцтову кислоту і воду видаляли у вакуумі. Залишок відфільтровували через силікагель із використанням суміші толуолу, етилацетату і метанолу (8:1:1) як елюент. Відповідні фракції збирали і випарювали. Вихід: 275 мг 1 Н ЯМР (ДМСО-d6): =7,44 (1Н, с), 3,85 (3Н, с). 5,6-Дигідрокси-4-нітроізобензофуран-1,3-діон 5-Гідрокси-6-метокси-4-нітроізобензофуран-1,3-діон (115 мг), алюмінійхлорид (80 мг) змішували з етилацетатом (3 мл). По краплях додавали піридин (155 мкл) в етилацетаті (2 мл). Одержану в результаті суміш перемішували при кімнатній температурі протягом 0,5 години, нагрівали до температури кипіння зі зворотним холодильником протягом 3 годин і потім гасили водою (0,5 мл) і концентрованою НСl (0,5 мл) при 60 °C. Етилацетат і воду видаляли у вакуумі. Залишок змішували з сольовим розчином (2 мл) і екстрагували два рази етилацетатом (15 мл). Об'єднані органічні шари сушили над безводним сульфатом натрію, фільтрували, випарювали і розтирали з діетиловим ефіром. Вихід: 55 мг 1 Н ЯМР (ДМС0-d6): =7,42 (1Н, с). Приклад 23 5,6-Дигідрокси-4-нітро-3Н-ізобензофуран-1-он 5,6-Дигідрокси-3Н-ізобензофуран-1-он 5,6-Диметокси-3Н-ізобензофуран-1-он (2,91 г) розчиняли в дихлорметані (150 мл) із подальшим охолодженням до -50 °C. В атмосфері азоту по краплях додавали трибромистий бор (34,9 мл, 1,0 М розчин у дихлорметані). Суміші давали можливість повільно нагрітися протягом ночі до кімнатної температури з подальшим перемішуванням протягом 3 годин. Реакцію гасили метанолом із подальшим випарюванням досуха. Залишок змішували з 5 % водним Na2SO3 (20 мл) і сольовим розчином (20 мл) і відфільтровували. Вихід: 2,31 г 1 Н ЯМР (ДМСО-d6): =10,22 (1H, ушир.с), 9,70 (1Н, ушир.с), 7,09 (1Н, с), 6,93 (1H, с), 5,17 (2Н, с). 6-Ацетокси-3-оксо-1,3-дигідроізобензофуран-5-іловий ефір оцтової кислоти (8) 5,6-Дигідрокси-3Н-ізобензофуран-1-он (2,26 г), оцтовий ангідрид (25 мл) і піридин (2,31 мл) перемішували протягом 5 годин при кімнатній температурі. Оцтовий ангідрид видаляли у вакуумі і залишок змішували з водою (20 мл), відфільтровували і промивали водою. Вихід: 3,35 г 1 Н ЯМР (ДМСО-d6): =7,81 (1Н, с), 7,64 (1H, с), 5,42 (2Н, с), 2,34 (3Н, с), 2,32 (3Н, с). 6-Гідрокси-3-оксо-1,3-дигідроізобензофуран-5-іловий ефір оцтової кислоти 6-Ацетокси-3-оксо-1,3-дигідроізобензофуран-5-іловий ефір оцтової кислоти (5,0 г) розчиняли в N, N-диметилформаміді (100 мл) із подальшим додаванням морфоліну (1,78 мл). Розчин перемішували при кімнатній температурі протягом ночі з подальшою концентрацією при зниженому тиску. До залишку додавали етилацетат (200 мл). Органічну фазу два рази промивали сумішшю водної НСl (50 мл, 2М) і сольового розчину (50 мл). Органічний розчинник сушили над безводним сульфатом натрію, відфільтровували і випарювали досуха. Вихід; 3,96 г 1 Н ЯМР (ДМСО-d6): =11,01 (1H, ушир.с), 7,51 (1Н, с), 7,12 (1Н, с), 5,29 (2Н, с), 2,28 (3Н, с). 6-Гідрокси-7-нітро-3-оксо-1,3-дигідроізобензофуран-5-іловий ефір оцтової кислоти 6-Гідрокси-3-оксо-1,3-дигідроізобензофуран-5-іловий ефір оцтової кислоти (3,8 г) змішували з оцтовою кислотою (150 мл) із подальшим додаванням 65 % азотної кислоти (2,5 мл). Після розчинення суміш перемішували при кімнатній температурі протягом 2 годин з подальшим видаленням оцтової кислоти і води у вакуумі. Залишок відфільтровували через силікагель з 1 5 10 15 20 25 30 35 40 45 50 55 60 18 UA 98608 C2 5 10 15 20 25 30 35 40 45 50 55 використанням суміші толуолу, етилацетату і метанолу (8:1:1) як елюент. Відповідні фракції збирали і випарювали досуха. Вихід: 4,1 г 1 Н ЯМР (ДМСО-d6): =7,91 (1Н, с), 5,59 (2Н, с), 2,33 (3Н, с). 5,6-Дигідрокси-4-нітро-3Н-ізобензофуран-1-он 6-Гідрокси-7-нітро-3-оксо-1,3-дигідроізобензофуран-5-іловий ефір оцтової кислоти (4,1 г) суспендували в метанолі (150 мл) і 37 % НСl (20 мл) із подальшим перемішуванням при кімнатній температурі протягом 3 днів. Осад відфільтровували і промивали метанолом. Вихід: 2,25 г 1 Н ЯМР (ДМСО-d6): =7,32 (1Н, с), 5,50 (2Н, с). Приклад 24 5,6-Дигідрокси-4,7-динітро-3Н-ізобензофуран-1-он 5,6-Диметокси-4,7-динітро-3Н-ізобензофуран-1-он 5,6-Диметокси-3Н-ізобензофуран-1-он (582 мг) охолоджували у водно-льодяній бані. По краплях додавали охолоджену суміш сірчаної кислоти (2 мл) і димлячої азотної кислоти (2 мл). Суміш перемішували протягом 15 хвилин і залишали стояти на 45 хвилин. Реакцію гасили льодом. Водну фазу екстрагували три рази етилацетатом (30 мл) і промивали сольовим розчином (15 мл). Органічний розчинник сушили над безводним сульфатом натрію, відфільтровували і випарювали досуха. Вихід: 586 мг 1 Н ЯМР (ДМСО-d6): =5,67 (2Н, с), 4,12 (3Н, с), 4,00 (3Н, с). 5-Гідрокси-6-метокси-4,7-динітро-3Н-ізобензофуран-1-он 5,6-Диметокси-4,7-динітро-3Н-ізобензофуран-1-он (450 мг), оцтову кислоту (15 мл) і 37 % водну НСl (3 мл) нагрівали зі зворотним холодильником протягом 7,25 годин. Оцтову кислоту і воду випарювали у вакуумі. Залишок очищали колонковою хроматографією (толуолетилацетат-метанол 8:1:1). Вихід: 215 мг 1 Н ЯМР (ДМСО-d6): =5,48 (2Н, с), 3,86 (3Н, с). 5,6-Дигiдрокси-4,7-динітро-3Н-ізобензофуран-1-он 5-Гідрокси-6-метокси-4,7-динітро-3Н-ізобензофуран-1-он (210 мг) розчиняли в етилацетаті (2,5 мл) із подальшим додаванням хлориду алюмінію (132 мг) в атмосфері азоту. По краплях додавали піридин (265 мкл, 3,28 ммоль). Одержану в результаті суміш нагрівали до температури кипіння зі зворотним холодильником протягом 2 годин, а потім гасили водою (0,5 мл) і концентрованою НСl (0,5 мл) при 75 °C. Додавали етилацетат (15 мл) і фази розділяли. Водний шар екстрагували один раз етилацетатом (15 мл). Об'єднані органічні шари сушили над безводним сульфатом натрію. Продукт відфільтровували, випарювали досуха і перекристалізовували з суміші гептан-толуол-етилацетат. Вихід: 76 мг 1 Н ЯМР (ДМСО-d6): =5,41 (2Н, с). Приклад 25 7-Нітро-2-фенілбензотіазол-5,6-діол Катехолциклогексиліденкеталь Катехол (55 г), циклогексанон (65 мл), моногідрат п-толуолсульфонової кислоти (0,50 мл) і толуолу (500 мл) нагрівали зі зворотним холодильником за допомогою апарату Старка протягом 4,5 годин. Реакційну суміш промивали розчином NaOH і водою, сушили і випарювали досуха. Вихід: 90 г 1 Н ЯМР (ДМСО-d6): =1,46 (м, 2Н), 1,65 (м, 4Н), 1,85 (т, 4Н, J=6,2 Гц), 6,75-6,85 (м, 4Н). 4-Нітрокатехолциклогексиліденкеталь До розчину катехолциклогексиліденкеталю (87,3 г) у метиленхлориді (900 мл) додавали розчин азотної кислоти в метиленхлориді (2М, 250 мл) при такій швидкості, щоб підтримувати температуру близько 25 °C із використанням водяної бані. Суміш продукту промивали розчином гідроксиду натрію (1М, 500 мл). Органічну фазу відділяли, сушили і випарювали. Вихід: 106 г 1 Н ЯМР (ДМСО-d6): =1,49 (м, 2Н), 1,67 (м, 4Н), 1,95 (т, 4Н, J=6,2 Гц), 7,08 (д, 1Н, J=8,8 Гц), 7,70 (д, 1Н, J=2,4 Гц), 7,86 (дд, 1Н, J=2,4 і 8,8 Гц). 4-Амінокатехолциклогексиліденкеталь 4-Нітрокатехолциклогексиліденкеталь (2 г) гідрогенізували в етилацетаті (12 мл) із Pd-C (0,2 г) як каталізаторі. Вихід: 1,77 г 19 UA 98608 C2 Н ЯМР (ДМСО-d6): =1,45 (м, 2Н), 1,60 (м, 4Н), 1,79 (м, 4Н), 4,62 (ушир., 2Н), 5,94 (дд, 1Н, J=3,1 і 12,2 Гц), 6,14 (д, 1Н, J=3,1 Гц), 6,48 (д, 1H, J=12,2 Гц). 2-Фенілбензотіазол-5,6-діолциклогексиліденкеталь 4-Амінокатехолциклогексиліденкеталь (1,77 г), бензальдегід (0,82 мл) і сірку (0,55 г) нагрівали зі зворотним холодильником у диметилацетаміді (8,6 мл) протягом 2 годин. Реакційну суміш виливали у воду (100 мл) та екстрагували простим ефіром (100 мл), сушили, випарювали і перекристалізовували з ацетонітрилу. Вихід: 0,93 г 1 Н ЯМР (ДМСО-d6): =1,49 (м, 2Н), 1,69 (м, 4Н), 1,94 (м, 4Н), 7,50-7,57 (м, 5Н), 7,99-8,01 (м, 2Н). 7-Нітро-2-фенілбензотіазол-5,6-діолциклогексиліденкеталь До розчину 2-фенілбензотіазол-5,6-діолциклогексиліденкеталю (0,93 г) в оцтовій кислоті (25 мл) додавали концентровану азотну кислоту (1,5 мл). Реакційну суміш відфільтровували. До фільтрату додавали воду й осад відфільтровували. Останній продукт перекристалізовували з ацетонітрилу. Вихід: 0,40 г 1 Н ЯМР (ДМСО-d6): =1,57 (м, 2Н), 1,75 (м, 4Н), 2,10 (м, 4Н), 7,58-7,60 (м, 3Н), 7,99 (с, 1Н), 8,09-8,11 (м, 2Н). 7-Нітро-2-фенілбензотіазол-5,6-діол 7-Нітро-2-фенілбензотіазол-5,6-діолциклогексиліденкеталь (0,35 г), оцтову кислоту (8,8 мл) і концентровану соляну кислоту (3,5 мл) нагрівали зі зворотним холодильником протягом 2 годин. Продукт відфільтровували і промивали оцтовою кислотою. Вихід: 0,27 г Точка плавлення: 221-224 °C 1 Н ЯМР (ДМСО-d6): =7,55-7,58 (м, 3Н), 7,79 (с, 1Н), 8,07-8,09 (м, 2Н), 10,6 (ушир., 2Н). Приклад 26 Метиловий ефір 6,7-Дигідрокси-5-нітробензо[b]тіофен-2-карбонової кислоти 4-Гідрокси-3-метокси-5-нітробензальдегід До розчину концентрованої азотної кислоти (900 мл) і води (900 мл) додавали 4-гідрокси-3метоксибензальдегід (300 г) при температурі до 10 °C. Після перемішування протягом 1 години при 0 °C осад відфільтровували і промивали водою. 1 Н ЯМР (ДМСО-d6): =3,90 (с, 3Н), 7,64 (д, 1H, J=1,8 Гц), 8,09 (д, 1H, J=1,8 Гц), 9,88 (с, 1H). 2-Бром-3,4-дигiдрокси-5-нітробензальдегід Продукт попередньої стадії реакції, концентровану бромистоводневу кислоту (2 л) і оцтову кислоту (2 л) нагрівали зі зворотним холодильником протягом 2 днів. Додавали воду (1 л) і насичений розчин Na2SO4 (1 л) і суміш екстрагували простим ефіром. Органічну фазу сушили сульфатом натрію і випарювали до меншого об'єму. Осаджений продукт відфільтровували. 1 Н ЯМР (ДМСО-d6): =7,92 (с, 1Н), 10,3 (с, 1Н). 2-Бром-3,4-діетокси-5-нітробензальдегід 2-Бром-3,4-дигідрокси-5-нітробензальдегід (5,2 г), етилбромід (4,5 мл) і N, Nдіізопропілетиламін (10,5 мл) у N, N-диметилформаміді (50 мл) перемішували при 70 °C протягом 2 днів. Суміш виливали у воду та екстрагували простим ефіром. Органічну фазу промивали розчином NaOH, сушили сульфатом натрію і випарювали досуха. 1 Н ЯМР (ДМСО-d6): =1,33 (т, 3Н, J-8,0 Гц), 1,40 (т, 3Н, J=8,0 Гц), 4,15 (кв., 2H, J=8,0 Гц), 4,30 (кв., 2Н, J=8,0 Гц), 8,09 (с, 1Н), 10,2 (с, 1Н). Метиловий ефір 6,7-діетокси-5-нітробензо[b]тіофен-2-карбонової кислоти До розчину 2-бром-3,4-діетокси-5-нітробензальдегіду (1,5 г) у N, N-диметилформаміді (5 мл) при 0 °C додавали метилтіогліколят (1,5 г) і триетиламін (2,2 мл). Перемішування продовжувалося при кімнатній температурі протягом ночі. Додавали 1М НСl і продукт екстрагували простим ефіром. Органічну фазу сушили сульфатом натрію і випарювали. Неочищений продукт розтирали з метанолом. 1 Н ЯМР (ДМСО-d6): =1,34 (т, 3Н, J=7,8 Гц), 1,39 (т, 3Н, J=7,8 Гц), 3,92 (с, 3Н), 4,22 (кв, 2Н, J=7,8 Гц), 4,31 (кв, 2Н, J=7,8 Гц), 8,30 (с, 1H), 8,82 (с, 1Н). Метиловий ефір 6,7-дигідрокси-5-нітробензо[b]тіофен-2-карбонової кислоти Метиловий ефір 6,7-діетокси-5-нітробензо[b]тіофен-2-карбонової кислоти (0,77 г), хлорид цинку (5,0 г) і концентровану НСl (1,3 мл) перемішували і нагрівали при 100 °C протягом 2 годин. Реакційну суміш охолоджували. Додавали воду (20 мл) і осад відфільтровували. Неочищений продукт двічі перекристалізовували з метанолу. Точка плавлення: 216-218 °C 1 Н ЯМР (ДМСО-d6): =3,84 (с, 3Н), 8,17 (с, 1H), 8,21 (с, 1H), 10,2 (ушир., 2Н). 1 5 10 15 20 25 30 35 40 45 50 55 60 20 UA 98608 C2 5 10 15 20 25 30 35 40 45 50 55 Приклад 27 1-(5,6-Диметокси-7-нітробензо[b]тіофен-2-іл)нонан-1-он 1-(5,6-Диметокси-7-нітробензо[b]тіофен-2-іл)нонан-1-он 5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонову кислоту (0,1 г) із прикладу 17, 1-октанол (2 мл) і концентровану сірчану кислоту (одну краплю) нагрівали зі зворотним холодильником при 120 °C протягом 3 годин. Продукт очищали за допомогою колонкової хроматографії з використанням суміші толуол-етилацетат-оцтова кислота 8:1:1 як елюенту. Точка плавлення: 115-117 °C Вихід: 62,4 мг 1 Н ЯМР (ДМСО-d6): =0,83-0,87 (м, 3Н), 1,26-1,39 (м, 10Н), 1,68-1,73 (м, 2Н), 4,26-4,30 (кв, 2Н), 7,69 (с, 1Н), 8,11 (с, 1Н). Приклад 28 (3-Хлор-5,6-дигідрокси-4,7-динітробензо[b]тіофен-2-іл)морфолін-4-ілметанон (3-Хлор-5,6-дигідроксибензо[b]тіофен-2-іл)морфолін-4-ілметанон Алюмінійхлорид (6,62 г) поступово додавали в охолоджений ацетонітрил (14,7 мл) при 10 °C і потім додавали йодид натрію (5,57 г). Розчин перемішували при кімнатній температурі протягом 30 хвилин. Додавали (3-хлор-5,6-диметоксибензо[b]тіофен-2-іл)морфолін-4-ілметанон (2,1 г) із прикладу 8. Розчин перемішували при 50 °C протягом 5 годин і при кімнатній температурі протягом ночі. У холодну реакційну суміш додавали 2н НСl (8,4 мл), і потім додавали сульфіт натрію (1,58 г) і воду (35 мл). Суміш перемішували при 40 °C протягом 30 хвилин. Продукт відфільтровували, промивали водою і сушили у вакуумі. 1 Н ЯМР (ДМСО-d6): =3,52 (м, 4Н), 3,63 (м, 4Н), 7,11 (1Н), 7,32 (1Н), 9,63 (1Н), 9,70 (1H). (3-Хлор-5,6-дигідрокси-4,7-динітробензо[b]тіофен-2-іл)морфолін-4-ілметанон (3-Хлор-5,6-дигідроксибензо[b]тіофен-2-іл)морфолін-4-ілметанон (1,0 г) суспендували в метансульфоновій кислоті (20 мл), а потім поступово додавали нітрат калію (0,73 г). Реакційну суміш перемішували при кімнатній температурі і через 15 хвилин виливали в льодяну воду (100 мл). Продукт відфільтровували, промивали водою і метанолом і сушили у вакуумі. Точка плавлення: 233-235 °C 1 Н ЯМР (ДМСО-d6): =3,52 (м, 4Н), 3,62 (м, 4Н), 9,6-10,4 (ушир., 2Н). Приклад 29 (3,4-Дихлор-5,6-дигідрокси-7-динітробензо[b]тіофен-2-іл)морфолін-4-ілметанон (3,4-Дихлор-5,6-дигідрокси-7-динітробензо[b]тіофен-2-іл)морфолін-4-ілметанон (3-Хлор-5,6-дигідрокси-7-динітробензо[b]тіофен-2-іл)морфолін-4-ілметанон (0,5 г) із прикладу 8, хлорид міді (II) (0,9 г) і хлорид літію (0,3 г) в оцтовій кислоті (5 мл) нагрівали при кипінні зі зворотним холодильником протягом 5 годин. До реакційної суміші додавали воду. Одержану в результаті тверду речовину відфільтровували, промивали водою і сушили у вакуумі. Точка плавлення: 273-279 °C 1 Н ЯМР (ДМСО-d6): =3,64 (м, 8Н), 8,8-10,8 (ушир., 2Н). Приклад 30 (3-Хлор-5,6-дигідрокси-4-нітробензо[b]тіофен-2-іл)морфолін-4-ілметанон (3-Хлор-5,6-дигідрокси-4-нітробензо[b]тіофен-24л)морфолін-4-ілметанон (3-Хлор-5,6-дигідроксибензо[b]тіофен-2-іл)морфолін-4-ілметанон (2,0 г) із прикладу 28 суспендували в метансульфоновій кислоті (40 мл), а потім поступово додавали нітрат калію (0,64 г). Реакційну суміш перемішували при кімнатній температурі і через 15 хвилин виливали в льодяну воду (100 мл). Тверду речовину відфільтровували, промивали водою (50 мл) і сушили у вакуумі. Одержану в результаті тверду речовину розчиняли в ДМФА (диметилформаміді) (6,2 мл), і потім додавали етанол (18,4 мл). Продукт відфільтровували і промивали метанолом (15 мл). Точка плавлення: 216 °C 1 Н ЯМР (ДМСО-d6): =3,43 (м, 4Н), 3,62 (м, 4Н), 7,59 (с, 1H), 10,55 (ушир, 1Н), 11,21 (ушир., 1H). Приклад 31 (3-Хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-іл)-(2,6-диметилморфолін-4-іл)метанон (3-Хлор-5,6-диметоксибето[b]тioфен-2-іл)-(2,6-диметилморфолін-4-іл)метанон 3-Хлор-5,6-диметоксибензо[b]тіофен-2-карбонілхлорид (2,0 г) і 2,6-диметилморфолін (1,82 г) суспендували в тетрагідрофурані (15 мл) і додавали триетиламін (0,96 мл) і перемішування продовжували при кімнатній температурі протягом тижня. Додавали воду, рН доводили до 3 за допомогою НСl і осад відфільтровували. 21 UA 98608 C2 Н ЯМР (400 МГц, ДМСО-d6): =1,10 (с, 6Н), 2,6-4,5 (ушир., 6Н), 3,85 (с, 3Н), 3,88 (с, 3Н), 7,22 (с, 1Н), 7,68 (с, 1Н). (3-Хлор-5,6-дигідроксибензо[b]тіофен-2-іл)-(2,6-диметилморфолін-4-іл)метанон Йодид натрію (1,62 г) додавали до розчину хлориду алюмінію (2,16 г) в ацетонітрилі (5 мл). Через 30 хвилин перемішування додавали (3-хлор-5,6-диметоксибензо[b]тіофен-2-іл)-(2,6диметилморфолін-4-іл)метанон і суміш нагрівали при 50 °C протягом 12 годин. До суміші додавали 2н НСl (4 мл), Na2SO3 (0,68 г) і воду і нагрівали при 60 °C протягом 30 хвилин, а потім охолоджували до кімнатної температури. Осад відфільтровували. 1 Н ЯМР (400 МГц, ДМСО-d6): =1,09 (с, 6Н), 2,6-4,4 (ушир., 6Н), 7,11 (с, 1H), 7,31 (с, 1Н), 9,63 (с, 1Н), 9,70 (с, 1Н). (3-Хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-іл)-(2,6-диметилморфолін-4-іл)метанон (3-Хлор-5,6-дигідроксибензо[b]тіофен-2-іл)-(2,6-диметилморфолін-4-іл)метанон (0,20 г) розчиняли в етилацетаті і додавали 1н розчин HNO3 у дихлорметані (0,64 мл). Перемішування продовжували протягом 4 годин. Суміш концентрували до меншого об'єму й осад відфільтровували і промивали водою. Неочищений продукт перекристалізовували з суміші N, Nдиметилформамід/етанол (25:75). 1 Н ЯМР (400 МГц, ДМСО-d6): =1,09 (с, 6Н), 2,6-4,5 (ушир., 6Н), 7,49 (с, 1H). Приклад 32 (3-Хлор-5,6-дигідрокси-7-нітробензо[b]тіофен-2-іл)-(4-гідроксипіперидин-1-іл)метанон (3-Хлор-5,6-диметоксибензо[b]тіофен-2-іл)-(4-гідроксипіперидин-1-іл)метанон 3-Хлор-5,6-диметоксибензо[b]тіофен-2-карбонілхлорид (2,0 г) і 4-гідроксипіперидин (1,60 г) суспендували в тетрагідрофурані (15 мл) і додавали триетиламін (0,96 мл) і перемішування продовжували при кімнатній температурі протягом 2 годин. Додавали воду, рН доводили до 3 за допомогою НСl і осад відфільтровували. 1 Н ЯМР (400 МГц, ДМСО-d6): =1,38-1,42 (м, 2Н), 1,72-1,85 (м, 2Н), 3,2-3,3 (м, 2Н), 3,4-4,2 (ушир., 2Н) 3,7-3,8 (м, 1Н), 3,85 (с, 3Н), 3,88 (с, 3Н), 4,81 (д, 1H, J=4,1 Гц), 7,21 (с, 1Н), 7,67 (с, 1H). (3-Хлор-5,6-дигідроксибензо[b]тіофен-2-іл)-(4-гідроксипіперидин-1-iл)метанон Йодид натрію (1,62 г) додавали до розчину хлориду алюмінію (2,52 г) в ацетонітрилі (7 мл). Через 30 хвилин перемішування додавали (3-хлор-5,6-диметоксибензо[b]тіофен-2-іл)-(4гідроксипіперидин-1-іл)метанон (0,96 г) і суміш нагрівали при 50 °C протягом 12 годин. До суміші додавали 2н НСl (4 мл), Na2SO3 (0,68 г) і воду і суміш нагрівали при 60 °C протягом 30 хвилин, а потім охолоджували до кімнатної температури. Осад відфільтровували. 1 Н ЯМР (400 МГц, ДМСО-d6): =1,35-1,45 (м, 2Н), 1,72-1,82 (м, 2Н), 3,18-3.30 (м, 2Н), 3,4-4,2 (ушир., 2Н), 3,7-3,8 (м, 1H), 4,80 (д, 1H, J=4,1 Гц), 7,10 (с, 1Н), 7,31 (с, 1Н), 9,61 (с, 1Н), 9,68 (с, 1Н). (3-Хлор-5,6-дигiдрокси-7-нітробензо[b]тіофен-2-іл)-(4-гідроксипіперидин-1-іл)метанон Розчин 1М HNO3 у дихлорметані (0,67 мл) додавали до розчину (3-хлор-5,6дигідроксибензо[b]тіофен-2-іл)-(4-гідроксипіперидин-1-іл)метанону (0,17 г) в етилацетаті (10 мл). Перемішування продовжували при 60 °C протягом 3 годин, а потім при кімнатній температурі протягом ночі. Суміш концентрували до меншого об'єму й осад відфільтровували і промивали водою. Неочищений продукт перекристалізовували з суміші N, N-диметилформамід/етанол (25:75). 1 Н ЯМР (400 МГц, ДМСО-d6): =1,35-1,45 (м, 2Н), 1,70-1,85 (ушир., 2Н), 3,1-4,0 (ушир., 6Н), 7,49 (с, 1Н). Приклад 33 (3-Бромметил-5,6-дигідрокси-7-нітробензо[b]тіофен-2-іл)морфолін-4-ілметанон (3-Бромметил-5,6-диметоксибензо[b]тіофен-2-іл)морфолін-4-ілметанон (5,6-Диметокси-3-метилбензо[b]тіофен-2-іл)морфолін-4-ілметанон (2,0 г) із прикладу 20, Nбромсукцинімід (1,18 г) і 2,2'-азобіс(2-метилпропіонітрил) (40 мг) у тетрахлориді вуглецю (6 мл) нагрівали зі зворотним холодильником в атмосфері аргону протягом 4 годин. Суміш охолоджували і відфільтровували і фільтрат випарювали досуха. Продукт являв собою суміш (4-бром-5,6-диметокси-3-метилбензо[b]тіофен-2-іл)морфолін-4-ілметанону і (3-бромметил-5,6диметоксибензо[b]тіофен-2-іл)морфолін-4-ілметанону. Сполуки розділяли флешхроматографією з використанням суміші етилацетат/гептан (1:4) як елюент. (3-Бромметил-5,6-диметоксибензо[b]тіофен-2-іл)морфолін-4-ілметанон: 1 Н ЯМР (400 МГц, ДМСО-d6): =3,53 (ушир., 4Н), 3,64 (ушир., 4Н), 3,84 (с, 3Н), 3,86 (с, 3Н), 4,91 (с, 2Н), 7,45 (с, 1Н), 7,61 (с, 1Н). (4-Бром-5,6-диметокси-3-метилбензо[b]тіофен-2-іл)морфолін-4-ілметанон: 1 5 10 15 20 25 30 35 40 45 50 55 22 UA 98608 C2 Н ЯМР (400 МГц, ДМСО-d6): =2,56 (с, 3Н), 3,51 (ушир., 4Н), 3,57 (ушир., 4Н), 3,76 (с, 3Н), 3,89 (с, 3Н), 7,73 (с, 1Н). (3-Бромметил-5,6-дигідроксибензо[b]тіофен-2-іл)морфолін-4-ілметанон Розчин 1н трибромистого бору в дихлорметані (3,4 мл) додавали до розчину (3-бромметил5,6-диметоксибензо[b]тіофен-2-іл)морфолін-4-ілметанону (0,46 г) у дихлорметані (10 мл) при 20 °C. Перемішування продовжували при 0 °C протягом 1 години. Додавали метанол і суміш випарювали досуха. До залишку додавали 5 % розчин Na2SO3 (5 мл), суміш підкисляли й осад відфільтровували. 1 Н ЯМР (400 МГц, ДМСО-d6): =3,52 (ушир., 4Н), 3,61 (ушир., 4Н), 4,78 (с, 2Н), 7,26 (с, 1Н), 7,28 (с, 1H), 9,39 (с, 1H), 9,56 (с, 1Н). (3-Бромметил-5,6-дигідрокси-7-нітробензо[b]тіофен-2-іл)морфолін-4-ілметанон Розчин 1М HNO3 у дихлорметані (1,02 мл) додавали до розчину (3-бромметил-5,6дигідроксибензо[b]тіофен-2-іл)морфолін-4-ілметанону (0,35 г) в етилацетаті (50 мл) і перемішування продовжували при 60 °C протягом 2 годин. Охолоджену суміш промивали водою, сушили і випарювали досуха. Продукт перекристалізовували з ацетону. 1 Н ЯМР (400 МГц, CDCl3): =3,68 (ушир., 4Н), 3,78 (ушир., 4Н), 4,70 (с, 2Н), 5,94 (с, 1Н), 7,78 (с, 1Н), 11,6 (с, 1H). Приклад 34 5,6-Дигідрокси-3-метил-2-(морфолін-4-карбоніл)бензо[b]тіофен-4-карбонітрил 5,6-Диметокси-3-метил-2-(морфолін-4-карбоніл)бензо[b]тіофен-4-карбонітрил (4-Бром-5,6-диметокси-3-метилбензо[b]тіофен-2-іл)морфолін-4-ілметагюн (0,42 г) із прикладу 33 і ціанід міді (І) (2,0 г) у N, N-диметилформаміді (8 мл) піддавали опроміненню в мікрохвильовій печі при 150 °C протягом 1,5 годин. До суміші додавали воду і продукт екстрагували етилацетатом. Етилацетат сушили і випарювали досуха. 1 Н ЯМР (400 МГц, CDCl3): =2,66 (с, 3Н), 3,5-3,8 (ушир., 8Н), 3,96 (с, 3Н), 4,05 (с, 3Н), 7,46 (с, 1Н). NOЕSY ЯМР показав ціаногрупу в 4 положенні. 5,6-Дигідрокси-3-метил-2-(морфолін-4-карбоніл)бензо[b]тіофен-4-карбонітрил Розчин 1н трибромистого бору в дихлорметані (3,4 мл) додавали до розчину 5,6-диметокси3-метил-2-(морфолін-4-карбоніл)бензо[b]тіофен-4-карбонітрилу (0,19 г) у дихлорметані (40 мл) при 0 °C. Суміш залишали стояти при 6 °C протягом 2 днів. Додавали метанол і суміш випарювали досуха. До залишку додавали 1н НСl і продукт екстрагували етилацетатом. Етилацетат сушили і випарювали досуха. Сполуки перекристалізовували з ізопропанолу. 1 Н ЯМР (400 МГц, ДМСО-d6): 5-2,49 (с, 3Н), 3,51 (ушир., 4Н), 3,60 (ушир., 4Н), 7,54 (с, 1H). Приклад 35 (3-Хлор-5,6-дигідрокси-7-ціанобензо[b]тіофен-2-іл)морфолін-4-ілметанон (3-Хлор-6-гідрокси-5-метоксибензо[b]тіофен-2-іл)морфолін-4-ілметанон (3-Хлор-5,6-диметоксибензо[b]тіофен-2-іл)морфолін-4-ілметанон (11,8 г) із прикладу 8 суспендували в дихлорметані (250 мл) і поступово додавали хлорид алюмінію (33 г). Реакційну суміш перемішували при кімнатній температурі протягом 24 годин. Потім поступово додавали 6М хлористоводневу кислоту (96 мл). Органічний шар сушили сульфатом натрію, випарювали і сушили у вакуумі. Продукт являв собою суміш двох сполук і використовувався для наступної стадії без будь-якого очищення. (7-Бром-3-хлор-6-гідрокси-5-метоксибензо[b]тіофен-2-іл)морфолін-4-ілметанон (3-Хлор-6-гідрокси-5-метоксибензо[b]тіофен-2-іл)морфолін-4-ілметанон (6,9 г) суспендували в оцтовій кислоті. Поступово додавали розчин брому (3,51 г) в оцтовій кислоті (31 мл). Реакційну суміш перемішували при кімнатній температурі і через 15 хвилин додавали воду (125 мл). Реакційну суміш перемішували на холоді протягом 1,5 годин. Тверду речовину відфільтровували і сушили у вакуумі. Продукт являв собою суміш двох сполук і використовувався для наступної стадії без будь-якого очищення. (7-Бром-3-хлор-5,6-диметоксибензо[b]тіофен-2-іл)морфолін-4-ілметанон (7-Бром-3-хлор-6-гідрокси-5-метоксибензо[b]тіофен-2-іл)морфолін-4-ілметанон (7,0 г) розчиняли в 1-метил-2-піролідиноні (35 мл) і поступово додавали діізопропілетиламін. Реакційний розчин нагрівали при 80 °C протягом 3 годин. Потім додавали воду (350 мл). Реакційну суміш перемішували при кімнатній температурі протягом 30 хвилин. Продукт екстрагували етилацетатом. Органічну фазу промивали 1М хлористоводневою кислотою і розчином сульфату натрію, випарювали і сушили у вакуумі. Продукт очищали флешхроматографією з використанням суміші гептан-етилацетат як елюенту. 1 Н ЯМР (ДМСО-d6): =3,46 (ушир., 4Н), 3,64 (ушир., 4Н), 3,84 (с, 3Н), 3,97 (с, 3Н), 7,39 (с, 1Н). (3-Хлор-7-ціано-5,6-диметоксибензо[b]тіофен-2-іл)морфолін-4-ілметанон 1 5 10 15 20 25 30 35 40 45 50 55 23 UA 98608 C2 5 10 15 20 25 30 35 (7-Бром-3-хлор-5,6-диметоксибензо[b]тіофен-2-іл)морфолін-4-ілметанон (0,7 г) і ціанід міді (І) (2,3 г) у N, N-диметилформаміді піддавали опроміненню в мікрохвильовій печі при 180 °C протягом 1,5 годин. До суміші додавали воду (40 мл) і етилацетат (40 мл). Тверду речовину відфільтровували та органічну фазу випарювали і сушили у вакуумі. Продукт очищали флешхроматографією з використанням суміші гептан-етилацетат як елюенту. 1 Н ЯМР (ДМСО-d6): =3,65 (ушир, 8Н), 4,00 (м, 3Н), 4,05 (м, 3Н), 7,39 (с, 1Н). (3-Хлор-7-ціано-5,6-дигідроксибензо[b]тіофен-2-іл)морфолін-4-ілметанон (3-Хлор-7-ціано-5,6-диметоксибензо[b]тіофен-2-іл)морфолін-4-ілметанон (0,05 г) суспендували в дихлорметані в атмосфері азоту, охолоджували до -20 °C і обробляли по краплях розчином 1М трибромистого бору в дихлорметані. Суспензію перемішували при -20 °C протягом 30 хвилин і залишали на холоді протягом ночі. Суміш виливали в охолоджену льодом воду і перемішували при кімнатній температурі протягом 30 хвилин. Продукт відфільтровували та очищали за допомогою препаративної плати (зворотна фаза) з використанням суміші толуолу, етилацетату та оцтової кислоти (8:1:1) як елюенту. 1 Н ЯМР (ДМСО-d6): =3,52 (м, 4Н), 3,63 (ушир., 4Н), 7,02 (с, 1Н). Як вже до цього згадувалося, сполуки формули І виявляють цікаві фармакологічні властивості, а саме, вони виявляють посилену інгібуючу активність ферменту катехол-Ометилтрансферази (СОМТ) і мають поліпшену біодоступність і/або пролонгують тривалість дії завдяки повільному елімінуванню через глюкуронідування. Крім того, вони не роз'єднують окисне фосфорилування. Зазначені властивості демонструються фармакологічними випробуваннями, наведеними нижче. ЕКСПЕРИМЕНТ 1 Визначення СОМТ інгібуючої активності in vitro Величини Кі визначали за допомогою вимірювання активності СОМТ різними концентраціями лікарських засобів із використанням рекомбінантної людської розчинної форми СОМТ (hS-COMT). hS-COMT попередньо інкубували з 25 мкМ S-аденозил-L-метіонину (SAM) і СОМТ інгібітором у 100 мкМ Na2HPO4 буфера (рН 7,4), що містить 5 мкМ MgCl2 протягом 5 хвилин при 37 °C. Реакцію ініціювали додаванням субстрат ескулетину (10 мкМ). Продукування О-метильованого ескулетину вимірювали за допомогою флуоресценції з розділенням у часі (збудження при 355 нм, емісія при 460 нм) із використанням флюорометра FlexStation (Molecular Probes, США), Аналіз виконували на 96-ямкових планшетах. Константу інгібування щільного зв'язування Кі визначали за кінетикою реакції, що спостерігається при концентраціях інгібітора, що варіюють, із використанням програмного забезпечення PlateKi (BioKin, США). Результати показані в таблиці 1. Результати показують, що сполуки формули І здатні інгібувати СОМТ активність in vitro з ефективністю, кращою або такою, що дорівнює ефективності ентакапону. Таблиця 1 СОМТ інгібуюча активність in vitro Сполука Сполука прикладу 4 Сполука прикладу 5 Сполука прикладу 7 Сполука прикладу 8 Сполука прикладу 12 Сполука прикладу 13 Сполука прикладу 16 Сполука прикладу 23 Ентакапон 40 45 Кі/нМ 0,5 1,5 1,5 0,6 0,6 0,2 0,9 2,0 1,9 Експеримент 2 Визначення метаболічної стабільності in vitro Метаболічну стабільність досліджували за допомогою інкубування сполук разом із мікросомами печінки людини (Human Biologies Inc.) із використанням уридин-5'дифосфоглюкуронової кислоти (UDPGA, Sigma) у ролі кофактора. Інкубування здійснювали в 100 мМ фосфатному буфері (рН 7,4), що містить 5 мМ MgCl2. Кінцева концентрація випробуваної речовини становила 100 мкМ, а кількість мікросомального білка - 0,4 мг/мл. Після 5-хвилинної попередньої інкубації починали реакцію із попередньо підігрітої UDPGA, кінцева 24 UA 98608 C2 5 10 концентрація 5 мМ. Суміш інкубували в трубках Епендорфа протягом 60 хвилин при 37 °C і реакцію закінчували додаванням метанолу або суміші перхлорна кислота/метанол (1:9). Після осадження білка глюкуронід, що утворився, відділяли високоефективною рідинною хроматографією (HPLC). Зону глюкуроніду на HPLC хроматограмі порівнювали із зоною, що утворюється від ентакапону за тих самих експериментальних умов, з одержанням відносної величини глюкуронідування для кожної сполуки. Результати показані в таблиці 2. Результати показують, що сполуки формули І мають підвищену метаболічну стабільність щодо глюкуронідування в порівнянні з ентакапоном. Було показано, що глюкуронідування є головним способом елімінування ентакапону, і, таким чином, сполуки формули І мають поліпшену біодоступність і/або пролонговану тривалість дії. Таблиця 2 Метаболічна стабільність in vitro (відносне глюкуронідування; ентакапон = 1,00) Сполука Сполука прикладу 4 Сполука прикладу 12 Сполука прикладу 16 Сполука прикладу 23 Ентакапон 15 20 25 30 35 40 45 50 Відносне глюкуронідування 50 >50 >50 10 2,6 Сполуки формули І виявляють СОМТ інгібуючу активність. Даний винахід, таким чином, забезпечує сполуки або їх солі або ефір для використання у ролі лікарських засобів. Крім того, надається спосіб лікування захворювань або станів, при яких показані СОМТ інгібуючі агенти. Наприклад, пропонують спосіб лікування хвороби Паркінсона, такий як потенціювання терапії за допомогою левадопи або терапії іншим допаміновим попередником. У зазначеному способі суб'єкту, що потребує такого лікування, вводиться терапевтично ефективна кількість, принаймні, однієї сполуки формули І. Пропонують також застосування сполук формули І для виробництва лікарського засобу для лікування захворювань або станів, при яких показані СОМТ інгібуючі агенти, наприклад, хвороби Паркінсона. Сполуки формули І можуть вводитися, наприклад, ентерально, топічно або парентерально у вигляді будь-якої фармацевтичної рецептури, корисної для зазначеного введення і що містить, принаймні, одну активну сполуку формули І у фармацевтично прийнятних і ефективних кількостях разом із фармацевтично прийнятними розріджувачами, носіями і/або ексципієнтами, відомими в даній галузі техніки. Терапевтична доза, що дається пацієнту, який потребує лікування, буде змінюватися залежно від сполуки, що вводиться, віку і статі суб'єкта, що піддається лікуванню, конкретного стану, що піддається лікуванню, а також від шляху і способу введення, i легко визначається фахівцем у даній галузі. Відповідно, типове дозування для перорального введення складає від 5 мкг/кг до 100 мг/кг на день, і для парентерального введення - від 0,5 мкг/кг до 10 мг/кг, для дорослого ссавця. Сполуки згідно з даним винаходом дають пацієнту як такі або в поєднанні з одним або більше іншими активними інгредієнтами і/або придатними фармацевтичними наповнювачами. Остання група включає звичайно ексципієнти, що використовуються, і рецептурні допоміжні засоби, такі як наповнювачі, зв'язуювальні, дезінтегруючі агенти, змащувальні агенти, розчинники, гелеутворюючі агенти, емульгатори, стабілізатори, барвні агенти і/або консерванти. Сполуки формули І формулюються в дозувальні форми з використанням загальновідомих фармацевтичних способів виробництва. Дозувальними формами можуть бути, наприклад, таблетки, капсули, гранули, медичні свічки, емульсії, суспензії або розчини. Залежно від шляху введення і галенової форми кількість активного агента в рецептурі може звичайно варіювати між 0,01 % і 100 % (мас/мас). Для лікування хвороби Паркінсона сполуки формули І можуть даватися разом з леводопою або іншим допаміновим попередником, кожним у своїй власній композиції або в поєднанні в одній композиції. Може бути присутнім також інгібітор допадекарбоксилази (DDC), такий як бензеразид або карбідопа, і/або інгібітор моноаміноксидази типу В (МАО-В), такий як лазабемід, разагілін, сафінамід або селегілін. Кількість леводопи може складати від 50 мг до 400 мг, наприклад, від 50 до 300 мг, така як від 50 мг до 200 мг. Кількість карбідопи може складати від 5 мг до 200 мг, наприклад, від 5 мг до 100 мг, така як від 5 мг до 50 мг. Інгібітор DDC і попередник допаміну, такий як леводопа, звичайно вводяться в співвідношенні від 1:1 до 1:40, наприклад, від 1:4 до 1:10. Добова доза лазабеміду складає звичайно від 100 мг до 800 мг, наприклад, від 100 мг до 200 мг, розділених на 1-10 окремих доз, наприклад, на 1-2 окремі дози. Добова доза разагіліну складає звичайно від 0,1 мг до 5 мг, наприклад, від 0,5 мг до 2 мг, розділених на 1-10 окремих 26 UA 98608 C2 5 доз, наприклад, на 1-2 окремі дози. Добова доза сафінаміду складає звичайно від 10 мг до 600 мг, наприклад, від 50 мг до 150 мг, розділених на 1-10 окремих доз, наприклад, на 1-2 окремі дози. Добова доза селегіліну складає звичайно від 1 мг до 20 мг, наприклад, від 2 мг до 10 мг, розділених на 1-10 окремих доз, наприклад, на 1-2 окремі дози. Фахівці в даній галузі, очевидно розуміють, що втілення винаходу, описані в даній заявці, можуть видозмінюватися без відхилення від концепції винаходу. Фахівці в даній галузі також розуміють, що винахід не обмежується конкретними описаними втіленнями, а призначені також для включення модифікацій втілень, які охоплюються суттю та обсягом винаходу. ФОРМУЛА ВИНАХОДУ 10 1. Сполука формули І R4 R3 X Y R2 15 20 25 30 35 40 45 50 55 R1 Z ,І в якій R2 знаходиться в орто-положенні до R3, і R1 знаходиться в орто-положенні до R2; або R1 знаходиться в орто-положенні до R3, і R4 знаходиться в орто-положенні до R1; R1 являє ціано або нітро; R2 являє гідрокси; R3 являє гідрокси; R4 являє Н, (С1-С6)алкіл, галоген(С1-С6)алкіл, ціано, форміл, (С1-С6)алкіл-(С=О)-, галоген або нітро; пунктирна лінія являє собою одинарний або подвійний зв'язок; два з X, Y або Z являють собою CR5(R6)m, і один з X, Y або Z являє собою N(R7)n, О або S; або один з X, Y або Z являє собою CR5(R6)m, і один з X, Y або Z являє собою N(R7)n, і один з X, Y або Z являє S; m являє незалежно в кожному випадку 0 або 1; n являє незалежно в кожному випадку 0, 1 або 2; R5 являє собою незалежно в кожному випадку Н, (С 1-С6)алкіл, галоген, галоген(С1С6)алкіл, (С1-С8)алкокси-(С=O)-, карбокси, арил, гетероарил, гетероцикліл-(С=О)-, (R8)2N-(C=O)-, де вказаний гетероцикліл, як такий або як частина якої-небудь іншої групи, належать до 5-, 6- або 7-членної насиченої циклічної групи, що містить 1 або 2 гетероатоми, кожен з яких незалежно вибраний з N, О і S; вказаний арил, як такий або як частина якої-небудь іншої групи, належить до моно- або біциклічної ароматичної карбоциклічної групи, яка містить 6 або 10 атомів вуглецю; вказаний гетероарил належить до 5-, 6- або 7-членної ароматичної групи, яка містить 1, 2, 3 або 4 гетероатоми, кожен з який незалежно вибраний з N, О і S, і де вказані гетероцикліл, арил або гетероарил, як самі по собі або як частина ще якоїнебудь групи, є незаміщеними або заміщеними 1 або 2 замісниками, кожний з яких незалежно являє собою (С1-С6)алкіл або гідрокси; R6 являє собою незалежно в кожному випадку Н; або R5 і R6, приєднані, обидва, до одного і того ж кільцевого атома вуглецю, утворюють разом із кільцевим атомом вуглецю, до якого вони приєднані, -(С=О)-групу; R7 являє собою незалежно в кожному випадку (С1-С6)алкіл або арил, де вказаний арил належить до моно- або біциклічної ароматичної карбоциклічної групи, яка містить 6 або 10 атомів вуглецю; де вказаний арил є заміщеним 1 замісником, який являє собою галоген; або R8 являє собою незалежно в кожному випадку Н, (С1-С6)алкіл, (С1-С6)алкокси, арил або арил(С1-С6)алкіл, де вказаний арил, як такий або як частина якої-небудь іншої групи, належить до моно- або біциклічної ароматичної карбоциклічної групи, яка містить 6 або 10 атомів вуглецю; де вказаний арил, як сам по собі або як частина ще якої-небудь групи, є незаміщеним або заміщеним 1 або 2 замісниками, кожний з яких незалежно являє собою (С1-С6)алкіл, галоген, гідрокси, карбокси або (С1-С6)алкокси; або її фармацевтично прийнятна сіль або ефір. 2. Сполука за п. 1, яка відрізняється тим, що R2 знаходиться в орто-положенні до R3, і R1 знаходиться в орто-положенні до R2. 27 UA 98608 C2 5 10 15 20 25 30 35 40 45 50 55 60 3. Сполука за п. 1, яка відрізняється тим, що R1 знаходиться в орто-положенні до R3, і R4 знаходиться в орто-положенні до R1. 4. Сполука за будь-яким із пп. 1-3, яка відрізняється тим, що R4 являє собою Н, галоген або нітро. 5. Сполука за п. 4, яка відрізняється тим, що R4 являє собою Н. 6. Сполука за будь-яким із пп. 1-5, яка відрізняється тим, що R1 являє собою ціано. 7. Сполука за будь-яким із пп. 1-5, яка відрізняється тим, що R1 являє собою нітро. 8. Сполука за будь-яким із пп. 1-7, яка відрізняється тим, що одна з пунктирних ліній являє собою подвійний зв'язок. 9. Сполука за будь-яким із пп. 1-8, яка відрізняється тим, що два з X, Y або Z являють собою CR5(R6)m, і один із X, Y або Z являє собою N(R7)n. 10. Сполука за будь-яким із пп. 1-8, яка відрізняється тим, що один із X, Y або Z являє собою CR5(R6)m, один із X, Y або Z являє собою N(R7)n, і один із X, Y або Z являє собою S. 11. Сполука за будь-яким із пп. 1-8, яка відрізняється тим, що два з X, Y або Z являють собою CR5(R6)m, і один із X, Y або Z являє собою О. 12. Сполука за будь-яким із пп. 1-8, яка відрізняється тим, що два з X, Y або Z являють собою CR5(R6)m, і один із X, Y або Z являє собою S. 13. Сполука за будь-яким із пп. 1-12, яка відрізняється тим, що R5 являє собою незалежно в кожному випадку Н, (С1-С6)алкіл, галоген, галоген(С1-С6)алкіл, (С1-С8)алкокси(С=О)-, карбокси, арил, гетероарил, гетероцикліл-(С=О)- або (R8)2N-(С=O)-, де вказаний арил належить до моно- або біциклічної ароматичної карбоциклічної групи, яка містить 6 або 10 атомів вуглецю; вказаний гетероарил належить до 5-, 6- або 7-членної ароматичної групи, яка містить 1, 2, 3 або 4 гетероатоми, кожен з яких незалежно вибраний з N, О і S, і вказаний гетероцикл як такий або як частина якої-небудь іншої групи, належить до 5-, 6або 7-членної насиченої циклічної групи, яка містить 1 або 2 гетероатоми, кожен з яких незалежно вибраний з N, О і S і де вказаний гетероцикліл, арил або гетероарил, як сам по собі або як частина ще якоїнебудь групи, є незаміщеним або заміщеним 1, 2 або 3 замісниками, які являють, кожен незалежно, (С1-С6)алкіл або гідрокси, R6 являє собою незалежно в кожному випадку Н, або R5 і R6, приєднані, обидва, до одного і того ж кільцевого атома вуглецю, утворюють разом із кільцевим атомом вуглецю, до якого вони приєднані, -(С=О)-групу; R8 являє собою незалежно в кожному випадку (С1-С6)алкіл або арил, де вказаний арил належить до моно- або біциклічної ароматичної карбоциклічної групи, яка містить 6 або 10 атомів вуглецю; де вказаний арил є незаміщеним або заміщеним 1 або 2 замісниками, які являють, кожен незалежно, карбокси або (С1-С6)алкокси. 14. Сполука за п. 13, яка відрізняється тим, що m являє собою незалежно в кожному випадку 0, R5 являє незалежно в кожному випадку Н, галоген, (С1-С8)алкокси-(С=О)-, карбокси, гетероцикліл-(С=О)- або (R8)2N-(C=O)-, де вказаний гетероцикліл, як такий або як частина якоїнебудь іншої групи, належить до 5-, 6- або 7-членної насиченої циклічної групи, яка містить 1 або 2 гетероатоми, кожен з яких незалежно вибраний з N, О і S, і де вказаний гетероцикліл як частина ще якої-небудь групи є незаміщеним або заміщеним 1, 2 або 3 замісниками, які являють собою, кожен незалежно, (С 1-С6)алкіл або гідрокси; R8 являє незалежно в кожному випадку (С1-С6)алкіл або арил, де вказаний арил належить до моно- або біциклічної ароматичної карбоциклічної групи, яка містить 6 або 10 атомів вуглецю; і де вказаний арил є незаміщеним або заміщеним 1 замісником, що являє собою карбокси або (С1-С6)алкокси. 15. Сполука за п. 1, вибрана з групи: 2-(4-хлорфеніл)-5,6-дигідрокси-4-нітро-2,3-дигідроізоіндол-1-он, 5,6-дигідрокси-7-нітро3Н-ізобензофуран-1-он, 7-нітро-2-піридин-4-ілбензотіазол-5,6-діолу метансульфонат, 3-хлор5,6-дигідрокси-7-нітробензо[b]тіофен-2-карбонова кислота, етиловий ефір 3-хлор-5,6дигідрокси-7-нітробензо[b]тіофен-2-карбонової кислоти, 3-хлор-5,6-дигідрокси-4нітробензо[b]тіофен-2-карбонова кислота, 3-хлор-5,6-дигідрокси-7-нітробензо[b]тіофен, (3-хлор5,6-дигідрокси-7-нітробензо[b]тіофен-2-іл)морфолін-4-ілметанон, діетиламід 3-хлор-5,6дигідрокси-7-нітробензо[b]тіофен-2-карбонової кислоти, (3-хлор-5,6-дигідрокси-7нітробензо[b]тіофен-2-іл)піперидин-1-ілметанон, феніламід 3-хлор-5,6-дигідрокси-7 28
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzofused five-membered heterocycles and use thereof
Автори англійськоюAhlmark Marko, Baeckstroem Reijo, Luiro Anne, Pystynen Jarmo, Tiainen Eija
Назва патенту російськоюБензоконденсированные пятичленные гетероциклы и их применение
Автори російськоюАлмарк Марк, Бякстрем Рейо, Луйро Анне, Пюстюнен Ярмо, Тиайнен Эйя
МПК / Мітки
МПК: A61K 31/428, A61P 25/16, C07D 307/82, C07D 333/62, A61K 31/381, C07D 277/02, A61K 31/343
Мітки: п'ятичленні, бензоконденсовані, гетероцикли, застосування
Код посилання
<a href="https://ua.patents.su/31-98608-benzokondensovani-pyatichlenni-geterocikli-i-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Бензоконденсовані п’ятичленні гетероцикли і їх застосування</a>
Попередній патент: Пасажирський транспортний пристрій, такий як ескалатор або конвеєр, та його привідна система
Наступний патент: Пристрій для термообробки огрудкованих сировинних матеріалів
Випадковий патент: Планетарна муфта