Концентрат міцел сироваткового протеїну та спосіб його одержання
Номер патенту: 98763
Опубліковано: 25.06.2012
Автори: Боветто Ліонель Жан Рене, Шмітт Крістоф Жозеф Етьєн, Пузо Матьє, Робін Фредерік
Формула / Реферат
1. Спосіб виробництва концентрату міцел сироваткового протеїну, який включає етапи:
(a) доведення рН демінералізованого водного розчину нативного сироваткового протеїну до значення між 5,8 та 6,6, в якому концентрація водного розчину сироваткового протеїну менше 12 %, та в якому, якщо водний розчин сироваткового протеїну містить додаткові компоненти, то кількість зазначених додаткових компонентів не перевищує 10 мас. % від загальної маси розчину,
(b) обробка водного розчину при температурі між 80 та 89 °С, при цьому нагрівання здійснюють в діапазоні від 10 секунд до 2 годин,
(c) концентрація дисперсії, одержаної на етапі b, та
(d) при необхідності, розпилювальне сушіння або сублімаційне сушіння концентрату міцел сироваткового протеїну.
2. Спосіб за п. 1, в якому концентрація водного розчину сироваткового протеїну менше 4 %. 3. Спосіб за п. 1, в якому час нагрівання становить 15 хвилин.
4. Спосіб за будь-яким з пп. 1-3, в якому нагрівання досягається за допомогою мікрохвиль.
5. Спосіб за будь-яким з пп. 1-3, в якому вихід міцел перед концентруванням становить принаймні 35 %.
6. Спосіб за п. 5, в якому вихід міцел перед концентруванням становить принаймні 50 %.
7. Спосіб за п. 6, в якому вихід міцел перед концентруванням становить принаймні 80 %.
8. Спосіб за будь-яким з пунктів 1-3 або п. 7, в якому міцели мають середній розмір менше 1 мкм.
9. Спосіб за п. 8, в якому міцели мають середній розмір 100-900 нм, переважно 100-700 нм, найбільш переважно 200-400 нм.
10. Спосіб за п. 9, в якому пропорція міцел з середнім розміром від 100 до 700 нм вище 80 %.
11. Спосіб за п. 1, в якому концентрування здійснюють упарюванням, центрифугуванням, седиментацією, ультрафільтрацією і/або мікрофільтрацією.
12. Спосіб за п. 11, в якому центрифугування здійснюють в режимі високого або низького прискорення після підкислення до рН 4,5.
13. Спосіб за п. 11, в якому спонтанну седиментацію здійснюють при рН 4,5.
14. Спосіб за п. 13, в якому час седиментації складає більше ніж 12 годин.
15. Концентрат міцел сироваткового протеїну, який отримано способом за будь-яким з пп. 1-14.
16. Концентрат за п. 15, який має концентрацію білка більше 12 % та у якому принаймні 80 % міцел сироваткового протеїну мають середній розмір від 100 до 700 нм.
17. Концентрат за п. 15 або п. 16, в якому більше 50 % білків є міцелами сироваткового протеїну.
18. Концентрат за п. 15 або п. 16, який знаходиться у формі дисперсії або в напівтвердій формі.
19. Концентрат за п. 15, який знаходиться у формі порошку.
20. Концентрат за п. 19, який включає принаймні 20 % міцел сироваткового протеїну.
21. Концентрат за п. 19, який включає принаймні 50 % міцел сироваткового протеїну.
22. Концентрат за п. 19, який включає принаймні 80 % міцел сироваткового протеїну.
23. Концентрат за будь-яким з пп. 19-22, який у формі порошку має здатність зв'язувати воду принаймні до 50 %.
24. Концентрат за п. 23, який у формі порошку має здатність зв'язувати воду принаймні до 90 %.
25. Концентрат за п. 23, який у формі порошку має здатність зв'язувати воду принаймні до 100 %.
26. Концентрат за будь-яким з пп. 19-22, який у формі порошку має здатність зв'язувати гліцерин принаймні до 50 %.
27. Концентрат за будь-яким з пп. 19-22, який у формі порошку має здатність зв'язувати етанол принаймні до 50 %.
28. Концентрат за будь-яким з пп. 19-22, який у формі порошку має здатність зв'язувати олію принаймні до 30 %.
29. Застосування концентрату міцел сироваткового протеїну за будь-яким з пп. 19-28 як технологічної домішки в харчових, косметичних або фармацевтичних продуктах.
30. Застосування за п. 29, де технологічна домішка є емульгатором, стабілізатором пін або емульсій, наповнювачем, вибілювальним або пінотворним агентом.
31. Застосування за п. 29, де технологічна домішка є замінником жиру або замінником міцелярного казеїну.
Текст
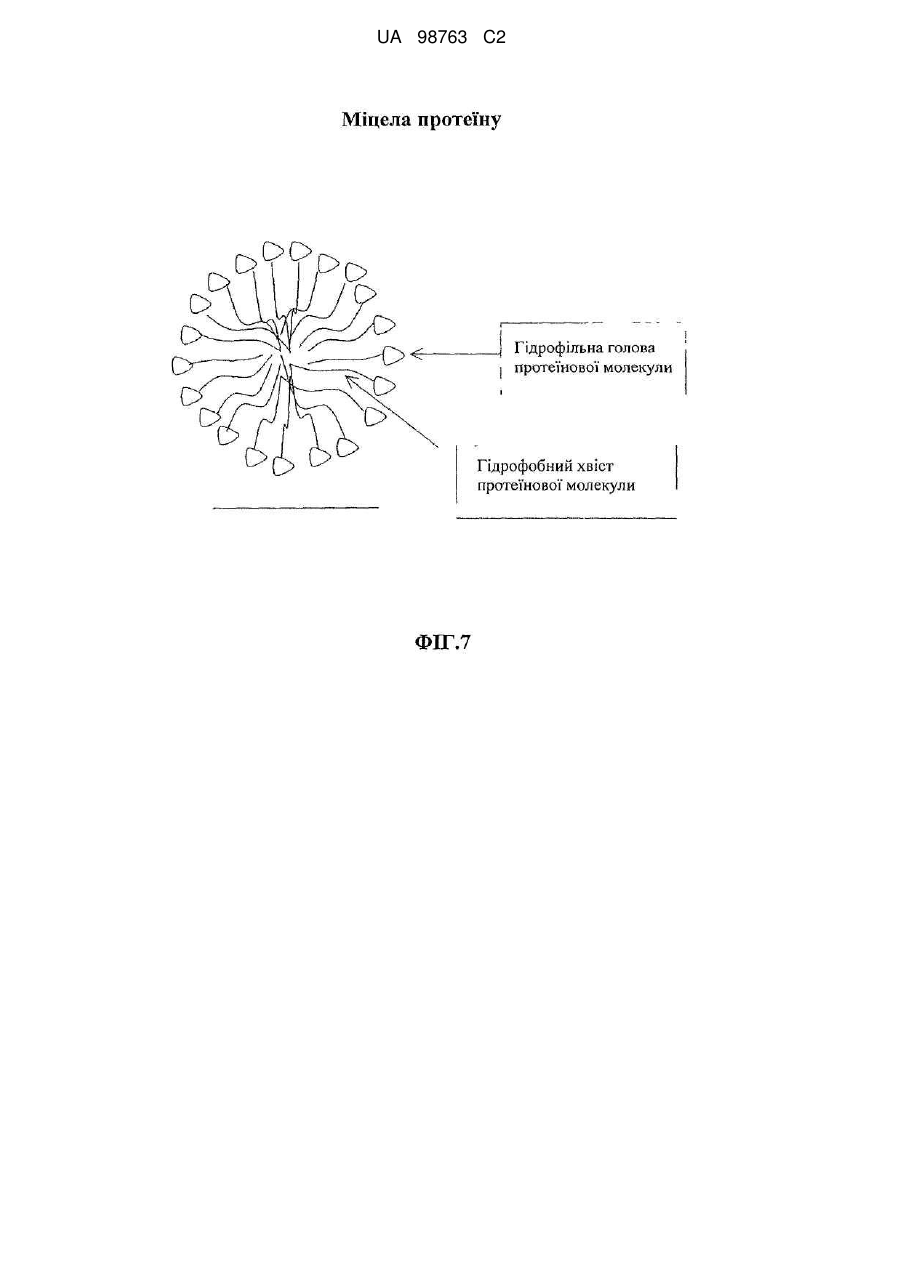
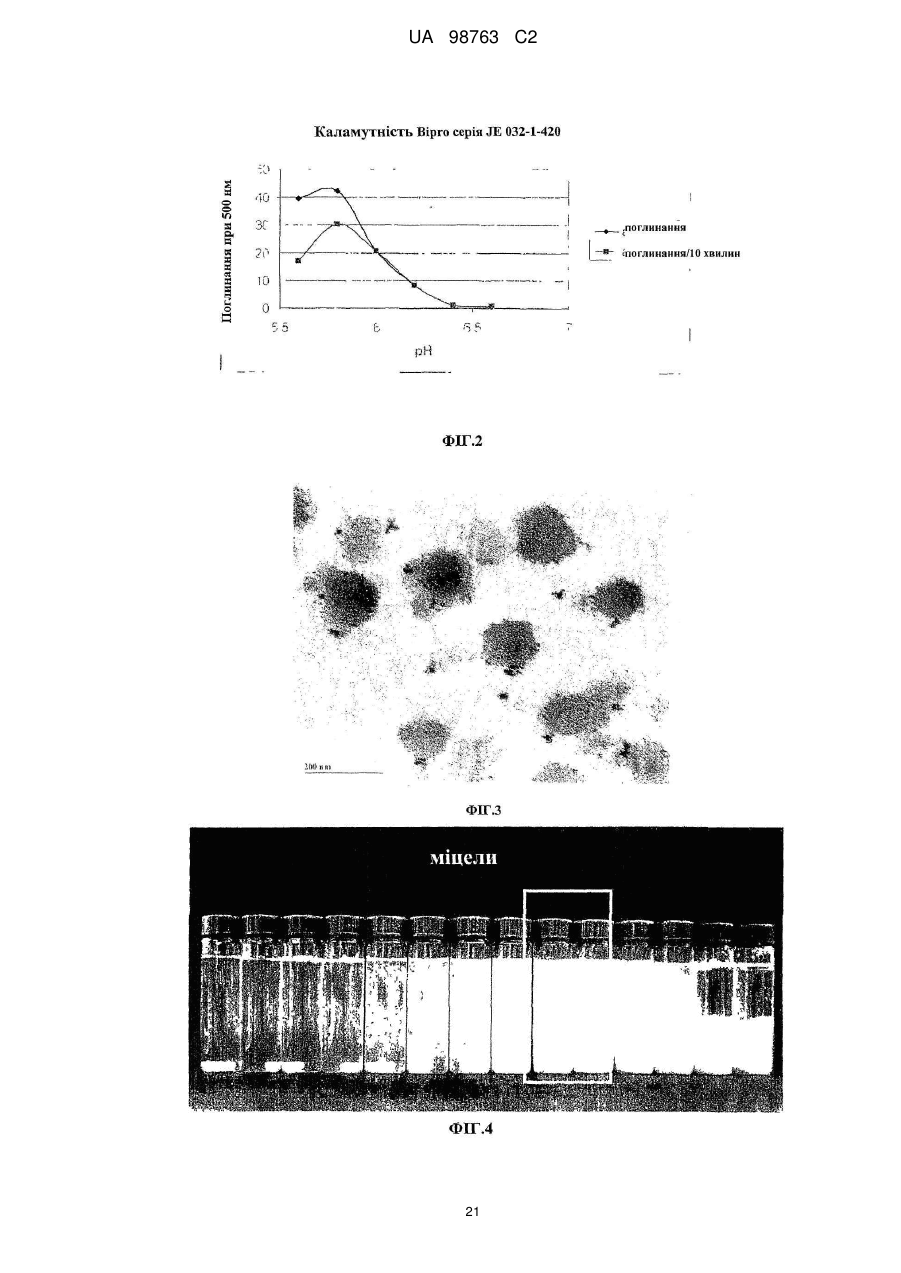
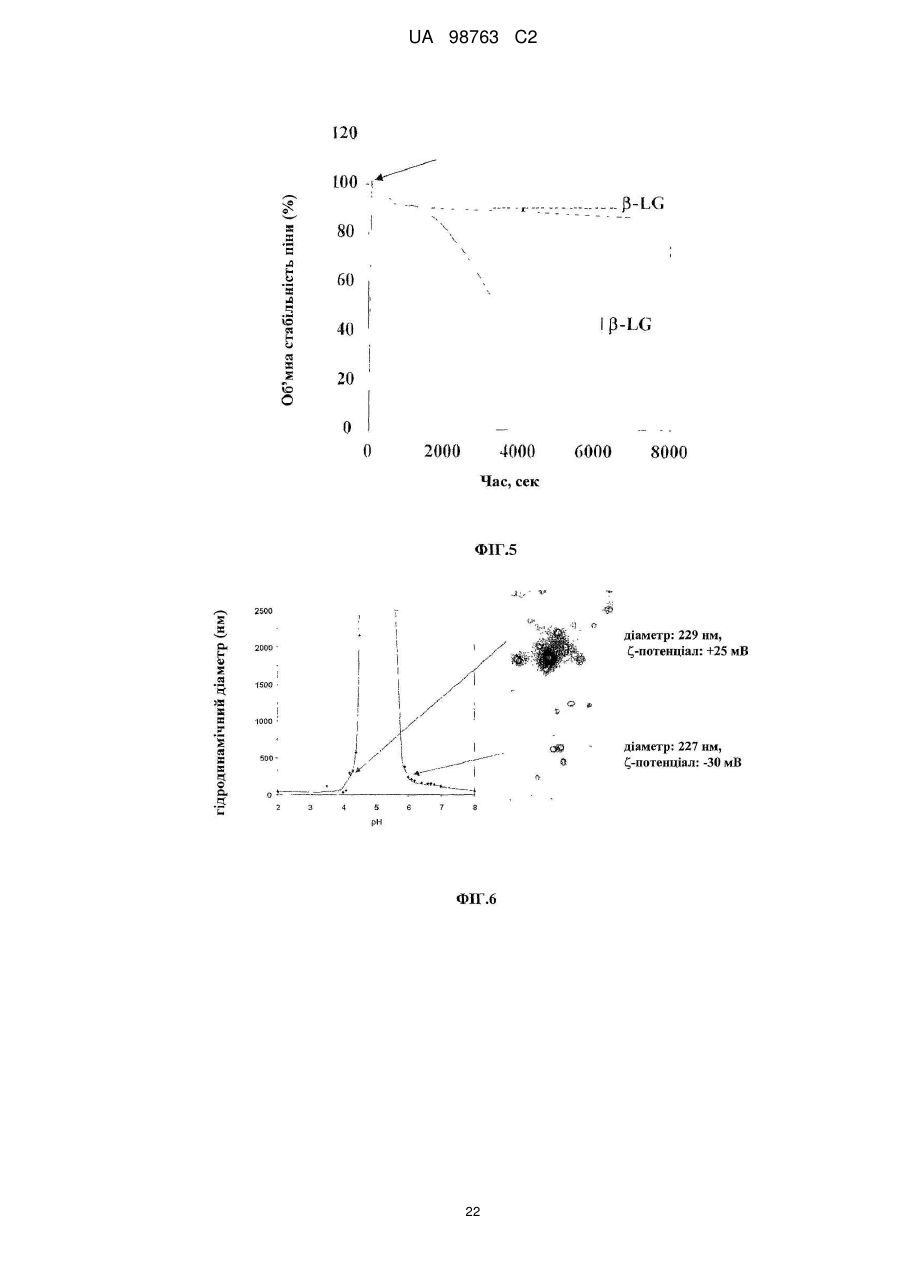
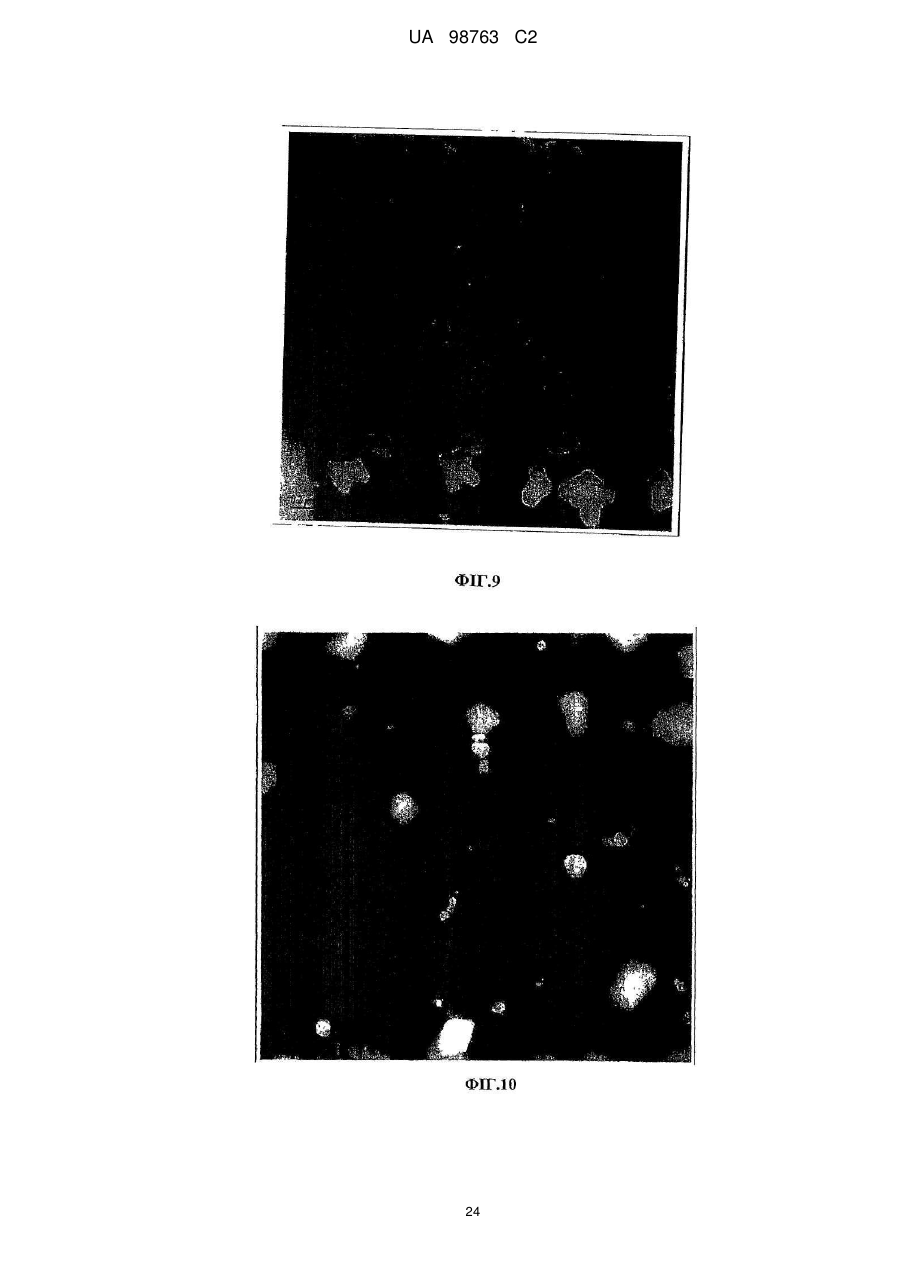
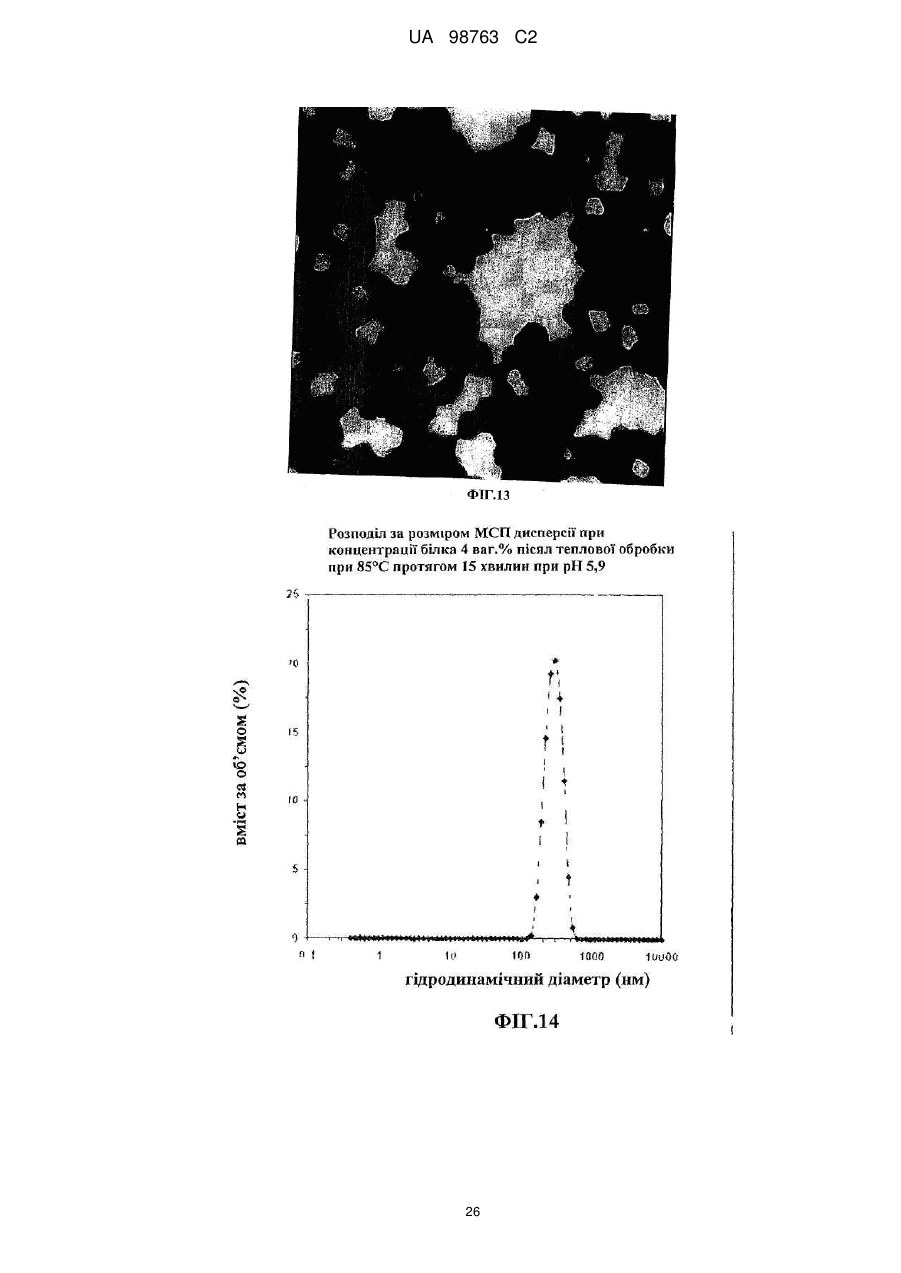
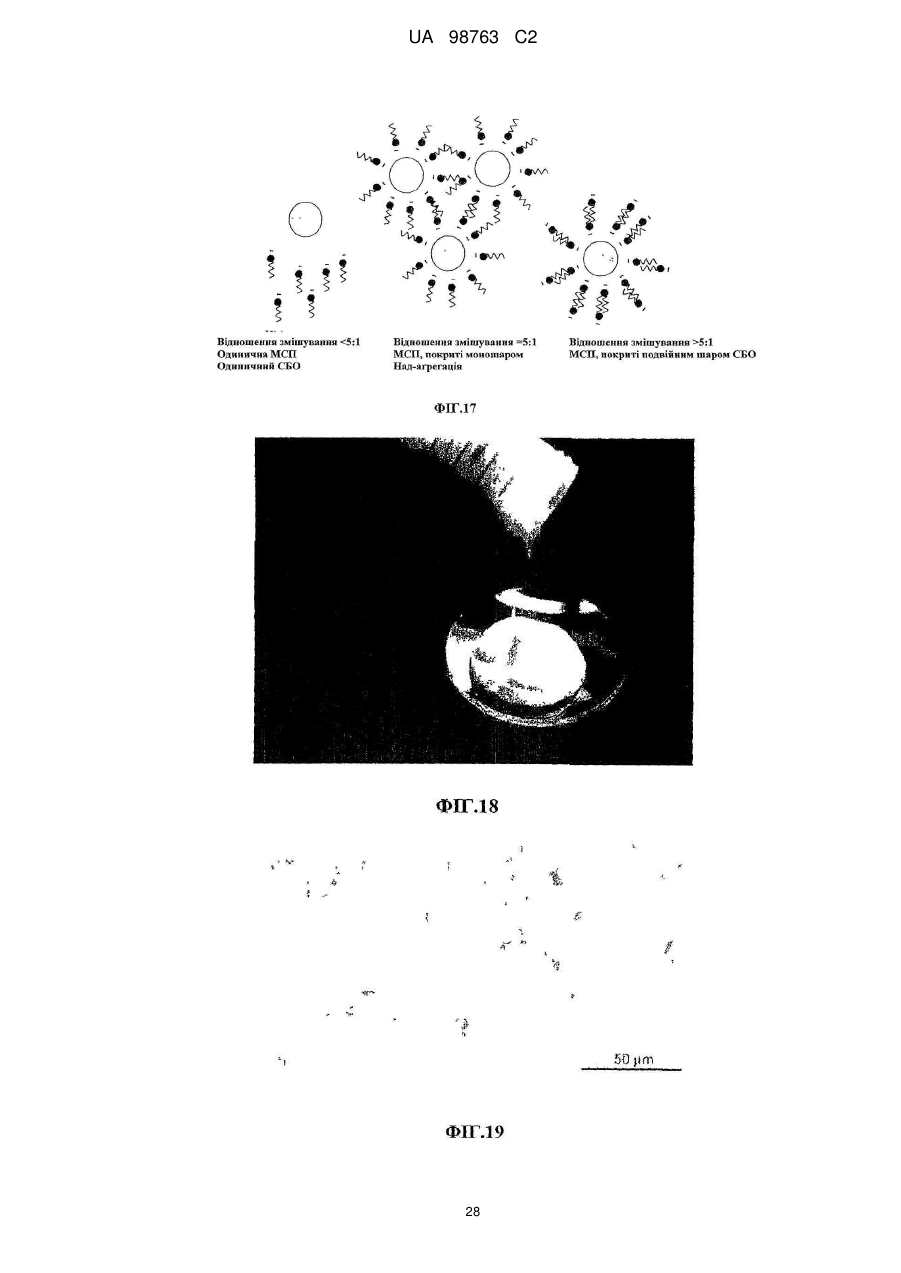
Реферат: Винахід належить до способу виробництва концентрату міцел сироваткового протеїну, який включає етап (a) доведення рН демінералізованого водного розчину нативного сироваткового протеїну до значення між 5,8 та 6,6, в якому концентрація водного розчину сироваткового протеїну менше 12 % та в якому, якщо водний розчин сироваткового протеїну містить додаткові компоненти, то кількість зазначених додаткових компонентів не перевищує 10 мас. % від загальної маси розчину, (b) обробку водного розчину при температурі між 80 та 89 °С, при цьому нагрівання здійснюють в діапазоні від 10 секунд до 2 годин, (c) концентрацію дисперсії, одержаної на етапі b, та (d) при необхідності, розпилювальне сушіння або сублімаційне сушіння концентрату міцел сироваткового протеїну. Винахід належить також до концентрату міцел сироваткового протеїну, одержаного зазначеним способом. UA 98763 C2 (12) UA 98763 C2 UA 98763 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується міцел сироваткового протеїну, зокрема концентратів міцел сироваткового протеїну та їх порошків, і способів їх виробництва. Даний винахід також стосується застосування цих концентратів міцел та їх порошків в широкому діапазоні прикладень. Протеїн складає незамінну частину дієти багатьох людей. Він застосовується не тільки завдяки поживній цінності, але також надає бажану текстуру і стабілізацію харчовим продуктам. Наприклад, в жировмісних продуктах жир зберігає стабільність впродовж терміну придатності продукту, оскільки не відбувається розділення фаз. В даний час застосовуються емульгуючі агенти, які забезпечують стабілізацію емульсії при формуванні, на основі внутрішньої властивості ліпофільної або гідрофільної частини, розчинної у неводній фазі, і полярній або гідрофільній частини, розчинної у воді, так що вказані молекули полегшують емульгування однієї фази в іншій фазі. Додатково, емульгуючі агенти також захищають одноразово утворенні крапельки від агрегації та коалесценції. Як емульгуючі агенти використовуються натуральні речовини, такі як гідроколоїди, фосфоліпіди (лецитин) або гліколіпіди, а з іншого боку можуть застосовуватися синтетичні агенти, такі як стеарил-2лактилат або моно-, діацилгліцериди тощо. Один з багатьох недоліків агентів полягає в тому, що вони іноді істотно збільшують вартість кінцевого продукту, не підвищуючи харчової цінності продукту. Іноді такі види матеріалів не демонструють адекватних стабілізуючих властивостей внаслідок поверхневої конкуренції з білками. Таким чином, все частіше білок застосовують як емульгатор для часткової заміни жиру. Патент US 6767575 В1 розкриває приготування агрегованого продукту сироваткового протеїну, де сироватковий протеїн денатурують шляхом ацидифікації і нагрівання. Агрегати протеїну, одержані таким чином, застосовують для харчових продуктів. Патент GB 1079604 описує удосконалення у виробництві сиру, де сироваткові протеїни зазнають теплової обробки при оптимальному значенні рН, для того, щоб одержати нерозчинні сироваткові протеїни, які потім додають в сире молоко. Патент WO 93/07761 стосується забезпечення сухого білкового продукту з мікрочастинок, який можна використовувати як замінник жиру. Патент US 5750183 розкриває процес виробництва білкових мікрочастинок, які придатні як замінник жиру, що не містить жиру. Білковий замінник жиру розкритий також в публікації WO 91/17665, де білки знаходяться у формі розподілених у воді мікрочастинок денатурованого сироваткового протеїну. Крім харчових продуктів, білки також присутні в багатьох фармацевтичних і косметичних композиціях. Однією з проблем, які зустрічаються при виробництві продуктів, що включають глобулярні білки загалом і сироватковий протеїн зокрема, однак, є їх обмежена здатність до обробки при промисловому виробництві продуктів харчування. Дійсно, коли білкові молекули нагріваються, або коли піддаються кислотній або лужній обробці, або у присутності солей, то вони проявляють тенденцію до втрати їх природної структури і збираються в різні довільні структури, такі як, наприклад, гелі. Приготування жельованих водних композицій сироваткових протеїнів є предметом ЕР 1281322. Elofsson et al. у International Dairy Journal, 1997, p.601-608 описує холодне желювання концентратів сироваткового протеїну. Схожим чином, Kilara et al. у Journal of Agriculture and Food 20 Chemistry, 1998, p. 1830-1835 описує вплив рН на агрегацію сироваткових протеїнів та їх желювання. Даний желеутворюючий ефект представляє обмеження в умовах не тільки в здатності до обробки (наприклад, засмічення машин, які застосовуються при виробництві білоквмісних продуктів), але також в умовах одержаної таким чином текстури, яка може бути небажана в широкому діапазоні білкових продуктів. Таким чином, бажана контрольована денатурація білків для того, щоб розширити виробництво білків. У Proceedings of the Second International Whey Conference, Чикаго, жовтень 1997, що повідомляються в International Dairy Federation, 1998, 189-196, Britten M. обговорює теплову обробку для поліпшення функціональних властивостей сироваткових протеїнів. Описаний процес виробництва дисперсії мікрочастинок сироваткового протеїну при 95 °C. Erdman в Journal of American College of Nutrition, 1990, p.398-409 вказує, що на якість мікрочастинок протеїну не впливає застосування високого зсуву і нагрівання. ЕР 0603981 також описує стійкі до нагрівання емульсії олія-у-воді, які включають білки. 1 UA 98763 C2 5 10 15 20 25 30 35 40 45 50 55 Sato et al. у US 5,882,705 одержав міцелярний сироватковий протеїн шляхом теплової обробки гідролізованого розчину сироваткового протеїну. Міцелярний сироватковий протеїн характеризується неправильною (асиметричною) формою. Таким чином, задачею винаходу є поліпшення придатності білків в промислових виробничих процесах. Короткий виклад суті винаходу Для досягнення даної задачі пропонується спосіб виробництва концентратів міцел сироваткових протеїнів, в першому аспекті, який включає етапи обробки розчину, що включає нативні сироваткові протеїни, при конкретній температурі, при конкретному рН, і концентрації одержаного таким чином розчину для виробництва концентрату міцел сироваткового протеїну, який включає міцели сироваткового протеїну з діаметром менше 1 мкм. Зокрема, даний винахід стосується процесу виробництва концентрату міцел сироваткового протеїну, який включає етапи: a. Доведення рН водного розчину сироваткового протеїну до значення між 3,0-8,0, b. Обробки водного розчину при температурі між 70-95 °C і c. Концентрації дисперсії, одержаної на етапі Ь. У другому аспекті винахід стосується концентрату міцел сироваткового протеїну, одержаного таким чином, і міцел сироваткового протеїну з концентрацією білка більше 12 %. У подальшому аспекті даний винахід стосується застосування вказаного концентрату в харчових і/або косметичних і/або фармацевтичних продуктах. Композиція, яка включає концентрат сироваткового протеїну, також є аспектом даного винаходу. Далі, концентрат міцел сироваткового протеїну може бути висушений, зокрема за допомогою сублімаційного сушіння, вальцьового сушіння або розпилювального сушіння з одержання порошку міцел сироваткового протеїну. Таким чином, відповідно до іншого аспекту, винахід забезпечує порошок міцел сироваткового протеїну, який включає принаймні 20 % міцел. Концентрат міцел сироваткового протеїну може бути висушений розпилюванням з додатковими інгредієнтами з одержанням в результаті змішаного порошку сироваткового протеїну, який включає міцели сироваткового протеїну і додаткові інгредієнти в масовому співвідношенні від 30:1 до 1:1000, відповідно до подальшого аспекту винаходу. Застосування порошку сироваткового протеїну або змішаного порошку сироваткового протеїну, наприклад, у виробництві збагачених протеїном продуктів харчування і композицій, які включають ці порошки, є ознаками даного винаходу. Міцели сироваткового протеїну і продукти харчування, які включають вказані міцели, також є ознаками даного винаходу. Опис фігур Даний винахід далі описується з посиланням на деякі переважні втілення, показані на супровідних фігурах, на яких: Фіг. 1 показує результати експерименту, що демонструє вплив рН і теплової обробки на міцелізацію Р-лактоглобуліну. Фіг. 2 демонструє засіб визначення рН міцелізації комерційного препарату (Вірго®, серія JE032-1-420) із застосуванням вимірювань каламутності при 500 нм. Фіг. 3 є мікрографією ТЕМ (Трансмісійної Електронної Мікроскопії) міцел сироваткового протеїну (2 мас. %, WPI 95, Lactalis) при рН 7,4. Масштаб шкали 200 нм. Фіг. 4 демонструє результати експерименту, який оцінює дію іонної сили (Аргінін НС1) на утворення протеїнових міцел при постійному рН 7,0. Фіг. 5 демонструє стабільність об'єму (FVS) піни, стабілізованої 1 мас. % міцел (3лактоглобуліну (Davisco) при рН 7,0 у присутності 60 мМ Аргінін НС1 в порівнянні з неміцелізованим |3-лактоглобуліном. Фіг. 6 демонструє оснований на інтенсивності еквівалентний гідродинамічний діаметр сироваткового протеїну, одержаного тепловою обробкою 1 мас. % дисперсії (3-лактоглобуліну протягом 15 хвилин при 85 °C в діапазоні рН від 2 до 8. Міцели сироваткового протеїну одержані при рН 4,25 (позитивно заряджені із зета-потенціалом близько +25mV) і при рН6,0 (негативно заряджені із зета-потенціалом близько -30 mV). Z-усереднений гідродинамічний діаметр міцел склав 229,3 нм при рН 4,25 та 227,2 нм при рН 6,0. Показані відповідні мікрографії міцел, одержані за допомогою ТЕМ після негативного забарвлювання. Масштаб шкали становить 1 мкм. Фіг. 7 демонструє дуже схематичну структуру міцели сироваткового протеїну. 2 UA 98763 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 8 демонструє СЕМ (Скануюча електронна мікроскопія) мікрографію порошку міцел сироваткового протеїну, одержаного після висушування розпилюванням дисперсії з вмістом білка 20 % після мікрофільтрації. Фіг. 9 є негативно забарвленою ТЕМ мікрографією дисперсії міцел сироваткового протеїну, одержаної при вмісті білка 4 %. Фіг. 10 є негативно забарвленою ТЕМ мікрографією дисперсії міцел сироваткового протеїну, одержаної при вмісті білка 20 % після мікрофільтрації. Фіг. 11 демонструє стійкість до нагрівання дисперсії міцел сироваткового протеїну, одержаної при вмісті білка 10 % після мікрофільтрації при рН 7,0 у присутності NaCl після нагрівання до 8 5 °C протягом 15 хвилин. Фіг. 12 демонструє стійкість до нагрівання дисперсії сироваткового протеїну, одержаної при вмісті білка 4 % при рН 7,0 у присутності NaCl після нагрівання до 8 5 °C протягом 15 хвилин. Фіг. 13 є негативно забарвленою ТЕМ мікрографією 4 % дисперсії міцел сироваткового протеїну, основаної на порошку міцел чистого сироваткового протеїну, висушеного розпилюванням після дисперсії при 50 °C в деіонізованій воді. Фіг. 14 є графіком, що показує розподіл за розміром міцел, одержаних шляхом процесу винаходу із застосуванням 4 % Prolacta 90 ізоляту сироваткового протеїну, обробленого при рН 5,9. Фіг. 15 є СЕМ мікрографією, яка показує внутрішню структуру після розрізання гранул порошку, висушеного розпилюванням, який представлений на Фігурі 8. Фіг. 16 є негативно забарвленою ТЕМ мікрографією 4 % дисперсії міцел сироваткового протеїну, основаної на порошку міцел чистого ліофілізованого сироваткового протеїну після обробки при кімнатній температурі в деіонізованій воді. Масштаб шкали 0,5 мкм. Фіг. 17 є схематичним зображенням МСП, покритих СБО (сульфатованим бутил-олеатом) при підвищенні відношення змішування при рН 3.0. Сірий круг: МСП з позитивним поверхневим зарядом. Чорна голова+хвіст: негативно заряджена голова і гідрофобний хвіст від СБО. Фіг. 18 є фотографією концентрату міцел сироваткового протеїну при 20 %, одержаного після випаровування, в який додано 4 % NaCl. Фіг. 19 є мікрографією за допомогою мікроскопії у світлому полі напівтонкої секції порошку міцел сироваткового протеїну після забарвлювання толуїдиновим синім. Масштаб шкали 50 мікрон. Фіг. 20 є СЕМ мікрографією порожнистої частинки порошку міцел сироваткового протеїну після розрізання. Зліва: внутрішня структура. Справа: Деталі міцели сироваткового протеїну, що складає матрикс частинки порошку. Масштаб шкали 10 та 1 мікрон, відповідно. Розкриття винаходу Фігура 7 є схематичним представленням міцел за даним винаходом, де сироваткові протеїни розташовуються таким чином, що гідрофільні частини білків орієнтовані у напрямку до зовнішньої частини агломерату, а гідрофобні частини білків орієнтовані у напрямку до внутрішньої "серцевини" міцели. Ця енергетично сприятлива конфігурація надає хорошу стабільність даним структурам в гідрофільному оточенні. Специфічну структуру міцели можна бачити на фігурах, зокрема, на Фігурах 3, 9, 10, 13 та 15, де міцели за даним винаходом складаються, по суті, з сферичних агломератів денатурованого сироваткового протеїну. Міцели за даним винаходом, зокрема, характеризуються правильною, сферичною формою. Через подвійний характер (гідрофільний і гідрофобний), цей денатурований стан протеїну, як здається, забезпечує взаємодію з гідрофобною фазою, наприклад, крапелькою жиру або повітрям, і гідрофільною фазою. Міцели сироваткового протеїну, таким чином, мають чудові емульгуючі і піноутворюючі властивості. Далі, міцели, вироблені способом за даним винаходом, мають вкрай вузький розподіл за розміром (див. Фіг.14), так, що більше 80 % вироблених міцел має розмір менше 1 мікрона, переважно між 100 нм та 900 нм, більш переважно між 100-770 нм, найбільш переважно між 200 та 400 нм. Середній діаметр міцел можна визначити за допомогою Трансмісійної Електронної Мікроскопії (ТЕМ). Для того, щоб провести її, рідкі зразки міцел інкапсулюють в пробірки з агаровим гелем. Фіксації досягають зануренням в розчин 2,5 % глутаральдегіду в 0ДМ, рН 7,4 какоділатному буфері і подальшою фіксацією з 2 % тетроксидом осмію в тому самому буфері, де обидва розчини містять0,04 % Рутенієвий червоний. Після дегідрування у відсортованій серії етанолу (70, 80, 90, 96, 100 % етанол), зразки вносять до смоли Спура (Спур/етанол 1:1, 2:1, 100 %). Після полімеризації смоли (70 °C, 48 годин), готують напівтонкі та ультратонкі секції за допомогою ультрамікротома Leica ultracut UCT. Ультратонкі секції, забарвлені водним ураніл 3 UA 98763 C2 5 10 15 20 25 30 35 40 45 50 ацетатом і цитратом свинцю, досліджують за допомогою трансмісійної електронної мікроскопії (Philips CM 12, 80 кв). Не бажаючи бути зв'язаними теорією, автори даного винаходу вважають, що при формуванні міцел відповідно до способу за даним винаходом, міцели досягають "максимального" розміру через загальний електростатичний заряд міцели, що відштовхує будьяку додаткову білкову молекулу, так що міцела не може далі збільшуватися в розмірі. Це пояснює вузький розподіл за розміром, що спостерігається (см. Фіг. 14). Міцели, описані вище, виробляють способом відповідно до даного винаходу, де вказаний спосіб детально описаний далі. Як сироватковий протеїн, що застосовується в даному винаході, можуть використовуватися будь-які комерційно доступні ізоляти або концентрати сироваткового протеїну, тобто сироватковий протеїн, одержаний шляхом будь-якого способу приготування сироваткового протеїну, відомого в даній галузі техніки, а також фракції, приготовані з нього або білків, таких як Р-лактоглобулін (БЛГ), а-лактальбумін і сироватковий альбумін. Зокрема, солодка сироватка, що одержується як побічний продукт при виробництві сиру, кисла сироватка, що одержується як побічний продукт при виробництві кислотного казеїну, натуральна сироватка, що одержується при мікрофільтрації молока, або сичужна сироватка, що одержується як побічний продукт при виробництві сичужного казеїну, можуть бути використані як сироватковий протеїн. Сироватковий протеїн може бути одержаний з єдиного джерела або із суміші будь-яких джерел. Переважно, щоб сироватковий протеїн не піддавався якому-небудь етапу гідролізу перед утворенням міцел. Так, сироватковий протеїн не піддають якій-небудь ферментативній обробці перед міцелізацією. Відповідно до винаходу, важливо, щоб в процесі утворення міцел застосовувався сироватковий протеїн, а не його гідролізати. Даний винахід не обмежений сироватковими ізолятами коров'ячого походження, але відноситься до сироваткових ізолятів від всіх видів ссавців тварин, таких як вівці, кози, коні і верблюди. Також, спосіб відповідно до даного винаходу додається до мінералізованих, демінералізованих або трохи мінералізованих сироваткових препаратів. Під "трохи мінералізованим" розуміють будь-який сироватковий препарат після видалення вільних мінералів, які діалізуються або діафільтруються, але який містить мінерали, зв'язані з його природною мінералізацією після приготування концентрату або, наприклад, ізоляту сироваткового протеїну. Ці "трохи мінералізовані" сироваткові препарати не мають специфічне мінеральне збагачення. Сироваткові протеїни є відмінним джерелом незамінних амінокислот (АА) (45 %). В порівнянні з казеїном (що містить 0,3 г цистеїну на 100 г білка), протеїни солодкої сироватки містять в 7 разів більше цистеїну, а кислої сироватки - в 10 разів більше цистеїну. Цистеїн є щвидкість-обмежувальною амінокислотою для синтезу глутатіону (GSH), трипептиду, цистеїну, що складається з глутамату, і гліцину, який має первинні важливі функції в захисті організму у випадку стресу. Потреба в цих амінокислотах може зростати у випадку стресу та у літніх людей. Також було показано, що при пероральному додаванні глутатіону з сироватковим протеїном зростає рівень GSH в плазмі у ВІЛ-інфікованих пацієнтів (Eur. J. Clin. Invest. 2001; 31, 171-178). Інші корисні для здоров'я ефекти, що забезпечуються сироватковими протеїнами, включають посилення розвитку і побудови м'язів, а також підтримку стану м'язів у дітей, дорослих або літніх людей, посилення імунної функції, поліпшення когнітивної функції, контроль глюкози крові, так що вони придатні для хворих діабетом, регуляція ваги і насичення; протизапальні ефекти, загоєння ран і відновлення шкіри, зниження кров'яного тиску тощо. Сироваткові протеїни мають кращій коефіцієнт ефективності білка (КЕБ = 118) у порівнянні, наприклад, з казеїном (КЕБ = 100). КЕБ є мірою якості білка, що оцінюється шляхом визначення, наскільки добре такий білок підтримує приріст ваги. Його можна підрахувати за наступною формулою: КЕБ = зростання ваги тіла (г) / вага споживаного білка (г). Приклади: КЕБ % Казеїну казеїн 3,2 100 яйце 3,8 118 сироватка 3,8 118 цілісна соя 2,5 78 глютен пшениці 0,3 9 Для способу за винаходом, сироваткові протеїни можуть бути присутніми у водному розчині в кількості від 0,1 мас. % до 12 мас. %, переважно в кількості від 0,1 мас. % до 8 мас. %, більш переважно в кількості від 0,2 мас. % до 7 мас. %, навіть більш переважно в кількості від 0,5 4 UA 98763 C2 5 10 15 20 25 30 35 40 45 50 55 мас. % до 6 мас. %, найбільш більш переважно в кількості від 1 мас. % до 4 мас. % до загальної маси розчину. Водний розчин препарату сироваткового протеїну, як він присутній перед етапом міцелізації, може також включати додаткові сполуки, такі як побічні продукти відповідних процесів виробництва сироватки, інші білки, камедь або вуглеводи. Розчин може також включати інші харчові інгредієнти (жир, вуглеводи, рослинні екстракти тощо). Кількість таких додаткових сполук переважно не перевищує 50 мас. %, переважно 20 мас. %, і більш переважно не перевищує 10 мас. % від загальної маси розчину. Сироватковий протеїн може застосовуватися в очищеній формі або так само у формі сирого продукту. Відповідно до переважного втілення, вміст двовалентних катіонів у сироватковому протеїні для приготування концентрату міцел сироваткового протеїну може бути менше 2,5 %, більш переважно менше 2 %, навіть більш переважно менше 0,2 %. Найбільш переважно, сироваткові протеїни є повністю демінералізованими. Відповідно до даного рішення, рН та іонна сила є важливими факторами в даному способі. Так, для сильно діалізованих зразків, які практично позбавлені або повністю позбавлені вільних катіонів, таких як Са, К, Na, Mg, було знайдено, що коли виконують теплову обробку протягом періоду часу від 10 секунд до 2 годин при рН нижче 5,4, одержується згусток, тоді як рН вище 6,8 дає розчинний сироватковий протеїн (див. Фігуру 1). Так, тільки в цьому достатньо вузькому вікні рН можна одержати міцели сироваткових протеїнів, які мають діаметр менше 1 мкм. Ці міцели мають в цілому негативний заряд. Та сама форма міцел може бути одержана симетрично нижче ізоелектричного рН, тобто від 3,5 до 5,0, більш переважно від 3,8 до 4,5, де міцели, що утворилися, позитивно заряджені (див. Фігуру 6). Так, відповідно до даного винаходу, для того, щоб одержати позитивно заряджені міцели, міцелізація сироваткових протеїнів може здійснюватися у вільному від солей розчині при значенні рН, підведеним між 3,8 та 4,5, залежно від вмісту мінералів у джерелі білка. Переважно, одержані міцели мають загальний негативний заряд. Так, в переважному втіленні, рН доводять до діапазону від 6,3 до 9,0, до вмісту двовалентних катіонів між 0,2 % та 2,5 % в порошку сироваткового протеїну. Конкретніше, для одержання негативно заряджених міцел, рН доводять до діапазону від 5,6 до 6,4, більш переважно від 5,8 до 6,0 для низького вмісту двовалентних катіонів (наприклад, менше 0,2 % від вихідного порошку сироваткового протеїну). Значення рН може бути підвищене до 8,4, залежно від вмісту мінералів в джерелі сироваткового протеїну (концентраті або ізоляті). Зокрема, рН може бути між 7,5 та 8,4, переважно, між 7,6 та 8,0 для одержання негативно заряджених міцел у присутності великих кількостей вільних мінералів, і рН може бути між 6,4 та 7,4, переважно між 6,6 та 7,2 для одержання негативно заряджених міцел у присутності помірних кількостей вільних мінералів. Як загальне правило, чим вище вміст кальцію і/або магнію у вихідному порошку сироваткового протеїну, тим вище рН міцелізації. Для того, щоб стандартизувати умови утворення міцел сироваткового протеїну, найбільш переважно демінералізувати шляхом будь-якої з відомих методик демінералізації (діалізу, ультрафільтрації, зворотного осмосу, іонообмінної хроматографії…) будь-яке джерело рідких природних сироваткових протеїнів з концентрацією протеїнів в діапазоні від солодкої сироватки, пермеата молока мікрофільтрації або кислої сироватки (0,6 % вміст білка) до концентрату з 30 % вмістом білка. Діаліз може бути здійснений проти води (дистильованої, деіонізованої або м'якої), але оскільки вона тільки дозволяє видалити іони, слабко зв'язані з сироватковими протеїнами, більш переважно діалізувати проти кислоти при рН нижче 4.0 (органічної або неорганічної) для кращого контролю іонного складу сироваткових протеїнів. При виконанні цього, рН утворення міцел сироваткового протеїну залишається нижче рН 7,0, більш переважно між 5,8 та 6,6. Перед нагріванням водного розчину сироваткового протеїну рН звичайно доводять шляхом додавання кислоти, переважно харчової якості, такої як, наприклад, соляна кислота, фосфорна кислота, оцтова кислота, лимонна кислота, глюконова кислота або молочна кислота. Коли вміст мінералів є високим, рН звичайно підводять додаванням лужного розчину, переважно харчової якості, такого як гідроксид натрію, гідроксид калію або гідроксид амонію. Альтернативно, якщо етап регулювання рН не потрібний, можна відрегулювати іонну силу препарату сироваткового протеїну при збереженні постійного рН. Далі, іонну силу можна відрегулювати органічними або неорганічними іонами, так, щоб здійснити міцелізацію при постійному значенні рН 7. Фігура 4 представляє втілення даного винаходу, де міцели можуть бути сформовані при постійному значенні рН 7,0, тоді як іонну силу змінюють шляхом додавання 70-80 мМ аргінін-НСІ. 5 UA 98763 C2 5 10 15 20 25 30 35 40 Далі може бути доданий буфер до водного розчину сироваткового протеїну, щоб уникнути істотної зміни значення рН під час теплової обробки сироваткового протеїну. В принципі, буфер може бути вибраний з будь-якої буферної системи харчової якості, тобто оцтової кислоти та її солей, таких як, наприклад, ацетат натрію або ацетат калію, фосфорної кислоти та її солей, наприклад, NaH^PC^, Na2HPC>4, KH2PO4, К2НРО4, або лимонної кислоти та її солей. Регулювання рН і/або іонної сили водного розчину, відповідно до даного винаходу, призводить до контрольованого процесу, який дає міцели, що мають розмір між 100 нм, -900 нм, переважно між 100-700 нм, найбільш перевалено між 200-400 нм. Переважно, пропорція міцел із середнім розміром між 100-700 нм становить більше 80 % при виконанні процесу даного винаходу (див. Фігуру 14). Для того, щоб одержати міцели правильної форми, також важливо, відповідно до даного винаходу, щоб сироватковий протеїн не піддавався якому-небудь етапу гідролізації перед утворенням міцел. На другому етапі способу за даним винаходом, вихідний водний розчин сироваткового протеїну потім піддають тепловій обробці. В цьому відношенні було знайдено, що для одержання міцел сироваткового протеїну важливо мати температуру в діапазоні від приблизно 70 до нижче 95 °C, переважно від 80 до приблизно 90 °C, більш переважно від приблизно 82 до приблизно 89 °C, навіть більш переважно від приблизно 84 до приблизно 87 °C, найбільш переважно приблизно 85 °C. Також було знайдено, що в промисловому масштабі важливо, щоб температура була переважно нижче 95 °C, більш переважно між 80 °C та 90 °C, найбільш переважно близько 85 °C. Як тільки досягнута бажана температура, підтримують цю температуру протягом мінімум 10 секунд, і максимум 2 годин. Переважно, період часу, під час якого водний розчин сироваткового протеїну зберігається при бажаній температурі, знаходиться в діапазоні від 12 до 25 хвилин, більш переважно від 12 до 20 хвилин, або найбільш переважно приблизно 15 хвилин. Теплова обробка може також здійснюватися в мікрохвильовій печі або будь-якому подібному обладнанні, яке дозволяє нагрівати за допомогою мікрохвиль, із співвідношенням час/кількість 10 сек/10 мл для 4 % мас. % розчину білка, що нагрівається в апараті 1500 W до температури кипіння (98 °C при висоті над рівнем моря 833 м). Тривалий процес може також застосовуватися шляхом додавання 8 або більше магнетронів навколо скляної пробірки, з можливим подовженням витримки пробірки для підвищення часу інкубації. Як показано на Фігурі 2, вимірювання каламутності є показником утворення міцел. Відповідно до даного винаходу, каламутність, виміряна за поглинанням при 500 нм, становить принаймні 3 одиниці поглинання для 1 % розчину білка, але може досягати 16 одиниць поглинання при досягненні міцелізації вище 80 % (див.Фігуру 2). Щоб далі ілюструвати ефект утворення міцел з фізико-хімічної точки зору, 1 мас. % дисперсії Вірго® нагрівали протягом 15 хвилин при 85 °C та рН 6,0 і 6,8 у воді MilliQ. Гідродинамічний діаметр агрегатів, одержаних після теплової обробки, вимірювали динамічним світлорозсіянням. Явну молекулярну вагу агрегатів визначали статичним світлорозсіянням із застосуванням так званої дебаєвської побудови. Поверхневу гідрофобність вимірювали за допомогою гідрофобного АНС-зонда і за допомогою вільних доступних тіолових груп за допомогою ДТНБ-методу із застосуванням цистеїну як стандартної амінокислоти. Остаточно, морфологію агрегатів вивчали шляхом ТЕМ з негативним забарвлюванням. Результати представлені в таблиці 1. 45 Таблиця 1 Фізико-хімічні властивості агрегатів розчинного сироваткового протеїну, одержаних шляхом теплової обробки (85 °C, 15 хв.) 1 мас. % дисперсії білка у присутності або відсутності NaCl. рН Гідродинамічний діаметр (нм) Молекулярна 6 вага Мw (10 -1 г.моль ) 6,0 120,3±9,1 27,02±8,09 6,8 56,2±4,6 0,64±0,01 Морфологія Сферичні міцели Лінійні агрегати потенціал (mV) Гідрофобність поверхні білка -1 (г.ммоль АНС) доступні SH групи (нмоль -1 SH.мг білк.) -31,8±0,8 105,4 3,5±0,4 -27,9±1,2 200,8 6,8±0,5 З таблиці 1 зрозуміло, що міцели сироваткового протеїну, які формуються при рН 6,0, дозволяють протеїну знизити його специфічну АНС поверхневу гідрофобність на фактор 2 в 6 UA 98763 C2 5 10 15 20 25 30 35 40 45 50 55 порівнянні з неміцелізованим сироватковим протеїном, нагрітим в тих самих умовах, але при рН 6,8. Утворення міцел може також спостерігатися при дуже високій молекулярній масі 27×10 -1 -1 г.моль , в порівнянні з 0,64×106 г.моль для неміцелізованого протеїну, вказуючи на сильно конденсований стан речовини всередині міцели (низька кількість води). Досить цікаво, що потенціал міцел є навіть більш негативним, ніж у неміцелізованих протеїнів, навіть якщо останні утворені при більш лужному рН, ніж міцели. Це є результатом більш гідрофільної поверхні міцел, на яких діє розчинник. Остаточно, можна відзначити, що тіолова реактивність міцел набагато нижча, ніж у не-міцелзованного протеїну, через відмінність рН теплової обробки. Було знайдено, що вихід перетворення нативного сироваткового протеїну в міцели знижується, коли початкова концентрація білка зростає перед підведенням рН і тепловою обробкою. Наприклад, якщо починати з ізоляту сироваткового протеїну Prolacta90 (серія 673 від Lactalis), вихід утворення міцел сироваткового протеїну падає з 85 % (коли починають з 4 % білка) до 50 % (коли починають з 12 % білка). Для того, щоб збільшити утворення міцел сироваткового протеїну (>85 % від вихідного вмісту білка), краще починати з водного розчину сироваткового протеїну, що має концентрацію білка нижче 12 %, переважно нижче 4 %. Залежно від призначених кінцевих застосувань, концентрацію білка підводять перед тепловою обробкою, для підтримки оптимального виходу міцел сироваткового протеїну. Міцели сироваткових протеїнів, одержані відповідно до даного способу, повинні мати середній розмір менше 1 мкм, переважно від 100 до 90 нм, більш переважно від 100 до 700 нм, найбільш переважно від 200 до 400 нм. Залежно від бажаного застосування, вихід міцел перед концентрацією становить принаймні 35 %, переважно принаймні 50 %, більш переважно принаймні 80 %, і вміст залишкових розчинних агрегатів або розчинного білка становить переважно нижче 20 %. Середній розмір міцел характеризується індексом полідисперсності нижче 0,200. Спостерігається, що міцели сироваткового протеїну можуть утворювати агрегати навколо рН 4,5, однак, без ознак макроскопічного розділення фаз через принаймні 12 годин при 4 °C. Чистота міцел сироваткового протеїну, виробленого відповідно до способу за даним винаходом, може бути одержана шляхом визначення кількості залишкових розчинних білків. Міцели видаляють центрифугуванням при 20 °C та 26900 g протягом 15 хв. Надосадову рідину використовують для визначення кількості білка в кварцових кюветах при 280 нм (довжині оптичного шляху 1 см). Значення виражають у вигляді відсотка від вихідного значення до і після теплової обробки. Пропорція міцел = (кількість вихідних білків - кількість розчинних білків) / кількість вихідних білків. Перевагою способу за даним винаходом є те, що відповідно приготовані міцели сироваткового протеїну не піддаються якому-небудь механічному стресу, що веде до зниження розміру частинок при формуванні, в протилежність звичайним способам. Даний спосіб індукує спонтанну міцелізацію сироваткових протеїнів при тепловій обробці за відсутності зсуву. Міцели сироваткового протеїну можуть застосовуватися як такі в будь-якій композиції, такій як харчові композиції, косметичні композиції, фармацевтичні композиції тощо. Далі, міцели сироваткового протеїну можуть бути заповнені активним компонентом. Вказаний компонент може бути вибраний з кави, кофеїну, екстрактів зеленого чаю, рослинних екстрактів, вітамінів, мінералів, біоактивних агентів, солі, цукру, підсолоджувачів, ароматизаторів, жирних кислот, олій, білкових гідролізатів, пептидів тощо, та їх сумішей. Далі, міцели сироваткового протеїну (чисті або наповнені активними компонентами) за даним винаходом можуть бути покриті емульгатором, таким як фосфоліпіди, наприклад, або іншими покриваючими агентами, такими як білок, пептид, гідролізат білка або камедь, така як камедь акації, для того, щоб модулювати функціональність і смак міцел сироваткового протеїну. Коли білок застосовують як покриваючий агент, він може бути вибраний з будь-яких білків, що мають ізоелектричну точку значно вище або нижче, ніж у сироваткового протеїну. Ними є, наприклад, протамін, лактоферін і деякі білки рису. Коли білковий гідролізат застосовується як покриваючий агент, він переважно є гідролізатом білків, таких як протамін, лактоферін, білок рису, казеїн, білок сироватки, пшениці, сої, або їх суміші. Переважно, оболонка є емульгатором, вибраним з сульфатованого бутилолеату, ефірів діацетил-винної кислоти і моно- та дигліцеридів, ефірів лимонної кислоти і моногліцеридів, стеароїл-лактилатів, та їх сумішей. Фіг. 17 є схематичним представленням такої оболонки із сульфатованим бутил-олеатом. Нанесення оболонки може здійснюватися будьяким із способів, відомих в даній галузі техніки. Далі, сумісне висушування розпилюванням, як описано тут далі, може також призводити до покривання міцел сироваткового протеїну. 7 UA 98763 C2 5 10 15 20 25 30 35 40 45 50 55 Показано, що міцели сироваткового протеїну ідеально підходять для застосування як емульгатор, замінник жиру, замінник міцелярного казеїну або піноутворюючий агент, оскільки вони здатні стабілізувати жир і/або повітря у водній системі протягом тривалого періоду. Стабільність піни показана на Фігурі 5, яка порівнює застосування неміцелізованого сироваткового протеїну і міцелізованого сироваткового протеїну за даним винаходом. Так, міцели сироваткового протеїну можуть застосовуватися як емульгуючий агент, для якого даний матеріал ідеально підходить, оскільки має нейтральний смак і при застосуванні такого матеріалу не створюється побічний запах. Вони можуть також застосовуватися як міцелярний замінник казеїну. У доповнення, дані міцели сироваткового протеїну залишаються здатними служити як вибілюючий агент, так що з одною сполукою може бути виконано декілька задач. Оскільки сироватка є повсюдно доступним матеріалом, її застосування знижує вартість продукту, що потребує емульгуючого, наповнюючого, вибілюючого або піноутворюючого агента, в той самий час доповнюючи його харчову цінність. Відповідно, міцели сироваткового протеїну, одержані відповідно до способу за даним винаходом, можуть бути використані для приготування будь-якого виду споживаного продукту, що вимагає стабілізації емульсії або піни, як, наприклад, присутнього у вигляді мусу або морозива, в замінниках вершків для кави, або також в молочних продуктах з низьким вмістом жиру або вільних від жиру, або також вони знаходять застосування у вигляді замінника міцелярного казеїну. "Споживаний" означає будь-який харчовий продукт в будь-якій формі, включаючи напої, супи, напівтверді продукти тощо, які можуть вживатися людиною або тваринами. Прикладами продуктів, де дані міцели сироваткового протеїну можуть знайти застосування, є, наприклад, молочні продукти, майонез, дресінг (заправка) для салату, пастеризоване нагріванням при надвисокій температурі молоко, солодке згущене молоко, йогурт, кисломолочні продукти, соуси, соуси із зниженим вмістом жиру, такі як, наприклад, соус бешамель, ферментовані продукти на основі молока, молочний шоколад, білий шоколад, темний шоколад, муси, піни, емульсії, морозиво, ферментовані продукти на основі зернових, порошки на основі молока, дитячі суміші, дієтичні домішки, корм для тварин, таблетки, рідкі бактерійні суспензії, висушені пероральні біологічно активні домішки, вологі пероральні біологічно активні домішки, поживні батончики, спреди, фруктові напої, кавові суміші. Далі, дані міцели сироваткового протеїну можуть бути використані окремо або разом з іншими активними матеріалами, такими як полісахариди, (наприклад, камедь акації або карагінани) для стабілізації матриксів і, наприклад, молочного пінного матриксу. Завдяки нейтральному смаку, вибілюючій силі і стабільності після теплової обробки, дані міцели сироваткового протеїну можуть застосовуватися для посилення білого кольору молочної пінки (вершків) і відчуття в порожнині рота. Також як і підвищення вибілюючої сили молочних систем при тому самому загальному вмісті білка, може бути знижено і вміст жиру в харчовому матриксі. Ця характеристика представляє особливу перевагу даних міцел сироваткового протеїну, оскільки дозволяє виробляти продукти з низьким вмістом жиру, наприклад, додавати молочний замінник вершків без додавання додаткового жиру, одержаного з молока як такого. У способі за даним винаходом, дисперсію міцел сироваткового протеїну, одержану після теплової обробки, концентрують до одержання концентрату міцел сироваткового протеїну. Відповідно, етап концентрації може здійснюватися шляхом упарювання, центрифугування, седиментації, ультрафільтрації і/або мікрофільтрації. Упарювання може проводитися в дисперсії міцел шляхом подачі на випарник під вакуумом, при температурі між 50 °C та 85 °C. Центрифугування може проводитися в режимі високого прискорення (більше 2000g) або в режимі низького прискорення (менше 500g) після підкислення дисперсії міцел сироваткового протеїну до рН нижче 5, переважно 4,5. Спонтанна седиментація також може бути проведена в дисперсії міцел сироваткового протеїну шляхом підкислення. Переважно, рН становить 4,5, а час седиментації - більше 12 годин. Переважно, концентрація міцел сироваткового протеїну відповідно до даного винаходу може бути досягнута шляхом мікрофільтрації дисперсії міцел. Ця техніка збагачення не тільки дозволяє концентрувати міцели сироваткового протеїну шляхом видалення розчинника, але також дозволяє видалити неміцелізований білок (такий як нативні білки або розчинні агрегати). Так, кінцевий продукт складається тільки з міцел (як перевірено Трансмісійною Електронною Мікроскопією - див. Фігуру 9 та 10). В цьому випадку, фактор концентрування, якого можна 8 UA 98763 C2 5 10 15 20 25 30 35 40 45 50 55 60 досягти, що одержується після початкової швидкості потоку пермеата через мембрану, падає до 20 % від його вихідного значення. Концентрат сироваткового протеїну, одержаний способом даного винаходу, має концентрацію білка принаймні 12 %. Далі, концентрат містить принаймні 50 % білка у формі міцел. Цікаво відзначити, що концентрат, при підведенні концентрації білка до 10 %, має здатність витримувати подальшу теплову обробку при 85 °C протягом 15 хв. при рН 7,0 в присутності, наприклад, до 0,15 М хлориду натрію, як показано на Фігурі 11. Як порівняння, дисперсія нативного сироваткового протеїну (Prolacta 90, серія 500658 від Lactalis) утворює гель у присутності 0,1 М хлориду натрію при концентрації білка всього 4 % (див. Фігуру 12). Даний винахід також представляє перевагу в тому, що висока стабільність міцелярної структури зберігається під час етапу концентрування. Далі, міцели відповідно до даного винаходу мають Коефіцієнт Ефективності Білка, еквівалентний вихідному сироватковому протеїну, принаймні 100, переважно принаймні 110, що робить їх важливими поживними інгредієнтами. Збагачення міцел сироваткового протеїну пропонує виняткові переваги, оскільки збагачені протеїном продукти можуть бути одержані при концентрації, якої раніше не досягали. Далі, оскільки концентрат може діяти як замінник жиру при підтримці бажаних структурних, текстурованих та органолептичних властивостей, може бути одержана широка різноманітність продуктів з низьким вмістом жиру. Додатково, він надає перевагу у вартості, оскільки потрібна менша кількість концентрату для одержання бажаних ефектів. Концентрат міцел сироваткового протеїну (після упарювання або мікрофільтрації) може бути використаний в рідкій формі як дисперсія, або в напівтвердій формі, або у висушеній формі. Він може застосовуватися в широкій різноманітності застосувань, таких як ті, які описані вище, по відношенню до застосувань міцел сироваткового протеїну. Наприклад, 20 % концентрат протеїну, одержаний шляхом упарювання, має кремову, напівтверду текстуру (див. Фіг. 18) і може бути текстурований до спредо-подібної текстури шляхом підкислення із застосуванням молочної кислоти. Ця рідка, кремова, тістоподібна текстура може застосовуватися для приготування кислих, солодких, солоних, ароматизованих, збагачених білком споживаних продуктів. Концентрат міцел сироваткового протеїну в будь-якій формі може бути змішаний з 5 % кислої фруктової основи і 5 % сахарози, щоб одержати стабільний збагачений сироватковим протеїном кислий фруктовий напій. Він може також застосовуватися у виробництві молочних продуктів, морозива, або застосовуватися як вибілювач кави серед іншого. Подальші застосування включають засоби для шкіри і засоби для порожнини рота, такі як зубна паста, жувальна гумка, або, наприклад, агент для вибілювання гумки. Вибілююча сила концентрату в будь-якій формі значно зростає в порівнянні з неконцентрованими міцелами або з порошками нативного протеїну. Наприклад, вибілююча сила 4 мл 15 % концентрату міцел сироваткового протеїну еквівалентна 0,3 % окису титану в 100 мл 2 % чашки розчинної кави. Цікаво, що можна диспергувати розчинну каву і сахарозу в концентрат міцел сироваткового протеїну так, що одержується концентрат З-в-1, що має загальну концентрацію сухих речовин 60 % без жиру. Концентрат може застосовуватися як такий або розбавлений, залежно від застосування. Наприклад, концентрат міцел сироваткового протеїну в рідкій або сухій формі може бути розбавлений до вмісту білка 9 %, як в солодкому і згущеному молоці. Мінерали молока, лактоза і сахароза можуть бути додані так, що кінцевий продукт буде мати схожий поживний профіль в порівнянні з молоком, але тільки сироватковий протеїн як джерело білка. Дана суміш на основі сироваткового протеїну є більш стабільною, ніж солодке згущене молоко, за даними реакції Майяра (на основі швидкості розвитку коричневого забарвлювання) при інкубації протягом 2 годин при 98 °C (температура киплячої води при висоті над рівнем моря 833 м). Висушена форма концентрату сироваткового протеїну, одержаного за допомогою способу за даним винаходом, може бути одержана шляхом будь-якої відомої техніки, такої як розпилювальна сушка, ліофілізація, вальцьова сушка тощо. Так, концентрат сироваткового протеїну за даним винаходом може бути висушений розпилюванням з додаванням або без додавання додаткових інгредієнтів, і може застосовуватися як система доставки або структурний елемент для застосування в широкому діапазоні процесів, наприклад, у виробництві продуктів харчування, косметичних продуктів тощо. Фігура 8 демонструє порошок, який одержаний шляхом розпилювального сушіння без додавання яких-небудь додаткових інгредієнтів, має середній розмір діаметра частинок більше 9 UA 98763 C2 5 10 15 20 25 30 35 40 45 50 55 1 мікрона, завдяки агрегації міцел, що відбувається при розпилювальному сушінні. Типовий середній діаметр медіани об'єму (D43) порошків за винаходом становить від 45 до 55 мікрон, переважно 51 мікрон. Діаметр медіани поверхні (D32) порошків за даним винаходом становить переважно від 3 до 4 мікрон, більш переважно 3,8 мікрон. Вміст вологи в порошках, одержаних після розпилювального сушіння, переважно менше 10 %, більш переважно менше 4 %. Такий порошок міцел сироваткового протеїну може включати принаймні 85 % сироваткового протеїну, в якому принаймні 20 %,' переважно більше 50 %, найбільш переважно більше 80 % знаходиться в міцелярній формі. Далі, порошок міцел сироваткового протеїну за даним винаходом має високу зв'язувальну здатність відносно розчинників, таких як вода, гліцерин, етанол, олія, органічні розчинники тощо. Зв'язувальна здатність порошків відносно води становить принаймні 50 %, переважно принаймні 90 %, найбільш переважно принаймні 100 %. Для розчинників, таких як гліцерин та етанол, зв'язувальна здатність становить принаймні 50 %. Для олії зв'язувальна здатність становить принаймні 30 %. Ця властивість порошків міцел сироваткового протеїну за даним винаходом дозволяє їм бути розпиленими або наповненими подальшими функціональними інгредієнтами, такими як кава, кофеїн, екстракти зеленого чаю, рослинні екстракти, вітаміни, мінерали, біоактивні агенти, сіль, цукор, підсолоджувані, ароматизатори, жирні кислоти, олії, гідролізати білків, пептиди тощо, та їх суміші. Функціональні інгредієнти можуть бути включені в порошок в кількості 0,1-50 %. Так, порошок може діяти як носій для цих функціональних інгредієнтів. Це надає перевагу, наприклад, в тому, що сприйняття гіркоти кофеїну знижується при наповненні в порошки за даним винаходом і застосуванні в поживних батончиках з кофеїном, наприклад. Додаткові інгредієнти можуть бути змішані з концентратом міцел сироваткового протеїну перед розпилювальним сушінням. Вони включають розчинні або нерозчинні солі, пептиди, гідролізати білків, наприклад, гідролізат культивованого глютену пшениці, бактерійні пробіотики, барвники, цукру, мальтодекстрини, жири, емульгатори, підсолоджувачі, ароматизатори, рослинні екстракти, ліганди, біоактивні агенти, кофеїн, вітаміни, мінерали, ліки, молоко, білки молока, сухе знежирене молоко, міцелярний казеїн, казеїнат, рослинний білок, амінокислоти, поліфеноли, пігмент тощо, і їх будь-які можливі суміші. Одержані змішані порошки сироваткового протеїну включають міцели сироваткового і принаймні один додатковий інгредієнт в масовому співвідношенні від 30:1 до 1:1000. Це сумісне висушування розпилюванням дає порошки, які складаються з міцел сироваткового протеїну, агломерованих або покритих додатковим інгредієнтом. Переважно, масове відношення міцел сироваткового протеїну і додаткового інгредієнта становить 1:1. Це може надалі полегшувати солюбілізацію цих порошків, і може представляти особливий інтерес при виробництві дегідрованих харчових продуктів, таких як супи, соуси тощо, які включають міцели сироваткового протеїну. Порошки міцел сироваткового протеїну (МСП), одержані за допомогою даного винаходу, характеризуються внутрішньою структурою, побудованою в основному з порожнистих сфер, але також із стислих сфер (див. Фіг.19). Структура порожнистих сфер може бути легко пояснена шляхом утворення крапельки пари всередині крапельки концентрату МСП при розпилювальному сушінні. Оскільки крапелька пари залишає крапельку МСП через температуру вище 100 °C, залишається порожниста сфера. "Форма кістки" обумовлена комбінацією випаровування води з крапельки і зовнішнього тиску в межах крапельки. Внутрішню структуру сферичних порожнистих сфер досліджували за допомогою СЕМ після розрізання частинки близько до її діаметра (Фігура 20, зліва). Товщина стінок частинки була близько 5 мкм і здавалася дуже гладкою, тоді як внутрішня структура мала більш зернистий вигляд. Підвищене збільшення показало, що ця зернистість була фактично обумовлена присутністю вихідних МСП, які були розплавлені до формування внутрішнього матриксу частинки порошку. Цікаво, що сферична форма міцел зберігалася під час розпилювального сушіння, так само як і гомогенний розподіл частинок за розміром (Фігура 20, справа). Так, на мікроскопічній основі, порошки міцел сироваткового протеїну характеризуються унікальною морфологією гранул порожнистих або стислих сфер, що містять інтактні та індивідуалізовані міцели сироваткового протеїну. Порошки міцел сироваткового протеїну характеризуються дуже високою текучістю, яка забезпечує переваги, раніше не одержувані. Наприклад, ці порошки поводяться майже як рідини, і надають переваги легкого застосування і транспортування. Кут природного укосу цих порошків переважно нижче 35°, більш переважно нижче 30°. Такий низький кут природного 10 UA 98763 C2 5 10 15 20 25 30 35 40 45 50 55 60 укосу дозволяє використовувати порошки за даним винаходом, наприклад, як антизлежуючі (текучі) агенти в харчових застосуваннях. Дуже важливою рисою цих порошків змішаних або "чистих" є те, що основна структура міцел сироваткових протеїнів зберігається. Фігура 15 показує зерно порошку сироваткового протеїну, яке було розрізане, і таким чином спостерігаються індивідуальні міцели сироваткового протеїну. Далі, структура міцел може бути легко відновлена в розчинниках. Було показано, що порошки, одержані з концентрату міцел сироваткового протеїну, можуть бути легко редисперговані у воді при кімнатній температурі або при 50 °C. Розмір і структура міцел сироваткового протеїну повністю зберігаються в порівнянні з вихідним концентратом. Наприклад, на Фігурі 13 концентрат сироваткового протеїну, який був висушений при розпилюванні при 20 % концентрації білка, був редиспергований в деіонізованій воді при 50 °C при концентрації білка 4 %. Структура міцел була досліджена за допомогою ТЕМ, і її можна порівняти з Фігурою 10. Була одержана схожа форма міцел. При динамічному світлорозсіянні з індексом полідисперсності 0,2 було знайдено, що діаметр міцел становить 315 нм. Фігура 16 також показує дисперсію ліофілізованого порошку міцел сироваткового протеїну, де міцели відновлені. Той факт, що міцели сироваткового протеїну і лише мінорна фракція агрегатів спостерігаються в розчині після відновлення висушених розпилюванням або ліофілізованих порошків, підтверджує, що міцели сироваткового протеїну є фізично стабільними при розпилювальному сушінні і ліофілізації. Порошки за даним винаходом можуть застосовуватися в широкому діапазоні продуктів, такому як ті, які описані вище по відношенню до міцел сироваткового протеїну та їх концентратів. Наприклад, збагачені протеїном продукти харчування, такі як шоколад, поживні батончики, дегидратовані кулінарні продукти, жувальна гумка тощо можуть легко бути вироблені із застосуванням порошків концентрату міцел. Завдяки високій стабільності при обробці, порошки за даним винаходом можуть далі бути покриті емульгаторами або камедями, наприклад. Це може бути перевагою для модуляції функціональності і смаку цих порошків. Наступні приклади ілюструють даний винахід, не обмежуючи його. Приклади Винахід далі визначає з посиланням на наступні приклади, які описують в деталях приготування міцел за даним винаходом. Винахід, описаний і заявлений тут, не обмежується обсягом конкретних втілень, розкритих тут, оскільки ці втілення наведені як ілюстрації конкретних аспектів винаходу. Будь-які еквівалентні втілення призначені для обсягу даного винаходу. Дійсно, різні модифікації винаходу, у доповнення до тих, які показані та описані тут, очевидні для фахівців в даній галузі техніки з попереднього опису. Такі модифікації також призначені для входження в обсяг формули, що додається. Приклад 1: Міцелізація -Лактоглобуліну шляхом підведення рН (-Лактоглобулін (серія JE002-8-922, 13-12-2000) був одержаний від Davisco (Ле Суєвр, Міннесота, США). Протеїн був одержаний очищенням із солодкої сироватки шляхом ультрафільтрації та іонообмінної хроматографії. До складу порошку входить 89,7 % білка, 2+ 2+ + + 8,85 % вологи, 1,36 % золи (0,079 % Са , 0,013 % Mg , 0,097 % К , 0,576 % Na , 0,050 % Сl). Всі інші реагенти, що використовуються, були аналітичної якості (Merck Дармштадт, Німеччина). Розчин протеїну був приготований з 0,2 % концентрацією шляхом сольвації (лактоглобуліну у воді MilHQ® (Millipore), і перемішування при 20 °C протягом 2 годин. Потім рН аліквотних частин доводили до 5,0, 5,2, 5,4, 5,6, 5,8, 6,0, 6,2, 6,4, 6,6, 6,8, 7,0 шляхом додавання НС1. Розчини були розлиті в 20-мл скляні пробірки (Agilent Technologies) і запечатані алюмінієвими капсулами, що містять силіконове/ПТФЕ кріплення. Розчини прогрівали при 8 5 °C протягом 15 хвилин (час для досягнення температури 2,30-3,00 хв). Після теплової обробки зразки охолоджували в крижаній воді до 20 °C. Візуальний контроль продуктів (Фігура 1) показує, що оптимальним рН міцелізації є 5,8. Приклад 2: Міцелізація ізоляту сироваткового протеїну Ізолят сироваткового протеїну (ІСП) (Вірго®, серія JE032-1-420) був одержаний від Davisco (Ле Суєвр, Міннесота, США). Склад порошку наведений в таблиці 2. Розчин протеїну готували з 3,4 % білка шляхом сольвації порошку сироваткового протеїну у воді MilliQ® (Millipore), і перемішування при 20 °C протягом 2 годин. Початковий рН склав 7,2. Потім рН аліквотних частин доводили до 5,6, 5,8, 6,0, 6,2, 6,4 та 6,6 шляхом додавання НСl 0,1N. Розчини розливали в 20 мл скляні пробірки (Agilent Technologies) і запечатували алюмінієвими капсулами, які містять силіконове/ПТФЕ кріплення. Розчини прогрівали при 85 °C 11 UA 98763 C2 5 10 протягом 15 хвилин (час для досягнення температури 2,30-2,50 хв). Після теплової обробки зразки охолоджували в крижаній воді до 20 °C. Каламутність нагрітих сироваткових протеїнів визначали при 500 нм та 25 °C, зразки розбавляли для забезпечення вимірювання в діапазоні 0,1-3 абсолютних одиниць. (Спектрофотометр Uvikon 810, Kontron Instrument). Значення були підраховані для вихідної концентрації білка 3,4 %. Вважалося, що рН міцелізації досягався при стабільності (менше 5 % варіації вихідного значення) поглинання, виміряного при 500 нм з інтервалом 10 хвилин для одного того самого зразка, як проілюстровано на Фігурі 2. Для даного продукту оптимальний рН для міцелізації склав 6,0-6,2. Для даного рН, підведеного перед тепловою обробкою, стабільна каламутність склала 21, а залишковий розчинний білок, що оцінюється за поглинанням при 280 нм після центрифугування, склав 1,9 %. Ми можемо зробити висновок, що 45 % від вихідних білків були трансформовані в міцели при рН 6,0. Таблиця 2: Склад ІСП і характеристики зразка після міцелізації. Постачальник Найменування продукту № серії Склад (мг/100 г) Натрій Калій Хлорид* 10 якщо < 40 Кальцій Фосфор Магній Вихідний рН рН міцелізації Каламутність (500 нм) для 3,4 % білка в розчині Залишковий розчинений білок (%) за поглинанням при 280 нм Davisco Вірго JE 032-1-420 650 44 10 82 49 6 7,2 6,0 21 1,9 15 20 25 30 35 40 Приклад 3: Мікроскопічне спостереження міцел Виробництво міцел: Розчин протеїну готували при 2 % білка шляхом сольвації порошку сироваткового протеїну (WPI 90 серія 989/2, Lactalis, Ретієр, Франція) у воді MilliQ® (Millipore), і перемішування при 20 °C протягом 2 годин. Потім рН аліквотних частин доводили із застосуванням НС1 0,1N або NaOH 0,1N. Розчини розливали в 20 мл скляні пробірки (Agilent Technologies) запечатували алюмінієвими капсулами, які містять силіконове/ПТФЕ кріплення. Розчини прогрівали при 85 °C протягом 15 хв. (час досягнення температури 2,30-2,50 хв.). Після теплової обробки зразки охолоджували в крижаній воді до 20 °C. Для цього продукту оптимальний рН для міцелізації склав 7,4. Спостереження при мікроскопії: Зразки рідких міцел інкапсулювали в пробірки з агаровим гелем. Фіксації досягали шляхом імерсії в розчині 2,5 % глутаральдегіду в ОДМ, рН 7,4 какодилатному буфері і подальшій фіксації з 2 % тетроксидом осмію в тому самому буфері, де обидва розчини містили 0,04 % рутенієвий червоний. Після дегідратації в розсортованій серії етанолу (70, 80, 90, 96, 100 % етанол), зразки вносили до смоли Спура (Спур/етанол 1:1, 2:1, 100 %). Після полімеризації смоли (70 °C, 48 годин), відрізували напівтонкі та ультратонкі секції з ультра-мікротомом Leica ultracut UCT. Ультратонкі секції, забарвлені водним ураніл-ацетатом і цитратом свинцю, досліджували за допомогою трансмісійної електронної мікроскопії (Philips CM12, 80 kV). ТЕМ мікрографія представлена на Фігурі 3. Одержані міцели присутні в сферичній формі з діаметром 200 нм. Розподіл частинок за розміром Оснований на інтенсивності розподіл міцел за розміром оцінювали для міцел, одержаних шляхом теплової обробки 1 мас. % дисперсії -лактоглобуліну протягом 15 хвилин при 85 °C при рН 4,25 (позитивно заряджених із зета-потенціалом близько +25mV), і при рН 6,0 (негативно заряджених із зета-потенціалом близько -30mV). Z-усереднений гідродинамічний діаметр міцел 12 UA 98763 C2 5 10 15 20 25 30 35 40 45 50 55 склав 229,3 мм при рН 4,25 та 227,2 при рН 6,0. Агрегацію -ЛГ і сироваткового протеїну відстежували із застосуванням динамічного світлорозсіювання. Використовували прилад Nanosizer ZS (Malvern Instruments, Великобританія), обладнаний пристроєм лазерної емісії при 633 нм і джерелом живлення 4,0 мВ. Прилад застосовували в конфігурації зворотного розсіяння, де розпізнавання здійснювали з кутом розсіяння 173°. Це забезпечувало значне зменшення множинних сигналів, знайдених в каламутних зразках. Зразки поміщали в квадратну кварцову кювету (Hellma, довжина шляху 1 cm). Довжина шляху світлового пучка автоматично встановлювалася приладом залежно від каламутності зразка (ослаблення). Функція автокореляції розраховувалася за коливанням розсіяної інтенсивності. Результати представлені на Фігурі 6. Вони показують, що середня частинка характеризується дуже обмеженим (вузьким) індексом полідисперсності (
ДивитисяДодаткова інформація
Назва патенту англійськоюWhey protein micelle concentrate and a method for obtaining thereof
Автори англійськоюSchmitt Christoph Joseph Etien, Bovetto Lionel Jean Rene, Robin Frederick, Puzo Mathieu
Назва патенту російськоюКонцентрат мицелл сывороточного протеина и способ его получения
Автори російськоюШмитт Кристоф Жозеф Этьен, Боветто Лионель Жан Рене, Робин Фредерик, Пузо Матье
МПК / Мітки
МПК: A23C 21/00, A23J 3/08, A23J 1/20
Мітки: одержання, протеїну, сироваткового, міцел, концентрат, спосіб
Код посилання
<a href="https://ua.patents.su/31-98763-koncentrat-micel-sirovatkovogo-protenu-ta-sposib-jjogo-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Концентрат міцел сироваткового протеїну та спосіб його одержання</a>
Попередній патент: Моноклональне антитіло, яке зв’язується з tat226, та імунокон’югат
Наступний патент: Вимірювальний перетворювач тиску, спосіб контролю стану вимірювального перетворювача тиску і датчик тиску
Випадковий патент: Спосіб модифікування виливків сталей дисперсно-структурованими модифікаторами