Похідні 3,4-дизаміщеного оксазолідинону та їх застосування як інгібіторів кальцій-активованих калієвих каналів
Формула / Реферат
1. Сполука формули (І):
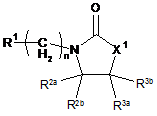 , (I)
, (I)
де
X1 являє собою О або NH;
n являє собою ціле число між 1-4;
R1 являє собою водень, ціано, -C(O)R1a, -C(O)NR1bR1c, гетероарил або СН2ОН;
R1a являє собою водень, С1-С6алкіл, C1-С6алкокси, феніл або гетероарил;
R1b і R1c кожний незалежно являє собою водень, С1-С6алкіл, феніл або гетероарил, де вказаний С1-С6алкіл, вказаний феніл або вказаний гетероарил можливо заміщені одним або більше, зокрема одним-трьома замісниками, незалежно вибраними з групи, яка складається з гідрокси, галогену, С1-С6алкілу, C1-С6алкокси, галоС1-С6алкілу і галоС1-С6алкокси;
R2a являє собою водень або C1-С6алкіл;
R2b являє собою галоС1-С6алкіл, С1-С6алкіл, феніл або гетероарил, де вказаний феніл або вказаний гетероарил можливо заміщені одним або більше, зокрема одним або двома замісниками, незалежно вибраними з групи, яка складається з гідрокси, галогену, С1-С6алкілу і галоС1-С6алкілу;
R3a і R3b кожний незалежно являє собою феніл або гетероарил, де вказаний феніл або вказаний гетероарил можливо заміщені одним або більше, зокрема одним-трьома замісниками, незалежно вибраними з групи, яка складається з галогену, С1-С6алкілу і галоС1-С6алкілу;
або її фармацевтично прийнятні солі.
2. Сполука за п. 1, де X1 являє собою О.
3. Сполука за будь-яким з пп. 1 або 2, де n дорівнює 1 або 2, більш конкретно, де n дорівнює 1.
4. Сполука за будь-яким з пп. 1-3, де R1 являє собою водень, ціано, -C(O)R1a, -C(O)NR1bR1c або 1,2,4-триазоліл.
5. Сполука за будь-яким з пп. 1-4, де R1 являє собою ціано, -C(O)R1a, -C(O)NR1bR1c або триазоліл.
6. Сполука за будь-яким з пп. 1-5, де R1 являє собою ціано, -C(O)R1a або -C(O)NR1bR1c.
7. Сполука за будь-яким з пп. 1-6, де R1 являє собою -C(O)R1a або -C(O)NR1bR1c.
8. Сполука за будь-яким з пп. 1-7, де R1a являє собою водень, С1-С3алкіл, С1-С3алкокси, більш конкретно, де R1а являє собою C1-С3алкокси, найбільш конкретно, де R1a являє собою метокси або етокси.
9. Сполука за будь-яким з пп. 1-7, де R1b і R1c кожний незалежно являє собою водень, С1-С3алкіл, феніл або гетероарил, більш конкретно, де R1b і R1c кожний незалежно являє собою водень або С1-С3алкіл, найбільш конкретно, де R1b i R1c кожний незалежно являє собою водень, метил або етил.
10. Сполука за будь-яким з пп. 1-9, де R2a являє собою водень.
11. Сполука за будь-яким з пп. 1-10, де R2b являє собою пергалоС1-С3алкіл, С1-С3алкіл, феніл або гетероарил, де вказаний феніл або вказаний гетероарил можливо заміщені одним або більше замісниками, незалежно вибраними з групи, яка складається з гідрокси, галогену, С1-С3алкілу і галоС1-С3алкілу.
12. Сполука за будь-яким з пп. 1-11, де R2b являє собою пергалоС1-С3алкіл, С1-С3алкіл, феніл або піридиніл, де вказаний феніл або вказаний піридиніл можливо заміщені одним або двома замісниками, незалежно вибраними з групи, яка складається з галогену, С1-С3алкілу і галоС1-С3алкілу.
13. Сполука за будь-яким з пп. 1-12, де R2b являє собою феніл або піридиніл, де вказаний феніл або вказаний піридиніл можливо заміщені одним або двома замісниками, незалежно вибраними з групи, яка складається з галогену і С1-С3алкілу.
14. Сполука за будь-яким з пп. 1-13, де R2b являє собою феніл, можливо заміщений одним або двома замісниками, незалежно вибраними з групи, яка складається з галогену і С1-С3алкілу.
15. Сполука за будь-яким з пп. 1-14, де R2b являє собою феніл, можливо заміщений одним або двома замісниками, незалежно вибраними з групи, яка складається з хлору, фтору і метилу.
16. Сполука за будь-яким з пп. 1-15, де R3a і R3b кожний незалежно являє собою феніл або гетероарил, де вказаний феніл або вказаний гетероарил можливо заміщені одним або більше замісниками, незалежно вибраними з групи, яка складається з галогену, С1-С6алкілу і галоС1-С6алкілу.
17. Сполука за будь-яким з пп. 1-16, де R3а і R3b кожний незалежно являє собою феніл, можливо заміщений одним або більше галогеном.
18. Сполука за будь-яким з пп. 1-17, де R3a і R3b кожний незалежно являє собою феніл, можливо заміщений одним або більше, зокрема одним-двома галогенами.
19. Сполука за будь-яким з пп. 1-18, де R3а і R3b є однаковими і являють собою феніл, можливо заміщений одним або більше хлором або фтором.
20. Сполука за будь-яким з пп. 1-19, де R3a і R3b кожний незалежно являє собою феніл, можливо заміщений одним-двома хлором або фтором.
21. Сполука за будь-яким з пп. 1-20, де обидва R3a i R3b являють собою феніл, заміщений одним фтором.
22. Сполука за будь-яким з пп. 1-21, вибрана з:
-2-[(S)-4-(2,4-дифторфеніл)-5,5-біс-(4-фторфеніл)-2-оксооксазолідин-3-іл]-ацетаміду;
-2-[(S)-4,5,5-трис-(4-фторфеніл)-2-оксооксазолідин-3-іл]-ацетаміду;
-2-[(S)-5,5-біс-(4-фторфеніл)-4-(2-фторфеніл)-2-оксооксазолідин-3-іл]-ацетаміду;
-2-[(S)-4,5,5-трис-(2-фторфеніл)-2-оксооксазолідин-3-іл]-ацетаміду;
-2-[(S)-5,5-біс-(3-фторфеніл)-4-(2-фторфеніл)-2-оксооксазолідин-3-іл]-ацетаміду;
-2-[(S)-4-(2-фторфеніл)-2-оксо-5,5-дифенілоксазолідин-3-іл]-ацетаміду;
-2-[(S)-4-(2-хлорфеніл)-5,5-біс-(4-фторфеніл)-2-оксооксазолідин-3-іл]-ацетаміду;
-(S)-метил-2-(4-(2-фторфеніл)-5,5-біс(4-фторфеніл)-2-оксооксазолідин-3-іл)ацетату;
-(S)-2-(4-(2-фторфеніл)-5,5-біс(4-фторфеніл)-2-оксооксазолідин-3-іл)-N-метилацетаміду;
-(S)-2-(5,5-біс(3,4-дифторфеніл)-2-оксо-4-фенілоксазолідин-3-іл)ацетаміду;
та її фармацевтично прийнятні солі.
23. Сполука за будь-яким з пп. 1-15, яка являє собою 2-[(S)-5,5-біс-(4-фторфеніл)-4-(2-фторфеніл)-2-оксооксазолідин-3-іл]-ацетамід.
24. Сполука за будь-яким з пп. 1-23 для застосування в лікуванні або профілактиці полікістозу нирок, астми, набряку мозку, запальної хвороби кишечнику, відторгнення трансплантата, атеросклерозу, фіброзу нирок, раку, рестенозу.
25. Сполука за будь-яким з пп. 1-23 для застосування як терапевтично активної речовини.
26. Сполука за будь-яким з пп. 1-23 для лікування або профілактики полікістозу нирок, астми, набряку мозку, запальної хвороби кишечнику, відторгнення трансплантата, атеросклерозу, фіброзу нирок, раку, рестенозу.
27. Сполука за п. 22 або 23 для застосування в лікуванні або профілактиці полікістозу нирок.
28. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-23, змішану з щонайменше одним фармацевтично прийнятним носієм, ексципієнтом або розріджувачем.
29. Застосування сполуки за будь-яким з пп. 1-23 для одержання лікарського засобу для лікування або профілактики полікістозу нирок, астми, набряку мозку, запальної хвороби кишечнику, відторгнення трансплантата, атеросклерозу, фіброзу нирок, раку, рестенозу.
Текст
Реферат: В даному винаході запропоновані сполуки загальної формули І O R 1 C H2 n N X 1 R3b R2a R2b 1 2a R3a 2b 3а , (I) 3b де n, R , R , R , R і R є такими, як тут визначено, композиції, які містять вказані сполуки і способи застосування вказаних сполук. UA 114649 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід належить до органічних сполук, корисних для лікування або профілактики у ссавців, і, зокрема, до інгібіторів KCa3.1, каналу, залученого у різні події секреції і клітинної сигналізації і є, таким чином придатними, наприклад, для лікування або профілактики полікістозу нирок. Сполуки формули (I) є блокаторами KCa3.1 (проміжний активований кальцієм калієвий канал, також відомий як KCCN4, IK1, IKCA1, KCA4, SK4, hIKCa1, hKCa4, hSK4 або Гардосканал). KCa3.1 канали знайдені в клітинах, що походять від гемопоетичних клітин (тобто еритроцити, тромбоцити, лімфоцити, тучні клітини і моноцити/макрофагі), епітеліальних тканинах шлунково-кишкового тракту, легенів і ендо- та екзокринних залоз, а також ендотеліоцитах судинної стінки, фібробластах і проліферуючих клітинах неоінтими гладкої мускулатури судин (H. Wulff Expert Rev. Clin. Pharmacol. 2010, 3, 385). Для каналу KCa3.1, експресованого в епітелії слизової оболонки шлунково-кишкового тракту, в епітелії легенів, в каналах секретуючих рідину залоз (тобто слинних, сльозової, підшлункової залози і передміхурової залози), а також в багатошаровому епітелії (в тому числі шкіри, рогівки, слизової оболонки порожнини роту та уротелій) активація KCa3.1 каналів забезпечує шлях для потоку калію, який допомагає полегшати секрецію хлориду і, відповідно, водний транспорт через епітелій. Це має особливе значення для лікування полікістозу нирок (PKD), зокрема, аутосомнодомінантного полікістозу нирок (ADPKD), де цАМФ-залежна секреція хлориду вважається ключовим чинником розширення кіст і прогресування хвороби. Було показано на MDCK 3-D моделі кісти ADPKD, що застосування блокатора KCa3.1 TRAM-34 інгібує утворення кісти (M. Albaqumi et al. Kidney International 2008, 74, 740). Втрати іонів калію через канал KCa3.1 з клітини також вносить свій внесок у підтримку негативного мембранного потенціалу, допомагаючи підтримувати вхід кальцію в клітини. 2+ Підвищення внутрішньоклітинного Ca є необхідним для продукції запальних хемокінів і цитокінів Т-клітинами, макрофагами і тучними клітинами. Воно також є необхідною умовою для проліферації багатьох типів клітин. Було також показано, що KCa3.1 опосередкований контроль Ca2 + входження бере участь в міграції макрофагів (I. Chung et al. J. Neuroimmunol. 2002, 122, 40), мікроглії (T. Schilling et al. Eur.J. Neurosci. 2004, 19, 1496), клітин гладких м’язів судин (D. Tharp et al. Am. J. Physiol. Heart Circ. Physiol. 2006, 291, H2493) і тучних клітин (G. Cruse et al. Thorax 2006, 61, 880). Протизапальні ефекти блокади KCa3.1 були продемонстровані як на тваринних моделях ревматоїдного артриту (C Chou in IBC Assays and Celluclar Targets 2005 (CA, USA), так і у людини (J. Wojtulewski et al Ann. Rheum. Dis. 1980, 39, 469). Було показано, що KCa3.1 блокатор Senicapoc знижує викликаний алергенами опір дихальних шляхів і гіпер-реактивність в моделі астми на вівцях (US2010/0056637A1). Також було показано, що KCa3.1 блокатори є нейропротекторами, зменшуючи набряк головного мозку і обсяг інфаркту черепно-мозкових травм у щурів (F. Mauler et al. Eur. J. Neurosci. 2004, 20, 1761). Лікування мишей KCa3.1 блокатором TRAM-34 в моделі запального захворювання кишечнику людини (коліт, індукований тринітробензол-сульфоновою кислотою) значно знижувало важкість симптомів. (Proc. Natl. Acad. Sci. USA 2010, 107, 1541). Крім того, було показано, що блокатор KCa3.1 TRAM-34 в поєднанні з Kv1.3 блокатором знижує інфільтрацію Т-клітин і макрофагів на ранніх стадіях хронічного відторгнення трансплантату нирки (I. Grgic Transplant. Proc. 2009, 41, 2601). Антипроліферативні ефекти KCa3.1 блокади були продемонстровані на різних багаточисельних тваринних моделях. Наприклад, лікування щурів, які пройшли балонну ангіопластику сонної артерії, за допомогою TRAM-34 значно зменшує гіперплазію неоінтимальної гладкої мускулатури (R. Kohler et al. Circulation 2003, 108, 1119) і аналогічно у свинячої моделі коронарного надрозтягнення у свиней (D. Tharp Thromb. Vasc. Biol. 2008, 28, -/1084), що має особливе значення для лікування рестенозу. KCa3.1 блокада у ApoE мишей значно зменшує розвиток атеросклерозу шляхом зниження проліферації клітин гладких м’язів (K. Toyama et al. J. Clin. Invest. 2008, 118, 3025). На моделі односторонньої обструкції сечоводу було показано, що лікування KCa3.1 блокатором TRAM-34 значно зменшує фіброз нирок, запобігаючи проліферації фібробластів (I. Grgic Proc. Natl. Acad. Sci.USA 2009, 106, 14518). Також було показано, що KCa3.1 блокада відіграє важливу роль у розвитку різних форм раку, бере участь в проліферації LNCaP та PC-3 ракових клітин людини, лейкозних HL-60 і клітин гліобластоми GL-15, клітин MCF- 7 раку молочної залози, BxPC-3 і MIaPa Ca-2 клітин раку підшлункової залози і HEC-1а і KLE клітин раку ендометрія (C. Chou et al. Expert. Rev. Mol. Diagn. 2008, 8, 179). KCa3.1 блокатор клотримазол, як було показано, зменшує кількість метастазів при важкому комбінованому імунодефіциті у мишей, інокульованих меланомою 1 UA 114649 C2 людини (L. Benzaquen Nat. Med. 1995, 1, 534), і уповільнює ріст пухлин у безтимусних мишей, яким вводили клітини раку ендометрія людини (Z. Wang et al. Oncogene 2007, 26, 5107). Даний винахід належить до нових сполук формули I, O R 1 H2 C R n 10 15 20 25 30 35 40 45 50 1 X 2a R 5 N 2b R 3a R 3b I де 1 X являє собою O або NH; n являє собою ціле число між 1 - 4; 1 1a 1b 1c R являє собою водень, ціано, –C(O)R , -C(O)NR R , гетероарил або CH2OH; 1a R являє собою водень, C1-C6 алкіл, C1-C6 алкокси, феніл або гетероарил; 1b 1c R і R кожний незалежно являє собою водень, C1-C6 алкіл, феніл або гетероарил, де вказаний C1-C6 алкіл, вказаний феніл або вказаний гетероарил можливо заміщені одним або більше, зокрема, одним - трьома замісниками, незалежно вибраними з групи, яка складається з гідрокси, галогену, C1-C6 алкілу, C1-C6 алкокси, галоC1-C6 алкілу і галоC1-C6 алкокси; 2a R являє собою водень або C1-C6 алкіл; 2b R являє собою галоC1-C6алкіл, C1-C6 алкіл, феніл або гетероарил, де вказаний феніл або вказаний гетероарил можливо заміщені одним або більше, зокрема одним або двома замісниками, незалежно вибраними з групи, яка складається з гідрокси, галогену, C1-C алкілу і галоC1-C6алкілу; 3a 3b R і R кожний незалежно являє собою водень, феніл або гетероарил, де вказаний феніл або вказаний гетероарил можливо заміщені одним або більше, зокрема, одним - трьома замісниками, незалежно вибраними з групи, яка складається з галогену, C 1-C6алкілу і галоC1C6алкілу; або фармацевтично прийнятних солей. В даному винаході запропонований спосіб лікування полікістозу нирок, який включає введення пацієнту, що потребує цього, терапевтично ефективної кількості сполуки Формули I, I’ або I”. Крім того, даний винахід належить до способу одержання вищезазначених сполук, фармацевтичних препаратів, які містять такі сполуки, застосування цих сполук для одержання фармацевтичних препаратів. Якщо не вказане інше, наступні терміни, що використовуються в описі і формулі винаходу, мають значення, надані нижче: «Гало» або «галоген» означає фтор, хлор, бром або йод, зокрема, хлор або фтор, більш конкретно фтор. «Гідрокси» належить до –OH групи. «(C1-C6)алкіл» належить до розгалуженого або лінійного вуглеводневого ланцюжка з одного – шести атомів вуглецю, такого як метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, вторбутил, трет-бутил, пентил і гексил. a a «(C1-C6)алкокси» означає групу формули –OR , де R являє собою (C1-C6)алкільний залишок, як тут визначено. Приклади (C1-C6)алкокси залишків включають, без обмеження, метокси, етокси, ізопропокси, тощо. Термін «пергало(C1-C3)алкіл» означає (C1-C3)алкільну групу, як визначено вище, де всі атоми водню заміщені на атоми галогенів. Більш конкретно, «(C1-C3)прегалоалкіл» являє собою (C1-C3)перфторалкіл, більш переважно, трифторметил. «Гало-(C1-C6)алкіл» належить до алкілу, як визначено вище, заміщеного одним або більше атомами галогену, зокрема, одним – трьома атомами галогену. Більш конкретно, гало-(C1C6)алкіл являє собою хлор- і фтор-(C1-C6)алкіл. В деяких конкретних втіленнях гало-(C1-C6)алкіл належить до пергало(C1-C3)алкілу, такого як трифторметил. «Гало-(C1-C6)алкокси» належить до алкокси, як визначено вище, заміщеного одним або більше атомами галогену, зокрема, одним-трьома атомами галогену. Більш конкретно, гало-(C1C6)алкокси являє собою хлор- і фтор-(C1-C6)алкокси. «Гетероарил» означає моновалентний моноциклічний або біциклічний залишок з 5 - 12 кільцевих атомів, який має щонайменше одне ароматичне кільце, яке містить один, два або три кільцевих гетероатоми, вибраних з N, O, або S (переважно, N або O), кільцеві атоми, які залишилися, являють собою C, за умови, що точка приєднання гетероарильного залишку 2 UA 114649 C2 5 10 15 20 25 30 35 40 45 50 55 60 знаходиться на ароматичному кільці. Більш конкретно, термін гетероарил включає, без обмеження, піридиніл, фураніл, тієніл, тіазоліл, ізотіазоліл, триазоліл, імідазоліл, ізоксазоліл, оксазоліл, піроліл, піразоліл, піримідиніл, бензофураніл, тетрагідробензофураніл, ізобензофураніл, бензотіазоліл, бензоізотіазоліл, бензотриазоліл, індоліл, ізоіндоліл, бензоксазоліл, хіноліл, тетрагідрохінолініл, ізохіноліл, бензімідазоліл, бензизоксазоліл або бензотієніл, імідазо[1,2-а]піридиніл, імідазо[2,1-b]тіазоліл, і їх похідні. Більш конкретно, «гетероарил» належить до піридинілу, оксазолілу або триазолілу (більш конкретно, 1,2,4триазолілу). «Можливий» або «можливо» означає, що описана далі подіяабо обставина може, але не обов’язково відбувається, і що опис включає випадки, коли подія або обставина має місце, і випадки, коли її немає. Наприклад, «арильна група можливо заміщена алкільною групою» означає, що алкіл може, але не повинен бути присутнім, і опис включає ситуації, в яких арильна група заміщена алкільною групою, і ситуації, коли арильна група не заміщена алкільною групою. «Фармацевтично прийнятний ексципієнт» означає ексципієнт, який корисний в приготуванні фармацевтичної композиції, який звичайно є безпечним, нетоксичним і не є ні біологічно, ні якнебудь ще небажаним і включає такий, який є прийнятним для ветеринарного використання, а також для фармацевтичного застосування для людини. «Фармацевтично прийнятний ексципієнт», як використовується в даному винаході і формулі, включає як один такий ексципієнт, так і більше одного. Такі солі включають: (1) кислотно-адитивні солі, утворені з неорганічними кислотами, такими як соляна кислота, бромистоводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота тощо, або утворені з органічними кислотами, такими як оцтова кислота, пропіонова, капронова кислоти, циклопентанпропіонова кислота, гліколева кислота, піровиноградна кислота, молочна кислота, малонова кислота, бурштинова кислота, яблучна кислота, малеїнова кислота, фумарова кислота, винна кислота, лимонна кислота, бензойна кислота, 3-(4-гідроксибензоїл)бензойна кислота, корична кислота, мигдальна кислота, метансульфонова кислота, етансульфонова кислота, 1,2-етан-дисульфонова кислота, 2-гідроксіетансульфонова кислота, бензолсульфонова кислота, 4-хлорбензолсульфонова кислота, 2-нафталінсульфокислота, 4-толуолсульфокислота, камфорсульфокислота, 4метилбіцикло[2.2.2]окт-2-ен-1-карбонова кислота, глюкогептонова кислота, 3-фенілпропіонова кислота, триметилоцтова кислота, третбутилоцтова кислота, лаурилсірчана кислота, глюконова кислота, глутамінова кислоти, гідроксинафтоєва кислота, саліцилова кислота, стеаринова кислота, муконова кислота тощо, або (2) солі, утворені, коли протон кислоти присутній в вихідній сполуці, або замінений на іон металу, наприклад, іон лужного металу, іон лужноземельного металу або іон алюмінію, або зв’язаний з органічною основою, такою як етаноламін, діетаноламін, триетаноламін, трометамін, N-метилглюкамін тощо. Термін «незалежно» використовується в даному винаході для позначення, що варіанти застосовні до будь-якого окремого випадку безвідносно до присутності або відсутності змінної з таким самим значенням або різних визначень всередині однієї і тієї самої сполуки. Зокрема, для термінів, чиї визначення надані вище, є тими, які конкретно наведені в прикладах. Сполуки, які мають однакову молекулярну Формулу, але розрізнюються за природою або послідовністю зв’язування їх атомів або розташуваннями їх атомів в просторі, називають «ізомери». Ізомери, які розрізнюються за розташуванням атомів у просторі, називають «стереоізомерами». Стереоізомери, які не є дзеркальними відображеннями один одного називаються «діастереомерами» і ті, які є дзеркальними відображеннями, що не накладаються одне на одне, називають «енантіомерами». Коли сполука має центр асиметрії, наприклад, якщо атом вуглецю зв’язаний з чотирма різними групами, можлива пара енантіомерів. Енантіомер може бути охарактеризований абсолютною конфігурацією його центра асиметрії та описується R- та S-послідовними правилами Кана, Інгольда і Прелога, або способом, в якому молекула обертає площину поляризації світла і позначається як правообертаючий або лівообертаючий (тобто, як (+) або (-)-ізомери відповідно). Хіральна сполука може існувати у вигляді індивідуального енантіомера або у вигляді їх суміші. Суміш, яка містить рівні пропорції енантіомерів називається «рацемічною сумішшю». Сполуки формули (I) можуть мати один або більше асиметричних центрів. Якщо не вказане інше, опис або назва конкретної сполуки в описі і формулі винаходу включає як індивідуальні енантіомери, так і їх суміші, рацемічні або інші, а також індивідуальні епімери та їх суміші. Способи визначення стереохімії і розділення стереоізомерів добре відомі в даній галузі техніки (див. обговорення в Chapter 4 °F «Advanced Organic Chemistry», 4th edition J. March, John Wiley and Sons, New York, 1992). Деякі сполуки можуть проявляти таутомеризм. Таутомерні сполуки можуть існувати у 3 UA 114649 C2 5 10 15 20 вигляді двох або більше взаємоперехідних видів. Прототропні таутомери утворюються в результаті міграції ковалентно зв’язаного атома водню між двома атомами. Таутомери звичайно існують в рівновазі, і спроби ізолювати окремі таутомери звичайно призводять до одержання суміші, хімічні і фізичні властивості якої відповідають суміші сполук. Положення рівноваги залежить від хімічних властивостей всередині молекули. Наприклад, у багатьох аліфатичних альдегідів і кетонів, таких як ацетальдегід, переважає кето-форма, в той час як у фенолів переважає енольна форма. Прототропні таутомери, що часто зустрічаються, включають кето/енол (-C(=O)-CH- ↔ -C(-OH)=CH-), амід/імідова кислота (-C(=O)-NH- ↔ -C(-OH)=N-) і амідинові (-C(=NR)-NH- ↔ -C(-NHR)=N-) таутомери. Останні два особливо поширені у гетероарильних і гетероциклічних кільцях, і даний винахід охоплює всі таутомерні форми заявлених сполук. Технічні і наукові терміни, що використовуються в даному винаході, мають значення, яке звичайно розуміє кваліфікований фахівець в даній галузі техніки, до якої належить даний винахід, якщо не вказане інше. Різні способи і матеріали, на які посилається даний винахід, відомі фахівцям в даній галузі техніки. Стандартні довідкові видання, в яких викладаються загальні принципи фармакології включають Goodman and Gilman's The Pharmacological Basis of th Therapeutics, 10 Ed., McGraw Hill Companies Inc., New York (2001). Будь-які придатні матеріали і/або способи, відомі кваліфікованим фахівцям можуть бути використані при здійсненні даного винаходу. Однак, переважні матеріали і способи описані. Матеріали, реагенти тощо, на які посилається наступний опис і приклади, можуть бути одержані з комерційних джерел, якщо не вказане інше. В іншому втіленні, в даному винаході запропонована сполука формули I’ R H2 C 1 R 2b 3a 40 45 2b R 3a R 3b 3b 1 H2 C R O 1 N X 2b R 3a R 3b I” де R , R , R , R і R є такими, як тут визначено. В окремому втіленні, в даному винаході запропонована сполука формули I, I’ або I” як тут 1 описано, де X являє собою O. В окремому втіленні, в даному винаході запропонована сполука формули I, як тут описано, де n являє собою 1 або 2, більш конкретно, де n являє собою 1. В окремих втіленнях, в даному винаході запропонована сполука формули I, I’ або I” як тут 1 1a 1b 1c 1 описано, де R являє собою водень, ціано, –C(O)R , -C(O)NR R або гетероарил, зокрема R 1a 1b 1c являє собою водень, ціано, –C(O)R , -C(O)NR R або триазоліл (більш конкретно, 1,2,41 1a 1b 1c триазоліл), більш конкретно, де R являє собою ціано, –C(O)R , -C(O)NR R або триазоліл 1 1a (більш конкретно, 1,2,4-триазоліл), ще більш конкретно, де R являє собою ціано, –C(O)R або 1b 1c 1 1a 1b 1c C(O)NR R , найбільш конкретно, де R являє собою –C(O)R або -C(O)NR R . В окремих втіленнях, в даному винаході запропонована сполука формули I, I’ або I” як тут 1a 1a описано, де R являє собою водень, C1-C3 алкіл, C1-C3 алкокси, більш конкретно, де R являє 1a собою C1-C3 алкокси, найбільш конкретно, де R являє собою метокси або етокси. В окремих втіленнях, в даному винаході запропонована сполука формули I, I’ або I”, як тут 1b 1c описано, де R і R кожний незалежно являє собою водень, C 1-C3 алкіл, феніл або гетероарил, 1b 1c більш конкретно, де R і R кожний незалежно являє собою водень або C1-C3 алкіл, найбільш 1b 1c конкретно, де R і R кожний незалежно являє собою водень, метил або етил. В окремих втіленнях, в даному винаході запропонована сполука формули I або I’ як тут 2a описано, де R являє собою водень. В окремих втіленнях, в даному винаході запропонована сполука формули I або I’ як тут 1 35 X I’ де R , R , R , R і R є такими, як тут визначено. В іншому втіленні, в даному винаході запропонована сполука формули I” 2a R 30 1 N 2a R 1 25 O 2a 2b 3a 3b 4 UA 114649 C2 2b 5 10 15 20 25 30 35 40 45 50 55 60 описано, де R являє собою пергалоC1-C3алкіл, C1-C3 алкіл, феніл або гетероарил, де вказаний феніл або вказаний гетероарил можливо заміщені одним або більше, зокрема одним або двома замісниками, незалежно вибраними з групи, яка складається з гідрокси, галогену, C 1-C3 алкілу і галоC1-C3алкілу. В інших окремих втіленнях, в даному винаході запропонована сполука формули I, I’ або I” як 2b тут описано, де R являє собою пергалоC1-C3алкіл, C1-C3 алкіл, феніл або піридиніл, де вказаний феніл або вказаний піридиніл можливо заміщені одним або двома замісниками, незалежно вибраними з групи, яка складається з галогену, C1-C3 алкілу і галоC1-C3алкілу, 2b зокрема, де R являє собою феніл або піридиніл, де вказаний феніл або вказаний піридиніл можливо заміщені одним або двома замісниками, незалежно вибраними з групи, яка складається з галогену і C1-C3 алкілу. В окремих втіленнях, в даному винаході запропонована сполука формули I, I’ або I” як тут 2b описано, де R являє собою феніл, можливо заміщений одним або двома замісниками, незалежно вибраними з групи, яка складається з галогену і C 1-C3 алкілу. В окремих втіленнях, в даному винаході запропонована сполука формули I, I’ або I” як тут 2b описано, де R являє собою феніл, можливо заміщений одним або двома замісниками, незалежно вибраними з групи, яка складається з хлору, фтору і метилу. В окремих втіленнях, в даному винаході запропонована сполука формули I, I’ або I” як тут 3a 3b описано, де R і R кожний незалежно являє собою феніл, можливо заміщений одним або 3a 3b більше, зокрема одним-двома галогенами, зокрема, де R і R кожний незалежно являє собою феніл, можливо заміщений одним-двома хлором або фтором. В окремих втіленнях, в даному винаході запропонована сполука формули I, I’ або I” як тут 3a 3b описано, де R і R є однаковими і являють собою феніл, можливо заміщений одним або 3a 3b більше, зокрема одним-двома хлором або фтором, більш конкретно, де обидва R і R являють 3a 3b собою феніл, заміщений одним фтором, найбільш конкретно, де обидва R і R являють собою феніл, заміщений в пара-положенні одним фтором. В більш конкретному втіленні, в даному винаході запропонована сполука формули I, I’ або II” 1 1 1b 1c 1b 1c як тут описано, де X являє собою O, R являє собою -C(O)NR R , де R і R кожний 2a 2b незалежно являє собою водень, C1-C3 алкіл, феніл або гетероарил, R являє собою водень, R являє собою пергалоC1-C3алкіл, C1-C3 алкіл, феніл або піридиніл, де вказаний феніл або вказаний піридиніл можливо заміщені одним або двома замісниками, незалежно вибраними з 3a 3b групи, яка складається з галогену, C 1-C3 алкілу і галоC1-C3алкілу, R і R кожний незалежно являє собою феніл, можливо заміщений одним або більше, зокрема одним-двома галогенами. Більш конкретно, в даному винаході запропонована сполука формули I, I’ або II” як тут 1 1 1b 1c 1b 1c описано, де X являє собою O, R являє собою -C(O)NR R , де R і R являють собою водень, 2a 2b де R являє собою водень, R являє собою феніл, можливо заміщений одним або двома 3a 3b замісниками, незалежно вибраними з групи, яка складається з хлору, фтору і метилу, де R і R кожний незалежно являє собою феніл, можливо заміщений одним або більше, зокрема однимдвома галогенами. Більш конкретно, в даному винаході запропонована сполука формули I, I’ або II” як тут 1 1 1b 1c 1b 1c описано, де X являє собою O, R являє собою -C(O)NR R , де R і R являють собою водень, 2a 2b де R являє собою водень, R являє собою феніл, можливо заміщений одним або двома 3a замісниками, незалежно вибраними з групи, яка складається з хлору, фтору і метилу, де R і 3b R являють собою феніл, заміщений одним фтором. Більш конкретно, в даному винаході запропонована сполука формули I, I’ або II” як тут 1 1 1b 1c 1b 1c описано, де X являє собою O, R являє собою -C(O)NR R , де R і R являють собою водень, 2a 2b де R являє собою водень, R являє собою феніл, можливо заміщений одним або двома 3a 3b замісниками, незалежно вибраними з групи, яка складається з хлору, фтору і метилу, де R і R являють собою феніл, заміщений в пара-положенні фтором. Конкретні приклади сполук формули (I), як тут описано, вибрані з: - 2-[(S)-4-(2,4-дифтор-феніл)-5,5-біс-(4-фтор-феніл)-2-оксо-оксазолідин-3-іл]-ацетамід; - 2-[(S)-4,5,5-трис-(4-фтор-феніл)-2-оксо-оксазолідин-3-іл]-ацетамід; - 2-[(S)-5,5-біс-(4-фтор-феніл)-4-(2-фтор-феніл)-2-оксо-оксазолідин-3-іл]-ацетамід; - 2-[(S)-4,5,5-трис-(2-фтор-феніл)-2-оксо-оксазолідин-3-іл]-ацетамід; - 2-[(S)-5,5-біс-(3-фтор-феніл)-4-(2-фтор-феніл)-2-оксо-оксазолідин-3-іл]-ацетамід; - 2-[(S)-4-(2-фтор-феніл)-2-оксо-5,5-дифеніл-оксазолідин-3-іл]-ацетамід; - 2-[(S)-4-(2-хлор-феніл)-5,5-біс-(4-фтор-феніл)-2-оксо-оксазолідин-3-іл]-ацетамід; - (S)-метил 2-(4-(2-фторфеніл)-5,5-біс(4-фторфеніл)-2-оксооксазолідин-3-іл)ацетат; -(S)-2-(4-(2-фторфеніл)-5,5-біс(4-фторфеніл)-2-оксооксазолідин-3-іл)-N-метилацетамід; -(S)-2-(5,5-біс(3,4-дифторфеніл)-2-оксо-4-фенілоксазолідин-3-іл)ацетамід; 5 UA 114649 C2 5 10 15 20 25 30 35 40 45 50 55 60 та їх фармацевтично прийнятні солі. В іншому втіленні, в даному винаході запропонована сполука відповідно до формули I, I’ або I” як тут описано для застосування як терапевтично активної речовини. В ще одному втіленні, в даному винаході запропонована сполука відповідно до формули I, I’ або I” як тут описано для лікування або профілактики полікістозу нирок, астми, набряку мозку, запальної хвороби кишечнику, відторгнення трансплантату, атеросклерозу, фіброзу нирок, раку, рестенозу. В окремому втіленні, в даному винаході запропонована сполука відповідно до формули I, I’ або I” як тут описано для лікування або профілактики полікістозу нирок. Відповідно до даного винаходу, рак належить, зокрема до меланоми, лейкемії, раку молочної залози, підшлункової залози і раку ендометрія. В іншому втіленні, в даному винаході запропоноване застосування сполуки відповідно до формули I, I’ або I” як тут описано для одержання лікарського засобу для лікування або профілактики полікістозу нирок, астми, набряку мозку, запальної хвороби кишечнику, відторгнення трансплантату, атеросклерозу, фіброзу нирок, раку, рестенозу. В одному аспекті, в даному винаході запропонований спосіб лікування KCa3.1 порушень у суб’єкта, який має зв’язані з KCa3.1 порушення, вказаний спосіб включає введення суб’єкту, який потребує цієї терапевтично ефективної кількості будь-якої з вищезазначених сполук. В іншому втіленні, в даному винаході запропонований спосіб лікування або профілактики полікістозу нирок, астми, набряку мозку, запальної хвороби кишечнику, відторгнення трансплантату, атеросклерозу, фіброзу нирок, раку, рестенозу, який включає введення ефективної кількості сполуки відповідно до формули I, I’ або I” як тут описано. В окремому втіленні, в даному винаході запропонований спосіб лікування або профілактики полікістозу нирок, який включає введення ефективної кількості сполуки відповідно до формули I, I’ або I” як тут описано. Зокрема, KCa3.1 порушення або зв’язані з KCa3.1 хвороби являють собою полікістоз нирок, астму, набряк мозку, запальне захворювання кишечнику, відторгнення трансплантату, атеросклероз, фіброз нирок, рак, рестеноз. В одному аспекті, в даному винаході запропонована фармацевтична композиція, яка містить сполуку за будь-яким з вищезазначених втілень, змішану з щонайменше одним фармацевтично прийнятним носієм, таким як ексципієнт або розріджувач. В іншому втіленні, в даному винаході запропоноване застосування сполуки Формули I, I’ або I” при виготовленні лікарського засобу для лікування хвороб, асоційованих з KCa3.1. Композиції складають, дозують і вводять способами відповідно до належної медичної практики. Чинники для розгляду в даному контексті, включають конкретне захворювання, яке підлягає лікуванню, конкретного ссавця, якого піддають лікуванню, клінічний стан конкретного пацієнта, причину розладу, місце доставки агента, спосіб введення, схему введення та інші чинники, відомі практикуючим лікарям. Наприклад, така кількість може бути нижче тієї, яка є токсичною для нормальних клітин або ссавців в цілому. Сполуки за винаходом можуть вводитися будь-яким придатним способом, включаючи пероральний, місцевий (включаючи букальний і сублінгвальний), ректальний, вагінальний, трансдермальний, парентеральний, підшкірний, внутрішньочеревний, внутрішньолегеневий, внутрішньошкірний, інтратекальний і епідуральний і інтраназальний, і, якщо необхідно для місцевого лікування, внутрішньовогнищевий введення. Парентеральні інфузії включають внутрішньом’язове, внутрішньовенне, внутрішньоартеріальне, внутрішньочеревне або підшкірне введення. Сполуки за даним винаходом можна вводити в будь-якій зручній формі введення, наприклад, таблетки, порошки, капсули, розчини, дисперсії, суспензії, сиропи, аерозолі, супозиторії, гелі, емульсії, пластирі тощо. Такі композиції можуть містити компоненти, звичайні в фармацевтичних композиціях, наприклад, розріджувачі, носії, модифікатори рН, підсолоджувачі, наповнювачі і додаткові активні агенти. Типові композиції одержують змішуванням сполуки даного винаходу і фармацевтично прийнятного носія або ексципієнта. Придатні фармацевтично прийнятні носії та ексципієнти добре відомі кваліфікованим фахівцям та описані детально в, наприклад, Ansel, Howard C., et al., Ansel’s Pharmaceutical Dosage Forms and Drug Delivery Systems. Philadelphia: Lippincott, Williams & Wilkins, 2004; Gennaro, Alfonso R., et al. Remington: The Science and Practice of Pharmacy. Philadelphia: Lippincott, Williams & Wilkins, 2000; and Rowe, Raymond C. Handbook of Pharmaceutical Excipients. Chicago, Pharmaceutical Press, 2005. Фармацевтично прийнятні носії можуть бути як твердими, так і рідкими. Тверді лікарські препарати включають порошки, таблетки, пілюлі, капсули, саше, супозиторії і дисперговані гранули. Твердий носій може бути 6 UA 114649 C2 5 10 15 20 25 30 35 40 однією або декількома речовинами, які також можуть діяти як розріджувачі, смакові домішки, розчинники, любриканти, суспендуючі агенти, зв'язуючі речовини, консерванти, розпушувачі для таблеток або інкапсулюючий матеріал. У випадку порошків носій звичайно являє собою дрібно подрібнену тверду речовину, яка змішана з дрібно подрібненим активним компонентом. У випадку таблеток активний компонент звичайно змішаний з носієм, який має необхідну зв'язуючу здатність, в придатних пропорціях і спресований у потрібну форму потрібного розміру. Порошки і таблетки переважно містять від приблизно одного (1) до приблизно сімдесяти (70) відсотків активної сполуки. Придатні носії включають, без обмеження, карбонат магнію, стеарат магнію, тальк, цукор, лактозу, пектин, декстрин, крохмаль, желатин, трагакант, метилцелюлозу, натрій-карбоксиметилцелюлозу, легкоплавкий віск, масло какао тощо. Дозування може варіюватися в широких межах і, звичайно, буде підібрана до індивідуальних вимог у кожному конкретному випадку. Загалом, у випадку перорального введення повинна бути придатною добова доза від близько 0,1 мг до 20 мг на кг маси тіла, переважно від близько 0,5 мг до 4 мг на кг маси тіла (наприклад, приблизно 300 мг на людину), переважно розділити на 1-3 індивідуальних доз, які можуть складатися, наприклад, з однакової кількості. Однак, буде зрозуміло, що вказана тут верхня межа може бути перевищена, коли це необхідно. Втілення, таким чином, включає фармацевтичну композицію, яка містить сполуку за даним винаходом, описану тут, або її стереоізомер. У додатковому втіленні включають фармацевтичну композицію, яка містить сполуку за даним винаходом, описану тут, або її стереоізомер, разом з фармацевтично прийнятним носієм або ексципієнтом. Інше втілення включає фармацевтичну композицію, яка містить сполуку за даним винаходом, описану тут, для застосування при лікуванні KCa3.1 зв’язаних хвороб. Інше втілення включає фармацевтичну композицію, яка містить сполуку за даним винаходом, описану тут, для застосування при лікуванні KCa3.1 зв’язаних хвороб. В іншому втіленні в даному винаході запропоноване виробництво сполук формули (I) як тут описано. Одержання сполук формули (I) за даним винаходом може бути здійснене послідовними або конвергентними шляхами синтезу. Синтези за винаходом показані на наступних загальних схемах. Навички, необхідні для здійснення реакції та очищення одержаних продуктів відомі фахівцям в даній галузі техніки. У випадку, якщо під час реакції одержують суміш енантіомерів або діастереоізомерів, ці енантіомери або діастереоізомери можуть бути розділені за допомогою способів, описаних тут, або способами, відомими фахівцю в даній галузі, такими як, наприклад, хіральна хроматографія або кристалізація. Більше того, сполуки даного винаходу можуть бути одержані з комерційно доступних вихідних речовин або за допомогою використання загальних способів і методик синтезу, які відомі кваліфікованим фахівцям. Нижче наведена реакційна схема 1, придатна для одержання таких сполук. Замісники та індекси, що використовуються в наступному описі способів, мають надані тут значення. Додаткові ілюстрації можуть бути знайдені в конкретних прикладах, описаних детальніше нижче. Схема 1 7 UA 114649 C2 R O 2a R O NH2 NH2 2b R R 4 2a R HN OH 2b O R R 3a 2a O R 2b R 3b R 1 R 3a 2 3b 3 1 R ( )n N O O R 2a R R O HN R O R 2b R HN 5 4 O OH 2a R 2b R 5 3a R R 1a O 3b O ( )n N O 6 7 R 1b R O R 2b R R R 2a O 2b R 2a 5 R R 3a O 3a R 3b 4 3b 1c HO N O O ( )n N 2a O ( )n N R O R 2b R R 3a R 2a R 3b O O 2b R 3a R 3b 8 9 H2N O O ( )n N R 2a R O 2b R 3a R 3b 10 1 5 10 15 1a 1b 2a 2b 3a 3b 4 5 На Схемі 1, R , R , R , R , R , R , R , R та R є такими, як тут визначено. Загальні методики синтезу Ефіри 1 є комерційно доступними або можуть бути без зусиль одержані з комерційно 4 доступних амінокислот за допомогою відомих способів (R звичайно являє собою (C1-C6) алкіл, наприклад, метил або етил). Пряма взаємодія 1 з надлишком реактиву Гриньяра (як комерційно доступного, так і приготованого з відповідного галіду з використанням відомих способів, наприклад обробкою металічним магнієм в киплячому ТГФ або за допомогою реакції обміну з ізопропілмагнію хлоридно-літієвим комплексом в ТГФ при зниженій температурі, наприклад, 0 3a 3b 10 °C) вводить групи R R з одержанням аміноспирту 2. Наступна циклізація 2 до оксазолідинону 3 може бути здійснена за допомогою використання фосгену та еквіваленту фосгену (наприклад, дифосген, трифосген) у присутності аміно основи (наприклад, триетиламін) в розчиннику, такому як дихлорметан, при зниженій температурі (0 °C або нижче), або за допомогою використання 1,1’-карбонілдімідазолу в такому самому розчиннику. 5 Альтернативно, 3, де R = C1-C6 алкіл, може бути одержано за допомогою початкового захисту 8 UA 114649 C2 5 10 15 20 25 30 аміногрупи сполуки 1 за допомогою карбаматної захисної групи, наприклад, третбуткосикарбоніл, етоксикарбоніл відомими способами з одержанням 5 і наступною взаємодією з 5 надлишком реактиву Гриньяра з одержанням захищеного аміноспирту 6. У випадку, коли R = трет-бутил, депротекція кислотою (наприклад, 4 н соляною кислотою в діоксані, або трифтороцтовою кислотою, як в чистому вигляді, так і в розчині дихлорметану) дає сполуку 2. У 5 випадку, коли R являє собою нижчий алкокси, наприклад, метил або етил, тоді обробка сполуки 6 стехіометричною кількістю сильної основи, наприклад трет-біталатом калію, в полярному розчиннику, такому як етанол, при кімнатній температурі і з нагріванням, наприклад при 80 °C, зразу дає оксазолідинон 3. Оксазолідинон 3 може бути потім дериватизований за допомогою депротонуовання і наступної реакції з алкілуючою групою. Наприклад, він може взаємодіяти з гетероарил-алкілгалідами за допомогою депротонування із сильною основою (наприклад, гідрид натрію) в розчинниках, таких як ТГФ або ДМФ, при кімнатній або зниженій температурі, наприклад, 0 °C з одержанням продуктів 4, або альтернативно взаємодіяти з 1a галоалкілацетатними похідними в аналогічних умовах з одержанням ефіру 7 (де R являє собою (C1-C6)алкокси, наприклад метокси або етокси). Цей ефір потім може бути конвертований в гетероцикл 4 з використанням відомих способів. Ефір 7 потім може бути сапоніфікований в звичайних умовах (наприклад, обробкою водним гідроксидом натрію в спиртових розчинниках, таких як етанол, метанол) з одержанням карбонової кислоти 7. Активування цієї кислоти з використанням звичайних реагентів (наприклад, 1,1-карбонілдімідазол, 2-(1H-бензотриазол-іл)1,1,3,3-тетраметилуронію тетрафторборат) в полярних розчинниках, таких як ДМФ, і взаємодія з 1b 1c амінами дає продукт 9, де R і R є такими, як тут визначено, або взаємодія з амонієм дає продукт 10. Альтернативно, продукт 10 може бути одержаний зразу з оксазолідинону 3 за допомогою депротонування 3 за допомогою сильної основи (наприклад, гідрид натрію) в розчинниках, таких як ТГФ або ДМФ при кімнатній або зниженій температурі, наприклад 0 °C і 3a 3b алкілування наприклад, 2-бромацетамідом у випадку, коли n =1. У випадку, коли R та R не є 5 однаковими, необхідний альтернативний підхід (Схема 2). Заміщені амінокислоти 11, де R є таким, як тут описано, можуть бути конвертовані у відповідні N-метокси, N-метил аміди 12 за допомогою звичайних способів амідного зв’язування. Взаємодія 12 з надлишком реактиву Гриньяра (як тут описано) дає кетон 13. Цей кетон може згодом вступити в реакцію з різним 3a 3b реактивом Гриньяра з одержанням аміноспирту 6, де R і R не є однаковими, як тут описано. 3b Для випадку, коли R = H, кетон 13 може бути селективно відновлений до цис-спирту за допомогою борогідриду натрію в метанолі. Аміноспирт 6 може згодом бути оброблений до кінцевих продуктів аналогічно тому, як описано на Схемі 1. 3a 3b Схема 2. Загальний синтез несиметрично R /R заміщених похідних. 35 O O O HN R 2a R R O 5 O HN R OH 2b 2a R N 2b R 5 R O 2a R R O R 5 3a 2b O 11 O HN O 12 13 O R HN R O OH 2a R 2b R 5 3a R 3b 6 2a 40 2b 3a 3b 5 На Схемі 2, R , R , R , R і R є такими, як тут визначено. Синтез імідазолінонових похідних починається з аміноспирту 2 (Схема 1), який взаємодіє з 6 ізоціанатом, що несе кислотно-лабільну групу R , наприклад 4-метоксибензил, в інертному розчиннику, такому як тетрагідрофуран або дихлорметан, з одержанням сечовини 14. Ця сполука може бути одночасно циклізована і піддана депротекції за допомогою нагрівання з кислотою Льюїса, такою як трьохфтористий ефірат бору в інертному розчиннику, наприклад, 9 UA 114649 C2 дихлорметані, з одержанням імідазолінону 15. Ця проміжна сполука потім може бути оброблена аналогічно сполуці 3 (Схема 1). Схема 3. Загальний синтез імідазолінонових похідних R NH2 R 2a R 3a 25 R R R HN N OH 2a R 3b 2b R 3a R 3b 2b 3a 3b O 6 HN NH 2a R 2b R R 14 2a 20 O 2 5 15 O N OH 2b R 10 6 3a 3b R 15 6 На Схемі 3, R , R , R , R і R є такими, як тут визначено. Наступні Приклади служать для ілюстрації даного винаходу в деталях. Однак, вони не призначені для того, щоб обмежувати його обсяг будь-яким чином. Всі реакції виконуються в інертній атмосфері, якщо не вказане інше. В основному, номенклатура, використана в даному винаході, основана на Struct2Name, комп’ютерній системі генерації систематичної номенклатури ІЮПАК компанії Perkin Elmer. Якщо існують розбіжності між зображеною структурою і назвою, наданою цій структурі, зображена структура є головною. Крім того, якщо не вказана стереохімія структури або частини структури за допомогою, наприклад, жирної або переривчастої ліній, структура або частина структури необхідно інтерпретувати, як таку, що охоплює всі її стереоізомери. Абревіатури: ДМФ диметилформамід EtOAc етилацетат н-Гепт н-гептан ВЕРХ високоефективна рідинна хроматографія MS мас-спектрометрія ТГФ тетрагідрофуран Приклад 1 (S)-2-(5,5-біс(4-фторфеніл)-2-оксо-4-фенілоксазолідин-3-іл)ацетамід H2N O N O F O F 30 35 40 A) (S)-2-аміно-1,1-біс(4-фторфеніл)-2-фенілетанол До охолодженої на кризі суспензії (S)-метил 2-аміно-2-фенілацетату гідрохлориду (1 г, 5.0 ммоль) в ТГФ (50 мл) додали по краплях (4-фторфеніл)магнію бромід (19.8 мл, 1 M в ТГФ, 20 ммоль). Після закінчення додавання, крижану ванну прибрали і реакційній суміші дали досягти кімнатної температури. Потім реакційну суміш влили в насичений розчин хлориду амонію та екстрагували етилацетатом. Об’єднанні органічні шари промили сольовим розчином, висушили (Na2SO4) і сконцентрували. Очищення за допомогою колонкової флеш-хроматографії (елюент EtOAc:н-Гепт градієнт 1:4-1:1) дало сполуку, вказану в заголовку у вигляді безбарвного, + кристалічного осаду (0.8 г, 50%). MS: (MH) 326.2. B) (S)-5,5-біс(4-фторфеніл)-4-фенілоксазолідин-2-он До охолодженого на кризі розчину (S)-2-аміно-1,1-біс(4-фторфеніл)-2-фенілетанолу (0.8 г, 2.5 ммоль) і триетиламіну (1.0 мл, 7.5 ммоль) у метиленхлориді (15 мл) додали розчин трихлорметил хлорформіату (0.3 мл, 2.5 ммоль) у метиленхлориді (2 мл). Крижану ванну 10 UA 114649 C2 5 10 15 20 25 30 прибрали і реакційній суміші дали досягти кімнатної температури. Реакційну суміш потім розбавили метиленхлоридом, промили 1 н. соляною кислотою, висушили (Na 2SO4) і сконцентрували. Очищення за допомогою колонкової флеш-хроматографії (елюент EtOAc:нГепт градієнт 1:4-3:2) дало сполуку, вказану в заголовку у вигляді безбарвного, кристалічного + осаду (0.7 г, 80%). MS: (MH) 352.2. C) (S)-етил 2-(5,5-біс(4-фторфеніл)-2-оксо-4-фенілоксазолідин-3-іл)ацетат До охолодженого на кризі розчину (S)-5,5-біс(4-фторфеніл)-4-фенілоксазолідин-2-ону (0.2 г, 0.6 ммоль) та етил 2-бромацетату (76 мкл, 0.7 ммоль) в ТГФ (5 мл) додали гідрид натрію (0.05 г, 60% дисперсія в мінеральному маслі, 1.1 ммоль). Крижану ванну прибрали і реакційній суміші дали досягти кімнатної температури. Реакційну суміш потім розбавили метиленхлоридом, промили 1 н. соляною кислотою, висушили (Na2SO4) і сконцентрували. Очищення за допомогою колонкової флеш-хроматографії (елюент EtOAc: н-Гепт 2:3) дало сполуку, вказану в заголовку у + вигляді сіро-білого, кристалічного осаду (0.25 г, 84%). MS: (MH) 438.2. D) (S)-2-(5,5-біс(4-фторфеніл)-2-оксо-4-фенілоксазолідин-3-іл)оцтова кислота До суспензії (S)-етил 2-(5,5-біс(4-фторфеніл)-2-оксо-4-фенілоксазолідин-3-іл)ацетату (0.19 г, 0.4 ммоль) в етанолі (5 мл) додали гідроксид натрію (0.15 мл, 6 M у воді, 0.9 ммоль) і реакційну суміш перемішували протягом 15 хвилин. Реакційну суміш потім підкислили за допомогою солі ® Amberlite IR120, відфільтрували і сконцентрували з одержанням сполуки, вказаної в заголовку (0.18 г, 100%) у вигляді безбарвної піни. MS: (M-H) 408.2. E) (S)-2-(5,5-біс(4-фторфеніл)-2-оксо-4-фенілоксазолідин-3-іл)ацетамід У розчин (S)-2-(5,5-біс(4-фторфеніл)-2-оксо-4-фенілоксазолідин-3-іл)оцтової кислоти (0.12 г, 0.3 ммоль) в ДМФ (1мл) додали 1, 1-карбонілдімідазол (61 мг, 0.3 ммоль) і суміш перемішували протягом 1 години при 60 °C. Після охолодження до кімнатної температури додали гідроксид амонію (0.5 мл, 25% у воді, 3.1 ммоль) і суміш перемішували протягом 2 годин, після цього часу сконцентрували досуху. Залишок розділили між водою та етилацетатом, органічну фазу промили сольовим розчином, висушили (Na2SO4) і сконцентрували. Очищення за допомогою колонкової флеш-хроматографії (елюент градієнт EtOAc: н-Гепт 0:1-1:0) дало сполуку, вказану в + заголовку, у вигляді білої піни (0.083 г, 65%). MS: (MH) 409.3. Приклад 2 2-[(S)-5,5-біс-(2-фтор-феніл)-2-оксо-4-феніл-оксазолідин-3-іл]-ацетамід H2N O O F N O F 35 40 45 50 A) (S)-трет-бутил 2,2-біс(2-фторфеніл)-2-гідрокси-1-фенілетилкарбамат До ізопропілмагнію хлорид – літій хлоридного комплексу (38.5 мл, 1.3 M в ТГФ, 50 ммоль), охолодженого в ванні з водою, додали 1-фтор-2-йодбензол зі швидкістю, при якій температура зберігалась нижче 40 °C. Після закінчення додавання суміш перемішували протягом 0.5 години. Потім її додали в розчин (S)-метил 2-(трет-бутоксикарбоніламіно)-2-фенілацетату (3.8 г, 14.3 ммоль) в ТГФ (20 мл) з охолодженням у водяній ванні. Суміш перемішували протягом додаткових 3 годин, після цього часу влили в насичений розчин хлориду амонію та екстрагували етилацетатом. Об’єднанні органічні шари промили сольовим розчином, висушили (Na2SO4) і сконцентрували. Очищення за допомогою колонкової флеш-хроматографії (елюент EtOAc: н-Гепт градієнт 0:1-1:1) і наступна перекристалізація з EtOAc/н-гексану дали сполуку, вказану в заголовку у вигляді безбарвного, кристалічного осаду (1.8 г, 30%). MS: (M-H) 424.3. B) (S)-2-аміно-1,1-біс(2-фторфеніл)-2-фенілетанол У розчин(S)-трет-бутил 2,2-біс(2-фторфеніл)-2-гідрокси-1-фенілетилкарбамату (1.8 г, 4.2 ммоль) у метиленхлориді (25 мл) додали трифтороцтову кислоту (3.6 мл, 46 моль) і суміш перемішували протягом 2 годин при кімнатній температурі. Потім суміш обережно влили в насичений розчин гідрокарбонату натрію і продукт екстрагували метиленхлоридом. Об’єднанні органічні шари промили сольовим розчином, висушили (Na 2SO4) і сконцентрували з 11 UA 114649 C2 + 5 10 15 одержанням сполуки, вказаної в заголовку, у вигляді безбарвного осаду (1.4 г, 96%). MS: (MH) 326.1. C) (S)-5,5-біс(2-фторфеніл)-4-фенілоксазолідин-2-он До охолодженого на кризі розчину (S)-2-аміно-1,1-біс(2-фторфеніл)-2-фенілетанолу (0.3 г, 0.9 ммоль) і триетиламіну (0.4 мл, 2.8 ммоль) у метиленхлориді (6 мл) додали розчин трихлорметил хлорформіату (0.06 мл, 0.5 ммоль) у метиленхлориді (2.5 мл). Крижану ванну прибрали і реакційній суміші дали досягти кімнатної температури. Реакційну суміш потім розбавили метиленхлоридом, промили 1 н. соляною кислотою, сольовим розчином, висушили (Na2SO4) і сконцентрували. Очищення за допомогою колонкової флеш-хроматографії (елюент EtOAc: н-Гепт градієнт 0:1-1:0) дало сполуку, вказану в заголовку у вигляді безбарвного осаду + (0.2 г, 58%). MS: (MH) 352.2. D) 2-[(S)-5,5-біс-(2-фтор-феніл)-2-оксо-4-феніл-оксазолідин-3-іл]-ацетамід Сполуку, вказану в заголовку одержали з (S)-5,5-біс(2-фторфеніл)-4-фенілоксазолідин-2-ону + за аналогією з прикладом 1 (стадії C, D та E) у вигляді білої піни. MS: (MH) 409.3. Приклад 3 H2N O O N F O F 20 2-[(S)-5,5-біс-(3-фтор-феніл)-2-оксо-4-феніл-оксазолідин-3-іл]-ацетамід Сполуку, вказану в заголовку одержали аналогічно Прикладу 2 з (S)-метил 2-(трет+ бутоксикарбоніламіно)-2-фенілацетату і 1-фтор-3-йодобензолу. MS: (MH) 409.2 Приклад 4 O O F O N F O F F 25 30 [4-(2,4-дифтор-феніл)-5,5-біс-(4-фтор-феніл)-2-оксо-оксазолідин-3-іл]-оцтової кислоти етиловий ефір A) трет-бутоксикарбоніламіно-(2,4-дифтор-феніл)-оцтової кислоти метиловий ефір До метил 2-аміно-2-(2,4-дифторфеніл)ацетату (2.7 г, 13.4 ммоль) у метиленхлориді (100 мл) додали ди-трет-бутилдикарбонат (2.9 г, 13.4 ммоль) і реакційну суміш перемішували протягом 16 годин. Потім її евапорували, одержавши сполуку, вказану в заголовку (4.2 г, 100%) з + чистотою, достатньою для використання неочищеною. MS: (MH) 302.2 B) [4-(2,4-дифтор-феніл)-5,5-біс-(4-фтор-феніл)-2-оксо-оксазолідин-3-іл]-оцтової кислоти етиловий ефір Сполуку, вказану в заголовку одержали з трет-бутоксикарбоніламіно-(2,4-дифтор-феніл)оцтової кислоти метилового ефіру і (4-фторфеніл)магнію броміду за аналогією з прикладом 2 + (стадії A, B, C) з наступною стадією С прикладу 1. MS: (MH) 474.4 Приклад 5 12 UA 114649 C2 O H2N F O N F O F F 5 2-[(S)-4-(2,4-дифтор-феніл)-5,5-біс-(4-фтор-феніл)-2-оксо-оксазолідин-3-іл]-ацетамід Сполуку, вказану в заголовку одержали у вигляді рацемату з [4-(2,4-дифтор-феніл)-5,5-біс(4-фтор-феніл)-2-оксо-оксазолідин-3-іл]-оцтової кислоти етилового ефіру (Приклад 4) за аналогією з прикладом 1 (стадії D, E). Хіральне розділення здійснювали за допомогою колонки Chiralpak® AD (елюент етанол: н-Гептан 1:3) з одержанням необхідного (-) ізомеру у вигляді + білого осаду. MS: (MH) 445.5. Приклад 6 O O O N F O F F 10 [(S)-4,5,5-трис-(4-фтор-феніл)-2-оксо-оксазолідин-3-іл]-оцтової кислоти етиловий ефір Сполуку, вказану в заголовку одержали з (S)-метил 2-аміно-2-(4-фторфеніл)ацетату і (4фторфеніл)магнію броміду за аналогією з прикладом 1 (стадії A, B, C) з наступною стадією С + прикладу 1, одержавши білу піну. MS: (MH) 456.2. Приклад 7 H2N O N O F O F F 15 20 2-[(S)-4,5,5-трис-(4-фтор-феніл)-2-оксо-оксазолідин-3-іл]-ацетамід Сполуку, вказану в заголовку одержали з [(S)-4,5,5-трис-(4-фтор-феніл)-2-оксо-оксазолідин3-іл]-оцтової кислоти етилового ефіру (Приклад 6) за аналогією з прикладом 1 (стадії D, E), + одержавши білу піну. MS: (MH) 427.3. Приклад 8 13 UA 114649 C2 O H2N F O N F O F F 5 10 2-[4-(2,6-дифтор-феніл)-5,5-біс-(4-фтор-феніл)-2-оксо-оксазолідин-3-іл]-ацетамід A) метил 2-(трет-бутоксикарбоніламіно)-2-(2,6-дифторфеніл)ацетат Сполуку, вказану в заголовку одержали з метил 2-аміно-2-(2,6-дифторфенілацетату) за + аналогією з прикладом 4A, з одержанням в’язкого масла. MS: (MH) 302.2. B) 2-[4-(2,6-дифтор-феніл)-5,5-біс-(4-фтор-феніл)-2-оксо-оксазолідин-3-іл]-ацетамід Сполуку, вказану в заголовку одержали з метил 2-(трет-бутоксикарбоніламіно)-2-(2,6дифторфеніл)ацетату і (4-фторфеніл)магнію броміду за аналогією з прикладом 2 з одержанням + білого осаду. MS: (MH) 445.4. Приклад 9 O H2N O N F O F F 15 20 2-(4-(3-фторфеніл)-5,5-біс(4-фторфеніл)-2-оксооксазолідин-3-іл)ацетамід A) метил 2-(трет-бутоксикарбоніламіно)-2-(3-фторфеніл)ацетат Сполуку, вказану в заголовку, одержали з метил 2-аміно-2-(3-фторфенілацетату) за + аналогією з прикладом 4A, з одержанням в’язкого масла. MS: (MH) 284.2 B) 2-(4-(3-фторфеніл)-5,5-біс(4-фторфеніл)-2-оксооксазолідин-3-іл)ацетамід Сполуку, вказану в заголовку, одержали з метил 2-(трет-бутоксикарбоніламіно)-2-(3фторфеніл)ацетату і (4-фторфеніл)магнію броміду за аналогією з прикладом 2, з одержанням + білого осаду. MS: (MH) 427.3. Приклад 10 O O F O N F O F [5,5-біс-(4-фтор-феніл)-4-(2-фтор-феніл)-2-оксо-оксазолідин-3-іл]-оцтової кислоти етиловий ефір 14 UA 114649 C2 5 10 A) (S)-метил 2-(трет-бутоксикарбоніламіно)-2-(2-фторфеніл)ацетат Сполуку, вказану в заголовку, одержали з (S)-метил 2-аміно-2-(2-фторфеніл)ацетату за + аналогією з прикладом 4A, з одержанням безбарвного кристалічного осаду. MS: (MH) 284.1. B) (S)-4-(2-фторфеніл)-5,5-біс(4-фторфеніл)оксазолідин-2-он Сполуку, вказану в заголовку, одержали з метил 2-(трет-бутоксикарбоніламіно)-2-(2фторфеніл)ацетату і (4-фторфеніл)магнію броміду за аналогією з прикладом 2 (стадії A, B, C) з + одержанням безбарвного осаду. MS: (MH+MeCN) 411.1. C) [5,5-біс-(4-фтор-феніл)-4-(2-фтор-феніл)-2-оксо-оксазолідин-3-іл]-оцтової кислоти етиловий ефір Сполуку, вказану в заголовку, одержали з (S)-4-(2-фторфеніл)-5,5-біс(4фторфеніл)оксазолідин-2-ону за аналогією з прикладом з наступною стадією С прикладу 1, + одержавши безбарвну смолу. MS: (MH) 456.2. Приклад 11 O H2N O N F F O F 15 20 25 2-[(S)-5,5-біс-(4-фтор-феніл)-4-(2-фтор-феніл)-2-оксо-оксазолідин-3-іл]-ацетамід У розчин (S)-4-(2-фторфеніл)-5,5-біс(4-фторфеніл)оксазолідин-2-ону (0.2 г, 0.5 ммоль, Приклад 10 B) в ТГФ (1 мл) в атмосфері аргону додали гідрид натрію (0.03 г, 60% дисперсія в мінеральному маслі, 0.8 ммоль). Реакційну суміш перемішували протягом 5 хвилин, після чого додали твердий 2-бромацетамід (0.1 г, 0.8 ммоль) і реакційну суміш перемішували протягом додаткових 0.5 години. Реакційну суміш влили в 1 н соляну кислоту, екстрагували етилацетатом, органічну фазу промили водою, сольовим розчином, висушили (Na 2SO4) і сконцентрували. Очищення за допомогою колонкової флеш-хроматографії (елюент EtOAc: нГепт градієнт 2:8-7:3) дало сполуку, вказану в заголовку у вигляді безбарвної піни (0.2 г, 86%). + MS: (MH) 427.2. Приклад 12 O O O F F N O F 30 [(S)-4,5,5-трис-(2-фтор-феніл)-2-оксо-оксазолідин-3-іл]-оцтової кислоти етиловий ефір Сполуку, вказану в заголовку, одержали з (S)-метил 2-(трет-бутоксикарбоніламіно)-2-(2фторфеніл)ацетату (Приклад 11A) і 1-фтор-2-йодобензолу за аналогією з прикладом 2 (стадії A, + B, C) з наступною стадією 1 С, одержавши безбарвну смолу. MS: (MH) 456.1. Приклад 13 15 UA 114649 C2 O H2N O F F N O F 5 2-[(S)-4,5,5-трис-(2-фтор-феніл)-2-оксо-оксазолідин-3-іл]-ацетамід Сполуку, вказану в заголовку, одержали з [(S)-4,5,5-трис-(2-фтор-феніл)-2-оксо-оксазолідин3-іл]-оцтової кислоти етилового ефіру (Приклад 12) за аналогією з прикладом 1 (стадії D, E), + одержавши білу піну. MS: (MH) 427.5. Приклад 14 O O O N F F O F 10 [(S)-5,5-біс-(3-фтор-феніл)-4-(2-фтор-феніл)-2-оксо-оксазолідин-3-іл]-оцтової кислоти етиловий ефір Сполуку, вказану в заголовку, одержали з (S)-метил 2-(трет-бутоксикарбоніламіно)-2-(2фторфеніл)ацетату (Приклад 11A) і 1-фтор-3-йодобензолу за аналогією з прикладом 2, + одержавши безбарвну смолу. MS: (MH) 456.5. Приклад 15 O H2N F O N F O F 15 2-[(S)-5,5-біс-(3-фтор-феніл)-4-(2-фтор-феніл)-2-оксо-оксазолідин-3-іл]-ацетамід Сполуку, вказану в заголовку, одержали з [(S)-5,5-біс-(3-фтор-феніл)-4-(2-фтор-феніл)-2оксо-оксазолідин-3-іл]-оцтової кислоти етилового ефіру (Приклад 14) за аналогією з прикладом + 1 (стадії D, E), одержавши білу піну. MS: (MH) 427.4. Приклад 16 16 UA 114649 C2 O O N F 5 O [(S)-4-(2-фтор-феніл)-2-оксо-5,5-дифеніл-оксазолідин-3-іл]-оцтової кислоти етиловий ефір Сполуку, вказану в заголовку, одержали з (S)-метил 2-(трет-бутоксикарбоніламіно)-2-(2фторфеніл)ацетату (Приклад 11A) і фенілмагнію броміду за аналогією з прикладом 2 (стадії A, + B, C), з наступною Стадією 1 C, одержавши безбарвну смолу. MS: (MH) 420.5. Приклад 17 O H2N O N F 10 O O 2-[(S)-4-(2-фтор-феніл)-2-оксо-5,5-дифеніл-оксазолідин-3-іл]-ацетамід Сполуку, вказану в заголовку, одержали з [(S)-4-(2-фтор-феніл)-2-оксо-5,5-дифенілоксазолідин-3-іл]-оцтової кислоти етилового ефіру (Приклад 16) за аналогією з прикладом 1 + (стадії D, E), одержавши білу піну. MS: (MH) 391.5. Приклад 18 H2N O N O NH F F 15 20 25 (S)-2-(4,4-біс(4-фторфеніл)-2-оксо-5-фенілімідазолідин-1-іл)ацетамід A) (S)-1-(2,2-біс(4-фторфеніл)-2-гідрокси-1-фенілетил)-3-(2,4-диметоксибензил)сечовина У розчин (S)-2-аміно-1,1-біс(4-фторфеніл)-2-фенілетанолу (Приклад 1A) (0.75 г, 2.3 ммоль) у метиленхлориді (10 мл) додали 1-(ізоціанатометил)-2,4-диметоксибензол (0.53 г, 2.8 ммоль) і реакційну суміш перемішували протягом 1 години. Потім суміш абсорбували на силікагелі та очистили за допомогою колонкової флеш-хроматографії (елюент градієнт EtOAc: н-Гепт 1:9-1:1) з одержанням продукту, вказаного в заголовку, у вигляді безбарвного кристалічного осаду (0.89 + г, 75%). MS: (MH) 518.5. B) (S)-4,4-біс(4-фторфеніл)-5-фенілімідазолідин-2-он До суспензії (S)-1-(2,2-біс(4-фторфеніл)-2-гідрокси-1-фенілетил)-3-(2,4диметоксибензил)сечовини (0.89 г, 1.7 ммоль) у метиленхлориді (5 мл) в закритій пробірці додали ефірат трьохфтористого бору (0.4 мл, 3.4 ммоль) і суміш нагрівали до 50 °C протягом 3 годин. Реакційну суміш потім розбавили метиленхлоридом і промили насиченим розчином гідрокарбонату натрію, висушили (Na2SO4) і сконцентрували. Очищення за допомогою 17 UA 114649 C2 5 10 15 20 колонкової флеш-хроматографії (елюент EtOAc: н-Гепт градієнт 1:1-1:0) дало сполуку, вказану в + заголовку, у вигляді безбарвної солі (0.48 г, 80%). MS: (MH) 351.2. C) (S)-2-(4,4-біс(4-фторфеніл)-2-оксо-5-фенілімідазолідин-1-іл)-N,N-біс(2,4диметоксибензил)ацетамід До охолодженого на кризі розчину 2-хлор-N,N-біс(2,4-диметоксибензил)ацетаміду (0.17 г. 0.4 ммоль, одержаного за допомогою взаємодії 2-хлороцтового ангідриду і біс(2,4+ диметоксибензил)аміну MS: (MH, Cl) 394.1), і ( S)-4,4-біс(4-фторфеніл)-5-фенілімідазолідин-2ону (0.1 г, 0.3 ммоль) у безводному ТГФ (3 мл) додали гідрид натрію (0.03 г, 60% дисперсія в мінеральному маслі, 0.6 ммоль), і реакційну суміш перемішували протягом 1 години при 0 °C і 1 години при кімнатній температурі. Реакційну суміш потім розбавили етилацетатом, промили 1н HCl, сольовим розчином, висушили (Na2SO4) і сконцентрували. Очищення за допомогою колонкової флеш-хроматографії (елюент EtOAc: MeOH градієнт 1:0-1:9) дало сполуку, вказану в + заголовку, у вигляді безбарвної солі (0.2 г, 50%). MS: (MH) 708.6. D) (S)-2-(4,4-біс(4-фторфеніл)-2-оксо-5-фенілімідазолідин-1-іл)ацетамід У розчин (S)-2-(4,4-біс(4-фторфеніл)-2-оксо-5-фенілімідазолідин-1-іл)-N,N-біс(2,4диметоксибензил)ацетаміду (0.1 г, 0.1 ммоль) у метиленхлориді (2 мл) додали трьохфтористий ефірат бору (0.04 мл, 0.3 ммоль) і суміш перемішували протягом 6 годин. Додаткову кількість трьохфтористого ефірату бору (0.04 мл, 0.3 ммоль) додали і суміш перемішували протягом ночі, після цього часу реакційну суміш розбавили метиленхлоридом, промили насиченим розчином гідрокарбонату натрію, висушили (Na2SO4) і сконцентрували. Залишок очистили за допомогою препаративної ВЕРХ з одержанням сполуки, вказаної в заголовку, у вигляді безбарвного осаду + (0.02 г, 33%). MS: (MH) 408.3. Приклад 19 H2N Cl O O N F O F 25 30 2-[(S)-4-(2-хлор-феніл)-5,5-біс-(4-фтор-феніл)-2-оксо-оксазолідин-3-іл]-ацетамід A) (S)-метил 2-(трет-бутоксикарбоніламіно)-2-(2-хлорфеніл)ацетат Сполуку, вказану в заголовку, одержали з (S)-метил 2-аміно-2-(2-хлорфеніл)ацетату за + аналогією з прикладом 4A, одержавши світло-коричневу смолу. MS: (MH-Boc, Cl) 200.2 B) [5,5-біс-(4-фтор-феніл)-4-(2-хлор-феніл)-2-оксо-оксазолідин-3-іл]-оцтової кислоти етиловий ефір Сполуку, вказану в заголовку, одержали з метил 2-(трет-бутоксикарбоніламіно)-2-(2фторфеніл)ацетату і (4-фторфеніл)магнію броміду за аналогією з прикладом 2, одержавши + кристалічний осад. MS: (MH) 456.2. Приклад 20 H2N O N O F O F 35 2-[(S)-5,5-біс-(4-фтор-феніл)-2-оксо-4-o-толіл-оксазолідин-3-іл]-ацетамід 18 UA 114649 C2 5 10 A) (метил 2-(трет-бутоксикарбоніламіно)-2-o-толілацетат Сполуку, вказану в заголовку, одержали з метил 2-аміно-2-o-толілацетату гідрохлориду за + аналогією з прикладом 4A, одержавши світло-жовту смолу. MS: (MH-Boc) 180.2 B) [5,5-біс-(4-фтор-феніл)-4-(2-хлор-феніл)-2-оксо-оксазолідин-3-іл]-оцтової кислоти етиловий ефір Сполуку, вказану в заголовку, одержали з метил 2-(трет-бутоксикарбоніламіно)-2-oтолілацетату і (4-фторфеніл)магнію броміду за аналогією з прикладом 2, одержавши кристалічний осад. Хіральне розділення здійснювали за допомогою колонки Chiralpak® AD (елюент ізопропанол: н-гептан 1:9) з одержанням необхідного (-) ізомеру у вигляді білого осаду. + MS: (MH) 423.5. Приклад 21 O O F O N F O F 15 (S)-метил 2-(4-(2-фторфеніл)-5,5-біс(4-фторфеніл)-2-оксооксазолідин-3-іл)ацетат Сполуку, вказану в заголовку, одержали з (S)-4-(2-фторфеніл)-5,5-біс(4фторфеніл)оксазолідин-2-ону (Приклад 10 B) за аналогією зі стадією 10 C і бромоцтової кислоти + метилового ефіру з одержанням безбарвної соли. MS: (MH) 442.3. Приклад 22 O HN F N O F O F 20 25 30 (S)-2-(4-(2-фторфеніл)-5,5-біс(4-фторфеніл)-2-оксооксазолідин-3-іл)-N-метилацетамід A) [5,5-біс-(4-фтор-феніл)-4-(2-фтор-феніл)-2-оксо-оксазолідин-3-іл]-оцтова кислота Сполуку, вказану в заголовку, одержали з [5,5-біс-(4-фтор-феніл)-4-(2-фтор-феніл)-2-оксооксазолідин-3-іл]-оцтової кислоти етилового ефіру (Приклад 10) за аналогією зі стадією 1D, + одержавши білу піну. MS: (MH) 428.4. B) (S)-2-(4-(2-фторфеніл)-5,5-біс(4-фторфеніл)-2-оксооксазолідин-3-іл)-N-метилацетамід До розчину [5,5-біс-(4-фтор-феніл)-4-(2-фтор-феніл)-2-оксо-оксазолідин-3-іл]-оцтової кислоти (50 мг, 0.10 ммоль) і 2-(1H-бензатриазол-1-іл)-1,1,3,3-тетраметилуронію тетрафторборату (41 мг, 0.13 ммоль) у диметилформаміді (0.5 мл) додали діізопропілетиламін (0.1 мл, 0.59 ммоль) з наступним гідрохлоридом метиламіну (9 мг, 0.13 ммоль). Суміш перемішували при кімнатній температурі протягом 1 години, після цього часу, реакційну суміш влили в 1 н соляну кислоту і екстрагували етилацетатом. Органічну фазу промили сольовим розчином, висушили (Na2SO4) і сконцентрували. Очищення за допомогою колонкової флешхроматографії (елюент EtOAc: н-гептан градієнт 0:1-1:1) дало сполуку, вказану в заголовку, у + вигляді безбарвної солі (23 мг, 45%). MS: (MH) 441.5. Приклад 23 19 UA 114649 C2 O HN O N F F O F 5 (S)-N-етил-2-(4-(2-фторфеніл)-5,5-біс(4-фторфеніл)-2-оксооксазолідин-3-іл)ацетамід Сполуку, вказану в заголовку, одержали за аналогією з прикладом 22 з [5,5-біс-(4-фторфеніл)-4-(2-фтор-феніл)-2-оксо-оксазолідин-3-іл]-оцтової кислоти (Приклад 22A) і гідрохлориду + етиламіну з одержанням безбарвної соли. MS: (MH) 455.5. Приклад 24 N O N F F O F 10 15 [(S)-5,5-біс-(4-фтор-феніл)-4-(2-фтор-феніл)-2-оксо-оксазолідин-3-іл]-ацетонітрил До суміші (S)-4-(2-фторфеніл)-5,5-біс(4-фторфеніл)оксазолідин-2-ону (0.035 г, 0.09 ммоль) (Приклад 10B) і 3-(хлорметил)-1,2,4-оксадіазолу (0.015 г, 0.12 ммоль) в ТГФ в атмосфері аргону додали гідрид натрію (0.008 г, 60% дисперсія в мінеральному маслі, 0.19 ммоль) і реакційну суміш перемішували протягом 24 годин. Після закінчення цього часу суміш нейтралізували смолою Amberlite® IR120, відфільтрували і сконцентрували. Очищення за допомогою перекристалізації з 20% EtOAc/н-гептан дало продукт, вказаний в заголовку, у вигляді білих + кристалів. MS: (MH) 408.1. Приклад 25 N N HN F O N F O F 20 (S)-3-((4H-1,2,4-триазол-3-іл)метил)-4-(2-фторфеніл)-5,5-біс(4-фторфеніл) оксазолідин-2-он A) (S)-2-(4-(2-фторфеніл)-5,5-біс(4-фторфеніл)-2-оксооксазолідин-3-іл)ацетогідразид У розчин [5,5-біс-(4-фтор-феніл)-4-(2-фтор-феніл)-2-оксо-оксазолідин-3-іл]-оцтової кислоти етилового ефіру (0.17 г, 0.36 ммоль, Приклад 10) в етанолі (3 мл) додали моногідрат гідразину 20 UA 114649 C2 5 10 (0.18 мл, 3.62 ммоль) і суміш нагрівали hgb 80 °C протягом 2 годин. Суміш потім евапорували досуху, одержавши сполуку, вказану в заголовку, у вигляді безбарвної піни (0.16g, 100%). MS: + (MH) 442.3. B) (S)-3-((4H-1,2,4-триазол-3-іл)метил)-4-(2-фторфеніл)-5,5-біс(4-фторфеніл)оксазолідин-2он У розчин (S)-2-(4-(2-фторфеніл)-5,5-біс(4-фторфеніл)-2-оксооксазолідин-3-іл)ацетогідразиду (0.05 г, 0.1 ммоль) в NMP (0.6 мл) додали гідрохлорид етилформімідату (0.06 г, 0.6 ммоль) і суміш нагрівали до 200 °C в мікрохвильовій печі протягом 15 хвилин. Реакційну суміш потім розбавили етилацетатом, промили два рази водою, сольовим розчином, висушили (Na 2SO4) і сконцентрували. Очищення за допомогою колонкової флеш-хроматографії (елюент EtOAc: нгептан градієнт 4:6-7:3) дало сполуку, вказану в заголовку, у вигляді кристалічного осаду (8 мг, + 15%). MS: (MH) 451.3. Приклад 26 O O O N F O N F 15 20 Етил 2-(5,5-біс(4-фторфеніл)-2-оксо-4-(піридин-3-іл)оксазолідин-3-іл)ацетат A) етил 2-(трет-бутоксикарбоніламіно)-2-(піридин-3-іл)ацетат Сполуку, вказану в заголовку, одержали з етил 2-аміно-2-(піридин-3-іл)ацетату за аналогією + з прикладом 4A з одержанням безбарвного кристалічного осаду. MS: (MH) 284.1. B) етил 2-(5,5-біс(4-фторфеніл)-2-оксо-4-(піридин-3-іл)оксазолідин-3-іл)ацетат Сполуку, вказану в заголовку одержали з етил 2-(трет-бутоксикарбоніламіно)-2-(піридин-3іл)ацетату і (4-фторфеніл)магнію броміду за аналогією з прикладом 1 (стадії A, B, C) з + наступною стадією С прикладу 1, одержавши жовтогарячу піну. MS: (MH) 439.4. Приклад 27 H2N O N O F O N F 25 2-(5,5-біс(4-фторфеніл)-2-оксо-4-(піридин-3-іл)оксазолідин-3-іл)ацетамід Сполуку, вказану в заголовку одержали з етил 2-(5,5-біс(4-фторфеніл)-2-оксо-4-(піридин-3іл)оксазолідин-3-іл)ацетату (Приклад 26) за аналогією з прикладом 1 (стадії D, E), одержавши + білу піну. MS: (MH) 410.4. Приклад 28 21 UA 114649 C2 O H2N O N F F O F F 5 10 15 (S)-2-(5,5-біс(3,4-дифторфеніл)-2-оксо-4-фенілоксазолідин-3-іл)ацетамід A) (S)-етил 2,2-біс(3,4-дифторфеніл)-2-гідрокси-1-фенілетилкарбамат Одержавши з (S)-метил 2-(етоксикарбоніламіно)-2-фенілацетату і реактиву Гриньяра, одержаного з 1,2-дифтор-4-йодобензолу за аналогією з прикладом 2A, одержали сполуку, + вказану в заголовку, у вигляді білої піни. MS: (M-OH) 416. B) (S)-5,5-біс(3,4-дифторфеніл)-4-фенілоксазолідин-2-он У розчин (S)-етил 2,2-біс(3,4-дифторфеніл)-2-гідрокси-1-фенілетилкарбамату (1.5 г, 3.5 ммоль) в EtOH додали трет-бутилат калію (0.4 г, 3.5 ммоль) і реакційну суміш перемішували при 80 °C протягом 30 хвилин. Реакційну суміш потім підкислили за допомогою солі Amberlite® IR120, відфільтрували і сконцентрували з одержанням сполуки, вказаної в заголовку, у вигляді білого осаду (1.2 г, 89%). MS: (M-H) 386.5. C) (S)-2-(5,5-біс(3,4-дифторфеніл)-2-оксо-4-фенілоксазолідин-3-іл)ацетамід Сполуку, вказану в заголовку, одержали з (S)-5,5-біс(3,4-дифторфеніл)-4-фенілоксазолідин+ 2-ону за аналогією з прикладом 1 (стадії C, D, E) з одержанням білої піни. MS: (MH) 445.3. Приклад 29 H2N O O N Cl O Cl 20 2-[(S)-5,5-біс-(3-хлор-феніл)-2-оксо-4-феніл-оксазолідин-3-іл]-ацетамід Сполуку, вказану в заголовку, одержали з (S)-метил 2-(етоксикарбоніламіно)-2-фенілацетату і (3-хлорфеніл)магнію броміду за аналогією з прикладом 28, з одержанням білого осаду. MS: + (MH, 2Cl) 441.3. Приклад 30 O H2N N O F O N F 25 2-(5,5-біс(4-фторфеніл)-2-оксо-4-(піридин-2-іл)оксазолідин-3-іл)ацетамід Сполуку, вказану в заголовку, одержали з етил 2-аміно-2-(піридин-2-іл)ацетату за аналогією + з прикладом 27 з одержанням безбарвної соли. MS: (MH) 410.5. 22 UA 114649 C2 Приклад 31 O O N O O F F F F 5 10 15 20 25 30 35 40 [(4RS,5SR)-5-(4-фтор-феніл)-2-оксо-4-(3-трифторметил-феніл)-оксазолідин-3-іл]-оцтової кислоти етиловий ефір A) (4-фторфеніл)(2-(3-(трифторметил)феніл)-1,3-дитіан-2-іл)метанол У розчин 2-(3-(трифторметил)феніл)-1,3-дитіану (2.00 г, 7.57 ммоль, J. Organometallic Chem. 2000, 220) в ТГФ (40 мл) додали n-BuLi (5.2 мл, 8.32 ммоль, 1.6 M в гексані) при -78 °C. його перемішували при -78 °C протягом 2 годин, потім додали розчин 4-фторбензальдегіду (0.85 мл, 7.8 ммоль) в ТГФ (6 мл). Суміш перемішували при -78 °C протягом 1 години і потім дали нагрітися до кімнатної температури. Потім її влили в насичений розчин хлориду амонію. Суміш екстрагували EtOAc. Об’єднанні органічні шари промили сольовим розчином, висушили (Na2SO4) і сконцентрували. Очищення за допомогою колонкової флеш-хроматографії (елюент EtOAc: н-гептан градієнт 0:1-3:7) дало сполуку, вказану в заголовку, у вигляді безбарвної солі + (2.70 г, 92%). MS: (M+ NH4) 406.3. B) 2-(4-фторфеніл)-2-гідрокси-1-(3-(трифторметил)феніл)етанон У розчин (4-фторфеніл)(2-(3-(трифторметил)феніл)-1,3-дитіан-2-іл)метанолу (2.67 г, 6.9 ммоль) в ацетонітрилі (12 мл) і воді (2 мл) по краплях додали розчин [біс(трифторацетокси)йод]бензолу (4.43 г, 10.3 ммоль) в ацетонітрилі (8 мл). Реакційну суміш перемішували при кімнатній температурі протягом 1 години, потім обережно влили в насичений розчин гідрокарбонату натрію. Суміш екстрагували EtOAc. Об’єднанні органічні шари промили сольовим розчином, висушили (Na2SO4) і сконцентрували. Очищення за допомогою колонкової флеш-хроматографії (елюент EtOAc: н-гептан градієнт 0:1-4:6) дало сполуку, вказану в заголовку, у вигляді безбарвного масла (0.5 г, 25%). MS: (M-H) 297.2. C) (2-(4-фторфеніл)-2-гідрокси-1-(3-(трифторметил)феніл)етанон O-бензилоксим У розчин 2-(4-фторфеніл)-2-гідрокси-1-(3-(трифторметил)феніл)етанону (487 мг, 1.6 ммоль) і O-бензилгідроксиламіну гідрохлориду (287 мг, 1.8 ммоль) в ТГФ (7 мл) і воді (3 мл) додали ацетат натрію (147 мг, 1.8 ммоль). Реакційну суміш нагрівали до кипіння із зворотнім холодильником протягом 12 годин, потім охолодили і розділили між EtOAc і водою. Суміш екстрагували двічі EtOAc і об’єднанні органічні шари промили сольовим розчином, висушили (Na2SO4) і сконцентрували. Очищення за допомогою колонкової флеш-хроматографії (елюент EtOAc: н-гептан градієнт 0:1-3:7) дало сполуку, вказану в заголовку, у вигляді безбарвного + масла (603 мг, 92%). MS: (M+H) 404.3. D) (1SR,2RR)-2-аміно-1-(4-фторфеніл)-2-(3-(трифторметил)феніл)етанол У розчин (2-(4-фторфеніл)-2-гідрокси-1-(3-(трифторметил)феніл)етанон O-бензилоксиму (200 мг, 0.5 ммоль) в метанолі (5 мл) додали 10% Pd/C. Суміш перемішували при 1 атмосфері водню (балон) протягом 16 годин, після цього часу відфільтрували через Hyflo і сконцентрували з одержанням сполуки, вказаної в заголовку, у вигляді безбарвного масла (111 мг, 75%). MS: + (M+H) 300.2 E) [(4RS,5SR)-5-(4-фтор-феніл)-2-оксо-4-(3-трифторметил-феніл)-оксазолідин-3-іл]-оцтової кислоти етиловий ефір Сполуку, вказану в заголовку, одержали з (1SR,2RR)-2-аміно-1-(4-фторфеніл)-2-(3+ (трифторметил)феніл)етанолу за аналогією з прикладом 1 (стадії B, C). MS: (M+H) 412.3. Приклад 32 23 UA 114649 C2 O O O N O F F F F 5 10 15 20 25 30 35 40 45 [(4RS,5SR)-4-(4-фтор-феніл)-2-оксо-5-(3-трифторметил-феніл)-оксазолідин-3-іл]-оцтової кислоти етиловий ефір A) трет-бутил 1-(4-фторфеніл)-2-(метокси(метил)аміно)-2-оксоетилкарбамат До суміші 2-(трет-бутоксикарбоніламіно)-2-(4-фторфеніл)оцтової кислоти (14.5 г, 54 ммоль), N,O-диметилгідроксиламіну гідрохлориду (8.4 г, 86 ммоль), N-метилморфоліну (9.5 мл, 86 ммоль) і диметиламінопіридину (0.7 г, 5 ммоль) у дихлорметані (150 мл) і диметилформаміді (32 мл) при 0 °C додали 1-етил-3-(3-диметиламінопропіл)карбодіімід (12.4 г, 5 ммоль). Реакційній суміші дали нагрітися до кімнатної температури і перемішували протягом 2 годин, потім влили в холодну 1 н соляну кислоту і екстрагували EtOAc. Органічні шари промили водою, насиченим розчином гідрокарбонату натрію, сольовим розчином, висушили (Na 2SO4) і сконцентрували з + одержанням сполуки, вказаної в заголовку, у вигляді білого осаду (14.5 г, 99%). MS: (M+H) 313.4. B) трет-бутил 1-(4-фторфеніл)-2-оксо-2-(3-(трифторметил)феніл)етилкарбамат 3-йодбензотрифторид (2.3 мл, 16 ммоль) додали по краплях до ізопропілмагнію хлорид-літій хлориду (12.3 мл, 16 ммоль,1.3 M в ТГФ), підтримуючи температуру нижче 40 °C з використанням водяної ванни. Через 30 хвилин додали в розчин трет-бутил 1-(4-фторфеніл)-2(метокси(метил)аміно)-2-оксоетилкарбамат (2.00 г, 6.4 ммоль) в ТГФ (26 мл) при 0 °C. Реакційну суміш перемішували при 0 °C протягом 15 хвилин і при кімнатній температурі протягом 1 години, потім влили в насичений розчин хлориду амонію і екстрагували EtOAc. Органічні шари промили сольовим розчином, висушили (Na2SO4) і сконцентрували. Очищення за допомогою колонкової флеш-хроматографії (елюент EtOAc: н-гептан градієнт 0:1-1:1) дало сполуку, вказану в заголовку, у вигляді білого осаду (2.42 г, 95%). MS: (M-H) 396.4. C) трет-бутил (1RS,2SR)-1-(4-фторфеніл)-2-гідрокси-2-(3-(трифторметил)феніл) етилкарбамат У розчин трет-бутил 1-(4-фторфеніл)-2-оксо-2-(3-(трифторметил)феніл)етилкарбамату (2.4 г, 6.0 ммоль) у метанолі (40 мл) додали борогідрид натрію (248 мг, 6.6 ммоль), барботували. Суміш перемішували при кімнатній температурі протягом 30 хвилин. Суміш влили у воду і перемішували протягом 10 хвилин, потім відфільтрували, промили водою і висушили, одержавши продукт у вигляді білого осаду (2.23 г, 95%). MS: (M-H) 398.5 D) (1SR,2RS)-2-аміно-2-(4-фторфеніл)-1-(3-(трифторметил)феніл)етанол До суспензії трет-бутил (1RS,2SR)-1-(4-фторфеніл)-2-гідрокси-2-(3(трифторметил)феніл)етилкарбамату (2.2 г, 5.6 ммоль) у дихлорметані (35 мл) додали трифтороцтову кислоту (4.8 мл, 62.5 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 90 хвилин, і потім обережно влили в насичений розчин гідрокарбонату натрію та екстрагували дихлорметаном. Органічні шари промили сольовим розчином, висушили (Na2SO4) і сконцентрували з одержанням продукту, вказаного в заголовку, у вигляді безбарвної + солі (1.8 г,100%). MS: (M+H) 300.4 E) (4RS,5SR)-4-(4-фторфеніл)-5-(3-(трифторметил)феніл)оксазолідин-2-он Розчин (1SR,2RS)-2-аміно-2-(4-фторфеніл)-1-(3-(трифторметил)феніл)етанолу (1.7 г, 5.7 ммоль) і триетиламіну (2.4 мл, 16.9 ммоль) у дихлорметані (45 мл) охолодили до 0 °C. Потім додали дифосген (375 мкл, 3.1 ммоль) у дихлорметані (5 мл). Реакційну суміш перемішували при 0 °C протягом 30 хвилин, потім розділили між 1 M соляною кислотою і дихлорметаном. Органічні шари промили сольовим розчином, висушили (Na 2SO4) і сконцентрували. Очищення за допомогою колонкової флеш-хроматографії (елюент EtOAc: н-гептан градієнт 0:1-1:0) дало + сполуку, вказану в заголовку, у вигляді білого осаду (1.4 г, 77%). MS: (M+H) 326.4. F) [(4RS,5SR)-4-(4-фтор-феніл)-2-оксо-5-(3-трифторметил-феніл)-оксазолідин-3-іл]-оцтової кислоти етиловий ефір 24 UA 114649 C2 Сполуку, вказану в заголовку, одержали за аналогією з прикладом 1 стадія C з (4RS,5SR)-4(4-фторфеніл)-5-(3-(трифторметил)феніл)оксазолідин-2-ону. + MS: (M+H) 412.2. Приклад 33 O O O N O F F F F 5 10 F F (4RS,5SR)-2-оксо-4,5-біс-(3-трифторметил-феніл)-оксазолідин-3-іл]-оцтової кислоти етиловий ефір Сполуку, вказану в заголовку, одержали за аналогією з прикладом 31 з використанням як вихідної речовини 2-(3-(трифторметил)феніл)-1,3-дитіану і 3-(трифторметил)бензальдегіду. + MS: (M+H) 462.0. Приклад 34 O O O N O F 15 F (4RS,5SR)-2-оксо-4,5-біс-(4-фторфеніл)-оксазолідин-3-іл]-оцтової кислоти етиловий ефір Сполуку, вказану в заголовку, одержали за аналогією з прикладом 31 з використанням як + вихідної речовини 2-(4-фторфеніл)-1,3-дитіану і 4-фторбензальдегіду. MS: (M+H) 362.2. Приклад 35 O O O N F O F 20 [(S)-4-трет-бутил-5,5-біс-(4-фтор-феніл)-2-оксо-оксазолідин-3-іл]-оцтової кислоти етиловий ефір Сполуку, вказану в заголовку, одержали за аналогією з прикладом 4, використовуючи (S)+ метил 2-аміно-3,3-диметилбутаноату гідрохлорид. MS: (M+H) 417.4. Приклад 36 25 UA 114649 C2 O HN O N O F F F F 5 2-((4RS,5SR)-4-(4-фторфеніл)-2-оксо-5-(3-(трифторметил)феніл)оксазолідин-3-іл)-Nметилацетамід Сполуку, вказану в заголовку, одержали з [(4RS,5SR)-4-(4-фтор-феніл)-2-оксо-5-(3трифторметил-феніл)-оксазолідин-3-іл]-оцтової кислоти етилового ефіру (Приклад 32E) за + аналогією з прикладом 22. MS: (M+H) 397.4. Приклад 37 O HN O N O F F F F 10 N-етил-2-((4RS,5SR)-4-(4-фторфеніл)-2-оксо-5-(3-(трифторметил)феніл)оксазолідин-3іл)ацетамід Сполуку, вказану в заголовку, одержали з [(4RS,5SR)-4-(4-фтор-феніл)-2-оксо-5-(3трифторметил-феніл)-оксазолідин-3-іл]-оцтової кислоти етилового ефіру (Приклад 32E) за + аналогією з прикладом 23. MS: (M+H) 411.4. Приклад 38 N O N O F F F 15 20 F 2-((4RS,5SR)-4-(4-фторфеніл)-2-оксо-5-(3-(трифторметил)феніл)оксазолідин-3іл)ацетонітрил Сполуку, вказану в заголовку, одержали з [(4RS,5SR)-4-(4-фтор-феніл)-2-оксо-5-(3трифторметил-феніл)-оксазолідин-3-іл]-оцтової кислоти етилового ефіру (Приклад 32E) за + аналогією з прикладом 24. MS: (M+H) 365.4. Приклад 39 26 UA 114649 C2 N O O N O F F F F (4RS,5SR)-4-(4-фторфеніл)-3-(оксазол-2-ілметил)-5-(3-(трифторметил)феніл) оксазолідин-2он 5 Сполуку, вказану в заголовку, одержали з [(4RS,5SR)-4-(4-фтор-феніл)-2-оксо-5-(3трифторметил-феніл)-оксазолідин-3-іл]-оцтової кислоти етилового ефіру (Приклад 32E) і 2+ (хлорметил)оксазолу за аналогією з прикладом 24. MS: (M+H) 407.5. Приклад 40 N O O N O F F F F 10 15 20 25 30 35 ((4RS,5SR)-4-(4-фторфеніл)-3-((4-метилоксазол-2-іл)метил)-5-(3-(трифторметил) феніл)оксазолідин-2-он Сполуку, вказану в заголовку, одержали з [(4RS,5SR)-4-(4-фтор-феніл)-2-оксо-5-(3трифторметил-феніл)-оксазолідин-3-іл]-оцтової кислоти етилового ефіру (Приклад 32E) і 2+ (хлорметил)-5-метилоксазолу за аналогією з прикладом 24. MS: (M+H) 421.4. Аналіз блокади каналу KCa3.1; Аналіз припливу талію Аналіз припливу талію здійснювався на клітинах CHOK1, надекспресуючих KCa3.1, що одержані від Evotec і зберігаються в середовищі MEM Alpha з додаванням 10% фетальної бичачої сироватки, 100 U/мл пеніцилін/100 мг/мл стрептоміцин і 250 мг/мл G418. Клітини CHOK1 дикого типу пасирували з використанням середовища F12/Ham’s з додаванням 10% фетальної бичачої сироватки, 2 мМ глутаміну, 100 U/мл пеніцилін/100 мг/мл стрептоміцин. Всі клітини культивували в колбах T175. За день до аналізу клітини збирали з культуральних колб з використанням звичайного розчеплення трипсином. Клітини підрахували і щільності вирівняли і розподілили в 384-ямкові покриті полі-D-лізином планшети при 7500 клітин/50мкл/ямка, планшети для аналізу інкубували протягом ночі в CO2-інкубаторі при 37 °C. На наступний день ростове середовище видалили з наступним додаванням 25мкл/ямка TM завантажувального барвника FluxOR (Invitrogen) в буфері для аналізу на основі глюконату (135 мМ глюконат натрію, 2.5 мМ глюконат калію, 2 мМ CaNO3, 1 мМ MgNO3, 10 мМ HEPES (кислотний), 5 мМ глюкоза, pH доведений до 7.4). Планшети для аналізу інкубували протягом 1 години при 37 °C. Потім завантажувальний барвник замінили глюконатним буфером для аналізу, який містить пробенецид. Сполуки, розведені в глюконатному буфері вмістили в планшети для аналізу (25 мкл/ямку) з наступною інкубацією протягом 20 хвилин при кімнатній температурі. Потім планшети для аналізу вмістили в планшетний рідер Fluorometric Imaging Plate Reader (FLIPR), базову лінію зчитували протягом 20 секунд захоплення, з наступним додаванням 25 мкл/ямку розчину, 27 UA 114649 C2 5 активуючого канали, в глюконатному буфері - для KCa3.1 клітин використовували талій (3.3 мМ)/іономіцин (1 мкМ), для дикого типу тільки іономіцин, потім вимірювали флуоресценцію протягом наступних 90 секунд. Сполуки I даного винаходу показали значення IC 50 в аналізі талію від 10 нм до 20 мкМ, переважно від 10 нМ до 1 мкМ для припливу талію. В наступній таблиці показані виміряні значення для деяких вибраних сполук даного винаходу. Приклад № 1 2 3 4 5 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 24 23 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 10 15 IC50 талій (мкМ) 0.86 0.83 0.63 3.14 0.66 1.14 1.34 0.72 7.15 6.05 1.9 0.25 1.1 0.34 3.6 0.7 1 0.88 3.7 0.74 2.2 0.65 0.6 1.48 1.96 10 9.2 6.7 0.77 6.7 17.5 7.54 0.6 1.56 6.7 0.45 6.6 4.9 1.6 11 6.9 Електрофізіологічна фіксація потенціалу ® Сполуки тестували з використанням PatchXpress (Model 7000A, Molecular Devices, Union City CA) на CHO клітинах, надекспресуючих hKCa3.1 в компанії ChanTest Corporation, 14656 Нео Паквей, Клівленд, Огайо. Сполуки I даного винаходу показали значення IC50 в аналізі фіксації потенціалу від 10 нМ до 10 мкМ, переважно від 10 нМ до 1 мкМ для фіксації потенціалу. В наступній таблиці показані виміряні значення для деяких вибраних сполук даного винаходу. 28
ДивитисяДодаткова інформація
Назва патенту англійською3,4-disubstituted oxazolidinone derivatives and their use as inhibitors of the calcium activated potassium channel
Автори англійськоюGreen, Luke, Wang, Haiyan
Автори російськоюГрин Люк, Ван Хайян
МПК / Мітки
МПК: A61K 31/421, C07D 263/32, C07D 413/06, C07D 413/04, C07D 263/20, A61K 31/422
Мітки: калієвих, 3,4-дизаміщеного, оксазолідинону, інгібіторів, похідні, застосування, каналів, кальцій-активованих
Код посилання
<a href="https://ua.patents.su/32-114649-pokhidni-34-dizamishhenogo-oksazolidinonu-ta-kh-zastosuvannya-yak-ingibitoriv-kalcijj-aktivovanikh-kaliehvikh-kanaliv.html" target="_blank" rel="follow" title="База патентів України">Похідні 3,4-дизаміщеного оксазолідинону та їх застосування як інгібіторів кальцій-активованих калієвих каналів</a>












