Сполуки 1н-індолпіридинкарбоксаміду і 1н-індолпіперидинкарбоксаміду, спосіб їх одержання і фармацевтична композиція, яка їх містить
Номер патенту: 89544
Опубліковано: 10.02.2010
Автори: Пуйоль Жан-Франсуа, Бріон Жан-Даніель, Левуарьє Ерік, Вайссманн Діна, Ле Рідан Ален, Бінтен Фабріс, Разон Патрік, Ренко Зафіарізоа Долор, Арпі Катрін, Разе Родольф
Формула / Реферат
1. Сполука формули:
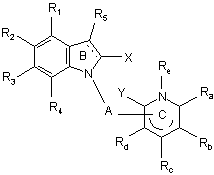 , (I)
, (I)
в якій:
А являє собою двовалентний радикал:
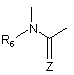 ,
, 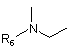 або
або 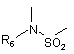 ,
,
де:
Z являє собою атом кисню або атом сірки,
R6 являє собою:
атом водню,
лінійну або розгалужену (С1-С6)алкільну групу, С(О)-АА, в якій АА являє собою амінокислотний радикал, лінійну або розгалужену (С1-С6)алкоксикарбонільну групу, CHR’-O-C(O)-R", в якій R’ являє собою атом водню або лінійну або розгалужену (С1-С6)алкільну групу і R" являє собою лінійну або розгалужену (С1-С6)алкільну групу,
лінійну або розгалужену (С2-С6)алкенільну групу, арильну групу, арил-(С1-С6)алкільну групу, в якій алкільна частина є лінійною або розгалуженою, лінійну або розгалужену (С1-С6)полігалоалкільну групу,
або лінійний або розгалужений (С1-С6)алкільний ланцюг, заміщений одним або більше атомами галогену, однією або більше гідроксигрупами, лінійними або розгалуженими (С1-С6)алкоксигрупами або аміногрупами, необов’язково заміщеними однією або двома однаковими або різними, лінійними або розгалуженими (С1-С6)алкільними групами,
в кільці В
![]() являє собою одинарний або подвійний зв’язок,
являє собою одинарний або подвійний зв’язок,
в кільці С
![]() являє собою одинарний або подвійний зв’язок, кільце С містить, найбільше, тільки один одинарний зв’язок,
являє собою одинарний або подвійний зв’язок, кільце С містить, найбільше, тільки один одинарний зв’язок,
R1, R2, R3 і R4, які можуть бути однаковими або відрізнятись, кожний незалежно від іншого, являють собою:
атом водню або галогену,
лінійну або розгалужену (С1-С6)алкільну групу, лінійну або розгалужену (С1-С6)алкоксигрупу, гідроксигрупу, ціаногрупу, нітрогрупу, лінійну або розгалужену (С1-С6)полігалоалкільну групу, аміногрупу (необов’язково заміщену однією або двома лінійними або розгалуженими (С1-С6)алкільними і/або лінійними або розгалуженими (С2-С6)алкенільними групами, алкільна і алкенільна групи можуть бути однаковими або відрізнятись),
або лінійний або розгалужений (С1-С6)алкільний ланцюг, заміщений одним або більше атомами галогену, однією або більше гідроксигрупами, лінійними або розгалуженими (С1-С6)алкоксигрупами або аміногрупами, необов’язково заміщеними однією або двома однаковими або різними, лінійними або розгалуженими (С1-С6)алкільними групами,
R5 являє собою:
атом водню,
лінійну або розгалужену (С1-С6)алкільну групу, аміналкільну групу, в якій алкільна частина являє собою лінійний або розгалужений ланцюг з 1-6 атомів вуглецю, або лінійну або розгалужену (С1-С6)гідроксіалкільну групу,
X і Y, які можуть бути однаковими або відрізнятись, кожний незалежно від іншого, являють собою:
атом водню або лінійну або розгалужену (С1-С6)алкільну групу,
Ra, Rb, Rc і Rd, які можуть бути однаковими або відрізнятись, кожний незалежно від інших, являють собою:
атом водню або галогену,
лінійну або розгалужену (С1-С6)алкільну групу, гідроксигрупу, лінійну або розгалужену (С1-С6)алкоксигрупу, ціаногрупу, нітрогрупу, лінійну або розгалужену (С1-С6)полігалоалкільну групу, аміногрупу (необов’язково заміщену однією або двома однаковими або різними лінійними або розгалуженими (С1-С6)алкільними групами),
або лінійний або розгалужений (С1-С6)алкільний ланцюг, заміщений однією або більше групами, вибраними з галогену, гідрокси, лінійного або розгалуженого (С1-С6)алкокси і аміно, необов’язково заміщених однією або двома однаковими або різними, лінійними або розгалуженими (С1-С6)алкільними групами,
розуміється, що, коли А зв’язаний з кільцем С на атомі вуглецю, який несе один із замісників Ra, Rb, Rc, Rd або Y, і згаданий зв’язувальний атом вуглецю також несе подвійний зв’язок, тоді відповідний замісник Ra, Rb, Rc, Rd або Y відсутній,
Re являє собою:
атом водню,
лінійну або розгалужену (С1-С6)алкільну групу; арил-(С1-С6)алкільну групу, в якій алкільна частина є лінійною або розгалуженою; лінійну або розгалужену (С2-С6)алкенільну групу; лінійну або розгалужену (С2-С6)алкінільну групу; лінійний або розгалужений (С1-С6)алкільний ланцюг, заміщений однією або більше групами, які вибирають з гідрокси, аміно (необов’язково заміщеного однією або двома, однаковими або різними, лінійними або розгалуженими (С1-С6)алкільними групами), лінійного або розгалуженого (С1-С6)алкокси, і NR7R8, в якій R7 і R8, разом з атомом азоту, який несе їх, утворюють необов’язково заміщений 4-8-членний гетероцикл, який необов’язково містить один або більше зв’язків в гетероциклі і необов’язково містить в циклічній системі другий гетероатом, який вибирають з атома кисню і атома азоту; або лінійний або розгалужений (С2-С6)алкенільний ланцюг, заміщений тими ж групами, що і алкільний ланцюг, або лінійний або розгалужений (С2-С6)алкінільний ланцюг, заміщений тими ж групами, що і алкільний ланцюг,
її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою,
розуміється, що:
як необов’язково заміщений 4-8-членний гетероцикл, який необов’язково містить один або більше зв’язків в гетероциклі і необов’язково містить в циклічній системі другий гетероатом, який вибирають з атома кисню і атома азоту, може бути згаданий, без будь-якого обмеження, піролідин, піперидин, азепан, піперазин і морфолін, ці гетероцикли необов’язково заміщені (включаючи на другому атомі азоту піперазину) однією або більше однаковими або різними групами, які вибирають з лінійного або розгалуженого (С1-С6)алкілу, лінійного або розгалуженого (С1-С6)гідроксіалкілу, лінійного або розгалуженого (С1-С6)алкоксі-(С1-С6)алкілу, CO2Rv, CO2-Rw-NRvR’v, CO2-Rw-ORv (в якій Rv являє собою атом водню або лінійну або розгалужену (С1-С6)алкільну групу, R’v є таким ж, як визначено для Rv, і Rw являє собою лінійний або розгалужений (С1-С6)алкіленовий ланцюг), арилу, арилоксикарбонілу, лінійного або розгалуженого арил-(С1-С6)алкоксикарбонілу, необов’язково заміщеного циклоалкілу, необов’язково заміщеного циклоалкілалкілу, необов’язково заміщеного гетероциклоалкілу, необов’язково заміщеного гетероциклоалкілалкілу і аміноалкілу, в якому алкільна частина являє собою лінійний або розгалужений ланцюг від 1 до 6 атомів вуглецю і аміночастина необов’язково заміщена однією або двома однаковими або різними лінійними або розгалуженими (С1-С6)алкільними групами,
арил означає фенільну або нафтильну групу, кожна є необов’язково заміщеною одним або більше атомами галогену, нітро, аміно, лінійною або розгалуженою (С1-С6)алкільною або лінійною або розгалуженою (С1-С6)алкоксигрупами,
циклоалкіл означає насичену 4-8-членну моноциклічну групу,
циклоалкілалкіл означає циклоалкілалкільну групу, в якій алкільна група означає лінійний або розгалужений ланцюг від 1 до 6 атомів вуглецю і циклоалкільна група означає насичену 4-8-членну моноциклічну групу,
гетероциклоалкіл означає насичену 4-8-членну моноциклічну групу, яка містить 1 або 2 гетероатоми, які вибирають з азоту, кисню і сірки,
гетероциклоалкілалкіл означає гетероциклоалкілалкільну групу, в якій алкільна група означає лінійний або розгалужений ланцюг від 1 до 6 атомів вуглецю і гетероциклоалкільна група означає насичену 4-8-членну моноциклічну групу, яка містить 1 або 2 гетероатоми, які вибирають з азоту, кисню і сірки,
вираз "необов’язково заміщений", коли він стосується груп циклоалкілу, циклоалкілалкілу, гетероциклоалкілу і гетероциклоалкілалкілу, означає, що ці групи можуть бути заміщені одним або більше однаковими або різними замісниками, які вибирають з лінійного або розгалуженого (С1-С6)алкілу, лінійного або розгалуженого (С1-С6)гідроксіалкілу, лінійного або розгалуженого (С1-С6)алкоксі(С1-С6)алкілу, карбокси, лінійного або розгалуженого (С1-С6)алкоксикарбонілу і аміноалкілу, в якому алкільна частина являє собою лінійний або розгалужений ланцюг від 1 до 6 атомів вуглецю і аміночастина необов’язково заміщена однією або двома однаковими або різними лінійними або розгалуженими (С1-С6)алкільними групами,
амінокислотний радикал означає радикали аланілу, аргінілу, аспарагінілу, a-аспартилу, цистеїнілу, a-глутамілу, глутамінілу, гліцилу, гістидилу, ізолейцилу, лейцилу, лізилу, метіонілу, фенілаланілу, пролілу, серилу, треонілу, триптофілу, тирозилу і валілу.
2. Сполука формули (І) за п. 1, яка відрізняється тим, що А являє собою двовалентний радикал:
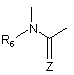 ,
,
де R6 є таким же, як визначено для формули (І), і Z являє собою атом кисню, її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
3. Сполука формули (І) за пп. 1 або 2, яка відрізняється тим, що R6 являє собою атом водню, її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
4. Сполука формули (І) за будь-яким з пп. 1-3, яка відрізняється тим, що R1, R2, R3 і R4 являють собою атом водню, атом галогену або лінійну або розгалужену (С1-С6)алкоксигрупу, її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
5. Сполука формули (І) за будь-яким з пп. 1-4, яка відрізняється тим, що R5 являє собою атом водню або лінійну або розгалужену (С1-С6)алкільну групу, її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
6. Сполука формули (І) за будь-яким з пп. 1-5, яка відрізняється тим, що X i Y являють собою атом водню або лінійну або розгалужену (С1-С6)алкільну групу, її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
7. Сполука формули (І) за будь-яким з пп. 1-6, яка відрізняється тим, що Ra, Rb, Rc і Rd являють собою атом водню, її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
8. Сполука формули (І) за будь-яким з пп. 1-7, яка відрізняється тим, що Re являє собою атом водню або лінійну або розгалужену (С1-С6)алкільну групу, або лінійну або розгалужену (С2-С6)алкенільну групу, її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
9. Сполука формули (І) за будь-яким з пп. 1-8, яка відрізняється тим, що вона являє собою сполуки формули (ІА):
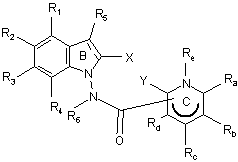 , (IA)
, (IA)
в якій ![]() , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
, X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
10. Сполука формули (І) за будь-яким з пп. 1-9, яка відрізняється тим, що вона являє собою сполуки формули (IB):
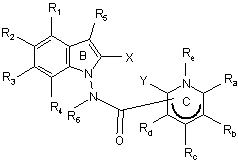 , (IB)
, (IB)
в якій ![]() , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
, X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
11. Сполука формули (І) за будь-яким з пп. 1-10, яка відрізняється тим, що вона являє собою сполуки формули (IС):
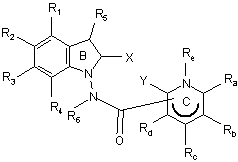 , (IC)
, (IC)
в якій ![]() , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
, X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
12. Сполука формули (І) за будь-яким з пп. 1-11, яка відрізняється тим, що вона являє собою сполуки формули (ID):
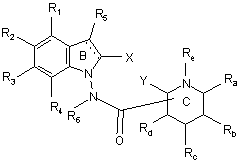 , (ІD)
, (ІD)
в якій ![]() , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
, X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
13. Сполука формули (І) за будь-яким з пп. 1-12, яка відрізняється тим, що вона являє собою сполуки формули (IE):
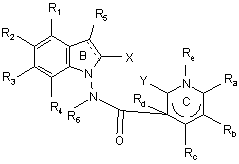 , (IE)
, (IE)
в якій ![]() , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
, X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
14. Сполука формули (І) за будь-яким з пп. 1-13, яка відрізняється тим, що вона являє собою сполуки формули (IF):
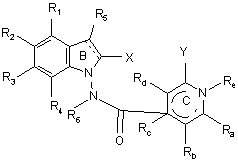 , (IF)
, (IF)
в якій ![]() , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
, X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
15. Сполука формули (І) за будь-яким з пп. 1-14, яка відрізняється тим, що вона являє собою сполуки формули (IG):
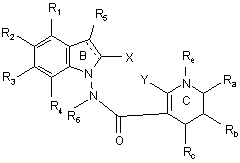 , (IG)
, (IG)
в якій ![]() , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули, її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
, X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули, її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
16. Сполука формули (І) за будь-яким з пп. 1-15, яка відрізняється тим, що вона являє собою сполуки формули (ІН):
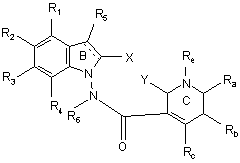 , (IH)
, (IH)
в якій ![]() , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
, X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
17. Сполука формули (І) за будь-яким з пп. 1-16, яка відрізняється тим, що вона являє собою сполуки формули (IJ):
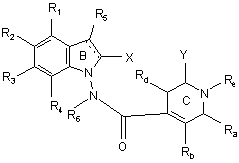 , (IJ)
, (IJ)
в якій ![]() , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
, X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
18. Сполука формули (І) за п. 1, яка являє собою:
N-(1Н-індол-1-іл)-1-метил-1,2,5,6-тетрагідропіридин-3-карбоксамід,
N-(2,3-дигідро-1Н-індол-1-іл)-1-метил-1,4,5,6-тетрагідропіридин-3-карбоксамід,
N-(5-фтор-1Н-індол-1-іл)-1-метил-1,2,5,6-тетрагідропіридин-3-карбоксамід,
N-(2,3-дигідро-1Н-індол-1-іл)-1-метил-1,4,5,6-тетрагідропіридин-3-карбоксамід,
1-[2-(диметиламіно)етил]-N-(1Н-індол-1-іл)-1,2,5,6-тетрагідропіридин-3-карбоксамід,
N-(1Н-індол-1-іл)-1-[2-(4-метил-1-піперазиніл)етил]-3-піперидинкарбоксамід,
N-(5-хлор-1Н-індол-1-іл)-1-(2-гідроксіетил)-1,4,5,6-тетрагідропіридин-3-карбоксамід,
трет-бутил-4-(2-{3-[(1Н-індол-1-іламіно)карбоніл]-1-піперидил}етил)піперазин-1-карбоксилат,
1-[3-(диметиламоній)пропіл]-3-[(1Н-індол-1-іламіно)карбоніл]піперидиній,
N-(1Н-індол-1-іл)-1-[3-(1-піперидил)пропіл]-3-піперидинкарбоксамід,
N-(1Н-індол-1-іл)-1-[3-(4-метил-1-піперазиніл)пропіл]-3-піперидинкарбоксамід,
N-(індол-1-іл)-1-(2-піперидин-1-ілетил)-1,2,5,6-тетрагідропіридин-3-карбоксамід,
(±)-N-(індол-1-іл)-1-[2-[4-(1-метилпіперидин-4-іл)піперазин-1-іл)]етил]-піперидин-3-карбоксамід,
(±)-N-(індол-1-іл)-1-[3-[4-(2-гідроксіетил)піперазин-1-іл)]пропіл]піперидин-3-карбоксамід,
(±)-N-(індол-1-іл)-1-[4-(4-метилпіперазин-1-іл)бутил]піперидин-3-карбоксамід,
(±)-N-(індол-1-іл)-1-алілпіперидин-3-карбоксамід,
(±)-N-(індол-1-іл)-1-[4-(піперидин-1-іл)бут-2-ен-1-іл]піперидин-3-карбоксамід,
(R або S) (-)-N-(індол-1-іл)-1-[2-(піперидин-1-іл)етил]піперидин-3-карбоксамід енантіомер 1,
(R або S) (+)-N-(індол-1-іл)-1-[2-(піперидин-1-іл)етил]піперидин-3-карбоксамід енантіомер 2,
її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
19. Спосіб одержання сполук формули (І), який відрізняється тим, що як вихідний матеріал використовують сполуку формули (II):
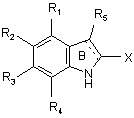 , (II)
, (II)
в якій R1, R2, R3, R4, R5 і X є такими ж, як визначено для формули (І),
сполуку додають до дифенілфосфінілгідроксиламіну з одержанням сполуки формули (III):
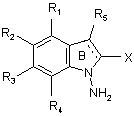 , (III)
, (III)
в якій R1, R2, R3, R4, R5 і X є такими ж, як визначено тут вище,
сполуку формули (III) конденсують зі сполукою формули (IV):
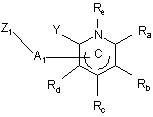 , (IV)
, (IV)
в якій Ra, Rb, Rc, Rd, Re і Y є такими ж, як визначено для формули (І), А1 являє собою групу формули-C(=Z)-,-СН2- або -SO2-, в якій Z є таким же, як визначено для формули (І), і Z1 являє собою групу, яку вибирають з гідрокси, етокси і метокси,
з одержанням сполуки формули (І/а), окремого випадку сполук формули (І):
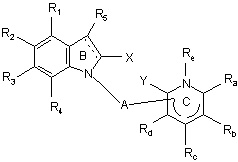 , (I/a)
, (I/a)
в якій R1, R2, R3, R4, R5, Ra, Rb, Rc, Rd, Re, X і Y є такими ж, як визначено тут вище, і А є таким же, як визначено для формули (І),
сполуки формули (І/а) утворюють цілісність сполук даного винаходу, які очищують, якщо необхідно, відповідно до звичайної техніки очищення, розділяють, коли бажано, на їх різні ізомери відповідно до звичайної техніки розділення і перетворюють, коли бажано, в їх N-оксиди і, де прийнятно, їх адитивні солі з фармацевтично прийнятною кислотою або основою.
20. Фармацевтична композиція, яка містить як активний інгредієнт щонайменше одну сполуку за будь-яким з пп. 1-18 в комбінації з одним або більше фармацевтично прийнятними, інертними, нетоксичними наповнювачами або носіями.
21. Фармацевтична композиція за п. 20, яка містить щонайменше один активний інгредієнт, індуктор тирозингідроксилаз, за будь-яким з пп. 1-18, для застосування у лікуванні депресії, тривоги, розладів пам’яті в ході старіння і/або нейродегенеративних захворювань, і в паліативному лікуванні хвороби Паркінсона, і для пристосовування до стресу.
Текст
1. Сполука формули: (19) 1 3 атомів вуглецю, або лінійну або розгалужену (С1С6)гідроксіалкільну групу, X і Y, які можуть бути однаковими або відрізнятись, кожний незалежно від іншого, являють собою: атом водню або лінійну або розгалужену (С1С6)алкільну групу, Ra, Rb, Rc і Rd, які можуть бути однаковими або відрізнятись, кожний незалежно від інших, являють собою: атом водню або галогену, лінійну або розгалужену (С1-С6)алкільну групу, гідроксигрупу, лінійну або розгалужену (С1С6)алкоксигрупу, ціаногрупу, нітрогрупу, лінійну або розгалужену (С1-С6)полігалоалкільну групу, аміногрупу (необов’язково заміщену однією або двома однаковими або різними лінійними або розгалуженими (С1-С6)алкільними групами), або лінійний або розгалужений (С1-С6)алкільний ланцюг, заміщений однією або більше групами, вибраними з галогену, гідрокси, лінійного або розгалуженого (С1-С6)алкокси і аміно, необов’язково заміщених однією або двома однаковими або різними, лінійними або розгалуженими (С1С6)алкільними групами, розуміється, що, коли А зв’язаний з кільцем С на атомі вуглецю, який несе один із замісників Ra, Rb, Rc, Rd або Y, і згаданий зв’язувальний атом вуглецю також несе подвійний зв’язок, тоді відповідний замісник Ra, Rb, Rc, Rd або Y відсутній, Re являє собою: атом водню, лінійну або розгалужену (С1-С6)алкільну групу; арил-(С1-С6)алкільну групу, в якій алкільна частина є лінійною або розгалуженою; лінійну або розгалужену (С2-С6)алкенільну групу; лінійну або розгалужену (С2-С6)алкінільну групу; лінійний або розгалужений (С1-С6)алкільний ланцюг, заміщений однією або більше групами, які вибирають з гідрокси, аміно (необов’язково заміщеного однією або двома, однаковими або різними, лінійними або розгалуженими (С1-С6)алкільними групами), лінійного або розгалуженого (С1-С6)алкокси, і NR7R8, в якій R7 і R8, разом з атомом азоту, який несе їх, утворюють необов’язково заміщений 4-8-членний гетероцикл, який необов’язково містить один або більше зв’язків в гетероциклі і необов’язково містить в циклічній системі другий гетероатом, який вибирають з атома кисню і атома азоту; або лінійний або розгалужений (С2-С6)алкенільний ланцюг, заміщений тими ж групами, що і алкільний ланцюг, або лінійний або розгалужений (С2-С6)алкінільний ланцюг, заміщений тими ж групами, що і алкільний ланцюг, її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою, розуміється, що: як необов’язково заміщений 4-8-членний гетероцикл, який необов’язково містить один або більше зв’язків в гетероциклі і необов’язково містить в циклічній системі другий гетероатом, який вибирають з атома кисню і атома азоту, може бути згаданий, без будь-якого обмеження, піролідин, піперидин, азепан, піперазин і морфолін, ці 89544 4 гетероцикли необов’язково заміщені (включаючи на другому атомі азоту піперазину) однією або більше однаковими або різними групами, які вибирають з лінійного або розгалуженого (С1-С6)алкілу, лінійного або розгалуженого (С1-С6)гідроксіалкілу, лінійного або розгалуженого (С1-С6)алкоксі-(С1С6)алкілу, CO2Rv, CO2-Rw-NRvR’v, CO2-Rw-ORv (в якій Rv являє собою атом водню або лінійну або розгалужену (С1-С6)алкільну групу, R’v є таким ж, як визначено для Rv, і Rw являє собою лінійний або розгалужений (С1-С6)алкіленовий ланцюг), арилу, арилоксикарбонілу, лінійного або розгалуженого арил-(С1-С6)алкоксикарбонілу, необов’язково заміщеного циклоалкілу, необов’язково заміщеного циклоалкілалкілу, необов’язково заміщеного гетероциклоалкілу, необов’язково заміщеного гетероциклоалкілалкілу і аміноалкілу, в якому алкільна частина являє собою лінійний або розгалужений ланцюг від 1 до 6 атомів вуглецю і аміночастина необов’язково заміщена однією або двома однаковими або різними лінійними або розгалуженими (С1-С6)алкільними групами, арил означає фенільну або нафтильну групу, кожна є необов’язково заміщеною одним або більше атомами галогену, нітро, аміно, лінійною або розгалуженою (С1-С6)алкільною або лінійною або розгалуженою (С1-С6)алкоксигрупами, циклоалкіл означає насичену 4-8-членну моноциклічну групу, циклоалкілалкіл означає циклоалкілалкільну групу, в якій алкільна група означає лінійний або розгалужений ланцюг від 1 до 6 атомів вуглецю і циклоалкільна група означає насичену 4-8-членну моноциклічну групу, гетероциклоалкіл означає насичену 4-8-членну моноциклічну групу, яка містить 1 або 2 гетероатоми, які вибирають з азоту, кисню і сірки, гетероциклоалкілалкіл означає гетероциклоалкілалкільну групу, в якій алкільна група означає лінійний або розгалужений ланцюг від 1 до 6 атомів вуглецю і гетероциклоалкільна група означає насичену 4-8-членну моноциклічну групу, яка містить 1 або 2 гетероатоми, які вибирають з азоту, кисню і сірки, вираз "необов’язково заміщений", коли він стосується груп циклоалкілу, циклоалкілалкілу, гетероциклоалкілу і гетероциклоалкілалкілу, означає, що ці групи можуть бути заміщені одним або більше однаковими або різними замісниками, які вибирають з лінійного або розгалуженого (С1-С6)алкілу, лінійного або розгалуженого (С1-С6)гідроксіалкілу, лінійного або розгалуженого (С1-С6)алкоксі(С1С6)алкілу, карбокси, лінійного або розгалуженого (С1-С6)алкоксикарбонілу і аміноалкілу, в якому алкільна частина являє собою лінійний або розгалужений ланцюг від 1 до 6 атомів вуглецю і аміночастина необов’язково заміщена однією або двома однаковими або різними лінійними або розгалуженими (С1-С6)алкільними групами, амінокислотний радикал означає радикали аланілу, аргінілу, аспарагінілу, a-аспартилу, цистеїнілу, a-глутамілу, глутамінілу, гліцилу, гістидилу, ізолейцилу, лейцилу, лізилу, метіонілу, фенілаланілу, пролілу, серилу, треонілу, триптофілу, тирозилу і валілу. 5 89544 2. Сполука формули (І) за п.1, яка відрізняється тим, що А являє собою двовалентний радикал: 6 відрізняється тим, що вона являє собою сполуки формули (IB): R1 R6 N R5 R2 Z , де R6 є таким же, як визначено для формули (І), і Z являє собою атом кисню, її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою. 3. Сполука формули (І) за пп.1 або 2, яка відрізняється тим, що R6 являє собою атом водню, її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою. 4. Сполука формули (І) за будь-яким з пп.1-3, яка відрізняється тим, що R1, R2, R3 і R4 являють собою атом водню, атом галогену або лінійну або розгалужену (С1-С6)алкоксигрупу, її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою. 5. Сполука формули (І) за будь-яким з пп.1-4, яка відрізняється тим, що R5 являє собою атом водню або лінійну або розгалужену (С1-С6)алкільну групу, її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою. 6. Сполука формули (І) за будь-яким з пп.1-5, яка відрізняється тим, що X i Y являють собою атом водню або лінійну або розгалужену (С1-С6)алкільну групу, її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою. 7. Сполука формули (І) за будь-яким з пп.1-6, яка відрізняється тим, що Ra, Rb, Rc і Rd являють собою атом водню, її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою. 8. Сполука формули (І) за будь-яким з пп.1-7, яка відрізняється тим, що Re являє собою атом водню або лінійну або розгалужену (С1-С6)алкільну групу, або лінійну або розгалужену (С2С6)алкенільну групу, її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою. 9. Сполука формули (І) за будь-яким з пп.1-8, яка відрізняється тим, що вона являє собою сполуки формули (ІА): R1 R5 R2 B N R3 R4 Re X Y N R6 N C Rd O Ra R4 Re X Y N R6 Ra N C Rd O Rb Rc , (IB) , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, в якій Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою. 11. Сполука формули (І) за будь-яким з пп.1-10, яка відрізняється тим, що вона являє собою сполуки формули (IС): R1 R5 R2 B N R3 R4 Re X Y N R6 Ra N C Rd O Rb Rc , (IC) , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, в якій Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою. 12. Сполука формули (І) за будь-яким з пп.1-11, яка відрізняється тим, що вона являє собою сполуки формули (ID): R1 R5 R2 B N R3 R4 Re X Y N R6 O Ra N C Rd Rb Rc , (ІD) в якій , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою. 13. Сполука формули (І) за будь-яким з пп.1-12, яка відрізняється тим, що вона являє собою сполуки формули (IE): R1 Rb Rc B N R3 R5 R2 , (IA) в якій , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою. 10. Сполука формули (І) за будь-яким з пп.1-9, яка B N R3 R4 X Y Rd N Re N C R6 O Ra Rb Rc , (IE) 7 89544 в якій , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою. 14. Сполука формули (І) за будь-яким з пп.1-13, яка відрізняється тим, що вона являє собою сполуки формули (IF): R1 R5 R2 B N R3 R4 Y X Rd N C R6 Rc O N Re Ra Rb , (IF) в якій , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою. 15. Сполука формули (І) за будь-яким з пп.1-14, яка відрізняється тим, що вона являє собою сполуки формули (IG): R1 R5 R2 B N R3 R4 Re X Y N N C R6 Ra Rb O Rc , (IG) в якій , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули, її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою. 16. Сполука формули (І) за будь-яким з пп.1-15, яка відрізняється тим, що вона являє собою сполуки формули (ІН): R1 R5 R2 B N R3 R4 Re X Y N N C R6 Ra Rb O Rc , (IH) в якій , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою. 17. Сполука формули (І) за будь-яким з пп.1-16, яка відрізняється тим, що вона являє собою сполуки формули (IJ): 8 R1 R5 R2 B N R3 R4 Y X Rd N C R6 N Re Ra O Rb , (IJ) в якій , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою. 18. Сполука формули (І) за п.1, яка являє собою: N-(1Н-індол-1-іл)-1-метил-1,2,5,6тетрагідропіридин-3-карбоксамід, N-(2,3-дигідро-1Н-індол-1-іл)-1-метил-1,4,5,6тетрагідропіридин-3-карбоксамід, N-(5-фтор-1Н-індол-1-іл)-1-метил-1,2,5,6тетрагідропіридин-3-карбоксамід, N-(2,3-дигідро-1Н-індол-1-іл)-1-метил-1,4,5,6тетрагідропіридин-3-карбоксамід, 1-[2-(диметиламіно)етил]-N-(1Н-індол-1-іл)-1,2,5,6тетрагідропіридин-3-карбоксамід, N-(1Н-індол-1-іл)-1-[2-(4-метил-1піперазиніл)етил]-3-піперидинкарбоксамід, N-(5-хлор-1Н-індол-1-іл)-1-(2-гідроксіетил)-1,4,5,6тетрагідропіридин-3-карбоксамід, трет-бутил-4-(2-{3-[(1Н-індол-1-іламіно)карбоніл]-1піперидил}етил)піперазин-1-карбоксилат, 1-[3-(диметиламоній)пропіл]-3-[(1Н-індол-1іламіно)карбоніл]піперидиній, N-(1Н-індол-1-іл)-1-[3-(1-піперидил)пропіл]-3піперидинкарбоксамід, N-(1Н-індол-1-іл)-1-[3-(4-метил-1піперазиніл)пропіл]-3-піперидинкарбоксамід, N-(індол-1-іл)-1-(2-піперидин-1-ілетил)-1,2,5,6тетрагідропіридин-3-карбоксамід, (±)-N-(індол-1-іл)-1-[2-[4-(1-метилпіперидин-4іл)піперазин-1-іл)]етил]-піперидин-3-карбоксамід, (±)-N-(індол-1-іл)-1-[3-[4-(2-гідроксіетил)піперазин1-іл)]пропіл]піперидин-3-карбоксамід, (±)-N-(індол-1-іл)-1-[4-(4-метилпіперазин-1іл)бутил]піперидин-3-карбоксамід, (±)-N-(індол-1-іл)-1-алілпіперидин-3-карбоксамід, (±)-N-(індол-1-іл)-1-[4-(піперидин-1-іл)бут-2-ен-1іл]піперидин-3-карбоксамід, (R або S) (-)-N-(індол-1-іл)-1-[2-(піперидин-1іл)етил]піперидин-3-карбоксамід енантіомер 1, (R або S) (+)-N-(індол-1-іл)-1-[2-(піперидин-1іл)етил]піперидин-3-карбоксамід енантіомер 2, її енантіомери, діастереоізомери і N-оксиди, а також її адитивні солі з фармацевтично прийнятною кислотою або основою. 19. Спосіб одержання сполук формули (І), який відрізняється тим, що як вихідний матеріал використовують сполуку формули (II): 9 R1 89544 10 випадку сполук формули (І): R5 R1 R2 B N H R3 X , (II) в якій R1, R2, R3, R4, R5 і X є такими ж, як визначено для формули (І), сполуку додають до дифенілфосфінілгідроксиламіну з одержанням сполуки формули (III): R5 R2 B N R3 R4 X NH2 , (III) в якій R1, R2, R3, R4, R5 і X є такими ж, як визначено тут вище, сполуку формули (III) конденсують зі сполукою формули (IV): Re Z1 Y N Ra C A1 B N R3 R4 R1 Rb Rd R5 R2 R c , (IV) в якій Ra, Rb, Rc, Rd, Re і Y є такими ж, як визначено для формули (І), А1 являє собою групу формулиC(=Z)-,-СН2- або -SO2-, в якій Z є таким же, як визначено для формули (І), і Z1 являє собою групу, яку вибирають з гідрокси, етокси і метокси, з одержанням сполуки формули (І/а), окремого Даний винахід стосується нових сполук 1Ніндол-піридинкарбоксаміду і 1Н-індолпіперидинкарбоксаміду, способу їх одержання і фармацевтичних композицій, які їх містять. З літератури відомі численні приклади сполук, які проявляють структуру ебурнану, що особливо характерно для сполук з опису патенту US 3 454 583, який стосується вінкаміну (метил (3α,14β,16α)-(14,15-дигідро-14-гідроксиебурнаменін-14-карбоксилат) і його сполук стосовно їх судинорозширювальних властивостей. Заявки на видачу патентів FR 2 433 528 і FR 2 381048 представляють нові 20,21-диноребурнамінові сполуки і Заявка на видачу патенту ЕР 0 287 468 представляє нові 17-аза -20,21-диноребурнамінові сполуки. Заявка на видачу патенту ЕР 0 658 557 описує ебурнанові сполуки, модифіковані у 14- і 15-положеннях ебурнанової основи. Заявка на видачу патенту ЕР 0 563 916 розкриває сполуки 1Н-індол-циклогексанкарбоксаміду. Крім того факту, що вони є новими, сполуки за даним винаходом володіють дуже цінними фармакологічними властивостями. Зокрема, винайшли, що вони є потужними селективними або неселективними індукторами тирозингіроксилази. R4 Re X Y A N C Rd Ra Rb Rc , (I/a) в якій R1, R2, R3, R4, R5, Ra, Rb, Rc, Rd, Re, X і Y є такими ж, як визначено тут вище, і А є таким же, як визначено для формули (І), сполуки формули (І/а) утворюють цілісність сполук даного винаходу, які очищують, якщо необхідно, відповідно до звичайної техніки очищення, розділяють, коли бажано, на їх різні ізомери відповідно до звичайної техніки розділення і перетворюють, коли бажано, в їх N-оксиди і, де прийнятно, їх адитивні солі з фармацевтично прийнятною кислотою або основою. 20. Фармацевтична композиція, яка містить як активний інгредієнт щонайменше одну сполуку за будь-яким з пп.1-18 в комбінації з одним або більше фармацевтично прийнятними, інертними, нетоксичними наповнювачами або носіями. 21. Фармацевтична композиція за п.20, яка містить щонайменше один активний інгредієнт, індуктор тирозингідроксилаз, за будь-яким з пп.1-18, для застосування у лікуванні депресії, тривоги, розладів пам’яті в ході старіння і/або нейродегенеративних захворювань, і в паліативному лікуванні хвороби Паркінсона, і для пристосовування до стресу. Більш конкретно, даний винахід стосується сполук формули (І): (I) в якій: - А являє собою двовалентний радикал:2 де: Ζ являє собою атом кисню або атом сірки, R6 являє собою: атом водню, лінійну або розгалужену (С1-C6)алкільну групу, С(О)-АА, в якій АА являє собою амінокислотний радикал, лінійну або розгалужену (С1C6)алкоксикарбонільну групу, CHR'-O-C(O)-R", в якій R' являє собою атом водню або лінійну або 11 розгалужену (С1-C6)алкільну групу і R" являє собою лінійну або розгалужену (С1-C6)алкільну групу, лінійну або розгалужену (С2-С6)алкенільну групу, арильну групу, арил-(С1-C6)алкільну групу, в якій алкільна частина є лінійною або розгалуженою, лінійну або розгалужену (С1C6)полігалоалкільну групу, або лінійний або розгалужений (С1C6)алкільний ланцюг, заміщений одним або більше атомами галогену, однією або більше гідроксигрупами, лінійними або розгалуженими (С1C6)алкоксигрупами або аміногрупами, необов'язково заміщеними однією або двома однаковими або різними, лінійними або розгалуженими (С1C6)алкільними групами, - в кільці В являє собою одинарний або подвійний зв'язок, - в кільці С являє собою одинарний або подвійний зв'язок, кільце С містить, найбільше, тільки один одинарний зв'язок, - R1, R2, R3 і R4, які можуть бути однаковими або відрізнятись, кожний незалежно від іншого, являють собою: атом водню або галогену, лінійну або розгалужену (С1-C6)алкільну групу, лінійну або розгалужену (С1-C6)алкоксигрупу, гідроксигрупу, ціаногрупу, нітрогрупу, лінійну або розгалужену (С1-C6)полігалоалкільну групу, аміногрупу (необов'язково заміщену однією або двома лінійними або розгалуженими (С1-C6)алкільними і/або лінійними або розгалуженими (С2С6)алкенільними групами, алкільна і алкенільна групи можуть бути однаковими або відрізнятись), або лінійний або розгалужений (С1C6)алкільний ланцюг, заміщений одним або більше атомами галогену, однією або більше гідроксигрупами, лінійними або розгалуженими (С1C6)алкоксигрупами або аміногрупами, необов'язково заміщеними однією або двома однаковими або різними, лінійними або розгалуженими (С1C6)алкільними групами, - R5 являє собою: атом водню, лінійну або розгалужену (С1-C6)алкільну групу, аміналкільну групу, в якій алкільна частина являє собою лінійний або розгалужений ланцюг з 1-6 атомів вуглецю, або лінійну або розгалужену (С1C6)гідроксіалкільну групу, - X і Y, які можуть бути однаковими або відрізнятись, кожний незалежно від іншого, являє собою: атом водню або лінійну або розгалужену (С1C6)алкільну групу, - Ra, Rb, Rc і Rd, які можуть бути однаковими або відрізнятись, кожний незалежно від інших, являє собою: атом водню або галогену, лінійну або розгалужену (С1-C6)алкільну групу, гідроксигрупу, лінійну або розгалужену (С1C6)алкоксигрупу, ціаногрупу, нітрогрупу, лінійну або розгалужену (С1-C6)полігалоалкільну групу, аміногрупу (необов'язково заміщену однією або двома однаковими або різними лінійними або розгалуженими (С1-C6)алкільними групами), 89544 12 або лінійний або розгалужений (С1C6)алкільний ланцюг, заміщений однією або більше групами, вибраними з галогену, гідрокси, лінійного або розгалуженого (С1-C6)алкокси і аміно, необов'язково заміщених однією або двома однаковими або різними, лінійними або розгалуженими (С1-C6)алкільними групами, розуміється, що, коли А зв'язаний з кільцем С на атомі вуглецю, який несе один із замісників Ra, Rb, Rc, Rd або Υ і згаданий зв'язувальний атом вуглецю також несе подвійний зв'язок, тоді відповідний замісник Ra, Rb, Rc, Rd або Υ відсутній, - Re являє собою: атом водню, лінійну або розгалужену (С1-С6)алкільну групу; арил-(С1-C6)алкільну групу, в якій алкільна частина є лінійною або розгалуженою; лінійну або розгалужену (С2-С6)алкенільну групу; лінійну або розгалужену (С2-С6)алкінільну групу; лінійний або розгалужений (С1-C6)алкільний ланцюг, заміщений однією або більше групами, які вибирають з гідрокси, аміно (необов'язково заміщеного однією або двома, однаковими або різними, лінійними або розгалуженими (С1-C6)алкільними групи), лінійного або розгалуженого (С1-C6)алкокси, і NR7Rg, в якій R7 і R8, разом з атомом азоту, який несе їх, утворюють необов'язково заміщений 4-8-членний гетероцикл, який необов'язково містить один або більше зв'язків в гетероциклі і необов'язково містить в циклічній системі другий гетероатом, який вибирають з атома кисню і атома азоту; або лінійний або розгалужений (С2-С6)алкенільний ланцюг, заміщений тими ж групами, що і алкільний ланцюг, або лінійний або розгалужений (С2-С6)алкінільний ланцюг, заміщений тими ж групами, що і алкільний ланцюг, їх енантіомерів, діастереоізомерів і N-оксидів, а також до їх адитивних солей з фармацевтично прийнятною кислотою або основою, є зрозумілим, що: як необов'язково заміщений 4-8-членний гетероцикл, який необов'язково містить один або більше зв'язків в гетероциклі і необов'язково містить в циклічній системі другий гетероатом, який вибирають з атома кисню і атома азоту, може бути згаданий, без будь-якого обмеження, піролідин, піперидин, азепан, піперазин і морфолін, ці гетероцикли необов'язково заміщені (включаючи на другому атомі азоту піперазину) однією або більше однаковими або різними групами, які вибирають з лінійного або розгалуженого (С1-C6)алкілу, лінійного або розгалуженого (С1-C6)гідроксіалкілу, лінійного або розгалуженого (С1-C6)алкоксі- (С1C6)алкілу, CO2Rv, CO2-Rw-NRvR'v, CO2-Rw-ORv (в якій Rv являє собою атом водню або лінійну або розгалужену (С1-C6)алкільну групу, R'v є таким же, як визначено для Rv, і Rw являє собою лінійний або розгалужений (С1-C6)алкіленовий ланцюг), арилу, арилоксикарбонілу, лінійного або розгалуженого арил-(С1-C6)алкоксикарбонілу, необов'язково заміщеного циклоалкілу, необов'язково заміщеного циклоалкілалкілу, необов'язково заміщеного гетероциклоалкілу, необов'язково заміщеного гетероциклоалкілалкілу і аміноалкілу, в якому алкільна частина являє собою лінійний або розгалужений 13 ланцюг від 1 до 6 атомів вуглецю і аміно частина необов'язково заміщена однією або двома, однаковими або різними, лінійними або розгалуженими (С1-C6)алкільними групами, арил означає фенільну або нафтильну групу, кожна є необов'язково заміщеною одним або більше атомами галогену, нітро, аміно, лінійною або розгалуженою (С1-C6)алкільною або лінійною або розгалуженою (С1-C6)алкоксигрупами, циклоалкіл означає насичену, 4-8-членну, моноциклічну групу, циклоалкілалкіл означає циклоалкіл-алкільну групу, в якій алкільна група означає лінійний або розгалужений ланцюг від 1 до 6 атомів вуглецю і циклоалкільна група означає насичену, 4-8членну, моноциклічну групу, гетероциклоалкіл означає насичену, 4-8членну, моноциклічну групу, яка містить 1 або 2 гетероатоми, які вибирають з азоту, кисню і сірки, гетероциклоалкілалкіл означає гетероциклоалкіл-алкільну групу, в якій алкільна група означає лінійний або розгалужений ланцюг від 1 до 6 атомів вуглецю і гетероциклоалкільна група означає насичену, 4-8-членну, моноциклічну групу, яка містить 1 або 2 гетероатоми, які вибирають з азоту, кисню і сірки, вираз "необов'язково заміщений", коли він стосується груп циклоалкілу, циклоалкілалкілу, гетероциклоалкілу і гетероциклоалкілалкілу означає, що ці групи можуть бути заміщені одним або більше однаковими або різними замісниками, які вибирають з лінійного або розгалуженого (С1C6)алкілу, лінійного або розгалуженого (С1C6)гідроксіалкілу, лінійного або розгалуженого (С1C6)алкоксі-(С1-C6)алкілу, карбокси, лінійного або розгалуженого (С1-C6)алкокси-карбонілу і аміноалкілу, в якому алкільна частина являє собою лінійний або розгалужений ланцюг від 1 до 6 атомів вуглецю і аміно частина необов'язково заміщена однією або двома, однаковими або різними, лінійними або розгалуженими (С1-C6)алкільними групами, амінокислотний радикал означає радикали аланілу, аргінілу, аспарагінілу, α-аспартилу, цистеїнілу, α-глутамілу, глутамінілу, гліцилу, гістидилу, ізолейцилу, лейцилу, лізилу, метіонілу, фенілаланілу, пролілу, серилу, треонілу, триптофілу, тирозилу і валілу. Серед фармацевтично прийнятних кислот можуть бути згадані, без будь-якого обмеження, хлористоводнева кислота, бромисто-воднева кислота, сірчана кислота, фосфонова кислота, оцтова кислота, трифтороцтова кислота, молочна кислота, піровиноградна кислота, малонова кислота, янтарна кислота, глутарова кислота, фумарола кислота, винна кислота, малеїнова кислота, лимонна кислота, аскорбінова кислота, щавлева кислота, метансульфонова кисла, камфорна кислота, лізин і т.д. Серед фармацевтично прийнятних основ можуть бути згадані, без будь-якого обмеження, гідроксид натрію, гідроксид калію, триетиламін, третбутиламін і т.д. Переважні сполуки винаходу являють собою ті, в яких А являє собою двовалентний радикал: 89544 14 де R6 є таким же, як визначено для формули (І), і Ζ являє собою атом кисню. Відповідно до даного винаходу, перевага віддається атому водню як заміснику R6. Відповідно до даного винаходу, перевага віддається атому водню, атому галогену або лінійній або розгалуженій (С1-C6)алкоксигрупі як замісникам R1, R2, R3 і R4. Відповідно до даного винаходу, перевага віддається атому водню або лінійній або розгалуженій (С1-C6)алкільній групі як заміснику R5. Відповідно до даного винаходу, перевага віддається атому водню або лінійній або розгалуженій (С1-C6)алкільній групі як замісникам X і Y. Відповідно до даного винаходу, перевага віддається атому водню як замісникам Ra, Rb, Rc і Rd. Відповідно до даного винаходу, перевага віддається атому водню або лінійній або розгалуженій (С1-C6)алкільній групі, або лінійній або розгалуженій (С2-С6)алкенільній групі як заміснику Re. Відповідно до переважного втілення винаходу, переважні сполуки являють собою сполуки формули (ІА): (IA) в якій , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І). Відповідно до другого переважного втілення винаходу, переважні сполуки являють собою сполуки формули (IB): (IB) в якій , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І). Відповідно до третього переважного втілення винаходу, переважні сполуки являють собою сполуки формули (lС): (IC) 15 89544 в якій , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І). Відповідно до четвертого переважного втілення винаходу, переважні сполуки являють собою сполуки формули (ID): (ID) в якій , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І). Відповідно до п'ятого переважного втілення винаходу, переважні сполуки являють собою сполуки формули (IE): (IE) в якій , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І). Відповідно до шостого переважного втілення винаходу, переважні сполуки являють собою сполуки формули (IF): (IF) в якій , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І). Відповідно до сьомого переважного втілення винаходу, переважні сполуки являють собою сполуки формули (IG): (IG) в якій , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І). Відповідно до восьмого переважного втілення винаходу, переважні сполуки являють собою сполуки формули (ІН): 16 (IH) в якій , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І). Відповідно до дев'ятого переважного втілення винаходу, переважні сполуки являють собою сполуки формули (IJ): (IJ) в якій , X, Y, R1, R2, R3, R4, R5, R6, Ra, Rb, Rc, Rd і Re є такими ж, як визначено для формули (І). Сполуки, яким віддають перевагу відповідно до даного винаходу, являють собою: N-(1Н-індол-1-іл)-1-метил-1,2,5,6тетрагідропіридин-3-карбоксамід, - N-(2,3-дигідро-1Н-індол-1-іл)-1-метил-1,4,5,6тетрагідропіридин-3-карбоксамід, Ν-(5-фтор-1Н-індол-1-іл)-1-метил-1,2,5,6тетрагідропіридин-3-карбоксамід, - N-(2,3-дигідро-1Н-індол-1-іл)-1-метил-1,4,5,6тетрагідропіридин-3-карбоксамід, - 1-[2-(диметиламіно)етил]-N-(1Н-індол-1-іл)1,2,5,6-тетрагідропіридин-3-карбоксамід, Ν-(1Н-індол-1-іл)-1-[2-(4-метил-1піперазиніл)етил]-3-піперидинкарбокс-амід, N-(5-хлор-1Н-індол-1-іл)-1-(2-гідроксіетил)1,4,5,6-тетрагідропіридин-3-карбоксамід, трет-бутил 4-(2-{3-[(1Н-індол-1іламіно)карбоніл]-1-піперидил}етил)-піперазин-1карбоксилат, - 1-[3-(деметиламоній)пропіл]-3-[(1Н-індол-1іламіно)карбоніл]піперидиній, - Ν-(1Н-індол-1-іл)-1-[3-(1-піперидил)пропіл]-3піперидинкарбоксамід, Ν-(1Н-індол-1-іл)-1-[3-(4-метил-1піперазиніл)пропіл]-3-піперидинкарбокс-амід, N-(індол-1-іл)-1-(2-піперидин-1-іл-етил)1,2,5,6-тетрагідропіридин-3-карбоксамід, - (±)-N-(індол-1-іл)-1-[2-[4-(1-метилпіперидин-4іл)піперазин-1-іл)]етил]-піперидин-3-карбоксамід, (±)-N-(індол-1-іл)-1-[3-[4-(2гідроксіетил)піперазин-1-іл)]пропіл]піперидин-3карбоксамід, (±)-N-(індол-1-іл)-1-[4-(4-метилпіперазин-1іл)бутил] піперидин-3-карбоксамід, (±)-N-(індол-1-іл)-1-алілпіперидин-3карбоксамід, (±)-N-(індол-1-іл)-1-[4-(птеридин-1-іл)бут-2ен-1-іл]піперидин-3-карбокс-амід, 17 89544 - (R або S) (-)N-(індол-1-іл)-1-[2-(піперидин-1іл)етил]піперидин-3-карбоксамід енантіомер 1, - (R або S) (+)-N-(індол-1-іл)-1-[2-(піперидин-1іл)етил]піперидин-3-карбоксамід енантіомер 2. Енантіомери, діастереоізомери, N-оксиди і адитивні солі з фармацевтично прийнятною кислотою або основою переважних сполук утворюють невід'ємну частину даного винаходу. Даний винахід має стосується також способу одержання сполук формули (І), який відрізняється тим, що як вихідний матеріал використовують сполуку формули (II): (II) в якій R1, R2, R3, R4, R5 і X є такими ж, як визначено для формули (І), сполуку піддають реакції з дифенілфосфінілгідроксиламіном для одержання сполуки формули (III): 18 реакцій органічного синтезу, добре відомого кваліфікованому в даній галузі фахівцю. Сполука формули (IV) в окремому випадку, коли являє собою подвійний зв'язок між атомами вуглецю, які несуть замісники Rc і Rd, формули (IV/a): (IV/a) в якій Ra, Rb, Rc, Re, Y, А1 i Z1 є, як такими ж, як визначено тут вище, можуть бути головним чином одержані, починаючи зі сполуки формули (V): (V) (III) в якій Ra, Rb, Rc, Υ, А1 i Z1 є, як такими ж, як визначено тут вище, яку обробляють карбонатом калію і хлорметил хлорформіатом для одержання сполуки формули (VI): в якій R1, R2, R3, R4, R5 і X є такими ж, як визначено тут вище, сполуку формули (III) конденсують зі сполукою формули (IV): (VI) (IV) в якій Ra, Rb, Rc, Rd, Re і Υ є такими ж, як визначено для формули (І), А1 являє собою групу формули -C(=Z)-, -СН2- або -SO2-, в якій Ζ є таким же, як визначено для формули (І), і Ζ1 являє собою групу, яку вибирають з гідрокси, етокси і метокси, для одержання сполуки формули (І/а), окремого випадку сполук формули (І): в якій Ra, Rb, Rc, Υ, А1 i Z1 є, як такими ж, як визначено тут вище, сполуку формули (VI) піддають реакції алкілування у присутності сполуки формули (VII): Re-Hal (VII) в якій Hal являє собою атом галогену і Re є таким же, як визначено тут вище, для одержання сполуки формули (IV/a), як визначено тут вище. Сполука формули (IV) в окремому випадку, коли являє собою подвійний зв'язок між атомами вуглецю, які несуть замісники Rd і Y, формули (IV/b): (I/a) (IV/b) в якій R1, R2, R3, R4, R5, Ra, Rb, Rc, Rd, Re, X і Υ є, як такими ж, як визначено тут вище, і А є таким же, як визначено для формули (І), сполуки формули (І/а) утворюють цілісність сполук даного винаходу, які очищують, якщо необхідно, відповідно до звичайної техніки очищення, можуть бути розділені, коли бажано, на їх різні ізомери відповідно до звичайної техніки розділення і перетворені, коли бажано, в їх N-оксиди і, де прийнятно, їх адитивні солі з фармацевтично прийнятною кислотою або основою. Сполуки формул (II) і (IV) є або комерційно доступними, або їх одержують шляхом звичайних в якій Ra, Rb, Rc, Re, Υ, Α1 і Ζ1 є, як такими ж, як визначено тут вище, може бути головним чином одержана, починаючи зі сполуки формули (VIII) (VIII) в якій Ra, Rb, Rc, Υ, Α1 і Ζ1 є, як такими ж, як визначено тут вище, яку піддають реакції алкілування у присутності сполуки формули (VII), як визначено тут вище, для одержання сполуки формули (IX): 19 89544 (IX) в якій Ra, Rb, Rc, Re, Y, А1 і Z1 є, як такими ж, як визначено тут вище, і Наl- являє собою аніон галіду, сполуку формули (IX) піддають частковому відновленню реакцією з триетиламіном і PtO2, для одержання сполуки формули (IV/b), як визначено тут вище. Сполука формули (IV) в окремому випадку, коли являє собою одинарний зв'язок, формули (IV/c): (IV/c) в якій Ra, Rb, Rc, Rd, Re, Υ, Α1 і Z1 є, як такими ж, як визначено тут вище, може бути головним чином одержана, починаючи зі сполуки формули (X): (X) в якій Ra, Rb, Rc, Rd, Y, А1 і Ζ1 є, як такими ж, як визначено тут вище, яку піддають дії сполуки формули (VII), як визначено тут вище, для одержання сполуки формули (IV/c), як визначено тут вище. Сполуки формул (II), (IV), (V), (VII), (VIII) і (X) є або комерційно доступними, або їх одержують за допомогою звичайних реакцій органічного синтезу, добре відомими кваліфікованому в даній галузі фахівцю. Сполуки формули (І) володіють цінними фармакологічними властивостями, особливо тими, що вони є потужними індукторами тирозингідроксилази (ТН). Відомо, що тирозингідроксилаза являє собою фермент, що лімітує швидкість реакцій, який контролює, зокрема, синтез нейронтрансмітерів у центральних катехоламінергічних і допамінергічних нейронах. Швидкість синтезу цих нейротрансмітерів пов'язана особливо з появою тонічних мозкових дисфункцій, які складають численні поведінкові патології у людини, такі як тривога, психози, депресія, стрес і т.д. Через їх здатність індукувати тирозингідроксилазу, сполуки за даним винаходом будуть відповідним чином застосовані терапевтично у лікуванні депресії, тривоги, розладів пам'яті в ході старіння і/або найродегенеративних захворювань, і в паліативному лікуванні хвороби Паркінсона, і для прилаштовування до стресу. Даний винахід стосується також фармацевтичних композицій, які містять як активний інгредієнт, щонайменше, одну сполуку формули (І), її енантіомер, діастереоізомер або N-оксид, або її адитив 20 ну сіль з фармацевтично прийнятною кислотою або основою, одну або в комбінації з одним або більш фармацевтично прийнятним, інертним, нетоксичним наповнювачем або носієм. Фармацевтичні композиції, які таким чином одержують, взагалі будуть присутні у формі дозування; наприклад, вони можуть мати форму таблеток, драже, капсул, супозиторіїв, придатних для ін'єкцій або пиття розчинів і можуть бути введені оральним, ректальним, внутрішньом'язовим або парентеральним шляхом. Серед фармацевтичних композицій відповідно до даного винаходу можуть бути згадані більш конкретно ті, які придатні для орального, парентерального (внутрішньовенний, внутрішньом'язового або підшкірного), під- або черезшкірного, внутрішньовагінального, ректального, назального, під'язикового, буккального, очного або респіраторного введення. Фармацевтичні композиції відповідно до даного винаходу для парентеральних ін'єкцій особливо включають водні і неводні стерильні розчини, дисперсії, суспензії або емульсії, також як і стерильні порошки для відновлення вологовмісту ін'єктованих розчинів або дисперсій. Фармацевтичні композиції відповідно до даного винаходу для твердого орального введення особливо включають таблетки або драже, під'язикові таблетки, саше, капсули і гранули, і для рідинного орального, назального, буккального або очного введення особливо включають емульсії, розчини, суспензії, краплі, сиропи і аерозолі. Фармацевтичні композиції для ректального або вагінального введення переважними є супозиторії або овулі, і композиції для під- або через шкірного введення особливо включають порошки, аерозолі, креми, мазі, гелі і пластирі. Вищезазначені фармацевтичні композиції ілюструють винахід, але не обмежують його жодним чином. Серед інертних, нетоксичних, фармацевтично прийнятних наповнювачів або носіїв можуть бути згадані, з метою прикладу і без будь-якого обмеження, розріджувачі, розчинники, консерванти, змочувальні агенти, емульгатори, диспергатори, зв'язувальні речовини, агенти набухання, агенти, які викликають дезинтеграцію, уповільнювачі, змащувальні речовини, абсорбенти, суспендуючи речовини, барвники, агенти, які надають смак, і т.д. Корисне дозування змінюється відповідно до віку і ваги пацієнта, шляху введення, фармацевтичної композиції, яку використовують, природи і тяжкості розладу, і того, чи застосовують будь-яке пов'язане лікування. Дозування знаходиться в діапазоні від 0,1мг до 100мг за день за одне або більше введень. Наступні Приклади ілюструють винахід, але не обмежують його жодним чином. Вихідні матеріали, які використовують, являють собою відомі продукти або їх одержують відповідно до відомих методик. Різні Приготування дають проміжні сполуки синтезу, які є корисними в одержанні сполук даного винаходу. 21 89544 Структури сполук, які описують у Прикладах і у Приготуваннях, були визначені відповідно до звичайної спектрометричної методики (інфрачервоний, ядерний магнітний резонанс, масспектрометрія і т.д.). Точки плавлення були визначені, використовуючи апарат TOTTOLI (без послідовної колонкової корекції). Коли сполука знаходиться у формі солі, точка плавлення відповідає точці плавлення сполуки у формі. Приготування 1: Одифенілфосфінілгідроксиламін До водного розчину 149,44г гідроксиламін гідрохлориду (340мл води) додають розчин 72,75г гідроксиду натрію (290мл води) і 960мл 1,4діоксану. Суміш охолоджують до -15°С і потім, через 15 хвилин, додають одразу розчин 180г дифенілфосфініл хлориду в 725мл діоксану з механічним перемішуванням. Через 5 хвилин, одразу додають 3 літри води. Утворюється білий осад, який відфільтровують і потім додають в 0,25 Μ розчин гідроксиду натрію при 0°С. Суміш механічно перемішують при 0°С протягом 30 хвилин перед повторним фільтруванням. Осад висушують у вакуумі (пентоксид фосфору) для одержання 72,5г очікуваного продукту. Точка плавлення: 104°С Елементний мікроаналіз: Підраховано: Знайдено: С% 61,80 61,20 Н% 5,19 5,07 N% 6,01 5,72 Приготування 2: N-аміноіндол До суспензії 177,72г розтертого гідроксиду калію в 1,3 літрах DMF додають 21,85г індол і потім, несподівано, 72,5г суспензії сполуки Приготування 1 в 1,3 літрах DMF. Густу суміш нагрівають при температурі між 60 і 70°С протягом 3 годин 30 хвилин з механічним помішуванням і потім, поки суміш гаряча, виливають в 3,5 літри льодяної води. Після охолодження, одержаний розчин екстрагують 3 рази, використовуючи 1,5 літри етилового ефіру. Органічну фазу висушують над сульфатом натрію, фільтрують і потім концентрують під зниженим тиском. Хроматографія на силікагелі (циклогексан/ефір: 80/20 і потім 50/50) дозволяє одержати 16,5г очікуваного продукту. Точка плавлення: 35°С Елементний мікроаналіз: Підраховано: Знайдено: С% 72,70 72,68 Н% 6,10 6,14 N% 21,20 21,17 Приготування 3: 5-Хлор-N-аміноіндол Продукт одержують відповідно до методики Приготування 2, використовуючи 5-хлоріндол замість індолу. Точка плавлення: 46°С Елементний мікроаналіз: Підраховано: Знайдено: С% 57,61 57,51 Н% 4,23 4,41 N% 16,81 16,68 22 Приготування 4: 3-Метил-N-аміноіндол Продукт одержують відповідно до методики Приготування 2, використовуючи 3-метиліндол замість індолу. Приготування 5: 2,3-Диметил-N-аміноіндол Продукт одержують відповідно до методики Приготування 2, використовуючи 2,3-диметиліндол замість індолу. Приготування 6: N-аміноіндолін Стадія А: 1-Нітрозоіндолін До розчину, який охолоджують до 0°С, 4г індоліну в 100мл 50% водної оцтової кислоти додають, краплями, розчин 2,32г NaNО2 в 50мл води; розчин потім перемішують протягом 30 хвилин при 0°С. Суспензію потім підлуговують за допомогою додавання 190мл 20% водного розчину гідроксиду натрію і потім екстрагують три рази етилацетатом. Об'єднані органічні фази висушують над сульфатом натрію, фільтрують і потім випаровують. Одержують 4,92г очікуваного продукту. Точка плавлення: 68°С Елементний мікроаналіз: Підраховано: Знайдено: С% 64,85 64,67 Н% 5,44 5,56 N% 18,91 18,69 Стадія В: N-аміноіндолін 4г сполуки вищезазначеної Стадії А розчиняють в 50мл суміші діетиловий ефір/дихлорметан 85/15 і потім виливають краплями у розчин 1,4г LіAIH4 1M/Et2O (36мл) при 0°С. Після додавання протягом 30 хвилин, реакційну суміш перемішують протягом 3 годин при температурі навколишнього середовища, і потім додають повільно 1,5мл води, 4,5мл 15% розчину гідроксиду натрію і потім 1,5мл води. Алюмінієві солі відфільтровують над Целітом (елююючи з дихлорметаном) і розчинники потім випаровують під зниженим тиском. Хроматографія на силікагелі (циклогексан/діетиловий ефір: 7/3) дозволяє виділити 2,9г очікуваного продукту у формі оранжевої олії. Інфрачервоний (vсм-1): 3335 (vN-H); 3046; 3025 (v=C-H); 2954; 2844 (vC-H); 1605 (vC=C); 1478 (δC-H). Приготування 7: Метил 1-метил-1,4,5,6тетрагідропіридин-3-карбоксилат Стадія А: 3-(Метоксикарбоніл)-1метилпіридиній йодид 10г метил нікотинату розчиняють в 5,2мл метил йодиду і потім реакційну суміш нагрівають при 60°С протягом 24 годин, при захисті від світла. Залишок очищують флеш-хроматографією на силікагелі (СН2Сl2/СН3ОН: 9/1 і потім 85/15), дозволяючи виділити 13,46г очікуваного продукту. Стадія В: Метил 1-метил-1,4,5,6тетрагідропіридин-3-карбоксилат 4г сполуки вищезазначеної Стадії А, розбавленої 100мл абсолютного метанолу, гідрогенізують в атмосферному тиску протягом 20 годин при 20°С у присутності 4мл триетиламіну і 800мг 10% Pd/C. Після відфільтровування каталізатора над Целітом і промивання (двічі метанолом), фільтрат випаровують у вакуумі і одержують жовтий залишок. Залишок старанно промивають три рази дис 23 тильованим діетиловим ефіром і потім, після випарування розчинника у вакуумі, виділяють 2,15г жовтої олії. Приготування 8: 2-Метил-і-індолінамін Продукт одержують відповідно до методики Приготування 6, використовуючи 2-метил-індолін замість індоліну. Приготування 9: 5-фтор-N-аміноіндол Продукт одержують відповідно до методики Приготування 2, використовуючи 5-фторіндол замість індолу. Приготування 10: 5-Метоксі-N-аміноіндол Продукт одержують відповідно до методики Приготування 2, використовуючи 5-метокси-індол замість індолу. Приготування 11: Етил 1-алілпіперидин-3карбоксилат 2г етил піперидин-3-карбоксилату додають до 1,6г аліл броміду, і потім додають 13мл бензолу. Додають 1,08г карбонату натрію і реакційну суміш перемішують протягом ночі зі зворотним холодильником у бензолі. Реакційну суміш фільтрують і потім випаровують під зниженим тиском. Очищення шляхом дистиляції, використовуючи скляну піч, дозволяє виділити 1,53г очікуваного продукту. Тплавлення(8´10-2bar):80-85°С Інфрачервоний (vсм-1): 3078 (v=C-H); 2980; 2941; 2866 (vC-H); 2791(vN-CH2); 1733 (vC=O); 1644 (vC=C); 1468; 1453 (δC-H); 1368 (vC-N); 1223; 1182 (vC-O). Приготування 12; Етил 1-метилпіперидин-3карбоксилат 3г етил піперидин-3-карбоксилату, 4мл водного формальдегіду, 300мг 10% Pd/C і 4мл льодяної оцтової кислоти вміщують в атмосферу водню (1атм.) при 20°С протягом 17 годин. Після відфільтровування каталізатора над Целітом і промивання 50мл етанолу, розчин випаровують під зниженим тиском і одержують маслянистий залишок. Залишок розбавляють сумішшю толуол/вода (1/1) і рН доводять до 9 за допомогою додавання 20% K2СО3. Після розділення двох фаз, водну фазу екстрагують двічі толуолом. Органічні фази промивають водою, висушують над Na2SO4 і одержують світлу забарвлену олію. Дистилювання під зниженим тиском дає 2,4г очікуваного продукту. Точка плавлення: 105-110°С (Р=20ммHg) Приготування 13: Етил 1-пропілпіперидин-3карбоксилат 2г етил піперидин-3-карбоксилату додають до 1,6г 1-бромпропану, і потім додають 13мл бензолу. Додають 1,08г карбонату натрію і реакційну суміш перемішують протягом ночі при кип'ятінні зі зворотним холодильником у бензолі. Реакційну суміш фільтрують і потім висушують під зниженим тиском. Очищення дистилюванням, використовуючи скляну піч, дозволяє виділити 1,53г очікуваного продукту. Приготування 14: Метил 1-(2-гідроксіетил)1,2,5,6-тетрагідро-піридин-3-карбоксилат Стадія А: Метил 1,2,5,6-тетрагідропіридин-3карбоксилат 7г ареколін гідроброміду розчиняють в 20мл води, і потім розчин підлуговують за допомогою 89544 24 додавання 5,13г карбонату калію, з наступним насиченням NaCl. Водну фазу екстрагують три рази ефіром. Об'єднані органічні фази висушують над сульфатом натрію, фільтрують і потім випаровують, доки не одержать вагу 4,7г безбарвної олії. Олію розбавляють 33мл безводного толуолу, і потім додають 3,92мл 1-хлоретил хлорформіату. Утворюється осад, і суміш кип'ятять протягом ночі зі зворотним холодильником у толуолі. Осад відфільтровують і потім органічну фазу промивають розчином 0,1Μ хлористоводневої кислоти; водну фазу екстрагують один раз ефіром. Об'єднані органічні фази висушують над сульфатом натрію, фільтрують і потім випаровують під зниженим тиском. Залишок додають в 25мл метанолу і потім кип'ятять зі зворотним холодильником протягом 2 годин. Метанол випаровують під зниженим тиском, і одержують 3,8г метил 1,2,5,6-тетрагідропіридин3-карбоксилат гідрохлориду. Очікуваний продукт одержують за допомогою розчинення метил 1,2,5,6-тетрагідропіридин-3-карбоксилат гідрохлориду у воді і потім підлуговування за допомогою додавання карбонату калію, доки не досягнуть рН10. Проводять насичення хлоридом натрію і потім водну фазу екстрагують три рази ефіром; об'єднані органічні фази висушують над сульфатом натрію, фільтрують і потім випаровують, доки не одержать 3г очікуваного продукту. Стадія В: Метил 1-(2-гідроксіетил)-1,2,5,6тетрагідропіридин-3-карбоксилат До розчину 1,77г сполуки вищезазначеної Стадії А в 17мл безводного 1,4-діоксану додають 5,22г карбонату калію, 24мг йодиду натрію і потім 900мкл брометанолу. Реакційну суміш кип'ятять зі зворотним холодильником протягом ночі при перемішуванні і потім концентрують під зниженим тиском. Залишок додають у воду, і водну фаза екстрагують двічі етилацетатом. Об'єднані органічні фази висушують над сульфатом натрію, який фільтрують і потім випаровують, дозволяючи виділити 1,75г очікуваного продукту. Інфрачервоний (vсм-1): 3398 (vO-H); 2950; 2815 (vC-H); 1710 (vC=O); 1656 (vC=C). Приготування 15: Метил 1-(2-{[третбутил(диметил)силіл]окси}-етил)-1,2,5,6тетрагідропіридин-3-карбоксилат До розчину 1,5г сполуки Приготування 14 в 15мл піридину додають 2,08г третбутилдиметилсиліл хлориду. Розчин перемішують протягом ночі при температурі навколишнього середовища. Одержану тверду речовину розчиняють в дихлорметані і потім промивають рН11 розчином карбонату натрію; водну фазу екстрагують дихлорметаном. Об'єднані органічні фази висушують над сульфатом натрію, фільтрують і потім випаровують під зниженим тиском. Флешхроматографія на силікагелі (циклогексан/AcOEt: 3/1 і потім 2/1) дозволяє виділити 1,9г очікуваного продукту. Інфрачервоний (vсм-1): 2951; 2929; 2856 (vC-H); 1716 (vC=O); 1658 (vC=C). 25 89544 Приготування 16: Метил 1-(2диметиламіноетил)-1,2,5,6-тетрагідропіридин-3карбоксилат До розчину 1,94г сполуки Стадії А Приготування 14 в 27мл безводного 1,4-діоксану додають 2,03г йодиду натрію, 4,3г карбонату натрію і 1,45г 2-диметиламіноетил хлориду. Реакційну суміш перемішують протягом ночі при кип'ятіння зі зворотним холодильником у діоксані, і реакційну суміш потім фільтрують і промивають дихлорметаном. Фільтрат випаровують під зниженим тиском. Залишок додають в дихлорметан, промивають рН10 розчином карбонату натрію, висушують над Na2SO4, фільтрують і потім випаровують під зниженим тиском. Очищення, використовуючи скляну піч, дозволяє виділити 846мг очікуваного продукту. Інфрачервоний (vсм-1): 2948; 2816 (vC-H); 2765 (vN-CH3); 1712 (vC=O); 1657 (vC=C). Приготування 17: Метил 1-(2-гідроксіетил)1,4,5,6- тетрагідропіридин-3-карбоксилат Стадія А: 1-(2-Гідроксіетил)-3(метоксикарбоніл)піридиній бромід 10г метил нікотинату розчиняють в 5,2мл 2брометанолу і потім реакційну суміш нагрівають при 60°С протягом 24 годин, із захистом від світла. Залишок очищують флеш-хроматографією на силікагелі (кремнезему СН2СІ2/СН3ОН: 9/1 і потім 85/15), дають виділити 13,46г очікуваного продукту. Точка плавлення: 90°С Елементний мікроаналіз: Підраховано: Підраховано +Н2О: Знайдено: С% 41,24 38,59 37,99 Н% 4,61 5,04 5,01 N% 5,34 5,00 4,83 Стадія В: Метил 1-(2-гідроксіетил)-1,4,5,6тетрагідропіридин-3-карбоксилат До розчину 4г сполуки Вищезазначеної Стадії А в 100мл ректифікованого МеОН додають 2,73мл триетиламіну і 400мг 10% Pd/C. Суміш дегазують двічі у вакуумі і вміщують під водень. Реакційну суміш перемішують протягом 18 годин і потім фільтрують над Целітом (елююючи з СН2СІ2). Розчин випаровують під зниженим тиском Залишок додають в 100мл діетилового ефіру і води; водну фазу екстрагують двічі ефіром, і одержують 2,41г очікуваного продукту. Точка плавлення: 38°С Елементний мікроаналіз: Підраховано: Знайдено: С% 58,36 57,65 Н% 8,16 8,41 N% 7,56 7,38 Приготування 18: Метил 1-[(2диметиламіно)етил]-1,4,5,6-тетрагідропіридин-3карбоксилат До розчину 2г сполуки Приготування 17 в 20мл безводного дихлорметану додають 2мл триетиламіну і потім 1,1мл мезил хлориду при 0°С. Реакційну суміш перемішують протягом 30 хвилин при температурі навколишнього середовища і потім 26 додають 20мл води; органічну фазу розбавляють дихлорметаном. Водну фазу екстрагують двічі дихлорметаном. Об'єднані органічні фази висушують над Na2SO4, фільтрують і потім випаровують під зниженим тиском. Залишок додають в 20мл ацетонітрилу, і потім додають 12,5мл 2М диметиламіну в МеОН. Реакційну суміш перемішують протягом 15 годин при температурі навколишнього середовища і потім протягом 2 годин при 50°С. Реакційну суміш концентрують під зниженим тиском, додають в дихлорметан і промивають рН11 розчином K2СО3 і потім насиченим розчином NaCl. Органічну фазу висушують над Na2SO4, фільтрують і потім випаровують під зниженим тиском, даючи виділити 1,42г очікуваного продукту. Інфрачервоний, (vсм-1): 2961; 2853 (vC-H); 2771 (vN-CH3); 1678 (vC=O); 1617 (vC=C). Приготування 19: Етил 1-[2(диметиламіно)етил]піперидин-3-карбоксилат 3,51г 2-диметиламіноетил хлориду розчиняють в 50мл безводного 1,4-діоксану і потім додають 9,58г карбонату натрію і 4,52г йодиду натрію, з наступним додаванням 5,16г етил піперидин-3карбоксилату. Реакційну суміш кип'ятять зі зворотним холодильником протягом 20 годин і потім діоксан випаровують під зниженим тиском. Залишок додають в етилацетат і промивають водою і потім насиченим розчином хлориду натрію. Органічну фазу висушують над сульфатом натрію і потім випаровують під зниженим тиском. Очищення дистиляцією, використовуючи скляну піч, дозволяє виділити 3,41г очікуваного продукту. Точка плавлення =90°С (5´10-1бар) Інфрачервоний (vсм-1): 2941; 2857; 2815 (vC-H); 2766 (vN-CH3); 1730 (vC=O); 1464 (δC-H). Приготування 20; Етил И2-(4морфолініл)етил1піперидин-3-карбоксилат 2,0г сполуки Приготування 36 і 2,3мл морфоліну розчиняють в 15мл 70% етанолу. Реакційну суміш перемішують при температурі навколишнього середовища протягом 96 годин. Розчин потім концентрують і згодом додають в 30мл дихлорметану. Органічну фазу потім промивають декілька разів водою, висушують над Na2SO4, фільтрують і потім концентрують. Хроматографія на силікагелі (СН2СІ2/МеОН: 9/1) дозволяє виділити 2,3г очікуваного продукту. Інфрачервоний (vсм-1): 2943, 2854, 2810 (vC-H), 1729 (vC=O ефір), 1449 (δС-Н), 1372 (vC-N), 1117 (vC-O-C). Приготування 21; Етил 1-[2-(1піперидил)етил]піперидин-3-карбоксилат Продукт одержують відповідно до методики Приготування 20, використовуючи піперидин замість морфоліну. Інфрачервоний (vсм-1): 2939, 2859 (vC-H), 1726 (vC=O ефір), 1453 (δСН), 1372 (vC-N), 1183, 1154 (vC-O). Приготування 22: Етил 1-[2-(4-метил-1піперазиніл)етил]піперидин-3-карбоксилат 27 Продукт одержують відповідно до методики Приготування 20, використовуючи N-метилпіперазин замість морфоліну. Інфрачервоний (vсм-1): 2939, 2799 (vC-H), 1731 (С=О ефір), 1452 (δСН), 1373 (vC-N). Приготування 23: Етил 1-{2-[4-гідроксіетил)-1піперазиніл]етил}-піперидин-3-карбоксилат Продукт одержують відповідно до методики Приготування 20, використовуючи (2гідроксіетил)піперазин замість морфоліну. Інфрачервоний (νсм-1): 3235 (νΟ-Η), 2940, 2810 (vC-H), 1730 (vC=O ефір), 1451 (δС-Н), 1371 (vC-N), 1222 (vC-O). Приготування 24: Етил 1-[2-(1піролідиніл)етил]піперидин-3-карбоксилат Продукт одержують відповідно до методики Приготування 20, використовуючи піролідин замість морфоліну. Інфрачервоний (νсм-1): 2942, 2782 (vC-H), 1732 (vC=O ефір), 1452 (δСН), 1371 (vC-N), 1226 (vC-O). Приготування 25: Етил 1-[2-(1азепаніл)етил]піперидин-3-карбоксилат Продукт одержують відповідно до методики Приготування 20, використовуючи гексаметиленімін замість морфоліну. Інфрачервоний (vсм-1): 2925, 2853, 2810 (vC-H), 1733 (vС=O ефір), 1450 (δС-Н), 1370 (vC-N), 1225 (vC-O). Приготування 26: Етил 1-[2-(4-феніл-1піпеоазиніл)етил]піпепидин-3-карбоксилат Продукт одержують відповідно до методики Приготування 20, використовуючи 4-фенілпіперазин замість морфоліну. Інфрачервоний (vсм-1): 2942, 2817 (vC-H), 1731 (vC=O ефір), 1600 (vC=C), 1502, 1451 (vC-H). Приготування 27: 1-[2-(1Піперидил)етил]піперидин-3-карбоальдегід 0,98г сполуки Приготування 18 розчиняють в 30мл безводного THF і потім розчин охолоджують до -80°С. 2,5мл розчину DIBAL-H (1,5М в толуолі) потім повільно додають шприцом. Розчину потім перемішують при -80°С і потім, через 1,5 години, наступні 2,5мл розчину DIBAL-H додають до суміші. Після піддавання реакції протягом 3 годин при 80°С, додають 15мл води і температурі потім дають повернутись до температури навколишнього середовища. Розчин потім екстрагують двома 50мл кількостями СН2Сl2 і потім промивають насиченим розчином NaCl. Після висушування над Na2SO4 і концентрування одержують очікуваний продукт і його використовують без подальшого очищення на наступних стадіях. Приготування 28; 5-Хлор-N-аміноіндолін Стадія А: 1-Ацетиліндолін 23мл оцтового ангідриду додають краплями до 5г індоліну, підтримуючи температуру суміші при 0°С. Суміш кип'ятять зі зворотним холодильником протягом 4 годин, при перемішуванні, і потім випаровують під зниженим тиском. Флешхроматографія на силікагелі (циклогексан/ AcOEt: 6/4 і потім чистий AcOEt) дозволяє виділити 6,4г очікуваного продукту. 89544 28 Стадія В: 5-Хлоріндолін 3,84г SO2CI2 додають краплями при 0°С до розчину 6,4г сполуки вищезазначеної Стадії А в 170мл тетрахлорид вуглецю. Утворюється білий осад, який перемішують при температурі навколишнього середовища протягом однієї години. Суспензію розбавляють дихлорметаном і водою. Органічну фазу екстрагують і потім промивають 20% розчином гідроксиду водного натрію. Органічну фазу висушують над сульфатом натрію, фільтрують і потім випаровують під зниженим тиском. Залишок додають в 110мл абсолютного етанолу і кип'ятять зі зворотним холодильником, доки не завершиться розчинення. Додають 49мл 37% НСI і розчин потім перемішують при кип'ятінні зі зворотним холодильником протягом 3 годин 30 хвилин. Етанол випаровують під зниженим тиском, і водну фазу потім розбавляють 50мл води, екстрагують ефіром і потім підлуговують, використовуючи 20% водний розчин гідроксиду натрію. Водну фазу екстрагують три рази ефіром. Об'єднані органічні фази висушують над сульфатом натрію, фільтрують і потім випаровують під зниженим тиском. Флешхроматографія на силікагелі (циклогексан/AcOEt: 7/3) дозволяє виділити 3,53г очікуваного продукту. Стадія С: 5-Хлор-1-нітроіндолін До розчину, який охолоджують до 0°С, 3,53г сполуки вищезазначеної Стадії В в 70мл 50% водної оцтової кислоти додають, краплями, розчин 1,59г NaNO2 в 35мл води; розчин потім перемішують протягом 30 хвилин при 0°С. Суміш потім підлуговують за допомогою додавання 130мл 20% водного розчину гідроксиду натрію і потім екстрагують три рази етилацетатом. Об'єднані органічні фази висушують над сульфатом натрію, фільтрують і потім випаровують під зниженим тиском, дозволяючи виділити 4,15г очікуваного продукту. Точка плавлення: 89°С Елементний мікроаналіз: Підраховано: Знайдено: С% 52,62 53,86 Н% 3,86 4,41 N% 15,34 15,45 Стадія Р: 5-Хлор-N-аміноіндолін Суспензію 570мг LiAIH4 в 15мл безводного ефіру перемішують при кип'ятінні зі зворотним холодильником в ефірі протягом 45 хвилин і потім перемішують протягом ночі при температурі навколишнього середовища. 2г сполуки вищезазначеної Стадії С розчиняють в 6мл безводного THF і потім розбавляють 14мл безводного ефіру. Розчин, який таким чином одержують, додають краплями до розчину LiAlH4 при 0°С. Розчин перемішують протягом трьох годин при 0°С, і потім додають 0,5мл води, 1,5мл 15% водного розчину гідроксиду натрію і 0,5мл води під атмосферою азоту. Алюмінієві солі відфільтровують над Целітом (елююючи дихлор-метаном). Розчин випаровують під зниженим тиском. Флеш-хроматографія на силікагелі (циклогексан/AcOEt: 85/15 і потім 8/2 до 7/3) дозволяє виділити 1,7г очікуваного продукту. 29 89544 Точка плавлення: 30°С Елементний мікроаналіз: Підраховано: Знайдено: С% 56,98 58,13 Н% 5,38 5,61 N% 16,61 16,44 Приготування 29; Метил 1-(2-{[третбутил(диметил)силіл]окси}етил)-1,4,5,6-тетрагідро3-піридинкарбоксилат Продукт одержують відповідно до методики Приготування 15, використовуючи сполуку Приготування 17 замість сполуки Приготування 14. Приготування 30: Етил 1-(2гідроксіетил)піперидин-3-карбоксилат 2г етил піперидин-3-карбоксилату додають до 1,6г 2-брометанолу і потім розбавляють 13мл бензолу. Додають 1,08г карбонату натрію і реакційну суміш перемішують протягом ночі при кип'ятінні зі зворотним холодильником в бензолі. Реакційну суміш фільтрують і потім випаровують під зниженим тиском. Очищення дистиляцією, використовуючи піч для відпалу скла, дозволяє виділити 1,53г очікуваного продукту. Точка кипіння: 100°С (3´10-2бар) Інфрачервоний (vсм-1): 3412 (vO-H); 2941; 2808 (vC-H); 1730 (vC=O); 1468 (δС-Н). Приготування 31: Етил 1-бензилпіперидин-3карбоксилат Продукт одержують відповідно до методики Приготування 30, використовуючи бензил бромід замість 2-брометанолу. Приготування 32: Метил 4-(4-фторфеніл)-1метилпіперидин-3-карбоксилат 2,5г ареколіну розчиняють в 20мл безводного діетилового ефіру і 25мл безводного дихлорметану. Розчин охолоджують до -30°С і додають краплями 32,2мл 1М розчину (4-фторфеніл)магній броміду. Суміш перемішують протягом 3 годин при температурі від -30°С до -35°С і потім охолоджують до -78°С протягом 30 хвилин. Потім додають краплями 10мл 1/1 суміші трифтороцтової кислоти і ефіру; температуру суміші потім доводять 0°С і додають 15мл 1М розчину хлористоводневої кислоти, з наступним додаванням 28% розчину гідроксиду амонію, щоб довести до рН12. Органічну фазу збирають і Водну фазу екстрагують три рази етилацетатом. Об'єднані органічні фази висушують над сульфатом натрію, фільтрують і потім випаровують під зниженим тиском. Флешхроматографія на силікагелі (циклогексан/триетиламін: 3/1) дозволяє виділити очікуваний продукт. Приготування 33: трет-Бутил 4-{2-[3(етоксикарбоніл)-1-піперидил]-етил}піперазин-1карбоксилат Очікуваний продукт одержують відповідно до методики Приготування 20, використовуючи третбутил піперазин-1-карбоксилат замість морфоліну. Інфрачервоний (vсм-1): 2938, 2811 (vC-H); 1731 (vC=O ефір); 1698 (vС=O NBOc); 1455, 1421,1373 (vC-N) 30 Приготування 34: Етил 1-[3(диметиламіно)пропіл]піперидин-3-карбоксилат 1,5г сполуки Приготування 24 і 4,8мл диметиламіну розчиняють в 10мл 70% етанолу. Реакційну суміш перемішують при температурі навколишнього середовища протягом 48 годин. Додають наступні 4,8мл диметиламіну і реакційну суміш потім нагрівають при 50°С протягом 24 годин. Розчину потім концентрують, використовуючи роторний випарник, і згодом додають в 50мл дихлорметану. Органічна фаза потім промивають декілька разів водою, висушують над Na2SO4, фільтрують і потім концентрують. Хроматографія на силікагелі (СН2Сl2/МеOН: 9/1) дозволяє виділити 0,81г очікуваного продукту. Інфрачервоний (vсм-1): 2942, 2813, 2761 (ν С-Н); 1730 (vC=O ефір); 1466 (δС=Н); 1373 (νC-N); 1235, 1179 (vC=O), 1104 Приготування 35: Етил 1-(3гідроксипропіл)піперидин-3-карбоксилат Продукт одержують відповідно до методики Приготування 30, використовуючи 3бромпропанол замість 2-брометанолу. Точка кипіння: 125°С (3´10-2бар) Інфрачервоний (vсм-1): 3388 (vO-H); 2941; 2861; 2811 (vC-H) 1729 (vC=O); 1470 (δС-Н). Приготування 36: Етил 1-(2хлоретил)піперидин-3-карбоксилат 10,0г етил 3-піперидин-3-карбоксилату розчиняють в 80мл ацетону, і потім додають 11мл 1бром-2-хлоретану і 14г карбонату калію при температурі навколишнього середовища. Після перемішування протягом 40 годин, розчинник випаровують і потім додають 50мл води і 100мл діетилового ефіру. Органічну фазу відокремлюють, промивають водою, висушують над Na2SО4 і потім концентрують. Хроматографія на силікагелі (петролейний ефір/етиловий ефірі: 6/4) дозволяє виділити 9,24г очікуваного продукту. Інфрачервоний (vсм-1): 2943, 2808 (vC-H), 1729 (vС=O ефір), 1468, 1450 (δС-Н), 1370 (vC-N), 1209, 1179 (vC-O). Приготування 37: Етил 1-(3хлорпропіл)піперидин-3-карбоксилат Продукт одержують відповідно до методики Приготування 36, використовуючи 1-бром-3хлорпропан замість 1-бром-2-хлорпропану. Інфрачервоний (νсм-1): 2945, 2808 (vC-H), 1730 (vC=O ефір), 1469, 1446 (vC-H), 1371 (vC-N), 1179, 1153 (vC-O). Приготування 38: Етил 1-[3-(1піперидил)пропіл1піперидин-3-карбоксилат Продукт одержують відповідно до методики Приготування 20, використовуючи піперидин замість морфоліну і сполуку Приготування 37 замість сполуки Приготування 36. Інфрачервоний (vсм-1): 2933, 2854, 2802, 2761 (vC-H), 1731 (vC=O ефір), 1469, 1463 (δС-Н), 1373 (vC-N), 1271, 1178 (vC-O). Приготування 39: Етил 1-[3-(4-метил-1піперазин)пропіл]піперидин-3-карбоксилат 31 Продукт одержують відповідно до методики Приготування 20, використовуючи N-метилпіперазин замість морфоліну і сполуку Приготування 37 замість сполуки Приготування 36. Інфрачервоний (vсм-1): 2939, 2794 (vC-H), 1730 (vC=O ефір), 1448 (δСН), 1372 (vC-N), 1283,1150 (vC-O). Приготування 40: Етил 1-(2-{[третбутил(диметил)силіл]окси}етил)-піперидин-3карбоксилат 1,276г трет-бутилдиметилсиліл хлориду додають до розчину 1г сполуки Приготування 30 в 16мл піридину. Реакційну суміш перемішують протягом ночі при температурі навколишнього середовища, і потім піридин випаровують під зниженим тиском (співвипаровування з толуолом). Залишок додають в дихлорметан, промивають двічі водою і потім насиченим розчином NaCl. Органічну фазу висушують над сульфатом натрію, фільтрують і потім випаровують. Флеш-хроматографія на силікагелі (циклогексан/AcOEt: 3/1) дозволяє виділити 1,1г очікуваного продукту. Інфрачервоний (νсм-1): 2930; 2857 (vC-H); 1733 (vC=O); 1470 (δС-Н). Приготування 41; Етил 1-(3-{[третбутил(диметилкиліл]окси}-пропіл)піперидин-3карбоксилат Продукт одержують відповідно до методики Приготування 40, використовуючи сполуку Приготування 35 замість сполуки Приготування 30. Інфрачервоний (νсм-1): 2951; 2930; 2857 (vC-H); 1734 (vC=O); 1471 (δС-Н). Приготування 42: Метил 1-(2-хлоретил)1,2,5,6-тетрагідропіридин-3-карбоксилат. Стадія А: Гідрохлорид гувацину 7г ареколін гідроброміду розчиняють в 20мл води, розчин підлуговують за допомогою додавання 5,13г карбонату калію і потім насичують з NaCl. Водну фазу екстрагують три рази діетиловим ефіром. Об'єднані органічні фази висушують над сульфатом натрію, фільтрують і потім випаровують, доки не одержать вагу 4,7г безбарвної олії. Олію додають в 20мл толуолу; розчин є мутним. Після додавання сульфату натрію і фільтрування, нерозчинний матеріал промивають 13мл толуолу. До органічного розчину додають 3,92мл 1-хлоретил хлорформіату. Утворюється осад і реакційну суміш кип'ятять протягом 12 годин зі зворотним холодильником в толуолі. Осад відфільтровують і потім органічну фазу промивають 0,1Μ водним розчином хлористоводневої кислоти; водну фазу екстрагують однин раз діетиловим ефіром. Об'єднані органічні фази висушують над сульфатом натрію, фільтрують і потім випаровують під зниженим тиском. Залишок додають в 25мл метанолу і потім кип'ятять зі зворотним холодильником протягом 2 годин. Метанол випаровують під зниженим тиском, і одержують 3,8г очікуваного продукту з виходом 73%. Гувацинову основу одержують за допомогою розчинення гідрохлориду у воді; водну фазу підлуговують за допомогою додавання карбонату калію, доки не досягають рН10, і її насичують з NaCl. Водну фазу екстрагують три рази діетиловим ефіром і об'єднані органічні фази висушують над сульфа 89544 32 том натрію, фільтрують і потім випаровують доти, доки не одержують 3г безбарвної олії. Елементний мікроаналіз: Підраховано: Знайдено: С% 47,33 47,38 Н% 6,81 6,93 N% 7,89 7,83 Стадія В: Метил 1-(2-хлоретил)-1,2,5,6тетрагідропіридин-3-карбоксилат До суспензії 530мг сполуки вищезазначеної Стадії А в 12мл ацетону додають 2,53мл триетиламіну і 1,1мл 1-бром-2-хлоретану. Суміш перемішують при температурі навколишнього середовища протягом 18 годин і потім кип'ятять зі зворотним холодильником протягом 8 годин. Випаровують під зниженим тиском, додають в дихлорметан і промивають водним розчином карбонату калію. Водну фазу екстрагують дихлорметаном. Об'єднані органічні фази висушують над сульфатом натрію, фільтрують і потім випаровують під зниженим тиском. Залишок очищують флешхроматографією на силікагелі (циклогексан/AcOEt: 7/3), дозволяючи одержати 430мг очікуваної сполуки. Елементний мікроаналіз: Підраховано: Знайдено: С% 53,08 53,74 Н% 6,93 7,22 N% 6,88 6,72 Інфрачервоний (νсм-1): 2951; 2917; 2811 (vC-H); 2767 (vN-CH2); 1709 (vC=O); 1657 (vC=C); 1462; 1436 (δС-Н); 1375 (vCN); 1261 (vC-O). Приготування 43: Метил 1-[2-(4метилпіперазин-1-іл)етил1]-1,2,5,6тетрагідропіридин-3-карбоксилат До розчину 320мг сполуки Приготування 42 в 5мл 70% водного етанолу додають 540мкл 1метилпіперазину. Розчин перемішують при температурі навколишнього середовища протягом 72 годин і потім випаровують під зниженим тиском. Залишок додають в дихлорметан і промивають двічі водним розчином карбонату натрію. Органічну фазу висушують над сульфатом натрію, фільтрують і випаровують під зниженим тиском, щоб одержати 320мг очікуваної сполуки. Інфрачервоний (νсм-1): 2938 (vC-H); 2793 (vN-CH3); 1712 (vC=O); 1657 (vC=C); 1438 (δС-Н); 1373 (vC-N); 1262 (vC-O). Приготування 44: 5-Метил-N-аміноіндол Продукт одержують відповідно до методики Приготування 2, використовуючи 5-метил-індол замість індолу. Приготування 45: Метил 1-[2-[4-[2-(третбутилдиметилсиланокси)-етил]піперазин-1іл]етил]-1,2,5,6-тетрагідропіридин-3-карбоксилат Стадія А: Метил 1-[2-[4-(2гідроксіетил]піперазин-1-іл]етил]-1,2,5.6тетрагідропіридин-3-карбоксилат Продукт одержують відповідно до методики Приготування 43, використовуючи 4-(2гідроксіетил)піперазин замість 1-метилпіперазину. Інфрачервоний (νсм-1): 33 89544 3350 (vO-H); 2946 (vC-H); 2812 (vN-CH2); 1710 (vC=O); 1656 (vC=C); 1437 (δС-Н); 1351 (vC-N); 1262 (vC-O). Стадія В: Метил 1-[2-[4-[2-(третбугилдиметалсиланокси)етил]піперазин-1-іл]етил]1,2,5,6-тетрагідропіридин-3-карбоксилат До розчину 340мг сполуки вищезазначеної Стадії А в 5мл піридину додають 260мг хлориду трибутилдиметилсилілу. Розчин перемішують при температурі навколишнього середовища протягом 16 годин і потім піридин випаровують під зниженим тиском. Після розчинення залишку в дихлорметані, органічну фазу екстрагують водним розчином карбонату калію. Водну фазу екстрагують дихлорметаном. Об'єднані органічні фази висушують над сульфатом натрію, фільтрують і випаровують під зниженим тиском. Флеш-хроматографія на силікагелі (CH2Cl2/CH3OH: 9/1, потім 85/15) дозволяє одержати 360мг очікуваного продукту. Приготування 46: Метил 1-[2-(піперидин-1іл)етил]-1,2,5,6-тетрагідропіридин-3-карбоксилат Продукт одержують відповідно до методики Приготування 43, використовуючи піперидин замість 1-метилпіперазину. Інфрачервоний (νсм-1): 2955; 2932; 2872 (vC-H); 1736 (vC=O); 1661 (vC=C); 1434 (δC-H); 1368; 1341 (vC-N); 1236; 1194 (vC-O). Приготування 47: 1,2-Біс[3-(етоксикарбоніл)1,2,5,6-тетрагідро-піридин-1-іл]-етан До розчину 900мг сполуки Стадії А Приготування 42 в 10мл метанолу додають 0,32мл 2бромхлоретану, з наступним додаванням 1,6мл триетиламіну. Суміш кип'ятять зі зворотним холодильником протягом 20 годин і випаровують під зниженим тиском. Залишок розчиняють в дихлорметані і екстрагують насиченим водним розчином карбонату калію. Водну фазу екстрагують дихлорметаном. Об'єднані органічні фази висушують над сульфатом натрію, фільтрують і випаровують під зниженим тиском. Флеш-хроматографія на силікагелі (AcOEt, потім AcOEt/MeOH: 95/5 до 90/10) дозволяє одержати 500мг очікуваного продукту. Точка плавлення: 77°С Елементний мікроаналіз: Підраховано: Знайдено: С% 61,13 61,17 Н% 7,91 7,76 N% 8,91 8,80 Інфрачервоний (νсм-1): 2950; 2908 (vC-H); 2807 (vN-CH2); 1708 (vC=O); 1656 (vC=C); 1435 (δС-Н); 1351 (vC-N); 1258 (vCO). Приготування 48: Етил (±)-1-[2-[4[(тетрагідрофуран-2-іл)метил]піперазин-1іл]етил]піперидин-3-карбоксилат Продукт одержують відповідно до методики Приготування 20, використовуючи 4[(тетрагідрофуран-2-іл)метил]піперидин замість морфоліну. Хроматографія на силікагелі (СН2Сl2/СН3ОН: 95/5) дозволяє виділити 1,2г очікуваного продукту. Інфрачервоний (vсм-1): 34 2939; 2871; 2810 (vC-H); 1730 (vC=O ефір); 1451 (δС-Н); 1371 (vC-N); 1300; 1154 (vC-O). Приготування 49: Етил 1-[2-[4-[2(диметиламіно)етил]піперазин-1іл)]етил]піперидин-3-карбоксилат Продукт одержують відповідно до методики Приготування 20, використовуючи N-[2(диметиламіно)етил]піперидин замість морфоліну. Інфрачервоний (vсм-1): 2941; 2810 (vC-H); 1730 (vC=O ефір); 1466 (δСН); 1304; 1154 (vC-O). Приготування 50: Метил (±)-1-[2-(4-(2метоксіетил)піперазин-1-іл)етил]піперидин-3карбоксилат Продукт одержують відповідно до методики Приготування 20, використовуючи (2метоксіетил)піперидин замість морфоліну. Інфрачервоний (vсм-1): 2941; 2809 (vC-H); 1734 (vC=O ефір); 1451 (δСН); 1305 (vC-N); 1155 (vC-O); 1014. Приготування 51: Етил 1-[2-[4-(1метилпіперидин-4-іл)піперазин-1іл]етил]піперидин-3-карбоксилат Продукт одержують відповідно до методики Приготування 20, використовуючи (1метилпіперидин-4-іл)піперазин замість морфоліну. Інфрачервоний (vсм-1): 2936; 2807 (vC-H); 1731 (vC=O ефір); 1449 (δСН); 1375 (vC-N); 1152 (vC-O). Приготування 52: Етил (±)-1-[3-[4-[2-(третбутилдиметилсилілокси)-етил]піперазин-1іл]пропіл]-піперидин-3-карбоксилат Стадія А: Етил (±)-1-[3-[4-(2гідроксіетил)піперазин-1-іл]пропіл]-піперидин-3карбоксилат Продукт одержують відповідно до методики Приготування 20, використовуючи (2пдроксіетил)піперазин замість морфоліну. Інфрачервоний (vсм-1): 2940; 2810 (vC-H); 1 731 (vC=O ефір); 1573; 1372; 1154 (vC-O). Стадія В: Етил (±)-1-[3-[4-[2-(третбутилдиметилсилілокси)-етил]піперазин-1іл]пропіл]піперидин-3-карбоксилат 1,0г сполуки вищезазначеної Стадії А розчиняють в 10мл піридину, і додають 0,7г TBDMSC1. Реакційну суміш перемішують при температурі навколишнього середовища протягом 12 годин; розчинник видаляють, у присутності толуолу, за допомогою дистилювання за допомогою роторного випарника. Хроматографія на силікагелі (СН2Сl2/МеОН: 95/5) дозволяє одержати 1,15г очікуваного продукту. Інфрачервоний (vсм-1): 2935; 2858; 2807 (vC-H); 2477; 1731 (vC=O ефір); 1460 (δС-Н); 1409; 1372; 1337; 1314; 1278; 1217; 1181. Приготування 53: 3-[N-Iндол-1іл)амінокарбоніл]-1-(4-хлорбутил)-піридиній бромід Стадія А: 1-(4-Хлорбутил)-3(метоксикарбоніл)піридиній бромід 3,0г метил нікотинату розчиняють в 9мл метанолу, і потім додають 5мл 1-бром-4-хлорбутану. Реакційну суміш кип'ятять зі зворотним холодильником протягом 24 годин. Після повернення до 35 89544 температури навколишнього середовища, додають 25мл діетилового ефіру. Олію, яка утворюється, виділяють за допомогою відведення супернатанту і промивають двічі 20мл діетилового ефіру. Після висушування під зниженим тиском одержують 4,2г очікуваного продукту. Стадія В: 3-[N-Індол-1-іл)амінокарбоніл]-1-(4хлорбутил)бромід піридиній 0,28г сполуки Приготування 2 розчиняють в 4мл безводного дихлорметану. Розчин охолоджують до -20°С і 2,1мл 2М розчину триметилалюмінію в гексані додають в атмосфері аргону. Після підвищування температури реакційної суміші до 0°С протягом 1 години 30 хвилин додають розчин 0,6г сполуки вищезазначеної Стадії А в 4мл безводного дихлорметану. Реакційну суміш потім кип'ятять зі зворотним холодильником протягом 18 годин. Після повернення температури до температури навколишнього середовища, додають 40мл дихлорметану і 20% (ваг./об.) водного розчину гідроксиду натрію додають краплями доти, доки не припинить виділятись метан. Органічну фазу відокремлюють, промивають послідовно 20% (ваг./об.) водним розчином гідроксиду натрію і насиченим розчином NaCl, висушують над Na2SO4 і концентрують до об'єму близько 10мл. Додають 50мл діетилового ефіру. Одержану тверду речовину відокремлюють фільтруванням і потім промивають декілька разів діетиловим ефіром. Після висушування одержують 0,53г очікуваного продукту. Точка плавлення: 164°С Інфрачервоний (vсм-1): 3028; 1625; 1589; 1556; 1443; 1286; 1210; 11 74. Приготування 54: Етил (±)-1-[2-(4бутилпіперазин-1-іл)етил]-піперидин-3карбоксилат Продукт одержують відповідно до методики Приготування 20, використовуючи 1бутилпіперазин замість морфоліну. Хроматографія на силікагелі (СН2Сl2/СН3ОН: 9/1+0,5% NEt3) дозволяє виділити 1,2г очікуваного продукту. Інфрачервоний (vсм-1): 2935; 2806 (vC-H); 1732 (vC=O ефір); 1450 (δСН); 1373 (vC-N); 1155 (vC-O). Приготування 55: Етил (±)-1-(проп-2ініл)піперидин-3-карбоксилат Продукт одержують відповідно до методики Приготування 11, використовуючи пропаргіл бромід замість алілброміду. Флеш-хроматографія на силікагелі (циклогексан/AcOEt: 85/15, потім 8/2) дозволяє одержати 500мг очікуваного продукту. Елементний мікроаналіз: Підраховано: Знайдено: С% 67,66 67,44 Н% 8,78 8,98 N% 7,17 7,30 Інфрачервоний (vсм-1): 3291 (νºС-Н); 2940; 2858; 2806 (νС-Н); 1727 (νС=О); 1629 (νС=С); 1468; 1450 (δС-Н); 1368; 1310 (vN-C); 1223; 1181 (vC-O). 36 Приготування 56: Етил (±)-1-[4-(піперидин-1іл)бут-2-ен-1-іл]піперидин-3-карбоксилат Під добре вентильованим ковпаком додають, послідовно і при температурі навколишнього середовища, до розчину 680мг 1,4-дибромбутену в 5мл бензолу, краплями, розчин 500мг етил ніпекотату в 5мл бензолу і 340мг карбонату натрію. Реакційну суміш перемішують при температурі навколишнього середовища протягом 18 годин, і потім додають 1,26мл піперидину. Суспензію перемішують при температурі навколишнього середовища протягом однієї години і реакційну суміш випаровують під зниженим тиском. Залишок розчиняють в дихлорметані і органічну фазу екстрагують водним розчином карбонату натрію. Водну фазу екстрагують дихлорметаном. Об'єднані органічні фази висушують над сульфатом натрію, фільтрують і випаровують під зниженим тиском. Флешхроматографія на силікагелі (СН2СІ2СН3ОН: 95/5, потім 9/1) дозволяє одержати 260мг очікуваного продукту. Інфрачервоний (vсм-1): 2934; 2854 (νС-Н); 2796; 2757 (vN-CH2); 1731 (νC=Ο); 1467; 1442 (δС-Н); 1368; 1352 (vC-N); 1218; 1180 (vC-O). Приклад 1: N-(1Н-індол-1-іл)-1-метил-1,2,5,6тетрагідропіридин-3-карбоксамід 1,94г метил 1-метил-1,2,5,6-тетрагідропіридин3-карбоксилат гідрохлориду розчиняють в 5мл води, і розчин потім підлуговують, використовуючи карбоніт калію, щоб досягнути рН10, і потім насичують NaCl. Водну фазу екстрагують три рази діетиловим ефіром. Об'єднані органічні фази висушують над Na2SO4, фільтрують і потім випаровують. 1,3г сполуки Приготування 2 розчиняють в 26мл безводного дихлорметану і потім, після охолодження до -25°С, додають 9мл 2М розчину триметилалюмінію в гексані. Через 1 годину 30 хвилин, додають розчин 1,27г ареколіну в 6,5мл безводного дихлорметану при температурі навколишнього середовища. Реакційну суміш кип'ятять зі зворотним холодильником протягом ночі і потім розбавляють дихлорметаном і виливають в 50мл 20% водного розчину гідроксиду натрію. Органічну фазу виділяють і водну фазу екстрагують дихлорметаном. Об'єднані органічні фази промивають насиченим розчином NaCl, висушують над сульфатом натрію, фільтрують і потім випаровують під зниженим тиском. Флеш-хроматографія на силікагелі (СН2Сl2/МеОН: 95/5 і потім 9/1) дозволяє виділити 470мг очікуваного продукту. Елементний мікроаналіз: Підраховано: Знайдено: С% 70,56 70,35 Н% 6,71 6,80 N% 16,46 16,36 Mac-спектрометрія (ESI+, m/z): 256,1 (М+Н+); 278,1 (M+Na+). Приклад 2: N-(1Н-індол-1-іл)-1-метил-1,2,3,6тетрагідропіридин-3-карбоксамід Очікуваний продукт одержують в ході очищення сполуки Прикладу 1. 180мг сполуки одержують після додавання залишку в діетиловий ефір, по 37 89544 рошкування і фільтрування над склоподібною фритою. Точка плавлення: 117°С Елементний мікроаналіз: Підраховано: Знайдено: С% 70,56 70,08 Н% 6,71 6,81 N% 16,46 16,24 Приклад 3: N-(1H-індол-1-іл)-1-метил-1,4,5,6тетрагідропіридин-3-карбоксамід 1г сполуки Приготування 2 розчиняють в 10мл безводного дихлорметану і потім реакційну суміш охолоджують до -20°С. Додають 5,5мл 2М розчину триметилалюмінію в гексані і реакційну суміш перемішують протягом 1 години 30 хвилин, дозволяючи підвищитись температурі. Додають розчин 1,5г сполуки Приготування 7 в 5мл дихлорметану і реакційну суміш кип'ятять зі зворотним холодильником протягом 12 годин. Реакційну суміш розбавляють дихлорметаном і потім виливають у 20% водного розчину гідроксиду натрію. Органічну фазу відокремлюють і промивають, спочатку 20% розчином гідроксиду натрію і потім насиченим розчином NaCl. Органічну фазу висушують над сульфатом натрію, фільтрують і потім випаровують під зниженим тиском. Флеш-хроматографія на силікагелі (дихлорметан) дозволяє виділити 0,640г очікуваного продукту. Точка плавлення: 207°С Елементний мікроаналіз: Підраховано: Знайдено: С% 70,56 70,40 Н% 6,71 6,70 N% 16,46 16,35 Mac-спектрометрія (ESI+, m/z): 256 (М+H+). Приклад 4; N-(2,3-дигiдpo-1H-iндoл-1-iл)-1мeтил-1,4,5,6-тeтpaгiдpo-піридин-3-карбоксамід Стадія А: N-(2,3-дигідро-1Н-індол-1іл)нікотинамід До 600мг сполуки Приготування 2, яку розчиняють в 18мл безводного дихлорметану додають, при 0°С, 108мг DMAP і 1,9мл триетиламіну, з наступним додаванням 955мг нікотиноїл хлорид гідрохлориду. Реакційну суміш перемішують протягом ночі при температурі навколишнього середовища і потім розбавляють дихлорметаном і потім промивають розчином карбонату калію доти, доки не досягають рН11. Водну фазу екстрагують дихлорметаном. Об'єднані органічні фази промивають насиченим розчином NaCl, висушують над Na2SO4, фільтрують і потім випаровують під зниженим тиском. Флеш-хроматографїя на силікагелі (СН2СІ2 і потім СН2СІ2/СН3ОН: 96/4 і 95/5) дозволяє виділити 600мг очікуваного продукту. Інфрачервоний (vсм-1): 3224 (vN-H); 3048 (v=C-H); 2845 (vC-H); 1656 (vC=O); 1590; 1532 (vC=C). Стадія В: 3-[(2,3-Дигідро-1Н-індол-1іламіно)карбоніл]-1-метилпіридиній йодид 420мг сполуки вищезазначеної Стадії А розчиняють в 1,56мл йодметану. Утворюється коричнева олія, яку перемішують протягом 24 годин при температурі навколишнього середовища, із захис 38 том від світла. Надлишок йодметану видаляють під зниженим тиском. Таким чином одержують 670мг очікуваного продукту. Інфрачервоний (vсм-1): 3224 (vN-H); 3048 (ν=С-Н ); 2845 (vC-H); 1656 (vC-O); 1590; 1532 (vC=C). Стадія С: N-(2,3-дигідро-1Н-індол-1-іл)-1метил-1,4,5,6-тетрагідро-піридин-3-карбоксамід 1,1г сполуки вищезазначеної Стадії В розчиняють в 15мл метанолу, і потім додають 450мкл триетиламіну і 100мг РtO2. Реакційну суміш дегазують і потім розміщують під атмосферою водню (процедуру повторюють двічі). Реакційну суміш перемішують протягом однієї години при температурі навколишнього середовища і потім очищують азотом. Суміш фільтрують над Целітом (елююючи метанолом) і потім розчинники випаровують під зниженим тиском. Флеш-хроматографія на силікагелі (AcOEt) дозволяє виділити 320мг очікуваного продукту. Точка плавлення: 127°С Елементний мікроаналіз: Підраховано: Знайдено: С% 70,01 69,80 Н% 7,44 7,55 N% 16,33 16,24 Приклад 5; 1-Метил-N-(2-метил-2,3-дигідро1Н-індол-1-іл)-1,2,5,6-тетрагідропіридин-3карбоксамід Продукт одержують відповідно до методики Прикладу 3, використовуючи сполуку Приготування 8 замість сполуки Приготування 2, і ареколін гідрохлорид замість сполуки Приготування 7. Точка плавлення: 178°С Елементний мікроаналіз: Підраховано: Знайдено: С% 70,82 69,97 Н% 7,80 7,84 N% 15,49 15,11 Mac-спектрометрія (ESI+, m/z): 272 (М+H+). Приклад 6: N-(5-хлор-1Н-індол-1-іл)-1-метил1,2,5,6-тетрагідропіридин-3-карбоксамід Продукт одержують відповідно до методики Прикладу 3, використовуючи сполуку Приготування 3 замість сполуки Приготування 2, і ареколін замість сполуки Приготування 7. Точка плавлення: 155°С Елементний мікроаналіз: Підраховано: Знайдено: С% 62,18 62,09 Н% 5,57 5,59 N% 14,50 14,44 Приклад 7: N-(5-фтор-1Н-індол-1-іл)-1-метил1,2,5,6-тетрагідропіридин-3-карбоксамід Продукт одержують відповідно до методики Прикладу 3, використовуючи сполуку Приготування 9 замість сполуки Приготування 2, і ареколін замість сполуки Приготування 7. Точка плавлення: 105°С Елементний мікроаналіз: 39 Підраховано: Знайдено: 89544 С% 65,92 65,75 Н% 5,90 5,96 N% 15,37 15,19 Приклад 8: N-(5-метокси-1Н-індол-1-іл)-1метил-1,2,5,6-тетрагідро-піридин-3-карбоксамід Продукт одержують відповідно до методики Прикладу 3, використовуючи сполуку Приготування 10 замість сполуки Приготування 2, і ареколін замість сполуки Приготування 7. Точка плавлення: 162°С Елементний мікроаналіз: Підраховано: Знайдено: С% 67,35 66,76 Н% 6,71 6,85 N% 14,72 14,73 Приклад 9: N-(2,3-диметил-1Н-індол-1-іл)-1метил-1,2,5,6-тетрагідро-піридин-3-карбоксамід Продукт одержують відповідно до методики Прикладу 3, використовуючи сполуку Приготування 5 замість сполуки Приготування 2, і ареколін замість сполуки Приготування 7. Точка плавлення: 168°С Елементний мікроаналіз: Підраховано: Знайдено: С% 72,06 71,59 Н% 7,47 7,74 N% 14,83 14,75 Приклад 10: 1-Метил-N-(3-метил-1H-індол-1іл)-1,2,5,6-тетрагідропіридин-3-карбоксамід Продукт одержують відповідно до методики Прикладу 3, використовуючи сполуку Приготування 4 замість сполуки Приготування 2, і ареколін замість сполуки Приготування 7. Точка плавлення: 152°С Елементний мікроаналіз: Підраховано: Знайдено: С% 71,35 71,36 Н% 7,11 7,17 N% 15,60 15,59 Приклад 11: N-(1Н-індол-1-іл)-1-метил-1,2,5,6тетрагiдропіридин-4-карбоксамід Продукт одержують відповідно до методики Прикладу 3, використовуючи метил 1-метил1,2,5,6-тетрагідропіридин-4-карбоксилат замість сполуки Приготування 7. Точка плавлення: 112°С Елементний мікроаналіз: Підраховано: Знайдено: С% 70,56 70,23 Н% 6,71 6,79 N% 16,46 16,17 Приклад 12: 1-Аліл-N-(5-хлор-1H-індол-1іл)піперидин-3-карбоксамід Продукт одержують відповідно до методики Прикладу 3, використовуючи сполуку Приготування 3 замість сполуки Приготування 2 і сполуку Приготування 11 замість сполуки Приготування 7. Точка плавлення: 130°С Елементний мікроаналіз: 40 Підраховано: Знайдено: С% 64,25 64,18 Н% 6,34 6,47 N% 13,22 13,20 Приклад 13: N-(5-хлор-1H-індол-1іл)піперидин-3-карбоксамід Продукт одержують відповідно до методики Прикладу 3, використовуючи сполуку Приготування 3 замість сполуки Приготування 2 і етил ніпекотат замість сполуки Приготування 7. Точка плавлення: 167°С Елементний мікроаналіз: Підраховано: Знайдено: С% 60,54 60,36 Н% 5,81 5,93 N% 15,13 15,12 Mac-спектрометрія (ЕІ): 277 (М+Н+). Приклад 14: 3-[(1Н-індол-1-іламіно)карбоніл]-1метилпіперидиній хлорид Стадія А: N-(1Н-індол-1-іл)-1-метилпіперидин3-карбоксамід Продукт одержують відповідно до методики Прикладу 3, використовуючи сполуку Приготування 12 замість сполуки Приготування 7. Macспектрометрія (ESI+, m/z): 258 (М+H+). Стадія В: 3-[(1Н-індол-1-іламіно)карбоніл]-1метилпіперидиній хлорид 6 крапель концентрованої НСI додають до розчину 228мг сполуки вищезазначеної Стадії А в 6мл безводного THF. Розчинник випаровують і залишок потім промивають діетиловим ефіром, дозволяючи одержати 256мг очікуваного продукту. Точка плавлення: >250°С Елементний мікроаналіз: Підраховано: Знайдено: С% 61,32 61,14 Н% 6,86 6,99 N% 14,30 14,16 Приклад 15: N-(2,3-дигідро-1Н-індол-1-іл)-1метил-1,2,5,6-тетрагідро-піридин-3-карбоксамід Продукт одержують відповідно до методики Прикладу 3, використовуючи сполуку Приготування 6 замість сполуки Приготування 2 і ареколін замість сполуки Приготування 7. Точка плавлення: 152°С Елементний мікроаналіз: С% Н% N% Підраховано: 70,01 7,44 16,33 Знайдено: 69,99 7,47 16,28 Приклад 16: 1-Метил-N-(2-метил-2,3-дигідро1Н-індол-1-іл)піперидин-3-карбоксамід Продукт одержують відповідно до методики Прикладу 3, використовуючи сполуку Приготування 8 замість сполуки Приготування 2 і сполуку Приготування 12 замість сполуки Приготування 7. Точка плавлення: 133°С Елементний мікроаналіз: Підраховано: Знайдено: С% 70,30 70,19 Н% 8,48 8,56 N% 15,37 15,23 41 89544 Mac-спектрометрія (ЕІ): 273 (М+H+). Приклад 17: N-(5-хлор-1H-індол-1-іл)-1пропілпіперидин-3-карбоксамід Продукт одержують відповідно до методики Прикладу 3, використовуючи сполуку Приготування 13 замість сполуки Приготування 7. Точка плавлення: 157°С Елементний мікроаналіз: Підраховано: Знайдено: С% 63,84 63,30 Н% 6,94 7,09 N% 13,14 13,12 Mac-спектрометрія (ESI+, m/z): 320, 322 (М+H+). Приклад 18: N-(5-хлор-1H-індол-1-іл)-1-(2гідроксіетил)-1,2,5,6-тетрагідро-3піридинкарбоксамід Стадія А: 1-(2-{[тpeтБyтил(димeтил)cилiл]oкci}eтил)-N-(5-xлop-1Hiндoл-1-іл)-1,2,5,6-тетрагідро-3-піридинкарбоксамід 1г сполуки Приготування 3 розчиняють в 10мл безводного дихлорметану і потім реакційну суміш охолоджують до -20°С. Додають 5,5мл 2М триметилалюмінію в гексані і реакційну суміш перемішують протягом 1 години 30 хвилин, дозволяючи температурі збільшитись. Додають розчин 1,5г сполуки Приготування 15 в 5мл дихлорметану і реакційну суміш кип'ятять протягом ночі зі зворотним холодильником у дихлорметані. Реакційну суміш розбавляють дихлорметаном і потім виливають у 20% водний розчин гідроксиду натрію. Органічну фазу відокремлюють і потім промивають 20% розчином гідроксиду натрію і потім насиченим розчином NaCl. Органічну фазу висушують над сульфатом натрію, фільтрують і потім випаровують під зниженим тиском. Флеш-хроматографія на силікагелі (AcOEt/циклогексан: 1/1 і потім 2/1) дозволяє виділити 1,5г очікуваного продукту. Інфрачервоний (vсм-1): 3244 (vN-H); 2953; 2928; 2856 (vC-H); 1672 (vC=O); 1642; 1520 (vC=C). Стадія В; N-(5-хлор-1Η-індол-1-іл)-1-(2гідроксіетил)-1,2,5,6-тетрагідро-3піридинкарбоксамід 6,72мл 1Μ Bu3NF в THF додають до розчину 1,46г сполуки вищезазначеної Стадії А в 12мл безводного THF, і реакційну суміш потім перемішують протягом ночі при температурі навколишнього середовища. Суміш концентрують під зниженим тиском і потім додають в дихлорметан і промивають водою і потім рН11 розчином карбонату натрію. Водні фази екстрагують дихлорметаном. Об'єднані органічні фази висушують над сульфатом натрію, фільтрують і потім випаровують під зниженим тиском. Флеш-хроматографія на силікагелі (AcOEt/MeOH: 95/5 і потім 9/1) дозволяє виділити 920мг очікуваного продукту. Точка плавлення: 84°С Елементний мікроаналіз: Підраховано: Знайдено: С% 60,09 59,94 Н% 5,67 5,78 N% 13,14 12,98 42 Приклад 19: 1-[2-(Диметиламіно)етил]-N-(1Ніндол-1-іл)-1,2,5,6-тетрагідро-3-піридинкарбоксамід дигідрохлорид Стадія А: 1-[2-(Диметиламіно)етил]-N-(1Ніндол-1-іл)-1,2,5,6-тетрагідро-3-піридинкарбоксамід Продукт одержують відповідно до методики Стадії А Прикладу 18, використовуючи сполуку Приготування 2 замість сполуки Приготування 3 і сполуку Приготування 16 замість сполуки Приготування 15. Стадія В: 1-[2-(Диметиламіно)етил]-N-(1Hіндол-1-іл)-1,2,5,6-тетрагідро-3-піридинкарбоксамід дигідрохлорид 200мг сполуки вищезазначеної Стадії А розчиняють в 0,5мл метанолу, і потім додають 285мкл 4,53Μ метанольної хлористоводневої кислоти. Розчин заливають ефіром і утворений осад відфільтровують і потім промивають ефіром. Одержують 210мг очікуваного продукту за допомогою висушування під зниженим тиском. Точка плавлення: 210°С Елементний мікроаналіз: Підраховано: Знайдено: С% 53,60 53,63 Н% 7,00 7,41 Ν% 13,89 13,42 Приклад 20: N-(5-хлор-1Н-індол-1-іл)-1-[2(диметиламіно)етил]-1,4,5,6-тетрагідро-3піридинкарбоксамід Продукт одержують відповідно до методики Стадії А Прикладу 18, використовуючи сполуку Приготування 18 замість сполуки Приготування 15. Точка плавлення: 166°С Елементний мікроаналіз: Підраховано: Знайдено: С% 62,33 62,17 Н% 6,68 6,73 Ν% 16,15 16,04 Mac-спектрометрія (ESI+, m/z): 347,1; 349,1 (M+H+); 369,1; 371,1 (M+Na+). Приклад 21: 1-[2-(Диметиламіно)етил]-N-(1Ніндол-1-іл)-1,4,5,6-тетрагідро-3-піридинкарбоксамід Продукт одержують відповідно до методики Стадії А Прикладу 18, використовуючи сполуку Приготування 2 замість сполуки Приготування 3, і сполуку Приготування 18 замість сполуки Приготування 15. Точка плавлення: 106°С Елементний мікроаналіз: Підраховано: Знайдено: С% 69,20 68,98 Н% 7,74 7,79 N% 17,93 17,84 Mac-спектрометрія (ESI+, m/z): 313,1 (М+H+); 335,2 (M+Na+). Приклад 22: 1-[2-(Диметиламіно)етил]-N-(1Ніндол-1-іл)-3-піперидин-карбоксамід Продукт одержують відповідно до методики Стадії А Прикладу 18, використовуючи сполуку Приготування 2 замість сполуки Приготування 3 і сполуку Приготування 19 замість сполуки Приготування 15. 43 89544 Точка плавлення: 79°С Елементний мікроаналіз: Підраховано: Знайдено: С% 68,76 68,70 Н% 8,33 8,41 N% 17,82 17,79 Mac-спектрометрія (ESI+, m/z): 315,2 (М+Н+); 337,2 (M+Na+). Приклад 23: N-(1Н-індол-1-іл)-1-[2-(4морфолініл)етил]-3-піперидин-карбоксамід Продукт одержують відповідно до методики Стадії А Прикладу 18, використовуючи сполуку Приготування 2 замість сполуки Приготування 3 і сполуку Приготування 20 замість сполуки Приготування 15. Точка плавлення: 131°С Елементний мікроаналіз: Підраховано: Знайдено: С% 67,39 67,44 Н% 7,92 8,04 N% 15,72 15,78 Приклад 24: N-(1H-індол-1-іл)-1-[2-(1піперидил)етил]-3-піперидин-карбоксамід Продукт одержують відповідно до методики Стадії А Прикладу 18, використовуючи сполуку Приготування 2 замість сполуки Приготування 3 і сполуку Приготування 21 замість сполуки Приготування 15. Точка плавлення: 113°С Елементний мікроаналіз: Підраховано: Знайдено: С% 71,15 71,01 Н% 8,53 8,54 N% 15,80 15,75 Інфрачервоний (vсм-1): 3108 (vN-H амід +v=C-H), 2921, 2853 (vC-H), 1690 (vC=O ефір). Приклад 25: N-(1H-індол-1-іл)-1-[2-(4-метил-1піперазиніл)етил]-3-піперидинкарбоксамід Продукт одержують відповідно до методики Стадії А Прикладу 18, використовуючи сполуку Приготування 2 замість сполуки Приготування 3 і сполуку Приготування 22 замість сполуки Приготування 15. Точка плавлення: 117°С Елементний мікроаналіз: Підраховано: Знайдено: С% 68,26 68,14 Н% 8,46 8,49 N% 18,95 18,88 Приклад 26: 1-{2-[4-(2-Гідроксіетил)-1піперазиніл]етил)-N-(1Н-індол-1-іл)-3піперидинкарбоксамід Продукт одержують відповідно до методики Стадії А Прикладу 18, використовуючи сполуку Приготування 2 замість сполуки Приготування 3 і сполуку Приготування 23 замість сполуки Приготування 15. Точка плавлення: 118°С Елементний мікроаналіз: 44 Підраховано: Знайдено: С% 66,14 65,96 Н% 8,32 8,33 N% 17,53 17,49 Приклад 27: N-(1H-індол-1-іл)-1-[2-(1піролідиніл)етил]-3-піперидинкарбоксамід Продукт одержують відповідно до методики Стадії А Прикладу 18, використовуючи сполуку Приготування 2 замість сполуки Приготування 3 і сполуку Приготування 24 замість сполуки Приготування 15. Точка плавлення: 117°С Елементний мікроаналіз: Підраховано: Знайдено: С% 70,56 70,54 Н% 8,29 8,21 N% 16,46 16,44 Приклад 28: 1-[2-(1-Азепаніл)етил]-N-(1Ніндол-1-іл)-3-піперидин-карбоксамід Продукт одержують відповідно до методики Стадії А Прикладу 18, використовуючи сполуку Приготування 2 замість сполуки Приготування 3 і сполуку Приготування 25 замість сполуки Приготування 15. Точка плавлення: >250°С Елементний мікроаналіз: Підраховано: Знайдено: С% 58,90 58,88 Н% 7,82 7,84 N% 12,48 12,38 Приклад 29: N-(1Н-індол-1-іл)-1-[2-(4-феніл-1піперазиніл)eтил]-3-піперидинкарбоксамід тригідрохлорид Продукт одержують відповідно до методики Стадії А Прикладу 18, використовуючи сполуку Приготування 2 замість сполуки Приготування 3, і сполуку Приготування 26 замість сполуки Приготування 15. 430мг залишку, який одержують в результаті, розчиняють в 1,5мл безводного МеОН, і потім додають 1,65мл 2М метанольного НСI розчину. Тригідрохлорид одержують за допомогою осаджування шляхом додавання 5мл ефіру, фільтрування і потім висушування у вакуумі. Точка плавлення: >250°С Елементний мікроаналіз: Підраховано: Знайдено: С% 55,87 55,84 Н% 6,85 6,83 N% 12,52 12,45 Приклад 30: N-(1Н-індол-1-іл)-N-({1-[2-[1птеридил)етил]-3-піперидил}-метил)амін тригідрохлорид Продукт одержують відповідно до методики Стадії А Прикладу 18, використовуючи сполуку Приготування 2 замість сполуки Приготування 3 і сполуку Приготування 27 замість сполуки Приготування 15. 310мг залишку, який одержують в результаті, розчиняють в 1,5мл безводного МеОН, і потім додають 1,5мл 2М метанольного НСI розчину. Тригі 45 89544 дрохлорид одержують за допомогою осаджування шляхом додавання 5мл ефіру, фільтрування і потім висушування у вакуумі. Точка плавлення: >250°С Елементний мікроаналіз: Підраховано: Знайдено: С% 56,06 55,88 Н% 7,84 8,02 N% 12,45 12,29 Приклад 31: N-(5-хлор-2,3-дигідро-1Н-індол-1іл)-1-(2-гідроксіетил)-1,4,5,6-тетрагідро-3піридинкарбоксамід Стадія А: N-(5-хлор-2,3-дигідро-1Н-індол-1іл)нікотинамід Продукт одержують відповідно до методики Стадії А Прикладу 4, використовуючи сполуку Приготування 28 замість сполуки Приготування 2. Інфрачервоний (vсм-1): 3265 (vN-H); 3025 (v=C-H); 2975; 2883 (vC-H); 1652 (vC=O); 1605; 1591; 1578; 1537(vC=C). Стадія В: 3-{[(5-Хлор-2,3-дигідро-1H-індол-1іл)аміно]карбоніл}-1-(2-гідроксіетил)піридиній бромід Продукт одержують відповідно до методики Стадії В Прикладу 4, використовуючи сполуку вищезазначеної Стадії А і використовуючи 2брометанол замість йодметану. Інфрачервоний (νсм-1): 3349 (vN-H, vO-H); 3052 (v=C-H); 2854 (vC-H); 1675 (vC=O); 1634; 1606; 1543 (vC=C). Стадія С: N-(5-хлор-2,3-дигідро-1Н-індол-1-іл)1-(2-гідроксіетил)-1,4,5,6-тетрагідро-3піридинкарбоксамід Продукт одержують відповідно до методики Стадії С Прикладу 4, використовуючи сполуку вищезазначеної Стадії В. Точка плавлення: 161°С Елементний мікроаналіз: Підраховано: Знайдено: С% 59,72 59,86 Н% 6,26 6,35 N% 13,06 13,16 Приклад 32: N-(2,3-дигідро-1H-індол-1-іл)-1-[2(диметиламіно)етил]-3-піперидинкарбокcамід дигідрохлорид Стадія А: N-(2,3-дигідро-1Н-індол-1-іл)-1-[2(диметиламіно)етил]-3-піперидинкарбоксамід 3мл трифтороцтової кислоти додають до 500мг сполуки Прикладу 22, розчиненої в 3мл безводного THF. Реакційну суміш вміщують під потік азоту і потім розчин 1г ціаноборгідриду натрію в 10мл THF додають краплями протягом 2 годин. Розчинники випаровують під зниженим тиском, залишок додають в дихлорметан і воду, суміш підлуговують розчином карбонату калію доти, доки не досягнуть рН11, і водну фазу потім екстрагують двічі дихлорметаном. Об'єднані органічні фази висушують над сульфатом нагрію, фільтрують і потім випаровують під зниженим тиском. Залишок додають в 13мл абсолютного етанолу, і потім додають 1,5мл 2N хлористоводневої кислоти. Реакційну суміш кип'ятять зі зворотним холодильником протягом 5 годин і потім випаровують під зниже 46 ним тиском. Залишок додають в 20мл 1/1 суміші дихлорметану і води, водну фазу підлуговують за допомогою додавання карбонату натрію доти, доки не досягнуть рН11. Органічну фазу відокремлюють, і потім водну фазу екстрагують двічі дихлорметаном. Об'єднані органічні фази висушують над сульфатом натрію, фільтрують і потім випаровують. Флеш-хроматографія на силікагелі (AcOEt/MeOH: 9/1 і потім 8/2 до 6/4) дозволяє виділити 255мг очікуваного продукту. Стадія В: N-(2,3-дигідро-1H-індол-1-іл)-1-[2(диметиламіно)етил]-3-піперидин-карбоксамід дигідрохлорид 255мг сполуки вищезазначеної Стадії А розчиняють в 4мл дихлорметану і потім додають 360мкл 4,53Μ метанольної хлористоводневої кислоти. Розчин перемішують протягом 5 хвилин і потім додають велику кількість ефіру: утворюється осад, який відфільтровують над склоподібною фритою, дозволяючи виділити 270мг очікуваного продукту. Точка плавлення: 108°С Елементний мікроаналіз: Підраховано: Знайдено: С% 55,52 55,63 Н% 7,77 7,91 Ν% 14,39 14,23 Приклад 33: N-(5-хлор-1Н-індол-1-іл)-1-(2гідроксіетил)-1,4,5,6-тетрагідро-3піридинкарбоксамід Продукт одержують відповідно до методики Стадії А Прикладу 18, використовуючи сполуку Приготування 17 замість сполуки Приготування 15. Точка плавлення: 195°С Елементний мікроаналіз: Підраховано: Знайдено: С% 60,69 60,20 Н% 5,67 5,86 Ν% 13,14 12,90 Приклад 34: 1-(2-Гідроксіетил)-N-(1H-індол-1іл)-1,4,5,6-тетpaгідро-3-піридинкарбоксамід Стадія А: 1-(2-{[тpeтБyтил(димeтил)cилiл]oкcи}мeтил)-N-(1H-iндoл-1iл)-1,4,5,6-тетрагідро-3-піридинкарбоксамід Продукт одержують відповідно до методики Стадії А Прикладу 18, використовуючи сполуку Приготування 2 замість сполуки Приготування 3 і сполуку Приготування 29 замість сполуки Приготування 15. Стадія В: 1-(2-Гідроксіетил)-N-(1Н-індол-1-іл)1,4,5,6-тетрагідро-3-піридин-карбоксамід Продукт одержують відповідно до методики Стадії В Прикладу 18, використовуючи сполуку вищезазначеної Стадії А. Точка плавлення: 152°С Елементний мікроаналіз: Підраховано: Знайдено: С% 67,35 67,37 Н% 6,71 6,81 N% 14,73 14,70 Mac-спектрометрія (ESI+, m/z): 286 (М+H+). Приклад 35: N-(Індол-1-іл)-N-[(1-метил-1,2,5,6тетрагідропіридин-3-іл)метил]амін дигідрохлорид 47 89544 Стадія А: (Z,Е)-(Індол-1-іл)[(піридин-3іл)метилен]амін 2,0г піридин-3-карбоксальдегіду розчиняють в 100мл толуолу, і потім додають 3,7г сполуки Приготування 2. Суміш вмішують в колбу, забезпечену апаратом Діна-Старка, і кип'ятять зі зворотним холодильником, при перемішуванні, доти, доки не одержують теоретичний об'єм води (18 годин). Реакційну суміш концентрують, використовуючи роторний випарник, і залишок потім очищують хроматографією на силікагелі (СН2Сl2/МеOН: 98/2), дозволяючи одержати 3,8г очікуваної сполуки. Точка плавлення: 112°С Стадія В: 3-[(Z, Е)-N-Індол-1-іл)імінометил]-1метилпіридиній йодид 5мл йодметану додають до розчину 2,0г сполуки вищезазначеної Стадії А в 10мл метанолу. Реакційну суміш перемішують при температурі навколишнього середовища протягом 24 годин. Додають 50мл діетилового ефіру; осад відокремлюють фільтруванням і висушують для одержання 3,05г очікуваної сполуки. Точка плавлення: 218°С Елементний мікроаналіз: Підраховано: Знайдено: С% 49,60 49,62 Н% 3,89 3,98 N% 11,57 11,48 Інфрачервоний (vсм-1): 3120; 3038; 1633; 1593; 1475; 1450; 1297; 1251; 1158. Стадія (Z,Е)-(Індол-1-іл)[(1-метил-1,2,5,6тетрагідропіридин-3-іл]метилен)]амін 522мг NaBH4 додають невеликими порціями до розчину 1,0г сполуки вищезазначеної Стадії В в 20мл метанолу, охолодженого до 0°С. Після додавання температура піднімається до температури навколишнього середовища і потім реакційну суміш перемішують протягом 1 години. Потім додають 50мл насиченого розчину гідрокарбонату натрію і суміш екстрагують 3´30мл дихлорметану. Об'єднані органічні фази екстрагують послідовно розчином гідрокарбонату натрію і насиченим розчином NaCl. Після висушування над Na2SO4 розчинники видаляють у вакуумі, використовуючи роторний випарник. Хроматографія на силікагелі (СН2Сl2/МеОН: 95/5) дозволяє одержати 0,51г очікуваного продукту. Елементний мікроаналіз: Підраховано: Знайдено: С% 75,28 72,02 Н% 7,16 7,35 N% 17,56 17,75 Інфрачервоний (vсм-1): 3104; 3053; 2964; 2960; 2930; 2895; 2846; 2762; 1642; 1614; 1454; 1292; 1255. Стадія D: (Індол-1-іл)[(1-метил-1,2,5,6тетрагідропіридин-3-іл)метил]амін дигідрохлорид 0,4г LiAltH4 додають, невеликими порціями і при температурі навколишнього середовища, до розчину 0,65г сполуки вищезазначеної Стадії С в 10мл діетилового ефіру. Реакційну суміш перемішують при температурі навколишнього середови 48 ща протягом 2 годин і потім додають 10мл води. Реакційну суміш екстрагують 3´20мл дихлорметану; органічну фазу промивають насиченим розчином гідрокарбонату натрію, висушують над сульфатом натрію і фільтрують, і потім випаровують під зниженим тиском. Залишок, очищений за допомогою хроматографії на силікагелі (СН2Сl2/МеОН: 95/5+0.5% NEt3), дозволяє одержати 0,56г основи. 100мг основи розчиняють в 0,5мл безводного МеОН, і потім додають 0,45мл 2М метанольного НСI розчину. Дигідрохлорид осаджується після додавання 5мл діетилового ефіру і його відокремлюють фільтруванням і потім висушують у вакуумі. Точка плавлення: 152°С Елементний мікроаналіз: Підраховано: Знайдено: С% 54,22 54,15 Н% 6,98 7,02 N% 12,65 12,48 Інфрачервоний (vсм-1): 2956; 2437; 2024; 1437; 1376; 1258. Приклад 36: 1-Бензил-N-(5-хлор-1Н-індол-1іл)-3-піперидинкарбоксамід Продукт одержують відповідно до методики Стадії А Прикладу 18, використовуючи сполуку Приготування 31 замість сполуки Приготування 15. Точка плавлення: 197°С Елементний мікроаналіз: Підраховано: Знайдено: С% 68,56 68,45 Н% 6,03 6,25 N% 11,42 11,31 Приклад 37: 3-{[(5-Хлор-1Н-індол-1іламіно]карбоніл}метилпіперидиній гідрохлорид Стадія А: N-(5-хлор-1Н-індол-1-іл)-1-метил-3піперидинкарбоксамід Продукт одержують відповідно до методики Стадії А Прикладу 18, використовуючи сполуку Приготування 12 замість сполуки Приготування 15. Інфрачервоний (vсм-1): 3117, 3081, 2937, 2464, 1697 Стадія В: 3-{[(5-Хлор-1Н-індол-1іл)аміно]карбоніл}-1-метилпіперидиній гідрохлорид 6 крапель концентрованої НСI додають до розчину 228мг сполуки вищезазначеної Стадії А в 6мл безводного THF. Розчинник випаровують і залишок потім промивають етиловим ефіром, дозволяючи одержати 256мг очікуваного продукту. Точка плавлення: >250°С Елементний мікроаналіз: Підраховано: Знайдено: С% 54,89 54,87 Н% 5,83 5,98 N% 12,80 12,83 Mac-спектрометрія (ESI+, m/z): 292 (М+H+). Приклад 38: (3R,4S)-3-(4-Фторфеніл)-N-(1Hіндол-1-іл)-1-метилпіперидин-4-карбоксамід 590мг сполуки Приготування 2 розчиняють у 6мл безводного дихлорметану і потім, після охолодження до -20°С, додають 4,1мл 2М триметила 49 89544 люмінію в гексані. Реакційну суміш перемішують протягом 1 години 30 хвилин без контролювання температури. Додають 930мг сполуки Приготування 32 в 4мл безводного дихлорметану і розчин потім перемішують протягом 18 годин при кип'ятінні зі зворотним холодильником у дихлорметані. Розчин розбавляють дихлорметаном і потім виливають у 20% водний розчин гідроксиду натрію. Органічну фазу відокремлюють і потім промивають 20% водним розчином гідроксиду натрію і насиченим NaCl розчином. Органічну фазу висушують над сульфатом натрію, фільтрують і потім випаровують під зниженим тиском. Залишок очищують флеш-хроматографією на силікагелі (СН2Сl2/МеOН: 97/3 і потім 95/5 і 9/1). Очікуваний продукт одержують шляхом осаджування у присутності ефіру. Точка плавлення: 134°С Mac-спектрометрія (ESI+, m/z): 352,1 (М+H+) Приклад 39: (3R,4R)-3-(4-Фторфеніл)-N-(1Hіндол-1-іл)-1-метилпіперидин-4-карбоксамід Очікуваний продукт одержують під час очищення сполуки Прикладу 38. Точка плавлення: 205°С Елементний мікроаналіз: Підраховано: Знайдено: С% 71,77 71,05 Н% 6,31 6,37 N% 11,96 11,86 Mac-спектрометрія (ESI+, m/z): 352,1 (М+H+); 374,2 (M+Na+). Приклад 40: трет-Бутил 4-(2-{3-[(1H-індол-1іламіно)карбоніл]-1-піперидил}етил)піперазин-1карбокcилат Продукт одержують відповідно до методики Стадії А Прикладу 18, використовуючи сполуку Приготування 2 замість сполуки Приготування 3 і сполуку Приготування 33 замість сполуки Приготування 15. Точка плавлення: 48°С Елементний мікроаналіз: Підраховано: Знайдено: С% 65,91 65,34 Н% 8,19 8,21 N% 15,37 15,00 Приклад 41: 1-[3-(Диметиламоній)пропіл]-3[(1Н-індол-1-іламіно)-карбоніліпіперидиній дигідрохлорид Продукт одержують відповідно до методики Прикладу 37, використовуючи сполуку Приготування 2 замість сполуки Приготування 3 і сполуку Приготування 34 замість сполуки Приготування 12. Точка плавлення: >250°С Елементний мікроаналіз: Підраховано: Знайдено: С% 54,41 54,45 Н% 7,69 7,71 N% 13,36 13,41 Приклад 42: N-(1H-індол-1-іл)-1-[3-(1піперидил)пропіл]-3-піперидин-карбоксамід Продукт одержують відповідно до методики Стадії А Прикладу 18, використовуючи сполуку 50 Приготування 2 замість сполуки Приготування 3 і сполуку Приготування 38 замість сполуки Приготування 15. Точка плавлення: 95°С Елементний мікроаналіз: Підраховано: Знайдено: С% 68,36 68,30 Н% 8,86 8,94 N% 14,44 14,24 Приклад 43: N-(1Н-індол-1-іл)-1-[3-(4-метил-1піперазиніл)пропіл]-3-піперидинкарбоксамід Продукт одержують відповідно до методики Стадії А Прикладу 18, використовуючи сполуку Приготування 2 замість сполуки Приготування 3 і сполуку Приготування 39 замість сполуки Приготування 15. Елементний мікроаналіз: Підраховано: Знайдено: С% 68,90 68,60 Н% 8,67 8,71 N% 18,00 18,15 Приклад 44: N-(5-хлор-1Н-індол-іл)-1-(2гідроксіетил)-3-піперидин-карбоксамід Стадія А: 1-(2-{[третБутил(диметил)сиділ]окси}етил)-N-(5-хлор-1Ніндол-1-іл)-3-піперидинкарбоксамід Продукт одержують відповідно до методики Стадії А Прикладу 18, використовуючи сполуку Приготування 40 замість сполуки Приготування 15. Інфрачервоний (vсм-1): 3225 (vN-H); 2930; 2856 (vC-H); 1677 (vC=O); 1517 (vC=C). Стадія В: N-(5-хлор-1Н-індол-1-іл)-1-(2гідроксіетил)-3-піперидин-карбоксамід Продукт одержують відповідно до методики Стадії В Прикладу 18, використовуючи сполуку вищезазначеної Стадії А. Точка плавлення: 125°С Елементний мікроаналіз: Підраховано: Знайдено: С% 59,72 59,02 Н% 6,55 6,26 N% 13,06 12,79 Mac-спектрометрія (ESI+, m/z): 322,1; 324,1 (М+Н+); 344,1; 346,1 (M+Na+). Приклад 45: 1-(3-Гідроксипропіл) N-(1H-індол1-іл)-3-піперидин-карбоксамід Стадія А: 1-(3-{[третБутил(диметил)силіл]окси}пропіл)-N-(1Н-індол-1іл)-3-піперидинкарбоксамід Продукт одержують відповідно до методики Стадії А Прикладу 18, використовуючи сполуку Приготування 2 замість сполуки Приготування 3 і сполуку Приготування 41 замість сполуки Приготування 15. Точка плавлення: 94°С Інфрачервоний (vсм-1): 2951; 2927; 2855 (vC-H); 1706 (vC=O); 1614; 1584 (vC=C). Стадія В: 1-(3-Гідроксипропіл)-N-(1H-індол-1іл)-3-піперидинкарбоксамід 51 89544 Продукт одержують відповідно до методики Стадії В Прикладу 18, використовуючи сполуку вищезазначеної Стадії А. Точка плавлення: 51°С Елементний мікроаналіз: Підраховано: Знайдено: С% 67,75 67,18 Н% 7,69 7,82 N% 13,94 13,49 Приклад 46: N-(Індол-1-іл)-1-[2-(4метилпіперазин-1-іл)етил]-1,2,5,6тетрагідропіридин-3-карбоксамід Продукт одержують відповідно до методики Прикладу 3, використовуючи сполуку Приготування 43 замість сполуки Приготування 7. Флеш-хроматографія (СН2СІ2/СН3ОН: 95/5, потім 9/1 і 8/2) дозволяє виділити 380мг очікуваного продукту. Точка плавлення: 130°С Елементний мікроаналіз: Підраховано: Знайдено: С% 68,63 68,49 Н% 7,95 8,09 N% 19,06 18,93 Інфрачервоний (vсм-1): 3054 (v=C-H); 2935 (vC-H); 2795 (vN-CH3); 1681 (vС=O); 1646; 1614 (vС=C); 1521 (δΝ-Η); 1458 (δCH); 1372 (vC-N). Приклад 47: N-(5-Xлopiндoл-1-iл)-1-[2-(4мeтилпiпepaзин-1-iл)eтил]-1,2,5,6тетрагідропіридин-3-карбоксамід До розчину 782мг сполуки Приготування 3 в 12мл безводного дихлорметану, попередньо охолодженого до -20°С, додають 4,30мл 2М розчину триіметилалюмінію в гексані. Розчин перемішують під атмосферою азоту протягом 1 години 30 хвилин, дозволяючи температурі поступово повернутись до температури навколишнього середовища. Потім додають 1,05г розчину сполуки Приготування 43 в 8мл безводного дихлорметану. Суміш кип'ятять зі зворотним холодильником під атмосферою азоту протягом 16 годин. До реакційної суміші, охолодженої до 0°С, додають 100мл 1М водного НСI розчину (повільне додавання на початку), і потім 250мл води. Перше екстрагування, використовуючи 3´100мл дихлорметану, видаляє надлишок N-аміно-5-хлоріндолу. Водну фазу підлуговують, використовуючи насичений розчину карбонату калію доти, доки не досягнуть рН10, і екстрагують, використовуючи 3´100мл дихлорметану. Органічну фазу висушують над сульфатом натрію, фільтрують і концентрують під зниженим тиском. Хроматографія на колонці силікагелю (NH4OH/MeOH/CH2Cl2: 1/1/98 до 2/18/80), з наступною рекристалізацією з 15мл суміші iPrOH/AcOEt (1/2), дозволяє одержати 470мг очікуваного продукту. Точка плавлення: 157°С Елементний мікроаналіз: Підраховано: С% 62,75 Н% 7,02 N% 17,42 52 Знайдено: 62,50 6,92 17,23 Mac-спектрометрія (ESI+, m/z): 402 (М+1). Інфрачервоний (νсм-1): 2946 до 2814 (νСН); 1681 (νCO); 1650; 1531; 1465. Приклад 48: N-(5-Метоксііндол-1-іл)-1-[2-(4метилпіперазин-1-іл)етил]-1,2,5,6тетрагідропіридин-3-карбоксамід Продукт одержують відповідно до методики Прикладу 47, використовуючи сполуку Приготування 10 замість сполуки Приготування 3. Хроматографія на колонці силікагелю (NH4OH/MeOH/CH2Cl2: 1/1/98 до 2/18/80) з наступним порохкуванням у 15мл діетилового ефіру протягом 15 хвилин і наступною кристалізацією з 10мл суміші AcOEt/Et2O (1/2) дозволяє одержати 820мг очікуваного продукту. Точка плавлення: 121°С Елементний мікроаналіз: Підраховано: Знайдено: С% 66,47 65,98 Н% 7,86 8,07 N% 17,62 17,33 Mac-спектрометрія (ESI+, m/z): 398 (М+1). Інфрачервоний (vсм-1): 3216 (vNH); 2938 до 2788 (νСН); 1669 (νCO); 1636; 1514; 1477. Приклад 49; N-(5-Метоксііндол-1-іл)-1-[2-(4метилпіперазин-1-іл)етил1-1,2,5,6тетрагідропіридин-5-карбоксамід Продукт одержують в ході очищення сполуки Прикладу 48. Рекристалізація з 5мл діізопропілового ефіру дозволяє одержати 138мг очікуваного продукту. Точка плавлення: 127°С Елементний мікроаналіз: Підраховано: Знайдено: С% 66,47 66,41 Н% 7,86 8,02 N% 17,62 17,41 Mac-спектрометрія (ESI+, m/z): 398 (М+1). Інфрачервоний (vсм-1): 3102 (νΝΗ); 2932 і 2799 (νСН); 1684 (νCO); 1480; 1445. Приклад 50: N-(5-Метиліндол-1-іл)-1-[2-(4метилпіперазин-1-іл)етил]-1,2,5,6тетрагідропіридин-3-карбоксамід Продукт одержують відповідно до методики Прикладу 47, використовуючи сполуку Приготування 44 замість сполуки Приготування 3. Хроматографія на колонці силікагелю (NH4OH/MeOH/CH2Cl2: 1/1/98 до 2/18/80) з наступним порохкуванням у 15мл діетилового ефіру протягом 15 хвилин дозволяє одержати 1,16г очікуваного продукту. Точка плавлення: 140°С Елементний мікроаналіз: Підраховано: Знайдено: С% 69,26 68,85 Н% 8,19 8,41 N% 18,36 17,96 53 89544 Mac-спектрометрія (ESI+, m/z): 382 (М+1). Інфрачервоний (vсм-1): 2945 до 2816 (vCH); 1681 (vCO); 1651; 1533; 1466. Приклад 51: N-(5-Метиліндол-1-іл)-1-[2-(4метилпіперазин-1-іл)етил]-1,2,5,6тетрагідропіридин-5-карбоксамід Продукт одержують в ході очищення сполуки Прикладу 50. Рекристалізація з 5мл діізопропілового ефіру дозволяє одержати 120мг очікуваного продукту. Точка плавлення: 131°С Елементний мікроаналіз: Підраховано: Знайдено: С% 69,26 69,12 Н% 8,19 8,41 N% 18,36 18,18 Mac-спектрометрія (ESI+, m/z): 382 (М+1). Інфрачервоний (vсм-1): 3141 (vNH); 2934 до 2766 (νCH); 1694 (νCO); 1515; 1457. Приклад 52; N-(Індол-1-іл)-1-[2-(4-(2гідроксіетил)піперазин-1-іл)етил]-1,2,5,6тетрагідропіридин-3-карбоксамід Стадія А: N-(Iндол-1-іл)-1-[2-[4-[2-(третбутилдиметилсиланокси)етил]-піперазин-1іл]етил]-1,2,5,6-тетрагідропіридин-3-карбоксамід До розчину 200мг сполуки Приготування 2 в 5мл безводного дихлорметану, після охолодження до -20°С, додають 1,35мл 2М розчину триіметилалюмінію в гексані. Розчин перемішують протягом 1 години 30 хвилин без контролювання температури і потім додають 500мг сполуки Приготування 45 в 3мл безводного дихлорметану при температурі навколишнього середовища. Суміш кип'ятять зі зворотним холодильником протягом 16 годин і, після охолодження, розбавляють дихлорметаном і виливають в 20% водний розчин гідроксиду натрію. Органічну фазу збирають і водну фазу екстрагують дихлорметаном. Об'єднані органічні фази висушують над сульфатом натрію, фільтрують і випаровують під зниженим тиском. Флешхроматографія на силікагелі (СН2СІ2/СН3ОН: 9/1, потім 8/2) дозволяє 400мг одержати очікуваний продукт. Інфрачервоний (vсм-1): 3244 (vN-H); 2949; 2929; 2855 (vC-H); 2811 (vNCH2); 1674 (vC=O); 1644 (νC=C); 1521; 1505 (δΝ-Η); 1460 (δC-H); 1360 (vC-N); 1256; 1223 (vC-O). Стадія В: N-(Iндoл-1-iл)-1-[2-[4-(2гiдpoкcieтил)піперазин-1-iл]eтил]-1,2,5,6тетрагідропіридин-3-карбоксамід До розчину 300мг сполуки вищезазначеної Стадії А в 4мл безводного THF додають 1,17мл 1М розчину тетрабутиламоній фториду в THF. Суміш перемішують протягом 12 годин при температурі навколишнього середовища, і потім розчин концентрують під зниженим тиском. Після додавання залишку в дихлорметан, органічну фазу екстрагують водним розчином гідроксиду натрію; водну фазу екстрагують дихлорметаном. Об'єднані органічні фази висушують над сульфатом натрію, фільтрують і випаровують під зниженим тиском. Флеш-хроматографія на силікагелі (AcOEt/MeOH: 54 7/3+0,1% триетиламін) дозволяє одержати 180мг очікуваного продукту. Точка плавлення: 113°С Елементний мікроаналіз: Підраховано: Знайдено: С% 63,59 64,12 Н% 8,00 8,08 N% 16,85 16,49 Інфрачервоний (vсм-1): 3192 (νΝ-Η); 2939 (νC-H); 2815 (νN-CH2); 1674 (νC=O); 1644 (νC=C); 1523 (δΝ-Η); 1459 (δC-H); 1353 (vC-N); 1270; 1223 (vC-O). Приклад 53: N-(Індол4-іл)-1-(2-піперидин-1-ілетил)-1,2,5,6-тетрагідро-піридин-3-карбоксамід Продукт одержують відповідно до методики Прикладу 3, використовуючи сполуку Приготування 46 замість сполуки Приготування 7. Флеш-хроматографія на силікагелі (СН2Сl2/СН3ОН: 9/1, потім 8/2) дозволяє виділити 240мг очікуваного продукту. Точка плавлення: 65°С Елементний мікроаналіз: Підраховано: Знайдено: С% 69,78 69,98 Н% 8,09 8,17 N% 15,50 15,40 Інфрачервоний (vсм-1): 3238 (vN-H); 2931 (vC-H); 2788 (vN-CH2); 1672 (vC=O); 1643 (vC=C); 1521 (δΝ-Η); 1459 (δC-H); 1370 (vC-N). Приклад 54: N-(Індол-1-іл)-1-[2-[3(етоксикарбоніл)-1,2,5,6-тетрагідро-піридин-1іл]етил]-1,2,5,6-тетрагідропіридин-3-карбоксамід Продукт одержують відповідно до методики Прикладу 3 використовуючи сполуку Приготування 47 замість сполуки Приготування 7. Флеш-хроматографія на силікагелі (AcOEt, потім AcOEt/CH3OH: 95/5) дозволяє виділити 180мг очікуваного продукту. Точка плавлення: 82°С Елементний мікроаналіз: Підраховано: Знайдено: С% 67,63 67,41 Н% 6,91 7,09 N% 13,72 13,63 Інфрачервоний (vсм-1): 3265 (vN-H); 2948; 2915; 2802 (vC-H); 1708; 1673 (vC=O); 1646; 1614; 1519 (vC=C); 1459; 1436 (δC-H); 1371; 1351 (vC-N); 1261; 1223; 1194 (vC-O). Приклад 55: (±)-N-(Індол-1-іл)-1-[2-[4[(тетрагідрофуран-2-іл)метил]-піперазин-1іл)]етил]піперидин-3-карбоксамідил тригідрохлорид 0,49г сполуки Приготування 48 розчиняють в 9мл безводного дихлорметану. Розчин охолоджують до -20°С, і потім додають в атмосфері аргону 3,5мл 2М розчину триіметилалюмінію в гексані. Після повернення температури реакційної суміші назад до 0°С протягом 1 години 30 хвилин, додають розчин 1,1г сполуки Приготування 48 в 6мл безводного дихлорметану. Реакційну суміш потім кип'ятять зі зворотним холодильником протягом 18 55 89544 годин. Після охолодження додають 50мл дихлорметану; потім краплями додають 20% (мас/об.) водного розчину гідроксиду натрію доти, доки не припинить виділятись метан. Органічну фазу відокремлюють, промивають послідовно 20% (мас/об.) водним розчином гідроксиду натрію і насиченим NaCl розчином, потім висушують над Na2SO4 і концентрують. Хроматографія на силікагелі (СН2Сl2/МеOН: 9/1+0,5% Net3) дозволяє одержати 0,46г очікуваного аміду. 150мг аміду розчиняють у 1,0мл безводного МеОН; до розчину додають 0,6мл 2М метанольного НСI розчину. Очікуваний продукт осаджують шляхом додавання 5мл діетилового ефіру; його потім відокремлюють шляхом відфільтровування і висушування у вакуумі. Точка плавлення: >250°С Елементний мікроаналіз: Підраховано: Знайдено: С% 54,70 55,02 Н% 7,34 7,48 N% 12,76 12,70 Інфрачервоний (vсм-1): 3385; 2975; 2411; 1694; 1531; 1458; 1325. Приклад 56: Етил (±)-N-(індол-1-іл)-1-[2-[4-[2(диметиламіно)етил]-піперазин-1іл]етил]піперидин-3-карбоксилаттетрагідрохлорид Продукт одержують відповідно до методики Прикладу 55, використовуючи сполуку Приготування 49 замість сполуки Приготування 48. Хроматографія на силікагелі (СН2Сl2/МеOН: 9/1 до 7/3+0,5% NEt3) дозволяє одержати 0,59г очікуваного аміду. 130мг аміду розчиняють у 0,5мл безводного МеОН; до розчину додають 0,7мл 2М метанольного НСI розчину. Очікуваний продукт одержують шляхом осадження після додавання 5мл діетилового ефіру; його відокремлюють шляхом фільтрування і висушують у вакуумі. Точка плавлення: >250°С Елементний мікроаналіз: Підраховано: Знайдено: С% 50,36 50,15 Н% 7,40 7,48 N% 14,68 14,40 Інфрачервоний (vсм-1): 2938; 2815; 1689; 1460; 1396; 1315. Приклад 57: (±)-N-(Iндoл-1-iл)-1-[2-[4-(2мeтoкcieтил)пiпepaзин-1-iл)]eтил]-піперидин-3карбоксамід тригідрохлорид Продукт одержують відповідно до методики Прикладу 55, використовуючи сполуку Приготування 50 замість сполуки Приготування 48. Хроматографія на силікагелі (СН2Сl2/МеOН: 90/10) дозволяє одержати 0,22г очікуваного аміду. 200мг аміду розчиняють у 1,0мл безводного МеОН; до розчину 0,8мл 2М метанольного НСI розчину. Очікуваний продукт одержують шляхом осадження після додавання 5мл діетилового ефіру; його відокремлюють шляхом фільтрування і висушують у вакуумі. Точка плавлення: >250°С Елементний мікроаналіз: 56 Підраховано: Знайдено: С% 52,83 52,74 Н% 7,32 7,39 N% 13,39 13,32 Інфрачервоний (vсм-1): 3381; 2981; 2503; 2299; 1689; 1656; 1449; 1325. Приклад 58: (±)-N-(Індол-1-іл)-1-[2-[4-(1метилпіперидин-4-іл)піперазин-1іл)]етил]піперидин-3-карбоксамід тетрагідрохлорид Продукт одержують відповідно до методики Прикладу 55, використовуючи сполуку Приготування 51 замість сполуки Приготування 48. Хроматографія на силікагелі (СН2Сl2/МеOН: 8/2+0,5% NEt3) дозволяє одержати 0,51г очікуваного аміду. 227мг аміду розчиняють у 1,0мл безводного МеОН; до розчину додають 1,1мл 2М метанольного НСI розчину. Очікуваний продукт одержують шляхом осадження після додавання 5мл діетилового ефіру; його відокремлюють шляхом фільтрування і висушують у вакуумі. Точка плавлення: >250°С Елементний мікроаналіз: Підраховано: Знайдено: С% 52,18 52,03 Н% 7,41 7,41 N% 14,04 13,94 Інфрачервоний (vсм-1): 3502; 3126; 2980; 2410; 1696 (vC=O амід); 1543; 1473; 1458. Приклад 59: (±)-N-(Індол-1-іл)-1-[3-[4-(2гідроксіетил)піперазин-1-іл)]пропіл]-піперидин-3карбоксамід тригідрохлорид Стадія А: (±)-N-(Індол-1-іл)-1-[3-[4-(2-третбутилдиметилсилілоксіетил)-піперазин-1іл)]пропіл]піперидин-3-карбоксамід тригідрохлорид Продукт одержують відповідно до методики Прикладу 55, використовуючи сполуку Приготування 52 замість сполуки Приготування 48. Хроматографія на силікагелі (СН2Сl2/МеOН: 9/1 до 8/2+0,5% NEt3) дозволяє одержати 0,89г очікуваного продукту. Інфрачервоний (vсм-1): 2934; 2856; 2810; 1682; 1460; 1361; 1253; 1155; 1099. Стадія В: (±)-N-(Індол-1-іл)-1-[3-[4-(2гідроксіетил)піперазин-1-іл)]пропіл]-піперидин-3карбоксамід тригідрохлорид 0,35г продукту вищезазначеної Стадії А розчиняють в 5мл етанолу 95%. Додають 500мкл 12М НСI розчину при температурі навколишнього середовища. Розчин потім нагрівають при 60°С протягом 2 годин. Після охолодження до температури навколишнього середовища, суспензію фільтрують над склоподібною фритою; одержану тверду речовину промивають декілька разів етанолом і висушують, дозволяючи одержати 0,29г очікуваного продукту. Точка плавлення: >250°С Елементний мікроаналіз: Підраховано: Знайдено: С% 53,83 53,37 Н% 7,32 7,41 N% 13,39 13,20 57 89544 Інфрачервоний (vсм-1): 3266; 3155; 2978; 2688; 2503; 2436; 1713; 1515; 1499; 1460. Приклад 60: (±)-N-(Індол-1-іл)-1-[4-(4метилпіперазин-1-іл)бутил]-піперидин-3карбоксамід тригідрохлорид Стадія A: 3-[N-(Індол-1-іл)амінокарбоніл]-1-[4(4-метилпіперазин-1-іл)бутил]піридиній бромід 0,6г сполуки Приготування 53 і 500мкл Nметилпіперазину розчиняють у 8мл етанолу 70%. Реакційну суміш перемішують при 50°С протягом 18 годин. Додають додаткові 1мл Nметилпіперазину двічі в ході наступних 24 годин в тих же умовах. Розчинники і надлишок Nметилпіперазину видаляють шляхом дистилювання, використовуючи роторний випарник. Сирий залишок використовують на наступній Стадії без подальшого очищення. Стадія В: N-(Індол-1-іл)-1-[4-(4метилпіперазин-1-iл)бутил]-1,4,5,6тетрагідропіридин-3-карбоксамід Сполуку вищезазначеної Стадії А розчиняють в 9мл суміші етилацетат/етанол (6:3); додають 100мг паладію-на-вуглеці (10%). Суспензію дегазують при перемішування у вакуумі і потім вміщують під атмосферу водню. Реакційну суміш витримують протягом 18 годин в атмосфері водню, потім очищують і вміщують під атмосферу азоту. Реакційну суміш фільтрують над Целітом і фільтрат концентрують. Хроматографія на силікагелі (СН2Сl2МеOН: 9/1 до 8/2+0,5% NEt3) дозволяє одержати 0,29г очікуваного продукту. Інфрачервоний (vсм-1): 2933; 1615; 1574; 1497; 1355; 1293; 1181. Стадія С: (±)-N-(Iндол-1-іл)-1-[4-(4метилпіперазин-1-іл)бутил]піперидин-3карбоксамід тригідрохлорид До розчину 295мг сполуки вищезазначеної Стадії В в 8мл суміші оцтова кислота/метанол (6:2) додають, невеликими порціями і при температурі навколишнього середовища, 200мг ціаноборгідриду натрію. Реакційну суміш перемішують протягом 3 годин при температурі навколишнього середовища. Потім додають 20мл 10% розчину гідроксиду натрію і 20мл дихлорметану. Органічну фазу промивають 3 рази 10% розчином гідроксиду натрію, висушують над сульфатом натрію, фільтрують і випаровують під зниженим тиском. Хроматографія на силікагелі (СН2Сl2/МеOН: 8/2+0.5% NEt3) дозволяє одержати 0,14г аміду. 100мг аміду розчиняють у 0,5мл безводного МеОН; до розчину додають 0,75мл 2М метанольного НСI розчину. Очікуваний продукт одержують шляхом осадження після додавання 5мл діетилового ефіру; його відокремлюють шляхом фільтрування і висушують у вакуумі. Точка плавлення: >250°С Елементний мікроаналіз: Підраховано: Знайдено: С% 54,49 54,60 Н% 7,56 7,80 N% 13,82 13,61 Інфрачервоний (vсм-1): 3382; 2948; 2401; 1687; 1528; 1458; 1315. 58 Приклад 61: (±)-N-(Індол-1-іл)-1-[4-(4-(2гідроксіетил)піперазин-1-іл]бутил]піперидин-3карбоксамід тригідрохлорид Стадія А: 3-[N-(Індол-1-іл)амінокарбоніл]-1-[4([4-(2-гідроксіетил)піперазин-1-іл)бутил]піридинїй бромід Продукт одержують відповідно до методики Стадії А Прикладу 60, використовуючи сполуку 1(2-гідроксіетил)піперазин замість Nметилпіперазину. Стадія В: N-(Індол-1-іл)-1-[4-[4-(2гідроксіетил)піперазин-1-іл)]бутил-1,4,5,6тетрагідропіридин-3-карбоксамід Продукт одержують відповідно до методики Стадії В Прикладу 60, використовуючи сполуку вищезазначеної Стадії А. Хроматографія на силікагелі (СН2Сl2МеOН: 8/2 до 7/3+0,5% NEt3) дозволяє одержати 0,12г очікуваного продукту. Стадія С: (±) N-(Індол-1-іл)-1-[4-(4-(2гідроксіетил)піперазин-1-іл)]бутил]-піперидин-3карбоксамід тригідрохлорид Продукт одержують відповідно до методики Стадії С Прикладу 60, використовуючи сполуку вищезазначеної Стадії В. Точка плавлення: >250°С Елементний мікроаналіз: Підраховано: Знайдено: С% 53,68 53,42 Н% 7,51 7,61 N% 13,04 12,89 Приклад 62: (±)-N-(Індол-1-іл)-1-[4-(4-(2гідроксіетил)піперазин-1-іл)]бутилі-піперидин-3карбоксамід тригідрохлорид Продукт одержують відповідно до методики Прикладу 55, використовуючи сполуку Приготування 54 замість сполуки Приготування 48. Хроматографія на силікагелі (СН2Сl2/МеOН: 9/1+0,5% NEt3) дозволяє одержати 0,82г очікуваного аміду. 600мг аміду розчиняють у 2,0мл безводного МеОН; до розчину додають 2,3мл 2М метанольного НСI розчину. Очікуваний продукт одержують шляхом осадження після додавання 10мл діетилового ефіру; його відокремлюють шляхом фільтрування і висушують у вакуумі. Точка плавлення: >250°С Елементний мікроаналіз: Підраховано: Знайдено: С% 55,33 55,12 Н% 7,74 7,91 N% 13,44 13,26 Інфрачервоний (vсм-1): 3371; 2959; 1686; 1535; 1459; 1372; 1314. Приклад 63: (±)-N-(Індол-1-іл)-1-алілпіперидин3-карбоксамід Продукт одержують відповідно до методики Прикладу 3, використовуючи сполуку Приготування 11 замість сполуки Приготування 7. Флеш-хроматографія на силікагелі (AcOEt) дозволяє одержати 930мг очікуваного продукту. Точка плавлення: 92°С Елементний мікроаналіз: 59 Підраховано: Знайдено: С% 72,06 71,70 89544 Н% 7,47 7,73 N% 14,83 14,61 Інфрачервоний (vсм-1): 3198 (νΝ-Η); 3032 (ν=C-H); 2940 (νС-Н); 2792 (νN-CH2); 1687 (νC=С); 1667 (νC=Ο); 1615 (vC=C); 1542 (δΝ-Η); 1462; 1421 (δC-H); 1378; 1362 (vC-N). Приклад 64; (±) N-(Індол-1-іл)-1-(проп-2iніл)піперидин-3-карбоксамід Продукт одержують відповідно до методики Прикладу 3, використовуючи сполуку Приготування 55 замість сполуки Приготування 7. Флеш-хроматографія на силікагелі (циклогексан/AcOEt: 2/8, потім AcOEt) дозволяє одержати 550мг очікуваного продукту. Точка плавлення: 154°С Елементний мікроаналіз: Підраховано: Знайдено: С% 72,57 72,38 Н% 6,81 6,97 N% 14,94 14,78 Інфрачервоний (vсм-1): 3232 (vºC-H); 3050 (ν=С-Н); 2946; 2913 (vC-H); 2118 (νC-C); 1698 (νC=Ο); 1614 (vC=C); 1569 (SNH); 1475; 1458 (δC-Η); 1368; 1340 (vC-N). Приклад 65: (±)-N-(Iндол-1-іл)-1-[4-(піперидин1-іл)бут-2-ен-1-іл]піперидин-3-карбоксамід До розчину 140мг сполуки Приготування 2 в 4мл безводного дихлорметану, розчин був охолоджений до -20°С, додають 0,97мл 2М триіметилалюмінію в гексані. Через 1 годину 30 хвилин без контролювання температури, розчин 260мг сполуки Приготування 56 в 2мл безводного дихлорметану додають при температурі навколишнього середовища. Реакційну суміш кип'ятять зі зворотним холодильником протягом 12 годин; додають дихлорметан, і суміш потім виливають в 20% (мас/об.) водного розчину гідроксиду натрію. Органічну фазу відокремлюють і водну фазу екстрагують дихлорметаном. Об'єднані органічні фази висушують над сульфатом натрію, фільтрують і потім випаровують під зниженим тиском. Флеш-хроматографія на силікагелі (СН2СІ2/СН3ОН: 9:1, потім 8/2) дозволяє одержати 310мг неочищеної фракції очікуваної сполуки. Тверду речовину розчиняють в 6мл суміші THF/H2O (2:1). Додають 50мг LiOH.H2O при температурі навколишнього середовища; суспензію перемішують протягом 12 годин. Дихлорметан і воду додають до реакційної суміші. Органічну фазу відокремлюють і водну фазу екстрагують дихлорметан. Об'єднані органічні фази висушують над сульфатом натрію, фільтрують і випаровують під зниженим тиском. Флеш-хроматографія на силікагелі (СН2СІ2СН3ОН:9/1, потім 8/2) дозволяє одержати 180мг очікуваного продукту. Точка плавлення: 116°С Елементний мікроаналіз: Підраховано: Знайдено: С% 70,92 71,15 Н% 8,54 8,50 N% 14,38 14,30 60 Інфрачервоний (vсм-1): 3166 (vN-H); 2999; 2934; 2854 (νС-Н); 2798; 2754 (vN-CH2); 1667 (νС=O); 1539 (δΝ-Η); 1459 (δСН); 1367 (vC-N). Приклад 66: (R або S) (-)-N-(Індол-1-іл)-[2(піперидин-1-іл)етил]піперидин-3-карбоксамід енантіомер 1 Цю сполуку одержують розділенням двох енантіомерів сполуки Прикладу 24, яке проводять шляхом напівпрепаративної хіральної ВЕРХ (Daicel Chiralpak AD, 1´25см) в наступних умовах: елюент: гексан (+0,1% TEA)/EtOH (+0,1% TEA): 96/4; швидкість потоку: 4,7мл/хв. Час утримування: 17хв.; чистота 100%; [α]D29=-15°(c=1,0; MeOH). Приклад 67: (R або S) (+)-N-(Індол-1-іл)-[2(піперидин-1-іл)етил]-піперидин-3-карбоксамід енантіомер 2 Цю сполуку одержують розділенням двох енантіомерів сполуки Прикладу 24, яке проводять шляхом напівпрепаративної хіральної ВЕРХ (Daicel Chiralpak AD, 1´25см) в наступних умовах: елюент: гексан (+0,1% ТЕА)/ЕtOН (+0,1% TEA): 96/4; швидкість потоку: 4,7мл/хв. Час утримування: 13хв.; чистота 100%; [α]D29=+13°(c=1,0; MeOH). Фармакологічні дослідження сполук за даним винаходом Приклад А: Індукування тирозин гідроксилази Пошук проводять серед сполук на ті, які здатні викликати збільшення білка тирозингідроксилази (ТН) в блакитній плямі (LC), чорній субстанції (SN) і вентральній тегментальній ділянці (VTA) мозку миші Ваlb/С. Використані тварини є родинними самцями мишей чистого штаму Balb/C (Charles River Laboratories) віком 6 тижнів під час лікування. Мишам дають єдину ін'єкцію, внутрішньочеревинним шляхом, сполуки, яку досліджують, розчиненої в 0,04М НСI розчині (відповідний контроль: 0,04М НСI), якщо сполука є достатньо розчинною, або в оливковій олії 90%/DMSO 10% (відповідний контроль: оливкова олія 90%/DMSO 10%) для сполук, які є нерозчинними у водному середовищі. Об'єм, який ін'єктують, складає 100мкл. Досліджувані групи включають 10 тварин. Через три дні після ін'єкції кожної сполуки всіх тварин умертвляють шляхом декапітації. Мозок видаляють і потім заморожують в розчині ізопентану при -30°С протягом 45 секунд і потім зберігають при -80°С. Потім роблять серійні коронарні зрізи товщиною 20 мікронів, використовуючи кріомікротом. Кожну структуру, яка представляє інтерес, потім досліджують вздовж передньозадньої вісі мозку шляхом взяття зрізів з 80-мікронними інтервалами у випадку LC і з 80- або 160-мікронними інтервалами у випадку VTA і SN. Інтервал значень цих структур є тим, який описаний в атласі Франкліна і Паксіноса. Загальну кількість білків кожного з цих зрізів переносять шляхом прямого збирання зрізів у нітроцелюлозний фільтр (Millipore). Кількості ΤΉ, присутньої в кожному зразку, вимірюють шляхом імунохімії, флуорометричного визначення і візуального аналізу. Результати: Результати індукування ТН в LC представлені в Таблиці І нижче.
ДивитисяДодаткова інформація
Назва патенту англійською1h-indole-pyridinecarboxamide and 1h-indole-piperidinecarboxamide derivatives, process for the preparation thereof and pharmaceutical composition comprising thereof
Автори англійськоюBrion Jean-Daniel, Bintein Fabrice, Razet Rodolphe, Razon Patrick, Renko Zafiarisoa Dolor, Levoirier Eric, Pujol Jean-Francois, Weissmann Dinah, Le Ridant Alain, Harpey Catherine
Назва патенту російськоюСоединения 1н-индолпиридинкарбоксамида и 1н-индолпиперидинкарбоксамида, способ их получения и фармацевтическая композиция, которая их содержит
Автори російськоюБрион Жан-Даниэль, Бинтен Фабрис, Разе Родольф, Разон Патрик, Ренко Зафиаризоа Долор, Левуарье Эрик, Пуйоль Жан-Франсуа, Вайссманн Дина, Ле Ридан Ален, Арпи Катрин
МПК / Мітки
МПК: C07D 401/12
Мітки: яка, 1н-індолпіперидинкарбоксаміду, сполуки, одержання, містить, композиція, 1н-індолпіридинкарбоксаміду, спосіб, фармацевтична
Код посилання
<a href="https://ua.patents.su/32-89544-spoluki-1n-indolpiridinkarboksamidu-i-1n-indolpiperidinkarboksamidu-sposib-kh-oderzhannya-i-farmacevtichna-kompoziciya-yaka-kh-mistit.html" target="_blank" rel="follow" title="База патентів України">Сполуки 1н-індолпіридинкарбоксаміду і 1н-індолпіперидинкарбоксаміду, спосіб їх одержання і фармацевтична композиція, яка їх містить</a>
Попередній патент: Крихка геланова безшовна капсула і спосіб її виготовлення
Наступний патент: Спосіб лікування чи попередження станів, викликаних грампозитивними бактеріями
Випадковий патент: Кумулятивний перфоратор












