Сполуки піролідину і тіазолідину, спосіб їх одержання і фармацевтична композиція, яка їх містить
Номер патенту: 84553
Опубліковано: 10.11.2008
Автори: Де Нантей Гійом, Арлей Елізабет, Комбетт Мюріель, Бенуат Ален
Формула / Реферат
1. Сполука формули (І):
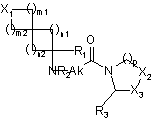 , (I)
, (I)
де:
Х1 являє собою атом або групу, вибрану з CR4aR4b, О, S(O)q1 і NR5,
де R4а і R4b, які можуть бути однаковими або відрізнятись, кожний являє собою атом водню або лінійну або розгалужену С1-С6алкільну групу,
або R4a і R4b разом утворюють, з атомом вуглецю, який несе їх, С3-С7циклоалкільну групу,
q1 являє собою нуль, 1 або 2,
і R5 являє собою атом водню або лінійну або розгалужену С1-С6алкільну групу, необов'язково заміщену гідроксигрупою,
m1 являє собою нуль або ціле число від 1 до 4 включно,
m2 являє собою ціле число від 1 до 4 включно,
n1 і n2, які можуть бути однаковими або відрізнятись, кожний являє собою ціле число від 1 до 3 включно,
R1 являє собою атом водню або групу, вибрану з карбокси, лінійного або розгалуженого С1-С6алкоксикарбонілу, карбамоїлу, необов'язково заміщеного 1 або 2 лінійними або розгалуженими С1-С6алкільними групами, і лінійного або розгалуженого С1-С6алкілу, необов'язково заміщеного гідроксигрупою або аміногрупою, необов'язково заміщеною 1 або 2 лінійними або розгалуженими С1-С6алкільними групами,
R2 являє собою атом водню або лінійну або розгалужену С1-С6алкільну групу,
Ak являє собою лінійний або розгалужений С1-С4алкіленовий ланцюг, необов'язково заміщений одним або більше атомами галогену, переважно фтором,
р являє собою нуль, 1 або 2,
R3 являє собою атом водню або ціаногрупу,
Х2 і Х3, які можуть бути однаковими або відрізнятись, кожний являє собою або S(O)q2 групу, де q2 являє собою нуль, 1 або 2, або СR6аR6b групу, де R6а і R6b, які можуть бути однаковими або відрізнятись, кожний являє собою атом водню або атом галогену, або R6a являє собою атом водню і R6b являє собою гідроксигрупу,
її оптичні ізомери, де вони існують, і її адитивні солі з фармацевтично прийнятною кислотою.
2. Сполука формули (І) за п. 1, де Х1 являє собою атом кисню або -СН2- групу.
3. Сполука формули (І) за п. 1 або 2, де m1 і m2 кожний являє собою 1 або 2.
4. Сполука формули (І) за будь-яким з пп. 1-3, де n1 і n2 кожний являє собою 1 або 2 і є однаковими.
5. Сполука формули (І) за п. 1, де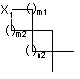 являє собою групу, вибрану з
являє собою групу, вибрану з
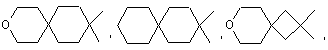
![]() .
.
6. Сполука формули (І) за будь-яким з пп. 1-5, де R2 являє собою атом водню.
7. Сполука формули (І) за будь-яким з пп. 1-6, де Ak являє собою -СН2- групу.
8. Сполука формули (І) за будь-яким з пп. 1-7, де р являє собою 1.
9. Сполука формули (І) за будь-яким з пп. 1-8, де R3 являє собою ціаногрупу.
10. Сполука формули (І) за будь-яким з пп. 1-9, де Х2 являє собою СR6аR6b групу.
11. Сполука формули (І) за будь-яким з пп. 1-10, де Х3 являє собою CR6aR6b групу.
12. Сполука формули (І) за пп. 9, 10 і 11, в яких конфігурація вуглецю, який несе R3 групу, являє собою (S).
13. Сполука формули (І) за п. 9, де Х2 або Х3 являє собою групу S(O)q2 і конфігурація вуглецю, який несе R3 групу, являє собою (R).
14. Сполука формули (І) за п. 1, яка вибрана з наступних сполук:
(2S)-1-({[9-(гідроксиметил)-3-оксаспіро[5.5]ундец-9-ил]аміно}ацетил)-2-піролідинкарбонітрил, і його адитивні солі з фармацевтично прийнятною кислотою;
(2S)-1-({[3-(гідроксиметил)спіро[5.5]ундец-3-ил]аміно}ацетил)-2-піролідинкарбонітрил, і його адитивні солі з фармацевтично прийнятною кислотою;
(2S)-1-({[2-(гідроксиметил)спіро[3.4]окт-2-ил]аміно}ацетил)-2-піролідинкарбонітрил, і його адитивні солі з фармацевтично прийнятною кислотою;
(4R)-3-[(спіро[5.5]ундец-3-иламіно)ацетил]-1,3-тіазолідин-4-карбонітрил, і його адитивні солі з фармацевтично прийнятною кислотою;
2-({2-[(2S)-2-ціанопіролідиніл]-2-оксоетил}аміно)спіро[3.3]гептан-2-карбоксамід, і його адитивні солі з фармацевтично прийнятною кислотою;
(2S)-1-({[(2-(2-гідроксиметил)-7-оксаспіро[3.5]нон-2-іл]аміно}ацетил)-2-піролідинкарбонітрил, і його адитивні солі з фармацевтично прийнятною кислотою;
(2S,4S)-4-фтор-1-({[9-(гідроксиметил)-3-оксаспіро[5.5]ундец-9-ил]аміно}-ацетил)-2-піролідинкарбонітрил, його (2S,4R)ізомер, його (2R,4R)ізомер і його адитивні солі з фармацевтично прийнятною кислотою;
(2S)-4,4-дифтор-1-({[9-(гідроксиметил)-3-оксаспіро[5.5]ундец-9-ил]аміно}-ацетил)-2-піролідинкарбонітрил, і його адитивні солі з фармацевтично прийнятною кислотою;
і (4R)-3-({[9-(гідроксиметил)-3-оксаспіро[5.5]ундец-9-ил]аміно}ацетил)-1,3-тіазолідин-4-карбонітрил, і його адитивні солі з фармацевтично прийнятною кислотою.
15. Спосіб синтезу сполуки формули (І) за п. 1, де сполуку формули
(II):
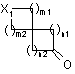 , (ІІ)
, (ІІ)
де Х1, m1, m2. n1 і n2 є такими, як визначено в пункті 1,
перетворюють у сполуку формули (III):
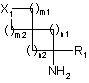 , (ІІІ)
, (ІІІ)
де Х1, m1, m2, n1, n2 і R1 є такими, як визначено в пункті 1,
яку піддають реакції зі сполукою формули (IV):
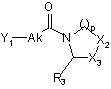 , (IV)
, (IV)
де Ak, р, R3, Х2 і Х3 є такими, як визначено в пункті 1, і Y1 являє собою відхідну групу,
з одержанням сполуки формули (Іа), конкретний випадок сполуки формули (І), де R2 являє собою атом водню:
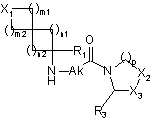 , (Іа)
, (Іа)
де Х1, m1, m2, n1, n2, R1, Ak, р, R3, Х2 і Х3 є такими, як визначено в пункті 1, яку, коли бажаним є одержати сполуку формули (І), де R2 відрізняється від атому водню, піддають реакції зі сполукою формули (V):
Y2-R'2, (V)
де Y2 являє собою відхідну групу і R'2 являє собою лінійну або розгалужену С1-С6алкільну групу,
з одержанням сполуки формули (Іb), конкретний випадок сполуки формули (І), де R2 являє собою лінійну або розгалужену С1-С6алкільну групу:
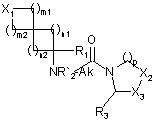 , (Іb)
, (Іb)
де X1, m1, m2. n1, n2, R1, Ak, p, R3, Х2 і Х3 є такими, як визначено в пункті 1, і
R'2 є таким же, як визначено вище,
сполуки формул (Іа) і (Іb), які складають сукупність сполук формули (І), очищують відповідно до звичайної техніки очищення, необов'язково
розділяють на їх оптичні ізомери відповідно до звичайної техніки розділення і
необов’язково перетворюють на адитивні солі з фармацевтично прийнятною кислотою.
16. Фармацевтична композиція, яка містить як активний інгредієнт сполуку за будь-яким з пп. 1-14 у поєднанні з одним або більше фармацевтично прийнятними, інертними, нетоксичними носіями.
17. Застосування сполуки за будь-яким з пп. 1-14 для виробництва ліків для застосування як інгібіторів дипептидилпептидази IV.
18. Застосування сполуки за будь-яким з пп. 1-14 для виробництва ліків при лікуванні непереносимості глюкози і розладів, асоційованих з гіперглікемією.
19. Застосування сполуки за будь-яким з пп. 1-14 для виробництва ліків для застосування у лікуванні діабетів II типу.
Текст
1. Сполука формули (І): 2 C2 1 3 84553 С6алкоксикарбонілу, карбамоїлу, необов'язково заміщеного 1 або 2 лінійними або розгалуженими С1-С6алкільними групами, і лінійного або розгалуженого С1-С6алкілу, необов'язково заміщеного гідроксигрупою або аміногрупою, необов'язково заміщеною 1 або 2 лінійними або розгалуженими С1-С6алкільними групами, R2 являє собою атом водню або лінійну або розгалужену С 1-С6алкільну гр упу, Ak являє собою лінійний або розгалужений С1С4алкіленовий ланцюг, необов'язково заміщений одним або більше атомами галогену, переважно фтором, р являє собою нуль, 1 або 2, R3 являє собою атом водню або ціаногрупу, Х2 і Х3, які можуть бути однаковими або відрізнятись, кожний являє собою або S(O)q2 групу, де q2 являє собою нуль, 1 або 2, або СR6аR6b груп у, де R6а і R6b, які можуть бути однаковими або відрізнятись, кожний являє собою атом водню або атом галогену, або R6a являє собою атом водню і R6b являє собою гідроксигрупу, її оптичні ізомери, де вони існують, і її адитивні солі з фармацевтично прийнятною кислотою. 2. Сполука формули (І) за п.1, де Х1 являє собою атом кисню або -СН2- груп у. 3. Сполука формули (І) за п.1 або 2, де m 1 і m 2 кожний являє собою 1 або 2. 4. Сполука формули (І) за будь-яким з пп.1-3, де n1 і n2 кожний являє собою 1 або 2 і є однаковими. X1 ( )m1 ( )m2 5. Сполука формули (І) за п.1, де ( )n2 являє собою групу, вибрану з O , , O , i . 6. Сполука формули (І) за будь-яким з пп.1-5, де R2 являє собою атом водню. 7. Сполука формули (І) за будь-яким з пп.1-6, де Ak являє собою -СН2- гр упу. 8. Сполука формули (І) за будь-яким з пп.1-7, де р являє собою 1. 9. Сполука формули (І) за будь-яким з пп.1-8, де R3 являє собою ціаногрупу. 10. Сполука формули (І) за будь-яким з пп.1-9, де Х2 являє собою СR6аR6b груп у. 11. Сполука формули (І) за будь-яким з пп.1-10, де Х3 являє собою CR6aR6b груп у. 12. Сполука формули (І) за пп.9, 10 і 11, в яких конфігурація вуглецю, який несе R3 групу, являє собою (S). 13. Сполука формули (І) за п.9, де Х2 або Х3 являє собою групу S(O)q2 і конфігурація вуглецю, який несе R3 групу, являє собою (R). 14. Сполука формули (І) за п.1, яка вибрана з наступних сполук: (2S)-1-({[9-(гідроксиметил)-3-оксаспіро[5.5]ундец-9ил]аміно}ацетил)-2-піролідинкарбонітрил, і його адитивні солі з фармацевтично прийнятною кислотою; 4 (2S)-1-({[3-(гідроксиметил)спіро[5.5]ундец-3ил]аміно}ацетил)-2-піролідинкарбонітрил, і його адитивні солі з фармацевтично прийнятною кислотою; (2S)-1-({[2-(гідроксиметил)спіро[3.4]окт-2ил]аміно}ацетил)-2-піролідинкарбонітрил, і його адитивні солі з фармацевтично прийнятною кислотою; (4R)-3-[(спіро[5.5]ундец-3-иламіно)ацетил]-1,3тіазолідин-4-карбонітрил, і його адитивні солі з фармацевтично прийнятною кислотою; 2-({2-[(2S)-2-ціанопіролідиніл]-2оксоетил}аміно)спіро[3.3]гептан-2-карбоксамід, і його адитивні солі з фармацевтично прийнятною кислотою; (2S)-1-({[(2-(2-гідроксиметил)-7-оксаспіро[3.5]нон-2іл]аміно}ацетил)-2-піролідинкарбонітрил, і його адитивні солі з фармацевтично прийнятною кислотою; (2S,4S)-4-фтор-1-({[9-(гідроксиметил)-3оксаспіро[5.5]ундец-9-ил]аміно}-ацетил)-2піролідинкарбонітрил, його (2S,4R)ізомер, його (2R,4R)ізомер і його адитивні солі з фармацевтично прийнятною кислотою; (2S)-4,4-дифтор-1-({[9-(гідроксиметил)-3оксаспіро[5.5]ундец-9-ил]аміно}-ацетил)-2піролідинкарбонітрил, і його адитивні солі з фармацевтично прийнятною кислотою; і (4R)-3-({[9-(гідроксиметил)-3-оксаспіро[5.5]ундец9-ил]аміно}ацетил)-1,3-тіазолідин-4-карбонітрил, і його адитивні солі з фармацевтично прийнятною кислотою. 15. Спосіб синтезу сполуки формули (І) за п.1, де сполуку формули (II): X1 ( )m1 ( )n1 ( )m2 ( )n2 O , (ІІ) де Х1, m 1, m 2. n1 і n2 є такими, як визначено в пункті 1, перетворюють у сполуку формули (III): X1 ( ) m1 ( ) n1 ( )m2 ( ) n2 R1 NH2 , (ІІІ) де Х1, m 1, m 2, n1, n2 і R1 є такими, як визначено в пункті 1, яку піддають реакції зі сполукою формули (IV): O Y1 Ak N ( )p X2 X3 R3 , (IV) де Ak, р, R3, Х2 і Х3 є такими, як визначено в пункті 1, і Y1 являє собою відхідну груп у, з одержанням сполуки формули (Іа), конкретний випадок сполуки формули (І), де R2 являє собою атом водню: 5 84553 ( )m1 X1 ( )n1 ( )m2 ( ) n2 N H O R1 N Ak ( )p X2 X3 R3 , (Іа) де Х1 , m 1, m 2, n1, n2, R 1, Ak, р, R 3, Х2 і Х3 є такими, як визначено в пункті 1, яку, коли бажаним є одержати сполуку формули (І), де R2 відрізняється від атому водню, піддають реакції зі сполукою формули (V): Y2-R' 2, (V) де Y2 являє собою відхідну груп у і R'2 являє собою лінійну або розгалужену С1-С6алкільну групу, з одержанням сполуки формули (Іb), конкретний випадок сполуки формули (І), де R2 являє собою лінійну або розгалужену С1-С6алкільну групу: ( )m1 X1 ( )n1 ( )m2 ( )n2 O R1 NR`2-Ak N R3 ( )p X2 X3 6 де X1 , m 1, m 2. n1, n2, R 1, Ak, p, R 3, Х2 і Х3 є такими, як визначено в пункті 1, і R'2 є таким же, як визначено вище, сполуки формул (Іа) і (Іb), які складають сукупність сполук формули (І), очищують відповідно до звичайної техніки очищення, необов'язково розділяють на їх оптичні ізомери відповідно до звичайної техніки розділення і необов’язково перетворюють на адитивні солі з фармацевтично прийнятною кислотою. 16. Фармацевтична композиція, яка містить як активний інгредієнт сполуку за будь-яким з пп.1-14 у поєднанні з одним або більше фармацевтично прийнятними, інертними, нетоксичними носіями. 17. Застосування сполуки за будь-яким з пп.1-14 для виробництва ліків для застосування як інгібіторів дипептидилпептидази IV. 18. Застосування сполуки за будь-яким з пп.1-14 для виробництва ліків при лікуванні непереносимості глюкози і розладів, асоційованих з гіперглікемією. 19. Застосування сполуки за будь-яким з пп.1-14 для виробництва ліків для застосування у лікуванні діабетів II типу. , (Іb) Даний винахід відноситься до нових сполук піролідину і тіазолідину, до способу їх одержання, до фармацевтичних композицій, які їх містять і до їх застосування як інгібіторів дипептидилпептидази IV (DPP IV). Дипептидил-пептидаза IV являє собою мембранну серинову протеазу, присутню в численних людських тканинах і залучену в численні патології. Зокрема, було продемонстровано, що DPP IV є відповідальною за інактивацію GLP-1 (глюкагонподібний пептид-1). GLP-1, будучи важливим стимулятором секреції інсуліну в підшлунковій залозі, має прямий позитивний вплив на рівень глюкози в крові. Інгібування DPP IV відповідно являє собою надзвичайно багатообіцяючий підхід у лікуванні непереносимості глюкози і розладів, пов'язаних з гіперглікемією, таких як, наприклад, інсулінонезалежний діабет (діабет типу II) або ожиріння. DPP IV-інгібітори вже були описані в літературі, зокрема сполуки аміду в заявці на видачу [патенту EР 0 490 379 і в журналі Adv. Exp. Med. Biol. 1997, 421. 157-160], сполуки карбамату в заявці на видачу [патенту DE 19826972], сполуки αамінокислоти в заявці на видачу [патенту ЕР 1 258 476] і сполуки сульфону в заявці на видачу [патенту EР 1 245 568]. Сполуки винаходу володіють дипептидилпептидаза IV-інгібуючими властивостями, роблячи їх особливо корисними для лікування непереносимості глюкози і розладів, пов'язаних з гіперглікемією. Більш конкретно, даний винахід відноситься до сполук формули (І): (I) де: - X1 являє собою атом або групу, вибрану з CR4aR4b, O, S(O)q1 і NR5, де R4a і R4b , які можуть бути однаковими або відрізнятись, кожний являє собою атом водню або лінійну або розгалужену С1-С6алкільну групу, або R4a і R4b разом утворюють, з атомом вуглецю, який несе їх, C3-С7циклоалкільну гр упу, q1 являє собою нуль, 1 або 2, і R5 являє собою атом водню або лінійну або розгалужену С1-С6алкільну груп у, необов'язково заміщену гідроксигрупою, - m 1 являє собою нуль або ціле число від 1 до 4 включно, - m 2 являє собою ціле число від 1 до 4 включно, - n1 і n2, які можуть бути однаковими або відрізнятись, кожний являє собою ціле число від 1 до 3 включно, - R1 являє собою атом водню або групу, вибрану з карбокси, лінійного або розгалуженого С 1С6алкоксикарбонілу, карбамоїлу, необов'язково заміщеного 1 або 2 лінійними або розгалуженими С1-С6алкільними групами, і лінійного або розгалуженого С1-С6алкілу, необов'язково заміщеного гідроксигрупою або аміногрупою, необов'язково заміщеною 1 або 2 лінійними або розгалуженими С1-С6алкільним групами, - R2 являє собою атом водню або лінійну або розгалужену С1-С6алкільну гр упу, 7 84553 - Ak являє собою лінійний або розгалужений С1-С4алкіленовий ланцюг, необов'язково заміщений одним або більше атомами галогену, переважно фтором, - р являє собою нуль, 1 або 2, - R3 являє собою атом водню або ціаногрупу, - X2 і X3, які можуть бути однаковими або відрізнятись, кожний являє собою або S(O)q2 групу, де q2 являє собою нуль, 1 або 2, або CR6aR6b, гр упу, де R6a і R6b які можуть бути однаковими або відрізнятись, кожний являє собою атом водню або атом галогену, переважно фтор, або R6a являє собою атом водню і R6b являє собою гідроксигрупу, до їх оптичних ізомерів, де вони існують, і до їх адитивних солей з фармацевтично прийнятною кислотою. Серед фармацевтично прийнятних кислот можуть бути згадані, без будь-якого обмеження, хлористоводнева кислота, бромистоводнева кислота, сірчана кислота, фосфорна кислота, оцтова кислота, трифтороцтова кислота, молочна кислота, піровиноградна кислота, малонова кислота, янтарна кислота, глутарова кислота, фумарова кислота, винна кислота, малеїнова кислота, лимонна кислота, аскорбінова кислота, метансульфонова кислота, камфорна кислота, оксалінова кислота. X1 переважно являє собою атом кисню або CH2- групу. m 1 і m 2 переважно кожний являє собою 1 або 2. n1 і n2 переважно кожний являє собою 1 або 2, і переважно вони є однаковими. 8 адитивні солі з фармацевтично прийнятною кислотою; (4R)-3-[(cпipo[5.5]yндeц-3-илaмiнo)aцeтил]-1,3тiaзoлiдин-4-кapбoнiтpил, і його адитивні солі з фармацевтично прийнятною кислотою; 2-({2-[(2S)-2-ціанопіролідиніл]-2оксоетил}аміно)спіро[3.3]гептан-2-карбоксамід, і його адитивні солі з фармацевтично прийнятною кислотою; (2S)-1-({[(2-(2-гідроксиметил)-7оксаспіро[3.5]нон-2-іл]аміно}ацетил)-2піролідинкарбонітрил, і його адитивні солі з фармацевтично прийнятною кислотою; (2S,4S)-4-фтор-1-({[9-(гідроксиметил)-3оксаспіро[5.5]ундец-9-ил]аміно}-ацетил)-2піролідинкарбонітрил, його (2S,4R)ізомер, його (2R,4R)ізомер і його адитивні солі з фармацевтично прийнятною кислотою; (2S)-4,4-дифтор-1-({[9-(гідроксиметил)-3оксаспіро[5.5]ундец-9-ил]аміно}-ацетил)-2піролідинкарбонітрил, і його адитивні солі з фармацевтично прийнятною кислотою; і (4R)-3-({[9-(гідроксиметил)-3оксаспіро[5.5]ундец-9-ил]аміно}ацетил)-1,3тіазолідин-4-карбонітрил, і його адитивні солі з фармацевтично прийнятною кислотою. Винахід відноситься також до способу одержання сполук формули (І), починаючи зі сполуки формули (II): (lI) де Х1, m 1, m 2, n1 і n2 є такими, як визначено для формули (І), яку перетворюють у сполуку формули (III): переважно являє собою групу, вибрану з , , , , . R2 переважно являє собою атом водню. Ak переважно являє собою -CH2- груп у. р переважно являє собою 1. R3 переважно являє собою ціаногрупу. В такому випадку, конфігурація вуглецю, який несе його, переважно являє собою (S), коли X2 і X3 кожний являє собою CR6aR6b, груп у, і (R), коли X2 або X3 являє собою S(O)q2 груп у. X2 і X3 переважно кожний являє собою CR6aR6b груп у. Переважні сполуки формули (І) являють собою: (2S)-1-({[9-(гідроксиметил)-3оксаспіро[5.5]ундец-9-ил]аміно}ацетил)-2піролідинкарбонітрил, і його адитивні солі з фармацевтично прийнятною кислотою; (2S)-1-({[3-(гідроксиметил)спіро[5.5]ундец-3ил]аміно}ацетил)-2-піролідин-карбонітрил, і його адитивні солі з фармацевтично прийнятною кислотою; (2S)-1-({[2-(гідроксиметил)спіро[3.4]окт-2ил]аміно}ацетил)-2-піролідин-карбонітрил, і його (llI) де X1, m 1, m 2, n1, n2 і R1 є такими, як визначено для формули (І), яку піддають реакції зі сполукою формули (IV): (IV) де Ak, р, R3, X1 і X3 є такими, як визначено для формули (І), і Y1 являє собою відхідну гр упу, з тим, щоб одержати сполуки формули (Ia), конкретний випадок сполук формули (І), де R2 являє собою атом водню: (Ia) де Х1 , m 1, m 2, n1 , n2 , R1, Ak, р, R3, X2 і X3 є такими, як визначено для формули (І), 9 84553 яку, коли бажаним є одержати сполуки формули (І), де R 2 відрізняється від атому водню, піддають реакції зі сполукою формули (V): Y2-R 2 (V) де Y2 являє собою відхідн у гр упу і R2 являє собою лінійну або розгалужену С 1-С6алкільну групу, з тим, щоб одержати сполуки формули (Ib), конкретний випадок сполук формули (І), де R2 являє собою лінійну або розгалужену С 1-С6алкільну груп у: 10 де X1, m 1, m 2, n1 і n2 є такими, як визначено для формули (І), яку нагрівають з сульфа том барію, з тим, щоб одержати сполуку формули (IIIb), конкретний випадок сполук формули (III), де R1 являє собою карбокси групу: (IIIb) де X1, m 1, m 2, n1 і n2 є такими, як визначено для формули (І), яку етерифікують до сполуки формули (IIIс), конкретного випадку сполук формули (III), де R1 являє собою алкоксикарбонільну гр упу: (Ib) (IIIc) де X1 , m 1, m 2, n1 , n2 , R1, Ak, р, R3, X2 і X3 є такими, як визначено для формули (І), і R'2 є таким же, як визначено вище, сполуки формул (Ia) і (Ib), які складають сукупність сполук формули (І), очищують відповідно до звичайної техніки очищення, необов'язково розділяють на їх оптичні ізомери відповідно до звичайної техніки розділення і, якщо бажано, перетворюють в адитивні солі з фармацевтично прийнятною кислотою. Сполуки формули (IV) можуть бути одержані відповідно до способу, який описується в [J. Med. Chem. 2002, Vol.45(12), 2362-2365]. Коли бажаним є одержати сполуки формули (І), де R1 являє собою атом водню, сполуку формули (II) піддають реакції з гідроксиламіном, з тим, щоб одержати сполуку формули (VI): (VI) де Х1, m 1, m 2, n1 і n2 є такими, як визначено для формули (І), яку потім гідрогенізують до сполуки формули (IIIa), конкретного випадку сполук формули (III), де R1 являє собою атом водню: (Illa) де X1, m 1, m 2, n1 і n2 є такими, як визначено для формули (І). Коли бажаним є одержати сполуки формули (І), де R1 являє собою гідроксиметильну, карбокси або алкоксикарбонільну гр упу, сполуку формули (II) піддають реакції з карбонатом амонію і ціанідом калію, з тим, щоб одержати сполуку формули (VII): (VII) де X1, m 1, m 2, n1 і n2 є такими, як визначено для формули (І), і R7 являє собою лінійну або розгалужену С 1-С6алкільну гр упу, відновлення якої дає сполуку формули (IIId), конкретний випадок сполук формули (III), де R1 являє собою гідроксиметильну груп у: (IIId) де X1, m 1, m 2, n1 і n2 є такими, як визначено для формули (І). Коли бажаним є одержати сполуки формули (І), де R1 являє собою 1-гідрокси-1-метилетильну груп у, сполуку формули (IIIс), після захисту амінофункції, піддають реакції з йодидом метилмагнію, з тим, щоб одержати, після зняття захисту амінофункції, сполуку формули (IIIe), конкретний випадок сполук формули (III), де R1 являє собою 1гідрокси-1-метилетильну груп у: (IIIe) де X1, m 1, m 2, n1 і n2 є такими, як визначено для формули (І). Коли бажаним є одержати сполуки формули (І), де R1 являє собою карбамоїльну групу, сполуку формули (IIIb), після захисту амінофункції, піддають реакції з аміаком у присутності зв'язувального агента, з тим, щоб одержати, після зняття захисту амінофункції, сполуку формули (llIf), конкретний випадок сполук формули (III), де R1 являє собою карбамоїльну гр упу: (Illf) де Х1, m 1, m 2, n1 і n2 є такими, як визначено для формули (І). Сполуки формули (II) можуть бути одержані, починаючи зі сполуки формули (VIII): 11 84553 (VIII) де Х1, m 1, m 2 і n2 є такими же, як визначено вище, і n' 1 являє собою нуль, 1 або 2, яку вміщують у присутності основи, такої як гідрид натрію, з тим, щоб одержати сполуку формули (IX): (IX) де Х1, m 1, m 2, n1 і n2 є таким же, як визначено вище, реакція якої з гідроксидом калію дає сполуку формули (II). Сполуки формули (IIа), конкретний випадок сполук формули (II), де n1 і n2 є однаковими і кожний являє собою 1, Також можуть бути одержані, починаючи зі сполуки формули (X): (X) де Х1, m 1 і m 2 є такими, як визначено для формули (І), яку піддають реакції з хлоридом трихлороцтової кислоти і цинком, з тим, щоб одержати сполуку формули (XI): (XI) де X1, m 1 і m 2 є такими, як визначено для формули (І), відновлення якої дає сполуку формули (llа): (Ila) де X1, m 1 і m 2 є такими, як визначено для формули (І). Сполуки формули (IIb), конкретний випадок сполук формули (II), де n1 і n2 є однаковими і кожний являє собою 2, можуть також бути одержані, починаючи зі сполуки формули (XII): (XlI) де X1, m 1 і m 2 є такими, як визначено для формули (І), яку піддають реакції з метил вінільним кетоном, з тим, щоб одержати сполуку формули (XIII): (XIII) де X1, m 1 і m 2 є такими, як визначено для фо 12 рмули (І), каталітична гідрогенізація якої дає сполуку формули (llb): (Ilb) де Х1, m 1 і m 2 є такими, як визначено для формули (І). На додаток до факту, що вони є новими, сполуки за даним винаходом володіють цінними фармакологічними властивостями. Вони володіють дипептидил-пептидаза IV-інгібуючими властивостями, що робить їх корисними у лікуванні непереносимості глюкози і розладів, асоційованих з гіперглікемією, таких як діабету II типу або ожиріння. Винахід поширюється також на фармацевтичні композиції, які містять як активний інгредієнт щонайменше одну сполуку формули (І) з одним або більше придатним, інертним, нетоксичним ексципієнтом. Серед фармацевтичних композицій відповідно до даного винаходу можуть бути згадані більш конкретно m1, які придатні для орального, парентерального (внутрішньовенного, внутрішньом'язового або підшкірного) або назального введення, таблетки або драже, під'язикові таблетки, желатинові капсули, коржики, супозиторії, ін'єктовані приготування, питні суспензії. Корисне дозування встановлюється відповідно до природи і тяжкості розладу, шля ху введення, а також віку і ваги пацієнта і будь-якого пов'язаного лікування. Дозування варіює від 0,5мг до 2г за 24 години за одне або більше введень. Вихідні матеріали, які використовуються, являють собою відомі продукти або продукти, які одержують відповідно до відомих процедур. Структури сполук, які описуються у Прикладах, були визначені відповідно до звичайної спектрометричної техніки (інфрачервоний аналіз, ЯМР, мас-спектрометрія). Повинно бути зрозумілим, що сполука, яка має (2RS) конфігурацію, є рацемічною сумішшю сполук конфігурацій (2R) і (2S). Приклад 1: (2S)-1-({[9-(Гідроксиметил)-3оксаспіро[5,5]ундец-9-ил]аміно}-ацетил)-2піролідинкарбонітрил: Стадія А: 3-Оксаспіро[5.5]ундец-7-ен-9-он 0,5мл сірчаної кислота додають до 317ммол тетрагідро-2Н-піран-4-карбоксальдегіду і 317ммол метил вінільного кетону в 500мл бензолу. Реакційну суміш потім нагрівають зі зворотним холодильником протягом 3 годин, воду видаляють, використовуючи апарат Діна-Старка, і потім додають наступні 317ммол метил вінільного кетону і продовжують нагрівання зі зворотним холодильником протягом 3 годин. Суміш потім промивають, сушать і потім концентрують, і залишок, який одержують, дистилюють, з тим щоб одержати очікуваний продукт. Стадія В: 3-Оксаспіро[5.5]ундекан-9-он 147,4ммол сполуки, одержаної на вищезазначеній Стадії, гідрогенізують протягом 15 годин, при температурі навколишнього середовища і тиску 4,6бар, в 100мл етилацетату у присутності каталітичної кількості 10% Pd/C. 13 84553 Каталізатор потім відфільтровують і промивають етилацетатом і концентрування проводять з тим, щоб одержати очікуваний продукт. Стадія C: 11-Окса-1,3діазадіспіро[4.2.5.2]пентадекан-2,4-діон 165мл водного 60% етанолу і 480ммол карбонату амонію додають до 300ммол сполуки, одержаної на вищезазначеній Стадії. Реакційну суміш потім нагрівають до 55°C, 5,3г ціаніду калію в 40мл води згодом додають протягом 5хв., і суміш перемішують протягом 2 годин при 55°С. Етанол потім випаровують і суміш згодом фільтрують; коржик промивають водою і ацетоном і потім сушать, з тим, щоб одержати очікуваний продукт у формі шарува тої твердої речовини білого кольору. Стадія D: Гідрохлорид 9-Аміно-3оксаспіро[5.5]ундекан-9-карбонової кислоти У 1-літровому автоклаві 177,8ммол сульфату барію додають до 88,9ммол сполуки, одержаної на вищезазначеній Стадії, в 335мл води. Суміш потім нагрівають протягом ночі при 160°C і згодом охолоджують в льодяній ванні. Карбонат барію, який утворюється, відфільтровують і промивають водою, і діоксид вуглецю барботують у водну фазу. Водну фазу потім знову фільтрують і фільтрат згодом концентрують досуха, з тим, щоб одержати очікуваний продукт у формі порошку. Стадія E: Метил 9-аміно-3оксаспіро[5.5]ундекан-9-карбоксилат гідрохлорид 100мл метанолу додають до 61,3ммол сполуки, одержаної на вищезазначеній Стадії. Одержану суспензію охолоджують до 5°C і потім додають краплями 184ммол тіоніл хлориду. Реакційну суміш згодом перемішують протягом 1 години при 20°C і потім протягом 2 годин при нагріванні зі зворотним холодильником, перед випаровуванням досуха, з тим, щоб одержати очікуваний продукт у формі порошку. Стадія F: (9-Аміно-3-оксаспіро[5.5]ундец-9ил)метанол 6,8г літій алюміній гідриду і потім 59,7ммол сполуки, одержаної на вищезазначеній Стадії, у формі основи у розчині в 75мл тетрагідрофурану, додають при 0°C до 50мл тетрагідрофурану. Реакційну суміш згодом перемішують протягом 30хв. при 0°C і потім протягом ночі при 20°C. Її згодом охолоджують до 5°С і т потім додають 6,8мл води, 6,8мл 15% розчину гідроксиду натрію і 3´6,8мл води. Суміш енергійно перемішують протягом 20хв. і потім фільтрують над целітом. Осад промивають ефіром і фільтрат сушать і потім випаровують, з тим, щоб одержати очікуваний продукт у формі твердої речовини. Стадія G: (2S)-1-({[9-(Гідроксиметил)-3оксаспіро[5.5]ундец-9-ил]аміно}-ацетил)-2піролідинкарбонітрил 90мл дихлорметану, 6ммол (2S)-1(хлорацетил)-2-піролідинкарбонітрилу і потім 24ммол карбонату калію додають до 12ммол сполуки, одержаної на вищезазначеній Стадії. Після перемішування протягом 6 днів при 20°C, утворений осад відфільтровують і промивають дихлорметаном, і фільтрати концентрують досуха. Залишок, який одержують, очищують хроматографією на силікагелі (елюент: дихлорметан/метанол 97/3), 14 з тим, щоб одержати очікуваний продукт у формі жовтої олії, яка стає твердою на холоді, з тим, щоб одержати білий порошок. Елементний мікроаналіз: Підраховано Знайдено %С 64,45 64,50 %Н 8,71 8,78 %N 12,53 12,28 Приклад 2: (2S)-1-[(Спіро[5.5]ундец-3иламіно)ацетил]-2-піролідин-карбонітрил гідрохлорид: Стадія А: Спіро[5.5]ундекан-3-он Очікуваний продукт одержують відповідно до методики, описаної на Стадіях А і В Прикладу 1, замінюючи тетрагідро-2Н-піран-4-карбоксальдегід на циклогексанкарбоксальдегід на Стадії А. Стадія В: Спіро[5.5]ундекан-3-он оксим: 70мл піридину і 3,45г гідроксиламін гідрохлориду додають до 39ммол сполуки, одержаної на вищезазначеній Стадії, у розчині в діоксані. Реакційну суміш потім нагрівають зі зворотним холодильником протягом ночі і згодом концентрують досуха, з тим, щоб одержати олію, яка кристалізується і яку промивають водою, з тим, щоб одержати очікуваний продукт у формі порошку після фільтрування і сушіння. Стадія C: Спіро[5.5]ундец-3-иламін 3мл концентрованого гідроксиду амонію і каталітичну кількість нікелю Ренея додають до 15,8ммол сполуки, одержаної на вищезазначеній Стадії, у розчині в діоксані. Реакційну суміш потім гідрогенізують протягом ночі при температурі навколишнього середовища і тиску. Каталізатор потім відфільтровують і промивають і розчин концентрують, з тим щоб одержати очікуваний продукт у формі олії. Стадія D: (2S)-1-[(Спіро[5.5]ундец-3иламіно)ацетил]-2-піролідинкарбонітрил Очікуваний продукт одержують відповідно до методики, описаної на Стадії G Прикладу 1, починаючи зі сполуки, одержаної на вищезазначеній Стадії, і (2S)-1-(хлорацетил)-2піролідинкарбонітрилу. Стадія E: (2S)-1-[(Спіро[5.5]ундец-3иламіно)ацетил]-2-піролідинкарбонітрил гідрохлорид Очікуваний продукт одержують за допомогою перетворення сполуки, одержаної на вищезазначеній Стадії, в сіль, використовуючи хлористоводневу кислоту. Елементний мікроаналіз: Підраховано Знайдено %С 63,60 63,66 %Н 8,90 8,92 %N 12,36 12,18 %Сl 10,43 10,23 Приклад 3: (2S)-1-[(Спіро[4.5]дец-8иламіно)ацетил]-2-піролідинкарбо-нітрил гідрохлорид: Очікуваний продукт одержують відповідно до методики Прикладу 2, замінюючи циклогексанкарбоксальдегід на циклопентанкарбоксальдегід на Стадії А. 15 84553 Елементний мікроаналіз: Підраховано Знайдено %С 62,66 62,58 %Н 8,66 8,76 Елементний мікроаналіз: %N 12,89 12,92 %Сl 10,88 10,97 Приклад 4: N-[2-оксо-2-(1піролідиніл)етил]спіро[5.5]ундец-3-иламін гідрохлорид: Очікуваний продукт одержують відповідно до методики Прикладу 2, замінюючи (2S)-1(хлорацетил)-2-піролідинкарбонітрил на і(хлорацетил)-піролідин на Стадії D. Елементний мікроаналіз: Підраховано Знайдено %С 64,84 65,54 %Н 9,92 9,89 %N 8,90 8,98 %Сl 11,26 11,28 Приклад 5: (2S)-1-({[3(Гідроксиметил)спіро[5.5]ундец-3ил]аміно}ацетил)-2-піролідинкарбонітрил: Очікуваний продукт одержують відповідно до методики Прикладу 1, замінюючи тетрагідро-2Нпіран-4-карбоксальдегід на циклогексанкарбоксальдегід на Стадії А. Елементний мікроаналіз: Підраховано Знайдено %С 68,43 68,78 %Н 9,37 9,32 %N 12,60 12,45 Приклад 6: (2S)-1-[(Спіро[5.7]тридец-3иламіно)ацетил]-2-піролідинкарбо-нітрил гідрохлорид: Очікуваний продукт одержують відповідно до методики Прикладу 2, замінюючи циклогексанкарбоксальдегід на циклооктанкарбоксальдегід на Стадії А. Елементний мікроаналіз: Підраховано Знайдено %С 65,28 65,56 %Н 9,31 9,01 %N 11,42 11,21 %Сl 9,63 9,63 Приклад 7: (2S)-1-[(3-Оксаспіро[5.5}ундец-9иламіно)ацетил]-2-піролідин-карбонітрил гідрохлорид: Очікуваний продукт одержують відповідно до методики, описаної на Стадіях B-E Прикладу 2, починаючи зі сполуки, одержаної на Стадії В Прикладу 1. Елементний мікроаналіз: Підраховано Знайдено %С 59,72 59,79 %Н 8,26 7,96 16 %N 12,29 12,16 %Сl 10,37 10,96 Приклад 8: (2S)-1-[(Диспіро[5.2.5.2]гексадец-3иламіно)ацетил]-2-піролідинкарбонітрил: Очікуваний продукт одержують відповідно до методики, описаної на Стадіях A-D Прикладу 2, замінюючи циклогексанкарбоксальдегід на спіро[5.5]ундекан-3-карбоксальдегід на Стадії А. Підраховано Знайдено %С 74,35 74,40 %Н 10,04 9,94 %N 11,31 11,07 Приклад 9: (2S)-1-[(Спіро[3.3]гепт-2иламіно)ацетил]-2-піролідинкарбо-нітрил гідрохлорид: Стадія А: 1,1 -Ди хлорспіро[3.3]гептан-2-он 6,25г порошкоподібного цинку і потім 11мл хлориду три фтороцтової кислоти у розчині в 170мл ефіру додають до 5г метиленциклобутану у розчині в ефірі. Розчин піддають обробці ультразвуком протягом 3 годин, підтримуючи температуру при 20°C, і тоді чорний розчин фільтрують через фільтр Ватмана. Фільтрат промивають, сушать, фільтр ують і концентрують, з тим, щоб одержати очікуваний продукт у формі коричневої олії. Стадія В: Спіро[3.3]гептан-2-он 28г сполуки, одержаної на вищезазначеній Стадії, і потім 620мл води додають до 420мл льодяної оцтової кислоти. Реакційну суміш о холоджують, використовуючи холодну водну баню, і потім додають 28,1г порошкоподібного цинку. Після перемішування протягом 20хв. баню видаляють і реакційну суміш перемішують протягом ночі при 20°C. Розчин фільтрують, екстрагують пентаном і випаровують. Залишок додають в пентан і розчин промивають, сушать, фільтрують і концентрують, з тим, щоб одержати очікуваний продукт у формі світло-жовтої рідини. Стадія C: (2S)-1-[(Спіро[3.3]гепт-2иламіно)ацетил]-2-піролідинкарбонітрил Очікуваний продукт одержують відповідно до методики, описаної на Стадіях B-D Прикладу 2, починаючи зі сполуки, одержаної на вищезазначеній Стадії. Стадія D: (2S)-1-[(Спіро[3.3]гепт-2иламіно)ацетил]-2-піролідинкарбонітрил гідрохлорид Очікуваний продукт одержують за допомогою перетворення сполуки, одержаної на вищезазначеній Стадії, в сіль, використовуючи хлористоводневу кислоту. Елементний мікроаналіз: Підраховано Знайдено %С 59,25 59,27 %Н 7,81 7,78 %N 14,81 14,51 %Сl 12,49 12,93 Приклад 10: (2S)-1-[(Спіро[5.9]пентадец-3иламіно)ацетил]-2-піролідин-карбонітрил: Очікуваний продукт одержують відповідно до методики, описаної на Стадіях A-D Прикладу 2, замінюючи циклогексанкарбоксальдегід на циклодеканкарбоксальдегід на Стадії А. Елементний мікроаналіз: Підраховано Знайдено %С 73,49 73,46 %Н 10,37 10,44 %N 11,69 11,64 17 84553 Приклад 11: (2S)-1-[(Спіро[3.5]ноніламіно)ацетил]-2-піролідинкарбонітрил гідрохлорид: Стадія А: Етил 7-оксоспіро[3.5]нонан-6карбоксилат 20,6ммол етилового ефіру 3-[1(етоксикарбонілетил)циклобутил]пропіонової кислоти у розчині в тетрагідрофурані додають при 0°C до 22,7ммол 95% гідриду натрію у суспензії в 15мл тетрагідрофурану. Реакційну суміш нагрівають зі зворотним холодильником протягом 4 годин і потім додають 49мл оцтової кислоти. Тетрагідрофуран випаровують і залишок, який одержують, екстрагують етилацетатом. Об'єднані органічні фази промивають, фільтрують, сушать i випаровують, з тим, щоб одержати олію, яку піддають хроматографії на силікагелі (елюент: дихлорметан/етилацетат 95/5), з тим, щоб одержати очікуваний продукт. Стадія В: Спіро[3.5]нонан-7-он 11,1г гідроокису калію в 100мл води додають до 39,7ммол сполуки, одержаної на вищезазначеній Стадії, у розчині в діоксані. Реакційну суміш нагрівають зі зворотним холодильником протягом ночі і потім, після повернення до температури навколишнього середовища, екстрагують ефіром. Об'єднані органічні фази промивають, сушать, фільтрують і випаровують, з тим, щоб одержати очікуваний продукт у формі леткої олії. Стадія C: (2S)-1-[(Спіро[3.5]нон-7іламіно)ацетил]-2-піролідинкарбонітрил гідрохлорид Очікуваний продукт одержують відповідно до методики, описаної на Стадіях B-E Прикладу 2, починаючи зі сполуки, одержаної на вищезазначеній Стадії. Елементний мікроаналіз: Підраховано Знайдено %С 61,62 61,39 %Н 8,40 8,32 %N 13,47 13,22 %Сl 11,37 11,91 Приклад 12: (2S)-1-[(Спіро[3.5]ноніламіно)ацетил]-2-піролідинкарбонітрил трифторацетат: Стадія А: (2S)-1-[(Спіро[3.5]нон-2іламіно)ацетил]-2-піролідинкарбонітрил Очікуваний продукт одержують відповідно до методики, описаної на Стадіях A-C Прикладу 9, замінюючи метиленциклобутану на метиленциклогексан на Стадії А. Стадія В: (2S)-1-[(Спіро[3.5]нон-2іламіно)ацетил]-2-піролідинкарбонітрил трифторацетат Очікуваний продукт одержують за допомогою перетворення сполуки, одержаної на вищезазначеній Стадії, в сіль, використовуючи три фтороцтову кислоту. Mac-спектрометрія: [M+H]+=276. Приклад 13: (2S)-1-[(Спіро[5.6]додец-3иламіно)ацетил]-2-піролідин-карбонітрил: Очікуваний продукт одержують відповідно до методики, описаної на Стадіях A-D Прикладу 2, замінюючи циклогексанкарбоксальдегіду на циклогептанкарбоксальдегід на Стадії А. 18 Елементний мікроаналіз: Підраховано Знайдено %С 71,88 71,52 %Н 9,84 9,95 %N 13,24 13,14 Приклад 14: (2S)-1-[(Спіро[3.4]окт-2иламіно)ацетил]-2-піролідинкарбо-нітрил гідрохлорид: Стадія А: Спіро[3.4]октан-2-он Очікуваний продукт одержують відповідно до методики, описаної на Стадіях А і В Прикладу 9, замінюючи метиленциклобутан на метиленциклопентан на Стадії А. Стадія В: (2S)-1-[(Спіро[3.4]окт-2иламіно)ацетил]-2-піролідинкарбонітрил гідрохлорид Очікуваний продукт одержують відповідно до методики, описаної на Стадіях B-E Прикладу 2, починаючи зі сполуки, одержаної на вищезазначеній Стадії. Елементний мікроаналіз: Підраховано Знайдено %С 60,49 61,08 %Н 8,12 8,00 %N 14,11 14,18 %Сl 11,90 11,37 Приклад 15: (2S)-1-{[(3,3-Діоксо-3тіаспіро[5.5]ундец-9-иламіно)ацетил]-2піролідинкарбонітрил: Очікуваний продукт одержують відповідно до методики, описаної на Стадіях A-D Прикладу 2, замінюючи циклогексанкарбоксальдегід на тетрагідро-2Н-тіопіран-4-карбоксальдегід 1,1-діоксид на Стадії А. Елементний мікроаналіз: Підраховано Знайдено %С 57,76 57,42 %Н 7,70 7,54 %N 11,89 11,48 %S 9,07 8,83 Приклад 16: (2S)-1-({[2(Гідроксиметил)спіро[33]гепт-2-ил]аміно}ацетил)-2піролідинкарбонітрил гідрохлорид: Стадія А: (2S)-1-({[2(Гідроксиметил)спіро[3.3]гепт-2-ил]аміно}ацетил)2-піролідинкарбонітрил Очікуваний продукт одержують відповідно до методики, описаної на Стадіях C-G Прикладу 1, замінюючи 3-оксаспіро[5.5]ундекан-9-он на Стадії C сполукою, одержаною на Стадії В Прикладу 9. Стадія В: (2S)-1-({[2(Гідроксиметил)спіро[3.3]гепт-2-ил]аміно}ацетил)2-піролідинкарбонітрил гідрохлорид Очікуваний продукт одержують за допомогою перетворення сполуки, одержаної на вищезазначеній Стадії, в сіль, використовуючи хлористоводневу кислоту. Елементний мікроаналіз: Підраховано Знайдено %С 57,41 57,32 %Н 7,71 8,02 %N 13,39 13,33 %Сl 11,30 11,91 19 84553 Приклад 17: (2S)-1-({[2(Гідроксиметил)спіро[3.4]окт-2-ил]аміно}ацетил)-2піролідинкарбонітрил гідрохлорид: Стадія А: (2 S)-1-({[2(Гідроксиметил)спіро[3.4]окт-2-ил]аміно}ацетил)-2піролідинкарбонітрил Очікуваний продукт одержують відповідно до методики, описаної на Стадіях C-G Прикладу 1, замінюючи 3-оксаспіро[5.5]ундекан-9-он на Стадії C сполукою, одержаною на Стадії А Прикладу 14. Стадія В: (2S)-1-({[2(Гідроксиметил)спіро[3.4]окт-2-ил]аміно}ацетил)-2піролідинкарбонітрил гідрохлорид Очікуваний продукт одержують за допомогою перетворення сполуки, одержаної на вищезазначеній Стадії, в сіль, використовуючи хлористоводневу кислоту. Елементний мікроаналіз: Підраховано Знайдено %С 58,62 58,53 %Н 7,99 7,90 %N 12,82 12,65 %Сl 10,81 10,81 Приклад 18: (4R)-3-[(Cnipo[5.5]ундец-3-иламіно)ацетил]-1,3-тіазолідин-4-карбонітрил трифторацетат: Стадія А: (4R)-3-[(Спіро[5.5]ундец-3-иламіно)ацетил]-1,3-тіазолідин-4-карбонітрил Очікуваний продукт одержують відповідно до методики, описаної на Стадії G Прикладу 1, починаючи зі сполуки, одержаної на Стадії C Прикладу 2, і (4R)-3-(хлорацетил)-1,3 -тіазолідин-4карбонітрилу. Стадія В: (4R)-3-[(Спіро[5.5]ундец-3-иламіно)ацетил]-1,3-тіазолідин-4-карбонітрил трифторацетат Очікуваний продукт одержують за допомогою перетворення сполуки, одержаної на вищезазначеній Стадії, в сіль, використовуючи три фтороцтову кислоту. Елементний мікроаналіз: Підраховано Знайдено %С 52,40 52,10 %Н 6,54 6,48 %N 9,65 9,42 %S 7,36 7,19 Приклад 19: 2-({2-[(2S)-2-Ціанопіролідиніл]-2оксоетил}аміно)спіро[3.3]-гептан-2-карбоксамід: Стадія А: 2-Аміноспіро[3.3]гептан-2-карбонова кислота Очікуваний продукт одержують відповідно до методики, описаної на Стадіях C і D Прикладу 1, починаючи зі сполуки, одержаної на Стадії В Прикладу 9. Стадія В: 2-(третБутилоксикарбоніламіно)спіро[3.3]гептан-2карбонова кислота 40мл діоксану і потім, при 0°C, 6,71г ди(третбутил)дикарбонату в діоксані додають до 4,35г сполуки, одержаної на вищезазначеній Стадії, у розчині в 11мл розчину гідроксиду натрію. Через одну ніч при 20°C діоксан випаровують і залишок, який одержують, додають у воду. Екстрагування проводять з ефіром, і потім водну фазу підкислюють до рН3, використовуючи водний 10% розчин 20 лимонної кислоти. Водну фазу екстрагують етилацетатом. Органічні фази об'єднують і промивають соляним розчином, суша ть і концентрують досуха, з тим, щоб одержати очікуваний продукт у формі білої пасти. Стадія С: 2-(третБутилоксикарбоніламіно)спіро[3.3]гептан-2карбоксамід 811мг N-гідроксисукциніміду і 1,45г дициклогексилкарбодііміду додають до 1,8г сполуки, одержаної на вищезазначеній Стадії, у розчині в тетрагідрофурані. Через одну ніч при 20°C реакційну суміш фільтрують, і газоподібний аміак барботують у фільтрат. Через одну ніч при 20°C реакційну суміш фільтрують знову і концентрують досуха, з тим, щоб одержати очікуваний продукт у формі білого порошку. Стадія D: 2-Аміноспіро[3.3]гептан-2карбоксамід гідрохлорид 1,84г сполуки, одержаної на вищезазначеній Стадії, розчиняють в етилацетаті і потім газоподібну HCl барботують при 0°C протягом 10хв. З'являється осад. Через 30хв. при 0°C осад відфільтровують і промивають етил ацетатом, і потім сушать, з тим, щоб одержати очікуваний продукт у формі білого порошку. Стадія E: 2-({2-[(2S)-2-Ціанопіролідиніл]-2оксоетил}аміно)спіро[3.3]гептан-2-карбоксамід Очікуваний продукт одержують відповідно до методики, описаної на Стадії G Прикладу 1, починаючи зі сполуки, одержаної на вищезазначеній Стадії, і (2S)-1-(хлорацетил)-2піролідинкарбонітрилу. Елементний мікроаналіз: Підраховано Знайдено %С 62,05 62,05 %Н 7,48 7,64 %N 19,30 19,20 Приклад 20: (2S)-1-[(3-Азаспіро[5.5]ундец-9иламіно)ацетил]-2-піролідин-карбонітрил біс(трифторацетат): Стадія А: 3-Азаспіро[5.5]ундекан-9-он Очікуваний продукт одержують відповідно до методики, описаної на Стадіях А і В Прикладу 1, замінюючи тетрагідро-2Н-піран-4-карбоксальдегід на бензил 4-форміл-1-піперидинкарбоксилат на Стадії А. Стадія В: трет-Бутил 9-оксо-3азаспіро[5.5]ундекан-3-карбоксилат: Очікуваний продукт одержують реакцією сполуки, одержаної на вищезазначеній Стадії, з дитрет-бутил дикарбонатом згідно з процедурою, яка описується на Стадії В Прикладу 19. Стадія C: трет-Бутил 9-({2-[(2S)-2ціанопіролідиніл]-2-оксоетил}аміно)-3-азаспіро[5.5]ундекан-3-карбоксилат Очікуваний продукт одержують відповідно до методики, описаної на Стадіях B-D Прикладу 2, починаючи зі сполуки, одержаної на вищезазначеній Стадії. Стадія D: (2S)-1-[(3-Азаспіро[5.5]ундец-9иламіно)ацетил]-2-піролідин-карбонітрил біс(трифторацетат) Очікуваний продукт одержують реакцією спо 21 84553 луки, одержаної на вищезазначеній Стадії, з 30 еквівалентів трифтороцтової кислоти в дихлорметані при 0-5°C протягом 1 години. Суміш концентрують досуха. Сполуку очищують препаративною ВЕРХ. Mac-спектрометрія: [M+H]+=305 Приклад 21: (2S)-1-({[3-(Гідроксиметил)-9,9диметилспіро[5.5]ундец-3-ил]-аміно}ацетил)-2піролідинкарбонітрил: Очікуваний продукт одержують відповідно до методики Прикладу 1, замінюючи тетрагідро-2Нпіран-4-карбоксальдегід на 4,4диметилциклогексан-карбоксальдегід на Стадії А. Елементний мікроаналіз: Підраховано Знайдено %С 69,77 69,54 %Н 9,76 9,72 %N 11,62 11,43 Приклад 22: (2S)-1-({[2-(1-Гідрокси-1метилетил)спіро[3.3]гепт-2-ил]аміно}ацетил)-2піролідинкарбонітрил гідрохлорид: Стадія А: Метил 2-аміноспіро[3.3]гептан-2карбоксилат Очікуваний продукт одержують відповідно до методики, описаної на Стадії E Прикладу 1, починаючи зі сполуки, одержаної на Стадії Прикладу 19. Стадія В: Метил 2-(третбутилоксикарбоніламіно)спіро[3.3]гептан-2карбоксилат 5,8мл триетиламіну і потім, при 0°C, 9,02г ди(трет-бутил)дикарбонату в дихлорметані, додають до 8,5г сполуки, одержаної на вищезазначеній Стадії, у розчині в дихлорметані. Після перемішування протягом ночі при 20°C реакційну суміш промивають водним 10% розчином лимонної кислоти і потім водою. Органічну фазу сушать, фільтрують і концентрують, з тим, щоб одержати очікуваний продукт у формі оранжевої олії. Стадія С: 2-(2третЧзутилоксикарбоніламіноспіро[3.3]гепт-2-ил)2-пропанол До 50мл ефіру додають 42мл 3М розчину йодиду метилмагнію в ефірі і потім, при 0°C і краплями, 5г сполуки, одержаної на вищезазначеній Стадії, у розчині в ефірі. Після перемішування протягом 1 години при 0°C, додають хлорид амонію і потім реакційну суміш перемішують протягом 1 години при 20°C. Водну фазу екстрагують етилацетатом і потім об'єднані органічні фази промивають, сушать і концентрують досуха, з тим, щоб одержати очікуваний продукт у формі олії, яка кристалізується. Стадія D: 2-(2-Аміноспіро[3.3]гепт-2-ил)-2пропанолтрифторацетат 40мл трифтороцтової кислоти додають при 0°C до 4,8г сполуки, одержаної на вищезазначеній Стадії, у розчині в дихлорметані. Після перемішування протягом 30хв. в 0°C реакційну суміш випаровують досуха і залишок додають декілька разів з толуолом; толуол потім випаровують, з тим, щоб одержати очікуваний продукт у формі безбарвної олії. Стадія E: (2S)-1-({[2-(1-Гідрокси-1 22 метилетил)спіро[3.3]гепт-2-ил]аміно}-ацетил)-2піролідинкарбонітрил Очікуваний продукт одержують відповідно до методики, описаної на Стадії G Прикладу 1, починаючи зі сполуки, одержаної на вищезазначеній Стадії, і (2S)-1-(хлор-ацетил)-2піролідинкарбонітрилу. Стадія F: (2S)-1-({[2-(1-Гідрокси-1метилетил)спіро[3.3]гепт-2-ил]аміно}-ацетил)-2піролідинкарбонітрил гідрохлорид Очікуваний продукт одержують за допомогою перетворення сполуки, одержаної на вищезазначеній Стадії, в сіль, використовуючи хлористоводневу кислоту. Елементний мікроаналіз: Підраховано Знайдено %С 59,72 58,96 %Н 8,26 8,48 %N 12,29 11,95 %Сl 10,37 10,99 Приклад 23: (2S)-1-[(3-Тіаспіро[5.5]ундец-9иламіно)ацетил]-2-піролідин-карбонітрил гідрохлорид: Стадія А: 3-Тіаспіро[5.5]ундекан-9-он оксим 3,3-діоксид Очікуваний продукт одержують відповідно до методики, описаної на Стадіях А і В Прикладу 2, замінюючи циклогексанкарбоксальдегід на тетрагідро-2Н-тіопіран-4-карбоксальдегід 1,1-діоксид на Стадії А. Стадія В: 3-Тіаспіро[5.5]ундекан-9-амін 4г сполуки, одержаної на вищезазначеній Стадії, додають порціями до 7,9г літій алюміній гідриду у суспензії в 200мл тетрагідрофурану. Реакційну суміш потім нагрівають зі зворотним холодильником протягом 12 годин і потім гідролізують додаванням 8мл води, 8мл 15% розчину гідроксиду натрію і 16мл води. Солі, які одержують, потім відфільтровують і фільтрат згодом концентрують досуха, з тим, щоб одержати вказаний у заголовку продукт. Стадія C: (2S)-1-[(3-Тіаспіро[5.5]ундец-9иламіно)ацетил]-2-піролідин-карбонітрил Очікуваний продукт одержують відповідно до методики, описаної на Стадії G Прикладу 1, починаючи зі сполуки, одержаної на вищезазначеній Стадії, і (2S)-1-(хлорацетил)-2піролідинкарбонітрилу. Стадія D: (2S)-1-[(3-Тіаспіро[5.5]ундец-9иламіно)ацетил]-2-піролідинкарбо-нітрил гідрохлорид Очікуваний продукт одержують за допомогою перетворення сполуки, одержаної на вищезазначеній Стадії, в сіль, використовуючи хлористоводневу кислоту. Елементний мікроаналіз: Підраховано Знайдено %С 57,04 59,67 %Н 7,88 7,96 %N %S %Сl 11,74 9,14 9,90 11,56 8,96 10,52 Приклад 24: (2S)-1-({[3-(2-Гідроксіетил-3азаспіро[5.5]ундец-9-ил]аміно}-ацетил)-2піролідинкарбонітрил біс(трифторацетат): Стадія А: 3-Азаспіро[5.5]ундекан-9-он 23 84553 Очікуваний продукт одержують відповідно до методики, описаної на Стадіях А і В Прикладу 1, замінюючи тетрагідро-2Н-піран-4-карбоксальдегід на бензил 4-форміл-1-піперидинкарбоксилат на Стадії А. Стадія В: 3-(2-Гідроксіетил)-3азаспіро[5.5]ундекан-9-он Очікуваний продукт одержують алкілуванням сполуки, одержаної на вищезазначеній Стадії, 2брометанолом у присутності карбонату калію. Стадія C: (2S)-1-({[3-(2-Гідроксіетил)-3азаспіро[5.5]ундец-9-ил]аміно}-ацетил)-2піролідинкарбонітрил Очікуваний продукт одержують відповідно до методики, описаної на Стадіях B-D Прикладу 2, починаючи зі сполуки, одержаної на вищезазначеній Стадії. Стадія D: (2S)-1-({[3-(2-Гідроксіетил)-3азаспіро[5.5]ундец-9-ил]аміно}-ацетил)-2піролідинкарбонітрил біс(трифторацетат) Очікуваний продукт одержують за допомогою перетворення сполуки, одержаної на вищезазначеній Стадії, в сіль, використовуючи три фтороцтову кислоту. Елементний мікроаналіз: Підраховано Знайдено %С 47,92 47,28 %Н 5,94 5,94 %N 9,72 9,38 Приклад 25: (2S)-1-({[2-(2-Гідроксиметил)-7оксаспіро[3.5]нон-2-іл]аміно}-ацетил)-2піролідинкарбонітрил: Стадія А: 7-Оксаспіро[3.5]нонан-2-он Очікуваний продукт одержують відповідно до методики, описаної на Стадіях А і В Прикладу 9, замінюючи метиленциклобутан на 4метилентетрагідро-2Н-піран на Стадії А. Стадія В: (2S)-1-({[2-(2-Гідроксиметил)-7оксаспіро[3.5]нон-2-іл]аміно}-ацетил)-2піролідинкарбонітрил Очікуваний продукт одержують відповідно до методики, описаної на Стадіях C-G Прикладу 1, починаючи зі сполуки, одержаної на вищезазначеній Стадії. Точка плавлення: 103°C. Елементний мікроаналіз: Підраховано Знайдено %С 62,52 62,56 %Н 8,20 8,25 %N 13,67 13,32 Приклад 26: (2S)-1-({[2-(2Гідроксиметил)спіро[3.5]нон-2-іл]аміно}ацетил)-2піролідинкарбонітрил: Стадія А: Спіро[3.5]нонан-2-он Очікуваний продукт одержують відповідно до методики, описаної на Стадіях А і В Прикладу 9, замінюючи метиленциклобутан на метиленциклогексан на Стадії А Стадія В: (2S)-1-({[2-(2Гідроксиметил)спіро[3.5]нон-2-іл]аміно}ацетил)-2піролідинкарбонітрил Очікуваний продукт одержують відповідно до методики, описаної на Стадіях C-G Прикладу I5 24 починаючи зі сполуки, одержаної на вищезазначеній Стадії. Елементний мікроаналіз: Підраховано Знайдено %С 66,85 66,66 %Н 8,91 8,55 %N 13,76 13,65 Приклад 27: (2S)-1-[(7-Оксаспіро[3.5]нон-2іламіно)ацетил]-2-піролідин-карбонітрил трифторацетат: Стадія А: (2S)-1-[(7-Оксаспіро[3.5]нон-2іламіно)ацетил]-2-піролідин-карбонітрил Очікуваний продукт одержують відповідно до методики, описаної на Стадіях A-C Прикладу 9, замінюючи метиленциклобутан на 4метилентетрагідро-2Н-піран на Стадії А. Стадія В: (2S)-1-[(7-Оксаспіро[3.5]нон-2іламіно)ацетил]-2-піролідин-карбонітрил трифторацетат Очікуваний продукт одержують за допомогою перетворення сполуки, одержаної на вищезазначеній Стадії, в сіль, використовуючи три фтороцтову кислоту. Елементний мікроаналіз: Підраховано Знайдено %С 52,17 52,15 %Н 6,18 6,35 %N 10,74 10,73 Приклад 28: (2S)-1-[(Спіро[2.5]окт-6иламіно)ацетил]-2-піролідин-карбонітрил: Стадія А: Спіро[2.5]октан-6-он Очікуваний продукт одержують відповідно до методики, описаної на Стадіях А і В Прикладу 11, замінюючи 3-[1(етоксикарбонілетил)циклобутил]пропіонову кислоту на 3-[1(етоксикарбонілетил)циклопропіл]пропіонову кислоту на Стадії А. Стадія В: (2S)-1-[(Спіро[2.5]окт-6иламіно)ацетил]-2-піролідинкарбонітрил Очікуваний продукт одержують відповідно до методики, описаної на Стадіях A-D Прикладу 2, починаючи зі сполуки, одержаної на вищезазначеній Стадії. Елементний мікроаналіз: Підраховано Знайдено %С 68,93 68,90 %Н 8,87 8,76 %N 16,08 16,06 Приклад 29: (2S,4S)-4-Фтор-1-({[9(гідроксиметил)-3-оксаспіро[5.5]ундец-9ил]аміно}ацетил)-2-піролідинкарбонітрил: Очікуваний продукт одержують відповідно до методики, яка описується у Прикладі 1, замінюючи (2S)-1-(хлорацетил)-2-піролідинкарбонітрил на (2S,4S)-1-(хлорацетил)-4-фтор-2піролідинкарбонітрил на Стадії G. Елементний мікроаналіз: Підраховано Знайдено %С 61,17 61,63 %Н 7,99 7,87 %N 11,89 11,47 25 84553 Приклад 30: (2S)-4,4-Дифтор-1-({[9(гідроксиметил)-3-оксаспіро[5.5]ундец-9ил]аміно}ацетил)-2-піролідинкарбонітрил: Очікуваний продукт одержують відповідно до методики, яка описується у Прикладі 1, замінюючи (2S)-1-(хлорацетил)-2-піролідинкарбонітрил на (2S)-1-(хлорацетил)-4,4-дифтор-2піролідинкарбонітрил на Стадії G. Елементний мікроаналіз: Підраховано Знайдено %С 58,21 58,30 %Н 7,33 7,62 %N 11,31 11,21 Приклад 31: (9-{[2-Оксо-2-(1піролідиніл)етил]аміно}-3-оксаспіро[5.5]-ундец-9ил)метанол: Очікуваний продукт одержують відповідно до методики, яка описується у Прикладі 1, замінюючи (2S)-1-(хлорацетил)-2-піролідинкарбонітрил на 1(хлорацетил)піролідин на Стадії G. Елементний мікроаналіз: Підраховано Знайдено %С 65,77 65,75 %Н 9,74 9,62 %N 9,02 8,85 Приклад 32: (4R)-3-({[9-(Гідроксиметил-3оксаспіро[5.5]ундец-9-ил]аміно}-ацетил)-1,3 тіазолідин-4-карбонітрил: Очікуваний продукт одержують відповідно до методики, яка описується у Прикладі 1, замінюючи (2S)-1-(хлорацетил)-2-піролідинкарбонітрил на (4R)-3-(хлорацетил)-1,3-тіазолідин-4-карбонітрил на Стадії G. Елементний мікроаналіз: Підраховано Знайдено %С 57,76 57,44 %Н 7,70 7,88 %N 11,89 11,51 %S 9,07 8,02 Приклад 33: (2S,4S)-4-Гідрокси-1-({[9(гідроксиметил)-3-оксаспіро[5.5]-ундец-9ил]аміно}ацетил)-2-піролідинкарбонітрил: Очікуваний продукт одержують відповідно до методики, яка описується у Прикладі 1, замінюючи (2S)-1-(хлорацетил)-2-піролідинкарбонітрил на (2S,4S)-1-(хлорацетил)-4-гідрокси-2піролідинкарбонітрил на Стадії G. Приклад 34: (2S,4R)-4-Фтор-1-({[9(гідроксиметил)-3-оксаспіро[5.5]ундец-9ил]аміно}ацетил)-2-піролідинкарбонітрил трифторацетат: Очікуваний продукт одержують відповідно до методики, яка описується у Прикладі 1, замінюючи (2S)-1-(хлорацетил)-2-піролідинкарбонітрил на (2S,4R)-1-(хлорацетил)-4-фтор-2піролідинкарбонітрил на Стадії G. Елементний мікроаналіз: Підраховано Знайдено %С 50,67 50,47 %Н 6,13 6,05 %N 8,77 8,47 26 Приклад 35: [9-({2-[(3S)-3-Фторпіролідиніл]-2оксоетил}аміно)-3-оксаспіро[5.5]ундец-9ил]метанол: Очікуваний продукт одержують відповідно до методики, яка описується у Прикладі 1, замінюючи (2S)-1-(хлорацетил)-2-піролідинкарбонітрил на (3S)-1-(хлорацетил)-3-фторпіролідин на Стадії G. Приклад 36: (9-{[2-Оксо-2-(3,3,4,4-тетрафтор1-піролідиніл)етил]аміно}-3-оксаспіро[5.5]ундец-9ил)метанол: Очікуваний продукт одержують відповідно до методики, яка описується у Прикладі 1, замінюючи (2S)-1-(хлорацетил)-2-піролідинкарбонітрил на 1(хлорацетил)-3,3,4,4-тетрафторпіролідин на Стадії G. Елементний мікроаналіз: Підраховано Знайдено %С 53,40 53,83 %Н 6,85 6,67 %N 7,33 7,18 Приклад 37: (2S)-1-({[7(Гідроксиметил)спіро[3.5]нон-7-іл]аміно}ацетил)-2піролідинкарбонітрил: Очікуваний продукт одержують відповідно до методики, яка описується у Прикладі 1, замінюючи 3-оксаспіро[5.5]ундекан-9-он на Стадії C сполукою, одержаною на Стадії В Прикладу 11. Приклад 38: (2S)-1-({[8(Гідроксиметил)спіро[4.5]дец-8-ил]аміно}ацетил)-2піролідинкарбонітрил: Очікуваний продукт одержують відповідно до методики Прикладу 1, замінюючи тетрагідро-2Нпіран-4-карбоксальдегід на циклопентанкарбоксальдегід на Стадії А. Приклад 39: (2S)-1-{[(2,2-Діоксо-2тіаспіро[3.5]нон-7-іл)аміно]ацетил}-2піролідинкарбонітрил: Очікуваний продукт одержують відповідно до методики, описаної на Стадіях A-D Прикладу 2, замінюючи циклогексанкарбоксальдегід на 3тіетанкарбоксальдегід 1,1-діоксид на Стадії А. Приклад 40: (2S)-1-[3-(Спіро[5.5]ундец-3иламіно)пропаноїл]-2-піролідин-карбонітрил гідрохлорид: Стадія А: (2S)-1-[3-(Спіро[5.5]ундец-3иламіно)пропаноїл]-2-піролідин-карбонітрил Очікуваний продукт одержують відповідно до методики, описаної на Стадії G Прикладу 1, починаючи зі сполуки, одержаної на Стадії C Прикладу 2, і (2S)-1-(3-хлорпропіоніл)-2піролідинкарбонітрилу. Стадія В: (2S)-1-[3-(Спіро[5.5]ундец-3иламіно)пропаноїл]-2-піролідин-карбонітрил гідрохлорид Очікуваний продукт одержують за допомогою перетворення сполуки, одержаної на вищезазначеній Стадії, в сіль, використовуючи хлористоводневу кислоту. Mac-спектрометрія: [M+H]+=318. Приклад 41: (2S)-1-((2RS)-2-{[9(Гідроксиметил)-3-оксаспіро[5.5]ундец-9-ил]аміно}пропаноїл)-2-піролідинкарбонітрил трифторацетат Очікуваний продукт одержують відповідно до 27 84553 методики Прикладу 1, замінюючи (2S)-1(хлорацетил)-2-піролідинкарбонітрил на (2S)-1[(2RS)-2-бромпропаноїл]-2-піролідинкарбонітрил на Стадії G. Mac-спектрометрія: [M+H]+=350. Приклад 42: (2R)-1-({[9-(Гідроксиметил)-3оксаспіро[5.5]ундец-9-ил]-аміно}ацетил)-2піролідинкарбонітрил: Очікуваний продукт одержують відповідно до методики Прикладу 1, замінюючи (2S)-1(хлорацетил)-2-піролідинкарбонітрил на (2R)-1(хлорацетил)-2-піролідинкарбонітрил на Стадії G. Елементний мікроаналіз: Підраховано Знайдено %С 64,45 64,04 %Н 8,71 8,75 %N 12,53 12,21 Приклад 43: (2RS)-4,4-Дифтор-1-({[9(гідроксиметил)-3-оксаспіро[5.5]-ундец-9ил]аміно}ацетил)-2-піролідинкарбонітрил Очікуваний продукт одержують відповідно до методики Прикладу 1, замінюючи (2S)-1(хлорацетил)-2-піролідинкарбонітрил на (2RS)-1(хлорацетил)-4,4-дифтор-2-піролідинкарбонітрил на Стадії G. Елементний мікроаналіз: Підраховано Знайдено %С 58,21 57,46 %Н 7,33 7,41 %N 11,31 10,94 Приклад 44: (2R)-4,4-Дифтор-1-({[9(гідроксиметил)-3-оксаспіро[5.5]ундец-9ил]аміно}ацетил)-2-піролідинкарбонітрил Очікуваний продую: одержують відокремленням препаративною хіральною ВЕРХ хроматографією рацемічної сполуки Прикладу 43. Точка плавлення: 128°С. Фармакологічні дослідження сполук за даним винаходом Приклад 45: Інгібування дипептидилпептидази IV в нирці свині Приготування мембранної фракції нирки свині Тканину нирки свині (велика біла свиня, віком від 2 до 3 місяців) гомогенізували (5г тканини в 15мл Tris буфера (114мМ, рН7,8-8)) і потім центрифугували при 150000´g протягом 30хв. при 4°C. Краплю осаду додавали в 15мл буфера і рецентрифугували при 150000´g протягом 30хв. при 4°С. При перемішуванні, одержану краплю осаду розчиняли в 15мл буфера з 60мМ n-октил-рглюкопіранозидом протягом 30хв. при температурі навколишнього середовища. Після центрифугування при 150000´g протягом 30хв. при 4°С, супе Комп’ютерна в ерстка Т. Чепелев а 28 рнатант діалізували (MWCO 12-14000) проти 114мМ Tris рН7,8-8, і потім розділяли на аліквоти при -80°C. Вимірювання активності дипептидил пептидази IV (DPP IV): Ензиматичну активність вимірюють розщепленням хромогенного субстрату, гліцил-проліл-рнітроаніліду (Gly-Pro-pNA), даючи Gl y-Pro і pNA (рнітроанілін); останню виявляють абсорбуванням при 405нм. Активність вимірюють за відсутності (контроль) або у присутності 10мкл інгібіторів, використовуючи 10мкл приготування нирки свині (0,81, мОд., 1Од.=1мкмол pNA продукт/хв. при 37°C). Інкубування починають додаванням субстрату (250мкл), розчиненого в Tris буфері (114мМ) рН7,8-8, протягом періоду 60хв. при 37°С. Для продуктів, розчинених в диметил сульфоксиді, кінцева концентрація останнього не перевищувала 0,37%. Результати були виражені як процент контролю, і IC50 значення (ефективна доза для 50% інгібування контрольної активності) були визначені, використовуючи нелінійний аналіз між 0 і 100%, (GraphPad Prism version 4.01 for Windows). Кожне вимірювання було проведене чотири рази і кожне визначення IC50 було проведене від 1 до 5 разів. Результати, які одержуються (середнє геометричне значень ІС5о) для сполук, які представляють винахід, складені у наступній Таблиці: Складовий Приклад 1 Приклад 5 Приклад 6 Приклад 8 Приклад 17 Приклад 18 Приклад 20 Приклад 23 Приклад 28 Приклад 29 Приклад 30 IC50 DPPIV (nМ) 76,1 68,5 27,2 23,0 43,6 3,5 73,1 27,0 171 31,6 20,5 Вищезазначені результати показують, що сполуки за даним винаходом є сильними інгібіторами DPP IV. Приклад 46: Фармацевтична композиція Склад для приготування 1000 таблеток, кожна з яких містить дозу 10мг сполука Прикладу 1 10г гідроксипропіл целюлоза 2г пшеничний крохмаль 10г лактоза 100г стеарат магнію 3г тальк 3г. Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrrolidines and thiazolidines derivatives, their preparation and pharmaceutical composition containing them
Автори англійськоюDe Nanteuil Guillaume, Benoist Alain, Combettes Murielle, Harley Elizabeth
Назва патенту російськоюСоединения пиролидина и тиазолидина, способ их получения и фармацевтическая композиция, которая их содержит
Автори російськоюБенуат Ален, Комбетт Мюриэль, Арлей Элизабет
МПК / Мітки
МПК: C07D 405/12, A61P 3/10, C07D 417/12, C07D 409/12, A61K 31/438, C07D 311/96, A61K 31/426, A61K 31/4025, C07D 401/12, A61P 43/00, C07D 277/06, C07D 207/16, A61K 31/40, A61K 31/427, C07D 207/06, C07D 295/18
Мітки: сполуки, одержання, піролідину, містить, яка, спосіб, тіазолідину, композиція, фармацевтична
Код посилання
<a href="https://ua.patents.su/14-84553-spoluki-pirolidinu-i-tiazolidinu-sposib-kh-oderzhannya-i-farmacevtichna-kompoziciya-yaka-kh-mistit.html" target="_blank" rel="follow" title="База патентів України">Сполуки піролідину і тіазолідину, спосіб їх одержання і фармацевтична композиція, яка їх містить</a>
Попередній патент: Система фіксації деталей за допомогою шпильок з комірами
Наступний патент: Транспортна система з напрямними коліями та спосіб керування візками такої транспортної системи
Випадковий патент: Пристрій для вимірювання магнітної сприйнятливості речовин












