Заміщені сполуки [1,4]бензодіоксино[2,3-e]ізоіндолу, спосіб їх одержання і фармацевтична композиція, яка їх містить
Номер патенту: 79997
Опубліковано: 10.08.2007
Автори: Леонс Стефан, Лепіфр Франк, Кеньяр Даніель-Енрі, Рутьє Сільвен, Кудер Жерар, Ікман Джон, Пьєр Ален, Ренар Пьєр, Ейерб Наталі
Формула / Реферат
1. Сполука формули (І):
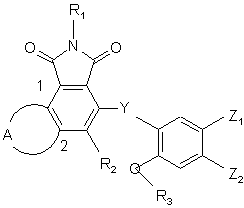 (I),
(I),
де:
А, разом з атомами вуглецю, з якими він зв’язаний, являє собою групу формули (a) або (b):
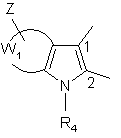 (a)
(a) 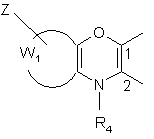 (b),
(b),
де:
W1, разом з атомами вуглецю, з якими він зв'язаний, являє собою фенільну групу або піридильну групу,
Z являє собою групу, яка вибирається з атомів водню і галогену і груп лінійного або розгалуженого (С1-С6)алкілу, нітро, ціано, гідрокси, лінійного або розгалуженого (С1-С6)алкокси, арилу, арил-(С1-С6)алкілу (в якому алкільна частина може бути лінійною або розгалуженою), арилокси і арил-(С1-С6)алкокси (в якому алкоксичастина може бути лінійною або розгалуженою) і NR5R6, де R5 і R6 які є однаковими або відрізняються, кожний незалежно від іншого являє собою групу, яка вибирається з атома водню і лінійної або розгалуженої (С1-С6)алкільної групи,
R4 являє собою групу, яка вибирається з атома водню і груп лінійного або розгалуженого (С1-С6)алкілу, арилу і арил-(С1-С6)алкілу (в якому алкільна частина є лінійною або розгалуженою), або групу -C(O)-OR'5, де R'5 являє собою групу, яка вибирається з груп лінійного або розгалуженого (С1-С6)алкілу, арилу і арил-(С1-С6)алкілу (в якому алкільна частина є лінійною або розгалуженою),
Y являє собою групу, яка вибирається з атома кисню і групи метилену,
R2 являє собою атом водню і, у такому випадку,
R3 являє собою групу, яка вибирається з атома водню і груп лінійного або розгалуженого (С1-С6)алкілу, арилу, арил-(С1-С6)алкілу (в якому алкільна частина є лінійною або розгалуженою) і SО2СF3,
або R2 і R3 утворюють зв'язок,
R1 являє собою групу, яка вибирається з атома водню і груп лінійного або розгалуженого (С1-С6)алкілу, арилу і арил-(С1-С6)алкілу (в якому алкільна частина є лінійною або розгалуженою) або лінійного або розгалуженого (С1-С6)алкіленового ланцюга, заміщеного однією або більше однаковими або різними групами, які вибираються з -OR"5 і -NR"5R"6, де R"5 і R"6 є такими ж, як визначено для R5 і R6 вище,
Z1 і Z2 кожний являє собою атом водню, або
Z1 і Z2, разом з атомами вуглецю, які несуть їх, утворюють фенільну групу,
за умови, що, коли Z являє собою атом водню, R1 відрізняється від атома водню,
її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтичнo прийнятною кислотою або основою,
де "арил", як повинно бути зрозумілим, являє собою фенільну, нафтильну, дигідронафтильну, тетрагідронафтильну, інденільну або інданільну групу, кожна з яких необов'язково заміщена однією або більше однаковими або різними групами, які вибираються з галогену, лінійного або розгалуженого (С1-С6)алкілу, лінійного або розгалуженого (С1-С6)тригалоалкілу, гідрокси, лінійного або розгалуженого (С1-С6)алкокси і аміно, необов'язково заміщеного однією або двома лінійними або розгалуженими (С1-С6)алкільними групами.
2. Сполука формули (І) за п. 1, яка відрізняється тим, що вона являє собою сполуку формули (ІА):
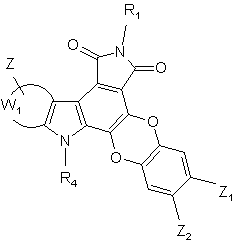 (IA),
(IA),
де R1, R4, W1, Z, Z1 і Z2 є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтичнo прийнятною кислотою або основою.
3. Сполука формули (І) за п. 1 або 2, яка відрізняється тим, що вона являє собою сполуку формули (IВ):
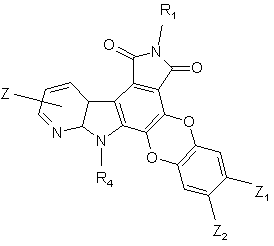 (IB),
(IB),
де R1, R4, Z, Z1 і Z2 є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтичнo прийнятною кислотою або основою.
4. Сполука формули (І) за п. 1 або 2, яка відрізняється тим, що вона являє собою сполуку формули (IC):
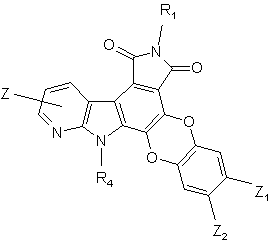 (IC),
(IC),
де R1, R4, Z, Z1 і Z2 є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтичнo прийнятною кислотою або основою.
5. Сполука формули (І) за п. 1, яка відрізняється тим, що вона являє собою сполуку формули (ID):
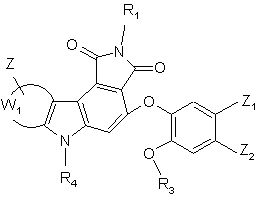 (ID),
(ID),
де R1, R3, R4, W1, Z, Z1 і Z2 є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтично прийнятною кислотою або основою.
6. Сполука формули (І) за п. 1 або 5, яка відрізняється тим, що вона являє собою сполуку формули (ІЕ):
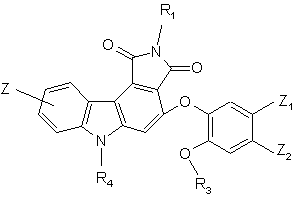 (IE),
(IE),
де R1, R3, R4, Z, Z1 і Z2 є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтично прийнятною кислотою або основою.
7. Сполука формули (І) за п. 1 або 5, яка відрізняється тим, що вона являє собою сполуку формули (IF):
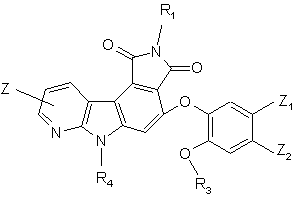 (IF),
(IF),
де R1, R3, R4, Z, Z1 і Z2 є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтичнo прийнятною кислотою або основою.
8. Сполука формули (І) за п. 1 або 5, яка відрізняється тим, що вона являє собою сполуку формули (IG):
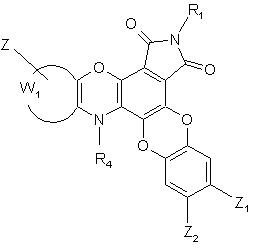 (IG),
(IG),
де R1, R4, W1, Z, Z1 і Z2 є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтично прийнятною кислотою або основою.
9. Сполука формули (І) за п. 1 або 8, яка відрізняється тим, що вона являє собою сполуку формули (ІН):
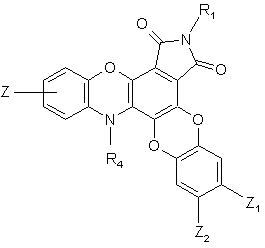 (IH),
(IH),
де R1, R4, Z, Z1 і Z2 є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтично прийнятною кислотою або основою.
10. Сполука формули (І) за п. 1 або 8, яка відрізняється тим, що вона являє собою сполуку формули (IJ):
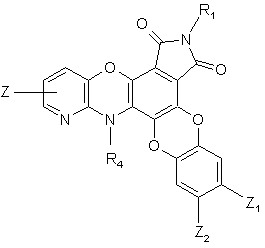 (IJ),
(IJ),
де R1, R4, Z, Z1 і Z2 є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтично прийнятною кислотою або основою.
11. Сполука формули (І) за будь-яким з пп. 1-10, яка відрізняється тим, що Z являє собою атом водню, атом галогену або гідроксигрупу, її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтичнo прийнятною кислотою або основою.
12. Сполука формули (І) за будь-яким з пп. 1-11, яка відрізняється тим, що А, разом з атомами вуглецю, з якими він зв'язаний, являє собою групу формули:
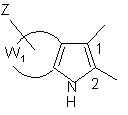 або
або 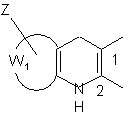 ,
,
її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтичнo прийнятною кислотою або основою.
13. Сполука формули (І) за будь-яким з пп. 1-12, яка відрізняється тим, що R3 являє собою атом водню або лінійну або розгалужену (С1-С6)алкільну групу, її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтичнo прийнятною кислотою або основою.
14. Сполука формули (І) за будь-яким з пп. 1-13, яка відрізняється тим, що R1 являє собою атом водню, лінійну або розгалужену (С1-С6)алкільну групу або лінійний або розгалужений (С1-С6)алкіленовий ланцюг, заміщений однією або більше однаковими або різними групами, вибраними з -NR5R6, де R5 і R6 є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтичнo прийнятною кислотою або основою.
15. Сполука формули (І) за будь-яким з пп. 1-14, яка відрізняється тим, що Z1 і Z2 являють собою атоми водню, її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтично прийнятною кислотою або основою.
16. Сполука формули (І) за п. 1, яка являє собою:
7-метил[1,4]бензодіоксино[2,3-а]піроло[3,4-с]карбазол-6,8-діон,
10-фтор-7-метил[1,4]бензодіоксино[2,3-а]піроло[3,4-с]карбазол-6,8-діон,
11-фтор-7-метил[1,4]бензодіоксино[2,3-а]піроло[3,4-с]карбазол-6,8-діон,
7-[2-(диметиламіно)етил]-10-фтор[1,4]бензодіоксино[2,3-а]піроло[3,4-с]-карбазол-6,8-діон,
10-гідрокси[1,4]бензодіоксино[2,3-а]піроло[3,4-с]карбазол-6,8-діон,
11-гідрокси[1,4]бензодіоксино[2,3-а]піроло[3,4-с]карбазол-6,8-діон,
7-[2-(диметиламіно)етил][1,4]бензодіоксино[2,3-а]піроло[3,4-с]карбазол-6,8-діон,
7-[2-(диметиламіно)етил]-10-гідрокси[1,4]бензодіоксино[2,3-а]піроло[3,4-с]-карбазол-6,8-діон,
7-[2-(диметиламіно)етил]-11-гідрокси[1,4]бензодіоксино[2,3-а]піроло[3,4-с]-карбазол-6,8-діон,
7-[2-(диметиламіно)етил][1,4]бензодіоксино[2,3-е]піридо[2',3':5,6]-[1,4]оксазино[3,2-g]ізоіндол-6,8-діон,
її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтично прийнятною кислотою або основою.
17. Спосіб одержання сполук формули (І) за п. 1, який відрізняється тим, що як вихідний матеріал використовують сполуку формули (II):
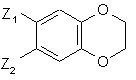 (II),
(II),
де Z1 і Z2 є такими ж, як визначено для формули (І),
сполуку формули (II) піддають реакції з N-бромсукцинімідом у присутності бензоїл пероксиду, з тим, щоб одержати сполуку формули (III):
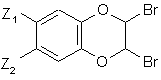 (III),
(III),
де Z1 і Z2 є такими ж, як визначено вище,
сполуку формули (III) піддають реакції з йодидом натрію, з тим, щоб одержати сполуку формули (IV):
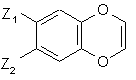 (IV),
(IV),
де Z1 і Z2 є такими ж, як визначено вище,
сполуку формули (IV) піддають реакції з н-бутиллітієм і потім з хлоридом триметилолова, з тим, щоб одержати сполуку формули (V):
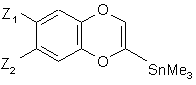 (V),
(V),
де Z1 і Z2 є такими ж, як визначено вище, сполуку формули (V):
- або обробляють у присутності тетракис(трифенілфосфін)паладію(0) сполукою формули (VI):
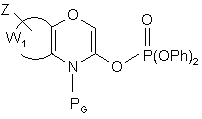 (VI),
(VI),
де RG являє собою амінозахисну групу, відому в органічному синтезі, і W1 і Z є такими ж, як визначено для формули (І), з тим, щоб одержати сполуку формули (VII):
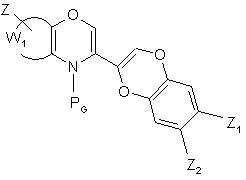 (VII),
(VII),
де RG, Z, Z1, Z2 і W1 є такими ж, як визначено вище, сполуку формули (VII) обробляють сполукою формули (VIII):
 (VIII),
(VIII),
де R1a являє собою атом водню або метильну групу з тим, щоб одержати сполуку формули (IX):
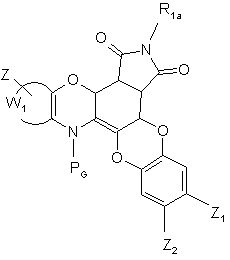 (IX),
(IX),
де RG, R1a, Z, Z1, Z2 і W1 є такими ж, як визначено вище,
сполуку формули (IX) обробляють N-бромсукцинімідом і бензоїл пероксидом з тим, щоб одержати сполуку формули (І/а), конкретний випадок сполук формули (І):
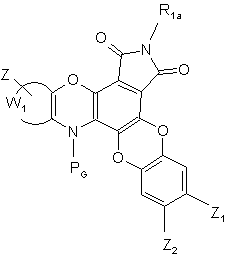 (I/a),
(I/a),
де RG, R1a, Z, Z1, Z2 і W1 є такими ж, як визначено вище, сполуку формули (І/а) необов'язково обробляють сполукою формули (X):
R1b–NH2 (X),
де R1b має те ж визначення, що і R1 у формулі (І), але відрізняється від атома водню або метальної групи, з тим, щоб одержати сполуку формули (І/b), конкретний випадок сполук формули (І):
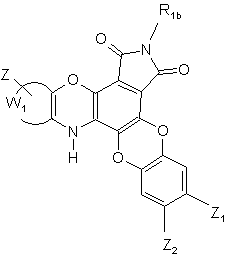 (I/b),
(I/b),
де R1b, Z, Z1, Z2 і W1 є такими ж, як визначено вище,
сполуки формул (І/а) і (І/b) які являють собою сполуку формули (І/с) :
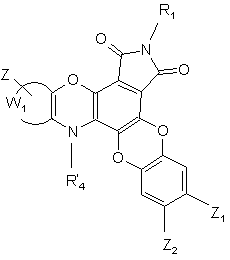 (І/с),
(І/с),
де R'4 являє собою атом водню або групу РG, і R1, Z, Z1, Z2 і W1 є такими ж, як визначено вище,
- або обробляють у присутності хлориду біс(трифенілфосфін)паладію(II) сполукою формули (XI):
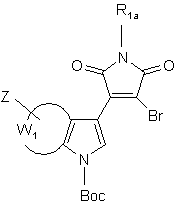 (XI),
(XI),
де Вос являє собою трет-бутоксикарбонільну групу і R1a, W1 і Z є такими ж, як визначено вище, з тим, щоб одержати сполуку формули (XII):
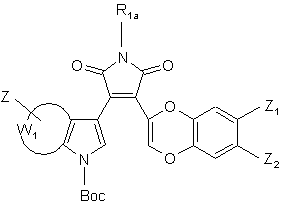 (XII),
(XII),
де Вос, R1a, Z, Z1, Z2 і W1 є такими ж, як визначено вище,
сполуку формули (XII):
- або опромінюють УФ лампою, у присутності йоду, в неполярному і апротонному розчиннику, з тим, щоб одержати сполуки формул (I/d) і (І/e), конкретні випадки сполук формули (І):
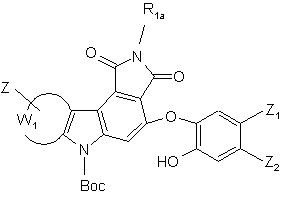 (I/d),
(I/d), 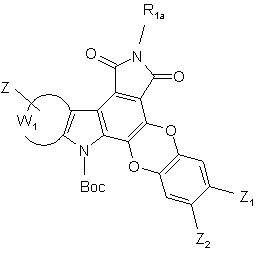 (І/е),
(І/е),
де Вос, R1a, Z, Z1, Z2 і W1 є такими ж, як визначено вище,
сполуку формули (I/d):
- необов'язково піддають зняттю захисту амінофункції відповідно до звичайних способів органічного синтезу, з тим, щоб одержати сполуку формули (I/f), конкретний випадок сполук формули (І):
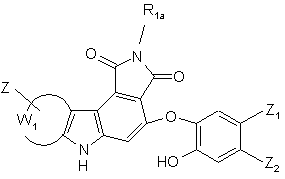 (I/f),
(I/f),
де R1a, Z, Z1, Z2 і W1 є такими ж, як визначено вище,
- або необов'язково піддають дії сполуки формули (XIII):
R3a–G (ХIII),
де R3a має те ж визначення, що і R3 у формулі (І),але відрізняється від атома водню, і G є таким же, як визначено вище, з тим, щоб одержати сполуку формули (I/g), конкретний випадок сполук формули (І):
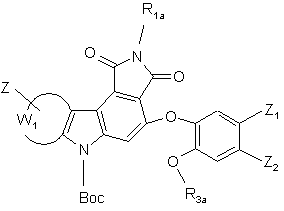 (I/g),
(I/g),
де Вос, R1a, R3а, Z, Z1, Z2 і W1 є такими ж, як визначено вище, сполуки формул (I/d), (І/е) і (I/g) являють собою сполуку формули (I/h):
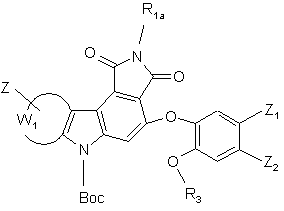 (I/h),
(I/h),
де Вос, R1a, R3а, Z, Z1, Z2 і W1 є такими ж, як визначено вище,
сполуку формули (I/h) необов'язково піддають тим же умовам реакції, що і сполуку формули (І/а), з тим, щоб одержати сполуку формули (І/і), конкретний випадок сполук формули (І):
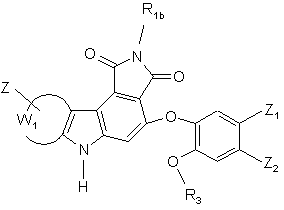 (І/і),
(І/і),
де R1b, R3, Z, Z1, Z2 і W1 є такими ж, як визначено вище,
- або піддають дії хлористоводневої кислоти, з тим, щоб одержати сполуку формули (XIV):
 (XIV),
(XIV),
де R1a, Z, Z1, Z2 і W1 є такими ж, як визначено вище, сполуку формули (XIV) піддають дії сполуки формули (XV):
R4a–G (XV),
де G являє собою відхідну групу і R4a має те ж визначення, що і R4 у формулі (І), але відрізняється від атома водню, з тим, щоб одержати сполуку формули (XVI):
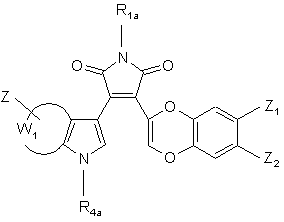 (XVI),
(XVI),
де R1a, R4a, Z, Z1, Z2 і W1 є такими ж, як визначено вище,
сполуку формули (XVI) піддають тим же умовам реакції, що і сполуку формули (XII), з тим, щоб одержати сполуки формул (I/j) і (I/k), конкретні випадки сполук формули (І):
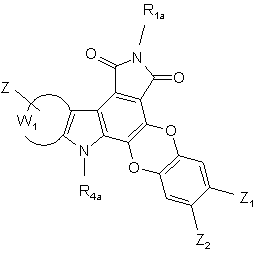 (I/j),
(I/j), 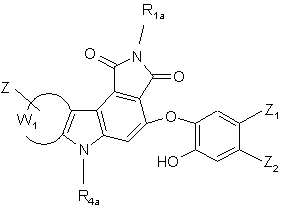 (I/k),
(I/k),
де R1a, R4a, Z, Z1, Z2 і W1 є такими ж, як визначено вище,
сполуку формули (I/k) необов'язково піддають дії сполуки формули (XIII), як визначено вище, з тим, щоб одержати сполуку формули (I/l):
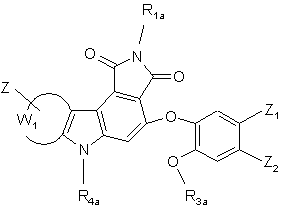 (I/l),
(I/l),
де R1a, R3а, R4a, Z, Z1, Z2 і W1 є такими ж, як визначено вище, сполуки формул (I/j), (I/k) і (I/l) являють собою сполуку формули (І/m):
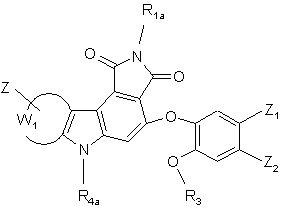 (І/m),
(І/m),
де R1a, R3, R4a, Z, Z1, Z2 і W1 є такими ж, як визначено вище,
сполуку формули (І/m) необов'язково піддають тим же умовам реакції, що і сполуку формули (I/h), з тим, щоб одержати сполуку формули (І/n):
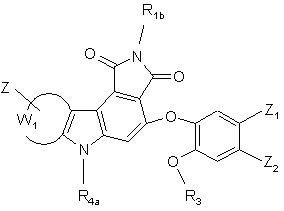 (І/n),
(І/n),
де R1b, R3, R4a, Z, Z1, Z2 і W1 є такими ж, як визначено вище,
сполуки формул (І/e), (I/h) і (І/і), (І/m) і (І/n) являють собою сполуку формули (І/о):
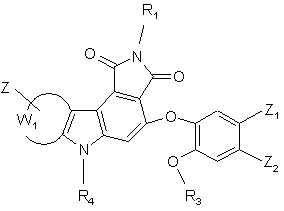 (І/о),
(І/о),
де R1, R3, R4, Z, Z1, Z2 і W1 є такими ж, як визначено вище,
сполуки формул (І/а)-(І/о) які являють собою сукупність сполук формули (І), які очищують, коли необхідно, відповідно до звичайної техніки очищення, які можуть, якщо бажано, бути розділені на їх різні ізомери відповідно до звичайної техніки розділення і, якщо бажано, перетворені у їх N-оксиди і, де придатно, у їх адитивні солі з фармацевтично прийнятною кислотою або основою.
18. Фармацевтична композиція, яка містить як активний інгредієнт щонайменше одну сполуку формули (І) за будь-яким з пп. 1-16, одну або у поєднанні з одним або більше інертними, нетоксичними ексципієнтами або носіями.
19. Фармацевтична композиція за п. 18 для застосування як ліків у лікуванні різних типів раку.
Текст
1. Сполука формули (І): 3 79997 льна частина є лінійною або розгалуженою) і SО2СF3 , або R2 і R3 утворюють зв'язок, R1 являє собою груп у, яка вибирається з атома водню і груп лінійного або розгалуженого (С1С6)алкілу, арилу і арил-(С1-С6)алкілу (в якому алкільна частина є лінійною або розгалуженою) або лінійного або розгалуженого (С1-С6)алкіленового ланцюга, заміщеного однією або більше однаковими або різними групами, які вибираються з -OR"5 і -NR"5R"6, де R"5 і R"6 є такими ж, як визначено для R5 і R6 ви ще, Z1 і Z 2 кожний являє собою атом водню, або Z1 і Z 2, разом з атомами вуглецю, які несуть їх, утворюють фенільну груп у, за умови, що, коли Z являє собою атом водню, R1 відрізняється від атома водню, її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтичнo прийнятною кислотою або основою, де "арил", як повинно бути зрозумілим, являє собою фенільну, нафтильну, дигідронафтильну, тетрагідронафтильну, інденільну або інданільну групу, кожна з яких необов'язково заміщена однією або більше однаковими або різними групами, які вибираються з галогену, лінійного або розгалуженого (С1-С6)алкілу, лінійного або розгалуженого (С1-С6)тригалоалкілу, гідрокси, лінійного або розгалуженого (С1-С6)алкокси і аміно, необов'язково заміщеного однією або двома лінійними або розгалуженими (С1-С6)алкільними групами. 2. Сполука формули (І) за п. 1, яка відрізняється тим, що вона являє собою сполуку формули (ІА): R1 O N Z W1 4. Сполука формули (І) за п. 1 або 2, яка відрізняється тим, що вона являє собою сполуку формули (IC): R1 O N O Z N O R4 Z1 Z2 де R1, R4, Z, Z1 і Z2 є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери, Nоксид і адитивні солі з фармацевтичнo прийнятною кислотою або основою. 5. Сполука формули (І) за п. 1, яка відрізняється тим, що вона являє собою сполуку формули (ID): R1 O N Z O O N Z2 R4 R3 де R1, R3, R4, W 1, Z, Z1 і Z 2 є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтично прийнятною кислотою або основою. 6. Сполука формули (І) за п. 1 або 5, яка відрізняється тим, що вона являє собою сполуку формули (ІЕ): O (IA), N Z R4 N R1 Z1 O Z1 де R1, R4, W1, Z, Z1 і Z 2 є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтичнo прийнятною кислотою або основою. 3. Сполука формули (І) за п. 1 або 2, яка відрізняється тим, що вона являє собою сполуку формули (IВ): O O Z2 (IE), Z2 R4 R3 де R1, R3, R4, Z, Z 1 і Z2 є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтично прийнятною кислотою або основою. 7. Сполука формули (І) за п. 1 або 5, яка відрізняється тим, що вона являє собою сполуку формули (IF): N R1 O O Z N (ID), Z1 O W1 R1 O O (IC), O N O O N 4 (IB), O N Z Z1 Z2 де R1, R4, Z, Z1 і Z2 є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери, Nоксид і адитивні солі з фармацевтичнo прийнятною кислотою або основою. O O O R4 N N N R4 Z1 O (IF), Z2 R3 де R1, R3, R4, Z, Z 1 і Z2 є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтичнo прийнятною кислотою або основою. 5 79997 8. Сполука формули (І) за п. 1 або 5, яка відрізняється тим, що вона являє собою сполуку формули (IG): R1 O O O W1 N (IG), O O R4 Z1 Z2 де R1, R4, W1, Z, Z1 і Z 2 є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтично прийнятною кислотою або основою. 9. Сполука формули (І) за п. 1 або 8, яка відрізняється тим, що вона являє собою сполуку формули (ІН): R1 O N O O Z N O (IH), O R4 Z1 Z2 де R1, R4, Z, Z1 і Z2 є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери, Nоксид і адитивні солі з фармацевтично прийнятною кислотою або основою. 10. Сполука формули (І) за п. 1 або 8, яка відрізняється тим, що вона являє собою сполуку формули (IJ): R1 O N O O Z N N R4 Z Z W1 1 N 2 H N Z 6 O (IJ), O Z1 Z2 де R1, R4, Z, Z1 і Z2 є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери, Nоксид і адитивні солі з фармацевтично прийнятною кислотою або основою. 11. Сполука формули (І) за будь-яким з пп. 1-10, яка відрізняється тим, що Z являє собою атом водню, атом галогену або гідроксигрупу, її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтичнo прийнятною кислотою або основою. 12. Сполука формули (І) за будь-яким з пп. 1-11, яка відрізняється тим, що А, разом з атомами вуглецю, з якими він зв'язаний, являє собою групу формули: 1 W1 N 2 H або , її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтичнo прийнятною кислотою або основою. 13. Сполука формули (І) за будь-яким з пп. 1-12, яка відрізняється тим, що R3 являє собою атом водню або лінійну або розгалужену (С1-С6)алкільну груп у, її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтичнo прийнятною кислотою або основою. 14. Сполука формули (І) за будь-яким з пп. 1-13, яка відрізняється тим, що R1 являє собою атом водню, лінійну або розгалужену (С1-С6)алкільну груп у або лінійний або розгалужений (С1С6)алкіленовий ланцюг, заміщений однією або більше однаковими або різними групами, вибраними з -NR5R6, де R5 і R6 є такими ж, як визначено для формули (І), її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтичнo прийнятною кислотою або основою. 15. Сполука формули (І) за будь-яким з пп. 1-14, яка відрізняється тим, що Z1 і Z2 являють собою атоми водню, її енантіомери, діастереоізомери, Nоксид і адитивні солі з фармацевтично прийнятною кислотою або основою. 16. Сполука формули (І) за п. 1, яка являє собою: 7-метил[1,4]бензодіоксино[2,3-а]піроло[3,4с]карбазол-6,8-діон, 10-фтор-7-метил[1,4]бензодіоксино[2,3а]піроло[3,4-с]карбазол-6,8-діон, 11-фтор-7-метил[1,4]бензодіоксино[2,3а]піроло[3,4-с]карбазол-6,8-діон, 7-[2-(диметиламіно)етил]-10фтор[1,4]бензодіоксино[2,3-а]піроло[3,4-с]карбазол-6,8-діон, 10-гідрокси[1,4]бензодіоксино[2,3-а]піроло[3,4с]карбазол-6,8-діон, 11-гідрокси[1,4]бензодіоксино[2,3-а]піроло[3,4с]карбазол-6,8-діон, 7-[2-(диметиламіно)етил][1,4]бензодіоксино[2,3а]піроло[3,4-с]карбазол-6,8-діон, 7-[2-(диметиламіно)етил]-10гідрокси[1,4]бензодіоксино[2,3-а]піроло[3,4-с]карбазол-6,8-діон, 7-[2-(диметиламіно)етил]-11гідрокси[1,4]бензодіоксино[2,3-а]піроло[3,4-с]карбазол-6,8-діон, 7-[2-(диметиламіно)етил][1,4]бензодіоксино[2,3е]піридо[2',3':5,6]-[1,4]оксазино[3,2-g]ізоіндол-6,8діон, її енантіомери, діастереоізомери, N-оксид і адитивні солі з фармацевтично прийнятною кислотою або основою. 17. Спосіб одержання сполук формули (І) за п. 1, який відрізняється тим, що як вихідний матеріал використовують сполуку формули (II): 7 79997 8 R1a O Z1 O (II), Z O Z2 де Z1 і Z2 є такими ж, як визначено для формули (І), сполуку формули (II) піддають реакції з Nбромсукцинімідом у присутності бензоїл пероксиду, з тим, щоб одержати сполуку формули (III): Z1 O O O W1 PG O Z1 Z2 Br (III), де Z1 і Z 2 є такими ж, як визначено вище, сполуку формули (III) піддають реакції з йодидом натрію, з тим, щоб одержати сполуку формули (IV): де RG, R1a, Z, Z 1, Z2 і W1 є такими ж, як визначено вище, сполуку формули (IX) обробляють Nбромсукцинімідом і бензоїл пероксидом з тим, щоб одержати сполуку формули (І/а), конкретний випадок сполук формули (І): R1a O Z1 O (IV), Z O Z2 де Z1 і Z 2 є такими ж, як визначено вище, сполуку формули (IV) піддають реакції з нбутиллітієм і потім з хлоридом триметилолова, з тим, щоб одержати сполуку формули (V): N O O W1 (I/a), O N O PG O Z1 (IX), O N Br Z2 N O Z1 (V), O Z2 Z2 SnMe3 де Z1 і Z2 є такими ж, як визначено вище, сполуку формули (V): або обробляють у присутності тетракис(трифенілфосфін)паладію(0) сполукою формули (VI): Z O O W1 N O P(OPh) 2 (VI), де RG, R1a, Z, Z 1, Z2 і W1 є такими ж, як визначено вище, сполук у формули (І/а) необов'язково обробляють сполукою формули (X): R1b–NH2 (X), де R1b має те ж визначення, що і R1 у формулі (І), але відрізняється від атома водню або метальної групи, з тим, щоб одержати сполуку формули (І/b), конкретний випадок сполук формули (І): R1b O PG де RG являє собою амінозахисну гр упу, відому в органічному синтезі, і W1 і Z є такими ж, як визначено для формули (І), з тим, щоб одержати сполуку формули (VII): Z N O O W1 (I/b), O N H O O W1 PG Z1 O N (VII), O Z1 Z2 де RG, Z, Z1, Z2 і W1 є такими ж, як визначено вище, сполуку формули (VII) обробляють сполукою формули (VIII): R1a O Z N O (VIII), Z2 де R1b, Z, Z1 , Z 2 і W1 є такими ж, як визначено вище, сполуки формул (І/а) і (І/b) які являють собою сполуку формули (І/с) : R1 O Z N O O W1 (І/с), O N O R'4 де R1a являє собою атом водню або метильну групу з тим, щоб одержати сполуку формули (IX): Z1 Z2 9 79997 де R'4 являє собою атом водню або групу РG, і R1, Z, Z 1, Z2 і W1 є такими ж, як визначено вище, - або обробляють у присутності хлориду біс(трифенілфосфін)паладію(II) сполукою формули (XI): 10 R1 a O N Z (XI), Br N Boc де Вос являє собою трет-бутоксикарбонільну гр упу і R1a, W 1 і Z є такими ж, як визначено вище, з тим, щоб одержати сполуку формули (XII): R1a O Z1 HO Z2 де R1a, Z, Z1 , Z 2 і W1 є такими ж, як визначено вище, - або необов'язково піддають дії сполуки формули (XIII): R3a–G (ХIII), де R3a має те ж визначення, що і R3 у формулі (І), але відрізняється від атома водню, і G є таким же, як визначено вище, з тим, щоб одержати сполуку формули (I/g), конкретний випадок сполук формули (І): R 1a N O O Z O Z1 (XII), O N N O Z O N Z2 Boc Z1 O W1 W1 R 1a R 3a де Вос, R1a, R3а, Z, Z1 , Z2 і W1 є такими ж, як визначено вище, сполуки формул (I/d), (І/е) і (I/g) являють собою сполуку формули (I/h): R1a O N O Z O N N O O N Z1 HO W1 ((I/d), Z2 R 1a O І/е), O N R3 R1 b O W1 Z2 Boc N Z (I/h), де Вос, R1a, R3а, Z, Z1 , Z2 і W1 є такими ж, як визначено вище, сполуку формули (I/h) необов'язково піддають тим же умовам реакції, що і сполуку формули (І/а), з тим, щоб одержати сполуку формули (І/і), конкретний випадок сполук формули (І): Boc O Z1 O W1 Z (I/g), Z2 Boc де Вос, R1a, Z, Z1 , Z2 і W 1 є такими ж, як визначено вище, сполуку формули (XII): - або опромінюють УФ лампою, у присутності йоду, в неполярному і апротонному розчиннику, з тим, щоб одержати сполуки формул (I/d) і (І/e), конкретні випадки сполук формули (І): O (I/f), O N H O W1 O W1 R1a O N Z O Z O W1 O Boc Z1 N H Z2 де Вос, R1a, Z, Z1 , Z2 і W 1 є такими ж, як визначено вище, сполуку формули (I/d): - необов'язково піддають зняттю захисту амінофункції відповідно до звичайних способів органічного синтезу, з тим, щоб одержати сполуку формули (I/f), конкретний випадок сполук формули (І): N Z1 O (І/і), Z2 R3 де R1b, R3, Z, Z1 , Z2 і W1 є такими ж, як визначено вище, - або піддають дії хлористоводневої кислоти, з тим, щоб одержати сполуку формули (XIV): 11 79997 12 R 1a R 1a N O O O Z O Z1 O (XIV), O Z2 O де R1a, Z, Z1 , Z 2 і W1 є такими ж, як визначено вище, сполук у формули (XIV) піддають дії сполуки формули (XV): R4a–G (XV), де G являє собою відхідну груп у і R4a має те ж визначення, що і R4 у формулі (І), але відрізняється від атома водню, з тим, щоб одержати сполуку формули (XVI): R4 a R3a де R1a, R3а, R4a, Z, Z1 , Z2 і W 1 є такими ж, як визначено вище, сполуки формул (I/j), (I/k) і (I/l) являють собою сполуку формули (І/m): R1a O N O Z N O Z O Z1 O N Z2 (XVI), R4a де R1a, R4a , Z, Z1 , Z 2 і W1 є такими ж, як визначено вище, сполуку формули (XVI) піддають тим же умовам реакції, що і сполуку формули (XII), з тим, щоб одержати сполуки формул (I/j) і (I/k), конкретні випадки сполук формули (І): R1 b O O Z W1 (I/j), O O Z O R3 де R1b, R3 , R4a , Z, Z 1, Z2 і W 1 є такими ж, як визначено вище, сполуки формул (І/e), (I/h) і (І/і), (І/m) і (І/n) являють собою сполуку формули (І/о): O O W1 N R4 O O Z1 HO (I/k), Z2 R4a де R1a, R4a , Z, Z1 , Z 2 і W1 є такими ж, як визначено вище, сполуку формули (I/k) необов'язково піддають дії сполуки формули (XIII), як визначено вище, з тим, щоб одержати сполуку формули (I/l): N O Z N N Z2 N Z1 R1a W1 (І/n), R1 Z2 Z Z1 O W1 O R 4a O N R4 a N N Z2 R3 де R1a, R3 , R4a , Z, Z 1, Z2 і W 1 є такими ж, як визначено вище, сполуку формули (І/m) необов'язково піддають тим же умовам реакції, що і сполуку формули (I/h), з тим, щоб одержати сполуку формули (І/n): R 1a O O R4a W1 (І/m), Z1 O W1 R 1a N (I/l), Z2 N H O Z1 O W1 W1 N N Z Z1 O (І/о), Z2 R3 де R1, R3, R4, Z, Z1, Z2 і W 1 є такими ж, як визначено вище, сполуки формул (І/а)-(І/о) які являють собою сукупність сполук формули (І), які очищують, коли необхідно, відповідно до звичайної техніки очищення, які можуть, якщо бажано, бути розділені на їх різні ізомери відповідно до звичайної техніки розділення і, якщо бажано, перетворені у їх N-оксиди і, де придатно, у їх адитивні солі з фармацевтично прийнятною кислотою або основою. 13 79997 14 18. Фармацевтична композиція, яка містить як активний інгредієнт щонайменше одну сполуку формули (І) за будь-яким з пп. 1-16, одну або у поєд нанні з одним або більше інертними, нетоксичними ексципієнтами або носіями. 19. Фармацевтична композиція за п. 18 для застосування як ліків у лікуванні різних типів раку. Даний винахід відноситься до нових заміщених сполук [1,4]бензодіоксино-[2,3-е]ізоіндолу, до способу їх одержання і до фармацевтичних композицій, які їх містять. Застосування сполук за даним винаходом є багатообіцяючим завдяки їх протипухлинній активності. Заявка на [патент WO 00/18407] розкриває сполуки піролокарбазолу для застосування у запобіганні і лікуванні глухоти і відчуття втрати рівноваги. Заявки на [патенти US 5705511 і WO 96/11933] розкривають сполуки циклопентан[g]піроло[3,4-е]індолу, які об'єднуються на їх індольній частині і частині циклопентену до ароматичної або неароматичної циклічної системи, яка необов'язково містить гетероатоми. Такі сполуки володіють фармакологічними активностями, які роблять їх застосовними особливо у лікування ракових клітин. Заявка на [патент WO 01/85686] розкриває сполуки піролокарбазол-арилу для застосування в лікуванні різних типів раку. Заявка на [патент ЕР 0841337] заявляє заміщені сполуки 7,12-діокси-бензо[а]антрацену і розкриває їх протиракові властивості. Сполуки даного винаходу є новими як в їх структурі, так і у їх застосуванні як протипухлинних агентів. Більш конкретно, даний винахід відноситься до сполук формули (І): - W1, разом з атомами вуглецю, з якими він зв'язаний, являє собою фенільну груп у або піридильну груп у, - Ζ являє собою гр упу, яка вибирається з атомів водню і галогену і груп лінійного або розгалуженого (С1-С6)алкілу, нітро, ціано, гідрокси, лінійного або розгалуженого (С1-С6)алкокси, арилу, арил-(С1-С6)алкілу (в якому алкільна частина може бути лінійною або розгалуженою), арилокси і арил(С1-С6)алкокси (в якому алкокси частина може бути лінійною або розгалуженою) і NR5R6, де R5 і R6, які є однаковими або відрізняються, кожний незалежно від іншого являє собою групу, яка вибирається з атома водню і лінійної або розгалуженої (С1-С6)алкільної групи, - R4 являє собою групу, яка вибирається з атома водню і груп лінійного або розгалуженого (С1-С6)алкілу, арилу і арил-(С1-С6)алкілу (в якому алкільна частина є лінійною або розгалуженою), або групу -C(O)-OR'5 , де R' 5 являє собою гр упу, яка вибирається з груп лінійного або розгалуженого (С1-С6)алкілу, арилу і арил-(С1-С6)алкілу (в якому алкільна частина є лінійною або розгалуженою), - Υ являє собою груп у, яка вибирається з атома кисню і групи метилену, - R2 являє собою атом водню і, у такому випадку: R3 являє собою групу, яка вибирається з атома водню і груп лінійного або розгалуженого (С1С6)алкілу, арилу, арил-(С1-С6)алкілу (в якому алкільна частина є лінійною або розгалуженою) і SO2CF3 , - або R2 і R3 утворюють зв'язок, - R1 являє собою групу, яка вибирається з атома водню і груп лінійного або розгалуженого (С1-С6)алкілу, арилу і арил-(С1-С6)алкілу (в якому алкільна частина є лінійною або розгалуженою) або лінійного або розгалуженого (С1С6)алкіленового ланцюга, заміщеного однією або більше однаковими або різними групами, які вибираються з -OR"5 і -NR"5R"6, де R"5 і R"6 є такими ж, як визначено для R5 і R6 вище, - Z1 і Z 2 кожний являють собою атом водню або Z1 і Ζ2, разом з атомами вуглецю, які несуть їх, утворюють фенільну груп у, за умови, що, коли Ζ являє собою атом водню, R1 відрізняється від атома водню, до їх енантіомерів, діастереоізомерів, Nоксиду і до адитивних солей з фармацевтично прийнятною кислотою або основою, де "арил", як повинно бути зрозумілим, являє собою фенільну, нафтильну, дигідронафтильну, тетрагідронафтильну, інденльну або інданільну груп у, кожна з яких необов'язково заміщена однією або більше однаковими або різними групами, які де: - А, разом з атомами вуглецю, з якими він зв'язаний, являє собою групу формули (а) або (b): де: 15 79997 вибираються з галогену, лінійного або розгалуженого (С1-С6)алкілу, лінійного або розгалуженого (С1-С6)тригалоалкілу, гідрокси, лінійного або розгалуженого (С1-С6)алкокси і аміно, необов'язково заміщеного однією або двома лінійними або розгалуженими (С1-С6)алкільними групами. Серед фармацевтично прийнятних кислот можуть бути згадані, без будь-якого обмеження, хлористоводнева кислота, бромистоводнева кислота, сірчана кислота, фосфонова кислота, оцтова кислота, трифтороцтова кислота, молочна кислота, піровиноградна кислота, малонова кислота, янтарна кислота, глутарова кислота, фумарова кислота, винна кислота, малеїнова кислота, лимонна кислота, аскорбінова кислота, щавлева кислота, метансульфонова кислота, камфорна кислота і т.д. Серед фармацевтично прийнятних основ можуть бути згадані, без будь-якого обмеження, гідроксид натрію, гідроксид калію, триетиламін і т.д. Переважні сполуки за даним винаходом являють собою сполуки формули (І), які відповідають більш конкретно формулі (ІА): 16 , де R1, R4, Ζ, Ζ1 і Ζ22 є такими ж, як визначено для формули (І). Відповідно до четвертого переважного втілення, переважні сполуки за даним винаходом являють собою сполуки формули (І), які відповідають більш конкретно формулі (ID): , де R1, R3, R4, W1, Ζ, Ζ1 і Ζ2 є такими ж, як визначено для формули (І). Відповідно до п'ятого переважного втілення, переважні сполуки за даним винаходом являють собою сполуки формули (І), які відповідають більш конкретно формулі (IE): , де R1, R4, W1, Z, Z1, і Z2 є такими ж, як визначено для формули (І). Відповідно до другого переважного втілення, переважні сполуки за даним винаходом являють собою сполуки формули (І), які відповідають більш конкретно формулі (IB): , де R1, R3, R4, Ζ, Ζ1 i Ζ 2 є такими ж, як визначено для формули (І). Відповідно до шостого переважного втілення, переважні сполуки за даним винаходом являють собою сполуки формули (І), які відповідають більш конкретно формулі (IF): , де R1, R4, Ζ, Ζ 1 і Ζ2 є такими ж, як визначено для формули (І). Відповідно до третього переважного втілення, переважні сполуки за даним винаходом являють собою сполуки формули (І), які відповідають більш конкретно формулі (IС): , 17 79997 де R1, R3, R4, Ζ, Z1 і Z 2 є такими ж, як визначено для формули (І). Відповідно до сьомого переважного втілення, переважні сполуки за даним винаходом являють собою сполуки формули (І), які відповідають більш конкретно формулі (IG): , де R1, R4, W1, Ζ, Ζ 1 і Ζ2 є такими ж, як визначено для формули (І). Відповідно до восьмого переважного втілення, переважні сполуки за даним винаходом являють собою сполуки формули (І), які відповідають більш конкретно формулі (1Н): , де R1, R4, Ζ, Ζ 1 і Ζ2 є такими ж, як визначено для формули (І). Відповідно до дев'ятого переважного втілення, переважні сполуки за даним винаходом являють собою сполуки формули (І), які відповідають більш конкретно формулі (IJ): , де R1, R4, Ζ, Ζ 1 і Ζ2 є такими ж, як визначено для формули (І). 18 В одному втіленні, що представляє інтерес, група Ζ, якій віддають перевагу відповідно до даного винаходу, являє собою атом водню, атом галогену або гідроксигрупу. Переважно, група А, разом з атомами вуглецю, з якими вона зв'язують, якій віддають перевагу відповідно до даного винаходу, являє собою групу формули: . В особливо переважному втіленні, група R3, якій віддають перевагу відповідно до даного винаходу, являє собою атом водню або лінійну або розгалужену (С1-С6)алкільну гр упу. В особливо переважному втіленні, група R1, якій віддають перевагу відповідно до даного винаходу, являє собою атом водню, лінійну або розгалужену (С1-С6)алкільну групу або лінійний або розгалужений (С1-С6)алкіленовий ланцюг, заміщений однією або більше однаковими або різними групами, вибраними з -NR 5R6, де R5 і R6 є такими ж, як визначено для формули (І). В іншому втіленні, що представляє інтерес, групи Z1 і Z2, яким віддають перевагу відповідно до даного винаходу, являють собою атоми водню. Сполуки, яким віддають перевагу відповідно до даного винаходу, являють собою: 7-метил[1,4]бензодіоксино[2,3-а]піроло[3,4с]карбазол-6,8-діон, 10-фтор-7-метил[1,4]бензодіоксино[2,3а]піроло[3,4-с]карбазол-6,8-діон, 11-фтор-7-метил[1,4]бензодіоксино[2,3а]піроло[3,4-с]карбазол-6,8-діон, 7-[2-(диметиламіно)етил]-10фтор[1,4]бензодіоксино[2,3-а]піроло[3,4-с]карбазол-6,8-діон, 10-гідрокси[1,4]бензодіоксино[2,3а]піроло[3,4-с]карбазол-6,8-діон, 11-гідрокси[1,4]бензодіоксино[2,3а]піроло[3,4-с]карбазол-6,8-діон, 7-[2(диметиламіно)етил][1,4]бензодіоксино[2,3а]піроло[3,4-с]карбазол-6,8-діон, 7-[2-(диметиламіно)етил]-10гідрокси[1,4]бензодіоксино[2,3-а]піроло[3,4-с]карбазол-6,8-діон, 7-[2-(диметиламіно)етил]-11гідрокси[1,4]бензодіоксино[2,3-а]піроло[3,4-с]карбазол-6,8-діон, 7-[2(диметиламшо)етил][1,4]бензодюксино[2,3е]тридо[2',3':5,6]-[1,4]oкcaзинo[3,2-g]iзoiндoл-6,8дioн. Енантіомери, діастереоізомери, N-оксиди і адитивні солі з фармацевтично прийнятною кислотою або основою переважних сполук утворюють невід'ємну частину вина ходу. Винахід відноситься також до способу одержання сполук формули (І), який відрізняється тим, що як вихідний матеріал використовують сполуку формули (II): 19 79997 20 сполуку формули (VII) обробляють сполукою формули (VIII): де Z1 і Ζ2 є такими ж, як визначено для формули (І), сполуку формули (II) піддають реакції з Nбромсукцинімідом у присутності бензоїл пероксиду, з тим, щоб одержати сполуку формули (III): де R1a являє собою атом водню або метальну груп у, з тим, щоб одержати сполуку формули (IX): де Ζ1 і Z 2 є такими ж, як визначено вище, сполуку формули (III) піддають реакції з йодидом натрію, з тим, щоб одержати сполуку формули (IV): де Ζ1 і Z 2 є такими ж, як визначено вище, сполуку формули (IV) піддають реакції з nбутиллітієм і потім з хлоридом триметилолова, з тим, щоб одержати сполуку формули (V): де PG, R1a, Ζ, Z1, Z 2 і W 1 є такими ж, як визначено вище, сполуку формули (IX) обробляють Nбромсукцинімідом і бензоїл пероксидом, з тим, щоб одержати сполуку формули (І/а), конкретний випадок сполук формули (І): де Z1 і Z 2 є такими ж, як визначено вище, сполуку формули (V): - або обробляють, у присутності тетракіс(трифенілфосфін)паладію(0), сполукою формули (VI): де PG являє собою амінозахисну гр упу, відому в органічному синтезі, і W1 і Ζ є такими ж, як визначено для формули (І), з тим, щоб одержати сполуку формули (VII): де PG, Z, Z1, Z2 i W1 є такими ж, як визначено вище, де PG, R1a, Ζ, Z1, Z 2 і W 1 є такими ж, як визначено вище, сполуку формули (І/а) необов'язково обробляють сполукою формули (X): R1b—NH2 (X) де R1b має те ж визначення, що і R 1 у формулі (І), але відрізняється від атома водню або метальної групи, з тим, щоб одержати сполуку формули (І/b), конкретний випадок сполук формули (І): 21 79997 22 - або опромінюють УФ лампою в присутності йоду в неполярному і апротонному розчиннику з тим, щоб одержати сполуки формул (I/d) і (І/е), конкретні випадки сполук формули (І): де R1b, Z, Z1, Z2 i W 1 є такими ж, як визначено вище, сполуки формул (І/а) і (І/b) яких складають сполуки формули (l/с): де R'4 являє собою атом водню або групу PG, і R1, Z, Z 1, Z2 i W1 є такими ж, як визначено вище, - або обробляють у присутності хлориду біс(трифенілфосфін)паладію(ll) сполукою формули (XI): де Вос, R1a, Z, Z1 , Z2 i W1 є такими ж, як визначено вище, сполуки формули (I/d): - необов'язково піддають зняттю захисту аміно функції відповідно до звичайних способів органічного синтезу з тим, щоб одержати сполуку формули (I/f), конкретний випадок сполук формули (І): де R1a, Z, Z1, Ζ2 і W 1 є такими ж, як визначено вище, - або необов'язково піддають дії сполуки формули (XIII): де R3a має те ж визначення, що і R 3 у формулі (І), але відрізняється від атома водню, і G є таким же, як визначено вище, з тим, щоб одержати сполуку формули (I/g), конкретний випадок сполук формули (І): де Вос являє собою трет-бутоксикарбонільну груп у і R1a , W 1 і Ζ є такими ж, як визначено вище, з тим, щоб одержати сполуку формули (XII): де Вос, R1a, R3a , Z, Z1 , Z2 і W1 є такими ж, як визначено вище, сполуки формул (I/d), (І/е) і (I/g) яких складають сполуку формули (I/h): де Вос, R1a, Ζ, Ζ1 , Ζ2 і W1 є такими ж, як визначено вище, сполуку формули (XII): 23 79997 24 де R1a, R4a , Z, Z1 , Z2 і W1 є такими ж, як визначено вище, сполуку формули (XVI) піддають тим же умовам реакції, що і сполуку формули (XII), з тим, щоб одержати сполуки формул (I/j) і (Ι/k), конкретні випадки сполук формули (І): де Вос, R1a, R3, Z, Z1, Z 2 і W1 є такими ж, як визначено вище, сполуку формули (I/h) необов'язково піддають тим же умовам реакції, що і сполуку формули (І/а), з тим, щоб одержати сполуку формули (І/і), конкретний випадок сполук формули (І): де R1a, R4a , Z, Z1 , Z2 і W1 є такими ж, як визначено вище, сполуку формули (Ι/k) необов'язково піддають дії сполуки формули (XIII), як визначено вище, з тим, щоб одержати сполуку формули (l/1): де R1b, R 3, Ζ, Ζ1 , Ζ 2 і W1 є такими ж, як визначено вище, - або піддають дії хлористоводневої кислоти, з тим, щоб одержати сполуку формули (XIV): де R1a, R3a, R4a, Z, Z 1, Z 2 i W1 є такими ж, як визначено вище, сполуки формул (I/j), (I/k) і (l/1) яких складають сполуки формули (І/m): де R1a, Z, Z1, Z2 i W 1 є такими ж, як визначено вище, сполуку формули (XIV) піддають дії сполуки формули (XV): де G являє собою відхідну груп у і R4a має те ж визначення, що і R4 у формулі (І), але відрізняється від атома водню з тим, щоб одержати сполуку формули (XVI): де R1a, R3, R4a , Z, Z1, Z2 і W 1 є такими ж, як визначено вище, сполуку формули (Ι/m) необов'язково піддають тим же умовам реакції, що і сполуку формули (I/h), з тим, щоб одержати сполуку формули (І/n): 25 79997 26 Сполуки формули (XI) можуть переважно бути одержані, починаючи зі сполуки формули (С): де R1b, R3, R4a , Ζ, Z1, Z2 і W 1 є такими ж, як визначено вище, сполуки формул (І/е), (I/h) і (І/і), (Ι/m) і (I/n) складають сполуки формули (І/о): де R1a є такими ж, як визначено вище, сполуку формули (С) обробляють, у присутності літій біс(триметилсиліл)аміду, сполукою формули (D): де W1 і Ζ є такими ж, як визначено вище, з тим, щоб одержати сполуку формули (Е): де R1, R3, R4, Ζ, Z1, Z2 і W1 є такими ж, як визначено вище, сполуки формул (І/а)-(І/о) яких складають сукупність сполук формули (І), які очищують, коли необхідно, відповідно до звичайної техніки очищення, які можуть, якщо бажано, бути розділені на їх різні ізомери відповідно до звичайної техніки розділення і, якщо бажано, перетворені у їх Nоксиди і, де придатно, в їх адитивні солі з фармацевтично прийнятною кислотою або основою. Сполуки формули (VI) можуть бути переважно одержані, починаючи зі сполуки формули (А): де Ζ і W1 є такими ж, як визначено вище, аміно функцію сполуки формули (А) захи щають захисною групою PG, відомою фахівцю, кваліфікованому в даній галузі, з тим, щоб одержати сполуку формули (В): де PG являє собою трет-бутоксикарбонільну або феноксикарбонільну групу і W1 і Ζ є такими ж, як визначено вище, сполуку формули (В) обробляють літій діізопропіламідом, з наступним дифеніл хлорфосфатом, з тим, щоб одержати сполуку формули (VI). де R1a, Z і W 1 є такими ж, як визначено вище, сполуку формули (Е) піддають реакції з дитрет-бутил дикарбонатом у присутності 4диметиламінопіридину, з тим, щоб одержати сполуку формули (XI). Сполуки формул (II), (VIII), (X), (XIV), (XVI), (А), (С) і (D) або є комерційними сполуками або їх одержують відповідно до звичайних способів органічного синтезу, добре відомих фахівцю, кваліфікованому в даній галузі. Сполуки формули (І) володіють цінними фармакологічними властивостями. Вони мають відмінну in vitro цитотоксичність не тільки на лініях лейкемії, але також на лініях солідних пухлин, і також мають дію на клітинний цикл і є активними in vivo на моделі лейкемії. Такі властивості дають їм можливість бути використаними терапевтично як протипухлинні агенти. Серед типів раку, які піддаються лікуванню сполуками за даним винаходом, можуть бути згадані наступні, без будь-якого обмеження, аденокарциноми і карциноми, саркоми, гліоми і лейкемії. Даний винахід відноситься також до фармацевтичних композицій, які включають продукти формули (І), їх енантіомери, діастереоізомери, Nоксиди або адитивну сіль з фармацевтично прийнятною основою або кислотою, самі або у поєднанні з одним або більше інертними, нетоксичними ексципієнтами або носіями. Серед фармацевтичних композицій відповідно до даного винаходу можуть бути згадані більш конкретно ті, які придатні для орального, паренте 27 79997 рального, назального, ректального, під'язикового, очного або респіраторного введення, і особливо таблетки або драже, під'язикові таблетки, саше, желатинові капсули, коржики, супозиторії, креми, мазі, шкірні гелі, ін'єктовані або придатні для пиття препарати, аерозолі, очні краплі або краплі для носа. Беручи до уваги фармакологічні властивості сполук формули (І), які є їх характеристикою, фармацевтичні композиції, які містять вказані сполуки формули (І) як активний інгредієнт, таким чином є особливо корисними у лікуванні різних типів раку. Корисне дозування змінюють відповідно до віку і ваги пацієнта, шля ху введення, природи терапевтичного показання і будь-яких пов'язаних лікувань і варіює від 0,1 до 400 мг на день за одне або більше введень. Наступні Приклади ілюструють винахід, але не обмежують його жодним чином. Вихідні матеріали, які залучаються, являють собою відомі продукти або продукти, одержані відповідно до відомих методик. Структури сполук, які описуються у Прикладах, були визначені відповідно до звичайної спектрофотометричної техніки (інфрачервоний, ядерний магнітний резонанс, мас-спектрометрія і т.д.). Приготування А: Бензо[1,4]діоксин-2іл(триметил)станан Стадія А: 2,3-Бибром-2,3-дигідро-1,4бензодіоксин В інертній атмосфері, 73,45ммол 1,4бензодіоксану, 150мл тетрахлориду вуглецю і потім 163,32ммол перекристалізованого Nбромсукциніміду і 88,1ммол бензоїл пероксиду змішують разом. Реакційну суміш нагрівають зі зворотним холодильником за допомогою лампи (60W) протягом 6 годин. Осаджений сукцинімід видаляють фільтруванням і фільтрат концентрують, дозволяючи виділити очікуваний продукт. Стадія В: Бензо[1,4]діоксин 73,45ммол сполуки, одержаної на попередній Стадії А, розчиняють в 125мл ацетону; розчин потім перемішують протягом 2 годин при нагріванні зі зворотним холодильником, у присутності йодиду натрію (359,9ммол). Після випарування розчинника, залишок розчиняють в суміші вода/етилацетат (100мл/200мл). Органічну фазу потім промивають 20% водним розчином тіосульфату натрію і потім водну фазу екстрагують двічі етилацетатом. Органічні фази об'єднують, сушать над сульфатом магнію і потім концентрують досуха. Очищення хроматографією на силікагелі (нафтовий ефір/етилацетат: 95/5) дозволяє одержати очікуваний продукт. ІЧ (плівка NaCL): n (C=C енольний ефір)=1665см -1; n (C=C Аr)=1590см -1. Стадія С: Бензо[1,4]діоксин-2іл(триметил)станан 14,91ммол 1,4-бензодіоксину розчиняють в 18мл безводного тетрагідрофурану в безводній атмосфері, і температуру розчину знижують до 78°С. 23,86ммол 1,5Μ розчину n-бутиллітію в гексані додають краплями до реакційної суміші, яку перемішують при -78°С протягом 2 годин 15 хвилин. 37,28ммол хлориду триметилолова, розчине 28 ного в 10мл безводного тетрагідрофурану, додають краплями і реакційну суміш перемішують при 78°С протягом 45 хвилин і потім повертають до температури навколишнього середовища протягом 15 годин. Реакційну суміш гідролізують 15% водним розчином фториду калію і перемішують протягом 45 хвилин. Осаджені солі олова видаляють фільтруванням, і водну фазу екстрагують 3 рази етилацетатом. Органічні фази об'єднують і концентрують. Очи щення флеш-хроматографією на силікагелі (нафтовий ефір/етилацетат: 95/5) дозволяє одержати очікуваний продукт. ІЧ (плівка NaCO: n (C=C енольний ефір)=1639см -1; n (C=C Аr)=1592см -1. Приготування В: Нафто[2,3-b][1,4]діоксин-2іл(трибутил)станан Стадія А: Етил 2,3-дигідронафто[2,3b][1,4]діоксин-2-карбоксилат В інертній атмосфері, 47,03ммол сухого карбонату калію додають до розчину 62,43ммол 2,3дигідроксинафталену в 150мл безводного ацетону. Реакційну суміш нагрівають зі зворотним холодильником, після додавання 17,2ммол етил 2,3дибромпропаноату. Через 15 хвилин 47,03ммол сухого карбонату калію, і також 17,2ммол етил 2,3дибромпропаноату знову додають до реакційної суміші. Цю дію повторюють ще двічі, з 15хвилинними проміжками. Нагрівання зі зворотним холодильником підтримують протягом 18 годин. Реакційну суміш потім фільтрують і залишок промивають ацетоном. Фільтрат концентрують і потім додають в етилацетат і промивають 100мл води. Водну фазу екстрагують тричі етилацетатом і потім органічні фази об'єднують, сушать над сульфатом магнію, фільтрують і випаровують під зниженим тиском. Очищення флеш-хроматографією на силікагелі (нафтовий ефір/етилацетат: 9/1) дозволяє виділити очікуваний продукт. ІЧ (плівка NaCl): n C=O=1759см-1. Мас-спектр: 259 [Μ+1]+. Стадія В: Етил нафто[2,3-b][1,4]діоксин-2карбоксилат В інертній атмосфері, розчин 25,94ммол сполуки, одержаної на попередній Стадії А, в 120мл тетрахлорид вуглецю нагрівають зі зворотним холодильником за допомогою лампи (60W) у присутності 57,03ммол перекристалізованого Nбромсукциніміду і каталітичної кількості бензоїл пероксиду. Перемішування підтримують при нагріванні зі зворотним холодильником протягом 2 годин 30 хвилин. Після охолодження, вивільнений сукцинімід фільтрують і фільтрат концентрують досуха у вакуумі. Дибромований ефір, який одержують, розчиняють в 100мл ацетону, і потім додають 129,62ммол йодиду натрію. Перемішування підтримують при температурі навколишнього середовища протягом 4 годин. Після випарування розчинника, залишок додають в суміш водна/етилацетат і промивають 1М водним розчином тіосульфату натрію. Органічну фаза сушать над сульфатом магнію, фільтрують і випаровують. Очищення флеш-хроматографією на силікагелі (нафтовий ефір/етилацетат: 9/1) дозволяє виділити очікуваний продукт. Точка плавлення: 98°С. 29 79997 ІЧ (KВr): n C=O=1724см -1; n C=C=1682см-1. Мас-спектр: 257 [Μ+1]+. Стадія С: Нафто[2,3-b][1,4]діоксин-2карбоциклічна кислота Розчин 24,58ммол сполуки, одержаної на попередній Стадії В, в 25мл метанолу, нагрівають зі зворотним холодильником протягом однієї години, у присутності 20мл 1М водного розчину гідроксиду літію. Після охолодження і випарування метанолу реакційну суміш окислюють 1М водним розчином хлористоводневої кислоти доти, доки не одержать рН=1. Утворений осад відфільтровують, дозволяючи виділити очікуваний продукт. Точка плавлення: >360°С. ІЧ (KВr): n C=O=1678см -1; n C=C=1661см -1; -1 n OH=3450см . Мас-спектр: 229 [Μ+1]+. Стадія D: Нафто[2,3-b][1,4]діоксин Розчин 0,66ммол сполуки, одержаної на попередній Стадії С, в 1мл хіноліну, нагрівають при 220°С протягом 3 годин, у присутності каталітичної кількості порошкоподібної міді. Після охолодження залишок додають в етилацетат і промивають 1М водним розчином хлористоводневої кислоти. Органічну фазу сушать над суль фатом магнію, фільтрують і концентрують. Очищення флешхроматографією на силікагелі (нафтовий ефір/етилацетат: 9/1) дозволяє одержати очікуваний продукт. Точка плавлення: 96-98°С. ІЧ (KВr): n C=C=1665см-1; n C-O=1296см-1. Стадія Е: Нафто[2,3-b][1,4]діоксин-2іл(трибутил)станан Очікуваний продукт одержують відповідно до методики, описаної на Стадії С Приготування, виходячи зі сполуки попередньої Стадії D і трибутилтіну хлориду. ІЧ (плівка NaCl): n C-O=1166, 1247см -1. Мас-спектр: 473 [Μ+1]+. Приготування С: Феніл 3[(дифеноксифосфорил)окси]-4Н-1,4-бензоксазин4-карбоксилат Стадія А: Феніл 2,3-дигідро-4Н-1,4бензоксазин-3-он-4-карбоксилат В безводній атмосфері, розчин 10ммол 2Н-1,4бензоксазин-3-ону в 50мл тетрагідрофурану о холоджують до -78°С. При цій температурі 11ммол 1,6Μ розчину n-бутиллітію в гексані додають краплями. Після взаємодії протягом 30 хвилин при 78°С 11ммол феніл хлорформіфату додають краплями і перемішування проводять протягом наступних 2 годин. Після повернення до температури навколишнього середовища розчин гідролізують і потім екстрагують етилацетатом. Органічну фазу сушать над сульфатом магнію, фільтрують і випаровують. Після очищення хроматографією на силікагелі (нафтовий ефір/етилацетат: 8/2), виділяють очікуваний продукт. ІЧ (плівка NaCl): n C=O=1739, 1796см -1. Мас-спектр: 270 (Μ+1). Стадія В: Феніл 3[(дифеноксифосфорил)окси]-4Н-1,4-бензоксазин4-карбоксилат В безводній атмосфері, розчин 10ммол продукту, який одержують на попередній Стадії А, в 30 50мл безводного ТГФ, охолоджують до -78°С. При цій температурі 12ммол 2М LDA (у розчині гептан/ТГФ) додають краплями. Після перемішування протягом 2 годин, 12ммол дифеніл хлорфосфату додають краплями до реакційної суміші, яку підтримують протягом наступних 2 годин при -78°С. Після повернення до температури навколишнього середовища розчин гідролізують і потім екстрагують етилацетатом. Органічну фаз у суша ть над сульфатом магнію, фільтрують і концентрують. Після очищення залишку хроматографією на силікагелі (нафтовий ефір/етилацетат: 9/1) виділяють очікуваний продукт. ІЧ (плівка NaCl): n C=O=1748см-1; n P=O=1315см -1 Мас-спектр: 502 (Μ+1). Приготування D: Феніл 3[(дифеноксифосфрил)окси]-2,3-дигідро-4Н-піридо[3,2-b][1,4]оксазин-4-карбоксилат Стадія А: Феніл 2,3-дигідро-4Н-піридо[3,2b][1,4]оксазин-4-карбоксилат Очікуваний продукт одержують відповідно до методики, описаної на Стадії А Приготування С, використовуючи феніл хлор форміфат як субстрат. Точка плавлення: 97°С. ІЧ (KBr): n C=O=1717см -1; 1803см -1. Мас-спектр: m/z 271 (Μ+1). Стадія В: Феніл 3[(дифеноксифосфорил)окси]-2,3-дигідро-4Нпіридо[3,2-b][1,4]оксазин-4-карбоксилат Очікуваний продукт одержують відповідно до методики, описаної на Стадії В Приготування С, виходячи зі сполуки попередньої Стадії. Точка плавлення: 82°С. ІЧ (KBr): n C=O=1749см -1; n P=O=1294см-1. Мас-спектр: m/z 503 (Μ+1). Приготування Ε: 3-Бром-4-(1Н-1-карбоксилат трет-бутил-індол-3-іл)-1-метил-1Н-пірол-2,5-діону Стадія А: 3-Бром-4-(1Н-індол-3-іл)-1-метил-1Нпірол-2,5-діон 11,16ммол індол розчиняють у 29мл безводного тетрагідрофурану в інертній атмосфері. Температур у реакційної суміші знижують до -15°С, і потім 17,85ммол 1М розчину біс(триметилсиліл)літію в гексані додають краплями. Після перемішування при -15°С протягом 1 години 10 хвилин 7,44ммол 2,3-дибром-N-метил-малеіміду, розчиненого в 8мл безводного тетрагідрофурану додають до реакційної суміші, яку потім перемішують протягом 20 хвилин при -15°С і протягом 15 хвилин при від 15°С до температури навколишнього середовища. Реакційну суміш гідролізують декількома мілілітрами 0,3N водного розчину хлористоводневої кислоти, доки не одержують рН близько 7. Потім додають декілька мілілітрів етилацетату і водну фазу екстрагують чотири рази етилацетатом. Органічні фази об'єднують, промивають насиченим водним розчином хлориду натрію і потім випаровують. Залишок промивають, фільтрують і полощуть метанолом, дозволяючи виділити очікуваний продукт. Точка плавлення: 167°С (розкладання). ІЧ (KBr): n C=O=1715, 1767см-1; n NH=3304см -1. Мас-спектр: 305 [Μ+1]+. Стадія В: 3-Бром-4-(1Н-1-карбоксилат третбутил-індол-3-іл)-1-метил-1Н-пірол-2,5-діону 31 79997 8,19ммол сполуки, одержаної на попередній Стадії А, розчиняють, при 0°С, в 37,5мл безводного тетрагідрофурану, у присутності 28,68ммол дитрет-бутил дикарбонату і 614,5mмол 4диметиламінопіридину. Реакційну суміш доводять до температури навколишнього середовища і перемішують протягом 2 годин 30 хвилин. Після випарування розчинника, одержаний залишок додають в метанол, фільтрують, полощуть метанолом і потім сушать у вакуумі, дозволяючи виділити очікуваний продукт. Точка плавлення: 142°С. ІЧ (KBr): n C=O=1762см -1. Мас-спектр: 405 [Μ+1]+. Приготування F: 3-Бром-4-(1Н-індол-3-іл)-1Нпірол-2,5-діон 15,69ммол індолу розчиняють в 25мл безводного тетрагідрофурану в інертній атмосфері. Додають 15,69ммол 3М розчину етилмагній броміду в діетиловому ефірі і реакційну суміш нагрівають при 60°С протягом 1 години 30 хвилин. Як тільки вона охолодилась, суміш додають краплями до розчину 3,92ммол 2,3-диброммалеіміду в 6мл безводного тетрагідрофурану і потім реакційну суміш перемішують при температурі навколишнього середовища протягом однієї години. Реакційну суміш гідролізують, використовуючи 20мл 0,3N водного розчину хлористоводневої кислоти доти, доки не одержують рН 8,5, і додають декілька мілілітрів етилацетату. Водну фазу екстрагують тричі етилацетатом; органічні фази потім об'єднують, промивають насиченим водним розчином хлориду натрію і потім випаровують досуха у вакуумі. Залишок промивають, фільтрують і полощуть метанолом, дозволяючи виділити очікуваний продукт. Точка плавлення: >300°С. ІЧ (KBr): n C=O=1772см -1; n NH=3343, 3699см -1. Мас-спектр: 291 [Μ+1]+. Приготування G: 3-Бром-4-(5-фтор-1Н-індол-3іл)-1-метил-1Н-пірол-2,5-діон Очікуваний продукт одержують відповідно до методики, описаної на Стадії А Приготування Е, використовуючи 5-фторіндол. Точка плавлення: >300°С. ІЧ (KBr): n C=O=1705см -1; n NH=3358см -1. Мас-спектр: 323 [Μ+1]+. Приготування Η: 3-Бром-4-(6-фтор-1Н-індол-3іл)-1-метил-1Н-пірол-2,5-діон Очікуваний продукт одержують відповідно до методики, описаної на Стадії А Приготування Е, використовуючи 6-фторіндол. Точка плавлення: 201°С. ІЧ (KBr): n C=O=1701, 1767см-1; n NH=3312см -1. Мас-спектр: 323 [Μ+1]+. Приготування І: 3-Бром-4-(5-фтор-1Н-індол-3іл)-1Н-пірол-2,5-діон Очікуваний продукт одержують відповідно до методики, описаної у Приготуванні F, використовуючи 5-фторіндол. Точка плавлення: 219°С (розкладання). ІЧ (KBr): n C=O=1723, 1769см-1; n NH=3358см -1. Мас-спектр: 309,5 [Μ+1]+. Приготування J: 3-Бром-4-(6-фтор-1Н-індол-3іл)-1Н-пірол-2,5-діон 32 Очікуваний продукт одержують відповідно до методики, описаної у Приготуванні F, використовуючи 6-фторіндол. Точка плавлення: 199°С (розкладання). ІЧ (KBr): n C=O=1723, 1778см-1; n NH=3329см -1. Мас-спектр: 309 [Μ+1]+. Приготування K: трет-Бутил 5-(бензилокси)-3(4-бром-1-метил-2,5-діоксо-2,5-дигідро-1Н-пірол-3іл)-1Н-індол-1-карбоксилат Стадія А: 3-[5-(Бензилокси)-1Н-індол-3-іл]-4бром-1-метил-1Н-пірол-2,5-діон Очікуваний продукт одержують відповідно до методики, описаної на Стадії А Приготування Е, використовуючи 5-бензилоксііндол. Точка плавлення: 150°С (розкладання). ІЧ (KBr): n C=O=1698см -1; n NH=3315см -1. Мас-спектр: 411 [Μ+1]+. Стадія В: трет-Бутил 5-(бензилокси)-3-(4-бром1-метил-2,5-діоксо-2,5-дигідро-1Н-пірол-3-іл)-1Ніндол-1-карбоксилат Очікуваний продукт одержують відповідно до методики, описаної на Стадії В Приготування Е, виходячи зі сполуки попередньої Стадії А. Точка плавлення: 155°С. ІЧ (KBr): n C=O=1709, 1738, 1773см -1. Мас-спектр: 511 [Μ+1]+. Приготування L: трет-Бутил 6-(бензилокси)-3(4-бром-1-метил-2,5-діоксо-23-дигідро-1Н-пірол-3іл)-1Н-індол-1-карбоксилат Стадія А: 3-[6-(Бензилокси)-1Н-індол-3-іл]-4бром-1-метил-1Н-пірол-2,5-діон Очікуваний продукт одержують відповідно до методики, описаної на Стадії А Приготування Е, використовуючи 6-бензилоксііндол. Точка плавлення: 138°С (розкладання). ІЧ (KBr): n C=O=1705, 1762см-1; n NH=3314см -1. Мас-спектр: 411 [Μ+1]+. Стадія В: трет-Бутил 6-(бензилокси)-3-(4-бром1-метил-2,5-діоксо-2,5-дигідро-1Н-пірол-3-іл)-1Ніндол-1-карбоксилат Очікуваний продукт одержують відповідно до методики, описаної на Стадії В Приготування Е, виходячи зі сполуки попередньої Стадії А. Точка плавлення: 158°С (розкладання). ІЧ (KBr): n C=O=1715, 1737, 1745см -1. Мас-спектр: 511 [Μ+1]+. Приготування М: трет-Бутил 5-(бензилокси)-3[4-бром-1-(трет-бутоксикарбоніл)-2,5-діоксо-2,5дигідро-1Н-пірол-3-іл]-1Н-індол-1-карбоксилат Стадія А: 3-[5-(Бензилокси)-1Н-індол-3-іл]-4бром-1Н-пірол-2,5-діон Очікуваний продукт одержують відповідно до методики, описаної у Приготуванні F, використовуючи 5-бензилоксііндол. Точка плавлення: 154°С (розкладання). ІЧ (KBr): n C=O=1697см -1; n NH=3333см -1. Мас-спектр: 397 [Μ+1]+. Стадія В: трет-Бутил 5-(бензилокси)-3-[4-бром1-(трет-бутоксикарбоніл)-2,5-діоксо-2,5-дигідро-1Нпірол-3-іл]-1Н-індол-1-карбоксилат Очікуваний продукт одержують відповідно до методики, описаної на Стадії В Приготування Е, виходячи зі сполуки попередньої Стадії А. Точка плавлення: 134°С. ІЧ (KBr): n C=O=1743, 1768, 1801см -1. 33 79997 Мас-спектр: 495 [М-Вос]+. Приготування Ν: трет-Бутил 6-(бензилокси)-3[4-бром-1-(трет-бутоксикарбоніл)-2,5-діоксо-2,5дигідро-1Н-пірол-3-іл]-1Н-індол-1-карбоксилат Стадія А: 3-[6-(Бензилокси)-1Н-індол-3-іл]-4бром-1Н-пірол-2,5-діон Очікуваний продукт одержують відповідно до методики, описаної у Приготуванні F, використовуючи 6-бензилоксііндол. Точка плавлення: 166°С (розкладання). ІЧ (KBr): n C=O=1697, 1762см-1; n NH=3353см -1. Мас-спектр: 397 [Μ+1]+. Стадія В: трет-Бутил 6-(бензилокси)-3-[4-бром1-(трет-бутоксикарбоніл)-2,5-діоксо-2,5-дигідро-1Нпірол-3-іл]-1Н-індол-1-карбоксилат Очікуваний продукт одержують відповідно до методики, описаної на Стадії В Приготування Е, виходячи зі сполуки попередньої Стадії А. Точка плавлення: 120°С. ІЧ (KBr): n C=O=1719, 1744, 1764, 1807см -1. Приготування О: трет-Бутил 7(бензгідрилокси)-3-(4-бром-1-метил-2,5-діоксо-2,5дигідро-1Н-пірол-3-іл)-1Н-індол-1-карбоксилат Стадія А: 1-(Бензгідрилокси)-2-нітробензол До розчину сухого орто-нітрофенолу (79ммол) в 200мл ацетону додають 127ммол карбонату калію і також 79ммол дифенілметан броміду. Реакційну суміш нагрівають зі зворотним холодильником протягом 6 годин і, після того, як температура була знижена до температури навколишнього середовища, перемішують надалі протягом ночі. Реакційну суміш фільтрують і полощуть ацетоном. Фільтрат випаровують і потім додають в діетиловий ефір і гідролізують. Водну фазу екстрагують діетиловим ефіром; органічну фазу потім сушать над сульфатом магнію, фільтрують і концентрують. Одержаний залишок додають в нафтовий ефір, фільтрують, полощуть нафтовим ефіром і потім сушать у вакуумі, дозволяючи виділити очікуваний продукт. Точка плавлення: 98°С. Мас-спектр: 323 [М+NH4+]+. Стадія В: 7-(Бензгідрилокси)-1Н-індол 11,95ммол сполуки, одержаної на попередній Стадії А, розчиняють, в інертній атмосфері, в 80мл безводного тетрагідрофурану. Температуру реакційної суміші потім знижують до -40°С і потім 41,84ммол ЇМ розчину вінілмагній броміду в тетрагідрофурані додають краплями до розчину, який потім перемішують протягом 2 годин 50 хвилин при від -40°С до 0°С. Реакційну суміш потім гідролізують при 0°С, використовуючи 100мл насиченого водного розчину хлориду амонію, і водну фазу екстрагують тричі етилацетатом. Органічні фази об'єднують, сушать над сульфатом магнію, фільтрують і випаровують. Очи щення флешхроматографією на силікагелі (нафтовий ефір/етилацетат: 9/1) дозволяє виділити очікуваний продукт. Точка плавлення: 114°С (розкладання). ІЧ (KBr): n NH=3425см -1. Мас-спектр: 300 [М+1]+. Стадія С: 3-[7-(Бензгідрилокси)-1Н-індол-3-іл]4-бром-1-метил-1Н-пірол-2,5-діон 34 Очікуваний продукт одержують відповідно до методики, описаної на Стадії А Приготування Е, використовуючи сполук у ви щезазначеної Стадії В. Точка плавлення: 205°С. ІЧ (KBr): n C=O=1699, 1763см-1; n NH=3345см -1. Мас-спектр: 487 [Μ+1]+. Стадія D: трет-Бутил 7-(бензгідрилокси)-3-(4бром-1-метил-2,5-діоксо-2,5-дигідро-1Н-пірол-3-іл)1Н-індол-1-карбоксилат Очікуваний продукт одержують відповідно до методики, описаної на Стадії В Приготування Е, виходячи зі сполуки попередньої Стадії С Точка плавлення: 148°С (розкладання). ІЧ (KBr): n C=O=1709, 1759см-1. Мас-спектр: 587 [Μ+1]+. Приклад 1: Феніл 7-Метил-6,8-діоксо-7,8дигідро[1,4]бензодіоксино[2,3-а]-піроло[3,4с]феноксазин-15(6Н)карбоксилат Стадія А: Феніл 3-(1,4-бензодіоксин-2-іл)-4Н1,4-бензоксазин-4-карбоксилат В інертній атмосфері, суміш 1ммол сполуки Приготування С, 2ммол сполуки Приготування, 3ммол хлориду літію і тетракіс(трифенілфосфін)паладію(0) 5% в 5мл тетрагідрофурані нагрівають зі зворотним холодильником. Після охолодження і концентрування залишок додають в етилацетат і промивають насиченим розчином хлориду натрію. Органічну фазу сушать над сульфатом магнію, фільтрують і концентрують. Очищення хроматографією на силікагелі (нафтовий ефір/етилацетат: 6/4) дозволяє виділити очікуваний продукт. Точка плавлення: 75°С (смола). ІЧ (KBr): n C=O=1739см -1. Мас-спектр: 386 [М+1]+. Стадія В: Феніл 7-Метил-6,8-діоксо5b,6,7,8,8а,8b-гексагідро[1,4]бензо-діоксино[2,3а]піроло[3,4-с]феноксазин-15(5аН)-карбоксилат У закритій системі, 1ммол сполуки, одержаної на попередній Стадії А, і 3ммол N-метилмалеіміду перемішують при 95°С протягом 2 годин у присутності декількох крапель толуолу. Очищення хроматографією на силікагелі (нафтовий ефір/етилацетат: 3/7) дозволяє одержати очікуваний продукт. Точка плавлення: >250°С. ІЧ (KBr): n C=O=1709, 1769см-1. Мас-спектр: 497 [Μ+1]+. Стадія С: Феніл 7-Метил-6,8-діоксо-7,8дигідро[1,4]бензодіоксино[2,3-а]-піроло[3,4с]феноксазин-15(6Н)-карбоксилат В інертній атмосфері, 1ммол сполуки, одержаної на попередній Стадії В, і 3ммол перекристалізованого N-бромсукциніміду нагрівають в дистильованому тетрахлориді вуглецю при нагріванні зі зворотним холодильником протягом 7 хвилин за допомогою лампи (60W), у присутності каталітичної кількості бензоїл пероксиду. Після охолодження, розчин фільтрують і концентрують. Очи щення хроматографією на силікагелі (нафтовий ефір/етилацетат: 1/1) дозволяє одержати очікуваний продукт. Точка плавлення: 130°С (смола). ІЧ (KBr): n C=O=1714, 1745см-1. Мас-спектр: 493 [Μ+1]+. 35 79997 Приклад 2: 7-[2(Диметиламіно)етил][1,4]бензодіоксино[2,3а]піроло[3,4-с]-феноксазин-6,8(7Н,15Н)-діон] В інертній атмосфері, 0,1ммол сполуки Прикладу 1 в 2мл Ν,Ν-диметилетилендіаміну нагрівають при 100°С протягом 6 годин. Після охолодження, розчин концентрують. Очи щення хроматографією на силікагелі (дихлорметан/метанол: 8/2) дозволяє одержати очікуваний продукт. Точка плавлення: 150°С. ІЧ (KBr): n C=O=1701, 1751см-1; n NH=3423см -1. Мас-спектр: 430 [Μ+1]+. Приклад 3: Феніл 7-метил-6,8-діоксо-7,8дигідро[1,4]бензодіоксино[2,3-е]піридо[2',3':5,6][1,4]оксазино[3,2-g]ізоіндол-15(6Н)карбоксилат Стадія А: Феніл 3-(1,4-бензодіоксин-2-іл)-4Нпіридо[3,2-b][1,4]оксазин-4-карбоксилат Очікуваний продукт одержують відповідно до методики, описаної на Стадії А Прикладу 1, починаючи зі сполуки Приготування D. Точка плавлення: 142°С. ІЧ (KBr): n C=O=1741см -1. Мас-спектр: 387 [М+1]+. Стадія В: Феніл 7-Метил-6,8-діоксо5b,6,7,8,8а,8b-гексагідро[1,4]-бензодіоксино[2,3е]піридо[2',3':5,6][1,4]оксазин[3,2-g]ізоіндол15(5аН)-карбоксилат Очікуваний продукт одержують відповідно до методики, описаної на Стадії В Прикладу 1, виходячи зі сполуки попередньої Стадії А. Точка плавлення: 245°С. ІЧ (KBr): n C=O=1709, 1769см-1. Мас-спектр: 498 [М+1]+. Стадія С: Феніл 7-Метил-6,8-діоксо-7,8дигідро[1,4]бензодіоксино[2,3-е]піридо[2',3':5,6][1,4]оксазино[3,2-g]ізоіндол-15(6Н)карбоксилат Очікуваний продукт одержують відповідно до методики, описаної на Стадії С Прикладу 1, починаючи зі сполуки, одержаної на попередній Стадії В. Точка плавлення: >250°С. ІЧ (KBr): n C=O=1711, 1760см-1. Мас-спектр: 494 [Μ+1]+. Приклад 4: 7-[2(Диметиламіно)етил][1,4]бензодіоксино[2,3е]піридо-[2',3':5,6][1,4]оксазино[3,2-g]ізоіндол6,8(7Н,15Н)-діон Очікуваний продукт одержують відповідно до методики Прикладу 2, починаючи зі сполуки Прикладу 3. Точка плавлення: 150°С (розкладання). ІЧ (KBr): n C=O=1703, 1759см-1; n NH=3433см -1. Мас-спектр: 431 [Μ+1]+. Приклад 5: трет-Бутил 7-метил-6,8-діоксо-7,8дигідро[1,4]бензодіоксино-[2,3-а]піроло[3,4с]карбазол-13(6Н)-карбоксилат Стадія А: трет-Бутил 3-[4-(1,4-бензодіоксин-2іл)-1-метил-2,5-діоксо-2,5-дигідро-1Н-пірол-3-іл]1Н-індол-1-карбоксилат До розчину 592,23mмол сполуки Приготування А у 10мл 1,4-діоксану додають 493,52mмол сполуки Приготування Е, 49,35mмол йодид міді і 36 49,35mмол тетракси(трифенілфосфін)паладію. Реакційну суміш нагрівають при 100°С протягом 3 годин 35 хвилин, в інертній атмосфері. Розчин потім фільтрують для того, щоб видалити залишки паладію і фільтрат випаровують. Очищення флешхроматографією на силікагелі (нафтовий ефір/етилацетат/триетиламін: 8/1,9/0,1) дозволяє одержати очікуваний продукт. Точка плавлення: 140°С. ІЧ (KBr): n C=O=1704, 1740см-1. Мас-спектр: 459 [Μ+1]+. Стадія В: трет-Бутил 7-метил-6,8-діоксо-7,8дигідро[1,4]бензодіоксино[2,3-а]-піроло[3,4с]карбазол-13(6Н)-карбоксилат 218,1mмол сполуки, одержаної на попередній Стадії А, і 5,91ммол двічі-очищеного йоду розчиняють в 500мл толуолу всередині комірки апаратуопромінювача. Після опромінювання протягом 30 хвилин, з перемішуванням, реакційну суміш о холоджують і потім розбавляють етилацетатом. Промивання 80мл 20% водного розчину тіосульфату натрію проводять доти, доки органічна фаза не знебарвиться. Водну фазу екстрагують етилацетатом тричі і потім органічні фази об'єднують і безпосередньо концентрують у вакуумі. Збирають коричневий, напівмаслянистий, напівтвердий залишок. Процедуру повторюють надалі п'ять разів таким же чином, використовуючи ті ж кількості. Сирі продукти реакції шести процедур об'єднують. Промивання етилацетатом проводять на шести сирих продуктах реакції, які потім фільтрують. Фільтрат випаровують і потім додають в метанол, фільтрують, полощуть метанол і потім сушать у вакуумі, дозволяючи виділити очікуваний продукт. Точка плавлення: 189°С (розкладання). Мас-спектр: 457 [М+1]+. Приклад 6: 7-Метил[1,4]бензодіоксино[2,3а]піроло[3,4-с]карбазол-6,8-(7Н,13Н)-діон Стадія А: 3-(1,4-Бензодіоксин-2-іл)-4-(1Ніндол-3-іл)-1-метил-1Н-пірол-2,5-діон 331,54mмол сполуки Стадії Прикладу 5 розчиняють в 9мл мурашиної кислоти. Реакційну суміш перемішують в інертній атмосфері і при температурі навколишнього середовища протягом 3 годин 30 хвилин. Розчинник видаляють під зниженим тиском; залишок потім промивають, фільтрують і полощуть метанолом і потім сушать у вакуумі, дозволяючи виділити очікуваний продукт. Точка плавлення: 219°С. ІЧ (KBr): n C=O=1697см -1. Мас-спектр: 359,5 [Μ+1]+. Стадія В: 7-Метил[1,4]бензодіоксино[2,3а]піроло[3,4-с]карбазол-6,8(7Н,13Н)-діон 418,5mмол сполуки, одержаної на попередній Стадії А, розчиняють в 50мл толуолу в реакторі опромінювання і потім 5,91ммол двічі-очищеного йоду вміщують в реакційну суміш. Опромінювання проводять при 500W протягом 1 години 10 хвилин. Реакційну суміш потім розбавляють етилацетатом, після чого її промивають 80мл 20% водного розчину тіосульфату натрію доти, доки органічна фаза не знебарвиться. Водну фазу екстрагують тричі етилацетатом; органічні фази потім об'єднують і безпосередньо концентрують. Твердий залишок, який одержують, спочатку промивають діетиловим 37 79997 ефіром і потім фільтрують. Потім його промивають етилацетатом і потім тетрагідрофураном і фільтрують. Очи щення флеш-хроматографією на силікагелі (нафтовий ефір/етилацетат: 6/4) дозволяє одержати очікуваний продукт. Точка плавлення: >355°С. ІЧ (KBr): n C=O=1692,1703см -1; n NH=3343см -1. Мас-спектр: 357 [Μ+1]+. Приклад 7: 7-[2(Диметиламіно)етил][1,4]бензодіоксино[2,3а]піроло[3,4-с]-карбазол-6,8(7Н,13Н)-діон 238,5mмoл сполуки Прикладу 6 розчиняють в 4мл Ν,Ν-диметилетилендіаміну. Реакційну суміш нагрівають зі зворотним холодильником протягом 16 годин і її потім охолоджують і концентрують. Залишок, який одержують, промивають, фільтрують і полощуть метанолом перед сушінням у вакуумі, дозволяючи виділити очікуваний продукт. Точка плавлення: 298°С (розкладання). ІЧ (KBr): n C=O=1692, 1703см-1; n NH=3441см -1. Мас-спектр: 414 [Μ+1]+. Приклад 8: 7,13Диметил[1,4]бензодіоксино[2,3-а]піроло[3,4с]карбазоло-6,8-(7Н,13Н)-діон Стадія А: 3-(1,4-Бензодіоксин-2-іл)-1-метил-4(1-метил-1Н-індол-3-іл)-1Н-пірол-2,5-діон 69,76mмол сполуки, одержаної на Стадії А Прикладу 6, 111,62mмол гідроксиду натрію, 7,46mмoл хлориду бензилтриетиламіною і 418,58ммол метил йодиду розчиняють в 0,5мл дихлорметану. Реакційну суміш перемішують при температурі навколишнього середовища протягом 1 години 45 хвилин і тоді розчинник видаляють у вакуумі. Очи щення флеш-хроматографією на силікагелі (від нафтовий ефір/етилацетат: 7/3 до етилацетату) дозволяє одержати очікуваний продукт. Точка плавлення: 204°С (розкладання). ІЧ (KBr): n C=O=1697см -1. Мас-спектр: 373 [Μ+1]+. Стадія В: 7,13-Диметил[1,4]бензодіоксино[2,3а]піроло[3,4-с]карбазол-6,8-(7Н,13Н)-діон Очікуваний продукт одержують відповідно до методики, описаної на Стадії В Прикладу 5, починаючи зі сполуки, одержаної на попередній Стадії А. Приклад 9: 13-Етил-7метил[1,4]бензодіоксино[2,3-а]піроло[3,4с]карбазол-6,8(7Н,13Н)-діон Стадія А: 3-(1,4-Бензодіоксин-2-іл)-4-(1-етил1Н-індол-3-іл)-1-метил-1Н-пірол-2,5-діон Очікуваний продукт одержують відповідно до методики, описаної на Стадії А Прикладу 8, починаючи зі сполуки, одержаної на Стадії А Прикладу 6, і замінюючи метил йодид на етил йодид. Стадія В: 13-Етил-7метил[1,4]бензодіоксино[2,3-а]піроло[3,4с]карбазол-6,8(7Н,13Н)діон Очікуваний продукт одержують відповідно до методики, описаної на Стадії В Прикладу 6, починаючи зі сполуки, одержаної на попередній Стадії А. Приклад 10: Нафто[2',3':5,6][1,4]діоксино[2,3а]піроло[3,4-с]карбазол-5,7-(6Н,16Н)-діон Стадія А: 3-(1Н-Індол-3-іл)-4-нафто[2,3b][1,4]діоксин-2-іл-1Н-пірол-2,5-діон 38 Очікуваний продукт одержують відповідно до методики, описаної на Стадії А Прикладу 5, починаючи зі сполук Приготувань В і F. Точка плавлення: 261°С. ІЧ (KBr): n C=O=1759см -1; n NH=3171, 3398см -1. Мас-спектр: 395 [Μ+1]+. Стадія В: Нафто[2',3':5,6][1,4]діоксино[2,3а]піроло[3,4-с]карбазол-5,7(6Н,16Н)-діон Очікуваний продукт одержують відповідно до методики, описаної на Стадії В Прикладу 6, починаючи зі сполуки, одержаної на попередній Стадії. Приклад 11: 10-Фтор-7метил[1,4]бензодіоксино[2,3-а]піроло[3,4-с]карбазол-6,8(7Н,13Н)-діон Стадія А: 3-(1,4-Бензодіоксин-2-іл)-4-(5-фтор1Н-індол-3-іл)-1-метил-1Н-пірол-2,5-діон Очікуваний продукт одержують відповідно до методики, описаної на Стадії А Прикладу 5, починаючи зі сполуки Приготування G. Точка плавлення: 229°С. ІЧ (KBr): n C=O=1698см -1; n NH=3380см -1. Мас-спектр: 377 [Μ+1]+. Стадія В: 10-фтор-7метил[1,4]бензодіоксино[2,3-а]піроло[3,4с]карбазол-6,8(7Н,13Н)-діон Очікуваний продукт одержують відповідно до методики, описаної на Стадії В Прикладу 6, починаючи зі сполуки, одержаної на попередній Стадії А. Точка плавлення: >355°С. ІЧ (KBr): n C=O=1699, 1753см-1; n NH=3339см -1. Мас-спектр: 375 [Μ+1]+. Приклад 12: 7-[2-(Диметиламіно)етил]-10фтор[1,4]бензодіоксино[2,3-а]-піроло[3,4с]карбазол-4,8(7Н,13Н)-діон Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 7, починаючи зі сполуки Прикладу 11. Точка плавлення: 337°С (розкладання). ІЧ (KBr): n C=O=1701, 1755см-1; n NH=3447см -1. Мас-спектр: 432 [Μ+1]+. Приклад 13: 11-Фтор-7метил[1,4]бензодіоксино[2,3-а]піроло[3,4с]карбазол-6,8(7Н,13Н)-діон Стадія А: 3-(1,4-Бензодіоксин-2-іл)-4-(6-фтор1Н-індол-3-іл)-1-метил-1Н-пірол-2,5-діон Очікуваний продукт одержують відповідно до методики, описаної на Стадії А Прикладу 5, починаючи зі сполуки Приготування Н. Точка плавлення: 214°С. ІЧ (KBr): n C=O=1693см -1; n NH=3322см -1. Мас-спектр: 377 [Μ+1]+. Стадія В: 11-Фтор-7метил[1,4]бензодіоксино[2,3-а]піроло[3,4с]карбазол-6,8-(7Н,13Н)-діон Очікуваний продукт одержують відповідно до методики, описаної на Стадії В Прикладу 6, починаючи зі сполуки, одержаної на попередній Стадії А. Точка плавлення: >360°С. ІЧ (KBr): n C=O=1697, 1752см-1; n NH=3349см -1. Мас-спектр: 375 [Μ+1]+. Приклад 14: 7-[2-(Диметиламіно)етил]-11фтор[1,4]бензодіоксино[2,3-а]-піроло[3,4с]карбазол-6,8(7Н,13Н)-діон 39 79997 Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 7, починаючи зі сполуки Прикладу 13. Точка плавлення: 301°С (розкладання). ІЧ (KBr): n C=O=1703, 1752см-1; n NH=3439см -1. Мас-спектр: 432 [Μ+1]+. Приклад 15: 10-Фтор[1,4]бензодіоксино[2,3а]піроло[3,4-с]карбазол-6,8-(7Н,13Н)-діон Стадія А: 3-(1,4-Бензодіоксин-2-іл)-4-(5-фтор1Н-індол-3-іл)-1Н-пірол-2,5-діон Очікуваний продукт одержують відповідно до методики, описаної на Стадії А Прикладу 5, починаючи зі сполуки Приготування І. Точка плавлення: 241°С (розкладання). ІЧ (KBr): n C=O=1693см -1; n NH=3177, 3335см -1. Мас-спектр: 363 [Μ+1]+. Стадія В: 10-Фтор[1,4]бензодіоксино[2,3а]піроло[3,4-с]карбазол-6,8(7Н,13Н)-діон Очікуваний продукт одержують відповідно до методики, описаної на Стадії В Прикладу 6, починаючи зі сполуки, одержаної на попередній Стадії А. Точка плавлення: >360°С. ІЧ (KBr): n C=O=1707см -1; n NH=3258, 3379см -1. Мас-спектр: 361 [Μ+1]+. Приклад 16: 11-Фтор[1,4]бензодіоксино[2,3а]піроло[3,4-с]карбазол-6,8-(7Н,13Н)-діон Стадія А: 3-(1,4-Бензодіоксин-2-іл)-4-(6-фтор1Н-індол-3-іл)-1Н-пірол-2,5-діон Очікуваний продукт одержують відповідно до методики, описаної на Стадії А Прикладу 5, починаючи зі сполуки Приготування J. Точка плавлення: 203°С. ІЧ (KBr): n C=O=1697, 1762см -1; n NH=3179, 3344см -1. Мас-спектр: 363 [Μ+1]+. Стадія В: 11-Фтор[1,4]бензодіоксино[2,3а]піроло[3,4-с]карбазол-6,8-(7Н,13Н)-діон Очікуваний продукт одержують відповідно до методики, описаної на Стадії В Прикладу 6, починаючи зі сполуки, одержаної на попередній Стадії А. Точка плавлення: >360°С. ІЧ (KBr): n C=O=1710см -1; n NH=3190, 3455см -1. Мас-спектр: 361 [Μ+1]+. Приклад 17: трет-Бутил 10-(бензилокси)-7метил-6,8-діоксо-7,8-дигідро[1,4]бензодіоксино[2,3-а]піроло[3,4-с]карбазол13(6Н)-карбоксилат Стадія А: трет-Бутил 3-[4-(1,4-бензодіоксин-2іл)-1-метил-2,5-діоксо-2,5-дигідро-1Н-пірол-3-іл]-5(бензилокси)-1Н-індол-1-карбоксилат Очікуваний продукт одержують відповідно до методики, описаної на Стадії А Прикладу 5, починаючи зі сполуки Приготування K. Точка плавлення: 93°С. IR (KBr): n C=O=1703, 1706, 1737, 1741см -1. Мас-спектр: 565,5 [Μ+1]+. Стадія В: трет-Бутил 10-(бензилокси)-7-метил6,8-діоксо-7,8-дигідро[1,4]-бензодіксино[2,3а]піроло[3,4-с]карбазол-13(6Н)-карбоксилат 177,1mмол сполуки, одержаної на попередній Стадії А, і 5,91ммол двічіочищеного йоду розчиняють в 500мл толуолу всередині комірки апаратуопромінювача. Після опромінювання протягом 40 40 хвилин при 500W, з перемішуванням, реакційну суміш охолоджують і потім розбавляють етилацетатом. Промивання 80мл 20% водного розчину тіосульфату натрію проводять доти, доки органічна фаза не знебарвиться. Водну фазу екстрагують етилацетатом тричі, і тоді органічні фази об'єднують і безпосередньо концентрують у вакуумі. Процедуру повторюють надалі два рази таким же чином, використовуючи ті ж кількості. Сирі продукти реакції трьох процедур об'єднують і одержану коричневу тверду речовину промивають, фільтрують і полощуть метанолом перед сушінням у вакуумі, дозволяючи виділити очікуваний продукт. Точка плавлення: 302°С (розкладання). ІЧ (KBr): n C=O=1705, 1731, 1760см -1. Мас-спектр: 463 [М-Вос+1]+. Приклад 18: 10-Гідрокси-1метил[1,4]бензодіоксино[2,3-а]піроло[3,4-с]карбазол-6,8(7Н,13Н)-діон 44,4mмoл сполуки Прикладу 17 розчиняють, в інертній атмосфері, в 3,5мл безводного дихлорметану. 1 М розчин триброміду бору в ди хлорметані (89mмол) потім додають краплями і з сильним перемішуванням до розчину, який був охолоджений до 0°С. Реакційну суміш перемішують при 0°С протягом 15 хвилин і потім протягом 1 години 15 хвилин доти, доки не буде дозволено повернутись до температури навколишнього середовища. Після гідролізу дистильованою водою, реакційну суміш розбавляють етилацетатом і водну фазу екстрагують тричі етилацетатом. Органічні фази об'єднують і випаровують досуха. Залишок, який одержують, промивають, фільтрують і полощуть метанолом і потім сушать у вакуумі, дозволяючи виділити очікуваний продукт. Точка плавлення: >350°С. ІЧ (KBr): n C=O=1691, 1749см-1; n OH,NH=3345см -1. Мас-спектр: 373 [Μ+1]+. Приклад 19: 10-(Бензилокси)-7-[2(диметиламіно)етил][1,4]бензодіоксино-[2,3а]піроло[3,4-с]карбазол-6,8(7Н,13Н)-діон Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 7, починаючи зі сполуки Прикладу 17. Точка плавлення: 254°С (розкладання). ІЧ (KBr): n C=O=1701см -1; n NH=3433см -1. Мас-спектр: 520,5 [Μ+1]+. Приклад 20: 7-[2-(Диметиламіно)]-10гідрокси[1,4]бензодіоксино[2,3-а]-піроло[3,4с]карбазол-6,8(7Н,13Н)-діон Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 18, починаючи зі сполуки Прикладу 19. Точка плавлення: >360°С. ІЧ (KBr): n C=O=1697см -1; n OH,NH=3447см -1. Мас-спектр: 430 [Μ+1]+. Приклад 21: трет-Бутил 11-(бензилокси)-7метил-6,8-діоксо-7,8-дигідро[1,4]бензодіоксино[2,3-а]піроло[3,4-с]карбазол-13(6Н)карбоксилат Стадія А: трет-Бутил 3-[4-(1,4-бегоодіоксин-2іл)-1-метил-2,5-діоксо-2,5-дигідро-1Н-пірол-3-іл]-6(бензилокси)-1Н-індол-1-карбоксилат 41 79997 Очікуваний продукт одержують відповідно до методики, описаної на Стадії А Прикладу 5, починаючи зі сполуки Приготування L. Точка плавлення: 88°С. ІЧ (KBr): n C=O=1703, 1737см-1. Мас-спектр: 565 [Μ+1]+. Стадія В: трет-Бутил 11-(бензилокси)-7-метил6,8-діоксо-7,8-дигідро[1,4]-бензо-діоксино[2,3а]піроло[3,4-с]карбазол-13(6Н)-карбоксилат Очікуваний продукт одержують відповідно до методики, описаної на Стадії В Прикладу 17, починаючи зі сполуки, одержаної на попередній Стадії А. Точка плавлення: 204°С. ІЧ (KBr): n C=O=1703, 1747см-1. Мас-спектр: 463 [М-Вос+1]+. Приклад 22: 11-Гідрокси-7метил[1,4]бензодіоксино[2,3-а]піроло[3,4-с]карбазол-6,8(7Н,13Н)-діон Очікуваний продукт одержують відповідно до методики, описаної на Стадії В Прикладу 18, починаючи зі сполуки Прикладу 21. Точка плавлення: 360°С. ІЧ (KBr): n C=O=1684, 1696, 1737см -1; -1 n OH,NH=3317, 3442см . Мас-спектр: 373 [Μ+1]+. Приклад 23: 11-(Бензилокси)-7-[2(диметиламіно)етил][1,4]бензодіоксино-[2,3а]піроло[3,4-с]карбазол-6,8(7Н,13Н)-діон Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 7, починаючи зі сполуки Прикладу 21. Точка плавлення: 262°С (розкладання). ІЧ (KBr): n C=O=1701, 1750см-1; n ОH,NH=3432см -1. Мас-спектр: 520,5 [Μ+1]+. Приклад 24: 7-[2-(Диметиламіно)етил]-11гідрокси[1,4]бензодіоксино[2,3-а]піроло[3,4с]карбазол-6,8(7Н,13Н)-діон Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 18, починаючи зі сполуки Прикладу 23. Точка плавлення: >360°С. ІЧ (KBr): n C=O=1686см -1; n OH,NH=3405см -1. Мас-спектр: 430 [Μ+1]+. Приклад 25: трет-Бутил 10-(бензилокси)-6,8діоксо-7,8-дигідро[1,4]бензо-діоксино[2,3а]піроло[3,4-с]карбазол-13(6Н)-карбоксилат Стадія А: трет-Бутил 3-[4-(1,4-бензодіоксин-2іл)-1-(трет-бутоксикарбоніл)-2,5-діоксо-2,5-дигідро1Н-пірол-3-іл]-5-(бензилокси)-1Н-індол-1карбоксилат Очікуваний продукт одержують відповідно до методики, описаної на Стадії А Прикладу 5, починаючи зі сполуки Приготування М. Точка плавлення: 76°С. ІЧ (KBr): n C=O=1741, 1763, 1797см -1. Мас-спектр: 551,5 [М-Вос+1]+. Стадія В: трет-Бутил 10-(бензилокси)-6,8діоксо-7,8-дигідро[1,4]-бензодіоксино[2,3а]піроло[3,4-с]карбазол-13(6Н)-карбоксилат Очікуваний продукт одержують відповідно до методики, описаної на Стадії В Прикладу 6, починаючи зі сполуки, одержаної на попередній Стадії А. Точка плавлення: >304°С. 42 ІЧ (KBr): n C=O=1719, 1731см-1; n NH=3198см -1. Мас-спектр: 549,5 [Μ+1]+. Приклад 26: 10-Гідрокси[1,4]бензодіоксино[2,3а]піроло[3,4-с]карбазол-6,8-(7Н,13Н)-діон Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 8, починаючи зі сполуки Прикладу 25. Точка плавлення: >360°С. ІЧ (KBr): n C=O=1712, 1750см-1; n OH,NH=3061, 3218, 3442см -1. Мас-спектр: 359 [Μ+1]+. Приклад 27: трет-Бутил 11-(бензилокси)-6,8діоксо-7,8-дигідро[1,4]бензо-діоксино[2,3а]піроло[3,4-с]карбазол-13(6Н)-карбоксилат Стадія А: трет-Бутил 3-[4-(1,4-бензодіоксин-2іл)-1-(трет-бутоксикарбоніл)-2,5-діоксо-2,5-дигідро1Н-пірол-3-іл]-6-(бензилокси)-1Н-індол-1карбоксилат Очікуваний продукт одержують відповідно до методики, описаної на Стадії А Прикладу 5, починаючи зі сполуки Приготування N. Точка плавлення: 81°С. ІЧ (KBr): n C=O=1716, 1739, 1762см -1. Мас-спектр: 551,5 [М-Вос+1]+. Стадія В: трет-Бутил 11-(бензилокси)-6,8діоксо-7,8-дигідро[1,4]-бензодіоксино[2,3-а]піроло[3,4-с]карбазол-13(6Н)-карбоксилат Очікуваний продукт одержують відповідно до методики, описаної на Стадії В Прикладу 6, починаючи зі сполуки, одержаної на попередній Стадії А. Точка плавлення: 199°С. ІЧ (KBr): n C=O=1731, 1761см-1; n NH=3384см -1. Мас-спектр: 549,5 [Μ+1]+. Приклад 28: 11-Гідрокси[1,4]бензодіоксино[2,3а]піроло[3,4-с]карбазол-6,8(7Н,13Н)-діон Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 8, починаючи зі сполуки Прикладу 27. Точка плавлення: >340°С. ІЧ (KBr): n C=O=1711, 1745см-1; n OH,NH=3054, 3197, 3427см -1. Мас-спектр: 359 [Μ+1]+. Приклад 29: трет-Бутил 6-метил-5,7-діоксо-6,7дигідронафто[2',3':5,6]-[1,4]діоксино[2,3а]піроло[3,4-с]карбазол-16(5Н)-карбоксилат Стадія А: трет-Бутил 3-(1-метил-4-нафто[2,3и][1,4]діоксин-2-іл-2,5-діоксо-2,5-дигідро-1Н-пірол3-іл)-1Н-індол-1-карбоксилат Очікуваний продукт одержують відповідно до методики, описаної на Стадії А Прикладу 5, починаючи зі сполуки Приготування В. Точка плавлення: 158°С. ІЧ (KBr): n C=O=1702,1736см -1. Мас-спектр: 409 [М-Вос+1]+. Стадія В: трет-Бутил 6-метил-5,7-діоксо-6,7дигідронафто-[2',3':5,6][1,4]діоксино-[2,3а]піроло[3,4-с]карбазол-16(5Н)-карбоксилат Очікуваний продукт одержують відповідно до методики, описаної на Стадії В Прикладу 5, починаючи зі сполуки, одержаної на попередній Стадії А. 43 79997 Приклад 30: трет-Бутил 8-(бензилокси)-4-(2гідроксифенокси)-1,3-діоксо-2,3-дигідропіроло[3,4с]карбазол-6(1Н)-карбоксилат Очікуваний продукт одержують в ході очищення сполуки Стадії В Прикладу 27. Точка плавлення: 198°С. ІЧ (KBr): n C=O=1725, 1757см-1; n OH,NH=3277см -1. Мас-спектр: 551,5 [Μ+1]+. Приклад 31: трет-Бутил 9-(бензилокси)-4-(2гідроксифенокси)-2-метил-1,3-діоксо-2,3дигідропіроло[3,4-с]карбазол-6(1Н)-карбоксилат В апараті-опромінювачі 177,1mмол сполуки, одержаної на Стадії А Прикладу 17, розчиняють в 500мл толуолу і потім 5,91ммол двічі очищеного йоду вміщують в реакційну суміш. Опромінювання проводять при 500W протягом 40 хвилин. Реакційну суміш згодом розбавляють етилацетатом і потім промивають 80мл 20% водного розчину тіосульфату натрію доти, доки органічна фаза не знебарвиться. Водну фазу екстрагують етилацетатом тричі і потім органічні фази об'єднують і безпосередньо концентрують досуха у вакуумі. Процедуру проводять надалі три рази таким же чином, використовуючи ті ж кількості. Сирі продукти реакції чотирьох процедур об'єднують. Одержаний залишок промивають, фільтрують і полощуть метанолом і потім випаровують. Очи щення флешхроматографією на силікагелі (нафтовий ефір/етилацетат: 4/6) дозволяє виділити очікуваний продукт. Точка плавлення: 170°С. ІЧ (KBr): n C=O=1700, 1727, 1759см -1; -1 n OH,NH=3425см . Мас-спектр: 565,0 [Μ+1]+. Приклад 32: 9-Гідрокси-4-(2-гідроксифенокси)2-метилпіроло[3,4-с]-карбазол-1,3 (2Н,6Н)-діон Очікуваний продукт одержують відповідно до методики Прикладу 18, починаючи зі сполуки Прикладу 31. Точка плавлення: 277°С (розкладання). ІЧ (KBr): n C=O=1698, 1757см-1; n OH,NH=3366см -1. Мас-спектр: 375 [Μ+1]+. Приклад 33: трет-Бутил 4-(2-гідроксифенокси)2-метил-1,3-діоксо-2,3-дигідропіроло[3,4с]карбазол-6(1Н)-карбоксилат До розчину 740,2mмол сполуки Приготування А у 12,5мл 1,4-діоксану додають 616,9mмол сполуки Приготування Е, 61,7mмол йодиду міді і 61,7mмол тетракіс(трифенілфосфін)паладію. Реакційну суміш нагрівають при 100°С, в інертній атмосфері, протягом 21 годин. Розчин потім фільтрують, щоб видалити залишки паладію і фільтрат випаровують досуха. Очи щення флеш-хроматографією на силікагелі (нафтовий ефір/етилацетат: 7/3) дозволяє одержати очікуваний продукт. Точка плавлення: 182°С (розкладання). ІЧ (KBr): n C=O=1697, 1730, 1757см -1; -1 n ОH=3432см . Мас-спектр: 459 [Μ+1]+. Приклад 34: трет-Бутил 4-(2-метоксифенокси)2-метил-1,3-діоксо-2,3-дигідропіроло[3,4с]карбазол-6(1Н)-карбоксилат До розчину 152,68mмол сполуки Прикладу 33 в 5мл ацетону додають 458,05mмол сухого карбона 44 ту калію і 763,41mмол метил йодиду. Реакційну суміш нагрівають зі зворотним холодильником і перемішують протягом 2 годин 25 хвилин. Розчинник потім видаляють у вакуумі і зібраний залишок промивають, фільтрують і полощуть метанолом перед сушінням у вакуумі, дозволяючи виділити очікуваний продукт. Точка плавлення: >333°С. ІЧ (KBr): n C=O=1705, 1724см-1. Мас-спектр: 473,5 [Μ+1]+. ПРИКЛАД 35: 4-(2-Метоксифенокси)-2метилпіроло[3,4-с]карбазол-13(2Н,6Н)-діон 84,6mмол сполуки Прикладу 34 розчиняють в 2мл трифтороцтової кислоти і потім реакційну суміш перемішують при температурі навколишнього середовища протягом 3 годин. Кислоту видаляють у вакуумі і залишок потім промивають, фільтрують і полощуть метанолом перед сушінням у вакуумі, дозволяючи виділити очікуваний продукт. Точка плавлення: 228°С. ІЧ (KBr): n C=O=1698, 1753см -1; n NH=3341, 3643см -1. Мас-спектр: 373 [Μ+1]+. Приклад 36: 4-(2-Гідроксифенокси)-2метилпіроло[3,4-с]карбазол-1,3(2Н,6Н)-діон 261,7mмол сполуки Прикладу 33 розчиняють в 7мл мурашиної кислоти; реакційну суміш потім перемішують при температурі навколишнього середовища протягом 18 годин. Кислоту видаляють у вакуумі і залишок потім промивають, фільтрують і полощуть метанолом перед сушінням у вакуумі, дозволяючи виділити очікуваний продукт. Точка плавлення: 258°С. ІЧ (KBr): n C=O=1695, 1757см-1; n OH,NH=3243, 3525см -1. Мас-спектр: 359 [М+1]+. Приклад 37: трет-Бутил 2-метил-1,3-діоксо-4(2-{[(трифторметил)-сульфоніл]окси}фенокси)-2,3дигідропіроло[3,4-с]карбазол-6(1Н)-карбоксилат 124,3mмол сполуки Прикладу 33 розчиняють в безводній атмосфері в 1мл сухого ди хлорметану. Температуру розчину знижують до 0°С і потім 161,5mмол триетиламіну і 161,5mмол трифторметансульфонового ангідриду послідовно додають краплями до реакційної суміші, яку перемішують протягом 1 години 20 хвилин при від 0°С до температури навколишнього середовища. Після гідролізу дистильованою водою, реакційну суміш розбавляють дихлорметаном і потім водну фазу екстрагують тричі тим же розчинником. Органічні фази об'єднують, сушать над сульфатом магнію, фільтрують і концентрують. Очи щення хроматографією на силікагелі (нафтовий ефір/етилацетат: 7/3) дозволяє виділити очікуваний продукт. Точка плавлення: 182°С. ІЧ (KBr): n C=O=1710, 1737, 1766см -1. Мас-спектр: 591 [М+1]+. Приклад 38: 2-[(2-Метил-1,3-діоксо-1,2,3,6тетрагідропіроло[3,4-с]карбазол-4-іл)окси]феніл трифторметансульфонат В інертній атмосфері 67,7mмол сполуки Прикладу 37 розчиняють в 1мл дистильованого диметилформаміду у присутності 6,8mмол біс(трифенілфосфін)-паладій хлориду, 203,1mмол 45 79997 сухого хлориду літію і 81,2mмoл 1,8діазабіцикло[5.4.0]ундец-7-ену. Після перемішування при 140°С протягом 4 годин 20 хвилин, реакційну суміш охолоджують і диметилформамід потім видаляють. Очищення хроматографією на силікагелі (нафтовий ефір/етилацетат: 6/4) дозволяє виділити очікуваний продукт. Точка плавлення: 214°С. ІЧ (KBr): n C=O=1700-1708, 1757см -1; n NH=3430см-1. Мас-спектр: 491 [Μ+1]+. Приклад 39: трет-Бутил 8-(бензилокси)-4-(2гідроксифенокси)-2-метил-1,3-діоксо-2,3дигідропіроло[3,4-с]карбазол-6(1Н)-карбоксилат Очікуваний продукт одержують в ході очищення сполуки Стадії В Прикладу 21. Точка плавлення: 191°С. ІЧ (KBr): n C=O=1701, 1734см-1; n OH=3425см-1. Мас-спектр: 565 [Μ+1]+. Приклад 40: трет-Бутил 8-(бензилокси)-2метил-1,3-діоксо-4-(2-{[(трифторметил)сульфоніл]окси}фенокси)-2,3дигідропіроло[3,4-с]-карбазол-6(1Н)-карбоксилат Очікуваний продукт одержують відповідно до методики Прикладу 37, починаючи зі сполуки Прикладу 39. Точка плавлення: 186°С. ІЧ (KBr): n C=O=1703, 1714, 1724см -1. Мас-спектр: 697 [Μ+1]+. Приклад 41: 8-Гідрокси-4-(2-гідроксифенокси)2-метилпіроло[3,4-с]-карбазол-1,3(2Н,6Н)-діон Очікуваний продукт одержують відповідно до методики Прикладу 18, починаючи зі сполуки Прикладу 39. Точка плавлення: 200°С. ІЧ (KBr): n C=O=1691см -1; n OH,NH=3399см -1. Мас-спектр: 375 [Μ+1]+. ПРИКЛАД 42: трет-Бутил 12-(бензгідрилокси)7-метил-6,8-діоксо-7,8дигідро[1,4]бензодіоксино[2,3-а]піроло[3,4с]карбазол-13(6Н)-карбоксилат Стадія А: трет-Бутил 7-(бензгідрилокси)-3-[4(1,4-бензодіоксин-2-іл)-1-метил-2,5-діоксо-2,5дигідро-1Н-пірол-3-іл]-1Н-індол-1-карбоксилат Очікуваний продукт одержують відповідно до методики, описаної на Стадії F Прикладу 5, починаючи зі сполуки Приготування О. Точка плавлення: 138°С (розкладання). ІЧ (KBr): n C=O=1707, 1753см-1. Мас-спектр: 641,5 [Μ+1]+. Стадія В: трет-Бутил 12-(бензгідрилокси)-7метил-6,8-діоксо-7,8-дигідро[1,4]бензодіоксино[2,3-а]піроло[3,4-с]карбазол-13(6Н)карбоксилат Очікуваний продукт одержують відповідно до методики, описаної на Стадії В Прикладу 17, виходячи зі сполуки попередньої Стадії А. Фармакологічні дослідження сполук за даним винаходом % Т/С (миша) = 46 Приклад 43: In vitro активність L1210 мишача лейкемія L1210 мишачу лейкемію використовували in vitro. Клітини культивували в RPMI 1640 повному культуральному середовищі, яке містить 10% фетальну бичачу сироватку, 2мМ глутаміну, 50одиниць/мл пеніциліну, 50мкг/мл стрептоміцину і 10мМ Hepes, pH=7,4. Клітини розподіляють на мікропланшетах і піддають дії цитотоксичних сполук протягом 4 дублюючих періодів або 48 годин. Кількість життєздатних клітин потім визначають шляхом колориметричного аналізу, Microculture Tetrazolmm Assay [J. Carmichael et al., Cancer Res.: 47, 939-942 (1987)]. Результати виражають як ІС 50, концентрація цитотоксичного агента, що інгібує оброблені клітини до 50%. Всі сполуки даного винаходу показують добру цитотоксичність відносно цієї клітинної лінії. З метою прикладу, сполука Прикладу 20 має ІС50, що складає 0,074mΜ щодо L1210. Людські клітинні лінії Сполуки даного винаходу також були тестовані на людських клітинних лініях, що походять від солідних пухлин, згідно з тим же тест-протоколом, що був описаний для L1210 мишачої лейкемії, але з інкубаційними періодами, що складають 4 дні замість 2 днів. З метою прикладу, сполука Прикладу 20 має ІС50, що складає 190нМ щодо DU145 карциноми простати і порядку від 10 до 200нМ щодо людських ліній, які походять від А549 недрібноклітинної легеневої карциноми, НТ-29 карциноми ободової кишки і KВ-3-1 епідермоїдної карциноми. Приклад 44: Дія на клітинний цикл L1210 клітини інкубують протягом 21 годин при 37°С у присутності різних концентрацій тестованих сполук. Клітини потім фіксують 70% (об./об.) етанолу, двічі промивають в PBS та інкубують протягом 30 хвилин при 20°С в PBS, що містить 100мкг/мл РНК і 50мкг/мл пропідій йодиду. Результати виражають як процент клітин, які накопичились у G2+M фазі через 21 годину, порівняні з контролем (контроль: 20%). Сполуки винаходу представляють особливий інтерес, у концентрації менше ніж 2,5mΜ вони індукують накопичення щонайменше 70% клітин у G2+M фазі через 21 годину. Приклад 45: In vivo активність Протипухлинна активність на Ρ 388 лейкемію Лінію Р388 (мишача лейкемія) одержували від National Cancer Institute (Frederick, USA). Пухлинні клітини (106 клітин) інокулювали у день 0 в черевну порожнину самиць мишей B6D2F1 (Iffa Credo, France). Використовують шість мишей, які важать від 18 до 20г, на кожну тест-груп у. Продукти вводять інтраперітонеальним шляхом у день 1. Протипухлинну активність виражають як % Т/С: Середній час виживання тварин, яких обробляють ´ 100 Середній час виживання котрольних тварин 47 79997 Одержані результати демонструють відмінну in vivo активність на Ρ 388 моделі лейкемії, з Т/С, що складає 210% для дози 50мг/кг, разом з низькою токсичністю сполук, вказуючи на відмінний терапевтичний індекс. Комп’ютерна в ерстка О. Гапоненко 48 Приклад 46: Фармацевтична композиція: ін'єкційний розчин Сполука Прикладу 20 10мг Дистильована вода для ін'єкційних розчинів 25мл Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted compounds of [1,4] benzodioxine [2,3-e]izoindole, process for preparation thereof and pharmaceutical composition, which comprises them
Автори англійськоюLepifre, Franck, Caignard Daniel-Henri, Renard Pierre, Hickman, John, PIERRE Alain, Leonce Stephane
Назва патенту російськоюЗамещенные соединения [1,4]бензодиоксино[2,3-e]изоиндола, способ их получения и фармацевтическая композиция, которая их содержит
Автори російськоюКеньяр Даниэль-Энри, Ренар Пьер, Икман Джон, Пьер Ален, Леонс Стефан
МПК / Мітки
МПК: A61P 35/00, C07D 487/04, C07D 471/14, C07D 491/14, C07D 491/147, C07D 498/14, C07D 491/22
Мітки: яка, містить, фармацевтична, одержання, композиція, спосіб, сполуки, заміщені, 1,4]бензодіоксино[2,3-e]ізоіндолу
Код посилання
<a href="https://ua.patents.su/24-79997-zamishheni-spoluki-14benzodioksino23-eizoindolu-sposib-kh-oderzhannya-i-farmacevtichna-kompoziciya-yaka-kh-mistit.html" target="_blank" rel="follow" title="База патентів України">Заміщені сполуки [1,4]бензодіоксино[2,3-e]ізоіндолу, спосіб їх одержання і фармацевтична композиція, яка їх містить</a>
Попередній патент: Спосіб обробки донних мулистих відкладень
Наступний патент: Спосіб одержання проміжної сполуки для пестицидів
Випадковий патент: Пересувний зерноочищувальний пристрій












