Способи одержання сполук боронового естеру та кислоти
Номер патенту: 90108
Опубліковано: 12.04.2010
Автори: Еммоскейто Вінс, Гомес Жан-Марк, Пікерсджилл І. Фрейзер, Чуй Фан-Тін, Келльнер Крістоф, Хетт Роберт, Ло Янг, Гайзер Ахім, Бішоп Джон, Манк Стефен, Кулкарні Вітхалананд Р.
Формула / Реферат
1. Спосіб одержання сполуки боронового естеру формули (І):
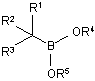 , (I)
, (I)
в якій
R1 являє собою необов'язково заміщену С1-8аліфатичну, С6-10арильну або (С6-10арил)(С1-6аліфатичну) групу;
R2 являє собою водень або хлор;
R3 являє собою хлор; і
кожен з R4 і R5, незалежно, являє собою необов'язково заміщену С1-12аліфатичну, С6-14ароматичну або 5-14 членну гетероароматичну групу, або R4 і R5, взяті разом з проміжними атомами кисню і бору, утворюють необов'язково заміщений 5-10-членний цикл, що містить 0-2 додаткових цикличних гетероатоми, які вибирають з N, О або S;
де вказаний спосіб включає:
(a) забезпечення бор "ат" комплексу формули (II):
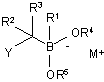 , (II)
, (II)
в якій
Y являє собою нуклеофугну групу;
М+ являє собою катіон; і
кожен з R1-R5 є таким, як визначено вище; і
(b) контактування бор "ат" комплексу формули (II) з кислотою Льюїса в умовах, за яких одержують сполуку боронового естеру формули (І), де вказану стадію контактування проводять в реакційній суміші, яка містить:
(і) координуючий ефірний розчинник, який має низьку міру змішуваності з водою; або
(іі) ефірний розчинник, який має низьку міру змішуваності з водою, і координуючий співрозчинник, причому координуючий співрозчинник складає не більш, ніж приблизно 20 об.% реакційної суміші;
де розчинність води у ефірному розчиннику у (і) або (іі), що має низьку міру змішуваності з водою, становить менш, ніж 5 мас.%;
і де ефірний розчинник у (і) або (іі), що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об.% реакційної суміші;
(c) промивання реакційної суміші водним розчином; і
(d) концентрування промитої реакційної суміші шляхом видалення розчинників з одержанням залишку, який містить сполуку боронового естеру формули (І).
2. Спосіб за п. 1, де реакційна суміш містить координуючий співрозчинник.
3. Спосіб за п. 2, де координуючий співрозчинник вибирають з групи: тетрагідрофурану, діоксану, води і їх сумішей.
4. Спосіб за п. 1, де координуючий співрозчинник складає не більш, ніж приблизно 15 об.% реакційної суміші.
5. Спосіб за п. 1, де розчинність води в ефірному розчиннику, який має низьку міру змішуваності з водою, становить менш, ніж приблизно 2 мас.%.
6. Спосіб за п. 5, де ефірний розчинник, який має низьку міру змішуваності з водою, вибирають з групи: трет-бутил метилового естеру, трет-бутил етилового естеру, трет-аміл метилового естеру, ізопропілового естеру і їх сумішей.
7. Спосіб за п. 1, де щонайменше приблизно 5 молів бор "ат" комплексу формули (II) забезпечують на стадії (а).
8. Спосіб за п. 1, де щонайменше приблизно 20 молів бор "ат" комплексу формули (II) забезпечують на стадії (а).
9. Спосіб за п. 1, де щонайменше приблизно 50 молів бор "ат" комплексу формули (II) забезпечують на стадії (а).
10. Спосіб за п. 1, де щонайменше приблизно 100 молів бор "ат" комплексу формули (II) забезпечують на стадії (а).
11. Спосіб, за п. 1, де кислоту Льюїса вибирають з групи: хлориду цинку, броміду цинку, хлориду заліза і броміду заліза.
12. Спосіб за п. 11, де кислота Льюїса є вологою.
13. Спосіб за п. 11, де на стадії (а) бор "ат" комплекс формули (II) забезпечують в розчині, який містить ефірний розчинник, який має низьку міру змішуваності з водою, і стадія контактування (b) включає стадії:
(і) забезпечення розчину, який містить кислоту Льюїса і тетрагідрофуран; і
(іі) додавання розчину кислоти Льюїса до розчину бор "ат" комплексу формули (II) зі стадії (а);
де розчинність води у ефірному розчиннику, що має низьку міру змішуваності з водою, становить менш, ніж 5 мас.%;
і де ефірний розчинник, що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об.% реакційної суміші.
14. Спосіб за п. 11, де на стадії (а) бор "ат" комплекс формули (ІІ) забезпечують в розчині, який містить ефірний розчинник, який має низьку міру змішуваності з водою, і стадія контактування (b) включає стадії:
(і) забезпечення розчину, який містить кислоту Льюїса і воду; і
(іі) додавання розчину кислоти Льюїса до розчину бор "ат" комплексу формули (II) зі стадії (а);
де розчинність води у ефірному розчиннику, що має низьку міру змішуваності з водою, становить менш, ніж 5 мас.%;
і де ефірний розчинник, що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об.% реакційної суміші
15. Спосіб за п. 1, де Y являє собою галоген.
16. Спосіб за п. 1, де Y являє собою хлор.
17. Спосіб за п. 1, де М+ вибирають з групи: Li+, Na+ і К+.
18. Спосіб за п. 1, де R4 і R5, разом з проміжними атомами кисню і бору, утворюють необов'язково заміщений 5-членний цикл.
19. Спосіб за п. 18, де R4 і R5 разом являють собою хіральний фрагмент.
20. Спосіб за п. 19, де бор "ат" комплекс формули (II) являє собою:
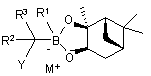 або
або 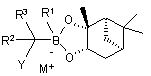 .
.
21. Спосіб за п. 19, де стадія (b) забезпечує сполуку боронового естеру формули (І), в якій атом вуглецю, який несе R1, R2 і R3, являє собою хіральний центр, який має діастереомерне співвідношення, що становить щонайменше приблизно 96:4 по відношенню до хірального центру в R4-R5 хіральному фрагменті.
22. Спосіб за п. 19, де стадія (b) забезпечує сполуку боронового естеру формули (І), в якій атом вуглецю, який несе R1, R2 і R3, являє собою хіральний центр, який має діастереомерне співвідношення щонайменше приблизно 97:3 по відношенню до хірального центру в R4-R5 хіральному фрагменті.
23. Спосіб за п. 19, який відрізняється щонайменше однією з наступних ознак:
(a) стадію контактування (b) проводять в реакційній суміші, яка містить трет-бутил метиловий естер;
(b) кислота Льюїса являє собою хлорид цинку;
(c) щонайменше приблизно 5 моль боронового естеру формули (II) забезпечують на стадії (а);
(d) стадію контактування (b) проводять при температурі реакції в діапазоні від приблизно -60°С до приблизно -30°С;
(e) кислота Льюїса є вологою;
(f) Y являє собою хлор;
(g) R3 являє собою хлор;
(h) R2 являє собою водень; і
(і) R1 являє собою С1-4аліфатичну групу.
24. Спосіб за п. 23, який відрізняється щонайменше двома з ознак (а)-(і).
25. Спосіб за п. 23, який відрізняється щонайменше трьома з ознак (а)-(і).
26. Спосіб за п. 23, який відрізняється всіма девятьма ознаками (а)-(і).
27. Спосіб за п. 1, де залишок містить щонайменше приблизно п'ять молів сполуки боронового естеру формули (І).
28. Спосіб за п. 27, де сполука боронового естеру формули (І), присутня в залишку, має діастереомерне співвідношення, що становить щонайменше приблизно 96:4 на атомі вуглецю, який несе R1, R2 і R3, по відношенню до хірального центру в R4-R5 хіральному фрагменті.
29. Спосіб за п. 27, де сполука боронового естеру формули (І), присутня в залишку, має діастереомерне співвідношення, що становить щонайменше приблизно 97:3 на атомі вуглецю, який несе R1 R2 і R3, по відношенню до хірального центру в R4-R5 хіральному фрагменті.
30. Спосіб одержання сполуки боронового естеру формули (І):
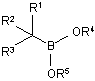 , (I)
, (I)
в якій
R1 являє собою необов'язково заміщену С1-8аліфатичну, С6-10арильну або (С6-10арил)(С1-6аліфатичну) групу;
R2 являє собою водень або хлор;
R3 являє собою хлор; і
кожен з R4 і R5, незалежно, являє собою необов'язково заміщену аліфатичну, ароматичну або гетероароматичну групу, або R4 і R5, взяті разом з проміжними атомами кисню і бору, утворюють необов'язково заміщений 5-10-членний цикл, що містить 0-2 додаткових цикличних гетероатоми, які вибирають з N, О або S;
де вказаний спосіб включає:
(a) забезпечення розчину, який містить
(і) бороновий естер формули (III):
 , (III)
, (III)
в якій R1, R4 і R5 є таким, як визначено вище; і
(іі) ефірний розчинник, який має низьку міру змішуваності з водою;
де розчинність води у ефірному розчиннику, що має низьку міру змішуваності з водою, становить менш, ніж 5 мас.%.;
(b) обробку розчину реагентом формули (IV):
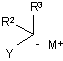 , (IV)
, (IV)
з одержанням бор "ат" комплекс формули (II):
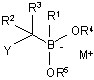 , (II)
, (II)
в якій Y являє собою нуклеофугну групу;
М+ являє собою катіон; і
кожен з R1-R5 є таким, як визначено вище; і
(c) контактування бор "ат" комплексу формули (II) з кислотою Льюїса в умовах, за яких одержують сполуку боронового естеру формули (І), де вказану стадію контактування проводять в реакційній суміші, яка містить:
(і) координуючий ефірний розчинник, який має низьку міру змішуваності з водою; або
(іі) ефірний розчинник, який має низьку міру змішуваності з водою, і координуючий співрозчинник, причому координуючий співрозчинник складає не більш, ніж приблизно 20 об.% реакційної суміші;
де розчинність води у ефірному розчиннику у (і) або (іі), що має низьку міру змішуваності з водою, становить менш, ніж 5 мас.%;
і де ефірний розчинник у (і) або (іі), що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об.% реакційної суміші;
(d) промивання реакційної суміші водним розчином; і
(e) концентрування промитої реакційної суміші видаленням розчинників для одержання залишку, який містить бороновий естер сполуки формули (І).
31. Спосіб одержання сполуки боронового естеру формули (І):
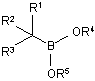 , (I)
, (I)
в якій
R1 являє собою необов'язково заміщену С1-8аліфатичну, С6-10арильну або (С6-10арил)(С1-6аліфатичну) групу;
R2 являє собою водень або хлор;
R3 являє собою хлор; і
кожен з R4 і R5, незалежно, являє собою необов'язково заміщену аліфатичну, ароматичну або гетероароматичну групу, або R4 і R5, взяті разом з проміжними атомами кисню і бору, утворюють необов'язково заміщений 5-10-членний цикл, яке містить 0-2 додаткових цикличних гетероатоми, які вибирають з N, О або S;
де вказаний спосіб включає:
(а) забезпечення розчину, який містить:
(і) бороновий естер формули (III):
 , (III)
, (III)
в якій R1, R4 і R5 є такими, як визначено вище;
(іі) сполуку формули (V):
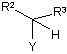 , (V)
, (V)
в якій Y являє собою нуклеофугну групу, і
R2 і R3 є такими, як визначено вище; і
(iіі) розчинник, який містить:
(аа) координуючий ефірний розчинник, який має низьку міру змішуваності з водою; або
(bb) ефірний розчинник, який має низьку міру змішуваності з водою, і координуючий співрозчинник, причому координуючий співрозчинник складає не більш, ніж приблизно 20 об.% реакційної суміші;
де розчинність води у ефірному розчиннику у (аа) або (bb), що має низьку міру змішуваності з водою, становить менш, ніж 5 мас.%;
і де ефірний розчинник у (аа) або (bb), що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об.% реакційної суміші;
(b) обробку розчину стадії (а) сильною, стерично утрудненою основою з одержанням бор "ат" комплекс формули (II):
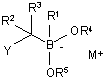 , (II)
, (II)
де М+ являє собою катіон, який походить від основи, і кожен Y і R1-R5 є зтакими, як визначено вище; і
(c) контактування бор "ат" комплексу формули (II) з кислотою Льюїса в розчині, який містить ефірний розчинник, який має низьку міру змішуваності з водою, де розчинність води у ефірному розчиннику, що має низьку міру змішуваності з водою, становить менш, ніж 5 мас.%;
і де ефірний розчинник, що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об.% реакційної суміші;
(d) промивання реакційної суміші водним розчином; і
(e) концентрування промитої реакційної суміші видаленням розчинників для одержання залишку, який містить бороновий естер сполуки формули (І).
32. Спосіб одержання сполуки боронового естеру формули (І):
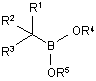 , (I)
, (I)
в якій
R1 являє собою необов'язково заміщену С1-8аліфатичну, С6-10арильну або (С6-10арил)(С1-6аліфатичну) групу;
R2 являє собою водень або хлор;
R3 являє собою хлор; і
R4 і R5, взяті разом, утворюють необов'язково заміщений зв'язувальний ланцюг, який містить 2-5 атомів вуглецю і 0-2 гетероатоми, які вибирають з групи, яка складається з N, О або S;
де вказаний спосіб включає:
(a) забезпечення розчину, який містить
(і) сполуку боронової кислоти формули (VI):
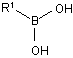 , (VI)
, (VI)
в якій R1 є таким, як визначено вище;
(іі) сполуку формули HO-R4-R5-ОН, в якій R4 і R5 є такими, як визначено вище; і
(ііі) органічний розчинник, який утворює азеотроп з водою;
(b) нагрівання розчину стадії (а) зі зворотним холодильником, з азеотропним видаленням води, з одержанням боронового естеру формули (III):
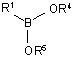 , (III)
, (III)
в якій R1, R4 і R5 є такими, як визначено вище;
(c) забезпечення розчину, який містить:
(і) бороновий естер формули (ІІІ);
(іі) сполуку формули (V):
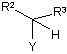 , (V)
, (V)
в якій Y являє собою нуклеофугну групу, і
R2 і R3 є зтакими, як визначено вище; і
(ііі) розчинник, який містить:
(аа) координуючий ефірний розчинник, який має низьку міру змішуваності з водою; або
(bb) ефірний розчинник, який має низьку міру змішуваності з водою, і координуючий співрозчинник, причому координуючий співрозчинник складає не більш, ніж приблизно 20 об.% реакційної суміші;
де розчинність води у ефірному розчиннику у (аа) або (bb), що має низьку міру змішуваності з водою, становить менш, ніж 5 мас.%;
і де ефірний розчинник у (аа) або (bb), що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об.% реакційної суміші;
(d) обробку розчину зі стадії (с) сильною, стерично утрудненою основою з одержанням бор "ат" комплексу формули (II):
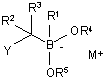 , (II)
, (II)
в якій М+ являє собою катіон, який походить від основи, і кожен з Y і R1-R5 є таким, як визначено вище; і
(e) контактування бор "ат" комплексу формули (II) з кислотою Льюїса в розчині, який містить ефірний розчинник, що має низьку міру змішуваності з водою;
де розчинність води у ефірному розчиннику, що має низьку міру змішуваності з водою, становить менш, ніж 5 мас.%;
і де ефірний розчинник, що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об.% реакційної суміші;
(f) промивання реакційної суміші водним розчином; і
(g) концентрування промитої реакційної суміші шляхом видалення розчинників з одержанням залишку, який містить бороновий естер сполуки формули (І).
33. Спосіб за п. 31 або 32, де стерично утруднена основа являє собою діалкіламідну основу лужного металу формули М2N(R#)2, в якій М2 вибирають з групи: Li, Na і К, і кожен R#, незалежно, являє собою розгалужену або циклічну С3-6аліфатичну групу.
34. Спосіб за п. 32, де органічний розчинник на стадії (а) вибирають з групи: з ацетонітрилу, толуолу, гексану, гептану і їх сумішей.
35. Спосіб за п. 32, де органічний розчинник на стадії (а) являє собою ефірний розчинник, який має низьку міру змішуваності з водою.
36. Спосіб за п. 35, де розчини на стадіях (а) і (с) містять однаковий ефірний розчинник.
37. Спосіб за п. 36, де стадія (b) забезпечує розчин продукту, який містить бороновий естер формули (III), і розчин продукту зі стадії (b) використовують на стадії (с) без виділення боронового естеру формули (III).
38. Спосіб одержання сполуки аміноборонового естеру формули (VII):
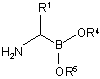 , (VII)
, (VII)
або її кислотної адитивної солі,
в якій
R1 являє собою необов'язково заміщену С1-8аліфатичну, С6-10арильну або (С6-10арил)(С1-6аліфатичну) групу; і
кожен R4 і R5, незалежно, являє собою необов'язково заміщену аліфатичну, ароматичну або гетероароматичну групу, або R4 і R5, взяті разом з проміжними атомами кисню і бору, утворюють необов'язково заміщений 5-10-членний цикл, яке містить 0-2 додаткових цикличних гетероатоми, які вибирають з N, О або S;
де вказаний спосіб включає:
(a) забезпечення бор "ат" комплексу формули (II):
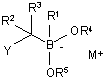 , (II)
, (II)
в якій Y являє собою нуклеофугну групу;
М+ являє собою катіон;
R2 являє собою водень;
R3 являє собою хлор; і
кожен з R1, R4 і R5 є таким, як визначено вище;
(b) контактування бор "ат" комплексу формули (II) з кислотою Льюїса в умовах, за яких одержують сполуку боронового естеру формули (І):
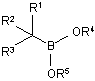 , (I)
, (I)
де кожен з R1-R5 є таким, як визначено вище, а вказану стадію контактування проводять в реакційній суміші, яка містить:
(і) координуючий ефірний розчинник, який має низьку міру змішуваності з водою; або
(іі) ефірний розчинник, який має низьку міру змішуваності з водою, і координуючий співрозчинник, причому координуючий співрозчинник складає не більш, ніж приблизно 20 об.% реакційної суміші;
де розчинність води у ефірному розчиннику у (і) або (іі), що має низьку міру змішуваності з водою, становить менш, ніж 5 мас.%;
і де ефірний розчинник у (і) або (іі), що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об.% реакційної суміші;
де розчинність води у ефірному розчиннику, що має низьку міру змішуваності з водою, що становить менш, ніж 5 мас.%.;
(c) обробку сполуки боронового естеру формули (І) реагентом формули М1-N(Si(R6)3)2, де М1 являє собою лужний метал і кожен R6 незалежно вибирають з групи: алкілу, аралкілу і арилу, де арил або арильний фрагмент аралкілу є необов'язково заміщеними, з одержанням побічного продукту формули M1-R3 і сполуки формули (VIII):
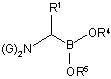 , (VIII)
, (VIII)
в якій кожен G являє собою -Si(R6)3 і R1-R5 є такими, як визначено вище; і
(d) видалення G груп з одержанням сполуки формули (VII):
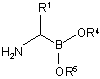 , (VII)
, (VII)
або її кислотної адитивної солі.
39. Спосіб за п. 38, де реакційна суміш на стадії (с) містить органічний розчинник, де проміжний продукт M1-R3 має низьку розчинність.
40. Спосіб за п. 39, де М1 являє собою Li і R3 являє собою Сl.
41. Спосіб за п. 40, де реакційна суміш на стадії (с) включає органічний розчинник, який вибирають з групи: метилциклогексану, циклогексану, гептану, гексану, толуолу і їх сумішей.
42. Спосіб за п. 38, де реакцію на стадії (с) проводять при температурі реакції в діапазоні від приблизно -100 °С до приблизно 50 °С.
43. Спосіб за п. 42, де температура реакції знаходиться в діапазоні від приблизно -50 °С до приблизно 25 °С.
44. Спосіб за п. 42, де температура реакції знаходиться в діапазоні від приблизно -30°С до приблизно 0 °С.
45. Спосіб за п. 38, де стадія (d) включає обробку сполуки формули (VIII) кислотою і виділення сполуки формули (VII) як кислої адитивної солі.
46. Спосіб за п. 45, де кислота являє собою трифтороцтову кислоту.
47. Спосіб за п. 38, де стадія (с) додатково включає фільтрування реакційної суміші із забезпеченням фільтрату, який містить сполуку формули (VIII).
48. Спосіб за п. 47, де на стадії (с) реагент формули M1-N(Si(R6)3)2 додають до реакційної суміші як розчин, що містить тетрагідрофуран, і стадія (с) додатково включає видалення тетрагідрофурану перед фільтруванням реакційної суміші.
49. Спосіб за п. 47, де фільтрат використовують безпосередньо на стадії (d).
50. Спосіб за п. 38, який додатково включає стадію:
(e) зв'язування сполуки формули (VII) зі сполукою формули (IX):
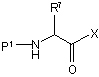 , (IX)
, (IX)
в якій
Р1 являє собою блокуючий фрагмент аміногрупи;
R7 вибирають з групи: водню, С1-10аліфатичної групи, необов'язково заміщеної С6-10арильної групи або С1-6аліфатичної-R8 групи; і
R8 вибирають з групи: алкокси, алкілтіо, необов'язково заміщеної арильної, гетероарильної і гетероциклільної груп, і необов'язково захищеної аміно, гідрокси і гуанідино груп; і
Х являє собою ОН або відхідну групу;
з одержанням сполуки формули (Х):
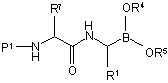 , (X)
, (X)
в якій кожен з Р1, R1, R4, R5 і R7 є таким, як визначено вище.
51. Спосіб за п. 50, де Р1 являє собою розщеплювану захисну групу.
52. Спосіб за п. 51, який додатково включає стадії:
(f) розщеплення захисної групи Р1 з одержанням сполуки формули (XI)
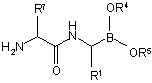 , (XI)
, (XI)
або її кислотної адитивної солі, в якій кожен з R1, R4, R5 і R7 є таким, як визначено вище;
(g) зв'язування сполуки формули (XI) з реагентом формули Р2-Х, в якій Р2 являє собою блокуючий фрагмент аміногрупи, і
Х являє собою відхідну групу з одержанням сполуки формули (XII):
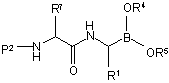 , (XII)
, (XII)
в якій кожен з Р1, R1, R4, R5 і R7 є таким, як визначено вище; і
(h) зняття захисту фрагменту боронової кислоти з одержанням сполуки формули (XIII):
 , (XIII)
, (XIII)
або її ангідриду боронової кислоти,
в якій кожен з Р1, R1 і R7 є таким, як визначено вище.
53. Спосіб одержання сполуки аміноборонового естеру формули (VIIa):
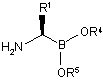 (VIIa)
(VIIa)
або її кислотної адитивної солі,
в якій
R1 являє собою необов'язково заміщену аліфатичну, ароматичну або гетероароматичну групу; і
R4 і R5, взяті разом з проміжними атомами кисню і бору, утворюють необов'язково заміщений хіральний циклічний бороновий естер;
де вказаний спосіб включає:
(а) забезпечення бор "ат" комплексу формули (IIа):
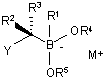 , (IIа)
, (IIа)
в якій
Y являє собою нуклеофугну групу;
M+ являє собою катіон;
R2 являє собою водень;
R3 являє собою нуклеофугну групу; і
R4 і R5 є такими, як визначено вище;
(b) контактування бор "ат" комплексу формули (IIа) з кислотою Льюїса в умовах, за яких одержують сполуку боронового естеру формули (Iа):
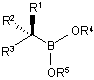 , (Ia)
, (Ia)
в якій кожен з R1–R5 є таким, як визначено вище, а вказану стадію контактування проводять в реакційній суміші, яка містить:
(і) координуючий ефірний розчинник, який має низьку міру змішуваності з водою; або
(іі) ефірний розчинник що має низьку міру змішуваності з водою, і координуючий співрозчинник, причому координуючий співрозчинник складає не більш, ніж приблизно 20 об.% реакційної суміші;
де розчинність води у ефірному розчиннику у (і) або (іі), що має низьку міру змішуваності з водою, становить менш, ніж 5 мас.%;
і де ефірний розчинник у (і) або (іі), що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об.% реакційної суміші;
(c) обробку сполуки боронового естеру формули (Іа) реагентом формули M1-N(G)2, де М1 являє собою лужний метал і кожен G являє собою захисний фрагмент аміногрупи, з одержанням сполуки формули (VIIIa):
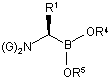 , (VIIIa)
, (VIIIa)
в якій кожен G і R1-R5 є таким, як визначено вище; і
(d) видалення G груп з одержанням сполуки формули (VIIa):
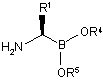 (VIIa),
(VIIa),
або її кислотної адитивної солі.
54. Спосіб одержання сполуки аміноборонового естеру формули (VIIb):
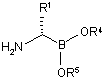 (VIIb)
(VIIb)
або її кислотної адитивної солі,
в якій
R1 являє собою необов'язково заміщену аліфатичну, ароматичну або гетероароматичну групу; і
R4 і R5 взяті разом з проміжними атомами кисню і бору, утворюють необов'язково заміщений хіральний циклічний бороновий естер;
де вказаний спосіб включає:
(а) забезпечення бор "ат" комплексу формули (IIb):
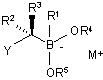 , (IIb)
, (IIb)
в якій
Y являє собою нуклеофугну групу;
M+ являє собою катіон;
R2 являє собою водень;
R3 являє собою нуклеофугну групу; і
R4 і R5 є такими, як визначено вище;
(b) контактування бор "ат" комплексу формули (IIb) з кислотою Люїса в умовах, за яких одержують сполуку боронового естеру формули (Ib):
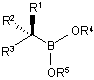 , (Іb)
, (Іb)
в якій кожен з R1–R5 є таким, як визначено вище, а вказану стадію контактування проводять в реакційній суміші, яка містить:
(і) координуючий ефірний розчинник, який має низьку міру змішуваності з водою; або
(іі) ефірний розчинник, що має низьку міру змішуваності з водою, і координуючий співрозчинник, причому координуючий співрозчинник складає не більш, ніж приблизно 20 об.% реакційної суміші;
де розчинність води у ефірному розчиннику у (і) або (іі), що має низьку міру змішуваності з водою, становить менш, ніж 5 мас.%;
і де ефірний розчинник у (і) або (іі), що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об. % реакційної суміші;
(c) обробку сполуки боронового естеру формули (Іb) реагентом формули M1-N(G)2, де М1 являє собою лужний метал і кожен G являє собою захисний фрагмент аміногрупи, з одержанням сполуки формули (VIIIb):
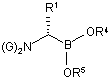 , (VIIIb)
, (VIIIb)
в якій кожен G і R1-R5 є такими, як визначено вище; і
(d) видалення G груп з одержанням сполуки формули (VIIb):
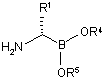 , (VIIb)
, (VIIb)
або її кислотної адитивної солі.
55. Спосіб одержання сполуки формули (XIV):
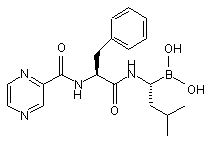 , (XIV)
, (XIV)
або її ангідриду боронової кислоти,
де вказаний спосіб включає:
(a) забезпечення бор "ат" комплексу формули (XV):
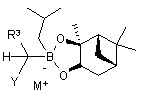 , (XV)
, (XV)
в якій
R3 являє собою нуклеофугну групу;
Y являє собою нуклеофугну групу;
М+ являє собою лужний метал;
(b) контактування бор "ат" комплексу формули (XV) з кислотою Льюїса в умовах, за яких одержують сполуку боронового естеру формули (XVI):
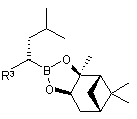 , (XVI)
, (XVI)
де вказану стадію контактування проводять в реакційній суміші, яка містить ефірний розчинник, який має низьку міру змішуваності з водою;
де розчинність води у ефірному розчиннику, що має низьку міру змішуваності з водою, становить менш, ніж 5 мас. %.;
і де ефірний розчинник, що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об. % реакційної суміші;
(с) обробку сполуки боронового естеру формули (XVI) реагентом формули М1-N(G)2, в якій М1 являє собою лужний метал і кожен G окремо чи разом являє собою захисну групу аміногрупи, з одержанням сполуки формули (XVII):
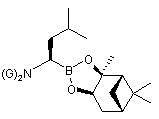 , (XVII)
, (XVII)
(d) видалення G груп з одержанням сполуки формули (XVIII):
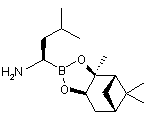 , (XVIII)
, (XVIII)
або її кислотної адитивної солі;
(е) зв'язування сполуки формули (XVIII) зі сполукою формули (XIX);
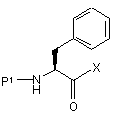 , (XIX)
, (XIX)
в якій
Р1 являє собою розщеплюваний захисний фрагмент аміногрупи; і
X являє собою ОН або відхідну групу;
з одержанням сполуки формули (XX):
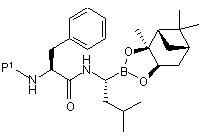 , (XX)
, (XX)
в якій Р1 є таким, як визначено вище;
(f) видалення захисної групи Р1 з одержанням сполуки формули (XXI):
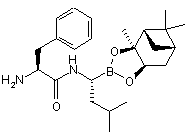 , (XXI)
, (XXI)
або її кислотної адитивної солі;
(g) зв'язування сполуки формули (XXI) з реагентом формули (XXII):
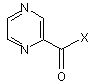 , (ХХII)
, (ХХII)
в якій Х являє собою ОН або відхідну групу, з одержанням сполуки формули (XXIII):
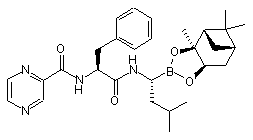 (XXIII); і
(XXIII); і
(h) зняття захисту фрагмента боронової кислоти з одержанням сполуки формули (XIV) або її ангідриду боронової кислоти.
56. Спосіб за п. 54, який відрізняється щонайменше однією з наступних ознак (1)-(5):
(1) у бор "ат" комплексі формули (XV) R3 і Y обидва являють собою хлор;
(2) стадія зв'язування (е) включає стадії:
(і) зв'язування сполуки формули (XVIII) зі сполукою формули (XIX), в якій Х являє собою ОН, у присутності 2-(1Н-бензотриазол-1-іл)-1,1,3,3-тетраметилуроній тетрафторборату (TBTU) і третинного аміну в дихлорметані;
(іі) заміну розчинників для заміщення дихлорметану етилацетатом; і
(ііі) промивання водою розчину етилацетату;
(3) стадія видалення захисної групи (f) включає стадії:
(і) обробки сполуки формули (XX) НСl в етилацетаті;
(іі) додавання гептану до реакційної суміші; і
(ііі) виділення шляхом кристалізації сполуки формули (XXI) як її НСl адитивної солі;
(4) стадія зв'язування (g) включає стадії:
(і) зв'язування сполуки формули (XXI) з 2-піразинкарбоновою кислотою у присутності TBTU і третинного аміну в дихлорметані;
(іі) заміну розчинників із заміщенням дихлорметану на етилацетат; і
(ііі) промивання водою розчину етилацетату; і
(5) стадія зняття захисту боронової кислоти (h) включає стадії:
(і) забезпечення двофазної суміші, яка містить сполуку формули (XXIII), органічний акцептор боронової кислоти, нижчий алканол, C5-8 вуглеводневий розчинник і водну мінеральну кислоту;
(іі) перемішування двофазної суміші з одержанням сполуки формули (XIV);
(ііі) відокремлення шарів розчиннику; і
(iv) екстрагування сполуки формули (XIV) або її ангідриду боронової кислоти в органічний розчинник.
57. Спосіб за п. 56, який відрізняється всіма п'ятьма ознаками (1)-(5).
58. Спосіб за п. 56, де стадія (h)(iii) включає стадії:
(1) відокремлення шарів розчиннику;
(2) доведення водного шару до основного рН;
(3) промивання водного шару органічним розчинником; і
(4) доведення водного шару до рН менш, ніж приблизно 8.
59. Спосіб за п. 58, де на стадії (h)(iii)(3) водний шар промивають дихлорметаном.
60. Спосіб за п. 58, де на стадії (h)(iv), сполуку формули (XIV) або її ангідрид боронової кислоти екстрагують в дихлорметані, розчинник замінюють на етилацетат і сполуку формули (XIV) або її ангідрид боронової кислоти кристалізують шляхом додавання гексану або гептану.
61. Спосіб за п. 60, де додавання гексану або гептану приводить до кристалізації циклічного тривимірного ангідриду боронової кислоти формули (XXIV):
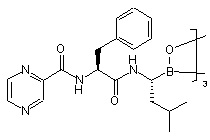 , (XXIV).
, (XXIV).
62. Спосіб одержання сполуки формули (XIV):
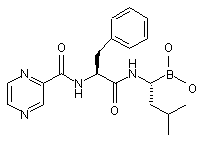 , (XIV)
, (XIV)
або її ангідриду боронової кислоти, який включає стадії:
(a) забезпечення борон "ат" комплексу формули (XV):
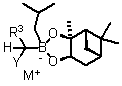 , (XV)
, (XV)
в якій
R3 являє собою нуклеофугну групу;
Y являє собою нуклеофугну групу; і
M+ являє собою лужний метал;
(b) контактування борон "ат" комплексу формули (XV) з кислотою Льюїса в умовах, за яких одержують сполуку боронового естеру формули (XVI):
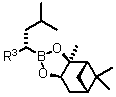 , (XVI)
, (XVI)
де вказану стадія контактування проводять у реакційній суміші, що містить:
(і) координуючий ефірний розчинник, який має низьку міру змішуваності з водою; або
(іі) ефірний розчинник, що має низьку міру змішуваності з водою, і координуючий співрозчинник, причому координуючий співрозчинник складає не більш, ніж приблизно 20 об. % реакційної суміші;
де розчинність води у ефірному розчиннику у (і) або (іі), що має низьку міру змішуваності з водою, становить менш, ніж 5 мас. %;
і де ефірний розчинник у (і) або (іі), що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об. % реакційної суміші;
(c) обробку сполуки боронового естеру формули (XVI) реагентом формули M1‑N(Si(R6)3)2, де M1 являє собою лужний метал, а кожен R6 незалежно вибирають з групи: алкілу, аралкілу та арилу, де арил чи арильний фрагмент аралкілу є необов׳язково заміщеними, з одержанням сполуки формули (XVII):
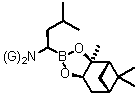 , (XVII)
, (XVII)
де кожен G являє собою -Si(R6)3;
(d) видалення (R6)3Si груп з одержанням сполуки формули (XVIII):
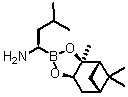 , (XVIII)
, (XVIII)
чи її кислої адитивної солі;
(e') звязування сполуки формули (XVIII) зі сполукою формули (XIXa):
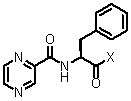 , (XIXa)
, (XIXa)
де X являє собою OH чи відхідну группу, з одержанням сполуки формули (XXIII):
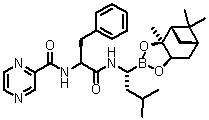 (XXIII); та
(XXIII); та
(f') зняття захисної групи з боронової кислоти з одержанням сполуки формули (XIV) чи її ангідриду борної кислоти.
63. Спосіб за п. 62, що відрізняється щонайменше однією з наступних ознак (1)-(3):
(1) у борон "ат" комплексі формули (XV), R3 та Y обидва являють собою хлор;
(2) стадія зв׳язування (e') включає стадії:
(i) зв׳язування сполуки формули (XVIII) зі сполукою формули (XIXa), де X являє собою OH у присутності 2-(1H-бензотріазол-1-іл)-1,1,3,3-тетраметилуроній тетрафтороборату (TBTU) та третинного аміну у дихлорметані;
(ii) заміну розчинника із заміщенням дихлорметану на етилацетат; та
(iii) промивання водою розчину етилацетату;
(3) стадія зняття захисту борної кислоти (f') включає стадії:
(i) одержання двофазної суміші, яка містить сполуку формули (XXIII), органічний акцептор боронової кислоти, нижчий алканол, C5-8 вуглеводневий розчинник і водну мінеральну кислоту;
(іі) перемішування двофазної суміші з одержанням сполуки формули (XIV);
(ііі) відокремлення шарів розчиннику; і
(iv) екстрагування сполуки формули (XIV) або її ангідриду боронової кислоти в органічний розчинник.
64. Спосіб за п. 63, де стадія (f')(iii) включає стадії:
(1) відокремлення шарів розчиннику;
(2) доведення водного шару до основного рН;
(3) промивання водного шару органічним розчинником; і
(4) доведення водного шару до рН менш, ніж приблизно 8.
65. Спосіб за п. 64, де на стадії (f')(iii)(3) водний шар промивають дихлорметаном.
66. Спосіб за п. 64, де на стадії (f')(iv) сполуку формули (XIV) або її ангідрид боронової кислоти екстрагують в дихлорметані, розчинник замінюють на етилацетат, сполуку формули (XIV) або її ангідрид боронової кислоти кристалізують шляхом додавання гексану або гептану.
67. Спосіб за п. 66, де додавання гексану або гептану приводить до кристалізації циклічного тривимірного ангідриду боронової кислоти формули (XXIV):
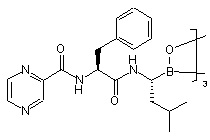 (XXIV).
(XXIV).
Текст
1. Спосіб одержання сполуки боронового естеру формули (І): 2 3 6. Спосіб за п.5, де ефірний розчинник, який має низьку міру змішуваності з водою, вибирають з групи: трет-бутил метилового естеру, трет-бутил етилового естеру, трет-аміл метилового естеру, ізопропілового естеру і їх сумішей. 7. Спосіб за п.1, де щонайменше приблизно 5 молів бор "ат" комплексу формули (II) забезпечують на стадії (а). 8. Спосіб за п.1, де щонайменше приблизно 20 молів бор "ат" комплексу формули (II) забезпечують на стадії (а). 9. Спосіб за п.1, де щонайменше приблизно 50 молів бор "ат" комплексу формули (II) забезпечують на стадії (а). 10. Спосіб за п.1, де щонайменше приблизно 100 молів бор "ат" комплексу формули (II) забезпечують на стадії (а). 11. Спосіб, за п.1, де кислоту Льюїса вибирають з групи: хлориду цинку, броміду цинку, хлориду заліза і броміду заліза. 12. Спосіб за п.11, де кислота Льюїса є вологою. 13. Спосіб за п.11, де на стадії (а) бор "ат" комплекс формули (II) забезпечують в розчині, який містить ефірний розчинник, який має низьку міру змішуваності з водою, і стадія контактування (b) включає стадії: (і) забезпечення розчину, який містить кислоту Льюїса і тетрагідрофуран; і (іі) додавання розчину кислоти Льюїса до розчину бор "ат" комплексу формули (II) зі стадії (а); де розчинність води у ефірному розчиннику, що має низьку міру змішуваності з водою, становить менш, ніж 5 мас.%; і де ефірний розчинник, що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об. % реакційної суміші. 14. Спосіб за п.11, де на стадії (а) бор "ат" комплекс формули (ІІ) забезпечують в розчині, який містить ефірний розчинник, який має низьку міру змішуваності з водою, і стадія контактування (b) включає стадії: (і) забезпечення розчину, який містить кислоту Льюїса і воду; і (іі) додавання розчину кислоти Льюїса до розчину бор "ат" комплексу формули (II) зі стадії (а); де розчинність води у ефірному розчиннику, що має низьку міру змішуваності з водою, становить менш, ніж 5 мас. %; і де ефірний розчинник, що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об. % реакційної суміші 15. Спосіб за п.1, де Y являє собою галоген. 16. Спосіб за п.1, де Y являє собою хлор. 17. Спосіб за п.1, де М+ вибирають з групи: Li+, Na+ і К+. 18. Спосіб за п.1, де R4 і R5, разом з проміжними атомами кисню і бору, утворюють необов'язково заміщений 5-членний цикл. 19. Спосіб за п.18, де R4 і R5 разом являють собою хіральний фрагмент. 20. Спосіб за п.19, де бор "ат" комплекс формули (II) являє собою: 90108 4 R3 R1 R2 Y R3 O R2 B O R1 B Y O O M+ або . 21. Спосіб за п.19, де стадія (b) забезпечує сполуку боронового естеру формули (І), в якій атом вуглецю, який несе R1, R2 і R3, являє собою хіральний центр, який має діастереомерне співвідношення, що становить щонайменше приблизно 96:4 по відношенню до хірального центру в R4-R5 хіральному фрагменті. 22. Спосіб за п.19, де стадія (b) забезпечує сполуку боронового естеру формули (І), в якій атом вуглецю, який несе R1, R2 і R3, являє собою хіральний центр, який має діастереомерне співвідношення щонайменше приблизно 97:3 по відношенню до хірального центру в R4-R5 хіральному фрагменті. 23. Спосіб за п.19, який відрізняється щонайменше однією з наступних ознак: (a) стадію контактування (b) проводять в реакційній суміші, яка містить трет-бутил метиловий естер; (b) кислота Льюїса являє собою хлорид цинку; (c) щонайменше приблизно 5 моль боронового естеру формули (II) забезпечують на стадії (а); (d) стадію контактування (b) проводять при температурі реакції в діапазоні від приблизно -60°С до приблизно -30°С; (e) кислота Льюїса є вологою; (f) Y являє собою хлор; (g) R3 являє собою хлор; (h) R2 являє собою водень; і (і) R1 являє собою С1-4аліфатичну групу. 24. Спосіб за п.23, який відрізняється щонайменше двома з ознак (а)-(і). 25. Спосіб за п.23, який відрізняється щонайменше трьома з ознак (а)-(і). 26. Спосіб за п.23, який відрізняється всіма девятьма ознаками (а)-(і). 27. Спосіб за п.1, де залишок містить щонайменше приблизно п'ять молів сполуки боронового естеру формули (І). 28. Спосіб за п.27, де сполука боронового естеру формули (І), присутня в залишку, має діастереомерне співвідношення, що становить щонайменше приблизно 96:4 на атомі вуглецю, який несе R1, R2 і R3, по відношенню до хірального центру в R4-R5 хіральному фрагменті. 29. Спосіб за п.27, де сполука боронового естеру формули (І), присутня в залишку, має діастереомерне співвідношення, що становить щонайменше приблизно 97:3 на атомі вуглецю, який несе R1 R2 і R3, по відношенню до хірального центру в R4-R5 хіральному фрагменті. 30. Спосіб одержання сполуки боронового естеру формули (І): M+ R1 R2 R3 OR4 B OR5 , (I) в якій R1 являє собою необов'язково заміщену С1С6-10арильнуабо (С6-10арил)(С18аліфатичну, 6аліфатичну) групу; 5 R2 являє собою водень або хлор; R3 являє собою хлор; і кожен з R4 і R5, незалежно, являє собою необов'язково заміщену аліфатичну, ароматичну або гете4 5 роароматичну групу, або R і R , взяті разом з проміжними атомами кисню і бору, утворюють необов'язково заміщений 5-10-членний цикл, що містить 0-2 додаткових цикличних гетероатоми, які вибирають з N, О або S; де вказаний спосіб включає: (a) забезпечення розчину, який містить (і) бороновий естер формули (III): R1 OR4 B OR5 , (III) в якій R1, R4 і R5 є таким, як визначено вище; і (іі) ефірний розчинник, який має низьку міру змішуваності з водою; де розчинність води у ефірному розчиннику, що має низьку міру змішуваності з водою, становить менш, ніж 5 мас. %.; (b) обробку розчину реагентом формули (IV): 90108 6 R1 являє собою необов'язково заміщену С1С6-10арильну або (С6-10арил)(С18аліфатичну, 6аліфатичну) групу; R2 являє собою водень або хлор; 3 R являє собою хлор; і кожен з R4 і R5, незалежно, являє собою необов'язково заміщену аліфатичну, ароматичну або гетероароматичну групу, або R4 і R5, взяті разом з проміжними атомами кисню і бору, утворюють необов'язково заміщений 5-10-членний цикл, яке містить 0-2 додаткових цикличних гетероатоми, які вибирають з N, О або S; де вказаний спосіб включає: (а) забезпечення розчину, який містить: (і) бороновий естер формули (III): R1 OR4 B OR5 , (III) в якій R1, R4 і R5 є такими, як визначено вище; (іі) сполуку формули (V): R2 R3 R3 H R2 Y - M+ Y , (IV) з одержанням бор "ат" комплекс формули (II): R3 R2 R1 Y B OR4 M+ OR5 , (II) в якій Y являє собою нуклеофугну групу; М+ являє собою катіон; і кожен з R1-R5 є таким, як визначено вище; і (c) контактування бор "ат" комплексу формули (II) з кислотою Льюїса в умовах, за яких одержують сполуку боронового естеру формули (І), де вказану стадію контактування проводять в реакційній суміші, яка містить: (і) координуючий ефірний розчинник, який має низьку міру змішуваності з водою; або (іі) ефірний розчинник, який має низьку міру змішуваності з водою, і координуючий співрозчинник, причому координуючий співрозчинник складає не більш, ніж приблизно 20 об. % реакційної суміші; де розчинність води у ефірному розчиннику у (і) або (іі), що має низьку міру змішуваності з водою, становить менш, ніж 5 мас.%; і де ефірний розчинник у (і) або (іі), що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об.% реакційної суміші; (d) промивання реакційної суміші водним розчином; і (e) концентрування промитої реакційної суміші видаленням розчинників для одержання залишку, який містить бороновий естер сполуки формули (І). 31. Спосіб одержання сполуки боронового естеру формули (І): R1 R2 R3 OR4 B OR5 в якій , (I) , (V) в якій Y являє собою нуклеофугну групу, і R2 і R3 є такими, як визначено вище; і (iіі) розчинник, який містить: (аа) координуючий ефірний розчинник, який має низьку міру змішуваності з водою; або (bb) ефірний розчинник, який має низьку міру змішуваності з водою, і координуючий співрозчинник, причому координуючий співрозчинник складає не більш, ніж приблизно 20 об. % реакційної суміші; де розчинність води у ефірному розчиннику у (аа) або (bb), що має низьку міру змішуваності з водою, становить менш, ніж 5 мас. %; і де ефірний розчинник у (аа) або (bb), що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об. % реакційної суміші; (b) обробку розчину стадії (а) сильною, стерично утрудненою основою з одержанням бор "ат" комплекс формули (II): R3 R2 R1 Y B OR4 OR5 M+ , (II) де М+ являє собою катіон, який походить від основи, і кожен Y і R1-R5 є зтакими, як визначено вище; і (c) контактування бор "ат" комплексу формули (II) з кислотою Льюїса в розчині, який містить ефірний розчинник, який має низьку міру змішуваності з водою, де розчинність води у ефірному розчиннику, що має низьку міру змішуваності з водою, становить менш, ніж 5 мас. %; і де ефірний розчинник, що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об.% реакційної суміші; (d) промивання реакційної суміші водним розчином; і (e) концентрування промитої реакційної суміші видаленням розчинників для одержання залишку, який містить бороновий естер сполуки формули (І). 7 32. Спосіб одержання сполуки боронового естеру формули (І): R2 R1 OR4 B R3 OR5 , (I) в якій R1 являє собою необов'язково заміщену С1С6-10арильну або (С6-10арил)(С18аліфатичну, 6аліфатичну) групу; R2 являє собою водень або хлор; R3 являє собою хлор; і R4 і R5, взяті разом, утворюють необов'язково заміщений зв'язувальний ланцюг, який містить 2-5 атомів вуглецю і 0-2 гетероатоми, які вибирають з групи, яка складається з N, О або S; де вказаний спосіб включає: (a) забезпечення розчину, який містить (і) сполуку боронової кислоти формули (VI): R1 OH B OH , (VI) 1 в якій R є таким, як визначено вище; (іі) сполуку формули HO-R4-R5-ОН, в якій R4 і R5 є такими, як визначено вище; і (ііі) органічний розчинник, який утворює азеотроп з водою; (b) нагрівання розчину стадії (а) зі зворотним холодильником, з азеотропним видаленням води, з одержанням боронового естеру формули (III): R1 OR4 B OR5 , (III) в якій R1, R4 і R5 є такими, як визначено вище; (c) забезпечення розчину, який містить: (і) бороновий естер формули (ІІІ); (іі) сполуку формули (V): R2 R3 90108 8 в якій М+ являє собою катіон, який походить від основи, і кожен з Y і R1-R5 є таким, як визначено вище; і (e) контактування бор "ат" комплексу формули (II) з кислотою Льюїса в розчині, який містить ефірний розчинник, що має низьку міру змішуваності з водою; де розчинність води у ефірному розчиннику, що має низьку міру змішуваності з водою, становить менш, ніж 5 мас. %; і де ефірний розчинник, що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об.% реакційної суміші; (f) промивання реакційної суміші водним розчином; і (g) концентрування промитої реакційної суміші шляхом видалення розчинників з одержанням залишку, який містить бороновий естер сполуки формули (І). 33. Спосіб за п.31 або 32, де стерично утруднена основа являє собою діалкіламідну основу лужного металу формули М2N(R#)2, в якій М2 вибирають з групи: Li, Na і К, і кожен R#, незалежно, являє собою розгалужену або циклічну С3-6аліфатичну групу. 34. Спосіб за п.32, де органічний розчинник на стадії (а) вибирають з групи: з ацетонітрилу, толуолу, гексану, гептану і їх сумішей. 35. Спосіб за п.32, де органічний розчинник на стадії (а) являє собою ефірний розчинник, який має низьку міру змішуваності з водою. 36. Спосіб за п.35, де розчини на стадіях (а) і (с) містять однаковий ефірний розчинник. 37. Спосіб за п.36, де стадія (b) забезпечує розчин продукту, який містить бороновий естер формули (III), і розчин продукту зі стадії (b) використовують на стадії (с) без виділення боронового естеру формули (III). 38. Спосіб одержання сполуки аміноборонового естеру формули (VII): R1 H Y , (V) в якій Y являє собою нуклеофугну групу, і R2 і R3 є зтакими, як визначено вище; і (ііі) розчинник, який містить: (аа) координуючий ефірний розчинник, який має низьку міру змішуваності з водою; або (bb) ефірний розчинник, який має низьку міру змішуваності з водою, і координуючий співрозчинник, причому координуючий співрозчинник складає не більш, ніж приблизно 20 об. % реакційної суміші; де розчинність води у ефірному розчиннику у (аа) або (bb), що має низьку міру змішуваності з водою, становить менш, ніж 5 мас. %; і де ефірний розчинник у (аа) або (bb), що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об. % реакційної суміші; (d) обробку розчину зі стадії (с) сильною, стерично утрудненою основою з одержанням бор "ат" комплексу формули (II): R3 R2 B OR4 OR5 OR5 , (VII) або її кислотної адитивної солі, в якій R1 являє собою необов'язково заміщену С1С6-10арильну або (С6-10арил)(С18аліфатичну, 6аліфатичну) групу; і кожен R4 і R5, незалежно, являє собою необов'язково заміщену аліфатичну, ароматичну або гетероароматичну групу, або R4 і R5, взяті разом з проміжними атомами кисню і бору, утворюють необов'язково заміщений 5-10-членний цикл, яке містить 0-2 додаткових цикличних гетероатоми, які вибирають з N, О або S; де вказаний спосіб включає: (a) забезпечення бор "ат" комплексу формули (II): R3 M+ , (II) R2 R1 Y R1 Y OR4 B H2 N B OR4 OR5 M+ , (II) в якій Y являє собою нуклеофугну групу; М+ являє собою катіон; 9 R2 являє собою водень; R3 являє собою хлор; і кожен з R1, R4 і R5 є таким, як визначено вище; (b) контактування бор "ат" комплексу формули (II) з кислотою Льюїса в умовах, за яких одержують сполуку боронового естеру формули (І): R1 R2 R3 OR4 B OR5 , (I) де кожен з R1-R5 є таким, як визначено вище, а вказану стадію контактування проводять в реакційній суміші, яка містить: (і) координуючий ефірний розчинник, який має низьку міру змішуваності з водою; або (іі) ефірний розчинник, який має низьку міру змішуваності з водою, і координуючий співрозчинник, причому координуючий співрозчинник складає не більш, ніж приблизно 20 об. % реакційної суміші; де розчинність води у ефірному розчиннику у (і) або (іі), що має низьку міру змішуваності з водою, становить менш, ніж 5 мас. %; і де ефірний розчинник у (і) або (іі), що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об. % реакційної суміші; де розчинність води у ефірному розчиннику, що має низьку міру змішуваності з водою, що становить менш, ніж 5 мас.%.; (c) обробку сполуки боронового естеру формули (І) реагентом формули М1-N(Si(R6)3)2, де М1 являє собою лужний метал і кожен R6 незалежно вибирають з групи: алкілу, аралкілу і арилу, де арил або арильний фрагмент аралкілу є необов'язково заміщеними, з одержанням побічного продукту формули M1-R3 і сполуки формули (VIII): R1 OR4 B (G)2N 90108 10 43. Спосіб за п.42, де температура реакції знаходиться в діапазоні від приблизно -50°С до приблизно 25°С. 44. Спосіб за п.42, де температура реакції знаходиться в діапазоні від приблизно -30 °С до приблизно 0°С. 45. Спосіб за п.38, де стадія (d) включає обробку сполуки формули (VIII) кислотою і виділення сполуки формули (VII) як кислої адитивної солі. 46. Спосіб за п.45, де кислота являє собою трифтороцтову кислоту. 47. Спосіб за п.38, де стадія (с) додатково включає фільтрування реакційної суміші із забезпеченням фільтрату, який містить сполуку формули (VIII). 48. Спосіб за п.47, де на стадії (с) реагент формули M1-N(Si(R6)3)2 додають до реакційної суміші як розчин, що містить тетрагідрофуран, і стадія (с) додатково включає видалення тетрагідрофурану перед фільтруванням реакційної суміші. 49. Спосіб за п.47, де фільтрат використовують безпосередньо на стадії (d). 50. Спосіб за п.38, який додатково включає стадію: (e) зв'язування сполуки формули (VII) зі сполукою формули (IX): R7 P1 X N H O , (IX) в якій Р1 являє собою блокуючий фрагмент аміногрупи; R7 вибирають з групи: водню, С1-10аліфатичної групи, необов'язково заміщеної С6-10арильної групи або С1-6аліфатичної-R8 групи; і R8 вибирають з групи: алкокси, алкілтіо, необов'язково заміщеної арильної, гетероарильної і гетероциклільної груп, і необов'язково захищеної аміно, гідрокси і гуанідино груп; і Х являє собою ОН або відхідну групу; з одержанням сполуки формули (Х): OR4 R7 OR5 , (VIII) в якій кожен G являє собою -Si(R6)3 і R1-R5 є такими, як визначено вище; і (d) видалення G груп з одержанням сполуки формули (VII): R1 OR4 H2 N B OR5 , (VII) або її кислотної адитивної солі. 39. Спосіб за п.38, де реакційна суміш на стадії (с) містить органічний розчинник, де проміжний продукт M1-R3 має низьку розчинність. 40. Спосіб за п.39, де М1 являє собою Li і R3 являє собою Сl. 41. Спосіб за п.40, де реакційна суміш на стадії (с) включає органічний розчинник, який вибирають з групи: метилциклогексану, циклогексану, гептану, гексану, толуолу і їх сумішей. 42. Спосіб за п.38, де реакцію на стадії (с) проводять при температурі реакції в діапазоні від приблизно -100°С до приблизно 50°С. P1 H N N H B OR5 O R1 , (X) в якій кожен з Р , R1, R4, R5 і R7 є таким, як визначено вище. 51. Спосіб за п.50, де Р1 являє собою розщеплювану захисну групу. 52. Спосіб за п.51, який додатково включає стадії: (f) розщеплення захисної групи Р1 з одержанням сполуки формули (XI) 1 OR4 R7 H N H2N B OR5 O R1 , (XI) або її кислотної адитивної солі, в якій кожен з R1, 4 5 7 R , R і R є таким, як визначено вище; (g) зв'язування сполуки формули (XI) з реагентом формули Р2-Х, в якій Р2 являє собою блокуючий фрагмент аміногрупи, і Х являє собою відхідну групу з одержанням сполуки формули (XII): 11 OR4 R7 P2 H N N H B OR5 O R1 , (XII) в якій кожен з Р1, R1, R4, R5 і R7 є таким, як визначено вище; і (h) зняття захисту фрагменту боронової кислоти з одержанням сполуки формули (XIII): R7 P2 O B R1 , (XIII) або її ангідриду боронової кислоти, в якій кожен з Р1, R1 і R7 є таким, як визначено вище. 53. Спосіб одержання сполуки аміноборонового естеру формули (VIIa): R1 B OR5 , (VIIa) або її кислотної адитивної солі, в якій R1 являє собою необов'язково заміщену аліфатичну, ароматичну або гетероароматичну групу; і R4 і R5, взяті разом з проміжними атомами кисню і бору, утворюють необов'язково заміщений хіральний циклічний бороновий естер; де вказаний спосіб включає: (а) забезпечення бор "ат" комплексу формули (IIа): R1 B OR4 M+ , (IIа) в якій Y являє собою нуклеофугну групу; M+ являє собою катіон; R2 являє собою водень; R3 являє собою нуклеофугну групу; і R4 і R5 є такими, як визначено вище; (b) контактування бор "ат" комплексу формули (IIа) з кислотою Льюїса в умовах, за яких одержують сполуку боронового естеру формули (Iа): OR5 R1 R2 R3 B OR5 , (VIIIa) в якій кожен G і R1-R5 є таким, як визначено вище; і (d) видалення G груп з одержанням сполуки формули (VIIa): R1 OR4 B H2N OR5 OR4 Y R1 OR4 OH R3 і де ефірний розчинник у (і) або (іі), що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об. % реакційної суміші; (c) обробку сполуки боронового естеру формули 1 1 (Іа) реагентом формули M -N(G)2, де М являє собою лужний метал і кожен G являє собою захисний фрагмент аміногрупи, з одержанням сполуки формули (VIIIa): (G)2N H N R2 12 OH N H H2N 90108 OR4 B 5 OR , (Ia) в якій кожен з R1–R5 є таким, як визначено вище, а вказану стадію контактування проводять в реакційній суміші, яка містить: (і) координуючий ефірний розчинник, який має низьку міру змішуваності з водою; або (іі) ефірний розчинник що має низьку міру змішуваності з водою, і координуючий співрозчинник, причому координуючий співрозчинник складає не більш, ніж приблизно 20 об. % реакційної суміші; де розчинність води у ефірному розчиннику у (і) або (іі), що має низьку міру змішуваності з водою, становить менш, ніж 5 мас. %; (VIIa), або її кислотної адитивної солі. 54. Спосіб одержання сполуки аміноборонового естеру формули (VIIb): R1 OR4 B H2N OR5 (VIIb) або її кислотної адитивної солі, в якій R1 являє собою необов'язково заміщену аліфатичну, ароматичну або гетероароматичну групу; і R4 і R5 взяті разом з проміжними атомами кисню і бору, утворюють необов'язково заміщений хіральний циклічний бороновий естер; де вказаний спосіб включає: (а) забезпечення бор "ат" комплексу формули (IIb): R3 R2 R1 Y B OR4 M+ OR5 , (IIb) в якій Y являє собою нуклеофугну групу; M+ являє собою катіон; R2 являє собою водень; R3 являє собою нуклеофугну групу; і R4 і R5 є такими, як визначено вище; (b) контактування бор "ат" комплексу формули (IIb) з кислотою Люїса в умовах, за яких одержують сполуку боронового естеру формули (Ib): R1 R2 R3 OR4 B OR5 , (Іb) в якій кожен з R1–R5 є таким, як визначено вище, а вказану стадію контактування проводять в реакційній суміші, яка містить: (і) координуючий ефірний розчинник, який має низьку міру змішуваності з водою; або 13 90108 (іі) ефірний розчинник, що має низьку міру змішуваності з водою, і координуючий співрозчинник, причому координуючий співрозчинник складає не більш, ніж приблизно 20 об.% реакційної суміші; де розчинність води у ефірному розчиннику у (і) або (іі), що має низьку міру змішуваності з водою, становить менш, ніж 5 мас.%; і де ефірний розчинник у (і) або (іі), що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об. % реакційної суміші; (c) обробку сполуки боронового естеру формули (Іb) реагентом формули M1-N(G)2, де М1 являє собою лужний метал і кожен G являє собою захисний фрагмент аміногрупи, з одержанням сполуки формули (VIIIb): 14 де вказану стадію контактування проводять в реакційній суміші, яка містить ефірний розчинник, який має низьку міру змішуваності з водою; де розчинність води у ефірному розчиннику, що має низьку міру змішуваності з водою, становить менш, ніж 5 мас. %.; і де ефірний розчинник, що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об. % реакційної суміші; (с) обробку сполуки боронового естеру формули (XVI) реагентом формули М1-N(G)2, в якій М1 являє собою лужний метал і кожен G окремо чи разом являє собою захисну групу аміногрупи, з одержанням сполуки формули (XVII): R1 OR4 B (G)2N O B (G)2N O OR5 , (VIIIb) в якій кожен G і R1-R5 є такими, як визначено вище; і (d) видалення G груп з одержанням сполуки формули (VIIb): , (XVII) (d) видалення G груп з одержанням сполуки формули (XVIII): R1 OR4 B H2N O OR5 , (VIIb) або її кислотної адитивної солі. 55. Спосіб одержання сполуки формули (XIV): O N B OH , (XIV) або її ангідриду боронової кислоти, де вказаний спосіб включає: (a) забезпечення бор "ат" комплексу формули (XV): H Y N H O , (XIX) в якій Р1 являє собою розщеплюваний захисний фрагмент аміногрупи; і X являє собою ОН або відхідну групу; з одержанням сполуки формули (XX): O B O M+ B H N P1 N H , (XV) в якій R3 являє собою нуклеофугну групу; Y являє собою нуклеофугну групу; М+ являє собою лужний метал; (b) контактування бор "ат" комплексу формули (XV) з кислотою Льюїса в умовах, за яких одержують сполуку боронового естеру формули (XVI): R3 X P1 O R3 , (XVIII) або її кислотної адитивної солі; (е) зв'язування сполуки формули (XVIII) зі сполукою формули (XIX); OH H N N H N O B H2N O O , (XX) в якій Р1 є таким, як визначено вище; (f) видалення захисної групи Р1 з одержанням сполуки формули (XXI): H N H2N O O B O B O O O , (XVI) , (XXI) або її кислотної адитивної солі; 15 90108 (g) зв'язування сполуки формули (XXI) з реагентом формули (XXII): N X N O , (ХХII) в якій Х являє собою ОН або відхідну групу, з одержанням сполуки формули (XXIII): O N N N H H N O B O O , (XXIII); і (h) зняття захисту фрагмента боронової кислоти з одержанням сполуки формули (XIV) або її ангідриду боронової кислоти. 56. Спосіб за п.54, який відрізняється щонайменше однією з наступних ознак (1)-(5): (1) у бор "ат" комплексі формули (XV) R3 і Y обидва являють собою хлор; (2) стадія зв'язування (е) включає стадії: (і) зв'язування сполуки формули (XVIII) зі сполукою формули (XIX), в якій Х являє собою ОН, у присутності 2-(1Н-бензотриазол-1-іл)-1,1,3,3тетраметилуроній тетрафторборату (TBTU) і третинного аміну в дихлорметані; (іі) заміну розчинників для заміщення дихлорметану етилацетатом; і (ііі) промивання водою розчину етилацетату; (3) стадія видалення захисної групи (f) включає стадії: (і) обробки сполуки формули (XX) НСl в етилацетаті; (іі) додавання гептану до реакційної суміші; і (ііі) виділення шляхом кристалізації сполуки формули (XXI) як її НСl адитивної солі; (4) стадія зв'язування (g) включає стадії: (і) зв'язування сполуки формули (XXI) з 2піразинкарбоновою кислотою у присутності TBTU і третинного аміну в дихлорметані; (іі) заміну розчинників із заміщенням дихлорметану на етилацетат; і (ііі) промивання водою розчину етилацетату; і (5) стадія зняття захисту боронової кислоти (h) включає стадії: (і) забезпечення двофазної суміші, яка містить сполуку формули (XXIII), органічний акцептор боронової кислоти, нижчий алканол, C5-8 вуглеводневий розчинник і водну мінеральну кислоту; (іі) перемішування двофазної суміші з одержанням сполуки формули (XIV); (ііі) відокремлення шарів розчиннику; і (iv) екстрагування сполуки формули (XIV) або її ангідриду боронової кислоти в органічний розчинник. 57. Спосіб за п.56, який відрізняється всіма п'ятьма ознаками (1)-(5). 58. Спосіб за п.56, де стадія (h)(iii) включає стадії: (1) відокремлення шарів розчиннику; (2) доведення водного шару до основного рН; 16 (3) промивання водного шару органічним розчинником; і (4) доведення водного шару до рН менш, ніж приблизно 8. 59. Спосіб за п.58, де на стадії (h)(iii)(3) водний шар промивають дихлорметаном. 60. Спосіб за п.58, де на стадії (h)(iv), сполуку формули (XIV) або її ангідрид боронової кислоти екстрагують в дихлорметані, розчинник замінюють на етилацетат і сполуку формули (XIV) або її ангідрид боронової кислоти кристалізують шляхом додавання гексану або гептану. 61. Спосіб за п.60, де додавання гексану або гептану приводить до кристалізації циклічного тривимірного ангідриду боронової кислоти формули (XXIV): O N N H N H N O B 3 O , (XXIV). 62. Спосіб одержання сполуки формули (XIV): O N O H N N H B O O N , (XIV) або її ангідриду боронової кислоти, який включає стадії: (a) забезпечення борон "ат" комплексу формули (XV): R3 O H B Y - O M+ , (XV) в якій R3 являє собою нуклеофугну групу; Y являє собою нуклеофугну групу; і M+ являє собою лужний метал; (b) контактування борон "ат" комплексу формули (XV) з кислотою Льюїса в умовах, за яких одержують сполуку боронового естеру формули (XVI): R3 B O O , (XVI) де вказану стадія контактування проводять у реакційній суміші, що містить: (і) координуючий ефірний розчинник, який має низьку міру змішуваності з водою; або (іі) ефірний розчинник, що має низьку міру змішуваності з водою, і координуючий співрозчинник, причому координуючий співрозчинник складає не більш, ніж приблизно 20 об. % реакційної суміші; 17 де розчинність води у ефірному розчиннику у (і) або (іі), що має низьку міру змішуваності з водою, становить менш, ніж 5 мас. %; і де ефірний розчинник у (і) або (іі), що має низьку міру змішуваності з водою, складає щонайменше приблизно 70 об. % реакційної суміші; (c) обробку сполуки боронового естеру формули (XVI) реагентом формули M1 -N(Si(R6)3)2, де M1 являє собою лужний метал, а кожен R6 незалежно вибирають з групи: алкілу, аралкілу та арилу, де арил чи арильний фрагмент аралкілу є необов׳язково заміщеними, з одержанням сполуки формули (XVII): B O (G)2N O , (XVII) де кожен G являє собою -Si(R6)3; (d) видалення (R6)3Si груп з одержанням сполуки формули (XVIII): H2N B O O , (XVIII) чи її кислої адитивної солі; (e') звязування сполуки формули (XVIII) зі сполукою формули (XIXa): O N N H N X O , (XIXa) де X являє собою OH чи відхідну группу, з одержанням сполуки формули (XXIII): O N N N H H N O B O 90108 18 (1) у борон "ат" комплексі формули (XV), R3 та Y обидва являють собою хлор; (2) стадія зв׳язування (e') включає стадії: (i) зв׳язування сполуки формули (XVIII) зі сполукою формули (XIXa), де X являє собою OH у присутності 2-(1H-бензотріазол-1-іл)-1,1,3,3тетраметилуроній тетрафтороборату (TBTU) та третинного аміну у дихлорметані; (ii) заміну розчинника із заміщенням дихлорметану на етилацетат; та (iii) промивання водою розчину етилацетату; (3) стадія зняття захисту борної кислоти (f') включає стадії: (i) одержання двофазної суміші, яка містить сполуку формули (XXIII), органічний акцептор боронової кислоти, нижчий алканол, C5-8 вуглеводневий розчинник і водну мінеральну кислоту; (іі) перемішування двофазної суміші з одержанням сполуки формули (XIV); (ііі) відокремлення шарів розчиннику; і (iv) екстрагування сполуки формули (XIV) або її ангідриду боронової кислоти в органічний розчинник. 64. Спосіб за п.63, де стадія (f')(iii) включає стадії: (1) відокремлення шарів розчиннику; (2) доведення водного шару до основного рН; (3) промивання водного шару органічним розчинником; і (4) доведення водного шару до рН менш, ніж приблизно 8. 65. Спосіб за п.64, де на стадії (f')(iii)(3) водний шар промивають дихлорметаном. 66. Спосіб за п.64, де на стадії (f')(iv) сполуку формули (XIV) або її ангідрид боронової кислоти екстрагують в дихлорметані, розчинник замінюють на етилацетат, сполуку формули (XIV) або її ангідрид боронової кислоти кристалізують шляхом додавання гексану або гептану. 67. Спосіб за п.66, де додавання гексану або гептану приводить до кристалізації циклічного тривимірного ангідриду боронової кислоти формули (XXIV): O (XXIII); та (f') зняття захисної групи з боронової кислоти з одержанням сполуки формули (XIV) чи її ангідриду борної кислоти. 63. Спосіб за п.62, що відрізняється щонайменше однією з наступних ознак (1)-(3): Даний винахід відноситься до синтезу сполук боронового ефіру і кислоти. Більш конкретно, винахід відноситься до великомасштабних способів синтезу для одержання сполук боронового ефіру і кислоти шляхом стимульованого кислотою Люїса перегрупування бор "ат" комплексів. Сполуки боронової кислоти та ефіру демонструють різноманітність фармакологічно корисних біологічних активностей. Shenvi et al, U.S. Pat. No.4,499,082 (1985) розкриває те, що пептидборо O N N N H H N O B 3 O (XXIV). нові кислоти являють собою інгібітори певних протеолітичних ензимів. Kettner і Shenvi, U.S. Pat. No.5,187,157 (1993), U.S. Pat. No.5,242,904 (1993), і U.S. Pat. No.5,250,720 (1993) описує клас пептидних боронових кислот, які інгібують трипсинподібні протеази. Kleeman et al., U.S. Pat. No.5,169,841 (1992), розкриває N-кінцеві модифіковані пептидні боронові кислоти, які інгібують дію реніну. Kinder et al, U.S. Pat. No.5,106,948 (1992) розкриває те, що 19 певні сполуки трипептидборонової кислоти інгібують зростання ракових клітин. Нещодавно сполуки боронової кислоти та ефіру проявили особливу перспективу бути використаними як інгібітори протеасоми, мультикаталітичної протеази, відповідальної за більшу частину внутрішньоклітинного обігу білка. Ciechanover, Cell, 79: 13-21 (1994) розкриває, що протеасома являє собою протеолітичний компонент шляху убікутин-протеасома, в якому білки є мішенню для розпаду шляхом кон'югації численних молекул убікутину. Ciechanover також розкриває те, що шлях убікутин-протеасома відіграє ключову роль у множині важливих фізіологічних процесів. Adams et al, U.S. Pateni No.5,780,454 (1998), U.S Patent No.6,066,730 (2000),U.S. Patent No.6,083,903 (2000), U.S. Patent No.6,297,217 (2001), U.S. Patent No.6,548,668 і U.S. Patent No.6,617,317 (2003), які повністю включені в даний опис за допомогою посилання, описують сполуки пептидного боронового ефіру та кислоти, корисні як інгібітори протеасоми. Посилання також розкривають застосування сполук боронового ефіру та кислоти для зменшення ступеню розпаду м'язового білка, для зменшення активності NF-κΒ у клітині, для зменшення ступню розпадання р53 білка у клітині, для інгібування розпадання цикліну у клітині, для інгібування зростання ракових клітин, для інгібування презентації антигену в клітині, для інгібування NF-κΒ залежної клітинної адгезії і для інгібування реплікації ВІЛ. Albanell і Adams, Drugs of the Future 27: 10791092 (2002) розкриває те, що один такий інгібітор протеасоми пептидної боронової кислоти, бортезоміб (N-2-піразинкарбоніл-L-фенілаланін-Lлейцинборонова кислота) проявляє значну протипухлинну активність на моделях ксентрансплантату людської пухлини і на даний момент клінічно оцінюється. Richardson et al., New Engl. J. Med., 348: 2609 (2003) повідомляє про результати Фази 2 дослідження бортезомібу, показуючи його ефективність у лікуванні рецидивуючої і важковиліковної множинної мієломи. Дослідження інгібіторів протеази боронової кислоти значно просунулись вперед шляхом розвитку хімії щодо одержання функціоналізованих сполук боронової кислоти, зокрема альфа-гало- і alpha-аміноборонової кислот. Matteson і Majumdar, J. Am.Chem Soc, 102: 7590 (1980) розкриває спосіб одержання альфа-хлорборонових ефірів шляхом гомологізації боронових ефірів, і Matteson і Ray, J. Am. Chem. Soc, 102: 7591 (1980) повідомляє, що хіральний контроль реакції гомологізації може бути досягнуто шляхом застосування пінандіолових боронових ефірів. Про одержання сполук альфааміноборонової кислоти та ефіру з відповідних альфа-хлорборонових ефірів також повідомлялось (Matteson et al, J. Am. Chem. Soc, 103: 5241 (1981); Shenvi, U.S. Patent No.4,537,773 (1985)). Matteson і Sadhu, U.S;. Patent No.4,525,309 (1985) розкриває вдосконалену методику гомологізації боронових ефірів шляхом перегрупування проміжного бор "ат" комплексу у присутності каталізатора кислоти Льюїса. Як повідомляється, кислота Льюїса сприяє реакції перегрупування і міні 90108 20 мізує епімеризацію альфа-вуглецевого атома. Однак, для оптимальних результатів вимагається повне видалення води і ретельний контроль стехіометрії кислоти Льюїса. Ці ознаки спричиняють ускладнення при реакції з тим, щоб вдало бути виконаною у промисловому масштабі, і обмежують можливість одержання фармацевтично важливих сполук боронового ефіру, таких як бортезоміб. Таким чином, в рівні техніки залишається потреба удосконалити способи великомасштабного одержання сполук боронового ефіру та кислоти. Даний винахід забезпечує вдосконалені способи синтезу для великомасштабного одержання сполук боронового ефіру та кислоти. Ці способи забезпечують підвищений вихід і чистоту, підвищений об'єм випуску і більшу легкість поводження у порівнянні зі способами з попереднього рівня техніки. Особливо, способи, розкриті в даному описі, є придатними для серійного виробництва у великому, багатокілограмовому масштабі, що обмежується лише розміром доступної виробничої бази. Способи за даним винаходом, зокрема, є переважними для синтезу хіральних сполук боронового ефіру та кислоти, включаючи сполуки альфа-аміноборонового ефіру та кислоти. Незалежно від масштабу, бажані продукти одержують з дуже високою хімічною та стереохімічною чистотою. Патентна та наукова література, на яку тут посилаються, встановлює рівень знань, що є доступним кваліфікованим в даній галузі фахівцям. Якщо інше не зазначено, всі технічні та наукові терміни, які тут використовуються, мають те ж саме значення, яке є загальновідомим для звичайних фахівців у галузі, до якої відноситься даний винахід. Хоча способи та матеріали подібні або еквівалентні до тих, які тут розкрито, можуть бути використані у практиці або дослідженні даного винаходу, переважні способи та матеріали розкриті саме тут. Видані патенти, заявки та посилання, які цитовані в даному описі, включені в нього за допомогою посилання в гому обсязі, в якому кожний з них міг би бути окремо зазначений як такий, що включений за допомогою посилання. У випадку неузгодженостей слід керуватись даним описом, включаючи визначення. В доповнення, матеріали, способи і приклади є лише ілюстративними і не призначені жодним чином обмежувати даний винахід. Термін "близько", який використовується в даному описі, означає приблизно, в межах, орієнтовно, близько. Коли термін "близько" використовують в поєднанні з діапазоном числових значень, він варіює цей діапазон шляхом розширення меж вище та нижче встановлених числових значень. Загалом, термін "близько" використовують в даному описі для того, щоб варіювати значення вище або нижче встановленого значення шляхом коливань на 10%. Термін "включає" використовують в даному описі як такий, що означає "включає, але не обмежується". Термін "аліфатичний", як використано в даному описі, означає нерозгалужений, розгалужений або циклічний С1-12 вуглеводень, який повністю насичений або який містить одну або більше оди 21 ниць ненасичення, але не є ароматичним. Наприклад, прийнятні аліфатичні групи включають заміщену або незаміщену лінійну, розгалужену або циклічну алкільну, алкенільну, алкінільну групи і їх суміші, такі як (циклоалкіл)алкіл, (циклоалкеніл)алкіл або (циклоалкіл)алкеніл. У різних втіленнях, аліфатичні група має 1-12, 1-8, 1-6 або 1-4 вуглеців. Терміни "алкіл", "алкеніл" і "алкініл", використані окремо або як частина більшого фрагмента, відносяться до нерозгалуженої або розгалуженої аліфатичної групи, яка має від 1 до 12 атомів вуглецю, яка є необов'язково заміщеною одним, двома або трьома замісниками. Для цілей даного винаходу, термін "алкіл" буде використано, коли атом вуглецю, який прикріпляє аліфатичну групу до частини молекули, яка залишилась, являє собою насичений вуглецевий атом. Однак, алкільна група може включати ненасичення в інших атомах вуглецю. Таким чином, алкільні групи включають, без обмеження, метил, етил, пропіл, аліл, пропаргіл, бутил, пентил і гексил. Для цілей даного винаходу, термін "алкеніл" буде використано, коли атом вуглецю, який прикріпляє аліфатичну групу до частини молекули, яка залишилась, утворює частину подвійного зв'язку вуглець-вуглець. Алкенільні групи включають, без обмеження, вініл, 1-пропеніл, 1-бутеніл, 1-пентеніл і 1-гексеніл. Для цілей даного винаходу, термін "алкініл", коли атом вуглецю, який прикріпляє аліфатичну групу до частини молекули, яка залишилась, утворює частину потрійного зв'язку вуглецьвуглець. Алкінільні групи включають, без обмеження, етиніл, 1-пропініл, 1-бутиніл, 1-пентиніл і 1гексиніл. Терміни "циклоалкіл", "карбоцикл", "карбоцикліл", "карбоцикло", або "карбоциклічний", використані окремо або як частина більшого фрагмента, означають насичену або частково ненасичену аліфатичну кільцеву систему, яка має від 3 до близько 14 членів, в якій аліфатична кільцева система є необов'язково заміщеною. Циклоалкільні групи включають, без обмеження, циклопропіл, циклобугил, циклопентил, циклопентеніл, циклогексил, циклоциклогексеніл, циклогетил, циклогептеніл, циклооктил, циклооктеніл і циклооктадієніл. У деяких втіленнях циклоалкіл має 3-6 вуглеців. Терміни "циклоалкіл", "карбоцикл", "карбоцикліл", "карбоцикло" або "карбоциклічний" також включають аліфатичні кільця, які є прикріпленими до одного або більше ароматичних або неароматичних кілець, таких як декагідронафтил або тетрагідронафтил, де радикал або точка прикріплення знаходиться на аліфатичному кільці. Терміни "галоалкіл", "галоалкеніл" і "галоалкокси" відносяться до алкільної, алкенільнї або алкоксигруп, в залежності від обставин, заміщених одним або більше атомами галогену. Як використано в даному описі, термін "галоген" або "гало" означає F, С, Вr або І. Якщо інше не вказано, терміни "алкіл", "алкеніл" і "алкокси" включають галоалкільну, галоалкенільну і галоалкоксигрупи, включаючи, зокрема, ті, які мають 1-5 атомів фтору. Терміни "арил" і "ар-", використані окремо або як частина більшого фрагмента, наприклад, "арал 90108 22 кіл", "аралкокси" або "арилоксіалкіл", відносяться до С6-4 ароматичного фрагмента, який включає від одного до трьох ароматичних кілець, які є необов'язково заміщеними Переважно, арильна група являє собою С6-10 арильну групу. Арильні групи включають, без обмеження, феніл, нафтил і антраценіл. Термін "арил", як використано в даному описі, також включає групи, в яких ароматичне кільце прикріплене до одного або більше неароматичних кілець, таких як інданіл, фенантридиніл або тетрагідронафтил, де радикал або точка прикріплення знаходиться на аліфатичному кільці. Термін "арил" може бути використано взаємозамінно з терміном "арильне кільце". "Аралкільна" або "арилалкільна" група включає арильну групу, ковалентно прикріплену до алкільної групи, будь-яка з яких незалежно є необов'язково заміщеною. Переважно, аралкільна група являє собою С6-10 арил(С1-6)алкіл, включаючи, без обмеження, бензил, фенетил і нафтилметил. Терміни "гетероарил" і "гетероар-", використані окремо або як частина більшого фрагмента, наприклад, гетероаралкіл, або "гетероаралкокси", відносяться до груп, які мають від 5 до 14 кільцевих атомів, переважно 5, 6, 9 або 10 кільцевих атомів; які мають 6, 10 або 14 електронів, розподілених у циклічному порядку; і які мають, в доповнення до атомів вуглецю, від одного до чотирьох гетероатомів, які вибирають з групи, яка складається з Ν, Ο і S. Гетероарильні групи включають, без обмеження, тієніл, фураніл, піроліл, імідазоліл, піразоліл, триазоліл, тетразоліл, оксазоліл, ізоксазоліл, оксадіазоліл, тіазоліл, ізотіазоліл, тіадіазоліл, піридил, піридазиніл, пірмідиніл, піразиніл, індоліл, ізоіндоліл, бензотієніл, бензофураніл, дибензофураніл, індазоліл, бензімідазоліл, бензтіазоліл, пуриніл, хіноліл, ізохіноліл, цинолініл, фталазиніл, хіноксалініл, нафтиридиніл, птеридиніл, карбазоліл, акридиніл і феназиніл. Терміни "гетероарил" і "гетероар-", як використано в даному описі, також включають групи, в яких гетероароматичне кільце прикріплене до одного або більше неароматичних кілець, де радикал або точка прикріплення знаходиться на аліфатичному кільці. Необмежувальні приклади включають тетрагідрохінолініл, тетрагідроізохінолініл і піридо[3,4d]піримідиніл. Термін "гетероарил" може бути використано взаємозамінно з терміном "гетероарильне кільце" або терміном "гетероароматичний", будь-який з термінів включає кільця, які необов'язково заміщені. Термін "гетероаралкіл" відноситься до алкільної групи, заміщеної гетероарилом, в якій алкільна і гетероарильна частини незалежно є необов'язково заміщеними. Як використано в даному описі, терміни "гетероцикл", "гетероцикліл" або "гетероциклічний радикал" відносяться до стійкого 5-7-членного моноциклічного або 7-10-членного біциклічного гетероциклічного фрагмента, який є або насиченим або частково ненасиченим, і який має, в доповнення до атомів вуглецю, один або більше, переважно від одного до чотирьох, гетероатомів, які вибирають з групи, яка складається з Ν, Ο і S, в якій гетероатоми азоту і сірки необов'язково окислюють і атоми азоту необов'язково кватернізують. 23 Гетероциклічне кільце може бути прикріплене до своєї бічної групи в будь-якому гетероатомі або атомі вуглецю, що приводить до стійкої структури, і будь-який з кільцевих атомів може бути необов'язково заміщеним. Приклади таких насичених або частково ненасичених гетероциклічних радикалів включають, без обмеження, тетрагідрофураніл, тетрагідротієніл, піролідиніл, піролідоніл, піперидиніл, піролініл, тетрагідрохінолініл, тетрагідроізохінолініл, декагідрохінолініл, оксазолідиніл, піперазиніл, діоксаніл, діоксоланіл, діазепініл, оксазепініл, тіазепініл і морфолініл. Терміни "гетероцикл", "гетероцикліл" і "гетероциклічний радикал", як використано в даному описі, також включають групи, в яких кільце, яке містить неароматичний гетероатом, прикріплене до одного або більше неароматичних кілець, таких як індолініл, хроманіл, фенантридиніл або тетрагідрохінолініл, де радикал або точка прикріплення знаходиться на кільці, як містить неароматичний гетероатом. Термін "гетероциклілалкіл" відноситься до алкільної групи, заміщеної гетероциклілом, де алкільна і гетероциклільна частини незалежно є необов'язково заміщеними. Як використано в даному описі, термін "частково ненасичений" відноситься до кільцевого фрагмента, який включає щонайменше один подвійний або потрійний зв'язок між кільцевими атомами. Термін "частково ненасичений" призначений включати кільця, які мають одну або множину ділянок ненасичення, але не призначений включати арильну або гетероарильну частини, як тут визначено. Термін "заміщений", як використано в даному описі, означає, що один або більше атомів водню вказаного фрагмента заміщені, за умови, що заміщення приводить до стійкої або хімічно припустимої сполуки. Стійка сполука або хімічно припустима сполука являє собою ту, в якій хімічна структура у значній мірі не змінюється, коли сполуку зберігають при температурі 40°С або нижче, за відсутності вологи або інших хімічно реагуючих станів, протягом щонайменше тижня, або сполуку, яка підтримує свою цілісність протягом досить тривалого часу для того, щоб бути корисною для способів синтезу за даним винаходом. Вираз "один або більше замісників", як використано в даному описі, відноситься до числа замісників, яке дорівнює від одного до максимального числа замісників, основуючись на кількості доступних зв'язувальних ділянок, за умови, що задовольняються вказані вище умови відносно стабільності або хімічної припустимості. Арильна група (включаючи арильний фрагмент в аралкілі, аралкокси, арилоксиалкілі і подібному) або гетероарильна група (включаючи гетероарильний фрагмент в гетероаралкілі і гетероарилалкокси і подібному) може містити один або більше замісників. Приклади прийнятних замісників на ненасиченому вуглецевому атомі арильної або гетероарильної групи включають -гало, NO2, -CN, -R*, -OR*, -SR°, -N(R+)2, -NR+C(O)R*, NR+C(O)N(R+)2, -NR+CO2R°, -O-CO2R*, -O-C(O)R*-, -CO2R*, -C(O)R* -C(O)N(R+)2, -OC(O)N(R+)2, S(O)2R°, -SO2N(R+)2, -S(O)R° і -NR+SO2N(R+)2. Кож 90108 24 ний R+ незалежно вибирають з групи, яка складається з R*, -C(O)R*, -CO2R* і -SO2R*, або два R+ на тому ж атомі азоту, взяті разом з атомом азоту, утворюють 5-8-членне ароматичне або неароматичне кільце, яке має, в доповнення до азоту, 0-2 кільцевих гетероатомів, які вибирають з Ν, Ο і S. Кожний R* незалежно являє собою водень або необов'язково заміщену аліфатичну, арильну, гетероарильну або гетероциклільну групу. Кожний R° незалежно являє собою необов'язково заміщену аліфатичну або арильну групу. Аліфатична група також може бути заміщена одним або більше замісниками. Приклади прийнятних замісників на насиченому вуглеці аліфатичної групи або неароматичного гетероциклічного кільця включають, без обмеження, ті, які перелічені вище для ненасиченого вуглецю арильної або гетероарильної групи. Дані винахідники виявили, що вимога відносно бездоганно сухого обладнання, розчинників і реагентів, які характеризуються попередньо розкритими методиками для стимульованого кислотою Люїса перегрупування бор "ат" комплексів, може бути усунена шляхом застосування ефірного розчинника, який має низьку міру зміщуваності з водою. Дивовижно, що застосування такого розчинника дозволяє реакції протікати у багатокілограмовому масштабі без погіршання виходу або чистоти. По суті, масштаб реакції обмежується лише розміром доступної промислової бази. В одному аспекті, таким чином, винахід забезпечує великомасштабний спосіб одержання сполуки боронового ефіру формули (І): (I) в якій: R1 являє собою необов'язково заміщену аліфатичну, ароматичну або гетероароматичну групу; R2 являє собою водень, нуклеофугну групу або необов'язково заміщену аліфатичну, ароматичну або гетероароматичну групу; R3 являє собою нуклеофугну групу або необов'язково заміщену аліфатичну, ароматичну або гетероароматичну групу; і кожний з R4 і R5, незалежно, являє собою необов'язково заміщену аліфатичну, ароматичну або гетероароматичну групу, або R4 і R5, взяті разом з проміжними атомами кисню і бору, утворюють необов'язково заміщене 5-10-членне кільце, яке має 0-2 додаткових кільцевих гетероатоми, які вибирають з Ν, Ο або S. Спосіб включає стадії: (a) забезпечення бор "ат" комплексу формули (II): (II) в якій Υ являє собою нуклеофугну групу; М+ являє собою катіон; і кожний з R1-R5 є таким же, як визначено тут вище; і 25 (b) контактування бор "ат" комплексу формули (II) з кислотою Льюїса в умовах, які дають сполуку боронового ефіру формули (І), вказану стадію контактування проводять в реакційній суміші, яка включає: (і) координуючий ефірний розчинник, який має низьку міру зміщуваності з водою; або (іі) ефірний розчинник, який має низьку міру зміщуваності з водою, і координуючий співрозчинник. Способи, про які йшла мова, для стимульованого кислотою Льюїса перегрупування бор "ат" комплексів залучають тетрагідрофуран, ефірний розчинник, який є повністю змішуваним з водою. Неспроможність залучити досконально сухе обладнання, розчинники і реагенти у цих способах приводить до значного зменшення у діастереоізомерному співвідношенні. Гігроскопічні кислоти Льюїса, зокрема, типово повинні бути одразу висушені полум'ям перед застосуванням у реакції. Хоча методики для проходження чутливих до вологи реакцій є відомими кваліфікованим в даній галузі фахівцям і регулярно практикуються у промисловому масштабі, такі реакції є дорогими і важкими для здійснення у збільшеному масштабі. Більш того, спроба збільшити масштаб виробництва у способах попереднього рівня техніки приводить до подальшого погіршення діастереоізомерного співвідношення протягом обробки і виділення продукту сполуки боронового ефіру. Matteson і Erdiik, Organometallics, 2: 1083 (1983), повідомляє, що піддавання продуктів альфагалоборонового ефіру дії вільного іону галогеніду приводить до епімеризації в альфа-вуглецевому центрі. Не бажаючи бути зв'язаними з теорією, дані винахідники вірять, що епімеризація є практично проблематичною протягом реакційної обробки та/або наступних стадій. Наприклад, як вважають, епімеризація виникає протягом концентрації реакційної суміші для того, щоб видалити тетрагідрофурановий розчинник і змінити його на водонерозчинний розчинник. Неспроможність повністю видалити тетрагідрофуран також негативно впливає на діастереоізомерне співвідношення протягом наступних промивань водою. Важко запобігти піддаванню продукту дії іону галогеніду протягом цих стадій, особливо коли реакцію виконують у великому масштабі. Дані винахідники виявили, що перетворення бор "ат" комплексів переважно виконувати в ефірному розчиннику, який має низьку міру зміщуваності з водою. Застосування таких розчинників усуває потребу у зміні розчинників перед промиваннями водою, навіть при виконанні у великому масштабі. Переважно, розчинність води в ефірному розчиннику є меншою, ніж близько 5%ваг./ваг., більш переважно менше, ніж близько 2%ваг./ваг. У різних втіленнях, ефірний розчинник, який має низьку міру зміщуваності з водою, складає щонайменше близько 70%, щонайменше близько 85%, щонайменше близько 90% або щонайменше близько 95% об./об. реакційної суміші. Ефірний розчинник переважно являє собою той, який придатний для регулярного застосування у великомасштабному виробництві. Як використа 90108 26 но в даному описі, термін "великомасштабний" відноситься до реакції, яка використовує щонайменше близько 5молей щонайменше одного вихідного матеріалу. Переважно, великомасштабний спосіб використовує щонайменше 10, 20, 50 або 100молей щонайменше одного вихідного матеріалу. Для цілей даного винаходу термін "ефір" відноситься до будь-якого класу хімічних сполук, які мають атом кисню, прикріплений до двох атомів вуглецю. "Ефірний розчинник" являє собою ефірну сполуку, яка існує у рідкій формі при бажаній температурі реакції і є здатною до розчинення вихідного матеріалу(ів) та/або продукту(ів) реакції. Необмежувальні приклади ефірних розчинників, придатних для застосування у способі даного винаходу, включають трет-бутил метиловий ефір, трет-бутил етиловий ефір, трет-аміл метиловий ефір та ізопропіловий ефір. В одному втіленні, реакційна суміш надалі містить координуючий співрозчинник. В іншому втіленні ефірний розчинник, який має низьку міру зміщуваності з водою, є достатньо координуючим, так що немає потреби у координуючому співрозчиннику. Для цілей даного винаходу, терміни "координуючий співрозчинник" та "координуючий розчинник" відносяться до розчинника, який здатний координувати кислоту Льюїса та розчиняти іонні компоненти реакції. Утруднені ефірні розчинники, такі як трет-бутил метиловий ефір, є недостатньо координуючими і їх переважно використовують з координуючим співрозчинником. Необмежувальні приклади координуючих співрозчинників, придатних для застосування на практиці даного винаходу, включають тетрагфдрофуран, діоксан, воду та їх суміші. У деяких втіленнях, реакційна суміш містить щонайменше близько 5% або щонайменше 10% об./об. координуючого співрозчинника. Переважно, кількість водорозичнного координуючого співрозчинника, присутнього у реакційній суміші, не є такою високою, щоб бути перешкодою фазі розділення протягом реакції або обробки. У різних втіленнях координуючий співрозчинник складає не більше, ніж близько 20%, близько 15% або близько 10% об./об. реакційної суміші. Як використано в даному описі, термін "нуклеофугний" відноситься до будь-якої групи, яка є здатною до перенесеного нуклеофільного заміщення в умовах перебудови даного способу. Такі нуклеофугні групи є відомими з рівня техніки. Переважно, нуклеофугна група являє собою галоген, більш переважно хлор або бром. В ході реакції перебудови, перетворюючи бор "ат" комплекс формули (II) у сполуку боронового ефіру формули (І), нуклеофугна група Υ вивільняється як Υ'. З метою прикладу, коли Υ являє собою хлор, хлоридний іон вивільняється на стадії (b). Змінна М+ являє собою будь-який катіонний протиіон для негативно зарядженого чотирьохвалентного атома бору формули (II). У деяких переважних втіленнях М+ вибирають з групи, яка складається з Li+, Na+ і K+. Кваліфікований в даній галузі фахівець визначить, що сіль M+Y- утворю 27 ється як побічний продукт у реакції перебудови стадії (b). Змінна R переважно являє собою групу з хорошою схильністю до міграції. У деяких втіленнях, 1 R являє собою С1-8 аліфатичну, С6-10 арильну, або (С6-10арил)(С1-6 аліфатичну) групу, будь-яка з яких необов'язково заміщена. У певних втіленнях, R1 являє собою С1-4 аліфатичну групу, переважно ізобутил. Змінна R переважно являє собою водень, нуклеофугну групу або необов'язково заміщену С1С6-10арильну або (С6-10арил)(С18аліфатичну, 3 6аліфатичну) групу. Змінна R переважно являє собою нуклеофугну групу або необов'язково заміщену С1-8аліфатичну, С6-10 арильну або (С610арил)(С1-6аліфатичну) групу. Кваліфікований в даній галузі фахівець визначить, що функціональні замісники можуть бути присутніми на будь-якому з R1, R2 або R3, за умови, що функціональний замісник не є перешкодою для утворення бор "ат" комплексу формули (II). Одне втілення винаходу відноситься до способу одержання сполуки боронового ефіру формули (І), в якій R3 являє собою нуклеофугну групу. Такі сполуки є корисними як посередники синтезу сполук альфа-заміщеного боронового ефіру і кислоти, включаючи сполуки альфа-аміноборонового ефіру і кислоти, як розкрито нижче. У певних втіленнях R3 являє собою нуклеофугну групу і R2 являє собою водень. Змінні R4 і R5 можуть бути однаковими або різ4 5 ними. У деяких втіленнях, R і R є безпосередньо зв'язаними, так що R4 і R5, взяті разом з проміжними атомами кисню і бору, утворюють необов'язково заміщене 5-10-членне кільце, яке може мати 02 додаткові кільцеві гетероатоми, які вибирають з Ν, Ο або S. У деяких втіленнях, кільце являє собою 5- або 6-членне кільце, переважно 5-членне кільце. Даний винахід є особливо переважним для стимульованої кислотою Льюїса перебудови бор "ат" комплексів формули (II), в якій R4 і R5 є безпосередньо зв'язаними і разом являють собою хіральний фрагмент. Одне втілення даного винаходу відноситься до перебудови таких хіральних бор "ат" комплексів для того, щоб забезпечити сполуку боронового ефіру формули (І), в якій атом вуглецю, який несе R1, R2 і R3, являє собою хіральний центр. Реакція перебудови переважно протікає з високим ступенем стереоспрямування R4-R5 хіральним фрагментом для того, щоб забезпечити сполуку боронового ефіру формули (І), яка має діастереомерне співвідношення на атомі вуглецю, який несе R1, R2 і R3, щонайменше близько 96:4 по відношенню до хірального центра в R4-R5 хіральному фрагменті. Переважно, діастереомерне співвідношення складає щонайменше близько 97:3. Терміни "стереоізомер", "енантіомер", "діастереомер", "епімер" і "хіральний центр" використовують в даному описі відповідно до значення, яке надане при звичайному застосуванні кваліфікованим в даній галузі фахівцем. Таким чином, стереоізомери являють собою сполуки, які мають однакову атомну зв'язаність, але відрізняються у просторовому розташуванні атомів. Енантіомери 90108 28 являють собою стереоізомери, які мають взаємовідношення дзеркального відображення, що означає, що стереохімічна конфігурація на всіх відповідних хіральних центрах є протилежною. Діастереомери являють собою стереоізомери, які мають більше, ніж один хіральний центр, які відрізняються один від одного тим, що стереохімічна конфігурація щонайменше одного, але не всіх, з відповідних хіральних центрів є протилежною. Епімери являють собою діастереомери, які відрізняються за стереохімічною конфігурацією тільки на одному хіральному центрі. Як використано в даному описі, термін "діастереомерне співвідношення" відноситься до співвідношення між діастереомерами, які відрізняються за стереохімічною конфігурацією на одному хіральному центрі, по відношенню до другого хірального центра в тій же молекулі 3 метою прикладу, хімічна структура з двома хіральними центрами забезпечує чотири можливі стереоізомери: R*R, R*S, S*R, і S*S, де зірочка означає відповідний хіральний центр в кожному стереоізомері. Діастереомерне співвідношення для такої суміші стереоізомерів являє собою співвідношення одного діастереомера і його енантіомера до іншого діастереомера і його енантіомера =(R*R+S*S):(R*S+S*R). Кваліфікований в даній галузі фахівець визначить, що додаткові стереоізомери є можливими, коли молекула має більше, ніж два хіральних центри. Для цілей даного винаходу, термін "діастереомерне співвідношення" має теж значення у посиланні на сполуки з множинними хіральними центрами, що і у посиланні на сполуки, які мають два хіральні центри. Таким чином, термін "діастереомерне співвідношення" відноситься до співвідношення всіх сполук, які мають R*R або S*S конфігурацію у визначених хіральних центрах до всіх сполук, які мають R*S або S*R конфігурацію у визначених хіральних центрах. Для зручності, на це співвідношення тут посилаються як на діастереомерне співвідношення на поміченому зірочкою вуглеці, по відношенню до другого визначеного хірального центра. Діастереомерне співвідношення може бути виміряне будь-яким аналітичним методом, придатним для розрізнення між діастереомерними сполуками, які мають різні порівняльні стереохімічні конфігурації у визначених хіральних центрах. Такі методи включають, без обмеження, ядерний магнітний резонанс (ЯМР), газову хроматографію (ГХ) та високоефективну рідинну хроматографію (ВЕРХ). Як обговорювалось вище, одне втілення даного винаходу спрямоване на способи, які забезпечують сполуку боронового ефіру формули (І), яка має діастереомерне співвідношення на атомі вуглецю, який несе R1, R2 і R3, щонайменше близько 96:4 по відношенню до хірального центра в R4-R5 хіральному фрагменті. Кваліфікований в даній галузі фахівець визначить, що R4-R5 хіральний фрагмент може сама містити більше, ніж один хіральний центр. Коли R4-R5 має більше, ніж один хіральний центр, вона переважно має високу діастереомерну чистоту, і діастереомерне співвідно 29 шення на атомі вуглецю, який несе R1, R2 і R3 може бути виміряне по відношенню до будь-якого з хіральних центрів у R4-R5. У способах за даним винаходом, R4-R5 хіральний фрагмент переважно має високий рівень енантіомерної чистоти. Для цілей даного винаходу, термін "енантіомерна чистота" використовують зі значенням "енантіомеріний надлишок", що являє собою кількість, на яку значні енантіомери перевищують незначні енантіомери, виражену у процентах до загального. Переважно, R4-R5 хіральний фрагмент має енантіомерну чистоту щонайменше близько 98%, більш переважно щонайменше близько 99%, ще більш переважно щонайменше близько 99,5% і найбільш переважно щонайменше близько 99,9%. Коли R4-R5 хіральний фрагмент має дуже високу енантіомерну чистоту, діастереомерне співвідношення на атомі вуглецю, який несе R1, R2, R3, приблизно дорівнює епімерному співвідношенню в цьому центрі, тобто, діастереомерне співвідношення (R*R):(S*R) або (R*S):(S*S) (R*):(S*). Як використано в даному описі, термін "епімеріне співвідношення" відноситься до співвідношення продукту, який має одну абсолютну стереохімічну конфігурацію в заданому хіральному центрі, до продукту, який має протилежну стереохімічну конфігурацію у відповідному хіральному центрі. Переважно, продукти мають однакові стереохімічні конфігурації на всіх інших відповідних хіральних центрах. В одному втіленні, таким чином, винахід відноситься до перебудови хірального бор "ат" комплексу формули (II) для того, щоб забезпечити сполуку боронового ефіру формули (І), в якій епімерне співвідношення на атомі вуглецю, який несе R1, R2 і R3, складає щонайменше близько 96:4, більш переважно щонайменше близько 97:3. Кислоти Льюїса, придатні для застосування на практиці даного винаходу, являють собою ті, які здатні до комплексоутворення з нуклеофугною групою для того, щоб покращити її розташування при міграції R1. Переважно, кислота Льюїса є додатково здатною до координування з атомом кисню, прикріпленим до бору. Необмежувальні приклади придатних кислот Льюїса включають бромід цинку, хлорид цинку, бромід заліза і хлорид заліза. У певних переважних втіленнях, кислота Льюїса являє собою хлорид цинку. Стадію контактування переважно виконують при низькій температурі, але вона також може бути виконана при температурі навколишнього середовища або підвищеній температурі. Вибір відповідної температури реакції буде сильно залежати від залученої кислоти Льюїса, а також від здатності до міграції R1 фрагмента. Кваліфікований в даній галузі фахівець буде здатний вибрати придатну температуру, беручи до уваги використовувані умови реакції. У деяких втіленнях, стадію контактування виконують при температурі реакції щонайменше близько -100°С, -78°С або -60°С. У деяких втіленнях, стадію контактування виконують при температурі реакції, яка не перевищує близько 80°С, 40°С або 30°С. Будь-який діапазон, включаючи ці високі та низькі температури, включені в об'єм даного 90108 30 винаходу. Переважно, стадію контактування виконують при температурі реакції в діапазоні від близько -100°С до близько 80°С, від близько -70°С до близько 40°С, від близько -60°С до близько 30°С або від близько -50°С до близько 30°С. У певних переважних втіленнях, стадію контактування починають при низькій температурі, переважно в діапазоні від близько -70°С до близько -30°С, а потім реакційній суміші дають нагрітись, переважно до температури навколишнього середовища. Несподівано, спосіб даного винаходу не вимагає спеціальних застережень з тим, щоб запобігти присутності води під час самої реакції перебудови. У деяких втіленнях, залучають вологу кислоту Льюїса, з мінімальним пошкодженням у діастереомерному співвідношенні. Коли використано у відношенні кислоти Льюїса, термін "вологий" означає, що вміст води в кислоті Льюїса є більшим, ніж близько 100, 200, 500 або 1,000м.ч. Дивовижно, але кислота Льюїса може бути навіть додана до реакційної суміші у формі водного розчинну без шкідливого впливу на діастереомерне співвідношення. У деяких втіленнях, таким чином, спосіб даного винаходу включає стадії: (a) забезпечення розчину, який містить бор "ат" комплекс формули (II) і (і) координуючий ефірний розчинник, який має низьку міру зміщуваності з водою; або (іі) ефірний розчинник, який має низьку міру змішуваності з водою, і координуючий співрозчинник; і (b) додавання до розчину стадії (а) розчину кислоти Льюїса, який містить воду і кислоту Льюїса. У деяких інших втіленнях, розчин кислоти Льюїса включає тетрагідрофуран і кислоту Льюїса. Таким чином, на відміну від способів з попереднього рівня техніки, спосіб даного винаходу легко піддається великомасштабному виробництву. У різних втіленнях, щонайменше близько 5, 10, 20, 50, 100, 500 або 1000молей бор "ат" комплексу формули (II) контактує з кислотою Льюїса в умовах, які дають сполуку боронового ефіру формули (І). Винахід далі забезпечує композицію, яка містить сполуку боронового ефіру формули (І), як описано тут вище, та ефірний розчинник, який має низьку міру змішуваності з водою. Композиція переважно включає щонайменше близько 5, 10, 20, 50, 100, 500 або 1000молей сполуки боронового ефіру формули (І). У певних втіленнях, R4 і R5 разом являють собою хіральний фрагмент, і сполука формули (І), присутня у композиції, має діастереомерне співвідношення щонайменше близько 96:4 на атомі вуглецю, який несе R1, R2 і R3, по відношенню до хірального центра в R4-R5 хіральному фрагменті. Обробка реакції переважно включає промивання реакційної суміші водним розчином і концентрування промитої реакційної суміші шляхом видалення розчинників для того, щоб дати залишок, який містить сполуку боронового ефіру формули (І). Переважно, залишок включає щонайменше близько 5, 10, 20, 50, 100, 500 або 1000молей сполуки боронового ефіру формули (І). У тих втіленнях, в яких R4-R5 являє собою хіральний фраг 31 90108 мент, сполука боронового ефіру формули (І), присутня в залишку, переважно має діастереомерне співвідношення щонайменше близько 96:4 на атомі вуглецю, який несе R1, R2 і R3, по відношенню 4 5 до хірального центра в R -R хіральному фрагменті. Більш переважно, діастереомерне співвідношення складає щонайменше близько 97:3. Бор "ат" комплекс формули (II) може бути одержаний будь-яким відомим способом, але переважно його одержують реакцією боронового ефіру формули (III): (III) з реагентом формули (IV): (IV) + 1 5 де кожний з М , Υ і R -R є такими ж, як визначено вище для бор "ат" комплексу формули (II). У деяких втіленнях, реакцію виконують при температурі реакції щонайменше близько -100°С, -78°С або -60°С. У деяких втіленнях, реакцію виконують при температурі реакції не більше, ніж близько 0°С, -20°С або -40°С. Будь-який діапазон, охоплюючи ці високі та низькі температури, включені в об'єм даного винаходу. Реакцію переважно виконують при температурі реакції в діапазоні від близько -100°С до близько 0°С, від близько -78°С до близько -20°С або від близько -60°С до близько 40°С. У деяких втіленнях, бор "ат" комплекс формули (II) одержують у розчині, який містить ефірний розчинник, який має який має низьку міру змішуваності з водою, і реакційну суміш безпосередньо обробляють кислотою Льюїса, щоб спричинити перебудову в сполуку боронового ефіру формули (І). У деяких втіленнях, реагент формули (IV) утворюють in situ. Такі втілення включають стадії: (і) забезпечення розчину, який містить сполуку боронового ефіру формули (III), як визначено вище, і сполуку формули (V): (V) 2 3 в якій R і R є такими ж, як визначено для реагенту формули (IV); і (іі) обробку розчину сильною, стерично утрудненою основою для того, щоб утворити бор "ат" комплекс формули (II). У деяких втіленнях, стерично утруднена основа являє собою основи діалкіламіду лужних металів формули Μ2N(R#)2, в якій Μ2 являє собою Li, Na або K, і кожний R# незалежно являє собою розгалужену або циклічну С3-6 аліфатичну групу. In situ утворення реагенту формули (IV) є особливо переважним у тих втіленнях, коли Υ являє собою нуклеофугну групу, завдяки нестійкості реагенту формули (IV). Бороновий ефір формули (III) можна одержати будь-яким відомим способом, але звичайно його одержують етерифікацією відповідної сполуки боронової кислоти, наприклад, способами, розкритими у Brown et al., Organometallics, 2 1311-1316 (1983). Циклічні боронові ефіри формули (III) переважно одержують шляхом: 32 (a) забезпечення розчину, який містить: (і) сполуку боронової кислоти формули R1B(OH)2; (іі) сполуку формули HO-R4-R5-OH, в якій R4 і 5 R , взяті разом, являють собою необов'язково заміщений зв'язувальний ланцюг, який містить 2-5 атомів вуглецю і 0-2 гетероатомів, які вибирають з групи, яка складається з О, N і S; і (in) органічний розчинник, який утворює азеотроп з водою; і (b) нагрівання розчину зі зворотним холодильником з азеотропним видаленням води. Як використано при посиланні на R4 і R5, термін "зв'язувальний ланцюг" відноситься до найкоротшого лінійного ланцюга атомів, які зв'язують атоми кисню, до яких прикріплені R4 і R5. Зв'язувальний ланцюг необов'язково заміщений на будьякому ланцюговому атомі, і один або більше ланцюгових атомів також можуть утворювати частину кільцевої системи, яка має спільний атом у сусідніх кілець, прикріплена або утворює місток лінійного зв'язувального ланцюга. З метою прикладу, але не обмежуючи жодним чином, у деяких втіленнях сполука формули HO-R4-R5-OH являє собою пінандіол, який має структуру. У таких втіленнях, зв'язувальний ланцюг R4-R5 включає два атоми вуглецю, які разом утворюють один бік біцикло[3.1.1]гептан кільцевої системи, і один з яких додатково заміщений метильною групою. У деяких втіленнях, сполука формули HO-R45 R -OH являє собою хіральний діол, переважно той, який має високу діастереомерну та енантіомерну чистоту. Кваліфікований в даній галузі фахівець оцінить, що в такому втіленні, сполука формули HO-R4-R5-OH залучена як хіральний помічник, щоб спрямувати стереохімічну конфігурацію на вуглець, який несе R1, R2 і R3. Хіральні діоли, корисні як хіральні помічники в органічному синтезі, є добре відомими з рівня техніки. Необмежувальні приклади включають 2,3-бутандіол, переважно (2R,3R)-(-)-2,3-бутандіол або (2S,3S)(+)-2,3-бутандіол; пінандіол, переважно (1R,2R,3R,5S)-(-)-пінандіол або (1S,2S,3S,5R)-(+)пінандіол; 1,2-циклопентандіол, переважно (1S,2S)-(+)-транс-1,2-циклопентандіол або (1R,2R)(-)-транс-1,2-циклопентандіол; 2,5-гександіол, переважно(2S,5S)-2,5-гександіол або (2R,5R)-2,5гександіол; 1,2-дициклогексил-1,2-етандіол, переважно (1R,2R)-1,2-дициклогексил-1,2-етандіол або (1S,2S)-1,2-дициклогексил-1,2-етандіол; гідробензоїн, переважно (S,S)-(-)-гідробензоїн або (R,R)(+)-гідробензоїн; 2,4-пентандіол, переважно (R,R)(-)-2,4-пентандіол або (S,S,)-(+)-2,4-пентандіол; еритронічний -лактон, переважно D-еритронічний -лактон. Карбогідрати, наприклад 1,2,5,6симетрично захищений маніт, також можуть бути використані як хіральні діоли. Необмежувальні приклади органічних розчинників, придатні для застосування в реакції етерифікації включають ацетонітрил, толуол, гексан, гептан і їх суміші. У деяких втіленнях, органічний 33 90108 розчинник являє собою ефірний розчинник, переважно ефірний розчинник, який має низьку міру зміщуваності з водою. У певних переважних втіленнях, реакцію етерифікації виконують в ефірному розчиннику, який має низьку міру зміщуваності з водою, і розчин продукту, який містить бороновий ефір формули (III), використовують безпосередньо на наступній стадії, без виділення боронового ефіру. Як зазначено вище, спосіб за даним винаходом вперше дозволяє обробку великомасштабних реакцій без значних погіршень у діастереомерному співвідношенні. В іншому аспекті, таким чином, винахід забезпечує композицію, яка містить щонайменше близько 5, 10, 20, 50, 100, 500 або 1000молей сполуки боронового ефіру формули (І): (I) в якій: R1 являє собою необов'язково заміщену аліфатичну, ароматичну або гетероароматичну групу; R2 являє собою водень, нуклеофугну групу або необов'язково заміщену аліфатичну, ароматичну або гетероароматичну групу; R5 являє собою нуклеофугну групу або необов'язково заміщену аліфатичну, ароматичну або гетероароматичну групу; і R4 і R5, взяті разом з проміжними атомами кисню і бору, утворюють необов'язково заміщене 510-членне хіральне кільце, яке має 0-2 додаткових кільцевих гетероатоми, які вибирають з Ν, Ο або S; де атом вуглецю, до якого прикріплені R1, R2 і 3 R , являє собою хіральний центр, який має діастереомерне співвідношення щонайменше близько 96:4, переважно щонайменше близько 97:3, по відношенню до хірального центра в R -R хіральному фрагменті. Переважні значення для R1-R3 є такими, як описано вище. Переважно, розчинники складають менше, ніж близько 30%ваг./ваг., 20%ваг./ваг., 10%ваг./ваг. або 5%ваг./ваг. сполуки відповідно до даного аспекту винаходу. У деяких втіленнях, сполука боронового ефіру формули (І) складає щонайменше близько 70%ваг./ваг., 80%ваг./ваг., 90%ваг./ваг. або 95%ваг./ваг. композиції. Одне втілення відноситься до композиції, описаної вище, в якій щонайменше одна з наступних характеристик присутня: (a) R3 являє собою хлор; (b) сполука боронового ефіру (І) являє собою (c) R2 являє собою водень; і (d) R1 являє собою С1-4 аліфатичну групу. Всі сполуки боронового ефіру формули (І), присутні у композиції, можуть бути одержані єдиною партією. Для цілей даного винаходу, термін "партія" відноситься до виконання синтетичного способу, в якому кожну стадію способу виконують тільки один раз. Переважно, сполуку боронового 34 ефіру формули (І), присутню в композиції, одержують єдиною партією способу відповідно до першого аспекту даного винаходу. Кваліфікований в даній галузі фахівець оцінить, що одержання заданої кількості продукту єдиною партією великомасштабного способу є більш ефективним і забезпечує більш гомогенний продукт, ніж одержання тієї ж кількості продукту повторюваним виконанням дрібномасштабного способу. Сполуки боронового ефіру формули (І), в якій R3 являє собою нуклеофугну групу є корисними як посередники для синтезу сполук альфааміноборонового ефіру. В іншому аспекті, таким чином, винахід забезпечує великомасштабний спосіб одержання альфа-аміноборонового ефіру, переважно способом, який включає такі стадії: (a) забезпечення бор "ат" комплексу формули (II): (II) в якій Υ являє собою нуклеофугну групу, М+ являє собою катіон; R1 являє собою необов'язково заміщену аліфатичну, ароматичну або гетероароматичну групу; R2 являє собою водень; R3 являє собою нуклеофугну групу; і кожний R4 і R5, незалежно, являють собою необов'язково заміщену аліфатичну, ароматичну або гетероароматичну групу, або R4 і R5, взяті разом з проміжними атомами кисню і бору, утворюють необов'язково заміщене 5-10-членне кільце, яке має 0-2 додаткових кільцевих гетероатоми, які вибирають з Ν, Ο або S; (b) контактування бор "ат" комплексу формули (II) з кислотою Льюїса в умовах, які дають сполуку боронового ефіру формули (І): (I) в якій кожний R1-R5 є таким же, як визначено вище, вказану стадію контактування проводять в реакційній суміші, яка містить: (і) координуючий ефірний розчинник, який має низьку міру змішуваності з водою; або (іі) ефірний розчинник, який має низьку міру змішуваності з водою, і координуючий співрозчинник; і (c) обробку сполуки боронового ефіру формули (І) реагентом формули М1-N(G)2, де М1 являє собою лужний метал і кожний G індивідуально або разом являє собою захисну групу аміногрупи для того, щоб утворити побічний продукт формули М'R3 і сполуку формули (VIII): (VIII) в якій кожний G і R1-R5 є такими ж, як визначено тут вище; і (d) видалення G груп для того, щоб утворити сполуку формули (VII): 35 90108 (VII) або її кислотну адитивну сіль. У деяких втіленнях, на стадії (с), сполуку боронового ефіру формули (І) обробляють реагентом формули M1-N(Si(R6)3)2, де М1 являє собою лужний метал і кожний R6 незалежно вибирають з групи, яка складається з алкілу, аралкілу і арилу, де арил або арильна частина аралкілу є необов'язково заміщеними. Реакцію сполуки боронового ефіру формули (І) з реагентом формули М1-N(G)2 переважно проводять при температурі реакції в діапазоні від близько -100°С до близько 50°С, переважно від близько -50°С до близько 25°С і більш переважно від близько -30°С до близько 0°С. У деяких втіленнях, R3 являє собою гало, переважно хлор, і М1 являє собою Li. Для того, щоб покращити виділення продукту формули (VIII), реакційна суміш переважно включає органічний розчинник, в якому проміжний продукт М'-R3 має низьку розчинність. Необмежувальні приклади придатних органічних розчинників включають метилциклогексан, циклогексан, гептан, гексан і толуол. У деяких втіленнях, стадія (с) надалі включає фільтрування реакційної суміші для того, щоб видалити M1-R3, і забезпечити фільтрат, який містить сполуку формули (VIII). Переважно, фільтрат використовують безпосередньо на стадії (d). У тих втіленнях, в яких реакційна суміш включає органічний розчинник, в якому проміжний продукт M1-R3 має низьку розчинність, реакційна суміш може додатково містити розчинник, в якому проміжний продукт M1-R3 має високу розчинність. У таких випадках, розчинник, в якому проміжний продукт M1-R3 має високу розчинність, переважно видаляють до фільтрування реакційної суміші. З метою прикладу, у деяких втіленнях, реагент формули M1-N(Si(R6)3)2 додають до реакційної суміші як розчин, який містить тетрагідрофуран. У таких втіленнях, стадія (с) переважно надалі включає видалення тетрагідрофурану перед фільтруванням реакційної суміші. Кваліфіковані в даній галузі фахівці знайомі з різними способами, які можуть бути використані для видалення захисних груп G у сполуці формули (VIII), включаючи, наприклад, водний гідроліз або обробку кислотою. Продукт альфаамінобороновий ефір формули (VII) має низьку стабільність і переважно є миттєво дериватизованим (Matteson et al, J. Am. Chem.Soc, 103: 5241 (1981)) або виділеним як кислотна адитивна сіль. У деяких втіленнях, стадія (d) включає обробку сполуки формули (VIII) кислотою та виділення сполуки формули (VII) як кислотної адитивної солі. У певних переважних втіленнях, кислота являє собою трифтороцтову кислоту, а сполуку формули (VII) виділяють як адитивну сіль трифтороцтової кислоти. Як обговорювалось вище, способи за даним винаходом є особливо добре придатними для одержання сполук альфа-аміноборонового ефіру формули (VII), в якій альфа вуглець являє собою 36 хіральний центр. Таким чином, одне втілення даного винаходу має відношення до великомасштабного способу одержання сполуки альфааміноборонового ефіру формули (VІla) або (Vllb): (VIIa) (VIIb) або її кислотної адитивної солі, де: R1 являє собою необов'язково заміщену аліфатичну, ароматичну або гетероароматичну групу; і R4 і R5, взяті разом з проміжними атомами кисню і бору, утворюють необов'язково заміщений хіральний циклічний бороновий ефір; вказаний спосіб включає: (a) забезпечення бор "ат" комплексу формули (ІІа) або (ІІb): (IIa) (IIb) в якій Υ являє собою нуклеофугну групу; + М являє собою катіон; 2 R являє собою водень; R3 являє собою нуклеофугну групу; і R4 і R5 є такими ж, як визначено тут вище; (b) контактування бор "ат" комплексу формули (llа) або (llb) з кислотою Льюїса в умовах, які дають сполуку боронового ефіру формули (Іа) або (Іb): (Ia) (Ib) в яких кожний R1-R5 є таким же, як визначено тут вище, вказану стадію контактування проводять в реакційній суміші, яка містить: (і) координуючий ефірний розчинник, який має низьку міру змішуваності з водою; або (іі) ефірний розчинник, який має низьку міру змішуваності з водою, і координуючий співрозчинник; і (c) обробку сполуки боронового ефіру формули (Іа) або (Іb) реагентом формули M*-N(G)2, де М1 являє собою лужний метал і G являє собою захисний фрагмент аміногрупи для того, щоб утворити сполуку формули (Vllla) або (VIllb): (VIIIa) 37 90108 (VIIIb) в якій кожний G і R1-R5 є такими ж, як визначено тут вище; і d) видалення G груп для того, щоб утворити сполуку формули (Vlla) або (Vllb) (VIIa) (VIIb) або її кислотної адитивної солі. Переважні значення для Y, M+, R1-R5 і G є такими, як описано тут вище. Сполука формули (Vlla) або (Vllb) переважно має діастереомерне співвідношення на альфа-вуглеці щонайменше 96:4, більш переважно щонайменше близько 97:3, по відношенню до хірального центра в R4-R5 хіральному фрагменті. Сполуки альфа-аміноборонового ефіру формули (VII) є корисними синтетичними посередниками для одержання сполук пептидил боронового ефіру. У деяких втіленнях, таким чином, спосіб відповідно до цього аспекту даного винаходу надалі включає зв'язування сполуки формули (VII) зі сполукою формули (IX): (IX) в якій Р1 являє собою блокуючий фрагмент аміногрупи; R7 вибирають з групи, яка складається з водню, С1-10 аліфатичної групи, необов'язково заміщеної С6-10 арильної групи або С1-6 аліфатичної-R8 групи; і R8 вибирають з групи, яка складається з алкокси, алкілтіо, необов'язково заміщеної арильної, гетероарильної і гетероциклільної груп, і необов'язково захищеної аміно, гідрокси і гуанідино груп; і X являє собою ОН або відхідну групу; для того, щоб утворити сполуку формули (X): (X) в якій кожний з Ρ1, R1, R4, R5 і R7 є такими ж, як визначено тут вище. Відхідна група X являє собою будь-яку групу, здатну до нуклеофільного заміщення альфа-аміно групою сполуки формули (VII). У деяких втіленнях, фрагмент -С(О)-Х являє собою активований ефір, такий як O-(N-гідроксисукцинімід)ефір. У деяких втіленнях, активований ефір генерується in situ за допомогою контактування сполуки формули (IX), в якій X являє собою ОН, з пептид зв'язувальним реагентом. Приклади придатних пептид зв'язувальних реагентів включають, без обмеження, карбодіімід, наприклад, дициклогексилкарбодіімід 38 (DCC) або 1-(3-диметиламінопропіл)-3етилкарбодіімід (EDC); реагенти фосфонію, наприклад, бензотриазол-іілокситрис(диметиламіно)-фосфоній гексафторфосфат (реагент ВОР); і реагенти уронію, наприклад, О-(1H-бензотриазол-1-іл)-N,N,N',N'тетраметилуроній тетрафторборат (TBTU). Кваліфіковані в даній галузі фахівці знайомі з методиками, які дозволяють безпосереднє зв'язування силіл захищених амінів, без попередньої стадії зняття захисту. У таких методиках, силільні групи видаляють in situ в реакційних умовах зв'язування. У деяких втіленнях даного винаходу, таким чином, сполуку формули (VIII) піддають контактуванню зі сполукою формули (IX) в умовах, які сприяють видаленню (R6)3Si групи in situ і утворенню сполуки формули (X). Для цілей даного винаходу, термін "блокуючий фрагмент аміногрупи" відноситься до будь-якої групи, використовуваної, щоб дериватизувати аміногрупу, особливо N-кінцеву аміногрупу пептидної або амінокислоти. Термін "блокуючий фрагмент аміногрупи" включає, але не обмежується цим, захисні групи, які звичайно залучаються в органічному синтезі, особливо синтезі пептидів. Дивіться, наприклад, Gross and Mienhoffer, eds., The Пептидs, Vol.3, Academic Press, New York, 1981, pp.388; Green and Wilts, Protective Groups in Organic Synthesis, 3rd edition, John Wiley and Sons, Inc., New York, 1999. Якщо інше не вказане, однак, не є обов'язковим для блокуючого фрагмента аміногрупи бути легко розщеплюваним. Блокуючі фрагменти аміногрупи включають, наприклад, алкільний, ацильний, алкоксикарбонільний, амінокарбонільний і сульфонільний фрагмент. У деяких втіленнях, блокуючий фрагмент аміногрупи являє собою ацильний фрагмент, який походить від амінокислоти або пептиду, або їх похідного або аналога. Як використано в даному описі, термін "амінокислота" включає як природні, так і неприродні амінокислоти. Для цілей даного винаходу, "похідне" амінокислоти або пептиду являє собою те, в якому функціональний група, наприклад, гідрокси, аміно, карбокси або гуанідиногрупа на N-кінці або на бічному ланцюгу, модифікована блокуючою групою. Як використано в даному описі, "аналог" амінокислоти або пептиду являє собою той, який включає модифікований основний або бічний ланцюг. Термін "пептидний аналог", як мається на увазі, включає пептиди, в яких один або більше стереоцентрів інвертовані і один або більше пептидних зв'язків заміщені пептидною ізостерою. У деяких втіленнях, захисна група Р1 є розщеплюваною. Приклади розщеплюваних захисних груп включають, без обмеження, ацильні захисні групи, наприклад, форміл, ацетил (Ас), сукциніл (Suc) або метоксисукциніл (MeOSuc), і уретанові захисні групи, наприклад, трет-бутоксикарбоніл (Вос), бензилоксикарбоніл (Cbz) або фторенілметоксикарбоніл (Fmoc). У деяких таких втіленнях, спосіб відповідно до цього аспекту даного винаходу надалі включає стадії: 39 90108 (f) видалення захисної групи Р1 для того, щоб утворити сполуку формули (XI): (XI) або її кислотну адитивну сіль, в якій кожний з R1, R4, R5 і R7 є таким же, як визначено тут вище; і (g) зв'язування сполуки формули (XI) з реагентом формули Р2-Х, в якій Р2 являє собою будьякий блокуючий фрагмент аміногрупи, як описано вище, і X являє собою відхідну групу, для того, щоб утворити сполуку формули (XII): (XII) в якій кожний з Р2, R1, R4, R5 і R7 є таким же, як визначено тут вище. Кваліфікований в даній галузі фахівець розпізнає, що в тих втіленнях, в яких Р2 являє собою ацильну групу, включаючи, наприклад, ацильний фрагмент, який походить від амінокислоти або пептиду, або її аналог або похідне, відхідна група X може бути генерована in situ, як обговорено вище, для сполуки формули (IX). У кожній зі сполук (X) і (XII) фрагмент боронової кислоти є захищеним як бороновий ефір. Якщо бажано, може бути знято захист фрагмента боронової кислоти будь-яким способом, відомим в даній галузі. Переважно, захист фрагмента боронової кислоти знімають шляхом трансетерифікації у двохфазній суміші. Більш переважно, стадія зняття захисту боронової кислоти включає етапи: (і) забезпечення двохфазної суміші, яка містить сполуку боронового ефіру формули (X) або (XII), органічний акцептор боронової кислоти, нижчий алканол, С5-8 вуглеводневий розчинник і водну мінеральну кислоту; (іі) перемішування двохфазної суміші для того, щоб одержати відповідну сполуку боронової кислоти зі знятим захистом формули (Ха) або (XIII): (Xa) 40 захисту. Сполука боронового ефіру формули (III) може потім бути використані в іншій партії способу, який описується вище. У таких втіленнях, фрагмент R4-R5 є ефективно використовують повтор4 но, що може особливо бути переважним, якщо R 5 R являє собою хіральний фрагмент, яка дорого коштує. Щоб збільшити чистоту продукції, водний шар, який містить сполуку формули (Ха) або (XIII), переважно промивають для того, щоб видалити нейтральні органічні домішки перед стадією екстрагування (iv). У таких втіленнях, стадія (ііі) переважно включає етапи: (1) відокремлення розчиняючих шарів; (2) доведення водного шару до основного рН; (3) промивання водного шару органічним розчинником; і (4) доведення водного шару до рН менше, ніж близько 6. У деяких втіленнях, винахід відноситься до вдосконаленого способу виробництва бортезомібу інгібітора протеасоми. Таким чином, в одному втіленні, даний винахід забезпечує великомасштабний спосіб одержання сполуки формули (XIV): (XIV) або її ангідриду боронової кислоти. Спосіб включає стадії: (a) забезпечення бор "ат" комплексу формули (XV): (XV) в якій: R3 являє собою нуклеофугну групу; Υ являє собою нуклеофугну групу; і М+ являє собою лужний метал; (b) контактування бор "ат" комплексу формули (XV) з кислотою Льюїса в умовах, які дають сполуку боронового ефіру формули (XVI): (XIII) (ііі) відокремлення розчиняючих шарів; і (iv) екстрагування сполуки формули (Ха), (XIII) або їх ангідриду боронової кислоти, в органічний розчинник. Органічний акцептор боронової кислоти на стадії (і) переважно являє собою аліфатичну, арильну або ар(аліфатичну)боронову кислоту. У деяких втіленнях, акцептор боронової кислоти вибирають з групи, яка складається з фенілборонової кислоти, бензилборонової кислоти, бутилборонової кислоти, пентилборонової кислоти, гексилборонової кислоти і циклогексилборонової кислоти. У певних втіленнях, акцептор боронової кислоти являє собою ізобутилборонову кислоту. У деяких втіленнях, акцептор боронової кислоти вибирають так, щоб сполука боронового ефіру формули (III) була утворена як проміжний продукт реакції зняття (XVI) вказану стадію контактування проводять в реакційній суміші, яка містить: (і) координуючий ефірний розчинник, який має низьку міру змішуваності з водою; або (іі) ефірний розчинник, який має низьку міру змішуваності з водою, і координуючий співрозчинник; (c) обробку сполуки боронового ефіру формули (XVI) реагентом формули М1-N(G)2, в якій Μ1 являє собою лужний метал і кожний G індивідуально або разом являє собою захисну групу аміногрупи, для того, щоб утворити сполуку формули (XVII): 41 90108 (XVII) (d) видалення G груп для того, щоб утворити сполуку формули (XVIII): (XVIII) або її кислотну адитивну сіль; (e) зв'язування сполуки формули (XVIII) зі сполукою формули (XIX): (XIX) в якій: Р1 являє собою розщеплюваний захисний фрагмент аміногрупи; і X являє собою ОН або відхідну групу; для того, щоб утворити сполуку формули (XX): (XX) в якій Р1 є таким же, як визначено тут вище; (f) видалення захисної групи Р1 для того, щоб утворити сполуку формули (XXI): (XXI) або її кислотну адитивну сіль; (g) зв'язування сполуки формули (XXI) з реагентом формули (XXII) (XXII) в якій X являє собою ОН або відхідну групу, для того, щоб утворити сполуку формули (XXIII): 42 певних переважних втіленнях, спосіб характеризується всіма п'ятьма ознаками (1)-(5), вказаними нижче. (1) У бор "ат" комплексі формули (XV) R3 і Υ обидва являють собою хлор. (2) Стадія зв'язування (e) включає етапи: (і) зв'язування сполуки формули (XVIII) зі сполукою формули (XIX), в якій X являє собою ОН у присутності 2-(1Н-бензотриазол-1-іл)-1,1,3,3тетраметилуроній тетрафторборату (TBTU) і третинного аміну в дихлорметані; (іі) виконання заміни розчинників для заміщення дихлорметану етилацетатом; і (ііі) виконання водного промивання розчину етилацетату. (3) Стадія видалення захисної групи (f) включає етапи: (і) обробка сполуки формули (XX) з НСI в етилацетаті; (іі) додавання гептану до реакційної суміші; і (ііі) виділення шляхом кристалізації сполуки формули (XXI) як її НСI адитивну сіль. (4) Стадія зв'язування (g) включає етапи: (і) зв'язування сполуки формули (XXI) з 2піразинкарбоновою кислотою у присутності TBTU і третинного аміну в дихлорметані; (іі) виконання заміни розчинників для того, щоб замінити дихлорметан на етилацетат; і (ііі) виконання водного промивання розчину етилацетату. (5) Стадія зняття захисту боронової кислоти (h) включає етапи: (і) забезпечення двохфазної суміші, яка містить сполуку формули (XXIII), органічний акцептор боронової кислоти, нижчий алканол, С5-8 вуглеводневий розчинник і водну мінеральну кислоту; (іі) перемішування двохфазної суміші для того, щоб одержати сполуку формули (XIV); (ііі) відокремлення розчиняючих шарів; і (iv) екстрагування сполуки формули (XIV) або її ангідриду боронової кислоти, в органічний розчинник. Переважно, стадія (h)(iii) включає етапи: (1) відокремлення розчиняючих шарів; (2) доведення водного шару до основного рН; (3) промивання водного шару органічним розчинником; і (4) доведення водного шару до рН менше, ніж близько 6. В іншому втіленні, винахід відноситься до великомасштабного способу одержання сполуки формули (XIV) (XIV) (XXIII) i (h) зняття захисту фрагмента боронової кислоти для того, щоб утворити сполуку формули (XIV) або її ангідрид боронової кислоти. У деяких втіленнях, спосіб характеризується щонайменше однією з наступних ознак (1)-(5). У або її ангідриду боронової кислоти, який включає такі стадії: (аа) зв'язування сполуки формули (XVIII): (XVIII) 43 90108 або її кислотної адитивної солі, зі сполукою формули (XIX): (XIX) в якій: Р1 являє собою розщеплюваний захисний фрагмент аміногрупи; і X являє собою ОН або відхідну групу; для того, щоб утворити сполуку формули (XX): (XX) в якій Р1 є таким же, як визначено тут вище, вказана стадія зв'язування (аа) включає етапи: (і) зв'язування сполуки формули (XVIII) зі сполукою формули (XIX), в якій X являє собою ОН у присутності 2-(1Н-бензотриазол-1-іл)-1,1,3,3тетраметилуроній тетрафторборату (TBTU) і третинного аміну в дихлорметані; (іі) виконання заміни розчинників для того, щоб замінити дихлорметан на етилацетат; і (ііі) виконання водного промивання розчину етилацетату; (bb) видалення захисної групи Р1 для того, щоб утворити сполуку формули (XXI): (XXI) або її кислотну адитивну сіль, вказана стадія видалення захисної групи (bb) включає етапи: (і) обробка сполуки формули (XX) НСI в етилацетаті; (іі) додавання гептану до реакційної суміші; і (ііі) виділення шляхом кристалізації сполуки формули (XXI) як її НСI адитивну сіль; (сс) зв'язування сполуки формули (XXI) з реагентом формули (XXII): (XXII) в якій X являє собою ОН або відхідну групу, для того, щоб утворити сполуку формули (XXIII): (XXXIII) вказана стадія зв'язування (сс) включає етапи: (і) зв'язування сполуки формули (XXI) з 2піразинкарбоновою кислотою у присутності TBTU і третинного аміну в дихлорметані; 44 (іі) виконання заміни розчинників для того, щоб замінити дихлорметан на етилацетат; і (ііі) виконання водного промивання розчину етилацетату; і (dd) зняття захисту фрагмента боронової кислоти для того, щоб утворити сполуку формули (XIV) або її ангідрид боронової кислоти, вказана стадія зняття захисту (dd) включає такі етапи: (і) забезпечення двохфазної суміші, яка містить сполуку формули (XXIII), органічний акцептор боронової кислоти, нижчий алканол, С5-8 вуглеводневий розчинник і водну мінеральну кислоту; (іі) перемішування двохфазної суміші для того, щоб одержати сполуку формули (XIV); (ііі) відокремлення розчиняючих шарів; і (iv) екстрагування сполуки формули (XIV) або її ангідриду боронової кислоти, в органічний розчинник. Переважно, стадія (dd)(iii) включає такі етапи: (1) відокремлення розчиняючих шарів; (2) доведення водного шару до основного рН; (3) промивання водного шару органічним розчинником; і (4) доведення водного шару до рН менше, ніж близько 6; Ефективність способів, які описуються вище, надалі збільшується за допомогою телескопічних стадій, наприклад, за допомогою перенесення реакційної суміші або розчину обробленого продукту з однієї реакції безпосередньо в наступну реакцію, без виділення проміжного продукту. Наприклад, у деяких втіленнях, стадія (е)(ііі) або (аа)(ііі) дає розчин етилацетату, який містить сполуку формули (XX), і розчин етилацетату безпосередньо піддають на стадії (f) або (bb) дії умов, ефективних для того, щоб видалити захисну групу Р1. У деяких таких втіленнях, захисна група Р1 являє собою кислотно-лабільну захисну групу, наприклад, третбутоксикарбоніл (Вос), і розчин етилацетату зі стадії (е)(ііі) або (аа)(ііі) обробляють кислотою. У певних переважних втіленнях, розчин етилацетату зі стадії (е)(ііі) або (аа)(ііі) висушують азеотропічно і потім обробляють газоподібною НСI. Коли стадію зняття захисту (f) або (bb) виконують у безводних умовах, як описано вище, продукт формули (XXI) може бути виділений шляхом кристалізації з реакційної суміші як його НСI адитивна сіль. Кристалізації солі продукту сприяє додавання вуглеводневого розчинника, такого як nгептан. У деяких втіленнях, реакційну суміш частково концентрують перед додаванням вуглеводневого розчинника. Дані винахідники відкрили, що кристалізація сполуки формули (XXI) таким чином ефективно видаляє будь-які трипептидні домішки, які можуть утворюватись протягом стадії зв'язування (e) або (аа). Такі домішки важко видалити на пізніших стадіях в синтезі. Подальше зменшення стадій способу можливе за допомогою перенесення суміші продукту зі стадії зв'язування (g) або (сс) безпосередньо на стадію зняття захисту фрагмента боронової кислоти (h) або (dd). Переважно, органічний розчинник з реакції зв'язування спершу замінюють на етилацетат для того, щоб полегшити промивання водою. Друга зміна розчинників на вуглеводневий розчин 45 90108 ник потім дозволяє використати розчин продукту зі стадії (g) або (сс) безпосередньо на двохфазній стадії зняття захисту боронової кислоти (h) або (dd), без виділення сполуки формули (XXIII). Альтернативно, може бути прийнято більш конвергентний підхід для синтезу сполуки формули (XIV). Таким чином, у ще іншому втіленні, винахід забезпечує великомасштабний спосіб одержання сполуки формули (XIV) (XIV) або її ангідриду боронової кислоти. Спосіб включає етапи: (a) забезпечення бор "ат" комплексу формули (XV): (XV) в якій: R3 являє собою нуклеофугну групу; Υ являє собою нуклеофугну групу; і М+ являє собою лужний метал; (b) контактування бор "ат" комплексу формули (XV) з кислотою Льюїса в умовах, які дають сполуку боронового ефіру формули (XVI): (XVI) вказану стадію контактування проводять в реакційній суміші, яка містить: (і) координуючий ефірний розчинник, який має низьку міру змішуваності з водою; або (іі) ефірний розчинник, який має низьку міру змішуваності з водою, і координуючий співрозчинник; (c) обробка сполуки боронового ефіру формули (XVI) з реагентом формули M1'-N(Si(R6)3)2, де М1 являє собою лужний метал і кожний R6 незалежно вибирають з групи, який складається з алкілу, аралкілу і арилу, де арил або арильна частина аралкілу є необов'язково заміщеною, для того, щоб утворити сполуку формули (XVII): (XVII) (d) видалення (R6)3Si груп для того, щоб утворити сполуку формули (XVIII): (XVIII) або її кислотну адитивну сіль; 46 (e') зв'язування сполуки формули (XVIII) зі сполукою формули (ХІХа): (XIXa) в якій X являє собою ОН або відхідну групу, для того, щоб утворити сполуку формули (XXIII): (XXIII) (f) зняття захисту фрагмента боронової кислоти для того, щоб утворити сполуку формули (XIV) або її ангідрид боронової кислоти. У деяких втіленнях, спосіб характеризується щонайменше однією з наступних ознак (1)-(3). У певних переважних втіленнях, спосіб характеризується всіма трьома ознаками (1)-(3), наведеними нижче. (1) У бор "ат" комплексі формули (XV) R3 і Υ обидва являють собою хлор. (2) Стадія зв'язування (e') включає етапи: (і) зв'язування сполуки формули (XVIII) зі сполукою формули (ХІХа), в якій X являє собою ОН у присутності 2-(1H-бензотриазол-1-іл)-1,1,3,3тетраметилуроній тетрафторборат (TBTU) і третинного аміну в дихлорметані; (іі) виконання заміни розчинників для того, щоб замінити дихлорметан на етилацетат; і (ііі) виконання водного промивання розчину етилацетату. (3) Стадія зняття захисту боронової кислоти (f) включає такі етапи: (і) забезпечення двохфазної суміші, яка містить сполуку формули (XXIII), органічний акцептор боронової кислоти, нижчий алканол, С5-8 вуглеводневий розчинник і водну мінеральну кислоту; (іі) перемішування двохфазної суміші для того, щоб одержати сполуку формули (XIV); (ііі) відокремлення розчиняючих шарів; і (iv) екстрагування сполуки формули (XIV) або її ангідриду боронової кислоти, в органічний розчинник. Переважно, стадія (f)(iii) включає етапи: (1) відокремлення розчиняючих шарів; (2) доведення водного шару до основного рН; (3) промивання водного шару органічним розчинником; і (4) доведення водного шару до рН менше, ніж близько 6; На стадії (h)(iv), (dd)(iv) або (f)(iv) способів, які описуються вище, сполуку формули (XIV) або її ангідрид боронової кислоти, переважно екстрагують в етилацетат і кристалізують шляхом додавання гексану або гептану. У деяких втіленнях, спосіб надалі включає видалення ангідриду боронової кислоти сполуки формули (XIV), переважно тривимірного ангідриду боронової кислоти формули (XXIV): 47 90108 48 (XXIV) (XXIV) Способи даного винаходу роблять можливим великомасштабне виробництво бортезомібу дуже високої хімічної та стереохімічної чистоти. Способи попереднього рівня техніки були обмежені щодо масштабу виробництва і давали продукт нижчої загальної чистоти. У ще іншому аспекті, таким чином, винахід забезпечує композицію, яка включає щонайменше один кілограм сполуки формули (XXIV): Сполуку формули (XXIV) переважно одержують відповідно до способу, розкритого вище, і переважно містить щонайменше 99%ваг./ваг. композиції відповідно до цього аспекту даного винаходу. Приклади Скорочення вос D.I. DMF ГХ ГХ-МС год. HDPE ВЕРХ LDA LOD хв. МТВЕ ЗФ-ВЕРХ RPM TBTU THF трет-бутоксикарбоніл де-іонізований Ν,Ν-диметилформамід газова хроматографія газова хроматографія-мас-спектрометрія Години поліетилен високої щільності високоефективна рідинна хроматографія діізопропіламід літію втрати при сушінні Хвилини t-бутил метил ефір високоефективна рідинна хроматографія оберненої фази обернення за хвилину О-бензотриазол-1-іл-N,N,N',N'-тетраметилуроній тетрафторборат тетрагідрофуран Приклад 1: Спосіб виробництва (1R)-(S)пінандіол 1-амоній трифторацетат-3-метилбутан1-боронату (1S)-(S)-Пінандіол 1-хлор-3-метилбутан-1боронат 1. (S)-Пінандіол-2-метилпропан-1-боронат (12,0кг, 50,8молей) завантажують в реакційну посудину, підтримувану в атмосфері азоту. 2. Завантажують трет-Бутил метил ефір (53кг) і дихлорметан (22,5кг) і одержану в результаті суміш охолоджують до -57°С з перемішуванням. 3. Діізопропіламін (6,7кг) завантажують в іншу реакційну посудину, підтримувану в атмосфері азоту. 4. трет-Бутил метил ефір (27кг) завантажують до діізопропіламіну і одержану в результаті суміш охолоджують до -10°С з перемішуванням. 5. n-Гексиллітій у гексані (33,2ваг.% розчин) (17,6кг) додають до суміші діізопропіламіну протягом періоду у 57 хвилин, в той час, як температуру реакції підтримують при -10°С до -7°С. 6. Цю суміш (LDA-суміш) перемішують протягом 33 хвилин при -9°С до -7°С перед тим, як її використовують. 7. Хлорид цинку (12,1кг) завантажують в третю реакційну посудину, підтримувану в атмосфері азоту. 8. трет-Бутил метил ефір (16кг) завантажують в хлорид цинку і одержану в результаті суміш нагрівають до 30°С з перемішуванням. 9. Тетрагідрофуран (53кг) додають до суспензії хлориду цинку протягом періоду у 18 хвилин, в той час, як температуру реакції підтримують при 35°С-40°С. 10 Цю суміш (ZnCl2-суміш) перемішують протягом 4 годин і 28 хвилин при 38°С-39°С, поки її не використано. 11. LDA-суміш (з №3-6) додають протягом періоду у 60 хвилин до реакційної посудини, яка містить (S)-пінандіол-2-метилпропан-1-боронат, в той час, як температуру реакції підтримують при -60°С до -55°С. 12. Промивний розчин трет-бутил метил ефіру (10кг) використовують для того, щоб завершити додавання. 13. Реакційну суміш перемішують протягом додаткових 20 хвилин при -59°С до-55°С. 14. Реакційну суміш нагрівають до -50°С протягом періоду у 11 хвилин. 15. ZnCl2- суміш (з №7-10) додають протягом періоду у 48 хвилин до реакційної посудини, яка містить (S)-пінандіол-2-метилпропан-1-боронат і LDA-суміш, в той час, як температуру реакції підтримують при -50°С до -45°С. 16. Промивний розчин трет-бутил метил ефіру (10кг) використовують для того, щоб завершити додавання. 17. Реакційну суміш перемішують протягом додаткових 30 хвилин при -45°С до -40°С і потім нагрівають до 10°С протягом періоду у 81 хвилин. 18. 10% розчин сірчаної кислоти (72кг) додають протягом періоду у 40 хвилин до реакційної посудини, в той час, як температуру реакції підтримують при 10°С-21°С. 49 19. Реакційну суміш перемішують протягом 16 хвилин при температурі навколишнього середовища, перед тим, як водну фазу відокремлюють. 20. Органічну фазу промивають послідовно деіонізованою (D.I.) водою (32кг) і 10% розчином хлориду натрію (26,7кг), кожне промивання включало інтенсивне перемішування протягом 15-17 хвилин при температурі навколишнього середовища. 21. Реакційну суміш концентрують під зниженим тиском (pmin=81мбар), підтримуючи зовнішню (сорочка/баня) температуру при 50°С-55°С, забезпечуючи залишок, який розчиняють в метилциклогексані (56кг). 22. Реакційну суміш нагрівають зі зворотним холодильником (в холодильнику типу Діна-Старка для відокремлення води) під зниженим тиском (pmin=67мбар), підтримуючи зовнішню (сорочка/баня) температуру при 50°С-55°С протягом 2 годин і 7 хвилин, поки не припиниться відокремлення води. 23. Близько 35л розчинників відганяють під зниженим тиском (pmin=81мбар), підтримуючи зовнішню (сорочка/баня) температуру при 50°С-55°С. 24. Одержану в результаті суху суміш метилциклогексану, яка містить (1S)-(S)-пінандіол 1хлор-3-метилбутан-1-боронат, охолоджують до 14°С. (R)-(5)-Пінандіол 1-біс (триметилсиліл)аміно-3метилбутан-і-боронат 1. Літій біс(триметилсиліл)амід в тетрагідрофурані (19,4ваг.% розчин), (41,8кг) завантажують в реакційну посудину, підтримувану в атмосфері азоту, і охолоджують до -19°С з перемішуванням. 2. Суміш метилциклогексану, яка містить (1S)(S)-пінандіол 1-хлор-3-метилбутан-1-боронат додають протягом періоду у 55 хвилин, в той час, як температуру реакції підтримують при -19°С до 13°С. 3. Промивний розчин метилциклогексану (5кг) використовують для того, щоб завершити додавання. 4. Реакційну суміш перемішують протягом додаткових 65 хвилин при -13°С до -12°С і потім нагрівають до 25°С протягом періоду у 25 хвилин. 5. Суспензію Целіту (2,5кг) в метилциклогексані (22кг) додають до реакційної суміші. 6. Реакційну суміш концентрують під зниженим тиском (рmin=25мбар), підтримуючи зовнішню (сорочка/баня) температуру при 45°С-50°С, забезпечуючи залишок, який розчиняють в метилциклогексані (36кг). 7. Пробу потім видаляють для дослідження в ході виробництва на вміст тетрагідрофурану за допомогою ГХ. 8. Кількісний аналіз тетрагідрофурану дав 0,58%. 9. Тверді речовини видаляють шляхом фільтрування, фільтрат фільтрують через вставку силікагелю (2,0кг). 10. Обидві фільтрувальні одиниці промивають ізопропіловим ефіром (30кг). 11. Одержану в результаті суміш метилциклогексан/ізопропіловий ефір, яка містить (1R)-(S)пінандіол 1-біс(триметилсиліл)аміно-3 90108 50 метилбутан-1-боронат, зберігають в контейнері при температурі навколишнього середовища, поки її не використовують на наступній стадії. (R)-(S)-Пінандіол 1-амоній трифторацетат-3метилбутан-1-боронат 1. Трифтороцтову кислоту (12кг) завантажують в іншу реакційну посудину, підтримувану в атмосфері азоту. 2. Ізопропіловий ефір (78кг) завантажують до трифтороцтової кислоти і одержану в результаті суміш охолоджують до -10°С з перемішуванням. 3. Суміш метилциклогексан/ізопропілового ефіру, яка містить (1R)-(S)-пінандіол 1біс(триметилсиліл)аміно-3-метилбутан-1-боронат, додають протягом періоду у 53 хвилини, спричиняючи осадження продукту, в той час, як температуру реакції підтримують при -10°С до -5°С. 4. Промивний розчин ізопропілового ефіру (5кг) використовують для того, щоб завершити додавання. 5. Реакційну суміш перемішують протягом додаткових 8 годин і 20 хвилин при -9°С до -7°С. 6. Тверду речовину збирають фільтруванням, промивають ізопропіловим ефіром (70кг) двома частинами і висушують під зниженим тиском (pmrn=56мбар) при 41°С-42°С протягом 2 годин і 15 хвилин. 7. Тверду речовину перемішують з D.I. водою (60кг) протягом 24 хвилин при температурі навколишнього середовища, перед тим, як D.I. воду видаляють фільтруванням. 8. Тверду речовину промивають D.I. водою (12кг). 9. Тверду речовину потім висушують під вакуумом (рmsn=4мбар) при 40°С-44°С протягом 9 годин і 22 хвилин, після цього часу втрати при сушінні були 0,51%, що задовольняє вимогам 1%. 10. Проміжний продукт, (1R)-(S)-1-пінандіол 1амоній трифторацетат-3-метилбутан-1-боронат, сирий, потім упаковують в одинарні поліетиленові пакети в поліпропіленових коробках і маркірують. Вихід складає 72%. Перекристалізація (1R)-(S)-1-пінандіол 1амоній трифторацетат-3-метилбутан-1-боронату, сирий 1. (1R)-(S)-Пінандіол 1-амоній трифторацетат3-метилбутан-1-боронат, сирий, (13кг) завантажують в реакційну посудину, підтримувану в атмосфері азоту. 2. Трифтороцтову кислоту (31кг) завантажують до реакційної посудини і одержану в результаті суміш охолоджують до 4°С з перемішуванням. 3. Як тільки всі тверді речовини були розчинені, залишаючи злегка мутну суміш, додають ізопропіловий ефір (29кг) протягом періоду у 57 хвилин, в той час, як температуру реакції підтримують при 2°С-3°С. 4. Після завершеного додавання суміш фільтрують через фільтр в приймальну посудину, підтримувану в атмосфері азоту. 5. Реактор і фільтр промивають сумішшю трифтороцтової кислоти (3,8кг) та ізопропілофого ефіру (5кг). Промивний розчин додають до фільтрату. 51 6. Ізопропіловий ефір (126кг) додають протягом періоду у 15 хвилин, викликаючи осадження продукту, в той час, як температуру реакції підтримують привід 16°С до 18°С, 7. Суміш перемішують при 16°С-18°С протягом 15 хвилин, потім охолоджують до -5°С протягом періоду у 67 хвилин і перемішують при -3°С до 5°С в атмосфері азоту протягом 89 хвилин. 8. Тверду речовину потім виділяють фільтруванням, промивають ізопропіловим ефіром (48кг) двома частинами і висушують під вакуумом (рmin=2мбар) при 34°С-40°С протягом 2 годин і 55 хвилин, після цього часу втрати при сушінні складають 0,32%, що задовольняє вимогам 0,5%. 9. Продукт, (1R)-(S)-пінандіол 1-амоній трифторацетат-3-метилбутан-1-боронат, потім упаковують в подвійні поліетиленові пакети в картонні барабани і маркірують. Вихід складає 86%. Приклад 2: Спосіб виробництва N-[-(2Піразинкарбоніл)-L-фенілаланін-L-лейцин боронового ангідриду (1S,2S,3R,5S)-iпандіол N-ВОС-1-фенілаланінL-лейцин боронат 1. У витяжній шафі, тригорлу скляну реакційну колбу, обладнану головкою Кляйзена, термографом і механічною мішалкою, продувають азотом. 2. (1R)-(S)-Пінандіол 1-амоній трифторацетат3-метилбутан-1-боронат (2,0кг) завантажують в колбу. 3. BOC-L-фенілаланін (1,398кг) завантажують в колбу. 4. 2-(1Н-Бензотриазол-1-іл)-1,1,3,3-тетраметил уроній тетрафторборат, TBTU (1,864кг) завантажують в колбу. 5. Дихлорметан (15,8л) завантажують в колбу. 6. Перемішуючий двигун регулюють таким чином, щоб забезпечити перемішування при 260 RPM. 7. Використовуючи охолоджуючу баню з льодяною водою, реакційну суміш охолоджують до 1,0°С, підтримуючи атмосферу азоту. 8. Ν,Ν-Діізопропілетиламін (2,778л) завантажують в скляну колбу і переносять в реакційну суміш протягом періоду у 117 хвилин, використовуючи перистальтичний насос, підтримуючи діапазон температури реакції у 0,7°С-2,1°С. Загальна швидкість додавання складає 23,7мл/хв. 9. Промивний розчин дихлорметану (0,2L) колби в реакційну суміш використовують для того, щоб завершити додавання. 10. Реакційну суміш перемішують протягом додаткових 35 хвилин. Температура на початку часу перемішування складає 1,8°С, і 2,5°С - в кінці. 11. Пробу потім видаляють для дослідження в ході виробництва шляхом високоефективної рідинної хроматографії оберненої фази (ЗФ-ВЕРХ). Перетворення у відсотках визначають як 99,3%. 12. Реакційну суміш переносять двома приблизно рівними половинами в дві колби роторного випарника. Реакційну суміш концентрують під зниженим тиском, використовуючи роторний випарник, підтримуючи зовнішню температуру бані при 29-30°С. 90108 52 13. Етилацетат (4,0л) розділяють на дві приблизно рівні частини і завантажують в дві колби роторного випарника. 14. Суміші в кожній колбі знову концентрують під зниженим тиском, використовуючи роторний випарник, підтримуючи зовнішню температуру бані при 29-30°С. 15. Залишки в кожній колбі роторного випарника потім були переносять назад в реакційну колбу, використовуючи етилацетат (13,34л). 16. У скляній колбі, обладнаній мішалкою, 1% водний розчин фосфорної кислоти одержують за допомогою змішування D.I. води (13,18л) і фосфорної кислоти (0,160кг). 17. У скляній колбі, обладнаній мішалкою, 2% водний розчин карбонату калію (12,0л) одержують за допомогою змішування D.I. води (11,76л) і карбонату калію (0,24кг). 18. У скляній колбі, обладнаній мішалкою, 10% водний розчин хлориду натрію (13,34л) одержують за допомогою змішування D.I. води (13,34л) і хлориду натрію (1,334кг). 19. D.I. воду (13,34л) завантажують в реакційну колбу, яка містить розчин етилацетату і суміш, яку перемішують при 380 RPM протягом 7 хвилин. Шарам дають відокремитись і водну фазу (нижній шар) переносять під вакуумом у відповідну колбу і відкидають. 20. Знову, D.I. воду (13,34л) завантажують в реакційну колбу, яка містить розчин етилацетату і суміш, яку перемішують при 385 RPM протягом 7 хвилин. Шарам дають відокремитись і водну фазу (нижній шар) переносять під вакуумом у відповідну колбу і відкидають. 21. 1% розчин фосфорної кислоти, одержаній на Стадії 16, завантажують в реакційну колбу, яка містить розчин етилацетату і суміш, яку перемішують при 365 RPM протягом 7 хвилин. Шарам дають відокремитись і кислотну водну фазу (нижній шар) переносять у відповідну колбу і відкидають. 22. 2% розчин карбонату калію, одержаній на Стадії 17, завантажують в реакційну колбу, яка містить розчин етилацетату і суміш, яку перемішують при 367 RPM протягом 7 хвилин. Шарам дають відокремитись і основну водну фазу (нижній шар) переносять у відповідну колбу і відкидають. 23. 10% розчин хлориду натрію, одержаній на Стадії 18, завантажують в реакційну колбу, яка містить розчин етилацетату і суміш, яку перемішують при 373 RPM протягом 6 хвилин. Шарам дають відокремитись і водну фазу (нижній шар) переносять у відповідну колбу і відкидають. 24. Розчин етилацетату переміщують в колбу роторного випарника і концентрують під зниженим тиском, використовуючи роторний випарник, підтримуючи температуру бані при 29-30°С для того, щоб забезпечити залишок. 25. Залишок потім повторно розчиняють в етилацетаті (4,68л). 26. Розчин концентрують під вакуумом, використовуючи роторний випарник, підтримуючи температуру бані при 29-30°С для того, щоб забезпечити залишок ще раз. 53 27. Знову, залишок потім повторно розчиняють в етилацетаті (4,68л) і дві проби беруть для визначення вмісту водного шляхом титрування Карла Фішера. Вміст води двох проб визначають як 0,216% і 0,207%. 28. Використовуючи наступну кількість етилацетату (12,66л), суміш переміщують з колби роторного випарника в суху реакційну колбу, обладнану термографом, механічною мішалкою і фритованою трубкою для дисперсії газу, і очищують азотом. (1S,2S,3R,5S)-Пінандіол L-фенілаланін-Lлейцин боронат, сіль НСI 1. Розчин етилацетату, який містить (1S,2S,3R,5S)-пінандіол N-BOC-L-фенілаланін-Lлейцин боронат, охолоджують, використовуючи охолоджувальну баню з льодяною водою до 0,9°С. 2. Газ хлористого водню (1,115кг) барботують в реакційну суміш протягом періоду у 1,48 годин. Температура на початку додавання складає 0,9°С, і 6,8°С - в кінці. 3. Реакційній суміші потім дають нагрітись до 14,4°С протягом 50 хвилин, підтримуючи атмосферу азоту. 4. Пробу видаляють для дослідження в ході виробництва шляхом ЗФ-ВЕРХ. Перетворення у відсотках складає 68,9% (область %). 5. Реакційну суміш перемішують протягом 35 хвилин. Температура на складає 14°С, і 14,8°С - в кінці. 6. Пробу видаляють для дослідження в ході виробництва шляхом ЗФ-ВЕРХ. Перетворення у відсотках складає 94,7% (область %). 7. Реакційну суміш перемішують протягом приблизно наступних 50 хвилин, підтримуючи температуру при 10°С±5°С. 8. Пробу видаляють для дослідження в ході виробництва шляхом ЗФ-ВЕРХ. Перетворення у відсотках складає 97,3%. 9. Реакційну суміш перемішують протягом приблизно наступних 50 хвилин, підтримуючи температуру при 10°С±5°С. Кінцева температура складає 14,6°С. 10. Пробу видаляють для дослідження в ході виробництва шляхом ЗФ-ВЕРХ. Загальний час реакції після додавання газу хлористого водню складає чотири (4) години. 11. Перетворення у відсотках складає 99%. 12. Спостерігають глинисту суспензію. 13. n-Гептан (8,8л) завантажують в реакційну суміш. 14. Глинисту суспензію перемішують протягом 2 годин. Температура на початку часу перемішування складає 12,7°С, і 15,3°С - в кінці. 15. Тверду речовину виділяють фільтруванням в лійці Бюхнера, прокладеній пропіленовою повстяною фільтрувальною подушкою. 16. Тверду речовину промивають n-гептаном (4,68л). 17. У шафі, тверду речовину переміщують в три сушильні піддони при не більше, ніж 1дюймовій глибині і висушують повітрям протягом 1 години. 90108 54 18. Тверду речовину потім висушують при 35°С під вакуумом 27-дюйм Hg протягом 16 годин 28 хвилин у вакуумній печі, обладнаній вакуумметром і термографом. 19. Відбирають проби твердої речовини з кожного сушильного піддону для того, щоб визначити% втрат при висушуванні. LOD визначають як 0%, 0,02% і 0,02% на трьох взятих пробах. 20. (1S,2S,3R,5S)-Пінандіол L-фенілаланін-Lлейцин боронат, сіль НСI потім упаковують у подвійні полі пакети в "картонних барабанах і маркірують, і відбирають проби. 21. Виділений вихід складає 1,87кг, 79,1%. Проміжний продукт зберігають при 2-8°С, поки його не використовують у подальшому виробництві. (1S,2S,3R,5S)-Пінандіол N-(2-піразинкарбоніл)L-фенілаланін-L-лейцин боронат 1. У витяжній шафі тригорлу скляну реакційну колбу, обладнану головкою Кляйзена, термографом і механічною мішалкою, продувають азотом. 2. (1S,2S,3R,5S)-Пінандіол L-фенілаланін-Lлейцин боронат, сіль НСI (1,85кг) завантажують в колбу. 3. 2-Піразинкарбонову кислоту (0,564кг) завантажують в колбу. 4. 2-(Н-Бензотриазол-1-іл)-1,1,3,3-тетраметил уроній тетрафторборат, TBTU (1,460кг) завантажують в колбу. 5. Дихлорметан (18,13л) завантажують в колбу. 6. Перемішувальний двигун регулюють для того, щоб забезпечити перемішування при 272 RPM. 7. Використовуючи охолоджувальну баню, реакційну суміш охолоджують до -1,2°С. 8. Ν,Ν-Діізопропілетиламін (1,865кг) завантажують в скляну колбу і переміщують в реакційну суміш протягом періоду у 50 хвилин, використовуючи перистальтичний насос, який підтримує діапазон температури реакції при -1,2°С до 2,8°С. 9. Промивний розчин дихлорметану (0,37л) колби в реакційну суміш використовують для того, щоб завершити додавання. 10. Реакційній суміші дають нагрітись і перемішують протягом додаткових 81 хвилин. 11. Температура на початку часу перемішування складає 15°С, і 24,9°С - в кінці. 12. Пробу потім видаляють для досліджування в ході виробництва шляхом ЗТ-ВЕРХ. Перетворення у відсотках визначають як 99,9%. 13. Реакційну суміш переносять двома приблизно рівними частинами до двох колб роторного випарника. Реакційну суміш концентрують під зниженим тиском, використовуючи два роторні випарники, підтримуючи зовнішню температуру бані при 33-34°С. 14. Етилацетат (12,95л) розділяють на дві приблизно рівні частини і завантажують в дві колби роторного випарника. 15. Суміші в кожній колбі потім концентрують під зниженим тиском, використовуючи роторний випарник, підтримуючи зовнішню температуру бані при 33-34°С. 55 16. Залишки в кожній колбі роторного випарника потім переміщують назад в реакційну колбу, використовуючи етилацетат (12,95л). 17. У скляній колбі, обладнаній мішалкою, 1% водний розчин фосфорної кислоти (12,34л) одержують за допомогою змішування D.I. води (12,19л) і фосфорної кислоти (0,148кг). 18. У скляній колбі, обладнаній мішалкою, 2% водний розчин карбонату калію (12,34л) одержують за допомогою змішування D.I. води (12,09л) і карбонату калію (0,247кг). 19. У скляній колбі, обладнаній мішалкою, 10% водний розчин хлориду натрію (12,34л) одержують за допомогою змішування D.I. води (12,34л) і хлориду натрію (1,234кг). 20. D.I. воду (12,34л) завантажують в реакційну колбу, яка містить розчин етилацетату, і суміш перемішують при 382 RPM протягом 7 хвилин. Шарам дають відокремитись і водну фазу (нижній шар) переміщують у відповідну колбу і відкидають. 21. Знову, D.I. воду (12,34л) завантажують в реакційну колбу, яка містить розчин етилацетату, і суміш перемішують при 398 RPM протягом 7 хвилин. Шарам дають відокремитись і водну фазу (нижній шар) переміщують у відповідну колбу і відкидають. 22. 1% розчин фосфорної кислоти, одержаний на Стадії 17, завантажують в реакційну колбу, яка містить розчин етилацетату, і суміш перемішують при 364 RPM протягом 8 хвилин. Шарам дають відокремитись і кислотну водну фазу (нижній шар) переміщують у відповідну колбу і відкидають. 23. 2% розчин карбонату калію, одержаний на Стадії 18, завантажують в реакційну колбу, яка містить розчин етилацетату, і суміш перемішують при 367 RPM протягом 8 хвилин. Шарам дають відокремитись і основну водну фазу (нижній шар) переміщують у відповідну колбу і відкидають. 24. 10% розчин хлориду натрію, одержаний на Стадії 19, завантажують в реакційну колбу, яка містить розчин етилацетату, і суміш перемішують при 374 RPM протягом 8 хвилин. Шарам дають відокремитись і водну фазу (нижній шар) переміщують у відповідну колбу і відкидають. 25. Розчин етилацетату переносять під вакуумом двома приблизно рівними частинами до двох колб роторного випарника і концентрують під зниженим тиском, використовуючи роторний випарник, підтримуючи зовнішню температуру бані при 34°С. 26. n-Гептан (14,8л) розділяють на дві приблизно рівні частини і завантажують у дві колби роторного випарника. Суміші в кожній колбі потім концентрують під зниженим тиском, використовуючи роторний випарник, підтримуючи зовнішню температуру бані при 34°С. N-(2-Піразинкарбоніл)-L-фенілаланін-L-лейцин бороновий ангідрид, сирий 1. У скляній колбі, обладнаній мішалкою, 1N розчин хлористоводневої кислоти (22,2л) одержують за допомогою змішування D.I. води (20,36л) і хлористоводневої кислоти (1,84кг). 2. У скляній колбі, обладнаній мішалкою, 2N розчин гідроксиду натрію (12,03л) одержують за 90108 56 допомогою змішування D.I. води (12,03л) і гідроксиду натрію (0,962кг). 3. Залишки, які містять (1S,2S,3R,5S)пінандіол N-(2-піразинкарбоніл)-L-фенілаланін-Lлейцин боронат в кожній колбі роторного випарника потім переміщують в скляну тригорлу реакційну колбу, обладнану термографом та механічною мішалкою, використовуючи n-гептан (14,8л) і метанол (14,8л). 4. Перемішувальний двигун регулюють так, щоб забезпечити перемішування при 284 RPM. 5. 2-Метилпропанборонову кислоту (0,672кг) завантажують в колбу. 6. IN хлористоводневу кислоту, одержану на Стадії 1 (11,2л), завантажують в колбу. 7. Перемішувальний двигун регулюють, щоб забезпечити перемішування при 326 RPM. 8. Реакційну суміш перемішують протягом 16,38 годин. Температура на початку одержання партії складає 28,6°С, і температура в кінці одержання партії складає 21,6°С. 9. Пробу потім видаляють для дослідження в ході виробництва шляхом ЗФ-ВЕРХ. 10. Перетворення у відсотках визначають як 100%. 11. Перемішування зупиняють і двохфазній суміші дають відокремитись. 12. Шар (верхній шар) n-гептану переміщують у відповідну колбу і відкидають. 13. n-гептан (5,37л) завантажують в реакційну колбу і суміш перемішують при 381 RPM протягом 6 хвилин. Шарам дають відокремитись і фазу nгептану (верхній шар) переміщують у відповідну колбу і відкидають. 14. Знову, n-гептан (5,37л) завантажують в реакційну колбу і суміш перемішують при 340 RPM протягом 6 хвилин. Шарам дають відокремитись і фазу n-гептану (верхній шар) переміщують у відповідну колбу і відкидають. 15. Водний розчин метанолу переміщують двома приблизно рівними частинами до двох колб роторного випарника і концентрують під зменшеним тиском, використовуючи роторний випарник, підтримуючи зовнішню температуру бані при 3334°С. 15л метанолу концентрують. 16. Дихлорметан (5,37л) використовують для того, щоб перемістити залишок з колб роторного випарника назад в реакційну колбу. 17. 2N гідроксид натрію (11,2л), одержаний на Стадії 2, завантажують в колбу. 18. Шар (нижчий шар) дихлорметану переміщують у відповідну колбу і відкидають. 19. Дихлорметан (5,37л) завантажують в колбу і суміш перемішують при 374 RPM протягом 6 хвилин. Фазам дають відокремитись і шар (нижчий шар) дихлорметану переміщують у відповідну колбу і відкидають. 20. Знову, дихлорметан (5,37л) завантажують в колбу і суміш перемішують при 368 RPM протягом 8 хвилин. Фазам дають відокремитись і шар (нижчий шар) дихлорметану перемішують у відповідну колбу і відкидають. 21. Дихлорметан (5,37л) завантажують в колбу. 57 22. 1N хлористоводневу кислоту (10,7л) завантажують в колбу з перемішуванням. РН водної фази визначають як 6. 23. Перемішування припиняють і фазам дають відокремитись. 24. Фазу (нижчий шар) дихлорметану переносять під вакуумом у скляну приймальну колбу. 25. Дихлорметан (5,37л) завантажують в колбу і суміш перемішують при 330 RPM протягом 6 хвилин. Фазам дають відокремитись і шар (нижчий шар) дихлорметану переміщують в скляну приймальну колбу. 26. Знову, дихлорметан, (5,37л) завантажують в колбу і суміш перемішують при 335 RPM протягом 6 хвилин. Фазам дають відокремитись і шар (нижчий шар) дихлорметану переміщують в скляну приймальну колбу. 27. Екстракти дихлорметану об'єднують і переносять двома приблизно рівними частинами до двох колб роторного випарника і концентрують під зниженим тиском, використовуючи роторний випарник, підтримуючи зовнішню температуру бані при 33-34°С. 28. Етилацетат (12,95л) розділяють на дві приблизно рівні частини і завантажують у дві колби роторного випарника. Суміші в кожній колбі потім концентрують під зниженим тиском, використовуючи роторний випарник, підтримуючи зовнішню температуру бані при 45-46°С. 29. Знову, етилацетат (12,95л) розділяють на дві приблизно рівні частини і завантажують у дві колби роторного випарника. Суміші в кожній колбі потім концентрують під зниженим тиском, використовуючи роторний випарник, підтримуючи зовнішню температуру бані при 45-46°С, доки не залишиться приблизно 10% первинного об'єму. 30. n-гептан (10,2л) розділяють на дві приблизно рівні частини і завантажують у дві колби роторного випарника і глинисту суспензію перемішують під атмосферою азоту протягом 2,67 годин при 2223°С. 31. Тверду речовину виділяють фільтруванням в лійці Бюхнера, прокладеній пропіленовою повстяною фільтрувальною подушкою. 32. Тверду речовину промивають n-гептаном (2,96л). 33. У шафі, тверду речовину переміщують в чотири сушильні піддони і висушують повітрям протягом 1,25 години. 34. Тверду речовину потім висушують при 3650°С під вакуумом 27-дюйм Hg протягом 18 годин 27 хвилин у вакуумній печі, обладнаній вакуумметром і термографом. 35. Відбирають проби твердої речовини з кожного піддону для того, щоб визначити% втрат при висушуванні (LOD). LOD визначають як 0,38%, 0,62%, 071% і 0,63% на чотирьох взятих пробах. 36. N-(2-Піразинкарбоніл)-L-фенілаланін-Lлейцин бороновий ангідрид, сирий упаковують в дві 5-літрові, HDPE, широкогорлі пляшки, захищені від невмілого поводження, і маркірують. 37. Виділений вихід складає 1,314кг, 83%. Перекристалізація N-(2-Піразинкарбоніл)-Lфенілаланін-L-лейцин боронового ангідриду, сирий 90108 58 1. У шафі скляну реакційну колбу, обладнану механічною мішалкою, зворотний холодильник і термографі продувають азотом. 2. Етилацетат (21л) завантажують в колбу. 3. Етилацетат нагрівають до 66,8°С в атмосфері азоту, використовуючи гарячу баню з гарячою водою/парою. 4. N-(2-Піразинкарбоніл)-L-фенілаланін-Lлейцин бороновий ангідрид, сирий (1,311кг) повільно завантажують в реакційну колбу. Завантаження триває протягом періоду у 3 хвилин. 5. Суміш перемішують протягом 1 хвилини, поки всі тверді речовини не розчиняться. Температура розчину складає 64°С. 6. Джерело тепла видаляють і суміш повільно охолоджують до 60°С, використовуючи холодну баню. 7. Гарячий розчин етилацетату переносять в приймальну колбу через poly трубопровід і поліпропіленову капсулу вбудованого фільтра, використовуючи перистальтичний насос. 8. Суміші дають охолонути до 27,2°С і дають постояти в атмосфері азоту без перемішування, протягом 17,75 годин. Кінцеву температуру реєструють як 20,5°С. 9. Суміш охолоджують, використовуючи льодяну/водну баню з перемішуванням протягом 2,33 годин. Температура на початку часу перемішування складає 3,8°С, і -2,8°С - в кінці. 10. Тверду речовину виділяють фільтруванням в лійці Бюхнера, прокладеній пропіленовою повстяною фільтрувальною подушкою. Фільтрат збирають у збиральну колбу. 11. Тверду речовину промивають етилацетатом (2,96л), охолоджують до 4,7°С. 12. У шафі, тверду речовину перемішують в два сушильні піддони. 13. Тверду речовину потім висушують при 5165°С під вакуумом 27-дюйм Hg протягом 19 годин 10 хвилин у вакуумній печі, обладнаній вакуумметром і термографом. 14. Відбирають проби твердої речовини для того, щоб визначити% втрат при висушуванні (LOD). LOD визначають як 0,65% і 0,62% на двох взятих пробах. 15. N-(2-Піразинкарбоніл)-L-фенілаланін-Lлейцин бороновий ангідрид упаковують в чотири 1-літрові, Тип 3, янтарні широкогорлі пляшки з ковпачками з вкладишами з тефлону і маркірують. 16. Виділений вихід складає 1,132кг, 86.3%. 17. N-(2-Піразинкарбоніл)-L-фенілаланін-Lлейцин бороновий ангідрид зберігають при -25 до 15°С. Приклад 3: Конвергентний синтез N-(2Піразинкарбоніл)-L-фенілаланін-L-лейцин боронового ангідриду (1S,2S,3R,5S)-Пінандіол N-(2-піразинкарбоніл)L-фенілалатн-L-лейцин боронат Розчин (1R)-(S)-Пінандіол 1-амоній трифторацетат-3-метилбутан-1-боронату (13,97г) і Nгідроксисукциніміду (6,23г) в 66мл DMF охолоджують до -5°С, з наступним додаванням дициклогексилкарбодііміду (10,83г). Одержану в результаті суспензію перемішують протягом однієї години при температурі від -5 до 0°С. До розчину N-(2 59 піразинкарбоніл)-L-фенілаланіну (19,52г; одержаний за допомогою зв'язування попередньо утвореного сукцинімідового ефіру піразинкарбонової кислоти з L-фенілаланіном в діоксані-воді) в 62мл DMF додають N-метилморфолін (5,7мл) при температурі 0°С, і одержаний в результаті розчин додають до суспензії. Суспензію доводять до рН7 шляхом додавання інших 5,7мл Nметилморфоліну і перемішують протягом ночі, повільно підвищуючи температуру до 21°С. Після фільтрування, фільтрувальний коржик промивають двічі МТВЕ і об'єднані фільтрати розбавляють 950мл МТВЕ. Органічний шар промивають 20% водною лимонною кислотою (3x150мл), 20% водним NaHCO3 (3x150мл) і розсолом (2х). Органічний шар висушують над Na2SO4, фільтрують і концентрують, одержуючи 25,5г (95,5%) вказаної у заголовку сполуки як піну. Як вказано ТШХ цей матеріал містить деякі незначні домішки, включаючи приблизно 2% циклогексильної сечовини. N-(2-Піразинкарбоніл)-L-фенілаланін-L-лейцин бороновий ангідрид Розчин (1S,2S,3R,5S)-пінандіол N-(2піразинкарбоніл)-L-фенілаланін-L-лейцин боронату (25,2г) в 207мл МеОН і 190мл гексану охолоджують до 15°С, і 109,4мл 1N HCI додають порціями, підтримуючи температуру між 15 і 25°С. 2метилпропанборонову кислоту (8,67г) потім додають при енергійному перемішуванні, і перемішування двохфазної суміші продовжують протягом ночі. Після відокремлення двох фаз, нижчий шар 90108 60 екстрагують один раз 75мл гексану. Нижній шар потім концентрують у вакуумі доти, доки він не стане непрозорим, з наступним додаванням 109,4мл 2N NaOH і 100мл Et2O. Дві фази відокремлюють, нижній шар екстрагують Еt2О (4x100мл кожний), і потім доводять до рН6,0 шляхом додавання 109мл 1N HCI. Після екстрагування з 100мл етилацетату, нижній шар доводять до рН6,0 за допомогою 1N HCI і ще раз екстрагують з 75мл етилацетату. Об'єднані етилацетатні шари промивають напівнасиченим розсолом (2x25мл) і розсолом (2x25мл), висушують над Na2SO4, фільтрують і концентрують для того, щоб одержати 15,3г (81,8%) сирого N-(2-тразинкарбоніл)-Lфенілаланін-L-лейцин боронового ангідриду як піну. Сирий матеріал розчиняють в 150мл етилацетату і концентрують у вакуумі до суспензії, з наступним додаванням 150мл МТВЕ. Суспензію зберігають при між 2 і 8°С протягом ночі, фільтрують, промивають двічі МТВЕ і висушують під високим вакуумом, одержуючи 10,69г (57,2%) N-(2піразинкарбоніл)-L-фенілаланін-L-лейцин боронового ангідриду як тверду речовину білого кольору. Приклад 4: Вимірювання діастереомерного співвідношення (1R)-(1S,2S,3R,5S)-пінандіол-1амонійтрифторацетат-3-метилбутан-1-боронату Діастереомерну чистоту (1R)-(1S,2S,3R,5S)пінандіол-1-амонійтрифторацетат-3-метилбутан-1боронату (сполука 1) визначають нехіральною газовою хроматографією (ГХ). Хімічні речовини: Ацетонітрил (р.а. Bruker або Еквівалент) Тетрадекан (внутрішній стандарт) (Fluka puriss. Або еквівалент) Трифтороцтовий ангідрид (TFAA) (р.а. Merck або еквівалент) Інструментальний засіб: Система Trace-GC 2000 або еквівалент Рухома фаза: Н2 Розчинник А (з внутрішнім Приблизно 300мг тетрадекану відважують з точністю до 0,1мг в 100-мл мірну стандартом) колбу. Додають 1,5мл TFAA додають і колбу доводять до об'єму ацетонітрилом Одержання проби: Близько 150 мг проби точно відважують (до 0,1мг) в 10-мл мірну колбу. Колбу доводять до об'єму розчинником. Розчин зберігають протягом 15 хвилин перед введенням. Параметри ГХ: Колонка: Rtx-200; 105мx0,25мм внутр.діам. x0,25мкм плівка Рухома фаза: Н2 Температурна програма: 130°С (0,5хв.); 0,5°С/хв. до 200°С (0хв.); 30°С/хв. до 300°С (2хв.) Швидкість потоку: 0,9мл/хв. (пост, потік) Температура впорскувача: 250°С Температура детектора: 250°С (FID) Співвідношення: 1:50 Об'єм введення: 1мкл Речовини Сполука 1 (1R)-(1S,2S,3R,5S)-пінандіол-1амонійтрифторацетат-3-метилбутан-1-боронат Сполука 2 (1S)-(1S,2S,3R,5S)-пінандіол-1амонійтрифторацетат-3-метилбутан-1-боронат Стійкість розчину Вихідний розчин сполуки 1 одержують за допомогою відважування 150,13мг сполуки 1 в 10-мл мірну колбу і доводять її до об'єму Розчинником А. Стійкість цього розчину досліджують при температурі навколишнього середовища протягом 48 го
ДивитисяДодаткова інформація
Назва патенту англійськоюSynthesis of boronic ester and acid compounds
Автори англійськоюPickersgill I. Fraser, Bishop John, Koellner Christoph, Gomez Jean-Marc, Geiser Achim, Hett Robert, Ammoscato Vince, Munk Stephen, Lo Young, Chui Fang-Ting, Kulkarni Vithalanand R.
Назва патенту російськоюСпособы получения соединений боронового эстера и кислоты
Автори російськоюПикерсджилл И. Фрейзер, Бишоп Джон, Келльнер Кристоф, Гомес Жан-Марк, Гайзер Ахим, Хетт Роберт, Эммоскейто Винс, Манк Стефен, Ло Янг, Чуй Фан-Тин, Кулкарни Витхалананд Р.
МПК / Мітки
МПК: C07F 5/00, A61K 31/69, A61P 35/00
Мітки: боронового, кислоти, сполук, способи, одержання, естеру
Код посилання
<a href="https://ua.patents.su/32-90108-sposobi-oderzhannya-spoluk-boronovogo-esteru-ta-kisloti.html" target="_blank" rel="follow" title="База патентів України">Способи одержання сполук боронового естеру та кислоти</a>
Попередній патент: Пристрій для відбору механічної потужності між валами високого тиску і низького тиску двовалового газотурбінного двигуна
Наступний патент: Спосіб і пристрій для скорочення службових сигналів у вдосконаленій висхідній лінії зв’язку в системі безпровідного зв’язку
Випадковий патент: Судновий кабель




































