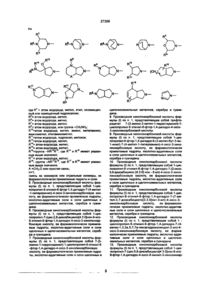
Похідні хінолонкарбонової кислоти, суміш їх ізомерів або окремі ізомери, їх фармакологічно прийнятні гідрати та солі, що мають антибактеріальну активність, та проміжні сполуки
Номер патенту: 27309
Опубліковано: 15.09.2000
Автори: ШЕНКЕ Томас, Ендерманн Райнер, Цайлер Ханс-Йоахім, ГРОХЕ Клаус, ПЕТЕРСЕН Уве, БРЕММ Клаус Дітер, Хіммлер Томас, МЕТЦГЕР Карл-Георг, КРЕБС Андреас
Текст
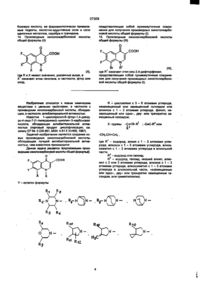
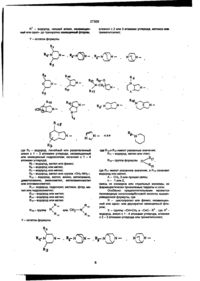
1. Производные хинолонкарбоновой кислоты общей формулы (I) СООН X R (I) в которой R= Сз-Сб циклоалкил, Сі-Сз алкил, незамещенный или одно-, дву- или трехкратно замещенный атомом галогена фенил; X=-CR2=CHR1, ^ = — R 3 ,-СН2-СН=СН2, где 1 R = атом водорода, Сі-Сз алкил, Сі-Сз алкокси, Сі-Сз алкоксиметил; R = атом водорода или галогена; R3 = атом водорода или галогена, Сі-Сз алкил, СгСз алкени л, Сі-Сз алкокси, незамещенный или одно-, дву- или трехкратно замещенный атомом галогена Сі-Сз алкоксиметил, триметилсилил; CM О о CO CM 27309 где R4 = атом водорода, незамещенный или замещенный гидрокеилом или метоксигруппой линейный или разветвленный Сі-Сд алкил, С1-С4 оксоалкил, d-Сз ацил; Р5= атом водорода, метил, фенил, тиенил, пиридил; R6= атом водорода, метил; R7 = атом водорода, метил; R8 = атом водорода, метил; R9 « атом водорода, метил, или группа -CH2NR7R8, где R7 и R8 имеют указанные вьше значения; R = атом водорода, метил, амино, незамещенные или замещенные гидрокеилом С1-С2 алкил или диалкиламино, аминометил, аминоэтил, незамещенные или замещенные гидрокеилом CiС? алкил или диалкиламинометил; R = атом водорода или галогена, гидроксил, метокси, метилтио, метил, гидроксиметил; R12 = атом водорода, метил; R13 = атом водорода, метил, этил; R14 = атом водорода, метил, этил; R15 « атом водорода, метил, этил; R16 =группа - N R 1 V 5 или -CH 2 NR 14 R 15 , где R14 и R15 имеют указанные выше значения; R17 « атом водорода, d-Сз алкил, незамещенные или замещенные гидрокеилом С1-С4 алкоксикарбонил или Ci-Cs ацил; R 18 - атом водорода, гидроксил, фуппа -NR17R19, где R17 имеет указанное выше значение, а R -атом водорода, метил или гидроксиметил; группа -CHaNR R , где R17 и R19 имеют указанные выше значения; А= СН 2 , О или простая связь; n s 1 или 2; смесь их изомеров или отдельные изомеры, их фармакологически приемлемые гидраты и соли. 2. Производные хинолонкарбоновой кислоты по п.1, обладающие антибактериальной активностью. 3. Производные хинолонкарбоновой кислоты по п.1, где R= C3-C5 циклоалкил, незамещенный или одно-, двухкратно замещенный атомом галогена фенил; Х= -CR2=CHR1, = — R 3 ,-СН2-СН=:СН2, где 1 R = атом водорода, С г С 2 алкил, метокси, метоксиметил; R2=aTOM водорода; R3= атом водорода, Сі-Сз алкил, С2-Сз алкенил, метокси, триметилсилил; R7 R«-N N ,0V О N R9 R13 16 N— N— где R атом водорода, незамещенный или замещенный гидрокеилом линейный или разветвленный Сі-Сз алкил, С1-С4 оксоалкил; R5= атом водорода, метил, фенил; R6= атом водорода, метил; R7= атом водорода, метил; R9= атом водорода, метил, или группа -CH2NH2; R10= атом водорода, метил, амино, метиламино, диметиламино, аминометил, метиламинометил или этиламинометил; R11= атом водорода, гидроксил, метокси, метил, гидроксиметил; R « атом водорода, метил; R14= атом водорода, метил; R15* атом водорода, метил; I N R16= группа -NR 14 R 15 или -CH 2 NR 14 R 15 , где R14 и R15 имеют указанные выше значения; R17= атом водорода, метил или этил; R18 группа -NR 17 R 19 , где R17 имеет указанное выше значение, a R19= атом водорода, метил; А= СНг, О или простая связь; п = 1 или 2; смесь их изомеров или отдельные изомеры, их фармакологически приемлемые гидраты и соли. 4. Производные хинолонкарбоновой кислоты по п. 1, где R= циклопропил, незамещенный или одно-, двухкратно замещенный атомом фтора фенил; х=-сн=сн2, 3 —^=—R3,^e R = атом водорода, d-Сэ алкил, С2-Сз алкенил, триметилсилил; 27309 Y* R7 N £Г\ о N R13 R" o' N N— Rl-N J ^ где R = атом водорода, метил, этил, незамещенный или замещенный гидроксилом; R5= атом водорода, метил; R6= атом водорода, метил; R7= атом водорода, метил; R9= атом водорода, или группа -CH2NH2; R10=aTOM водорода, метил, амино, метиламино, аминометил, этиламинометил; R11=aTOM водорода, гидроксил, метокси; R13=aTOM водорода, метил; R14= атом водорода, метил; R t 5 = атом водорода, метил; R16=rpynna -NR 14 R 15 , где R 14 и R имеют указангде R ные выше значения; R17= атом водорода, метил; R18- группа -NR R19, где R17 и R19 имеют указанные выше значения; А =СНг,0 или простая связь; п=1; смесь их изомеров или отдельные изомеры, их фармакологически приемлемые гидраты и соли. 5. Производные хинолонкарбоновой кислоты формулы (I) по п. 1, представляющие собой 1-циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(4-метил -1-пиперазинил)-4-оксо-3-хинолинкарбоновую кислоту, ее фармакологически приемлемые гидраты,, кислотно-аддитивные соли и соли щелочных и щелочноземельных металлов, серебра и гуанидина. 6. Производные хинолонкарбоновой кислоты формулы (I) по п. 1, представляющие собой 1-циклопропил-7-(цис-2,8-диазабицикло[4.3.0]нон-8-ил)8-этинил-6-фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновую кислоту, ее фармакологически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных и щелочноземельных металлов, серебра и гуанидина. 7. Производные хинолонкарбоновой кислоты формулы (I) по п. 1,представляющие собой 7-(3амино-1 -пирролидинил)-1 -циклопрол ил-8-этинил-6 -фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновую кислоту, ее фармакологически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных и N — щелочноземельных металлов, серебра и гуанидина. 8. Производное хинолонкарбоновой кислоты формулы (I) по п. 1, представляющее собой трифторацетат 7-(3-амино-3-метил-1-пирролидинил)-1циклопропил-8-этинил-6-фтор-1,4-дигидро-4-оксо3-хинолинкарбоновой кислоты. 9. Производные хинолонкарбоновой кислоты формулы (I) по п. 1, представляющие собой 1-циклопропил-6-фтор-1,4-дигидро-8-(3-метил-бут-3-ен1-инил)-7-(4-метил-1-пиперазинил)-4-оксо-3-хинолинкарбоновую кислоту, ее фармакологически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных и щелочноземельных металлов, серебра и гуанидина. 10. Производные хинолонкарбоновой кислоты формулы (I) по п. 1, представляющие собой 1-циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(2-оксо5,8-диазабицикло [4.3.0] нон - 8-ил)-4-оксо-3-хинолинкарбоновую кислоту, ее фармакологически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных и щелочноземельных металлов, серебра и гуанидина. 11. Производные хинолонкарбоновой кислоты формулы (I) по п. 1, представляющие собой 1-циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(7-метил-3,7-диазабицикло[3.3.0]окт-3-ил)-4-оксо-3хинолинкарбоновую кислоту, ее фармакологически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных и щелочноземельных металлов, серебра и гуанидина. 12. Производные хинолонкарбоновой кислоты формулы (I) по п. 1, представляющие собой 1 циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(4метил-1,3,3а,5,7,7а-гексагидроизоиндол-2-ил)-4оксо-3-хинолинкарбоновую кислоту, ее фармакологически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных и щелочноземельных металлов, серебра и гуанидина 13. Производные хинолонкарбоновой кислоты формулы (I) по п. 1, представляющие собой 1-цик-' лопропил-7-(цис-5,8-диазабицикло[4 3 0]нон-8-ил)6-фтор-1,4-дигидро-4-оксо-8-винил-3-хинолинкар 27309 боновую кислоту, ее фармакологически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных металлов, серебра и гуанидина. 14. Производные хинолонкарбоновой кислоты общей формулы (II) представляющие собой промежуточные соединения для получения производных хинолонкарбоновой кислоты общей формулы (I). 15. Производные хинолонкарбоновой кислоты общей формулы (III) СООН СООН («0. где R и X имеют значения, указанные выше, а X означает атом галогена, в частности, фтор или хлор, Изобретение относится к новым химическим веществам с ценными свойствами, в частности к производным хинолонкарбоновой кислоты, обладающим, в частности, антибактериальной активностью. Известна 1-циклопропил-6-фтор-1,4-дигидро-4-окоо-7-(1-пиперазинил)-хинолин-3-карбоновая кислота, обладающая антибактериальной активностью (торговый продукт ципрофлоксацин; см. заявку ЕР №. О 230 881, МКИ: А 61 К 31/495,1987). Задачей изобретения является создание новых производных хинолонкарбоновой кислоты, обладающих лучшей антибактериальной активностью, чем известное производное Данная задача решается предлагаемыми производными хинолонкарбоновой кислоты общей формульі(І) О * СООН ] R 16 N— ^r R R w /g I где R атом водорода, незамещенный или замещенный гидрокеилом линейный или разветвленный Сі-Сз алкил, С1-С4 оксоалкил; R5= атом водорода, метил, фенил; R6= атом водорода, метил; R7= атом водорода, метил; R9= атом водорода, метил, или группа -СНгЫНг; R10= атом водорода, метил, амино, метиламино, диметиламино, аминометил, метиламинометил или этиламинометил; R11= атом водорода, гидроксил, метокси, метил, гидроксиметил; R « атом водорода, метил; R14= атом водорода, метил; R15» атом водорода, метил; N R16= группа -NR 1 4 R 1 5 или -CH 2 NR 14 R 15 , где R14 и R15 имеют указанные выше значения; R17= атом водорода, метил или этил; R18 группа -NR 17 R 19 , где R17 имеет указанное выше значение, a R19= атом водорода, метил, А= СН 2 , О или простая связь; п- 1 или 2, смесь их изомеров или отдельные изомеры, их фармакологически приемлемые гидраты и соли. 4. Производные хинолонкарбоновой кислоты по п. 1, где R= циклопропил, незамещенный или одно-, двухкратно замещенный атомом фтора фенил; х=-сн=сн2, — ^ = — К 3 і Г Д Є R3 = атом водорода, Сі-Сз алкил, С2-Сз алкенил, триметилсилил; 27309 \1У NR5 j13 Re N R,ю A Rn R1 N— где R4 = атом водорода, метил, этил, незамещенный или замещенный гидроксилом; R5= атом водорода, метил; R6= атом водорода, метил; R7= атом водорода, метил, R9= атом водорода, или группа -CH2NH2; R10-aTOM водорода, метил, амино, метиламино, аминометил, этиламинометил; R11=aTOM водорода, гидроксил, метокси; R13=aTOM водорода, метил; R14= атом водорода, метил; R15= атом водорода, метил; R16=rpynna -NR R , где R14 и R15 имеют указанные выше значения; R17= атом водорода, метил; R18- группа -NR R19, где R17 и R19 имеют указанные выше значения; А -СН2,О или простая связь; п=1; смесь их изомеров или отдельные изомеры, их фармакологически приемлемые гидраты и соли. 5. Производные хинолонкарбоновой кислоты формулы (I) по п. 1, представляющие собой 1-циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(4-метил -1 -пиперазинил)-4-оксо-3-хинолинкарбоновую кислоту, ее фармакологически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных и щелочноземельных металлов, серебра и гуанидина. 6. Производные хинолонкарбоновой кислоты формулы (I) по п. 1, представляющие собой 1-циклопропил-7-(цис-2,8-диазабицикло[4.3.0]нон-8-ил)8-этинил-6-фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновую кислоту, ее фармакологически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных и щелочноземельных металлов, серебра и гуанидина. 7. Производные хинолонкарбоновой кислоты формулы (І) по п 1, представляющие собой 7-(3амино-1-пирролидинил)-1-циклопропил-8-этинил-6 -фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновую кислоту, ее фармакологически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных и щелочноземельных металлов, серебра и гуанидина 8. Производное хинолонкарбоновой кислоты формулы (I) по п 1, представляющее собой трифторацетат 7-(3-амино-3-метил-1 -пирролидинил)-1 циклопропил-8-этинил-6-фтор-1,4-дигидро-4-оксо3-хинолинкарбоновой кислоты 9 Производные хинолонкарбоновой кислоты формулы (І) по п 1, представляющие собой 1-циклопропил-6-фтор-1,4-дигидро-8-(3-метил-бут-3-ен1-инил)-7-(4-метил-1-пиперазинил)-4-оксо-3-хинолинкарбоновую кислоту, ее фармакологически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных и щелочноземельных металлов, серебра и гуанидина 10. Производные хинолонкарбоновой кислоты формулы (I) по п 1, представляющие собой 1 -циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(2-оксо5,8-диазабицикло [4.3.0] нон - 8-ил)-4-оксо-3-хинолинкарбоновую кислоту, ее фармакологически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных и щелочноземельных металлов, серебра и гуанидина. 11. Производные хинолонкарбоновой кислоты формулы (I) по п. 1, представляющие собой 1-циклолропил-8-этинил-6-фтор-1,4-дигидро-7-(7-метил-3,7-диазабицикло[3.3 0]окт-3-ил)-4-оксо-3хинолинкарбоновую кислоту, ее фармакологически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных и щелочноземельных металлов, серебра и гуанидина. 12. Производные хинолонкарбоновой кислоты формулы (I) по п. 1, представляющие собой 1 циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(4метил-1,3,За,5,7,7а-гексагидроизоиндол-2-ил)-4оксо-3-хинолинкарбоновую кислоту, ее фармакологически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных и щелочноземельных металлов, серебра и гуанидина 13. Производные хинолонкарбоновой кислоты формулы (I) по п. 1, представляющие собой 1-циклопропил-7-(цис-5,8-диазабицикло[4 3 0]нон-8-ил)6-фтор-1,4-дигидро-4-оксо-8-винил-3-хинолинкар 27309 боновую кислоту, ее фармакологически приемлемые гидраты, кислотно-аддитивные соли и соли щелочных металлов, серебра и гуанидина. 14. Производные хинолонкарбоновой кислоты общей формулы (II) представляющие собой промежуточные соединения для получения производных хинолонкарбоновой кислоты общей формулы (I). 15. Производные хинолонкарбоновой кислоты общей формулы (III) СООН СООН где R и X имеют значения, указанные выше, а X означает атом галогена, в частности, фтор или хлор, Изобретение относится к новым химическим веществам с ценными свойствами, в частности к производным хинолонкарбоновой кислоты, обладающим, в частности, антибактериальной активностью. Известна 1-цикпопропил-6-фтор-1,4-дигидро-4-оксо-7-(1-пиперазинил)-хинолин-3-карбоновая кислота, обладающая антибактериальной активностью (торговый продукт ципрофлоксацин, см заявку ЕР №. 0 230 881, МКИ А 61 К 31/495,1987). Задачей изобретения является создание новых производных хинолонкарбоновой кислоты, обладающих лучшей антибактериальной активностью, чем известное производное Данная задача решается предлагаемыми производными хинолонкарбоновой кислоты общей формулы^) О * СООН 1 і Y - остаток формулы R RВ N Rio О N Br R" (III), 1 где R означает этил или 2,4-дифторфенил, представляющие собой промежуточные соединения для получения производных хинолонкарбоновой кислоты общей формулы (I). R - циклоалкил с 3 - 6 атомами углерода, незамещенный или замещенный галоидом или алкилом с 1 - 3 атомами углерода, фенил, незамещенный или одно-, дву- или трехкратно замещенный галоидом; Х- группы -C=CH-R R2 ; -CsC-R или -СН2-СН=СН2 , где R1 - водород, алкил с 1 - 3 атомами углерода, алкокси с 1 - 3 атомами углерода, алкоксиметил с 1 - 3 атомами углерода в алкильной части; R2 - водород или галоид; R3 - водород, галоид, низший алкил, алкенил с 2 или 3 атомами углерода, алкокси с 1 - 3 атомами углерода, алкоксиметил с 1 - 3 атомами углерода в алкоксильной части, незамещенные или одно-, дву- или трехкратно замещенные галоидом, или триметилсилил; 27309 R^ R? N R N-CH 15 N N R — N R4- водород, линейный или разветвленный алкил с 1 - 4 атомами углерода, незамещенный или замещенный гидроксилом или метоксигруппой, циклопропил, оксоалкил с 1 - 4 атомами углерода, ацил с 1 - 3 атомами углерода; Rs-водород, метил, фенил, тиенил, пиридил; Re_ водород или метил; R7 - водород или метил, Re - водород или метил; Rg- водород, метил или группа ИЛИ где R H и R15 имеют указанные значения; Ri7 - водород, алкил с 1 - 3 атомами углерода, алкоксикарбонил с 1 - 4 атомами углерода в алкоксильной части или ацил с 1 - 3 атомами углерода, незамещенные или замещенные гидроксилом; Rie - водород, гидроксил, группа формулы _^' R t7 Л 19' где R17 - имеет указанное значение, a R19 означает водород, метил или гидроксиметил; R 8, где R7 и Re имеют указанные значения; Rio - водород, метил, амино, алкил- или диалкиламино-группа с 1 или 2 атомами углерода в каждой алкильной части, незамещенная или замещенная гидроксилом, аминометил, аминоэтил, алкил- или диалкиламинометил с 1 или 2 атомами углерода в алкильной части, незамещенный или замещенный гидроксигруппой; Ru- водород, гидроксил, метокси, метилтио, галоген, метил, гидроксиметип; Ri2- водород или метил; Ri3- водород, метил или этил; Ri4- водород, метил или этил; Ri5- водород, метил или этил, Ri6 - группа формулы OL-: R I4 R l5 ' или группа формулы где Ru и R19 йме19 ют указанные значения А - СНг, 0 или простая связь; п - 1 или 2, смесь их изомеров или отдельные изомеры, их фармацевтически приемлемые гидраты и соли. Предпочтительными являются производные хинолонкарбоновой кислоты вышеприведенной формулы (I), где R - циклоалкил с 3 - 5 атомами углерода или фенил, незамещенный или замещенный или одно- или двухкратно замещенный галоидом; X - группы -С—СН—R', -CsC-R3 или R2 -СН2-СН2=СН2.где R - водород, алкил с 1 - 2 атомами углерода, метокси или метоксиметил; R2 - водород; 27309 3 R - водород, низший алкил, незамещенный или одно- до трехкратно замещенный фтором, алкенил с 2 или 3 атомами углерода, метокси или триметилсилил; Y - остаток формулы R, R *5 N N- К — где F4 - водород, линейный или разветвленный * алкил с 1 - 3 атомами углерода, незамещенный или замещенный гидроксилом, оксалкил с 1 - 4 атомами углерода; Rb - водород, метил или фенил; Re - водород или метил; R? - водород или метил; Rs - водород, метил или группа -CH2-NH2-; Rio - водород, метил, амино, метиламино, диметиламино, аминометил, метиламинометил или этиламинометил; R n - водород, гидроксил, метокси, фтор, метил или гидроксиметил; Ri3 - водород или метил; Ri4 - водород или метил; Ri6~ водород или метил г группа N или 15 Y - остаток формулы N R 15 или N где R14 и Ris имеют указанные значения; Ri7 - водород, метил или этил; 17 Rie- группа формулы R R, N l9 где Rn имеют указанное значение, a Rig означает водород или метил; А - СНг, 0 или прямая связь; п - 1 или 2, смесь их изомеров или отдельные изомеры, их фармацевтически приемлемые гидраты и соли. Особенно предпочтительными являются производные хинолонкарбоновои кислоты вышеприведенной формулы, где R - циклопропил или фенил, незамещенный или одно- или двухкратно замещенный фтором; X - группы -ЄН=СН 2 и - О С - R3 , где R3 водород, алкил с 1 - 4 атомами углерода, алкенил с 2 - 3 атомами углерода или триметилсилил; N 27309 R15 где R4 - водород, метил, этил, незамещенный или замещенный гидроксилом; R 5 __ водород или метил; Re- водород или метил; R7 - водород или метил; Rg- водород или группа CH2-NH2; Rio - водород, метил, амино, метиламино, аминометил, этиламинометил; Rn - водород, гидроксил или метокси; Ri3 - водород или метил; Ri4- водород или метил; Ri5 - водород или метил; у R 14 Rie - группа формулы N R. где Ri4 и Ris имеют указанные значения; Ri7 - водород или метил; Rie - группа формулы новую кислоту, 1-циклопропил-8-этинил-б-фтор-1,4-дигидро-7-(2-окса-5,8-диазабицикло[4 3.0}нон-8-ил)-4-оксо-3-хинолинкарбоновую кислоту, 1-циклопропил-8-этинил-6-фтор-1,4-дигидро7-(7-метил-3,7-диазабицикло[3.3.0]окт-3-ил)-4-оксо-3-хинолинкарбоновую кислоту, 1-циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(4-метил1,3,За,5,717а-гексагидроизоиндол-2-ил)-4-оксо-3хинолинкарбоновую кислоту, 1-циклопропил-7(цис-.в-диазабицикло^.З.ОІнон-в-илУ-б-фтор-і^-дигидро-4-оксо-8-винил-3-хинолинкарбоновую кислоту, их фармакологически переносимые гидраты, кислотно-аддитивные соли и соли щелочных металлов, серебра и гуанидина и трифторацетат 7-{3-амино-3-метил-1 -лирролидинил)-1 -циклопропил-8-этинил-б-фтор-1,4-дигидро-4-оксо3-хинолинкарбоновой кислоты. Соединения общей формулы (I) получают тем, что соединение общей формулы (II) Н где Ru имеет указанное значение, a Rig -водород или метил; А -СНг, О или простая связь; п-1, смесь их изомеров или отдельные изомеры, их фармацевтически приемлемые гидраты и соли. В частности предпочитаются производные хинолонкарбоновой кислоты вышеприведенной формулы (I), выбранные из группы, включающей -1 -циклопропил-8-этинил-6-фтор-1,4-дигидро-7 -(4-метил-1-пиперазинил)-4-оксо-3-хинолинкарбоновую кислоту, 1-циклопропил-7-(цис-2,8диазабицикло[4.3.0]нон-8-ил)-8-этинил-6-фтор1,4-дигидро-4-оксо-3-хинолинкарбоновую кислоту, 7-(3-амино-1-пиррол идинил)-1-циклопропил-8-этинил-6-фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновую кислоту, 1-циклопропил-6-фтор1,4-дигидро-8-(3-метил-6ут-3- ен-1-инил)~7-(4метил-1-пиперазинил)-4-оксо-3-хинолинкарбо соон (И). где R и X имеют вышеуказанные значения, а X1 означает галоген, в частности фтор или хлор, подвергают взаимодействию с соединением общей формулы (III) Y-H (III), где Y имеет вышеуказанное значение, в случае необходимости в присутствии связывающего кислоту средства. Если применяют, например, в качестве исходных соединений 1-циклопропил-8-этинил6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновую кислоту и 1-метилпиперазин, то реакция протекает по следующей схеме 27309 О СООН СООН с III сн А 8-(1-хлорвинил)-хинолонкарбоновые кислоты получаются также при взаимодействии 8-этинил-хинолонкарбоновых кислот с соляной кислотой при температуре от 10 °С до 100 °С, предпочтительно при 20 °С - 60 °С. Применяемые в качестве исходных соединений формулы (И) являются новыми и поэтому представляют собой дополнительный объект изобретения. Они могут быть получены взаимодействием соединений формулы (IV) СООН (N) . X" R где R и X имеют вышеуказанные значения, X2 означает галоген, в частности йод, бром или хлор, с соединением формулы (V) М-Х (V) где X имеет вышеуказанное значение, М - SnR'3, ZnX', B(OR")2, где R'-означает алкил с 1-4 атомами углерода, R" - водород или алкил с 1-4 атомами углерода, X і - бром или хлор, в присутствии катализатора - переходного металла с отщеплением имеющихся защитных групп. Применяемые для реакции металлорганические винил- и алкинилсоединения являются либо известными, или могут быть получены описанными в литературе методами. Так, например, винил-триалкил-оловосоединения из соответствующих винилиодидов, - бромидов или хлоридов получают таким образом, что путем взаимодействия с магнием получают винильные соединения Гриньяра и последние взаимодействием с триалкилхлоридом олова переводят в желаемые производные винил-олова. Металлорганические алкильные соединения получают известным способом, например, тем, что 1-алкин металлируют н-бутил-, втор-бутил или третбутиллитием при температуре между -20 и -78°С в апротонном растворителе, например, тетрагидрофуране и затем подвергают взаимодействию с металлгалоидным соединением, например с хлоридом цинка, бромидом магния, йодидом меди или триалкилхлоридом олова. Предпочтительно проводят взаимодействие при температуре - 78°С, Кроме предпочтительного растворителя тетрагидрофурана применяются также и другие эфиры, как диэтиловый эфир, дипропиловый эфир или третбутил-метиловыи эфир или смесь этих эфиров с апротонными алифатическими или ароматическими растворителями, как нгексан или толуол. Так среди винильных соеди нений, так и среди алкильных соединений предпочтительны производные хлорида, цинка и триалкилолова. Под "алкилом" в соединениях триалкилолова понимают алкил с 1-6 атомами углерода, предпочтительны метил и н-бутил. Соединения триалкилвинилолова могут быть получены описанным в литературе способом путем гидростаннилирования алкинов триалкилхлоридами олова в присутствии переходных металлов в качестве катализаторов [J. Org. Спет. 55 (1990) 1857-18671. Металлорганические винил- и алкенилсоединения взаимодействуют с производными 8галогенхинолонкарбоновой кислоты общей формулы (IV) в присутствии подходящего катализатора по принципу известных способов. Под галогеном понимается здесь иод, бром или хлор; предпочтительны бром и хлор, особенно предпочтителен бром. В качестве катализаторов выступают, например, соединения таких переходных металлов как кобальт, рутений, родий, ирридий, никель, палладий или платина. Предпочтительны соединения платины, палладия и никеля, особенно предпочти-' телен палладий. Такие переходные металлы могут применяться в виде их солей, например как NiCb, PdCb или Pd(OAc)2 или в виде комплексов с подходящими лигандами. Предпочтительно применение комплексов. В качестве лигандов применяются предпочтительно фосфины, например, трифенилфосфин, три(о-толил)фосфин, триметилфосфин, трибутилфосфин и три(2-фурил)фосфин, Предпочтителен трифенилфосфин. В качестве предпочтительных комплексных катализаторов следует назвать бис(трифенилфосфин)никель(П)хлорид, бис(трифенилфосфин)палладий(Н)хлорид, трис(трифенилфосфин)палладий(0) и тетракис(трифенилфосфин)палладий(О). Комплексные катализаторы применяются в количествах от 0,1 до 20 моль% в расчете на вводимый эфир 8-галогенхинолонкарбоновой кислоты, предпочтительно в количестве 0,5 до 10 моль%, особенно предпочтительно 1-5 моль%. Реакции сочетания проводятся в подходящем инертном растворителе, например, в бензоле, толуоле, ксилоле, диметилформамиде, диметилацетомиде, диметоксиэтане или смеси этих растворителей; предпочтительными являются диметилформамид и толуол. Растворители перед употреблением сушат известными методами. Реакции сочетания проводятся при температурах между 20 и 200"С; предпочтительны температуры между 50 и 180°С. Длительность взаимодействия определяется реактивностью реагентов и составляет в общем от 2 до 40 часов; предпочтительным является время реакции 4-24 часа. Взаимо 27309 действие проводят а атмосфере защитного газа. В качестве защитного газа применяются инертные газы, например, гелий, аргон или азот; предпочтительным является азот. Реакция сочетания проводится как правило при нормальном давлении. Само собой разумеется, что реакцию можно проводить при пониженном или повышенном давлении. Применяемые в качестве исходных соединений амины обшей формулы (III) большей частью являются известными. Хиральные амины могут применяться как в виде рацематов, так и в виде энантомерных или диастереомерных соединений. Замещенные 1, 3 , За , 4 , 7 , 7а-гексагидроизоиндолы являются большей частью новыми. Они могут быть получены, например, взаимодействием по Дильсу-Альдеру диенов общей формулы (V), (V). где Rg имеет указанное выше значение и R21 или идентичен с Rie или является функциональной группой, с диенофилами общей формулы (VI), О (VI), где R22 является водородом или защитной группой, как триметилсилил, бензил, алкилфенилметил с 1-4 атомами углерода з алкильной части, метоксибензил или бензгидрил, с последующим восстановлением карбонильной группы, а также отщеплением имеющейся защитной группы. Для реакции Дильса-Альдера прменяются в качестве разбавителя все инертные органические растворители. К ним относятся предпочтительно эфиры, как например диизопропиловый эфир, дин-бутиловый эфир, диметоксиэтан, тетрагидрофуран и анизол, углеводороды, как например гек сан, метилциклогексан, толуол, ксилол и мезитилен, и галогенированные углеводороды, как например, хлороформ, 1,2-дихлорэтан и хлорбензол. Реакция Дильса-Альдера может также проводиться и без растворителя. Температура реакции может варьироваться в широком интервале В основном работают при температуре между -20Х и + 200°С, предпочтительно между -20"С и +150°С. Реакция Дильса-Альдера проводится, как правило, при нормальном давлении, однако можно применить давление до 1,5 ГПа Восстановление акрбонильных групп можно проводить с помощью комплексных гидридов. В качестве гидридов могут применяться, например, литийалюминийгидрид, литийборгидрид, литийтриэтилборгидрид, натрий-бис-2-метоксиэтокси-алюминийгидрид или натрий-боргидрид в присутствии катализатора кислот Льюиса, как например, триметилсилан, эфират трифторида бора или алюминийхлорид. В качестве разбавителя могут применяться эфиры, например, диэтиловый эфир, тетрагидрофуран, диоксан или диметоксиметан, и углеводороды, например, гексан, метилциклогексан и толуол или их смеси. Температура варьируется в широком интервале между -40"С и 180"С, предпочтительно между 0°С и 140 в С, Восстановление проводят обычно при нормальном давлении, однако можно его проводить также при пониженном или повышенном давлении. Рекомендуется применение давлений между 100 и 1000 КПа, чтобы можно было достичь высоких температур с легкокипящими растворителями. Комплексные гидриды применяются по меньшей мере в стехиометрическом количестве. Однако обычно применяются в избытке, предпочтительно между 30 и 300%. Отщепление возможно имеющейся защитной группы протекает по общеизвестным методам. Исходные соединения общих формул (V) и (VI) известны или могут быть получены известными в органической химии методами. Если применяют, например, 1-(трет.-бутилоксикарбониламино)-1,3-бутадиен и маленимид в качестве исходных соединений и литийалюминийгидрид в качестве восстановителя, то реакция протекает по следующей схеме: 1ЛАШ 4 HNC-O-C(CH3)3 сс т HN-C-O-C(CH 3 ) 3 1 1 О NHCHj Согласно особой форме осуществления способа можно проводить все стадии с применением подходящего растворителя, например, тетрагидрофурана, без выделения промежуточных продуктов. Если применяют в качестве исходных соединений, например, 1-(трет.-бутипоксикарбониламино)-1,3пентадиен и N-триметилсилил-малеинимид, то реакция протекает по следующей схеме: 27309 Т. пл.: 173-174вС. Пример 11 Этиловый эфир 1-(2, 4-дифторфенил)-8-этинил-6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты Раствор 4,6 г этилового эфира 1-(2,4-дифторфенил)-6,7-дифтор-1,4-дигидро-8-(триметилсилилэтинил)-4-оксо-3-хинолиновой кислоты в 20 мл хлороформа прикапывают при комнатной температуре к раствору 2 г фторида калия в смеси растворителей из 3 мл воды 25 мл хлороформа и 50 мл диметилформамида. Перемешивают 1 час при 20°С, затем реакционную смесь обрабатывают дополнительно хлороформом, многократно встряхивают с водой, органическую фазу сушат и сгущают. Полученный остаток перекристаллизовывают из метанола. Получают 3,4 г этилового эфира 1 -(2,4-дифторфенил)-8-этинил-6,7-дифтор-1,4дигидро-4-оксо-З-хинолинкарбоновой кислоты (87% от теории). Т. пл.: 189°С. Пример 12 1-(2,4-дифторфенил)-8-этинил-6,7-дифтор1,4-дигидро-4-оксо-3-хинолинкарбрновая кислота 1,17 г этилового эфира 1-(2,4-дифторфенил)-8-этинил-6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты кипятят с обратным холодильником в смеси из 9 мл ледяной уксусной кислоты, 0,75 мл воды и 0,2 мл концентрированной серной кислоты в течение 1 часа. Выкристаллизовавшееся при комнатной температуре твердое вещество отфильтровывают и сушат. Получают 0,98 г 1-(2,4-дифторфенил)-8-этинил-6,7дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты (90% от теории). Т. пл.:220°С(сразл.). Пример 13 Этгловый эфир 1-циклопропил-6,7-дифтор1,4-дигидро-4-оксо-8-(пропин-1 -ил)-3-хинолинкарбоновой кислоты 7,5 г этилового эфира 8-бром-1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты, 9,1 г 1-трибутил-станнил-проп-1ина и 1,16 г тетракис(трифенилфосфин)-палладия (0) кипятят с обратным холодильником в 80 мл абсолютного толуола в течение 8 часов. Выкристаллизовавшееся при - 18°С твердое вещество отфильтровывают и сушат. Получают 2,05 г этилового эфира 1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-8-(пропин-1-ил)-3-хинолинкарбоновой кислоты (31% от теории). 1 Н-ЯМР (200 МГц, СОСІз): б 1,1-1,35 (м, 4Н), 1,40 (г, ЗН), 2,16 (д; ЗН), 4,1-4,3 (м; 1Н), 4,35 (кв;2Н), 8,15 (с; 1Н), части/мил. Тпл.:180-182°С. Пример 14 1 -циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-8(пропин-1-ил)-3-хинолинкарбоновая кислота 1,4 г этилового эфира 1-циклопропил-6,7дифтор-1,4-дигидро-4-оксо-8-(пропин-1 -ил)-3-хинолинкарбоновой кислоты кипятят с обратным холодильником в смеси из 20 мл ледяной уксусной кислоты, 1,5 мл воды и 0,5 мл концентрированной серной кислоты в течение часа После разбавления 10 мл воды отфильтровывают выпавший продукт и сушат Получают 1,05 г 1-циклопропил-6,7 дифтор-1,4-дигидро-4-оксо-8-(пропин-1-ил)-3-хигЮлинкарбоновой кислоты (82% от теории). 1 Н-ЯМР (200 МГц, CDCI3): 6 1,4 (м; 4Н), 2,26 (д;ЗН), 4,4-46 (м, 1Н), 8,16 (дд; 1Н), 8,81 (с; 1Н) части/мил. Т. пл : 212-213°С. Пример 15 Этиловый эфир 1-этил-6,7-дифтор-1,2-дигидро-8-(триметилсилилэтинил)-4-оксо-3-хинолинкарбоновой кислоты 5,4 г этилового эфира 8-бром-1-этил-6,7дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты (пример 22), 10,8 г трибутилстаннил-триметилсилил-ацетилена и 0,87 г тетракис(трифенилфосфин)палладия (0) кипятят с обратным холодильником в 50 мл абсолютного толуола в атмосфере азота 24 часа. Полученное твердое вещество отфильтровывают и сушат. Получают 4,53 г этилового эфира 1-этил-6,7-дифтор-1,4-дигидро8-(триметилсилилэтинил)-4-оксо-3-хинолинкарбоновой кислоты (80% от теории). Т. пл.:151-152°С. Пример 16 Этиловый эфир 1-циклопролил-6,7-дифтор1,4-дигидро-8-(триметилсилилэтинил)-4-оксо-3-хинолинкарбоновой кислоты 1,64 г этилового эфира 8-хлор-1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты, 3 г трибутилстаннил-триметилсилил-ацетилена и 0,29 г тетракис(трифенилфосфин) палладия (0) кипятят с обратным холодильником в 20 мл абсолютного толуола 42 часа в атмосфере азота. Реакционную смесь охлаждают до -18°С и фильтруют. После высушивания отфильтрованного остатка получают 0,74 г этилового эфира 1-циклопропил-6,7-дифтор-1,4-дигидро-8-(триметилсилилэтинил)-4-оксо-3-хинолинкарбоновой кислоты (38% от теории). Пример 17 Этиловый эфир 1-циклопропил-6,7-дифтор1,4-дигидро-8-(3-метил-бут-3-ен-1 -инил )-4-оксо-3хинолинкарбоновой кислоты 1,86 г этилового эфира 8-бром-1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты, 2,8 г трибутилстаннил-3-метилбут-З-ен-1-ина и 0,29 г тетеракис(трифенилфосфин)-палладия (0) кипятят с обратным холодильником в 20 мл абсолютного толуола 6 часов в атмосфере азота. Реакционную смесь фильтруют в горячем состоянии, сгущают и остаток перемешивают с гексаном. После фильтрования и сушки получают 1,43 г этилового эфира 1циклопропил-6,7-дифтор-1,4-дигидро-8-(3-метилбут-3-ен-1-инил)-4-оксо-3-хинолинкарбоновой кислоты (80% от теории). Т. пл. 169-17ГС. Пример 18 1 -циклопропил-6,7-дифтор-1,4-дигидро-8-(3метил-бут-3-ен-1-инил)-4-оксо-3-хинолинкарбоновая кислота 0,715 г этилового эфира 1-циклопропил-6,7дифтор-1,4-дигидро-8-(3-метил-бут-3-ен-1 -инил)-4оксо-3-хинолинкарбоновой кислоты кипятят с обратным холодильником в смеси из 10 мл ледяной уксусной кислоты, 0,5 мл воды и 0,2 мл концентрированной серной кислоты 1,5 часа. Реакционную смесь выливают в 100 мл воды Вы 12 27309 павшее твердое вещество отфильтровывают, промывают водой и сушат. Получают 0,53 г 1-циклопропил-6,7-дифтор-1,4-дигидро-8-(3-метил-бутЗ-ен-1 -инл)-4-оксо-3-хинолинкарбоновой кислоты (80% от теории). Т. пл.: 204-206°С. Пример 19 . Этиловый эфир 2-(3-бром-2,4,5-трифтор-бензоил)-3-(2,4-дифторфениламино)-акриловой кислоты 40 г (0,1 моль) этилового эфира 2-(3-бром2,4,5-трифтор-бензоил)-3-этоксиакриловой кислоты подвергают взаимодействию с 14,5 г (0,11 моль) 2,4-дифтор-анилина в 180 мл этанола* при охлаждении льдом. Смесь выдерживают в течение ночи при 10вС, отфильтровывают выпавший остаток, промывают холодным этанолом и сушат в вакууме. Выход: 38 г (81% от теории). Т. пл.: 102-103вС (с разл.) из изопропанола. Пример 20 Этиловый эфир 1-(2,4-дифторфенил)-б,7-дифтор-1,4-дищдро-4-оксо-3-хинолинкарбоновой кислоты 38 г (82 ммоль) этилового эфира 2-(3-бром2,4,5-трифторбензоил)-3-(2,4-дифторфениламино) -акриловой кислоты обрабатывают 7,6 г фторидом натрия в 200 мл диметилформамида и кипятят с обратным холодильником 2 часа. Смесь выливают в ледяную воду, осадок отфильтровывают, хорошо промывают водой и сушат при температуре 180°С в камерной сушилке с циркуляцией воздуха. Выход: 34,7 г (95% от теории). Т. лл.: 208-210°С (с разл.) из монометилового эфира гликоля. Кислым омылением этого эфира получают 8-бром-1-(2,4-дифторфенил)-6,7дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновую кислоту с т. пл 210-21 Г С ( с разл.). Пример 21 Этиловый эфир 2-(3-бром-2,4,5-трифторбензоил )-3-этил-аминоакриловой кислоты 20 г (0,05 моль) этилового эфира 2-(3-бром2,4,5-трифторбензоил)-3-этокси-акриловой кислоты обрабатывают в 40 мл этанола при охлаждении льдом 5,5 г 50%-го водного раствора этиламина. Оставляют на ночь при 10°С, обрабатывают суспензию 200 мл воды,отфильтровывают выпавший осадок, промывают водой и сучат при 60°С в вакууме. Выход: 17,3 г (91% от теории). Т. пл.: 101-102°С (с разл.) из изопропанола. Пример 22 Этиловый эфир 8-бром-1-этил-6,7-дифтор1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты Повторяют пример 20, используя 16 г (42 ммоль) этилового эфира 2-( 3-бром-2,4,5-трифторбензоил )-3- этиламиноакриловой кислоты. Выход: 14,6 г (96% от теории}. Т. пл.: 172-173°С (с разл.) из монометилового эфира гликоля. Кислым омылением получают из этого эфира 8-бром-1-этил-6,7-дифтор-1,4-дигидро-4-оксо-3хинолинкарбоновую кислоту с т. пл. 215-217Х (с разл.). Пример 23 4-метиламино-1,3, За, 4,7,7а-гексагмдроизоиндол Метод I: 14,4 г (60 ммоль) 70%-го 1 -(трет.-бутилоксикарбонил-амино)-1,3-бутадиена в виде раствора в 30 мл абсолютного тетрагидрофурана прикапывают к 10,1 г (60 ммоль) N-триметилсилил-малеинимида в 30 мл абсолютного тетрагидрофурана. После окончания экзотермической реакции кипятят еще один час с обратным холодильником. Охлажденную смесь прикапывают в атмосфере азота к 7,6 г (0,2 моль) литийалюминийгидрида в 200 мл абсолютного тетрагидрофурана. Затем кипятят 14 часов с обратным холодильником. К охлажденной реакционной смеси прикапывают последовательно 7,6 г воды в 23 мл тетрагидрофурана, 7,6 10%-ной натриевой щелочи и 22,8 г воды. Соли отфильтровывают и фильтрат сгущают в вакууме. Остаток (10,3 г) перегоняют при 87°С/0,8 мбар. Дистиллят помещают в 80 мл абсолютного пентана, фильтруют и продукт кристаллизуют при охлаждении до -70°С. Выход: 3.3 г. Т. пл. 72-82Х. Обработкой эквимолярным количеством 2 н. соляной кислоты получают 4-метиламино1,3,3а,4,7,7а-гексагидро-изоиндол-дигидрохлорид с т. пл. 265-268°С (из метанола). Метод II: а) 4(трет.-бутилоксикарбониламино)-1,3диоксо-1,3, За,4,7,7а-гексагидроизоиндол 48.0 г (0,5 моль) мелеинимида растворяют в 200 мл абсолютного тетрагидрофурана и прикапывают 120 г (0,5 моль) приблизительно 70%-ного 1(трет.-бутилоксикарбониламино)-1, 3-бутадиена в виде раствора в 500 мл абсолютного тетрагидрофурана, при этом температуру поддерживают 2030°С. В течение ночи перемешивают при комнатной температуре, затем сгущают и перекристаллизовывают из этилацетата. Получают 57 г продукта с т. пл. 177-182°С. Из маточника дополнительно получают 13 г с т. пл. 158-160°С. б)4-метиламино-1,3,3а,4,7,7а-гексагидроизоиндол . 27.1 г (0,71 моль) литийалюминийгидрида вносят в атмосфере азота в 30 мл абсолютного тетрагидрофурана и прикапывают раствор 57 г (0,21 моль) 4(трет.-бутилоксикарбониламино)-1,3диоксо-1,3,3а,4,7,7а-гексагидроизоиндола в 570 мл абсолютного тетрагидрофурана. Затем кипятят в течение ночи с обратным холодильником. После охлаждения последовательно прикалывают 27,1 г воды в 82 мл тетрагидрофурана, 27,1 г 10%-ной натриевой щелочи и 81,3 г воды. Соли отфильтровывают, промывают тетрагидрофураном и фильтрат сгущают в вакууме. Остаток перегоняют в глубоком вакууме. Выход: 19,1 г. Пример 24 4-амино-1,3,За,4,7,7а-гексагидроизоиндол 13,3 г (50 ммоль) 4-трет.-бутилоксикарбониламино-1,3-диоксо-1,3,3а,4,7,7а-гексагидро-изоиндола (из примера 23, метод II) перемешивают в 166 мл трифторуксусной кислоты в течение ночи при комнатной температуре. Затем отгоняют при 10 мбар трифторуксусную кислоту и остаток отделяют в глубоком вакууме от остатков кислоты. Затем помещают в абсолютный тетрагидрофуран и прикапывают в атмосфере азота к раствору 11,3 (0,3 моль) литийалюминийгидрида в 300 мл абсолютного тетрагидрофурана. Затем кипятят 16 часов с обратным холодильником. После охлаждения последовательно прикапывают 11,3 г воды в 13 27309 34 мл тетрагидрофурана, 11,3 10%-ной натриевой щелочи и 34 мл воды. Осадок отфильтровывают и промывают тетрагидрофураном. Фильтрат сгущают и остаток перегоняют. Выход: 2,2 г, содержание 92% (определ. хроматографически). Т. пл.: 70°С/О,2 мбар. Пример 25 7-метил-4-метиламино-1,3,3а,4,7,7а-гексагидроизоиндол Аналогично примеру 23, метод 1, 21,9 г (0,12 моль) 1 -(трет.-бутилоксикарбониламино)-1,2-пентадиена подвергают взаимодействию с 20,3 г (0,12 моль) N-триметилсилил-малеинимида и затем восстанавливают 15,2 г (0,4 моль) литийалюминийтдридом, Сырой продукт перефисталлизовывают из тетрагидрофурана. Выход: 6,2 г, т.пл.: 106-108°C. Пример 26 1-циклотропил-6,7-дифтор-1,4-дигидро-8-(3-метокси-пропин-1-ил)-4-оксо-3-хинолинкарбоновая кислота А) 1,86 г (5 ммоль) этилового эфира 8-бром-1циклопропил-6,7-дифтор-1,4-дигидро-4чжсо-3-хинолинкарбоновой кислоты подвергают взаимодействию в 20 мл абсолютного толуола с 2,5 г (7 ммоль) 1-трибутилстаннил-3-метокси-пропина и 0,29 г (соот. 5 мольн.%) тетракис-(трифенилфосфоний)-палладия (0) и кипятят 4 часа с обратным холодильником в атмосфере азота. Реакционную смесь сгущают, остаток перемешивают с гексаном, твердое вещество отфильтровывает и очищают хроматографически на силикагеле. Выход: 0,74 г (41% от теории) этилового эфира 1-циклопропил-6,7-дифтор-1 .Фдигидро-вЧЗ-метоксипропин-1-ил)-4-оксо-3-хинолинкарбоновой кислоты. Т. пл.: 144-146°С. Б) 0,36 г (1 ммоль) продукта со стадии А кипятят с обратным холодильником в смеси из 3 мл ледяной уксусной кислоты, 0,2 мл воды и 0,05 мл концентрированной серной кислоты в течение часа. Смесь вьь ливают в воду, осадок отфильтровывают и перекристаллизовывают из этанола. Выход: 153 мг (46% от теории) 1-циклопропил6,7-дифтор-1,4-дигидро-8-(3-метокси-пропин-1-ил)-4оксо-3-хинолинкарбоновой кислоты. Т. пл.: 170-172°С. 1 Н-ЯМР (270 МГц, CDCI3). 6 1,24 м (2Н), 1,4 м (2Н), 3,45 с (ОСНз), 4,35 м (1Н), 4,41 с (О-СН?-), 8,27 т (1Н), 8,87 с (1Н) части/милл. Нижеследующие примеры поясняют получение производных хинолонкарбоновой кислоты общей формулы (I). Пример 27 О F, — JL.COOH перемешивают с ацетонитрилом, отфильтровывают нерастворившиеся кристаллы и сушат. Выход: 1,83 г (62% от теории) 1-циклопропил-8этинил-6-фтор-1,4-дигидро-7-(4-метил-1 -пиперазинил)-4-оксо-3-хинолинкарбоновой кислоты. Т. пл.: 228-230°С ( с разл.) 1 6 H-flMP(d -DMF): 8 (4,95 части/милл. С(-ОэС-Н). Б) Аналогично получают с 2-метилпиперазином 1 -циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(3-метил-1-пиперазинил)-4-оксо-3-хинолинкарбоновую кислоту. 1 6 Н-ЯМР ( d -DMSO): 8 5,03 части/милл. С + + (-СнС-Н). Масс-спектр: м/е 369 (М ), 325 (М -СО2), 300, 293, 269, 244, 44 (СО2). Аналогично примеру 27 получают из продуктов по примерам 14, 7 и 9 соединения общей формулы: F СН3 ^ С ні с I О J L -СООН 1 А R Пример 28 (R=CH3) 1 -циклопропил-б-фтор-1,4-дигидро-7-(4-метил-1-пиперазинил)-4-оксо-8-(пропин-1-ил)-3-хинолинкарбоновая кислота. Т. пл.: 246-249Х (с разл.). Пример 29 1 -циклопропил-6-фтор-8-(гексин-1 -ил)-1,4дигидро-7-(4-метил-1-пиперазинил)-4-оксо-3-хинолинкарбоновая кислота. Т. пл.: 206-208°С (с разл.). Пример 30 (R=C(CH)3)3 1-циклопропил-8-(3,3-диметилбутин-1-ил)-6фтор-1,4-дигидро-7-(4-метил-1 -пиперазинил)-4-оксо-3-хинолинкарбоновая кислота. Т. пл.: 234-237°С ( с разл.). Пример 31 О л СООН 'N' SА сн Повторяют пример 1, используя цис-2,8диазабицикло[4.3.0] нонан. Получают 1-циклопропил-7-(цис-2,8-диазабицикло [4.3.9] нон-8-ил)-8этинил-6-фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновую кислоту с т. пл. 225-227Х ( с разл.). ^Н-ЯМР (d 6 -DMF): 8 4,9 с (-С=С-Н). Пример 32 СООН А) 2,32 г (8ммоль) 1 -циклопропил-8-этинил6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты кипятят с обратным холодильником в смеси из 60 мл ацетонитрила и 30 мл диметилформамида с 0,92 г (8 ммоль) 1,4-диаза-бицикло[2,2,2]октана и 1,2 г (12 ммоль) N-метилпиперазина в течение часа. Суспензию сгущают, остаток хН 2 О 14 27309 3,6 г (12 ммоль) 1-циклопропил-8-этинил6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты, 1,56 г (14 ммоль) 1,4-диазабицикло [2.2.2]октана и 2,75 г (18 ммоль) 3-(2,2-диметилпропилиденамино)пирролидина кипятят с обратным холодильником в смеси из 120 мл ацетонитрила и 60 мл диметилформамида в течение 1 часа. Раствор сгущают, остаток перемешивают с 100 мл воды (рН=7), осадок отфильтровывают, промывают водой и затем для полного отщепления защитной группы суспендируют в 50 мл воды и обрабатывают 1 час в ультразвуковой ванне. Затем фильтруют, промывают водой и сушат в вакууме при температуре 80°С. Выход: 3,8 г (82% от теории) гидрата 7-{3амино-1 -пиррол идини л)-1 -циклопрол ил-8-этинил-6 -фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты. Т.пл.: 193-196Х (с разл.) Пример 33 Пример 35 СООН Повторяют пример 27, подвергая взаимодействию 2-оксо-5,8-диазабицикло[4.3.0] нонан с продуктом по примеру 14 с получением 1-циклопропил-6-фтор-1,4-дигидро-7-( 2-оксо-5,8-диазабицикло [4.3.0]нон-8-ил)-3-хинолинкарбоновой кислоты ст. пл. 241-242°С (с разл ). Пример 36 О соон С R-NHV-J S A сн A: R- СО-О-С(СНз)з В: R - Н х CF3COOH А) Повторяют пример 27, используя 3-трет.бутоксикарбонил-амино-3-метил-пирролидин. При этом получают 7-(3-трет.-бутоксикарбонил-аминоЗ-метил-1 -пиррол идинил)-1-циклопропил-8-этинил -6-фтор-1,4-дигидро-4-оксо-3-хинол инкарбоновую кислоту с т. пл. 244-246°С ( с разл.). 1 Н-ЯМР (d 6-DMCO): 5 4,92 части/милл. с (-CsOH). Б) 500 мг продукта со стадии А растворяют в 5 мл трифторуксусной кислоты при охлаждении льдом, раствор сгущают в вакууме, остаток кристаллизуют путем трехкратного перемешивания с 1 мл этанола, соль отфильтровывают, промывают этанолом и -сушат. Выход: 270 г (52% от теории) триацетата 7-(3-амино-3метил-1 -пирролидинил)-1 -циклопропил-8-этинил -6-фтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты. Т. пл. 242-244Х ( с разл.). Пример 34 О Г • пі А сн Повторяют пример 27, используя 2-окса-5,8диазабицикло[4.3.0]нонан. При этом получают 1циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(2-окса-5,8-диазабицикло[4,3,0]нон-8-ил)-4-оксо-3-хинолинкарбоновую кислоту с т. пл. 290°С ( с разл.), спекается уже при 179°С. 1 Н-ЯМР (d 6 -DMCO): 5,0 части/милл. с СН 3 A: R= (СНз)зС-О-СОВ: R=H А) 303 мг (1 ммоль) продукта по примеру 14, 240 мг З-трет.-бутоксикарбониламино-3-метилпирролидина и 134 мг (1,2 ммоль) 1,4-диазабицикло[2.2.2]октана нагревают с обратным холодильником в смеси из 6 мл ацетонитрила и 3 мл диметилформамида в течение 2 часов. Сгущают в вакууме, перемешивают с 30 мл воды и сушат при 80°С в вакуууме. Выход: 420 мг (87% от теории) 7-(3-трет.-бутилоксикарбонил-амино-З-метил-1-пирролидинил) -1 -циклопропил-6-фтор-1,4-дигидро-4-оксо-8-(пропин-1 -ил)-3-хинолинкарбоновой кислоты. Т. пл.: 195-196°С ( с разл.). 1 Н-ЯМР ( d 6 - DMCO): § 1,42 с (СН 3 у пирролидина), 2,21 части/милл с (СНз -С^С-). Б) 180 мг продукта со стадии А растворяют при 0°С в 1,6 мл трифторуксусной кислоты и раствор сгущают спустя 1,25 часа. Остаток хроматографически очищают (силикагель, дихлорметан/ /метано/17%-ный водный аммиак - 30 : 8 : 1). Выделяют 10 мг 7-(3-амино-3-метил-1-пирролидинил)-1 -циклопропил-6-фтор-1,4-дигидро-4-оксо-8(пропин-1ил )-3-хинолинкарбоновой кислоты с т. пл.: 209-210°С ( с разл.). Масс-спектр: м/е (М+), 309, 298, 267 (100%), 133, 70. Пример 37 СООН 27309 Повторяют пример 27, превращая продукт по примеру 12 с N-метилпиперазином в 8-этинил6-фтор-1 -(2,4-дифторфенил)-1,4-дигидро-7-(4-метил-1-пиперазинил)-4-оксо-3-хинолинкарбоновую кислоту с т. пл.: 193-195°С (с разл.). 1 Н-ЯМР (CDCIa)' 3,35 с (-ОСН) Пример 38 Повторяют пример 27, используя 4-метиламино-1,3,3а,4,7,7а-гексагидроизоиндол При этом получают 1 -цикл опроли л-8-этинил-6-фтор-1,4-дищцро-7-{4-метиламино-1,31За,4,7,7а-гексагидро-изоиндол-2-ил)-4-оксо-3-хинолинкарбоновую кислоту с т. пл. 128-133°С (с разл.). 1 6 Н-ЯМР ( d - DMCO): 8 4,93 части/ милл. с (-СзС-Н) Пример 41 соон CHrN с СН3 Повторяют пример 27, используя 3-метил3,3-диаэабицикло{4.3.0]нонан. Полученную сырую 1 -циклопропи л-8-этини л-6-фтор-1,4-дигидро-7-(3метил-3,8-диазабицикло[4 3 0]нон-8-ил)-4-оксо-3хинолинкарбоновую кислоту очищают хроматографически (силикагель; дихлорметан/метан/20%ный водный аммиак 2 * 4 : 1 1 Н-ЯМР (CDCfe): 5 4,15 с (-ОС-Н). Пример 39 lit с I с Повторяют пример 27, используя 3-метил3,7-диазабицикло[3 3.0]октан Получают 1-циклопропил-8-этинил-6-фтор-1,4-дигидро-7-(7-метил -3,7-диазьбицикло[3 3.0]окт-3-ил)-4-оксо-3-хинолинкарбоновую кислоту с т пл 212-216°С ( с разл.). 1 Н-ЯМР (d66 -ДМФ) 5 4,95 с (-( Пример 40 О соон А СООН -NH сн Пример 43 Повторяют пример 27, используя 2,8-диазабицикло[4.3.0]нонан. Получают 1-циклопропил-7-(2,8диазабицикло[4.3 0]нон-8-ил)-6-фтор-1,4-дигидро-8(3-метил-бут-3-ен-1-инил)-4-оксо-3-хинолинкарбоновую кислоту с т. пл. 201-202°С (с разл). N" С lit сн, 164 мг (0,5 ммоль) продукта по примеру 18 обрабатывают аналогично примеру 27 1-метилпиперазином. Получают 120 мг 1-циклопропил6-фтор-1,4-дигидро-8-(3-метил-бут-3-ен-1-инил)7-(4-метил-1-пиперазинил)-4-оксо-3-хинолинкарбоновой кислоты с т пл. 195-197°С ( с разл.), перекристаллизованной из монометилового эфира гликоля. 1 Н-ЯМР (CDCI3): 5 5,36 м Г ^ С Н г ), 2,4 с (N-СНз), 2,0 т (С-СНз). Пример 42 ссон CH, А А О N І A. R N С II! С А I НлС с сн В. С. R= N HO--8-(3-метил-бут-3-ен-1 -инил)-4оксо-3-хинолинкарбоновую кислоту с т. пл. 190-198"С (сразл ) В. 1 Ч4иклопропил-6-фтор-1,4-дигидро-8-(3-метил-бут-З-ен-1 -инил)-7-(3-метил-1 -пиперазинил) -4-окоо3-хинолинкарбоновую кислоту. Пример 44 370 мг продукта по примеру 36А растворяют в 9 мл полуконцентрированной соляной кислоты и раствор сгущают в глубоком вакууме. Выход- 340 мг гидрохлорида цис-транс-7-(3амино-3-метил-1-пирролидинил)-8-(1-хлор-1-пропенил)-1 -циклопропил-6-фтор-1,4-дигидро-4-оксо3-хинолинкарбоновой кислоты. 6 *Н-ЯМР (d - ДМСО): 5 6,19 кв и 6,36 кв ( "7С=СН-СНз; 2 сигналадля цис-транс-форм ). Пример 47 СООН хНСІ хна 100 мг продукта по примеру 27 растворяют в 40 мл соляной кислоты и перемешивают 2 часа при 30°С. Получают суспензию, которую сгущают. Остаток перемешивают с небольшим количеством изопропанола. Осадок отфильтровывают, промывают изопропанолом и сушат в вакууме при 90°С. Выход- 0,1 г (83% от теории) гидрохлорида 8-(1хлоривинил)-1 -циклопропил-б-фтор-1,4-диг>щро-7-(4метил-1 -пиперазинил)Ч-оксо-3-хинолонкарбоновой кислоты. 10 мг продукта по примеру 37 нагревают в 4,5 мл 2,5 н соляной кислоты 1 час при 60°С. Смесь сгущают и получают гидрохлорид 8-(1хлорвинил)-6-фтор-1-(2,4-дифторфенил)-1,4-дигидро-7-(4-метил-1-пиперазинил)-4-оксо-3-хинолинкарбоновой кислоты Масс-спектр: м/е 477 (М*), 442 (M*-CI), 36 (100%, HCI) Пример 48 1 Н-ЯМР (d6 - ДМСО).5 6,0 части/милл Пример 45 О Л ХООН СООН xHQ 291 мг (1ммоль) продукта по примеру 2 в смеси из 20 мл ацетонитрила и 10 мл диметилформамида смешивают с (2,2 ммопь) 1,4-диазабицикло-[2 2 2] октана и 360 мг (2,3 ммоль) 3-(2,2диметил-пропилиден-амино)-пирролидина и смесь кипятят с обратным холодильником 32 часа. Сгущают, перемешивают темный маслянистый остаток с 10 мл воды и отфильтровывают выпавшее темное вещество (103 мг), очищают хроматографией (силикагель; дихлорметан/метанол/17%-ный водный аммиак 30 : 8 :1). Выход: 58 мг (16% от теории) 7-(3-амино-1пирролидинил)-1 -циклопропил-6-фтор-1,4-дигидро -4-оксо-8-винил-3-хинолинкарбоновой кислоты. Т. пл : 179-182°С (с разл.). Масс-спектр: м/е 358 (M+J-0,340 (М+Н-Н2О)*. Пример 49 сн 3 А) 100 мг продукта по примеру 28 нагревают с 58 мл 4 н соляной кислоты 5 часов при 60°С. Смесь сгущают, остаток перемешивают с диэтиловым эфиром и сушат в вакууме при 70°С. Выход: 90 мг гидрохлорида цис-транс-8-(1-хлор-1пропенил)-1 -циклопропил-6-фтор-1,4-дигидро-7-(4метил-1-пиперазинил)-4-оксо-3-хинолинкарбоновой кислоты. Т. пл.: 236-237°С ( с разл.). Масс-спектр: м/е 419 (М*), 71,58 (100%), 43,36. 1 Н-ЯМР (d 6 - ДМСО): 5 6,12 кв и 6,35 кв (-С^СН-СНз; два сигнала для цис-транс-форм). . Б) Аналогично с соединением по примеру 29 получаютгоодрохлоридцис-транс-8-(1-хлор-1-гексенил)-1циклолропил-6-фтор-1,4-дищдро-7-(4-метил-1-пиперазинил)-4-оксо-3-хинолинкарбоновой кислоты. Масс-спектр: м/е 461 (М*), 425 (M-HCI), 71, 58 (100%), 43,36. Пример 46 СООН 145 мг (0,5 ммоль) продукта по примеру 2 в смеси из 10 мл ацетонитрила и 5 мл диметилформамида смешивают с 60 мг (0,54 ммоль) цис2,8-диазабицикло-[4.3.0]нонана и полученную смесь кипятят 4 часа с обратным холодильником. Раствор сгущают, перемешивают с 5 мл воды и 17
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of quinoline carboxylic acid, mixture of isomers or individual isomers, their pharmaceutically acceptable hydrates and salts, having antibacterial activity
Автори англійськоюPetersen Uwe, Himmler Thomas, Schenke Thomas, Krebs Andreas, Grohe Klaus, Bremm Klaus-Dieter, Metzger Karl Georg, Endermann Rainer, Zeiler Hans-Joachim
Назва патенту російськоюПроизводные хинолонкарбоновой кислоты, смесь их изомеров или отдельные изомеры, их фармакологически приемлемые гидраты и соли, имеющие антибактериальную активность, и промежуточные соединения
Автори російськоюПетерсен Уве, Химмлер Томас, Шенке Томас, Кребс Андреас, ГРОХЕ Клаус, Бремм Клаус-Дитер, Метцгер Карл Георг, Эндерманн Райнер, Цайлер Ханс-Иоахим
МПК / Мітки
МПК: A61P 31/04, C07D 487/10, A61K 31/495, C07D 487/04, C07D 401/04, C07D 498/04, A61P 33/10, C07D 487/08, A61K 31/47, A61P 33/00, C07D 413/04, A61K 31/535, C07D 471/08, A61K 31/55, C07D 215/56, A61P 33/02, C07D 405/14, C07D 471/04
Мітки: сполуки, гідрати, проміжні, солі, ізомерів, фармакологічно, мають, кислоти, антибактеріальну, прийнятні, окремі, суміш, активність, ізомери, похідні, хінолонкарбонової
Код посилання
<a href="https://ua.patents.su/33-27309-pokhidni-khinolonkarbonovo-kisloti-sumish-kh-izomeriv-abo-okremi-izomeri-kh-farmakologichno-prijjnyatni-gidrati-ta-soli-shho-mayut-antibakterialnu-aktivnist-ta-promizhni-spoluki.html" target="_blank" rel="follow" title="База патентів України">Похідні хінолонкарбонової кислоти, суміш їх ізомерів або окремі ізомери, їх фармакологічно прийнятні гідрати та солі, що мають антибактеріальну активність, та проміжні сполуки</a>
Наступний патент: Спосіб і пристрій (варіанти) для виробництва мінеральної вати і мінеральна вата, отримана цим способом
Випадковий патент: Гідростатичний гранулятор