Похідні піроліну, що мають спорідненість до альфа-2-дельта субодиниць кальцієвих каналів
Формула / Реферат
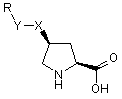
1. Застосування сполуки формули (І):
 , (I)
, (I)
в якій
X означає або O, S, NH, або CH2 і Y означає CH2 або простий зв’язок, Y означає або O, S або NH і X означає CH2; і
R означає 3-12-членний циклоалкіл, 2,3-дигідробензофураніл, арил або гетероарил, де будь-яке кільце може бути необов’язково заміщене одним або більшою кількістю замісників, незалежно вибраних з
галогену, гідрокси, ціано, нітро, аміно, гідроксикарбонілу,
C1-C6 алкілу, C1-C6 алкенілу, C1-C6 алкінілу,
C1-C6 алкокси, гідроксиС1-C6 алкілу, C1-C6 алкоксиС1-C6 алкілу, перфторC1-C6 алкілу, перфторС1-C6 алкокси,
C1-C6 алкіламіно, ді-C1-C6 алкіламіно, аміноС1-C6 алкілу, C1-C6 алкіламіноС1-C6 алкілу, ді-C1-C6 алкіламіно С1-C6 алкілу,
C1-C6ацилу, C1-C6ацилокси, C1-C6ацилоксиС1-C6 алкілу, C1-C6 ациламіно,
C1-C6 алкілтіо, C1-C6 алкілтіокарбонілу, C1-C6 алкілтіоксо, C1-C6 алкоксикарбонілу,
C1-C6 алкілсульфонілу, C1-C6 алкілсульфоніламіно,
аміносульфонілу, C1-C6 алкіламіносульфонілу, ді-C1-C6 алкіламіносульфонілу,
3-8-членного циклоалкілу, 4-8-членного гетероциклоалкілу, фенілу та моноциклічного гетероарилу;
або фармацевтично прийнятної солі, сольвату або їх пролікарської форми у виробництві медикаменту для лікування болю.
2. Застосування за п. 1, де R означає необов’язково заміщену циклогексильну, 2,3-дигідробензофуранільну, ізохінолільну або фенільну групу.
3. Застосування за п. 1 або 2, де R означає необов‘язково заміщену фенільну групу.
4. Застосування за будь-яким з пп. 1-4, де R є необов’язково заміщений однією або двома групами, вибраними з галогену, гідрокси і (C1-C6)алкокси.
5. Застосування за будь-яким з пп. 1-4, де R є заміщений однією або двома групами, вибраними з метокси, фтору, хлору і брому.
6. Застосування за будь-яким з пп. 1-5, де X означає O, S, NH або CH2 і Y означає CH2 або простий зв’язок, або X означає CH2 і Y означає О.
7. Застосування за будь-яким з пп. 1-6, де -Y-X- означає окси, тіо, аміно, метилен, метилентіо, метилeнокси або оксиметилен.
8. Застосування за будь-яким з пп. 1-7, де -Y-X- означає окси, метилен або оксиметилен.
9. Спосіб лікування болю у ссавця, включаючи людину, що полягає в введенні сполуки формули (I), як описано в пункті 1, або її фармацевтично прийнятної солі або сольвату.
10. Сполука формули (Іа):
 ,
,
в якій Ra вибраний з галогену, гідрокси, (C1-C6)алкокси, ціано, нітро, аміно, гідроксикарбонілу,
C1-C6 алкілу, C1-C6 алкенілу, C1-C6 алкінілу,
гідроксиС1-C6 алкілу, C1-C6 алкоксиС1-C6 алкілу, перфторC1-C6 алкілу,
перфторС1-C6 алкокси,
C1-C6 алкіламіно, ді-C1-C6 алкіламіно, аміноС1-C6 алкілу, C1-C6 алкіламіноС1-C6 алкілу, ді-C1-C6алкіламіноС1-C6 алкілу,
C1-C6ацилу, C1-C6ацилокси, C1-C6ацилоксиС1-C6 алкілу, C1-C6 ациламіно,
C1-C6 алкілтіокарбонілу, C1-C6 алкілтіоксо, C1-C6 алкоксикарбонілу,
C1-C6 алкілсульфонілу, C1-C6 алкілсульфоніламіно,
аміносульфонілу, C1-C6 алкіламіносульфонілу, ді-C1-C6 алкіламіносульфонілу,
3-8-членного циклоалкілу, 4-8-членного гетероциклоалкілу, фенілу та моноциклічного гетероарилу;
Rb вибраний з водню, галогену, гідрокси, (C1-C6)алкокси, ціано, нітро, аміно, гідроксикарбонілу,
C1-C6 алкілу, C1-C6 алкенілу, C1-C6 алкінілу,
C-C6 алкокси, гідроксиС1-C6 алкілу, C1-C6 алкоксиС1-C6 алкілу, перфторC1-C6 алкілу,
перфторС1-C6 алкокси,
C1-C6 алкіламіно, ді-C1-C6 алкіламіно, аміноС1-C6 алкілу, C1-C6 алкіламіноС1-C6 алкілу, ді-C1-C6алкіламіноС1-C6 алкілу,
C1-C6ацилу, C1-C6ацилокси, C1-C6ацилоксиС1-C6 алкілу, C1-C6 ациламіно,
C1-C6 алкілтіо, C1-C6 алкілтіокарбонілу, C1-C6 алкілтіоксо, C1-C6 алкоксикарбонілу,
C1-C6 алкілсульфонілу, C1-C6 алкілсульфоніламіно,
аміносульфонілу, C1-C6 алкіламіносульфонілу, ді-C1-C6 алкіламіносульфонілу,
3-8-членного циклоалкілу, 4-8-членного гетероциклоалкілу, фенілу та моноциклічного гетероарилу;
або її фармацевтично прийнятна сіль або сольват.
11. Сполука формули (Ib):
 ,
,
в якій Ra вибраний з галогену, гідрокси, ціано, нітро, аміно, гідроксикарбонілу,
C1-C6 алкілу, C1-C6 алкенілу, C1-C6 алкінілу,
гідроксиС1-C6 алкілу, C1-C6 алкоксиС1-C6 алкілу, перфторC1-C6 алкокси,
C1-C6 алкіламіно, ді-C1-C6 алкіламіно, аміноС1-C6 алкілу, C1-C6 алкіламіноС1-C6 алкілу, ді-C1-C6алкіламіноС1-C6 алкілу,
C1-C6ацилу, C1-C6ацилокси, C1-C6ацилоксиС1-C6 алкілу, C1-C6 ациламіно,
C1-C6 алкілтіо, C1-C6 алкілтіокарбонілу, C1-C6 алкілтіоксо, C1-C6 алкоксикарбонілу,
C1-C6 алкілсульфонілу, C1-C6 алкілсульфоніламіно,
аміносульфонілу, C1-C6 алкіламіносульфонілу, ді-C1-C6 алкіламіносульфонілу,
3-8-членного циклоалкілу, 4-8-членного гетероциклоалкілу, фенілу та моноциклічного гетероарилу;
Rb вибраний з водню, галогену, гідрокси, (C1-C6)алкокси, ціано, нітро, аміно, гідроксикарбонілу,
C1-C6 алкілу, C1-C6 алкенілу, C1-C6 алкінілу,
C-C6 алкокси, гідроксиС1-C6 алкілу, C1-C6 алкоксиС1-C6 алкілу, перфторC1-C6 алкілу,
перфторС1-C6 алкокси,
C1-C6 алкіламіно, ді-C1-C6 алкіламіно, аміноС1-C6 алкілу, C1-C6 алкіламіноС1-C6 алкілу, ді-C1-C6алкіламіноС1-C6 алкілу,
C1-C6ацилу, C1-C6ацилокси, C1-C6ацилоксиС1-C6 алкілу, C1-C6 ациламіно,
C1-C6 алкілтіо, C1-C6 алкілтіокарбонілу, C1-C6 алкілтіоксо, C1-C6 алкоксикарбонілу,
C1-C6 алкілсульфонілу, C1-C6 алкілсульфоніламіно,
аміносульфонілу, C1-C6 алкіламіносульфонілу, ді-C1-C6 алкіламіносульфонілу,
3-8 членного циклоалкілу, 4-8 членного гетероциклоалкілу, фенілу та моноциклічного гетероарилу;
або її фармацевтично прийнятна сіль або сольват.
12. Сполука формули (Іс):
 ,
,
в якій Ra і Rb незалежно вибрані з водню, галогену, гідрокси, (C1-C6)алкокси, ціано, нітро, аміно, гідроксикарбонілу,
C1-C6 алкілу, C1-C6 алкенілу, C1-C6 алкінілу,
C-C6 алкокси, гідроксиС1-C6 алкілу, C1-C6 алкоксиС1-C6 алкілу, перфторC1-C6 алкілу,
перфторС1-C6 алкокси,
C1-C6 алкіламіно, ді-C1-C6 алкіламіно, аміноС1-C6 алкілу, C1-C6 алкіламіноС1-C6 алкілу, ді-C1-C6алкіламіноС1-C6 алкілу,
C1-C6ацилу, C1-C6ацилокси, C1-C6ацилоксиС1-C6 алкілу, C1-C6 ациламіно,
C1-C6 алкілтіо, C1-C6 алкілтіокарбонілу, C1-C6 алкілтіоксо, C1-C6 алкоксикарбонілу,
C1-C6 алкілсульфонілу, C1-C6 алкілсульфоніламіно,
аміносульфонілу, C1-C6 алкіламіносульфонілу, ді-C1-C6 алкіламіносульфонілу,
3-8-членного циклоалкілу, 4-8-членного гетероциклоалкілу, фенілу та моноциклічного гетероарилу;
або її фармацевтично прийнятна сіль або сольват.
13. Сполука формули (Іа) за п. 10, якою є
(2S,4S)-4-(3-Хлорфенокси)піролідин-2-карбонова кислота;
або її фармацевтично прийнятна сіль або сольват.
14. Сполука формули (Ib) за п. 11, яка вибрана з:
(2S,4S)-4-(3-Фторбензил)піролідин-2-карбонової кислоти;
(2S,4S)-4-(2,3-Дифторбензил)піролідин-2-карбонової кислоти; та
(2S,4S)-4-(2,5-Дифторбензил)піролідин-2-карбонової кислоти;
або їх фармацевтично прийнятних солей або сольватів.
15. Сполука формули (Iс) за п. 12, яка вибрана з:
(2S,4S)-4-(3-Фторфеноксиметил)піролідин-2-карбонової кислоти;
(2S,4S)-4-(3,6-Дифторфеноксиметил)піролідин-2-карбонової кислоти;
(2S,4S)-4-(2,3-Дифторфеноксиметил)піролідин-2-карбонової кислоти; і
(2S,4S)-4-(3-Метоксифеноксиметил)піролідин-2-карбонової кислоти;
або їх фармацевтично прийнятних солей або сольватів.
16. Фармацевтична композиція, яка містить сполуку формули (І) (I), (Iа), (Ib) або (Iс) за будь-яким з пп. 1 - 15 або її фармацевтично прийнятну сіль або сольват і один або більшу кількість фармацевтично прийнятних ексципієнтів, розчинників або носіїв.
17. Комбінація, яка містить сполуку формули (I), (Iа), (Ib) або (Iс) за будь-яким з пп. 1 - 15 або її фармацевтично прийнятну сіль або сольват і принаймні один інший терапевтично активний агент.
18. Комбінація згідно з пунктом 17, де іншим терапевтично активним агентом є PDEV інгібітор.
Текст
1. Застосування сполуки формули (І): R Y X 2 (11) 1 АЛЬФА-2-ДЕЛЬТА СУБОДИНИЦ Ь UA ЩО МАЮТЬ (19) (54) ПОХІДНІ ПІРОЛІНУ, КАЛЬЦІЄВИХ КАНАЛІВ ДО ПАТЕНТУ НА ВИНАХІД 3 81437 Ra Rb O N H CO 2H (Ia) , в якій Ra вибраний з галогену, гідрокси, (C1C6)алкокси, ціано, нітро, аміно, гідроксикарбонілу, C1-C6 алкілу, C1-C6 алкенілу, C1-C6 алкінілу, гідроксиС1-C6 алкілу, C1-C6 алкоксиС 1-C6 алкілу, перфторC1-C6 алкілу, перфторС1-C6 алкокси, C1-C6 алкіламіно, ді-C1-C6 алкіламіно, аміноС 1-C6 алкілу, C1-C6 алкіламіноС 1-C6 алкілу, ді-C1C6алкіламіноС1-C6 алкілу, C1-C6ацилу, C1-C6ацилокси, C1-C6ацилоксиС1-C6 алкілу, C1-C6 ациламіно, C1-C6 алкілтіокарбонілу, C1-C6 алкілтіоксо, C1-C6 алкоксикарбонілу, C1-C6 алкілсульфонілу, C1-C6 алкілсульфоніламіно, аміносульфонілу, C1-C6 алкіламіносульфонілу, діC1-C6 алкіламіносульфонілу, 3-8-членного циклоалкілу, 4-8-членного гетероциклоалкілу, фенілу та моноциклічного гетероарилу; Rb вибраний з водню, галогену, гідрокси, (C1C6)алкокси, ціано, нітро, аміно, гідроксикарбонілу, C1-C6 алкілу, C1-C6 алкенілу, C1-C6 алкінілу, C-C6 алкокси, гідроксиС1-C6 алкілу, C1-C6 алкоксиС 1-C6 алкілу, перфторC1-C6 алкілу, перфторС1-C6 алкокси, C1-C6 алкіламіно, ді-C1-C6 алкіламіно, аміноС 1-C6 алкілу, C1-C6 алкіламіноС 1-C6 алкілу, ді-C1C6алкіламіноС1-C6 алкілу, C1-C6ацилу, C1-C6ацилокси, C1-C6ацилоксиС1-C6 алкілу, C1-C6 ациламіно, C1-C6 алкілтіо, C1-C6 алкілтіокарбонілу, C1-C6 алкілтіоксо, C1-C6 алкоксикарбонілу, C1-C6 алкілсульфонілу, C1-C6 алкілсульфоніламіно, аміносульфонілу, C1-C6 алкіламіносульфонілу, діC1-C6 алкіламіносульфонілу, 3-8-членного циклоалкілу, 4-8-членного гетероциклоалкілу, фенілу та моноциклічного гетероарилу; або її фармацевтично прийнятна сіль або сольват. 11. Сполука формули (Ib): Ra Rb N H (Ib) CO 2H , 4 в якій Ra вибраний з галогену, гідрокси, ціано, нітро, аміно, гідроксикарбонілу, C1-C6 алкілу, C1-C6 алкенілу, C1-C6 алкінілу, гідроксиС1-C6 алкілу, C1-C6 алкоксиС 1-C6 алкілу, перфторC1-C6 алкокси, C1-C6 алкіламіно, ді-C1-C6 алкіламіно, аміноС 1-C6 алкілу, C1-C6 алкіламіноС 1-C6 алкілу, ді-C1C6алкіламіноС1-C6 алкілу, C1-C6ацилу, C1-C6ацилокси, C1-C6ацилоксиС1-C6 алкілу, C1-C6 ациламіно, C1-C6 алкілтіо, C1-C6 алкілтіокарбонілу, C1-C6 алкілтіоксо, C1-C6 алкоксикарбонілу, C1-C6 алкілсульфонілу, C1-C6 алкілсульфоніламіно, аміносульфонілу, C1-C6 алкіламіносульфонілу, діC1-C6 алкіламіносульфонілу, 3-8-членного циклоалкілу, 4-8-членного гетероциклоалкілу, фенілу та моноциклічного гетероарилу; Rb вибраний з водню, галогену, гідрокси, (C1C6)алкокси, ціано, нітро, аміно, гідроксикарбонілу, C1-C6 алкілу, C1-C6 алкенілу, C1-C6 алкінілу, C-C6 алкокси, гідроксиС1-C6 алкілу, C1-C6 алкоксиС 1-C6 алкілу, перфторC1-C6 алкілу, перфторС1-C6 алкокси, C1-C6 алкіламіно, ді-C1-C6 алкіламіно, аміноС 1-C6 алкілу, C1-C6 алкіламіноС 1-C6 алкілу, ді-C1C6алкіламіноС1-C6 алкілу, C1-C6ацилу, C1-C6ацилокси, C1-C6ацилоксиС1-C6 алкілу, C1-C6 ациламіно, C1-C6 алкілтіо, C1-C6 алкілтіокарбонілу, C1-C6 алкілтіоксо, C1-C6 алкоксикарбонілу, C1-C6 алкілсульфонілу, C1-C6 алкілсульфоніламіно, аміносульфонілу, C1-C6 алкіламіносульфонілу, діC1-C6 алкіламіносульфонілу, 3-8 членного циклоалкілу, 4-8 членного гетероциклоалкілу, фенілу та моноциклічного гетероарилу; або її фармацевтично прийнятна сіль або сольват. 12. Сполука формули (Іс): Rb Ra O N H CO 2H (Ic) , в якій Ra і Rb незалежно вибрані з водню, галогену, гідрокси, (C1-C6)алкокси, ціано, нітро, аміно, гідроксикарбонілу, C1-C6 алкілу, C1-C6 алкенілу, C1-C6 алкінілу, C-C6 алкокси, гідроксиС1-C6 алкілу, C1-C6 алкоксиС 1-C6 алкілу, перфторC1-C6 алкілу, перфторС1-C6 алкокси, C1-C6 алкіламіно, ді-C1-C6 алкіламіно, аміноС 1-C6 алкілу, C1-C6 алкіламіноС 1-C6 алкілу, ді-C1C6алкіламіноС1-C6 алкілу, 5 81437 6 C1-C6ацилу, C1-C6ацилокси, C1-C6ацилоксиС1-C6 алкілу, C1-C6 ациламіно, C1-C6 алкілтіо, C1-C6 алкілтіокарбонілу, C1-C6 алкілтіоксо, C1-C6 алкоксикарбонілу, C1-C6 алкілсульфонілу, C1-C6 алкілсульфоніламіно, аміносульфонілу, C1-C6 алкіламіносульфонілу, діC1-C6 алкіламіносульфонілу, 3-8-членного циклоалкілу, 4-8-членного гетероциклоалкілу, фенілу та моноциклічного гетероарилу; або її фармацевтично прийнятна сіль або сольват. 13. Сполука формули (Іа) за п. 10, якою є (2S,4S)-4-(3-Хлорфенокси)піролідин-2-карбонова кислота; або її фармацевтично прийнятна сіль або сольват. 14. Сполука формули (Ib) за п. 11, яка вибрана з: (2S,4S)-4-(3-Фторбензил)піролідин-2-карбонової кислоти; (2S,4S)-4-(2,3-Дифторбензил)піролідин-2карбонової кислоти; та (2S,4S)-4-(2,5-Дифторбензил)піролідин-2карбонової кислоти; або їх фармацевтично прийнятних солей або сольватів. 15. Сполука формули (Iс) за п. 12, яка вибрана з: (2S,4S)-4-(3-Фторфеноксиметил)піролідин-2карбонової кислоти; (2S,4S)-4-(3,6-Дифторфеноксиметил)піролідин-2карбонової кислоти; (2S,4S)-4-(2,3-Дифторфеноксиметил)піролідин-2карбонової кислоти; і (2S,4S)-4-(3-Метоксифеноксиметил)піролідин-2карбонової кислоти; або їх фармацевтично прийнятних солей або сольватів. 16. Фармацевтична композиція, яка містить сполуку формули (І) (I), (Iа), (Ib) або (Iс) за будьяким з пп. 1 - 15 або її фармацевтично прийнятну сіль або сольват і один або більшу кількість фармацевтично прийнятних ексципієнтів, розчинників або носіїв. 17. Комбінація, яка містить сполуку формули (I), (Iа), (Ib) або (Iс) за будь-яким з пп. 1 - 15 або її фармацевтично прийнятну сіль або сольват і принаймні один інший терапевтично активний агент. 18. Комбінація згідно з пунктом 17, де іншим терапевтично активним агентом є PDEV інгібітор. Даний винахід стосується похідних проліну, корисних як фармацевтичні агенти, процесів їх виробництва, фармацевтичних композицій, що їх містять та їх застосування для лікування станів, викладених нижче. Гапабентин (Neurontin®) є антиконвульсантом, що є корисним в лікуванні епілепсії ι недавно було виявлено, що він може бути ефективним для лікування неврогенного болю. Він представляє собою 1(амінометил)циклогексилоцтову кислоту структурної формули: підтипів, що були описані в літературі: [наприклад, N. S. Gee, J. P. Brown, V. U. Dissanayake, J. Offord, R.Thurlow і G. N. Woodruff, J-Biol-Chem 27Ί (10): 5768-76,1996, (тип 1); Gong, J. Hang, W. Kohler, Z. Li і T-Z. Su, J. Membr. Biol. 184 (1): 35-43,2001, (типи 2 і 3); Ε. Marais, N. Klugbauer і F. Hofmann, Моl. Pharmacol. 59 (5): 1243-1248, 2001. (типи 2 і 3); і N. Qin, S. Yagel, M. L. Momplaisir, E. E. Codd і Μ. R. D'Andrea. Моl. Pharmacol. 62 (3): 485-496, 2002, (тип 4)]. Вони можуть також бути відомі як GABA аналоги. [Міжнародні патентні заявки №№WO0230871 і WO0222568] описують сполуки типу І і типу II, відповідно, Гапабентин є одним з серії сполук формули 2 в якій R є воднем або нижчим алкільним радикалом і η дорівнює 4, 5 або 6. Ці сполуки [описані в американській патентній заявці US-A4024175 та виділеній з неї патентній заявці US-A4087544]. Гапабентин є корисним в лікуванні ряду захворювань, включаючи біль і епілепсію. Гапабентин і подібні сполуки, такі як прегабалін, можуть бути віднесені до альфа-2дельта лігандів. Рецептор альфа-2-дельта ліганда є будь-якоюмолекулою, що зв'язується з будьяким підтипом альфа-2-дельта субодиниці кальцієвого каналу людини. Альфа-2-дельта субодиниця кальцієвого каналу включає ряд які також мають афінність до сайту зв'язування габапентину і мають фізіологічні дії, подібні до габапентину, зокрема, щодо аналгезії. [Міжнародна патентна заявка №WO0119817] описує 3-піролідинілокси-3'-піридильні етери, що є корисними для керування вивільнення нейромедіатора. [Міжнародна патентна заявка №WO0222575] описує похідні бензамідину, що є інгібіторами серинпротеази. Певні з сполук, включених в найширшу формулу представленого винаходу розкриті для застосувань, не зв'язаних з представленим винаходом, зокрема, згідно з Таблицею 1: 7 81437 8 Представлений винахід забезпечує похідні проліну та їх фармацевтично придатні солі, 9 81437 сольвати, поліморфи і пролікарські форми, корисні в лікуванні широкого переліку захворювань, включаючи епілепсію, напади непритомності, гіпокінезію, черепно-мозкові розлади, нейродегенеративні розлади, депресію, тривогу, панічний стан, біль, фіброміалгію, розлади сну, остеоартрит, ревматоїдний артрит та невропатологічні розлади. Сполуки, можуть також бути корисні в лікуванні внутрішнього болю, функціональних розладів кишечнику, таких як гастро-стравохідний рефлекс, диспепсія, синдром подразненого кишечнику і функціонального абдомінального болевого синдрому і запальних хвороб кишечнику, таких як хвороба Крона, ілеїт і виразковий коліт і інших типів внутрішнього болю, асоційованого з дисменореєю, тазовий біль, цистит і панкреатиті. Вони можуть також використовува тися для лікування предменструального синдрому. Таким чином, представлений винахід забезпечує застосування сполуки формули (І): в якій X означає або О, S, NH або СН2 і Υ означає СН2 або простий зв'язок, Υ означає або О, S або ΝΗ і X означає СН2; і R означає 3-12 членний циклоалкіл, 4-12 членний гетероциклоалкіл, арил або гетероарил, де будь-яке кільце може бути необов'язково заміщене одним або більшою кількістю замісників, незалежно вибраних з галогену, гідрокси, ціано, нітро, аміно, гідроксикарбонілу, С1-С6алкілу, С1-С6алкенілу, С1-С6алкінілу, С1-С6алкокси, гідроксиС 1-С6алкілу, С1С6апкоксиС1-С6алкілу, перфтор С1-С6алкілу, перфторС1-С6алкокси, С1-С6алкіламіно, ді-С1-С6алкіламіно, аміноС1С6алкілу, С1-С6алкіламіноС1-С6алкілу, ді-С1С6алкіламіно С1-С6алкілу, С1-С6ацилу, С1-С6ацилокси, С1-С6ацилоксиС 1С6алкілу, С1-С6ациламіно, С1-С6алкілтіо, С1С6алкілтіокарбонілу, С1-С6алкілтіоксо, С1С6алкоксикарбонілу, С1-С6алкілсульфонілу, С1С6алкілсульфоніламіно, аміносульфонілу, С1-С6алкіламіносульфонілу, ді-С1-С6алкіламіносульфонілу, 3-8 членного циклоалкілу, 4-8 членного гетероциклоалкілу, фенілу та моноциклічного гетероарилу; або фармацевтично прийнятної солі, сольвату або їх пролікарської форми у лікувальній терапії. У подальшому аспекті, представлений винахід забезпечує застосування сполуки формули (І) або фармацевтично прийнятної солі, сольвату або їх пролікарської форми у виробництві медикаменту для лікування розладу, в якому задіяний альфа-2дельта рецептор. Відповідно, розлад, в якому задіяний альфа-2-дельта рецептор, вибирають з епілепсії, нападів непритомності, гіпокінезії, 10 черепно-мозкових розладів, нейродегенеративних розладів, депресії, тривоги, панічного розладу, болю, фіброміалгії, синдрому подразненого кишечнику, розладів сну, остеоартриту, ревматоїдного артриту, невропатологічних розладів, внутрішнього болю, функціональних розладів кишечнику, запальних хвороб кишечнику, болю, асоційованого з дисменореєю, тазового болю, циститу і панкреатиту. Як альтернатива до першого аспекту представлений винахід стосується способу лікування ссавця, включаючи людину, розладу, в якому задіяний альфа-2-дельта рецептор, який включає призначення ефективної кількості сполуки формули (І) або фармацевтично прийнятної солі, сольвату або їх пролікарської форми. Згідно з формулою (І), відповідно X означає О, S, NH або СН2 і Υ означає СН2 або простий зв'язок, або X означає СН2 і Υ означає О. Переважно, -Υ-Χ- означає метилен, метиленокси, метилентіо, оксиметилен, аміно, тіо або окси. Особливо переважно, -Υ-Χ-означає окси, метилен або оксиметилен. Згідно з формулою (І), R є прийнятним гетероарилом, арилом, 4-8 членним гетероциклоалкілом або 3-12 членним циклоапкілом, необов'язково заміщеним одним або більшою кількістю замісників, незалежно вибраних з галогену, С1-С6алкілу, С1-С6алкокси, С1-С6алкокси С 1-С6алкілу, перфтор С1-С6алкілу, перфтор С1-С6алкокси, ціано, аміноС1-С6алкілу, діС1-С6алкіламіноС 1-С6алкілу та моноциклічного гетероарилу. R є більш прийнятним необов'язково заміщеним арилом, 4-8 членним гетероциклоалкілом або 3-12 членним циклоапкілом. R є переважно необов'язково заміщеним фенілом, циклогексилом, дигідробензофуранілом або ізохінолілом. Більш переважно R є необов'язково заміщеним фенілом. Найбільш переважно, R є фенілом, заміщеним у мета-положенні і необов'язково дизаміщеним. Згідно з формулою (І), прийнятні необов'язкові замісники на R, переважно, принаймні, в метаположенні, незалежно вибирають з гідрокси, (С1С6)алкокси або галогену, переважно метокси, фтор у, хлор у або брому, більш переважно фтору або хлору. Особливо переважні сполуки винаходу включають ті, в яких кожний змінюваний замісник у Формулі (І) вибирають з прийнятних груп для кожного замісника. Навіть більш переважні сполуки винаходу включають ті, де кожний змінюваний замісник у Формулі (І) вибирають з переважних або більш переважних груп для кожного замісника. Для фахівця даної галузі буде зрозуміло, що певні сполуки, зображені формулою (І), включаючи особливо сполуки, що описані тут, є новими і, тому, окремо й разом утворюють подальший аспект представленого винаходу. Переважні сполуки формули (І) вибирають з: (2S,4S)-4-(Бензилсульфаніл)піролідин-2карбонової кислоти; (23,48)-4-[(4-хлорбензил)окси]піролідин-2карбонової кислоти; 11 (2S,4S)-4-[(4-бромфенілтіо]піролідин-2карбонової кислоти; (2S,4S)-4-фенілтіопіролідин-2-карбонової кислоти; (2S,4S)-4-[2-фторфенокси]піролідин-2карбонової кислоти; (2S,4S)-4-[(4-хлорфенокси]піролідин-2карбонової кислоти; (2S,4S)-4-[2-ізохінолінокси]піролідин-2карбонової кислоти; (2S,4S)-4-(3-Хлорфенокси)піролідин-2карбонової кислоти; (2S,4S)-4-(Бензилокси)піролідин-2-карбонової кислоти; (2S,4S)-4-(3-Фторбензил)піролідин-2карбонової кислоти; (2S,4S)-4-(2,3-Дифторбензил)піролідин-2карбонової кислоти; (2S,4S)-4-(2,5-Дифторбензил)піролідин-2карбонової кислоти; (2S,4S)-4-Циклогексилметилпіролідин-2карбонової кислоти; (2S,4S)-4-(3-Метоксибензил)піролідин-2карбоновоі кислоти; (28,43)-4-(3-Фторфеноксиметил)піролідин-2карбонової кислоти; (23,48)-4-(3-Хлорфеноксиметил)піролідин-2карбонової кислоти; (2S,4S)-4-(2,3-Дигідробензофуран-6ілокси)піролідин-2-карбонової кислоти; (2S,4S)-4-(3-Хлорфеніламіно)піролідин-2карбонової кислоти; (2S,4S)-4-(2,5Дифторфеноксиметил)піролідин-2-карбонової кислоти; (2S,4S)-4-(2,3Дифторфеноксиметил)піролідин-2-карбонової кислоти; і (2S,4S)-4-(3-Метоксифеноксиметил)піролідин2-карбонової кислоти. Навіть більш переважні сполуки формули (І) вибирають з (2S,4S)-4-(3-Хлорфенокси)піролідин-2карбонової кислоти; (2S,4S)-4-(3-Фторбензил)піролідин-2карбонової кислоти; (2S,4S)-4-(2,3-Дифторбензил)піролідин-2карбонової кислоти; (2S,4S)-4-(2,5-Дифторбензил)піролідин-2карбонової кислоти; (2S,4S)-4-Циклогексилметилпіролідин-2карбонової кислоти; (2S,4S)-4-(3-Метоксибензил)піролідин-2карбонової кислоти; (2S,4S)-4-(3-Фторфеноксиметил)піролідин-2карбонової кислоти; (2S,4S)-4-(2,5Дифторфеноксиметил)піролідин-2-карбонової кислоти; (2S,4S)-4-(2,3Дифторфеноксиметил)піролідин-2-карбонової кислоти; і (2S,4S)-4-(3-Метоксифеноксиметил)піролідин2-карбонової кислоти. 81437 12 Певні сполуки в межах формули (І) були розкриті для нетерапевтичного застосування. Таким чином, як подальший аспект, забезпечується сполука формули (І) або фармацевтично прийнятна сіль, сольват, поліморф або їх пролікарська форма, виключаючи будь-яку сполуку, розкриту у попередньому рівні техніки для нетерапевтичного застосування, зокрема ті сполуки, що описані в вищенаведеній Таблиці 1, тобто (2S,4S)-4-(бензилокси)піролідин2-карбонову кислоту, (2S,4S)-4(бензилтіо)піролідин-2-карбонова кислоту, (2S,4S)4-феноксипіролідин-2-карбонову кислоту, (2S,4S)4-(2-нафтилокси)піролідин-2-карбонову кислоту, (2S,4S)-4-[(4-метоксибензил)тіо]піролідин-2карбонову кислоту, (2S,4S)-4-[(4метилфеніл)тіо]піролідин-2-карбонову кислоту, (2S,4S)-4-(фенілтіо)піролідин-2-карбонову кислоту, (2S,4S)-4-(2-нафтилтіо)піролідин-2-карбонову кислоту, (2S,4S)-4-бензилпіролідин-2-карбонову кислоту, (2S,4S)-4-(3-метоксибензил)піролідин-2карбонову кислоту, (2S,4S)-4-[4(трифторметил)бензил]піролідин-2-карбонову кислоту, (2S,4S)-4-[(4-нітробензил)окси]піролідин2-карбонову кислоту, (2S,4S)-4-[(4циклогексибензил)тіо]піролідин-2-карбонову кислоту, (2S,4S)-4-(4-хлорбензил)піролідин-2карбонову кислоту, (2S,4S)-4-[(4фтор фенокси)піролідин-2-карбонову кислоту, (2S,4S)-4-(4-метилфенокси)піролідин-2-карбонову кислоту, (2S,4S)-4-(3-метилтіофенокси)піролідин2-карбонову кислоту, (2S,4S)-4-(4хлорфенокси)піролідин-2-карбонову кислоту, (2S,4S)-4-(4-метоксифенокси)піролідин-2карбонову кислоту, (2S,4S)-4-(1нафталенокси)піролідин-2-карбонову кислоту, (2S,4S)-4-(4-хлорфенілтіо)піролідин-2-карбонову кислоту, трифторметилфенілтіо)піролідин-2карбонову кислоту, (2S,4S)-4-(4фтор фенілтіо)піролідин-2-карбонову кислоту, (28,43)-4-(4-ацетилоксифенілтіо)піролідин-2карбонову кислоту, (2S,4S)-4-(4хлорбензилокси)піролідин-2-карбонову кислоту, (2S,4S)-4-(4-фенілфенокси) піролідин-2-карбонову кислоту, (2S,4S)-4-(4-фенілфенілтіо)піролідин-2карбонову кислоту, (2S,4S)-4-(4метилбензилокси)піролідин-2-карбонову кислоту і (2S,4S)-4-(4-фторбензил)піролідин-2-карбонову кислоту. Як альтернативний аспект представленого винаходу, забезпечується сполука формули (la), (Ib) або (Іс): в якій Ra і Rb незалежно вибирають з водню, галогену, гідрокси, (С1-С6)алкокси, ціано, нітро, аміно, гідроксикарбонілу, С1-С6алкілу, С1С6алкенілу, С1-С6алкінілу, 13 81437 С1-С6алкокси, гідроксиС 1-С6алкілу, С1С6алкоксиС 1-С6алкілу, перфтор С1-С6алкілу, перфторС1-С6алкокси, С1-С6алкіламіно, ді-С1-С6алкіламіно, аміноС1С6алкілу, С1-С6алкіламіноС1-С6алкілу, ді-С1С6алкіламіноС1-С6алкілу, С1-С6ацилу, С1-С6ацилокси, С1-С6ацилоксиС 1С6алкілу, С1-С6ациламіно, С1-С6алкілтіо, С1С6алкілтіокарбонілу, С1-С6алкілтіоксо, С1С6алкоксикарбонілу, С1-С6алкілсульфонілу, С1С6алкілсульфоніламіно, аміносульфонілу, С1-С6алкіламіносульфонілу, ді-С1-С6алкіламіносульфонілу, 3-8 членного циклоалкілу, 4-8 членного гетероциклоалкілу, фенілу та моноциклічного гетероарилу; або фармацевтично прийнятна сіль, сольват або їх пролікарська форма. за умови, що для сполуки формул (la) і (Ib), Ra i Rb не можуть обидва бути воднем і, коли Rb є паразамісником, Ra не може бути воднем, для сполуки формули (Іа), коли Ra означає метилтіо, Rb не може бути воднем, і для сполуки формули (Іb), коли Ra означає метокси, Rb не може бути воднем. У відношенні формул (Іа), (16) або (Іс), Ra означає відповідно не водень. У вищезгаданих визначеннях, гало означає фтор, хлор, бром або йод. Алкільні та алкокси групи, що містять необхідну кількість атомів вуглецю, крім де зазначено, можуть бути нерозгалуженим або розгалуженим ланцюгом. Приклади алкілу включають групи з лінійними та розгалуженими ланцюгами, такі як метил, етил, нпропіл, і-пропіл, н-бутил, і-бутил, втор-бутил і третбутил. Приклади алкокси включають групи з лінійними та розгалуженими ланцюгами, такі як метокси, етокси, н-пропокси, і-пропокси, н-бутокси, і-бутокси, втор-бутокси і трет-бутокси. Алкенільні та апкінільні групи, як згадано тут, включають аліфатичні групи з лінійними та розгалуженими ланцюгами, що мають, відповідно, один подвійний або потрійний зв'язок. Приклади алкенільних та алкінільних груп включають відповідно, етеніл, проп-1-еніл, проп-2-еніл і етиніл, проп-1-ініл і проп2-ініл. 4-8 членний гетероциклоалкіл, в даному контексті, стосується мононасиченої або частково ненасиченої кільцевої системи, що містить, принаймні, один кільцевий гетероатом незалежно вибраний з О, S і N. 4-12 членний гетероциклоалкіл, в даному контексті, стосується мононасиченого або частково ненасиченого кільця або конденсованої кільцевої системи, що містить, принаймні, один кільцевий гетероатом незалежно вибраний з О, S і N. Таким чином, поліциклічна конденсована кільцева система, що містить один або більшу кількість карбоциклічних конденсованих, насичених, частково ненасичених або ароматичних кілець знаходиться у межах визначення 4-12 членного гетероциклоалкілу, за умови, що система також містить, принаймні, одне конденсоване кільце, що містить, принаймні, один з вищезгаданих гетероатомів. Придатні гетероциклоалкільні групи включають 14 піролідинільну, тетрагідрофуранільну, дигідрофуранільну, тетрагідропіранільну, піранільну, тіопіранільну, азиридинільну, оксиранільну, метилендіоксильну, хроменільну, ізоксазолідинільну, 1,3-оксазолідин-3-ільну, ізотіазолідинільну, 1,3-тіазолідин-3-ільну, 1,2піразолідин-2-ільну, 1,3-піразолідин-1-ільну, піперидинільну, тіоморфолінільну, 1,2тетрагідротіазин-2-ільну, 1,3-тетрагідротіазин-3ільну, тетрагідротіадіазинільну, морфолінільну, 1,2-тетрагідродіазин-2-ільну, 1,3-тетрагідродіазин1-ільну, тетрагідроазепінільну, піперазинільну, хроманільну, 2,3-дигідробензофуранільну і т.д. Гетероарил, в даному контексті, стосується моно-ароматичного кільця або конденсованої, прийнятної біциклічної, ароматичної кільцевої системи, що містить, принаймні, один кільцевий гетероатом незалежно вибраний з О, S і N. Таким чином, поліциклічна, конденсована кільцева система, що містить один або більшу кількість карбоциклічних конденсованих насичених, частково ненасичених або ароматичних кілець знаходиться у межах визначення гетероарилу, за умови, що система також містить, принаймні, одне конденсоване, ароматичне кільце, що містить, принаймні, один з вищезгаданих гетероатомів. Прийнятні гетероарильні групи включають фурильну, тієнільну, тіазолільну, піразолільну, ізотіазолільну, оксазолільну, ізоксазолільну, піролільну, триазолільну, тетразолільну, імідазолільну, 1,3,5-оксадіазолільну, 1,2,4оксадіазолільну, 1,2,3-оксадіазолільну, 1,3,5тіадіазолільну, 1,2,3-тіадіазолільну, 1,2,4тіадіазолільну, піридильну, піримідильну, піразинільну, піридазинільну, 1,2,4-триазинільну, 1,2,3-триазинільну, 1,3,5-триазинільну, піразоло[3,4-b]піридинільну, цинолінільну, птеридинільну, пуринільну, 6,7-дигідро-5Н[1]піриндинільну, бензо[b]тіофенільну, 5,6,7,8тетрагідрохінолін-3-ільну, бензоксазолільну, бензотіазолільну, бензізотіазолільну, бензізоксазолільну, бензімідазолільну, тіанафтенільну, ізотіанафтенільну, бензофуранільну, ізобензофуранільну, ізоіндолільну, індолільну, індолізинільну, індазолільну, ізохінолільну, хінолільну, фталазинільну, хіноксалінільну, хіназолінільну, бензоксазинільну і т.д. С3-С8циклоалкіл, в даному контексті, стосується мононасиченої або частково ненасиченої карбоцикпічної кільцевої системи. С3С12циклоалкіл, в даному контексті, стосується моно- або конденсованої карбоциклічної кільцевої системи, що містить, принаймні, одне насичене або частково ненасичене кільце, де інше кільце в конденсованій системі може бути фенілом. Прийнятні циклоалкільні групи включають циклопропільну, циклобутильну, циклопентильну, циклогексильну, циклогептильну, інданову та 1,2,3,4-тетрагідронафтиленову групи. Арил, в даному контексті, стосується фенілу або нафтилу. Ацил, в даному контексті, стосується аліфатичних або циклічних вуглеводнів, 15 81437 приєднаних до карбонільної групи, за допомогою яких зв'язується замісник. Сполуки, згідно з винаходом, можуть існувати як в несольватованих, так і в сольватованих формах. Термін „сольват" використовується в даному контексті для описумолекулярного комплексу, що включає сполуку винаходу ймолекули одного або більшої кількості фармацевтично прийнятних розчинників, наприклад, етанолу. Термін "гідрат", в даному контексті, використовується у разі, коли розчинником є вода. В межі винаходу включені комплекси, такі як клатрати, комплекси включення, такі як лікарська речовина-"хазяїн", в яких, на відміну від вищезгаданих сольватів, лікарська речовина та "хазяїн" присутні в стехіометричних або нестехіометричних кількостях. Також включені комплекси є комплексами лікарська речовина, що містить два або більше органічних і/або неорганічних компонентів, що можуть бути в сте хіометричних або нестехіометричних кількостях. Одержувані комплекси, можуть бути іонізовані, частково іонізовані або не-іонізовані. Для огляду таких комплексів, [див. J. Pharm. Sci, 64 (8), 1269-1288, Haleblian (серпень 1975)]. Хоча стереохімія на піролідиновому кільці формули (І) є сталою, певні з сполук формули (І), що містять один або більшу кількість асиметричних атомів вуглецю можуть існувати як два або більша кількість стереоізомерів. У випадках, коли сполука формули (І) містить алкенільну або алкеніленову груп у, можливі геометричні цис/транс (або Z/E) ізомери. У випадках, коли сполука містить, наприклад, кетоабо оксим- групу або ароматичний залишок, може існувати та утомерна ізомерія ("таутомерія"). З вищевикладеного випливає, що окрема сполука може існувати в формі більше ніж одного типу ізомерії. Включені в межах представленого винаходу всі сполуки є стереоізомерами, геометричними ізомерами і таутомерними формами сполук формули (І), включаючи сполуки, що існують в формі більше ніж одного типу ізомерії і сумішей одного або більшої їх кількості. Включені також кислотні додавання або основні солі, де протиіон є оптично активним, наприклад, D-лактат або Lлізин, або рацемічним, наприклад, DL-тартрат або DL-аргінін. Цис/транс ізомери можуть бути виділені за допомогою стандартних методик, добре відомих фа хівцям даної галузі, наприклад, за допомогою хроматографії та фракційної кристалізації. Стандартні методики для одержання/виділення індивідуальних енантіомерів включають хіральний синтез з прийнятного оптично чистого прекурсора або розділення рацемата (або рацемата солі або похідного) використовуючи, наприклад, хіральну рідинну хроматографію високого тиску (ВЕРХ). Альтернативно, рацемат (або рацемічний прекурсор) можна піддавати реакції з прийнятною оптично активною сполукою, наприклад, спиртом, 16 або у разі, коли сполука формули (І) містить кислий або основний залишок, кислоту або основу, такі як винна кислота або 1-фенілетиламін. Одержана діастереомерна суміш може бути виділена за допомогою хроматографії або фракційної кристалізації й один або обидва з діастереоізомерів, перетворюються на відповідні чисті енантіомери за допомогою засобів, добре відомих фа хівцям даної галузі. Хіральні сполуки винаходу (і їх хіральні прекурсори) можуть бути отримані в енантіомернозбагаченій формі, використовуючи хроматографію, типово ВЕРХ, на асиметричній смолі з мобільною фазою, що складається з вуглеводню, зазвичай гептану або гексану, що містить від 0 до 50% ізопропанолу, зазвичай від 2 до 20% і від 0 до 5% алкіламіну, зазвичай 0,1% діетиламіну. Концентруванням елюату одержують збагачену суміш. Стереоізомерні конгломерати можуть бути виділені за допомогою стандартних методик, добре відомих фа хівцям цієї галузі - дивиться, [наприклад, "Стереохімію Органічних сполук" Ε L Eliel (Wiley, Нью-Йорк, 1994)]. Представлений винахід також включає всі придатні ізотопні варіації сполуки винаходу або її фармацевтично прийнятної солі. Ізотопна варіація сполуки винаходу, або її фармацевтично прийнятної солі, визначаєтся як та, в якій, принаймні, один атом замінений атомом, що має той же самий атомний номер, але атомну масу, відмінну від природної атомної маси. Приклади ізотопів, що придатні для включення в сполуки винаходу і їх фармацевтично прийнятних солей, включають ізотопи водню, вуглецю, азоту, кисню, фосфору, сірки, фтору і хлору, такі як 2Н, 3Н, 13С, 14С, 15N, 17O, 18O,31Р, 32Р, 35 S, 18 F і 36СІ, відповідно. Певні мічені ізотопами сполуки формули (І) і їх фармацевтично прийнятні солі, наприклад, ті в які включені радіоактивні ізотопи, такі як 3Н або 14С є корисними в ліках і/або в дослідженнях по розподіленню субстрату у тканинах. Особлива перевага надається триатидам, тобто, 3Н, та вуглецю-14, тобто, 14С, завдяки легкості їх одержання та здатності для виявлення. Заміщення важкими ізотопами, такими як, дейтерій, тобто, 2Н, може мати певні терапевтичні переваги внаслідок їх більшої метаболічної стабільності, наприклад, підвищеного часу напівжитгя in vivo або зменшених вимог до дозування і, отже, може бути бажаним в деяких обставинах. Заміщення ізотопами, що випускаються позитроном, такими як 11С, 18F, 15О та 13N, може бути корисним в Positron Emission Topography (PET) дослідженнях для вивчення інтенсивності зв'язування рецептора з субстратом. Мічені ізотопами сполуки формули (І) можуть взагалі бути одержані за допомогою стандартних методик, відомих фа хівцям даної галузі, або процесів, аналогічних тим, що описані у супровідних Прикладах та Препаративних прикладах, заміщенням легко доступного міченого ізотопом реагента на не мічений ізотопом реагент. 17 81437 Фармацевтично прийнятні сольвати відповідно до винаходу включають ті, в яких розчинник кристалізації може бути заміщений ізотопами, наприклад, D2O, d6-ацетон, d6-ДМСО. Сполуки представленого винаходу є амінокислотами. Оскільки амінокислоти є амфотерними, фармакологічно сумісними солями можуть бути солі відповідних нетоксичних неорганічних або органічних кислот або основ. Придатними кислотно-адитивними солями є гідрохлорид/хлоридні, гідробромід/бромідні, гідройодид/йодидні, сульфатні, бісуль фатні, нітратні, фосфатні, гідрофосфатні, ацетатні, фумаратні, аспартатні, бесилатні, бікарбонат/карбонатні, камсилатні, D- та Lлактатні, D- та L-тартратні, едизилатні, мезилатні, малонатні, оротатні, глуцептатні, метилсульфатні, стеаратні, глюкуронатні, 2-напсилатні, тозилатні, хібензатні, нікотинатні, ізотіонатні, малатні, малеатні, цитратні, глюконатні, сукцинатні, сахаратні, бензоатні, езилатні, трифторацетатні та памоатні солі. Придатні основні солі утворюються з основ, що утворюють нетоксичні солі. Приклади включають натрієві, калієві, алюмінієві, кальцієві, магнієві, цинкові, холінові, діоламінові, оламінові, аргінінові, гліцинові, трометамінові, бензатинові, лізинові, меглумінові та діетиламінові солі. Сполуки даного винаходу також можуть бути утворені у вигляді цвіттер-іонів. Придатною сіллю амінокислотних сполук даного винаходу є гідрохлоридна сіль. Для огляду придатних солей [див. Stahl і Wermuth, Handbook of Pharmaceutical Salts: Properties, Selection and Use (Довідник з фармацевтичних солей: властивості, вибір та застосування), Wiley-VCH, Weinheim, Німеччина (2002)]. Також можуть бути одержані солі з іонами четвертинного амонію, наприклад, з іоном тетраметиламонію. Дослідження показали, що оральна абсорбція певних лікарських засобів може бути підвищена шля хом одержання "м'якої" четвертинної солі. Четвертинна сіль зветься "м'якою" четвертинною сіллю тому, що на відміну від звичайних четвертинних солей, наприклад, RN+(CH3)3, вона може вивільняти активну лікарську речовину при гідролізі. "М'які" четвертинні солі мають корисні фізичні властивості у порівнянні з основними лікарськими речовинами або їх солями. У порівнянні з іншими солями, такими як гідрохлоридні, розчинність у воді може бути підвищена, але більш важливим є те, що може бути підвищена абсорбція лікарської речовини із кишечника. Абсорбція підвищується ймовірно завдяки тому факту, що "м'яка" четвертинна сіль має властивості поверхнево-активної речовини і здатна утворювати міцелій та неіонізовані іонні пари з жовчними кислотами і т.п., які здатні проникати в епітелій кишечнику більш ефективно. Проліки після абсорбції швидко гідролізуються з вивільненням активної лікарської речовини. Фармацевтично прийнятна сіль сполуки формули (І) може бути легко одержана, змішуванням разом розчинів сполуки формули (І) і бажаної кислоти або основи, в разі необхідності. 18 Сіль може осаджуватися з розчину і збиратися фільтруванням або може бути відновлена випаровуванням розчинника. Ступінь іонізації в солі може змінюватися від повністю іонізованої до майже не-іонізованої. Надалі всі посилання на сполуки формули (І) включають посилання на солі, сольвати та їх комплекси, та на сольвати та комплекси їх солей. Сполуки винаходу включають сполуки формули (І), як визначено вище, поліморфи, проліки та їх ізомери (включаючи оптичні, геометричні і таутомерні ізомери), як визначено надалі та мічені ізотопами сполуки формули (І). Як заявляється, винахід включає всі поліморфи сполук формули (І), як визначно вище. Також в об'єм винаходу входять так звані "проліки" сполук формули (1). Так, певні похідні сполук формули (1), які мають незначну або взагалі не мають фармакологічної активності, якщо вводяться в організм або на тіло, можуть бути перетворені у сполуки формули (І), що мають бажану активність, наприклад, за допомогою гідролізного розщеплення або окисного метаболізму. Такі похідні згадуються як "проліки". Подальша інформація щодо використання проліків може бути знайдена і у ["Prodrugs as Novel Delivery System", Vol. 14, ACS Symposium Series (T Higuchi і W Stella) та "Bioreversible Carriers in Drug Design", Pergamon Press, 1987 (ред. Ε Β Roche, Американська Фармацевтична Асоціація)]. Проліки згідно з винаходом можуть бути одержані, наприклад, заміною відповідних функціональних груп, присутніх в сполуках формули (1), певними фрагментами, відомими фа хівцям як "προ-фрагменти" як [описано в "Design of ester pro-drugs to enhance oral absorption of poorly permeable compounds", K. Beaumont та інші, Current Drug Metabolism, 2003 і "Design of Prodrugs" H. Bundgaard (Elsevier) 1985]. На завершення, певні сполуки винаходу можуть самі діяти як проліки інших сполук винаходу. Всі захищені похідні і проліки сполук винаходу включені в межі винаходу. Деякі приклади проліків відповідно до винаходу включають: (і) естер карбонової кислоти (-СООН) сполуки формули (І), наприклад, заміна водню (С1-С6) алкілом або його карбоксамід, наприклад, заміна гідроксилу аміногрупою (-NH2, -NHR або NRR', де R і R' кожний незалежно є (С1-С6) алкілом); (іі) амід вторинної аміногрупи (NHR, де R¹Η) сполуки формули (І), наприклад, заміна водню (С1С6) алканоїлом. Подальші приклади замінних груп відповідно до попередніх прикладів і прикладів інших типів проліків можуть бути знайдені у вищезгаданих цитуваннях, що включені в заявку як посилання. Аміноацил-гліколевий та -молочний естери відомі як проліки амінокислот [Wermuth C.G., Chemistry and Industry (Хімія та промисловість), 1980: 433-435]. Карбонільна група амінокислот може бути естерифікована відомими способами. Проліки та "м'які" лікарські засоби відомі вданій галузі [Palomino Ε., Drugs of the Future (Ліки майбутнього), 1990; 15 (4): 361-368]. 19 81437 Винахід також стосується терапевтичного використання представлених сполук як агентів для лікування або полегшення симптомів нейродегенеративних розладів. Такі нейродегенеративні розлади включають, наприклад, хворобу Альцгеймера, хворобу Хантінгтона, хворобу Паркінсона і аміотрофічний латеральний склероз. Представлений винахід також охоплює лікування нейродегенеративних розладів, що звуться гострими ушкодженнями мозку. Такі ушкодження включають, але не обмежуються ними: інсульт, травму голови та асфіксію. Інсульт стосується церебрального судинного захворювання і може також згадуватися як церебральна судинна травма (CVA) і включає гострий тромбоемболічний інсульт. Інсульт включає як фокальну, так і глобальну ішемію. Також, включені транзиторні мозкові ішемічні напади й інші церебрально-васкулярні проблеми, пов'язані з церебральною ішемією. Ці васкулярні розлади можуть зустрічатися у пацієнтів, що піддавались каротидній ендартеректомії або іншим цереброваскулярним або васкулярним хірургічним процедурам узагалі, або діагностичним васкулярним процедурам, включаючи церебральну ангіографію і т.п.. Інші випадками є травма голови, травма спинного мозку або ушкодження від загальної аноксії, гіпоксії, гіпоглікемії, гіпотонії, а також подібних ушкоджень, що спостерігаються в процесі емболії, гіперфузії і гіпоксії. Даний винахід буде корисним в ряді випадків, наприклад, в процесі кардіального шунтування, у випадках внутрішньочерепного крововиливу, при перинатальній асфіксії, при зупинці серця і епілептичному стані. Кваліфікований лікар буде здатний визначити відповідну ситуацію для призначення способів згідно з представленим винаходом, при якій суб'єкти є схильні до інсультів або при небезпеці, наприклад, інсульту, так само як при перенесенні інсульту. Сполуки представленого винаходу корисні для загального лікування болю, особливо невропатичного болю. Фізіологічний біль є важливим механізмом захисту, призначеним попереджувати про небезпеку від потенційно пошкоджуючих стимулів із зовнішнього середовища. Система діє через специфічну сукупність первинних сенсорних нейронів і активується виключно шкідливими сигналами через механізми периферийної трансдукції ([Millan 1999 Prog. Neurobio. 57: 1-164] для інтегративного огляду). Такі сенсорні волокна відомі як ноціцептори і характеризуються аксонами маленького діаметру з невеликими швидкостями провідності. Ноціцептори кодують інтенсивність, тривалість та якість шкідливих сигналів і завдяки їх топографічній проекції на спинний мозок, визначають стимул. Ноціцептори знайдені на ноціцептивних нервових волокнах, серед яких є два основних типи: Α-дельта волокна (мієлінізовані) та С-волокна (немієлінізовані). Активність, що генерується ноціцептором на вході передається після комплексної обробки в дорсальні роги, в кожен безпосередньо або через 20 трансляційні основи стовбуру мозку на вентробазальний таламус і потім на кору, де генерується відчуття болю. Інтенсивний гострий біль та хронічний біль можуть включати ті ж самі провідні шляхи, керовані патофізіологічними процесами, та по суті припиняти захисні механізми та натомість сприяти виснажливим симтомам, асоційованим із станами багатьох хвороб. Біль є ознакою багатьох травм і хвороб. Коли зустрічається суттєве ушкодження тканин тіла внаслідок хвороби або травми, характеристики ноціцепторної активації змінюються. Існує сенсибілізація в периферичній, локальній - біля місця ушкодження і центральній області, де ноціцептори припиняють дію. Це призводить до гіперчутливості в місці ушкодження і в навколишніх тканинах. При гострому болю ці механізми можуть бути корисними і дозволяють відбуватися репаративним процесам і гіперчутливість повертається до нормальної, як тільки ушкодження загоюється. Однак, при багатьох хронічних больових станах, гіперчутливість триває значно довше процесів загоєння і зазвичай зберігається внаслідок ушкодження нервової системи. Це ушкодження часто призводить до недостатньої адаптації аферентних волокон (Woolf & Salter 2000 Science 288: 1765-1768). Клінічний біль є присутнім, коли дискомфорт і анормальна чутливість є серед симптомів у пацієнта. Пацієнти мають тенденцію бути досить гетерогенними і можуть мати різні симптоми болю. Мається безліч субтипів болю: 1) спонтанний біль, що може бути тупим, пекучим або пронизуючим; 2) перебільшена больова відповідь на шкідливі стимули (гіпералгезія); 3) біль, що викликається нормальними нешкідливими стимулами (алодинія) (Me yer та ін., 1994 Textbook of Pain 13-44). Хоча пацієнти із болем у хребті, артритичним болем, травмою ЦНС або нейропатичним болем можуть мати подібні симптоми, основні механізми різні і, тому, можуть вимагати різних стратегій лікування. Тому біль може бути розділений на безліч різних областей через відмінність патофізіології, вони включають ноціцептивний, нейропатичний, запальний біль і т.д. Повинно бути відзначено, що деякі типи болю мають різноманітну етіологію і таким чином можуть класифікуватися в більше, ніж одній області, наприклад, хребтовий біль, раковий біль можуть мати ноціцептивні запальні і нейропатичні компоненти. Ноціцептивний біль викликається ушкодженням тканини або інтенсивними стимулами з потенціалом зпричинення ушкодження. Аферентний біль активізується трансдукцією стимулів ноціцепторами на місці ушкодження і підвищує чутливість спинного мозку на рівні їх закінчення. Це потім передається на спинні тракти до мозку, де біль сприймається [Me yer та ін., 1994 Textbook of Pain 13-44]. Активація ноціцепторів активізує два типи аферентних нервових волокон. Мієлінізовані Αдельта волокна передають швидко і є відповідальними за гострий і пронизуючий біль, в той час як немієлінізовані С волокна передають з 21 81437 меншою швидкістю і є відповідальними за передачу тупого або ниючого болю. Помірний до серйозного гострого ноціцептивний біль є помітною особливістю, але не обмежується болем від напруги/розтягань, постопераційним болем (біль після будь-якого типу хірургічної процедури), посттравматичним болем, опіками, інфарктом міокарду, гострим панкреатитом і нирковою колікою. Також з гострим больовим синдромом пов'язаний рак, зазвичай внаслідок терапевтичних взаємодій, таких як хіміотерапевтична токсичність, імунотерапія, гормональна терапія і радіотерапія. Помірний до серйозного гострого, ноціцептивний біль є помітною особливістю захворювань, які не обмежується наступними: раковий біль, що може бути пов'язаний з пухлинним болем (наприклад, біль у кістках, головний біль і лицьовий біль, вісцеральний біль) або пов'язаний з лікуванням раку (наприклад, постхіміотерапевтичний синдром, хронічний постхірургічний больовий синдром, пострадіаційний синдром), хребтовий біль, що може бути наслідком утворення грижі або розриву інтервертебральних дисків або анормально рухливих суглобів, крижових суглобів, параспинальних м'язів або задніх подовжніх зв'язок. Нейропатичний біль визначається, як біль, що ініційований або викликаний первинним ушкодженням або дисфункцією центральної нервовової системи (IASP визначення). Ушкодження нерва може бути викликано травмою і хворобою і, таким чином, термін "нейропатичний біль" включає багато розладів з різною етіологією. Вони включають, але не обмежуються такими: діабетична нейропатія, постгерпетична невралгія, хребтовий біль, ракова нейропатія, ВІЛ нейропатія, фантомний біль, зап'ястний тунельний синдром, хронічний алкоголізм, гіпотироїдизм, тригемінальна невралгія, уремія або вітамінодефіцит. Нейропатичний біль є патологічним, оскільки не має ніякої захисної ролі. Він часто зустрічається набагато пізніше того, як первісна причина розсіяна, зазвичай триває протягом років, суттєво зменшуючи якість життя пацієнтів [Woolf and Mannion 1999 Lancet 353: 1959-1964]. Симптоми нейропатичного болю важко піддаються лікуванню, оскільки вони часто гетерогенні навіть між пацієнтами з тією же самою хворобою [Woolf & Decosterd 1999 Pain Supp. 6: S141-S147; Woolf and Mannion 1999 Lancet 353: 1959-1964]. Вони включають спонтанний біль, що може бути безперервним або пароксизмальним і анормально викликаним болем, таким як гіпералгезія (збільшена чутливість до шкідливого стимулу) і алодинія (чутливість до звичайного нешкідливого стимулу). Запальний процес є складним рядом біохімічних і клітинних процесів, активізованих у відповідь на ушкодження тканини або присутність сторонніх речовин, що проявляється у набряках та болю [Levine and Taiwo 1994: Textbook of Pain 4556]. Артритичний біль становить більшість запального болю серед популяції. Ревматоїдне захворювання є одним із самих загальних хронічних запальних станів у розвинених країнах, 22 а ревматоїдний артрит (РА) є звичайною причиною непрацездатності. Точна етіологія РА невідома, але поточні гіпотези говорять, що як генетичні, так і мікробіологічні фактори можуть бути важливими [Grennan & Jayson 1994 Textbook of Pain 397-407]. Було встановлено, що майже 16 мільйонів американців мають симптоми остеоартриту (ОА) або дегенеративну супутню хворобу, більшості з яких є більше 60 років, і очікується збільшення захворюваності до 40 мільйонів, оскільки вік популяції зростає, роблячи це національною проблемою здоров'я величезного значення [Houge & Mersfelder 2002 Ann Pharmacother. 36: 679-686; McCarthy та ін., 1994 Textbook of Pain 387-395]. Більшість пацієнтів з ОА звертаються по медичну допомогу внаслідок болю. Артрит має значний вплив на психологічну та фізичну функцію і, як відомо, є головною причиною непрацездатності в більш пізньому віці. Інші типи запального болю включають, але не обмежуються ними, запальні захворювання кишечнику (IBD). Інші типи болю включають, але не обмежуються наступними: - М'язовоскелетні розлади включають, але не обмежуються ними: міалгію, фіброміалгію, спондиліт, серонегативні (неревматоїдні) артропатії, неартрикулярний ревматизм, дистрофінопатію, глікогеноліз, поліміозит, піоміозит. - Центральний біль або "таламічний біль", визначений як біль, що викликається ушкодженням або дисфункцією нервової системи, включаючи, але не обмежуючись наступними: центральний післяінсультний біль, розсіяний склероз, травма спинного мозку, хвороба Паркінсона та епілепсія. - Серцевий та судинний біль, включаючи, але не обмежуючись наступними: стенокардія, інфаркт міокарду, стеноз мітрального клапану, перикардит, віброхвороба, склеродома, ішемія скелетних м'язів. - Внутрішній біль та шлунково-кишкові розлади. Нутрошчі включають органи черевної порожнини. Ці органи включають статеві органи, селезінку та частину травного тракту. Біль, пов'язаний з нутрощами може поділятися на внутрішній біль травного тракту та вн утрішній біль нетравного тракту. Шлунково-кишкові розлади (GI), що зазвичай зустрічаються, включають розлади функціонування кишечнику (FBD) та запальні захворювання кишечнику (IBD). Ці GI розлади включають широкий діапазон хворобливих станів, що на даний час лише помірно контролюються, включаючи FBD, гастростравохідний рефлекс, диспепсію, синдром подразненого кишечнику (IBS) та функціональний абдомінальний болевий синдром (FAPS), та IBD, хворобу Крона, ілеїт та виразковий коліт, всі з яких регулярно продукують вн утрішній біль. Інші типи внутрішнього болю включають біль, пов'язаний з дисменореєю, тазовий біль, цистит та панкреатит. - Головний біль, включаючи, але не обмежуючись наступними: мігрень, мігрень з аурою, мігрень без аури, сильний нападоподібний 23 81437 головний біль з періодичними рецидивами, головний біль напруги. - Біль ротової порожнини, включаючи, але не обмежуючись наступними: зубний біль, скроневощелепний міофасціальний біль. Сполуки винаходу, як очікується, будуть корисними в лікуванні депресії. Депресія може бути результатом органічного захворювання, вторинного, обумовленого стресом асоційованим з втратою особистості або ідіопатичного походження. Існує стійка тенденція для сімейних проявів деяких форм депресії, що вказує на механістичну причину, принаймні, деяких форм депресії. Діагностика депресії базується насамперед на кількісній зміні настрою пацієнтів. Ці оцінки настрою взагалі здійснюються лікарем або нейрофізіологом з використанням затвердженої шкали оцінок, такої як, шкала Гамільтона оцінки депресії, або короткої психіатричної шкали оцінок. Численні інші шкали були розроблені для того, щоб визначати кількість і вимірювати ступінь змін настрою у пацієнтів з депресією, такою як інсомнія, дефіцит концентрації уваги, гіпоенергія, почуття нікчемності і провини. Стандарти для діагнозу депресії, також як усіх психіатричних діагнозів, зібрані в діагностичному і статистичному довіднику психічних розладів [(Четверте Видання), згаданому як DSM-IV-R довідник, виданий Американською Асоціацією Психіатрів, 1994]. Ще одним подальшим аспектом є забезпечення способу лікування захворювання, вибраного з епілепсії, нападів непритомності, гіпокінезії, черепно-мозкових розладів, нейродегенеративних розладів, депресії, тривоги, паніки, болю, синдрому подразненого кишечнику, розладів сну, остеоартриту, ревматоїдного артриту, невропатологічних розладів, внутрішнього болю, функціональних розладів кишечнику, запальних захворювань кишечнику, болю, асоційованого з дисменореєю, тазового болю, циститу та панкреатиту, що включає введення терапевтично ефективної кількості сполуки формули (І) ссавцеві, що потребує згаданого лікування. Біологічна активність альфа-2-дельта лігандів згідно з винаходом може бути виміряна в радіолігандному аналізі зв'язування з використанням [3Н]габапентину та α2δ субодиниць, що походять з тканин свинячого мозку [Gee N. S., Brown J. P., Dissanayake V. U. K., Offord J., Thurlow R., Woodruff G.N., J. Biol. Chem., 1996; 271: 58795776]. Результати можуть виражатися в одиницях мкМ або нМ α2δ зв'язувальної активності. Сполуки згідно з даним винаходом можуть також призначатися в комбінації, окремо, послідовно або одночасно з одним або декількома іншими фармакологічно активними агентами. Придатні агенти, зокрема, для лікування болю, включають: (і) опіоїдні анальгетики, наприклад, морфін, героїн, гідроморфон, оксиморфон, леворфанол, левалорфан, метадон, меперидин, фентаніл, кодеїн, дигідрокодеїн, оксикодон, гідрокодон, пропоксифен, налмефен, налорфін, налоксон, 24 налтрексон, бупренорфін, буторфанол, налбуфін та пентазоцин; (іі) опіоїдні антагоністи, наприклад, налоксон, налтрексон; (ііі) нестероїдні протизапальні засоби (НПЗЗ), наприклад, аспірин, диклофенак, дифлусинал, етодолак, фенбуфен, фенопрофен, флуфенісал, флурбіпрофен, ібупрофен, індометацин, кетопрофен, кеторолак, меклофенамінова кислота, мефенамінова кислота, набуметон, напроксен, оксапрозин, фенілбутазон, піроксикам, суліндак, толметин, зомепірак та їх фармацевтично прийнятні солі; iv) барбітуратні седативні засоби, наприклад, амобарбітал, апробарбітал, бутабарбітал, бутабітап, мефобарбітал, метарбітал, метогекситал, пентобарбітал, фенобарбітал, секобарбітап, талбутал, теамілал, тіопентал та їх фармацевтично прийнятні солі; (ν) бензодіазепіни, що мають седативну дію, наприклад, хлордіазепоксид, клоразепат, діазепам, флуразепам, лоразепам, оксазепам, темазепам, триазолам та їх фармацевтично прийнятні солі; (vi) H1 антагоністи, що мають седативну дію, наприклад, дифенгідрамін, піриламін, прометазин, хлорфенірамін, хлорциклізин та їх фармацевтично прийнятні солі; (vii) змішані седативні засоби, такі як глутетимід, мепробамат, метаквалон, дихлоралфеназон та їх фармацевтично прийнятні солі; (viii) релаксанти скелетних м'язів, наприклад, баклофен, карізопродол, хлорзоксазон, циклобензаприн, метокарбамол, орфренадин та їх фармацевтично прийнятні солі, (іх) антагоністи NMD A рецепторів, наприклад, декстрометорфан ((+)-3-гідрокси-ІМметилморфінан) та його метаболіт декстрорфан ((+)-3-гідрокси-г>І-метилморфінан), кетамін, мемантин, піролохінолін хінон та цис-4(фосфонометил)-2-піперидинкарбонова кислота та її фармацевтично прийнятні солі; (х) альфа-адренергічноактивні сполуки, наприклад, доксазозин, тамсулозин, клонідин та 4аміно-6,7-диметокси-2-(5-метансульфонамідо1,2,3,4-тетрагідроізохінол-2-іл)-5-(2піридил)хіназолін; (хі) трициклічні антидепресанти, наприклад, дезипрамін, іміпрамін, амітриптилін та нортриптилін; (хіі) антиконвульсанти, наприклад, карбамазепін та валпроат; (хііі) інгібітори зворотного захвату серотоніну, наприклад, флуоксетин, пароксетин, ситалопрам та сертралін; (xi v) змішані інгібітори зворотного захвату серотонін-норадреналіну, наприклад, мілнаципран, венлафаксин та дулоксетин; (xv) інгібітори зворотного захвату норадреналіну, наприклад, ребоксетин; (xvi) антагоністи тахікініну (NK), зокрема, NK-3, NK-2 та NK-1 антагоністи наприклад, (αR,9R)-7[3,5-бiс(трифторметил)бензил-8,9,10,11тетрагідро-9-метил-5-(4-метилфеніл)-7Н 25 81437 [1,4]діазоцино[2,1-g][1,7]нафтридин-6-13-діон (ТАK-637), 5-[[(2R,3S)-2-[(1R)-1-[3,5бiс(трифторметил)феніл]етокси-3-(4-фторфеніл)4-морфолініл]метил]-1,2-дигідро-3Н-1,2,4-триазол3-он (МK-869), ланепітант, дапітант та 3-[[2метокси-5-(трифторметокси)феніл]метиламіно]-2фенілпіперидин (2S,3S) (xvii) антагоністи мускаринових рецепторів, наприклад, оксибутин, толтеродин, пропіверин, тропсіумхлорид та дарифенацин; (xviii) СОХ-2 інгібітори, наприклад, целекоксиб, рофекоксиб та валдекоксиб; (хі х) неселективні СОХ інгібітори (переважно з GI захистом), наприклад, нітрофлурбіпрофен (НСТ-1026); (хх) PDEF інгібітори, наприклад, силденафіл, варденафіл (Bayer), тадалафіл (Icos Lilly), 1-{6етокси-5-[3-етил-6,7-дигідро-2-(2-метоксиетил)-7оксо-2Н-піразоло[4,3-d]піримідин-5-іл]-3піридилсульфоніл}-4-етилпіперазин, 5-(5-ацетил-2бутокси-3-піридиніл)-3-етил-2-(1-етил-3азетидиніл)-2,6-дигідро-7Н-піразоло[4,3d]піримідин-7-он і 5-[2-етокси-5-(4-етилпіперазин-1ілсульфоніл)піридин-3-іл]-3-етил-2-[2метоксиетил]-2,6-дигідро-7Н-піразоло[4,3d]піримідин-7-он; (ххі) кам'яновугільні анальгетики, зокрема, парацетамол; (ххіі) нейролептики, такі як дроперидол; (ххііі) агоністи ванілоїдних рецепторів, наприклад, резинфератоксин; (xxi v) бета-адренергічні сполуки, такі як пропранолол; (xxv) локальні анестетики, такі як мексилетин; (xxvi) кортикостероїди, такі як дексаметазон; (xxvii) агоністи та антагоністи рецепторів серотоніну; (xxviii) холінергічні (нікотинові) анальгетики; та (ххі х) змішані агенти, такі як Трамадол®. Таким чином, винахід забезпечує комбінацію, що включає сполуку формули (І) або фармацевтично прийнятну сіль, сольват або їх проліки та сполуку або клас сполук, вибраних із групи (і)-(ххі х), наведеної вище. Забезпечується також фармацевтична композиція, що включає таку комбінацію, разом з фармацевтично прийнятним ексципієнтом, розбавником або носієм, особливо, для лікування захворювання, в якому задіяний альфа-2-дельта ліганд. Таким чином, як подальший аспект, винахід забезпечує комбінований продукт, що включає сполуку формули (І) або її фармацевтично прийнятну сіль та PDEV інгібітор. Переважно, PDEV інгібітор вибирають з силденафілу, варденафілу, тадалафілу, 1-{6-етокси-5-[3-етил6,7-дигідро-2-(2-метоксиетил)-7-оксо-2Нпіразоло[4,3-d]піримідин-5-іл]-3піридилсульфоніл}-4-етилпіперазину, 5-(5-ацетил2-бутокси-3-піридиніл)-3-етил-2-(1-етил-3азетидиніл)-2,6-дигідро-7Н-піразоло[4,3d]піримідин-7-ону і 5-[2-етокси-5-(4-етилпіперазин1-ілсулфоніл)піридин-3-іл]-3-етил-2-[2метоксиетил]-2,6-дигідро-7Н-піразоло[4,3d]піримідин-7-ону. 26 Комбінації сполук представленого винаходу й інших терапевтичних агентів можуть призначатися окремо, послідовно або одночасно. По мірі того, як це може бути бажаним призначати комбінацію активних сполук, наприклад, для цілей лікування специфічного захворювання або стану, в межах представленого винаходу дві або більша кількість фармацевтичних композицій, принаймні, одна з яких містить сполуку згідно з винаходом, можуть бути легко об'єднані у формі набору, придатного для сумісного призначення композицій. Таким чином, набір винаходу включає дві або більше окремих фармацевтичні композиції, принаймні одна з яких містить сполуку формули (І) відповідно до винаходу і засоби для окремого збереження згаданих композицій, такі як контейнер, розділена пляшка або розділена упаковка з фольги. Приклад такого набору є відома блістер упаковка, використовувана для упакування таблеток, капсул і т.п.. Набір винаходу особливо прийнятний для призначення різних дозованих форм, наприклад, оральним і перентеральним, для введення окремими композиціями з різними інтервалами дозування або для титрування окремих композицій для порівняння однієї з іншою. Для дотримання стандартів, набір типово включає інструкції по призначенню і може забезпечуватися так званою пам'яткою. Сполуки згідно з винаходом, що призначені для фармацевтичного застосування можуть призначатися у вигляді кристалічного або аморфного продуктів. Вони можуть бути отримані, наприклад, у вигляді твердих тампонів, порошків або плівок за допомогою способів, таких як осаджування, кристалізація, сублімаційна сушка, сушка розпиленням або випарюванням. Для цієї цілі може використовуватися мікрохвильове або радіочастотне висушування. Придатні композиції сполук винаходу можуть бути в гідрофільній або гідрофобній матриці, у вигляді комплексу з іонообмінною смолою, у формі з покриттям або без покриття та інших типах, як [описано в патенті US 6,106,864]. Сполуки згідно з винаходом можуть призначатися поодинці або β комбінації з одним або більшою кількістю інших лікарських засобів (або у вигляді будь-якої їх комбінації). Взагалі вони будуть призначатися як рецептура у сполученні з одним або більшою кількістю відповідного фармацевтично прийнятного ексціпієнта(ів). Термін "ексціпієнт", використовуваний тут, описує будь-який інгредієнт, відмінний від сполуки винаходу. Вибір ексціпієнта у значній мірі буде залежати від специфічного способу введення, впливу ексціпієнта на розчинність і стабільность і характеру дозованої форми. При необхідності, можуть бути додані допоміжні речовини. Допоміжними речовинами є консерванти, антиоксиданти, ароматизатори або барвники. Фармацевтичні композиції, прийнятні для доставки сполук представленого винаходу та способи їх одержання будуть очевидні для фа хівців даної галузі. Такі композиції та способи їх 27 81437 одержання можуть бути знайдені, [наприклад, в "Remington's Pharmaceutical Sciences", 19-е Видання (Mack Publishing Company, 1995)]. Сполуки представленого винаходу можуть вводитися оральним шляхом. Оральне введення може включати ковтання, внаслідок чого сполука потрапляє в шлунково-кишковий тракт, або може застосовуватися букальне або сублінгвальне введення для того, щоб сполука потрапляла в кров безпосередньо з рота. Рецептури, прийнятні для орального введення включають тверді композиції, такі як таблетки, капсули, що містять частинки, розчини або порошки, мульти- та наночастинки, гелі, плівки (включаючи, мукоадгезиви), порошок, овули, еліксири, лозенги (включаючи, рідинонаповнені), жувальні гумки, твердий розчин, ліпосоми, суспензії, спреї і рідкі композиції. Рідкі рецептури включають супензії, розчини, сиропи й еліксири. Такі сполуки можуть застовуватися як наповнювачі в м'яких або твердих капсулах і зазвичай включати носій, наприклад, воду, етанол, поліетиленгліколь, пропіленгліколь, метилцелюлозу або придатне масло та один або більшу кількість емульсифікаторів або супендувальних агентів. Рідкі рецептури можуть також бути одержані відтворенням твердої речовини, наприклад, з саше. Сполуки згідно з винаходом можуть також прийматися у вигляді осмотичної дозованої форми або у формі високоенергетичної дисперсії, або у вигляді покритих частинок, або у вигляді швидкорозчинних дозованих форм та дозованих форм, що швидко розпадаються, як це [описано в Досвідченій Думці в Терапевтичних Патентах, 11 (6), 981-986 Liang і Chen (2001)]. Для дозованих форм у вигляді таблеток, у залежності від дози, лікарській засіб може складати від 1ваг.% до 80ваг.% дозованої форми, більш типово від 5ваг.% до 60ваг.% дозованої' форми. На додаток до лікарського засобу, таблетки, як правило, містять дезінтегрант. Приклади дезінтегрантів включають крохмальгліколят натрію, натрійкарбоксиметилцелюлозу, кальційкарбоксиметилцелюлозу, натрійкроскармелозу, кросповідон, полівінілпіролідон, метилцеллюлозу, мікрокристалічну целюлозу, заміщену нижчим алкілом гідроксипропілцелюлозу, крохмаль, прежелатинізований крохмаль та альгінат натрію. Як правило, дезінтегрант буде включати від 1ваг.% до 25ваг.%, переважно від 5ваг.% до 20ваг.% дозованої форми. Зв'язувальні агенти в основному використовуються для надання зв'язувальних властивостей таблетованій формі. Прийнятні зв'язування включають мікрокристалічну целюлозу, желатин, цукри, поліетиленгліколь, природні і синтетичні смоли, полівінілпіролідон, прежелатинізований крохмаль, гідроксипропілцелюлозу і гідроксипропілметилцелюлозу. Таблетки можуть також містити розчинники, такі як лактозу 28 (моногідрат, моногідрат висушений розпиленням, безводний і т.п.), маніт, ксиліт, декстрозу, сахарозу, сорбіт, мікрокристалічну целюлозу, крохмаль і двоосновний фосфорнокислий кальцій. Таблетки можуть також необов'язково включати поверхнево-активні агенти, такі як лаурилсульфат натрію та полісорбат 80 та агенти для покращення ковзання, такі як діоксид кремнію та тальк. Якщо агенти присутні, поверхневі активні агенти можуть складати від 0,2ваг.% до 5ваг.% таблетки та агенти для покращення ковзання можуть складати від 0,2ваг.% до 1ваг.% таблетки. Таблетки також, як правило, містять змащувальні агенти, такі як стеарат магнію, стеарат кальцію, стеарат цинку, стеарилфумарат натрію і суміші стеарату магнію з лаурилсульфатом натрію. Змащувальні агенти, як правило, складають від 0,25ваг.% до 10ваг.%, переважно від 0,5ваг.% до 3ваг.% таблетки. Інші можливі інгредієнти включають антиоксиданти, фарбувальні агенти, ароматизатори, консерванти і смакові агенти. Типові таблетки містять до приблизно 80% лікарської речовини, приблизно від 10ваг.% до приблизно 90ваг.% зв'язувального агента, приблизно від 0ваг.% до приблизно 85ваг.% розчинника, приблизно від 2ваг.% до приблизно 10ваг.% дезінтегранту та приблизно від 0,25ваг.% до приблизно 10ваг.% змащувального агента. Таблеткові суміші можуть бути вироблені безпосереднім пресуванням або за допомогою валика, для формування таблеток. Таблеткові суміші або порції сумішей можуть бути альтернативно одержані вологим-, сухим- або гранулюванням з розплаву, твердінням розплаву або екструзією, перед таблетуванням. Кінцева композиція може включати один або декілька шарів і може бути з покриттям або без покриття; може бути навіть інкапсульована. Склад таблеток обговорений у ["Pharmaceutical Dosage Forms: Tablets, Vol.1", Η. Lieberman і L. Lachman, Marcel Dekker, Ν. Υ., Ν. Υ., 1980 (ISBN 0-8247-6918-Х)]. Тверді композиції для орального прийому, для забезпечення негайного і/або модифікованого вивільнення. Композиції модифікованого вивільнення включають затримане-, тривале-, імпульсне-, контрольоване-, цільове та запрограмоване вивільнення. Прийнятні композиції модифікованого вивільнення для цілей винаходу [описані в патенті США №6,106, 864]. Деталі інших придатних методик вивільнення таких форм як високоенергетична дисперсія або у вигляді осмотичної дозованої форми і у вигляді покритих частинок, [описані в Verma та інш., Pharmaceutical Technology On-line, 25 (2), 1-14 (2001)]. Тверді композиції подібного типу можуть також застосовуватися як наповнювачі в капсулах, таких як желатинові, крохмальні або ГПМЦ капсули. Серед ексціпієнтів перевага в цьому відношенні надається лактозі, крохмалю, целюлозі, молочному цукру або високомолекулярним поліетиленгліколям. Рідкі композиції можуть використовува тися як наповнювачі в м'яких або 29 81437 твердих капсулах, таких як желатинові капсули. Для водних та масляних суспензій, розчинів, сиропів і/або еліксирів сполуки згідно з винаходом можуть об'єднуватися з різними підсолоджувальними або смаковими агентами, фарбувальними агентами або барвниками, з емульгаторами і/або суспенгаторами і з розбавниками, такими як вода, етанол, пропіленгліколь, метилцелюлоза, альгінова кислота або альгінат натрію, гліцерин, масла, гідроколоїдні агенти та їх комбінації. Крім того, композиції, що містять ці сполуки та ексціпієнти, можуть бути представлені у вигляді сухого продукту для розведення водою або іншими придатними розчинниками перед використанням. Сполуки представленого винаходу можуть також призначатись у вигляді ін'єкцій, таких як внутрішньовенні, внутрішньом'язові, внутрішньошкірні, інтрадуоденальні або інтраперитонеальні, внутрішньоартеріальні, інтратекальні, інтравентрикулярні, інтрауретральні, інтрастернальні, інтракраніальні, інтраспинальні або підшкірні, або вони можуть вводитися інфузією, голковими ін'єкціями (включаючи мікроголкову), безголковими ін'єкціями або за методиками ін'єкцій імплантату. Для такого патентерального введення найкраще використовува ти їх у формі стерильного водного розчину, суспензії або емульсії (або системи, що може включати міцелі), які можуть містити інші речовини, відомі в галузі, наприклад, достатню кількість солей або вуглеводів, таких як глюкоза, для того, щоб зробити розчин ізотонічним з кров'ю. Водні розчини, при необхідності, повинні бути придатним чином буферизован! (переважно до рН від 3 до 9). Для деяких форм парентерального введення їх можна використовувати у формі стерильної неводної системи, такої як жирні масла, включаючи моно- або дигліцериди, та жирні кислоти, включаючи олеїнову кислоту. Одержання придатних парентеральних композицій в стерильних умовах, наприклад, ліофілізацією, легко здійснюють за стандартними фармацевтичними методиками, добре відомими фа хівцям. Альтернативно, активний інгредієнт може бути у формі порошку для розведення відповідним розчинником (наприклад, стерильною апірогенною водою) перед використанням. Здатність до розчинності сполуки формули (І), використовувана при одержанні розчинів для парентерального введення може бути підвищена за допомогою відповідних методик складання рецептур, таких як додавання агентів, здатних підвищувати розчинність. Композиції для парентерального введення можуть бути сформовані, для негайного і/або модифікованого вивільнення. Таким чином, сполуки згідно з винаходом можуть бути сформовані в більш твердій формі для введення як імплантованого депо, що забезпечує довготривале вивільнення активної сполуки. Сполуки представленого винаходу можуть вводитися інтраназально або інгаляцією. Вони зручним чином доставляються у формі сухого порошку (або окремо, або у вигляді суміші, 30 наприклад, сухої суміші з лактозою, або частинок компоненту, змішаних, наприклад, з фосфоліпідами) за допомогою інгалятору сухого порошку або у вигляді аерозольного спрею з контейнеру під тиском, помпи, аерозольного балону, пульверизатора (переважно, пульверизатора з використанням електрогідродинамічних елементів для одержання тонкодисперсного пилу) або розпилювача з або без використання придатного пропеленту, наприклад, дихлордифторметану, трихлорфторметану, дихлортетрафторетану, гідрофторалкану, такого як 1,1,1,2-тетрафторетан (HFA 134A [торгова марка]) або 1,1,1,2,3,3,3гептафторпропан (EFA 227EA [торгова марка]), діоксид вуглецю, інші перфоровані вуглеводні, такі як Перфлуброн (торгова марка) або інший придатний газ. Для інтраназального використання порошок може містити біоадгезийний агент, наприклад, хітозан або циклодекстрин. У випадку аерозолю під тиском, доза може визначатись шляхом встановлення клапану, що забезпечує доставку відміряної кількості. Контейнер під тиском, помпа, аерозольний балон, пульверизатор або розпилювач містять розчин або суспензію сполук згідно з винаходом, що містять етанол (водний етанол) або придатний агент для диспергування, розчинення або затриманого вивільнення та пропелент, як розчинник, який може додатково містити лубрикант, наприклад, триолеат сорбіту або олігомолочну кислоту. Перед використанням в композиції сухого порошку або в суспензії для інгаляції сполуки згідно з винаходом повинні бути мікронізовані до розмірів, придатних для доставки інгаляцією (зазвичай вважається менше, ніж 5 мікронів). Мікронізація може досягатися рядом способів, наприклад, змелюванням за допомогою гвинтового реактивного млина, змелюванням в реактивному млині з псевдозрідженим шаром, використанням надкритичної рідинної кристалізації з утворенням наночастинок, гомогенезацією високим тиском або сушкою розпилюванням. Капсули (зроблені, наприклад, з желатину або ГПМЦ), блістери та картриджі для використання в інгаляторі або інсуфляторі можуть містити порошкову суміш сполуки винаходу, придатну порошкову основу, таку як лактоза або крохмаль та модифікатор ефективності, такий як 1-лейцин, маніт або стеарат магнію. Лактоза може бути у безводній формі або у формі моногідрату, переважно у формі останнього. Інші придатні ексціпієнти включають декстран, глюкозу, мальтозу, сорбіт, ксиліт, фруктозу, са харозу і трегалозу. Придатна композиція розчину для використання в розпилювачі із застосуванням електрогідродинамічних елементів для одержання тонкодисперсного пилу може містити від 1мкг до 20мг сполуки згідно з винаходом на запуск і об'єм такого запуску може змінюватися від 1мкл до 100мкл. Звичайна композиція може містити сполуку згідно з винаходом, пропіленгліколь, стерильну воду, етанол та хлорид натрію. Замість пропіленгліколю можуть використовуватися 31 81437 альтернативні розчинники, наприклад, гліцерин або поліетиленгліколь. Придатні ароматизатори, такі як ментол та левоментол або підсолоджувачі, такі як сахарин або сахарин натрію, можуть бути додані до тих рецептур винаходу, що призначені для інгаляційного/інтраназального введення. Композиції для інгаляційного/інтраназального введення можуть бути сформовані, для забезпечення негайного і/або модифікованого вивільнення, наприклад, полі(DL)-молочнокогліколева кислота (PGLA). Композиції модифікованого вивільнення включають затримане-, тривале-, імпульсне-, контрольоване-, цільове і запрограмоване вивільнення. Альтернативно, сполуки згідно з винаходом можуть призначатися місцево на шкіру, слизову оболонку, тобто, дермально або трансдермально. Типові композиції призначені для цієї цілі включають гелі, гідрогелі, лосьйони, розчини, креми, мазі, присипки, пов'язки, піни, плівки, шкірні пластирі, пластинки, імплантати, тампони, волокна, бандажі та мікроемульсії. Можуть також використовува тися ліпосоми. Для таких застосувань сполуки згідно з винаходом можуть бути суспендовані або розчинені, наприклад, в суміші з одною або декількома наступними речовинами: мінеральним маслом, рідким вазелином, білим вазелином, пропіленгліколем, поліоксиетиленполіоксипропіленом, здатним до емульгування воском, жирними маслами, в тому числі синтетичними моно- або дигліцеридами та жирними кислотами, в тому числі олеїновими кислотами, водою, сорбітмоностеаратом, поліетиленгліколем, рідким парафіном, полісорбатом 60, восками на основі цетилових естері в, цетеариловим спиртом, 2октилдодеканолом, бензиловим спиртом, спиртами, такими як етанол. Можуть використовува тися підсилювачі проникнення дивіться, [наприклад, J. Pharm. Sci., 88 (10), 955958 Finnin та Morgan (жовтень 1999). Додатково можуть також використовуватися полімери, вуглеводи, білки і фосфоліпіди у формі наночастинок (таких як ніосоми або ліпосоми). Інші засоби місцевого введення включають доставку з використанням іонтофорезу, електропорації, фонофорезу, сонофорезу і безголковою або мікроголковою ін'єкцією (наприклад, Powderjec ™, Bioject™ і т.д.). Композиції для місцевого введення можуть бути сформовані, для забезпечення негайного і/або модифікованого вивільнення. Композиції модифікованого вивільнення включають затримане-, тривале-, імпульсне-, контрольоване-, цільове і запрограмоване вивільнення. Альтернативно, сполуки винаходу можуть вводитися ректально, наприклад, у формі супозиторіїв, песарій або клізми. Вони можуть також уводитися вагінальним шляхом. Наприклад, такі композиції можуть бути одержані змішуванням лікарської речовини з придатними неподразнювальними ексціпієнтами, такими як масло какао, синтетичні естери гліцеридів або поліетиленгліколі, які є твердими при звичайних 32 температурах, але перетворюються в рідкий стан і/або розчиняються в порожнинах з вивільненням лікарської речовини. Композиції для ректального/вагінального введення можуть бути сформовані, для забезпечення негайного і/або модифікованого вивільнення. Композиції модифікованого вивільнення включають затримане-, тривале-, імпульсне-, контрольоване-, цільове і запрограмоване вивільнення. Сполуки винаходу можуть також вводитися безпосередньо до ока або до вуха, зазвичай у вигляді крапель мікронізованої суспезії в ізотонічному, рН доведеному, стерильному розчині солі. Інші сполуки, що прийнятні для введення очним шляхом та до вуха включають мазі, імплантати, що піддаються біодеструкції (наприклад, гемостатичні губки, колаген) або не піддаються біодеструкції (наприклад, силікон), пластинки, лінзи або доставлятися через партикулярні або везикулярні системи, такі як ніосоми або ліпосоми. Полімер, такий як поперечнозшита поліакрилова кислота, полівініловий спирт, гіалуронова кислота, полімер целюлози (наприклад, гідроксипропілметилцелюлоза, гідроксиетилцелюлоза, метилцелюлоза) або гетерополісахаридний полімер (наприклад, гелеподібна камедь) може додаватись в поєднанні з консервантом, таким як хлорид бензалконію. Такі композиції можуть доставлятися з використанням іонтофорезу. Композиції для введення до ока/вуха можуть бути сформовані, для забезпечення негайного і/або модифікованого вивільнення. Композиції модифікованого вивільнення включають затримане-, тривале-, імпульсне-, контрольоване-, цільове і запрограмоване вивільнення. Сполуки винаходу можуть також бути об'єднані з здатними до розчинності високомолекулярними речовинами, такими як циклодекстрин і його придатними похідними або поліетиленгліколь-вмісними полімерами, щоб поліпшити їх здатність до розчинності, швидкість розчинення, смак, біодоступність і/або стабільність для використання в будь-якому з вищезгаданих способів введення. Комплекси лікарська речовина-циклодекстрин, наприклад, загалом є корисними для більшості дозованих форм та шляхів введення. Можуть використовува тися комплекси включення і комплекси невключения. Як альтернатива безпосередньому комплексоутворенню з лікарською речовиною, циклодекстрин може використовува тися як допоміжна добавка, тобто, як носій, розбавник або солюбілізатор. Зазвичай, найбільш використовуваними є альфа-, бета- та гамма-циклодекстрини і відповідні приклади [описані в патентних заявках WO-A-91/11172, WOA-94/02518 та WO-A-98/55148]. Термін "введений" включає доставку вірусним та невірусним способами. Механізми вірусної доставки включають, але не обмежуються ними: аденовірусні вектори, аденоасоційовані вірусні (ААВ) вектори, герпетичні вірусні вектори, 33 81437 ретровірусні вектори, лентівірусні вектори та бакуловірусні вектори. Механізми невірусної доставки включають опосередковану ліпідами трансфекцію, ліпосоми, імуноліпосоми, ліпофектин, катіонні ліцеві амфіфіли (CFAs) та їх комбінації. Шляхи для таких механізмів доставки включають, але не обмежуються ними: слизовий, назальний, оральний, парентеральний, шлунковокишковий, місцевий або сублінгвальний шляхи. Таким чином, подальший аспект даного винаходу о хоплює фармацевтичну композицію, яка містить сполуку формули (І) або фармацевтично прийнятну сіль, сольват, поліморф або їх проліки, разом з фармацевтично прийнятним ексціпієнтом, розбавником або носієм. Складовий елемент фармацевтичного препарату переважно знаходиться в одиничній дозованій формі. В такій формі препарат підрозділяється на одиничні дози, що містять придатні кількості активного компоненту. Одинична дозована форма може бути упакованим препаратом, упаковка містить дискретні кількості препарату, такі як упаковані таблетки, капсули та порошки у флаконах або ампулах. Також, одинична дозована форма може бути капсулами, таблеткою, саше або лозенге, або вона може бути придатною кількістю будь-якої з цих упакованих форм. Кількість активного компонента в одиничній дозі може змінюватися або корегуватися від 0,1 міліграма до 1г відповідно до конкретного застосування і ефективності активних сполук. В медичному застосуванні лікарський засіб може вводитися від одного до трьох разів на добу як, наприклад, капсули 100 або 300мг. У терапевтичному застосуванні, сполуки, використовувані у фармацевтичному способі згідно з винаходом вводяться при початковому дозуванні приблизно 0,01мг до приблизно 100мг/кг на день. Перевага надається діапазону добової дози приблизно від 0,01мг до приблизно 100мг/кг. Дозування засновані на людині середнього віку, що має вагу від приблизно 65кг до 70кг. Лікар може легко визначити дози для суб'єктів, вага яких виходить за межі цього діапазону, таких як дитина та людина похилого віку. Дозування, однак, можуть бути змінені в залежності від вимог пацієнта, серйозності стану, який лікують та використовуваних сполук. Визначення належного дозування в конкретній ситуації відоме для фа хівця даної галузі. Загалом, лікування починають з малих доз, які є меншими, ніж оптимальна доза сполук. Після цього дозування збільшують невеличкими прибавками доти, поки в даних обставинах не буде досягнутий оптимальний ефект. Для зручності загальна денна доза може бути розподілена і призначена, за бажанням, частинами протягом дня. Фармацевтична композиція відповідно до представленого винаходу може, якщо бажано, також містити один або більшу кількість сумісних терапевтичних агентів. Зокрема, композиція може бути об'єднана з будь-якою однією або більшою кількістю сполук, корисних в лікуванні болю, таких як були наведені вище. Таким чином, представлений винахід представляє 34 фармацевтичну композицію, що включає сполуку формули (І), один або більшу кількість інших фармакологічно активних агентів та один або більшу кількість фармацевтично прийнятних носіїв. Для запобігання сумніву, наведений термін "лікування" включає посилання на лікувальне, паліативне та профілактичне лікування. Загальні способи Сполуки формули (І) можуть бути синтезувані, використовуючи різні способи, викладені нижче: Відповідно до першого процесу, (А), сполука формули (І) може бути одержана шляхом зняття захисту з сполуки формули (II), (III) або (IV) де R, X і Υ мають значення такі, як описані для формули (І), R, є придатною захисною групою карбонової кислоти, такою як d-6 алкіл і PG є придатною захисною групою, такою як третбутоксикарбоніл, за допомогою стандартних способів, наприклад, за допомогою гідролізу у кислому середовищі, використовуючи сильну кислоту, таку як трифтороцтова кислота або хлорводнева кислота, у придатному розчиннику, такому як діоксан або дихлорметан. Сполуки формули (І) можуть бути одержані безпосередньо з сполук формули (III) шляхом розщеплення гідролізом. Сполуки формули (II) можуть бути одержані за допомогою гідролітичного розщеплення естерних функціональних груп сполуки (III), де X, Y, R, PG і R1 мають значення, як зазначено вище і гідроліз полегшений гідроксидом лужного металу, таким як гідроксид літію, у придатному розчиннику, такому як водний розчин діоксану. Сполуки формули (III) можуть бути сформовані наступними способами: і) За допомогою реакції сполуки формули (VI) де Ζ означає придатну відхідн у гр упу, таку як мезилат, тозилат, трифлат або гало з сполукою RYX-H, використовуючи придатну основу, таку як сіль лужного металу, таку як K2СО3 або гідрид лужного металу, такий як NaH, у придатному розчиннику, такому як ДМФ, при температурі 20140°С. іі) Якщо RYX- є - АrО-, де Аr є необов'язково заміщеним арильним або гетероарильним 35 81437 36 кільцем, за допомогою реакції сполуки формули (VII) з сполукою формули АRОH, використовуючи Mitsunobu умови прийнятного азидодикарбоксилату, такого як DIAD та трифенілфосфіну або трибутилфосфіну у придатному розчиннику, такому як ТГФ, при температурі 25-60°С. ііі) За допомогою гідрогенолізу сполуки формули (VIII) Сполуки формули (IX) гідролізують до одержання сполук формули (XVII) у присутності основи, такої як водний розчин гідроксиду літію в ТГФ/Н2О. Сполуки формули (XVIII) одержують з (XVII), використовуючи стандартні конденсувальні реагенти, такі як DCC, DMAP та придатний спирт, такий як ментол (R2) у дихлорметані при кімнатній температурі. з придатним каталізатором, таким як паладій на вугіллі. Сполуки формули (VIII) можуть бути одержані з сполук формули (XII) шля хом додавання металорганічної речовини в присутності прийнятного каталізатора та допоміжних речовин, наприклад бензилцинкбромід у присутності NBu4L, паладієвого каталізатора та фосфінового ліганда в придатному розчиннику, такому як 1:1 ТГФ:1метил-2-піролідинон Сполуки формули (XVIII) піддають гідруванню протягом 1-18 годин в атмосфері водню при 15псі при кімнатній температурі, використовуючи придатний каталізатор, такий як РtO2 у ЕtOАс і/або толуолі, з одержанням сполуки формули (XIV). Сполуки формули (XIV), піддають повному зняттю захисту згідно з методикою Процесу А, використовуючи 6М хлорводневої кислоти протягом 18 годин при 60°С-120°С, одержуючи сполуки формули (І), де X означає СН 2 Сполуки формули (XII) одержують з сполук формули (X) шля хом додавання придатної основи з наступним додаванням трифторметансульфонуючого агенту, наприклад, додаванням н-бутиллітію при -78°С - -20°С в придатному розчиннику, такому як ТГФ з наступним додаванням ангідриду трифторметансульфонової кислоти. iv) Якщо X означає СН2, за допомогою гідрогенолізу сполуки формули (IX) Альтернативно, сполуки формули (VIII) і (IX) можуть бути одержані шляхом дегідратації сполук формули (XI), що каталізується кислотою. з придатним каталізатором, таким як паладій на вуглецю. Сполуки формули (IX) можуть бути одержані з сполук формули (X), використовуючи реакцію Wittig, в якій ілід утворюється з придатної солі фосфонію і основи, такої як 1Μ tBuOK/ТΓΦ або трет-амілату натрію у толуолі або дихлорметан при кімнатній температурі. Сполуки формули (XI) можуть бути одержані додаванням металоорганічних речовин до сполук формули (VIII), наприклад, додаванням броміду бензилмагнію до VIII у придатному розчиннику, такому як ТГФ, при температурі -78°С - 20°С. ν) Якщо Υ означає О і X означає СН2, за допомогою реакції сполуки формули (XVI) з сполукою формули R-OH, використовуючи Mitsunobu умови. Сполуки формули (XVI) можуть бути одержані шляхом гідроборування сполук формули (XV). 37 81437 38 EtOH TFA BOC Сполуки формули (XV) можуть бути одержані з сполук формули (XIII) шляхом гідролізу естерних функціональних груп, з одержанням сполуки формули (XIV), з наступною повторною естерифікацією. Сполуки формули (XIII) можуть бути одержані з сполук формули (X), використовуючи придатний метиленовий реагент Wittig, такий як бромід метилтрифенілфосфонію і основу, таку як третбутоксид калію в придатному розчиннику, наприклад, толуолі. Сполуки формули (XVI) можуть також бути одержані шляхом відновлення карбонових кислот формули (XVII), використовуючи гідроборуючий агент, такий як ВН3 у придатному розчиннику, такому як ТГФ при температурі 0-30°С. Сполуки формули (XVII) можуть бути одержані шляхом оксидування ароматичного фрагмента сполук формули (XVIII), використовуючи придатні умови, такі як хлорид рутенію і перйодат натрію в суміші розчинників, таких як Н2О, ЕtOАс і CH3CN при кімнатній температурі. Що стосується загальних способів, наведених вище, то для фа хівця цієї галузі буде зрозуміло, що, якщо є присутніми захисні групи, вони будуть загалом взаємозамінні іншими захисними групами подібної природи, наприклад, якщо амін описаний як захищений трет-бутоксикарбонільною групою, то вона може бути легко замінена будь-якою придатною амінною захисною групою. Представлений винахід проілюстрований наступними необмеженими прикладами і проміжними сполуками, в яких використовуються наступні скорочення: ТГФ DMF DIAD EtOAc DCM rt MeOH Тетрагідрофуран Диметилформамід Діізопропілазодикарбоксилат Етилацетат Дихлорметан Кімнатна температура Метанол Етанол Трифтороцтова кислота Трет-бутилоксикарбоніл Приклад 1 (2S,4S)-4-(Бензилсульфаніл)пІролідин-2карбонова кислота До розчину ди-трет-бутилового естеру (2S,4S)4-Бензилсульфанілпіролідин-1,2-дикарбонової кислоти (Препаративний приклад 2,130мг, 3,3ммоль) в дихлорметані (2,5мл) додавали трифтороцтову кислоту (2,5мл) і суміш перемішували при кімнатній температурі в атмосфері азоту протягом 36 годин. Розчинник видаляли при зниженому тиску і залишок очищали іонообмінною хроматографією використовуючи Dowex™ 50WX8-200 смолу, елююючи спочатку водою і потім 10% водним розчином амонію, одержуючи вказану в заголовку сполуку (66мг, 75%) у вигляді твердої речовини білого кольору. 1 Н-ЯМР (400МГц, D2O) δ=1,88-1,98 (1Н, м); 2,452,56 (1Н, м); 3,07-3,13 (1Н, м); 3,22-3,38 (2Н, м); 3,66-3,74 (2Н, с); 3,93-4,01 (1Н, м); 7,11-7,29 (5Н, м) НРМС (електророзпилення): m/z [ΜΗ+] 238; [MNa+] 260; [МH-] 236 Мікроаналіз: Одержано С, 59,36; Н, 6,33; N, 5,77. C12H15NO2S·0,3 Н2О розраховано С, 59,38; Н, 6,48; N, 5,77 Приклад 2 (2S,4S)-4-[(4-хлорбензил)окси]піролідин-2карбонова кислота (2S,4S)-1-(трет-бутоксикарбоніл)-4-[(4хлорбензил)окси]-2-піролідинкарбонову кислоту (Препаративний приклад 4, 96мг, 0,38ммоль) розчиняли у дихлорметані (5мл). Додавали трифтороцтову кислоту (5мл) і суміш залишали протягом ночі при кімнатній температурі. Реакційну суміш розподіляли між дихлорметаном (25мл) і водою (25мл). Водний шар виділяли, промивали великою кількістю дихлорметану (25мл) і випаровували до сухого залишку. Продукт очищали, використовуючи Dowex™ 50WX8-200 смолу, елююючи спочатку водою, потім сумішшю 9:1 вода:амоній, одержуючи вказану в заголовку сполуку (5мг, вихід 5%) у вигляді твердої речовини білого кольору. 1 Н-ЯМР (400МГц, CD3OD) δ=2,4-2,5 (м, 1Н), 2,6-2,7 (м, 1Н), 3,4-3,5 (м, 1Н), 3,6-3,7 (м, 1Н), 4,54,7 (м, 4Н), 7,3-7,5 (м, 4Н). РХМС (електророзпилення): m/z [M-] 254 Приклад 3 (2S,4S)-4-[(4-бромфенілтіо]піролідин-2карбонова кислота 39 81437 1-трет-бутиловий естер (2S,4S)-4-(4Бромфенілсульфаніл)піролідин-1,2-дикарбонової кислоти (Препаративний приклад 7, 54мг, 0,14ммоль) розчиняли у 4М НСІ у діоксані і перемішували протягом 2 годин при кімнатній температурі. Розчинник видаляли у вакуумі, одержуючи тверду речовину кремового кольору (32мг, 76%). 1 Н-ЯМР (400МГц, CD3OD) δ=2,20 (1Н, м), 2,83 (1Н, м), 3,32 (1Н, м), 3,70 (1Н, м), 4,15 (1Н, м), 4,50 (1Н, м), 7,40 (2Н, д), 7,55 (2Н, м). НРМС (електророзпилення): m/z [ΜΗ +] 302,304. Мікроаналіз: Одержано С, 39,01; Н, 4,23; Ν, 4,14. C11H12NO2SBr·0,9 НСІ розраховано С, 39,44; Н, 3,88; N,4,18. Приклад 4 (2S,4S)-4-фенілтіопіролідин-2-карбонова кислота Вказану в заголовку сполуку одержували за допомогою способу Прикладу 3, виходячи з сполуки, вказаної в заголовку Препаративного прикладу 8. Вихід був 60% і вказану в заголовку сполуку одержували у вигляді твердої речовини білого кольору. 1Н-ЯМР (400МГц, CD3OD) δ=2,19 (1Н, м), 2,80 (1Н, м), 3,34 (1Н, м), 3,70 (1Н, м), 4,10 (1Н, м), 4,56 (1Н, м), 7,030-7,60 (5Н, м). РХМС (електророзпилення): m/z [ΜΗ+] 224. Мікроаналіз: Одержано С, 48,95; Н, 5,50; Ν, 4,97. C11H13NO 2S·НСІ·0,5 Н2О розраховано С, 49,16; Н, 5,63; N,5,21. Приклад 5 (2S,4S)-4-[2-фторфенокси1піролідин-2карбонова кислота Вказану в заголовку сполуку одержували за допомогою способу Прикладу 3 з 74% виходом, виходячи зі сполуки, вказаної в заголовку Препаративного прикладу 10. 1Н-ЯМР (400МГц, MeOD): δ=2,60-2,76 (м, 2Н), 3,57-3,65 (м, 1Н), 3,75 (д, 2Н), 4,56-4,64 (м, 1Н), 4,85 (с, 3Н), 5,18-5,24 (м, 1Н), 6,98-7,19 (м, 4Н). НРМС (електророзпилення): [М-1] 224, [МН+] 226. Мікроаналіз: Одержано: С, 50,38; Н, 4,95; Ν, 5,29% C11H12FNO3 розраховано С, 50,49; Н, 5,01, N, 5,35% Приклад 6 (2S,4S)-4-[(4-хлорфенокси1піролідин-2карбонова кислота 40 ВОС захищений продукт (250мг, 0,73ммоль), одержаний в Препаративному приклади2 перемішували в 4М НСІ у діоксані (5мл) при 0°С протягом 2 годин. Додавали діетиловий етер (10мл) і одержаний осад відфільтровували і промивали діетиловим етером, одержуючи вказану в заголовку сполук у (178мг, 87%). 1 Н-ЯМР (400МГц, MeOD): δ=2,59-2,71 (м, 2Н), 3,56-3,72 (м, 2Н), 4,57-4,66 (м, 1Н), 4,82-4,93 (м, 3Н), 5,17-5,25 (м, 1Н), 6,88-6,98 (м, 2Н), 7,26-7,36 (м, 2Н). НРМС (електророзпилення): [М-1] 240, [МН+] 242, [MNa +] 264. Мікроаналіз: Одержано: С, 47,48; Н, 4,71; N, 4,92. C11H12CINO3·НСІ розраховано С, 47,50; Н, 4,71; N,5,04% Приклад 7 (2S,4S)-4-[2-ізохінолінокси|піролідин-2карбонова кислота 1-трет-бутиловий естер (2S,4S)-4-(Ізохінолін-7ілокси)піролідин-1,2-дикарбонової кислоти (Препаративний приклад 13, 120мг, 0,29ммоль) перемішували в TFA (3мл) протягом 4,5 годин при кімнатній температурі. Розчинник видаляли у вакуумі і розтирали з діетиловим етером, одержуючи дуже гігроскопічну тверду речовину, яку повторно розчиняли в 2N НСІ (3мл) і перемішували при кімнатній температурі протягом однієї години. Розчин промивали один раз діетиловим етером (5мл) і водний розчин випаровували, одержуючи пінисту речовину. Розтиранням з етером одержували вказану в заголовку сполуку у вигляді скла (24мг, 28%). 1 Н-ЯМР (400МГц, CH3OD): δ=2,68-2,80 (м, 1Н), 2,82-2,97 (м, 1Н), 3,75-3,91 (м, 2Н), 4,62-4,75 (м, 1Н), 4,75-4,96 (м, 5Н, що обмінюються), 5,48-5,60 (м, 1Н), 7,75-7,81 (м, 1Н), 7,98-8,02 (м, 1Н), 8,26 (д, 1Н), 8,39-8,55 (м, 2Н), 9,64 (с, 1Н) НРМС (електророзпилення) [М-1] 257, [МН+] 259 Приклад 8 (2S,4S)-4-(3-Хлорфенокси)піролідин-2карбонова кислота Вказану в заголовку сполуку одержували за допомогою способу Прикладу 6, виходячи з сполуки, вказаної в заголовку Препаративного прикладу 15, шляхом промивання продукту діетиловим етером (2´20мл), одержували тверду речовину білого кольору (52мг, 93%). 1Н ЯМР 41 81437 (400МГц, CD3OD): δ=2,65 (м, 2Н), 3,60 (дд, 1Н), 3,70 (д, 1Н), 4,60 (дд, 1Н), 5,02 (м, 1Н), 6,88 (м, 1Н), 6,97 (с, 1Н), 7,03 (д, 1Н), 7,29 (дд, 1Н). НРМС (електророзпилення [МН+] 242, [М-1] 240. Мікроаналіз: Одержано, С, 46,97; Н, 4,70; Ν, 4,90. C11H12CINO 3·НСІ·0,1 Н2О розраховано С, 47,20; Н, 4,75; N, 5,00. Приклад 9 (2S,4S)-4-(Бензилокси)піролідин-2-карбонова кислота (2S,4S)-1-(трет-бутоксикарбоніл)-4(бензилокси)піролідин-2-карбонову кислоту (Препаративний приклад 17, 150мг, 0,47ммоль) розчиняли у дихлорметані (5мл). Додавали трифтороцтову кислоту (5мл) і суміш при перемішуванні залишали протягом ночі при кімнатній температурі. Реакційну суміш розподіляли між дихлорметаном (25мл) і водою (25мл). Водний шар виділяли, промивали великою кількістю дихлорметану (25мл) і випаровували до сухого залишку. Продукт очи щали, використовуючи іонообмінну колонку (Dowex 50WX8-200 смола), елююючи спочатку водою, потім сумішшю 9:1 вода:амоній, одержуючи вказану в заголовку сполуку (34мг, 33% вихід) у вигляді твердої речовини білого кольору. 1 Н-ЯМР (400МГц, CD3OD) δ=2,3-2,5 (м, 1Η), 3,1-3,18 (м, 1Η), 3,4-3,5 (д, 1Η), 3,9-3,95 (м, 1Н), 4,2 (С, 1Η), 4,4-4,55 (дд, 3Н), 7,2-7,4 (м, 5Н). РХМС (електророзпилення): m/z [MNa +] 244. Приклад 10 (2S,4S)-4-(3-Фторбензил)піролідин-2карбонової кислоти моногідрохлоридна сіль 4-(3-Фторбензил)піролідин-1,2-дикарбонової кислоти 1-трет-бутиловий естер 2-(2-ізопропіл-5метилциклогексиловий) естер (Препаративний приклад 35, 0,91г, 1,96ммоль) розчиняли у толуолі (2мл). Додавали 6N хлорводневої кислоти (50мл) і перемішували при кип'ятинні протягом 18 годин. Реакційну суміш охолоджували до кімнатної температури і екстрагували етилцетатом (3´20мл). Водний шар концентрували шляхом випаровування при зниженому тиску, одержуючи вказану в заголовку сполуку (417мг, 81%) у вигляді твердої речовини білого кольору. 1Н-ЯМР показав співвідношення 7:1 цис:транс діастереоізомерів, таким чином, продукт перекристалізували з ізопропілового спирту, одержуючи вказану в заголовку сполуку (170мг, 65%) у співвідношенні 14:1 цис:транс, як визначено ЯМР. 1 Н-ЯМР (400МГц, CD3OD): (суміш діастереоізомеров 2S,4S:2S,4R (14:7)): δ=1,85 (к, 1Н), 2,51 (квін, 1Н), 2,69-2,85 (м, 3Н), 3,07 (т, 1Н), 42 3,41 (дд, 1Н), 4,38 і 4,48 (т, 1Н), 6,90-7,04 (м, 3Н), 7,32 (к, 1Н). НРМС (ХІАТ): m/z [MH]+ 224. [α]D25 -1,27° (с=9,00 у метанолі). Мікроаналіз: Одержано С, 55,56; Н, 5,81; N, 5,34%. C12H14FNO 2·НСІ розраховано С, 55,50; Н, 5,82; N, 5,39%. Приклад 11 (2S,4S)-4-(2,3-Дифторбензил)піролідин-2карбонової кислоти моногідрохлоридна сіль 45 Вказану в заголовку сполуку одержували способом, описаним в Прикладі 10, виходячи зі сполуки, вказаної в заголовку Препаративного прикладу 37 і очищали шля хом перекристалізації сумішшю ацетон/ефір, одержуючи вказану в заголовку сполуку у вигляді суміші діастереоізомеров (2S,4S:2S,4R(12:1)) визначаючи за допомогою 1Н-ЯМР (500мг, 60%) у вигляді твердої речовини білого кольору. 1 Н-ЯМР (400МГц, CD3OD) (суміш діастереоізомерів цис:транс (12:1)): δ=0,80-1,90 (м, 0,92Н), 2,12-2,20 (м, 0,08Н), 2,28-2,36 (м, 0,08Н), 2,49-2,58 (к, 0,92Н), 2,66-2,81 (м, 1Н), 2,83-2,95 (м, 2Н), 3,02-3,13 (т, 1Н), 3,46 (дд, 1Н), 4,40 (дд, 0,92Н), 4,48-4,54 (м, 0,08Н), 7,03-7,20 (м, 3Н). НРМС (електророзпилення): m/z [Μ+Η]+ 242. Мікроаналіз: Одержано С, 51,42; Н, 5,08; Ν, 5,01%. C12H13NO2F2 ·НСІ розраховано С, 51,90; Н, 5,08; N, 5,04%. Приклад 12 (2S,4S)-4-(2,5-Дифторбензил)піролідин-2карбонової кислоти моногідрохлоридна сіль Вказану в заголовку сполуку одержували способом, наведеним у Прикладі 10, виходячи зі сполуки, вказаної в заголовку Препаративного прикладу 36. 1 Н-ЯМР (400МГц, CD3OD): (суміш діастереоізомеров 2S,4S:2S,4R (26:1)): δ=1,86 (к, 1Н), 2,51-2,54 (м, 1Н), 2,75-2,83 (м, 3Н), 3,09 (т, 1Н), 3,45 (к, 1Н), 4,39 і 4,49 (2т, 1Н) 26:1, 7,00-7,14 (м, 3Н). НРМС (ХІАТ): m/z [MH]+ 242. Мікроаналіз: Одержано С, 50,18; Η, 4,94; Ν, 4,83%. C12H13F2NO2 ·НСІ розраховано С, 51,90; Η, 5,08; Ν, 5,04%. [α]D25-0,22° (c=1,84 у метанолі). Приклад 13 (2S,4S)-4-Циклогексилметилпіролідин-2карбонової кислоти моногідрохлоридна сіль 43 81437 4-Циклогексилметилпіролідин-1,2дикарбонової кислоти 1-трет-бутиловий естер 2-(2ізопропіл-5-метилциклогексиловий) естер (Препаративний приклад 38,316мг, 0,70ммоль) розчиняли у толуолі (2мл). Додавали 6N хлорводневої кислоти (50мл) і перемішували при кип'ятінні протягом 72 годин. Реакційну суміш охолоджували до кімнатної температури і екстрагували етилцетатом (3´20мл). Водний шар концентрували шляхом випаровування при зниженому тиску, одержуючи вказану в заголовку сполуку у вигляді твердої речовини білого кольору (80мг, 48%). 1 Н-ЯМР (400МГц, CD3OD): (суміш діастереоізомеров 2S,4S:2S,4R (6:1)): δ=0,83-1,00 (м, 2Н), 1,13-1,40 (м, 6Н), 1,62-1,81 (м, 6Н), 2,48 (м, 2Н), 2,90 (т, 1Н), 3,48 (т, 1Н), 4,32 і 4,42 (2т, 1Н). НРМС (ХІАТ): m/z [MH]+ 212. [α]D25-1,86° (с=2,04 у метанолі). Приклад 14 (2S,4S)-4-(3-Метоксибензил)піролідин-2карбонової кислоти моногідрохлоридна сіль Вказаний в заголовку продукт одержували способом, наведеним у Прикладі 10, виходячи з сполуки, вказаної в заголовку Препаративного прикладу 39. 1 Н-ЯМР (400МГц, CD3OD): (суміш діастереоізомеров 2S,4S:2S,4R (15:1)): δ=1,79-1,89 (м, 1Н), 2,47-2,52 (м, 1Н), 2,68-2,77 (м, 3Н), 3,06 (т, 1Н), 3,36 (т, 1Н), 3,39 (с, 3Н), 4,37 ι 4,47 (т, 1Η), 6,81 (д, 3Н), 7,22 (т, 1Η). НРМС (ХІАТ): m/z [MH]+ 236. Мікроаналіз: Одержано С, 56,77; Н, 6,62; N, 5,06%. C13H17NO3·НСІ розраховано С, 57,46; Н, 6,68; N,5,15%. [α]D25-6,90°(c=3,1,Me OH). Приклад 14А (2S,4S)-4-(3-Метоксибензил)піролідин-2карбонової кислоти моногідрохлоридна сіль може також бути одержана способом, [описаним у J. Ezquerra, С. Pedegrel, В. Yrurtagoyena і A. Rubio у J. Org. Chem. 1995, 60, 2925-2930]. Приклад 15 (2S,4S)-4-(3-фторфеноксиметил)піролідин-2карбонова кислота 44 4-(3-фторфеноксиметил)піролін-1,2дикарбонової кислоти ди-трет-бутиловий естер (Препаративний приклад 44, 475мг, 1,2ммоль) розчиняли у розчині безводного хлористого водню в діоксані (4М, 15мл) і перемішували при 50°С в атмосфері азоту протягом 1 години. Розчинник видаляли при зниженому тиску і одержану напівтверду речовину розтирали з етилцетатом, одержуючи тверду речовину білого кольору, яку перекристалізували з суміші етилцетат/ізопропіловий спирт, одержуючи вказану в заголовку сполуку у вигляді суміші діастереомерів (~5:1 2S,4S:2S,4R) у вигляді твердої гідрохлоридної солі білого кольору (90мг, 35%) 1 Н-ЯМР (400МГц, CD3OD): δ=2,04-2,09 (м, 0,8Н); 2,33-2,47 (м, 0,4Н); 2,65-2,75 (м, 0,8Н); 2,883,00 (м, 1Н); 3,33-3,40 (м, 1Н); 3,52-3,60 (м, 0,8Н); 3,60-3,68 (0,2Н); 3,96-4,04 (м, 1Н); 4,04-4,12 (м, 1Н); 4,42-4,51 (м, 0,8Н); 4,40-4,56 (м, 0,2Н); 6,656,80 (м, 3Н), 7,21-7,30 (м, 1Н). НРМС (електророзпилення): [М+1] 240; [М+23] 262; [М-1] 238. Наступні сполуки можуть бути одержані способом, аналогічним способу, наведеному в Прикладі 15: Приклад 16 (2S,4S)-4-(2,5Дифторфеноксиметил)піролідин-2-карбонова кислота: Приклад 17 (2S,4S)-4-(2,3ДиФторфеноксиметил)піролідин-2-карбонова кислота: Приклад 18 (2S,4S)-4-(3Метоксифеноксиметил)піролідин-2-карбонова кислота Приклад 19 (2S,4S)-4-(3хлорфеноксиметил)піролідин-2-карбонова кислота 45 81437 (2S,4S)-4-(3-хлорфеноксиметил)піролідин-1,2дикарбонової кислоти ди-трет-бутиловий естер (Препаративний приклад 46, 67мг, 0,16ммоль) розчиняли у розчині безводного хлористого водню в діоксані (4М, 5мл) і перемішували протягом 18 годин при кімнатній температурі. Розчинник видаляли при зниженому тиску і залишок розтирали з етилцетатом, одержуючи вказану в заголовку сполуку у вигляді твердої гідрохлоридної солі білого кольору (13мг, 27%) 1 Н-ЯМР (400МГц, CD3OD): δ=2,07-2,18 (м, 1Н); 2,63-2,74 (м, 1Н); 2,88-3,00 (м, 1Н); 3,32-3,40 (м, 1Н); 3,52-3,61 (м, 1Н); 3,96-4,04 (м, 1Н); 4,04-4,10 (м, 1Н); 4,42-4,51 (т, 1Н); 6,82-6,89 (д, 1Н); 6,807,00 (м, 2Н); 7,20-7,28 (т, 1Н). НРМС (електророзпилення): [М+1] 256; [М+23] 278; [М-1] 254 Приклад 20 (2S,4S)-4-(2,3-ДигідробензоФуран-6ілокси)піролідин-2-каобонова кислота Вказану в заголовку сполуку одержували способом, наведеним у Прикладі 3, з 100% виходом у вигляді твердої речовини блідо-жовтого кольору. 1 Н-ЯМР (400МГц, D2O): δ=2,35-2,56 (м, 2Н); 2,86-3,04 (м, 2Н); 3,35-3,65 (м, 2Н); 4,10 4,26 (м, 3Н); 4,97-5,05 (м, 1Н); 6,20-6,36 (м, 2Н); 7,02 (д, 1Н). НРМС (електророзпилення): [МН+] 250 Мікроаналіз: Одержано: С 54,16; Η, 5,78; Ν, 4,72%. Ο13Η15ΝΟ4 ·НСІ·0,15 Η2Ο розраховано, 54,14; Η, 5,70; Ν, 4,86. Приклад 21 (2S,4S)-4-(3-Хлорфеніламіно)піролідин-2карбонова кислота 4-(3-Хлорфеніламіно)піролідин-1,2дикарбонової кислоти 1-трет-бутиловий естер (Препаративний приклад 41, 155мг, 0,456ммоль) перемішували в 4Μ НСІ у діоксані (4мл) при 0°С протягом 2 годин. До суміші додавали етер (4мл) і одержану гігроскопічну тверду речовину білого кольору відфільтровували і сушили в вакуумі при 40°С, одержуючи вказану в заголовку сполуку (90мг, 60,3%). 1 Н-ЯМР (400МГц, CD3OD): 2,20-2,29 (м, 1Н); 2,95-3,05 (м, 1Н); 3,28-3,39 (м, 2Н); 4,22-4,31 (м, 1Н); 4,45-4,55 (м, 1Н); 4,90 (с, 5Н); 6,62 (д, 1Н); 6,70-6,75 (м, 2Н); 7,13 (т, 1Н). НРМС (електророзпилення): [М-1] 239. Мікроаналіз: Одержано: С, 40,37; Н, 5,07; N, 8,46%. С11Н13СІN2O 2·2НСІ·0,75 Н2О розраховано С, 40,39; Н, 5,08; N, 8,56. 46 Препаративний приклад 1 (2S,4R)-4-(Толуол-4-сульФонілокси)піролідин1,2-дикарбонової кислоти ди-трет-бутиловий естер До розчину (2S,4R)-4-гідроксипіролідин-1,2дикарбонової кислоти ди-трет-бутилового естеру [CAS Peг. №170850-75-6] (1г, 3,48ммоль) в 20мл СН2СІ2 додавали піридин (3,9мл) і птолуолсулфонілхлорид (0,7г, 3,67ммоль) і суміш перемішували при кімнатній температурі в атмосфері азоту протягом 72 годин. Розчинник видаляли при зниженому тиску і залишок розчиняли у ЕtOАс (100мл) і промивали насиченим розчином лимонної кислоти (50мл), потім водою (50мл). Органічну фазу сушили (сульфат магнію), фільтрували і випаровували при зниженому тиску. Залишок очищали за допомогою колоночної хроматографії, елююючи сумішшю етилцетат: гептан (3:10), одержуючи вказану в заголовку сполуку (1,5г, 98%) у вигляді безбарвної смоли. 1 Н-ЯМР (400МГц, CDCI3) δ=1,39-1,49 (18Н, м), 2,01-2,16 (1Н, м), 2,33-2,6 (4Н, м), 3,50-3,64 (2Н, м), 4,20-4,29 (1Н, м), 4,96-5,06 (1Н, м); 7,31-7,40 (2Н, м), 7,65-7,80 (2Н, м). НРМС (електророзпилення): m/z [ΜΗ+] 464, [ΜΗ-] 440 Препаративний приклад 2 (2S,4S)-4-Бензилсульфанілпіролідин-1,2дикарбонової кислоти ди-трет-бутиловий естер До розчину, одержаного в Препаративному прикладі 1 (200мг, 4,53ммоль), в етанолі (10мл) в атмосфері азоту додавали бензилмеркаптан (0,107мл, 8,86ммоль) і трет-бутоксид калію (101мг, 8,86ммоль) і суміш перемішували при кімнатній температурі протягом 18 годин. Розчинник видаляли при зниженому тиску і залишок, розчиняли у ЕtOАс (25мл) і промивали водою (10мл). Органічну фаз у сушили (сульфат магнію), фільтрували і випаровували при зниженому тиску. Залишок очищали за допомогою колоночної хроматографії, елююючи сумішшю гептан : етилцетат (9:1), одержуючи вказану в заголовку сполуку (1 30мг, 73%) у вигляді безбарвного масла. 1 Н-ЯМР (400МГц, CDCI3) δ=1,38-1,50 (18Н, м), 1,80-1,90 (1Н, м), 2,44-2,55 (1Н, м), 3,00-3,29 (2Н, м), 3,70-3,78 (2Н, с), 3,84-3,95 (1Н, м), 4,04-4,16 (1Н, м), 7,277,34 (5Н, м). НРМС (електророзпилення): m/z [MNa+] 416 Препаративний приклад 3 (2S,4S)-4-(4-Хлорбензилокси)піролідин-1,2дикарбонової кислоти 1-трет-бутиловий естер 2метиловий естер 47 81437 48 (2S,4S)-4-(4-Бромфенілсульфаніл)піролідин1,2-дикарбонової кислоти 1-трет-бутиловий естер 2-етиловий естер (2S,4S)-4-Гідроксипіролідин-1,2-дикарбонової кислоти 1-трет-бутиловий естер 2-метиловий естер [CAS Peг. №227935-38-8] (300мг, 1,0ммоль) і 60% дисперсію гідриду натрію в мінеральному маслі (61мг, 1,1ммоль) розчиняли в безводному диметилформаміді (9мл) при 0°С в атмосфері азоту. Через 10 хвилин при перемішуванні краплями додавали 4-хлорбензилбромід (265мг, 1,2ммоль) в СН2СІ2 (1мл) і реакційну суміш перемішували до кімнатної температури протягом 1 години. Розчинник видаляли при зниженому тиску і залишок, розводили у етилцетатіі (25мл), промивали водою (2´25мл), сушили (сульфат магнію), фільтрували і випаровували при зниженому тиску. Залишок очищали, використовуючи флеш-хроматографію, елююючи розчинником з градієнтом 4:1 гептан:етилцетат, одержуючи вказану в заголовку сполуку (170мг, вихід 40%) у вигляді масла. 1Н-ЯМР (400МГц, CDCI3) δ=1,4-1,5 (м, 9Н), 2,0-2,45 (м, 2Н), 3,5-3,8 (м, 5Н), 4,05- 4,2 (с, 1Н), 4,25-4,4 (м, 1Н), 4,4-4,55 (м, 2Н), 7,3 (м, 4Н). РХМС (електророзпилення): m/z [MNa+] 392. Препаративний приклад 4 (2S,4S)-1-(трет-бутоксикарбоніл)-4-[(4хлорбензил)окси]піролідин-2-карбонова кислота Вказану в заголовку сполуку, одержану в Препаративному прикладі 3 (157мг, 0,42ммоль) розчиняли у тетрагідрофурані (10мл). LiOH·Н2О (54мг, 1,3ммоль) розчиняли у воді (5мл). Два розчини змішували, залишали при перемішуванні при кімнатній температурі протягом двох днів, потім випаровували до сухого залишку при зниженому тиску. Одержаний залишок розчиняли у етилцетаті (25мл) і промивали насиченою лимонною кислотою (25мл). Органічну фракцію сушили (сульфат магнію), фільтрували і випаровували до сухого залишку при зниженому тиску. Залишок очищали, використовуючи флешхроматографію, елююючи розчинником з градієнтом суміші 20:1 дихлорметан:метанол, одержуючи вказану в заголовку сполуку (106мг, вихід 71%) у вигляді масла. 1 Н-ЯМР (400МГц, CDCI3) δ=1,4 (м, 9Н), 2,9-3,0 (м, 1Н), 3,4-3,6 (м, 2Н), 4,2-4,7 (м, 5Н), 7,2-7,35 (м, 4Н). РХМС (електророзпилення): m/z [M-] 354 Препаративний приклад 5 Етоксид натрію (112мг, 1,65ммоль) повільно додавали до перемішуваного розчину 4бромтіофенолу (302мг, 1,65ммоль) у ЕtOН (6мл) при кімнатній температурі в атмосфері азоту. Через 30 хвилин до одержаної суміші додавали розчин (2S,4R)-4-(толуол-4сульфонілокси)піролідин-1,2-дикарбонової кислоти 1-трет-бутилового естеру 2-метилового естеру [CAS Peг. № 88043-21-4] (300мг, 0,75ммоль) в 1мл ЕtOН і розчин перемішували протягом 48 годин. Реакційну суміш виливали в 0,5М NaOH (50мл) і екстрагували за допомогою СН 2СІ2 (2´50мл). Об'єднані органічні шари сушили (сульфат магнію) і концентрували під вакуумом. За допомогою колонкової флеш-хроматографії одержували продукт у вигляді твердої речовини рожевого кольору (120мг, 40%). 1 Н-ЯМР (400МГц, CDCI3) δ=1,25 (3Н, т), 1,40 (9Н, с), 2,00 (1Η, с), 2,60 (1Η, м), 3,35 (1Н, м), 3,60 (1Н, м), 3,90 (1Н, с), 4,18 (2Н, к), 4,22 (1Н, м), 7,35 (2Н, д), 7,40 (2Н, д). НРМС (електророзпилення): m/z [MNa +] 454. Препаративний приклад 6 (2S,4S)-4-(Фенілсульфаніл)піролідин-1,2дикарбонової кислоти 1-трет-бутиловий естер 2етиловй естер Вказану в заголовку сполуку одержували способом, описаним в Препаративному прикладі 5, з 40% виходом у вигляді твердої речовини рожевого кольору. 1Н-ЯМР (400МГц, CDCI3) δ=1,23 (3Н, т), 1,41 (9Н, с), 2,00 (1Н, м), 2,61 (1Н, м), 3,38 (1Н, м), 3,62 (1Н, м), 3,90-4.03 (1Н, м), 4,15-4,35 (3Н, м), 7,20-7,50 (5Н, м). НРМС (електророзпилення): m/z [MNa+] 374. Препаративний приклад 7 (2S,4S)-4-(4-Бромфенілсульфаніл)піролідин1,2-дикарбонової кислоти 1-трет-бутиловий естер (2S,4S)-4-(4-Бромфенілсульфаніл)піролідин1,2-дикарбонової кислоти 1-трет-бутиловий естер 2-етиловий естер (Препаративний приклад 5, 49 81437 120мг, 0,30ммоль) розчиняли в МеОН (6мл) і додавали 2М гідроксиду натрію (0,83мл, 1,66ммоль). Розчин перемішували протягом 14 годин, концентрували і додавали до 0,5М НСІ (50мл). Водні шари екстрагували СН 2СІ2 (50мл), сушили (сульфат магнію) і концентрували. За допомогою колонкової флеш-хроматографії (елююючи спочатку СН 2СІ2 і потім 95% СН2СІ2/МеОН) одержували кислоту у вигляді прозорої рідини (130мг, 48%). 1 Н-ЯМР (400МГц, CDCI3) δ 1,43 (9Н, с), 2,4-2,8 (2Н, м), 3,35 (1Н, м), 3,62 (1Н, м), 3,8-4,0 (1Н, м), 4,3-4,4 (1Н, м), 7,28 (2Н, м), 7,41 (2Н, м). НРМС (електророзпилення): m/z [M-] 400, 402. Препаративний приклад 8 (2S,4S)-4-(Фенілсульфаніл)піролідин-1,2дикарбонової кислоти 1-трет-бутиловий естер Вказану в заголовку сполуку одержували способом, описаним в Препаративному прикладі 7, з сполуки, вказаної в заголовку Препаративного прикладу 6, з 83% виходом у вигляді прозорого масла. 1 Н-ЯМР (400МГц, CDCI3) δ 1,41 (9Н, с), 2,10 (0,5Н, м), 2,38 (0,5Н, м), 2,50-2,75 (1Н, м), 3,36 (1Н, м), 3,62 (1Н, м), 3,82-4,03 (1Н, м), 4,25-4,41 (1Н, м), 7,20-7,45 (5Н, м). НРМС (електророзпилення): m/z [M-] 322. Препаративний приклад 9 4-(2-ФторФенокси)піролідин-1,2-дикарбонової кислоти 1-трет-бутиловий естер 2-метиловий естер (2S,4R)-4-Гідроксипіролідин-1,2-дикарбонової кислоти 1-трет-бутиловий естер 2-метиловий естер [CAS Peг. №74844-91-0] (300мг, 1,22ммоль) розчиняли у ТГФ (10мл) і додавали трифенілфосфін (385мг, 1,47ммоль) і 2фтор фенол (164,5мг, 1,47ммоль). Реакційну суміш охолоджували льодом, додавали краплями DIAD (0,23мл, 1,2ммоль) і реакційну суміш перемішували при кімнатній температурі протягом ночі. Суміш концентрували у вакуумі, додавали СН2СІ2 (20мл) і розчин промивали 2N NaOH (10мл). Фази відокремлювали й органічну фазу промивали насиченим розчином солі (10мл), сушили над MgSO4 і випаровували. Залишок розчиняли в мінімальній кількості діетилового етеру і до розчину додавали пентан, поки непочинав утворюватися осад. Після початку кристалізації оксиду три фенілфосфіну, розчин охолоджували льодом і одержаний осад фільтрували. Фільтрат випаровували і залишок, 50 очищали за допомогою флеш-хроматографії на силікагелі (50г), елююючи спочатку сумішшю пентан:діетиловий етер (об'ємом 2:1), потім сумішшю пентан : діетиловий етер (об'ємом 1:1) з одержанням вказаного в заголовку продукту (388мг, 58%) у вигляді неочищеного масла, що містить як домішку діізопропілбікарбамат. 1H-ЯМР (400МГц, CDCI3): δ=1,45 (д, 9Н), 2,35-2,57 (м, 2Н), 3,65-3,79 (м, 5Н), 4,43-4,57 (м, 1Н), 4,88-5,02 (м, 1Н), 6,81-6,98 (м, 2Н), 6,98-7,10 (м, 2Н). НРМС (електророзпилення): m/z [MNa+] 362 Препаративний приклад 10 (2S,4S)-4-(2-Фторфенкси)піролідин-1,2дикарбонової кислоти 1-трет-бутиловий естер Естер (400мг, 1,18ммоль), одержаний в Препаративному прикладі 9 розчиняли у ТГФ (4мл) і додавали LiOH·Н2О (106мг, 3,53ммоль) у воді (2мл). Суміш перемішували при кімнатній температурі протягом ночі. Після промивання СН2СІ2 (10мл), водний розчин доводили до рН2 за допомогою насиченого водного розчину лимонної кислоти і повторно екстрагували СН 2СІ2 (2´10мл). Об'єднані органічні екстракти повторно промивали насиченим розчином солі сушили над MgSO4, фільтрували і випаровували, одержуючи вказану в заголовку сполуку у вигляді твердої речовини білого кольору (383мг, 49%), що містить невелику кількість домішки діізопропілбікарбамату (2%), визначеної за допомогою ЯМР. 1 Н-ЯМР (400МГц, CDCI3): δ=1,16-1,70 (м, 9Н), 2,20-2,92 (м, 2Н), 3,58-3,85 (м, 2Н), 4,38-4,63 (м, 1Н), 4,83-5,02 (м, 1Н), 6,78-7,17 (м, 4Н). НРМС (електророзпилення): m/z [M-1] 324 Препаративний приклад 11 (2S,4S)-4-(4-Хлорфенокси)піролідин-1,2дикарбонової кислоти 1-трет-бутиловий естер 2метиловий естер (2S,4R)-4-Гідроксипіролідин-1,2-дикарбонової кислоти 1-трет-бутиловий естер 2-метиловий естер [CAS Peг. №74844-91-0] (1,10г, 4,08ммоль) розчиняли у ТГФ (25мл) і додавали 4-хлорфенол (0,78г, 6,12ммоль) і трифенілфосфін (1,6г, 6,12ммоль). Розчин охолоджували в льодяній бані і додавали краплями DIAD (0,96мл, 4,88ммоль). Реакційну суміш перемішували при кімнатній температурі протягом ночі. Після випаровування розчинника, залишок розчиняли у діетиловому етері (20мл) і додавали пентан, поки не починав утворюватися осад. Після початку кристалізації оксиду трифенілфосфіну, розчин охолоджували льодом. Одержаний осад фільтрували і фільтрат 51 81437 випаровували. Залишок завантажували з сумішшю пентан : діетиловий етер (об'ємом 2:1) на колонку і очищали за допомогою флеш-хроматографії на силікагелі (100г), і елююючи сумішшю пентан : діетиловий етер (об'ємом 1:1), одержували вказану в заголовку сполуку у вигляді безбарвного масла (1,35г, 69%), що містить невелику кількість домішки діізопропілбікарбамату [CAS Peг. №19740-72-8], визначену за допомогою ЯМР. 1НЯМР (400МГц, CDCI3): δ=1,43 (д, 9Н), 2,36-2,57 (м, 2Н), 3,61-3,81 (м, 5Н), 4,39-4,59 (м, 1Н), 4,80-4,90 (м, 1Н), 6,64-6,78 (м, 2Н), 7,18-7,30 (м, 2Н). НРМС (електророзпилення): m/z [MNa+] 378 Препаративний приклад 12 (2S,4S)-4-(4-Хлорфенокси)піролідин-1,2дикарбонової кислоти 1-трет-бутиловий естер Естер, одержаний в Препаративному прикладі 11, розчиняли у ТГФ (30мл) і додавали розчин LiOH·Н2О (440мг, 10,56ммоль) у воді (15мл). Реакційну суміш перемішували при кімнатній температурі протягом ночі і потім розчинник концентрували у вакуумі. Залишок розподіляли між СН 2СІ2 (20мл) і насиченим водним розчином лимонної кислоти (10мл) і фази відокремлювали. Органічний шар промивали насиченим розчином солі (10мл), сушили над MgSO4 і випаровували. Неочищений продукт частково очищали за допомогою флеш-хроматографії на силікагелі (100г), елююючи спочатку за допомогою СН 2СІ2 і потім сумішшю СН 2СІ2: МеОН (об'ємом 25:1), одержуючи матеріал, який все ще містив діізопропілбікарбамат, визначений за допомогою ЯМР. Шля хом перекристалізації з ЕtOАс одержували кристали білого кольору, які фільтрували і промивали сумішшю ЕtOАс:пентан (1:1), одержуючи вказану в заголовку сполуку (517мг, 55%). 1 Н-ЯМР (400МГц, CDCI3): δ=1,23-1,67 (м, 9Н), 2,20-2,88 (м, 2Н), 3,55-3,81 (м, 2Н), 4,40-4,61 (м, 1Н), 4,78-4,92 (м, 1Н), 6,63-6,84 (м, 2Н), 7,11-7,32 (м, 2Н). НРМС (електророзпилення): m/z [M-1] 340 Препаративний приклад 13 (2S,4S)-4-(Ізохінолін-7-ілокси)піролідин-1,2дикарбонової кислоти ди-трет-бутиловий естер Вказану в заголовку сполуку синтезували з (2S,4R)-4-гідроксипіролідин-1,2-дикарбонової кислоти ди-трет-бутилового естеру [CAS Peг. №170850-75-6] і ізохінолін-7-олу, використовуючи спосіб, описаний в Препаративному прикладі 11, і 52 одержували вказану в заголовку сполуку у вигляді масла з 15% виходом. 1 Н-ЯМР (400МГц, CDCI3): δ=1,41-1,53 (м, 18Н), 2,43-2,63 (м, 2Н), 3,68-3,97 (м, 2Н), 4,30-4,52 (м, 1Н), 4,99-5,06 (м, 1Н), 7,08-7,16 (м, 1Н), 7,41-7,77 (м. 3Н), 8,42 (д, 1Н), 9,10-9,18 (м, 1Н). РХМС (електророзпилення): m/z [ΜΗ+] 415 Препаративний приклад 14 (2S,4S)-4-(3-Хлорфенокси)піролідин-1,2дикарбонової кислоти 1-трет-бутиловий естер 2метиловий естер До перемішуваного розчину (2S,4R)-4гідроксипіролідин-1,2-дикарбонової кислоти 1трет-бутилового естеру 2-метилового естеру [CAS Peг. №74844-91-0] (0,3г, 1,22ммоль), 3хлорфенолу (0,189г, 1,47ммоль) і трифенілфосфіну (0,385г, 1,47ммоль) у ТГФ (2мл), охолодженого при 0°С в атмосфері N2, додавали краплями діізопропілазодикарбоксилат (0,29мл, 1,47ммоль). Суміш перемішували протягом 3 днів при кімнатній температурі. Розчинник видаляли у вакуумі і продукт очищали за допомогою хроматографії на силікагелі, використовуючи як елюент суміш етер/н-пентан:40/60, одержуючи 0,27г (62%) суміші, вказаної в заголовку сполуки і відновленого діізопропілазодикарбоксилату (1/1) у вигляді масла. 1 H ЯМР (400МГц, CDCI3): δ=1,46, 1,49 (2 χ с, 9Η), 2,47 (2Н, м), 3,71 (5Н, м), 4,42 (1Н, м), 4,42, 4,54 (1Н, 2´м), 4,87 (1Н, м), 6,68 (1Н, м), 6,79 (1Н, с), 6,92 (1Н, м), 7,18 (1Н, м). НРМС (електророзпилення): m/z 378 (MNa+). Препаративний приклад 15 (2S,4S)-4-(3-Хлорфенокси)піролідин-1,2дикарбонової кислоти 1-тре/77-бутиловий естер До продуктів, одержаних в Препаративному прикладі 14 (0,25г, 0,7ммоль), у ТГФ (4мл) додавали розчин гідрокисиду літію (50мг) у воді (4мл). Суміш перемішували, про тягом ночі потім додавали воду (10мл) і етер (20мл). Водну фазу промивали два рази етером (2´20мл) потім підкислювали 2Ν НСІ і екстрагували етером (2´20мл). Етерні фази сушили (сульфат магнію), фільтрували і випаровували, одержуючи вказану в заголовку сполуку (80мг, 33%). 1 Н ЯМР (400МГц, CDCI3): δ=1,42, 1,48 (2 χ с, 9Η), 2,30-2,70 (м, 2Н), 3,60-3,80 (м, 2Н), 4,40-4,60 (м, 1Н), 4,86 (м, 1Н), 6,71 (м, 1Н), 6,82 (м, 1Н), 6,94 (м, 1Н), 7,16 (м, 1Н). НРМС (електророзпилення): m/z [MNa +] 364, 340 [М-1] 340. 53 81437 54 Препаративний приклад 16 (2S,4S)-4-Бензилоксипіролідин-1,2дикарбонової кислоти 1-трет-бутиловий естер 2метиловий естер (2S,4S)-4-Гідроксиліролідин-1,2-дикарбонової кислоти 1-трет-бутиловий естер 2-метиловий естер [CAS Peг. №227935-38-8] (300мг, 1,2ммоль) і 60% дисперсію гідриду натрію в мінеральному маслі (61мг, 1,5ммоль) розчиняли в безводному диметилформаміді (9мл) при 0°С в атмосфері азоту. Через 10 хвилин додавали краплями при перемішуванні бензилбромід (0,153мл, 1,3ммоль) в СН2СІ2 (1мл) і реакційну суміш перемішували до кімнатної температури протягом 1 години. Розчинник видаляли при зниженому тиску і залишок розчиняли в етилцетаті (25мл), промивали водою (2´25мл), сушили (сульфат магнію), фільтрували і випаровували при зниженому тиску. Залишок очищали, використовуючи флеш-хроматографію, елююючи розчинником з градієнтом 4:1 гептан:етилцетат, одержуючи вказану в заголовку сполуку (167мг, 42% вихід) у вигляді масла. 1 Н-ЯМР (400МГц, CDCI3) δ=1,2-1,6 (м, 12Н), 2,2-2,45 (м, 1Н), 3,4-3,8 (м, 4Н), 4,05-4,2 (м, 1Н), 4,3-4,5 (м, 2Н), 7,15-7,4 (м, 5Н). РХМС (електророзпилення): m/z [MNa+] 358. Препаративний приклад 17 (2S,4S)-1-(трет-Бутоксикарбоніл)-4(бензилокси)піролідин-2-карбонова кислота Вказану в заголовку сполуку, одержану в Препаративному прикладі 16 (167мг, 0,5ммоль) розчиняли у тетрагідрофурані (10мл). LiOH·Н2О (63мг, 1,5ммоль) розчиняли у воді (5мл). Два розчини перемішували, залишали перемішуватись при кімнатній температурі протягом двох днів, потім випаровували до сухого залишку при зниженому тиску. Одержаний залишок розчиняли у етилцетаті (25мл) і промивали насиченою лимонною кислотою (25мл). Органічну фракцію сушили (сульфат магнію), фільтрували і випаровували до сухого залишку при зниженому тиску. Неочищену сполуку (150мг, 94% вихід) використовували на наступній стадії (Приклад 9) у вигляді масла. РХМС (електророзпилення): m/z [Μ] 320, [MNa +] 344. Препаративний приклад 18 (2S,4S)-4-(2,3-Дигідробензофуран-6ілокси)піролідин-1,2-дикарбонової кислоти 1-третбутиловий естер 2-метиловий естер Вказану в заголовку сполуку одержували з (2S,4R)-4-гідроксипіролідин-1,2-дикарбонової кислоти 1-трет-бутилового естеру 2-метилового естеру і 2,3-дигідробензофуран-6-олу за допомогою способу, застосованого в Препаративному прикладі 14, з 41,6% виходом у вигляді твердої речовини білого кольору. 1 Н-ЯМР (400МГц, CDCI3): δ=1,43 (д, 9Н); 2,362,50 (м, 2Н); 3,03-3,17 (м, 2Н); 3,59-3,80 (м, 5Н); 4,15-4,41 (м, 3Н); 4,78-4,83 (м, 1Н); 6,21-6,32 (м, 2Н); 6,98-7,02 м, 1Η). НРМС (електророзпилення): [MNa+] 386 Препаративний приклад 19 (2S,4S)-4-(2,3-Дигідробензофуран-6ілокси)піролідин-1,2-дикарбонова кислота 1-третбутиловий естер Вказану в заголовку сполуку одержували з 4(2,3-дигідробензофуран-6-ілокси)піролідин-1,2дикарбонової кислоти 1-трет-бутилового естеру 2метилового естеру за допомогою способу, застосованого в Препаративному прикладі 15, з 78% виходом у вигляді твердої речовини білого кольору. 1 Н-ЯМР (400МГц, CDCI3): δ=1,38-1,58 (м, 9Н); 2,21-2,83 (м, 2Н); 3,02-3,18 (м, 2Н); 3,59-3,82 (м, 2Н); 4,38-4,60 (м, 3Н); 4,80-4,90 (м, 1Н); 6,22-6,42 (м, 2Н); 6,97-7,10 (м, 1Н). НРМС (електророзпилення): [М-1] 348. Препаративний приклад 20 4-(3-Фторбензиліден)піролідин-1,2дикарбонової кислоти-1-трет-бутиловий естер 2метиловий естер До розчину м-Фторбензилтрифенілфосфоній2 броміду (8,08г, 0,018ммоль) у безводному дихлорметані (200мл), додавали краплями третбутоксид калію (1Μ у ТГФ, 17,2мл, 0,017ммоль) при кімнатній температурі і перемішували протягом 1 години. Суміш охолоджували до 0°С і до неї додавали краплями розчин (2S) 4оксопіролідин-1,2-дикарбонової кислоти 1-третбутилового естер у 2-метилового естеру3 (3,8г, 0,016ммоль) в дихлорметані (20мл). Суміш нагрівали до кімнатної температури і 55 81437 перемішували протягом 18 годин. Реакцію зупиняли насиченим розчином хлориду амонію (100мл), водні шари екстрагували дихлорметаном (2´100мл) і об'єднані органічні шари сушили над сульфатом магнію. Розчинник видаляли шляхом випарювання при зниженому тиску. Залишок очищали за допомогою флеш-хроматографії на силікагелі, елююючи розчинником з градієнтом суміші гептан:етилцетат (4:1), одержуючи вказану в заголовку сполуку (3,48г, 67%) у вигляді безбарвного масла. 1 Н-ЯМР (400МГц, CD3OD) (суміш геометричних ізомерів, цис і транс): δ=1,44 (с, ЮН), 1,50 (с, 8Н), 2,79-2,94 (м, 2Н), 3,20-3,37 (м, 2Н), 3,66 (д, 3Н), 3,72 (д, 3Н), 4,20-4,38 (м, 4Н), 4,42-4,48 (м, 1Н), 4,52-4,60 (м, 1Н), 6,42-6,51 (м, 2Н), 6,89-7,10 (м, 6Н), 7,30-7,40 (м, 2Н). НРМС (XIAT):m/z [(M+H)-Boc]+ 236. Мікроаналіз: Одержано: С, 64,46; Н, 6,77; N, 4,07%. C18H22FNO4 . Розраховано С, 64,46; Η, 6,61; Ν, 4,18%. 2. [Κ. Rafizadeh і К. Yates; J. Org. Chem. 1984, 49, 9, 1500-1506]. 3. [Org. Lett, 2001, 3041-3043]. Препаративні приклади 21-24. Сполуки наступних зведених у таблицю прикладів загальної формули: були підготовлені способом, аналогічним наведеному в Препаративному прикладі 20, використовуючи відповідну сіль броміду фосфонію і (2S) 4-оксопіролідин-1,2-дикарбонової кислоти 1трет-бутиловий естер 2-метиловий естер3 56 Препаративний приклад 25. 4-(3-Фторбензиліден)піролідин-1,2дикарбонової кислоти 1-тpет-бутиловий естер До перемішуваного розчину 4-(3Фторбензиліден)піролідин-1,2-дикарбонової кислоти 1-трет-бутилового естеру 2-метилового естеру (3,23г, 9,63ммоль) у тетрагідрофурані (150мл), додавали 1М моногідрат гідроксиду літію (1,21г, 28,9ммоль) у воді (50мл). Суміш перемішували при кімнатній температурі протягом 3 днів. Тетрагідрофуран видаляли випаровуванням при зниженому тиску, залишок розводили водою (30мл) і підкислювали до рН2,03,0, використовуючи 1Μ хлорводневої кислоти. Водні шари екстрагували діетиловим етером (3´100мл) і об'єднані органічні екстракти, сушили над сульфатом магнію. Розчинник видаляли шляхом випаровування при зниженому тиску, одержуючи вказану в заголовку сполуку (2,37г, 77%) у вигляді білої піни. 1 Н-ЯМР (400МГц, CD3OD) (суміш геометричних ізомерів, цис і транс): δ=1,44 (с, 5Н), 1,50 (с, 4Н), 2,80-2,96 (м, 1Н), 3,20-3,38 (м, 1Н), 4,24-4,34 (м, 2Н), 4,45-4,45 (м, 0,5Н), 4,46-4,58 (м, 0,5Н), 6,43-6,54 (м, 1Н), 6,90-7,05 (м, 3Н), 7,30-7,40 (м, 1Н). НРМС (XIAT):m/z [М-Н]+ 320. Мікроаналіз: Одержано: С, 63,10; Н, 6,53; N, 4,05%. C17H20NO4F. Розраховано С, 63,54; Н, 6,27; N, 4,36%. Препаративні приклади 26-29. Сполуки наступних зведених у таблицю прикладів загальної формули: були одержані способом, аналогічним, наведеному в Препаративному прикладі 25, використовуючи відповідний вихідний естер. 57 81437 58 були одержані способом, аналогічним наведеному в Препаративному прикладі 30, використовуючи відповідну ви хідну кислоту. Препаративний приклад 30 4-(3-Фторбензиліден)піролідин-1,2дикарбонової кислоти 1-трет-бутиловий естер 2-(2ізопропіл-5-метилциклогексиловий) естер До розчину 4-(3-Фторбензиліден)піролідин-1,2дикарбонової кислоти 1-трет-бутилового естеру (2,68г, 8,35ммоль), додавали 1R,2S,5R(-) ментол (1,31г, 8,35ммоль) з наступним додаванням диметиламінопіридину (1,02г, 8,35ммоль). Суміш охолоджували до 0°С і додавали однією порцією дициклогексилкарбодіімід (1,89г, 9,19ммоль) в дихлорметані (10мл). Суміш нагрівали до кімнатної температури, перемішували протягом 18 годин. Суміш фільтрували і фільтрат промивали 1N хлорводневої кислоти (30мл), насиченим розчином гідрокарбонату натрію (30мл) і водою (30мл). Органічні шари сушили над сульфатом магнію і розчинник видаляли випаровуванням при зниженому тиску. Очищенням за допомогою колонкової флешхроматографії, елюючи сумішшю гептан : етилцетат (12:1), одержували вказану в заголовку сполуку (1,20г, 31%) у вигляді безбарвного масла. 1Н-ЯМР (400МГц, CD3OD): δ=0,55 (т, 2Η), 0,69 (т, 2Η), 0,80-0,93 (м, 8Н), 0,951,05 (м, 1Н), 1,20-1,35 (м, 2Н), 1,44 (д, 9Н), 1,602,00 (м, 3Н), 2,73-2,90 (м, 1Н), 4,03-4,68 (м, 4Н), 6,43-6,52 (м, 1Н), 6,93-7,11 (м, 3Н), 7,33-7,40 (м, 1Н). НРМС (ΧΙΑТ): m/z [MH]+ 460. Препаративні приклади 31-34. Сполуки наступних зведених у таблицю прикладів загальної формули: Препаративний приклад 35 4-(3-Фторбензил)піролідин-1,2-дикарбонової кислоти 1-трет-бутиловий естер 2-(2-ізопропіл-5метилциклогексиловий) естер 4-(3-Фторбензиліден)піролідин-1,2дикарбонової кислоти 1-трет-бутиловий естер 2-(2ізопропіл-5-метилциклогексиловий) естер (1,20г, 2,61ммоль) розчиняли в суміші етилацетат:толуол (1:1,12мл). Розчин піддавали гідруванню на оксиді платини (120мг, 10ваг.%) при 25°С і 15псі протягом 1 години. Реакційну суміш фільтрували крізь арбоцел і фільтрат відновлювали під тиском. Залишок очищали за допомогою флешхроматографії, елююючи сумішшю гептан:етилацетат (15:1), одержуючи вказану в заголовку сполуку у вигляді безбарвного масла (1,11г, 91%). 1 Н-ЯМР (400МГц, CD3OD): δ=0,72-1,37 (м, 13 Η), 1,44 (д, 9Н), 1,43-1,75 (м, 4Н), 1,87-2,01 (м, 2Н), 2,31-2,58 (м, 2Н), 2,83 (д, 2Н), 3,07 (т, 1Н), 3,503,65 (м, 1Н), 4,13- 4,30 (дт, 1Н), 4,71 (тд, 1Н), 6,90 (д, 2Н), 7,00 (д, 1Н), 7,30 (к, 1Н). НРМС (ХІАТ): m/z [MH-BOC]+ 362. Препаративні приклади 36-39. Сполуки наступних зведених у таблицю прикладів загальної формули: 59 81437 були одержані способом, аналогічним наведеному в Препаративному прикладі 35, використовуючи відповідний вихідний ментоловий естер алкену. Препаративний приклад 40 (2S,4S5)-4-(3-Хлорфеніламіно)піролідин-1,2дикарбонової кислоти 1-трет-бутиловий естер 2метиловий естер 4-Оксопіролідин-1,2-дикарбонової кислоти 1трет-бутиловий естер 2-метиловий естер (364,5мг, 1,5ммоль) і 3-хлоранілін (191мг, 1,5ммоль) розчиняли в DCM (10мл). До цього розчину додавали триацетоксиборогідрид натрію (413мг, 1,95ммоль) і оцтову кислоту (0,085мл, 1,5ммоль) і реакційну суміш перемішували при кімнатній температурі протягом ночі. Реакційну суміш промивали 2N NaOH (5мл), насиченим розчином солі (5мл), сушили над MgSO4 і випаровували. Залишок очищали за допомогою флешхроматографії на силікагелі, елююючи DCM, одержуючи вказану в заголовку сполуку у вигляді безбарвного масла (215мг, 40%). 1 Н-ЯМР (400МГц, CDCI3): δ=1,42 (д, 9Н); 2,042,17 (м, 1Н); 2,39-2,55 (м, 1Н); 3,48-3,61 (м, 1Н); 3,63-3,79 (м, 4Н); 4,02-4,15 (м, 1Н); 4,25-4,41 (м, 1Н); 6,42-6,51 (м, 1Н); 6,55-6,61 (м, 1Н); 6,65-6,75 (м, 1Н); 7,01-7,11 (м, 1Н). НРМС (електророзпилення): [MNa+] 377. Препаративний приклад 41 (2S,4S)-4-(3-ХлорФеніламіно)піролідин-1,2дикарбонової кислоти 1-трет-бутиловий естер 60 До розчину (2S,4S)-4-(3хлорфеніламіно)піролідин-1,2-дикарбонової кислоти 1-трет-бутилового естеру 2-метилового естеру (200мг, 0,58ммоль) у ТГФ (2мл) додавали розчин LiOH·Н2О (73мг 1,74ммоль) і реакційну суміш перемішували при кімнатній температурі протягом ночі. Розчинник концентрували у вакуумі і залишок водного розчину промивали DCM (2мл). Водні шари потім доводили до рН5 насиченим водним розчином лимонної кислоти і знову екстрагували за допомогою DCM (2´10мл). Ці об'єднані екстракти сушили над MgSO4 і випаровували, одержуючи вказану в заголовку сполуку у ви гляді білої піни (168мг, 88%) 1 Н-ЯМР (400МГц, CDCI3): δ=1,18-1,69 (м, 9Н); 2,11-2,45 (м, 1Н); 2,53-2,61 (м, 1Н); 3,44-3,62 (м, 2Н); 4,04-4,11 (м, 1Н); 4,48-4,53 (м, 1Н); 6,38-6,61 (м, 2Н); 6,65-6,74 (м, 1Н); 7,04-7,15 (м, 1Н). НРМС (електророзпилення): [М-1] 339 Препаративний приклад 42 4-гідроксиметилпіролідин-1,2-дикарбонової кислоти ди-трет-бутиловий естер До розчину 2-метил-2-бутену (2М у тетрагідрофурані, 30мл, 60ммоль) у безводному тетрагідрофурані (40мл) при 0°С в атмосфері азоту додавали краплями борантетрагідрофурановий комплекс (1Μ у тетрагідрофурані, 30мл, 30ммоль) більш ніж 10 хвилин і залишали перемішуватись протягом 2 годин. Реакційну суміш о холоджували до -20°С і додавали краплями розчин 4-метиленпіролідин1,2-дикарбонової кислоти ди-трет-бутиловий естер (2,84г, 10ммоль) [CAS peг. №163 190-46-3] у тетрагідрофурані (20мл) і перемішували до кімнатної температури більш ніж 18 годин. Додавали обережно воду (40мл) з наступним додаванням гідроксиду натрію (0,5М, 20мл) потім пероксид водню (27,5% в/в у воді, 10мл) і перемішували при кімнатній температурі протягом 2 годин. Органічний розчинник видаляли при зниженому тиску і водні розчини екстрагували етилцетатом (2´60мл). Об'єднані екстракти сушили (MgSO4), фільтрували і випаровували при зниженому тиску. Залишок очищали за допомогою хроматографії на силікагелі, елююючи 40% сумішшю етилцетат/гептан, одержуючи вказану в заголовку сполуку у вигляді суміші діастереомерів (-5:1 2S,4S:2S,4R) у вигляді безбарвного масла (1,25г, 41%) 1 Н-ЯМР (400МГц, CD3OD): δ =1,39-1,49 (м, 18Н); 1,63-1,75 (м, 0,8Н); 1,96-2,07 (м, 0,4Н); 2,32
ДивитисяДодаткова інформація
Назва патенту англійськоюProline derivatives having affinity for the calcium channel alpha-2-delta subunit
Автори англійськоюRawson David James
Назва патенту російськоюПроизводные пролина, которые имеют сродство с альфа-2-дельта субъединицами кальциевых каналов
Автори російськоюРоусон Девид Джеймс
МПК / Мітки
МПК: A61P 25/00, A61K 31/00, C07D 401/12, C07D 405/12, C07D 207/16, A61K 31/401
Мітки: каналів, спорідненість, похідні, субодиниць, альфа-2-дельта, мають, піроліну, кальцієвих
Код посилання
<a href="https://ua.patents.su/33-81437-pokhidni-pirolinu-shho-mayut-sporidnenist-do-alfa-2-delta-subodinic-kalciehvikh-kanaliv.html" target="_blank" rel="follow" title="База патентів України">Похідні піроліну, що мають спорідненість до альфа-2-дельта субодиниць кальцієвих каналів</a>
Попередній патент: Повітророзподільник гальма залізничного транспортного засобу
Наступний патент: Пристрій пожежогасіння транспортного засобу
Випадковий патент: Спосіб визначення ароматичних сполук у суміші продуктів каталітичного риформінгу












