Інгібітори протеїнтирозинкіназної активності
Номер патенту: 108878
Опубліковано: 25.06.2015
Автори: Годетт Фредерік, Раппель Франк, Жан Ліджі, Вайсбург Аркадій, Кларідж Стівен Уільям, Раппель Стефан
Формула / Реферат
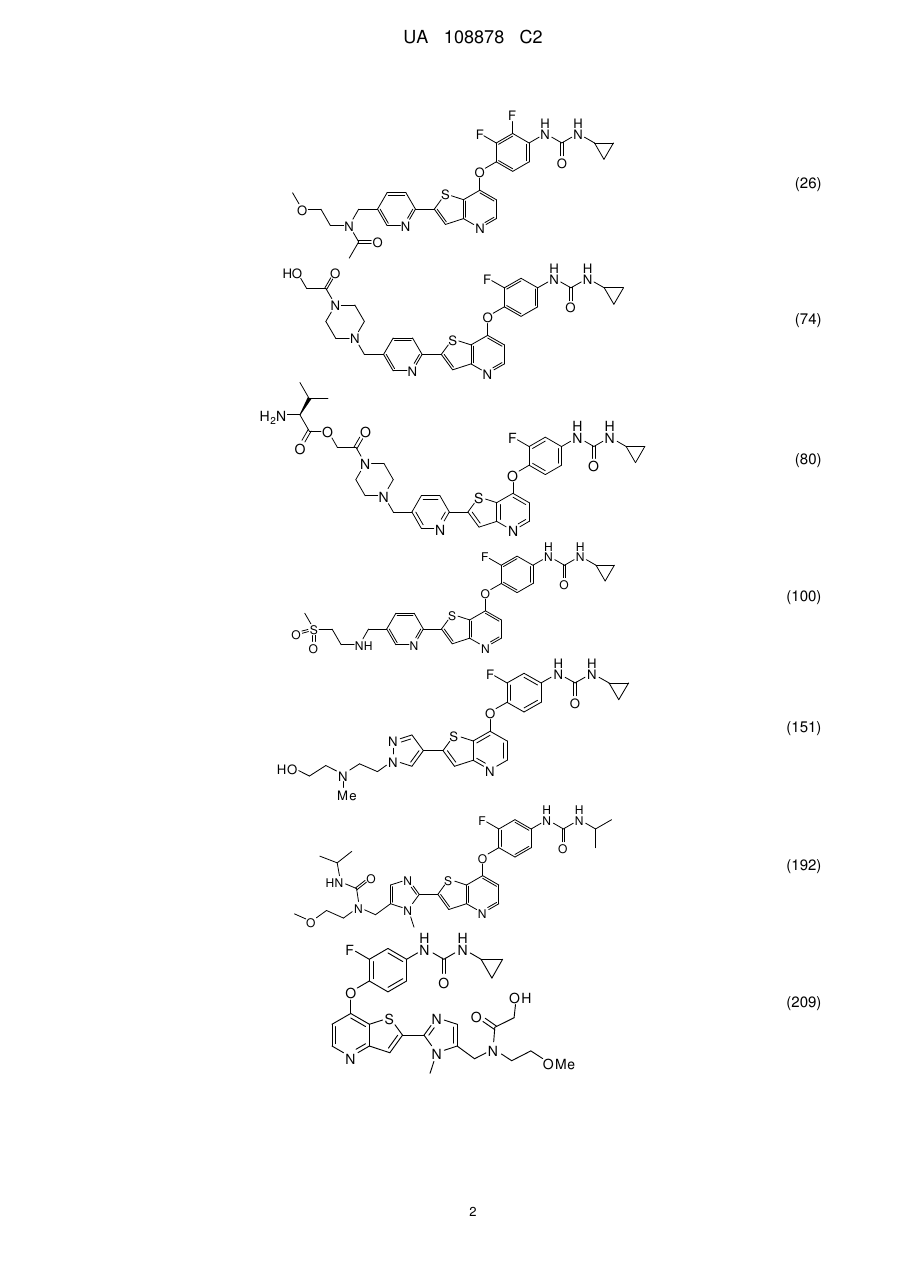
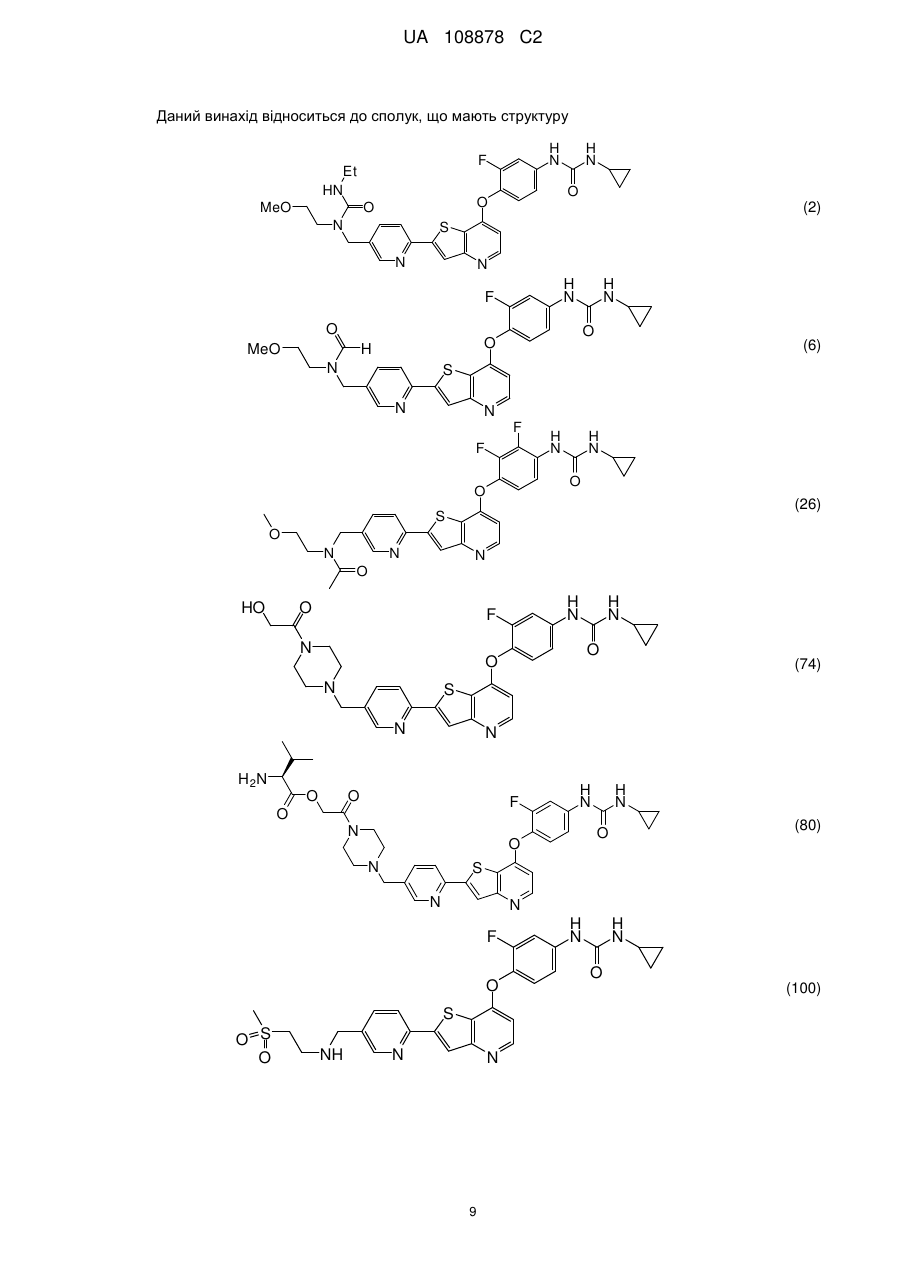
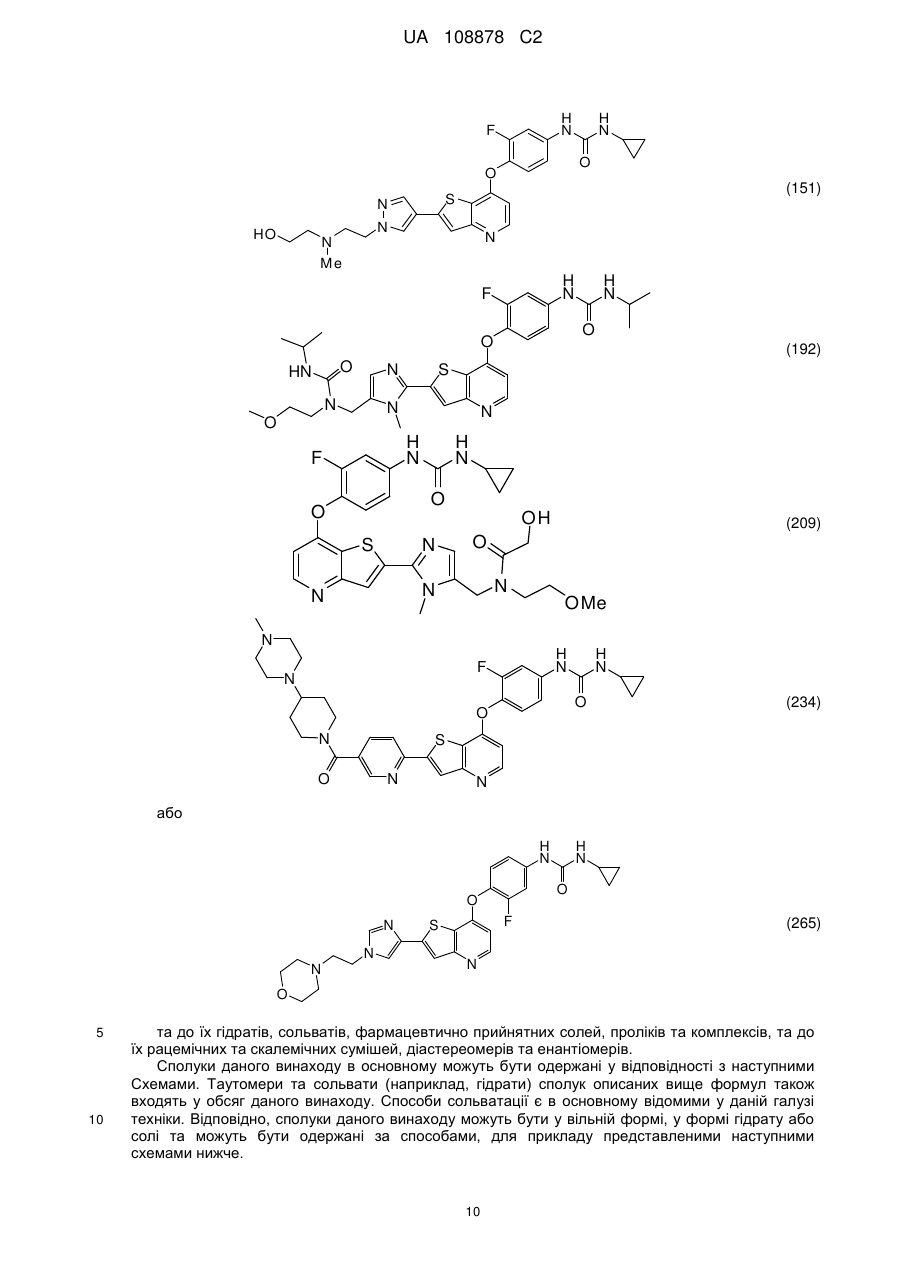
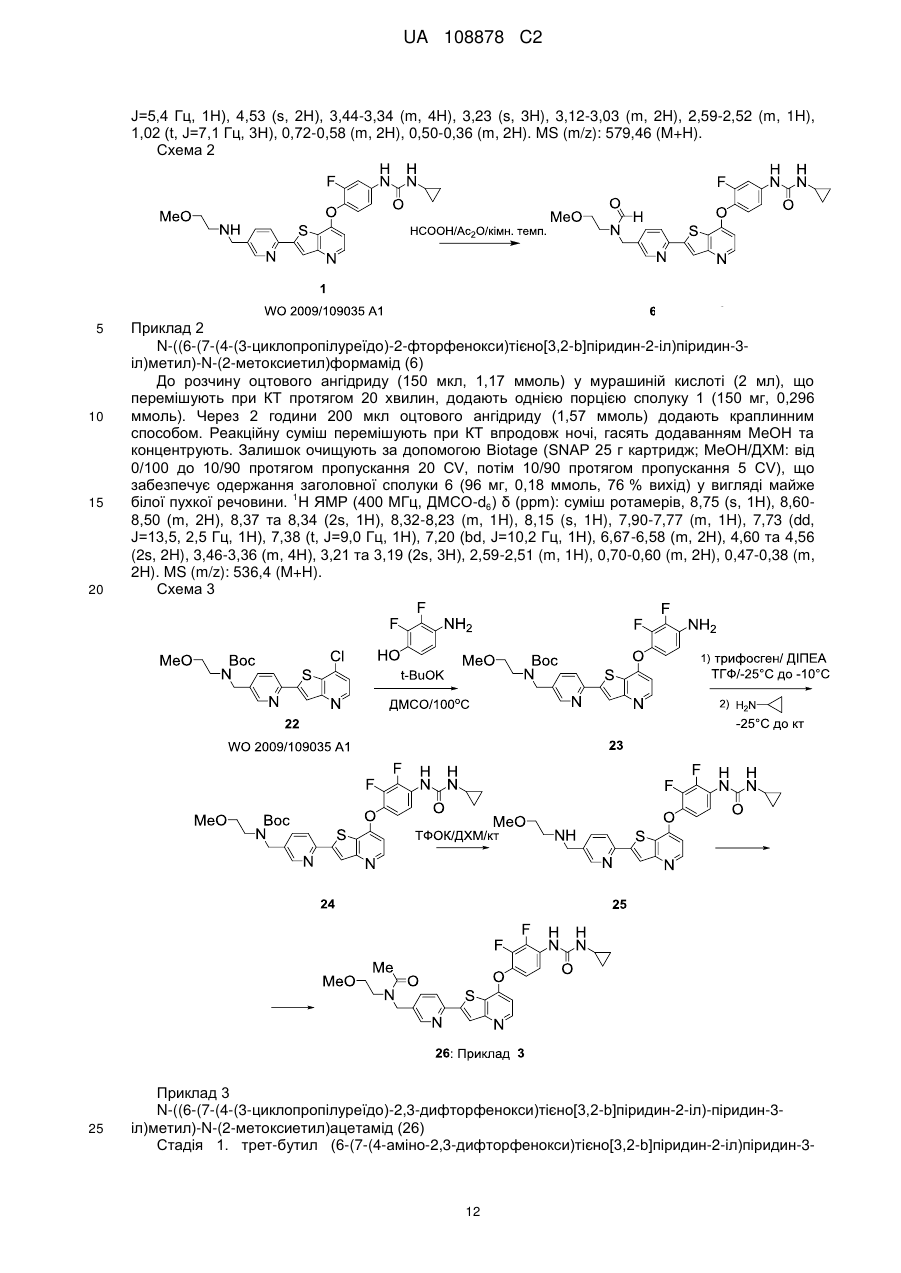
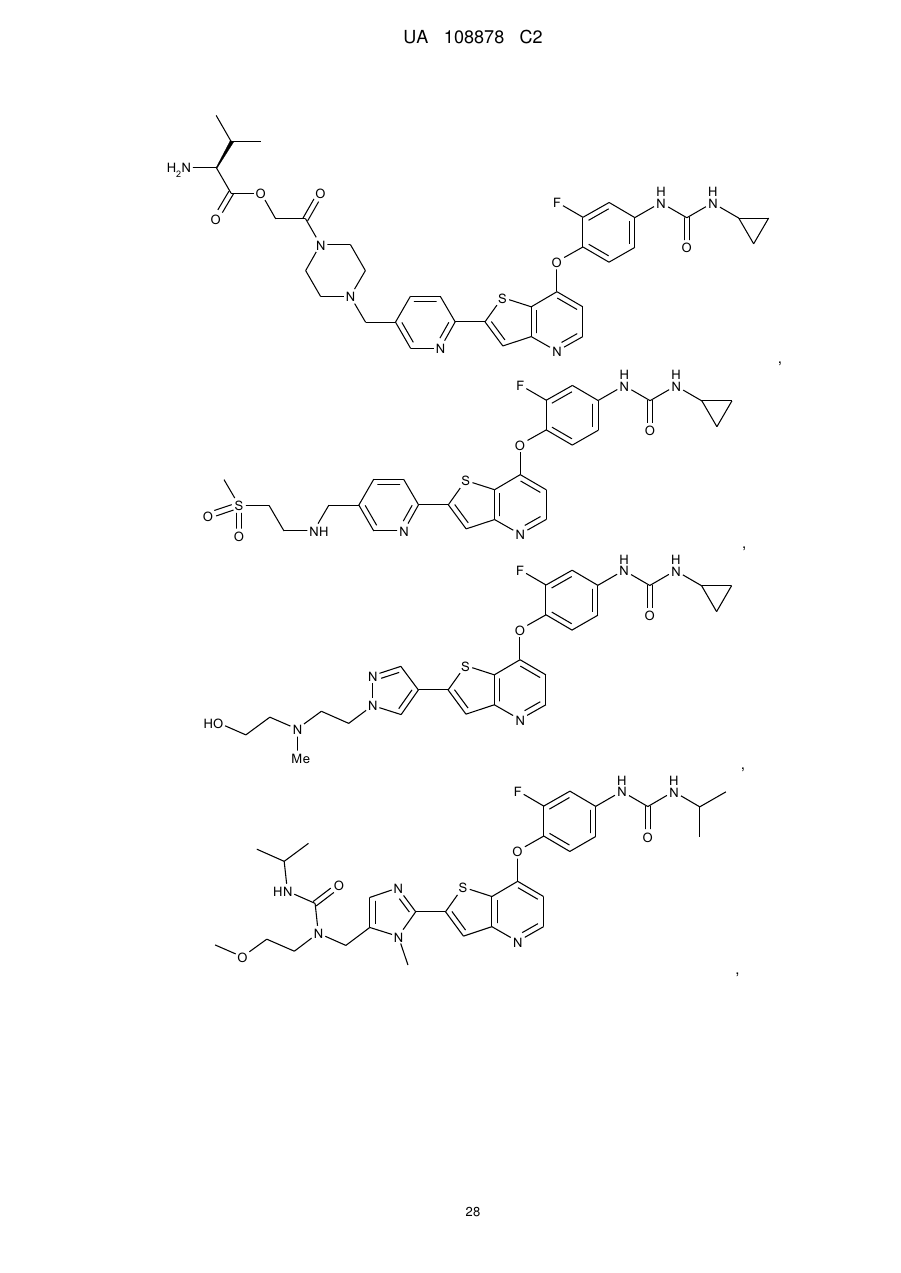
1. Сполука, вибрана з групи, що складається з:
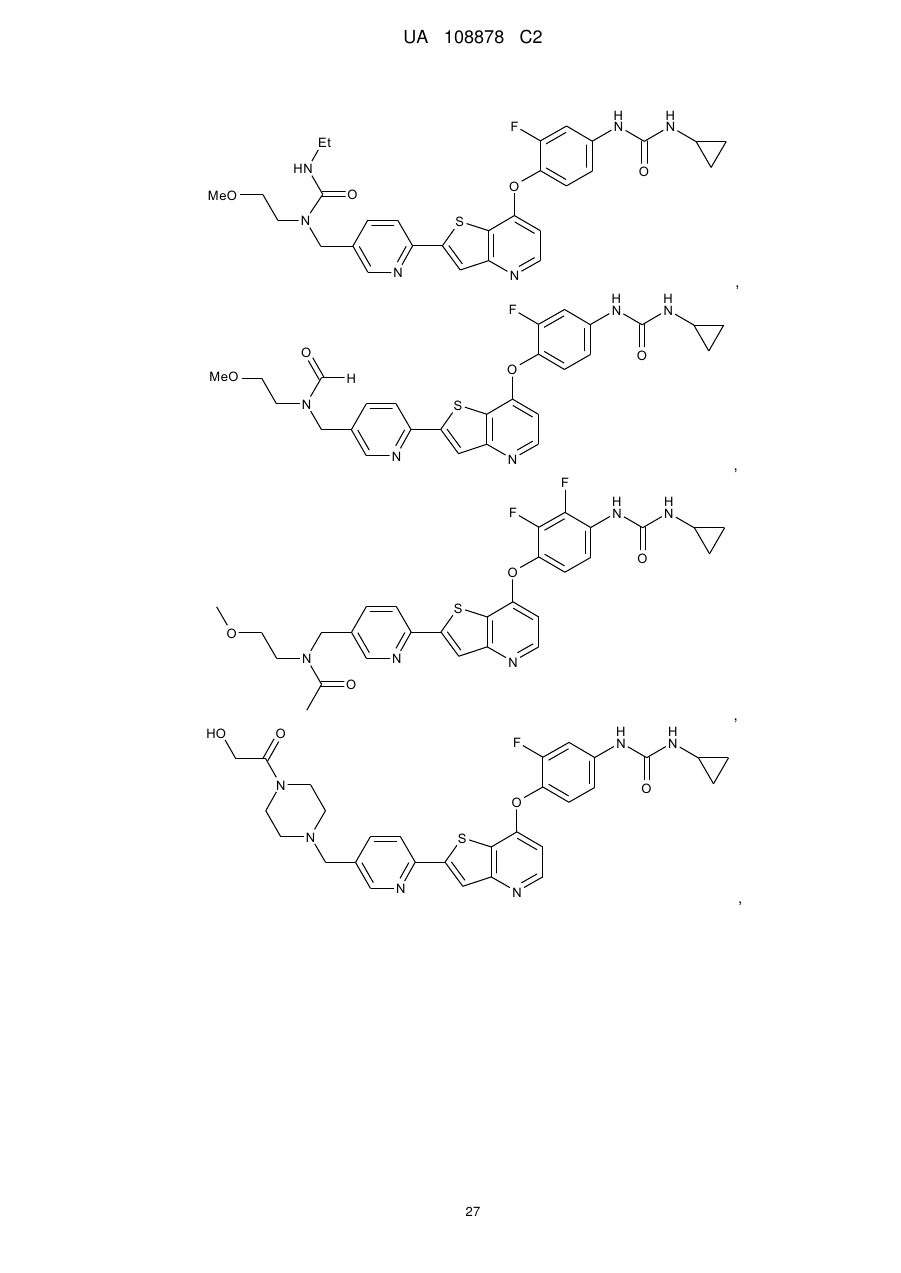
 ,
,  ,
, 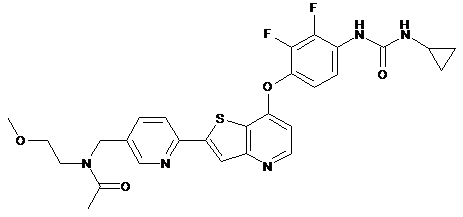 ,
,  ,
,  ,
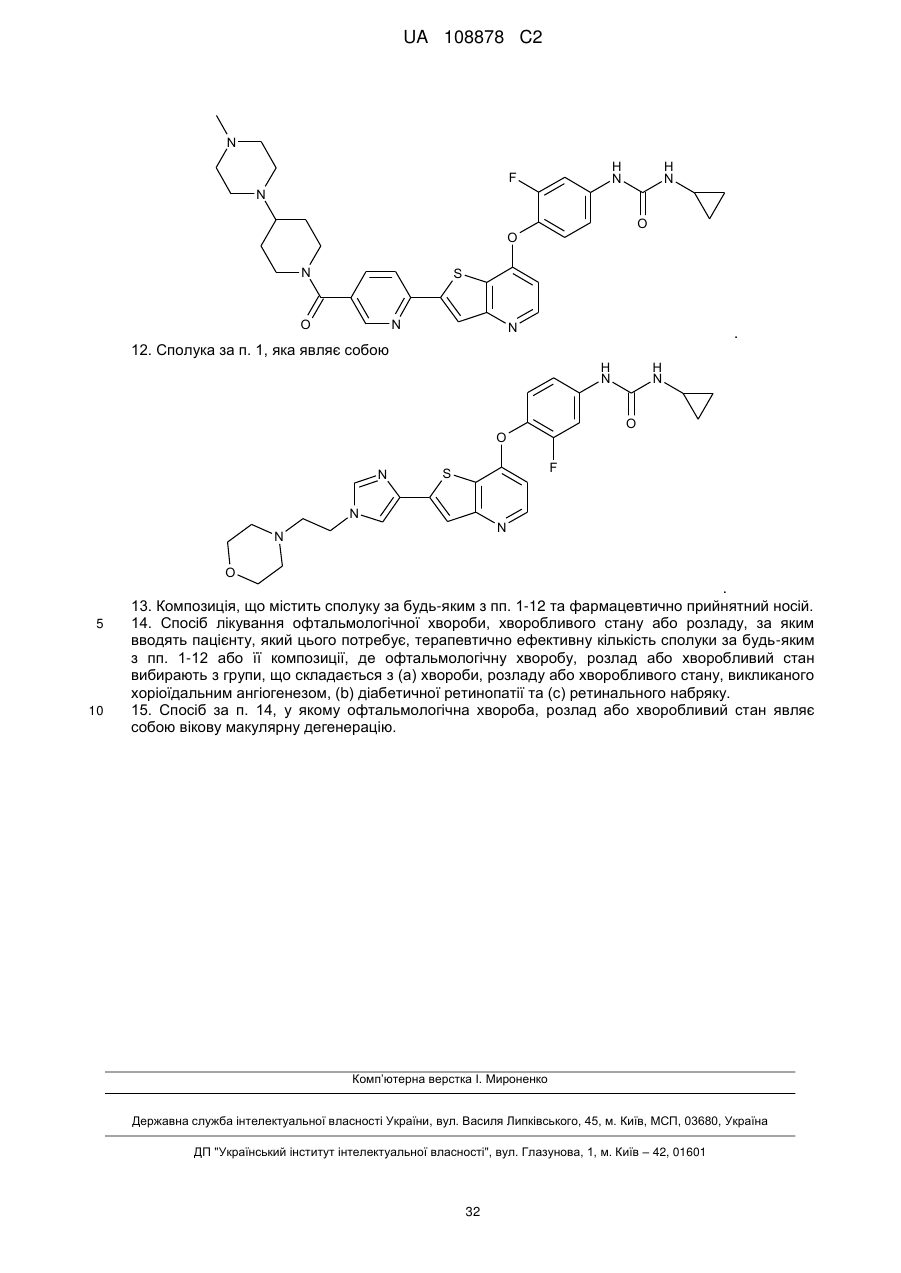
, 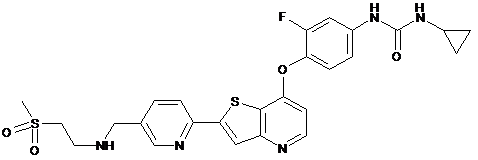 ,
, 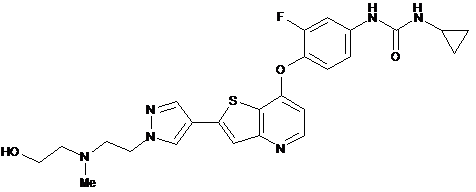 ,
, 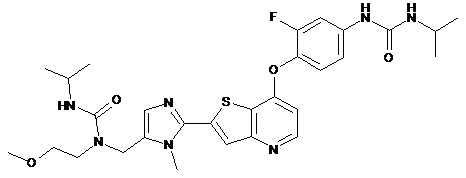 ,
, 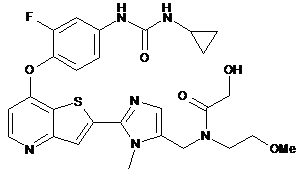 ,
,  та
та 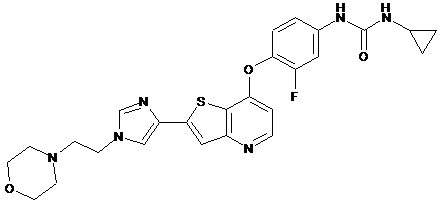 ,
,
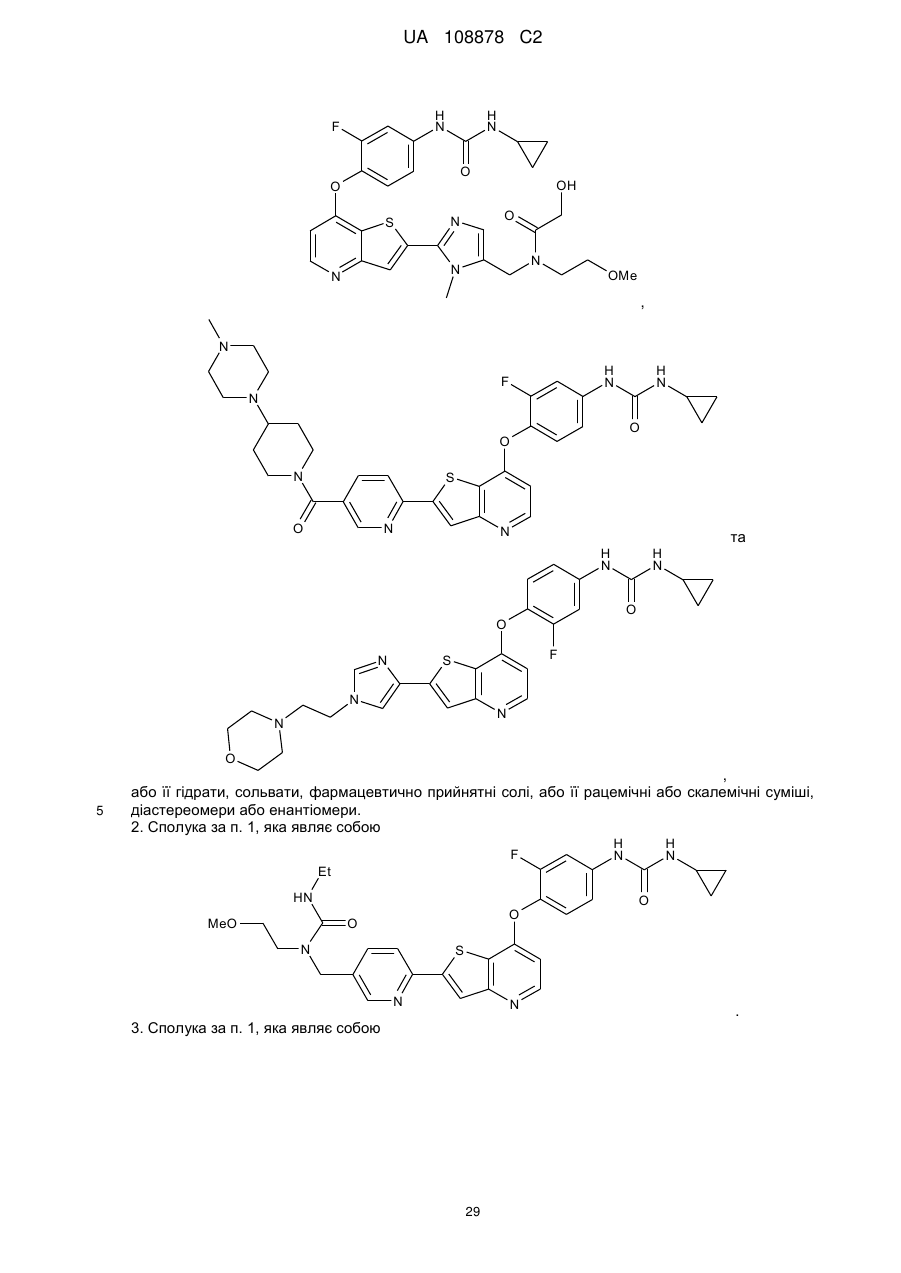
або її гідрати, сольвати, фармацевтично прийнятні солі, або її рацемічні або скалемічні суміші, діастереомери або енантіомери.
2. Сполука за п. 1, яка являє собою
 .
.
3. Сполука за п. 1, яка являє собою
 .
.
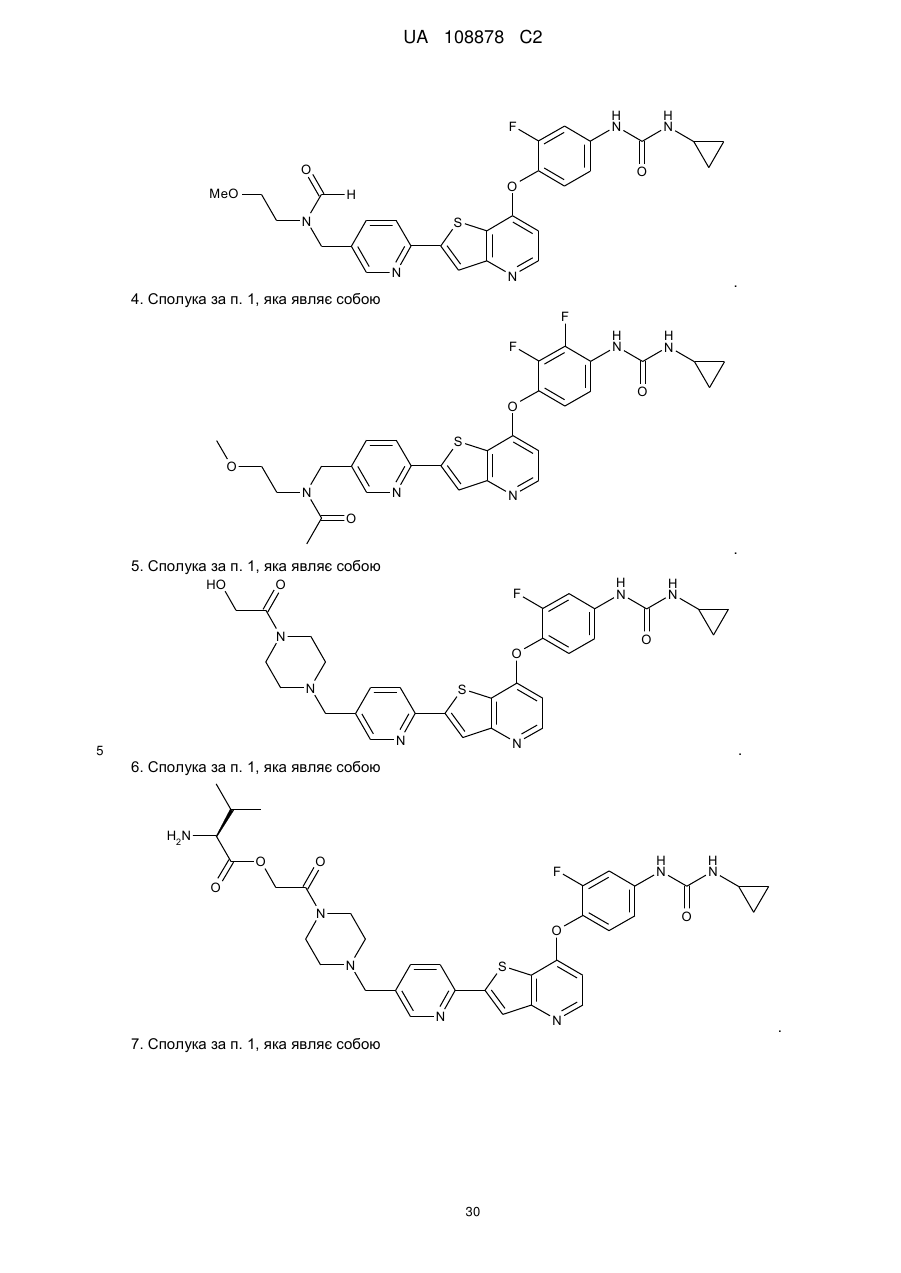
4. Сполука за п. 1, яка являє собою
 .
.
5. Сполука за п. 1, яка являє собою
 .
.
6. Сполука за п. 1, яка являє собою
 .
.
7. Сполука за п. 1, яка являє собою
 .
.
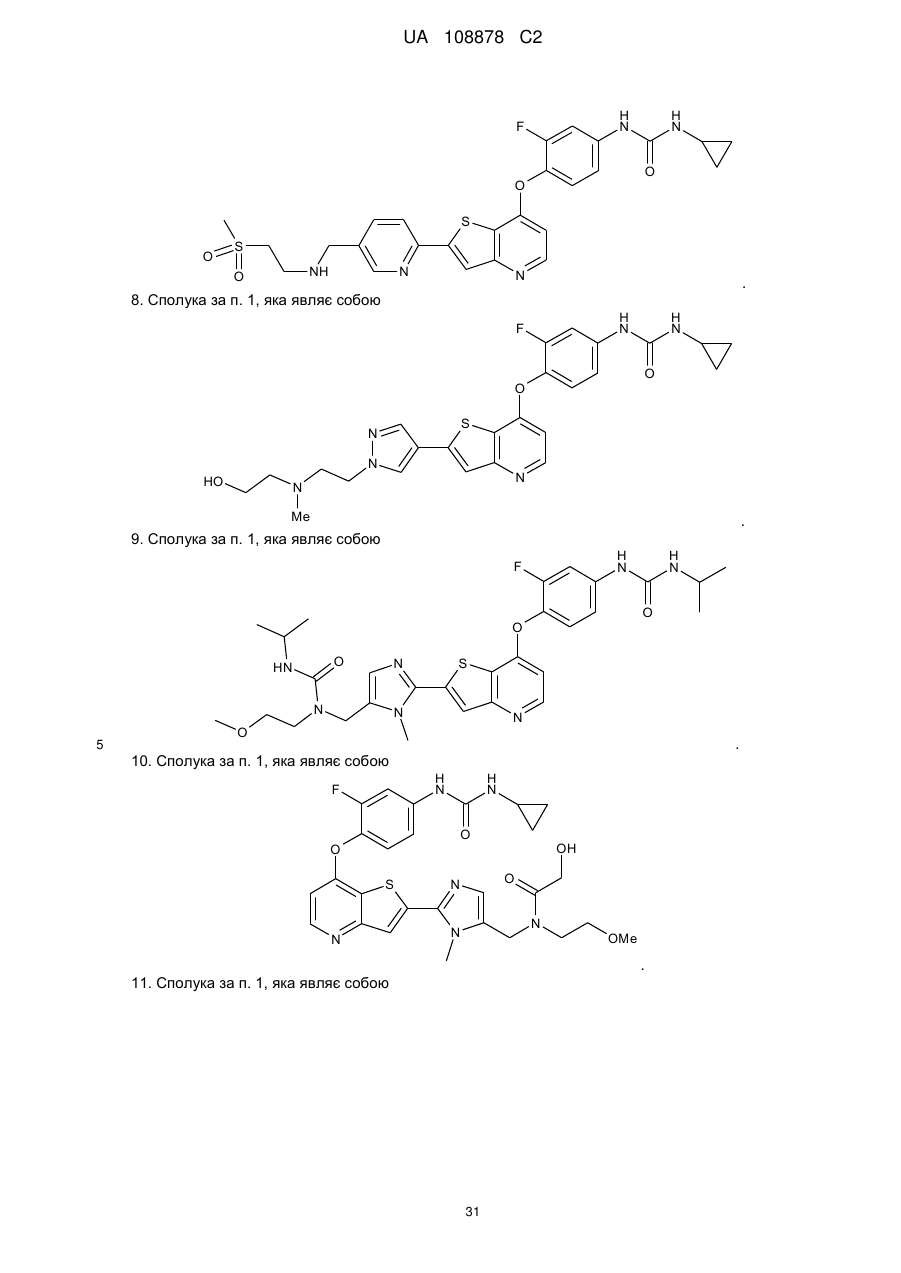
8. Сполука за п. 1, яка являє собою
 .
.
9. Сполука за п. 1, яка являє собою
 .
.
10. Сполука за п. 1, яка являє собою
 .
.
11. Сполука за п. 1, яка являє собою
 .
.
12. Сполука за п. 1, яка являє собою
 .
.
13. Композиція, що містить сполуку за будь-яким з пп. 1-12 та фармацевтично прийнятний носій.
14. Спосіб лікування офтальмологічної хвороби, хворобливого стану або розладу, за яким вводять пацієнту, який цього потребує, терапевтично ефективну кількість сполуки за будь-яким з пп. 1-12 або її композиції, де офтальмологічну хворобу, розлад або хворобливий стан вибирають з групи, що складається з (а) хвороби, розладу або хворобливого стану, викликаного хоріоїдальним ангіогенезом, (b) діабетичної ретинопатії та (с) ретинального набряку.
15. Спосіб за п. 14, у якому офтальмологічна хвороба, розлад або хворобливий стан являє собою вікову макулярну дегенерацію.
Текст
Реферат: Даний винахід стосується нових сполук та їх композицій. Даний винахід також стосується способу лікування офтальмологічних хвороб, розладів та хворобливих станів. UA 108878 C2 (12) UA 108878 C2 UA 108878 C2 5 10 15 20 25 30 35 40 Споріднена заявка Дана заявка заявляє пріоритет до Попередньої Заявки США Серійний Номер 61/324,803, поданої 16 квітня 2010 року. Повне розкриття зазначеної вище заявки включене у даний опис шляхом посилання. Галузь винаходу Даний винахід відноситься до сполук, які інгібують протеїн-тирозин-кіназну активність. Зокрема даний винахід відноситься до сполук, які інгібують протеїн-тирозин-кіназну активність рецепторів фактору росту, що приводить до інгібування рецептору сигнального шляху, наприклад, інгібування VEGF рецептору сигнального шляху та HGF рецептору сигнального шляху. Більш особливо, даний винахід відноситься до сполук, композицій та способів лікування офтальмологічних хвороб, розладів або хворобливих станів. Короткий опис попереднього рівня техніки Тирозин-кінази можуть бути класифіковані як рецептор фактору росту (наприклад, EGFR, PDGFR, FGFR та erbB2) або нерецепторні (наприклад, c-src та bcr-abl) кінази. Тирозинкінази рецепторного типу утворюють приблизно 20 різних підсімейств. Тирозинкінази нерецепторного типу утворюють численні підсімейства. Ці тирозинкінази мають відмінну біологічну активність. Рецепторні тирозинкінази являють собою великі ферменти, які закріплюються на клітинній мембрані та мають позаклітинний зв'язуючий домен для факторів росту, трансмембранний домен, та внутрішньоклітинну частину, яка функціонує як кіназа для фосфорилювання специфічного тирозинового залишку у білків та, отже, для створення впливу на клітинну проліферацію. Аберантна або невідповідна протеїн-кіназна активність може робити внесок у збільшення хворобливих станів, пов'язаних з такою аберантною кіназною активністю. Наприклад, тирозинкінази роблять свій внесок у патологію офтальмологічних хвороб, розладів та хворобливих станів, таких як вікова макулярна дегенерація (AMD) та діабетична ретинопатія (DR). Сліпота від таких хвороб пов'язана з аномаліями у ретинальній неоваскуляризації. Ангіогенез являє собою важливий компонент певних нормальних фізіологічних процесів, таких як ембріогенез та загоєння рани, але аберантний ангіогенез робить внесок у певні патологічні розлади. Утворення нових кров'яних судин регулюється факторами росту, такими як VEGF та HGF, які активують рецепторні тирозин-кінази, що приводить до ініціації сигнальних шляхів, яка веде до витікання плазми у макулу, спричиняючи втрату зору. Таким чином, кінази є привабливими цілями для лікування хвороб очей, що включають неоваскуляризацію. Таким чином, існує необхідність у розробці стратегії для контролювання неоваскуляризації ока та у розробці стратегії для лікування офтальмологічних хвороб. У цьому описі автори описують невеликі молекули, які є сильними інгібіторами протеїнтирозин-кіназної активності. Короткий опис винаходу Даний винахід забезпечує нові сполуки та їх композиції. Даний винахід також забезпечує способи лікування офтальмоголічної хвороби, розладу або хворобливого стану такими сполуками або їх композиціями. Сполуки даного винаходу є інгібіторами кіназної активності, такої як протеїн-тирозин-кіназна активність, наприклад, протеїн-тирозин-кіназна активність рецепторів фактору росту, або, наприклад, тирозин-кіназне сигналювання рецепторного типу. У першому аспекті, даний винахід забезпечує сполуки, що мають структуру F Et HN MeO O O N H N O (2) S N N F O MeO H N O H N S N N 1 H N H N O (6) UA 108878 C2 F F H N H N O O (26) S O N N N O HO O N H N O O N O (74) S N H2N H N F N O H N F O N O O N H N (80) S N N H N F H N O O (100) S O S O NH N N H N F O O (151) S N N HO N N Me H N F O N N H N O O OH S N N H N F (192) S N O H N O O HN H N N (209) O N N 2 OMe UA 108878 C2 N H N F N (234) O O N H N S O N N або H N O O N F S N H N (265) N N O 5 10 15 20 25 30 35 40 та їх гідрати, сольвати, фармацевтично прийнятні солі, проліки та комплекси, та їх рацемічні та скалемічні суміші, діастереомери та енантіомери. У другому аспекті, даний винахід забезпечує композиції, що включають сполуку у відповідності з даним винаходом та фармацевтично прийнятний носій, наповнювач або розріджувач. У третьому аспекті, даний винахід забезпечує спосіб лікування офтальмологічної хвороби, розладу або хворобливого стану, де спосіб включає введення пацієнту, який цього потребує, терапевтично ефективної кількості сполуки у відповідності з даним винаходом, або терапевтично ефективної кількості композиції у відповідності з даним винаходом. У деяких варіантах втілення цього аспекту, хвороба викликана хоріоідальним ангіогенезом. У деяких варіантах втілення цього аспекту, хвороба являє собою вікову макулярну дегенерацію, діабетичну ретинопатію або ретинальний набряк. У деяких варіантах втілення цього аспекту, пацієнт являє собою ссавця, наприклад, примата, наприклад, людину. У п'ятому аспекті, даний винахід забезпечує застосування сполуки у відповідності з даним винаходом для або у виробництві лікарського засобу для лікування офтальмологічної хвороби, розладу або хворобливого стану. У деяких варіантах втілення цього аспекту, офтальмологічна хвороба, розлад або хворобливий стан викликані хоріоідальним ангіогенезом. У деяких варіантах втілення цього аспекту, хвороба являє собою вікову макулярну дегенерацію, діабетичну ретинопатію або ретинальний набряк. У шостому аспекті, даний винахід забезпечує застосування сполуки у відповідності з даним винаходом, або її композиції, для лікування офтальмологічної хвороби, розладу або хворобливого стану. У деяких варіантах втілення цього аспекту, офтальмологічна хвороба, розлад або хворобливий стан викликані хоріоідальним ангіогенезом. У деяких варіантах втілення цього аспекту, хвороба являє собою вікову макулярну дегенерацію, діабетичну ретинопатію або ретинальний набряк. Описане вище всього лише сумує деякі аспекти даного винаходу та не призначене для обмеження його. Ці аспекти та інші аспекти та варіанти втілення більш повно описані нижче. Детальний опис винаходу Даний винахід забезпечує нові сполуки та їх композиції. Даний винахід також забезпечує способи лікування офтальмологічної хвороби, розладу або хворобливого стану такими сполуками або їх композиціями. Цей патент та наукова Джерела інформації:, на які посилаються у цьому описі, відображають знання, яке є доступним спеціалістам, кваліфікованим у даній галузі техніки. Видані патенти, опубліковані патентні заявки та посилання, які процитовані у цьому описі, таким чином, включаються шляхом посилання у такому ж обсязі, як якби було специфічно та окремо показано, що кожен включений шляхом посилання. У випадку невідповідностей, дане розкриття буде мати пріоритетне значення. Терміни "кіназний інгібітор" та "інгібітор кіназної активності" та подібні використовують для визначення сполуки, яка здатна взаємодіяти з кіназою та інгібувати її ферментативну активність. 3 UA 108878 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "інгібування кіназної ферментативної активності" та подібні використовують у значенні зниження здатності кінази переносити фосфатну групу з донорної молекули, такої як АТФ, на специфічну цільову молекулу (субстрат). Наприклад, інгібування кіназної активності може становити щонайменше приблизно 10 %. У деяких варіантах втілення даного винаходу, таке зниження кіназної активності становить щонайменше приблизно 25 %, альтернативно щонайменше приблизно 50 %, альтернативно щонайменше приблизно 75 %, та альтернативно щонайменше приблизно 90 %. У інших варіантах втілення, кіназна активність знижується на щонайменше 95 % та альтернативно на щонайменше 99 %. IC50 значення являє собою концентрацію кіназного інгібітору, який знижує активність кінази до 50 % неінгібованого ферменту. Терміни "інгібітор VEGF рецептору сигнального шляху" використовують для позначення сполуки, що має структуру, визначену у цьому описі, яка здатна взаємодіяти з VEGF рецептором та інгібувати активність VEGF рецептору. У деяких варіантах втілення, таке зниження активності становить щонайменше приблизно 50 %, альтернативно щонайменше приблизно 75 %, та альтернативно щонайменше приблизно 90 %. У деяких варіантах втілення, активність знижується на щонайменше 95 % та альтернативно на щонайменше 99 %. Термін "інгібуюча ефективна кількість" використовують для позначення дози, достатньої для спричинення інгібування кіназної активності. Кількість сполуки даного винаходу, яка складає "інгібуючу ефективну кількість" буде змінюватися в залежності від сполуки, кінази та подібного. Інгібуюча ефективна кількість може бути визначена рутинним способом спеціалістом, ординарно кваліфікованим у даній галузі техніки. Кіназа може бути у клітині, яка у свою чергу може бути у багатоклітинному організмі. Багатоклітинний організм може являти собою, наприклад, тварину, наприклад, ссавця та, наприклад, людину. У прикладі варіанту втілення, таке інгібування є специфічним, тобто інгібітор кінази знижує здатність кінази переносити фосфатну групу з донорної молекули, такої як АТФ, до специфічної цільової молекули (субстрату) у концентрації, яка є нижчою, ніж концентрація інгібітору, яка є необхідною для створення іншого, незв'язаного біологічного ефекту. Наприклад, концентрація інгібітору, необхідна для інгібуючої кіназу активності, становить щонайменше у 2 рази нижчу, альтернативно щонайменше у 5 разів нижчу, альтернативно щонайменше у 10 разів нижчу, та альтернативно щонайменше у 20 разів нижчу, ніж концентрація, необхідна для створення незв'язаного біологічного ефекту. Таким чином, даний винахід забезпечує спосіб інгібування кіназної ферментативної активності, що включає приведення у контакт кінази з інгібуючою ефективною кількістю сполуки або композиції у відповідності з даним винаходом. У деяких варіантах втілення, кіназа знаходиться у організмі. Таким чином, даний винахід забезпечує спосіб інгібування кіназної ферментативної активності у організмі, що включає введення у організм інгібуючої ефективної кількості сполуки або композиції у відповідності з даним винаходом. У деяких варіантах втілення, організм являє собою ссавця, наприклад, домашнього ссавця. У деяких варіантах втілення, організм являє собою людину. Термін "терапевтично ефективна кількість", як використано у цьому описі, являє собою кількість сполуки даного винаходу, яка при введенні пацієнті, викликає бажаний терапевтичний ефект. Терапевтичний ефект залежить від хвороби, яку лікують, та бажаного результату. Як такий, терапевтичний ефект може являти собою лікування хворобливого стану. Додатково, терапевтичний ефект може являти собою інгібування кіназної активності. Кількість сполуки даного винаходу, яка становить "терапевтично ефективну кількість", буде змінюватися в залежності від сполуки, стану хвороби та її серйозності, віку пацієнта, якого лікують, та подібного. Терапевтично ефективна кількість може бути визначена рутинним способом спеціалістом, ординарно кваліфікованим у даній галузі техніки. У деяких варіантах втілення, терапевтичний ефект являє собою лікування офтальмологічної хвороби, розладу або хворобливого стану. Фраза "лікування офтальмологічної хвороби, розладу або хворобливого стану" призначена для позначення здатності сполуки у відповідності з даним винаходом лікувати (a) хворобливий розлад або стан, викликаний хоріоідальним ангіогенезом, включає, без обмеження, вікову макулярну дегенерацію, або (b) діабетичну ретинопатію або ретинальний набряк. У деяких варіантах втілення фраза "лікування офтальмологічної хвороби, розладу або хворобливого стану" призначена для позначення здатності сполуки у відповідності з даним винаходом лікувати ексудативну та/або запальну офтальмологічну хворобу, розлад або хворобливий стан, розлад, пов'язаний з порушеною ретинальною судинною проникністю та/або цілісністю, розлад, пов'язаний з ретинальним мікросудинним розривом, що веде до фокального крововиливу, хворобу задньої стінки ока, ретинальну хворобу, або хворобу передньої стінки ока, або іншу офтальмологічну хворобу, 4 UA 108878 C2 5 10 15 20 25 30 35 40 45 50 55 60 розлад або хворобливий стан. У деяких варіантах втілення, офтальмологічна хвороба, розлад або хворобливий стан включає, не обмежуючись наведеними, такі як: вікова макулярна дегенерація (ARMD), ексудативна макулярна дегенерація (також відома як "волога" або неоваскулярна вікова макулярна дегенерація (волога-AMD), макулярний набряк, стареча дискоформна макулярна дегенерація, кистоподібний макулярний набряк, пальпебральний набряк, ретинальний набряк, діабетична ретинопатія, гостра макулярна нейроретинопатія, центральна серозна хоріопатія, хоріоретинопатія, хоріоідальна неоваскуляризація, неоваскулярна макулопатія, неоваскулярна глаукома, обструктивна артеріальна та венозна ретинопатія (наприклад, ретинальна венозна оклюзія або ретинальна артеріальна оклюзія), центральна оклюзія вени сітківки, дисемінована внутрішньосудинна коагулопатія, оклюзія відгалуження вени сітківки, гіпертензивні зміни очного дна, очний ішемічний синдром, ретинальні артеріальні мікроаневризми, хвороба Коутса, парафовеальна телеангіектазія, гемі-оклюзія вени сітківки, папілофлебіт, центральна ретинальна артеріальна оклюзія, ретинальна оклюзія відгалуження артерії, хвороба сонної артерії (CAD), глазурований ангііт відгалужень, серповидно-клітинна ретинопатія та інші гемоглобінопатії, ангіоідні смуги сітківки, макулярний набряк, що є результатом етіологій, таких як хвороба (наприклад, діабетичний макулярний набряк), ураження ока або хірургічна операція на оці, ретинальна ішемія або дегенерація, викликана, наприклад, ураженням, травмою, увеіт, ірит, ретинальний васкуліт, ендофтальміт, панофтальміт, метастатична офтальмія, хоріоідит, ретинальний пігментний епітелііт, кон'юнктивіт, цикліт, склерит, епісклерит, неврит зорового нерву, ретробульбарний неврит зорового нерву, кератит, блефарит, ексудативне відшарування сітківки, виразка рогівки, кон'юнктивальна виразка, хронічний нумулярний кератит, кератит Тайджесона, прогресуюча виразка Мурена, очна запальна хвороба, викликана бактеріальною або вірусною інфекцією або офтальмологічною операцією, очна запальна хвороба, викликана фізичним ураженням ока, та симптом, викликаний очною запальною хворобою, включаючи такі як: свербіж, запальна гіперемія, набряк та виразка, еритема, ексудативна мультиформна, нодозна еритема, кільцевидна еритема, склеродермія, дерматит, ангіоневротичний набряк, набряк гортані, набряк голосової щілини, підзв'язочний ларингіт, бронхіт, риніт, фарингіт, синусит, ларингіт або отит середнього вуха. У деяких варіантах втілення, офтальмологічна хвороба, розлад або хворобливий стан являє собою (a) хворобливий розлад або стан, викликаний хоріоідальним ангіогенезом, що включає, без обмеження, вікову макулярну дегенерацію, або (b) діабетичну ретинопатію або ретинальний набряк. У деяких варіантах втілення, офтальмологічна хвороба, розлад або хворобливий стан включає, не обмежуючись наведеними, вікову макулярну дегенерацію, діабетичну ретинопатію, ретинальний набряк, оклюзію вени сітківки, неоваскулярну глаукому, ретинопатію недоношених, пігментну ретинальну дегенерацію, увеіт, неоваскуляризацію рогівки або проліферативну вітреоретинопатію. У деяких варіантах втілення, офтальмологічна хвороба, розлад або хворобливий стан являє собою вікову макулярну дегенерацію, діабетичну ретинопатію або ретинальний набряк. Таким чином, даний винахід забезпечує спосіб лікування офтальмологічної хвороби, розладу або хворобливого стану у тварини, що включає введення тварині, якій необхідне таке лікування, терапевтично ефективної кількості сполуки або композиції даного винаходу. У деяких варіантах втілення, твариною є ссавець, наприклад, домашній ссавець. У деяких варіантах втілення, твариною є людина. У деяких варіантах втілення, терапевтичний ефект являє собою інгібування ретинальної неоваскуляризації. Фраза "інгібування ретинальної неоваскуляризації" призначена для позначення здатності сполуки у відповідності з даним винаходом затримувати ріст кров'яних судин у оці, наприклад, нових кров'яних судин, що беруть початок з ретинальних вен, наприклад, затримувати ріст нових кров'яних судин, що беруть початок з ретинальних вен та розповсюджуються по внутрішній (вітреальній) поверхні сітківки. У прикладі варіанту втілення, ретинальну неоваскуляризацію затримують щонайменше на 25 % у порівнянні з ретинальною неоваскуляризацією неконтактованих кров'яних судин, альтернативно щонайменше на 50 %, альтернативно щонайменше на 75 %, альтернативно щонайменше на 90 %, альтернативно щонайменше на 95 %, та альтернативно, щонайменше на 99 %. Альтернативно, ретинальну неоваскуляризацію інгібують на 100 % (тобто кров'яні судини не збільшуються у розмірі або кількості). У деяких варіантах втілення, фраза "інгібування ретинальної неоваскуляризації" включає регресію у кількості або розмірі кров'яних судин, у порівнянні з неконтактованими кров'яними судинами. Таким чином, сполука у відповідності з даним винаходом, яка інгібує ретинальну неоваскуляризацію, може викликати затримку у рості 5 UA 108878 C2 5 10 15 20 25 30 35 40 45 50 55 60 кров'яних судин, зупинку росту кров'яних судин, або викликати регресію росту кров'яних судин. Таким чином, даний винахід забезпечує спосіб інгібування ретинальної неоваскуляризації у тварини, що включає введення тварині, якій необхідне таке лікування, терапевтично ефективної кількості сполуки або композиції даного винаходу. У деяких варіантах втілення, твариною є ссавець, наприклад домашній ссавець. У деяких варіантах втілення, твариною є людина. Термін "пацієнт", як використано у цьому описі для цілей даного винаходу, включає людей та інших тварин, наприклад, ссавців. Таким чином, сполуки, композиції та способи даного винаходу є застосовними як для терапії людини, так і для ветеринарних застосувань. У деяких варіантах втілення пацієнт являє собою ссавця, наприклад, людину. Терміни "лікуючий", "лікування" або подібні, як використано у цьому описі, охоплюють лікування хворобливого стану у організмі, та включають щонайменше одне з таких як: (i) запобігання появи хворобливого стану, зокрема, коли така тварина схильна до хворобливого стану, але у неї ще не діагностовано його; (ii) інгібування хворобливого стану, тобто часткове або повне зупинення його розвинення; (iii) полегшення хворобливого стану, тобто спричинення регресії симптомів хворобливого стану або покращення стану симптому цієї хвороби; та (iv) реверсія або регресія хворобливого стану, така як усунення або виліковування цієї хвороби. У деяких варіантах втілення даного винаходу організм являє собою тварину, наприклад, ссавця, наприклад, примата, наприклад, людину. Як відомо у даній галузі техніки, пристосування системного застосування, що стосується місцевої доставки, віку, маси тіла, загального стану здоров'я, статі, дієти, часу введення, взаємодії лікарських засобів, серйозності стану, тощо, може бути необхідне та буде встановлене шляхом рутинного експериментування спеціалістом, ординарно кваліфікованим у даній галузі. У деяких варіантах втілення, терміни "лікуючий", "лікування" або подібні, як використано у цьому описі, охоплюють лікування хворобливого стану у організмі, та включають щонайменше одне з (ii), (iii) та (iv), описаних вище. Приклади шляхів введення включають, не обмежуючись наведеними, системну, періокулярну, ретробульбарну, внутрішньоканальцеву, інтравітреальну ін'єкцію, місцеве введення (наприклад, очні краплі), субкон'юнктивальну ін'єкцію, субтенонову ін'єкцію, трансклеральне, інтракамеральне, субретинальне введення, електропорацію, та імплант уповільненого вивільнення. Інші шляхи введення, інші місця для ін'єкцій або інші форми введення для офтальмологічних випадків будуть добре відомі або визначені спеціалістом, кваліфікованим у даній галузі техніки, та, як передбачають, попадають у обсяг даного винаходу. У деяких варіантах втілення даного винаходу, шляхи введення включають місцеву, субкон'юнктивальну ін'єкцію, інтравітреальну ін'єкцію, або інші очні шляхи, системно, або інші способи, відомі спеціалісту, кваліфікованому у даній галузі, пацієнту після хірургічної операції на оці. У деяких інших варіантах втілення даного винаходу, шляхи введення включають місцеве, інтравітреальне, трансклеральне, періокулярне, кон'юнктивальне, субтенонове, інтракамеральне, субретинальне, субкон'юнктивальне, ретробульбарне або внутрішньоканальцеве введення. У деяких варіантах втілення даного винаходу, шляхи введення включають місцеве введення (наприклад, очні краплі), системне введення (наприклад, пероральне або внутрішньовенне), субкон'юнктивальну ін'єкцію, періокулярну ін'єкцію, інтравітреальну ін'єкцію, та хірургічний імплант для місцевої доставки. У деяких варіантах втілення даного винаходу, шляхи введення включають інтравітреальну ін'єкцію, періокулярну ін'єкцію, та імплант з уповільненим вивільненням для місцевої доставки. У деяких варіантах втілення даного винаходу, внутрішньоочна ін'єкція може бути у скловидне тіло (інтравітреальна), під кон'юнктиву (субкон'юнктивальна), за око (ретробульбарна), у склеру, під тенонову капсулу (субтенонова), або може бути у формі депо. У деяких варіантах втілення даного винаходу, введення є місцевим, включаючи, без обмеження, місцеве, інтравітреальне, періорбітальне, внутрішньоочне та інше місцеве введення у око, очні та/або навколоочні тканини та простори, включаючи, без обмеження, введення за допомогою пристрою для доставки. Сполуки даного винаходу утворюють солі, які також попадають у обсяг даного винаходу. Термін "сіль(солі)”, як використано у цьому описі, позначає кислотні солі, що утворюються з неорганічними та/або органічними кислотами. Фармацевтично прийнятні (тобто нетоксичні (що показують мінімальні токсикологічні ефекти або ніяких небажаних ефектів), фізіологічно прийнятні) солі є кращими, хоча інші солі є також корисними, наприклад, у стадіях виділення або очищення, які можуть бути використані у процесі одержання. Солі сполук даного винаходу можуть утворюватися, наприклад, шляхом введення у реакцію сполуки даного винаходу з кількістю кислоти, такою як еквівалентна кількість, у середовищі, такому як середовище, у якому 6 UA 108878 C2 5 10 15 20 25 30 35 40 45 50 55 60 солі осаджуються, або у водному середовищі після ліофілізації. Сполуки даного винаходу, які містять основний залишок, амін або піридинове, піразольне або імідазольне кільце, можуть утворювати солі з цілою низкою органічних та неорганічних кислот. Приклади солей приєднання кислоти включають ацетати (такі як ті, що утворюються з оцтовою кислотою або тригалооцтовою кислотою, наприклад, трифтороцтовою кислотою), адипати, альгінати, аскорбати, аспартати, бензоати, бензолсульфонати, бісульфати, борати, бутирати, цитрати, камфорати, камфорсульфонати, циклопентанпропіонати, диглюконати, додецилсульфати, етансульфонати, фумарати, глюкогептанoати, гліцерофосфати, гемісульфати, гептаноати, гексаноати, гідрохлориди, гідроброміди, гідройодиди, гідроксиетансульфонати (наприклад, 2-гідроксиетансульфонати), лактати, малеати, метансульфонати, нафталінсульфонати (наприклад, 2-нафталінсульфонати), нікотинати, нітрати, оксалати, пектинати, персульфати, фенілпропіонати (наприклад, 3-фенілпропіонати), фосфати, пікрати, півалати, пропіонати, саліцилати, сукцинати, сульфати (такі як ті, що утворюються з сірчаною кислотою), сульфонати, тартрати, тіоціанати, толуолсульфонати, такі як тозилати, ундеканоати та подібні. Як використано у цьому описі, термін "фармацевтично прийнятні солі" призначений для позначення солей, які зберігають бажану біологічну активність визначених вище сполук та показують мінімальні токсикологічні ефекти або не показують ніяких токсикологічних ефектів. Приклади таких солей включають, не обмежуючись наведеними, солі, що утворюються з неорганічними кислотами (наприклад, соляна кислота, бромисто-воднева кислота, сірчана кислота, фосфорна кислота, азотна кислота та подібні), та солі, що утворюються з органічними кислотами, такими як оцтова кислота, щавлева кислота, винна кислота, бурштинова кислота, яблучна кислота, аскорбінова кислота, бензойна кислота, дубильна кислота, пальмітинова кислота, альгінова кислота, поліглутамінова кислота, нафталінсульфонова кислота, нафталіндисульфонова кислота, метансульфонова кислота, п-толуолсульфонова кислота та полігалактуронова кислота. Інші солі включають фармацевтично прийнятні четвертинні солі, відомі спеціалістам, кваліфікованим у даній галузі техніки, які спеціально включають сіль четвертинного амонію формули --NR+Z--, де R являє собою водень, алкіл, або бензил, та Z являє собою протиіон, включаючи хлорид, бромід, йодид, -O-алкіл, толуолсульфонат, метилсульфонат, сульфонат, фосфат, або карбоксилат (такий як бензоат, сукцинат, ацетат, гліколят, малеат, малат, цитрат, тартрат, аскорбат, бензоат, циннамоат, манделоат, бензилоат, та дифенілацетат). У деяких варіантах втілення даного винаходу, солі сполук даного винаходу, можуть утворюватися з хіральними або рацемічними кислотами або їх діастереомерами. Хіральні центри таких кислот можуть мати S або R конфігурацію. Рацемічні форми можуть бути розділеними за допомогою фізичних способів, таких як, наприклад, фракційна кристалізація, розділення або кристалізація діастереомерних похідних або розділення за допомогою хіральної колонкової хроматографії. Окремі оптичні ізомери можуть бути одержані або виходячи з хіральних попередників/проміжних сполук або з рацематів шляхом будь-якого підходящого способу, включаючи без обмеження, звичайно використовувані способи, такі як, наприклад, утворення солі з оптично активною кислотою, що супроводжують кристалізацією. Даний винахід також включає всі таутомерні форми сполук, розкритих у цьому описі. Інший аспект даного винаходу забезпечує композиції, що включають сполуку у відповідності з даним винаходом. Наприклад, у деяких варіантах втілення даного винаходу, композиція включає сполуку, або N-оксид, гідрат, сольват, фармацевтично прийнятну сіль, комплекс або проліки сполуки у відповідності з даним винаходом, що присутні у щонайменше приблизно 30 % енантіомерному або діастереомерному надлишку. У деяких варіантах втілення даного винаходу, сполука, N-оксид, гідрат, сольват, фармацевтично прийнятна сіль, комплекс або проліки присутні у щонайменше приблизно 50 %, щонайменше приблизно 80 %, або навіть щонайменше приблизно 90 % енантіомерному або діастереомерному надлишку. У деяких варіантах втілення даного винаходу, сполука, N-оксид, гідрат, сольват, фармацевтично прийнятна сіль, комплекс або проліки присутні у щонайменше приблизно 95 %, альтернативно щонайменше приблизно 98 % та альтернативно щонайменше приблизно 99 % енантіомерному або діастереомерному надлишку. У інших варіантах втілення даного винаходу, сполука, N-оксид, гідрат, сольват, фармацевтично прийнятна сіль, комплекс або проліки присутні по суті у вигляді рацемічної суміші. Даний винахід також включає проліки сполук даного винаходу. Мається на увазі, що термін "проліки" являє собою сполуку, ковалентно зв'язану з носієм, де проліки здатні вивільняти активний інгредієнт, коли проліки вводять ссавцевому суб'єкту. Вивільнення активного інгредієнту відбувається in vivo. Проліки можуть бути одержані за технологіями, відомими 7 UA 108878 C2 5 10 15 20 25 30 35 40 45 50 55 60 спеціалісту, кваліфікованому у даній галузі. Ці технології в основному модифікують підходящі функціональні групи у даної сполуки. Ці модифіковані функціональні групи, однак, регенерують вихідні функціональні групи шляхом рутинних маніпуляцій або in vivo. Проліки сполук даного винаходу включають сполуки, у яких гідрокси, аміно, карбонова або подібна група є модифікованою. Приклади проліків включають, не обмежуючись наведеними, складні ефіри (наприклад, похідні ацетату, форміату та бензоату), карбамати (наприклад, N, Nдиметиламінокарбоніл) гідрокси або аміно функціональних груп у сполуках даного винаходу), аміди (наприклад, трифторацетиламіно, ацетиламіно, та подібні), та подібні. Сполуки даного винаходу можуть вводитися, наприклад, як є або у вигляді проліків, наприклад, у формі складного ефіру, що in vivo гідролізується, або аміду, що in vivo гідролізується. Складний ефір сполуки даного винаходу, що in vivo гідролізується, що містить карбокси або гідрокси групу, являє собою, наприклад, фармацевтично прийнятний складний ефір, який гідролізується у організмі людини або тварини до створення вихідної кислоти або спирту. Підходящі фармацевтично прийнятні складні ефіри для карбокси включають C1C6алкоксиметил складні ефіри (наприклад, метоксиметил), C 1-C6алканоїлоксиметил-складні ефіри (наприклад, півалоїлоксиметил), фталідил-складні ефіри, C3C8циклоалкоксикарбонілокси-C1-C6алкіл-складні ефіри (наприклад, 1циклогексилкарбонілоксиетил); 1,3-діоксолен-2-онілметил-складні ефіри (наприклад, 5-метил1,3-діоксолен-2-онілметил; та C1-C6алкоксикарбонілоксиетил- складні ефіри (наприклад, 1метоксикарбонілоксиетил) та можуть бути утворені на будь-якій прийнятній карбокси групі у сполуках даного винаходу. Складний ефір сполуки даного винаходу, що in vivo гідролізується, що містить гідрокси групу, включає неорганічні складні ефіри, такі як фосфат-складні ефіри та α-ацилоксиалкілефіри та споріднені сполуки, які в результаті in vivo гідролізу складного ефіру розкладаються з утворенням вихідної гідрокси групи. Приклади α-ацилоксиалкіл- ефірів включають ацетоксиметокси та 2,2-диметилпропіонілокси-метокси. Вибір складного ефіру, що in vivo гідролізується, який утворює групи для гідрокси, включають алканоїл, бензоїл, фенілацетил та заміщений бензоїл та фенілацетил, алкоксикарбоніл (з утворенням алкіл-карбонат-складних ефірів), діалкілкарбамоїл та N-(N, N-діалкіламіноетил)-N-алкілкарбамоїл (з утворенням карбаматів), N, N-діалкіламіноацетил та карбоксиацетил. Приклади замісників на бензоїлу включають морфоліно та піперазино, прикріплені від кільцевого атому азоту через метиленову групу до 3- або 4- положення бензоїлоного кільця. Підходяще значення для аміду сполуки даного винаходу, що in vivo гідролізується, яка містить карбокси групу, включає, наприклад, NC1-C6алкіл або N, N-ди-C1-C6алкіл-амід, такий як N-метил-, N-етил-, N-пропіл-, N, N-диметил-, Nетил-N-метил- або N, N-діетил-амід. Після введення суб'єкту, проліки піддаються хімічному перетворенню шляхом метаболічного або хімічного процесів з одержанням сполуки даного винаходу. Даний винахід також відноситься до сольватів та гідратів сполук даного винаходу. Термін "сольват" відноситься до молекулярного комплексу сполуки з однією або більшою кількістю молекул розчиннику у стехіометричній або нестехіометричній кількості. Молекулярний комплекс сполуки або залишку сполуки та розчиннику може бути стабілізований нековалентними внутрішньо молекулярними силами, такими як, наприклад, електростатичні сили, ван-дерваальсовські сили, або водневі зв'язки. Спеціалісти, кваліфіковані у галузі органічної хімії, визнають, що багато органічних сполук може утворювати такі комплекси з розчинниками, у яких їх одержують, готують або синтезують, або з яких їх осаджують або кристалізують. Термін "гідрат" відноситься до комплексу, у якому одна або більша кількість молекул розчиннику являють собою воду та включає моногідрати, гемі-гідрати, дигідрати, гексагідрати та подібні. Значення слів "сольват" та "гідрат" добре відомі спеціалістам, кваліфікованим у даній галузі техніки. Технології для одержання сольватів є загально визнаними у даній галузі (дивись, наприклад, Brittain, Polymorphism in Pharmaceutical solids. Marcel Dekker, New York, 1999; Hilfiker, Polymorphism in the Pharmaceutical Industry, Wiley, Weinheim, Germany, 2006). У деяких варіантах втілення цього аспекту, розчинник являє собою неорганічний розчинник (наприклад, воду). У деяких варіантах втілення цього аспекту, розчинник являє собою органічний розчинник (такий як, не обмежуючись наведеними, спирти, такі як, без обмеження, метанол, етанол, ізопропанол, та подібні, оцтова кислота, кетони, складні ефіри, та подібні). У певних варіантах втілення, розчинник являє собою такий розчинник, який загально використовують у галузі фармацевтики, що, як відомо, є нешкідливим для реципієнта, якому такий сольват вводять (наприклад, вода, етанол, та подібні) та у кращих варіантах втілення, не заважає біологічній активності розчиненої речовини. Сполуки 8 UA 108878 C2 Даний винахід відноситься до сполук, що мають структуру Et HN MeO H N F O O O N H N (2) S N N H N F O MeO H N O O H N (6) S N N F F H N H N O O (26) S O N N N O HO O N O O N O F O N H N H N (80) O O N S N N F O S NH (74) S N O S O H N O N H2N H N F N N 9 H N H N O (100) UA 108878 C2 H N F O O (151) S N N HO N N Me H N F HN N N N H N F (192) S N O H N O O O H N H N O O OH S N N N N OMe N H N F N (209) O O O N H N (234) S O N N або H N O O N N N F S H N (265) N O 5 10 та до їх гідратів, сольватів, фармацевтично прийнятних солей, проліків та комплексів, та до їх рацемічних та скалемічних сумішей, діастереомерів та енантіомерів. Сполуки даного винаходу в основному можуть бути одержані у відповідності з наступними Схемами. Таутомери та сольвати (наприклад, гідрати) сполук описаних вище формул також входять у обсяг даного винаходу. Способи сольватації є в основному відомими у даній галузі техніки. Відповідно, сполуки даного винаходу можуть бути у вільній формі, у формі гідрату або солі та можуть бути одержані за способами, для прикладу представленими наступними схемами нижче. 10 UA 108878 C2 5 10 15 20 25 30 35 40 45 50 Наступні приклади та одержання описують спосіб та процес одержання та застосування даного винаходу та є скоріше ілюстративними, ніж обмежуючими. Повинно бути зрозуміло, що можуть бути й інші варіанти втілення, які відповідають суті та попадають у обсяг даного винаходу, як визначено Формулою винаходу, що додається. Сполуки називали, використовуючи Chemdraw Ultra (версії 10,0, 10,0,4 або версія 8,0,3), які є доступними у Cambridgesoft (www.Cambridgesoft.com, 100 Cambridge Park Drive, Cambridge, MA 02140, або були отримані з них. Дані, представлені у цьому описі, демонструють інгібіторні ефекти кіназних інгібіторів даного винаходу. Ці дані дозволяють сподіватися, що сполуки даного винаходу є корисними не тільки для інгібування кіназної активності, протеїн-тирозин-кіназної активності, або їх варіантів втілення, таких як, VEGF рецептор сигнального шляху, але як терапевтичні агенти для лікування офтальмологічних хвороб, розладів та хворобливих станів. Схеми синтезу та експериментальні процедури Сполуки даного винаходу можуть бути одержані у відповідності із схемами реакцій або прикладами, проілюстрованими нижче, використовуючи способи, відомі спеціалісту, ординарно кваліфікованому у даній галузі техніки. Ці схеми слугують для ілюстрації деяких процедур, які можуть бути використані для одержання сполук даного винаходу. Спеціаліст, ординарно кваліфікований у даній галузі техніки, визнає, що можуть бути використані інші загальні процедури синтезу. Сполуки даного винаходу можуть бути одержані з вихідних компонентів, які є комерційно доступними. Будь-яке з заміщень може бути зроблене до вихідних компонентів для одержання сполук даного винаходу у відповідності з процедурами, які є добре відомими спеціалістам, кваліфікованим у даній галузі техніки. Всі реагенти та розчинники були одержані з комерційних джерел та використані у тому 1 вигляді, у якому їх одержали. H-ЯМР спектри були записані на приладі Mercury Plus Varian 400 MГц у зазначених розчинниках. Мас-спектри низького розділення (LRMS) були зроблені на приладі Agilent MSD. Аналітичну ВЕРХ провели на приладі Agilent 1100, використовуючи Zorbax 3 мкм, XDB-C8, 2,1 × 50 мм колонку; елююючи сумішшю метанол/вода, що містить 0,1 % мурашиної кислоти, з градієнтом 5-95 % метанолу за 15 хвилин. Автоматизовану колонкову хроматографію проводили на приладах Biotage SP1 або Biotage SP4, використовуючи Biotage® SNAP, SiliaSep™ або SiliaFlash® картриджі. Флеш колонкову хроматографію проводили, використовуючи силікагель (SiliaFlash F60, 40-63 мкм, розмір пор 60 Å, SiliCycle®). Препаративну колонкову хроматографію проводили на приладі Gilson 215, використовуючи Phenomenex Luna 15 мкм, C18(2) 100A, 250 × 21 мм колонку, елююючи сумішшю метанол/вода, що містить 0,05 % мурашиної кислоти, з градієнтом 0-95 % метанолу за 60 хвилин. Специфічні приклади Схема 1 Приклад 1 N-[3-((6-(7-(4-(3-циклопропілуреїдо)-2-фторфенокси)тієно[3,2-b]піридин-2-іл)піридин-3іл)метил)]-N-(1-етил)-N-[3-(2-метоксиетил)]сечовина (2) Розчин 1-циклопропіл-3-(3-фтор-4-(2-(5-((2-метоксиетиламіно)метил)-піридин-2-іл)тієно[3,2b]піридин-7-ілокси)феніл)сечовини (1, 100 мг, 0,197 ммоль, ) та етил-ізоціанат (25 мкл, 0,315 ммоль) у ТГФ (5 мл) перемішують (обробка ультразвуком впродовж деякого часу) при КТ впродовж ночі. Реакційну суміш концентрують та очищують шляхом Biotage (SNAP 25 г картридж; MeOH/ДХМ: від 0/100 до 10/90 протягом пропускання 20 CV, потім 10/90 протягом пропускання 5 CV). Бажані фракції збирають та концентрують. Залишок спів осаджують у AcOEt (із слідами MeOH)/гексани, збирають фільтруванням, промивають гексанами, сушать на повітрі та сушать у високому вакуумі, що забезпечує одержання заголовної сполуки 2 (63 мг, 0,11 1 ммоль, 56 % вихід) у вигляді білої пухкої речовини. H ЯМР (400 MГц, ДМСО-d6) δ (ppm): 8,73 (s, 1H), 8,52 (d, J=5,5 Гц, 1H), 8,48 (d, J=1,6 Гц, 1H), 8,31 (s, 1H), 8,24 (d, J=8,2 Гц, 1H), 7,78-7,69 (m, 2H), 7,38 (t, J=9,0 Гц, 1H), 7,24-7,17 (m, 1H), 6,64 (bd, J=5,4 Гц, 1H), 6,62-6,56 (m, 1H), 6,44 (t, 11 UA 108878 C2 J=5,4 Гц, 1H), 4,53 (s, 2H), 3,44-3,34 (m, 4H), 3,23 (s, 3H), 3,12-3,03 (m, 2H), 2,59-2,52 (m, 1H), 1,02 (t, J=7,1 Гц, 3H), 0,72-0,58 (m, 2H), 0,50-0,36 (m, 2H). MS (m/z): 579,46 (M+H). Схема 2 5 10 15 20 25 Приклад 2 N-((6-(7-(4-(3-циклопропілуреїдо)-2-фторфенокси)тієно[3,2-b]піридин-2-іл)піридин-3іл)метил)-N-(2-метоксиетил)формамід (6) До розчину оцтового ангідриду (150 мкл, 1,17 ммоль) у мурашиній кислоті (2 мл), що перемішують при КТ протягом 20 хвилин, додають однією порцією сполуку 1 (150 мг, 0,296 ммоль). Через 2 години 200 мкл оцтового ангідриду (1,57 ммоль) додають краплинним способом. Реакційну суміш перемішують при КТ впродовж ночі, гасять додаванням MeOH та концентрують. Залишок очищують за допомогою Biotage (SNAP 25 г картридж; MeOH/ДХМ: від 0/100 до 10/90 протягом пропускання 20 CV, потім 10/90 протягом пропускання 5 CV), що забезпечує одержання заголовної сполуки 6 (96 мг, 0,18 ммоль, 76 % вихід) у вигляді майже 1 білої пухкої речовини. H ЯМР (400 MГц, ДМСО-d6) δ (ppm): суміш ротамерів, 8,75 (s, 1H), 8,608,50 (m, 2H), 8,37 та 8,34 (2s, 1H), 8,32-8,23 (m, 1H), 8,15 (s, 1H), 7,90-7,77 (m, 1H), 7,73 (dd, J=13,5, 2,5 Гц, 1H), 7,38 (t, J=9,0 Гц, 1H), 7,20 (bd, J=10,2 Гц, 1H), 6,67-6,58 (m, 2H), 4,60 та 4,56 (2s, 2H), 3,46-3,36 (m, 4H), 3,21 та 3,19 (2s, 3H), 2,59-2,51 (m, 1H), 0,70-0,60 (m, 2H), 0,47-0,38 (m, 2H). MS (m/z): 536,4 (M+H). Схема 3 Приклад 3 N-((6-(7-(4-(3-циклопропілуреїдо)-2,3-дифторфенокси)тієно[3,2-b]піридин-2-іл)-піридин-3іл)метил)-N-(2-метоксиетил)ацетамід (26) Стадія 1. трет-бутил (6-(7-(4-аміно-2,3-дифторфенокси)тієно[3,2-b]піридин-2-іл)піридин-3 12 UA 108878 C2 5 10 15 20 25 30 35 40 45 50 іл)метил(2-метоксиетил)карбамат (23) До перемішуваного розчину 4-аміно-2,3-дифторфенолу (1,471 г, 10,14 ммоль) у ДМСО (11,5 мл) при КТ у атмосфері азоту додають калію трет-бутоксид (1,345 г, 11,98 ммоль). Через 30 хвилин, трет-бутил (6-(7-хлортієно[3,2-b]піридин-2-іл)піридин-3-іл)метил(2метоксиетил)карбамат (22, 4,0 г, 9,22 ммоль) додають та реакційну суміш нагрівають при 100ºC впродовж 2,5 год., потім охолоджують до КТ. Реакційну суміш виливають у воду (90 мл) та перемішують впродовж 30 хвилин. Додають насичений водний розчин хлориду натрію та зазначену суміш перемішують при КТ впродовж 3 днів. Тверду речовину збирають фільтруванням, промивають водою, сушать на повітрі та сушать у високому вакуумі. Сирий продукт очищують за допомогою Biotage (40+M картридж; AcOEt/гексани: 50/50 протягом пропускання 3 CV, 50/50 до 100 % AcOEt протягом пропускання 6 CV, потім 100 % AcOEt протягом пропускання 8 CV), що забезпечує одержання матеріалу, який після розтирання з діетиловим ефіром забезпечує одержання заголовної сполуки 23 (1,94 г, 3,58 ммоль, 38 % вихід) у вигляді майже білої твердої речовини. MS (m/z): 543,3 (M+H). Стадія 2. трет-бутил (6-(7-(4-(3-циклопропілуреїдо)-2,3-дифторфенокси)-тієно[3,2-b]-піридин2-іл)піридин-3-іл)метил(2-метоксиетил)карбамат (24) До перемішуваного розчину аніліну 23 (500 мг, 0,92 ммоль) та ДІПЕА (0,8 мл, 4,61 ммоль) у ТГФ (18 мл) при -25ºC у атмосфері азоту додають краплинним способом розчин трифосгену (273 мг, 0,920 ммоль) у ТГФ (2 мл). Реакційну суміш перемішують при -25ºC та повільно додають циклопропіламін (0,32 мл, 4,61 ммоль). Реакційну суміш залишають нагрітися до RT впродовж 1,5 год. та перемішують при КТ впродовж ночі. Реакційну суміш потім розподіляють між AcOEt та водою. Органічний шар послідовно промивають за допомогою насиченого водного розчину хлориду амонію, 1N NaOH та сольового розчину, сушать над безводним сульфатом магнію, фільтрують та концентрують, що забезпечує одержання заголовної сполуки 24 у вигляді майже білої твердої речовини. Неочищений матеріал використовують у наступній стадії без будь-якого додаткового очищення. MS (m/z): 626,6 (M+H). Стадія 3. 1-циклопропіл-3-(2,3-дифтор-4-(2-(5-((2-метоксиетиламіно)метил)-піридин-2іл)тієно[3,2-b]піридин-7-ілокси)феніл)сечовина (25) Розчин проміжного продукту 24 (0,92 ммоль) та ТФОК (10 мл) у ДХМ (50 мл) перемішують при КТ впродовж 3 год. Реакційну суміш концентрують, розбавляють мінімальною кількістю MeOH та додають воду. pH доводять до приблизно pH 12 за допомогою 4N NaOH. Тонку суспензію обробляють ультразвуком впродовж 15 хвилин, збирають фільтруванням, промивають водою та сушать у високому вакуумі, що забезпечує одержання заголовної сполуки 25 (578 мг, 0,9 ммоль, 98 % вихід, ТФОК сіль) у вигляді твердої речовини кольору слонової 1 кістки. H ЯМР (400 MГц, ДМСО-d6) δ (ppm): 8,78-8,61 (m, 1H), 8,57 (d, J=1,6 Гц, 1H), 8,53 (d, J=5,5 Гц, 1H), 8,33 (s, 1H), 8,23 (d, J=8,2 Гц, 1H), 8,02 (t, J=7,8 Гц, 1H), 7,90 (dd, J=8,1, 2,1 Гц, 1H), 7,28 (td, J=9,0, 2,1 Гц, 1H), 7,16-7,01 (m, 1H), 6,75 (d, J=5,3 Гц, 1H), 3,78 (d, J=6,1 Гц, 2H), 3,41 (t, J=5,7 Гц, 2H), 3,24 (s, 3H), 2,65 (q, J=6,0 Гц, 2H), 2,61-2,53 (m, 1H), 2,30-2,21 (m, 1H), 0,72-0,58 (m, 2H), 0,49-0,36 (m, 2H). MS (m/z): 526,6 (M+H). Стадія 4. N-((6-(7-(4-(3-циклопропілуреїдо)-2,3-дифторфенокси)тієно[3,2-b]піридин-2-іл)піридин-3-іл)метил)-N-(2-метоксиетил)ацетамід (26) Суспензію сполуки 25 (100 мг, 0,156 ммоль, ТФОК сіль) у оцтовому ангідриді (1 мл) перемішують при КТ протягом 2 днів. Реакцію у суміші гасять додаванням метанолу та води. Тонку суспензію збирають фільтруванням, промивають послідовно водою, 1N NaOH, водою та сушать на повітрі. Сирий продукт очищують за допомогою Biotage (SNAP 25 г картридж; MeOH/ДХМ: від 0/100 до 10/90 протягом пропускання 20 CV, потім 10/90 протягом пропускання 5 CV), що забезпечує одержання заголовної сполуки 26 (34 мг, 0,06 ммоль, 38 % вихід) у вигляді 1 білої твердої речовини. H ЯМР (400 MГц, ДМСО-d6) δ (ppm): суміш ротамерів, 8,57-8,44 (m, 3H), 8,38 та 8,34 (2s, 1H), 8,30 та 8,24 (2d, J=8,2 Гц, 1H), 8,04 (bt, J=8,3 Гц, 1H), 7,82-7,75 (m, 1H), 7,32-7,25 (m, 1H), 6,87 (bd, J=2,7 Гц, 1H), 6,79-6,74 (m, 1H), 4,71 та 4,59 (2s, 2H), 3,54-3,40 (m, 4H), 3,24 та 3,21 (2s, 3H), 2,61-2,53 (m, 1H), 2,13 та 2,05 (2s, 3H), 0,73-0,58 (m, 2H), 0,50-0,36 (m, 2H). MS (m/z): 568,6 (M+H). Схема 4 13 UA 108878 C2 5 10 15 20 25 30 Приклад 4 1-циклопропіл-3-(3-фтор-4-(2-(5-((4-(2-гідроксиацетил)піперазин-1-іл)метил)піридин-2іл)тієно[3,2-b]піридин-7-ілокси)феніл)сечовина (74) Стадія 1. трет-бутил 4-((6-(7-(4-(3-циклопропілуреїдо)-2-фторфенокси)тієно[3,2-b]-піридин-2іл)піридин-3-іл)метил)піперазин-1-карбоксилат (48) Суспензію 1-циклопропіл-3-(3-фтор-4-(2-(5-формілпіридин-2-іл)тієно[3,2-b]піридин-7ілокси)феніл)сечовини (47, 3 г, 5,90 ммоль, ацетатна сіль), 1-boc-піперазину (1,65 г, 8,85 ммоль) та оцтової кислоти (675 мкл, 11,80 ммоль) у NMP (50 мл) при КТ у атмосфері азоту обробляють ультразвуком протягом 3 годин для того, щоб отримати розчин, потім додають NaBH(OAc) 3 (3,95 г, 17,70 ммоль). Реакційну суміш перемішують при КТ впродовж 3 днів потім гасять додаванням води. pH доводять до 12-13 за допомогою 4N NaOH та цю суспензію перемішують та обробляють ультразвуком протягом 1 години. Тверду речовину збирають фільтруванням, промивають водою та сушать на повітрі. Залишок очищують двічі шляхом Biotage (SNAP 50г KP-Sil картридж; MeOH/ДХМ: від 1/99 до 10/90 протягом пропускання 20 CV). Бажані фракції збирають, концентрують, та спів-осаджують з AcOEt із слідовими кількостями метанолу/гексанів, що забезпечує одержання сполуки 48 (1,511 г, 2,44 ммоль, 41 % вихід) у 1 вигляді білої пухкої речовини. H ЯМР (400 MГц, ДМСО-d6) δ (ppm): 8,71 (s, 1H), 8,56 (bd, J=2,0 Гц, 1H), 8,52 (d, J=5,5 Гц, 1H), 8,33 (s, 1H), 8,25 (d, J=8,2 Гц, 1H), 7,87 (dd, J=8,1, 2,1 Гц, 1H), 7,73 (dd, J=13,6, 2,4 Гц, 1H), 7,38 (t, J=9,1 Гц, 1H), 7,20 (bdd, J=8,8, 1,2 Гц, 1H), 6,65 (d, J=5,3 Гц, 1H), 6,57 (bd, J=2,5 Гц, 1H), 3,57 (s, 2H), 4H приховуються піком води, 2,59-2,51 (m, 1H), 2,42-2,27 (m, 4H), 1,39 (s, 9H), 0,72-0,58 (m, 2H), 0,50-0,36 (m, 2H). MS (m/z): 619,4 (M+H). Стадія 2. 1-циклопропіл-3-(3-фтор-4-(2-(5-(піперазин-1-ілметил)піридин-2-іл)тієно[3,2-b]піридин-7-ілокси)феніл)сечовина (49) Розчин сполуки 48 (1,456 г, 2,35 ммоль) та ТФОК (15 мл) у ДХМ (50 мл) перемішують при КТ протягом 5 годин. ТФОК видаляють шляхом співвипарювання з ДХМ, залишок розбавляють водою, та pH доводять до ~12-13 за допомогою 1N NaOH. Отриману суспензію обробляють ультразвуком впродовж 15 хвилин. Тверду речовину збирають фільтруванням, промивають водою та сушать у високому вакуумі, що забезпечує одержання сполуки 49 (1,227 г, слідові 1 кількості ТФОК) у вигляді майже білої пухкої речовини. H ЯМР (400 MГц, ДМСО-d6) δ (ppm): 8,76 (bs, 1H), 8,54 (d, J=1,4 Гц, 1H), 8,52 (d, J=5,5 Гц, 1H), 8,32 (s, 1H), 8,24 (d, J=8,2 Гц, 1H), 7,85 (dd, J=8,1, 2,1 Гц, 1H), 7,73 (dd, J=13,5, 2,3 Гц, 1H), 7,38 (t, J=9,1 Гц, 1H), 7,20 (bd, J=10,2 Гц, 1H), 6,64 (d, J=5,5 Гц, 1H), 6,62 (bs, 1H), 3,58-3,48 (m, 2H), 2,73-2,64 (m, 4H), 2,59-2,52 (m, 1H), 2,38 14 UA 108878 C2 5 10 15 20 25 30 35 40 45 50 2,25 (m, 4H), 0,69-0,62 (m, 2H), 0,46-0,40 (m, 2H), один NH відсутній. MS (m/z): 519,6 (M+H). Стадія 3. 1-циклопропіл-3-(3-фтор-4-(2-(5-((4-(2-гідроксиацетил)піперазин-1-іл)метил)піридин-2-іл)тієно[3,2-b]піридин-7-ілокси)феніл)сечовина (74) До перемішуваного розчину сполуки 49 (122 мг, 0,235 ммоль, схема 15), гліколевої кислоти (36 мг, 0,47 ммоль) та ДІПЕА (123 мкл, 0,71 ммоль) у ДМФА (4 мл) у атмосфері азоту додають HATU реагент (224 мг, 0,59 ммоль), та реакційну суміш перемішують при КТ впродовж ночі. Реакційну суміш потім гасять додаванням води та 1N NaOH, перемішують протягом 2 годин, та екстрагують за допомогою ДХМ. Об'єднаний органічний екстракт сушать над безводним сульфатом магнію, фільтрують та концентрують. Залишок очищують двічі шляхом Biotage (SNAP 25 г картридж; 2 % гідроксиду амонію у MeOH/ДХМ: від 0/100 до 10/90 протягом пропускання 20 CV; потім SiliaFlash 40 г картридж, 2 % гідроксиду амонію у MeOH/ДХМ: від 0/100 до 10/90 протягом пропускання 20 CV, потім від 10/90 до 15/85 протягом пропускання 20CV), що приводить до одержання матеріалу, який після розтирання з MeOH забезпечує одержання заголовної сполуки 74 (53 мг, 0,09 ммоль, 39 % вихід) у вигляді білої твердої 1 речовини. H ЯМР (400 MГц, ДМСО-d6) δ (ppm): 8,77-8,69 (m, 1H), 8,57 (d, J=1,6 Гц, 1H), 8,52 (d, J=5,5 Гц, 1H), 8,34 (s, 1H), 8,26 (d, J=8,0 Гц, 1H), 7,88 (dd, J=8,1, 2,1 Гц, 1H), 7,73 (dd, J=13,5, 2,3 Гц, 1H), 7,38 (t, J=9,1 Гц, 1H), 7,20 (bd, J=9,2 Гц, 1H), 6,65 (d, J=4,9 Гц, 1H), 6,63-6,56 (m, 1H), 4,55 (t, J=5,5 Гц, 1H), 4,07 (d, J=5,5 Гц, 2H), 3,60 (s, 2H), 3,53-3,43 (m, 2H), 2H приховані, 2,592,51 (m, 1H), 2,45-2,33 (m, 4H), 0,72-0,58 (m, 2H), 0,50-0,36 (m, 2H). MS (m/z): 577,5 (M+H). Приклад 5 Стадія 1. (S)-2-(4-((6-(7-(4-(3-циклопропілуреїдо)-2-фторфенокси)тієно[3,2-b]піридин-2іл)піридин-3-іл)метил)піперазин-1-іл)-2-оксоетил 2-(трет-бутоксикарбоніламіно)-3метилбутаноат (74-A) До перемішуваного розчину сполуки 74 (117 мг, 0,20 ммоль), Boc-L-валіну (132 мг, 0,61 ммоль) та ДМАП (25 мг, 0,20 ммоль) у безводному ДМФА (4 мл) у атмосфері азоту додають DCC реагент (251 мг, 1,22 ммоль), та реакційну суміш перемішують при КТ впродовж 24 годин. Реакційну суміш розподіляють між AcOEt та насиченим водним розчином бікарбонату натрію. Після розділення, органічний шар послідовно промивають насиченим водним розчином бікарбонату натрію, насиченим водним розчином хлориду амонію та сольовим розчином, сушать над безводним сульфатом магнію, фільтрують та концентрують. Залишок очищують за допомогою Biotage (Snap 25 г картридж; MeOH/ДХМ: від 1/99 до 10/90 протягом пропускання 20 CV, потім 10/90 протягом пропускання 5 CV), що забезпечує одержання бажаного продукту 74-A (151 мг, 0,195 ммоль, 96 % вихід) у вигляді безбарвно-білої клейкої піни. MS (m/z): 776,7 (M+H). Стадія 2. (S)-2-(4-((6-(7-(4-(3-циклопропілуреїдо)-2-фторфенокси)тієно[3,2-b]піридин-2іл)піридин-3-іл)метил)піперазин-1-іл)-2-оксоетил 2-аміно-3-метилбутаноат (80). Суспензію Boc-валін-складного ефіру 74-A (151 мг, 0,195 ммоль) та розчину HCl (0,49 мл, 1,95 ммоль, 4M у 1,4-діоксан) у безводному ДХМ (10 мл) перемішують при КТ протягом 2,5 годин. Реакційну суміш концентрують та розбавляють насиченим водним розчином бікарбонату натрію. Водний розчин екстрагують за допомогою ДХМ, що містить слідові кількості метанолу. Об'єднаний органічний шар сушать над безводним сульфатом магнію, фільтрують та концентрують. Залишок очищують за допомогою Biotage (Silia Flash 12г картридж; 2 % гідроксиду амонію у MeOH/ДХМ: від 1/99 до 15/85 протягом пропускання 20 CV, потім від 15/85 до 20/80 протягом пропускання 10 CV), що забезпечує одержання бажаного продукту 80 (80 мг, 1 0,118 ммоль, 60 % вихід) у вигляді майже білої клейкої речовини. H ЯМР (400 MГц, ДМСО-d6) δ (ppm): суміш ротамерів, 8,73 (s, 1H), 8,58 (bd, J=1,4 Гц, 1H), 8,52 (d, J=5,3 Гц, 1H), 8,34 (s, 1H), 8,26 (dd, J=8,1, 0,7 Гц, 1H), 7,88 (dd, J=8,2, 2,2 Гц, 1H), 7,73 (dd, J=13,6, 2,4 Гц, 1H), 7,38 (t, J=9,0 Гц, 1H), 7,20 (dd, J=9,0, 1,4 Гц, 1H), 6,65 (dd, J=5,3, 0,8 Гц, 1H), 6,59 (bd, J=2,5 Гц, 1H), 4,84 (d, J=14,7 Гц, 1H), 4,77 (d, J=14,9 Гц, 1H), 3,63-3,58 (m, 2H), 3,50-3,37 (m, 4H), 3,20 (d, J=5,1 Гц, 1H), 2,59-2,51 (m, 1H), 2,47-2,33 (m, 4H), 2,00-1,60 (m, 3H), 0,92 (d, J=6,8 Гц, 3H), 0,86 (d, J=6,8 Гц, 3H), 0,72-0,58 (m, 2H), 0,50-0,36 (m, 2H). MS (m/z): 577,6 та 676,7 (M+H). Схема 5 15 UA 108878 C2 5 10 15 20 25 30 Приклад 6 1-циклопропіл-3-(3-фтор-4-(2-(5-((2-(метилсульфоніл)етиламіно)метил)піридин-2-іл)тієно[3,2b]піридин-7-ілокси)феніл)сечовина (100) Стадія 1. N-((6-(7-(2-фтор-4-нітрофенокси)тієно[3,2-b]піридин-2-іл)піридин-3-іл)метил)-2(метилтіо)етанамін (95) До суспензії сполуки 94 (300 мг, 0,759 ммоль) у дихлорметані (20 мл) додають 2(метилтіо)етиламін (141 мкл, 1,518 ммоль) та оцтову кислоту (87 мкл). Після перемішування протягом 20 хвилин при кімнатній температурі, додають триацетоксиборгідрид натрію (482 мг, 2,276 ммоль). Реакційну суміш перемішують при КТ протягом 16 годин. Реакційну суміш потім розбавляють за допомогою ДХМ, промивають за допомогою 1N NaOH, сушать над безводним сульфатом натрію, фільтрують та концентрують. Сирий продукт очищують за допомогою Biotage (Snap 50г; MeOH/ДХМ: від 0/100 до 20/80 протягом пропускання 20 CV), що забезпечує одержання заголовної сполуки 95 (357 мг, кількісний вихід). MS (m/z): 471,5 (M+H). Стадія 2. трет-бутил (6-(7-(2-фтор-4-нітрофенокси)тієно[3,2-b]піридин-2-іл)піридин-3-іл)метил(2-(метилтіо)етил)карбамат (96) Суміш сполуки 95 (357 мг, 0,759 ммоль), Boc-ангідриду (414 мг, 1,897 ммоль), ДМАП (93 мг, 0,759 ммоль) та триетиламіну (106 мкл, 0,61 ммоль) у ДХМ (20 мл) перемішують протягом вихідних при КТ. Реакційну суміш потім концентрують, розбавляють етилацетатом, та послідовно промивають насиченим водним розчином бікарбонату натрію та насиченим водним розчином хлориду амонію, сушать над безводним сульфатом натрію, фільтрують та концентрують. Залишок очищують за допомогою Biotage (SNAP 100 г картридж; MeOH/ДХМ: від 0/100 до 20/80 протягом пропускання 20 CV), що забезпечує одержання заголовної сполуки 96 (220 мг, 0,386 ммоль, 50 % вихід). MS (m/z): 571,6 (M+H). Стадія 3. трет-бутил (6-(7-(2-фтор-4-нітрофенокси)тієно[3,2-b]піридин-2-іл)піридин-3іл)метил(2-(метилсульфоніл)етил)карбамат (97) До розчину сполуки 96 (220 мг, 0,386 ммоль) у MeOH (29 мл) та воді (10 мл) додають Oxone™ (486 мг, 0,790 ммоль). Реакційну суміш перемішують впродовж ночі, концентрують, обробляють 1N NaHSO3 розчином та водну фазу екстрагують за допомогою етилацетату. 16 UA 108878 C2 5 10 15 20 25 30 35 Органічний екстракт промивають водою, сушать над безводним сульфатом натрію, фільтрують та концентрують. Неочищену сполуку 97 (232 мг, 0,385 ммоль) використовують у наступній стадії без будь-якого додаткового очищення. MS (m/z): 603,6 (M+H). Стадія 4. трет-бутил (6-(7-(4-аміно-2-фторфенокси)тієно[3,2-b]піридин-2-іл)піридин-3іл)метил(2-(метилсульфоніл)етил)карбамат (98) До розчину сполуки 97 (232 мг, 0,385 ммоль) у MeOH (17,5 мл) та воді (1,75 мл) додають хлорид амонію (62 мг, 1,16 ммоль) та порошкове залізо (215 мг, 3,85 ммоль). Реакційну суміш нагрівають до зрошення протягом 2 годин, потім при КТ. Цю суспензію фільтрують через Celite™, промивають за допомогою MeOH, та фільтрат концентрують. Залишок очищують за допомогою Biotage (SNAP 25 г картридж; MeOH/ДХМ: від 0/100 до 20/80 протягом пропускання 20 CV), що забезпечує одержання заголовної сполуки 98 (241 мг, кількісний вихід). MS (m/z): 573,7 (M+H). Стадія 5. трет-бутил (6-(7-(4-(3-циклопропілуреїдо)-2-фторфенокси)тієно[3,2-b]піридин-2іл)піридин-3-іл)метил(2-(метилсульфоніл)етил)карбамат (99) До розчину сполуки 98 (115 мг, 0,20 ммоль) у ТГФ (20 мл) при -25 °C додають ДІПЕА (140 мкл, 0,80 ммоль), а потім трифосген (59,6 мг, 0,20 ммоль). Реакційну суміш перемішують при 25 °C впродовж 1 години, потім додають циклопропіламін (71 мкл, 1,00 ммоль) та реакційну суміш залишають нагрітися до КТ. Після перемішування впродовж ночі, реакцію у суміші гасять додаванням метанолу, концентрують, та розподіляють між EtOAc та насиченим водним розчином хлориду амонію. Органічну фазу сушать над безводним сульфатом натрію, фільтрують, та концентрують. Сирий продукт очищують за допомогою Biotage (Snap 25г; MeOH/ДХМ: від 0/100 до 20/80 протягом пропускання 20 CV), що забезпечує одержання заголовної сполуки 99 (120 мг, 0,18 ммоль, 91 % вихід). MS (m/z): 656,6 (M+H). Стадія 6. 1-циклопропіл-3-(3-фтор-4-(2-(5-((2-(метилсульфоніл)етиламіно)метил)-піридин-2іл)тієно[3,2-b]піридин-7-ілокси)феніл)сечовина (100) До розчину сполуки 99 (120 мг, 0,18 ммоль) у ДХМ (20 мл) додають ТФОК (5,6 мл). Реакційну суміш перемішують при КТ впродовж ночі, концентрують, розбавляють етилацетатом, промивають насиченим водним розчином бікарбонату натрію, сушать над безводним сульфатом натрію, фільтрують та концентрують. Сирий продукт очищують за допомогою Biotage (SNAP 25 г картридж; MeOH/ДХМ: від 0/100 до 20/80 протягом пропускання 20 CV), що забезпечує одержання заголовної сполуки 100 (90 мг, 0,13 ммоль, 72 % вихід, ТФОК сіль) у 1 вигляді майже білої твердої речовини. H ЯМР (400 MГц, ДМСО-d6) δ (ppm): 8,74 (s, 1H), 8,60 (s, 1H), 8,52 (d, J=5,2 Гц, 1H), 8,34 (s, 1H), 8,26 (d, J=8,4 Гц, 1H), 7,91 (d, J=8,0 Гц, 1H), 7,73 (dd, J=13,6, 2,4 Гц, 1H), 7,38 (t, J=8,8 Гц, 1H), 7,20 (d, J=10,0 Гц, 1H), 6,64 (d, J=5,2 Гц, 1H), 6,61 (s, 1H), 3,84 (s, 2H), 3,35-3,25 (m, 2H), 3,05 (s, 3H), 3,02-2,90 (m, 2H), 2,59-2,50 (m, 1H), 0,69-0,62 (m, 2H), 0,46-0,40 (m, 2H). MS (m/z): 556,5 (M+H). Схема 6 17 UA 108878 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 7 1-циклопропіл-3-(3-фтор-4-(2-(1-(2-((2-гідроксиетил)(метил)аміно)етил)-1H-піразол-4іл)тієно[3,2-b]піридин-7-ілокси)феніл)сечовина (151) Стадія 1: 2-(1-((1,3-діоксолан-2-іл)метил)-1H-піразол-4-іл)-7-(2-фтор-4-нітрофенокси)тієно[3,2-b]піридин (145) До суспензії сполуки 144 (3,57 г, 8,57 ммоль) у ДМЕ (50 мл) та воді (5 мл) додають 1-((1,3діоксолан-2-іл)метил)-4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1H-піразол (2 г, 7,14 ммоль), CsF (3,25 г, 21,42 ммоль), NaHCO3 (1,799 г, 36 ммоль) та Pd(PPh3)4 (0,825 г, 0,714 ммоль), та реакційну суміш нагрівають до зрошення впродовж ночі. Зазначену суміш охолоджують до КТ, розбавляють за допомогою EtOAc та промивають водою. Органічну фазу збирають, сушать над безводним Na2SO4, фільтрують та концентрують. Отриману тверду речовину розтирають з Et2O, що забезпечує одержання заголовної сполуки 145 (3 г, 95 % вихід) у вигляді бежевої твердої речовини. MS (m/z) = 443,51 (M+H). Стадія 2: 2-(4-(7-(2-фтор-4-нітрофенокси)тієно[3,2-b]піридин-2-іл)-1H-піразол-1-іл)ацетальдегід (146) До розчину сполуки 145 (900 мг, 2,034 ммоль) у ТГФ (20 мл) додають 3M HCl (30 мл) та реакційну суміш нагрівають до зрошення впродовж 24 годин. Зазначену суміш охолоджують до КТ, та концентрують. Водний розчин, що залишився, обробляють за допомогою твердого бікарбонату натрію та потім екстрагують за допомогою ДХМ. Органічну фазу збирають, сушать над безводним Na2SO4, фільтрують та концентрують. Неочищений альдегід 146 (810 мг, 100 % вихід) використовують у наступній стадії без додаткового очищення. MS (m/z) = 399,3 (M+H) Стадія 3: 2-((2-(4-(7-(2-фтор-4-нітрофенокси)тієно[3,2-b]піридин-2-іл)-1H-піразол-1іл)етил)(метил)аміно)етанол (147) До розчину сполуки 146 (810 мг, 2,033 ммоль) у ДХМ (40 мл) додають HOAc (0,233 мл, 4,07 ммоль) та 2-(метиламіно)етанол (305 мг, 4,07 ммоль), та реакційну суміш перемішують при КТ впродовж однієї години. Додають триацетоксиборгідрид натрію (1,293 г, 6,10 ммоль) та зазначену суміш перемішують при КТ впродовж ночі. Цю суміш потім розбавляють насиченим NaHCO3 розчином, потім додають твердий NaHCO 3 для нейтралізації кислоти. ДХМ шар збирають, сушать над безводним Na2SO4, фільтрують та концентрують, що забезпечує одержання заголовної сполуки 147 (930 мг, 100 % вихід), яку використовують безпосередньо у наступній стадії без додаткового очищення. MS (m/z) = 458,50 (M+H). Стадія 4: трет-бутил 2-((2-(4-(7-(2-фтор-4-нітрофенокси)тієно[3,2-b]піридин-2-іл)-1H-піразол1-іл)етил)(метил)аміно)етил-карбонат (148) До розчину сполуки 147 (930 мг, 2,033 ммоль) у ДХМ (40 мл) додають Boc 2O (1,331 г, 6,10 ммоль) та ДМАП (49,7 мг, 0,407 ммоль) та реакційну суміш перемішують при КТ впродовж ночі. Реакційну суміш концентрують та очищують шляхом колонкової хроматографії (елюент від EtOAc до 20 % MeOH у EtOAc), що забезпечує одержання заголовної сполуки 148 (420 мг, 37 % вихід) у вигляді коричневого масла. (MS (m/z) = 558,49 (M+H) Стадія 5: 2-((2-(4-(7-(4-аміно-2-фторфенокси)тієно[3,2-b]піридин-2-іл)-1H-піразол-1-іл)етил)(метил)аміно)етил трет-бутил-карбонат (149) До розчину сполуки 148 (420 мг, 0,753 ммоль) у MeOH (20 мл) додають хлорид амонію (81 мг, 1,506 ммоль) у воді (5 мл) та порошкоподібний цинк (197 мг, 3,01 ммоль) та реакційну суміш нагрівають до зрошення впродовж 3 годин. Зазначену суміш охолоджують до КТ, потім фільтрують та фільтрат концентрують при зниженому тиску. Залишок розчиняють у ДХМ та промивають водою. Органічну фазу збирають, сушать над безводним Na2SO4, фільтрують та концентрують, що забезпечує одержання заголовної сполуки 149 (397 мг, 100 % вихід), яку використовують безпосередньо у наступній стадії без додаткового очищення. MS (m/z) = 528,49 (M+H). Стадія 6: трет-бутил 2-((2-(4-(7-(4-(3-циклопропілуреїдо)-2-фторфенокси)тієно[3,2-b]піридин2-іл)-1H-піразол-1-іл)етил)(метил)аміно)етил-карбонат (150) До перемішуваного розчину сполуки 149 (0,397 мг, 0,752 ммоль) та піридину (0,183 мл, 2,257 ммоль) у ДМФА (20 мл) при 0ºC у атмосфері азоту додають феніл-хлорформіат (295 мг, 1,881 ммоль) та реакційну суміш перемішують при 0ºC впродовж 2 годин. Додають циклопропіламін (215 мг, 3,76 ммоль) та реакційну суміш нагрівають при 55ºC протягом 5 годин. Реакційну суміш розподіляють між EtOAc та насиченим розчином бікарбонату натрію, потім промивають насиченим розчином хлориду амонію та сольовим розчином, сушать над безводним сульфатом натрію, фільтрують та концентрують. Сирий продукт очищують шляхом колонкової хроматографії (від EtOAc до 30 % MeOH у EtOAc), що забезпечує одержання заголовної сполуки 150 (150 мг, 33 % вихід) у вигляді білої твердої речовини. MS (m/z) = 611,70 (M+H). Стадія 7: 1-циклопропіл-3-(3-фтор-4-(2-(1-(2-((2-гідроксиетил)(метил)аміно)етил)-1H-піразол 18 UA 108878 C2 5 10 15 20 25 30 35 40 45 4-іл)тієно[3,2-b]піридин-7-ілокси)феніл)сечовина (151) До розчину сполуки 150 (150 мг, 0,246 ммоль) у ДХМ (10 мл) додають HCl у діоксані (0,307 мл, 1,118 ммоль) та білий осад перемішують при КТ впродовж 2 годин. Цю суміш розбавляють насиченим NaHCO3 розчином та перемішують впродовж 10 хвилин перед розділенням шарів. Органічну фазу збирають, сушать над Na 2SO4, фільтрують та концентрують. Залишок очищують шляхом колонкової хроматографії (елюент від EtOAc до 30 % MeOH у EtOAc), що забезпечує 1 одержання заголовної сполуки 151 (100 мг, 80 % вихід) у вигляді білої твердої речовини. H ЯМР (400 MГц, ДМСО-d6) δ (ppm): 8,43 (d, J=5,48 Гц, 1H), 7,84 (s, 1H), 7,77 (s, 1H), 7,63 (m, 1H), 7,47 (s, 1H), 7,17 (m, 2H), 7,03 (s, 1H), 6,45 (d, J=5,48 Гц, 1H), 4,92 (s, 1H), 4,27 (t, J=6,26 Гц, 2H), 3,56 (t, J=5,08 Гц, 2H), 2,95 (t, J=6,26 Гц, 2H), 2,60 (m, 3H), 2,34 (s, 3H), 0,91 (m, 2H), 0,72 (m, 2H). MS (m/z) = 511,60 (M+H). Схема 7 Приклад 8 N-((2-(7-(4-(3-циклопропілуреїдо)-2-фторфенокси)тієно[3,2-b]піридин-2-іл)-1-метил-1Hімідазол-5-іл)метил)-2-гідрокси-N-(2-метоксиетил)ацетамід (209) Стадія 1: 2-(((2-(7-(2-фтор-4-нітрофенокси)тієно[3,2-b]піридин-2-іл)-1-метил-1H-імідазол-5іл)метил)(2-метоксиетил)аміно)-2-оксоетилацетат (206) До розчину сполуки 158 (423 мг, 0,925 ммоль) у ДМФА (18 мл) додають 2-ацетоксиоцтову кислоту (164 мг, 1,387 ммоль), ДІПЕА (0,565 мл, 3,24 ммоль) та HATU реагент (1055 мг, 2,77 ммоль). Реакційну суміш перемішують при кімнатній температурі протягом 1 години, що супроводжують додаванням NaHCO3 насиченого розчину (200 мл) та EtOAc (300 мл). Утворюється білий осад, який збирають фільтруванням та відкидають. Органічний шар фільтрату збирають, сушать над безводним сульфатом натрію та концентрують, що приводить до одержання жовтуватої твердої речовини, яку розтирають з ефіром, що приводить до одержання заголовної сполуки 206 (570 мг, 111 % вихід, неочищений матеріал), яку + використовують у наступній стадії без додаткового очищення. MS: 558 (MH) . Стадія 2: 2-(((2-(7-(4-аміно-2-фторфенокси)тієно[3,2-b]піридин-2-іл)-1-метил-1H-імідазол-5іл)метил)(2-метоксиетил)аміно)-2-оксоетилацетат (207) Реакційну суміш, що складається зі сполуки 206 (300 мг, 0,538 ммоль), хлориду амонію (24,75 мг, 0,463 ммоль) та порошкового заліза (255 мг, 4,57 ммоль) у суміші етанол (6 мл)/вода (3,0 мл) нагрівають до зрошення протягом 1 години. Реакційну суміш фільтрують гарячою та концентрують. Залишок очищують за допомогою Biotage (MeOH/ДХМ, 0-20 %, SNAP 25 г картридж), що забезпечує одержання заголовної сполуки 207 (133 мг, 0,252 ммоль, 47 % вихід) у вигляді білої твердої речовини. MS: 528 (MH)+. Стадія 3: 2-(((2-(7-(4-(3-циклопропілуреїдо)-2-фторфенокси)тієно[3,2-b]піридин-2-іл)-1-метил1H-імідазол-5-іл)метил)(2-метоксиетил)аміно)-2-оксоетилацетат (208) До розчину сполуки 207 (130 мг, 0,246 ммоль) у ТГФ (20 мл) при 0 °C додають ДІПЕА (0,172 мл, 0,986 ммоль) та трифосген (43,9 мг, 0,148 ммоль). Реакційну суміш перемішують протягом 1 години при 0 °C перед додаванням циклопропіламіну (70,3 мг, 1,232 ммоль). Реакційну суміш залишають нагрітися до кімнатної температури та перемішують протягом 1 години перед концентруванням. Залишок очищують за допомогою Biotage (MeO/ДХМ, 0-20 %, SNAP 25 г картридж), що забезпечує одержання заголовної сполуки 208 (104 мг, 0,170 ммоль, 69 % вихід) у вигляді білої твердої речовини. MS: 611 (MH)+. 19 UA 108878 C2 5 10 15 20 Стадія 4: N-((2-(7-(4-(3-циклопропілуреїдо)-2-фторфенокси)тієно[3,2-b]піридин-2-іл)-1-метил1H-імідазол-5-іл)метил)-2-гідрокси-N-(2-метоксиетил)ацетамід (209) До розчину сполуки 208 (104 мг, 0,170 ммоль) у ТГФ (18 мл) додають розчин LiOH (32,6 мг, 1,362 ммоль) у воді (6 мл) та зазначену суміш перемішують протягом 2 годин при кімнатній температурі перед концентруванням. Залишок очищують за допомогою Biotage (MeOH/ДХМ, 020 %, SNAP 25 г картридж), що приводить до одержання заголовної сполуки 209 (40 мг, 0,070 1 ммоль, 41 % вихід) у вигляді білої твердої речовини. H ЯМР (400 MГц, ДМСО-d6) δ (ppm): 8,75 (s, 1H), 8,55 (d, 1H, J=5,3Гц), 7,94 (s, 1H), 7,75 (dd, 1H, J1=2,3Гц, J2=13,5Гц), 7,41 (t, 1H, J=9,0Гц), 7,24-7,22 (m, 1H), 7,09 (s, 1H), 6,70 (d, 1H, J=5,5Гц), 6,60 (m, 1H), 4,74 (s, 2H), 4,68-4,66 (m, 1H), 4,24 (d, 2H, J=5,7Гц), 3,87 (s, 3H), 3,45 (m, 2H), 3,35 (s, 3H), 3,28 (m, 2H), 2,60-2,57 (m, 1H), 0,710,67 (m, 2H), 0,48-0,45 (m, 2H). MS: 569,6 (MH)+ Приклад 9 1-((2-(7-(4-Ізопропіламінокарбоніламіно-2-фторфенокси)тієно[3,2-b]піридин-2-іл)-1-метил-1Hімідазол-5-іл)метил)-3-ізопропіл-1-(2-метоксиетил)сечовина (192) Сполуку 192 одержують, слідуючи процедурам, подібним до тих, що використані у схемі 7 для синтезу сполуки 209 шляхом заміни 2-ацетоксиоцтової кислоти у присутності ДІПЕА та HATU реагенту на трифосген, а потім ізопропіламін у стадії 1, та циклопропіламін на 1 ізопропіламін у стадії 3. H ЯМР (400 MГц, ДМСО-d6) δ (ppm): 8,67 (s, 1H), 8,49 (d, J=5,5 Гц, 1H), 7,89 (s, 1H), 7,68 (dd, J1=2,6 Гц, J2=13,5 Гц, 1H), 7,34 (t, J=9,0 Гц, 1H), 7,12-7,09 (m, 1H), 6,94 (s, 1H), 6,64 (d, J=5,5 Гц, 1H), 6,14-6,09 (m, 2H), 4,55 (s, 2H), 3,83 (s, 3H), 3,80-3,74 (m, 2H), 3,38-3,27 (m, 4H), 3,21 (s, 3H), 2,06-1,04 (m, 12H). MS (m/z) = 598,6 (M+H). Схема 8 25 Приклад 10 1-Циклопропіл-3-(3-фтор-4-(2-(5-(4-(4-метилпіперазин-1-іл)піперидин-1-карбоніл)піридин-2іл)тієно[3,2-b]піридин-7-ілокси)феніл)сечовина (234) Стадія 1: 6-(7-(4-(3-Циклопропілуреїдо)-2-фторфенокси)тієно[3,2-b]піридин-2-іл)-нікотинова 20 UA 108878 C2 5 10 15 20 25 кислота (225) До суспензії альдегіду 47 (200 мг, 0,446 ммоль) у ДМФА (10 мл) додають Oxone® (330 мг, 0,535 ммоль) при КТ та реакційну суміш перемішують при 50 °C протягом 16 годин. Реакційну суміш охолоджують до 0 °C, обробляють 1N водним розчином HCl (20 мл) та перемішують при КТ протягом ще однієї години. Отриманий осад збирають фільтруванням, промивають водою (30 мл) та сушать. Сирий продукт розтирають з MeOH, що забезпечує одержання заголовної сполуки 225 (165 мг, 80 % вихід) у вигляді бежевої твердої речовини. ЯМР (400 MГц, CD 3OD) δ (ppm): 9,66 (bs, 1H), 8,98 (dd, J=1,9, 0,9 Гц, 1H), 8,51 (d, J=5,5 Гц, 1H), 8,31 (s, 1H), 8,22 (dd, J=8,1, 1,9 Гц, 1H), 8,17 (dd, J=8,1, 0,9 Гц, 1H), 7,77 (dd, J=13,7, 2,5 Гц, 1H), 7,45 (bs, 1H), 7,37 (t, J=9,1 Гц, 1H), 7,26 (dd, J=8,9, 1,5 Гц, 1H), 6,62 (d, J=5,3, 0,8 Гц, 1H), 2,60-2,52 (m, 1H), 0,69-0,56 + (m, 2H), 0,50-0,37 (m, 2H). [Карбоновий OH не спостерігається]. MS: 465,3 (MH) Стадія 2: 1-Циклопропіл-3-(3-фтор-4-(2-(5-(4-(4-метилпіперазин-1-іл)піперидин-1-карбоніл)піридин-2-іл)тієно[3,2-b]піридин-7-ілокси)феніл)сечовина (234) До перемішуваного розчину кислоти 225 (300 мг, 0,646 ммоль) у ДМФА (10 мл) при 0 °C додають HOBt (198 мг, 1,292 ммоль), ЕДХ (248 мг, 1,292 ммоль) та 1-метил-4-(піперидин-4іл)піперазин (118 мг, 0,646 ммоль). Реакційну суміш перемішують при кімнатній температурі впродовж ночі, розбавляють NaHCO3 насиченим розчином, та екстрагують за допомогою EtOAc. Екстракт сушать над безводним Na2SO4 та концентрують у вакуумі. Залишок очищують три рази шляхом Biotage (MeOH/EtOAc, 0-50 %, 25г колонка), що супроводжують очищенням на Gilson [MeOH/H2O, 50-95 %, HCOOH (0,05 %)], що забезпечує одержання заголовної сполуки 234 (50 мг, 0,079 ммоль, 12,29 % вихід) у вигляді моно-форміатної солі. ЯМР (400 MГц, CD3OD) δ (ppm): 8,67 (dd, J1=0,8 Гц, J2=2,1 Гц, 1H, ), 8,48 (s, 1H), 8,47 (s, 1H), 8,19 (dd, J1=0,8 Гц, J2=8,3 Гц, 1H), 8,16 (s, 1H), 7,97 (dd, J1=2,2Гц, J2=8,2Гц, 1H), 7,65 (dd, J1=2,4Гц, J2=13,1Гц, 1H), 7,29 (t, 1H, J=8,8 Гц, H), 7,20-7,18 (m, 1H), 6,65 (dd, J1=0,8 Гц, J2=5,5 Гц, 1H), 3,83 (br. s, 1H), 3,24 (br s, 1H), 3,01 (br. s, 6H), 2,85 (br. s, 3H), 2,76-2,70 (m, 2H), 2,67 (s, 3H), 2,61-2,57(m, 1H), 2,02 (br. s, 1H), + 1,91-1,85 (br. s, 1H), 1,56-1,49 (br. s, 2H), 0,78-0,74 (m, 2H), 0,55-0,51(m, 2H). MS: 630,4 (MH) Схема 9 30 21 UA 108878 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 11 1-циклопропіл-3-(3-фтор-4-(2-(1-(2-морфоліноетил)-1H-імідазол-4-іл)тієно[3,2-b]піридин-7ілокси)феніл)сечовина (265) Стадія 1. 1-(2,2-діетоксиетил)-4-йод-1H-імідазол (260) До перемішуваного розчину 4йодімідазолу (10 г, 51,6 ммоль) та бромацетальдегід діетил-ацеталю (9,31 мл) у ДМСО (30 мл) додають K2CO3 (10,69 г, 77 ммоль). Реакційну суміш нагрівають при 110 °C протягом 16 годин. Після охолодження до КТ, реакційну суміш розбавляють водою та екстрагують за допомогою AcOEt. Органічний екстракт промивають за допомогою сольового розчину, сушать над безводним сульфатом натрію, фільтрують та концентрують. Залишок очищують за допомогою Biotage (SNAP 80 г картридж; AcOEt/Hex: від 0/100 до 50/50 протягом пропускання 20 CV). Бажані фракції збирають та концентрують, що забезпечує одержання заголовної сполуки 260 (11,29 г, 36,4 ммоль, 71 % вихід) у вигляді жовтого масла. MS (m/z): 310,97 (M+H). Стадія 2. 7-хлор-2-(1-(2,2-діетоксиетил)-1H-імідазол-4-іл)тієно[3,2-b]піридин (261) До перемішуваного розчину 7-хлортієно[3,2-b]піридину (9,26 г, 54,6 ммоль) у ТГФ (88 мл) при -15 °C додають n-BuLi (21,84 мл, 54,6 ммоль). Через 30 хвилин, розчин ZnCl2 0,5M у ТГФ (109 мл, 54,6 ммоль) додають при -15 °C та реакційну суміш нагрівають до КТ впродовж 45 хвил. Додають розчин тетракістрифенілфосфіну паладію (0,841 г, 0,73 ммоль) та йодиду 260 (11,29 г, 36,4 ммоль) у ТГФ (33 мл) та цю суміш нагрівають до зрошення протягом 3 годин, потім концентрують. Залишок розбавляють водою та гідроксидом амонію та екстрагують за допомогою ДХМ. Органічний екстракт промивають за допомогою сольового розчину, сушать над безводним сульфатом натрію, фільтрують та концентрують. Залишок очищують за допомогою Biotage (SNAP 80 г картридж; AcOEt/Hex: від 0/100 до 100/0 протягом пропускання 20 CV), що приводить до одержання матеріалу, який після розтирання з MTBE забезпечує одержання заголовної сполуки 261 (1,2 г, 3,41 ммоль, 9 % вихід) у вигляді світло-коричневої твердої речовини. MS (m/z): 437,45 (M+H). Стадія 3. 4-(2-(1-(2,2-діетоксиетил)-1H-імідазол-4-іл)тієно[3,2-b]піридин-7-ілокси)-3фторанілін (262) До перемішуваного розчину гідрохлориду 4-аміно-2-фторфенолу (1,39 г, 8,53 ммоль) у ДМСО (20 мл) додають t-BuOK (1,99 г, 17,76 ммоль). Через 30 хвилин, додають хлорид 261 (2,5 г, 7,11 ммоль) та реакційну суміш нагрівають при 100 °C протягом 1 години. У окремій колбі розчин гідрохлориду 4-аміно-2-фторфенолу (1,39 г, 8,53 ммоль) у ДМСО (20 мл) обробляють за допомогою t-BuOK (1,99 г, 17,76 ммоль) та отриманий фенолятний розчин додають до вихідної реакційної суміші при 100 °C. Через 30 хвилин, цю суміш виливають у воду (300 мл) з утворенням осаду, який збирають фільтруванням та сушать у високому вакуумі, що забезпечує одержання заголовної сполуки 262 (2,86 г, 6,46 ммоль, 91 % вихід) у вигляді світлокоричневої твердої речовини. MS (m/z): 443,44 (M+H). Стадія 4. 1-циклопропіл-3-(4-(2-(1-(2,2-діетоксиетил)-1H-імідазол-4-іл)тієно[3,2-b]піридин-7ілокси)-3-фторфеніл)сечовина (263) До перемішуваного розчину аміну 262 (2,86 г, 6,46 ммоль) та піридину (1,04 мл, 12,93 ммоль) у ДМФА (50 мл) при 0 °C додають феніл-хлорформіат (973 мкл, 7,76 ммоль). Через 30 хвилин, циклопропіламін (1,14 мл, 16,16 ммоль) додають при 0 °C та реакційну суміш нагрівають при 60 °C протягом 45 хвил. Додають ще циклопропіламіну (1 мл, 14,18 ммоль) та реакційну суміш нагрівають при 60 °C протягом додаткових 10 хвилин. Після охолодження до КТ, реакцію у суміші гасять додаванням води з утворенням осаду. Тверду речовину збирають фільтруванням, промивають водою та сушать у вакуумі протягом 2 годин. Залишок очищують за допомогою Biotage (SNAP 80 г картридж; MeOH/ДХМ: від 0/100 до 10/90 протягом пропускання 20 CV). Бажані фракції збирають, концентрують, розтирають з MTBE та сушать у високому вакуумі, що забезпечує одержання заголовної сполуки 263 (2,95 г, 5,61 ммоль, 87 % вихід) у вигляді рожевої твердої речовини. MS (m/z): 526,60 (M+H). Стадія 5. 1-циклопропіл-3-(3-фтор-4-(2-(1-(2-оксоетил)-1H-імідазол-4-іл)тієно[3,2-b]піридин-7ілокси)феніл)сечовина (264) До розчину ацеталю 263 (2,95 г, 5,61 ммоль) у AcOH/H 2O (20/20 мл) додають концентровану HCl (2 мл) та реакційну суміш нагрівають при 90 °C впродовж 1 години. Реакційну суміш концентрують, розбавляють водою та 4M NaOH до pH 10 з утворенням осаду, який збирають фільтруванням, промивають водою та сушать у вакуумі. Цей матеріал потім очищують шляхом Biotage (SNAP 100 г картридж; 2 % гідроксиду амонію у MeOH/ДХМ: від 0/100 до 15/85, протягом пропускання 20 CV), що забезпечує одержання заголовної сполуки 264 (1,2 г, 2,66 ммоль, 47 % вихід) у вигляді коричневої твердої речовини. MS (m/z): 484,51 (M+H). Стадія 6. 1-циклопропіл-3-(3-фтор-4-(2-(1-(2-морфоліноетил)-1H-імідазол-4-іл)тієно[3,2b]піридин-7-ілокси)феніл)сечовина (265) 22 UA 108878 C2 5 10 15 20 25 30 35 40 45 50 55 60 До розчину сполуки 264 (200 мг, 0,443 ммоль), морфоліну (46 мкл, 0,532 ммоль) та AcOH (51 мкл, 0,886 ммоль) у NMP (10 мл) додають триацетоксиборгідрид натрію (282 мг, 1,329 ммоль) та реакційну суміш перемішують протягом 18 годин при КТ. Реакційну суміш гасять водою та екстрагують за допомогою ДХМ. Органічний екстракт послідовно промивають насиченим розчином хлориду амонію та сольовим розчином, сушать над безводним сульфатом натрію, фільтрують та концентрують. Залишок очищують за допомогою Biotage (SNAP 40 г картридж; 2 % гідроксиду амонію у MeOH/ДХМ: від 0/100 до 15/85 протягом пропускання 20 CV) та шляхом Gilson (Phenomenex, Luna 15µ, C18(2) 100A, 250 × 50,0 мм, 15 мкм; 0,05 % мурашиної кислоти у обох MeOH/вода: від 20/80 до 95/5 впродовж 60 хвилин, потік: 30 мл/хвил.), що забезпечує одержання заголовної сполуки 265 (30 мг, 0,057 ммоль, 13 % вихід, форміатна сіль) у вигляді 1 білої твердої речовини. H ЯМР (400 MГц, ДМСО-d6) δ (ppm): 9,52 (bs, 1H), 8,41 (d, J=5,6 Гц, 1H), 8,36 (bs, 1H), 7,92 (d, J=1,2 Гц, 1H), 7,78 (d, J=1,2 Гц, 1H), 7,71 (dd, J=2,4 та 14,0 Гц, 1H), 7,65 (s, 1H), 7,33 (t, J=9,2 Гц, 1H), 7,32 (bs, 1H), 7,22 (dd, J=1,6 та 8,8 Гц, 1H), 6,54 (d, J=5,6 Гц, 1H), 4,14 (t, J=6,0 Гц, 2H), 3,57 (t, J=4,4 Гц, 4H), 2,66 (t, J=6,4 Гц, 2H), 2,58-2,51 (m, 1H), 2,49-2,40 (m, 4H), 0,64-0,59 (m, 2H), 0,43-0,39 (m, 2H). MS (m/z): 523,55 (M+H). Фармацевтичні композиції У деяких варіантах втілення, даний винахід забезпечує фармацевтичні композиції, що включають сполуку у відповідності з даним винаходом та фармацевтично прийнятний носій, наповнювач або розріджувач. Композиції даного винаходу можуть бути сформульовані за будьяким способом, добре відомим у даній галузі техніки, та можуть бути одержані для введення різними шляхами, включаючи місцевий, інтравітреальний, періорбітальний, внутрішньоочний та інші способи місцевого введення у око, очні та/або навколоочні тканини та простори, включаючи введення за допомогою пристроїв доставки. У деяких варіантах втілення, введення може відбуватися пероральним шляхом. Характеристики носію, наповнювача або розріджувача будуть залежати від шляху введення. Як використано у цьому описі, термін "фармацевтично прийнятний" означає нетоксичний матеріал, який є сумісним з біологічною системою, такою як клітина, клітинна культура, тканина або організм, та який не заважає ефективності біологічної активності активного(их) інгредієнту(ів). Таким чином, композиції у відповідності з даним винаходом можуть містити, окрім інгібітору, розріджувачі, наповнювачі, солі, буфери, стабілізатори, солюбілізатори та інші матеріали, добре відомі у даній галузі техніки. Одержання фармацевтично прийнятних композицій описане, наприклад, у Remington's Pharmaceutical Sciences, 18-те видання, ред. A. Gennaro, Mack Publishing Co., Easton, Pa., 1990. Активну сполуку включають у фармацевтично прийнятний носій, наповнювач або розріджувач у кількості, достатній для доставки пацієнту терапевтично ефективної кількості без спричинення серйозних токсичних ефектів у пацієнта, якого лікують. Інтервал ефективної дози фармацевтично прийнятної похідної може бути розрахований на основі маси вихідної сполуки, яку необхідно доставити. Якщо похідна показує активність сама по собі, ефективна доза може бути оцінена як описано вище, використовуючи масу похідної, або шляхом інших засобів, відомих спеціалістам, кваліфікованим у даній галузі техніки. Приклади досліджень Інгібування VEGF активності Наступний протокол використовують для дослідження сполук даного винаходу. Приклад Дослідження 1 In Vitro дослідження рецепторної тирозин-кінази (VEGF рецептор KDR) У цьому тесті вимірюють здатність сполук інгібувати ферментативну активність рекомбінантного людського VEGF рецептору. 1,6-kb кДНК (де kb – тисяча пар нуклеотидів), яка відповідає каталітичному домену VEGFR2 (KDR) (номер доступу в Genbank AF035121 амінокислоти від 806 до 1356) клонують у Pst I сайт pDEST20 Gateway вектору (Invitrogen) для продукування GST-міченої версії цього ферменту. Цю конструкцію використовують для створення рекомбінантного бакуловірусу, використовуючи систему Bac-to-BacTM, відповідно до інструкцій виробника (Invitrogen). Білок GST-VEGFR2806-1356 експресують у клітинах Sf9 (Spodoptera frugiperda) після інфікування конструкцією рекомбінантного бакуловірусу. Описуючи коротко, клітини Sf9, які вирощують у суспензії та підтримують у безсироватковому середовищі (Sf900 II доповненому 6 гентаміцином) при щільності клітин приблизно 2 × 10 клітин/мл, інфікують зазначеними вище вірусами при множинності зараження (MOI) 0,1 впродовж 72 годин при 27 °C при перемішуванні зі швидкістю 120 об./хвил. на роторному шейкері. Інфіковані клітини збирають центрифугуванням при 398g впродовж 15 хвилин. Клітинну масу заморожують при -80 °C до проведення очищення. 23 UA 108878 C2 5 10 15 20 25 30 Всі стадії, описані для клітинної екстракції та очищення проводять при 4 °C. Заморожені клітинні маси Sf9, інфіковані GST-VEGFR2806-1356 рекомбінантним бакуловірусом розморожують та обережно ресуспендують у Буфері A (PBS (фосфатно-сольовий буфер) pH 7,3, доповненому 1 мкг/мл пепстатину, 2 мкг/мл Апротиніну та лейпептину, 50 мкг/мл PMSF, 50 мкг/мл TLCK та 10 мкM E64 та 0,5 мM DTT), використовуючи 3 мл буферу на грам клітин. Суспензію гомогенізують у гомогенізаторі Даунса та до гомогенізату додають 1 % Triton X-100, після чого його центрифугують при 22500g, 30 хвилин, 4 °C. Супернатант (клітинний екстракт) використовують як вихідний матеріал для очищення GST-VEGFR2806-1356. Супернатант завантажують у колонку з GST-агарозою (Sigma), урівноважену за допомогою PBS pH 7,3. З наступним промиванням чотирма об'ємами колонки (CV) з використанням PBS pH 7,3+1 % Triton X-100 та промивання 4 CV з використанням буферу B (50 мM Тріс pH 8,0, 20 % гліцерин та 100 мM NaCl), зв'язані білки східчасто елюють з використанням 5 CV буферу B, доповненого 5 мM DTT та 15 мM глутатіону. Фракції, збагачені GST-VEGFR2806-1356, після зазначеної стадії хромаграфування, об'єднують, виходячи з УФ записів, тобто фракції з високою оптичною щільністю (O.D.) 280. Кінцеві концентрації препаратів білку GST-VEGFR2806-1356 становлять приблизно 0,7 мг/мл з чистотою, наближеною до 70 %. Очищені вихідні розчини білку GST-VEGFR2806-1356 розділяють на аліквоти та заморожують при -80 °C до використання у ферментативному дослідженні. Інгібування VEGFR/KDR вимірюють у дослідженні DELFIATM (Perkin Elmer). Субстрат полі(Glu4,Tyr) іммобілізують на чорних полістиролових 96-лункових планшетах з високим ступенем зв'язування. Покриті планшети промивають та зберігають при 4 °C. Під час дослідження, фермент пре-інкубують з інгібітором та Mg-АТФ на льоду у поліпропіленових 96лункових планшетах впродовж 4 хвил., а потім переносять в покриті планшети. Наступна кіназна реакція відбувається при 30 °C впродовж 10-30 хвилин. Концентрації АТФ у дослідженні становлять 0,6 мкM для VEGFR/KDR (2X Km (константа Міхаеліса)). Концентрація ферменту становить 5 нM. Після інкубування, кіназні реакції гасять за допомогою ЕДТК та промивають планшети. Фосфорильований продукт визначають шляхом інкубування з міченим Європієм анти-фосфотирозин MoAb. Після промивання планшетів, зв'язаний MoAb визначають з використанням методу роздільної за часом флуоресценції у планшет-рідері SpectraMax Gemini (Molecular Devices). Роблять оцінку сполук відносно діапазону концентрацій та значень IC 50 (концентрація сполуки, що забезпечує 50 % інгібування ферментативної активності). Результати показані в Таблиці 1. В цій таблиці, "a" вказує на те, що значення IC 50 становить менше ніж 50 нМ; "b" вказує на те, що значення IC50 50, але 100 нМ, "c" вказує на те, що значення IC50 100, але < 250 нМ; та "d" вказує на те, що значення IC50 ≥ 250 нМ. 35 Таблиця 1 Спол. № 2 6 26 74 80 100 151 192 209 234 265 40 45 VEGFR IC50 (мкM) a a a a a a a b a a a Приклад Дослідження 2 VEGF-залежне ERK фосфорилювання Клітини та фактор росту: Клітини HUVEC замовляють у Cambrex Bio Science Walkersville, Inc та піддають культивуванню відповідно до інструкцій постачальника. Повнорозмірну кодуючу послідовність VEGF165 клонують, використовуючи технологію клонування Gateway Cloning Technology (Invitrogen) для експресії клітин Sf9 бакуловірусу. VEGF 165 очищують від кондиціонованого середовища, використовуючи NaCl градієнтне елюювання з HiTrap гепаринової колонки (GE Healthcare Life Sciences) з наступним градієнтним елююванням імідазолом з HiTrap хелатуючої колонки (GE Healthcare Life Sciences), потім зберігають у буфері з PBS, доповненому 0,1 % BSA, та стерилізують шляхом фільтрування. 24 UA 108878 C2 5 10 15 20 25 30 35 40 45 50 55 Клітинні дослідження: Клітини засівають при концентрації 8000 клітин/лунку у 96 лунковий планшет та вирощують впродовж 48 годин. Потім клітини вирощують впродовж ночі у сироватковому та вільному від фактору середовищі та піддають дії розведенням сполук впродовж 1,5 год. Після 15 хвил. інкубування у середовищі, клітини VEGF 165 (150 нг/мл) лізують у льодяному буфері для лізису (50 мM HEPES, pH 7,4, 150 мM NaCl, 1,5 мM MgCl 2, 1 % Triton X100, 10 % гліцерин), що містить 1 мM 4-(2-аміноетил)бензолсульфонілфториду гідрохлориду, 200 мкM ортованадату натрію, 1 мM фториду натрію, 10 мкг/мл лейпептину, 10 мкг/мл апротиніну, 1 мкг/мл пепстатину та 50 мкг/мл Na-п-тозил-L-лізин-хлорметилкетону гідрохлориду, та обробляють як Вестерн блоти для виявлення анти-фосфо ERK1/2 (T202/Y204) (Cell Signaling Technologies). Вестерн-блотинг: зразки лізатів з разово-оброблених лунок розділяють на 5-20 % SDSPAGE гелях та імуноблотинг здійснюють, використовуючи полівініліденові дифторидні мембрани Immobilon (Amersham) у відповідності з інструкціями виробника. Блоти промивають у Tris-забуференому фізіологічному розчині з 0,1 % детергентом Tween 20 (TBST) та досліджують на антитіла проти фосфо-Thr202/Tyr204-ERK (Cell Signaling Technologies). Хемілюмінесцентний детекторний аналіз (Amersham, ECL plus) здійснюють відповідно до інструкцій виробника, використовуючи денситометр Storm (GE Healthcare; 800 PMT, роздільна здатність 100 нM) для формування зображення та денситометричних досліджень. Значення діапазону розведень використовують для побудови кривих IC50, використовуючи 4-параметрову узгоджену модель. Зазначені криві прораховують з використанням програмного забезпечення GraFit 5.0. Приклад Дослідження 3 In Vivo модель хороїдальної неоваскуляризації (CNV) У цьому дослідженні визначають здатність сполук інгібувати прогресування CNV. CNV представляє собою основну причину сильної втрати зору у пацієнтів, що страждають від вікової макулярної дегенерації (AMD). У цих дослідженнях використовували сірих щурів (Brown-Norway rats) чоловічої статі (Japan Clea Co., Ltd.). Щурів анестезувати внутрішньочеревинною ін'єкцією пентобарбіталу, та розширили праву зіницю за допомогою 0,5 % тропікаміду та 0,5 % фенілефрину гідрохлориду. У правому оці виконали 6 лазерних опіків між ретинальними судинами, використовуючи систему доставки опромінення щілинною лампою Green laser Photocoagulator (Nidex Inc, Японія), та TM використовуючи предметне скло Healon (AMO Inc) як контактні лінзи. Потужність лазера становила 100 або 200 мВт впродовж 0,1 секунди та діаметр щілини становив 100 мкм. Під час випалювання лазером, спостерігали утворення бульбашок, що є ознакою руйнування оболонки Бруха, яка є важливою для генерації CNV. Щурів розділяли на групи, виходячи з їх маси тіла, використовуючи програмне забезпечення SAS (SAS institute Japan, R8.1) після опромінення лазером (День 0). Після цього тварин анестезувати, та розширювали праву зіницю (як описано вище), у праве око тварини шляхом ін'єкції (10 мкл/око) вводили сполуку або інертний носій у дозах 10 або 3 нмоль/око у День 3. Сполуки перед ін'єкцією були розчинені або суспендовані у CBS (цитратно-сольовому буфері), PBS або іншому прийнятному носії. У День 10, тварин анестезували з використанням ефіру, і через хвостову вену (20 мг/щура) здійснили ін'єкцію високомолекулярного флуоресцеїн ізотіоціанату (FITC)-декстрану (SIGMA, 2 6 × 10 молекулярна маса). Приблизно через 30 хвилин після ін'єкції (FITC)-декстрану, тварин піддавали евтаназії ефіром або діоксидом вуглецю, очі вилучали та зафіксовували з використанням 10 % розчину буферного нейтрального формаліну. Через 1 годину після фіксації, отримували плоскі гістологічні зрізи ПЕС (пігментного епітелію сітківки) - судинної оболонки ока - білкової оболонки ока, шляхом видалення рогівки, кришталика та сітківки з очного яблука. Плоскі гістологічні зрізи були підготовлені до мікроскопічного дослідження у 50 % гліцерині на предметному склі мікроскопу, та ділянки, випалені лазером, були сфотографовані з використанням флуоресцентного мікроскопу (Nikon Corporation, фільтр збудження: 465-495 нм, фільтр абсорбції: 515-555 нм). Область CNV одержували шляхом визначення гіперфлуоресцентних областей, які спостерігаються на фотографії із застосуванням Scion image. Середня область CNV з 6 опіків використовувалась як окреме значення області CNV, та середня область CNV з групи, обробленої сполукою, порівнювалась з відповідною групою, обробленою інертним носієм. Результати з деякими зі сполук даного винаходу показані у Таблиці 2, та виражені як % інгібування прогресування CNV ("A" вказує на більше ніж або еквівалентне 60 % інгібування, та "B" вказує на інгібування від ≥40 % до
ДивитисяДодаткова інформація
Назва патенту англійськоюInhibitors of protein tyrosine kinase activity and use thereof to treat ophthalmic disorders
Автори англійськоюRaeppel, Stephane, Zhan, Lijie, Claridge, Stephen William, Raeppel, Franck, Gaudette, Frederic, Vaisburg, Arkadii
Автори російськоюРаппель Стефан, Жан Лиджи, Кларидж Стивен Уильям, Раппель Франк, Годетт Фредерик, Вайсбург Аркадий
МПК / Мітки
МПК: A61K 31/5377, A61K 31/444, A61K 31/4365, A61K 31/496, A61P 27/02, C07D 495/04
Мітки: інгібітори, активності, протеїнтирозинкіназної
Код посилання
<a href="https://ua.patents.su/34-108878-ingibitori-protentirozinkinazno-aktivnosti.html" target="_blank" rel="follow" title="База патентів України">Інгібітори протеїнтирозинкіназної активності</a>
Попередній патент: Спосіб та композиція для системи довготривалого виділення аромату та смаку
Наступний патент: Спосіб обробки потоку крекінг-газу, який виходить з установки піролізу вуглеводнів, та відповідна установка
Випадковий патент: Розсувна колісна пара рейкового рухомого складу