Спосіб одержання сполучень beta-лактама
Номер патенту: 6041
Опубліковано: 29.12.1994
Автори: Косімо Скарафілє, Джованні Франческі, Федеріко Аркамоне, Аврора Санфіліппо, Маурізіо Фольо
Формула / Реферат
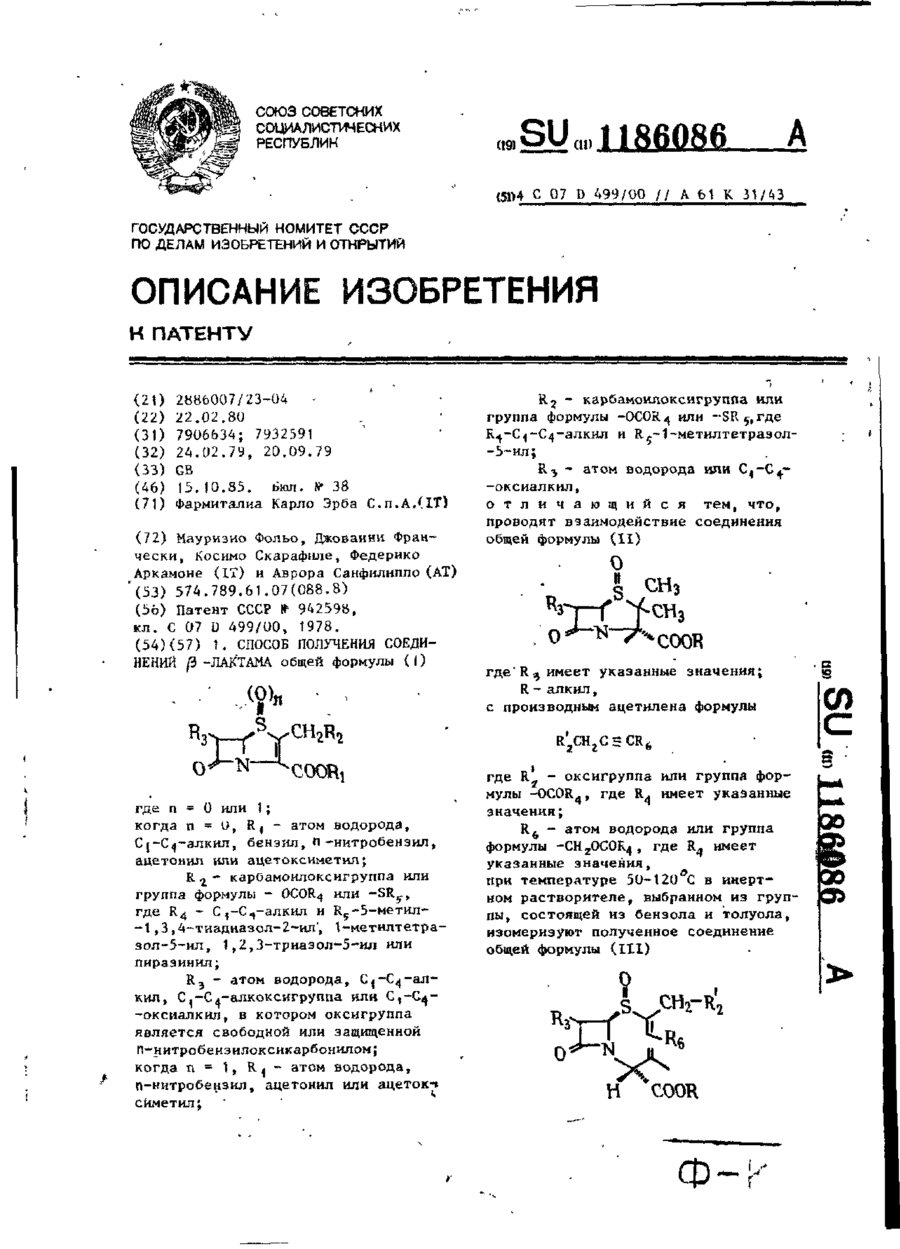
1 . Способ получения соединений b-лактама общей формулы (I)
где n = 0 или 1;
когда n = 0, R1 - атом водорода, С1-С4-алкил, бензил, n-нитробензил, ацетонил или ацетоксиметил; R2 - карбамоилоксигруппа или група формулы -ОСО R4 или -SR5, где R4 - С1-С4-алкил и R5 -5-метил-1,3,4-тиадиазол-2-ил, 1-метилтетразол-5-ил, 1,2,3-триазол-5-ил или пиразинил;
R3-атом водорода, С1-С4-алкил, С1-С4-алкоксигруппа или С1-С4-оксиалкил, в котором оксигруппа является свободной или защищенной n-нитробензилоксикарбонилом;
когда n = 1, R1 - атом водорода, n-нитробензил, ацетонил или ацетоксиметил;
R2 - карбамоилоксигруппа или группа формулы -ОСО R4 или -SR5, где R4-С1-С4-алкил и R1-1-метилтетразол-5-ил;
R3 - атом водорода или С1-С4-оксиалкил, отличающийся тем, что проводят взаимодействие соединения общей формулы (II)
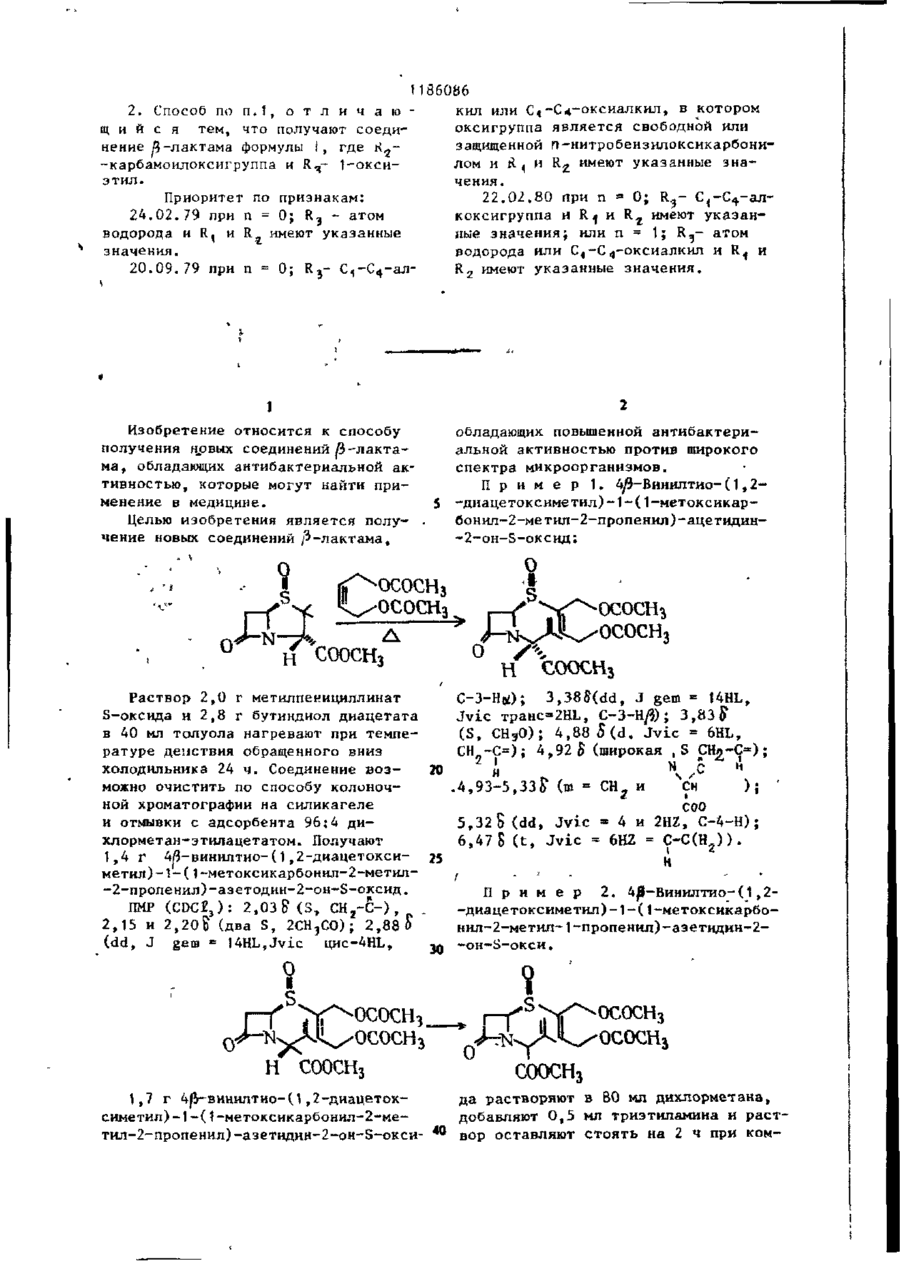
где R3 имеет указанные значення; К - алкил, с производным ацетилена формулы
где R'2 - оксигруппа или группа формулы -ОСОR4, где R4 имеет указанные значения;
R6 - атом водорода или группа формулы -СН2ОСОR4, где R4 имеет указанные значения, при температуре 50-120°С в инертном растворителе, выбранном из группы, состоящей из бензола и толуола, изомеризуют полученное соединение общей формулы (III)
где R, R'2, R3 и R6 имеют указанные значения, в дихлорметане в присутствии триэтиламина при комнатной температуре, полученное в результате соединения общей формулы (IV)
где R, R'2, R3 и R6 имеют указанные значения, восстанавливают трехбромистым фосфором в ди-метилформамиде при температуре (-40) -0°С, и в случае, если R’2-оксигруппа, полученное бромпроизводное подвергают взаимодействию с соединением формулы
где R5 имеет указанные значения, в тетрагидрофуране или ацетонитриле при 00С, или соединение формулы IV, где R'2 - оксигруппа, обрабатывают хлорсульфонилизоцианатом в ацетонитриле или трихлорацетилизоцианатом в ацетоне при температуре 0°С и полученное карбамоилпроизводное восстанавливают трехбромистым фосфором в диметилформамиде, полученное соединение общей формулы (V)
где R, R2, R3 и R6 имеют указанные значения, подвергают озонированию при температуре от -20 до -78°С в растворителе, выбранном из группы, состоящей из дихлорметана, этилацетата и тетра-гидрофурана, образующееся в результате соединение подвергают гидролизу в присутствии силикагеля в метаноле или этилацетате, или их смеси, при комнатной температуре, полученное соединение общей формулы (VI)
где R2 и R3 имеют указанные знаения, подвергают взаимодействию с соединением формулы
где R1 имеет указанные значения, при температуре 40-100°С в бензоле или толуоле, полученное соединение общей формулы (VII)
где R1, R2 и R3 имеют указанные значения, хлорируют тионилхлоридом в присутствии пиридина при температуре от -20 до 20°С, полученное соединение общей формулы (VIII)
где R1, R2 и R3 имеют указанные значения, конденсируют с трифенилфосфином при температуре от 40 до 80°С в присутствии пиридина или 2,6-лутидина и полученное соединение формулы (IX)
где R1, R3 и R3 имеют указанные значения, подвергают циклизации нагреванием до температуры 30-140°С в толуоле или бензоле, в случае необходимости полученное соединение формулы (I) окисляют органической перкислотой в дихлорметане при комнатной температуре с целью получения соединения формулы (I), где n = 1, и/или в случае необходимости соединение формулы (I), где R3 - оксиэтил, в котором оксиг-руппа является защищенной n-нитробензилок-сикарбонилом, и/или где R1 не означает атом водорода, подвергают щелочному гидролизу под действием едкого натра или гидрогенолизу в присутствии палладия на угле и получают целевой продукт, где R3 - оксиэтил и/или R1 - атом водорода.
2. Способ по п. 1, отличающийся тем, что получают соединение b-лактама формулы I, где R2 - карбамоилоксигруппа и R3 - 1-оксиэтил.
Приоритет по признакам:
24.02.79 при n = 0; R3- атом водорода и R1 и R2 имеют указанные значения.
20.09.79 при n = 0; R3 - С1-С4-алкил или С1-С4-оксиалкил, в котором оксигруппа является свободной или защищенной n-нитробензилоксикарбонилом и R1 и R2 имеют указанные значения.
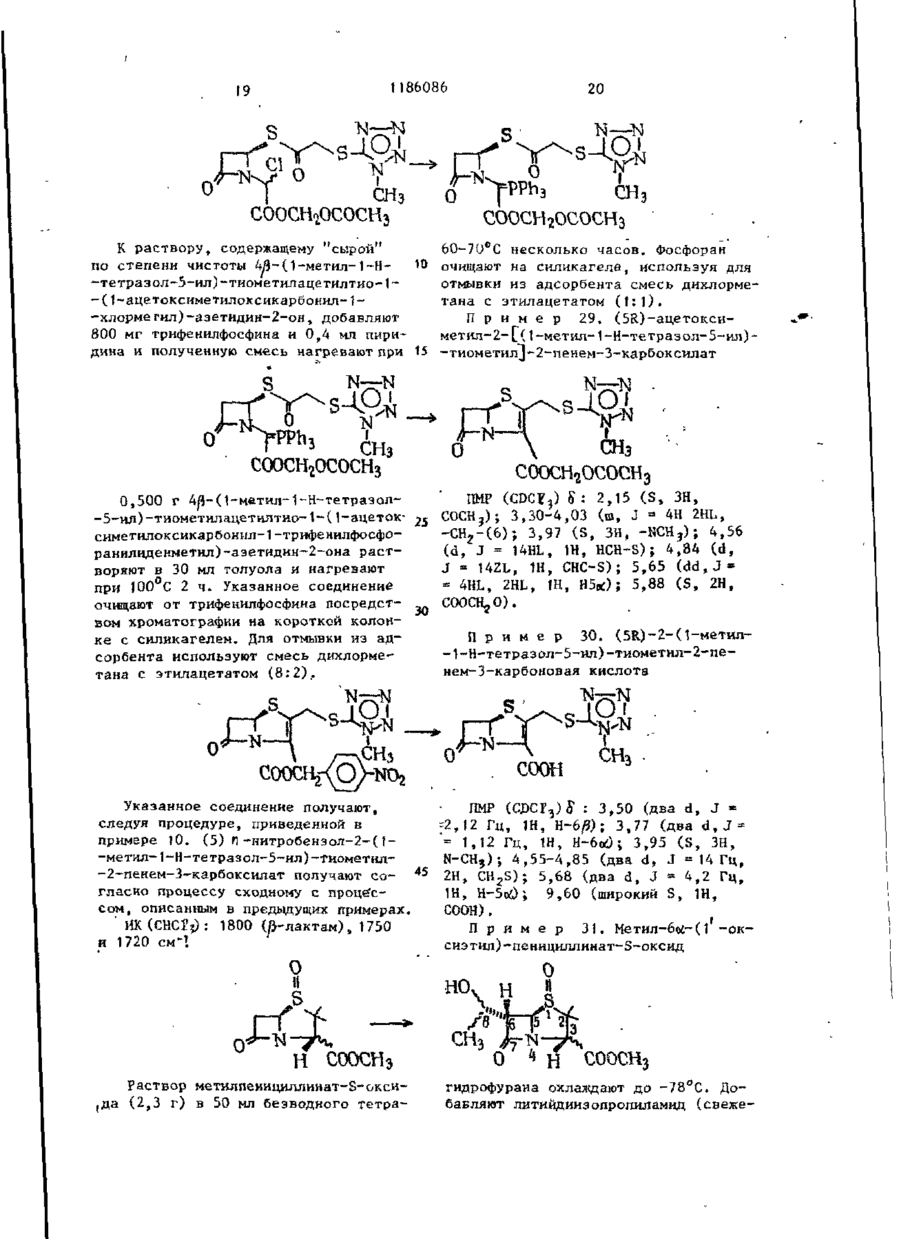
22.02.80 при n = 0; R3- С1-С4-алкоксигруппа и R1 и R2 имеют указанные значения; или n = 1; R3 -атом водорода или С1-С4-оксиалкил и R1 и R2 имеют указанные значения.
Текст
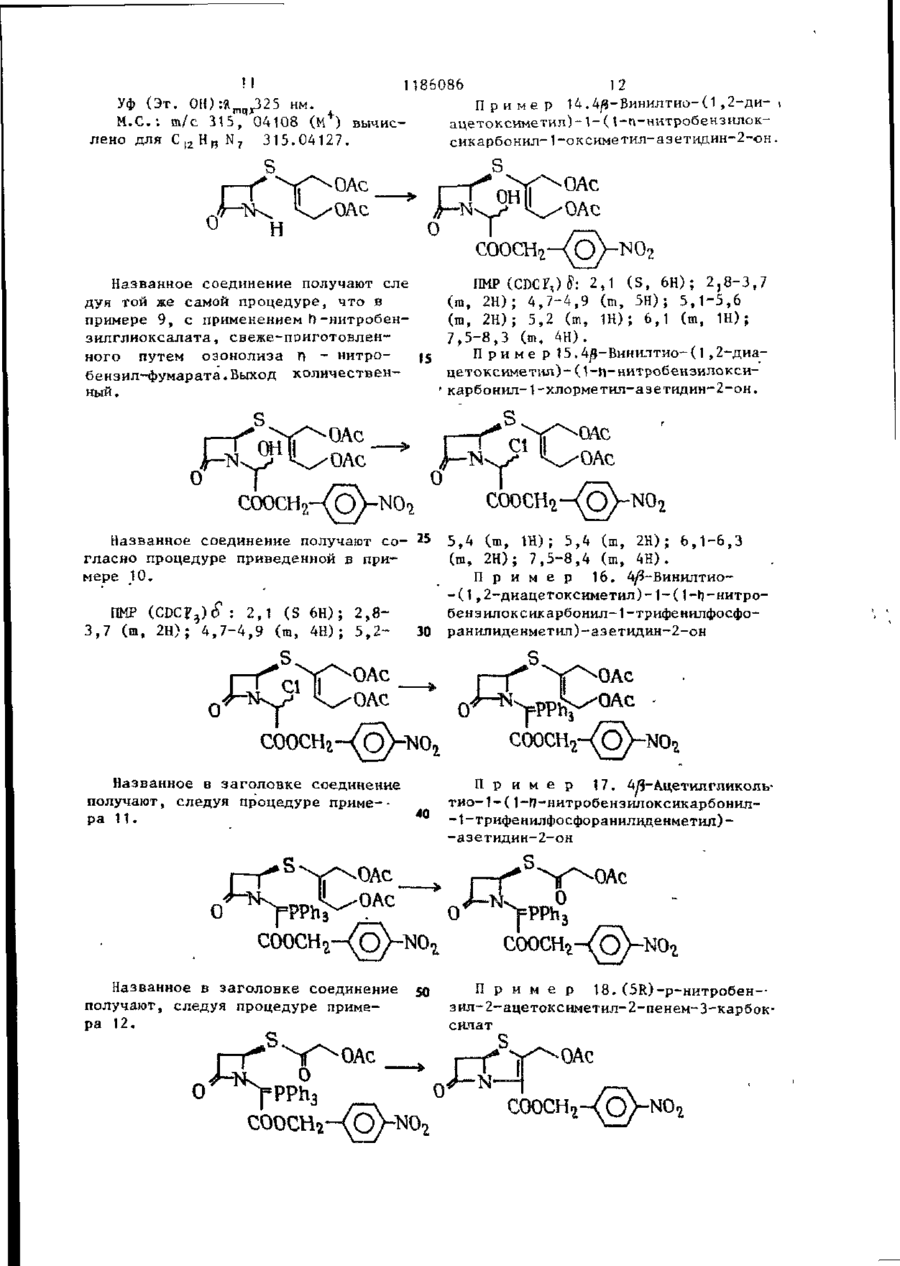
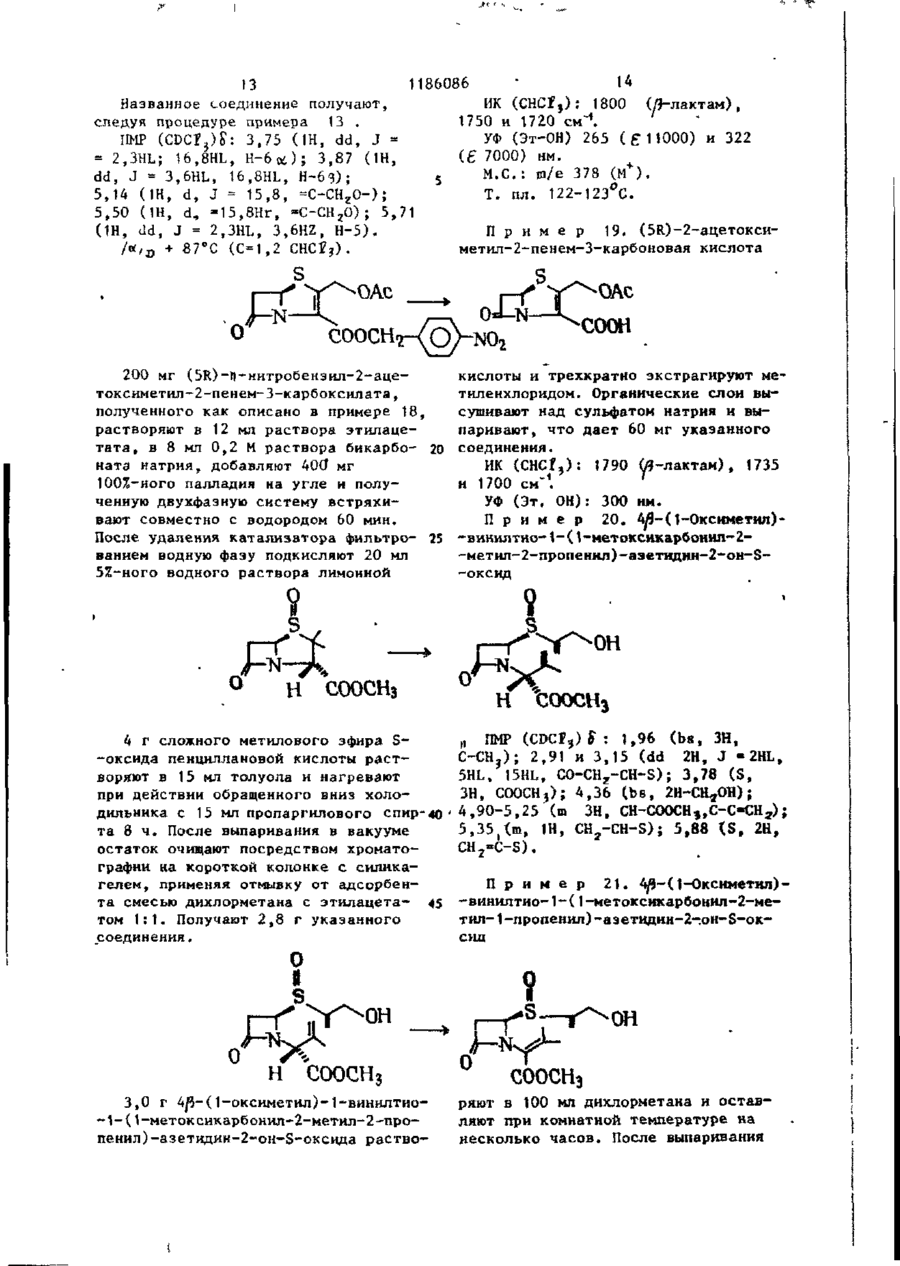
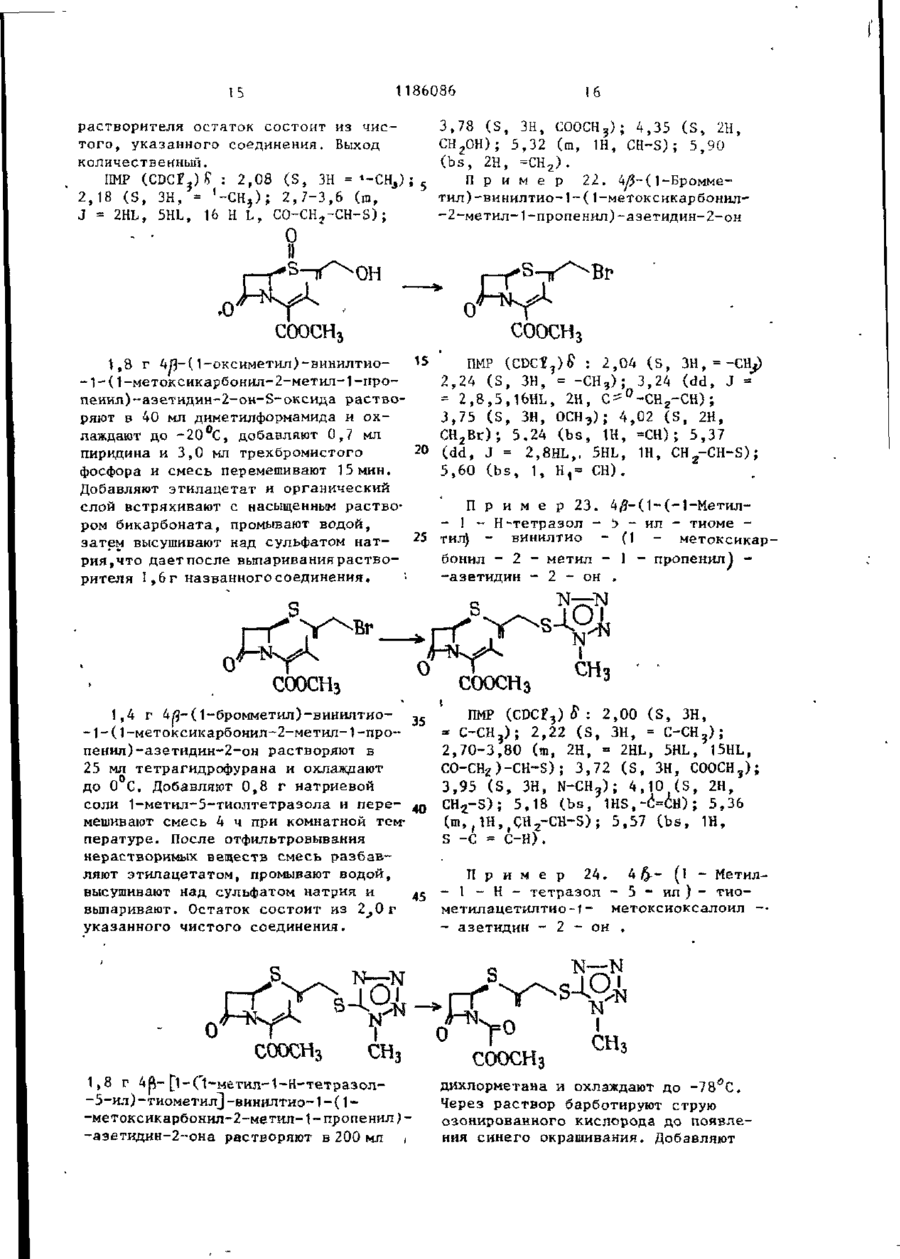
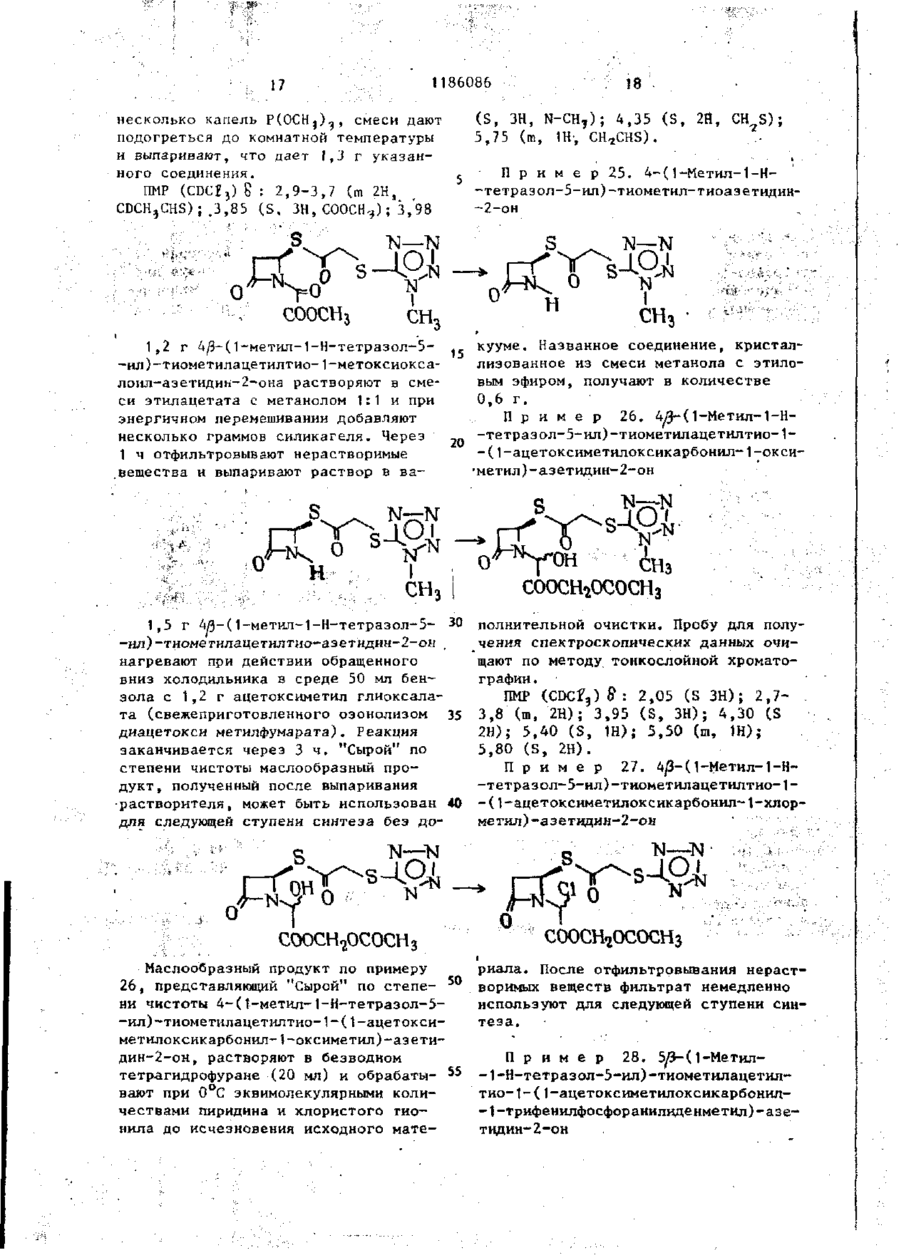
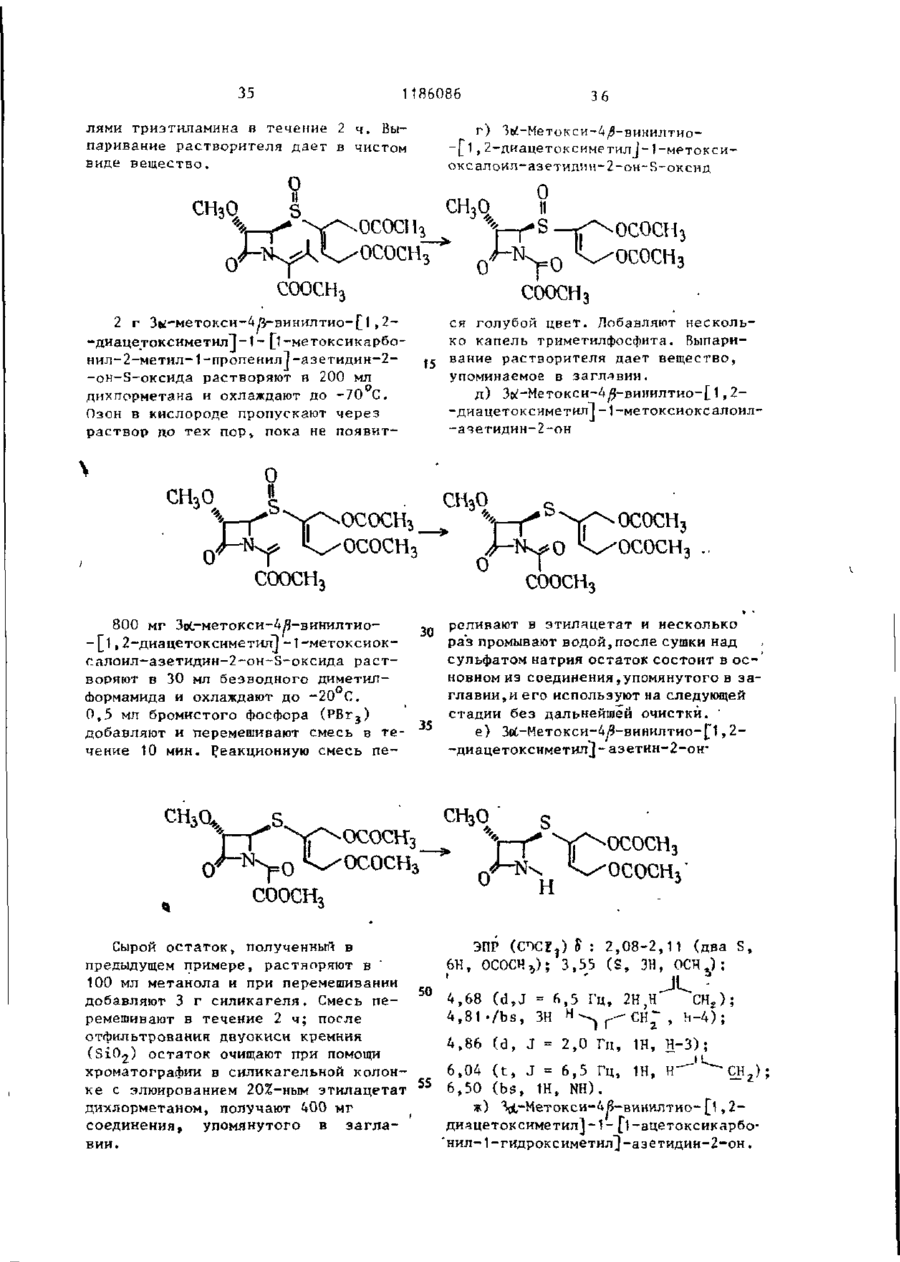
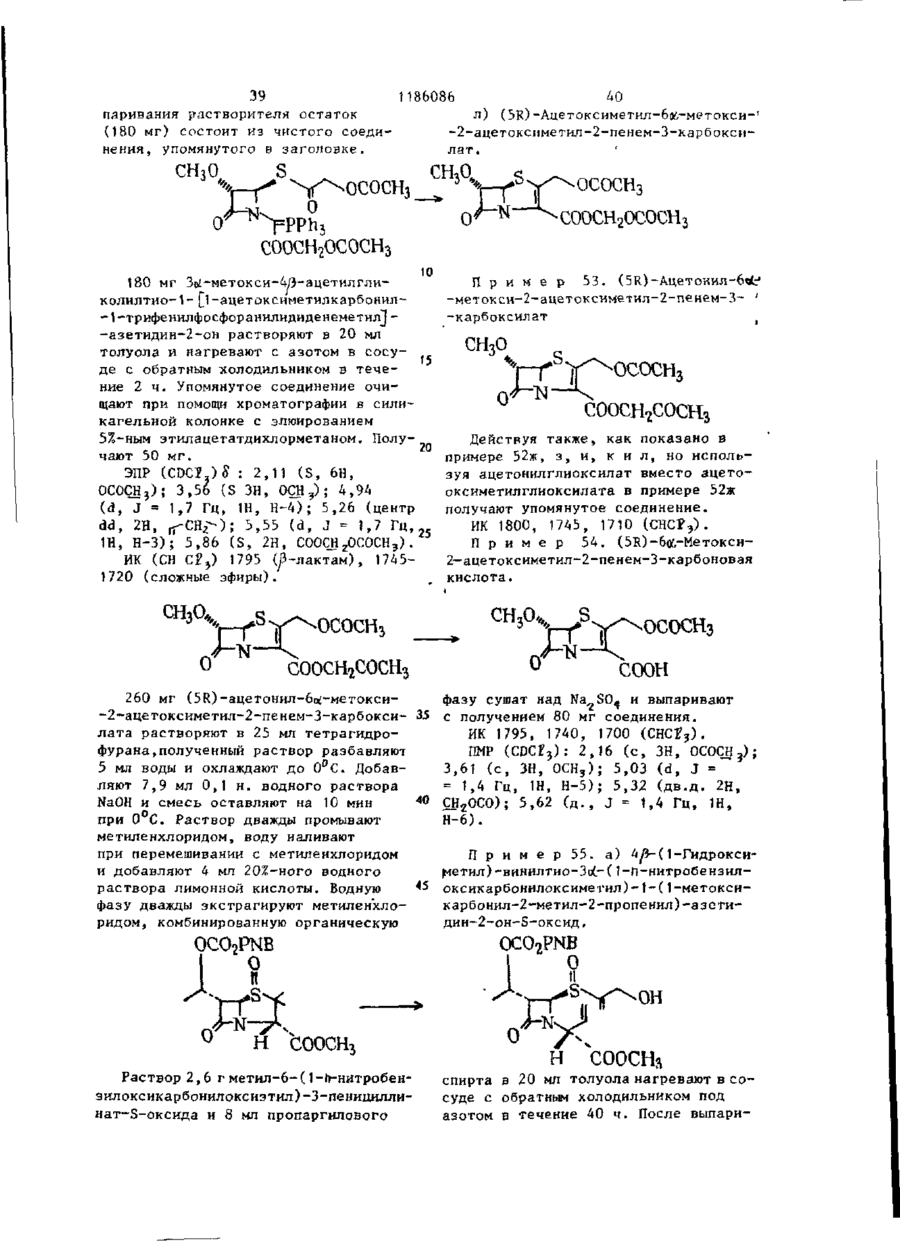
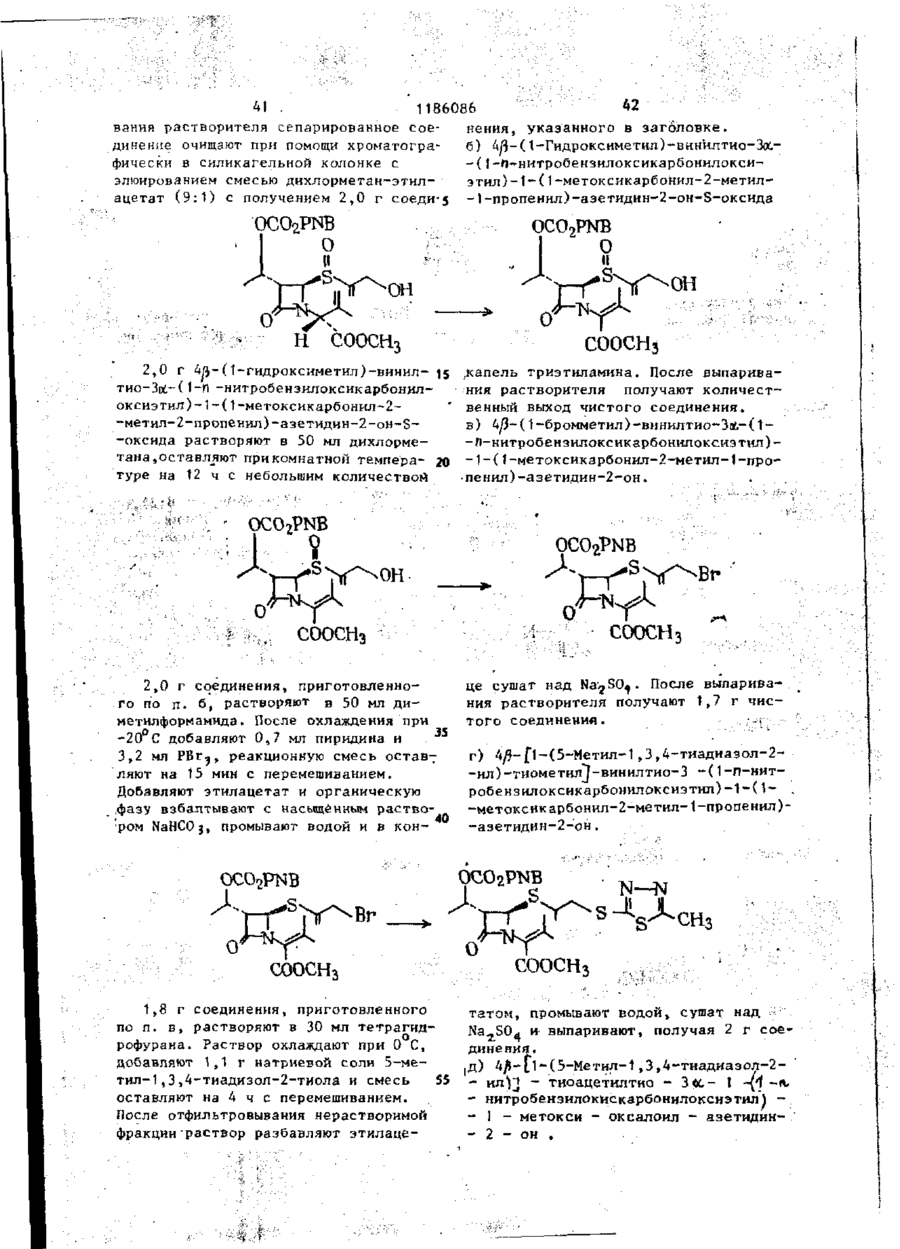
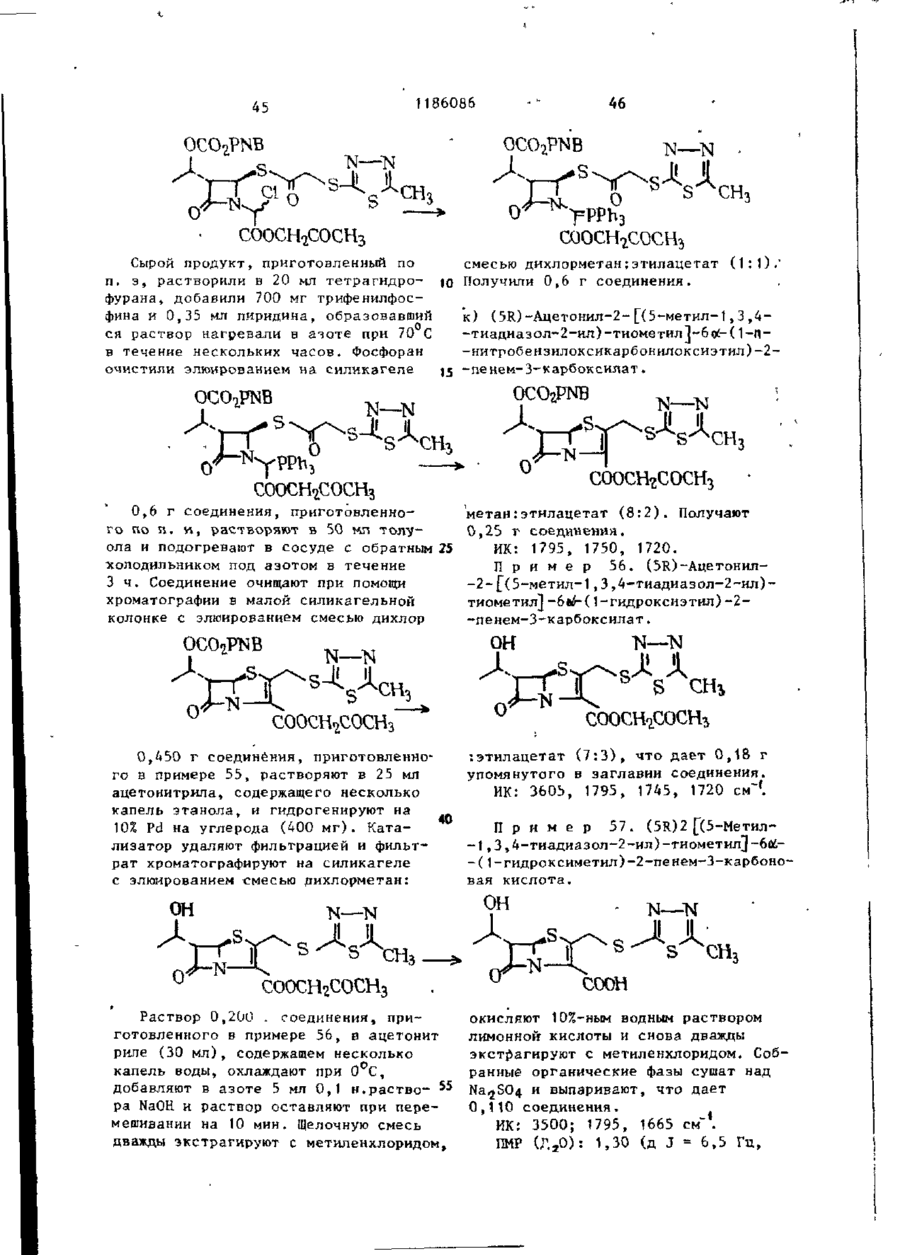
Ш СОЮЗ СОВЕТСНИХ СОЦИАЛИСТИЧЕСКИХ РЕСПУБЛИН Щ0 (191 А SU ( 1 1 J (51)4 С 07 D 499/00 // А 61 К ГОСУДАРСТВЕННЫЙ НОМИТЕТ С С С Р ПО Д Е Л А М ИЗОБРЕТЕНИЙ И ОТНРЫТИИ ОПИСАНИЕ ИЗОБРЕТЕНИЯ И ПАТЕНТУ (21) (22) (31) 2Ь8Ь0О7/23-О4 22.02.80 7906634; 7932591 (32) 2 4 . 0 2 . 7 9 , 20.09.79 (33) GB (46) 15.10.85 ъюл. К 38 * (71) Фармиталиа Карло Эрба С.п.А,(ІТІ (72) Мауризио Фольо, Джовакни Франчески, Косимо Скарафиле, Федерико Аркамоне (IX) и Аврора Санфнлиппо (AT) "(53) 574.789.61.07(088.8) (Зо) Патент СССР № 94259b, кл. С 07 D 499/00, 1978. (54)(57) 1. СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ р -ЛАКТАМА общей формулы (I) и 0 >-N—k где n - 0 или 1; когда n = U, Rj - атом водорода, Сj-Cq-алкил, бензил, п-нитробензил, ацетонил или ацетоксиметил; R 2 - карОамоилоксигруппа или группа формулы - ОСОЇЦ или -SRg., где R 4 - С,-С^-алкил и К ? -5-метил-1 ,3,4-тиадиазол-2-ил', t-метнлтетразол-5-ил, 1,2,3-триаэол-5-ил или пираэинил; R 3 - атом водорода, С^-С^-алкил, С^-Сд-алкоксигруппа или C t -C^-оксиалкил, в котором оксигруппа является свободной или защищенной П-нитробенэилоксикарбонилом; когда и - )у ЇЦ - атом водорода, n-ннтробензкл, ацетонил или ацеток-? симетил; К г - карбамоилоксигруппа или группа формулы -ОС0ЇЦ или ^ (два S f 2СН?СО) ; 2,88 £ нил-2-метил-1-пропенил)-азетидин-2(dd, J gem = 14HL,Jvic цис-4НЬ, -OH-S-ОКСИ, С Н Н СООСНз 1,7 г 4/і-виннлтио-(1,2-диацетоксиметил)-1-(ї-метоксикарбонил-2-метил-2-пропенил)-азетидин-2-он-5-окси СООСНз да растворяют в 80 мл дихлорметана, добавляют 0,5 мл триэтиламина и раствор оставляют стоять на 2 ч при ком натной температуре. После выпарива-j ния растворителя получают соединение в чистом виде и с количественными выходами, 186086 J v i c транс = 2 , 5 HZ); С-З-Н/5) ; 3,82& (S, СН 3 О); 4,88 6і ( d , J v i c = 6,5HZ, CH 2 -C=); 4,92 ff(S C -C=); H 5,158 (dd, J v i c = 5 и 2,5HZ, C-4-H) ; 6 , 5 0 5 ( t , J v i c 6,5HZ =C-/H,) . 1ІМР (CDC? 3 ): 2,13(98) и 2,32 (ЗН) 8 (два S, 2СН3СО и 2СН 3 ~С=); 2,92& (dd, J gem = 15HZ, Jvic цис = 5HZ, ' С-З-Нос); 3,38В (dd, J gem = 15HZ, П р и м е р 3: 4#-Винилтио-(1, 2-диацетоксиметил)-1-метоксиоксалоилацетидин-2-он-5-оксид ГҐ ОСОСНз ОСОСНз' соосн, СООСНз 2,0 г 4Д-винилтио-(1,2-диацетоксиметил)-1-(1-метоксикарбонил-2-метил-1-пропенил)-азетидин-^-он-Ь-оксида 20 растворяют в 150 мл дихлорметана и после охлаждения до -78 С барботируют струю азона в кислороде до тех пор, пока не появится слабо-синее окрашивание. Раствору дают подогреть-25 ся до комнатной температуры,' встряхивают с водным раствором пиросернистокислого натрия (Na 2 S 2 0y) и высушивают над сульфатом натрия. Полученная органическая фаза дает, после выпа- 3 0 ривания растворителя, в вакууме 1,4 г названного соединения. ПКР (CDCf 3 ): 2,05 и 2 , 0 8 $ (два S, 2СН,СО): 3,ОЗ£ (dd, J gem = 17HZ, J v i c цис = 5,5HZ, C 7 3-Hoi); 3 , 5 o £ (dd, J gem = 17HZ, J v i c транс = 3HZ, С-3-Н/Э); 3,9O8(S,CH); 4 , 8 2 ? (d, J v i c = = 6,5 HZ, CH ? -C=); 4,90 £ ( S , CH 2 -C=); 5,32 £ (dd, Jvic 1 = 5,5 и 3Z, C-4-H); 6,47 ^ ( t , J v i c = 6,5HZ, =C-C(H Z ). ИК (CH 2 C2 2 ): 1830 см~\"^-лактам •С=0; 1750 см"1, сложные эфиры С=0; 1715 см~'амид С=0. П р и м е р 4. 4Д-ВИНИЛТИО-(1,2-диацетоксиметил)-1-метоксиоксалоилацетидин-2-он. COOCH СООСНз = 3.5HZ, С-З-Н/З); 3 , 6 5 5 ( d d , J gem = Раствор 1,4 г 4/$-винилтио-(1 ,240 = 19HZ, J v i c цнс - 5HZ, C-3-Hfc:); -диацетоксиметил)~1-метоксиоксалоил3 , 9 0 S ( S , CH,O); 4 , 7 3 Б ( d , J v i c = -азетидин-2-он-Б-оксида в 10 мл без=6,5HZ, C H 2 - C = ) ; 4 , 8 8 Б (широкая водного диметилформамида охлаждают (h) до -25°С и добавляют 0,9 мл трехбромистого фосфора. Через 10 мин 45 SCH 2 -C=); 5,525 ( d d , J v i c = 5 н 3,5HZ, C-4-H); 6,25 5 ( t , J v i c = смесь разбавляют этилацетатом и =6,5HZ, =C-( промывают дважды насыщенным раствором бикарбоната натрия. После выИК (CHC£ 3 ): 1815 см р-лактам сушивания над сульфатом натрия и выC=0; 1475 см" 1 сложные эфиры С=0; паривания растворителя.получают 50 171Ґ1 г- " а ъл\л п Г* = П 0,9 г названного соединения. П*р и м є р 5. 4іЗ-ВинилтиоПМР (СОСГ 3 ): 2,07 8 (S, 2СН,С0); - (1,2-диацетоксиметил)-азетидин-2-он 3,17 & (dd, J gem = 19HZ, Jvic транс= соосн3. о 1186086 1,5 г 4/3-винилтио- 11 » 2-диацетокснметил)-\-метоксиоксалоил-азетидин-2-она растворяют в 100 мл метинола и добавляют несколько граммов силикагеля при перемешивании. Через 1 ч силикаг-ель отфильтровывают и метанольный раствор выпаривают, что дает 0,8 г 4^-винилтио-(1,2-днзцетокеиметил)~азетидин-2-она. ПИР (CDC? ? ): 2,25 S (S 2СН Э СО); 2,98 $ (dd, J gem = 15HZ, Jvic транс = = 2H,Z C-3-H/9; 3,488 (dd, J gem = * 15HZ, J v i c цис = 4.5HZ, С-З-Ноб) ; 4 , 7 8 8 (d, J v i c - 7Н, Z СН,-С=); (и) 5 4,875 і ( S , СН 2 -С=); 5 , 0 3 8 ( d d , J v i c • - 4 , 5 и 2HZ, C-4-H); 6,02 S ( t , Jvic= = 7HZ=C-G(H Z ); 7,13 8 (широкая N-H) hi ИК (CHCf9; 1770 см~ ,/?-лактам 10 C=0; 1740 см^1 сложные эфиры С=0. П р и м е р 6: 4/3-Винилтио-(1,2-диацетоксиметил)-азетидии-2-OH-S-оксид. 0 II .s ОСОСНз ОСОСНз СООСН3 3 , 0 - 3 , 3 5 Ы 2 протона при С - 3 ) : 4 , 7 0 0,800 г 4Д-винилтио-(1,2-диацетокS(m C - 4 - H ) ; 4,8ВS ( d , J v i c = 6HZ, симетил)-1-метоксиоксалоил-азетидин-2~oH-S-oKCHAa растворяют в 80 мл CH 2 -C=); 4 , 9 3 Б (S CH^-CH=); 6,35& ( t , 25 этанола и добавляют несколько грамJvic HH ' "~ »C-C/H/, ч 7,23 S (S,NH). 6HZ, мов силикагеля при перемешивании. Чев .и. рез 1 ч силикагель отфильтровывают ИК (CHC2 ? ): 1790 см'^-лактаи и после выпаривания растворителя поС=0, 1745 см" сложные эфиры С=0. лучают 0,5 г 4/5~винилтио-( 1,2-диацеП р и м е р 7. 4^-Ацетилгликотоксиметил)-азетидин-2-он-5-оксида. 30 лилтио-1-зцетоксиметилоксиоксалоилПМР (CDCI)): 2,138 (S 2СН,СО) ; азетидин-2-он ОСОСНз COOCH2OCOCH3 0,8 г 4/$-винилтио-(1 ,2-диацетоксиметил)-1-(1-ацетоксиметнлоксикарбонил-2-метил-1-пропенил)-азетидин-2-она растворяют в 80 мл днхлорметана, охлаждают до -78°Си барботируют струю озона в кислороде до тех пор, пока не появится синее окрашивание. После встряхивания с водным раствором пиросернистокислого натрия раствор высушивают над сульфатом натрия, что дает 0,45 г названного соединения. 4 о COOCH3 0,6 г 4/5-ацетилглнколътио-1-меток~ сиоксалоил-азетидин-2-она растворяют в 100 мл метанола и добавляют несколь C0OCH2OCOCH3 r , ПМР ( C D C f ? ) : 2,10 и 2,13К ( д в е S, 2CH 3 CO); 3 , 2 0 & ( d d , J gem = 17HZ, • J v i c транс = 3,5Н, С - 3 - Н ^ ) ; 3 , 7 7 ^ (dd, J gem = 17HL,Jvic цис = 5,5HL, C~3-Htf); 4 , 7 3 E ( S , -G00GH 2 -0G0-); 5,73 S ( d d , J v i c 5 , 5 и 3,5 HL C - 4 - H ) ; 5,87 8 ( S , COO-CH 2 ' -OCO-). • . П р и м е р 8. тио-аэетидин-2-он. 4Й-Ацетилгликоль s 0 'H 0 ко граммов силикагеля при перемешивании. Через 1 ч силнкагель отфильтровывают и полученный раствор, после вы 1186086 8 паривания растворителя, дает О,ЗЬ г Jvic = 4,5 е 2,5HZ, C-4-H) ; 6,40 S (ши названного соединения. рокая S, NH). ПИР (CDC?,): 2 , A J & ( S CH,CO); 3,03 S (dd, J gem = 16HZ, J v i c транс = 5 П р и м е р 9. 4/3-Винилтио-(1 ,2= 2,5HZ, С-З-НЛ); 3,50 ft -диацетоксиметил)-1-(t-ацетоксиметилft(dd, J gem = 'оксикарбонил-1-оксиметил)-аэетидин-2= 16HL, Jvic цис = 4,5HL, С-ЗНк; 4,77# (S, -СО-СНд-ОССЬ) ; 5,32^ (dd, -он s О н 0,7 г ацетоксиметил-гликсалата (свежеприготовленного посредством озонолиза диацетоксиметилфумарата) растворяют в 30 мл бензола и полученный раствор нагревают 30 мин при действии обращенного вниз холодильника, с включенным прибором Дина-Старка. После охлаждения до 50-60°С до2» бавляют 0,7 г 4#-винилтио-(1,2-диацетоксиметил) -азетидин-2-она, растворенного в 10 мл бензола, и полученный раствор нагревают при действии обращенного вниз холодильника 2 ч. Названное соединение получают с поч- 30 ти количественными выходами. Это сое динение возможно использовать как "сырую" по степени чистоты смесь для следующей ступени синтеза. Для целей сооснгососн3 ососн о сооснгососн3 анализа чистую пробу получают по методу препаративной тонкослойной хроматографии. ПМР (CDC? ? ): 2,07u(S, ЗСН 3 СО); 2,97 £ (dd, J gem 18HZ, Jvic транс = = 2HZ, С-З-Н/5); 3,40 8 (dd, J gem = = 18HZ, Jvic, цис = 4HZ, С-3-Но«);4,70(Г (d, Jvic = 6HL, CH,-C=); 4,77^ (S, CH 7 -C=); 5,0-5,4 В (m, C-4-H и N-CH-COO); 5^77 В (S -COO-C1L-OCO) ; 6,12 J(t, Jvic = 6HZ, =C-C(H 2 ). H П р и м е р 10. 4^Э-Винилтил-(1,2-диацетоксиметил-1-(t-ацетоксиметилоксикарбонил-1-хлорметил)азетидин-2-он COOCH2OCOCHj 0,6 г 40- винилтил-(1,2-диацетокстки для следующей ступени синтеза. симетил)- 1-(1-ацетоксиметилоксикар-( ПМР (CDCr 3 )- 2,14 $ (S, ЗСН ? СО); 45 3,10В (dd, J £em = 15.5HZ, Jvic бонил-1-оксиметил)-зцетидин-2-она, растворенного в 15 мл тетрагидротранс = 2HZ, С-З-Н/з); 3,55Ї> (dd, фурана, охлаждают до 0°С; добавляют J gem = 15,5HZ, Jvic цис * 5HZ, 0,115 мл пиридина и 0,104 мл хлоC-3-Htf); 4,77S (d, Jvic = 6,5HZ, ристого тионила и смесь перемешиваC H - - O ) ; 4,83 8 (S, CH--C-); 5,450 ют 10 мин. Нерастворимый материал 5,95 \m, C-4-H и -N CHC?-COO-); отфильтровывают, раствор выпаривают 5,88S (S, -СОО-СНг-ОСО-); 6,13 S в вакууме при комнатной температуре, (t, Jvic = 6,5HZ, =C-C/H/). что приводит к получению соединения с высокими выходами. Пробу очищают 4 по методу препаративной тонкослойной П р и м е р 11. 4й-Винилтиохроматографии для аналитических це-(1,2-диацетоксиметил)-1-(1-ацетоклей; "сырую" по степени чистоты * симетилоксикарбонил-1-трифенилфоссмесь возможно использовать без очи-! форанилиденметил)-ацетидин-2-он 1186086 0 С О С Н з COOCH2OCOCH3 СООСНЇОСОСНЗ ' • t Расгвор 0,430 г 4Л-виннлтио-(1,2-диацетоксиметил)-1-(1-ацетоксиметилоксикарбонил*1-хлорметил)-аэетидин-2-она в 5 мл тетрагидрофурана и 5 мл диоксана, содержащего 0,520 г трифенилфосфина и 0,08 мл пиридина, оставляют на ночь при перемешивании при 50°С. Полученный фосфоран очищают посредством колоночной хроматографии на силикагеле, используя для отмывки из адсорбента смесь 70:30 дихлорме (0 t5 тана с этилацетатом. Получено 0,400 г названного соединения, IMP (CDCf 3 ): 2,058 (S, З СНХСО); 4,70S (d, J v i c = 6.5HL, СН г -С«);" "" 4 , 7 3 S ( S , CH r -C=); 5,775 (S, И -С00-CH?-OCO); 5,90? ( t , J v i c = 6,5 HZ, C-C/H / ) ; 7,1-8,OS (m, 3 C6H9). П р и м е р 12.4^-Ацетилтио-1-(і-ацетоксиметилоксикарбонил- 1-три-фенилФосфораннлденметил -азетидин-2-он. соосн г ососн 3 СООСН 2 ОСОСН 3 сколько капель триметилфосфита. Орга0,7 г 4^-Винилтио-(1,2-диацетоксинический раствор промывают насыщенметил)-1-(1-ацетоксиметилоксикарбоным раствором бикарбоната натрия и нил-1-трифенилфосфоранилиденметил)30 высушивают над сульфатом натрия, что -азетидин-2-она растворяют в 40 мл дает 0,550 г соединения. дихлорметана и после охлаждения до ПМР (CDCi,): 2,10 и 2,1 SS (две d, -20 С, добавляют 50 мл 10%-ного 2СН3СО); 4,72S4S, -CO-CH^-OCO-); раствора трифторуксусной кислоты в ' 5 , b 4 & ( S , -COO-CH^OCO) ; 7 , 1 - 8 , о £ дихлорметане. Через несколько минут начинают барботировать струю озона 35 ( т , 3 С 6 Н ? ) . в кислороде при -20 С до появления П р и м е р 13. (5Я)-Ацетоксислабого синего окрашивания. Тогда метил-2-ацетоксиметил-2-пенем-3реакцию прекращают и добавляют не-карбоксиалата •ОСОСНз СООСН 2 ОСОСН 3 0 •соош2ососн3 0,7 г 4Я-ацетилгликолилтио-1-(1тил-2-ацетоксиметил-2-пенем-3-карбоксилата. -ацетоксиметилоксикарбонил-1-трифенилфосфоранилиденметил)-азетидин-2ПМР (CDCI 3 ): 2,11 и 2,13ff (две S, -она растворяют в 30 мл сухого толу50 '2СН 5 СО); 3 , 4 y ^ ( d d , J gem = 16,5HL, ола и нагревают при температуре дейJ v i c транс = 2HL, C-6-H^); 3,86S ствия обращенного вниз холодильника (dd, J gem = 16,5 HL, J v i c цис = 3,8 2 ч. Реакционную смесь, состоящую из HL C76-H0O; 5,12 и 5,45S (два d, J названного соединения и оксида триgem = 15,5HZ, =C-CH 2 ); 5 , 6 8 ? (dd, фенилфосфина очищают по методу хроматографии на короткой колонке и на J v i c = 3,8 и 2 HL, C-5-H); 5,875 і • силикагеле, с отмывкой из адсорбента (S, -COO-CHjOCO-}. смесью 97:3 дихлорметана с этилацеИК (СНСЇ,): 1800 сМ-'/3-лактам С=0, татом, что дает 0,250 г ацетоксиме0 1 7 2 5 см" сложные эфиры С=0. П 12 1186086 П р и м е р 14.4/3-Винилтио-(1 ,2-диацетоксиметил)-1-(1-п-нитробензилоксикарбонил-1-оксиметил-азетидин-2-он Уф О т . ОН):й„ ічд n 4 X 325 нм. M.G.: т / с 315, 04108 (М ) вычис5 лено для С12 Н N 315.04127. S S ОАс ОАс IMP (CDC?,)£: 2,1 ( S , 6H); 2 , 8 - 3 , 7 Названное соединение получают еле (ш, 2Н); 4 , 7 - 4 , 9 (m, 5H); 5 , 1 - 5 , 6 дуя той же самой процедуре, что в (ш, 2Н); 5,2 (ш, 1Н); 6,1 (m, 1H); примере 9, с применением h-нитробензилглиоксалата, свеже-поиготовлен7 , 5 - 8 , 3 ( т , АН). ного путем оэонолиза П - нитроП р и м е р 15.4^-Винилтио-(1,2-диа15 бензил-фумарата.Выход количественцетоксиметїіп)-(1-П-нитробензилоксиный . карбонил-1-хлорметил-азетидин-2-он. Названное соединение получают с о - 25 гласно процедуре приведенной в примере 10 П Р (CDCХ%) О : 2,1 (S 6Н) ; 2 , 8 М 3,7 ( т , 2Н); 4 , 7 - 4 , 9 ( т , 4Н) ; 5 , 2 30 5,4 ( т , 1Н); 5,А ( т , 2Н); 6 , 1 - 6 , 3 (га, 2Н) ; 7,5-8,А ( т , АН). П р и м е р 16. 4/3-Винилтио-(1,2-днацетоксиметил)-1-( 1-Г|-нитробензилоксикарбонил-1-трифенилфосфоранилиденметил)-азетидин-2-он S. ОАс -^-* * - -s_j ^>х- UAC л COOCHJ-/O)-NO, Названное в заголовке соединение получают, следуя процедуре приме-ра 1 1 . П р и м е р \ 7 . 4Я- Ацетил г л ико льтио-1-(1-П-нитробензилоксикарбонил~ 40 -t-трифенилфосфоранилиденметил)-азетидин-2-он Названное в заголовке соединение получают, следуя процедуре примера 12. 50 .S П р и м е р 18. (5Ю-р-нитробен— зил-2-ацетоксиметил-2-пенем-3-карбоксилат S * ОАс СООСН^-ЧОУ-NOr, 14 1186086 13 Названное соединение получают, следуя процедуре примера 13 . ПМР (CDCfj)S: 3,75 (IH, dd, J = 2.3HL; 16,8HL, Н-6 * ) ; 3,87 ( Ш , dd, J = 3,6HL, 16.8HL, Н-63); 5,14 (IH, d, J = 15,8, =С-СН г О->; 5,50 ( Ш , d , =15,8Нг, = О С Н г О ) ; 5,71 . (IH, dd, J = 2.3HL, 3,6HZ, H-5). /tf/o + 87°С ИК (CHCf,): 1800 (Я-лактам), 1750 и 1720 см~*. УФ (Эт-ОН) 265 (£11000) и 322 200 мг (Ы0-Ц-нитробенэил-2-ацетоксиметил-2-пенем-З-карбоксилата, полученного как описано в примере 18, растворяют в 12 мл раствора этилацетата, в 8 мл 0,2 М раствора бикарбо- 20 натэ натрия, добавляют 400 мг 100%-ного палладия на угле и полученную двухфазную систему встряхивают совместно с водородом 60 мнн. После удаления катализатора фильтро- 25 ванием водную фазу подкисляют 20 мл 5%-ного водного раствора лимонной кислоты и трехкратно экстрагируют метиленхлоридом. Органические слои высушивают над сульфатом натрия н выпаривают, что дает 60 мг указанного соединения. ИК (CHCf,): 1790 (Я-лактам), 1735 и 1700 см"1. УФ (Эт. ОН): 300 нм. П р и м е р 20. 4уЗ-(1-Оксиметил)-винилтио-1- (1-метоксикарбонил-2 (в 7000) нм. М.С.: ш/е 378 ( М + ) . Т. пл. 122-123°С. П р и м е р 19. (5к.)-2-ацетоксиметил-2-пенем-З-карбоновая кислота -метил-2-пропеннл)-аэетидин-2-oH-S-оксид И COOCHj „ ПМР (CDCP ? )$ : 1,96 (bs, ЗН, 4 г сложного метилового эфира SC-CHj); 2,91 и 3,15 (dd 2H, J -2HL, -оксида пенциллановой кислоты раст5HL, 15HLt СО-СН г -СН-Б); 3,78 (S, воряют в 15 мл толуола и нагревают ЗН, СООСН 3 ); 4,36 (bs, 2Н-ОЦОН); при действии обращенного вниз холодильника с 15 мл пропаргилового спир-40 4,90-5,25 (ш ЗН, СН-СООСН,,С-С-СН г ); 5,35,(10, IH, CH 2 -CH-S); 5,88 {S, 2Н # та 8 ч. После выпаривания в вакууме CH 2 =C-S). остаток очищают посредством хроматографии на короткой колонке с скликагелем, применяя отмывку от адсорбенП р и м е р 21. 4/}-(1-0ксиметил)та смесью дихлорметана с этилацета- 45 -винилтио-1-(1-метокснкарбонил-2-метом 1:1. Получают 2,8 г указанного тил-1-пропенил)-аэетидин-2-он-Б-оксид .соединения. Н СООСНз 3,0 г 4^-(1-оксиметил)-1-виннлтио-1-(1-метоксикарбонил-2-метил-2-пропенил)-азетидин-2-он-3~оксида раство СООСН3 ряют в 100 мл дихлорметана и оставляют при комнатной температуре на несколько часов. После выпаривания 1186086 растворителя остаток состоит из чистого, указанного соединения. Выход количественный. IMP (CDC?3)S : 2,08 (S, ЗН = *-СНэ) ; 5 2,18 (S, ЗН, = ' - С Н ? ) ; 2,7-3,6 (m, J = 2HL, 5HL, 16 Н L, C0-CH 7 -CH-S); -• о СООСНз 3,78 ( S , ЗН, СООСН3); 4,35 ( S , 2H, СН2ОН); 5,32 (m, 1H, CH-S); 5,90 ( b s , 2H, =СН 2 ). П р и м е р 22. 4/3~( 1-Бромметил)-винилтио-1~(1-метоксикарбонил~2-метил-1-пропенил)-азетидин-2-он 0 СООСН: 1,8 г 4Я~(1-оксиметил)-винилтио2,04 ( S , ЗН, = -СН,) ПМР -1-(1-метоксикарбонил-2-метил-1-про3,24 (dd, J = 2,24 ( S , ЗН, 3 ) ; пеиил)-азетидин-2-он-5-оксида раство= 2,8,5,16HL, 2Н, С - " - С Н г - С Н ) ; ряют в 40 мл диметилформамида и ох3,75 ( S , ЗН, ОСН Э ); 4,02 ( S , 2H, лаждают до -20 С, добавляют 0,7 мл СН 2 Вг); 5,24 ( b s , 1H, =СН); 5,37 20 (dd, J = 2,8HL,, 5HL, 1Н, CH -CH-S); пиридина и 3,0 мл трехбромистого 2 фосфора и смесь перемешивают 15 мин. 5,60 ( b s , 1, H,= CH). Добавляют этилацетат и органический слой встряхивают с насыщенным раствоП р и м е р 23. 4#-(1-(-1-Метил~ ром бикарбоната, промывают водой, - 1 - Н-тетразол - 5 - ил - тиоме 25 тил) - винилтио - (1 метоксикарзатем высушивают над сульфатом натрия,что дает после выпариваний раствобонил - 2 - метил - 1 - пропенил} рителя 1,6г названногосоединения. -азетидин - 2 - он . N—N СООСНз сЬоснз 1,4 г 4fl-(1-бромметил)-винилтио- 35 ПМР (CDC£3) £ : 2,00 ( S , ЗН, -1-(1-метоксикарбонил-2-метил-1-про= С-СН 3 ); 2,22 ( S , ЗН, = С-СН ? ); пенил)-азетидин~2-он растворяют в 2,70-3,80 (m, 2H, = 2HL, 5HL, 15HL, 25 мл тетрагидрофурана и охлаждают СО-СН г )-СН-5); 3,72 ( S , ЗН, СООСН3); до 0 С. Добавляют 0,8 г натриевой 3,95 ( S , ЗН, N-CH 3 ); 4,10 ( S , 2H, соли 1-метил-5-тиолтетразола и пере- 40 CH 2 -S); 5,18 ( b s , 1HS,-(!=CH); 5,36 мешивают смесь 4 ч при комнатной тем( т , jiH^CH^CH-S) ; 5,57 ( b s , 1H, пературе. После отфильтровывания S -С = C-H). нерастворимых веществ смесь разбавляют этилацетатом, промывают водой, П р и м е р 24. 4 &- (і - Метилвысушивают над сульфатом натрия и - 1 - Н - тетразол - 5 - ил ) - тиовыпаривают. Остаток состоит из 2_,0г метилацетилтио-1метоксиоксалоил -• указанного чистого соединения. - азетидин - 2 - он . N-—N СООСНз 1,8 г 4^- [і-Сі-метил-1-Н-тетразол-5-ил)-тиометил]-винилтио-1-(1-метоксикарбонил~2-метил-1 -пропенил )-азетидин-2--она растворяют в 200 мл , дихлорметана и охлаждают до -78°С. Через раствор барботируют струю озонированного кислорода до появления синего окрашивания. Добавляют 1186086 17 несколько капель P(OCHj)^, смеси дают подогреться до комнатной температуры и выпаривают, что дает 1,J г указанного соединения. ПМР (CDCJ 3 ) S : 2 , 9 - 3 , 7 (m 2H, CDCH^CHS); . 3 , 8 5 ( S , ЗН, СООСІЦ) ; 3 , 9 8 18 ( S , ЗН, N-CH,); 4 , 3 5 ( S , 2Я, СН S ) ; 5,75 ( т , Ш , CHECKS). П р и м е р 2 5 . 4-(1-Метил-1-Н-тетраэол-5-ил)-тиометил-тиоазетидин-2-ОН >•-•'*•' COOCHj 1,2 г 4/3-(1 -метил- 1-Н-тетразол-5- 15 -ил)-тиометилацетилтио-1-метоксиоксалоил-азетидин-2-она растворяют в смеси этилацетата с метанолом 1:1 и при энергичном перемешивании добавляют несколько граммов силикагеля. Через 20 1 ч отфильтровывают нерастворимые вещества и выпаривают раствор в ва *,• ' * кууме. Названное соединение, кристаллизованное из смеси метанола с этиловым эфиром, получают в количестве 0,6 г. П р и м е р 26. 4/#~(1-Метил~1-Н-тетразол-5-ил)-тиометилацетилтио-1-(і-ацетоксиметилоксикарбонил-1-окси• метил)-азетидин-2-он " О н 1,5 г 4/3-(1-метил-1-Н-тетразол-5- з о -ил)-тиомегилацегнлтио-азетидин-2-он , нагревают при действии обращенного вниз холодильника в среде 50 мл бензола с 1,2 г ацетоксиметил глиоксалата (свежеприготовленного озонолизом 35 диацетокси метилфумарата). Реакция заканчивается через 3 ч. "Сырой" по степени чистоты маслообразный продукт, полученный после выпаривания растворителя, может быть использован 40 для следующей ступени синтеза без до О СООСНг,ОСОСН3 Маслообразный продукт по примеру 26, представляющий "Сырой" по степени чистоты 4-(|-метил-1-Н-тетразол-5-ил)~тиометилацетилтио-1-(1-ацетоксиметилоксикарбонил- 1-оксиметил)-азетидин-2-он, растворяют в безводном 55 тетр&гидрофуране (20 мл) и обрабатывают при 0°С эквимолекулярными количествами пиридина и хлористого тионила до исчезновения исходного мате СООСН^ОСОСНз полнительной очистки. Пробу для получения спектроскопических данных очищают по методу тонкослойной хроматографии . ПМР (CDCf 3 )£: 2,05 (S З Н ) ; 2,73,8 Cm, 2H); 3,95 (S, ЗН); 4,30 (S 2Н); 5,40 (S, 1Н); 5,50 (ш, 1Н); 5,80 (S, 2H). П р и м е р 27. 4/3-(1 -Метил- 1-Н-тетразол-5-ил)-тиометилацетилтио-1-(1-ацетоксиметилоксикарбонил-1-хлорметил) -азетидин-2-он СООСН 2 ОСОСН 3 риала. После отфильтровьшания нерастворимых веществ фильтрат немедленно используют для следующей ступени синтеза. П р и м е р 28. 5/3-(1-Метил-1-Н-тетразол-5-ил)-тиометилацетилтио-1-(1-ацетоксиметилоксикарбонил-1-трифенилфосфоранилиденметил)-азетидин-2-он 1186086 19 20 N СООСН^ОСОСИэ К раствору, содержащему "сырой" по степени чистоты 4/3-(1 -метил-1 -Н~тетразол-5-ил)-тиометилацетилтио-t-(1-ацетоксиметилоксикарбонил-1-хлормегил)-азетидии-2-он, добавляют 800 мг трифенилфосфнна и 0„4 мл пиридина и полученную смесь нагревают при СООСИ2ОСОСИз 60-70°С несколько часов. Фосфоран очищают на силикагеле, используя для отмывки из адсорбента смесь дихлорметана с этилацетатом (t:i). П р и м е р 29. (5Ю-ацетоксиметил-2-С(1-метил-1-Н-тетразол-5-кл)' -тиометилJ-2-пенем-З-карбоксилат • К COOCH 2 OCOCH 3 СООСН2ОШСН3 " П Р (CDC?,) В: 2,15 ( S , ЗН, М 0,500 г А|5-(1-метил-1-Н-тетразол~ -5-ил)-тнометилацетилтио-1-(1-ацеток- 2 5 СОСН3); 3,30-4,03 (ш, J = 4Н 2HL, - С Н г - ( 6 ) ; 3,97 ( S , ЗН, -NCH 3 ); 4,56 симетилоксикарбоннл-1-трифенилфосфо(d, J = 14HL, Ш, HCH-S); 4,84 ( d , ранилиденметил)-аэетидин-2-она растJ = 14ZL, 1H, CHC-S); 5,65 ( d d , J * воряют в 30 мл толуола и нагревают - 4HL, 2HL, 1H, H5oc); 5,88 ( S , 2H, при 100°С 2 ч. Указанное соединение очищают от трифенилфосфина посредст- 3 0 COOCHjO). вом хроматографии на короткой колонП р и м е р 30. (5Я)-2-(1-метилке с силикагелем. Для отмывки из ад-1-Н-тетрзэол-5-ил)-тиометил-2-песорбента используют смесь дихлорменем-3-карбоновая кислота тана с этилацетатом (8:2),. . соон Указанное соединение получают, ПМР (СРСГ3)5* : 3,50 (два d, J * следуя процедуре, приведенной в =2,12 Гц, Ш , Н-6^); 3,77 (два d, J = примере 10. (5) Г ~нитробенэол-2~( 1) '= 1,12 Гц, !Н } H-6oi); 3,95 (S, ЗН, -метнл-1-Н-тетразол~5-ил)-тиометил~N - C H ? ) ; 4,55-4,85 (два d, J = 14 Гц, -2-пенем-З-карбоксилат получают со- 45 2Н, CH^S); 5,68 (два d, J = 4,2 Гц, гласно процессу сходному с процес1Н, H-5od); 9,60 (широкий S, Ш , сом, описанным в предыдущих примерах СООН). ' И К ( С Н С Ї Ї ) : 1800 (fl-лактам), 1750 П р и м е р 3]. Метил-6о£-(1 -оки 1720 см'\ сиэтил)-пенициллинат-5-оксид Н СООСНз да Раствор метшшенициллинат-S-окси (2,3 г) в 50 мл безводного тетра СООСНз гидрофурана охлалсдают до -78°С. Добавляют литийдииэопропиламид (свеже 22 21 1186086 приготовленный из 5 мл диизопропилнесущего гидроксил, основываясь на амина и 20 мл 1,6 М раствора бутилданных протонного магнитного резонанлития в гексане), растворенный в безса, являясь новой C^-Cg связью лишь водном тетрагидрофуране, и смесь в оС-положении, учитывая стереоспециоставляют при -78°С на 10 мин. Затем 5 фичность реакции при применяемых добавляют 5 мл ацетильдегида и переусловиях, мешивают 15 мин. Затем реакцию быстро ПМР (CDCt 3 ) б Ї 1,27 (S, ЗН,Л-СН 3 ) " прекращают путем добавления насыщен1,40 (d, 3H, J = 5,7HL, CH^-CHOH) ного водного раствора хлористого амосновной изомер; 1,48 (d, 3K, J = мония, экстрагируют этилацетатом, )0 = 5,7HL, СН^-СНОН) меньший изомер; промывают дважды водой и высушивают 1,70 (S, З Н Л - С Н Э ) ; 3,4-3,8 (m, 1H, ' над сульфатом натрия. После выпариваH-6); 3,80 (S, 3H, COOCH 3 ); 4,1-4,7 ния растворителя осадок вскоре очи(m, 1H, CHOH); 4,50 (S, Ш , H - 3 ) ; щают по методу колоночной хроматогра4,98 (d, J = 1.9HL, 1H, H-5) меньший фии на силикагеле, применяя для от- 15 изомер; 5,05 (d, J = 1.9HL, Ш , H-5) мывки из адсорбента смесь дихлорметаосновной изомер. на с этилацетатом (1:1). Получено 1,5 г. Указанное соединение представПример 32. Метил-6-(1-оксиляет смесь 2:3 эпимеров углерода, этил)-3-пеницилланат ОН ^ •N-Д н сооснэ К раствору 2,2 г метилпенициллатаната в 30 мл безводного тетрагидрофурана добавляют с незначительным избытком литийдиизопропиламид при -78 С в атмосфере азота. Добавляют по каплям избыточное количество ацедальдегида, смесь перемешивают 5 мин, реакцию быстро прекращают добавлением следов уксусной кислоты, выливают ОН v н соосн3 в воду и экстрагируют метиленхлоридом. Органический слой высушивают над сульфатом натрия и выпаривают в вакууме. Получают 0,8 г указанного соединения. П р и м е р 33. Метил-6-(1-И-нитробензилоксикарбонилоксиэтил)-3-пеницилланат . OCO 2 PNB -14-74 H COOCHj 1,2 г метил-6-(1-оксиэтил)-3-пенициллатината растворяют в 40 мл тетрагидрофурана, охлаждают до -78 С и обрабатывают одним эквивалентом бутиллития. К предыдущей смеси добавляют * 1,2 эквивалента П-нитробензилоксикарбонилхлорида, после выдерживания реакционной смеси 30 мин, при -78°С, реакционную смесь оставляют на 60 мин Н COOCHj при комнатной температуре, выливают в воду и экстрагируют метиденхлоридом. После высушивания над сульфатом натрия и выпаривания получено 1.4 г t указанного соединения. П р и м е р 34. Метил-6-(1-п'-нитробензилоксикарбонилоксиэтил)-З-пеницилланат-З-оксид OCO2PNB OCO 2 PNB A Н COOCHj I 1,8 г метил-6-(1-п-нитробензчлоксикарбонилоксиэтил)-3-пеницилла ната растворяют в 50 мл метиленхлорида и обрабатывают при 0 С 1,5экви 1186086 23 24 П р и м е р 35. 4-Винилтио-(1,2валентами м-хлорбензойной кислоты. -диацетоксиметил)-3-( i-ti-нитробенОрганическую фазу встряхивают с назилоксикарбонилоксиэтил ) - 1 - ( 1 сыщенным раствором бикарбоната нат- метоксикарбонил - 2 - метил рия( экстрагируют, высушивают над -2 - пропенил) - азетидин сульфатом натрия и выпаривают. Полу_ 2 - он - "оксид-' чают 1,4 г сульфоксида. Н Н СООСНз СООСНз Раствор 2,0 г метил-6-(1-п-нитро мывки из адсорбента смесь дихлормебензилоксикарбонилоксиэтил)-3~пенитана с этилацетатом 9:1: Получено цилланат-Б-оксида и 2,4 бутиндиол 1,1 г указанного соединения. диацетата в 50 мл толуола нагревают П р и м е р 36. 4/3-Винилтиопри действии обращенного вниз холо-(1,2-диацетоксиметил)-3-(1-tf-нитдильника 24 ч. Отделенное соединеробензилоксикарбонилоксиэтил)-1-(метние затем очищают по методу колоноч _ 20 оксикарбонил-2-метил-1-пропенил)ной хроматографии, применяя для от-азетидин-2-он~3-оксид OCO2PNB ОСОСНз ОСОСНз' СООСНз 1,3 г 4/3-вшшлтио-( 1,2-диацетокэанное соединение получают с колисиметил) -3- ( 1-п-нитробенэилоксикарчественным выходом после выпаривабонилоксиэтил)-1-(метоксикарбонилния растворителя. -2-метил-2~пропенил)-азетидин-2-он- 35 S-оксида растворяют в 80 мл дихлорП р и м е р 37. 4/ї-Винилтиометана; добавляют 0,3 мл триэтил-(1,2-диацетоксиметил)-3-(1-П-нитроамина и оставляют смесь при комнатбензилоксикарбонилоксиэтил)-1-метокной температуре на 2 ч. Чистое укасиоксалоил-азетіідин-2-он-З-оксид OCOoPNB I OCO2PNB О О ОСОСНз соосн. СООСНз Раствор 1,1 г 4/$-винилтж>-(1,2-диацетоксиметил)-3-(t-П-нитробензолоксикарбонилоксиэтил)-1-(метоксикарбонил-2-метил-1-пропенил)-азетидин-2-он-З-оксида в 100 мл дихлорметана охлаждают до -78 С и барботируют озок з кислороде до появления синего окрашивания. Раствор встряхивают с водным раствором гшро 50 сернистокислого натрия (NaS^Oy) и высушивают над сульфатом натрия. После выпаривания получают 0,5 г указанного соединения. 55 П р и м е р 38. 4#-Винилтио-(1,2-диацетоксиметил)-3-(1-п-нитробензилоксикарбонилоксиэтил)-1-метоксиоксалоил-азетидин-2-он 26 186086 25 OCOoPNB I 1 о о 0C0 2 PNB ОСОСНэ ОСОСНз ОСОСНз СООСНз СООСН3 Раствор 0,8 г 4/3-винилтио-(1,2-дипромывают дважды насыщенным раствоацетоксиметил)-3-(1-П-нитробензолокром бикарбоната натрия. Органическая сикарбонилоксиэтил)-1-метоксиоксафаза, высушенная над сульфатом натрия ноил-азетидин-2-она в 15 мл безводи выпаренная, дает 0,4 г восстановного диметилформамида охлаждают до ленного соединения. -20 С и добавляют 0,6 мл трехбромис- 15 П р и м е р 39. 4Д-Винилтио-(1,2того фосфора. Через 10 мин реакцион-диацетоксиметил)-3-(1-П-нйтробензилную смесь разбавляют этилацетатом и оксикарбонилоксиэтил)~азетидин-2-он OCO2PNB OCO2PNB н СООСН 25 1,2 г 4Я-винилтио-(1,2-диацетоксиметил)-3-(1-П-ннтробензилоксикарбонилоксиэтил)-1-метоксиоксалоил-азетидин-2-она растворяют в метаноле и к раствору добавляют 2 г силикагеля. Через 60 мин нерастворимые вещества 30 отфильтровывают и органическую фазу выпаривают. Хроматография на корот- • П р и м е р 40. 4/?-Винилтио-(,1 ,2-диацетоксиметил)-3-(1-Л-нитробензилоксикарбонилоксиэтил)-1-(1-ацетоксиметилоксикарбонил-1-оксиметил)-азе: тидин-2-он OCO2PNB OCO2PNB н Ікой колонке дает 0,4 г указанного ^соединения. '^іГ^ОСОСНз ОТ ^ОСОСНз ОСОСНз 0,6 г Afl-винилтио-С1,2-диацетоксиметил)-3-(1-п-нитробензилоксикарбонилоксиэтил)-азетидин-2-она растворяют в 30 мл бензола, добавляют 0,6 г ацетокси метилфумарата (свежеприготовленного озонолизом ацетоксиметилфумарата) и нагревают при действии обращенного вниз холодильника. Реакция заканчивается через 2 ч. Продукт кон 40 ОСО 2 РТЯВ СООСН2ОСОСН3 0,5 г 4Я-винилтио-(1,2-диацегоксиметил)-3-(1-И-нитробензилоксикарбонил соосн г ососн 3 денсации возможно использовать для следующей ступени синтеза без дополнительной очистки. П р и м е р 4 1 . 4^-Винилтио-(1,2-диацетоксиметил)-3-(1-п-нитробензилоксикарбонилоксиэтил)-1-(Нацетоксиметилоксикарбонил-1-хлорметил)-азетидин-2-он OCO2PNB С00СНп»0С0СНэ оксиэтил)-1-(1-ацетоксиметилоксикарбонил-1-оксиметил)-азетидин-2-она 27 28 1186086 растворяют в 12 мл безводного т е т р а гидрофурана и охлаждают до 0 С, добавляют 1,1 эквивалента пиридина и 1,1 эквивалента хлористого тионила, ІЇ смесь оставляют при перемешивании на Ю мин. Нерастворимые вещества отфильтровывают и раствор выпаривают при комнатной температуре, что дает указанное соединение с приблизительно 10 количественным выходом. Продукт можно использовать для последующей ступени синтеза без дополнительной ОЧНСТКИ. П р и м е р 4 2 . 43-Винилтио -(1,2-диацетоксиметил)-3-(1-п-нитробеизилоксикарбонилоксиэтил)-1-(ацетоксиметилоксикарбонил-1-трифенилфосфоранилиденметил)-азетидин-2-он OCO2PNB I PPh СООСН^ОСОСНз ОСОСНз ОСОСНз СООСН2ОСОСНз Раствор 0,760 г 4/3-винилтио-( 1,2колонке с силикагелем, используя -диацетоксиметил)-3-(1-П-нитробензил _ 20 для отмывки из адсорбента смесь диоксикарбонилоксиэтил)-1-(1-ацетоксихлорметана с этилацетатом 70:30. метклоксикарбонил-1-оксиметил)-аэеПолучают 0,480 г соединения. тидин-2-она в 10 мл тетрагидрофурана и 10 мл диоксана совместно с 2 П р и м е р 43. 4/3-Ацетилгли25 эквивалентами трифенилфосфина и 1,1 кольтио-3-(1-Л~нитробензилоксикарэквивалентами пиридина перемешивают бонилоксипентил-1-1-ацетоксиметилвсю ночь при 50 С. Фосфоран очищают оксикарбонил-1-трифенилфосфоранилипосредством хроматографирования на денметил)-азетидин-2-он OCO^PNB OC02PNB n i > P P f о Г СООСН^ОСОСНз 0,45 г 4^-виннлтио-(1,2-диацеток симетил)-3-(i-d-нитробензилоксикарбонилоксиэтил)-1-(ацетоксиметилокси 40 карбонил-1 -тpифeї^илфocфopaнилидeнметил)-азетидин-2-она растворяют в 50 мл дихлорметана и охлаждают до -20°С; добавляют 30 мл раствор трифторуксусной кислоты в дихлор~ метане; затем несколько минут барба- 45 тируют озоном в кислороде до появле ния слабого синего окрашивания. t N T ^ ососнз COOCH 2 OCOCH 3 Прекращают реакцию и добавляют несколько капель триметилфосфита. Органическую фазу промывают насыщенным раствором бикарбоната натрия и высушивают над сульфатом натрия. Получают 0,260 г указанного соединения. П р и м е р 44. 4/3-Винилтио-(1,2-диацетоксиметил)-3-(1-М-нитробензилоксикарбонилоксиэтил)-1-(метоксикарбонил-2-метил~1-пропенил)-азетидин-2-он OCOoPNB I О СООСНз 1,5 г винилтио~(1,2-диацетоксиметил)-3-(1-П-нитробензилоксикарбо нилоксиэтил)-1-(метоксикарбонил-2 -метил-1-прспенил)-азетидин-2-она растворяют в 10 мл безводного диметилформамкда и охлаждают до -20°С, 1186086 29 добавляют 0,8 мл трехбромистого фосфора, перемешивают смесь 10 мин,разбавляют -этилацетатом и промывают дважды насыщенным раствором бикарбоната натрия. Органический слой высушивают над сульфатом натрия и вы 30 паривают, что дает 1,1 г указанного соединения. П р и м е р 45. 4/3-Ацетилгликольс тио-3-(1-п-нитробензилоксикарбонилоксиэтил)-1-метокеиоксанил-азетидин-2-он СООСНз СООСНз 1,4 г 4р-винилтио-(1,2-диaцeтoкcи- 15 мeтил)-3-( 1-П-нитробензилоксикарбонилоксиэтил)-1-(метоксикарбонил-2-метил-1-пропенил)-азетидин-2-она в 120 мл дихлорметана охлаждают до -78°С и барботируют озон в кислороде 20 до появления синего окрашивания. Раствор встряхивают с водным раствором О ^ СООСНз 30 0,800 г 4Й-ацетилгликольтио-3-(1-Ц-нитробензилокснкарбонилоксиэтил)-1-метоксиоксалил-азетидин-2-она раст воряют в 50 мл метанола и добавляют несколько граммов силикагеля. Смесь оставляют при комнатной температуре 35 на 60 мин, нерастворимые вещества от пиросернистокислого натрия ( N a ? C 2 0 5 ) їй высушивают над сульфатом натрия. Выпаривание приводит к 0,8 г названного в заголовке соединения. П р и м е р 46, 4/3-Ацетилгликольтио-3-(1-п-нитробензилоксикарбонилоксиэтил)-азетидин-2-он 0 О Н фильтровывают. Фильтрат после упаривания дает 0,300 г указанного соединения. П р и м е р 47. 4й-Ацетилгликольтио-3-(1-П-нитробензилоксикарбонилоксиэтил)-1-(1-ацетоксиметилоксикарбонил-1-оксиметил)-азетидин-2-он 0CO2PNB соосн г ососн 3 0,5 г 4/3-ацетилгликольтио-3-(1-П45 -нитробензилоксикарбонилоксиэтил)-1-(і-ацетоксиметилоксикарбонил-1-оксиметил)-азетидин-2-она и 0,5 г ацетоксиметилфумарата в 30 мл бензола нагревают при действии обращенного гвниз холодильника до окончания реак- 5 0 ции (2 ч ) . Полученное соединение в о з OC02PNB СООСН2ОСОСН3 можно использовать для следующей ступени синтеза без дополнительной очистки. П р и м е р 48. 4^-Адетилгликольтио-3-(i-tt-нитробензилоксикарбонилоксиэтил)-1-(1-ацетоксиметилоксикарбонил-1-хлорметил)-азетидин-2-он OCO2PNB S СООСН2ОСОСН3 31 1186086 32 нение с количественным выходом. "Сы 0,35 гfi '-ацетилгликольтио-3-(1-а-г рой" по степени чистоты продукт мож -нитробензилоксикарбонилоксиэтил)но применять для следующей ступени -1-(1-ацетоксиметилкарбонил-1-оксисинтеза. метил )-азетидин-I-она растворяют в 10 мл безводного тетрагидрофурана 5 при 0 С; добавляют 1,1 эквивалента П р и м е р 49. 4/ї-ацетилглипиридина и 1,1 эквивалента хлористого кольтио-3-С1-п-нитрооензилоксикарбонилоксиэтил)-1-(1-ацетоксиметилтионила и перемешивают смесь 10 мин. оксикарбонил-1-трифенилфосфоранилиОсадок отфильтровывают, фильтрат после выпаривания дает указанное соеди- to денметил) -азетидин-2-он _ OCO 2 PNB s OCO 2 PNB -V COOCH 2 OCOCH 3 0,400 г 4fl-ацетилгликольтио-З-(1 -П-нитробензилоксикарбонилоксиэтил) -l-(1-ацетоксиметилоксикарбонил-і-хлорметил)-азетидин-2-она растворяют в 20 мл смеси тетрагидрофурана с диоксаном 1:1, добавляют 2 эквивалента трифенилфорсфина и 1,1 эквивалента пиридина и перемешивают смесь всю ночь при 50 С. Указанное ососн 3 соосн 2 ососн 3 соединение очищают по методу колоночной хроматографии применяя для отмыв 20 ки из адсорбента смесь дихлорметана с этилацетатом 70:30. Получают 0,280 г фосфорана. П р и м е р 50. (5ї0-Ацетоксиметил-6-(1-П-ниробензилоксикарбонил25 оксиэтил)-2-ацетоксиметил-2-пенем-3-карбоксилат 0C0 2 PNB OCO 2 PNB СООСН^ОСОСНз s СООСН^ОСОСНз 0,210 г 4й-ацетилгликольтио-3-(1-. 35 -П-нитробензилоксикарбонилоксиэтил)-1-(і-ацетоксиметилоксикарбонил-1-трифенилфосфоранилиденметил)-азетидин-2-она растворяют в 7 мл толуола и раствор нагревают при действии 40 обратного холодильника 2 ч. Очищают по методу колоночной хроматографии, применяя для отмывки из адсорбента смесь дихлорметана с этилацетатом 9 5 : 5 , что приводит к 0,050 г указанного соединения. П р и м е р 5 1 . (510~Ацетоксиметил-6-(1-оксиэтил)-2-ацетоксиметил-2-пенем-З-карбоксилат OCO 2 PNB ОСОСНэ сооснгососн3 о соосн2ососн3 50 геле дала 0,015 г указанного соедине0,60 г 5Я-ацетоксиметил-6-( \-t\ния. • -нитробензилоксикарбонилоксиэтил)-2Действуя, как описано в предшест-ацетоксиметил-2-пенем-З-карбоксивующих примерах, но с применением лата выливают в смесь воды с этано5-метил-2-тиол-1,3,4-тиадиазола; лом и вторичным кислым фосфорнокислым калием (К^НРО^) и подвергают 55 5-ТИОЛ-1,2,3-триазола или же тиолгидргенолизу с Iu^-ным палладием пираэина взамен 1-метил-5-тиолтетрана угле. Быстрая очистка по методу зола, получают (5К)-2- £(5'-метил-1' , і колоночной хроматографии на силикаЗ ,4 -тиадиазол-2 -ил)-тиометилП-2 33 ї 86086 34 -3-пенициллинат, следуя широко из-пенем-3-карбоновую кислоту; (5R)-2вестной процедуре, получаот соответст-Г(1 ,1 , З -триазол-5-ил)-тйометил7 -2-пенем-3-карбоновую кислоту; (5К)~ вующие 6-этил-производные. -2-(і' ,2 ,З' -триазол-5-ил)-тиометилПМР (CDC?,): 1,35 (g, J = 0,5 Гц, -2-пенем-З-карбоновую кислоту; (5R)ЗН, СН,СН); 2,12 (С, 6Н, СОСН,, СОСН ,-2-(пиразинил)-тиометил-2-пенем-32,87 (8 с, Ш , ОН); 3,75 (g,g. , J = -карбоновою кислоту; (5R)-6- [(1 -ок= 1,5;fa,0Гц, 1Н, Н^б); 4,21 (м , счэтил)| - 2 - |дЬ -метил-1 ,3 ,4 -тиади 1Н, СН О Н ) ; 5,10, 5,42 (g.,g., J = азол-2"-ил)-тнометил!~2-пенем-3-карбоновую кислоту; (5R)-7- ( Г - о к с и э т и л Н о = 1 6 » ° ГД> 2 Н » СН20С0) ; 5,65 ( g . , J = 6,0 Гц, Ш, Н-5); 5,84 ( с , 2Н, С00СН 2 0). -2-пенем-З-карбоновую кислоту; -6-(1 -океиэтил)-2-(пиразинил)-тиометил-2-пенем-З-карбоновую кислоту. П р и м е р 52. а) Сложный метиДействуя, как описано ранее,но f "ловый эфир S-оксид 6о(,-метоксипенициллановой кислоты. восстанавливая метил-6-(1' -оксиэтилен) Сложный этило6рб-метоксипеницилвый эфир лановая кислота ' Q СН3О СНА О COOCHj 3,200 мг сложного метилового эфира бсб-метоксипенициллановой кислоты, приготовленного в соответствии с ме- 25 тодикой, описанной Giddings и др. Tetrahedron Letters 11,995 (1978) растворяют в 20 мл дихлорметана и по порциям обрабатывают 570 мг м-хлорбензойной кислоты при комнатной тем _ 30 пературе. Органическую фазу промыва сн 3 о о о О СООСНз ют насыщенным раствором бикарбоната натрия (NaHCOj) и выпаривают. Упомянутое в заглавии соединение кристаллизуют из простого этилового эфира. Получают 600 мг продукта. о) Зоі-метокси-4/З-винилтио- {_1, 2-диацетоксиметилТ-Н-^метоксикарбонил-2-метил-2-пропенил"]-азетидин-2-он-S-оксид. СН3О у н соосн 3 550 мг сложного метилового эфира л S-оксид а 6с6~метоксипеницилла новой кислоты растворяют в 25,0 мл толуола, добавляют 1,2 г бутиндиолдиацетатаи получившийся раствор в течение 10 ч нагревают в сосуде с обратным холодильником.. Реакционную смесь очищают при помощи хроматографии в силикагельной ОСОСНз ОСОСНз Н СООСНз колонке с элюированием 10%-ным этилацетатдихлорметаном. Получают 450 мг соединения , упомянутого в заглавии. в) Зк.-Метокси-4/З-винилтил- [J , 2-диацетоксиметилЗ~1- J/1-метоксикарбонил-2-метил-1-пропенилЗ-аэетилин-2-OH-S-ОКСИД. о сн3оА 0С0СН Н СООСНз 400 мг ЗоС-метокси-4/З-винилтио, 2-диацетоксиметш^-1-|_ метоксикарu бонил-2-метил-2-пропенил]-азетизин СООСН3 -2-он-Э-оксида растворяют в 10 мл дихлорметана и перемешивают при комнатной температуре с несколькими кап 35 1186086 лями триэтиламинз в течение 2 ч. Выпаривание растворителя дает в чистом виде вещество. 36 г) Зь£-Метокси-4/ї-винилтио-[1,2-диацетоксиметш^-1-метоксиоксалоил-азетиднн-2-он-Я-оксид СН,0 ососн ОСОСНз_ ососн7 о СООСНз 2 г З^-метокси-4А-винилтио-[1, 2-диацетоксиметилі-t- [1-метоксикарбонил-2-метил-1-пропенил[-азетидин-2-OH-S-оксида растворяют и 200 мл дихпорметана и охлаждают до -70 С. Озон в кислороде пропускают через раствор до тех пор, пока не появит сн.о •N СООСНз !5 ся голубой цвет. .Добавляют несколько капель триметилфосфита. Выпаривание растворителя дает вещество, упоминаемое в заглавии. д) 3^-Метокси-4^-винилтио-£1,2-диацетоксиметил! -1-метоксиоксалоил-азетидин-2-он сн 3 о СООСН 800 мг Зо(.-метокси-4Я-винилтио-£i,2-диацетоксиметшт] -t-метоксиоксалоил-азетидин-2~он-Б-оксида растворяют в 30 мл безводного диметил(Ьормамида и охлаждают до -20 С. 0,5 мл бромистого фосфора (РБг 3 ) добавляют и перемешивают смесь в те чение 10 мин. реакционную смесь пе о Т СООСНз ЗС реливают в этилацетат и несколько раз промывают водой,после сушки над сульфатом натрия остаток состоит в основном из соединения,упомянутого в заглавии,и его используют на следующей стадии без дальнейшей очистки. ' 35 е) ЗоС-Метокси-4у9-винилтио-£ 1,2-диацетоксиметил^]-азетин-2-он СН 3 О о соосн, о N\ н Ч/ОСОСН: Сырой остаток, полученный в ЭПР (С^СГр У : 2,08-2,11 (два S, предьщущем примере, растворяют в 6Н, ОСОСНь); 3,55 ( S , ЗН, OCHJ; 100 мл метанола и при перемешивании СН 2 ); добавляют 3 г силикагеля. Смесь пе- 50 4,68 ( d , J = 6,5 Гц, 2Н,Н Н ремешивают в течение 2 ч; после 4 , 8 1 - / b s , ЗН ^ Г - ^ С Н ^ , Ь - 4 ) ; отфильтрования двуокиси кремния 4,86 ( d , J = 2,0 Гц, 1Н, Н-3); (Si02) остаток очищают при помощи хроматографии в силикагельной колон6,04 ( t , J = 6,5 Гц, 1Н, н г ке с злюированием 20%-ным этилацетат 55 6,50 ( b s , 1Ht NH). дихлорметаном, получают 400 мг ж) Яо(,-Метокси-4Й-винилтио-[1,2соединения, упомянутого в загладиацетоксиметил]-1- fi-ацетоксикарбовии. нил-1-гидроксиметил^]-азетидин-2-он. 37 CH3O О S •N OCOCH3 OCOCH3 ОСОСНз ососн3 H СООСН2ОСОСН3 250 мг Зо^-метокси-4/5-винилтио-fi,2-диацетоксичетил~І-азетидин-2-OH растворяют в 20 мл бензола и на- . гревают в сосуде с обратным хологиль"ником в течение 3 ч с 300 мг ацетоксиметилглиоксилата (свежеприготовленного озонированием диацетокснметилфумарата). Сырую смесь очищают при помощи хроматографии в силикагель •ОСОСНз _ yvy 38 " J186086 іч ^у ной колонке с элюированием 40%-ным этилацетатхлорметаном, что дает 150мг чистого соединения в виде смеси циастереоизомеров. з) Зй-Метокси-4^ -винилтио-f1,2-диацетоксиметилJ-1- 11-ацетоксиметилоксикарбонил-1-хлорметилJ-азетидин-2-он сн 3 о ^^ ОСОСНз сооснгососн3 150 мг Зо£-метокси-4|}-винилтио-М,2-диацетоксиметил1-1-Гі-ацетокси" і метилоксикарбонил-1-гидроксиметил_|- 25 -азетидин-2-он растворяют в 10 мл безводного тетрагидрофурана и охлаждают до -20 С; добавляют стехиометрические количества пиридина и тионилхлорида и смесь перемешивают в те- 30 чение 10 мин. Смесь фильтруют от нерастворимых веществ на цеолите и выпаривают при комнатной температуре, что дает остаток, который используют на следующей стадии без дальнейшей 35 очистки. и) Зо(.-Метокси-4/3-винилтио- [і у 2-диацетоксиметил1-1-[і-ацетоксиметилоксикарбонил-1-трифенилфосфоранилиди-40 ецеметил -азетидин-2-он. ценеметап] -азетидин-2-он. CH ^V^ S СООСН2ОСОСН3 Сырой остаток, полученный в предыдущем примере, состоящий почти из чистого 3#-метокси-4/3-винилтио-Гі , 2 -диацетоксиметил] - 1 - fi-ацетоксиметилоксикарбонил-1-хлорметилі -азетидин-2-он растворяют в 10 мл толуола, добавляют 200 мг трифенилфосфина и получившийся раствор нагревают с азотом в сосуде с обратным холодильником в течение 2 ч. Фосфоран очищают при помощи хроматографической обработки в малой силикагельной колонке с элюированием 40%-ным ацетатдихлорметаном, что дадает 180 мг соединения, упомянутого в заглавии. к) 3#-Метокси-4у9-ацетилгликолилтио-1-р-ацетоксиметилоксикарбонил-і-трифенилфосфоранилиденеметшЛ -азетидин-2-он. % ^s 0^> СООСН 2 ОСОСН 3 230 мг З^-метокси-А^-винилтио" - [1,2-диaцeтoкcимeтилJ-1- [1-ацетоксиметилоксикарбонил-1-трифенилфосфорани лиденеметилі-азетидин-2-он растворяют в 50 мл дихлорметана и пос-5 5 ле охлаждения до - 20 ° С добавляют 0 , 5 мл трифторуксусноч кислоты. СООСН 2 ОСОСН 3 Озон в кислор'оде барботируют через раствор до появления голубого цвета. Добавляют несколько капель триметилфосфита, реакционную смесь разбавляют дихлорметаном и несколько раз промывают насыщенным раствором бикарбоната натрия (ЫаНСОз). После сушки над сульфатом натрия (Na 2 S0^) и вы 39 пяривания растворителя остаток (180 мг) состоит из чистого соеди нения, упомянутого в заголовке. 40 1186086 л) (5їО-Ацетоксиметил-6&-метокси- т -2~ацетоксиметил-2-пенем-3-карбоксилат. от сн 3 о OCOCH3 СООСН 2 ОСОШ 3 СООСН2ОСОСН3 10 180 мг Зы~метокси-4/}-ацетилгликолилтио-1- [1-ацетоксиметилкарбонил-1-трифенилфосфораиилидиденеметил]-азетидин-2-он растворяют в 20 мл толуола и нагревают с азотом в сосуде с обратным холодильником в течение 2 ч. Упомянутое соединение очищают при помощи хроматографии в силикагельной колонке с элюированием 5%-ным этилацетатдихлорметаном. Полу20 чают 50 мг. ЭПР (CDC?,)S : 2,11 (S, 6H, ОСОСН ? ); 3,56 {S ЗН, ОСН,); 4,94 (d, J = 1,7 Гц, 1Н, Н-4); 5,26 (центр dd, 2H, ггСП^); 5,55 (d, J = 1,7 Гц 1Н, Н-3); 5,86 (S, 2H, С00СН 2 0С0СН 3 ). ИК (СН С? 3 ) t795 (jJ-лактам), 17А51720 (сложные эфиры). П р и м е р 53. -метокси~2-ацетоксиме?ил-2-пенем-3-карбоксилат СН 3 О ОСОСН о соосн 2 сосн 3 Действуя также, как показано в примере 52ж, з, и, к и л , но используя ацетонилглиоксилат вместо ацетооксиметилглиоксилата в примере 52ж получают упомянутое соединение. ИК 1800, 1745, 1710 (СНСТ,) . П р и м е р 54. (5Ю-6&-Метоксн2—ацетоксиметил-2-пенем-З-карбоновая кислота. ОСОСН•' по п. в, растворяют в 30 мл тетрагидNa-S0 4 и выпаривают» получая 2 г соерофурана. Раствор охлаждают при 0 С, динения, добавляют 1,1 г натриевой соли 5-меід) 4/І-Гі~(5-Метил-1,3,4-тиадиазол-2тил-1,3,4-тиадизол-2-тиолз и смесь 55 - ил)т - тиоацетилтио - Зсс- ! -\\ -ft оставляют на 4 ч с перемешиванием. - нитробензилокискарбонилоксиэтил) После отфильтровывания нерастворимой - I - метокси - оксалоил - азетидин- . фракции раствор разбавляют этилаце- 2 - он . 44 1186086 N-N ЄНCOOCH3 СООСН3 2 г соединения, приготовленного по п. г, растворяют в 250 мл дихлорметана и охлаждают при -78 С. Поток озонированного кислорода барботируют через раствор до появления голубого цвета. Добавляют несколько капель 0CO 2 PNB JL N Xf АЩ ^ 3 , смесь подогревают до комнатной температуры и выпаривают, что дает 1,5 г соединения. є) 4/ї- [і-(5-Метил-1 ,3,4-тиадиазол-2-ил)]-тиоацетилтио-Зы-(1-г'-нитробензилоксикарбонилоксиэтил)-азетидин-2-он OCO2PNB С1 н COOCH 1,5 г соединения, приготовленного рое хроматографируют на силикагеле со по п. ж, растворяют в смеси метанол• смесью дихлорметана-этилацетат (8:2), этилацетат (1:1). Добавляют нескольчто дает 0,9 г чистого соединения, ко граммов силикагеля, смесь оставляж) 4/?- [1-(5-Метил-1 ,3,4-тиадиазолют при комнатной температуре при ин- 25 -2-ил]-тиоацетилтио-ЗЛ-(1-П-нитробентенсивном перемешивании. После отзилоксикарбонилоксизтил)-1-(1-азетофильтровывания силикагеля фильтрат нилоксикарбонил-1-оксиметил)-азетидинвыпаривают с получением масла, кото-2-он. Y СООСЩСОСНз 0,9 г соединения, приготовленного по п. е, растворяют в 40 мл бензола, добавляют 0,6 г ацетонилглиоксилата, образованный раствор подогревают в со- 40 суде с обратным холодильником в течение 3 ч. После выпаривания растворителя сырое масло используют на еле N дующей стадии без дальнейшей очистки. з) 4Я- [і-(5-Метил- 1 ,3 ,4-тиадиазол-2-ил)] -тиоацетилтио-Зоі-(1-П-нитробен зилоксикарбонилоксиэтил)-1-(1-ацетонилоксикарбонил-1-хлорметил )-ацетидин-2-он. •N сн, О' СООСН2СОСН3 Сырое масло, полученное по п. ж, растворяют в безводном тетрагидрофуране (30 мл) и охлаждают при 0 С. Добавляют эквимолярное количество 55 пиридинтионилхлорида до исчезновения исходного вещества. После отфильт ровывания нерастворимого материала СН 3 соосн2соси3 фильтрат сразу же используют для следующей стадии. и) 4/)- [і-(5-Метил-1,3 ,4-тиадиазол-2-ил)] -тиоацетилтио-Зоі-Сі-П-нитробензилоксикарбонилоксиэтил)-1-(1-ацетонилоксикарбонил-1-трифенилфосфоранилиденеметил)-азетидин-2-он. J186086 46 м OCO2PNB OCO^PNB A 0 COOCH2COCH3 Сырой продукт, приготовленный по п. з, растворили в 20 мл тетрагидрофу рана, добавили 700 мг трифенилфосфина и 0,35 мл пиридина, образовавший ся раствор нагревалив азоте при 70 С в течение нескольких часов. Фосфоран очистили элюированием на силикэгеле смесью дихлорметан;этилацетат (1:1). Получили 0,6 г соединения. к) (5К)-Ацетонил-2- (^(5-метил-1,3,4-тиадиазол-2-ил)-тнометил]~6о£-(1-П-нитробензилоксикарбонилоксиэтил)-2-пенем-3-карбоксилат. 0CO 2 PNB о "N—"N II соосн г сосн 3 0,6 г соединения, приготовленнометан:этилацетат (8:2). Получают го по п. и, растворяют в 50 мл толу0,25 г соединения. ола и подогревают в сосуде с обратным 25 ИК: 1795, 1750, 1720. холодильником под азотом в течение П р и м е р 56. (514)-Ацетонил3 ч. Соединение очищают при помощи -2-£(5-метил-1,3,4-тиадиазол-2-ил)хроматографии в малой силикагельной тиометил] -6в^-( 1-гидроксиэтил) - 2 -пенем-3-карбоксилат. колонке с элюированием смесью дихлор о J СИ, •"N С00Шг>С0СН 3 0,450 г соединения, приготовленного в примере 55, растворяют в 25 мл ацетонитрила, содержащего несколько капель этанола, и гидрогенируют на 40 10% Pd на углерода (400 мг). Катализатор удаляют фильтрацией и фильтрат хроматографируют на силикагеле с элюированием смесью дихлорметан: О' л *N ОН N :этилацетат ( 7 : 3 ) , что дает 0,18 г упомянутого в заглавии соединения. ИК: 3605, 1795, 1745, 1720 с м 4 . Пример 57. (5R)2 [(5-Метил-1,3,4-тиадиазол-2-ил)-тиометил]-6об-(1-гидроксиметил)-2-пенем-3-карбоновая кислота. СООСН2СОСН3 Раствор 0,200 . соединения, приготовленного в примере 56, в ацетонит риле (30 м л ) , содержащем несколько капель воды, охлаждают при 0°С, добавляют в азоте 5 мл 0,1 н.раство- 5 5 pa NaOH и раствор оставляют при перемешивании на 10 мин. Щелочную смесь дважды экстрагируют с метиленхлоридом, окисляют 10%-ным водным раствором лимонной кислоты и снова дважды экстрагируют с метиленхлоридом. Собранные органические фазы сушат над Na^S04 и выпаривают, что дает 0,110 соединения. ИК: 3500; 1795, 1665 см~ . ПМР С п , 2 0): 1,30 (д 3 = 6,5 Гц, 47 З Н , СН2СН) І ' 3 , 8 0 ( с , З Н ^ С Н , ) ; 3,92 ( д в . д . J = 1,5 6 , 0 Г ц , 1Н, Ц - 6 ) ; 4 , 2 5 ( м , 1Н, С Н С Н , ) ; 4 , 5 4 , 4 , 8 6 ( д в а д . Л = 15 Г ц , 2 Н , QHZS) ; 5 , 6 2 ( д . J = 1,5 Г ц , 1Н, Н - 5 ) . 186086 Пример 58. а) 4/30-0,2,3-Триазол-5-ил)-тиометш^-винилтио-3^-(1-П-нитробензилокснкарбонилоксиэтил)-1~(1-метокснкарбонил-2-метил-1-пропенил)-азетидин-2-он. OCO2PNB СООСНз COOCH3 Начиная с 2,5 г соединения, приготовленного в примере 55 в, и действуя^ также, как в примере 55 г, но используя натриевую соль 1,2,3-триазол-5-тиола, получают 2,2 г соединения. A б) 4Ді-(1,2,3~Триазол-5-ил]-тиоацетилтио~Зс(-С1-^-нитробензилоксикарбоншюксиэтил)-1~метокси-оксалоил-аэетидин-2-он. о СООСНз СООСН Начиная с 1,6 г соединения, приготовленного по п. а, и действуя также, как и в примере 55 д, получают 1,1 г соединения. 30 OCO2PNB н в) 4^-[1-(1,2,3-Триазол-5-ил5] -тиоацетилтио-Зй- (1-И-нитробензилокснкарбонилоксиэтил) - азетидин - 2 • он. OCO2PNB V -N " н сооснз Начиная с 1,1 г соединения, приготовленного по п. б, и действуя также, как в примере 55 е, получают 0,6 г соединения. г) 4/}[ї-(1,2,3-Триаэол-5-илУ]-тиоаце тилтио-За£-( 1-П-нитробенэилоксикарбонилоксиэтил)-1-(1-ацетонилоксикарбонил- 1-оксиметил)-азетиднн-2-он. 45 OCO 2 PNB OCO2PNB н н Начиная с 0,6 г соединения, приго- І5 товлекного по п. в, и действуя также, как и в примере 55 ж, получают 0,7 г соединения. >N. соосн г сосн 3 д) 4/) D~(1,2,3-Триаэол-5-ил)] -тиоацетилтио-ЗЫ-О-п-нитробенэилоксикарбонилоксиэтил)-1-О-ацетонилоксикарбонил-1-хлорметил)-аэетидин~2-он. 50 1186086 OC02PNB И СООСНгСОСНз н О СООСН2СОСН3 Начиная с 0,7 r соединения, приїо10 товленного по п, г, и действуя так же, как описано в примере 55 э, получают сырое хлорпроизводное. Продукт используют на следующей стадии без дальнейшей очистки. е) ЬП- [1-( 1 ,2,3-Триазол-5-ил)^-тиоацетилтио~Зоі-( 1-ї>-ни-гробензилоксикарбонилоксиэтил)-1-(1-ацетонилоксикарбонилоксиэтил- 1-трифенилфосфоранилиденеметил)-азетиднн-2-он. OCO2PNB OCO2PNB 1 •S ->L н 0 н r=PPh3 С0ОСН2СОСН3 СООСН2СОСН3 Начиная с сырого хлорпроиэводного, полученного по п. д, и действуя так 25 же, как показано в примере 55 и, получают 0,55 г соединения. ж) (5К)-Ацетонил-2~ £( 1,2,3-триаэол-5-ил) -тиометшт]!-бы- (1 - п-нитробензилоксикарбонилоксиэтил)-2-пенем-3-карбоксилат. OCO2PNB OCO2PNB сооснгсосн3 О СООСН2СОСН3 Начиная с 45 г соединения, приготовленного по п. е, и действуя также , как описано в примере 55 к, получают 0,180 г соединения. ИК: 1795, 1750, 1720 см~\ OCO2PNB .N If П р и м е р 59. (5Ю-Ацетонил-2 - [(1,2,3-триазол-5-ил)тиометнлТ-6оі-(1-гидроксиэтил)-2-пенем-3-карбоксилат. (Ж N II •N н СООСН^СОСНэ COOCH2COCH3 Начиная с 0,380 г соединения, приютовленного в примере 58, и действуя по примеру 56, потучили 0,12 г 50 соединения. ОН X о •"N ИК: 3610, 1795, f750, 1720 см 1 . П р и м е р 60. ( 5 Ю - 2 - [ О , 2 > 3 -Триаэол-5-ил)~тометил^-6ой-(1-гидроксиэтил)-2-пенем-3-карбоновая кислота, ОН хт і Н СООСН2СОСН3 соон н 1 186086 52 ) 12,8 (бс)> Н-5); 7,60 (г,У Начиная I 0,2b г соединения, приготовленного в примере 59, и действуя также, как показано в примере 57, получают 0,135 г соединения. ) ИК: 3490, 1795, 16660 см"'. П р и м е р 61. а) 4/3 (1-КарбаПМР (Д 2 0): 1,29 (д, J = 6,5 Гц, моилоксиметил)-винилтио-Зк-(1-ПЗН, СН,СН); 3,90 (дв.д J = 1,5, -нитробенэилоксикарбонилпксиэтил)6,0 Гц, 1Н, ЇІ--6); 4,28 (м. 1Н, - 1-(1-метоксикарбонил-2-метил-1-проСНСН»); 4,55 4,90 (два д, J= 14 Гц, 2Н, C H 2 S ) ; 5,63 (Д. J = 1,5 Гц, 1Н, 10 пенил)-азетидин-2-он-3-оксид 51 OCO^PNB О \ О СООСНз СООСНз 2,2 г соединения, приготовленного 20 мешиванием на несколько минут и затем в примере 55 б, растворяют в 30 мл экстрагируют этилацетатом. После сушацетонитрила и охлаждают при 0°С. ки над Na^O^ выпаривание раствори0,8 изоцианатхлорсульфонила добавлятеля дает 1,5 г соединения. ют под азотом и смесь оставляют, б) 4ft-(1-Карбамоилоксиметил)-винилперемешивая в течение 2 ч. Реакцион25 тио-3о£- (1 -П-нитробензилоксикарбонилную смесь приливают к насыщенному оксиэтил)-1-(1-метоксикарбонил-2раствору NaHCO , оставляют с пере-метил-1-пропенил)-азетидин-2-он. OCO2PNB II О сооснг Начиная с 1,7 г соединения, приготовленного по п. а, и действуя также, как в примере 55 в получают 1,4 г соединения. OCO2PNB о OCO2PNB о соосн3 35 в) 4Д-(1-Карбамоилоксиметнл)-ацетилтио-Зоі-( 1-П-нитробензилоксикарбонилоксиэтил)-1-метоксиоксалоил-азетидин-2-он. OCO2PNB СООСНз СООСНз Начиная с 2,2 г соединения, приготовленного по и.б, и действуя так, как показано в примере 55 д, получают 50 1,4 г соединения. OCO2PNB г) 4^-(1-Карбамоилоксиметил) -ацетилтио - Зо^- (i - n - нитробензилоксикарбонилоксиэтил) - азетидин - 2 - он. OCO2PNB о 53 1186086 54 Начиная с 1,4 г соединения,пригод) 4^-(1-Карбамоилоксиметил)-ацетил тио-3#-( 1-п-нитробензилоксикарбонил товленного по п. в, и действуя также, оксиэтил)-1-С1-ацетонилоксикарбонил как покатано в примере 55 е, получают 0,9 г соединения. -1-гидроксиметил)-азетидин-2-он. OCO 2 PNB соосн сосн Начиная с 0,9 г соединения, приготовленного по п. г, и 0,6 г ацетонилглиоксилата, и действуя также, как в примере 55 ж, получают сырой карбониламид. г 3 е) 4Я-(1-Карбамоилоксиметил)-ацетил тио-Зо£-(1-П-нитробензилоксикарбонил оксиэтил)-1-(1-ацетовилоксикарбонил 15 — 1 — хлорметил) - азетидин - 2 - он . OCCbPNB О СООСН2СОСН3 Начиная с сырого продукта, полученного по п. д, и действуя также, как в примере 55 з, получают сырое хлоропроиэвод нее. 25 ж) 4Л-(1-Карбамоилоксиметил)-ацетилтио-ЗМ-(1-П-нитробензилокснкарбонилоксиэтил)-1-(1-ацетонилоксикарбонил-1-трифєнилфосфоранилиденеметил)-азетидин-2-он. 0C0 2 PNB ' OCO^PNB о О 0 соосн г сосн 3 COOCH2COCH3 Начиная с сырого продукта, полученного по п. е, и действуя так же, как показано в примере 55 и, получают 0,40 г фосфорана. з) (5Ю~Ацетонил--2-карбамоилокси метил-6о^-( 1-П-нитробензилоксикарбонилоксиэтил) - 2 - пенем - 3 - карбоксилат, OCO 2 PNB СООСН2СОСН3 C00CH z C0CH 3 Начиная с 0,4 г соединения, получинного по п. ж, и действуя также, как в примере 55 h, получают 0,11 г соединения. 55 П р и м е р 62. (5Ю-Ацетонил-2-карбамоилоксиметил-6к-(1-гидроксиэтил) - 2 - пенем - 3 - карбокси лат. OH OCO 2 PTSIB 0 56 1186086 55 Л J-N 0CONH 2 0 Начиная с 0,35 г соединения, приготовленного в примере 6 1 , и жействуя так же, как в примере 56, получили 0,11 г соединения. 10 СООСНЇСОСНЗ П р и м е р 63. (5Ю-2-(Карбамоилоксиметил) - 6 об - (] - гидроксиэтилр - 2 - пенем - 3 - карбоновая кислота. ОН ОН V.—f OCONHa о COOCH2COCH3 2 0 Начиная с 0 , 1 1 г соединения, п р и г о т о в л е н н о г о в примере 6 2 , и д е й с т в у я т а к же, как в примере 5 7 , получают 0,060 г соединения. ИК: 3 4 0 0 - 3 5 0 0 , 1 7 9 5 , 1700-1650 см' 1 ^ ПМР ( Д 2 0 ) : 1,31 ( д , J = 6,5 Гц, ЗН, СН^СН); 3,91 ( д в . д . J = 1,5 6 , 0 Гц, 1Н, Н - 6 ) ; 4 , 2 5 ( м . 1Н, СНОН); N соон 5 , 0 2 - 5 , 3 6 (два д . 2Н, СН, 0 С 0 ) ; 5 , 6 6 ( д . , J = 1,5 Гц, 1Н, Н - 5 ) . . П р и м е р, 64. . а) . . . ГЛ1л и к о л и л т и о - З ^ - ^ - П - н и т р о б е н з и л о к с и к а р ' г бонилоксиэтилЗ~1-[1-ацетонилоксикарбонил-1-гидроксиметил^-азетидин-2-он. OCO2PNB Л Л о О Раствор 1,04 г Afl-ацетилгликолил-3^~[1-П-нитробензнлокснкарбонилоксиэтил1-зэетидин-2-он, приготовленного в соответствии с примером 4 6 t и 1,8 г ацетонилглиоксилата в 40 20 мл бензола нагревают в сосуде с обратным холодильником s течение 4 ч Выпаривание растворителя позволяет 1 о OCONH 2 получить сырое соединение, которое используют на следующей стадии без дальнейшей очистки. _ _ б) 4/ї-Ацетилгликолилтио-Зо£-І,1робензилоксикарбонилоксиэтилj-1• [ 1 - ацетонилоксикарбонил - 1 азетидин - 2 - хлорметил I - он , QCO2PNB 1 7 сосн соосн COOCH2COCH3 Сырой карбиноламид, полученный в предыдущем примере, растворяют в 20 мл обезвоженного тетрагидрофурана и охлаждают при 0 С. Зквимоляр ные количества пиридина и тионилхло рида добавляют до тех пор, пока не прореагирует весь исходный материал Осадок фильтруют, выпаривание 55 г 3 фильтрата дает сырое соединение, к о торое используют на следующей стадии без дальнейшей очистки, в) 4/^-Ацетилгликолилтио-Зв£-[і-п-нитробензилоксикарбонилоксиметилі-1Г" - [ацетонилоксикарбонил-1-трифенипфосфор'анилиденеметилТ - чэетидчн - 2 - он .
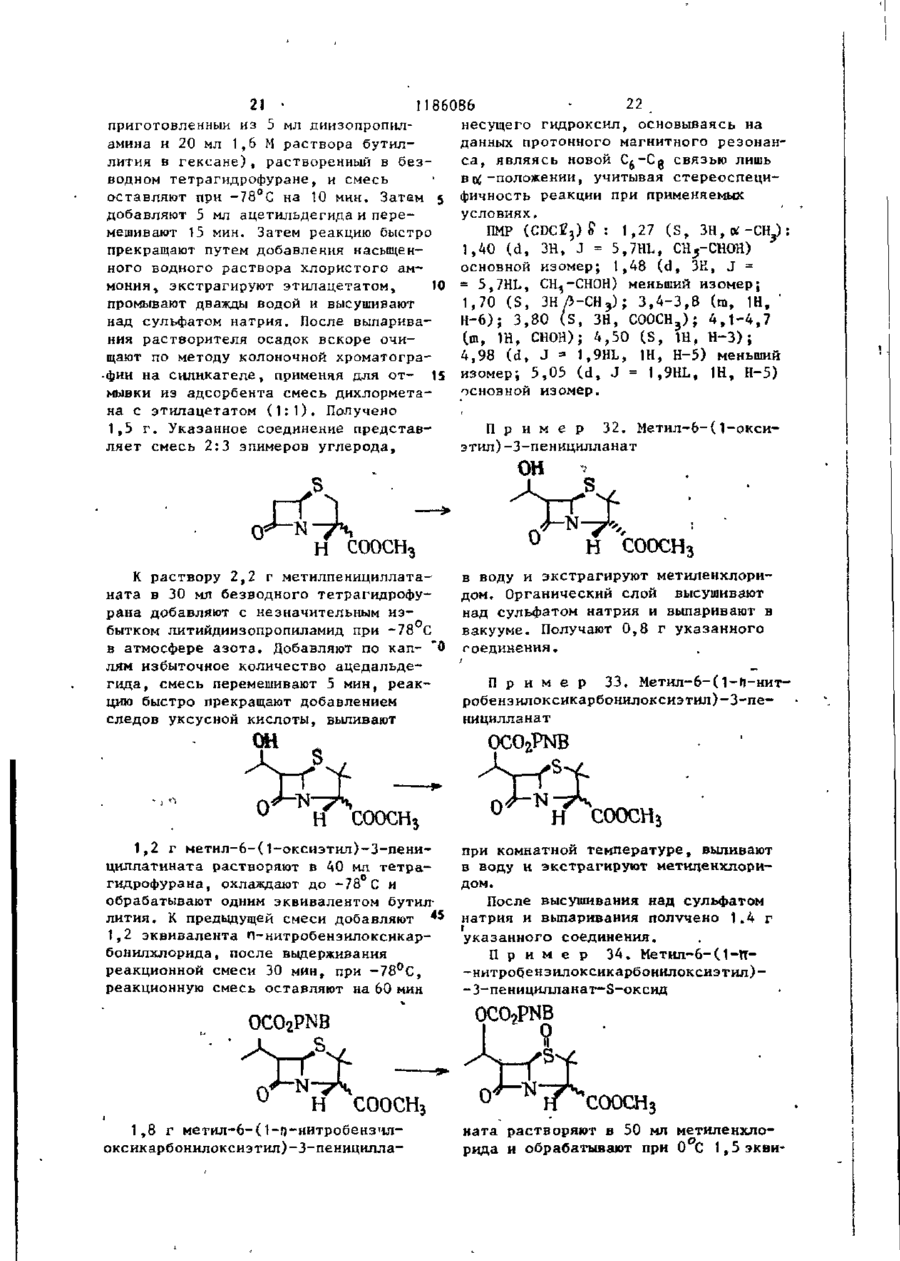
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of b-lactam-containing compounds
Назва патенту російськоюСпособ получения соединений beta-лактама
МПК / Мітки
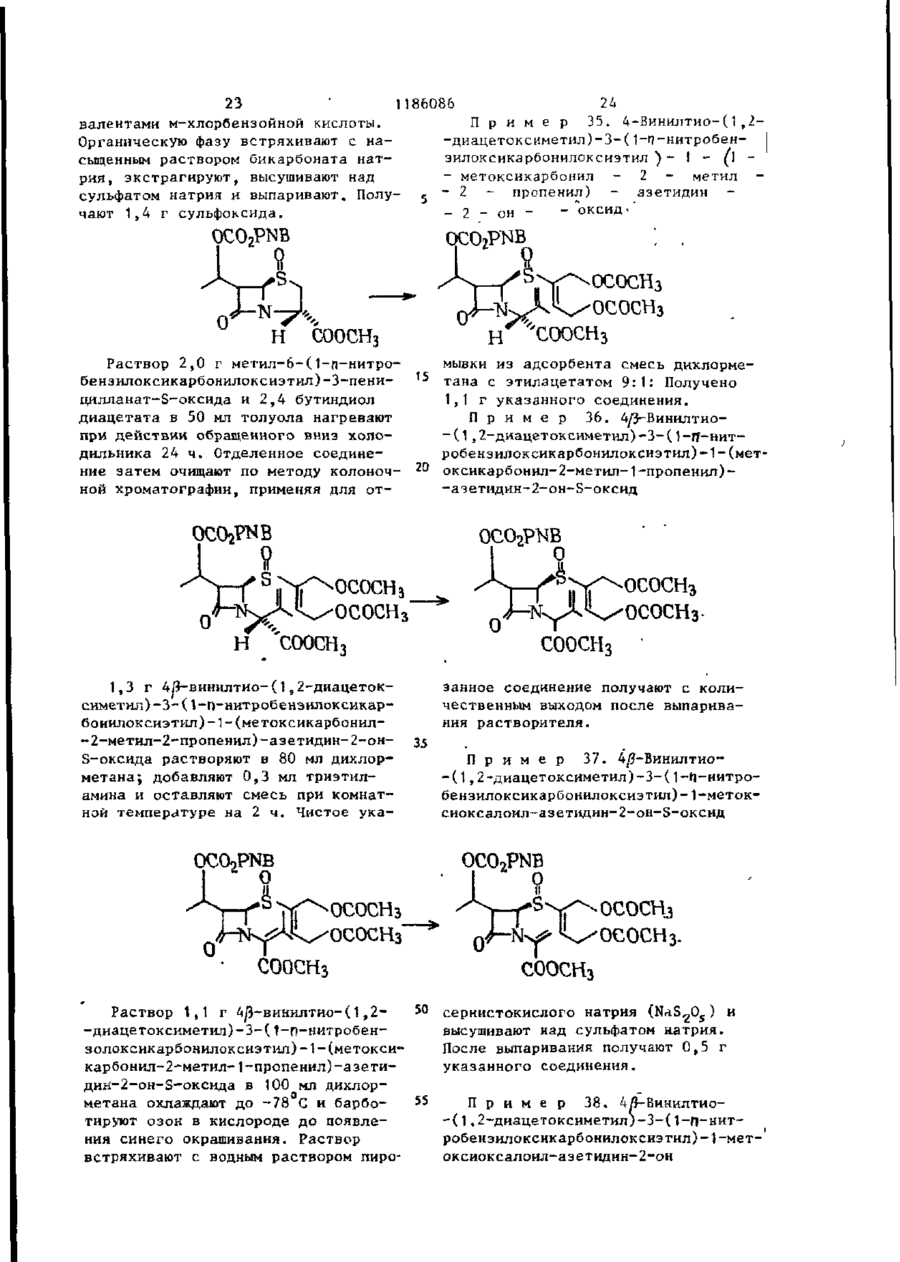
МПК: C07D 499/00, C07D 205/00, C07F 9/568
Мітки: сполучень, одержання, спосіб, beta-лактама
Код посилання
<a href="https://ua.patents.su/34-6041-sposib-oderzhannya-spoluchen-beta-laktama.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання сполучень beta-лактама</a>
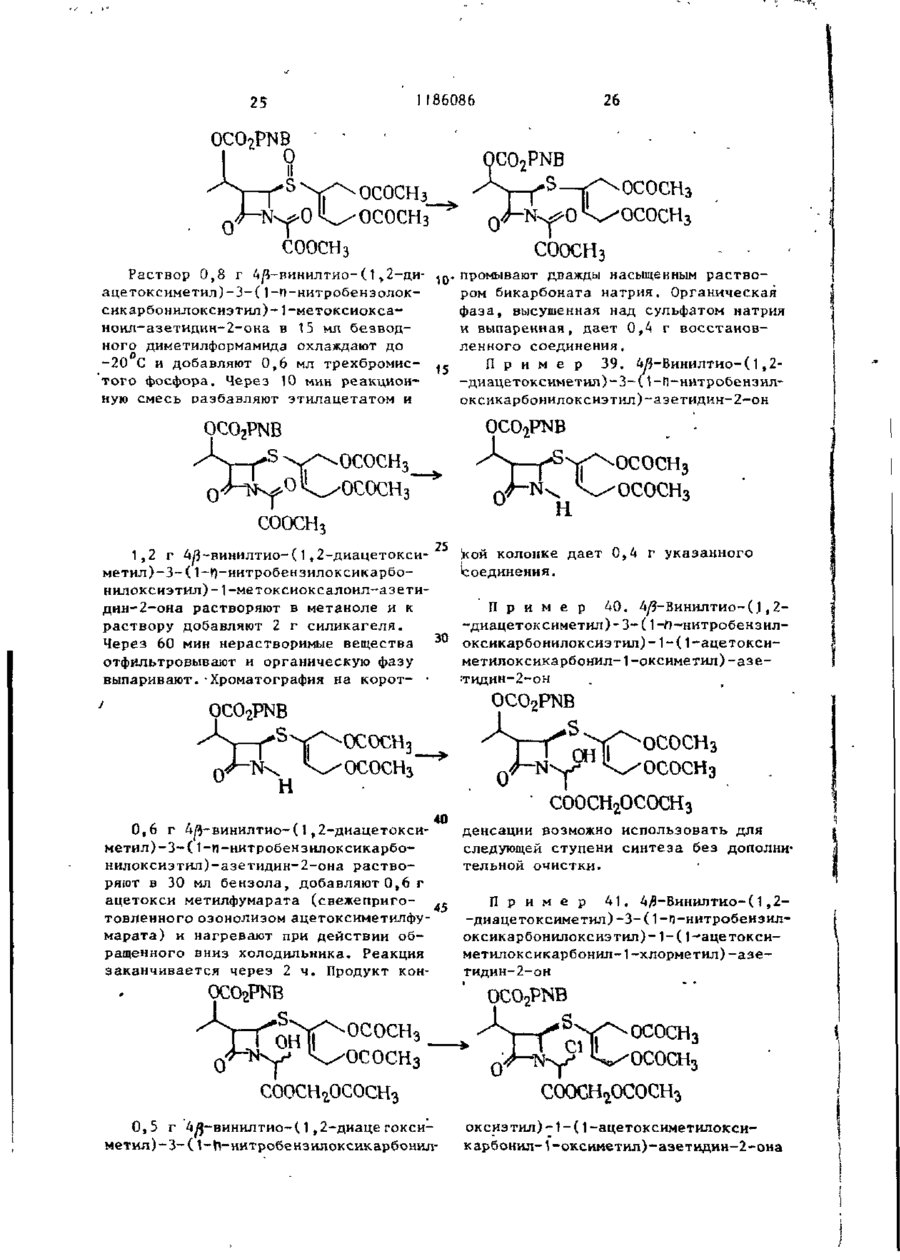
Попередній патент: Спосіб одержання пенакарбонового ефіру
Наступний патент: Спосіб одержання похідних хлорамбуціла /його варіанти/
Випадковий патент: Спосіб бурового видобутку слабоміцного кімберліту з-під заболоченого грунту