Похідні оксазолідинону, спосіб їх одержання та фунгіцидна композиція
Номер патенту: 35548
Опубліковано: 16.04.2001
Автори: Адамс Джон Бенджамін, Джеффкен Детлеф, Рейнер Денніз Реймонд
Формула / Реферат
1. Производные оксазолидинона общей формулы (I)
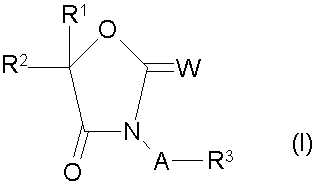
где:А-кислород или NR4;
W-кислород или S;
R1 - водород, С1-С6-алкил, С1-С6-галоалкил, С3-С6-циклоалкил, С2-С6-алкенил, С2-С6 алкинил, С2-С6-алкоксиалкил, С1-С3-алкил, замещенный С3-С6-циклоалкилом, фенил или бензил, причем фенильное или бензольное кольцо замещено в кольце радикалом R6, а бензиловый углерод замещен R7, R2 - фенил, замещенный R5 и R6, нафтил, замещенный 1-2 группами, выбранными из R6, тиенил, замещенный R5 и R6, фурил, замещенный R6, пиридил, замещенный одним из следующих заместителей: R6, фенокси, замещенный R6, или фенилтио, замещенный R6; С1-С2-алкил, замещенный фенокси или фенилтио, причем фенокси или фенилтио замещены в кольце радикалом R6; С1-С6-алкил или С5-С7-циклоалкил; R1 и R2, взятые вместе с атомом углерода, к которому они присоединены, могут образовывать карбоциклическое или гетероциклическое кольцо, содержащее О, N-R7 или S, из 5-7 атомов в кольце, и где гетероциклическое кольцо может быть сконденсировано с R5- замещенным бензольным кольцом или R6- замещенным тиофеновым кольцом, причем гетероатом не присоединен к спироцентру, и карбоциклическое кольцо может быть конденсировано с 1 или 2 R5-замещенными бензольными кольцами или R6- замещенным тиофеновым кольцом; R3 - фенил, замещенный R10, бензил, замещенный на бензиловом углероде группой, выбранной из R7, и замещенный в фенильном кольце R10, нафтил, замещенный R10, кроме того, R3 может обозначать тиенил, замещенный R10, фурил, замещенный R10, пиридил, замещенный R10, пиримидил, замещенный R10, или пиридазил, замещенный R10, или R3 может обозначать С2-С10-алкил или С5-С7-циклоалкил; R4- водород, формил, С2-С4-алкилкарбонил, С2-С4-галоалкилкарбонил, С2-С4-алкоксиалкилкарбонил, С2-С4-алкоксикарбонил, С2-С5-алкиламинокарбонил, С1-С4-алкилсульфонил, С1-С4-алкил, С4-С6-циклоалкил, фениламинокарбонил, где фенил замещен R10, и R4 может обозначать С3-С4-алкенил или С3-С4-алкинил, или R3 и R4 взятые вместе с атомом азота, к которому они присоединены, могут образовывать кольца пирролидина, пиперидина или пиррола, замещенные R10, причем указанные кольца могут быть конденсированы с R10-замещенным бензольным кольцом; R5 - водород, галоген, С1-С12-алкил, С1-С12-галоалкил, С1-С12-алкокси, С3-С12-алкенил, С3-С12-галоалкенил, С3-С12-алкенилокси, С3-С12-алкинил, С3-С12-галоалкинил, С3-С12-алкилтио, С1-С12-галоалкилтио, С1-С12-галоалкокси, С1-С12-алкилсульфонил, С1-С12-галоалкилсульфонил, нитро, фенил, замещенный R6, фенокси, замещенный R6, фенилтио, замещенный R6, циано, С3-С12-алкинилокси, С2-С12-алкоксиалкил, С2-С12-алкоксиалкокси, феноксиметил, замещенный в фенильном кольце R6, фенитилокси, замещенный в фенильном кольце R6, бензилокси, замещенный в фенильном кольце R6, фенетил, замещенный в фенильном кольце R6, бензилокси, замещенный в фенильном кольце R6, фенетил, замещенный в фенильном кольце R6, бензил, замещенный в фенильном кольце R6, С2-С12-карбоалкокси, С5-С6-циклоалкил, NMe2; или NR8R9; R6-водород, 1-2 галогена, С1С4-алкил, трифторметил, С1-С4-алкокси, метилтио, нитро, фенокси, С2-С6-циклоалкилокси или С5-С6-циклоалкил; R7- водород или С1-С4-алкил; R8- водород или С1-С4-алкил; R8-вoдopoд или С1-С4-алкил; R9-вoдopoд, фенил, замещенный Н, 1-2 галогена, СF3, С1-С2-алкил или С1-С2-алкокси, а R10 обозначает до 2-х групп, выбранных из Н, СF3, СF3О, NO2, СО2Ме, галогена, С1-С5-алкила, С1-С5-алкокси, или CN, при условии, что, когда фенильное кольцо двузамещенное, одна из алкильной или алкокси-групп не превышает С1 при условии:
когда А - кислород, тогда R3-фенил, замещенный R5 или R6,
когда R2 - незамещенный фенил, тогда R1 отличен от водорода, метила или бензила,
когда R1 - водород, метил или циклогексил, тогда R2 не обозначает метил, изопропил или циклогексил,
и R1 и R2 не соединяются с образованием –(CH2)5-,
в качестве фунгицидов для борьбы с грибковыми заболеваниями растений.
2. Соединение по п.1, отличающееся тем, что А обозначает NR4; R1 обозначает C1-С4-алкил, С1-С3-галоалкил, винил, этинил или метоксиметил; R2 - фенил, замещенный R5 и R6, С5-С7-циклоалкил, тиенил, замещенный R6; или пиридил, замещенный R6; R3 - фенил, замещенный R10 и R4 - водород, С1-С4-алкил или С1-С3-алкилкарбонил, при условии, что, когда R2 - незамещенный фенил, тогда R1 не обозначает метил.
3. Соединение по п.2, отличающееся тем, что R1 обозначает С1-С4-алкил или винил; R2-фенил, замещенный R5 и R6; R3-фенил, замещенный 1-2 галогенами, метилом или метокси; R4-водород, галоген, С1-С4-алкил, С1-С4-галоалкил, С1-С6-алкокси, бензилокси, F3СО, F2НСО, С1-С6-галоалкокси, фенокси, замещенный R6, при условии, что, если R5 не обозначает Η или F, тогда он находится в пара-положении к точке присоединения к кольцу; R6 - водород, 1-2 F или Сl, метил или метокси, а R7 - водород, при условии, что, когда R2 незамещенный фенил, тогда R1 не обозначает метил.
4. Соединение по п.3, отличающееся тем, что R1 обозначает СН3; R4 - водород или метил; R5 обозначает Н, F, Сl, СН3, С1-С6-алкокси или фенокси, замещенный галогеном, СН3, СН3О или NO2; R6 обозначает Н или F и R10 обозначает F, Н или СН3, при условии, что R2 не обозначает незамещенный фенил.
5. Соединение по п.4, отличающееся тем, что оно выбрано из группы, состоящей из следующих соединений:
5-метил-5-(4-феноксифенил)-3-(фениламино)-2-тиокси-4-оксазолидинон и его (S)-энантиомер,
5-метил-5-фенил-3-(N´-фенил-N'-метиламино)-2-тиоксо-4-оксозолидинон и его (S)-энантиомер,
5-(4-(4-бромфенокси)фенил)-5-метил-3-(фениламино)-2-тиоксо-4-оксазолидинон и его (S)-энантиомер,
5-(4-(3-фторфенокси)фенил)-5-метил-3-(фениламино)-2-тиоксо-4-оксазолидинон и его (S)-энантиомер,
5-(2,4-дифторфенил)-5-метил-3-(фениламино)-2,4-оксазолидиндион и его (S)-энантиомер,
5-метил-5-(4-феноксифенил)-3-(фениламино)-2,4-оксазолидиндион и его (S)-энантиомер, а также их смеси.
6. Фунгицидная композиция, включающая активный ингредиент и целевые добавки, отличающаяся тем, что в качестве активного ингредиента она содержит эффективное количество производных оксазолидинона общей формулы (I), а в качестве целевых добавок, - по крайней мере, одно из следующих соединений: поверхностно-активное вещество, твердый или жидкий разбавитель.
7. Композиция по п.6, отличающаяся тем, что в качестве активного ингредиента она содержит эффективное количество производных оксазолидинона общей формулы (I) в комбинации с цимоксанилом.
8. Способ получения замещенных 3-амино-2-тиоксооксазолидин-4-онов формулы (Ib)
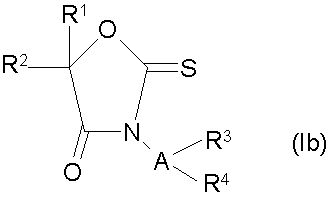
путем синтеза, отличающийся тем, что в органическом растворителе сложный эфир 2-гидроксикарбоновой кислоты формулы (VI)
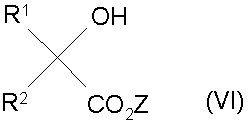
подвергают взаимодействию с основанием, затем полученный продукт подвергают взаимодействию с сероуглеродом, после чего подвергают взаимодействию с ацилирующим агентом и полученный продукт подвергают взаимодействию с замещенным гидразином с последующим выделением продукта из реакционной смеси, при этом Ζ обозначает алкил (С1-С12), алкенил (С2-С4), циклоалкил (С3-С12), циклоалкилалкил (C6-С7), алкоксиалкил (С2-С4), бензил, R1 обозначает Н, алкил (С1-С6), галоалкил (С1-С6), циклоалкил (С3-С6), алкенил (С2-С6), алкинил (С2-С6), алкоксиалкил (C2-С6), алкил (С1-С3), замещенный циклоалкилом(С3-С6), фенил или бензил, замещенный в кольце R6; R2 - фенил, замещенный R5 и R6, нафтил, замещенный 1-2 группами, выбранными из R6, тиенил, замещенный R5 и R6, фурил, замещенный R6; пиридил, замещенный R6, фенокси или фенилтио, алкил (С1-С6), циклоалкил(С5-С7); R1 и R2 могут быть взяты вместе с атомом углерода, к которому они присоединены, с образованием карбоциклического или гетероциклического кольца, содержащего О, N-R7 или S, из 5-7 атомов в кольце, причем гетероциклическое кольцо может быть конденсировано с R5-замещенным бензольным кольцом или R6-замещенным тиофеновым кольцом, при этом гетероатом не присоединен к спироцентру; карбоциклическое кольцо может быть конденсировано с 1-2 R5-замещенными бензольными кольцами или с R6-замещенным тиофеновым кольцом; R3-фенил, замещенный R8, бензил, замещенный на бензиловом углероде R7 и/или фенильным кольцом R8, нафтил, замещенный R8, тиенил, замещенный R8, фурил, замещенный R8, пиридил, замещенный R8, пиримидил, замещенный R8, пиридазил, замещенный R8, алкил (С2-С10), циклоалкил (С5-С7); R4 обозначает Н, формил, алкилкарбонил (С2-С4), галоалкилкарбонил (С2-С4), алкоксикарбонил (С2-С4), алкоксиалкилкарбонил (С2-С4), алкиламинокарбонил (С2-С5), алкилсульфонил (С1-С4), алкил (С1-С4), алкенил (С3-С4), алкинил (С3-С4), циклоалкил (С4-С6), фениламинокарбонил, где фенил замещен R8; R3 и R4 могут быть взяты вместе с атомом азота, к которому они присоединены, с образованием кольца пирролидино, пиперидино или пирроло, причем кольца могут быть конденсированы R8-замещенным бензольным кольцом; R5 - водород, галоген, алкил (С1-С6), галоалкил (С1-С4), алкокси (С1-С6), алкенилокси (С3-С4), алкилтио (С1-С5), галоалкилтио (С1-С4), галоалкокси (С1-С4), алкилсульфонил (С1-С4), галоалкилсульфонил (С1-С4), нитро, фенил, замещенный R6, фенокси, замещенный R5, фенилтио, замещенный R6, циано, алкинилокси (С3-С4), алкоксиалкил (С2-С4), алкоксиалкокси (С2-С6), феноксиметил с фенилом, замещенным R6, фенетилокси с фенилом, замещенным R6, бензил с фенилом, замещенным R6, фенетил с фенилом, замещенным R6, карбоалкокси (С2-С6), циклоалкил (С5-С6); R6- водород, галоген (1-2), метил, трифторметил, алкокси (С1-С4), метилтио, нитро; R7-водород или алкил (С1-С4); R8 обозначает 0-2 группы, выбранные из Н, СF3, СF3О, NO2, СO2Ме, галогена, С1-С5-алкила, С1-С5-алкокси или CN, при условии, что, когда фенильное кольцо двузамещенное, одна из алкильной или алкокси-групп не больше С1, при условии, что, когда А обозначает кислород, R3 обозначает фенил, замещенный R5 и R6.
9. Способ по п. 8, отличающийся тем, что в качестве основания используют алкоксид, гидроксид или гидрид щелочного металла.
10. Способ по п. 8, отличающийся тем, что в качестве органического растворителя используют простой или сложный эфир, амид, нитрил или сложный эфир 2-гидроксикарбоновой кислоты формулы II.
11. Способ по п. 10, отличающийся тем, что в качестве органического растворителя используют сложный эфир 2-гидроксикарбоновой кислоты формулы II, тетрагидрофуран, Ν,Ν-диметилформамид, Ν,Ν-диметилацетамид или 1-метил-2-пирролидон.
12. Способ по п. 8, отличающийся тем, что в качестве ацилирующего агента используют хлорформиат.
13 Способ по п. 12, отличающийся тем, что в качестве ацилирующего агента используют этилхлорформиат или метилхлорформиат.
14. Способ по п. 8, отличающийся тем, что в качестве замещенного гидразина используют соединение формулы H2NNR3R4.
15. Способ по п. 14, отличающийся тем, что в качестве замещенного гидразина используют фенилгидразин или 4-фторфенилгидразин.
16. Способ по п. 8, отличающийся тем, что используют сложный эфир 2-гидроксикарбоновой кислоты, в котором Ζ обозначает С1-С4-алкил, R1 обозначает метил, R2-фенил, замещенный R5 и R6, R3 - фенил, замещенный R6, и R4 обозначает водород.
17. Способ по п. 16, отличающийся тем, что используют сложный эфир 2-гидроксикарбоновой кислоты, в котором Ζ обозначает метил или этил, R1 обзначает метил, R2- фенил, 2,4-дидторфенил, 4-феноксифенил, 4-бромфенил или (3-фторфенокси)фенил.
18. Способ по п. 8, отличающийся тем, что в качестве основания используют трет-бутоксид калия, в качестве растворителя - тетрагидрофуран, в качестве ацилирующего агента - этилхлорформиат, замещенного гидразина - фенилгидразин, Ζ - метил, R1 - метил, R2 - фенил, R3 - фенил и R4 - водород.
19. Способ по п. 8, отличающийся тем, что реакцию сложного эфира 2-гидроксикарбоновой кислоты формулы VI с основанием осуществляют при температуре от -80 до 100 ºС, реакцию полученного продукта с сероуглеродом - при температуре от -20 до 100 °С, реакцию с ацилирующим агентом - при температуре от -20 до 50 ºС, а реакцию с замещенным гидразином - при температуре от -20 до 100 °С.
Текст
35548 Изобретение относится к новым производным оксазолидинона, фунгицидным композициям на их основе и способам борьбы с грибковыми заболеваниями на растениях. В литературе описаны способы получения оксазолидинонов: Geffken, D.; Z. Naturforch., 1983, 38b, 1008; Geffken, D.; Zinner, D.; Chem. Ber., 1983, 106, 2246; Geffken, D.; Arch. Pharm., 1982, 315, 802; Geffken, D.; Z. Naturforsch., 1987, 42b, 1202. Однако в этих ссылках не раскрыто конкретное назначение этих соединений. Аналогичные соединения описаны в патенте JP 61/200987-А. Указано назначение этих соединений для медицинских и агрохимических составов и в качестве микробиоцидов. В ЕР 248328А описаны производные оксазолидинонов в качестве биоцидов общего назначения. Однако указанные источники не описывают предлагаемых производных оксазолидинонов. И ни в одной из них не упоминается о фунгицидной активности и об использовании их в качестве эффективных средств защиты сельскохозяйственных культур от заболеваний. Настоящее изобретение предлагает новые производные оксазолидинонов общей формулы (І): (І) где: А означает О или NR4; W означает О или S; R1 означает Н, С1-С6-алкил, С1-С6-галоалкил, С3-С6-циклоалкил, С2-С6-алкенил, С2-С6-алкенил, С2-С6алкоксиалкил, С1-С3-алкил замещенный С 3-С6-циклоалкилом, фенил или бензил, причем указанное фенильное или бензильное кольцо замещено в кольце радикалом R 6; R2 означает фенил, замещенный R5 и R6, нафтил, тиенил, замещенный R5 и R6, фурил, замещенный 6 R , пиридил, замещенный Н 6 , который может быть галогеном; С1-С2алкил, замещенный фенокси или фенилтио, причем фенокси или фенилтио замещены в кольце радикалом R6; С1-С6-алкил; или С5-С7циклоалкил; и R1 и R2, взятые вместе с атомом углерода, к которому они присоединены, могут образовывать карбоциклическое или гетероциклическое кольцо, содержащее О или S, из 5-7 атомов и кольце, и где гетероциклическое кольцо может быть сконденсировано с бензольным кольцом, причем гетероатом не присоединен к спироцентру, и карбоциклическое кольцо может быть сконденсировано с 1 или 2 бензольными кольцами или тиофеновым кольцом; R3 обозначает фенил, замещенный R10, бензил, замещенный на бензильном углероде группой, выбранной из R7 и замещенный в фенильном кольце радикалом R 10, тиснил, замещенный радикалом R10, фурил, замещенный R10, пиридил, замещенный R10, пиримидил, замещенный R10, или пиридазил, замещенный R10; или R3 может обозначать С2-С10-алкил или С 5-С7-циклоалкил; R4 обозначает водород, формил, С2-С4-алкилкарбонил, С2-С4-галоалкилкарбонил, С2-С4алкоксиалкилкарбонил, С2-С4-алкоксикарбонил, С2-С5-алкиламинокарбонил, или С1-С5-алкил; или R3 и R4, вместе взятые с атомом азота, к которому они присоединены, могут образовывать пирральное кольцо, которым может быть приконденсировано к бензольному кольцу; R5 обозначает водород, галоген, С1-С1-алкил, С1-С12-галоалкил, С1-С12-алкокси, С1-С12-галоалкокси, С1С12-алкилсульфонил, нитро, фенил, фенокси, замещенный R6, фенилтио, циано, С1-С12-алкоксиалкокси, феноксиметил, замещенный в фенильном кольце R6, бензилокси, замещенный в фенильном кольце R6, фенетилокси, бензил, С5-С6-циклоалкил, NMe2 или NR8R9; R6 обозначает водород, 1-2 галогена, С1-С4-алкил, трифторметил, С1-С4-алкокси, метилтио, нитро, фенокси или С1-С6-циклоалкил; R8 обозначает водород или С1-С4-алкил; R9 обозначает водород или С1-С4-алкил; R10 обозначает водород или С5-С6-алкил; и R10 обозначает 0-2 группы, выбранные из водорода, СF3, СF3О, NO2 . СО2 Мe, галоген, С1-С5-алкил, или С1-С5-алкоксил, при условии, что когда кольцо в радикале R3 дизамещено, одна из алкил- или алкоксигрупп преимущественно является метилом или метоксилом при условии, что: 1) когда А обозначает О, тогда R3 обозначает фенил, замещенный R10; 2) когда R2 обозначает фенил, а R5 и R6 являются водородами, тогда R1 отличен от водорода, метила или бензила; 3) когда R1 обозначает водород, метил, бензил или циклогексил, тогда R2 не является метилом, изопропилом или циклогексилом; и 4) R 1 и R2 не соединяются с образованием -(CH2)5-. Предпочтительны соединения формулы (I), где: А обозначает NR4; R1 обозначает С1-С4-алкил, С1-С3-галоалкил, винил или этинил; R2 обозначает фенил, замещенный R5 и R6; С5-С7-циклоалкил, тиенил, замещенный радикалом R6, или пиридил, замещенный R6; R3 обозначает фенил, замещенный радикалом R10; и R4 обозначает водород, С1-С3-алкил или С2-С3-алкилкарбонил; в частности, предпочтительны соединения формулы (I), где: R1 обозначает С1-С4-алкил или винил; R2 обозначает фенил, замещенный радикалами R5 и R6; 35548 R3 обозначает фенил, замещенный 1-2 галогеном, метилом или метоксилом; R4 обозначает водород или метил; R5 обозначает водород, галоген, С1-С4-алкил, С1-С4-галоалкил, C1-С6-алкоксил; бензилокси, F3СО, F2НСО, фенокси, замещенный радикалом R6; 5 при условии, чтоесли R не обозначает Н или F, тогда он находится в пара-положении по отношению к месту присоединения к кольцу; R6 обозначает Н, 1-2 атомами F или Сl, метил или метокси; и R7 обозначает водород. Из них особенно предпочтительны соеди-нения, где: R3 обозначает СН3; R4 обозначает водород или метил; R5 обозначает Н, F, СІ, СН3. С 1-С6алкокси, или фенокси, замещенный галогеном, СН3, СН3О или NО2; R6 обозначает Н или F; и R10 обозначает 0-2 атома F, Н или СН3. Из числа указанных предпочтительных соединений формулы (I) можно назвать соединения, выбранные из группы, 1) 5-метил-5-(4-фсноксифенил)-3-(фенил-ами-но)-2-тиоксо-4-оксазолидинон и его (S)-энантиомер: 2) 5-метил-5-фенил-3-(N'-фенил-N'-ме-тилами-но)-2-тиоксо-4-оксазолидинон и его (S)-энантиомер: 3) 5-[4-(4-бромфенокси)фенил]-5-метил-3-(фе-ниламино)-2-тиокси-4-оксазолидинон энантиомер: 4) 5-[4-(3-фторфенокси)фенил]-5-метил-3-(фе-ниламино)-2-тиоксо-4-оксазолидин энантиомер: и он его и его (S) (S) 5) 5-(2,4-дифторфснил)-5-метил-3-(фенилами-но)-2,4-оксазолидиндион и его (S)-энантиомер: 6) 5-метил-5-(4-феноксифенил)-3-(фенилами-но)-2,4-оксазолидиндион и его (S)-энантиомер: Другим объектом данного заболеваниями растений. изобретения являются фунгицидные композиции для борьбы с 35548 В частности, предложена фунгицидная композиция, включающая активный ингредиент - 1,3оксазолидинон общей формулы (I) в эффективном количестве и по крайней мере одну из целевых добавок (композиция А). Предпочтительно использовать в качестве целевых добавок по крайней мере одно из следующи х веществ: поверхностно-активное вещество, твердый или жидкий разбавитель, а в качестве производного оксазолидинона - производное, выбранное из группы: соединения формулы (I), где А обозначает NR4; R1 обозначает С1-С4-алкил, С1-С3-галоалкил, винил или этинил; R2 обозначает фенил, замещенный R5 и R6; С5-С7-циклоалкил, тиенил, замещенный радикалом R6, или пиридил, замещенный R6; R3 обозначает фенил, замещенный радикалом R10; и R4 обозначает водород, С1-С3-алкил или С2-С3-алкилкарбонил; либо R1 обозначает С1-С4-алкил или винил; R2 обозначает фенил, замещенный радикалами R5 и R6; R3 обозначает фенил, замещенный 1-2 галогеном, метилом или метоксилом; R4 обозначает водород или метил; R5 обозначает водород, галоген, С1-С4-алкил, С1-С4-галоалкил, С1-С6-алкоксил; бензилокси, F3CO, F2HCO, фенокси, замещенный радикалом R6; при условии, что если R5 не обозначает Н или F, тогда он находится в параположении по отношению к месту присоединения к кольцу; R6 обозначает Н, 1-2 F или Сl, метил или метокси; и R7 обозначает водород; либо R1 обозначает СН3; R4 обозначает водород или метил; R5 обозначает Н, F, Сl, СН3, C1-C6алкокси; или фенокси, замещенный галогеном. СН3, СН3О или NО2 ; R6 обозначает Н или F; и R10 обозначает 0-2 атома F, Н или СН3: в частности, соединения, выбранные из группы: 5-метил-5-(4-феносифенил)-3-(фениламино)-2-тиоксо-4-оксазолидинон или его (S)-энантиомер; 5-[4-(4-бромфенокси)фенил]-5-метил-3-(фе-ниламино) -2-тиоксо-4-оксазолидинон или его (S)энантиомер; 5-[4-(3-фторфенокси)фенил]-5-метил-3-(фе-ниламино)-2тиоксо-4-оксазолидинон или его (S)энантиомер; 5-(2,4-дифторфснил)-5-метил-3-(фенилами-но)2,4-оксазолидиндион или его (S)-энантиомер; 5-метил-5-(4-феноксифенил)-3-(фениламино)-2,4-оксазолидиндион или его (5)-энантиомер. Другой фунгицидной композицией, предложенной согласно изобретению, является композиция, включающая активный ингредиент - производное оксазолидинона формулы (I), цимоксанил, в весовом соотношении равном 1:0,05-7,5, взятые в эффективном количестве, и по крайней мере одну из целевых добавок (композиция В). Объектом данного изобретения также являются способы борьбы с грибковыми заболеваниями путем обработки защищаемого локуса активным ингредиентом - производным оксазолидинона формулы (I), взятым в эффективном количестве, либо производным оксазолидинона формулы (I) и цимоксанилом в соотношении (весовом) 1:0,05-17,5, взятых в эффективном количестве. При этом предпочтительно использовать в случае обработки локуса производными оксазолидинона, выбранными из группы, указанной выше при описании фунгицидной композиции А. Синтез Соединения настоящего изобретения можно получить согласно нижеприведенному способу по схеме с получением 5-метил-5-фенил-3-(фениламино)-2-тиоксо-4-оксазолидинона: Подробно эти способы и их варианты описаны в нижеследующи х уравнениях. В том случае, когда R1 и R2 имеют различные значения, соединения формулы I в уравнении 1 имеют хиральный центр. Данное изобретение относится к рацемическим смесям и к чистым энантиомерам. Хотя 35548 один энантиомер может, иметь белее высокую фунгицидную активность для данного соединения формулы (I), другой энантиомер также активен и не препятствует проявлению активности более активного энантиомера. Как показано в уравнении 1, соединения формулы (I) могут быть получены путем обработки гетероциклического соединения II соответствующим амином III. Уравнение 1 Реакцию проводят при температуре от 0 до 50°С в инертном растворителе, таком как метиленхлорид, ТГФ или бензол. Подробные экспериментальные методики раскрываются в приведенных ниже ссылках. Соединения, описанные формулой (I), где W обозначает S, могут быть получены по способу, указанному в уравнении 2. Уравнение 2 Обработка тиоксодиоксазинонов ІІа гидроксил-аминами (А=О ) или гидразинами (А=NR4) в инертном растворителе, таком как метиленхлорид, бензол или ТГФ, при температуре от –10° до 35°С приводит к получению тиоксооксазолидинонов Іа (Gеffkеn, D.; Z. Naturforsch., 1983, 38b, 1008). Тиоксодиоксазиноны ІІа получают в соответствии с уравнением 3. Уравнение 3 Гидроксамовые кислоты IV подвергают взаимодействию с тионоирующим агентом V, таким как тиофосген (X=Cl), в присутствии основания или 1,1'-тиокарбончлдиимидазола (Х-имидазол), получая тиоксодиоксазиноны На. Реакции осуществляют при температуре от -20° до 25°С в инертном растворителе (Geffkеn, D.; Z. Naturforsch., 1983, 38b, 1008). Продукты, как правило, являются нестабильными при температуре окружающей среды и поэтому подвергаются взаимодействию с желательным амином III сразу же после выделения. Получение гидроксиламинов (Castellino, AJ.; Rapoport, H.; J. Organic Chemistry, 1984, 49, 1358) (III, А=О) и гидразинов (J. Timberlake; J. Stowell; The Chemistry of the Hydrazo, Azo and Azo xy Groups (S. Patai, Ed) John Wiley and Sons, Ltd., London 0975), p.69; D'emers, J.P., Klaubert, D.J.: Tetrahedron Lett., 1987, 4933) (III, F=NR4) можно осуществить известными в литературе способами. Синтез требуемых гидроксамовых кислот IV можно осуществить несколькими известными способами. Как показано в уравнении 4, конденсация альфа-гидроксикарбоновой кислоты VI (Z-H) с хлоргидратом Nметил-гидроксиламина позволяет получить требуемые гидроксамовые кислоты IV. (Geffken, D.; Kampf, H.; J. Chem. Ltd.. 1979, 103, 19). Триэтиламин обычно используют в качестве основания, а 1,3дициклогексилклрбодиимид (ДЦК) используют в качестве дегидратирующего агента. Уравнение 4 2-Гидроксикарбоновые кислоты могут быть использованы в готовом виде из коммерческих источников или приготавливаться из кетонов или альдегидов путем образования циангидринов с последующим гидролизом, в известных условия х. Например, Org. Syn. Coll., v. IV, 58 (1968) раскрывая получение атролактиновой кислоты из ацетофенона. Сложные эфиры могут быть получены из 2-гидроксикарбоновых кислот известными способами. Альтернативно, ариловые сложные эфиры альфа-гидроксикарбоновой кислоты могут быть получены путем обработки сложных эфиров пировиноградной кислоты 35548 нуклеофильными металлорганическими реагентами, такими как фенилмагнийбромид или фениллитий, как описано в литературе (Salomon, R.G., Pardo, S.N.. Ghosh, S., J. Org. Chem., 1982, 47, 4692). "Словарь органических соединений", том 3, 4-я редакция (1965), с.1791 (Oxford Univ. Press) перечисляет примеры атролактиновой кислоты и сложных эфиров. В литературе известны альтернативные способы получения соединений формулы IV. Как показано в уравнении 5, альфа-гидрокси-гидроксамовые кислоты IV могут быть синтезированы путем обработки альфа-кетогидроксамовых кислот VII избыточным количеством реагента Гриньяра (Geffkеn, D., Borchardt. A., Arch. Pharm., 1988, 321, 311). Реакции осуществляют в кипящем простом эфире в течение 2-6 ч. Уравнение 5 Данная методика наилучшим образом работает в том случае, когда R2 гидроксамовых кислот VII представляет собой неэнолизируемую группу, например, фенильную гр уппу. a-Кетогидроксамовые кислоты VII могут быть получены конденсированием хлорангидридов глиоксиловой кислоты VIII, полученных из соответствующи х карбоновых кислот (Geffken, D., Burchardt, A., Arch. Ptiarm., 1988, 321, 311), с О-триметилсили-N-метилгидроксиламином (Geffken, D., Burchardt, A., Arch. Pharm., 1988, 321, 311) (уравнение 6). Уравнение 6 Эту реакцию осуществляют в смеси пиридина и метиленхлорида при температуре от 0 до 25°С. Исходные a-кетокислоты VIII либо поставляют из коммерческих источников, либо получают окислением соответствующего метилкетона с использованием диоксида селена (Hallman, G., Hacgele. К., Annairn, 1963, 662, 147). Третий способ получения альфа-гидро-ксигидроксамовых кислот IV является специфическим для случаев, когда R1=R2 (IVa). Данный способ, приведенный в уравнении 7, предусматривает прибавление избыточного количества реактива Гриньяра (обычно пять эквивалентов), к раствору гидроксамовых кислот IX в простом эфире (Geffken, D., Arch. Pharm., 1987, 320, 382). Реакции обычно осуществляют при температуре кипения. Уравнение 7 Исходные гидроксамовые кислоты IX получают п утем обработки этилоксалилхлорида Х хлоргидратом N-метилгидроксиламина. Карбонат натрия прибавляют в качестве акцептора кислоты (уравнение 8) (Geffken, D., Arch. Pharm., 1987, 320, 382). Уравнение 8 Соединение общей формулы 1, где W и А обозначают О (Iс), получают способом, показанным в уравнении 9. Уравнение 9 Добавление карбонилирующего агента, например, фосгена (Х=С l), 1,1'-тиокарбонил-диимидазола (Х=имидазол ) или оксалилхлорида, к гидроксамовым кислотам типа XI приводит к получению диоксотетрагидрооксазолов Іс. 35548 Циклизацию можно осуществлять в инертном растворителе, например, бензоле или метиленхлориде, при температуре в диапазоне от 0 до 80°С. Экспериментальные подробности относительно реакций данного типа изложены при описании получения исходных гидроксамовых кислот XI. (Geffken, D., Zinnеr, О., Chem. Ber., 1973, 106, 2246). Соединения формулы I, где W обозначает J и А обозначает NR4 (Id), синтезируют п утем обработки гидроксамовых кислот IIb различными гидразинами, как показано в уравнении 10. В зависимости от природы заместителей на IIb и реагирующего гидразина, промежуточные N-аминокарбаматы XII могут или не могут быть выделены. В случаях, когда замыкание кольца не происходит спонтанно в условиях реакции, обработка соединения XII триотиламином в инертном растворителе (таком как ТГФ) при температуре в диапазоне от 25°С до 80°С индуцирует циклизацию в соединение Id (Geffken, D., Arch. Phann., 1982, 315, 802; Geffken, D., Synthesis, 1981, 38). Уравнение 10 Диоксизионы IIb легко получают из соответствующей альфа-гидроксигидроксамовой кислоты путем обработки 1,1'-карбонил-диимидазолом (уравнение 11). Циклизацию осуществляют в инертном растворителе, таком как метиленхлорид, и завершают менее, чем за одну минуту при температуре 25°С (Geffken. D., Arch. Phann., 1982, 315. 802: Geffken, D., Synthesis, 1981, 38). Уравнение 11 Кроме описанных выше способов, окса-золидиндионы формулы I, где W обозначает О, могут быть получены десульфуризацией тиоксооксазолидинонов как показано в уравнении 12. Уравнение 12 Общая методика получения оксазолилин-дионов описывается ниже. Тиоксооксазолидинон (IЬ) растворяют в органическом растворителе, который не смешивается с водой, например, метаноле, ацетоне, ацетонитриле, диметилформамиде, диоксане, тетрагидрофуране и так далее. Метанол и ацетон являются предпочтительными растворителями. Раствор обрабатывают десульфурирующим агентом, таким как водный OXONE® (КНSО3), водный нитрат серебра, отбеливатель (NaOCl), различные перекиси и перкислоты или другие реагенты, известные специалистам для окисления серы. Предпочтительны водный OXONE® и водный нитрат серебра. Реакционную смесь перемешивают при температуре в диапазоне от 20 до 100°С до завершения реакции. Продукт можно выделить упариванием растворителя и очистить промывкой водой в растворителе, который не смешивается с водой, например, метиленхлориде или простом эфире. Сушка, упаривание растворителя и последующая очистка перекристаллизацией или хроматографией позволяют получить чистые оксазолидиндионы Id. Возможно получение тиокcооксазолидинонов Ib с хорошим выходом. Способ предусматривает проведение четырех последовательных реакций: 1) реакция сложного эфира 2-гидрокси-карбоновой кислоты с основанием, 2) реакция продукта реакции (1) с сероуглеродом, 3) реакция продукта реакции (2) с ацилирующим агентом, и 4) реакция продукта реакции (3) с замешенным гидразином. Данную последовательность реакций удобно осуществлять в одном реакторе без выделения химических промежуточных coединений. В уравнении 13 представлен способ для получения 5-метил-5-фенил-3-(фениламино)-2-тиоксо-4оксазолидинона, а в уравнении 14 предоставлен способ для общего случая. Уравнение 13 35548 Уравнение 14 где значения радикалов указаны ниже. Получение сложных альфа-гидроксиэфиров VI в уравнении 14 обсуждено выше. Группой сложного эфира может быть алкил (С1-С12), циклоалкил (С3-С12), циклоалкилалкил (С6-С7), алкоксиалкил (С2-С4) или бензил. Для упрощения синтеза, снижения стоимости и более высокой пригодности предпочтительны сложные эфиры, в которых Z обозначает С1-С4алкил. Тиоксооксазолидиноны Ib, полученные данным способом, предпочтительны благодаря простоте синтеза, низкой стоимости и более высокой активности, и они представляют собой соединения, в которых R1 обозначает метил, R2 обозначает фенил, замещенный R5 и R6; R3 обозначает фенил, замешенный R10, и R4 обозначает водород. В каждой стадии реакции по уравнению 14 оптимальное сочетание времени реакции, температуры реакции, стехиометрии, растворителей и тому подобного будет зависеть от конкретного получаемого продукта, а также от относительной важности этих факторов и результатов для каждого отдельного случая. Например, время реакции должно быть достаточным для осуществления требуемой реакции; температура реакции должна быть достаточной для осуществления требуемой реакции в желательное время без разложения продуктов или побочных реакций; стехиометрия реагентов должна быть теоретической в интересах экономки, с различными вариантами для компенсации упаривания или други х потерь; растворитель (растворители) можно выбрать, например, таким образом, чтобы реакционные ингредиенты имели достаточную растворимость, для ускорения реакции. На стадии I используют подходящие основания, т.е. те, которые способны депротонировать гидроксильную группу при отсутствии побочных реакций. В их число входят третичные алкоксиды щелочных металлов, гидриды и гидроксиды. В целях более высокой растворимости, реакционной способности, простоты или безопасности использования, для получения высоких выходов или экономии предпочтительными являются третичные алкооксиды калия, такие как трет.-бутоксид калия и трет.-амилат калия. Особенно предпочтителен трет.-бутоксид калия. Пригодными растворителями являются сложный эфир 2-гидроксикарбоновой кислоты и обычно негидроксильные растворители, включая простые эфиры (например, диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан), сложные эфиры (например, метил и этилацетат), амиды (например, N,Nдиметилформамид, N,N-диметилацетамид, 1-метил-2-пирролидон), нитрилы (например, ацетонитрил) и так далее, а также смеси, содержащие один или более этих растворителей. Предпочтительны растворители, в которых реагенты имеют достаточную растворимость. Температура может варьироваться приблизительно от -80 до 100°С, предпочтительно приблизительно от -20 до 80°С, более предпочтительно приблизительно от -5 до 50°С. Температура окружающей среды является удобной температурой, при которой осуществляют реакцию. Необходимое время реакции обычно достаточно короткое при использовании растворимых реагентов. Не более нескольких минут необходимо для того, чтобы достичь температуры от ледяной до комнатной, например, от 0,5 до 15 мин. На стадии 2 сероуглерод (CS2) подвергают взаимодействию с продуктом стадии 1 при температуре приблизительно от -20 до 100 0С, предпочтительно от -10 до 50°С, в течение примерно от 5 с до 24 ч, предпочтительно от 5 до 30 мин. Реакция является быстрой в случае растворимых реагентов. Температура окружающей среды является удобной температурой, при которой проводят реакцию. На стадии 3 ацилирующий агент, способный образовывать смешанный ангидрид с продуктом стадии 2, подвергают взаимодействию с продуктом стадии 2. Такие ацилирующие агенты включают хлорформиаты, например, метилхлорформиат, этилхлорформиат, пропилхлорформиат, бутилхлор формиат и бензилхлорформиат, а также другие ацилирующие агенты. Предпочтительными ацилирующими агентами являются метил- и этилхлорформиат. Реакция является быстрой и завершается приблизительно от 5 с до одного часа при использовании растворимых реагентов. Большинство реакций завершается приблизительно от 1 до 30 мин. Температура может варьироваться в диапазоне приблизительно от -20 до 50°С. Предпочтительный диапазон составляет приблизительно от -10 до 25°С. Температура в пределах от ледяной ло температуры окружающей среды является удобной для проведения данной реакции. На стадии 4 замещенный гидразин подвергают взаимодействию с продуктом стадии 3. Замещенный гидразин можно использовать в виде свободного основания или в виде смеси его кислой соли с добавлением акцептора кислоты, такого как третичный амин (например, триэтиламин, N,N-диизопропил-Nэтиламин). Реакция является быстрой и требует не более нескольких минут для ее завершения с растворимыми реагентами. Время реакции может составить примерно от 10 с до одного дня, 35548 предпочтительно от 1 мин до 8 ч. Температура реакции может варьироваться в пределах приблизительно от -20 до 100°С. Для завершения реакции удобно использовать температуру от ледяной до комнатной. Продукт стадии 4 можно выделить упариванием реакционного растворителя, и он может быть очищен, при желании, путем растворения в растворителе, который не смешивается с водой (например, четырех хлористый углерод, бутилхторид, простой эфир). промывки водой, минеральной кислотой и основанием с последующей сушкой и упариванием растворителя, после "его осуществляют кристаллизацию или хроматографию, если желательно. Соединения, которые можно получить способом настоящего изобретения, описываются в примерах и таблицах и не должны быть истолкованы как ограничивающие объем настоящего изобретения. Пример 1 Этил 2-(3-торпирид-4-)лактат 27 мл коммерчески доступного раствора 2,03 М литий диизопропиламида в ТГФ/гептанс (Lithco) разбавляют 50 мл сухо го ТГФ, охлаждают до температуры -60°С под азотом и перемешивают с одновременным добавлением раствора 4,3 мл (4,8 г, 50 ммоль) 3-фторпиридина в 10 мл сухого ТГФ со скоростью, которая сохраняет смесь при температуре ниже -55°С. Полученную суспензию перемешивают при температуре -60°С в течение 30 мин и затем продолжают охлаждать и перемешивать раствор 6,0 мл (6,4 г, 55 ммоль) этилпирувата в 30 мл сухого ТГФ, который добавляют в смесь как можно быстрее, поддерживая внутреннюю температуру -60°С. Полученную жидкую суспензию доводят до температуры – 10°С, затем разбавляют 200 мл воды и 200 мл простого эфира. Водную фазу до водят до рН 7,0 путем прибавления 1н водного раствора НСІ, эфирную фазу отделяют, водную фазу экстрагируют двумя порциями 100 мл простого эфира и объединенные эфирные фазы промывают тремя 100 мл порциями и 100 мл солевого раствора, сушат в присутствии сульфата магния и упаривают с получением 5,8 г темнокоричневого масла. Хроматография на силикагеле, элюирование метиленхлоридом-метанодом 99:1 приводят к получению 3,7 г (35%) указанного в заголовке соединения в виде палево-желтого твердого вещества с температурой плавления 55-60°С; ИК (нужол) 2600-3400, 1755, 1730 см -1; ЯМР (CDCl3, 200 МГц), 1,2 (3Н, t, J=7); 1,8 (3Н, s); 3,9 (1Н, s); 4,3 (2H, q, J=7); 7,5 (1Н, dd, J=5, 7); 8,4-8.5 (2H, m). Пример 2 Этил 2-(4-феноксифенил)лактат 205-мл колбу, снабженную магнитной мешалкой, водным конденсатором, 125-мл капельной воронкой, термометром и отверстием для впуска азота, загружают 2,7 г (110 ммоль) металлического магния и сушат тепловой пушкой при сильной продувке азотом. После охлаждения в капельную воронку загружают раствор 17,5 мл (24,9 г, 100 ммоль) 4-бромдифенилового эфира в 67 мл сухого ТГФ, и 10 мл пропускают в колбу. При переме-шивании спонтанно начинается реакция Гриньяра, а остальную часть бромидного раствора добав-ляют в течение 15 мин, поддерживая внутреннюю температуру 67-68°С. После завершения прибав-ления температуру со храняют на уровне 68°С в течение 5 мин, затем начинают понижение, дости-гая 30°С через 45 мин. В этом же время 250 мл колбу, магнитную мешалку и 125 мл капельную воронку, предварительно высушенную в печи, со-бирают горячими под азотом и охлаждают. Вводят низкотемпературный термометр в устройство, кол-бу загружают раствором 11,5 мл (12,2 г, 105 ммоль) отилпирувата в 66 мл сухого ТГФ. и раствор реагента Гриньяра переносят в капельную воронку при помощи шприца. Пируватный раствор охлаждают до температуры -10°С, и раствор Гриньяра обрабатывают в течение 15 мин с хоро-шим перемешиванием, охлаждая так, чтобы под-держать внутреннюю температур у от -5 до -10°С. Полученный раствор перемешивают и обрабатывают 50 мл воды и 50 мл насыщенного водного раствора хлористого аммония, получая две светлые фазы, которые разделяют, и верхнюю фазу подвергают вращательному упариванию с целью удаления большей части ТГФ. Прибавление 50 мл порций воды и метилен хлорида приводит к получению двух прозрачных фаз, которые разделяют, водную фазу промывают 25 мл метиленхлорида и объединенные органические фазы промывают водой и солевым раствором, сушат в присутствии сульфата магния и упаривают с получением 23,8 г оранжево-желтого масла. Перегонка Kugеlrohr при 140°С/0,1-0,2 мм в течение 60 мин позволяет удалить летучие примеси, оставляя 17,1 г (60%) продукта в виде светло-оранжевого масла: пр26 1,5555; ИК (беспримесный) 3490, 1725 см-1; ЯМР (СОСl3, 200 МГц), 1,3 (3Н, t, J=7), 1,8 (3H,s),3,8 (1H, br.s), 4,2 (2H, m), 6,9-7,0 (4H, m), 7,1 (1H, t J=7), 7,3 (2H, t, J=7), 7,5 (2H, d , J=9). Пример 3 Получение 5-метил-5-фенил-3-(фениламино)-2-тиоксо-4-оксазолидинона 35548 Раствор метилатролактата (7,64 г, 0,0424 моль) в тетрагидрофуране (80 мл) перемешивают и охлаждают в ледяной ванне, прибавляя затем трет.-бутоксид калия (4,76 г, 0,0424 моль). Ледяную ванну удаляют и смесь перемешивают в течение 10 мин. Данная методика приводит к получению светлого раствора желтого цвета при температуре 21°С. Добавляют сероуглерод (2,8 мл, 0,046 моль), что приводит к окрашиванию реакционной массы в оранжевый цвет, после чего температуру повышают до 32°С. Раствор охлаждают в ванне со льдом в течение 10 мин, в результате чего температура снижается до 4°С. В охлажденный на льду раствор добавляют этилхлорформиат (4,1 мл, 0,043 моль), индуцируя образование мутно-желтой смеси и температура повышается до 12°С. Смесь перемешивают при охлаждении в ванне со льдом в течение 5 мин и температура в это время понижается до 5. Добавляют фенилгидразин (97%, 4,5 мл, 0,044 моль). Температура повышается до 24°С при использовании охладительной ванны. После того, как температура упала до 20°С, смесь перемешивают в течение 10 мин, затем упаривают при пониженном давлении до масла, которое смешивают с 1-хлорбутаном и водой, и слои разделяют. Органический слой промывают 1н раствором HCl, водой и насыщенным водным раствором бикарбоната натрия. Органический раствор сушат (сульфат магния), фильтруют и упаривают при пониженном давлении до масла. Масло кристаллизуют из четыреххлористого углерода/гексана (около 40 мл/20 мл), получая продукт (7,40 г, 58,5% от теоретического) светло-желтого цвета с температурой плавления 104-105°С. Продукт далее очищают перекристаллизацией из четыреххлористого углерода/гексана с 93% вы ходом. В другом случае при получении того же продукта используют четыреххлористый углерод вместо 1хлорбутана во время переработки. Кристаллизация из раствора четыреххлористого углерода путем разбавления гексаном позволяет получить продукт с 54% выходом; Перекристаллизация из изопропанола/воды приводит к получению продукта в виде белого твердого вещества, температура плавления 108-109 (92% выход). Пример 4 Получение 5-фенил-3-(фениламино)-2-тиоксо-4-оксазолидинона Перемешанный раствор трет.-бутоксида калия (11,22 г, 0,1 моль) в тетрагидрофуране (100 мл), поддерживаемый при температуре от 0 до -5°С, обрабатывают порционно раствором метилманделата (16,62 г, 0,1 ммоль) в тетрагидрофуране (70 мл), пату чая оранжево-красный раствор. Через 4 мин добавляют сероуглерод (6,04 мл, 0,1 моль). Через 5 мин при температуре от 0 до -5°С оранжевый раствор охлаждают до температуры -30°С и обрабатывают этилхлорформиатом (9,5 мл, 0,1 моль). Через 2 мин раствор нагревают до температуры -10°С. После 5-ти минутной выдержки при температуре -10°С раствор охлаждают до температуры -30°С и обрабатывают 97% фенилгидразином (10,1 мл, 0,1 моль). Желтый раствор нагревают до 25°С и через 10 мин смесь упаривают при пониженном давлении до мутного масла, которое смешивают с водой и 1-хлорбутаном, слои разделяют и органический раствор промывают 1н раствором NCI, второй (дважды) и насыщенным раствором бикарбоната натрия. Высушенный (сульфат магния) раствор упаривают при пониженном давлении до желто-оранжевого масла и масло растворяют в хлороформе. Фильтрация на силикагеле хлороформенного раствора с последующим упариванием фильтрата при пониженном давлении позволяет получить зеленое масло, которое начинает отвердевать. Дальнейшая очистка проводится кристаллизацией из 1-хлорбутана, что приводит к получению продукта (9,9 г, 35% теоретического выхода) в виде белого твердого телл, температура плавления 140-141°С. Инфракрасный спектр (нужол) показывает характерную абсорбцию при 3295 см -1 (N-HO и 1760 см-1 (имид С=0). Пример 5 Получение 3' (фениламино)-2'-тиоксо-спиро (9Н-флуорен-9,5-оксазолидин)-4'-она Раствор 9-гидрикси-9-флуоренкарбоновой кислоты, сложного метилового эфира (8,91 г, 0,0371 г, моль), в те трагидрофуране (89 мл) обрабатывают трет.-бутоксидом калия (4,16 г, 0,0371 моль). Через 6 мин раствор охлаждают в ванне со льдом и добавляют сероуглерод (2,3 мл, 0,038 моль). Через 7 мин к холодному раствору добавляют этилхлорформиат (3,6 мл, 0,035 моль). Через 7 мин добавляют 97% 35548 фенилгидразин (3,9 мл, 0,038 моль). Через 3 минуты смесь упаривают при пониженном давлении до желтого сиропа. Сироп обрабатывают 1-хлорбутаном и водой и органический слой промывают насыщенным раствором бикарбоната натрия, водой, 1н раствором НСl и водой. Высушенный в присутствии сульфа та магния раствор фильтруют и упаривают при пониженном давлении до масла. Масло кристаллизуют из четыреххлористого углерода/гексана и твердый продукт очищают кипячением с изопропанолом (без растворения всего твердого вещества), охлаждением и фильтрацией. Продукт получают в виде (3,56 г 27% от теоретического аналитически чистого твердого вещества, температура плавления 187-189°С. Анализ: вычислено для С21H14N2О2S: С 70,37%. Н, 3,94%: N, 7.82%, найдено: С, 70,28% Н, 4,19% N, 7,68%. Инфракрасный спектр (Nujol) показывает абсорбцию при 3275 см –1(N-H) и 1770 см -1 (имид С=0). Пример 6 5-(3-фторпирид-4-ил)-5-метил-3-фениламино-2-тиоксо-4-оксазолидинон Раствор 3,2 г (15 ммоль) этил 2-(3-фто-ропирид-4-ил)-лактата 20 мл ТГФ перемешивают и охлаждают в ванне с ледяной водой при одновременном добавлении порциями 1,6 г (15 ммоль) твердого трет.бутоксида калия. Охлаждающую баню удаляют 1,0 мл (1,2 г, 15,5 ммоль) сероуглерода, смесь перемешивают в течение 10 мин, возобновляют охлаждение, добавляют 1,4 мл (1,6 г, 15 ммоль) этилхлор формиата, смесь перемешивают в течение 10 минут, добавляют 1,5 мл (15 ммоль) фенилгидразина, полученную суспензию перемешивают и доводят до комнатной температуры, затем добавляют 20 мл ТГФ и смесь перемешивают 15 мин при комнатной температуре. Большую часть растворителя затем удаляют роторным испарителем, остаток распределяют между 1-хлорбутаном и водой и органическую фазу отделяют, промывают 1н водным раствором НСl, водой, насыщенным водным раствором бикарбоната натрия, водой и солевым раствором, сушат в присутствии сульфата магния и упаривают с получением 3,7 г зеленой смолы. Хроматография на силикагеле с элюированием смесью метилен-хлорид: метанол 98:2 приводит к получению 1,7 г (35%) указанного в заголовке соединения в виде полутвердого вещества. Кристаллизация из этилацетатагексанов 1:1 позволяет получить палево-желтые кристаллы: температура плавления 165-169°С: НК (нужол) 3200, 3130, 1780см -1: ЯМР (СDCl3, 200 МГц), 2,2 (ЗН, s), 6,4 (1Н, s), 6,8 (2Н, d, J=8), 7,0 (1H, t, J=8), 7,3 (2H, t, J=8) 7,5 (1Н, t, J=6), 8,6 (2H, m). Повторяя аналогичную методику с этил2-(2-фторпирид-3-ил)ацетатом, получают 5-(2-фторпирил-3-ил)5-метил-3-фениламино-2-тиоксо-4-оксазолидинон, температура плавления 130-135°С. Пример 7 (S)-5-метил-5-фенил-3-фениламино-2-тиоксо-4-оксазолидинон Раствор 1,0 г (6,0 ммоль) (S) -атролактиновой кислоты в 7 мл метанола охлаждают в бане с ледяной водой и перемешивают при добавлении по каплям 0,70 мл (1,15 г, 9,6 ммоль) тионилхлорида. Полученную смесь перемешивают при комнатной темпиратуре в течение 1 ч, затем концентрируют при пониженном давлении с получением 1,1 г метил (S-атролактата, nD25 1,5096. Данное вещество растворяют в 10 мл 1 ТГФ и раствор перемешивают и охлаждают в ванне с ледяной водой при одновременном добавлении трет.-бутоксида калия за одну порцию. Полученную суспензию перемешивают при комнатной температуре в течение 40 мин, затем добавляют 0,40 мл (0,51 г, 6,7 ммоль) сероуглерода, получая раствор. Возобновляют охлаждение на льду и через 10 мин добавляют 0,58 мл (0,66 г, 6,1 ммоль) этилхлорформиата, получая суспензию. Через 5 мин добавляют 0,60 мл (0,66 г, 6,1 ммоль) фенилгидразина, охлаждение прекращают и смесь нагревают до комнатной температуры. Большую часть ТГФ удаляют при пониженном давлении, остаток распределяют между водой и 1хлорбутаном и органическую фазу промывают последовательно 1н водным раствором НСl, водой, насыщенным водным раствором бикарбоната натрия и солевым раствором, сушат в присутствии сульфата магния и упаривают с получением 1,4 г масла. Хроматография на силикагеле с элюированием метиленхлоридом-гексанами 70:30 позволяет получить 0689 г (50%) указанного в заголовке соединения в виде масла, которое медленно отвердевает при отстаивании. Кристаллизация из 1-хлорбутана-гексанов 5:3 приводит к получению бесцветных игольчатых кристаллов: температура плавления 81-85°С; [альфа[D23+70,1 (c=0,52, EtOH); ИК (нужол) 3250, 1775 см -1; ЯМР (CDCl3, 200 МГц), 2,05 (ЗН, s), 6,37 (1Н, s), 6,73 (2H, d, J=8), 7,02 (1Н, t, J=8), 7,24 (2H, 1, J-8), 7,4 7,5 (3Н, m), 7,5-7,6 (2H, m). Повторяя аналогичные методики в отношении (Р)-атролактиновой кислоты, получают (R)-3(фениламино)-5-фенил-5-метил-2-тиоксо-4-оксазо-лидинон: температура плавления 81-85°С; [альфа [D2370,5 (с=0,52, EtOH). Пример 8 Получение 5-метил-5-(4-феноксифенил)-3-(фениламино)-2,4-оксазолидиндиона 35548 Раствор 5-метил-5-(4-феноксифенил)-3-фе-ниламино-2-тиоксооксазолндин-4-она (2 г, 0,0051 моль) в 50 мл ацетона (0,1 M) обрабатывают при комнатной температуре раствором KHSО5 (OXONE® 4,72 г, 0.0154 моль) в 20 мл воды. Белую суспензию нагревают при температуре 50°С в течение 2 ч, затем охлаждают до комнатной температуры н фильтруют. Остаток промывают свежим ацетоном и фильтраты упаривают при пониженном давлении до тех пор, пока ацетон не перегонится. Остаток растворяют в метиленхлориде и промывают водой и солевым раствором. Органический слой сушат (MgS04), фильтруют и упаривают с получением неочищенного продукта. Перекристаллизация из 1-хлорбутана и петролейного эфира позволяет получить 1,68 г (88% от теоретического) чистого продукта в виде белого твердого вещества с температурой плавления 140-142°С. Табл. 1-3 показывают фунгицидные соединения, которые можно получить описанными выше способами. Эти таблицы являются иллюстративными и не ограничивают объем настоящего изобретения. В табл. 4 приведены спектральные данные для соединений, полученных в виде масла. Композиции Соединения настоящего изобретения обычно используют в состава х с жидким или твердым разбавителем или с органическим растворителем. Пригодные составы соединений формулы (І) можно получить традиционными способами. Они включают дусты, гранулы, шарики, растворы, эмульсии, смачиваемые порошки, эмульгируемые концентраты и так далее. Многие из них можно наносить непосредственно. Распыляемые составы могут находиться в пригодных средах и использоваться при объемах распыления приблизительно от одного до нескольких сотен литров на гектар. Высокоустойчивые композиции используют главным образом в качестве промежуточных для дальнейшего составления. Составы обычно содержат около 1-99% по массе активного ингредиента(ов) и по крайней мере одно из числа следующих: (а) около 0,1-35% поверхностно-активного вещество (веществ) и (б) около 5-99% твердого или жидкого инертного разбавителя (разбавителей). Более конкретно, они будут содержать эти ингредиенты в приблизительных пропорциях (см. табл. 5). Большие или меньшие количества активного ингредиента, конечно, зависят от предназначенного использования и физических свойств соединения. Иногда желательны более высокие отношения поверхностно-активного вещества к активному ингредиенту и они достигаются при введении в состав или при смешивании в резервуаре. Типичные твердые разбавители описаны в работе Walking, et al., "Handbook of Insecticide Dust Diluents and Carriers", 2-е изд., Borland Books, Caldwell, New Jersey. Более абсорбирующие разбавители являются предпочтительными для смачиваемых порошков, а более плотные разбавители - для дустов. Типичные жидкие разбавители и растворители описаны в работе Marsden "Solvents Guide", 2-е изд., Intersdence, New York, 1950. Растворимость ниже 0,1% характерна для концентратов суспензий: растворы концентратов обычно устойчивы против фазового разделения при температуре 0°С. Поверхностно-активные вещества их использование приведены в "McCutchcon's Detergents and Emulsifiers Annual", Me Publishing Corp., Ridgewood, New Jersey, a также в работе Sisely и Wood, "Encyclopedia of Surface Active Agents", Chemical Publ. Co., Inc., New York, 1964. Bсe составы могут содержать меньшие количества присадок с целью снижения пенообразования, спекания, коррозии, микробиологического роста и так далее. Предпочтительно, чтобы используемые ингредиенты были одобрены Агентством по Защите Окружающей Среды США для предназначенного применения. Способы получения таких композиций хорошо известны. Растворы получают путем простого смешивания ингредиентов. Твердые композиции тонкого помола получают смешиванием и обычно измельчением в молотковой мельнице или дробилке с жидкостным приводом. Суспензии получают мокрым помолом (см., например, Littlеr, патент США 3060084). Гранулы и шарики могут быть изготовлены путем распыления активного вещества на предварительно подготовленный зернистый носитель или методом агломерации. См., J.E. Browning, "Agglomeration", Chemical Engineering, Dec. 4, 1967, pp. 147ff и "Perry's Chemical Engineer's Handbook", 4-е изд., McOraw-Hill, N.Y., 1963. pp. 8-59ff. Дополнительную информацию, касающуюся области приготовления композиций, см., например: H.M. Loux, патент США 3235361, 15 февраля 1966 года, колонка 6, строка 16 - колонка 7, строка 19, а также примеры 10-41; R.W. Luckcnbaugh, патент США 3W9192, 14 марта 1967 года, колонка 5, строка 43 - колонка 7, строка 62, а также примеры 8, 12, 15, 39, 41, 52, 53, 58, 132, 138-140. 162-164, 166, 167, 169-182; H. Gysin и E. Knusli, патент США 2891855, 23 июня 1959 года, колонка 3, строка 65 - колонка 5, строка 17, а также примеры 1-4; G.C. Klingman, "Weed control as a Science", John Wiley and Sons, Inc., New York, 1961, pp. 8196; J.D. Fryer и S.A. Evans "Weed Control Handbook", 5-е изд., Blackwell Scientific Publications, Oxford, 1968. pp. 101-103. Примеры пригодных составов соединений настоящего изобретения приведены ниже. Примеры Пример 217. Смачиваемый порошок 5-метил-5-фенил-3-(фениламино)-280% тиоксо-4-оксазолидинон алкилнафталинсульфонат натрия 4% 35548 лигнинсульфонат натрия 2% синтетический аморфный кремнезем 1% каолинит 13% Ингредиенты смешивают, измельчают молотковой дробилкой, смешивают повторно и упаковывают. Пример 218. Высокопрочный концентрат 5-метил-5-фенил-3-(фениламино)-280% тиоксо-4-оксазолидинон аэрогель кремнезема 0.5% синтетический аморфный кремнезем 1,0% Ингредиенты смешивают и измельчают в молотковой мельнице с получением высокопрочного концентрата, который по существу весь пропускают через сито N 50 Американского Стандарта (0,3 мм отверстия). Данное вещество затем можно использовать различными способами. Пример 219. Раствор 5-метил-5-фенил-3-(фениламино)-225% тиоксо-4-оксазолидинон метил-2-пирролидон 75% Ингредиенты объединяют и перемешивают с получением раствора, который можно использовать для низкообъемных применений. Пример 220. Эмульгируемый концентрат 5-метил-5-фенил-3-(фениламино)-25% тиоксо-4-оксазолидинон смесь сульфонатов кальция и неионогенных поверхностно-активных 6% веществ ацетофенон 79% Ингредиенты объединяют и перемешивают до растворения активного компонента и фильтруют через мелкий фильтр при упаковке для гарантии, что в продукте отсутствует постороннее нерастворенное вещество . Полезность Соединения настоящего изобретения пригодны в качестве агентов по борьбе с -заболеваниями растений. Они обеспечивают контроль за болезнями, вызванными широким спектром растительных патогенов в классе basidiomyceTe и ascomycete, и особенно против грибков в классе oomycetc. Они эффективны при борьбе с широким спектром растительных болезней, в частности, лиственных болезнетворных организмов декоративных, овощных, полевых, злаковых и фр уктовых к ультур, таких как Plasmopara viticola. Phytophtora infestans. Peronospora tabacina, Pseudoperonospora cubensis. Phytophtora niegaspemla. Botrytis cincrca. Venturia inaeclualis, Puccinia recondiTa, Pythium aphanidcnnatum, Altcrnaria brassicola, Septoria nodorum, Cercosporidium pcrsonatum, и виды, относящиеся к этим болезнетворным организмам. Соединения настоящего изобретения можно смешивать с фунгицидами, бактерицидами, акарицидами, нематоцидами, инсектицидами или другими биологически активными соединениями с целью достижения желаемых результатов с минимальным расходом времени, усилий и материала. Пригодные компоненты данного типа хорошо известны специалистам в данной области техники. Некоторые из них представлены ниже: Фунгициды метил-2-бензимидазалкарбамат (карбенда-зим), тетраметилтиурамдисульфид (тиурам), н-додецилгуанидинацетат (долин), этиленбисдитискарбамат марганца (манеб), 1,4-дихлор-2,5-димстоксибензол (хлоронеб), метил 1-(бутилкарбамоил)-2-бензимидазол-карбамат (беномил), 2-циано-N-этилкарбамоил-2-метоксиимино-ацетамид (цимоксанил), N-трихлорметилтиотетрагидрофталамил (каптан), N-трихлорметилтиофталамид (фолпет), диметил 4,4'-(о-фенилен)бис(3-тиоаллофанат) (тиофанат-метил), 2-(тиазол-4-ил) бензимидазол (тиабендазол), три(0-этил-фосфонат) алюминия (фозетилалюминий), тетрахлоризофталонитрил (хлороталонил), 2,6-дихлор-4-нитроапилин (дихлоран), N-(2,6-диметилфенил)-N-(метоксиацетил)ала-нин метиловый эфир (металаксил), цис-N-11,1,2,2-тетрахлорэтил)тио[циклогекс-4-ен-1,2-дикарбоксимид (каптафол), 3-(3,5-дихлорфенил)-N-(1-метилэтил)-2,4-ди-оксо-1-имидазолидин карбоксамил (ипродион), 3-(3,5-дихлорфенил)-5-этенил-5-мстил-2,4-оксазолидиндион (винклозолин) казугамицин, О-этил-5,5-дифенилфосфородитиоат (эдифенфос), 4-[3-14-(1,1-диметилэтил)фенил 1-2-метил [пропил-2.6-диметилморфолин (фенпропиморф), 4-(3-[4-(1,1-диметилэтил)фенил 1-2-метил [пропилпиперидин (фенпропидин), 1-(4-хлорфенокси)-3,3-диметил-1-dH-1,2,4-триазол-1-ил)бутан (триадимефон), 35548 2-(4-хлорфенил)-2-(1Н-1,2,4-триазол-1-илме-тил) гексаннитрил (миклобутанил), тебуконазол, 3-хлор-4-[4-метил-2-(1Н-1,2,4-триазол)-1-илме-тил1-1,3-диоксолан-2-ил[фенил-4-хлорфениловый эфир (дифеноконазат), 1-[2-(2,4-дихлорфенил)пентил]-1Н-1,2,4-триа-зол (пенконазол), альфа-(2-фторфенил)-a--(4-фторфенил)-1Н-1,2,4-триазол-1-этанол (флутриафол), 2-метокси-N-(2-оксо-1,3-оксазалидин-3-ил) ацет-2,6-ксилидид (оксадиксил), 1-[[бис(4-фторфенил)метилсилил]метил[-1Н-1,2,4-триазол (флусилазол), 1-N-пропил-N-[2-(2,4,6-трихлорфенокси)этил] карбамоилимидазол(прохлораз), 1-[[2-(2,4-дихлорфенил)-4-пропил-1,3-диоксо-лан-2-ил]метил]-1Н-1,2,4-триазол (пропиконазол), альфа-(2-хлорфенил)-a-(4-хлорфенил)-5-пи-ридинметанол (фенаримол), оксихлорид меди, метилN-(2,6-димeтилфенил)-N-(2-фypaнил-карбонил)-DL-аланинат (фуралаксил), гексаконазол, 4-хлор-N-(цианоэтоксиметил)бензамид, 4-[3-(4-хлорфенил)-3-(3,4-диметоксифенил-1-оксо-2-пропенил]морфолин. Бактерициды: трехосновный медный сульфат, сульфат стрептомицина, окситетрациклин. Акарициды: сенеционовая кислота, сложный эфир с 2-втор-бутил-4,6-динитрофенолом (бинападрил), 6-метил-1,3-дитиоло[2,3-В]хинонолин-2-он(ок-ситиохинокс), 2,2,2-трихлор-1,1-бис(4-хлорфенил)этанол (дикофол), бис(пентахлор-2,4-циклопснтадиен-1-ил) (дие-нохлор), гидроокись трициклогексилолова (цигексатин), гексакис(2-метил-2-фенилпропил)дистаннок-сан (оксид фенбутина). Нематициды: 2-[диэтоксифосфонилимино[-1,3-диэтиэтан (фостиэтан), S-метил-1-(диметилкарбамоил)-N-(метилкар бамоилокси)тиоформимидат (оксамил), S-метил-1-карбамоил-N-(метилкарбамоилок си) тиоформимидат, N-изопропилфосфорамидиновая кислота, сложный О-этил-О'-14-(метилтио)-m-толил]диэфир (фенамифос). Инсектициды 3-гидpoкcи-N-метилкpoтoнaмид (диметил-фосфат) эфир (монокротофос), метилкарбаминовая кислота, сложный эфир с 2,3-дипндро-2,2-диметил-7-бензофуранолом (карбофуран), О-[2,4,5-трихлор-a-(хлорметил) бензил]фос-форная кислота, сложный О',О'-диметиловый эфир (тетрахлорвинфос), 2-меркаптоянтарная кислота, сложный диэ-тиловый эфир, сложный S-эфир с тионофос-форной кислотой, сложный диметиловый эфир (малатион), тионофосфорной кислоты, О,О-диметил, О-р-нитрофениловый сложный эфир (метилпа-ратион), метилкарбаминовая кислота, сложный эфир с a- -нафтолом (карбарил), метил N-[[(метиламино)карбонил]окси]этани-мидотиоат (метомил), N'-(4-xлop-О-тoпил)-N,N-димeтилфopмaми дин (хлородимеформ), О,О-диэтил-О-(2-изопропил-4-метил-6-пири-мидил)фосфортиоат (диазинон), октахлорокамфен (токсафен), О-этил-О-р-нитрофенил фенилфосфонотиоат (EPN), циано(3-феноксифснил)метил4-хлоро-альфа-(1-метилэтил)бензолацетат (фенвалерат), (3-феноксифенил)метил(±/цис,транс-3(2,2-ди-хлорэтенил)-2,2-димстилциклопро-панкарбоксилат (перметрин), диметил N,N'-[тиобис(N-метиламино)карбокси][бис(этанимидотиоат) (тиодикарб), фосфоротиолотионовая кислота, сложный O-этил-О-[4-(метилтио)фенил|-S-n-пропиловый эфир (сульпрофос), альфа-циано-3-феноксибензил3-(2,2-дихлор-винил)-2,2-диметилциклопропан карбоксилат (циперметрин), циано(3-феноксифенил)метил4-(дифторметок-си)-альфа-(метил-этил)бензолацетат (флуцит-ринат), О,О-диэтил-О-(3,5,6-трихлор-2-пиридил)фос-фортиоат (хлорпирифос), О,О-диметил-5-[(4-оксо-1,2,3-бензотриазин-3-(4Н)-ил)метил]фосфордитиоат (азинфосметил), 5,6-диметил-2-диметиламино-4-пиримидинил диметилкарбамат (пиримикарб), S-(N-фopмил-N-мeтилкapбaмoилмeтил)-О,О-диметилфосфордитиоат (формотион), 8-2-(этилтиоэтил)-О,О-диметилфосфортиоат (деметон-S-метил), альфа-циано-3-феноксибензил цис-3-(2,2-ди-бромвинил)-2,2-диметилциклопропанкар-боксилат (дельтаметрин), циано(3-феноксифенил)метиловый эфир N-(2-хлор-4-трифторметилфенил)аланина (флува-линат). В некоторых случаях сочетания с другими фунгицидами, имеющими аналогичный спектр борьбы с заболеваниями, но отличающиеся режимом действия, будут особенно предпочтительны для повышения резистентности и/или улучшения свойств, таких как лечебная активность в отношении устоявшихся 35548 инфекций. Особенно эффективной комбинацией в отношении обоих этих факторов является сочетание соединения формулы (І) с циноксанилом Применение Борьбу с заболеваниями обычно осуществляют п утем нанесения эффективного количества соединения либо перед заражением, либо после такового, на часть растения, которая подлежит защите, например, корни, стебли, листва, плод, семена, клубень или луковицы. Соединение также можно наносить на семя, из которого растут защищаемые растения. Нормы внесения этих соединений могут зависеть от многих факторов окружающей среды и должны определяться в условиях фактического использования. Для листвы обычно требуется для защиты при обработке соединение с количеством активного ингредиента менее 1 г/гa-10000 г/га. Семя и проростки обычно бывают защищены, когда семя обрабатывают дозой от 0,1 до 10 г на кг семени. Пример А Испытуемые соединения растворяют в ацетоне в количестве, равном 3% конечного объема, и затем суспендируют при концентрации 200 ppm (частей на миллион) в очищенной воде, содержащей 250 ppm поверхностно-активного вещества Трем 014 (сложные эфиры многоатомного спирта). Данную суспензию распыляют в точку поверхностного стока проростков яблони. На следующий день проростки инокулируют суспензией спор Venturia inacgualis (каузальный агент парши яблони) и инкубируют в насыщенной атмосфере при температуре 20°С в течение 24 ч, посте чего переносят в растильню при температуре 22°С на 6 суток, по истечении которых делают оценки заболевания. Пример В Испытуемые соединения растворяют в ацетоне в количестве, равном 3% конечного объема, и затем суспендируют при концентрации 200 ppm в очищенной воде, содержащей 250 ppm поверхностно-активного вещества Трем 014 (сложные эфиры многоатомного спирта). Данную суспензию наносят в точку поверхностного стока проростков арахиса. На следующий день проростки инокулируют суспензией спор Cercosporidium pеrsonatum (каузальный агент поздней пятнистости листьев арахиса) и инкубируют в насыщенной атмосфере при температуре 22-30°С в течение 5 суток, после чего переносят в растильню при температуре 29°С на 6 суток, по истечении которых осуществляют оценку заболевания. Пример С Испытуемые соединения растворяют в ацетоне в количестве, равном 3% конечного объема, и затем суспендируют при концентрации 200 ppm в очищенной воде, содержащей 250 ppm поверхностно-активного вещества Трем 014 (сложные эфиры многоатомных спиртов). Суспензию наносят в точку поверхностного стока проростков винограда. На следующий день проростки инокулируют споровой суспензией Puccinia recondita (каузальный агент ложной мучнистой росы винограда) и инкубируют в насыщенной атмосфере при температуре 20°С в течение 24 ч, перемещают в растильню при температуре 20°С на 6 дней, после чего осуществляют оценку заболевания. Пример D Испытуемые соединения растворяют в ацетоне в количестве, равном 3% конечного объема, и затем суспендируют при концентрации 200 ppm в очищенной воле, содержащей 250 ppm поверхностно-активного вещества Трем 014 (сложные эфиры многоатомных спиртов). Данную суспензию распыляют на точку поверхностного стока проростков помидоров. На следующий день проростки инокулируют споровой суспензией Phytophthora infestans (каузальный агент ранней гнили картофеля и томатов) и инкубируют в насыщенной атмосфере при температуре 20°С в течение 24 ч, а затем переносятв растильню при температуре 20°С на 5 суток, после чего осуществляют оценку заболевания. Пример Е Испытуемые соединения растворяют в ацетоне в количестве, равном 3% конечного объема, и затем суспендируют при концентрации 40 ppm в очищенной воде, содержащей 250 ppm поверхностно-активного вещества Трем 014 (сложные эфиры многоатомного спирта). Данную суспензию распыляют на точку поверхностного стока проростков пшеницы. На следующий день проростки инокулируют споровой суспензией Flasmopara viticola (каузальный агент листовой ржавчины пшеницы) и инкубируют в насушенной атмосфере при температуре 20°С в течение 24 ч, после чего переносят в растильню при температуре 20°С на 6 суток, затем инкубируют в насыщенной атмосфере при 20°С в течение 24 ч, по истечении которых осуществляют оценку заболевания. Пример F Испытуемые соединения растворяют в ацетоне в количестве, равном 3% конечного объема, и затем суспендируют при концентрации 200 ppm в очищенной воде, содержащей 250 ppm поверхностно-активного вещества Трем 014 (сложные эфиры многоатомных спиртов). Данную суспензию распыляют на точку поверхностного стока проростков огурцов. На следующий день проростки инокулируют споровой суспензией Botrytis cinerea (каузальный агент серой плесени на многих культурах) и инкубируют в насыщенной атмосфере при температуре 20°С в течение 48 ч. после чего переносят в растильню при температуре 20°С на 5 суток, по истечении которых осуществляют оценку заболевания. Пример G Испытуемые соединения растворяют в ацетоне в количестве, равном 2% конечного объема, и затем суспендируют при концентрации 40 ppm в очищенной воде, содержащей 250 ppm поверхностно-активного вещества Трем 014 (сложные эфиры многоатомных спиртов). Данную суспензию распыляют на точку поверхностного стока проростков табака. На следующий день проростки инокулируют споровой суспензией Peronospora tabacina (каузальный агент голубой плесени табака) и инкубируют в насыщенной атмосфере 35548 при температуре 22°С в течение 24 ч, после чего переносят в растильню при температуре 20°С на 6 суток, после чего инкубируют в насыщенной атмосфере при температуре 20°С в течение 24 ч, по истечении которых осуществляют оценку заболевания. Пример Н Испытуемые соединения растворяют в ацетоне в количестве, равном 3% конечного объема, и затем суспендируют при концентрации 40 ppm в очищенной воде, содержащей 250 ppm поверхностно-активного вещества Трем 014 (сложные эфиры многоатомных спиртов). Данную суспензию распыляют на точку поверхностного стока проростков огурцов. На следующий день проростки инокулируют споровой суспензией Pseudoperonospora cubensis (каузальный агент ложной мучнистой росы огурцов) и инкубируют в насыщенной атмосфере при температуре 20°С в течение 24 ч, переносят в растильню при температуре 20°С на 6 суток и инкубируют в насыщенной атмосфере при температуре 20°С в течение 24 ч, после чего осуществляют оценку заболевания. Пример I Испытуемые соединения растворяют в ацетоне в количестве, равном 3% конечного объема, и затем суспендируют при концентрации 200 ppm в очищенной воде, содержащей 250 ppm поверхностно-активного вещества Трем 014 (сложные эфиры многоатомных спиртов). Данную суспензию распыляют на точку поверхностного стока проростков пшеницы. На следующий день проростки инокулируют спорами Erysiphe gramims (каузальный агент настоящей мучнистой росы пшеницы) и инкубируют в растильне при температуре 20°С в течение 7 суток, по истечении которых осуществляют оценку заболевания. Пример J Испытуемые соединения растворяют в ацетоне в количестве, равном 3% конечного объема, и затем суспендируют при концентрации 200 ppm в очищенной воде, содержащей 250 ppm поверхностно-активного вещества Трем 014 (сложные эфиры многоатомных спиртов). Данную суспензию распыляют на точку поверхностного стока проростков риса. На следующий день проростки инокулируют споровой суспензией Rhizoctonia solani (каузальный агент заболевания оберток риса) и инкубируют в насыщенной атмосфере при температуре 27°С в течение 48 часов, переносят в растильню при температуре 29°С на 48 часов, после чего осуществляют опенку заболевания. Пример К Испытуемые соединения растворяют в ацетоне в количестве, равном 3% конечного объема, и затем суспендируют при концентрации 200 ppm в счищенной воде, содержащей 250 ppm поверхностно-активного вещества Трем 014 (сложные эфиры многоатомных спиртов). Суспензию распыляют на точку поверхностного стока всходов риса. На следующий день всходы инокулируют споровой суспензией Pyricularia orvzae (каузальный агент пирихуляриоза риса) и инкубируют и насыщенной атмосфере при температуре 27°С в течение 24 ч, переносят в растильню при температуре 30°С на 4 суток, по истечении которых осуществляют оценку заболевания. Примеры, дополнительно иллюстрирующие настоящее изобретение, указаны в табл. 6. В таблице показатель 100 соответствует 100%-ному исходу борьбы с заболеванием, а показатель 0 соответствует отсутствию какого бы то ни было результата в борьбе с заболеванием относительно контрольных проб, распыленных с носителем). Знак "-" обозначает, что при указанной концентрации не было проведено испытание в отношении данного заболевания. Пример L Тестируемые композиции приготавливают следующим образом: к 73 мг 50%-ного влажного порошка, содержащего Соединение 305 (36,5мг активного ингредиента), добавляют 32 мл дистиллированной воды для получения готового раствора Соединения 305. Цимоксанил используют в качестве промышленно применяемого 50%-ного состава влажного порошка CurzateÒ. Готовый раствор получают путем добавления 32 мл дистиллированной воды к 73 мг состава влажного порошка (36,5 мг активного ингредиента). Готовый раствор затем разбавляют дистиллированной водой и используют для распыления. Используют разбавления для получения нужных соотношений, приведенные в табл. 7. Для совместного использования Соединения 305 и цимоксанила, приблизительно разбавленные готовые растворы, содержащие Соединение 305 и цимоксанил, комбинируют и затем используют для распыления. Картофель (Solanum tuberosum "Superior"), выращенный в клеточной культуре, трансплантируют в 4дюймовые (10х16 см) вегетационные сосуды и оставляют в теплице. Спустя 5-6 недель после трансплантации отбирают одинаковые растения высотой 6-8 дюймов (15,24-20,32 см). Растения обрызгивают смесью цимоксанила и Соединения 305 во всех подобранных соотношениях. После обрызгивания растения оставляют в теплице на 2 дня. Затем растения инокулируют аэрозольной суспензией зооспор Р. infеctans (2·104 зооспор на мл) в дистиллированной воде. Растения сразу же помещают в камеру с увлажнением (98% средней влажности) на 48 ч, чтобы обеспечить необходимые условия для полного заражения. Следующие 24 ч переходного периода их содержат в осве щенной растильне, а затем возвращают в теплицу. Болезнь развивается в течение 6 дней после инокуляции и регистрируется по проценту поражения поверхности листа типичному для Р. infеstans на базальной стороне четырех полностью раскрытых настоящих листьев. Каждую обработку повторяют 3 раза. Основной процент контрольного поражения представлен в табл. 8. 35548 Таблица 1 Пример W R1 R2 R3 R4 Т.пл., 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 S S S S S S S S S S S S S S S S S S S S S S S S S S S Me Me Me Н Et Н-гексил Н-бутил CF3 CF3CH2CH2CH2 Циклопропил Циклобутил Циклогексил Винил Аллил Ацетиленил Пропаргил Метоксиметил Циклопропилметил Бензил 4’-метоксибензил 4’-нитробензил 4’-трифторметил-бензил 4’-метилбензил 2’,4’-дихлорбензил 4’-фторбензил Me Me Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н 1091 872 873 142 96 28 S Me Ph Н 29 30 31 S S S Me Me Me Ph Ph Ph Н Н Н 32 S Me Ph Н 33 S Н Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph 4-н-октилфенил 4-(2-октенилокси)фенил 4-(2пропенил)фенил 4-(2-октил)фенил 4-н-октилтиофенил 4-(1,1-дихлораллил)фенил 4-(2пропенил)фенил Ме Ph Н °С 100 98 Масло 107 113 116 117 Продолжение табл. 1 Пример 34 35 36 37 38 39 40 41 42 43 44 45 46 W R1 R2 R3 R4 Т.пл., S S S S S S S S S S S S S Н Н Н Me t-Bu i-Pr Циклогексил Ме Ме Феноксиметил н-гексил Циклогексил 4-хлорфенил 3-хлорфенил 2-хлорфенил 4-фторфенил 3-фторфенил Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Н Н Н Н Н Н Н Н Н Н Н Н Н 98 107 90 132 99 77 Me Me Me Me Me Me Me Me °С масло 156 105 170 150 108 35548 47 48 49 50 51 52 53 54 55 S S S S S S S S S Me Me Me Me Me Et H Винил Me 4-бромфенил 3,5-дихлорфенил 3,4-дихлорфенил 2,4-дихлорфенил 2-фторфенил 2-фторфенил 2-фторфенил 2-фторфенил 2-фторфенил 56 S Me 2-фторфенил 57 S Me 2-фторфенил 58 S Me 2-фторфенил 59 60 61 62 63 64 65 66 67 68 69 70 S S S S S S S S S S S S Me Me Me Me Me Me Me Et H Винил Me Me 2-фторфенил 2,3-дифторфенил 2,5-дифторфенил 3,5-дифторфенил 2,6-дифторфенил 3,4-дифторфенил 2,4-дифторфенил 2,4-дифторфенил 2,4-дифторфенил 2,4-дифторфенил 2,4-дифторфенил 2,4-дифторфенил 71 S Me 2,4-дифторфенил 72 S Me 2,4-дифторфенил 73 S Me 2,4-дифторфенил 74 75 76 77 78 79 80 S S S S S S S Н Me Me Me Me Me Me 81 S Me 82 83 S S Me Me 2-метилфенил 2-метилфенил 4-метилфенил 2,5-диметилфенил 4-t-бутилфенил 4-циклогексилфенил 3-трифторметилфенил 3-нанофторбутилфенил 2-метоксифенил 4-метоксифенил Ph Ph Ph Ph Ph Ph Ph Ph 4фтор фенил 2-метилфенил 4-метилфенил 2,6-дихлорфенил Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph 2,6-дихлорфенил 4фтор фенил 4-метилфенил 2-метилфенил Ph Ph Ph Ph Ph Ph Ph Н Н Н Н Н Н Н Н Н 115 152 143 161 123 130 Н 129 Н 140 Н 148 Ме Н Н Н Н Н Н Н Н Н Н Н 134 120 119 135 137 97 127 Н 136 Н 134 102 129 128 185 Н Н Н Н Н Н Н Н Ph Н Н 124 160 133 Н Ph Ph 121 115 108 154 156 Продолжение табл. 1 Пример 84 85 W R1 R2 R3 R4 Т.пл., S S Me Me Ph Ph Н Н 64 79 86 87 88 S S S Me Me Me Ph Ph Ph Н Н Н 89 S Me Ph Н 90 91 92 S S S Me Me Me Ph Ph Ph Н Н Н 146 93 S Me 4-этоксифенил 4-n-пентилоксифенил 4-аллилоксифенил 3-метилтиофенил 4-трифторметилтиофенил 4-трифторметоксифенил 2-цианофенил 4-цианофенил 2-n-пентилоксифенил 3-n-пентилоксифенил Ph Н 67 °С 35548 94 S Me 95 S Me 96 97 98 99 100 S S S S S Me Et H Me Me 4-диметиламинофенил 4-(N-метил-Nфениламино)фенил 4-феноксифенил 4-феноксифенил 4-феноксифенил 4-феноксифенил 4-феноксифенил 101 S Me 4-феноксифенил 102 S Me 4-феноксифенил 103 104 105 S S S Me Me Me 106 S Me 107 S Me 108 S Me 109 S Me 110 S Me 111 S Me 112 S Me 113 114 S S Me Me 115 S Me 116 S Me 117 118 119 120 121 S S S S S Me Me Me Me H 3-феноксифенил 2-феноксифенил 4-(4-хлорфенокси)фенил 4-(4-бромфенокси)фенил 4-(4-фторфенокси)фенил 4-(3-фторфенокси)фенил 4-(2-фторфенокси)фенил 4-(4-нитрофенокси)фенил 4-(4-метилфенокси)фенил 4-(2-метилфенокси)фенил 4-бензиноксифенил 2-фтор-4-феноксифенил 4-карбометоксифенил 4-карбофеноксифенил 3-пиридил 4-пиридил 4-фтор-3-пиридил 3-фтор-2-пиридил 3-(3,5-дихлорфенокси)фенил Ph Н Ph Н Ph Ph Ph Ph 2-метилфенил 4-метилфенил 4-фторфенил Ph Ph Ph Н Н Н Н Н Н Н Н Масло 156 114 Ph Н 111 Ph Н 137 Ph Н 88 Ph Н 110 Ph Н 61 Ph Н Ph Н Ph Ph Н Н Ph Н Ph Н Ph Ph Ph Ph Ph Н Н Н Н Н 115 75 139 Н Н Масло 135 157 114 130 Продолжение табл. 1 Пример 122 W R1 R2 R3 R4 Т.пл., S H Ph Н Масло* 123 124 S S H Me Ph Ph Н Н 136 125 S Me Ph Н Масло* 126 S Me Ph Н 121 127 S Me Ph Н 128 129 S S Me Me Ph Ph Н Н 170 134 130 131 132 S S S Me Me Me 3-(3-трифторметилфенокси)фенил 3-феноксифенил 4-(4-трифторметилфенокси)фенил 4-(4-метоксифенокси)фенил 4-(2,4-дихлорфенокси)фенил 4-метансульфонилфенил 4-нитрофенил 3-трифторметилфенил 4-фенилтиофенил 4-фенилфенил 2-нафтил Ph Ph Ph Н H H 144 172 152 °С 35548 133 134 135 136 137 138 139 140 141 S S S S S S S S S Me Me Me Me Me Me Me Me Me 142 143 144 145 146 147 148 149 150 151 152 153 S S S S S S S S S S S S Me Me Me Me Me Me Me Me Me Me 154 155 156 S S S 157 1-нафтил 2-тиенил 5-хлор-2-тиенил 4,5-дихлор-2-тиенил 5-метил-2-тиенил З-метокси-2-тиенил 3-тиенил 2,5-дихлор-З-тиенил 2,5-диметил-3тиенил 2-фенокси-3-тиенил 2-нитро-4-тиенил 3-метокси-4-тиенил 2-фурил 3-фурил 2-пиридил 5-фтор-3-пиридил 2-фтор-3-пиридил 2-фтор-4-пиридил 3-фтор-4-пиридил -CH2(CH2)3CH2-CH2(CH2)3CH2 Ph Ph Ph Ph Ph Ph Ph Ph Ph H H H H H H H H H Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph 3,5-дихлорфенил Ph Ph Ph H H H H H H H H H H H H 168 Масло 184 H H H 168 S Ph H 158 S Ph H 159 S Ме Ph H 160 161 S S Ме Ph Ph H H -CH2NMeCH2CH2-CН2CH2SCH2CH2 4-карбометоксифенил 4-бензилфенил 139 132 121 146 88 134 104 189 Продолжение табл. 1 Пример W R1 R2 R3 R4 Т.пл., 162 S Me Ph Н 142 163 S Циклопропил Ph Н 133 164 S Me Феноксиметил Н 146 165 S Me Ph Н 157 166 S Me 4-феноксифенил Н 118 167 S Me Феноксиметил Н 122 168 S H t-Bu Н 87 169 S Me Ph Н 72 170 S Me 4-фторфенил 3,5-дихлорфенил 3,5-дихлорфенил 3,5-дихлорфенил 2,6-дихлорфенил 2,6-дихлорфенил 2,6-дихлорфенил 2,6-дихлорфенил 4-фторфенил 4-фторфенил Н 91 °С 35548 171 S Me 4-циклогексилфенил 172 S Me Фенилтиометил 173 S Me Ph 174 S Me Ph 175 S Me Ph 176 S Me Ph 177 S Me Ph 178 S Me Ph 179 S Me Ph 180 S Me Ph 181 S Me 4-фторфенил 182 S Me 4-феноксифенил 183 S Me Фенилтиометил 184 S Me Феноксиметил 185 S Me 2,5-дихлор-3-тиенил 186 S Me Ph 187 S Me Ph 188 S Me Ph 4-фторфенил 4-фторфенил 3-фторфенил 4-хлорфенил 3-хлорфенил 2хлорфенил 2-фторфенил 2,5-дифторфенил 2-бромфенил 4метилфенил 4-метилфенил 4-метилфенил 4-метилфенил 4-метилфенил 4-метилфенил 2,6-диметилфенил 4-t-бутилфенил 3-метилфенил Н 155 Н 68 Н 70 Н 136 Н 132 Н 121 Н Масло* Н Масло* Н 120 Н 142 Н 106 Н 146 Н 89 Н 155 Н 145 Н 101 Н 125 Н 97 Продолжение табл. 1 Пример W R1 R2 R3 R4 Т.пл., 189 S Me Ph Н 100 190 S Me Ph Н 110 191 S Me Ph Н 135 192 S Me Ph Н Масло* 193 S Me Ph Н Масло* 194 S Me Ph 195 S Me Ph 196 S Me Ph 197 S Me Ph 198 S Me Ph 2-метилфенил 2-метоксифенил 4-метоксифенил 3-метоксифенил 4-n-пентилоксифенил 4-аллилоксифенил 4-трифторметоксифенил 4-трифторметилфенил 3-трифторметилфенил 2-трифторметилфенил °С Н Н 73 Н Н Н 115 35548 199 S Me Ph 200 S Me Ph 201 S Me Ph 202 S Me Ph 203 204 205 206 207 S S S S S Me Me Me Me Me Ph Ph Ph Ph Ph 208 S Me Ph 209 S Me Ph 210 211 212 213 214 215 216 217 218 S S S S S S S S S Me Me Me Me Me Me Me Me Mе Ph Ph Ph Ph Ph Ph Ph Ph Ph 2-нитрофенил 4-нитрофенил 4-цианофенил 4-карбометоксифенил бензил 2-тиенил 3-фурил 2-пиридил 5-трифторметил-2пиридил 2-пиримидил 6-хлор-3пиридазил Этил Цилогексил t-Bu n-гексил n-децил Ph Ph Ph Ph Н 137 Н Н Н 151 Н Н Н Н Н 82 147 150 Н 187 Н 184 H H H H H Формил Ацетил Трифторацетил Метоксиацетил Масло* 48 Масло* 96 62 Масло Продолжение табл. 1 Пример 219 220 221 222 223 224 225 226 Т.пл., W R1 R2 R3 R4 S S S S S S S S Me Me Me Me 4-фторфенил Me Me Me Ph Ph Ph Метокси-карбонил Метиламинокарбонил Метансуль фонил Метил Метил Метил Фениламинокарбонил Метил Масло* 227 S Me Метил 147 228 S Me Ph Метил 146 229 230 231 S S S Me Me Me 2,5-дихлор-3тиенил 4,5-дихлор-2тиенил Ph Ph 3-тиенил Ph Ph Ph Ph Ph Ph Ph 2-метилфенил Ph Этил n-пентил Н Масло* * 101 232 S Me 3-тиенил Ацетил 111 233 234 235 236 237 S S S S S Me Me Me Me Me Ph Ph Ph Ph Ph Ph Ph 4-фторфенил 4-фторфенил Ph Ph Ph Ph 238 S Me Ph 3-тиенил Ph Ph Ph Ph °С 82 118 62 Аллил Пропаргил Циклобутил Бензил 161 Ph 2-бром-пропионил масло 35548 239 240 S S Me Me 241 S Me 242 243 244 S S S Me Me Me 245 246 247 248 249 250 251 252 253 254 255 256 257 258 259 260 S О О О О О О О О О О О О О О О Me Me Me Н Et n-гексил СF3 CF3CH2CH2CH2 Пример W R1 R2 R3 R4 261 262 263 264 265 266 267 268 269 270 271 О О О О О О О О О О О Бензил 4'-метоксибензил 4'-нитробензил 4'-трифторметил-бензил 4'-металбензил 2',4'-дихлорбензил Me Ph Me Me Me Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph H Н H H H H H H H H H 272 О Me Ph H 273 274 275 276 277 278 279 280 281 282 283 284 285 286 О О О О О О О О О О О О О О Me H H H Н Me Бензил Me Me Me Me Me Me Me Ph Ph Ph Ph Ph Ph Ph 4-n-октилфенил 4-n-октилтиофенил 4-(2-октенил)фенил 4-(2-октенилокси)фенил 4-(2-пропенил) фенил 4-(2-бутинил)фенил Me t-Bu i-Pr Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph H H H H H H H H H H H H H H Циклопропил Циклогексил Винил Аллил Ацетиленил Пропаргил Метоксиметил Циклопропилметил Ph 2,5-дихлор-3тиенил 4,5-дихлор-2тиенил Ph 4-фторфенил 4циклогексилфенил 3-тиенил Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Циклогексил Me Me Феноксиметил n-гексил 4-хлорфенил 3-хлорфенил 2-фторфенил 4-фторфенил 3-фторфенил Ph Ph Бромацетил Метоксиацетил 112 82 Ph Метоксиацетил 80 1-пирроло 1-пирроло 1-пирроло 1-пирроло Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph 80 118 112 84 H 1634 H 925 H H H H H H H H H H H H H Продолжение табл. 1 Т.пл., °С 115 116 127 102 35548 287 288 289 290 291 292 293 294 295 О О О О О О О О О Me Me Me Me Me Et H Винил Me 4-бромфенил 3,5-дихлорфенил 3,4-дихлорфенил 2,4-дихлорфенил 2-фторфенил 2-фторфенил 2-фторфенил 2-фторфенил 2-фторфенил 296 О Me 2-фторфенил 297 О Me 2-фторфеннл 298 О Me 2-фторфенил 299 300 301 302 303 304 305 О О О О О О О Me Me Me Me Me Me Me 2-фторфенил 2,3-дифторфенил 2,5-дифторфенил 3,5-дифторфенил 2,6-дифторфенил 3,4-дифторфенил 2,4-дифторфенил Ph Ph Ph Ph Ph Ph Ph Ph 4-фторфенил 2-метилфенил 4-метилфенил 2,6-дихлорфенил Ph Ph Ph Ph Ph Ph Ph H H Н Н H H H H Н 131 152 149 163 H 140 Н 138 H Me H Н H H H Н 141 142 Продолжение табл. 1 Пример W R1 R2 R3 R4 306 307 30S 309 310 О О О О О Et Н винил Me Me 2,4-дифторфенил 2,4-дифторфенил 2,4-дифторфенил 2,4-дифторфенил 2,4-дифторфенил H 11 H Me H 311 О Me 2.4-дифторфенил 312 О Me 2,4-дифторфенил 313 О Me 2,4-дифторфенил 314 315 316 317 318 319 О О О О О О Me Me Me Me Me Me 320 О Me Ph H 322 323 324 325 326 О О О О О Me Me Me Me Me Ph Ph Ph Ph Ph H Н Н Н H 327 О Me Ph H 328 329 О О Me Me 2-метилфенил 4-метилфенил 2,5-диметилфенил 4-t-бутилфенил 4-циклогексилфенил 3-трифторметилфенил 3-нонафторбутилфенил 4-метоксифенил 4-n-пентоксифенил 4-аллилоксифенил 3-метилтиофенил 4-трифторметилтиофенил 4-трифторметоксифенил 2-цианофенил 4-цианофенил Ph Ph Ph Ph 2,6-дихлорфенил 4-фторфенил 4-метилфенил 2-метилфенил Ph Ph Ph Ph Ph Ph Ph Ph H H Т.пл., °С 129 Н 162 H 124 H H H H H H H 140 128 104 128 35548 330 331 332 333 334 О О О О О Me Et H Me Me 4-феноксифенил 4-феноксифенил 4-феноксифенил 4-феноксифеиил 4-феноксифенил 335 О Me 4-феноксифенил 336 О Me 4-феноксифенил 337 338 339 О О О Me Me Me 340 О Me 341 О Me 342 О Me 343 О Me 3-феноксифенил 2-феноксифенил 4-(4-хлорфенокси) фенил 4-(4-бромфенокси) фенил 4-(4-фторфенокси)фенил 4-(3-фторфеноксифенил 4-(2-фторфенокси)фенил Ph Ph Ph Ph 2-метилфенил 4-метилфенил 4-фторфенил Ph Ph Ph H H H Me H 142 Ph H Ph H Ph H 123 Ph H 137 171 95 118 H H H H H 162 Продолжение табл. 1 Пример W R1 R2 R3 R4 Т.пл., 344 О Me Ph H 63 345 О Me Ph H 346 О Me Ph H 347 348 О О Me Me Ph Ph H H 349 О Me Ph H 350 О Me Ph H 351 О Н Ph Н 352 О H Ph H 353 354 О О H Me Ph Ph H H 355 О Me Ph H 153 356 О Me. Ph И 125 357 О Me Ph H 358 359 О О Me Me Ph Ph H H 116 360 361 362 363 364 О О О О О Me Me Me Me Me 4-(4-нитрофенокси)фенил 4-(4-метилфенокси)фенил 4-(2-метилфенокси)фенил 4-бензилоксифенил 2-фтор-4-феноксифенил 4-карбометоксифенил 4-карбофеноксифенил 3-(3,5-дихлорфенокси)фенил 3-(3-трифторметилфенокси)фенил 3-феноксифенил 4-(4-трифторметилфенокси)фенил 4-(4-метоксифенокси)фенил 4-(2,4-дихлорфенокси)фенил 4-метансульфонилфенил 4-нитрофенил 3-трифторметилфенил 4-фенилтиофенил 4-фенилфенил 2-нафтил 1-нафтил 2-тиенил Ph Ph Ph Ph Ph H H H H H 158 °С 155 129 35548 365 366 367 368 369 370 О О О О О О Me Me Me Me Me Me 371 372 373 374 375 376 377 378 379 380 381 О О О О О О О О О О О Me Me Me Me Me Me Me Me Me Me 5-хлор-2-тиенил 5-метил-2-тиенил 3-метокси-2-тиенил 3-тиенил 2,5-хлор-3-тиенил 2,5-диметил-3тиенил 2-фенокси-3-тиенил 2-нитро-4-тиенил 3-метокси-4-тиенил 2-фурил 3-фурил 2-пиридил 3-пиридил 2-фтор-3-пиридил 4-пиридил 3-фтор-4-пиридил -CH2(CH2)3CH2 Ph Ph Ph Ph Ph Ph H H Н H Н H Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Н H H H H H H Н H H H 146 170 131 Продолжение табл. 1 Пример W 382 О -CH2(CH2)3CH2 383 384 385 О О О -CH2NMeCH2CH2-CН2CH2SCH2CH2 386 О 387 388 389 О О О Me Me 390 О Me 391 392 О О 393 R1 R2 R3 R4 3,5-дихлорфенил Ph Ph Ph Н Ph Н 4-фтор-3-пиридил 3-фтор-2-пиридил Ph Ph Ph H Н H Ph H Me 4-кирбометоксифенил 4-бензилфенил Ph Ph Н Н О Me Ph H 391 О Циклопропил Ph 395 О Me Феноксиметил 396 О Me Ph 397 О Me 4-феноксифенил 398 О Me Феноксиметил 399 О Н t - Bu 400 О Me Ph 401 О Me 4-фторфенил 3,5-дихлорфенил 3,5-дихлорфенил 3,5-дихлорфенил 2,6-дихлорфенил 2,6-дихлорфенил 2,6-дихлорфенил 2,6-дихлорфенил 4-фторфенил 4-фторфенил Т.пл., °С Н H H H Н Н Н Н Н Н И 163 35548 402 О Me 4-циклогексилфенил 403 О Me Фенилтиометил 404 О Me Ph 405 О Me Ph 406 О Me Ph 407 О Me 4-метоксифенил 408 О Me Ph 409 О Me Ph 410 О Me Ph 4-фторфенил 4-фторфенил 3фтор фенил 4-хлорфенил 3-хлорфенил 3-хлорфснил 2-фторфенил 2,5-дифторфенил 4-метилфенил Н Н Н 164 Н Н 59 Н 152 Н Н Н Продолжение табл. 1 Пример W R1 R2 R3 R4 411 О Me 4-фторфенил Н 412 О Me 4-феноксифенил 413 О Me Фенилтиометил 414 О Me Феноксиметил 415 О Me Ph 416 О Me Ph 417 О Me Ph 418 О Me Ph 419 О Me Ph 420 О Me Ph 421 О Me Ph 422 О Me Ph 423 О Me Ph 424 О Me Ph 425 О Me Ph 426 О Me Ph 427 О Me Ph 428 429 О О Me Me Ph Ph 4-метилфенил 4-метилфенил 4-метилфенил 4-метилфенил 2,6-диметилфенил 4-t-бутилфенил 3-метилфенил 2-метилфенил 4-метоксифенил 4-n-пентилоксифенил 4-аллилоксифенил 4-трифторметилфенил 3-трифторметилфенил 2-трифторметилфенил 4-нитрофенил 4-цианофенил 4-карбометоксифенил Бензил 2-тиенил Т.пл., °С Н Н Н Н Н Н Н Н 134 Н Н Н Н Н Н Н Н Н Н 141 35548 43О 431 432 О О О Me Me Me Ph Ph Ph 433 О Me Ph 434 О Me Ph 435 436 437 438 439 440 О О P О О О Me Me Me Me Me Me Ph Ph Ph Ph Ph Ph 3-фурил 2-пиридил 5-трифторметил-2пиридил 2-пиримидил 6-хлор-3пиридазил Этил Циклогексил t-Bu n-децил Ph Ph Н Н Н Н Н Н Н Н Н Формил Ацетил Продолжение табл. 1 Пример W R1 R2 R3 R4 441 442 443 444 О О О О Me Me Me Me Ph Ph Ph Ph Ph Ph Ph Ph Трифторацетил Метоксиацетил Метоксикарбонил 445 О Me Ph Ph 446 447 448 449 О О О О Me 4-фторфенил Me Me 3-тиенил Ph Ph Ph Ph Ph Ph Ph 450 451 452 453 454 О О О О О Me Me Me Me Me Ph Ph Ph Ph Ph Ph Ph Ph Ph 455 О Me 2-цианофенил Н 456 О Me 457 458 459 О О S Me Me винил 2-N,N-диметиламинофенил 3-пиридил 4-пиридил Фенил 2-метилфенил Ph Н Н Н 46О S Me Ph Ph 4-фторфенил Ph 461 S Me Ph Н 462 S Me Ph Н 463 S Me Ph Н 464 S Me Ph H 465 S Me Ph H 466 О Me Ph H Т.пл., (°С) 4-(6,6,6-трихлоргексилтио)фенил 4-(6,6,6-трифторгексилокси)фенил 4-(трифторметансульфонил)фенил 4-(2'-фторбензилокси)фенил 4-(4'-феноксибен зилокси)фенил 3-фтор-4-фсноксифенил 3-фтор-4феноксифенил Метиламинокарбонил Метансульфонил Метил Метил Метил Фениламинокарбонил Аллил Пропаргил Циклобутил Бензил 118 131 Н Н 64 35548 467 S Me 468 О Me 469 S Me 470 О Me 471 S Me 2-фтор-4-(2-фторфенокси)фенил 2-фтор-4-(2-фторфенокси)фенил 4-(2,4-дифторфенокси)фенил 4- (2,4-дифторфенокси)фенил 4-(4-n-бутилоксифенокси)фенил Ph H Ph H Ph H Ph H Ph H Продолжение табл. 1 Пример 472 R1 R2 R3 R4 S Me Me Ph H 474 S Me Ph Н 475 S Me Ph Н 476 477 S S Me Me Н Н 478 S Me Ph 4-фтор-2метилфенил Ph 479 S Me Ph Н 480 О Me Ph Н 481 S Me Ph Н 482 S Me Ph Н 483 S Me Ph Т.пл., °С H S 4-(4-n-бутилфенокси)фенил 4-(4-циклогексилоксифенокси)фенил 4-(4-метоксиметил)фенил 4-фенетилоксифенил 4-(2'-фторфенил) Ph Ph 473 1 W Н 4-(N-фениламино)фенил 4-(N-метиламино)фенил 4-(N-метиламино)фенил 4-(N-бутиламино)фенил 4-(N-(2-фторфенил)амино)фенил 4-(N-(4-метилфенил)амино)фенил Н - рацемическая смесь; 2 - (R)-энантиомер; 3 - (S)-энантиомер; 4 - рацемическая смесь; 5 (S)-энантиомер Таблица 2 Пример W R1 R2 R5 R6 484 485 486 487 488 489 490 491 492 493 494 S О S S S S S S S S S Me Me н Трифторметил Me Me Me Me Me Me Me Ph Ph Ph Ph 3-тиенил 4-фторфенил 2,4-дифторфенил 4-феноксифенил 3-трифторметилфенил Ph Ph H H H H H H H H H 4-фтор 3-трифторметил H H H H H H H H H H H Т.пл., (°С) 82 Масло 35548 495 496 497 S S S Me Me Me Ph Ph Ph 4-фенокси 2-хлор 2-Ме Н 4-хлор 6-Ме Таблица 3 Пример W R1 R2 R3 R4 498 499 500 501 502 503 504 505 506 507 508 509 510 511 512 513 514 515 516 517 518 519 520 521 522 523 524 525 526 527 528 529 530 531 532 533 534 535 S О S О О S О О О О О О О S О S S О S О S О S О О S О S S О О О О О О О О О Me Me Me Me Me Mе Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me 2-фтор-4-метоксифенил 2-фтор-4-метоксифенил 4-(4-феноксифенокси)фенил 4-(4-феноксифенокси)фенил 4-аминофенил 3-бром-2,6-дифторфенил 3-бром-2,6-дифторфенил 4-феноксифенил 2,4-дифторфенил 2-фтор-4-(3-фторфенокси)фенил 4-N,N-диметиламинофенил 4,5-дихлор-2-тиенил 5-хлор-2-тиенил 3-хлор-4-фторфенил 3-хлор-4-фторфенил 2,5-дихлорфенил 3-хлор-4-феноксифенил 3-хлор-4-феноксифенил 4-трифторметоксифенил 4-метилсульфонилфенил 4-метилтиофенил 4-трифторметилфенил 4-трифторметилфенил 2,5-дихлорфенил 3-хлор-4-фторфенил 2,5-дихлорфенил 3,5-дихлорфенил 3,5-дихлорфенил 3-хлор-4-фторфенил 3-хлорфенил 4-(2-хлорфенокси)фенил 2,5-дифтор-4-метилфенил 3-хлор-4-(2-хлорфенокси)фенил 4-(4-n-бутоксифенокси)фенил 3-бром-4-фторфенил 3-бромфенил 3-бром-4-феноксифенил Ph Ph Ph Ph Ph Ph Ph 3-фторфенил 3-фторфенил Ph Ph Ph Ph Ph Ph Ph Ph Pli Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph H H H H H H H H H H H H H H H H H Н H H H H H Н H H H H H H H H Н Н H H H H Т.пл., (°С) 117 182 134 113 156 137 155 117 118 121 132 152 116 111 170 135 122 117 95 175 109 143 111 179 170 135 131 153 111 127 150 157 157 134 173 120 131 207 536 537 О О Me Me 4-фeнoксифенил 4-феноксифенил Ph Ph H H 1506 1507 35548 538 539 540 541 542 Пример 543 544 545 546 547 548 549 550 551 552 553 554 555 556 557 558 559 560 561 562 563 564 565 566 567 568 569 570 571 572 573 574 575 576 577 578 579 580 581 582 583 584 585 586 587 588 О О S О О Me Me Me Me Me і-пропил 4-(2,2,2-трифторотокси)фенил 4-(2,2,2-трифторэтокси)фенил 4-феноксифенил Ph Ph Ph Ph 3,5-диметилфенил 4-трифторметилфенил H 91 H 124 144 Н Н 172 Н 148 Продолжение табл. 3 W R1 R2 R3 R4 О О S О S О S О О О О О О О О О О О О О О О S О О О О S о S О S О S О О О О О О О О О О S О Me Me Me Me Me Me Me Me Н CF3 Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me 4-феноксифенил 4-феноксифенил Ph n-гексил n-гексил 4-фенилтиофенил 3-хлор-4-феноксифенил 3-хлор-4-феноксифенил Ph Ph 2-фтор-5-метилфенил 2-фтор-5-хлорфенил 2,5-дифторфенил 4-феноксифенил 2,4-дифторфенил 2,5-дифторфенил 2-фторфенил 3-фтор-4-фепоксифенил 2,4-дифторфенил 4-трифторметоксифенил 2-фторфенил 4-метилтиофенил 4-(3-хлорфенокси)фенил 4-(4-хлорфенокси)фенил 4-(4-метилфенокси)фенил 4-(3-хлорфенокси)фенил 4-(2-метилфенокси)фенил 4-(2-і-пpoпилфенокси)фенил 4-(2-і-пропилфенокси)фенил 4-(3-і-пропилфенокси)фенил 4-(3-і-пропилфенокси)фенил 4-(3-t-бутилфеногкси)фенил 4-(3-t-бутилфенокси)фенил 4-(4-t-бутилфенокси)фенил 4-(4-t-бутилфенjкси)фенил 2-(фенилтио)фенил 4-n-бутокси-2-фторфенил 2-фтор-4-зтоксифенил 4-n-бутилфенил 4-n-пропилфенил 4-этилфенил 2-фтор-4-метилфенил 2-(фенокси)этил 2,6-дифторпирид-3-ил 2,6-дифторпирид-3-ил 4-феноксифенил 4-і-пропилфенил 4-трифтор-метоксифенил 4-трифтор-метоксифенил Рh Ph Ph Ph Ph Ph Ph Рh Ph 4-метилфенил 3-хлорфенил 3-хлорфенил 3-фторфенил 3-фторфенил Ph 2-фторфенил Ph 3-хлорфенил Ph Ph Ph Ph Рh Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph 2-(метоксикарбонил)-3тиенил Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н H Н H H H H H H H H H H H H H Н Т.пл., °С 161 153 93 57 70 158 122 117 208 88 128 148 133 115 139 140 і 32 121 122 109 114 150 109 145 145 123 156 Масло* 125 Масло* 125 Масло* 138 143 154 69 100 140 109 110 118 145 102 127 131 Масло
ДивитисяДодаткова інформація
Назва патенту англійськоюOxazolidinone derivatives, a process for the preparation thereof and fungicidal composition
Автори англійськоюAdams John Benjamin, Geffken Detlef, Rayner Dennis Raymond
Назва патенту російськоюПроизводные оксазолидинона, способ их получения и фунгицидная композиция
Автори російськоюАдамс Джон Бенджамин, Джеффкен Детлеф, Рейнер Денниз Рэймонд
МПК / Мітки
МПК: C07D 413/12, C07D 495/10, A01P 3/00, C07D 263/44, C07D 413/04
Мітки: композиція, фунгіцидна, одержання, оксазолідинону, спосіб, похідні
Код посилання
<a href="https://ua.patents.su/35-35548-pokhidni-oksazolidinonu-sposib-kh-oderzhannya-ta-fungicidna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Похідні оксазолідинону, спосіб їх одержання та фунгіцидна композиція</a>
Попередній патент: Спосіб лікування хронічного обструктивного бронхіту у робітників пилонебезпечних виробництв
Наступний патент: Спосіб двохстороннього жаріння м’яса і м’ясопродуктів під осьовим тиском
Випадковий патент: Цифровий гібридний медіанний фільтр












