Оксабіспідинові сполуки та їх застосування у лікуванні серцевих аритмій
Формула / Реферат
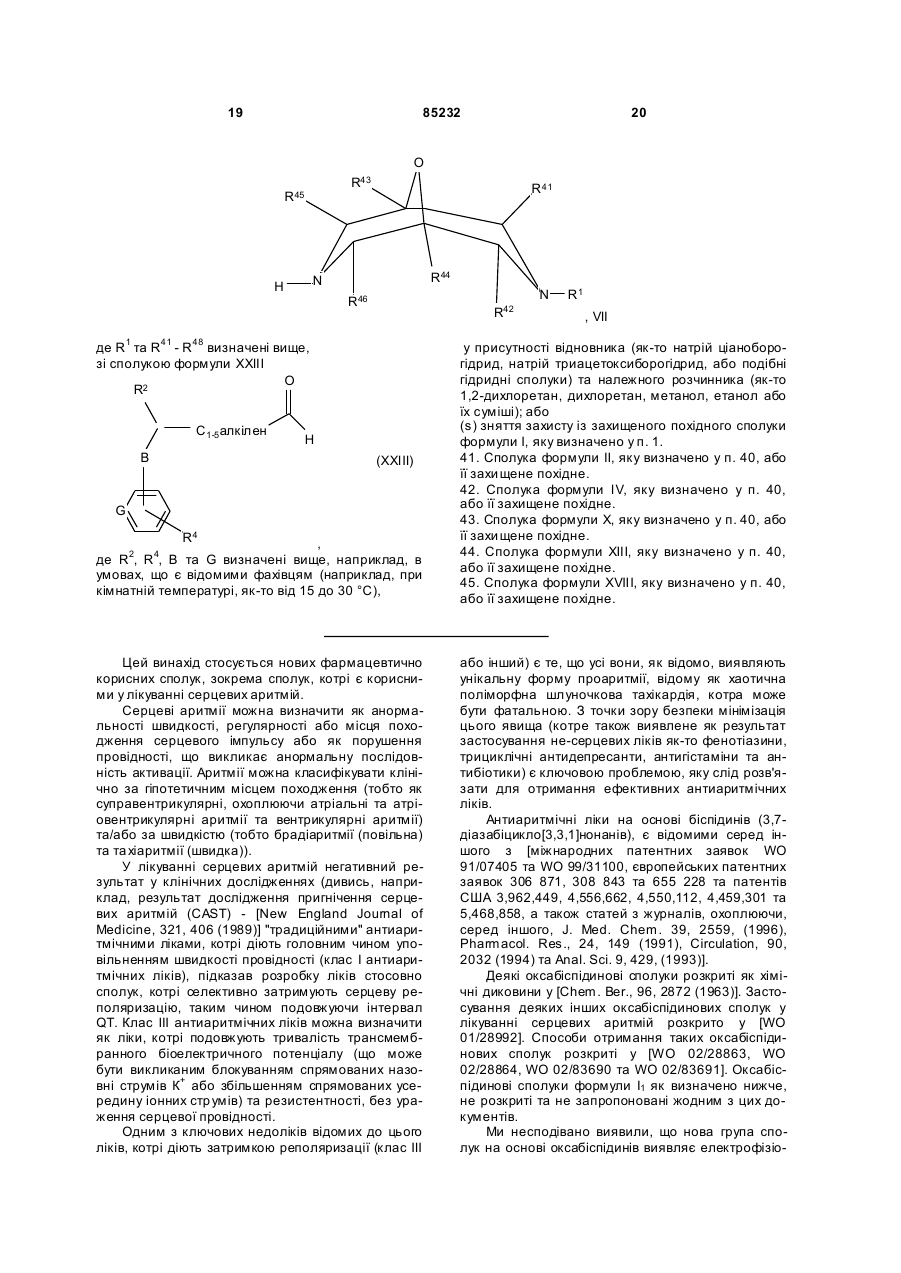
1. Сполука формули І
 , I
, I
дe
R1 - C1-12 алкіл (цей алкіл, як варіант, заміщений одним або більше, вибраним з групи: галоген, ціано, нітро, арил, Het1, -C(O)R5a, -OR5b, -N(R6)R5c, -C(O)XR7, -C(O)N(R8a)R5d,
-OC(O)N(R8b)R5e, -S(O)2R9a, -S(O)2N(R9b)R9c та -N(R9b)S(O)2R9d) або R1 - -C(O)XR7, -C(O)N(R8a)R5d або -S(O)2R9a;
R5a - R5e, незалежно, у кожному випадку, - Н, С1-6 алкіл (останній, як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН, галоген, ціано, нітро, арил, арилоксил, Het2, -S(O)2N(R9b)R9c та -N(R9b)S(O)2R9d), арил або Het3, або R5d або R5e, разом з, відповідно, R8a або R8b, можуть представляти С3-6 алкілен (цей алкілен, як варіант, перервано атомом О та/або, як варіант, заміщено одним або більше С1-3 алкілами);
R6 - Н, С1-6 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН, галоген, ціано, нітро, арил, -S(O)2N(R9b)R9c та -N(R9b)S(O)aR9d), арил, -C(O)R10a, -C(O)OR10b, -C(O)N(R10c)R10d або -S(O)2R10e;
R10a - R10e, незалежно, - С1-6 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН, галоген, ціано, нітро та арил), арил, або R10a, R10c або R10d - Н;
R7, у кожному випадку , - С1-12 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН, галоген, ціано, нітро, арил, С1-6 алкоксил, Het4, -S(O)2N(R9d)R9c та -N(R9b)S(O)2R9d);
R8a та R8b, незалежно, - H, С1-12 алкіл, С1-6 алкоксил (останні дві групи, як варіант, заміщені одним або більше замісниками, вибраними з групи: -ОН, галоген, ціано, нітро, С1-4 алкіл, С1-4 алкоксил, -S(O)2N(R9b)R9c та -N(R9b)S(O)2R9d), -D-арил, -D-арилоксил, -D-Het5, -D-N(H)C(O)R11a, -D-S(O)2R12a, -D-C(O)R11b, -D-C(O)OR12b, -D-C(O)N(R11c)R11d, або R8a або R8b, разом з, відповідно, R5d або R5e, можуть представляти С3-6 алкілен (цей алкілен, як варіант, перервано атомом О та/або, як варіант, заміщено одним або більше C1-3 алкілами);
R11a - R11d незалежно, - Н, С1-6 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН, галоген, ціано, нітро та арил), арил, або R11c та R11d, разом, - С3-6 алкілен;
R12a та R12b, нeзалежно, - С1-6 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН, галоген, ціано, нітро та арил) або арил;
D, у кожному випадку , - безпосередній зв'язок або С1-6 алкілен;
X-O aбo S;
R9а, у кожному випадку , - С1-6 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН, галоген, ціано, нітро, арил, -S(O)2N(R9b)R9c та -N(R9b)S(O)2R9d) або арил;
R9b, у кожному випадку , - Н або С1-6 алкіл;
R9c та R9d незалежно, у кожному випадку наявності тут, - С1-6 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН, галоген, ціано, нітро, арил та Неt6), арил або Het7, або R9с - Н;
R2 - -S(O)2R3a, -C(O)OR3b, -C(O)R3c, -C(O)N(R3d)(R3e) або -S(O)2N(R3f)(R3g);
R3a - R3g, незалежно, - С1-6 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген, -Е-арил, -E-Het8, -C(O)R16a, -C(O)OR16b та -C(O)N(R16c)R18d), арил або Het9, або R3cTa R3d - R3g, незалежно, - H;
R16a - R16d незалежно, у кожному випадку , - Н, С1-6 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген, арил та Het10), арил, Het11, або R16c та R16d, разом, - С3-6 алкілен, як варіант, перерваний атомом О;
E, у кожному випадку , - безпосередній зв'язок або С1-4 алкілен;
Het1 - Het11, незалежно, - 5-12-членні гетероциклічні групи, що містять один або більше гетероатомів, вибраних з оксигену, нітрогену та/або сульфуру, ці групи, як варіант, заміщені одним або більше замісниками, вибраними з групи: -ОН, оксо, галоген, ціано, нітро, С1-6 алкіл, C1-6 алкоксил, арил, арилоксил, -N(R17a)R17b, -C(O)R17c, -C(O)OR17d, -C(O)N(R17e)R17f, -N(R17g)C(O)R17h, -S(O)2N(R17i)R17j та -N(R17k)S(O)2R171;
R17a - R171, незалежно, - C1-6 алкіл, арил або R17a - R17k, незалежно, - H;
A - C2-6 алкілен, як варіант, перерваний -S(O)2N(R18a)- або -N(R18b)S(O)2- та/або, як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН, галоген та аміно;
В - -Z1-{[C(O)]aC(H)(R19a)}b-, -Z2-[C(O)]cN(R19b)-, -Z2-S(O)n-, -Z2-N(R18c)S(O)2-, -Z2-S(O)2N(R18d)- або -Z2-O- (де 6 груп Z1 або Z2 приєднано до атома нітрогену, що з'єднаний з R2);
Z1 - безпосередній зв'язок або С1-4 алкілен, як варіант, перерваний -N(R18e)S(O)2-або -S(O)2N(R18f)-;
Z2, у кожному випадку , - С2-4 алкілен, як варіант, перерваний -N(R18g)S(O)2 або -S(O)2N(R18h)-;
a, b та с, незалежно, - 0 або 1;
n - 0, 1 або 2;
R18a - R18h нeзалежно, - Н або C1-6 алкіл;
R19a - Н, або разом з одиничним замісником R4 у позиції на фенільній або піридильній групі, що знаходиться у позиції орто- відносно позиції зв’язку групи В, R19a - С2-4 алкілен, як варіант, перерваний або закінчений О, S або N(R20);
R19b - Н, С,-є алкіл або, разом з одиничним замісником R4 у позиції на фенільній або піридильній групі, що знаходиться у позиції орто- відносно позиції зв'язку групи В, R19b - С2-4 алкілен;
R20 - Н або С1-6 алкіл;
G - СН або N;
R4 - один або більше можливих замісників, вибраних з групи; -ОН, ціано, галоген, нітро, С1-6 алкіл (як варіант, закінчений -N(H)C(O)OR21a), C1-6 алкоксил, -N(R22a)R22b, -C(O)R22c, -C(O)OR22d, -C(O)N(R22e)R22f, -N(R22g)C(O)R22h, -N(R22i)C(O)N(R22j)R22k, -N(R22m)S(O)2R21b, -S(O)2N(R22n)R22o, -S(O)2R21c, -OS(O)2R21d та арил,
a R4 замісник у позиції на фенільній або піридильній групі, що знаходиться у позиції орто- відносно позиції зв'язку групи В може
(і) разом з R19a, представляти С2-4 алкілен, як варіант, перерваний або закінчений О, S або N(R20c), або
(іі) разом з R19b, представляти С2-4 алкілен;
R21a - R21d, незалежно, представляти С1-6 алкіл;
R22a та R22b, незалежно, представляти Н, С1-6 алкіл або разом представляти С3-6 алкілен, що дає 4-7-членне нітрогеновмісне кільце;
R22c - R22o, незалежно, - Н або С1-6 алкіл; та
R41 - R46, незалежно, - Н або С1-3 алкіл;
де кожний арил та арилоксил, якщо не вказане інше, як варіант, заміщений;
або її фармацевтично прийнятне похідне.
2. Сполука за п. 1, де з можливих замісників на арилі та арилоксилі є один або більше замісників, вибраних з групи: -ОН, галоген, ціано, нітро, C1-6 алкіл, С1-6 алкоксил, -N(R22a)R22b, -C(O)R22c, -C(O)OR22d, -C(O)N(R22e)R22f, -N(R22g)C(O)R22h, -N(R22m)S(O)2R21b, -S(O)2N(R22n)R22o, -S(O)2R21c, та -OS(O)2R21d (де R21b - R21d та R22a - R22o визначені вище у п. 1).
3. Сполука за п. 1 або п. 2, де R1 - С1-8 алкіл (цей алкіл, як варіант, заміщений одним або більше, вибраним з групи: галоген, арил (останній, як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН, галоген, ціано, нітро, С1-5 алкіл, С1-4 алкоксил (останні дві групи, як варіант, заміщені одним або більше атомами галогену), -C(O)R22c тa
-S(O)2R21c), Het1, -C(O)R5a, -OR5b, -N(R6)R5c, -C(O)N(R8a)R5d, -OC(O)N(R8b)R5e, -S(O)2R9a, -S(O)2N(H)R9c та -N(H)S(O)2R9d) або R1 - -C(O)OR7, -C(O)N(R8a)R5d або -S(O)2R9a.
4. Сполука за будь-яким з попередніх пунктів, де R5a - R5e, незалежно, у кожному випадку, - Н, С1-6 алкіл (останній, як варіант, заміщений одним або більше замісниками, вибраними з групи: ціано, нітро, як варіант, заміщений арил та, як варіант, заміщений арилоксил), арил (останній, як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН, галоген, ціано, нітро, N(R22a)R22b (де останні групи R22a та R22b, разом, - С3-6 алкілен), С1-5 алкіл та С1-5 алкоксил (останні дві групи, як варіант, заміщені одним або більше атомами галогену), Het3, або R5d, разом з R8a, - С4-5 алкілен (цей алкілен, як варіант, перервано атомом О).
5. Сполука за будь-яким з попередніх пунктів, де R6 - Н, С1-6 алкіл, як варіант, заміщений арил -C(O)R10a, -C(O)OR10b, -C(O)N(R10c)R10d або -S(O)2R10e.
6. Сполука за будь-яким з попередніх пунктів, де R10a, R10b та R10e, незалежно, - С1-4 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген та, як варіант, заміщений арил) або, як варіант, заміщений арил.
7. Сполука за будь-яким з попередніх пунктів, де R10c та R10d, незалежно, - Н або С1-4 алкіл.
8. Сполука за будь-яким з попередніх пунктів, де R7 - С1-6 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген, як варіант, заміщений арил, С1-4 алкоксил та Het4).
9. Сполука за будь-яким з попередніх пунктів, де R8a та R8b, незалежно, - Н, С1-6 алкіл (останній, як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген, ціано та нітро), -D-(як варіант, заміщений арил), -D-(як варіант, заміщений арилоксил), -D-Hets, -D-N(H)C(O)R11a, -D-C(O)R11b, або R8a, разом з R5d - С4-5 алкілен (цей алкілен, як варіант, перервано атомом О).
10. Сполука за будь-яким з попередніх пунктів, де R11a та R11d, незалежно, - С1-4 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген, ціано, нітро та, як варіант, заміщений арил) або, як варіант, заміщений арил.
11. Сполука за будь-яким з попередніх пунктів, де D, у кожному випадку , - безпосередній зв’язок або С1-4 алкілен.
12. Сполука за будь-яким з попередніх пунктів, де R9a - С1-6 алкіл (як варіант, заміщений одним або більше галогенами групи) або, як варіант, заміщений арил.
13. Сполука за будь-яким з попередніх пунктів, де R9c та R9d, незалежно, у кожному випадку , - С1-5 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген, як варіант, заміщений арил та Het6), як варіант, заміщений арил або Het7, або R9c - Н.
14. Сполука за будь-яким з попередніх пунктів, де R2 - -S(O)2R3a, -C(O)OR3b, -C(O)R3c або -C(O)N(R3d)R3e.
15. Сполука за будь-яким з попередніх пунктів, де R3a - R3e, незалежно, - С1-5 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген, як варіант, заміщений арил та Het8), як варіант, заміщений арил або Het9, або R3d - Н.
16. Сполука за будь-яким з попередніх пунктів, де Het1 та Het3 - Het9, незалежно, -4-10-членні гетероциклічні групи, що містять 1-4 гетероатоми, вибрані з оксигену, нітрогену та/або сульфуру, ці групи, як варіант, заміщені одним або більше замісниками, вибраними з групи: -ОН, оксо, галоген, ціано, Сщ алкіл, См алкоксил, феніл, -N(H)R17a, -C(O)R17c, -N(H)C(O)R17h та -N(H)S(O)2R17j.
17. Сполука за будь-яким з попередніх пунктів, де R17a, R17c, R17h та R17j, незалежно, - С1-4 алкіл або, як варіант, заміщений арил або R17a, R17c та R17h, незалежно, - Н.
18. Сполука за будь-яким з попередніх пунктів, де А - С2-4 алкілен, як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН та аміно.
19. Сполука за будь-яким з попередніх пунктів, де В - -Z1-, -Z2-N(H)-, -Z2-C(O)N(R19b)-, -Z2-S(O)2-, -Z2-N(H)S(O)2-, -Z2-S(O)2N(H)- або -Z2-O- (де останні 6 груп Z2 приєднано до атома нітрогену, що з'єднаний з R2).
20. Сполука за будь-яким з попередніх пунктів, де Z1 - безпосередній зв'язок або С1-4 алкілен.
21. Сполука за будь-яким з попередніх пунктів, де Z2 - С2-4 алкілен.
22. Сполука за будь-яким з попередніх пунктів, де R19b - Н, С1-4 алкіл, або, разом з одиничним замісником R4 у позиції на фенільній або піридильній групі, що знаходиться у позиції орто- відносно позиції зв'язку групи В, R19b - С2-4 алкілен.
23. Сполука за будь-яким з попередніх пунктів, де коли G - N, G знаходиться в орто- або пара-позиції відносно точки приєднання В.
24. Сполука за будь-яким з попередніх пунктів, де коли G - N, R4 відсутній або є одиничною ціаногрупою.
25. Сполука за будь-яким з пп. від 1 до 23, де R4 відсутній або є одним або більше замісниками, вибраними з групи: -ОН, ціано, галоген, нітро, C1-6 алкіл, C1-6 алкоксил, -C(O)N(R22e)R22f та -N(R22m)S(O)2-C1-4 алкіл, або замісник R4 у позиції на фенільній або піридильній групі, що знаходиться у позиції орто- відносно позиції зв'язку групи В може разом з R19b представляти С2-4 алкілен.
26. Сполука за будь-яким з пп. 1 до 23 та 25, де R21c – С1-4 алкіл, a R22c, R22e, R22f та R22m, незалежно, - Н або С1-4 алкіл.
27. Сполука за будь-яким з попередніх пунктів, де R41 - R46, незалежно, - Н.
28. Сполука за будь-яким з попередніх пунктів, де з можливих замісників на арилі та арилоксилі є, якщо не вказане інше, один або більше замісників, вибраних з групи: галоген, ціано, нітро, С1-4 алкіл та С1-4 алкоксил (останні дві групи, як варіант, заміщені одним або більше атомами галогену), -N(H)S(O)2R21b та -S(O)2N(H)R22o.
29. Сполука за будь-яким з попередніх пунктів, де алкіл та алкоксил можуть бути, якщо не вказане інше:
(і) з лінійним чи розгалуженим ланцюгом або циклічним, або є частиною циклічного/ациклічного алкілу;
(іі) насиченим або ненасиченим;
(ііі) перерваним одним або більше атомами оксигену; та/або
(iv) заміщеним одним або більше атомами флуору або хлору.
30. Сполука за п. 1, котрою є:
(і) трет-бутил [2-(7-{2-[[2-(4-ціанофеноксил)етил](метилсульфоніл)аміно]етил}-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл)етил]карбамат;
(іі) трет-бутил {2-[7-(2-{(амінокарбоніл)[2-(4-ціанофеноксил)етил]аміно}етил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}карбамат;
(iiі) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(4-метоксифеніл)-2-оксоетил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)метансульфонамід;
(iv) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(4-метоксифеніл)-2-оксоетил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)сечовина;
(v) N-[2-(7-бeнзил-9-oкca-3,7-дiaзaбiциклo[3,3,1]нон-3-іл)етил]-N-[2-(4-ціанофеноксил)етил]метансульфонамід;
(vi) N-[2-(7-бензил-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл)етил]-N-[2-(4-ціанофеноксил)етил]сечовина;
(vii) 2-[7-(2-{(амінокарбоніл)[2-(4-ціанофеноксил)етил]аміно}етил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]-N-(трет-бутил)ацетамід;
(viii) 2-[7-(2-{(амінокарбоніл)[2-{4-ціанофеноксил)етил]аміно}етил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]-N-бензилацетамід;
(іх) 2-[7-(2-{(амінокарбоніл)[2-(4-ціанофеноксил)етил]аміно}етил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]-N-(1-метил-1-фенілетил)ацетамід;
(х) N-(трет-бутил)-2-(7-{2-[[2-(4-ціанофеноксил)етил](метилсульфоніл)аміно]етил}-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл)ацетамід;
(хі) N-бензил-2-(7-{2-[[2-(4-ціанофеноксил)етил](метилсульфоніл)аміно]етил}-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл)ацетамід;
(хіі) 2-(7-{2-[[2-(4-ціанофеноксил)етил](метилсульфоніл)аміно]етил}-9-окса-3,7-діазабіцикло[3,3,1]нон-3-iл)-N-(1-метил-1-фенілетил)ацетамід;
(xiii) трет-бутил [2-(7-{2-[[3-(4-ціанофеніл)пропіл](метилсульфоніл)аміно]етил}-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл)етил]карбамат;
(xiv) N-(трет-бутил)-2-(7-{2-[[3-(4-ціанофеніл)пропіл](метилсульфоніл)аміно]етил}-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл)ацетамід;
(xv) N-[2-(7-бензил-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл)етил]-N-[3-(4-ціанофеніл)пропіл]метансульфонамід;
(xvi) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(2,6-диметилфеноксил)етил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)сечовина;
(xvii) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(4-ціанофеніл)етил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)сечовина;
(xviii) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(4-метоксифеніл)етил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)сечовина;
(хіх) N-(2-{7-[2-(4-ацетилфеніл)етил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)-N-[2-(4-ціанофеноксил)етил]сечовина;
(хх) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(2-фенілетил)-9-окса-3,7-діазабіцикло-[3,3,1]нон-3-іл]етил}сечовина;
(ххі) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(3-флуорфеніл)етил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)сечовина;
(ххіі) N-{2-{7-[(2-хлорпіридин-3-іл)метил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)-N-(2-(4-ціанофеноксил)етил]метансульфонамід;
(ххііі) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[(6-метоксипіридин-3-іл)метил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)метансульфонамід;
(xxiv) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[(4,5-диметил-2-фурил)метил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)метансульфонамід;
(xxv) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(4-флуорбензил)-9-окса-3,7-діаза-біцикло[3,3,1]нон-3-іл]етил}метансульфонамід;
(xxvi) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[4-(трифлуорметил)бензил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)метансульфонамід;
(xxvii) N-{2-[7-(4-xлopбeнзил)-9-oкca-3,7-діaзaбiциклo[3,3,1]нoн-3-iл]eтил}-N-[2-(4-ціанофеноксил)етил]метансульфонамід;
(xxviii) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-{4-(дифлуорметоксил)бензил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)метансульфонамід;
(ххіх) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[4-(мeтилсульфоніл)бензил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)метансульфонамід;
(ххх) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(2-флуорбензил)-9-окса-3,7-діаза-біцикло[3,3,1]нон-3-іл]етил}метансульфонамід;
(хххі) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(2,4-дифлуорбензил)-9-окса-3,7-діаза-біцикло[3,3,1]нон-3-іл]етил}метансульфонамід;
(хххіі) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(2,5-дихлорбензил)-9-окса-3,7-діаза-біцикло[3,3,1]нон-3-іл]етил}метансульфонамід;
(хххііі) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[3-(трифлуорметил)бензил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)метансульфонамід;
(xxxiv) N-{2-[7-(4-цiaнoбeнзил)-9-oкca-3,7-діaзaбiциклo[3,3,1]нoн-3-iл]eтил}-N-[2-(4-ціанофеноксил)етил]метансульфонамід;
(xxxv) N-{2-[7-(2-ціанобензил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}-N-[2-(4-ціанофеноксил)етил]метансульфонамід;
(xxxvi) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[(2,6-дихлорпіридин-4-іл)метил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)метансульфонамід;
(xxxvii) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(піридин-4-ілметил)-9-окса-3,7-діаза-біцикло[3,3,1]нон-3-іл]етил}метансульфонамід;
(xxxviii) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(піридин-3-ілметил)-9-окса-3,7-діаза-біцикло[3,3,1]нон-3-іл]етил}метансульфонамід;
(хххіх) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[{3,5-диметилізоксазол-4-іл)метил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)метансульфонамід;
(хl) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[(2,4-диметил-1,3-тіазол-5-іл)метил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)метансульфонамід;
(хlі) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[(1-метил-1Н-імідазол-2-іл)метил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)метансульфонамід;
(хlіі) N-бензил-N-{2-[7-(4-ціанобензил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}метансульфонамід;
(xliii) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(3-фенілпропіл)-9-окса-3,7-діаза-біцикло[3,3,1]нон-3-іл]етил}метансульфонамід;
(xliv) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[3-(4-ціанофеніл)пропіл]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)метансульфонамід;
(xlv) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[3-(3-метоксифеніл)пропіл]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)метансульфонамід;
(xlvi) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(2,6-диметилбензил)-9-окса-3,7-діаза-біцикло[3,3,1]нон-3-іл]етил}метансульфонамід;
(xlvii) N-{2-[7-(4-трет-бутилбензил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}-N-[2-(4-ціанофеноксил)етил]метансульфонамід;
(xlviii) N-[2-(7-бензил-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл)етил]-N-[2-(4-ціанофеноксил)етил]-N’,N’-диметилсечовина;
(xlix) N-{2-[7-(4-ціанобензил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}-N-[2-(4-ціанофеноксил)етил]-N’,N’-диметил сечовина;
(l) N-[2-(4-цiaнoфeнoкcил)eтил]-N-(2-{7-[2-флyop-4-(тpифлyopмeтил)бeнзил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)-N’,N’-диметилсечовина;
(lі) N-[2-(4-цiанофеноксил)етил]-N-{2-[7-(4-флуорбензил)-9-окса-3,7-дiазабіцикло[3,3,1]нон-3-іл]етил}-N’,N’-диметилсечовина;
(liі) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[4-(дифлуорметоксил)бензил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-iл}етил-N’,N’-диметилсечовина;
(lііі) N-[2-(4-цiaнoфeнoкcил)eтил]-N’,N’-димeтил-N-{2-[7-(2-фeнiлeтил)-9-oкca-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}сечовина;
(liv) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(4-ціанофеніл)етил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)-N’,N’-диметилсечовина;
(lv) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(3-флуорфеніл)етил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-iл}етил)-N’,N’-диметилсечовина;
(lvi) N-[2-(4-цiaнoфeнoкcил)eтил]-N’,N’-димeтил-N-{2-[7-(3-фeнiлпpoпiл)-9-oкca-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}сечовина;
(lviі) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(2-фенілетил)-9-окса-3,7-діазабіцикло-[3,3,1]нон-3-іл]етил}метансульфонамід;
(lviii) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(4-ціанофеніл)етил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)метансульфонамід;
(liiх) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(4-флуорфеніл)етил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)метансульфонамід;
(lх) N-бензил-N-(2-{7-[2-(4-ціанофеноксил)етил]-9-окса-3,7-діазабіцикло-[3,3,1]нон-3-іл}етил)метансульфонамід;
(lхі) N-(2-{7-[2-(4-ціанофеноксил)етил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)-N-(2-фенілетил)метансульфонамід;
(lхіі) N-(2-{7-[3-(4-ціанофеноксил)пропіл]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)-N-(2-фенілетил)метансульфонамід;
(lхііі) N-(2-{7-[2-(4-ціанофеноксил)етил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)-N-(2-феноксіетил)метансульфонамід;
(lxiv) N-{2-[7-(4-ціанобензил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}-N-{2-феноксіетил)метансульфонамід;
(lxv) N-{2-[7-(4-ціанобензил)-9-окса-3,7-діазабіцикло[3(3,1]нон-3-іл]етил}-N-(2-фенілетил)метансульфонамід;
(lxvi) N-(2-{7-[3-(4-ціанофеноксил)пропіл]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-iл}eтил)-N-(2-фeнoкcieтил)мeтaнcyльфoнaмiд;
(lxvii) N-бензил-N-{2-[7-(4-флуорбензил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}метансульфонамід;
(lxviii) N-бензил-N-{2-[7-(4-хлорбензил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}метансульфонамід;
(lхiх) N-бензил-N-{2-[7-(4-ціанобензил)-9-окca-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}бензолсульфонамід;
(lхх) N-(4-цiaнoбeнзил)-N-{2-[7-(4-цiaнoбeнзил)-9-oкca-3,7-діaзaбiциклo-[3,3,1]нон-3-іл]етил}метансульфонамід;
(lххі) N-(2-ціанобензил)-N-{2-[7-(4-ціанобензил)-9-окса-3,7-діазабіцикло-[3,3,1]нон-3-іл]етил}метансульфонамід;
(lххіі) N-{2-[7-(4-ціанобензил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}-N-{4-флуорбензил)метансульфонамід;
(lxxiii) N-{2-[7-(4-ціанобензил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}-N-(3-флуорбензил)метансульфонамід;
(lxxiv) N-{2-[7-{4-ціанобензил)-9-окca-3,7-діазабіцикло[3,3,1]нон-3-iл]етил}-N-[4-(дифлуорметоксил)бензил]метансульфонамід;
(lxxv) N-(4-хлорбензил)-N-{2-[7-(4-ціанобензил)-9-окса-3,7-діазабіцикло-[3,3,1]нон-3-іл]етил}метансульфонамід;
(lxxvi) N-бензил-N-{2-[7-(4-ціанобензил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}етансульфонамід;
(lxxvii) N-бензил-N-{2-[7-(4-ціанобензил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}-N’-метил сечовина;
(lxxviii) N-бензил-N-{2-[7-(4-ціанобензил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}-N’,N’-диметилсечовина;
(lххіх) N-бензил-N-(2-{7-[2-(4-ціанофеніл)етил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)метансульфонамід;
(lххх) N-бензил-N-(2-{7-[2-(2,4-диціанофеноксил)етил]-9-окса-3,7-діазабіцикло-[3,3,1]нон-3-іл}етил)метансульфонамід;
(lхххі) N-бензил-N-(2-{7-[3-(4-ціанофеноксил)пропіл]-9-окса-3,7-діазабіцикло-[3,3,1]нон-3-іл}етил)метансульфонамід;
(lхххіі) N-бензил-N-{2-[7-(4-ціанобензил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}-1,1,1-трифлуорметансульфонамід;
(lхххііі) N-бензил-N-{2-[7-(4-ціанобензил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}ацетамід;
(lxxxiv) N-бензил-N-{2-[7-(4-ціанобензил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}сечовина;
(lxxxv) N-бензил-N-{2-[7-(4-ціанобензил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}пропан-2-сульфонамід; або
(lxxxvi) N-{2-[7-(4-ціанобензил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}-N-(4-флуорбензил)сечовина;
або її фармацевтично прийнятне похідне.
31. Сполука за п. 30, котрою є N-бензил-N-{2-[7-(4-ціанобензил)-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}метан-сульфонамід, або її фармацевтично прийнятне похідне.
32. Фармацевтична композиція, що містить сполуку, визначено у будь-якому з пп. 1-31, у суміші з фармацевтично прийнятним ад'ювантом, розріджувачем чи носієм.
33. Фармацевтична композиція для застосування у профілактиці або лікуванні аритмії, яка містить сполуку, яку визначено у будь-якому з пп. 1-31.
34. Сполука, яку визначено у будь-якому з пп. 1-31, для застосування як фармацевтична сполука.
35. Сполука, яку визначено у будь-якому з пп. 1-31, для застосування у профілактиці або лікуванні аритмії.
36. Застосування сполуки, яку визначено у будь-якому з пп. 1-31, як активного інгредієнта для виробництва медикаменту для застосування у профілактиці або лікуванні аритмії.
37. Застосування за п. 36, де аритмією є атріальна або вентрикулярна аритмія.
38. Спосіб профілактики або лікування аритмії, який полягає у застосуванні терапевтично ефективної кількості сполуки, яку визначено у будь-якому з пп. 1-31, до особи, що страждає від такого стану чи схильна до нього.
39. Сполука за будь-яким з пп. 1-31 у комбінації з будь-якими іншими ліками для застосування як медикаменту для лікування аритмій або серцево-судинних розладів.
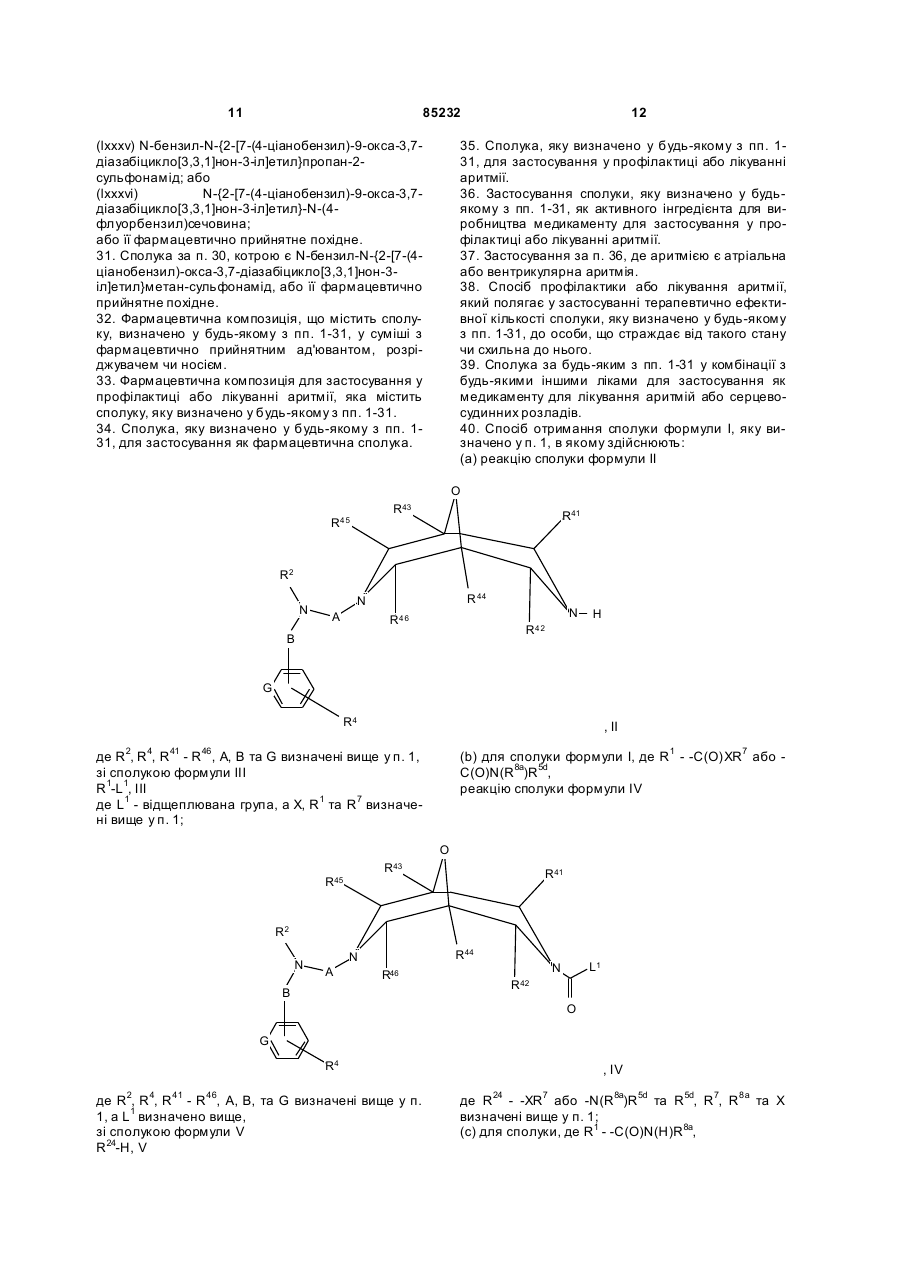
40. Спосіб отримання сполуки формули І, яку визначено у п. 1, в якому здійснюють:
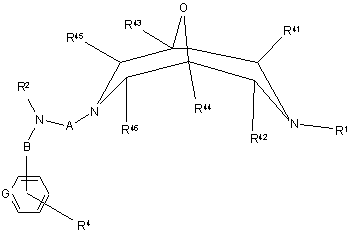
(а) реакцію сполуки формули II
 , II
, II
де R2, R4, R41 - R46, А, В та G визначені вище у п. 1,
зі сполукою формули III
R1-L1 , III
де L1 - відщеплювана група, а X, R1 та R7 визначені вище у п. 1;
(b) для сполуки формули І, де R1 - -C(O)XR7 або -C(O)N(R8a)R5d,
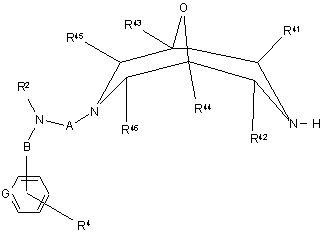
реакцію сполуки формули IV
 , IV
, IV
де R2, R4, R41 - R46, А, В, та G визначені вище у п. 1, a L1 визначено вище,
зі сполукою формули V
R24-H , V
де R24 - -XR7 або -N(R8a)R5d та R5d, R7, R8a та X визначені вище у п. 1;
(c) для сполуки, де R1 - -C(O)N(H)R8a,
реакцію сполуки формули II, яку визначено вище, зі сполукою формули VI
R8a-N=C=O , VI
де R8a визначено вище у п. 1;
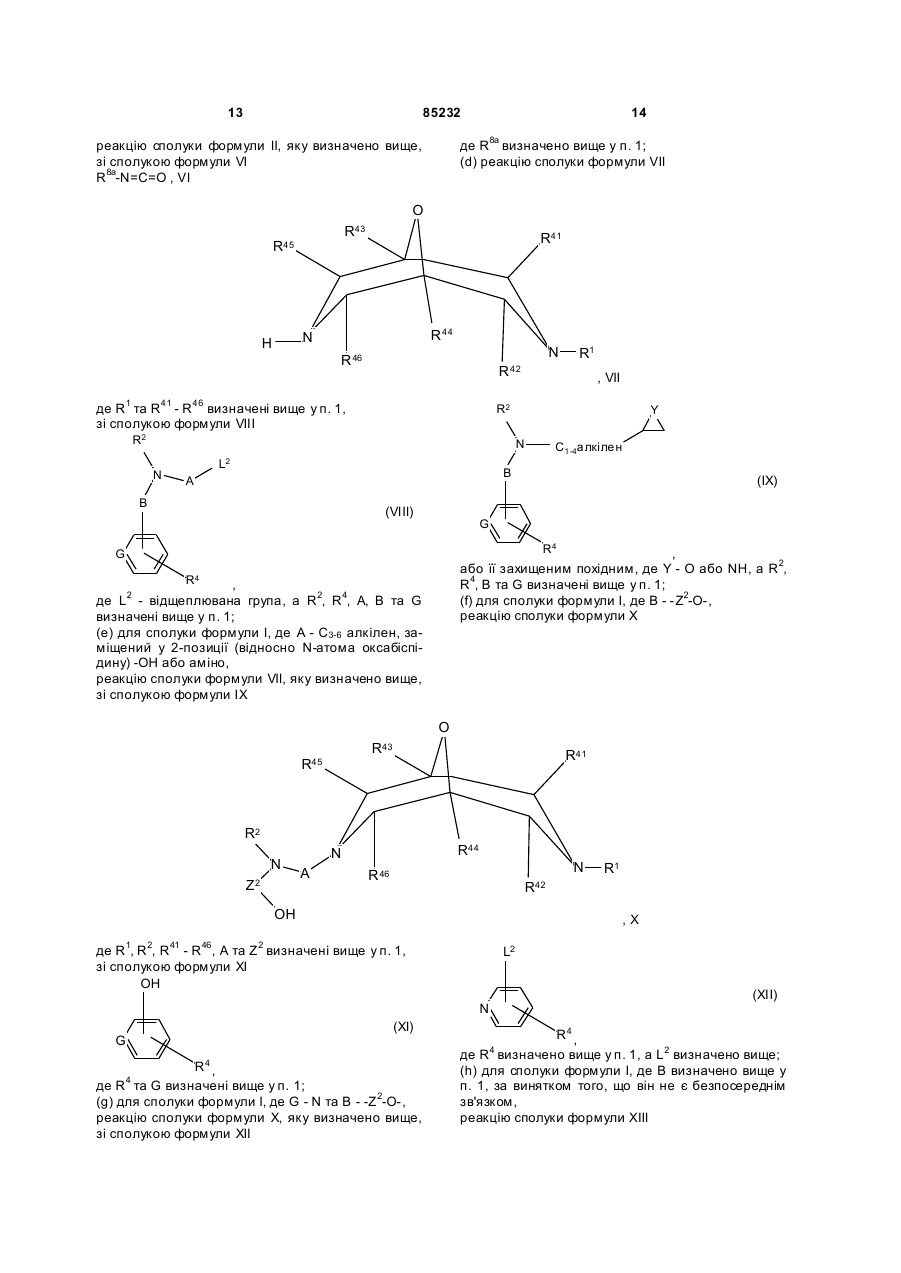
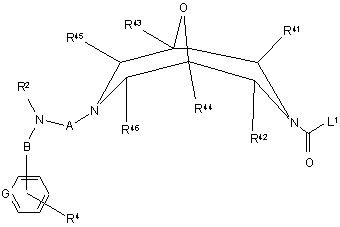
(d) реакцію сполуки формули VII
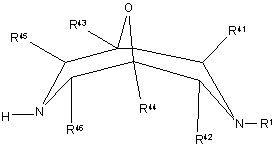 , VII
, VII
де R1 та R41 - R46 визначені вище у п. 1,
зі сполукою формули VIII
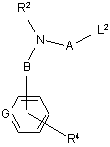 , VIII
, VIII
де L2 - відщеплювана група, a R2, R4, А, В та G визначені вище у п. 1;
(e) для сполуки формули І, де А - С3-6 алкілен, заміщений у 2-позиції (відносно N-атома оксабіспідину) -ОН або аміно,
реакцію сполуки формули VII, яку визначено вище, зі сполукою формули IX
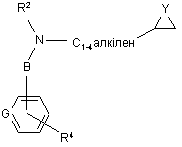 , IX
, IX
або її захищеним похідним, де Y - О або NH, a R2, R4, В та G визначені вище у п. 1;
(f) для сполуки формули І, де В - -Z2-O-,
реакцію сполуки формули X
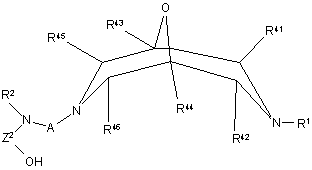 , X
, X
де R1, R2, R41 - R46, А та Z2 визначені вище у п. 1,
зі сполукою формули XI
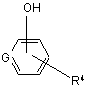 , XI
, XI
де R4 та G визначені вище у п. 1;
(g) для сполуки формули І, де G - N та В - -Z2-O-,
реакцію сполуки формули X, яку визначено вище, зі сполукою формули XII
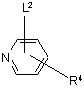 , XII
, XII
де R4 визначено вище у п. 1, a L2 визначено вище;
(h) для сполуки формули І, де В визначено вище у п. 1, за винятком того, що він не є безпосереднім зв'язком,
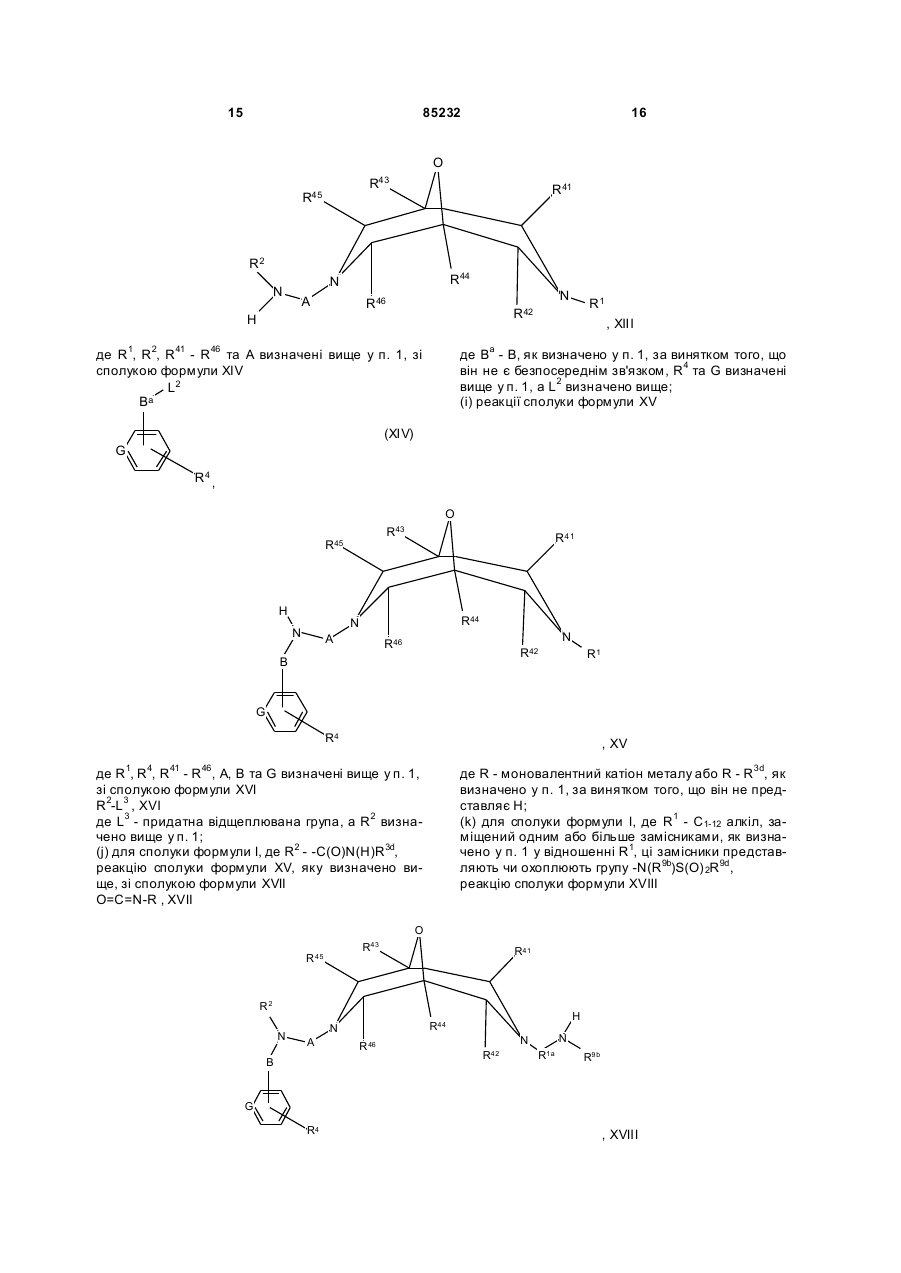
реакцію сполуки формули XIII
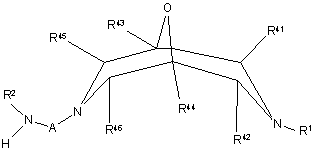 , XIII
, XIII
де R1, R2, R41 - R46 та А визначені вище у п. 1, зі сполукою формули XIV
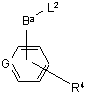 , XIV
, XIV
де Ва - В, як визначено у п. 1, за винятком того, що він не є безпосереднім зв'язком, R4 та G визначені вище у п. 1, a L2 визначено вище;
(і) реакції сполуки формули XV
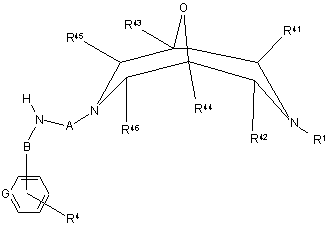 , XV
, XV
де R1, R4, R41 - R46, А, В та G визначені вище у п. 1,
зі сполукою формули XVI
R2-L3 , XVI
де L3 - придатна відщеплювана група, a R2 визначено вище у п. 1;
(j) для сполуки формули І, де R2 - -С(О)N(Н)R3d,
реакцію сполуки формули XV, яку визначено вище, зі сполукою формули XVII
O=C=N-R , XVII
де R - моновалентний катіон металу або R - R3d, як визначено у п. 1, за винятком того, що він не представляє Н;
(k) для сполуки формули І, де R1 - С1-12 алкіл, заміщений одним або більше замісниками, як визначено у п. 1 у відношенні R1, ці замісники представляють чи охоплюють групу -N(R9b)S(O)2R9d,
реакцію сполуки формули XVIII
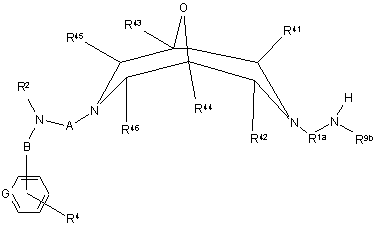 , XVIII
, XVIII
де R1a - С1-12 алкілен, ця група, як варіант, заміщена одним або більше замісниками як визначено у п. 1 у відношенні R1, a R2, R4, R9b, R41 - R46, А, В та G визначені вище у п. 1,
зі сполукою формули XIX
L2-S(O)2R9d , XIX
де R9d визначено вище у п. 1, a L2 визначено вище;
(І) для сполуки формули І, де R1 - С1-12 алкіл, заміщений одним або більше замісниками, як визначено у п. 1 у відношенні R1, ці замісники представляють чи охоплюють групу -S(O)2N(R9b)R9c або -N(R9b)S(O)2R9d,
реакцію сполуки формули II, яку визначено вище, зі сполукою формули ХІХА або ХІХВ
L1-R1a-SO2N(Rab)R9c , ХІХА
L1-R1a-N(R9b)-SO2-R9d , ХІХВ
де L1 та R1a визначені вище, a R9b, R9c тa R9d визначені вище у п. 1;
(m) для сполуки формули І, де R1 - -C(O)XR7, -C(O)N(R8a)R5d або -S(O)2R9a,
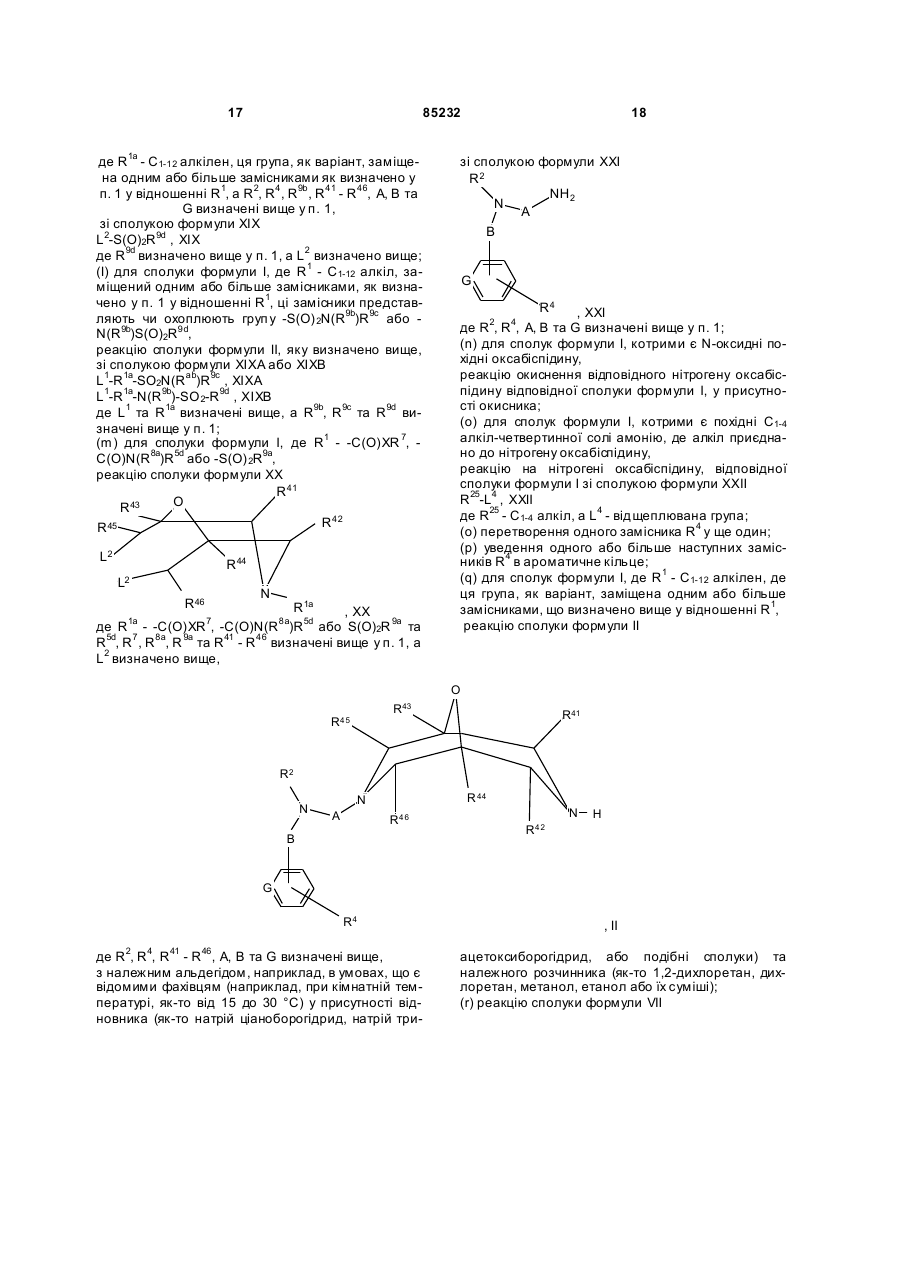
реакцію сполуки формули XX
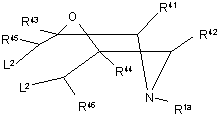 , XX
, XX
де R1a - -C(O)XR7, -C(O)N(R8a)R5d або S(O)2R9a та R5d, R7, R8a, R9a та R41 - R46 визначені вище у п. 1, a L2 визначено вище,
зі сполукою формули XXI
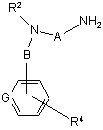 , XXI
, XXI
де R2, R4, А, В та G визначені вище у п. 1;
(n) для сполук формули І, котрими є N-оксидні похідні оксабіспідину,
реакцію окиснення відповідного нітрогену оксабіспідину відповідної сполуки формули І, у присутності окисника;
(о) для сполук формули І, котрими є похідні С1-4 алкіл-четвертинної солі амонію, де алкіл приєднано до нітрогену оксабіспідину,
реакцію на нітрогені оксабіспідину, відповідної сполуки формули І зі сполукою формули XXII
R25-L4 , XXII
де R25 - С1-4 алкіл, a L4 - відщеплювана група;
(о) перетворення одного замісника R4 у ще один;
(р) уведення одного або більше наступних замісників R4 в ароматичне кільце;
(q) для сполук формули І, де R1 - С1-12 алкілен, де ця група, як варіант, заміщена одним або більше замісниками, що визначено вище у відношенні R1,
реакцію сполуки формули II
 , II
, II
де R2, R4, R41 - R46, А, В та G визначені вище,
з належним альдегідом, наприклад, в умовах, що є відомими фахівцям (наприклад, при кімнатній температурі, як-то від 15 до 30 °С) у присутності відновника (як-то натрій ціаноборогідрид, натрій триацетоксиборогідрид, або подібні сполуки) та належного розчинника (як-то 1,2-дихлоретан, дихлоретан, метанол, етанол або їх суміші);
(r) реакцію сполуки формули VII
 , VII
, VII
де R1 та R41 - R48 визначені вище,
зі сполукою формули XXIII
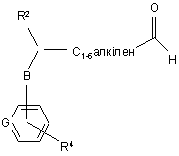 , ХХІІІ
, ХХІІІ
де R2, R4, В та G визначені вище, наприклад, в умовах, що є відомими фахівцям (наприклад, при кімнатній температурі, як-то від 15 до 30 °С),
у присутності відновника (як-то натрій ціаноборогідрид, натрій триацетоксиборогідрид, або подібні гідридні сполуки) та належного розчинника (як-то 1,2-дихлоретан, дихлоретан, метанол, етанол або їх суміші); або
(s) зняття захисту із захищеного похідного сполуки формули І, яку визначено у п. 1.
41. Сполука формули II, яку визначено у п. 40, або її захищене похідне.
42. Сполука формули IV, яку визначено у п. 40, або її захищене похідне.
43. Сполука формули X, яку визначено у п. 40, або її захищене похідне.
44. Сполука формули XIII, яку визначено у п. 40, або її захищене похідне.
45. Сполука формули XVIII, яку визначено у п. 40, або її захищене похідне.
Текст
1. Сполука формули І O R 43 R45 R 41 R2 R 44 N A R46 R1 R10a - R10e, незалежно, - С1-6 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН, галоген, ціано, нітро та арил), арил, або R10a, R10c або R10d - Н; R7, у кожному випадку , - С1-12 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН, галоген, ціано, нітро, арил, С1-6 алкоксил, Het4, -S(O)2N(R9d)R9c та -N(R9b)S(O)2R9d); R8a та R8b , незалежно, - H, С1-12 алкіл, С1-6 алкоксил (останні дві групи, як варіант, заміщені одним або більше замісниками, вибраними з групи: -ОН, галоген, ціано, нітро, С1-4 алкіл, С1-4 алкоксил, S(O)2N(R9b)R9c та -N(R9b)S(O)2R9d), -D-арил, -Dарилоксил, -D-Het5, -D-N(H)C(O)R11a, -D-S(O)2R12a, -D-C(O)R11b, -D-C(O)OR12b , -D-C(O)N(R11c)R11d, або R8a або R8b, разом з, відповідно, R5d або R5e, можуть представляти С 3-6 алкілен (цей алкілен, як варіант, перервано атомом О та/або, як варіант, заміщено одним або більше C1-3 алкілами); R11a - R11d незалежно, - Н, С1-6 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН, галоген, ціано, нітро та арил), арил, або R11c та R11d, разом, - С3-6 алкілен; 85232 дe R1 - C1-12 алкіл (цей алкіл, як варіант, заміщений одним або більше, вибраним з групи: галоген, ціано, нітро, арил, Het1, -C(O)R5a, -OR5b, -N(R6)R5c, C(O)XR7, -C(O)N(R 8a)R5d, -OC(O)N(R8b)R5e, -S(O)2R 9a, -S(O)2N(R9b)R9c та N(R9b)S(O)2R9d) або R1 - -C(O)XR7, -C(O)N(R8a)R5d або -S(O)2R9a; R5a - R5e, незалежно, у кожному випадку, - Н, С1-6 алкіл (останній, як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН, галоген, ціано, нітро, арил, арилоксил, Het2, S(O)2N(R9b)R9c та -N(R9b)S(O)2R9d), арил або Het3, або R5d або R5e, разом з, відповідно, R8a або R8b, можуть представляти С 3-6 алкілен (цей алкілен, як варіант, перервано атомом О та/або, як варіант, заміщено одним або більше С1-3 алкілами); R6 - Н, С1-6 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН, галоген, ціано, нітро, арил, -S(O)2N(R9b)R9c та -N(R9b)S(O)aR9d), арил, -C(O)R10a, -C(O)OR 10b, -C(O)N(R10c)R10d або -S(O)2R10e; ,I (11) R4 UA G (13) C2 B N R42 (19) N 3 85232 R12a та R12b, нeзалежно, - С1-6 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН, галоген, ціано, нітро та арил) або арил; D, у кожному випадку, - безпосередній зв'язок або С1-6 алкілен; X-O aбo S; R9а, у кожному випадку, - С1-6 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН, галоген, ціано, нітро, арил, S(O)2N(R9b)R9c та -N(R9b)S(O) 2R9d) або арил; R9b, у кожному випадку, - Н або С 1-6 алкіл; R9c та R9d незалежно, у кожному випадку наявності тут, - С1-6 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН, галоген, ціано, нітро, арил та Неt6), арил або Het7, або R9с - Н; R2 - -S(O) 2R3a, -C(O)OR 3b, -C(O)R 3c, -C(O)N(R3d)(R3e) або -S(O) 2N(R3f)(R3g ); R3a - R3g , незалежно, - С1-6 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген, -Е-арил, -E-Het8, -C(O)R16a, C(O)OR 16b та -C(O)N(R16c)R18d), арил або Het9, або R3cTa R3d - R3g , незалежно, - H; R16a - R 16d незалежно, у кожному випадку, - Н, С1-6 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген, арил та Het10), арил, Het11, або R16c та R16d, разом, - С3-6 алкілен, як варіант, перерваний атомом О; E, у кожному випадку, - безпосередній зв'язок або С1-4 алкілен; Het1 - Het11, незалежно, - 5-12-членні гетероциклічні групи, що містять один або більше гетероатомів, вибраних з оксигену, нітрогену та/або сульфуру, ці групи, як варіант, заміщені одним або більше замісниками, вибраними з групи: -ОН, оксо, галоген, ціано, нітро, С1-6 алкіл, C1-6 алкоксил, арил, арилоксил, -N(R17a)R17b , -C(O)R17c , -C(O)OR 17d, C(O)N(R17e)R17f , -N(R17g )C(O)R17h, -S(O)2N(R17i)R17j та -N(R17k)S(O) 2R171; R17a - R171, незалежно, - C1-6 алкіл, арил або R17a R17k, незалежно, - H; A - C2-6 алкілен, як варіант, перерваний S(O)2N(R18a)- або -N(R18b)S(O)2- та/або, як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН, галоген та аміно; В - -Z1-{[C(O)]aC(H)(R19a)}b-, -Z 2-[C(O)]cN(R19b)-, -Z2S(O)n-, -Z 2-N(R18c)S(O) 2-, -Z2-S(O)2N(R18d)- або -Z2O- (де 6 гр уп Z1 або Z2 приєднано до атома нітрогену, що з'єднаний з R2); Z1 - безпосередній зв'язок або С 1-4 алкілен, як варіант, перерваний -N(R18e)S(O)2-або -S(O)2N(R18f)-; Z2, у кожному випадку, - С2-4 алкілен, як варіант, перерваний -N(R18g )S(O)2 або -S(O)2N(R18h)-; a, b та с, незалежно, - 0 або 1; n - 0, 1 або 2; R18a - R18h нeзалежно, - Н або C1-6 алкіл; R19a - Н, або разом з одиничним замісником R 4 у позиції на фенільній або піридильній групі, що знаходиться у позиції орто- відносно позиції зв’язку групи В, R19a - С2-4 алкілен, як варіант, перерваний або закінчений О, S або N(R 20); R19b - Н, С,-є алкіл або, разом з одиничним замісником R4 у позиції на фенільній або піридильній 4 групі, що знаходиться у позиції орто- відносно позиції зв'язку групи В, R 19b - С2-4 алкілен; R20 - Н або С 1-6 алкіл; G - СН або N; R4 - один або більше можливих замісників, вибраних з групи; -ОН, ціано, галоген, нітро, С1-6 алкіл (як варіант, закінчений -N(H)C(O)OR21a), C1-6 алкоксил, -N(R22a)R22b, -C(O)R22c, -C(O)OR 22d, C(O)N(R22e)R22f , -N(R22g )C(O)R22h , 22i 22j 22k N(R )C(O)N(R )R , -N(R22m)S(O) 2R21b, S(O)2N(R22n)R 22o, -S(O)2R21c, -OS(O)2R21d та арил, a R4 замісник у позиції на фенільній або піридильній групі, що знаходиться у позиції орто- відносно позиції зв'язку групи В може (і) разом з R19a, представляти С 2-4 алкілен, як варіант, перерваний або закінчений О, S або N(R20c), або (іі) разом з R19b, представляти С 2-4 алкілен; R21a - R21d, незалежно, представляти С1-6 алкіл; R22a та R22b, незалежно, представляти Н, С1-6 алкіл або разом представляти С 3-6 алкілен, що дає 4-7членне нітрогеновмісне кільце; R22c - R22o , незалежно, - Н або С 1-6 алкіл; та R41 - R46, незалежно, - Н або С 1-3 алкіл; де кожний арил та арилоксил, якщо не вказане інше, як варіант, заміщений; або її фармацевтично прийнятне похідне. 2. Сполука за п. 1, де з можливих замісників на арилі та арилоксилі є один або більше замісників, вибраних з групи: -ОН, галоген, ціано, нітро, C1-6 алкіл, С1-6 алкоксил, -N(R22a)R22b , -C(O)R22c, C(O)OR 22d , -C(O)N(R22e)R22f , -N(R22g )C(O)R22h, N(R22m)S(O) 2R21b, -S(O)2N(R22n)R22o , -S(O)2R21c, та OS(O)2R21d (де R21b - R21d та R22a - R22o визначені вище у п. 1). 3. Сполука за п. 1 або п. 2, де R1 - С1- 8 алкіл (цей алкіл, як варіант, заміщений одним або більше, вибраним з групи: галоген, арил (останній, як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН, галоген, ціано, нітро, С1-5 алкіл, С1-4 алкоксил (останні дві групи, як варіант, заміщені одним або більше атомами галогену), C(O)R22c тa -S(O)2R21c), Het1, -C(O)R5a, -OR5b, -N(R6)R5c, C(O)N(R8a)R5d, -OC(O)N(R8b)R 5e, -S(O) 2R9a , S(O)2N(H)R9c та -N(H)S(O)2R9d) або R1 - -C(O)OR7, C(O)N(R8a)R5d або -S(O) 2R9a. 4. Сполука за будь-яким з попередніх пунктів, де R5a - R5e, незалежно, у кожному випадку, - Н, С1-6 алкіл (останній, як варіант, заміщений одним або більше замісниками, вибраними з групи: ціано, нітро, як варіант, заміщений арил та, як варіант, заміщений арилоксил), арил (останній, як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН, галоген, ціано, нітро, N(R 22a)R22b (де останні групи R22a та R22b , разом, - С3-6 алкілен), С1-5 алкіл та С1-5 алкоксил (останні дві групи, як варіант, заміщені одним або більше атомами галогену), Het3, або R5d, разом з R8a, - С4-5 алкілен (цей алкілен, як варіант, перервано атомом О). 5. Сполука за будь-яким з попередніх пунктів, де R6 - Н, С1-6 алкіл, як варіант, заміщений арил C(O)R10a, -C(O)OR10b, -C(O)N(R10c)R10d або S(O)2R10e. 5 85232 6. Сполука за будь-яким з попередніх пунктів, де R10a, R10b та R10e, незалежно, - С1-4 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген та, як варіант, заміщений арил) або, як варіант, заміщений арил. 7. Сполука за будь-яким з попередніх пунктів, де R10c та R 10d , незалежно, - Н або С 1-4 алкіл. 8. Сполука за будь-яким з попередніх пунктів, де R7 - С1-6 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген, як варіант, заміщений арил, С1-4 алкоксил та Het4). 9. Сполука за будь-яким з попередніх пунктів, де R8a та R8b, незалежно, - Н, С1-6 алкіл (останній, як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген, ціано та нітро), -D(як варіант, заміщений арил), -D-(як варіант, заміщений арилоксил), -D-Hets, -D-N(H)C(O)R11a, -DC(O)R11b, або R8a, разом з R5d - С4-5 алкілен (цей алкілен, як варіант, перервано атомом О). 10. Сполука за будь-яким з попередніх пунктів, де R11a та R11d, незалежно, - С1-4 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген, ціано, нітро та, як варіант, заміщений арил) або, як варіант, заміщений арил. 11. Сполука за будь-яким з попередніх пунктів, де D, у кожному випадку, - безпосередній зв’язок або С1-4 алкілен. 12. Сполука за будь-яким з попередніх пунктів, де R9a - С1-6 алкіл (як варіант, заміщений одним або більше галогенами групи) або, як варіант, заміщений арил. 13. Сполука за будь-яким з попередніх пунктів, де R9c та R9d, незалежно, у кожному випадку, - С1-5 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген, як варіант, заміщений арил та Het6), як варіант, заміщений арил або Het7, або R9c - Н. 14. Сполука за будь-яким з попередніх пунктів, де R2 - -S(O)2R3a , -C(O)OR 3b, -C(O)R3c або C(O)N(R3d)R3e. 15. Сполука за будь-яким з попередніх пунктів, де R3a - R3e, незалежно, - С1-5 алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген, як варіант, заміщений арил та Het8), як варіант, заміщений арил або Het9, або R3d - Н. 16. Сполука за будь-яким з попередніх пунктів, де Het1 та Het3 - Het9, незалежно, -4-10-членні гетероциклічні групи, що містять 1-4 гетероатоми, вибрані з оксигену, нітрогену та/або сульфуру, ці групи, як варіант, заміщені одним або більше замісниками, вибраними з групи: -ОН, оксо, галоген, ціано, Сщ алкіл, См алкоксил, феніл, -N(H)R17a, -C(O)R17c, -N(H)C(O)R17h та -N(H)S(O) 2R17j. 17. Сполука за будь-яким з попередніх пунктів, де R17a, R17c , R17h та R17j, незалежно, - С1-4 алкіл або, як варіант, заміщений арил або R17a, R17c та R17h, незалежно, - Н. 18. Сполука за будь-яким з попередніх пунктів, де А - С2-4 алкілен, як варіант, заміщений одним або більше замісниками, вибраними з групи: -ОН та аміно. 19. Сполука за будь-яким з попередніх пунктів, де В - -Z1-, -Z 2-N(H)-, -Z2-C(O)N(R19b)-, -Z2-S(O)2-, -Z2N(H)S(O)2-, -Z2-S(O) 2N(H)- або -Z2-O- (де останні 6 6 груп Z2 приєднано до атома нітрогену, що з'єднаний з R2). 20. Сполука за будь-яким з попередніх пунктів, де Z1 - безпосередній зв'язок або С1-4 алкілен. 21. Сполука за будь-яким з попередніх пунктів, де Z2 - С 2-4 алкілен. 22. Сполука за будь-яким з попередніх пунктів, де R19b - Н, С1-4 алкіл, або, разом з одиничним замісником R4 у позиції на фенільній або піридильній групі, що знаходиться у позиції орто- відносно позиції зв'язку групи В, R 19b - С2-4 алкілен. 23. Сполука за будь-яким з попередніх пунктів, де коли G - N, G знаходиться в орто- або пара-позиції відносно точки приєднання В. 24. Сполука за будь-яким з попередніх пунктів, де коли G - N, R4 відсутній або є одиничною ціаногрупою. 25. Сполука за будь-яким з пп. від 1 до 23, де R 4 відсутній або є одним або більше замісниками, вибраними з групи: -ОН, ціано, галоген, нітро, C1-6 алкіл, C1-6 алкоксил, -C(O)N(R22e)R22f та N(R22m)S(O) 2-C1-4 алкіл, або замісник R4 у позиції на фенільній або піридильній групі, що знаходиться у позиції орто- відносно позиції зв'язку групи В може разом з R19b представляти С 2-4 алкілен. 26. Сполука за будь-яким з пп. 1 до 23 та 25, де R21c - С1-4 алкіл, a R22c, R 22e, R22f та R22m, незалежно, - Н або С 1-4 алкіл. 27. Сполука за будь-яким з попередніх пунктів, де R41 - R46, незалежно, - Н. 28. Сполука за будь-яким з попередніх пунктів, де з можливих замісників на арилі та арилоксилі є, якщо не вказане інше, один або більше замісників, вибраних з групи: галоген, ціано, нітро, С1-4 алкіл та С1-4 алкоксил (останні дві групи, як варіант, заміщені одним або більше атомами галогену), -N(H)S(O)2R21b та -S(O) 2N(H)R22o. 29. Сполука за будь-яким з попередніх пунктів, де алкіл та алкоксил можуть бути, якщо не вказане інше: (і) з лінійним чи розгалуженим ланцюгом або циклічним, або є частиною циклічного/ациклічного алкілу; (іі) насиченим або ненасиченим; (ііі) перерваним одним або більше атомами оксигену; та/або (iv) заміщеним одним або більше атомами флуору або хлору. 30. Сполука за п. 1, котрою є: (і) трет-бутил [2-(7-{2-[[2-(4ціанофеноксил)етил](метилсульфоніл)аміно]етил}9-окса-3,7-діазабіцикло[3,3,1]нон-3іл)етил]карбамат; (іі) трет-бутил {2-[7-(2-{(амінокарбоніл)[2-(4ціанофеноксил)етил]аміно}етил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]етил}карбамат; (iiі) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(4метоксифеніл)-2-оксоетил]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (iv) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(4метоксифеніл)-2-оксоетил]-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл}етил)сечовина; 7 85232 (v) N-[2-(7-бeнзил-9-oкca-3,7дiaзaбiциклo[3,3,1]нон-3-іл)етил]-N-[2-(4ціанофеноксил)етил]метансульфонамід; (vi) N-[2-(7-бензил-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл)етил]-N-[2-(4ціанофеноксил)етил]сечовина; (vii) 2-[7-(2-{(амінокарбоніл)[2-(4ціанофеноксил)етил]аміно}етил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]-N-(третбутил)ацетамід; (viii) 2-[7-(2-{(амінокарбоніл)[2-{4ціанофеноксил)етил]аміно}етил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]-N-бензилацетамід; (іх) 2-[7-(2-{(амінокарбоніл)[2-(4ціанофеноксил)етил]аміно}етил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]-N-(1-метил-1фенілетил)ацетамід; (х) N-(трет-бутил)-2-(7-{2-[[2-(4ціанофеноксил)етил](метилсульфоніл)аміно]етил}9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл)ацетамід; (хі) N-бензил-2-(7-{2-[[2-(4-ціанофеноксил)етил](метилсульфоніл)аміно]етил}-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл)ацетамід; (хіі) 2-(7-{2-[[2-(4ціанофеноксил)етил](метилсульфоніл)аміно]етил}9-окса-3,7-діазабіцикло[3,3,1]нон-3-iл)-N-(1-метил1-фенілетил)ацетамід; (xiii) трет-бутил [2-(7-{2-[[3-(4ціанофеніл)пропіл](метилсульфоніл)аміно]етил}-9окса-3,7-діазабіцикло[3,3,1]нон-3-іл)етил]карбамат; (xi v) N-(трет-бутил)-2-(7-{2-[[3-(4ціанофеніл)пропіл](метилсульфоніл)аміно]етил}-9окса-3,7-діазабіцикло[3,3,1]нон-3-іл)ацетамід; (xv) N-[2-(7-бензил-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл)етил]-N-[3-(4ціанофеніл)пропіл]метансульфонамід; (xvi) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(2,6диметилфеноксил)етил]-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл}етил)сечовина; (xvii) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(4ціанофеніл)етил]-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл}етил)сечовина; (xviii) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(4метоксифеніл)етил]-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл}етил)сечовина; (хі х) N-(2-{7-[2-(4-ацетилфеніл)етил]-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл}етил)-N-[2-(4ціанофеноксил)етил]сечовина; (хх) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(2фенілетил)-9-окса-3,7-діазабіцикло-[3,3,1]нон-3іл]етил}сечовина; (ххі) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(3флуорфеніл)етил]-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл}етил)сечовина; (ххіі) N-{2-{7-[(2-хлорпіридин-3-іл)метил]-9-окса3,7-діазабіцикло[3,3,1]нон-3-іл}етил)-N-(2-(4ціанофеноксил)етил]метансульфонамід; (ххііі) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[(6метоксипіридин-3-іл)метил]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (xxi v) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[(4,5диметил-2-фурил)метил]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; 8 (xxv) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(4флуорбензил)-9-окса-3,7-діаза-біцикло[3,3,1]нон-3іл]етил}метансульфонамід; (xxvi) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[4(трифлуорметил)бензил]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (xxvii) N-{2-[7-(4-xлopбeнзил)-9-oкca-3,7діaзaбiциклo[3,3,1]нoн-3-iл]eтил}-N-[2-(4ціанофеноксил)етил]метансульфонамід; (xxviii) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-{4(дифлуорметоксил)бензил]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (ххі х) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[4(мeтилсульфоніл)бензил]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (ххх) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(2флуорбензил)-9-окса-3,7-діаза-біцикло[3,3,1]нон-3іл]етил}метансульфонамід; (хххі) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(2,4дифлуорбензил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}метансульфонамід; (хххіі) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(2,5дихлорбензил)-9-окса-3,7-діаза-біцикло[3,3,1]нон3-іл]етил}метансульфонамід; (хххііі) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[3(трифлуорметил)бензил]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (xxxi v) N-{2-[7-(4-цiaнoбeнзил)-9-oкca-3,7діaзaбiциклo[3,3,1]нoн-3-iл]eтил}-N-[2-(4ціанофеноксил)етил]метансульфонамід; (xxxv) N-{2-[7-(2-ціанобензил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]етил}-N-[2-(4ціанофеноксил)етил]метансульфонамід; (xxxvi) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[(2,6дихлорпіридин-4-іл)метил]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (xxxvii) N-[2-(4-ціанофеноксил)етил]-N-{2-[7(піридин-4-ілметил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}метансульфонамід; (xxxviii) N-[2-(4-ціанофеноксил)етил]-N-{2-[7(піридин-3-ілметил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}метансульфонамід; (хххі х) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[{3,5диметилізоксазол-4-іл)метил]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (хl) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[(2,4диметил-1,3-тіазол-5-іл)метил]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (хlі) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[(1-метил1Н-імідазол-2-іл)метил]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (хlіі) N-бензил-N-{2-[7-(4-ціанобензил)-9-окса-3,7діазабіцикло[3,3,1]нон-3іл]етил}метансульфонамід; (xliii) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(3фенілпропіл)-9-окса-3,7-діаза-біцикло[3,3,1]нон-3іл]етил}метансульфонамід; 9 (xliv) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[3-(4ціанофеніл)пропіл]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (xl v) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[3-(3метоксифеніл)пропіл]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (xl vi) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(2,6диметилбензил)-9-окса-3,7-діаза-біцикло[3,3,1]нон3-іл]етил}метансульфонамід; (xl vii) N-{2-[7-(4-трет-бутилбензил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]етил}-N-[2-(4ціанофеноксил)етил]метансульфонамід; (xl viii) N-[2-(7-бензил-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл)етил]-N-[2-(4ціанофеноксил)етил]-N’,N’-диметилсечовина; (xlix) N-{2-[7-(4-ціанобензил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]етил}-N-[2-(4ціанофеноксил)етил]-N’,N’-диметил сечовина; (l) N-[2-(4-цiaнoфeнoкcил)eтил]-N-(2-{7-[2-флyop-4(тpифлyopмeтил)бeнзил]-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл}етил)-N’,N’диметилсечовина; (lі) N-[2-(4-цiанофеноксил)етил]-N-{2-[7-(4флуорбензил)-9-окса-3,7-дiазабіцикло[3,3,1]нон-3іл]етил}-N’,N’-диметилсечовина; (liі) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[4(дифлуорметоксил)бензил]-9-окса-3,7діазабіцикло[3,3,1]нон-3-iл}етил-N’,N’диметилсечовина; (lііі) N-[2-(4-цiaнoфeнoкcил)eтил]-N’,N’-димeтил-N{2-[7-(2-фeнiлeтил)-9-oкca-3,7діазабіцикло[3,3,1]нон-3-іл]етил}сечовина; (liv) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(4ціанофеніл)етил]-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл}етил)-N’,N’диметилсечовина; (lv) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(3флуорфеніл)етил]-9-окса-3,7діазабіцикло[3,3,1]нон-3-iл}етил)-N’,N’диметилсечовина; (lvi) N-[2-(4-цiaнoфeнoкcил)eтил]-N’,N’-димeтил-N{2-[7-(3-фeнiлпpoпiл)-9-oкca-3,7діазабіцикло[3,3,1]нон-3-іл]етил}сечовина; (lviі) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(2фенілетил)-9-окса-3,7-діазабіцикло-[3,3,1]нон-3іл]етил}метансульфонамід; (lviii) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(4ціанофеніл)етил]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (liiх) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(4флуорфеніл)етил]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (lх) N-бензил-N-(2-{7-[2-(4-ціанофеноксил)етил]-9окса-3,7-діазабіцикло-[3,3,1]нон-3іл}етил)метансульфонамід; (lхі) N-(2-{7-[2-(4-ціанофеноксил)етил]-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл}етил)-N-(2фенілетил)метансульфонамід; (lхіі) N-(2-{7-[3-(4-ціанофеноксил)пропіл]-9-окса3,7-діазабіцикло[3,3,1]нон-3-іл}етил)-N-(2фенілетил)метансульфонамід; 85232 10 (lхііі) N-(2-{7-[2-(4-ціанофеноксил)етил]-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл}етил)-N-(2феноксіетил)метансульфонамід; (lxiv) N-{2-[7-(4-ціанобензил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]етил}-N-{2феноксіетил)метансульфонамід; (lxv) N-{2-[7-(4-ціанобензил)-9-окса-3,7діазабіцикло[3(3,1]нон-3-іл]етил}-N-(2фенілетил)метансульфонамід; (lxvi) N-(2-{7-[3-(4-ціанофеноксил)пропіл]-9-окса3,7-діазабіцикло[3,3,1]нон-3-iл}eтил)-N-(2фeнoкcieтил)мeтaнcyльфoнaмiд; (lxvii) N-бензил-N-{2-[7-(4-флуорбензил)-9-окса-3,7діазабіцикло[3,3,1]нон-3іл]етил}метансульфонамід; (lxviii) N-бензил-N-{2-[7-(4-хлорбензил)-9-окса-3,7діазабіцикло[3,3,1]нон-3іл]етил}метансульфонамід; (lхiх) N-бензил-N-{2-[7-(4-ціанобензил)-9-окca-3,7діазабіцикло[3,3,1]нон-3іл]етил}бензолсульфонамід; (lхх) N-(4-цiaнoбeнзил)-N-{2-[7-(4-цiaнoбeнзил)-9oкca-3,7-діaзaбiциклo-[3,3,1]нон-3іл]етил}метансульфонамід; (lххі) N-(2-ціанобензил)-N-{2-[7-(4-ціанобензил)-9окса-3,7-діазабіцикло-[3,3,1]нон-3іл]етил}метансульфонамід; (lххіі) N-{2-[7-(4-ціанобензил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]етил}-N-{4флуорбензил)метансульфонамід; (lxxiii) N-{2-[7-(4-ціанобензил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]етил}-N-(3флуорбензил)метансульфонамід; (lxxiv) N-{2-[7-{4-ціанобензил)-9-окca-3,7діазабіцикло[3,3,1]нон-3-iл]етил}-N-[4(дифлуорметоксил)бензил]метансульфонамід; (lxxv) N-(4-хлорбензил)-N-{2-[7-(4-ціанобензил)-9окса-3,7-діазабіцикло-[3,3,1]нон-3іл]етил}метансульфонамід; (lxxvi) N-бензил-N-{2-[7-(4-ціанобензил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]етил}етансульфонамід; (lxxvii) N-бензил-N-{2-[7-(4-ціанобензил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]етил}-N’-метил сечовина; (lxxviii) N-бензил-N-{2-[7-(4-ціанобензил)-9-окса3,7-діазабіцикло[3,3,1]нон-3-іл]етил}-N’,N’диметилсечовина; (lххіх) N-бензил-N-(2-{7-[2-(4-ціанофеніл)етил]-9окса-3,7-діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (lххх) N-бензил-N-(2-{7-[2-(2,4диціанофеноксил)етил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)метансульфонамід; (lхххі) N-бензил-N-(2-{7-[3-(4ціанофеноксил)пропіл]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)метансульфонамід; (lхххіі) N-бензил-N-{2-[7-(4-ціанобензил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]етил}-1,1,1трифлуорметансульфонамід; (lхххііі) N-бензил-N-{2-[7-(4-ціанобензил)-9-окса3,7-діазабіцикло[3,3,1]нон-3-іл]етил}ацетамід; (lxxxiv) N-бензил-N-{2-[7-(4-ціанобензил)-9-окса3,7-діазабіцикло[3,3,1]нон-3-іл]етил}сечовина; 11 85232 (lxxxv) N-бензил-N-{2-[7-(4-ціанобензил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]етил}пропан-2сульфонамід; або (lxxxvi) N-{2-[7-(4-ціанобензил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]етил}-N-(4флуорбензил)сечовина; або її фармацевтично прийнятне похідне. 31. Сполука за п. 30, котрою є N-бензил-N-{2-[7-(4ціанобензил)-окса-3,7-діазабіцикло[3,3,1]нон-3іл]етил}метан-сульфонамід, або її фармацевтично прийнятне похідне. 32. Фармацевтична композиція, що містить сполуку, визначено у будь-якому з пп. 1-31, у суміші з фармацевтично прийнятним ад'ювантом, розріджувачем чи носієм. 33. Фармацевтична композиція для застосування у профілактиці або лікуванні аритмії, яка містить сполуку, яку визначено у будь-якому з пп. 1-31. 34. Сполука, яку визначено у будь-якому з пп. 131, для застосування як фармацевтична сполука. 12 35. Сполука, яку визначено у будь-якому з пп. 131, для застосування у профілактиці або лікуванні аритмії. 36. Застосування сполуки, яку визначено у будьякому з пп. 1-31, як активного інгредієнта для виробництва медикаменту для застосування у профілактиці або лікуванні аритмії. 37. Застосування за п. 36, де аритмією є атріальна або вентрикулярна аритмія. 38. Спосіб профілактики або лікування аритмії, який полягає у застосуванні терапевтично ефективної кількості сполуки, яку визначено у будь-якому з пп. 1-31, до особи, що страждає від такого стану чи схильна до нього. 39. Сполука за будь-яким з пп. 1-31 у комбінації з будь-якими іншими ліками для застосування як медикаменту для лікування аритмій або серцевосудинних розладів. 40. Спосіб отримання сполуки формули І, яку визначено у п. 1, в якому здійснюють: (а) реакцію сполуки формули II O R43 R4 5 R41 R2 N R 44 N A N R4 6 H R4 2 B G R4 , II де R2, R4, R41 - R46 , А, В та G визначені вище у п. 1, зі сполукою формули III R1-L1, III де L1 - відщеплювана група, а X, R1 та R7 визначені вище у п. 1; (b) для сполуки формули І, де R1 - -C(O)XR7 або C(O)N(R8a)R5d, реакцію сполуки формули IV O R43 R45 R41 R2 N R44 N A R46 B L1 N R42 O G R4 де R2, R4, R41 - R46, А, В, та G визначені вище у п. 1, a L1 визначено вище, зі сполукою формули V R24-H, V , IV де R24 - -XR7 або -N(R8a)R5d та R5d, R7, R8a та X визначені вище у п. 1; (c) для сполуки, де R1 - -C(O)N(H)R8a, 13 85232 14 де R8a визначено вище у п. 1; (d) реакцію сполуки формули VII реакцію сполуки формули II, яку визначено вище, зі сполукою формули VI R8a-N=C=O , VI O R43 R45 R41 R 44 N H N R 46 де R1 та R41 - R46 визначені вище у п. 1, зі сполукою формули VIII , VII R2 R2 Y N L2 N R1 R 42 C1 -4алкілен B A B (VIII) (IX) G R4 , або її захищеним похідним, де Y - О або NH, a R2, R4, В та G визначені вище у п. 1; (f) для сполуки формули І, де В - -Z2-O-, реакцію сполуки формули X G R4 , де L - відщеплювана група, a R2, R4, А, В та G визначені вище у п. 1; (e) для сполуки формули І, де А - С3-6 алкілен, заміщений у 2-позиції (відносно N-атома оксабіспідину) -ОН або аміно, реакцію сполуки формули VII, яку визначено вище, зі сполукою формули IX 2 O R43 R45 R41 R2 N Z2 R44 N A N R 46 R42 OH 1 2 41 46 ,X 2 де R , R , R - R , А та Z визначені вище у п. 1, зі сполукою формули XI OH L2 (XII) N G (XI) R4 , де R та G визначені вище у п. 1; (g) для сполуки формули І, де G - N та В - -Z 2-O-, реакцію сполуки формули X, яку визначено вище, зі сполукою формули XII 4 R1 R4 , де R визначено вище у п. 1, a L 2 визначено вище; (h) для сполуки формули І, де В визначено вище у п. 1, за винятком того, що він не є безпосереднім зв'язком, реакцію сполуки формули XIII 4 15 85232 16 O R43 R45 R41 R2 N R44 N A N R46 R1 R42 H де R1, R2, R41 - R46 та А визначені вище у п. 1, зі сполукою формули XIV L2 Ba , XIII де Ва - В, як визначено у п. 1, за винятком того, що він не є безпосереднім зв'язком, R4 та G визначені вище у п. 1, a L 2 визначено вище; (і) реакції сполуки формули XV (XIV) G R4 , O R43 R45 H R4 1 R44 N N A N R46 R42 B R1 G R4 , XV де R1, R4, R41 - R46 , А, В та G визначені вище у п. 1, зі сполукою формули XVI R2-L3 , XVI де L3 - придатна відщеплювана група, a R2 визначено вище у п. 1; (j) для сполуки формули І, де R2 - -С(О)N(Н)R3d, реакцію сполуки формули XV, яку визначено вище, зі сполукою формули XVII O=C=N-R , XVII де R - моновалентний катіон металу або R - R3d, як визначено у п. 1, за винятком того, що він не представляє Н; (k) для сполуки формули І, де R1 - С1-12 алкіл, заміщений одним або більше замісниками, як визначено у п. 1 у відношенні R1, ці замісники представляють чи охоплюють групу -N(R9b)S(O) 2R9d , реакцію сполуки формули XVIII O R43 R 45 R41 R2 N A B H R44 N R 46 N N R42 R1a R9b G R4 , XVIII 17 85232 де R1a - С1-12 алкілен, ця група, як варіант, заміщена одним або більше замісниками як визначено у п. 1 у відношенні R1, a R2, R4 , R9b , R41 - R46, А, В та G визначені вище у п. 1, зі сполукою формули XIX L2-S(O)2R9d , XIX де R9d визначено вище у п. 1, a L 2 визначено вище; (І) для сполуки формули І, де R1 - С1-12 алкіл, заміщений одним або більше замісниками, як визначено у п. 1 у відношенні R1, ці замісники представляють чи охоплюють груп у -S(O) 2N(R9b)R9c або N(R9b)S(O)2R9d, реакцію сполуки формули II, яку визначено вище, зі сполукою формули ХІХА або ХІХВ L1-R1a-SO2N(Rab)R9c , ХІХА L1-R1a-N(R9b)-SO 2-R9d , ХІХВ де L1 та R1a визначені вище, a R9b, R9c тa R9d визначені вище у п. 1; (m) для сполуки формули І, де R1 - -C(O)XR 7, C(O)N(R8a)R5d або -S(O) 2R9a, реакцію сполуки формули XX R 41 O R 43 R 42 R 45 L2 R 44 L2 N R 46 R 1a , XX де R - -C(O)XR , -C(O)N(R )R5d або S(O)2R 9a та 5d 7 8a 9a 41 46 R , R , R , R та R - R визначені вище у п. 1, a L2 визначено вище, 1a 7 8a 18 зі сполукою формули XXI R2 NH2 N A B G R4 , XXI де R2, R4, А, В та G визначені вище у п. 1; (n) для сполук формули І, котрими є N-оксидні похідні оксабіспідину, реакцію окиснення відповідного нітрогену оксабіспідину відповідної сполуки формули І, у присутності окисника; (о) для сполук формули І, котрими є похідні С1-4 алкіл-четвертинної солі амонію, де алкіл приєднано до нітрогену оксабіспідину, реакцію на нітрогені оксабіспідину, відповідної сполуки формули І зі сполукою формули XXII R25-L4 , XXII де R25 - С1-4 алкіл, a L4 - відщеплювана група; (о) перетворення одного замісника R4 у ще один; (р) уведення одного або більше наступних замісників R4 в ароматичне кільце; (q) для сполук формули І, де R1 - С1-12 алкілен, де ця група, як варіант, заміщена одним або більше замісниками, що визначено вище у відношенні R1, реакцію сполуки формули II O R43 R4 5 R41 R2 N R 44 N A R4 6 B N H R4 2 G R4 де R2, R4, R41 - R46 , А, В та G визначені вище, з належним альдегідом, наприклад, в умовах, що є відомими фахівцям (наприклад, при кімнатній температурі, як-то від 15 до 30 °С) у присутності відновника (як-то натрій ціаноборогідрид, натрій три , II ацетоксиборогідрид, або подібні сполуки) та належного розчинника (як-то 1,2-дихлоретан, дихлоретан, метанол, етанол або їх суміші); (r) реакцію сполуки формули VII 19 85232 20 O R43 R45 R41 R44 N H N R46 R42 де R1 та R41 - R48 визначені вище, зі сполукою формули XXIII O R2 C1-5 алкілен B H (ХХІІІ) G R4 , де R , R , В та G визначені вище, наприклад, в умовах, що є відомими фахівцям (наприклад, при кімнатній температурі, як-то від 15 до 30 °С), 2 4 Цей винахід стосується нових фармацевтично корисних сполук, зокрема сполук, котрі є корисними у лікуванні серцевих аритмій. Серцеві аритмії можна визначити як анормальності швидкості, регулярності або місця походження серцевого імпульсу або як порушення провідності, що викликає анормальну послідовність активації. Аритмії можна класифікувати клінічно за гіпотетичним місцем походження (тобто як суправентрикулярні, охоплюючи атріальні та атріовентрикулярні аритмії та вентрикулярні аритмії) та/або за швидкістю (тобто брадіаритмії (повільна) та та хіаритмії (швидка)). У лікуванні серцевих аритмій негативний результат у клінічних дослідженнях (дивись, наприклад, результат дослідження пригнічення серцевих аритмій (CAST) - [New England Journal of Medicine, 321, 406 (1989)] "традиційними" антиаритмічними ліками, котрі діють головним чином уповільненням швидкості провідності (клас І антиаритмічних ліків), підказав розробку ліків стосовно сполук, котрі селективно затримують серцеву реполяризацію, таким чином подовжуючи інтервал QT. Клас III антиаритмічних ліків можна визначити як ліки, котрі подовжують тривалість трансмембранного біоелектричного потенціалу (що може бути викликаним блокуванням спрямованих назовні струмів К+ або збільшенням спрямованих усередину іонних стр умів) та резистентності, без ураження серцевої провідності. Одним з ключових недоліків відомих до цього ліків, котрі діють затримкою реполяризації (клас III R1 , VII у присутності відновника (як-то натрій ціаноборогідрид, натрій триацетоксиборогідрид, або подібні гідридні сполуки) та належного розчинника (як-то 1,2-дихлоретан, дихлоретан, метанол, етанол або їх суміші); або (s) зняття захисту із захищеного похідного сполуки формули І, яку визначено у п. 1. 41. Сполука формули II, яку визначено у п. 40, або її захи щене похідне. 42. Сполука формули IV, яку визначено у п. 40, або її захищене похідне. 43. Сполука формули X, яку визначено у п. 40, або її захи щене похідне. 44. Сполука формули XIII, яку визначено у п. 40, або її захищене похідне. 45. Сполука формули XVIII, яку визначено у п. 40, або її захищене похідне. або інший) є те, що усі вони, як відомо, виявляють унікальну форму проаритмії, відому як хаотична поліморфна шлуночкова тахікардія, котра може бути фатальною. З точки зору безпеки мінімізація цього явища (котре також виявлене як результат застосування не-серцевих ліків як-то фенотіазини, трициклічні антидепресанти, антигістаміни та антибіотики) є ключовою проблемою, яку слід розв'язати для отримання ефективних антиаритмічних ліків. Антиаритмічні ліки на основі біспідинів (3,7діазабіцикло[3,3,1]нонанів), є відомими серед іншого з [міжнародних патентних заявок WO 91/07405 та WO 99/31100, європейських патентних заявок 306 871, 308 843 та 655 228 та патентів США 3,962,449, 4,556,662, 4,550,112, 4,459,301 та 5,468,858, а також статей з журналів, охоплюючи, серед іншого, J. Med. Chem. 39, 2559, (1996), Pharmacol. Res., 24, 149 (1991), Circulation, 90, 2032 (1994) та Anal. Sci. 9, 429, (1993)]. Деякі оксабіспідинові сполуки розкриті як хімічні диковини у [Chem. Ber., 96, 2872 (1963)]. Застосування деяких інших оксабіспідинових сполук у лікуванні серцевих аритмій розкрито у [WO 01/28992]. Способи отримання таких оксабіспідинових сполук розкриті у [WO 02/28863, WO 02/28864, WO 02/83690 та WO 02/83691]. Оксабіспідинові сполуки формули I1 як визначено нижче, не розкриті та не запропоновані жодним з цих документів. Ми несподівано виявили, що нова група сполук на основі оксабіспідинів виявляє електрофізіо 21 85232 логічну активність, та тому, як очікують, будуть корисними у лікуванні серцевих аритмій. Нова група сполук на основі оксабіспідинів має переважні властивості порівняно зі сполуками попереднього рівня техніки, як-то посилена потужність, посилена селективність, та/або зменшення загального кліренсу. Ці переважні властивості можуть характеризувати застосування таких сполук як фармацевтичних засобів за зниженням добової клінічної дози, подовженням тривалості дії, та/або поліпшенням профілю побічної дії. Згідно з винаходом запропоновано сполуки формули І, I де R1 - С1-2алкіл (цей алкіл, як варіант, заміщений одним або більше, вибраним з групи: галоген, ціано, нітро, арил, Het1, -C(O)R5a, -OR5b, -N(R6)R5c, C(O)XR7, -C(O)N(R8a)R 5d, -OC(O)N(R8b)R5e , S(O)2R9a , -S(O) 2N(R9b)R9c та -N(R9b)S(O)2R9d) або R1 - -C(O)XR 7, -C(O)N(R 8a)R5d або -S(O)2R9a; R5a - R5e, незалежно, у кожному випадку наявності тут, - H, С1-6алкіл (останній, як варіант, заміщений одним або більше замісниками, вибраними з групи: -OH, галоген, ціано, нітро, арил, арилоксил, Het2, -S(O) 2N(R9b)R9c та -N(R9b)S(O)2R9d), арил або Het3, або R5d або R5e , разом з, відповідно, R8a або R8b, можуть представляти C3-6алкілен (цей алкілен, як варіант, перервано атомом O та/або, як варіант, заміщено одним або більше C1-3алкілами); R6 - H, C1-6алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: -OH, галоген, ціано, нітро, арил, -S(O)2N(R9b)R9c та N(R9b)S(O)2R9d), арил, -C(O)R10a , -C(O)OR 10b, C(O)N(R10c)R10d або -S(O)2R10e; R10a - R 10e , незалежно, - C1-6алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: -OH, галоген, ціано, нітро та арил), арил, або R10a, R10c aбo R10d-H; R7, у кожному випадку наявності тут, - С112алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: -OH, галоген, ціано, нітро, арил, C1-6алкоксил, Het4, S(O)2N(R9b)R9c та -N(R9b)S(O)2R9c); R8a та R8b, незалежно, - H, С1-12алкіл, C16алкоксил (останні дві групи, як варіант, заміщені одним або більше замісниками, вибраними з групи: -OH, галоген, ціано, нітро, C1-4алкіл, C19b 9c та -N(R9b)S(O)2R9d), -D4алкоксил, -S(O)2N(R )R арил, -D-арилоксил, -D-Het5, -D-N(H)C(O)R 11a, -DS(O)2R12a, -D-C(O)R 11b , -D-C(O)OR12b, -DC(O)N(R11c)R11d , або R8a або R8b, разом з, відповідно, R5d або R5e, можуть представляти С 3-6алкілен 22 (цей алкілен, як варіант, перервано атомом O та/або, як варіант, заміщено одним або більше C 13алкілами); R11a-R11d незалежно, - H, C1-6алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: -OH, галоген, ціано, нітро та арил), арил, або R11c тa R11d, разом, - С3-6алкілен; R12a та R12b , незалежно, - C1-6алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: -OH, галоген, ціано, нітро та арил) або арил; D, у кожному випадку наявності тут, - безпосередній зв'язок або C1-6алкілен; X-O або S; R9a, у кожному випадку наявності тут, - C16алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: -OH, галоген, ціано, нітро, арил, -S(O)2N(R9b)R9c та N(R9b)S(O)2R9d) або арил; 9b R , у кожному випадку наявності тут, - H або C1-6алкіл; R9c та R9d, незалежно, у кожному випадку наявності тут, - C1-6алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: OH, галоген, ціано, нітро, арил та Het6), арил або Het7, або R9c - H; R2 - -S(O)2R3a, -C(O)OR 3b, -C(O)R3c, C(O)N(R3d)(R3a) або -S(O) 2N(R3f)(R3g ); R3a - R 3g , незалежно, - C1-6алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген, -Е-арил, -E-Het8, -C(O)R16a , C(O)OR 16b та -C(O)N(R16c)R 16d), арил або Het9, або R3c та R3d - R3g , незалежно, - H; R16a - R16d, незалежно, у кожному випадку наявності тут, - H, C1-6алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген, арил та Het10), арил, Het11 , або R16c та R16d, разом, - C3-6алкілен, як варіант, перерваний атомом O; E, у кожному випадку наявності тут, - безпосередній зв'язок або C1-4алкілен; Het1 - Het11, незалежно, - 5-12-членні гетероциклічні групи, що містять один або більше гетероатомів, вибраних з оксигену, нітрогену та/або сульфур у, ці групи, як варіант, заміщені одним або більше замісниками, вибраними з групи: -OH, оксо, галоген, ціано, нітро, C1-6алкіл, C1-6алкоксил, арил, арилоксил, -N(R17a)R17b , -C(O)R17c , -C(O)OR 17d, C(O)N(R17e)R17f , -N(R17g )C(O)R17h, -S(O)2N(R17i)R17j та -N(R17k)S(O) 2R17l; R17a - R17l , незалежно, - C1-6алкіл, арил або R17a - R17k, незалежно, - H; A - C2-6алкілен, як варіант, перерваний S(O)2N(R18a)-, або -N(R18b)S(O)2-, та/або, як варіант, заміщений одним або більше замісниками, вибраними з групи: -OH, галоген та аміно; В - -Z1-{[C(O)]aC(H)(R19a)} b-, -Z2-[C(O)]cN(R19b)-, 2 Z -S(O) n-, -Z2-N(R18c)S(O)2-, -Z2-S(O)2N(R18d)- або Z2-O- (де 6 гр уп Z1 або Z 2 приєднано до атому нітрогену, що з'єднаний з R2); Z1 - безпосередній зв'язок або C1-4алкілен, як варіант, перерваний -N(R18a)S(O)2або 18f S(O)2N(R )-; 23 85232 Z2, у кожному випадку наявності тут, - C218g )S(O)2- або 4алкілен, як варіант, перерваний -N(R 18h -S(O)2N(R )-; a, b та с, незалежно, - 0 або 1; n - 0, 1 або 2; R18a - R18h, незалежно, - H або C1-6алкіл; R19a – H, або разом з одиничним замісником R4 у позиції на фенільній або піридиль-ній групі, що знаходиться у позиції орто- відносно позиції зв'язку групи В, R19a - C2-4алкілен, як варіант, перерваний або закінчений O, S або N(R 20); R19b - H, C1-6алкіл або, разом з одиничним замісником R4 у позиції на фенільній або піридильній групі, що знаходиться у позиції орто- відносно позиції зв'язку групи В, R 19b - C2-4алкілен; R20 - H або C1-6алкіл; G - CH або N; R4 - один або більше можливих замісників, вибраних з групи: -OH, ціано, галоген, нітро, C1-6алкіл (як варіант, закінчений -N(H)C(O)OR21a), C122a )R22b , -C(O)R22с, -C(O)OR 22d, 6алкоксил, -N(R 22e 22f C(O)N(R )R , -N(R22g )C(O)R22h , N(R22i)C(O)N(R22j)R22k, -N(R22m)S(O) 2R21b, S(O)2N(R22n)R 22o, -S(O)2R21c, -OS(O)2R21d та арил, а замісник R4 у позиції на фенільній або піридильній групі, що знаходиться у позиції орто- відносно позиції зв'язку групи В може (і) разом з R19a, представляти C2-4алкілен, як варіант, перерваний або закінчений O, S або N(R20c), або (іі) разом з R19b, представляти C2-4алкілен; R21a - R21d незалежно, представляти C1-6алкіл; R22a та R22b , незалежно, представляти H, C16алкіл або, разом, представляти C 3-6алкілен, що дає 4-7-членне нітрогеновмісне кільце; R22c - R22o, незалежно, представляти H або C16алкіл; та R41 - R46, незалежно, представляти H або C13алкіл; де кожний арил та арилоксил, якщо не вказане інше, як варіант, заміщений; або її фармацевтично прийнятне похідне; ці сполуки далі позначені як "сполуки винаходу". Для запобігання невизначеності слід розуміти, що там, де у цьому описі група 'визначена вище', вказана група охоплює перше та найширше визначення а також кожне та усі з інших визначень для цієї групи. Якщо не вказане інше, алкіл та алкоксил, що тут визначено, можуть мати лінійний ланцюг, або, коли є достатнє число (тобто мінімум три) атомів карбону мати розгалужений ланцюг, та/або бути циклічним. Крім того, коли є достатнє число (тобто мінімум чотири) атомів карбону, такі алкіл та алкоксил можуть також бути циклічними/ациклічними. Такі алкіл та алкоксил можуть також бути насиченими або, коли є достатнє число (тобто мінімум два) атомів карбону, бути ненасиченими та/або перерваними одним або більше атомами оксигену та/або сульфур у. Якщо не вказане інше, алкіл та алкоксил можуть також бути заміщеними одним або більше галогенами, а особливо атоми флуору. Якщо не вказане інше, алкілени, що тут визначено, можуть мати лінійний ланцюг або, коли є 24 достатнє число (тобто мінімум два) атомів карбону, мати розгалужений ланцюг. Такі ланцюги алкілену можуть також бути насиченими або, коли є достатнє число (тобто мінімум два) атомів карбону, бути ненасиченими та/або перерваними одним або більше атомами оксигену та/або сульфур у. Якщо не вказане інше, алкілени можуть також бути заміщеними одним або більше атомами галогену. Термін "арил", при застосуванні тут, охоплює С6-10арил як-то феніл, нафтил то що. Термін "арилокси", при застосуванні тут о хоплює С 610арилоксили як-то феноксил, нафтоксил тощо. Для запобігання невизначеності, арилоксили, згадані тут, приєднані до рештки молекули через Оатом окси-групи. Якщо не вказане інше, арил та арилоксил можуть бути заміщеними одним або більше замісниками, охоплюючи -OH, галоген, ціано, нітро, C1-6алкіл, C1-6алкоксил, -N(R22a)R22b, C(O)R22c, -C(O)OR 22d, -C(O)N(R22e)R22f, 22g 22h 22m N(R )C(O)R , -N(R )S(O)2R21b , S(O)2N(R22n)R 22o, -S(O) 2R21c , та/або -OS(O) 2R21d (де R21b - R21d та R22a -R22o визначені вище). Коли вони заміщені, арил та арилоксил переважно заміщені одним-трьома замісниками. Термін "галоген", при застосуванні тут, охоплює флуор, хлор, бром та йод. Het (Het1, Het2, Het3, Het4, Het5, Het6, Het7, Het8 , Het9, Het10 та Het11), що можна згадати охоплюють групи, що містять 1-4 гетероатоми (вибрані з оксигену, нітрогену та/або сульфур у), у котрих загальне число атомів у кільцевій системі між 5 та 12. Het (Het1, Het2, Het3, Het4, Het5, Het6, Het7, Het8, Het9, Het10 та Het11) можуть бути повністю насиченими, повністю ароматичними, частково ароматичними та/або біциклічними. Гетероциклічні групи, що можна згадати, охоплюють 1азабіцикло[2,2,2]октаніл, бензимідазоліл, бензизооксазоліл, бензодіоксаніл, бензодіоксепаніл, бензодіоксоліл, бензофураніл, бензофуразаніл, бензоморфолініл, 2,1,3-бензоксадіазоліл, бензоксазиноніл, бензоксазолідиніл, бензоксазоліл, бензопіразоліл, бензо[е]піримідин, 2,1,3бензотіадіазоліл, бензотіазоліл, бензотієніл, бензотриазоліл, хроманіл, хроменіл, цинолініл, 2,3дигідробензимідазоліл, 2,3дигідробензо[b]фураніл, 1,3дигідробензо[с]фураніл, 2,3-дигідропіроло[2,3b]піридиніл, діоксаніл, фураніл, гексагідропіримідиніл, гідантоїніл, імідазоліл, імідазо[1,2а]піридиніл, імі-дазо[2,3-b]тіазоліл, індоліл, ізохінолініл, ізоксазоліл, малеімідо, морфолініл, оксадіазоліл, 1,3-оксазинаніл, оксазоліл, фталазиніл, піперазиніл, піперидиніл, ригініл, піраніл, піразиніл, піразоліл, піридиніл, піримідиніл, піролідиноніл, піролідиніл, піролініл, піроло[2,3-b]піридиніл, піроло[5,1-b]піридиніл, піроло[2,3-с]піридиніл, піроліл, хіназолініл, хінолініл, сульфоланіл, 3-сульфоленіл, 4,5,6,7-тетрагідробензимідазоліл, 4,5,6,7тетрагідробензопіразоліл, 5,6,7,8тетрагідробензо[е]-піримідин, тетрагідрофураніл, тетрагідропіраніл, 3,4,5,6-тетрагідропіридиніл, 1,2,3,4-тетрагідропіримідиніл, 3,4,5,6тетрагідропіримідиніл, тіадіазоліл, тіазолідиніл, тіазоліл, тієніл, тієно[5,1-с]піридиніл, тіохроманіл, триазоліл, 1,3,4-триазоло[2,3-b]піримідиніл тощо. 25 85232 Значення Het1, що можна згадати, охоплюють 2,3-дигідробензо[b]фураніл, фураніл, імідазоліл, ізоксазоліл, піридиніл та тіазоліл. Замісники на Het (Het1, Het2, Het3, Het4, Het5, 6 Het , Het7, Het8, Het9, Het10 та Het11) можуть, де належно, бути локалізованими на будь-якому атомі у кільцевій системі, що містить гетероатом. Точка приєднання Het (Het1, Het2 , Het3, Het4, Het5, Het6, Het7, Het8, Het 9, Het10 та Het11) може бути через будь-який атом у кільцевій системі, що містить (де належно) гетероатом, або атом на будь-якому конденсованому карбоциклічному кільці, що може бути частиною кільцевої системи. Het (Het1, Het2, Het3, Het4, Het5, Het6, Het7, Het 8, Het9 , Het10 та Het11) можуть також бути у N- або S-окисненій формі. Фармацевтично прийнятні похідні охоплюють солі та сольвати. Солі, котрі можна згадати, охоплюють кислотно-адитивні солі. Фармацевтично прийнятні похідні також охоплюють для оксабіспідину або (коли G-N) піридильні нітрогени, C14алкіл-четвертинні солі амонію та N-оксиди, за умови, що наявний N-оксид: (a) жодний Het (Het1, Het2, Het3, Het4, Het 5, Het8 , 7 Het , Het8, Het9 , Het10 та Het11) не містить неокиснений S-атом; та/або (b) n не дорівнює 0 коли В - -Z2-S(O)n-. Сполуки винаходу можуть виявляють таутомерію. Усі таутомерні форми та їх суміші охоплені рамками винаходу. Сполуки винаходу можуть також містити один або більше асиметричних атомів карбону та можуть тому виявляти оптичну та/або діастереоізомерію. Діастереоізомери можна розділяти звичайними способами, наприклад, хроматографією або фракційною кристалізацією. Різні стереоізомери можна виділяти розділенням рацемічної або іншої суміші сполук звичайними способами, наприклад, фракційною кристалізацією або ВЕРХ. Альтернативно потрібні оптичні ізомери можна отримувати реакцією належних оптично активних вихідних матеріалів в умовах, котрі не викликають рацемізацію або епімеризацію, або дериватизацію, наприклад, гомохіральною кислотою, а потім розділенням діастереоізомерних етерів звичайними способами (наприклад, ВЕРХ, хроматографією через силікагель). Усі стереоізомери охоплені рамками винаходу. Скорочення наведені у кінці цього опису. Переважні значення кожної змінної групи такі. Ці значення можна застосовувати де належно з будь-яким зі значень, визначень, пунктів формули винаходу, аспектів або втілень, визначених вище або далі. Зокрема, кожне можна застосовувати як індивідуальне обмеження найширшого визначення формули (І). Конкретні значення кожної змінної групи такі. Ці значення можна застосовувати де належно з будь-яким зі значень, визначень, пунктів формули винаходу, аспектів або втілень, визначених вище або далі. Зокрема, кожне можна застосовувати як індивідуальне обмеження найширшого визначення формули (І). R1 - C1-4алкіл, цей алкіл заміщений принаймні одним фенілом або феноксилом (обидва, як варіант, заміщені одним або більше з групи: галоген, 26 ціано, метил, метоксил, флуорметоксил, дифлуорметоксил або трифлуорметоксил); А - безпосередній зв'язок або C1-3алкілен (якто C2алкілен); В - безпосередній зв'язок, C1-3алкілен (як-то C2алкілен), або C1-3алкоксил (як-то C2алкоксил, де оксиген приєднано до фенілу, що, як варіант, заміщений R4); R2 - -S(O)2R3a, -C(O)OR 3b , -C(O)R3c або C(O)N(R3d)R3e; R3a - R3b кожний незалежно, - гідроген або C13алкіл (як-то метил, етил, ізопропіл або пропіл); G - карбон; R41 - R46 - гідроген; а R4 - один або більше можливих замісників, вибраних з групи: ціано та/або галоген (як-то флуор), а замісник R4 є у позиції на фенільній групі, що розташований орто- та/або пара- відносно позиції зв'язку гр упи В. Переважні сполуки винаходу о хоплюють сполуки, де: R1 – С1-8 алкіл (цей алкіл, як варіант, заміщений одним або більше, вибраним з групи: галоген, арил (останній, як варіант, заміщений одним або більше замісниками, вибраними з групи: -OH, галоген, ціано, нітро, C1-5алкіл, C1-4алкоксил (останні дві гр упи, як варіант, заміщені одним або більше атомами галогену), -C(O)R22c та -S(O)2R21c), Het1, C(O)R5a, -OR5b, -N(Re)R5c, -C(O)N(R8a)R5d , OC(O)N(R8b)R5e, -S(O) 2R9a , -S(O) 2N(H)R9c та N(H)S(O)2R9d) або R1 - -C(O)OR7, -C(O)N(R 8a)R5d або -S(O)2R9a; R5a - R5e незалежнo, у кожному випадку наявності тут, - H, C1-6алкіл (останній, як варіант, заміщений одним або більше замісниками, вибраними з групи: ціано, нітро, як варіант, заміщений арил та, як варіант, заміщений арилоксил), арил (останній, як варіант, заміщений одним або більше замісниками, вибраними з групи: -OH, галоген, ціано, нітро, N(R22a)R22b (де останні групи R22a та R22b, разом, - С3-6алкілен), C1-5алкіл та С1-5алкоксил (останні дві групи, як варіант, заміщені одним або більше атомами галогену)), Het3, або R5d, разом з R8a, - С 4-5алкілен (цей алкілен, як варіант, перервано атомом O); R6 - H, C1-6алкіл, як варіант, заміщений арил C(O)R10a, -C(O)OR10b, -C(O)N(R10c)R10d або S(O)2R10e; R10a, R10b та R10e, незалежно, - C1-5алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген та, як варіант, заміщений арил) або, як варіант, заміщений арил; R10c та R 10d , незалежно, - H або C1-4алкіл; R7 - C1-6алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген, як варіант, заміщений арил, C1-4алкоксил та Het4); R8a та R 8b, незалежно, - H, C1-6алкіл (останній, як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген, ціано та нітро), О-(як варіант, заміщений арил), -О-(як варіант, заміщений арилоксил), -D-Het5, -D-N(H)C(O)R 11a, D-C(O)R11b, або R8a, разом з R5d - C4-5алкілен (цей алкілен, як варіант, перервано атомом O); 27 85232 R11a та R11d , незалежно, - C1-4алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген, ціано, нітро та, як варіант, заміщений арил) або, як варіант, заміщений арил; D, у кожному випадку наявності тут, - безпосередній зв'язок або C1-4алкілен; R9a - C1-6алкіл (як варіант, заміщений одним або більше галогенами групи) або, як варіант, заміщений арил; R9c та R9d, незалежно, у кожному випадку наявності тут, - C1-5алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген, як варіант, заміщений арил та Het6), як варіант, заміщений арил або Het7, або R9c - H; R2 - -S(O)2R3a, -C(O)OR 3b , -C(O)R3c або C(O)N(R3d)R3e; R3a - R 3e, незалежно, - C1-5алкіл (як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген, як варіант, заміщений арил та Het8), як варіант, заміщений арил або Het9, або R3d - H; Het1 та Het3 - Het9, незалежно, - 4-10-членні гетероциклічні групи, що містять 1-4 гетероатоми, вибрані з оксигену, нітрогену та/або сульфур у, ці групи, як варіант, заміщені одним або більше замісниками, вибраними з групи: -OH, оксо, галоген, ціано, C1-4алкіл, C1-4алкоксил, феніл, -N(H)R17a, C(O)R17c, -N(H)C(O)R17h та -N(H)S(O) 2R17j; R17a, R17c , R17h та R17j незалежно, - C1-4алкіл або, як варіант, заміщений арил або R17a, R17c та R17h, незалежно, - H; A - C2-4алкілен, як варіант, заміщений одним або більше замісниками, вибраними з групи: -OH та аміно; В - -Z1-, -Z2-N(H)-, -Z 2-C(O)N(R19b)-, -Z2-S(O)2-, 2 Z -N(H)S(O)2-, -Z 2-S(O)2N(H)- або -Z2-O- (де останні 6 груп Z 2 приєднано до атому нітрогену, що з'єднаний з R2); Z1 - безпосередній зв'язок або C1-4алкілен; Z2 - С 2-4алкілен; R19b - H, C1-4алкіл, або, разом з одиничним замісником R4 у позиції на фенільній або піридильній групі, що знаходиться у позиції орто- відносно позиції зв'язку групи В, R 19b - С2-4алкілен; коли G - N, G знаходиться в орто- або, зокрема, пара-позиції відносно точки приєднання В; коли G-N1R4 відсутній або є одиничною ціаногрупою; R4 відсутній (тобто представляє H) або є одним або більше замісниками, вибраними з групи: OH, ціано, галоген, нітро, C1-6алкіл, C1-6алкоксил, C(O)N(R22e)R22f , та -N(R22m)S(O) 2-C1-4алкіл, або замісник R4 у позиції на фенільній або піридильній групі, що знаходиться у позиції орто- відносно позиції зв'язку групи В може разом з R19b, представляти С 2-4алкілен; R21c - C1-4алкіл; R22c, R22e, R22f та R22m, незалежно, - H або C14алкіл; R41 - R46, незалежно, - H; можливими замісниками на арилі та арилоксилі є, якщо не вказане інше, один або більше замісників, вибраних з групи: галоген, ціано, нітро, C14алкіл, C 1-4алкоксил (останні дві групи, як варіант, 28 заміщені одним або більше атомами галогену), N(H)S(O)2R21b та -S(O) 2N(H)R22o. Більш переважні сполуки винаходу о хоплюють сполуки, де: R1 - алкіл з лінійним чи розгалуженим ланцюгом, або є частиною циклічного/ациклічного алкілу C1-6, цей алкіл, як варіант, перерваний оксигеном та/або заміщений: (і) одним або більше галогенами або OR5b; та/або (іі) одним вибраним з групи: феніл (останній, як варіант, заміщений одним або більше (наприклад, 1 - 3) замісниками, вибраними з групи: галоген, ціано, C1-4алкіл, C1-3алкоксил (останні дві групи, як варіант, заміщені одним або більше атомами галогену (наприклад, флуор у)), C(O)-C1-3алкіл та -S(O)2-C1-4алкіл), Het1, -C(O)R5a, N(R6JR5c -C(O)N(R8a)R5d, -OC(O)N(H)R 8b та -S(O)2C1-4алкіл, або R1 - -C(O)OR7, -C(O)N(R8a)R 5d чи S(O)2-C1-5алкіл; Het1 - 4- (наприклад, 5-)-10-членна гетероциклічна група, що містить 1-3 гетероатоми, вибрані з оксигену, нітрогену та/або суль фуру, цю гр упу, як варіант, заміщено одним або більше (наприклад, 1-3) замісниками, вибраними з групи: галоген, C13алкіл, C 1-3алкоксил та -C(O)-C 1-4алкіл; R5a, R5b та R5d незалежно, - H, C1-5алкіл, феніл (останній, як варіант, заміщений одним або більше замісниками, вибраними з групи: -OH, галоген, ціано, піролідин-1-іл, C1-4алкіл та C1-5алкоксил (останній, як варіант, заміщений одним або більше атомами галогену (наприклад, флуору))), або Het3; R5c - H або C1-5алкіл (як варіант, заміщений фенілом або феноксилом, останні дві групи, як варіант, заміщені 1-3 замісниками, вибраними з групи: галоген, ціано та C1-2алкіл); Het3 - 5-10-членна гетероциклічна група, що містить один або два гетероатоми, вибрані з групи: оксиген та нітроген, ця група, як варіант, заміщена одним або більше замісниками, вибраними з групи: оксо, C1-2алкіл та -C(O)-C1-4алкіл; R6 - H1 C1-4алкіл, феніл (останній, як варіант, заміщений одною або більше ціаногру-пами), C(O)O-C1-5алкіл, -C(O)N(R10c)R10d або -S(O) 2R10e; R10c та R 10d , незалежно, - H або C1-3алкіл; R10e - C1-5алкіл (як варіант, заміщений одним або більше атомами флуор у) або феніл (як варіант, заміщений одним або більше замісниками, вибраними з групи: галоген, C1-3алкіл та C13алкоксил); R7 - C1-5алкіл, як варіант, заміщений Het4; Het4 - 5-10-членна гетероциклічна група, що містить один або два гетероатоми, вибрані з групи: оксиген та нітроген, ця група, як варіант, заміщена одним або більше замісниками, вибраними з групи: C1-2алкіл та -C(O)-C1-4алкіл; R8a та R8b , незалежно, - H, C1-5алкіл або -D(феніл), фенільна частина останнього, як варіант, заміщена одним або більше (наприклад, 1-3) замісниками, вибраними з групи: галоген, C1-3алкіл та C1-3алкоксил; D - C 1-3алкілен (наприклад, CH2 або С(СН 3)2); R2 - -S(O) 2R3a або -C(O)N(R3d)R3e; R3a - C 1-4алкіл (як варіант, заміщений фенілом або одним або більше атомами галогену (наприклад, флуору)), феніл (останній, як варіант, заміщений одним або більше (наприклад, 1-3) замісни 29 85232 ками, вибраними з групи: галоген, C1-3алкіл та C19 3алкоксил) або Het ; 9 Het - 5-10-членна гетероциклічна група, що містить 1-3 гетероатоми, вибрані з ок-сигену, нітрогену та/або сульфур у, цю гр упу, як варіант, заміщено 1-3 замісниками, вибраними з групи: галоген, C1-2алкіл та C1-2алкоксил; R3d та R3e, незалежно, - H або C1-3алкіл (ця остання група є фенілом або одним або більше атомами галогену (наприклад, флуор у)), феніл (останній, як варіант, заміщений одним або більше (наприклад, 1-3) замісниками, вибраними з групи: галоген, C1-3алкіл та C1-3алкоксил); A-C2 н-алкілен або C3н-алкілен, ця остання група, як варіант, заміщена у 2-позиції відносно точки приєднання до N-атому оксабіспідину, -OH; В - -Z1-, -Z 2-N(H)-, -Z 2-C(O)N(R19b)-, -Z 2-S(O) 2або -Z2-O- (де останні 4 групи, Z2 приєднано до атому нітрогену, що з'єднаний з R2); Z1 - C 1-4лкілен; Z2 - С 2-3 алкілен; R19b, разом з одиничним замісником R4 у позиції на фенільній або піридильній групі, що знаходиться у позиції орто- відносно позиції зв'язку групи В, представляє С 2-3алкілен; G - CH; R4 відсутній (тобто представляє H) або представляє одну або дві ціаногрупи в орто-позиції та/або, зокрема, пара-позиції відносно точки приєднання групи В, або альтернативно, коли B - -Z2C(O)N(R19b)-, (і) R4-замісник у позиції на фенільній або піридильній групі, що знаходиться у позиції орто- відносно позиції зв'язку групи В може разом з R 19b представляти С 2-3 алкілен, та (іі) R4 може крім того представляти нітрогрупу у пара-позиції відносно точки приєднання групи В. Конкретні сполуки винаходу охоплюють, наприклад, сполуки формули І, або їх фармацевтично-прийнятні солі, де, якщо не вказане інше, кожна з кожної змінної групи має будь-яке зі значень, визначених вище або у параграфах (а) - (d) далі: (a) R1 - C1-C5 алкіл, (як-то метил, етил, пропіл, бутил, пропіл або пентил), що, як варіант, заміщено групою, вибраною з групи: феніл, 2-ціанофеніл, 4-ціанофеніл, 2,4-диціанофеніл, 2,6диметилфеніл, 3-метоксифеніл, 4-метоксифеніл, 4-ацетилфеніл, 2-флуорфеніл, 3-флуорфеніл, 4флуорфеніл, 4-хлорфеніл, 2,4-дифлуорфеніл, 3піридин, 4-піридин, 2-хлор-З-піридин, 6-метокси-Зпіридин, 2,6-дихлор-4-піридин, 4,5-диметил-2фуран, 3-трифлуорметилфеніл, 4трифлуорметилфеніл, 4-хлорфеніл, 4(дифлуорметоксил)феніл, 4(метилсульфоніл)феніл, 2,5-дихлорфеніл, 3,5диметил-4-ізоксазол, 2,4-диметил-5-(1,3-тіазол), (1-метил-2-(1Н-імідазол), 2,6-диметилфеніл, 4трет-бутилфеніл, або 2-флуор-4(трифлуорметил)феніл; та/або, як варіант, перерваний або закінчений атомом оксигену; (b) R41 - R46 - гідрогени; (c) R2 - метилсульфоніл, амінокарбоніл, Ν,Νдиметиламінокарбоніл, фенілсу-льфоніл, етилсульфоніл, N-метиламінокарбоніл, трифлуорметилсульфоніл, ацетил, або ізопропілсульфоніл; 30 (d) група - феніл, 2-ціанофеніл, 3ціанофеніл, 4-ціанофеніл, 2-флуорфеніл, 3флуорфеніл, 4-флуорфеніл, 4(дифлуорметоксил)феніл, 2-хлорфеніл, 3хлорфеніл, або 4-хлорфеніл. Зокрема переважні сполуки винаходу охоплюють сполуки, де: R1 - C1-6алкіл з лінійним чи розгалуженим ланцюгом, або є частиною циклічного/ациклічного C16алкілу, цей алкіл, як варіант, перерваний оксигеном та/або заміщений групою: (і) одним або більше галогенами або OR5b; та/або (іі) одним вибраним з групи: феніл (останній, як варіант, заміщений одним або більше (наприклад, 1 - 3) замісниками, вибраними з групи: галоген, ціано, C1-4алкіл (наприклад, метил або C4алкіл як-то трет-бутил), C1-2алкоксил (ці C1-4алкіл та C12алкоксил, як варіант, заміщені одним або більше атомами галогену (наприклад, флуору)), -C(O)-C1та -S(O)2-C1-2алкіл), Het1, -C(O)R5a, 2алкіл 6 5c N(R )R , -C(O)N(H)R8a та -S(O)2-C1-4алкіл; Het1 - 5- чи 6-членна гетероциклічна група, що містить 1 чи 2 гетероатоми, вибрані з оксигену, нітрогену та/або сульфур у, цю гр упу, як варіант, заміщено одним або більше (наприклад, 1 або 2) замісниками, вибраними з групи: галоген (наприклад, хлор), C1-2алкіл та C1-2алкоксил; R5a та R5b, незалежно, - феніл, як варіант, заміщений 1-3 замісниками, вибраними з групи: галоген, C1-2алкіл та C1-2алкоксил; R5c – C1-3алкіл, заміщений фенілом або феноксилом (останні дві групи, як варіант, заміщені одною або двома ціаногрупами); R6 - H, C 1-4алкіл, -C(O)O-C1-5алкіл C(O)N(R10c)R10d або -S(O)2R10e; R10c та R10d , незалежно, - H або C1-2алкіл (наприклад, метил); R10e – С1-3 алкіл (як варіант, заміщений одним або більше атомами флуору); R8a - C1-4алкіл (наприклад, трет-бутил) або -О(феніл); R2 - -S(O) 2R3a або -C(O)N(R3d)R3e; R3a - C 1-2алкіл (як варіант, заміщений фенілом або одним або більше атомами галогену (наприклад, флуор у)); R3d та R3е незалежно, - H або C1-2алкіл (наприклад, метил); A-C2 або C3н-алкілен; В - -Z1- або -Z2-O- (де остання група Z2 приєднана до атому нітрогену, що з'єднаний з R2); Z1 - C 1-3алкілен; Z2 - С 2-3н-алкілен (наприклад, C2н-алкілен); R4 відсутній (тобто представляє H) або є ціаногрупою у пара-позиції відносно точки приєднання групи В. Особливо переважні сполуки винаходу охоплюють сполуки, де: R1 – С1-3алкіл з лінійним чи розгалуженим ланцюгом, заміщений OR5b, феніл (останній, як варіант, заміщений одним або двома замісниками, вибраними з групи: галоген (наприклад, флуор або хлор), ціано, трет-бутил, метил, метоксил (останні 31 85232 дві групи, як варіант, заміщені 1-3 атомами флуору), -C(O)CH3 та -S(O)2CH3), Het1 , -C(O)R5a, N(R6)R5c, -N(H) С3-4алкіл або -C(O)N(H)R8a; Het1 - ароматична 5- чи 6-членна гетероциклічна група, що містить 1 чи 2 гетероатоми, вибрані з оксигену, нітрогену та/або сульфур у, цю груп у, як варіант, заміщено одним або двома замісниками, вибраними з групи: хлор, метил та метоксил; R5a та R5b, незалежно, - феніл, як варіант, заміщений одним або двома метилами чи метоксилами; R5c - H або бензил; R6 - -C(O)O-C3-4алкіл, -C(O)N(R10c)R10d або S(O)2CH3; R10c та R10d, незалежно, - метил або, переважно, H; R8a - трет-бутил, СН2-феніл або С(СН 3)2-феніл; R2 - -C(O)N(CH3)2, -C(O)N(H)CH 3, -C(O)NH2, або, зокрема, -S(O)2CH3; A- -(CH2) 2-; В - -(CH2)1-3- (наприклад, -CH2- або -(СН2)3-) або -(CH2)2-O- (в останній групі частину -(СН2)2приєднано до атому нітрогену, що з'єднаний з R2). Переважні сполуки винаходу о хоплюють сполуки з прикладів, розкритих далі. У цьому відношенні переважні сполуки винаходу, що можна згадати, охоплюють: (і) трет-бутил [2-(7-{2-[[2-(4ціанофеноксил)етил](метилсульфоніл)аміно]етил}9-окса-3,7-діазабіцикло[3,3,1]нон-3іл)етил]карбамат; (ii) трет-бутил {2-[7-(2-{(амінокарбоніл)[2-(4ціанофеноксил)етил]аміно}етил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]етил}карбамат; (iiі) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(4метоксифеніл)-2-оксоетил]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (iv) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(4метоксифеніл)-2-оксоетил]-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл}етил)сечовина; (ν) N-[2-(7-бензил-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл)етил]-N-[2-(4ціанофеноксил)етил]метансульфонамід; (vi) N-[2-(7-бензил-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл)етил]-N-[2-(4ціанофеноксил)етил]сечовина; (vii) 2-[7-(2-{(амінокарбоніл)[2-(4ціанофеноксил)етил]аміно}етил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]-N-(третбутил)ацетамід; (viii) 2-[7-(2-{(амінокарбоніл)[2-(4ціанофеноксил)етил]аміно}етил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]-N-бензилацетамід; (іх) 2-[7-(2-{(амінокарбоніл)[2-(4ціанофеноксил)етил]аміно}етил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]-N-(1-метил-1фенілетил)ацетамід; (х) N-(трет-бутил)-2-(7-{2-[[2-(4ціанофеноксил)етил](метилсульфоніл)аміно]етил}-9-окса-3,7-діазабіцикло[3,3,1]нон-3іл)ацетамід; (хі) N-бeнзил-2-(7-{2-[[2-(4цiaнoфeнoкcил)eтил](мeтилcyльфoнiл)aмiнo]eтил}9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл)ацетамід; 32 (хіі) 2-(7-{2-[[2-(4ціанофеноксил)етил](метилсульфоніл)аміно]етил}9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл)-Ν-(1-метил1-фенілетил)ацетамід; (хііі) трет-бутил [2-(7-{2-[[3-(4ціанофеніл)пропіл](метилсульфоніл)аміно]етил}-9окса-3,7-діазабіцикло[3,3,1]нон-3-іл)етил]карбамат; (xi v) N-(тpeт-бyтил)-2-(7-{2-[[3-(4цiaнoфeнiл)пpoпiл](мeтилcyльфoнiл)aмiнo]eтил}-9окса-3,7-діазабіцикло[3,3,1]нон-3-іл)ацетамід; (xv) N-[2-(7-бензил-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл)етил]-N-[3-(4ціанофеніл)пропіл]метансульфонамід; (xvi) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2(2,6-диметилфеноксил)етил]-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл}етил)сечовина; (xvii) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(4ціанофеніл)етил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)сечовина; (xviii) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2(4-метоксифеніл)етил]-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл}етил)сечовина; (хі х) N-(2-{7-[2-(4-ацетилфеніл)етил]-9-окса3,7-діазабіцикло[3,3,1]нон-3-іл}етил)-N-[2-(4ціанофеноксил)етил]сечовина; (хх) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(2фенілетил)-9-окса-3,7-діазабіциісло-[3,3,1]нон-3іл]етил}сечовина; (ххі) N-[2-(4-цiaнoфeнoкcил)eтил]-N-(2-{7-[2-(3флyopфeнiл)eтил]-9-oкca-3,7-дiaзaбіцикло[3,3,1]нон-3-іл}етил)сечовина; (ххіі) N-(2-{7-[(2-хлорпіридин-3-іл)метил]-9окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)-N-[2-(4ціанофеноксил)етил]метансульфонамід; (ххііі) N-[2-(4-цiaнoфeнoкcил)eтил]-N-(2-{7-[(6мeтoкcипipидин-3-iл)мeтил]-9-oкca-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (xxi v) N-[2-(4-ціанофеноксил)етил]-N-(2-{7[(4,5-диметил-2-фурил)метил]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (xxv) N-[2-(4-цiанофеноксил)етил]-N-{2-[7-(4флуорбензил)-9-окса-3,7-дiаза-біцикло[3,3,1]нон-3іл]етил}метансульфонамід; (xxvi) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[4(трифлуорметил)бензил]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (xxvii) N-{2-[7-(4-хлорбензил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]етил}-N-[2-(4ціанофеноксил)етил]метансульфонамід; (xxviii) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[4(дифлуорметоксил)бензил]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (ххі х) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[4(метилсульфон1л)бензил]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (ххх) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(2флуорбензил)-9-окса-3,7-діаза-біцикло[3,3,1]нон-3іл]етил}метансульфонамід; 33 85232 (хххі) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(2,4дифлуорбензил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}метансульфонамід; (хххіі) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(2,5дихлорбензил)-9-окса-3,7-дiаза-біцикло[3,3,1]нон3-іл]етил}метансульфонамід; (хххііі) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[3(трифлуорметил)бензил]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (xxxi v) N-{2-[7-(4-ціанобензил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]етил}-N-[2-(4ціанофеноксил)етил]метансульфонамід; (xxxv) N-{2-[7-(2-ціанобензил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]етил}-N-[2-(4ціанофеноксил)етил]метансульфонамід; (xxxvi) N-[2-(4-ціанофеноксил)етил]-N-(2-{7[(2,6-дихлорпіридин-4-іл)метил]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (xxxvii) N-[2-(4-ціанофеноксил)етил]-N-{2-[7(піридин-4-ілметил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}метансульфонамід; (xxxviii) N-[2-(4-ціанофеноксил)етил]-N-{2-[7(піридин-3-ілметил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}метансульфонамід; (хххі х) N-[2-(4-цiанофеноксил)етил]-N-(2-{7[(3,5-диметилізоксазол-4-іл)метил]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (хl) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[(2,4диметил-1,3-тіазол-5-іл)метил]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (хlі) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[(1метил-1Н-імідазол-2-іл)метил]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (хlіі) N-бензил-N-{2-[7-(4-ціанобензил)-9-окca3,7-діазабіцикло[3,3,1]нон-3іл]етил}метансульфонамід; (xliii) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(3фенілпропіл)-9-окса-3,7-діазабіцикло-[3,3,1]нон-3іл]етил}метансульфонамід; (xliv) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[3-(4ціанофеніл)пропіл]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (xl v) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[3-(3метоксифеніл)пропіл]-9-окса-3,7діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (xl vi) N-[2-(4-Ціанофеноксил)етил]-N-{2-[7-(2,6диметилбензил)-9-окса-3,7-дiазабіцикло[3,3,1]нон3-іл]етил}метансульфонамід; (xl vii) N-{2-[7-(4-трет-бутилбензил)-9-окса-3,7діазабiцикло[3,3,1]нон-3-іл]етил}-N-[2-(4ціанофеноксил)етил]метансульфонамід; (xl viii) N-[2-(7-бензил-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл)етил]-N-[2-(4ціанофеноксил)етил]-N',N'-диметилсечовина; (xlix) N-{2-[7-(4-ціанобензил)-9-окса-3,7діазабіцикпо[3,3,1]нон-3-іл]етил}-Ν-[2-(4ціанофеноксил)етил]-N',N'-диметилсечовина; 34 (І) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2флуор-4-(трифлуорметил)бензил]-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл}етил)-N',N'диметилсечовина; (Ii) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(4флуорбензил)-9-окса-3,7-діаза-біцикло[3,3,1]нон-31л]етил}-N',N'-диметилсечовина; (liі) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[4(дифлуорметоксил)бензил]-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл}етил)-N',N'диметилсечовина; (Iiii) N-[2-(4-ціанофеноксил)етил]-N',N'диметил-N-{2-[7-(2-фенілетил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]етил}сечовина; (liv) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(4ціанофеніл)етил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-т}етил)-N',N'-диметилсечовина; (Iv) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(3флуорфеніл)етил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)-N',N'диметилсечовина; (lvi) N-[2-(4-цiaнoфeнoкcил)eтил]-N',N'димeтил-N-{2-[7-(3-фeнiлпpoпiл)-9-oкca-3,7діазабіцикло[3,3,1]нон-3-іл]етил}сечовина; (Ivii) N-[2-(4-ціанофеноксил)етил]-N-{2-[7-(2фенілетил)-9-окса-3,7-діазабіцикло-[3,3,1]нон-3іл]етил}метансульфонамід; (lviii) N-[2-(4-ціанофеноксил)етил]-N-(2-{7-[2-(4ціанофеніл)етил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)метансульфонамід; (lix) N-[2-(4-ц|анофеноксил)етил]-N-(2-{7-[2-(4флуорфенiл)етил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)метансульфонамід; (Ix) N-бензил-N-(2-{7-[2-(4ціанофеноксил)етил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)метансульфонамід; (Іхі) N-(2-{7-[2-(4-ціанофеноксил)етил]-9-окса3,7-діазабіцикло[3,3,1]нон-3-іл}етил)-N-(2фентетил)метансульфонамід; (Ixii) N-(2-{7-[3-(4-ціанофеноксил)пропіл]-9окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)-N-(2фенілетил)метансульфонамід; (Іхііі) N-(2-{7-[2-(4-ціанофеноксил)етил]-9-окса3,7-діазабіцикло[3,3,1]нон-3-іл}етил)-N-(2феноксіетил)метансульфонамід; (Ixi v) N-{2-[7-(4-ціанобензил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]етил}-N-(2феноксіетил)метансульфонамід; (Ιxv) N-{2-[7-(4-ціанобензил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]етил}-N-(2фенілетил)метансульфонамід; (Ixvi) N-(2-{7-[3-(4-ціанофеноксил)пропіл]-9окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)-N-(2феноксіетил)метансульфонамід; (Ixvii) N-бензил-N-{2-[7-(4-флуорбензил)-9окса-3,7-діазабіцикло[3,3,1]нон-3іл]етил}метансульфонамід; (Ixviii) N-бeнзил-N-{2-[7-(4-xлopбeнзил)-9-oкca3,7-дiaзaбiциклo[3,3,1]нон-3іл]етил}метансульфонамід; (Іхі х) N-бензил-N-{2-[7-(4-ціанобензил)-9-окса3,7-діазабіцикло[3,3,1]нон-3іл]етил}бензолсульфонамід; 35 85232 (Іхх) N-(4-ціанобензил)-N-{2-[7-(4-ціанобензил)9-окса-3,7-діазабіциісло[3,3,1]нон-3іл]етил}метансульфонамід; (Іххі) N-(2-ціанобензил)-N-{2-[7-(4ціанобензил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3іл]етил}метансульфонамід; (Іххіі) N-{2-[7-(4-ціанобензил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]етил}-N-(4флуорбензил)метансульфонамід; (Іххііі) N-{2-[7-(4-ціанобензил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]етил}-N-(3флуорбензил)метансульфонамід; (Ixxi v) N-{2-[7-(4-ціанобензил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]етил}-N-[4(дифлуорметоксил)бензил]метансульфонамід; (Ixxv) N-(4-хлорбензил)-N-{2-[7-(4ціанобензил)-9-окса-3,7-діазабіцикло[3,3,1]нон-3іл]етил}метансульфонамід; (Ixxvi) N-бензил-N-{2-[7-(4-ціанобензил)-9-окса3,7-діазабіцикло[3,3,1]нон-3іл]етил}етансульфонамід; (Ixxvii) N-бензил-N-{2-[7-(4-ціанобензил)-9окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}-N'-метил сечовина; (Ixxviii) N-бензил-N-{2-[7-(4-ціанобензил)-9окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}-N',N'диметилсечовина; (Іххі х) N-бензил-N-(2-{7-[2-(4-ціанофеніл)етил]9-окса-3,7-діазабіцикло[3,3,1]нон-3іл}етил)метансульфонамід; (Іххх) N-бензил-N-(2-{7-[2-(2,4диціанофеноксил)етил]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)метансульфонамід; (Іхххі) N-бензил-N-(2-{7-[3-(4ціанофеноксил)пропіл]-9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл}етил)метансульфонамід; (Іхххіі) N-бензил-N-{2-[7-(4-ціанобензил)-9окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}-1,1,1трифлуорметансульфонамід; (Іхххііі) N-бензил-N-{2-[7-(4-ціанобензил)-9окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}ацетамід; (Ixxxi v) N-бензил-N-{2-[7-(4-ціанобензил)-9окса-3,7-діазабіциісло[3,3,1]нон-3іл]етил}сечовина; (Ixxxv) N-бензил-N-{2-[7-(4-ціанобензил)-9окса-3,7-діазабіцикло[3,3,1]нон-3-іл]етил}пропан-2сульфонамід; та (Ixxxvi) N-{2-[7-(4-ціанобензил)-9-окса-3,7діазабіцикпо[3,3,1]нон-3-іл]етил}-N-(4флуорбензил)сечовина; або їх фармацевтично прийнятні похідні. Отримання Згідно з винаходом також запропоновано спосіб отримання сполук формули І, котрий полягає у: (a) реакції сполуки формули II, 36 II де R2, R4, R41 - R46 , А, В та G визначені вище, зі сполукою формули III, R1-L1 III де L1 - відщеплювана група, як-то галоген, алкансульфонат, перфлуоралкансульфо-нат, аренсульфонат, -OC(O)XR7 , імідазол або R23O- (де R23, наприклад, - С1-10алкіл або арил, ці групи, як варіант, заміщені одним або більше галогенами або нітрогрупами), a X, R1 та R7 визначені вище, наприклад, при температурі між кімнатною та температурою кипіння під зворотним холодильником у присутності придатної основи (як-то триетиламін, калій карбонат або гідрокарбонат, як-то натрій гідрокарбонат) та належного розчиннику (як-то дихло-рметан, хлороформ, ацетонітрил, Ν,Νдиметилформамід, ТГФ, толуол, вода, нижчий алкіл-спирт (як-то етанол) або їх суміші); (b) для сполуки формули І, де R1 - -C(O)XR7 або -C(O)N(R8a)R5d, реакції сполуки формули IV, IV де R2, R4, R41 - R46 , А, В, G та L1 визначені вище, зі сполукою формули V, R24-H V де R24 - -XR7 або -N(R8a)R5d, a R5d , R7, R8a та X визначені вище, наприклад, в умовах, подібним описаним вище (спосіб етапу (а)); (c) для сполуки, де R1 - -C(O)N(H)R8a, реакції сполуки формули II, яку визначено вище, зі сполукою формули Vl, R8a-N=C=O VI де R8a визначено вище, наприклад, при температурі між 0°C та температурою кипіння під зворотним холодильником у присутності належного органічного розчиннику (як-то дихло-рметан), або твердо-фазним синтезом в умовах, відомих фахівцям; (d) реакції сполуки формули VII, 37 85232 38 XI VII де R1 та R41 - R46 визначені вище, зі сполукою формули VIII, VIII де L2 - відщеплювана група, як-то галоген, алкансульфонат (як-то мезилат), перфлуоралкансульфонат або аренсульфонат (як-то бензолсульфонат, 2- або 4-нітробензолсульфонат або, зокрема, толуолсульфонат), a R2, R4, А, В та G визначені вище, наприклад, при підвищеній температурі (як-то між 35°С та температурою кипіння під зворотним холодильником) у присутності придатної основи (як-то триетиламін або калій карбонат) та належного органічного розчиннику (як-то ацетонітрил, дихлорметан, хлороформ, диметилсульфоксид, Ν,Ν-диметилформамід, нижчого алкіл-спирту (як-то етанол), ізопропілацетат або їх суміші); (e) для сполуки формули І, де А - С3-6алкілен, заміщений у 2-позиції (відносно N-атому оксабіспідину), -OH або аміно, реакції сполуки формули VII, яку визначено вище, зі сполукою формули IX, IX де R4 та G визначені вище, наприклад, в умовах реакції Міцунобу, наприклад, при температурі між зовнішньою (як-то 25°С) та температурою кипіння під зворотним холодильником у присутності похідного третинного фосфіну (як-то трибутилфосфін або трифенілфосфін), азодикарбоксилату (якто діетилазодикарбоксилат або 1,1'(азодикарбоніл)дипіперідин) та належного органічного розчиннику (як-то дихлорметан або толуол); (g) для сполуки формули I1 де G - N та В - -Z2O-, реакції сполуки формули X, яку визначено вище, зі сполукою формули XII, XII де R4 та L2 визначені вище, наприклад, при температурі між 10°C та температурою кипіння під зворотним холодильником у присутності придатної основи (як-то натрій гідрид) та належного розчиннику (як-то Ν,Ν-диметилформамід); (h) для сполуки формули І, де В визначено вище, за винятком того, що він не є безпосереднім зв'язком, реакції сполуки формули XIII, XIII де R1, R2, R41 - R48 та А визначені вище, зі сполукою формули XIV, XIV або її захищеним похідним, де Y - O або NH та R2, R4, В та G визначені вище, наприклад, при підвищеній температурі (наприклад, при температурі між 60°C та температурою кипіння під зворотним холодильником) у присутності придатного розчиннику (як-то нижчого алкіл-спирту (як-то IPA), ацетонітрил, або суміш нижчого алкіл-спирту та води); (f) для сполуки формули І, де В - -Z2-O-, реакції сполуки формули X, X де R1, R2, R41 - R46, А та Z2 визначені вище, зі сполукою формули Xl, де Ва - B1 що визначено вище, за винятком того, що він не є безпосереднім зв'язком, а R4, G, та L2 визначені вище, наприклад, при підвищеній температурі (як-то між 35°C та температурою кипіння під зворотним холодильником) у присутності придатної основи (як-то три-етиламін або калій карбонат) та належного органічного розчиннику (як-то ацетонітрил, дих-лорметан, хлороформ, диметилсульфоксид, Ν,Ν-диметилформамід, нижчий алкілспирт (як-то етанол), ізопропілацетат або їх суміші); (і) реакції сполуки формули XV, 39 85232 XV де R1, R4, R41 - R46 , А, В та G визначені вище, зі сполукою формули XVI, R2-L3 XVI де L3 - придатна відщеплювана група (як-то галоген, -OS(O)2R3a, -OC(O)OR 3b, -OC(O)R3c або NH2), та R2 визначено вище, наприклад, в умовах, відомих фахівцям (як-то: (1) коли R2 - -S(O)2R3a, C(O)N(R3d)(R3e) або S(O) 2N(R3f)(R3g ), a L3 - галоген або -OS(O)2R3a , реакції при температурі між підзовнішньою (як-то 0-10°C) та зовнішньою температурою (як-то 20-30°C) у присутності придатної основи (як-то триетиламін) та належного розчиннику (як-то ДХМ); та (2) коли R2 - -C(O)N(R3d)(R3e) та L3 -N(R3d)(R3e), реакції при підвищеній температурі (як-то 110-150°C, як-то 130°C)); (j) для сполуки формули I, де R2 - C(O)N(H)R3d, реакції сполуки формули XV, яку визначено вище, зі сполукою формули XVII O=C=N-R XVII де R - моновалентний катіон металу (як-то катіон лужного металу, як-то іон калію) або R - R3d, що визначено вище, за винятком того, що він не є H, наприклад, в умовах, відомих фахівцям (як-то коли R - іон калію, реакції при зовнішній температурі (як-то 15-30°C) у присутності придатної кислоти (як-то оцтової кислоти) та належного розчиннику (як-то 1,4-діоксан, вода або їх суміш); (k) для сполуки формули І, де R1 - C1-12алкіл, заміщений одним або більше замісниками, що визначено вище у відношенні R1, ці замісники представляють чи охоплюють -N(R9b)S(O)2R9d, реакції сполуки формули XVIII, XVIII де R1a – С1-12алкілен, ця група, як варіант, заміщена одним або більше замісниками, що визначено вище у відношенні R1, та R2, R4, R9b, R41 - R46, А, В та G визначені вище, зі сполукою формули XIX, L2-S(O)2R9d XIX де R9d та L2 визначені вище, наприклад, в умовах, що відомі фахівцям (як-то при зовнішній температурі (як-то від 15 до 30°C) у присутності придатної основи (як-то триетиламін, калій карбонат 40 або натрій гідрокарбонат) та належного розчиннику (як-то ДХМ, CHCI3, ацетонітрил, ДМФ, ТГФ, толуол, або їх суміші); (І) для сполуки формули І, де R1 - C1-12 алкіл, заміщений одним або більше замісниками, що визначено вище у відношенні R1, ці замісники представляють чи охоплюють -S(O)2N(R9b)R9c або N(R9b)S(O)2R9d, реакції сполуки формули II, яку визначено вище, зі сполукою формул XIXA або XIXB, L1-R1a-SO2-N(R9b)R9c XIXA L1-R1a-N(R9b)-SO 2-R9d XIXB де L1, R1a, R9b, R9c тa R9d визначені вище, наприклад, в умовах, що відомі фахівцям, (як-то при температурі між зовнішньою та температурою кипіння під зворотним холодильником у присутності придатної основи (як-то триетиламін, калій карбонат або натрій гідрокарбонат) та належного розчиннику (як-то ДХМ, CHCI3, ацетонітрил, ДМФ, ТГФ, толуол, або їх суміші); (m) для сполуки формули І, де R1 - -C(O)XR7, C(O)N(R8a)R5d або -S(O)2R9a , реакції сполуки формули XX, XX де R1a - -C(O)XR7, -C(O)N(R8a)R5d або -S(O)2R9a та R5d, R7, R8a, R9a, R 41 - R 46 та L2 визначені вище, зі сполукою формули XXI, XXI де R2, R4, А, В та G визначені вище, наприклад, при температурі між кімнатною та температурою кипіння під зворотним холодильником у присутності придатної основи (як-то натрій гідрокарбонат або калій карбонат) та належного органічного розчиннику (як-то ацетонітрил); (n) для сполук формули І, котрі є N-оксидними похідними оксабіспідину, окиснення відповідного нітрогену оксабіспідину відповідної сполуки формули І, у присутності придатного окиснику (як-то мХПБК), наприклад, при 0°С у присутності придатного органічного розчиннику (як-то дихлорметан); (о) для сполук формули І, котрими є похідні C 14алкіл-четвертинної солі амонію, де алкіл приєднано до нітрогену оксабіспідину, реакції на нітрогені оксабіспідину, відповідної сполуки формули І зі сполукою формули XXII, R25-L4 XXII де R25 – С1-4алкіл, a L4 - відщеплювана група, як-то галоген, алкансульфонат або аренсульфонат, наприклад, при кімнатній температурі у присутності належного органічного розчиннику (як-то Ν,Ν-диметилформамід), з наступною очисткою (наприклад, ВЕРХ) у присутності придатного постачальнику проти-іону (як-то NH4OAc); 41 85232 (о) перетворення одного заміснику R4 у ще один способами, добре відомими фахівцям; (р) уведення одного або більше (наступних) замісників R4 в ароматичне кільце способами, добре відомими фахівцям (як-то хлорування); (q) для сполуки формули І, де R1 - С1-12алкілен, ця група, як варіант, заміщена одним або більше замісниками, що визначено вище у відношенні R1, реакції сполуки формули Il II де R2, R4, R41 - R46, A1 В та G визначені вище, з належним альдегідом, наприклад, в умовах, що є відомими фахівцям (наприклад, при кімнатній температурі, як-то від 15 до 30°C) у присутності відновнику (як-то натрій ціаноборогідрид, натрій триацетоксиборогідрид, або подібні сполуки) та належного розчиннику (як-то 1,2-дихлоретан, дихлоретан, метанол, етанол або їх суміші); (r) реакції сполуки формули VII VII де R1 та R41 - R46 визначені вище, зі сполукою формули XXIII XXIII де R2, R4, В та G визначені вище, наприклад, в умовах, що є відомими фахівцям (наприклад, при кімнатній температурі, як-то від 15 до 30°C) у присутності відновнику (як-то натрій ціаноборогідрид, натрій триацетоксиборогідрид, або подібна гідридна сполука) та належного розчиннику (як-то 1,2дихлоретан, дихлоретан, метанол, етанол або їх суміші); або (s) зняття захисту із захищеного похідного сполуки формули І, що визначено вище. Сполуки формул II, IV, VII 1 VIII, IX, X, XIII, XV, XVIII, XX та XXI можна отримувати способами, описаними у [WO 01/28992, WO 02/28863, WO 02/28864, WO 02/83690 та WO 02/83691], чи аналогічно, розкриття цих документів уведені як посилання. Сполуки формул III, V, Vl, Xl, XII, XIV, XVI, XVII, XIX, XIXA, XIXB, XXII та їх похідні, комерційно доступні, відомі з літератури, або їх можна отримува 42 ти аналогічно способам, описаними тут, або звичайними способами синтезу, стандартними способами, з легко доступних ви хідних матеріалів, застосовуючи належні реагенти та умови реакцій. Замісники на арилі (наприклад, фенілі) та (при належності) гетероциклічних групах у сполуках, визначених тут, можна перетворити в інші заявлені замісники способами, добре відомими фахівцям, наприклад, гідроксил можна перетворити в алкоксил, феніл можна галогенувати для отримання галогенфенілу, нітро можна відновлювати для отримання аміно, галоген можна замінювати ціано, тощо. Фахівцю також зрозуміло, що різні взаємоперетворення та перетворення стандартних замісників або функціональних груп у деяких сполуках формули І даватимуть інші сполуки формул І., наприклад, карбоніл можна відновлювати до гідроксилу або алкілену, а гідроксил можна перетворити в галоген. Сполуки винаходу можна виділяти з їх реакційних сумішей звичайними способами. Фахівцям зрозуміло, що в описаних вище способах, функціональні групи інтермедіатів можуть бути захи щеними або можуть потребувати захисту захисними групами. Функціональні групи, котрі бажано захищати, охоплюють гідроксил, аміно та карбоксильні. Придатні захисні групи для гідроксилу охоплюють триалкілсиліл та діарилалкілсиліли (наприклад, третбутилдиметилсиліл, трет-бутилди фенілсиліл або триметилсиліл), тетрагід-ропіраніл та алкілкарбоніл (наприклад, метил- та етилкарбоніл). Придатні захисні групи для аміно охоплюють бензил, сульфонамідо (наприклад, бензолсульфонамідо), третбутилоксикарбоніл, 9-флуореніл-метоксикарбоніл або бензилоксикарбоніл. Придатні захисні групи для амідино та гуанідино охоплюють бензилоксикарбоніл. Придатні захисні групи для карбоксильної групи охоплюють d-e алкілові або бензилові естери. Захист та зняття захисту функціональних груп можна проводити до або після будь-якого з описаних ви ще реакційних етапів. Захисні гр упи можна видаляти способами, котрі добре відомі фахівцям та описані далі. Застосування захисних груп повністю описано у ["Protective Groups in Organic Chemistry", edited by J.W.F. McOmie, Plenum Press (1973), та "Protective Groups in Organic Synthesis", 3rd edition, T.W. Greene & P.G.M. Wutz, Wiley-lnterscience (1999)]. Фахівцям зрозуміло, що для отримання сполук винаходу альтернативним та у деяких випадках більш легким чином індивідуальні етапи способів, згаданих тут, можна проводити у відмінному порядку, та/або індивідуальні реакції можна проводити на відмінних етапах загального шляху (тобто замісники можна додавати до відмінних інтермедіатів та/або хімічні перетворення проводити на інтермедіатах, відмінних від інтермедіатів, асоційованих ви ще з конкретною реакцією). Це залежатиме серед іншого від факторів, як-то природа інших наявних функціональних гр уп, зокрема субстрату, здатність до прийняття ключових інтермедіатів та стратегії захисних гр уп (якщо це 43 85232 має місце). Безумовно, тип застосовуваної хімії впливатиме на вибір реагенту, що застосовано у вказаних етапах синтезу, потреби та тип у захисних груп, що застосовують, та послідовності синтезу. Фахівцям також зрозуміло, що хоча деякі захи щені похідні сполук формули І, котрі можна отримувати до етапу кінцевого зняття захисту, можуть не виявляти фармакологічної активності як такі, їх можна застосувати парентерально або перорально та вони далі можуть метаболізуватисяся в організмі з утворенням сполук винаходу, котрі є фармакологічно активними. Такі похідні можна тому описати як "проліки". Більш того, деякі сполуки формули І можуть діяти як проліки інших сполук формули І. Усі проліки сполук формули І охоплені рамками винаходу. Деякі з інтермедіатів, згаданих вище є новими. Згідно з наступним аспектом винаходу тому запропоновано: (а) сполуку формули II, що визначено вище, або її захи щене похідне; (b) сполуку формули IV, або її захищене похідне; (с) сполуку формули VIII, або її за хищене похідне; (d) сполуку формули IX, або її за хищене похідне; (e) сполуку формули X, або її захи щене похідне; (f) сполуку формули XIII, або її за хищене похідне; (g) сполуку формули XV, або її захищене похідне, за умови, що А перервано -S(O)2N(R18a)- або -N(R18b)S(O)2та/або В - -Z 1-[C(O)] aC(H)(R19a)-, -Z 2-[C(O)]cN(R19b)-, -Z2-N(R18c)S(O) 2- або -Z2-S(O)2N(R18d)-, де R 19a не є H, a R19b не є H або C1-6алкіл; (h) сполуку формули XVIII, або її захищене похідне; та (і) сполуку формули XXI, або її захи щене похідне. Медичне та фармацевтичне застосування Сполуки винаходу є корисними внаслідок того, що вони виявляють фармакологічну активність. Вони тому показані як фармацевтичні. Таким чином, згідно з наступним аспектом винаходу запропоновано сполуки винаходу для застосування як фармацевтичних. Зокрема, сполуки винаходу виявляють міокардіальну електрофізіологічну активність, наприклад, як продемонстровано в описаному нижче тесті. Сполуки винаходу таким чином, як очікують, будуть корисними у профілактиці та лікуванні аритмій, та зокрема атріальних та вентрикулярних аритмій. Сполуки винаходу таким чином показані у лікуванні або профілактиці серцевих хвороб, або у показаннях, пов'язаних з серцевими хворобами, де аритмії, можна вважати, грають головну роль, охоплюючи ішемічну хворобу серця, раптовий серцевий напад, інфаркт міокарду, серцеву недостатність, серцеву хірургію та тромбоемболію. У лікуванні аритмій, сполуки винаходу, як виявлено, селективно затримують серцеву реполяризацію та збільшують резистентність. Згідно з наступним аспектом винаходу запропоновано спосіб лікування аритмії, спосіб полягає у застосуванні терапевтично ефективної кількості сполуки винаходу до особи, що страждає від такого стану чи схильна до нього. Фармацевтичні препарати Сполуки винаходу слід звичайно застосувати перорально, підшкірно, внутрішньовенно, внутріш 44 ньоартеріально, трансдермально, інтраназально, інгаляцією, або будь-яким іншим парентеральним шляхом у формі фармацевтичних препаратів, що містять активний інгредієнт як вільну основу або нетоксичну органічну або неорганічну кислотноадитивну сіль у фармацевтично прийнятній дозованій формі. Залежно від розладу та пацієнта, якого лікують, а також шляху застосування, композиції можна застосувати у різних дозах. Сполуки винаходу можна також комбінувати з будь-якими іншими ліками, корисними у лікуванні аритмій та/або інших серцево-судинних розладів. Зокрема сполуки винаходу можна комбінувати з антикоагулянтом. При застосуванні тут, термін "антикоагулянт" охоплює речовини, вибрані з групи: аспірин, варфарин, еноксапарин, гепарин, низькомолекулярний гепарин, цилостазол, клопідогрель, тиклопідин, тирофібан, абциксимаб, дипіридамол, фракція білків плазми, альбумін людини, низькомолекулярний декстран, гетакрохмаль, ретеплаз, альтеплаз, стрертокіназа, урокіназа, далтепарин, філграстин, іммуноглобулін, гінколід В, гірудини, форопафант, роцепафант, бівалірудин, дерматан сульфат медіоланум, ертилібатид, тирофібан, тромбомодулін, абциксимаб, низько-молекулярний дерматан сульфаторокрин, ертаког альфа, аргатробан, фондапарінукс натрій, тифасогін, лепірудин, дезирудин, ОР2000, роксифібан, парнапарин натрій, гемоглобін людини (Гемосол), гемоглобін корови (Біопур), гемоглобін людини (Нортгфілд), тромбін III, PPP 13, гепарін-пероральний (Емісфер) трансгений антитромбін III, Н37695, еноксапарин натрій, мезоглікан, CTC 111, бівалірудин та будь-як їх похідні та/або комбінаці. Конкретні антикоагулянти, що можна згадати, охоплюють аспірин та варфарин. Термін "антикоагулянт" також охоплює посилання на інгібітори тромбіну. Інгібітори тромбіну, що можна згадати, охоплюють низько-молекулярні інгібітори тромбіну. Термін "низькомолекулярні інгібітори тромбіну" зрозумілий фахівцям та охоплює посилання на будь-яку композицію (наприклад, хімічну сполуку), що інгібує тромбін в експериментально визначуваному ступеню (як визначено тестами in vivo та/або in vitro), та має молекуляру масу нижче приблизно 2000, переважно нижче приблизно 1000. Переважні низько-молекулярні інгібітори тромбіну охоплюють інгібітори тромбіну на основі низько-молекулярного пептиду, на основі амінокислот, та/або на основі аналогу пептиду, а також їх похідні. Термін "інгібітори тромбіну на основі низькомолекулярного пептиду, на основі амінокислот, та/або на основі аналогу пептиду" добре зрозумілий фахівцю і о хоплює посилання на низькомолекулярні інгібітори тромбіну з 1-4 пептид зв'язками, та охоплює описані в огляді [Claesson у Blood Coagul. Fibrin. 5, 411 (1994), а також розкриті у патентах США No 4,346,078, міжнародних патентних заявках WO 93/11152, WO 93/18060, WO 93/05069, WO 94/20467, WO 94/29336, WO 95/35309, WO 95/23609, WO 96/03374, WO 96/06832, WO 96/06849, WO 96/25426, WO 45 85232 96/32110, WO 97/01338, WO 97/02284, WO 97/15190, WO 97/30708, WO 97/40024, WO 97/46577, WO 98/06740, WO 97/49404, WO 97/11693, WO 97/24135, WO 97/47299, WO 98/01422, WO 98/57932, WO 99/29664, WO 98/06741, WO 99/37668, WO 99/37611, WO 98/37075, WO 99/00371, WO 99/28297, WO 99/29670, WO 99/40072, WO 99/54313, WO 96/31504, WO 00/01704 та WO 00/08014; та Європейських патентних заявках 648 780, 468 231, 559 046, 641 779, 185 390, 526 877, 542 525,195 212, 362 002, 364 344, 530 167, 293 881, 686 642, 669 317, 601 459 та 623 596], розкриття у усі цих документів уведені як посилання. У цій заявці похідні інгібіторів тромбіну охоплюють хімічні модифікації, як-то етери, про-ліки та метаболіти, активні або неактивні, та фармацевтично прийнятні солі та сольвати, як-то гідрати, будь-чого з цього, та сольвати будь-якої такої солі. Переважні низько-молекулярні пептиди на основі інгібіторів тромбіну охоплюють відомі як "гатрани". Конкретні гатрани, котр можна згадати охоплюють HOOC-CH2-(R)Cha-Pic-Nag-H (відомий як іногатран) та HOOC-CH2-(R)Cgl-Aze-Pab-H (відомий як мелагатран) [дивись міжнародні патентні заявки WO 93/11152 та WO 94/29336, відповідно, та переліки скорочень тут]. [Міжнародна патентна заявка WO 97/23499] розкриває ряд сполук, котрі, як виявлено, є корисними як проліки інгібіторів тромбіну. Вказані проліки мають загальну формулу RaOOC-CH2-(R)Cgl-Aze-Pab-R b де R3 - H, бензил або С 1-10алкіл, Rb (котрий заміщує одн з атомів гідрогену в амідино групі PabH) - OH, OC(O)Rc або C(O)OR d, Rc – C1-17алкіл, феніл або 2-нафтил, a Rd - C1-12алкіл, феніл, C1-3 алкілфеніл, або 2-нафтил. Переважні сполуки охоплюють RaOOC-CH2-(R)Cgl-Aze-Pab-OH, де R3 бензил або C1-10алкіл, наприклад, етил або ізопропіл, особливо EtOOC-CH 2-(R)Cgl-Aze-Pab-OH. Самі активні інгібітори тромбіну розкриті у [WO 94/29336]. Згідно з наступним аспектом винаходу тому запропоновано фармацевтичну композицію, що містить сполуку винаходу у суміші з фармацевтично прийнятним ад'ювантом, розріджувачем чи носієм. Придатними добовими дозами сполук винаходу у терапевтичному лікуванні людей є приблизно 0,005-50,0мг/кг маси тіла при пероральному застосуванні та приблизно 0,005-15,0мг/кг маси тіла при парентеральному застосуванні. Переважні межі добових доз сполук винаходу у терапевтичному лікуванні людей є приблизно 0,005-20,0мг/кг маси тіла при пероральному застосуванні та приблизно 0,005-5,0мг/кг маси тіла при парентеральному застосуванні. Сполуки винаходу мають перевагу в тому, що вони є ефективними проти серцевої аритмії. Сполуки винаходу можуть також мати перевагу в тому, що вони можуть бути більш ефективними, бути менш токсичними, мати ширші межі активності (охоплюючи виявлення будь-якої комбінації класу І, класу II, класу III та/або класу IV активності (особливо класу І та/або класу IV активності на 46 додаток до класу III активності)), бути більш потужними, довше діючими, мати меншу побічну дію (охоплюючи менше випадків проаритмій, як-то хаотична поліморфна шлуночкова тахікардія), легше поглинатися, або мати інші корисні фармакологічні властивості відносно сполук, відомих у попередньому рівні техніки. Біологічні тести Тест А Первинна електрофізіологічна дія ν анестезованих морських свинок Застосовували морських свинок масою між 500 та 1000г тварин тримали протягом принаймні одного тижня перед експериментом та давали вільний доступ до їжі та води. Анестезію індукували інтраперитонеальною ін'єкцією пентобарбіталу (50-60мг/кг) та уводили катетери в одну сонну артерію (для реєстрації кров'яного тиску та відбору зразків крові) та в одну яремну вену (для уведення ліків). Гольчаті електроди розміщали на задніх лапах для реєстрації електрокардіограм (провід II). Термістор розміщали у прямій кишці та тварин поміщали на електрогрілку, підтримували ректальну температуру між 37,5 та 38,5°С. Проводили трахеотомію та тварину штучно вентилювали кімнатним повітрям застосуванням невеликого вентилятора, фіксованого для підтримки газів крові у нормальних межах для виду. Для зменшення автономних впливів обидва блукаючі нерви розрізали на шиї, та 0,5мг/кг анаприліну уводили внутрішньовенно за 15 хвилин перед початком експерименту. Лівий вентрикулярний епікард відкривали лівобічною торактомією, та замовлений присосковий електрод для реєстрації монофазового біоелектричного потенціалу (МАР) пристосовували до вільної лівої вентрикулярної стінки. Електрод тримали у позиції так довго, щоб зареєструвати прийнятний сигнал, а далі переставляли його у нову позицію. Біполярний електрод для кардіостимуляції прикладали до лівого передсердя. Тривалість кардіостимуляції (1мс, подвійний діастолічний поріг) проводили з стимулятором постійного струму, ви готовленим згідно з індивідуальним замовленням. Серцю задавали темп частоти трохи вищий спонтанного синусового ритму протягом 30 с кожну 5-ту хвилину протягом· дослідження. МАР-сигнал, сигнал кров'яного тиску та провід Il електрокардіограми поєднували (частота відбору зразків була 1000Гц та кожний період відбору зразків 10с) на персональному комп'ютері протягом останніх 10с з кожних 30с послідовності кардіостимуляції та останні 10с із хвилин періоду синусового ритму. Сигнали обробляли, застосовуючи виготовлену за індивідуальним замовленням комп'ютерну програму (PharmLab v 4,0). Спосіб тестування мав дві базові контрольні реєстрації, 3 хвилин порізно, протягом кардіостимуляції та синусового ритму. Після другої контрольної реєстрації, першу дозу тест-речовини вливали в об'ємі 0,2мл/кг у катетер яремної вени протягом 30с. Трьома хвилинами пізніше починали кардіостимуляцію та отримували нову реєстрацію. П'ять хвилин після попередньої дози застосували 47 85232 наступну дозу тест-речовини. 6 - 10 послідовних доз давали протягом кожного експерименту. Аналіз даних З ряду змінних, виміряних у цьому аналізі, три були вибрані як найважливіші для співставлення та відбору активних сполук. Трьома вибраними змінними були тривалість МАР при 75 процентах реполяризації протягом кардіостимуляції, час атріовентрикулярної (AV) провідності (визначений як інтервал між атріальним моментом пульсу та початком вентрикулярного МАР) протягом кардіостимуляції, та серцевий ритм (визначений як інтервал RR протягом синусового ритму). Систолічний та діастолічний кров'яний тиск вимірювали для визначення гемодинамічного статусу анестезованих тварин. Крім того, електрокардіограму перевіряли стосовно аритмії та/або морфологічних змін. Середнє з двох контрольних реєстрацій приймали за нуль та дію, зареєстровану після послідовних доз тест-речовини виражали як процент зміни від цього значення. Відкладанням цих процентів проти кумулятивної дози, застосованої перед кожною реєстрацією, було можливо створювати криві доза-відгук. Цим шляхом кожним експериментом створено три криві доз-відгук, одна для тривалості MAP 1 одна для часу AV-провідності та одна для синусової частоти (інтервал RR). Середню криву усіх експериментів, проведених з тест-речовиною, розраховували, а значення потужності були похідними від середньої кривої. Усі криві доза-відгук у ци х експериментах створювали лінійним зв'язком отриманих даних для точок. Кумулятивну дозу, подовжуючу тривалість МАР на 10% від базисної, застосовували як індекс для оцінки електрофізіологічної потужності засобу класу III при дослідженні (D10). Тест В Аналіз витоку Rb+ для визначення блокаторів каналу HERG Ген, пов'язаний з етер-a-go-go людини (HERG) кодує потенціалозалежний канал K+, що лежить в основі серцевого швидко затримуваного випрямленого струму ІKr. Значення IK50 для блокади каналу HERG визначали, застосовуючи високопродуктивний функціональний аналіз на основі індукованого деполяризацією витоку Rb+ з клітин яєчнику китайського хом'яка, стабільно експресуючих HERG-канал. Клітини вирощували у Ham F12 (Life Technologies 31765-027), доповненому 10% сироватка зародка теляти та 0,6мг/мл гігроміцину В та регулярно пересівали двічі на тиждень. Для експериментальних досліджень клітини висівали на планшети при густині 15000 клітини/комірку у 384коміркові планшети для культур тканин з чорними стінками та прозорим дном Falcon та далі інкубували протягом ночі при 37°C в інкубаторі для культур клітин. Після інкубації протягом ночі клітинні планшети промивали та додавали Rb+ - завантажувальний буфер (фізіологічний буфер, що містить Rb+). Клітинні планшети тоді інкубували протягом 3 годин та далі промивали. Після промивки додавали тест-сполуки. Клітинні планшети тоді інкубували 48 ще 10 хвилин та після цього періоду інкубації зовнішню концентрацію K+ збільшували для деполяризації клітин та активації каналів HERG. Через 10 хвилин при збільшеній концентрації K+, надосадкові шари переносили у нові мікропланшети для наступного визначення вмісту Rb+, застосовуючи атомно-абсорбційний спектрометричний аналіз. Базовий витік Rb + (вміст Rb+ (мг/л) у надосадкових шарах з комірок з промивальним буфером тільки) визначали як 100% інгібування, а стимульований витік Rb+ (вміст Rb+ (мг/л) у надосадкових шарах з комірок тільки зі збільшеною зовнішньою концентрацією калію) визначали як 0% інгібування. Активність сполуки виражали як: é А -В ù 100 ´ ê1 ú ë С-Вû + А: вміст Rb у комірках з тест-сполукою +збільшений зовнішній K+. В: Базовий витік Rb+. C: Стимульований витік Rb+. Винахід ілюстровано наступними прикладами. Приклади Загальні експериментальні способи Мас-спектри реєстрували на одному з приладів: MUX(8)-LCT, ZQ та Quattro micro, усі від Waters Micromass. PX-MC: Розділення проводили, застосовуючи Agilent 1100 Series Modules або Waters 1525 pump на ACT АСЕ С8 3´50мм 3мкм з елюванням з градієнтом. Зразки уводили, застосовуючи Waters 2700 Sample Manager. Рухомі фази: Загальні градієнти були від 5% до 95% ацетонітрилу. Застосовували буфери, що містять 10мМ амоній ацетат або 5мМ амоній форміат/5мМ мурашину кислоту. Мас-спектри реєстрували Waters ZQ2000 або Waters ZMD з електророзпилювальним інтерфейсом, з переключенням з позитивного на негативний режим іонізації. УФ спектри реєстрували Agilent 1100 PDA або Waters 2996 DAD та сигнал випаровуючого світлорозсіювання (ELS) за допомогою Sedere Sedex 55 або 75. Збір даних та оцінку проводили, застосовуючи програмне забезпечення MassLynx. Вимірювання 1H ЯМР та 13C ЯМР проводили на спектрометрах BRUKER ACP 300 та Varian 300, 400, 500 та 600 Mercury, Unity plus та Inova, на частотах 1H 300, 400, 500 та 600МГц, відповідно, та на частотах 13C 75,4, 100,6, 125,7 та 150,9МГц, відповідно. Ротамери можуть бути або не бути позначеними у спектрах залежно від легкості інтерпретації спектрів. Якщо не вказане інше, хімічні зсуви наведені у млн -1 з розчинником як внутрішнім стандартом. Синтез інтермедіатів Наступні інтермедіати комерційно не доступні, та їх тому отримували способами, описаними нижче. Отримання А 49 85232 Метансуль фонової кислоти 2-{[3-(4ціанофеніл)пропіл]метансульфоніламіно}етиловий естер (і) 3-(4-ціанофеніл)акрилової кислоти етиловий естер До розчину 4-бромбензонітрилу (50г, 0,275моль) та етилакрилату (35,4г, 0,412моль) у сухому ДМФ (250мл), додавали паладій ацетат (0,61г, 0,0027моль), трис-о-толілфосфін (3,34г, 0,011моль) та триетиламін (57,3мл, 0,412моль) та гріли при кипінні під зворотним холодильником при 95-100°C протягом 2 годин в атмосфері аргону. Реакцію гасили додаванням води (250мл) та екстрагували ефіром (3´ 250мл). Поєднаний екстракт промивали 1,5H HCI (250мл), водою та розсолом та сушили безводним натрій сульфатом. Випарювання розчиннику під зменшеним тиском та очистка колонковою хроматографією через нейтральний алюміній оксид, застосовуючи етилацетат у петролейному ефірі як елюент, дали 55г (90%) підзаголовної сполуки як білуватого твердого продукту. (іі) 3-(4-Ціанофеніл)пропіонової кислоти етиловий естер Pd/C (5г, 10%) додавали до розчину 3-(4ціанофеніл)акрилової кислоти етилового естеру (50г, 0,25моль; дивись етап (і) вище) у сухому етилацетаті (500мл) в атмосфері азоту, а потім триетиламін (50,3г, 0,5моль) та мурашину кислоту (57,2г, 1,24моль). Суміш гріли при кипінні під зворотним холодильником протягом ночі в атмосфері азоту. Після завершення реакції (контролювали ТШХ), суміш фільтрували та фільтрат тоді промивали водою, 5% розчином NaHCO3 та розсолом, перед сушкою безводним натрій сульфатом. Випарювання розчиннику під зменшеним тиском дал 50г (99%) підзаголовної сполуки як блідо-жовте масло. (ііі) 4-(3-Гідроксипропіл)бензонітрил До розчину LiBH4 (14г, 0,65моль) у сухому ефірі (400мл) додавали 3-(4-ціанофеніл)пропіонової кислоти етиловий естер (50г, 0,249моль; дивись етап (іі) вище), а потім метанол (27мл) краплями. Реакційну суміш гріли при кипінні під зворотним холодильником протягом 3 годин. Після завершення (відстежували ТШХ), реакцію гасили додаванням холодного, насиченого розчину амоній хлориду (100мл), а потім води (300мл). Шари тоді розділяли. Водний шар екстрагували ефіром (2´100мл) та поєднані органічні шари промивали розсолом. Після сушки безводним натрій сульфатом органічний шар концентрували для отримання сирого твердого продукту. Цей сирий продукт очищали колонковою хроматографією через силікагель, застосовуючи етилацетат у петролейному ефірі як елюент. Це дало 16,5г (42%) підзаголовної сполуки як блідо-жовту рідину. (iv) 4-(3-Бромпропіл)бензонітрил До розчину 4-(3-гідроксипропіл)бензонітрил (13г, 0,081моль; дивись етап (ііі) вище) та трифенілфосфін (42,3г, 0,16моль) у ДХМ (150мл) додавали, краплями при 0-5°C, розчин CBr4 (53,5г, 0,16моль) у ДХМ (100мл). Утворену суміш перемішували при кімнатній температурі протягом ночі. Реакційну суміш концентрували та продукт очищали колонковою хроматографією через силіка 50 гель, застосовуючи петролейний ефір в етилацетаті як елюент, для отримання 12,5г (69%) підзаголовної сполуки як жовту рідину. (v) 4-[3-(2Гідроксіетиламіно)пропіл]бензонітрил До розчину 4-(3-бромпропіл)бензонітрилу (8г, 0,0357моль; дивись етап (iv) вище) у сухому ацетонітрилі (150мл) додавали безводний K2CO3 (7,4г, 0,0535моль) та етаноламін (10,9г, 0,179моль). Утворену реакційну суміш тоді перемішували протягом ночі при кімнатній температурі, після чого її фільтрували та концентрували. Сирий продукт, отриманий таким чином очищали колонковою хроматографією через силікагель, застосовуючи метанол у хлороформ як елюент, для отримання 4,2г (57,5%) підзаголовної сполуки як блідо-жовтий твердий продукт. (vi) Метансульфонової кислоти 2-{[3-(4ціанофеніл)пропіл]метансульфоніламіно}етиловий естер До розчину 4-[3-(2гідроксіетиламіно)пропіл]бензонітрил (4г, 0,0196моль; дивись етап (ν) вище) у сухому ДХМ (80мл) додавали, при 0-5°C, триетиламін (5,9г, 0,0588моль) та мезилхлорид (5,6г, 0,049моль). Утворену суміш тоді перемішували при кімнатній температурі протягом 30 хвилин, після чого реакцію гасили додаванням води (50мл). Утворений водний шар екстрагували ДХМ (2 ´50мл) та поєднані органічні шари промивали розсолом. Розчинник видаляли під зменшеним тиском та сирий продукт перекристалізовували з метанолу для отримання 4,2г (62%) заголовної сполуки як білого твердого продукту. Отримання В (і) 7-(2-{[3-(4ціанофеніл)пропіл]метансульфоніламіно}етил)-9окса-3,7-діазабіцикло-[3,3,1]нонан-3-карбонової кислоти трет-бутиловий естер Суміш 9-окса-3,7-діаза-біцикло[3,3,1]нонан-3карбонової кислоти трет-бутилового естер у (2,35г, 0,01моль; [дивись WO 01/28992]), метансульфонової кислоти 2-{[3-(4ціанофеніл)пропіл]метансульфоніламіно}етилового естеру (3,7г, 0,01моль; дивись Отримання А вище) та безводного K2CO3 (2,1г, 0,015моль) у сухому ацетонітрилі (70мл) перемішували в атмосфері азоту при 55-60°С протягом 3 діб. Після фільтрування та концентрування сирий продукт очищали колонковою хроматографією (силікагель: 60-120меш, елюент: петролейний ефір-етилацетат, 50:50). Вихід: 3,25г (66%). (іі) N-[3-(4-ціанофеніл)пропіл]-N-[2-(9-окса-3,7діазабіцикло[3,3,1]нон-3іл)етил]метансульфонамід, гідрохлорид 7-(2-{[3-(4ціанофеніл)пропіл]метансульфоніламіно}етил)-9окса-3,7-діазабіцикло-[3,3,1]нонан-3-карбонової кислоти трет-бутиловий естер (3,8г, 0,0095моль; дивись етап (і) вище) додавали до насиченого розчину НСІ(Г) в етилацетаті (50мл) та утворену суміш тоді перемішували протягом ночі. На завершення реакції (як визначено TLUX), етилацетат декантували та продукт сушили під високим ваку 51 85232 умом для отримання заголовної сполуки. Вихід: 1,5г (54%). Отримання C N-(2-Брометил)-N-[2-(4ціанофеноксил)етил]метансульфонамід (і) 4-(2-Брометоксил)бензонітрил Безводний калій карбонат (233г, 1,68моль) додавали до розчину 4-гідроксибензонітрилу (100г, 0,84моль) у ДМФ (700мл), та утворену суміш перемішували протягом 1 години в атмосфері азоту. 1,2-Дибром-етан (362мл, 4,2моль) додавали повільно до реакційної суміші, котру тоді перемішували при 55-60°C протягом ночі. Реакційну суміш розбавляли водою та екстрагували етилацетатом (3´750мл). Поєднаний органічний шар промивали водою та тоді концентрували. Сирий продукт очищали колонковою хроматографією (силікагель: 60120 меш, елюент: петролейний ефір-етилацетат, 90:10). Вихід: 60г (32%). (іі) 4-[2-(2Гідроксіетиламіно)стокси]бензонітрил 4-(2-Брометоксил)бензонітрил (30г, 0,133моль; дивись етап (і) вище) та етаноламін (48мл, 0,78моль) змішували та гріли при кипінні під зворотним холодильником в атмосфері азоту приблизно при 120°C протягом 3 годин. Реакцію гасили додаванням розчину натрій гідроксиду до суміші. Підзаголовну сполуку екстрагували, застосовуючи ДХМ (2´250мл), сушили безводним натрій сульфатом та тоді концентрували. Вихід: 13,1г (48%). (iiі) Метансульфонової кислоти 2-{[2-(4ціанофеноксил)етил]метансульфоніламіно}етиловий естер До розчину 4-[2-(2гідроксіетиламіно)етокси]бензонітрилу (14г, 0,068моль; дивись етап (іі) вище) у сухому ДХМ (200мл) додавали триетиламін (28,4мл, 0,2моль), а потім метансульфонілхлорид (13мл, 0,17моль) при 0-5°C. Реакційну суміш перемішували при кімнатній температурі протягом 1 години. Після завершення реакції (ТШХ), додавали воду (250мл) та органічний шар відділяли. Водний шар екстрагували ДХМ (2´100мл) та поєднані органічні шари промивали водою. Після концентрування сирий продукт далі очищали колонковою хроматографією (силікагель: 60-120меш, елюєнт: хлороформметанол, 98,5:1,5). Вихід: 18,2г (74%). (iv) N-(2-Брометил)-N-[2-(4ціанофеноксил)етил]метансульфонамід До розчину метансульфонової кислоти 2-{[2(4-ціанофеноксил)етил]метансульфоніламіно}етилового естеру (10г, 0,028моль; дивись етап (ііі) вище) у сухому ацетоні (100мл), додавали літій бромід (4,8г, 0,055моль). Реакційну суміш гріли при кипінні під зворотним холодильником протягом ночі в атмосфері азоту, перед фільтруванням та концентруванням для отримання заголовної сполуки. Вихід: 10г (97%). Отримання D Толуол-4-сульФонової кислоти 2-{1-[2-(4ціанофеноксил)етил]уреїдо}етиловий естер (і) N-[2-(4-Ціанофеноксил)етил]-N-(2гідроксіетил)сечовина До розчину 4-[2-(2гідроксіетиламіно)етокси]бензонітрилу (5г, 52 0,0242моль; дивись Отримання С(іі) вище) у діоксан (65мл) та воді (65мл) додавали, при кімнатній температурі, калій ціанат (4,92г, 0,0606моль), а потім оцтову кислоту (4,36г, 0,0726моль). Реакційну суміш тоді перемішували при кімнатній температурі протягом ночі, перед концентруванням під зменшеним тиском. Утворений залишок розподіляли між водою та дихлорметаном. Органічний шар відділяли, промивали водою та розсолом, сушили безводним натрій сульфатом та тоді концентрували. Сирий продукт далі очищали колонковою хроматографією. Вихід: 3,5г. (іі) Толуол-4-сульфонової кислоти 2-{1-[2-(4ціанофеноксил)етил]уреїдо)етиловий естер До розчину інтермедіату 1-[2-(4ціанофеноксил)етил]-1-(2-гідроксіетил)сечовини (4,7г, 0,0188моль; дивись етап (і) вище) у сухому ТГФ (150мл) додавали н-бутиллітій (18,89мл, 1,1M) при -78°С. Реакційну суміш перемішували при -78°C протягом 1 години, після чого додавали краплями розчин тільки що перекристалізованого п-толуолсуль фонілхлориду (4,3г, 0,023моль) у ТГФ (50мл). Реакційну суміш тоді перемішували при 78°С протягом ще 30 хвилин, перед нагріванням до -30°C, та перемішували протягом більше 2 годин. Реакційну суміш гасили водою та екстрагували етилацетатом. Органічний шар промивали розсолом, сушили безводним натрій сульфатом, концентрували та залишок перекристалізовували з суміші етилацетат/гексан для отримання заголовної сполуки як білуватого твердого продукту. Вихід: 3,5г. Отримання E N-[2-(4-Ціанофеноксил)етил]-N-[2-(9-окса-3,7діазабіцикло[3,3,1]нон-3-іл)етил]сечовина (і) 7-(2-{1-[2-(4ціанофеноксил)етил]уреїдо}етил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-карбонової кислоти третбутиловий естер Суміш толуол-4-сульфонової кислоти 2-{1-[2(4-ціанофеноксил)етил]-уреїдо}етилового естеру (15г, 0,0372моль, 1,0екв.; дивись Отримання D вище), 9-окса-3,7-діаза-біцикло[3,3,1]нонан-3карбонової кислоти трет-бутилового естеру (8,525г, 0,0372моль, 1,0екв.; [дивись WO 01/28992]), плавленого K2CO3 (7,7г, 0,0558моль, 1,5екв.) та літій броміду (9,6г, 0,1116моль, 3,0екв.) у сухому ацетонітрилі (350мл) гріли до 40°C під азотом протягом 4 діб. Реакційну суміш охолоджували до кімнатної температури, фільтрували та фільтрат концентрували під зменшеним тиском. Утворений залишок очищали колонковою хроматографією через силікагель, застосовуючи 3% метанол та ДХМ як елюент, для отримання підзаголовної сполуки як білого твердого продукту. Вихід: 7г, 40,9%. (ii) N-[2-(4-ціанофеноксил)етил]-N-[2-(9-окса3,7-дiазабiцикло[3,3,1]нон-3-iл)етил]-сечовина 7-(2-{1-[2-(4-Ціанофеноксил)етил]уреїдо}етил)9-окса-3,7-діазабіцикло-[3,3,1]нонан-3-карбонової кислоти трет-бутиловий естер (6,44г; дивись етап (і) вище) додавали до розчину насиченого HCI сухого діоксану (300мл) при 0°C. Реакційну суміш тоді перемішували при кімнатній температурі протягом 1 години. Утворений осад фільтрували під 53 85232 азотом, промивали сухим ефіром та тоді сушили під вакуумом для отримання заголовної сполуки. Вихід: 6г. Отримання F Толуол-4-сульФонової кислоти 2-{1-[3-(4ціанофеніл)пропіл]уреїдо}етиловий естер (і) 1-[3-(4-ціанофеніл)пропіл]-1-(2гідроксіетил)сечовина 4-[3-(2-Гідроксіетиламіно)пропіл]бензонітрил (6,7г, 0,0328моль; дивись Отримання Α (ν) вище) та сечовину (2г, 0,0328моль) змішували та гріли при 130°C протягом 2 годин. Реакційну суміш о холоджували до кімнатної температури та додавали воду. Утворенй твердий матеріал фільтрували та сушили для отримання 5,9г (72%) підзаголовної сполуки як білого твердого продукту. (іі) Толуол-4-сульфонової кислоти 2-{1-[3-(4ціанофеніл)пропіл]уреїдо}етиловий естер 1-[3-(4-Ціанофеніл)пропіл]-1-(2гідроксіетил)сечовину (5,9г, 0,0238моль; дивись етап (і) вище) переносили у сухий піридин (20мл). Тільки що отриманий п-толуолсульфонілхлорид (4,9г, 0,02627моль) тоді додавали порціями при 0°C. Реакційну суміш перемішували при 0°C протягом 3 годин, після чого додавали етилацетат (для видалення піридину з продукту) та утворений твердий матеріал фільтрували. Продукт тоді очищали колонковою хроматографією, застосовуючи метанол у дихлорметані як елюент, а потім кристалізацією з ізопропанолу. Це дало 2,7г (62%) заголовної сполуки як безбарвний, кристалічний твердий продукт. 1 H ЯМР (300МГц; CD3OD) δ 7,76-7,70 (m, 4H), 7,45 (d, 2H), 7,27 (d, 2H), 4,75 (t, 2H), 3,95 (t, 2H), 3,52 (t, 2H), 2,83 (t, 2H), 2,41 (с, ЗН), 2,0 (m, 2H); 13 C ЯМР (75,5 МГц, CD3OD) δ 163,46, 148,78, 144,13, 142,18, 133,91, 131,06, 130,34, 127,41, 120,34, 111,47, 70,52, 48,65, 46,13, 34,05, 29,20, 21,81. Отримання G 1-[2-(4-ціанофеноксил)етил]-3,3-диметил-1-(2оксоетил)сечовина (і) 1-[2-(4-ціанофеноксил)етил]-1-(2гідроксіетил )-3,3-диметилсечовина 4-{2-[(2-Гідроксіетил)аміно]етокси}бензонітрил (5г, 0,0242моль; дивись Отримання C, етап (іі) вище) переносили у сухий дихлорметан (50мл) та охолоджували до 0°C. Триетиламін (4мл, 0,03моль), а потім Ν,Ν-диметилкарбамоїл хлорид (3,9г, 0,03моль), додавали, та реакційну суміш перемішували при кімнатній температурі протягом ночі. Реакційну суміш розбавляли водою та екстрагували дихлорметаном. Органічний шар промивали водою та розсолом та сушили безводним натрій сульфатом. Розчинник випарювали під зменшеним тиском. Очистка колонковою хроматографією, застосовуючи ди хлорметан у метанолі дала 6г підзаголовної сполуки як блідо-жовту рідину. (іі) 1-[2-(4-ціанофеноксил)етил]-3,3-диметил-1(2-оксоетил)сечовина Оксалілхлорид (6,3г, 0,0497моль) додавали краплями при перемішуванні до розчину ДМСО (7,6г, 0,094моль) та дихлорметану (100мл) при 78°C. Після перемішування протягом 15 хвилин 54 при тій же температурі додавали 1-[2-(4ціанофеноксил)етил]-1-(2-гідроксіетил)-3,3диметилсечовину (6г, 0,0325моль; дивись етап (і) вище) у ди хлорметані та перемішування продовжували протягом 3 годин в атмосфері азоту. Триетиламін (16,4мл, 0,1625моль) додавали краплями та реакційну суміш тоді повільно гріли до -30°C. Реакційну суміш гасили водним розчином лимонної кислоти, та утворену суміш екстрагували дихлорметаном. Органічний шар промивали водою та розсолом та сушили безводним натрій сульфатом. Випарювання розчиннику під зменшеним тиском дало 4,5г сирої заголовної сполуки, котру застосовували без наступної очистки. Отримання H 1-[2-(4-ціанофеноксил)етил]-3,3-диметил-1-[2(9-окса-3,7-діаза-біцикло[3,3,1]нон-3іл)етил]сечовина 7-(2-{1-[2-(4-Ціанофеноксил)етил]-3,3диметилуреїдо}етил)-9-окса-3,7-діазабіцикло[3,3,1]нонан-3-карбонової кислоти трет-бутилов естер (6,5г; дивись Приклад 5 нижче) переносили у HCI у діоксані (50мл) та перемішували протягом 30 хвилин. Реакційну суміш декантували та твердий матеріал переносили у двофазну суміш дихлорметану та водного NaHCO3. Органічний шар відділяли, промивали водою, сушили безводним натрій сульфатом та концентрували. Очистка колонковою хроматографією дала 1,3г заголовної сполуки як блідо-жовтий твердий продукт. Отримання І Толуол-4-суль фонової кислоти 2-{1-[2-(4ціанофеноксил)етил]-3-метилуреїдо}-етиловий естер (і) 1-[2-(4-Ціанофеноксил)етил]-1-(2гідроксіетил)-3-метилсечовина 4-[2-(2-Гідроксіетиламіно)етокси]бензонітрил (1г, 0,009моль; дивись Отримання C, етап (іі) вище) та Ν,Ν'-диметилсечовину (0,43г, 0,0049моль) гріли з перемішування при 130°C протягом 4 годин. Реакційну суміш очищали безпосередньо колонковою хроматографією для отримання 0,7г підзаголовного продукту як білуватий твердий матеріал. (іі) Толуол-4-сульфонової кислоти 2-{1-[2-(4ціанофеноксил)етил]-3-метил-уреїдо}етиловий естер При гарному перемішуванні до розчину 1-[2-(4ціанофеноксил)етил]-1-(2-гідроксіетил)-3метилсечовини (6,6г, 0,0257моль; дивись етап (і) вище) у сухому ТГФ (70мл) додавали H-BuLi (2,85N, 1,766г, 0,0276моль) при -78°C, краплями в атмосфері азоту. Після перемішування при тій же температурі протягом 45 хвилин, птолуолсульфонілхлорид (5,25г, 0,0276моль) у сухому ТГФ додавали (краплями) та реакційну суміш тоді перемішували при -40°C протягом 2 годин. Реакцію гасили 50мл води та гріли до кімнатної температури. Продукт екстрагували етилацетатом, промивали розсолом розчин та сушили безводним натрій сульфатом. Випарювання розчиннику під зменшеним тиском, а потім колонкова хроматографія через силікагель (застосовуючи 15-25% метанол у хлороформ) дали 1,36г заголовної сполуки як коричневу густу рідину. 55 85232 Отримання J 1-[2-(4-ціанофеноксил)етил]-3-метил-1-[2-(9окса-3,7-діазабіцикло[3,3,1]-нон-3-іл)етил]сечовин, гідрохлорид 7-(2-{1-[2-(4-Ціанофеноксил)етил]-3метилуреїдо}етил)-9-окса-3,7-діазабіцикло[3,3,1]нонан-3-карбонової кислоти трет-бутиловий естер (920мг; дивись Приклад 6 нижче) розчиняли у 10мл сухого діоксану, до котрого додавали 10мл діоксану, насиченого HCI. Реакційну суміш перемішували при кімнатній температурі протягом 1 години. Твердий продукт, що утворився фільтрували, промивали сухим діетиловим естером та тоді сушили під вакуумом для отримання 400мг заголовної сполуки як жовтий твердий продукт. Отримання K 1-[3-(4-ціанофеніл)пропіл]-3,3-диметил-1-(2оксоетил)сечовина (і) 4-[3-(2-Гідроксіетиламіно)пропіл]бензонітрил 4-(3-Бромпропіл)бензонітрил (20г, 0,089моль) в ацетонітрилі додавали при енергійному перемішуванні до суміші етаноламіну (27,2г, 0,447моль) та калій карбонату (18,5г, 0,133моль) у 300мл сухого ацетонітрилу. Перемішування тоді продовжували при кімнатній температурі протягом ночі в атмосфері азоту. Реакційну суміш фільтрували та концентрували під зменшеним тиском. Сирий отриманий продукт очищали колонковою хроматографією (застосовуючи метанол у хлороформі) для отримання 15г підзаголовної сполуки. (ii) 1-[З-(4-Ціанофеніл)пропіл]-1-(2гідроксіетил)-3,3-диметилсечовина Ν,Ν-Диметилкарбамоїлхлорид (3,9г, 0,0368моль) додавали до суміші 4-[3-(2гідроксіетиламіно)пропіл]бензонітрилу (5г, 0,025моль; дивись етап (і) вище) та триетиламіну (3,7г, 0,368моль) у дихлорметані (100мл) при 0°C. Перемішування тоді продовжували при кімнатній температурі протягом ночі. Реакційну суміш розбавляли водою та екстрагували дихлорметаном. Органічний шар промивали водою та розсолом та сушили безводним натрій сульфатом. Випарювання розчиннику під зменшеним тиском з наступною очисткою колонковою хроматографією (застосовуючи 4% метанол у ди хлорметані) дало 7г підзаголовної сполуки як блідо-жовту густу рідину. (ііі) 1-[3-(4-ціанофеніл)пропіл]-3,3-диметил-1(2-оксоетил)сечовина Оксалілхлорид (4,84г, 0,038моль) додавали краплями при перемішуванні до розчину ДМСО (5,9г, 0,0763моль) та дихлорметану (100мл) при 78°C. Після 15 хвилин при тій же температурі додавали 1-[3-(4-ціанофеніл)пропіл]-1-(2гідроксіетил)-3,3-диметилсечовину (7г, 0,0254моль) у ди хлорметані та перемішування продовжували протягом 3 годин в атмосфері азоту. Триетиламін (12,8г, 0,127моль) додавали (краплями), та реакційну суміш тоді гріли повільно до 30°C. Реакційну суміш гасили 10% лимонною кислотою (водн.) та екстрагували дихлорметаном. Органічний шар промивали водою та розсолом, сушили безводним натрій сульфатом та концентрували для отримання 6,5г сирої заголовної сполуки, котру застосовували без наступної очистки. Отримання L 56 1-[3-(4-ціанофеніл)пропіл]-3,3-диметил-1-[2-(9окса-3,7діазабіиикло-[3,3,1]нон-3-іл)етил]сечовина гідрохлорид 7-(2-{1-[3-(4-Ціанофеніл)пропіл]-3,3диметилуреїдо}етил)-9-окса-3,7-діазабіцикло[3,3,1]нонан-3-карбонової кислоти трет-бутиловий естер (7,5г; дивись Приклад 7 нижче) переносили у діоксан (20мл, насичений газуватим HCI) та перемішували протягом 2 годин. Органічний шар декантували та залишок промивали сухим діетиловим естером та сушили під вакуумом для отримання 3г заголовної сполуки як блідо-жовтий твердий продукт. Отримання M N-(2-[7-(4-ціанобензил)-9-окса-3,7дiазабiцикло[3,3,1]нон-3-іл]етил}метансульфонамід (і) 7-(4-ціанобензил)-9-окса-3,7діазабіцикло[3,3,1]нонан-3-карбонової кислоти трет-бутиловий естер 4-Ціанобензилбромід (2г, 0,01моль), 9-окса3,7-діаза-біцикло[3,3,1]нонан-3-карбонової кислоти трет-бутиловій естер (2,33г, 0,01моль; [дивись WO 01/28992]) та калій карбонат (3,52г, 0,026моль) переносили у сухий ацетонітрил (25мл) та перемішували при 60°C протягом ночі в атмосфері азоту. Реакційну суміш охолоджували до кімнатної температури, фільтрували та фільтрат концентрували під зменшеним тиском. Отриманий залишок очищали колонковою хроматографією (застосовуючи 5% етилацетат у петролейному ефірі) для отримання 2,6г підзаголовної сполуки як білого твердого продукту. (іі) 4-(9-Окса-3,7-діазабіиикло[3,3,1]нон-3ілметил)бензонітрил, гідрохлорид 7-(4-Ціанобензил)-9-окса-3,7діазабіцикло[3,3,1]нонан-3-карбонової кислоти трет-бутилов естер (2,2г) переносили у діоксан (25мл, насичений газуватим HCI) та реакційну суміш перемішували при кімнатній температурі протягом 3 годин. Діоксан декантували, твердий продукт тоді промивали діетиловим естером та сушили під вакуумом для отримання 1,82г підзаголовної сполуки як білого твердого продукту. (ііі) N-(2-Брометил)метансульфонамід Суспензію 2-брометиламін гідроброміду (15г, 0,0724моль) у дихлорметані (220мл) обробляли триетиламіном (18,31г, 0,181моль) протягом 30 хвилин. В утворену суміш додавали краплями при 0°C метансульфонілхлорид (9,11г, 0,0796моль). Реакційну суміш тоді перемішували при кімнатній температурі протягом 3 годин перед гасінням водою. Органічний шар промивали водою та тоді розсолом перед сушкою безводним натрій сульфатом. Випарювання розчиннику під зменшеним тиском, а потім колонкова хроматографія через силікагель (застосовуючи 2% етилацетат у петролейному ефірі як елюент) дали 4,5г підзаголовної сполуки як блідо-жовте масло. (iv) N-{2-[7-(4-ціанобензил)-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл]-етил)метансульфонамід 4-(9-Окса-3,7-діазабіцикло[3,3,1]нон-3ілметил)бензонітрил, гідрохлорид (1г, 3,1ммоль; дивись етап (іі) вище), N-(2-брометил)метан 57 85232 сульфонамід (0,75г, 3,72ммоль; дивись етап (ііі) вище) та калій карбонат (1,07г, 7,75ммоль) переносили у сухий ацетонітрил (20мл) та перемішували протягом 15 хвилин при кімнатній температурі в атмосфері азоту. Реакційну суміш концентрували під зменшеним тиском та отриманий залишок розподіляли між водою та дихлорметаном. Органічний шар промивали водою, а потім розсолом та тоді сушили безводним натрій сульфатом. Випарювання розчиннику, а потім вакуумна сушка залишку дали 0,9г заголовної сполуки як коричневий твердий продукт. Отримання N N-Бензил-N-[2-(9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл)-етил]-метансульфонамід гідрохлорид (і) N-бензил етаноламін Суміш бензилброміду (15г, 0,0872моль) та етаноламіну (26,5г, 0,436моль) перемішували при 120°C протягом 3 годин. Реакційну суміш розбавляли розсолом та екстрагували дихлорметаном. Органічний шар промивали водою та розсолом та сушили безводним натрій сульфатом. Розчинник випарювали під зменшеним тиском та залишок очищали колонковою хроматографією через силікагель, застосовуючи 4% метанол у дихлорметані як елюенті для отримання N-бензил етаноламіну (12г) як рідини. (ii) Метансульфонової кислоти 2-(бензилметансульфоніл-аміно)-етиловий естер Метансуль фонілхлорид (18,9г, 0,1655моль) додавали краплями при 0°C до розчину Nбензилетаноламіну (10г, 0,0662моль, з етапу (і) вище) та триетиламін (27,6мл, 0,1987моль) у дихлорметані (100мл). Реакційну суміш перемішували при кімнатній температурі протягом 3 годин в атмосфері азоту та розподіляли між водою та дихлорметаном. Органічний шар відділяли, промивали водою та розсолом та сушили безводним натрій сульфатом. Розчинник випарювали під зменшеним тиском та залишок очищали колонковою хроматографією через силікагель, застосовуючи 3% метанол у дихлорметані, як елюент для отримання підзаголовної сполуки (12г) як твердого продукту. (ііі) 7-[2-(Бензил-метансульфоніл-аміно)-етил]9-окса-3,7-діаза-біцикло[3,3,1]нонан-3-карбонової кислоти трет-бутиловий естер Суспензію метансульфонової кислоти 2(бензил-метансульфоніл-аміно)-етилового естеру (4г, 0,0130моль; з етапу (іі) вище), 9-окса-3,7-діазабіцикло[3,3,1]нонан-3-карбонової кислоти третбутилового естеру (3г, 0,013моль; [дивись WO 01/28992]), сухий K 2CO3 (3,6г, 0,026моль) та літій бромід (2,2г, 0,026моль) у сухому ацетонітрилі (50мл) перемішували при 60°C протягом ночі під азотом. Реакційну суміш фільтрували та фільтрат концентрували під зменшеним тиском. Залишок очищали колонковою хроматографією через силікагель, застосовуючи 4% метанол у дихлорметані як елюент для отримання (5г) підзаголовної сполуки як твердого продукту. (іv) N-Бензил-N-[2-(9-окса-3,7-діазабіцикло[3,3,1]нон-3-іл)-етил]-метансульфонамід гідрохлорид 58 7-[2-(Бензил-метансульфоніл-аміно)-етил]-9окса-3,7-діаза-біцикло[3,3,1]нонан-3-карбонової кислоти трет-бутиловий естер (5г, 0,011моль, з етапу (ііі) вище) переносили у 20мл діоксану (насиченого газуватим HCI) та перемішували протягом ЗО хвилин при кімнатній температурі. Осаджений твердий матеріал фільтрували, промивали сухим ефіром та сушили під вакуумом для отримання (3г) заголовної сполуки як білуватого твердого продукту. Отримання О Метансуль фонової кислоти 2(метансульфоніл-фенетил-аміно)-етиловий естер (і) 2-фенетиламіно-етанол Суміш етаноламіну (10г, 0,162моль) та 1фенілетилброміду (5г, 0,027моль) перемішували при 120°C протягом 3 годин. Реакційну суміш розподіляли між водою та дихлорметаном. Органічний шар промивали водою та розсолом, сушили безводним натрій сульфатом та концентрували. Залишок очищали колонковою хроматографією через силікагель, застосовуючи 3% метанол у дихлорметані для отримання (2,5г) потрібного продукту як твердого матеріалу. (іі) Метансульфонової кислоти 2(метансульфоніл-фенетил-аміно)-етиловий естер Метансуль фонілхлорид (4,3г, 0,037моль) додавали краплями при 0°C при гарному перемішуванні до розчину 2-фенетиламіно-етанолу (2,5г, 0,015моль, з етапу (і) вище) та триетиламіну (4,6г, 0,045моль) у сухому ди хлорметані (50мл). Реакційну суміш перемішували при кімнатній температурі протягом 3 годин та гасили водою. Реакційну суміш екстрагували дихлорметаном. Органічний шар промивали водою та розсолом, сушили безводним натрій сульфатом та концентрували. Залишок очищали колонковою хроматографією через силікагель, застосовуючи 3% метанол у дихлорметані як елюент для отримання (3г) сполуки як твердого матеріалу. Отримання P МетансульФонової кислоти 2[метансульфоніл-(2-феноксіетил)-аміно]-етиловий естер (і) (2-Бром-етоксил)-бензол: Суспензію фенолу (5г, 0,053моль), 1,2диброметану (60г, 0,319моль) та K2CO3 (22г, 0,16моль) у сухому ацетонітрилі (100мл) перемішували при 60°C протягом ночі в атмосфері азоту. Реакційну суміш фільтрували та розчинник концентрували під зменшеним тиском. Залишок очищали колонковою хроматографією через силікагель, застосовуючи 10% етилацетат у петролейному ефірі як елюент для отримання (10г) підзаголовної сполуки як твердого матеріалу. (іі) 2-(2-Феноксіетиламіно)-етанол Суміш етаноламіну (18,2г, 0,298моль) та (2Брометоксил)-бензол (10г, 0,0497моль, з етапу (і) вище) перемішували при 120°C протягом 3 годин. Реакційну суміш розподіляли між водою та дихлорметаном. Органічний шар промивали водою та розсолом, сушили безводним натрій сульфатом та концентрували. Залишок очищали колонковою хроматографією через силікагель, застосовуючи 59 85232 4% метанол у дихлорметані для отримання (3,8г) підзаголовної сполуки як твердого матеріалу. (ііі) МетансульФонової кислоти 2[метансульфоніл-(2-феноксіетил)-аміно]-етиловий естер Метансуль фонілхлорид (5,5г, 0,058моль) додавали краплями при 0°C при гарному перемішуванні до розчину 2-(2-феноксіетиламіно)-етанолу (3,5г, 0,0193моль, з етапу (іі) вище) та триетиламіну (5,85г, 0,058моль) у сухому ди хлорметані (50мл). Реакційну суміш перемішували при кімнатній температурі протягом 3 годин та гасили водою. Сполуку екстрагували дихлорметаном. Органічний шар промивали водою та розсолом, сушили безводним натрій сульфатом та концентрували. Залишок очищали колонковою хроматографією через силікагель, застосовуючи 2% метанол у дихлорметані як елюент для отримання (4г) заголовної сполуки як жовтий твердий продукт. Отримання Q Трифлуор-метансульфонової кислоти 2(бензил-трифлуорметансульфоніл-аміно)етиловий естер (і): Трифлатний ангідрид (11,18г, 6,5мл, 39ммоль), розчинений у 90мл ДХМ, додавали краплями при гарному перемішуванні до розчину Nбензилетаноламіну (2г, 13,2ммоль) та діізопропілетиламіну (5,1г, 6,9мл, 39,7ммоль) у дихлорметані (160мл) при 0°C та перемішували при кімнатній температурі протягом 1 години в атмосфері азоту. Реакційну суміш гасили водою та екстрагували дихлорметаном. Органічний шар промивали водою та сушили натрій сульфатом. Випарювання розчиннику під зменшеним тиском дало 500мг заголовної сполуки як масла Отримання R Толуол-4-суль фонової кислоти 2-(1-бензил-3метил-уреїдо)-етиловий естер (і) 1-Бензил-1-(2-гідроксіетил)-3-метилсечовина Суміш N-бензилетаноламіну (3г, 0,0198моль) та Ν,Ν'-диметилсечовини перемішували при 130°C протягом ночі. Реакційну суміш охолоджували до кімнатної температури та сирий продукт очищали колонковою хроматографією через силікагель, застосовуючи 3% метанол у дихлорметані як елюент для отримання 3,5г підзаголовної сполуки як рідини. (іі) Толуол-4-сульФонової кислоти 2-(1-бензил3-метил-уреїдо)-етиловий естер nBuLi (2,8N, 1,01г, 0,0157моль) додавали при 78°C до розчину 1-бензил-1-(2-гідроксіетил)-3метил-сечовини (3г, 0,0143моль, з (і) вище) у 30мл сухого ТГФ та перемішували при тій же температурі протягом 30 хвилин в атмосфері азоту. Птолуолсульфонілхлорид (3г, 0,0157моль) у 20мл сухого ТГФ додавали краплями при -78°C та перемішували протягом 3 годин в атмосфері азоту. Реакцію гасили метанолом та розчинник випарювали під зменшеним тиском. Сирий продукт очищали колонковою хроматографією через силікагель, застосовуючи 12% метанол у дихлорметані як елюент для отримання 2,5г заголовної сполуки як твердого матеріалу. Отримання S 60 Етансульфонової кислоти 2-(бензилетансульфоніл-аміно)-етиловий естер Етансульфонілхлорид (2,1г, 16,6ммоль) додавали краплями при 0°C при гарному перемішуванні до розчину N-бензилетаноламіну (1г, 6,6ммоль) та триетиламіну (2,8мл. 19ммоль) у сухому ди хлорметані (10мл). Реакційну суміш перемішували при кімнатній температурі протягом 1 години та гасили водою. Сполуку екстрагували дихлорметаном, органічний шар промивали водою, розсолом та сушили безводним натрій сульфатом. Випарювання розчиннику під зменшеним тиском, а потім колонкова хроматографія через силікагель, застосовуючи 2% метанол у хлороформі як елюент дали (0,8г) заголовної сполуки як рідини. Приклади Приклад 1 Ν-[2-(7-Бензил-9-окса-3,7діазабіцикло[3,3,1]нон-3-іл)етил]-N-[2-(4ціанофеноксил)етил]сечовина 3-Бензил-9-окса-3,7-діаза-біцикло[3,3,1]нонан (0,18г, 0,82ммоль; [дивись WO 01/28992]) та толуол-4-сульфонової кислоти 2-{1-[2-(4ціанофеноксил)етил]-уреїдо}етиловий естер (0,50г, 1,24ммоль; дивись Отримання D вище) змішували у сухому ацетонітрилі (15мл) та перемішували при 60°C протягом ночі. ДХМ (10мл) додавали, разом з 0,5г PS-NCO (ізоціанат на полімерній підкладці). Суміш перемішували протягом 2 годин, тоді фільтрували та випарювали. Сирий продукт переносили на шар SCX-II (катіонообмінний), шар тоді елювали ДХМ:МеОН (NН3насиченим), 80:20. Продукт далі очищали на препаративній колонці Horizon (40г, А: ДХМ(1%МеОН), В: ДХМ/МеОН(NН3-sat.), 80:20. Градієнт 0-30% В для 1080мл). Продукт далі очищали препаративноюВЕРХ та під кінець екстрагували ДХМ/Nа2СО3 (водн.) для отримання 193мг (51,9%) заголовної сполуки. 13 C ЯМР (100,6МГц, CDCI3) δ. 162,2, 161,5, 136,2, 134,3, 129,9, 128,6, 127,7, 119,3, 115,3, 104,4, 68,6, 67,9, 64,2, 61,4, 57,3, 56,1, 49,2, 48,7 Приклад 2 N-[2-(7-Бензил-9-окса-37діазабіцикло[3,3,1]нон-3-іл)етил]-N-[2-(4ціанофеноксил)етил]метансульфонамід, тартрат Метансуль фонової кислоти 2-{[2-(4ціанофеноксил)етил]метансульфоніламіно}етиловий естер (0,60г, 1,65ммоль; дивись Отримання С(ііі) вище) та 3-бензил-9-окса-3,7діаза-біцикло[3,3,1]нонан (0,36г, 1,65ммоль; [дивись WO 01/28992]) змішували в ацетонітрилі (12мл). Утворений розчин ділили на 3 рівні частини, котрі переносили у мікрохвильові камери. K2CO3 (0,11г, 0,46ммоль) додавали до кожної камери та реакцію проводили у мікрохвильовому реакторі протягом 10 хвилин при 160°C. Реакційні суміші фільтр ували, поєднували та тоді переносили на 5г шару SCX-II, шар промивали ДХМ, ацетонітрилом та ДХМ:MeOH (80:20) доки увесь (відносно) аполярний матеріал не елювався. Продукт тоді елювали ДХМ:МеОН(NН3-насиченим) 80:20. Аналіз 1H ЯМР показав залишковий оксабіспідиновий вихідний матеріал, та тому продукт розчиняли у ДХМ (30мл) та додавали 300мг ізоціанату на
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel oxabispidine compounds and their use in the treatment of cardiac arrhythmias
Автори англійськоюBjoere Annika, Gran Ulrik, Strandlund Gert
Назва патенту російськоюОксабиспидиновые соединения и их применение в лечении сердечных аритмий
Автори російськоюБйоре Анника, Гран Ульрик, Страндлунд Герт
МПК / Мітки
МПК: C07D 498/08, A61P 9/06
Мітки: сполуки, лікуванні, аритмій, серцевих, застосування, оксабіспідинові
Код посилання
<a href="https://ua.patents.su/37-85232-oksabispidinovi-spoluki-ta-kh-zastosuvannya-u-likuvanni-sercevikh-aritmijj.html" target="_blank" rel="follow" title="База патентів України">Оксабіспідинові сполуки та їх застосування у лікуванні серцевих аритмій</a>
Попередній патент: Короткохвильова газорозрядна галогенна лампа низького тиску
Наступний патент: Пристрій для підсилення перекриття будинків
Випадковий патент: Спосіб класифікації зразків сої за вмістом білка й олії в насінні