Похідне 7-піперидиналкіл-3,4-дигідрохінолону
Номер патенту: 105187
Опубліковано: 25.04.2014
Автори: Шібата Цуоші, Канума Косуке, Кавамура Мадока, Міякоші Наокі
Формула / Реферат
1. Сполука, представлена формулою (І), її фармацевтично прийнятна сіль або гідрат:
[Формула 1]
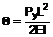 , (I)
, (I)
де у формулі (І)
R - атом водню або С1-6алкільна група;
А1, А2 та А3, які можуть бути однакові або різні, кожний, являють собою атом водню, атом галогену, С1-6алкільну групу або С1-6алкоксигрупу;
X - С1-6алкіленова група;
Y - зв'язок або С1-6алкіленова група;
Z - зв'язок або С1-6алкіленова група, причому С1-6алкіленова група може бути заміщена арильною групою;
W - зв'язок або атом кисню;
Су - фенільна група або піридильна група, де фенільна або піридильна група може мати від одного до трьох замісників, які можуть бути однакові або різні, вибраних з-поміж атома галогену, ціаногрупи, С1-6алкільної групи, С1-6алкоксигрупи, причому С1-6алкільна група або С1-6алкоксигрупа може бути заміщена одним-трьома атомами галогену, та С2-6алканоїльної групи, або
сполука, представлена формулою (І), її фармацевтично прийнятна сіль або гідрат, де у формулі (І)
R - атом водню;
А1, А2 та А3 - кожний - атоми водню;
X - С1-6алкіленова група;
Y - зв'язок;
Z - зв'язок або С1-6алкіленова група, причому С1-6алкіленова група може бути заміщена арильною групою;
W - зв'язок або атом кисню;
Су - фенільна або піридильна група, де фенільна або піридильна група може мати від одного до трьох замісників, які можуть бути однакові або різні, вибраних з-поміж атома галогену, ціаногрупи, С1-6алкільної групи, С1-6алкоксигрупи, причому С1-6алкільна група або С1-6алкоксигрупа може бути заміщена одним-трьома атомами галогену, та С2-6алканоїльної групи, або
сполука, представлена формулою (І), її фармацевтично прийнятна сіль або гідрат, де у формулі (І),
R - атом водню;
А1, А2 та А3 - кожний - атоми водню;
X - метиленова група, де метиленова група може бути заміщена метиловою групою;
Y - зв'язок;
Z - зв'язок або метиленова група;
W - зв'язок або атом кисню;
Су - фенільна група, де фенільна група може мати від одного до трьох замісників, які можуть бути однакові або різні, вибраних з-поміж атома галогену, С1-6алкільної групи, С1-6алкоксигрупи та С2-6алканоїльної групи.
2. Сполука, її фармацевтично прийнятна сіль або гідрат за п. 1, де сполука, представлена формулою (І), вибрана з групи:
3-метоксі-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід,
3-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід,
3,5-дифтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід,
3,4-дифтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід,
4-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід,
3-хлор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід,
3-метил-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід,
3,5-дихлор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід,
3,4-дихлор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід,
4-фтор-3-метил-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід,
4-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}-3-(трифторметил)бензамід,
3-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}-5-(трифторметил)бензамід,
3,5-диметоксі-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід,
N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід,
N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}-2,2-дифенілацетамід,
4-хлор-3-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід,
3-бром-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід,
3-фтор-5-метоксі-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід,
3-хлор-4-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід,
3-ацетил-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід,
3,4,5-трифтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід,
4-фтор-3-метоксі-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід,
3-хлор-5-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід,
3-ціан-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід,
5-xлop-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}піридин-3-карбоксамід,
3-хлор-5-метоксі-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід,
4-хлор-3-метил-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід,
2-(3-хлор-4-фторфеноксі)-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}ацетамід,
2-(3-хлорфеноксі)-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}ацетамід,
3-хлор-4-фтор-N-{1-[1-(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)етил]піперидин-4-іл}бензамід або
N-{1-[(6-фтор-2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}-3-метоксібензамід.
3. Фармацевтична композиція, яка містить як діючий компонент сполуку, її фармацевтично прийнятну сіль або гідрат за п. 1 або 2.
4. Фармацевтична композиція за п. 3, яка являє собою антагоніст рецептора гормону, що концентрує меланін.
5. Профілактичний або лікувальний засіб, який містить як діючий компонент сполуку, її фармацевтично прийнятну сіль або гідрат за п. 1 або 2, проти депресії, бентежності (наприклад, загального бентежного розладу, синдрому посттравматичного стресу, панічного синдрому, синдрому нав'язливої поведінки або страху публічних невдач), дефіциту уваги, манії, маніакально-депресивного психозу, шизофренії, розладів настрою, стресу, розладів сну, припадків, погіршення пам'яті, погіршення судження, слабоумства, амнезії, делірію, опасистості, розладів харчування, розладів апетиту, гіперфагії, булімії, патологічної відрази до їжі, діабету, серцево-судинних розладів, гіпертензії, дисліпідемії, інфаркту міокарда, розладів руху (наприклад, хвороби Паркінсона, епілепсії, судоми або дриґот), зловживання наркотиками, наркозалежності або статевих розладів.
Текст
Реферат: Задача Створення нової сполуки, її фармацевтично прийнятної солі або гідрату для профілактики або лікування депресії, бентежності (наприклад, загального бентежного розладу, синдрому посттравматичного стресу, панічного синдрому, синдрому нав'язливої поведінки або страху публічних невдач), дефіциту уваги, манії, маніакально-депресивного психозу, шизофренії, розладів настрою, стресу, розладів сну, припадків, погіршення пам'яті, погіршення судження, слабоумства, амнезії, делірію, опасистості, розладів харчування, розладів апетиту, гіперфагії, булімії, патологічної відрази до їжі, діабету, серцево-судинних розладів, гіпертензії, дисліпідемії, інфаркту міокарда, розладів руху (наприклад, хвороби Паркінсона, епілепсії, судоми або дриґот), зловживання наркотиками, наркозалежності або статевих розладів, на основі дії антагоніста рецептора гормону, що концентрує меланін (рецептора МСН). Вирішення задачі Сполука, її фармацевтично прийнятна сіль або гідрат, представлені формулою (І). [Формула(І)] A 1 O A O N R X A 3 2 Y N N H z W Cy UA 105187 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки [0001] Цей винахід стосується сполуки, яка чинить антагоністичну дію проти рецептора гормону, що концентрує меланін, її фармацевтично прийнятної солі або гідрату. Передумови створення винаходу [0002] Депресії та бентежність – це найбільш поширені психіатричні захворювання. Вважається, що останнім часом вірогідність захворіти на депресію та бентежність протягом життя постійно зростає. В якості антидепресантів на основі моноамінової гіпотези створені трициклічні антидепресанти (TCA), селективні інгібітори повторного засвоєння серотоніну (SSRI), інгібітори повторного засвоєння серотоніну та норадреналіну (SNRI)та подібні. Бензодіазепіни на основі механізму -аміноолійної кислоти (GABA) використовуються як анксіолітики. Останнім часом показано, що SSRI та SNRI також ефективно лікують такі бентежні стани, як панічний синдром та синдром нав’язливої поведінки, проти яких бензодіазепіни не здатні діяти, і що їх можна використовувати на першому етапі лікування бентежних розладів. Однак SSRI та SNRI не діють на хворих, які страждають на рефрактерну до лікування депресію, і потрібно кілька тижнів, щоб виявилася якась антидепресивна та анксіолітична дія, наприклад, несприятлива. Отже, є доцільним створення антидепресивного та анксіолітичного засобу на основі іншого механізму, ніж застосований у відомих ліках. [0003] Гормон, що концентрує меланін (MCH) – нейропептид, який складається з 19 амінокислот, біосинтезується й поширюється у лімбічній системі, а також у мозку. Рецептор гормону, що концентрує меланін-1 (MCH1R) та рецептор гормону, що концентрує меланін-2 (MCH2R) вже відомі як два підтипи рецепторів MCH. MCH2R не має експресії у гризунів, і його фізіологічні функції ще не з’ясовані; однак відомо, що MCH1R тісно пов’язаний з поведінкою при їжі та метаболізмом енергії. Зокрема, повідомлялося, що споживання корму збільшується при впорскуванні MCH щурам. Також є повідомлення, що маса тіла зменшується, а метаболізм посилюється у MCH-дефектних генно-модифікованих мишей (див. Непатентний документ 1). Отже, антагоніст MCH1R може використовуватися для профілактики та лікування опасистості, розладів харчування, розладів апетиту, гіперфагії, булімії, патологічної відрази до їжі тощо. З іншого боку, повідомлялося, що MCH1R бере активну участь у регулюванні реакцій на стрес та емоцій. Антагоніст MCH1R протидіє активізації осі гіпоталамус-гіпофіз-надниркова залоза (HPA) під дією MCH, й виробляється нейтралізуюче антитіло проти фактору вивільнення кортикотропіну (CRF). Вважається, що вивчення MCH з використанням позбавлених MCH1R мишей показує, що MCH1R активізує систему HPA, сприяючи виділенню CRF з гіпоталамусу. MCH1R переважно розподіляється у сусідніх тканинах, що пов’язано з мотивацією та винагородою. Після впорскування MCH до цього сайту спостерігаються депресивні симптоми при випробуванні вимушеним плаванням, тоді як позбавлені MCH миші виявляють антидепресивні симптоми. Антагоніст негативно регулює активність допамінергійних нейронів, пов’язаних з винагородою у сусідніх тканинах. Більш того, ATC0175 – непептидний антагоніст MCH1R – чинить антидепресивну та анксіолітичну дію в експериментальних моделях на тваринах (непатентний документ 2). На підставі цих фактів можна припустити, що MCH1R бере участь не лише у контролі поведінки при їжі та метаболізму енергії, а й у появі депресії та бентежності, а відтак можна очікувати, що антагоніст рецептора MCH, зокрема, антагоніст MCH1R, може слугувати антидепресивним та анксіолітичним засобом, механізм дії якого відрізняється від відомих. [0004] Останнім часом з’явилися описи антагоністів рецепторів MCH, які мають нафталіновий скелет та 1,3-бензодіоксольний скелет, у патентному документі 1 та непатентних документах 3, 4, 5 та 6. Втім, у цих документах не наводиться й не пропонується структура сполуки згідно з цим винаходом. [0005] Патентний документ 1: Опублікована патентна заявка США № 2005/209274 Непатентний документ 1: Trends Endocrinol Metab vol. 11, p. 299-303 (2000) Непатентний документ 2: Drug Development Research vol. 65, p. 278-290 (2005) Непатентний документ 3: 224th The American Chemical Society MEDI-343 (2002) Непатентний документ 4: Bioorganic & Medicinal Chemistry Letters vol. 16, p. 5445-5450 (2006) Непатентний документ 5: Bioorganic & Medicinal Chemistry Letters vol. 15, p. 3412-3416 (2005) Непатентний документ 6: Bioorganic & Medicinal Chemistry Letters vol. 17, p. 874-878 (2007) Сутність винаходу 1 UA 105187 C2 5 10 15 20 Завдання, що їх вирішує винахід [0006] Мета цього винаходу полягає у створенні нової сполуки, придатної для попередження або лікування таких захворювань, як депресія, бентежність (наприклад, загальний бентежний розлад, синдром посттравматичного стресу, панічний синдром, синдром нав’язливої поведінки або страх публічних невдач), дефіцит уваги, манія, маніакально-депресивний психоз, шизофренія, розлади настрою, стрес, розлади сну, припадки, погіршення пам’яті, погіршення судження, слабоумство, амнезія, делірій, опасистість, розлади харчування, розлади апетиту, гіперфагія, булімія, патологічна відраза до їжі, діабет, серцево-судинні розлади, гіпертензія, дисліпідемія, інфаркт міокарду, розлади руху (наприклад, хвороба Паркінсона, епілепсія, судома або дриґоти),наркозалежність або статеві розлади, на основі дії антагоніста рецептора MCH, її фармацевтично прийнятної солі або гідрату. Засоби вирішення завдань [0007] В результаті інтенсивних досліджень авторами цього винаходу встановлено, що сполука 7піперидиналкіл-3,4-дигідрохінолону, представлена наступною формулою (I), чинить могутню антагоністичну дію щодо рецептора MCH. На підставі цього відкриття створено даний винахід. [0008] Зокрема, цей винахід пропонує: [0009] 1) Сполуку, представлену формулою (I), її фармацевтично прийнятну сіль або гідрат: [формула 1] 25 30 35 40 45 50 де у формулі (I) R – атом водню або C1-6 алкільна група; 1 2 3 A , A та A , які можуть бути однакові або різні, кожний з яких являє собою атом водню, атом галогену, C1-6 алкільну групу або C1-6 алкоксігрупу; X - C1-6 алкіленова група; Y – зв’язок або C1-6 алкіленова група; Z - зв’язок або C1-6 алкіленова група, де C1-6 алкіленова група може бути заміщена арильною групою; W – зв’язок або атом кисню; Cy – арильна або гетероарильна група, де арильна або гетероарильна група може мати від одного до трьох замісників, які можуть бути однакові або різні, обраних з-поміж атома галогену, ціаногрупи, C1-6 алкільної групи, C1-6 алкоксігрупи, причому C1-6 алкільна група або C1-6 алкоксігрупа може бути заміщена 1-3 атомами галогену, та C2-6 алканоїльної групи; [0010] 2) Сполуку, її фармацевтично прийнятну сіль або гідрат за п. 1), де у формулі (I) R – атом водню; 1 2 3 A , A та A кожний – атом водню; X - C1-6 алкіленова група; Y – зв’язок; Z - зв’язок або C1-6 алкіленова група, де C1-6 алкіленова група може бути заміщена арильною групою; W – зв’язок або атом кисню; Cy – фенільна або піридільна група, де фенільна або піридільна група може мати від одного до трьох замісників, які можуть бути однакові або різні, обраних з-поміж атома галогену, ціаногрупи, C1-6 алкільної групи, C1-6 алкоксігрупи, причому C1-6 алкільна група або C1-6 алкоксігрупа може бути заміщена 1-3 атомами галогену, та C2-6 алканоїльної групи; [0011] 2 UA 105187 C2 5 10 15 20 25 30 35 40 45 50 55 60 3) Сполуку, її фармацевтично прийнятну сіль або гідрат за п. 1), де у формулі (I) R – атом водню; 1 2 3 A , A та A кожний – атом водню; X – метиленова група, причому метиленова група може бути заміщена метиловою групою; Y – зв’язок; Z – зв’язок або метиленова група; W – зв’язок або атом кисню; Cy - фенільна група, де фенільна група може мати від одного до трьох замісників, які можуть бути однакові або різні, обраних з-поміж атома галогену, C1-6 алкільної групи, C1-6 алкоксігрупи та C2-6 алканоїльної групи; 4) Сполуку, її фармацевтично прийнятну сіль або гідрат за п. 1), де сполука, представлена формулою (I), являє собою 3-метоксі-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3,5-дифтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл }бензамід, 3,4-дифтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 4-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3-хлор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3-метил-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3,5-дихлор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3,4-дихлор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 4-фтор-3-метил-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 4-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}-3(трифторметил)бензамід, 3-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}-5(трифторметил)бензамід, 3,5-діметоксі-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}-2,2-дифенілацетамід, 4-хлор-3-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3-бром-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3-фтор-5-метоксі-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3-хлор-4-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3-ацетил-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3,4,5-трифтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 4-фтор-3-метоксі-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3-хлор-5-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3-ціан-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 5-хлор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}піридин-3карбоксамід, 3-хлор-5-метоксі-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 4-хлор-3-метил-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 2-(3-хлор-4-фторфеноксі)-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4іл}ацетамід, 2-(3-хлорфенксі)-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}ацетамід, 3-хлор-4-фтор-N-{1-[1-(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)етил]піперидин-4-іл}бензамід або N-{1-[(6-фтор-2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}-3-метоксібензамід; [0012] 5) Фармацевтичну композицію, яка містить сполуку, її фармацевтично прийнятну сіль або гідрат за пп. 1)- 4) в якості діючого компонента; [0013] 6) Фармацевтичну композицію за п.5), яка є антагоністом рецептора гормону, що концентрує меланін; [0014] 7) Профілактичний або лікувальний засіб, який містить сполуку, її фармацевтично прийнятну сіль або гідрат за пп. 1)- 4) в якості діючого компонента, проти депресії, бентежності, дефіциту уваги, манії, маніакально-депресивного психозу, шизофренії, розладів настрою, стресу, розладів сну, приступів, погіршення пам’яті, погіршення судження, слабоумства, амнезії, білої гарячки, опасистості, розладів харчування, розладів апетиту, гіперфагії, булімії, патологічної відрази до їжі, діабету, серцево-судинних розладів, гіпертензії, дисліпідемії, інфаркту міокарду, 3 UA 105187 C2 5 10 15 20 25 30 35 40 45 50 55 розладів руху, наркозалежності або статевих розладів. Переваги винаходу [0015] Встановлено, що сполука згідно з винаходом посідає антагоністичну активність щодо рецепторів МСН. Лікарський засіб, який містить сполуку згідно з винаходом, є придатний для профілактики або лікування депресії, бентежності (наприклад, загального бентежного розладу, синдрому посттравматичного стресу, панічного синдрому, синдрому нав’язливої поведінки або страху публічних невдач), дефіциту уваги, манії, маніакально-депресивного психозу, шизофренії, розладів настрою, стресу, розладів сну, припадків, погіршення пам’яті, погіршення судження, слабоумства, амнезії, делірію, опасистості, розладів харчування, розладів апетиту, гіперфагії, булімії, патологічної відрази до їжі, діабету, серцево-судинних розладів, гіпертензії, дисліпідемії, інфаркту міокарду, розладів руху (наприклад, хвороби Паркінсона, епілепсії, судоми або дриґот),наркозалежності або статевих розладів, на основі дії антагоніста рецептора MCH. Найкращий варіант здійснення винаходу [0016] Терміни, які вживаються у цьому описі, визначаються наступним чином. [0017] "Атом галогену" означає атом фтору, атом хлору, атом брому чи атом йоду. "C1-6 алкільна група" означає алкільну групу з прямим ланцюгом, яка має від 1 до 6 атомів вуглецю, або алкільну групу з розгалуженим ланцюгом, яка має від 3 до 6 атомів вуглецю. Алкільна група з прямим ланцюгом представляє метилову, етилову, пропилову, бутилову, пентилову та гексилову групи. Алкільна група з розгалуженим ланцюгом представляє, наприклад, ізопропилову, ізобутилову, трет-бутилову, ізопентилову, 1-еилпропилову та ізогексилову групи. "C1-6 алкоксігрупа" означає алкоксігрупу з прямим ланцюгом, яка має від 1 до 6 атомів вуглецю, або алкоксігрупу з розгалуженим ланцюгом, яка має від 3 до 6 атомів вуглецю. Алкоксігрупа з прямим ланцюгом представляє метоксігрупу, етоксігрупу, пропоксігрупу, бутоксігрупу, пентилоксігрупу та гексилоксігрупу. Алкоксігрупа з розгалуженим ланцюгом представляє, наприклад, ізопропоксігрупу, ізобутоксігрупу, трет-бутоксігрупу, ізопентилоксігрупу, a 1-етилпропоксігрупу та ізогексилоксігрупу. "C1-6 алкіленова група" означає алкіленову групу з прямим ланцюгом, яка має від 1 до 6 атомів вуглецю, або алкіленову групу з розгалуженим ланцюгом, яка має від 3 до 6 атомів вуглецю, наприклад, метиленову, етиленову, пропиленову, бутиленову, пентиленову, гексиленову, ізопропиленову, ізобутиленову, трет-бутиленову, 1-етилпропиленову, ізогексиленову групу тощо. [0018] "C2-6 алканоїльна група" означає карбонільну групу, яка має C 1-5 алкільну групу. Як приклади можна навести метилкарбонільну, етилкарбонільну, пропилкарбонільну, бутилкарбонільну, пентилкарбонільну, гексилкарбонільну, ізопропилкарбонільну, ізобутилкарбонільну, третбутилкарбонільну, ізопентилкарбонільну, 1-етилпропилкарбонільну, ізогексилкарбонільну групу тощо. "Арильна група» - це ароматична карбоциклічна група від моно- до тетрациклічної, утворена 6 – 18 атомами вуглецю, наприклад, фенільна, нафтильна, антраценільна та 9Н-флуоренільна групи. "Гетероарильна група" - це ароматична гетероциклічна група від моно- до біциклічної, утворена 5 – 10 атомами, у тому числі 1 – 3 гетероатомами, обраними з-поміж атомів азоту, кисню та сірки, які відрізняються від атомів вуглецю. До прикладів належать піролільна, піразолільна, імідазолільна, фурильна, оксазолільна, тієнільна, тіазолільна, ізотіазолільна, піридільна, піримідинільна, піридазинільна, піразинільна, індолільна, бензофурильна, бензотієнільна, бензімідазолільна, бензоксазолільна, бензотіазолільна, бензопіразолільна, бензізоксазолільна, бензізотіазолільна, хінолільна, ізохінолільна, хіназолінильна, хіноксалінильна, фталазинільна, хінолінільна та 9-ксантенільна групи. [0019] В одному аспекті цей винахід стосується сполуки 7-піперидиналкіл-3,4-дигідрохінолону, її фармацевтично прийнятної солі або гідрату, представлених формулою (I): [0020] [Формула 2] 4 UA 105187 C2 1 5 10 15 20 25 30 35 40 2 3 {де (у формулі (I)), R, X, Y, Z, W, A , A , A та Cy є такі, як визначено вище}. Переважно сполука згідно з винаходом має такі характеристики. У формулі (I) R – атом 1 2 3 водню, A , A та A кожний представляють атом водню, X - C1-6 алкіленова група, Y – зв’язок, Z – зв’язок або C1-6 алкіленова група (де C1-6 алкіленова група може бути заміщена арильною групою), W – зв’язок або атом кисню, а Cy –фенільна або піридільна група (де фенільна або піридільна група може мати від одного до трьох замісників, які можуть бути однакові або різні, обраних з-поміж атома галогену, ціаногрупи, C1-6 алкільної групи, C1-6 алкоксігрупи, причому C1-6 алкільна група або C1-6 алкоксігрупа може бути заміщена 1 – 3 атомами галогену, та C2-6 алканоїльної групи). Інший переважний варіант сполуки згідно з винаходом виглядає наступним чином. У 1 2 3 формулі (I) R – атом водню, A , A та A кожний представляють атом водню, X – метиленова група (причому метиленова група може бути зміщена метиловою групою), Y- зв’язок, Z – зв’язок або метиленова група, W – зв’язок або атом кисню, а Cy –фенільна група (де фенільна група може мати від одного до трьох замісників, які можуть бути однакові або різні, обраних з-поміж атома галогену, C1-6 алкільної групи, C1-6 алкоксігрупи та C2-6 алканоїльної групи). Зазначена фенільна група переважно являє собою незаміщену фенільну групу або заміщену фенільну групу, представлену однією з формул (IIa) - (IId): [0021] [Формула 3] A B C {де R , R та R , які можуть бути однакові або різні, кожний представляють атом водню, C1-6 алкільну групу, C1-6 алкоксігрупу або C2-6 алканоїльну групу}. Переважними окремими сполуками згідно з винаходом є такі: 3-метоксі-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3,5-дифтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3,4-дифтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 4-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3-хлор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3-метил-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3,5-дихлор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3,4-дихлор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 4-фтор-3-метил-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 4-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7іл)метил]піперидин-4-іл}-3(трифторметил)бензамід, 3-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}-5(трифторметил)бензамід, 3,5-діметоксі-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}-2,2-дифенілацетамід, 5 UA 105187 C2 5 10 15 20 25 30 35 40 45 50 55 60 4-хлор-3-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3-бром-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3-фтор-5-метоксі-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3-хлор-4-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3-ацетил-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3,4,5-трифтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 4-фтор-3-метоксі-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3-хлор-5-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 3-ціан-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 5-хлор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}піридин-3карбоксамід, 3-хлор-5-метоксі-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 4-хлор-3-метил-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}бензамід, 2-(3-хлор-4-фторфеноксі)-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4іл}ацетамід, 2-(3-хлорфеноксі)-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}ацетамід, 3-хлор-4-фтор-N-{1-[1-(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)етил]піперидин-4-іл}бензамід, N-{1-[(6-фтор-2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4-іл}-3-метоксібензамід, їх фармацевтично прийнятні солі або гідрати. В іншому аспекті цей винахід стосується лікарського засобу, який містить принаймні одну із сполук або їх фармацевтично прийнятних солей,наведених у цьому описі,в якості діючого компонента. Ще одним аспектом цього винаходу є лікарський засіб, який містить в якості діючого компонента принаймні одну із сполук або їх фармацевтично прийнятних солей, наведених у цьому описі, як антагоніста рецептора МСН. Також одним з аспектів цього винаходу є профілактичний або лікувальний засіб, який містить в якості діючого компонента принаймні одну із сполук або їх фармацевтично прийнятних солей чи гідратів, наведених у цьому описі, проти депресії, бентежності (наприклад, загального бентежного розладу, синдрому посттравматичного стресу, панічного синдрому, синдрому нав’язливої поведінки або страху публічних невдач), дефіциту уваги, манії, маніакальнодепресивного психозу, шизофренії, розладів настрою, стресу, розладів сну, припадків, погіршення пам’яті, погіршення судження, слабоумства, амнезії, делірію, опасистості, розладів харчування, розладів апетиту, гіперфагії, булімії, патологічної відрази до їжі, діабету, серцевосудинних розладів, гіпертензії, дисліпідемії, інфаркту міокарду, розладів руху (наприклад, хвороби Паркінсона, епілепсії, судоми або дриґот),наркозалежності або статевих розладів. Переважно профілактичний або лікувальний засіб, який містить в якості діючого компонента принаймні одну із сполук або їх фармацевтично прийнятних солей чи гідратів, наведених у цьому описі, застосовується проти депресії та бентежності. Також переважно профілактичний або лікувальний засіб, який містить в якості діючого компонента принаймні одну із сполук або їх фармацевтично прийнятних солей чи гідратів, наведених у цьому описі, застосовується проти опасистості, розладів харчування, розладів апетиту, гіперфагії, булімії, патологічної відрази до їжі. Переважно сполука за винаходом є могутнім антагоністом рецепторів МСН, але посідає низьку зв’язувальну спорідненість до каналу hERG. Сполука з високою спорідненістю до каналу hERG може чинити несприятливу бічну дію на серцево-судинну систему. Отже, сполука, яка чинить таку дію, має посідати високу терапевтичну ефективність і водночас високу безпечність. [0022] Сполуку (I) за винаходом, її фармацевтично прийнятні солі та гідрати можна синтезувати різними шляхами органічного синтезу, відомими фахівцям. Деякі приклади таких методів наведені далі, однак винахід не обмежується лише цими прикладами. У наведених схемах 1 2 3 реакцій R, X, Y, Z, W, A , A , A та Cy мають однакові значення, які визначені вище. [0023] "Інертними розчинниками" можуть бути, наприклад, ароматичні розчинники, як бензол, толуол, ксилол та піридин; вуглеводневі розчинники, як гексан, пентан та циклопентан; галогеновані вуглеводневі розчинники, як дихлорметан, хлороформ, 1,2-дихлоретан та тетрахлорид вуглецю; етерні розчинники, тетрагідрофуран, діетилетер, 1,2-діметоксіетан та 1,4діоксан; ефірні розчинники, як етилацетат та етилформіат; спиртові розчинники, як метанол, етанол, ізопропиловий спирт, трет-бутиловий спирт та етиленгліколь; кетонові розчинники, як ацетон та метилетилкетон; амідні розчинники, як N,N-діметилформамід, N-метилпіролідон та N,N-діметилацетамід; сульфоксидні розчинники, як діметилсульфоксид; нітрилові розчинники, 6 UA 105187 C2 5 10 15 20 25 як ацетонітрил та пропіонітрил; вода та гомогенні й негомогенні суміші зазначених розчинників. Ці інертні розчинники обирають відповідно до різних умов реакції, як відомо фахівцям. [0024] "Основами" є, наприклад, гідриди лужних або лужноземельних металів, як от гідрид літію, гідрид натрію, гідрид калію та гідрид кальцію; аміди лужних або лужноземельних металів, як от амід літію, амід натрію, діізопропиламід літію, діциклогексиламід літію, гексаметилдісилазид літію, гексаметилдісилазид натрію та гексаметилдісилазид калію; нижчі алкоксиди лужних або лужноземельних металів, як от метоксид натрію, етоксид натрію та трет-бутоксид калію; алкіл літієві сполуки, як от бутиллітій, сек-бутиллітій, трет-бутиллітій та метилітій; гідроксиди лужних або лужноземельних металів, як от гідроксид натрію, гідроксид калію, гідроксид літію та гідроксид барію; карбонати лужних або лужноземельних металів, як от карбонат натрію, карбонат калію та карбонат цезію; бікарбонати лужних або лужноземельних металів, як от бікарбонат натрію та бікарбонат калію; аміни, як от триетиламін, N-метилморфолін, N,Nдіізопропилетиламін, 1,8-діазабіцикло[5.4.0]ундец-7-ен (DBU), 1,5- діазабіцикло [4.3.0]нон-5-ен (DBN) та N,N-діметиланілін; й основні гетероциклічні сполуки, як от піридин, імідазол та 2,6лутидин. Ці основи обирають відповідно до різних умов реакції, як відомо фахівцям. "Кислотою" є, наприклад, неорганічна кислота, як от соляна, бромисто-воднева, сірчана, азотна та фосфорна кислоти, й органічна кислота, як от p-толуолсульфонова, метансульфонова, трифтороцтова, мурашина та оцтова кислоти. Ці кислоти обирають відповідно до різних умов реакції, як відомо фахівцям. [Спосіб одержання 1] Сполуку (I) згідно з винаходом можна одержати способом, зображеним на схемі 1. (Схема 1) [0026] [Формула 4] 1 30 35 40 де X представляє зв’язок або C1-5 алкіленову групу; 2 X представляє зв’язок або C1-4 алкіленову групу; a X представляє атом галогену або гідроксильну групу; 1 R представляє C1-5 алкільну групу; 2 1 за умови, що сума атомів вуглецю X та R становить від 1 до 5; 1 P представляє атом водню або захисну групу аміногрупи, наприклад, метоксікарбонільну групу, етоксікарбонільну групу, трет-бутоксікарбонільну групу, бензилоксікарбонільну групу, ацетильну групу або бензильну групу (див. Protective Groups in Organic Synthesis, the third edition, John Wiley & Sons, INC.). [0027] Етап 1: Карбонільну сполуку (1) або (2) та амінову сполуку (3) піддають реакції відновлювального амінування з використанням відновлювача в інертному розчиннику у присутності кислоти або без неї. В результаті можна одержати сполуку (4). (див. Comprehensive 7 UA 105187 C2 5 10 15 20 25 30 Organic Transformations, 1989, VCH Publishers, INC.). Використовують наявну на ринку або відому карбонільну сполуку (1) або (2). Більш того, карбонільну сполуку (1) або (2) можна синтезувати різноманітними відомими фахівцям способами органічного синтезу з наявних на ринку або відомих сполук. Відновлювачем може бути, наприклад, триацетоксіборогідрид натрію, ціаноборогідрид натрію та борогідрид натрію. 1 Етап 2: Захисну групу P аміногрупи сполуки (4) видаляють різними прийомами органічного синтезу, відомими фахівцям (див. Protective Groups in Organic Synthesis, the third edition, John Wiley & Sons, INC.). В результаті можна одержати амінову сполуку (5). Більш того, якщо у 1 сполуці (3) P являє собою атом водню, амінову сполуку (5) можна одержати одразу у реакції відновлювального амінування за етапом 1. a Етап 3: Амінову сполукау (5) та кислий галід (6), де X є атом водню, або сполуку карбонової a кислоти (6), де X – гідроксильна група, піддають реакції амідування в інертному розчиннику у присутності основи або без неї. В результаті можна одержати сполуку (I) за винаходом. Кислий галід (6) або сполука карбонової кислоти(6) наявні на ринку або відомі. Більш того, кислий галід (6) або сполуку карбонової кислоти(6) можна синтезувати різноманітними відомими фахівцям способами органічного синтезу з наявних на ринку або відомих сполук. У застосованій тут реакції амідування використовують конденсуючий засіб, наприклад, N,N'діциклогексилкарбодіімід, 1-етил-3-(3-діметиламінпропил)карбодіімід гідрохлорид, дифенілфосфорилазид або карбонілдіімідазол, в інертному розчиннику у присутності основи або без неї, або ж реакцію амідування ведуть через змішаний кислотний ангідрид із застосуванням етилхлоркарбонату, ізобутилхлоркарбонату, півалоїлхлориду тощо (див. Fundamental and Experiment of Peptide Synthesis, 1985, Maruzen Co., Ltd.). У реакції амідування з конденсуючим засобом за потреби можна застосовувати добавку, наприклад, 1гідроксібензотриазол. [0028] Більш того, карбонільну сполуку, яка є вихідним матеріалом у схемі 1, можна одержати як сполуку (11) або (13) способом, наведеним у схемі 2. (Схема 2) [0029] [Формула 5] 2 35 де R - C1-6 алкільна група. [0030] Етап 4: Сполуку карбонової кислоти (7) піддають реакції Фріделя-Крафтса у присутності кислотного каталізатора. В результаті можна одержати карбонільну сполуку (8). Кислотним каталізатором може бути трихлорид алюмінію, хлорсульфонова кислота та поліфосфорна 8 UA 105187 C2 5 10 15 20 25 кислота (див. Tetrahedron, 2007, Vol. 63, p. 389-395). Етап 5: Карбонільну сполуку (8) піддають реакції Шмідта (див. Strategic Applications of Named Reactions in Organic Synthesis, 2005, Elsevier, INC., або патент США № 2006/0063799)з використанням азиду натрію або подібного у присутності кислотного каталізатора, як от метансульфонова кислота, сірчана кислота, поліфосфорна кислота або тетрахлорид титану. В результаті можна одержати амідну сполуку (9). Етап 6: Сполука (9) реагує з ціанідом цинку, ціанідом міді, ціанідом калію тощо у присутності паладієвого каталізатора. В результаті можна одержати нітрильну сполуку (10) (див. Tetrahedron, 2006, vol. 62, p. 4705-4708). Етап 7: Нітрильну сполуку (10) відновлюють в інертному розчиннику у присутності металевого каталізатора. В результаті можна одержати карбонільну сполуку (11) (див. Comprehensive Organic Transformations, 1989, VCH Publishers, INC., або Міжнародну публікацію WO1996/20180). Металевим каталізатором слугують нікелевий каталізатор Ренея, дихлорид олова та подібні. Етап 8: Нітрильну сполуку (10) можна перетворити на нітрильну сполуку (12) різними реакціями алкілювання, відомими фахівцям (див. Comprehensive Organic Transformations, 1989, VCH Publishers, INC.). Етап 9: Нітрильну сполуку (12) можна перетворити на карбонільну сполуку (13), як наведено для етапу 7. [0031] Більш того, карбонільну сполуку (1), яка є вихідним матеріалом у схемі 1, можна одержати як карбонільну сполуку (17) за способом, наведеним у схемі 3. (Схема 3) [0032] [Формула 6] 3 30 35 40 45 де X представляє зв’язок або C1-4 алкілен; b X – група, що використовується у реактиві Віттіга або у реактиві Хорнера-Еммонса (наприклад, сіль фосфонію або діефір фосфорної кислоти тощо); 3 R - C1-6 алкільна група. [0033] Етап 10: Карбонільну сполуку (14) обробляють реактивом Віттіга або реактивом ХорнераЕммонса (15) в інертному розчиннику у присутності основи (див. Comprehensive Organic Transformations, 1989, VCH Publishers, INC.). В результаті можна одержати олефінову сполуку (16). Етап 11: Олефінову сполуку (16) можна перетворити на карбонільну сполуку (17) різними реакціями гідролізу, відомими фахівцям (див. Protective Groups in Organic Synthesis, the third edition, John Wiley & Sons, INC.). [0034] Більш того, карбонільну сполуку (1), яка є вихідним матеріалом у схемі 1, можна одержати як карбонільну сполуку (19) за способом, наведеним у схемі 4. (Схема 4) [0035] [Формула 7] 9 UA 105187 C2 3 5 10 15 20 25 де X такий, як визначено вище; 4 R - C1-5 алкільна група; 3 4 за умови, що сума атомів вуглецю X та R становить від 1 до 5; а M – метал, що використовується у реакції алкілування. Це можуть бути, наприклад, галіди літію та магнію тощо. [0036] Етап 12: Карбонільну сполуку (14) піддають реакції алкілування з металоорганічним 4 реактивом, представленим формулою R -M (див. Comprehensive Organic Transformations, 1989, VCH Publishers, INC.) в інертному розчиннику. В результаті можна одержати спиртову сполуку (18). Етап 13: Спиртову сполуку (18) можна перетворити на карбонільну сполуку (19) реакцією окислення, відомою фахівцям (див. Oxidations in Organic Chemistry, 1990, American Chemical Society), в інертному розчиннику. До таких відомих фахівцям реакцій окислення належать, наприклад, реакція окислення хромовою кислотою з використанням піридинійдіхромату або піридинійхлорхромату тощо, реакція окислення з використанням двооксиду марганцю, реакція окислення діметилсульфоксидом з використанням активатора - оксалілхлориду (окислення за Сверном) або діциклогексилкарбодііміду (окислення за Моффатом) тощо, реакція окислення 2,2,6,6-тетраметил-1-піперидинілоксі (окислення TEMPO) з використанням співокислювача, як гіпохлорит натрію, або реакція окислення з використанням реактиву Десса-Мартіна. [0037] Більш того, сполуку (24), яка являє собою карбонільну сполуку (1), що слугує вихідним 1 2 3 матеріалом у схемі 1, де принаймні один з A , A та A є атомом водню, можна одержати за способом, наведеним у схемі 5. (Схема 5) [0038] [Формула 8] 4 30 35 40 45 5 6 де A , A та A , які можуть бути однакові або різні, кожний представляють атом водню або атом галогену; 4 5 6 за умови, що принаймні один з A , A та A є атомом галогену; 2 P представляє захисну групу гідроксильної групи, наприклад, трет-бутилдіметилсилільну, трет-бутилдифенілсилільну, тетрагідпіранільну, метоксіметильну, ацетильну, бензоїльну або бензильну групу (див. Protective Groups in Organic Synthesis, the third edition, John Wiley & Sons, INC.). [0039] Етап 14: Гідроксильна група спиртової сполуки (20) захищена захисною групою, наприклад, трет-бутилдіметилсилільною, трет-бутилдифенілсилільною, тетрагідпіранільною, метоксіметильною, ацетильною, бензоїльною або бензильною групою (див. Protective Groups in Organic Synthesis, the third edition, John Wiley & Sons, INC.). В результаті можна одержати сполуку (21). Етап 15: Сполуку (21) перетворюють на сполуку (22), яка має галогеновий замісник в ароматичному кільці, різними реакціями галогенування, відомими фахівцям (див. Comprehensive Organic Transformations, 1989, VCH Publishers, INC. або Tetrahedron Letters 1999, vol. 40, p. 2673-2676). 2 Етап 16: Захисну групу P сполуки (22) видаляють різними прийомами органічного синтезу, відомими фахівцям (див. Protective Groups in Organic Synthesis, the third edition, John Wiley & Sons, INC.). В результаті можна одержати спиртову сполуку (23). Етап 17: Спиртову сполуку (23) можна перетворити на карбонільну сполуку (24), як в етапі 10 UA 105187 C2 13. 5 10 15 20 [0040] [Спосіб одержання 2] Сполуку (I) згідно з винаходом можна одержати способом, наведеним на схемі 6. (Схема 6) [0041] [Формула 9] 1 2 a 1 1 де X , X , X , R та P є такі, як визначено вище. [0042] Етап 18: Сполуку (25) можна перетворити на сполуку (26) так саме, як в етапі 3 схеми 1. Етап 19: Сполуку (26) можна перетворити на сполуку (27) так саме, як в етапі 2 схеми 1. 1 Більш того, якщо у сполуці (25) де P є атомом водню, здійснюють реакцію амідування, як в етапі 3 схеми 1. В результаті можна одразу одержати сполуку (27). Етап 20: Карбонільну сполуку (1) або (2) піддають реакції відновлювального амінування з амінною сполукою (27), як в етапі 1 схеми 1. В результаті можна одержати сполуку (I) згідно з винаходом. Більш того, нітрильну сполуку (10) у схемі 2 можна одержати з фенольної сполуки (28) способом, наведеним на схемі 7. (Схема 7) [Формула 10] 25 30 де L представляє вихідну групу, наприклад, атом галогену, метансульфонілоксігрупу, трифторметансульфонілоксігрупу, р-толуолсульфонілоксігрупу тощо. Етап 21: Використовують доступну на ринку або відому фенольну сполуку (28). Більш того, фенольну сполуку (28) можна синтезувати різними відомими фахівцям прийомами органічного синтезу з доступних на ринку або відомих компонентів. Якщо L є атомом галогену, сполуку (29) можна одержати реакцією галогенування гідроксильної групи сполуки (28) за допомогою галогенуючого засобу, наприклад, брому або оксалілхлориду, в інертному розчиннику у присутності триметилфосфіну, трибутилфосфіну, трифенілфосфіну або подібних, або ж 11 UA 105187 C2 5 10 15 20 25 30 35 40 45 50 55 60 реакцією галогенування гідроксильної групи за допомогою галогенуючого засобу, наприклад, тіонілхлориду, трихлориду фосфору, пентахлориду фосфору, трибромиду фосфору, пентабромиду фосфору або оксіхлориду фіосфору, в інертному розчиннику або без розчинника у присутності основи або без неї. Або ж, якщо L представляє метансульфонілоксігрупу, трифторметансульфонілоксігрупу або р-толуолсульфонілоксігрупу, сполуку (29) можна одержати реакцією гідроксильної групи сполуки (28) з, наприклад, метансульфонілхлоридом, метансульфоновим ангідридом, трифторметансульфоновим ангідридом, N-феніл-біс(трифторметансульфонімідом) або pтолуолсульфонілхлоридом, в інертному розчиннику у присутності основи або без неї. [див. Comprehensive Organic Transformations, 1989, VCH Publishers, Inc.]. Етап 22: Сполуку (29) можно перетворити на нітрильну сполуку (10) таким саме чином, як в етапі 6 схеми 2. [0043] Коли сполука (I) згідно з винаходом утворює сіль й використовується як лікарський засіб, це переважно є фармацевтично прийнятна сіль. Фармацевтично прийнятною може бути, наприклад, сіль неорганічної кислоти, як от гідрохлорид, сульфат, гідробромат, нітрат або фосфат; або сіль органічної кислоти, як от ацетат, оксалат, лактат, цитрат, малат, тартрат, малеат, фумарат, сукцинат, сіль метансульфонової кислоти, етансульфонат, бензолсульфонат або р-толуолсульфонат, однак перелік фармацевтично прийнятних солей цим не вичерпується. [0044] Більш того, фармацевтично прийнятними можуть бути солі лужних металів (наприклад, натрію, калію), солі лужноземельних металів (наприклад, кальцію, магнію, барію), солі неорганічних основ, наприклад, алюмінію або амонію, або солі органічних основ, як от триметиламін, триетиламін, піридин, піколін, етаноламін, діетаноламін, триетаноламін, діциклогексиламін або N,N-дібензилетилендіамін [0045] Коли сполука (I) згідно з винаходом включає оптичний ізомер, стереоізомер, регіоізомер або поворотний ізомер, як чиста сполука, так і їх суміш охоплюються поняттям сполуки згідно з цим винаходом. Більш того, коли сполука (I) згідно з винаходом утворює гідрат або сольват, вони також входять до обсягу винаходу. Далі, сполука (I) згідно з винаходом може бути мічена 3 13 14 15 35 125 ізотопом (наприклад, D, H, C, C, N, S, I тощо). [0046] Антагоніст рецептора МСН та лікарський засіб згідно з винаходом одержують із сполуки (I) згідно з винаходом, її фармацевтично прийнятної солі або гідрату як таких або разом з фармакологічно прийнятним носієм відомими способами. Фармакологічно прийнятними носіями можуть слугувати різноманітні звичайно застосовані з цією метою органічні або неорганічні речовини. Наприклад, це можуть бути наповнювачі для твердих препаратів (як от лактоза, білий цукор, D-манітол, крохмаль, кукурудзяний крохмаль, кристалічна целюлоза, легкий ангідрид кременевої кислоти), мастила (як от стеарат магнію, стеарат кальцію, тальк, колоїдний кремнезем), в’яжуче (наприклад, кристалічна целюлоза, білий цукор, D-манітол, декстрин, гідроксіпропилцелюлоза, гідроксипропилметилацелюлоза, полівініліпролідон, крохмаль, сахароза, желатин, метилцелюлоза, натрійкарбоксіметилцелюлоза), дезінтегрант (як от сахароза, карбоксіметилцелюлоза, кальційкарбоксіметилцелюлоза, натрійкроскармелоза, натрійкарбоксіметилкрохмаль, гідроксіпропилцелюлоза з низьким ступенем заміщення), або розчинник для рідких препаратів (як от вода для ін’єкцій, спирт, пропиленгліколь, макрогол, кунжутна олія, кукурудзяна олія), солюбілізатор (як от поліетиленгліколь, пропиленгліколь, Dманітол, бензилбензоат, етанол, трисамінометан, холестерин, триетаноламін, карбонати натрію, цитрат натрію), суспендуючий агент (наприклад, ПАВ, як от стеарилтриетанолмамін, лаурилсульфат натрію, лауриламінопропіонат, лецитин, бензалконійхлорид, бензетонійхлорид та гліцеринмоностеарат, або гідрофільний полімер, як от полівініловий спирт, полівінілпіролідон, натрийкарбоксіметилцелюлоза, метилцелюлоза, гідроксіметилцелюлоза та гідроксіпропилцелюлоза), ізотонічний засіб (як от глюкоза, D-сорбітол, хлорид натрію, гліцерин, D-манітол), буфер (як от фосфат, ацетат, карбонат, цитрат) або заспокійливий засіб (як от бензиловий спирт) тощо. Крім того, за потреби при одержанні препарату застосовують антисептик (наприклад, параоксібензоати, хлорбутанол, бензиловий спирт, фенетиловий спирт, дегідрацетову кислоту, сорбинову кислоту), антиоксидант (наприклад, сульфіт, аскорбінову кислоту), фарбник, підсолоджувач, адсорбент, зволожник тощо. [0047] Антагоніст рецептора МСН та лікарський засіб згідно з винаходом можна вводити орально або парентерально (наприклад, шляхом внутрішньовенних, локальних, ректальних інжекцій). 12 UA 105187 C2 5 10 15 20 25 30 35 40 45 50 55 60 Прикладами випускних форм можуть бути таблетки (в тому числі з цукровим або плівковим покриттям), порошки, гранули, дусти, пастилки, капсули (у тому числі м’які), рідини, композиції для ін’єкцій (наприклад, для підшкірних, внутрішньовенних, внутрішньом'язових, внутрішньочеревних ін’єкцій), препарати для зовнішнього введення (у тому числі ті, що вводяться крізь ніс, крізь шкіру, мазі, креми), супозиторії (наприклад, ректальні, вагінальні), засоби уповільненої дії (у тому числі мікрокапсули уповільненої дії), крупки та краплі. Усі ці засоби можна одержувати звичайними прийомами (наприклад, тими, що наводяться у 15-му виданні Японської фармакопеї). [0048] Дозу антагоніста рецептора МСН та лікарського засобу згідно з винаходом обирають у залежності від мети введення, шляху введення, виду хвороби, віку, маси тіла хворого та конкретних симптомів. Наприклад, для дорослого хворого доза становить від 1 до 2000 мг на добу. Дозу вводять одноразово або частинами протягом доби. [0049] При застосуванні антагоніста рецептора МСН як діючого компонента лікарських засобів було помічено, що він придатний не лише для людей, а й для інших ссавців. Наприклад, завдяки останнім досягненням ветеринарної медицини вважається, що антагоніста рецептора МСН може використовуватися для лікування опасистості у свійських тварин (наприклад, кішок, собак), а також для лікування інших свійських тварин (наприклад, їстівних тварин, як от корів, птиці, риб), які страждають на невідомі хвороби або розлади. Приклади [0050] Далі винахід докладніше описується на наступних прикладах; втім, ці приклади ніяким чином не обмежують винахід і можуть піддаватися модифікаціям в межах його обсягу. У прикладах "кімнатна температура" означає температуру від 0C до 40C. "Силікагель 60 N" та "Chromatorex NH", які використовуються при очищенні колонковою хроматографією, випускаються фірмами Kanto Chemical Co., Inc. та Fuji Silysia відповідно. [0051] У прикладах дані вимірювань були отримані за допомогою наступних пристроїв. Мас-спектрографічні спектри: Shimadzu LCMS-2010EV або micromass Platform LC ЯМР спектри: 600 МГц (JNM-ECA 600, JEOL Ltd.) або 200 МГц (GEMINI 2000/200, Varian Inc.) Позначки сполук наводяться у відповідності до класифікації ACD/Name (ACD/Labs 11.00, Advanced Chemistry Development Inc.). [0052] Абревіатури, що вживаються у прикладах, означають наступне: Ac2O (оцтовий ангідрид), AcOH (оцтова кислота), APCI (хімічна іонізація під атмосферним тиском), brs (широкий синглет), CDCl3 (дейтерований хлороформ), CHCl3 (хлороформ), CH3CN (ацетонітрил), d (дублет), dd (подвійний дублет), ddd (подвійний подвійний дублет), DMAP (N,Nдіметил-4-амінопіридин), DMF (N,N-діметилформамід), DMSO-d6 (дейтерований діметилсульфоксид), dt (подвійний триплет), EDC [1-етил-3-(3-діметиламінпропил)карбодіімід], EI (електронна іонізація), ESI (електророзпилювальна іонізація), Et 3N (триетиламін), Et2O (діетилетер), EtOAc (етилацетат), EtOH (етанол), H (протон), HCl (гідрохлорид або соляна кислота), H2O (вода), HOBt (1-гідроксібензотриазол), Гц (герц), IPA (ізопропиловий спирт), IPE (ізопропилетер), J (стала зв’язку), K2CO3 (карбонат калію), m (мультиплет), MeI (метилйодид), MeMgBr (метилмагнійбромид), MeOH (метанол), MeOH-d4 (дейтерований метанол), MgSO4 (сульфат магнію), MnO2 (двооксид марганцю), MS (мас-спектрометрія), NaBH4 (борогідрид натрію), NaH (гідрид натрію), NaHCO3 (бікарбонат натрію), Na2SO4 (сульфат натрію), NH4Cl (хлорид амонію), ЯМР (ядерна магніторезонансна спектроскопія), NaBH(OAc) 3 (триацетоксіборогідрид натрію), NaNH2 (амід натрію), NaOH (гідроксид натрію), Pd2(dba)3 [трис(дібензиліденацетон)діпаладій], Ph3PCH2OMeBr [(метоксіметил)трифенілфосфонійбромид], iPr 2Net (діізопропилетиламін), q (квартет), s (синглет), t (триплет), td (потрійний дублет), THF (тетрагідрофуран), TMEDA (тетраметилетилендіамін), v/v об’ємн. (об’ємне співвідношення), Xantphos [4,5біс(дифенілфосфін)-9,9-діметилксантен]. [0053] Приклад 1: Синтез 3-метоксі-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4іл}бензаміду Етап 1-1: До хлорсульфонової кислоти (1.19 л) додають 3-(4-бромфеніл)пропанову кислоту (91.1 г) з перемішуванням на кризі й суміш перемішують 2 години. Реакційну суміш повільно додають до H2O (2.00 л) з перемішуванням на кризі та екстрагують 6 разів CHCl3. З’єднані 13 UA 105187 C2 5 10 15 20 25 30 35 40 45 50 55 60 органічні фази промивають насиченим водним розчином NaHCO 3, сушать над Na2SO4 та концентрують під зниженим тиском. До одержаного осаду додають MeOH й суміш нагрівають із зворотним холодильником 30 хвилин. Фільтрацією одержують тверду речовину A. Фільтрат концентрують під зниженим тиском, одержуючи тверду речовину B таким саме чином. Далі фільтрат знову концентрують під зниженим тиском, одержуючи тверду речовину С таким саме чином. Тверді фази А, В і С з’єднують, одержуючи 6-бром-2,3-дигідро-1H-інден-1-он (59.3 г, жовтава тверда маса). 1 H ЯМР (600 МГц, CDCl3, ): 2.66-2.75 (m, 2H), 3.04-3.12 (m, 2H), 7.36 (d, J = 8.3 Гц, 1H), 7.67 + (dd, J = 8.0, 2.1 Гц, 1H), 7.86 (d, J = 1.8 Гц, 1H); ESI/APCI MS m/z 210 [M+H] . Етап 1-2: До розчину у CHCl3 (560 мл) сполуки (39.5 г), одержаної на етапі 1-1, та метансульфонової кислоти (122 мл) окремо потроху додають азид натрію (36.5 г) з перемішуванням на кризі й суміш нагрівають із зворотним холодильником 2.5 години. Реакційну суміш повільно додають до H2O (400 мл) з перемішуванням на кризі, коригують рН до 9 з допомогою 28% аміачної води. й тричі екстрагують CHCl3. З’єднані органічні фази сушать над Na2SO4 та концентрують під зниженим тиском. Далі осад очищують колонковою хроматографією (силікагель 60 N, рухома фаза: EtOAc/гексан = 50/50 to 75/25; в об’ємн. співвіднош..). Одержану тверду масу суспендують у розчині EtOAc/гексану (1/1; в об’ємн. співвіднош..) й суміш перемішують при кімнатній температурі 1 годину. Фільтрацією одержують 7-бром-3,4-дигідрохінолін-2(1H)-он (15.5 г, жовтава тверда маса). 1 H ЯМР (200 МГц, CDCl3, ): 2.59-2.68 (m, 2H), 2.88-2.97 (m, 2H), 6.91-7.16 (m, 3H), 8.27 (brs, + 1H); ESI/APCI MS m/z 226 [M+H] . Етап 1-3: До розчину у DMF (14.5 мл) сполуки (3.00 г), одержаної на етапі 1-2, додають ціанід цинку (1.04 г), Pd2(dba)3 (122 мг), Xantphos (154 мг) та TMEDA (590 мл) й суміш перемішують під мікрохвильовим опромінюванням (180C) 5 хвилин. До реакційної суміші додають CHCl3, суміш фільтрують крізь целіт та промивають DMF. Фільтрат концентрують під зниженим тиском. Осад очищують колонковою хроматографією (силікагель 60 N, рухома фаза: EtOAc/гексан = 50/50 - 100/0; в об’ємн. співвіднош..). До одержаної твердої маси додають EtOAc при кімнатній температурі й суміш перемішують 30 хвилин. Осад фільтрують та промивають EtOAc, одержуючи 2-оксо-1,2,3,4-тетрагідрохінолін-7-карбонітрил (15.5 г, жовтава тверда маса). 1 H ЯМР (600 МГц, CDCl3, ): 2.64-2.68 (m, 2H), 3.00-3.04 (m, 2H), 7.04 (s, 1H), 7.23-7.29 (m, + 2H), 8.46 (brs, 1H); ESI/APCI MS m/z 173 [M+H] . Етап 1-4: До розчину в мурашиній кислоті (250 мл) сполуки (32.6 г), одержаної на етапі 1-3, додають скелетний нікелевий каталізатор гідрування (50.0 г) і суміш перемішують при 50C 2 години. Далі реакційну суміш фільтрують крізь целіт, фільтрат концентрують під зниженим тиском. До осаду додають насичений розчин NaHCO 3, коригують рН суміші до 6 та фільтрують з одержанням твердої речовини А. Фільтрат тричі екстрагують CHCl3, з’єднані органічні фази сушать над Na2SO4 та концентрують під зниженим тиском. З’єднують осад та тверду речовину А й суспендують у розчині суміші EtOAc/CHCl3/ацетону (10/10/1; в об’ємн. співвіднош..), суміш перемішують при кімнатній температурі 1 годину та фільтрують, одержуючи 2-оксо-1,2,3,4тетрагідрохінолін-7-карбальдегід (19.8 г, жовтава тверда маса). 1 H ЯМР (200 МГц, CDCl3, ): 2.65-2.76 (m, 2H), 3.02-3.13 (m, 2H), 7.31-7.38 (m, 2H), 7.49-7.55 + (m, 1H), 9.13 (brs, 1H), 9.95 (s, 1H); ESI/APCI MS m/z 176 [M+H] . Етап 1-5: Розчин сполуки (19.8 г), одержаної на етапі 1-4, та трет-бутилпіперидин-4ілкарбамату (24.8 г) у CHCl3 (450 мл) перемішують при 70C 1.5 години й дають охолонути до кімнатної температури. Далі до суміші додають NaBH(OAc) 3 (35.9 г) при перемішуванні на кризі й суміш перемішують при кімнатній температурі 12 годин. До реакційної суміші додають насичений водний розчин NaHCO3 й відокремлюють водну фазу від органічної фази. Водну фазу тричі екстрагують CHCl3. З’єднані органічні фази сушать над Na2SO4 та концентрують під зниженим тиском. Осад очищують колонковою хроматографією (силікагель 60 N, рухома фаза: MeOH/CHCl3 = 33/66 до 100/0; в об’ємн. співвіднош..), одержуючи трет-бутил{1-[(2-оксо-1,2,3,4тетрагідрохінолін-7-іл)метил]піперидин-4-іл}карбамат (37.8 г, безбарвна тверда маса). 1 H ЯМР (600 МГц, CDCl3, ): 1.35-1.51 (m, 11H), 1.82-1.96 (m, 2H), 2.07 (t, J = 10.5 Гц, 2H), 2.49-2.66 (m, 2H), 2.78 (brs, 2H), 2.93 (t, J = 7.6 Гц, 2H), 3.29-3.55 (m, 3H), 4.48 (brs, 1H), 6.76 (s, + 1H), 6.90 (d, J = 7.3 Гц, 1H), 7.08 (d, J = 7.8 Гц, 1H), 8.37 (brs, 1H); ESI/APCI MS m/z 360 [M+H] . Етап 1-6:До розчину в EtOAc (130 мл)сполуки (37.8 г), одержаної на етапі 1-5, додають розчин 4 M HCl/EtOAc (263 мл) при перемішуванні на кризі й суміш перемішують при кімнатній температурі 1 годину. Реакційну суміш концентрують під зниженим тиском. Осад суспендують в EtOAc (200 мл)та фільтрують, одержуючи тверду масу. До останньої додають CHCl 3 (200 мл) та H2O (200 мл) й суміш перемішують 15 хвилин. Розділяють водну та органічну фази, водну фазу двічі промивають CHCl3. До водної фази додають 2 M водний розчин NaOH, доводячи рН до 10, 14 UA 105187 C2 5 10 15 20 25 30 після чого розчин екстрагують 30 разів CHCl 3. З’єднані органічні фази сушать над Na2SO4 та концентрують під зниженим тиском. Осад очищують колонковою хроматографією (Chromatorex NH, рухома фаза: MeOH/CHCl3 = 1/4; в об’ємн. співвіднош..), одержуючи 7-[(4-амінпіперидин-1іл)метил]-3,4-дигідрохінолін-2(1H)-он (17.9 г, безбарвна тверда маса). 1 H ЯМР (600 МГц, CDCl3, ): 1.32-1.49 (m, 2H), 1.74-1.88 (m, 2H), 1.93-2.09 (m, 2H), 2.54-2.70 (m, 3H), 2.80 (d, J = 11.9 Гц, 2H), 2.93 (t, J = 7.6 Гц, 2H), 3.41 (s, 2H), 6.74 (s, 1H), 6.90 (d, J = 9.2 + Гц, 1H), 7.07 (d, J = 7.3 Гц, 1H), 8.28 (brs, 1H); ESI/APCI MS m/z 260 [M+H] . Етап 1-7: До розчину у CHCl3 (5.00 мл) сполуки (250 мг), одержаної на етапі 1-6,додають iPr2NEt (370 мл) та 3-метоксібензоїлхлорид (180 мг) й суміш перемішують при кімнатній температурі три доби. До реакційної суміші додають насичений водний розчин NaHCO 3 та екстрагують чотири рази CHCl3. З’єднані органічні фази сушать над Na2SO4 та концентрують під зниженим тиском. Осад очищують колонковою хроматографією [(силікагель 60 N, рухома фаза: MeOH/CHCl3 = 0/100 до 10/90; в об’ємн. співвіднош..) та (Chromatorex NH, рухома фаза: CHCl 3) у такій послідовності], одержуючи тверду масу. До неї додають IPA при кімнатній температурі та суміш перемішують 1 годину, фільтрують та промивають IPA й гексаном, одержуючи цільову сполуку (159 мг, безбарвна тверда маса). 1 H ЯМР (600 МГц, CDCl3, ): 1.48-1.62 (m, 2H), 1.94-2.06 (m, 2H), 2.10-2.21 (m, 2H), 2.57-2.67 (m, 2H), 2.78-2.87 (m, 2H), 2.90-2.99 (m, 2H), 3.44 (s, 2H), 3.85 (s, 3H), 3.94-4.05 (m, 1H), 6.01 (d, J = 7.8 Гц, 1H), 6.74 (s, 1H), 6.91 (d, J = 7.3 Гц, 1H), 7.02 (dd, J = 7.6, 2.1 Гц, 1H), 7.09 (d, J = 7.8 Гц, + 1H), 7.21-7.27 (m, 1H), 7.29-7.35 (m, 2H), 7.85 (s, 1H); ESI/APCI MS m/z 394 [M+H] . [0054] Приклад 2: Синтез 3-метоксі-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4іл}бензамід моногрідрохлориду моногідрату До суспензії в EtOAc (1.70 мл)сполуки (167 мг), одержаної на етапі 1-7, додають розчин 4 M HCl/EtOAc (140 мл) й суміш перемішують при кімнатній температурі 1.5 години та фільтрують, одержуючи цільову сполуку (160 мг, безбарвна тверда маса). 1 H ЯМР (600 МГц, MeOH-d4, ): 1.98 (brs, 2H), 2.18 (brs, 2H), 2.53-2.62 (m, 2H), 2.98 (t, J = 7.6 Гц, 2H), 3.03-3.19 (m, 2H), 3.50 (brs, 2H), 3.81 (s, 3H), 4.11 (brs, 1H), 4.23 (brs, 2H), 6.98 (s, 1H), + 7.05-7.15 (m, 2H), 7.27-7.39 (m, 4H); ESI/APCI MS m/z 394 [M(вільний)+H] [0055] Сполуки за прикладами 3 – 30 одержують таким саме чином, як у прикладі 1. [0056] [Таблиця 1-1] Таблиця 1 Приклад Назва сполуки Фізичні властивості № 1 3 3-фтор-N-{1-[(2-оксо-1,2,3,4- H ЯМР (600 МГц, DMSO-d6, δ): 1.46-1.59 (m,2H), 1.73тетрагідрохінолін-71.76 (m,2H), 1.95-2.01 (m,2H), 2.37-2.43 (m,2H), 2.73-2.86 іл)метил]піперидин-4(m,2H), 3.32-3.35 (m,2H), 3.70-3.80 (m,1H), 6.77-6.82 іл}бензамід (m,2H), 7.06 (d, J = 7.3 Гц, 1H), 7.29-7.37 (m,1H), 7.47 (td, J = 8.0, 6.0 Гц, 1H), 7.60 (dd, J = 9.6, 2.3 Гц , 1H), 7.65 (d, J = 7.8 Гц, 1H), 8.28-8.33 (m, 1H), 10.00 (s, 1H), ESI/APCI MS + m/z 382 [M+H] . 1 4 3,5-дифтор-N-{1-[(2-оксоH ЯМР (600 МГц, DMSO-d6, δ): 1.45-1.57 (m,2H), 1.731,2,3,4-тетрагідрохінолін-7- 1.76 (m,2H), 1.95-2.00 (m,2H), 2.37-2.42 (m,2H), 2.74-2.83 іл)метил]піперидин-4-іл} (m,4H), 3.33 (s,2H), 3.65-3.76 (m,1H), 6.76-6.83 (m,2H), бензамід 7.06 (d, J = 7.8 Гц, 1H), 7.40-7.45 (m,1H), 7.48-7.55 (m,2H), 8.38 (d, J = 7.8 Гц, 1H), 10.00 (s, 1H), ESI/APCI MS m/z 400 + [M+H] . 1 5 3,4-дифтор-N-{1-[(2-оксоH ЯМР (600 МГц, DMSO-d6, δ): 1.46-1.57 (m,2H), 1.731,2,3,4-тетрагідрохінолін-7- 1.76 (m,2H), 1.95-2.01 (m,2H), 2.37-2.42 (m,2H), 2.73-2.84 іл)метил]піперидин-4-іл} (m,2H), 3.33 (s,2H), 3.65-3.75 (m,1H), 6.76-6.82 (m,2H), бензамід 7.06 (d, J = 7.3 Гц, 1H), 7.46-7.56 (m,1H), 7.70 (dd, J = 8.0, 3.9 Гц, 1H), 7.83-7.89 (m, 1H), 8.31 (d, J = 7.3 Гц, 1H), + 10.00 (s, 1H), ESI/APCI MS m/z 400 [M+H] . 35 15 UA 105187 C2 1 H ЯМР (600 МГц, CDCl3, δ): 1.51-1.62 (m,2H), 1.97-2.07 (m,2H), 2.10-2.24 (m,2H), 2.57-2.68 (m,2H), 2.77-2.91 (m,2H),2.95 (t, J = 7.6 Гц, 2H), 3.46 (s,2H), 3.94-4.07 (m,1H), 6.01 (brs, 1H), 6.75 (s, 1H), 6.92 (d, J = 7.8 Гц, 1H), 7.05-7.15 (m,3H), 7.65 (brs, 1H), 7.78 (dd, J + = 8.7, 5.0 Гц, 2H), ESI/APCI MS m/z 382 [M+H] . 1 7 3-хлор-N-{1-[(2-оксо-1,2,3,4- H ЯМР (600 МГц, CDCl3, δ): 1.55-1.65 (m,2H), 1.94-2.05 (m,2H), тетрагідрохінолін-72.10-2.22 (m,2H), 2.57-2.68 (m,2H), 2.78-2.90 (m ,2H), 2.94 (t, J = іл)метил] піперидин-4- 7.6 Гц, 2H), 3.44 (s,2H), 3.95-4.08 (m,1H), 6.25 (d, , J = 7.8 Гц, 1H), іл}бензамід 6.77 (s, 1H), 6.90 (d, J = 6.4 Гц, 1H), 7.05-7.13 (m, 1H), 7.32-7.40 (m, 1H), 7.43-7.49 (m, 1H), 7.65 (d, , J = 7.8 Гц, 1H), 7.78 (s, 1H), 7.88 + (brs, 1H), ESI/APCI MS m/z 398 [M+H] . 6 4-фтор-N-{1-[(2-оксо-1,2,3,4тетрагідрохінолін-7іл)метил] піперидин-4іл}бензамід [0057] [Таблиця 1-2] Приклад Назва сполуки Фізичні властивості № 1 8 3-метил-N-{1-[(2-оксо-1,2,3,4- H ЯМР (600 МГц, CDCl3, δ): 1.48-1.57 (m,2H), 1.96-2.06 тетрагідрохінолін-7(m,2H), 2.10-2.21 (m,2H), 2.56-2.68 (m,2H), 2.79-2.88 іл)метил]піперидин-4(m,2H), 2.94 (t, J = 7.6 Гц, 2H), 3.45 (s, 2H), 3.94-4.07 (m, іл}бензамід 1H), 5.94 (d, J = 7.8 Гц, 1H), 6.72 (s, 1H), 6.92 (d, J = 7.3 Гц, 1H), 7.05-7.13 (m,1H), 7.50 (d, J = 4.1 Гц, 2H), 7.56 (s, + 1H), ESI/APCI MS m/z 378 [M+H] . 1 9 N-{1-[(2-оксо-1,2,3,4H ЯМР (600 МГц, CDCl3, δ): 1.57-1.64 (m,2H), 1.99-2.05 тетрагідрохінолін-7(m,2H), 2.13-2.20 (m,2H), 2.60-2.64 (m,2H), 2.82-2.89 іл)метил]піперидин-4-іл}-3(m,2H), 2.94 (t, J = 7.6 Гц, 2H), 3.45 (s, 2H), 4.00-4.07 (m, (трифторметил) бензамід 1H), 6.25 (d, J = 7.3 Гц, 1H), 6.76 (s, 1H), 6.91 (d, J = 7.3 Гц, 1H), 7.10 (d, J = 7.3 Гц, 1H), 7.56 (t, J = 7.8 Гц, 1H), 7.74 (d, J = 7.8 Гц, 1H), 7.84 (brs, 1H), 7.96 (d, J = 7.8 Гц, + 1H), 8.03 (s, 1H), ESI/APCI MS m/z 432. [M+H] . 1 10 3,5-дихлор-N-{1-[(2-оксоH ЯМР (600 МГц, CDCl3, δ): 1.61-1.68 (m,2H), 1.92-2.03 1,2,3,4-тетрагідрохінолін-7(m,2H), 2.11-2.17 (m,2H), 2.63-2.66 (m,2H), ), 2.85-2.91 іл)метил]піперидин-4-іл} (m,2H), 2.94 (t, J = 7.3 Гц, 2H), 3.44 (s, 2H), 3.99-4.05 (m, бензамід 1H), 6.61 (brs, 1H), 6.80 (s, 1H), 6.88 (d, J = 8.7 Гц, 1H), 7.09 (d, J = 7.3 Гц, 1H), 7.46 (t, J = 2.1 Гц, 1H), 7.72 (d, J = + 1.8 Гц, 2H), 8.21 (brs, 1H), ESI/APCI MS m/z 432 [M+H] . 1 11 4-хлор-N-{1-[(2-оксо-1,2,3,4H ЯМР (600 МГц, CDCl3, δ): 1.52-1.61 (m, 2H), 1.96-2.04 тетрагідрохінолін-7-іл)метил] (m, 2H), 2.15-2.18 (m, 2H), 2.59-2.65 (m, 2H), 2.84-2.86 (m, піперидин-4-іл}бензамід 2H),2.94 (t, J = 7.6 Гц, 2H), 3.44 (s, 2H), 3.95-4.04 (m, 1H), 6.08 (d, J = 7.8 Гц, 1H), 6.75 (s, 1H), 6.91 (d, J = 7.8 Гц, 1H), 7.09 (d, J = 7.8 Гц, 1H), 7.37-7.41 (m, 2H), 7.70 (d, J = + 8.7 Гц, 2H), 7.81 (s, 1H), ESI/APCI MS m/z 398 [M+H] . 1 12 3,4-дихлор-N-{1-[(2-оксоH ЯМР (600 МГц, CDCl3, δ): 1.59-1.69 (m,2H), 1.94-2.02 1,2,3,4-тетрагідрохінолін-7(m,2H), 2.15-2.17 (m,2H), 2.88-2.90 (m ,2H), 2.95 (t, J = 7.6 іл)метил] піперидин-4Гц, 2H), 3.45 (s,2H), 3.97-4.07 (m,1H), 6.54-6.60 (m,1H), іл}бензамід 6.81 (s, 1H), 6.90 (d, J = 7.3 Гц, 1H), 7.10 (d, J = 7.8 Гц, 1H), 7.50 (d, J = 8.3 Гц, 1H), 7.67 (dd, J = 8.3, 2.3 Гц, 1H), 7.96 (d, J = 1.8 Гц, 1H), 8.29 (brs, 1H), ESI/APCI MS m/z + 432 [M+H] . 5 16 UA 105187 C2 [0058] [Таблиця 1-3] Приклад Назва сполуки № 13 N-{1-[(2-оксо-1,2,3,4тетрагідрохінолін-7іл)метил]піперидин-4-іл}-3(трифторметоксі)бензамід 14 4-фтор-3-метил-N-{1-[(2-оксо1,2,3,4-тетрагідрохінолін-7іл)метил]піперидин-4-іл}бензамід 15 4-фтор-N-{1-[(2-оксо-1,2,3,4тетрагідрохінолін-7іл)метил]піперидин-4-іл}-3(трифторметил) бензамід 16 4-метил-N-{1-[(2-оксо-1,2,3,4тетрагідрохінолін-7-іл)метил] піперидин-4-іл}бензамід 17 3-фтор-4-метил-N-{1-[(2-оксо1,2,3,4-тетрагідрохінолін-7іл)метил] піперидин-4-іл}бензамід Фізичні властивості 1 H ЯМР (600 МГц, CDCl3, δ): 1.55-1.65 (m,2H), 1.942.04 (m,2H), 2.15-2.18 (m,2H), 2.59-2.66 (m,2H), 2.86-2.88 (m,2H), 2.94-2.96 (m,2H), 3.44 (s, 2H), 3.96-4.08 (m, 1H), 6.34 (d, J = 8.3 Гц, 1H), 6.78 (s, 1H), 6.90 (d, J = 7.8 Гц, 1H), 7.09 (d, J = 7.3 Гц, 1H), 7.34 (d, J = 8.3 Гц, 1H), 7.66-7.72 (m, 2H), 8.11 (s, + 1H), ESI/APCI MS m/z 448 [M+H] . 1 H ЯМР (600 МГц, CDCl3, δ): 1.53-1.61 (m,2H), 1.962.05 (m,2H), 2.11-2.19 (m,2H), 2.60-2.64 (m,2H), 2.81-2.88 (m,2H), 2.94 (t, J = 7.6 Гц, 2H), 3.44 (s, 2H), 3.96-4.03 (m, 1H), 6.07 (d, J = 7.8 Гц, 1H), 6.76 (s, 1H), 6.90 (d, J = 7.3 Гц, 1H), 7.02 (t, J = 8.9 Гц, 1H), 7.07-7.10 (m, 1H), 7.54-7.57 (m, 1H), 7.63 (d, J = 7.3 + Гц, 1H), 7.90 (s, 1H), ESI/APCI MS m/z 396. [M+H] . 1 H ЯМР (600 МГц, CDCl3, δ): 1.62-1.70 (m,2H), 1.932.02 (m,2H), 2.14 (t, J = 11.2 Гц, 2H), 2.54-2.64 (m,2H), ), 2.84-2.96 (m, 4H), 3.44 (s, 2H), 4.01-4.08 (m, 1H), 6.79-6.89 (m, 3H), 7.09 (d, J = 7.3 Гц, 1H), 7.21-7.27 (m,1H), 8.05-8.10 (m,1H), 8.12-8.15 (m,1H), + 8.56 (brs, 1H), ESI/APCI MS m/z 450 [M+H] . 1 H ЯМР (600 МГц, CDCl3, δ): 1.51-1.58 (m, 2H), 1.972.02 (m, 2H), 2.11-2.18 (m, 2H), 2.37 (s, 3H), 2.592.63 (m, 2H), 2.77-2.87 (m, 2H), 2.93 (t, J = 7.3 Гц, 2H), 3.43 (s, 2H), 3.96-4.03 (m, 1H), 6.00 (d, J = 7.8 Гц, 1H), 6.73 (s, 1H), 6.89-6.91 (m, 1H), 7.07-7.09 (m, 1H), 7.21 (d, J = 7.8 Гц, 2H), 7.63 (d, J = 8.3 Гц, 2H),7.75 (brs, 1H), 7.81 (s, 1H), ESI/APCI MS m/z 378 + [M+H] . 1 H ЯМР (600 МГц, CDCl3, δ): 1.51-1.64 (m,2H), 1.942.03 (m,2H), 2.07-2.19 (m,2H), 2.29 (s, 3H), 2.55-2.67 (m, 2H), 2.80-2.86 (m ,2H), 2.89-2.98 (m, 2H), 3.43 (s,2H), 3.95-4.04 (m,1H), 6.21 (d, J = 7.8 Гц, 1H), 6.76 (s, 1H), 6.89 (d, J = 7.8 Гц, 1H), 7.08 (d, J = 7.3 Гц, 1H), 7.18-7.27 (m, 1H), 7.38-7.50 (m, 2H), 8.07 (s, + 1H), ESI/APCI MS m/z 396 [M+H] . 5 17 UA 105187 C2 [0059] [Таблиця 1-4] Приклад Назва сполуки № 18 3-фтор-N-{1-[(2-оксо-1,2,3,4тетрагідрохінолін-7іл)метил]піперидин-4-іл}-5(трифторметил)бензамід 19 3,5-діметоксі-N-{1-[(2-оксо-1,2,3,4тетрагідрохінолін-7іл)метил]піперидин-4-іл}бензамід 20 N-{1-[(2-оксо-1,2,3,4тетрагідрохінолін-7іл)метил]піперидин-4-іл}-4(трифторметил) бензамід 21 N-{1-[(2-оксо-1,2,3,4тетрагідрохінолін-7-іл)метил] піперидин-4-іл}-4(трифторметоксі)бензамід 22 4-ціан-N-{1-[(2-оксо-1,2,3,4тетрагідрохінолін-7-іл)метил] піперидин-4-іл}бензамід Фізичні властивості 1 H ЯМР (600 МГц, CDCl3, δ): 1.66-1.79 (m,2H), 1.922.02 (m,2H), 2.10-2.21 (m,2H), 2.58-2.65 (m,2H), 2.87-2.98 (m,4H), 3.44 (s, 2H), 4.03-4.12 (m, 1H), 6.83-6.90 (m,2H), 7.07-7.12 (m, 1H), 7.11-7.19 (m, 1H), 7.43 (d, J = 8.3 Гц, 1H), 7.86 (d, J = 9.2 Гц, 1H), 7.96 (s, 1H), 8.68 (brs, 1H), ESI/APCI MS m/z 450 + [M+H] . 1 H ЯМР (600 МГц, CDCl3, δ): 1.50-1.59 (m,2H), 1.962.04 (m,2H), 2.11-2.21 (m,2H), 2.57-2.67 (m,2H), 2.79-2.86 (m,2H), ), 2.89-2.99 (m,2H), 3.44 (s, 2H), 3.82 (s, 6H), 3.94-4.04 (m, 1H), 5.99 (d, J = 7.8 Гц, 1H), 6.56 (t, J = 2.3 Гц, 1H), 6.73 (s, 1H), 6.86 (t, J = 2.3 Гц, 2H), 7.05-7.12 (m, 1H), 7.63 (s, 1H), ESI/APCI + MS m/z 424. [M+H] . 1 H ЯМР (600 МГц, CDCl3, δ): 1.52-1.62 (m,2H), 2.002.05 (m,2H), 2.13-2.19 (m,2H), 2.60-2.64 (m,2H), 2.83-2.89 (m, 2H), 2.94 (t, J = 7 .6 Гц, 2H), 3.45 (s, 2H), 4.03 (d, J = 7.8 Гц, 1H), 6.18 (brs, 1H), 6.75 (s, 2H), 6.91 (d, J = 7.8 Гц, 1H), 7.10 (d, J = 7.8 Гц, 1H), 7.69 (d, J = 8.3 Гц, 1H), 7.72 (brs, 1H), 7.88 (d, J = 8.3 + Гц, 1H), ESI/APCI MS m/z 432 [M+H] . 1 H ЯМР (600 МГц, CDCl3, δ): 1.50-1.59 (m, 2H), 1.962.01 (m, 2H), 2.10-2.16 (m, 2H), 2.58-2.61 (m, 2H), 2.80-2.84 (m, 2H), 2.91 (t, J = 7.6 Гц, 2H), 3.42 (s, 2H), 3.96-4.00 (m, 1H), 6.00 (d, J = 8.3 Гц, 1H), 6.70 (s, 1H), 6.88 (d, J = 6.0 Гц, 1H),7.07 (d, J = 7.8 Гц, 1H), 7.19-7.26 (m, 2H), 7.53 (s, 1H), 7.77 (d, J = 8.7 + Гц, 2H), ESI/APCI MS m/z 448 [M+H] . 1 H ЯМР (600 МГц, CDCl3, δ): 1.60-1.67 (m,2H), 1.962.03 (m,2H), 2.12-2.18 (m,2H), 2.59-2.63 (m, 2H), 2.84-2.91 (m ,2H), 2.94 (t, J = 7.6 Гц, 2H), 3.44 (s,2H), 4.00-4.07 (m,1H), 6.50 (d, J = 8.3 Гц, 1H), 6.78 (s, 1H), 6.89 (d, J = 6.0 Гц, 1H), 7.10 (d, J = 7.8 Гц, 1H), 7.72 (d, J = 8.7 Гц, 2H), 7.91 (d, J = 8.7 Гц, 2H), 8.11 + (brs, 1H), ESI/APCI MS m/z 389 [M+H] . 5 18 UA 105187 C2 [0060] [Таблиця 1-5] Приклад Назва сполуки № 23 N-{1-[(2-оксо-1,2,3,4тетрагідрохінолін-7іл)метил]піперидин-4іл}бензамід 24 25 26 27 Фізичні властивості 1 H ЯМР (600 МГц, CDCl3, δ): 1.51-1.61 (m,2H), 1.98-2.07 (m,2H), 2.12-2.22 (m,2H), 2.57-2.68 (m,2H), 2.80-2.87 (m,2H), 2.91-2.99 (m,2H), 3.45 (s, 2H), 3.97-4.06 (m, 1H), 6.03 (d, J = 7.8 Гц, 1H), 6.74 (s, 1H), 6.91 (d, J = 7.3 Гц, 1H), 7.09 (d, J = 7.8 Гц, 1H), 7.38-7.46 (m, 2H), 7.46-7.51 + (m, 1H), 7.68-7.78 (m, 3H), ESI/APCI MS m/z 364. [M+H] . 1 2-(4-фторфеніл)-N-{1-[(2-оксо- H ЯМР (600 МГц, CDCl3, δ): 1.28-1.39 (m,2H), 1.78-1.90 1,2,3,4-тетрагідрохінолін-7(m,2H), 2.03-2.11 (m,2H), 2.57-2.64 (m,2H), 2.66-2.76 іл)метил]піперидин-4(m,2H), 2.88-2.98 (m,2H), 3.38 (s, 2H), 3.49 (s, 2H), 3.73іл}ацетамід 3.84 (m, 1H), 5.19-5.26 (m, 1H), 6.68 (s, 1H), 6.87 (d, J = 7.3 Гц, 1H), 6.99-7.05 (m,2H), 7.07 (d, J = 7.3 Гц, 1H),7.177.23 (m, 2H), 7.63 (s, 1H), 7.54 (brs, 1H), ESI/APCI MS m/z + 396. [M+H] . 1 2-(3-метоксіфеніл)-N-{1-[(2H ЯМР (600 МГц, CDCl3, δ): 1.28-1.38 (m,2H), 1.79-1.88 оксо-1,2,3,4(m,2H), 2.01-2.13 (m,2H), 2.58-2.66 (m,2H), 2.67-2.77 тетрагідрохінолін-7(m,2H), 2.90-2.99 (m, 2H), 3.38 (s, 2H), 3.53 (s, 2H), 3.73іл)метил]піперидин-4-іл}3.83 (m, 1H), 3.81 (s, 3H), 5.24-5.32 (m, 1H), 6.69 (s, 1H), ацетамід 6.73-6.92 (m, 4H), 7.08 (d, J = 7.8 Гц, 1H), 7.22-7.29 (m, + 1H), 7.64 (brs, 1H), ESI/APCI MS m/z 408 [M+H] . 1 2-(4-метоксіфеніл)-N-{1-[(2H ЯМР (600 МГц, CDCl3, δ): 1.24-1.34 (m, 2H), 1.82 (dd, J оксо-1,2,3,4= 12.6, 3.4 Гц, 2H), 2.00-2.09 (m, 2H), 2.56-2.64 (m, 2H), тетрагідрохінолін-7-іл)метил] 2.64-2.76 (m, 2H), 2.92 (t, J = 7.6 Гц, 2H), 3.36 (s, 2H), піперидин-4-іл}ацетамід 3.48 (s, 2H), 3.73-3.82 (m, 4H), 5.23 (d, J = 8.3 Гц, 1H), 6.69 (s, 1H), 6.83-6.88 (m, 3H), 7.06 (d, J = 7.8 Гц, 1H), 7.10-7.15 (m, 2H), 7.94 (s, 1H), ESI/APCI MS m/z 408 + [M+H] . 1 N-{1-[(2-оксо-1,2,3,4H ЯМР (600 МГц, CDCl3, δ): 1.31-1.41 (m,2H), 1.85-1.92 тетрагідрохінолін-7-іл)метил] (m,2H), 2.07 (t, J = 10.8 Гц, 2H), 2.57-2.66 (m, 2H), 2.66піперидин-4-іл}-2,22.77 (m ,2H), 2.92 (t, J = 7.6 Гц, 2H), 3.37 (s, 2H), 3.83дифенілацетамід 3.90 (m,1H), 4.89 (s, 1H), 5.53 (d, J = 7.8 Гц, 1H), 6.71 (s, 1H), 6.86 (d, J = 7.3 Гц, 1H), 7.06 (d, J = 7.3 Гц, 1H), 7.187.27 (m, 6H), 7.27-7.38 (m, 4H), 8.09 (s, 2H), ESI/APCI MS + m/z 454 [M+H] . 5 19 UA 105187 C2 [0061] [Таблиця 1-6] Приклад Назва сполуки № 28 4-хлор-3-фтор-N-{1-[(2-оксо1,2,3,4-тетрагідрохінолін-7іл)метил]піперидин-4іл}бензамід 29 30 5 10 15 20 3-бром-N-{1-[(2-оксо-1,2,3,4тетрагідрохінолін-7іл)метил]піперидин-4іл}бензамід 3-фтор-5-метоксі-N-{1-[(2оксо-1,2,3,4тетрагідрохінолін-7іл)метил]піперидин-4-іл}бензамід Фізичні властивості 1 H ЯМР (600 МГц, CDCl3, δ): 1.55-1.66 (m,2H), 1.95-2.03 (m,2H), 2.09-2.18 (m,2H), 2.82-2.90 (m,2H), 2.92-2.97 (m,2H), 3.44 (s, 2H), 3.96-4.06 (m, 1H), 6.38 (d, J = 7.3 Гц, 1H), 6.78 (s, 1H), 6.89 (d, J = 6.4 Гц, 1H), 7.09 (d, J = 7.3 Гц, 1H), 7.40-7.48 (m, 1H), 7.50-7.56 (m, 1H),7.65 (dd, J = 9.6, 1.8 Гц, 2H), 8.02 (brs, 1H), ESI/APCI MS m/z 416. + [M+H] . 1 H ЯМР (600 МГц, CDCl3, δ): 1.56-1.67 (m,2H), 1.95-2.03 (m,2H), 2.10-2.19 (m,2H), 2.59-2.67 (m,2H), 2.82-2.90 (m,2H), 2.91-2.97 (m,2H), 3.44 (s, 2H), 3.97-4.05 (m, 1H), 6.36 (d, J = 7.3 Гц, 1H), 6.78 (s, 1H), 6.89 (d, J = 7.3 Гц, 1H), 7.05-7.12 (m, 1H), 7.30 (t, J = 7.8 Гц, 1H),7.58-7.63 (m, 1H), 7.72 (d, J = 7.8 Гц, 1H), 7.94 (s, 1H), 8.09 (brs, + 1H), ESI/APCI MS m/z 442. [M+H] . 1 H ЯМР (600 МГц, CDCl3, δ): 1.50-1.60 (m,2H), 1.96-2.04 (m,2H), 2.12-2.20 (m,2H), 2.60-2.65 (m,2H), 2.80-2.88 (m,2H), 2.91-2.99 (m, 2H), 3.44 (s, 2H), 3.83 (s, 3H), 3.944.02 (m, 1H), 5.96 (d, J = 7.8 Гц, 1H), 6.69-6.76 (m, 2H), 6.91 (d, J = 7.8 Гц, 1H), 6.99 (d, J = 8.7 Гц, 1H), 7.06-7.13 + (m, 2H), 7.65 (brs, 1H), ESI/APCI MS m/z 412 [M+H] . [0062] Приклад 31: Синтез 3-хлор-4-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7іл)метил]піперидин-4-іл}бензаміду До розчину у DMF (2.50 мл) сполуки (250 мг),одержаної на етапі 1-6, додають 3-хлор-4фторбензойну кислоту (191 мг), Et3N (320 мл), HOBtH2O (222 мг) та EDCHCl (222 мг) й суміш перемішують при кімнатній температурі три доби. До реакційної суміші додають насичений водний розчин NaHCO3 і чотири рази екстрагують CHCl3. З’єднані органічні фази сушать над Na2SO4 та концентрують під зниженим тиском. Осад очищують колонковою хроматографією [(силікагель 60 N, рухома фаза: MeOH/CHCl3 = 0/100 до 10/90; в об’ємн. співвіднош..) та(Chromatorex NH, рухома фаза: CHCl3) у такій послідовності]. До осаду додають IPA при кімнатній температурі й суміш перемішують 1 годину. Відфільтрований осад промивають IPA та гексаном, одержуючи цільову сполуку (263 мг, безбарвна тверда маса). 1 H ЯМР (600 МГц, CDCl3, ): 1.53-1.64 (m, 2H), 1.96-2.04 (m, 2H), 2.10-2.20 (m, 2H), 2.58-2.67 (m, 2H), 2.80-2.90 (m, 2H), 2.94 (t, J = 7.6 Гц, 2H), 3.45 (s, 2H), 3.93-4.04 (m, 1H), 6.18 (brs, 1H), 6.77 (s, 1 H), 6.90 (d, J = 7.3 Гц, 1H), 7.10 (d, J = 7.8 Гц, 1H), 7.18 (t, J = 8.7 Гц, 1H), 7.67 (ddd, J = + 8.6, 4.5, 2.1 Гц, 1H), 7.83-7.95 (m, 2H); ESI/APCI MS m/z 416 [M+H] . [0063] Сполуки за прикладами 32 - 47 одержують таким саме чином, як у прикладі 31. 20 UA 105187 C2 [0064] [Таблиця 2-1] Таблиця 2 Приклад Назва сполуки № 32 3-ацетил-N-{1-[(2-оксо1,2,3,4-тетрагідрохінолін-7іл)метил]піперидин-4іл}бензамід 33 34 35 36 Фізичні властивості 1 H ЯМР (600 МГц, CDCl3, δ): 1.54-1.64 (m,2H), 1.97-2.06 (m,2H), 2.11-2.21 (m,2H), 2.58-2.68 (m,2H), 2.81-2.90 (m,2H), ), 2.94 (t, J = 7.6 Гц, 2H), 3.45 (s,2H), 3.96-4.10 (m,1H), 6.20 (d, J = 8.3 Гц, 1H), 6.75 (s, 1H), 6.92 (d, J = 7.8 Гц, 1H), 7.07-7.14 (m, 1H), 7.47-7.59 (m, 1H), ), 7.74 (brs, 1H), 8.01 (d, J = 7.8 Гц, 1H), 8.07 (d, J = 7.3 Гц, 1H), + 8.31 (s, 1H), ESI/APCI MS m/z 406 [M+H] . 1 3,4,5-трифтор-N-{1-[(2-оксоH ЯМР (600 МГц, CDCl3, δ): 1.52-1.63 (m,2H), 1.96-2.01 1,2,3,4-тетрагідрохінолін-7(m,2H), 2.10-2.19 (m,2H), 2.58-2.67 (m,2H), 2.81-2.90 іл)метил]піперидин-4-іл} (m,2H), 2.95 (t, J = 7.6 Гц, 2H), 3.44 (s,2H), 3.92-4.05 бензамід (m,1H), 6.16 (brs, 1H), 6.75 (s, 1H), 6.90 (d, J = 7.3 Гц, 1H), 7.10 (d, J = 7.8 Гц, 1H), 7.46 (t, J = 7.1 Гц, 2H), 7.74 (brs, + 1H), ESI/APCI MS m/z 418 [M+H] . 1 3,4-етоксі-N-{1-[(2-оксоH ЯМР (600 МГц, CDCl3, δ): 1.41 (t, J = 6.9 Гц, 2H), 1.501,2,3,4-тетрагідрохінолін-71.59 (m,2H), 2.01-2.04 (m,2H), 2.16-2.18 (m,2H), 2.59-2.66 іл)метил]піперидин-4-іл} (m,2H), 2.83-2.86 (m, 2H), 2.94 (t, J = 7.6 Гц, 2H), 3.44 бензамід (s,2H), 3.95-4.03 (m,1H), 4.07 (q, J = 6.9 Гц, 2H), 5.98-6.05 (m, 1H), 6.91 (d, J = 7.8 Гц, 1H), 7.01 (dd, J = 8.5, 2.1 Гц, 1H), 7.09 (d, J = 7.8 Гц, 1H),7.28-7.34 (m,2H), 7.60 (brs, + 1H), ESI/APCI MS m/z 408 [M+H] . 1 4-фтор-3-метоксі-N-{1-[(2H ЯМР (600 МГц, CDCl3, δ): 1.55-1.63 (m,2H), 2.03-2.05 оксо-1,2,3,4(m,2H), 2.14-2.23 (m,2H), 2.61-2.68 (m,2H), 2.84-2.91 тетрагідрохінолін-7-іл)метил] (m,2H), 2.96 (t, J = 7.6 Гц, 2H), 3.47 (brs, 2H), 3.95 (s, 3H), піперидин-4-іл}бензамід 3.98-4.05 (m,1H), 6.07 (brs, 1H), 6.78 (brs, 1H), 6.93 (d, J = 7.3 Гц, 1H), 7.06-7.15 (m, 2H), 7.22 (brs, 1H), 7.53 (d, J = + 7.3 Гц, 1H), 7.73 (brs, 1H), ESI/APCI MS m/z 412 [M+H] . 1 3-хлор-5-фтор-N-{1-[(2-оксоH ЯМР (600 МГц, CDCl3, δ): 1.54-1.64 (m, 2H), 1.99-2.04 1,2,3,4-тетрагідрохінолін-7(m, 2H), 2.15-2.18 (m, 2H), 2.58-2.67 (m,2H), 2.82-2.90 (m іл)метил] піперидин-4,2H), 2.92-2.99 (m ,2H), 3.45 (s, 2H), 3.95-4.04 (m,1H), 6.24 іл}бензамід (brs, 1H), 6.76 (s, 1H), 6.90 (d, J = 7.3 Гц, 1H), 7.10 (d, J = 7.3 Гц, 1H), 7.19-7.22 (m, 1H), 7.42 (d, , J = 7.3 Гц, 1H), + 7.55 (s, 1H), 7.81 (brs, 1H), ESI/APCI MS m/z 416 [M+H] . 5 21 UA 105187 C2 [0065] [Таблиця 2-3] Приклад Назва сполуки № 37 3-ціан-N-{1-[(2-оксо-1,2,3,4тетрагідрохінолін-7іл)метил]піперидин-4іл}бензамід 38 39 40 41 Фізичні властивості 1 H ЯМР (600 МГц, CDCl3, δ): 1.58-1.69 (m,2H),2.00-2.05 (m,2H), 2.16-2.19 (m,2H), 2.59-2.69 (m,2H), 2.88-2.92 (m,2H), 2.95 (t, J = 7.6 Гц, 2H), 3.45 (s, 2H), 3.97-4.09 (m, 1H), 6.53 (brs, 1H), 6.79 (s, 1H), 6.89 (d, J = 7.8 Гц, 1H), 7.10 (d, J = 7.8 Гц, 1H), 7.56 (t, J = 7.8 Гц, 2H), 7.76 (d, J = 7.8 Гц, 1H), 8.05-8.06 (m, 1H), 8.15 (s, 1H), ESI/APCI MS + m/z 389 [M+H] . 1 5-хлор-N-{1-[(2-оксо-1,2,3,4H ЯМР (600 МГц, CDCl3, δ): 1.64-1.76 (m,2H), 1.91-2.03 тетрагідрохінолін-7(m, 2H), 2.09-2.16 (m, 2H), 2.59-2.68 (m, 2H), 2.87-2.92 (m, іл)метил]піперидин-4-іл} 2H), 2.94 (t, J = 7.6 Гц, 2H), 3.44 (s,2H), 4.02-4.12 (m,1H), піридин-3-карбоксамід 6.83-6.91 (m, 2H), 7.07-7.11 (m, 1H), 7.13 (brs, 1H), 8.25 (s, 1H), 8.66 (d, J = 2.8 Гц, 1H), ), 8.70 (brs, 1H), 8.96 (s, + 1H), ESI/APCI MS m/z 399 [M+H] . 1 3-хлор-5-метоксі-N-{1-[(2H ЯМР (600 МГц, CDCl3, δ): 1.54-1.65 (m,2H), 1.94-2.03 оксо-1,2,3,4(m,2H), 2.11-2.18 (m,2H), 2.60-2.66 (m,2H), 2.82-2.88 (m, тетрагідрохінолін-72H), 2.91-2.98 (m, 2H), 3.44 (s, 2H), 3.83 (s, 3H), 3.96-4.03 іл)метил]піперидин-4-іл} (m, 1H), 6.21-6.28 (m, 1H), 6.77 (s, 2H), 6.90 (d, J = 7.8 Гц, бензамід 1H), 7.00 (d, J = 2.3 Гц, 1H), 7.09 (d, J = 7.3 Гц, 1H),7.227.26 (m, 1H), 7.30 (s, 1H), 7.90 (brs, 1H), ESI/APCI MS m/z + 428 [M+H] . 1 2-(3-фторфеніл) -N-{1-[(2H ЯМР (600 МГц, CDCl3, δ): 1.31-1.40 (m,2H), 1.81-1.87 оксо-1,2,3,4(m,2H), 2.02-2.10 (m,2H), 2.58-2.63 (m,2H), 2.68-2.78 (m, тетрагідрохінолін-7-іл)метил] 2H), 2.92 (t, J = 7.6 Гц, 2H), 3.38 (s, 2H), 3.52 (s, 2H), 3.75піперидин-4-іл}ацетамід 3.82 (m, 1H), 5.37 (d, J = 8.3 Гц, 1H), 6.70 (s, 1H), 6.86 (d, J = 7.3 Гц, 1H), 6.95-7.03 (m, 3H), 7.07 (d, J = 7.8 Гц, 1H), 7.27-7.32 (m, 1H), 7.89 (brs, 1H), ESI/APCI MS m/z 396 + [M+H] . 1 2-(2-метоксіфеніл)-N-{1-[(2H ЯМР (600 МГц, CDCl3, δ): 1.24-1.33 (m, 2H), 1.77-1.85 оксо-1,2,3,4(m, 2H), 2.01-2.10 (m, 2H), 2.55-2.63 (m,2H), 2.64-2.73 (m тетрагідрохінолін-7-іл)метил] ,2H), 2.92 (t, J = 7.3 Гц, 2H), 3.37 (s, 2H), 3.51 (s, 2H), піперидин-4-іл}ацетамід 3.70-3.79 (m, 1H), 3.83 (s, 3H), 5.53-5.60 (m, 1H), 6.67 (s, 1H), 6.85-6.89 (m, 2H), 6.91-6.94 (m, 1H),7.07 (d, J = 7.8 Гц, 1H), 7.20 (dd, J = 7.3, 1.8 Гц, 1H), 7.23-7.28 (m, 1H), + 7.55 (s, 1H), ESI/APCI MS m/z 408 [M+H] . 5 22 UA 105187 C2 [0066] [Таблиця 2-4] Приклад Назва сполуки Фізичні властивості № 1 42 2-(3,4-дифторфеніл)-N-{1-[(2H ЯМР (600 МГц, CDCl3, δ): 1.33-1.43 (m,2H), 1.83-1.88 оксо-1,2,3,4-тетрагідрохінолін- (m,2H), 2.04-2.11 (m, 2H), 2.59-2.63 (m,2H), 2.75 (brs, 7-іл)метил]піперидин-41H), 2.93 (t, J = 7.6 Гц, 2H), 3.39 (brs, 1H), 3.45-3.48 (m, іл}ацетамід 2H), 3.76-3.81 (m, 1H), 5.39 (brs, 1H), 6.71 (brs, 1H), 6.87 (d, J = 7.3 Гц, 1H), 6.95-6.98 (m, 1H), 7.06-7.12 (m, 3H), + 7.63 (brs, 1H), ESI/APCI MS m/z 414 [M+H] . 1 43 4-хлор-3-метил-N-{1-[(2-оксоH ЯМР (600 МГц, CDCl3, δ): 1.50-1.61 (m,2H), 1.96-2.04 1,2,3,4-тетрагідрохінолін-7(m, 2H), 2.12-2.20 (m, 2H), 2.58-2.65 (m, 2H), 2.81-2.88 іл)метил]піперидин-4-іл} (m, 2H), 2.92-2.97 (m, 2H), 3.44 (s,2H), 3.95-4.04 (m, 1H), бензамід 6.07 (d, J = 7.8 Гц, 1H), 6.75 (s, 2H), 6.88-6.93 (m, 1H), 7.09 (d, J = 7.8 Гц, 1H), 7.34-7.39 (m, 1H), 7.49 (dd, J = 8.0, 2.1 Гц, 1H), 7.64 (d, J = 1.8 Гц, 1H), ), 7.74 (brs, 1H), + ESI/APCI MS m/z 412 [M+H] . 1 44 2-(2-фторфеніл)-N-{1-[(2-оксо- H ЯМР (600 МГц, CDCl3, δ): 1.28-1.43 (m,2H), 1.79-1.90 1,2,3,4-тетрагідрохінолін-7(m,2H), 2.02-2.13 (m,2H), 2.53-2.65 (m, 2H), 2.65-2.75 (m, іл)метил]піперидин-4-іл} 2H), 2.83-3.00 (m, 2H), 3.38 (s, 2H), 3.54 (s, 2H), 3.74ацетамід 3.82 (m, 1H), 5.34 (d, J = 7.8 Гц, 1H), 6.68 (s, 2H), 6.856.88 (m, 1H), 7.03-7.08 (m, 2H), 7.10-7.13 (m, 1H), 7.247.30 (m, 2H), 7.56 (brs, 1H), ESI/APCI MS m/z 396 + [M+H] . 1 45 2-(4-хлорфеніл)-2-метил-N-{1- H ЯМР (600 МГц, CDCl3, δ): 1.21-1.30 (m,2H), 1.52 (s, [(2-оксо-1,2,3,46H), 1.76-1.83 (m,2H), 2.01-2.10 (m, 2H), 2.56-2.63 тетрагідрохінолін-7-іл)метил] (m,2H), 2.63-2.69 (m, 2H), 2.88-2.96 (m, 2H), 3.36 (s, 2H), піперидин-4-іл}пропанамід 3.68-3.77 (m, 1H), 4.95 (d, J = 7.8 Гц, 1H), 6.67 (s, 1H), 6.86 (d, J = 6.0 Гц, 1H), 7.04-7.09 (m, 1H), 7.22-7.28 (m, 2H), 7.28-7.33 (m, 2H), 7.68 (s, 1H), ESI/APCI MS m/z 440 + [M+H] . 1 46 2-(3-хлор-4-фторфеноксі)- NH ЯМР (600 МГц, CDCl3, δ): 1.45-1.55 (m, 2H), 1.87-1.96 {1-[(2-оксо-1,2,3,4(m, 2H), 2.08-2.17 (m, 2H), 2.59-2.66 (m,2H), 2.74-2.82 (m тетрагідрохінолін-7-іл)метил] ,2H), 2.91-2.98 (m ,2H), 3.42 (s, 2H), 3.86-3.94 (m, 1H), піперидин-4-іл}ацетамід 4.41 (s, 2H), 6.34 (d, J = 7.8 Гц, 1H), 6.71 (s, 1H), 6.756.79 (m, 1H), 6.88-6.92 (m, 1H), 6.97 (dd, J = 6.0, 3.2 Гц, 1H), 7.09 (d, J = 8.3 Гц, 2H), 7.23-7.28 (m, 1H), 7.66 (brs, + 1H), ESI/APCI MS m/z 446 [M+H] . 5 [0067] [Таблиця 2-4] Приклад Назва сполуки № 47 2-(3-хлорфеноксі)-N-{1-[(2оксо-1,2,3,4тетрагідрохінолін-7іл)метил]піперидин-4іл}ацетамід 10 Фізичні властивості 1 H ЯМР (600 МГц, CDCl3, δ): 1.45-1.55 (m, 2H), 1.88-1.96 (m, 2H), 2.07-2.17 (m, 2H), 2.56-2.66 (m, 2H), 2.73-2.84 (m, 2H), 2.87-2.99 (m, 2H), 3.42 (s, 2H), 3.84-3.96 (m, 1H), 4.44 (s, 2H), 6.36 (d, J = 7.8 Гц, 1H), 6.71 (s, 1H), 6.79 (dd, J = 8.3, 2.3 Гц, 1H), 6.90 (d, J = 7.8 Гц, 1H), 6.93 (d, J = 2.3 Гц, 1H), 6.99-7.03 (m, 1H), 7.09 (d, J = 7.3 Гц, 1H), 7.21-7.25 + (m, 1H), 7.53 (brs, 1H), ESI/APCI MS m/z 428 [M+H] . [0068] Приклад 48: Синтез 3-хлор-4-фтор-N-{1-[(1-метил-2-оксо-1,2,3,4-тетрагідрохінолін-7іл)метил]піперидин-4-іл}бензаміду Етап 48-1: До розчину у DMF (20 мл) сполуки, (1.25 г), одержаної на етапі 1-3, додають NaH 23 UA 105187 C2 5 10 15 20 25 30 35 40 45 50 55 60 (0.29 г)при перемішуванні на кризі й суміш перемішують 30 хвилин. До суміші додають MeI (1.12 г) і суміш перемішують при кімнатній температурі 12 годин. Додають воду та тричі екстрагують реакційну суміш EtOAc. З’єднані органічні фази промивають водою та розсолом, сушать над MgSO4 та концентрують під зниженим тиском. Осад очищують колонковою хроматографією (силікагель 60 N, рухома фаза: EtOAc/гексан = 30/70 до 50/50; в об’ємн. співвіднош.), одержуючи 1-метил-2-оксо-1,2,3,4-тетрагідрохінолін-7-карбонітрил (0.94 г, безбарвна тверда маса). 1 H ЯМР (600 МГц, CDCl3, ): 2.64-2.73 (m, 2H), 2.92-3.04 (m, 2H), 3.37 (s, 3H), 7.21-7.23 (m, + 1H), 7.26-7.29 (m, 1H), 7.31-7.34 (m, 1H); EI MS m/z 186 [M] . Етап 48-2: Із сполуки (0.92 г), одержаної на етапі 48-1, одержують 1-метил-2-оксо-1,2,3,4тетрагідрохінолін-7-карбальдегід (0.93 г, жовтава олія) таким саме чином, як на етапі 1-4. 1 H ЯМР (600 МГц, CDCl3, ): 2.69-2.75 (m, 2H), 3.00-3.06 (m, 2H), 3.45 (s, 3H), 7.35-7.40 (m, + 1H), 7.51-7.53 (m, 1H), 7.54-7.57 (m, 1H), 10.02 (s, 1H); EI MS m/z 189 [M] . Етап 48-3: До розчину у CHCl3 (20 мл) сполуки (0.93 г), одержаної на етапі 48-2, додають трет-бутилпіперидин-4-ілкарбамат (0.82 г) та AcOH (0.27 г), додають NaBH(OAc) 3 (1.30 г) при кімнатній температурі й суміш перемішують при кімнатній температурі 12 годин. Додають насичений водний розчин NaHCO3, водну та органічну фазу розділяють. Водну фазу тричі екстрагують CHCl3. З’єднані органічні фази сушать над Na2SO4 та концентрують під зниженим тиском. Осад очищують колонковою хроматографією (Chromatorex NH, рухома фаза: EtOAc/гексан = 50/50; (в об’ємн. співвіднош.), одержуючи трет-бутил {1-[(1-метил-2-оксо-1,2,3,4тетрагідрохінолін-7-іл)метил]піперидин-4-іл}карбамат (0.78 г, безбарвна аморфна маса). 1 H ЯМР (600 МГц, CDCl3, ): 1.37-1.44 (m, 2H), 1.45 (s, 9H), 1.84-1.97 (m, 2H), 2.07-2.13 (m, 2H), 2.60-2.68 (m, 2H), 2.75-2.84 (m, 2H), 2.85-2.91 (m, 2H), 3.36 (s, 3H), 3.42-3.55 (m, 3H), 4.44 + (brs, 1H), 6.91-6.98 (m, 2H), 7.09 (d, J = 7.3 Гц, 1H); ESI/APCI MS m/z 374 [M+H] . Етап 48-4: Із сполуки (0.77 г), одержаної на етапі 48-3, одержують 7-[(4-амінопіперидин-1ілl)метил]-1-метил-3,4-дигідрохінолін-2(1H)-он (0.57 г, безбарвна тверда маса) таким саме чином, як на етапі 1-6. 1 H ЯМР (600 МГц, CDCl3, ): 1.33-1.45 (m, 2H), 1.76-1.82 (m, 2H), 2.00-2.07 (m, 2H), 2.58-2.67 (m, 2H), 2.66-2.71 (m, 1H), 2.79-2.85 (m, 2H), 2.86-2.90 (m, 2H), 3.37 (s, 3H), 3.48 (s, 2H), 6.95 (d, J + = 7.8 Гц, 1H), 6.98 (s, 1H), 7.09 (d, J = 7.3 Гц, 1H); ESI/APCI MS m/z 274 [M+H] . Етап 48-5: Із сполуки (200 мг), одержаної на етапі 48-4, та 3-хлор-4-фторбензойної кислоти (141 мг) одержують цільову сполуку (183 мг, безбарвна тверда маса) таким саме чином, як у прикладі 31. 1 H ЯМР (600 МГц, CDCl3, ): 1.51-1.58 (m, 2H), 1.98-2.05 (m, 2H), 2.18 (t, J = 10.8 Гц, 2H), 2.602.68 (m, 2H), 2.83-2.91 (m, 4H), 3.36 (s, 3H), 3.50 (s, 2H), 3.94-4.02 (m, 1H), 5.89 (d, J = 7.8 Гц, 1H), 6.95 (d, J = 7.3 Гц, 1H), 6.96-6.99 (m, 1H), 7.09 (d, J = 7.3 Гц, 1H), 7.18 (t, J = 8.7 Гц, 1H), 7.63 (ddd, + J = 8.6, 4.5, 2.1 Гц, 1H), 7.81 (dd, J = 6.9, 2.3 Гц, 1H); ESI/APCI MS m/z 430 [M+H] . [0069] Приклад 49: Синтез 3-хлор-4-фтор-N-({1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7іл)метил]піперидин-4-іл}метил)бензаміду Етап 49-1: Із сполуки (0.87 г), одержаної на етапі 1-4, та трет-бутил(піперидин-4ілметил)карбамату (0.88 g) одержують трет-бутил({1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7іл)метил]піперидин-4-іл}метил)карбамат (0.68 г, безбарвна тверда маса) таким саме чином, як на етапі 48-3. 1 H ЯМР (600 МГц, CDCl3, ): 1.20-1.31 (m, 2H), 1.43 (s, 9H), 1.43-1.45 (m, 1H), 1.61-1.67 (m, 2H), 1.88-1.98 (m, 2H), 2.60-2.67 (m, 2H), 2.83-2.90 (m, 2H), 2.90-2.98 (m, 2H), 2.99-3.05 (m, 2H), 3.42 (s, 2H), 4.56-4.63 (m, 1H), 6.73 (s, 1H), 6.91 (d, J = 7.8 Гц, 1H), 7.09 (d, J = 7.3 Гц, 1H), 7.86 (s, + 1H); ESI/APCI MS m/z 374 [M+H] . Етап 49-2: Із сполуки (0.66 г), одержаної на етапі 49-1, одержують 7-{[4(амінметил)піперидин-1-іл]метил}-3,4-дигідрохінолін-2(1H)-он (0.35 г, безбарвна аморфна маса) таким саме чином, як на етапі 1-6. 1 H ЯМР (600 МГц, CDCl3, ): 1.17-1.30 (m, 2H), 1.27-1.33 (m, 1H), 1.66-1.73 (m, 2H), 1.90-1.97 (m, 2H), 2.56-2.60 (m, 2H), 2.61-2.66 (m, 2H), 2.85-2.92 (m, 2H), 2.92-2.97 (m, 2H), 3.42 (s, 2H), 6.76 (s, 1H), 6.92 (d, J = 7.3 Гц, 1H), 7.09 (d, J = 7.8 Гц, 1H), 8.16 (brs, 1H); ESI/APCI MS m/z 274 + [M+H] . Етап 49-3: Із сполуки (211 мг), одержаної на етапі 49-2, та 3-хлор-4-фторбензойної кислоти (145 мг), одержують цільову сполуку (120 мг, безбарвна тверда маса) таким саме чином, як у прикладі 31. 1 H ЯМР (600 МГц, CDCl3, ): 1.29-1.40 (m, 2H), 1.59-1.67 (m, 1H), 1.68-1.74 (m, 2H), 1.92-2.00 (m, 2H), 2.58-2.65 (m, 2H), 2.86-2.91 (m, 2H), 2.91-2.96 (m, 2H), 3.30-3.37 (m, 2H), 3.42 (s, 2H), 6.07-6.13 (m, 1H), 6.70 (s, 1H), 6.90 (d, J = 7.3 Гц, 1H), 7.08 (d, J = 7.3 Гц, 1H), 7.18 (t, J = 8.7 Гц, 24 UA 105187 C2 5 10 15 20 25 30 35 40 45 50 55 60 1H), 7.45 (brs, 1H), 7.64 (ddd, J = 8.4, 4.5, 2.3 Гц, 1H), 7.82 (dd, J = 7.1, 2.1 Гц, 1H); ESI/APCI MS + m/z 430 [M+H] . [0070] Приклад 50: Синтез 3-метоксі-N-{1-[2-(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)етил]піперидин-4іл}бензаміду Етап 50-1: Суміш Ph3PCH2OMeBr (4.97 г) з включенням NaNH 2 у розчині THF (20 мл)перемішують на кризі 10 хвилин. До суміші повільно додають по краплинах розчин у THF (80 мл) сполуки (1.00 г), одержаної на етапі 1-4, протягом 4 годин. До реакційної суміші додають насичений водний розчин NaHCO3 та екстрагують один раз EtOAc і двічі CHCl3. З’єднані органічні фази промивають розсолом, сушать над MgSO 4 та концентрують під зниженим тиском. Осад очищують колонковою хроматографією (силікагель 60 N, рухома фаза: EtOAc/гексан = 20/80 до 40/60; (в об’ємн. співвіднош.), одержуючи 7-(2-метоксіетеніл)-3,4-дигідроксіхінолін2(1H)-он (0.60 g, безбарвна тверда маса). 1 H ЯМР (600 МГц, CDCl3, ): 2.48-2.76 (m, 2H), 2.79-3.07 (m, 2H), 3.59-3.84 (m, 3H), 5.10-7.18 + (m, 5H), 8.17-8.76 (m, 1H); ESI/APCI MS m/z 204 [M+H] . Етап 50-2: До розчину у THF(11.8 мл) сполуки (590 мг), одержаної на етапі 50-1, додають концентровану HCl (8.9 мл) при охолодженні кригою й суміш перемішують при тій самій температурі 1 годину. До реакційної суміші додають насичений водний розчин K 2CO3 та CHCl3. Органічну фазу сушать над MgSO4 та концентрують під зниженим тиском, одержуючи (2-оксо1,2,3,4-тетрагідрохінолін-7-іл)ацетальдегід (0.51 г, безбарвна аморфна маса). 1 H ЯМР (600 МГц, CDCl3, ): 2.60-2.70 (m, 2H), 2.91-3.01 (m, 2H), 3.57-3.76 (m, 2H), 6.58-7.20 + (m, 3H), 9.72-9.77 (m, 1H); EI MS m/z 189 [M] . Етап 50-3: До суспензії у DMF (780 мл) трет-бутил-4-aminoпіперидин-1-карбоксілату (78.0 г) та 3-метоксібензойної кислоти (65.2 г) додають Et3N (130 мл), HOBtH2O (71.7 г) та EDCHCl (82.8 г) та перемішують суміш при кімнатній температурі 12 годин. Додають H2O (1.56 л) та перемішують суміш на водяній бані 1.5 години. Осад фільтрують, одержуючи трет-бутил-4-[(3метоксібензоїл)амін]піперидин-1-карбоксілат (126 г, безбарвна тверда маса). До суспензії в EtOAc (900 мл) сполуки, одержаної вище, додають розчин 4 M HCl/EtOAc (900 мл) та перемішують суміш при кімнатній температурі 4 години. Реакційну суміш концентрують під зниженим тиском, а далі додають до осаду CHCl3 (2.00 л) та 2 M водний розчин NaOH (1.00 л) та перемішують суміш 15 хвилин. Водну фазу відокремлюють від органічної фази та двічі екстрагують CHCl3 (800 мл). З’єднані органічні фази сушать над Na2SO4 та концентрують під зниженим тиском, одержуючи 3-метоксі-N-піперидин-4-ілбензамід (87.8 г, жовтава тверда маса). 1 H ЯМР (200 МГц, CDCl3, ): 1.30-1.52 (m, 2H), 1.97-2.12 (m, 2H), 2.75 (dt, J = 12.0, 2.4 Гц, 2H), 3.11 (dt, J = 12.8, 3.5 Гц, 2H), 3.85 (s, 3H), 3.96-4.18 (m, 1H), 6.00 (d, J = 7.9 Гц, 1H), 6.98-7.07 (m, + 1H), 7.21-7.38 (m, 3H); ESI MS m/z 235, [M+H] . Етап 50-4: Із сполуки (0.51 г), одержаної на етапі 50-2, та сполуки (0.57 г), одержаної на етапі 50-3, одержують цільову сполуку (0.22 г, безбарвна тверда маса) таким саме чином, як на етапі 48-3. 1 H ЯМР (600 МГц, CDCl3, ): 1.50-1.62 (m, 2H), 2.00-2.11 (m, 2H), 2.19-2.27 (m, 2H), 2.54-2.65 (m, 4H), 2.72-2.78 (m, 2H), 2.88-2.99 (m, 4H), 3.84 (s, 3H), 3.96-4.06 (m, 1H), 5.96 (d, J = 7.8 Гц, 1H), 6.59 (s, 1H), 6.79-6.86 (m, 1H), 7.02 (dd, J = 8.3, 1.8 Гц, 1H), 7.07 (d, J = 7.8 Гц, 1H), 7.22-7.28 + (m, 1H), 7.29-7.36 (m, 2H), 7.80 (s, 1H); ESI/APCI MS m/z 408 [M+H] . [0071] Приклад 51: Синтез 3-хлор-4-фтор-N-{1-[1-(2-оксо-1,2,3,4-тетрагідрохінолін-7іл)етил]піперидин-4-іл}бензамід Етап 51-1: До розчину у THF (150 мл) сполуки (1.25 г), одержаної на етапі 1-4, додають 3 M розчин MeMgBr Et2O та перемішують суміш при кімнатній температурі 1 годину. До реакційної суміші додають насичений водний розчин NH4Cl, суміш перемішують 1 годину й відокремлюють органічну фазу. Водну фазу тричі екстрагують CHCl 3. З’єднані органічні фази сушать над MgSO 4 та концентрують під зниженим тиском. До осаду додають IPE та перемішують суміш 10 хвилин. Осад фільтрують, одержуючи 7-(1-гідроксіетил)-3,4-дигідрохінолін-2(1H)-он (1.02 г, жовтава тверда маса). 1 H ЯМР (600 МГц, CDCl3, ): 1.48 (d, J = 6.4 Гц, 3H), 2.59-2.67 (m, 2H), 2.91-3.01 (m, 2H), 4.814.91 (m, 1H), 6.76-6.79 (m, 1H), 6.96-7.00 (m, 1H), 7.13-7.16 (m, 1H), 7.57 (brs, 1H); ESI/APCI MS + m/z 192 [M+H] . Етап 51-2: До розчину в CHCl3 (120 мл)сполуки (1.00 г), одержаної на етапі 51-1, додають MnO2 (13.6 г) та перемішують суміш при кімнатній температурі 4 години. Реакційну суміш фільтрують крізь целіт, а фільтрат концентрують під зниженим тиском . Осад очищують колонковою хроматографією (силікагель 60 N, рухома фаза MeOH/CHCl 3 = 0/100 до 10/90; в 25 UA 105187 C2 5 10 15 20 25 30 35 40 45 50 55 60 об’ємн. співвіднош..), одержуючи 7-ацетил-3,4-дигідрохінолін-2(1H)-он (0.58 г, безбарвна тверда маса). 1 H ЯМР (600 МГц, CDCl3, ): 2.56-2.62 (m, 3H), 2.62-2.72 (m, 2H), 2.99-3.09 (m, 2H), 7.18-7.32 + (m, 1H), 7.34-7.40 (m, 1H), 7.51-7.65 (m, 1H), 8.18 (brs, 1H); ESI/APCI MS m/z 190 [M+H] . Етап 51-3: До розчину у CHCl3 (350 мл) трет-бутил-4-амінпіперидин-1-карбоксілату (35.0 г) додають Et3N (122 мл) та 3-хлор-4-фторбензоїлхлорид (37.1 г) з охолодженням на кризі і суміш перемішують при тій саме температурі 1.5 години. До реакційної суміші додають насичений водний розчин NaHCO3 і тричі екстрагують CHCl3. З’єднані органічні фази сушать над MgSO4 та концентрують під зниженим тиском, одержуючи трет-бутил-4-[(3-хлор-4фторбензоїл)амін]піперидин-1-карбоксилат (62.0 г). До суспензії в EtOAc (300 мл) одержаної речовини додають 4 M розчин HCl/EtOAc (300 мл) та перемішують суміш при кімнатній температурі 4 години. Реакційну суміш концентрують під зниженим тиском, до осаду додають 1 M водний розчин NaOH (300 мл) та тричі екстрагують CHCl 3. З’єднані органічні фази сушать над MgSO4 та концентрують під зниженим тиском. Осад суспендують у EtOAc/гексані (200 мл , 1/1; (в об’ємн. співвіднош..) та перемішують суміш 1 годину. Осад фільтрують, одержуючи 3-хлор-4фтор-N-піперидин-4-ілбензамід (37.7 г, безбарвна тверда маса). 1 H ЯМР (200 МГц, CDCl3, ): 1.30-1.53 (m, 2H), 1.94-2.12 (m, 2H), 2.75 (td, J = 12.0, 2.4 Гц, 2H), 3.10-3.14 (m, 2H), 3.93-4.17 (m, 1H), 5.87-6.09 (m, 1H), 7.19 (t, J = 8.6 Гц, 1H), 7.59-7.70 (m, 1H), + 7.83 (dd, J = 7.0, 2.2 Гц, 1H); ESI MS m/z 257, [M+H] . Етап 51-4: До розчину у MeOH (15 мл) сполуки (206 мг), одержаної на етапі 51-2, додають сполуку (560 мг), одержану на етапі 51-3, та AcOH (327 мг), додають NaBH3CN (274 мг) при кімнатній температурі й суміш нагрівають із зворотним холодильником 12 годин. Реакційну суміш охолоджують до кімнатної температури, додають NaBH 3CN (274 мг) та нагрівають із зворотним холодильником 72 години. Додають насичений водний розчин NaHCO 3, водну та органічну фази розділяють. Водну фазу тричі екстрагують CHCl3. З’єднані органічні фази сушать над MgSO4 та концентрують під зниженим тиском. Осад очищують колонковою хроматографією [(силікагель 60 N, рухома фаза: MeOH/CHCl3 = 0/100 до 20/80; (в об’ємн. співвіднош..) та (Chromatorex NH, рухома фаза MeOH/CHCl3 = 0/100 до 10/90; в об’ємн. співвіднош..) у такій послідовності], одержуючи цільову сполуку (7 мг, безбарвна тверда маса). 1 H ЯМР (600 МГц, CDCl3, ): 1.30-1.37 (m, 3H), 1.44-1.64 (m, 2H), 1.89-2.20 (m, 4H), 2.60-2.67 (m, 2H), 2.72-3.07 (m, 2H), 2.90-2.97 (m, 2H), 3.30-3.37 (m, 1H), 3.88-3.98 (m, 1H), 6.10 (d, J = 7.3 Гц, 1H), 6.73 (s, 1H), 6.87-6.92 (m, 1H), 7.09 (d, J = 7.8 Гц, 1H), 7.18 (t, J = 8.5 Гц, 1H), 7.66 (ddd, J + = 8.7, 4.6, 2.3 Гц, 1H), 7.79 (brs, 1H), 7.85 (dd, J = 6.9, 2.3 Гц, 1H); ESI/APCI MS m/z 430 [M+H] . [0072] Приклад 52: Синтез N-{1-[(8-фтор-2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4іл}-3-метоксібензаміду Етап 52-1: До розчину у MeOH (10.0 мл) сполуки (1.00 г), одержаної на етапі 1-4, додають NaBH4 (216 мг) з охолодженням на кризі і суміш перемішують при тій саме температурі 30 хвилин. До реакційної суміші додають насичений водний розчин NaHCO 3 й суміш концентрують під зниженим тиском. Далі до осаду додають H 2O і тричі екстрагують розчин CHCl3. З’єднані органічні фази промивають розсолом, сушать над Na2SO4 та концентрують під зниженим тиском. Осад очищують колонковою хроматографією (силікагель 60 N, рухома фаза: MeOH/CHCl3 = 0/100 до 10/90; (в об’ємн. співвіднош..), одержуючи 7-(гідроксіметил)-3,4дигідроксіхінолін-2(1H)-он (550 mg, безбарвна тверда маса). 1 H ЯМР (600 МГц, CDCl3, ): 2.56-2.61 (m, 2H), 2.92 (t, J = 7.6 Гц, 2H), 4.62 (d, J = 6.0 Гц, 2H), 6.76 (s, 1H), 6.94 (d, J = 7.8 Гц, 1H), 7.11 (d, J = 7.3 Гц, 1H), 7.90 (brs, 1H); ESI/APCI MS m/z 178 + [M+H] . Етап 52-2: До розчину у CHCl3 (30.0 мл) сполуки (670 мг), одержаної на етапі 52-1, додають Ac2O (536 мл), DMAP (20.0 мг) та Et3N (1.05 мл) з охолодженням на кризі і суміш перемішують при кімнатній температурі 45 хвилин. До реакційної суміші додають насичений водний розчин NaHCO3 і тричі екстрагують CHCl3. З’єднані органічні фази сушать над Na2SO4 та концентрують під зниженим тиском. Осад очищують колонковою хроматографією (силікагель 60 N, рухома фаза: MeOH/CHCl3 = 0/100 до 10/90; (в об’ємн. співвіднош..), одержуючи (2-оксо-1,2,3,4тетрагідрохінолін-7-іл)метилацетат (767 мг, жовтава тверда маса). 1 H ЯМР (600 МГц, CDCl3, ): 2.09 (s, 3H), 2.61-2.65 (m, 2H), 2.96 (t, J = 7.6 Гц, 2H), 5.04 (s, 2H), 6.74 (s, 1H), 6.96-6.99 (m, 1H), 7.15 (d, J = 7.3 Гц, 1H), 7.72 (brs, 1H); ESI/APCI MS m/z 220 + [M+H] . Етап 52-3: До розчину у CH3CN (22.0 мл) сполуки (958 мг), одержаної на етапі 52-2, додають бістетрафторборат 1-фтор-4-гідроксі-1,4-діазонійбіцикло[2.2.2]октану (1.91 г) і суміш перемішують при кімнатній температурі три доби. Далі реакційну суміш концентрують під 26 UA 105187 C2 5 10 15 20 25 30 35 40 45 50 55 60 зниженим тиском, осад очищують колонковою хроматографією (силікагель 60 N, рухома фаза: MeOH/CHCl3 = 0/100 до 10/90; в об’ємн. співвіднош.), одержуючи тверду речовину А та тверду речовину В. До розчину твердої речовини А у MeOH (2.00 мл) додають K2CO3 (69.0 мг) і суміш перемішують при кімнатній температурі 2 години. До реакційної суміші додають H 2O, суміш концентрують під зниженим тиском і тричі екстрагують CHCl 3. З’єднані органічні фази промивають розсолом, сушать над Na2SO4 та концентрують під зниженим тиском. Осад очищують колонковою хроматографією (силікагель 60 N, рухома фаза: MeOH/CHCl 3 = 0/100 до 15/85; в об’ємн. співвіднош..), одержуючи 8-фтор-7-(гідроксіметил)-3,4-дигідрохінолін-2(1H)-он (37.0 мг, безбарвна тверда маса). 1 H ЯМР (600 МГц, CDCl3, ): 2.63-2.66 (m, 2H), 2.98-3.01 (m, 2H), 4.74 (s, 2H), 6.95 (d, J = 7.8 + Гц, 1H), 7.02 (t, J = 7.6 Гц, 1H), 7.53 (brs, 1H); ESI/APCI MS m/z 196 [M+H] . Таким саме чином із твердої речовини В одержують 6-фтор-7-(гідроксіметил)-3,4дигідроксіхінолін-2(1H)-он (76.0 мг, безбарвна тверда маса). 1 H ЯМР (600 МГц, CDCl3, ): 2.60-2.62 (m, 2H), 2.94 (t, J = 7.6 Гц, 2H), 4.72 (s, 2H), 6.79 (d, J = + 6.4 Гц, 1H), 6.88 (d, J = 10.1 Гц, 1H), 7.38 (brs, 1H); ESI/APCI MS m/z 196 [M+H] . Етап 52-4: До розчину 8-фтор-7-(гідроксіметил)-3,4-дигідроксіхінолін-2(1H)-ону (39.0 мг), одержаного на етапі 52-3, у CHCl3 (6.00 мл) та ацетоні (6.00 мл) додають MnO 2 (152 мг) і суміш перемішують при кімнатній температурі 2 доби. Реакційну суміш фільтрують крізь целіт, а фільтрат концентрують під зниженим тиском, одержуючи 8-фтор-2-оксо-1,2,3,4тетрагідрохінолін-7-карбальдегід (40.0 mg, безбарвна тверда маса). 1 H ЯМР (600 МГц, CDCl3, ): 2.68-2.71 (m, 2H), 3.06-3.09 (m, 2H), 7.09 (d, J = 7.8 Гц, 1H), 7.47 + (d, J = 7.8 Гц, 1H), 7.60 (brs, 1H), 10.29 (s, 1H); ESI/APCI MS m/z 194 [M+H] . Етап 52-5: Із сполуки (40.0 мг), одержаної на етапі 52-4, та 3-метоксі-N-(піперидин-4іл)бензаміду (73.0 мг) одержують тверду речовину таким саме способом, як на етапі 1-5. До одержаної твердої речовини додають IPA при кімнатній температурі й суміш перемішують 1 годину. Осад відфіильровують, промивають IPA та гексаном, одержуючи цільову сполуку (8.0 мг, безбарвна тверда маса). 1 H ЯМР (600 МГц, CDCl3, ): 1.47-1.60 (m, 2H), 2.00-2.05 (m, 2H), 2.20-2.31 (m, 2H), 2.63-2.67 (m, 2H), 2.87 (brs, 2H), 2.99 (t, J = 7.6 Гц, 2H), 3.57 (brs, 2H), 3.84 (s, 3H), 3.99 (brs, 1H), 5.91 (brs, 1H), 6.90-6.98 (m, 2H), 7.02 (dd, J = 8.3, 1.8 Гц, 1H), 7.22-7.25 (m, 1H), 7.30-7.33 (m, 2H), 7.51 (brs, + 1H); ESI/APCI MS m/z 412 [M+H] . [0073] Приклад 53: Синтез N-{1-[(6-фтор-2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)метил]піперидин-4іл}-3-метоксібензаміду Етап 53-1: Із 6-фтор-7-(гідроксіметил)-3,4-дигідроксіхінолін-2(1H)-ону (76.0 мг), одержаного на етапі 52-3, одержують 6-фтор-2-оксо-1,2,3,4-тетрагідрохінолін-7-карбальдегід (32.0 мг, безбарвна тверда маса) таким саме способом, як на етапі 52-4. 1 H ЯМР (600 МГц, CDCl3, ): 2.63-2.66 (m, 2H), 3.02-3.05 (m, 2H), 7.03 (d, J = 9.6 Гц, 1H), 7.18 + (d, J = 5.5 Гц, 1H), 7.54 (brs, 1H), 10.30 (s, 1H); ESI/APCI MS m/z 194 [M+H] . Етап 53-2: Із сполуки (32.0 мг), одержаної на етапі 53-1, та 3-метоксі-N-(піперидин-4іл)бензаміду (58.0 мг) одержують цільову сполуку (38.0 мг, безбарвна тверда маса) таким саме способом, як на етапі 52-5. 1 H ЯМР (600 МГц, CDCl3, ): 1.51-1.62 (m, 2H), 2.00-2.05 (m, 2H), 2.21-2.28 (m, 2H), 2.59-2.63 (m, 2H), 2.81-2.88 (m, 2H), 2.93 (t, J = 7.6 Гц, 2H), 3.52 (brs, 2H), 3.84 (s, 3H), 4.00 (brs, 1H), 5.97 (brs, 1H), 6.76 (d, J = 5.5 Гц, 1H), 6.86 (d, J = 9.6 Гц, 1H), 7.02 (dd, J = 8.7, 2.3 Гц, 1H), 7.22-7.26 + (m, 1H), 7.30-7.34 (m, 2H), 7.42-7.46 (m, 1H); ESI/APCI MS m/z 412 [M+H] . Посилальний приклад 1: Синтез 3-метоксі-N-{1-[(2-оксо-1,2,3,4-тетрагідрохінолін-7іл)метил]піперидин-4-іл}бензаміду Етап R1-1: До суспензії 7-гідроксі-3,4-дигідроксіхінолін-2(1H)-ону (200 г) у CHCl3 (2.0 л) додають піридин (212 г) при кімнатній температурі протягом 10 хвилин. Додають Tf 2O (344 г) до суміші протягом 35 хвилин, підтримуючи температуру нижче 10°C. Суміші дають нагрітися до 15°C протягом 1 години, після чого суміш охолоджують до 0°C та загартовуютьь додаванням води (2.0 л). Органічну фазу відокремлюють, промивають насиченим водним розчином KHSO 4 і двічі водою, сушать над Na2SO4 та концентрують, одержуючи 2-оксо-1,2,3,4-тетрагідрохінолін-7ілтрифторметансульфонат у вигляді жовтавої твердої маси (346 г). 1 H ЯМР (200 МГц, CDCl3, ): 2.63-2.72 (m, 2H), 2.96-3.05 (m, 2H), 6.75 (d, J = 2.2 Гц, 1H), 6.90 (dd, J = 8.4, 2.2 Гц, 1H), 7.20-7.26 (m, 1H), 8.83 (brs, 1H); ESI/APCI MS m/z 294 [M-H] . Етап R1-2: Суміш 2-оксо-1,2,3,4-тетрагідрохінолін-7-ілтрифторметансульфонату (338 г), Zn(CN)2 (134 г) та Pd(PPh3)4 (33.5 г) у DMF (3.0 л) нагрівають при 100°C 4 години та охолоджують до кімнатної температури. До суміші додають Zn(CN) 2 (134 г) та Pd(PPh3)4 (12.7 г), 27 UA 105187 C2 5 10 15 20 25 30 35 40 і суміш перемішують при 100°C 2 години. Після охолодження до 60°C реакційну суміш фільтрують крізь целіт. Фільтрат концентруют, одержуючи тверду масу. Її двічі промивають EtOAc, одержуючи 2-оксо-1,2,3,4-тетрагідрохінолін-7-карбонітрил у вигляді жовтавої твердої маси (165 г). 1 H ЯМР (600 МГц, DMSO-d6, ): 2.43-2.45 (m, 2H), 2.90-2.97 (m, 2H), 7.12 (s, 1H), 7.31-7.37 (m, 2H), 10.29 (s, 1H) ; ESI/APCI MS m/z 171 [M-H] . Етап R1-3: До суспензії 2-оксо-1,2,3,4-тетрагідрохінолін-7-карбонітрилу (160 г) у HCO2H (1.6 л) додають нікелевий каталізатор Ренея (суспензія у воді, 160 г) при кімнатній температурі протягом 30 хвилин. Суміш нагрівають при 100°C 2 години. Після охолодження до кімнатної температури реакційну суміш фільтрують крізь целіт та промивають HCO2H. Фільтрат концентрують, одержуючи тверду речовину. Її перемішують з водою (1.3 л) та фільтрують, одержуючи 2-оксо-1,2,3,4-тетрагідрохінолін-7-карбальдегід у вигляді коричнюватої твердої маси (156 г). 1 H ЯМР (600 МГц, DMSO-d6, ): 2.43-2.45 (m, 2H), 2.94 (t, J = 7.6 Гц, 2H), 7.30 (s, 1H), 7.38 (d, + J = 7.3 Гц, 1H), 7.44-7.49 (m, 1H), 9.87 (s, 1H), 10.29 (s, 1H); ESI/APCI MS m/z 176 [M+H] . Етап R1-4: До розчину трет-бутил-4-амінпіперидин-1-карбоксилату (150 г) та Et3N (209 мл) в IPA (1.0 л) додають 3-метоксібензїлхлорид (102 мл )протягом 40 хвилин з охолодженням на кризі. Суміш перемішують при кімнатній температурі 2 години. Після охоложення до 0°C до суміші додають 12 M водний розчин HCl (0.5 л) протягом 30 хвилин і суміш перемішують при 50°C 1 годину. Після охоложення до 0°C до реакційної суміші додають 12 M водний розчин NaOH (0.5 л) та воду (0.4 L) протягрм 40 хвилин. Органічну фазу відокремлюють, а водну фазу екстрагують EtOAc. З’єднані органічні фази промивають розсолом, сушать над MgSO 4 та концентрують, одержуючи 3-метоксі-N-(піперидин-4-іл)бензамід у вигляді світлокоричневої твердої маси (160 г). 1 H ЯМР (600 МГц, DMSO-d6, ): 1.52-1.61 (m, 2H), 1.78-1.86 (m, 2H), 2.71 (td, J = 12.3, 2.5 Гц, 2H), 3.06-3.15 (m, 2H), 3.79 (s, 3H), 3.84-4.02 (m, 1H), 7.07 (ddd, J = 8.0, 2.5, 0.92 Гц, 1H), 7.33+ 7.46 (m, 3H), 8.32 (d, J = 7.8 Гц, 1H); ESI/APCI MS m/z 235 [M+H] . Етап R1-5: До суспензії 2-оксо-1,2,3,4-тетрагідрохінолін-7-карбальдегіду (135 г) у CHCl3 (1.4 л) додають 3-метоксі-N-(піперидин-4-іл)бензамід (190 г) та AcOH (45 мл) при кімнатній температурі. Суміш перемішують при кімнатній температурі 2 години. Після охоложення до 0°C до суміші додають NaBH(OAc)3 порціями. Суміш перемішують при кімнатній температурі 19 годин. Після охоложення до 0°C до реакційної суміші додають 8 M водний розчин NaOH (0.5 л) та воду (0.5 л). Органічну фазу відокремлюють,промивають водою та розсолом, сушать над MgSO4 та концентрують, одержуючи безбарвну тверду масу. Її суспендують в EtOAc (3.0 л), суміш нагрівають із зворотним холодильником 1 годину та охолоджують до кімнатної температури. Осад фільтрують, одержуючи безбарвну тверду масу.Її знову суспендують в EtOAc (2.4 л), суміш нагрівають із зворотним холодильником 1 годину та охолоджують до кімнатної температури. Осад фільтрують, одержуючи цільову сполуку у вигляді безбарвної твердої маси (229 г). 1 H ЯМР (600 МГц, CDCl3, ): 1.48-1.62 (m, 2H), 1.94–2.06 (m, 2H), 2.10–2.21 (m, 2H), 2.57-2.67 (m, 2H), 2.78–2.87 (m, 2H), 2.90–2.99 (m, 2H), 3.44 (s, 2H), 3.85 (s, 3H), 3.94–4.05 (m, 1H), 6.01 (d, J = 7.8 Гц, 1H), 6.77 (s, 1H), 6.91 (d, J = 7.3 Гц, 1H), 7.02 (dd, J = 7.6, 2.1 Гц, 1H), 7.09 (d, J = 7.8 + Гц, 1H), 7.21–7.27 (m, 1H), 7.29-7.35 (m, 2H), 8.00 (s, 1H); ESI/APCI MS m/z 394 [M+H] . [0074] 45 28
ДивитисяДодаткова інформація
Назва патенту англійською7-piperidinoalryl-3,4-dihydroquinolone derivative
Автори російськоюKanuma, Kosuke, Miyakishi, Naoki, Kawamura, Madoka, Shibata, Tsuyoshi
МПК / Мітки
МПК: A61P 25/02, A61P 1/14, A61P 25/28, A61P 3/04, A61P 3/10, C07D 401/06, A61P 25/20, A61P 25/00, A61P 9/10, C07D 401/14, A61P 25/24, A61P 25/36, A61P 43/00, A61K 31/4709, A61P 9/12, A61P 25/08, A61P 3/06, A61P 15/10, A61P 25/22, A61P 25/18
Мітки: похідне, 7-піперидиналкіл-3,4-дигідрохінолону
Код посилання
<a href="https://ua.patents.su/38-105187-pokhidne-7-piperidinalkil-34-digidrokhinolonu.html" target="_blank" rel="follow" title="База патентів України">Похідне 7-піперидиналкіл-3,4-дигідрохінолону</a>
Попередній патент: Поліпшення росту біфідобактерій у кисломолочних продуктах
Наступний патент: Спосіб варення біомаси, яка містить лігнін разом з целюлозою та/або геміцелюлозою
Випадковий патент: Спосіб проведення ультразвукового ангіосканування у хворих з великими варикозними трофічними виразками в зоні ранового дефекту












