Лікарська форма цитрату заліза(ііі)
Формула / Реферат
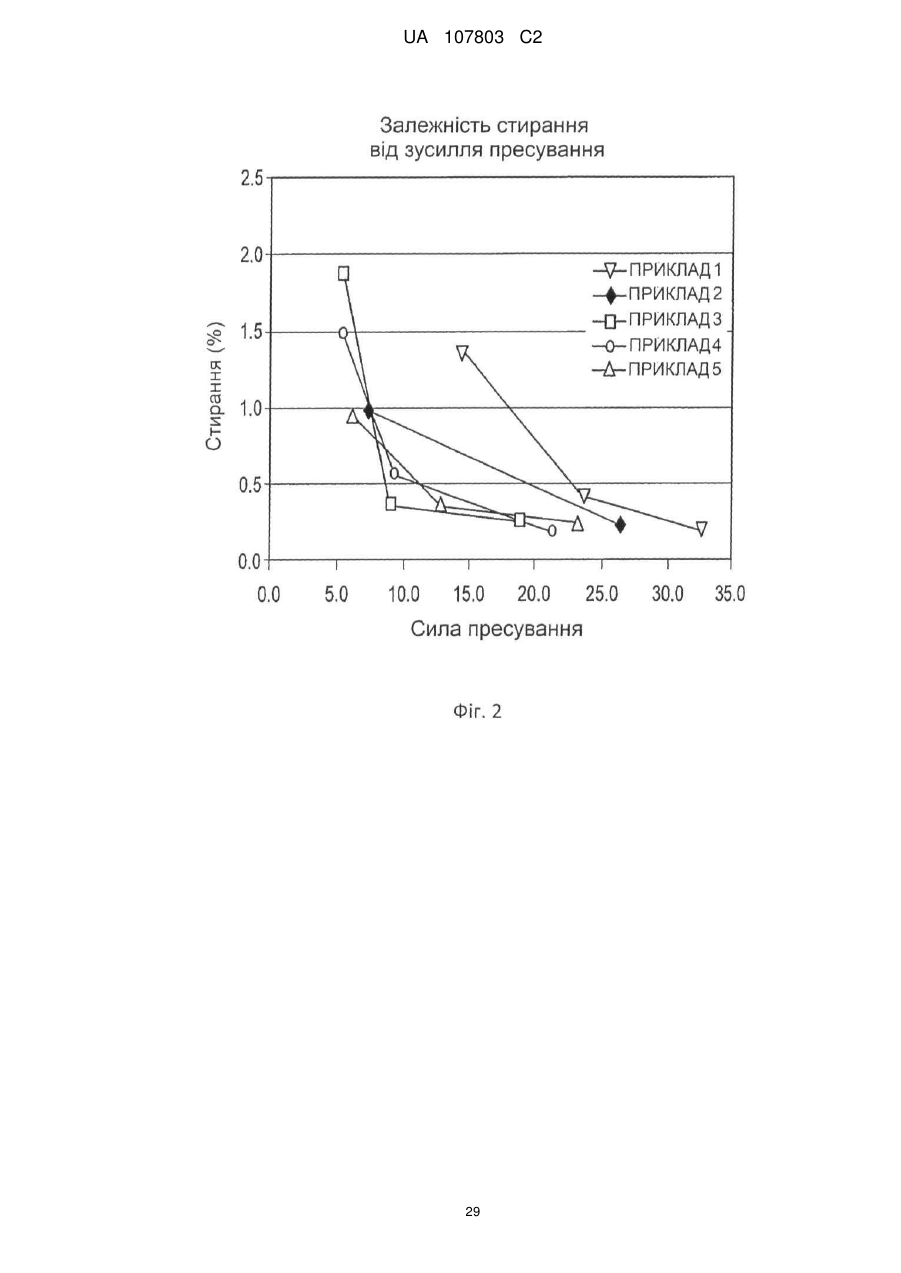
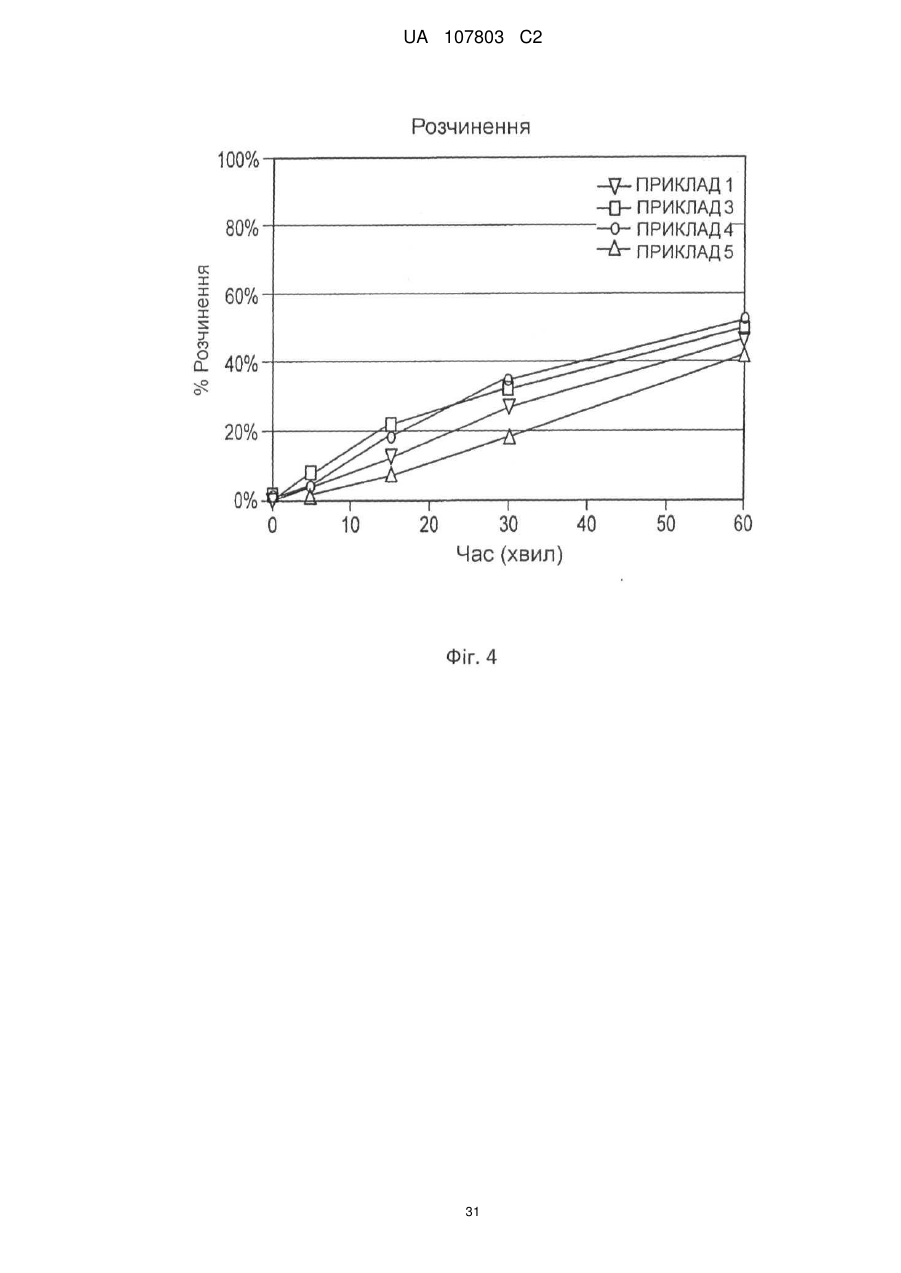
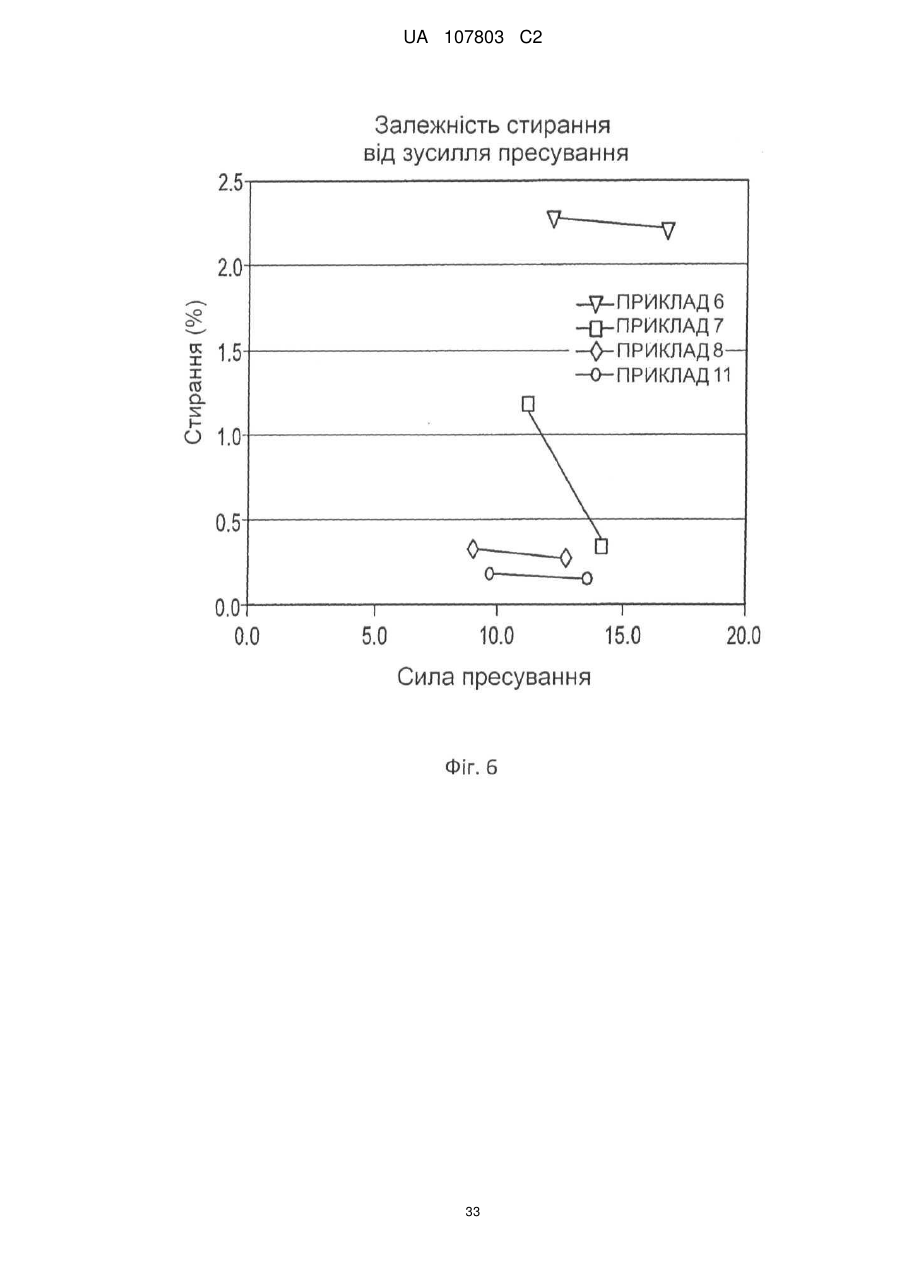
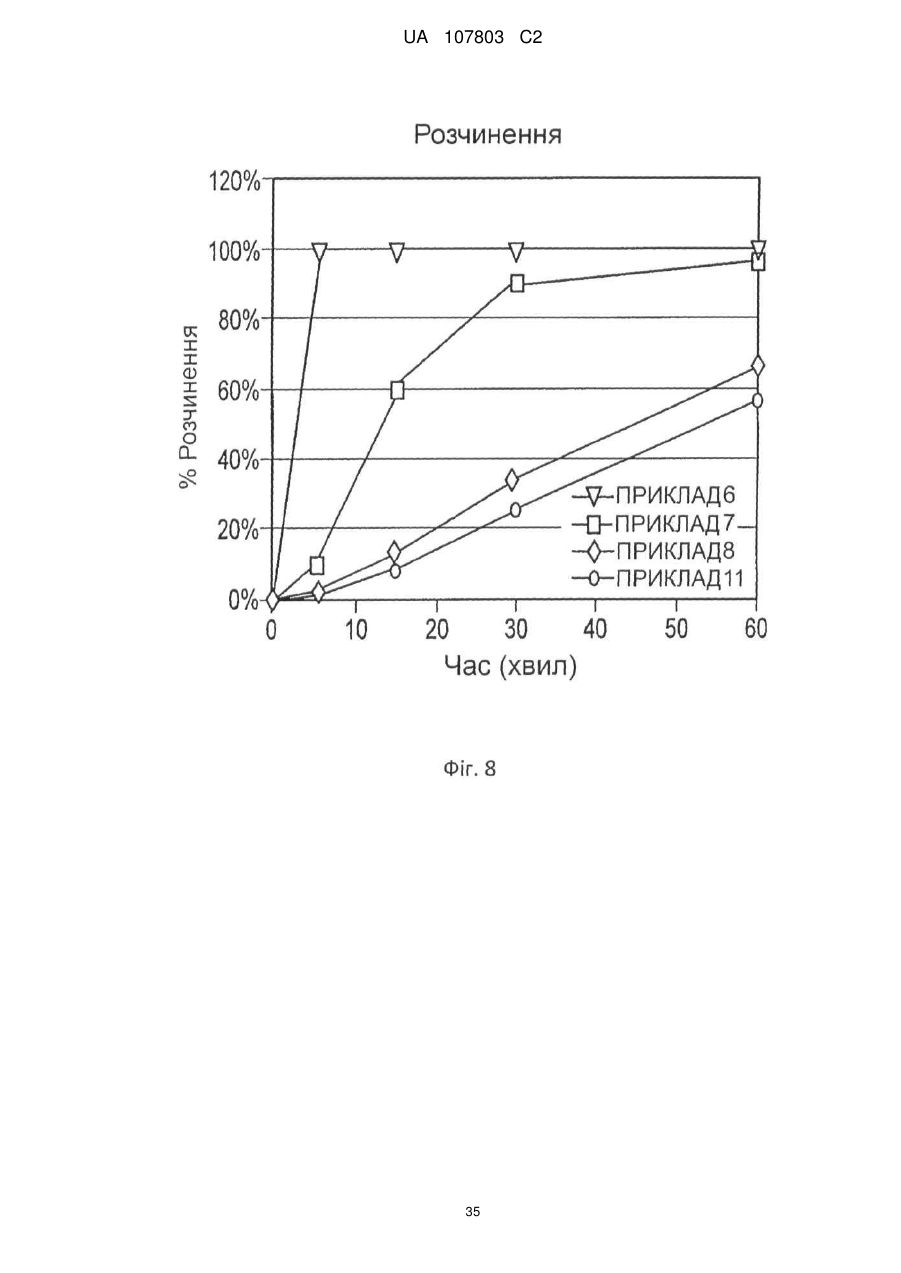
1. Залізо(ІІІ)цитратна пігулка, яка містить: (a) ядро (серцевину), яке містить 65-92 мас. % цитрату заліза(III) і 4,5-30 мас. % зв'язувальної речовини; і (b) покриття, при цьому зазначена пігулка має стиранність, рівну 1 мас./мас. % або менше, і в ній принаймні 80 % цитрату заліза(III) розчиняється протягом періоду часу, меншого або рівного 60 хвилинам.
2. Пігулка за п. 1, яка відрізняється тим, що розчинність визначають методом USP <711>.
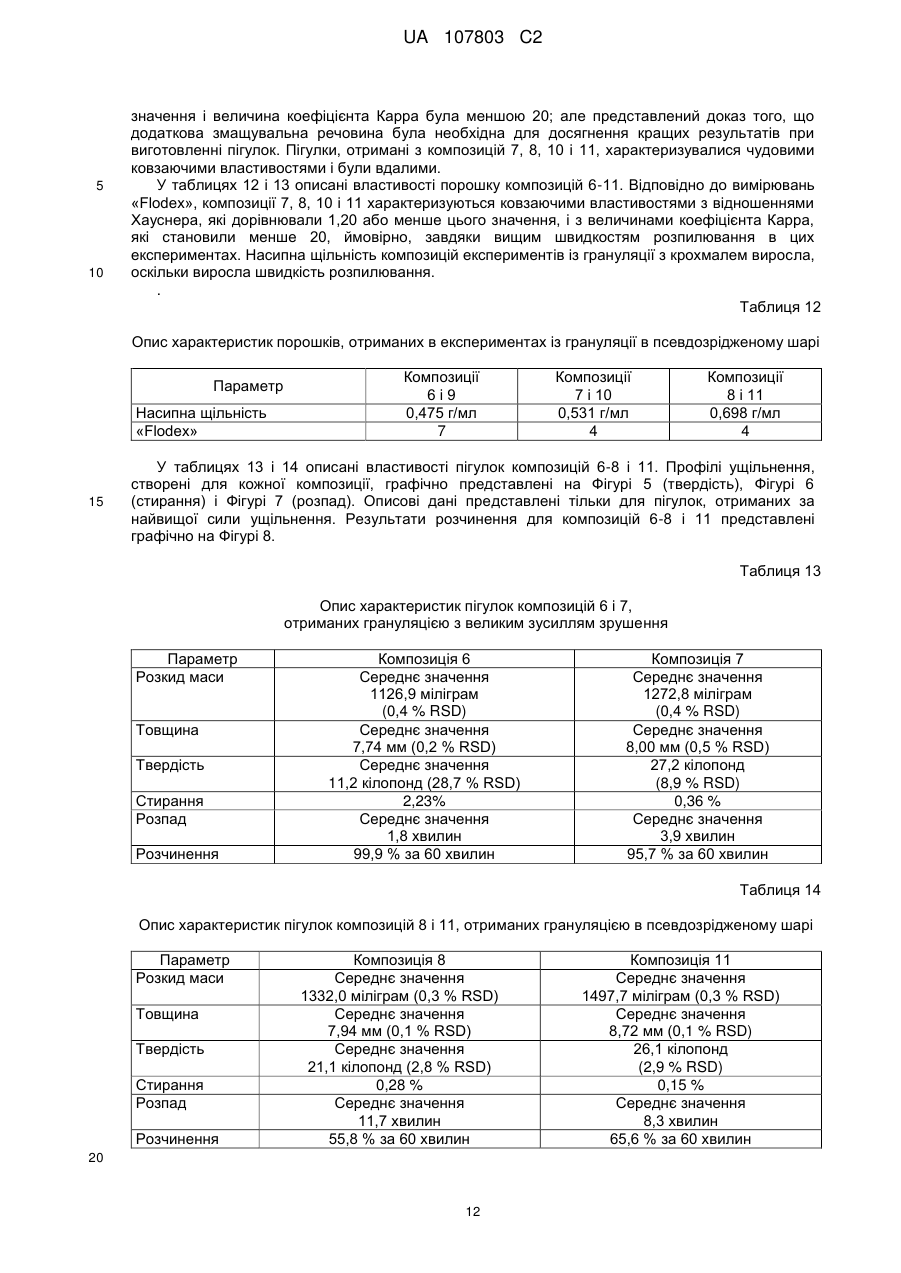
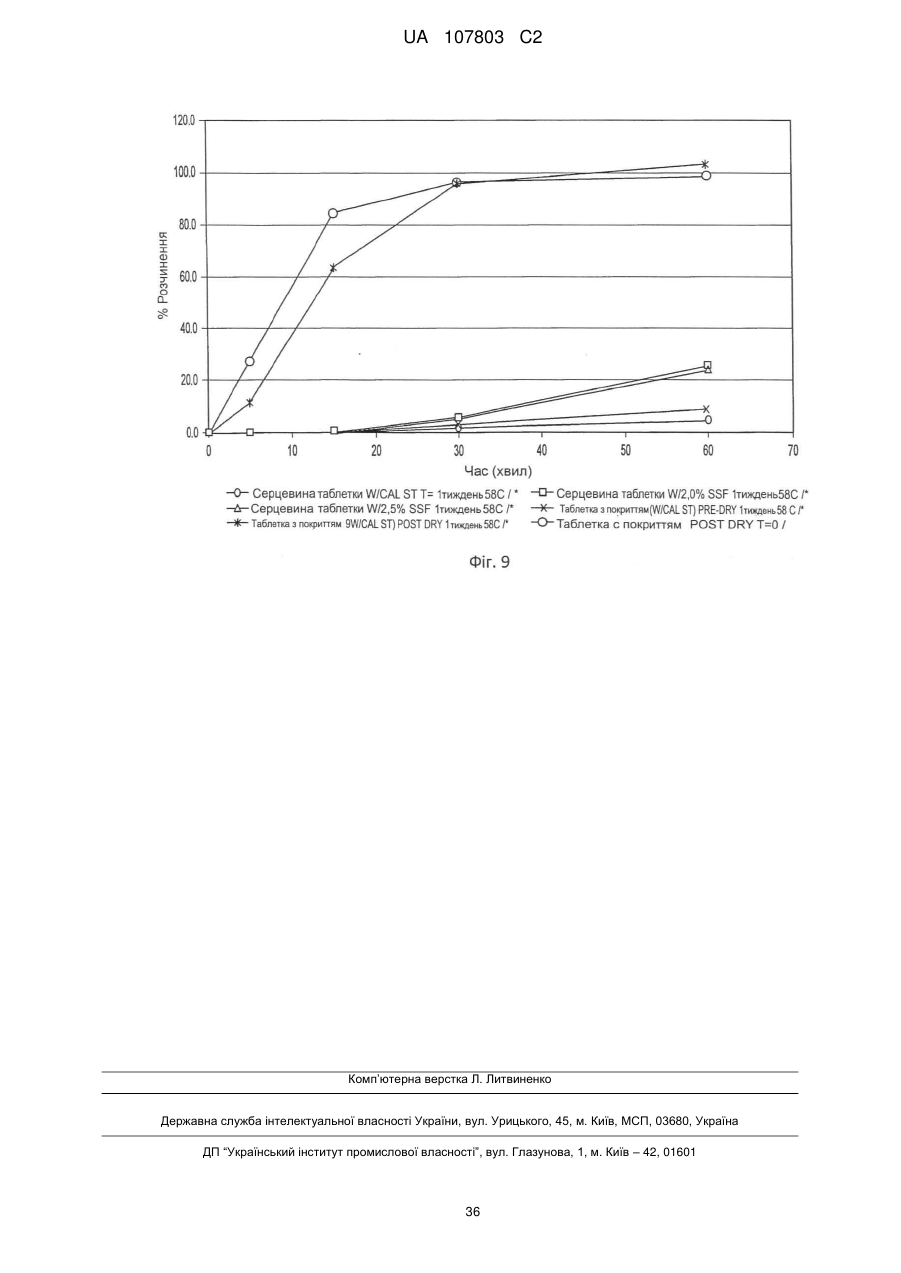
3. Пігулка за п. 1 або 2, яка відрізняється тим, що вміст вологи визначено методом LОD втрати вологи при висушуванні і становить менше ніж 15 % LOD.
4. Пігулка за кожним з пп. 1-3, яка відрізняється тим, що вміст вологи становить менше ніж 10 % LCD.
5. Пігулка за п. 1, яка відрізняється тим, що зв'язувальна речовина складається з однієї або декількох з-поміж гідроксипропілцелюлози (НРС), гідроксипропілметилцелюлози (НРМС), альгінату натрію, альгінової кислоти, гуарової камеді, аравійської камеді, ксантанової камеді, карбополу, гуміцелюлози (карбоксиметилцелюлози), етилцелюлози, мальтодекстрину, ПВП/ВА, повідону, мікрокристалічної целюлози, крохмалю (частково або повністю прежелатинізованого крохмалю) і метилцелюлози.
6. Пігулка за будь-яким з пп. 1-5, яка відрізняється тим, що зв'язувальна речовина являє собою прежелатинізований крохмаль.
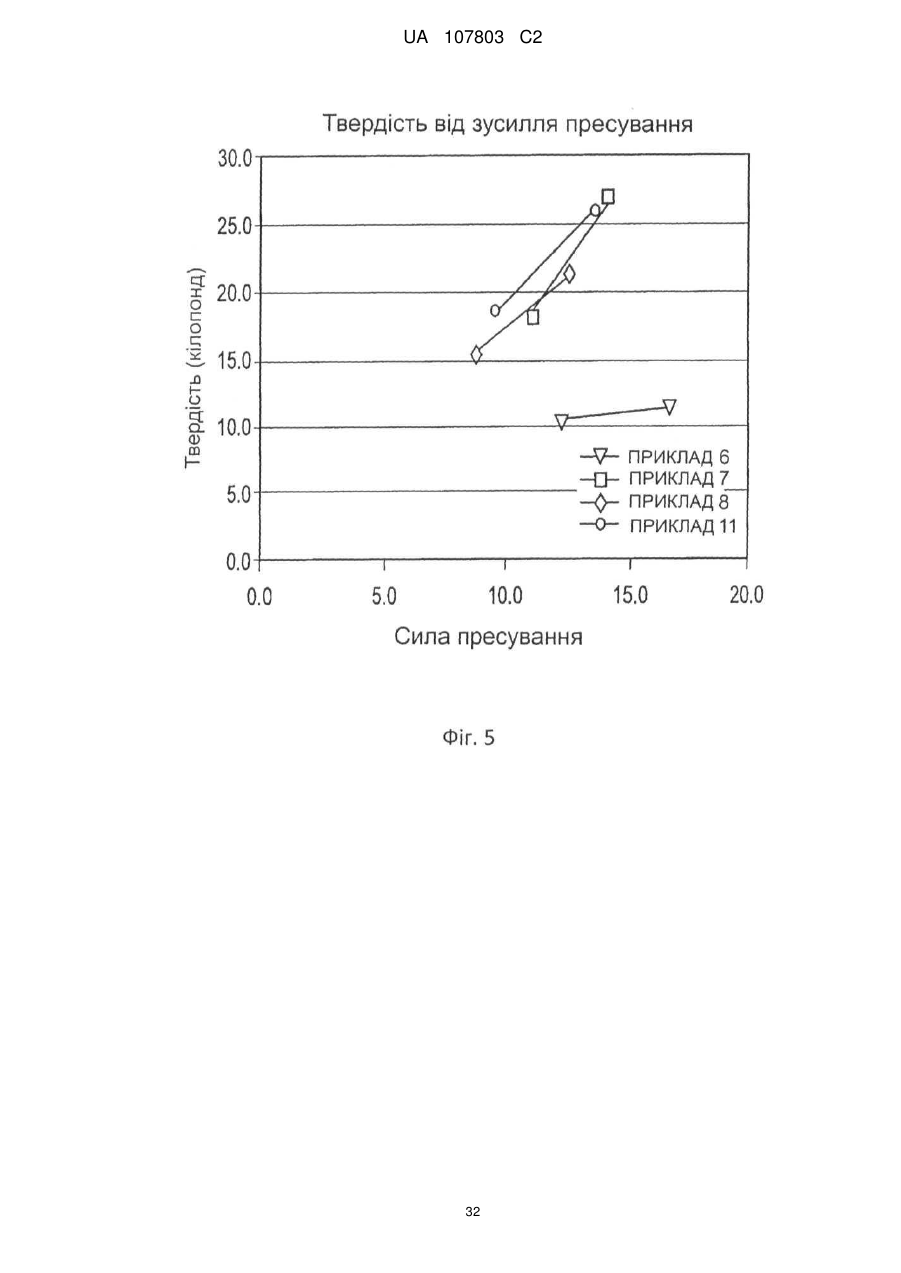
7. Пігулка за будь-яким з пп. 1-6, яка відрізняється тим, що ядро містить лубрикант (змащувальну речовину).
8. Пігулка за п. 7, яка відрізняється тим, що ядро містить 0,5-3 мас. % змащувальної речовини.
9. Пігулка за п. 7 або 8, яка відрізняється тим, що лубрикант вибрано з однієї або декількох з-поміж стеарату магнію, стеарату кальцію і стерилфумарату натрію або їх комбінацію.
10. Пігулка за п. 9, яка відрізняється тим, що лубрикант являє собою стеарат кальцію.
11. Пігулка за будь-яким з пп. 1-10, яка відрізняється тим, що ядро додатково містить розпушувач.
12. Пігулка за п. 11, яка відрізняється тим, що ядро містить 1,5-15 мас. % розпушувача.
13. Пігулка за п. 11 або п. 12, яка відрізняється тим, що розпушувач вибраний з одного або декількох з-поміж натрійкроскармелози, кросповідону, натрієвої солі гліколяту крохмалю і крохмалю.
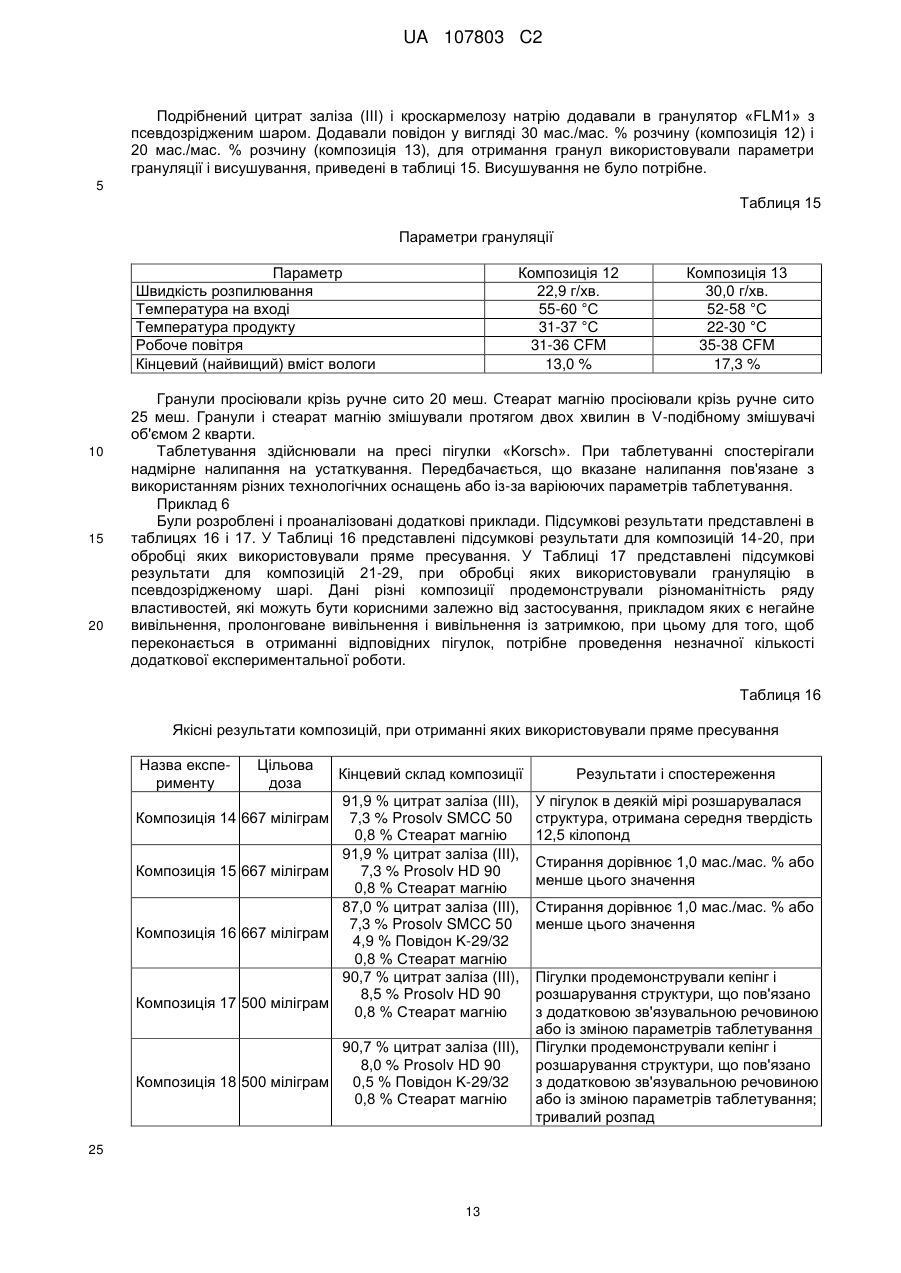
14. Пігулка за будь-яким з пп. 1-13, яка відрізняється тим, що містить принаймні 70 мас. % цитрату заліза(III).
15. Пігулка за будь-яким з пп. 1-14, яка відрізняється тим, що містить принаймні 80 мас. % цитрату заліза(III).
16. Пігулка за будь-яким з пп. 1-15, яка відрізняється тим, що містить принаймні 90 мас. % цитрату заліза(III).
17. Пігулка за будь-яким з пп. 1-16, яка відрізняється тим, що містить 1000 мг цитрату заліза(ІІІ).
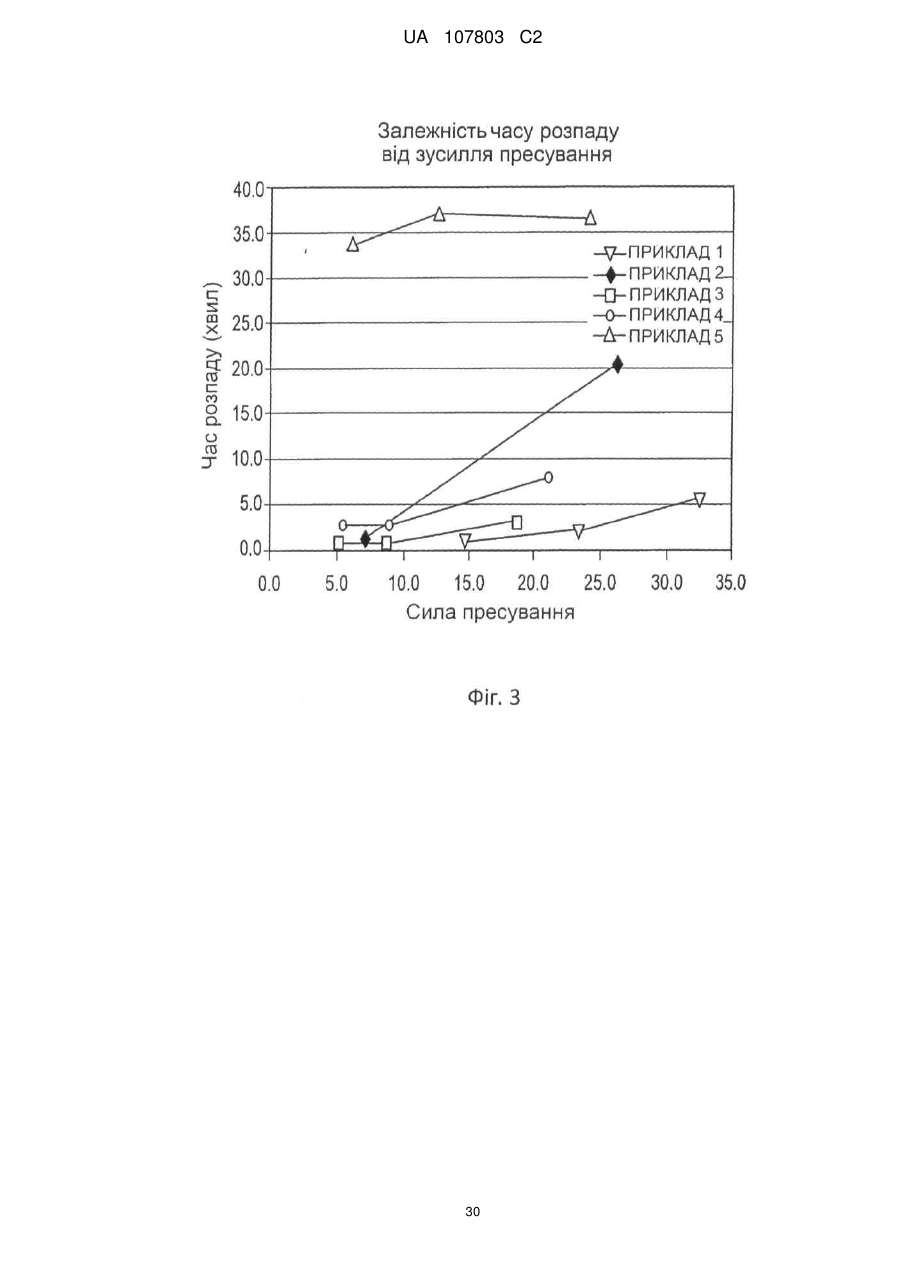
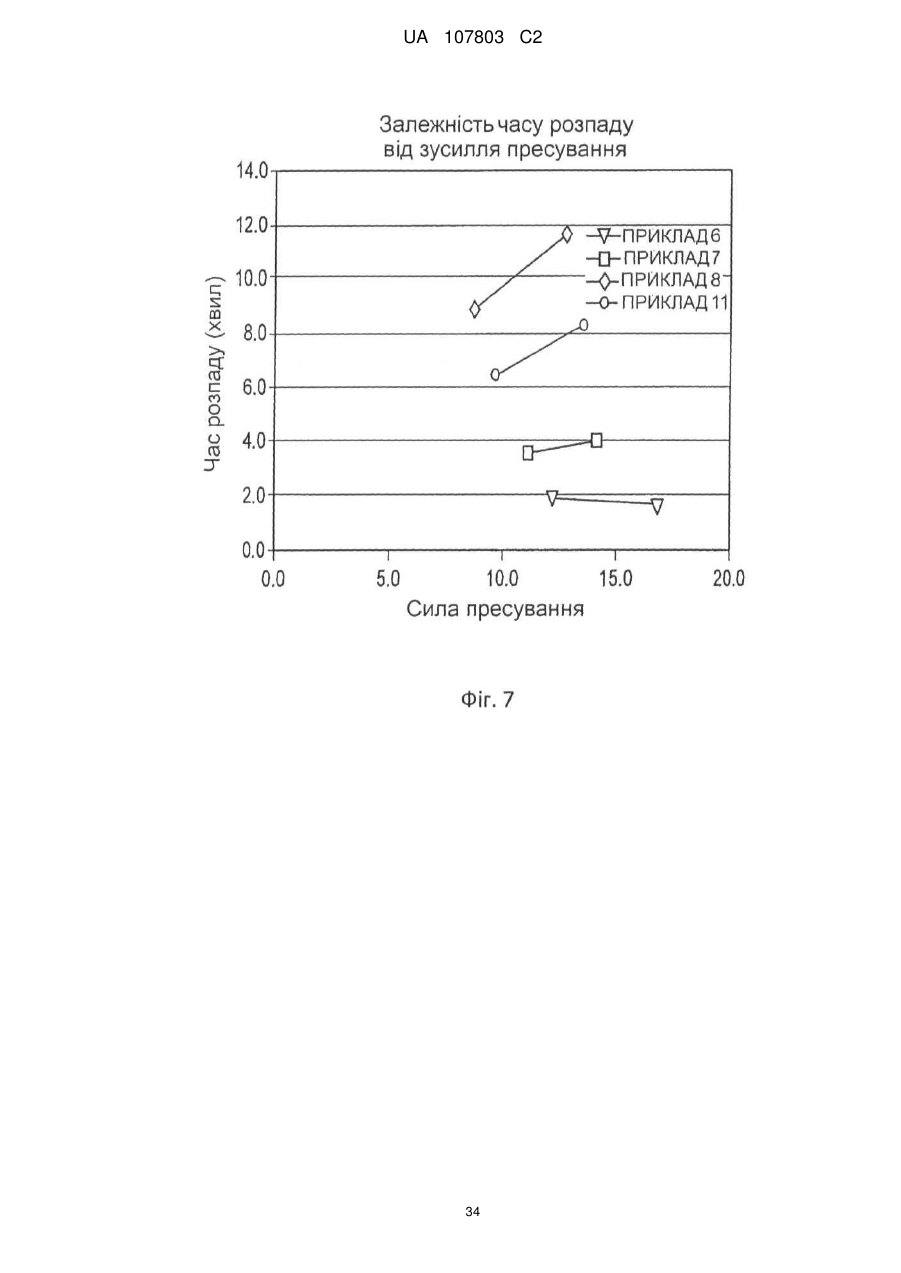
18. Пігулка за будь-яким з пп. 1-17, яка відрізняється тим, що має час дезінтеграції менший або рівний 15 хвилинам.
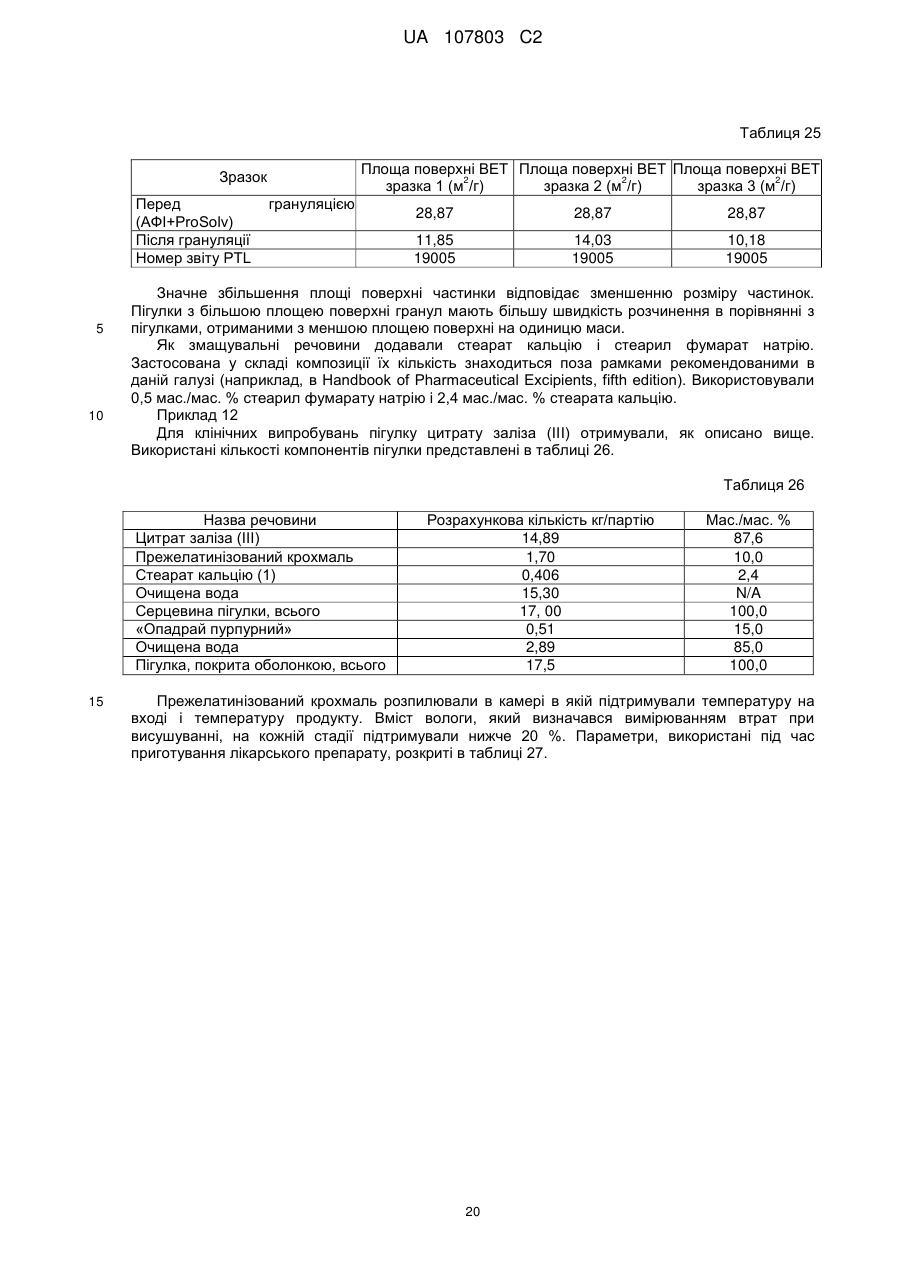
19. Залізоцитратна пігулка, яка містить 210 мг заліза(III), що містить: a) ядро, яке містить 87,6 мас. % цитрату заліза(III), 10 мас. % прежелатинізованого крохмалю і 2,4 мас. % стеарату кальцію; і b) покриття, в якій стиранність менше або дорівнює 1 мас./мас. %, час дезінтеграції менше ніж 15 хвилин, і в якій принаймні 80 % цитрату заліза(III) розчиняється протягом періоду часу, меншого або рівного 60 хвилинам, як виміряно в тесті USP <711>, а вміст вологи становить 8,84 % LOD.
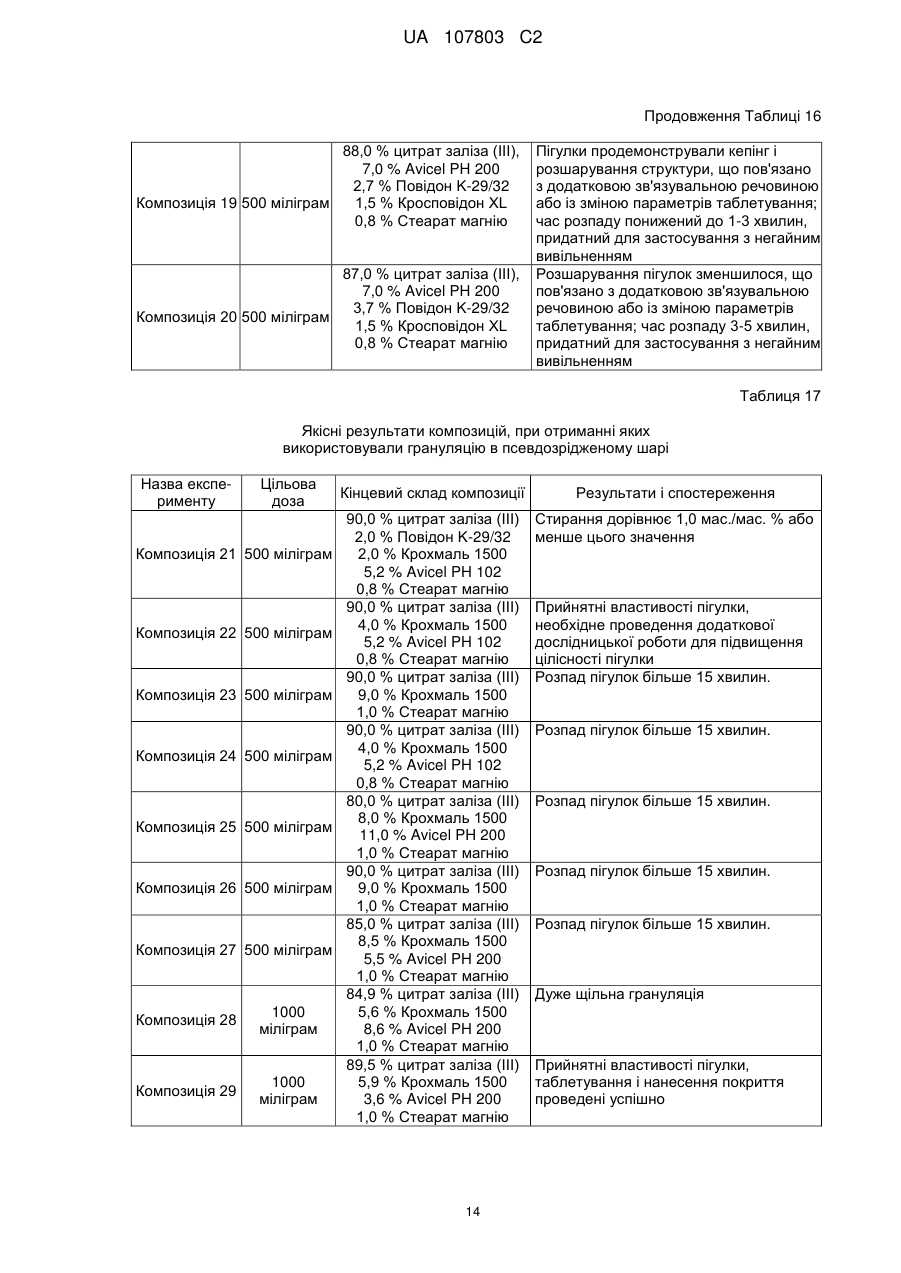
20. Спосіб профілактики або лікування гіперфосфатемії, що включає введення залізоцитратої пігулки за будь-яким з пп. 1-18 в терапевтично ефективній кількості.
21. Застосування пігулки за будь-яким з пп. 1-18 для виробництва медикаменту профілактики або лікування гіперфосфатемії.
22. Застосування залізоцитратної пігулки за будь-яким з пп. 1-18 як засобу для профілактики або лікування гіперфосфатемії.
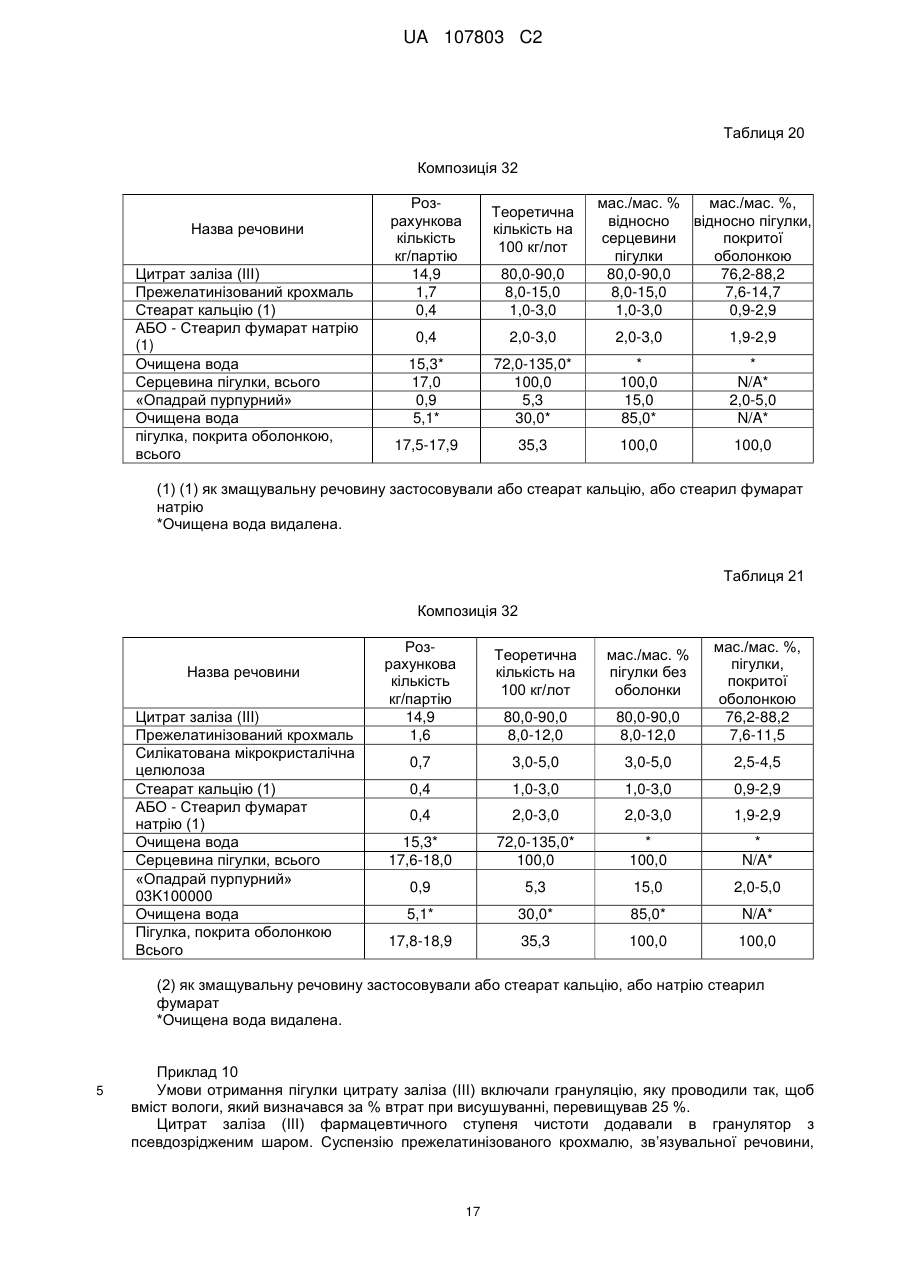
23. Спосіб отримання залізо(ІІІ)цитратної пігулки, що містить (і) ядро, яке містить 65-92 мас. % цитрату заліза(III) і 4,5-30 мас. % зв'язувальної речовини і 0,5-3 мас. % змащувальної речовини; і (іі) покриття, і в якій принаймні 80 % цитрату заліза(III) розчиняється протягом періоду часу меншого або рівного 60 хвилинам, причому вказаний спосіб включає:
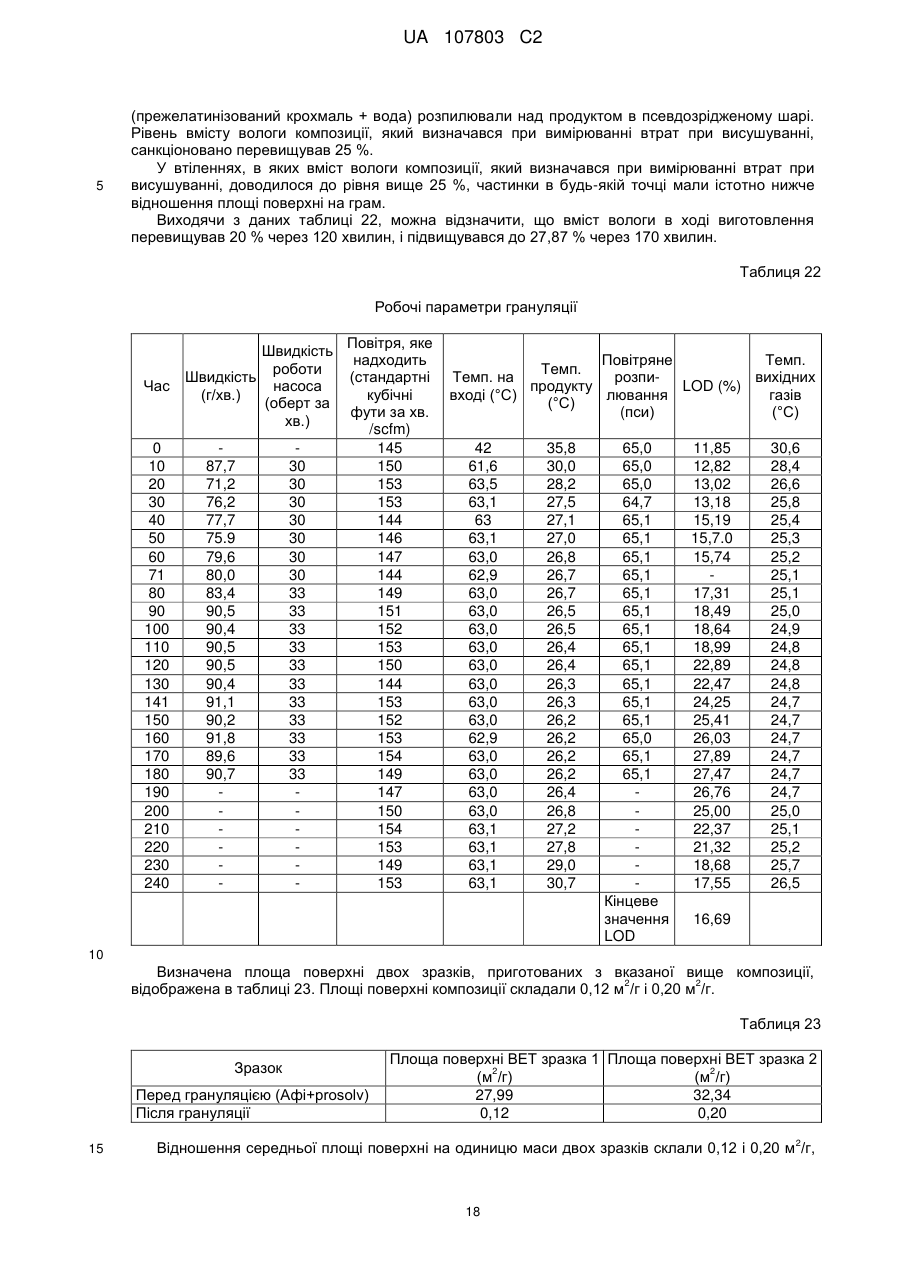
(a) додавання подрібненого цитрату заліза в попередньо нагрітий резервуар гранулятора з псевдозрідженим шаром і розпилення зв'язувальної речовини для отримання гранул, в яких вміст вологи при вимірюванні % втрат при сушінні (LOD) у процесі грануляції становить менше ніж 25 %;
(b) висушування гранул до величини LOD 15-17 %;
(c) перемішування висушених гранул з лубрикантом;
(d) таблетування отриманої суміші тиском;
(е) нанесення на пігулку покриття.
24. Спосіб отримання залізо(ІІІ) цитратної пігулки, що містить (і) ядро, яке містить 65-92 мас. % цитрату заліза(III) і 4,5-30 мас. % зв'язувальної речовини і 0,5-3 мас. % змащувальної речовини; і (іі) покриття, і в якій принаймні 80 % цитрату заліза(III) розчиняється протягом періоду часу, меншого або рівного 60 хвилинам, причому вказаний спосіб включає:
(a) перемішування висушених гранул з лубрикантом, причому ці висушені гранули містять цитрат заліза(ІІІ) та зв'язувальну речовину і мають величину LOD 15-17%;
(b) таблетування отриманої суміші тиском;
(c) нанесення на пігулку покриття.
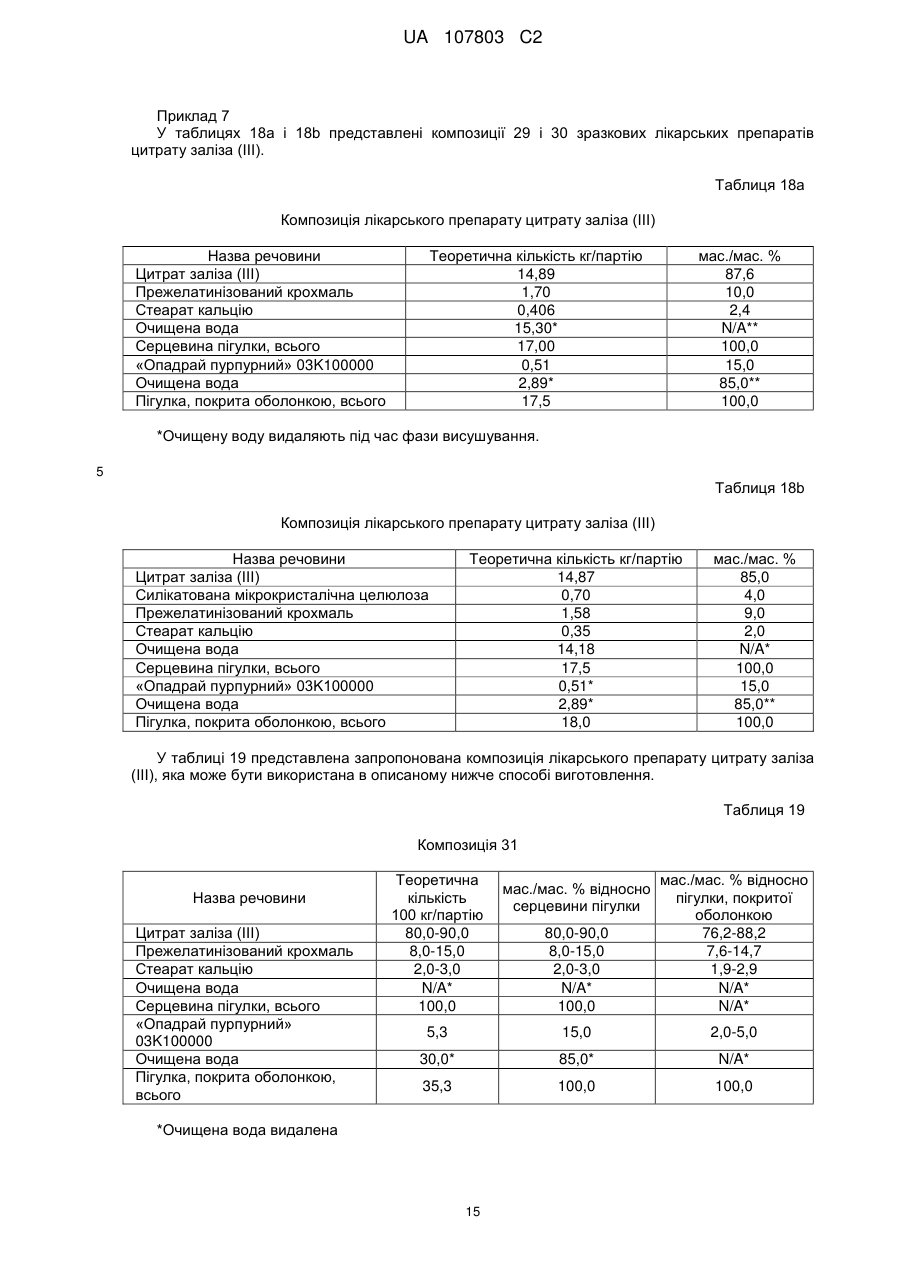
25. Спосіб за п. 23, який відрізняється тим, що швидкість розчинення таблетки вимірюють методом USP <711>.
26. Спосіб за п. 24, який відрізняється тим, що швидкість розчинення таблетки вимірюють методом USP <711>.
27. Спосіб за п. 23, який відрізняється тим, що гранули мають відношення середньої площі поверхні до маси 5 м2 на грам або більше.
28. Спосіб за п. 23, який відрізняється тим, що гранули мають відношення середньої площі поверхні до їх маси 10 м2 на грам або більше.
29. Спосіб за п. 24, який відрізняється тим, що гранули мають відношення середньої площі поверхні до маси 5 м2 на грам або більше.
30. Спосіб за п. 24, який відрізняється тим, що гранули мають відношення середньої площі поверхні до їх маси 10 м2 на грам або більше.
31. Спосіб за п. 23, який відрізняється тим, що додатково включає стадію (f), на якій проводять висушування таблеток з покриттям до LOD менше ніж 14 %.
32. Спосіб за п. 23, який відрізняється тим, що додатково включає стадію (f), на якій проводять висушування таблеток з покриттям до LOD 5-14 %.
33. Спосіб за будь-яким з пп. 23, 25, 27, 28, 31 або 32, який відрізняється тим, що ядро пігулки містить 80-92 мас. % цитрату заліза(III).
34. Спосіб за будь-яким з пп. 23, 25, 27, 28, 31 або 32, який відрізняється тим, що зв'язувальною речовиною є прежелатинізований крохмаль.
35. Спосіб за будь-яким з пп. 23, 25, 27, 28, 31 або 32, який відрізняється тим, що лубрикантом є стеарат кальцію.
36. Спосіб за будь-яким з п. 34, який відрізняється тим, що лубрикантом є стеарат кальцію.
37. Спосіб за п. 33, який відрізняється тим, що зв'язувальною речовиною є прежелатинізований крохмаль, а лубрикантом є стеарат магнію.
38. Спосіб за п. 36, який відрізняється тим, що ядро пігулки містить 80-90 мас. % цитрату заліза(III), 8-15 мас. % прежелатинізованого крохмалю і 1-3 мас. % стеарату кальцію.
39. Спосіб за п. 24, який відрізняється тим, що додатково включає стадію (d) висушування пігулки з покриттям до значення LOD менше 10 %.
40. Спосіб за п. 24, який відрізняється тим, що додатково включає стадію (d) висушування пігулки з покриттям до значення LOD менше 5-14 %.
41. Спосіб за будь-яким з пп. 24, 26, 29, 30, 39 або 40, який відрізняється тим, що ядро пігулки містить 80-92 % мас. цитрату заліза(III).
42. Спосіб за будь-яким з пп. 24, 26, 29, 30, 39 або 40, який відрізняється тим, що зв'язувальною речовиною є прежелатинізований крохмаль.
43. Спосіб за будь-яким з пп. 24, 26, 29, 30, 39 або 40, який відрізняється тим, що лубрикантом є стеарат кальцію.
44. Спосіб за п. 42, який відрізняється тим, що лубрикантом є стеарат кальцію.
45. Спосіб за п. 43, який відрізняється тим, що зв'язувальною речовиною є прежелатинізований крохмаль, а лубрикантом є стеарат кальцію.
46. Спосіб за п. 44, який відрізняється тим, що ядро пігулки містить 80-90 % мас. цитрату заліза(III), 8-15 % мас. прежелатинізованого крохмалю та 1-3 % мас. стеарату кальцію.
47. Спосіб за будь-яким з пп. 23, 25, 27, 28, 31 або 32, який відрізняється тим, що пігулка містить 1000 мг цитрату заліза(III).
48. Спосіб за будь-яким з пп. 24, 26, 29, 30, 39 або 40, який відрізняється тим, що пігулка містить 1000 мг цитрату заліза (III).
49. Спосіб отримання залізо(ІІІ)цитратної пігулки, що містить (і) ядро, яке містить 65-92 мас. % цитрату заліза(III) і 4,5-30 мас. % зв'язувальної речовини, і (іі) покриття, і в якій принаймні 80 % цитрату заліза(III) розчиняється протягом періоду часу, меншого або рівного 60 хвилинам, причому вказаний спосіб передбачає:
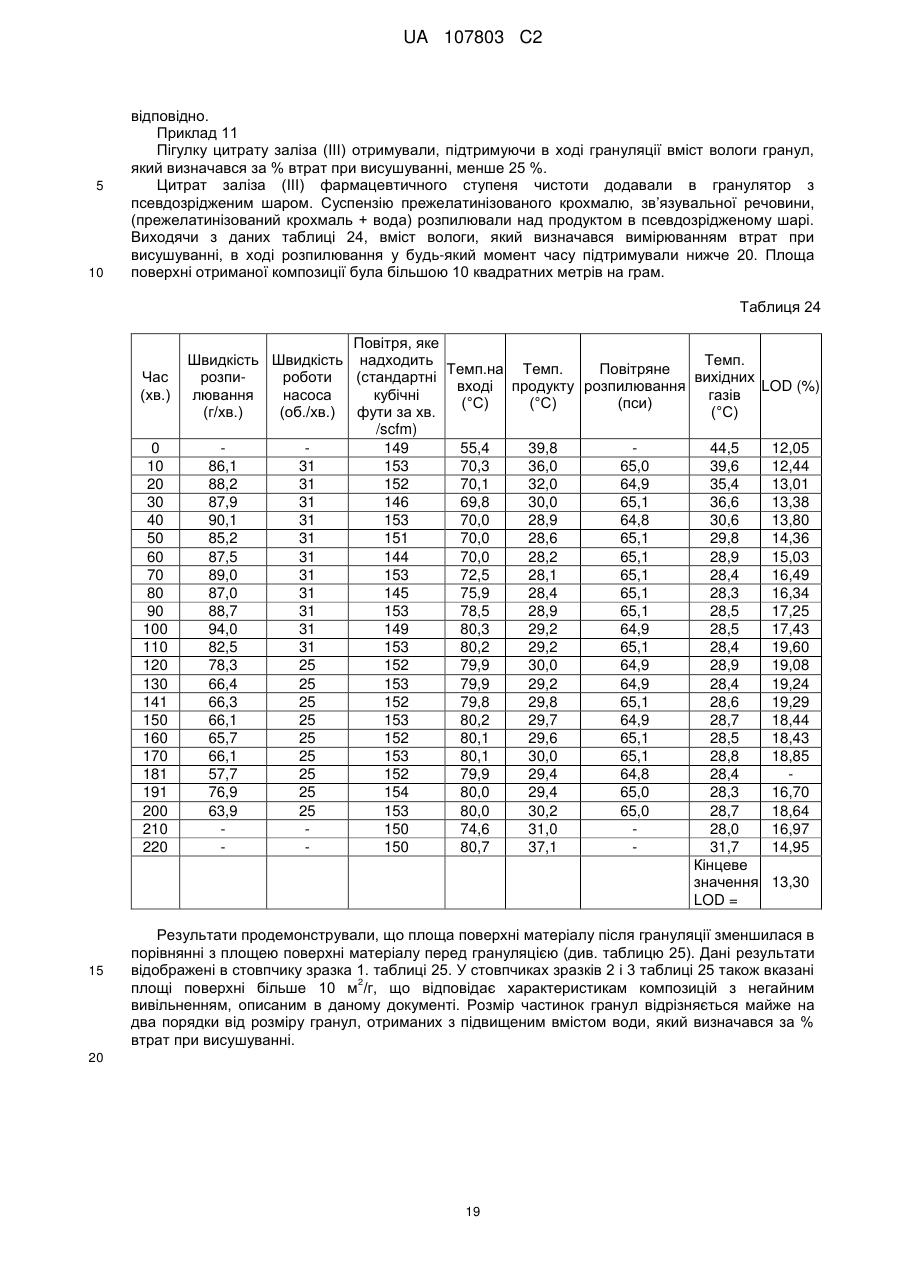
(a) розпилення зв'язувальної речовини на цитрат заліза в резервуарі гранулятора з псевдозрідженим шаром в умовах, при яких пік вмісту вологи в гранульованих частинках підтримується нижче ніж 25 % LOD в процесі грануляції;
(b) таблетування гранул тиском;
(c) нанесення на пігулку покриття;
(d) висушування таблеток з покриттям до LOD менше ніж 10 %.
50. Спосіб за п. 49, який відрізняється тим, що швидкість розчинення таблетки вимірюють методом USP <711>.
51. Спосіб за п. 49, який відрізняється тим, що гранули мають відношення середньої площі поверхні до маси 1 м2 на грам або більше.
52. Спосіб за п. 49, який відрізняється тим, що гранули мають відношення середньої площі поверхні до маси 5 м2 на грам або більше.
53. Спосіб за п. 49, який відрізняється тим, що гранули мають відношення середньої площі поверхні до маси 10 м2 на грам або більше.
54. Спосіб за п. 49, який відрізняється тим, що ядро пігулки містить 80-92 мас. % цитрату заліза(III).
55. Спосіб за будь-яким з пп. 49-54, який відрізняється тим, що зв'язувальна речовина складається з однієї або декількох речовин з-поміж гідроксипропілцелюлози (НРС), гідроксипропілметилцелюлози (НРМС), альгінату натрію, альгінової кислоти, гуарової камеді, аравійської камеді, ксантанової камеді, карбополу, гуміцелюлози (карбоксиметилцелюлози), етилцелюлози, мальтодекстрину, ПВП/ВА, повідону, мікрокристалічної целюлози, крохмалю (частково або повністю прежелатинізованого крохмалю) і метилцелюлози.
56. Спосіб за будь-яким з пп. 49-54, який відрізняється тим, що зв'язувальна речовина являє собою прежелатинізований крохмаль.
57. Спосіб за будь-яким з пп. 49-54, який відрізняється тим, що пігулка містить 1000 мг цитрату заліза(ІІІ).
58. Спосіб профілактики або лікування гіперфосфатемії, що включає введення залізо(ІІІ)цитратної пігулки за п. 19 в терапевтично ефективній кількості.
59. Застосування залізо(ІІІ)цитратної пігулки за п. 19 для виробництва медикаменту для профілактики або лікування гіперфосфатемії.
60. Застосування залізо(ІІІ)цитратної пігулки за п. 19 як засобу профілактики або лікування гіперфосфатемії.
Текст
Реферат: Винахід стосується залізоцитратної пігулки, що містить 65-92 мас. % цитрату заліза(III), способу отримання та застосування для профілактики або лікування гіперфосфатемії. UA 107803 C2 (12) UA 107803 C2 UA 107803 C2 5 10 15 20 25 30 35 40 45 50 55 60 Перехресне посилання на споріднені заявки Дана заявка PCT заявляє пріоритет попередньої патентної заявки США № 61/227,124, поданої 21 липня 2009 року, яка включена в цей документ шляхом посилання повністю і для будь-яких цілей. Галузь техніки, до якої відноситься винахід В цілому, галузь даного розкриття відноситься до фармацевтичних композицій цитрату заліза (III), до способів застосування даних композицій при лікуванні медичних станів і до способів отримання даних композицій. Попередній рівень техніки У патенті US 5753706 розкрито, що сполуки цитрату заліза (III) можна застосовувати для контролю фосфатного метаболізму і для профілактики метаболічного ацидозу у пацієнтів. Зміст патенту US 5753706 включений до цього документа шляхом посилання повністю. Сполуки цитрату заліза (III) можуть бути використані пацієнтами, які страждають від ниркової недостатності, пов'язаної з гіперфосфатемією або пацієнтами, схильними до розвитку гіперфосфатемічного стану. Цитрат заліза (III) також застосовують як біологічно активну або харчову добавку. Цитрат заліза (III) описаний як порошок від світло-коричневого до бежевого кольору, без запаху, з незначним присмаком заліза. Згідно «Merck Index», цитрат заліза (III) повільно, але повністю розчиняється в холодній воді, легко розчиняється в гарячій воді, при цьому з часом його розчинність знижується. У патенті US 6903235 розкрито, що цитрат заліза (III) комерційно доступний у формі невизначеної композиції з комбінації заліза і лимонної кислоти. Зміст патенту US 6903235 включений в цей документ повністю шляхом посилання. У патенті 235 пояснюється, що невизначеною композиція виходить внаслідок проблем, які виникають при її приготуванні, при цьому фахівці у даній галузі розуміють і, вимушено визнають, що комерційно доступний цитрат заліза (III) містить різні молярні співвідношення заліза і лимонної кислоти, а також містить різні кількості гідрату. У WO 2004/074444 розкриті способи виготовлення органічних сполук заліза, таких як цитрат заліза (III), з підвищеними швидкостями розчинення. WO 2007/022435 є частковим продовженням заявки WO 2007/074444 і в ньому розкриті способи виготовлення залізовмісних органічних сполук, які є розчинними у широкому діапазоні рН і мають велику площу поверхні. WO 2007/089577 присвячений способам лікування кальцифікації м'яких тканин за допомогою залізовмісних органічних сполук, таких як сполуки цитрату заліза (III). WO 2007/089571 присвячений способам лікування хронічного захворювання нирок за допомогою залізовмісних органічних сполук, таких як сполуки цитрату заліза (III). Розкриття винаходу У одному аспекті винахід пропонує пігулку, яка містить цитрат заліза (III). У деяких втіленнях пігулка може містити, щонайменше, 65 масових відсотків цитрату заліза (III). У іншому аспекті винахід пропонує пігулку, яка містить гранульовані частинки. Гранульовані частинки включають цитрат заліза (III) і зв'язувальну речовину, і середнє відношення площі 2 поверхні до маси гранульованих частинок становить 1 м на грам або більше. У різних втіленнях середнє відношення площі поверхні до маси вказаних гранульованих частинок становить або 5 2 2 м на грам, або 10 м на грам або перевищує ці значення. У іншому аспекті пігулка може містити, щонайменше, 70 масових відсотків цитрату заліза (III), щонайменше, 80 масових відсотків цитрату заліза (III) або, щонайменше, 90 масових відсотків цитрату заліза (III). У іншому аспекті зв'язувальна речовина може бути однією або більше з поміж гідроксипропілцелюлози (НРС), гідроксипропілметилцелюлози (НРМС), альгінату натрію, альгінової кислоти, гуарової камеді, аравійської камеді, ксантанової камеді, карбополу, гуміцелюлози (карбоксиметилцелюлози), етилцелюлози, мальтодекстрину, ПВП/ВА, повідону, мікрокристалічної целюлози, крохмалю (частково або повністю прежелатинізованого крохмалю) і метилцелюлози. У іншому аспекті пігулка може містити різні додаткові компоненти, які включають, наприклад, один або декілька розпушувачів і/або одну або кілька змащувальних речовин. Розпушувач може бути представлений одним або декількома з поміж мікрокристалічної целюлози, кроскармелози натрію, кросповідону, натрієвої солі гліколята крохмалю, і крохмалю. Змащувальна речовина може бути представлена однією або декількома з поміж стеарата магнію, стеарата кальцію, стеарил фумарату натрію, поліетиленгліколю (з молекулярною масою понад 3350), лаурилсульфата натрію, тальку, мінеральної олії, лейцину і полоксамеру. У деяких втіленнях пігулка може включати приблизно 65-92 % цитрату заліза (III), приблизно 4,5-30 % зв'язувальної речовини і приблизно 0,5-3 % змащувальної речовини. Зв’язувальна речовина може мати 1 UA 107803 C2 5 10 15 20 25 30 35 40 45 50 55 60 властивості розпушувача. Зв’язувальна речовина може бути прежелатинізованим крохмалем. У іншому аспекті пігулка може містити приблизно 65-92 % цитрату заліза (III), приблизно 4,530 % зв’язувальної речовини, приблизно 1,5-15 % розпушувача, і приблизно 0,5-3 % змащувальної речовини. У іншому аспекті пігулка може включати різні додаткові компоненти: мікрокристалічну целюлозу, прежелатинізований крохмаль і стеарил фумарат натрію. У одному втіленні цитрат заліза (III) може включати приблизно 85 мас. %, мікрокристалічної целюлози - приблизно 4 мас. %, прежелатинізованого крохмалю - приблизно 9 мас. % і стеарил фумарат натрію - приблизно 2 мас. %. У іншому аспекті пігулка може містити приблизно 10-60 % цитрату заліза (III), розчинного приблизно за 15 хвилин, приблизно 30-90 % цитрату заліза (III), розчинного приблизно за 30 хвилин і, щонайменше, приблизно 60 % цитрату заліза (III), розчинного приблизно за 60 хвилин в тесті розчинення відповідно до методики USP . Пігулка може продемонструвати розчинення, щонайменше, 90 % в межах 30 хвилин в тесті розчинення відповідно до методики USP . Пігулка може продемонструвати розчинення, щонайменше, 90 % в межах 60 хвилин в тесті розчинення відповідно до методики USP . Пігулка може демонструвати час розпаду менше 30 хвилин в тесті розпаду відповідно до методики USP . Пігулка може показати час розпаду більший, ніж 30 хвилин в тесті розпаду відповідно до методики тесту USP . Пігулка може включати приблизно 1000 міліграм цитрату заліза (III), приблизно 667 міліграм цитрату заліза (III), приблизно 500 міліграм цитрату заліза (III), приблизно 250 міліграм цитрату заліза (III) або приблизно 125 міліграм цитрату заліза (III). У різних аспектах % втраченої при висушуванні (англ. LOD%, Loss on Drying) вода в пігулці складає менше, ніж 20 мас./мас. %. У інших аспектах % втраченої при висушуванні води в пігулці складає менше, ніж 15 мас./мас. %. У інших аспектах % втраченої при висушуванні води в пігулці складає менше 10 мас./мас. %. У різних аспектах, щонайменше, 80 % цитрату заліза (III) в пігулці розчиняється протягом періоду часу меншого або рівнішого 60 хвилинам, визначеного в тесті USP . У іншому аспекті пігулка включає розпушувач. У деяких втіленнях розпушувач може бути вибраний з одного або декількох з поміж мікрокристалічної целюлози, кроскармелози натрію, кросповідону, натрієвої солі гліколяту крохмалю і крохмалю. У іншому аспекті, пігулка включає змащувальну речовину. У деяких втіленнях змащувальна речовина може бути вибраною з поміж одного або декількох із стеарата магнію, стеарата кальцію і стеарил фумарату натрію. У іншому аспекті розкриття винаходу направлене на спосіб приготування пігулки цитрату заліза (III). Спосіб передбачає змішування цитрату заліза (III) з одним або декількома зв'язуваними речовинами за умов, за яких визначений % втраченої при висушуванні води не перевищує 25%, з утворенням гранул цитрату заліза (III). Грануляція може бути здійснена будьяким відомим в даній галузі способом (наприклад, грануляцією в псевдозрідженому шарі або грануляцією з великим зусиллям зрушення). Після цього з гранул цитрату заліза (III) виготовляють пігулки. У іншому аспекті, пігулки нагрівають до температури вище 50 °C після таблетування. Пігулки можна застосовувати для профілактики або для лікування різних захворювань або хворобливих станів, перелік яких включає, але не обмежений цим, гіперфосфатемію. Втілення способу може включати одну або декілька ознак, описаних вище або далі в даному документі. Деталі різних втілень винаходу викладені нижче в кресленнях і описі. Ознаки і переваги різних втілень очевидні із даного опису, фігур і формули винаходу. Короткий опис фігур Фахівцям в даній галузі техніки повинно бути зрозуміло, що фігури, описані в даному документі, представлені тільки в ілюстративних цілях. Фігури не призначені для обмеження обсягу даного винаходу. Фіг. 1 є графіком, який демонструє залежність твердості від зусилля пресування для композицій 1-5. Фіг. 2 є графіком, який демонструє залежність стирання від зусилля пресування для композицій 1-5. Фіг. 3 є графіком, який демонструє залежність часу розпаду від зусилля пресування для композицій 1-5. Фіг. 4 є графіком, який демонструє час розчинення композицій 1 і 3-5. Фіг. 5 є графіком, який демонструє залежність твердості від сили стиснення композицій 6-8 і 2 UA 107803 C2 11. Фіг. 6 є графіком, який демонструє залежність стирання від сили стиснення композицій 6-8 і 11. 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 7 є графіком, який демонструє залежність часу розпаду від сили стиснення композицій 6-8 і 11. Фіг. 8 є графіком, що демонструє час розчинення композицій 6-8 і 11. Фіг. 9 демонструє час розчинення різних пігулок до висушування і після. Здійснення винаходу У цьому документі описані пігулки, що містять цитрат заліза (III). У різних втіленнях пігулки включають композиції цитрату заліза (III), які відповідають певним стандартам розчинення, таблетування і розпаду. У різних аспектах рецептури пігулок можуть включати цитрат заліза (III) як активний інгредієнт і зв’язувальну речовину. Композиції також можуть включати змащувальну речовину і/або розпушувач (який в деяких втіленнях, може бути тим же самим компонентом, що і зв'язувальна речовина). Пігулки У одному аспекті композиція є пігулкою, яка включає цитрат заліза (III) і зв’язувальну речовину. Термін «пігулка» так, як його використано в даному документі, є матеріалом, отриманим стисненням, наприклад, за допомогою машини, пігулки. У інших варіантах здійснення винаходу, композиція або пігулка можуть включати цитрат заліза (III), зв’язувальну речовину, змащувальну речовину і розпушувач. Пігулку або композицію можна застосовувати для профілактики або при лікуванні гіперфосфатемії, шляхом введення пігулки або композиції в ефективній кількості або кількостях, відомих в даній галузі. Композиція може бути охарактеризована як лікарський препарат з високою концентрацією цитрату заліза (III), присутнього в композиції в кількості більшій, ніж приблизно 65 % від маси композиції, більшій, ніж приблизно 70 % від маси композиції і аж до приблизно 92 % від маси композиції. Також можуть бути використані проміжні величини, такі як приблизно 80 мас. % цитрату заліза (III), приблизно 85 мас. % цитрату заліза (III) і приблизно 90 мас. % цитрату заліза (III). Характеристики пігулки з вказаними високими масовими відсотками цитрату заліза (III), контролюються за рахунок змінних, таких як вид зв'язувальної речовини, кількість зв’язувальної речовини, вид розпушувача, кількість розпушувача, спосіб, використаний при отриманні композиції (наприклад, грануляція, пряме стиснення), параметри таблетування і так далі Таким чином, якщо пігулка при виготовленні має незначне розшарування або кепінг (відшаровування верхньої частини), то змінивши одну або декілька вказаних вище змінних, можна виправити шаруватість структури або кепінг. У різних втіленнях, композиція пігулки містить один або декілька компонентів, вибраних з однієї або декількох зв’язувальних речовин, однієї або декількох змащувальних речовин і однієї або декількох розпушувачів. Зв’язувальна речовина може бути будь-якою з поміж відомих в даній галузі. Приклади зв’язувальних речовин можуть включати, не обмежуючись перерахованим, одну або декілька з поміж гідроксипропілцелюлози (НРС), гідроксипропілметилцелюлози (НРМС), альгінату натрію, альгінової кислоти, гуарової камеді, аравійської камеді, ксантанової камеді, карбополу, гуміцелюлози (карбоксиметилцелюлози), етилцелюлози, мальтодекстрину, ПВП/ВА (PVP/VA), повідону, мікрокристалічної целюлози, крохмалю (частково або повністю прежелатинізованого) і метилцелюлози. При використанні в композиціях цитрату заліза (III) мальтодекстрин, ПВП/ВА і метилцелюлоза діють як зв’язувальні речовини з негайним вивільненням. Слід також розуміти, що для контролю і зміни впливу зв’язувальної речовини можуть бути використані комбінації зв’язувальних речовин. Наприклад, система зв’язувальної речовини може бути складена з гідроксипропілцелюлози і полівінілпіролідону (повідону) з мікрокристалічною целюлозою або без неї. Гідроксипропілцелюлоза і/або повідон можуть бути заміщені прежелатинізованим крохмалем. У різних аспектах пігулка може включати змащувальну речовину. Наприклад, як змащувальна речовина для композицій цитрату заліза (III) можуть бути використані стеарат магнію, стеарат кальцію, стеарил фумарат натрію та їх комбінації. Інші придатні змащувальні речовини включають одну або декілька речовин з поміж поліетиленгліколю (молекулярна маса вище 3350), лаурилсульфату натрію, тальку, мінеральної олії, лейцину і полоксамеру. У різних аспектах пігулка може включати розпушувач. До композиції може бути включений розпушувач. Розпушувач може бути зв’язувальною речовиною або відрізнятися від неї. Необмежуючим прикладом є мікрокристалічна целюлоза, яка має як властивості зв’язувальної речовини, так і властивості розпушувача, і може бути використана в композиції як єдина зв’язувальна речовина/розпушувач. Приклади інших придатних розпушувачів включають 3 UA 107803 C2 5 10 15 20 25 30 35 40 45 50 55 60 кроскармелозу натрію, кросповідон, натрієву сіль гліколята крохмалю і крохмаль. Зв’язувальна речовина може бути представленою в композиції в діапазоні від приблизно 4,5 мас. % до приблизно 30 мас. %. Розпушувач може бути представлений в композиції в діапазоні від приблизно 1,5 % мас. % до приблизно 15 мас. %. У різних варіантах здійснення винаходу, деякі не крохмальні розпушувачі часто використовуються у менших кількостях, наприклад, до 0,25 % і, таким чином, за деяких умов кількість розпушувача в даній композиції може бути такою низькою як 0,25 %. Змащувальна речовина може бути присутньою в композиції в діапазоні від приблизно 0,5 мас. % до приблизно 3 мас. %. Слід розуміти, що деякі компоненти, такі як мікрокристалічна целюлоза, можуть виконувати роль як розпушувача, так і зв’язувальної речовини. Маса індивідуальних пігулок може залежати від отриманої кінцевої дози, наприклад, 125 міліграм, 250 міліграм, 500 міліграм, 667 міліграм, 750 міліграм і 1000 міліграм цитрату заліза (III). У різних втіленнях при нанесенні покриття суспензією «Опадрай» або еквівалентом в дражирувальному казані з перфорованим зовнішнім кожухом маса пігулки збільшується приблизно від 2 до 5 %. Як зазначено вище, стеарат кальцію і «Опадрай пурпурний» можуть бути заміщені або використані з різними змащувальними речовинами або системами покриття, відповідно. Пігулки, які мають високу площу поверхні на одиницю маси У одному варіанті описані пігулки містять гранульовані частинки з розміром, що має значно вищу середню площу поверхні на одиницю маси, ніж існуючі рецептури цитрату заліза (III). Було виявлено, що збільшення площі поверхні на одиницю об'єму призводить до негайного вивільнення (більш ніж 80 % за 60 хвилин після введення, при визначенні в тесті Фармакопеї США (USP) , описаному в United States Pharmacopeia Compendium of Standards, USP 30 NF 25, Vol.1 p.276-284 (2007), який включений до даного опису повністю як посилання). Не бажаючи бути обмеженими конкретною теорією або механізмом дії, вважаємо, що збільшена гранулярна площа поверхні гранул в пігулці приводить до збільшення виділення цитрату заліза (III) в розчинник. Час негайного вивільнення при розчиненні значно понижений у пігулки зменшеного розміру. У додаткових варіантах, пігулки, описані в даній заявці, можуть бути розроблені так, щоб мати відношення середньої площі поверхні гранульованої частинки до маси, яке дорівнює 1 квадратному метру на грам або більше цього значення. У додаткових варіантах пігулка має відношення середньої площі поверхні гранульованої частинки до маси, яке дорівнює 2 квадратним метрам на грам або більше цього значення. У додаткових варіантах пігулка має відношення середньої площі поверхні гранульованої частинки до маси, яке дорівнює 4 квадратним метрам на грам або більше цього значення. У додаткових варіантах композиція має відношення середньої площі поверхні гранульованої частинки до маси, яке дорівнює 6 квадратним метрам на грам або більше цього значення. У додаткових варіантах композиція має відношення середньої площі поверхні гранульованої частинки до маси, яке дорівнює 8 квадратним метрам на грам або більше цього значення. У додаткових варіантах композиція має відношення середньої площі поверхні гранульованої частинки до маси, яке дорівнює 10 квадратним метрам на грам або більше цього значення. У додаткових варіантах композиція має відношення середньої площі поверхні гранульованої частинки до маси, яке дорівнює 15 квадратним метрам на грам або більше цього значення. У додаткових варіантах композиція має відношення середньої площі поверхні гранульованої частинки до маси, яке дорівнює 20 квадратним метрам на грам або більше цього значення. У додаткових варіантах має відношення середньої площі поверхні гранульованої частинки до маси, яке дорівнює 30 квадратним метрам на грам або більше цього значення. У додаткових варіантах композиція має відношення середньої площі поверхні гранульованої частинки до маси, яке дорівнює 40 квадратним метрам на грам або більше цього значення. У додаткових варіантах композиція має відношення середньої площі поверхні гранульованої частинки до маси, яке дорівнює 50 квадратним метрам на грам або більше цього значення. Збільшення площі поверхні на частинку в пігулці призводить до значного збільшення швидкості розчинення. У інших варіантах пігулки мають понижений вміст води. У одному втіленні вміст вологи гранул, який визначався за % втрат при висушуванні (англ. LOD%, Loss on Drying), становить менше, ніж 20 %. У іншому втіленні, вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 19 %. У іншому втіленні, вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 18 %. У іншому втіленні, вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 17 %. У іншому втіленні, вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 16 %. У іншому 4 UA 107803 C2 5 10 15 20 25 30 35 40 45 50 55 60 втіленні, вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 15 %. У іншому втіленні, вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 14 %. У іншому втіленні, вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 13 %. У іншому втіленні, вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 12 %. У іншому втіленні, вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 11 %. У іншому втіленні, вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 10 %. У іншому втіленні, вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 9 %. У іншому втіленні, вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 8 %. У іншому втіленні, вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 7 %. У іншому втіленні, вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 6 %. У іншому втіленні, вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 5 %. Фахівцям в даній галузі техніки зрозуміло, що в різних варіантах здійснення винаходу способом вимірювання % води, втраченої при висушуванні (LOD), є спосіб термогравіметричного визначення вмісту вологи: в термогравіметричних способах волога матеріалу включає і речовини, які випаровуються під час нагрівання і тому сприяють втраті маси матеріалу. Окрім води ці речовини можуть включати спирт або продукт розпаду. При використанні способів термогравіметричних вимірювань (висушування за допомогою інфрачервоних ламп, галогенових ламп, мікрохвиль або термошафи) між водою та іншими леткими компонентами ніякого розмежування не робиться. Стирання Стирання, загалом, є мірою механічної міцності пігулок. В ході нанесення покриття, транспортування, упаковки і інших процесів, пігулки можуть втрачати деяку кількість маси. Щоб зміряти масові втрати, зразки підраховують і зважують. У різних втіленнях тест на стирання здійснюють як описано в «United States Pharmacopeia Compendium of Standards» (2007), який включений в даний документ повністю посиланням. Спосіб виготовлення пігулок У одному способі таблетування пігулки можуть бути приготовані в три стадії. На першій стадії формують гранули цитрату заліза (III) і зв’язувальної речовини. На другій, до композиції перед таблетуванням додають змащувальну речовину. На третій, пігулку сушать після необов'язкової стадії нанесення покриття. Грануляція Цитрат заліза (III), такий як цитрат заліза (III) фармацевтичної чистоти, описаний, наприклад, в патенті US № 6903235 В2, може бути гранульований будь-яким відомим в даній галузі способом. Типові способи грануляції включають грануляцію в псевдозрідженому шарі, грануляцію з великим зусиллям зрушення і грануляцію прямим пресуванням. У втіленнях, в яких вміст вологи, який визначався за втратою при висушуванні композиції, доводився до рівня вище 25 % частинки в будь-якій точці мали істотно нижче відношення площі поверхні на грам. Це досягалося, наприклад, обмеженням кількості води, що вводиться, або продуванням повітря і моніторингом кількості води в композиції. Для підвищення у частинок цитрату заліза (III) відношення площі поверхні до маси до значення більше ніж 1 квадратний метр на грам, або в інших втіленнях, більш ніж 10 квадратних метрів на грам, вміст вологи гранул протягом всього періоду утворення підтримують на рівні нижче 25 %, який визначався за втратою при висушуванні. У певних варіантах, вміст вологи гранул протягом всього періоду утворення підтримують на рівні нижче 24 %, 23 %, 22 %, 21 % або 20 %. Не будучи зв'язаними конкретним механізмом або способом дії, автори припускають, що підтримування рівня кількості води в ході грануляції нижче 25 %, який визначався за втратою при висушуванні, приводить до збереження гранул з високим відношенням площі поверхні до маси. Додавання великих кількостей води у будь-який момент в ході грануляції приводить до утворення крупніших гранул з нижчим відношенням площі поверхні до маси. Нижче відношення площі поверхні до маси знижує швидкість розчинення до рівня нижче за швидкість розчинення композиції для негайного вивільнення. Визначене нижче відношення середньої площі поверхні до маси гранул призводить до повільнішого розчинення і вивільнення. У різних втіленнях було відмічено, що зменшення відношення площі поверхні до маси композиції цитрату заліза (III) є необоротним після збільшення вмісту вологи вище 25%, який визначається за втратою при висушуванні. Відповідно, в різних варіантах здійснення винаходу в ході грануляції відсоток води підтримують нижче 25 %. Змішування 5 UA 107803 C2 5 10 15 20 25 30 35 40 45 50 55 60 У різних втіленнях, одна або декілька змащувальних речовин можуть бути змішані з гранулами. У різних втіленнях, перелік змащувальних речовин, який не обмежується названими, включає стеарати, такі як стеарат кальцію і стеарат магнію, стеарил фумарат натрію, стеаринову кислоту, тальк, поліетиленгліколь, гідрогенізовані рослинні олії, стеарат алюмінію, бензоат натрію, ацетат натрію, хлорид натрію, лейцин, «Карбовакс» і лаурилсульфат магнію. Як змащувальні речовини можуть бути розглянуті певні крохмалі, такі як крохмаль 1500, оскільки вони при використанні при прямому пресуванні до деякої міри проявляють змащувальні властивості. Можна застосувати будь-яку змащувальну речовину, відому в даній галузі техніки, включаючи будь-які з речовин, описаних в керівництві «Handbook of Pharmaceutical Excipients, fifth edition», включеного до даного документа повністю як посилання. Можливе поєднання багатьох змащувальних речовин. У певних втіленнях можливе застосування більшої кількості змащувальної речовини, ніж зазвичай використовується в даній галузі техніці. Автори із здивуванням виявили, що для зниження кількості налипань на пігулках цитрату заліза (III) кількість змащувальної речовини повинна бути вищою, ніж рекомендовано або прийнято в даній галузі. У певних варіантах як зв'язувальну речовину застосовують комбінацію стеарата магнію або стеарата кальцію і стеарил фумарату натрію. У додаткових втіленнях змащувальна речовина є комбінацією стеарата кальцію і стеарил фумаратом натрію. У різних втіленнях можливе застосування стеарата кальцію в кількості більшій, ніж рекомендується в даній галузі техніки. У керівництві «Handbook of Pharmaceutical Excipients, fifth edition» описана рекомендована кількість стеарата кальцію, яка максимально складає 1,0 мас./мас. %. У одному втіленні кількість стеарата кальцію дорівнює 2,0 мас./мас. % або перевищує це значення. У іншому втіленні, кількість стеарата кальцію дорівнює 2,2 мас./мас. % або перевищує це значення. У іншому втіленні, кількість стеарата кальцію дорівнює 2,4 мас./мас. % або перевищує це значення. Більше того, в різних втіленнях можливе застосування стеарил фумарату натрію в кількості, яка перевищує рекомендовану концентрацію 0,5-2,0 мас./мас. %. У одному втіленні кількість стеарил фумарату натрію дорівнює 2,1 мас./мас. % або перевищує це значення. У іншому втіленні кількість стеарил фумарату натрію дорівнює 2,2 мас./мас. % або перевищує це значення. У іншому втіленні кількість стеарил фумарату натрію дорівнює 2,3 мас./мас. % або перевищує це значення. У іншому втіленні кількість стеарил фумарату натрію дорівнює 2,4 мас./мас. % або перевищує це значення. У іншому втіленні кількість стеарил фумарату натрію дорівнює 2,5 мас./мас. % або перевищує це значення. У іншому втіленні кількість стеарил фумарату натрію дорівнює 2,6 мас./мас. % або перевищує це значення. У іншому втіленні кількість стеарил фумарату натрію дорівнює 2,7 мас./мас. % або перевищує це значення. Висушування після таблетування Після таблетування можливе проведення стадії висушування. Було виявлено, що без висушування після таблетування швидкість розчинення пігулок зростає з часом. Висушування дозволяє зберегти негайне вивільнення цитрату заліза (III) з пігулок, розкритих в даному документі. Не бажаючи бути обмеженим конкретним механізмом або способом дії, автори вважають, що розмір гранули росте із-за наявності залишкової води, а стадія висушування забезпечує велику площу поверхні на одиницю маси початкових гранул. У одному втіленні, кінцевий вміст вологи гранул, який визначався за % втрат при висушуванні (англ. LOD %, Loss on Drying), складає менше, ніж 20 %. У іншому втіленні, кінцевий вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 19 %. У іншому втіленні, кінцевий вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 18 %. У іншому втіленні, кінцевий вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 17 %. У іншому втіленні, кінцевий вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 16 %. У іншому втіленні, кінцевий вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 15 %. У іншому втіленні, кінцевий вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 14 %. У іншому втіленні, кінцевий вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 13 %. У іншому втіленні, кінцевий вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 12 %. У іншому втіленні, кінцевий вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 11 %. У іншому втіленні, кінцевий вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 10 %. У іншому втіленні, кінцевий вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 9 %. У іншому втіленні, кінцевий вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 8 %. У іншому втіленні, кінцевий вміст вологи гранул, який 6 UA 107803 C2 5 10 15 20 25 30 35 визначався за % втрат при висушуванні, складає менше, ніж 7 %. У іншому втіленні, кінцевий вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 6 %. У іншому втіленні, кінцевий вміст вологи гранул, який визначався за % втрат при висушуванні, складає менше, ніж 5 %. Приклади У прикладах нижче подано опис отримання і властивостей різних лікарських форм і способів, представлених в даному документі. Для фахівців в даній галузі техніці буде очевидною можливість практичного здійснення модифікацій як речовин, так і способів без порушення об'єму домагань даної заявки. Приклад 1 У наступних типових прикладах композицій і способів отримання композицій цитрату заліза (III) представлені дані, які демонструють характеристики композицій або пігулок, зокрема такі дані, як розчинення, розпад і стирання. Деякі речовини були отримані з наступних джерел: цитрат заліза (III) з «Biovectra»; силікатизована мікрокристалічна целюлоза (Prosolv SMCC 50 і Prosolv SMCC HD90, яка складається з мікрокристалічної целюлози, NF, і колоїдного діоксиду кремнію, NF) з «JRS Pharma»; крохмаль прежелатинізований, NF (крохмаль 1500) з «Colorcon»; повідон, NF (Plasdone K-29/32) з «ISP»; гідроксипропілцелюлоза, NF (Klucel EF) з «Hercules»; кроскармелоза натрію, NF (Ac-Di-Sol SD-711) з «FMC Biopolymer»; і стеарат магнію, NF з «Mallinckrodt». Устаткування, використовуване приготування лікарських форм складалося з: гранулятора «FLM1» з псевдозрідженим шаром, «Vector Corporation», Маріон, Айова; конусного млина «Comil», «Quadro Engineering», Мілбурн, Нью-Джерсі; гранулятора «GMX» з великим зусиллям зрушення з чашею 4L, «Vector Corporation» Маріон, Айова; V-подібного змішувача об'ємом 2 кварти, «Patterson Kelley», Східний Строудсбург, Пенсільванія; пігулки преса «XL100 Pro», «Korsch», Південний Істон, Масачусетс; прес-форми у вигляді капсул, «Elizabeth Carbide», Лексингтон, Північна Кароліна; звуковий просіювач з сепаратором, «Advanctech Manufacturing», Нью-Берлін, Вісконсін. Устаткування,яке використовується для аналітичного дослідження композицій, складалося з: тестера пігулок «8М» (твердоміра), «Dr.Schleuniger», Манчестер, Нью-Хемпшир; фриабілятора, «VanKel», Пало-Алто, Каліфорнія; установки для вимірювання насипної щільності «Flodex», «Hanson Research», Чатсворт, Каліфорнія; незанурювальної системи перевірки розпаду, модель 3106, і незанурювальної системи перевірки розпаду «Evolution 6100», «Distek», Північний Брансуїк, Нью-Джерсі; і спектрофотометра моделі 8453 Uv-Vis (ультрафіолетова і видима частина спектру), «Agilent», Санта-Клара, Каліфорнія. Грануляція з великим зусиллям зрушення Щоб визначити можливість застосування гранулятора з великим зусиллям зрушення проводили серії експериментів для отримання суміші пігулок, яка має придатні характеристики. Композиції 1-3 представлені нижче в таблицях 1-3. Таблиця 1 (Композиція 1) Компонент Подрібнений цитрат заліза (III) Силікатована мікрокристалічна целюлоза (Prosolv SMCC 50) Кроскармелоза натрію Гідроксипропілцелюлоза Стеарат магнію Всього 40 7 міліграм/пігулку 1190,3 238,1 47,6 95,2 15,9 1587,0 мас./мас. % 75,0 15,0 3,0 6,0 1,0 100,0 UA 107803 C2 Таблиця 2 (Композиція 2) Компонент Подрібнений цитрат заліза (III) Силікатована мікрокристалічна целюлоза (Prosolv SMCC 50) Кроскармелоза натрію Гідроксипропілцелюлоза Стеарат магнію Всього міліграм/пігулку 1190,4 595,2 59,5 119,0 19,8 1984,0 мас./мас. % 60,0 30,0 3,0 6,0 1,0 100,0 Таблиця 3 (Композиція 3) Компонент Подрібнений цитрат заліза (III) Силікатована мікрокристалічна целюлоза (Prosolv SMCC 50) Кроскармелоза натрію Гідроксипропілцелюлоза Стеарат магнію Всього 5 10 15 20 міліграм/пігулку 1190,3 258,8 86,3 172,5 17,3 1725,0 мас./мас. % 69,0 15,0 5,0 10,0 1,0 100,0 Процедуру отримання композицій 1-3 проводили таким чином. Подрібнений цитрат заліза (III), гідроксипропілцелюлозу, силікатовану мікрокристалічну целюлозу і кроскармелозу натрію змішували протягом 2 хвилин при 500 об./хв. у 4 л резервуарі гранулятора «GMX» з великим зусиллям зрушення. Деіонізовану воду додавали приблизно із швидкістю 18 г/хв. протягом 10 хвилин, з одночасним змішуванням на швидкості 900 об./хв. із швидкістю подрібнюючого ножа 1500 об./хв. Визначений кінцевий (найвищий) вміст вологи становив 24,3 %, 23,8 % і 24,4 %, відповідно. Гранули висушували в грануляторі «FLM1» з псевдозрідженим шаром протягом 5-8 хвилин за температури на вході 65 °C. Вміст вологи, який визначався за % втрат при висушуванні, становив 14,3 %, 15,5 % і 15,9 %, відповідно. Гранули просіювали крізь ручне сито 16 меш, потім через ручне сито 25 меш, для видалення гранул дуже великого розміру і грудок. Стеарат магнію просіювали крізь ручне сито 25 меш. Гранули і стеарат магнію змішували протягом 2 хвилин в V-подібному змішувачі об'ємом 2 кварти. Таблетування здійснювали на пресі пігулки «Korsch» з прес-формами у вигляді капсул. Було встановлено, що із-за неправильної форми гранул отримані суміші для виготовлення пігулок показали погану текучість крізь завантажувальний люк. Проте, на устаткуванні для таблетування змогли виготовити чудові пігулки. Приклад 2 Щоб визначити можливість застосування способу грануляції з псевдозрідженим шаром при створенні пігулок проводили наступні серії експериментів: Таблиця 4 (Композиції 4 і 5) Компонент Подрібнений цитрат заліза (III) Прежелатинізований крохмаль Стеарат магнію Всього 25 міліграм/пігулку 1190,7 119,1 13,2 1323,0 мас./мас. % 90,0 9,0 1,0 100,0 Процедуру отримання композицій 4 і 5, описаних в таблиці 4, проводили таким чином: Подрібнений цитрат заліза (III) додавали в гранулятор «FLM1» з псевдозрідженим шаром. Для композиції 4, прежелатинізований крохмаль додавали у вигляді 10 мас./мас. % розчину із швидкістю розпилювання, яка зростала від 24 г/хв. до 52 г/хв. протягом прогону. [Температура 8 UA 107803 C2 5 10 15 на вході = 64-77 °C; температура продукту = 25-35 °C; робоче повітря = 29-35 CFM (кубічних футів на хвилину)]. Визначений кінцевий (найвищий) вміст вологи становив 32,5 %. Для композиції 5, прежелатинізований крохмаль додавали у вигляді 10 мас./мас. % розчину з середньою швидкістю розпилювання 40,8 г/хв. [Температура на вході = 69-75 °C; температура продукту = 25-35 °C; робоче повітря = 24-38 CFM]. Визначений кінцевий (найвищий) вміст вологи становив 30,0 %. Гранули сушили протягом 7-10 хвилин за температури на вході 65 °C. Визначений вміст вологи після висушування становив 15,5 % і 16,7 %. Гранули подрібнювали в «Comil», обладнаною ситом 45R і квадратною крильчаткою зі швидкістю 1500 об./хв. Стеарат магнію просіювали крізь ручне сито 25 меш. Гранули і стеарат магнію змішували протягом двох хвилин в V-подібному змішувачі об'ємом 2 кварти. Таблетування здійснювали на пресі пігулки «Korsch» з прес-формами у вигляді капсул. Основна відмінність між пігулками композицій 4 і 5 полягала в часі розпаду. Пігулки композиції 5 розпадалися повільніше, ніж пігулки композиції 4. Дані дослідні зразки не мали жодних проблем з текучістю в ході таблетування. У таблицях 5 і 6 описані порошкові властивості композицій 1-5. Всі суміші мають чудові ковзаючі властивості, які визначались за допомогою «Flodex». Таблиця 5 Опис характеристик порошкових сумішей, отриманих грануляцією з великим зусиллям зрушення Параметр Насипна щільність «Flodex» Композиція 1 0,772 г/мл 4 Композиція 2 0,618 г/мл 5 Композиція 3 0,679 г/мл 10 Таблиця 6 Опис характеристик порошкових сумішей, отриманих грануляцією в псевдозрідженому шарі Параметр Насипна щільність Flodex Композиція 4 0,647 г/мл 4 Композиція 5 0,578 г/мл 4 20 25 30 35 40 45 Експериментальні склади композицій 1 і 5 вивчали скануючим електронним мікроскопом (СЕМ) і обидва зразки продемонстрували схожий розмірний ряд частинок. При цьому композиція 1, мабуть, має бімодальний розподіл, і обидва зразки відрізняються за морфологією частинок. Композиція 1, яка була отримана грануляцією з великим зусиллям зрушення, має гостріші, прямокутні частинки. Композиція 5, приготована грануляцією в псевдозрідженому шарі, має м'якші, округліші частинки. Вважається, що дана відмінність впливає на ковзаючі (реологічні) властивості, які спостерігаються в ході таблетування. У таблицях 7 і 8 описані властивості пігулок композицій 1-5. Профілі ущільнення, створені для кожної композиції, графічно представлені на Фігурі 1 (твердість), Фігурі 2 (стирання) і Фігурі 3 (розпад). Описові дані представлені тільки для пігулок, отриманих при найвищій силі ущільнення. Силу стиснення вимірювали в кілоньютонах. На Фігурі 4 графічно представлені результати розчинення для композицій 1 і 3-5. При дослідженнях твердості, пігулки тестували відповідно до USP на твердість/межу міцності на розрив. При дослідженнях стирання, пігулки тестували відповідно до USP на стирання. При дослідженнях розпаду, шість пігулок тестували в деіонізованій воді при 37 °C за допомогою приладу для оцінки розпаду. При дослідженнях розчинності, властивості розчинності шести пігулок тестували відповідно до представлених нижче умов. Результати розчинення пігулки представили так, щоб 100 % розчинення відповідало 1000 міліграм дози, коректуючи за необхідності фактичну середню вагу пігулки. Умови розчинення: Прилад для розчинення: «Distek Evolution 6100». Середовище: буферний розчин Мак-Ілвейна, рН 4,0. Пристрій USP: Пристрій II (спосіб, здійснений в приладі з лопаттю-мішалкою); 100 об./хв. Температура: 37 °C ± 0,5 °C. Час: Зразки відбирали через 5, 15, 30 і 60 хвилин. Спектрофотометр, який працює в ультрафіолетовій і видимій частинах спектру: «Aglient 9 UA 107803 C2 8453 UV-Vis»; 360-600 нм, з корекцією фону. Опис характеристик порошку сумішей, отриманих грануляцією з великим зусиллям зрушення. Таблиця 7 Опис характеристик експериментальних композицій, отриманих грануляцією з великим зусиллям зрушення (Композиції 1-3) Параметр Розкид маси Товщина Твердість Стирання Розпад Розчинення Композиція 1 Середнє значення 1580,8 міліграм (0,5 % RSD) Середнє значення 8,59 мм (0,2 % RSD) 18,1 кілопонд (2,6 % RSD) 0,19 % Середнє значення 5,8 хвилин 48,2 % за 60 хвилин Композиція 2 Середнє значення 1485,6 міліграм (0,4 % RSD) Середнє значення 8,37 мм (0,2 % RSD) 19,5 кілопонд (2,3 % RSD) 0,22 % Середнє значення 19,8 хвилин -- Композиція 3 Середнє значення 1518,4 міліграм (0,7 % RSD) Середнє значення 8,69 мм (0,4 % RSD) 21,5 кілопонд (3,8 % RSD) 0,26 % Середнє значення 3,0 хвилин 49,7 % за 60 хвилин 5 RSD – відносне стандартне відхилення Таблиця 8 Опис характеристик експериментальних композицій, отриманих грануляцією в псевдозрідженому шарі (приклади 4 і 5) Параметр Розкид маси Товщина Твердість Стирання Розпад Розчинення 10 15 20 Композиція 4 Середнє значення 1286,5 міліграм (0,3 % RSD) Середнє значення 7,18 мм (0,2 % RSD) Середнє значення 19,3 кілопонд (3,2 % RSD) 0,20 % Середнє значення 7,7 хвилин 50,4 % за 60 хвилин Композиція 5 Середнє значення 1313,2 міліграм (0,4 % RSD) Середнє значення 7,24 мм (0,2 % RSD) 20,5 кілопонд (7,4 % RSD) 0,23 % Середнє значення 36,3 хвилин 42,5 % за 60 хвилин RSD – відносне стандартне відхилення Для прототипів, отриманих грануляцією з великим зусиллям зрушення (Композиції 1-3) включення збільшеної кількості силікатованої мікрокристалічної целюлози (Композиція 1 і Композиція 2) поліпшило здатність до ущільнення, про що говорить зниження зусилля пресування при збереженні еквівалентної твердості. Крім того, здатність до ущільнення покращала при включенні збільшеної кількості гідроксипропілцелюлози (Композиції 1, 2 і 3), про що говорить зниження зусилля пресування при збереженні еквівалентної твердості. Приклад 4 Для досягнення рівноваги між профілем розчинення і прийнятними властивостями пігулки були проведені додаткові дослідження. Поступова зміна швидкості розпилювання при грануляції в псевдозрідженому шарі за допомогою прежелатинізованого крохмалю показала, що вміст вологи в ході процесу грає деяку роль в профілі розчинення і властивостях пігулки. Грануляція в псевдозрідженому шарі з крохмалем Партії композицій 6-11, представлених в таблицях 9 і 10, були приготовані з використанням прежелатинізованого крохмалю, із заданим розміром партії 1,0 кг 10 UA 107803 C2 Таблиця 9 Склад композицій 6-8 Компонент Подрібнений цитрат заліза (III) Прежелатинізований крохмаль Стеарат магнію Всього міліграм/пігулку 1190,7 119,1 13,2 1323,0 мас./мас. % 90,0 9,0 1,0 100,0 Таблиця 10 Склад композицій 9-11 Компонент Подрібнений цитрат заліза (III) Прежелатинізований крохмаль Силікатована мікрокристалічна целюлоза Стеарат магнію Всього 5 міліграм/пігулку 1190,7 119,1 147,2 13,2 1470,2 мас./мас. % 80,9 8,1 10,0 1,0 100,0 Композиції 6-11 отримували представленим нижче способом: Подрібнений цитрат заліза (III) додавали в гранулятор «FLM1» з псевдозрідженим шаром. Прежелатинізований крохмаль додавали у вигляді 10 мас./мас. % розчину, із застосуванням параметрів грануляції і висушування з таблиці 11. Всі партії сушили за температури на вході 65 °C. Таблиця 11 Параметри грануляції Параметр Швидкість розпилювання Температура на вході Температура продукту Робоче повітря Кінцевий (найвищий) вміст вологи Вміст вологи після висушування Час висушування Композиція 6і9 24,0 г/хв. 69-79 °C 26-35 °C 31-36 CFM 17,3 % 14,8 % 2 хвилини Композиція 7 і 10 32,5 г/хв. 72-75 °C 26-36 °C 32-38 CFM 23,4 % 16,1 % 5 хвилин Композиція 8 і 11 37,5 г/хв. 69-76 °C 26-35 °C 36-39 CFM 25,7 % 17,5 % 7 хвилин 10 15 20 25 Гранули з композицій 6, 7, 9 і 10 просіювали крізь ручне сито 20 меш. Гранули з композицій 8 і 11 подрібнювали в конусному млині «Comil», обладнаному ситом 45R і квадратною крильчаткою на швидкості 1500 об./хв., потім просіювали крізь ручне сито 20 меш. З кожної грануляції готували дві суміші. У першій суміші стеарат магнію просіювали крізь ручне сито 25 меш. Гранули і стеарат магнію змішували протягом двох хвилин в V-подібному змішувачі об'ємом 2 кварти. У другій суміші стеарат магнію просіювали крізь ручне сито 25 меш. Гранули, силікатовану мікрокристалічну целюлозу і стеарат магнію змішували протягом двох хвилин в V-подібному змішувачі об'ємом 2 кварти. Таблетування здійснювали з декількох приготованих сумішей на пресі пігулки «Korsch» з прес-формами у вигляді капсул. Пігулки, отримані з композицій 6 і 9, характеризувалися ковзаючими властивостями з величиною відношення Хауснера, яка дорівнювала 1,25 або менше, і/або величиною коефіцієнта Карра, яка дорівнювала 25 або менше. У різних втіленнях, відношення Хауснера дорівнювало 1,20 або менше цього значення. У додаткових втіленнях, відношення Хауснера дорівнювало 1,20 або менше цього значення. У різних втіленнях, коефіцієнт Карра був меншим 25. У додаткових втіленнях коефіцієнт Карра дорівнював 20 або менше цього значення. Чудова текучість: величини відношення Хауснера були близькими до 1,20 або менше цього 11 UA 107803 C2 5 10 значення і величина коефіцієнта Карра була меншою 20; але представлений доказ того, що додаткова змащувальна речовина була необхідна для досягнення кращих результатів при виготовленні пігулок. Пігулки, отримані з композицій 7, 8, 10 і 11, характеризувалися чудовими ковзаючими властивостями і були вдалими. У таблицях 12 і 13 описані властивості порошку композицій 6-11. Відповідно до вимірювань «Flodex», композиції 7, 8, 10 і 11 характеризуються ковзаючими властивостями з відношеннями Хауснера, які дорівнювали 1,20 або менше цього значення, і з величинами коефіцієнта Карра, які становили менше 20, ймовірно, завдяки вищим швидкостям розпилювання в цих експериментах. Насипна щільність композицій експериментів із грануляції з крохмалем виросла, оскільки виросла швидкість розпилювання. . Таблиця 12 Опис характеристик порошків, отриманих в експериментах із грануляції в псевдозрідженому шарі Параметр Насипна щільність «Flodex» 15 Композиції 6і9 0,475 г/мл 7 Композиції 7 і 10 0,531 г/мл 4 Композиції 8 і 11 0,698 г/мл 4 У таблицях 13 і 14 описані властивості пігулок композицій 6-8 і 11. Профілі ущільнення, створені для кожної композиції, графічно представлені на Фігурі 5 (твердість), Фігурі 6 (стирання) і Фігурі 7 (розпад). Описові дані представлені тільки для пігулок, отриманих за найвищої сили ущільнення. Результати розчинення для композицій 6-8 і 11 представлені графічно на Фігурі 8. Таблиця 13 Опис характеристик пігулок композицій 6 і 7, отриманих грануляцією з великим зусиллям зрушення Параметр Розкид маси Товщина Твердість Стирання Розпад Розчинення Композиція 6 Середнє значення 1126,9 міліграм (0,4 % RSD) Середнє значення 7,74 мм (0,2 % RSD) Середнє значення 11,2 кілопонд (28,7 % RSD) 2,23% Середнє значення 1,8 хвилин 99,9 % за 60 хвилин Композиція 7 Середнє значення 1272,8 міліграм (0,4 % RSD) Середнє значення 8,00 мм (0,5 % RSD) 27,2 кілопонд (8,9 % RSD) 0,36 % Середнє значення 3,9 хвилин 95,7 % за 60 хвилин Таблиця 14 Опис характеристик пігулок композицій 8 і 11, отриманих грануляцією в псевдозрідженому шарі Параметр Розкид маси Товщина Твердість Стирання Розпад Розчинення Композиція 8 Середнє значення 1332,0 міліграм (0,3 % RSD) Середнє значення 7,94 мм (0,1 % RSD) Середнє значення 21,1 кілопонд (2,8 % RSD) 0,28 % Середнє значення 11,7 хвилин 55,8 % за 60 хвилин 20 12 Композиція 11 Середнє значення 1497,7 міліграм (0,3 % RSD) Середнє значення 8,72 мм (0,1 % RSD) 26,1 кілопонд (2,9 % RSD) 0,15 % Середнє значення 8,3 хвилин 65,6 % за 60 хвилин UA 107803 C2 Подрібнений цитрат заліза (III) і кроскармелозу натрію додавали в гранулятор «FLM1» з псевдозрідженим шаром. Додавали повідон у вигляді 30 мас./мас. % розчину (композиція 12) і 20 мас./мас. % розчину (композиція 13), для отримання гранул використовували параметри грануляції і висушування, приведені в таблиці 15. Висушування не було потрібне. 5 Таблиця 15 Параметри грануляції Параметр Швидкість розпилювання Температура на вході Температура продукту Робоче повітря Кінцевий (найвищий) вміст вологи 10 15 20 Композиція 12 22,9 г/хв. 55-60 °C 31-37 °C 31-36 CFM 13,0 % Композиція 13 30,0 г/хв. 52-58 °C 22-30 °C 35-38 CFM 17,3 % Гранули просіювали крізь ручне сито 20 меш. Стеарат магнію просіювали крізь ручне сито 25 меш. Гранули і стеарат магнію змішували протягом двох хвилин в V-подібному змішувачі об'ємом 2 кварти. Таблетування здійснювали на пресі пігулки «Korsch». При таблетуванні спостерігали надмірне налипання на устаткування. Передбачається, що вказане налипання пов'язане з використанням різних технологічних оснащень або із-за варіюючих параметрів таблетування. Приклад 6 Були розроблені і проаналізовані додаткові приклади. Підсумкові результати представлені в таблицях 16 і 17. У Таблиці 16 представлені підсумкові результати для композицій 14-20, при обробці яких використовували пряме пресування. У Таблиці 17 представлені підсумкові результати для композицій 21-29, при обробці яких використовували грануляцію в псевдозрідженому шарі. Дані різні композиції продемонстрували різноманітність ряду властивостей, які можуть бути корисними залежно від застосування, прикладом яких є негайне вивільнення, пролонговане вивільнення і вивільнення із затримкою, при цьому для того, щоб переконається в отриманні відповідних пігулок, потрібне проведення незначної кількості додаткової експериментальної роботи. Таблиця 16 Якісні результати композицій, при отриманні яких використовували пряме пресування Назва експерименту Цільова доза Кінцевий склад композиції 91,9 % цитрат заліза (III), 7,3 % Prosolv SMCC 50 0,8 % Стеарат магнію 91,9 % цитрат заліза (III), Композиція 15 667 міліграм 7,3 % Prosolv HD 90 0,8 % Стеарат магнію 87,0 % цитрат заліза (III), 7,3 % Prosolv SMCC 50 Композиція 16 667 міліграм 4,9 % Повідон K-29/32 0,8 % Стеарат магнію 90,7 % цитрат заліза (III), 8,5 % Prosolv HD 90 Композиція 17 500 міліграм 0,8 % Стеарат магнію Композиція 14 667 міліграм 90,7 % цитрат заліза (III), 8,0 % Prosolv HD 90 Композиція 18 500 міліграм 0,5 % Повідон K-29/32 0,8 % Стеарат магнію 25 13 Результати і спостереження У пігулок в деякій мірі розшарувалася структура, отримана середня твердість 12,5 кілопонд Стирання дорівнює 1,0 мас./мас. % або менше цього значення Стирання дорівнює 1,0 мас./мас. % або менше цього значення Пігулки продемонстрували кепінг і розшарування структури, що пов'язано з додатковою зв'язувальною речовиною або із зміною параметрів таблетування Пігулки продемонстрували кепінг і розшарування структури, що пов'язано з додатковою зв'язувальною речовиною або із зміною параметрів таблетування; тривалий розпад UA 107803 C2 Продовження Таблиці 16 88,0 % цитрат заліза (III), 7,0 % Avicel PH 200 2,7 % Повідон K-29/32 Композиція 19 500 міліграм 1,5 % Кросповідон XL 0,8 % Стеарат магнію 87,0 % цитрат заліза (III), 7,0 % Avicel PH 200 3,7 % Повідон K-29/32 Композиція 20 500 міліграм 1,5 % Кросповідон XL 0,8 % Стеарат магнію Пігулки продемонстрували кепінг і розшарування структури, що пов'язано з додатковою зв'язувальною речовиною або із зміною параметрів таблетування; час розпаду понижений до 1-3 хвилин, придатний для застосування з негайним вивільненням Розшарування пігулок зменшилося, що пов'язано з додатковою зв'язувальною речовиною або із зміною параметрів таблетування; час розпаду 3-5 хвилин, придатний для застосування з негайним вивільненням Таблиця 17 Якісні результати композицій, при отриманні яких використовували грануляцію в псевдозрідженому шарі Назва експерименту Цільова доза Композиція 21 500 міліграм Композиція 22 500 міліграм Композиція 23 500 міліграм Композиція 24 500 міліграм Композиція 25 500 міліграм Композиція 26 500 міліграм Композиція 27 500 міліграм Композиція 28 1000 міліграм Композиція 29 1000 міліграм Кінцевий склад композиції Результати і спостереження 90,0 % цитрат заліза (III) 2,0 % Повідон K-29/32 2,0 % Крохмаль 1500 5,2 % Avicel PH 102 0,8 % Стеарат магнію 90,0 % цитрат заліза (III) 4,0 % Крохмаль 1500 5,2 % Avicel PH 102 0,8 % Стеарат магнію 90,0 % цитрат заліза (III) 9,0 % Крохмаль 1500 1,0 % Стеарат магнію 90,0 % цитрат заліза (III) 4,0 % Крохмаль 1500 5,2 % Avicel PH 102 0,8 % Стеарат магнію 80,0 % цитрат заліза (III) 8,0 % Крохмаль 1500 11,0 % Avicel PH 200 1,0 % Стеарат магнію 90,0 % цитрат заліза (III) 9,0 % Крохмаль 1500 1,0 % Стеарат магнію 85,0 % цитрат заліза (III) 8,5 % Крохмаль 1500 5,5 % Avicel PH 200 1,0 % Стеарат магнію 84,9 % цитрат заліза (III) 5,6 % Крохмаль 1500 8,6 % Avicel PH 200 1,0 % Стеарат магнію 89,5 % цитрат заліза (III) 5,9 % Крохмаль 1500 3,6 % Avicel PH 200 1,0 % Стеарат магнію Стирання дорівнює 1,0 мас./мас. % або менше цього значення 14 Прийнятні властивості пігулки, необхідне проведення додаткової дослідницької роботи для підвищення цілісності пігулки Розпад пігулок більше 15 хвилин. Розпад пігулок більше 15 хвилин. Розпад пігулок більше 15 хвилин. Розпад пігулок більше 15 хвилин. Розпад пігулокбільше 15 хвилин. Дуже щільна грануляція Прийнятні властивості пігулки, таблетування і нанесення покриття проведені успішно UA 107803 C2 Приклад 7 У таблицях 18а і 18b представлені композиції 29 і 30 зразкових лікарських препаратів цитрату заліза (III). Таблиця 18а Композиція лікарського препарату цитрату заліза (III) Назва речовини Цитрат заліза (III) Прежелатинізований крохмаль Стеарат кальцію Очищена вода Серцевина пігулки, всього «Опадрай пурпурний» 03K100000 Очищена вода Пігулка, покрита оболонкою, всього Теоретична кількість кг/партію 14,89 1,70 0,406 15,30* 17,00 0,51 2,89* 17,5 мас./мас. % 87,6 10,0 2,4 N/A** 100,0 15,0 85,0** 100,0 *Очищену воду видаляють під час фази висушування. 5 Таблиця 18b Композиція лікарського препарату цитрату заліза (III) Назва речовини Цитрат заліза (III) Силікатована мікрокристалічна целюлоза Прежелатинізований крохмаль Стеарат кальцію Очищена вода Серцевина пігулки, всього «Опадрай пурпурний» 03K100000 Очищена вода Пігулка, покрита оболонкою, всього Теоретична кількість кг/партію 14,87 0,70 1,58 0,35 14,18 17,5 0,51* 2,89* 18,0 мас./мас. % 85,0 4,0 9,0 2,0 N/A* 100,0 15,0 85,0** 100,0 У таблиці 19 представлена запропонована композиція лікарського препарату цитрату заліза (III), яка може бути використана в описаному нижче способі виготовлення. Таблиця 19 Композиція 31 Назва речовини Цитрат заліза (III) Прежелатинізований крохмаль Стеарат кальцію Очищена вода Серцевина пігулки, всього «Опадрай пурпурний» 03K100000 Очищена вода Пігулка, покрита оболонкою, всього Теоретична кількість 100 кг/партію 80,0-90,0 8,0-15,0 2,0-3,0 N/A* 100,0 80,0-90,0 8,0-15,0 2,0-3,0 N/A* 100,0 мас./мас. % відносно пігулки, покритої оболонкою 76,2-88,2 7,6-14,7 1,9-2,9 N/A* N/A* 5,3 15,0 2,0-5,0 30,0* 85,0* N/A* 35,3 100,0 100,0 *Очищена вода видалена 15 мас./мас. % відносно серцевини пігулки UA 107803 C2 5 10 15 20 25 30 35 40 (1) або що інші пов'язують, які перераховані в патенті (2) або інші зв'язуючі речовини, які перераховані в патенті (3) або інші системи покриття, які перераховані в патенті. Приклад 8 Пігулку лікарського препарату отримували грануляцією в псевдозрідженому шарі просіяного АФІ з суспензією зв’язувальної речовини з прежелатинізованого крохмалю, з визначеним вмістом вологи після грануляції приблизно 13-20 %. Потім гранульований активний компонент змішували з просіяним стеаратом кальцію і ущільнювали для отримання серцевини пігулки. Пігулка вийшла міцною із стираністю рівною 1,0 мас./мас. % або менше цього значення, твердістю 8–20 кілопонд, часом розпаду рівним 15 хвилинам або менше, і силою пресування близько 3,5–5,0 кН, з основною силою 5–20 кН. Слід визнати, що різні втілення знаходяться в діапазонах одного або декількох приведених параметрів. Маса індивідуальних пігулок може залежати від кінцевої отримуваної дози; наприклад, 125 міліграм, 250 міліграм, 500 міліграм, 667 міліграм, 750 міліграм і 1000 міліграм цитрату заліза (III). За допомогою даного способу можливе систематичне виготовлення пігулок з відхиленням від наміченого ± 5 %. Товщина і твердість пігулки відповідають описаним критеріям прийнятності. Покриття пігулок суспензією «Опадрай» або еквівалентом в дражирувальному казані з перфорованим зовнішнім кожухом дає приріст цільової маси приблизно на 2-5 %. Результати дослідного виробництва свідчать про те, що за допомогою вибраної композиції і способу можливе виготовлення міцної пігулки, яка відповідає заданим критеріям. Спочатку пропускали цитрат заліза (III) крізь просіваючий млин. Потім додаванням в ємність змішувача з неіржавіючої сталі очищеної води і прежелатинізованого крохмалю з подальшим перемішуванням отримували суспензію зв’язувальної речовини для гранульованого препарату. Гранульовані частинки отримували просіюванням цитрату заліза (III) крізь гранулятор з псевдозрідженим шаром. Суспензію зв’язувальної речовини та прежелатинізованого крохмалю розпилювали над продуктом в псевдозрідженому шарі. Після закінчення додавання зв’язувальної речовини продукт грануляції сушили. Висушені гранули завантажували в дифузійний змішувач. До продукту грануляції в дифузійному змішувачі додавали просіяний стеарат кальцію. Змішували гранули і змащувальну речовину. Гранули, покриті змащувальною речовиною, спресовували в пігулки. Пігулки збирали в проміжних насипних контейнерах. Водну суспензію плівкового покриття готували в ємкості змішувача з неіржавіючої сталі і за допомогою міксера. Пігулки завантажували в дражирувальний казан з перфорованим зовнішнім кожухом, і розпилювали покриваючу суспензію на шар продукту, який знаходиться в каскадному русі. Після завершення стадії розпилювання пігулки сушили. Пігулки з плівковим покриттям вивантажували в проміжні насипні контейнери. Пігулки з плівковим покриттям упаковували в запечатані фольгою HPDE-флакони з осушувачем і герметичною кришкою із захистом від дітей. Приклад 9 Пігулки цитрату заліза (III) отримували, як описано вище. У таблицях 20 і 21 представлені композиції пігулок 32 і 33. 16 UA 107803 C2 Таблиця 20 Композиція 32 Назва речовини Цитрат заліза (III) Прежелатинізований крохмаль Стеарат кальцію (1) АБО - Стеарил фумарат натрію (1) Очищена вода Серцевина пігулки, всього «Опадрай пурпурний» Очищена вода пігулка, покрита оболонкою, всього Розрахункова кількість кг/партію 14,9 1,7 0,4 Теоретична кількість на 100 кг/лот 80,0-90,0 8,0-15,0 1,0-3,0 мас./мас. % мас./мас. %, відносно відносно пігулки, серцевини покритої пігулки оболонкою 80,0-90,0 76,2-88,2 8,0-15,0 7,6-14,7 1,0-3,0 0,9-2,9 0,4 2,0-3,0 2,0-3,0 1,9-2,9 15,3* 17,0 0,9 5,1* 72,0-135,0* 100,0 5,3 30,0* * 100,0 15,0 85,0* * N/A* 2,0-5,0 N/A* 17,5-17,9 35,3 100,0 100,0 (1) (1) як змащувальну речовину застосовували або стеарат кальцію, або стеарил фумарат натрію *Очищена вода видалена. Таблиця 21 Композиція 32 Назва речовини Цитрат заліза (III) Прежелатинізований крохмаль Силікатована мікрокристалічна целюлоза Стеарат кальцію (1) АБО - Стеарил фумарат натрію (1) Очищена вода Серцевина пігулки, всього «Опадрай пурпурний» 03K100000 Очищена вода Пігулка, покрита оболонкою Всього Розрахункова кількість кг/партію 14,9 1,6 Теоретична кількість на 100 кг/лот мас./мас. % пігулки без оболонки 80,0-90,0 8,0-12,0 80,0-90,0 8,0-12,0 мас./мас. %, пігулки, покритої оболонкою 76,2-88,2 7,6-11,5 0,7 3,0-5,0 3,0-5,0 2,5-4,5 0,4 1,0-3,0 1,0-3,0 0,9-2,9 0,4 2,0-3,0 2,0-3,0 1,9-2,9 15,3* 17,6-18,0 72,0-135,0* 100,0 * 100,0 * N/A* 0,9 5,3 15,0 2,0-5,0 5,1* 30,0* 85,0* N/A* 17,8-18,9 35,3 100,0 100,0 (2) як змащувальну речовину застосовували або стеарат кальцію, або натрію стеарил фумарат *Очищена вода видалена. 5 Приклад 10 Умови отримання пігулки цитрату заліза (III) включали грануляцію, яку проводили так, щоб вміст вологи, який визначався за % втрат при висушуванні, перевищував 25 %. Цитрат заліза (III) фармацевтичного ступеня чистоти додавали в гранулятор з псевдозрідженим шаром. Суспензію прежелатинізованого крохмалю, зв’язувальної речовини, 17 UA 107803 C2 5 (прежелатинізований крохмаль + вода) розпилювали над продуктом в псевдозрідженому шарі. Рівень вмісту вологи композиції, який визначався при вимірюванні втрат при висушуванні, санкціоновано перевищував 25 %. У втіленнях, в яких вміст вологи композиції, який визначався при вимірюванні втрат при висушуванні, доводилося до рівня вище 25 %, частинки в будь-якій точці мали істотно нижче відношення площі поверхні на грам. Виходячи з даних таблиці 22, можна відзначити, що вміст вологи в ході виготовлення перевищував 20 % через 120 хвилин, і підвищувався до 27,87 % через 170 хвилин. Таблиця 22 Робочі параметри грануляції Час 0 10 20 30 40 50 60 71 80 90 100 110 120 130 141 150 160 170 180 190 200 210 220 230 240 Швидкість роботи Швидкість насоса (г/хв.) (оберт за хв.) 87,7 71,2 76,2 77,7 75.9 79,6 80,0 83,4 90,5 90,4 90,5 90,5 90,4 91,1 90,2 91,8 89,6 90,7 30 30 30 30 30 30 30 33 33 33 33 33 33 33 33 33 33 33 Повітря, яке надходить (стандартні кубічні фути за хв. /scfm) 145 150 153 153 144 146 147 144 149 151 152 153 150 144 153 152 153 154 149 147 150 154 153 149 153 Повітряне Темп. Темп. Темп. на розпивихідних продукту LOD (%) вході (°C) лювання газів (°C) (пси) (°C) 42 61,6 63,5 63,1 63 63,1 63,0 62,9 63,0 63,0 63,0 63,0 63,0 63,0 63,0 63,0 62,9 63,0 63,0 63,0 63,0 63,1 63,1 63,1 63,1 35,8 30,0 28,2 27,5 27,1 27,0 26,8 26,7 26,7 26,5 26,5 26,4 26,4 26,3 26,3 26,2 26,2 26,2 26,2 26,4 26,8 27,2 27,8 29,0 30,7 65,0 65,0 65,0 64,7 65,1 65,1 65,1 65,1 65,1 65,1 65,1 65,1 65,1 65,1 65,1 65,1 65,0 65,1 65,1 Кінцеве значення LOD 11,85 12,82 13,02 13,18 15,19 15,7.0 15,74 17,31 18,49 18,64 18,99 22,89 22,47 24,25 25,41 26,03 27,89 27,47 26,76 25,00 22,37 21,32 18,68 17,55 30,6 28,4 26,6 25,8 25,4 25,3 25,2 25,1 25,1 25,0 24,9 24,8 24,8 24,8 24,7 24,7 24,7 24,7 24,7 24,7 25,0 25,1 25,2 25,7 26,5 16,69 10 Визначена площа поверхні двох зразків, приготованих з вказаної вище композиції, 2 2 відображена в таблиці 23. Площі поверхні композиції складали 0,12 м /г і 0,20 м /г. Таблиця 23 Зразок Перед грануляцією (Афі+prosolv) Після грануляції 15 Площа поверхні ВЕТ зразка 1 Площа поверхні ВЕТ зразка 2 2 2 (м /г) (м /г) 27,99 32,34 0,12 0,20 2 Відношення середньої площі поверхні на одиницю маси двох зразків склали 0,12 і 0,20 м /г, 18 UA 107803 C2 5 10 відповідно. Приклад 11 Пігулку цитрату заліза (III) отримували, підтримуючи в ході грануляції вміст вологи гранул, який визначався за % втрат при висушуванні, менше 25 %. Цитрат заліза (III) фармацевтичного ступеня чистоти додавали в гранулятор з псевдозрідженим шаром. Суспензію прежелатинізованого крохмалю, зв’язувальної речовини, (прежелатинізований крохмаль + вода) розпилювали над продуктом в псевдозрідженому шарі. Виходячи з даних таблиці 24, вміст вологи, який визначався вимірюванням втрат при висушуванні, в ході розпилювання у будь-який момент часу підтримували нижче 20. Площа поверхні отриманої композиції була більшою 10 квадратних метрів на грам. Таблиця 24 Час (хв.) 0 10 20 30 40 50 60 70 80 90 100 110 120 130 141 150 160 170 181 191 200 210 220 15 Повітря, яке Швидкість Швидкість надходить Темп. Темп.на Темп. Повітряне розпироботи (стандартні вихідних вході продукту розпилювання LOD (%) лювання насоса кубічні газів (°C) (°C) (пси) (г/хв.) (об./хв.) фути за хв. (°C) /scfm) 149 55,4 39,8 44,5 12,05 86,1 31 153 70,3 36,0 65,0 39,6 12,44 88,2 31 152 70,1 32,0 64,9 35,4 13,01 87,9 31 146 69,8 30,0 65,1 36,6 13,38 90,1 31 153 70,0 28,9 64,8 30,6 13,80 85,2 31 151 70,0 28,6 65,1 29,8 14,36 87,5 31 144 70,0 28,2 65,1 28,9 15,03 89,0 31 153 72,5 28,1 65,1 28,4 16,49 87,0 31 145 75,9 28,4 65,1 28,3 16,34 88,7 31 153 78,5 28,9 65,1 28,5 17,25 94,0 31 149 80,3 29,2 64,9 28,5 17,43 82,5 31 153 80,2 29,2 65,1 28,4 19,60 78,3 25 152 79,9 30,0 64,9 28,9 19,08 66,4 25 153 79,9 29,2 64,9 28,4 19,24 66,3 25 152 79,8 29,8 65,1 28,6 19,29 66,1 25 153 80,2 29,7 64,9 28,7 18,44 65,7 25 152 80,1 29,6 65,1 28,5 18,43 66,1 25 153 80,1 30,0 65,1 28,8 18,85 57,7 25 152 79,9 29,4 64,8 28,4 76,9 25 154 80,0 29,4 65,0 28,3 16,70 63,9 25 153 80,0 30,2 65,0 28,7 18,64 150 74,6 31,0 28,0 16,97 150 80,7 37,1 31,7 14,95 Кінцеве значення 13,30 LOD = Результати продемонстрували, що площа поверхні матеріалу після грануляції зменшилася в порівнянні з площею поверхні матеріалу перед грануляцією (див. таблицю 25). Дані результати відображені в стовпчику зразка 1. таблиці 25. У стовпчиках зразків 2 і 3 таблиці 25 також вказані 2 площі поверхні більше 10 м /г, що відповідає характеристикам композицій з негайним вивільненням, описаним в даному документі. Розмір частинок гранул відрізняється майже на два порядки від розміру гранул, отриманих з підвищеним вмістом води, який визначався за % втрат при висушуванні. 20 19 UA 107803 C2 Таблиця 25 Площа поверхні ВЕТ Площа поверхні ВЕТ Площа поверхні ВЕТ 2 2 2 зразка 1 (м /г) зразка 2 (м /г) зразка 3 (м /г) Зразок Перед (АФІ+ProSolv) Після грануляції Номер звіту PTL 5 10 грануляцією 28,87 28,87 28,87 11,85 19005 14,03 19005 10,18 19005 Значне збільшення площі поверхні частинки відповідає зменшенню розміру частинок. Пігулки з більшою площею поверхні гранул мають більшу швидкість розчинення в порівнянні з пігулками, отриманими з меншою площею поверхні на одиницю маси. Як змащувальні речовини додавали стеарат кальцію і стеарил фумарат натрію. Застосована у складі композиції їх кількість знаходиться поза рамками рекомендованими в даній галузі (наприклад, в Handbook of Pharmaceutical Excipients, fifth edition). Використовували 0,5 мас./мас. % стеарил фумарату натрію і 2,4 мас./мас. % стеарата кальцію. Приклад 12 Для клінічних випробувань пігулку цитрату заліза (III) отримували, як описано вище. Використані кількості компонентів пігулки представлені в таблиці 26. Таблиця 26 Назва речовини Цитрат заліза (III) Прежелатинізований крохмаль Стеарат кальцію (1) Очищена вода Серцевина пігулки, всього «Опадрай пурпурний» Очищена вода Пігулка, покрита оболонкою, всього 15 Розрахункова кількість кг/партію 14,89 1,70 0,406 15,30 17, 00 0,51 2,89 17,5 Мас./мас. % 87,6 10,0 2,4 N/A 100,0 15,0 85,0 100,0 Прежелатинізований крохмаль розпилювали в камері в якій підтримували температуру на вході і температуру продукту. Вміст вологи, який визначався вимірюванням втрат при висушуванні, на кожній стадії підтримували нижче 20 %. Параметри, використані під час приготування лікарського препарату, розкриті в таблиці 27. 20 UA 107803 C2 Таблиця 27 ШвидШвидкість кість Час розпироботи (хв.) лювання насоса (г/хв.) (об./хв.) 0 10 20 30 40 50 60 71 80 90 100 110 120 130 141 150 160 170 180 5 107,6 109,1 109,5 109,5 109,6 109,5 109,9 94,7 91,0 88,5 81,7 85,7 97,9 94,5 93,3 93,4 95,6 38 38 38 38 38 38 38 38 30 35 30 30 33 35 33 34 34 34 Повітря, яке надходить (стандартні кубічні фути за хв. /scfm) 150 151 151 150 151 151 152 153 153 151 152 150 153 149 152 153 152 154 151 Темп.на вході (°C) Темп. продукту (°C) Повітряне розпилювання (пси) Темп. вихідних газів (°C) LOD (%) 61,5 63,0 63,1 63,0 63,0 62,9 69,4 72,8 72,3 71,7 72,1 73,3 73,2 72,4 72,0 71,9 71,8 72,2 71,9 42,6 31,3 27,1 26,1 25,5 25,3 25,9 26,9 26,9 27 27,1 27,4 27,7 27,4 27,4 27,3 27,5 27,5 29,5 60 60 60 60 60 60 60 60 60 60 60 60 60 60 60 60 60 60 11,24 12,4 13,32 14,37 15,64 16,99 17,66 19,35 17,05 19,66 19,57 18,88 16,39 18,87 18,78 18,62 18,30 19,49 16,71 41,3 34,5 29,5 27,5 26,4 25,7 25,5 26,3 26,3 26,3 26,3 26,4 26,6 26,5 26,3 26,3 26,3 26,4 26,8 Розрахунковий (найвищий) вміст вологи складав 19-20 % (LOD, визначений вимірюванням втрат при висушуванні), отриманий вміст вологи становив 19,66 % (LOD, визначених вимірюванням втрат при висушуванні). У таблицях 28 і 29 підсумовані фізичні властивості після стадій грануляції, таблетування і висушування. Таблиця 28 Характеристики після грануляції Розмір вічка сита 35(500 мкм) 45(355 мкм) 60(250 мкм) 80(180 мкм) 120(125 мкм) 170(90 мкм) 230(63 мкм) Підситовий залишок % утримання 0,0 1,3 11,1 16,2 19,4 16,0 16,3 18,8 Таблиця 29 Характеристики кінцевої суміші (після таблетування і висушування) Насипна щільність (г/мл) Насипна щільність після ущільнення (г/мл) Відношення Хауснера Коефіцієнт Карра 10 0,460 0,566 1,23 19 У таблицях 30 і 31 підсумовані характеристики кінцевих сумішей композицій. 21 UA 107803 C2 Таблиця 30 Характеристики кінцевої суміші Розмір вічок сита 35(500 мкм) 45(355 мкм) 60(250 мкм) 80(180 мкм) 120(125 мкм) 170(90 мкм) 230(63 мкм) Підситовий залишок % утримання 0,0 0,8 10,8 16,6 20,3 17,2 15,6 17,0 Таблиця 31 Тестові результати Насипна щільність(г/мл) Насипна щільність після ущільнення(г/мл) Співвідношення Хауснера Коефіцієнт Карра 0,436 0,573 1,31 24 Таблиця 32 Ознака або параметр Основна сила пресування (кН) Попередня сила пресування (кН) Швидкість роботи преса (обертів на хвилину) Стирання (%) Розпад (секунди) Початок 9,9 3,5 Середина 9,9 4,0 Кінець 28,69 28,69 0,2 88 95 105 Taблиця 33 Параметр Середнє Стандартне відхилення Мін. індивідуальне значення Макс. індивідуальне значення RSD/відносне стандартне відхилення Індекс Cpk 5 10 15 Маса 1161 9,39 1150 1186 0,81 1,88 Товщина 7,709 0,029 7,680 7,800 0,38 2,21 Твердість 15,7 1,13 13,8 18,0 7,20 1,26 Дані пресування свідчать про те, що за допомогою даної композиції і способу можливе отримання міцної пігулки з швидким розпадом. Індекс Срk маси індивідуальної пігулки свідчить про те, що за допомогою даного способу можливе систематичне виготовлення пігулок з відхиленням від наміченого значення ± 5 %. Товщина і твердість пігулки відповідають описаним критеріям прийнятності. Робочі параметри нанесення покриття і висушування Готували покриваючу суспензію «Опадрай» з концентрацією сухих речовин 15 мас. %. Теоретичне збільшення маси для даної партії складало 3 %. Плівкове покриття не було функціональним компонентом і застосовувалося тільки для естетичних цілей, і, відповідно, даний приріст маси не був критичним для функціонування лікарського препарату. Спосіб розповсюджується на теоретичну кількість суспензії, а не на конкретний приріст маси (коефіцієнт ефективності не був використаний). Середня маса пігулки з покриттям після висушування склала 1110 мг. Під час процесу нанесення покриття були використані робочі параметри таблиці 34: 22 UA 107803 C2 Таблиця 34 Час (хв.) 0 15 30 45 60 75 Потік повітря Темп. на Темп. газів, Точка роси (кубічні вході що відходять (°C) фути за (°C) (°C) хв./cfm) 308 55,0 4,9 33,2 317 46,0 5,6 36,4 307 45,1 6,3 37,3 309 50,4 7,6 34,6 307 44,4 7,6 36,7 310 52,9 7,5 37,3 Швидкість розпилювання (г/хв.) Повітряне розпилювання (пси) Швидкість обертання барабану (об./хв.) 45 48 44 40 51 53 37 37 37 37 37 37 10 10 10 10 10 10 В ході остаточного висушування пігулки використовували робочі параметри таблиці 35: Таблиця 35 Час (хв.) 0 15 30 45 60 75 90 105 120 135 150 Потік повітря Темп. газів, що (кубічні фути на Темп. на вході (°C) Точка роси (°C) відходять (°C) хвилину/cfm) 503 70,2 7,3 50,6 504 69,7 7,2 63,3 494 69,6 7,2 65,4 502 69,6 7,0 66,3 500 70,4 6,8 67,0 502 80,1 7,0 73,0 501 80,2 7,0 74,5 505 79,7 6,8 75,4 509 81,1 6,8 75,7 510 81,2 6,6 76,2 505 81,1 6,7 76,5 % Води (LOD) 13,19 11,93 11,33 11,14 10,14 9,73 9,59 8,96 8,78 8,21 7,88 5 10 15 20 25 30 Профілі розчинення демонструють, що внаслідок високих рівнів вмісту вологи в пігулці може знизитися динаміка у часі швидкості розчинення. Пігулки з високим вмістом вологи, які зазнали впливу високої температури, продемонстрували сильне зниження швидкості розчинення. Пігулка після висушування з вмістом вологим 8,84 % (LOD), не продемонструвала такого ж зниження швидкості розчинення. Пігулки, які містять високий рівень вологи і стеарат кальцію, продемонстрували найсильніше зниження швидкості розчинення. Вміст вологи в серцевинах і покритих пігулках, які містили стеарат кальцію, був незначно вищим (~ 15 % LOD), ніж у серцевинах пігулок, які містять стеарил фумарат натрію (~ 14 % LOD). Не бажаючи дотримуватися конкретної теорії або механізму дії, автори вважають, що це може призводити до відмінностей в спостережуваних швидкостях розчинення. Кінцевий вміст вологи в пігулці та вміст вологи в пігулці в ході її виготовлення, видно, впливають на характеристики негайного вивільнення і довгострокової стабільності пігулки. Вимірювали протягом одного місяця профіль стабільності пігулок до висушування і після висушування. Стабільність вивчали при 25 °C/60 % ВВ (відносній вологості), і 40 °C/60 % ВВ. Всі зразки поміщали в запечатані фольгою HPDE-флакони (з товщиною стінки 0,025 дюйма ~0,6 мм) з герметичною кришкою, а в невеликій частині дослідження флакони містили осушувач. У представлених нижче графіках підсумовані довільні дані стабільності. Виходячи з даних Фігури 9, можна відзначити, що пігулки, які піддавались висушуванню, зберегли швидкість негайного розчинення (більше ніж 80 % за 60 хвилин після введення). Без висушування швидкість розчинення через один тиждень сильно знизилася. Приклад 13. Клінічні випробування лікарських форм цитрату заліза (III) Нижче представлений протокол проведення клінічних випробувань описаної вище лікарської композиції цитрату заліза (III). Протокол включає 6-тижневе дослідження можливості застосування нової композиції KRX0502 (цитрату заліза (III)) пацієнтами з термінальною стадією ниркової недостатності (англ. End 23 UA 107803 C2 5 10 15 20 25 30 35 40 45 50 55 60 Stage Renal Disease, ESRD). Мета дослідження полягає у визначенні потенційної ефективності KRX-0502 (цитрату заліза (III) як дієтичної фосфат - зв′язуючої речовини та її переносимості з контролем і управлінням рівнями фосфору в сироватці пацієнтів з термінальною стадією ниркової недостатності, і при моніторингу змін фосфору в сироватці від початкового рівня до рівня в кінці чотиритижневого періоду лікування. Проект дослідження включає проведення дослідження лікарського препарату у пацієнтів з ESRD тричі на тиждень при гемодіалізі. У період від двох до трьох тижнів в дослідження лікарського препарату були включені приблизно 24 пацієнти (дванадцять пацієнтів-діабетиків і дванадцять пацієнтів-недіабетиків). Дослідження складалося з п'яти періодів: Відбір, Відмивочний період, Ініціація дослідження лікарського препарату, Обробка і Завершальний візит. Відразу після двотижневого відмивочного періоду слідує період шеститижневої обробки. Тривалість клінічного дослідження складає приблизно від трьох до чотирьох місяців, при цьому приблизно від двох до трьох тижнів було витрачено на відбір пацієнтів, відмивочний період та ініціацію дослідження лікарського препарату. У список для реєстрації можуть бути внесені всі пацієнти з ESRD з популяції, яка увійшла до дослідження, які проводили гемодіаліз тричі на тиждень протягом, щонайменше, трьох місяців до візиту перед початком дослідження (візит 3), і які в той момент приймали на день, щонайменше, три пігулки/капсули ацетату кальцію, карбонату кальцію, карбонату лантану або севеламеру (гідрохлориду або карбонату) або будь-яку комбінацію вказаних агентів. Приблизно дванадцять пацієнтів повинні бути діабетиками і дванадцять пацієнтів повинні бути недіабетиками. При виявленні приблизно 24 пацієнтів для дослідження лікарського препарату, необхідно обстежувати приблизно від 24 до 48 пацієнтів. Всі пацієнти вибираються з 2-4 місць мешкання. Дослідження введення лікарського препарату включає ініціацію приблизно 24 пацієнтів для дослідження KRX-0502 (цитрату заліза (III)), подальший двотижневий період відмивання від поточних фосфат-зв′язувальних речовин і моніторинг протягом дослідження рівня фосфору в сироватці. Шуканий рівень фосфору в сироватці складає приблизно 3,5 до 5,5 мг/дл. Рівні фосфору в сироватці необхідно перевіряти щонеділі протягом відмивочного періоду і протягом періоду обробки, починаючи з візитів 4, 5, 6 і закінчуючи завершальним візитом (візит 7). Дозу KRX-0502 визначають шляхом ініціації всіх пацієнтів фіксованою дозою досліджуваного препарату, 6 пігулок на день, де кожна пігулка цитрату заліза (III) містить 210 міліграм заліза (III) у вигляді цитрату заліза (III) (приблизно 720 міліграм заліза (III) у вигляді цитрату заліза (III)) і шляхом титрування зразків крові пацієнтів при візитах 4, 5 і 6, як вказано далі: При рівні фосфору в сироватці від 3,5-5,5 мг/дл крові, ніякі дії не потрібні, при збільшенні до > 5,6-6,9 мг/дл, необхідно збільшити дозування препарату на одну пігулку на день, і при збільшенні до 6,9 мг/дл, необхідно збільшити дозування від 3 пігулок на день до максимум 12 пігулок на день. Пацієнти приймають досліджуваний препарат перорально разом з основним прийомом їжі або за їжею в проміжках між основними, або протягом однієї години після основного прийому їжі або в проміжках після основних прийомів їжі. Пацієнтів інструктують не приймати досліджуваний препарат, якщо після основного прийому їжі або їжею в проміжках між основними прийомами пройшло більше однієї години. Деяким пацієнтам може знадобитися різний розподіл пігулок протягом конкретного дня через їжу в проміжках між основними прийомами їжі або із-за пропуску основної їжі. Наприклад, якщо пацієнт приймає початкову дозу 6 г/день, то пацієнт може бути прийняти 2 пігулки за сніданком, 2 за обідом і 2 за вечерею, і може перейти до прийому 1 за сніданком, 1 разом з ранковою проміжною їжею, 1 за обідом, 1 разом з післяобідньою проміжною їжею і 2 за вечерею, якщо того вимагає дієта. У другій, статистичній фазі, при дослідженні ефективності лікарського препарату, оцінювали перенесення і безпеку досліджуваного препарату. Безпеку лікарського препарату оцінювали за допомогою реєстрації і моніторингу побічних ефектів, які спостерігались за ефектами, які супроводжували застосування препарату, проведення загального фізичного огляду (маса, кров'яний тиск і частота серцевих скорочень), проведення серійного біохімічного аналізу крові (фосфору в сироватці, кальцію в сироватці і деяких параметрів заліза, що включає визначення) і визначення швидкостей побічних ефектів і змін лабораторних параметрів. Хоча в даному розкритті проілюстровані і описані лише деякі конкретні форми, очевидно, що на підставі докладного опису в тексті і кресленнях можливе здійснення різних модифікацій і комбінацій без виходу за межі суті і обсягу претензій даного винаходу. Наприклад, посилання на матеріали композицій, способи отримання композицій, конкретні величини, форми, корисність або застосування не призначені для обмеження яким-небудь чином, при цьому інші матеріали і 24 UA 107803 C2 величини можуть бути змінені при збереженні суті і обсягу претензій даного винаходу. ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 35 40 45 50 55 1. Залізо(ІІІ)цитратна пігулка, яка містить: (a) ядро (серцевину), яке містить 65-92 мас. % цитрату заліза(III) і 4,5-30 мас. % зв'язувальної речовини; і (b) покриття, при цьому зазначена пігулка має стиранність, рівну 1 мас./мас. % або менше, і в ній принаймні 80 % цитрату заліза(III) розчиняється протягом періоду часу, меншого або рівного 60 хвилинам. 2. Пігулка за п. 1, яка відрізняється тим, що розчинність визначають методом USP . 3. Пігулка за п. 1 або 2, яка відрізняється тим, що вміст вологи визначено методом LОD втрати вологи при висушуванні і становить менше ніж 15 % LOD. 4. Пігулка за кожним з пп. 1-3, яка відрізняється тим, що вміст вологи становить менше ніж 10 % LОD. 5. Пігулка за п. 1, яка відрізняється тим, що зв'язувальна речовина складається з однієї або декількох з-поміж гідроксипропілцелюлози (НРС), гідроксипропілметилцелюлози (НРМС), альгінату натрію, альгінової кислоти, гуарової камеді, аравійської камеді, ксантанової камеді, карбополу, гуміцелюлози (карбоксиметилцелюлози), етилцелюлози, мальтодекстрину, ПВП/ВА, повідону, мікрокристалічної целюлози, крохмалю (частково або повністю прежелатинізованого крохмалю) і метилцелюлози. 6. Пігулка за будь-яким з пп. 1-5, яка відрізняється тим, що зв'язувальна речовина являє собою прежелатинізований крохмаль. 7. Пігулка за будь-яким з пп. 1-6, яка відрізняється тим, що ядро містить лубрикант (змащувальну речовину). 8. Пігулка за п. 7, яка відрізняється тим, що ядро містить 0,5-3 мас. % змащувальної речовини. 9. Пігулка за п. 7 або 8, яка відрізняється тим, що лубрикант вибрано з однієї або декількох зпоміж стеарату магнію, стеарату кальцію і стерилфумарату натрію або їх комбінацію. 10. Пігулка за п. 9, яка відрізняється тим, що лубрикант являє собою стеарат кальцію. 11. Пігулка за будь-яким з пп. 1-10, яка відрізняється тим, що ядро додатково містить розпушувач. 12. Пігулка за п. 11, яка відрізняється тим, що ядро містить 1,5-15 мас. % розпушувача. 13. Пігулка за п. 11 або п. 12, яка відрізняється тим, що розпушувач вибраний з одного або декількох з-поміж натрійкроскармелози, кросповідону, натрієвої солі гліколяту крохмалю і крохмалю. 14. Пігулка за будь-яким з пп. 1-13, яка відрізняється тим, що містить принаймні 70 мас. % цитрату заліза(III). 15. Пігулка за будь-яким з пп. 1-14, яка відрізняється тим, що містить принаймні 80 мас. % цитрату заліза(III). 16. Пігулка за будь-яким з пп. 1-15, яка відрізняється тим, що містить принаймні 90 мас. % цитрату заліза(III). 17. Пігулка за будь-яким з пп. 1-16, яка відрізняється тим, що містить 1000 мг цитрату заліза(ІІІ). 18. Пігулка за будь-яким з пп. 1-17, яка відрізняється тим, що має час дезінтеграції менший або рівний 15 хвилинам. 19. Залізоцитратна пігулка, яка містить 210 мг заліза(III), що містить: a) ядро, яке містить 87,6 мас. % цитрату заліза(III), 10 мас. % прежелатинізованого крохмалю і 2,4 мас. % стеарату кальцію; і b) покриття, в якій стиранність менше або дорівнює 1 мас./мас. %, час дезінтеграції менше ніж 15 хвилин, і в якій принаймні 80 % цитрату заліза(III) розчиняється протягом періоду часу, меншого або рівного 60 хвилинам, як виміряно в тесті USP , а вміст вологи становить 8,84 % LOD. 20. Спосіб профілактики або лікування гіперфосфатемії, що включає введення залізоцитратої пігулки за будь-яким з пп. 1-18 в терапевтично ефективній кількості. 21. Застосування пігулки за будь-яким з пп. 1-18 для виробництва медикаменту профілактики або лікування гіперфосфатемії. 22. Застосування залізоцитратної пігулки за будь-яким з пп. 1-18 як засобу для профілактики або лікування гіперфосфатемії. 23. Спосіб отримання залізо(ІІІ)цитратної пігулки, що містить (і) ядро, яке містить 65-92 мас. % цитрату заліза(III) і 4,5-30 мас. % зв'язувальної речовини і 0,5-3 мас. % змащувальної речовини; і (іі) покриття, і в якій принаймні 80 % цитрату заліза(III) розчиняється протягом періоду часу меншого або рівного 60 хвилинам, причому вказаний спосіб включає: 25 UA 107803 C2 5 10 15 20 25 30 35 40 45 50 55 60 (a) додавання подрібненого цитрату заліза в попередньо нагрітий резервуар гранулятора з псевдозрідженим шаром і розпилення зв'язувальної речовини для отримання гранул, в яких вміст вологи при вимірюванні % втрат при сушінні (LOD) у процесі грануляції становить менше ніж 25 %; (b) висушування гранул до величини LOD 15-17 %; (c) перемішування висушених гранул з лубрикантом; (d) таблетування отриманої суміші тиском; (е) нанесення на пігулку покриття. 24. Спосіб отримання залізо(ІІІ) цитратної пігулки, що містить (і) ядро, яке містить 65-92 мас. % цитрату заліза(III) і 4,5-30 мас. % зв'язувальної речовини і 0,5-3 мас. % змащувальної речовини; і (іі) покриття, і в якій принаймні 80 % цитрату заліза(III) розчиняється протягом періоду часу, меншого або рівного 60 хвилинам, причому вказаний спосіб включає: (a) перемішування висушених гранул з лубрикантом, причому ці висушені гранули містять цитрат заліза(ІІІ) та зв'язувальну речовину і мають величину LOD 15-17 %; (b) таблетування отриманої суміші тиском; (c) нанесення на пігулку покриття. 25. Спосіб за п. 23, який відрізняється тим, що швидкість розчинення таблетки вимірюють методом USP . 26. Спосіб за п. 24, який відрізняється тим, що швидкість розчинення таблетки вимірюють методом USP . 27. Спосіб за п. 23, який відрізняється тим, що гранули мають відношення середньої площі 2 поверхні до маси 5 м на грам або більше. 28. Спосіб за п. 23, який відрізняється тим, що гранули мають відношення середньої площі 2 поверхні до їх маси 10 м на грам або більше. 29. Спосіб за п. 24, який відрізняється тим, що гранули мають відношення середньої площі 2 поверхні до маси 5 м на грам або більше. 30. Спосіб за п. 24, який відрізняється тим, що гранули мають відношення середньої площі 2 поверхні до їх маси 10 м на грам або більше. 31. Спосіб за п. 23, який відрізняється тим, що додатково включає стадію (f), на якій проводять висушування таблеток з покриттям до LOD менше ніж 14 %. 32. Спосіб за п. 23, який відрізняється тим, що додатково включає стадію (f), на якій проводять висушування таблеток з покриттям до LOD 5-14 %. 33. Спосіб за будь-яким з пп. 23, 25, 27, 28, 31 або 32, який відрізняється тим, що ядро пігулки містить 80-92 мас. % цитрату заліза(III). 34. Спосіб за будь-яким з пп. 23, 25, 27, 28, 31 або 32, який відрізняється тим, що зв'язувальною речовиною є прежелатинізований крохмаль. 35. Спосіб за будь-яким з пп. 23, 25, 27, 28, 31 або 32, який відрізняється тим, що лубрикантом є стеарат кальцію. 36. Спосіб за будь-яким з п. 34, який відрізняється тим, що лубрикантом є стеарат кальцію. 37. Спосіб за п. 33, який відрізняється тим, що зв'язувальною речовиною є прежелатинізований крохмаль, а лубрикантом є стеарат магнію. 38. Спосіб за п. 36, який відрізняється тим, що ядро пігулки містить 80-90 мас. % цитрату заліза(III), 8-15 мас. % прежелатинізованого крохмалю і 1-3 мас. % стеарату кальцію. 39. Спосіб за п. 24, який відрізняється тим, що додатково включає стадію (d) висушування пігулки з покриттям до значення LOD менше 10 %. 40. Спосіб за п. 24, який відрізняється тим, що додатково включає стадію (d) висушування пігулки з покриттям до значення LOD менше 5-14 %. 41. Спосіб за будь-яким з пп. 24, 26, 29, 30, 39 або 40, який відрізняється тим, що ядро пігулки містить 80-92 % мас. цитрату заліза(III). 42. Спосіб за будь-яким з пп. 24, 26, 29, 30, 39 або 40, який відрізняється тим, що зв'язувальною речовиною є прежелатинізований крохмаль. 43. Спосіб за будь-яким з пп. 24, 26, 29, 30, 39 або 40, який відрізняється тим, що лубрикантом є стеарат кальцію. 44. Спосіб за п. 42, який відрізняється тим, що лубрикантом є стеарат кальцію. 45. Спосіб за п. 43, який відрізняється тим, що зв'язувальною речовиною є прежелатинізований крохмаль, а лубрикантом є стеарат кальцію. 46. Спосіб за п. 44, який відрізняється тим, що ядро пігулки містить 80-90 % мас. цитрату заліза(III), 8-15 % мас. прежелатинізованого крохмалю та 1-3 % мас. стеарату кальцію. 47. Спосіб за будь-яким з пп. 23, 25, 27, 28, 31 або 32, який відрізняється тим, що пігулка містить 1000 мг цитрату заліза(III). 26 UA 107803 C2 5 10 15 20 25 30 35 48. Спосіб за будь-яким з пп. 24, 26, 29, 30, 39 або 40, який відрізняється тим, що пігулка містить 1000 мг цитрату заліза (III). 49. Спосіб отримання залізо(ІІІ)цитратної пігулки, що містить (і) ядро, яке містить 65-92 мас. % цитрату заліза(III) і 4,5-30 мас. % зв'язувальної речовини, і (іі) покриття, і в якій принаймні 80 % цитрату заліза(III) розчиняється протягом періоду часу, меншого або рівного 60 хвилинам, причому вказаний спосіб передбачає: (a) розпилення зв'язувальної речовини на цитрат заліза в резервуарі гранулятора з псевдозрідженим шаром в умовах, при яких пік вмісту вологи в гранульованих частинках підтримується нижче ніж 25 % LOD в процесі грануляції; (b) таблетування гранул тиском; (c) нанесення на пігулку покриття; (d) висушування таблеток з покриттям до LOD менше ніж 10 %. 50. Спосіб за п. 49, який відрізняється тим, що швидкість розчинення таблетки вимірюють методом USP . 51. Спосіб за п. 49, який відрізняється тим, що гранули мають відношення середньої площі 2 поверхні до маси 1 м на грам або більше. 52. Спосіб за п. 49, який відрізняється тим, що гранули мають відношення середньої площі 2 поверхні до маси 5 м на грам або більше. 53. Спосіб за п. 49, який відрізняється тим, що гранули мають відношення середньої площі 2 поверхні до маси 10 м на грам або більше. 54. Спосіб за п. 49, який відрізняється тим, що ядро пігулки містить 80-92 мас. % цитрату заліза(III). 55. Спосіб за будь-яким з пп. 49-54, який відрізняється тим, що зв'язувальна речовина складається з однієї або декількох речовин з-поміж гідроксипропілцелюлози (НРС), гідроксипропілметилцелюлози (НРМС), альгінату натрію, альгінової кислоти, гуарової камеді, аравійської камеді, ксантанової камеді, карбополу, гуміцелюлози (карбоксиметилцелюлози), етилцелюлози, мальтодекстрину, ПВП/ВА, повідону, мікрокристалічної целюлози, крохмалю (частково або повністю прежелатинізованого крохмалю) і метилцелюлози. 56. Спосіб за будь-яким з пп. 49-54, який відрізняється тим, що зв'язувальна речовина являє собою прежелатинізований крохмаль. 57. Спосіб за будь-яким з пп. 49-54, який відрізняється тим, що пігулка містить 1000 мг цитрату заліза(ІІІ). 58. Спосіб профілактики або лікування гіперфосфатемії, що включає введення залізо(ІІІ)цитратної пігулки за п. 19 в терапевтично ефективній кількості. 59. Застосування залізо(ІІІ)цитратної пігулки за п. 19 для виробництва медикаменту для профілактики або лікування гіперфосфатемії. 60. Застосування залізо(ІІІ)цитратної пігулки за п. 19 як засобу профілактики або лікування гіперфосфатемії. 27 UA 107803 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюFerric citrate dosage forms
Автори англійськоюLe, Henry Trong
Автори російськоюЛи Генри Тронг
МПК / Мітки
МПК: A61P 3/00, A61K 9/20, A61K 31/295
Мітки: форма, заліза(ііі, лікарська, цитрату
Код посилання
<a href="https://ua.patents.su/38-107803-likarska-forma-citratu-zalizaiii.html" target="_blank" rel="follow" title="База патентів України">Лікарська форма цитрату заліза(ііі)</a>
Попередній патент: Гербіцидно активні гетероарилзаміщені циклічні діони або їх похідні
Наступний патент: Суміші мезоіонних пестицидів
Випадковий патент: Спосіб ампутації стопи при діабетичній гангрені