Застосування toll-подібного рецептора і агоніста toll-подібного рецептора для лікування раку
Формула / Реферат
1. Вектор, що містить першу і другу нуклеїнові кислоти, де перша нуклеїнова кислота кодує toll-подібний рецептор, і друга нуклеїнова кислота кодує агоніст toll-подібного рецептора, причому вектор є експресійним вектором, toll-подібний рецептор є TLR-5, агоніст toll-подібного рецептора є флагеліном.
2. Вектор за п. 1, який відрізняється тим, що вектор є експресійним вектором ссавців.
3. Вектор за п. 1, який відрізняється тим, що вектор експресується з аденовірусу, лентивірусу або ліпосоми.
4. Вектор за п. 1, який відрізняється тим, що перша нуклеїнова кислота є формою toll-подібного рецептора, що секретується.
5. Вектор за п. 1, який відрізняється тим, що флагелін є формою флагеліну, що секретується.
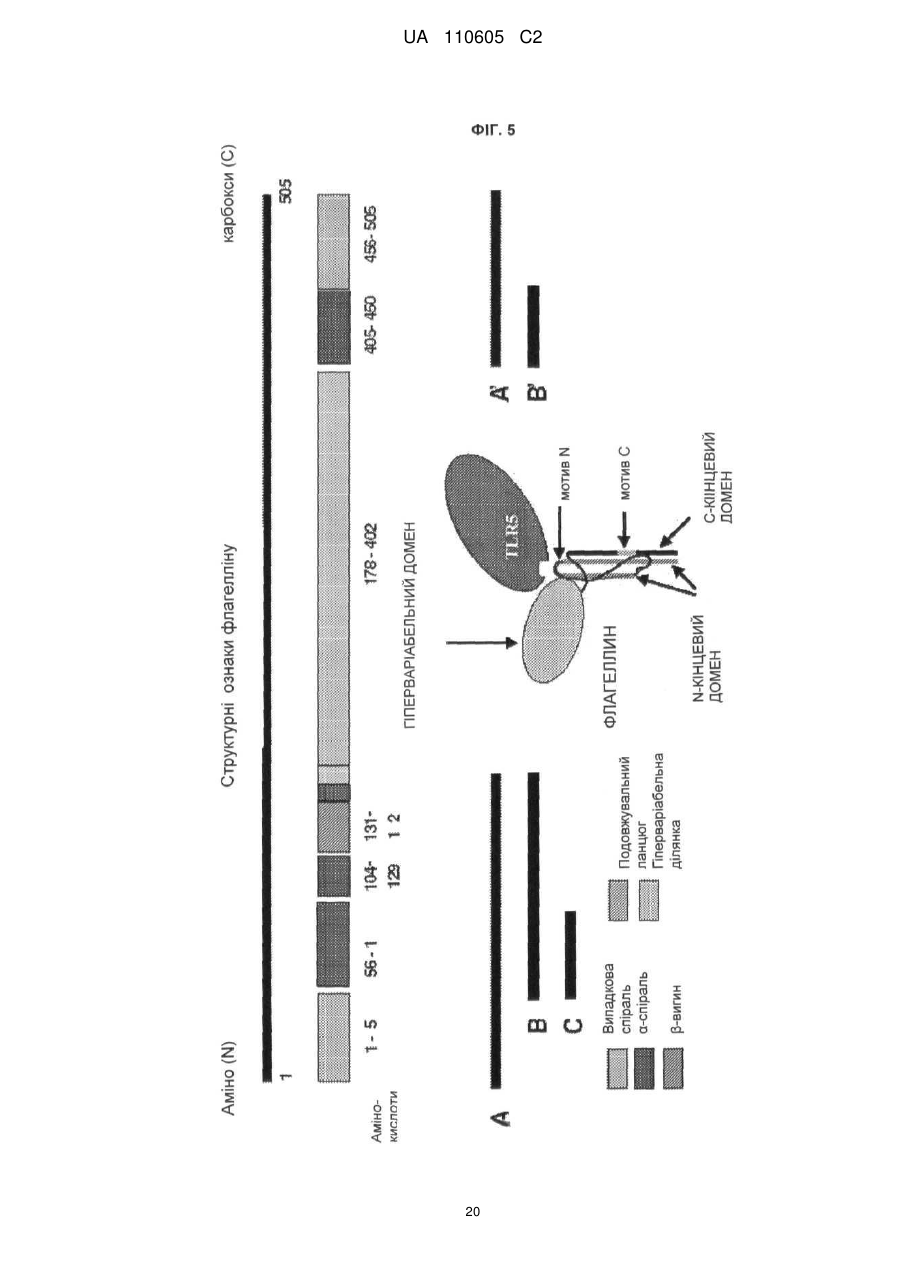
6. Вектор за п. 5, який відрізняється тим, що форма флагеліну, що секретується, містить тринадцять консервативних амінокислот флагеліну, показаних на фіг. 5, які можуть бути важливі для активності TLR5.
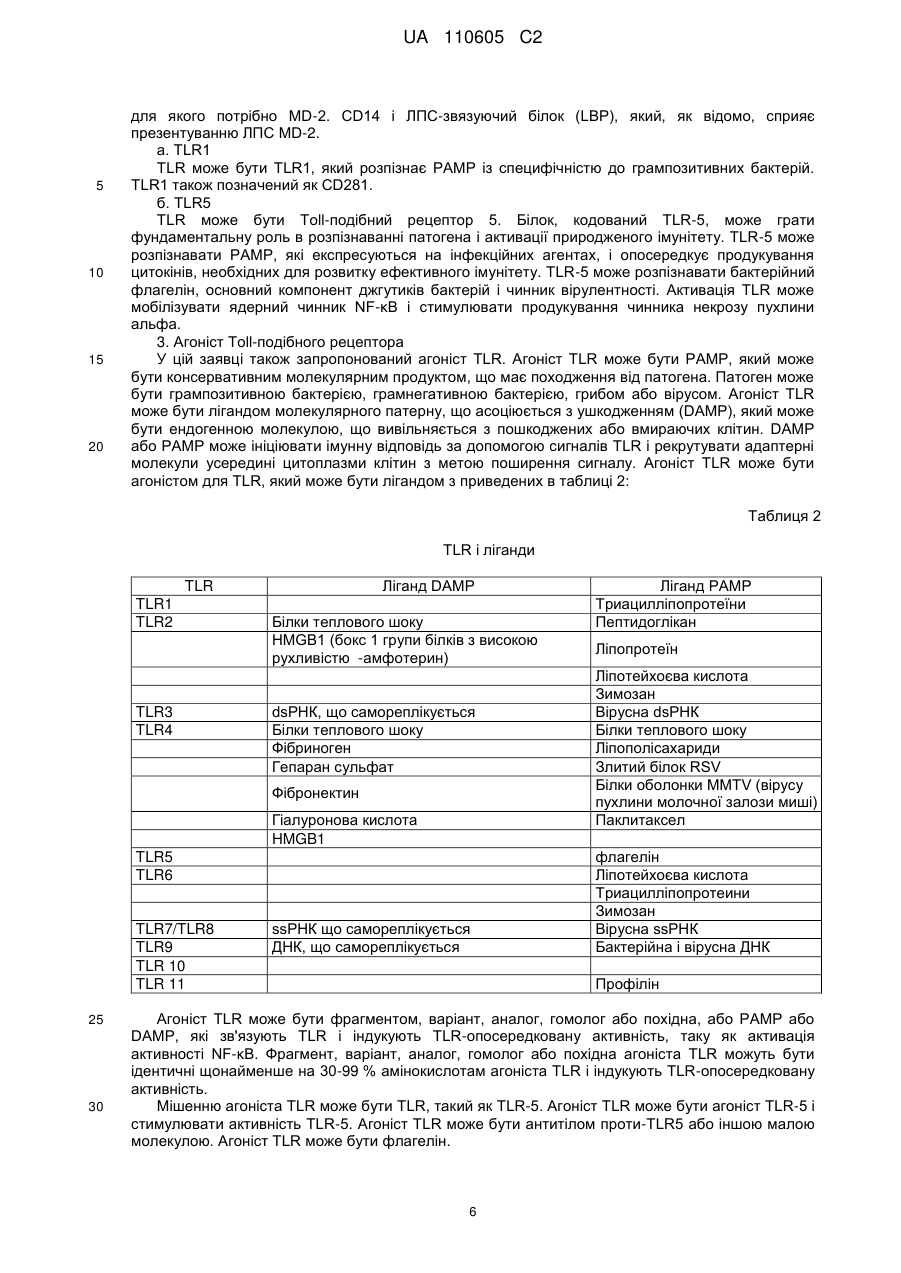
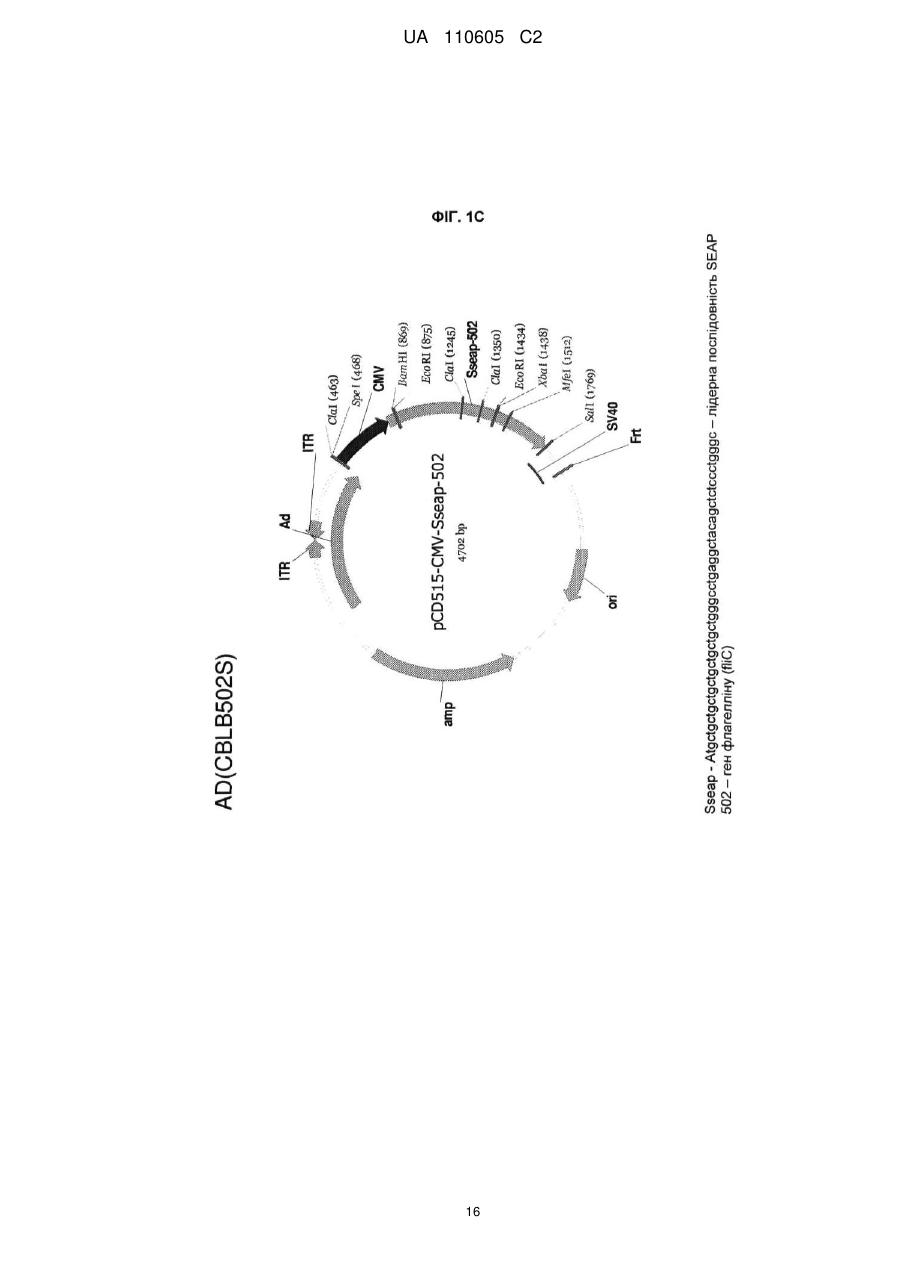
7. Вектор за п. 1, який відрізняється тим, що перша нуклеїнова кислота містить послідовність, як показано на фіг. 7, і друга нуклеїнова кислота містить послідовність, як показано на фіг. 9.
8. Спосіб лікування раку у ссавця, що включає введення ссавцеві, що потребує цього, агента, що містить вектор за п. 1.
9. Спосіб за п, 8, який відрізняється тим, що рак є пухлиною.
10. Спосіб за п. 9, який відрізняється тим, що пухлина має походження з групи, що складається з раку простати, молочної залози, ободової кишки, стравоходу, шлунку, легені, підшлункової залози, нирки, щитовидної залози, яєчників, гортані або шийки матки.
11. Спосіб за п. 9, який відрізняється тим, що пухлина має походження з групи, що складається з сарком, меланом, лейкозу і лімфом.
12. Спосіб за п. 9, який відрізняється тим, що агент вводять in trans відносно пухлини ссавця.
13. Спосіб за п. 9, який відрізняється тим, що агент вводять безпосередньо в пухлину ссавця.
14. Спосіб за п. 8, який відрізняється тим, що агент вводять в комбінації з імуностимулятором.
15. Спосіб за п. 8, який відрізняється тим, що імуностимулятор вибраний з групи, що складається з гормону росту, пролактину і вітаміну D.
16. Спосіб за п. 15, який відрізняється тим, що гормон росту є соматотропіном.
17. Спосіб за п. 8, який відрізняється тим, що агент вводять в комбінації з цитокіном.
18. Спосіб за п. 17, який відрізняється тим, що цитокін є фактором стовбурових клітин.
19. Спосіб лікування інфекції у ссавця, що включає введення ссавцеві, що потребує цього, агента, що містить вектор за п. 1.
20. Спосіб за п, 19, де інфекція є інфекцією, викликаною організмом, вибраним з групи, що складається з вірусу, бактерії, простих паразитів і гриба.
Текст
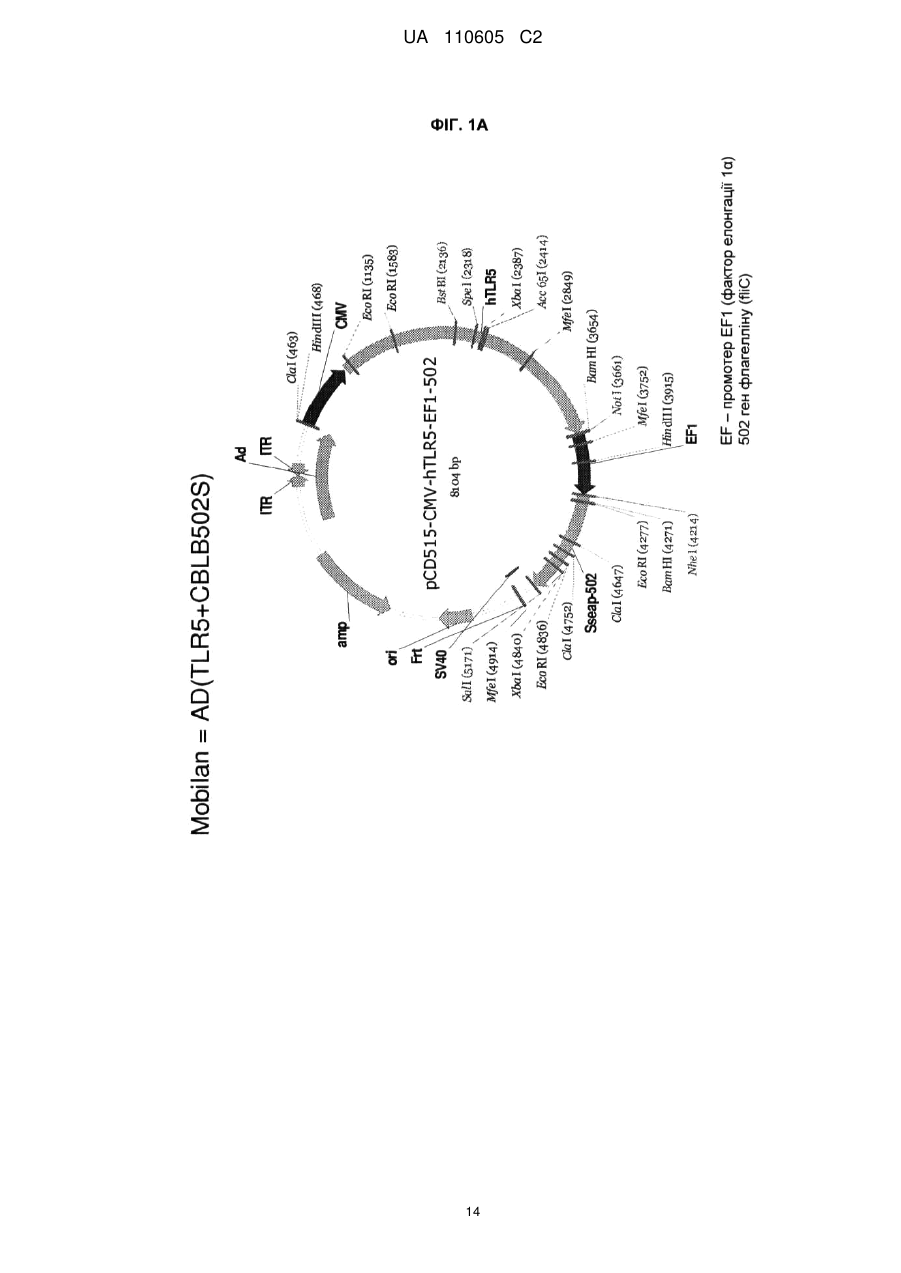
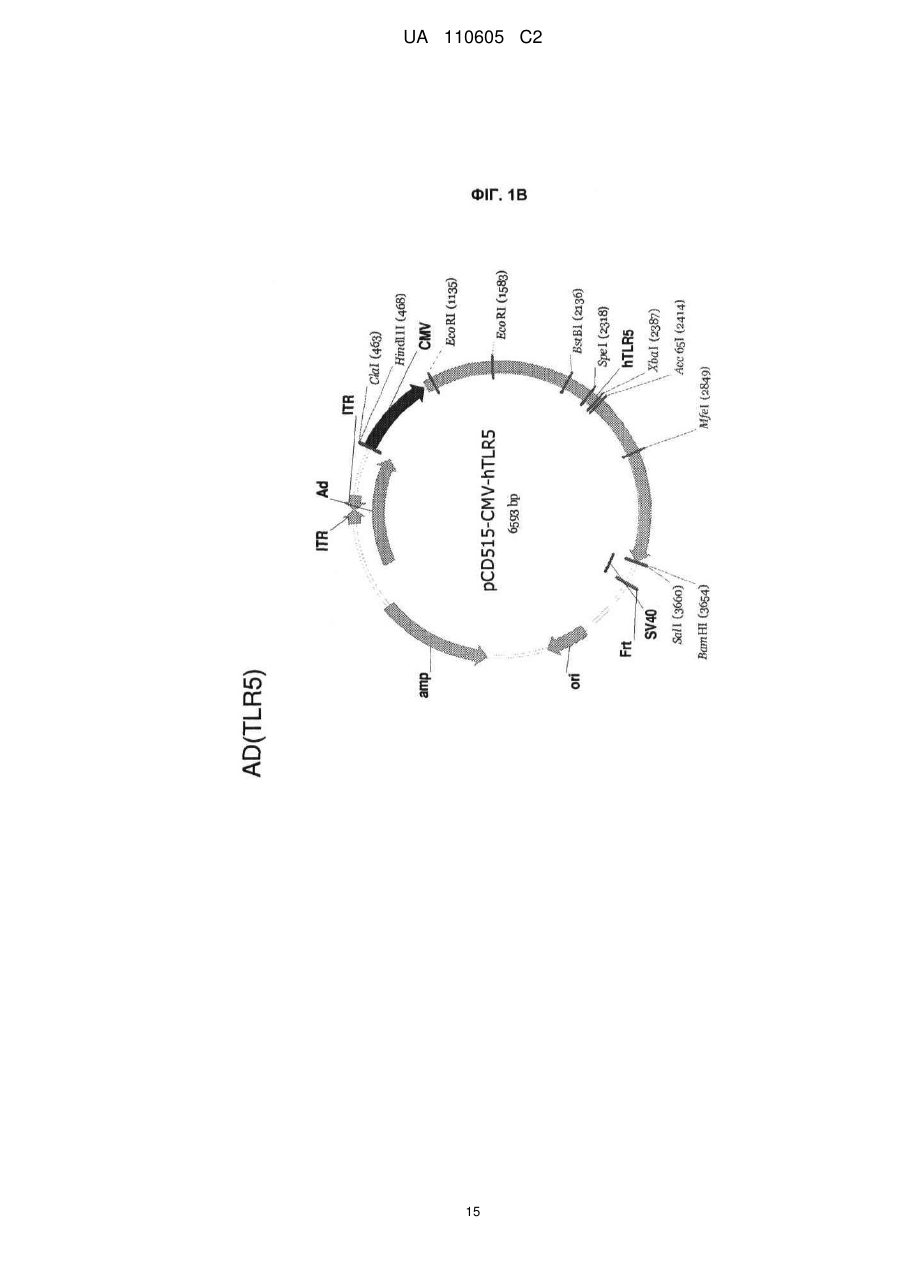
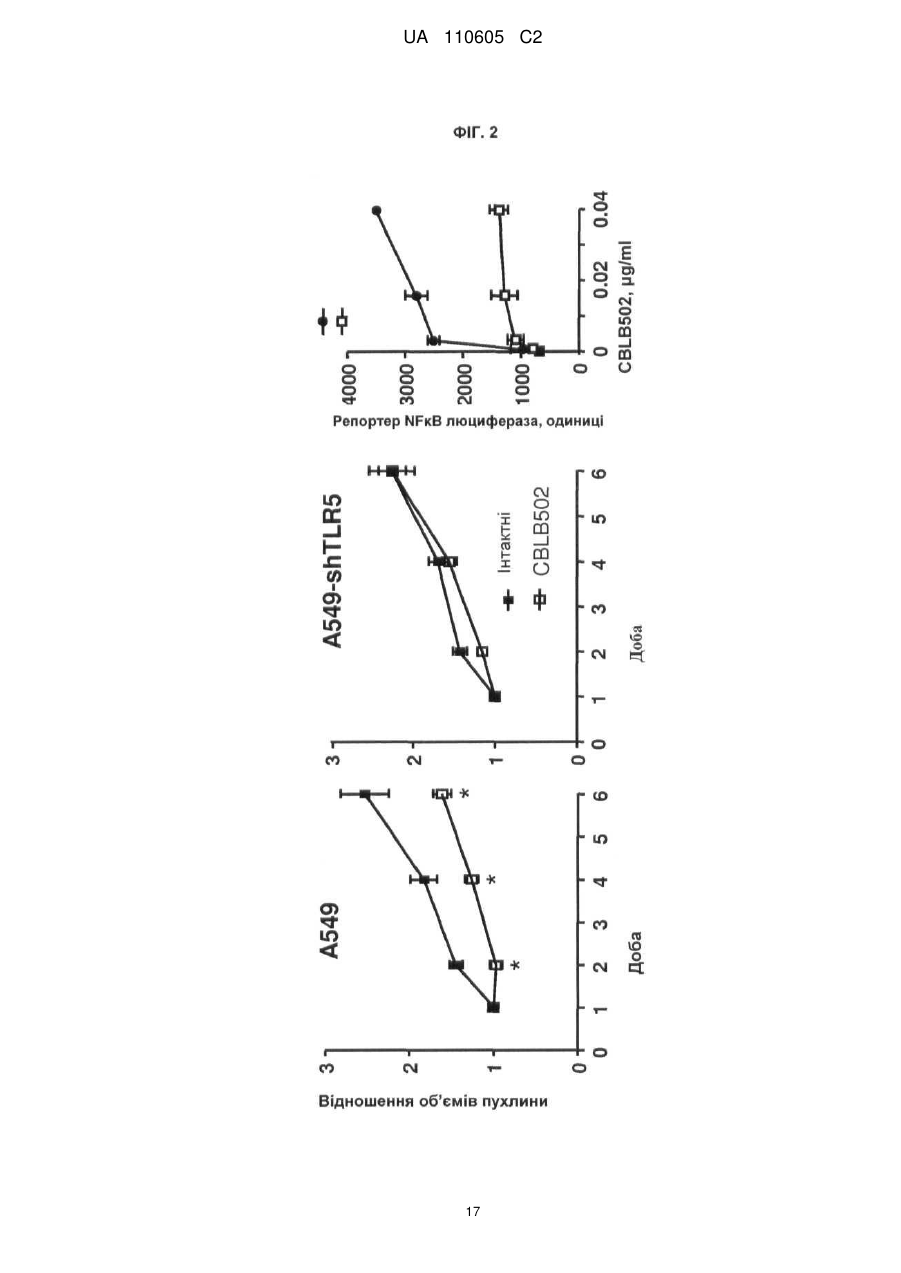
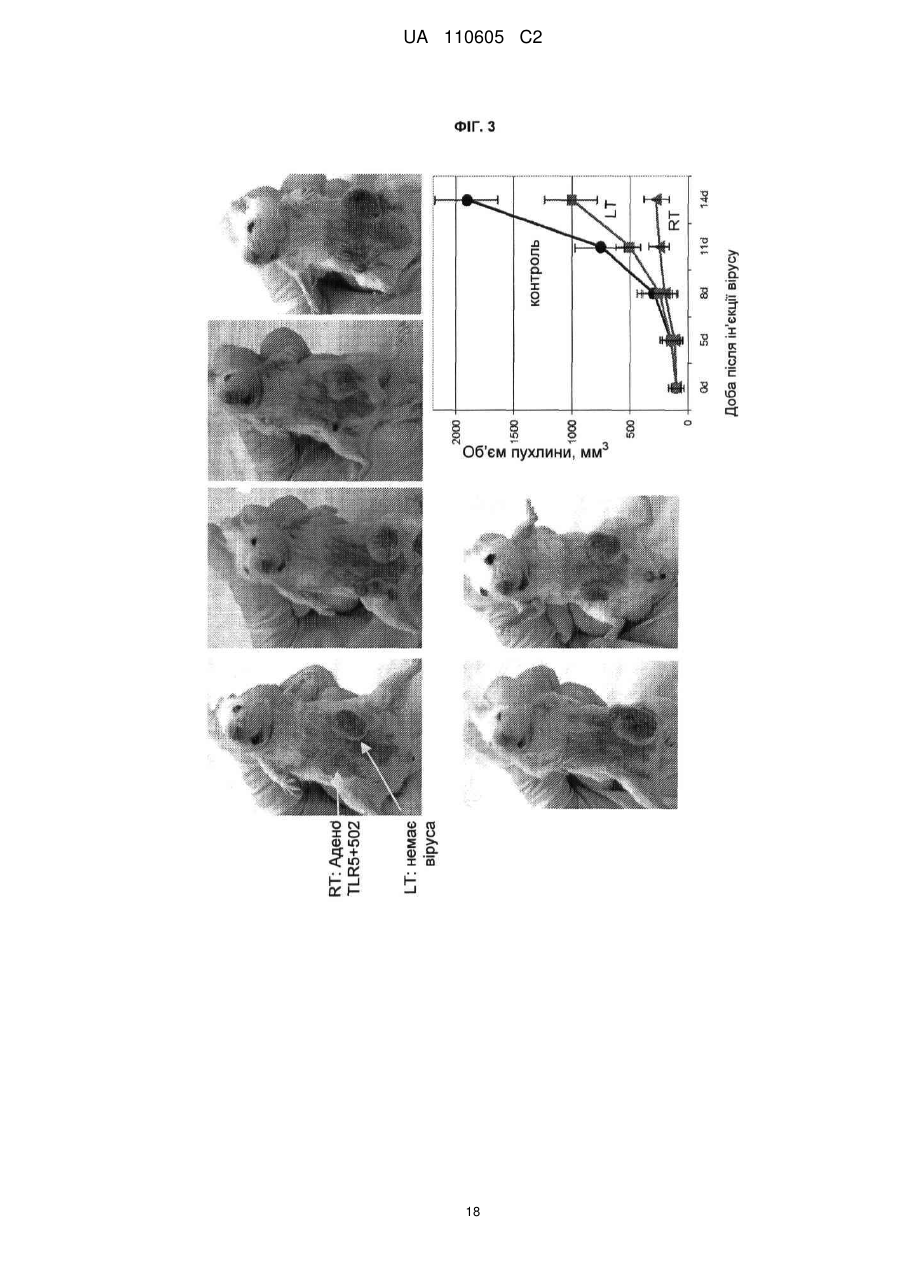
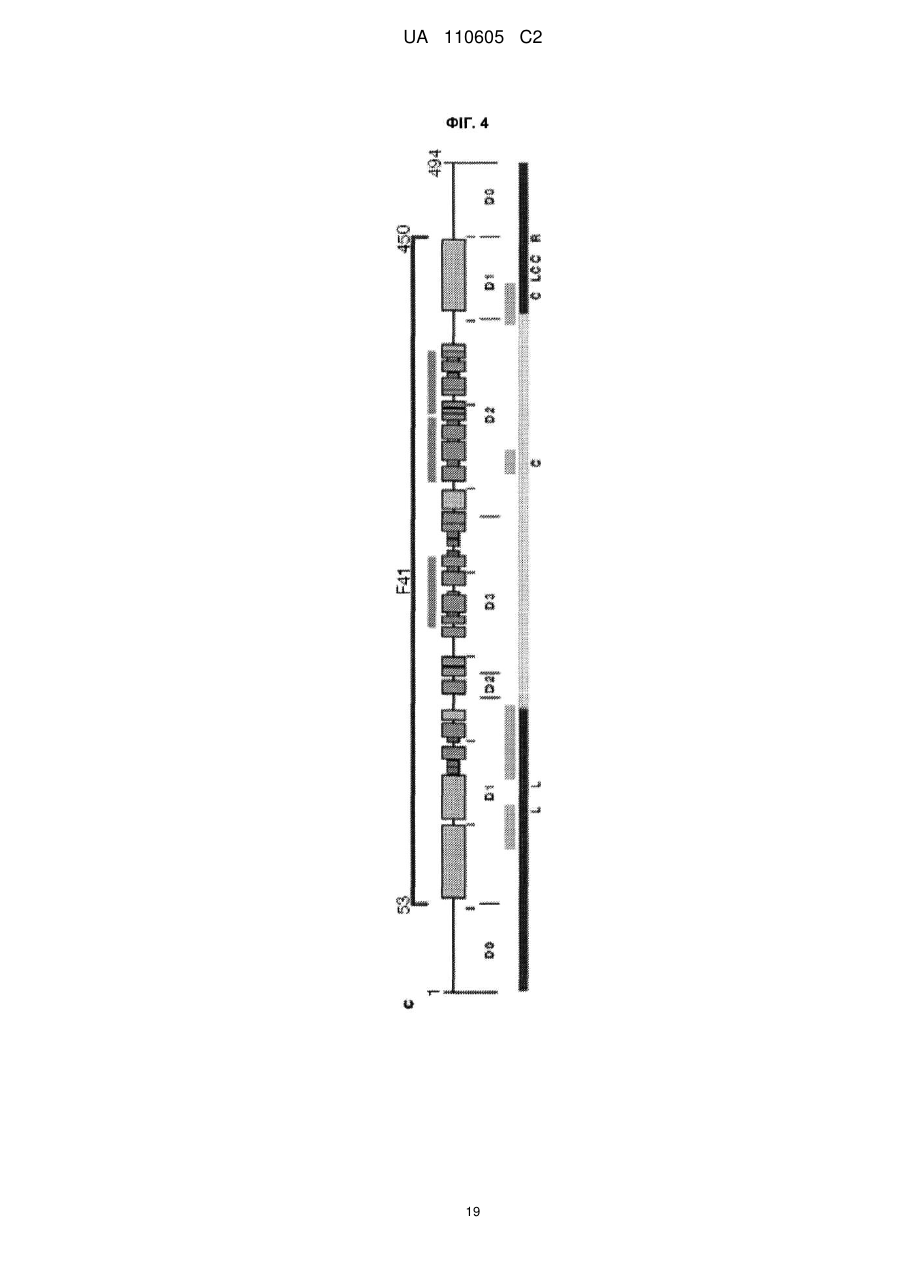
Реферат: Винахід належить до вектора, що містить першу і другу нуклеїнові кислоти, де перша нуклеїнова кислота кодує toll-подібний рецептор, і друга нуклеїнова кислота кодує агоніст tollподібного рецептора, причому вектор є експресійним вектором, toll-подібний рецептор є TLR-5, агоністом toll-подібного рецептора є флагелін, а також до застосування заявленого вектора у способі лікування раку у ссавця. UA 110605 C2 (12) UA 110605 C2 UA 110605 C2 5 10 15 20 25 30 35 40 45 50 55 60 ОБЛАСТЬ ВИНАХОДУ Цей винахід відноситься до способів лікування раку і інфекційних захворювань. ПОПЕРЕДНІЙ РІВЕНЬ ТЕХНІКИ Toll-подібні рецептори відповідальні за розпізнавання більшості загальних патернів бактерійних і вірусних патогенів. Їх активація призводить в результаті до рекрутменту природженої, а згодом адаптивної імунної відповіді. Рецепторні клітини імунної системи до сайту присутності антигенів є ключовою стадією в ефективній імунній відповіді. Саме тому в імунізацію залучено застосування різних типів адьювантів. Хоча більшість пухлин експресує пухлиноспецифічні антигени, вони використовують ряд механізмів, що дозволяють уникнути імунного розпізнавання. Нещодавно було продемонстровано в мишачих моделях, що активація TLR5 його лігандом і агоністом, бактерійним флагеліном, призводить в результаті до індукції протипухлинного ефекту проти тих пухлин, які експресують функціональний TLR5. Це відкриває широку можливість для розгляду агоністів TLR5 для імунотерапії раку. На шляху доведення цієї ідеї до практики існує дві основні перешкоди. По-перше, пухлина, що експресує функціональний TLR5, рідко зустрічається, обмежуюча застосовність цього підходу лише до невеликої підгрупи пухлин. По-друге, системне введення агоніста TLR5 призводить до активації передачі сигналу TLR5 в усіх клітинах, які мають функціональний рецептор, роблячи цю відповідь не сфокусованою і не пухлиноспецифічною. Відповідно, в цій області техніки існує потреба в механізмі або способі аутокринної активації передачі сигналу рецептором TLR в інфікованих або пухлинних клітинах при мінімальному системному ефекті, що забезпечує, таким чином, залучення природженої імунної відповіді специфічно до інфікованої клітини або пухлини. КОРОТКИЙ ВИКЛАД СУТІ ВИНАХОДУ Даний винахід може бути спрямований на вектор, що містить першу і другу нуклеїнові кислоти, де перша нуклеїнова кислота кодує toll-подібний рецептор, а друга нуклеїнова кислота кодує агоніст toll-подібного рецептора. Перша нуклеїнова кислота може кодувати форму, що секретується toll-подібного рецептора. Друга нуклеїнова кислота може кодувати форму, що секретується флагеліну. Агоніст toll-подібного рецептора може бути флагелін. Вектор може бути експресійним вектором ссавців. Вектор може експресуватися з аденовіруса, лентивіруса або ліпосоми. Формою флагеліна, що секретується, може бути CBLB502S. Toll-подібний рецептор може бути TLR-5. Даний винахід може бути спрямований на спосіб лікування раку у ссавця, що включає введення ссавцеві, що потребує цього, агента, що включає вектор, що містить першу і другу нуклеїнові кислоти, де перша нуклеїнова кислота кодує toll-подібний рецептор, а друга нуклеїнова кислота кодує агоніст toll-подібного рецептора. Рак може бути пухлиною. Пухлина може мати походження з групи, що складається з простати, молочної залози, ободової кишки, стравоходу, шлунку, легені, підшлункової залози, бруньки, щитовидної залози, яєчників, гортані або шийки матки. Пухлина може мати походження з групи, що складається з сарком, меланом, лейкозу і лімфом. Агент можна вводити in trans або поза пухлиною ссавця. Агент можна вводити безпосередньо в пухлину ссавця. Агент можна вводити в комбінації з імуностимулятором. Імуностимулятор вибирають з групи, що складається з гормону росту, пролактіну і вітаміну D. Гормон росту може бути соматотропіном. Агент можна вводити в комбінації з цитокіном. Цитокін може бути чинником стовбурових клітин. Даний винахід також спрямований на спосіб лікування інфекції у ссавця, що включає введення ссавцеві, що потребує цього, агента, що включає вектор, що містить першу і другу нуклеїнову кислоту, де перша нуклеїнова кислота кодує toll-подібний рецептор, а друга нуклеїнова кислота кодує агоніст toll-подібного рецептора. Рак може бути пухлиною. Інфекція може мати походження з групи, що складається з вірусів, бактерій, простих паразитів. КОРОТКИЙ ОПИС ГРАФІЧНИХ МАТЕРІАЛІВ На фіг. 1A-1C зображені схематичні карти аденовірусних векторів, експресуючих TLR5, CBLB502S і їх комбінацію (TLR5+CBLB502S). На фіг. 2 зображені результати відношення об'єму пухлини у мишей за число доби в пухлинних клітинах (A549), трансдукованих контрольним вектором (без TLR5) або вектором, експресуючим TLR5, де мишей обробляли три доби або CBLB502, або ФСБ. На фіг. 3 зображена супресія пухлинного росту ін'єкцією вектору, що містить аденовірус, спільно експресуючого CBLB502S і toll-подібний рецептор, де аденовірус ін'єктують ізогенним мишам з пухлиною, що є карциномою ободової кишки CT26, і дослідженням ефектів in-cis і intrans аденовірусних векторних конструкцій. На фіг. 4 показана доменна структура бактерійного флагеліна. Запис Ca скелета, розподіл гідрофобної серцевини і структурна інформація F41. Чотири окремі гідрофобні серцевини, які визначають домени D1, D2a, D2b і D3. Усі атоми гідрофобних бічних ланцюгів виявлені з Ca 1 UA 110605 C2 5 10 15 20 25 30 35 40 45 50 55 60 скелетом. Атоми бічних ланцюгів мають колірний код: Ala, жовтий; Leu, Ile або Val, помаранчевий; Phe і Tyr, пурпурний (атоми вуглецю) і червоний (атоми кисню). c, Положення і область різних структурних ознак в амінокислотній послідовності флагеліну. Показані, зверху вниз: фрагмент F41 синім кольором; три складки β-листа коричневим кольором; розподіл вторинної структури з α-спіралью жовтим кольором, β-структури зеленим кольором і β-вигин пурпурним кольором; періодична мітка на кожному 50-му залишку синім кольором; домени D0, D1, D2 і D3; область осьового контакту субодиниць без прото-елемента блакитним кольором; високо консервативна амінокислотна послідовність червоним кольором і варіабельна область фіолетовим кольором; точкові мутації в F41, які продукують елементи різних суперспіралей. Буквами знизу вказана морфологія елементів мутантів: L (D107E, R124A, R124S, G426A), пряма L-типу; R (A449V), пряма R-типу; C (D313Y, A414V, A427V, N433D), скручений 33. На фіг. 5 показано схематичне зображення доменів Salmonella, їх фрагментів і взаємодії з TLR5. Темні смуги означають ділянки гена флагеліну, використані для конструювання фрагментів, A, що містять, B, C, A' і B'. На фіг. 6 зображені похідні флагеліну. Доменна структура і приблизні межі (координати амінокислот) обраних похідних флагеліну (перерахованих справа). Домен FliC флагеліну Salmonella dublin позначений в межах 505 амінокислот (ак). На фіг. 7 показана нуклеїново-кислотна і амінокислотна послідовність для нижченаведених варіантів флагеліну: AA' (SEQ ID NO: 7-8), AB' (SEQ ID NO: 9-10), BA' (SEQ ID NO: 11-12), BB' (SEQ ID NO: 13-14), CA' (SEQ ID NO: 15-16), CB' (SEQ ID NO: 17-18), A (SEQ ID NO: 19-20), B (SEQ ID NO: 21-22), C (SEQ ID NO: 23-24), GST-A' (SEQ ID NO: 25-26), GST-B' (SEQ ID NO: 2728), AA'n1-170 (SEQ ID NO: 29-30), AA'n1-163 (SEQ ID NO: 33-34), AA'n54-170 (SEQ ID NO: 3132), AA'n54-163 (SEQ ID NO: 335-36), AB'n1-170 (SEQ ID NO: 37-38), AB'n1-163 (SEQ ID NO: 3940), AA'n1-129 (SEQ ID NO: 41-42), AA'n54-129 (SEQ ID NO: 43-44), AB'n1-129 (SEQ ID NO: 4546), AB'n54-129 (SEQ ID NO: 47-48), AA'n1-100 (SEQ ID NO: 49-50), AB'n1-100 (SEQ ID NO: 5152), AA'n1-70 (SEQ ID NO: 53-54) і AB'n1-70 (SEQ ID NO: 55-56). Лідерна послідовність pRSETb показана курсивом (лідер включає Met, який також є амінокислотою 1 FliC). N-кінцевий константний домен підкреслений. Амінокислотна лінкерна послідовність виділена жирним шрифтом. C-кінцевий константний домен підкреслений. GST, якщо є присутнім, виділений. На фіг. 8 показано порівняння амінокислотних послідовностей консервативного аміно (фіг. 8A) і карбокси (фіг. 8B) кінця з 21 виду бактерій. 13 консервативних амінокислот, важливих для активності TLR5, показано затінюванням. Амінокислотні послідовності ідентифікують за номерами по каталогу TrEMBL (перша буква = Q) або Swiss-Prot (перша буква = P). На фіг. 9 показана нуклеїново-кислотна і амінокислотна послідовність для білка Tollподібного рецептора 5 людини. ДЕТАЛЬНИЙ ОПИС Автори винаходу зробили несподіване відкриття, що забезпечення toll-подібним рецептором, таким як toll-подібний рецептор 5 (TLR-5), в комбінації з агоністом toll-подібного рецептора, таким як флагелін, призводить в результаті до цис- і транс-ефекту, який рекрутує клітини, залучені як в природжений (цис-ефект), так і в адаптивний (транс-ефект) імунна відповідь, для специфічного знищення ракових клітин і клітин, інфікованих патогенному, за допомогою біохімічного шляху апоптозу NF-κB. Не будучи пов'язаною теорією, ідея, застосована в цьому винаході, полягала в (i) подоланні залежності TLR-опосередкованих стратегій імунізації від передіснуючої експресії TLR в пухлині шляхом трансдукції пухлини конструкцією, що направляє експресію TLR; і (ii) напрямі імунної відповіді на пухлину за рахунок створення локального напів агоніста TLR. Наприклад, лікарські препарати, TLR, що містять, одночасно індукують експресію і активують TLR, піддаючи за допомогою цього пухлинні клітини дії імунної системи хазяїна, що імітує ситуацію масивного проникнення бактерій через стінку тонкого кишковика. За рахунок забезпечення TLR, таким як TLR5, і агоністом TLR, таким як флагелін, для взаємодії і активації як природженої, так і адаптивної імунної системи, цей спосіб можна застосовувати для лікування пухлин, що мають походження від раку простати, молочної залози, ободової кишки, стравоходу, шлунку, легенів, підшлункової залози, бруньки, щитовидної залози, яєчників, гортані або шийки матки, а також для лікування сарком, меланом, лейкозу і лімфом. Застосування цього способу не обмежені терапіями раку, оскільки цей спосіб можна також застосовувати для лікування інфекцій, що мають походження від вірусів, бактерій, простих паразитів і грибів. Варіанти забезпечення TLR і агоністом TLR можуть включати вектори, спільно експресуючі рецептор TLR і форму флагеліну, що секретується, який активує активність TLR в одній і тій же 2 UA 110605 C2 5 10 15 20 25 30 35 40 45 50 55 аномальній клітині ссавця. Спосіб згідно даного винаходу може також включати векторні конструкції, які експресують рецептор TLR в клітині ссавця і агоніст TLR, які вводять в клітину in trans. Наприклад, для аденовірусного вектору вимагається модифікація флагеліна, щоб досягти його ефективного синтезу і секреції клітинами ссавця. 1. Визначення Термінологія, використовувана в цій заявці, призначена тільки для мети опису конкретних форм здійснення і не повинна тлумачитися як обмежувальна. Як використовують в описі і формулі винаходу, що додається, форми однини включають відповідні форми множини, якщо контекстом чітко не продиктоване інше. Для перерахування в цій заявці числових інтервалів в прямій формі розглядають кожне проміжне число між ними з такою ж мірою точності. Наприклад, для інтервалу 6-9 чисел 7 і 8 розглядають на додаток до 6 і 9, а для інтервалу 6,0-7,0 в прямій формі розглядають числа 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9 і 7,0. "Введення" може означати одноразову дозу або багатократні дози агента або агент. "Аналог" може означати, в контексті пептиду або поліпептиду, пептид або поліпептид, що містить одну або більш ніж одну нестандартну амінокислоту або інші структурні варіації в порівнянні із загальноприйнятим набором амінокислот. "Антитіло" може означати антитіло класів IgG, IgM, IgA, IgD або IgE, або його фрагменти або похідні, включаючи Fab, F(ab")2, Fd і одноланцюгові антитіла, діатела, біспецифічні антитіла, біфункціональні антитіла і їх похідні. Антитіло може бути моноклональним антитілом, поліклональним антитілом, аффінно-очищене антитілом або їх сумішами, які проявляють достатню зв'язуючу специфічність до бажаного епітопа або послідовності, що має походження від нього. Антитіло може також бути химерним антитілом. Антитіло може бути дериватизоване приєднанням одного або більш ніж одного хімічного, пептидного або поліпептидного угрупування, відомого в цій області техніки. Антитіло може бути кон'юговане з хімічним угрупуванням. "Похідна" може означати пептид або поліпептид, що відрізняється в іншому, ніж первинна структура (амінокислоти і аналоги амінокислот). Похідні можуть відрізнятися тим, що вони глікозільовані, що є однією з форм посттрансляційної модифікації. Наприклад, пептиди або поліпептиди можуть проявляти патерни глікозилювання внаслідок експресії в гетерологічних системах. Якщо щонайменше одна біологічна активність зберігається, то ці пептиди або поліпептиди є похідними відповідно до винаходу. Інші похідні можуть включати злиті білки або злиті поліпептиди, що мають ковалентний модифікований N, - або C-кінець, пегілірування пептиди або поліпептиди, пептиди або поліпептиди, що асоціюються з ліпідними угрупуваннями, алкіловані пептиди або поліпептиди, пептиди або поліпептиди, зшиті через функціональну групу амінокислоти бічного ланцюга з іншими пептидами, поліпептидами або хімічними речовинами, і додаткові модифікації, які мають бути зрозумілі фахівцям в цій області техніки. "Фрагмент" може означати ділянку відповідного пептиду або поліпептиду. "Гомолог" може означати пептид або поліпептид, що має загального еволюційного попередника. "Лідерна послідовність" може бути нуклеїновою кислотою, що кодує яку-небудь пептидну послідовність, яка зшита і транслюється з відповідним пептидом, або поліпептидом, даючи можливість відповідному пептиду, або поліпептиду правильно пройти через ендоплазматичний ретикулум і комплекси Гольджи еукаріотичні клітини з метою позаклітинної секреції з мембрани клітини. Лідерна пептидна послідовність може мати походження від лужної фосфатази. Лідерна пептидна послідовність може мати послідовність ДНК, що включає atgctgctgctgctgctgctgctgggcctgaggctacagctctccctgggc. "Ліпосома" може означати крихітну бульбашку (везикулу), що складається з тієї ж речовини, що і клітинна мембрана. Ліпосому заповнюють лікарськими засобами і використовують для доставки лікарських засобів для раку і інших захворювань. Ліпосома може бути заповнена вектором. Мембрана ліпосоми може складатися з фосфоліпідів, які є молекулами, що мають групу голівки і групу хвоста. Голівка ліпосоми може притягуватися до води, а хвіст, який складається з довгого вуглеводневого ланцюга, відштовхується водою. Хвости можуть відштовхуватися водою і вибудовуватися з утворенням поверхні, що відштовхується від води. Ліпіди плазматичної мембрани можуть бути, головним чином, фосфоліпідами, такі як фосфатиділетаноламін і фосфатиділхолін. Ліпосоми можуть складатися з фосфоліпідів природного походження зі змішаними ліпідними ланцюгами (таких як фосфатиділетаноламін курячого яйця) або з чистих сурфактантних компонентів, таких як DOPE (діолеілфосфатиділетаноламін). 3 UA 110605 C2 5 10 15 20 25 30 35 40 45 50 55 "Пептид" або "поліпептид" може означати пов'язану послідовність амінокислот і може бути природним, синтетичним, або бути модифікацією або комбінацією природного і синтетичного. "По суті ідентичний" може означати, що перша і друга амінокислотна послідовність ідентичні щонайменше на 60 %, 65 %, 70 %, 75 %, 80 %, 85 %, 90 %, 95 %, 96 %, 97 %, 98 % або 99 % упродовж ділянки 10, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1100 амінокислот. Кожне з "лікування", "терапія" або "лікувати" може означати полегшувати, пригнічувати, інгібувати, усувати, попереджати або уповільнювати появу симптомів, клінічних ознак або патології стану або розладу, що лежить в основі, на тимчасовій або постійній основі. Попередження стану або розладу включає введення агента згідно даного винаходу суб'єктові до початку захворювання. Пригнічення стану або розладу включає введення агента згідно даного винаходу суб'єктові після індукції стану або розладу, але до його клінічного прояву. Інгібірування стану або розладу включає введення агента згідно даного винаходу суб'єктові після клінічного прояву захворювання. "Варіант" може означати пептид або поліпептид, який відрізняється по амінокислотній послідовності інсерцією, делецією або консервативною заміною амінокислот, але зберігає щонайменше одну біологічну активність. Репрезентативні приклади "біологічної активності" включають здатність до зв'язування з toll-подібним рецептором і до зв'язування специфічним антитілом. Варіант може також означати білок з амінокислотною послідовністю, яка по суті ідентична відповідному білку з амінокислотною послідовністю, який зберігає щонайменше одну біологічну активність. Консервативна заміна амінокислоти, тобто заміщення амінокислоти іншою амінокислотою подібних властивостей (наприклад, гідрофільності, міри і розподілу заряджених ділянок), визнана в цій області техніки як така, що типово включає мінорну зміну. Ці мінорні зміни можуть бути ідентифіковані частково шляхом обліку індексу гідропата амінокислот, як зрозуміло в цій області техніки. Kyte et al., J. Mol. Biol. 157:105-132 (1982). Індекс гідропата амінокислоти заснований на обліку її гідрофобності і заряду. У цій області техніки відомо, що амінокислоти подібних індексів гідропатів можуть бути замінені та все ж зберігають функцію білку. У одному аспекті замінюють амінокислоти, що мають гідропатичні індекси ±2. Гідрофільність амінокислот можна також використовувати для виявлення замін, які приведуть в результаті до білків, що зберігають біологічну функцію. Облік гідрофільності амінокислот в контексті пептиду дає можливість обчислення найвищої локальної середньої гідрофільності цього пептиду, корисної міри, яка, як повідомлялося, добре корелює з антигенністю і імуногенністю. Патент США № 4554101 повністю включений в цю заявку за допомогою посилання. Заміна амінокислот, що мають подібні значення гідрофільності, може привести в результаті до пептидів, що зберігають біологічну активність, наприклад, імуногенність, як зрозуміло в цій області техніки. Заміни можна здійснювати амінокислотами, що мають значення гідрофільності в межах ±2 один від одного. Як на індекс гідрофобності, так і на значення гідрофільності амінокислот впливає певний бічний ланцюг цієї амінокислоти. Відповідно до цього спостереження зрозуміло, що заміни амінокислот, які сумісні з біологічною функцією, залежать від відносної подібності амінокислот, і, зокрема, від бічних ланцюгів цих амінокислот, як виявлено на підставі гідрофобності, гідрофільності, заряду, розміру і інших властивостей. "Вектор" може означати нуклеїново-кислотну послідовність, що містить точку початку реплікації. Вектор може бути плазмідою, штучною хромосомою дріжджів або ссавців. Вектор може бути РНК або ДНК вектор. Вектор може бути або автономно реплікований екстрахромосомний вектор, або вектор, який інтегрує в геном хазяїна. 2. Toll-подібний рецептор У цій заявці запропонований toll-подібний рецептор (TLR), який може відноситися до типу рецепторів утворення структур (PRR). TLR може розпізнавати молекули, які є консервативними молекулярними продуктами, що мають походження від патогенів, які включають грампозитивні, грамнегативні бактерії, гриби і віруси, але є відмітними від молекул хазяїна, які всі разом називають патоген-асоційованими молекулярними патернами (PAMP). TLR можуть також розпізнавати ендогенні молекули, що вивільняються з пошкоджених або вмираючих клітин, які всі разом називають молекулярними патернами, що асоціюються з ушкодженням (DAMP). PAMP або DAMP можуть бути агоністом TLR, як додатково описано нижче. TLR може бути фрагментом, варіант, аналог, гомолог або похідна, які рекрутують адаптерні молекули в межах цитоплазми клітин з метою поширення сигналу. TLR може мати походження від людини або інших видів ссавців, таких як макак резус, миша або щур. TLR може бути щонайменше на 3099 % ідентичний TLR, який рекрутує адаптерні молекули в межах цитоплазми клітин з метою поширення сигналу. 4 UA 110605 C2 5 10 TLR може бути одним з типів TLR в кількості від десяти до п'ятнадцяти, які за оцінками існують у більшості видів ссавців. TLR може бути одним з 13 TLR (званих просто TLR1-TLR13), які ідентифіковані спільно у людей і мишей, або може бути еквівалентною формою, яка виявлена у інших видів ссавців. TLR може бути одним з 11 членів (TLR1-TLR11), які ідентифіковані у людей. TLR може експресуватися різними типами імунних клітин і може бути локалізований на клітинній поверхні або в цитоплазмі клітини. TLR може експресуватися на ракових клітинах. TLR може експресуватися нормальними епітеліальними клітинами в травній системі, нормальними кератиноцитами в шкірі, альвеолярними і бронхіальними епітеліальними клітинами і епітеліальними клітинами жіночих статевих шляхів. Ці клітини, що вистилають орган, можуть бути першою лінією захисту проти інвазії мікроорганізмів, і TLR, що експресується в епітеліальних клітинах, можуть грати критичну роль в регуляції проліферації і апоптозу. TLR-експресуюча ракова клітина може бути вибрана з приведеної нижче таблиці: Таблиця 1 Експресія TLR в ракових клітинах людини ТИП РАКУ Рак шлунку Колоректальний рак Рак яєчника Рак шийки матки Рак легені Рак простати Меланома Рак головного мозку Рак молочної залози Гепатоклітинна карцинома Рак гортані TLR TLR2, TLR4, TLR5, TLR9 TLR2, TLR3, TLR4, TLR5, TLR9 TLR2, TLR3, TLR4, TLR5 TLR3, TLR4, TLR5, TLR9 TLR2, TLR3, TLR4, TLR9 TLR4, TLR9 TLR2, TLR3, TLR4 TLR2, TLR4 TLR2, TLR3, TLR4, TLR9 TLR2, TLR3, TLR4, TLR6, TLR9 TLR2, TLR3, TLR4 15 20 25 30 35 40 TLR, що експресується на ракових клітинах, може підвищувати регуляцію каскаду NF-κB, і продукувати антиапоптичні білки, які вносять вклад в канцерогенез і проліферацію ракових клітин. Відомо, що чотири адаптерні молекули TLR залучено в передачу сигналу. Ці білки відомі як чинник міелоїдного диференціювання 88 (MyD88), Tirap (також званий Mai), Trif і Tram. Адаптери активують інші молекули усередині клітини, включаючи деякі протеінкінази (IRAK1, IRAK4, TBK1 і IKKi), які ампліфікують сигнал, і, кінець кінцем, призводять до індукції або супресії генів, які управляють запальною відповіддю. Біохімічні шляхи передачі сигналу TLR в процесі розпізнавання патогена можуть індукувати імунні реакції за допомогою позаклітинних і внутрішньоклітинних біохімічних шляхів, опосередкованих MyD88, ядерним чинником енхансером легкого ланцюга каппа активованих B клітин (NF-κB) і мітоген-асоційований протеінкіназою (MAPK). В цілому тисячі генів активуються передачею сигналу TLR, і всі разом TLR складають один з найбільш плейотропних, хоча і строго регульованих шлюзів для модуляції генів. TLR разом з рецепторами інтерлейкіну-1 утворює надсімейство рецепторів, відоме як "надсімейство рецепторів інтерлейкіну-1/Toll-подібних рецепторів". Усі члени цього сімейства мають загальний так званий домен TIR (Toll-IL-1 рецептор). Може існувати три підгрупи доменів TIR. Білки з доменами TIR підгрупи I є рецепторами інтерлейкінів, які продукуються макрофагами, моноцитами і дендритними клітинами і усі мають позаклітинні домени імуноглобуліну (Ig). Білки з доменами TIR підгрупи II є класичні TLR і зв'язуються безпосередньо або опосередковано з молекулами мікробного походження. Третя підгрупа білків, що містять домени TIR (III), складається з адаптерних білків, які є виключно цитозольними і опосередкують передачу сигналу від білків підгруп 1 і 2. TLR може бути фрагментом, варіант, аналог, гомолог або похідна, які зберігають домен TIR підгрупи I, домен TIR підгрупи II або домен TIR підгрупи III. TLR може функціонувати у вигляді димеру. Наприклад, хоча більшість TLR, мабуть, функціонують у вигляді гомодимерів, TLR2 утворює гетеродимери з TLR1 або TLR6, де кожен димер має лігандну специфічність, що відрізняється. TLR може також залежати від інших корецепторів для повної лігандної специфічності, як, наприклад, у разі розпізнавання TLR4 ЛПС, 5 UA 110605 C2 5 10 15 20 для якого потрібно MD-2. CD14 і ЛПС-звязуючий білок (LBP), який, як відомо, сприяє презентуванню ЛПС MD-2. а. TLR1 TLR може бути TLR1, який розпізнає PAMP із специфічністю до грампозитивних бактерій. TLR1 також позначений як CD281. б. TLR5 TLR може бути Toll-подібний рецептор 5. Білок, кодований TLR-5, може грати фундаментальну роль в розпізнаванні патогена і активації природженого імунітету. TLR-5 може розпізнавати PAMP, які експресуються на інфекційних агентах, і опосередкує продукування цитокінів, необхідних для розвитку ефективного імунітету. TLR-5 може розпізнавати бактерійний флагелін, основний компонент джгутиків бактерій і чинник вірулентності. Активація TLR може мобілізувати ядерний чинник NF-κB і стимулювати продукування чинника некрозу пухлини альфа. 3. Агоніст Toll-подібного рецептора У цій заявці також запропонований агоніст TLR. Агоніст TLR може бути PAMP, який може бути консервативним молекулярним продуктом, що має походження від патогена. Патоген може бути грампозитивною бактерією, грамнегативною бактерією, грибом або вірусом. Агоніст TLR може бути лігандом молекулярного патерну, що асоціюється з ушкодженням (DAMP), який може бути ендогенною молекулою, що вивільняється з пошкоджених або вмираючих клітин. DAMP або PAMP може ініціювати імунну відповідь за допомогою сигналів TLR і рекрутувати адаптерні молекули усередині цитоплазми клітин з метою поширення сигналу. Агоніст TLR може бути агоністом для TLR, який може бути лігандом з приведених в таблиці 2: Таблиця 2 TLR і ліганди Ліганд DAMP TLR TLR1 TLR2 TLR3 TLR4 Білки теплового шоку HMGB1 (бокс 1 групи білків з високою рухливістю -амфотерин) dsРНК, що самореплікується Білки теплового шоку Фібриноген Гепаран сульфат Фібронектин Гіалуронова кислота HMGB1 TLR5 TLR6 TLR7/TLR8 TLR9 TLR 10 TLR 11 25 30 ssРНК що самореплікується ДНК, що самореплікується Ліганд PAMP Триацилліпопротеїни Пептидоглікан Ліпопротеїн Ліпотейхоєва кислота Зимозан Вірусна dsРНК Білки теплового шоку Ліпополісахариди Злитий білок RSV Білки оболонки MMTV (вірусу пухлини молочної залози миші) Паклитаксел флагелін Ліпотейхоєва кислота Триацилліпопротеини Зимозан Вірусна ssРНК Бактерійна і вірусна ДНК Профілін Агоніст TLR може бути фрагментом, варіант, аналог, гомолог або похідна, або PAMP або DAMP, які зв'язують TLR і індукують TLR-опосередковану активність, таку як активація активності NF-κB. Фрагмент, варіант, аналог, гомолог або похідна агоніста TLR можуть бути ідентичні щонайменше на 30-99 % амінокислотам агоніста TLR і індукують TLR-опосередковану активність. Мішенню агоніста TLR може бути TLR, такий як TLR-5. Агоніст TLR може бути агоніст TLR-5 і стимулювати активність TLR-5. Агоніст TLR може бути антитілом проти-TLR5 або іншою малою молекулою. Агоніст TLR може бути флагелін. 6 UA 110605 C2 5 10 15 20 25 30 35 40 45 50 55 60 Флагелін може також бути флагелін або поліпептид, споріднений з флагеліном. Флагелін може мати походження з будь-якого джерела, включаючи ряд видів грампозитивних і грамнегативних бактерій. Флагелін може бути поліпептидом флагеліну з будь-якого виду грампозитивних або грамнегативних бактерій, включаючи, але не обмежуючись ними, поліпептид флагеліну, розкритий в публікації патенту США № 2003/000044429, зміст якої повністю включений в цю заявку за допомогою посилання. Наприклад, флагелін може мати амінокислотну послідовність з виду бактерії, зображеної на фіг. 7 опублікованого патенту США № 2003/000044429 Нуклеотидні послідовністі, що кодують поліпептиди флагеліну, перераховані на фіг. 7 публікацій патенту США № 2003/000044429, загальнодоступні з джерел, що включають базу даних NCBI Genbank. Флагелін може також бути пептидом флагеліну, що відповідає номеру по каталогу, вказаному в результатах BLAST, представлених на фіг. 25 публікацій патенту США № 2003/000044429, або його варіант. Флагелін може також бути поліпептидом флагеліну, який розкритий в заявці на патент США № 2009/0011982, зміст якої повністю включений в цю заявку за допомогою посилання. Флагелін може бути будь-яким з поліпептидів флагеліну, які розкриті на фіг. 6 і 7 цієї заявки. Флагелін може бути фрагментом, варіант, аналог, гомолог або похідна флагеліну, які зв'язують TLR5 і індукують TLR5-опосередковану активність, таку як активація активності NF-κB. Фрагмент, варіант, аналог, гомолог або похідна флагеліну може бути щонайменше на 30-99 % ідентичний амінокислотам флагеліну, який зв'язує TLR5 і індукує TLR5-опосередковану активність. Флагелін може мати походження з виду Salmonella, репрезентативним прикладом яких є S. dublin (кодований номером по каталогу GenBank M84972). Поліпептид, споріднений з флагеліном, може бути фрагмент, варіант, аналог, гомолог або похідна M84972, або їх комбінацію, які зв'язують TLR5 і індукують TLR5_опосередковану активність, таку як активація активності NF-κB. Фрагмент, варіант, аналог, гомолог або похідну флагеліну можна отримати шляхом раціонального конструювання на основі доменної структури флагеліну і консервативної структури, розпізнаваною TLR5. Флагелін може містити щонайменше 10, 11, 12 або 13 з 13 консервативних амінокислот, показаних на фіг. 5 (положення 89, 90, 91, 95, 98, 101, 115, 422, 423, 426, 431, 436 і 452). Флагелін може бути щонайменше на 30-99 % ідентичний амінокислотам 1174 і 418505 M84972. На фіг. 26 публікацій заявки на патент США № 2009/0011982, зміст якої повністю включений в цю заявку, представлений відсоток ідентичності аміно- і карбокси-кінця флагеліну з відомою TLR-5-стимулюючою активністю в порівнянні з M84972. Флагелін може бути основним компонентом джгутика бактерій. Флагелін може складатися з трьох доменів (фіг. 4). Домен 1 (D1) і домен 2 (D2) можуть бути переривчастими і можуть утворитися, коли залишки в аміно_кінці і карбокси-кінці з'єднуються за допомогою утворення шпилькової структури. Аміно- і карбокси-кінець, що містять домени D1 і D2, можуть бути найбільш консервативними, тоді як середній гіперваріабельний домен (D3) може бути високо варіабельним. Дослідження з рекомбінантним білком, що містить аміно-D1 і D2 і карбокси-D1 і D2, розділені шарніром Escherichia coli (ND1-2/ECH/CD2), показують, що D1 і D2 можуть мати біологічну активність при спаровуванні з елементом ECH. Ця химера, але не окрема шарнірна область, може індукувати розщеплювання IκBa, активацію NF-κB і продукування NO і IL-8 в двох лініях епітеліальних клітин тонкого кишковика. Неконсервативний домен D3 може знаходитися на поверхні нитки джгутика і може містити основні антигенні епітопи. Сильна прозапальна активність флагеліну може знаходитися у висококонсервативних областях N- і C-D1 і D2 (див. фіг. 4). Флагелін може індукувати активність NF-κB за допомогою зв'язування з Toll-подібним рецептором 5 (TLR5). TLR може розпізнавати консервативну структуру, яка специфічна для флагеліну. Консервативна структура може складатися з великої групи залишків, які являються деяким чином пермісивними для варіації в амінокислотному вмісті. У статті Smith et al., Nat Immunol. 4:1247-53 (2003), зміст якої включений в цю заявку за допомогою посилання, ідентифіковано 13 консервативних амінокислот у флагеліні, які є частиною консервативної структури, розпізнаваною TLR5. Ці 13 консервативних амінокислот флагеліну, які можуть бути важливі для активності TLR5, показані на фіг. 5. Отримані різні делеційні мутанти флагеліну, які зберігають щонайменше деяку TLR5стимулюючу активність. Флагелін може бути такий делеціонний мутант, і він може бути делеціонний мутант, розкритий в Прикладах цієї заявки. Флагелін може включати послідовність, що транслюється з номера по каталогу GenBank D13689, в якій відсутні амінокислоти 185-306 або 444-492, або з номера по каталогу GenBank M84973, в якій відсутні амінокислоти 179-415, або її варіант. 7 UA 110605 C2 5 10 15 20 25 30 35 40 45 50 55 60 Флагелін може включати інсерції транспозону і зміни у варіабельному домені D3. Домен D3 може бути замінений, частково або повністю, шарнірним або лінкерним поліпептидом, який дозволяє доменам D1 і D2 правильно укладатися, так що цей варіант стимулює активність TLR5. Варіанти шарнірних елементів можна знайти у білку MuκB E. coli, і він може мати послідовність, як представлено в SEQ ID NO: 3 і 4, або її варіант. Флагелін, як описано вище, може додатково містити лідерну послідовність. Флагелін, що додатково містить лідерну послідовність, може бути CBLB502S. 4. Агент Цей винахід також відноситься до агента, що містить терапевтично ефективну кількість TLR і агоніста TLR. Цей агент може доставляти TLR окремо від агоніста TLR. Агент може бути вектором. Цей вектор може містити першу нуклеїнову кислоту, кодуючу TLR, і другу нуклеїнову кислоту, що включає агоніст TLR. Вектор може мати здатність до трансдукції клітин ссавців. Вектор може мати здатність до біцистронної експресії TLR і агоніста TLR, використовуючи сильні промотори. Вектор може включати тільки ген, кодуючий TLR, який може знаходитися під контролем сильного промотора. Вектор може бути доставлений в клітину ссавців за допомогою вірусу або векторної системи, пов'язаної з ліпосомами. Вірусна векторна система може бути аденовірусом або цитомегаловірус. Агент може бути ліпосомою, що несе вектор. Ліпосома може мати здатність до трансдукції клітин ссавців і до доставки вектору для експресії. Агент може бути лікарським препаратом, який одночасно індукує експресію і активує TLR, за допомогою чого пухлинні або інфіковані клітини піддаються дії імунної системи хазяїна, імітуючи ситуацію масового проникнення через клітину тонкого кишковика. Агент може бути лікарським препаратом, який експресує TLR в комбінації з агоністом TLR і може бути доставлений системно в розчині для введення, наприклад внутрішньом'язово. Агент може бути лікарським препаратом, який експресує TLR в комбінації з агоністом TLR, який може експресуватися з того ж вектору, такого як аденовірусна або цитомегаловірусна векторна система. Агент може бути лікарським препаратом, який експресує TLR в комбінації з агоністом TLR, експресуючий у формі наночастки, яка може переносити функціональний агоніст до клітинної поверхні клітини ссавця. Агент може бути фармацевтичний агент, що містить вищеописаний лікарський препарат, який може бути отриманий з використанням способів, добре відомих в цій області техніки. Агент може також включати співагент. Вектор може містити першу нуклеїнову кислоту, кодуючу TLR, і другу нуклеїнову кислоту, включаючу флагелін. Вектор може мати здатність до експресії TLR5 і флагеліну, використовуючи сильний промотор. Експресійний вектор може додатково містити лідерну послідовність, клоновану вище за ген, кодуючого TLR або TLR5 і флагелін. Експресійний вектор може бути векторною системою на основі pCD515. Експресійний вектор може бути pCD515CMV-hTLR5-EF1-502, як описано на фіг. 1A. Експресійний вектор може бути pCD515-CMVhTLR5, як описано на фіг. 1B. Експресійний вектор може бути pCD515-CMV-Sseap-502, як описано на фіг. 1C. Агент може бути лікарським препаратом, який одночасно індукує експресію і активує TLR, за допомогою чого пухлинні або інфіковані клітини піддаються дії імунної системи хазяїна, імітуючи ситуацію масового проникнення через клітину тонкого кишковика. Цей лікарський препарат може знаходитися у формі вірусної експресійної системи, що несе вектор. Цей лікарський препарат може бути аденовірусною експресійною системою функціональної TLR5 людини в комбінації з: агоністом TLR, що доставляється системно в розчині для введення, наприклад внутрішньом'язово; агоністом TLR, що експресується з того ж експресійного вектору, що і TLR; або агоністом TLR, що експресується у формі наночасток, що несуть функціональний агоніст TLR, такий як флагелін, який може доставлятися з CBLB502 на їх поверхню. Наночастка може бути заснована на бактеріофагу T7 або повністю утворена так, що зберігає його біологічну активність. Нанопрепарат може забезпечувати дозозалежну, NF-κB-реактивну репортерну активацію і може призводити в результаті до клітинної інтерналізації за допомогою ендоцитоза для ефективного підходу до імунізації (Mobian AP-A). а. Введення Введення агентів з використанням способу, описаного в цій заявці, може бути пероральним, парентеральним, під'язиковим, черезшкірним, ректальним, через слизову оболонку, місцевим, за допомогою інгаляції, за допомогою трансбуккального введення, або бути їх комбінаціями. Парентеральне введення включає, але не обмежено цим, внутрішньовенне, внутрішньоартеріальне, внутрішньочеревинне, підшкірне, внутрішньом'язове, підоболонкове і 8 UA 110605 C2 5 10 15 20 25 30 35 40 45 50 55 60 внутрішньосуглобове. Для ветеринарного застосування агент можна вводити у вигляді відповідного прийнятного препарату відповідно до звичайної ветеринарної практики. Ветеринар може легко визначити режим дозування і шлях введення, який є найбільш відповідним для конкретної тварини. Агенти можна вводити пацієнтові-людині, кішці, собаці, великій тварині або птахові. Агент можна вводити одночасно або метрономічним шляхом з іншими терапіями. Термін "одночасний" або "одночасно", як використовують в цій заявці, означає, що агент і іншу терапію вводять в межах 48 годин, переважно 24 годин, прийнятніше 12 годин, ще прийнятніше 6 годин і найприйнятніше 3 годин або менш один від одного. Термін "метрономічним шляхом", як використовують в цій заявці, означає введення агента в моменти часу, відмінні від іншої терапії, і з певною частотою відносно повторного введення. Агент можна вводити у будь-який момент перед іншою терапією, включаючи приблизно 120 год., 118 год., 116 год., 114 год., 112 год., 110 год., 108 год., 106 год., 104 год., 102 год., 100 год., 98 год., 96 год., 94 год., 92 год., 90 год., 88 год., 86 год., 84 год., 82 год., 80 год., 78 год., 76 год., 74 год., 72 год., 70 год., 68 год., 66 год., 64 год., 62 год., 60 год., 58 год., 56 год., 54 год., 52 год., 50год, 48 год., 46 год., 44 год., 42 год., 40 год., 38 год., 36 год., 34 год., 32 год., 30 год., 28 год., 26 год., 24 год., 22 год., 20 год., 18 год., 16 год., 14 год., 12 год., 10 год., 8 год., 6 год., 4 год., 3 год., 2 год., 1 год., 55, 50 хв., 45 хв., 40 хв., 35 хв., 30 хв., 25 хв., 20 хв., 15 хв., 10 хв., 9 хв., 8 хв., 7 хв., 6 хв., 5 хв., 4 хв., 3 хв., 2 хв. і 1 хв. Агент можна вводити у будь-який момент перед другим введенням агента, включаючи приблизно 120 год., 118 год., 116 год., 114 год., 112 год., 110 год., 108 год., 106 год., 104 год., 102 год., 100 год., 98 год., 96 год., 94 год., 92 год., 90 год., 88 год., 86 год., 84 год., 82 год., 80 год., 78 год., 76 год., 74 год., 72 год., 70 год., 68 год., 66 год., 64 год., 62 год., 60 год., 58 год., 56 год., 54 год., 52 год., 50год, 48 год., 46 год., 44 год., 42 год., 40 год., 38 год., 36 год., 34 год., 32 год., 30 год., 28 год., 26 год., 24 год., 22 год., 20 год., 18 год., 16 год., 14 год., 12 год., 10 год., 8 год., 6 год., 4 год., 3 год., 2 год., 1 год., 55 хв., 50 хв., 45 хв., 40 хв., 35 хв., 30 хв., 25 хв., 20 хв., 15 хв., 10 хв., 9 хв., 8 хв., 7 хв., 6 хв., 5 хв., 4 хв., 3 хв., 2 хв. і 1 хв. Агент можна вводити у будь-який момент після іншої терапії, включаючи приблизно 1 хв., 2 хв., 3 хв., 4 хв., 5 хв., 6 хв., 7 хв., 8 хв., 9 хв., 10 хв., 15 хв., 20 хв., 25 хв., 30 хв., 35 хв., 40 хв., 45 хв., 50 хв., 55 хв., 1 год., 2 год., 3 год., 4 год., 6 год., 8 год., 10 год., 12 год., 14 год., 16 год., 18 год., 20 год., 22 год., 24 год., 26 год., 28 год., 30 год., 32 год., 34 год., 36 год., 38 год., 40 год., 42 год., 44 год., 46 год., 48 год., 50 год., 52 год., 54 год., 56 год., 58 год., 60 год., 62 год., 64 год., 66 год., 68 год., 70 год., 72 год., 74 год., 76 год., 78 год., 80 год., 82 год., 84 год., 86 год., 88 год., 90 год., 92 год., 94 год., 96 год., 98 год., 100 год., 102 год., 104 год., 106 год., 108 год., 110 год., 112 год., 114 год., 116 год., 118 год. і 120 год. Агент можна вводити у будь-який момент після другого введення агента, включаючи приблизно 120 год., 118 год., 116 год., 114 год., 112 год., 110 год., 108 год., 106 год., 104 год., 102 год., 100 год., 98 год., 96 год., 94 год., 92 год., 90 год., 88 год., 86 год., 84 год., 82 год., 80 год., 78 год., 76 год., 74 год., 72 год., 70 год., 68 год., 66 год., 64 год., 62 год., 60 год., 58 год., 56 год., 54 год., 52 год., 50год., 48 год., 46 год., 44 год., 42 год., 40 год., 38 год., 36 год., 34 год., 32 год., 30 год., 28 год., 26 год., 24 год., 22 год., 20 год., 18 год., 16 год., 14 год., 12 год., 10 год., 8 год., 6 год., 4 год., 3 год., 2 год., 1 год., 55 хв., 50 хв., 45 хв., 40 хв., 35 хв., 30 хв., 25 хв., 20 хв., 15 хв., 10 хв., 9 хв., 8 хв., 7 хв., 6 хв., 5 хв., 4 хв., 3 хв., 2 хв. і 1 хв. б. Препарат Спосіб може включати введення агента. Агенти, запропоновані в цій заявці, можуть знаходитися у формі пігулок або коржів, приготованих загальноприйнятим способом. Наприклад, пігулки і капсули для перорального введення можуть містити загальноприйняті ексціпієнти, які можуть бути єднальні агенти, наповнювачі, змащуючі агенти, розпушувачі і зволожуючі агенти. Єднальні агенти включають, але не обмежені цим, сироп, аравійську камедь, желатин, сорбіт, трагакант, клей з крохмалю і полівінілпіролідон. Наповнювачі можуть бути лактозою, цукром, мікрокристалічною целюлозою, кукурудзяним крохмалем, фосфатом кальцію і сорбітом. Змащуючі агенти включають, але не обмежені ними, стеарат магнію, стеаринову кислоту, тальк, поліетиленгліколь і кремнезем. Розпушувачі можуть бути картопляним крохмалем і натрієвою сіллю гліколята крохмалю. Зволожуючі агенти можуть бути лаурилсульфатом натрію. Пігулки можуть бути покриті оболонкою відповідно до способів, добре відомих в цій області техніки. Агенти, запропоновані в цій заявці, можуть також бути рідкими препаратами, такі як водні або масляні суспензії, розчини, емульсії, сиропи і еліксири. Агенти можна також включати в препарати у вигляді сухого препарату для відновлення водою або іншим відповідним розчинником перед застосуванням. Такі рідкі препарати можуть містити добавки, такі як суспендуючі агенти, емульгуючі агенти, неводні розчинники і консерванти. Агент, що суспендує, 9 UA 110605 C2 5 10 15 20 25 30 35 40 45 50 55 60 може бути сиропом сорбіту, метилцелюлозою, глюкозний/цукровий сироп, желатин, гідроксиетилцелюлозою, карбоксиметилцелюлозою, гель стеарату алюмінію і гідрогенізовані харчові жири. Емульгуючі агенти, можуть бути лецитином, сорбітан моноолеат і аравійською камеддю. Неводні розчинники можуть бути харчовими маслами, мигдалевим маслом, фракціонованим кокосовим маслом, маслянистими складними ефірами, пропіленгліколем і етиловим спиртом. Консерванти можуть бути метил або пропіл-пара-гідроксибензоат і сорбінову кислоту. Агенти, запропоновані в цій заявці, можна також включати в препарати у вигляді супозиторіїв, які можуть містити основи супозиторіїв, такі як масло какао або гліцериди. Агенти, запропоновані в цій заявці, можна також включати в препарати для інгаляції, які можуть знаходитися у формі, розчину, суспензії або емульсії, які можна вводити у вигляді сухого порошку або у формі аерозоля, використовуючи пропелент, такий як дихлордифторметан або трихлорфторметан. Агенти, запропоновані в цій заявці, можна також включати в препарати у вигляді черезшкірних препаратів, що містять водні або неводні розчинники, такі як креми, мазі, лосьйони, пасти, лікарський пластир, пов'язка або мембрана. Агенти, запропоновані в цій заявці, можна також включати в препарати для парентерального введення, такого як, наприклад, шляхом ін'єкції, внутрішньопухлинної ін'єкції або безперервної інфузії. Препарати для ін'єкцій можуть знаходитися у формі суспензій, розчинів або емульсій в масляних або водних розчинниках і можуть містити агенти для приготування препаратів, що включають, але не обмежені ними, агенти, що суспендують, стабілізуючі і диспергуючі. Агент може бути також запропонований у формі порошку для відновлення відповідним розчинником, що включає, але не обмежений, стерильну апірогенну воду. Агенти, запропоновані в цій заявці, можна також включати в препарати у вигляді депопрепарату, які можна вводити шляхом імплантації або шляхом внутрішньом'язової ін'єкції. Агенти можна готувати з відповідними полімерними або гідрофобними матеріалами (як, наприклад, емульсія в прийнятному маслі), іонообмінними смолами або у вигляді слаборозчинних похідних (таких, як, наприклад, слаборозчинна сіль). в. Дозування Спосіб може включати введення терапевтично ефективної кількості агента пацієнтові, що потребує цього. Терапевтично ефективна кількість, що вимагається для застосування в терапії, варіює залежно від природи стану, підмета лікування, тривалості часу, бажаній для активації TLR, і віку/стану пацієнта. Як правило, проте, дози, вживані для лікування дорослої людини, типово знаходяться в діапазоні від 0,001 мг/кг до приблизно 200 мг/кг на добу. Доза може складати від приблизно 1 мг/кг до приблизно 100 мг/кг на добу. Бажану дозу можна зручно вводити у вигляді одноразової дози або у вигляді багатократних доз, що вводяться через відповідні інтервали, наприклад, у вигляді двох, трьох, чотирьох або більшого числа субдоз на добу. Багатократні дози можуть бути бажані або потрібні. Дозування може складати будь-яке дозування, приблизно 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,7 мг/кг, 0,8 мг/кг, 0,9 мг/кг, 1 мг/кг, 25 мг/кг, 50 мг/кг, 75 мг/кг, 100 мг/кг, 125 мг/кг, 150 мг/кг, 175 мг/кг, 200 мг/кг, 225 мг/кг, 250 мг/кг, 275 мг/кг, 300 мг/кг, 325 мг/кг, 350 мг/кг, 375 мг/кг, 400 мг/кг, 425 мг/кг, 450 мг/кг, 475 мг/кг, 500 мг/кг, 525 мг/кг, 550 мг/кг, 575 мг/кг, 600 мг/кг, 625 мг/кг, 650 мг/кг, 675 мг/кг, 700 мг/кг, 725 мг/кг, 750 мг/кг, 775 мг/кг, 800 мг/кг, 825 мг/кг, 850 мг/кг, 875 мг/кг, 900 мг/кг, 925 мг/кг, 950 мг/кг, 975 мг/кг або 1 мг/кг. 5. Спосіб лікування раку У цій заявці запропонований спосіб лікування раку шляхом введення агента ссавцеві, що потребує цього. Цей спосіб забезпечує імунотерапію проти раку шляхом перетворення пухлинних клітин в стан, що реагує на агоніст TLR, спрямованою внутрішньопухлинною стимуляцією TLR, фокусуючи за допомогою цього імунну відповідь на пухлині. Цей спосіб можна застосовувати для лікування первинних пухлин перед їх хірургічним видаленням в цілях зниження ризику розвитку метастазів, а також для лікування інших вузлів пухлини. Цей спосіб може включати внутрішньопухлинну ін'єкцію. Цей спосіб може мати стадію ін'єкції агента в первинну пухлину перед її хірургічним видаленням для зниження ризику розвитку метастазів, а також для лікування інших вузлів пухлини. Цей спосіб можна застосовувати для лікування будьякої пухлини, яка доступна для внутрішньопухлинної ін'єкції аденовіруса. Відповідно до даного винаходу можна лікувати ряд раків, включаючи карциному, рак сечового міхура (включаючи прискорений і метастатичний рак сечового міхура), молочної залози, ободової кишки (включаючи колоректальний рак), бруньки, печінки, легені (включаючи дрібноклітинний і недрібноклітинний рак легені і аденокарциному легені), яєчника, простати, насінників, сечостатевих шляхів, лімфатичної системи, прямої кишки, гортані, підшлункової залози (включаючи екзокринну карциному підшлункової залози), стравоходу, шлунку, жовчного 10 UA 110605 C2 5 10 15 20 25 30 35 40 45 50 55 60 міхура, шийки матки, щитовидної залози і шкіри (включаючи лускато-клітинний рак); гемопоетичні пухлини лімфоїдної лінії, включаючи лейкоз, гострий лімфоцитарний лейкоз, гострий лімфобластний лейкоз, B-клітинну лімфому, T-клітинну лімфому, лімфому Ходжкина, неходжкинську лімфому, ретикулоендотеліоз, гістиоцитарну лімфому і лімфому Беркитта; гемопоетичні пухлини міелоїдної лінії, включаючи гострий і хронічний мієлогенний лейкоз, міелодиспластичний синдром, міелоїдний лейкоз і промієлоцитарний лейкоз; пухлини центральної і периферичної нервової системи, включаючи астроцитому, нейробластому, гліому і невриноми; пухлини мезенхимного походження, включаючи фібросаркому, рабдоміосаркому і остеосаркому; і інші пухлини, включаючи меланому, пігментну ксеродерму, кератоакантому, семіному, фолікулярний рак щитовидної залози, тератокарциному і рак шлунково-кишкового тракту або порожнини живота і тазу. Спосіб можна комбінувати з іншими способами лікування раку, включаючи застосування імуностимулятора, цитокіна або хіміотерапевтичного агента. Імуностимулятор може бути гормоном росту, пролактіном або вітаміном D. 6. Лікування інфікованих клітин У цій заявці запропонований спосіб лікування інфекційного захворювання шляхом одночасної доставки клітин, трансдукованих агентом. Цей спосіб можна застосовувати для лікування вірусної, бактерійної інфекції, інфекції простими паразитами або грибковій інфекції. Цей спосіб можна застосовувати для лікування будь-якого інфекційного захворювання за допомогою застосування внутрішньоклітинної ін'єкції, що призводить в результаті до аутокринної активації передачі сигналу TLR інфікованих клітин при мінімальному системному ефекті, і за допомогою того що забезпечує залучення природженої імунної відповіді, специфічної до інфікованих клітин. Цей спосіб можна комбінувати з іншими терапіями для лікування вірусних, бактерійних інфекцій, інфекцій простими паразитами або грибкових інфекцій. Цей спосіб може включати введення агента. Цей спосіб може включати введення вакцини, що містить агент, і може застосовуватися в комбінації з іншою вакцинацією, яка може включати конструкцію, експресуючий вибраний антиген. Приклад 1 Синтез біцистронного експресійного вектору TLR5/Флагелін і обробка пухлинних клітин Були створені векторні конструкції для експресії toll-подібного рецептора 5 (TLR-5) і флагеліну CBLB502. Вектор pCD515 використовували як каркас для цих конструкцій. Послідовність кДНК TLR-5 людину і ДНК, що кодує агоніст toll-подібного рецептора CBLB502, були індивідуально злиті з лідерним пептидом, що має походження від лужної фосфатази, забезпечуючи шлях експресованого білка через ендоплазматичний ретикулум (ЕР) і апарат Гольджи у напрямі позаклітинної секреції. Векторна конструкція pCD515-CMV-hTLR5-EFl-502s експресувала форму флагеліну CBLB502 (CBLB502S) і toll-подібний рецептор, що секретується, 5 (TLR5) на клітинній поверхні. Для цього аденовірусного вектора була потрібна модифікація CBLB502 для досягнення його ефективного синтезу і секреції клітинами ссавців. Аденовірусна конструкція містить лідерну нуклеїново-кислотну послідовність (Atgctgctgctgctgctgctgctgggcctgaggctacagctctccctgggc), що має походження від лужної фосфатази, і вона була клонована вище укороченого гена флагеліну Salmonella (див. Burdelya et al., Science 320:226-230 (2008)), щоб кодувати форму флагеліну (тобто CBLB502S), що секретується. Промотор EF1 (чинника елонгації 1α) був клонований вище за цю касету, кодуючою CBLB502S. Ген TLR5 має походження від людини і має амінокислотну послідовність, як показано на фіг. 9. Промотор CMV був клонований вище за ген TLR5. Ця конструкція спільно експресує TLR5 і CBLB502S. Ця конструкція показана на фіг. 1A. Експресійний вектор pCD515-CMV-hTLR5 був сконструйований для експресії форми TLR-5 людини (див. фіг. 9). Аденовірусна конструкція містить сильний промотор CMV, клонований вище за касету hTLR5. Ця конструкція показана на фіг. 1B. Експресійний вектор pCD515-CMV-Sseap-502 був сконструйований для експресії що секретується флагеліну CBLB502 і toll-подібного рецептора. Аденовірусна конструкція містить сильний промотор CMV, клонований вище за лідерну послідовність SEAP 502 гени флагеліну (fliC). Ця конструкція показана на фіг. 1C. [Потрібна інформація про клонування]. Приклад 2 Синтез біцистронного експресійного вектору TLR5/Флагелін і обробка пухлинних клітин Дві репортерні клітинні лінії ссавців, обоє експресуючі NF-κB-реактивний GFP і що відрізняються по їх стану TLR5, були трансдуковані векторними конструкціями pCD515, pCD515CMV-hTLR5-EFl-502s, pCD515-CMV-hTLR5-502, pCD515-CMV-hTLR5 і pCD515-CMV-Sseap-502 (див. таблицю 3 нижче). 11 UA 110605 C2 Таблиця 3 Активність аденовірусних конструкцій в якості активаторів передачі сигналу TLR5 Обробка CBLB502 Ad5 (контроль) (pCD515) Ad5 (TLR5) (pCD515-CMV-hTLR5) Ad5(TLR5) + CBLB502 (pCD515-CMV-hTLR5-EF1-502) Ad5 (CBLB502S) (pCD515-CMV-Sseap-502) Ad5 (TLR5) (pCD515-CMV-hTLR5) + Ad5(CBLB502S) (pCD515-CMV-hTLR5-EF1-502s) Ad5 (CBLB502S+TLR5) (pCD515-CMV-hTLR5-EF1-502s) 5 10 15 20 25 Репортерна лінія Репортерна лінія 293-null293-TLR + + + + + + + + Вектор, спільно експресуючий TLR5 і агоніст TLR5 CBLB502S, був достатній для індукції експресії репортера NF-κB в клітинах 293-null, які не експресують жоден з відомих TLR, і які не можуть активуватися одним агоністом TLR5. Цей експеримент демонструє, що TLR5 і Флагелін CBLB502S можуть діяти in trans або in cis по активації передачі сигналу TLR5. Приклад 3 Для тестування протипухлинних ефектів біцистронного аденовіруса (pCD515-CMV-hTLR5EFl-502s) 10 мл аденовірусної суспензії (1012-1011 МЕ/мл) ін'єктували в одну з двох вирощених підшкірно ізогенних пухлин у мишей Balb/c, що мають походження від клітин карциноми ободової кишки миші CT26, коли пухлини досягали 3-5 мм в діаметрі, і моніторинг розміру пухлини проводили до тих пір, поки контрольні не ін'єктовані пухлини не досягали граничного розміру, що вимагає закінчення експерименту. Контрольних мишей (знову ж таки, одну пухлину з двох на мишу) ін'єктували аденовірусним вектором, експресуючим червоний флуоресцентний білок (RFP). Результати репрезентативного експерименту показані на фіг. 4. Майже повна відсутність росту пухлин, ін'єктованих (pCD515-CMV-hTLR5-EFl-502s), супроводжувалася пониженим ростом не ін'єктованої пухлини у однієї і тієї ж тварини в порівнянні з пухлинами у контрольних тварин, ін'єктованих RFP-експресуючим аденовірусом. Цей результат показує (i) сильний ефект in-cis і (ii) видимий ефект in-trans pCD515-CMV-hTLR5-EF1-502s, що є показником рекрутмента як природженої (цис-еффект), так і адаптивної (транс-ефект) імунної відповіді. Жоден з інших контрольних вірусів, перерахованих в таблиці 1 (тобто AD5 (контроль) і Ad5 (TLR5)), ін'єктованих окремо, не мали ефектів пригнічення росту відносно пухлин. Таким чином, посилена ектопічна експресія TLR5 робить типи пухлинних клітин, які початково були дефіцитними по TLR5, високо реактивними на стимуляцію TLR5, що призводить в результаті до руйнування іммунотолерантності пухлини, сильного залучення природженої імунної відповіді, яка стимулює ефективний розвиток адаптивної імунної відповіді з наступним загальним протипухлинним ефектом. ФОРМУЛА ВИНАХОДУ 30 35 40 45 1. Вектор, що містить першу і другу нуклеїнові кислоти, де перша нуклеїнова кислота кодує tollподібний рецептор, і друга нуклеїнова кислота кодує агоніст toll-подібного рецептора, причому вектор є експресійним вектором, toll-подібний рецептор є TLR-5, агоніст toll-подібного рецептора є флагеліном. 2. Вектор за п. 1, який відрізняється тим, що вектор є експресійним вектором ссавців. 3. Вектор за п. 1, який відрізняється тим, що вектор експресується з аденовірусу, лентивірусу або ліпосоми. 4. Вектор за п. 1, який відрізняється тим, що перша нуклеїнова кислота є формою tollподібного рецептора, що секретується. 5. Вектор за п. 1, який відрізняється тим, що флагелін є формою флагеліну, що секретується. 6. Вектор за п. 5, який відрізняється тим, що форма флагеліну, що секретується, містить тринадцять консервативних амінокислот флагеліну, показаних на фіг. 5, які можуть бути важливі для активності TLR5. 7. Вектор за п. 1, який відрізняється тим, що перша нуклеїнова кислота містить послідовність, як показано на фіг. 7, і друга нуклеїнова кислота містить послідовність, як показано на фіг. 9. 12 UA 110605 C2 5 10 15 20 8. Спосіб лікування раку у ссавця, що включає введення ссавцеві, що потребує цього, агента, що містить вектор за п. 1. 9. Спосіб за п. 8, який відрізняється тим, що рак є пухлиною. 10. Спосіб за п. 9, який відрізняється тим, що пухлина має походження з групи, що складається з раку простати, молочної залози, ободової кишки, стравоходу, шлунку, легені, підшлункової залози, нирки, щитовидної залози, яєчників, гортані або шийки матки. 11. Спосіб за п. 9, який відрізняється тим, що пухлина має походження з групи, що складається з сарком, меланом, лейкозу і лімфом. 12. Спосіб за п. 9, який відрізняється тим, що агент вводять in trans відносно пухлини ссавця. 13. Спосіб за п. 9, який відрізняється тим, що агент вводять безпосередньо в пухлину ссавця. 14. Спосіб за п. 8, який відрізняється тим, що агент вводять в комбінації з імуностимулятором. 15. Спосіб за п. 8, який відрізняється тим, що імуностимулятор вибраний з групи, що складається з гормону росту, пролактину і вітаміну D. 16. Спосіб за п. 15, який відрізняється тим, що гормон росту є соматотропіном. 17. Спосіб за п. 8, який відрізняється тим, що агент вводять в комбінації з цитокіном. 18. Спосіб за п. 17, який відрізняється тим, що цитокін є фактором стовбурових клітин. 19. Спосіб лікування інфекції у ссавця, що включає введення ссавцеві, що потребує цього, агента, що містить вектор за п. 1. 20. Спосіб за п. 19, де інфекція є інфекцією, викликаною організмом, вибраним з групи, що складається з вірусу, бактерії, простих паразитів і гриба. 13 UA 110605 C2 14 UA 110605 C2 15 UA 110605 C2 16 UA 110605 C2 17 UA 110605 C2 18 UA 110605 C2 19 UA 110605 C2 20 UA 110605 C2 21 UA 110605 C2 22 UA 110605 C2 23 UA 110605 C2 24 UA 110605 C2 25 UA 110605 C2 26 UA 110605 C2 27 UA 110605 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of toll-like receptor and agonist for treating cancer
Автори англійськоюGudkov, Andrei, V.
Автори російськоюГудков Андрей В.
МПК / Мітки
МПК: C12N 15/63
Мітки: агоніста, раку, лікування, застосування, рецептора, toll-подібного
Код посилання
<a href="https://ua.patents.su/38-110605-zastosuvannya-toll-podibnogo-receptora-i-agonista-toll-podibnogo-receptora-dlya-likuvannya-raku.html" target="_blank" rel="follow" title="База патентів України">Застосування toll-подібного рецептора і агоніста toll-подібного рецептора для лікування раку</a>
Попередній патент: Кристалічна форма поліциклічної сполуки
Наступний патент: Нове протипухлинне застосування кабазитакселу
Випадковий патент: Композиція хлібопекарського виробу на хмелю