Заміщені 2,3-дигідроімідазо[1,2-c]хіназолінові солі
Номер патенту: 111604
Опубліковано: 25.05.2016
Автори: Мюллер Хартвіг, Петерс Ян Георг, Мілітцер Ханс-Крістіан
Формула / Реферат
1. Дигідрохлоридна сіль 2-аміно-N-[7-метокси-8-(3-морфолін-4-ілпропокси)-2,3-дигідроімідазо[1,2-c]хіназолін-5-іл]піримідин-5-карбоксаміду формули (II)
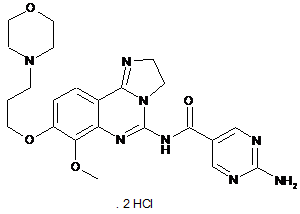 (II)
(II)
або її сольват, гідрат або таутомер.
2. Дигідрохлоридна сіль формули (II) за п. 1, яка знаходиться у кристалічній формі.
3. Спосіб одержання дигідрохлоридної солі за п. 1 або 2, де в зазначеному способі здійснюють додавання хлористоводневої кислоти до сполуки формули (І):
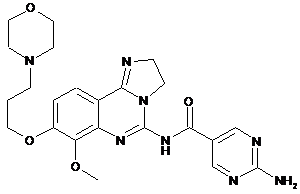 , (І)
, (І)
переважно у суспензії,
таким чином забезпечуючи зазначену дигідрохлориду сіль формули (II):
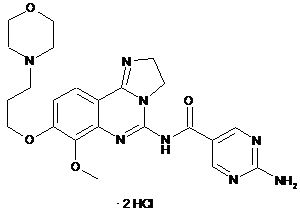 (II).
(II).
4. Спосіб за п. 3, де в зазначеному способі здійснюють:
a) додавання хлористоводневої кислоти, такої як водний розчин хлористоводневої кислоти (32 %), наприклад, до суспензії зазначеної сполуки формули (І) у середовищі, такому як вода, наприклад, при температурі від точки замерзання суміші до точки кипіння суміші, наприклад при температурі 20 °C (+-2°), до досягнення рН 3-4;
b) перемішування отриманої суміші при температурі від точки замерзання суміші до точки кипіння суміші, наприклад при кімнатній температурі, наприклад, впродовж періоду часу, такого як більше ніж, наприклад, 10 хвилин; та, необов'язково,
c) відфільтровування отриманої твердої речовини та промивання осаду на фільтрі, наприклад, водою, потім доведення рН фільтрату до рН 1,8-2,0, використовуючи хлористоводневу кислоту, таку як, наприклад, водний розчин хлористоводневої кислоти (32 %); та, необов'язково,
d) перемішування суміші впродовж періоду часу, такого як, наприклад, 10 хвилин, при температурі від точки замерзання до точки кипіння суміші, наприклад при кімнатній температурі, додавання етанолу, що супроводжують додатковим перемішуванням впродовж періоду часу, наприклад, 10 хвилин; та, необов'язково,
e) додавання зародків кристалів, що необов'язково супроводжують додаванням етанолу впродовж періоду часу, наприклад, 5 годин; та, необов'язково,
f) відфільтровування отриманого дигідрохлориду формули (II), необов'язково промивання сумішшю вода-етанол та необов'язково висушування, наприклад, у вакуумі,
таким чином, забезпечуючи одержання дигідрохлоридної солі за п. 1 або 2.
5. Спосіб за п. 3, де в зазначеному способі здійснюють:
a) додавання зазначеної хлористоводневої кислоти до зазначеної сполуки формули (І), наприклад, у суміші ацетон/вода або етанол/вода; та, потім, необов'язково,
b) нагрівання при температурі від точки кипіння до точки замерзання цієї суміші, наприклад, такій як 40-60 °C, наприклад, такій як 50 °C, впродовж періоду часу, наприклад, переважно від 0,2 до 2 годин, такого як, наприклад, 0,5 години; потім, необов'язково,
c) додаткове нагрівання при температурі від точки кипіння до точки замерзання цієї суміші, наприклад, такій як 30-40 °C, наприклад, такій як 35 °C, впродовж періоду часу, наприклад, такого як 1-4 години, з необов'язковим перемішуванням зазначеної суспензії при температурі від точки кипіння до точки замерзання цієї суміші, наприклад, такій як 10-45 °C, наприклад, такій як 35 °C, впродовж періоду часу, наприклад, переважно від 12 до 72 годин, наприклад, такого як 72 години, що необов'язково супроводжують перемішуванням зазначеної суспензії при температурі від точки замерзання цієї суміші до точки кипіння цієї суміші, наприклад, такій як кімнатна температура, впродовж періоду часу від 0 до 4 годин, наприклад, такого як 2 години; та, необов'язково,
d) фільтрування, необов'язково промивання та висушування,
таким чином, забезпечуючи одержання дигідрохлоридної солі за п. 1 або 2.
6. Спосіб за п. 3 або 5, у якому зазначена хлористоводнева кислота являє собою концентрований водний розчин хлористоводневої кислоти (36 % НСl) та її додають до зазначеної сполуки формули (І) у суміші ацетон/вода (8:2 об./об.), що супроводжують нагріванням при температурі 50 °C, впродовж періоду часу 0,5 години, що далі супроводжують додатковим нагріванням, при температурі 35 °C, впродовж періоду часу 72 години, далі з перемішуванням зазначеної суспензії при кімнатній температурі, впродовж періоду часу 2 години, що супроводжують фільтруванням, промиванням за допомогою суміші ацетон/вода та висушуванням у вакуумній печі (наприклад, 40 °C, 100 мбар, 16 год.), таким чином, забезпечуючи одержання зазначеної дигідрохлоридної солі за п. 1 або 2.
7. Застосування сполуки формули (І)
 (І)
(І)
для одержання дигідрохлоридної солі формули (II):
 (II).
(II).
8. Дигідрохлоридна сіль за п. 1 або 2 для лікування та/або профілактики хвороби.
9. Застосування дигідрохлоридної солі за п. 1 або 2 для одержання лікарського засобу для лікування та/або профілактики хвороби, зокрема гіперпроліферативного розладу та/або розладу ангіогенезу, особливо для лікування або профілактики раку, зокрема раку легень, особливо недрібноклітинної карциноми легень, колоректального раку, меланоми, раку підшлункової залози, гепатоцитної карциноми або раку молочної залози.
10. Застосування дигідрохлоридної солі за п. 1 або 2 для лікування та/або профілактики хвороби, вибраної з гіперпроліферативного розладу та/або розладу ангіогенезу, особливо для лікування або профілактики раку, зокрема раку легень, особливо недрібноклітинної карциноми легень, колоректального раку, меланоми, раку підшлункової залози, гепатоцитної карциноми або раку молочної залози.
11. Застосування за п. 9 або 10, де раком є лімфома.
12. Застосування за п. 11, де зазначена лімфома представлена СНІД-пов'язаною лімфомою, неходжкінською лімфомою, шкірною Т-клітинною лімфомою, лімфомою Беркіта, ходжкінською лімфомою та лімфомою центральної нервової системи.
13. Застосування за п. 11 або 12, де зазначена лімфома представлена неходжкінською лімфомою.
14. Фармацевтична композиція, що містить дигідрохлориду сіль за п. 1 або 2.
15. Фармацевтична композиція, що містить дигідрохлориду сіль за п. 1 або 2 та додатковий фармацевтичний агент.
16. Фармацевтична комбінація, що містить дигідрохлориду сіль за п. 1 або 2 та один або більше додаткових фармацевтичних агентів.
17. Фармацевтична комбінація за п. 16, у якій зазначений додатковий фармацевтичний агент вибирають з таких як: 131I-chTNT, абарелікс, абіратерон, акларубіцин, альдеслейкін, алемтузумаб, алітретиноїн, альтретамін, аміноглутетимід, амрубіцин, амсакрин, анастрозол, арглабін, триоксид арсенію, аспарагіназа, азацитидин, базиліксимаб, BAY 80-6946, BAY 1000394, BAY 86-9766 (RDEA 119), белотекан, бендамустин, бевацизумаб, бексаротен, бікалутамід, бісантрен, блеоміцин, бортезоміб, бусерелін, бусульфан, кабазитаксел, кальцію фолінат, кальцію левофолінат, капецитабін, карбоплатин, кармофур, кармустин, катумаксомаб, целекоксиб, целмолейкін, цетуксимаб, хлорамбуцил, хлормадинон, хлорметин, цисплатин, кладрибін, клодронова кислота, клофарабін, крисантаспаз, циклофосфамід, ципротерон, цитарабін, дакарбазин, дактиноміцин, дарбепоетин-альфа, дасатиніб, даунорубіцин, децитабін, дегарелікс, денілейкіну дифтитокс, деносумаб, деслорелін, диброспідію хлорид, доцетаксел, доксифлуридин, доксорубіцин, доксорубіцин+естрон, екулізумаб, едреколомаб, еліптинію ацетат, елтромбопаг, ендостатин, еноцитабін, епірубіцин, епітіостанол, епоетин-альфа, епоетин-бета, ептаплатин, ерибулін, ерлотиніб, естрадіол, естрамустин, етопозид, еверолімус, екземестан, фадрозол, філграстим, флударабін, фторурацил, флутамід, форместан, фотемустин, фулвестрант, нітрат галію, ганірелікс, гефітиніб, гемцитабін, гемтузумаб, глутоксим, госерелін, гістаміну дигідрохлорид, гістрелін, гідроксикарбамід, I-125 зерна, ібандронова кислота, ібритумомабу тіуксетан, ідарубіцин, іфосфамід, іматиніб, іміквімод, імпросульфан, інтерферон-альфа, інтерферон-бета, інтерферон-гамма, іпілімумаб, іринотекан, іксабепілон, ланреотид, лапатиніб, леналідомід, ленограстим, лентинан, летрозол, лейпрорелін, левамізол, лізурид, лобаплатин, ломустин, лонідамін, мазопрокол, медроксипрогестерон, мегестрол, мелфалан, мепітіостан, меркаптопурин, метотрексат, метоксален, метил-амінолевулінат, метилтестостерон, міфамуртид, мілтефозин, міриплатин, мітобронітол, мітогуазон, мітолактол, мітоміцин, мітотан, мітоксантрон, недаплатин, неларабін, нілотиніб, нілутамід, німотузумаб, німустин, нітракрин, офатумумаб, омепразол, опрелвекін, оксаліплатин, р53 генна терапія, паклітаксел, паліфермін, паладій-103 зерна, памідронова кислота, панітумумаб, пазопаніб, пегаспаргаз, ПЕГ-епоетин-бета (метокси-ПЕГ-епоетин-бета), пегфілграстим, пегінтерферон альфа-2b, пеметрексед, пентазоцин, пентостатин, пепломіцин, перфосфамід, піцибаніл, пірарубіцин, плериксафор, плікаміцин, поліглусам, поліестрадіолу фосфат, полісахарид-К, порфімер натрію, пралатрексат, преднімустин, прокарбазин, квінаголід, ралоксифен, ралтитрексед, ранімустин, разоксан, регорафеніб, ризедронова кислота, ритуксимаб, ромідерсин, роміплостим, сарграмостим, сипулейцел-Т, сизофіран, собузоксан, натрію гліцидидазол, сорафеніб, стрептозоцин, сунітиніб, талапорфін, тамібаротен, тамоксифен, тазонермін, тецелейкін, тегафур, тегафур+гімерацил+отерацил, темопорфін, темозоломід, темсиролімус, теніпозид, тестостерон, тетрофосмін, талідомід, тіотепа, тимальфазин, тіогуанін, тоцилізумаб, топотекан, тореміфен, тозитумомаб, трабектедин, трастузумаб, треосульфан, третиноїн, трилостан, трипторелін, трофосфамід, триптофан, убенімекс, валрубіцин, вандетаніб, вапреотид, вемурафеніб, вінбластин, вінкристин, віндезин, вінфлунін, вінорелбін, вориностат, ворозол, ітрій-90 скляні мікросфери, зиностатин, зиностатину стималамер, золедронова кислота, зорубіцин.
18. Спосіб лікування або профілактики хвороби, зокрема гіперпроліферативного розладу та/або розладу ангіогенезу, особливо для лікування або профілактики раку, зокрема раку легень, особливо недрібноклітинної карциноми легень, колоректального раку, меланоми, раку підшлункової залози, гепатоцитної карциноми або раку молочної залози, у суб'єкта, який включає введення зазначеному суб'єкту терапевтично ефективної кількості дигідрохлоридної солі за п. 1 або 2.
Текст
Реферат: Даний винахід стосується: дигідрохлоридної солі 2-аміно-N-[7-метокси-8-(3-морфолін-4-ілпропокси)-2,3-дигідроімідазо-[1,2с]хіназолін-5-іл]піримідин-5-карбоксаміду формули (II) O N N N O N O N H N O N . 2 HCI або її таутомеру, сольвату або гідрату; NH2 (II) UA 111604 C2 (12) UA 111604 C2 способів одержання зазначеної дигідрохлоридної солі; зазначеної дигідрохлоридної солі для лікування та/або профілактики хвороби; застосування зазначеної дигідрохлоридної солі для одержання лікарського засобу для лікування та/або профілактики хвороби, зокрема гіперпроліферативного розладу та/або розладу ангіогенезу, особливо для лікування або профілактики раку, зокрема раку легені, особливо недрібноклітинної карциноми легені, колоректального раку, меланоми, раку підшлункової залози, гепатоцитної карциноми або раку молочної залози; фармацевтичної композиції, що містить зазначену дигідрохлоридну сіль; та фармацевтичної комбінації, що містить зазначену сіль даного винаходу у комбінації з одним або більшою кількістю додаткових фармацевтичних агентів. UA 111604 C2 5 ПМ-7808 ЗАМІЩЕНІ 2,3-ДИГІДРОІМІДАЗО[1,2-c]ХІНАЗОЛІНОВІ СОЛІ Даний винахід відноситься: до дигідрохлоридної солі 2-аміно-N-[7-метокси-8-(3-морфолін-4-ілпропокси)-2,3дигідроімідазо-[1,2-c]хіназолін-5-іл]піримідин-5-карбоксаміду формули (II): O N N N O O N H N O N N NH2 . 2 HCl 10 15 20 (II), або до її таутомеру, сольвату або гідрату, (яку далі у цьому описі називають “сіль даного винаходу” або “дигідрохлоридна сіль”); - до способів одержання зазначеної солі даного винаходу; - до зазначеної солі даного винаходу для лікування та/або профілактики хвороби; - до застосування зазначеної солі даного винаходу для одержання лікарського засобу для лікування та/або профілактики хвороби, зокрема гіпер-проліферативного розладу та/або розладу ангіогенезу, особливо для лікування або профілактики раку, зокрема раку легені, особливо недрібноклітинної карциноми легені, колоректального раку, меланоми, раку підшлункової залози, гепатоцитної карциноми або раку молочної залози; - до фармацевтичної композиції, що включає зазначену сіль даного винаходу; та - до фармацевтичної комбінації, що включає зазначену сіль даного винаходу у комбінації з одним або більшою кількістю додаткових фармацевтичних агентів. Передумови створення винаходу Сполука формули (I): O N N N O N O O N H N N NH2 (I), 25 30 35 40 (яку далі у цьому описі називають “сполука формули (I)” або “вільна основа”), являє собою запатентований протираковий агент з новим механізмом дії, що інгібує фосфатидилінозитол-3кінази Класу I (PI3K). Цей клас кіназ являє собою важливу ціль, так як PI3K відіграють головну роль у трансдукції клітинних сигналів від поверхневих рецепторів для виживання та проліферації. Сполука формули (I) показує широкий спектр активності проти пухлин багатьох гістологічних видів, як in vitro, так і in vivo. Зазначена сполука формули (I) може бути синтезована відповідно до способів, представлених у міжнародній патентній заявці PCT/EP2003/010377, опублікованій як WO 04/029055 A1 08 квітня 2004 року, (яка включена у даний опис шляхом посилання у її повноті), на стор. 26 і далі. Більше того, зазначена сполука формули (I) представлена у міжнародній патентній заявці PCT/US2007/024985, опублікованій як WO 2008/070150 A1 12 червня 2008 року, (яка включена у даний опис шляхом посилання у її повноті), у вигляді сполуки Прикладу 13: 2-аміно-N-[7метокси-8-(3-морфолін-4-ілпропокси)-2,3-дигідроімідазо[1,2-c]хіназолін-5-іл]піримідин-5карбоксамід. Додатково, зазначена сполука формули (I), у WO 2008/070150, описана на стор. 9 і далі, та може бути синтезована відповідно до способів, представлених там на стор. 42 і далі. 1 UA 111604 C2 5 10 Дані біологічних досліджень для зазначеної сполуки формули (I) представлені у цій заявці на стор. 101 - 107. Зазначена сполука формули (I) може існувати у одній або багатьох таутомерних формах: таутомери, що іноді називаються таутомерами протонного зсуву, являють собою дві або більше сполук, які пов’язані між собою міграцією атому водню, що супроводжується міграцією одного або більше простих зв’язків та одного або більше суміжних подвійних зв’язків. Наприклад, сполука формули (I) може існувати у таутомерній формі (Ia), таутомерній формі (Ib) або таутомерній формі (Ic), або може існувати у вигляді суміші будь-яких з цих форм, як показано нижче. Передбачається, що всі такі таутомерні форми включаються у обсяг даного винаходу. O N N N (Ia) O NH N O O N N NH 2 O N N N (Ib) O N N O HO N N NH 2 O N N N (Ic) O N N O O N N 15 NH 2 Зазначена сполука формули (I) може існувати у вигляді сольвату: сольват для цілі даного винаходу являє собою комплекс розчиннику та сполуки формули (I) у твердому стані. Приклади сольватів включають, не обмежуючись наведеними, комплекси сполуки даного винаходу з етанолом або метанолом. Зазначена сполука формули (I) може існувати у вигляді гідрату: Гідрати являють собою 2 UA 111604 C2 5 10 15 20 25 специфічну форму сольвату, у якій розчинником є вода. Технічна проблема, яку необхідно вирішити: Загалом, для даної фармацевтично активної сполуки, фармацевтично прийнятні форми зазначеної даної фармацевтично активної сполуки є бажаними, з погляду покращення фармацевтичної ефективності зазначеної фармацевтично активної сполуки, наприклад, покращення фізико-хімічних характеристик, таких як хімічна стабільність, фізична стабільність, розчинність in vivo, покращення абсорбції фармацевтично активної сполуки in vivo, тощо. Крім того, в ідеалі лікарська речовина має бути у стабільній кристалічній формі, яка може бути одержана надійним шляхом. Аморфні або кристалічні форми низького порядку (наприклад, мезоморфні форми) є менш привабливими, так як вони мають ризик подальшої зміни форми та зміни фізичних властивостей. Однак, зазначена сполука формули (I) (яка є вільною основою) може бути одержана тільки у мезоморфній формі, яка є стійкою у твердій формі, але нестійкою при 70 °C у кислому водному середовищі та має зазначений вище ризик подальшої зміни форми. Утворення кристалічної сольової форми вільної основи (I) мало б вирішити зазначену вище проблему, так як властивості цієї форми є кращими у порівнянні із властивостями вільної основи (I). У своїх спробах одержати кристалічні сольові форми сполуки (I), Заявники виявили, що одержання кристалічних сольових форм сполуки (I) є не таким легким, як можна було б очікувати для сполуки, що має основні центри. Більше того, сполука формули (I) показує дуже низьку розчинність у воді та більшості органічних розчинників. З двома дуже основними центрами (Таблиця 1, дивись нижче), розчинність значно покращується у кислому середовищі. Отже, очищення та кінцева обробка сполуки формули (I) є складною задачею. Наступна структура показує сполуку формули (I), для якої розраховані pKa значення представлені у дужках. Сполука формули (I) O N (~ 7,5) (~ 10) N N O N O O N H N N NH2 30 Таблиця 1 pKa значення сполуки формули (I): функц. група / pKa значення pKa (Імідазоліноаміндин) pKa (Морфолін) pKa (Амінопіримідин) 35 40 експериментальне розраховане 10,1 7,43 – 7,5 1,99 - 2,11 Більш особливо, що стосується унікальної хімічної структури сполуки формули (I), дивись нижче, фізичні властивості сполуки формули (I) є не тільки складною задачею, що стосується хімічного процесу, обробки лікарської речовини та виробництва лікарського продукту, але додатково створюють також значні проблеми для розробки стабільного та надійного ВЕРХ методу. Було б бажано мати фармацевтично прийнятну та кристалічну форму сполуки формули (I), яка дозволяє робити її надійне очищення, наприклад, шляхом кристалізації, приймаючи до уваги складні, специфічні технічні проблеми та дуже низьку розчинність у воді, та з якою легко працювати (наприклад, яка являє собою сипучу тверду речовину). Вирішення технічної проблеми: Були зроблені різні спроби для одержання кристалічних солей сполуки формули (I). Доведено, що утворення кристалічних сольових форм є складним, так як загалом не було 3 UA 111604 C2 5 знайдено ніякого вирішення проблеми та у декількох випадках утворювалися смоло подібні липкі матеріали. Неочікувано, та це представляє основу даного винаходу, було виявлено, що дигідрохлоридна сіль сполуки формули (I) даного винаходу (ніякого специфічного розкриття якого не відомо Заявнику з попереднього рівня техніки) має технічно кращі властивості, як видно зокрема у Експериментальній частині та Заключній частині даного тексту. Таким чином, даний винахід відноситься: до дигідрохлоридної солі 2-аміно-N-[7-метокси-8-(3-морфолін-4-ілпропокси)-2,3дигідроімідазо-[1,2-c]хіназолін-5-іл]піримідин-5-карбоксаміду формули (II): 10 O N N N O O N H N O N N NH2 . 2 HCl 15 20 25 30 (II), або її таутомеру, сольвату або гідрату, (які далі у цьому описі називають “сіль даного винаходу” або “дигідрохлоридна сіль”); - до способів одержання зазначеної солі даного винаходу; - до зазначеної солі даного винаходу для лікування та/або профілактики хвороби; - до застосування зазначеної солі даного винаходу для одержання лікарського засобу для лікування та/або профілактики хвороби, зокрема гіпер-проліферативного розладу та/або розладу ангіогенезу, більш особливо для лікування або профілактики раку, зокрема недрібноклітинної карциноми легені, колоректального раку, меланоми, раку підшлункової залози, гепатоцитної карциноми або раку молочної залози; - до фармацевтичної композиції, що включає зазначену сіль даного винаходу; та - до фармацевтичної комбінації, що включає зазначену сіль даного винаходу у комбінації з одним або більшою кількістю додаткових фармацевтичних агентів. Способи одержання солі даного винаходу Даний винахід також відноситься до способу одержання дигідрохлоридної солі формули (II) даного винаходу, який включає додавання хлористоводневої кислоти до сполуки формули (I), або, навпаки, додавання сполуки формули (I) до хлористоводневої кислоти. Відповідно до варіанту втілення даного винаходу, зазначений спосіб одержання дигідрохлоридної солі формули (II) даного винаходу включає додавання хлористоводневої кислоти до сполуки формули (I): O N N N O N O O N H N N NH2 (I), 35 переважно у суспензії, таким чином утворюючи зазначену дигідрохлориду сіль формули (II): 4 UA 111604 C2 O N N N O N O O N H N . 2 HCl 5 10 15 20 25 30 35 40 45 50 N NH2 (II). Відповідно до варіанту втілення даного винаходу, зазначений спосіб одержання дигідрохлоридної солі формули (II) даного винаходу включає: a) додавання хлористоводневої кислоти, такої як водний розчин хлористоводневої кислоти (32%) наприклад, до суспензії зазначеної сполуки формули (I) у середовищі, такому як вода, наприклад, при температурі від точки замерзання суміші до точки кипіння суміші, наприклад при температурі 20 °C (+-2°), поки pH не досягне 3 - 4; b) перемішування отриманої суміші при температурі від точки замерзання суміші до точки кипіння суміші, наприклад, при кімнатній температурі, наприклад, впродовж періоду часу, такого як впродовж більше, ніж, наприклад, 10 хвилин; та, необов’язково c) відфільтровування отриманої твердої речовини та промивання осаду на фільтрі, такого як, наприклад, промивання водою, далі доводячи pH фільтрату до pH 1,8 – 2,0, використовуючи хлористоводневу кислоту, таку як, наприклад, водний розчин хлористоводневої кислоти (32%); та, необов’язково, d) перемішування суміші впродовж періоду часу, такого як 10 хвилин, наприклад, при температурі від точки замерзання до точки кипіння суміші, наприклад, при кімнатній температурі наприклад, додавання етанолу, що супроводжують додатковим перемішуванням впродовж періоду часу, такого як, наприклад, 10 хвилин; та, необов’язково, e) додавання зародків кристалів, що необов’язково супроводжують додаванням етанолу протягом періоду часу, такого як, наприклад, 5 годин; та, необов’язково, f) відфільтровування отриманого дигідрохлориду формули (II), необов’язково промиваючи водно-етанольною сумішшю та необов’язково висушуючи, наприклад, у вакуумі, таким чином, забезпечуючи одержання дигідрохлоридної солі формули (II) даного винаходу. Відповідно до варіанту втілення даного винаходу, зазначений спосіб одержання дигідрохлоридної солі формули (II) даного винаходу включає: a) додавання зазначеної хлористоводневої кислоти до зазначеної сполуки формули (I) у суміші ацетон/вода або етанол/вода, наприклад; та, потім, необов’язково, b) нагрівання при температурі від точки кипіння до точки замерзання цієї суміші, такій як при 40 - 60 °C наприклад, такій як, наприклад, при 50 °C, впродовж періоду часу, наприклад, переважно від 0,2 до 2 годин, такого як, наприклад, 0,5 години; потім, необов’язково, c) додаткове нагрівання при температурі від точки кипіння до точки замерзання цієї суміші, такій як, наприклад, при 30 - 40 °C, такій як, наприклад, при 35 °C, впродовж періоду часу, такого як, наприклад, 1 - 4 годин, з необов’язковим перемішуванням зазначеної суспензії при температурі від точки кипіння до точки замерзання цієї суміші, такій як, наприклад, 10 - 45 °C, такій як, наприклад, 35 °C, впродовж періоду часу, наприклад, переважно від 12 до 72 годин, такого як, наприклад, 72 годин, що необов’язково супроводжують перемішуванням зазначеної суспензії при температурі від точки замерзання суміші до точки кипіння суміші, такій як, наприклад, при кімнатній температурі, впродовж періоду часу від 0 до 4 годин, такого як, наприклад, 2 години; та, необов’язково, d) фільтрування, необов’язково промивання та сушіння, таким чином, забезпечуючи одержання дигідрохлоридної солі формули (II) даного винаходу. Відповідно до варіанту втілення даного винаходу, зазначений спосіб одержання дигідрохлоридної солі формули (II) даного винаходу є наступним: зазначена хлористоводнева кислота являє собою концентрований водний розчин хлористоводневої кислоти (1,33 г, 36% HCl) та її додають до зазначеної сполуки формули (I) у суміші ацетон / вода (50 мл, 8:2 об’єм/об’єм), що супроводжують нагріванням при температурі 50 °C, впродовж періоду часу - 0,5 години, потім супроводжують додатковим нагріванням при температурі 35 °C, впродовж періоду часу - 72 години, потім з перемішуванням зазначеної суспензії при кімнатній температурі, впродовж періоду часу - 2 години, що супроводжують 5 UA 111604 C2 5 фільтруванням, промиванням сумішшю ацетон/вода, та висушуванням у вакуумній печі (40 °C, 100 мбар, 16 год.), таким чином, забезпечуючи одержання зазначеної дигідрохлоридної солі формули (II) даного винаходу. ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА У наступному тексті використовуються наступні терміни та абревіатури: “сполука формули (I)” або “вільна основа” означає 2-аміно-N-[7-метокси-8-(3-морфолін-4ілпропокси)-2,3-дигідроімідазо[1,2-c]хіназолін-5-іл]піримідин-5-карбоксамід формули (I) : O N N N O O N H N O N N NH2 (I), 10 15 1. який являє собою сполуку Прикладу 13 WO 2008/070150 A1, як показано нижче. “DS” означає “ лікарську речовину”, тобто “сполуку формули (I)” або “вільну основу” “дигідрохлоридна сіль формули (II)” або “сіль формули (II)” означає дигідрохлорид 2-аміноN-[7-метокси-8-(3-морфолін-4-ілпропокси)-2,3-дигідроімідазо[1,2-c]хіназолін-5-іл]піримідин-5карбоксаміду, який являє собою дигідрохлоридну сіль формули (II): O N N N O N O O N H N N NH2 . 2 HCl (II) ; N 20 25 30 35 “NMP” означає N-метилпіролідинон (розчинник) : O 2. “XRPD” означає “рентгенівську порошкову дифрактометрію”: прилад, використовуваний для зазначених вимірювань, є наступним: STOE Система порошкової дифракції: Дифрактометр: Пропускання Монохроматор: Вигнутий германій (111) Генератор: 45 кВ, 35 мA Довжина хвилі: 1,540598 Cu Детектор: Лінійний позиційно-чутливий детектор (PSD) Режим сканування: Пропускання / Рухома PSD / Фіксована Омега Тип сканування: 2Тета:Омега Кімнатні умови : 25 °C, 40 – 60 % відносна вологість “IC” означає “іонообмінну хроматографію”: Прилад: іонообмінний хроматограф із супресорною системою Merck Детекція: Детектор провідності, Fa. Metrohm “TGA” означає “термогравіметричний аналіз”: 6 UA 111604 C2 5 10 15 20 25 Прилад: термогравіметричний аналізатор TGA 7 або TGA 850e Виробник: Perkin Elmer або Mettler-Toledo -1 Швидкість нагрівання: 10 K хвил. або 5 K/хвил. Продувний газ: азот, 20-30 мл/хвил. Тигель: відкритий платиновий тигель Підготовка зразку : ніякої “DSC” означає “Диференційну скануючу калориметрію” : Прилад: Диференційний скануючий калориметр DSC 7 або Pyris-1 або DSC 821e Виробник: Perkin-Elmer або Mettler-Toledo Швидкість нагрівання: 2 та 20 K/хвил. або 5 K/хвил. Продувний газ: азот Тигель : негерметичний алюмінієвий тигель Підготовка зразку : ніякої. „DVS“ означає „Динамічну сорбцію парів“ : Прилад: Аналізатор динамічної сорбції парів IGA Sorp від фірми Hiden Analytical. Робоча температура становила 25 °C. Підготовка зразку: ніякої. “перев.” або “переважн.” означає “переважно”. Загальне CD: (суб’єктивне) судження стосовно загальної здатності до створення хімічної речовини. Приклад 1 : дигідрохлоридна сіль формули (II) До суспензії сполуки формули I (3 г) у суміші ацетон/ вода (50 мл, 8:2 об./об.) додають концентрований водний розчин хлористоводневої кислоти (1,33 г, 36% HCl), що не приводить до видимих змін. Отриману суміш перемішують при 50 °C впродовж 0,5 години, а потім при 35 °C впродовж 3 днів, далі при кімнатній температурі впродовж 2 годин. Отриманий твердий матеріал виділяють фільтруванням, промивають сумішшю ацетон/ вода (8:2 об./об.) та сушать у вакуумній печі (40 °C, 100 мбар, 16 год.), що приводить до одержання бажаного матеріалу (3,2 г, 93% вихід). Примітка: тверда речовина має придатні фільтраційні характеристики. Характеристика: 30 Аналітичний метод ВЕРХ, мас.% DS IC, мас.% форма TGA DSC Результати Коментарі 72,8 мас.%, Якість значно покращена ~97,8% площ.%, сума домішок ~2,2% відносно Партії A сольова 10,3 мас.% 13,8% до 70 °C Широкі піки (60°, 120 °C) Відмінності можливі через комплексування розчинників XRPD 40 кристалічна Мікроскопія 35 Мікрокристалічна, агломерати XRPD результати узгоджуються з тим, що утворена тверда речовина є кристалічною. IC результати узгоджуються з утворенням дигідрохлориду. TGA результати узгоджуються з тим, що тверда речовина містить 13-14% розчиннику та/або води. Аналітична ВЕРХ мас.% DS узгоджуються з тим, що дигідрохлоридна тверда речовина містить 13-14% розчиннику та/або води. ВЕРХ площа інтеграції показує 2,2% домішок. Стабільність у вигляді твердої речовини: Дигідрохлорид формули (II) (100 мг з Прикладу 4) зберігають при 90 °C впродовж 1 тижня, потім досліджують за допомогою ВЕРХ. Аналітичний метод ВЕРХ, мас.% DS ВЕРХ, площ.% DS 45 ~1:2-сіль Результати ~ 65,6 мас.% ~ 98,2%; сума домішок ~1,8% Коментарі Стійкий Розчинність у воді: Дигідрохлорид формули (II) (500 мг з Прикладу 4) перемішують при 25 °C впродовж 20 годин у воді (5 мл). Отриману суспензію фільтрують через мембранний фільтр, вимірюють pH отриманого розчину та розчинність визначають за допомогою ВЕРХ. Твердий матеріал, що залишився на фільтрі, досліджують за допомогою XRPD та TGA. 7 UA 111604 C2 Аналітичний метод розчинність pH Результати > 8,8 мг/100 мл ~ 2,4 XRPD (твердий залишок) кристалічний 10 15 20 Насичений розчин у воді Майже ідентичний; незначне розширення кристалічної гратки (?) 13,9% до 200 °C; 2,4% вище 200 °C TGA (твердий залишок) 5 Коментарі Додаткові дані щодо розчинності: Дигідрохлорид формули (II) перемішують у 20 мл різних розчинників впродовж 20 годин при 25 °C. У всіх водних розчинниках повністю розчинилося приблизно 2 г дигідрохлориду формули (II). Розчинник Розчинність Ацетон 0,3 мг/100 мл - практично нерозчинний Ацетонітрил 1,1 мг/100 мл - практично нерозчинний Етанол 24,8 мг/100 мл - дуже легко розчинний ПЕГ400 301 мг/100 мл - легко розчинний 0,1M HCl ≥ 8800 мг/100 мл - розчинний Буфер pH 4,5 ≥ 8900 мг/100 мл - розчинний Буфер pH 7,0 ≥ 8700 мг/100 мл - розчинний Вода ≥ 9400 мг/100 мл - розчинний Стабільність у розчині: Гідролітична стабільність Різні водні розчини (0,05 % вільної основи формули (I); після додавання 50 % 2-пропанолу, [буферний розчин, відфільтрований за допомогою 0,5 мкм мембранного фільтру]) зберігають при 25 °C та 70 °C впродовж 24 годин та одного тижня. Умови Вода: Спочатку 24 год., 25 °C 24 год., 70 °C 1 тиждень, 25 °C 1 тиждень, 70 °C Буфер pH 7: Спочатку 24 год., 25 °C 24 год., 70 °C 1 тиждень, 25 °C 1 тиждень, 70 °C 0,1M HCl: Спочатку 24 год., 25 °C 24 год., 70 °C 1 тиждень, 25 °C 1 тиждень, 70 °C 0,1 M NaOH: Спочатку 24 год., 25 °C 24 год., 70 °C 1 тиждень, 25 °C 1 тиждень, 70 °C Органічні домішки, Сума всіх [площ. %] Органічні домішки, одинична [площ. %] злегка забарвлений розчин злегка забарвлений розчин злегка забарвлений розчин злегка забарвлений розчин злегка забарвлений розчин 2,79 3,43 58,00 5,33 98,59 0,25 0,23 25,89 0,54 45,44 злегка забарвлений мутний розчин злегка забарвлений мутний розчин злегка забарвлений розчин злегка забарвлений мутний розчин злегка забарвлений розчин 3,15 3,22 56,06 4,85 97,65 0,23 0,20 23,25 0,82 39,01 злегка забарвлений розчин злегка забарвлений розчин злегка забарвлений розчин злегка забарвлений розчин злегка забарвлений розчин 5,87 8,75 92,49 24,27 100,00 1,13 1,90 22,82 7,15 25,48 злегка забарвлений розчин злегка забарвлений розчин злегка забарвлений розчин злегка забарвлений розчин злегка забарвлений розчин 30,72 45,40 99,88 86,64 99,90 6,51 10,02 23,94 22,03 32,63 Зовнішній вигляд ІЧ та Раманівська спектроскопія 8 UA 111604 C2 Прилад та умови вимірювання Фур’є-ІЧ / Фур’є-Раманівський-спектрометр Спектральне розділення Кількість інтерферограм Інтервал хвильових чисел Потужність лазеру Одержання зразку Bruker IFS 66v / Bruker RFS 100 -1 -1 2 см / 2 см 32 / 64 -1 -1 4000 – 500 см / 3500 – 100 см - / 350 мВт KBr таблетка / твердий у пробірці Віднесення характеристичних смуг 5 Таблиця Віднесення характеристичних активних коливань до спектру з ν ≡ валентні коливання; δ ≡ деформаційні коливання; п.п. ≡ поза площини; Встановлена структура ν N-H ν =C-H ν C-H + ν NH ν амід I ν C=C, ν C=N, δ N-H, амід II ν C-O δ =C-H п.п. 10 -1 ІЧ положення смуги [см ] 3336 3176 2942 2687 – 2474 1669 1618 – 1477 1285 812 ν ≡ валентні коливання; δ ≡ деформаційні коливання; п.п. ≡ поза площини ІЧ спектр представлений на Фігурі 1. Раманівський спектр представлений на Фігурі 2. Спектроскопія в УФ та видимій частині спектру Прилад та умови вимірювання Спектрометр в УФ та видимій частині спектру Кювета Інтервал хвильових чисел Одержання зразку Смуги 15 -1 Раманівське положення смуги [см ] 3090 2990 – 2963 1664 1619 – 1476 1291 Varian Cary 4 кварц, 1 см 200-800 нм 4,67 мг / 500 мл води 309 нм Спектр в УФ та видимій частині представлений на Фігурі 3. ЯМР спектроскопія 1 H-ЯМР-спектроскопія Обладнання та експериментальні параметри: ЯМР спектрометр Робоча частота Розчинник Внутрішній стандарт Концентрація Діаметр пробірки Температура Спосіб Спектральна ширина Цифрове розділення Тривалість пульсу Час дослідження Час релаксації Кількість спадів вільної індукції Bruker, модель Avance 500,13 MГц Диметилсульфоксид (ДМСО-d6) Тетраметилсилан (TMS) 3,08 мг/мл розчину 5 мм приблизн. 25 °C режим Фур’є перетворення 20,65 ppm 0,079 Гц/Pt 4,5 мксек., 30° кут нахилу вектору пульсу 6,34 сек. 0,5 сек. 32 9 UA 111604 C2 Структурна формула для віднесення ЯМР сигналів HCl HCl 1 10 10a 9 29 30 26 O 4 3 11 N 8 O 15 12 25 O N 27 2 N 6a N 5 7 O 33 N 13 H 19 23 32 14 N N 17 NH2 21 5 Хімічний зсув, мультиплетність сигналу, відносна кількість ядер: H-атоми(a) Хімічний зсув δ (млн.ч.) H-26 H-29; H-33 H-30; H-32 H-27 -OCH3 H-25 H-2; H-3 H-9 NH2 H-10 H-16; H-20 HCl H-12 10 2,32 3,11; 3,48 3,83; 3,98 3,29 4,00 4,37 4,47; 4,19 7,39 7,54 8,21 8,97 11,1; 12,6 13,4 Мультиплетність та константи взаємодії (b) M M; M M; M M S T T; T D S D S bS; bS bS Кількість ядер H/молекула 2 2; 2 2; 2 2 3 2 2; 2 1 2 1 1; 1 1; 1 1 a) Нумерація відноситься до структурної формули для віднесення ЯМР-сигналів. b) S = Синглет bS = Широкий синглет D = Дублет T = Триплет M = Мультиплет 1 H-ЯМР спектр дигідрохлориду формули (II) представлений на Фігурі 4. 13 C-ЯМР-спектроскопія Обладнання та експериментальні параметри: 15 ЯМР спектрометр Робоча частота Розчинник Внутрішній стандарт Концентрація Діаметр пробірки Температура Спосіб Спектральна ширина Цифрове розділення Тривалість пульсу Час дослідження Час релаксації Кількість спадів вільної індукції Bruker, модель Avance 125,76 MГц Диметилсульфоксид-d6 (ДМСО) Тетраметилсилан (TMS) 37,2 мг/мл розчину 5 мм приблизн. 27 °C режим Фур’є перетворення 240,95 ppm 0,4624 Гц/Pt 11,0 мксек., 90° кут нахилу вектору пульсу 1,08 сек. 4 сек. 256 Хімічний зсув, мультиплетність сигналу, відносна кількість ядер: 10 UA 111604 C2 Хімічний зсув δ (ppm) C-атоми(a) C-26 C-2; C-3 C-29; C-33 C-27 OCH3 C-30; C-32 C-25 C-10a C-9 C-15 C-10 C-6a C-7 C-5 C-11 C-8 C-16; C-20 C-18 C=O Мультиплетність та константи взаємодії (b) 22,73 44,96; 45,65 50,84 53,01 61,24 63,03 66,81 100,79 112,17 118,16 123,86 132,43 133,95 148,58 156,29 156,89 160,20 164,61 175,65 Кількість ядер H/молекула T T; T T T Q T T S D S D S S S S S D S S 1 1; 1 1; 1 1 1 1; 1 1 1 1 1 1 1 1 1 1 1 1; 1 1 1 a) Нумерація відноситься до структурної формули для віднесення ЯМР-сигналів. b) S = синглет (C) D = дублет (CH) T = триплет (CH2) Q = квартет (CH3) 13 C-ЯМР спектри дигідрохлориду формули (II) представлені на Фігурах 5 та 6. Мас-спектрометрія Параметри обладнання 5 Мас-спектрометр Спосіб іонізації Розчинник Waters ZQ ESI (Іонізація методом електророзпилення) CH3CN/H2O Інтерпретація даних 10 Значення маси (m/z) 481,2 354,1 261,7 241,2 15 Відносна інтенсивність (%) 46 5 26 100 Іоноутворення + (M + H) + (C16 H16 N7 O3) +2 (M + 2H + CH3CN) +2 (M + 2H) Мас-спектр дигідрохлориду формули (II) представлений на Фігурі 7. Відноситься до спектру відносних пікових інтенсивностей. Елементний аналіз Елементний аналіз проведений компанією Bayer Industry Services, Leverkusen, Germany. Результати Виміряне [%] Розраховане [%] C H N O Cl 47,5 5,7 19,1 18,1 11,9 49,9 5,5 20,3 11,6 12,8 Розраховане, включаючи 7,0 % води [%] 46,4 5,9 18,8 17,0 11,9 Сума 102,3 100,1 100,0 Елемент 11 Різниця 1,1 0,2 0,3 1,1 0,0 UA 111604 C2 5 10 15 20 Елементний аналіз узгоджується з дигідрохлоридною сіллю формули II з 7% води. Приклад 2: Додатковий спосіб одержання дигідрохлоридної солі формули (II) До суспензії 366 г сполуки формули (I) у 1015 г води при підтриманні температури при 20 °C (+-2°) додають 183 г водного розчину хлористоводневої кислоти (32%) до досягнення pH 3 - 4. Отриману суміш перемішують при кімнатній температурі впродовж більше, ніж 10 хвилин, фільтрують та осад на фільтрі промивають додатковими 82 г води. Фільтрат доводять до pH 1,8 – 2,0, використовуючи водний розчин хлористоводневої кислоти (32%). Цю суміш перемішують впродовж 10 хвилин при кімнатній температурі, додають 146 г етанолу (100%) та перемішують впродовж ще 10 хвилин. Додають 1 г зародків кристалів, а потім 1592 г етанолу впродовж 5 годин. Отриману речовину відділяють фільтруванням, промивають водно-етанольною сумішшю та сушать у вакуумі, що приводить до одержання 410 г (97%) дигідрохлориду формули (II) чистоти >99% відповідно до ВЕРХ. Порівняльний приклад 1: моногідрохлорид сполуки формули (I) До суспензії сполуки формули (I) (0,5 г, 1,04 ммоль) у суміші ацетон / вода (9 мл, 8:2 об./об.) додають розчин концентрованої хлористоводневої кислоти (89 мкл, 1,07 ммоль, 1,0 еквів., 36% HCl). Спостерігається видима зміна у суміші, але прозорого розчину не отримують. Зазначену суміш нагрівають при перемішуванні при 50 °C впродовж 0,5 год., а потім при 35 °C впродовж 3 днів, далі при кімнатній температурі впродовж 2 годин. Суспендовану тверду речовину, що залишилася, виділяють фільтруванням, промивають сумішшю ацетон/вода (8:2 об./об.), та сушать (40 °C, 100 мбар, 16 год.), що приводить до одержання бажаного продукту (0,5 г). Характеристика: Аналітичний метод ВЕРХ, мас.% DS IC, мас.% форма TGA DSC XRPD Мікроскопія 25 30 35 40 сольова Результати Коментарі ~ 85,8 мас.%, ~98,4% площ.%, сума Якість значно покращена домішок ~1,6% відносно Партії A 6,0 мас.% ~1:1-сіль 6,3% до 200 °C Широкий пік при 75 °C Переважно аморфний n. t. Результати показують, що кристалічний моногідрохлорид не утворився. Хоча чистота основи покращилася шляхом експерименту, ніяких додаткових досліджень не проводили, так як матеріал був переважно аморфним. Порівняльний приклад 2 : Біс(гідросульфатна) сіль сполуки формули (I) До суспензії сполуки формули (I) (0,5 г, 0,103 ммоль) у суміші ацетон /вода (9 мл, 9:1 об./об.) додають концентрований розчин сірчаної кислоти (213 мг, 96 % H 2SO4, 2 еквів.). Спостерігається видима зміна у суміші, але прозорого розчину не отримують. Зазначену суміш нагрівають при перемішуванні при 50 °C впродовж 0,5 години, а потім при 35 °C впродовж 3 днів, потім при кімнатній температурі впродовж 2 годин. Суспендовану тверду речовину, що залишилася, виділяють фільтруванням, промивають (суміш ацетон/вода, 9:1 об./об.), та сушать (40 °C, 100 мбар, 16 год.) що приводить до одержання приблизно 30 мг бажаного продукту. Порівняльний приклад 3: сіль лимонної кислоти сполуки формули (I) До суспензії сполуки формули (I) (3,0 г, 6,24 ммоль) у суміші етанол/вода (50 мл, 1:2 об./об.) додають лимонну кислоту (2,4 г, 10,2 ммоль, 1,6 еквів.). Суміш нагрівають при перемішуванні до 35 °C, 25 мл води та 100 мл етанолу додають та перемішування продовжують при 35 °C протягом 2 год. Отриманий прозорий розчин охолоджують до кімнатної температури та перемішування продовжують впродовж 3 днів. Отриману тверду речовину відділяють фільтруванням, промивають за допомогою 10 мл етанолу та сушать (40 °C, 100 мбар, 24 год.), що приводить до одержання бажаного продукту (3,8 г, 90% вихід). Примітка: фільтрування цього матеріалу відбувається дуже повільно. Характеристика: 45 12 UA 111604 C2 Аналітичний метод ВЕРХ, мас.% DS IC, мас.% форма Результати 64,1 мас.%, 98,1 площ.%, сума домішок 1,9% Коментарі 30,2 мас.% > 1:1-сіль сольова DSC 3,8% мас.% до 50 °C; 29,4% при 130 - 200 °C Широкі піки XRPD Кристалічний Мікроскопія Мікрокристалічний; агломерати TGA 5 Всі результати показують, що гомогенна справжня сіль не утворюється, скоріше всього суміш солі лимонної кислоти, вільної основи та/або лимонної кислоти. Стабільність у вигляді твердої речовини: Сіль лимонної кислоти сполуки формули (I) (100 мг з Порівняльного прикладу 3) зберігають при 90 °C впродовж 1 тижня. Аналітичний метод ВЕРХ, мас.% DS ВЕРХ, площ.% DS 10 Плавиться з розкладанням Визначаються значні кількості вільної основи Результати 62,7 мас.% Коментарі Злегка нестабільна; Сума домішок злегка вище (3,7% проти 1,9%) 96,3 % Розчинність у водному розчині: Сіль лимонної кислоти сполуки формули (I) (500 мг з Порівняльного прикладу 3) перемішують при 25 °C впродовж 20 годин у воді (5 мл). Отриману суспензію фільтрують через мембранний фільтр, вимірюють pH розчину та розчинність визначають за допомогою ВЕРХ. Твердий матеріал на фільтрі, що залишився, аналізують за допомогою XRPD та TGA. 15 Аналітичний метод розчинність pH XRPD (твердий залишок) TGA (твердий залишок) 20 25 Результати Коментарі ~ 8,5 мг/100 мл 3,9 Насичений розчин у воді Широкі сигнали Значна зміна; менш кристалічний 4,4% при 30° - 120 °C; 27% при 120° - 250 °C Порівняльний приклад 4: сіль бурштинової кислоти сполуки формули (I) До суспензії сполуки формули (I) (3,0 г 6,24 ммоль) у суміші ацетон / вода (50 мл, 8:2 об./об.) додають бурштинову кислоту (1,48 г, 12,5 ммоль, 2 еквів.), що приводить до утворення білої суспензії. Суміш нагрівають при перемішуванні при 50 °C впродовж 0,5 години, а потім при 35 °C впродовж 3 днів, далі при кімнатній температурі впродовж 2 годин. Зовнішній вигляд суміші значно не змінився протягом цього періоду. Отриману тверду речовину видаляють фільтруванням, промивають декількома мілілітрами суміші ацетон / вода (8:2 об./об.), та сушіть (40 °C, 100 мбар, 16 год.), що приводить до одержання бажаного продукту (3,4 г, 91%). Характеристика: Аналітичний метод Результати Коментарі 75,6 мас.%, ВЕРХ, мас.% DS ~97,6% площ.%, сума домішок ~2,4% IC, мас.% сольова 15,1 мас.% 8,1 мг/100 мл 3,1 кристалічний Коментарі Насичений розчин у воді Майже ідентичний; незначне розширення кристалічної гратки (?) 8% при 30°-90 °C; 2,5% при 100°-150 °C; 14% вище 150 °C Порівняльний приклад 6: сіль метансульфонової кислоти сполуки формули (I) До суспензії сполуки формули (I) (3,0 г, 6,24 ммоль) у суміші ацетон / вода (50 мл, 9:1 об./об.) додають метансульфонову кислоту (1,2 г, 12,5 ммоль, 2 еквів.), що приводить до утворення липкого матеріалу. Зазначену суміш нагрівають при перемішуванні при 50 °C впродовж 0,5 год., а потім при 35 °C впродовж 3 днів. Зовнішній вигляд суміші значно не змінився протягом цього періоду. До цієї суміші додають додатковий ацетон (50 мл) та перемішування продовжують при кімнатній температурі протягом ще 5 днів, що приводить до одержання суспензії разом з липким матеріалом, яку можна фільтрувати. Цю суспензію відділяють фільтруванням, промивають ацетоном та сушать (40 °C, 100 мбар, 16 год.), що приводить до одержання бажаного продукту (3,5 г, 83,3 %). Характеристика: Аналітичний метод ВЕРХ, мас.% DS IC, мас.% форма TGA DSC сольова Результати 62,9 мас.%, ~96,1% площ.%, сума домішок ~3,9% 26,4 мас.% Коментарі ~ 1:2-сіль 6,3% при 30-100 °C; 22% при 220 °C (розклад) Широкі піки XRPD Переважно кристалічний Мікроскопія 25 Коментарі Розчинність у водному розчині: Сіль малеїнової кислоти сполуки формули (I) (500 мг з Порівняльного прикладу 5) перемішують у воді (5 мл) при 25 °C впродовж 20 годин. Отриману суспензію відфільтровують через мембранний фільтр, вимірюють pH розчину, та розчинність визначають за допомогою ВЕРХ. Твердий матеріал, що залишився на фільтрі, аналізують за допомогою XRPD та TGA. Аналітичний метод розчинність pH 10 Результати 59,4 мас.% ~ 96,9% (сума Стійка домішок ~3,1%) Частково аморфний мікрокрист., агломерати Всі результати показують, що може утворюватися кристалічна димезилатна сіль. Очевидно, що оптимальні умови кристалізації не були знайдені та/або димезилат є дуже чутливим до умов його утворення, так як матеріал є частково аморфним. Отримана таким чином поліморфна форма, здається, здатна поглинати розчинники/воду. Стабільність у вигляді твердої речовини: Сіль метансульфонової кислоти сполуки формули (I) (100 мг з Порівняльного прикладу 6) зберігають при 90 °C впродовж 1 тижня. 30 Аналітичний метод ВЕРХ, мас.% DS ВЕРХ, площ.% DS Результати 59,5 мас.% ~ 96,7% (сума домішок ~3,3%) Коментарі стабільна Розчинність у водному розчині: Сіль метансульфонової кислоти сполуки формули (I) (500 мг з Порівняльного прикладу 6) перемішують при 25 °C впродовж 20 год. у воді (5 мл). Зразок майже повністю розчинився. 15 UA 111604 C2 Отриману суміш фільтрують через мембранний фільтр, вимірюють pH розчину, та розчинність визначають за допомогою ВЕРХ. Однак, після фільтрування залишився недостатньо твердий матеріал для подальших досліджень. Аналітичний метод розчинність pH XRPD (твердий залишок) TGA (твердий залишок) Результати > 8,3 мг/100 мл ~ 2,3 n. t. n. t. Коментарі Насичений розчин у воді 5 ВИСНОВКИ З фізико-хімічної точки зору, дигідрохлоридна сіль формули (II) (Приклад 4) даного винаходу забезпечує неочікувані технічні результати, як видно у Прикладах та Порівняльних прикладах, що представлені вище, як підсумовано у Таблиці 5, нижче: 10 Таблиця 5 MeСполука Лимонна Бурштинова Малеїнова сульфоХлористоводнева формули кислота кислота кислота нова Властивість кислота (I) Критерій (Спол. (Спол. Пр. (Спол. Пр. кислота (Пр. 1) (вільна Пр. 3) 4) 5) (Спол. основа) Пр. 6) На основі стехіометрія ~ 1 : 1 ~1:1 ~1:2 ~1:2 1:2 ВЕРХ/IC вихід, хім. спосіб O O O кінцева ━ ━ ━ обробка площ.% чистота + + O O + O ВЕРХ стабільність Розклад O + n.d. ++ n.a. ━ солі з /у воді кристалічність O + O ++ O XRPD ━ 1 тижд. при 95% відн. гідрати ~ 4 H2O волог.; водн. розч. Розчинність у ~ 8,5. воді ~ 5,5 терм. стабільність розчину n.d. терм. стабільність розчину Загальне CD 15 n.d. + O > 8,1 n.d. ━━ ━━ > 8,3 n.d. + > 8,8 n.d. 16 + ━━ _ _ дуже несприятливе _ несприятливе O : несуттєве + : переважне ++ : дуже переважне n.a.: не застосовне ━ O + O 16 год при 25 °C (мг/100 мл) 24 год. при 70 °C; 1 тижд. при 25 °C + ++ O 1 тижд. при 90 °C UA 111604 C2 5 10 15 20 25 30 35 40 45 50 55 60 n.f.: не знайдене n.d.: не знайдене; жодного прозорого розчину після фільтрування, можливо через утворення міцел. По-перше, як показано у Порівняльному прикладі 1, неочікувано, результати показали, що кристалічний моногідрохлорид сполуки формули (I) не утворився: він був в основному аморфним. Навпаки, як показано у Прикладі 1, дигідрохлоридна сіль формули (II) може утворювати кристалічну, стабільну дигідрохлоридну сіль. Кристалічна дигідрохлоридна сіль є стійкою до перетворення у воді знову до вільної основи. Далі, дигідрохлоридна сіль даного винаходу має кращу стабільність у воді у порівнянні з іншими зазначеними солями. Це означає, що сіль у воді не перетворюється знову на вільну основу за умов тестування, тобто осадження вільної основи не відбувається. Кристалічність дигідрохлоридної солі даного винаходу є кращою у порівнянні з моногідрохлоридною сіллю (що, як знайдено за допомогою XRPD, є переважно аморфною). По-друге, як видно з Порівняльного прикладу 5, (характеристична таблиця), з XRPD результатів можна зробити висновки про відмінності у малеатній солі сполуки формули (I) Порівняльного прикладу 5: як зазначено, ці відмінності існують можливо через комплексування розчинників. Додатково, це може бути видно з Порівняльного прикладу 5, що чистота основи не покращувалася шляхом утворення малеатної солі. Навпаки, як показано у Прикладі 1 (дигідрохлоридна сіль даного винаходу), може бути видно, що чистота вільної основи покращувалася шляхом утворення дигідрохлоридної солі. Додатково, якість лікарської речовини покращується при утворенні дигідрохлоридної солі. Більше того, додатково технічно краща властивість дигідрохлоридної солі (II) даного винаходу полягає в тому, що кристалічна сольова форма в ідеалі, більше того, допомогла б покращити процес очищення та кінцеву обробку: вона є стійкою у вигляді твердої речовини та у розчині, та підходить для способу одержання галенових форм (наприклад, сіль даного винаходу розчиняється більш швидко, ніж сполука формули (I) (вільна основа), що являє собою очевидну технічну перевагу. Тому взагалі, як видно з Таблиці 5, дивись вище, дигідрохлорид є неочікувано кращим з точки зору чистоти, стійкості солі, кристалічності та розчинності у воді. Більше того, дуже важливо, як видно у PI3Kα та PI3Kβ біохімічних дослідженнях: як вільна основа, так і дигідрохлоридна сіль, показали подібну активність у обох PI3Kα та PI3Kβ біохімічних дослідженнях. Форма дигідрохлоридної солі має трохи кращу ефективність завдяки покращеній розчинності. Цей факт зрозуміло є переважним. Фармацевтичні композиції солі даного винаходу Як зазначено вище, сіль даного винаходу може бути у формі фармацевтичної композиції, яка є готовою до застосування для введення одночасно, паралельно, окремо або послідовно. Компоненти можуть бути введені незалежно один від іншого за допомогою перорального, внутрішньовенного, місцевого шляху, місцевими інгаляціями, внутрішньочеревинним або назальним шляхом. Зазначені композиції можуть бути використані для досягнення бажаного фармакологічного ефекту шляхом введення пацієнту, якому це необхідно. Пацієнт, для цілей даного винаходу, являє собою ссавця, включаючи людину, яка потребує лікування певного хворобливого стану або захворювання. Тому, даний винахід включає сіль даного винаходу, що знаходиться у формі фармацевтичної композиції, яка складається з фармацевтично прийнятного носія та фармацевтично ефективної кількості зазначеної солі. Фармацевтично прийнятний носій являє собою переважно носій, який є відносно нетоксичним та нешкідливим для пацієнта при концентраціях, що відповідають ефективній кількості активного інгредієнту, таким чином, що будь-які побічні ефекти, що можуть бути викликані носієм, не псують корисних ефектів компоненту та/або комбінації. Фармацевтично ефективна кількість комбінації являє собою переважно таку кількість, яка приводить до одержання результату або робить вплив на певний стан, який лікують. Солі даного винаходу можуть бути введені з фармацевтично-прийнятними носіями, добре відомими у даній галузі техніки, використовуючи будь-які ефективні звичайно використовувані лікарські одиничні форми, включаючи препарати з миттєвим, повільним та відстроченим вивільненням, перорально, парентерально, місцево, назально, офтальмологічно, очно, під’язично, ректально, вагінально та подібним способом. Для перорального введення, солі можуть бути сформульовані у тверді або рідкі препарати, такі як капсули, пігулки, таблетки, пастилки, льодяники, таблетки для розсмоктування, порошки, розчини, суспензії або емульсії, та можуть бути одержані відповідно до способів, відомих у даній галузі техніки, для виробництва фармацевтичних композицій. Тверді одиничні лікарські форми можуть являти собою капсулу, яка може мати звичайну тверду або м’яку желатинову оболонку, 17 UA 111604 C2 5 10 15 20 25 30 35 40 45 50 55 60 що містить, наприклад, поверхнево-активні речовини, лубриканти та внутрішні наповнювачі, такі як лактоза, сахароза, фосфат кальцію та кукурудзяний крохмаль. У іншому варіанті втілення, сіль даного винаходу може бути таблетована із звичайно використовуваними основами таблетки, такими як лактоза, сахароза та кукурудзяний крохмаль, у комбінації із зв’язуючими речовинами, такими як акацієва камедь, кукурудзяний крохмаль або желатин, дезінтегруючими агентами, призначеними для сприяння розпаду та розчиненню таблетки після введення, такими як картопляний крохмаль, альгінова кислота, кукурудзяний крохмаль та гуарова камедь, трагакантова камедь, акацієва камедь, лубрикантами, призначеними для покращення протікання гранулювання таблетки та запобігання прилипання матеріалу таблетки до поверхні прес-форм та пуасонних пресів для таблеток, наприклад, такими як тальк, стеаринова кислота або стеарат магнію, кальцію або цинку, барвниками, забарвлюючими агентами та ароматизаторами, такими як м’ятне масло, вінтергреневе масло або вишневий ароматизатор, призначеними для покращення естетичних якостей таблеток та для того, щоб зробити їх більш прийнятними для пацієнта. Підходящі наповнювачі для застосування у пероральних рідких лікарських формах включають гідрофосфат кальцію та розріджувачі, такі як вода та спирти, наприклад, етанол, бензиловий спирт та поліетиленові спирти, з додаванням або без додавання фармацевтично прийнятної поверхнево-активної речовини, суспендуючого агенту або емульгуючого агенту. Різні інші матеріали можуть бути присутніми як покриття або для модифікування іншим чином фізичної форми лікарської одиниці. Наприклад, таблетки, пігулки або капсули можуть бути покриті шелаком, цукром або обома. Диспергуємі порошки та гранули є підходящими для одержання водної суспензії. Вони забезпечують одержання активного інгредієнту у суміші з диспергуючим або змочуючим агентом, суспендуючим агентом та одним або більшою кількістю консервантів. Підходящі диспергуючі або змочуючі агенти та суспендуючі агенти вже описані для прикладу вище. Також можуть бути присутні додаткові наповнювачі, наприклад, підсолоджувачі, ароматизатори та барвники, описані вище. Фармацевтичні композиції даного винаходу також можуть бути у формі емульсій масло-уводі. Масляна фаза може являти собою рослинне масло, таке як рідкий парафін або суміш рослинних масел. Прийнятні емульгуючі агенти можуть являти собою (1) камеді природного походження, такі як акацієва камедь та трагакантову камедь, (2) фосфатиди природного походження, такі як соєвий лецитин, (3) складні ефіри або часткові складні ефіри, отримані з жирних кислот та ангідридів гекситу, наприклад, сорбітану моноолеат, (4) продукти конденсації зазначених часткових складних ефірів з етилен-оксидом, наприклад, поліоксиетилен-сорбітанмоноолеат. Емульсії також можуть містити підсолоджуючі та ароматизуючі агенти. Масляні суспензії можуть бути сформульовані шляхом суспендування активного інгредієнту у рослинному маслі, такому як, наприклад, арахісове масло, оливкове масло, кунжутне масло або кокосове масло, або у мінеральному маслі, такому як рідкий парафін. Масляні суспензії можуть містити згущуючий агент, такий як, наприклад, бджолиний віск, твердий парафін або цетиловий спирт. Суспензії також можуть містити один або більше консервантів, наприклад, етил або н-пропіл п-гідроксибензоат; один або більше барвників; один або більше ароматизаторів; та один або більше підсолоджувачів, таких як сахароза або сахарин. Сиропи та еліксири можуть бути сформульовані з підсолоджуючими агентами, такими як, наприклад, гліцерин, пропілен-гліколь, сорбіт або сахароза. Такі композиції також можуть містити пом’якшуючий засіб та консервант, такий як метил та пропіл парабени, та ароматизатори та барвники. Сіль даного винаходу також може бути введена парентерально, тобто підшкірно, внутрішньовенно, внутрішньоочно, внутрішньосуглобно, внутрішньом’язово або внутрішньочеревинно, у вигляді дозувань сполуки, що можуть бути введені ін’єкцією, переважно у фізіологічно прийнятному розчиннику з фармацевтичним носієм, який може являти собою стерильну рідину або суміш рідин, таких як вода, сольовий розчин, водні розчини декстрози та подібних цукрів, спирт, такий як етанол, ізопропанол, або гексадециловий спирт, гліколі, такі як пропілен-гліколь або поліетилен-гліколь, гліцерин-кеталі, такі як 2,2-диметил-1,1-діоксолан-4метанол, ефіри, такі як полі(етилен-гліколь) 400, масло, жирну кислоту, складний ефір жирної кислоти або гліцерид жирної кислоти, або ацетильований гліцерид жирної кислоти, з додаванням або без додавання фармацевтично прийнятної поверхнево-активної речовини, такої як омилююча речовина або детергент, суспендуючий агент, такий як пектин, карбомери, метилцелюлоза, гідроксипропілметилцелюлоза, або карбоксиметилцелюлоза, або емульгуючий агент та інші фармацевтичні допоміжні речовини. Приклади масел, які можуть бути використані у парентеральних композиціях даного винаходу, включають масло мінерального, тваринного, рослинного або синтетичного 18 UA 111604 C2 5 10 15 20 25 30 35 40 45 50 55 60 походження, наприклад, арахісове масло, соєве масло, кунжутне масло, бавовняне масло, кукурудзяне масло, оливкове масло, вазелінове та мінеральне масло. Підходящі жирні кислоти включають олеїнову кислоту, стеаринову кислоту, ізостеаринову кислоту та міристинову кислоту. Підходящі складні ефіри жирних кислот включають, наприклад, етил-олеат та ізопропіл-міристат. Підходящі омилюючі речовини включають жирну кислоту лужного металу, амонію та триетаноламінові солі, та підходящі детергенти включають катіонні детергенти, наприклад, галогеніди диметил-діалкіл-амонію, галогеніди алкіл-піридинію, та ацетати алкіламіну; аніонні детергенти, наприклад, алкіл, арил та олефін сульфонати, алкіл, олефін, ефір та моногліцерид сульфати та сульфосукцинати; неіонні детергенти, наприклад, оксиди жирного аміну, алканоламіди жирної кислоти, та полі(оксиетилен-оксипропілен)и або етиленоксид або пропілен-оксид співполімери; та амфорерні детергенти, наприклад, алкіл-бетаамінопропіонати, та 2-алкілімідазолінові четвертинні амонієві солі, а також суміші. Парентеральні композиції даного винаходу, як правило, будуть включати від приблизно 0,5% до приблизно 25% за масою активного інгредієнту у розчині. Консерванти та буфери переважно також можуть бути використані. Для того щоб мінімізувати або уникнути подразнення у місці введення, такі композиції можуть містити неіонну поверхнево-активну речовину, що має гідрофільно-ліпофільний баланс (HLB) переважно від приблизно 12 до приблизно 17. Кількість поверхнево-активної речовини у такій композиції переважно коливається у інтервалі від приблизно 5% до приблизно 15% за масою. Поверхнево-активна речовина може являти собою єдиний компонент, що має описаний вище HLB або може являти собою суміш двох або більше компонентів, що мають бажаний HLB. Приклади поверхнево-активних речовин, що використовуються у парентеральних композиціях, являють собою клас складних ефірів поліетилен-сорбіту та жирної кислоти, наприклад, сорбіт-моноолеат та високомолекулярні адукти етилен-оксиду з гідрофобною основою, що утворюються шляхом конденсації пропілен-оксиду з пропілен-гліколем. Фармацевтичні композиції можуть бути у формі стерильних водних суспензій, що можуть бути введені ін’єкцією. Такі суспензії можуть бути сформульовані відповідно до відомих способів, використовуючи підходящі диспергуючі або змочуючі агенти та суспендуючі агенти, такі як, наприклад, карбоксиметилцелюлоза натрію, метилцелюлоза, гідроксипропілметилцелюлоза, альгінат натрію, полівінілпіролідон, трагакантова камедь та акацієва камедь; диспергуючі або змочуючі агенти, які можуть являти собою фосфатид природного походження, такий як лецитин, продукт конденсації алкілен-оксиду з жирною кислотою, наприклад, стеарат поліоксиетилену, продукт конденсації етиленоксиду з довголанцюговим аліфатичним спиртом, наприклад, гептадека-етиленоксицетанол, продукт конденсації етилен-оксиду з частковим складним ефіром, отриманим з жирної кислоти та гекситу, такий як поліоксиетилен-сорбіт моноолеат, або продукт конденсації етилен-оксиду з частковим складним ефіром, отриманим з жирної кислоти та ангідриду гекситу, наприклад, поліоксиетилен- сорбіт моноолеат. Стерильний ін’єкційний препарат також може являти собою стерильний ін’єкційний розчин або суспензію у нетоксичному парентерально прийнятному розріджувачі або розчиннику. Розріджувачі та розчинники, які можуть бути використані, включають, наприклад, такі як: вода, розчин Рінгера, ізотонічні розчини хлориду натрію та ізотонічні розчини глюкози. Крім того, стерильні нелеткі масла звичайно використовуються як розчинники або суспензійні середовища. Для цієї мети, може бути використане будь-яке заспокійливе, нелетке масло, включаючи синтетичні моно- або дигліцериди. Крім того, жирні кислоти, такі як олеїнова кислота, можуть бути використані у одержанні ін’єкційних препаратів. Композиція даного винаходу також може бути введена у формі супозиторіїв для ректального введення лікарського засобу. Ці композиції можуть бути одержані шляхом змішування лікарського засобу з підходящим не подразнюючим наповнювачем, який є твердим при звичайних температурах, але рідким при ректальній температурі, та тому буде плавитися у товстій кишці з вивільненням лікарського засобу. Такі матеріали включають, наприклад, масло какао та поліетилен-гліколь. Інша композиція, використовувана у способах даного винаходу, застосовує пристрої трансдермальної доставки (“пов’язки”). Такі трансдермальні пов’язки можуть бути використані для забезпечення постійної або періодичної інфузії сполук даного винаходу у контрольованих кількостях. Конструкція та застосування трансдермальних пов’язок для доставки фармацевтичних агентів відомі у даній галузі техніки (дивись, наприклад, Патент США № 5,023,252, виданий 11 червня 1991 року, включений у даний опис шляхом посилання). Такі пов’язки можуть бути створені для постійної доставки, переривчастої доставки або доставки фармацевтичних агентів за вимогою. Композиції контрольованого вивільнення для парентерального введення включають 19 UA 111604 C2 5 10 15 20 25 30 35 40 45 50 55 60 ліпосомні, полімерні мікросферні та полімерні гелеві композиції, які відомі у даній галузі техніки. Може бути бажано або необхідно вводити фармацевтичну композицію пацієнту за допомогою механічного пристрою доставки. Конструкція та застосування механічних пристроїв доставки для доставки фармацевтичних агентів добре відомі у даній галузі техніки. Прямі способи, наприклад, для введення лікарського засобу безпосередньо у мозок зазвичай залучають встановлення катетеру доставки лікарського засобу у вертрикулярну систему пацієнта для обходження гемато-енцефалічного бар’єру. Одна така система доставки, що може бути імплантована, використовувана для транспортування агентів до специфічних анатомічних областей організму, описана у Патенті США № 5,011,472, виданому 30 квітня 1991 року. Композиції даного винаходу також можуть включати інші загально прийняті фармацевтично прийнятні інгредієнти суміші, які загалом називають носіями або розріджувачами, якщо необхідно або бажано. Можуть бути використані звичайні процедури для одержання таких композицій у відповідних лікарських формах. Такі інгредієнти та процедури включають ті, що описані у наступних посиланнях, кожне з яких включене у даний опис шляхом посилання: Powell, M.F. et al, "Compendium of Excipients for Parenteral Formulations" PDA Journal of Pharmaceutical Science & Technology 1998, 52(5), 238-311; Strickley, R.G "Parenteral Formulations of Small Molecule Therapeutics Marketed in the United States (1999)-Part-1" PDA Journal of Pharmaceutical Science & Technology 1999, 53(6), 324-349; and Nema, S. et al, "Excipients and Their Use in Injectable Products" PDA Journal of Pharmaceutical Science & Technology 1997, 51(4), 166-171. Загально використовувані фармацевтичні інгредієнти, які можуть бути використані, за необхідності, для формулювання композиції для її передбачуваного шляху застосування, включають: підкислюючі агенти (приклади включають, не обмежуючись наведеними, оцтову кислоту, лимонну кислоту, фумарову кислоту, хлористоводневу кислоту, азотну кислоту); підлужуючі агенти (приклади включають, не обмежуючись наведеними, розчин амонію, карбонат амонію, діетаноламін, моноетаноламін, гідроксид калію, борат натрію, карбонат натрію, гідроксид натрію, триетаноламін, троламін); адсорбенти (приклади включають, не обмежуючись наведеними, порошкоподібну глюкозу та активоване вугілля); аерозольні пропеленти (приклади включають, не обмежуючись наведеними, діоксид вуглецю, CCl2F2, F2ClC-CClF2 та CClF3); агенти заміщення повітря (приклади включають, не обмежуючись наведеними, азот та аргон); протигрибкові консерванти (приклади включають, не обмежуючись наведеними, бензойну кислоту, бутилпарабен, етилпарабен, метилпарабен, пропілпарабен, бензоат натрію); протимікробні консерванти (приклади включають, не обмежуючись наведеними, бензалконіум хлорид, бензетоніум хлорид, бензиловий спирт, цетилпіридиніум хлорид, хлорбутанол, фенол, фенілетиловий спирт, нітрат фенілртуті та тимеросал); антиоксиданти (приклади включають, не обмежуючись наведеними, аскорбінову кислоту, аскорбіл пальмітат, бутильований гідроксианізол, бутильований гідрокситолуол, гіпофосфорну кислоту, монотіогліцерин, пропіл-галат, аскорбат натрію, бісульфіт натрію, формальдегід сульфоксилат натрію, метабісульфіт натрію); зв’язуючі матеріали (приклади включають, не обмежуючись наведеними, блок полімери, природний та синтетичний каучук, поліакрилати, поліуретани, силікони, полісилоксани та стирол-бутадієн співполімери); буферні агенти (приклади включають, не обмежуючись наведеними, метафосфат калію, гідрофосфат калію, ацетат натрію, безводний цитрат натрію та дигідрат цитрату натрію); речовини-носії (приклади включають, не обмежуючись наведеними, акацієвий сироп, ароматичний сироп, ароматичний еліксир, вишневий сироп, сироп какао, апельсиновий сироп, патоку, кукурудзяне масло, мінеральне масло, арахісове масло, кунжутне масло, бактеріостатичний ін’єкційний розчин хлориду натрію та бактеріостатичну воду для ін’єкцій); хелатуючі агенти (приклади включають, не обмежуючись наведеними, динатрію едетат та едетову кислоту); барвники (приклади включають, не обмежуючись наведеними, FD&C червоний № 3, FD&C червоний № 20, FD&C жовтий № 6, FD&C блакитний № 2, D&C зелений № 5, D&C помаранчевий № 5, D&C червоний № 8, карамель та оксид заліза червоний); освітлюючи агенти (приклади включають, не обмежуючись наведеними, бентоніт); емульгуючі агенти (приклади включають, не обмежуючись наведеними, акацієву камедь, цетомакрогол, цетиловий спирт, гліцерил моностеарат, лецитин, сорбіт моноолеат, 20 UA 111604 C2 5 10 15 20 25 30 35 40 45 50 55 60 поліоксиетилен 50 моностеарат); інкапсулюючі агенти (приклади включають, не обмежуючись наведеними, желатин та ацетат фталат целюлози); ароматизатори (приклади включають, не обмежуючись наведеними, анісове масло, коричне масло, какао, ментол, апельсинове масло, м’ятне масло та ванілін); зволожуючі агенти (приклади включають, не обмежуючись наведеними, гліцерин, пропіленгліколь та сорбіт); відмулюючі агенти (приклади включають, не обмежуючись наведеними, мінеральне масло та гліцерин); масла (приклади включають, не обмежуючись наведеними, арахісове масло, мінеральне масло, оливкове масло, масло земляного горіху, кунжутне масло та рослинне масло); мазеві основи (приклади включають, не обмежуючись наведеними, ланолін, гідрофільну мазь, поліетилен-гліколеву мазь, вазелін, гідрофільний вазелін, білу мазь, жовту мазь, та мазь з трояндової води); посилювачі проникнення (трансдермальна доставка) (приклади включають, не обмежуючись наведеними, моногідрокси або полігідрокси спирти, моно- або полівалентні спирти, насичені або ненасичені жирні спирти, насичені або ненасичені жирні складні ефіри, насичені або ненасичені дикарбонові кислоти, ефірні масли, похідні фосфатидилу, цефалін, терпени, аміди, ефіри, кетони та сечовини); пластифікатори (приклади включають, не обмежуючись наведеними, діетил- фталат та гліцерин); розчинники (приклади включають, не обмежуючись наведеними, етанол, кукурудзяне масло, бавовняне масло, гліцерин, ізопропанол, мінеральне масло, олеїнову кислоту, арахісове масло, очищену воду, воду для ін’єкцій, стерильну воду для ін’єкцій та стерильну воду для промивання); агенти для підвищення жорсткості суміші (приклади включають, не обмежуючись наведеними, цетиловий спирт, віск цетилових ефірів, мікрокристалічний віск, парафін, стеариловий спирт, білий віск та жовтий віск); основи для супозиторіїв (приклади включають, не обмежуючись наведеними, масло какао та поліетилен-гліколі (суміші)); поверхнево-активні речовини (приклади включають, не обмежуючись наведеними, бензалконіум хлорид, ноноксинол 10, окстоксинол 9, полісорбат 80, лаурил-сульфат натрію та сорбіт моно-пальмітат); суспендуючі агенти (приклади включають, не обмежуючись наведеними, агар-агар, бентоніт, карбомери, карбоксиметилцелюлозу натрію, гідроксиетил- целюлозу, гідроксипропіл-целюлозу, гідроксипропіл-метилцелюлозу, каолін, метилцелюлозу, трагакант та вігум); підсолоджуючи агенти (приклади включають, не обмежуючись наведеними, аспартам, декстрозу, гліцерин, маніт, пропілен-гліколь, сахарин натрію, сорбіт та сахарозу); антиадгезиви для таблеток (приклади включають, не обмежуючись наведеними, стеарат магнію та тальк); зв’язуючі речовини для таблеток (приклади включають, не обмежуючись наведеними, акацієву камедь, альгінову кислоту, карбоксиметилцелюлозу натрію, пресований цукор, етилцелюлозу, желатин, глюкозний сироп, метилцелюлозу, не-перехресно-зв’язаний полівінілпіролідон, та пептизований крохмаль); розріджувачі для таблеток та капсул (приклади включають, не обмежуючись наведеними, двоосновний фосфат кальцію, каолін, лактозу, маніт, мікрокристалічну целюлозу, порошкоподібну целюлозу, осаджений карбонат кальцію, карбонат натрію, фосфат натрію, сорбіт та крохмаль); агенти покриття таблеток (приклади включають, не обмежуючись наведеними, глюкозний сироп, гідроксиетил-целюлозу, гідроксипропіл-целюлозу, гідроксипропіл-метилцелюлозу, метилцелюлозу, етилцелюлозу, целюлозу ацетат-фталату та шелак); наповнювачі прямого пресування таблеток (приклади включають, не обмежуючись наведеними, двоосновний фосфат кальцію); дезінтегранти для таблеток (приклади включають, не обмежуючись наведеними, альгінову кислоту, карбоксиметилцелюлозу кальцію, мікрокристалічну целюлозу, поліакрилін калію, перехресно-зв’язаний полівінілпіролідон, альгінат натрію, крохмалю натрію гліколят та крохмаль); гліданти для таблеток (приклади включають, не обмежуючись наведеними, колоїдний діоксид кремнію, кукурудзяний крохмаль та тальк); лубриканти для таблеток (приклади включають, не обмежуючись наведеними, стеарат 21 UA 111604 C2 5 10 15 20 25 30 35 40 45 50 55 60 кальцію, стеарат магнію, мінеральне масло, стеаринову кислоту та стеарат цинку); світлонепроникні агенти для таблеток/капсул (приклади включають, не обмежуючись наведеними, діоксид титану); глянсувальні агенти для таблеток (приклади включають, не обмежуючись наведеними, карнаубський віск та білий віск); згущуючі агенти (приклади включають, не обмежуючись наведеними, бджолиний віск, цетиловий спирт та парафін); агенти для регулювання тонічності (приклади включають, не обмежуючись наведеними, декстрозу та хлорид натрію); агенти для підвищення в’язкості (приклади включають, не обмежуючись наведеними, альгінову кислоту, бентоніт, карбомери, карбоксиметилцелюлозу натрію, метилцелюлозу, полівініл-піролідон, альгінат натрію та трагакант); та зволожуючі агенти (приклади включають, не обмежуючись наведеними, гептадекаетиленоксицетанол, лецитини, сорбіт моноолеат, поліоксиетилен-сорбіт моноолеат, та поліоксиетилен стеарат). Фармацевтичні композиції відповідно до даного винаходу можуть бути проілюстровані наступним чином: Стерильний внутрішньовенний розчин: 5 мг/мл розчину бажаної сполуки даного винаходу можуть бути одержані, використовуючи стерильну воду для ін’єкцій, та, якщо необхідно, доводять pH. Цей розчин розводять для введення до 1 – 2 мг/мл стерильним 5% розчином декстрози та вводять у вигляді внутрішньовенної інфузії впродовж приблизно 60 хвилин. Ліофілізований порошок для внутрішньовенного введення: Стерильний препарат може бути одержаний за допомогою (i) 100 - 1000 мг бажаної сполуки даного винаходу у вигляді ліофілізованого порошку, (ii) 32- 327 мг/мл цитрату натрію, та (iii) 300 – 3000 мг Декстрану 40. Композицію відновлюють за допомогою стерильного ін’єкційного сольового розчину або 5% розчину декстрози до концентрації 10 - 20 мг/мл, яку далі розводять сольовим розчином або 5% розчином декстрози до 0,2 – 0,4 мг/мл, та вводять або шляхом внутрішньовенного болюсу або шляхом внутрішньовенної інфузії впродовж 15 – 60 хвилин. Внутрішньом’язова суспензія: Наступний розчин або суспензія можуть бути одержані для внутрішньом’язової ін’єкції: 50 мг/мл бажаної, водо-нерозчинної сполуки даного винаходу 5 мг/мл карбоксиметилцелюлози натрію 4 мг/мл TWEEN 80 9 мг/мл хлориду натрію 9 мг/мл бензилового спирту Тверді капсули: Велику кількість одиничних капсул одержують шляхом наповнення стандартних твердих желатинових капсул, що складаються з двох частин, кожна з капсул містить 100 мг порошкоподібного активного інгредієнту, 150 мг лактози, 50 мг целюлози та 6 мг стеарат магнію. М’які желатинові капсули: Суміш активного інгредієнту у засвоюваному маслі, такому як соєве масло, бавовняне масло або оливкове масло, готують та вводять за допомогою поршневого насосу прямого витискування у розплавлений желатин з утворенням м’яких желатинових капсул, що містять 100 мг активного інгредієнту. Ці капсули промивають та сушать. Активний інгредієнт може бути розчинений у суміші поліетилен-гліколю, гліцерину та сорбіту з одержанням водорозчинної медичної суміші. Таблетки: Велику кількість таблеток готують шляхом звичайної процедури, таким чином, що лікарська одиниця містить 100 мг активного інгредієнту, 0,2 мг колоїдного діоксиду кремнію, 5 мг стеарату магнію, 275 мг мікрокристалічної целюлози, 11 мг крохмалю, та 98,8 мг лактози. Відповідні водні та неводні покриття можуть бути нанесені для підвищення смакової привабливості, покращення зовнішньої привабливості та стійкості або уповільненої абсорбції. Таблетки/капсули із швидким вивільненням: Вони являють собою тверді пероральні лікарські форми, що отримують за звичайно використовуваним та новим способами. Ці одиниці приймають перорально без води для швидкого розчинення та доставки лікарського засобу. Активний інгредієнт змішують у рідині, що містить інгредієнт, такий як цукор, желатин, пектин та підсолоджувачі. Ці рідини отвердівають у тверді таблетки або капсули шляхом сушіння замороженням та способами твердо-фазної екстракції. Сполуки лікарського засобу можуть бути спресовані з в’язко-пружними та термоеластичними цукрами та полімерами або шипучими компонентами з одержанням пористих матриць, призначених для швидкого вивільнення, без необхідності використання води. Спосіб лікування раку 22 UA 111604 C2 5 10 15 20 25 30 35 40 45 50 55 60 У контексті даного винаходу, термін “рак” включає, не обмежуючись наведеними, рак молочної залози, легені, мозку, репродуктивних органів, травного тракту, сечовивідних шляхів, печінки, ока, шкіри, голови та шиї, щитовидної залози, паращитовидної залози та їх віддалені метастази. Ці розлади також включають мієломну хворобу, лімфоми, саркоми та лейкемії. Приклади раку молочної залози включають, не обмежуючись наведеними, інфільтративну протокову карциному, інвазивний частковий рак, протокову карциному in situ, та лобулярну карциному in situ. Приклади раку дихальних шляхів включають, не обмежуючись наведеними, невеликоклітинну та недрібноклітинну легеневу карциному, а також бронхіальну аденому та плевро-легеневу бластому. Приклади раку мозку включають, не обмежуючись наведеними, гліому стовбуру мозку та гіпофізу, мозочкову та церебральну астроцитому, медулобластому, епендимому, а також нейроектодермальну пухлину та пухлину шишковидної залози. Пухлини чоловічих репродуктивних органів включають, не обмежуючись наведеними, рак передміхурової залози та яєчка. Пухлини жіночих репродуктивних органів включають, не обмежуючись наведеними, рак ендометрію, шийки матки, яєчнику, піхви та статевих губ, а також саркому матки. Пухлини травного тракту включають, не обмежуючись наведеними, рак анального каналу, кишечнику, товстої кишки, стравоходу, жовчного міхура, шлунку, підшлункової залози, прямої кишки, тонкої кишки та слинних залоз. Пухлини сечовивідних шляхів включають, не обмежуючись наведеними, рак сечового міхура, чоловічого статевого члену, нирки, ниркової миски, сечоводу, уретри та папілярний рак нирки людини. Ракові захворювання очей включають, не обмежуючись наведеними, внутрішньоочні меланоми та ретинобластоми. Приклади раку печінки включають, не обмежуючись наведеними, гепатоцелюлярну карциному (печінково-клітинний рак з або без фіброламелярного варіанту), холангіокарциному (карцинома внутрішньо печінкових жовчних протоків), та змішану гепатоцелюлярну холангіокарциному. Ракові захворювання шкіри включають, не обмежуючись наведеними, плоскоклітинну карциному, саркому Капоши, злоякісні меланоми, рак шкірних клітин Маркеля, та немеланомний рак шкіри. Ракові захворювання голови та шиї включають, не обмежуючись наведеними, рак гортані, підглотки, носоглотки, ротоглотки, губ та рак порожнини рота та плоских клітин. Лімфоми включають, не обмежуючись наведеними, СНІД-зв’язану лімфому, неходжкінську лімфому, шкірну Т-клітинну лімфому, лімфому Беркіта, ходжкінську лімфому та лімфому центральної нервової системи. Саркоми включають, не обмежуючись наведеними, саркому м’яких тканин, остеосаркому, злоякісну фіброзну гістіоцитому, лімфосаркому та рабдоміосаркому. Лейкемії включають, не обмежуючись наведеними, гострий мієлоцитарний лейкоз, гострий мієлобластний лейкоз, хронічний лімфоцитарний лейкоз, хронічний мієлолейкоз та лейкоз ворсистих клітин. Даний винахід відноситься до способу застосування солі даного винаходу, для лікування раку, як описано нижче, особливо недрібноклітинного раку легенів ссавців (NSCLC), колоректального раку (CRC), меланоми, раку підшлункової залози, гепатоцитної карциноми або раку молочної залози. Сіль даного винаходу може бути використана для інгібування, блокування, зниження, зменшення, тощо, клітинної проліферації та/або ділення клітин, та/або спричинення апоптозу, у лікуванні або профілактиці раку, зокрема NSCLC, CRC, меланоми, раку підшлункової залози, гепатоцитної карциноми або раку молочної залози. Зазначений спосіб включає введення ссавцю, якому це необхідно, включаючи людину, кількості комбінації даного винаходу, або її фармацевтично прийнятної солі, ізомеру, поліморфу, метаболіту, гідрату, сольвату або складного ефіру; тощо, яка є ефективною для лікування або профілактики раку, зокрема NSCLC, CRC, меланоми, раку підшлункової залози, гепатоцитної карциноми або раку молочної залози. Термін “лікувати” або “лікування”, як зазначено по всьому документу, використовується у стандартному значенні, наприклад, терапія або медична допомога суб’єкту з метою лікування, полегшення симптомів, зменшення, пом’якшення, покращення стану тощо, хвороби або розладу, такого як карцинома. Доза та введення На основі стандартних лабораторних технологій, відомих для оцінки сполук, корисних для 23 UA 111604 C2 5 10 15 20 25 30 35 40 45 50 55 60 лікування або профілактики раку, зокрема NSCLC, CRC, меланоми, раку підшлункової залози, гепатоцитної карциноми або раку молочної залози, за допомогою стандартних досліджень токсичності та за допомогою стандартних фармакологічних досліджень для визначення лікування хворобливих станів, ідентифікованих вище у ссавців, та за допомогою порівняння цих результатів з результатами відомих лікарських засобів, які використовують для лікування цих станів, ефективна доза солі даного винаходу може бути легко визначена для лікування показання. Кількість активного інгредієнту, яку необхідно ввести при лікуванні хворобливого стану, може змінюватися у широких межах відповідно до багатьох факторів, включаючи, не обмежуючись наведеними, використовувану певну комбінацію та лікарську одиницю, спосіб введення, період лікування, вік та стать пацієнта, якого лікують, та природу та важкість стану, що лікують. Загальна кількість активного інгредієнту, яку необхідно ввести, буде в основному змінюватися від приблизно 0,001 мг/кг до приблизно 200 мг/кг маси тіла на день, та переважно від приблизно 0,01 мг/кг до приблизно 20 мг/кг маси тіла на день. Клінічно корисні дозувальні графіки будуть коливатися від одного до трьох разів на день, дозуючи до одного разу на чотири тижні. Крім того, "лікарські канікули", на яких пацієнт не отримує доз лікарського засобу впродовж певного періоду часу, можуть бути корисними для загального балансу між фармакологічним ефектом та переносимістю. Одинична лікарська доза може містити від приблизно 0,5 мг до приблизно 1500 мг активного інгредієнту, та може вводитися один раз або більше разів на день або менше, ніж один раз на день. Середня денна доза для введення шляхом ін’єкції, включаючи внутрішньовенну, внутрішньом’язову, підшкірну та парентеральну ін’єкцію, та застосування способів інфузії буде переважно становити від 0,01 до 200 мг/кг загальної маси тіла. Режим середньої денної ректальної дози буде переважно містити від 0,01 до 200 мг/кг загальної маси тіла. Режим середньої денної вагінальної дози буде переважно містити від 0,01 до 200 мг/кг загальної маси тіла. Режим середньої денної місцевої дози буде переважно містити від 0,1 до 200 мг, що вводять від одного до чотирьох разів на день. Трансдермальна концентрація буде переважно такою, яка необхідна для підтримання денної дози від 0,01 до 200 мг/кг. Режим середньої денної дози інгаляції буде переважно містити від 0,01 до 100 мг/кг загальної маси тіла. Специфічні початкові та постійні дозові режими для кожного пацієнта будуть змінюватися в залежності від природи та серйозності стану, що визначається лікуючим діагностом, активності специфічної використовуваної комбінації, віку та загального стану пацієнта, часу введення, шляху введення, швидкості екскреції лікарського засобу, солей лікарських засобів та подібного. Бажаний спосіб лікування та кількість доз комбінації даного винаходу або фармацевтично прийнятної солі або складного ефіру або їх композиції може бути встановлена спеціалістами, кваліфікованими у даній галузі техніки, використовуючи звичайні лікувальні дослідження. Терапії, використовуючи сіль даного винаходу: один або більше додаткових фармацевтичних агентів. Сіль даного винаходу може бути введена у вигляді окремого фармацевтичного агенту або у комбінації з одним або більшою кількістю додаткових фармацевтичних агентів, де отримувана комбінація солі даного винаходу та додаткового фармацевтичного агенту не викликає неприйнятних побічних ефектів. Наприклад, сіль даного винаходу може бути змішана з компонентом C, тобто одним або більшою кількістю додаткових фармацевтичних агентів, таких як відомі анти-ангіогенезні, анти-гіпер-проліферативні, протизапальні, знеболюючі, імунорегулюючі, діуретичні, протиаритмічні, анти-гіперхолестеринемічні, анти-дисліпідемічні, антидіабетичні або противірусні агенти, та подібні, а також з їх сумішами та солями. Компонент C може являти собою один або більше фармацевтичних агентів, таких як альдеслейкін, алендронова кислота, альфаферон, алітретиноїн, алопуринол, алопрім, алоксі, альтретамін, аміноглутетимід, амифостин, амрубіцин, амсакрин, анастрозол, анзмет, аранесп, арглабін, триоксид миш’яку, аромазин, 5-азацитидин, азатіоприн, БЦЖ або вакцина БЦЖ, бестатин, бетаметазону ацетат, бетаметазону натрію фосфат, бексаротен, блеоміцину сульфат, броксуридин, бортезоміб, бусульфан, кальцитонін, кампат, капецитабін, карбоплатин, казодекс, цифезон, целмолейкін, церубідин, хлорамбуцил, цисплатин, кладрибін, кладрибін, клодронова кислота, циклофосфамід, цитарабін, дакарбазин, дактиноміцин, даунозом, декадрон, декадрону фосфат, делестроген, денілейкін дифтітокс, депо-медрол, деслорелін, дексометазон, дексразоксан, діетилстилбестрол, дифлукан, доцетаксел, доксифлуридин, доксорубіцин, дронабінол, DW-166HC, елігард, елітек, еленц, еменд, епірубіцин, епоетин альфа, епоген, ептаплатин, ергамізол, естрац, естрадіол, естрамустину фосфат натрію, етиніл естрадіол, етіол, етидронова кислота, етопофос, етопозид, фадрозол, фарстон, филграстим, фінастерид, фліграстим, флоксуридин, флуконазол, флударабін, 5-фтордеоксиуридину 24 UA 111604 C2 5 10 15 20 25 30 35 40 45 50 55 60 монофосфат, 5-фторурацил (5-FU), флуоксиместерон, флутамід, форместан, фостеабін, фотемустин, фулвестрант, гаммагард, гемцитабін, гемтузумаб, глівек, гліадел, госерелін, гранізетрон HCl, гістрелін, гікамтин, гідрокортон, еритро-гідроксиноніладенін, гідроксисечовина, ібритумомаб тіуксетан, ідарубіцин, іфосфамід, інтерферон альфа, інтерферон-альфа 2, інтерферон альфа-2A, інтерферон альфа-2B, інтерферон альфа-n1, інтерферон альфа-n3, інтерферон бета, інтерферон гама-1a, інтерлейкін-2, інтрон A, іресса, іринотекан, кітрил, лентинан сульфат, летрозол, лейковорин, лейпролід, лейпролід ацетат, леналідомід, левамізол, кальцієва сіль левофолінової кислоти, левотроїд, левоксил, ломустин, лонідамін, маринол, мехлоретамін, мекобаламін, медроксипрогестерон ацетат, мегестрол ацетат, мелфалан, менест, 6-меркаптопурин, Месна, метотрексат, метвікс, мілтефозин, міноциклін, мітоміцин C, мітотан, мітоксантрон, Модренал, Міоцет, недаплатин, неуласта, неумега, неупоген, нілутамід, нолвадекс, NSC-631570, OCT-43, октреотид, ондансетрон HCl, орапред, оксаліплатин, паклітаксел (коли компонент B сам не є паклітакселем), педіапред, пегаспаргаз, Пегасус, пентостатин, піцибаніл, пілокарпін HCl, пірарубіцин, плікаміцин, порфімер натрію, преднімустин, преднізолон, преднізон, премарін, прокарбазин, прокрит, ралтітрексед, RDEA 119, ребіф, реній-186 етідронат, ритуксимаб, роферон-A, ромуртид, салаген, сандостатин, сарграмостим, семустин, сизофіран, собузоксан, солу-медрол, спарфозинова кислота, терапія стовбуровими клітинами, стрептозоцин, стронцій-89 хлорид, синтроїд, тамоксифен, тамсулозин, тазонермін, тастолактон, таксотер, тецелейкін, томозоломід, теніпозид, тестостерону пропіонат, тестред, тіогуанін, тіотепа, тиротропін, тилудронова кислота, топотекан, тореміфен, тозитумомаб, трастузумаб, треосульфан, третиноїн, трексалл, триметилмеламін, триметрексат, трипторелін ацетат, трипторелін памоат, UFT, уридин, валрубіцин, веснаринон, вінбластин, вінкристин, віндезин, вінорелбін, вірулізин, зинекард, зиностатин стималамер, зофран, ABI-007, аколбіфен, актиммун, аффінітак, аміноптерин, арзоксифен, азоприсніл, атаместан, атрасентан, BAY 43-9006 (сорафеніб), авастин, CCI-779, CDC-501, целебрекс, цетуксимаб, криснатол, ципротерон ацетат, децитабін, DN-101, доксорубіцин-MTC, dSLIM, дутастерид, едотекарин, ефлорнітин, ексатекан, фенретинід, гістамін дигідрохлорид, імплантат гідрогелю гістреліну, гольмій-166 DOTMP, ібандронова кислота, інтерферон гама, інтрон-ПЕГ, іксабепілон, гемоціанін лімфи фісурела, L-651582, ланреотид, лазофоксифен, лібра, лонафарніб, міпроксифен, мінодронат, MS-209, ліпосомальний MTP-PE, MX-6, нафарелін, неморубіцин, неовастат, нолатрексед, облімерсен, онко-TCS, осидем, паклітаксел поліглутамат, памідронат динатрію, PN-401, QS-21, квазепам, R-1549, ралоксифен, ранпірназ, 13-цис-ретиноєва кислота, сатраплатин, серкальцитол, T-138067, тарцева, таксопрексин, талідомід, тимозин альфа 1, тіазофурин, типіфарніб, тиразамін, TLK-286, тореміфен, TransMID-107R, валсподар, вапреотид, ваталаніб, вертепорфін, вінфлунін, Z-100, золедронова кислота або їх солі. У варіанті втілення даного винаходу, компонент C може являти собою один або більше з наступних агентів: 131I-chTNT, абарелікс, абіратерон, акларубіцин, альдеслейкін, алемтузумаб, алітретиноїн, альтретамін, аміноглутетимід, амрубіцин, амсакрин, анастрозол, арглабін, триоксид арсенію, аспарагіназа, азацитидин, базиліксимаб, BAY 80-6946, BAY 1000394, BAY 869766 (RDEA 119), белотекан, бендамустин, бевацизумаб, бексаротен, бікалутамід, бісантрен, блеоміцин, бортезоміб, бусерелін, бусульфан, кабазитаксел, кальцію фолінат, кальцію левофолінат, капецитабін, карбоплатин, кармофур, кармустин, катумаксомаб, целекоксиб, целмолейкін, цетуксимаб, хлорамбуцил, хлормадинон, хлорметин, цисплатин, кладрибін, клодронова кислота, клофарабін, крисантаспаз, циклофосфамід, ципротерон, цитарабін, дакарбазин, дактиноміцин, дарбепоетин альфа, дасатиніб, даунорубіцин, децитабін, дегарелікс, денілейкін дифтитокс, деносумаб, деслорелін, диброспідій хлорид, доцетаксел, доксифлуридин, доксорубіцин, доксорубіцин + естрон, екулізумаб, едреколомаб, еліптиній ацетат, елтромбопаг, ендостатин, еноцитабін, епірубіцин, епітіостанол, епоетин альфа, епоетин бета, ептаплатин, ерібулін, ерлотиніб, естрадіол, естрамустин, етопозид, еверолімус, екземестан, фадрозол, філграстим, флударабін, фторурацил, флутамід, форместан, фотемустин, фулвестрант, нітрат галію, ганірелікс, гефітиніб, гемцитабін, гемтузумаб, флутоксим, госерелін, гістаміну дигідрохлорид, гістрелін, гідроксикарбамід, I-125 зерна, ібандронова кислота, ібритумомаб тіуксетан, ідарубіцин, іфосфамід, іматиніб, іміквімод, імпросульфан, інтерферон альфа, інтерферон бета, інтерферон гама, іпілімумаб, іринотекан, іксабепілон, ланреотид, лапатиніб, леналідомід, ленограстим, лентинан, летрозол, лейпрорелін, левамізол, лізурид, лобаплатин, ломустин, лонідамін, мазопрокол, медроксипрогестерон, мегестрол, мелфалан, мепітіостан, меркаптопурин, метотрексат, метокссален, Метил амінолевулінат, метилтестостерон, міфамуртид, мілтефозин, міріплатин, мітобронітол, мітогуазон, мітолактол, мітоміцин, мітотан, мітоксантрон, недаплатин, неларабін, нілотиніб, нілутамід, німотузумаб, німустин, нітракрин, офатумумаб, омепразол, опрелвекін, оксаліплатин, p53 генна терапія, паклітаксел, паліфермін, 25 UA 111604 C2 5 10 15 20 25 30 35 40 45 50 55 60 паладій-103 зерна, памідронова кислота, панітумумаб, пазопаніб, пегаспаргаз, ПЕГ-епоетин бета (метокси ПЕГ-епоетин бета), пегфілграстим, пегінтерферон альфа-2b, пеметрексед, пентазоцин, пентостатин, пепломіцин, перфосфамід, піцибаніл, пірарубіцин, плериксафор, плікаміцин, поліглусам, поліестрадіол фосфат, полісахарид-K, порфімер натрію, пралатрексат, преднімустин, прокарбазин, квінаголід, ралоксифен, ралтітрексед, ранімустин, разоксан, регорафеніб, ризедронова кислота, ритуксимаб, ромідерсин, роміплостим, сарграмостим, сипулейцел-T, сизофіран, собузоксан, натрію гліцидідазол, сорафеніб, стрептозоцин, сунітиніб, талапорфін, тамібаротен, тамоксифен, тазонермін, тецтлейкін, тегафур, тегафур + гімерацил + отерацил, темопорфін, темозоломід, темсіролімус, теніпозид, тестостерон, тетрофосмін, талідомід, тіотепа, тимальфазин, тіогуанін, тоцилізумаб, топотекан, тореміфен, тозитумомаб, трабектедин, трастузумаб, треосульфан, третиноїн, трилостан, трипторелін, трофосфамід, триптофан, убенімекс, валрубіцин, вандетаніб, вапреотид, вемурафеніб, вінбластин, вінкристин, віндезин, вінфлунін, вінорелбін, вориностат, ворозол, ітрій-90 скляні мікросфери, зиностатин, зиностатин стималамер, золедронова кислота, зорубіцин. Альтернативно, зазначений компонент C може являти собою один або більше додаткових фармацевтичних агентів, які вибирають з таких як: гемцитабін, паклітаксел (коли компонент B сам не є паклітакселем), цисплатин, карбоплатин, натрію бутират, 5-FU, доксирубіцин, тамоксифен, етопозид, трастумазаб, гефітиніб, інтрон A, рапаміцин, 17-AAG, U0126, інсулін, похідна інсуліну, PPAR ліганд, сульфонілсечовинний лікарський засіб, α-глюкозидазний інгібітор, бігуанід, PTP-1B інгібітор, DPP-IV інгібітор, 11-бета-HSD інгібітор, GLP-1, GLP-1 похідна, GIP, GIP похідна, PACAP, PACAP похідна, секретин або похідна секретину. Альтернативно, зазначений компонент C може являти собою один або більше фармацевтичних агентів, які вибирають з таких як: таксан, такий як Доцетаксел, Паклітаксел, або Таксол; епотилон, такий як Іксабепілон, Патупілон, або Сагопілон; Мітоксантрон; Преднізолон; Дексаметазон; Естрамустин; Вінбластин; Вінкристин; Доксорубіцин; Адріаміцин; Ідарубіцин; Даунорубіцин; Блеоміцин; Етопозид; Циклофосфамід; Іфосфамід; Прокарбазин; Мелфалан; 5-Фторурацил; Капецитабін; Флударабін; Цитарабін; Ара-C; 2-Хлор-2´деоксиаденозин; Тіогуанін; анти-андроген, такий як Флутамід, Ципротерону ацетат, або Бікалутамід; Бортезоміб; похідна платини, така як Цисплатин, або Карбоплатин; Хлорамбуцил; Метотрексат; та Ритуксимаб. Необов’язкові анти-гіпер-проліферативні агенти, які можуть бути додані як компонент C до комбінації солі даного винаходу, включають, не обмежуючись наведеними, сполуки, перераховані у схемах прийому протиракових хіміотерапевтичних лікарських засобів у 11-ому виданні Merck Index, (1996), яке включене у даний опис шляхом посилання, такі як: аспарагіназа, блеоміцин, карбоплатин, кармустин, хлорамбуцил, цисплатин, коласпаза, циклофосфамід, цитарабін, дакарбазин, дактиноміцин, даунорубіцин, доксорубіцин (адріаміцин), епірубіцин, етопозид, 5-фторурацил, гексаметилмеламін, гідроксисечовина, іфосфамід, іринотекан, лейковорин, ломустин, мехлоретамін, 6-меркаптопурин, месна, метотрексат, мітоміцин C, мітоксантрон, преднізолон, преднізон, прокарбазин, ралоксифен, стрептозоцин, тамоксифен, тіогуанін, топотекан, вінбластин, вінкристин, та віндезин. Інші анти-гіпер-проліферативні агенти, придатні для застосування як компонент C з комбінацією солі даного винаходу, включають, не обмежуючись наведеними, такі сполуки, що є корисними у лікуванні непластичних захворювань, як відомо з Goodman and Gilman's The Pharmacological Basis of Therapeutics (дев’яте видання), під редакцією Molinoff та інш., опублік. McGraw-Hill, стор. 1225-1287, (1996), що включене у даний опис шляхом посилання, такі як: аміноглутетимід, L-аспарагіназа, азатіоприн, 5-азацитидин кладрибін, бусульфан, діетилстилбестрол, 2',2'-дифтордеоксицитидин, доцетаксел, еритрогідроксиноніл аденін, етиніл естрадіол, 5-фтордеоксиуридин, 5-фтордеоксиуридину монофосфат, флударабін фосфат, флуоксиместерон, флутамід, гідроксипрогестерон капроат, ідарубіцин, інтерферон, медроксипрогестерону ацетат, мегестролу ацетат, мелфалан, мітотан, паклітаксел (коли компонент B сам не є паклітакселем), пентостатин, N-фосфоноацетил-L-аспартат (PALA), плікаміцин, семустин, теніпозид, тестостерон пропіонат, тіотепа, триметилмеламін, уридин та вінорелбін. Інші анти-гіпер-проліферативні агенти, придатні для застосування як компонент C з комбінацією солі даного винаходу, включають, не обмежуючись наведеними, інші протиракові агенти, такі як епотилон та його похідні, іринотекан, ралоксифен та топотекан. В основному, застосування цитотоксичних та/або цитостатичних агентів як компоненту C у комбінації з сіллю даного винаходу буде слугувати для: (1) одержання кращої ефективності у зменшенні росту пухлини або навіть ліквідації цієї пухлини у порівнянні з введенням тільки одного будь-якого агенту, 26 UA 111604 C2 5 10 15 20 25 30 35 40 45 (2) забезпечення введення менших кількостей хіміотерапевтичних агентів, що вводять, (3) забезпечення хіміотерапевтичного лікування, яке добре переноситься пацієнтом з меншою кількістю шкідливих фармакологічних ускладнень, ніж спостерігається при хіміотерапіях з окремими агентами та певних інших об’єднаних терапіях, (4) забезпечення лікування більш широкого спектру різних типів раку у ссавців, особливо людей, (5) забезпечення більш високої частоти відповіді серед пацієнтів, яких лікували, (6) забезпечення більш тривалого часу виживання серед пацієнтів, яких лікували, у порівняння із стандартними хіміотерапевтичними лікуваннями, (7) забезпечення більш тривалого часу прогресування пухлини, та/або (8) одержання результатів ефективності та переносимості щонайменше таких же сприятливих, що і у агентів, що використовувалися окремо, у порівняння з відомими випадками, коли інші солі - протиракові агенти викликають антагоністичні ефекти. БІОЛОГІЧНИЙ РОЗДІЛ PI3Kα та PI3Kβ радіоактивне ліпідкіназне дослідження p110α біохімічне дослідження являє собою радіоактивне дослідження, у якому вимірюється 33 включення P у p110α субстрат, фосфатидилінозитол (PI). Це дослідження являє собою модифікацію дослідження, розробленого при RCK (Fuchikami et al., 2002). His-мічені N-кінцеві процесовані (усічені) (∆N 1-108) p110α та такі ж процесовані p110β (∆N 1-108) білки, у яких немає p85-зв’язуючого домену, експресують у Sf9 клітинах та очищують до >50% чистоти. Для створення IC50 кривих реакцію проводять у 384-лунковому форматі, використовуючи MaxiSorp планшети за наступних умов. Планшети покривають за допомогою 2 мкг/лунку з 1:1 молярним співвідношенням фосфатидилінозитолу (PI: Avanti #840042C) та фосфатидилсеріну (PS: Avanti #840032C), розведеними у хлороформі. Органічний розчинник залишають випарюватися шляхом зберігання планшетів у витяжній шафі впродовж ночі. Потім планшети запечатують за допомогою майларової плівки для запечатування планшетів та зберігають до одного місяця при 4 °C до потреби. 7,5 нг процесованого очищеного p110α білку додають до кожної лунки, що містить 9 мкл реакційного буферу (50 мМ MOPSO pH 7,0, 100 мМ NaCl, 4 мМ MgCl2, 0,1%(мас./об.) BSA), за винятком лунок з негативним контролем, у які додавали тільки реакційний буфер. Один мікролітр кожної тестової сполуки у ДМСО переносять з вихідних розчинів для розведень для створення восьми-точкової кривої доза-відповідь (0,0, 0,003, 0,01 0,03, 0,1, 0,3, 1,0, 3,0 та 10 мкM кінцева концентрація BAY сполуки). Реакції починають шляхом 33 додавання 5 мкл 40 мкM АТФ розчину, що містить 20 мкКі/мл [γ- P]-АТФ, та залишають для проходження реакції впродовж двох годин при кімнатній температурі з обережним перемішуванням. Реакції закінчують шляхом додавання 5 мкл 25 мМ ЕДТА вихідного розчину. Планшети промивають пристроєм для промивання 384-лункового планшету у буфері без детергента та 25 мкл UltimaGold сцинтиляційної суміші додають до кожної лунки. Радіоактивність, включену у іммобілізований PI субстрат, визначають за допомогою рідинного сцинтиляційного лічильника BetaPlate. Інгібування розраховують, використовуючи наступну рівність: % інгібування = 1-(Tcpm - Bcpm)/(Pcpm- Bcpm) X 100. 33 Tcpm = P-cpm у присутності тестової сполуки 33 Bcpm = P-cpm у фоновому контролі (без ферменту) 33 Pcpm = P-cpm у p110 ферментному контролі (без інгібітору) (де cpm – число імпульсів на хвилину). IC50 значення для вільної основи та дигідрохлоридної солі у p110α та p110β біохімічних дослідженнях підсумовані у Таблиці A. Дві сполуки показали подібну активність у обох PI3Kα та PI3Kβ біохімічних дослідженнях. Злегка краща ефективність з дигідрохлоридною сольовою формою може бути завдяки покращеній розчинності. 50 Таблиця A Активність вільної основи та дигідрохлоридної солі у PI3Kα та PI3Kβ дослідженнях Сполука Вільна основа Дигідрохлоридна сіль PI3Kα IC50 (M) 4,96E-10 1,23E-10 PI3Kβ IC50 (M) 3,72E-09 1,00E-09 Дослідження проліферації Клітинну проліферацію визначають, використовуючи набір для визначення життєздатності 27 UA 111604 C2 5 10 15 20 клітин на основі їх метаболічної активності CellTiter-Glo (люмінесценція) від Promega (кат. № G7573) через 72 годин піддавання дії лікарських засобів. Коротко, клітини поміщають при щільності 500-1000 клітин/лунку у 384-лункові планшети у 25 мкл середовища для вирощування. Для кожної досліджуваної клітинної лінії, клітини поміщають у окремий планшет для визначення люмінесценції у часових точках t = 0 год. та t = 72 год. Після інкубації впродовж ночі при 37 °C, значення люмінесценції для зразків t = 0 визначають додаванням 25 мкл Cell Titer-Glo розчину на лунку, переносячи планшети у орбітальний шейкер на 10 хвилин при кімнатній температурі, та потім зчитуючи планшети на лічильнику Wallac Victor2 1420 Multilabel HTS, використовуючи люмінометричне вікно (визначення максимального світла проводять при 428 нм). Дозові планшети для часових точок t = 72 год. обробляють сполуками, розведеними у середовищі для вирощування у кінцевій концентрації 30 мкл. Потім клітини інкубують впродовж 72 годин при 37 °C. Значення люмінесценції для зразків t = 72 год. визначають шляхом додавання 30 мкл Promega CellTiter-Glo розчину, поміщаючи клітини на шейкер на 10 хвилин при кімнатній температурі, та потім зчитуючи люмінесценцію, використовуючи люмінометр Victor. Для обробки даних, t = 0 значення віднімають від значень, визначених для часових точок t = 72 гол., як для оброблених, так і для необроблених зразків. Відсоткові різниці у люмінесценції між обробленими лікарським засобом та контролями використовують для визначення відсотку інгібування росту. У панелі 16 пухлинних клітинних ліній, що охоплюють 6 ракових показань, як вільна основа, так і дигідрохлоридна сіль, показали сильну анти-проліферативну активність та відмінність у IC50 значеннях становила менше, ніж у 3-рази у всіх протестованих пухлинних клітинних лініях. Ці дані однозначно показали, що дигідрохлоридна сіль зберігає протипухлинну активність вільної основи. Таблиця B Анти-проліферативна активність вільної основи та дигідрохлориду у дослідженнях проліферації лінії пухлинних клітин Клітинна лінія KPL4 BT474 T47D BT20 MCF7 MDA-MB-468 SK-Br-3 LNCaP PC3 Colo205 HT29 HCT116 A549 H460 U87MG 786O Тканина Молочна залоза Передміхурова залоза Кишечник Легеня Мозок Нирка ІС ІС50 вільної основи 50 Співвідношення дигідрохлорид-ної (нМ) ІС50 солі (нМ) 3 3 1,0 5 10 0,5 6 2 2,8 6 2 3,1 27 9 3,0 760 256 3,0 2 1 1,5 69 671,0 100 90 1,1 48 110 0,4 27 10 2,7 56 72 0,8 37 44 0,8 46 67 0,7 85 85 1,0 116 247 0,5 25 Посилання: Fuchikami K, Togame H, Sagara A, Satoh T, Gantner F, Bacon KB, Reinemer P. J Biomol Screen. 7(5):441-50 (2002). A versatile high-throughput screen for inhibitors of lipid kinase activity: development of an immobilized phospholipid plate assay for phosphoinositide 3-kinase gamma. 30 РЕФЕРАТ Даний винахід відноситься: до дигідрохлоридної солі 2-аміно-N-[7-метокси-8-(3-морфолін-4-ілпропокси)-2,3дигідроімідазо-[1,2-c]хіназолін-5-іл]піримідин-5-карбоксаміду формули (II): 35 28
ДивитисяДодаткова інформація
Автори російськоюPeters, Jan, Georg, Militzer, Hans-Christian, Muller, Hartwig
МПК / Мітки
МПК: C07D 487/04, A61K 31/519, A61P 35/00
Мітки: заміщені, 2,3-дигідроімідазо[1,2-c]хіназолінові, солі
Код посилання
<a href="https://ua.patents.su/38-111604-zamishheni-23-digidroimidazo12-ckhinazolinovi-soli.html" target="_blank" rel="follow" title="База патентів України">Заміщені 2,3-дигідроімідазо[1,2-c]хіназолінові солі</a>
Попередній патент: Електродний вузол вакуумного вимикача
Наступний патент: Тонізуючий напій
Випадковий патент: Спосіб визначення показань до видалення дванадцятих ребер при виконанні абдомінопластики