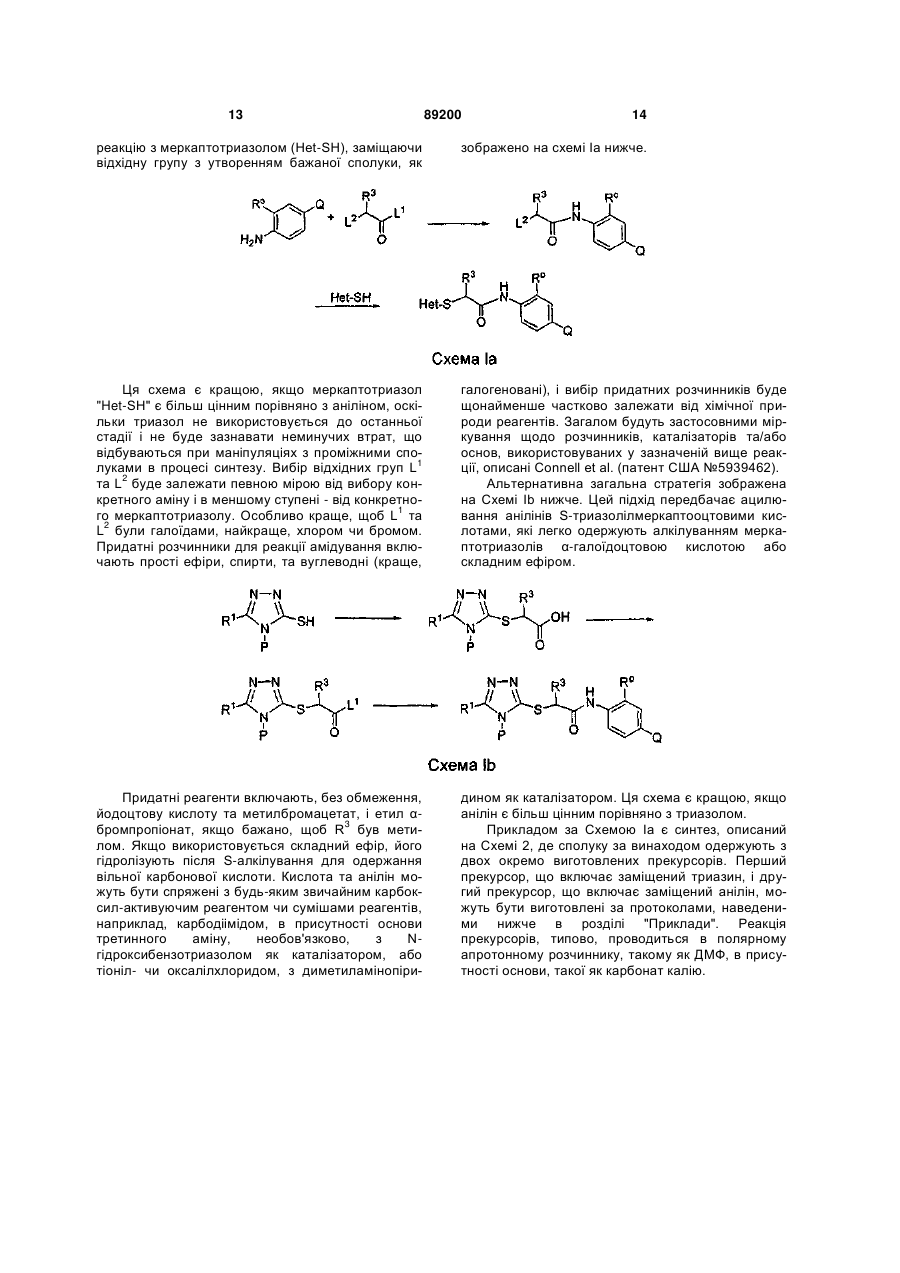
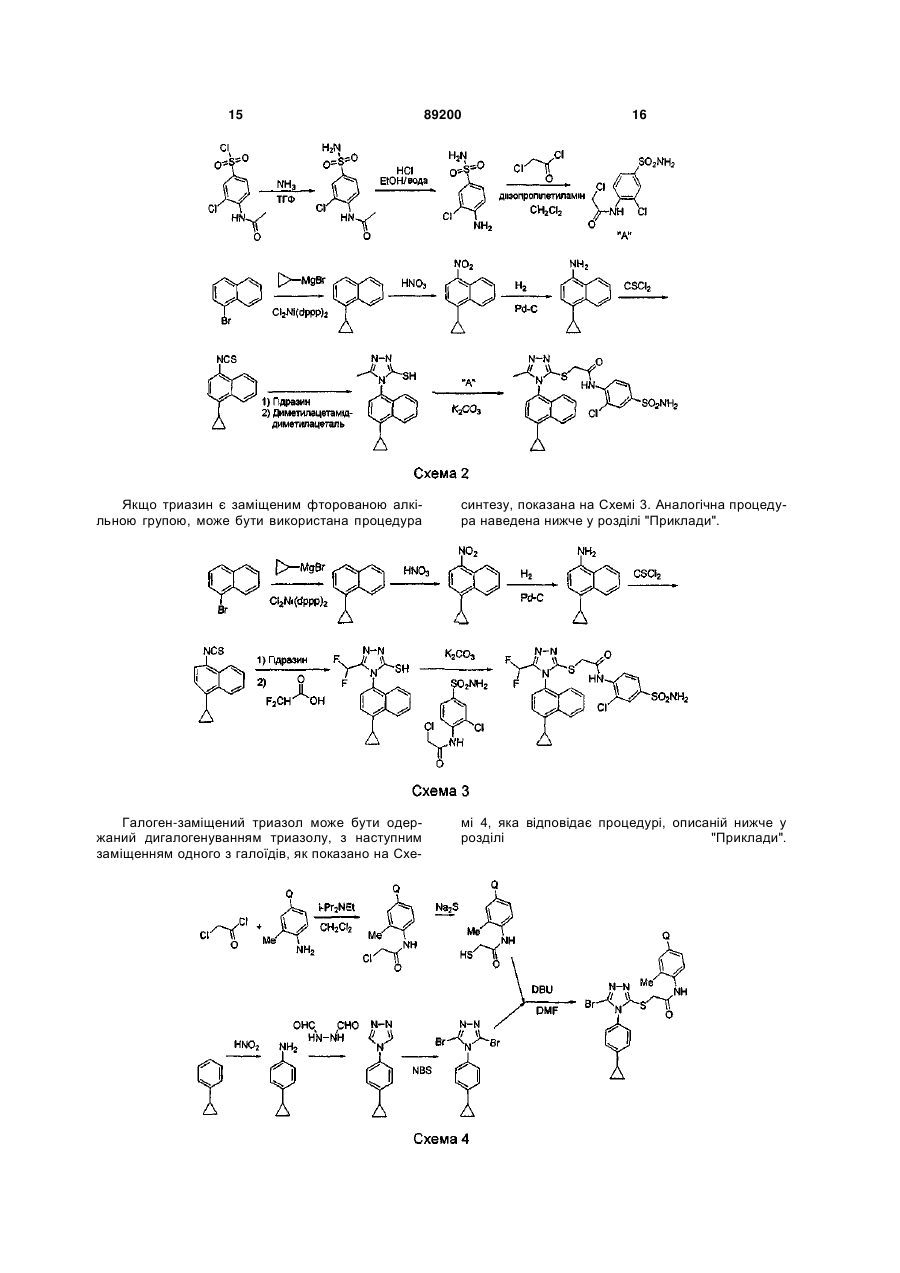
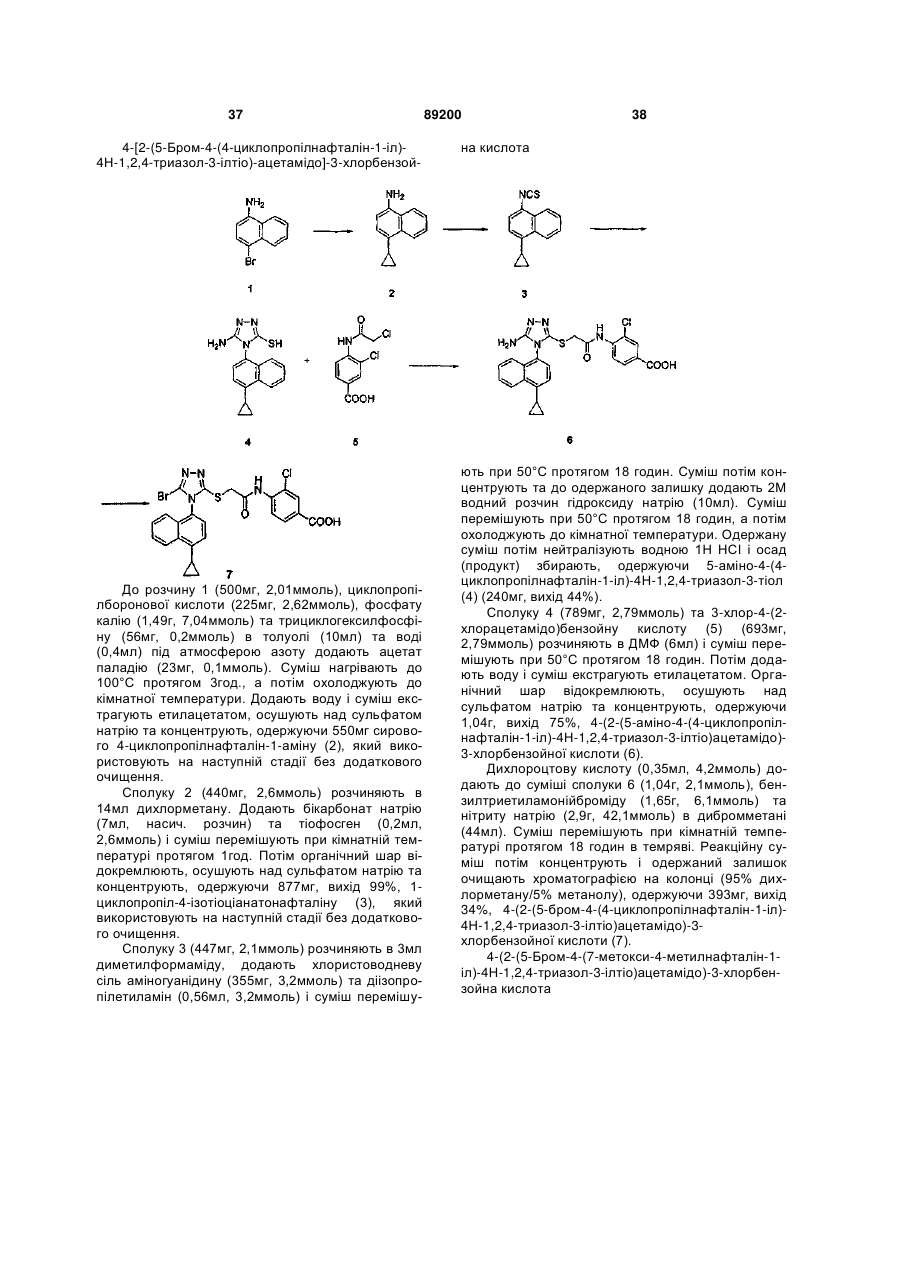
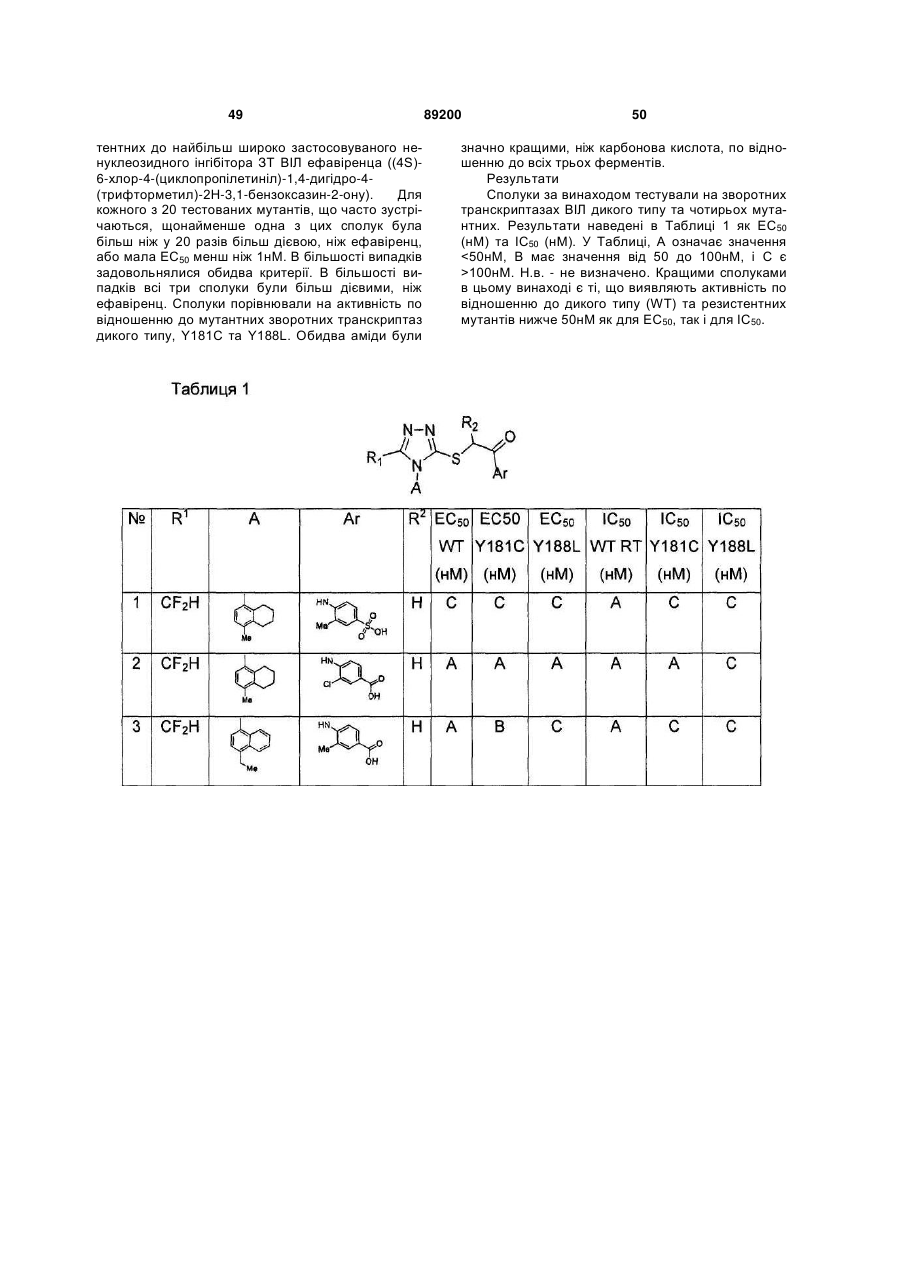
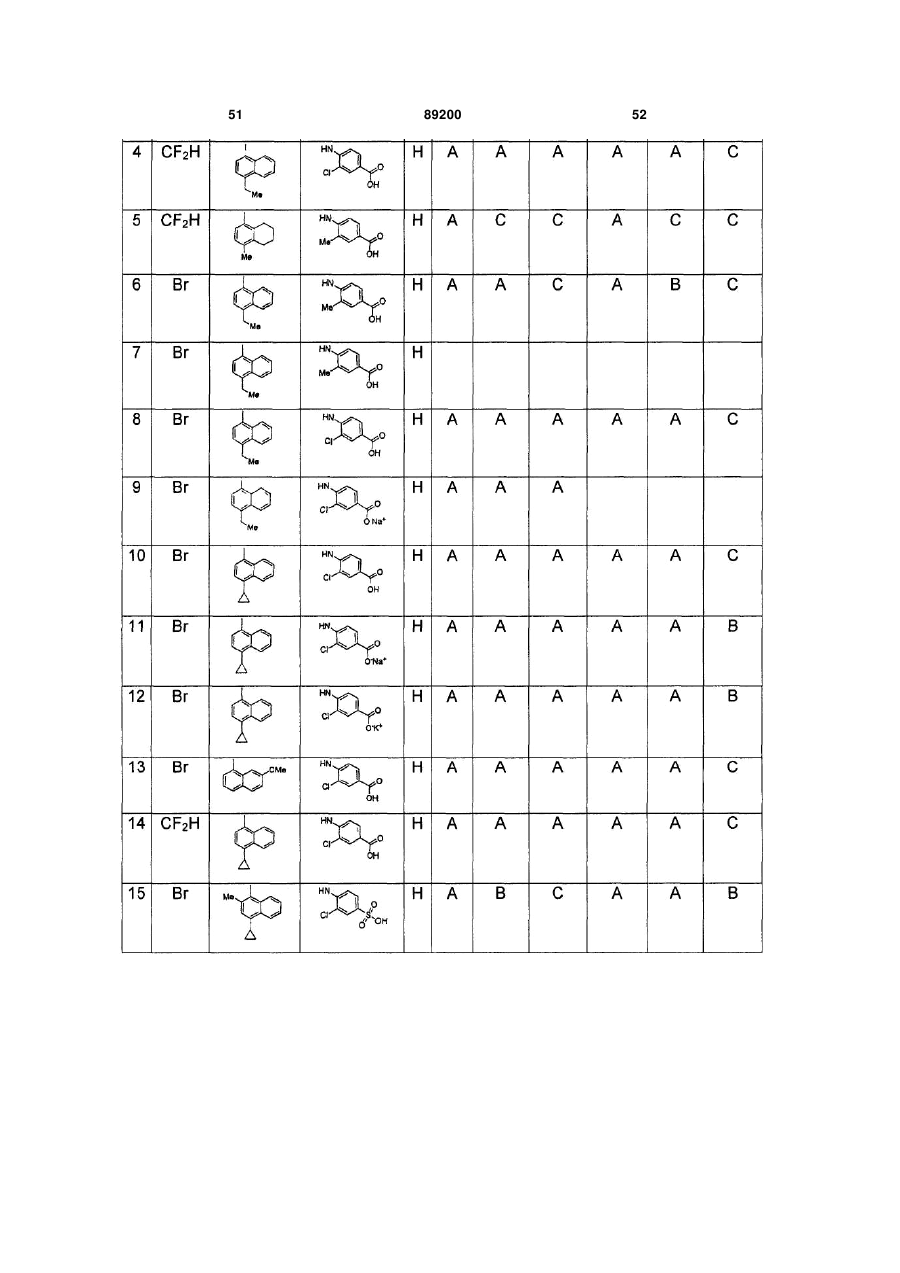
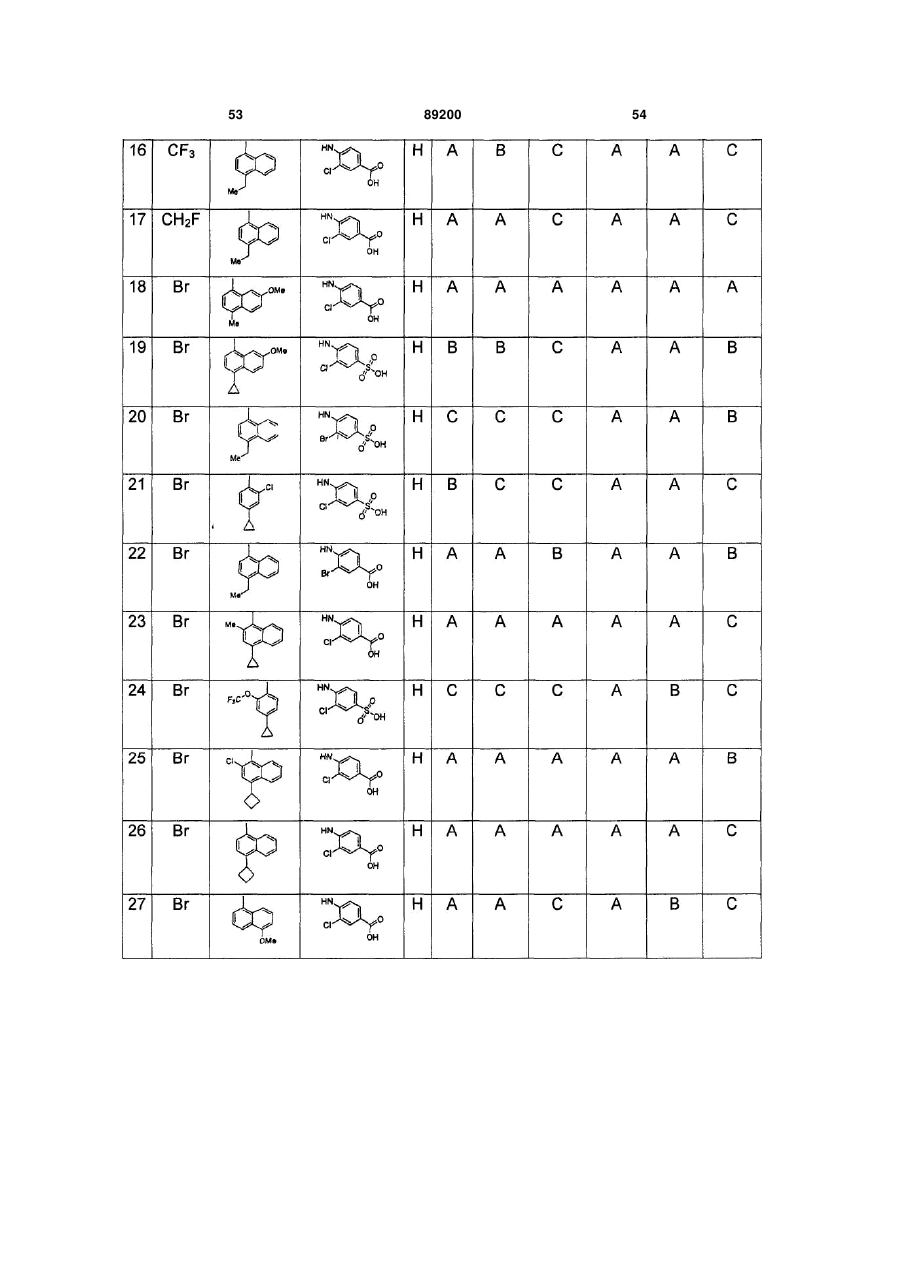
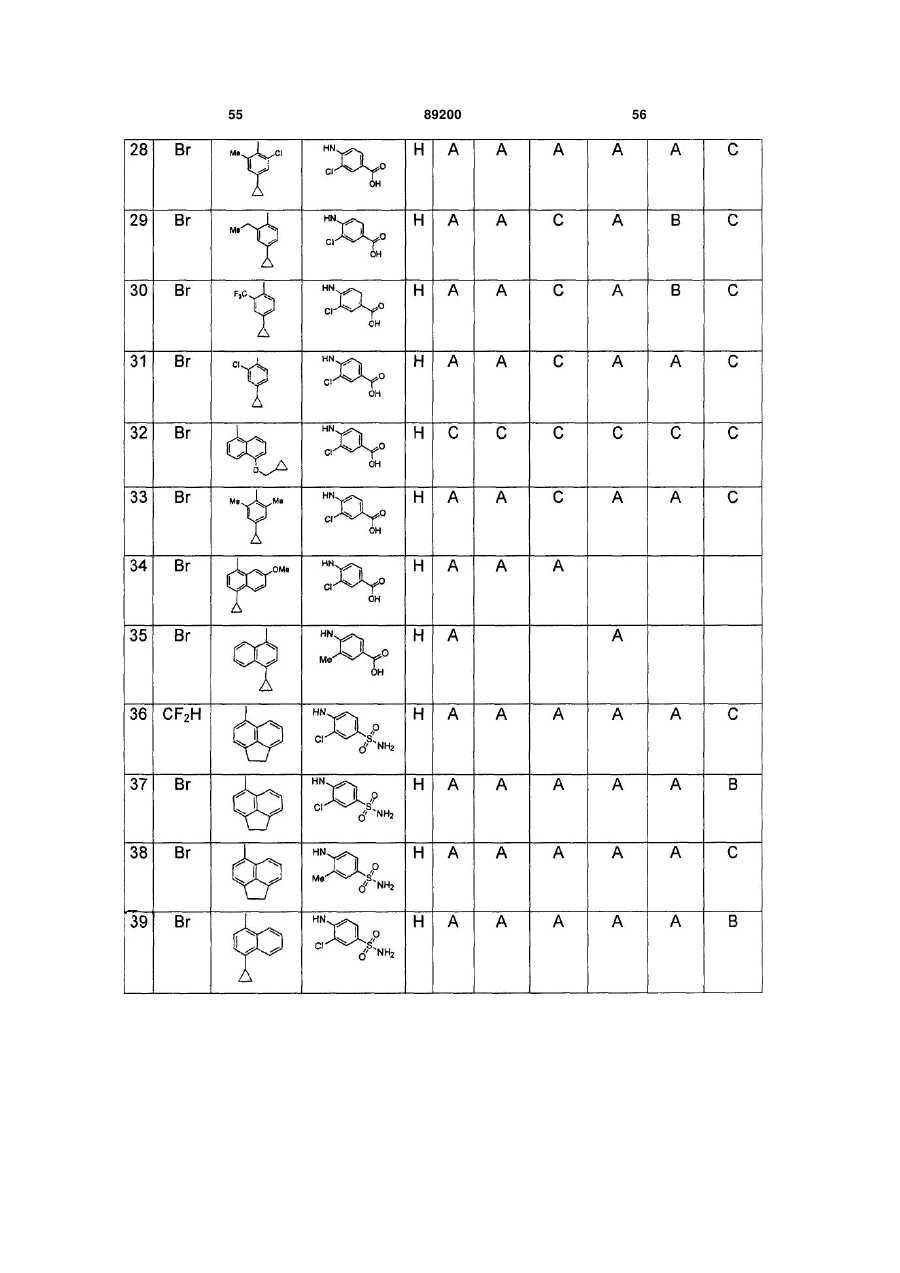
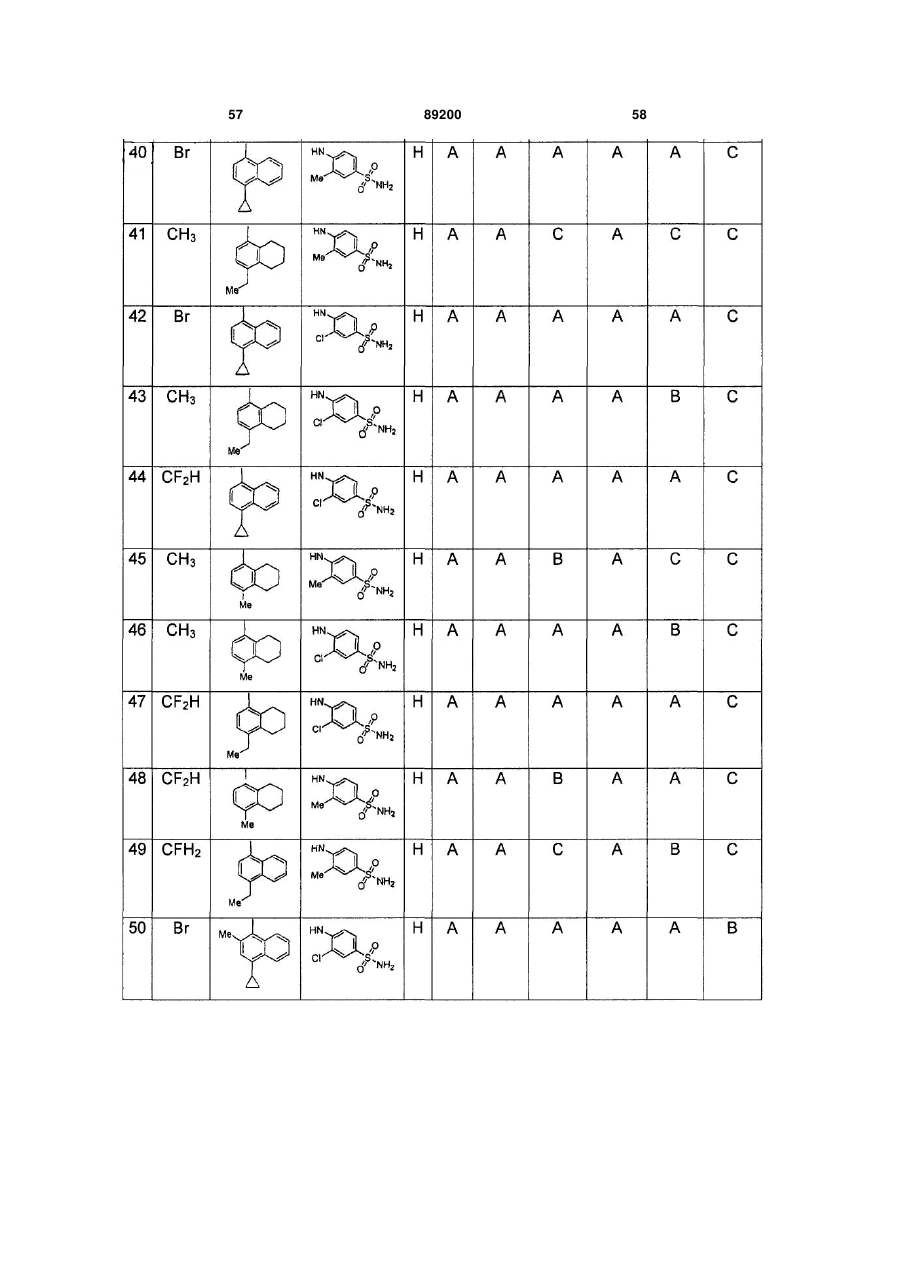
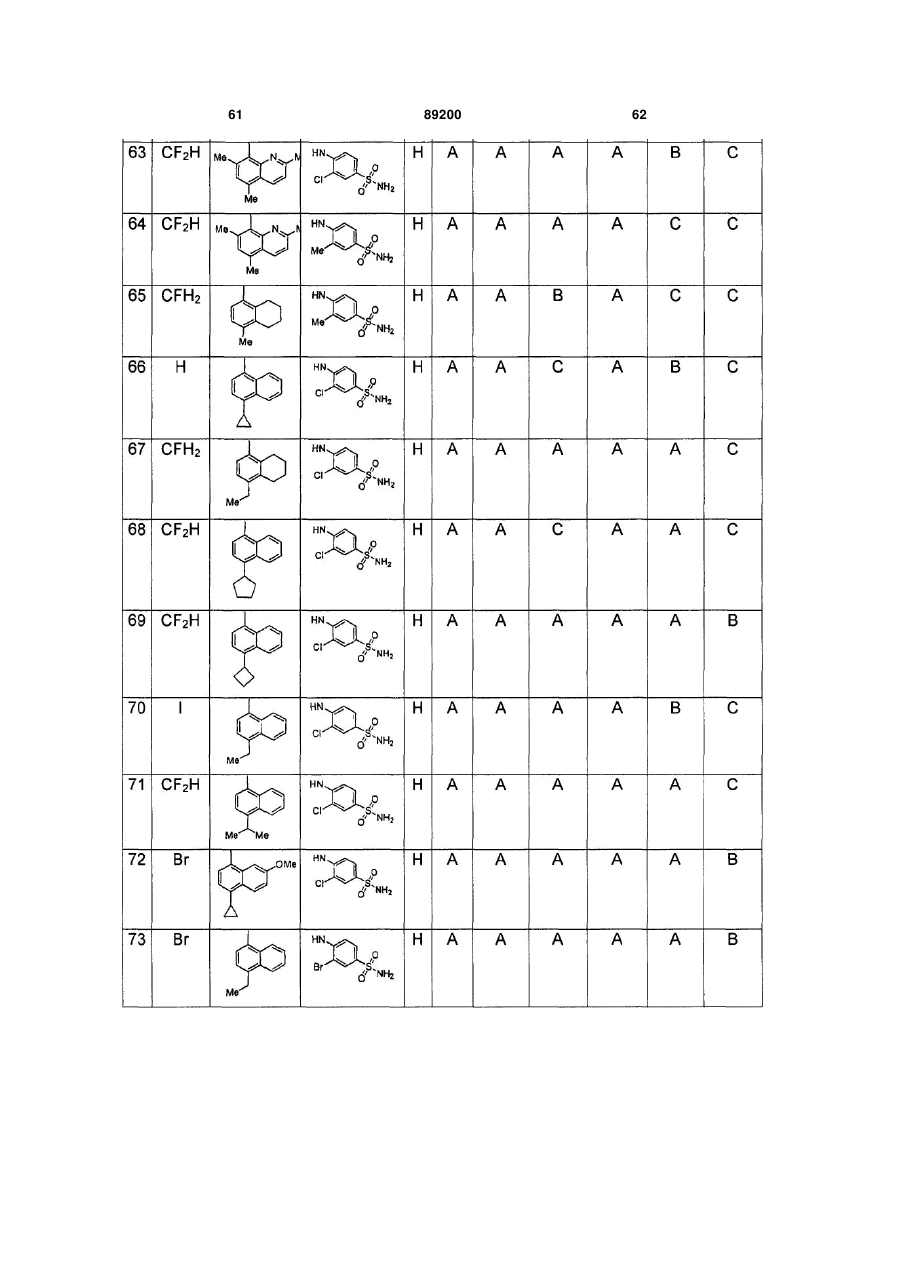
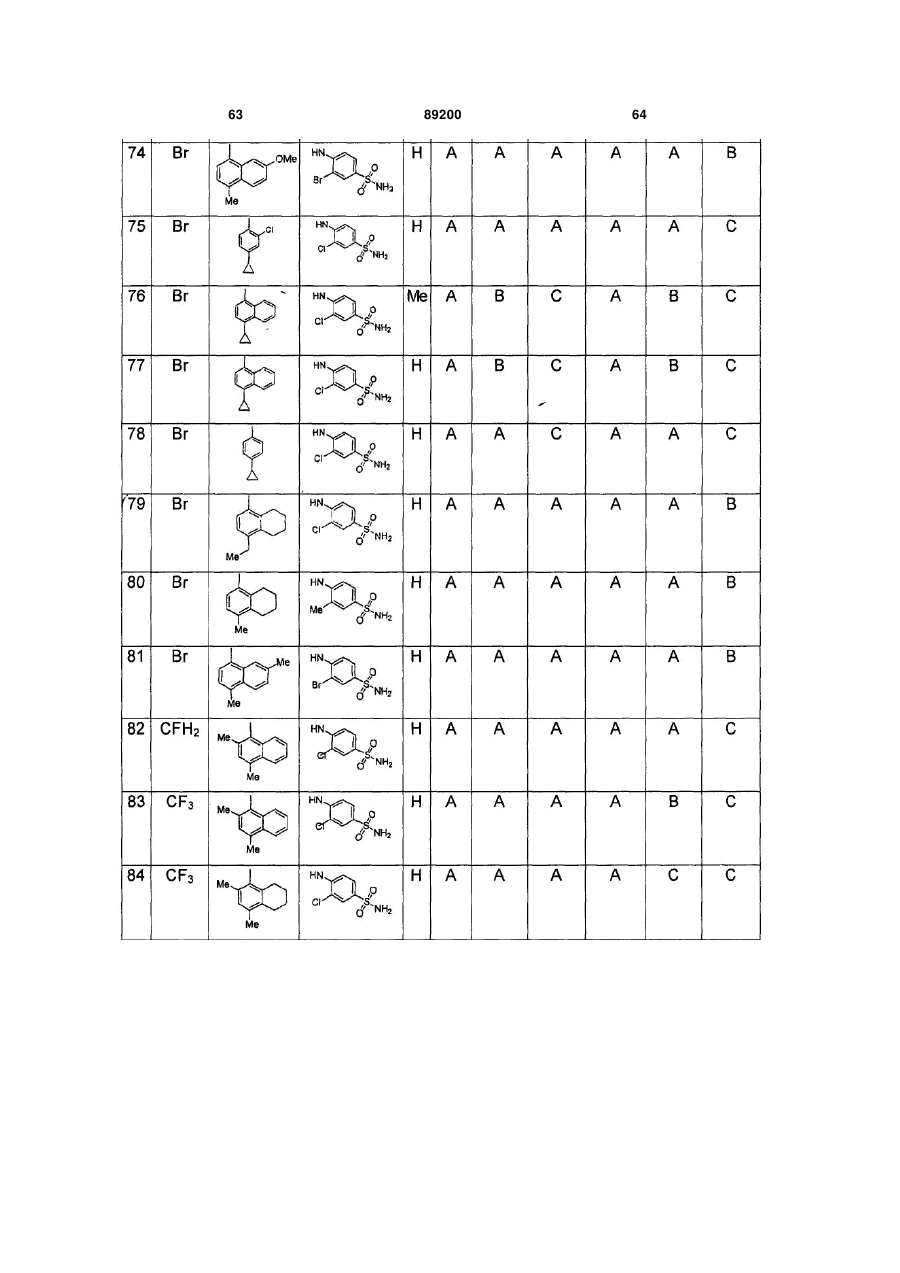
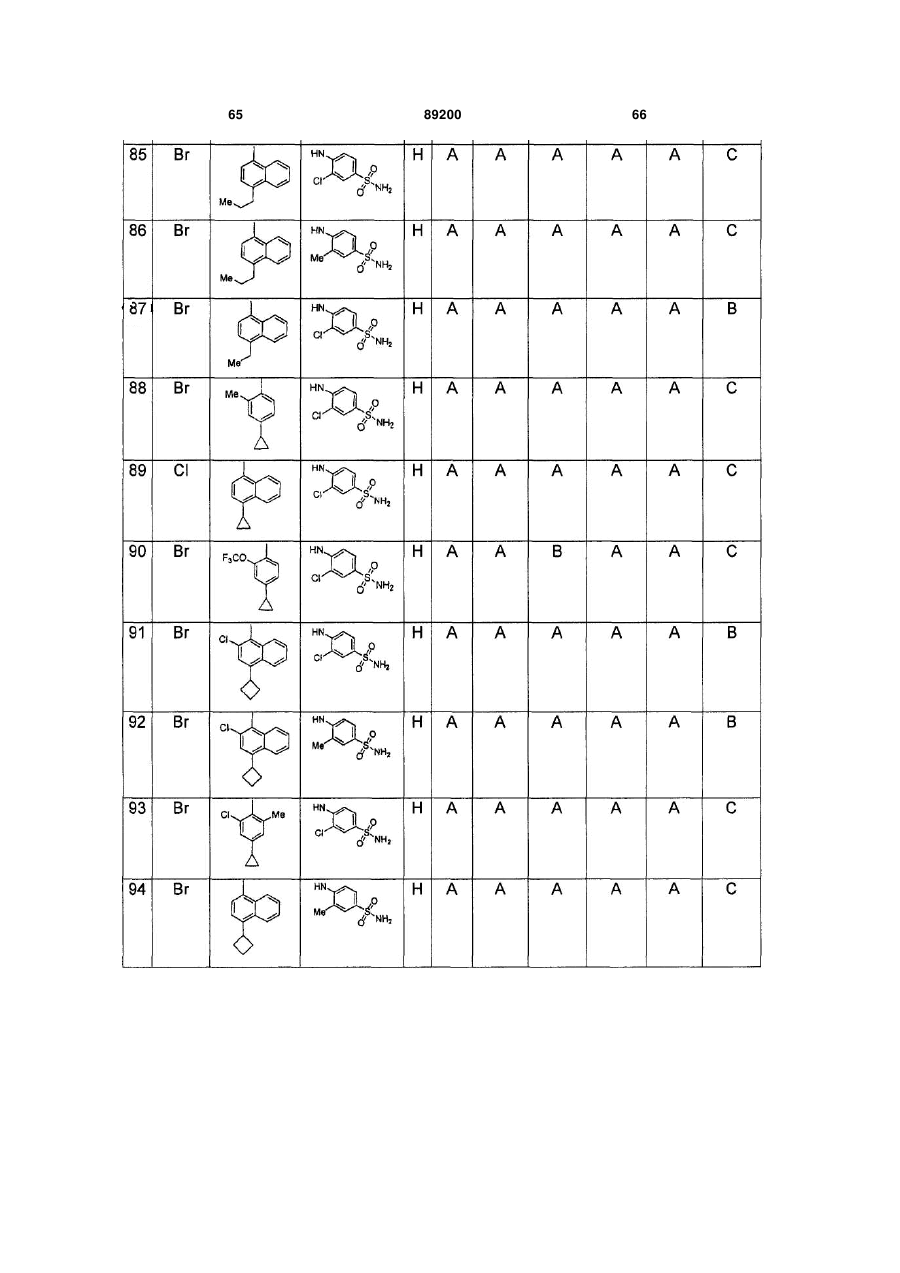
S-триазоліл-a-меркаптоацетаніліди як інгібітори зворотної транскриптази віл
Номер патенту: 89200
Опубліковано: 11.01.2010
Автори: Хонг Чжі, Ганік Есмір, Ленг Стенлі, Кім Хонг Ву, Кох Юнг-Хіо, де ла Роса Марта, Жірарде Жан-Люк
Формула / Реферат
1. Сполука, яка має наступну структуру:
 ,
,
у якій:
Q вибирають з групи, що складається з CO2H чи її солі, CONR'R", SO3H чи її солі та SO2NR'R";
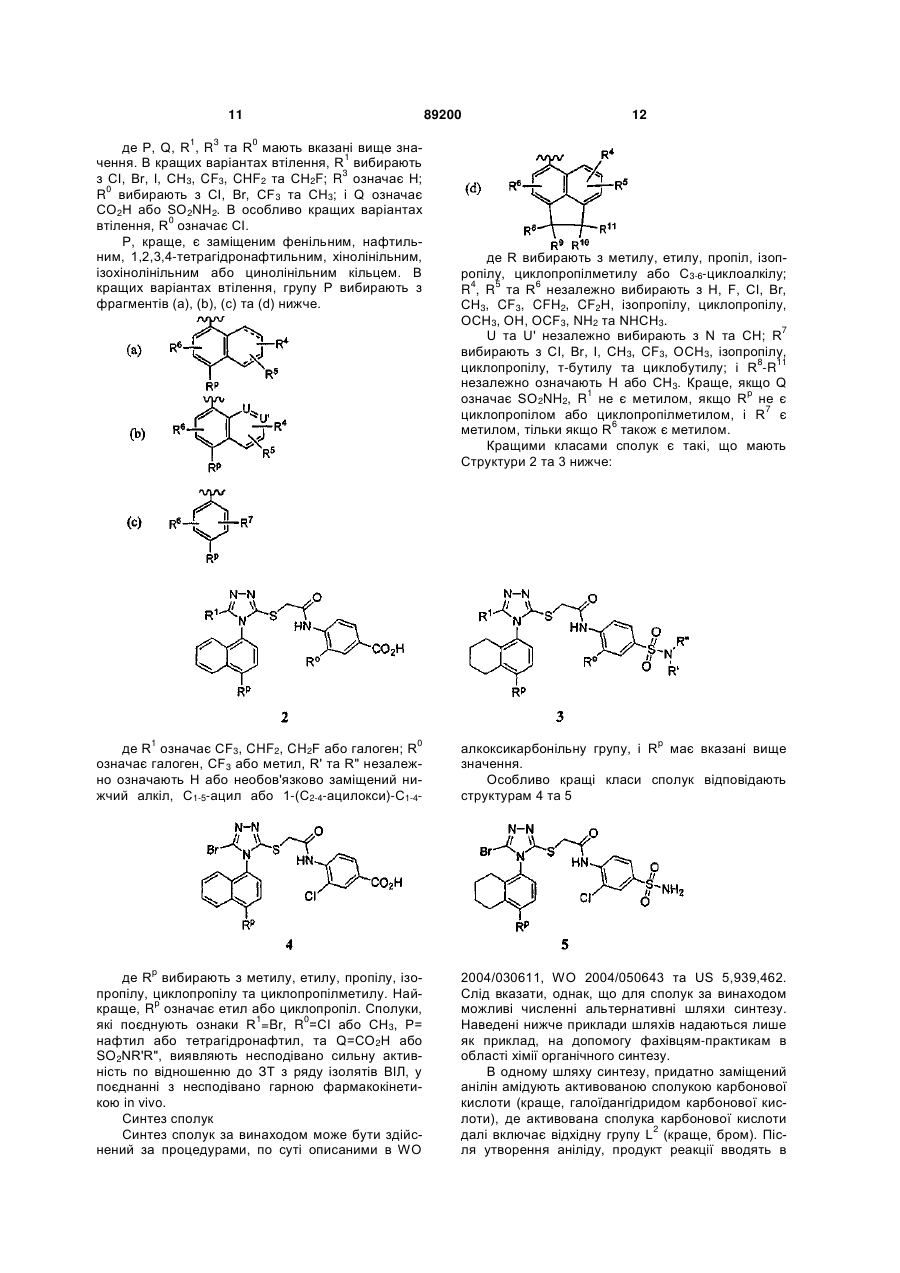
Р вибирають з групи, що складається з (а), (b), (с) та (d):
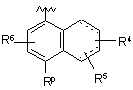 , (a)
, (a) 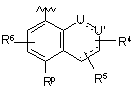 , (b)
, (b)
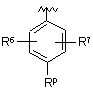 , (c)
, (c) 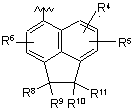 , (d)
, (d)
R1 вибирають з групи, що складається з Сl, Вr, I, СН3, CF3, CHF2 та CH2F;
R3 означає Н або СН3;
R' та R" незалежно вибирають з групи, що складається з Н, нижчого алкілу та нижчого алкілу, заміщеного однією чи більше OR, CO2R, NHR, NR2 або СF3 групами, де R означає Н чи нижчий алкіл,
або R' та R" разом з атомом азоту, до якого вони приєднані, утворюють 4-, 5- або 6-членне гетероциклічне кільце;
R0 вибирають з групи, що складається з Сl, Вr, СF3 та метилу;
Rp вибирають з групи, що складається з галогену, метилу, етилу, пропілу, ізопропілу, циклопропілметилу та С3-С6-циклоалкілу;
R4, R5 та R6 незалежно вибирають з групи, що складається з Н, F, Сl, Вr, СН3, CF3, CFH2, CF2H, ізопропілу, циклопропілу, ОСН3, ОН, ОСF3, NH2 та NНСН3;
U та U' незалежно вибирають з N та СН;
R7 вибирають з групи, що складається з Сl, Вr, І, СН3, СF3, ОСН3, ізопропілу, циклопропілу, трет-бутилу та циклобутилу; і
R8, R9, R10 та R11 незалежно означають Н або СН3;
за умови, що, коли Q означає SO2NH2,
R1 не є метилом, якщо Rp не є галогеном, циклопропілметилом або С3-С6-циклоалкілом, і R7 є метилом, тільки, якщо R6 є метилом.
2. Сполука за п. 1, у якій R4, R5 та R6 кожний незалежно вибирають з групи, що складається з Н, F, Сl, Вr, СН3, СF3, CFH2, CF2H, ізопропілу, циклопропілу, ОСН3 та ОСF3.
3. Сполука за п. 1, у якій Р вибирають з групи, що складається з (а), (b) та (d); та принаймні один з R4, R5 та R6 вибирають з групи, що складається з F, Сl, Вr, СF3, CFH2, CF2H, ізопропілу, циклопропілу, ОСН3, ОН, OCF3, NH2 та NНСН3.
4. Сполука за п. 1, у якій Р є заміщеним фенілом і R6 вибирають з групи, що складається з Н, F, Сl, Вr, СF3, CFH2, CF2H, ізопропілу, циклопропілу, ОСН3, ОН, ОСF3, NH2 та NHCH3.
5. Сполука за п. 2, у якій Р вибирають з групи, що складається з (а), (b) та (d); та принаймні один з R4, R5 та R6 вибирають з групи, що складається з F, Сl, Вr, СF3, CFH2, CF2H, ізопропілу, циклопропілу, ОСН3, ОН, ОСF3, NH2 та NHCH3.
6. Сполука за п. 3, у якій Р вибирають з групи, що складається з (а), (b) та (d); та принаймні один з R4, R5 та R6 вибирають з групи, що складається з F, Сl, Br, CF3, CFH2, CF2H, ізопропілу, циклопропілу, ОСН3, ОН, ОСF3, NН2 та NНСН3.
7. Сполука за п. 2, у якій Р є заміщеним нафтилом і R1 вибирають з групи, що складається з Br, СF3, CFH2 та CF2H.
8. Сполука за п. 7, у якій кожний з R4, R5 та R6 означає Н.
9. Сполука за п. 7, у якій Rp означає циклопропіл.
10. Сполука за п. 7, у якій R1 означає Br і R0 означає Сl.
11. Сполука за п. 2, у якій Р є заміщеним хіноліном або ізохіноліном і R1 вибирають з групи, що складається з Br, СF3, CFH2 та CF2H.
12. Сполука за п. 11, у якій кожний з R4, R5 та R6 означає Н.
13. Сполука за п. 11, у якій Rp означає циклопропіл.
14. Сполука за п. 11, у якій R1 означає Br і Rо означає Сl.
15. Сполука за будь-яким з пп. 3, 7 та 11, у якій Q означає SO2NH2.
16. Сполука за будь-яким з пп. 2, 4, 9 або 11, у якій Q означає CO2H.
17. Сполука за п. 16, у якій сіль є сіллю Na+, К+, Са++, Мg++ або DABCO.
18. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-17 в комбінації з одним чи більше фармацевтично прийнятними носіями.
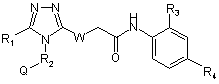
19. Сполука, яка має наступну структуру:
 , (A)
, (A)
де R1 означає С1-3-алкіл, -CF3, -CHF2, -CH2F, -Сl, -Br, -NH2 або водень;
R2 означає арильний чи гетероарильний фрагмент, який містить циклоалкільну або гетероциклічну групу, що може бути далі заміщеною алкільним, циклоалкільним, арильним або гетероарильним фрагментами, Q означає С3-5-циклоалкіл, W означає S, О або необов'язково заміщений амін;
R3 означає С1-3-алкіл, -СF3, -CHF2, -CH2F, -Сl, -Br; і
R4 означає СООН, -COR' або -S(O)2R', де R' означає -NH2 або -NН(алкіл).
20. Сполука за п. 19, у якій R2 означає 4-Q-нафт-1-ил або 4-Q-фен-1-іл.
21. Сполука за п. 20, у якій R' означає NH2 і R4 не є СООН.
22. Сполука за п. 21, у якій Q означає циклопропіл.
23. Сполука за п. 21, у якій W означає S.
24. Сполука за п. 22, у якій W означає S.
25. Сполука за п. 24, у якій R1 вибирають з групи, що складається з С1-3-алкілу, -СF3, -CHF2, -СН3F, -Сl, -Br і -NH2.
26. Сполука за п. 25, у якій R1 означає Br, R2 означає нафтил і R3 означає метил або Сl.
27. Сполука за п. 26, яка є
2-[5-бром-4-(4-циклопропілнафталін-1-іл)-4Н-[1,2,4]триазол-3-ілсульфаніл]-N-(2-хлор-4-сульфамоїлфеніл)ацетамідом або
2-[5-бром-4-(4-циклопропілнафталін-1-іл)-4Н-[1,2,4]триазол-3-ілсульфаніл]-N-(2-хлор-4-карбамоїлфеніл)ацетамідом.
28. Сполука за п. 26, яка є
2-[5-бром-4-(4-циклопропілнафталін-1-іл)-4Н-[1,2,4]триазол-3-ілсульфаніл]-N-(2-метил-4-сульфамоїлфеніл)ацетамідом або
2-[5-бром-4-(4-циклопропілнафталін-1-іл)-4Н-[1,2,4]триазол-3-ілсульфаніл]-N-(2-метил-4-карбамоїлфеніл)ацетамідом.
29. Сполука, яка має наступну структуру:
 ,
,
де R1 означає С1-3-алкіл, -CF3, -CHF2, -CH2F, -Сl, -Br, -NH2 або водень;
R2 означає 4-Q-нафт-1-ил або 4-Q-фен-1-іл-,
Q означає С2-5-алкіл,
W означає S, О або необов'язково заміщений амін;
R3 означає С1-3-алкіл, -CF3, -CHF2, -CH2F, -Сl, -Br; і
де R4 означає СООН, -COR' або -S(O)2R", де R' означає -NH2 або -NН(алкіл).
30. Сполука за п. 29, у якій W означає S.
31. Сполука за п. 30, у якій R' означає NH2 і R4 не є СООН.
32. Сполука за п. 30, у якій R1 вибирають з групи, що складається з С1-3-алкілу, -СF3, -CHF2, -CH2F, -Сl, -Вr і -NH2.
33. Сполука за п. 32, у якій Q означає етил.
34. Сполука за п. 33, у якій R3 означає хлор або метил.
35. Сполука за п. 34, яка є
2-[5-бром-4-(4-етилнафталін-1-іл)-4Н-[1,2,4]триазол-3-ілсульфаніл]-N-(2-хлор-4-сульфамоїлфеніл)ацетамідом або
2-[5-бром-4-(4-етилнафталін-1-іл)-4Н-[1,2,4]триазол-3-ілсульфаніл]-N-(2-хлор-4-карбамоїлфеніл)ацетамідом.
36. Сполука, яка має наступну структуру:
 ,
,
у якій:
P вибирають з групи, що складається з (а), (b), (с) та (d):
 , (a)
, (a)  , (b)
, (b)
 , (c)
, (c)  , (d)
, (d)
R1 вибирають з групи, що складається з Сl, Вr, І, СН3, СF3, CHF2 та CH2F;
R2 та R2' незалежно вибирають з групи, що складається з Н, необов'язково заміщеного С1-5-ацилу, 1-(С2-4-ацилоксі)-С1-4-алкоксикарбонілу та ацильної групи, похідної від a-амінокислоти;
R3 означає Н або СН3;
R0 вибирають з групи, що складається з Сl, Вr, СF3 та метилу;
Rp вибирають з групи, що складається з метилу, етилу, пропілу, ізопропілу, циклопропілметилу та С3-6-циклоалкілу;
R4, R5 та R6 незалежно вибирають з групи, що складається з Н, F, Сl, Вr, СН3, СF3, CFH2, CF2H, ізопропілу, циклопропілу, ОСН3, ОН, ОСF3, NH2 та NНСН3;
U та U' незалежно вибирають з N та СН;
R7 вибирають з групи, що складається з Сl, Вr, І, СН3, СF3, ОСН3, ізопропілу, циклопропілу, трет-бутилу, циклобутилу та метилу; і
R8, R9, R10 та R11 незалежно означають Н або СН3;
за умови, що, коли R2 та R2' означають Н,
R1 не є метилом, якщо R9 не означає циклопропіл, і
R7 є метилом, тільки, якщо R6 є метилом.
37. Сполука за п. 36, у якій R4, R5 та R6 кожний незалежно вибирають з групи, що складається з Н, F, Сl, Вr, СН3, СF3, CFH2, CF2H, ізопропілу, циклопропілу, ОСН3 та ОСF3.
38. Сполука за п. 36, у якій Р вибирають з групи, що складається з (а), (b) та (а); та принаймні один з R4, R5 та R6 вибирають з групи, що складається з F, Сl, Вr, СF3, CFH2, CF2H, ізопропілу, циклопропілу, ОСН3, ОН, ОСF3 NH2 та NНСН3.
39. Сполука за п. 36, у якій Р є заміщеним фенілом і R6 не є метилом.
40. Сполука за п. 37, у якій Р вибирають з групи, що складається з (а), (b) та (d); та принаймні один з R4, R5 та R6 вибирають з групи, що складається з F, Сl, Br, CF3, CFH2, СF2Н, ізопропілу, циклопропілу, ОСН3, ОН, ОСF3 NH2 та NНСН3.
41. Сполука за п. 38, у якій Р вибирають з групи, що складається з (а), (b) та (d); та принаймні один з R4, R5 та R6 вибирають з групи, що складається з F, Сl, Br, СF3, CFH2, CF2H, ізопропілу, циклопропілу, ОСН3, ОН, ОСF3 NH2 та NНСН3.
42. Сполука за п. 37, у якій Р є заміщеним нафтилом і R1 вибирають з групи, що складається з Br, СF3СFН2 та CF2H.
43. Сполука за п. 42, у якій кожний з R4, R5 та R6 означає Н.
44. Сполука за п. 42, у якій Rp означає циклопропіл.
45. Сполука за п. 42, у якій R1 означає Br і R0 означає Сl.
46. Сполука за п. 37, у якій Р є заміщеним хіноліном або ізохіноліном і R1 вибирають з групи, що складається з Br, СF3, CFH2 та CF2H.
47. Сполука за п. 46, у якій кожен з R4, R5 та R6 означає Н.
48. Сполука за п. 46, у якій Rp означає циклопропіл.
49. Сполука за п. 46, у якій R1 означає Br і R0 означає Сl.
50. Сполука за п. 38, у якій R2 означає ацетил або 2-ацетилпропоксикарбоніл.
51. Сполука за п. 37, у якій R2 означає ацетил або 1-ацетоксіетоксикарбоніл.
52. Сполука за п. 46, у якій R2 означає ацетил або 1-ацетоксіетоксикарбоніл.
53. Сполука за будь-яким з пп. 50, 51 та 52, у якій R2' означає Н.
54. Сполука за будь-яким з пп. 38, 42 та 46, у якій R2 та R2' обидва означають Н.
Текст
1. Сполука, яка має наступну структуру: R0 3 89200 Вr, СF3, CFH2, CF2H, ізопропілу, циклопропілу, ОСН3, ОН, ОСF3, NH2 та NHCH3. 5. Сполука за п. 2, у якій Р вибирають з групи, що складається з (а), (b) та (d); та принаймні один з R4, R5 та R6 вибирають з групи, що складається з F, Сl, Вr, СF3, CFH2, CF2H, ізопропілу, циклопропілу, ОСН3, ОН, ОСF3, NH2 та NHCH3. 6. Сполука за п. 3, у якій Р вибирають з групи, що складається з (а), (b) та (d); та принаймні один з R4, R5 та R6 вибирають з групи, що складається з F, Сl, Br, CF3, CFH2, CF2H, ізопропілу, циклопропілу, ОСН3, ОН, ОСF3, NН2 та NНСН3. 7. Сполука за п. 2, у якій Р є заміщеним нафтилом 1 і R вибирають з групи, що складається з Br, СF3, CFH2 та CF2H. 4 5 6 8. Сполука за п. 7, у якій кожний з R , R та R означає Н. 9. Сполука за п. 7, у якій Rp означає циклопропіл. 1 0 10. Сполука за п. 7, у якій R означає Br і R означає Сl. 11. Сполука за п. 2, у якій Р є заміщеним хіноліном 1 або ізохіноліном і R вибирають з групи, що складається з Br, СF3, CFH2 та CF2H. 12. Сполука за п. 11, у якій кожний з R4, R5 та R6 означає Н. 13. Сполука за п. 11, у якій Rp означає циклопропіл. 14. Сполука за п. 11, у якій R1 означає Br і Rо означає Сl. 15. Сполука за будь-яким з пп. 3, 7 та 11, у якій Q означає SO2NH2. 16. Сполука за будь-яким з пп. 2, 4, 9 або 11, у якій Q означає CO2H. 17. Сполука за п. 16, у якій сіль є сіллю Na+, К+, Са++, Мg++ або DABCO. 18. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-17 в комбінації з одним чи більше фармацевтично прийнятними носіями. 19. Сполука, яка має наступну структуру: N N R3 H N W R1 N Q R2 O R4 , (A) де R1 означає С1-3-алкіл, -CF3, -CHF2, -CH2F, -Сl, Br, -NH2 або водень; R2 означає арильний чи гетероарильний фрагмент, який містить циклоалкільну або гетероциклічну групу, що може бути далі заміщеною алкільним, циклоалкільним, арильним або гетероарильним фрагментами, Q означає С3-5циклоалкіл, W означає S, О або необов'язково заміщений амін; R3 означає С1-3-алкіл, -СF3, -CHF2, -CH2F, -Сl, -Br; і R4 означає СООН, -COR' або -S(O)2R', де R' означає -NH2 або -NН(алкіл). 20. Сполука за п. 19, у якій R2 означає 4-Q-нафт-1ил або 4-Q-фен-1-іл. 21. Сполука за п. 20, у якій R' означає NH2 і R4 не є СООН. 22. Сполука за п. 21, у якій Q означає циклопропіл. 23. Сполука за п. 21, у якій W означає S. 24. Сполука за п. 22, у якій W означає S. 4 25. Сполука за п. 24, у якій R1 вибирають з групи, що складається з С1-3-алкілу, -СF3, -CHF2, -СН3F, Сl, -Br і -NH2. 26. Сполука за п. 25, у якій R1 означає Br, R2 означає нафтил і R3 означає метил або Сl. 27. Сполука за п. 26, яка є 2-[5-бром-4-(4-циклопропілнафталін-1-іл)-4Н[1,2,4]триазол-3-ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамідом або 2-[5-бром-4-(4-циклопропілнафталін-1-іл)-4Н[1,2,4]триазол-3-ілсульфаніл]-N-(2-хлор-4карбамоїлфеніл)ацетамідом. 28. Сполука за п. 26, яка є 2-[5-бром-4-(4-циклопропілнафталін-1-іл)-4Н[1,2,4]триазол-3-ілсульфаніл]-N-(2-метил-4сульфамоїлфеніл)ацетамідом або 2-[5-бром-4-(4-циклопропілнафталін-1-іл)-4Н[1,2,4]триазол-3-ілсульфаніл]-N-(2-метил-4карбамоїлфеніл)ацетамідом. 29. Сполука, яка має наступну структуру: N N R3 H N W R1 N Q O R2 R4 , де R1 означає С1-3-алкіл, -CF3, -CHF2, -CH2F, -Сl, Br, -NH2 або водень; R2 означає 4-Q-нафт-1-ил або 4-Q-фен-1-іл-, Q означає С2-5-алкіл, W означає S, О або необов'язково заміщений амін; R3 означає С1-3-алкіл, -CF3, -CHF2, -CH2F, -Сl, -Br; і де R4 означає СООН, -COR' або -S(O)2R", де R' означає -NH2 або -NН(алкіл). 30. Сполука за п. 29, у якій W означає S. 31. Сполука за п. 30, у якій R' означає NH2 і R4 не є СООН. 32. Сполука за п. 30, у якій R1 вибирають з групи, що складається з С1-3-алкілу, -СF3, -CHF2, -CH2F, Сl, -Вr і -NH2. 33. Сполука за п. 32, у якій Q означає етил. 34. Сполука за п. 33, у якій R3 означає хлор або метил. 35. Сполука за п. 34, яка є 2-[5-бром-4-(4-етилнафталін-1-іл)-4Н[1,2,4]триазол-3-ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамідом або 2-[5-бром-4-(4-етилнафталін-1-іл)-4Н[1,2,4]триазол-3-ілсульфаніл]-N-(2-хлор-4карбамоїлфеніл)ацетамідом. 36. Сполука, яка має наступну структуру: 0 R N N R1 N R3 S H N O R2 S N O R2' O P , у якій: P вибирають з групи, що складається з (а), (b), (с) та (d): 5 89200 6 4 U R6 R5 Rp U' R6 R4 R5 Rp , (a) R4 , (b) R4 1 R6 R6 R5 R7 R8 R11 R R , (c) , (d) 1 R вибирають з групи, що складається з Сl, Вr, І, СН3, СF3, CHF2 та CH2F; 2 2' R та R незалежно вибирають з групи, що складається з Н, необов'язково заміщеного С1-5-ацилу, 1-(С2-4-ацилоксі)-С1-4-алкоксикарбонілу та ацильної групи, похідної від -амінокислоти; 3 R означає Н або СН3; 0 R вибирають з групи, що складається з Сl, Вr, СF3 та метилу; Rp вибирають з групи, що складається з метилу, етилу, пропілу, ізопропілу, циклопропілметилу та С3-6-циклоалкілу; R4, R5 та R6 незалежно вибирають з групи, що складається з Н, F, Сl, Вr, СН3, СF3, CFH2, CF2H, ізопропілу, циклопропілу, ОСН3, ОН, ОСF3, NH2 та NНСН3; U та U' незалежно вибирають з N та СН; R7 вибирають з групи, що складається з Сl, Вr, І, СН3, СF3, ОСН3, ізопропілу, циклопропілу, третбутилу, циклобутилу та метилу; і R8, R9, R10 та R11 незалежно означають Н або СН3; за умови, що, коли R2 та R2' означають Н, R1 не є метилом, якщо R9 не означає циклопропіл, і 7 6 R є метилом, тільки, якщо R є метилом. 37. Сполука за п. 36, у якій R4, R5 та R6 кожний незалежно вибирають з групи, що складається з Н, F, Сl, Вr, СН3, СF3, CFH2, CF2H, ізопропілу, циклопропілу, ОСН3 та ОСF3. 38. Сполука за п. 36, у якій Р вибирають з групи, що складається з (а), (b) та (а); та принаймні один Rp 9 10 Ця заявка претендує на пріоритет тимчасових заявок США 60/604219, поданої 25 серпня 2004p., 60/604220, поданої 25 серпня 2004р., та 60/686351, поданої 31 травня 2005p., обсяг кожної з яких цілком включений сюди за посиланням. Винахід стосується інгібіторів ферментів та використання інгібіторів ферментів для лікування хвороби. Більш конкретно, винахід стосується in vitro та in vivo інгібування зворотної транскриптази ВІЛ як способу лікування інфекції ВІЛ. Фахівцям відомі численні методи лікування ВІЛ, і, поміж інших фармацевтично активних сполуки, інгібітори зворотної транскриптази забезпечують значний терапевтичний ефект у багатьох ВІЛ-інфікованих пацієнтів. Наприклад, ламівудин 5 6 з R , R та R вибирають з групи, що складається з F, Сl, Вr, СF3, CFH2, CF2H, ізопропілу, циклопропілу, ОСН3, ОН, ОСF3 NH2 та NНСН3. 39. Сполука за п. 36, у якій Р є заміщеним фенілом і R6 не є метилом. 40. Сполука за п. 37, у якій Р вибирають з групи, що складається з (а), (b) та (d); та принаймні один 4 5 6 з R , R та R вибирають з групи, що складається з F, Сl, Br, CF3, CFH2, СF2Н, ізопропілу, циклопропілу, ОСН3, ОН, ОСF3 NH2 та NНСН3. 41. Сполука за п. 38, у якій Р вибирають з групи, що складається з (а), (b) та (d); та принаймні один 4 5 6 з R , R та R вибирають з групи, що складається з F, Сl, Br, СF3, CFH2, CF2H, ізопропілу, циклопропілу, ОСН3, ОН, ОСF3 NH2 та NНСН3. 42. Сполука за п. 37, у якій Р є заміщеним нафтилом і R1 вибирають з групи, що складається з Br, СF3СFН2 та CF2H. 4 5 6 43. Сполука за п. 42, у якій кожний з R , R та R означає Н. 44. Сполука за п. 42, у якій Rp означає циклопропіл. 45. Сполука за п. 42, у якій R1 означає Br і R0 означає Сl. 46. Сполука за п. 37, у якій Р є заміщеним хіноліном або ізохіноліном і R1 вибирають з групи, що складається з Br, СF3, CFH2 та CF2H. 47. Сполука за п. 46, у якій кожен з R4, R5 та R6 означає Н. 48. Сполука за п. 46, у якій Rp означає циклопропіл. 49. Сполука за п. 46, у якій R1 означає Br і R0 означає Сl. 50. Сполука за п. 38, у якій R2 означає ацетил або 2-ацетилпропоксикарбоніл. 2 51. Сполука за п. 37, у якій R означає ацетил або 1-ацетоксіетоксикарбоніл. 52. Сполука за п. 46, у якій R2 означає ацетил або 1-ацетоксіетоксикарбоніл. 53. Сполука за будь-яким з пп. 50, 51 та 52, у якій 2' R означає Н. 54. Сполука за будь-яким з пп. 38, 42 та 46, у якій R2 та R2' обидва означають Н. (ЗТС) або зидовудин (AZT) є відносно добре переносимими антиретровірусними лікарськими засобами. Однак, останнім часом виникли численні вірусні штами із значною резистентністю до цих сполук. Для подолання резистентності, щонайменше, в деякому ступені, можуть бути введені нові інгібітори типу нуклеозидів (самі або в комбінації з іншими інгібіторами типу нуклеозидів), і приклади альтернативних лікарських засобів включають ставудин (d4T), диданозин (ddl), комбівір (Combivir™) (фірмова назва для комбінації ламівудину та зидовудину) та тризивір (Trizivir™) (фірмова назва для комбінації ЗТС, AZT та абакавіру). На жаль, виникнення резистентності до одного інгібітора нуклеозидного типу часто супроводжу 7 ється виникненням певного ступеня резистентності до іншого інгібітора нуклеозидного типу, що часто призводить до необхідності переходу до іншого класу лікарських засобів. У таких випадках, пацієнт може одержати інгібітор протеази (наприклад, саквінавір, індинавір, нелфінавір і т.д.), типово, в комбінації з іншими антиретровірусними агентами. Однак, відносно складна схема введення таких комбінацій часто створює організаційні та фінансові проблеми для багатьох пацієнтів, і їхнє дотримання часто є меншим, ніж бажане. Нещодавно, лікування ВІЛ було сфокусоване на комбінаційних терапіях, які включають введення нуклеозидних інгібіторів зворотної транскриптази з інгібіторами протеази і з ненуклеозидними інгібіторами зворотної транскриптази, та потрійних комбінацій нуклеозидних інгібіторів зворотної транскриптази, ненуклеозидних інгібіторів зворотної транскриптази та інгібіторів протеази. На жаль, комбіновані терапії інгібіторами протеази з нуклеозидними інгібіторами зворотної транскриптази часто погано переносяться та часто призводять до дострокового припинення терапії. Тому, найсучасніші комбінаційні лікування включають комбінацію нуклеозидних інгібіторів зворотної транскриптази та ненуклеозидних інгібіторів зворотної транскриптази. Інгібітори ненуклеозидного типу (наприклад, невірапін, делавірдин та ефавіренц) є структурно неоднорідною групою сполук, які гадано зв'язуються з ненуклеозидним карманом зворотних транскриптаз. Вони істотно підвищують антивірусну ефективність при спільному введенні з інгібіторами нуклеозидного типу. Хоч інгібітори ненуклеозидного типу вважаються перспективним новим класом антивірусних лікарських засобів, у них залишається кілька недоліків. Вартість відомих зараз інгібіторів ненуклеозидного типу є відносно високою, а одна мутація вірусних зворотних транскриптаз може індукувати крос-резистентність по відношенню до великого класу ненуклеозидних інгібіторів зворотної транскриптази. Тому існує потреба в створенні нових ненуклеозидних інгібіторів зворотної транскриптази, які б мали сильний антивірусний ефект, особливо, проти мутантних штамів ВІЛ, що виявляють резистентність по відношенню до відомих зараз ненуклеозидних інгібіторів зворотної транскриптази. Вірус ВІЛ має відносно високу частоту мутацій, що часто призводить до лікарської резистентністі по відношенню до сучасних методів лікування. Проводилися дослідження з метою ідентифікації спектра мутацій в білках зворотної транскриптази (RT) вірусів, виділених у пацієнтів з невдалими результатами терапії з використанням щонайменше одного ненуклеозидного інгибітора зворотної транскриптази (NNRTI), і результати показали, що мутант K103N був домінуючим у пацієнтів, які приймали ефавіренц, у той час як Y181C був домінуючим у пацієнтів, які приймали невірапін. Інші одиничні мутації включали K01Е, G190S/A/E та Y188L/C. Деякі з найбільш поширених подвійних мутацій у пацієнтів з невдалою терапією з використанням ефавіренца включають K103N-P225H, K103N-V108I, K103N-K101Q, K103N-L100I, K103N 89200 8 F227L, V106I-Y188L, K103N-Y188L та K103NG190A. Існує потреба у створенні нових композицій та методів інгібування цих та інших мутантів зворотних транскриптаз. Дана заявка пов'язана з роботами, раніше розкритими в заявках PCT/US02/26186, поданій 23 серпня 2002p., неопублікованій, та PCT/US03/27433, поданій 22 серпня 2003p., опублікованій як WO 2004/030611 15 квітня 2004p., які знаходяться у суспільній власності. Патент США 5939462, виданий на ім'я Connell et al., розкриває велику кількість заміщених гетероциклів, придатних для застосування як антагоністи рецептора NPY5, деякі з яких є Sтриазолілмеркаптоацетанілідами, подібними до загальної структури 1, наведеної нижче. Simoneau et al., у міжнародній патентній публікації WO 2004/050643, розкривають тетразоли та кілька триазолів, що мають структури, подібні до описаних в даному винаході, які виявляють активність інгібіторів зворотної транскриптази. Автори винаходу знайшли, що зворотна транскриптаза (RT) ВІЛ може бути інгібована вибраним класом S-триазоліл-α-меркаптоацетанілідів, представлених загальною структурою 1. Несподівано, деякі з цих сполук були здатними інгібувати різні мутовані ЗТ, включаючи K103N, Y181C та Y188L. У формулі 1, R1 означає галоген, нижчий алкіл, нижчий алкеніл або нижчий алкініл, де нижчі алкільні, нижчі алкенільні або нижчі алкінільні групи можуть необов'язково бути заміщеними, краще, одним чи більше галогенами. R3 означає Η або метил, і замісник R0 означає Н, галоген, CF3, нижчу алкокси або нижчу алкілтіогрупу. Q означає СО2Н, SO3H, CONR'R" або SO2NR'R", де R' та R" незалежно означають Н, нижчий алкіл або нижчий алкіл, заміщений однією чи більше OR, CO 2R, NHR, NR2 або CF3 групою, де R означає Η чи нижчий алкіл, або R' та R" разом з атомом азоту, до якого вони приєднані, утворюють 4-, 5- або 6членне гетероциклічне кільце. Ρ означає ароматичне або гетероароматичне кільце, що має замісники, як більш детально описані далі. Відповідно, даний винахід пропонує сполуки, які інгібують зворотну транскриптазу ВІЛ in vitro та in vivo. Винахід також передбачає фармацевтичні композиції, які включають одну чи більше сполук за винаходом, використання сполук за винаходом для виготовлення фармацевтичних композицій для лікування ВІЛ, та методи лікування пацієнта, інфікованого ВІЛ, шляхом введення терапевтично ефективної кількості однієї чи більше сполук за винаходом або їхньої фармацевтично прийнятної солі. Термін "алкіл" в тому значенні, що використовується тут, стосується циклічного, розгалуженого або лінійного вуглеводневого радикала, у якому 9 всі вуглець-вуглецеві зв'язки є простими зв'язками, а термін "нижчий алкіл" стосується алкільних груп, що містять від одного до десяти атомів вуглецю. Термін "циклоалкіл" в тому значенні, що використовується тут, стосується циклічної або поліциклічної алкільної групи, що містить від 3 до 15 атомів вуглецю. Циклоалкільна група може включати численні сконденсовані кільця, причому одне з дистальних кілець може бути ароматичним (наприклад, індан-2-іл, тетрагідронафт-1-ил і т.д.) Аналогічно, термін "алкеніл" в тому значенні, що використовується тут, стосується циклічного, розгалуженого або лінійного вуглеводневого радикала, у якому один чи більше вуглець-вуглецевих зв'язків є подвійним зв'язком, а термін "нижчий алкеніл" стосується алкеніл ьної групи, що містить від одного до десяти атомів вуглецю. Термін "циклоалкеніл" в тому значенні, що використовується тут, стосується циклічної або поліциклічної алкільної групи, що містить 3-15 атомів вуглецю, у якій один чи більше з вуглець-вуглецевих зв'язків є подвійним зв'язком. Циклоалкенільна група може включати численні конденсовані кільця, причому одне з дистальних кілець може бути ароматичним (наприклад, інден-2-іл, 1,2-дигідронафт-1-ил і т.д.) Так само, термін "алкініл" в тому значенні, що використовується тут, стосується алкільної або алкенільної групи, що визначені вище, у яких щонайменше один вуглець-вуглецевий зв'язок був заміщений потрійним зв'язком. Термін "нижчий алкініл", таким чином, включає алкінільні групи, що містять від одного до десяти атомів вуглецю. В тому значенні, що використовується тут, термін "алкокси" стосується групи -OR, де R означає нижчий алкіл, нижчий алкеніл, нижчий алкініл, арил-нижчий алкіл, гетероарил-нижчий алкіл або гетероцикло-нижчий алкіл. Аналогічно, термін "арилокси" стосується групи -ОАr, де Аr означає арильну або гетероарильну групу. Терміни "арил" та "Аr" використовуються тут взаємозамінно, і стосуються моноциклічної або поліциклічної вуглеводневої групи з 6-14 атомами вуглецю, яка має щонайменше одне ароматичне кільце, що утворює точку приєднання групи. Поліциклічні арильні групи можуть мати ізольовані кільця (наприклад, біфеніл) або конденсовані кільця, у яких щонайменше одне кільце є ароматичним (наприклад, 1,2,3,4-тетрагідронафт6-ил, нафтил, антрил або фенантрил). Терміни "гетероцикл" або "гетероциклічне кільце" використовуються тут взаємозамінно і стосуються насиченої, частково нанасиченої або ароматичної циклоалкільної або арильної групи, що має одне кільце (наприклад, морфоліно, піридил чи фурил) або численні сконденсовані кільця (наприклад, нафтиридил, хіноксалініл, хінолініл чи індолізиніл), у якій щонайменше один атом вуглецю в кільці був заміщений гетероатомом. Термін "гетероатом" в тому значенні, що використовується тут, стосується атома, який не є вуглецем (типово, S, О, Ρ або Ν). Терміни "гетероарил" та "гетероароматичний" стосуються гетероциклів, у яких щонайменше одне гетероциклічне кільце є ароматичним. 89200 10 Далі, термін "необов'язково заміщений" в тому значенні, що використовується тут, означає, що один чи більше атомів водню, ковалентно зв'язаних з групою або замісником, визначеними вище, або вільною електронною парою на атомі азоту або фосфору, може бути заміщений ковалентнозв'язаним неводневим замісником, вибраним з групи, що складається з R, Аr, арил-нижчий алкіл, ОН, SH, OR, SR, OAr, SAr, S(=O)R, S(=O)Ar, SO 2R, SO2Ar, галоген, CF3, OCF3, SCF3, NH2, NHR, NR2, NR3+, NHCOR, NHCOAr, NHS(=O)R, NHS(=O)Ar, NHSO2R, NHSO2Ar, NO2, CN, CO2R, CONH2, CONHR, CONR2, C(=O)R, гетероарил та гетероарил-нижчий алкіл. У зазначених вище замісниках, R означає нижчий алкіл, нижчий алкеніл, нижчий алкініл, арил-нижчий алкіл, гетероарил-нижчий алкіл або гетероцикліл-нижчий алкіл. Термін "проліки" в тому значенні, що використовується тут, стосується модифікації сполуки за винаходом, у якій модифікована сполука виявляє меншу фармакологічну активність (порівняно з немодифікованою сполукою) і у якій модифікована сполука перетворюється назад на немодифікован форму in vivo, краще, у клітині-мішені (наприклад, Т-клітині або гепатоциті) або органі-мішені (наприклад, лімфатичному вузлі або селезінці). Перетворення сполуки за винаходом на форму проліків може бути корисним, якщо активний лікарський засіб є занадто токсичним для безпечного системного введення, якщо немодифікована сполука погано всмоктується з травного тракта або якщо організм має тенденцію до руйнування немодифікованої сполуки до того, як вона досягне своєї мішені. Термін "інгібування зворотної транскриптази" стосується прямого чи опосередкованого зменшення утворення ДНК з матричної РНК або ДНК зворотною транскриптазою. Пряме інгібування включає самогубне, конкурентне та неконкурентне інгібування, алостеричне інгібування або зв'язування інгібітора в ненуклеозидному кармані. Приклади опосередкованого інгібування включають виснаження нуклеозидів для синтезу ДНК, індукування або участь у конформаційних змінах і т.д. В тому значенні, що використовується тут, термін "зменшення вірусного розмноження" означає, що титр вірусу в зразку знижується. Зниження може бути досягнуте різними способами, включаючи часткове чи повне інгібування вірусної реплікації, часткове або повне інгібування процесингу або складання вірусного білка, інгібування вірусного входження до, або виходу з, інфікованої клітини, та/або виведення вірусу із системи за рахунок імунної відповіді на вірус. Винахід пропонує, поміж іншого, сполуки такої структури: 11 1 3 89200 0 де Р, Q, R , R та R мають вказані вище зна1 чення. В кращих варіантах втілення, R вибирають 3 з СІ, Вr, І, СН3, CF3, CHF2 та CH2F; R означає Η; 0 R вибирають з СІ, Вr, CF3 та СН3; і Q означає СО2Н або SO2NH2. В особливо кращих варіантах втілення, R0 означає СІ. Р, краще, є заміщеним фенільним, нафтильним, 1,2,3,4-тетрагідронафтильним, хінолінільним, ізохінолінільним або цинолінільним кільцем. В кращих варіантах втілення, групу Ρ вибирають з фрагментів (а), (b), (с) та (d) нижче. 1 12 де R вибирають з метилу, етилу, пропіл, ізопропілу, циклопропілметилу або С3-6-циклоалкілу; R4, R5 та R6 незалежно вибирають з Н, F, СІ, Вr, СН3, CF3, CFH2, CF2H, ізопропілу, циклопропілу, ОСН3, ОН, OCF3, NH2 та NHCH3. 7 U та U' незалежно вибирають з N та СН; R вибирають з СІ, Br, I, CH3, CF3, ОСН3, ізопропілу, 8 11 циклопропілу, т-бутилу та циклобутилу; і R -R незалежно означають Η або СН3. Краще, якщо Q 1 p означає SO2NH2, R не є метилом, якщо R не є 7 циклопропілом або циклопропілметилом, і R є 6 метилом, тільки якщо R також є метилом. Кращими класами сполук є такі, що мають Структури 2 та 3 нижче: де R означає CF3, CHF2, CH2F або галоген; R означає галоген, CF3 або метил, R' та R" незалежно означають Η або необов'язково заміщений нижчий алкіл, С1-5-ацил або 1-(С2-4-ацилокси)-С1-4 0 алкоксикарбонільну групу, і R має вказані вище значення. Особливо кращі класи сполук відповідають структурам 4 та 5 p де Rp вибирають з метилу, етилу, пропілу, ізопропілу, циклопропілу та циклопропілметилу. Найp краще, R означає етил або циклопропіл. Сполуки, які поєднують ознаки R1=Br, R0=СІ або СН3, Ρ= нафтил або тетрагідронафтил, та Q=СО2Н або SO2NR'R", виявляють несподівано сильну активність по відношенню до ЗТ з ряду ізолятів ВІЛ, у поєднанні з несподівано гарною фармакокінетикою in vivo. Синтез сполук Синтез сполук за винаходом може бути здійснений за процедурами, по суті описаними в WO 2004/030611, WO 2004/050643 та US 5,939,462. Слід вказати, однак, що для сполук за винаходом можливі численні альтернативні шляхи синтезу. Наведені нижче приклади шляхів надаються лише як приклад, на допомогу фахівцям-практикам в області хімії органічного синтезу. В одному шляху синтезу, придатно заміщений анілін амідують активованою сполукою карбонової кислоти (краще, галоїдангідридом карбонової кислоти), де активована сполука карбонової кислоти 2 далі включає відхідну групу L (краще, бром). Після утворення аніліду, продукт реакції вводять в 13 89200 14 реакцію з меркаптотриазолом (Het-SH), заміщаючи відхідну групу з утворенням бажаної сполуки, як зображено на схемі Іа нижче. Ця схема є кращою, якщо меркаптотриазол "Het-SH" є більш цінним порівняно з аніліном, оскільки триазол не використовується до останньої стадії і не буде зазнавати неминучих втрат, що відбуваються при маніпуляціях з проміжними спо1 луками в процесі синтезу. Вибір відхідних груп L та L2 буде залежати певною мірою від вибору конкретного аміну і в меншому ступені - від конкретного меркаптотриазолу. Особливо краще, щоб L1 та 2 L були галоїдами, найкраще, хлором чи бромом. Придатні розчинники для реакції амідування включають прості ефіри, спирти, та вуглеводні (краще, галогеновані), і вибір придатних розчинників буде щонайменше частково залежати від хімічної природи реагентів. Загалом будуть застосовними міркування щодо розчинників, каталізаторів та/або основ, використовуваних у зазначеній вище реакції, описані Connell et al. (патент США №5939462). Альтернативна загальна стратегія зображена на Схемі Іb нижче. Цей підхід передбачає ацилювання анілінів S-триазолілмеркаптооцтовими кислотами, які легко одержують алкілуванням меркаптотриазолів α-галоїдоцтовою кислотою або складним ефіром. Придатні реагенти включають, без обмеження, йодоцтову кислоту та метилбромацетат, і етил α3 бромпропіонат, якщо бажано, щоб R був метилом. Якщо використовується складний ефір, його гідролізують після S-алкілування для одержання вільної карбонової кислоти. Кислота та анілін можуть бути спряжені з будь-яким звичайним карбоксил-активуючим реагентом чи сумішами реагентів, наприклад, карбодіімідом, в присутності основи третинного аміну, необов'язково, з Nгідроксибензотриазолом як каталізатором, або тіоніл- чи оксалілхлоридом, з диметиламінопіри дином як каталізатором. Ця схема є кращою, якщо анілін є більш цінним порівняно з триазолом. Прикладом за Схемою Іа є синтез, описаний на Схемі 2, де сполуку за винаходом одержують з двох окремо виготовлених прекурсорів. Перший прекурсор, що включає заміщений триазин, і другий прекурсор, що включає заміщений анілін, можуть бути виготовлені за протоколами, наведеними нижче в розділі "Приклади". Реакція прекурсорів, типово, проводиться в полярному апротонному розчиннику, такому як ДМФ, в присутності основи, такої як карбонат калію. 15 89200 16 Якщо триазин є заміщеним фторованою алкільною групою, може бути використана процедура синтезу, показана на Схемі 3. Аналогічна процедура наведена нижче у розділі "Приклади". Галоген-заміщений триазол може бути одержаний дигалогенуванням триазолу, з наступним заміщенням одного з галоїдів, як показано на Схе мі 4, яка відповідає процедурі, описаній нижче у розділі "Приклади". 17 89200 18 Іншим шляхом одержання триазолу, заміщеного галогеном, є діазотування амінотриазолу, як показано на Схемі 5 нижче, яке відповідає процедурі, наведеній нижче у розділі "Приклади". Альтернативно, якщо триазол заміщений CF3, може бути використана процедура синтезу, зображена на Схемі 6, що відпоідає аналогічним процедурам, наведеним нижче у розділі "Приклади". Приклад альтернативного шляху синтезу, зображеного на Схемі Іа, показаний на Схемі 7 ниж че, де анілін ацилюють попередньо одержаною Sтриазолілмеркаптооцтовою кислотою. 19 Фармацевтичні композиції Якщо сполуки за винаходом вводяться як частина фармакологічної композиції, то передбачається, що придатні сполуки можуть бути скомбіновані в суміші з фармацевтично прийнятними носіями, ексципієнтами та іншими домішками. Особливо краще, щоб сполуки за винаходом входили до складу фармацевтичної композиції, яка містить один чи більше нетоксичних фармацевтично прийнятних носіїв. Фармацевтичні композиції можуть бути скомпоновані для перорального введення в твердій або рідкій формі, для парентеральної ін'єкції або для ректального введення. Фармацевтичні композиції за даним винаходом можуть бути введені людям та іншим тваринам перорально, ректально, парентерально, інтравагінально, інтраперитонеально, місцево, букально або у вигляді орального чи назального спрея. Термін "парентеральне" введення в тому значенні, що використовується тут, стосується способів введення, які включають, без обмеження, внутрішньовенну, внутрішньом'язову, інтраперитонеальну, підшкірну та внутрішньосуглобову ін'єкцію та інфузію. Фармацевтичні композиції для парентеральних ін'єкцій, краще, включають фармацевтично прийнятні стерильні водні або неводні розчини, дисперсії, суспензії або емульсії, а також стерильні порошки для відновлення до стерильних розчинів або дисперсій для ін'єкцій безпосередньо перед використанням. Приклади придатних водних та неводних носіїв, розріджувачів, розчинників та наповнювачів включають воду, етанол, поліоли (такі як гліцерин, пропіленгліколь, поліетиленгліколь, тощо) та їхні придатні суміші, рослинні олії (такі як оливкова олія), та придатні для ін'єкцій органічні складні ефіри, такі як етилолеат. Належна плинність може забезпечуватися, наприклад, завдяки використанню покривних матеріалів, таких як лецитин, шляхом підтримання потрібного розміру частинок у випадку дисперсії, та шляхом використання поверхнево-активних речовин. Композиції можуть також містити домішки, такі як консерванти, змочувальні агенти, емульгатори та диспергенти. Запобігання дії мікроорганізмів може бути забезпечене включенням різних антибактеріальних та протигрибкових агентів, наприклад, парабену, хлорбутанолу, фенолу, сорбінової кислоти, тощо. Може також бути бажаним включення ізотонічних агентів, таких як цукри, хлорид натрію, тощо. Уповільнене всмоктування фармацевтичної форми для ін'єкцій може бути забезпечене включенням агентів, що уповільнюють всмоктування, таких як алюмініймоностеарат та желатин. Для пролонгації ефекта сполук за винаходом, може бути бажаним уповільнювання всмоктування лікарського засобу, введеного підшкірною або внутрішньом'язовою ін'єкцією. Це може бути досягнуте використанням рідкої суспензії кристалічного або аморфного матеріалу з поганою розчинністю у воді. Швидкість всмоктування сполуки тоді буде залежати від її швидкості розчинення, яка, у свою чергу, може залежати від розміру кристалів та кристалічної форми. Альтернативно, уповільнене 89200 20 всмоктування парентерально введених сполук за винаходом може бути досягнуте шляхом розчинення або суспендування лікарського засобу в масляному носії. Форми депо для ін'єкцій виготовляють шляхом створення унітарної або мікродисперсної матриці сполуки за винаходом в біодеградуючих полімерах, включаючи, без обмеження, полілактидполігліколід, полі(складні ортоефіри) та поліангідриди. Швидкість вивільнення лікарського засобу можна контролювати шляхом зміни співвідношення лікарського засобу та полімеру і природи конкретного використовуваного полімеру. Композиції депо для ін'єкцій можуть бути також виготовлені шляхом включення сполуки до ліпосом або мікроемульсій, сумісних з тканинами організму. Тверді дозовані форми для перорального введення включають, без обмеження, капсули, таблетки, пілюлі, порошки, драже та гранули. В таких твердих дозованих формах активну сполуку змішують із щонайменше одним інертним фармацевтично прийнятним ексципієнтом або носієм, таким як цитрат натрію або дикальційфосфат та/або (а) наповнювачами або розріджувачами, такими як крохмалі, лактоза, сахароза, глюкоза, маніт та кремнекислота, (b) зв'язуючими, такими як карбоксиметилцелюлоза, альгінати, желатин, полівінілпіролідон, сахароза та гуміарабік, (с) зволожувачами, такими як гліцерин, (d) агентами, що викликають дезінтеграцію, такими як агар, карбонат кальцію, картопляний або маніоковий крохмаль, альгінова кислота, певні силікати та карбонат натрію, (e) агентами уповільнення розчинення, такими як парафін, (f) прискорювачами всмоктування, такими як четвертинні амонієві сполуки, (g) змочувальними агентами, такими як цетиловий спирт та гліцеринмоностеарат, (h) абсорбентами, такими як каолін та бентонітова глина, та (і) змащувальними речовинами, такими як тальк, стеарат кальцію, стеарат магнію, тверді поліетиленгліколі, лаурилсульфат натрію, та їхніми сумішами. Тверді дозовані форми можуть також включати буферні агенти. Тверді композиції можуть також бути використані як наповнювачі у наповнених м'яких та твердих желатинових капсулах з використанням таких ексципієнтів, як лактоза або молочний цукор, а також високомолекулярні поліетиленгліколі, тощо. Тверді дозовані форми можуть бути виготовлені з покриттями та оболонками, такими як ентеросолюбільні покриття та інші покриття, добре відомі фахівцям з приготування фармацевтичних композицій. Вони можуть необов'язково містити агенти забезпечення непрозорості і можуть також мати такий склад, щоб вони вивільняли активний інгредієнт(и) тільки або краще у певній частині кишкового тракта, необов'язково, уповільнено. Активні сполуки можуть також бути в мікрокапсульованій формі. Рідкі дозовані форми для перорального введення включають фармацевтично прийнятні емульсії, розчини, суспензії, сиропи та еліксири. На додаток до активних сполук, рідкі дозовані форми можуть містити інертні розріджувачі, звичайно використовувані фахівцями, такі як вода або інші 21 розчинники, солюбілізатори та емульгатори, такі як етиловий спирт, ізопропіловий спирт, етилкарбонат, етилацетат, бензиловий спирт, бензилбензоат, пропіленгліколь, 1,3-бутиленгліколь, диметилформамід, олії (зокрема, бавовняна, арахісова, кукурудзяна, зародкова, оливкова, рицинова та кунжутна олії), гліцерин, тетрагідрофурфуриловий спирт, поліетиленгліколі та складні ефіри жирних кислот та сорбіту, та їхні суміші. Пероральні рідкі композиції можуть також включати ад'юванти, такі як змочувальні агенти, емульгувальні та суспендувальні агенти, барвні, підсолоджувальні, смакові та ароматизуючі агенти. Композиції для ректального або вагінального введення є, краще, супозиторіями, які можуть бути приготовлені шляхом змішування сполук за даним винаходом з придатними неподразливими ексципієнтами або носіями, такими як какаова олія, поліетиленгліколь або інші воски для супозиторіїв, що є твердими при кімнатній температурі, але рідкими при температурі тіла і тому плавляться у порожнині прямої кишки або піхви та вивільняють активну сполуку. Сполуки за даним винаходом можуть також бути введені в формі ліпосом. Як відомо фахівцям, ліпосоми загалом одержують з фосфоліпідів або інших ліпідних речовин. Ліпосоми, типово, утворюють з моно- або багатоламелярних гідратованих рідких кристалів, диспергованих у водному середовищі. Можуть бути використані будь-які нетоксичні, фізіологічно прийнятні ліпіди, здатні утворювати ліпосоми. Композиції у формі ліпосом можуть містити, на додаток до сполуки за даним винаходом, стабілізатори мембран, консерванти, ексципієнти, тощо. Кращими ліпідами є фосфоліпіди та фосфатидилхоліни (лецитини), як природні, так і синтетичні. Способи утворення ліпосом є відомими фахівцям. Див., наприклад, Prescott, Ed., Methods in Cell Biology, Volume XIV, Academic Press, New York, N.Y. (1976), p.33 ets eq. Сполуки за даним винаходом можуть бути використані у формі фармацевтично прийнятних солей, утворених неорганічними або органічними кислотами. Під "фармацевтично прийнятною сіллю" розуміються такі солі, які, в межах обгрунтованої медичної оцінки, є придатними для використання в контакті з тканинами людей та нижчих тварин без неналежної токсичності, подразнення, алергічних реакцій, тощо, і мають прийнятне співвідношення корисний ефект/ризик. Фармацевтично прийнятні солі є добре відомими фахівцям. Наприклад, S.M. Berge et al. докладно описують фармацевтично прийняти солі у J. Pharmaceutical Sciences, 1977, 66: 1 et seq. Солі можуть бути одержані in situ під час кінцевого виділення та очищення сполук за винаходом або окремо шляхом проведення реакції вільної основної форми з придатною кислотою. Приклади кислотно-адитивних солей включають, без обмеження, ацетат, адіпат, альгінат, цитрат, аспартат, бензоат, бензолсульфонат, бісульфат, бутират, камфорат, камфорсульфонат, цитрат, глюконат, глутамат, гліцерофосфат, гемісульфат, гептаноат, гексаноат, фумарат, гідрохлорид, гідробромід, гідройодид, 2оксіетансульфонат (ізетіонат), лактат, малеат, 89200 22 метансульфонат, нікотинат, 2-нафталінсульфонат, оксалат, памоат, пектинат, 3-фенілпропіонат, фосфат, півалат, пропіонат, сукцинат, сульфат, тартрат, бікарбонат, п-толуолсульфонат та ундеканоат. Основні азотвмісні групи можуть також бути кватернізовані такими агентами, як нижчий галоїдалкіл, такий як хлор-, бром- та йодметили, етили, -пропіли та -бутили; діалкілсульфати, такі як диметил-, діетил-, дибутил- та діамілсульфати; довголанцюгові галоїдні сполуки, такі як хлор-, бром- та йоддецил, -лаурил, -міристил та стеарили; галоїдарилалкіл, такі як бромбензили і фенетили та інші. При цьому одержують водо- чи маслорозчинні чи -дисперговані продукти. Солі приєднання основи можуть бути одержані in situ під час кінцевого виділення та очищення сполук за даним винаходом або згодом, шляхом проведення реакції фрагмента, який включає групу карбонової кислоти, з придатною основою, такою як гідроксид, карбонат або бікарбонат фармацевтично прийнятного катіону металу, або з аміаком чи органічним первинним, вторинним чи третинним аміном. Фармацевтично прийнятні солі включають, без обмеження, солі лужних та лужноземельних металів, таких як літій, натрій, калій, кальцій, магній та алюміній, тощо, і нетоксичні солі четвертинного амонію та амінів, включаючи амоній, тетраметиламоній, тетраетиламоній, метиламін, диметиламін, триметиламін, триетиламін, діетиламін, етиламін, тощо. Інші приклади органічних амінів, придатних для утворення солей приєднання кислоти, включають етилендіамін, етаноламін, діетаноламін, піперидин, піперазин, глюкозамін, лейцин, тощо. Фактичні рівні доз активних інгредієнтів у фармацевтичній композиції за даним винаходом можуть змінюватися таким чином, щоб одержати кількість активної сполуки (сполук), що є ефективною для досягнення бажаної терапевтичної відповіді для конкретних пацієнта, композиції та способу введення. Вибраний рівень доз буде залежати від активності конкретної сполуки, шляху введення, схеми дозування, тяжкості стану, лікування якого проводиться, та стану і медичної історії пацієнта, що лікується. Дослідження з визначення доз є рутинними, і фахівці в даній області є здатними почати з доз сполуки на рівнях нижчих, ніж потрібні для досягнення бажаного терапевтичного ефекту, та поступово підвищувати дозу до досягнення бажаного ефекту. Загалом, пацієнтуссавцю вводять перорально дози на рівні від приблизно 0,1 до приблизно 100, краще, від приблизно 5 до приблизно 50мг активної сполуки на кілограм ваги тіла за добу. Якщо бажано, ефективна добова доза може бути розділена на кратні дози з метою введення, наприклад, від двох до чотирьох окремих доз за добу. Сполуки за винаходом можуть бути введені самі або в комбінації з іншими агентами для лікування ВІЛ. Особливо передбачувані додаткові сполуки включають інгібітори зворотної транскриптази нуклеозидного типу (наприклад, ламівудин, зидовудин, ставудин, абакавір, тенофовір або диданозин), ненуклеозидні інгібітори зворотної транскриптази (наприклад, невірапін, делавірдин, ефа 23 віренц), інгібітори протеази (наприклад, ритонавір, саквінавір, індинавір, нелфінавір), інгібітори злиття (наприклад, енфувіртид), антагоністи CCR5, імунотерапевтичні агенти (наприклад, рибавірин, IL-2), і активні, пасивні та/або терапевтичні вакцини. Комбіновані терапії за даним винаходом включають введення щонайменше однієї сполуки за даним винаходом або її функціонального похідного та щонайменше одного іншого фармацевтично активного інгредієнта. Активний інгредієнт(и) та фармацевтично активні агенти можуть бути введені окремо або разом і при введені окремо це може відбуватися одночасно або окремо в будь-якому порядку. Кількості активного інгредієнта(ів) та фармацевтично активного агента(ів) і відносний час введення слід вибирати таким чином, щоб досягнути бажаного комбінованого терапевтичного ефекту. Таким чином, даний винахід пропонує фармацевтичні композиції, які включають одну чи більше сполуку, що має структуру відповідно до будь-якої з формул 1-5, визначених вище, де сполука або сполуки є присутніми в концентрації, що ефективно інгібує зворотну транскриптазу та/або реплікацію ВІЛ у клітині пацієнта при введенні композиції пацієнту. В кращих варіантах втілення, фармацевтична композиція за винаходом включає одну чи більше сполук відповідно до однієї з формул 2-5. Особливо передбачається, що множина сполук може бути включена до однієї фармацевтичної композиції, з метою забезпечення інгібування в широкому діапазоні множини мутантних ферментів ЗТ. Що стосується придатних концентрацій передбачуваних сполук у фармацевтичних композиціях, слід розуміти, що пересічний фахівець в даній області може легко відрегулювати кількість сполуки для забезпечення інгібування зворотної транскриптази та/або реплікації ВІЛ. Наприклад, інгібування реплікації ВІЛ у клітині (типово, Т-клітинах, інфікованих вірусом ВІЛ) можна контролювати in vitro з використанням гемокультури та системи аналізу на основі люциферази, як описано нижче. Альтернативно, інгібування зворотної транскриптази може контролюватися in vivo з використанням полімеразної ланцюгової реакції зі зворотною транскриптазою (RT-PCR) для визначення кількості копій вірусної ДНК та/або РНК у крові або лімфатичних вузлах (що містять ВІЛ-інфіковані клітини). Загалом передбачається, що придатні концентрації будуть забезпечувати концентрацію у сироватці від 1нМ до 100мкМ, і у деяких випадках від 0,01нМ до 1нМ). Приклади Наступні експерименти наведені лише для прикладу, і не повинні розглядатися як такі, що обмежують обсяг винаходу. Сполуки за винаходом 2-[5-Бром-4-(4-циклопропілнафталін-1-іл)-4Н[1,2,4]триазол-3-ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамід (Метод А) 89200 24 1-Циклопропілнафталін Циклопропілмагнійбромід (150мл, 0,5М у тетрагідрофурані) повільно додають до розчину 1бромнафталіну (10г, 50ммоль) і [1,3біс(дифенілфосфіно)-пропан]дихлорнікеля(ІІ) в тетрагідрофурані (10мл) і перемішують при 0°С. Реакційну суміш перемішують при кімнатній температурі протягом 16 годин і розчинник випарюють при зниженому тиску. Додають ЕtOАс та хлорид амонію у воді. Після екстракції, органічний шар осушують над сульфатом натрію, фільтрують та концентрують при зниженому тиску. Залишок очищають хроматографією на силікагелі, одержуючи 1-циклопропілнафталін (6,4г, 76%). 1-Циклопропіл-4-нітронафталін Нітрит натрію (30мл) повільно додають (протягом 2 годин) до 1-циклопропілнафталіну (6,4г, 38ммоль), перемішуваного при 0°С. Реакційну суміш перемішують при 0°С ротягом ще 30хв., а потім повільно виливають на лід. Додають воду, а потім ЕtOАс. Після екстракції органічний шар промивають 1% водним розчином NaOH, потім промивають водою, осушують над сульфатом натрію, фільтрують та концентрують при зниженому тиску. Залишок очищають хроматографією на силікагелі, одержуючи 1-циклопропіл-4-нітронафталін (5,2г, 64%). 1-Аміно-4-циклопропілнафталін Розчин 1-циклопропіл-4-нітронафталіну (5г, 23ммоль) в етанолі (200мл) перемішують під воднем в присутності Pd/C (загалом 10%, 1,8г). Реакційну суміш струшують протягом ночі, потім фільтрують через целіт. Розчинник випарюють і залишок очищають хроматографією на силікагелі, одержуючи 1-аміно-4-циклопропілнафталін (3,1г, 73%). 1-Циклопропіл-4-ізотіоціанатонафталін Тіофосген (1,1г, 9,7ммоль) додають до розчину 1-аміно-4-циклопропілнафталіну (1,8г, 9,7ммоль) та діізопропілетиламіну (2екв.) в дихлорметані (50мл), перемішуваному при 0°С. Реакційну суміш перемішують протягом 5хв. при цій температурі, потім додають 1% розчин НСІ у воді та органічний шар відокремлюють, промивають розсолом, осушують над сульфатом натрію, фільтрують і розчинник випарюють при зниженому тиску. Додають гексан і осад, що утворюється, збирають на фільтрі. Розчинник випарюють, одержуючи 1циклопропіл-4-ізотіоціанатонафталін (1,88г, 86%). 5-Аміно-4-(4-циклопропілнафталін-1-іл)-4Н[1,2,41триазол-3-тіол Суміш аміногуанідину гідрохлориду (3,18г, 29ммоль), 1-циклопропіл-4-ізотіоціанатонафталіну (3,24г, 14ммоль) та діізопропілетиламіну (3екв.) в ДМФ (20мл) перемішують при 50°С протягом 15 годин. Розчинник випарюють, додають толуол і розчинник випарюють знову. Додають 2,0М водний 25 89200 26 розчин гідроксиду натрію (30мл) і реакційну суміш нагрівають при 50°С протягом 60 годин. Реакційну суміш фільтрують, і фільтрат нейтралізують 2,0М водним розчином НСІ. Знов фільтрують, потім випарюють розчинник та очищають залишок хроматографією на силікагелі, одержуючи 5-аміно-4-(4-циклопропілнафталін-1-іл)-4Н[1,2,4]триазол-3-тіол (2,0г, 49%). 2-[5-Аміно-4-(4-циклопропілнафталін-1-іл)-4Н[1,2,4]триазол-3-ілсульсфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамід До розчину 5-аміно-4-(4-циклопропілнафталін1-іл)-4Н-[1,2,4]триазол-3-тіолу (708мг, 2,5ммоль), K2СО3 (380мг, 2,5ммоль) в ДМФ (20мл) додають 2хлор-N-(2-хлор-4-сульфамоїлфеніл)ацетамід (710мг, 2,5ммоль). Реакційну суміш перемішують при кімнатній температурі протягом ночі. Після закінчення реакції розчинник випарюють. Залишок очищають хроматографією на силікагелі, одержуючи 2-[5-аміно-4-(4-циклопропілнафталін-1-іл)-4Н[1,2,4]триазол-3-ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамід (1,26г, 95%). 2-[5-Бром-4-(4-циклопропілнафталін-1-іл)-4Н[1,2,4]триазол-3-ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамід Дихлороцтову кислоту (180 мкл, 2,2ммоль) додають до суспензії 2-[5-аміно-4-(4циклопропілнафталін-1-іл)-4Н-[1,2,4]триазол-3ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетаміду (0,59г, 1,1ммоль), нітриту натрію (1,5г, 22ммоль) та ВТЕАВr (0,91г, 3,3ммоль) дибромметані (30мл). Реакційну суміш перемішують при кімнатній температурі протягом 4 годин, потім екстрагують дихлорметаном та бікарбонатом натрію у воді. Органічний шар осушують над сульфатом натрію, фільтрують та концентрують при зниженому тиску. Залишок очищають хроматографією на силікагелі, одержуючи 2-[5бром-4-(4-циклопропілнафталін-1-іл)-4Н[1,2,4]триазол-3-ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамід (224мг, 31%). 2-[5-Бром-4-(4-циклопропілнафталін-1-іл)-4Н[1,2,4]триазол-3-ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамід (Метод В) Метиловий складний ефір 2-[5-аміно-4-(4циклопропілнафталін-1-іл)-4Н-[1,2,4]триазол-3ілсульфаніл]оцтової кислоти До суспензії тіотриазолу та карбонату калію в ДМФ додають метилхлорацетат по краплях при кімнатній температурі протягом 5хв. Реакцію перемішують при кімнатній температурі протягом 24год. і повільно виливають в перемішуваний охолоджений льодом водний розчин. Осад коричнювато-жовтого кольору збирають вакуумфільтрацією та сушать під високим вакуумом при 50°С протягом 16год. в присутності Р2О5, одержуючи 2,24г (80%) названої в заголовку сполуки. Метиловий складний ефір 2-[5-бром-4-(4циклопропілнафталін-1-іл)-4Н-[1,2,4]триазол-3ілсульфаніл]оцтової кислоти Матеріали Кількість Мол.вага ммоль тіотриазол 2,24 282,36 7,9 метилхлорацетат 0,73мл 108,52 8,3(1,05екв.) карбонат калію 1,21г 138,21 8,7(1,1екв.) диметилформамід 40мл (5мл/ммоль) Процедура: Матеріали тіотриазол L10183-58 бромоформ нітрит натрію бензилтриетиламонійбромід дихлороцтова кислота Кількість 709мг 10мл 2,76г 1,63г 0,33мл Мол. вага 354,43 69,00 272,24 128,94 ммоль 2,0 (5мл/ммоль) 40(20екв.) 6,0(3екв.) 4,0(2екв.) 27 89200 Процедура: До розчину метилового складного ефіру 2-[5аміно-4-(4-циклопропілнафталін-1-іл)-4Н[1,2,4]триазол-3-ілсульфаніл]оцтової кислоти та бензилтриетиламонійхлориду в бромоформі додають нітрит натрію. До суміші додають дихлороцтову кислоту і реакційну суміш перемішують при кімнатній температурі протягом 3год. Суміш безпосередньо завантажують до 7-дюймової колонки силікагелю, заповненої СН2СІ2. Колонку спочатку елююють СН2СІ2 до повного закінчення елюції СНВr3, а потім елююють сумішшю ацетон/СН2СІ2 (5:95), одержуючи 713мг (85%) названої в заголовку сполуки. 2-[5-Бром-4-(4-циклопропілнафталін-1-іл)-4Н[1,2,4]триазол-3-ілсульфаніл]-оцтова кислота Матеріали метиловий складний ефір тіотриазолу тетрагідрофуран етанол вода гідроксид літію Кількість Мол. вага ммоль 1,14г 418,31 2,7 10мл 10мл 10мл 98мг (~3мл/ммоль) (~3мл/ммоль) (~3мл/ммоль) 23,95 4,1(1,5екв.) Процедура: До розчину метилового складного ефіру 2-[5бром-4-(4-циклопропілнафталін-1-іл)-4Н[1,2,4]триазол-3-ілсульфаніл]оцтової кислоти в суміші THF та ЕtOН при 0°С додають розчин LiOH в Н2О по краплях протягом 5хв. Реакція завершується після перемішування при 0°С протягом ще 45хв. Реакцію нейтралізують до рН7 додаванням 0,5Н розчину НСІ при 0°С і одержану суміш концентрують під вакуумом до 1/5 її вихідного об'єму. Суміш розводять Н2О (~20мл) та підкислюють до рН2-3 шляхом додавання 0,5Н НСІ до утворення липкої твердої речовини. (Якщо продукт утворюється у вигляді маслянистої рідини при підкислюванні, торекомендується екстракція СН2СІ2.) Тверду речовину жовтувато-коричнюватого кольору 28 збирають вакуум-фільтрацією та сушать під високим вакуумом при 50°С протягом 16год. в присутності P2O5, одержуючи 1,02г (93%) названої в заголовку сполуки. 2-[5-Бром-4-(4-циклопропілнафталін-1-іл)-4Н[1,2,4]-триазол-3-ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамід Матеріали тіотриазолкарбонова кислота 4-аміно-Зхлорфенілсульфонамід піридин оксихлорид фосфору Кількість Мол. вага ммоль 884мг 404,28 2,2 452мг 206,65 2,2 22мл (10мл/ммоль) 0,24мл 153,33 2,6(1,2екв.) Процедура: До розчину карбонової кислоти та аніліну, вказаних вище, у піридині при 0°С, додають РОСl 3 по краплях протягом 5хв. Реакція завершується після перемішування при 0°С протягом ще 50хв. Реакційну суміш гасять додаванням Н2О (1мл), потім концентрують під вакуумом до світло-коричневої маслянистої рідини, яку розводять СН2СІ2 (200мл). Органічний шар промивають Н2О (1 50мл), насиченим розчином NаНСО3 (1 50мл), а потім розсолом (1 50мл). Органічний розчин осушують над Na2SO4 та концентрують до сухого залишку. Одержану маслянисту рідину тритурують з ЕtOН, одержуючи світло-жовту тверду речовину. До суміші додають Н2О, щоб зібрати додаткову кількість твердої речовини. Світло-жовту тверду речовину збирають вакуум-фільтрацією та сушать під високим вакуумом протягом 16год., одержуючи 930мг (72%) продукту. Додатковий продукт (132мг, 10%) виділяють екстракцією фільтрату СН2СІ2, а потім хроматографією на колонці з використанням суміші ацетон/СН2Сl2 (20:80). 2-[5-Бром-4-(4-циклопропіл-7-метоксинафталін-1-іл)-4Н-[1,2,4]-триазол-3-ілсульфаніл]-N-(2хлор-4-сульфамоїлфеніл)ацетамід 29 89200 30 1-Аміно-4-циклопропіл-7-метоксинафталін До перемішуваного розчину 8-аміно-2-нафтолу (5г, 31,4ммоль) в суміші тетрагідрофурану (50мл) та дихлорметану (100мл) додають ди-тбутилдикарбонат (6,86г, 31,4ммоль). Суміш перемішують при 70°С протягом 18 годин. Після охолодження суміші до кімнатної температури, додають насичений водний карбонат натрію і продукт екстрагують дихлорметаном. Органічний шар промивають водою та розсолом, осушують над сульфатом натрію, фільтрують та концентрують при зниженому тиску. Одержаний залишок очищають хроматографією на колонці із силікагелем (дихлорметан:етилацетат, 9:1), одержуючи N-BOCпохідне а (4,85г, вихід 60%). До суміші N-BOC-похідного а (4,85г, 18,7ммоль) та триетиламіну (3,91, 28,1ммоль) в дихлорметані (170мл) додають метансульфоновий ангідрид (3,58г, 20,6ммоль) при 0°С. Суміш перемішують протягом 30хв. та виливають в насичений водний розчин бікарбонату натрію. Органічний шар екстрагують дихлорметаном, осушують над сульфатом натрію, фільтрують та концентрують при зниженому тиску, одержуючи складний метансульфонатний ефір b (6,22г, кількісний вихід). До розчину метансульфонату b (6,12г, 18,1ммоль) в 150мл оцтової кислоти додають Nбромсукцинімід (3,39г, 19ммоль). Суміш перемішують протягом 2год. і додають воду та дихлорметан. Водний шар доводять до рН7 додаванням 10Н водного гідроксиду натрію. Органічний шар екстрагують дихлорметаном, осушують над сульфатом натрію, фільтрують та концентрують при зниженому тиску, одержуючи сирове 5-бром похідне с (7,6г, кількісний вихід). Суміш с (7,72г, 18,5ммоль) та 10% водного розчину гідроксиду натрію (370мл) в тетрагідрофурані (220мл) перемішують при 50°С протягом 5 днів. Суміш охолоджують до 0°С та нейтралізують кон центрованою хлористоводневою кислотою. Суміш концентрують при зниженому тиску та продукт екстрагують етилацетатом. Органічний шар осушують над сульфатом натрію, фільтрують та концентрують, одержуючи нафтол d (5,87г, вихід 94%). Суміш нафтолу d (3,53г, 10,4ммоль), метилйодиду (0,65мл, 10,4ммоль) та гідроксиду натрію (417мг, 10,4ммоль) в ацетоні (25мл) перемішують при кімнатній температурі протягом 4 годин. Одержану суміш концентрують та залишок очищають хроматографією на колонці (85% гексан/15% етилацетат), одержуючи 2,39г, вихід 65%, простого метилового ефіру e. Суміш простого метилового ефіру e (3,25г, 9,22ммоль) в 4Н НСІ в 1,4-діоксані (92мл) перемішують при кімнатній температурі протягом 1 години. Суміш концентрують при зниженому тиску та додають етилацетат і насичений розчин бікарбонату натрію. Екстрагований органічний шар промивають водою та розсолом, осушують над сульфатом натрію та концентрують при зниженому тиску, одержуючи 2-метокси-5-бром-8амінонафталін f (2,14г, вихід 92%). До розчину амінонафталіну f (1г, 4,0ммоль), циклопропілборонової кислоти (438мг, 5,1ммоль), фосфату калію (2,97г, 14ммоль) та трициклогексилфосфіну (112мг, 0,4ммоль) в толуолі (21мл) та воді (0,8мл) під атмосферою азоту додають ацетат паладію (45мг, 0,2ммоль) при енергійному перемішуванні. Суміш нагрівають до 100°С протягом 3год., а потім охолоджують до кімнатної температури. Додають воду і суміш екстрагують етилацетатом, осушують над сульфатом натрію та концентрують. Очищення хроматографією на колонці (50% гексан/50% етилацетат) дає названу в заголовку сполуку g (699мг, вихід 82%). Сполуку g (699мг, 3,28ммоль) розчиняють в 18мл дихлорметану. Додають бікарбонат натрію (9мл, насич. розчин) та тіофосген (0,25мл, 3,28ммоль) і суміш перемішують при кімнатній температурі протягом 1год. Органічний шар відокремлюють, осушують над сульфатом натрію та концентрують, одержуючи 819мг, вихід 98%, спо луки h, яку використовують на наступній стадії без додаткового очищення. Сполуку h (819мг, 3,21ммоль) розчиняють в 6мл диметилформаміду, додають аміногуанідину гідрохлорид (532мг, 4,8ммоль) та діізопропілетиламін (0,84мл, 4,8ммоль) і суміш перемішують при 50°С протягом 18 годин. Суміш потім концентрують та до залишку додають 2М водний розчин 31 89200 32 гідроксиду натрію (10мл). Суміш перемішують при 50°С протягом 18 годин, а потім охолоджують до кімнатної температури. Одержану суміш потім нейтралізують водним 1Н НСІ і осад збирають, одержуючи сполуку i (200мг, вихід 25%). Сполуки i (63мг, 0,2ммоль) та j (57мг, 0,2ммоль) розчиняють в ДМФ (2мл) і додають карбонат калію (30мг, 0,2ммоль). Суміш перемішують при кімнатній температурі протягом 18 годин. Потім додають до суміші воду і утворений осад збирають, одержуючи 70мг (57%) сполуки k. Дихлороцтову кислоту (0,05мл, 0,226ммоль) додають до суміші сполуки j (63мг, 0,113ммоль), бензилтриетиламонійброміду (93мг, 0,34ммоль) та нітриту натрію (156мг, 2,26ммоль) в дибромметані (5мл). Суміш перемішують при кімнатній температурі протягом 18 годин в темряві. Реакційну суміш потім концентрують та утворений залишок очищають препаративною ТШХ (95% дихлорметану/5% метанолу), одержуючи 13,8мг сульфонової кислоти та 2мг названої в заголовку сполуки l. 2-[5-Бром-4-(4-циклопропіл-2-метилнафталін1-іл)-4Н-[1,2,4]-триазол-3-ілсульфаніл]-N-(2-хлор4-сульфамоілфеніл)ацетамід До перемішуваного розчину 2-метил-1амінонафталіну а (7,5г, 47,7ммоль) в тетрагідрофурані (225мл) додають N-бромсукцинімід (10г, 56,2ммоль) при 0°С. Суміш перемішують при кімнатній температурі протягом 4 годин. Додають до суміші воду і продукт екстрагують етилацетатом. Органічний шар промивають водою та розсолом, осушують над сульфатом натрію, фільтрують та концентрують при зниженому тиску. Одержаний залишок очищають хроматографією на колонці (75% гексану/25% етилацетату), одержуючи 4,73г, вихід 42%, сполуки b. До розчину b (1г, 4,24ммоль), циклопропілборонової кислоти (472мг, 5,5ммоль), фосфату калію (3,14г, 14,8ммоль) та трициклогексилфосфіну (118мг, 0,42ммоль) в толуолі (22мл) та воді (0,85мл) під атмосферою азоту додають ацетат паладію (47мг, 0,21ммоль). Суміш нагрівають до 100°С протягом 3год., а потім охолоджують до кімнатної температури. Додають воду і суміш екстрагують етилацетатом, осушують над сульфатом натрію та концентрують. Очищення хроматографією на колонці (90% гексану/10% етилацетату) дає сполуку с (728мг, вихід 87%). Сполуку с (728мг, 3,7ммоль) розчиняють в 18мл дихлорметану. Додають бікарбонат натрію (9мл, насич. розчин) та тіофосген (0,28мл, 3,7ммоль) і суміш перемішують при кімнатній температурі протягом 1год. Потім органічний шар відокремлюють, осушують над сульфатом натрію та концентрують, одержуючи 877мг, вихід 99%, сполуки d, яку використовують на наступній стадії без додаткового очищення. Сполуку d (877мг, 3,7ммоль) розчиняють в 6мл диметилформаміду, додають хлористоводневу сіль аміногуанідину (608,5мг, 5,5ммоль) та діізопропілетиламін (1,0мл, 5,5ммоль) і суміш перемішують при 50°С протягом 18 годин. Суміш концентрують і до одержаного залишку додають 2М водний розчин гідроксиду натрію (15мл). Суміш перемішують при 50°С протягом 18 годин, а потім охолоджують до кімнатної температури. Одержану суміш потім нейтралізують водним 1Η НСІ і осад збирають, одержуючи сполуку e (472мг, вихід 50%). Сполуки e (100мг, 0,34ммоль) та f (96мг, 0,34ммоль) розчиняють в ДМФ (2мл) і додають карбонат калію (51мг, 0,37ммоль). Суміш перемішують при кімнатній температурі протягом 18 годин. Потім додають до суміші воду і осад, що утворився, збирають та очищають препаративною ТШХ (90% дихлорметану/10% метанолу), одержуючи 83мг, вихід 45%, сполуки g. 33 89200 34 Дихлороцтову кислоту (0,03мл, 0,31ммоль) додають до суміші сполуки д (83мг, 0,15ммоль), бензилтриетиламонійброміду (125мг, 0,46ммоль) та нітриту натрію (21 Імг, 3,06ммоль) в дибромметані (5мл). Суміш перемішують при кімнатній температурі протягом 18 годин в темряві. Реакційну суміш потім концентрують і одержаний залишок очищають препаративною ТШХ (95% дихлорметану/5% метанолу), одержуючи 55,7мг сульфонової кислоти та 7мг названої в заголовку сполуки h. 2-[5-Бром-4-(2-хлор-4-циклопропілфеніл)-4Н[1,2,4]-триазол-3-ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамід Сполуку а (1г, 4,8ммоль) розчиняють в 10мл безводного метиленхлориду. До цієї суміші додають триетиламін (0,68мл, 4,8ммоль) і реакцію перемішують при кімнатній температурі протягом 5хв. Потім додають ацетилхлорид (0,5мл, 7,2ммоль) при 0°С і суміш перемішують при кімнатній температурі протягом 2 годин. Додають воду та дихлорметан і шари розділяють. Органічний шар потім осушають над сульфатом натрію та концентрують, одержуючи 1,11г, вихід 92%, сполуки b. До розчину b (500мг, 2,01ммоль), циклопропілборонової кислоти (225мг, 2,62ммоль), фосфату калію (1,49г, 7,04ммоль) та трициклогексилфосфіну (56мг, 0,2ммоль) в толуолі (10мл) та воді (0,4мл) під атмосферою азоту додають ацетат паладію (23мг, 0,1ммоль). Суміш нагрівають до 100°С протягом 3год., а потім охолоджують до кімнатної температури. Додають воду і суміш екстрагують етилацетатом, осушують над сульфатом натрію та концентрують, одержуючи 550мг сирового продукту с, який використовують на наступній стадії без додаткового очищення. Сполуку с (500мг, 2,4ммоль) розчиняють в 4мл етанолу. Додають водну 1Н НСІ (4мл) і суміш перемішують при кип'ятінні зі зворотним холодильником протягом 8 годин. Розчинник видаляють під вакуумом, одержуючи 440мг сполуки d, яку вико ристовують на наступній стадії без додаткового очищення. Сполуку d (440мг, 2,6ммоль) розчиняють в 14мл дихлорметану. Додають бікарбонат натрію (7мл, насич. розчин) та тіофосген (0,2мл, 2,6ммоль) і суміш перемішують при кімнатній температурі протягом 1год. Потім органічний шар відокремлюють, осушують над сульфатом натрію та концентрують, одержуючи 877мг, вихід 99%, сполуки e, яку використовують на наступній стадії без додаткового очищення. Сполуку e (447мг, 2,1ммоль) розчиняють в 3мл диметилформаміду, додають хлористоводневу сіль аміногуанідину (355мг, 3,2ммоль) та діізопропілетиламін (0,56мл, 3,2ммоль) і суміш перемішують при 50°С протягом 18 годин. Суміш потім концентрують та до одержаного залишку додають 2М водний розчин гідроксиду натрію (10мл). Суміш перемішують при 50°С протягом 18 годин, а потім охолоджують до кімнатної температури. Одержану суміш потім нейтралізують водною 1Н НСІ і осад (продукт) збирають, одержуючи сполуку f (240мг, вихід 44%). Сполуки f (89мг, 0,33ммоль) та g (94мг, 0,33ммоль) розчиняють в ДМФ (1,5мл) і додають карбонат калію (51мг, 0,37ммоль). Суміш перемішують при кімнатній температурі протягом 18 годин. Потім додають до суміші воду і утворений осад збирають та очищають препаративною ТШХ 35 89200 36 (90% дихлорметану/10% метанолу), одержуючи 116мг, вихід 68%, сполуки h. Дихлороцтову кислоту (0,04мл, 0,46ммоль) додають до суміші сполуки h (116мг, 0,23ммоль), бензилтриетиламонійброміду (183мг, 0,68ммоль) та нітриту натрію (304мг, 4,6ммоль) в дибромметані (5мл). Суміш перемішують при кімнатній температурі протягом 18 годин в темряві. Реакційну суміш потім концентрують та одержаний залишок очищають препаративною ТШХ (95% дихлорметану/5% метанолу), одержуючи 99,10мг сульфонової кислоти та 17,90мг названої в заголовку сполуки i. 4-(2-(5-Бром-4-(2-хлор-4-циклопропіл-6метилфеніл)-4Н-1,2,4-триазол-3-ілтіо)ацетамідо)3-хлорбензойна кислота До розчину 1 (1г, 4,5ммоль), циклопропілборонової кислоти (506мг, 5,9ммоль), фосфату калію (3,34г, 15,8ммоль) та трициклогексилфосфіну (126мг, 0,45ммоль) в толуолі (20мл) та воді (0,76мл) під атмосферою азоту додають ацетат паладію (51мг, 0,23ммоль). Суміш нагрівають до 100°С протягом 3год., а потім охолоджують до кімнатної температури. Додають воду і суміш екстрагують етилацетатом, осушують над сульфатом натрію та концентрують, одержуючи 775мг сирового 2-хлор-4-циклопропіл-6-метилбензоламіну (2), який використовують на наступній стадії без додаткового очищення. Сполуку 2 (775мг, 4,3ммоль) розчиняють в 9мл дихлорметану. Додають бікарбонат натрію (4,5мл, насич. розчин) та тіофосген (0,33мл, 4,3ммоль) і суміш перемішують при кімнатній температурі протягом 1год. Потім органічний шар відокремлюють, осушують над сульфатом натрію та концентрують, одержуючи 935мг 1-хлор-5-циклопропіл-2ізотіоціанато-3-метилбензолу (3), який використовують на наступній стадії без додаткового очищення. Сполуку 3 (935мг, 4,2ммоль) розчиняють в 5мл диметилформаміду, додають хлористоводневу сіль аміногуанідину (695мг, 6,3ммоль) та діізопропілетиламін (1,1мл, 6,3ммоль) і суміш перемішують при 50°С протягом 18 годин. Суміш потім концентрують і до одержаного залишку додають 2М водний розчин гідроксиду натрію (20мл). Суміш перемішують при 50°С протягом 18 годин, а потім охолоджують до кімнатної температури. Одержану суміш потім нейтралізують водною 1Н НСІ і осад (продукт) збирають, одержуючи 5-аміно-4-(2-хлор4-циклопропіл-6-метилфеніл)-4Н-1,2,4-триазол-3тіол (4) (780мг, вихід 66%). Сполуку 4 (100мг, 0,36ммоль) та 3-хлор-4-(2хлорацетамідо)бензойну кислоту (5) (88мг, 0,36ммоль) розчиняють в ДМФ (2мл) і суміш перемішують при 50°С протягом 18 годин. Потім додають воду і суміш екстрагують етилацетатом. Органічний шар відокремлюють, осушують над сульфатом натрію та концентрують, одержуючи 192мг сирової 4-(2-(5-аміно-4-(2-хлор-4циклопропіл-6-метилфеніл)-4Н-1,2,4-триазол-3ілтіо)ацетамідо)-3-хлорбензойної кислоти (6), яку використовують на наступній стадії без додаткового очищення. Дихлороцтову кислоту (0,065мл, 0,78ммоль) додають до суміші сполуки 6 (192мг, 0,39ммоль), бензилтриетиламонійброміду (318мг, 1,17ммоль) та нітриту натрію (538мг, 7,8ммоль) в дибромметані (10мл). Суміш перемішують при кімнатній температурі протягом 18 годин в темряві. Реакційну суміш потім концентрують і одержаний залишок очищають препаративною ТШХ (95% дихлорметану/5% метанолу), одержуючи 88мг, вихід 42%, 4(2-(5-бром-4-(2-хлор-4-циклопропіл-6-метилфеніл)4Н-1,2,4-триазол-3-ілтіо)ацетамідо)-3-хлорбензойної кислоти (7). 37 4-[2-(5-Бром-4-(4-циклопропілнафталін-1-іл)4Н-1,2,4-триазол-3-ілтіо)-ацетамідо]-3-хлорбензой До розчину 1 (500мг, 2,01ммоль), циклопропілборонової кислоти (225мг, 2,62ммоль), фосфату калію (1,49г, 7,04ммоль) та трициклогексилфосфіну (56мг, 0,2ммоль) в толуолі (10мл) та воді (0,4мл) під атмосферою азоту додають ацетат паладію (23мг, 0,1ммоль). Суміш нагрівають до 100°С протягом 3год., а потім охолоджують до кімнатної температури. Додають воду і суміш екстрагують етилацетатом, осушують над сульфатом натрію та концентрують, одержуючи 550мг сирового 4-циклопропілнафталін-1-аміну (2), який використовують на наступній стадії без додаткового очищення. Сполуку 2 (440мг, 2,6ммоль) розчиняють в 14мл дихлорметану. Додають бікарбонат натрію (7мл, насич. розчин) та тіофосген (0,2мл, 2,6ммоль) і суміш перемішують при кімнатній температурі протягом 1год. Потім органічний шар відокремлюють, осушують над сульфатом натрію та концентрують, одержуючи 877мг, вихід 99%, 1циклопропіл-4-ізотіоціанатонафталіну (3), який використовують на наступній стадії без додаткового очищення. Сполуку 3 (447мг, 2,1ммоль) розчиняють в 3мл диметилформаміду, додають хлористоводневу сіль аміногуанідину (355мг, 3,2ммоль) та діізопропілетиламін (0,56мл, 3,2ммоль) і суміш перемішу 89200 38 на кислота ють при 50°С протягом 18 годин. Суміш потім концентрують та до одержаного залишку додають 2М водний розчин гідроксиду натрію (10мл). Суміш перемішують при 50°С протягом 18 годин, а потім охолоджують до кімнатної температури. Одержану суміш потім нейтралізують водною 1Н НСІ і осад (продукт) збирають, одержуючи 5-аміно-4-(4циклопропілнафталін-1-іл)-4Н-1,2,4-триазол-3-тіол (4) (240мг, вихід 44%). Сполуку 4 (789мг, 2,79ммоль) та 3-хлор-4-(2хлорацетамідо)бензойну кислоту (5) (693мг, 2,79ммоль) розчиняють в ДМФ (6мл) і суміш перемішують при 50°С протягом 18 годин. Потім додають воду і суміш екстрагують етилацетатом. Органічний шар відокремлюють, осушують над сульфатом натрію та концентрують, одержуючи 1,04г, вихід 75%, 4-(2-(5-аміно-4-(4-циклопропілнафталін-1-іл)-4Н-1,2,4-триазол-3-ілтіо)ацетамідо)3-хлорбензойної кислоти (6). Дихлороцтову кислоту (0,35мл, 4,2ммоль) додають до суміші сполуки 6 (1,04г, 2,1ммоль), бензилтриетиламонійброміду (1,65г, 6,1ммоль) та нітриту натрію (2,9г, 42,1ммоль) в дибромметані (44мл). Суміш перемішують при кімнатній температурі протягом 18 годин в темряві. Реакційну суміш потім концентрують і одержаний залишок очищають хроматографією на колонці (95% дихлорметану/5% метанолу), одержуючи 393мг, вихід 34%, 4-(2-(5-бром-4-(4-циклопропілнафталін-1-іл)4Н-1,2,4-триазол-3-ілтіо)ацетамідо)-3хлорбензойної кислоти (7). 4-(2-(5-Бром-4-(7-метокси-4-метилнафталін-1іл)-4Н-1,2,4-триазол-3-ілтіо)ацетамідо)-3-хлорбензойна кислота 39 Суміш 8-аміно-2-нафтолу 1 (8,2г, 52ммоль), бензальдегіду (16мл, 156ммоль) та сульфату натрію (41,3г, 291ммоль) в ТГФ (100мл) перемішують при кипінні зі зворотним холодильником протягом ночі. Суміш охолоджують до кімнатної температури, фільтрують та концентрують при зниженому тиску. Одержаний залишок очищають хроматографією на колонці (гексан/етилацетат/триетиламін 75/23/2), одержуючи 12,65г неочищеного (Е)-8(бензиліденаміно)нафталін-2-олу (2), який використовують на наступній стадії без додаткового очищення. Суміш 2 (12,65г, 51,2ммоль), Mel (6,4мл, 102ммоль) та NaOH (6,14г, 153ммоль) в ацетоні (125мл) перемішують при кімнатній температурі протягом 2 годин. Одержану суміш концентрують та залишок розчиняють в простому ефірі, промивають водою та розсолом і концентрують. Одержаний залишок розчиняють в 2Н НСІ-ТГФ (780мл, 2:1) та перемішують при кімнатній температурі протягом 1,5год. Одержаний розчин промивають ефіром, водний шар підлуговують Na2CO3 та екстрагують ефіром. Органічний шар промивають розсолом, осушують над сульфатом натрію та концентрують. Одержаний залишок очищають хроматографією на колонці (Нех/ЕtOАс 3:1), одержуючи 6,94г, вихід 78%, 7-метоксинафталін-1аміну (3). До перемішуваної суміші 3 (6,94г, 40ммоль) та карбонату калію (16,6г, 120ммоль) в ацетоні (100мл) додають бензилбромід (19,0мл, 160ммоль) при 0°С. Суміш кип'ятять під зворотним холодильником протягом 3 днів і охолоджують до кімнатної температури. Осад видаляють і фільтрат концентрують. Одержаний залишок очищають 89200 40 хроматографією на колонці (гекс. 100%) для видалення непрореагованого бензилброміду, а потім етилацетатом (100%), одержуючи 11,75г, вихід 83%, N,N-дибензил-7-метоксинафталін-1-аміну (4). До перемішуваного розчину ДМФ (30мл) додають РОСl3 (10,65мл, 116ммоль) протягом 30 хвилин при 0°С. Суміш потім перемішують при 0°С протягом 30 хвилин та додають 4 (11,75г, 33,2ммоль) в ДМФ (120мл). Суміш перемішують при кімнатній температурі протягом шести днів та виливають у воду з льодом. Суміш продукту екстрагують дихлорметаном і органічний шар промивають водою, водним бікарбонатом натрію та розсолом, осушують над сульфатом натрію та концентрують, одержуючи 13,58г 4(дибензиламіно)-6-метокси-1-нафтальдегіду (5), який використовують на наступній стадії без додаткового очищення. Суміш 5 (5,0г, 13,1ммоль) та Pd/вугілля (812мг) в метанолі (150мл) перемішують під атмосферою водню (276кПа, 40 PSI) протягом 18 годин. Суміш пропускають через целіт та концентрують. Одержаний залишок очищають хроматографією на колонці (Нех/ЕTOАС 3:1), одержуючи 826мг, вихід 35%, 7-метокси-4метилнафталін-1-аміну (6). Сполуку 6 (826мг, 4,4ммоль) розчиняють в 25мл дихлорметану. Додають бікарбонат натрію (15мл, насич. розчин) та тіофосген (0,34мл, 4,4ммоль) і суміш перемішують при кімнатній температурі протягом 1год. Потім органічний шар відокремлюють, осушують над сульфатом натрію та концентрують, одержуючи 1,9г, вихід 99%, 4ізотіоціанато-6-метокси-1-метилнафталіну (7), 41 який використовують на наступній стадії без додаткового очищення. Сполуку 7 (1,0г, 4,4ммоль) розчиняють в 10мл диметилформаміду, додають хлористоводневу сіль аміногуанідину (723мг, 6,5ммоль) та діізопропілетиламін (1,14мл, 6,5ммоль) і суміш перемішують при 50°С протягом 18 годин. Суміш потім концентрують і до одержаного залишку додають 2М водний розчин гідроксиду натрію (10мл). Суміш перемішують при 50°С протягом 18 годин, а потім охолоджують до кімнатної температури. Одержану суміш потім нейтралізують водною 1Н НСІ і осад (продукт) збирають, одержуючи 5-аміно-4-(7метокси-4-метилнафталін-1-іл)-4Н-1,2,4-триазол3-тіол (8) (1,14мг, вихід 91%). Сполуку 8 (200мг, 0,7ммоль) та 3-хлор-4-(2хлорацетамідо)бензойну кислоту (9) (174мг, 0,7ммоль) розчиняють в ДМФ (3мл) і суміш перемішують при 50°С протягом 18 годин. Потім додають воду та суміш екстрагують етилацетатом. Органічний шар відокремлюють, осушують над сульфатом натрію та концентрують, одержуючи 304мг 4-(2-(5-аміно-4-(7-метокси-4-метилнафталін1-іл)-4Н-1,2,4-триазол-3-ілтіо)ацетамідо)-3хлорбензойної кислоти (10), яку використовують на наступній стадії без додаткового очищення. Дихлороцтову кислоту (0,1мл, 1,2ммоль) додають до суміші сполуки 10 (304мг, 0,6ммоль), бензилтриетиламонійброміду (492мг, 1,8ммоль) та нітриту натрію (828мг, 12ммоль) в дибромметані (10мл). Суміш перемішують при кімнатній температурі протягом 18 годин в темряві. Реакційну суміш потім концентрують і одержаний залишок очищають хроматографією на колонці (95% дихлорметану/5% метанолу), одержуючи 80мг, вихід 24%, 4-(2-(5-бром-4-(7-метокси-4-метилнафталін1-іл)-4Н-1,2,4-триазол-3-ілтіо)ацетамідо)-3хлорбензойної кислоти (11). 2-[5-Бром-4-(4-циклопропілнафталін-1-іл)-4Н[1,2,4]триазол-3-ілсульфаніл]-N-(2-хлор-4-Nпропіонілсульфамоїлфеніл)ацетамід До круглодонної колби на 50мл завантажують 2-[5-бром-4-(4-циклопропіл-нафталін-1-іл)-4Н[1,2,4]триазол-3-ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)-ацетамід (45мг, 0,076ммоль), EDC (29мг, 0,15ммоль) та пропіонову кислоту (6,7мкл, 0,09ммоль) в суміші 5мл ТГФ та 5мл метиленхлориду. До суміші додають DMAP (18,3мг, 0,15ммоль) однією порцією. Реакційну суміш перемішують при кімнатній температурі протягом 14год. Розчинники випаровують при зниженому тиску, одержуючи в'язкий маслянистий залишок. Залишок знов розчиняють в 20мл метиленхлориду, потім промивають 20мл 2,0М водного розчину НСІ. Органічний шар осушують над Na2SO4. Розчинник видаляють за допомогою роторного випар 89200 42 ника, одержуючи маслянистий залишок. Залишок очищають хроматографією на колонці силікагелю сумішшю метанолу та метиленхлориду (1:9). Одержують 18,5мг (38%) бажаного продукту у вигляді білої твердої речовини. 2-[5-Бром-4-(4-циклопропілнафталін-1-іл)-4Н[1,2,4]триазол-3-ілсульфаніл]-N-(2-хлор-4пропіонілсульфамоїлфеніл)лізинамід До круглодонної колби на 25мл завантажують 2-[5-бром-4-(4-циклопропіл-нафталін-4-іл)-4Н[1,2,4]триазол-3-ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)-ацетамід (50мг, 0,085ммоль), EDC (35мг, 0,18ммоль), Boc-Lys(Boc)-OH DCHA (47мг, 0,09ммоль) в суміші 5мл ТГФ та 5мл метиленхлориду. До суміші додають DMAP (16мг, 0,13ммоль) однією порцією. Реакційну суміш перемішують при кімнатній температурі протягом 14год. Розчинники випарюють при зниженому тиску, одержуючи в'язкий маслянистий залишок. Залишок розчиняють в 5мл 4,0М НСІ в діоксані. Реакцію перемішують при кімнатній температурі протягом 14год. Розчинник випарюють при зниженому тиску, одержуючи в'язкий маслянистий залишок. Залишок промивають по черзі 10мл метиленхлориду та 10мл ефіру, одержуючи названу в заголовку сполуку у вигляді світло-жовтої твердої речовини (44мг, 65%). Реагенти 1-Метил-4-нітронафталін До 1-метилнафталіну (8,0г, 56ммоль) в круглодонній колбі при 0°С додають азотну кислоту (26мл) по краплях. (ПРИМІТКА: Повільне додавання азотної кислоти є дуже важливим для запобігання утворення інших регіоізомерів). Після перемішування реакційної суміші протягом ще 15хв. при 0°С її виливають в 65мл Н2О. Водний розчин двічі екстрагують бензолом і об'єднаний бензольний розчин промивають 10% розчином NaOH, осушають Na2SO4 та концентрують. Хроматографія на силікагелі (ЕtOАс:гексани =5:95) дає продукт, який містить ще кілька процентів іншого регіоізомеру. Його перекристалізовують з ЕtOАс/гексанів, одержуючи 9,0г (43%) 1. 4-Метилнафталін-1-іламін До розчину 1-метил-4-нітронафтиламіну (4,0г, 21ммоль) в етанолі (300мл) додають нікель Ренея 43 89200 44 (4 човника для зважування). Суміш перемішують під Н2 (1атм) протягом 16год. Реакцію фільтрують крізь шар целіту та концентрують. Очищення флеш-хроматографією на колонці із силікагелем (ЕtOАс:гексани =15:85) дає продукт (3,2г, 75%). 4-Етил-5,6,7,8-тетрагідронафталін-1-іламін Процедура є по суті ідентичною шляху для 4метилнафталін-1-іламіну, описаному вище, однак, починається з розчину 5-етил-8-нітро-1,2,3,4тетрагідронафталіну (795мг, 3,95ммоль). 4-Метилнафталін-1-ілтіосемікарбазид До розчину тіофосгену (0,33мл, 4,3ммоль) в безводному метиленхлориді (5мл) при 0°С додають по краплях розчин 4-метилнафтиламіну (671мг, 4,3ммоль) та діізопропілетиламіну (1,5мл, 8,6ммоль) в безводному метиленхлориді (5мл). Після перемішування реакційної суміші протягом ще 10хв. при 0°С, її промивають 1% розчином НСІ, а потім Н2О, осушують Na2SO4 та концентрують, одержуючи темно-коричневу маслянисту рідину. Маслянисту рідину розчиняють в гексанах (15мл) і одержану коричневу суспензію фільтрують. Фільтрат концентрують, одержуючи чистий тіоізоціанат. До розчину тіоізоціанату в безводному ацетонітрилі (20мл) додають гідразин (0,13мл, 4,3ммоль) при кімнатній температурі. Після перемішування при кімнатній температурі протягом 20хв. суміш концентрують. Одержану маслянисту рідину жовтого кольору тритурують з ЕtOАс:гексанами (1:1), одержуючи (701мг, вихід 71%) продукту у вигляді білуватої твердої речовини. 5-Дифторметил-4-(4-метилнафталін-1-іл)-4Н[1,2,4]триазол-3-тіол Розчин 4-метилнафтилтіосемікарбазиду (180мг, 0,78ммоль) в дифтороцтовій кислоті (2мл) нагрівають при 100°С протягом 4год. Коли суміш охолоджують до кімнатної температури, з реакційної суміші кристалізується біла тверда речовина. Щоб зібрати більшу кількість продукту, до суміші додають 2мл гексанів. Фільтрація дає продукт (179мг, вихід 79%) у вигляді білої твердої речовини. 5-Фторметил-4-(4-метилнафталін-1-іл)-4Н[1,2,4]триазол-3-тіол До розчину 4-метилнафтилтіосемікарбазиду (158мг, 0,68ммоль) в МеОН (10мл) та 4,37М NaOMe (0,23мл, 1,02ммоль) додають етилфторацетат (0,13мл, 1,37ммоль) та перемішують при кімнатній температурі протягом 17год. Реакційну суміш концентрують, додають воду і промивають діетиловим ефіром. У водному шарі встановлюють рН за допомогою НСІ та збирають на фільтрі продукт у вигляді білої твердої речовини (78мг, вихід 42%). 1 Н NMR (ДМСО, 300МГц) δ 14,26 (с, 1Н), 8,14 (д, J=8,4Гц, 1Н), 7,67-7,52 (м, 4Н), 7,26 (д, J=8,4Гц, 1Н), 5,20 (дд, J=12,0, 21,0Гц, 1Н), 5,03 (дд, J=12,0, 20,4Гц, 1Н), 2,74 (с, 3Н). 2-[5-Дифторметил-4-(4-метилнафталін-1-іл)4Н-[1,2,4]триазол-3-ілсульфаніл]-N-(2-метил-4сульфамоїлфеніл)ацетамід До розчину 5-дифторметил-4-(4метилнафталін-1-іл)-4Н-[1,2,4]триазол-3-тіолу (53мг, 0,18ммоль), K2СО3 (27,0мг, 0,20ммоль) в ДМФ (1,5мл) додають 2-метил-N-(2-метил-4сульфамоїлфеніл)ацетамід (47мг, 0,18ммоль). Реакційну суміш перемішують при кімнатній температурі протягом 16год. Після завершення реакції додають до реакції Н2О (4,0мл) і перемішують до утворення осаду та збирають продукт на фільтрі (77,0мг, вихід 83%). 1 Н NMR (ДМСО, 300МГц) δ 9,84 (шир.с, 1Н), 8,18 (д, J=8,0Гц, 1Н), 7,70-7,53 (м, 7Н), 7,18 (т, J=51,5Гц, 1Н), 7,11 (д, J=8,0Гц, 1Н), 4,26 (с, 2Н), 2,82 (с, 3Н), 2,27 (с, 3Н). N-(2-Хлор-4-сульфамоїлфеніл)-2-[5-дифторметил-4-(4-етил-5,6,7,8-тетрагідронафталін-1-іл)4Н-[1,2,4]триазол-3-ілсульфаніл]ацетамід До розчину 5-дифторметил-4-(4-етил-5,6,7,8тетрагідронафталін-1-іл)-4Н-[1,2,4]триазол-3-тіолу (85мг, 0,28ммоль), K2СО3 (41,8мг, 0,30ммоль) в ДМФ (2,0мл) додають 2-хлор-N-(2-метил-4сульфамоїлфеніл)ацетамід (77,8мг, 0,28ммоль). Реакційну суміш перемішують при кімнатній температурі протягом ночі. Після закінчення реакції, додають до реакції МеОН та перемішують до 45 утворення осаду і збирають продукт на фільтрі (71,0мг, вихід 46%). 1 Н NMR (ДМСО, 300МГц) δ 10,14 (с, 1Н), 8,03 (д, J=8,1Гц, 1Н), 7,88 (д, J=2,4Гц, 1Н), 7,74 (дд, J=2,1, 8,4Гц, 1Н), 7,46 (шир.с, 2Н), 7,34-7,00 (м, 3Н), 4,33 (уявн.кв, J=15,6Гц, 2Н), 2,71 (т, J=5,7Гц, 2Н), 2,62 (кв, J=7,5Гц, 2Н), 2,28-2,08 (м, 2Н), 1,721,60 (м, 4Н), 1,19 (т, J=7,5Гц, 3Н). N-(2-Хлор-4-сульфамоїлфеніл)-2-[5дифторметил-4-(4-метилнафталін-1-іл)-4Н[1,2,4]триазол-3-ілсульфаніл]ацетамід До розчину 5-дифторметил-4-(4метилнафталін-1-іл)-4Н-[1,2,4]триазол-3-тіолу (59мг, 0,20ммоль), K2СО3 (30,0мг, 0,22ммоль) в ДМФ (1,5мл) додають 2-хлор-N-(2-метил-4сульфамоїлфенiл)ацетамід (57мг, 0,20ммоль). Реакційну суміш перемішують при кімнатній температурі протягом 16год. Після завершення реакції додають до реакції Η2Ο (4,0мл) та перемішують до утворення осаду і збирають продукт на фільтрі (77,0мг, вихід 71%). 1 Н NMR (ДМСО, 300МГц) δ 10,11 (шир.с, 1Н), 8,18 (д, J=10,0Гц, 1Н), 8,01 (д, J=10,0Гц, 1Н), 7,87 (с, 1Н), 7,75-7,54 (м, 5Н), 7,46 (шир.с, 2Н), 7,18 (т, J=50,0Гц, 1Н), 7,11 (д, J=10,0Гц, 1Н), 4,32 (с, 2Н), 2,27 (с, 3Н). 2-[5-Фторметил-4-(4-метилнафталін-1-іл)-4Н[1,2,4]триазол-3-ілсульфаніл]-N-(2-метил-4сульфамоїлфеніл)ацетамід До розчину 5-фторметил-4-(4-метилнафталін1-іл)-4Н-[1,2,4]триазол-3-тіолу (89мг, 0,33ммоль), K2СО3 (50,0мг, 0,36ммоль) в ДМФ (2,0мл) додають 2-хлор-N-(2-метил-4-сульфамоїлфеніл)ацетамід (87мг, 0,33ммоль). Реакційну суміш перемішують при кімнатній температурі протягом 16год. Після завершення реакції додають до реакції Н2О (2,0мл) та перемішують до утворення осаду і фільтрують. Очищення оберненофазовою ВЕРХ дає продукт у вигляді твердої речовини (53,3мг, вихід 50%). 1 Н NMR (ДМСО, 300МГц) δ 9,84 (шир.с, 1Н), 8,18 (д, J=8,4Гц, 1Н), 7,71-7,53 (м, 7Н), 7,26 (с, 2Н), 7,10 (д, J=8,7Гц, 1Н), 5,34 (дд, J=12,0, 27,3Гц, 1Н), 5,18 (дд, J=12,3, 26,4Гц, 1Н), 4,22 (с, 2Н), 2,75 (с, 3Н), 2,25 (с, 3Н). N-(2-Хлор-4-сульфамоілфеніл)-2-[5фторметил-4-(4-метилнафталін-1-іл)-4Н[1,2,4]триазол-3-ілсульфаніл]ацетамід 89200 46 До розчину 5-фторметил-4-(4-метилнафталін1-іл)-4Н-[1,2,4]триазол-3-тіолу (89мг, 0,33ммоль), K2СО3 (50,0мг, 0,36ммоль) в ДМФ (2,0мл) додають 2-хлор-N-(2-хлор-4-сульфамоїлфеніл)ацетамід (93мг, 0,33ммоль). Реакційну суміш перемішують при кімнатній температурі протягом 16год. Після завершення реакції додають до реакції Н2О (2,0мл) та перемішують до утворення осаду і фільтрують, одержуючи тверду речовину (126,8мг, вихід 74%). 1 Н NMR (ДМСО, 300МГц) δ 10,12 (шир.с, 1Н), 8,18 (д, J=8,7Гц, 1Н), 8,04 (дд, J=4,8, 8,7Гц), 7,87 (с, 1Н), 7,76-7,52 (м, 5Н), 7,46 (с, 2Н), 7,11 (д, J=8,7Гц, 1Н), 5,35 (дд, J=12,3, 26,7Гц, 1Н), 5,19 (дд, J=11,7, 25,8Гц, 1Н), 4,26 (с, 2Н), 2,75 (с, 3Н). N-(2-Хлор-4-сульфамоїлфеніл)-2-[4-(4-етил5,6,7,8-тетрагідронафталін-1-іл)-5-фторметил-4Н[1,2,4]триазол-3-ілсульфаніл]ацетамід До розчину 4-(4-етил-5,6,7,8тетрагідронафталін-1-іл)-5-фторметил-4Н[1,2,4]триазол-3-тіолу (85мг, 0,29ммоль), K2СО3 (44,4мг, 0,32ммоль) в ДМФ (2,0мл) додають 2хлор-N-(2-хлор-4-сульфамоїлфеніл)ацетамід (82,6мг, 0,29ммоль). Реакційну суміш перемішують при кімнатній температурі протягом 16год. Після завершення реакції додають до реакції Н2О (2,0мл) та перемішують до утворення осаду і фільтрують, одержуючи тверду речовину (73,0мг, вихід 1 47%). Н ЯМР (ДМСО, 300МГц) δ 10,15 (с, 1 Η), 8,05 (д, J=8,4Гц, 1H), 7,87 (с, 1Н), 7,74 (д, J=8,4Гц, 1Н), 7,46 (с, 2Н), 7,21-7,06 (м, 2Н), 5,26 (д, J=48,0 Гц, 2Н), 4,29 (уявн.кв, J=15,6Гц, 2Н), 2,71-2,58 (м, 3Н), 2,25 (с, 1Н), 2,25-2,09 (м, 2Н), 1,72-1,59 (м,4Н), 1,19 (т, J=7,5Гц, 3Н). З використанням відповідних вихідних матеріалів, наступні сполуки були одержані за процедурами, аналогічними описаним вище методам: 2-[5-бром-4-(2-хлор-4(циклопропілметил)феніл)-4Н-[1,2,4]-триазол-3ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамід, 2-[5-бром-4-(2-хлор-4-циклобутилфеніл)-4Н[1,2,4]-триазол-3-ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамід, 2-[5-бром-4-(2-хлор-4(циклопропілметил)нафталін-1-іл)-4Н-[1,2,4]триазол-3-ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамід, 47 2-[5-бром-4-(2-хлор-4-циклопропілфеніл)-4Н[1,2,4]-триазол-3-ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамід, 2-[5-трифторметил-4-(2-хлор-4циклопропілнафталін-1-іл)-4Н-[1,2,4]-триазол-3ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамід, 2-[5-бром-4-(4-циклопропіл-5,6,7,8тетрагідронафталін-1-іл)-4Н-[1,2,4]-триазол-3ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамід, 2-[5-бром-4-(4-етилнафталін-1-іл)-4Н-[1,2,4]триазол-3-ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамід, 2-[5-бром-4-(4-етил-5,6,7,8тетрагідронафталін-1-іл)-4Н-[1,2,4]-триазол-3ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамід, 2-[5-бром-4-(5-цикпопропілхінолін-8-іл)-4Н[1,2,4]-триазол-3-ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамід, 2-[5-бром-4-(5-циклопропілізохінолін-8-іл)-4Н[1,2,4]-триазол-3-ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамід, 2-[5-бром-4-(5-циклопропілхінолін-8-іл)-4Н[1,2,4]-триазол-3-ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамід, 2-[5-бром-4-(1-метилаценафтен-5-іл)-4Н[1,2,4]-триазол-3-ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамід, 2-[5-бром-4-(2-метилаценафтен-5-іл)-4Н[1,2,4]-триазол-3-ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамід, 2-[5-бром-4-(1,1-диметилаценафтен-5-іл)-4Н[1,2,4]-триазол-3-ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамід. Інгібування зворотної транскриптази ВІЛ-1 Проводили скринінг сполук на інгібуючу активність проти вірусу імунодефіциту людини типу 1 (ВІЛ-1) за допомогою високопродуктивного клітинного аналізу з використанням ВІЛ-1, що експресує люциферазу світлячка як репортерний ген, псевдотипованого оболонковим глікопротеїном вірусу езикулярного стоматиту (VSV-G). Експериментальні процедури були по суті такими, як описано Connor et al., Journal of Virology (1996), 70: 53065311 (Characterization of the functional properties of env genes from long-term survivors of human immunodeficiency virus type 1 infection), та Popik et al., Journal of Virology (2002), 76: 4709-4722 (Human immunodeficiency virus type 1 uses lipid raftcolocalized CD4 and chemokine receptors for productive entry into CD4+ Т cells). Слід особливо зазначити, що вірус містить дві інтродуковані мутації гена ЗТ (K103N та Y181C, створені ПЛРмутагенезом), які роблять вірус високорезистентним по відношенню до сучасних ненуклеозидних лікарських засобів проти ВІЛ-1. Вихідний вірусний матеріал був одержаний котрансфекцією плазмідної ДНК, що кодує VSV-G, з вектором pNL4-3Env()Luc(+) в клітини 293Т. Через шістдесят чотири години після трансфекції, вірусвмісне середовище збирають центрифугуванням та зберігають замороженим при -80°С 89200 48 Клітини HeLa інфікують VSV-G псевдотипованим вірусом в присутності діагностичної сполуки у форматі 384-лункового мікротитрувального планшета. Через сорок вісім годин після первинного інфікування додають до клітин лізисний буфер та реагент для аналізу люциферази (Promega) і визначають люциферазну активність підрахунком створеної люмінесценції за допомогою люмінометра LJL. Оскільки ген люциферази переноситься у вірусному геномі, рівень його експресії безпосередньо відображає рівень реплікації вірусу в присутності сполуки. Для оцінки активності сполук проти ВІЛ-1 дикого типу використовували клітинну лінію HeLa-JC53, що експресує високі рівні CD4 та CCR5 (Platt et al., Journal of Virology (1998), 72: 2855-2864: Effect of CCR5 and CD4 cell surface concentrations on infection by macrophagetropic isolates of human immunodeficiency virus type 1). Клітинна лінія була модифікована шляхом виділення стабільної клітинної лінії, що експресує люциферазу під контролем промотора ВІЛ-1 (довгий термінальний повтор, тобто, ДТП). ВІЛ-1 інфекція цієї клітинної лінії стимулює транскрипцію люциферази з промотора ВІЛ-1 і рівень експресії гена люциферази є пропорційним рівню реплікації вірусу (Harrington et al. у Journal of Virology Methods (2000), 88: 111-115: Direct detection of nfection of HIV-1 in blood using a centrifugation-indicator cell assay; та Roos et al. у Virology (2000), 273: 307-315: LuSIV cells: a reporter cell line for the detection and quantitation of a single cycle of HIV та SIV replication). Процедури вірусної інфекції, тестування сполук та визначення люциферазної активності були такими самими, як для VSV-G псевдотипованого ВІЛ-1. Були використані два підходи для оцінки цитотоксичності позитивних сполук, виявлених шляхом проведення аналізів на вірус ВІЛ-1. Перший підхід використовував іншу модифіковану клітинну лінію HeLa-JC53, яка конститутивно експресує високий рівень люциферази без вірусної інфекції. Рівень експресії люциферази в цих клітинах служив індикатором реплікації клітин в присутності сполук. Процедури тестування сполук та визначення люциферазної активності були такими саме, як у тестах вірусної інфекції. Інший аналіз токсичності використовував клітини HeLe-JC53 та комерційно доступний аналітичний набір MTS (Promega) для вимірювання мітохондріальної функції клітин. З використанням методів, аналогічних описаним вище, були синтезовані 2-[5-бром-4-(4циклопропілнафталін-1-іл)-4Н-[1,2,4]триазол-3ілсульфаніл]-N-(2-метил-4сульфамоїлфеніл)ацетамід та 2-[5-бром-4-(4етилнафталін-1-іл)-4Н-[1,2,4]триазол-3ілсульфаніл]-N-(2-хлор-4сульфамоїлфеніл)ацетамід, а також N-4карбамільний аналог, 2-[5-бром-4-(4етилнафталін-1-іл)-4Н-[1,2,4]триазол-3ілсульфаніл]-N-(2-хлор-4карбамоїлфеніл)ацетамід, та N-4-карбоксильний аналог. Кожну сполуку тестували з використанням панелі мутантних зворотних транскриптаз ВІЛ, включаючи 20 з 22 мутантів, які зустрічаються у приблизно 2% чи більше зразків пацієнтів, резис 49 тентних до найбільш широко застосовуваного ненуклеозидного інгібітора ЗТ ВІЛ ефавіренца ((4S)6-хлор-4-(циклопропілетиніл)-1,4-дигідро-4(трифторметил)-2Н-3,1-бензоксазин-2-ону). Для кожного з 20 тестованих мутантів, що часто зустрічаються, щонайменше одна з цих сполук була більш ніж у 20 разів більш дієвою, ніж ефавіренц, або мала ЕС50 менш ніж 1нМ. В більшості випадків задовольнялися обидва критерії. В більшості випадків всі три сполуки були більш дієвими, ніж ефавіренц. Сполуки порівнювали на активність по відношенню до мутантних зворотних транскриптаз дикого типу, Y181C та Y188L. Обидва аміди були 89200 50 значно кращими, ніж карбонова кислота, по відношенню до всіх трьох ферментів. Результати Сполуки за винаходом тестували на зворотних транскриптазах ВІЛ дикого типу та чотирьох мутантних. Результати наведені в Таблиці 1 як EC50 (нМ) та ІС50 (нМ). У Таблиці, А означає значення 100нМ. Н.в. - не визначено. Кращими сполуками в цьому винаході є ті, що виявляють активність по відношенню до дикого типу (WT) та резистентних мутантів нижче 50нМ як для EC50, так і для IC50. 51 89200 52 53 89200 54 55 89200 56 57 89200 58 59 89200 60
ДивитисяДодаткова інформація
Назва патенту англійськоюS-triazolyl-a-mercaptoacetanildes as inhibitors of hiv reverse transcriptase
Автори англійськоюGirardet Jean-Luc, Koh Yung-Hyo, De La Rosa Martha, Gunic Esmir, Hong Zhi, Lang Stanley, Kim Hong Woo
Назва патенту російськоюS-триазолил-б-меркаптоацетанилиды как ингибиторы обратной транскриптазы вич
Автори російськоюЖирарде Жан-Люк, Кох Юнг-Хио, Де Ла Роса Марта, Ганик Эсмир, Хонг Чжи, Ленг Стенли, Ким Хонг Ву
МПК / Мітки
МПК: A61K 31/4196
Мітки: зворотної, інгібітори, транскриптази, s-триазоліл-a-меркаптоацетаніліди, віл
Код посилання
<a href="https://ua.patents.su/38-89200-s-triazolil-a-merkaptoacetanilidi-yak-ingibitori-zvorotno-transkriptazi-vil.html" target="_blank" rel="follow" title="База патентів України">S-триазоліл-a-меркаптоацетаніліди як інгібітори зворотної транскриптази віл</a>