Спосіб одержання флавінмононуклеотиду (5′-фмн)
Номер патенту: 22568
Опубліковано: 25.04.2007
Автори: Яцишин Валентина Юріївна, Вороновський Андрій Ярославович, Сибірний Андрій Андрійович, Федорович Дарія Василівна, Дмитрук Костянтин Васильович, Іщук Олена Петрівна
Формула / Реферат
Спосіб одержання флавінмононуклеотиду (5'-ФМН), що полягає у введенні в геном мікроорганізмів генетичної інформації про синтез флавінмононуклеотиду, який відрізняється тим, що промотор гена FMN1 (кодує рибофлавінкіназу) дріжджів Debaryomyces hansenii вирізають, замінюють на сильний промотор фактора елонгації трансляції - TEF1 дріжджів Candida famata, конструюють вектори для надекспресії гена FMN1, за допомогою яких в геном Candida famata вводять фрагмент ДНК, що несе генетичну інформацію про синтез 5'-ФМН, отримують рекомбінантні штами з високою активністю рибофлавінкінази, в культуральній рідині яких нагромаджується 5'-ФМН.
Текст
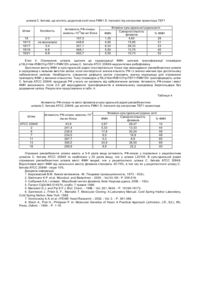
Корисна модель відноситься до галузі біотехнології і є способом отримання флавінмононуклеотиду (ФМН) за допомогою рекомбінантних штамів дріжджів Candida famata (C. famata). 5’-ФМН (рибофлавін-5’-фосфат) є сполукою, яка відіграє важливу роль як коензим у різноманітних ферментативних реакціях у живих організмах і є ефективним засобом профілактики і лікування захворювань, пов’язаних з порушенням біосинтезу цієї сполуки. Препарати ФМН, отримані ферментативним способом, можуть знайти застосування як: 1 - лікарські препарати, які не містять домішок з невстановленою біологічною активністю; 2 - реактиви високого ступеня чистоти; 3 - проміжні продукти для отримання флавінаденіндинуклеотиду (ФАД) та його похідних; 4 - компоненти системи біолюмінісцентного аналізу. Відомо, що 5’-ФМН у промислових масштабах отримують шляхом фосфорилювання рибофлавіну (РФ) хімічними агентами [1], що приводить до утворення препарату, який містить побічні продукти: ізомерні форми флавінмононуклеотиду, такі як 2’-ФМН і 4’-ФМН, рибофлавін динуклеотиди (5’,4’-ФДН і 5’,3’-ФДН), а також поліфосфати, які не мають вітамінної активності. Очищення 5’-ФМН від цих сполук є складним завданням. Комерційні препарати містять не більше 74% натрієвої солі 5’-ФМН, крім того, препарати ФМН, отримані таким способом, є дуже дорогими, що знижує можливості їх широкого використання у практиці. Відомо досить багато мікроорганізмів, здатних до надсинтезу РФ, зокрема, рекомбінантні штами бактерій Bacillus subtilis, цвільовий гриб Ashbya gossypii та флавіногенні дріжджі С. famata [2, 3]. Однак не описано жодного прикладу прямого мікробного синтезу значних кількостей ФМН. Найбільш близьким до запропонованого є спосіб отримання ФМН, в якому використані бактерії родів Corynebacterium, Brevibacterium, Escherichia, Enterobacter i Pseudomonas, що містять рекомбінантну ДНК з фрагментом, який несе генетичну інформацію про синтез ФМН [4]. Однак у цих мікроорганізмів перетворення РФ до ФМН і наступну реакцію, фофорилювання ФМН до ФАД, здійснює той самий білок [5], тому в к ультура х нагромаджуються обидва нуклеотиди - ФМН і ФАД. В основу корисної моделі поставлено завдання за допомогою генноінженерних підходів сконструювати рекомбінантні штами дріжджів з високою активністю рибофлавінкінази (РФ-кіназа), здатні до надсинтезу ФМН. Поставлене завдання досягається тим, що у способі отримання флавінмононуклеотиду (5’-ФМН), який полягає у введенні в геном мікроорганізмів генетичної інформації про синтез ФМН, згідно з корисною моделлю промотор гена FMN1 (кодує РФ-кіназу) дріжджів Debaryomyces hansenii (D. hansenii) вирізають, замінюють на сильний промотор фактора елонгації трансляції - TEF1 дріжджів С famata, конструюють вектори для надекспресії гена FMN1, за допомогою яких в геном С. famata вводять фрагмент ДНК, що несе генетичну інформацію про синтез 5’-ФМН, отримують рекомбінантні штами з високою активністю РФ-кінази, в культуральній рідині яких нагромаджується 5’-ФМН. Суть корисної моделі полягає у введенні в геном дріжджів фрагменту ДНК, який несе генетичну інформацію про синтез ФМН під контролем сильного конститутивного промотора, що забезпечує високий рівень експресії гена FMN1 і нагромадження цільового продукту - ФМН, а не суміші флавінових н уклеотидів, ФМН і ФАД, як це має місце при використанні бактерійної моделі [5]. Біосинтез ФМН і ФАД у дріжджів С famata здійснюється за допомогою послідовної каталітичної дії 2 різних ферментів - РФ-кінази (КФ 2.7.1.26) та ФАД-синтетази (КФ 2.7.27.2), які забезпечують утворення ФМН і ФАД у незначній кількості, необхідній для життєдіяльності клітини. [3]. У запропонованому способі використовують такі методи: полімеразна ланцюгова реакція (ПЛР), конструювання рекомбінантних плазмід, виділення плазмід з Escherichia coli, рестрикційний аналіз, електрофорез в агарозному гелі, трансформація Е. coli методом електропорації, описані в [6]. Трансформацію С. famata проводять, як описано в [7]. Виділення сумарної ДНК з транс формантів С. famata проводиться як для S. cerevisiae [8]. Спосіб отримання ФМН ілюструється графічними матеріалами. На Фіг.1 зображено нуклеотидну послідовність відкритої рамки зчитування та термінатора гена РФ-кінази FMN1 дріжджів D. hansenii, де інтрон вказаний нежирним шрифтом, старт- та стоп-кодони підкреслені, термінатор позначено курсивом нежирним шрифтом. Послідовність взято з банку даних [„Genolevures: Debaryomyces Hansen”, http://cbi.labri.fr/Genolevures/elt/DEHA]. На Фіг.2. зображено лінійну схему плазміди p19L2+prTEF1+FMN1Dh, де фрагмент, що містить ген LEU2 S. cerevisiae, позначено сірою смугою; фрагмент, що містить промотор TEF1 С. famata, позначено вертикальними штри хами; фрагмент, що містить відкриту рамку зчитування FMN1 D. hansenii, позначено білою смугою; інтрон FMN1 D. hansenii, позначено крапками; тонкою чорною лінією позначено бактерійну частину вектора. Сайти рестрикції позначено: Н - HindІІІ; Sp - SphІ; P - PstІ; К - KpnІ; Rl -ЕсоІІІ; SI - SalІ; Xb - XbaІ; В - ВаmІІІ; Sm - SmaІ; Sc - SacI. На Фіг.3 зображено лінійну схему плазміни p19L2+ble+RIBCf+prTEF1+FMN1Dh, де фрагмент, що містить ген RIВ1 С. famata, позначено горизонтальними смугами; фрагмент, що містить ген blе S. aureus позначено діагональним штрихом; фрагмент гена LEU2 S. cerevisiae, позначено сірою смугою; фрагмент, що містить промотор TEF1 С. famata, позначено вертикальними штрихами; фрагмент, що містить відкриту рамку зчитування FMN1 D. hansenii, позначено білою смугою; інтрон FMN1 D. hansenii, позначено крапками; тонкою чорною лінією позначено бактерійну частину вектора. Сайти рестрикції позначено: Н - HindIII; Sp - SphI; P - PstI; К - КрnI, S - SalI; Sm - SmaI; Xb - XbaI; Sc - SacI; RI - EcoRI; В - BamHI. Спосіб здійснюють кількома етапами. Етап 1. Конструювання плазміди, що містить ген FMN1 Debaryomyces hansenii під промотором TEF1. Відкриту рамку зчитування (ВРЗ), що містить інтрон, а також термінатор гена FMN1 D. hansenii (Фіг.1) ампліфікують за допомогою ПЛР з використанням геномної ДНК D. hansenii як матриці та праймерів А51 і А52 (Табл. 1). Фрагмент очікуваної величини (824 пари нуклеотидів, (п.н.)) обробляють рестриктазою SalI (сайти цього фермента фланкують одержаний продукт ПЛР). Фрагмент, що містить промотор TEF1 С famata, ампліфікують за допомогою ПЛР з використанням праймерів Р7-2В і P7-3S (Табл. 1) та геномної ДНК С. famata як матриці. Продукт очікуваної величини (658п.н.) обробляють рестриктазами ВатНІ та SalI, сайти яких фланкують цей продукт. BаmНІ/SаlI-фрагмент з промотором TEF1 С. famata та SalI-фрагмент з ВРЗ і термінатором FMN1 D. hansenii клонують на вектор p19L2 [7]. Сконструйовану плазміду позначено p19L2+prTEF1+FMN1Dh (Фіг.2). Таблиця 1 Перелік праймерів, які використовують у 1, 2 та 3 етапах способу Назва праймера Р7-2В P7-3S А51 А52 Ко36 Послідовність нуклеотидів 5’-TGC GGA ТСС ТАА CGA АС А GCT CAT CAG-3’ 5’-TGC GTC GAC TTT GCT ТАА TGT ATA ATA ATA G-3’ 5’- CCC GTC GAC ATG ACG AGA CCT GAA ACT C AC GTT CC-3’ 5’-CGG GTC GAC CCT TAA GTA AAA GTA CCC CAA AAT AG AAC G-3’ 5’-TTT GAG CTC ATG TTA CAG TCT АТС CCG GC-3’ Етап 2. Конструювання рекомбінантних штамів С. famata Плазмідою p19L2+prTEF1+FMN1Dh, попередньо лінеаризованою рестриктазою HindIII, трансформують реципієнтний штам С. famata L20105 (leu2). Трансформацію проводять методом електропорації, селекцію Leu+трансформантів проводять на мінімальному середовищі Беркгольдера без лейцину [7]. Серед низки трансформантів відбирають стабільні Leu+-інтегранти. Наявність в геномі трансформантів гена FMN1 D. hansenii під промотором TEF1 С. famata перевіряють за допомогою ПЛР з використанням відповідної пари праймерів (Р72В та А52) (Табл. 1). Інтегранти, що містять цю рекомбінантну конструкцію, відбирають для перевірки активності РФ-кінази та продукції ФМН. Трансформанти вирощують протягом 2 діб в колбах Ерленмейєра у середовищі з низьким вмістом заліза (0,01мг Fe/л). Частина відібраних рекомбінантних штамів №3, 9, 18, 33 мають у 3-6 разів вищу активність РФ-кінази у порівнянні з вихідним штамом С famata L20105 і рекомбінантним штамом К9, отриманим трансформацією тією ж плазмідою, але без гена FMN1 (Табл. 2). Таблиця 2 Активність РФ-кінази та вміст флавінів в культуральній рідині рекомбінантних штамів С famata, що містять ген FMN1 D. hansenii під контролем промотора TEF1 Активність РФ-кінази, мкмоль´10-5 /хв´мг білка Штам L20105 (контроль) К9 (контроль) 3 9 18 33 20,4 27,8 70,0 121,7 111,7 86,1 ФМН 0,2 0,45 0,80 1,35 1,30 1,30 Флавіни культуральної рідини, мг/л Сумарна % ФМН кількість флавінів 3,39 6 5,29 9 3,22 25 4,65 29 4,60 28 3,83 34 В культуральному середовищі отриманих рекомбінантних штамів 25-34% від загального вмісту флавінів припадає на ФМН, в той час як у ви хідного штаму L20105 та штаму К9 вміст ФМН не перевищує 10%. Етап 3. Конструювання плазміди для введення в геном додаткової копії гена FMN1 та селекція відповідних трансформантів. Для подальшого покращення продуцентів ФМН у геном відібраних трансформантів вводять додаткові копії гена FMN1 D. hansenii під контролем промотора TEF1 С. famata. Для цього конструкцію, що містить промотор TEF1 з геном FMN1, переклоновують у вектор, який містить ген ble Staphylococcus aureus (забезпечує стійкість до флеоміцину). Сконструйована плазміда отримала назву p19L2+ble+RIBCf+prTEF1+FMN1Dh. Її лінійна схема представлена на Фіг.3. Плазмідою p19L2+ble+RIB1Cf+prTEF1+FMN1Dh трансформують реципієнтний штам С. famata №18, який має підвищену активність РФ-кінази і нагромаджує в культуральній рідині 28% ФМН від загального вмісту фла вінів (Табл. 3). Трансформанти, резистентні до флеоміцину, відбирають на мінімальному середовищі Беркгольдера, що містить флеоміцин у концентрації 1,8мг/л. Серед низки трансформантів відбирають стабільні інтегранти, резистентні до флеоміцину. Наявність в геномі трансформантів частини плазміди p19L2+ble+RIBCf+prTEF1+FMN1Dh, що містить ген FMN1 D. hansenii під промотором TEF1 С. famata та ген ble, перевіряють за допомогою ПЛР з використанням відповідної пари праймерів (Р7-2В та Ко36) (Табл. 1). Інтегранти, що містять цю рекомбінантну конструкцію відбирають для подальшого аналізу. Наявність декількох копій гена FMN1 підтверджують за допомогою Саузерн-блот аналізу [6]. Для перевірки активності РФ-кінази і продукції ФМН отримані трансформанти вирощують протягом 2 діб у середовищі з низьким вмістом заліза (0,01мг Fe/л). Відібрані рекомбінантні штами характеризуються в 3-4,5 рази вищою активністю РФкінази в порівнянні з реципієнтним штамом С. famata №18 і в 13-17 разів - порівняно із рекомбінантним штамом К9, отриманим трансформацією плазмідою без гена FMN1 (Табл. 2, 3). В к ультуральній рідині отриманих рекомбінантних штамів вміст ФМН у 4-5 разів вищий, ніж у реципієнтного штама С. famata №18. Таблиця 3 Активність РФ-кінази та вміст флавінів в культуральній рідині рекомбінантних штамів С. famata, що містять додаткові копії гена FMN1 D. hansenii під контролем промотора TEF1 Штам Копійність Активність РФ-кінази, мкмоль´10-5/хв´мг білка 18 18/13 18/17 18/19 18/21 2-3 не визначали 3-4 6-8 6-8 107,3 448,6 351,1 468,1 482,7 Флавіни культуральної рідини,мг/л Сумарна кількість ФМН % ФМН флавінів 1,30 4,60 28 4,95 15,95 31 6,33 28,33 23 5,50 13,75 40 5,50 10,73 52 Етап 4. Отримання штамів, здатних до надпродукції ФМН, шля хом трансформації плазмідою p19L2+ble+RIBCf+prTEF1+FMN1Dh штаму С. famata ATCC 20849-надсинтетика рибофлавіну. Зростання вмісту ФМН в культуральній рідині спостерігається тільки при вирощуванні рекомбінантних штамів в середовищі з низьким вмістом заліза, коли синтезується значна кількість РФ і є значно нижчим при достатньому забезпеченні залізом. Необхідність створення дефіциту заліза становить значну перешкоду для отримання препарату ФМН у великих кількостях. Тому плазмідою p19L2+ble+RIB1Cf+prTEF1+FMN1Dh трансформують штам С. famata ATCC 20849, продукція РФ у якого не залежить від забезпечення залізом. Активність РФ-кінази і вміст ФМН визначають після 2,5 діб вирощування трансформантів в мінімальному середовищі Беркгольдера без додавання заліза. Результати представлено в табл. 4. Таблиця 4 Активність РФ-кінази та вміст флавінів в культуральній рідині рекомбінантних штамів С. famata АТСС 20849, що містять FMN1 D. hansenii під контролем TEF1 промотора Штам АТСС 20849 2 6 7 11 13 16 Активність РФ-кінази, мкмоль´10-5 /хв´мг білка 43,9 241,4 238,9 234,0 287,7 390,0 299,9 Флавіни культуральної рідини, мг/л Сумарна кількість ФМН % ФМН флавінів 2,67 28,47 10 5,33 13,33 44 17,8 30,24 59 8,0 16,9 48 5,3 8,9 60 24,9 36,50 69 8,9 22,2 40 Отримані рекомбінантні штами мають в 5-9 разів вищу активність РФ-кінази у порівнянні з реципієнтним штамом С. famata АТСС 20849 та приблизно у 20 разів вищу, ніж у штама L20105. В культуральній рідині отриманих рекомбінантних штамів вміст ФМН вищий, ніж у реципієнтного штама С. famata АТСС 20849. Відсотковий вміст ФМН від загального вмісту флавінів становить 40-70%, в той час як у реципієнтного штаму С. famata АТСС 20849 - лише 10%. Джерела інформації: 1. Березовский В.М. Химия витаминов. -М.: Пищевая промышленность, 1973. - 632с. 2. Stahmann K.P. et al. Microbiol. and Biotechnol. - 2000. - Vol.53, N5 - P. 509-516. 3. Сибірний А.А. і співавт. Мікробний синтез флавінів, Київ: Наукова думка, 2006. - 192с. 4. Патент США №5.514574, опубл. 7 травня 1996. 5. Manstein D.J. and Pai E.F.J. Biol. Chem. - 1986. - Vol. 261, №34. - P. 16169-16173. 6. Sambrook J., Fritsh E. F., Maniatis T. Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory, Cold Spring Harbor, New York. 1989. 7. Voronovsky A.A. et al. //FEMS Yeast Research. - 2002. - Vol. 2. - P. 381-388. 8. Wach A., Pick H., Philipsen P. In: Molecular Genetics of Yeast. A Practical Approach (Johnston, J.R., Ed.), IRL Press, Oxford. - 1994. - P. 1-16.
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of flavin mononucleotide (5'-fmn)
Автори англійськоюVoronovskyi Andrii Yaroslavovych, Dmytruk Kostiantyn Vasyliovych, Ischuk Olena Petrivna, Sybirnyi Andrii Andriiovych, Fedorovych Dariia Vasylivna, Yatsyshyn Valentyna Yuriivna
Назва патенту російськоюСпособ получения флавинмононуклеотида (5'-фмн)
Автори російськоюВороновский Андрей Ярославович, Дмитрук Константин Васильевич, Ищук Елена Петровна, Сибирный Андрей Андреевич, Федорович Дария Васильевна, Яцишин Валентина Юрьевна
МПК / Мітки
МПК: C12P 25/00
Мітки: спосіб, одержання, флавінмононуклеотиду, 5'-фмн
Код посилання
<a href="https://ua.patents.su/4-22568-sposib-oderzhannya-flavinmononukleotidu-5-fmn.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання флавінмононуклеотиду (5′-фмн)</a>
Попередній патент: Спосіб лікування хворих на вторинну неоваскулярну глаукому
Наступний патент: Спосіб діагностики папілярних карцином щитовидної залози
Випадковий патент: Спосіб лікування гострого некротичного панкреатиту