Спосіб одержання етилових естерів 1,5,6,7-тетрагідро-3-іміно-7-r-5-оксо-3н-тіазоло[3,4-c]піримідин-8-карбонової кислоти
Номер патенту: 37066
Опубліковано: 10.11.2008
Автори: Дорохов Віктор Іванович, Кос Павло Олегович, Вовк Михайло Володимирович
Формула / Реферат
Спосіб одержання етилових естерів 1,5,6,7-тетрагідро-3-іміно-7-R-5-оксо-3H-тіазоло[3,4-с]піримідин-8-карбонової кислоти загальної формули:
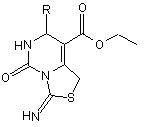 ,
,
де R = Me, Ph, 4-СlС6Н4, 4-МеОС6Н4, 4-MeSC6H4, 4-HOOCC6H4,
який відрізняється тим, що 4-R-5-етоксикарбоніл-6-галогенометил-3,4-дигідропіримідин-2(1H)-они піддають взаємодії з роданідом калію в середовищі диметилформаміду при 65-75 °С впродовж 4-5 год. з наступним виділенням цільових продуктів звичайними методами.
Текст
Спосіб одержання етилових естерів 1,5,6,7тетрагідро-3-іміно-7-R-5-оксо-3H-тіазоло[3,4с]піримідин-8-карбонової кислоти загальної формули: 2 3 37066 льоване з тіазольним є системами з вираженою біоактивністю. Зокрема, в ряду тіазоло[4,5d]піримідинів виявлені потенційні імунотерапевтичні агенти [1] та антагоністи CXCR2 хемокіназ [2], що стало підґрунтям для створення нової стратегії терапевтичного втручання в запальні захворювання. Випробовування похідних тіазоло[3,2а]піримідину як інгібіторів аденозин-циклічної 3'5'монофосфатази фосфодіестерази [3,4] показало їх високу гіпотензивну дію. Похідні тіазоліно[3,2с]піримідин-5,7-діону [5] виявились активними субстратами для інгібування гонатропін-звільнюючого гормона з гіпоталамусу, що, в свою чергу може знижувати больові відчуття в деяких видах захворювань. Для синтезу 6-арил-1,3,6,8тетрагідротіазоло[3,4-с]піримідин-5,7-діонів [6] використовують вн утрішньомолекулярну циклоконденсацію метилових естерів відповідних 2заміщених (5,5-диметил-3-арилкарбамоїлтіазолідин-4-іл)оцтових кислот. Одначе, внаслідок відносної важкодоступності останніх [7] метод не набув широкого синтетичного розвитку. Окрім цього, він не може бути застосованим для отримання поліфункціональних похідних тіазоло[3,4с]піримідину, зокрема, з полярними алкоксикарбо R HN O O N H нільною та аміногрупами в різних ядрах конденсованої гетероциклічної системи. Задачею корисної моделі є спосіб одержання нових похідних 1,5,6,7-тетрагідро-3-іміно-7-К-5оксо-3H-тіазоло[3,4-с]піримідин-8-карбонової кислоти загальної формули : O R HN S HN де R=Me, Ph, 4-СlС6Н4, 4-МеОС6Н4, 4MeSC6H4, 4-НООСС 6Н4 Спосіб отримання сполук, які заявляються, полягає в тому, що 4-R-5-етоксикарбоніл-6галогенометил-3,4-дигідропіримідин-2(1H/)-они піддають взаємодії з роданідом калію в середовищі диметилформаміду при 65-75°С впродовж 4-5 год. Очікувані продукти виділяють з реакційної суміші стандартними методами. Виходи становлять 56-74%. Hlg HN KSCN -KHlg O O N O R O 4 O R O HN O SCN N H O N O S HN де Hlg=Br, СІ; R=Me, Ph, 4-СlС 6Н4, 4-МеОС6Н4, 4-MeSC 6H4, 4-HOOCC 6H4 Запропонований синтетичний варіант відкриває шлях до сполук, які можуть знайти практичне застосування як фармацевтичні препарати, а також, завдяки наявності в структурі конденсованої системи схильних до легкої хімічної модифікації екзоциклічних етоксикарбонільної та іміногруп, як важливі скафолди для створення комбінаторних бібліотек потенційних проліків. Отриманий результат a priori важко було передбачити, оскільки, виходячи з амбідентного характеру тіоціанат-аніона, досить ймовірним був перебіг реакції з первинним утворенням сполук ізотіоціанатної структури, які б в подальшому циклізувались до регіоізомерних похідних 3-тіоімідазо[3,4-с]піримідин-8-карбонової кислоти, тим більше, що ізотіоціанатна група як електрофільніша за тіоціанатну , легше б піддавалась подальшій циклізації. O R HN O O N N H S Насправді ж реальний перебіг процесу циклоконденсації відзначається утворенням на першій стадії проміжного 6-тіоціанатометилпіримідин-2ону, який в розчині диметилформаміду при 6575°С схильний до формування тіазолінового циклу за рахунок взаємодії з NH-фрагментом піримідинового циклу. Переконливим доказом структури отриманих сполук є відсутність в їх спектрах ЯМР13С сигналів C=S групи (очікуваний діапазон 190-210 м.ч.) і наявність сигналів C=NH групи в діапазоні 140 м.ч. Індивідуальність та склад синтезованих естерів тіазоло[3,4-с]піримі-дин-8-карбонової кислоти доказані результатами хромато-мас-спектрометрії і елементного аналізу, а будо ва -ІЧ, Я МР1Н та 13С спектрами. Корисна модель ілюструється загальним методом отримання естерів тіазоло[3,4-с]піримідин 5 37066 8-карбонової кислоти і фізико-хімічними характери-тиками всіх синтезованих сполук. 13 Загальний спосіб одержання естерів 1,5,6,7тетрагідро-3-іміно-7-R-5-оксо-3H-тіазоло[3,4с]піримідин-8-карбонової кислоти До розчину 3.0 ммоль 4-R-5-етоксикарбоніл-6бромо(хлоро)метил-3,4-дигідропіримідин-2(1H)-ону в 25 мл диметилформаміду додавали 0.88 г (6.0 ммоль) роданіду калію і перемішували при 65-75°С впродовж 4-5 год. Реакційну суміш о холоджували, виливали в 100 мл крижаної води, утворений осад відфільтровували, сушили на повітрі і кристалізували із водного етанолу. Приклад 1 Етиловий естер 1,5,6,7-тетрагідро-3-іміно-7метил-5-оксо-3Н-тіазоло[3,4-с]піримідин-8карбонової кислоти. Вихід 56%, т.топл. 145-146°С. ІЧ спектр, см -1: 1645 (ON), 1695, 1730 (ON), 3275 (NH). Спектр ЯМР1Н, d , м.ч.: 1.18д (3Н, СН3), 1.26 т (3Н, СН3), 4.08-4.28м (5Н, СН2+2Н1+1H7), 7.30с (1Н, NH), 9.25с (1Н, =NH). Спектр ЯМР 13С, d , м.ч.: 13.95 (СН3), 23.01 (СН3), 31.08 (С1), 46.33 (С7), 59.71 (СН2), 103.16 (С8), 111.48 (С8а), 144.89 (С3), 152.12 (С5), 164.38 [C(O)OEt]. Знайдено, %: С46.89; Н5.27; N16.29. C10H13N3O 3S. Вирахувано, %: С47.05; Н5.13; N16.46. Приклад 2 Етиловий естер 1,5,6,7-тетрагідро-3-іміно-7феніл-5-оксо-3Н-тіазоло[3,4-с]піримідин-8карбонової кислоти. Вихід 69%, т.топл. 184-166°С. ІЧ спектр, см -1: 1660 (C=N), 1690, 1720 (C=O), 3260, 3330 (NH). Спектр ЯМР1Н, d , м.ч.: 1.16т (3Н, СН3), 4.03кв (2Н, СН2), 4.64дд (2Н1), 5.22с (1Н7), 7.17-7.34м (5Наром.), 8.66с (Ш, NH), 9.53 (1Н, NH). Спектр ЯМР13С, d , м.ч.: 13.72 (СН3), 28.48 (С1), 54.11 (С7), 60.09 (СН2), 102.88 (С8), 126.56 (С2'+С6'), 127.69 (С4), 128.35 (С3’+С5’), 142.57(С1’), 146.12 (С8а), 150.40 (С3), 158.73 (С5), 164.38 [C(O)OEt]. Знайдено, %: С58.96; Н5.85; N11.93. [М]+ 317.3. C15H15N3O3S. Вирахувано, % : С58.77, Н6.09, N12.09 . Приклад 3 Етиловий естер 1,5,6,7-тетрагідро-3-іміно-7-(4хлорофеніл)-5-оксо-3Н-тіазоло[3,4-с]піримідин-8карбонової кислоти. Вихід 76%, т.топл. 197-198°С. ІЧ спектр, см -1: 1655 (C=N), 1700, 1730 (С=О), 3270 (NH). Спектр ЯМР1Н, d , м.ч.: 1.12 т (3Н, СН3), 4.02 кв (2Н, СН2), 4.43 дд (2Н1), 5.22 д (1Н, Н7), 7.34 дд (4Н, Наром.). 8.69 д (1Н, NH), 9.54 с (1Н, =NH). Спектр ЯМР 13С, d , м.ч.: 13.31 (СН3), 28.53 (С1), 53.26 (С7), 60.15 (СН2), 102.32 (С8), 128.37 (С2’ +С6'), 128.54 (С3'+С5'), 132.59 (С1’), 141.40 (С8а), 146.50 (С3), 158.54 (С5), 163.51 [C(O)OEt]. Знайдено, %: С53.71; Н5.14; N10.87. [М]+ 351.8. C15H14CIN3O3S. Вирахувано, % : С 53.47; Н 5.28; N 11.00. Приклад 4 Етиловий естер 1,5,6,7-тетрагідро-3-іміно-7-(4метоксифеніл)-5-оксо-3Н-тіазоло[3,4-с]піримідин-8карбонової кислоти. 6 Вихід 76 %, т.топл. 173-174°С. ІЧ спектр, см -1: 1645 (C=N), 1700, 1725 (С=О), 3280 (NH). Спектр ЯМР *Н, 5, м.ч.: 1.13т (ЗН, СН3), 3.74с (3Н, СН3О), 4.02кв (2Н, СН2), 4.44дд (2Н1), 5.17д (1Н, Н7), 6.85д (2Наром.), 7.18д (2Наром.). 8.61д (1Н, NH), 9.54с (1Н, =NH). Спектр ЯМР 13С, 6 , м.ч.: 13.62 (СН3), 28.43 (С1), 53.42 (СН3О), 54.84 (С7), 60.05 (СН2), 103.22 (С8), 113.71 (С3'+С5'), 127.74 (С2'+С6>), 134.65 (Сг), 145.72 (С8а), 150.39 (С3), 158.84 (С4'), 158.87 (С5), 163.71 [C(O)OEt]. Знайдено, %: С57.52; Н6.03; N11.29. [М]+ 347.40. C16H17N3O 4S. Вирахувано, % : С57.28; Н6.14; N11.13. Приклад 5 Етиловий естер 1,5,6,7-тетрагідро-3-іміно-7-(4метилтіофеніл)-5-оксо-ЗН-тіазоло[3,4-с]піримідин8-карбонової кислоти. Вихід 76%, т.топл. 146-147°С. ІЧ спектр, см -1: 1645 (C=N), 1700, 1720 (С=О), 3275 (NH). Спектр ЯМР 1Н, d , м.ч.: 1.15т (3Н, СН3), 2.49с (3Н, CH3S), 4.03кв (2Н, СН2), 4.29дд (2Н1), 5.16д (1Н, Н7), 7.19м (4Наром.). 7.11д (1Н, NH), 9.44с (1Н, =NH). Спектр ЯМР 13С, 5, м.ч.: 13.75 (СН3), 14.86 (CH3S), 31.39 (С1), 53.48 (С7), 59.77 (СН2), 101.22 (С8), 111.55 (С4'), 125.90 (С2'+С6'), 126.84 (С3+С5'), 137.72 (С8а), 140.53 (С3), 145.64 (С4'), 151.48 (С5), 164.28 [C(O)OEt]. Знайдено, %: С53.09 ; Н4.85; N11.35. [М]+ 363.4. C16H17N3O3 S2. Вирахувано, % : С52.87; Н4.71; N11.56. Приклад 6 4-[8-(Етоксикарбоніл)-3-іміно-5-оксо-1,5,6тетрагідро [1,3]-тіазоло-[3,4-с]піримідин-7іл]бензойна кислота. Вихід 63%, т.топл. > 250 °С. 14 спектр, см -1: 1650 (C=N), 1695, 1715 (С=О), 3270 (NH) . Спектр ЯМР 1Н, 5, м.ч.: 1.14т (3Н, СН3), 4.04кв (2Н, СН2), 4.38дд (2Н1), 5.28д (1Н, Н7), 7.38д (2Наром.), 7.90д (2Наром.). 7.91д (1Н, NH), 9.53с (1Н, =NH), 12.69ш с (Ш, СООН). Спектр ЯМР 1ЗС, d , м.ч.: 13.77 (СН3), 31.41 (С1), 53.92 (С7), 59.89 (СН2), 100.98 (С8), 111.52 (С4’), 126.41 (С2’+С4’), 129.51 (С3’+С5’), 130.12 (С1’), 146.22 (С8а), 148.34 (С3), 151.46 (С5), 164.24 [С(О)ОН], 166.78 [C(O)OEt]. Знайдено, %: С51.37; Н4.24; N11.50. [М]+ 361.4. C16H15N3O5S. Вирахувано, % : С51.18; Н4.18; N11.63. Література 1. Nagahara К., Anderson J.D., Kini G.D., Dalley N.K., Larson S.B., Smee D.F., Jin A., Sharma B.C., Jolley W.D., Robins R.K., Cottom H.B. Thiazolo[4,5d]pyri-midine nucleosides. The synthesis of certain 3 p-D-ribofuranosylthiazolo[4,5-d]-pyrimidines as potential immunotherapeutic agents // J. Med. Chem.1990.- Vol.33, №1.- P.407-415. 2. Walters I., Austin C, Austin R., Bonnert R., Cade P., Christie M., Ebden M., Gardiner S., Grahames C, Hill S., Hunt F., Jowell R., Lewis S., Martin J., Nichols D., Robinson D. Evaluation of series of bicyclic CXCR2 antahonists // Bioorg. Med.Chem. Lett.- 2008.- Vol.18, №2.- P.798-803. 3. Glennon R.A., Rogers M.E., Smith J.D., ElSaid M.K. Mesoionic xantine analogues : phosphodiesterase inhibitory and hypotensive activity.- J. Med. Chem.- 1981.- Vol. 24,№6.- P.658-661. 7 37066 4. Rogers M.E., Glennon R.A., Smith J.D., Boots M.R., Navarati N., Maconaugrey J.E., Aub D., Thomas S., Boss R.G., Mbagwu G. Mesoionic purinone analogues as inhibitors of cyclic-AMP phosphodiesteraze: a comparison of several ring systems. J.Med. Chem.- 1990.- Vol.33,№l.-P.407-415. 5. Pontilo J., Chen C. Efficient synthesis of bicyclic oxazolino- and thiazilino-[3,2-c]pyrimidine-5,7 Комп’ютерна в ерстка А. Рябко 8 diones and its application to the synthesis of GnRH antagonists // Biorg. Med. Chem. Lett - 2005.Vol.15.- P. 1407-1411. 6. Hatam M., Kopper S., Martens J. Synthesis of homohydantoin-thiazilidine bicyclic compounds // Heterocycles.- 1996.- Vol.43, № 8.- P.1653-1663. Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of ethyl 1,5,6,7-tetrahydro-3-imino-7-r-5-oxo-3h-tiazolo[3,4-c]pyrimidine-8- catboxylates
Автори англійськоюVovk Mykhailo Volodymyrovych, Dorokhov Viktor Ivanovych, Kos Pavlo Olehovych
Назва патенту російськоюСпособ получения этиловых эстеров 1,5,6,7-тетрагидро-3-имино-7-r-5-оксо-3н-тиазоло[3,4-c]пиримидин-8-карбоновой кислоты
Автори російськоюВовк Михаил Владимирович, Дорохов Виктор Иванович, Кос Павел Олегович
МПК / Мітки
МПК: C07D 513/00
Мітки: спосіб, етилових, естерів, кислоти, 1,5,6,7-тетрагідро-3-іміно-7-r-5-оксо-3н-тіазоло[3,4-c]піримідин-8-карбонової, одержання
Код посилання
<a href="https://ua.patents.su/4-37066-sposib-oderzhannya-etilovikh-esteriv-1567-tetragidro-3-imino-7-r-5-okso-3n-tiazolo34-cpirimidin-8-karbonovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання етилових естерів 1,5,6,7-тетрагідро-3-іміно-7-r-5-оксо-3н-тіазоло[3,4-c]піримідин-8-карбонової кислоти</a>
Попередній патент: Механічний розпилювач
Наступний патент: Спосіб контролю механічних напружень в оптичних матеріалах
Випадковий патент: Кристалічна структура комбінованого лікарського препарату антиагрегативної дії у формі таблеток








