1,7-дизаміщені 5,6-дигідропіразоло[3,4-е][1,4]діазепін-4(5н)-они та спосіб їх одержання
Номер патенту: 85013
Опубліковано: 10.12.2008
Автори: Ліщинський Антон Анатолійович, Вовк Михайло Володимирович, Больбут Андрій Вікторович
Формула / Реферат
1. 1,7-Дизаміщені 5,6-дигідропіразоло[3,4-е][1,4]діазепін-4(5Н)-они загальної формули:
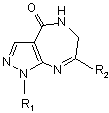 ,
,
дe R1 = Me, Рh, 4-FC6H4;
R2 = Ph, 4-FC6H4, 4-СlС6Н4, 3-СlС6Н4, 4-МеОС6Н4.
2. Спосіб одержання 1,7-дизаміщених 5,6-дигідропіразоло-[3,4-е][1,4]-діазепін-4(5Н)-онів за п. 1, який відрізняється тим, що 5-ароїлметил-піразоло[3,4-d]піримідини піддають взаємодії з киплячим водним або водно-диметилсульфоксидним розчином гідроксиду натрію з наступним виділенням цільових продуктів звичайними методами.
Текст
1. 1,7-Дизаміщені 5,6-дигідропіразоло[3,4е][1,4]діазепін-4(5Н)-они загальної формули: Винахід відноситься до органічної хімії, а саме до нових похідних 5,6-дигідропіразоло[3,4е][1,4]діазепін-4(5Н)-онів загальної формули: них препаратів на основі раніше не описаних похідних піразолодіазепінових систем. Вказані сполуки, їх властивості і застосування в науковій літературі та патентних виданнях не описані. Найближчими структурними аналогами сполук, які заявляються є регіоізомерні до них 5-арил3-метил-6,7-дигідропіразоло[4,3-е][1,4]-діазепін8(7Н)-они загальної формули : N N R2 N N R2 Ar R1 1 дe R =Me,Ph,4-FC 6H4 ; R2 = Ph, 4-FC6H4, 3-ClC6H4, 4-СlС6Н4, 4МеОС6Н4 та до способу їх одержання. Такого типу сполуки можуть знайти застосування як фармакологічно активні речовини, а також як вихідні для отримання нових фармацевтич Me N N NH N H O (13) 85013 (11) , дe R1 = Me, Рh, 4-FC 6H4; R2 = Ph, 4-FC 6H4 , 4-СlС6Н4, 3-СlС6Н4, 4-МеОС6Н4. 2. Спосіб одержання 1,7-дизаміщених 5,6дигідропіразоло-[3,4-е][1,4]-діазепін-4(5Н)-онів за п. 1, який відрізняється тим, що 5-ароїлметилпіразоло[3,4-d]піримідини піддають взаємодії з киплячим водним або воднодиметилсульфоксидним розчином гідроксиду натрію з наступним виділенням цільових продуктів звичайними методами. C2 R1 UA N H N N H N (19) O O 3 85013 де Ar= Ph, 4-СlС6Н4, 4-ВrС6Н4, 4-МеОС6Н4, 4C6H4C6H4, 4-NO2C6H 4 Наведені структури є модифікованими похідними бензодіазепінів [1] -сполук із широким спектром анксиолітичної, седативно-гіпнотичної, антиконвульсивної і м'язорозслаблюючої дії. Вони виявляють спорідненість до бенздіазепінового рецептора [2], практично близьку до найбільш важливого представника конденсованих піразолодіазепінів препарату ріпазепаму [3] -1етил-3-метил-8-феніл-4,6-дигідропіразоло[4,3е][1,4]-діазепін-5(4Н)-ону. В літературі [2] описано два підходи до синтезу 5-арил-3-метил-6,7дигідропіразоло[4,3-е][1,4]діазепін-8(7Н)-онів. В основі першого лежить тристадійне перетворення важкодоступної 3-метил-4-нітропіразол-5карбонової кислоти [4] під дією хлористого тіонілу в відповідний дикетопіперазин, наступна його взаємодія з амінокетонами, що приводить часто з невисокими виходами до Н-(ароїлметил)амідів 4нітро-5-піразолкарбонової кислоти , подальше відновлення-циклізація яких при дії порошкоподібного заліза дає цільові продукти. Другий підхід також є багатостадійним і передбачає використання не менш доступної 4-аміно-З-метилпіразол-5карбонової кислоти [5] , аміногрупа якої перед подальшими перетвореннями обов'язково захищається ди-трет-бутилкарбонатом. Наступна конденсація захищеної кислоти з амінокетонами відбувається в присутності N-гідроксисукциніміду та дициклогексилкарбодііміду. Утворені 4амінозахищені М-(ароїлметил)аміди піразол-5карбонової кислоти при дії трифтороцтової кислоти перетворюються в цільові продукти. Застосування важко доступних і відносно дорогих реагентів (3-метил-4-нітропіразол-5карбонова кислота, 4-аміно-3-метилпіразол-5карбонова кислота, амінометиларилкетони, Nгідроксисукцинімід, дициклогексил-карбодіімід) та препаративні труднощі , пов'язані з виділенням як проміжних, так і цільових продуктів значно пониO N R1 N жують ефективність таких методів. Варто також зазначити, що дикетопіперазинна методологія має обмежене використання і може бути придатною тільки для синтезу піразолодіазепінів, які в положенні 1 піразольного циклу не містять замісників. При їх наявності відповідні піразол-5-карбонові кислоти не можуть димеризуватись в дикетопіперазини. Задачею винаходу є пошук нових похідних 5,6дигідропіразоло[3,4-е][1,4]діазепін-4(5Н)-ону та спосіб їх одержання, що відкриває шлях до сполук, які можуть знайти застосування як біологічно активні препарати [6,7], а також як вихідні речовини в синтезі фармакологічно перспективних сполук. Задача досягається 1,7-дизаміщеними 5,6дигідропіразоло[3,4-е][1,4]-діазепін-4(5Н)-онами загальної формули: O H N N N N R2 R1 де R1 = Me, Ph, 4-FC 6H4 R2 = Ph, 4-FC6H4, 3-ClC6H4, 4-ClC 6H4, 4MeOC6H4 які легко отримуються при рециклізації піримідинового ядра 5-ароїлметилпіразоло[3,4d]тримідинів під дією лугу. Спосіб отримання сполук, які заявляються, полягає в тому, що 5-ароїлметилпіразоло[3,4d]піримідини піддають дії водного або воднодиметилсульфоксидного розчину гідроксиду натрію при 100°С . Цільові продукти, які утворюються у вигляді осаду, виділяють із реакційної суміші стандартними методами за допомогою операцій фільтрування та кристалізації. Виходи сягають 7295%. O O R2 N N 4 O NaO H, H2O 0 100 C NH R2 N H N N R1 де R1 = Me, CH 2Ph, Ph, 4-FC 6H4; R2 = Ph, 4-FC6H4, 3-ClC6H4, 4-ClC 6H4, 4MeOC6H4 Отриманий результат є принципово новим та оригінальним, оскільки як в науковій, так і патентній літературі відсутні дані про можливість рециклізації піридинового циклу в 5-заміщених піразоло[3,4-d]піримідинах при дії лугу в 1,4-діазепіновий цикл. З врахуванням літературних даних [2] стосовно формування діазепінового циклу, достовірно допустити, що первинними продуктами гідролітичного розщеплення 5-ароїлметилпіразоло[3,4d]тримідинів є N-ароїлметиламіди 5-амінопіразол N H2 N O N N R R1 4-карбонових кислот, які в реакційних умовах піддаються внутрішньомолекулярній циклоконденсації за рахунок взаємодії кето- та аміногруп. Перевагою запропонованого методу є також те, що ви хідні 5-ароїлметилпіразоло[3,4d]піримідини з високими виходами отримуються в дві стадії з 5-аміно-4-ціанопіразолів [8] : 1) кип'я тіння в мурашиній кислоті при 101°С [9]; 2) алкілування утворених піразоло[3,4-d]піримідин-4-онів в суміші ацетонітрил-диметилформамід (1:1) в присутності безводного карбонату калію при 110°С. Таким чином, розроблений спосіб одержання 1,7-дизаміщених 5,6-дигідропіразоло[3,4 5 85013 e][1,4]діазепін-4(5Н)-онів є реалізацією нової синтетичної методології, що ґрунтується на однореакторному процесі гідролітичного розщеплення 5ароїлметилпіразоло[3,4-d]піримідинів та подальшої конденсації. Будова та склад як проміжних 5ароїлметилпіразоло[3,4-d]піримідинів, так і цільових 5,6-дигідропіразоло[3,4-е][1,4]діазепін-4(5Н)онів доведені даними елементного аналізу, ІЧспектрів, спектрів ЯМР1Н та хромато-масспектрів. Винахід ілюструється загальними способами одержання 5-ароїлметил-піразоло[3,4d]піримідинів, 1,7-дизаміщених 5,6дигідропіразоло[3,4-е]-[1,4]-діазепін-4(5Н)-онів і фізико-хімічними характеристиками всіх синтезованих сполук. Загальний спосіб одержання 1,5-заміщених 1,5-дигідро-1H-піразоло[3,4-d]піримідин-4-онів. До суміші 20 ммоль піразоло[3,4-d]піримідин-4ону та 20 ммоль розтертого поташу в 50 мл ацетонітрилу додають 20 ммоль відповідного агалогенкетону і кип'ятять із зворотним холодильником протягом 7 год. Реакційну суміш охолоджують, виливають у воду; осад, що утворився, відфільтровують та промивають 10 мл води. Приклад 1 1-Метил-5-(2-оксо-2-фенілетил)-1,5-дигідро4Н-піразоло[3,4-d]піримідин-4-он. Вихід 88%, т.пл. 214-216°С. Знайдено, %: С 62,53; Н 4,34; N 20,96. C14H12N4 O2. Вирахувано, %: С 62,68; Н 4,51; N 20,88. Спектр ЯМР1Н (ДМСО-d6): 3,96 с (ЗН, СН3), 5,63 с (2Н, СН2), 7,62 т (2Н, 3J=7,1 Гц, аром.), 7,75 т (1Н, 3J=7,1 Гц, аром.), 8,07-8,12 м (3Н, аром.), 8,38 с (1Н, аром.). Приклад 2 5-[2-(4-Хлорофеніл)-2-оксоетил]-1-метил-1,5дигідро-4Н-піразоло[3,4-d]піримідин-4-он. Вихід 85%, т.пл. 229-231°С. Знайдено, %: С 55,45; Н 3,75; СІ 11,60; N 18,33. С14Н11СlN4O2. Вирахувано, %: С 55,55; Н 3,66; Сl 11,71; N 18,51. Спектр ЯМР1Н (ДМСО-d 6): 3,96 с (3Н, СН3), 5,63 с (2Н, СН2), 7,69 д (2Н, 3J=8,6 Гц, аром.), 8,09-8,14 м (3Н, аром.), 8,37 с (1Н, аром.). Приклад 3 5-[2-(4-Метоксифеніл)-2-оксоетил]-1-метил1,5-дигідро-4Н-піразоло[3,4-d]піримідин-4-он. Вихід 92%, т.пл. 199-201°С. Знайдено, %: С 60,50; Н 4,82; N 18,55. C15H14N4O 3. Вирахувано, %: С 60,40; Н 4,73; N 18,78. Спектр ЯМР 1Н (ДМСО-d6): 3,89 с (3Н, ОСН3), 3,95 с (3Н, NCH3), 5,57 с (2Н, СН2), 7,13 д (2Н, 3J=8,8 Гц, аром.), 8,04-8,12 м (3Н, аром.), 8,36 с (1Н, аром.). Приклад 4 5-(2-Оксо-2-фенілетил)-1-феніл-1,5-дигідро4Н-піразоло[3,4-d]піримідин-4-он. Отримують за загальною методикою з тією різницею, що до реакційної суміші додають 30 мл ДМФА. Вихід 95%, т. пл. 198-200°С. Знайдено, %: С 68,95; Н 4,18; N 16,88. C19H14N4O2 . Вирахувано, %: С 69,08; Н 4,27; N 16,96. Спектр ЯМР 1Н (ДМСО-d 6): 5,71 с (2Н, СН2), 7,44 т (1Н, 3J=6,8 Гц, аром.), 7,56-7,69 м (4Н, аром.), 7,76 т (1Н, 3J=6,5 Гц, аром.), 8,03-8,21 м (4Н, аром.), 8,42 с (1Н, аром.), 8,50 с (1Н, аром.). 6 Приклад 5 5-[2-(4-Флуорофеніл)-2-оксоетил]-1-феніл-1,5дигідро-4Н-піразоло[3,4-d]піримідин-4-он. Отримують за загальною методикою з тією різницею, що до реакційної суміші додають 30 мл ДМФА. Ви хід 87%, т.пл. 189-191°С. Знайдено, %: С 65,50; Н 3,75; F 5,63; N 15,95. C19H13FN4 O2 . Вирахувано, %: С 65,51; Н 3,76; F 5,45; N 16,08. Спектр ЯМР 1Н (ДМСО-d6): 5,69 с (2Н, СН2), 7,40-7,51 м (ЗН, аром.), 7,60 т (2Н, 3J=7,9 Гц, аром.), 8,07 д (2Н, 3 J=7,6 Гц, аром.), 8,18-8,26 м (2Н, аром.), 8,42 с (1Н, аром.), 8,48 с (1Н, аром.). Приклад 6 5-[2-(3-Хлорофеніл)-2-оксоетил]-1-(4-флуорофеніл)-1,5-дигідро-4Н-піразоло[3,4-d]піримідин-4он. Отримують за загальною методикою з тією різницею, що до реакційної суміші додають 30 мл ДМФА. Ви хід 86%, т.пл. 239-241°С. Знайдено, %: С 59,50; Н 3,33; СІ 9,25; F 5,05; N 14,72. C19H12C1FN4O2. Вирахувано, %: С 59,62; Н 3,16; СІ 9,26; F 4,96; N 14,64. Спектр ЯМР 1Н (ДМСО-d6): 5,71 с (2Н, СН2), 7,45 т (2Н, 3J=8,1 Гц аром.), 7,67 т (1Н, 3J=7,2 Гц, аром.), 7,83 д (1Н, 3J=6,8 Гц, аром.), 8,03-8,12 м (3Н, аром.), 8,13 с (1Н, аром.), 8,41 с (1Н, аром.), 8,46 с (1Н, аром.). Загальний спосіб одержання 1,7-заміщених5,6-дигідропіразоло[3,4-е][1,4]діазепін-4(1H)-онів. До 150 мл 0.1 М водного розчину гідроксиду натрію додають 0.015 моль 1,5-заміщеного 1,5дигідро-4H-піразоло[3,4-d]піримідин-4-ону та кип'я тять впродовж 5 год. При охолодженні із реакційної суміші випадає осад, який відфільтровують та кристалізують із ацетонітрилу. Приклад 7 1-Метил-7-феніл-5,6-дигідропіразоло[3,4-е][1, 4]діазепін-4(1Н)-он. Вихід 92%, т.пл. 241-243°С. Знайдено, %: С 64,83; Н 5,22; N 23,15. C13H12N4O. Вирахувано, %: С 64,99; Н 5,03; N 23,32. Спектр ЯМР 1Н (ДМСО-d6): 3,91 с (3Н, СН3), 4,14 д (2Н, 3 J=5,2 Гц, СН2), 7,53-7,66 м (3Н, аром.), 7,80 т (1Н, 3 J=5,2 Гц, NH), 7,88 с (1H, 3-СН), 8,14 д (2Н, аром.). Приклад 8 7-(4-Хлорофеніл)-1-метил-5,6дигідропіразоло[3,4-е][1,4]діазепін-4(1H)-он. Вихід 93%, т.пл. 210-212°С. Знайдено, %: С 56,98; Н 4,02; С1 12,71; N 20,64. C13H11ClN4O. Вирахувано, %: С 56,84; Н 4,04; С1 12,91; N 20,40. Спектр ЯМР 1 Н (ДМСО-d6): 3,90 с (3Н, СН3), 4,12 д (2Н, 3J=5,0 Гц, СН2), 7,60 д (2Н, 3J=8,6 Гц, аром.), 7,77 т (1Н, 3 J=5,0 Гц, NH), 7,88 с (1Н, 3-СН), 8,15 д (2Н, 3J=8,6 Гц, аром.). Приклад 9 7-(4-Метоксифеніл)-1-метил-5,6дигідропіразоло[3,4-е][1,4]діазепін-4(1H)-он. Вихід 95%, т.пл. 244-246°С. Знайдено, %: С 62,07; Н 5,31; N 20,78. C14H14N4O 2. Вирахувано, %: С 62,21; Н 5,22; N 20,73. Спектр ЯМР 1Н (ДМСО-d6): 3,87 д (6Н, ОМе, СН3), 4,10 д (2Н, 3J=5,1 Гц, СН2), 7,12 д (2Н, 3J=8,9Гц, аром.), 7,71 τ (1Н, 3J=5,1 Гц, NH), 7,83 с (1H, 3-CH), 8,12 д (2Н, 3J=8,9Гц, аром.) Приклад 10. 1,7-Дифеніл-5,6-дигідропіразоло[3,4е][1,4]діазепін-4(1Н)-он. 7 85013 Отримують за загальною методикою з тією різницею, що реакційну суміш кип'ятять 24год при перемішуванні. Вихід 74%, т.пл. 230-232°С. Знайдено, %: С 71,32; Η 4,47; Ν 18,74. C18H14N4O. Вирахувано, %: С 71,51; Η 4,67; Ν 18,53. Спектр ЯМР 1 Η (ДМСО-d 6): 4,27 д (2Н, 3J=5,1 Гц, СН2), 7,45т (1Η, 3J=7,3 Гц, аром.), 7,51-7,67 м (5Н, аром.), 7,75 д (2Н, 3J=7,8 Гц, аром.), 7,96-8,01 м (3Н, аром., NH) 8,15 с (1Н, 3-СН). Приклад 11. 7-(4-Флуорофеніл)-1-феніл-5,6дигідропіразоло[3,4-е][1,4]діазепін-4(1Н)-он. Отримують за загальною методикою з тією різницею, що реакційну суміш кип'ятять 24 год при перемішуванні. Вихід 72%, т.пл. 256-258°С. Знайдено, %: С 67,55; Η 4,12; F 5,73; Ν 17,25. C18H13FN4O. Вирахувано, %: С 67,49; Η 4,09; F 5,93; Ν 17,49. Спектр ЯМР 1Н (ДМСО-d6): 4,27 д (2Н, 3J=5,1 Гц, СН2), 7,36-7,50 м (3Н, аром.), 7,57 τ (2Н, 3J=7,6 Гц, аром.), 7,74 д (2Н, 3J=7,8 Гц, аром.), 7,97 т (1Н, 3 J=5,1 Гц, NH), 8,05-8,14 м (3Н, аром., 3-СН). Приклад 12. 7-(3-Хлорофеніл)-1-(4-флуорофеніл)-5,6дигідропіразоло[3,4-е][1,4]діазепін-4(1Н)-он. Отримують за загальною методикою з тією різницею, що реакцію проводять у суміші ДМСО - Н2О (1:3). Вихід 84%, т.пл. 264-266°С. Знайдено, %: С 61.09; Η 3.35; СІ 10,16; F 5,31; N 15,62. C18H12ClFN4O. Вирахувано, %: С 60.94; Η 3.41; СІ 9,99; F 5 ,36; Ν 15,79. Спектр ЯМР 1Н (ДМСО-d6): 4,26 с (2Н, СН2), 7,25-8,25 м (10Н, аром., ΝΗ). Література: 1. Богатский А.В., Андронати С.А., Головенко Н.Я. - Транквилизаторы : 1,4-бензодиазепины и Комп’ютерна в ерстка М. Ломалова 8 родственные структуры // Киев : Наукова думка, 1980.-279с. 2. Baraldi P.G., Manfredini S., Periotto V., Simoni D., Guarneri M., Borea P.A. Synthesis and Interaction of 5-(Substituted-phenyl)-3-methyl-6,7dihydropyrazolo[4,3-e] [ 1,4]diazepin-8(7H)-ones with Benzodiazepine Receptors in Rat Cerebral Cortex // J. Med. Chem.- 1985.- Vol. 28, №5.-P.683-685. 3. DeWald H.A., Nordin 1С, L'ltalien Y.J., Parcel R.F. Pyra zolodiazepines. 1,3- (and 2,3-) Dialkyl-4,6dihydro-8-arylpyrazolo[4,3-e][l,4]diazepin-5-ones as Antiaxiety Agents // J. Med. Chem.- 1973.- Vol.16, № 12.- P. 1346-1354. 4. Musante C. Some nitro halogenatet derivatives of ptrazole. // Gazz. Chim. ItaL- 1945.-Vol.75.-P. 109120. 5. Musante C, Mugnaini E. The Curtius degradation applied to some pyrazolecarboxylic acids. Gazz. Chim. Ital.-1947.- Vol.77.- P.182-198. 6. Honor T.A., Martin I.L. - Progress in Medicinal Chemistry, Ellis G.P., West G.B., Eds. // Elsevier : Amsterdam, 1983.- Vol. 20.- P.157-223. 7. Sternbach L.N. - The Benzodiazepines, Garattini S., Mussini E., Randall L.O., Eds. // New York : Raven Press , 1973.- P.l-26. 8. Cheng C.C., Robins R.K. Potential Purine Antagonists. VI. Synthesis of 1-Alkyl- and l-Aryl-4substituted Pyrazolo[3,4-d]pyrimidines // J. Org. Chem.- 1956.-Vol.21.-P. 1240-1242. 9. Peat A.J., Boucheron J.A., Dickerson S.H., Garrido D., Mills W., Peckha J.M., Preugschat F., Smalley., Scheiker S.L., Ja yme R., Wilson J.R.- Novel pyrazilopyrimidine derivatives as GSK-3 inhibitors // Bioorg. Med. Chem. Lett.- 2004.- Vol.14, № 9.P.2121-2126. Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською1,7-disubstituted 5,6-dihydropyrazolo[3,4-e][1,4]diazepine-4(5h)-ones and process for the preparation thereof
Автори англійськоюVovk Mykhailo Volodymyrovych, Bolbut Andrii Viktorovych, Lischynskyi Anton Anatoliiovych
Назва патенту російською1,7-дизамещенные 5,6-дигидропиразоло[3,4-е][1,4]диазепин-4(5н)-оны и способ их получения
Автори російськоюВовк Михаил Владимирович, Больбут Андрей Викторович, Лищинский Антон Анатольевич
МПК / Мітки
МПК: C07D 231/54, C07D 243/10, C07D 487/04
Мітки: спосіб, одержання, 1,7-дизаміщені, 5,6-дигідропіразоло[3,4-е][1,4]діазепін-4(5н)-они
Код посилання
<a href="https://ua.patents.su/4-85013-17-dizamishheni-56-digidropirazolo34-e14diazepin-45n-oni-ta-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">1,7-дизаміщені 5,6-дигідропіразоло[3,4-е][1,4]діазепін-4(5н)-они та спосіб їх одержання</a>
Попередній патент: Застосування гідрофобіну як емульгатора в буровому розчині та буровий розчин
Наступний патент: Захисна ребриста оболонка полімерного ізолятора
Випадковий патент: Спосіб покращення наповнюваності тютюну








