N-заміщені аміди 5-аміно-4-піразолкарбонових кислот та спосіб їх одержання
Номер патенту: 85426
Опубліковано: 26.01.2009
Автори: Вовк Михайло Володимирович, Ліщинський Антон Анатолійович, Больбут Андрій Вікторович
Формула / Реферат
1. N-Заміщені аміди 5-аміно-4-піразолкарбонових кислот загальної формули:
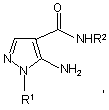
де R1 = Ph, R2 = Me, CH2Ph, CH2CH(OEt)2, CH2CH=CH2;
R1 = Me, R2 = CH2COOH, CH2CH2COOH.
2. Спосіб одержання N-заміщених амідів 5-аміно-4-піразолкарбонових кислот за п. 1, який відрізняється тим, що відповідні 5-заміщені піразоло[3,4-d]піримідини піддають нагріванню з гідроксидом натрію у спиртовому розчині при 78 °С з наступним виділенням цільових продуктів звичайними методами.
Текст
1. N-Заміщені аміди 5-аміно-4піразолкарбонових кислот загальної формули: 2 3 85426 Задача досягається 3-заміщеними амідами 5аміно-4-піразолкарбонових кислот, які легко отримуються при розкритті піримідинового ядра 5заміщених піразоло[3,4-d]піридин-4-онів під дією лугу, що відкриває шлях до сполук, які можуть знайти застосування як біологічно активні препарати [4,5], а також як вихідні речовини в синтезі фармакологічно перспективних сполук. Спосіб отримання сполук, які заявляються, полягає у тому, що 5-заміщені (серед них і такі, що містять естерні функціональні групи в алкільному ланцюгу) піразоло[3,4-d]піримідини піддають дії етанольного розчину гідроксиду натрію при 78°С (при цьому також і естерні групи гідролізуються до карбоксильних). Цільові продукти виділяють із реакційної суміші стандартними методами за допомогою випарювання реакційної суміші із наступною кристалізацією цільового продукту. Виходи сягають 63-86%. O O N N N R1 N R2 NHR 2 NaOH, EtOH, 78 0C -HCOONa N N R1 NH 2 , Де R1=Ph, R2=R3=CH3, CH2Ph, CH 2CH(OEt)2, CH2CH=CH2; R1 =Me, R2=CH2CO2Et, CH2CH2CO2Bu-н, R3=CH2COOH, CH 2CH2COOH Отриманий результат є принципово новим, оскільки як у науковій, так і патентній літературі відсутня інформація про можливість розкриття піримідинового циклу в піразоло[3,4-d]піримідинах при дії лугів. Заявлений спосіб є екологічно ефективним, оскільки продуктами перетворення окрім цільових сполук є мурашина кислота, яка утворюється після підкислення реакційної суміші і легко нейтралізуються. Слід також зазначити, що вихідні 5-заміщені піразоло[3,4-d]піримідин-4-они з високими виходами отримуються в два синтетичні прийоми з 5-аміно-4-ціанопіразолів [6]: 1) кип'ятіння в мурашиній кислоті при 101°С [7]; 2) алкілування утворених піразоло[3,4-d]піримідин-4-онів в органічному розчиннику, наприклад, ацетонітрилі при 80°С. Таким чином, запропонований метод синтезу N-заміщених амідів 5-аміно-4піразолкарбонових кислот є своєрідною модифікацією регіоселективного N-алкілування карбонільної групи в 4-N-незаміщених амідах 5амінопіразолкарбонових кислот за допомогою захисту 5-аміногрупи мурашиною кислотою. Після проведення операції алкілування по положенню 5 піримідинового циклу захисна функція мурашиної кислоти знімається дією лугу. Будова та склад всіх отриманих N-заміщених амідів 5-амінопіразол-4-карбонових кислот доведені даними елементного аналізу, ІЧ-спектрів (поглинання зв'язків С=О та N-H) та спектрів ЯМР 1Н (наявність сигналів арильних, алкільних та N-H протонів). Винахід ілюструється загальними способами отримання піразоло[3,4-d]піримідин-4-онів, 5заміщених піразоло[3,4-d]піримідин-4-онів, Nзаміщених амідів 5-амінопіразолкарбонових кис 4 лот і фізико-хімічними характеристиками всіх синтезованих сполук. Загальний спосіб одержання 1,5-заміщених 4,5-дигідро-1Н-піразоло[3,4-d]піримідин-4-онів. До суміші 20ммоль піразоло[3,4-d]піримідин-4ону та 20ммоль розтертого поташу в 50мл ацетонітрилу додають 20ммоль відповідного алкілгалогеніду і кип'ятять із зворотним холодильником протягом 7год. Реакційну суміш о холоджують, виливають у воду; осад, що утворився, відфільтровують та промивають 10мл води. Приклад 1 5-Метил-1-феніл-4,5-дигідро-1Н-піразоло[3,4d]піримідин-4-он. Вихід 97%, т. пл. 208-210°С. Знайдено, %: С 63,45; Н 4,33; N 24,58. C12H10N4O. Вирахувано, %: С 63,71; Н 4,46; N 24,76. ІЧ спектр (КВr): 1705 (С=О ). Спектр ЯМР 1Н (ДМСО-d6): 3,52с (3Н, СН3), 7,41т (1Н, аром.), 7,58т (2Н, аром.), 8,04д (2Н, аром.), 8,37 с (1Н, аром.), 8,50 с (1Н, аром.). Приклад 2 5-Бензил-1-феніл-4,5-дигідро-1Н-піразоло[3,4d]піримідин-4-он. Вихід 93%, т. пл. 171-173°С. Знайдено, %: С 71,36; Н 4,73; N 18,44. C18H14N4O. Вирахувано, %: С 71,51; Н 4,67; N 18,53. ІЧ спектр (КВr): 1700 (С=О ). Спектр ЯМР 1Н (ДМСО-d6,): 5,25с (2Н, СН2), 7,26-7,50м (6Н, аром.), 7,58т (2Н, аром.), 8,03д (2Н, аром.), 8,38с (1Н, аром.), 8,73с (1Н, аром.). Приклад 3 5-(2,2-Діетоксиетил)-1-феніл-4,5-дигідро-1Hпіразоло-[3,4-d]піримідин-4-он. Вихід 87%, т. пл. 116-118°С. Знайдено, %: С 61,03; Н 6,19; N 16,12. C17H20N4 O3. Вирахувано, %: С 62,18; Н 6,14; N 15,96. ІЧ спектр (КВr): 1705 (С=О). Спектр ЯМР 1Н (ДМСО-d6): 1,07т (6Н, СН3), 3,40-3,72м (4Н, СН2), 4,11д (2Н, СН2), 4,74т (1Н, СН), 7,43т (1Н, аром.), 7,59т (2Н, аром.), 8,03д (2Н, аром.), 8,40д (2Н, аром.). Приклад 4 5-Аліл-1-феніл-4,5-дигідро-1Н-піразоло[3,4d]піримідин-4-он. Вихід 89%, т. пл. 102-104°С. Знайдено, %: С 66,45; Н 4,82; N 22,13. C14H12N4O. Вирахувано, %: С 66,66; Н 4,79; N 22,21. ІЧ спектр (КВr): 1700 (C=О). Спектр ЯМР 1Н (ДМСО-d6): 4,67д (2Н, СН2), 5,10-5,26 виродж. кв (2Н, СН2), 5,95-6,17м (1H, СН), 7,42т (1Н, аром.), 7,58т (2Н, аром.), 8,04д (2Н, аром.), 8,39с (1Н, аром.), 8,49с (1H, аром.). Приклад 5 Етил 2-(1-метил-4-оксо-4,5-дигідро-1Нпіразоло[3,4-d]піримідин-5-іл)ацетат. Вихід 95%, т. пл. 130-132°С. Знайдено, %: С 50,76; Н 5,15; N 23,55. C10H12N4O3 . Вирахувано, %: С 50,84; Н 5,12; N 23,72. ІЧ спектр (КВr): 1695 (С=О). Спектр ЯМР 1 Н (ДМСО-d6): 1,21т (ЗН, СН3), 3,93с (3Н, СН3), 4,16 кв (2Н, СН2), 4,81с (2Н, СН2), 8,11с (1Н, аром.), 8,41с (1Н, аром.). Приклад 6 н-Бутил3-(1-метил-4-оксо-4,5-дигідро-1Нпіразоло[3,4-d]піримідин-5-іл)пропаноат. Вихід 92%, т. пл. 70-72°С. Знайдено, %: С 55,85; Н 6,45; N 19,97. C13H18N4 O3. Вирахувано, %: С 56,10; Н 6,52; N 20,13. ІЧ спектр (КВr): 1690 (С=О ). Спектр ЯМР 1Н (ДМСО-d6): 0,87т (3Н, СН3), 1,27м (2Н, 5 85426 СН2), 1,52м (2Н, СН2), 2,76т (2Н, СН2), 4,00т (2Н, СН2), 4,18т (2Н, СН2), 7,97с (1H, аром.), 8,33с (1Н, аром.). Загальний спосіб одержання 5-аміно-1Н-4піразолкарбоксамідів. До суспензії 15ммоль 5-алкіл-4,5-дигідро-1Hпіразоло[3,4-d]піримідин-4-ону в 40мл етанолу додають 15ммоль гідроксиду натрію в 10мл етанолу (у випадку 5-алкосикарбонілалкілзаміщених похідних 30ммоль гідроксиду натрію у 20ммоль етанолу) і нагрівають при кип'ятінні 5год. Розчинник випарюють, залишок промивають водою або кристалізують із суміші ізопропанол-гексан, 1:10. Приклад 7 (N-Метил)-5-аміно-1-феніп-1Н-4-піразолкарбоксамід. Після випарювання розчинника твердий залишок промивають 15мл води, відфільтровують і сушать. Вихід 86%, т. пл. 171-173°С. Знайдено, %: С 61,35; Н 5,63; N 25,75. C11H12N4O. Вирахувано, %: С 61,10; Н 5,59; N 25,91. ІЧ спектр (КВr): 3335 (NH), 1620 (амід 1), 1565 (амід 2). Спектр ЯМР 1Н (ДМСО-d6): 2,73д (3Н, СН3), 6,33 (2Н, NH2), 7,30-8,05м (7Н, аром., NH). Приклад 8 (N-Бензил)-5-аміно-1-феніл-1Н-4-піразолкарбоксамід. Після випарювання розчинника твердий залишок промивають 15мл води, відфільтровують і сушать. Вихід 84%, т. пл. 202-204°С. Знайдено, %: С 69,68; Н 5,45; N 18,94. C17H16N4O. Вирахувано, %: С 69,85; Н 5,52; N 19,16. ІЧ спектр (КВr): 3330 (NH), 1625 (амід 1), 1570 (амід 2). Спектр ЯМР 1Н (ДМСО-d 6): 4,43д (2Н, СН2), 6,39с (2Н, NH2), 7,18-7,60м (10Н, аром.), 7,99т (Ш, аром.), 8,47т (1H,NH). Приклад 9 [N-(2,2-Діетоксиетил)]-5-аміно-1-феніл-1Н-4піразолкарбоксамід. Після випарювання розчинника до твердого залишку додають 50мл бензолу, фільтрують, фільтрат випарюють, продукт кристалізують із суміші ізопропанол-гексан, 1:10. Вихід 63%, т. пл. 86-87°С. Знайдено, %: С 60,15; Н 6,87; N 17,65. C16H22N4 O3. Вирахувано, %: С 60,36; Н 6,96; N 17,60. ІЧ спектр (КВr): 3335 (NH), 1620 (амід 1, валентні коливання С=О ), 1565 (амід 2, деформаційні коливання NH). Спектр ЯМР 1Н (ДМСО-d6): 1,13т (6Н, СН3), 3,26т (2Н, СН2), 3,403,72м (4Н, СН2), 4,57т (1H, СН), 6,37с (2Н, NH2), 7,32-7,64м (5Н, аром.), 7,95-8,17м (2Н, аром., NH). Приклад 10 (N-Аліл)-5-аміно-1-феніл-1Н-4-піразолкарбоксамід. Після випарювання розчинника твердий залишок промивають 15мл води, відфільтровують і сушать. Вихід 82%, т. пл. 143-145°С. Знайдено, %: С 64.70; Н 5,73; N 23,34. C13H14N4O. Вирахувано, %: С 64,45; Н 5,82; N 23,12. ІЧ спектр (КВr): 3335 (NH), 1625 (амід 1), 1565 (амід 2). Спектр ЯМР 1Н (ДМСО-d6): 3,85т (2Н, СН2), 5,00-5,25 виродж. кв (2Н, СН2), 5,78-5,95м (1H, СН), 6,37с (2Н, NH2), 7,32-7,65м (5Н, аром.), 7,97т (1H, аром.), 8,09т (1H, NH). Приклад 11 2-(5-Аміно-1-метил-1Н-4-піразолілкарбоксамідо)оцтова кислота. Після випарювання розчинника до твердого залишку додають 20мл води. І нагрі 6 вають 15хв при 70°С. Нерозчинний осад відділяють фільтруванням, фільтрат підкислюють 10%ним розчином соляної кислоти до нейтрального середовища. Продукт відфільтровують, промивають 5мл води та сушать. Вихід 78%, т. пл. 230232°С. Знайдено, %: С 42,26; Н 5,03; N 28,36. С7Н10N4О 3. Вирахувано, %: С 42,42; Н 5,09; N 28,27. ІЧ спектр (КВr): 2380-3500 (NH, СО2Н), 1630 (амід 1), 1575 (амід 2). Спектр ЯМР 1Н (ДМСО-d6): 3,51с (3Н, СН3), 3,80д (2Н, СН2), 6,15с (2Н, NH2), 7,65с (1Н, аром.), 8,01т (1Н, NH), СО2Н-протон знаходиться в обміні з протонами води, що міститься у розчиннику. Приклад 12 3-(5-Аміно-1-метил-1Н-4-піразолілкарбоксамідо)пропанова кислота. Після випарювання розчинника до твердого залишку додають 20мл води і нагрівають 15хв при 70°С. Нерозчинний осад відділяють фільтруванням, фільтрат підкислюють 10%-ним розчином соляної кислоти до нейтрального середовища. Продукт відфільтровують, промивають 5мл води та сушать. Ви хід 73%, т. пл. 182-184°С. Знайдено, %: С 45,04; Н 5,75; N 26,23. C8H12N4O 3. Вирахувано, %: С 45,28; Н 5,70; N 26,40. ІЧ спектр (КВr): 2400-3500 (NH, СО2Н), 1625 (амід 1), 1570 (амід 2). Спектр ЯМР 1Н (ДМСО-d6): 2,45т (2Н СН2), 3,40м (2Н, СН2), 3,50с (3Н, СН3), 6,12с (2Н, NH2), 7,60с (1H, аром.), 7,75т (1H, NH), 12,16 ш. с (СО2Н). Література: 1. Mahdi О., Lavergne J-P., Viallefont P., Akssira M., Sedqui A. Synthese de Cyclodipeptides a Sept Chainons a Partir de beta-Amino Acidespyrazoliques // Bulletin Soc. Chim. Fr. - 1995. - Vol. 132, №7. P.675-680. 2. Nam S. C, Ki Y. S. Ring Closure Reactions of Meth yl N- (haloacetyl)anthranilates with Ammonia // J. Heterocyclic Chem. - 1989. - Vol. 26. - P.1807-1810. 3. Богатский А.В., Андронати С.А., Головенко Н.Я. - Транквилизаторы: 1,4-бензодиазепины и родственные структуры // Киев: Наукова думка, 1980. - 279с. 4. Naito Y., Akahoshi F., Takeda S., Okada Т., Kajii M., Nishimura H., Sugiura M., Fukaya C, Kagitani Y. Synthesis and Pharmacological Activity of Triazole Derivatives Inhibiting Eosinophilia // J. Med. Chem.- 1996. - Vol. 39, №15. - P.3019-3029. 5. Bartroli J., Turmo E., Alguero M., Boncompte E., Vericat M. L, Conte L., Ramis J., Merlos M., Garcia-Rafanell J., Forn J. New Azole Antifungals. 2. Synthesis and Antifungal Acti vity of Heterocyclecarboxamide Derivatives of 3-Amino-2aryl-l-azolyl-2-butanol // J. Med. Chem. - 1998. - Vol. 41, № 11. - P.1855-1868. 6. Cheng C.C., Robins R.K. Potential Purine Antagonists. VI. Synthesis of 1-Alkyl- and l-Aryl-4substituted Pyrazolo[3,4-d]pyrimidines // J. Org. Chem. - 1956. - Vol. 21. - P.1240-1242. 7. Peat A.J., Boucheron J.A., Dickerson S.H., Garrido D., Mills W., Peckha J.M., Preugschat F., Smalley Т., Schweiker S.L., Jayme R. Wilson J.R. Novel pyrazolopyrimidine derivatives as GSK-3 inhibitors // Bioorg. Med. Chem. Lett - 2004. - VoL14, №9. - P.2121-2126. 7 Комп’ютерна в ерстка В. Клюкін 85426 8 Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюN-substituted amides of 5-amino-4-pyrazole carboxylic acids and process for the preparation thereof
Автори англійськоюVovk Mykhailo Volodymyrovych, Bolbut Andrii Viktorovych, Lischynskyi Anton Anatoliiovych
Назва патенту російськоюN-замещенные амиды 5-амино-4-пиразолкарбоновых кислот и способ их получения
Автори російськоюВовк Михаил Владимирович, Больбут Андрей Викторович, Лищинский Антон Анатольевич
МПК / Мітки
МПК: C07D 231/38
Мітки: одержання, 5-аміно-4-піразолкарбонових, кислот, аміди, n-заміщені, спосіб
Код посилання
<a href="https://ua.patents.su/4-85426-n-zamishheni-amidi-5-amino-4-pirazolkarbonovikh-kislot-ta-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">N-заміщені аміди 5-аміно-4-піразолкарбонових кислот та спосіб їх одержання</a>
Попередній патент: Радіометричний спосіб надлишкових вимірювань температури об’єктів
Наступний патент: Залізнична цистерна
Випадковий патент: Спосіб зниження холодового шоку еритроцитів людини








