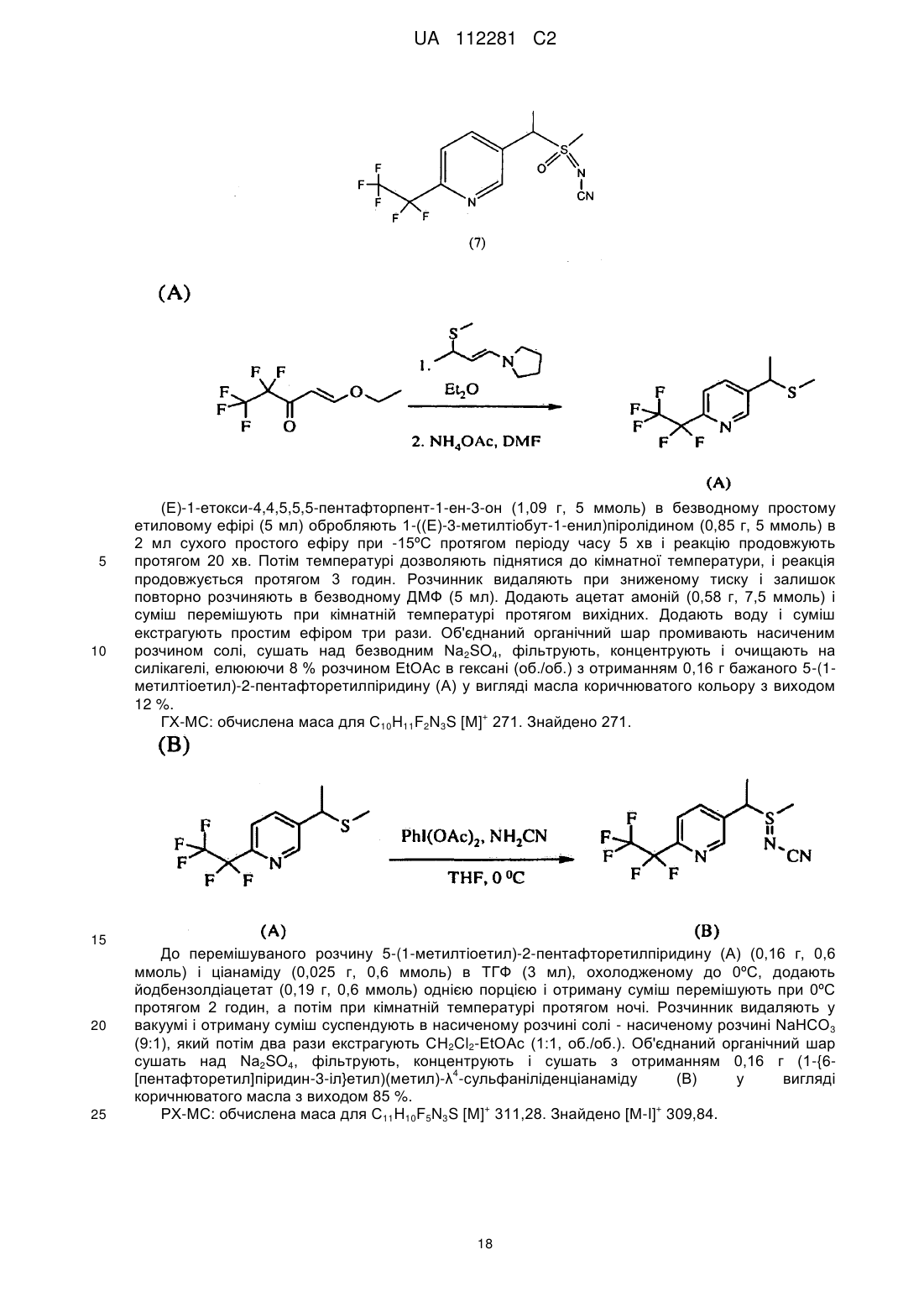
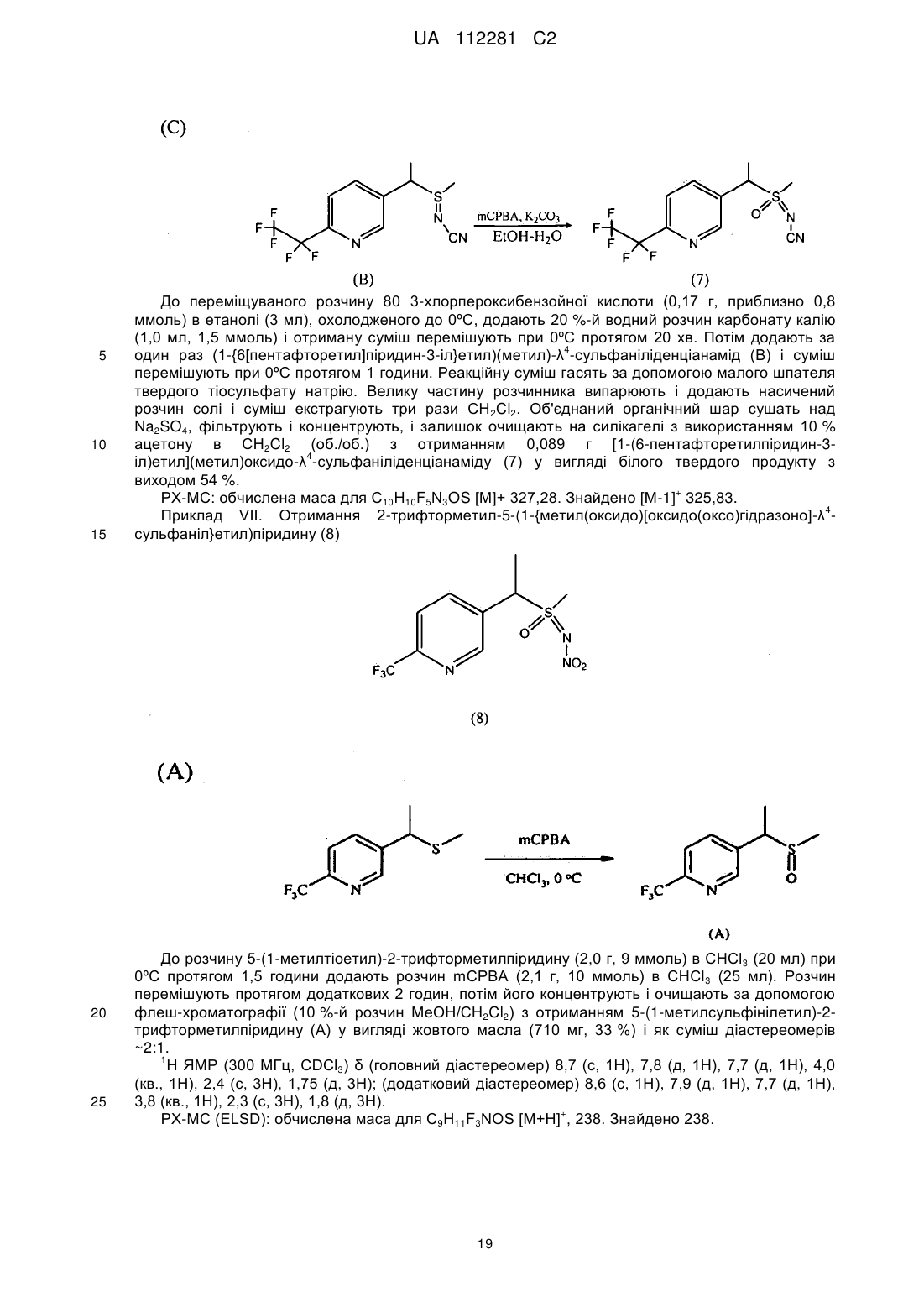
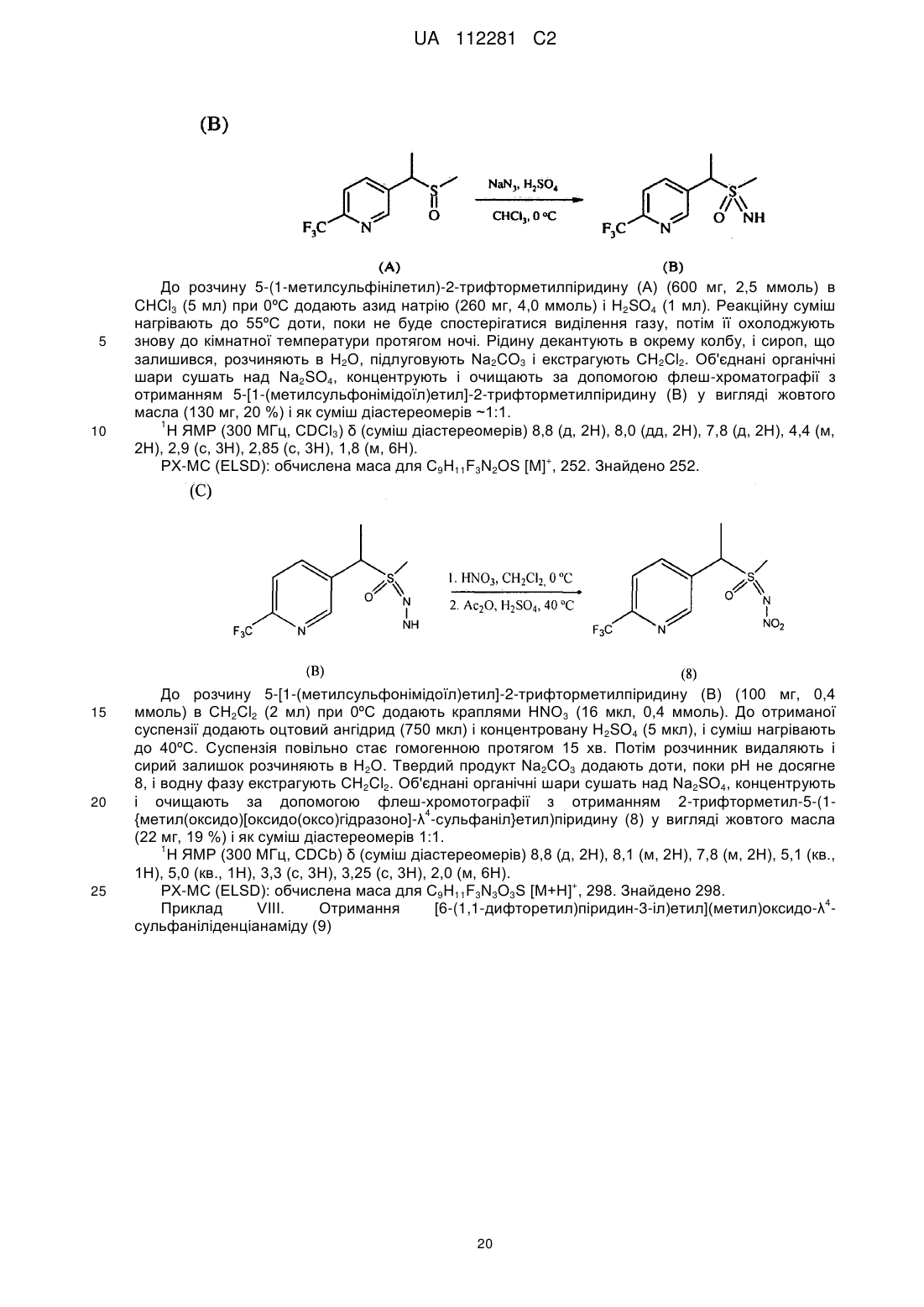
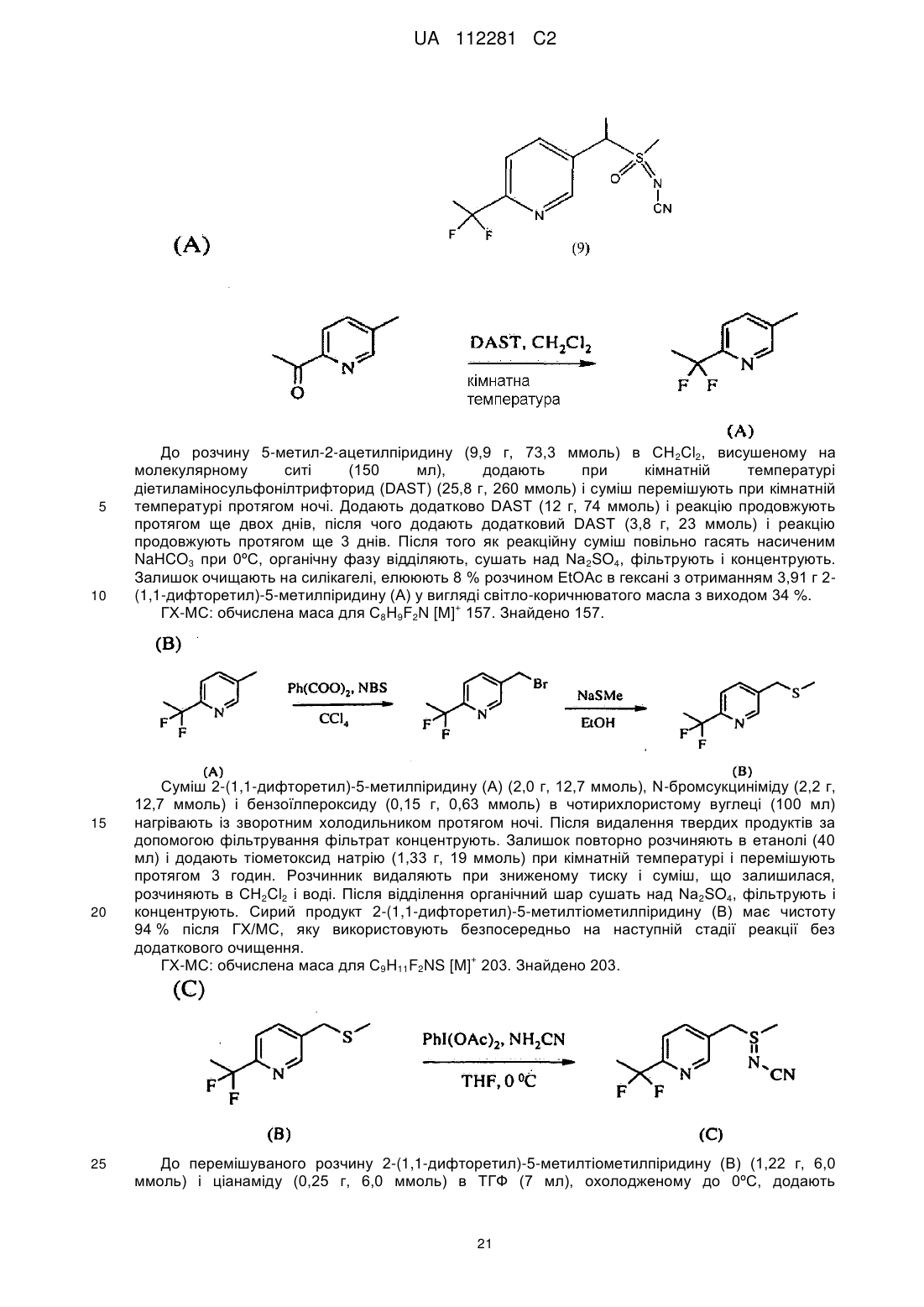
Стабільні інсектицидні композиції і способи їх отримання
Формула / Реферат
1. Спосіб отримання інсектицидної композиції, який включає:
отримання композиції, що має перше співвідношення стереоізомерів сполуки, яка має наступну структуру:
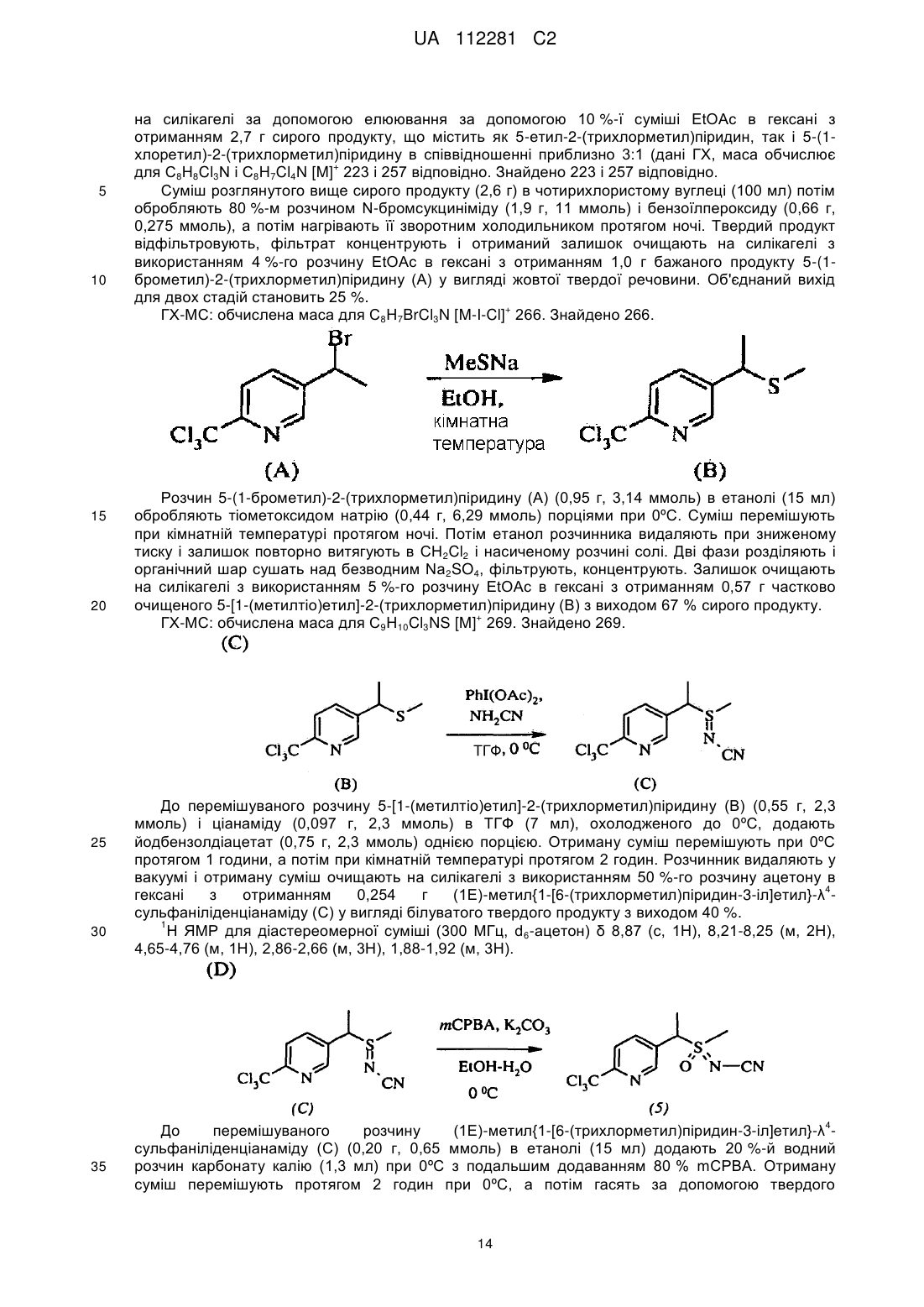
 ,
,
і нагрівання композиції способом, щоб отримати друге, інше, співвідношення стереоізомерів, в якому нагрівання здійснюють при мінімальній температурі 50 °C протягом від чотирьох до сімдесяти двох годин.
2.Спосіб отримання інсектицидної композиції, який включає:
отримання композиції, що містить стереоізомерну суміш сполуки, яка має наступну структуру:
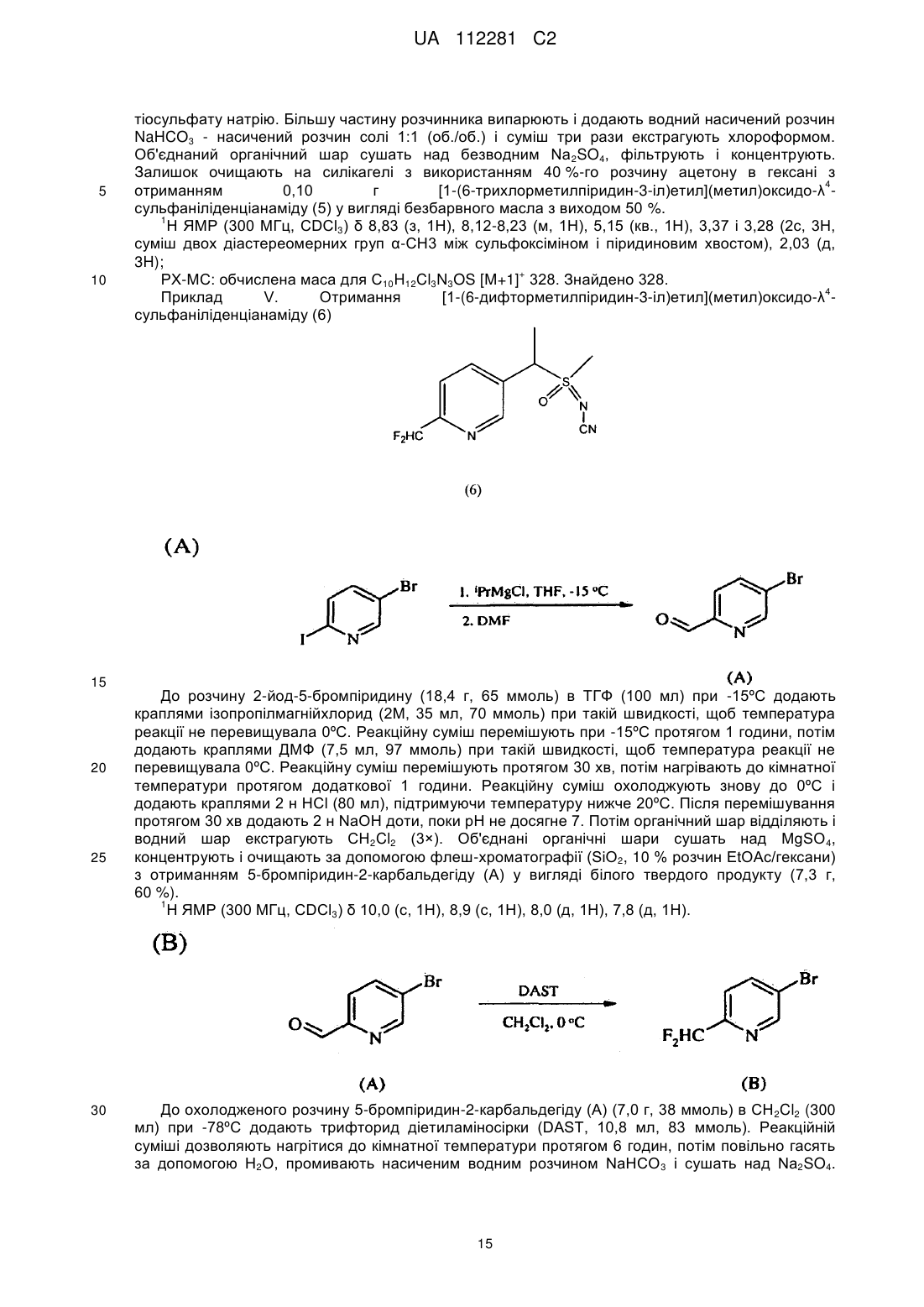
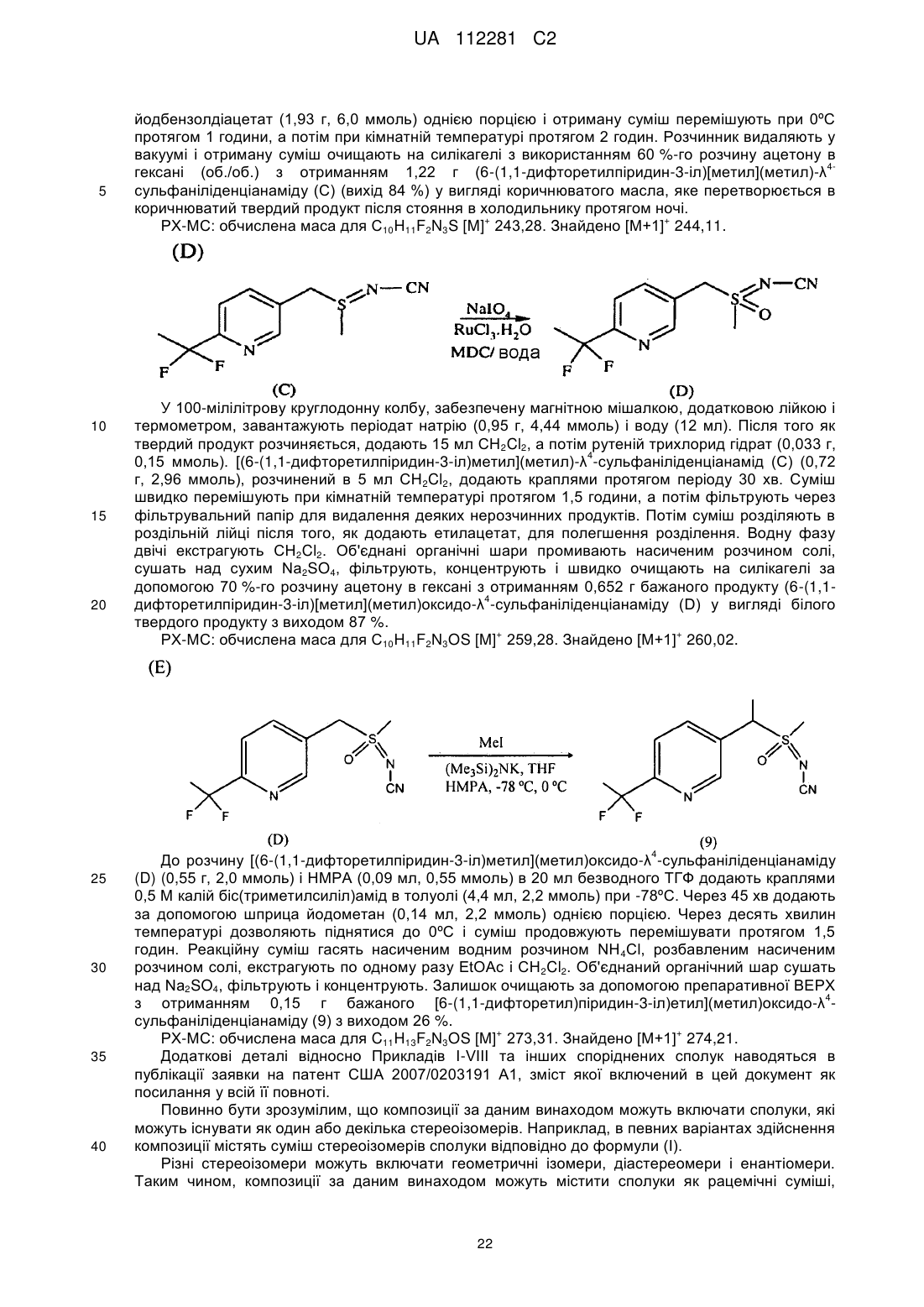
 ,
,
суміш містить першу пару діастереомерів і другу пару діастереомерів; і
нагрівання цієї композиції при мінімальній температурі 50 °C протягом від чотирьох до сімдесяти двох годин для перетворення щонайменше частини другої пари діастереомерів в першу пару діастереомерів.
3. Спосіб за п. 2, в якому композиція містить спіносин, вибраний з групи, яка складається зі спінетораму, спіносаду і їх суміші.
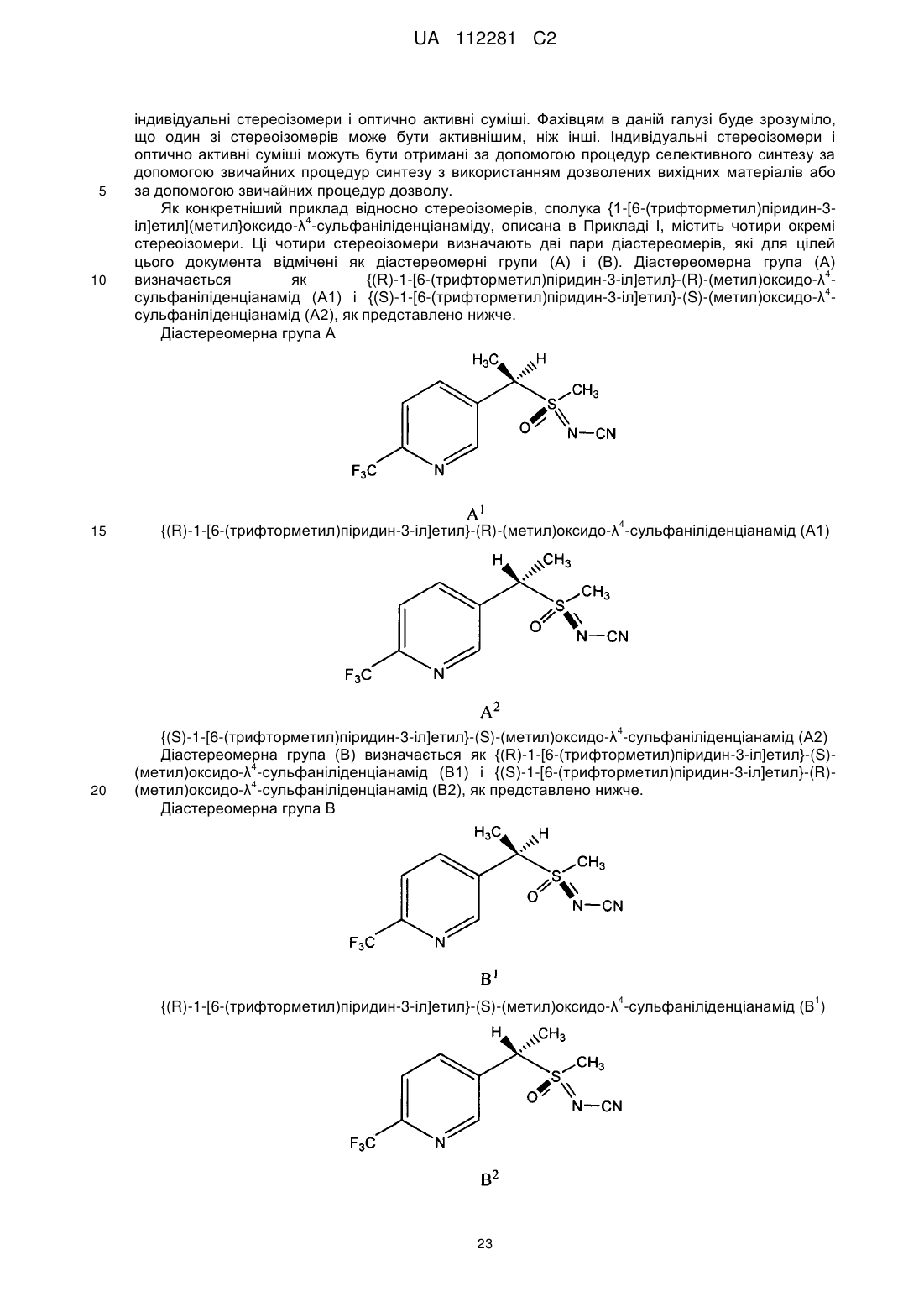
4. Композиція, яка містить стереоізомерну суміш {1-[6-(трифторметил)піридин-3-іл]етил}(метил)оксидо-l4-сульфаніліденціанаміду, що визначається першою парою діастереомерів і другою парою діастереомерів, де перша пара діастереомерів визначається {(R)-1-[6-(трифторметил)піридин-3-іл]етил-(R)-(метил)оксидо-l4-сульфаніліденціанамідом і {(S)-l-[6-(тpифтоpмeтил)піpидин-3-iл]eтил}-(S)-(мeтил)oкcидo-λ4-cyльфaнiлiдeнцiaнaмiдoм, і друга пара діастереомерів визначається {(R)-1-[6-(трифторметил)піридин-3-іл]етил}-(S)-(метил)оксидо-l4-сульфаніліденціанамідом і {(S)-l-[6-(трифторметил)піридин-3-іл]етил}-(R)-(метил)оксидо-l4-сульфаніліденціанамідом, де перша і друга пари діастереомерів присутні при співвідношенні щонайменше 3:1.
5. Композиція за п. 4, в якій перша і друга пари діастереомерів присутні при співвідношенні від 3:1 до 100:1.
6. Композиція за п. 5, в якій перша і друга пара діастереомерів присутні при співвідношенні від 3:1 до 40:1.
7. Композиція за п. 4, яка додатково містить спіносин, вибраний з групи, яка складається з спінетораму, спіносаду і їх сумішей.
8. Композиція за п. 7, в якій масове співвідношення {1-[6-(трифторметил)піридин-3-іл]етил}(метил)оксидо-l4-сульфаніліденціанаміду і спіносину складає від 3:1 до 1:3.
9. Спосіб одержання інсектицидної композиції, який включає:
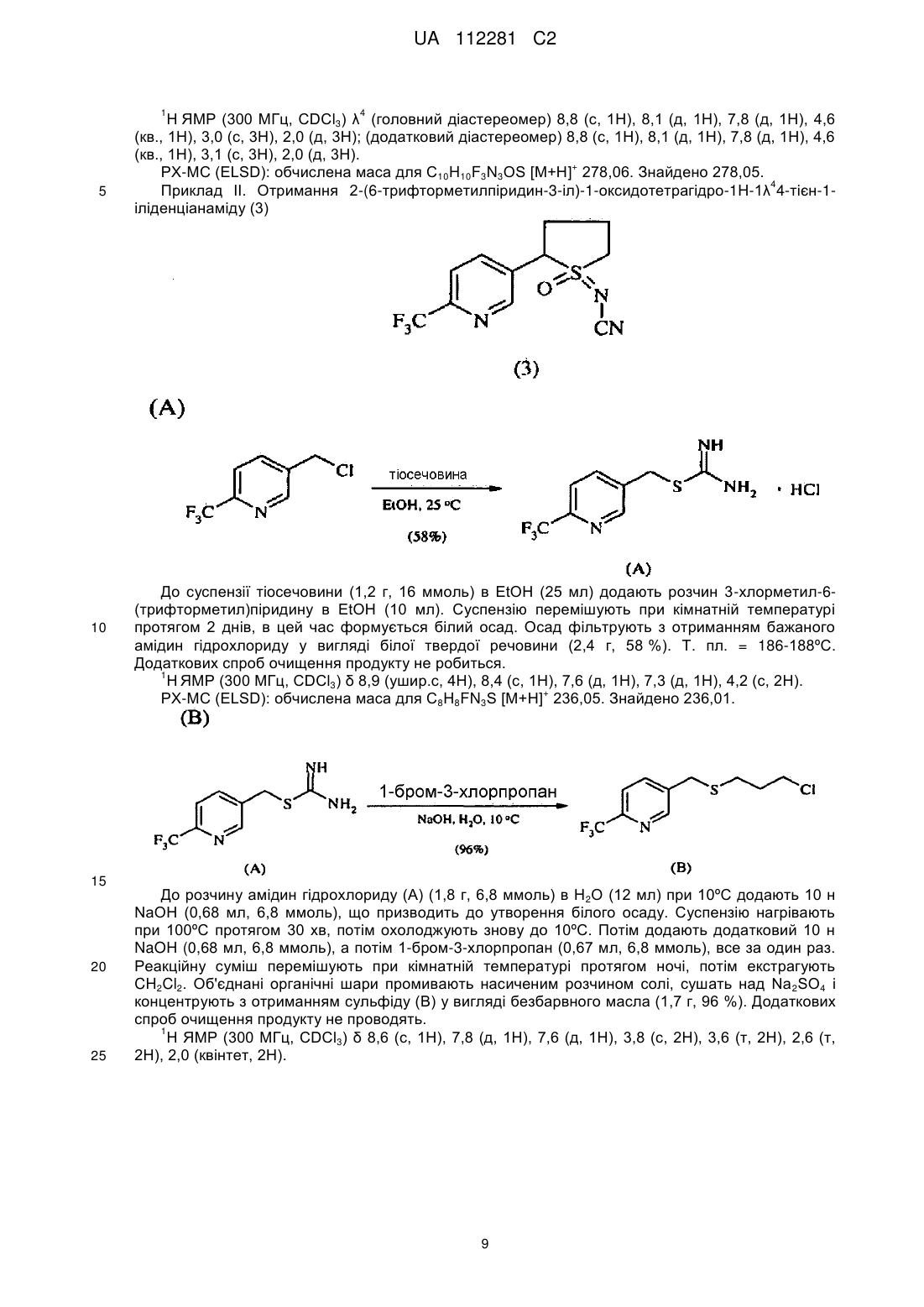
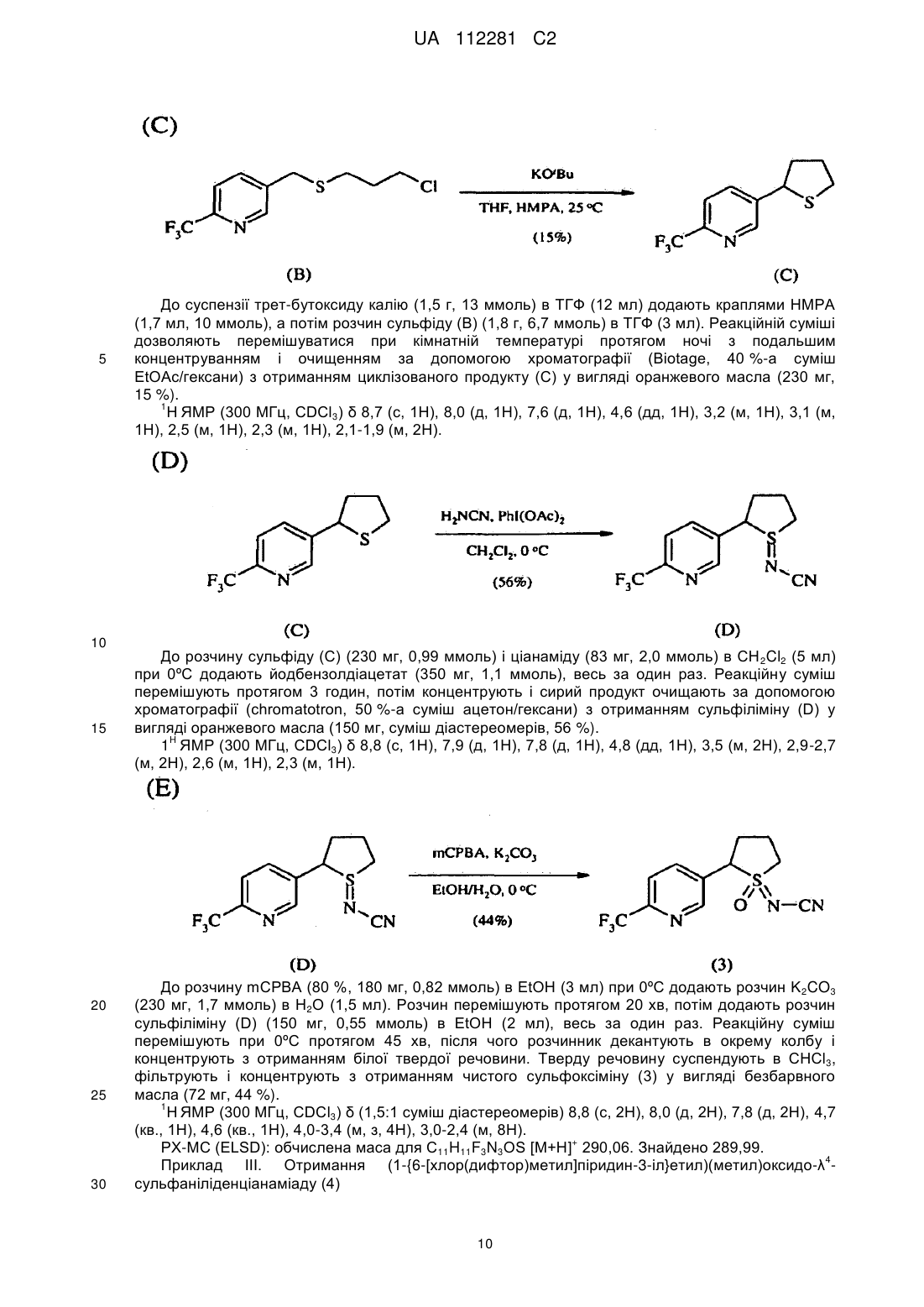
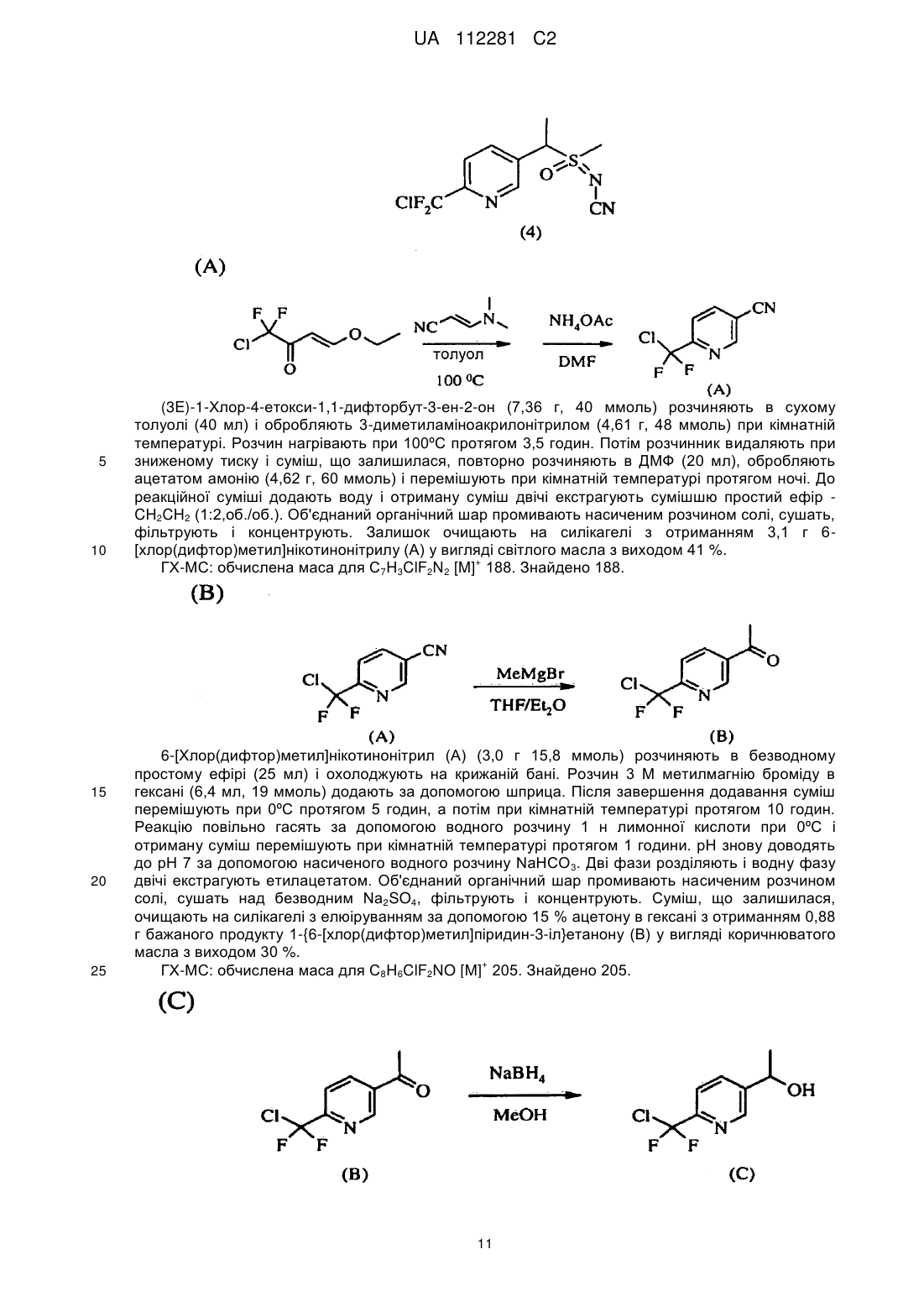
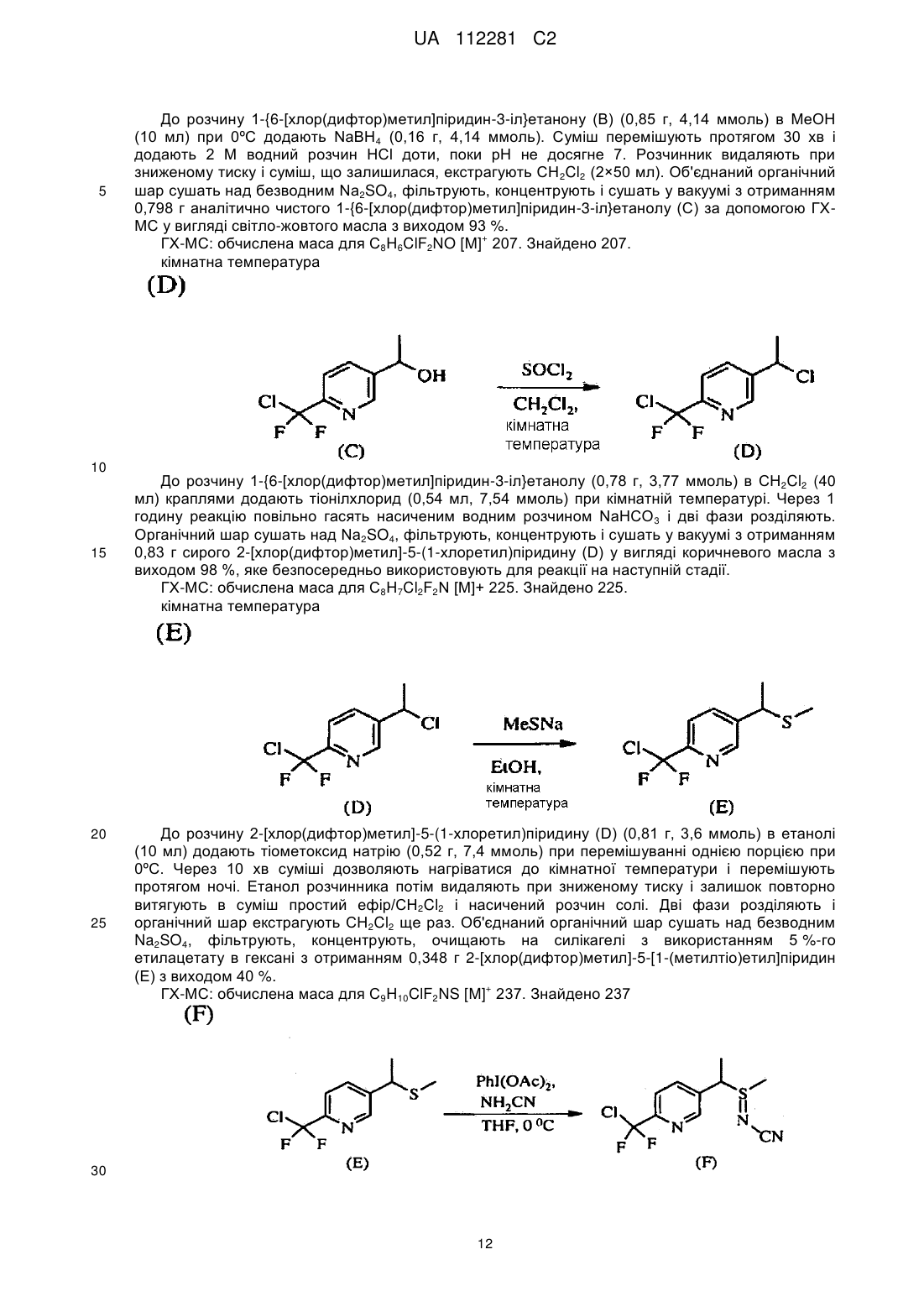
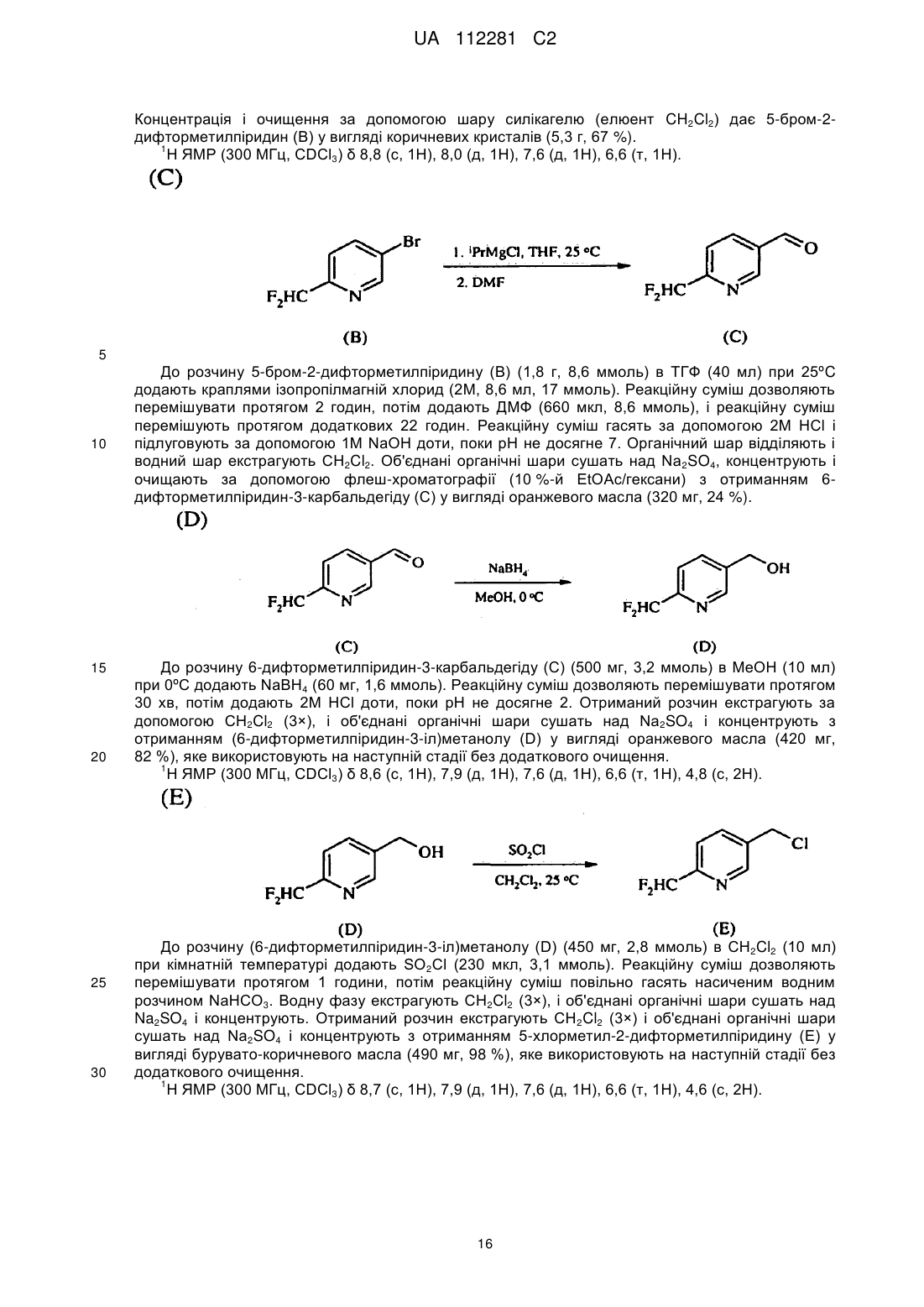
отримання композиції, що містить стереоізомерну суміш сполуки, яка має наступну структуру:
 ,
,
де сполука включає першу пару стереоізомерів, що визначається {(R)-l-[6-(трифторметил)піридин-3-іл]етил}-(R)-(метил)оксидо-l4-сульфаніліденціанамідом і {(S)-1-[6-(трифторметил)піридин-3-іл]етил}-(S)-(метил)оксидо-l4-сульфаніліденціанамідом, і другу пару стереоізомерів, що визначається {(R)-l-[6-(тpифтopмeтил)пipидин-3-iл]eтил}-(S)-(мeтил)oкcидo-l4-cyльфaнiлiдeнциaнaмiдoм і {(S)-1-[6-(трифторметил)піридин-3-іл]етил}-(R)-(метил)оксидо-l4-сульфаніліденціанамідом; і
перша пара діастереоізомерів присутня в співвідношенні близько 1:2 відносно другої пари діастереоізомерів; і
нагрівання композиції при температурі в інтервалі 40-70 °C протягом 4-72 годин з перетворенням частини другої пари діастереоізомерів в першу пару діастереоізомерів для того, щоб одержати присутність першої пари діастереоізомерів відносно другої пари діастереоізомерів у співвідношенні щонайменше 3:1.
10. Спосіб за п. 9, де композиція додатково включає спіносин, що вибраний з групи, яка складається з спінетораму, спіносаду і їх сумішей.
Текст
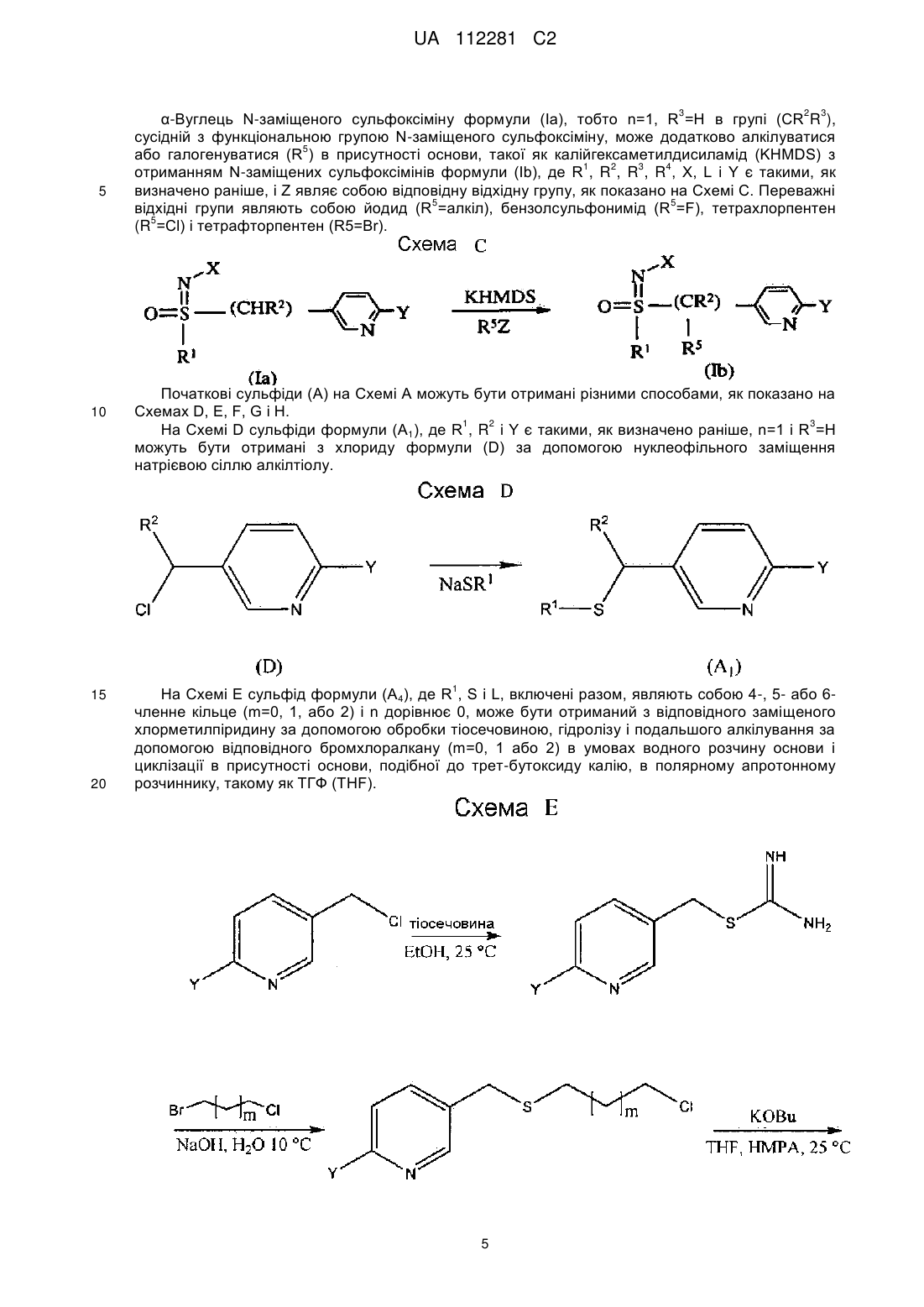
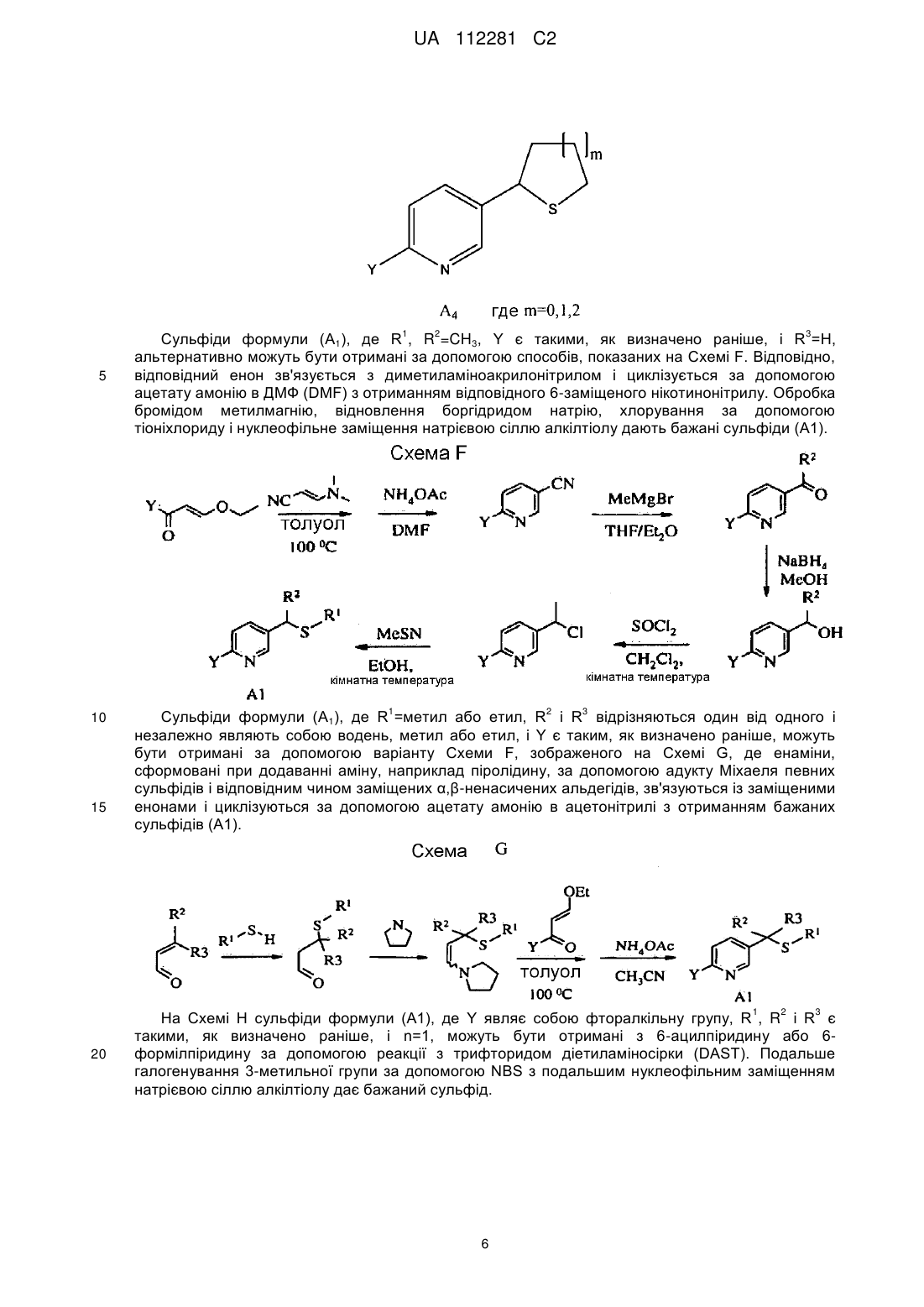
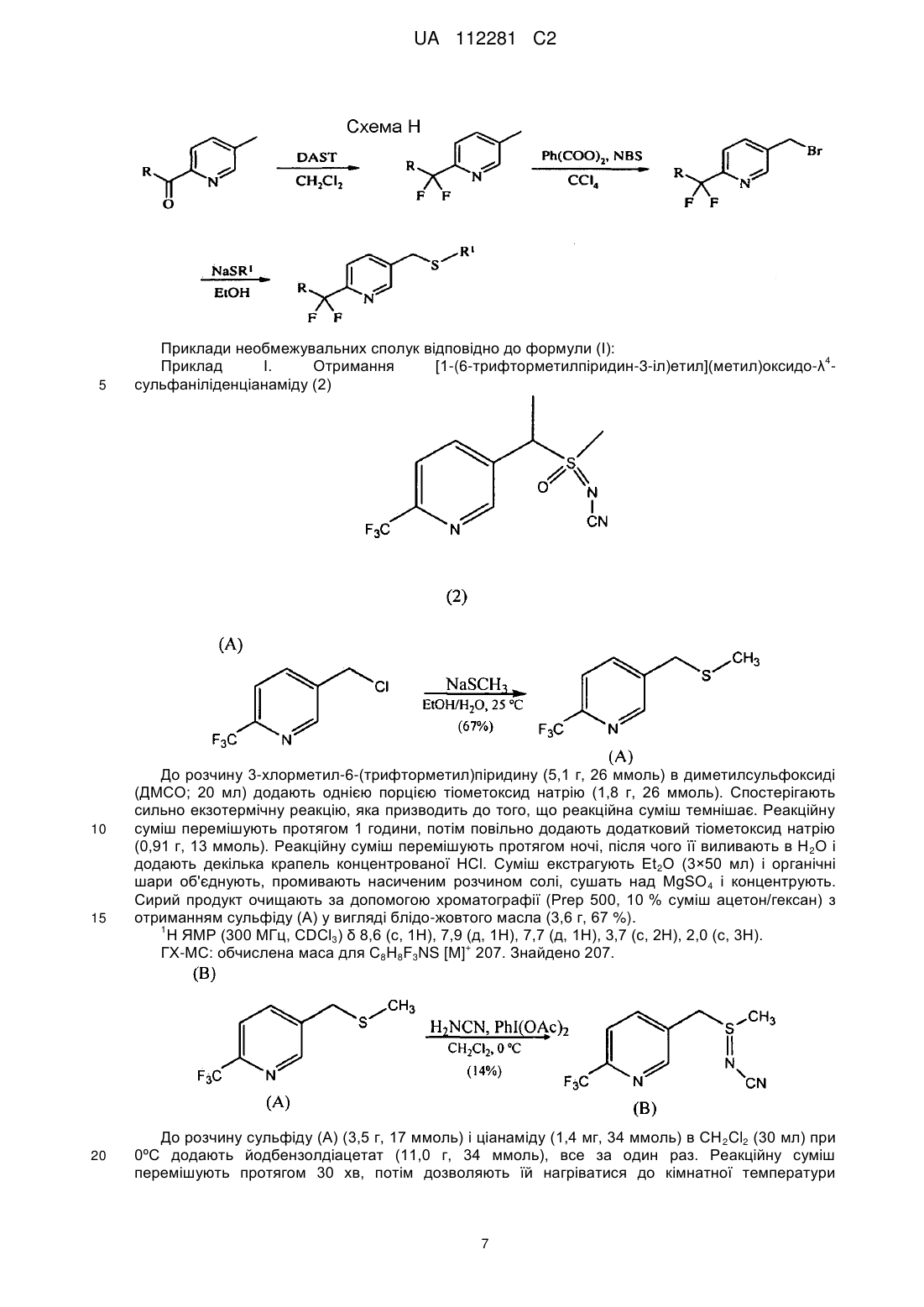
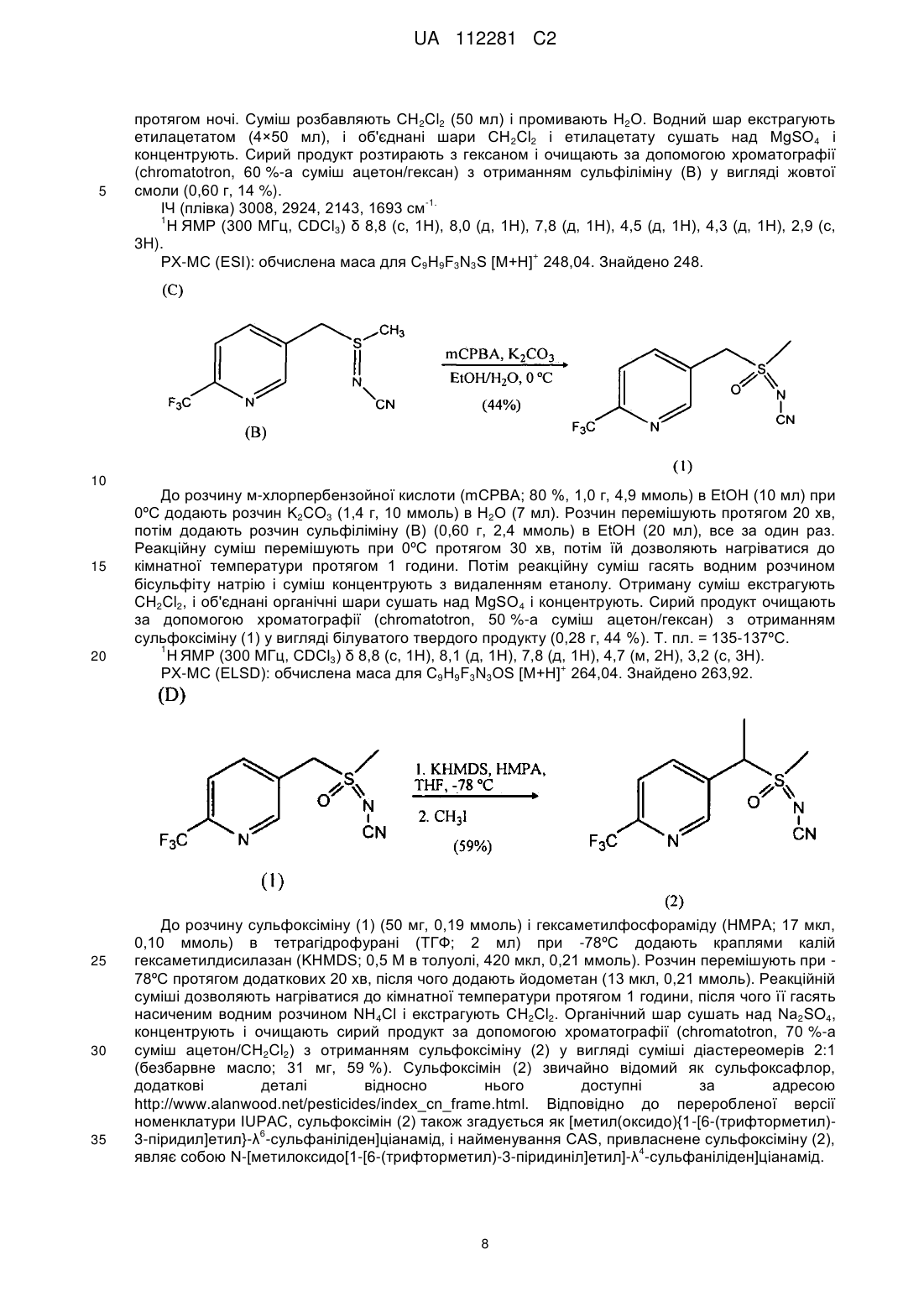
Реферат: Описуються композиції для боротьби з комахами, які містять сполуки N-заміщеного (6галогеналкілпіридин-3-іл)алкілсульфоксіміну, що демонструє підвищену стабільність, і способи їх отримання. UA 112281 C2 (12) UA 112281 C2 UA 112281 C2 5 10 15 20 25 30 35 40 45 Перехресні посилання на споріднені заявки Дана заявка вимагає пріоритет попередньої заявки на патент США № 61/203600, яка паралельно розглядається, поданої 26 грудня 2008 року, зміст якої включений в цей документ як посилання у всій його повноті. Галузь техніки, до якої належить винахід Винахід, описаний в цьому документі, належить до галузі пестицидів і до їх використання в боротьбі з комахами-шкідниками. Рівень техніки Комахи-шкідники викликають мільйони смертей людей у всьому світі щорічно. Крім того, є більше десяти тисяч видів комах-шкідників, які призводять до втрат в землеробстві. Ці сільськогосподарські втрати нараховують мільярди доларів США щорічно. Терміти викликають пошкодження різних структур, таких як будинки. Втрати від цих пошкоджень термітами нараховують мільярди доларів США щорічно. Як кінцеве зауваження, велика кількість запасів продуктів харчування з'їдаються і робляться непридатними для зберігання через комахшкідників. Ці втрати запасів продуктів харчування нараховують мільярди доларів США щорічно, але, що більш важливо, вони позбавляють людей необхідних продуктів харчування. Велика кількість пестицидних композицій розроблена з часом для знищення комах-шкідників і зменшення шкоди, яку вони наносять. Відносно щонайменше деяких з цих композицій, фізична і хімічна нестабільність може призводити до зменшення пестицидної активності композиції і/або викликати ускладнення при нанесенні композиції на ділянку, де є необхідною або бажаною боротьба з комахами-шкідниками. Наприклад, фізична і хімічна нестабільність може змінювати одну або декілька властивостей композицій, що робить складним або неможливим приготування відповідних розчинів композиції для використання. Конкретніше, багато які пестицидні композиції постачаються у вигляді концентрованого препарату від виробника і розбавляються потім кінцевим користувачем перед їх нанесенням. Протягом часу між отриманням і застосуванням рідкі форми пестицидних композицій можуть отверджуватися внаслідок хімічної і фізичної нестабільності композиції. Часто це отвердження унеможливлює або значно ускладнює диспергування композиції в розчині, придатному для застосування, що призводить до додаткових проблем для користувача і до збільшення вартості і/або до забруднення пестицидних продуктів. Крім того, коли фізична і хімічна нестабільність призводить до зменшення пестицидної активності композиції, часто потребується збільшення концентрації, при якій наноситься пестицид, і/або частіше нанесення пестицидної композиції. В результаті витрати користувача і витрати споживачів можуть зростати. З цієї причини, існує потреба в нових пестицидних композиціях, які виявляють поліпшені властивості відносно хімічної і фізичної стабільності композиції. Публікація заявки на патент США 2007/0203191 Al описує певні N-заміщені (6галогеналкілпіридин-3-іл)алкілсульфоксімінові сполуки і їх використання в боротьбі з комахами. У цей час виявлено, як можна поліпшити стабільність композицій, що містять одну або декілька цих сполук, протягом триваліших періодів часу. Суть винаходу Даний винахід належить до нових композицій, які містять N-заміщену (6галогеналкілпіридин-3-іл)алкілсульфоксімінову сполуку і виявляють підвищену стабільність, а також до їх використання в боротьбі з комахами і визначеними іншими безхребетними, зокрема, афідами та іншими сисними комахами. Даний винахід також включає нові процедури синтезу для отримання композицій і способів боротьби з комахами з використанням цих композицій. Даний винахід належить до композицій, придатних для боротьби з комахами, зокрема, придатних для боротьби з афідами та іншими сисними комахами, а також до способів їх отримання. Конкретніше, в одному з варіантів здійснення спосіб включає отримання композиції, що містить перше співвідношення стереоізомерів сполуки, що має формулу (I) , 50 де 4 X являє собою NO2, CN або COOR ; 1 UA 112281 C2 1 5 10 15 20 25 30 35 40 L являє собою одинарний зв'язок або R , S і L, включені разом, являють собою 4-, 5- або 6членне кільце; 1 R являє собою (C1-C4)алкіл; 2 3 R і R відрізняються один від одного та індивідуально являють собою водень, метил, етил, фтор, хлор або бром; 1 n дорівнює 1, коли L являє собою одинарний зв'язок, і дорівнює 0, коли R , S і L, включені разом, являють собою 4-, 5- або 6-членне кільце; Y являє собою (C1-C4) галогеналкіл, F, Cl, Br або I і 4 R являє собою (C1-C3) алкіл. Спосіб також включає нагрівання композиції способом, ефективним для отримання другого, іншого співвідношення стереоізомерів. У одній з конкретних форм способу композиція містить сполуку формули (I), де L являє собою одинарний зв'язок, тобто має наступну структуру, де n дорівнює 1 , де 4 X являє собою NO2, CN або COOR ; 1 R являє собою (C1-C4) алкіл; 2 3 R і R відрізняються один від одного та індивідуально являють собою водень, метил, етил, фтор, хлор або бром; Y являє собою (C1-C4) галогеналкіл, F, Cl, Br або I і 4 R являє собою (C1-C3) алкіл. 1 У іншій конкретній формі способу композиція містить сполуку формули (I), де R , S і L, включені разом, утворюють насичене 5-членне кільце і n дорівнює 0, тобто має структуру , де 4 X являє собою NO2, CN або COOR ; Y являє собою (C1-C4) галогеналкіл, F, Cl, Br або I і 4 R являє собою (C1-C3) алкіл. У інших формах способу композиція містить сполуки формули (I) в одному або декількох з наступних класів: (1) Сполуки формули (I), де X являє собою NO 2 або CN, найбільш переважно, CN. (2) Сполуки формули (I), де Y являє собою CF3. 2 3 (3) Сполуки формули (I), де R і R відрізняються один від одного і незалежно являють собою водень, метил або етил. 1 (4) Сполуки формули (I), де R являє собою CH3. Фахівцям в даній галузі буде зрозуміло, що одна або декілька композицій, описаних в цьому документі, можуть складатися зі сполучень описаних вище класів сполуки формули (I). У одній із форм способу, нагрівання здійснюється при мінімальній температурі приблизно 20ºC щонайменше приблизно протягом чотирьох годин. У іншій формі нагрівання здійснюється при мінімальній температурі приблизно 50ºC протягом від приблизно чотирьох до приблизно сімдесяти двох годин. У іншому варіанті здійснення, спосіб включає отримання композиції, яка містить стереоізомерну суміш сполуки, що має наступну структуру: 2 UA 112281 C2 5 10 15 20 25 30 35 40 , де 4 X являє собою NO2, CN або COOR ; 1 R являє собою (C1-C4) алкіл; 2 3 R і R відрізняються один від одного та індивідуально являють собою водень, метил, етил, фтор, хлор або бром; Y являє собою (C1-C4) галогеналкіл, F, Cl, Br або I; 4 R являє собою (C1-C3) алкіл і суміш визначається першою парою діастереомерів і другою парою діастереомерів. Спосіб також включає нагрівання композиції з перетворенням щонайменше частини другої пари діастереомерів в першу пару діастереомерів. У іншому варіанті здійснення, композиція містить стереоізомерну суміш {1-[64 (трифторметил)піридин-3-іл]етил}(метил)оксидо-λ -сульфаніліденціанаміду, що визначається першою парою діастереомерів і другою парою діастереомерів, де перша і друга пари діастереомерів присутні при співвідношенні щонайменше приблизно 3:1. У одній з форм перша і друга пари діастереомерів присутні при співвідношенні від приблизно 3:1 до 100:1. У іншій формі перша і друга пари діастереомерів присутні при співвідношенні від приблизно 3:1 до 40:1. Ще в одному варіанті здійснення спосіб включає нанесення на ділянку, де є бажаним знищення комах, деякої кількості пестицидної композиції. Додаткові варіанти здійснення, форми, ознаки, аспекти, вигоди, цілі і переваги даного винаходу стануть зрозумілі з докладного опису і наведених прикладів. Замісники (невичерпний список) Приклади, наведені для замісників, є (за винятком галогену) невичерпними і не повинні розглядатися як такі, що обмежують даний винахід, описаний в цьому документі. "Алкіл" (включаючи похідні терміни, такі як алкокси) означає групи з прямим ланцюгом, з розгалуженим ланцюгом і циклічні групи, включаючи, наприклад, метил, етил, 1-метилетил, пропіл, 1,1-диметилетил і циклопропіл. "Алкокси" означає алкіл, що додатково містить одинарний зв'язок вуглець-кисень, наприклад, метокси, етокси, пропокси, ізопропокси, 1-бутокси, 2-бутокси, ізобутокси, третбутокси, пентокси, 2-метилбутокси, 1,1-диметилпропокси, гексокси, гептокси, октокси, нонокси і деокси. "Арил" означає циклічний ароматичний замісник, що складається з водню і вуглецю, наприклад, феніл, нафтил і біфеніліл. "Галоген" означає фтор, хлор, бром і йод. "Галогеналкіл" означає алкільну групу, заміщену від одного до максимально можливої кількості атомами галогену, включаючи все поєднання галогенів. Докладний опис винаходу У цьому документі всі температури приводяться в ºС і всі % являють собою % мас., якщо не стверджується іншого. 1 2 3 4 Сполуки формули (Ia), де R , R , R , R , X, і Y є такими, як визначено раніше, L являє собою одинарний зв'язок і n дорівнює 1, можуть бути отримані за допомогою способів, показаних на Схемі А: 3 UA 112281 C2 5 10 15 20 25 30 На стадії а Схеми А сульфід формули (А) окиснюється за допомогою метахлорпероксибензойної кислоти (mCPBA) в полярному розчиннику при температурі нижче 0ºC з отриманням сульфоксиду формули (В). У більшості випадків дихлорметан являє собою переважний розчинник для окиснення. На стадії b Схеми А сульфоксид (В) імінується за допомогою азиду натрію в присутності концентрованої сірчаної кислоти в апротонному розчиннику при нагріванні з отриманням сульфоксіміну формули (С). У більшості випадків хлороформ являє собою переважний розчинник для цієї реакції. На стадії с Схеми А азот сульфоксіміну (С) може або ціануватися за допомогою ціаногену броміду в присутності основи або нітруватися за допомогою азотної кислоти в присутності оцтового ангідриду при помірно підвищеній температурі, або карбоксилуватися за допомогою алкіл (R4) хлорформіату в присутності основи, такої як 4-диметиламінопіридин (DMAP) з отриманням N-заміщеного сульфоксіміну (Ia). Основа необхідна для ефективного ціанування і карбоксилування, і переважна основа являє собою DMAP, в той час як сірчана кислота використовується як каталізатор для ефективної реакції нітрування. 1 2 3 4 Сполуки формули (Ia), де X являє собою CN і R , R , R , R і Y є такими, як визначено раніше, і n дорівнює 1, можуть бути отримані за допомогою м'якого і ефективного способу, що ілюструється на Схемі В. На стадії а Схеми В сульфід окиснюється йодбензолдіацетатом в присутності ціанаміду при 0ºC з отриманням сульфіліміну (D). Реакція може здійснюватися в полярному апротонному розчиннику, подібному до CH2Cl2. На стадії b Схеми В сульфілімін (D) окиснюється за допомогою mCPBA. Основа, така як карбонат калію, використовується для нейтралізації кислотності mCPBA. Протонні полярні розчинники, такі як етанол і вода, використовуються для підвищення розчинності вихідного матеріалу сульфіліміну і використовуваної основи. Сульфілімін (D) може також окиснюватися за допомогою водного розчину натрію або калію періодинату в присутності каталізатора рутенію трихлориду гідрату або подібного каталізатора. Органічний розчинник для цього каталізу може являти собою полярний апротонний розчинник, такий як CH 2Cl2, хлороформ або ацетонітрил. 4 UA 112281 C2 3 5 10 15 20 2 3 α-Вуглець N-заміщеного сульфоксіміну формули (Ia), тобто n=1, R =Н в групі (CR R ), сусідній з функціональною групою N-заміщеного сульфоксіміну, може додатково алкілуватися 5 або галогенуватися (R ) в присутності основи, такої як калійгексаметилдисиламід (KHMDS) з 1 2 3 4 отриманням N-заміщених сульфоксімінів формули (Ib), де R , R , R , R , X, L і Y є такими, як визначено раніше, і Z являє собою відповідну відхідну групу, як показано на Схемі С. Переважні 5 5 відхідні групи являють собою йодид (R =алкіл), бензолсульфонимід (R =F), тетрахлорпентен 5 (R =Cl) і тетрафторпентен (R5=Br). Початкові сульфіди (А) на Схемі А можуть бути отримані різними способами, як показано на Схемах D, Е, F, G і Н. 1 2 3 На Схемі D сульфіди формули (A1), де R , R і Y є такими, як визначено раніше, n=1 і R =Н можуть бути отримані з хлориду формули (D) за допомогою нуклеофільного заміщення натрієвою сіллю алкілтіолу. 1 На Схемі Е сульфід формули (A4), де R , S і L, включені разом, являють собою 4-, 5- або 6членне кільце (m=0, 1, або 2) і n дорівнює 0, може бути отриманий з відповідного заміщеного хлорметилпіридину за допомогою обробки тіосечовиною, гідролізу і подальшого алкілування за допомогою відповідного бромхлоралкану (m=0, 1 або 2) в умовах водного розчину основи і циклізації в присутності основи, подібної до трет-бутоксиду калію, в полярному апротонному розчиннику, такому як ТГФ (THF). 5 UA 112281 C2 1 5 10 15 2 3 Сульфіди формули (A1), де R , R =CH3, Y є такими, як визначено раніше, і R =Н, альтернативно можуть бути отримані за допомогою способів, показаних на Схемі F. Відповідно, відповідний енон зв'язується з диметиламіноакрилонітрилом і циклізується за допомогою ацетату амонію в ДМФ (DMF) з отриманням відповідного 6-заміщеного нікотинонітрилу. Обробка бромідом метилмагнію, відновлення боргідридом натрію, хлорування за допомогою тіоніхлориду і нуклеофільне заміщення натрієвою сіллю алкілтіолу дають бажані сульфіди (A1). 1 2 3 Сульфіди формули (A1), де R =метил або етил, R і R відрізняються один від одного і незалежно являють собою водень, метил або етил, і Y є таким, як визначено раніше, можуть бути отримані за допомогою варіанту Схеми F, зображеного на Схемі G, де енаміни, сформовані при додаванні аміну, наприклад піролідину, за допомогою адукту Міхаеля певних сульфідів і відповідним чином заміщених α,β-ненасичених альдегідів, зв'язуються із заміщеними енонами і циклізуються за допомогою ацетату амонію в ацетонітрилі з отриманням бажаних сульфідів (A1). 1 20 2 3 На Схемі Н сульфіди формули (A1), де Y являє собою фторалкільну групу, R , R і R є такими, як визначено раніше, і n=1, можуть бути отримані з 6-ацилпіридину або 6формілпіридину за допомогою реакції з трифторидом діетиламіносірки (DAST). Подальше галогенування 3-метильної групи за допомогою NBS з подальшим нуклеофільним заміщенням натрієвою сіллю алкілтіолу дає бажаний сульфід. 6 UA 112281 C2 5 10 15 20 Приклади необмежувальних сполук відповідно до формули (I): 4 Приклад I. Отримання [1-(6-трифторметилпіридин-3-іл)етил](метил)оксидо-λ сульфаніліденціанаміду (2) До розчину 3-хлорметил-6-(трифторметил)піридину (5,1 г, 26 ммоль) в диметилсульфоксиді (ДМСО; 20 мл) додають однією порцією тіометоксид натрію (1,8 г, 26 ммоль). Спостерігають сильно екзотермічну реакцію, яка призводить до того, що реакційна суміш темнішає. Реакційну суміш перемішують протягом 1 години, потім повільно додають додатковий тіометоксид натрію (0,91 г, 13 ммоль). Реакційну суміш перемішують протягом ночі, після чого її виливають в H 2O і додають декілька крапель концентрованої HCl. Суміш екстрагують Et 2O (3×50 мл) і органічні шари об'єднують, промивають насиченим розчином солі, сушать над MgSO 4 і концентрують. Сирий продукт очищають за допомогою хроматографії (Prep 500, 10 % суміш ацетон/гексан) з отриманням сульфіду (А) у вигляді блідо-жовтого масла (3,6 г, 67 %). 1 Н ЯМР (300 МГц, CDCl3) δ 8,6 (с, 1H), 7,9 (д, 1H), 7,7 (д, 1H), 3,7 (с, 2H), 2,0 (с, 3H). + ГХ-МС: обчислена маса для C8H8F3NS [M] 207. Знайдено 207. До розчину сульфіду (А) (3,5 г, 17 ммоль) і ціанаміду (1,4 мг, 34 ммоль) в CH 2Cl2 (30 мл) при 0ºC додають йодбензолдіацетат (11,0 г, 34 ммоль), все за один раз. Реакційну суміш перемішують протягом 30 хв, потім дозволяють їй нагріватися до кімнатної температури 7 UA 112281 C2 5 10 15 20 25 30 35 протягом ночі. Суміш розбавляють CH2Cl2 (50 мл) і промивають H2O. Водний шар екстрагують етилацетатом (4×50 мл), і об'єднані шари CH 2Cl2 і етилацетату сушать над MgSO4 і концентрують. Сирий продукт розтирають з гексаном і очищають за допомогою хроматографії (chromatotron, 60 %-а суміш ацетон/гексан) з отриманням сульфіліміну (В) у вигляді жовтої смоли (0,60 г, 14 %). -1. ІЧ (плівка) 3008, 2924, 2143, 1693 см 1 Н ЯМР (300 МГц, CDCl3) δ 8,8 (с, 1H), 8,0 (д, 1H), 7,8 (д, 1H), 4,5 (д, 1H), 4,3 (д, 1H), 2,9 (с, 3H). + РХ-МС (ESI): обчислена маса для C9H9F3N3S [M+Н] 248,04. Знайдено 248. До розчину м-хлорпербензойної кислоти (mCPBA; 80 %, 1,0 г, 4,9 ммоль) в EtOH (10 мл) при 0ºC додають розчин K2CO3 (1,4 г, 10 ммоль) в H2O (7 мл). Розчин перемішують протягом 20 хв, потім додають розчин сульфіліміну (В) (0,60 г, 2,4 ммоль) в EtOH (20 мл), все за один раз. Реакційну суміш перемішують при 0ºC протягом 30 хв, потім їй дозволяють нагріватися до кімнатної температури протягом 1 години. Потім реакційну суміш гасять водним розчином бісульфіту натрію і суміш концентрують з видаленням етанолу. Отриману суміш екстрагують CH2Cl2, і об'єднані органічні шари сушать над MgSO 4 і концентрують. Сирий продукт очищають за допомогою хроматографії (chromatotron, 50 %-а суміш ацетон/гексан) з отриманням сульфоксіміну (1) у вигляді білуватого твердого продукту (0,28 г, 44 %). Т. пл. = 135-137ºC. 1 Н ЯМР (300 МГц, CDCl3) δ 8,8 (с, 1H), 8,1 (д, 1H), 7,8 (д, 1H), 4,7 (м, 2H), 3,2 (с, 3H). + РХ-МС (ELSD): обчислена маса для C9H9F3N3OS [M+Н] 264,04. Знайдено 263,92. До розчину сульфоксіміну (1) (50 мг, 0,19 ммоль) і гексаметилфосфораміду (HMPA; 17 мкл, 0,10 ммоль) в тетрагідрофурані (ТГФ; 2 мл) при -78ºC додають краплями калій гексаметилдисилазан (KHMDS; 0,5 M в толуолі, 420 мкл, 0,21 ммоль). Розчин перемішують при 78ºC протягом додаткових 20 хв, після чого додають йодометан (13 мкл, 0,21 ммоль). Реакційній суміші дозволяють нагріватися до кімнатної температури протягом 1 години, після чого її гасять насиченим водним розчином NH4Cl і екстрагують CH2Cl2. Органічний шар сушать над Na2SO4, концентрують і очищають сирий продукт за допомогою хроматографії (chromatotron, 70 %-а суміш ацетон/CH2Cl2) з отриманням сульфоксіміну (2) у вигляді суміші діастереомерів 2:1 (безбарвне масло; 31 мг, 59 %). Сульфоксімін (2) звичайно відомий як сульфоксафлор, додаткові деталі відносно нього доступні за адресою http://www.alanwood.net/pesticides/index_cn_frame.html. Відповідно до переробленої версії номенклатури IUPAC, сульфоксімін (2) також згадується як [метил(оксидо){1-[6-(трифторметил)6 3-піридил]етил}-λ -сульфаніліден]ціанамід, і найменування CAS, привласнене сульфоксіміну (2), 4 являє собою N-[метилоксидо[1-[6-(трифторметил)-3-піридиніл]етил]-λ -сульфаніліден]ціанамід. 8 UA 112281 C2 1 5 10 15 20 25 4 Н ЯМР (300 МГц, CDCl3) λ (головний діастереомер) 8,8 (с, 1H), 8,1 (д, 1H), 7,8 (д, 1H), 4,6 (кв., 1H), 3,0 (с, 3H), 2,0 (д, 3H); (додатковий діастереомер) 8,8 (с, 1H), 8,1 (д, 1H), 7,8 (д, 1H), 4,6 (кв., 1H), 3,1 (с, 3H), 2,0 (д, 3H). + РХ-МС (ELSD): обчислена маса для C10H10F3N3OS [M+Н] 278,06. Знайдено 278,05. 4 Приклад II. Отримання 2-(6-трифторметилпіридин-3-іл)-1-оксидотетрагідро-1H-1λ 4-тієн-1іліденціанаміду (3) До суспензії тіосечовини (1,2 г, 16 ммоль) в EtOH (25 мл) додають розчин 3-хлорметил-6(трифторметил)піридину в EtOH (10 мл). Суспензію перемішують при кімнатній температурі протягом 2 днів, в цей час формується білий осад. Осад фільтрують з отриманням бажаного амідин гідрохлориду у вигляді білої твердої речовини (2,4 г, 58 %). Т. пл. = 186-188ºC. Додаткових спроб очищення продукту не робиться. 1 Н ЯМР (300 МГц, CDCl3) δ 8,9 (ушир.с, 4H), 8,4 (с, 1H), 7,6 (д, 1H), 7,3 (д, 1H), 4,2 (с, 2H). + РХ-МС (ELSD): обчислена маса для C8H8FN3S [M+Н] 236,05. Знайдено 236,01. До розчину амідин гідрохлориду (А) (1,8 г, 6,8 ммоль) в H2O (12 мл) при 10ºC додають 10 н NaOH (0,68 мл, 6,8 ммоль), що призводить до утворення білого осаду. Суспензію нагрівають при 100ºC протягом 30 хв, потім охолоджують знову до 10ºC. Потім додають додатковий 10 н NaOH (0,68 мл, 6,8 ммоль), а потім 1-бром-3-хлорпропан (0,67 мл, 6,8 ммоль), все за один раз. Реакційну суміш перемішують при кімнатній температурі протягом ночі, потім екстрагують CH2Cl2. Об'єднані органічні шари промивають насиченим розчином солі, сушать над Na 2SО4 і концентрують з отриманням сульфіду (В) у вигляді безбарвного масла (1,7 г, 96 %). Додаткових спроб очищення продукту не проводять. 1 Н ЯМР (300 МГц, CDCl3) δ 8,6 (с, 1H), 7,8 (д, 1H), 7,6 (д, 1H), 3,8 (с, 2H), 3,6 (т, 2H), 2,6 (т, 2H), 2,0 (квінтет, 2H). 9 UA 112281 C2 5 10 15 20 25 30 До суспензії трет-бутоксиду калію (1,5 г, 13 ммоль) в ТГФ (12 мл) додають краплями HMPA (1,7 мл, 10 ммоль), а потім розчин сульфіду (В) (1,8 г, 6,7 ммоль) в ТГФ (3 мл). Реакційній суміші дозволяють перемішуватися при кімнатній температурі протягом ночі з подальшим концентруванням і очищенням за допомогою хроматографії (Biotage, 40 %-а суміш EtOAc/гексани) з отриманням циклізованого продукту (С) у вигляді оранжевого масла (230 мг, 15 %). 1 Н ЯМР (300 МГц, CDCl3) δ 8,7 (с, 1H), 8,0 (д, 1H), 7,6 (д, 1H), 4,6 (дд, 1H), 3,2 (м, 1H), 3,1 (м, 1H), 2,5 (м, 1H), 2,3 (м, 1H), 2,1-1,9 (м, 2H). До розчину сульфіду (С) (230 мг, 0,99 ммоль) і ціанаміду (83 мг, 2,0 ммоль) в CH 2Cl2 (5 мл) при 0ºC додають йодбензолдіацетат (350 мг, 1,1 ммоль), весь за один раз. Реакційну суміш перемішують протягом 3 годин, потім концентрують і сирий продукт очищають за допомогою хроматографії (chromatotron, 50 %-а суміш ацетон/гексани) з отриманням сульфіліміну (D) у вигляді оранжевого масла (150 мг, суміш діастереомерів, 56 %). H 1 ЯМР (300 МГц, CDCl3) δ 8,8 (с, 1H), 7,9 (д, 1H), 7,8 (д, 1H), 4,8 (дд, 1H), 3,5 (м, 2H), 2,9-2,7 (м, 2H), 2,6 (м, 1H), 2,3 (м, 1H). До розчину mCPBA (80 %, 180 мг, 0,82 ммоль) в EtOH (3 мл) при 0ºC додають розчин K 2CO3 (230 мг, 1,7 ммоль) в H2O (1,5 мл). Розчин перемішують протягом 20 хв, потім додають розчин сульфіліміну (D) (150 мг, 0,55 ммоль) в EtOH (2 мл), весь за один раз. Реакційну суміш перемішують при 0ºC протягом 45 хв, після чого розчинник декантують в окрему колбу і концентрують з отриманням білої твердої речовини. Тверду речовину суспендують в CHCl3, фільтрують і концентрують з отриманням чистого сульфоксіміну (3) у вигляді безбарвного масла (72 мг, 44 %). 1 Н ЯМР (300 МГц, CDCl3) δ (1,5:1 суміш діастереомерів) 8,8 (с, 2H), 8,0 (д, 2H), 7,8 (д, 2H), 4,7 (кв., 1H), 4,6 (кв., 1H), 4,0-3,4 (м, з, 4H), 3,0-2,4 (м, 8H). + РХ-МС (ELSD): обчислена маса для C11H11F3N3OS [M+Н] 290,06. Знайдено 289,99. 4 Приклад III. Отримання (1-{6-[хлор(дифтор)метил]піридин-3-іл}етил)(метил)оксидо-λ сульфаніліденціанаміаду (4) 10 UA 112281 C2 5 10 15 20 25 (3E)-1-Хлор-4-етокси-1,1-дифторбут-3-ен-2-он (7,36 г, 40 ммоль) розчиняють в сухому толуолі (40 мл) і обробляють 3-диметиламіноакрилонітрилом (4,61 г, 48 ммоль) при кімнатній температурі. Розчин нагрівають при 100ºC протягом 3,5 годин. Потім розчинник видаляють при зниженому тиску і суміш, що залишилася, повторно розчиняють в ДМФ (20 мл), обробляють ацетатом амонію (4,62 г, 60 ммоль) і перемішують при кімнатній температурі протягом ночі. До реакційної суміші додають воду і отриману суміш двічі екстрагують сумішшю простий ефір CH2CH2 (1:2,об./об.). Об'єднаний органічний шар промивають насиченим розчином солі, сушать, фільтрують і концентрують. Залишок очищають на силікагелі з отриманням 3,1 г 6[хлор(дифтор)метил]нікотинонітрилу (А) у вигляді світлого масла з виходом 41 %. + ГХ-МС: обчислена маса для C7H3ClF2N2 [M] 188. Знайдено 188. 6-[Хлор(дифтор)метил]нікотинонітрил (А) (3,0 г 15,8 ммоль) розчиняють в безводному простому ефірі (25 мл) і охолоджують на крижаній бані. Розчин 3 M метилмагнію броміду в гексані (6,4 мл, 19 ммоль) додають за допомогою шприца. Після завершення додавання суміш перемішують при 0ºC протягом 5 годин, а потім при кімнатній температурі протягом 10 годин. Реакцію повільно гасять за допомогою водного розчину 1 н лимонної кислоти при 0ºC і отриману суміш перемішують при кімнатній температурі протягом 1 години. pH знову доводять до pH 7 за допомогою насиченого водного розчину NaHCO 3. Дві фази розділяють і водну фазу двічі екстрагують етилацетатом. Об'єднаний органічний шар промивають насиченим розчином солі, сушать над безводним Na2SO4, фільтрують і концентрують. Суміш, що залишилася, очищають на силікагелі з елюіруванням за допомогою 15 % ацетону в гексані з отриманням 0,88 г бажаного продукту 1-{6-[хлор(дифтор)метил]піридин-3-іл}етанону (В) у вигляді коричнюватого масла з виходом 30 %. + ГХ-МС: обчислена маса для C8H6ClF2NO [M] 205. Знайдено 205. 11 UA 112281 C2 5 10 15 20 25 До розчину 1-{6-[хлор(дифтор)метил]піридин-3-іл}етанону (В) (0,85 г, 4,14 ммоль) в MeOH (10 мл) при 0ºC додають NaBH4 (0,16 г, 4,14 ммоль). Суміш перемішують протягом 30 хв і додають 2 M водний розчин HCl доти, поки pH не досягне 7. Розчинник видаляють при зниженому тиску і суміш, що залишилася, екстрагують CH 2Cl2 (2×50 мл). Об'єднаний органічний шар сушать над безводним Na2SO4, фільтрують, концентрують і сушать у вакуумі з отриманням 0,798 г аналітично чистого 1-{6-[хлор(дифтор)метил]піридин-3-іл}етанолу (С) за допомогою ГХМС у вигляді світло-жовтого масла з виходом 93 %. + ГХ-МС: обчислена маса для C8H6ClF2NO [M] 207. Знайдено 207. кімнатна температура До розчину 1-{6-[хлор(дифтор)метил]піридин-3-іл}етанолу (0,78 г, 3,77 ммоль) в CH2Cl2 (40 мл) краплями додають тіонілхлорид (0,54 мл, 7,54 ммоль) при кімнатній температурі. Через 1 годину реакцію повільно гасять насиченим водним розчином NaHCO 3 і дві фази розділяють. Органічний шар сушать над Na2SO4, фільтрують, концентрують і сушать у вакуумі з отриманням 0,83 г сирого 2-[хлор(дифтор)метил]-5-(1-хлоретил)піридину (D) у вигляді коричневого масла з виходом 98 %, яке безпосередньо використовують для реакції на наступній стадії. ГХ-МС: обчислена маса для C8H7Cl2F2N [M]+ 225. Знайдено 225. кімнатна температура До розчину 2-[хлор(дифтор)метил]-5-(1-хлоретил)піридину (D) (0,81 г, 3,6 ммоль) в етанолі (10 мл) додають тіометоксид натрію (0,52 г, 7,4 ммоль) при перемішуванні однією порцією при 0ºC. Через 10 хв суміші дозволяють нагріватися до кімнатної температури і перемішують протягом ночі. Етанол розчинника потім видаляють при зниженому тиску і залишок повторно витягують в суміш простий ефір/CH2Cl2 і насичений розчин солі. Дві фази розділяють і органічний шар екстрагують CH2Cl2 ще раз. Об'єднаний органічний шар сушать над безводним Na2SO4, фільтрують, концентрують, очищають на силікагелі з використанням 5 %-го етилацетату в гексані з отриманням 0,348 г 2-[хлор(дифтор)метил]-5-[1-(метилтіо)етил]піридин (Е) з виходом 40 %. + ГХ-МС: обчислена маса для C9H10ClF2NS [M] 237. Знайдено 237 30 12 UA 112281 C2 5 10 До перемішуваного розчину 2-[хлор(дифтор)метил]-5-[1-(метилтіо)етил]піридин (Е) (0,32 г, 1,35 ммоль) і ціанаміду (0,058 г, 1,35 ммоль) в ТГФ (7 мл) додають йодбензолдіацетат (0,44 г, 1,35 ммоль) однією порцією при 0ºC і отриману суміш перемішують при цій температурі протягом 1 години, а потім при кімнатній температурі протягом 2 годин. Потім розчинник видаляють при зниженому тиску і отриману суміш розчиняють в CH2Cl2, промивають напівнасиченим розчином солі, сушать над безводним Na 2SO4, фільтрують, концентрують і очищають на силікагелі з використанням 50 %-го розчину ацетону в гексані з отриманням 0,175 4 г (1-{6-[хлор(дифтор)метил]піридин-3-іл}етил)(метил)-λ -сульфаніліденціанаміду (F) у вигляді світло-жовтого масла з виходом 48 %. 1 Н ЯМР (300 МГц, CDCl3) δ 8,7 1 (д, J=1,8 Гц, 1H), 7,91 (дд, J=8,4, 1,8 Гц, 1H) 7,78 (д, J=8,4 Гц, 1H), 4,42 (кв., J=6,9 Гц, 1H), 2,64 (с, 3H), 1,92 (д, J=6,9 Гц, 3H). + РХ-МС: обчислена маса для C10H10ClF2N3S [M+Н] 278. Знайдено 278. 4 15 20 25 30 35 До перемішуваного розчину (1-{6-[хлор(дифтор)метил]піридин-3-іл}етил)(метил)-λ сульфаніліденціанаміду (F) (0,16 г, 0,6 ммоль) в етанолі (10 мл) додають 20 %-й водний розчин карбонату калію (1,24 г, 1,8 ммоль) при 0ºC при перемішуванні. Після 10 хв перемішування додають до суміші 80 % mCPBA (0,19 г, приблизно 0,9 ммоль), перемішують при 0ºC протягом 2 годин, після чого реакційну суміш гасять за допомогою шпателя твердого тіосульфату натрію. Велику частину етанолу розчинника видаляють при зниженому тиску і додають водний насичений розчин NaHCO3 - насичений розчин солі (1:1, об./об.), і суміш три рази екстрагують хлороформом. Об'єднаний органічний шар сушать над Na 2SO4, фільтрують і концентрують. Залишок очищають на силікагелі з використанням 35-50 % -го розчину ацетону в гексані як елюент з отриманням 0,092 г продукту (1-{6-[хлор(дифтор)метил]піридин-34 іл}етил)(метил)оксидо-λ -сульфаніліденціанаміду (4) у вигляді безбарвного масла з виходом 57 %. 1 Н ЯМР (300 МГц, CDCl3) δ 8,79 (с, 1H), 8,09 (д, J=8,1 Гц, 1H), 7,80 (д, J=8,1 Гц, 1H), 4,73 (кв., J=7,2 Гц, 1H), 3,16 і 3,11 (2 с, 3H, суміш двох діастереомерних груп α-CH3 між сульфоксіміном і піридиновим хвостом), 2,00 (д, J=7,2 Гц, 3H). + РХ-МС: обчислена маса для C10H10ClF2N3OS [M-I] 292. Знайдено 292. 4 Приклад IV. Отримання [1-(6-трихлорметилпіридин-3-іл)етил](метил)оксидо-1λ сульфаніліденціанаміду (5) Суміш 5-етилпіридин-2-карбонової кислоти (1,98 г, 13 ммоль), фенілфосфонодихлориду (2,8 г, 14,3 ммоль), пентахлориду фосфору (7,7 г, 32 ммоль) перемішують і повільно нагрівають. Після утворення прозорої жовтої рідини суміш нагрівають із зворотним холодильником протягом ночі. Після охолоджування, леткі продукти видаляють при зниженому тиску. Залишок обережно виливають в насичений водний розчин карбонату натрію, охолоджений на крижаній бані. Потім водну фазу екстрагують CH2Cl2 два рази. Об'єднаний органічний шар промивають насиченим розчином солі, сушать над безводним Na2SO4, фільтрують, концентрують і частково очищають 13 UA 112281 C2 5 10 15 20 25 30 на силікагелі за допомогою елюювання за допомогою 10 %-ї суміші EtOAc в гексані з отриманням 2,7 г сирого продукту, що містить як 5-етил-2-(трихлорметил)піридин, так і 5-(1хлоретил)-2-(трихлорметил)піридину в співвідношенні приблизно 3:1 (дані ГХ, маса обчислює + для C8H8Cl3N і C8H7Cl4N [M] 223 і 257 відповідно. Знайдено 223 і 257 відповідно. Суміш розглянутого вище сирого продукту (2,6 г) в чотирихлористому вуглеці (100 мл) потім обробляють 80 %-м розчином N-бромсукциніміду (1,9 г, 11 ммоль) і бензоїлпероксиду (0,66 г, 0,275 ммоль), а потім нагрівають її зворотним холодильником протягом ночі. Твердий продукт відфільтровують, фільтрат концентрують і отриманий залишок очищають на силікагелі з використанням 4 %-го розчину EtOAc в гексані з отриманням 1,0 г бажаного продукту 5-(1брометил)-2-(трихлорметил)піридину (А) у вигляді жовтої твердої речовини. Об'єднаний вихід для двох стадій становить 25 %. + ГХ-МС: обчислена маса для C8H7BrCl3N [M-I-Cl] 266. Знайдено 266. Розчин 5-(1-брометил)-2-(трихлорметил)піридину (А) (0,95 г, 3,14 ммоль) в етанолі (15 мл) обробляють тіометоксидом натрію (0,44 г, 6,29 ммоль) порціями при 0ºC. Суміш перемішують при кімнатній температурі протягом ночі. Потім етанол розчинника видаляють при зниженому тиску і залишок повторно витягують в CH2Cl2 і насиченому розчині солі. Дві фази розділяють і органічний шар сушать над безводним Na2SO4, фільтрують, концентрують. Залишок очищають на силікагелі з використанням 5 %-го розчину EtOAc в гексані з отриманням 0,57 г частково очищеного 5-[1-(метилтіо)етил]-2-(трихлорметил)піридину (В) з виходом 67 % сирого продукту. + ГХ-МС: обчислена маса для C9H10Cl3NS [M] 269. Знайдено 269. До перемішуваного розчину 5-[1-(метилтіо)етил]-2-(трихлорметил)піридину (В) (0,55 г, 2,3 ммоль) і ціанаміду (0,097 г, 2,3 ммоль) в ТГФ (7 мл), охолодженого до 0ºC, додають йодбензолдіацетат (0,75 г, 2,3 ммоль) однією порцією. Отриману суміш перемішують при 0ºC протягом 1 години, а потім при кімнатній температурі протягом 2 годин. Розчинник видаляють у вакуумі і отриману суміш очищають на силікагелі з використанням 50 %-го розчину ацетону в 4 гексані з отриманням 0,254 г (1E)-метил{1-[6-(трихлорметил)піридин-3-іл]етил}-λ сульфаніліденціанаміду (С) у вигляді білуватого твердого продукту з виходом 40 %. 1 Н ЯМР для діастереомерної суміші (300 МГц, d 6-ацетон) δ 8,87 (с, 1H), 8,21-8,25 (м, 2H), 4,65-4,76 (м, 1H), 2,86-2,66 (м, 3H), 1,88-1,92 (м, 3H). 4 35 До перемішуваного розчину (1E)-метил{1-[6-(трихлорметил)піридин-3-іл]етил}-λ сульфаніліденціанаміду (С) (0,20 г, 0,65 ммоль) в етанолі (15 мл) додають 20 %-й водний розчин карбонату калію (1,3 мл) при 0ºC з подальшим додаванням 80 % mCPBA. Отриману суміш перемішують протягом 2 годин при 0ºC, а потім гасять за допомогою твердого 14 UA 112281 C2 5 10 15 20 25 30 тіосульфату натрію. Більшу частину розчинника випарюють і додають водний насичений розчин NaHCO3 - насичений розчин солі 1:1 (об./об.) і суміш три рази екстрагують хлороформом. Об'єднаний органічний шар сушать над безводним Na2SO4, фільтрують і концентрують. Залишок очищають на силікагелі з використанням 40 %-го розчину ацетону в гексані з 4 отриманням 0,10 г [1-(6-трихлорметилпіридин-3-іл)етил](метил)оксидо-λ сульфаніліденціанаміду (5) у вигляді безбарвного масла з виходом 50 %. 1 Н ЯМР (300 МГц, CDCl3) δ 8,83 (з, 1H), 8,12-8,23 (м, 1H), 5,15 (кв., 1H), 3,37 і 3,28 (2с, 3H, суміш двох діастереомерних груп α-CH3 між сульфоксіміном і піридиновим хвостом), 2,03 (д, 3H); + РХ-МС: обчислена маса для C10H12Cl3N3OS [M+1] 328. Знайдено 328. 4 Приклад V. Отримання [1-(6-дифторметилпіридин-3-іл)етил](метил)оксидо-λ сульфаніліденціанаміду (6) До розчину 2-йод-5-бромпіридину (18,4 г, 65 ммоль) в ТГФ (100 мл) при -15ºC додають краплями ізопропілмагнійхлорид (2M, 35 мл, 70 ммоль) при такій швидкості, щоб температура реакції не перевищувала 0ºC. Реакційну суміш перемішують при -15ºC протягом 1 години, потім додають краплями ДМФ (7,5 мл, 97 ммоль) при такій швидкості, щоб температура реакції не перевищувала 0ºC. Реакційну суміш перемішують протягом 30 хв, потім нагрівають до кімнатної температури протягом додаткової 1 години. Реакційну суміш охолоджують знову до 0ºC і додають краплями 2 н HCl (80 мл), підтримуючи температуру нижче 20ºC. Після перемішування протягом 30 хв додають 2 н NaOH доти, поки pH не досягне 7. Потім органічний шарвідділяють і водний шар екстрагують CH2Cl2 (3×). Об'єднані органічні шари сушать над MgSO 4, концентрують і очищають за допомогою флеш-хроматографії (SiO2, 10 % розчин EtOAc/гексани) з отриманням 5-бромпіридин-2-карбальдегіду (А) у вигляді білого твердого продукту (7,3 г, 60 %). 1 Н ЯМР (300 МГц, CDCl3) δ 10,0 (с, 1H), 8,9 (с, 1H), 8,0 (д, 1H), 7,8 (д, 1H). До охолодженого розчину 5-бромпіридин-2-карбальдегіду (А) (7,0 г, 38 ммоль) в CH2Cl2 (300 мл) при -78ºC додають трифторид діетиламіносірки (DAST, 10,8 мл, 83 ммоль). Реакційній суміші дозволяють нагрітися до кімнатної температури протягом 6 годин, потім повільно гасять за допомогою H2O, промивають насиченим водним розчином NaHCO 3 і сушать над Na2SO4. 15 UA 112281 C2 Концентрація і очищення за допомогою шару силікагелю (елюент CH2Cl2) дає 5-бром-2дифторметилпіридин (В) у вигляді коричневих кристалів (5,3 г, 67 %). 1 Н ЯМР (300 МГц, CDCl3) δ 8,8 (с, 1H), 8,0 (д, 1H), 7,6 (д, 1H), 6,6 (т, 1H). 5 10 15 20 25 30 До розчину 5-бром-2-дифторметилпіридину (В) (1,8 г, 8,6 ммоль) в ТГФ (40 мл) при 25ºC додають краплями ізопропілмагній хлорид (2M, 8,6 мл, 17 ммоль). Реакційну суміш дозволяють перемішувати протягом 2 годин, потім додають ДМФ (660 мкл, 8,6 ммоль), і реакційну суміш перемішують протягом додаткових 22 годин. Реакційну суміш гасять за допомогою 2M HCl і підлуговують за допомогою 1M NaOH доти, поки pH не досягне 7. Органічний шар відділяють і водний шар екстрагують CH2Cl2. Об'єднані органічні шари сушать над Na2SO4, концентрують і очищають за допомогою флеш-хроматографії (10 %-й EtOAc/гексани) з отриманням 6дифторметилпіридин-3-карбальдегіду (С) у вигляді оранжевого масла (320 мг, 24 %). До розчину 6-дифторметилпіридин-3-карбальдегіду (С) (500 мг, 3,2 ммоль) в MeOH (10 мл) при 0ºC додають NaBH4 (60 мг, 1,6 ммоль). Реакційну суміш дозволяють перемішувати протягом 30 хв, потім додають 2M HCl доти, поки pH не досягне 2. Отриманий розчин екстрагують за допомогою CH2Cl2 (3×), і об'єднані органічні шари сушать над Na2SO4 і концентрують з отриманням (6-дифторметилпіридин-3-іл)метанолу (D) у вигляді оранжевого масла (420 мг, 82 %), яке використовують на наступній стадії без додаткового очищення. 1 Н ЯМР (300 МГц, CDCl3) δ 8,6 (с, 1H), 7,9 (д, 1H), 7,6 (д, 1H), 6,6 (т, 1H), 4,8 (с, 2H). До розчину (6-дифторметилпіридин-3-іл)метанолу (D) (450 мг, 2,8 ммоль) в CH2Cl2 (10 мл) при кімнатній температурі додають SO2Cl (230 мкл, 3,1 ммоль). Реакційну суміш дозволяють перемішувати протягом 1 години, потім реакційну суміш повільно гасять насиченим водним розчином NaHCO3. Водну фазу екстрагують CH2Cl2 (3×), і об'єднані органічні шари сушать над Na2SO4 і концентрують. Отриманий розчин екстрагують CH2Cl2 (3×) і об'єднані органічні шари сушать над Na2SO4 і концентрують з отриманням 5-хлорметил-2-дифторметилпіридину (Е) у вигляді бурувато-коричневого масла (490 мг, 98 %), яке використовують на наступній стадії без додаткового очищення. 1 Н ЯМР (300 МГц, CDCl3) δ 8,7 (с, 1H), 7,9 (д, 1H), 7,6 (д, 1H), 6,6 (т, 1H), 4,6 (с, 2H). 16 UA 112281 C2 5 10 15 До розчину тіометоксиду натрію (240 мг, 3,3 ммоль) в EtOH (10 мл) при кімнатній температурі додають розчин 5-хлорметил-2-дифторметилпіридину (Е) (490 мг, 2,8 ммоль) в EtOH (3 мл). Реакційну суміш дозволяють перемішувати протягом 9 годин, потім реакційну суміш концентрують, витягують в Et2O і промивають H2O. Органічну фазу сушать над Na2SO4 і концентрують з отриманням 2-дифторметил-5-метилтіометилпіридину (F) у вигляді оранжевого масла (422 мг, 81 %), яке використовують на наступній стадії без додаткового очищення. 1 Н ЯМР (300 МГц, CDCl3) δ 8,6 (с, 1H), 7,8 (д, 1H), 7,6 (д, 1H), 6,6 (т, 1H), 3,7 (с, 2H), 2,0 (с, 3H). 4 [(6-Дифторметилпіридин-3-іл)метил](метил)оксидо-λ -сульфаніліденціанамід (G) синтезують з 2-дифторметил-5-метилтіометилпіридину (F) в дві стадії, як описується в Прикладах I-B і I-C. Виділяють у вигляді білого твердого продукту (вихід 51 %). 1Н ЯМР (300 МГц, CDCl3) δ 8,7 (с, 1H), 8,0 (д, 1H), 7,8 (д, 1H), 6,7 (т, 1H), 4,7 (дд, 2H), 3,2 (с, 3H); + РХ-МС (ELSD): обчислена маса для C9H10F2N3OS [M+Н] , 246. Знайдено 246. 4 20 25 [1-(6-дифторметилпіридин-3-іл)етил](метил)оксидо-λ -сульфаніліденціанамід (6) синтезують 4 з [(6-дифторметилпіридин-3-іл)метил](метил)оксидо-λ -сульфаніліденціанаміду (G) за одну стадію, як описується в Прикладі I. Виділяють у вигляді безбарвного масла (вихід 74 %) і як суміш діастереомерів 1:1. 1Н ЯМР (300 МГц, CDCl3) δ (суміш двох діастереомерів) 8,7 (с, 2H), 8,0 (д, 2H), 7,8 (д, 2H), 6,7 (т, 2H), 4,6 (кв., 2H), 3,1 (с, 3H), 3,0 (с, 3H), 2,0 (д, 6H). + РХ-МС (ELSD): обчислена маса для C10H12F2N3OS [M+Н] , 260. Знайдено 260. 4 Приклад VI. Отримання [1-(6-пентафторетилпіридин-3-іл)етил](метил)оксидо-λ сульфаніліденціанаміду (7) 17 UA 112281 C2 5 10 15 20 25 (Е)-1-етокси-4,4,5,5,5-пентафторпент-1-ен-3-он (1,09 г, 5 ммоль) в безводному простому етиловому ефірі (5 мл) обробляють 1-((Е)-3-метилтіобут-1-енил)піролідином (0,85 г, 5 ммоль) в 2 мл сухого простого ефіру при -15ºC протягом періоду часу 5 хв і реакцію продовжують протягом 20 хв. Потім температурі дозволяють піднятися до кімнатної температури, і реакція продовжується протягом 3 годин. Розчинник видаляють при зниженому тиску і залишок повторно розчиняють в безводному ДМФ (5 мл). Додають ацетат амоній (0,58 г, 7,5 ммоль) і суміш перемішують при кімнатній температурі протягом вихідних. Додають воду і суміш екстрагують простим ефіром три рази. Об'єднаний органічний шар промивають насиченим розчином солі, сушать над безводним Na2SO4, фільтрують, концентрують і очищають на силікагелі, елююючи 8 % розчином EtOAc в гексані (об./об.) з отриманням 0,16 г бажаного 5-(1метилтіоетил)-2-пентафторетилпіридину (А) у вигляді масла коричнюватого кольору з виходом 12 %. + ГХ-МС: обчислена маса для C10H11F2N3S [M] 271. Знайдено 271. До перемішуваного розчину 5-(1-метилтіоетил)-2-пентафторетилпіридину (А) (0,16 г, 0,6 ммоль) і ціанаміду (0,025 г, 0,6 ммоль) в ТГФ (3 мл), охолодженому до 0ºC, додають йодбензолдіацетат (0,19 г, 0,6 ммоль) однією порцією і отриману суміш перемішують при 0ºC протягом 2 годин, а потім при кімнатній температурі протягом ночі. Розчинник видаляють у вакуумі і отриману суміш суспендують в насиченому розчині солі - насиченому розчині NaHCO3 (9:1), який потім два рази екстрагують CH2Cl2-EtOAc (1:1, об./об.). Об'єднаний органічний шар сушать над Na2SO4, фільтрують, концентрують і сушать з отриманням 0,16 г (1-{64 [пентафторетил]піридин-3-іл}етил)(метил)-λ -сульфаніліденціанаміду (В) у вигляді коричнюватого масла з виходом 85 %. + + РХ-МС: обчислена маса для C11H10F5N3S [M] 311,28. Знайдено [M-I] 309,84. 18 UA 112281 C2 5 10 15 20 25 До переміщуваного розчину 80 3-хлорпероксибензойної кислоти (0,17 г, приблизно 0,8 ммоль) в етанолі (3 мл), охолодженого до 0ºC, додають 20 %-й водний розчин карбонату калію (1,0 мл, 1,5 ммоль) і отриману суміш перемішують при 0ºC протягом 20 хв. Потім додають за 4 один раз (1-{6[пентафторетил]піридин-3-іл}етил)(метил)-λ -сульфаніліденціанамід (В) і суміш перемішують при 0ºC протягом 1 години. Реакційну суміш гасять за допомогою малого шпателя твердого тіосульфату натрію. Велику частину розчинника випарюють і додають насичений розчин солі і суміш екстрагують три рази CH 2Cl2. Об'єднаний органічний шар сушать над Na2SO4, фільтрують і концентрують, і залишок очищають на силікагелі з використанням 10 % ацетону в CH2Cl2 (об./об.) з отриманням 0,089 г [1-(6-пентафторетилпіридин-34 іл)етил](метил)оксидо-λ -сульфаніліденціанаміду (7) у вигляді білого твердого продукту з виходом 54 %. + РХ-МС: обчислена маса для C10H10F5N3OS [M]+ 327,28. Знайдено [M-1] 325,83. 4 Приклад VII. Отримання 2-трифторметил-5-(1-{метил(оксидо)[оксидо(оксо)гідразоно]-λ сульфаніл}етил)піридину (8) До розчину 5-(1-метилтіоетил)-2-трифторметилпіридину (2,0 г, 9 ммоль) в CHCl3 (20 мл) при 0ºC протягом 1,5 години додають розчин mCPBA (2,1 г, 10 ммоль) в CHCl 3 (25 мл). Розчин перемішують протягом додаткових 2 годин, потім його концентрують і очищають за допомогою флеш-хроматографії (10 %-й розчин MeOH/CH2Cl2) з отриманням 5-(1-метилсульфінілетил)-2трифторметилпіридину (А) у вигляді жовтого масла (710 мг, 33 %) і як суміш діастереомерів ~2:1. 1 Н ЯМР (300 МГц, CDCl3) δ (головний діастереомер) 8,7 (с, 1H), 7,8 (д, 1H), 7,7 (д, 1H), 4,0 (кв., 1H), 2,4 (с, 3H), 1,75 (д, 3H); (додатковий діастереомер) 8,6 (с, 1H), 7,9 (д, 1H), 7,7 (д, 1H), 3,8 (кв., 1H), 2,3 (с, 3H), 1,8 (д, 3H). + РХ-МС (ELSD): обчислена маса для C9H11F3NOS [M+Н] , 238. Знайдено 238. 19 UA 112281 C2 5 10 15 20 25 До розчину 5-(1-метилсульфінілетил)-2-трифторметилпіридину (А) (600 мг, 2,5 ммоль) в CHCl3 (5 мл) при 0ºC додають азид натрію (260 мг, 4,0 ммоль) і H2SO4 (1 мл). Реакційну суміш нагрівають до 55ºC доти, поки не буде спостерігатися виділення газу, потім її охолоджують знову до кімнатної температури протягом ночі. Рідину декантують в окрему колбу, і сироп, що залишився, розчиняють в H2O, підлуговують Na2CO3 і екстрагують CH2Cl2. Об'єднані органічні шари сушать над Na2SO4, концентрують і очищають за допомогою флеш-хроматографії з отриманням 5-[1-(метилсульфонімідоїл)етил]-2-трифторметилпіридину (В) у вигляді жовтого масла (130 мг, 20 %) і як суміш діастереомерів ~1:1. 1 Н ЯМР (300 МГц, CDCl3) δ (суміш діастереомерів) 8,8 (д, 2H), 8,0 (дд, 2H), 7,8 (д, 2H), 4,4 (м, 2H), 2,9 (с, 3H), 2,85 (с, 3H), 1,8 (м, 6H). + РХ-МС (ELSD): обчислена маса для C9H11F3N2OS [M] , 252. Знайдено 252. До розчину 5-[1-(метилсульфонімідоїл)етил]-2-трифторметилпіридину (В) (100 мг, 0,4 ммоль) в CH2Cl2 (2 мл) при 0ºC додають краплями HNO3 (16 мкл, 0,4 ммоль). До отриманої суспензії додають оцтовий ангідрид (750 мкл) і концентровану H 2SO4 (5 мкл), і суміш нагрівають до 40ºC. Суспензія повільно стає гомогенною протягом 15 хв. Потім розчинник видаляють і сирий залишок розчиняють в H2O. Твердий продукт Na2CO3 додають доти, поки pH не досягне 8, і водну фазу екстрагують CH2Cl2. Об'єднані органічні шари сушать над Na2SO4, концентрують і очищають за допомогою флеш-хромотографії з отриманням 2-трифторметил-5-(14 {метил(оксидо)[оксидо(оксо)гідразоно]-λ -сульфаніл}етил)піридину (8) у вигляді жовтого масла (22 мг, 19 %) і як суміш діастереомерів 1:1. 1 Н ЯМР (300 МГц, CDCb) δ (суміш діастереомерів) 8,8 (д, 2H), 8,1 (м, 2H), 7,8 (м, 2H), 5,1 (кв., 1H), 5,0 (кв., 1H), 3,3 (с, 3H), 3,25 (с, 3H), 2,0 (м, 6H). + РХ-МС (ELSD): обчислена маса для C9H11F3N3O3S [M+Н] , 298. Знайдено 298. 4 Приклад VIII. Отримання [6-(1,1-дифторетил)піридин-3-іл)етил](метил)оксидо-λ сульфаніліденціанаміду (9) 20 UA 112281 C2 5 10 15 20 25 До розчину 5-метил-2-ацетилпіридину (9,9 г, 73,3 ммоль) в CH2Cl2, висушеному на молекулярному ситі (150 мл), додають при кімнатній температурі діетиламіносульфонілтрифторид (DAST) (25,8 г, 260 ммоль) і суміш перемішують при кімнатній температурі протягом ночі. Додають додатково DAST (12 г, 74 ммоль) і реакцію продовжують протягом ще двох днів, після чого додають додатковий DAST (3,8 г, 23 ммоль) і реакцію продовжують протягом ще 3 днів. Після того як реакційну суміш повільно гасять насиченим NaHCO3 при 0ºC, органічну фазу відділяють, сушать над Na2SO4, фільтрують і концентрують. Залишок очищають на силікагелі, елююють 8 % розчином EtOAc в гексані з отриманням 3,91 г 2(1,1-дифторетил)-5-метилпіридину (А) у вигляді світло-коричнюватого масла з виходом 34 %. + ГХ-МС: обчислена маса для C8H9F2N [M] 157. Знайдено 157. Суміш 2-(1,1-дифторетил)-5-метилпіридину (А) (2,0 г, 12,7 ммоль), N-бромсукциніміду (2,2 г, 12,7 ммоль) і бензоїлпероксиду (0,15 г, 0,63 ммоль) в чотирихлористому вуглеці (100 мл) нагрівають із зворотним холодильником протягом ночі. Після видалення твердих продуктів за допомогою фільтрування фільтрат концентрують. Залишок повторно розчиняють в етанолі (40 мл) і додають тіометоксид натрію (1,33 г, 19 ммоль) при кімнатній температурі і перемішують протягом 3 годин. Розчинник видаляють при зниженому тиску і суміш, що залишилася, розчиняють в CH2Cl2 і воді. Після відділення органічний шар сушать над Na2SO4, фільтрують і концентрують. Сирий продукт 2-(1,1-дифторетил)-5-метилтіометилпіридину (В) має чистоту 94 % після ГХ/МС, яку використовують безпосередньо на наступній стадії реакції без додаткового очищення. + ГХ-МС: обчислена маса для C9H11F2NS [M] 203. Знайдено 203. До перемішуваного розчину 2-(1,1-дифторетил)-5-метилтіометилпіридину (В) (1,22 г, 6,0 ммоль) і ціанаміду (0,25 г, 6,0 ммоль) в ТГФ (7 мл), охолодженому до 0ºC, додають 21 UA 112281 C2 5 10 15 20 йодбензолдіацетат (1,93 г, 6,0 ммоль) однією порцією і отриману суміш перемішують при 0ºC протягом 1 години, а потім при кімнатній температурі протягом 2 годин. Розчинник видаляють у вакуумі і отриману суміш очищають на силікагелі з використанням 60 %-го розчину ацетону в 4гексані (об./об.) з отриманням 1,22 г (6-(1,1-дифторетилпіридин-3-іл)[метил](метил)-λ сульфаніліденціанаміду (С) (вихід 84 %) у вигляді коричнюватого масла, яке перетворюється в коричнюватий твердий продукт після стояння в холодильнику протягом ночі. + + РХ-МС: обчислена маса для C10H11F2N3S [M] 243,28. Знайдено [M+1] 244,11. У 100-мілілітрову круглодонну колбу, забезпечену магнітною мішалкою, додатковою лійкою і термометром, завантажують періодат натрію (0,95 г, 4,44 ммоль) і воду (12 мл). Після того як твердий продукт розчиняється, додають 15 мл CH2Cl2, а потім рутеній трихлорид гідрат (0,033 г, 4 0,15 ммоль). [(6-(1,1-дифторетилпіридин-3-іл)метил](метил)-λ -сульфаніліденціанамід (С) (0,72 г, 2,96 ммоль), розчинений в 5 мл CH2Cl2, додають краплями протягом періоду 30 хв. Суміш швидко перемішують при кімнатній температурі протягом 1,5 години, а потім фільтрують через фільтрувальний папір для видалення деяких нерозчинних продуктів. Потім суміш розділяють в роздільній лійці після того, як додають етилацетат, для полегшення розділення. Водну фазу двічі екстрагують CH2Cl2. Об'єднані органічні шари промивають насиченим розчином солі, сушать над сухим Na2SO4, фільтрують, концентрують і швидко очищають на силікагелі за допомогою 70 %-го розчину ацетону в гексані з отриманням 0,652 г бажаного продукту (6-(1,14 дифторетилпіридин-3-іл)[метил](метил)оксидо-λ -сульфаніліденціанаміду (D) у вигляді білого твердого продукту з виходом 87 %. + + РХ-МС: обчислена маса для C10H11F2N3OS [M] 259,28. Знайдено [M+1] 260,02. 4 25 30 35 40 До розчину [(6-(1,1-дифторетилпіридин-3-іл)метил](метил)оксидо-λ -сульфаніліденціанаміду (D) (0,55 г, 2,0 ммоль) і HMPA (0,09 мл, 0,55 ммоль) в 20 мл безводного ТГФ додають краплями 0,5 M калій біс(триметилсиліл)амід в толуолі (4,4 мл, 2,2 ммоль) при -78ºC. Через 45 хв додають за допомогою шприца йодометан (0,14 мл, 2,2 ммоль) однією порцією. Через десять хвилин температурі дозволяють піднятися до 0ºC і суміш продовжують перемішувати протягом 1,5 годин. Реакційну суміш гасять насиченим водним розчином NH 4Cl, розбавленим насиченим розчином солі, екстрагують по одному разу EtOAc і CH2Cl2. Об'єднаний органічний шар сушать над Na2SO4, фільтрують і концентрують. Залишок очищають за допомогою препаративної ВЕРХ 4 з отриманням 0,15 г бажаного [6-(1,1-дифторетил)піридин-3-іл)етил](метил)оксидо-λ сульфаніліденціанаміду (9) з виходом 26 %. + + РХ-МС: обчислена маса для C11H13F2N3OS [M] 273,31. Знайдено [M+1] 274,21. Додаткові деталі відносно Прикладів I-VIII та інших споріднених сполук наводяться в публікації заявки на патент США 2007/0203191 A1, зміст якої включений в цей документ як посилання у всій її повноті. Повинно бути зрозумілим, що композиції за даним винаходом можуть включати сполуки, які можуть існувати як один або декілька стереоізомерів. Наприклад, в певних варіантах здійснення композиції містять суміш стереоізомерів сполуки відповідно до формули (I). Різні стереоізомери можуть включати геометричні ізомери, діастереомери і енантіомери. Таким чином, композиції за даним винаходом можуть містити сполуки як рацемічні суміші, 22 UA 112281 C2 5 10 15 індивідуальні стереоізомери і оптично активні суміші. Фахівцям в даній галузі буде зрозуміло, що один зі стереоізомерів може бути активнішим, ніж інші. Індивідуальні стереоізомери і оптично активні суміші можуть бути отримані за допомогою процедур селективного синтезу за допомогою звичайних процедур синтезу з використанням дозволених вихідних матеріалів або за допомогою звичайних процедур дозволу. Як конкретніший приклад відносно стереоізомерів, сполука {1-[6-(трифторметил)піридин-34 іл]етил](метил}оксидо-λ -сульфаніліденціанаміду, описана в Прикладі I, містить чотири окремі стереоізомери. Ці чотири стереоізомери визначають дві пари діастереомерів, які для цілей цього документа відмічені як діастереомерні групи (А) і (В). Діастереомерна група (А) 4 визначається як {(R)-1-[6-(трифторметил)піридин-3-іл]етил}-(R)-(метил)оксидо-λ 4 сульфаніліденціанамід (A1) і {(S)-1-[6-(трифторметил)піридин-3-іл]етил}-(S)-(метил)оксидо-λ сульфаніліденціанамід (A2), як представлено нижче. Діастереомерна група А 4 {(R)-1-[6-(трифторметил)піридин-3-іл]етил}-(R)-(метил)оксидо-λ -сульфаніліденціанамід (A1) 4 20 {(S)-1-[6-(трифторметил)піридин-3-іл]етил}-(S)-(метил)оксидо-λ -сульфаніліденціанамід (A2) Діастереомерна група (В) визначається як {(R)-1-[6-(трифторметил)піридин-3-іл]етил}-(S)4 (метил)оксидо-λ -сульфаніліденціанамід (B1) і {(S)-1-[6-(трифторметил)піридин-3-іл]етил}-(R)4 (метил)оксидо-λ -сульфаніліденціанамід (B2), як представлено нижче. Діастереомерна група В 4 1 {(R)-1-[6-(трифторметил)піридин-3-іл]етил}-(S)-(метил)оксидо-λ -сульфаніліденціанамід (B ) 23 UA 112281 C2 4 5 10 15 20 25 30 35 40 45 50 55 60 2 {(S)-1-[6-(трифторметил)піридин-3-іл]етил}-(R)-(метил)оксидо-λ -сульфаніліденціанамід (B ) Для композицій, що містять суміш стереоізомерів сполуки відповідно до формули (I), передбачається взаємне перетворення стереоізомерів з часом, воно призводить до співвідношень стереоізомерів, які відрізняються від початкового співвідношення стереоізомерів безпосередньо після синтезу сполуки. Як конкретніший приклад, після початкового синтезу 4 сполуки {1-[6-(трифторметил)піридин-3-іл]етил}(метил)оксидо-λ -сульфаніліденціанаміду діастереомерні групи (А) і (В) присутні в суміші приблизно як 1:2. Однак спостерігається, що можливе взаємне перетворення діастереомерних груп (А) і (В) з часом, при цьому виникають різні проблеми відносно хімічної і фізичної стабільності до композиції, що містить сполуки {1-[64 (трифторметил)піридин-3-іл]етил}(метил)оксидо-λ -сульфаніліденціанаміду. Тепер були несподівано виявлені способи селективного контролю взаємного перетворення стереоізомерів сполуки відповідно до формули (I) в композиції, що містить стереоізомерну суміш сполуки. Наприклад, в одній із форм взаємне перетворення стереоізомерів, присутніх в композиції при першому співвідношенні, прискорюється за допомогою нагрівання композиції, способом, ефективним для отримання другого співвідношення стереоізомерів, що відрізняється від першого співвідношення. У одному з конкретних прикладів цієї форми нагрівання здійснюється при мінімальній температурі приблизно 10ºC протягом щонайменше приблизно 4 годин. У іншому прикладі нагрівання здійснюється при мінімальній температурі приблизно 20ºC протягом щонайменше приблизно 4 годин. Ще в одному прикладі нагрівання здійснюється при мінімальній температурі приблизно 30ºC протягом щонайменше приблизно 4 годин. Ще в іншому прикладі нагрівання здійснюється при мінімальній температурі приблизно 40ºC протягом щонайменше приблизно 4 годин. У іншому прикладі нагрівання здійснюється при мінімальній температурі приблизно 50ºC протягом щонайменше приблизно 4 годин. Ще в одному прикладі нагрівання здійснюється при мінімальній температурі приблизно 60ºC протягом щонайменше приблизно 4 годин. У додатковому прикладі нагрівання здійснюється при мінімальній температурі приблизно 70ºC протягом щонайменше приблизно 4 годин. Ще в одному прикладі нагрівання здійснюється при мінімальній температурі приблизно 80ºC протягом щонайменше приблизно 4 годин. Ще в одному прикладі нагрівання здійснюється при мінімальній температурі приблизно 90ºC протягом щонайменше приблизно 4 годин. У іншому прикладі нагрівання здійснюється при мінімальній температурі приблизно 100ºC протягом щонайменше приблизно 4 годин. Крім того, розглядаються і інші варіанти температури і часу, при яких здійснюється нагрівання. Наприклад, в одній або декількох формах передбачається, що нагрівання може здійснюватися при одній з температур, вказаних вище, але протягом альтернативного періоду часу, наприклад, від приблизно 1 до приблизно 100 годин. У конкретнішій формі, нагрівання здійснюють при одній із вказаних вище температур, від приблизно 2 до приблизно 90 годин. У іншій формі, нагрівання здійснюють при одній із вказаних вище температур від приблизно 4 до приблизно 72 годин. У іншому варіанті передбачається, що нагрівання може здійснюватися при температурі аж до температури трохи нижче температури розкладання або плавлення сполуки відповідно до формули (I) в композиції, запобігаючи тим самим розкладанню сполуки під час нагрівання. Як один з необмежувальних прикладів, коли композиція містить сполуки {1-[64 (трифторметил)піридин-3-іл]етил}(метил)оксидо-λ -сульфаніліденціанаміду, нагрівання повинно здійснюватися при температурі нижче, ніж приблизно 128ºC, яка нижча обох температур плавлення для діастереомерних груп А і В. У іншому конкретнішому прикладі нагрівання здійснюється при температурі 23-70ºC протягом періоду 4-72 години. У іншому прикладі нагрівання здійснюється при температурі 23ºC протягом щонайменше приблизно чотирьох годин. Ще в одному прикладі нагрівання здійснюється при температурі приблизно 54ºC протягом періоду 24-72 години. Ще в одному прикладі нагрівання здійснюється при температурі приблизно 70ºC протягом періоду 4-72 години. У іншому варіанті цього прикладу період вибирається із з 4, 8, 24 і 72 годин. Крім того, розглядаються інші зміни в температурі і часі, при яких здійснюється нагрівання. Наприклад, передбачається, що коли значення для одного з параметрів температури і періоду часу, при яких здійснюється нагрівання, змінюється, значення іншого параметра з температури і періоду часу, при яких здійснюється нагрівання, також може змінюватися. У одній або декількох формах передбачається, що нагрівання може здійснюватися до того, як завершується приготування композиції. Наприклад, в одному з варіантів здійснення композиція, яка містить стереоізомерну суміш сполуки відповідно до формули (I) і по суті не містить інших матеріалів, нагрівається для отримання бажаного взаємного перетворення стереоізомерів. Потім до композиції можуть додаватися один або декілька додаткових матеріалів, таких як фармацевтично прийнятний носій, змочувальний агент, загущувальний 24 UA 112281 C2 5 10 15 20 25 30 35 40 45 50 55 60 агент, інсектицид або антифриз, просто в порядку переліку деяких можливостей. У альтернативному варіанті здійснення композиція, яка містить стереоізомерну суміш сполуки відповідно до формули (I) і щонайменше один інший інсектицид і по суті не містить інших матеріалів, нагрівається для отримання бажаного взаємного перетворення стереоізомерів. Потім в композицію можуть додаватися один або декілька додаткових матеріалів, такі як фармацевтично прийнятний носій, змочувальний агент, загущувальний агент або антифриз просто для того, щоб перерахувати декілька прикладів. Однак розглядаються і інші варіанти відносно того порядку, в якому можуть приготовлятися композиції, описані в цьому документі. Наприклад, в одній або декількох формах приготування композиції може завершуватися до її нагрівання. У доповнення до вказаного вище необхідно зрозуміти, що композиція може зазнавати додаткової обробки після нагрівання, включаючи, наприклад, обробку в кульовому млині, для зменшення розмірів частинок композиції. У одному з варіантів здійснення стереоізомери сполуки відповідно до формули (I) визначають дві пари діастереомерів і нагрівання перетворює щонайменше частину однієї пари діастереомерів в іншу пару діастереомерів, змінюючи тим самим співвідношення діастереомерів сполуки, присутньої в композиції. У конкретнішій формі співвідношення пар діастереоізомерів після нагрівання складає щонайменше приблизно 3:1. У іншій формі співвідношення пар діастереоізомерів після нагрівання більше, ніж приблизно 10:1. Ще в одній формі співвідношення пар діастереоізомерів після нагрівання більше, ніж приблизно 20:1. Ще в іншій формі співвідношення пар діастереоізомерів після нагрівання більше, ніж приблизно 30:1. У іншій формі співвідношення пар діастереоізомерів після нагрівання більше, ніж приблизно 40:1. У додатковій формі співвідношення пар діастереоізомерів після нагрівання більше, ніж приблизно 50:1. У іншій формі співвідношення пар діастереоізомерів після нагрівання більше, ніж приблизно 60:1. Ще в одній формі співвідношення пар діастереоізомерів після нагрівання більше, ніж приблизно 70:1. Ще в одній формі співвідношення пар діастереоізомерів після нагрівання більше, ніж приблизно 80:1. У іншій формі співвідношення пар діастереоізомерів після нагрівання більше, ніж приблизно 90:1. Ще в одній формі співвідношення пар діастереоізомерів після нагрівання складає щонайменше приблизно 100:1. У іншій формі передбачається, що після нагрівання залишається тільки одна пара діастереомерів. У іншій конкретній формі співвідношення пар діастереомерів після нагрівання складає від приблизно 3:1 до приблизно 100:1. Ще в одній формі співвідношення пар діастереомерів після нагрівання складає від приблизно 3:1 до приблизно 50:1. У іншій формі співвідношення пар діастереомерів після нагрівання складає від приблизно 3:1 до приблизно 40:1. Крім того, в іншій формі співвідношення пар діастереомерів після нагрівання складає від приблизно 3:1 до приблизно 39:1. Ще в одній формі співвідношення пар діастереомерів після нагрівання складає від приблизно 19:1 до приблизно 39:1. У іншій формі співвідношення пар діастереомерів після нагрівання складає від приблизно 25:1 до приблизно 39:1. Крім того, в інших формах співвідношення пар діастереомерів після нагрівання становить приблизно 39:1. Необхідно зрозуміти, однак, що розглядаються і інші варіанти співвідношення пар діастереомерів. У іншому варіанті здійснення композиція містить сполуки відповідно до формули (I) у вигляді стереоізомерної суміші, що визначається двома парами діастереомерів. У одній із форм суміш містить відносно загальної маси стереоізомерної суміші в композиції першу пару діастереомерів від приблизно 50 до приблизно 98 % мас. і другу пару діастереомерів від приблизно 2 до приблизно 50 % мас. У іншій формі суміш містить відносно загальної маси стереоізомерної суміші в композиції першу пару діастереомерів від приблизно 60 до приблизно 98 % мас. і другу пару діастереомерів від приблизно 2 до приблизно 40 % мас. У іншій формі суміш містить відносно загальної маси стереоізомерної суміші в композиції першу пару діастереомерів від приблизно 75 до приблизно 98 % мас. і другу пару діастереомерів від приблизно 2 до приблизно 25 % мас. У додатковій формі суміш містить відносно загальної маси стереоізомерної суміші в композиції першу пару діастереомерів від приблизно 85 до приблизно 98 % мас. і другу пару діастереомерів від приблизно 2 до приблизно 15 % мас. Крім того, в іншій формі суміш містить відносно загальної маси стереоізомерної суміші в композиції першу пару діастереомерів від приблизно 90 до приблизно 98 % мас. і другу пару діастереомерів від приблизно 2 до приблизно 10 % мас. У іншій формі суміш містить відносно загальної маси стереоізомерної суміші в композиції першу пару діастереомерів від приблизно 95 до приблизно 98 % мас. і другу пару діастереомерів від приблизно 2 до приблизно 5 % мас. У іншій формі суміш містить відносно загальної маси стереоізомерної суміші в композиції першу пару діастереомерів приблизно 99 % мас. і другу пару діастереомерів приблизно 1 % мас. У додатковій формі суміш містить відносно загальної маси стереоізомерної суміші в композиції приблизно 100 % мас. першої пари діастереомерів. 25 UA 112281 C2 5 10 15 20 25 30 35 40 45 50 55 60 У одній із конкретних форм цього варіанту здійснення сполука відповідно до формули (I) 4 являє собою {1-[6-(трифторметил)піридин-3-іл]етил}(метил)оксидо-λ -сульфаніліденціанамід і перша пара стереоізомерів визначається {(R)-1-[6-(трифторметил)піридин-3-іл]етил}-(R)4 (метил)оксидо-λ -сульфаніліденціанамідом і {(S)-1-[6-(трифторметил)піридин-3-іл]етил}-(S)4 (метил)оксидо-λ -сульфаніліденціанамідом, а друга пара діастереомерів визначається {(R)-1-[64 (трифторметил)піридин-3-іл]етил}-(S)-(метил)оксидо-λ -сульфаніліденціанамідом і (S)(-1-[64 (трифторметил)піридин-3-іл]етил}-(R)-(метил)оксидо-λ -сульфаніліденціанамідом. У іншому варіанті цієї форми стереоізомерна суміш, що має одне із вказаних вище % мас. співвідношень діастереомерів, приготовляється задопомогою нагрівання композиції при температурі від приблизно 20-70ºC протягом періоду від приблизно 4-72 годин. У доповнення до цього або альтернативно передбачається, що в цю форму можуть включатися один або декілька інших інсектицидів. Як один з прикладів композиція може містити спіносин, такий як спінеторам, спіносад або їх суміші. Коли вони присутні, композиція може містити масове співвідношення {14 [6-(трифторметил)піридин-3-іл]етил}(метил)оксидо-λ -сульфаніліденціанаміду і спіносину від приблизно 1:10 до приблизно 10:1. У іншій формі композиція може містити масове 4 співвідношення {1-[6-(трифторметил)піридин-3-іл]етил}(метил)оксидо-λ -сульфаніліденціанаміду і спіносину від приблизно 1:5 до приблизно 5:1. Ще в одній формі композиція може містити 4 масове співвідношення {1-[6-(трифторметил)піридин-3-іл]етил}(метил)оксидо-λ сульфаніліденціанаміду і спіносину від приблизно 1:3 до приблизно 3:1. Ще в одній формі композиція може містити масове співвідношення {1-[6-(трифторметил)піридин-34 іл]етил}(метил)оксидо-λ -сульфаніліденціанаміду і спіносину від приблизно 2:1 до приблизно 2,4:1. 4 Хоч вище описана суміш {1-[6-(трифторметил)піридин-3-іл]етил}(метил)оксидо-λ сульфаніліденціанаміду та інсектициду, такого як спіносин, необхідно зрозуміти, що в певних варіантах здійснення композиція може містити будь-яку сполуку відповідно до формули (I) і один або декілька інших інсектицидів. Наприклад, ці композиції можуть містити сполуки відповідно до формули (I) і спіносин, такий як спінеторам, спіносад, або їх суміші. Коли вони присутні, ці композиції можуть містити масове співвідношення сполуки відповідно до формули (I) та інсектициду від приблизно 1:10 до приблизно 10:1. У іншій формі ці композиції можуть містити масове співвідношення сполуки відповідно до формули (I) та інсектициду від приблизно 1:5 до приблизно 5:1. Ще в одній формі ці композиції можуть містити масові сполуки відповідно до формули (I) та інсектициду від приблизно 1:3 до приблизно 3:1. Композиції за даним винаходом можуть також забезпечуватися фармацевтично прийнятним інертним носієм у формі спреїв, матеріалів для місцевої обробки, гелів, покриттів для зерен, препаратів мікрокапсул, препаратів для системного прийому, приманок, вушних бирок або пластирів, болюсів, фогерів, аерозолів фумігантів, дустів і багато чого іншого. Як правило, препарати наносяться у вигляді водних суспензій або емульсій. Такі суспензії або емульсії отримують з водорозчинних суспендованих або емульсифікованих у воді препаратів, які являють собою (1) тверді продукти, звичайно відомі як змочувані порошки або дисперговані у воді гранули, або (2) рідини, звичайно відомі як емульсифіковані концентрати, водні емульсії, суспензійні концентрати і суспендовані у воді капсули, що містять композицію. Як можна легко зрозуміти, може використовуватися будь-який матеріал, до якого може додаватися композиція, при умові, що він дає бажані корисні властивості без значного негативного впливу на активність композиції як пестициду. Змочувані порошки, які можуть компактуватися, екструдуватися або оброблятися за допомогою диспергування у воді з подальшим сушінням розпиленням або агломерацією в псевдозрідженому шарі з утворенням диспергованих у воді гранул, містить дрібнодисперсну суміш композиції, інертного носія і поверхнево-активних речовин. Концентрація композиції в змочуваному порошку звичайно складає від 10 % до 90 % мас. відносно загальної маси змочуваного порошку, більш переважно від 25 % мас. до 75 % маси. При приготуванні препаратів змочуваних порошків композиція може компаундуватися з дрібнодисперсним твердим матеріалом, таким як профіліт, тальк, крейда, гіпс, Фулерова земля, бентоніт, атапульгіт, крохмаль, казеїн, глютен, монтморилонітові глини, діатомові землі, очищені силікати або що-небудь подібне. При таких операціях дрібнодисперсний носій і поверхнево-активні речовини, як правило, змішуються з композицією і подрібнюються. Емульсифіковані концентрати композиції містять зручну концентрацію, наприклад від 5 % мас. до 75 % мас., композиції у відповідній рідині відносно загальної маси концентрату. Композицію розчиняють в інертному носії, який являє собою або воду, розчинник, що змішується з водою, розчинник, що не змішується з водою, або їх суміш і емульсифікатори. Концентрати можуть розбавлятися водою і маслом з формуванням розпилювальних сумішей у 26 UA 112281 C2 5 10 15 20 25 30 35 40 45 50 55 60 формі емульсій типу масло-у-воді. Придатні для використання органічні розчинники включають ароматичні сполуки, зокрема висококиплячінафталінові і олефінові фракції нафти, такі як важка ароматична нафта. Можуть також використовуватися інші органічні розчинники, такі, наприклад, як терпенові розчинники, включаючи похідні каніфолі, аліфатичні кетони, такі як циклогексанон, і складні спирти, такі як 2-етоксіетанол. Емульсифікатори, які можуть використовуватися в цьому документі з перевагами, можуть легко визначатися фахівцями в даній галузі, і вони включають різні неіонні, аніонні, катіонні і амфотерні емульсифікатори або суміш двох або більше емульсифікаторів. Приклади неіонних емульсифікаторів, придатних при приготуванні емульсифікованих концентратів, включають простий ефір поліалкіленгліколей і продукти конденсації алкіл- і арилфенолів, аліфатичних спиртів, аліфатичних амінів або жирних кислот з етиленоксидом, пропіленоксидами, такі як етоксиловані алкілфеноли і складний ефір карбонових кислот, солюбілізовані за допомогою поліолу або поліоксіалкілену. Катіонні емульсифікатори включають сполуки четвертинного амонію і солі амінів жирних кислот. Аніонні емульсифікатори включають маслорозчинні солі (наприклад, кальцію) алкіларилсульфонових кислот, маслорозчинні солі або простий ефір сульфатованих полігліколей і відповідні солі простого ефіру фосфатованих полігліколей. Репрезентативні органічні рідини, які можуть використовуватися при приготуванні емульсифікованих концентратів композиції, являють собою ароматичні рідини, такі як фракції ксилолу, пропілбензолу; або змішані нафталінові фракції, мінеральні масла, заміщені ароматичні органічні рідини, такі як діоктилфталат; гас; діалкіламіди різних жирних кислот, зокрема, диметиламіди жирних гліколей і похідних гліколей, такі як простий н-бутиловий ефір, простий етиловий ефір або простий метиловий ефір діетиленгліколю і простий метиловий ефір тріетиленгліколю, і т. п. Суміші двох або більше органічних рідин можуть також використовуватися при приготуванні емульсифікованого концентрату. Переважні органічні рідини включають фракції ксилолу і пропілбензолу, при цьому фракції пропілбензолу є найбільш переважними. Поверхнево-активні емульсифікуючі агенти, як правило, використовуються в рідких препаратах і в кількості від 0,1 до 20 % мас. відносно об'єднаної маси емульсифікованого агента і композиції. Препарати, що містять композицію за даним винаходом, можуть також містити інші сумісні добавки, наприклад, акарициди, інсектициди, регулювальники зростання рослин, інші фунгіциди, та інші біологічно активні сполуки, використовувані в землеробстві. Водні суспензії містять суспензії композицій, дисперговані у водному наповнювачі, при концентрації в межах від 5 до 50 % мас. відносно загальної маси водної суспензії. Водні суспензії готують за допомогою енергійного перемішування композиції за даним винаходом або її розчину, в наповнювачі, що складається з води і поверхнево-активних речовин, вибраних з тих типів, які обговорюються вище. Інші компоненти, такі як неорганічні солі і синтетичні або природні смоли, також можуть додаватися для збільшення щільності і в'язкості водного наповнювача. Приклади водних суспензій включають суспензії крапель масла (EW), твердих продуктів (SC) і капсул (CS). Композиція може також наноситися у вигляді гранульованих препаратів, які є особливо придатними для нанесення на грунт. Гранульовані препарати звичайно містять від 0,5 до 10 % мас., відносно загальної маси, гранульованого препарату композиції, диспергованого в інертному носії, який складається повністю або здебільшого із грубо перемолотого інертного матеріалу, такого як атапульгіт, бентоніт, діатоміт, глина або схожа недорога речовина. Такі препарати звичайно готують за допомогою розбавлення композиції у відповідному розчиннику і нанесення її на гранульований носій, який заздалегідь формується з відповідним розміром частинок, в межах від 0,5 до 3 мм. Придатний для використання розчинник являє собою розчинник, в якому сполука є по суті або повністю розчинною. Такі препарати можуть також бути отримані за допомогою отримання тесту або пасти носія і композиції, і розчинника, і подрібнення, і сушіння з отриманням бажаних гранульованих частинок. Композиція за даним винаходом може також наноситися у вигляді диспергованих у воді гранул або сухого сипкого препарату. Дисперговані у воді гранули, як правило, складають від 10 до 70 % композиції, відносно загальної маси препарату. Такі препарати, як правило, отримують за допомогою змішування і/або розпилення суміші над носієм, з додаванням диспергуючого і/або змочувального агента, і об'єднання з водою з отриманням суміші, придатної для подальшої переробки з використанням добре відомих технологій гранулювання, таких як гранулювання на піддоні, екструзія, сушка розпиленням, скупчення в псевдозрідженому шарі і т. п. Дусти, що містять композицію, можуть бути отримані за допомогою ретельного перемішування композиції разом з відповідним пилоподібним сільськогосподарським носієм, 27 UA 112281 C2 5 10 15 20 25 30 35 таким, наприклад, як каолінова глина, подрібнена вулканічна порода, і т. п. Дусти можуть, відповідно, містити від 1 до 10 % мас. композиції відносно загальної маси дусту. Дусти можуть також бути отримані за допомогою просочення композицією носія способом, схожим з тим, який описаний вище для гранул. Препарати за даним винаходом можуть додатково містити допоміжні поверхнево-активні речовини для поліпшення осадження, змочування і проникнення композицій в цільову сільськогосподарську культуру і організм. Ці допоміжні поверхнево-активні речовини можуть необов'язково використовуватися як компонент препарату або як суміш, що міститься в танку. Кількість допоміжної поверхнево-активної речовини буде, як правило, змінюватися від 0,01 до 1,0 % об., відносно розпилювального об'єму води, переважно, від 0,05 до 0,5 %об. Відповідні допоміжні поверхнево-активні речовини включають, але не обмежуючись цим, етоксиловані нонілфеноли, етоксиловані синтетичні або природні спирти, солі складного ефіру або сульфоянтарних кислот, етоксиловані органосилікони, етоксиловані жирні аміни і суміші поверхнево-активних речовин з мінеральними або рослинними маслами. Приклад IX. Отримання композиції, що містить стереоізомерну суміш (1-[64 (трифторметил)піридин-3-іл]етил}(метил)оксидо-λ -сульфаніліденціанаміду 1 літр загального об'єму (загальна маса ~1100 г) продукту суспендованого концентрату, що 4 має концентрацію 240 г/л {1-[6-(трифторметил)піридин-3-іл]етил}(метил)оксидо-λ сульфаніліденціанаміду з приблизним співвідношенням діастереомерних груп А і В 1:2, готують за допомогою додавання спочатку деіонізованої води в чисту хімічну склянку, забезпечену механічною мішалкою. Потім в хімічну склянку додають наступні інгредієнти, в будь-якому порядку при безперервному перемішуванні: 3,5 г Agniqueо® DFM 112S, придушувача піноутворення на основі кремнію, комерційно доступного від Cognis Group, штаб-квартира в Monheim, Germany; 20 г Tersperseо® 2500, полімерної поверхнево-активної речовини, комерційно доступної від Huntsman Performance Products, 10003 Woodloch Forest Drive, The Woodlands, TX 77380; 30 г Morwetо® D-360, поверхнево-активної речовини, комерційно доступної від Akzo Nobel Surfactants, 525 W. Van Buren St., Chicago, IL 60607; 20 г Ethylanо® NS 500 LQ, поверхнево-активної речовини, комерційно доступної від Akzo Nobel Surfactants, 525 W. Van Buren St., Chicago, IL 60607; 40 г пропіленгліколю; 1 г Proxelо® GXL, розчину мікробіостатику, комерційно доступного від Arch Chemicals, Inc., 1955 Lake Drive, Suite 100, Smyrna, GA 30080. Потім в хімічну склянку додають 240 г {1-[6-(трифторметил)піридин-34 іл]етил}(метил)оксидо-λ -сульфаніліденціанаміду з подальшим додаванням 10 г Avicel® CL-611, стабілізатора, комерційно доступного від FMC BioPOlymer, 1735 Market Street, Philadelphia, PA 19103, і 2 г Kelzan, ксантанової смоли, комерційно доступної від CP Kelco, 1000 Parkwood Circle, Suite 1000, Atlanta, GA 30339. Інгредієнти перемішують доти, поки не вийде гомогенна суміш. Потім суміш перемелюють за допомогою кульового млина до середнього розміру частинок 3-5 мкм. Кінцевий препарат цього продукту суспендованого концентрату наведений в Таблиці 1. Таблиця 1 Інгредієнти 4 {1-[6-(трифторметил)піридин-3-іл]етил}(метил)оксидо-λ сульфаніліденціанамід Agnique® DFM 112S Avicel® CL-611 Tersperse® 2500 Morwet® D-360 Ethylan® NS 500 LQ Пропіленгліколь Proxel® GXL Kelzan® Вода 40 45 г/л 240 3,5 10 20 30 20 40 1 2 Залишок Композицію, що має загальний об'єм 160 мл, готують за допомогою об'єднання 80 мл продукту суспендованого концентрату, описаного вище, що має концентрацію 240 г/л {1-[64 (трифторметил)піридин-3-іл]етил}(метил)оксидо-λ -сульфаніліденціанаміду, і 80 мл Radiant® SC, препарату інсектициду, що має концентрацію 120 г/л спінетораму і комерційно доступного від Dow AgroSciences, LLC, 9330 Zionsville Road, Indianapolis, IN 46268. Композицію ретельно перемішують до отримання гомогенної консистенції. Потім шістнадцять індивідуальних 10 28
ДивитисяДодаткова інформація
Назва патенту англійськоюStable insecticide compositions and methods for producing same
Автори російськоюQin, Kuide, Boucher, Raymond, E.
МПК / Мітки
МПК: C07D 213/26, C07D 409/04, A01N 43/10, C07D 213/34, A01P 7/04, A01N 47/40
Мітки: композиції, стабільні, інсектицидні, способи, отримання
Код посилання
<a href="https://ua.patents.su/40-112281-stabilni-insekticidni-kompozici-i-sposobi-kh-otrimannya.html" target="_blank" rel="follow" title="База патентів України">Стабільні інсектицидні композиції і способи їх отримання</a>
Попередній патент: Упаковка з повторно закупорюваним фіксатором, тверда упаковка з уф-отверджуваним закупорювальним засобом та спосіб формування упаковки з повторно закупорюваним фіксатором
Наступний патент: Антагоніст толл-подібного рецептора 3
Випадковий патент: Безперервний процес попередньої обробки лігноцелюлозної сировини