Застосування інгібітору il-18 для лікування і/або попередження алкогольного гепатиту
Номер патенту: 94022
Опубліковано: 11.04.2011
Автори: Шватшко Йоланд, Ван Девентер Сантер, Платер-Зіберк Крістін, Дінарелло Чарльз А., Рубінштейн Менахем, Кім Соо Хіун, Новік Даніела
Формула / Реферат
1. Застосування інгібітору IL-18, що вибраний з антитіла проти IL-18 і IL-18-зв'язуючого білка, або ізоформ, мутеїнів, злитих білків, функціональних похідних, активних фракцій або похідних із циклічною перестановкою, що мають по суті таку ж активність, як і IL-18-зв'язуючий білок, для виготовлення лікарського засобу для лікування і/або попередження алкогольного гепатиту.
2. Застосування за п. 1, де антитіло до IL-18 являє собою гуманізоване антитіло до IL-18.
3. Застосування за п. 1, де антитіло до IL-18 являє собою антитіло до IL-18 людини.
4. Застосування за п. 1, де IL-18-зв'язуючий білок оброблений поліетиленгліколем.
5. Застосування за п. 1, де інгібітор IL-18 являє собою злитий білок, що містить весь IL-18-зв'язуючий білок або його частину, злитий з усім імуноглобуліном або його частиною, і де злитий білок зв'язується з IL-18.
6. Застосування за п. 5, де злитий білок містить всю константну ділянку імуноглобуліну або її частину.
7. Застосування за п. 6, де імуноглобулін є ізотипом IgGl або IgG2.
8. Застосування за будь-яким з попередніх пунктів, де лікарський засіб містить також інтерферон.
9. Застосування за п. 8, де інтерферон являє собою інтерферон-β.
10. Застосування за п. 8 або 9, де інгібітор IL-18 застосовується одночасно, послідовно або окремо від інтерферону.
11. Застосування за будь-яким з попередніх пунктів, де лікарський засіб містить також антагоніст фактора некрозу пухлини (TNF).
12. Застосування за п. 11, де антагоніст TNF являє собою ТВРІ і/або ТВРІІ.
13. Застосування за п. 11 або 12, де інгібітор IL-18 і/або інтерферон застосовується одночасно, послідовно або окремо від антагоніста TNF.
14. Застосування за будь-яким з попередніх пунктів, де лікарський засіб містить також інгібітор СОХ.
15. Застосування за п. 14, де інгібітор СОХ являє собою інгібітор СОХ-2.
16. Застосування за будь-яким з попередніх пунктів, де інгібітор IL-18 застосовується в кількості приблизно 0,4-4 мг на кг маси тіла.
17. Застосування за будь-яким з попередніх пунктів, де інгібітор IL-18 застосовується в кількості приблизно 1 мкг на кг маси тіла.
18. Застосування за будь-яким з попередніх пунктів, де інгібітор IL-18 вводять підшкірно.
19. Застосування за будь-яким з попередніх пунктів, де інгібітор IL-18 вводять внутрішньом'язово.
20. Застосування за будь-яким з попередніх пунктів, де інгібітор IL-18 вводять щодня.
21. Застосування за будь-яким з попередніх пунктів, де інгібітор IL-18 вводять через день.
22. Застосування експресуючого вектора, що містить кодуючу послідовність IL-18-зв'язуючого білка, для виготовлення лікарського засобу для лікування і/або попередження алкогольного гепатиту.
23. Застосування за п. 22 для генної терапії.
24. Застосування клітини, генетично модифікованої для продукування IL-18-зв'язуючого білка, при виготовленні лікарського засобу для лікування і/або попередження алкогольного гепатиту.
Текст
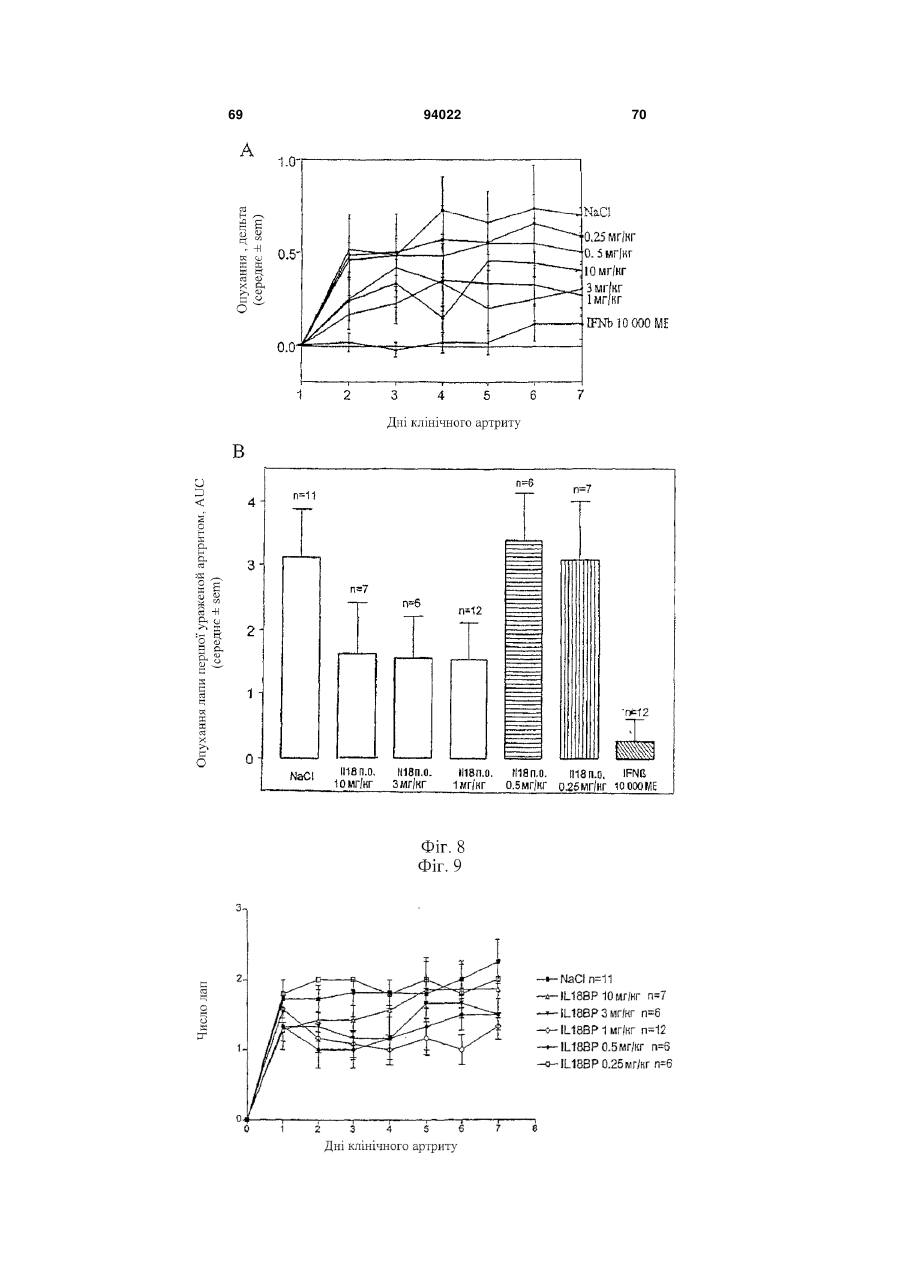
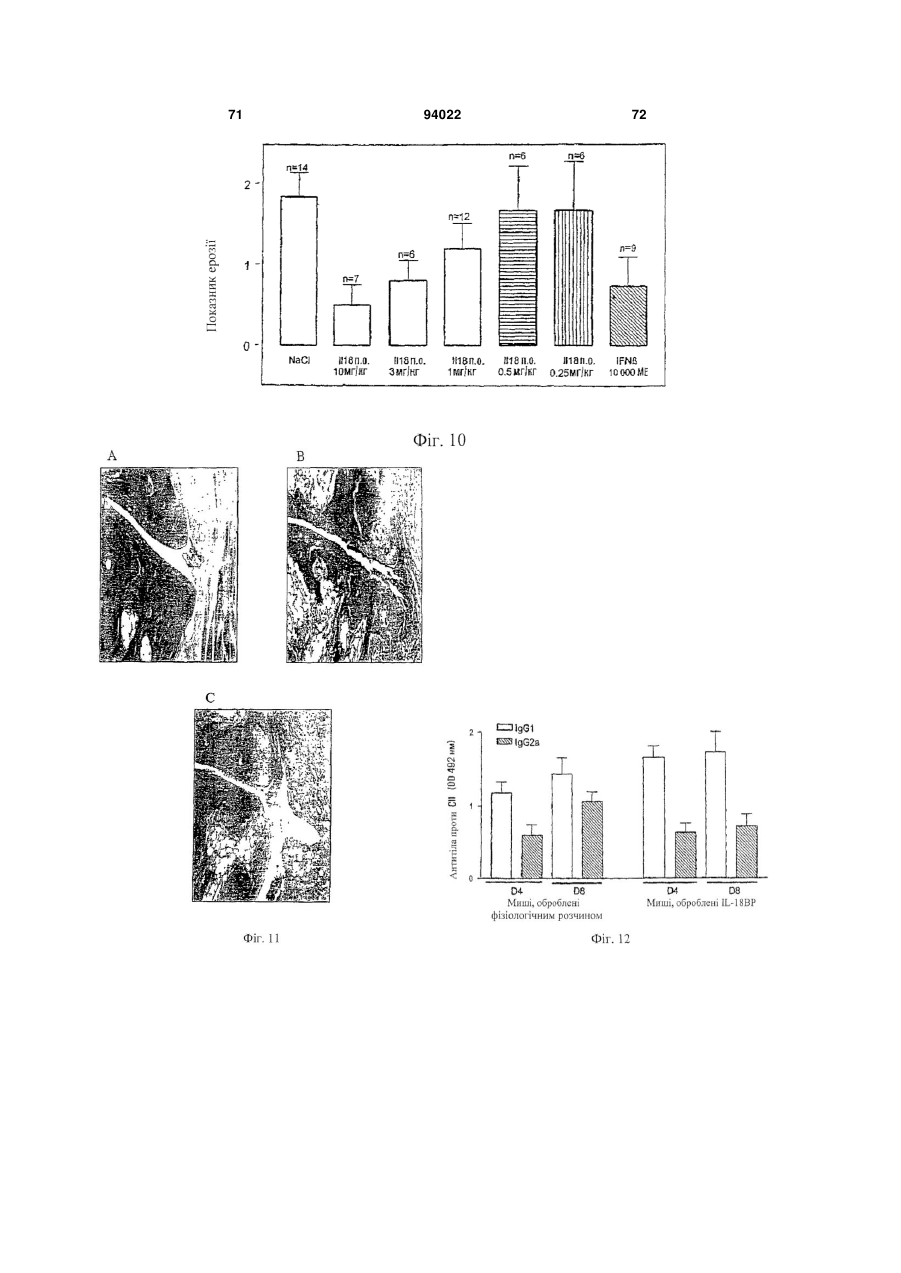
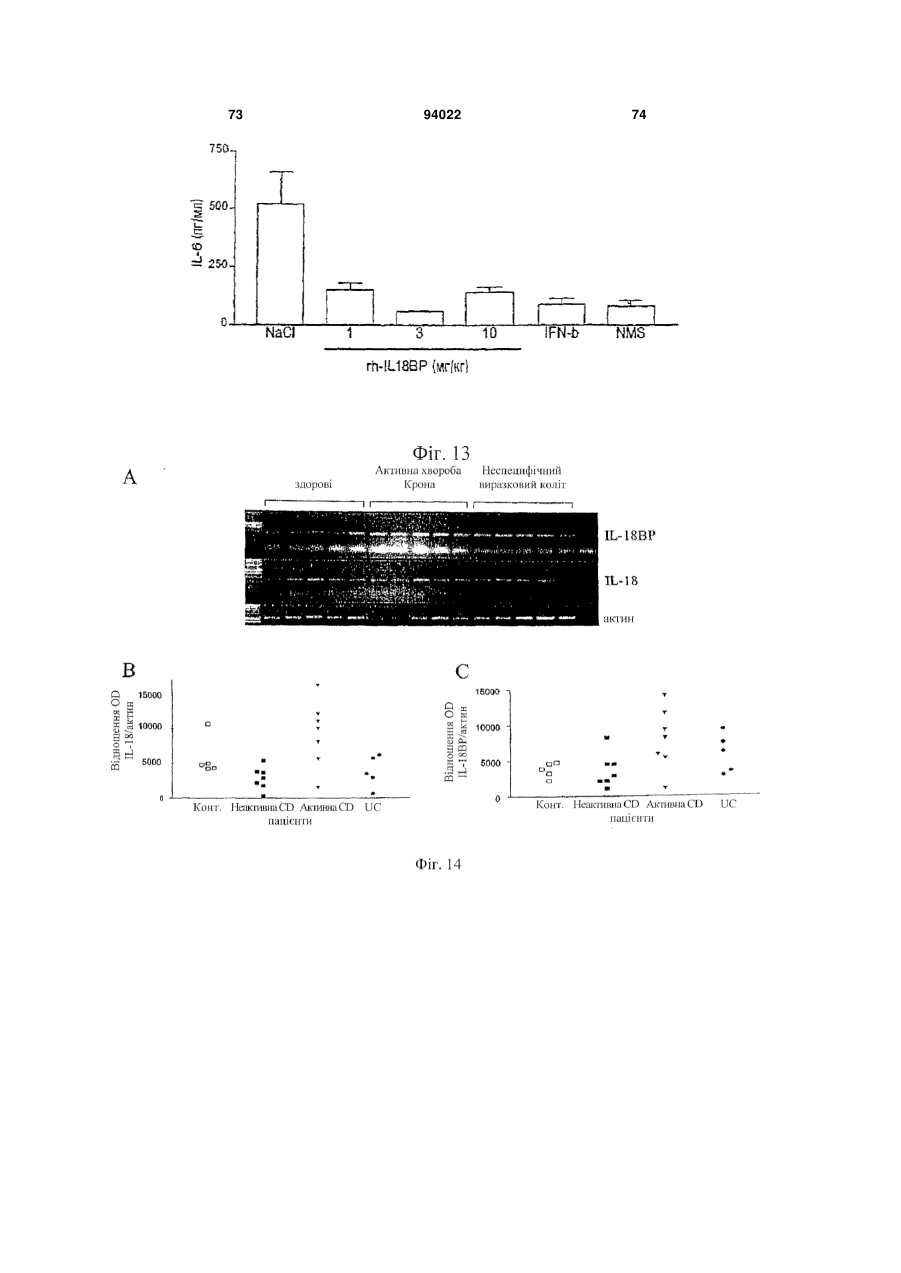
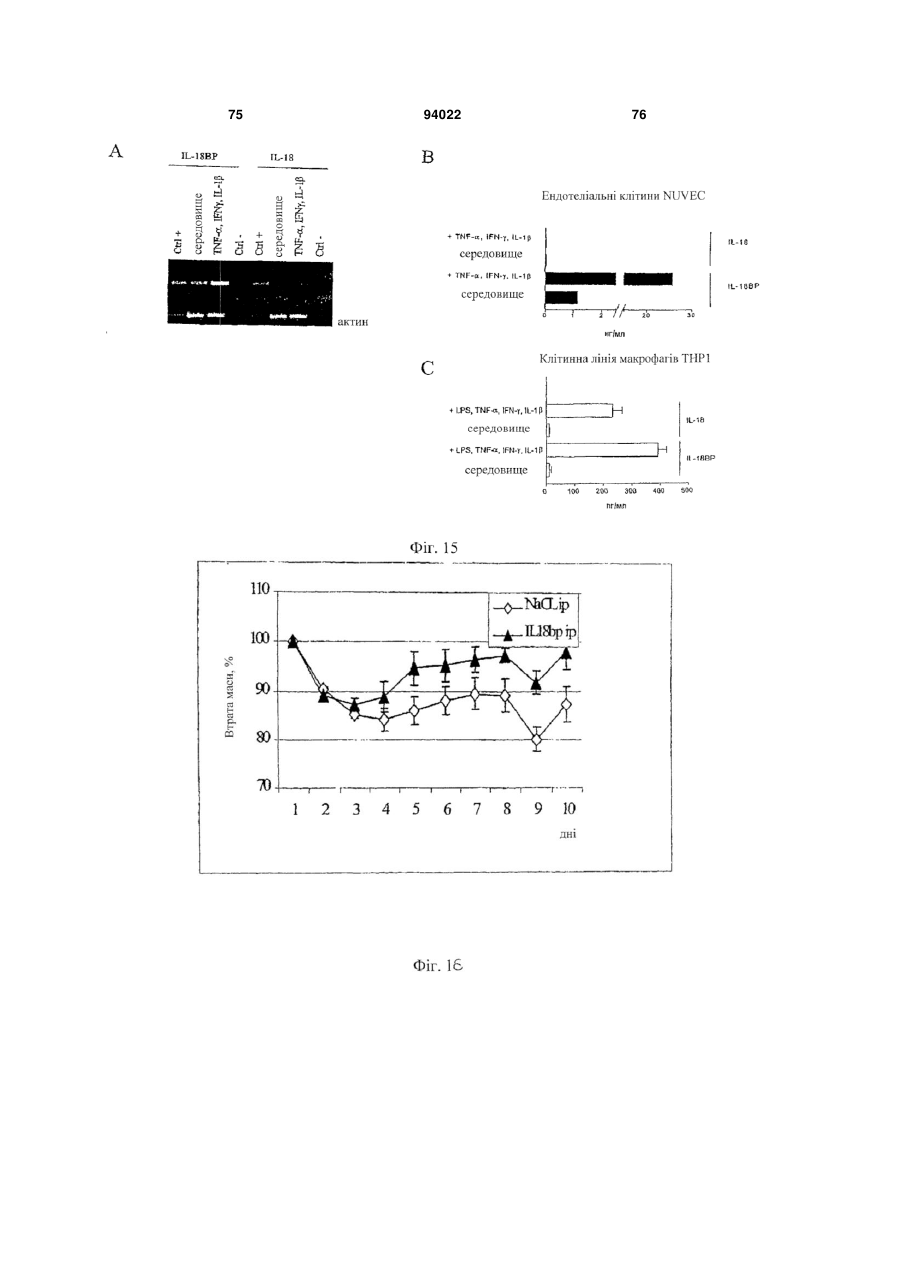
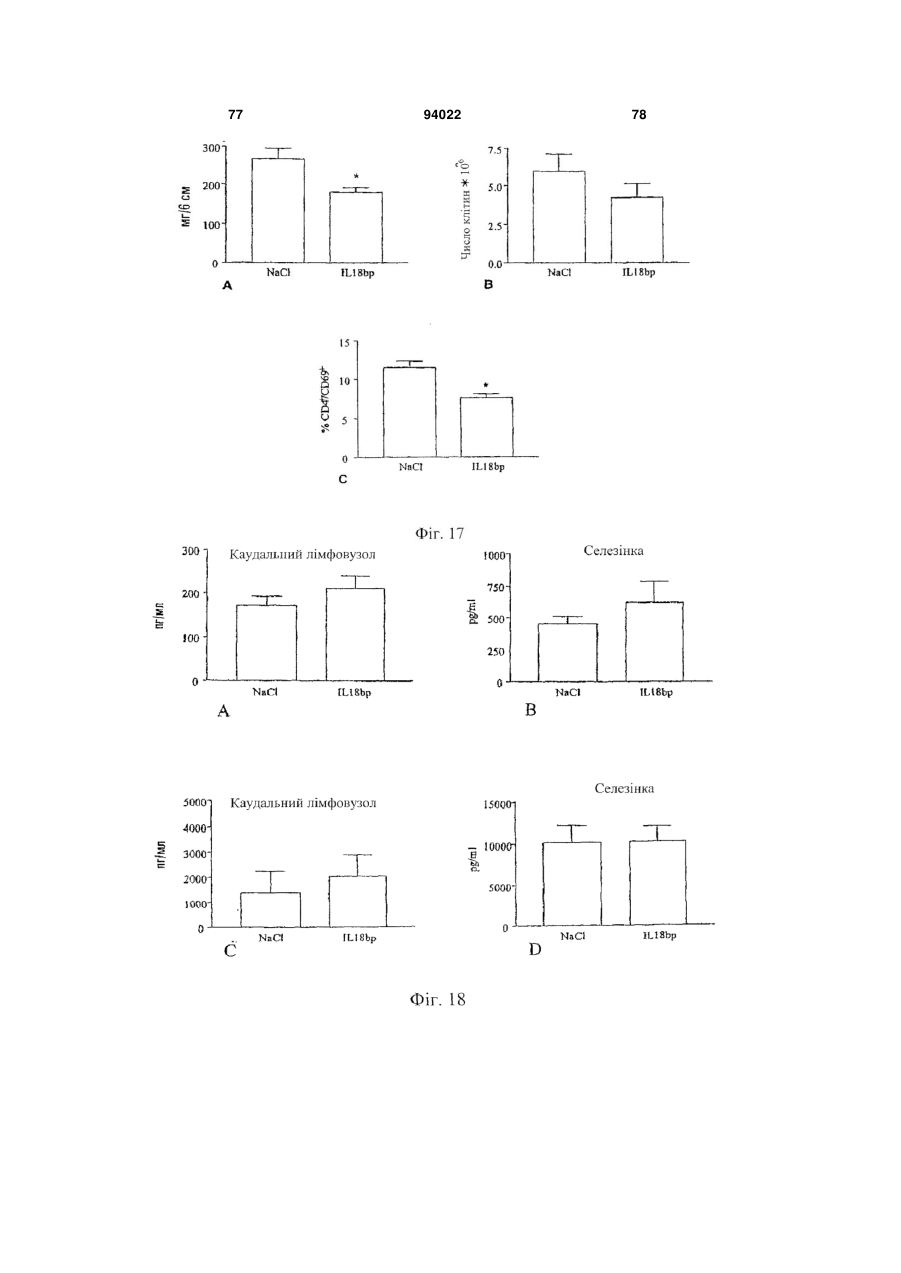
1. Застосування інгібітору IL-18, що вибраний з антитіла проти IL-18 і IL-18-зв'язуючого білка, або ізоформ, мутеїнів, злитих білків, функціональних похідних, активних фракцій або похідних із циклічною перестановкою, що мають по суті таку ж активність, як і IL-18-зв'язуючий білок, для виготовлення лікарського засобу для лікування і/або попередження алкогольного гепатиту. 2. Застосування за п. 1, де антитіло до IL-18 являє собою гуманізоване антитіло до IL-18. 3. Застосування за п. 1, де антитіло до IL-18 являє собою антитіло до IL-18 людини. 2 (19) 1 3 94022 4 21. Застосування за будь-яким з попередніх пунктів, де інгібітор IL-18 вводять через день. 22. Застосування експресуючого вектора, що містить кодуючу послідовність IL-18-зв'язуючого білка, для виготовлення лікарського засобу для лікування і/або попередження алкогольного гепатиту. 23. Застосування за п. 22 для генної терапії. 24. Застосування клітини, генетично модифікованої для продукування IL-18-зв'язуючого білка, при виготовленні лікарського засобу для лікування і/або попередження алкогольного гепатиту. Галузь техніки, до якої відноситься винахід Даний винахід відноситься до лікувального застосування інгібіторів IL-18 при деяких паталогічних станах. Конкретніше, винахід відноситься до лікування і/або попередження артриту, до лікування і/або попередження хвороб печінки і до лікування і/або попередження запальних захворювань кишечнику (IBD). Передумови створення винаходу В 1989 описана ендотоксиніндукована сироваткова активність, яка індукує інтерферон- (EFN-), одержаний з клітин селезінки миші (Micallef et al., 1996). Така сироваткова активність діє не як прямий індуктор IFN-, а як спів стимулятор разом з IL-2 або мітогенами. При спробі виділити активність в чистому вигляді з постендотоксинної мишачої сироватки виявили явно гомогенний білок в 50-55 кДа. Оскільки інші цитокіни можуть діяти як співстимулятори для продукування IFN-, неефективність нейтралізуючих антитіл до IL-1, IL-4, IL-5, IL-6 або TNF для нейтралізації сироваткової активності дозволила передбачити, що вона є особливим фактором. У 1995 ті ж вчені показали, що ендоксиніндукований співстимулятор для продукування IFN- присутній в екстрактах печінки мишей, заздалегідь кондиціонованих P. acnes (Novick et al., 1992). На даній моделі росте популяція печінкових макрофагів (клітини Купфера), і у таких мишей низька доза бактерійного ліпополісахариду (LPS), не летальна для мишей, заздалегідь некондиціонованих, стає летальною. Фактор, названий IFN--індукуючим фактором (IGIF), а пізніше названий інтерлейкіном-18 (IL-18), виділений в чистому вигляді з 1200 г печінки мишей, оброблених P. acnes. Вироджені олігонуклеотиди, одержані з амінокислотних послідовностей очищеного IL18, використали для клонування кДНК мишачого IL-18 (Novick et al., 1992). IL-18 являє собою білок в 18-19 кДа з 157 амінокислот, що не володіє явною подібністю з яким-небудь пептидом в базі даних. Матричні РНК IL-18 і інтерлейкіну-12 (IL-12) добре виявляються в клітинах Купфера і активованих макрофагах. Рекомбінантний IL-18 індукує IFN-гамма сильніше, ніж IL-12, очевидно, через окремий каскад (Novick et al., 1992). Подібно ендотоксиніндукованій сироватковій активності, IL-18 сам не індукує IFN-, а діє насамперед як співстимулятор з мітогенами або IL-2. IL-18 посилює клітинну проліферацію, очевидно, через IL-2залежний каскад, і посилює продукування цитокінів Th1 in vitro і виявляє синергізм при поєднанні з IL-2 у значенні посиленого продукування IFN- (Malizewski et al., 1990). Показано, що нейтралізуючі антитіла до мишачого IL-18 запобігають летальності низької дози LPS для мишей, заздалегідь кондиціонованих P. acnes. Є інші повідомлення про важливість IFN-γ як медіатора летальності LPS у заздалегідь кондиціонованих мишей. Наприклад, нейтралізуючі анти-IFN--антитіла захищають мишей від шоку, подібного шоку Шварцмана (Fantuzzi et al., 1998), і оброблені галактозаміном миші з недоліком в IFN- рецепторах були стійкі до LPS загибелі, що викликається (Вут, 1990). Тому не стало несподіванкою, що нейтралізуючі антитіла до мишачого IL-18 захищають мишей, заздалегідь кондиціонованих P. acnes, від летального LPS (Novick et al., 1992). Обробка антимишачим IL-18 також захищала мишей, що вижили від важкої печінкової цитотоксичності. Після того, як була клонована мишача форма, в 1996 з'явилося повідомлення про послідовність кДНК для IL-18 людини (Okamura et al., 1995). Рекомбінантний IL-18 людини виявляє природну IL18-активність (Okamura et al., 1995). Рекомбінантний IL-18 людини не виявляє прямої IFN-індукуючої активності у відношенні Т-клітин людини, але діє як співстимулятор продукування IFN- і інших цитокінів Т-хелперних клітин-1 (Th1) (Okamura et al., 1995). На сьогоднішній день IL-18 розглядають насамперед як співстимулятор продукування цитокінів Th1 (IFN-, IL-2 і колонієстимулюючого фактора гранулоцитів-макрофагів) (Izaki, 1978), а також як співстимулятор FAS-лігандопосередкованої цитотоксичності мишачих клонів клітин природних кілерів (Novick et al., 1989). Шляхом клонування IL-18 із уражених тканин і дослідження експресії гена IL-18 виявлений тісний зв'язок цього цитокіну з аутоімунною хворобою. У миші з діабетом, не пов'язаним з ожирінням (NOD), спонтанно розвивається аутоімунний інсуліт і діабет, які можна прискорити і синхронізувати однією ін'єкцією циклофосфаміду. На ранніх стадіях інсуліту у підшлунковій залозі NOD-миші методом ПЛР із зворотною транкрипцією показана наявність мРНК IL-18. Рівні мРНК IL-18 швидко підвищуються після обробки циклофосфамідом і передують зростанню рівня мРНК IFN- і потім розвитку діабету. Представляє інтерес те, що така кінетика нагадує кінетику мРНК IL-12-p40, причому одержують тісну кореляцію рівнів окремих мРНК. Клонування кДНК IL-18 з РНК підшлункової залози з подальшим секвенуванням показує ідентичність з послідовністю IL-18, клонованою з клітин Купфера і заздалегідь активованих in vivo макрофагів. Також макрофаги NOD-миші відповідали на циклофосфамід експресією гена IL-18, в той час як макрофаги паралельно оброблених мишей Balb/c не реагували. Отже, експресія IL-18 у аутоімунної 5 NOD-миші регулюється аномально і тісно пов'язана з розвитком діабету (Novick et al., 1992). IL-18 грає можливу роль в імунорегуляції або в запаленні шляхом збільшення функціональної активності Fas-ліганду на клітинах Th1 (Conti et al., 1997). IL-18 також експресується в корковій речовині надниркової залози і, отже, може являти собою секретований нейромодулятор, граючи важливу роль в організації імунної системи після сильного стресу (Chater, 1986). In vivo IL-18 утворюється шляхом розщеплення про-IL-18, і виявляється, що його ендогенна активність відповідає за продукування IFN- при летальності, опосередкованої P. acnes і LPS. Зрілий IL-18 продукується зі свого попередника за допомогою IL-1-конвертуючого ферменту (IL-1 бета-конвертуючий фермент, ICE, каспаза-1). Рецептор IL-18 складається щонайменше з двох компонентів, спільно діючих при скріпленні ліганду. Високо- і низькоафінні сайти скріплення IL-18 виявлені в Т-клітинах, стимульованих мишачим IL-12 (Yoshimoto et al., 1998), що наводить на думку про багатоланцюговий рецепторний комплекс. Поки ідентифіковані дві рецепторні субодиниці, причому обидві належать сімейству рецепторів IL-1 (Parnet et al., 1996). Сигнальна трансдукція IL-18 бере участь в активації NF-B (DiDonato et al., 1997). Деякі відомі цитокінзв'язуючі білки є розчинними цитокіновими рецепторами і відповідають позаклітинним лігандзв'язуючим доменам їх відповідних цитокінових рецепторів клітинної поверхні. Вони утворюються або шляхом альтернативного сплайсингу пре-мРНК, звичайного для рецептора клітинної поверхні, або шляхом протеолітичного розщеплення рецептора клітинної поверхні. Такі розчинні рецептори описані, в тому числі, серед інших, розчинні рецептори IL-6 і IFN- (Nakamura et al., 1989), TNF (Dao et al., 1996; Englemann et al., 1989), IL-1 і IL-4 (John, 1986), IFN-/ (Mizushima and Nagata, 1990) і інші. Виявляється, що один цитокінзв'язуючий білок, названий остеопротегерином (OPG, також відомий як фактор, який інгібує остеокласти - OCIF), член сімейства TNFR/Fas, є першим прикладом розчинного рецептора, який існує тільки у вигляді секретованого білка (Anderson, 1997; Bollon, 1980). Нещодавно розчинний білок з високою афінністю до IL-18 виділений з людської сечі, і описані кДНК людини і миші (Novick et al., 1999; WO 99/09063). Білок названий IL-18-зв'язуючим білком (IL-18BP). IL-18BP є не позаклітинним доменом одного з відомих рецепторів IL-18, a секретованим природно циркулюючим білком. Він належить новому сімейству секретованих білків. Сімейство також включає в себе деякі кодовані поксвірусами білки з високою гомологією з IL-18BP (Novick et al., 1999). IL-18BP конститутивно експресується в селезінці, належить суперсемейству імуноглобулінів і має обмежену гомологію з рецептором IL-1 типу II. Його ген локалізується на хромосомі людини 11q13, і екзон, що кодує трансмембранний домен, в геномній послідовності 8,3 т.п.н. не виявлений (Novick et al., 1999). 94022 6 Чотири ізоформи IL-18BP людини і дві ізоформи миші, що є результатом сплайсингу мРНК, виявлені в різних бібліотеках кДНК і експресовані, очищені і перевірені на скріплення і нейтралізацію біологічної активності IL-18 (Kirn et al., 2000). Ізоформа IL-18BP людини (IL-18BPa) виявила найвищу афінність до IL-18 з швидким "включенням" (rapid on-rate) і повільним "вимкненням" (slow offrate) і константою дисоціації (K(d)) 399 пМ. IL18BPc розділяє загальний Ig-домен з IL-18ВРа, за винятком 29 С-кінцевих амінокислот; K(d) IL18ВРс в 10 разів менше (2,94 нМ). Проте, IL-18BPa і IL-18BPc нейтралізують IL-18 >95% при молярному надлишку того і іншого. Ізоформи IL-18BPb і IL-18BPd втрачають повний Ig-домен і втрачають здатність зв'язувати або нейтралізувати IL-18. Мишачі ізоформи IL-18ВРс і IL-18BPd, що володіють ідентичністю з Ig-доменом, також нейтралізують >95% мишачого IL-18 при молярному надлишку того і іншого. Однак мишачий IL-18BPd, що розділяє загальний звичайний С-кінцевий мотив з IL-18BPa людини, також нейтралізує IL-18 людини. За допомогою молекулярного моделювання ідентифікований великий надлишок електростатичного і гідрофобного зв'язуючого сайту в Ig-домені IL18BP, який може відповідати за його високоафінне скріплення з лігандом (Kirn et al., 2000). Нещодавно зроблене припущення, що інтерлейкін IL-18 бере участь у розвитку патогенності при хронічних запальних захворюваннях, в тому числі ендотоксинного шоку, гепатиту і аутоімунного діабету (Kahiwamura and Okamura, 1998). Інша вказівка на позитивну роль IL-18 в розвитку пошкодження печінки виходить з експериментів, результати яких опубліковані Tsui et al. (Tsui et al., 1999), де на мишачій моделі показаний підвищений рівень IL-18 при викликаному ліпополісахаридому гострому пошкодженні печінки. Однак механізм дії багатофункціонального фактора IL-18 при розвитку пошкодження печінки поки не з'ясований. Пошкодження печінки може мати різні причини. Це може відбуватися, наприклад, через вірусні або бактерійні інфекції, зловживання алкоголем, імунні розлади або рак. Вірусні гепатити, викликані, наприклад, вірусом гепатиту В або вірусом гепатиту С, є погано керованими хворобами, що вражають велике число людей у всьому світі. Число відомих вірусів гепатиту постійно росте. Крім вірусів гепатиту В і С поки виявлені щонайменше чотири інших віруси, що викликають пов'язаний з вірусом гепатит, названі вірусами гепатиту A, D, Ε і G. Алкогольна хвороба печінки є іншим широко розповсюдженим захворюванням, пов'язаним з хронічним вживанням алкоголю. Імунний гепатит є рідким аутоімунним захворюванням, яке погано лікується. Пошкодження печінки також включає в себе пошкодження жовчних протоків. Первинний біліарний цироз (ПБЦ) є аутоімунним захворюванням печінки, що характеризується руйнуванням внутрішньопечінкових жовчних протоків. У деяких дослідженнях показано, що пошкодження печінки при хворобах, таких як алкогольний гепатит, цироз печінки, вірусний гепатит і первинний біліарний цироз, пов'язане з реакціями Т 7 хелперних клітин-1 (Th1). У одній з робіт створена нова модель пошкодження печінки у мишей шляхом направленої доставки в печінку овальбумінвміщуючих ліпосом з подальшим адоптивним перенесенням овальбумінспецифічних клітин Th1. Комбінована обробка мишей овальбумінвміщуючими ліпосомами і переносником клітин Th1 спричиняла підвищення сироваткової трансаміназної активності паралельно з підвищенням рівнів IFN- в сироватці. Як різкий контраст, перенесення овальбумінспецифічних клітин Th2 приводило до підвищення рівнів IL-4 в сироватці, але не викликало пошкодження печінки. Пошкодження печінки блокувалося антитілами проти IFN- і антитілами проти фактора некрозу пухлини TNF-. Такі результати показують, що клітини Th1 є головними ефекторними клітинами при гострому пошкодженні печінки (Nishimura and Ohta, 1999). У ряді інших робіт показано, що у мишей з понадекспресією виявляється спонтанний гепатит без якого-небудь патогену або якого-небудь іншого стимулятора (Okamoto et al., 1998). Інше дослідження пов'язане з реакціями Th1 при первинному біліарному цирозі (ПБЦ). ПБЦ є аутоімунною хворобою печінки, що характеризується руйнуванням внутрішньопечінкових жовчних протоків. Як правило, вважають, що до такого пошкодження жовчних протоків приводять клітинні імунні механізми, зокрема, з участю Т-клітин. Останнім часом зроблене припущення, що відносна сила реакцій Th1 і Th2 є важливим фактором в патофізіології різних аутоімунних хвороб. У даному дослідженні баланс підмножин при ПБЦ оцінювали шляхом виявлення цитокінів, специфічних для двох підмножин Т-клітин, тобто, IFN- для клітин Th1 і IL-4 для клітин Th2. Клітини, позитивні у відношенні IFN--матричної РНК (мРНК) і IL-4-мРНК, підраховували у відділах печінки 18 пацієнтів з ПБЦ і 35 контрольних хворих, що мали хронічний активний гепатит С, позапечінкову біліарну обструкцію і здорову печінку, з використанням неізотопної гібридизації in situ і імуногістохімії. Мононуклеарні клітини, які експресують мРНК IFN- і IL-4, при ПБЦ збиралися в запалених вхідних шляхах в печінці, але рідко були присутніми у відділах печінки при позапечінковій біліарній обструкції, алкогольному фіброзі або при здоровій печінці. Клітини, позитивні у відношенні мРНК IFN- і IL-4, при ПБЦ печінці виявлялися в значно більшому числі, ніж в печінці в контролі (Р
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of il-18 inhibitor for the treatment and/or prevention of alcoholic hepatitis
Автори англійськоюChvatchko Yolande, Dinarello Charles, Plater Zyberk Christine, Van Deventer Santer, Rubinstein Menachem, Novick Daniela, Kim Soo Hyun
Назва патенту російськоюПрименение ингибитора il-18 для лечения и/или предупреждения алкогольного гепатита
Автори російськоюШватшко Йоланд, Динарелло Чарльз А, Платер-Зиберк Кристин, Ван Девентер Сантер, Рубинштейн Менахем, Новик Даниэла, Ким Соо Хиун
МПК / Мітки
МПК: A61K 39/395, A61K 38/21, A61P 1/16
Мітки: інгібітору, алкогольного, застосування, гепатиту, попередження, лікування, il-18
Код посилання
<a href="https://ua.patents.su/40-94022-zastosuvannya-ingibitoru-il-18-dlya-likuvannya-i-abo-poperedzhennya-alkogolnogo-gepatitu.html" target="_blank" rel="follow" title="База патентів України">Застосування інгібітору il-18 для лікування і/або попередження алкогольного гепатиту</a>
Попередній патент: Модифіковані антагоністи (мутеїни) рецептора il-4
Наступний патент: Застосування паразитичних біологічних агентів для боротьби з захворюваннями
Випадковий патент: Похідні 3,6-дизаміщеного-1,2,4,5-тетразину для боротьби з кліщами, акарицидна композиція на їх основі, спосіб її отримання, спосіб зменшення кількості кліщів