Спосіб одержання ривароксабану та проміжних сполук, які одержано в даному способі
Номер патенту: 114601
Опубліковано: 10.07.2017
Автори: Лукач Дьюла, Кованьіне Лакс Дьйордь, Хаваші Балаж, Тотне Лауриц Маріа, Краснаі Дьйордь, Ружич Дьйордь, Печі Єва, Боза Андраш, Хегедюш Ласло Йожеф, Таборіне Тот Маріа Юліа, Шіпош Єва, Волк Балаж, БАРКОЦІ Йожеф
Формула / Реферат
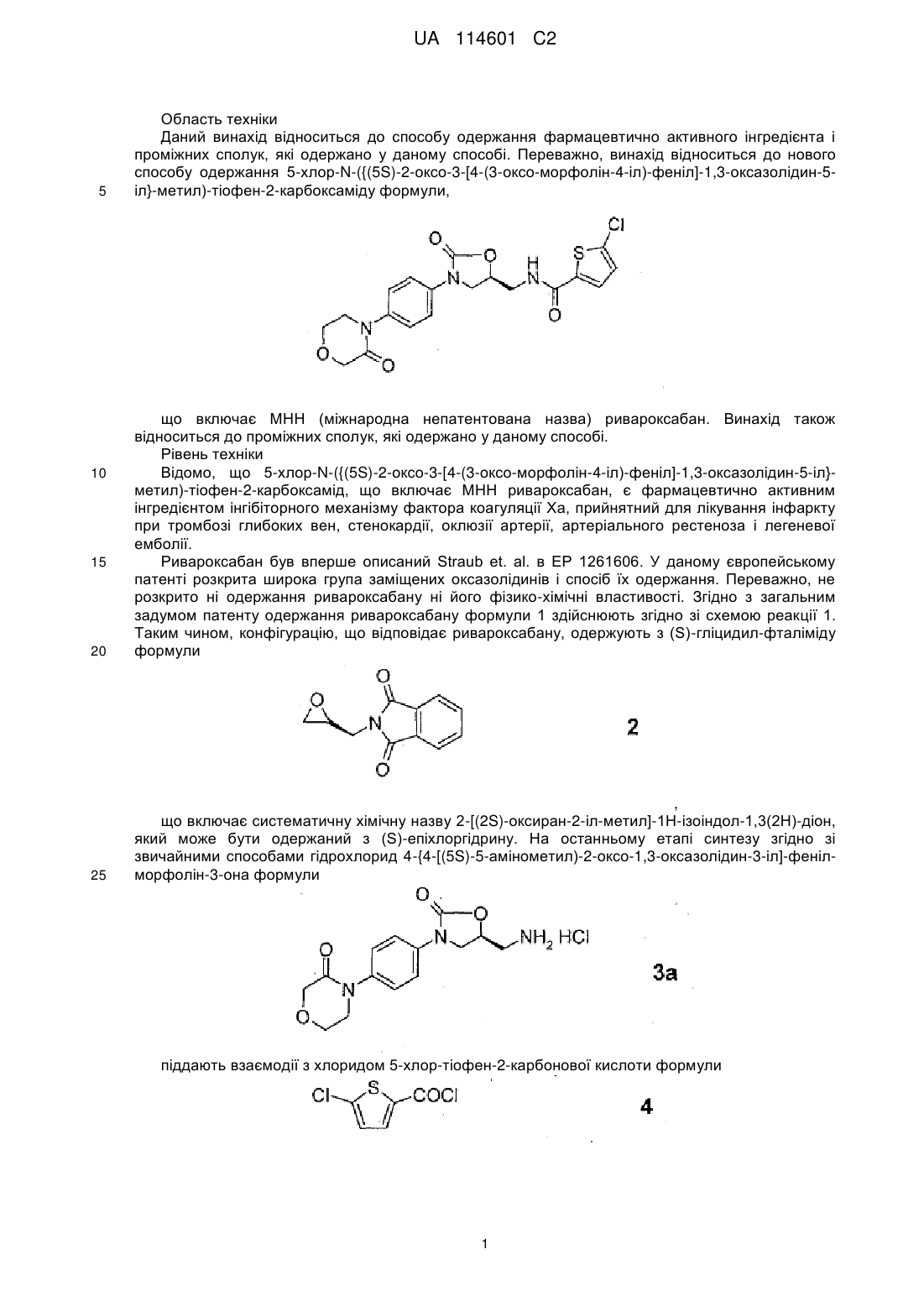
1. Спосіб одержання фармацевтично активного інгредієнта 5-хлор-N-({(5S)-2-оксо-3-[4-(3-оксоморфолін-4-іл)-феніл]-1,3-оксазолідин-5-іл}-метил)-тіофен-2-карбоксаміду (ривароксабану) формули
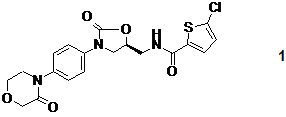 ,
,
що включає
а) піддавання 4-(4-((5S)-5-амінометил-2-оксо-1,3-оксазолідин-3-іл)-феніл)-морфолін-3-ону формули
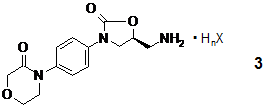
або її рацемату або S-енантіомерної солі загальної формули
дана сполука або її рацемат (де HnX є моно- або полівалентною органічною або неорганічною кислотою: n є 1, 2 або 3 і Х є іоном кислотного залишку), у разі застосування рацемічної вихідної речовини, поділу з подальшою взаємодією з 5-хлортіофен-2-карбоновою кислотою формули
![]()
за наявності агента реакції сполучення; або
b) на першому етапі піддавання S-енантіомерної сполуки загальної формули
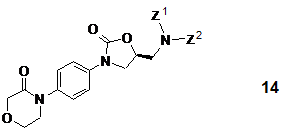
або її рацемату (де Z1 і Z2 є воднем або захисною групою, за умови, що щонайменше Z1 не є воднем, і Z1 і Z2 разом не є фталімідом), у разі застосування рацемічної вихідної речовини, поділу і подальшому видаленню захисної групи (груп), і виділенню одержаної таким чином S-енантіомерної сполуки формули 12 або її рацемату чи можливо її солі,
на другому етапі піддавання одержаного продукту, в разі застосування рацемічної вихідної речовини, поділу і подальшій взаємодії з 5-хлортіофен-2-карбонової кислоти формули 15 при наявності агента реакції сполучення; або
c) на першому етапі піддавання R-енантіомерної сполуки загальної формули
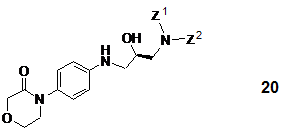
або її рацемату (де Z1 і Z2 включають значення, вказані вище), у разі застосування рацемічної вихідної речовини, поділу і подальшій взаємодії з агентом, що здатен ввести карбонільну групу,
на другому етапі піддавання S-енантіомерної сполуки загальної формули 14 або її одержаного рацемату (де Z1 і Z2 включають значення, вказані вище), у разі застосування рацемічної вихідної речовини, поділу і видаленню захисної групи (груп), і подальшому виділенню одержаної таким чином S-енантіомерної сполуки формули 12 або її рацемату чи можливо солі,
на третьому етапі піддавання одержаного продукту, в разі застосування рацемічної вихідної речовини, поділу і подальшій взаємодії з 5-хлортіофен-2-карбоновою кислотою формули 15 при наявності агента реакції сполучення; або
d) на першому етапі піддавання R-енантіомерної сполуки загальної формули 19

або її рацемату (де Z1 і Z2 включають значення, вказані вище), у разі застосування рацемічної вихідної речовини, поділу і подальшій взаємодії з 4-(4-амінофеніл)-морфолін-3-оном формули 5
 ,
,
на другому етапі піддавання одержаної таким чином R-енантіомерної сполуки формули 20 (де Z1 і Z2 включають значення, вказані вище) або її рацемату, у разі застосування рацемічної вихідної речовини, поділу і подальшій взаємодії з агентом, який здатен ввести карбонільну групу,
на третьому етапі піддавання одержаної S-енантіомерної сполуки формули 14 (де Z1 і Z2 включають значення, вказані вище) або її рацемату, у разі застосування рацемічної вихідної речовини, поділу, після чого видаленню захисної групи (груп) і виділенню одержаної таким чином S-енантіомерної сполуки формули 12 або її рацемату чи можливо її солі,
на четвертому етапі піддавання одержаного таким чином продукту, в разі застосування рацемічної вихідної речовини, поділу і взаємодії з 5-хлортіофен-2-карбоновою кислотою формули 15 при наявності агента реакції сполучення; або
e) на першому етапі піддавання взаємодії S-енантіомерної сполуки формули 11
![]()
або її рацемату сполуки загальної формули Z1Z2NH (де Z1 і Z2 включають значення, вказані вище),
на другому етапі піддавання R-енантіомерної сполуки загальної формули 19 або її рацемату (де Z1 і Z2 включають значення, вказані вище), у разі застосування рацемічної вихідної речовини, поділу і подальшій взаємодії з 4-(4-амінофеніл)-морфолін-3-оном формули 5,
на третьому етапі піддавання одержаної R-енантіомерної сполуки загальної формули 20 або її рацемату (де Z1 і Z2 мають значення, вказані вище), у разі застосування рацемічної вихідної речовини, поділу і подальшій взаємодії з агентом, що здатний ввести карбонільну групу,
на четвертому етапі піддавання одержаної S-енантіомерної сполуки загальної формули 14 або її одержаного рацемату, у разі застосування рацемічної вихідної речовини, поділу і подальшому видаленню захисної групи (груп), і виділенню одержаної таким чином S-енантіомерної сполуки формули 12 або її рацемату чи можливо її солі,
на п'ятому етапі піддавання одержаної сполуки, у разі застосування рацемічної вихідної речовини, поділу і подальшій взаємодії з 5-хлортіофен-2-карбоновою кислотою формули 15 при наявності агента реакції сполучення,
де агент реакції сполучення вибраний з хлоретилформіату, N,N'-діізопропілкарбодііміду (ДІК), N,N'-дициклогексилкарбодііміду (ДЦК), ангідриду трипропілфосфонової кислоти (ТФА) або N,N'-карбонілдіімідазолу (КДІ);
агент, що здатний ввести карбонільну групу, представлений N,N'-карбонілдіімідазолом, фосгеном, дифосгеном або трифосгеном;
за умови, що у випадку, якщо в сполуці загальної формули 3 n є 1 і Х є хлором, агент реакції сполучення не є N,N'-карбонілдіімідазолом.
2. Спосіб за п. 1, який відрізняється тим, що n є 1 і Х є ацетатним іоном.
3. Спосіб за варіантами b), с), d) і е) п. 1, який відрізняється тим, що в загальній формулі 14 Z1 і Z2 є бензилом.
4. Спосіб за варіантами с), d) і е) п. 1, який відрізняється тим, що в загальній формулі 20 Z1 і Z2 є бензилом.
5. Спосіб за варіантами d) і е) п. 1, який відрізняється тим, що в загальній формулі 19 Z1 і Z2 є бензилом.
6. Спосіб за варіантом е) п. 1, який відрізняється тим, що в загальній формулі Z1Z2NH Z1 і Z2 є бензилом.
7. Спосіб за п. 1, який відрізняється тим, що при взаємодії S-енантіомерної сполуки формули 12

або її рацемату або можливо її солі загальної формули 3 з 5-хлортіофен-2-карбоновою кислотою формули 15 як агент реакції сполучення застосовують хлоретилформіат або КДІ, взаємодію при бажанні проводять при наявності органічної або неорганічної основи, переважно триетиламіну, діізопропілетиламіну, карбонату натрію або гідрокарбонату натрію, в органічному розчиннику, переважно ацетонітрилі, дихлорметані, ацетоні, толуолі, тетрагідрофурані або їх суміші або суміші даних розчинників з водою, при 0-110 °С, переважно при 40-70 °С;
за умови, що у випадку, якщо в сполуці загальної формули 3 n є 1 і Х є хлором, тоді агент реакції сполучення не є N,N'-карбонілдіімідазолом.
8. Спосіб за п. 1, який відрізняється тим, що захисні групи S-енантіомерної сполуки формули 13
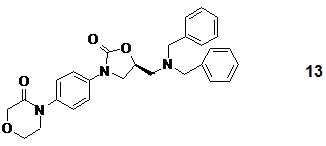 ,
,
що є спеціальною формою сполук загальної формули 14, або її рацемату видаляють за допомогою відновлення і відновлення проводять в C1-4-аліфатичному спирті, льодяній оцтовій кислоті, воді або суміші даних розчинників одного з одним або з додатковими органічними розчинниками, за допомогою каталітичної гідрогенізації або хімічного відновлення.
9. Спосіб за п. 1, який відрізняється тим, що при перетворенні R-енантіомерної сполуки загальної формули 20 або її рацемату в S-енантіомерну сполуку загальної формули 14 або її рацемат (де Z1 і Z2 є воднем або захисною групою, за умови, що принаймні Z1 не є воднем і Z1 і Z2 разом не є фталімідом) як агент, здатний ввести карбонільну групу, застосовують N,N'-карбонілдіімідазол і взаємодію здійснюють в прийнятному розчиннику, переважно толуолі.
10. Спосіб за п. 1, який відрізняється тим, що взаємодію R-енантіомерної сполуки загальної формули 19 або її рацемату (де Z1 і Z2 є воднем або захисною групою, за умови, що принаймні Z1 не є воднем і Z1 і Z2 разом не є фталімідом) і 4-(4-амінофеніл)-морфолін-3-ону формули 5 переважно проводять у протонному розчиннику або суміші розчинників або в суміші протонного розчинника і води при 0-150 °С, переважно при 60-90 °С, протягом 0,5-60 годин, переважно 20-40 годин.
11. Спосіб за п. 1, який відрізняється тим, що взаємодію S-енантіомерної сполуки формули 11 або її рацемату і сполуки загальної формули Z1Z2NH (де Z1 і Z2 є воднем або захисною групою, за умови, що принаймні Z1 не є воднем і Z1 і Z2 разом не є фталімідом), переважно N-бензил-1-фенілметанаміну формули
 ,
,
проводять за відсутності або наявності органічного розчинника або у воді, або в суміші зазначених розчинників, переважно при наявності речовини, що зв'язує органічні або неорганічні кислоти.
12. S-енантіомерна сіль загальної формули 3

або її рацемічна сіль (де HnX є моно- або полівалентною органічною або неорганічною кислотою: n є 1, 2 або 3 і Х є іоном кислотного залишку, за умови, якщо n є 1, то Х не є хлором.
13. Оцтовокисла сіль 4-{4-[(5S)-5-(амінометил)-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3-ону формули
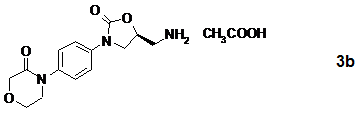
і її рацемат.
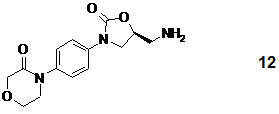
14. Спосіб одержання S-енантіомерної сполуки формули 12

або її рацемату або S-енантіомерної солі загальної формули 3

або її рацемічної солі, що включає надання S-енантіомерної сполуки загальної формули 14

або її рацемату (де Z1 і Z2 є воднем або захисною групою, за умови, що принаймні Z1 не є воднем і Z1 і Z2 разом не є фталімідом), для подальшого видалення захисної групи (груп) і виділення одержаної таким чином S-енантіомерної сполуки формули 12 або її рацемату або можливо S-енантіомерної солі загальної формули 3 або її рацемічної солі.
15. Спосіб за п. 14, який відрізняється тим, що S-енантіомерна соль загальної формули 3 представлена оцтовокислою сіллю формули 3b і S-енантіомерна сполука загальної формули 14 представлена S-енантіомерною сполукою формули 13
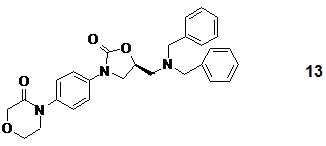 .
.
16. S-енантіомерна сполука загальної формули 14

і її рацемати (де Z1 і Z2 є воднем або захисною групою, за умови, що принаймні Z1 не є воднем і Z1 і Z2 разом не є фталімідом).
17. 4-(4-{[(2R)-3-дибензиламіно-2-гідроксипропіл]-аміно}-феніл)-морфолін-3-он формули 13
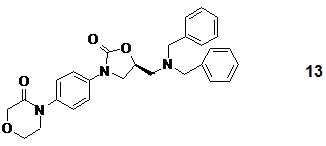
і його рацемат.
18. Спосіб одержання S-енантіомерних сполук загальної формули 14
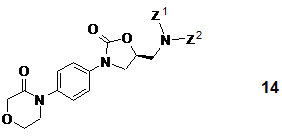
або їх рацематів (де Z1 і Z2 є воднем або захисною групою, за умови, що принаймні Z1 не є воднем і Z1 і Z2 разом не є фталімідом), що включає піддавання R-енантіомерної сполуки загальної формули 20
або її рацемату (де Z1 і Z2 є вищевказаними), у разі застосування рацемічної вихідної речовини, поділу і подальшій взаємодії з агентом, що здатний ввести карбонільну групу, який представлений N,N'-карбонілдіімідазолом, фосгеном, дифосгеном або трифосгеном.
19. Спосіб за п. 18, який відрізняється тим, що Z1 і Z2 є бензилом.
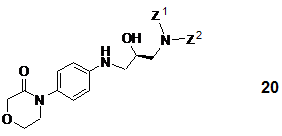
20. R-енантіомерні сполуки загальної формули 20

та їх рацемати (де Z1 і Z2 є воднем або захисною групою, за умови, що принаймні Z1 не є воднем і Z1 і Z2 разом не є фталімідом).
21. 4-(4-{[(2R)-3-дибензиламіно-2-гідроксипропіл]-аміно}-феніл)-морфолін-3-он формули
 .
.
22. Спосіб одержання R-енантіомерних сполук загальної формули 20

або їх рацематів (де Z1 і Z2 є воднем або захисною групою, за умови, що принаймні Z1 не є воднем і Z1 і Z2 разом не є фталімідом), що включає піддавання S-енантіомерної сполуки загальної формули 19

або її рацемату (де Z1 і Z2 є вищевказаними), у разі застосування рацемічної вихідної речовини, поділу і подальшій взаємодії з 4-(4-амінофеніл)-морфолін-3-оном формули 5
 .
.
23. Спосіб за п. 22, який відрізняється тим, що Z1 і Z2 є бензилом.
Текст
Реферат: Винахід стосується способу одержання 5-хлор-N-({(5S)-2-оксо-3-[4-(3-оксоморфолін-4-іл)феніл]-1,3-оксазолідин-5-іл}-метил)-тіофен-2-карбоксаміду, що включає міжнародну непатентовану назву ривароксабан. Винахід стосується проміжних сполук, що одержані за даним способом. UA 114601 C2 (12) UA 114601 C2 UA 114601 C2 5 Область техніки Даний винахід відноситься до способу одержання фармацевтично активного інгредієнта і проміжних сполук, які одержано у даному способі. Переважно, винахід відноситься до нового способу одержання 5-хлор-N-({(5S)-2-оксо-3-[4-(3-оксо-морфолін-4-іл)-феніл]-1,3-оксазолідин-5іл}-метил)-тіофен-2-карбоксаміду формули, 20 що включає МНН (міжнародна непатентована назва) ривароксабан. Винахід також відноситься до проміжних сполук, які одержано у даному способі. Рівень техніки Відомо, що 5-хлор-N-({(5S)-2-оксо-3-[4-(3-оксо-морфолін-4-іл)-феніл]-1,3-оксазолідин-5-іл}метил)-тіофен-2-карбоксамід, що включає МНН ривароксабан, є фармацевтично активним інгредієнтом інгібіторного механізму фактора коагуляції Ха, прийнятний для лікування інфаркту при тромбозі глибоких вен, стенокардії, оклюзії артерії, артеріального рестеноза і легеневої емболії. Ривароксабан був вперше описаний Straub et. al. в ЕР 1261606. У даному європейському патенті розкрита широка група заміщених оксазолідинів і спосіб їх одержання. Переважно, не розкрито ні одержання ривароксабану ні його фізико-хімічні властивості. Згідно з загальним задумом патенту одержання ривароксабану формули 1 здійснюють згідно зі схемою реакції 1. Таким чином, конфігурацію, що відповідає ривароксабану, одержують з (S)-гліцидил-фталіміду формули 25 , що включає систематичну хімічну назву 2-[(2S)-оксиран-2-іл-метил]-1Н-ізоіндол-1,3(2Н)-діон, який може бути одержаний з (S)-епіхлоргідрину. На останньому етапі синтезу згідно зі звичайними способами гідрохлорид 4-{4-[(5S)-5-амінометил)-2-оксо-1,3-оксазолідин-3-іл]-фенілморфолін-3-она формули 10 15 піддають взаємодії з хлоридом 5-хлор-тіофен-2-карбонової кислоти формули 1 UA 114601 C2 5 10 15 20 25 30 35 40 45 з утворенням ривароксабану формули 1. Реакцію конденсації проводять в піридині. Недоліком способу є те, що кінцеву реакцію конденсації проводять за допомогою застосування дуже дорогого хлориду 5-хлор-тіофен-2-карбонової кислоти та застосування високотоксичного піридину як розчинника. Додатковим недоліком є те, що хлорид 5-хлор-тіофен-2-карбонової кислоти є в'язким маслом складним для роботи. Воно легко розкладається і при зберіганні при 0-5°С швидко гідролізується до 5-хлор-тіофен-2-карбонової кислоти. Таким чином, даний вихідний матеріал не може довго зберігатися, а повинен бути негайно використаний, що робить технологію складною, зокрема при виробництві в промисловому масштабі. Хлорид 5-хлортіофен-2-карбонової кислоти одержують з 5-хлор-тіофен-2-карбонової кислоти за допомогою тіонілхлориду: останній реагент також є корозійною речовиною, що володіє неприємним запахом і шкідливий для здоров'я і навколишнього середовища. Наприкінці реакції залишковий тіонілхлорид повинен бути видалений, що вимагає додаткового етапу дистиляції. Побічні продукти хлороводень і діоксид сірки, що утворюються в процесі одержання хлориду кислоти, повинні бути адсорбовані і видалені в ручну, що представляє додаткову технологічну складність і завдає шкоди здоров'ю. В ЕР 1583761 описаний зовсім інший шлях синтезу, наведений на схемі реакції 2. Так, ривароксабан формули 1 одержують за допомогою застосування як вихідного матеріалу (2S)-3аміно-пропан-1,2-діол-хлористоводневої солі. У даному документі розкриті певні етапи способу і деякі проміжні сполуки. Загальний вихід способу становить лише 37 %. Структурна ланка, 5хлор-тіофен-2-карбоніл, вводять за допомогою хлориду 5-хлор-тіофен-2-карбонової кислоти. Його недоліки обговорені вище. В WO 2005/0261335 описано одержання проміжної сполуки 4-(4-аміно-феніл)-морфолін-3она формули , застосовується у вищевказаних двох заявки на патент, як показано на схемі реакції 3. У даній міжнародній заявці на патент 4-(4-нітро-феніл)-3-морфолінон формули у аліфатичний спирт захищений від каталітичної гідрогенізації. Даний спосіб відрізняється від способу, який викладено в ЕР 1261606, при якому каталітичну гідрогенізацію проводять у тетрагідрофурані. Згідно WO 2005/0068456 (еквівалентний DE 102004002044) ривароксабан одержують згідно способу синтезу, який наведено на схемі реакції 4. Даний спосіб практично ідентичний способу, який розкрито в основному патенті та наведено на схемі реакції 1, за винятком того, що виходи деяких етапів поліпшені за рахунок оптимізації умов реакції. У даній міжнародній заявці на патент описано одержання ривароксабану за рахунок конденсації гідрохлориду 4-{4-[(5S)-5амінометил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3-она формули 3а з хлоридом 5-хлортіофен-2-карбонової кислоти формули 4 або в спиртовому або в кетонному розчиннику або їх суміші в присутності неорганічної основи. Як розчинник для реакції конденсації переважно може бути застосована суміш ацетону і води і як неорганічна основа переважно гідроксид натрію, гідрокарбонат натрію або карбонат натрію, переважно, може бути застосований карбонат натрію. У прикладі, що показує етап конденсації солі формули 3а з карбонатом натрію, основу виділяють у вільному вигляді, після чого додають воду і ацетон і при 8-12°С додають по краплі приблизно 30 мас. % розчину хлориду 5-хлор-тіофен-2-карбонової кислоти формули 4 в толуолі. Потім при 50°С додають ацетон, реакцію продовжують, реакційну суміш охолоджують до 25°С і ривароксабан відфільтровують. Недоліки реагенту хлориду 5-хлор-тіофен-2карбонової кислоти, що застосовується в даному способі, обговорено вище. Додатковий недолік способу полягає в тому, що видалення фталільної захисної групи за допомогою великого надлишку (4,4 екв) метиламіну виконують тільки на останній стадії способу. Оскільки 2 UA 114601 C2 5 10 15 20 25 30 застосовують великий надлишок метиламіну і суворі умови реакції, утворення домішок неминуче. Виходи показують, що даний спосіб є неекономічним. WO 2005/068456 не згадує про ВЕРХ-чистоті конкретних проміжних сполук, не кажучи вже про кінцевий продукт ривароксабан формули 1. Хлористоводневу сіль формули 3а одержують згідно міжнародної заявки на патент з виходом 82,7 %, у якій не розкрита її чистота. При відтворенні прикладу вищезгаданої заявки на патент ми виявили, що повне видалення захисної групи вимагає щонайменше 20 годин замість 2 годин, як вказано в міжнародній заявці на патент. Після видалення фталільної захисної групи якість проміжної сполуки формули 3а є неприйнятною для одержання кінцевого продукту фармацевтичного ступеня чистоти. Тому проміжна сполука формули 3а повинна бути піддана перекристалізації, яка знизить загальний вихід способу. Стаття, опублікована в IP. com. Journal 2010 (IPCOM0000195906D), одержання 4-(4-амінофеніл)-морфолін-3-она формули 5 починається з 4-(4-нітро-феніл)-3-морфолінона формули 6. Для того, щоб уникнути каталітичну гідрогенізацію автори розробили новий спосіб відновлення, згідно з яким відновлення здійснюють за допомогою металу чи металевої солі в присутності кислоти. Як метал переважно застосовували цинк або залізо, і як кислоти переважно застосовували соляну кислоту: відновлююче середовище є спиртом або суміш спирту і води. Найкращий вихід склав 78 %. У статті IP.com. Journal, опублікованій в IP.com. Journal (IPCOM000199058D) в 2009, I, II, III і IV кристалічні форми 4-{4-[(5S)-5-амінометил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3она формули і мезилат (кристалічна форма А), тартрат (форма В), фосфат (С), цитрат (D), сульфат (Е), сіль 5-хлор-тіофен-2-карбонової кислоти (F), фумарат (G), тозилат (Н), малеат (J) і солі бром оводню (К), які описано і охарактеризовано за допомогою рентгенівської дифракції. В WO 2010/124385 розкрито нові синтетичні шляхи одержання ривароксабану і його енантіомерів. Ці та замінюючі визначення наведено на схемі реакції 5. На конкретних прикладах одержання ривароксабану вказана реакція сполуки формули і 5-хлор-тіофен-2-карбонової кислоти формули t 35 У трьох прикладах як основу застосовують бутиллітій (вихід 62 %), LiCl-Bu OK (вихід 32) і LiHMDS (вихід 64 %). Розмір партії становить менше 1 г. Таким чином, не визначено, чи буде спосіб прийнятним для виробництва в промисловому масштабі. Автори винаходу очищали продукт на кожному етапі за допомогою хроматографії і даний спосіб є неприйнятним для виробництва в промисловому масштабі. У звичайній схемі реакції WO2010/124285 (реакційна схема 5) розкрито сполуку формули 3 UA 114601 C2 і 2 5 10 15 20 25 30 де L є галогеном чи алкілом - або арилсульфонілоксилом групи. Формально ривароксабан формули 1 може бути отриманим за допомогою реакції сполуки формули 10 з 5-хлор-тіофен-2карбоновим амідом формули 8. Фактично в даній заявці не описано одержання сполук формули 9 і 10, ні їх фізико-хімічні характеристики. Так, звичайна схема реакції згадує даний варіант реакції як теоретично можливий. Дана частина заявки на патент додатково ослаблена експериментальним досвідом, який показує, що сполука формули , 2 що включає переважну заміщувану групу (дана сполука є сполукою формули 10, в якій L є I) не реагує з амідом формули 8 за допомогою застосування органічної або неорганічної основи t (KOBu , піридин) при дуже суворих умовах (90°С, ДМФ). В WO 2011/012321 розкриті способи одержання ривароксабану за допомогою кристалізації і одержання ривароксабану високої чистоти. На схемі реакції 6 міжнародної заявки на патент представлено приклад одержання сполуки формули 1 за допомогою реакції 5-хлор-тіофен-2карбонової кислоти формули і N,N'-карбоніл-диімідазола (1,2 екв.) і триетил аміна (1,2 екв.) і хлористоводневої солі формули 3а (1,03 екв.) у диметил формаміді. Однак згідно з даним способом неочищений ривароксабан може бути отриманим тільки з високими втратами з виходом 72 % (щодо сполуки формули 3а) і одержаний неочищений продукт вимагає додаткового очищення. Вихід очищеного продукту, що становить 61 % (щодо сполуки формули 3а) є тільки середнім і набагато нижче, ніж вихід реакції алкілування, яку виконано за допомогою хлориду кислоти формули 4. Заявка на патент не згадує у розкритті даних, що пов'язані з чистотою продукту. Короткий опис винаходу Метою даного винаходу є розробка синтетичного способу одержання ривароксабану формули 1 в промисловому масштабі, де даний спосіб забезпечує переважні виходи і де в способі використовують кристалічні і легко очищаючі проміжні сполуки. Вищевказану мету досягають за допомогою наступного методу. На першому етапі способу сполука загальної формули , 4 UA 114601 C2 1 2 (де Z і Z є воднем або звичайною аміно захисною групою, наприклад, бензил, заміщений бензил, п-метокси-бензил, бензилоксикарбоніл або третбутоксикарбоніл за умови, що 1 1 2 принаймні Z не є воднем і Z і Z переважно є бензилом), одержують за допомогою реакції сполуки формули 5 10 15 20 25 30 1 2 сполука загальної формули Z Z NH. На другому етапі способу, сполуку загальної формули 19 піддають взаємодії зі сполукою формули 5 з виходом сполуки загальної формули 1 , 2 (де Z і Z є вищевказаними). На третьому етапі способу сполука загальної формули , 1 2 (де Z і Z є вищевказаними) одержують за допомогою реакції сполуки загальної формули 20 з агентом, що здатен ввести карбонільну групу. На четвертому етапі способу із сполуки загальної формули 14 одержують основу формули 12 або її сіль загальної формули , (де HnX є моно - або бівалентною органічною або неорганічною кислотою; n є 1, 2 або 3 і Х є іонами кислотного залишку) за допомогою видалення захисної групи(п). Як органічна кислота може бути застосована, наприклад, сульфонова кислота, карбонова кислота, включаючи моновалентні карбонові кислоти, наприклад, мурашину кислоту, оцтову кислоту, пропіонову кислоту, масляну кислоту і т.д., і як неорганічну кислоту може бути застосована, наприклад, сірчана кислота, сірчиста кислота, азотна кислота, фосфорна кислота, бромоводнева, йодоводнева. На останньому етапі способу основу формули 12 або його сіль загальної формули 3 (де H nX є таким, що вище вказано) реагує з 5-хлор-тіофен-2-карбонової кислоти з виходом ривароксабану формули 1. На останньому етапі ацилування при отриманні ривароксабану ми застосовуємо кислоту формули 15, яка істотно менш реактивна, ніж хлорид 5-хлор-тіофен-2карбонової кислоти формули 4, який раніше застосовувався на останньому етапі ацилування при отриманні ривароксабану формули 1. Згадану реакцію проводять у присутності сполучної 5 UA 114601 C2 5 10 15 20 25 30 35 40 45 50 55 60 речовини і органічного або неорганічного заснування в інертному розчиннику: при бажанні застосуванням кислого сполучного агента можна знехтувати. Спосіб може бути здійсненим за допомогою застосування рацемічного вихідного матеріалу, при бажанні. В даному випадку спочатку за допомогою поділу одержують сполуки, що включають хіральність, показані на схемах реакції 7а, 7b, 8a і 8b. Несподівано сполука загальної формули 14 також можуть бути отримані таким чином, що на першому етапі сполука загальної формули 9 за допомогою реакції з агентом, здатним ввести карбонільну групу, одержують сполуку загальної формули 10 (де L 2 є хлором, бромом, йодом, алкілсульфонілоксилом або арилсульфонілоксилом, наприклад, метансульфонілоксил, бензолсульфонілоксил або п-толуолсульфонілоксил, переважно хлор, бром або йод). 2 На другому етапі способу сполука загальної формули 10 (де L включає таке ж значення, як 1 2 1 2 вищевказано) реагує із сполукою загальної формули Z Z NH (де Z і Z є воднем або звичайною аміно-захисною групою, наприклад, бензил, заміщений бензил, п-метокси-бензил, 1 2 бензилоксикарбоніл або третбутоксикарбоніл, за умови, що принаймні один із символів Z і Z 1 2 не є воднем, і Z і Z переважно є бензилом). Винахід відноситься до проміжних сполук, що застосовуються у вищевказаному способі, що відповідає даним загальним формулам, і до проміжних сполук, які одержано у бажаних втіленнях вищевказаного способу. Детальний опис винаходу. Винахід відноситься до способу одержання фармацевтично активного інгредієнта 5-хлор-N({(5S)-2-оксо-3-[4-(3-оксо-морфолін-4-іл)-феніл]-1,3-оксазолідин-5-іл}-метил)-тіофен-2карбоксаміду формули 1, який включає наражання поділу 4-{4-[(5S)-5-(амінометил)-2-оксо-1,3оксазолідин-3-іл]-феніл}-морфолін-3-она формули 12 або її рацемату формули rac12 або його S-енантіомерної солі формули 3 або його рацемату загальної формули rac3 (де HnX є моно або полівалентною органічною або неорганічною кислотою: n є 1, 2 або 3: Х є іоном кислотного залишку), у разі застосування рацемічного вихідного матеріалу, з наступною реакцією з 5-хлортіофен-2-карбонової кислоти формули 15 в присутності сполучної речовини; або на першому етапі наражання S-енантіомерної сполуки загальної формули 14 або її 1 2 1 рацемату (де Z і Z є воднем або захисною групою, за умови, що щонайменше Z не є воднем) поділу, у разі застосування рацемічного вихідного матеріалу, з подальшим видаленням захисної групи(п), і відділенням одержаного таким чином S-енантіомерної основи формули 12 або її рацемату або, можливо, її солі; на другому етапі наражання одержаного продукту поділу, у разі застосування рацемічного вихідного матеріалу, і подальшої взаємодії з 5-хлор-тіофен-2карбонової кислоти формули 15 в присутності сполучної речовини; або на першому етапі наражання S-енантіомерної сполуки загальної формули 20 або її 1 2 рацемату (де Z і Z є вищевказаними) поділу, у разі застосування рацемічного вихідного матеріалу, з наступною реакцією з агентом, що здатен ввести карбонільну групу; на другому етапі наражання одержаної S-енантіомерної сполуки загальної формули 14 або її рацемату поділу, у разі застосування рацемічного вихідного матеріалу, з подальшим відновленням продукту, відокремленням одержаної таким чином S-енантіомерної основи формули 12 або її рацемату; на третьому етапі наражання одержаного продукту поділу, у разі застосування рацемічного вихідного матеріалу, з наступною реакцією з 5-хлор-тіофен-2-карбонової кислоти формули 15 в присутності сполучної речовини; або на першому етапі наражання R-енантіомерної сполуки загальної формули 19 або її 1 2 рацемату (де Z і Z є вищевказаними) поділу, у разі застосування рацемічних вихідних матеріалів, з наступною реакцією з 4-(4-амінофеніл)-морфолін-3-оном, сполукою формули 5, на 1 другому етапі наражання R-енантіомерної сполуки загальної формули 20 або її рацемату (де Z 2 і Z є вищевказаними) поділу, у разі застосування рацемічного вихідного матеріалу, з наступною реакцією з агентом, що здатен ввести карбонільну групу, на третьому етапі наражання 1 2 одержаної S-енантіомерної сполуки загальної формули 14 або її рацемату (де Z і Z є вищевказаними) поділу, у разі застосування рацемічного вихідного матеріалу, видалення захисної групи(п), і відокремленням одержаної таким чином S-енантіомерної основи формули 12 або її рацемату або, можливо, її солі; на четвертому етапі наражання одержаного таким чином продукту поділу, у разі застосування рацемічного вихідного матеріалу, і подальшої реакції з 5-хлор-тіофен-2-карбонової кислоти формули 15 в присутності сполучної речовини; або на першому етапі реакція S-енантіомерної сполуки формули 11 або її рацемату сполука 1 2 1 2 загальної формули Z Z NH (де Z і Z є вищевказаними), на другому етапі наражання одержаної 1 2 таким чином сполуки загальної формули 19 або її рацемату (де Z і Z є вищевказаними) поділу, у разі застосування рацемічного вихідного матеріалу, з наступною реакцією з 4-(4-аміно-феніл) 6 UA 114601 C2 5 10 15 морфолін-3-оном формули 5, на третьому етапі наражання одержаної R-енантіомерної сполуки 1 2 загальної формули 20 або її рацемату (де Z і Z є вищевказаними) поділу, у разі застосування рацемічного вихідного матеріалу, з наступною реакцією з агентом, що здатен ввести карбонільну групу; на четвертому етапі наражання S-енантіомерної основи загальної формули 1 2 14 або її рацемату (де Z і Z є вищевказаними) поділу, у разі застосування рацемічного вихідного матеріалу з подальшим видаленням захисної групи(п) і відокремленням одержаної таким чином S-енантіомерної сполуки формули 12 або її рацемату або, можливо, її солі, на п'ятому етапі наражання одержаного продукту поділу, у разі застосування рацемічного вихідного матеріалу, з наступною реакцією з 5-хлор-тіофен-2-карбонової кислоти формули 15 в присутності сполучної речовини; або на першому етапі наражання R-енантіомерної сполуки загальної формули 9 або її рацемату 2 (де L є вищевказаним), поділу у разі застосування рацемічного вихідного матеріалу з наступною реакцією з агентом, що здатен ввести карбонільну групу, перетворенням одержаної 2 R-енантіомерної сполуки загальної формули 10 або її рацемату (де L є вищевказаним), при бажанні R-енантіомерної сполуки формули 2 (де L є хлором або бромом) або її рацемату в R-енантіомерну сполуку формули 20 25 30 35 40 45 або її рацемату, або R-енантіомерну сполуку формули 10с або її рацемату, на другому етапі наражання R-енантіомерної сполуки загальної формули 10 або її рацемату 2 (де L включає теж значення, як вищевказано) поділу, у разі застосування рацемічного 1 2 вихідного матеріалу, з подальшою реакцією сполука загальної формули Z Z NH, на третьому 1 2 етапі наражання S-енантіомерної сполуки загальної формули 14 або її рацемату (де Z і Z є вищевказаними) поділу, у разі застосування рацемічного вихідного матеріалу з подальшим видаленням захисної групи(п) і відокремленням одержаної таким чином S-енантіомерної основи загальної формули 12 або, можливо, її солі; на четвертому етапі наражання одержаного таким чином продукту поділу, у разі застосування рацемічного вихідного матеріалу і продукту реакції з 5-хлор-тіофен-2-карбонової кислоти формули 15 в присутності сполучної речовини. за умови, що в загальній формулі 3 n є 1, і Х є хлором, крім того, сполучна речовина не є N,N'-карбоніл-диімідазолом. Згідно з переважним втілення винаходу n є 1, і Х є іоном ацетату. 1 2 Згідно з переважним втілення винаходу в загальній формулі 14 Z і Z є бензилом. 1 2 Згідно з переважним втілення винаходу в загальній формулі 20 Z і Z є бензилом. 1 2 Згідно з переважною ознакою винаходу в загальній формулі 19 Z і Z є бензилом. 1 2 1 2 Згідно з переважною ознакою винаходу в загальній формулі Z Z NH Z і Z є бензилом. Згідно з переважним втіленням винаходу S-енантіомерну основу формули 12 або її рацемат чи можливо її сіль реагує з 5-хлор-тіофен-2-карбонової кислоти формули 15 в присутності хлорформіата, N,N'-диізопропіл-карбодііміду (ДІК), N,N'-дициклогексил-карбодііміду (ДЦК), ангідриду трипропілфосфонової кислоти (ТФА) або N,N'-карбоніл-диімідазолу (КДІ), переважно хлоретилформіату або КДІ як сполучної речовини. Реакцію проводять переважно у присутності органічної або неорганічної основи, переважно триетиламіну, диізопропілетиламіну, карбонату натрію або гідрокарбонату натрію, в органічному розчиннику, переважно ацетонітрилі, дихлорметані, ацетоні, толуолі, тетрагідрофурані та його сумішах або сумішах згаданих ° розчинників з водою. Реакцію проводять при температурі 0-110°С, переважно 40-70 С. Згідно з додатковим переважним втіленням винаходу захисну групу(пи) S-енантіомерної основи формули 7 UA 114601 C2 5 10 15 20 25 30 35 40 видаляють за допомогою відновлення і вказану реакцію відновлення проводять в С1-4– аліфатичному спирті, крижаній оцтовій кислоті, воді або суміші вказаних розчинників, що одержано один з одним або з іншими органічними розчинниками. Може бути застосована каталітична гідрогенізація або хімічне відновлення. Згідно ще з одним переважним втіленням даного винаходу R-енантіомерна сполука загальної формули 20 або її рацемат перетворюють в S-енантіомерну сполуку загальної 1 2 1 формули 14 або її рацемат (де Z і Z є воднем або захисною групою, за умови, що принаймні Z не є воднем) шляхом застосування як агента, здатного ввести карбонільну групу, N,N'-карбонілдиімідазолу, фосгену, дифосгену або трифосгену, переважно N,N'-карбоніл-диімідазолу. Реакцію проводять в прийнятному розчиннику, переважно в толуолі. Згідно з наступним переважним втіленням способу, реакцію R-енантіомерної сполуки 1 2 формули 19 або її рацемату (де Z і Z є воднем або захисною групою, за умови, що принаймні 1 Z не є воднем) і 4-(4-аміно-феніл)-морфолін-3-она формули 5 проводять переважно в суміші ° протонного розчинника і води при температурі 0-150°С, переважно 60-90 С, переважно протягом періоду 20-40 годин. Згідно з додатковим переважним втіленням винаходу S-енантіомерна сполука формули 11 1 2 1 2 реагує зі сполукою загальної формули Z Z NH (де Z і Z є воднем або захисною групою, за 1 умови, що принаймні Z не є воднем), переважно реакцію з N-бензил-1-феніл-метанаміном формули проводять у відсутності розчинника або в органічному розчиннику або воді або їх суміші, переважно у присутності речовини, що зв'язує органічні або неорганічні кислоти. Згідно з переважним втіленням винаходу перетворення R-енантіомерної сполуки формули 10а або її рацемату в R-енантіомерну сполуку формули 10b або її рацемату проводять за допомогою реакції з бромідом лужного металу, переважно з бромідом натрію. Конверсію сполуки формули 10с або її рацемат виконують за допомогою реакції з йодидом лужного металу, переважно йодидом натрію і дану реакцію проводять у прийнятному органічному розчиннику або його суміші з водою при 0-150°С, переважно 80-130°С. Згідно ще з одним переважним втіленням винаходу реакцію сполуки загальної формули 1 2 1 2 1 Z Z NH (де Z і Z є воднем або захисною групою, за умови, що принаймні Z не є воднем), переважно з N-бензил-1-фенілметанаміном формули 16) проводять у присутності або відсутності розчинника, у присутності речовини, що зв'язує органічні або неорганічні кислоти, переважно карбонату цезію при 0-150°С, переважно 60-100°С. Згідно з додатковим переважним втіленням винаходу R-енантіомерної сполуки загальної формули 9 або її рацемату перетворюють в R-енантіомерну сполуку загальної формули 10 або її рацемату за допомогою застосування як агента, прийнятного для введення карбонільної групи N,N'-карбоніл-диімідазолу, фосгену, дифосгену або трифосгену, переважно N,N'-карбонілдиімідазолу. Реакцію проводять в розчиннику або суміші розчинників, переважно толуолі, 1метил-2-піролідині або їх суміші, при 0-150°С, переважно при температурі флегми розчинника або суміші розчинника. Винахід відноситься до 4-{4-[(5S)-5-(амінометил)-2-оксо-1,3-оксазолідин-3-іл]-феніл}морфолін-3-ону або його рацематів формули 12 і його S-енантіомерних солей загальної формули 3 або його рацемічних солей (де HnX є моно - або полівалентна органічна або 8 UA 114601 C2 неорганічна кислота, n є 1, 2 або 3, і Х є іоном кислотного залишку, за умови, що n є 1, а Х не є хлором). Винахід відноситься до оцтовокислої солі 4-{4-[(5S)-5-(амінометил)-2-оксо-1,3-оксазолідин-3іл]-феніл}-морфолін-3-она формули 5 10 15 20 25 30 35 40 або його рацематів. Винахід відноситься до способу одержання S-енантіомерної сполуки формули 12 і її рацемату або S-енантіомерної солі загальної формули 3 або її рацемічної солі, переважно оцтовокислої солі формули 3b або її рацемічної оцтовокислої солі, що включає наражання S1 2 енантіомерної сполуки загальної формули 14 або її рацемату (де Z і Z є воднем або захисною 1 групою, за умови, що принаймні Z не є воднем) поділу, у разі застосування рацемічного вихідного матеріалу, переважно S-енантіомерної сполуки формули 13 або її рацемату (у разі, 1 2 коли Z і Z є бензилом) поділу, у разі застосування рацемічного вихідного матеріалу, з подальшим видаленням захисної групи(п) і відділенням S-енантіомерної основи формули 12 або її рацемату, або, можливо, S-енантіомерної солі загальної формули 3 або її рацемічної солі, переважно солі оцтової кислоти формули 3b або рацемічної солі оцтової кислоти. Згідно винаходу також запропоновані S-енантіомерна сполука загальної формули 14 і її 1 2 1 1 рацемати (де Z і Z є воднем або захисною групою, за умови, що принаймні Z не є воднем і Z і 2 Z разом є іншою групою ніж фталімідом). Винахід відноситься до 4-{4-[(5S)-5-[(дибензил-аміно)-метил]-2-оксо-1,3-оксазолідин-3-іл]феніл}-морфолін-3-ону формули 13 і її рацематів. Згідно винаходу також запропоновані спосіб одержання S-енантіомерних сполук загальної 1 2 1 формули 14 і їх рацематів (де Z і Z є воднем або захисною групою, за умови, що принаймні Z 1 2 1 не є воднем, і Z і Z є бензилом), що включає наражання сполуки загальної формули 20 (де Z і 2 Z є вищевказаними) поділу, у разі застосування рацемічного вихідного матеріалу, і подальшої реакції з агентом, що здатен ввести карбонільну групу. 1 Винахід відноситься до R-енантіомерних сполук загальної формули 20 і їх рацематів (де Z і 2 1 1 2 Z є воднем або захисною групою, за умови, що принаймні Z не є воднем, і Z і Z разом не можуть бути фталімідом). Винахід відноситься до 4-{4-[(2R)-33-(дибензиламіно)-2-гідропропіл]-аміно}-феніл)морфолін-3-ону формули Винахід відноситься до способу одержання R-енантіомерних сполук загальної формули 20 і 1 2 1 їх рацематів (де Z і Z є воднем або захисною групою, за умови, що принаймні Z не є воднем, 1 2 та переважно Z і Z є бензилом), що включають наражання S-енантіомерної сполуки загальної 1 2 формули 19 або її рацемату (де Z і Z є вищевказаними) поділу, у разі застосування рацемічного вихідного матеріалу, і подальшої реакції з 4-(4-аміно-феніл)-морфолін-3-оном формули 5. 1 Винахід відноситься до S-енантіомерних сполук загальної формули 19 і їх рацематів (де Z і 2 1 1 Z є воднем або захисною групою, за умови, що принаймні Z не є воднем і у разі коли Z є 2 бензилом. Z не є бензилом). 9 UA 114601 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід відноситься до одержання S-енантіомерних сполук загальної формули 14 і їх 1 2 1 1 рацематів (де Z і Z є воднем або захисною групою, за умови, що принаймні Z не є воднем і Z 2 і Z переважно є бензилом), що включають наражання R-енантіомерної сполуки загальної 2 формули 10 або її рацемату (де L є хлором, бромом, йодом, алкілсульфонілокси або арилсульфонілокси) поділу, у разі застосування рацемічного вихідного матеріалу, і подальшої 1 2 1 2 реакції продукту сполуки загальної формули Z Z NH (де Z і Z є вищевказаними). 2 Винахід відноситься до R-енантіомерних сполук загальної формули 10 і їх рацематів (де L є хлором, бромом, йодом, алкілсульфонілокси або арилсульфонілокси, переважно хлором, бромом або йодом). Винахід відноситься до способу одержання R-енантіомерних сполук формули 10 і їх 2 рацематів, де L є хлором, бромом, йодом, алкілсульфонілокси або арилсульфонілокси, переважно хлором, бромом або йодом, що включає наражання R-енантіомерної сполуки 2 формули 9 (де L є вищевказаним) або її рацемату поділу, у разі застосування рацемічного 2 вихідного матеріалу, і подальшої реакції з агентом, що здатен ввести карбонільну групу (де L є вищевказаним). Винахід відноситься до способу одержання R-енантіомерної сполуки формули 10b або її рацемату формули rac10b або R-енантіомерної сполуки формули 10с або її рацемату формули rac10c, що включає в себе реакцію R-енантіомерної сполуки формули 10а або її рацемату формули rac10a з бромідом лужного металу, переважно з бромідом натрію йодидом або лужного металу, переважно йодидом натрію. 2 Винахід відноситься до R-енантіомерних сполук загальної формули 9 і їх рацематів, де L є хлором, бромом, йодом, алкілсульфонілокси або арилсульфонілокси, переважно хлором, бромом або йодом. Найбільш поширені форми реалізації синтезу ривароксабану формули 1 наведені на схемах реакції 7а і 7b. Визначення у формулі на схемах реакції 7а і 7b є наступним: 1 2 1 2 - в загальних формулах Z Z NH, 19, 20 та 14, Z і Z є воднем або захисною групою, а саме звичайну аміно-захисну групу, наприклад, бензил, замещений бензил, п-метокси-бензил, 1 1 2 бензилоксикарбоніл або третбутоксикарбоніл, за умови, що принаймні Z не є воднем, і Z і Z переважно є бензилом; - у загальній формулі 3 HnX є моно - або бівалентною органічною або неорганічною кислотою (де n є 1, 2 або 3 і Х є іоном кислотного залишку). Як органічна кислота можуть бути застосовані, наприклад, сульфонові кислоти карбонові кислоти, переважно моновалентні карбонові кислоти, наприклад, мурашина кислота, оцтова, пропіонова кислота, масляна кислота, і в як неорганічних кислот можуть бути застосовані, наприклад, сірчана кислота, сірчиста кислота, азотна кислота, фосфорна кислота, соляна кислота, бромоводнева або йодоводнева; 2 - в загальних формулах 9 і 10, де L є хлором, бромом, йодом, алкілсульфонілокси або арилсульфонілокси, наприклад, метансульфонілокси, бензолсульфонілокси або птолуолсульфонілокси, переважно хлор, бром або йод. На першому етапі реакційного шляху, який показано на схемі 7а, сполука формули 11 реагує 1 2 1 2 сполуку загальної формули Z Z NH (де Z і Z є вищевказаними) у відсутності розчинника або в органічному розчиннику або воді або їх суміші, переважно у присутності речовини, що сполучає органічні або неорганічні кислоти. На другому етапі реакційного шляху, який показано на схемі 7а, сполука загальної формули 1 2 19 (де Z і Z є вищевказаними) реагує зі сполукою формули 5. Реакцію проводять переважно в протонному розчиннику або суміші розчинників або в суміші протонного розчинника і води при 0150°С, переважно при 60-90°С, протягом 0,5-60 годин, переважно 20-40 годин. На третьому етапі реакційного шляху, який показано на схемі 7а, одержаної сполуки 1 2 загальної формули 20 одержують сполуку загальної формули 14 (де Z і Z є вищевказаними). Реакцію проводять за допомогою застосування агента, здатного ввести карбонільную групу, переважно N,N'-карбоніл-диімідазолу, фосгену, дифосгену або трифосгену, переважно N,N'карбоніл-диімідазолу, в прийнятному розчиннику або суміші розчинників, переважно в толуолі. На четвертому етапі реакційного шляху, який показано на схемі реакції 7а, зі сполуки 1 2 загальної формули 14 (де Z і Z є вищевказаними) одержують основу формули 12 або її сіль загальної формули 3 за допомогою видалення захисної групи, переважно за допомогою відновлення (де HnX є вищевказаними). Відновлення проводять в С1-С4-аліфатичному спирті, крижаній оцтовій кислоті, воді або суміші вказаних розчинників один з одним або додатковим органічним розчинником. Можуть бути застосовані каталітична гідрогенізація або хімічне відновлення. 10 UA 114601 C2 5 10 15 20 25 Сполука формули 3b виділяють безпосередньо або з оцтовокислої солі формули 3b, основу формули 12 виділяють відомим способом або, можливо, отриману уксуснокислу сіль перетворюють на сіль загальної формули 3 відомим способом (де HnX є вищевказаними). На останньому етапі реакційного шляху, який показано на схемі реакції 7а, основу формули 12 або її сіль загальної формули 3 (де HnX є вищевказаними) реагує з 5-хлор-тіофен-2карбоновою кислотою формули 15 в присутності сполучної речовини і органічної або неорганічної основи в органічному розчиннику. Як сполучна речовина можуть бути застосовані N,N'-диізопропіл-карбодиімід (ДІК), N,N'-дициклогексил-карбодиімід (ДЦК), ангідрид трипропілфосфонової кислоти (ТФА) або N,N'-карбоніл-диімідазол (КДІ), переважно хлоретилформіат або КДІ. Як розчинник можуть бути застосовані ацетонітрил, дихлорметан, ацетон, толуол, тетрагідрофуран або їх суміш один з одним або водою. Як органічна або неорганічна основа можуть бути застосовані триетиламін, диізопропілетиламін, карбонат натрію або гідрокарбонат натрію. Реакцію проводять при 0-100°С, переважно при 40-70°С. Застосування речовини, що зв'язує кислоту, може бути виключено. На першому етапі реакційного шляху, який показано на схемі реакції 7b із сполуки загальної 2 формули 9 одержують сполуку загальної формули 10 (де L є вищевказаним). У реакції як агент, що здатен ввести карбонільную групу, можуть бути застосовані переважно N,N'-карбонілдиімідазол, фосген, дифосген або трифосген, переважно N,N'-карбоніл-диімідазол. Реакцію проводять в прийнятному розчиннику або суміші розчинників, переважно в толуолі, 1-метил-2піролідині або їх суміші, при 0-150°С, переважно при температурі флегми розчинника або суміші розчинників. 2 У випадку сполук загальної формули 9, яка показана на схемі реакції 7b L є хлором, тобто сполука є формулою і бром або йод-аналоги сполук загальної формули 9, тобто сполук формули і 30 35 можуть бути виготовлені зі сполуки формули 9а відомим способом попереднього рівня техніки. На другому етапі реакційного шляху схеми реакції 7b одержують сполуку загальної формули 2 14 за допомогою реакції сполуки загальної формули 10 (де L є вищевказаним) зі сполукою 1 2 1 2 загальної формули Z Z NH (де Z і Z є вищевказаними). Реакцію проводять у відсутності або присутності розчинника, у присутності речовини, що зв'язує органічні або неорганічні кислоти, переважно карбонату цезію при температурі 0-150°С, переважно 60-100°С. Додаткові реакційні етапи, два останніх етапи, наведені на схемі реакції 7b, ідентичні двом останнім етапами, наведеними на схемі реакції 7а. 11 UA 114601 C2 5 10 15 20 25 30 35 40 45 50 Переважні втілення способу одержання ривароксабану формули 1 за винаходом, який наведено на схемі реакції 8а. На схемах реакції 7а і 8а ми вказали хіральність проміжних сполук згідно з номенклатурою Кана-Інгольда-Прелога. Новий шлях синтезу також здійснюють за допомогою застосування рацемічних форм сполуки, наведених на схемі реакції 8а, починаючи з епіхлоргідрину. Рацемічні сполуки, які відповідають проміжним сполукам формули 18, 13 і 3b прийнятні для утворення солі і таким чином їх відповідні енантіомери можуть бути отримані за допомогою поділу. Розділення проводять за допомогою звичайних способів рівня техніки за допомогою ферменту або кінетичного поділу або утворення діастериомерної солі і подальшого відділення діастериомерних похідних за допомогою хроматографії або фракційної кристалізації або фізичних способів. Із сполук, які наведено на схемі реакції 8а - 4-(4-аміно-феніл)-морфолін-3-он формули 5 - (2S)-хлорметил-оксиран, з широковідомою назвою епіхлоргідрин, формули 11 - N-бензил-1-фенілметинамін, з широковідомою назвою дибензиламін, формули 16 - (2S)-N,N-дибензил-1-оксиран-2-іл-метанамін формули 17 - 5-хлор-тіофен-2-карбонова кислота формули 15 і - ривароксабан формули 1 широковідомі в області техніки сполуки 1, 5, 11, 16 і 15 комерційно доступні. 4-(4-аміно-феніл)-морфолін-3-он формули 5, який розкрито в ЕР 11261606, WO 2004/101556, WO 2005/026135, WO 2006/0632193 та статті IPCOM0000195906D, опублікованій в 2010 IP.com.Journal. (S)-епіхлоргідрин формули 11 і її рацемічна форма, дибензиламін формули 16 і 5-хлор-тіофен-2-карбонова кислота формули 15 комерційно доступні. (2S)-N,N-дибензилоксиран-2-іл-метанамін формули 17, який описано в СР 2003200582. Одержання рацемічної форми сполуки формули 17, яку розкрито серед іншого в US 4656180. З проміжних сполук, які наведено на реакційній схемі 8а, -4-(4-{[(2R)-3-(дибензиламіно)-2-гідрокси-пропіл]аміно}феніл)морфолін-3 формули 18 -4-(4-{(5S)-5-[(дибензиламіно)метил]-2-оксо-1,3-оксазолідин-3-іл}феніл)морфолін3-он формули 13 і сіль 4-{4-[(5S)-5-(амінометил)-2-оксо-1,3-оксазолідин-3-іл]феніл}морфолін-3-оцтової кислоти формули 3b і їх рацемічної форми не відома з рівня техніки. Сполуки формул 18 і 13 прийнятні для утворення солі. Крім того, сполуки формул 18 і 13 та їх рацемічні еквіваленти можуть існувати у вигляді сольватів і можуть утворювати со-кристали, відповідно. Винахід також відноситься до солей, сольватів і гідрати сполук формул 18 і 13 та їх рацемату і також до со-кристалів даних сполук. Винахід відноситься до 4-(4-{[(2R)-3-дибензиламіно-2-гідрокси-пропіл]-аміно}-фенілморфолін-3-ону формули 18 і її рацемічної форми. Винахід відноситься до одержання сполук формули 18, виходячи зі сполуки формули 17. Винахід відноситься до одержання рацемічної форми сполуки формули 18, виходячи з рацемічної форми сполуки формули 17. 1 2 Винахід також відноситься до сполук загальної формули 20 і їх рацемічних форм (де Z і Z є 1 воднем або захисною групою, за умови, що принаймні Z не є воднем). Винахід відноситься до способу одержання сполук загальної формули 20 і їх рацемічних форм, виходячи із сполуки загальної формули 19 або її рацемічної форми. Винахід відноситься до 4-(4-{(5S)-5-[(дибензиламіно)-метил]-2-оксо-1,3-оксазолідин-3-іл}феніл-морфолін-3-ону формули 13 і її рацемічної форми. Винахід відноситься до способу одержання сполуки формули 13, виходячи з формули сполуки 18. Винахід відноситься до способу одержання рацемічної форми сполуки формули 13, виходячи з рацемічної форми сполуки формули 18. 12 UA 114601 C2 1 5 10 15 20 25 30 35 40 45 50 55 2 Винахід відноситься до сполук загальної формули 14 і її рацемічних форм (де Z і Z є 1 воднем або захисною групою, за умови, що принаймні Z не є воднем). Винахід відноситься до способу одержання сполук загальної формули 14 і їх рацемічним форм, виходячи з сполук загальної формули 20 і її рацемічної форми. Винахід відноситься до способу одержання сполуки формули 12 і її рацемічних форм, починаючи зі сполуки формули 14 або її рацемічної форми. Винахід відноситься до оцтовокислої солі 4-{4-[(5S)-5-амінометил-2-оксо-1,3-оксазолідин-3іл]-феніл}-морфолін-3-она формули 3b та її рацемічної форми. Винахід відноситься до способу одержання оцтовокислих солі 4-{4-[(5S)-5-амінометил-2оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3-она формули 3b або її рацемічної форми, починаючи із сполуки формул 13 або 14 або їх рацемічних форм. Винахід відноситься до способу одержання ривароксабану формули 1 за допомогою реакції сполуки загальної формули 3 (де HnX є моно - або полівалентною органічною або неорганічною кислотою; n є 1, 2 або 3, і Х є іоном кислотного залишку) або сполуки формули 12 і 5-хлортіофен-2-карбонової кислоти формули 15. Згідно переважного втілення способу (див. реакційну схему 8а) сполуку формули 17 одержують за допомогою реакції сполуки формули 11 з дибензиламіном формули 16 (в даному 1 2 випадку Z і Z є бензилом). Реакцію проводять у відсутності розчинника або в органічному розчиннику або воді або їх суміші і переважно у присутності речовини, що зв'язує органічну або неорганічну кислоту. Згідно переважного втілення способу винаходу сполуку формули 18 одержують за допомогою реакції 4-аміно-феніл-морфолінона формули 5 с (2S)-N,N-дибензил-1-оксиран-2-ілметанаміном формули 17. Реакцію переважно проводять у протонному розчиннику або суміші розчинників або в суміші протонного розчинника і води при 0-150 °C, переважно 60-90 °C протягом періоду 0,5-60 годин, переважно 20-40 годин. Сполука формули 18 володіє високою температурою плавлення, швидко кристалізується і переважно прийнятна для застосування як проміжної сполуки при фармацевтичному виробництві промислового масштабу. Згідно способу за даним винаходом дана сполука може бути отримана без перекристалізації з хімічною чистотою вище 98 % і з дуже високою енантіомерною чистотою 99 %. З попереднього рівня техніки відомо, що розкриття кільця сполук епоксидного типу за допомогою нуклеофільних агентів призводить до утворення суміші регіоізомерів залежно від того який з нуклеофільних центрів буде атакувати (у разі присутності аміногруп сполуки формули 5), що призводить до позитивної поляризації вуглецевого атома епокси-групи сполуки формули 17. Крім того, в реакції даного типу, в залежності від умов реакції існує небезпека часткової або повної рацемізації хірального центру. Несподівано виявилося, що при застосуванні в способі по даному винаходу оптимізованих умов реакції небажаний регіоізомер утворюється тільки в дуже невеликій мірі, рацемізація практично не відбувається і отримана сполука формули 18 може бути охарактеризована хімічною чистотою 98,4 % і значенням енантіомерної чистоти 99 %. Згідно з переважним конкретним втіленням згідно даного винаходу рацемічну форму сполуки формули 18 одержують за допомогою реакції 4-аміно-феніл-морфолінона формули 5 з рацемічною формою N,N-дибензил-1-оксиран-2-іл-метанаміна формули 17. Реакцію проводять переважно в протонному розчиннику або суміші розчинників або в суміші протонного розчинника і води при 0-150°С, переважно при 40-80°С протягом періоду часу 0,5-60 годин, переважно 40-50 годин. Згідно способу за даним винаходом рацемічна форма сполуки формули 18 може бути виготовлена з дуже хорошим виходом. Сполука володіє високою температурою плавлення, може бути швидко кристалізованою і прийнята як проміжна сполука при способах виробництва у фармацевтичній промисловості. Згаданий продукт, у разі одержання згідно способу по даному винаходу, може бути застосований на додаткових етапах синтезу без перекристалізації. При оптимізованих реакційних умовах даного винаходу небажаний регіоізомер утворюється тільки в дуже невеликій кількості і отримана проміжна сполука (рацемічна форма сполуки формули 18) може бути застосована на додаткових етапах синтезу без перекристалізації. Згідно переважного конкретного втілення способу по даному винаходу сполуку формули 13 одержують шляхом взаємодії 4-(4-{[(2R)-3-дибензиламіно-2-гідрокси-пропіл]-аміно}феніл)морфолін-3-она формули 18 і агента, здатного ввести карбонільну групу, переважно N,N'карбоніл-диімідазола, фосгену, дифосгена або трифосгена, переважно N,N'-карбонілдиімідазола в прийнятному розчиннику, переважно толуолі. 13 UA 114601 C2 5 10 15 20 25 30 35 40 45 50 55 Сполука формули 13 володіє високою температурою плавлення, може бути легко кристалізована і високо прийнятною як проміжна сполука при способах виробництва у фармацевтичній промисловості. Згідно способу за даним винаходом сполука формули 13 може бути одержаною з дуже високим виходом, хімічною чистотою 99,9 % і практично з енантіомерною чистотою 99,9 %. З попереднього рівня техніки відомо, що в реакціях даного типу замість переважної внутрішньомолекулярної циклізації в ході міжмолекулярної реакції можуть утворюватися побічні продукти, оскільки застосовується реагент Cl, що пов'язує дві молекули один з одним через їх NH - і ОН - функціональні групи. Крім того, оскільки у вихідному матеріалі формули 18 гідроксильна група прикріплена до хірального центру, втрата води може призвести до утворення побічних продуктів, що включають подвійний зв'язок, а також часткової або повної рацемізації. Несподівано виявлено, що при застосуванні оптимізованих умов реакції в способі за даним винаходом утворення побічних продуктів є дуже низьким, і отримана сполука формули 13 може бути охарактеризована хімічною чистотою 99,9 % і значенням енантіомерної чистоти 99,9 %. Переважне конкретне втілення способу одержання ривароксабану формули 1 по винаходу наведено на схемі реакції 8b. На схемах реакції 7b і 8b вказана хіральність проміжних сполук згідно з Кан-Інгольд-Прелогу. Як видно зі схеми реакції 8b вихідний матеріал способу є (2R(-хлорметил-оксиран (з добре відомою назвою (R-епіхлоргідрину) формули 11, і з даної сполуки в шість етапів одержують ривароксабан формули 1, що включає (S)-конфігурацію. На етапі реакції 10b(10с)→13 конфігурацію очевидно змінюють, однак у дійсності це не є інверсійним етапом, а конверсія (R)хіральності в (S)-хіральність є лише зміною номенклатури в результаті нової ієрархії груп при введенні нової структурної ланки. Зі сполук, що наведені на схемі реакції 8b - 4-(4-аміно-феніл)-морфолін-3-он формули 5 - (2S)-хлорметил-оксиран (широковідома назва (S)-епіхлоргідрину) формули 11 - N-бензил-1-фенілметанамін (широковідома назва дибензиламін) формули 16 - 5-хлор-тіофен-2-карбонова кислота формули 15 і - ривароксабан формули 1 відомі з області техніки і комерційно доступні. З проміжних сполук та їх безпосередніх аналогів, що наведені на схемі реакції 8b - 4-{4-[((2R)-3-хлор-2-гідроксипропіл)-аміно]-феніл}-морфолін-3-он формули 9а 4-{4-[((2R)-3-бром-2-гидроксипропіл)-аміно]-феніл}-морфолін-3-он формули 9b 2 (представляє собою сполуку формули 9, де L є бромом) 4-{4-[((2R)-3-йод-2-гідроксипропіл)-аміно]-феніл}-морфолін-3-он (сполука загальної 2 формули 9с, де L є йодом) - 4-{4-[(5R)-5-хлорметил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3-он формули 10а - 4-{4-[(5R)-5-бромметил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3-он формули 10b і - 4-{4-[(5R)-5-йодметил-2-оксо-1,3-оксазолідин-3-іл]феніл}-морфолін-3-он формули 10с підпадають під загальну формулу WO 2010/124385, однак відсутнє посилання на їх одержання і не розкриті фізичні константи, прийнятні для ідентифікації даних сполук. З проміжних сполук, які наведено на схемі реакції 8b 4-(4-{(5S)-5-(дибензиламіно-метил]-2-оксо-1,3-оксазолідин-3-іл}-феніл-морфолін-3-он формули 13 і - оцтовокисла сіль 4-{4-[(5S)-5-амінометил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3она формули 3 не відома з області техніки. Для довідки, ми проводили послідовність реакції, починаючи з комерційно доступного (S)епіхлоргідрину формули 11S, і отримували енантіомер ривароксабану формули 1R, а саме (5хлор-N-({(5R)-2-оксо-3-[4-(3-оксо-морфолін-4-іл)-феніл]-1,3-оксазолідин-5-іл}-метил(метил)тіофен-2-карбоксамід (схема реакції 9). З проміжних сполук, які наведено на схемі реакції 9 - 4-{4-[((2S)-3-хлор-2-гідроксипропіл)-аміно]-феніл}-морфолін-3-он формули 9аS - 4-{4-[(5S)-5-хлорметил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3-он формули 10аS - 4-{4-[(5S)-5-йодметил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3-он формули 10сS 4-(4-{5R-5-[(дибензиламіно-метил]-2-оксо-1,3-оксазолідин-3-іл}-феніл)-морфолін-3-он формули 13R і - оцтовокисла сіль 4-{4-[5R-5-амінометил-2-оксо-1,3-оксазолідин-3-іл}-феніл}-морфолін-3она формули 3bR не описано в попередньому рівні техніки. 14 UA 114601 C2 5 10 15 20 25 30 35 40 45 50 55 Також ми проводили послідовність синтезу, починаючи з комерційно доступного (±)епіхлоргідрину формули rac11, і отримували рацемічний еквівалент ривароксабану формули rac1 (див. реакційну послідовність 10). З проміжних сполук, які наведено на схемі реакції 10 - 4-{4-[(3-хлор-2-гідроксипропіл)-аміно]-феніл}-морфолін-3-он формули rac9a - 4-{4-[5-хлорметил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3-он формули гас10а - 4-{4-[5-йодметил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3-он формули гас10с - 4-[4-[5-(дибензиламіно-метил)-2-оксо-1.3-оксазолідин-3-іл]-феніл}-морфолін-3-он формули rac13 і - оцтовокисла сіль 4-(-{4-[5-амінометил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3-она формули rac3b не описані в попередньому рівні техніки. Сполука формул rac9a, rac13 і rac3b включають азотисту основу і таким чином за допомогою поділу можуть бути отримані потенційно прийнятні енантіомери, які можуть бути застосовані для одержання ривароксабану формули 1, як наведено на реакційній схемі 8b за допомогою застосування способів, відомих в області техніки. Розділення проводять за допомогою звичайних способів, наприклад, за допомогою застосування ферменту, кінетичного поділу, утворення диастериомерної солі і подальшого відділення диастериомерних похідних за допомогою хроматографії або фракціонованої кристалізації або за допомогою фізичних методів. Сполука формул 9а і 13 і їх енантіомери і рацемічні форми можуть формувати солі. Крім того, сполука формул 9а, 10а, 10b, 10с і 13 і їх енантіомери і рацемічні форми також можуть існувати у вигляді гідратів та інших сольватів і також можуть утворювати ко-кристали. Винахід відноситься до сполук формул 9а, 10а, 10b, 10c і 13 і їх енантіомерів і їх рацемічних форм і їх солей, гідратів, сольватів і ко-кристалів. Винахід відноситься до 4-{4-[((2R)-3-хлор-2-гідроксипропіл)-аміно]-феніл}-морфолін-3-ону 2 формули 9а (сполука формули 9, де L є хлором) і її рацемічної форми. Винахід відноситься до 4-{4-[((2R)-3-бром-2-гідроксипропіл)-аміно]-феніл}-морфолін-3-ону 2 формули 9b (сполука формули 9, де L є бромом) і її рацемічної форми. Винахід відноситься до 4-{4-[((2R)-3-йод-2-гідроксипропіл)-аміно]-феніл}-морфолін-3-ону 2 формули 9с (сполука формули 9, де L є йодом) і її рацемічної форми. Згідно з даним винаходом запропоновано спосіб одержання сполуки формули 9а та її рацемічної форми, починаючи з формули сполуки 11 і її рацемічної форми. Згідно з даним винаходом також запропонована сполука 4-{4-[(5R)-5-хлорметил-2-оксо-1,3оксазолідин-3-іл]феніл}морфолін-3-он формули 10а і її рацемічної форми. Згідно з даним винаходом також запропонована сполука 4-{4-[(5R)-5-бромметил-2-оксо-1,3оксазолідин-3-іл]феніл}морфолін-3-он формули 10b і її рацемічної форми. Згідно з даним винаходом також запропонована сполука 4-{4-[(5R)-5-йодметил-2-оксо-1,3оксазолідин-3-іл]феніл}морфолін-3-он формули 10с і її рацемічної форми. Згідно даним винаходом також запропоновано спосіб одержання сполуки 10а і її рацемічної форми, починаючи з формули сполуки 9а або її рацемічної форми. Згідно з даним винаходом також запропоновано спосіб одержання сполуки 10b і її рацемічної форми, починаючи з формули сполуки 9b або її рацемічної форми. Згідно з даним винаходом також запропоновано спосіб одержання сполуки 10с і її рацемічної форми, починаючи з формули сполуки 9с або її рацемічної форми. Згідно з даним винаходом також запропоновано спосіб одержання сполуки формули 10b і її рацемічної форми, починаючи з формули сполуки 10а або її рацемічної форми. Згідно з даним винаходом також запропоновано спосіб одержання сполуки формули 10с і її рацемічної форми, починаючи з формули сполуки 10а або її рацемічної форми. Згідно з даним винаходом також запропоновано спосіб одержання сполуки формули 13 і її рацемічної форми, починаючи з формули сполуки 10а, 10b або 10с або їх рацемічних форм. Згідно з даним винаходом також запропоновано спосіб одержання формули сполуки 14 та його рацемічної форми, починаючи з формули сполуки 10а, 10b або 10с або їх рацемічних форм. Згідно з переважним конкретним втіленням способу щодо винаходу (див. схему реакції 8b) сполуку формули 9а одержують за допомогою реакції 4-аміно-феніл-морфолін формули 5 з епіхлоргідрином формули 11 в органічному розчиннику або суміші водорозчинного органічного розчинника і води при температурі 0-150°С, переважно при температурі флегми розчинника або суміші розчинників протягом 0,5-60 годин. 15 UA 114601 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполука загальної формули 9 володіє високою температурою плавлення, може бути швидко кристалізована і переважно прийнятна для застосування як проміжної сполуки засобів виробництва у фармацевтичній промисловості. Згідно способу по даному винаходу сполука формули 9а може бути приготовано без перекристалізації з хімічною чистотою вище 95 % і видатною енантіомерною чистотою понад 99 %. З попереднього рівня техніки відомо, що розкриття кільця сполук епоксидного типу за допомогою нуклеофільних агентів призводить до утворення суміші регіоізомерів в залежності від того який з нуклеофільних центрів (у разі присутності аміногруп сполуки формули 5) атакований, що призводить до позитивної поляризації атома вуглецю епокси-групи відповідної сполуки формули 11. Крім того, в реакціях даного типу, у випадку оптично активних вихідних матеріалів, в залежності від умов реакції існує ризик часткової або повної рацемізації хіральним центром. Несподівано було виявлено, що при оптимізованих умовах реакції згідно з даним винаходом небажаний регіоізомер утворюється тільки в дуже невеликій кількості. У разі застосування оптично активних вихідних матеріалів рацемізація практично не відбувається. Згідно з іншим переважним конкретним втіленням винаходу сполуки формули 10а одержують за допомогою реакції сполуки формули 9а з агентом, що здатен ввести карбонільну групу, переважно N, N'-карбоніл-диімідазолом, фосгеном, дифосгеном або трифосгеном, переважно N,N'-карбоніл-диімідазолом в прийнятному розчиннику або суміші розчинників. Переважно в толуолі, 1-метил-2-пірролідоні або їх суміші при 0-150°С, переважно при температурі флегми розчинника або суміші розчинників. Сполука загальної формули 10 володіє високою температурою плавлення, може бути швидко кристалізована і переважно прийнятна для застосування як проміжної сполуки засобів виробництва у фармацевтичній промисловості. Згідно способу по даному винаходу вказані сполуки можуть бути отримані з хімічною чистотою 95 % і енантіомерною чистотою понад 99 % без перекристалізації. Сполуку формули 10с може бути одержано зі сполуки формули 10а з високим виходом 95,2 %. З попереднього рівня техніки відомо, що в процесі реакцій даного типу замість бажаного внутрішньомолекулярного закриття кільця має місце межмолекулярная реакція і можуть утворюватися побічні продукти, оскільки застосовується агент Cl, що з'єднує дві молекули через їх NH - і ОН - функціональні групи. Крім того, оскільки у вихідних матеріалах формули 9 гідроксигрупа прикріплена до хірального центру, втрата і додаткове поглинання води може призвести до утворення побічних продуктів, що включають подвійний зв'язок, а також може мати місце часткова або повна рацемізація. Несподіваним чином ми виявили, що при оптимізованих умовах реакції даного винаходу побічні продукти утворюються тільки в дуже невеликій мірі і рацемізація навіть не відбувається. Згідно з переважним конкретним втіленням даного винаходу сполуку формули 10с одержують із сполуки формули 10а за допомогою реакції згаданої сполуки формули 10а з йодидом лужного металу, переважно йодидом натрію, в прийнятному розчиннику або суміші розчинників, переважно в суміші органічного розчинника і води, при 0-150°С, переважно 80130°С. Згідно з іншим переважним конкретним втілення даного винаходу сполуку формули 10b одержують із сполуки формули 10а допомогою реакції згаданої сполуки формули 10а з бромідом лужного металу, переважно бромідом натрію, в прийнятному органічному розчиннику або суміші розчинників, при 0-150°С, переважно 80-130°С. Згідно з переважним конкретним втіленням даного винаходу сполуку формули 13 одержують за допомогою реакції сполуки формули 10а, 10b або 10с з прийнятною хіральністю, переважною є сполука формули 10с з прийнятною хіральності, з дибензиламіном формули 16 (в 1 2 даному випадку Z і Z є бензилом) в присутності або відсутності розчинника, в присутності карбонату цезію, при 0-150°С, переважно 60-100°С, після чого реакційну суміш обробляють і одержаний продукт піддають при бажанні додатковому очищенню. Сполука формули 13 володіє високою температурою плавлення, може бути швидко кристалізованою і зокрема прийнятною для застосування як проміжної сполуки засобів виробництва фармацевтичної промисловості. Згідно з іншим способом даного винаходу (схема реакції 8b) дана сполука може бути отримана після перекристалізації з видатною хімічною чистотою понад 99,5 % і енантіомерною чистотою понад 99,9 %. З попереднього рівня техніки відомо, що при реакції нуклеофільного заміщення (SN) даного типу, у випадку оптично активних вихідних матеріалів, в залежності від умов реакції, існує небезпека часткової або повної рацемізації хіральним центром або інверсії, відповідно. Враховуючи характерну побічну реакцію галід водню відокремлюють через умовності нуклеофільного агента (у разі присутності дибензиламіна). Несподіваним чином ми виявили, що 16 UA 114601 C2 5 10 15 20 25 30 35 40 45 50 55 при застосуванні оптимізованих умов реакції за даним винаходу має місце недетектована елімінація побічної реакції, та у разі оптично активного вихідного матеріалу не відбувається інверсія ні рацемізація. Останні два етапи способу, наведені на схемах реакції 8а і 8b, ідентичні і з цієї причини два останніх етапи двох переважних конкретних втілень даного винаходу обговорюються разом. Згідно з переважним конкретним втіленням способу за даним винаходом сполуку формули 3b одержують за допомогою наражання 4-(4-{(5S)-[дибензиламіно-метил]-2-оксо-1,3оксазолідин-3-іл}-феніл)морфолін-3-она формули 13 каталітичної гідрогенізації або хімічним відновленню в С1-4-аліфатичному спирті, крижаній оцтовій кислоті, воді або суміші згаданих розчинників, утвореної ними один з одним або з іншими органічними розчинниками, обробки реакційної суміші і відділенню продукту за допомогою додавання оцтової кислоти у вигляді солі формули 3b. Згідно з іншим переважним конкретним втіленням сполуку формули 3b одержують за допомогою перетворення одержаного 4-(4-{(5S)-5-амінометил-2-оксо-1,3-оксазолідин-3-іл]феніл}-морфолін-3-она формули 12 за допомогою будь-якого шляху синтезу, відомого в області техніки або описаного в даній заявці на патент, в сіль формули 3b за допомогою додавання оцтової кислоти. Сполука формули 3b володіє високою температурою плавлення, може бути легко кристалізована і переважно прийнятною як проміжна сполука способів фармацевтичного виробництва. У разі одержання згідно способу за даним винаходом згадану сполуку одержують з дуже високим виходом (98 %), видатною хімічною чистотою (99,5 %) і високою енантіомерною чистотою (99,9 %) без перекристалізації. Згідно з переважним конкретним втіленням способу за даним винаходом ривароксабан формули 1 одержують за допомогою реакції оцтовокислої солі 4-(4-((5S(-5-амінометил-2оксо1,3-оксазолідин-3-іл)-феніл)-морфолін-3-она формули 3b з 5-хлор-тіофен-2-карбонової кислоти формули 15 в присутності сполучної речовини і органічної або неорганічної основи, в органічному розчиннику. Як сполучна речовина можуть бути застосовані хлоретилформіат, N,Nдиізопропіл-карбодимід (ДІК), N, N'-дициклогексил-карбодиімід (ДЦК), трипропіл-фосфоновий ангідрид (ТФА) або N,N-карбоніл-диімідазол (КДІ), переважно хлоретилформіат або КДІ. Як розчинник можуть бути застосовані ацетонітрил, дихлорметан, ацетон, толуол, тетрагідрофуран або їх суміш або суміш даного органічного розчинника, який утворено з водою. Як органічною або неорганічною основою можуть бути застосовані триетиламін, диізопропілетиламін, карбонат натрію або гідрокарбонат натрію. Реакцію проводять при температурі 0-110°С, переважно 40-70°С. Можливо, застосування речовини, що зв'язує кислоту, може бути опущено. Перевагою способу за даним винаходу є те, що проміжні сполуки володіють високою температурою плавлення, можуть бути швидко кристалізовані і високо прийнятні як проміжні сполуки способів фармацевтичного виробництва. Дані сполуки можуть бути отримані згідно способу за даним винаходом з найвищою хімічної та енантіомерною чистотою без перекристалізації. Таким чином, наприклад, сполуки формул 13 і 3b можуть бути отримані згідно способу, який наведено на реакційній схемі 8b, без перекристалізації з хімічною чистотою понад 95 % для сполуки формули 13, переважно 99,4 % і з енантіомерною чистотою понад 99 % для сполук формул 13 і 3b, переважно 99,9 %. Додатковою перевагою способу винаходу є високі виходи етапів реакції. Додатковою перевагою способу винаходу є те, що з проміжна сполука 4-{4-[(5S)-5(дибензиламіно-метил)-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3-она формули 13 захисна група може бути видалена при набагато більш м'яких умовах, ніж фталільна захисна група, яка застосовується згідно WO 2005/068456 (див. схему реакції 4) і тому остання проміжна сполука формули 3b шляху синтезу може бути отримані з більш високою чистотою, ніж описана в рівні техніки. Додаткова перевага способу за даним винаходом полягає в тому, що реагент формули 15, який застосовувався на останньому етапі (ацилювання) одержання ривароксабану формули 1 є більш виграшним за деякими властивостями, ніж хлорангідрид формули 4. Дані переваги є наступними: - сполука формули 15 є твердою і кристалічною, в той час як сполука формули 4 представляє собою в'язку субстанцію, складну в обігу, - сполука формули 15 є стабільною, у той час як сполука формули 4 легко гідролізується, вміст її ефективної кількості поступово знижується при зберіганні, навіть у разі зберігання при 05°С, 17 UA 114601 C2 5 10 15 20 25 30 35 40 45 50 55 - при отриманні сполуки формули 15 застосування кородуючої речовини, тионілхлориду, яка володіє неприємним запахом і може складно видалятися, може елімінувати, і може уникнути обробки токсичними газами, несприятливими для навколишнього середовища, що утворюються при реакції тионілхлориду, - сполука формули 15 є значно дешевшим реагентом, ніж сполука формули 4. Додаткові переваги способу за даним винаходом порівняно зі способом, який описано в WO 2011/012321, який також застосовує 5-хлор-тіофен-2-карбоновій кислоті формули 15, є наступним: за допомогою вибору більш прийнятного розчинника і застосування більш виграшних умов реакції і оцтовокислої солі формули 3b замість солянокислої солі згідно способу щодо винаходу може бути досягнутий вихід 87 %, на відміну від виходу неочищеного продукту 72 %, розкритого в WO 2011/012321. Після перекристалізації загальний вихід згідно WO 2011/012321 становить 61 %, у той час як загальний вихід згідно з даним винаходом становить 70 %. В WO 2011/012321 не приведені дані по чистоті, в той час як ВЕРХ чистота продукту, одержаного згідно способу щодо винаходу становить 99,32 %. Додатковою перевагою способу винаходу є те, що з оцтовокислого середовища, яке застосовувалось при каталітичній реакції дебензіліровання (133b), оцтовокисла сіль формули 3b може бути безпосередньо виділена з виключно високим виходом (98 %), хімічною чистотою 99,91 % і енантіомерною чистотою 99,9 %. Таким чином спосіб по даному винаходу безпосередньо прийнятний для одержання кінцевого продукту формули 1, який є чистим і задовольняє вимогам чистоти фармацевтичної промисловості. Додатковою перевагою способу, що наведено на реакційній схемі 8а є те, що при оптимізованих умовах реакції, яка застосовуються при отриманні сполуки формули 18, небажані регіоізомери утворюються, але в дуже невеликій мірі і рацемізація практично не відбувається. Таким чином, сполуку 18 формули одержують з хімічною чистотою 98,4 % і вона може бути охарактеризована значенням енантіомерної чистоти 99 %. Додатковою перевагою способу, що наведено на схемі реакції 8а є те, що при оптимізованих умовах реакції, що застосовуються при отриманні сполуки формули 13, побічні продукти утворюються тільки в дуже невеликій мірі і рацемізація зовсім не відбувається. Таким чином сполуку формули 18 одержують з хімічною чистотою 99,9 %, і вона може бути охарактеризована значенням енантіомерної чистоти 99 %. Додатковою перевагою способу, що наведено на реакційних схемах 7b і 8b є те, що при оптимізованих умовах реакції, яка застосовується при реакції сполук формули 11 і 5, утворення небажаного регіоізомера є дуже незначним, і в разі застосування оптично активного вихідного матеріалу, рацемізація практично не відбувається. Додатковою перевагою способу, що наведено на схемах реакції 7b і 8b є те, що при оптимізованих умовах реакції, яка застосовується при отриманні сполук формули 10, побічні продукти утворюються тільки в дуже невеликій мірі і рацемізація зовсім не відбувається. Додатковою перевагою способу, що наведено на схемах реакції 7b і 8b є те, що при оптимізованих умовах реакції, яка застосовується при отриманні сполук формули 13, детектуюча побічна реакція елімінації не відбувалася і, в разі застосування оптично активних вихідних матеріалів, рацемізація не відбувається зовсім. Додатковою перевагою способу за даним винаходом, що наведено на реакційних схемах 7а, 7в, 8а і 8b, є те, що він пропонує шлях синтезу для одержання ривароксабану формули 1, який є більш ефективним і більш прийнятний для виробництва у промисловому масштабі, ніж способи одержання ривароксабану формули 1, відомі в області техніки. Додаткові деталі даного винаходу будуть наведені в прикладах, без обмеження обсягу правової охорони згаданими прикладами. Приклад 1 Одержання (2S)-N,N-дибензил-1-оксиран-2-іл-метанаміну формули 17 До розчину 49,25 г (48 мл, 0,25 моль) дибензиламіну (сполука формули 16) в 40 мл 2пропанола при 0°С додають по краплі 25,44 г (21,56 мл, 0,275 моль) (S)-епіхлоргідрину (сполука формули 11) при перемішуванні. Після закінчення додавання реакційній суміші дозволяють нагріватися до кімнатної температури і перемішують протягом 24 годин. До реакційної суміші додають 90 мл 2-пропанола і суміш охолоджують до 0°С. До реакційної суміші по частинах додають 112,0 г (2,0 моль) гідроксиду калію, температуру підтримують при 0°С, після закінчення додавання реакційну суміш перемішують протягом додаткового періоду 30 хвилин, після чого додають 250 мл дистильованої води і 150 мл гексану. Фази розділяють, водний шар екстрагують три рази за допомогою 100 мл гексану кожен, об'єднані органічні фази промивають двічі за допомогою 150 мл води кожен, висушують над сульфатом магнію і розчинник 18 UA 114601 C2 5 10 15 20 25 30 35 40 45 50 55 60 видаляють під вакуумом. Таким чином, одержують 62,0 г (98,5 %) переважного продукту у вигляді масла, ВЕРХ чистота 95,8 %, енантіомерна чистота 99,15 %. -1 IR (плівка): 3062, 2797, 1494, 1453, 746, 699 см . 1 Н ЯМР (CDCl3, 500 МГц): 7,38 (м, 4Н), 7,30 (м, 4Н), 7,22 (м, 2Н), 3,79 (d, J=13,7 Гц, 1 Н), 3,56 (d, J=13,6 Гц, 1 Н), 3,06 (м, 1 Н), 2,75 (dd, J1=3,7 Гц, J2=13,7 Гц, 1 Н), 2,65 (dd, J1=4,2 Гц, J2=4,9 Гц, 1 Н), 2,43 (dd, J1=6,2 Гц, J2=13,7 Гц, 1 Н), 2,39 (dd, J1=2,7 Гц, J2=4,9 Гц, 1 Н) ppm. 13 С ЯМР: (CDCl3, 125 МГц): 139,3, 128,8, 128,2, 126,9, 58,9, 55,8, 51,0, 45,0 ppм. Елементарний аналіз для формули C17H19NO (М:253,35): З 80,60: Н 7,56: N 5,53 %. Виявлено: З 78,90: Н 8,04: N 5,45 %. 20 о 3 Обертання: [α] D=+5,12 (588 нм/20 °C; с=0,05 г/10 см ДМСО) Приклад 2 Одержання 4-(4-{[(2R)-3-дибензиламіно-2-гідрокси-пропіл-]-аміно}-феніл)-морфолін-3-она формули 18 19,2 г 4-аміно-феніл-морфолінона (сполука формули 5) суспендують у суміші 150 мл 2пропанола і 5 мл дистильованої води при 25°С, після чого додають 25,3 г (0,1 моль) (2S)-N, Nдибензил-1-оксиран-2-іл-метанаміну (сполука формули 17). Реакційну суміш нагрівають до 8082°С і перемішують при даній температурі протягом 44 годин. На 18-й годині до реакційної суміші додають 12,6 г (0,05 моль) (2S)-N,N-дибензил-1-оксиран-2-іл-метанамін. Після 44-х годин реакційній суміші дозволяють охолонути до кімнатної температури, перемішують у крижаній бані протягом години і осаджену тверду речовину відфільтровують. Продукт промивають на фільтрі за допомогою 50 мл 2-пропанола і висушують під інфрачервоною лампою до постійної маси. Таким чином, одержують 23,4 г (53 %) білого твердого продукту, ВЕРХ чистота 98,4 %: енантіомерна чистота 99,40 %. Тпл: 179-180°С. Тпл.:179-180 °C IR (KBr): 3372, 1623, 1528, 1103, 749, 699. Н ЯМР (ДМСО, а400): 7,37 (м, 4Н), 7,32 (м, 4Н), 7,24 (м, 2Н), 7,01 (d, J=8,7 Гц, 2 Н), 6,53 (d, J=8,5 Гц, 2 Н), 5,37 (bt, J=5,8 Гц, 1 Н), 4,68 (d, J=4,8 Гц, 1 Н), 4,13 (s, 2Н), 3,93 (м, 2Н), 3,85 (м, 1Н), 3,67 (d, J=13,7 Гц, 2 Н), 3,60 (м, 2Н), 3,53 (d, J=13,7 Гц, 2Н), 3,15 (м, 1Н), 2,75 (м, 1Н), 2,50 (м, 2Н). Спектр ЯМР: 165,89, 147,66, 139,42, 130,34, 128,82, 128,31, 126,98, 126,54, 111,98, 67,91, 67,10, 63,72, 58,57, 57,87, 49,76, 48,25, 39,70. Елементарний аналіз для формули C27H31N3O3 (М:445,57): С 72,78; Н 7,01; N 9,43 %. Знайдено: С 72,39; Н 6,97; N 9,49 %. 20 о 3 Обертання: [α] D=-13,83 (588 нм/20 °C; с=0,1 г/10 см ДМСО). Приклад 3 Одержання 4-(4-{(5S)-5-(дибензиламіно-метил]-2-оксо-1,3-оксазолідин-3-іл}-феніл)морфолін-3-она формули 13 I 23 г (51 мілімоль) 4-(4-{[(2R)-3-дибензиламіно-2-гідроксипропіл](-аміно}-фенілморфолін-3она (сполука формули 18) 10,19 г (63 мілімоль) N,N'-карбоніл-диімідазол суспендують у 70 мл толуолу при 25°С. Суміш нагрівають до 80-83°С і перемішують при даній температурі протягом 20 хвилин. Реакційну суміш охолоджують до 60°С і додають по краплі 230 мл етанолу. Реакційній суміші дозволяють охолонути до кімнатної температури, перемішують у крижаній бані протягом години, після чого осаджену тверду речовину відфільтровують і висушують під інфрачервоною лампою до постійної маси. Таким чином, одержують 22,3 г (93 %) білої твердої речовини, ВЕРХ чистота 99,92 %, енантіомерна чистота 100 %, Тпл.: 154-155 °C. -1 IR (KBr): 1732, 1653, 1521, 1415 см . 1 Н ЯМР (ДМСО-d6, 400 МГц): 7,48 (d, J=9,1 Гц, 2Н), 7,39 (d, J=9,1 Гц, 2Н), 7,36 (м, 4Н), 7,32 (м, 4Н), 7,24 (м, 2Н), 4,83 (м, 1Н), 4,20 (s, 2Н), 4,03 (м, 1Н), 3,97 (м, 2Н), 3,72 (м, 2Н), 3,68 (d, J=4,39 Гц, 2Н), 3,65 (d, J=13,8 Гц, 2Н), 3,57 (м, 1Н), 2,80 (м, 1Н), 2,74 (м, 1Н) ррм. 13 С ЯМР (ДМСО-d6, 100 МГц): 166,1, 154,3, 139,0, 137,2, 136,6, 128,9, 128,4, 127,2, 126,0, 118,5, 71,3, 67,9, 63,6, 58,3, 55,9, 49,2, 48,2 ppм. Елементарний аналіз для формули C28H29N3O4 (М: 471,56): С 71,32; Н 6,20; N 8,91 %. Знайдено: С 70,95; Н 6,30; N 9,09 %. 20 о 3 Обертання: [α] D=-19,7 (588 нм/20 °C; с=0,1 г/10 см ДМСО). II Той самий протокол, що відноситься до способу, який описаному в I, виключаючи те, що після суспендування 23 г (51 мілімоль) 4-(4-{[(2R)-3-дибензиламіно-2-гидроксипропіл]-аміно}феніл)-морфолін-3-она (сполука формули 18) і 10,19 г (63 мілімоль) N,N'-карбоніл-диімідазолу 3 суспендують в 70 см толуолі при 25°С, суміш негайно нагрівають до температури кипіння. 19 UA 114601 C2 5 10 15 20 25 30 35 40 45 50 55 Приклад 4 Одержання солі 4-{4-[(5S)-5-амінометил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3-она, утвореної за допомогою оцтової кислоти (сполука формули 3b) 18,28 г (0,039 моль) 4-(4-{(5S)-5-(дибензиламіно-метил]-2-оксо-1,3-оксазолідин-3-іл}-феніл)морфолінон-3-она формули 13 розчиняють в 200 мл крижаної оцтової кислоти при кімнатній температурі. До розчину додають 1,8 г 10 % каталізатора палладірованного вугілля і проводять гідрогенізацію в автоклаві під тиском водню 10 бар протягом 24 годин. Після завершення гідрогенізації каталізатор фільтрують, фільтрат випаровують до сухості і з осаду чотири рази проганяють по 100 мл етанолу кожен раз під тиском 75 мбар. До таким чином одержаного осаду додають 50 мл етанолу, суміш перемішують в охолоджуючій бані протягом 30 хвилин. Осаджену тверду речовину відфільтровують, промивають на фільтрі за допомогою 30 мл етанолу і висушують під інфрачервоною лампою до постійної маси. Таким чином одержують 13,28 г (98 %) білого продукту. Тпл.: 142-143 °C. -1 IR (KBr): 2557, 1747, 1725, 1650, 1524, 1413 см . 1 Н ЯМР (ДМСО-d6, 500 МГц): 7,58 (d, J=8,8 Гц, 2Н), 7,40 (d, J=8,6 Гц, 2Н), 5,27 (br s, 3Н), 4,65 (м, 1Н), 4,19 (s, 2Н), 4,08 (м, 1Н), 3,96 (м, 2Н), 3,87 (м, 1Н), 3,71 (м, 2Н), 2,88 (м, 2Н), 1,88 (s, 3Н) ррм. 13 С ЯМР (ДМСО-d6, 125 МГц): 172,5, 166,1, 154,5, 137,1, 136,9, 126,1, 118,4, 73,7, 67,9, 63,7, 49,2, 47,3, 44,1, 21,6 ppм. Елементарний аналіз формули C16H21N3O6 (М: 351,36): С 54,70; Н 6,02; N 11,96 %. Знайдено: С 54,42; Н 6,05; N 12,00 %. 20 3 Обертання: [α] D=-29,65 (588 нм/20 °C; с=0,1 г/10 см ДМСО). Приклад 5 Одержання ривароксабану формули 1 Розчин 0,13 г (11,25 мілімоль) карбонату натрію в 1,6 мл води, охолоджують до температури 10°С при перемішуванні, після чого додають 0,35 г (1,0 мілімоль) оцтовокислої солі 4-{4-[(5S)-5амінометил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3-она (сполука формули 3b) і 0,7 мл ацетону. Реакційну суміш зберігають при температурі 8-12°С і додають 0,62 г 32,5 об'єм. % толуольного розчину хлориду 5-хлор-тіофен-2-карбонової кислоти (4) і потім додають 0,7 мл толуолу. Реакційну суміш нагрівають до 50°С, додають 0,7 мл ацетону і суміш перемішують протягом періоду 30 хвилин при 50-55°С. Реакційну суміш охолоджують до 26°С, осаджений продукт відфільтровують, промивають за допомогою 5 мл води і 2,5 мл ацетону і висушують під інфрачервоною лампою до постійної маси. Таким чином, одержують 0,38 г (87 %) неочищеного продукту, ВЕРХ чистота 98,8 %, Тпл.: 227°С. При перекристалізації продукту з 5,7-кратного кількості крижаної оцтової кислоти одержують 0,32 г білого кінцевого продукту, ВЕРХ чистота 99,5 %, Тпл.: 229°С. Приклад 6 Одержання ривароксабану формули 1 I 11,9 м (12 мілімоль) 5-хлор-тіофен-2-карбонової кислоти (15) і 1,9 м (12 мілімоль) N,N'карбоніл-диімідазолу розчиняють у 50 мл сухого ацетонітрилу. Реакційну суміш перемішують при 50-55°С протягом години, після чого при даній температурі додають 0,78 г (7,5 мілімоль) карбонату натрію, 3,4 м (9,67 мілімоль) оцтовокислої солі 4-{4-[(5S)-5-амінометил-2-оксо-1,3оксазолідин-3-іл]-феніл}-морфолін-3-она (3b) і 1 мл дистильованої води. Реакційну суміш перемішують при 50°С протягом години і дозволяють охолоджуватися до кімнатної температури. Тверду речовину відфільтровують і висушують під інфрачервоною лампою до постійної маси. Таким чином, одержують 3,65 г (86,5 %) неочищеного продукту. Неочищений продукт перекристалізовують з 22 мл крижаної оцтової кислоти з виходом 3,24 г (89 %) білого кінцевого продукту, ВЕРХ чистота 99,3 %, Тпл.: 230-231°С. II Ті ж протоколи, які описані в частині I, за винятком того, що як основу застосовують 0,8 г (8 мілімоль) триетиламін. Якість одержаного неочищеного продукту (33,42 г, 81 %) ідентично такому неочищеного продукту, який одержано завдяки способу I. III Ті ж протоколи, які описані в частині I за винятком того, що не застосовують агент, що зв'язує кислоту (у способі I застосовують карбонат натрію). Якість одержаного неочищеного продукту (3,25 г, 77 %) ідентично такому неочищеного продукту, який одержано за способом I. Приклад 7 20 UA 114601 C2 5 10 15 20 25 30 35 40 45 50 Одержання рацемічної 4-(4-{[(3-дибензиламіно-2-гідрокси-пропіл]-аміно}-феніл)-морфолін-3она формули 18 (рацемічна форма сполуки формули 18) 10,0 г (50 мілімоль) 4-аміно-феніл-морфолінона (сполука формули 5) і 2,0 г броміду літію суспендують у суміші 65 мл 2-пропанола і 26 мл дистильованої води при 25°С, після чого додають 13,0 г (50 мілімоль) N,N-дибензил-1-оксиран-2-іл-метанамін (рацемічну форму сполуки формули 17). Реакційну суміш нагрівають до 58-62°С і перемішують при даній температурі протягом 48 годин. На 18-ій годині додають додаткові 4 г (15,7 мілімоль) і на 42-ій годині додають додаткові 2,0 г (7,9 мілімоль) N,N-дибензил-1-оксиран-2-іл-метанамін. Після 48 годин реакційній суміші дозволяють охолонути до кімнатної температури, осаджений продукт відфільтровують, промивають 15 мл 2:5 суміші дистильованої води і 2-пропанола та висушують під інфрачервоною лампою до постійної маси. Таким чином одержують 18,8 г (84 %) білої твердої речовини. Тпл.: 154-155°С. Приклад 8 Рацемічний 4-(4-{(5S)-5-(дибензиламіно-метил]-2-оксо-1,3-оксазолідин-3-іл}-феніл)морфолін-3-он формули 13 (рацемічна форма сполуки формули 13) I 0,90 м (2 мілімоль) 4-(4-{[2R/-3-дибензиламіно-2-гідроксипропіл]-аміно}-феніл)-морфолін-3она, рацемічна форми сполуки формули 18, і 0,338 г (3 мілімоль) N,N'-карбоніл-диімідазолу ° суспендують в 10 мл толуолу при 25 С. Реакційну суміш нагрівають до кипіння, потім нагрівають до кипіння протягом 2 годин, охолоджують до кімнатної температури і додають 2,5 мл етанолу. Реакційну суміш перемішують у крижаній водяній бані протягом години. Осаджену тверду речовину відфільтровують і висушують під інфрачервоною лампою до стійкої маси. Таким 0 чином, одержують 0,3 г (68 %) білої твердої речовини. Тпл.: 133-137 С. II 3,3 г (0,083 моль) 4-{4-[5-йодметил-2-оксо-1,3-оксазолідін-3-іл]-феніл}-морфолін-3-вона 3 (rac10c) перемішують 87 см дибензиламіну (16), після чого додають 1,73 м (0,0053 моль) карбонату цезію. Реакційній суміші дають прореагувати при 80°С протягом 35 годин, карбонат цезію відфільтровують і дибензиламін відганяють. Маслянистий осад (7,9 г) перемішують з 40 3 ° см диетилового ефіру і дозволяють кристалізуватися при перемішуванні при 25 С протягом ночі. Продукт відфільтровують, промивають за допомогою ефіру і висушують. Таким чином, одержують 3,6 м (93,5 %) неочищеного продукту, який плавиться при 126-128 °C. Неочищений продукт перекристалізовують з 105 мл метанолу. Одержують 1,7 м (75 %) білого бажаного продукту. Тпл.: 146-148°С. Дані ІЧ, 1Н ЯМР і 13С ідентичні такій сполуці 13R. Приклад 9 Одержання рацемічної форми оцтовокислої солі 4-{4-[(5S)-5-амінометил-2-оксо-1,3оксазолідин-3-іл]-феніл}-морфолін-3-она формули 0,30 г (0,64 мілімоль) 4-(4-{5-[(дибензиламіно)-метил]-2-оксо-1,3-оксазолідин-3-іл}-феніл)3 морфолін-3-вона формули 13 (рацемічна форма) розчиняють в суміші 12 см метанолу і 0,12 3 см мурашиної кислоти при кімнатній температурі. До розчину додають 0,03 г 10 % каталізатора палладированного вугілля і суміш гідрогенізують в автоклаві при тиску водню 10 бар. Гідрогенізацію проводять протягом 44 годин, після чого каталізатор відфільтровують і фільтрат 3 випарюють до сухості. До осаду додають 10 см етанолу, осаджений продукт фільтрують і висушують під інфрачервоною лампою до постійної маси. Таким чином одержують 0,12 г (67 %) білого твердого з'єднання, зазначеного в заголовку. Т пл.: 113-115°С. Приклад 10 Одержання рацемічної оцтовокислих солі 4-{4-[(5S)-5-амінометил-2-оксо-1,3-оксазолідин-3іл]-феніл}-морфолін-3-вона (рацемічна форма сполуки формули 3b) 5,15 м (10,90 мілімоль) 4-{4-[(5S)-5-[дибензиламіно-метил]-2-оксо-1,3-оксазолідин-3-іл]феніл}-морфолін-3-вона формули 13 (рацемічна форма) розчиняють у 100 мл крижаної оцтової 21 UA 114601 C2 5 10 15 20 25 30 35 40 45 50 55 60 кислоти при кімнатній температурі. До розчину додають 0,5 г 10 % каталізатора палладированного вугілля. Гідрогенізацію проводять в автоклаві при кімнатній температурі під тиском водню 10 бар протягом 24 годин. Потім реакційну суміш нагрівають до 40 °C і каталізатор відфільтровують. Фільтрат випарюють до сухості і з осаду чотири рази відганяють 3 3 50 см етанолу кожен раз при тиску 75 мілібар. До даного одержаного осаду додають 30 см етанолу, суміш перемішують охолоджуючої ванні протягом 30 хвилин. Осаджену тверду 3 речовину відфільтровують, промивають 25 см етанолу на фільтрі і висушують під інфрачервоною лампою до постійної маси. Таким чином одержують 3,80 м (99,2 %) білої твердої сполуки, зазначеного в заголовку. ВЕРХ чистота 99,7 %, Тпл.: 145-146 °C. Приклад 11 Одержання ривароксабану (сполука формули 1) з формули сполуки 3b I 1,9 м (11,7 мілімоль) 5-хлор-тіофен-2-карбонової кислоти (15) і 1,9 м (11,7 мілімоль) N,N'карбоніл-диімідазолу розчиняють у 50 мл сухого ацетонітрилу. Реакційну суміш перемішують при 50-55 °C протягом години, потім залишають остигати при кімнатній температурі. До розчину при даній температурі додають краплинами розчин 0,78 г (9,3 мілімоль) карбонату натрію і 3,2 г (69,1 мілімоль) ацетату 4-{4-[(5S)-амінометил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3она (3b) в 17 мл води і 10 мл ацетонітрилу кімнатної температури. Реакційну суміш перемішують при 50-55 °C протягом години, потім охолоджують у ванні з крижаною водою і перемішують протягом півгодини. Осаджену тверду речовину відфільтровують, промивають три рази 10 мл дистильованої води кожен раз і 10 мл ацетону і висушують під інфрачервоною лампою до постійної маси. Таким чином одержують 2,33 г (59 %) сполуку, зазначену в заголовку, ВЕРХ чистота 99,47 %. Неочищений продукт кристалізують з 14 мл крижаної оцтової кислоти з виходом 2,04 г 0 (70 %) ривароксабану, ВЕРХ чистота 99,85 %. Т пл.: 230-231 С. II Такі ж протоколи, як описано в частині I, за винятком того, що в якості основи застосовують 1,23 г (9,5 мілімоль) N,N'-диізопропіл-етиламіну. Якість одержаного таким чином неочищеного продукту (2,17 м, 55 %) ідентично такому неочищеного продукту, одержаного за допомогою способу I. Приклад 12 Одержання ривароксабану (сполука формули 1) з формули сполуки 3а До суміші 1,51 г (15 мілімоль) триетиламіну і 15 мл дихлорметану додають краплинами 0,81 г (7,5 мілімоль) хлоретилформіату при кімнатній температурі. До реакційної суміші додають краплинами суміш 0,8 г (5 мілімоль) 5-хлор-тіофен-2-карбонової кислоти (15) і 5 мл дихлорметану. Реакційну суміш перемішують при кімнатній температурі протягом години, після чого додають 1,64 г (5 мілімоль) гідрохлориду 4-{4-[(5S)-5-амінометил-2-оксо-1,3-оксазолідин-3іл]-феніл}-морфолін-3-вона (3а). Реакційну суміш перемішують протягом півгодини при кімнатній температурі. Утворену сіль гідрохлориду триетиламіну відфільтровують і фільтрат випарюють до сухості. Осад суспендують у 10 мл крижаної оцтової кислоти, суспензію нагрівають до кип'ятіння і перемішують протягом 10 хвилин. Розчину дають охолонути до кімнатної температури, потім інокулюють за допомогою ложечки кількістю кристалів ривароксабану (1) і перемішують на льоду протягом 20 хвилин. Осаджений білий твердий продукт фільтрують і висушують під інфрачервоною лампою до постійної маси. Таким чином, отримають 0,80 м (37 %) сполуку, зазначену в заголовку. Т пл.: 230-233 °C. Приклад 13 Одержання ривароксабану (сполука формули 1) з формули сполуки 3а 0,16 г (1 мілімоль) 5-хлор-тіофен-2-карбонової кислоти (15) додають до 4 мл сухого ацетонітрилу. До суспензії під аргоном додають 0,13 г (1 мілімоль) N,N'-діізопропіл-карбодіїміду. Реакційну суміш перемішують при кімнатній температурі протягом 30 хвилин, після чого розчин додають краплинами до суміші 0,33 г (1 мілімоль) гідрохлориду 4-{4-[(5S)-5-амінометил-2-оксо1,3-оксазолідин-3-іл]-феніл}-морфолін-3-вона (3а) і 0,10 г (1,25 мілімоль) гідрокарбонату натрію 3 в 4 см сухого ацетонітрилу при кімнатній температурі. Реакційну суміш перемішують при 50 °C протягом 4,5 годин, потім нагрівають до кипіння і перемішують при даній температурі протягом 6 годин. Реакційній суміші дозволяють охолонути до кімнатної температури, твердий продукт 3 промивають двічі 25 см дистильованої води кожен раз і висушують під інфрачервоною лампою до постійної маси. Таким чином, одержують 0,24 р (56 %) сполуку, зазначену в заголовку. Т пл.: 230-233 °C. Приклад 14 Одержання ривароксабану (сполука формули 1) з формули сполуки 3а 22 UA 114601 C2 5 10 15 20 25 30 35 40 45 50 55 60 0,16 г (1 мілімоль) 5-хлор-тіофен-2-карбонової кислоти (15) і 0,25 г (2,5 мілімоль) триетиламіну зважують у 8 мл сухого дихлорметану. До даної отриманої суміші додають краплинами 0,16 г (1 мілімоль) хлоретилформіату при кімнатній температурі. Реакційну суміш перемішують при кімнатній температурі протягом 30 хвилин, після чого одержаний розчин додають до суміші 0,33 г (1 мілімоль) 4-{4-[(5S)-5-амінометил-2-оксо-1,3-оксазолідин-3-іл]3 феніл}-морфолін-3-он-гідрохлориду (3а) в 4 см висушеного дихлорметану. Реакційній суміші дозволяють охолонути до кімнатної температури, гідрохлорид триетиламіну що утворився фільтрують, фільтрат випарюють до сухості. Таким чином отриманий осад перемішують до 2 3 3 см суміші ацетону і 3 см дистильованої води протягом 20 хвилин. Одержану бежеву тверду 3 речовину відфільтровують, двічі промивають 0,5 см дистильованої води кожен і висушують під інфрачервоною лампою до постійної маси. Таким чином, одержують 0,10 г (23 %) сполуку, зазначену в заголовку. Тпл.: 230-235 °C. Приклад 15 Одержання ривароксабану (сполука формули 1) з формули сполуки 3а 1,9 м (11,7 мілімоль) 5-хлор-тіофен-2-карбонової кислоти (15) і 1,9 м (11,7 мілімоль) N,N'карбоніл-диімідазолу розчиняють у 50 мл сухого ацетонітрилу. Реакційну суміш перемішують при 50-55 °C протягом години, після чого додають 0,78 г (9,3 мілімоль) карбонату натрію, 3,27 г (10 мілімоль) гідрохлориду 4-{4-[(5S)-5-амінометил-2-оксо-1,3-оксазолідин-3-іл]феніл}-морфолін3-ону і 1 мл дистильованої води. Реакційну суміш перемішують при 50 °C протягом години, охолоджують в крижаній ванні і перемішують протягом додаткових 0,5 години. Осаджену тверда речовина відфільтровують, промивають тричі 10 мл води кожен раз і 10 мл ацетону і висушують під інфрачервоною лампою до постійної маси. Таким чином, одержують 3,9 г (77 %) сполуку, зазначену в заголовку. Даний неочищений продукт перекристалізовують з 24 мл крижаної оцтової кислоти. Таким чином одержують 3,34 г (86 %) ривароксабану з ВЕРХ чистотою 99,0 %. Тпл.: 229-230 °C. Приклад 16 Одержання ривароксабану (сполука формули 1) з формули сполуки 3а В 8 мл сухого тетрагідрофурану зважують 0,16 г (1 мілімоль) 5-хлор-тіофен-2-карбонової кислоти (15), 0,16 г (1 мілімоль) N,N'-карбоніл-диімідазолу, 0,10 г (11,25 мілімоль) гідрокарбонату натрію і 0,33 г (1 мілімоль) 4-{4-[(5S)-5-амінометил-2-оксо-1,3-оксазолідин-3-іл]феніл}-морфолін-3-он-гідрохлориду (3а). Реакційну суміш нагрівають до 50 °C і перемішують при даній температурі протягом 13 годин. Реакційну суміш випарюють до сухості. Осад 3 3 перемішують суміші 5 мл ацетону, 3 см толуолу і 1 см дистильованої води протягом 20 хвилин. Осаджену біла тверда речовина відфільтровують, промивають за допомогою 1:1 суміші ацетону і дистильованої води і висушують під інфрачервоною лампою до постійної маси. Таким чином одержують 0,32 г (74 %) сполуку, зазначену в заголовку. ВЕРХ чистота - 98,7 %. Тпл.: 230233 °C. Приклад 17 Одержання ривароксабану (сполука формули 1) з формули сполуки 3b I 0,16 г (1 мілімоль) 5-хлор-тіофен-2-карбонової кислоти (15) і 0,35 г (1 мілімоль) 4-{4-[(5S)-5амінометил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3-он-ацетату (3b) розчиняють у 6 мл N,N'-диметтил-формаміду при кімнатній температурі. До розчину додають 0,078 г (0,93 мілімоль) карбонату натрію, після чого краплинами додають 50 % розчин 1,35 мл пропілфосфонового ангідриду (ПФА) N, N'-діметилформаміду. Реакційну суміш нагрівають до 50-55 °C 3 і перемішують при даній температурі протягом 19 годин. До реакційної суміші додають 20 см дистильованої води температури 2 °C і суміш перемішують у крижаній водній ванні протягом години. Осаджену тверду речовину відфільтровують, промивають три рази 1 мл дистильованої води щоразу і 1 мл ацетону і висушують під інфрачервоною лампою до постійної маси. Таким чином одержують 0,01 г (23 %) сполуку, зазначену в заголовку. II Такий же протокол як і згідно частини I за винятком того, що в якості основи застосовують 0,106 г (1,05 мілімоль) триетиламіну. Якість одержаного продукту (0,09 г, 21 %) ідентично такому, отриманому згідно способу I. Приклад 18 Одержання 4-{4-[((2S)-3-хлор-2-гідроксипропіл)-аміно]-феніл}-морфолін-3-вона формули 9аS 25 м (0,13 моль) 4-(4-аміно-феніл)-морфолін-3-вона (5) суспендують у суміші 200 мл ацетонітрилу і 40 мл дистильованої води при перемішуванні, після чого додають 0,5 мл (11,93 р, 0,13 моль) (S)-епіхлоргідрину. Суміш нагрівають до 50-55 °C, після чого світло-коричневий розчин перемішують протягом 6 годин і додають додаткову кількість 10,5 мл (S)-епіхлоргідрину. 23 UA 114601 C2 5 10 15 20 25 30 35 40 45 50 55 60 Після 6 годин до суміші додають чотири рази кожен 6-й час 2,62 мл (2,3 г) (S)-епіхлоргідрину (11S). Після додавання останньої частини суміш перемішують протягом 3 годин. Ацетонітрил відганяють у вакуумі і воду видаляють з двофазної системи за допомогою азеотропної дистиляції при додаванні етилацетату. При успішній дистиляції продукт осідає з суміші у вигляді світло-бежевої суспензії. Продукт кристалізують ніч при температурі (-15)-(-20)°С, потім відфільтровують, промивають 0-5 °C етилацетатом і висушують під інфрачервоною лампою до постійної маси. Таким чином, одержують 25,81 г (70 %) світло-бежевого продукту, що має температуру плавлення 135-137 °C, хімічну чистоту 94,9 % і хіральну чистоту (ВЕРХ) 99,5 %. Неочищений продукт суспендують в 150 мл гексану, суспензію нагрівають і до гарячої суспензії при перемішуванні додають 500 мл ацетону до розчинення. Суміші дають охолонути до 25 °C і перемішують при 0-2 °C протягом години до кристалізації. Суміш фільтрують і продукт висушують під інфрачервоною лампою. Таким чином, одержують 17,8 г (69 %) сполуку, зазначену в заголовку. Тпл.: 138-139 °C, хімічна чистота 98,2 %, хіральна чистота (ВЕРХ) 99,5 %. ІК (KBr): 3377, 1627, 1604, 1531, 1345, 1126 1 Н-ЯМР (ДМСО-d6, 500 МГц): 7,03 (d, J=8,4 Гц, 2Н), 6,61 (d, J=8,6 Гц, 2Н), 5,68 (t, J=5,8 Гц, 1Н), 5,32 (d, J=5,1 Гц, 1Н), 4,13 (s, 2Н), 3,92 (м, 2Н), 3,85 (м, 1Н), 3,68 (м, 1Н), 3,60 (м, 3Н), 3,18 (м, 1Н), 3,06 (м, 1Н). 13 С-ЯМР (ДМСО-d6, 125 МГц): 165,91, 147,44, 130,56, 126,63, 112,09, 68,94, 67,89, 63,71, 49,74, 48,10, 46,67. Елементарний аналіз формули C13H17ClN2O3 (М: 284,75): С 54,84 %; Н 6,02 %; Cl 12,45 %; N 9,84 %. Знайдено: С 54,87 %; Н 6,15 %; Cl 12,35; N 9,88 %. 20 о Обертання: [α] D=+2,0 (588 нм/20 °C; с=0,1 г/10 мл ДМСО) Приклад 19 Одержання 4-{4-[(5S)-5-хлорметил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3-вона формули 10aS 21,2 г (0,07 моль) 4-{4-[((2S)-3-хлор-2-гідроксипропіл)-аміно]-феніл}-морфолін-3-вона 3 3 формули (9aS) суспендують у суміші 190 см толуолу і 22,3 см 1-метил-2-піролідону при перемішуванні, після чого додають 15,09 р (0,099 моль) CDI. Суміш перемішують при температурі 80-82 °C протягом 20 хвилин, потім дають охолонути до 60 °C, додають краплинами 43 мл етанолу, суміш поступово охолоджують до 25 °C, при цьому продукт починає осідати. Суміш перемішують при даній температурі протягом 50 годин, після чого суміш випарюють до половини її об'єму і кристалізують при температурі між (-15)-(-20)оС протягом ночі. Продукт відфільтровують, промивають 0-5 °C ацетоном і висушують під інфрачервоною лампою. Таким чином, одержують 17,1 г (74 %) сполуку зазначену в заголовку. Т пл.: 148-150 °C, хімічна чистота 99,5 %, хіральна чистота (ВЕРХ) 99,76 %. ІК (KBr): 1743, 1660, 1521, 1313, 1229, 1122. 1 Н-ЯМР (ДМСО-d6, 500 МГц): 7,59 (d, J=8,8 Гц, 2Н), 7,41 (d, J=8,8 Гц, 2Н), 5,02 (м, 1Н), 4,22 (м, 1Н), 4,19 (s, 2Н), 4,01 (м, 1Н), 3,97 (м, 2Н), 3,95 (м, 1Н), 3,85 (м, 1Н), 3,72 (м, 2Н). 13 С-ЯМР (ДМСО-d6, 125 МГц): 166,10, 153,94, 137,31, 136,37, 126,12, 118,46, 71,27, 67,87, 63,61, 49,14, 47,54, 46,31. Елементарний аналіз формули С14Н15ClN2O4 (М: 310,74): С 54,11 %; Н 4,87 %; Cl 11,41 %; N 9,02 %. Знайдено: С 54,01 %; Н 4,89 %; Cl 11,37 %; N 9,05 %. 20 Обертання: [α] D=+52,26°(588 нм/20 °C; с=0,1 г/10 мл ДМСО). Приклад 20 Одержання 4-{4-[(5S)-5-йодметил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3-вона формули 10сS 117 г (0,05 моль) 4-{4-[(5S)-5-хлорметил-2-оксо-1,3-оксазолідин-3-іл]феніл}-морфолін-3-вона (10аS) перемішують 310 мл ацетонітрилу, після чого додають 122,65 р (0,082 моль) йодиду натрію. Реакційну суміш нагрівають до кипіння протягом 15 годин, додають додаткову кількість 41,3 г (0,28 моль) йодиду натрію. Реакційну суміш нагрівають до кип'ятіння протягом 15 годин, додають додаткову кількість 20,65 р (0,14 моль) йодиду натрію. Реакційну суміш нагрівають до кип'ятіння протягом 7 годин, відфільтровують, ацетонітрил відганяють і до жовтого кристалічному осаду додають 200 мл дихлорметану і 100 мл води при перемішуванні. Фази поділяють і водний шар промивають двічі 100 мл дихлорметану кожен раз. Об'єднані органічні фази промивають три рази 100 мл води щоразу, сушать над сульфатом магнію і випарюють. Одержану жовту речовину перемішують 130 мл води протягом ночі. Практично білу суспензію фільтрують, промивають водою і висушують під інфрачервоною лампою. Таким чином одержують 21,2 р (96 %) сполуку зазначену в загловку. Т пл.: 158-161 °C, хімічна чистота (ВЕРХ) 95,4 %, хіральна чистота 99,4 %. ІК (KBr): 1738, 1659, 1518, 1312, 1231, 1121. 24 UA 114601 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 Н-ЯМР (ДМСО-d6, 500 МГц): 7,58 (d, J=9,0 Гц, 2Н), 7,41 (d, J=8,8 Гц, 2Н), 4,73 (м, 1Н), 4,21 (м, 1Н), 4,19 (s, 2Н), 3,97 (м, 2Н), 3,72 (м, 2Н), 3,68 (м, 1Н), 3,62 (dd, J1=5,1 Гц, J2=10,8 Гц, 1Н), 3,57 (dd, J1=4,6 Гц, J2=10,8 Гц, 1Н). 13 С-ЯМР (ДМСО-d6, 125 МГц): 166,09, 153,81, 137,31, 136,38, 126,11, 118,52, 70,94, 67,87, 63,61, 50,56, 49,15, 9,92. Елементарний аналіз формули С14Н15N2О4 (М: 402,19): С 41,81 %; Н 3,76 %; N 6,97 %. Знайдено: С 42,2 %; Н 3,75 %; N 7,09 %. 20 Обертання: [α] D=+52,74°(588 нм/20 °C; с=0,1 г/10 мл ДМСО) Приклад 21 Одержання 4-(4-{(5R)-5-(дибензиламіно-метил]-2-оксо-1,3-оксазолідин-3-іл}-феніл)морфолін-3-вона формули 13R 20,0 г (0,05 моль) 4-{4-[(5S)-5-йодметил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3-он (10cS) перемішують 533 мл дибензиламіна (12), після чого додають 10,33 г (0,03 моль) карбонату цезію. Реакцію проводять при 80 °C протягом 35 годин. Карбонат цезію відфільтровують і дибензиламін відганяють при 140 тиску 0,2 бар. Коричневий маслянистий осад (55,65 г) поміщають у 15 мл діетилового ефіру і дозволяють кристалізуватися при перемішуванні при 25 °C протягом ночі. Світло-бежеву речовину відфільтровують, промивають діетиловим ефіром і висушують. Таким чином, одержують 20,15 р (86 %) сполуку, зазначену в заголовку. Тпл.: 128-133 °C, хімічна чистота 85,5 %, хіральна чистота (ВЕРХ) 97,5 %. Неочищений продукт перекристалізовують з 260 мл етанолу, відфільтровують і висушують під інфрачервоною лампою. Таким чином, одержують 17,97 р (87 %) очищеного продукту, темп. плавлення 153-155 °C, хімічна чистота 99,9 % і хіральна чистота (ВЕРХ) 99,9 %. ІК (KBr): 1733, 1653, 1521, 1415, 1128. 1 Н-ЯМР (ДМСО-d6, 400 МГц): 7,48 (d, J=9,1 Гц, 2Н), 7,39 (d, J=9,1 Гц, 2Н), 7,36 (м, 4Н), 7,32 (м, 4Н), 7,24 (м, 2Н), 4,83 (м, 1Н), 4,20 (s, 2Н), 4,03 (м, 1Н), 3,97 (м, 2Н), 3,72 (м, 2Н), 3,68 (d, 2Н), 3,65 (d, J=13,8 Гц, 2Н), 3,57 (м. 1Н), 2,80 (м, 1Н), 2,74 (м, 1Н). 13 С-ЯМР (ДМСО-d6, 100 МГц): 166,11, 154,32, 139,00, 137,18, 136,64, 128,88, 128,41, 127,20, 126,03, 118,46, 71,27, 67,89, 63,63, 58,32, 55,92, 49,18, 48,19. Елементарний аналіз формули С28Н29N3O4 (М: 471,56): С 71,32 %; Н 6,20 %; N 8,91 %. Знайдено: С 70,86 %; Н 6,28 %; N 8,92 %. 20 о Обертання: [α] D=+19,32 (588 нм/20 °C; с=0,1 г/10 мл ДМСО). Приклад 22 Одержання ацетатної солі 4-{4-[(5R)-амінометил-2-оксо-1,3-оксазолідин-3-іл]-феніл}морфолін-3-вона формули 3bR 17,48 р (0,037 моль) 4-(4-{(5R)-5-(дибензиламіно-метил]-2-оксо-1,3-оксазолідин-3-іл]-феніл}3 морфолін-3-вона формули 13R розчиняють в 190 см крижаної оцтової кислоти при кімнатній температурі. До розчину додають 11,72 г 10 % каталізатора палладированного вугілля. Гідрогенізацію проводять в автоклаві при тиску водню 10 бар при кімнатній температурі протягом 24 годин. При завершенні гідрогенізації каталізатор фільтрують, фільтрат випарюють 3 до сухості і з осаду три рази відганяють 100 см етанолу кожен раз при тиску 75 мбар. Одержану 3 білу суспензію фільтрують, вологий фільтрат перемішують 100 см етанолу за допомогою застосування 0-5 °C охолоджуючої ванни протягом 30 хвилин. Сніжно-білий продукт відфільтровують, промивають 30 мл 0-5 °C етанолу на фільтрі і висушують під інфрачервоною лампою до постійної маси. Таким чином одержують 11,97 р (92 %) білого продукту, ВЕРХ чистота 99,91 %, енантіомірна чистота 99,9 %, Тпл.: 142-152 °C. ІЧ, 1Н ЯМР та 13С ЯМР спектральні характеристики продукту ідентичні такій сполуці 3b. Елементарний аналіз формули С16Н21N3О6 (М: 351,36): З 54,7 %; Н 6,02 %; N 11,96 %. Виявлено: З 54,27 %; Н 6,11 %; N 11,8 %. Обертання: [α]20D=+28,77о(588 нм/20 °C; с=0,1 г/ 10 мл ДМСО) Приклад 23 Одержання 5-хлор-N-({(5R)-2-оксо-3-(4-(3-оксо-морфолін-4-іл)-феніл]-1,3-оксазолідин-5-іл}метил-тіофен-2-карбоксаміду формули 1R (енантіомер ривароксабану) Розчин 3,7 м (0,035 моль) карбонату натрію в 51 мл води охолоджують до 10 °C при перемішуванні, після чого додають 10,0 г (0,0028 моль) 4-{4-[(5R)-амінометил-2-оксо-1,33 3 оксазолідин-3-іл]-феніл}-морфолін-3-он-ацетату (3bR), 3 см води і 23 см ацетону. Розчин 3 фільтрують, після чого при температурі 8 °C-12 °C додають 16,6 см толуольного розчину хлориду 5-хлор-тіофен-2-карбонової кислоти концентрації 36,1 г/100 мл (відповідає 5,97 г, 0,33 моль хлориду 5-хлор-тіофен-2-карбонової кислоти формули 4). Реакційну суміш нагрівають до 3 температури 50 °C, після чого додають 25 см ацетону і суміш перемішують протягом додаткового періоду 30 хвилин при 50-53 °C. Реакційну суміш охолоджують до 25 °C, осаджений 25 UA 114601 C2 3 5 10 15 20 25 30 35 40 45 50 55 60 продукт відфільтровують, промивають три рази по 20 мл ацетону кожен раз, три рази по 20 см води кожен раз і знову двічі 20 мл ацетону кожен. Таким чином, одержують 11,98 р (97 %) неочищеної продукту (мр.: 231-234 °C), який перекристалізовують з 6,2-кратної кількості крижаної оцтової кислоти. Таким чином, одержують 20,7 г (93 %) кінцевого продукту, ВЕРХ чистота 99,93 %, енантіомерн чистота 99,9 %, Т пл.: 231-234 °C. Елементарний аналіз формули С19Н18ClN3O5S (М: 435,89): 52,36 %; Н 4,16 %; Cl 8,13 %; N 9,64 %; S 7,36 %. Виявлено: З 52,08 %; Н 4,29 %; Cl 8,17; N 9,37 %; S 7,43 %. Обертання: [α]20D=+41,02о(588 нм/20 °C; с=0,1 г/10 мл ДМСО) Приклад 24 Одержання 4-{4-[((2R)-3-хлор-2-гидроксипропіл)-аміно]-феніл}-морфолін-3-вона формули 9а 10,4 г (0,0544 моль) 4-(4-аминофенил)-морфолін-3-вона (5) суспендують у суміші 84 мл ацетонітрилу і 17 мл дистильованої води при перемішуванні, після чого додають 4,4 мл (5,0 г, 0,054 моль) (R)-епіхлоргідрину (11). Реакційну суміш нагрівають до 50-52 °C, світло-коричневий розчин перемішують протягом 6 годин. після чого додають додаткові 4,4 мл (R)-епіхлоргідрину. Після 6 годин в інтервалі 6 годин чотири рази додають 1,1 мл (1,25 г, 00,0135 моль) (R)епіхлоргідрину. Після введення останньої частини реакцію продовжували протягом додаткового періоду 3 годин. Суміш нагрівають до 60 °C і перемішують при даній температурі протягом 3 додаткових годин. Ацетонітрил відганяють у вакуумі, до двофазному залишку додають етилацетат і проводять азеотропну дистиляцію. У разі успішної дистиляції продукт осідає у вигляді світло-жовтої суспензії. Кристалізацію проводять при температурі між (-15) і (-20)°С протягом ночі. Продукт відфільтровують, промивають 0-5 °C етилацетатом і висушують під інфрачервоною лампою до постійної маси. Таким чином одержують 10,3 м (67 %) бажаного неочищеного продукту, темп. плавлення.: 132-134 °C, хімічна чистота 95,1 %, хіральна чистота (ВЕРХ) 98,2 %. Неочищений продукт суспендують в 35 мл гексану, суспензію нагрівають і до гарячої суспензії додають краплинами 169 мл ацетону при перемішуванні до розчинення продукту. Суміші дають охолонути до 25 °C і кристалізацію проводять при 0-2 °C при перемішуванні протягом години. Продукт фільтрують і висушують під інфрачервоною лампою до постійної маси. Таким чином, одержують 8,16 р (82 %) сполуку, зазначену в заголовку. Т пл.: 137-139 °C, хімічна чистота 98 %, хіральна чистота (ВЕРХ) 98,2 %. Дані ІЧ, 1Н ЯМР та 13С ЯМР спектральних характеристик продукту ідентичні такій сполуці 9аS. Елементарний аналіз формули С13Н17ClN2O3 (М: 284,75 %): З 54,84 %; Н 6,02 %; Cl 12,45 %; N 9,84 %. Виявлено: З 54,77 %; Н 6,09 %; Cl 12,50; N 9,87 %. Обертання: [α]20D=-2,5о(588 нм/20 °C, с=0,1 г/10 мл ДМСО). Приклад 25 Одержання 4-{4-[(5R)-5-хлорметил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3-вона формули 10а 7,9 г (0,028 моль) 4-{4-[((2R)-3-хлор-2-гідроксипропіл)-аміно]-феніл}-морфолін-3-вона формули (9а) суспендують у суміші 71 мл толуолу і 12 мл 1-метил-2-піролідону при перемішуванні, після чого додають 5,6 г (0,035 моль) CDI. Суміш залишають реагувати при 8082 °C протягом 20 хвилин і потім нагрівають до кип'ятіння протягом години. Суміші дають охолонути до 60 °C і додають краплинами 15 мл етанолу. Суміш поступово охолоджують до 25° С, після чого продукт починає осаджуватися з суміші. Суміш перемішують при даній температурі протягом 50 годин, після чого випарюють до половини обсягу. Дозволяють відбутися кристалізації при температурі між-15 °C і -20 °C протягом ночі. Продукт відфільтровують, промивають 0-5 °C ацетоном і висушують під інфрачервоною лампою до постійної маси. Таким чином, одержують 6,9 г (80 %) сполуку, зазначену в заголовку. Т пл.: 143-146 °C, хімічна чистота 94,6 %, хіральна чистота (ВЕРХ) 99,59 %. Дані ІЧ, 1Н ЯМР та 13С ЯМР продукту ідентичні такій сполуці 10aS. Елементарний аналіз формули С14Н15ClN2O4 (М: 310,74): 54,11 %; Н 4,87 %; Cl 11,41 %; N 9,02 %. Виявлено: З 54,17 %; Н 5,05 %; Cl 11,13 %; N 9,39 %. Обертання: [α]20D=-53,49о(588 нм/20 °C; с=0,1 г/10 мл ДМСО) Приклад 26 Одержання 4-{4-[(5R)-5-йодметил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3-вона формули 10с 6,5 г (0,02 моль) 4-{4-[(5R)-5-хлорметил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3-он (10) перемішують 130 мл ацетонітрилу, після чого додають 46,89 р (0,31 моль) йодиду натрію. Реакційну суміш нагрівають до кип'ятіння протягом 15 годин, після чого додають 15,79 р (0,11 моль) йодиду натрію. Реакційну суміш перемішують протягом додаткового періоду 15 годин, 26 UA 114601 C2 5 10 15 20 25 30 35 40 45 50 55 60 додають додаткові 7,89 г (0,053 моль) йодиду натрію і суміш нагрівають до кип'ятіння протягом 7 годин. Суміш фільтрують, ацетонітрил відганяють і до жовтого кристалічному осаду додають 100 мл дихлорметану і 200 мл води при перемішуванні. Фази поділяють, водний шар екстрагують три рази 30 мл дихлорметану кожен. Об'єднані органічні фази промивають три рази 70 мл води кожен, сушать над сульфатом магнію і випарюють. Одержану жовту кристалічну речовину перемішують з 60 мл води протягом ночі. Практично білу суспензію фільтрують, промивають три рази по 20 мл води кожен і висушують під інфрачервоною лампою до постійної маси. Таким чином, одержують 8,0 м (95,2 %) сполуку, зазначену в заголовку. Тпл.: 154-157 °C. Хімічна чистота 95,87 %, хіральна чистота 99,7 % (ВЕРХ). 1Н ЯМР та 13С ЯМР спектральні характеристики продукту ідентичні такій сполуці 10сS. Елементарний аналіз формули С14Н15IN2O4 (М: 402,19): 41,81 %; Н 3,76 %; N 6,97 %. Виявлено: З 42,04 %; Н 3,84 %; N 7,17 %. Обертання: [α]20D=-53,55о(588 нм/20 °C; с=0,1 г/10 мл ДМСО) Приклад 27 Одержання 4-(4-{(5S)-5-(дибензиламіно-метил]-2-оксо-1,3-оксазолідин-3-іл}-феніл)морфолін-3-вона формули 13 7,0 м (0,017 моль) 4-{4-[(5R)-5-йодметил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3вона (10с) перемішують 187 мл дибензиламіну (12), після чого додають 3,62 г (0,011 моль) карбонату цезію і реакцію продовжують при 80 °C протягом 35 годин. Карбонат цезію відфільтровують і дибензиламін відганяють при 140 під тиском 0,2 мбар. Коричневий маслянистий осад кристалізують при перемішуванні з 70 мл діетилового ефіру протягом ночі. Світло-бежеву речовину фільтрують, промивають двічі 30 мл ефіру кожен раз і висушують. Таким чином, одержують 7,78 г (94,8 %) сполуку, зазначену в заголовку. Т пл.: 140-145 °C, хімічна чистота 90,3 %, хіральна чистота (ВЕРХ) 98,5 %. Неочищений продукт (7,5 м) перекристалізовують з 115 мл етанолу, фільтрують і висушують під інфрачервоною лампою до постійної маси. Вихід 6,2 г (82,7 %), Тпл.: 154-156 °C, хімічна чистота 99,4 %, хіральна чистота (ВЕРХ) 99,9 %. ІВ, 1Н ЯМР та 13С ЯМР спектральні характеристики продукту ідентичні такій сполуці 13R. Елементарний аналіз формули С28Н29N3O4 (М: 471,66): З 71,32 %; Н 6,20 %; N 8,91 %. Виявлено: З 71,59 %; Н 6,28 %; N 8,91 %. Обертання: [α]20D=-20,02о(588 нм/20 °C; с=0,1 г/10 мл ДМСО). Приклад 28 Одержання ривароксабану формули 1 Розчин 1,11 г (0,01 моль) карбонату натрію в 16,5 мл води охолоджують до 10 °C при перемішуванні, після чого додають 3,0 г (0,0085 моль) 4-{4-[(5S)-5-амінометил-2-оксо-1,3оксазолідин-3-іл]-феніл}-морфолін-3-он-ацетату (3b), 0,9 мл дистильованої води та 6,9 мл ацетону. До реакційної суміші при 8-12 °C додають 5 мл 36,1 % толуольного розчину хлориду 5хлор-тіофен-2-карбонової кислоти (4). Реакційну суміш нагрівають до 50 °C, додають 7,5 мл ацетону і суміш перемішують при 50-55 °C протягом додаткового періоду 30 хвилин. Реакційну суміш охолоджують до 25 °C, осаджений продукт фільтрують, промивають три рази 15 мл ацетону кожен, три рази 15 мл води кожен і знову три рази 15 мл ацетону кожен і висушують під інфрачервоною лампою до постійної маси. Таким чином, одержують 3,4 м (91,4 %) неочищеної продукту, ВЕРХ чистота 99,61 %, Тпл.: 230-232 °C. Неочищений продукт перекристаллизуют з 21 мл крижаної оцтової кислоти. Одержують 2,99 м (88 %) білу, сполуку зазначеного в заголовку. ВЕРХ чистота 99,88 %, Т пл.: 230-232 °C. Приклад 29 Одержання рацемического 4-{4-[(3-хлор-2-гідроксипропіл)-аміно]-феніл}-морфолін-3-вона формули rac9a 2,4 г 4-(4-аміно-феніл)-морфолін-3-вона (5) суспендують у суміші 424 мл етанолу і 12 мл дистильованої води при перемішуванні, після чого додають 0,98 мл (1,16 г, 0,013 моль) рацемічного епіхлоргідрину. Суміш зберігають при 25 °C протягом 72 годин, після чого додають 0,42 мл рацемического епіхлоргідрину. Реакцію продовжують протягом 24 годин, реакційну суміш вливають у 145 мл води і суміш екстрагують 145 мл етилацетату при перемішуванні. Шари поділяють, водну фазу екстрагують три рази 75 мл етилацетату кожен, загальні органічні шари висушують над сульфатом магнію, очищають активованим вугіллям і фільтрують. Фільтрат випарюють до утворення густої суспензії. Суміш охолоджують до 25° С, промивають 05 °C ацетоном і висушують під інфрачервоною лампою до постійної маси. Таким чином, одержують 2,0 г (62 %) сполуку, зазначену в заголовку. Тпл.: 152-153 °C. Дані ІС, 1Н ЯМР та 13С ЯМР продукту ідентичні такі сполука 9аS. Приклад 30 27 UA 114601 C2 5 10 15 20 25 30 35 40 45 50 Одержання рацемического 4-{4-[5-хлорметил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін3-вона формули rac10a 1,66 г (0,0058 моль) рацемічного 4-{4-[(3-хлор-2-гідроксипропіл)-аміно]-феніл}-морфолін-3вона формули (rac9a) суспендують у суміші 16,5 мл толуолу і 2,5 мл 1-метил-2-піролідону при перемішуванні, після чого додають 11,15 р (0,007 моль) CDI. Суміші дають прореагувати при 8082 °C протягом 20 хвилин, після чого нагрівають до кип'ятіння протягом години. Суміші дають охолонути до 60 °C і додають краплинами 3 мл етанолу. Суміш поступово охолоджують до 25 °C. Продукт починає осідати. Суміш перемішують при даній температурі протягом 48 годин, фільтрують, промивають 0-5 °C ацетоном і висушують під інфрачервоною лампою до постійної маси. Таким чином, одержують 1,69 г (94 %) сполуку, зазначену в заголовку. Т пл.: 188-191 °C. Дані ІС, 1Н ЯМР та 13С ЯМР продукту ідентичні такі сполука 10аS. Приклад 31 Одержання рацемического 4-{4-[5-йодметил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3вона формули (гас10с) 4,0 г (0,013 моль) 4-{4-[(5-хлорметил-2-оксо-1,3-оксазолідин-3-іл]-феніл}-морфолін-3-вона (rac10a) перемішують 100 мл ацетонітрилу, після чого додають 28,92 р (0,087 моль) йодиду натрію. Реакційну суміш нагрівають до кип'ятіння протягом 15 годин, додають додаткові 13,02 р (0,087 моль) йодиду натрію і реакційну суміш нагрівають до кип'ятіння протягом додаткового періоду 15 годин. Після фільтрування ацетонітрил фільтрують і до жовтого кристалічному осаду додають при перемішуванні 50 мл дихлорметану і 25 мл води. Шари поділяють і водну фазу екстрагують двічі 25 мл дихлорметану кожен. Загальні органічні солі промивають три рази 25 мл води кожен, сушать над сульфатом магнію і висушують. Одержану таким чином жовту кристалічну речовина перемішують у 30 мл води протягом ночі. Майже білу суспензію фільтрують, промивають водою і висушують під інфрачервоною лампою до постійної маси. Таким чином, одержують 4,18 г (80 %) сполуку, зазначену в заголовку. Т пл.: 167-168 °C. Дані ІС, 1Н ЯМР та 13С ЯМР продукту ідентичні такій сполуці 10сS. Приклад 32 Одержання основного рацемата 4-{4-[5-(амінометил)-2-оксо-1,3-оксазолідин-3-іл]-феніл}морфолін-3-вона формули 12 0,5 г (0,0015 моль) рацемічної ацетатної солі 4-{4-[5-амінометил-2-оксо-1,3-оксазолідин-3-іл]феніл}-морфолін-3-вона (rac3b) суспендують в 10 мл дистильованої води при перемішуванні. Суміш охолоджують до 0-5 °C і рН підводять до 10-11 допомогою додавання 1М гідроксиду натрію. Реакційну суміш перемішують при 25 °C протягом 20 годин, додають 20 мл дихлорметану. Шари поділяють після перемішування протягом 30 хвилин. Водну фазу екстрагують три рази 10 мл дихлорметану кожен. Об'єднані органічні солі випарюють. Таким чином, одержують 0,33 г (80 %) сполуку, зазначену в заголовку. ВЕРХ чистота 99,12 %. Тпл.: 147149 °C. Елементарний аналіз формули С14Н17N3O4 (М: 291,31): З 57,72 %; Н 5,88 %; N 14,42 %. Виявлено: З 57,35 %; Н 6,04 %; N 14,32 %. Приклад 33 Одержання рацемічного рівароксабану формули rac1 Розчин 0,64 г (0,006 моль) карбонату натрію у 9 мл води охолоджують до 10 °C при перемішуванні, після чого додають 1,8 г (0,005 моль) ацетату 4-{4-[5-амінометил-2-оксо-1,3оксазолідин-3-іл]-феніл}-морфолін-3-вона (rac3b), 0,6 мл води і 1,8 мл ацетону. Розчин фільтрують і при температурі 8-12 °C додають 3 мл толуольного розчину хлориду 5-хлортіофен-2-карбонової кислоти (сполука формули 4), що має концентрацію 36,1 г/100 мл (це відповідає 1,07 г, 0,059 моль хлориду 5-хлор-тіофен-2-карбонової кислоти). Реакційну суміш нагрівають до 50 °C, після чого додають 5 мл ацетону і суміш перемішують при 50-53 °C протягом додаткового періоду 30 хвилин. Реакційну суміш охолоджують до 25 °C. Осаджений продукт фільтрують, промивають тричі 5 мл ацетону кожен, три рази 5 мл води кожен і знову двічі 55 мл ацетону кожен. Таким чином одержують 1,75 г (83 %) сполуку, зазначену в заголовку. Тпл.: 229-231 °C. Продукт перекристалізовують з 6,2-кратного кількості крижаної оцтової кислоти. Таким чином, одержують 1,50 м (86 %) сполуку, зазначену в заголовку. Т пл.: 230-233 °C. 55 28
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of a rivaroxaban and intermediates formed in said process
Автори англійськоюSipos, Eva, Kovanyine Lax, Gyorgyi, Havasi, Balazs, Volk, Balazs, Krasznai, Gyorgy, Ruzsics, Gyorgy, Barkoczy, Jozsef, Tothne Lauritz, Maria, Lukacs, Gyula, Boza, Andras, Hegedus, Laszlo Jozsef, Taborine Toth, Maria Julia, Pecsi, Eva
Автори російськоюШипош Ева, Кованьине Лакс Дьёрдь, Хаваши Балаж, Вольк Балаж, Краснаи Дьёрдь, Ружич Дьёрдь, Баркоци Йожеф, Тотне Лауриц Мариа, Лукач Дьюла, Боза Андраш, Хегедюш Ласло Йожеф, Таборине Тот Мариа Юлиа, Печи Ева
МПК / Мітки
МПК: C07D 413/10, C07D 413/14, C07D 303/36
Мітки: ривароксабану, одержання, способи, проміжних, одержаної, сполук, спосіб, даному
Код посилання
<a href="https://ua.patents.su/41-114601-sposib-oderzhannya-rivaroksabanu-ta-promizhnikh-spoluk-yaki-oderzhano-v-danomu-sposobi.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання ривароксабану та проміжних сполук, які одержано в даному способі</a>
Попередній патент: Фармацевтична композиція для лікування захворювання у порожнині рота, що містить ребаміпід
Наступний патент: Способи лікування або попередження пов’язаних із холестерином розладів
Випадковий патент: Пристрій захисту від коротких замикань і перевантажень послідовно ввімкнутих електродвигунів постійного струму