Похідні дигідропсевдоеритроміцину
Номер патенту: 94065
Опубліковано: 11.04.2011
Автори: Шіма Хідеакі, Омура Сатоші, Ямабе Харуко, Суназука Тошіякі, Нагаі Кенічіро
Формула / Реферат
1. Сполука, представлена наступною формулою [І]
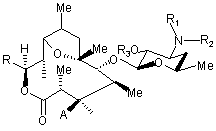 , [І]
, [І]
де Ме є метильна група,
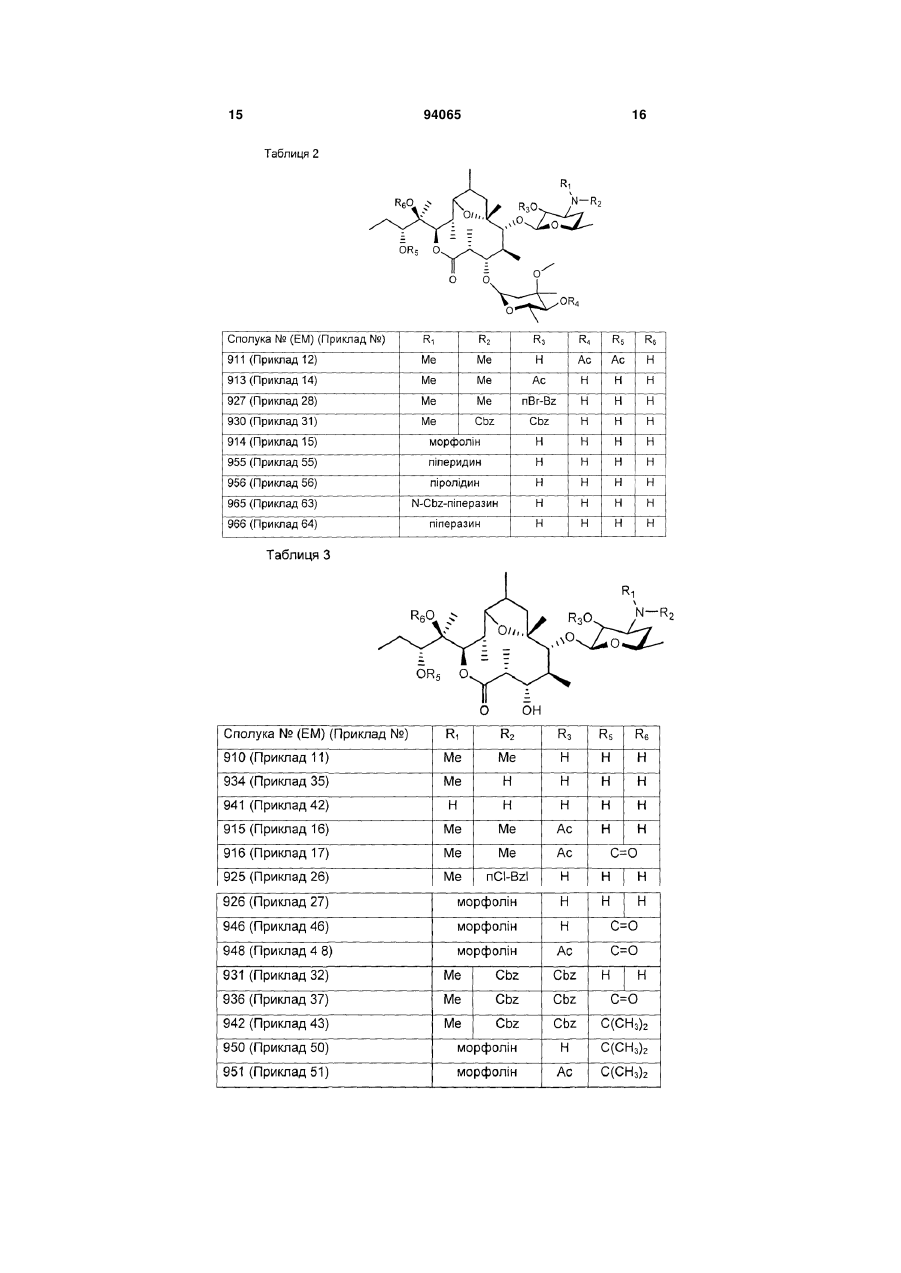
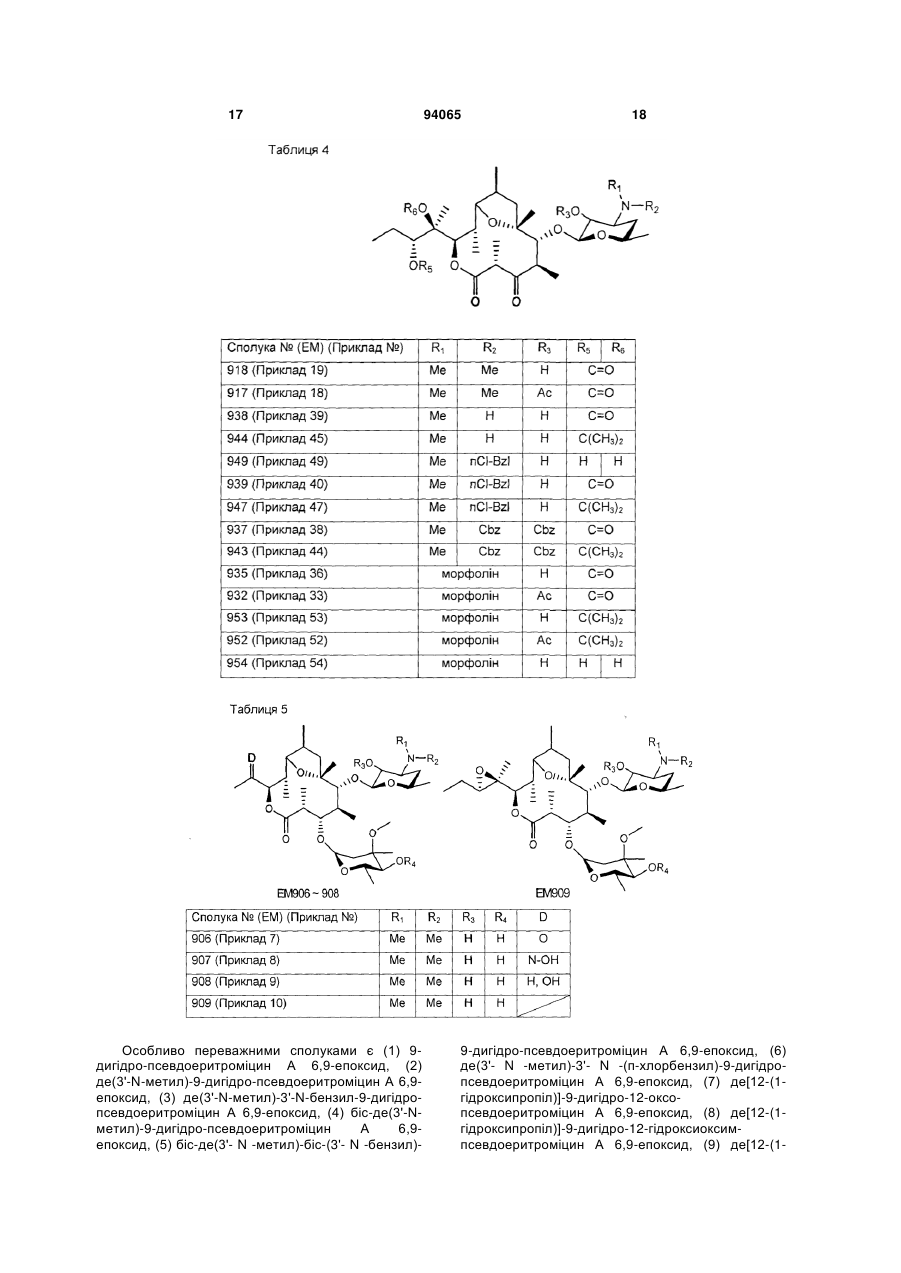
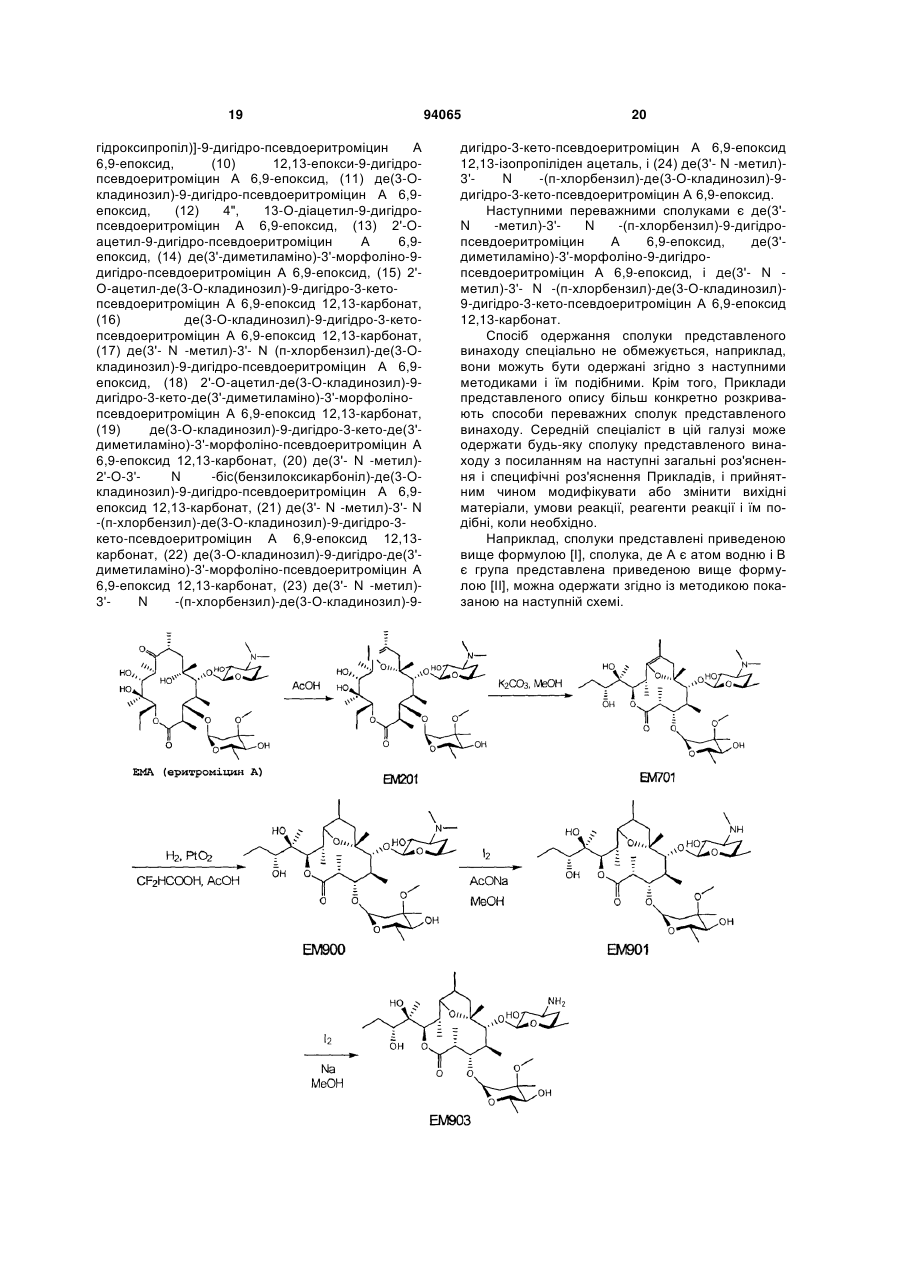
R1 і R2 є однаковими або різними і кожен є атом водню, алкільна група, ацильна група, сульфонільна група, заміщена або незаміщена арилзаміщена алкільна група, арилзаміщена алкоксикарбонільна група, алкенільна група або алкінільна група, або R1 і R2 в комбінації утворюють, разом з сусіднім атомом азоту, заміщену або незаміщену аліциклічну гетероциклічну групу,
R3 є атом водню, заміщена або незаміщена ацильна група або арилзаміщена алкоксикарбонільна група,
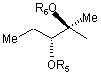
А є атом водню, В є гідроксильна група або група, представлена наступною формулою [II]
 , [II]
, [II]
де Ме є метильна група і R4 є атом водню або ацильна група, або А і В в комбінації дають =O,
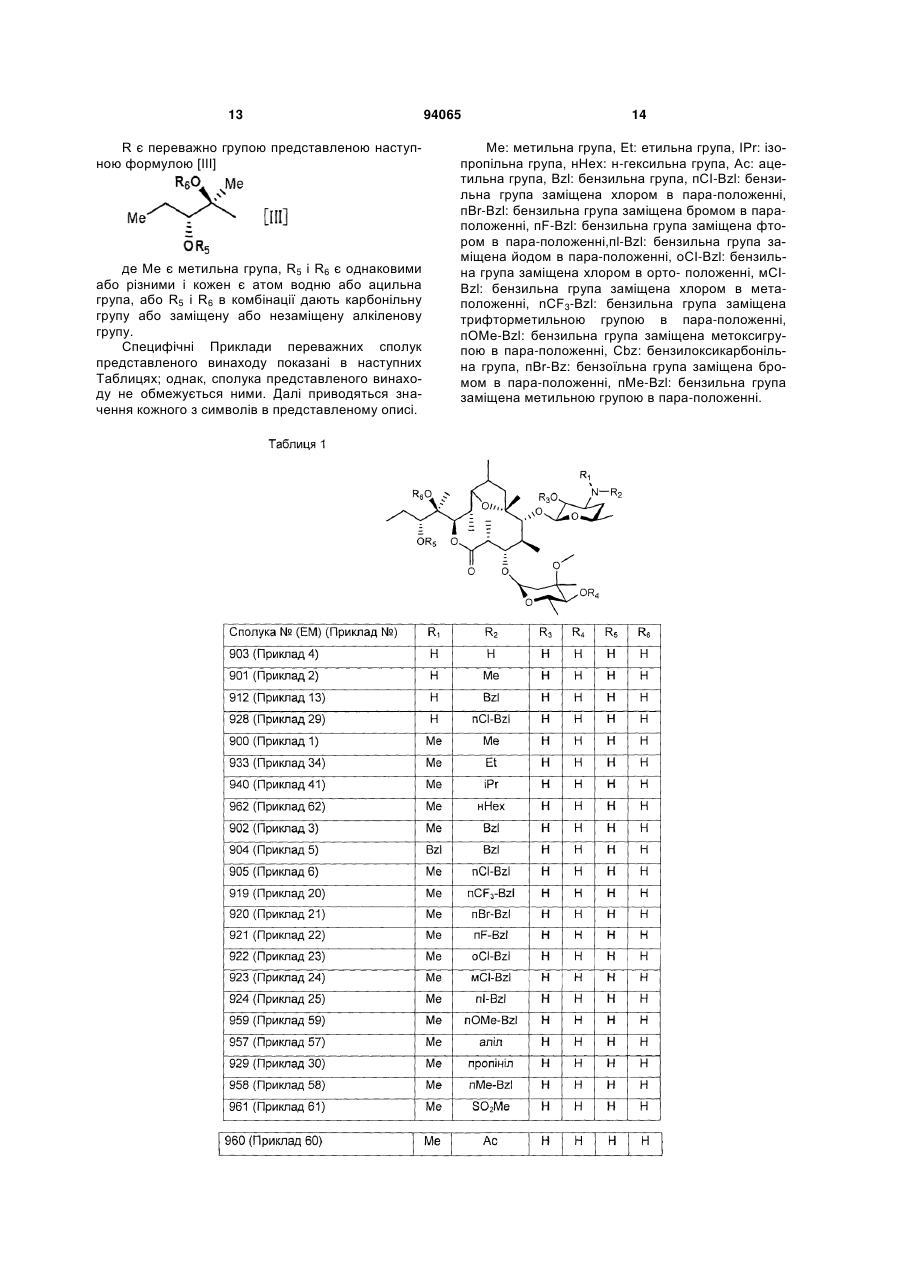
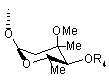
R є група, представлена наступною формулою [III]
 , [III]
, [III]
де Me є метильна група, R5 і R6 є однаковими або різними і кожен є атом водню або ацильна група, або R5 і R6 в комбінації дають карбонільну групу або заміщену або незаміщену алкіленову групу, замісник представлений наступною формулою [IV]
![]() , [IV]
, [IV]
де Me є метильна група, D є О або N-OH, або D є атом водню і гідроксильна група (-Н,-ОН), або замісник представлений наступною формулою [V]
![]() , [V]
, [V]
де Me є метильна група,
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, де R є група, представлена наступною формулою [III]
 , [III]
, [III]
де Me є метильна група, R5 і R6 є однаковими або різними і кожен є атом водню або ацильна група, або R5 і R6 в комбінації дають карбонільну групу або заміщену або незаміщену алкіленову групу, або її фармацевтично прийнятна сіль.
3. Сполука за п. 1 або 2, де А і В в комбінації дають =O, або її фармацевтично прийнятна сіль.
4. Сполука за п. 1 або 2, де А є атом водню і В є гідроксильна група, або її фармацевтично прийнятна сіль.
5. Сполука за п. 1 або 2, де А є атом водню і В є група представлена наступною формулою [II]
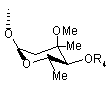 , [II]
, [II]
де Me є метильна група і R4 є атом водню або ацильна група, або її фармацевтично прийнятна сіль.
6. Сполука за п. 5, де R4 є атом водню, або її фармацевтично прийнятна сіль.
7. Сполука за будь-яким з пунктів 1-6, де R1 і R2 є однаковими або різними і кожен є атом водню, алкільна група, заміщена або незаміщена бензильна група або бензилоксикарбонільна група, або R1 і R2 в комбінації утворюють, разом з сусіднім атомом азоту, заміщену або незаміщену аліциклічну гетероциклічну групу, або її фармацевтично прийнятна сіль.
8. Сполука за п. 7, де R1 і R2 є однаковими або різними і кожен є атом водню, нижча алкільна група, що має 1-3 атоми вуглецю, або галогензаміщена бензильна група, або її фармацевтично прийнятна сіль.
9. Сполука за п. 7, де заміщеною або незаміщеною аліциклічною гетероциклічною групою, утвореною R1 і R2 в комбінації з сусіднім атомом азоту, є заміщене або незаміщене морфолінове кільце, піперидинове кільце, піперазинове кільце або піролідинове кільце, або її фармацевтично прийнятна сіль.
10. Сполука за будь-яким з пунктів 1-9, де R3 є атом водню, ацетильна група, заміщена або незаміщена бензоїльна група або бензилоксикарбонільна група, або її фармацевтично прийнятна сіль.
11. Сполука за п. 10, де R3 є атом водню, заміщена або незаміщена ацетильна група або бензоїльна група, або її фармацевтично прийнятна сіль.
12. Сполука, вибрана з групи, що включає:
(1) 9-дигідропсевдоеритроміцин А 6,9-епоксид,
(2) де(3'-N-метил)-9-дигідропсевдоеритроміцин А 6,9-епоксид,
(3) де(3'-N-метил)-3'-N-бензил-9-дигідропсевдоеритроміцин А 6,9-епоксид,
(4) біс-де(3'-N-метил)-9-дигідропсевдоеритроміцин А 6,9-епоксид,
(5) біс-де(3'-N-метил)-біс-(3'-N-бензил)-9-дигідропсевдоеритроміцин А 6,9-епоксид,
(6) де(3'-N-метил)-3'-N-(п-хлорбензил)-9-дигідропсевдоеритроміцин А 6,9-епоксид,
(7) де[12-(1-гідроксипропіл)]-9-дигідро-12-оксопсевдоеритроміцин А 6,9-епоксид,
(8) де[12-(1-гідроксипропіл)]-9-дигідро-12-гідроксіоксимпсевдоеритроміцин А 6,9-епоксид,
(9) де[12-(1-гідроксипропіл)]-9-дигідропсевдоеритроміцин А 6,9-епоксид,
(10) 12,13-епокси-9-дигідропсевдоеритроміцин А 6,9-епоксид,
(11) де(3-O-кладинозил)-9-дигідропсевдоеритроміцин А 6,9-епоксид,
(12) 4",13-O-діацетил-9-дигідропсевдоеритроміцин А 6,9-епоксид,
(13) 2'-O-ацетил-9-дигідропсевдоеритроміцин А 6,9-епоксид,
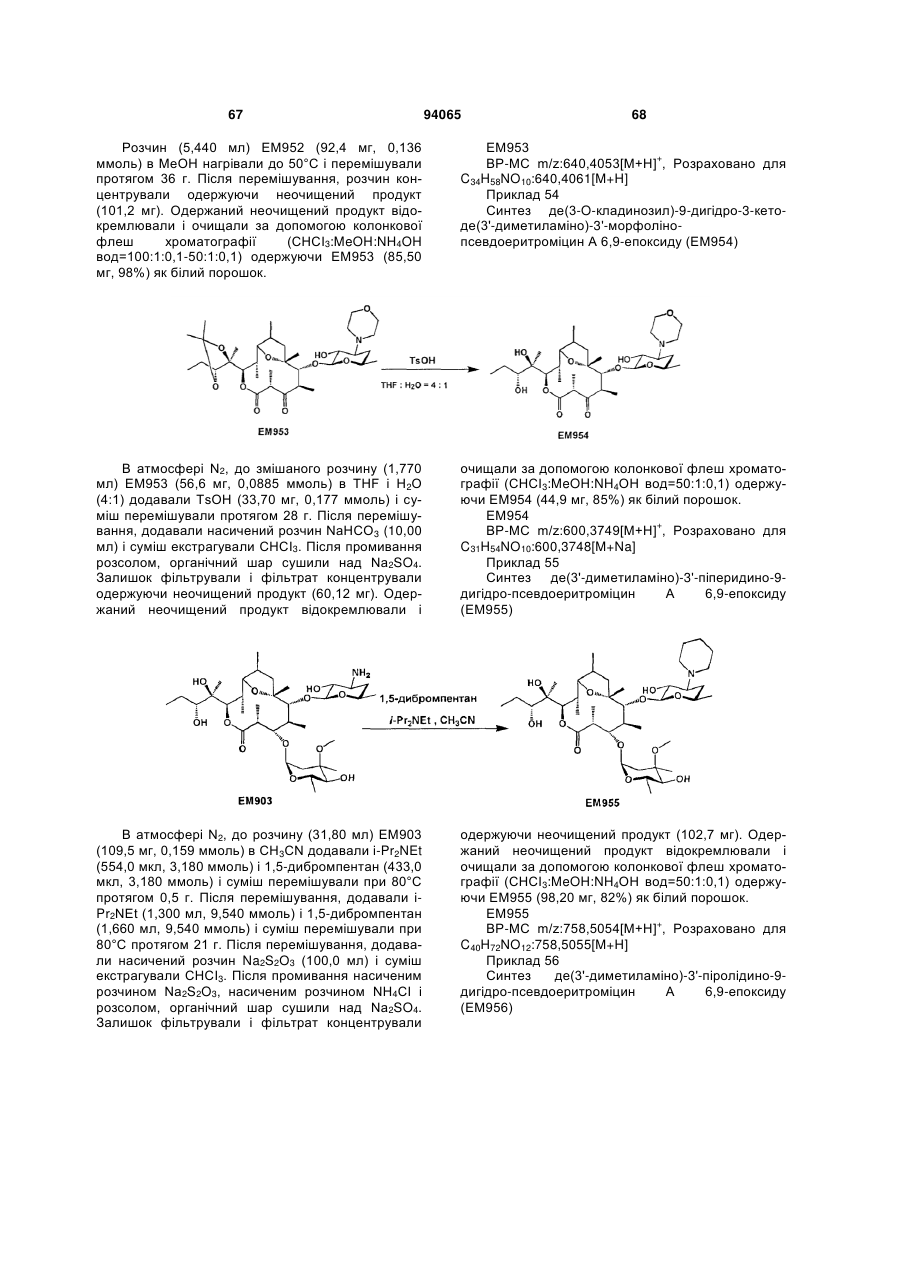
(14) де(3'-диметиламіно)-3'-морфоліно-9-дигідропсевдоеритроміцин А 6,9-епоксид,
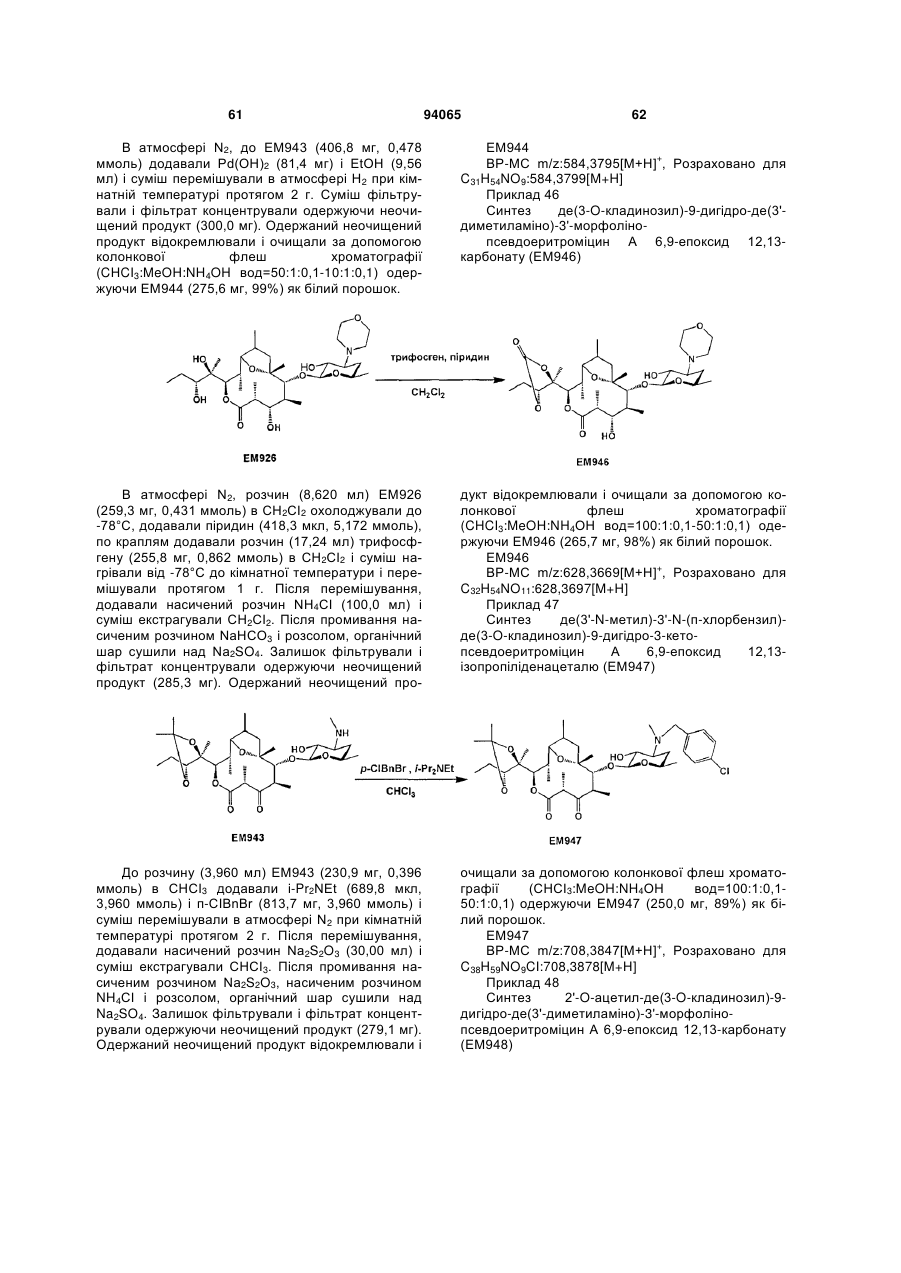
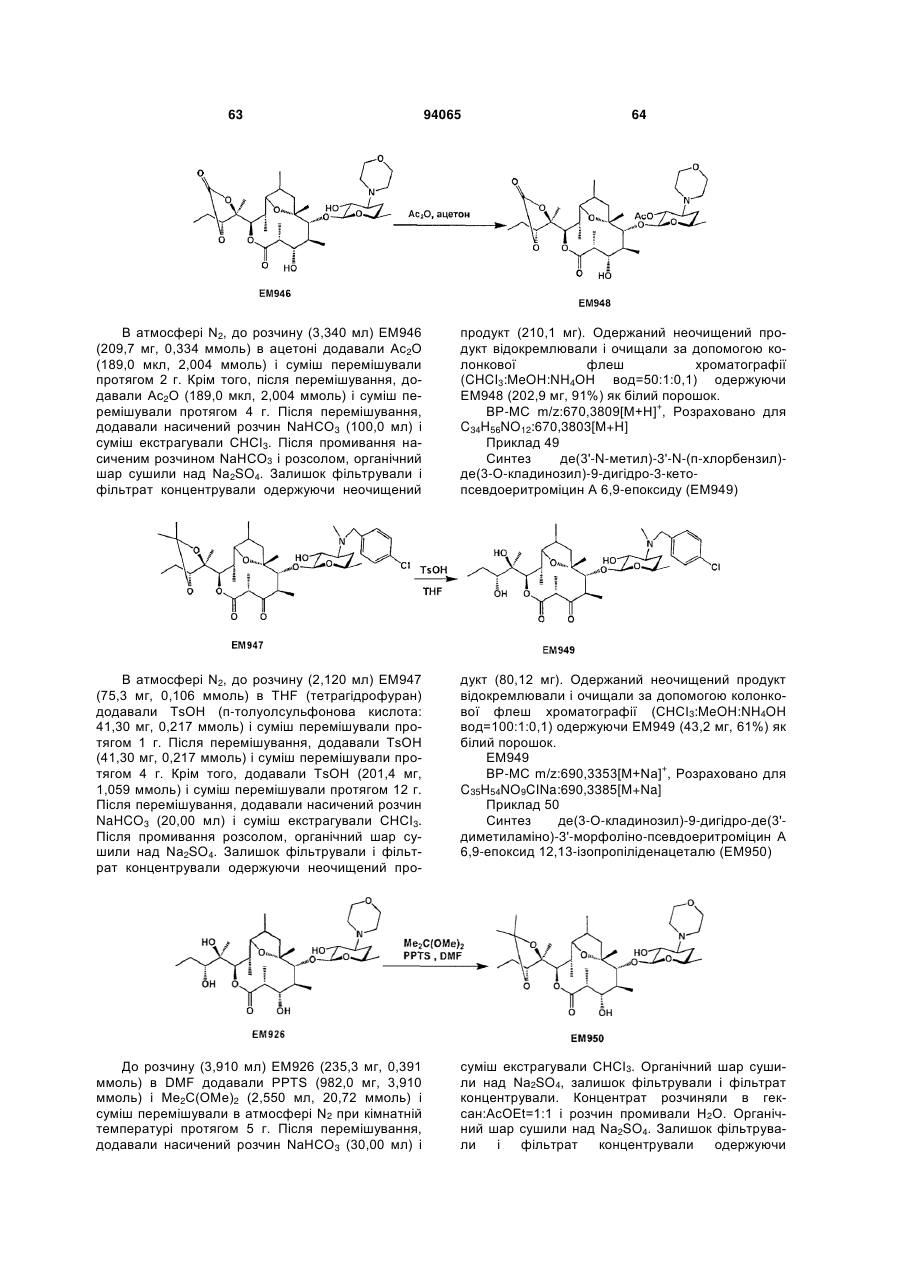
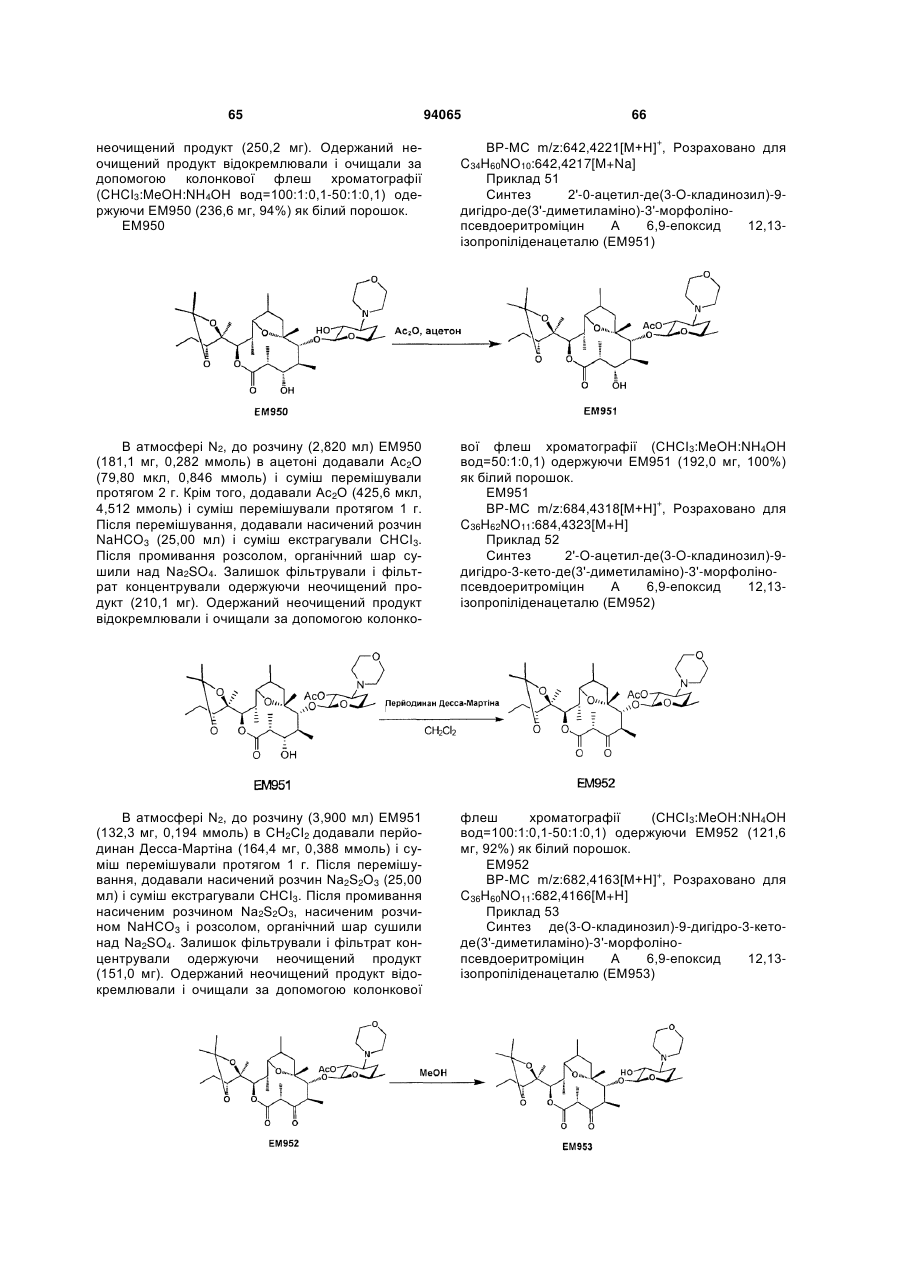
(15) 2'-O-ацетил-де(3-O-кладинозил)-9-дигідро-3-кетопсевдоеритроміцин А 6,9-епоксид 12,13-карбонат,
(16) де(3-O-кладинозил)-9-дигідро-3-кетопсевдоеритроміцин А 6,9-епоксид 12,13-карбонат,
(17) де(3'-N-метил)-3'-N-(п-хлорбензил)-де(3-O-кладинозил)-9-дигідропсевдоеритроміцин А 6,9-епоксид,
(18) 2'-O-ацетил-де(3-O-кладинозил)-9-дигідро-3-кето-де(3'-диметиламіно)-3'-морфолінопсевдоеритроміцин А 6,9-епоксид 12,13-карбонат,
(19) де(3-O-кладинозил)-9-дигідро-3-кето-де(3'-диметиламіно)-3'-морфолінопсевдоеритроміцин А 6,9-епоксид 12,13-карбонат,
(20) де(3'-N-метил)-2'-O-3'-N-біс(бензилоксикарбоніл)-де(3-O-кладинозил)-9-дигідропсевдоеритроміцин А 6,9-епоксид 12,13- карбонат,
(21) де(3'-N-метил)-3'-N-(п-хлорбензил)-де(3-O-кладинозил)-9-дигідро-3-кетопсевдоеритроміцин А 6,9-епоксид 12,13-карбонат,
(22) де(3-O-кладинозил)-9-дигідро-де(3'-диметиламіно)-3'-морфолінопсевдоеритроміцин А 6,9-епоксид 12,13-карбонат,
(23) де(3'-N-метил)-3'-N-(п-хлорбензил)-де(3-O-кладинозил)-9-дигідро-3-кетопсевдоеритроміцин А 6,9-епоксид 12,13-ізопропіліден ацеталь або
(24) де(3'-N-метил)-3'-N-(п-хлорбензил)-де(3-O-кладинозил)-9-дигідро-3-кетопсевдоеритроміцин А 6,9-епоксид,
або її фармацевтично прийнятна сіль.
13. Сполука, вибрана з групи, що включає:
(1) 9-дигідропсевдоеритроміцин А 6,9-епоксид,
(2) де(3'-N-метил)-3'-N-(п-хлорбензил)-9-дигідропсевдоеритроміцин А 6,9-епоксид,
(3) де(3'-диметиламіно)-3'-морфоліно-9-дигідропсевдоеритроміцин А 6,9-епоксид або
(4) де(3'-N-метил)-3'-N-(п-хлорбензил)-де(3-O-кладинозил)-9-дигідро-3-кетопсевдоеритроміцин А 6,9-епоксид 12,13-карбонат,
або її фармацевтично прийнятна сіль.
14. Фармацевтична композиція, що містить сполуку за будь-яким з пунктів 1-13 або її фармацевтично прийнятну сіль як активний інгредієнт.
15. Фармацевтична композиція за п. 14, яка використовується для профілактики або лікування запального захворювання.
16. Фармацевтична композиція за п. 15, де запальним захворюванням є запальне захворювання кишечнику.
17. Спосіб профілактики або лікування запального захворювання, який включає введення пацієнтові, що цього потребує, ефективної кількості сполуки за будь-яким з пунктів 1-13 або її фармацевтично прийнятної солі.
18. Спосіб за п. 17, де запальним захворюванням є запальне захворювання кишечнику.
19. Застосування сполуки за будь-яким з пунктів 1-13 або її фармацевтично прийнятної солі для одержання фармацевтичного засобу для профілактики або лікування запального захворювання.
20. Застосування за п. 19, де запальним захворюванням є запальне захворювання кишечнику.
21. Комерційне упакування, що містить засіб для профілактики або лікування запального захворювання, який містить сполуку за будь-яким з пунктів 1-13 або її фармацевтично прийнятну сіль як активний інгредієнт і друковану інструкцію, в якій вказується, що засіб може або повинен бути використаний для профілактики або лікування запального захворювання.
Текст
1. Сполука, представлена наступною формулою [І] Me R1 3 R6O Me Me OR5 , [III] де Me є метильна група, R5 і R6 є однаковими або різними і кожен є атом водню або ацильна група, або R5 і R6 в комбінації дають карбонільну групу або заміщену або незаміщену алкіленову групу, або її фармацевтично прийнятна сіль. 3. Сполука за п. 1 або 2, де А і В в комбінації дають =O, або її фармацевтично прийнятна сіль. 4. Сполука за п. 1 або 2, де А є атом водню і В є гідроксильна група, або її фармацевтично прийнятна сіль. 5. Сполука за п. 1 або 2, де А є атом водню і В є група представлена наступною формулою [II] OMe Me O O OR4 Me , [II] де Me є метильна група і R4 є атом водню або ацильна група, або її фармацевтично прийнятна сіль. 6. Сполука за п. 5, де R4 є атом водню, або її фармацевтично прийнятна сіль. 7. Сполука за будь-яким з пунктів 1-6, де R1 і R2 є однаковими або різними і кожен є атом водню, алкільна група, заміщена або незаміщена бензильна група або бензилоксикарбонільна група, або R1 і R2 в комбінації утворюють, разом з сусіднім атомом азоту, заміщену або незаміщену аліциклічну гетероциклічну групу, або її фармацевтично прийнятна сіль. 8. Сполука за п. 7, де R1 і R2 є однаковими або різними і кожен є атом водню, нижча алкільна група, що має 1-3 атоми вуглецю, або галогензаміщена бензильна група, або її фармацевтично прийнятна сіль. 9. Сполука за п. 7, де заміщеною або незаміщеною аліциклічною гетероциклічною групою, утвореною R1 і R2 в комбінації з сусіднім атомом азоту, є заміщене або незаміщене морфолінове кільце, піперидинове кільце, піперазинове кільце або піролідинове кільце, або її фармацевтично прийнятна сіль. 10. Сполука за будь-яким з пунктів 1-9, де R3 є атом водню, ацетильна група, заміщена або незаміщена бензоїльна група або бензилоксикарбонільна група, або її фармацевтично прийнятна сіль. 11. Сполука за п. 10, де R3 є атом водню, заміщена або незаміщена ацетильна група або бензоїльна група, або її фармацевтично прийнятна сіль. 12. Сполука, вибрана з групи, що включає: (1) 9-дигідропсевдоеритроміцин А 6,9-епоксид, (2) де(3'-N-метил)-9-дигідропсевдоеритроміцин А 6,9-епоксид, (3) де(3'-N-метил)-3'-N-бензил-9дигідропсевдоеритроміцин А 6,9-епоксид, (4) біс-де(3'-N-метил)-9-дигідропсевдоеритроміцин А 6,9-епоксид, 94065 4 (5) біс-де(3'-N-метил)-біс-(3'-N-бензил)-9дигідропсевдоеритроміцин А 6,9-епоксид, (6) де(3'-N-метил)-3'-N-(п-хлорбензил)-9дигідропсевдоеритроміцин А 6,9-епоксид, (7) де[12-(1-гідроксипропіл)]-9-дигідро-12оксопсевдоеритроміцин А 6,9-епоксид, (8) де[12-(1-гідроксипропіл)]-9-дигідро-12гідроксіоксимпсевдоеритроміцин А 6,9-епоксид, (9) де[12-(1-гідроксипропіл)]-9дигідропсевдоеритроміцин А 6,9-епоксид, (10) 12,13-епокси-9-дигідропсевдоеритроміцин А 6,9-епоксид, (11) де(3-O-кладинозил)-9дигідропсевдоеритроміцин А 6,9-епоксид, (12) 4",13-O-діацетил-9-дигідропсевдоеритроміцин А 6,9-епоксид, (13) 2'-O-ацетил-9-дигідропсевдоеритроміцин А 6,9-епоксид, (14) де(3'-диметиламіно)-3'-морфоліно-9дигідропсевдоеритроміцин А 6,9-епоксид, (15) 2'-O-ацетил-де(3-O-кладинозил)-9-дигідро-3кетопсевдоеритроміцин А 6,9-епоксид 12,13карбонат, (16) де(3-O-кладинозил)-9-дигідро-3кетопсевдоеритроміцин А 6,9-епоксид 12,13карбонат, (17) де(3'-N-метил)-3'-N-(п-хлорбензил)-де(3-Oкладинозил)-9-дигідропсевдоеритроміцин А 6,9епоксид, (18) 2'-O-ацетил-де(3-O-кладинозил)-9-дигідро-3кето-де(3'-диметиламіно)-3'морфолінопсевдоеритроміцин А 6,9-епоксид 12,13-карбонат, (19) де(3-O-кладинозил)-9-дигідро-3-кето-де(3'диметиламіно)-3'-морфолінопсевдоеритроміцин А 6,9-епоксид 12,13-карбонат, (20) де(3'-N-метил)-2'-O-3'-Nбіс(бензилоксикарбоніл)-де(3-O-кладинозил)-9дигідропсевдоеритроміцин А 6,9-епоксид 12,13карбонат, (21) де(3'-N-метил)-3'-N-(п-хлорбензил)-де(3-Oкладинозил)-9-дигідро-3-кетопсевдоеритроміцин А 6,9-епоксид 12,13-карбонат, (22) де(3-O-кладинозил)-9-дигідро-де(3'диметиламіно)-3'-морфолінопсевдоеритроміцин А 6,9-епоксид 12,13-карбонат, (23) де(3'-N-метил)-3'-N-(п-хлорбензил)-де(3-Oкладинозил)-9-дигідро-3-кетопсевдоеритроміцин А 6,9-епоксид 12,13-ізопропіліден ацеталь або (24) де(3'-N-метил)-3'-N-(п-хлорбензил)-де(3-Oкладинозил)-9-дигідро-3-кетопсевдоеритроміцин А 6,9-епоксид, або її фармацевтично прийнятна сіль. 13. Сполука, вибрана з групи, що включає: (1) 9-дигідропсевдоеритроміцин А 6,9-епоксид, (2) де(3'-N-метил)-3'-N-(п-хлорбензил)-9дигідропсевдоеритроміцин А 6,9-епоксид, (3) де(3'-диметиламіно)-3'-морфоліно-9дигідропсевдоеритроміцин А 6,9-епоксид або (4) де(3'-N-метил)-3'-N-(п-хлорбензил)-де(3-Oкладинозил)-9-дигідро-3-кетопсевдоеритроміцин А 6,9-епоксид 12,13-карбонат, або її фармацевтично прийнятна сіль. 5 94065 6 14. Фармацевтична композиція, що містить сполуку за будь-яким з пунктів 1-13 або її фармацевтично прийнятну сіль як активний інгредієнт. 15. Фармацевтична композиція за п. 14, яка використовується для профілактики або лікування запального захворювання. 16. Фармацевтична композиція за п. 15, де запальним захворюванням є запальне захворювання кишечнику. 17. Спосіб профілактики або лікування запального захворювання, який включає введення пацієнтові, що цього потребує, ефективної кількості сполуки за будь-яким з пунктів 1-13 або її фармацевтично прийнятної солі. 18. Спосіб за п. 17, де запальним захворюванням є запальне захворювання кишечнику. 19. Застосування сполуки за будь-яким з пунктів 113 або її фармацевтично прийнятної солі для одержання фармацевтичного засобу для профілактики або лікування запального захворювання. 20. Застосування за п. 19, де запальним захворюванням є запальне захворювання кишечнику. 21. Комерційне упакування, що містить засіб для профілактики або лікування запального захворювання, який містить сполуку за будь-яким з пунктів 1-13 або її фармацевтично прийнятну сіль як активний інгредієнт і друковану інструкцію, в якій вказується, що засіб може або повинен бути використаний для профілактики або лікування запального захворювання. Представлений винахід стосується нового похідного дигідропсевдоеритроміцину. Зокрема, представлений винахід стосується нового похідного дигідропсевдоеритроміцину, яке має надзвичайну протизапальну дію і є стабільним. Еритроміцин (14-членний макролід) досить складно використовувати як протизапальний агент оскільки він одночасно має протизапальну дію і протибактеріальну дію. Ця проблема вирішується похідним псевдоеритроміцину (12-членне кільце, дивіться THE KITASATO INSTITUTE, серії ЕМ700, WO2002/14338 і WO2004/39823), що має протизапальну дію, але позбавлений протибактеріальної дії. Характерною сполукою є ЕМ703, яка представлена наступною формулою: вання рухливості гастроінтестинального тракту, але не описується протизапальна дія. Представлений винахід спрямований на усунення протибактеріальної дії еритроміцину і створення сполуки, що має тільки протизапальну дію, зокрема, створення стабільного похідного псевдоеритроміцину. Винахідниками було проведено інтенсивні дослідження спрямовані на вирішення згаданої вище проблеми і вдалося усунути протибактеріальну дію шляхом використання 12-членного кільця, а також відновити сполуку з одержанням дигідроформи, і в той же час покращити стабільність до кислот, що призвело до створення представленого винаходу. Відповідно, представлений винахід забезпечує наступне. [1] Сполуку представлену наступною формулою [І] Згадане вище похідне псевдоеритроміцину має недолік з боку фармакологічної дії, яка є недостатньою при пероральному вживанні, оскільки, похідне частково розкладається кислотою і стає відносно нестабільним. Дигідроформа одержана шляхом відновлення вирішує проблему стабільності і проявляє добру фармакологічну дію при пероральному прийомі. В той же час в Faghih R, Nellans ΗΝ, Lartey PA, Petersen A, Marsh K, Bennani YL, Plattner JJ. Preparation of 9-deoxo-4"-deoxy-6,9epoxyerythromycin lactams "motilactides": potent and orally active prokinetic agents. Bioorg Med Chem Lett. 1998, 8(7):805-10 описуються похідні дигідропсевдоеритроміцину, всі з них є 4"дегідроксиформами кладинози (цукор в 3положенні). Документ описує, що похідні дигідропсевдоеритроміцину проявляють слабе стимулю де Me є метильна група, R1 і R2 є однаковими або різними і кожен є атом водню, алкільна група, ацильна група, сульфонільна група, заміщена або незаміщена арилзаміщена алкільна група, арил-заміщена алкоксикарбонільна група, алкенільна група або алкінільна група, або R1 і R2 в комбінації утворюють, разом з сусіднім атомом азоту, заміщену або незаміщену аліциклічну гетероциклічну групу, R3 є атом водню, заміщена або незаміщена ацильна група або арил-заміщена алкоксикарбонільна група, А є атом водню, В є гідроксильна група або група представлена наступною формулою [II] 7 де Me є метильна група і R4 є атом водню або ацильна група, або А і В в комбінації дають = O, R є група представленанаступною формулою [III] де Me є метильна група, R5 і R6 є однаковими або різними і кожен є атом водню або ацильна група, або R5 і R6 в комбінації дають карбонільну групу або заміщену або незаміщену алкіленову групу, замісник представлений наступною формулою [IV] де Me є метильна група, D є О або N-OH, або D є атом водню і гідроксильна група (-Н, -ОН), або замісник представлений наступною формулою [V] де Me є метильна група, або її фармакологічно прийнятну сіль. [2] Сполуку як згадано вище в [1], де R є група представлена наступною формулою [III] де Me є метильна група, R5 і R6 є однаковими або різними і кожен є атом водню або ацильна група, або R5 і R6 в комбінації дають карбонільну групу або заміщену або незаміщену алкіленову групу, або її фармакологічно прийнятну сіль. [3] Сполуку як згадано вище в [1] або [2], де А і В в комбінації дають =O, або її фармакологічно прийнятну сіль. [4] Сполуку як згадано вище в [1] або [2], де А є атом водню і В є гідроксильна група, або її фармакологічно прийнятну сіль. [5] Сполуку як згадано вище в [1] або [2], де А є атом водню і В є група представлена наступною формулою [II] 94065 8 де Me є метильна група і R4 є атом водню або ацильна група, або її фармакологічно прийнятну сіль. [6] Сполуку як згадано вище в [5], де R4 є атом водню, або її фармакологічно прийнятну сіль. [7] Сполуку як згадано вище в будь-якому одному з [1] - [6], де R1 і R2 є однаковими або різними і кожен є атом водню, алкільна група, заміщена або незаміщена бензильна група або бензилоксикарбонільна група, або R1 і R2 в комбінації утворюють, разом з сусіднім атомом азоту, заміщену або незаміщену аліциклічну гетероциклічну групу, або її фармакологічно прийнятну сіль. [8] Сполуку як згадано вище в [7], де R1 і R2 є однаковими або різними і кожен є атом водню, нижча алкільна група, що має 1 - 3 атоми вуглецю або галоген-заміщена бензильна група, або її фармакологічно прийнятну сіль. [9] Сполуку як згадано вище в [7], де заміщеною або незаміщеною аліциклічною гетероциклічною групою утвореною R1 і R2 в комбінації з сусіднім атомом азоту є заміщене або незаміщене морфолінове кільце, піперидинове кільце, піперазинове кільце або піролідинове кільце, або її фармакологічно прийнятну сіль. [10] Сполуку як згадано вище в будь-якому одному з [1] - [9], де R3 є атом водню, ацетильна група, заміщена або незаміщена бензоїльна група або бензилоксикарбонільна група, або її фармакологічно прийнятну сіль. [11] Сполуку як згадано вище в [10], де R3 є атом водню, заміщена або незаміщена ацетильна група або бензоїльна група, або її фармакологічно прийнятну сіль. [12] Наступні сполуки (1) 9-дигідро-псевдоеритроміцин А 6,9-епоксид (2) де(3'-N-метил)-9-дигідропсевдоеритроміцин А 6,9-епоксид (3) де(3'-N-метил)-3'-N-бензил-9-дигідропсевдоеритроміцин А 6,9-епоксид (4) біс-де(3'-N-метил)-9-дигідропсевдоеритроміцин А 6,9-епоксид (5) бic-де(3'-N-метил)-бic-(3'-N-бензил)-9дигідро- псевдоеритроміцин А 6,9-епоксид (6) де(3'-N-метил)-3'-М-(п-хлорбензил)-9дигідро-псевдоеритроміцин А 6,9-епоксид (7) де[12-(1-гідроксипропіл)]-9-дигідро-12-оксопсевдоеритроміцин А 6,9-епоксид (8) де[12-(1-гідроксипропіл)]-9-дигідро-12гідроксиоксим-псевдоеритроміцин А 6,9-епоксид (9) де[12-(1-гідроксипропіл)]-9-дигідропсевдоеритроміцин А 6,9-епоксид (10) 12,13-епокси-9-дигідропсевдоеритроміцин А 6,9-епоксид (11) де(3-О-кладинозил)-9-дигідропсевдоеритроміцин А 6,9-епоксид (12) 4",13-О-діацетил-9-дигідропсевдоеритроміцин А 6,9-епоксид (13) 2'-О-ацетил-9-дигідро-псевдоеритроміцин А 6,9-епоксид (14) де(3'-диметиламіно)-3'-морфоліно-9дигідро-псевдоеритроміцин А 6,9-епоксид (15) 2'-О-ацетил-де(3-О-кладинозил)-9дигідро-3-кето-псевдоеритроміцин А 6,9-епоксид 12,13-карбонат 9 (16) де(3-О-кладинозил)-9-дигідро-3-кетопсевдоеритроміцин А 6,9-епоксид 12,13-карбонат (17) де(3'-N-метил)-3'-N-(п-хлорбензил)-де(3О-кладинозил)-9-дипдро-псевдоеритроміцин А 6,9епоксид (18) 2'-O-ацетил-де(3-O-кладинозил)-9дигідро-3-кето-де(3'-диметиламіно)-3'-морфолінопсевдоеритроміцин А 6,9-епоксид 12,13-карбонат (19) де(3-О-кладинозил)-9-дигідро-3-кетоде(3'-диметиламіно)-3'-морфолінопсевдоеритроміцин А 6,9-епоксид 12,13-карбонат (20) де(3'-N-метил)-2'-О-3'-Nбіс(бензилоксикарбонт)-де(3-О-кладинозил)-9дигідро-псевдоеритроміцин А 6,9-епоксид 12,13карбонат (21) де(3'-N-метил)-3'-N-(п-хлорбензил)-де(3О-кладинозил)-9-дигідро-3-кетопсевдоеритроміцин А 6,9-епоксид 12,13-карбонат (22) де(3-О-кладинозил)-9-дигідро-де(3'диметиламіно)-3'-морфоліно-псевдоеритроміцин А 6,9-епоксид 12,13-карбонат (23) де(3'-N-метил)-3'-N-(п-хлорбензил)-де(3O-кладинозил)-9-дигідро-3-кетопсевдоеритроміцин А 6,9-епоксид 12,13ізопропіліден ацеталь або (24) де(3'-N-метил)-3'-N-(п-хлорбензил)-де(3О-кладинозил)-9-дигідро-3-кетопсевдоеритроміцин А 6,9-епоксид, або її фармакологічно прийнятну сіль. [13] Наступні сполуки (1) де(3'-N-метил)-3'-N-(п-хлорбензил)-9дигідро-псевдоеритроміцин А 6,9-епоксид (2) де(3'-N-диметиламіно)-3'-морфоліно-9дигідро-псевдоеритроміцин А 6,9-епоксид або (3) де(3'-N-метил)-3'-N-(п-хлорбензил)-де(3-Окладинозил)-9-дигідро-3-кето-псевдоеритроміцин А 6,9-епоксид 12,13-карбонат, або її фармакологічно прийнятну сіль. [14] Фармацевтичну композицію, що містить сполуку як згадано вище в одному з [1] - [13] або її фармакологічно прийнятну сіль як активний інгредієнт. [15] Фармацевтичну композицію як згадано вище в [14], яка використовується для профілактики або лікування запального захворювання. [16] Фармацевтичну композицію, як згадано вище в [15], де запальним захворюванням є запальне захворювання кишечнику. [17] Спосіб профілактики або лікування запального захворювання, який включає введення ефективної кількості сполуки як згадано вище в будь-якому одному з [1] - [13] або її фармакологічно прийнятної солі пацієнтові, що цього потребує. [18] Спосіб як згадано вище в [17], де запальним захворюванням є запальне захворювання кишечнику. [19] Застосування сполуки як згадано вище в будь-якому одному з [1] - [13] або її фармакологічно прийнятної солі, для одержання фармацевтичного агента для профілактики або лікування запального захворювання. [20] Застосування як згадано вище в [19], де запальним захворюванням є запальне захворювання кишечнику. 94065 10 [21] Комерційне упакування, що містить агент для профілактики або лікування запального захворювання, яке містить сполуку як згадано вище в будь-якому з [1] - [13] або її фармакологічно прийнятної солі як активного інгредієнту, і друковану інструкцію, в якій вказується, що агент може або повинен використовуватись для профілактики або лікування запального захворювання. Детальний опис винаходу В сполуці представленій приведеною вище формулою [І], стеричні структури в 8-положенні і 9положенні окремо не обмежуються. Сполука представленого винаходу охоплює всі стереоізомери в 8-положенні і 9-положенні. В представленому описі, "алкільною групою" є нерозгалужена або розгалужена алкільна група, що має 1-12 атомів вуглецю або циклічна алкільна група, що має 3-10 атомів вуглецю. Її прикладами є метильна група, an етил група, н-пропільна група, н-бутильна група, н-пентильна група, нгексильна група, н-гептильна група, н-октильна група, н-нонільна група, н-децильна група, нундецил група, н-додецильна група, ізопропільна група, ізобутильна група, втор-бутильна група, трет-бутильна група, ізопентильна група, третпентильна група, неопентильна група, 2-пентильна група, 3-пентильна група, 2-гексильна група, третоктильна група, циклопропільна група, циклобутильна група, циклопентильна група, циклогексильна група, 1-адамантильна група і т.і., перевага віддається нижчій алкільній групі, що має 1-3 атоми вуглецю (метильна група, етильна група, н-пропільна група і ті). В представленому описі, "ацильною групою" є формільна група, ацильна група має нерозгалужений або розгалужений алкільний ланцюг з 1 - 12 атомів вуглецю або циклічну алкільну групу, що має 3-10 атомів вуглецю, ацильна група має нерозгалужений або розгалужений алкенільний ланцюг з 2 - 12 атомів вуглецю або циклічну алкенільну групу, що має 3-10 атомів вуглецю, або ацильна група, що має арильну групу, що має 6-14 атомів вуглецю. Як тут використовується, арильною групою є моноциклічна - трициклічна ароматична вуглеводнева група, що має 6 - 14 атомів вуглецю. Її прикладами є фенільна група, біфенільна група, нафтильна група, антрильна група, фенанатрильна група і їм подібні. Прикладами ацильної групи є формільна група, ацетильна група, пропіонільна група, бутирильна група, ізобутирильна група, валерильна група, ізовалерильна група, півалоїльна група, гексаноїльна група, акрилоїльна група, метакрилоїльна група, кротоноїльна група, ізокротоноїльна група, бензоїльна група, нафтоїльна група і їм подібні, де перевага віддається ацетильній групі і бензоїльній групі. В представленому описі, "заміщена або незаміщена ацильна група" означає незаміщену ацильну групу (як визначено вище) або заміщену ацильну групу. Прикладами замісників є галоген (йод, бром, хлор, фтор), алкільна група (як визначено вище), алкоксигрупа, гідроксильна група, галогензаміщена алкільна група, галоген-заміщена алкокси група і їм подібні, де перевага віддається галогену. Як тут використовується, алкоксигрупою є 11 алкоксигрупа, що має нерозгалужений або розгалужений алкільний ланцюг, що має 1-12 атомів вуглецю, або циклічна алкільна група, що має 3 10 атомів вуглецю. Її прикладами є метоксигрупа, етоксигрупа, пропоксигрупа, 1-метилетоксигрупа, бутоксигрупа, 2-метилпропоксигрупа, 1,1диметилетоксигрупа, пентоксигрупа, 3метилбутоксигрупа, гексоксигрупа, 4метилпентоксигрупа, циклопропілоксигрупа, циклобутилоксигрупа, циклопентилоксигрупа, циклогексилоксигрупа і їм подібні. Галоген-заміщеною алкільною групою і галоген-заміщеною алкоксигрупою є алкільна група (як визначено вище) і алкоксигрупа (як визначено вище), кожна з яких є заміщеною одним або декількома галогенами (як визначено вище). В представленому описі, "заміщена або незаміщена арил-заміщена алкільна група" означає незаміщений арил-заміщену алкільну групу або заміщений арил-заміщену алкільну групу. "Арилзаміщеною алкільною групою" є алкільна група (як визначено вище) заміщена арильною групою (як визначено вище), така як фенілметильна група (бензильна група), дифенілметильна група, трифенілметильна група (тритильна група), фенілетильна група (фенетильна група), 3фенілпропільна група, 2-фенілпропільна група, 4фенілбутильна група, біфенілметильна група, нафтилметильна група і їм подібні, де перевага віддається бензильній групі. Прикладами замісника арил-заміщеної алкільної групи є алкоксигрупа (як визначено вище), галоген (як визначено вище), алкільна група (як визначено вище), гідроксильна група, галоген-заміщена алкільна група (як визначено вище), галоген-заміщена алкоксигрупа (як визначено вище) і їм подібні, де перевага віддається галогену. Якщо спеціально невизначено, положення і кількість цих замісників є необов'язковою і спеціально не обмежується. Коли заміщений двома або більше замісниками, замісники можуть бути однаковими або різними. В представленому описі, "арил-заміщена алкоксикарбонільна група" означає алкоксикарбонільну групу, що має нерозгалужений або розгалужений алкільний ланцюг з 1-12 атоми вуглецю або циклічну алкільну групу з 3 -10 атоми вуглецю, яка є заміщеною арильною групою (як визначено вище). її прикладами є бензилоксикарбонільна група, тритилоксикарбонільна група, дифенілметилоксикарбонільна група, фенетилоксикарбонільна група і їм подібні, де перевага віддається бензилоксикарбонільній групі. В представленому описі, "алкенільна група" означає нерозгалужену або розгалужену алкенільну групу, що має 2-12 атоми вуглецю, або циклічну алкенільну групу, що має 3-10 атоми вуглецю і один ненасичений зв'язок (подвійний зв'язок). її прикладами є алільна група, пропенільна група, бутенільна група, циклогексенільна група і їм подібні. Переважною є алільна група. В представленому описі, "алкінільна група" означає нерозгалужену або розгалужену алкінільну групу, що має 2-12 атоми вуглецю, або циклічну алкінільну групу, що має 3-10 атоми вуглецю і 94065 12 один ненасичений зв'язок (потрійний зв'язок). Її прикладами є пропаргільна група і 1-пентинільна група. В представленому описі, "заміщена або незаміщена аліциклічна гетероциклічна група" означає незаміщену аліциклічну гетероциклічну групу або заміщена аліциклічну гетероциклічну групу. "Аліциклічним гетероциклом" є моноцикл вільний від кон'югованих подвійних зв'язків в максимальній кількості, який утворюється зв'язуванням атома вуглецю з принаймні одним гетероатомом, таким як атом кисню, атом азоту, атом сірки і їм подібні. Його специфічними прикладами є піролінове кільце, піролідинове кільце, імідазолінове кільце, імідіазолідинове кільце, піразолінове кільце, піразолідинове кільце, піперидинове кільце, піперазинове кільце, морфолінове кільце і їм подібні. Переважним є морфолінове кільце, піперидинове кільце, піперазинове кільце і піролідинове кільце, і особливо переважним є морфолінове кільце і піперазинове кільце. Прикладами замісника аліциклічної гетероциклічної групи є алкільна група (як визначено вище), арильна група (як визначено вище), карбонільна група (наприклад, згадана вище арил-заміщена алкоксикарбонільна група) і їм подібні. R1 і R2 є переважно однаковими або різними і кожен є атом водню, алкільна група, заміщена або незаміщена бензильна група або бензилоксикарбонільна група, або R1 і R2 в комбінації утворюють, разом з сусіднім атомом азоту, заміщену або незаміщену аліциклічну гетероциклічну групу. Більш переважно, R1 і R2 є однаковими або різними і кожен є атом водню, нижча алкільна група, що має 1 - 3 атоми вуглецю або галоген-заміщена бензильна група, або R1 і R2 в комбінації утворюють, разом з сусіднім атомом азоту, заміщене або незаміщене морфолінове кільце, піперидинове кільце, піперазинове кільце або піролідинове кільце (переважно, морфолінове кільце або піперазинове кільце). Прикладами замісника аліциклічної гетероциклічної групи є алкільна група (як визначено вище), арильна група (як визначено вище), карбонільна група (як визначено вище) і їм подібні. Переважною є арил-заміщена алкоксикарбонільна група і більш переважною є бензилоксикарбонільна група. R3 переважно є атом водню, ацетильна група, заміщена або незаміщена бензоїльна група або бензилоксикарбонільна група, більш переважно атом водню або ацетильна група. А є атом водню, В є гідроксильна група або група представлена наступною формулою [II] де Me є метильна група, і R4 є атом водню або ацильна група, або А і В в комбінації переважно утворюють =O. R4 є особливо переважно атомом водню. 13 R є переважно групою представленою наступною формулою [III] де Me є метильна група, R5 і R6 є однаковими або різними і кожен є атом водню або ацильна група, або R5 і R6 в комбінації дають карбонільну групу або заміщену або незаміщену алкіленову групу. Специфічні Приклади переважних сполук представленого винаходу показані в наступних Таблицях; однак, сполука представленого винаходу не обмежується ними. Далі приводяться значення кожного з символів в представленому описі. 94065 14 Me: метильна група, Et: етильна група, ІРr: ізопропільна група, нНех: н-гексильна група, Ас: ацетильна група, Bzl: бензильна група, пCI-Bzl: бензильна група заміщена хлором в пара-положенні, пBr-Bzl: бензильна група заміщена бромом в параположенні, пF-Bzl: бензильна група заміщена фтором в пара-положенні,пl-Bzl: бензильна група заміщена йодом в пара-положенні, oCI-Bzl: бензильна група заміщена хлором в орто- положенні, мСІBzl: бензильна група заміщена хлором в метаположенні, nCF3-Bzl: бензильна група заміщена трифторметильною групою в пара-положенні, пOMe-Bzl: бензильна група заміщена метоксигрупою в пара-положенні, Cbz: бензилоксикарбонільна група, пВr-Bz: бензоїльна група заміщена бромом в пара-положенні, пMe-Bzl: бензильна група заміщена метильною групою в пара-положенні. 15 94065 16 17 Особливо переважними сполуками є (1) 9дигідро-псевдоеритроміцин А 6,9-епоксид, (2) де(3'-N-метил)-9-дигідро-псевдоеритроміцин А 6,9епоксид, (3) де(3'-N-метил)-3'-N-бензил-9-дигідропсевдоеритроміцин А 6,9-епоксид, (4) біс-де(3'-Nметил)-9-дигідро-псевдоеритроміцин А 6,9епоксид, (5) біс-де(3'- N -метил)-біс-(3'- N -бензил) 94065 18 9-дигідро-псевдоеритроміцин А 6,9-епоксид, (6) де(3'- N -метил)-3'- N -(п-хлорбензил)-9-дигідропсевдоеритроміцин А 6,9-епоксид, (7) де[12-(1гідроксипропіл)]-9-дигідро-12-оксопсевдоеритроміцин А 6,9-епоксид, (8) де[12-(1гідроксипропіл)]-9-дигідро-12-гідроксиоксимпсевдоеритроміцин А 6,9-епоксид, (9) де[12-(1 19 гідроксипропіл)]-9-дигідро-псевдоеритроміцин А 6,9-епоксид, (10) 12,13-епокси-9-дигідропсевдоеритроміцин А 6,9-епоксид, (11) де(3-Oкладинозил)-9-дигідро-псевдоеритроміцин А 6,9епоксид, (12) 4", 13-О-діацетил-9-дигідропсевдоеритроміцин А 6,9-епоксид, (13) 2'-Oацетил-9-дигідро-псевдоеритроміцин А 6,9епоксид, (14) де(3'-диметиламіно)-3'-морфоліно-9дигідро-псевдоеритроміцин А 6,9-епоксид, (15) 2'О-ацетил-де(3-О-кладинозил)-9-дигідро-3-кетопсевдоеритроміцин А 6,9-епоксид 12,13-карбонат, (16) де(3-О-кладинозил)-9-дигідро-3-кетопсевдоеритроміцин А 6,9-епоксид 12,13-карбонат, (17) де(3'- N -метил)-3'- N (п-хлорбензил)-де(3-Oкладинозил)-9-дигідро-псевдоеритроміцин А 6,9епоксид, (18) 2'-О-ацетил-де(3-O-кладинозил)-9дигідро-3-кето-де(3'-диметиламіно)-3'-морфолінопсевдоеритроміцин А 6,9-епоксид 12,13-карбонат, (19) де(3-О-кладинозил)-9-дигідро-3-кето-де(3'диметиламіно)-3'-морфоліно-псевдоеритроміцин А 6,9-епоксид 12,13-карбонат, (20) де(3'- N -метил)2'-O-3'N -біс(бензилоксикарбоніл)-де(3-Oкладинозил)-9-дигідро-псевдоеритроміцин А 6,9епоксид 12,13-карбонат, (21) де(3'- N -метил)-3'- N -(п-хлорбензил)-де(3-О-кладинозил)-9-дигідро-3кето-псевдоеритроміцин А 6,9-епоксид 12,13карбонат, (22) де(3-О-кладинозил)-9-дигідро-де(3'диметиламіно)-3'-морфоліно-псевдоеритроміцин А 6,9-епоксид 12,13-карбонат, (23) де(3'- N -метил)3'N -(п-хлорбензил)-де(3-О-кладинозил)-9 94065 20 дигідро-3-кето-псевдоеритроміцин А 6,9-епоксид 12,13-ізопропіліден ацеталь, і (24) де(3'- N -метил)3'N -(п-хлорбензил)-де(3-О-кладинозил)-9дигідро-3-кето-псевдоеритроміцин А 6,9-епоксид. Наступними переважними сполуками є де(3'N -метил)-3'N -(п-хлорбензил)-9-дигідропсевдоеритроміцин А 6,9-епоксид, де(3'диметиламіно)-3'-морфоліно-9-дигідропсевдоеритроміцин А 6,9-епоксид, і де(3'- N метил)-3'- N -(п-хлорбензил)-де(3-О-кладинозил)9-дигідро-3-кето-псевдоеритроміцин А 6,9-епоксид 12,13-карбонат. Спосіб одержання сполуки представленого винаходу спеціально не обмежується, наприклад, вони можуть бути одержані згідно з наступними методиками і їм подібними. Крім того, Приклади представленого опису більш конкретно розкривають способи переважних сполук представленого винаходу. Середній спеціаліст в цій галузі може одержати будь-яку сполуку представленого винаходу з посиланням на наступні загальні роз'яснення і специфічні роз'яснення Прикладів, і прийнятним чином модифікувати або змінити вихідні матеріали, умови реакції, реагенти реакції і їм подібні, коли необхідно. Наприклад, сполуки представлені приведеною вище формулою [І], сполука, де А є атом водню і В є група представлена приведеною вище формулою [II], можна одержати згідно із методикою показаною на наступній схемі. 21 94065 22 Тобто, згідно з посиланнями (а) І.О. Kibwage, R. Busson, G. Janssen, J. Hoogmartens, H. Vanderhaeghe, Translactonization of Erythromycins, J. Org. Chem., 52, 990-996, 1987, (b) H.A. Kirst, J.A. Wind, J.W. Paschal, Синтез Ring-Constracted Derivatives of Erythromycin, J. Org. Chem. 52, 43594362, 1987, еритроміцин А обробляли льодяною оцтовою кислотою одержуючи 8,9ангідроеритроміцин А 6,9-гемікеталь (ЕМ201). Післяцього, сполуку нагрівали із зворотнім холодильником в присутності карбонату калію в метанолі одержуючи 8,9-ангідро-псевдоеритроміцин А 6,9гемікеталь (ЕМ701). Потім, проводять каталітичне гідрування використовуючи оксид платини і дифтороцтову кислоту в оцтовій кислоті одержуючи 9-дигідропсевдоеритроміцин А 6,9-епоксид (ЕМ900). Потім, сполуку обробляють йодом і ацетатом натрію одержуючи де(3'N -метил)-9дигідропсевдоеритроміцин А 6,9-епоксид (ЕМ901), який потім обробляють йодом і метоксидом натрію одержуючи біс-де(3'N -метил)-9-дигідропсевдоеритроміцин А 6,9-епоксид (ЕМ903). Використовуючи приведені вище ЕМ901 або ЕМ903, можна синтезувати, використовуючи різні методики алкілування, ацилювання і їм подібні, різні похідні, які є сполуками представленого винаходу, такі як де(3'- N -метил)-3'- N -бензил-9дигідро-псевдоеритроміцин А 6,9-епоксид (ЕМ902). З іншого боку, якщо сполука представлена приведеною вище формулою [І], можна одержати сполуку, де А і В в комбінації дають =О, або А є атом водню і В є гідроксильна група, наприклад, згідно з методикою показаною на наступній схемі. Особливо, згаданий вище 9дигідропсевдоеритроміцин А 6,9-епоксид (ЕМ900), як вихідний матеріал, обробляють бензилоксикарбонілхлоридом одержуючи де(3'- N -метил)-2'-О-3'N -біс(бензилоксикарбоніл)-9-дигідропсевдоеритроміцин А 6,9-епоксид (ЕМ930), який потім обробляють хлорводневою кислотою в ацетонітрилі одержуючи де(3'- N -метил)-2'-0-3'- N біс(бензилоксикарбоніл)-де(3-О-кладинозил)-9дигідро-псевдоеритроміцин А 6,9-епоксид (ЕМ931). Згаданий вище ЕМ931 піддають каталітичному гідруванню використовуючи гідроксид паладію одержуючи де(3-О-кладинозил)-де(3'- N -метил)-9дигідро-псевдоеритроміцин А 6,9-епоксид (ЕМ934). ЕМ931 обробляють трифосфгеном в піридині одержуючи де(3'N -метил)-2'-О-3'N біс(6ензилоксикарбоніл)-де(3-О-кладинозил)-9дигідро-псевдоеритроміцин А 6,9-епоксид 12,13 карбонат (ЕМ936), який потім окислюють реагентом Десса-Мартіна одержуючи де(3'- N -метил)-2'О-3'N -біс(бензилоксикарбоніл)-де(3-Окладинозил)-9-дигідро-3-кето-псевдоеритроміцин А 6,9-епоксид 12,13-карбонат (ЕМ937), який потім піддають каталітичному гідруванню використовуючи гідроксид паладію одержуючи де(3-Окладинозил)-де(3'- N -метил)-9-дигідро-3-кетопсевдоеритроміцин А 6,9-епоксид 12,13-карбонат (ЕМ938). Використовуючи згаданий вище ЕМ934, ЕМ938 або їм подібні, синтезують різноманітні похідні використовуючи реакції алкілування, ацилювання і їм подібні, які є сполуками представленого винаходу, такі як де(3'- N -метил)-3'- N -(пхлорбензил)-де(3-О-кладинозил)-9-дигідропсевдоеритроміцин А 6,9-епоксид (ЕМ925). 23 Прикладами фармацевтично прийнятної солі, що може бути утворена із сполукою представленого винаходу є солі неорганічних кислот, такі як гідрохлорид, гідробромід, гідройодид, сульфат, нітрат, фосфат і їм подібні, солі органічних кислот, такі як сукцинат, фумарат, ацетат, метансульфонат, толуолсульфонат і їм подібні, солі лужних металів, такі як сіль натрію, сіль калію і їм подібні, солі лужноземельних металів, такі як сіль магнію, сіль кальцію і їм подібні, солі амонію, такі як сіль амонію, сіль алкіламонію і т.і. і їм подібні. Крім того, сольвати згаданої вище сполуки або її фармацевтично прийнятної солі також охоплюються представленим винаходом. Прикладами розчинника є вода, метанол, етанол, ізопропанол, ацетон, етилацетат і їм подібні. Оскільки сполука представленого винаходу і її фармацевтично прийнятна сіль проявляє надзвичайну протизапальну дію у ссавців, включаючи людину, таких як велика рогата худоба, коні, собаки, миші, щури і їм подібні, вона може переважно використовуватись для профілактики або лікування запальних захворювань. Прикладами підходящих захворювань є запальне захворювання кишечнику (IBD), таке як хвороба Крона, виразковий коліт і їм подібні, хронічні обструктивні легеневі захворювання (COPD), хронічний бронхіт, респіраторне захворювання, муковісцидоз, дифузивний панбронхіоліт (DPB), пневмонія, пневмофіброз, синусит, бронхоектаз, синобронхіальний синдром, інтерстиціальна пневмонія (пневмоніт), ексудативний отит середнього вуха, псоріаз, поллакіурія, інтерстиціальний цистит і їм подібні. Як активний інгредієнт фармацевтичного агента представленого винаходу, може бути використаний один або більша кількість речовин, що вибирають із згаданих вище сполук і їх солей, також як і їх гідратів і сольватів. Шлях введення фармацевтичного агента представленого винаходу спеціально не обмежується і агент може бути введений перорально або парентерально. Як фармацевтичний агент представленого винаходу, згадана вище речовина може бути безпосередньо введена пацієнтам. Однак, переважно, її слід вводити як рецептуру у формі фармацевтичної композиції, що містить активний інгредієнт і фармакологічно і фармацевтично прийнятну добавку. Як фармакологічно і фармацевтично прийнятну добавку можна згадати, наприклад, екціпієнт, дезінтегрант або помічник дезінтеграната, зв'язувальний агент, покривний агент, фарбник, розріджувач, основу, солюбілізатор або помічник солюбілізатора, ізотонічний агент, регулятор рН, стабілізатор, пропелант, адгезив і їм подібні. Прикладами рецептури придатної для перорального введення є таблетка, капсула, порошок, мілка гранула, гранула, рідина, сироп і їм подібні, і прикладами рецеп 94065 24 тури придатної для парентерального введення є ін'єкція, внутрішньовенна рідина, мазь, крем, підшкірний абсорбер, краплі для очей, крапля для вух, інгалянт, супозиторій і їм подібні. Однак, форма рецептури не обмежується цим. Рецептура придатна для перорального введення може містити, як добавки, наприклад, екціпієнт, такий як глюкоза, лактоза, D-маніт, крохмаль, кристалічну целюлозу і їм подібні; дезінтегрант або помічник дезінтегранта, такий як карбоксиметилцелюлоза, крохмаль, кальцій карбоксиметилцелюлоза і їм подібні; зв'язувальний агент, такий як гідроксипропілцелюлоза, гідроксипропілметилцелюлоза, полівінілпіролідон, желатин і їм подібні; змащувальний агент, такий як стеарат магнію, тальк і їм подібні; основу, таку як гідроксипропілметилцелюлоза, цукроза, поліетиленгліколь, желатин, каолін, гліцерин, очищена вода, твердий жир і їм подібні. Рецептура придатна для ін'єкції або внутрішньовенна рідина може містити добавки для рецептури, такі як солюбілізатор або помічник солюбілізатора здатний забезпечувати водну ін'єкцію або ін'єкцію, що розчиняється, коли використовується (наприклад, дистильована вода для ін'єкції, салін, пропіленгліколь і їм подібні); ізотонічний агент (наприклад, глюкоза, хлорид натрію, Dманіт, гліцерин і їм подібні); регулятор рН (наприклад, неорганічна кислота, органічна кислота, неорганічна або органічна основа, і т.і.); і їм подібні. В той час як доза фармацевтичного агента представленого винаходу буде прийнятно змінюватись в залежності від виду захворювання, що лікується, об'єкту профілактики або лікування, показників пацієнта, таких як вік, вага тіла, симптоми і їм подібні, добова доза для дорослої людини загалом становить приблизно 0,05 - 500 мг активного інгредієнту при пероральному введенні. Загалом, згадана вище доза може вводитись однією або декількома порціями на день або може вводитись кожні декілька днів. Коли включені два або більше видів активних інгредієнтів, загальна кількість попадає в межі цього інтервалу. Приклади Представлений винахід розкривається більш детально в наступних Прикладах синтезу вихідного матеріалу, Прикладах, Експериментальних прикладах і Прикладах рецептур, які не повинні трактуватись як обмеження. Всі публікації приведені в представленому винаході включені у всій своїй повноті як посилання. Якщо не вказано інше, реагенти, пристрої і матеріали, що використовуються в представленому винаході, є комерційно доступними. Приклад синтезу вихідного матеріалу 1 Синтез 8,9-ангідроеритроміцин А 6,9гемікеталю (ЕМ201) 25 94065 26 Розчин (710,0 мл) ЕМА (еритроміцин А; 104,4 г, 16,90 ммоль) в льодяній оцтовій кислоті перемішували при кімнатній температурі протягом 2 г і повільно до нейтралізації розчину додавали водний розчин NaHCO3. Реакційну суміш екстрагували СНСІ3 і органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (99,30 г). Одержаний неочищений продукт розчиняли в СНСІ3 (250 мл) і розчин перекристалізували додаючи гексан (50 мл) одержуючи ЕМ201 (74,50 г, 71%) як білий порошок. ЕМ201 Rf=0,63 (CHCI3:MeOH:NH4OH вод=15:1:0,2) Приклад синтезу вихідного матеріалу 2 Синтез 8,9-ангідропсевдоеритроміцин А 6,9гемікеталю (ЕМ701) До розчину (150,0 мл) ЕМ201 (7,600 г, 10,60 ммоль) в МеОН додавали К2СО3 (1,400 г, 10,60 ммоль) і суміш нагрівали із зворотнім холодильником протягом 2 г. Після охолодження до кімнатної температури, розчинник упарювали і залишок розчиняли у водному розчині NaHCO3. Реакційну суміш екстрагували СНСІ3 і органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (9,300 г). Одержаний неочищений продукт відо кремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=10:0,5:0,01-10:1:0,05) одержуючи ЕМ701 (5,900 г, 78%) як білий порошок. ЕМ701 Rf=0,47(CHCI3:MeOH:NH4OH вод=15:1:0,2) Приклад 1 Синтез 9-дигідро-псевдоеритроміцин А 6,9епоксиду (ЕМ900) До оцтової кислоти (АсОН; 7,000 мл) додавалиРtO2 (476,2 мг, 2,100 ммоль) і CF2HCOOH (299,0 мкл, 4,750 ммоль) і суміш перемішували в атмосфері Н2 при 5 атм і кімнатній температурі протягом 1 г. Додавали розчин (7,000 мл) ЕМ701 (1,000 г, 1,400 ммоль) в АсОН і суміш перемішували в атмосфері Н2 при 5 атм і кімнатній температурі протягом 4 г. Потім додавали CH3CO2NH4 (7,000 г), суміш перемішували і фільтрували і фільтрат концентрували. Концентрований розчин екстрагували СНСІ3 і екстракт промивали насиченим водним розчином NaHCO3 і розсолом. Промитий органічний шар сушили над Na2SO4, залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (968,4 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою 27 94065 28 колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=50:1:0,02-30:1:0,02) одержуючи ЕМ900 (767,7 мг, 76%) як білий порошок. ЕМ900 Rf=0,53(CHCI3:MeOH:NH4OH вод=15:1:0,2); ВР-МС m/z:718,4767[M+H]+, Розраховано для C37H68NO12:718,4742[M+H] Приклад 2 Синтез де(3'-М-метил)-9-дигідропсевдоеритроміцин А 6,9-епоксиду (ЕМ901) До розчину ЕМ900 (706,3 мг, 0,984 ммоль) в метанолі (МеОН) (9,840 мл) додавали ацетат натрію (AcONa; 403,6 мг, 4,920 ммоль), І2 (499,5 мг, 1,968 ммоль) і насичений розчин NaHCO3 і суміш перевіряли на основність використовуючи універсальний індикатор і перемішували при 50°С протягом 20 хв. Після перемішування, додавали Na2S2O3 (400,0 мг) і суміш охолоджували до кімнатної температури. Реакційну суміш екстрагували СНСІ3. Після промивання змішаним розчином розсолу і NH4OH вод, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (700,0 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,130:1:0,1) одержуючи ЕМ901 (546,5 мг, 79%) як білий порошок. ЕМ901 Rf=0,53(CHCI3:MeOH:NH4OH вод=10:1:0,2) ВР-МС m/z:704,4615[M+H]+, Розраховано для C36H66NO12:704,4585[M+H] Приклад 3 Синтез де(3'- N -метил)-3'- N -бензил-9дигідро-псевдоеритроміцин А 6,9-епоксиду (ЕМ902) До розчину (850,0 мкл) ЕМ901 (60,00 мг, 0,0852 ммоль) в СНСІ3 додавали діізопропілетиламін (i-Pr2NEt; 74,00 мкл, 0,426 ммоль) і бензилбромід (ВnВr; 51,00 мкл, 0,426 ммоль) і суміш перемішували в атмосфері Аr при кімнатній температурі протягом 1 г. Після перемішування, додавали насичений розчин Na2S2O3 (10,00 мл) і суміш екстрагували СНСІ3. Після промивання насиченим розчином Na2S2O3, насиченим водним розчином NH4Cl і розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (70,10 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,1) одержуючи ЕМ902 (62,30 мг, 92%) як білий порошок. ЕМ902 ВР-МС m/z:794,5073[M+H]+, Розраховано для C43H72NO12:794,5055[M+H] Приклад 4 Синтез біс-де(3'-N-метил)-9-дигідропсевдоеритроміцин А 6,9-епоксиду (ЕМ903) 29 94065 30 Розчин (15,80 мл) Na (21,80 мг, 0,9480 ммоль) в МеОН охолоджували до 0°С, додавали ЕМ901 (111,5 мг, 0,1580 ммоль) і l2 (200,5 мг, 0,7900 ммоль) і суміш перемішували в атмосфері Аr при 0°С протягом 40 хв. Після перемішування, додавали Na2S2O3 (100,0 мг) і суміш нагрівали до кімнатної температури. Реакційну суміш екстрагували СНСІ3. Після промивання змішаним розчином розсолу і NH4OH вод, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (100,0 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,110:1:0,1) одержуючи ЕМ903 (98,40 мг, 90%) як білий порошок. ЕМ903 Rf=0,43(CHCI3:MeOH:NH4OH вод=10:1:0,2) ВР-МС m/z:690,4431[M+H]+, Розраховано для C35H64NO12:690,4429[M+H] Приклад 5 Синтез біс-де(3'- N -метил)-біс-(3'- N -бензил)9-дигідро-псевдоеритроміцин А 6,9-епоксиду (ЕМ904) В атмосфері Аr, розчин (580,0 мкл) ЕМ903 (20,00 мг, 0,0290 ммоль) в 1,2-дихлоретані охолоджували до 0°С, додавали бензальдегід (3,100 мкл, 0,0300 ммоль), АсОН (2,500 мкл, 0,0440 ммоль) і NaBH(OAc)3 (9,300 мг, 0,0440 ммоль) і суміш перемішували при 0°С протягом 2,5 г. Після перемішування, додавали бензальдегід (14,80 мкл, 0,1430 ммоль), АсОН (8,300 мкл, 0,1460 ммоль) і NaBH(OAc)3 (31,00 мг, 0,1460 ммоль) і суміш нагрівали до кімнатної температури і перемішували протягом 1 г. Після перемішування, додавали насичений розчин NaHCO3 (7,000 мл) і суміш екстрагували СНСІ3. Після промивання насиченим розчином NaHCO3 і розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (23,00 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,1-50:1:0,1) одержуючи ЕМ904 (15,80 мг, 63%) як білий порошок. ЕМ904 BP-MC m/z:870,5385[M+H]+, Розраховано для C49H76NO12:870,5368[M+H] Приклад 6 Синтез де(3'- N -метил)-3'- N -(п-хлорбензил)9-дигідро-псевдоеритроміцин А 6,9-епоксиду (ЕМ905) 31 94065 32 До розчину (280,0 мкл) ЕМ901 (20,00 мг, 0,0280 ммоль) в СНСІ3 додавали i-Pr2NEt (24,40 мкл, 0,14 ммоль) і п-СІВnВr (п-хлорбензилбромід: 28,80 мг, 0,1400 ммоль), і суміш перемішували в атмосфері N2 при кімнатній температурі протягом 2 г. Після перемішування, додавали насичений розчин Na2S2O3 (7,000 мл) і суміш екстрагували СНСІ3. Після промивання насиченим розчином Na2S2O3, насиченим розчином NН4СІ і розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (24,10 мг). Одержаний не очищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,1) одержуючи ЕМ905 (21,60 мг, 93%) як білий порошок. ЕМ905 Rf=0,59(CHCI3:MeOH:NH4OH вод=30:1:0,2) BP-MC m/z:828,4657[M+H]+ Розраховано для C43H71NO12CI:828,4665[M+H] Приклад 7 Синтез де[12-(1-гідроксипропіл)]-9-дигідро-12оксо-псевдоеритроміцин А 6,9-епоксиду (ЕМ906) В атмосфері N2, розчин (14,00 мл) ЕМ900 (301,4 мг, 0,420 ммоль) в СН2СІ2 охолоджували до 0°С, додавали Рb(ОАс)4 (300,0 мг, 0,6720 ммоль) і суміш перемішували при 0°С протягом 3 г. Після перемішування, додавали насичений розчин NaHCO3 (25,00 мл) і суміш екстрагували СНСІ3. Після промивання насиченим розчином NaHCO3 і розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (305,0 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,150:1:0,1) одержуючи ЕМ906 (154,7 мг,56%) як білий порошок. ЕМ906 ВР-МС m/z:658,4172[M+H]+, Розраховано для С34Н60NО11:658,4166[М+Н] Приклад 8 Синтез де[12-(1 -гідроксипропіл)]-9-дигідро-12гідроксиоксим-псевдоеритроміцин А 6,9-епоксиду (ЕМ907) В атмосфері N2, розчин (1,100 мл) ЕМ906 (147,6 мг, 0,2250 ммоль) в ЕtOН охолоджували до 0°С, додавали NH2OH∙HCI (48,00 мг, 0,6750 ммоль), по краплям додавали піридин (1,1 мл, 13,60 ммоль) і суміш перемішували при 0°С протягом 4 г. Після перемішування, додавали насичений розчин NaHCO3 (5 мл) і суміш екстрагували СНСІ3. Органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (162,0 мг). Одержаний не очищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=30:1:0,1-10:1:0,1) одержуючи ЕМ907 (140,4 мг, 93%) як білий порошок. ЕМ907 ВР-МС m/z:673,4256[M+H]+ Розраховано для C34H61N2O11:673,4275[M+H] Приклад 9 Синтез де[12-(1-гідроксипропіл)]-9-дигідропсевдоеритроміцин А 6,9-епоксиду (ЕМ908) 33 94065 34 В атмосфері N2, розчин (3,000 мл) ЕМ906 (39,00 мг, 0,0593 ммоль) в МеОН охолоджували до -78°С, додавали NaBH4 (22,40 мг, 0,5930 ммоль), і суміш перемішували при -78°С протягом 1,5 г. Після перемішування, суміш нагрівали до кімнатної температури і розводили СНСІ3, додавали розсіл (30,00 мл) і суміш екстрагували СНСІ3. Після промивання водою, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (40,30 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=30:1:0,1-10:1:0,1) одержуючи ЕМ908 (30,80 мг, 79%) як білий порошок. ЕМ908 ВР-МС m/z:660,4319[M+H]+, Розраховано для C34H62NO11:660,4323[M+H] Приклад 10 Синтез 12,13-епокси-9-дигідропсевдоеритроміцин А 6,9-епоксиду (ЕМ909) В атмосфері N2, до розчину (1,500 мл) ЕМ900 (106,8 мг, 0,1490 ммоль) в СН2СІ2 додавали сульфат Мартіна (250,0 мг, 0,3720 ммоль) і суміш перемішували протягом 1,0 г. Після перемішування, додавали сульфат Мартіна (50,00 мг, 0,0740 ммоль) і суміш перемішували протягом 0,5 г. Після перемішування, додавали насичений розчин NaHCO3 (5,000 мл) і суміш екстрагували СНСІ3. Після промивання розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений про дукт (110,0 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=40:1:0,1-10:1:0,1) одержуючи ЕМ909 (34,60 мг, 33%) як білий порошок. ЕМ909 ВР-МС m/z:700,4655[M+H]+, Розраховано для C34H62NO11 :700,4636[M+Н] Приклад 11 Синтез де(3-O-кладинозил)-9-дигідропсевдоеритроміцин А 6,9-епоксиду (ЕМ910) До розчину (1,390 мл) ЕМ900 (100,0 мг, 0,1390 ммоль) в МеОН додавали CSA (камфорсульфонова кислота: 48,60 мг, 0,2090 ммоль) і суміш перемішували протягом 3 г. Після перемішування, додавали насичений розчин NaHCO3 (10,00 мл) і суміш екстрагували СНСІ3. Після промивання розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (99,00 мг). Одержаний неочищений продукт відокремлювали і очищали за 35 94065 36 допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=50:1:0,1-10:1:0,1) одержуючи ЕМ910 (18,70 мг, 24%) як білий порошок. ЕМ910 ВР-МС m/z:560,3813[M+H]+, Розраховано для C29H54NO9:560,3799[M+H] Приклад 12 Синтез 4",13-O-діацетил-9-дигідропсевдоеритроміцин А 6,9-епоксиду (ЕМ911) В атмосфері N2, до розчину (1,390 мл) ЕМ900 (100,0 мг, 0,1390 ммоль) в піридині додавали DMAP (4-(N,N-диметиламіно)піридин: 1,698 мг, 0,0139 ммоль) і Ас2О (78,69 мкл, 0,8340 ммоль), і суміш перемішували протягом 1 г. Після перемішування,додавали DMAP (1,698 мг, 0,0139 ммоль) і Ас2О (78,69 мкл, 0,8340 ммоль) і суміш перемішували протягом 2 г. Після перемішування, додавали 10% розчин лимонної кислоти (10,00 мл) і суміш екстрагували AcOEt. Після промивання насиченим розчином NaHCO3, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (120,0 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=50:1:0,1) одержуючи кінцевий продукт (116,0 мг) як білий порошок. Розчин (1,390 мл) цього кінцевого продукту (116,0 мг) в МеОН перемішували при 50°С протягом 12 г. Після перемішування, розчин концентрували одержуючи неочищений продукт (117,1 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=50:1:0,1-10:1:0,1) одержуючи ЕМ911 (104,5 мг, 94%) як білий порошок. ЕМ911 ВР-МС m/z:802,4973[M+H]+, Розраховано для C41H72NO14:802,4953[M+H] Приклад 13 Синтез біс-де(3'-N-метил)-3'-N-бензил-9дигідро-псевдоеритроміцин А 6,9-епоксиду (ЕМ912) В атмосфері Аr, розчин (580,0 мкл) ЕМ903 (20,00 мг, 0,0290 ммоль) в 1,2-дихлоретані охолоджували до 0°С, додавали бензальдегід (3,100 мкл, 0,0300 ммоль), АсОН (2,500 мкл, 0,0440 ммоль) і NaBH(OAc)3 (9,300 мг, 0,0440 ммоль), і суміш перемішували при 0°С протягом 2,5 г. Після перемішування, додавали бензальдегід (14,80 мкл, 0,1430 ммоль), АсОН (8,300 мкл, 0,1460 ммоль) і NaBH(OAc)3 (31,00 мг, 0,1460 ммоль) і суміш нагрівали до кімнатної температури і перемішували протягом 1 г. Після перемішування, додавали насичений розчин NaHCO3 (7,000 мл) і суміш екстрагували СНСІ3. Після промивання насиченим розчином NaHCO3 і розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (23,00 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,1-50:1:0,1) одержуючи ЕМ912 (6,900 мг, 31%) як білий порошок. ЕМ912 ВР-МС m/z:780,4900[M+H]+, Розраховано для C42H70NO12:780,4898[M+H] Приклад 14 Синтез 2'-О-ацетил-9-дигідропсевдоеритроміцин А 6,9-епоксиду (ЕМ913) 37 94065 38 В атмосфері N2, до розчину (8,950 мл) ЕМ900 (641,9 мг, 0,8950 ммоль) в ацетоні додавали Ас2О (506,7 мкл, 5,370 ммоль) і суміш перемішували протягом 0,5 г. Після перемішування, додавали насичений розчин NaHCO3 (100,0 мл) і суміш екстрагували СНСІ3. Після промивання насиченим розчином NaHCO3, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (670,0 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хромато графії (CHCI3:MeOH:NH4OH вод=50:1:0,1-20:1:0,1) одержуючи ЕМ913 (602,3 мг, 89%) як білий порошок. ЕМ913 ВР-МС m/z:760,4879[M+H]+, Розраховано для C39H70NO13:760,4847[M+H] Приклад 15 Синтез де(3'-диметиламіно)-3'-морфоліно-9дигідро-псевдоеритроміцин А 6,9-епоксиду (ЕМ914) В атмосфері Аr, до розчину (7,000 мл) ЕМ903 (24,20 мг, 0,0350 ммоль) в CH3CN додавали iPr2NEt (61,00 мкл, 0,3500 ммоль) і біс(2брометиловий) етер (44,00 мкл, 0,3500 ммоль), і суміш перемішували при 80°С протягом 20 г. Після перемішування, додавали і-Pr2NEt (61,00 мкл, 0,3500 ммоль) і біс(2-брометиловий) етер (44,00 мкл, 0,3500 ммоль) і суміш перемішували при 80°С протягом 6 г. Після перемішування, додавали насичений розчин Na2S2O3 (7,000 мл) і суміш екстрагували СНСІ3. Після промивання насиченим розчином Na2S2O3, насиченим розчином NH4CI і розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (36,50 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,130:1:0,1) одержуючи EM914 (23,60 мг, 89%) як білий порошок. ЕМ914 Rf=0,44(CHCI3:MeOH:NH4OH вод=30:1:0,2) ВР-МС m/z:760,4885[M+H]+, Розраховано для С39Н70NO13:760,4847[М+Н] Приклад 16 Синтез 2'-O-ацетил-де(3-O-кладинозил)-9дигідро-псевдоеритроміцин А 6,9-епоксиду (ЕМ915) До ЕМ913 (104,5 мг, 0,1380 ммоль) додавали 1,0N HCI вод (1,380 мл) і суміш перемішували протягом 5 г. Після перемішування, додавали насичений розчин NaHCO3 (20,00 мл) і суміш екстрагува ли СНСІ3. Після промивання розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (91,10 мг). Одержаний неочищений про 39 94065 40 дукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=50:1:0,1-20:1:0,1) одержуючи ЕМ915 (37,60 мг, 46%) як білий порошок. ЕМ915 ВР-МС m/z:602,3899[M+H]+, Розраховано для C31H56NO10:602,3904[M+H] Приклад 17 Синтез 2'-O-ацетил-де(3-O-кладинозил)-9дигідро-псевдоеритроміцин А 6,9-епоксид 12,13карбонату (ЕМ916) В атмосфері N2, розчин (1,100 мл) ЕМ915 (32,90 мг, 0,0547 ммоль) в СН2СІ2 охолоджували до -78°С, додавали піридин (79,10 мкл, 0,6560 ммоль), по краплям додавали розчин (2,200 мл) трифосфгену (32,30 мг, 0,1090 ммоль) в СН2СІ2 і суміш перемішували при -78°С протягом 2 г. Після перемішування, додавали піридин (106,2 мкл, 1,312 ммоль) і суміш нагрівали до кімнатної температури і перемішували протягом 0,5 г. Після перемішування, додавали насичений розчин NH4CI (15,00 мл) і суміш екстрагували СН2СІ2. Після промивання насиченим розчином NaHCO3 і розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концент рували одержуючи неочищений продукт (35,00 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=50:1:0,1-10:1:0,1) одержуючи ЕМ916 (25,00 мг, 73%) як білий порошок. ЕМ916 ВР-МС m/z:628,3697[M+H]+, Розраховано для C32H54NO11:628,3697[M+H] Приклад 18 Синтез 2'-O-ацетил-де(3-O-кладинозил)-9дигідро-3-кето-псевдоеритроміцин А 6,9-епоксид 12,13-карбонату (ЕМ917) В атмосфері N2, до розчину (782,0 мкл) ЕМ916 (24,50 мг, 0,0391 ммоль) в СН2СІ2 додавали перйодинан Десса-Мартіна (165,8 мг, 0,3910 ммоль) і суміш перемішували протягом 2 г. Після перемішування, додавали перйодинан Десса-Мартіна (165,8 мг, 0,3910 ммоль) і суміш перемішували протягом 41 г. Після перемішування, додавали насичений розчин Na2S2O3 (15,00 мл) і суміш екстрагували EtOAc. Після промивання насиченим розчином Na2S2O3, насиченим розчином NaHCO3 і розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (31,00 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=50:1:0,1) одержуючи ЕМ917 (19,50 мг, 80%) як білий порошок. ЕМ917 МС m/z:626[M+H]+ Приклад 19 Синтез де(3-O-кладинозил)-9-дигідро-3-кетопсевдоеритроміцин А 6,9-епоксид 12,13-карбонату (ЕМ918) 41 94065 42 Розчин (225,0 мкл) ЕМ917 (14,10 мг, 0,0225 ммоль) в МеОН нагрівали до 50°С і суміш перемішували протягом 30 г. Після перемішування, суміш концентрували одержуючи неочищений продукт (14,20 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=30:1:0,1) одержуючи ЕМ918 (12,20 мг, 92%) як білий порошок. ЕМ918 ВР-МС m/z:584,3452[M+H]+, Розраховано для C30H50NO10:584,3435[M+H] Приклад 20 Синтез де(3'-N-метил)-9-дигідро-3'-N-(птрифторметилбензил)-псевдоеритроміцин А 6,9епоксиду (ЕМ919) В атмосфері N2, до розчину (520,0 мкл) ЕМ901 (36,70 мг, 0,0522 ммоль) в СНСІ3 додавали i-Pr2NEt (45,50 мкл, 0,2610 ммоль) і n-CF3BnBr (птрифторметилбензилбромід: 62,40 мг, 0,2610 ммоль) і суміш перемішували при кімнатній температурі протягом 1 г. Після перемішування, додавали i-Pr2NEt (45,50 мкл, 0,2610 ммоль) і n-CF3BnBr (62,40 мг, 0,2610 ммоль) і суміш перемішували протягом 2 г. Після перемішування, додавали насичений розчин Na2S2O3 (10,00 мл) і суміш екстрагували СНСІ3. Після промивання насиченим розчином Na2S2O3, насиченим розчином NH4Cl і розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (50,00 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (СНСІ3:МеОН:МН4ОН вод=100:1:0,1) одержуючи ЕМ919 (33,30 мг, 74%) як білий порошок. ЕМ919 ВР-МС m/z:862,4966[M+H]+, Розраховано для C44H71NO12F3:862,4928[M+H] Приклад 21 Синтез де(3'-N-метил)-3'-N-(п-бромбензил)-9дигідро-псевдоеритроміцин А 6,9-епоксиду (ЕМ920) В атмосфері N2, до розчину (574,0 мкл) ЕМ901 (40,40 мг, 0,0574 ммоль) в СНСІ3 додавали i-Pr2NEt (50,00 мкл, 0,2870 ммоль) і п-ВrВnВr (пбромбензилбромід: 71,70 мг, 0,2870 ммоль) і суміш перемішували при кімнатній температурі протягом 1 г. Після перемішування, додавали i-Pr2NEt (50,00 мкл, 0,2870 ммоль) і п-ВrВnВr (71,70 мг, 0,2870 ммоль) і суміш перемішували при кімнатній температурі протягом 1 г. Після перемішування, додавали насичений розчин Na2S2O3 (50,00 мл) і суміш екстрагували СНСІ3. Після промивання насиченим розчином Na2S2O3, насиченим розчином NH4CI і розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (53,00 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,1) одержуючи ЕМ920 (33,30 мг, 67%) як білий порошок. ЕМ920 ВР-МС m/z:872,4158[M+H]+, Розраховано для C43H71NO12Br:872,4160[M+H] Приклад 22 Синтез де(3'-N-метил)-3'-N-(п-фторбензил)-9дигідро-псевдоеритроміцин А 6,9-епоксиду (ЕМ921) 43 94065 44 В атмосфері N2, до розчину (607,0 мкл) ЕМ901 (42,70 мг, 0,0607 ммоль) в СНСІ3 додавали i-Pr2NEt (53,00 мкл, 0,3040 ммоль) і п-FBnBr (пфторбензилбромід: 37,90 мкл, 0,3040 ммоль) і суміш перемішували при кімнатній температурі протягом 1 г. Після перемішування, додавали iPr2NEt (53,00 мкл, 0,3040 ммоль) і п-FBnBr (37,90 мкл, 0,3040 ммоль) і суміш перемішували при кімнатній температурі протягом 1,5 г. Після перемішування, додавали насичений розчин Na2S2O3 (40,00 мл) і суміш екстрагували СНСІ3. Після промивання насиченим розчином Na2S2O3, насиченим розчином NH4CI і розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (50,00 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,1) одержуючи ЕМ921 (42,40 мг, 86%) як білий порошок. ЕМ921 ВР-МС m/z:812,4985[M+H]+, Розраховано для C43H71FNO12:812,4960[M+H] Приклад 23 Синтез де(3'-N-метил)-3'-N-(о-хлорбензил)-9дигідро-псевдоеритроміцин А 6,9-епоксиду (ЕМ922) В атмосфері N2, до розчину (597,0 мкл) ЕМ901 (42,00 мг, 0,0597 ммоль) в СНСІ3 додавали i-Pr2NEt (77,50 мкл, 0,8960 ммоль) і о-СІВnВr (104,0 мкл, 0,5970 ммоль) і суміш перемішували при кімнатній температурі протягом 2 г. Після перемішування, додавали і-Pr2NEt (38,80 мкл, 0,2990 ммоль) і оСІВnВr (52,00 мкл, 0,2990 ммоль) і суміш перемішували при кімнатній температурі протягом 0,5 г. Після перемішування, додавали насичений розчин Na2S2O3 (40,00 мл) і суміш екстрагували СНСІ3. Після промивання насиченим розчином Na2S2O3, насиченим розчином NH4CI і розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (50,00 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,1) одержуючи ЕМ922 (48,60 мг, 98%) як білий порошок. ЕМ922 ВР-МС m/z:828,4646[M+H]+, Розраховано для C43H71CINO12:828,4665[M+H] Приклад 24 Синтез де(3'-N-метил)-3'-N-(м-хлорбензил)-9дигідро-псевдоеритроміцин А 6,9-епоксиду (ЕМ923) В атмосфері N2, до розчину (634,0 мкл) ЕМ901 (44,60 мг, 0,0634 ммоль) в СНСІ3 додавали i-Pr2NEt (55,20 мкл, 0,3170 ммоль) і м-СІВnВr (41,60 мкл, 0,3170 ммоль) і суміш перемішували при кімнатній 45 94065 46 температурі протягом 1 г. Після перемішування, додавали і-Pr2NEt (55,20 мкл, 0,3170 ммоль) і мСІВnВr (41,60 мкл, 0,3170 ммоль) і суміш перемішували при кімнатній температурі протягом 2 г. Після перемішування, додавали насичений розчин Na2S2O3 (40,00 мл) і суміш екстрагували СНСІ3. Після промивання насиченим розчином Na2S2O3, насиченим розчином NH4CI і розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (55,00 мг). Одержаний неочищений про дукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,1) одержуючи ЕМ923 (45,10 мг, 86%) як білий порошок. ЕМ923 ВР-МС m/z:828,4689[M+H]+ Розраховано для C43H71CINO12:828,4665[M+H] Приклад 25 Синтез де(3'-N-метил)-9-дигідро-3'-N-(пйодбензил)-псевдоеритроміцин А 6,9-епоксиду (ЕМ924) В атмосфері N2, до розчину (580,0 мкл) ЕМ901 (40,80 мг, 0,0580 ммоль) в СНСІ3 додавали i-Pr2NEt (50,50 мкл, 0,2900 ммоль) і п-ІВnВr (пйодбензилбромід: 86,10 мг, 0,2900 ммоль) і суміш перемішували при кімнатній температурі протягом 1 г. Після перемішування, додавали i-Pr2NEt (50,50 мкл, 0,2900 ммоль) і п-ІВnВr (86,10 мг, 0,2900 ммоль) і суміш перемішували при кімнатній температурі протягом 2 г. Після перемішування, додавали насичений розчин Na2S2O3 (40,00 мл) і суміш екстрагували СНСІ3. Після промивання насиченим розчином Na2S2O3, насиченим розчином NH4CI і розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (55,00 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,1) одержуючи ЕМ924 (48,20 мг, 90%) як білий порошок. ЕМ924 ВР-МС m/z:920,4011[M+H]+, Розраховано для C43H71NO12l:920,4021[M+H] Приклад 26 Синтез де(3'-N-метил)-3'-N-(п-хлорбензил)де(3-О-кладинозил)-9-дигідро-псевдоеритроміцин А 6,9-епоксиду (ЕМ925) В атмосфері N2, до розчину (689,0 мкл) ЕМ934 (37,60 мг, 0,0689 ммоль) одержаного в згаданому нижче Прикладі 35 в СНСІ3 додавали i-Pr2NEt (120,0 мкл, 0,6890 ммоль) і п-СІВnВr (141,6 мг, 0,6890 ммоль) і суміш перемішували при кімнатній температурі протягом 2 г. Після перемішування, додавали насичений розчин Na2S2O3 (40,00 мл) і суміш екстрагували СНСІ3. Після промивання насиченим розчином Na2S2O3, насиченим розчином NH4CI і розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (50,00 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,1) одержуючи ЕМ925 (33,00 мг, 72%) як білий порошок. ЕМ925 ВР-МС m/z:670,3705[M+H]+, Розраховано для C35H57CINO9:670,3722[M+H] Приклад 27 Синтез де(3-O-кладинозил)-де(3'диметиламіно)-3'-морфоліно-9-дигідропсевдоеритроміцин А 6,9-епоксиду (ЕМ926) 47 94065 48 До розчину (937,0 мкл) ЕМ914 (71,20 мг, 0,0937 ммоль) в CH3CN додавали 1.0N вод HCI (937,0 мкл) і суміш перемішували протягом 0,5 г. Після перемішування, додавали насичений розчин NaHCO3 (50,00 мл) і суміш екстрагували СНСІ3. Після промивання розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (60,00 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонко вої флеш хроматографії (СНСІ3:МеОН:NН4ОН вод=50:1:0,1-30:1:0,1) одержуючи ЕМ926 (25,30 мг, 44%) як білий порошок. ЕМ926 ВР-МС m/z:602,3884[M+H]+, Розраховано для C31H66NO10:602,3904[M+H] Приклад 28 Синтез 2'-О-(п-бромбензоїл)-9-дигідропсевдоеритроміцин А 6,9-епоксиду (ЕМ927) В атмосфері N2, до розчину (4,200 мл) ЕМ900 (100,8 мг, 0,1400 ммоль) в CH3CN додавали Et3N (58,30 мкл, 0,4200 ммоль) і n-BrBzCI (пбромбензоїлхлорид: 30,70 мг, 0,1400 ммоль) і суміш перемішували протягом 1,0 г. Після перемішування, додавали водний розчин NH3 (6,000 мл) і суміш концентрували одержуючи неочищений продукт (126,0 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=50:1:0,1-30:1:0,1) одержуючи ЕМ927 (107,4 мг, 85%) як білий порошок. ЕМ927 ВР-МС m/z:900,4091[M+H]+, Розраховано для C44H71NO13Br:900,4109[M+H] Приклад 29 Синтез біс-де(3'-N-метил)-3'-N-(п-хлорбензил)9-дигідро-псевдоеритроміцин А 6,9-епоксиду (ЕМ928) В атмосфері N2, розчин (1,440 мл) ЕМ903 (49,60 мг, 0,0719 ммоль) в 1,2-дихлоретані охолоджували до 0°С, додавали п-хлорбензальдегід (10,60 мг, 0,0755 ммоль), АсОН (6,180 мкл, 0,1080 ммоль) і NaBH(OAc)3 (22,90 мг, 0,1080 ммоль) і суміш перемішували при 0°С протягом 2,5 г, нагрівали до кімнатної температури і перемішували протягом 1 г. Після перемішування, додавали насичений розчин NaHCO3 (50,00 мл) і суміш екстрагували СНСІ3. Після промивання насиченим розчином NaHCO3 і розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (62,00 мг). Одержаний неочищений продукт відо 49 94065 50 кремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,1-10:1:0,1) одержуючи ЕМ928 (32,30 мг, 55%) як білий порошок. ЕМ928 ВР-МС m/z:814,4515[M+H]+, Розраховано для C42H69CINO12:814,4508[M+H] Приклад 30 Синтез де(3'-N-метил)-3'-N-пропаргіл-9дигідро-псевдоеритроміцин А 6,9-епоксиду (ЕМ929) До розчину (12,67 мл) ЕМ900 (909,3 мг, 1,267 ммоль) в МеОН додавали AcONa (519,7 мг, 6,335 ммоль), І2 (643,2 мг, 2,534 ммоль) і насичений розчин NaHCO3 і суміш перевіряли на основність використовуючи універсальний індикатор і перемішували при 50°С протягом 20 хв. Після перемішування, додавали Na2S2O3 (400,0 мг) і суміш охолоджували до кімнатної температури. Реакційну суміш екстрагували СНСІ3. Після промивання змішаним розчином розсолу і NH4OH, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт. В атмосфері N2, i-Pr2NEt (1,100 мл, 6,335 ммоль) і 3-бромпропін (471,9 мкл, 6,335 ммоль) додавали до розчину (12,67 мл) одержаного неочищеного продукту (892,0 мг, 1,267 ммоль) в СНСІ3 і суміш перемішували при кімнатній температурі протягом 1 г. Після перемішування, додавали i-Pr2NEt (1,100 мл, 6,335 ммоль) і 3бромпропін (471,9 мкл, 6,335 ммоль) і суміш пере мішували при кімнатній температурі протягом 12 г. Після перемішування, додавали насичений розчин Na2S2O3 (200,0 мл) і суміш екстрагували СНСІ3. Після промивання насиченим розчином Na2S2O3, насиченим розчином NH4CI і розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (940,2 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,1) одержуючи ЕМ929 (600,1 мг, 64%) як білий порошок. ЕМ929 + ВР-МС m/z:742,4730[M+H] , Розраховано для C39H68NO12:742,4742[M+H] Приклад 31 Синтез де(3'-N-метил)-2'-O-3'-Nбіс(бензилоксикарбоніл)-9-дигідропсевдоеритроміцин А 6,9-епоксиду (ЕМ930) До розчину (69,80 мл) ЕМ900 (5,004 г, 6,975 ммоль) в ЕtOАс додавали NaHCO3 (8,790 г, 104,6 ммоль), по краплям додавали CbzCI (бензилоксикарбонілхлорид: 14,93 мл, 104,6 ммоль) і суміш нагрівали до 70°С і перемішували протягом 2 г. Після перемішування, додавали Et3N і суміш охолоджували до кімнатної температури. Реакційну суміш екстрагували ЕtOАс. Після промивання розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (7,000 г). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=50:1:0,1) одержуючи ЕМ930 (6,365 г, 94%) як білий порошок. ЕМ930 ВР-МС m/z:994,5170[M+Na]+, Розраховано для C52H77NO16Na:994,5140[M+Na] Приклад 32 Синтез де(3'-N-метил)-2'-О-3'-Nбіс(бензилоксикарбоніл)-де(3-О-кладинозил)-9дигідро-псевдоеритроміцин А 6,9-епоксиду (ЕМ931) 51 94065 52 До розчину (104,6 мл) ЕМ930 (5,081 г, 5,230 ммоль) в CH3CN додавали 1.0N вод HCI (52,30 мл) і суміш перемішували протягом 4 г. Після перемішування, додавали насичений розчин NaHCO3 (400,0 мл) і суміш екстрагували СНСІ3. Після промивання розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (4,312 г). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хромато графії (CHCI3:MeOH:NH4OH вод=50:1:0,1) одержуючи ЕМ931 (4,028 г, 95%) як білий порошок. ЕМ931 ВР-МС m/z:814,4384[M+H]+, Розраховано для C44H64NO13:814,4378[M+H] Приклад 33 Синтез 2'-О-ацетил-де(3-О-кладинозил)-9дигідро-3-кето-де(3'-диметиламіно)-3'-морфолінопсевдоеритроміцин А 6,9-епоксид 12,13-карбонату (ЕМ932) В атмосфері N2, до розчину (4,560 мл) ЕМ948 (152,5 мг, 0,228 ммоль) одержаного в приведеному нижче Прикладі 48 в СН2СІ2 додавали перйодинан Десса-Мартіна (165,8 мг, 0,391 ммоль) і суміш перемішували протягом 2 г. Після перемішування, додавали насичений розчин Na2S2O3 (50,00 мл) і суміш екстрагували СНСІ3. Після промивання насиченим розчином Na2S2O3, насиченим розчином NaHCO3 і розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (160,0 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,1) одержуючи ЕМ932 (151,1 мг, 90%) як білий порошок. ЕМ932 ВР-МС m/z:668,3642[M+H]+, Розраховано для C34H54NO12:668,3646[M+H] Приклад 34 Синтез де(3'-N-метил)-3'-N-етил-9-дигідропсевдоеритроміцин А 6,9-епоксиду (ЕМ933) В атмосфері N2, до розчину (586,0 мкл) ЕМ901 (41,20 мг, 0,0586 ммоль) в CH3CN додавали iPr2NEt (102,1 мкл, 0,5860 ммоль) і брометан (43,70 мкл, 0,5860 ммоль) і суміш перемішували при кімнатній температурі протягом 22 г. Після перемішування, суміш нагрівали до 50°С і перемішували протягом 134 г. Крім того, додавали i-Pr2NEt (102,1 мкл, 0,5860 ммоль) і брометан (43,70 мкл, 0,5860 ммоль) і суміш перемішували при 50°С протягом 14 г. Після перемішування, додавали насичений розчин Na2S2O3 (40,00 мл) і суміш екстрагували СНСІ3. Після промивання насиченим розчином Na2S2O3, насиченим розчином NH4CI і розсолом, органічний шар сушили над Na2SO4. Залишок фі 53 94065 54 льтрували і фільтрат концентрували одержуючи неочищений продукт (50,00 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,1) одержуючи ЕМ933 (42,40 мг, 86%) як білий порошок. ЕМ933 ВР-МС m/z:732,4911[M+H]+, Розраховано для C38H70NO12:732,4898[M+H] Приклад 35 Синтез де(3-О-кладинозил)-де(3'-N-метил)-9дигідро-псевдоеритроміцин А 6,9-епоксиду (ЕМ934) В атмосфері N2, до ЕМ931 (108,4 мг, 0,1330 ммоль) додавали Pd(OH)2 (21,70 мг) і ЕtOН (2,660 мл) і суміш перемішували в атмосфері Н2 при кімнатній температурі протягом 1 г. Після перемішування, суміш фільтрували і фільтрат концентрували одержуючи неочищений продукт (150,1 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=30:1:0,1-10:1:0,1) одержуючи ЕМ934 (70,30 мг, 97%) як білий порошок. ЕМ934 ВР-МС m/z:546,3622[M+H]+, Розраховано для C28H54NO9:546,3642[M+H] Приклад 36 Синтез де(3-O-кладинозил)-9-дигідро-3-кетоде(3'-диметиламіно)-3'-морфолінопсевдоеритроміцин А 6,9-епоксид 12,13-карбонату (ЕМ935) Розчин (6,280 мл) ЕМ932 (104,6 мг, 0,157 ммоль) в МеОН нагрівали до 50°С і перемішували протягом 68 г. Після перемішування, суміш концентрували одержуючи неочищений продукт (101,2 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,1) одержуючи ЕМ935 (98,00 мг, 100%) як білий порошок. ЕМ935 ВР-МС m/z:626,3533[M+H]+, Розраховано для С32Н52NО11:626,3540[М+Н] Приклад 37 Синтез де(3'-N-метил)-2'-О-3'-Nбіс(бензилоксикарбоніл)-де(3-О-кладинозил)-9дигідро-псевдоеритроміцин А 6,9-епоксид 12,13карбонату (ЕМ936) В атмосфері N2, розчин (49,80 мл) ЕМ931 (2,027 г, 2,492 ммоль) в СН2СІ2 охолоджували до 78°С, додавали піридин (2,420 мл, 29,90 ммоль), по краплям додавали розчин (99,70 мл) трифосфгену (1,479 г, 4,984 ммоль) в СН2СІ2 і суміш нагрівали від -78°С до кімнатної температури і перемі 55 94065 56 шували протягом 0,5 г. Після перемішування, додавали насичений розчин NH4CI (400,0 мл) і суміш екстрагували СН2СІ2. Після промивання насиченим розчином NaHCO3 і розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (1,900 г). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,1) одержуючи ЕМ936 (1,882 г, 90%) як білий порошок. ЕМ936 ВР-МС m/z:862,4000[M+Na]+, Розраховано для C45H61NO14Na:862,3990[M+Na] Приклад 38 Синтез де(3'-N-метил)-2'-O-3'-Nбіс(бензилоксикарбоніл)-де(3-O-кладинозил)-9дигідро-3-кето-псевдоеритроміцин А6,9-епоксид 12,13-карбонату (ЕМ937) В атмосфері N2, до розчину (40,80 мл) ЕМ936 (1,718 г, 2,047 ммоль) в СН2СІ2 додавали перйодинан Десса-Мартіна (4,343 г, 10,24 ммоль) і суміш перемішували протягом 1,5 г. Після перемішування, додавали насичений розчин Na2S2O3 (300,0 мл) і суміш екстрагували СНСІ3. Після промивання насиченим розчином Na2S2O3, насиченим розчином NaHCO3 і розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (1,700 г). Одержаний неочищений продукт відо кремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=50:1:0,1) одержуючи ЕМ937 (1,668 г, 97%) як білий порошок. ЕМ937 ВР-МС m/z:838,4012[M+H]+, Розраховано для C45H60NO14:838,4014[M+H] Приклад 39 Синтез де(3-O-кладинозил)-9-дигідро-3-кетоде(3'-N-метил)-псевдоеритроміцин А 6,9-епоксид 12,13-карбонату (ЕМ938) В атмосфері N2, до ЕМ937(1,461 г, 1,745 ммоль) додавали Pd(OH)2 (292,2 мг) і EtOH (34,90 мл) і суміш перемішували в атмосфері Н2 при кімнатній температурі протягом З г. Після перемішування, в атмосфері N2 додавали Pd(OH)2 (292,2 мг) і суміш перемішували в атмосфері Н2 при кімнатній температурі протягом 2,5 г. Крім того, після перемішування, в атмосфері N2 додавали Pd(OH)2 (146,1 мг) і суміш перемішували в атмосфері Н2 при кімнатній температурі протягом 1 г. Суміш фільтрували і фільтрат концентрували одержуючи неочищений продукт (1,302 г). Одержаний неочи щений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=50:1:0,1-30:1:0,1) одержуючи ЕМ938 (967,3 мг, 97%) як білий порошок. ЕМ938 ВР-МС m/z:570,3307[M+H]+, Розраховано для C29H48NO10:570,3278[M+H] Приклад 40 Синтез де(3'-N-метил)-3'-N-(п-хлорбензил)де(3-0-кладинозил)-9-дигідро-3-кетопсевдоеритроміцин А 6,9-епоксид 12,13-карбонату (ЕМ939) 57 94065 58 До розчину (5,330 мл) ЕМ938 (303,4 мг, 0,533 ммоль) в СНСІ3 додавали i-Pr2NEt (928,4 мкл, 5,330 ммоль) і п-СІВnВr (1,095 г, 5,330 ммоль) і суміш перемішували в атмосфері N2 при кімнатній температурі протягом 2 г. Після перемішування, додавали насичений розчин Na2S2O3 (50,00 мл) і суміш екстрагували СНСІ3. Після промивання насиченим розчином Na2S2O3, насиченим розчином NH4CI і розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (350,1 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,1) одержуючи ЕМ939 (342,5 мг, 93%) як білий порошок. ЕМ939 ВР-МС m/z:694,3353[M+H]+, Розраховано для C36H53NO10CI:694,3358[M+H] Приклад 41 Синтез 9-дигідро-де(3'-N-метил)-3'-N-і-пропілпсевдоеритроміцин А 6,9-епоксиду (ЕМ940) В атмосфері N2, до розчину (564,0 мкл) ЕМ901 (39,70 мг, 0,0564 ммоль) в CH3CN додавали iPr2NEt (98,20 мкл, 0,5840 ммоль) і i-Prl (2йодпропан: 56,30 мкл, 0,5640 ммоль), і суміш перемішували при 50°С протягом 134 г. Після перемішування, додавали i-Pr2NEt (98,20 мкл, 0,5840 ммоль) і i-Prl (56,30 мкл, 0,5640 ммоль) і суміш перемішували при 50°С протягом 26,5 г. Крім того, додавали i-Pr2NEt (196,4 мкл, 1,128 ммоль) і i-Prl (112,6 мкл, 1,128 ммоль) і суміш перемішували при 50°С протягом 97,5 г. Після перемішування, додавали насичений розчин Na2S2O3 (30,00 мл) і суміш екстрагували СНСІ3. Після промивання насиченим розчином Na2S2O3, насиченим розчином NH4CI і розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (50,00 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,150:1:0,1) одержуючи ЕМ940 (16,10 мг, 38%) як білий порошок. ЕМ940 ВР-МС m/z:746,5043[M+H]+, Розраховано для C39H72NO12:746,5055[M+H] Приклад 42 Синтез де(3-О-кладинозил)-9-дигідро-біс-де(3'N-метил)-псевдоеритроміцин А 6,9-епоксиду (ЕМ941) Розчин (161,1 мл) Na (222,2 мг, 9,666 ммоль) в МеОН охолоджували до 0°С, в атмосфері N2 додавали ЕМ934 (878,6 мг, 1,611 ммоль) і І2 (2,044 г, 8,055 ммоль) і суміш перемішували при 0°С протягом 1 г. Після перемішування, додавали Na2S2O3 (6,000 г) і суміш нагрівали до кімнатної температури. Реакційну суміш екстрагували СНСІ3. Після промивання змішаним розчином розсолу і NH4OH, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи 59 94065 60 неочищений продукт (870,2 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=30:1:0,1-10:1:0,1) одержуючи ЕМ941 (549,7 мг, 64%) як білий порошок. ЕМ941 ВР-МС m/z:532,3509[M+H]+, Розраховано для C27H50NO9:532,3486[M+H] Приклад 43 Синтез де(3'-N-метил)-2'-O-3'-Nбіс(бензилоксикарбоніл)-де(3-O-кладинозил)-9дигідро-псевдоеритроміцин А 6,9-епоксид 12,13ізопропіліденацеталю (ЕМ942) До розчину (8,434 мл) ЕМ931 (686,5 мг, 0,843 ммоль) в DMF (диметилформамід) додавали PPTS (п-толуолсульфонат піридинію: 2,120 г, 8,434 ммоль), Ме2С(ОМе)2 (ацетондиметилацеталь: 5,497 мл, 44,70 ммоль) і суміш перемішували в атмосфері N2 при кімнатній температурі протягом 21 г. Після перемішування, додавали насичений розчин NaHCO3 (100,0 мл) і суміш екстрагували СНСІ3. Після промивання Н2О, органічний шар сушили над Na2SO4, залишок фільтрували і фільтрат концентрували. Концентрат розчиняли в гексан:AcOEt=1:1 і розчин промивали Н2О. Органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (700,2 мг). Одержаний неочищений продукт відокремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,1) одержуючи ЕМ942 (697,6 мг, 97%) як білий порошок. ЕМ942 ВР-МС m/z:876,4503[M+Na]+, Розраховано для C47H67NO13Na:876,4510[M+Na] Приклад 44 Синтез де(3'-N-метил)-2'-O-3'-Nбіс(бензилоксикарбоніл)-де(3-O-кладинозил)-9дигідро-3-кето-псевдоеритроміцин А 6,9-епоксид 12,13-ізопропіліденацеталю (ЕМ943) В атмосфері N2, до розчину (11,30 мл) ЕМ942 (482,6 мг, 0,565 ммоль) в СН2СІ2 додавали перйодинан Десса-Мартіна (479,3 мг, 1,130 ммоль) і суміш перемішували протягом 2 г. Після перемішування, додавали насичений розчин Na2S2O3 (100,0 мл) і суміш екстрагували СНСІ3. Після промивання насиченим розчином Na2S2O3, насиченим розчином NaHCO3 і розсолом, органічний шар сушили над Na2SO4. Залишок фільтрували і фільтрат концентрували одержуючи неочищений продукт (1,700 г). Одержаний неочищений продукт відо кремлювали і очищали за допомогою колонкової флеш хроматографії (CHCI3:MeOH:NH4OH вод=100:1:0,1) одержуючи ЕМ943 (480,0 мг, 100%) як білий порошок. ЕМ943 ВР-МС m/z:874,4383[M+Na]+, Розраховано для C47H65NO13Na:874,4354[M+Na] Приклад 45 Синтез де(3-О-кладинозил)-9-дигідро-3-кетоде(3'-N-метил)-псевдоеритроміцин А 6,9-епоксид 12,13-ізопропіліденацеталю (ЕМ944)
ДивитисяДодаткова інформація
Назва патенту англійськоюDihydropseudoerythromycin derivatives
Автори англійськоюOmura Satoshi, Sunazuka Toshiaki, Nagai Kenichiro, Shima Hideaki, Yamabe Haruko
Назва патенту російськоюПроизводные дигидропсевдоэритромицина
Автори російськоюОмура Сатоши, Суназука Тошияки, Нагаи Кеничиро, Шима Хидеаки, Ямабе Харуко
МПК / Мітки
МПК: A61P 1/04, A61K 31/7048, C07H 17/08, A61P 29/00
Мітки: похідні, дигідропсевдоеритроміцину
Код посилання
<a href="https://ua.patents.su/41-94065-pokhidni-digidropsevdoeritromicinu.html" target="_blank" rel="follow" title="База патентів України">Похідні дигідропсевдоеритроміцину</a>
Попередній патент: Суттєво одночасні сповіщення і їх використання у переривчастих конкурсах
Наступний патент: Призначення шаблона контрольного сигналу, адаптоване до характеристик каналу для системи зв’язку множинного доступу з ортогональним частотним розділенням
Випадковий патент: Спосіб прогнозування зриву адаптаційних можливостей імунної та метаболічної систем спортсменів, які займаються бодібілдингом