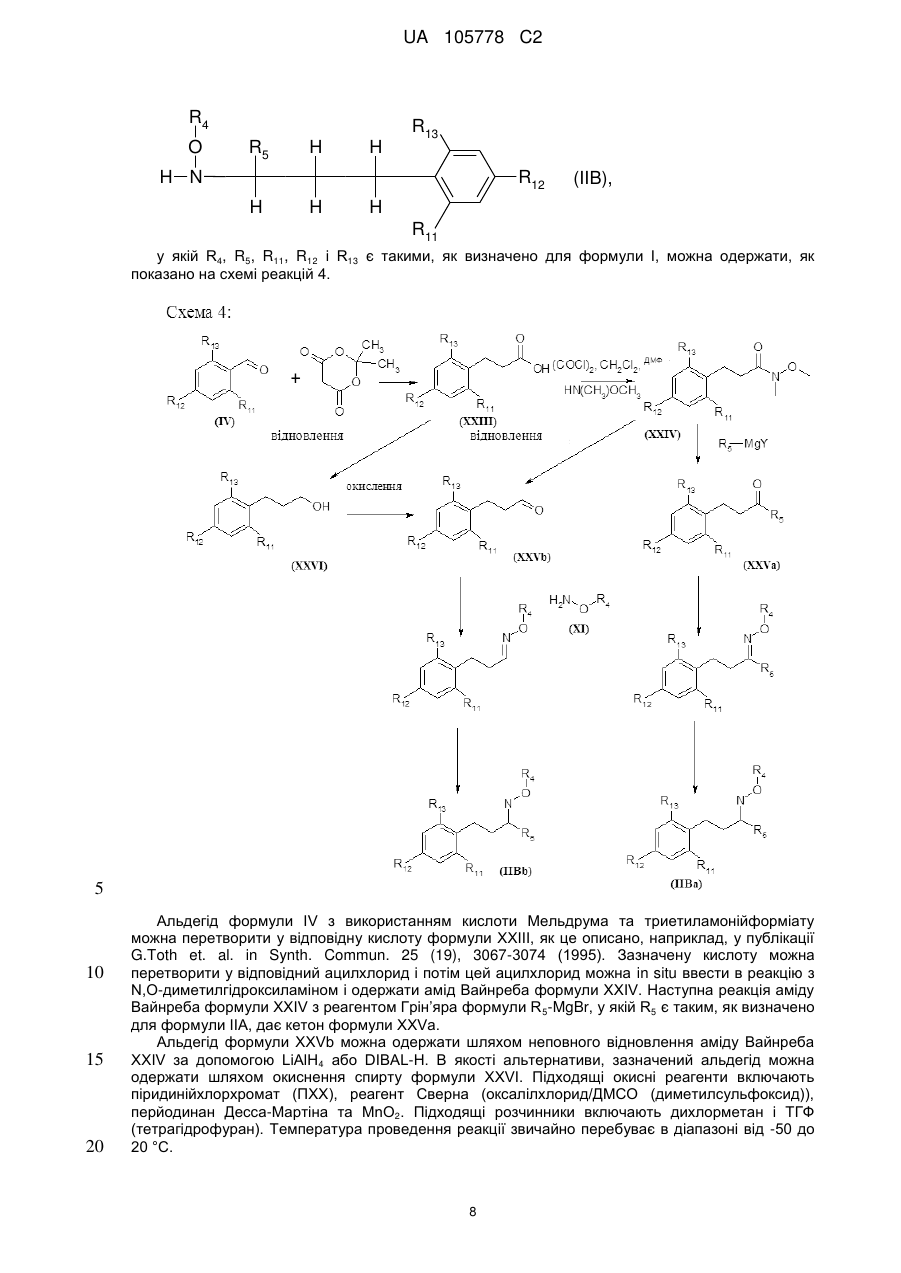
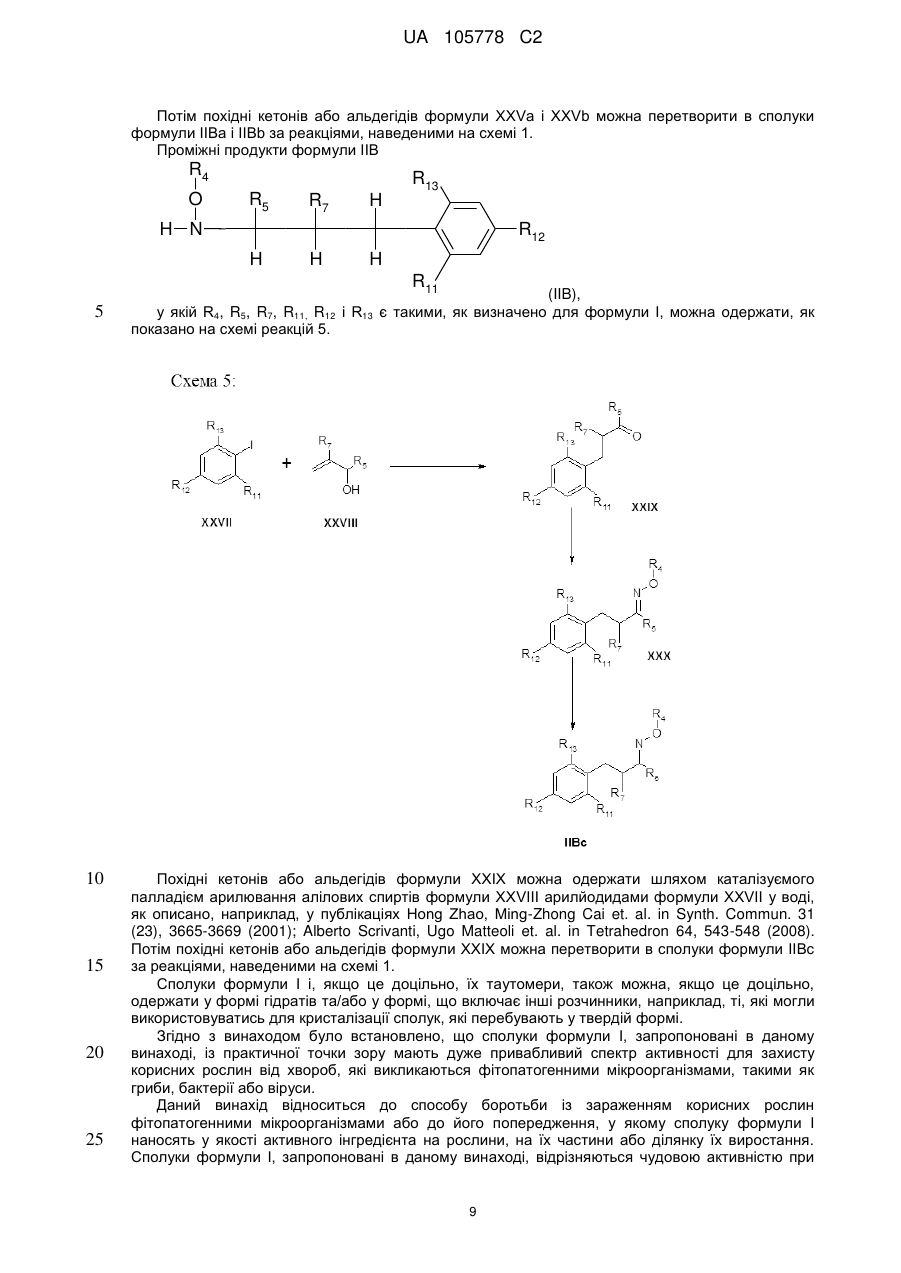
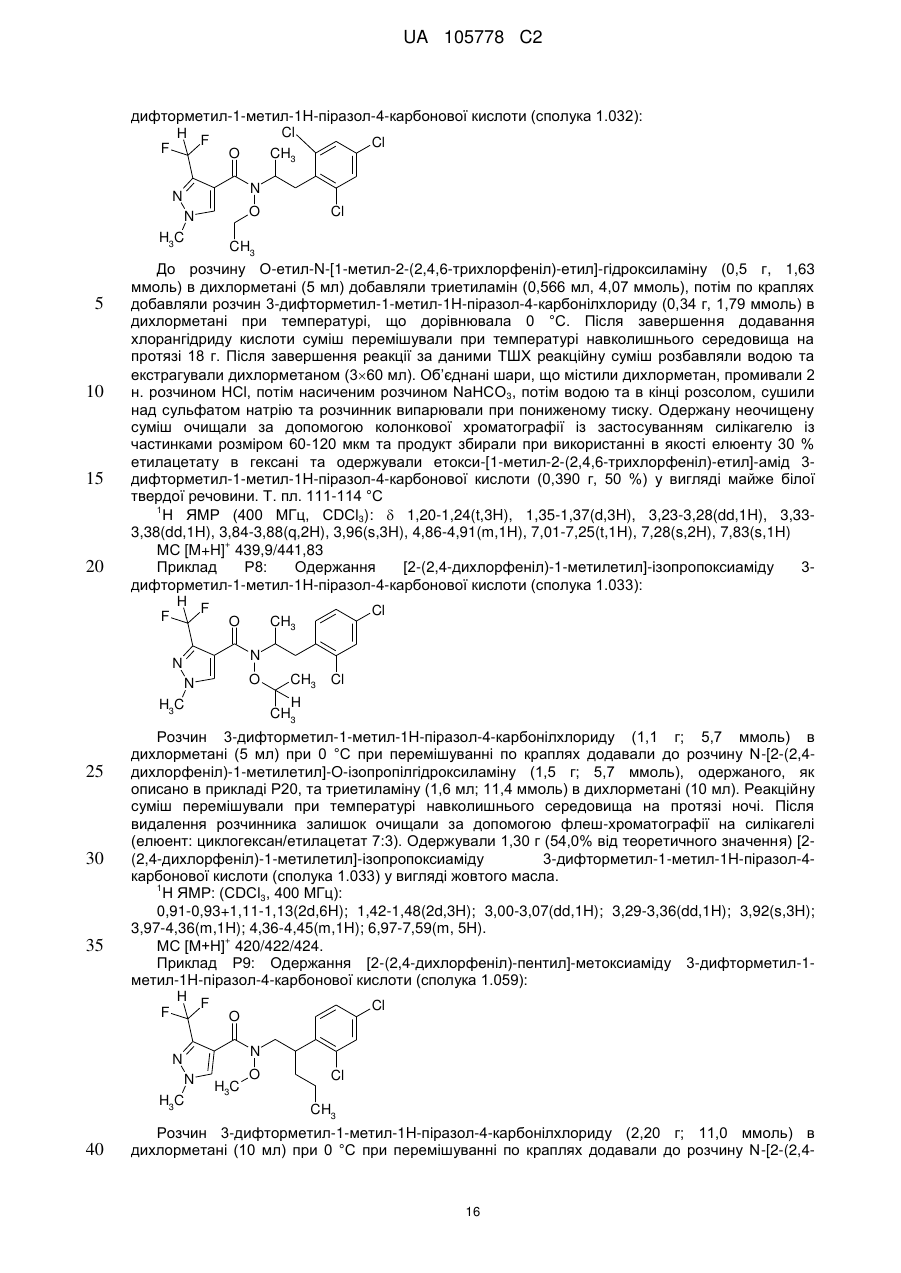
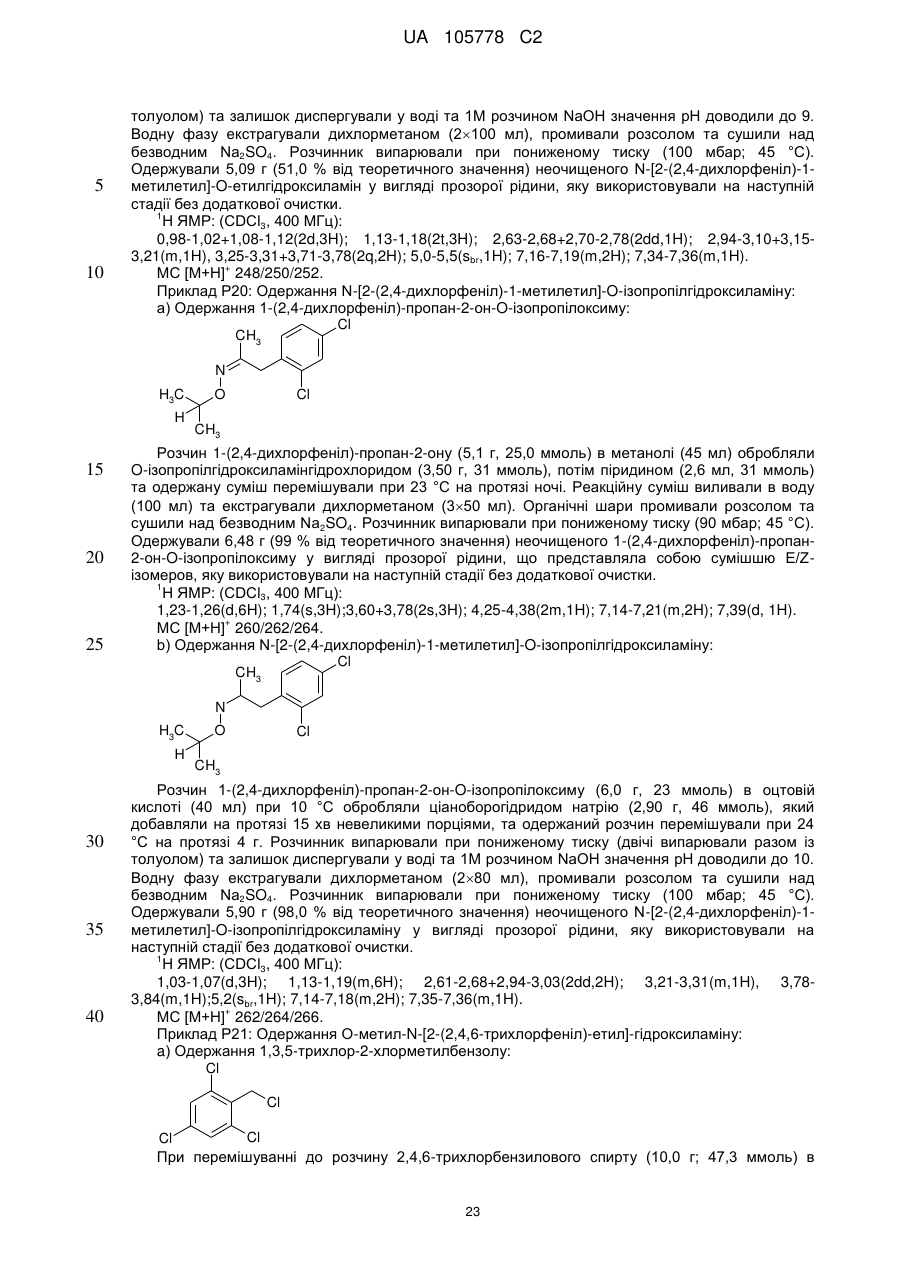
Піразол-4-n-алкоксикарбоксаміди як мікробіоциди, композиція, що їх містить, та спосіб боротьби із зараженням корисних рослин фітопагенними мікроорганізмами або його попередження з їх використанням
Формула / Реферат
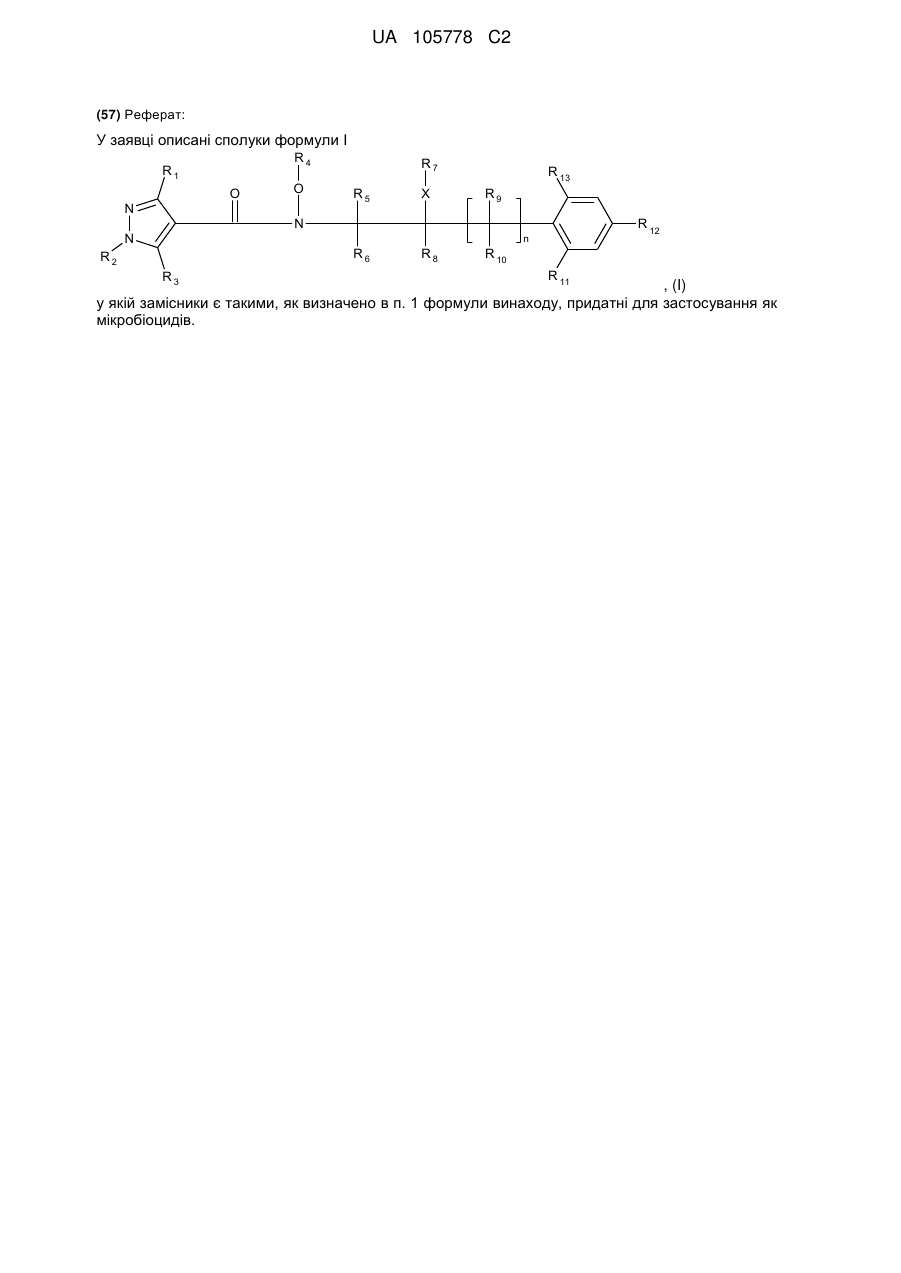
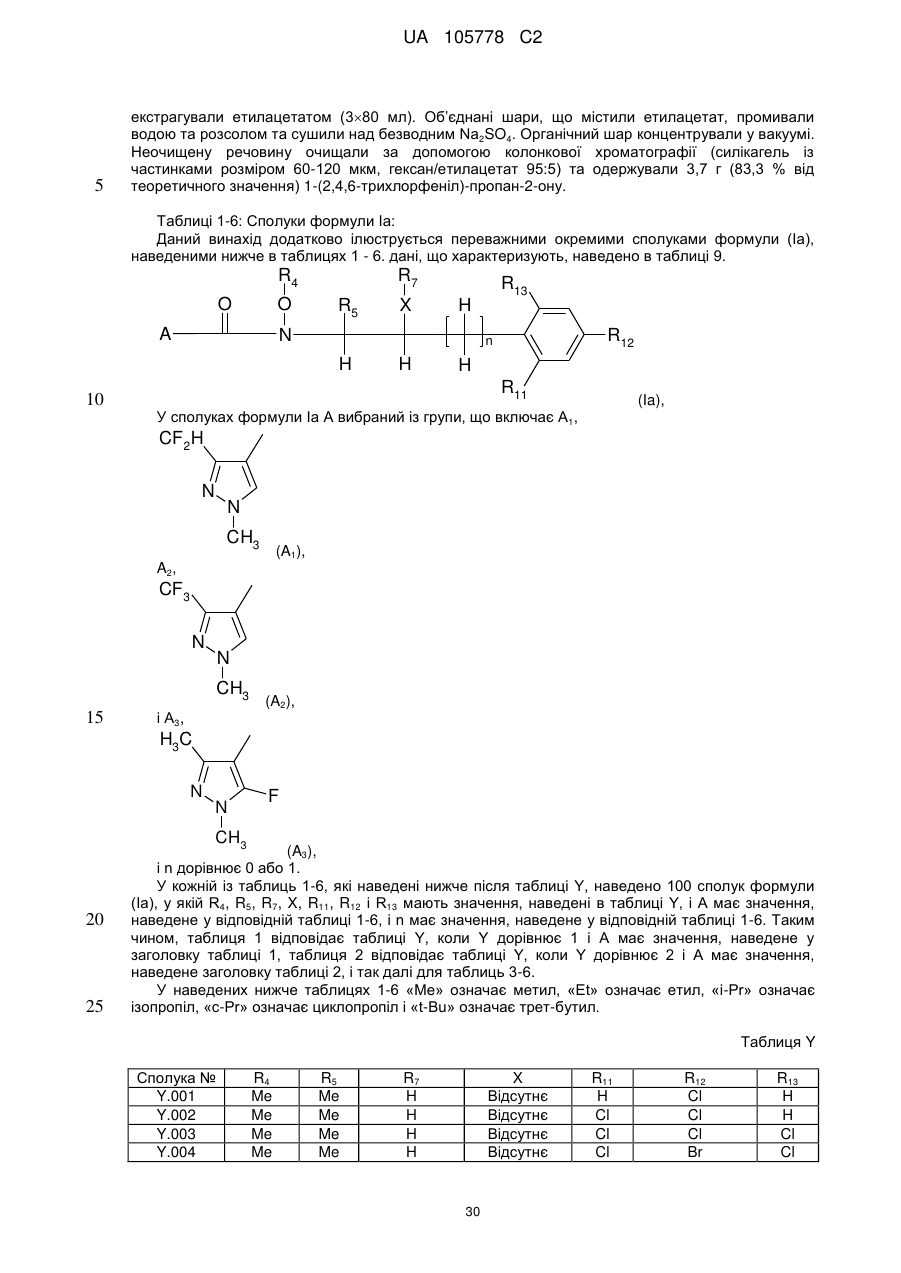
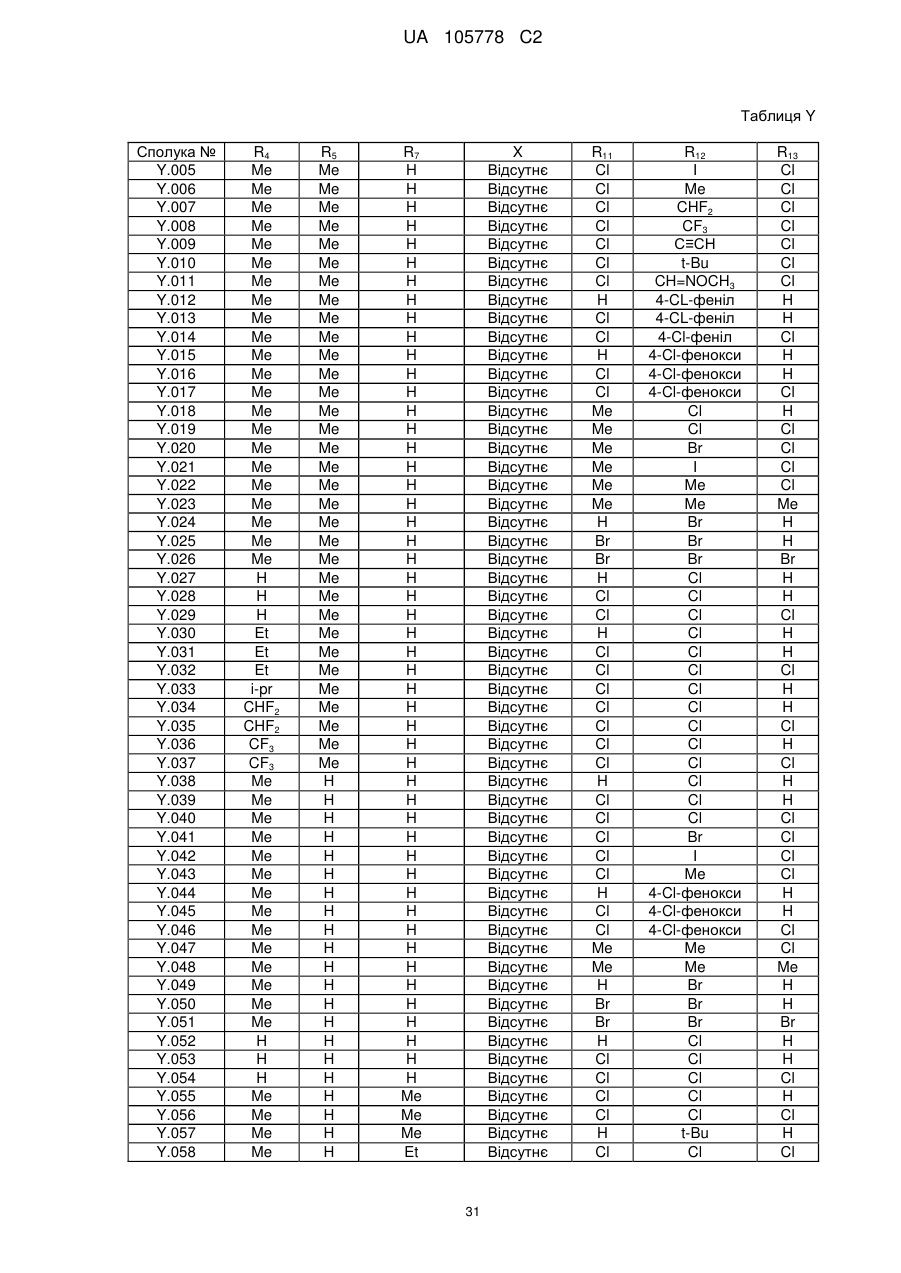
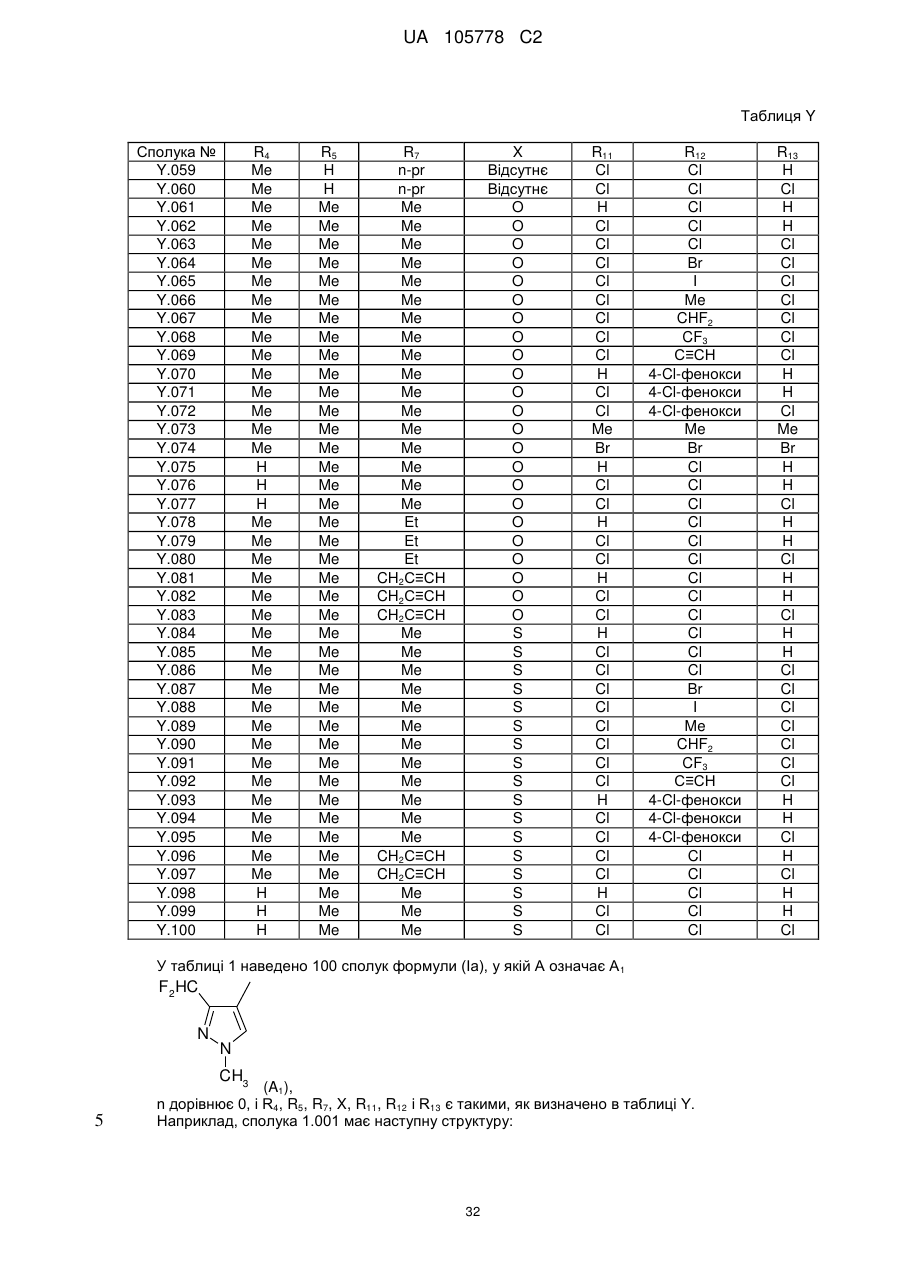
1. Сполука формули І
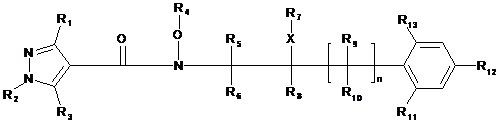 , (I)
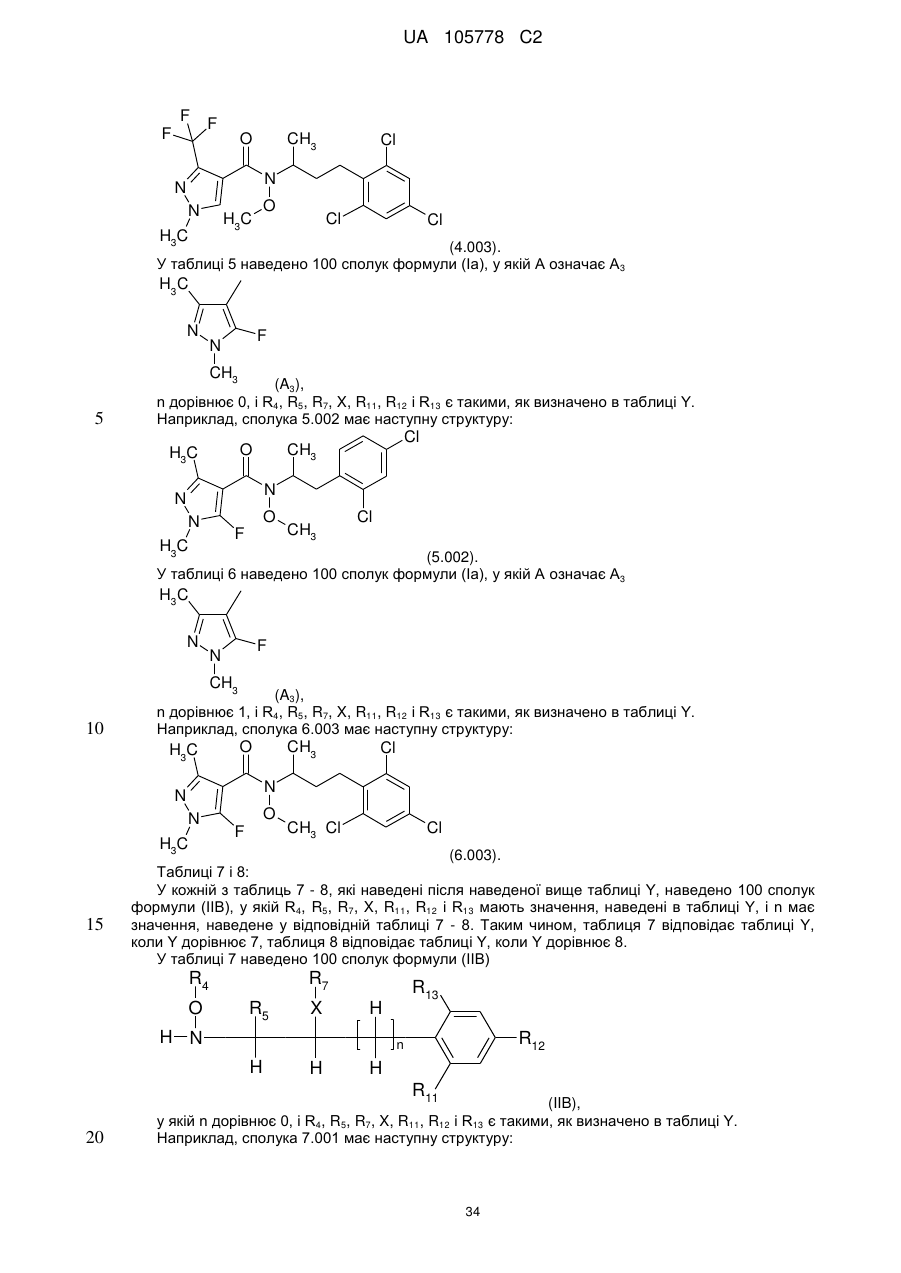
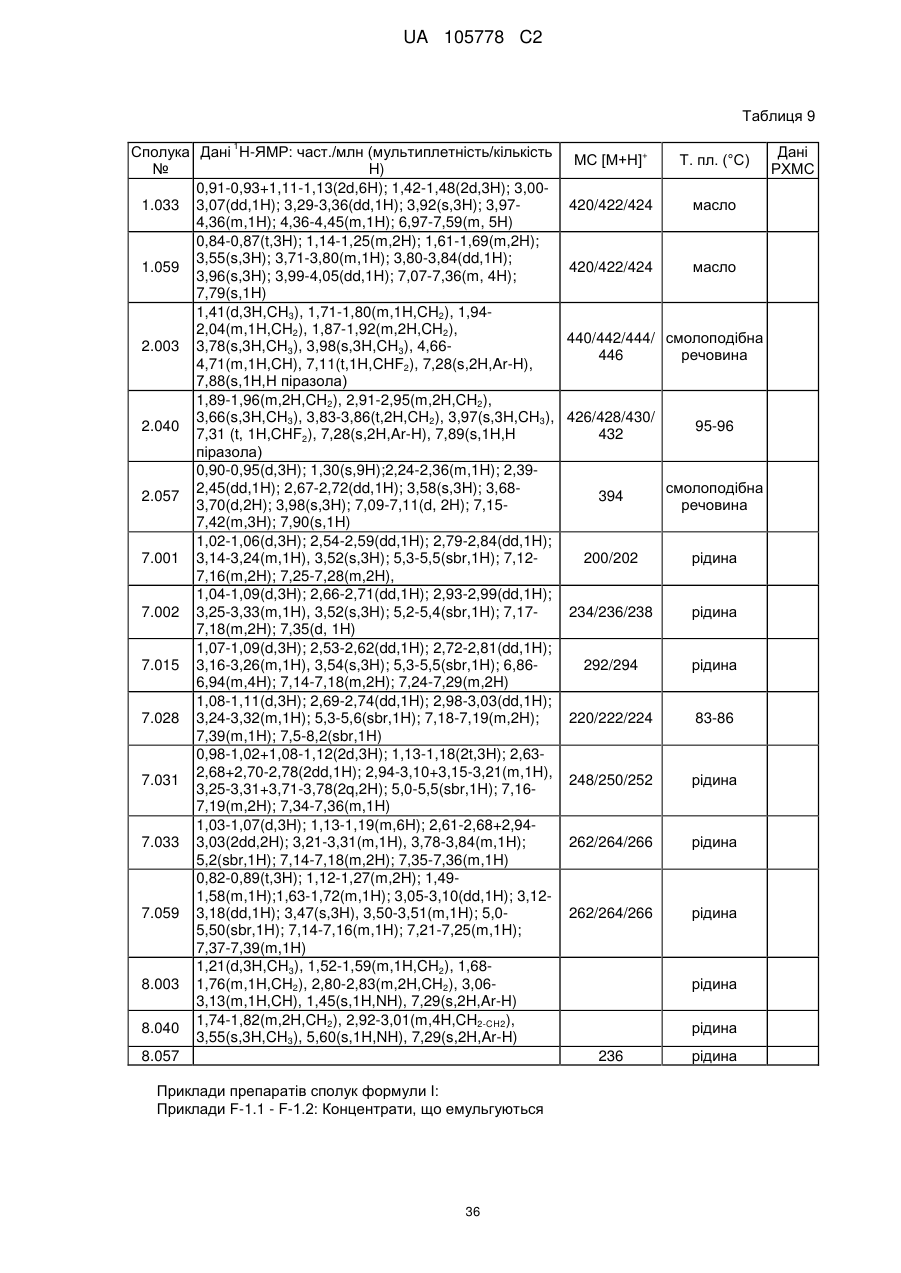
, (I)
у якій
R1 означає С1-С4-алкіл або С1-С4-галогеналкіл;
R2 означає С1-С4-алкіл;
R3 означає водень або галоген;
R4 означає водень, С1-С4-алкіл або С1-С4-галогеналкіл;
R5, R6, R8, R9 і R10 незалежно один від одного означають водень, галоген, С1-С4-алкіл або С1-С4-галогеналкіл;
R7 означає водень, галоген, С1-С4-алкіл, С2-С6-алкеніл або С3-С6-алкініл;
R11 означає водень, галоген або С1-С6-алкіл;
R12 означає водень, галоген, С1-С6-алкіл, С2-С6-алкеніл, С3-С6-алкініл, С3-С6-циклоалкіл-С3-С6-алкініл, галогенфеноксигрупу, галогенфеніл-С3-С6-алкініл, C(C1-C4-алкіл)=NО-С1-С4-алкіл, С1-С6-галогеналкіл, С1-С6-галогеналкоксигрупу, С2-С6-галогеналкеніл або С2-С6-галогеналкенілоксигрупу;
R13 означає водень, галоген, С1-С6-алкіл;
X означає кисень, сірку або є відсутнім; за умови, що R7 відрізняється від галогену, якщо X означає кисень або сірку;
n дорівнює 0 або 1;
та її агрономічно прийнятні солі.
2. Сполука за п. 1, у якій R1 означає дифторметил, трифторметил або метил.
3. Сполука за п. 1, у якій R2 означає метил.
4. Сполука за п. 1, у якій R3 означає водень або фтор.
5. Сполука за п. 1, у якій R4 означає водень, метил або етил.
6. Сполука за п. 1, у якій R4 означає метил.
7. Сполука за п. 1, у якій R5 означає водень або метил.
8. Сполука за п. 1, у якій n дорівнює 0.
9. Сполука за п. 1, у якій X означає кисень.
10. Сполука за п. 1, у якій R8, R9 і R10 означають водень.
11. Сполука за п. 1, у якій R11, R12 і R13 означають водень або хлор.
12. Сполука за п. 1, у якій R12 означає хлор або С1-С4-алкіл.
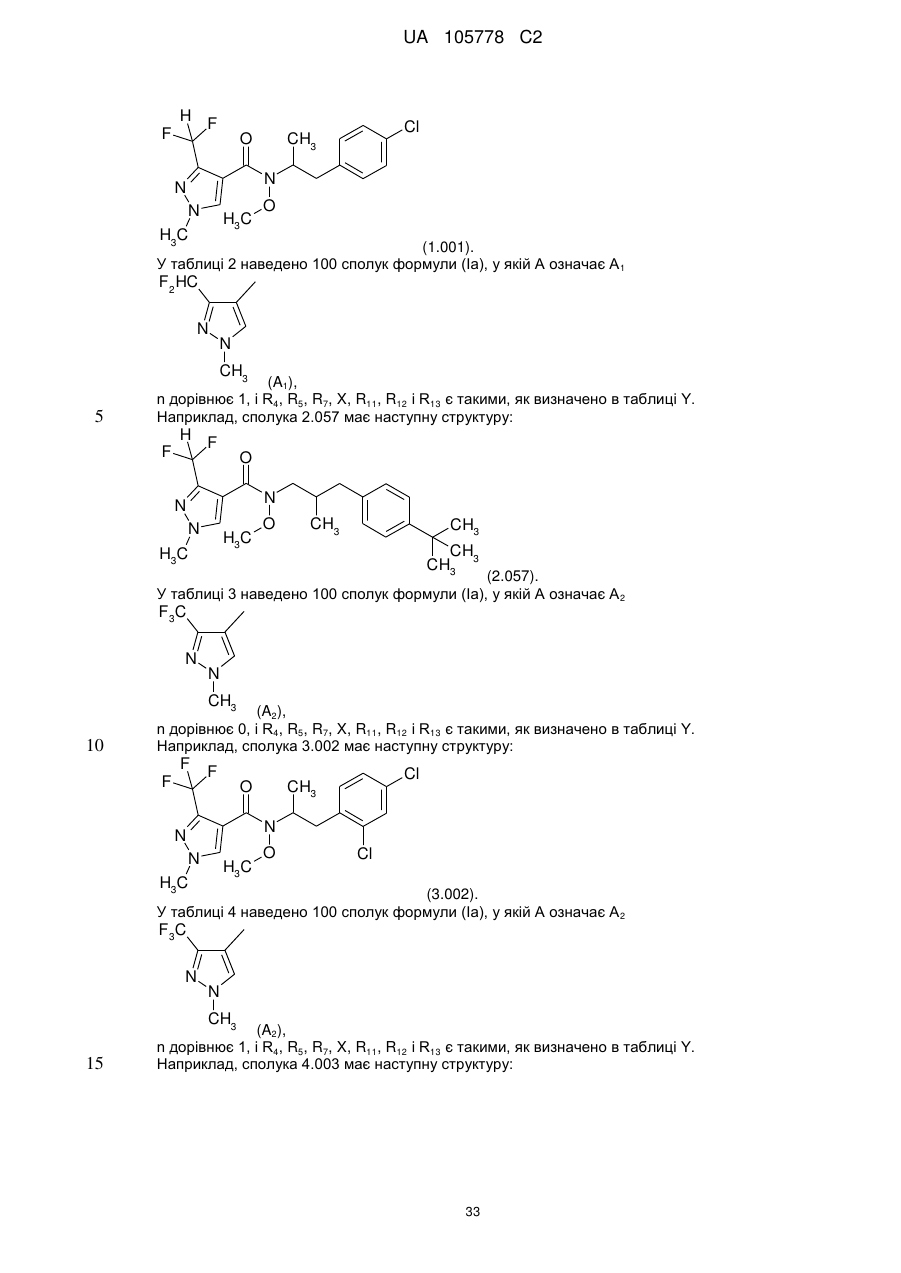
13. Сполука за п. 1, яка являє собою метокси[1-метил-2-(2,4,6-трихлорфеніл)етил]амід 3-дифторметил-1-метил-1Н-піразол-4-карбонової кислоти.
14. Спосіб боротьби із зараженням корисних рослин фітопатогенними мікроорганізмами або його попередження, у якому сполуку формули І за п. 1 або композицію, що містить цю сполуку як активний інгредієнт, наносять на рослини, на їх частини або ділянку їх росту.
15. Композиція, призначена для боротьби із зараженням фітопатогенними мікроорганізмами та для захисту від нього, що містить сполуку формули І за п. 1 та інертний носій.
Текст
Реферат: У заявці описані сполуки формули І R4 R1 O N O R7 R5 X R 13 R9 N N R 12 n R6 R2 R3 R8 R 10 R 11 , (I) у якій замісники є такими, як визначено в п. 1 формули винаходу, придатні для застосування як мікробіоцидів. UA 105778 C2 5 Даний винахід відноситься до нових мікробіоцидно активних, зокрема, фунгіцидно активних карбоксамідів. Даний винахід також відноситься до проміжних продуктів, що використовуються при одержанні цих сполук, до композицій, які містять ці сполуки, і до їх застосування в сільському господарстві або садівництві для боротьби із зараженням рослин фітопатогенними мікроорганізмами, переважно грибами, або для його попередження. Фунгіцидно активні карбоксаміди описані в EP 1787981 і EP 1792901. Згідно з винаходом встановлено, що нові карбоксаміди, що містять певну комбінацію замісників, мають мікробіоцидну активність. Таким чином, цей винахід відноситься до N-алкоксикарбоксамідів формули I R4 R1 O N 10 15 20 25 30 35 40 45 50 R5 X R13 R9 N N R2 O R7 R12 n R6 R8 R3 R10 R11 (I), у якій R1 означає C1-С4-алкіл або C1-С4-галогеналкіл; R2 означає C1-С4-алкіл; R3 означає водень або галоген; R4 означає водень, C1-С4-алкіл або C1-С4-галогеналкіл; R5, R6, R8, R9 і R10 незалежно один від одного означають водень, галоген, C1-С4-алкіл або C1С4-галогеналкіл; R7 означає водень, галоген, C1-С4-алкіл, C2-С6-алкеніл або C3-С6-алкініл; R11 означає водень, галоген або C1-С6-алкіл; R12 означає водень, галоген, C1-С6-алкіл, C2-С6-алкеніл, C3-С6-алкініл, C3-C6-циклоалкіл-C3C6-алкініл, галогенфеноксигрупу, галогенфеніл-C3-С6-алкініл, C(C1-C4-алкіл)=NO-C1-C4-алкіл, C1С6-галогеналкіл, C1-С6-галогеналкоксигрупу, C2-С6-галогеналкеніл або C2-С6галогеналкенілоксигрупу; R13 означає водень, галоген, C1-С6-алкіл; X означає кисень, сірку або є відсутнім; за умови, що R 7 відрізняється від галогену, якщо X означає кисень, сірку; та n дорівнює 0 або 1; і до агрономічно прийнятних солей /ізомерів /структурних ізомерів /стереоізомерів /діастереоізомерів /енантіомерів /таутомерів та N-оксидів цих сполук. Алкільні групи, що містяться у визначеннях замісників, можуть мати лінійний або розгалужений ланцюгом і представляють собою, наприклад, метил, етил, н-пропіл, н-бутил, нпентил, н-гексил, ізопропіл, н-бутил, втор-бутил, ізобутил або трет-бутил. Алкоксильні, алкенільні та алкінільні радикали утворені із зазначених алкільних радикалів. Алкенільні та алкінільні групи можуть бути моно- або диненасиченими. Циклоалкільні групи, що містяться у визначеннях замісників, представляють собою, наприклад, циклопропіл, циклобутил, циклопентил або циклогексил. Галоген звичайно означає фтор, хлор, бром або йод, переважно фтор, бром або хлор. Це також відноситься до комбінацій галогену з іншими значеннями, таким як галогеналкіл або галогеналкоксигрупа. Галогеналкільні групи переважно містять від 1 до 4 атомів вуглецю у ланцюзі. Галогеналкіл представляє собою, наприклад, фторметил, дифторметил, трифторметил, хлорметил, дихлорметил, трихлорметил, 2,2,2-трифторетил, 2фторетил, 2-хлоретил, пентафторетил, 1,1-дифтор-2,2,2-трихлоретил, 2,2,3,3-тетрафторетил та 2,2,2-трихлоретил; переважно трихлорметил, дифторхлорметил, дифторметил, трифторметил і дихлорфторметил. Алкоксигрупа представляє собою, наприклад, метоксигрупу, етоксигрупу, пропоксигрупу, ізопропоксигрупу, н-бутоксигрупу, ізобутоксигрупу, втор-бутоксигрупу та третбутоксигрупу; переважно метоксигрупу та етоксигрупу. Галогеналкоксигрупа представляє собою, наприклад, фторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу, 2,2,2трифторетоксигрупу, 1,1,2,2-тетрафторетоксигрупу, 2-фторетоксигрупу, 2-хлоретоксигрупу, 2,2дифторетоксигрупу та 2,2,2-трихлоретоксигрупу; переважно дифторметоксигрупу, 2хлоретоксигрупу; переважно дифторметоксигрупу, 2-хлоретоксигрупу та трифторметоксигрупу. В переважних сполуках формули I незалежно один від одного: a) R1 означає дифторметил, трифторметил або метил, b) R2 означає метил; c) R3 означає водень або фтор; 1 UA 105778 C2 5 10 15 20 d) R4 означає водень, метил або етил; e) R4 означає метил; f) R5 означає водень або метил; g) n дорівнює 0; h) X означає кисень; i) R8, R9 і R10 означають водень; j) R11, R12 і R13 означає водень або хлор; k) R12 означає хлор або C1-С 4-алкіл; l) R6 означає водень і m) R7 означає метил. Особливо переважними сполуками формули I є такі, у яких R1 означає дифторметил або трифторметил; R2 означає метил; R3 означає водень; R4 означає метил; R11, R12 і R13 незалежно один від одного означають водень або галоген, переважно водень або хлор. Іншими переважними сполуками формули I є такі, у яких X означає кисень та одночасно R7 означає C1-С4-алкіл, переважно метил; або X є відсутнім і R7 означає водень. Сполуки формули I можна одержати за реакцією сполуки формули II R4 R7 O R5 X R13 R9 H N R12 n R6 R8 R10 R11 (II), у якій R4, R5, R6, R7, X, R8, R9, R10, n, R11, R12 і R13 є такими, як визначено для формули I; зі сполукою формули III O R* R1 N 25 30 35 40 45 N R3 R2 (III), у якій R1, R2 і R3 є такими, як визначено для формули I, і R* означає галоген, гідроксигрупу або C1-С6-алкоксигрупу, переважно хлор. Реакції, що приводять для одержання сполук формули I, переважно проводять в апротонових інертних органічних розчинниках. Такими розчинниками є вуглеводні, такі як бензол, толуол, ксилол або циклогексан, хлоровані вуглеводні, такі як дихлорметан, трихлорметан, тетрахлорметан або хлорбензол, прості ефіри, такі як діетиловий ефір, диметиловий ефір етиленгліколю, диметиловий ефір діетиленгліколю, тетрагідрофуран або діоксан, нітрили, такі як ацетонітрил або пропіонітрил, аміди, такі як N,N-диметилформамід, діетилформамід або N-метилпірролідинон. Температура проведення реакції переважно становить від -20 до +120 °C. Звичайно реакції є трохи екзотермічними і, як правило, їх можна проводити при температурі навколишнього середовища. Для скорочення тривалості проведення реакції або для ініціювання реакції суміш можна короткочасно нагріти до температури кипіння реакційної суміші. Тривалість проведення реакції також можна скоротити шляхом додавання декількох крапель основи, у якості каталізатора реакції. Підходящими основами є, зокрема, третинні аміни, такі як триметиламін, триетиламін, хінуклідин, 1,4діазабіцикло[2.2.2]октан, 1,5-діазабіцикло[4.3.0]нон-5-ен або 1,5-діазабіцикло[5.4.0]ундец-7-ен. Однак у якості основ також можна використовувати неорганічні основи, такі як гідриди, наприклад, гідрид натрію або гідрид кальцію, гідроксиди, наприклад, гідроксид натрію або гідроксид калію, карбонати, такі як карбонат натрію та карбонат калію, або гідрокарбонати, такі як гідрокарбонат калію та гідрокарбонат натрію. Основи можна використовувати в чистому виді 2 UA 105778 C2 5 або з додаванням каталітичних кількостей міжфазового каталізатора, наприклад, краун-ефіру, зокрема 18-краун-6, або солі тетраалкіламонію. Якщо R* означає гідроксигрупу, то можна використовувати реагент сполучення, такий як бензотриазол-1-ілокситріс(диметиламіно)фосфонійгексафторфосфат, хлорангідрид біс-(2-оксо3-оксазолідиніл)-фосфінової кислоти (BOP-Cl), N,N’-дициклогексилкарбодиімід (ДЦК) або 1,1’карбонілдиімідазол (КДІ). Проміжні продукти формули II R4 O R7 R5 X R13 R9 H N R12 n R6 R8 R10 R11 10 15 20 25 (II), у якій R4, R5, R6, R7, X, R8, R9, R10, n, R11, R12 і R13 є такими, як визначено для формули I, у якій R4 переважно означає C1-С4-алкіл; при цьому є новими та розроблені спеціально для одержання сполук формули I. Відповідно до цього, такі проміжні продукти формули II також є частиною об'єкту даного винаходу. Переважні визначення замісників для сполук формули I також відносяться до сполуки формули II. Таким чином, переважними сполуками формули II є такі, у яких, незалежно один від одного: a) R4 означає водень, метил або етил; особливо переважно метил; b) R5 означає водень або метил; c) n дорівнює 0; d) X означає кисень; e) R8, R9 і R10 означають водень; f) R11, R12 і R13 означає водень або хлор; g) R12 означає хлор або C1-С4-алкіл; h) R6 означає водень і i) R7 означає метил. Проміжні продукти формули IIA R4 O R7 R5 R13 X H N R12 H H R11 (IIA), у якій R4, R5, X, R7, R11, R12 і R13 є такими, як визначено для формули I можна одержати, як показано на схемі реакцій 1. 3 UA 105778 C2 5 10 15 20 Нітроалкени формули VI, у якій R5, R11, R12 і R13 є такими, як визначено для формули IIA, можна одержати за реакцією Генрі (нітроальдольна реакція) нітроалкана формули V, у якій R5 є таким, як визначено для формули IIA, з карбонільною сполукою формули (IV), у якій R 11, R12 і R13 є такими, як визначено для формули IIA, в присутності оцтової кислоти та ацетату амонію при температурі від температури навколишнього середовища до температури кипіння реакційної суміші. Приєднання по Міхаелю сполуки формули VIIa, у якій R 7 і X є такими, як визначено для формули I, і M означає Li, Na, K або водень, до нітроалкенів формули Vl можна провести з використанням алкоголятів лужних металів, переважно солей натрію калію та літію у відповідному спирті, тіолі, толуолі або ефірному розчиннику, такому як діетиловий ефір, диметиловий ефір етиленгліколю, диметиловий ефір діетиленгліколю, тетрагідрофуран або діоксан, і одержати нітроалкани формули VIII, у якій R5, R7, R11, R12 і R13 є такими, як визначено для формули IIA. Нітроалкени формули VI, у якій R5, R11, R12 і R13 є такими, як визначено для формули IIA, можна відновити з використанням заліза та хлористоводневої кислоти та одержати оксими формули IX, у якій R5, R11, R12 і R13 є такими, як визначено для формули IIA. Зазначені оксими можна гідролізувати із одержанням кетонів формули Xa, у якій R 5, R11, R12 і R13 є такими, як визначено для формули IIA, як це описано, наприклад, у публікації M. Kulka and H. Hibbert J. Am. Chem. Soc. 65, 1180 (1943) і в публікації Prasun K. Pradhan et al. Synthetic Commun., 35, 913922, 2005. Реакцію проводять при температурах від 40 до 100 °С у підходящому органічному розчиннику, такому як метанол, етанол, трет-бутанол, трифторетанол або діоксан. Алкілування кетонів формули Xa з використанням сполуки формули R 7-Y, у якій R7 є таким, 4 UA 105778 C2 5 10 15 20 25 30 35 40 45 як визначено для формули IIA, і Y означає групу, що від’єднується, таку як галогенідна, мезилатна або тозилатна, у присутності основи дає -алкілований кетон формули Xb, у якій R5, R7, R11, R12 і R13 є такими, як визначено для формули IIA. Реакцію алкілування переважно проводять в апротонових інертних органічних розчинниках. Такими розчинниками є вуглеводні, такі як бензол, толуол, ксилол або циклогексан, прості ефіри, такі як діетиловий ефір, диметиловий ефір етиленгліколю, диметиловий ефір діетиленгліколю, тетрагідрофуран або діоксан, аміди, такі як N,N-диметилформамід, діетилформамід або N-метилпірролідинон. Температура проведення реакції переважно становить від -20 до +120 °C. Підходящими основами є, неорганічні основи, такі як гідриди, наприклад, гідрид натрію або гідрид кальцію, гідроксиди, наприклад, гідроксид натрію або гідроксид калію, у якості основ також можна використовувати карбонати, такі як карбонат натрію та карбонат калію, або гідрокарбонати, такі як гідрокарбонат калію та гідрокарбонат натрію. Основи можна використовувати в чистому виді або з додаванням каталітичних кількостей міжфазового каталізатора, наприклад, краун-ефіру, зокрема 18-краун-6, або солі тетраалкіламонію. Похідні О-алкоксиоксиму формули XIIa, XIIb можна одержати шляхом оксимування кетонів формули Xa і Xb з використанням похідних О-алкілгідроксиламіну O-алкілгідроксиламіну формули XI або їх солей. Розчинниками, що підходять для проведення стадії оксимування, є вуглеводні, такі як бензол, толуол, ксилол або циклогексан, хлоровані вуглеводні, такі як дихлорметан, трихлорметан, тетрахлорметан або хлорбензол, прості ефіри, такі як діетиловий ефір, диметиловий ефір етиленгліколю, диметиловий ефір діетиленгліколю, тетрагідрофуран або діоксан, нітрили, такі як ацетонітрил або пропіонітрил, аміди, такі як N,N-диметилформамід, діетилформамід, N-метилпірролідинон, вода або їх суміші. Температура проведення реакції переважно становить від -20 до +120 °C. Звичайно реакції можна проводити при температурі навколишнього середовища. Підходящими основами є, зокрема, третинні аміни, такі як триметиламін, триетиламін, хінуклідин, 1,4-діазабіцикло[2.2.2]октан, 1,5-діазабіцикло[4.3.0]нон5-ен або 1,5-діазабіцикло[5.4.0]ундец-7-ен. Однак у якості основ можна використовувати неорганічні основи, такі як гідриди, наприклад, гідрид натрію або гідрид кальцію, гідроксиди, наприклад, гідроксид натрію або гідроксид калію, карбонати, такі як карбонат натрію та карбонат калію, або гідрокарбонати, такі як гідрокарбонат калію та гідрокарбонат натрію. Похідні оксиму формули XIII можна одержати шляхом селективного відновлення нітроалкенів формули Vl у спирті або тіолі формули VIIb з використанням SnCL 2.2H2O відповідно до методики, описаної в публікації R.S. Varma and G.W. Kabalka Chem. Lett., 243-244 (1985). Похідні простого ефіру оксиму формули XIIc можна одержати шляхом O-алкілування похідних оксиму формули XIII з використанням сполуки формули R 4-Y, у якій R4 є таким, як визначено для формули IIA, і Y означає групу, що від’єднується, таку як галогенідна, мезилатна або тозилатна, у присутності основи. В якості альтернативи, похідні простого ефіру оксиму формули XIIc також можна одержати шляхом оксимування кетону формули XIV з використанням похідних О-алкілгідроксиламіну формули XI або їх солей. Кетони формули XIV можна одержати шляхом перетворення нітроалканів формули VIII за реакцією Нефа відповідно до методики, описаної в публікації J.M Aizpurua and C. Palomo THL, Vol. 28, No.44,pp 5361-5364 (1987). О-алкілгідроксиламіни формули IIAa, IIAb і IIAc можна одержати шляхом відновлення похідних О-алкоксиоксиму формули XIIA, XIIb і XIIc. Проміжні продукти формули IIA R4 O R5 R13 R7 H N R12 H H R11 (IIA), у якій R4, R5, R7, R11, R12 і R13 є такими, як визначено для формули I, можна одержати, як показано на схемі реакцій 2. 50 5 UA 105778 C2 5 10 15 Похідні -алкілованих арилацетатів формули XVI можна синтезувати шляхом алкілування похідних арилацетату формули XV галогенідом, таким як галогенід формули R 7-Y, у якій R7 є таким, як визначено для формули IIA і Y означає групу, що від’єднується, таку як галогенідна, мезилатна або тозилатна, у присутності основи. Сполуку формули XVI гідролізують гідроксидом, таким як LiOH. Потім одержану кислоту формули XVII можна перетворити у відповідний ацилхлорид і потім цей ацилхлорид можна in situ ввести в реакцію з N,Одиметилгідроксиламіном та одержати амід Вайнреба формули XVIII, у якій R 7, R11, R12 і R13 є такими, як визначено для формули IIA. Наступна реакція з реагентом Грін’яра формули R5MgBr, у якій R5 є таким, як визначено для формули IIA, дає кетон формули Xb, який можна перетворити в сполуку формули IIAb за реакціями, наведеними на схемі 1. Похідні альдегідів формули Xb1 можна одержати шляхом неповного відновлення аміду Вайнреба формули XVIII за допомогою LiAlH 4 або DIBAL-H (диізобутилалюмінійгідрид). Проміжні продукти формули IIA 6 UA 105778 C2 R4 O R5 R13 H H N R12 H H R11 (IIA), у якій R4, R5, R11, R12 і R13 є такими, як визначено для формули I, можна одержати, як показано на схемі реакцій 3. 5 10 15 Похідні альдегідів формули Xa1 можна одержати відповідно до методик, відомих у даній області техніки, шляхом відновлення похідного кислоти формули XIX у похідне спирту формули XX з наступним перетворенням в активоване бензильне похідне формули XXI, перетворенням у нітрильне похідне формули XXII, з наступним відновленням похідного альдегіду Xa1, як описано в розділі, присвяченому прикладам одержання. Наступна реакція нітрильного похідного формули XXII з реагентом Грін’яра формули R 5-MgBr, у якій R5 є таким, як визначено для формули IIA, дає кетон формули Xa, який можна перетворити в сполуку формули IIAb за реакціями, наведеними на схемі 1. Проміжні продукти формули IIB 7 UA 105778 C2 R4 O R13 R5 H H H N R12 H H (IIB), H R11 у якій R4, R5, R11, R12 і R13 є такими, як визначено для формули I, можна одержати, як показано на схемі реакцій 4. 5 10 15 20 Альдегід формули IV з використанням кислоти Мельдрума та триетиламонійформіату можна перетворити у відповідну кислоту формули XXIII, як це описано, наприклад, у публікації G.Toth et. al. in Synth. Commun. 25 (19), 3067-3074 (1995). Зазначену кислоту можна перетворити у відповідний ацилхлорид і потім цей ацилхлорид можна in situ ввести в реакцію з N,О-диметилгідроксиламіном і одержати амід Вайнреба формули XXIV. Наступна реакція аміду Вайнреба формули XXIV з реагентом Грін’яра формули R 5-MgBr, у якій R5 є таким, як визначено для формули IIA, дає кетон формули XXVa. Альдегід формули XXVb можна одержати шляхом неповного відновлення аміду Вайнреба XXIV за допомогою LiAlH4 або DIBAL-H. В якості альтернативи, зазначений альдегід можна одержати шляхом окиснення спирту формули XXVI. Підходящі окисні реагенти включають піридинійхлорхромат (ПХХ), реагент Сверна (оксалілхлорид/ДМСО (диметилсульфоксид)), перйодинан Десса-Мартіна та MnO2. Підходящі розчинники включають дихлорметан і ТГФ (тетрагідрофуран). Температура проведення реакції звичайно перебуває в діапазоні від -50 до 20 °C. 8 UA 105778 C2 Потім похідні кетонів або альдегідів формули XXVa і XXVb можна перетворити в сполуки формули IIBa і IIBb за реакціями, наведеними на схемі 1. Проміжні продукти формули IIB R4 O R13 R5 R7 H H N R12 H H H R11 5 10 15 20 25 (IIB), у якій R4, R5, R7, R11, R12 і R13 є такими, як визначено для формули I, можна одержати, як показано на схемі реакцій 5. Похідні кетонів або альдегідів формули XXIX можна одержати шляхом каталізуємого палладієм арилювання алілових спиртів формули XXVIII арилйодидами формули XXVII у воді, як описано, наприклад, у публікаціях Hong Zhao, Ming-Zhong Cai et. al. in Synth. Commun. 31 (23), 3665-3669 (2001); Alberto Scrivanti, Ugo Matteoli et. al. in Tetrahedron 64, 543-548 (2008). Потім похідні кетонів або альдегідів формули XXIX можна перетворити в сполуки формули IIBc за реакціями, наведеними на схемі 1. Сполуки формули I і, якщо це доцільно, їх таутомери, також можна, якщо це доцільно, одержати у формі гідратів та/або у формі, що включає інші розчинники, наприклад, ті, які могли використовуватись для кристалізації сполук, які перебувають у твердій формі. Згідно з винаходом було встановлено, що сполуки формули I, запропоновані в даному винаході, із практичної точки зору мають дуже привабливий спектр активності для захисту корисних рослин від хвороб, які викликаються фітопатогенними мікроорганізмами, такими як гриби, бактерії або віруси. Даний винахід відноситься до способу боротьби із зараженням корисних рослин фітопатогенними мікроорганізмами або до його попередження, у якому сполуку формули I наносять у якості активного інгредієнта на рослини, на їх частини або ділянку їх виростання. Сполуки формули I, запропоновані в даному винаході, відрізняються чудовою активністю при 9 UA 105778 C2 5 10 15 20 25 30 35 40 45 50 55 низьких нормах витрат, добре переносяться рослинами та є екологічно безпечними. Вони мають дуже корисні лікувальні, попереджувальні та системні характеристики та застосовуються для захисту багатьох культурних рослин. Сполуки формули I можна використовувати для придушення або знищення збудників захворювань, що перебувають на рослинах або частинах рослин (плодах, квітах, листях, стеблах, бульбах, коріннях) різних культур корисних рослин і одночасно для захисту також і тих частин рослин, які виростають пізніше, наприклад, від фітопатогенних мікроорганізмів. Сполуки формули I також можна використовувати в якості протравлюючих агентів для обробки матеріалу для розмноження рослин, особливо насіння (плоди, бульби, зерна) і саджанців рослин (наприклад, рису), для захисту від грибкових інфекцій, а також від фітопатогенних грибів, що зустрічаються в ґрунті. Крім того, сполуки формули I, запропоновані в даному винаході, можна використовувати для боротьби із грибами в суміжних галузях, наприклад, для захисту технічних матеріалів, включаючи деревину та виготовлені з використанням деревини технічні продукти, при зберіганні харчових продуктів або при гігієнічних заходах. Сполуки формули I, наприклад, є ефективними проти фітопатогенних грибів наступних класів: Fungi imperfecti (наприклад, Botrytis, Pyricularia, Helminthosporium, Fusarium, Septoria, Cercospora і Alternaria) і базидіомицетів (наприклад, Rhizoctonia, Hemileia, Puccinia). Крім того, вони також є ефективними проти класів аскоміцетів (наприклад, Venturia і Erysiphe, Podosphaera, Monilinia, Uncinula) і класів ооміцетів (наприклад, Phytophthora, Pythium, Plasmopara). Виявлена надзвичайно висока активність стосовно справжньої борошнистої роси (Erysiphe spp.). Крім того, нові сполуки формули I є ефективними проти фітопатогенних бактерій і вірусів (наприклад, проти Xanthomonas spp, Pseudomonas spp, Erwinia amylovora, а також проти вірусу тютюнової мозаїки). Виявлена гарна активність стосовно азіатської соєвої іржі (Phakopsora pachyrhizi). В обсязі даного винаходу корисні рослини, що підлягають захисту, звичайно включають наступні види рослин: злаки (пшениця, ячмінь, жито, овес, рис, кукурудза, сорго та споріднені види); буряк (цукровий буряк і кормовий буряк); яблука, кісточкові та ягоди (яблука, груші, сливи, персики, мигдаль, вишні, суниця, малина та чорна смородина); бобові рослини (боби, сочевиця, горох, соя); олійні рослини (рапс, гірчиця, мак, оливи, соняшник, кокос, рицина, какаобоби, земляний горіх); огіркові рослини (гарбуза, огірки, дині); волокнисті рослини (бавовна, льон, коноплі, джут); цитрусові фрукти (апельсини, лимони, грейпфрути, мандарини); городина (шпинат, латук, спаржа, капуста, морква, цибуля, помідори, картопля, червоний перець); лаврові (авокадо, кориця, камфора) і такі рослини, як тютюн, горіхи, кава, баклажани, цукровий очерет, чай, перець, виноград, хміль, банани та натуральні каучуконосні рослини, а також декоративні рослини. Термін «корисні рослини» слід розуміти як такі, що також включають корисні рослини, яким надана стійкість до гербіцидів, таким як бромоксиніл, або до класів гербіцидів (таким як, наприклад, інгібітори HPPD (4-гідроксифенілпіруватдіоксигеназа), інгібітори ALS (ацетолактатсинтаза), наприклад, прімісульфурон, просульфурон і трифлоксисульфурон, інгібітори EPSPS (3-фосфатсинтаза), інгібітори GS (глутамінсинтетаза), за допомогою звичайних методик селекції або генної інженерії. Прикладом культури, якій за допомогою звичайних методик селекції (мутагенезу) надана стійкість до імідазоліноів, наприклад, ® імазамоксу, є суріпиця Clearfield (канола). Приклади культур, яким за допомогою методик генної інженерії надана стійкість до гербіцидів або класів гербіцидів, включають сорти кукурудзи, стійкі до гліфосату та глуфосинату, які є в продажі під торговельними назвами ® Roundupready і Libertylink®. Термін «корисні рослини» слід розуміти як такий, що включає також корисні рослини, які шляхом використання методики на основі рекомбінантної ДНК є модифіковані таким чином, що здатні синтезувати один або більшу кількість токсинів, що справляють селективний вплив, таких як, для яких відомо, наприклад, що вони виробляються бактеріями, що продукують токсини, особливо бактеріями роду Bacillus. Прикладами таких рослин є: Yieldgard (сорт кукурудзи, який експресує токсин CryIA(b)); Yieldgard Rootworm (сорт кукурудзи, який експресує токсин CryIIIB(b1)); Yieldgard Plus (сорт кукурудзи, який експресує токсини CryIA(b) і CryIIIB(b1)); Starlink (сорт кукурудзи, який експресує токсин Cry9(c)); Herculex I (сорт кукурудзи, який експресує токсин CryIF(a2) і фермент фосфінотрицин-N-ацетилтрансферазу (PAT) для надання стійкості до гербіциду глуфосинат-амонію); Nucotn 33B (сорт бавовни, яка експресує токсин CryIA(c)); Bollgard I ® (сорт бавовни, яка експресує токсин CryIA(c)); Bollgard II (сорт бавовни, яка експресує токсин 10 UA 105778 C2 5 10 15 20 25 30 35 40 45 50 55 60 CryIA(c) і a CryIIA(b)); VIPCOT (сорт бавовни, яка експресує токсин VIP); Newleaf (сорт ® картоплі, яка експресує токсин CryIIIA); Naturegard Agrisure GT Advantage (GA21, що надає ® стійкість до гліфосату), Agrisure CB Advantage (Bt11, що надає стійкість до метелика кукурудзяного (МК)) і Protecta . Термін «корисні рослини» слід розуміти як такі, що включає також корисні рослини, які шляхом використання методики на основі рекомбінантної ДНК є модифіковані таким чином, що вони здатні синтезувати протипатогенні речовини, що справляють селективний вплив, такі як, наприклад, так звані «зв'язані з патогенезом білки» (PRP, див., наприклад, EP-A-0392225). Приклади таких протипатогенних речовин і трансгенних рослин, здатних синтезувати такі протипатогенні речовини, наведені, наприклад, в EP-A-0392225, WO 95/33818, і EP-A-0353191. Методики одержання таких трансгенних рослин звичайно відомі фахівцеві в даній області техніки та описані, наприклад, у зазначені вище публікаціях. Термін «ділянка росту» корисної рослини при використанні в даному винаході означає ділянку, на якій ростуть корисні рослини, на якій висіяні матеріали для розмноження корисних рослин або на якій будуть поміщені в ґрунт матеріали для розмноження корисних рослин. Прикладом такої ділянки росту є поле, на якому ростуть культурні рослини. Термін «матеріал для розмноження рослин» слід розуміти як такий, що означає всі генеративні частини рослини, такі як насіння, які можна застосовувати для розмноження рослин, і вегетативний матеріал, такий як черешки та бульби, наприклад, картопля. Наприклад, можна відзначити насіння (у точному значенні слова), коріння, плоди, бульби, цибулини, кореневища, частини рослин. Також можна відзначити пророслі рослини або розсаду, які необхідно пересадити після проростання або появи сходів із ґрунту. Цю розсаду можна захистити до пересадження шляхом повної або часткової обробки, проведеної шляхом занурення. Слід розуміти, що переважний «матеріал для розмноження рослин» означає насіння. Сполуки формули I можна застосовувати в незміненому виді або, переважно, разом із носіями та допоміжними речовинами, що звичайно застосовуються для приготування препаратів. З цієї причини даний винахід також відноситься до композицій для боротьби з фітопатогенними мікроорганізмами та захисту від них, що включають сполуку формули I та інертний носій, і до способу боротьби із зараженням корисних рослин фітопатогенними мікроорганізмами та до його попередження, у якому композицію, що включає сполуку формули I у якості активного інгредієнта, та інертний носій наносять на рослини, на їх частини або на ділянку їх росту. Для цього сполуки формули I та інертні носії звичайно приготовляють відомим способом у вигляді концентратів, що емульгуються, паст для нанесення, розчинів, що безпосередньо розприскуються або розбавляються, розведених емульсій, змочувальних порошків, розчинних порошків, пилоподібних матеріалів, гранулятів, а також форм, капсульованих, наприклад, у полімерних речовинах. Як і тип композиції, методики нанесення, такі як обприскування, атомізація, запилення, розкидання, нанесення шару або полив, вибираються відповідно до розв'язуваних завдань і переважаючих умов. Композиції також можуть містити інші допоміжні речовини, такі як стабілізатори, протипінні речовини, регулятори в'язкості, зв’язуючі речовини або речовини, що надають липкість, а також добрива, речовини, що є джерелом поживних мікроелементів або інші композиції, призначені для забезпечення спеціальних ефектів. Підходящі носії та допоміжні речовини можуть бути твердими або рідкими і представляють собою речовини, що застосовуються в технології приготування препаратів, наприклад, натуральні або регенеровані мінеральні речовини, розчинники, диспергуючі речовини, змочувальні агенти, речовини, що надають липкість, загусники, зв’язуючі речовини або добрива. Такі носії, наприклад, описані в WO 97/33890. Сполуки формули I або композиції, що включають сполуку формули I у якості активного інгредієнта та інертний носій, можна наносити на ділянку росту рослин або на оброблювану рослину одночасно або послідовно з додатковими сполуками. Цими додатковими сполуками можуть бути, наприклад, добрива або джерела мікроелементів або інші препарати, які впливають на ріст рослин. Ними також можуть бути селективні гербіциди, а також інсектициди, фунгіциди, бактерициди, нематоциди, молюскоциди або суміші декількох із цих препаратів, при необхідності разом з додатковими носіями, поверхнево-активними речовинами або допоміжними речовинами, що покращують нанесення, що звичайно застосовуються в області приготування препаратів. Преважним способом нанесення сполуки формули I або композиції, що включає сполуку формули I у якості активного інгредієнта та інертний носій, є некореневе нанесення. Частота 11 UA 105778 C2 5 10 15 20 25 30 35 40 45 50 55 60 нанесення та норма витрат залежать від небезпеки зараження відповідним патогеном. Однак сполуки формули I також можуть проникати в рослину через коріння із ґрунту (системний вплив) при дощуванні ділянки росту рослин рідким препаратом або при внесенні сполук у ґрунт у твердому виді, наприклад, у гранульованому виді (ґрунтове нанесення). Під затоплювані культури, такі як рис, такі грануляти можна наносити на залите рисове поле. Сполуки формули I також можна наносити на насіння (у вигляді покриття) шляхом просочування насіння або бульб рідким препаратом фунгіциду або шляхом нанесення на них покриття із твердого препарату. Препарат, тобто композицію, що містить сполуку формули I і при необхідності тверду або рідку допоміжну речовину, приготовляють за відомими методиками, звичайно шляхом ретельного перемішування та/або розмелу сполуки з наповнювачами, наприклад, розчинниками, твердими носіями та необов'язково поверхнево-активними речовинами. Агрохімічні препарати звичайно містять від 0,1 до 99 мас. %, переважно від 0,1 до 95 мас. % сполуки формули I, від 99,9 до 1 мас. %, переважно від 99,8 до 5 мас. % твердої або рідкої допоміжної речовини та від 0 до 25 мас. %, переважно від 0,1 до 25 мас. % поверхнево-активної речовини. У той час як комерційні продукти і переважним приготовляти у вигляді концентратів, кінцевий користувач звичайно буде використовувати розведені препарати. Переважні норми витрат звичайно становлять від 5 г до 2 кг активного інгредієнту (АІ) на гектар (га), переважно від 10 г до 1 кг (АІ)/га, найбільше переважно - від 20 г до 600 г (АІ)/га. При використанні в якості засобу для замочування насіння, звичайні дози становлять від 10 мг до 1 г активної речовини на 1 кг насіння. Норму витрат для забезпечення необхідного впливу можна визначити експериментально. Вона залежить, наприклад, від типу впливу, стадії розвитку корисної рослини та від нанесення (ділянки, тимчасового режиму, методики нанесення) і залежно від цих параметрів міняється в широких межах. Згідно з винаходом неочікувано було встановлено, що сполуки формули I також можна використовувати в способах захисту культур корисних рослин від нападу фітопатогенних мікроорганізмів, а також для лікування культур корисних рослин, заражених фітопатогенними мікроорганізмами, що включають нанесення гліфосату та, щонайменше, однієї сполуки формули I на рослину або ділянку її росту, де рослина є стійкою або чутливою до гліфосату. Зазначені способи можуть забезпечити несподіване покращення рівня боротьби із хворобами, в порівнянні із застосуванням сполук формули I при відсутності гліфосату. Зазначені способи можуть бути ефективними для покращення рівня боротьби із хворобами за допомогою сполук формули I. Хоча суміш гліфосату та, щонайменше, однієї сполуки формули I може, щонайменше, частково розширити спектр хвороб, з якими проводиться боротьба за допомогою сполуки формули I, також може спостерігатись підвищення активності впливу сполуки формули I при впливі на хвороби, у відношенні яких уже відомо, що вони деякою мірою пригнічуються сполукою формули I. Зазначені способи є особливо ефективними для боротьби з фітопатогенними мікроорганізмами царства гриби, типу базидіомицети, класу Uredinomycetes, підкласу Urediniomycetidae і загону Uredinales (що звичайно називаються іржею). Види іржі, що особливо сильно впливає на сільськогосподарські культури, включають види сімейства Phakopsoraceae, особливо види роду Phakopsora, наприклад, Phakopsora pachyrhizi, яка також називається азіатською соєвою іржею, і види сімейства Pucciniaceae, особливо види роду genus Puccinia, такі як Puccinia graminis, яка також відома, як стеблева іржа або чорна іржа, яка є небезпечною хворобою злаків, і Puccinia recondita, також відома, як бура іржа. Один варіант здійснення даного винаходу відноситься до способу захисту культур корисних рослин від нападу фітопатогенних мікроорганізмів та/або лікування культур корисних рослин, заражених фітопатогенними мікроорганізмами, зазначений спосіб включає одночасне нанесення гліфосату, включаючи його солі або складні ефіри, та, щонайменше, однієї сполуки формули I, яка має активність стосовно фітопатогенних мікроорганізмів, щонайменше, на один об'єкт, вибраний із групи, що включає рослину, частину рослини та ділянку росту рослини. Сполуки формули(I) або їх фармацевтичні солі, описані вище, також можуть мати спектр активності, що підходить для лікування та/або попередження мікробної інфекції у тварини. «Твариною» може бути будь-яка тварина, наприклад, комаха, ссавець, рептилія, риба, амфібія, переважно ссавець, найбільш переважно людина. «Лікування» означає застосування до тварини, у якої є мікробна інфекція, для зменшення, або ослаблення, або зупинки посилення або поширення інфекції, або для ослаблення інфекції, або для усунення інфекції. «Попередження» означає застосування до тварини, у якої відсутні видимі ознаки мікробної інфекції, для попередження будь-якої майбутньої інфекції, або для зменшення, або ослаблення посилення або поширення будь-якої майбутньої інфекції. 12 UA 105778 C2 5 10 15 20 25 30 Даний винахід відноситься до застосування сполуки формули (I) для приготування лікарського засобу, призначеного для лікування та/або попередження мікробної інфекції у тварини. Даний винахід також відноситься до застосування сполуки формули (I) у якості лікарського засобу. Даний винахід також відноситься до застосування сполуки формули (I) у якості протимікробного засобу для лікування тварини. Даний винахід також відноситься до фармацевтичної композиції, що включає в якості активного інгредієнту сполуку формули (I) або її фармацевтично прийнятну сіль і фармацевтично прийнятний розріджувач або носій. Цю композицію можна застосовувати для лікування та/або попередження мікробної інфекції у тварини. Ця фармацевтична композиція може знаходитись у формі, що підходить для перорального введення, такій як таблетка, пастилки, тверді капсули, водні суспензії, масляні суспензії, емульсії, порошки, що диспергуються, гранули, що диспергуються, сиропи та еліксири. В якості альтернативи, ця фармацевтична композиція може знаходитись у формі, що підходить для місцевого нанесення, такій як спрей, крем або лосьйон. В якості альтернативи, ця фармацевтична композиція може знаходитись у формі, що підходить для парентерального введення, наприклад, ін'єкції. В якості альтернативи, ця фармацевтична композиція може знаходитись у формі, що підходить для інгаляції, такій як аерозоль, що розпилюється. Сполуки формули (I) можуть бути ефективні для боротьби з мікроорганізмами різних видів, які можуть привести до мікробної інфекції у тварини. Прикладами таких видів мікроорганізмів є ті, які викликають аспергілез, такі як Aspergillus fumigatus, A. flavus, A. terrus, A. nidulans і A. niger; які викликають бластомікоз, такі як Blastomyces dermatitidis; які викликають кандидоз, такі як Candida albicans, C. glabrata, C. tropicalis, C. parapsilosis, C. krusei і C. lusitaniae; які викликають кокцидіоїдомікоз, такі як Coccidioides immitis; які викликають криптококкоз, такі як Cryptococcus neoformans; які викликають гістоплазмоз, такі як Histoplasma capsulatum, і які викликають зиготомікоз, такі як Absidia corymbifera, Rhizomucor pusillus і Rhizopus arrhizus. Іншими прикладами є Fusarium Spp, такі як Fusarium oxysporum і Fusarium solani, і Scedosporium Spp, такі як Scedosporium apiospermum і Scedosporium prolificans. Додатковими прикладами є Microsporum Spp, Trichophyton Spp, Epidermophyton Spp, Mucor Spp, Sporothorix Spp, Phialophora Spp, Cladosporium Spp, Petriellidium spp, Paracoccidioides Spp і Histoplasma Spp. Наведені нижче необмежуючі приклади більш докладно ілюструють даний винахід, описаний вище, не накладаючи на нього жодних обмежень. Приклади одержання: Приклад P1: Одержання [2-(4-хлорфеніл)-1-метилетил]-метоксиаміду 3-дифторметил-1метил-1H-піразол-4-карбонової кислоти (сполука 1.001): F H F O N H3C 40 45 50 Cl N N 35 CH3 H3C O Розчин 3-дифторметил-1-метил-1H-піразол-4-карбонілхлориду (564 мг; 2,9 ммоль) у дихлорметані (5 мл) при 0 °C при перемішуванні по краплям додавали до розчину N-[2-(4хлорфеніл)-1-метилетил]-O-метилгідроксиламіну (600 мг; 2,9 ммоль), одержаного, як описано в прикладі P13, і триетиламіну (0,80 мл; 5,8 ммоль) у дихлорметані (10 мл). Реакційну суміш перемішували при температурі навколишнього середовища на протязі 6 г. Реакційну суміш промивали 1M розчину NaOH (20 мл), 1M розчину HCl (20 мл), розсолом (20 мл) і потім сушили над Na2SO4. Після видалення розчинника залишок очищали за допомогою флеш-хроматографії на силікагелі (елюент: циклогексан/етилацетат 1:1). Одержували 0,99 г (93,4 % від теоретичного значення) [2-(4-хлорфеніл)-1-метилетил]-метоксиаміду 3-дифторметил-1-метил-1H-піразол-4карбонової кислоти (сполука 1.001) у вигляді смолоподібної речовини. 1 H ЯМР: (CDCl3, 400 МГц): 1,33-1,37(d,3H); 2,77-2,82(dd,1H); 3,07-3,13(dd,1H); 3,64(s,3H); 3,94(s,3H); 4,63-4,68(m,1H); 6,98-7,28(m, 5H); 7,61(s,1H). + МС (мас-спектрометрія) [M+H] 358/360. Приклад P2: Одержання [2-(2,4-дихлорфеніл)-1-метилетил]-метоксиаміду 3-дифторметил-1метил-1H-піразол-4-карбонової кислоти (сполука 1.002): 13 UA 105778 C2 F H F O N N N H3C 5 10 15 H3C H F H3C 35 H3C O Cl До розчину O-метил-N-[1-метил-2-(2,4,6-трихлорфеніл)-етил]-гідроксиламіну (0,65 г, 2,4 ммоль), одержаного, як описано в прикладі P15d, у дихлорметані (5 мл) додавали триетиламін (0,844 мл, 6,0 ммоль), потім при 0 °C по краплям додавали розчин 3-дифторметил-1-метил-1Hпіразол-4-карбонілхлориду (0,519 г, 2,67 ммоль) у дихлорметані. Після завершення додавання хлорангідриду кислоти суміш перемішували при температурі навколишнього середовища на протязі 18 г. Після завершення реакції за даними ТШХ (тонкошарова хроматографія) реакційну суміш розбавляли водою та екстрагували дихлорметаном (360 мл). Об'єднані шари, що містять дихлорметан, промивали 2 н. розчину HCl, потім насиченим розчином NaHCO 3, потім водою та на закінчення розсолом, потім сушили над сульфатом натрію та розчинник випарювали. Отриману неочищену суміш очищали за допомогою колонкової хроматографії із застосуванням силікагелю із частками розміром 60-120 мкм і продукт збирали при використанні в якості елюенту 30 % етилацетату в гексані та одержували метокси-[1-метил-2-(2,4,6трихлорфеніл)-етил]-амід 3-дифторметил-1-метил-1H-піразол-4-карбонової кислоти (0,51 г, 49 %) у вигляді майже білої твердої речовини. Т. пл. 110-112 °С 1 H ЯМР (400 МГц, CDCl3): 1,38-1,39(d,3H), 3,20-3,26(dd,1H), 3,32-3,37(dd,1H), 3,70(s,3H), 3,97(s,3H), 4,88-4,93(m,1H), 7,02-7,29(t,1H), 7,27(s,2H), 7,81(s,1H) + МС [M+H] 426/428/430 Приклад P4: Одержання {2-[4-(4-хлорфенокси)-феніл]-1-метилетил}-метоксиаміду 3дифторметил-1-метил-1H-піразол-4-карбонової кислоти (сполука 1.015): F H F O CH3 N N N H3C 40 Cl N N 30 Cl Cl CH3 O N 25 O Розчин 3-дифторметил-1-метил-1H-піразол-4-карбонілхлориду (0,91 г; 4,7 ммоль) у дихлорметані (5 мл) при 0 °C при перемішуванні по краплям додавали до розчину N-[2-(2,4дихлорфеніл)-1-метилетил]-O-метилгідроксиламіну (1,0 г; 4,27 ммоль), одержаного, як описано в прикладі P14, і триетиламіну (0,90 мл; 6,4 ммоль) у дихлорметані (7 мл). Реакційну суміш перемішували при температурі навколишнього середовища на протязі 1,5 г. Реакційну суміш промивали 1M розчину NaOH (20 мл), 1M розчину HCl (20 мл), розсолом (20 мл) і потім сушили над Na2SO4. Після видалення розчинника залишок очищали за допомогою флеш-хроматографії на силікагелі (елюент: гексан/етилацетат 7:3). Одержували 1,35 г (80,3% від теоретичного значення) [2-(2,4-дихлорфеніл)-1-метилетил]-метоксиаміду 3-дифторметил-1-метил-1H-піразол4-карбонової кислоти (сполука 1.002) у вигляді білої твердої речовини (Т. пл. 98-102 °C). 1 H ЯМР: (CDCl3, 400 МГц): 1,41-1,46(d,3H); 2,99-3,04(dd,1H); 3,17-3,23(dd,1H); 3,60(s,3H); 3,95(s,3H); 4,68-4,70(m,1H); 7,10-7,62(m, 5H). + МС [M+H] 392/394/396. Приклад P3: Одержання метокси-[1-метил-2-(2,4,6-трихлорфеніл)-етил]-аміду 3дифторметил-1-метил-1H-піразол-4-карбонової кислоти (сполука 1.003): F 20 Cl CH3 H3C O Cl O Розчин 3-дифторметил-1-метил-1H-піразол-4-карбонілхлориду (797 мг; 4,1 ммоль) у дихлорметані (5 мл) при 0 °C при перемішуванні по краплям додавали до розчину N-{2-[4-(4хлорфенокси)-феніл]-1-метилетил}-O-метилгідроксиламіну (1,2 г; 4,1 ммоль), одержаного, як 14 UA 105778 C2 5 10 описано в прикладі P16, і триетиламіну (1,10 мл; 8,2 ммоль) у дихлорметані (10 мл). Реакційну суміш перемішували при температурі навколишнього середовища на протязі ночі. Після видалення розчинника залишок очищали за допомогою флеш-хроматографії на силікагелі (елюент: циклогексан/етилацетат 1:1). Одержували 1,2 г (66 % від теоретичного значення) {2-[4(4-хлорфенокси)-феніл]-1-метилетил}-метоксиаміду 3-дифторметил-1-метил-1H-піразол-4карбонової кислоти (сполука 1.015) у вигляді масла. 1 H ЯМР: (CDCl3, 400 МГц): 1,36-1,39(d,3H); 2,78-2,84(dd,1H); 3,05-3,12(dd,1H); 3,65(s,3H); 3,94(s,3H); 4,64-4,68(m,1H); 6,80-6,90(m, 4H); 6,95-7,23(t,1H,CHF2); 7,17-7,26(m,4H); 7,67(s,1H). + МС [M+H] 450/452. Приклад P5: Одержання [2-(2,4-дихлорфеніл)-1-метилетил]-гідроксиаміду 3-дифторметил-1метил-1H-піразол-4-карбонової кислоти (сполука 1.028): F H F O Cl CH3 N N OH N Cl H3C 15 20 25 30 Розчин 3-дифторметил-1-метил-1H-піразол-4-карбонілхлориду (2,10 г; 11,0 ммоль) у дихлорметані (5 мл) при 0 °C при перемішуванні по краплям додавали до суспензії N-[2-(2,4дихлорфеніл)-1-метилетил]-гідроксиламіну (2,0 г; 9,10 ммоль), одержаного, як описано в прикладі P17, і триетиламіну (3,10 мл; 22 ммоль) у дихлорметані (15 мл). Реакційну суміш перемішували при температурі навколишнього середовища на протязі ночі. Реакційну суміш виливали в 1M розчин HCl (50 мл), екстрагували дихлорметаном (320 мл) і потім сушили над Na2SO4. Після видалення розчинника залишок (5,08 г) очищали за допомогою флешхроматографії на силікагелі (елюент: циклогексан/етилацетат 7:3). Одержували 1,51 г (43,8 % від теоретичного значення) [2-(2,4-дихлорфеніл)-1-метилетил]-гідроксиаміду 3-дифторметил-1метил-1H-піразол-4-карбонової кислоти (сполука 1.028) у вигляді білої твердої речовини (Т. пл. 162-167 °C). 1 H ЯМР: (CDCl3, 400 МГц): 1,40-1,41(d,3H); 2,89-2,94(dd,1H); 3,03-3,14(dd,1H); 3,86(s,3H); 4,3-4,5(mbr,1H); 6,57,0(mbr,2H); 7,19-7,21(m, 2H); 7,36(m,1H); 7,8-8,6(mbr,1H). + МС [M+H] 378/380/382. Приклад P6: Одержання [2-(2,4-дихлорфеніл)-1-метилетил]-етоксиаміду 3-дифторметил-1метил-1H-піразол-4-карбонової кислоти (сполука 1.031): F H F N H3C 40 45 Cl CH3 N N 35 O O Cl CH3 Розчин 3-дифторметил-1-метил-1H-піразол-4-карбонілхлориду (0,86 г; 4,4 ммоль) в дихлорметані (5 мл) при 0 °C при перемішуванні по краплях додавали до розчину N-[2-(2,4дихлорфеніл)-1-метилетил]-O-етилгідроксиламіну (1,0 г; 4,0 ммоль), одержаного, як описано в прикладі P18, та триетиламіну (0,82 мл; 6,0 ммоль) в дихлорметані (7 мл). Реакційну суміш перемішували при температурі навколишнього середовища на протязі 1,5 г. Реакційну суміш промивали 1M розчином NaOH (20 мл), 1M розчином HCl (20 мл), розсолом (20 мл) та потім сушили над Na2SO4. Після видалення розчинника залишок очищали за допомогою флешхроматографії на силікагелі (елюент: гексан/етилацетат 7:3). Одержували 0,75 г (45,7 % від теоретичного значення) [2-(2,4-дихлорфеніл)-1-метилетил]-етоксиаміду 3-дифторметил-1метил-1H-піразол-4-карбонової кислоти (сполука 1.031) у вигляді білої твердої речовини (Т. пл. 116-118 °C). 1 H ЯМР: (CDCl3, 400 МГц): 1,14-1,20(t,3H); 1,36-1,45(2d,3H); 2,98-3,03(dd,1H); 3,19-3,25(dd,1H); 3,74-3,82(q,3H); 3,94(s,3H); 4,64-4,70(m,1H); 6,93-7,65(m, 5H). + МС [M+H] 406/408/410. Приклад P7: Одержання етокси-[1-метил-2-(2,4,6-трихлорфеніл)-етил]-аміду 3 15 UA 105778 C2 дифторметил-1-метил-1H-піразол-4-карбонової кислоти (сполука 1.032): F O O N H3C 10 15 20 CH3 H F O O N Cl Розчин 3-дифторметил-1-метил-1H-піразол-4-карбонілхлориду (1,1 г; 5,7 ммоль) в дихлорметані (5 мл) при 0 °C при перемішуванні по краплях додавали до розчину N-[2-(2,4дихлорфеніл)-1-метилетил]-O-ізопропілгідроксиламіну (1,5 г; 5,7 ммоль), одержаного, як описано в прикладі P20, та триетиламіну (1,6 мл; 11,4 ммоль) в дихлорметані (10 мл). Реакційну суміш перемішували при температурі навколишнього середовища на протязі ночі. Після видалення розчинника залишок очищали за допомогою флеш-хроматографії на силікагелі (елюент: циклогексан/етилацетат 7:3). Одержували 1,30 г (54,0% від теоретичного значення) [2(2,4-дихлорфеніл)-1-метилетил]-ізопропоксиаміду 3-дифторметил-1-метил-1H-піразол-4карбонової кислоти (сполука 1.033) у вигляді жовтого масла. 1 H ЯМР: (CDCl3, 400 МГц): 0,91-0,93+1,11-1,13(2d,6H); 1,42-1,48(2d,3H); 3,00-3,07(dd,1H); 3,29-3,36(dd,1H); 3,92(s,3H); 3,97-4,36(m,1H); 4,36-4,45(m,1H); 6,97-7,59(m, 5H). + МС [M+H] 420/422/424. Приклад P9: Одержання [2-(2,4-дихлорфеніл)-пентил]-метоксиаміду 3-дифторметил-1метил-1H-піразол-4-карбонової кислоти (сполука 1.059): F H F Cl O N N N H3C 40 CH3 H CH3 H3C 35 Cl CH3 N N 30 Cl До розчину O-етил-N-[1-метил-2-(2,4,6-трихлорфеніл)-етил]-гідроксиламіну (0,5 г, 1,63 ммоль) в дихлорметані (5 мл) добавляли триетиламін (0,566 мл, 4,07 ммоль), потім по краплях добавляли розчин 3-дифторметил-1-метил-1H-піразол-4-карбонілхлориду (0,34 г, 1,79 ммоль) в дихлорметані при температурі, що дорівнювала 0 °С. Після завершення додавання хлорангідриду кислоти суміш перемішували при температурі навколишнього середовища на протязі 18 г. Після завершення реакції за даними ТШХ реакційну суміш розбавляли водою та екстрагували дихлорметаном (360 мл). Об’єднані шари, що містили дихлорметан, промивали 2 н. розчином HCl, потім насиченим розчином NaHCO3, потім водою та в кінці розсолом, сушили над сульфатом натрію та розчинник випарювали при пониженому тиску. Одержану неочищену суміш очищали за допомогою колонкової хроматографії із застосуванням силікагелю із частинками розміром 60-120 мкм та продукт збирали при використанні в якості елюенту 30 % етилацетату в гексані та одержували етокси-[1-метил-2-(2,4,6-трихлорфеніл)-етил]-амід 3дифторметил-1-метил-1H-піразол-4-карбонової кислоти (0,390 г, 50 %) у вигляді майже білої твердої речовини. Т. пл. 111-114 °С 1 H ЯМР (400 МГц, CDCl3): 1,20-1,24(t,3H), 1,35-1,37(d,3H), 3,23-3,28(dd,1H), 3,333,38(dd,1H), 3,84-3,88(q,2H), 3,96(s,3H), 4,86-4,91(m,1H), 7,01-7,25(t,1H), 7,28(s,2H), 7,83(s,1H) + МС [M+H] 439,9/441,83 Приклад P8: Одержання [2-(2,4-дихлорфеніл)-1-метилетил]-ізопропоксиаміду 3дифторметил-1-метил-1H-піразол-4-карбонової кислоти (сполука 1.033): F 25 Cl N N 5 Cl CH3 H F H3C O Cl CH3 Розчин 3-дифторметил-1-метил-1H-піразол-4-карбонілхлориду (2,20 г; 11,0 ммоль) в дихлорметані (10 мл) при 0 °C при перемішуванні по краплях додавали до розчину N-[2-(2,4 16 UA 105778 C2 5 10 дихлорфеніл)-пентил]-O-метилгідроксиламіну (3,0 г; 11,0 ммоль), одержаного, як описано в прикладі P22, та триетиламіну (3,0 мл; 22 ммоль) в дихлорметані (20 мл). Реакційну суміш перемішували при температурі навколишнього середовища на протязі 6 г. Після видалення розчинника залишок очищали за допомогою флеш-хроматографії на силікагелі (елюент: циклогексан/етилацетат 1:1). Одержували 3,85 г (83% від теоретичного значення) [2-(2,4дихлорфеніл)-пентил]-метоксиаміду 3-дифторметил-1-метил-1H-піразол-4-карбонової кислоти (сполука 1.059) у вигляді жовтого масла. 1 H ЯМР: (CDCl3, 400 МГц): 0,84-0,87(t,3H); 1,14-1,25(m,2H); 1,61-1,69(m,2H); 3,55(s,3H); 3,71-3,80(m,1H); 3,803,84(dd,1H); 3,96(s,3H); 3,99-4,05(dd,1H); 7,07-7,36(m, 4H);7,79(s,1H). + МС [M+H] 420/422/424. Приклад P10: Одержання метокси-[1-метил-3-(2,4,6-трихлорфеніл)-пропіл]-аміду 3дифторметил-1-метил-1H-піразол-4-карбонової кислоти (сполука 2.003): F H F O N H3C 20 25 30 35 H3C Cl Cl H F O Cl N N N H3C 45 O До розчину O-метил-N-[1-метил-3-(2,4,6-трихлорфеніл)-пропіл]-гідроксиламіну (0,6 г, 2,1 ммоль) одержаного, як описано в прикладі P23d, в дихлорметані (6 мл), добавляли триетиламін (0,73 мл, 5,2 ммоль), потім при 0 °С по краплях добавляли розчин 3-дифторметил-1-метил-1Hпіразол-4-карбонілхлориду (0,415 г, 2,1 ммоль) в дихлорметані. Після завершення додавання хлорангідриду кислоти реакційну суміш перемішували при температурі навколишнього середовища на протязі 18 г. Після завершення реакції за даними ТШХ реакційну суміш розбавляли водою та екстрагували дихлорметаном (360 мл). Об’єднані шари, що містили дихлорметан, промивали 2 н. розчином HCl, потім насиченим розчином NaHCO 3, потім водою та в кінці розсолом, сушили над сульфатом натрію та розчинник випарювали при пониженому тиску. Одержану неочищену суміш очищали за допомогою колонкової хроматографії із застосуванням силікагелю із частинками розміром 60-120 мкм та продукт збирали при використанні в якості елюенту 30% етилацетату в гексані та одержували метокси-[1-метил-3(2,4,6-трихлорфеніл)-пропіл]-амід 3-дифторметил-1-метил-1H-піразол-4-карбонової кислоти (0,53 г, 57 %) у вигляді смолоподібної речовини. Фізичні характеристики: 1 H ЯМР: (CDCl3, 400 МГц): 1,41(d,3H,CH3), 1,71-1,80(m,1H,CH2), 1,94-2,04(m,1H,CH2), 1,87-1,92(m,2H,CH2), 3,78(s,3H,CH3), 3,98(s,3H,CH3), 4,66-4,71(m,1H,CH), 7,11(t,1H,CHF2), 7,28(s,2H,Ar-H), 7,88(s,1H,H піразола) + МС [M+H] 440/442/444/446. Приклад P11: Одержання метокси-[3-(2,4,6-трихлорфеніл)-пропіл]-аміду 3-дифторметил-1метил-1H-піразол-4-карбонової кислоти (сполука 2.040): F 40 Cl N N 15 CH3 H3C O Cl Cl При перемішуванні до розчину O-метил-N-[3-(2,4,6-трихлорфеніл)-пропіл]-гідроксиламіну (0,35 г, 1,3 ммоль) одержаного, як описано в прикладі P24c, в дихлорметані (5 мл), при температурі, що дорівнювала 0 °С, повільно добавляли триетиламін (0,55 мл, 3,9 ммоль), розчин 3-дифторметил-1-метил-1H-піразол-4-карбонілхлориду в дихлорметані (2 мл). Після завершення додавання хлорангідриду кислоти суміш перемішували при температурі навколишнього середовища на протязі іще 3 г. Після завершення реакції за даними ТШХ реакційну суміш розбавляли водою та екстрагували дихлорметаном (360 мл). Об’єднані шари, що містили дихлорметан, промивали 2 н. розчином HCl, потім насиченим розчином NaHCO 3, потім водою та в кінці розсолом. Потім органічний шар сушили над безводним сульфатом натрію та концентрували при пониженому тиску. Одержану неочищену суміш очищали за допомогою колонкової хроматографії (силікагель із частинками розміром 60-120 мкм, 26 % 17 UA 105778 C2 5 10 етилацетату в гексані) та одержували метокси-[3-(2,4,6-трихлорфеніл)-пропіл]-амід 3дифторметил-1-метил-1H-піразол-4-карбонової кислоти (0,5 г, 91%) у вигляді білої кристалічної твердої речовини. Т.пл.: 95-96 °С Фізичні характеристики: 1 H ЯМР: (CDCl3, 400 МГц): 1,89-1,96(m,2H,CH2), 2,91-2,95(m,2H,CH2), 3,66(s,3H,CH3), 3,83-3,86(t,2H,CH2), 3,97(s,3H,CH3), 7,31 (t, 1H,CHF2), 7,28(s,2H,Ar-H), 7,89(s,1H,H піразола) + МС [M+H] 426/428/430/432 Приклад P12: Одержання [3-(4-трет-бутилфеніл)-2-метилпропіл]-метоксиаміду 3дифторметил-1-метил-1H-піразол-4-карбонової кислоти (сполука 2.057): F H F O N N N H3C H3C 15 20 25 O CH3 CH3 CH CH3 3 Розчин 3-дифторметил-1-метил-1H-піразол-4-карбонілхлориду (0,89 г; 4,6 ммоль) в дихлорметані (5 мл) при 0 °C при перемішуванні по краплях додавали до розчину N-[3-(4-третбутилфеніл)-2-метилпропіл]-O-метилгідроксиламіну (1,0 г; 4,2 ммоль), одержаного, як описано в прикладі P25, та триетиламіну (0,86 мл; 6,3 ммоль) в дихлорметані (7 мл). Реакційну суміш перемішували при температурі навколишнього середовища на протязі 1,5 г. Реакційну суміш промивали 1M розчином NaOH (20 мл), 1M розчином HCl (20 мл), розсолом (20 мл) та потім сушили над Na2SO4. Після видалення розчинника залишок очищали за допомогою флешхроматографії на силікагелі (елюент: гексан/етилацетат 7:3). Одержували 0,59 г (35,3 % від теоретичного значення) [3-(4-трет-бутилфеніл)-2-метилпропіл]-метоксиаміду 3-дифторметил-1метил-1H-піразол-4-карбонової кислоти (сполука 2.057) у вигляді смолоподібної речовини. 1 H ЯМР: (CDCl3, 400 МГц): 0,90-0,95(d,3H); 1,30(s,9H); 2,24-2,36(m,1H); 2,39-2,45(dd,1H); 2,67-2,72(dd,1H); 3,58(s,3H); 3,68-3,70(d,2H); 3,98(s,3H); 7,09-7,11(d, 2H); 7,15-7,42(m,3H); 7,90(s,1H). + МС [M+H] 394. Приклад P13: Одержання N-[2-(4-хлорфеніл)-1-метилетил]-O-метилгідроксиламіну: a) Одержання 1-(4-хлорфеніл)-пропан-2-он-O-метилоксиму: CH3 Cl N H3C 30 35 O Розчин 1-(4-хлорфеніл)-пропан-2-ону (8,5 г, 50,4 ммоль) в метанолі (100 мл) обробляли піридином (5,2 мл, 62 ммоль), потім O-метилгідроксиламінгідрохлоридом (5,20 г, 62 ммоль). Одержану суміш перемішували при 23 °C на протязі 16 г. Реакційну суміш виливали в воду (200 мл) та екстрагували дихлорметаном (350 мл). Органічні шари промивали розсолом та сушили над безводним Na2SO4. Після видалення розчинника залишок очищали за допомогою флешхроматографії на силікагелі (елюент: циклогексан/етилацетат 9:1). Одержували 7,38 г (74 % від теоретичного значення) 1-(4-хлорфеніл)-пропан-2-он-O-метилоксиму у вигляді прозорої рідини. 1 H ЯМР: (CDCl3, 400 МГц): 1,71(s,3H); 3,48+3,52(2s,2H); 3,87-3,89(2s,3H); 7,13-7,22(m,4H). + МС [M+H] 198/200. b) Одержання N-[2-(4-хлорфеніл)-1-метилетил]-O-метилгідроксиламіну: CH3 Cl N 40 H3C O Розчин 1-(4-хлорфеніл)-пропан-2-он-O-метилоксиму (1,0 г, 5,1 ммоль) в оцтовій кислоті (7,6 мл) при 10 °C обробляли ціаноборогідридом натрію (641 мг, 10,2 ммоль), який добавляли на протязі 10 хв невеликими порціями, та одержаний розчин перемішували при 24 °C на протязі 5 г. Розчинник випарювали при пониженому тиску (двічі випарювали разом із толуолом) та 18 UA 105778 C2 5 10 залишок диспергували у воді та 1M розчином NaOH значення pH доводили до 9. Водну фазу екстрагували дихлорметаном (220 мл), промивали розсолом та сушили над безводним Na2SO4. Після видалення розчинника (100 мбар; 45 °C) залишок (910 мг) очищали за допомогою флеш-хроматографії на силікагелі (елюент: циклогексан/етилацетат 9:1). Одержували 830 мг (82,0 % від теоретичного значення) N-[2-(4-хлорфеніл)-1-метилетил]-O-метилгідроксиламіну у вигляді прозорої рідини. 1 H ЯМР: (CDCl3, 400 МГц): 1,02-1,06(d,3H); 2,54-2,59(dd,1H); 2,79-2,84(dd,1H); 3,14-3,24(m,1H), 3,52(s,3H); 5,35,5(sbr,1H); 7,12-7,16(m,2H); 7,25-7,28(m,2H). + МС [M+H] 200/202. Приклад P14: Одержання N-[2-(2,4-дихлорфеніл)-1-метилетил]-O-метилгідроксиламіну: a) Одержання 1-(2,4-дихлорфеніл)-пропан-2-он-O-метилоксиму: Cl CH3 N H3C 15 20 25 O Cl Розчин O-метил гідроксиламінгідрохлориду (7,04 г, 0,0843 моль) у суміші води (130 мл) та ТГФ (50 мл) обробляли ацетатом натрію (5,9 г, 0,0720 моль), потім 1-(2,4-дихлорфеніл)-пропан2-оном (10 г, 0,0496 моль) та одержану суміш перемішували при 23 °C на протязі 4 г. Потім реакційну суміш розбавляли етилацетатом, промивали розсолом та сушили над безводним Na2SO4. Розчинник випарювали при пониженому тиску (100 мбар; 45 °C). Одержували 13,5 г (100 % від теоретичного значення) неочищеного 1-(2,4-дихлорфеніл)-пропан-2-он-Oметилоксиму у вигляді прозорої рідини, яку використовували на наступній стадії без додаткової очистки. 1 H ЯМР: (CDCl3, 400 МГц): 1,76(s,3H); 3,60+3,78(2s,2H); 3,87(s,3H); 7,12-7,19(m,2H); 7,39(d, 1H). + МС [M+H] 232/234/236. b) Одержання N-[2-(2,4-дихлорфеніл)-1-метилетил]-O-метилгідроксиламіну: Cl CH3 N H3C 30 35 40 O Cl Розчин 1-(2,4-дихлорфеніл)-пропан-2-он-O-метилоксиму (10,0 г, 0,0431 моль) в оцтовій кислоті (100 мл) при 10 °C обробляли ціаноборогідридом натрію (5,41 г, 0,0862 моль), який добавляли на протязі 15 хв невеликими порціями, та одержаний розчин перемішували при 24 °C на протязі 6 г. Розчинник випарювали при пониженому тиску (двічі випарювали разом із толуолом) та залишок диспергували у воді та 1M розчином NaOH значення pH доводили до 9. Водну фазу екстрагували дихлорметаном (2100 мл), промивали розсолом та сушили над безводним Na2SO4. Розчинник випарювали при пониженому тиску (100 мбар; 45 °C). Одержували 8,13 г (81,3 % від теоретичного значення) неочищеного N-[2-(2,4-дихлорфеніл)-1метилетил]-O-метилгідроксиламіну у вигляді прозорої рідини, яку використовували на наступній стадії без додаткової очистки. 1 H ЯМР: (CDCl3, 400 МГц): 1,04-1,09(d,3H); 2,66-2,71(dd,1H); 2,93-2,99(dd,1H); 3,25-3,33(m,1H), 3,52(s,3H); 5,25,4(sbr,1H); 7,17-7,18(m,2H); 7,35(d, 1H). + МС [M+H] 234/236/238. Приклад P15: Одержання O-метил-N-[1-метил-2-(2,4,6-трихлорфеніл)-етил]-гідроксиламіну: a) Одержання 1,3,5-трихлор-2-((E)-2-нітропропеніл)-бензолу: Cl O + N Cl 45 Cl O CH3 При перемішуванні до розчину 2,4,6-трихлорбензальдегіду (19 г, 90,69 ммоль) та ацетату амонію (16,75 г, 217 ммоль) в оцтовій кислоті (76 мл, 4 об.) при температурі, що дорівнювала 0 °С, по краплях добавляли нітроетан (45,1 мл, 625 ммоль). Реакційну суміш перемішували при 19 UA 105778 C2 5 10 температурі, що дорівнювала 100 °С, на протязі 90 хв. Після завершення реакції за даними ТШХ реакційній суміші давали охолонути до температури навколишнього середовища та її розбавляли охолодженою льодом водою (700 мл), потім водний шар екстрагували етилацетатом (350 мл). Об’єднані шари, що містили етилацетат, промивали насиченим розчином бікарбонату натрію до нейтральної реакції, потім водою, потім промивали розсолом та сушили над безводним Na2SO4, потім розчинники повністю випарювали. Одержану неочищену суміш очищали за допомогою колонкової хроматографії із застосуванням силікагелю із частинками розміром 60-120 мкм та продукт збирали при використанні в якості елюенту 1% етилацетат в гексані та одержували 1,3,5-трихлор-2-((E)-2-нітропропеніл)-бензол (15 г, 61 %) 1 H ЯМР (400 МГц, CDCl3): 2,10(s,3H,CH3), 7,24(s,2H,Ar-H), 7,77(s,1H,CH) b) Одержання 1-(2,4,6-трихлорфеніл)-пропан-2-ону: Cl O Cl 15 20 25 Cl CH3 При перемішуванні до розчину одержаного вище нітростиролу (5 г, 18,72 ммоль) у воді (20 мл) та метанолі (60 мл) в атмосфері азоту при температурі навколишнього середовища добавляли порошкоподібне залізо (2,355 г , 42,12 ммоль), потім концентровану HCl (11,5 мл, 112 ммоль). Реакційну суміш перемішували при 70 °С на протязі 1 г. Через 1 г до цієї реакційної суміші добавляли кількість порошкоподібного заліза що залишилась (2,355 г, 42,12 ммоль) та концентрованої HCl (11,5 мл, 112 ммоль) та перемішування продовжували при 70 °С на протязі 2 г. Після завершення реакції за даними ТШХ реакційну суміш охолоджували до температури навколишнього середовища та метанол видаляли в роторному випарнику. Одержаний залишок потім розбавляли водою та екстрагували етилацетатом (380 мл). В кінці об’єднані шари, що містили етилацетат, промивали водою, потім промивали розсолом та сушили над безводним сульфатом натрію, потім розчинники повністю випарювали. Одержану неочищену суміш очищали за допомогою колонкової хроматографії із застосуванням силікагелю із частинками розміром 60-120 мкм та продукт збирали при використанні в якості елюенту 5 % етилацетату в гексані та одержували 1-(2,4,6-трихлорфеніл)-пропан-2-он (3,7 г, 83,3 %). 1 H ЯМР (400 МГц, CDCl3): 2,26 (s,3H,CH3 ), 4,05(s,2H,CH2), 7,34 (s,2H, Ar-H) c) Одержання 1-(2,4,6-трихлорфеніл)-пропан-2-он-O-метилоксиму: Cl CH3 Cl N H3C 30 35 40 O Cl Розчин O-метилгідроксиламінгідрохлориду (0,79 г, 9,4 ммоль) в метанолі (20 мл) обробляли триетиламіном (1,32 мл, 9,4 ммоль), потім 1-(2,4,6-трихлорфеніл)-пропан-2-оном (1,5 г, 6,31 ммоль). Одержану суміш перемішували при 60 °C на протязі 3 г. Реакцію зупиняли водою та метанол випарювали. Одержану водну суміш екстрагували етилацетатом (350 мл). Об’єднані органічні шари промивали розсолом та сушили над безводним Na 2SO4. Розчинник випарювали при пониженому тиску (100 мбар; 45 °C). Одержану неочищену суміш очищали за допомогою колонкової хроматографії із застосуванням силікагелю із частинками розміром 60-120 мкм та продукт збирали при використанні в якості елюенту 2 % етилацетат в гексані та одержували 1(2,4,6-Трихлорфеніл)-пропан-2-он-O-метилоксим (1,2 г, 76 %), який потім вводили в реакцію відновлення. d) Одержання O-метил-N-[1-метил-2-(2,4,6-трихлорфеніл)-етил]-гідроксиламіну: Cl Cl CH3 N H3C 45 O Cl При перемішуванні до розчину одержаного вище 1-(2,4,6-трихлорфеніл)-пропан-2-он-Oметилоксиму (1,2 г, 4,51 ммоль) в 12 мл оцтової кислоти добавляли ціаноборогідрид натрію (0,568, 9 ммоль). Реакційну суміш перемішували при температурі навколишнього середовища на протязі 6 г. Після завершення реакції за даними ТШХ розчинник випарювали при 20 UA 105778 C2 5 10 пониженому тиску (двічі випарювали разом із толуолом). Одержаний залишок розбавляли водою та 2 н. розчином гідроксиду натрію значення pH доводили до 9, потім екстрагували етилацетатом (350 мл). Об’єднаний органічний шар промивали розсолом, потім сушили над безводним сульфатом натрію, потім розчинник випарювали. Одержану неочищену суміш очищали за допомогою колонкової хроматографії із застосуванням силікагелю із частинками розміром 60-120 мкм та продукт збирали при використанні в якості елюенту 5 % етилацетату в гексані та одержували O-метил-N-[1-метил-2-(2,4,6-трихлорфеніл)-етил]-гідроксиламін (0,91 г, 75 %). 1 H ЯМР (400 МГц, CDCl3): 0,91-0,93 (d,3H), 2,72-2,77 (dd,1H), 2,98-3,03(dd,1H), 3,25-3,30 (m,1H), 3,93 (s,3H), 7,15(s,2H) Приклад P16: Одержання N-{2-[4-(4-хлорфенокси)-феніл]-1-метилетил}-Oметилгідроксиламіну: a) Одержання 1-[4-(4-хлорфенокси)-феніл]-пропан-2-он-O-метилоксиму: O CH3 N H3C 15 20 25 Cl O Розчин 1-[4-(4-хлорфенокси)-феніл]-пропан-2-ону (10,0 г, 38 ммоль) в метанолі (65 мл) обробляли O-метилгідроксиламінгідрохлоридом (3,90 г, 47 ммоль), потім піридином (4,0 мл, 47 ммоль). Одержану суміш перемішували при температурі навколишнього середовища на протязі ночі. Реакційну суміш виливали в воду (150 мл) та екстрагували дихлорметаном (350 мл). Органічні шари промивали розсолом та сушили над безводним Na 2SO4. Одержували 11,0 г (100 % від теоретичного значення) неочищеного 1-[4-(4-хлорфенокси)-феніл]-пропан-2-он-Oметилоксиму у вигляді жовтої рідини, яку використовували на наступній стадії без додаткової очистки. 1 H ЯМР: (CDCl3, 400 МГц): 1,73+1,81(2s,3H); 3,44+3,65(2s,2H); 3,88+3,89(2s,3H); 6,89-6,94(m,4H);7,15-7,28(m,4H). + МС [M+H] 290/292. b) Одержання N-{2-[4-(4-хлорфенокси)-феніл]-1-метилетил}-O-метилгідроксиламіну: O CH3 N H3C 30 35 40 Cl O Розчин неочищеного 1-[4-(4-хлорфенокси)-феніл]-пропан-2-он-O-метилоксиму (6,0 г, 20,7 ммоль) в оцтовій кислоті (50 мл) при 10 °C обробляли ціаноборогідридом натрію (2,6 г, 41,4 ммоль), який добавляли на протязі 10 хв невеликими порціями, та одержаний розчин перемішували при 23 °C на протязі 3,5 г. Розчинник випарювали при пониженому тиску (двічі випарювали разом із толуолом) та залишок диспергували у воді та 1M розчином NaOH значення pH доводили до 11. Водну фазу екстрагували дихлорметаном (220 мл), промивали розсолом та сушили над безводним Na2SO4. Після видалення розчинника (100 мбар; 45 °C) залишок (7,17 г) очищали за допомогою флеш-хроматографії на силікагелі (елюент: циклогексан). Одержували 3,91 г (65,0 % від теоретичного значення) N-{2-[4-(4-хлорфенокси)феніл]-1-метилетил}-O-метилгідроксиламіну у виглядіпрозорої рідини. 1 H ЯМР: (CDCl3, 400 МГц): 1,07-1,09(d,3H); 2,53-2,62(dd,1H); 2,72-2,81(dd,1H); 3,16-3,26(m,1H), 3,54(s,3H); 5,35,5(sbr,1H); 6,86-6,94(m,4H); 7,14-7,18(m,2H);7,24-7,29(m,2H). + МС [M+H] 292/294. Приклад P17: Одержання N-[2-(2,4-дихлорфеніл)-1-метилетил]-гідроксиламіну: a) Одержання 1-(2,4-дихлорфеніл)-пропан-2-оноксиму: Cl CH3 N OH 45 Cl Розчин 1-(2,4-дихлорфеніл)-пропан-2-ону (3,46 г, 16,7 ммоль) в метанолі (40 мл) обробляли гідроксиламінгідрохлоридом (1,40 г, 20,6 ммоль), потім піридином (1,7 мл, 20,6 ммоль). 21 UA 105778 C2 5 Одержану суміш перемішували при температурі навколишнього середовища на протязі 16 г. Реакційну суміш виливали в воду (200 мл). Твердий продукт збирали за допомогою фільтрування, промивали водою та сушили (40 °C, 100 мбар). Одержували 3,63 г (100 % від теоретичного значення) 1-(2,4-дихлорфеніл)-пропан-2-оноксиму у вигляді білої твердої речовини (Т. пл. 120-124 °C). 1 H ЯМР: (CDCl3, 400 МГц): 1,86(s,3H); 3,61(s,2H); 7,12-7,21(m,2H); 7,39-7,41(d,1H); 8,2(sbr,1H). + МС [M+H] 218/220/222. b) Одержання N-[2-(2,4-дихлорфеніл)-1-метилетил]-гідроксиламіну: Cl CH3 N 10 15 20 25 OH Cl Розчин 1-(2,4-дихлорфеніл)-пропан-2-оноксиму (3,3 г, 15,1 ммоль) в оцтовій кислоті (30 мл) при 10 °C обробляли ціаноборогідридом натрію (1,90 г, 30,3 ммоль), який добавляли на протязі 10 хв невеликими порціями, та одержаний розчин перемішували при 23 °C на протязі 5 г. Розчинник випарювали при пониженому тиску (двічі випарювали разом із толуолом) та залишок диспергували у воді та 1M розчином NaOH значення pH доводили до 10. Водну фазу екстрагували дихлорметаном (320 мл), промивали розсолом та сушили над безводним Na2SO4. Після видалення розчинника (100 мбар; 45 °C) одержували 3,18 г (96,0 % від теоретичного значення) N-[2-(2,4-дихлорфеніл)-1-метилетил]-гідроксиламіну у вигляді білої твердої речовини (Т. пл. 83-86°C). 1 H ЯМР: (CDCl3, 400 МГц): 1,08-1,11(d,3H); 2,69-2,74(dd,1H); 2,98-3,03(dd,1H); 3,24-3,32(m,1H); 5,3-5,6(sbr,1H); 7,187,19(m,2H); 7,39(m,1H);7,5-8,2(sbr,1H). + МС [M+H] 220/222/224. Приклад P18: Одержання N-[2-(2,4-дихлорфеніл)-1-метилетил]-O-етилгідроксиламіну: a) Одержання 1-(2,4-дихлорфеніл)-пропан-2-он-O-етилоксиму: Cl CH3 N O Cl CH3 30 35 Розчин O-етилгідроксиламінгідрохлориду (4,10 г, 42,1 ммоль) у суміші води (130 мл) та ТГФ (50 мл) обробляли ацетатом натрію (2,95 г, 72 ммоль), потім 1-(2,4-дихлорфеніл)-пропан-2-оном (5 г, 24,8 ммоль) та одержану суміш перемішували при 23 °C на протязі 4 г. Потім реакційну суміш розбавляли етилацетатом, промивали розсолом та сушили над безводним Na 2SO4. Розчинник випарювали при пониженому тиску (90 мбар; 45 °C). Одержували 6,0 г (99 % від теоретичного значення) неочищеного 1-(2,4-дихлорфеніл)-пропан-2-он-O-етилоксиму у вигляді прозорої рідини, що представляла собою суміш E/Z-ізомеров, яку використовували на наступній стадії без додаткової очистки. 1 H ЯМР: (CDCl3, 400 МГц): 1,23-1,28(2t,3H); 1,74+1,76(2s,3H); 3,60+3,78(2s,3H); 4,09-4,16(2q,2H); 7,12-7,19(m,2H); 7,38(d, 1H). + МС [M+H] 246/248/250. b) Одержання N-[2-(2,4-дихлорфеніл)-1-метилетил]-O-етилгідроксиламіну: Cl CH3 N O 40 Cl CH3 Розчин 1-(2,4-дихлорфеніл)-пропан-2-он-O-метилоксиму (10,0 г, 0,0406 моль) в оцтовій кислоті (100 мл) при 10 °C обробляли ціаноборогідридом натрію (5,41 г, 0,0862 моль), який добавляли на протязі 10 хв невеликими порціями, та одержаний розчин перемішували при 24 °C на протязі 6 г. Розчинник випарювали при пониженому тиску (двічі випарювали разом із 22 UA 105778 C2 5 10 толуолом) та залишок диспергували у воді та 1M розчином NaOH значення pH доводили до 9. Водну фазу екстрагували дихлорметаном (2100 мл), промивали розсолом та сушили над безводним Na2SO4. Розчинник випарювали при пониженому тиску (100 мбар; 45 °C). Одержували 5,09 г (51,0 % від теоретичного значення) неочищеного N-[2-(2,4-дихлорфеніл)-1метилетил]-O-етилгідроксиламін у вигляді прозорої рідини, яку використовували на наступній стадії без додаткової очистки. 1 H ЯМР: (CDCl3, 400 МГц): 0,98-1,02+1,08-1,12(2d,3H); 1,13-1,18(2t,3H); 2,63-2,68+2,70-2,78(2dd,1H); 2,94-3,10+3,153,21(m,1H), 3,25-3,31+3,71-3,78(2q,2H); 5,0-5,5(sbr,1H); 7,16-7,19(m,2H); 7,34-7,36(m,1H). + МС [M+H] 248/250/252. Приклад P20: Одержання N-[2-(2,4-дихлорфеніл)-1-метилетил]-O-ізопропілгідроксиламіну: a) Одержання 1-(2,4-дихлорфеніл)-пропан-2-он-O-ізопропілоксиму: Cl CH3 N H3C H 15 20 25 O Cl CH3 Розчин 1-(2,4-дихлорфеніл)-пропан-2-ону (5,1 г, 25,0 ммоль) в метанолі (45 мл) обробляли O-ізопропілгідроксиламінгідрохлоридом (3,50 г, 31 ммоль), потім піридином (2,6 мл, 31 ммоль) та одержану суміш перемішували при 23 °C на протязі ночі. Реакційну суміш виливали в воду (100 мл) та екстрагували дихлорметаном (350 мл). Органічні шари промивали розсолом та сушили над безводним Na2SO4. Розчинник випарювали при пониженому тиску (90 мбар; 45 °C). Одержували 6,48 г (99 % від теоретичного значення) неочищеного 1-(2,4-дихлорфеніл)-пропан2-он-O-ізопропілоксиму у вигляді прозорої рідини, що представляла собою сумішшю E/Zізомеров, яку використовували на наступній стадії без додаткової очистки. 1 H ЯМР: (CDCl3, 400 МГц): 1,23-1,26(d,6H); 1,74(s,3H);3,60+3,78(2s,3H); 4,25-4,38(2m,1H); 7,14-7,21(m,2H); 7,39(d, 1H). + МС [M+H] 260/262/264. b) Одержання N-[2-(2,4-дихлорфеніл)-1-метилетил]-O-ізопропілгідроксиламіну: Cl CH3 N H3C H 30 35 40 O Cl CH3 Розчин 1-(2,4-дихлорфеніл)-пропан-2-он-O-ізопропілоксиму (6,0 г, 23 ммоль) в оцтовій кислоті (40 мл) при 10 °C обробляли ціаноборогідридом натрію (2,90 г, 46 ммоль), який добавляли на протязі 15 хв невеликими порціями, та одержаний розчин перемішували при 24 °C на протязі 4 г. Розчинник випарювали при пониженому тиску (двічі випарювали разом із толуолом) та залишок диспергували у воді та 1M розчином NaOH значення pH доводили до 10. Водну фазу екстрагували дихлорметаном (280 мл), промивали розсолом та сушили над безводним Na2SO4. Розчинник випарювали при пониженому тиску (100 мбар; 45 °C). Одержували 5,90 г (98,0 % від теоретичного значення) неочищеного N-[2-(2,4-дихлорфеніл)-1метилетил]-O-ізопропілгідроксиламіну у вигляді прозорої рідини, яку використовували на наступній стадії без додаткової очистки. 1 H ЯМР: (CDCl3, 400 МГц): 1,03-1,07(d,3H); 1,13-1,19(m,6H); 2,61-2,68+2,94-3,03(2dd,2H); 3,21-3,31(m,1H), 3,783,84(m,1H);5,2(sbr,1H); 7,14-7,18(m,2H); 7,35-7,36(m,1H). + МС [M+H] 262/264/266. Приклад P21: Одержання O-метил-N-[2-(2,4,6-трихлорфеніл)-етил]-гідроксиламіну: a) Одержання 1,3,5-трихлор-2-хлорметилбензолу: Cl Cl Cl Cl При перемішуванні до розчину 2,4,6-трихлорбензилового спирту (10,0 г; 47,3 ммоль) в 23 UA 105778 C2 5 10 хлороформі (100 мл) в атмосфері азоту при 0 °С на протязі 15 хв повільно добавляли тіонілхлорид (6,07 мл, 85,1 ммоль), потім каталітичну кількість ДМФ (диметилформамід). Реакційну суміш перемішували при температурі навколишнього середовища на протязі 3 г. Реакцію зупиняли за допомогою 50 мл води; водний шар екстрагували за допомогою ДХМ (дихлорметан) (3100 мл). Об’єднаний органічний шар промивали 5 % розчином бікарбонату натрію (250 мл), потім розсолом (50 мл) та сушили над безводним сульфатом натрію. Розчинник випарювали при пониженому тиску. Одержували 10,9 г (100,0 % від теоретичного значення) 1,3,5-трихлор-2-хлорметилбензолу у вигляді білої твердої речовини. 1 H ЯМР (CDCl3, 400 МГц): = 7,37 (2H, s); 4,82 (2H, s) Масс-спектр: M = 229,8 b) Одержання (2,4,6-трихлорфеніл)-ацетонітрилу: Cl N Cl Cl 15 20 При перемішуванні до розчину 1,3,5-трихлор-2-хлорметилбензолу (12,85 г, 58,8 ммоль) в етанолі (45 мл) при температурі навколишнього середовища добавляли розчин NaCN (3,20, 67,0 ммоль) у воді (15 мл). Реакційну суміш кип’ятили із зворотним холодильником на протязі 4 г до завершення реакції. Етанол випарювали та реакційну суміш розбавляли водою (50 мл). Водний шар екстрагували за допомогою EtOAc (3100 мл). Об’єднаний органічний шар промивали розсолом (30 мл) та сушили над сульфатом натрію. Органічний шар концентрували у вакуумі та одержували білу тверду речовину. Неочищений продукт очищали за допомогою хроматографії на колонці із силікагелем та одержували 9,0 г (75,0 % від теоретичного значення) (2,4,6-трихлорфеніл)-ацетонітрилу. 1 H ЯМР (CDCl3, 400 МГц): 7,41 (s, 2H); 3,97 (s, 2H). Масс-спектр: M = 218,9 c) Одержання (2,4,6-трихлорфеніл)-ацетальдегіду: Cl O 25 30 35 Cl Cl При перемішуванні до холодного (-70 °C) розчину (2,4,6-трихлорфеніл)-ацетонітрилу (5,7 г, 26,0 ммоль) в толуолі (120 мл) в атмосфері N2 на протязі 30 хв по краплях добавляли DIBAL-H (28,1 мл 1M розчин в ТГФ, 28,6 ммоль). Реакційну суміш перемішували при -70 °C на протязі 3 г. Після завершення реакції її зупиняли при -40 °C шляхом додавання по краплях HCl (60 мл, 2 н. розчин) та суміш витримували при температурі навколишнього середовища на протязі 30 хв. Шар, що містив толуол, відділяли та водний шар екстрагували етилацетатом (3100 мл). Об’єднаний органічний шар промивали розсолом (30 мл) та сушили над сульфатом натрію. Органічний шар концентрували у вакуумі. Одержували 4,5 г (78,0 % від теоретичного значення) (2,4,6-трихлорфеніл)-ацетальдегіду у вигляді білої твердої речовини. 1 H ЯМР (CDCl3, 400 МГц: 9,70 (s, 1H); 7,38 (s, 2H); 4,08 (s, 2H) Масс-спектр: M = 246,9 Приклад P22: Одержання N-[2-(2,4-дихлорфеніл)-пентил]-O-метилгідроксиламіну: a) Одержання 2-(2,4-дихлорфеніл)-пентаналь-O-метилоксиму: Cl Cl N H3C O CH3 40 45 Розчин 2-(4-хлорфеніл)-пентаналя 43,0 ммоль) в метанолі (75 мл) обробляли Oметилгідроксиламінгідрохлоридом 4,40 г, 53 ммоль), потім піридином 4,5 мл, 53 ммоль). Одержану суміш перемішували при 23 °C на протязі ночі. Реакційну суміш виливали в воду (200 мл) та екстрагували дихлорметаном (350 мл). Органічні шари промивали розсолом та сушили над безводним Na2SO4. Розчинник випарювали при пониженому тиску (100 мбар; 45 °C). Одержували 11,20 г (100,0 % від теоретичного значення) неочищеного 2-(2,4-дихлорфеніл)пентаналь-O-метилоксиму у вигляді прозорої рідини, яку використовували на наступній стадії 24 UA 105778 C2 без додаткової очистки. + МС [M+H] 260/262/264. b) Одержання N-[2-(2,4-дихлорфеніл)-пентил]-O-метилгідроксиламіну: Cl Cl N H3C O CH3 5 10 15 20 Розчин 2-(2,4-дихлорфеніл)-пентаналь-O-метилоксиму (6,0 г, 23 ммоль) в оцтовій кислоті (50 мл) при 10 °C обробляли ціаноборогідридом натрію (2,90 г, 46 ммоль), який добавляли на протязі 10 хв невеликими порціями, та одержаний розчин перемішували при 24 °C на протязі 4 г. Розчинник випарювали при пониженому тиску (двічі випарювали разом із толуолом) та залишок диспергували у воді та 1M розчином NaOH значення pH доводили до 11. Водну фазу екстрагували дихлорметаном (250 мл), промивали розсолом та сушили над безводним Na2SO4. Після видалення розчинника (100 мбар; 45 °C), залишок (6,2 г) очищали за допомогою флеш-хроматографії на силікагелі (250 г; елюент: циклогексан). Одержували 5,15 г (79,0 % від теоретичного значення) N-[2-(2,4-дихлорфеніл)-пентил]-O-метилгідроксиламіну у вигляді прозорої рідини. 1 H ЯМР: (CDCl3, 400 МГц): 0,82-0,89(t,3H); 1,12-1,27(m,2H); 1,49-1,58(m,1H); 1,63-1,72(m,1H); 3,05-3,10(dd,1H); 3,123,18(dd,1H); 3,47(s,3H), 3,50-3,51(m,1H); 5,0-5,50(sbr,1H); 7,14-7,16(m,1H); 7,21-7,25(m,1H); 7,377,39(m,1H). + МС [M+H] 262/264/266. Приклад P23: Одержання O-метил-N-[1-метил-3-(2,4,6-трихлорфеніл)-пропіл]гідроксиламіну: a) Одержання 3-(2,4,6-трихлорфеніл)-пропіонової кислоти: O Cl OH Cl Cl 25 30 35 До кислоти Мельдрума (2,06 г, 14,32 ммоль) при перемішуванні при температурі навколишнього середовища додавали ТЕАФ (7,05 мл) та реакційну суміш витримували в атмосфері азоту. Через 10 хв до реакційної суміші добавляли 2,4,6-трихлорбензальдегід (3г, 14,32 ммоль). Потім суміш кип’ятили із зворотним холодильником при 120 °C на протязі 3 г. Після завершення реакції суміш охолоджували до температури навколишнього середовища та виливали в суміш води із льодом (50 мл). Потім водний шар екстрагували етилацетатом (380 мл), об’єднаний органічний шар промивали розсолом (40 мл) та сушили над сульфатом натрію. Органічний шар концентрували у вакуумі. Одержували 3,10 г (86,0 % від теоретичного значення) 3-(2,4,6-трихлорфеніл)-пропіонової кислоти у вигляді білої твердої речовини. 1 H ЯМР (400 МГц, CDCl3): 7,32(s, 2H); 3,26-3,22 (m, 2H); 2,63-2,58 (m, 2H). + МС [M+H] 253/255/257 Одержання ТЕАФ (триетиламонійформіат): До розчину мурашиної кислоти (1,12 г ~0,93 мл, 24,5 ммоль) в атмосфері азоту при 0 °C повільно добавляли триетиламін (1 г, ~1,37 мл, 9,8 ммоль) та суміш перемішували на протязі 1,5 г при температурі навколишнього середовища. b) Одержання N-метокси-N-метил-3-(2,4,6-трихлорфеніл)-пропіонаміду: O Cl N 40 45 Cl Cl O CH3 CH3 До розчину хлорангідриду кислоти в хлороформі [хлорангідрид кислоти одержували із відповідної 3-(2,4,6-трихлорфеніл)-пропіонової кислоти (5 г,19,7 ммоль) та тіонілхлориду (5,87г, 49,4 ммоль) при кип’ятінні із зворотним холодильником при 110 °C на протязі 3 г] при 0 °C по краплях добавляли N,O-диметилгідроксиламінгідрохлорид (2,3 г, 23,9 ммоль), потім піридин (3,77 мл, 47,7 ммоль). Реакційну суміш перемішували при температурі навколишнього середовища на протязі 3 г. Після завершення реакції реакційну суміш розбавляли за допомогою 25 UA 105778 C2 5 70 мл ДХМ та 40 мл води. Органічний шар відділяли та водний шар двічі екстрагували за допомогою ДХМ (50 мл2). Об’єднаний органічний шар промивали розсолом (40 мл) та сушили над сульфатом натрію. Після видалення розчинника залишок очищали за допомогою хроматографії на силікагелі. Одержували 3,0 г (52,0 % від теоретичного значення) N-метокси-Nметил-3-(2,4,6-трихлорфеніл)-пропіонаміду у вигляді твердої речовини. 1 H ЯМР (CDCl3, 400 МГц): 7,31(s, 2H); 3,67 (s, 3H); 3,24-3,19 (m, 2H); 3,19 (s, 3H); 2,67-2,63 (m, 2H) + МС [M+H] 296/298/300 c) Одержання 4-(2,4,6-трихлорфеніл)-бутан-2-ону: O Cl CH3 10 15 20 Cl Cl При перемішуванні до холодного розчину (0 °C) N-метокси-N-метил-3-(2,4,6-трихлорфеніл)пропіонаміду (1 г, 3,37 ммоль) в ТГФ (15 мл) в атмосфері азоту добавляли MeMgI (1,3 мл 3M розчину в ефірі, 3,9 ммоль), та перемішування продовжували при 0 °C на протязі 2 г. Реакцію зупиняли при 0 °C 5% розчином HCl (10 мл) та водний шар екстрагували за допомогою EtOAc (330 мл). Об’єднаний органічний шар промивали за допомогою 20 мл розсолу та сушили над сульфатом натрію; концентрували у вакуумі та одержували майже білу тверду речовину. Залишок очищали за допомогою хроматографії на силікагелі. Одержували 0,50 г (60,0 % від теоретичного значення) 4-(2,4,6-трихлорфеніл)-бутан-2-ону у вигляді твердої речовини. 1 H ЯМР (CDCl3, 400 МГц): 2,14(s,3H,CH3), 2,72-2,76(t,2H,CH2), 2,93-2,97(t,2H,CH2), 7,13-7,16+7,16-7,19(2d,2H,Ar-H), 7,34-7,35(d,1H,Ar-H). + МС [M+H] 252/254/256 d) Одержання O-метил-N-[1-метил-3-(2,4,6-трихлорфеніл)-пропіл]- гідроксиламіну: CH3 N Cl O CH3 Cl 25 30 35 40 45 50 Cl При перемішуванні до розчину 4-(2,4,6-трихлорфеніл)-бутан-2-ону (0,9 г, 3,57 ммоль) в метанолі (5 мл) добавляли триетиламін (0,73 мл, 5,3 ммоль) та Oметилгідроксиламінгідрохлорид (0,447 г, 5,3 ммоль). Реакційну суміш нагрівали при температурі, що дорівнювала 60 °С, на протязі 3 г. Після завершення реакції за даними ТШХ реакційній суміші давали охолонути до температури навколишнього середовища. Реакційну суміш розбавляли водою та метанол випарювали, потім водний шар екстрагували етилацетатом (330 мл). Об’єднані шари, що містили етилацетат, промивали водою, потім розсолом та сушили над сульфатом натрію, потім розчинники повністю випарювали та одержували неочищений 4-(2,4,6-трихлорфеніл)-бутан-2-он-O-метилоксим (0,980 г), який вводили в реакцію відновлення без будь-якої додаткової очистки. До розчину 4-(2,4,6-трихлорфеніл)-бутан-2-он-O-метилоксиму (0,650 г, 2,33 ммоль) в оцтовій кислоті добавляли ціаноборогідрид натрію (0,293 г, 4,66 ммоль). Реакційну суміш перемішували при кімнатній температурі на протязі 6 г. Після завершення реакції за даними ТШХ із реакційній суміші видаляли оцтову кислоту шляхом азеотропної перегонки. Потім залишок підлуговували 10 % розчином NaOH та екстрагували етилацетатом (330 мл). Об’єднані шари, що містили етилацетат, промивали водою, потім розсолом та сушили над сульфатом натрію, потім концентрували. Одержану неочищену суміш очищали за допомогою колонкової хроматографії із застосуванням силікагелю із частинками розміром 60-120 мкм та продукт збирали при використанні в якості елюенту 3 % етилацетату в гексані та одержували O-метил-N-[1-метил-3(2,4,6-трихлорфеніл)-пропіл]-гідроксиламін (0,6 г, 90 %). 1 H ЯМР (400 МГц, CDCl3): 1,21(d,3H), 1,52-1,59(m,1H), 1,68-1,76(m,1H), 2,80-2,83(q,2H), 3,06-3,13(m,1H), 3,55 (s,3H), 5,45(s,1H), 7,29(s,2H) Фізичні характеристики: 1 H ЯМР (CDCl3, 400 МГц): 1,21(d,3H,CH3), 1,52-1,59(m,1H,CH2), 1,68-1,76(m,1H,CH2), 2,80-2,83(m,2H,CH2), 3,063,13(m,1H,CH), 1,45(s,1H,NH), 7,29(s,2H,Ar-H) 26 UA 105778 C2 Приклад P24: Одержання O-метил-N-[3-(2,4,6-трихлорфеніл)-пропіл]-гідроксиламіну: a) Одержання 3-(2,4,6-трихлорфеніл)-пропан-1-олу: Cl OH Cl Cl 5 Фізичні характеристики: 1 H ЯМР (CDCl3, 400 МГц): 1,79-1,86(m,2H,CH2), 2,95-2,99(m,2H,CH2), 3,71-3,749(t,2H,CH2), 7,30(s,2H,Ar-H) b) Одержання 3-(2,4,6-трихлорфеніл)-пропіонового альдегіду: Cl O Cl Cl 10 15 20 25 При перемішуванні до розчину N-метокси-N-метил-3-(2,4,6-трихлорфеніл)-пропіонаміду (0,9 г, 3,04 ммоль) в толуолі (18 мл) при -60 °С на протязі 20 хв повільно по краплях добавляли DIBAL-H (15,2 мл, 15,2 ммоль) та реакційну суміш перемішували при -60 °С на протязі 3 г. Потім реакцію зупиняли шляхом додавання по краплях розбавленої HCl (20 мл), потім суміш розбавляли водою (10 мл) та перемішували на протязі 15 хв. Шар, що містив толуол, та одержану водну фазу екстрагували етилацетатом (30 мл3). Об’єднаний органічний шар промивали водою та розсолом. Потім органічний шар сушили над безводним сульфатом натрію та концентрували при пониженому тиску. Одержану неочищену суміш очищали за допомогою колонкової хроматографії (силікагель із частинками розміром 60-120 мкм, 2 % етилацетату в гексані) та одержували 3-(2,4,6-трихлорфеніл)-пропіоновий альдегід (0,45 г, 62,5 %) у вигляді білої кристалічної твердої речовини 1 H ЯМР (400 МГц, CDCl3): 2,68(t,2H), 3,19-3,23(t,2H), 7,29(s,2H), 9,86(s,1H) + МС [M+H] : 235,9/239,9 Фізичні характеристики: 1 H ЯМР (CDCl3, 400 МГц): 2,68-2,72(m,2H,CH2), 3,19-3,23(m,2H,CH2), 7,29(s,2H,Ar-H), 9,86(s,1H,CHO) c) Одержання O-метил-N-[3-(2,4,6-трихлорфеніл)-пропіл]-гідроксиламіну: Cl N Cl 30 35 40 45 O CH3 Cl До розчину 3-(2,4,6-трихлорфеніл)-пропіонового альдегіду (0,45 г, 1,8 ммоль) в метанолі (5 мл) добавляли триетиламін (0,4 мл, 2,8 ммоль), потім O-метилгідроксиламінгідрохлорид (0,24 г, 2,8 ммоль) та суміш нагрівали при 60 °С на протязі 2 г. Після завершення реакції за даними ТШХ реакційній суміші давали охолонути до температури навколишнього середовища та реакцію зупиняли водою та метанол видаляли в роторному випарнику. Одержаний водний розчин екстрагували етилацетатом (330 мл). Об’єднані шари, що містили етилацетат, промивали водою та сушили над сульфатом натрію, потім розчинники повністю випарювали та одержували неочищену суміш. Одержану неочищену суміш очищали за допомогою колонкової хроматографії (силікагель із частинками розміром 60-120 мкм, 1 % етилацетату в гексані) та одержували O-метилоксим 3-(2,4,6-трихлорфеніл)-пропіонового альдегіду (0,5 г, 80 %). При перемішуванні до розчину O-метилоксиму 3-(2,4,6-трихлорфеніл)-пропіонового альдегіду в оцтовій кислоті при 0-10 °С добавляли NaCNBH3. Потім реакційну суміш перемішували при температурі навколишнього середовища на протязі 6 г. Після завершення реакції за даними ТШХ оцтову кислоту видаляли шляхом азеотропної перегонки. Залишок підлуговували 10 % розчином NaOH та водний розчин екстрагували етилацетатом (330 мл) . Об’єднаний органічний шар промивали водою та розсолом. Потім органічний шар сушили над безводним сульфатом натрію та концентрували при пониженому тиску. Одержану неочищену суміш очищали за допомогою колонкової хроматографії (силікагель із частинками розміром 60120 мкм, 3 % етилацетату в гексані) та одержували O-метил-N-[3-(2,4,6-трихлорфеніл)-пропіл]гідроксиламін (0,4 г, 88 %). 1 H ЯМР (400 МГц, ДМСО): 1,74-1,82(m,2H), 2,92-3,01(m,4H), 3,55(s,3H), 5,60(s,1H), 7,29(s,2H) + МС [M+H] : 268,13/272,17 27 UA 105778 C2 5 Фізичні характеристики: 1 H ЯМР (CDCl3, 400 МГц): 1,74-1,82(m,2H,CH2), 2,92-3,01(m,4H,CH2-CH2), 3,55(s,3H,CH3), 5,60(s,1H,NH), 7,29(s,2H,Ar-H). Приклад P25: Одержання N-[3-(4-трет-бутилфеніл)-2-метилпропіл]-O-метилгідроксиламіну: a) Одержання O-метилоксиму 3-(4-трет-бутилфеніл)-метилпропіонового альдегіду: H3C O N CH3 CH3 CH CH3 3 10 15 Розчин O-метилгідроксиламінгідрохлориду (3,30 г, 0,041 моль) у суміші води (65 мл) та ТГФ (25 мл) обробляли ацетатом натрію (2,85 г, 0,0348 моль), потім 3-(4-трет-бутилфеніл)метилпропіоновим альдегідом (5 г, 0,024 моль) та одержану суміш перемішували при 23 °C на протязі 4 г. Потім реакційну суміш розбавляли етилацетатом, промивали розсолом та сушили над безводним Na2SO4. Розчинник випарювали при пониженому тиску (100 мбар; 45 °C). Одержували 6,01 г (100 % від теоретичного значення) неочищеного O-метилоксиму 3-(4-третбутилфеніл)-метилпропіонового альдегіду у вигляді прозорої рідини, яку використовували на наступній стадії без додаткової очистки. + МС [M+H] 234. b) Одержання N-[3-(4-трет-бутилфеніл)-2-метилпропіл]-O-метилгідроксиламіну: H3C O N CH3 CH3 CH CH3 3 20 25 30 Розчин O-метилоксиму 3-(4-трет-бутилфеніл)-метилпропіонового альдегіду (5,0 г, 0,0213 моль) в оцтовій кислоті (50 мл) при 10 °C обробляли ціаноборогідридом натрію (2,63 г, 0,042 моль), який добавляли на протязі 15 хв невеликими порціями, та одержаний розчин перемішували при 24 °C на протязі 6 г. Розчинник випарювали при пониженому тиску (двічі випарювали разом із толуолом) та залишок диспергували у воді та 1M розчином NaOH значення pH доводили до 9. Водну фазу екстрагували дихлорметаном (2100 мл), промивали розсолом та сушили над безводним Na2SO4. Розчинник випарювали при пониженому тиску (100 мбар; 45 °C). Одержували 4,52 г (89,5 % від теоретичного значення) неочищеного N-[3-(4-третбутилфеніл)-2-метилпропіл]-O-метилгідроксиламіну у вигляді прозорої рідини, яку використовували на наступній стадії без додаткової очистки. + МС [M+H] 236. Приклад P26: Одержання 2,4-дихлор-1-(1-метокси-2-нітропропіл)-бензолу: a) Одержання 2,4-дихлор-1-((E)-2-нітропропеніл)-бензолу: O Cl + N 35 40 O CH3 Cl В колбі для сульфірування до льодяної оцтової кислоти (600 мл) добавляли 2,4дихлорбензальдегід (77 г, 0,44 моль), нітроетан (216 мл, 3,04 моль) та ацетат амонію (81,4 г, 1,06 моль). Одержаний розчин нагрівали при 90 °C на протязі 3 г. Після видалення розчинника добавляли воду із льодом (400 мл). Твердий продукт збирали за допомогою фільтрування, промивали водою та перекристалізовували із етанолу. Одержували 55,9 г (55 % від теоретичного значення) 2,4-дихлор-1-((E)-2-нітропропеніл)-бензолу у вигляді жовтої твердої речовини (Т. пл. 79-81 °C). 1 H ЯМР (400 МГц, CDCl3): 8,11(s,1H), 7,51(d,1H), 7,34(dd,1H), 7,27(d,1H), 2,33(s,3H,CH3). b) Одержання 2,4-дихлор-1-(1-метокси-2-нітропропіл)-бензолу: CH3 Cl O O + N Cl O CH3 28
ДивитисяДодаткова інформація
Автори російськоюRajan, Ramya, Walter, Harald, Stierli, Daniel
МПК / Мітки
МПК: A01N 43/26, C07C 239/00
Мітки: мікробіоциди, зараженням, корисних, спосіб, фітопагенними, композиція, піразол-4-n-алкоксикарбоксаміди, використанням, рослин, боротьби, містить, попередження, мікроорганізмами
Код посилання
<a href="https://ua.patents.su/42-105778-pirazol-4-n-alkoksikarboksamidi-yak-mikrobiocidi-kompoziciya-shho-kh-mistit-ta-sposib-borotbi-iz-zarazhennyam-korisnikh-roslin-fitopagennimi-mikroorganizmami-abo-jjogo-poperedzhenn.html" target="_blank" rel="follow" title="База патентів України">Піразол-4-n-алкоксикарбоксаміди як мікробіоциди, композиція, що їх містить, та спосіб боротьби із зараженням корисних рослин фітопагенними мікроорганізмами або його попередження з їх використанням</a>
Попередній патент: Фармацевтична композиція ефективного інгібітора вгс для перорального введення
Наступний патент: Агоністи рецептора gpr120 та їх застосування
Випадковий патент: Антагоністи кортикотропін-рилізинг фактора, способи їх одержанння, фармацевтична композиція та спосіб лікування