Антагоністи кортикотропін-рилізинг фактора, способи їх одержанння, фармацевтична композиція та спосіб лікування
Формула / Реферат
1. Соединение формулы I:
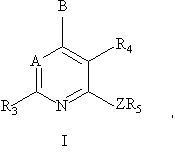
или его фармацевтически приемлемая соль, в которой
A - -CR7 или N;
В - -NR1R2, -CR1R2R11, -С(=CR2R12)R1, -NHCHR1R2, -OCHR1R2, -SCHR1R2, -CHR2OR12, -CHR2SR12, -C(S)R2 или -C(O)R2;
Z - NH, O, S, -N(C1-C2алкил) или -С(R13R14), где R13 и R14 независимо друг от друга представляют собой водород, трифторметил или метил, либо один из элементов R13 и R14 является цианогруппой, а другой - водородом или метилом;
R1 - C1-С6алкил, который может быть необязательно замещен одним или двумя заместителями R8, независимо друг от друга выбираемыми из группы, включающей гидрокси, фтор, хлор, бром, йод, СF3, C1-C4алкокси, -O-СО-(C1-C4алкил), -O-CO-NH(C1-C4алкил), -O-CO-N(C1-C4алкил)(C1-C2алкил), -NH(C1-C4алкил), -N(C1-C2алкил)(C1-C4алкил), -S(C1-C4алкил), -N(C1-C4алкил)СО(C1-C4алкил), -NHCO(C1-C4алкил), -СОО(C1-C4алкил), -CONH(C1-C4алкил), -CON(C1-C4алкил)(C1-C2алкил), CN, NO2, -SO(C1-C4алкил) и -SO2(C1-C4алкил), где C1-C6алкил и (C1-C4)алкильные части вышеуказанных групп R1 могут необязательно иметь одну углерод-углеродную двойную или тройную связь;
R2 - C1-C12алкил, арил или -(C1-C4алкилен)арил, где арилом является фенил, нафтил, тиенил, бензотиенил, пиридил, хинолил, пиразинил, пиримидил, имидазолил, фуранил, бензофуранил, бензотиазолил, изотиазолил, бензизотиазолил, бензизоксазолил, бензимидазолил, индолил или бензоксазолил; 3-8-членный циклоалкил или -(C1-C6алкилен)циклоалкил, где один или два атома углерода в кольце циклоалкила, имеющего не менее 4 членов, и в циклоалкильной части -(C1-C6алкилен)циклоалкила, имеющего не менее 4 членов в кольце, могут быть необязательно замещены атомом кислорода, серы или N-R9, где R9 является водородом или C1-C4алкилом; где каждая из вышеуказанных групп R2 может быть необязательно замещена одним-тремя заместителями, которые независимо друг от друга выбирают из хлора, фтора и C1-C4алкила, или одним заместителем, выбираемым из группы, включающей бром, йод, C1-C6алкокси, -O-СО-(C1-C6алкил), -O-CO-N(C1-C4алкил)(C1-C2алкил), -S(C1-C6алкил), CN, NO2, -SO(C1-C4алкил) и -SO2(C1-C4алкил), и где C1-C12алкил и C1-C4алкиленовая часть -(C1-C4алкилен)арила могут необязательно иметь одну углерод-углеродную двойную или тройную связь;
либо -NR1R2 или -CR1R2R11 могут образовывать насыщенное 5-8-членное карбоциклическое кольцо, которое может необязательно иметь одну или две углерод-углеродные двойные связи и в котором один или два атома углерода могут быть замещены атомом кислорода или серы;
R3 - метил, этил, фтор, хлор, бром, йод, циано, метокси, ОСF3, метилтио, метилсульфонил, СН2ОН или СН2ОСН3;
R4 - водород, C1-C4алкил, фтор, хлор, бром, йод, C1-C4алкокси, трифторметокси, -СН2OСН3, -СН2OСН2СН3, -СН2СН2OСН3, -СН2OF3, СF3, амино, нитро, -NH(C1-C4алкил), -N(СН3)2, NНСОСН3, -NНСОNНСН3, -SOn(C1-C4алкил), где n означает 0, 1 или 2, циано, гидрокси, -СО(C1-C4алкил), -СНО, циано или -СОО(C1-C4алкил), где C1-C4алкил может необязательно иметь одну двойную или тройную связь и может быть замещен одним заместителем, выбираемым из группы, включающей гидрокси, амино, -NНСОСН3, -NH(C1-C2алкил), -N(C1-C2алкил)2, -COO(C1-C4алкил), -CO(C1-C4алкил), C1-C3алкокси, C1-C3тиоалкил, фтор, хлор, циано и нитро;
R5 - фенил, нафтил, тиенил, бензотиенил, пиридил, хинолил, пиразинил, пиримидил, фуранил, бензофуранил, бензотиазолил или индолил, где каждая из вышеуказанных групп R5 замещена одним-тремя заместителями, которые независимо друг от друга выбирают из фтора, хлора, C1-C6алкила и C1-C6алкоксила, или одним заместителем, выбираемым из группы, включающей гидрокси, йод, бром, формил, циано, нитро, трифторметил, амино, -(C1-C6алкил)О(C1-C6)алкил, -NНСН3, -N(СН3)2, -СООН, -СОО(C1-C4алкил), -СО(C1-C4алкил), -SO2NH(C1-C4алкил), -SO2N(C1-C4алкил)(C1-C2алкил), -SO2NH2, -NHSO2(C1-C4алкил), -S(C1-C6алкил) и -SO2(C1-C6алкил), и где C1-C4алкильная и C1-C6алкильная части вышеуказанных групп R5 могут быть необязательно замещены одной или двумя фторогруппами либо одним заместителем, выбираемым из гидрокси, амино, метиламино, диметиламино и ацетила;
R7 - водород, метил, фтор, хлор, бром, йод, циано, гидрокси, -О(C1-C4алкил), С(О)(C1-C4алкил), -С(О)О(C1-C4алкил), -ОСF3, СF3, -CH2OH, -CH2OCH3 или -CH2OCH2CH3;
R11 - водород, гидрокси, фтор или метокси;
R12 - водород или C1-C4алкил;
или фармацевтически приемлемая соль такого соединения.
2. Соединение по п. 1, где В - -NR1R2, -NHCHR1R2, -SCHR1R2 или -OCHR1R2;
R1 - C1-C6алкил, который может быть необязательно замещен одним заместителем, выбираемым из гидроксила, фтора, СF3 или C1-C2алкоксильной группы, и может иметь одну двойную или тройную связь; и R2 - бензил или C1-C6алкил, который может необязательно иметь одну углерод-углеродную двойную или тройную связь, где C1-C6алкил или фенильная часть бензила могут быть замещены фтором, СF3, C1-C2алкилом или C1-C2алкоксилом.
3. Соединение по п. 1, где R1 - C1-C6алкил, который может быть замещен фтором, СF3, гидрокси, C1-C2алкилом или C1-C2алкоксилом и может иметь одну углерод-углеродную двойную или тройную связь.
4. Соединение по п. 1, где R2 - C1-C4алкил, который может быть необязательно замещен фтором, хлором, СF3, C1-C4алкилом или C1-C4алкоксилом.
5. Соединение по п. 1, где R3 - метил, хлор или метокси.
6. Соединение по п. 1, где R4 - метил, -CH2OH, циано, трифторметокси, метокси, хлор, трифторметил, -СООСН3, -СН2OСН3, -CH2Cl, -CH2F, этил, амино или нитро.
7. Соединение по п. 1, где R5 - фенил, замещенный двумя или тремя заместителями.
8. Соединение по п. 1, где R5 - пиридил, замещенный двумя или тремя заместителями.
9. Соединение по п. 7, где указанные заместители выбирают независимо друг от друга из группы, включающей фтор, хлор, бром, йод, C1-C4алкокси, трифторметил, C1-C6алкил, который может быть необязательно замещен одной гидроксильной, C1-C4алкоксильной или фторогруппой и может иметь одну углерод-углеродную двойную или тройную связь, -(C1-C4алкилен)О(C1-C2алкил), C1-C3гидроксиалкил, гидрокси, формил, -СОО(C1-C2алкил), -(C1-C2алкилен)амино и -С(О)(C1-C4алкил).
10. Соединение по п. 8, где указанные заместители выбирают независимо друг от друга из группы, включающей фтор, хлор, бром, йод, C1-C4алкокси, трифторметил, C1-C6алкил, который может быть необязательно замещен одной гидроксильной, C1-C4алкоксильной или фторогруппой и может иметь одну углерод-углеродную двойную или тройную связь, -(C1-C4алкилен)О(C1-C2алкил), C1-C3гидроксиалкил, гидроксил, формил, -COO(C1-C2алкил), -(C1-C2алкилен)амино и -С(О)(C1-C4алкил).
11. Соединение по п. 1, которым является:
4-(1-этилпропокси)-2,5-диметил-6-(2,4,6-триметилбензил)пиримидин;
2-(4-бром-2,6-диметилфенокси)-4-(1-этилпропокси)-3,6-диметилпиридин;
2-(4-этил-2,6-диметилфенокси)-4-(1-этилпропокси)-3,6-диметилпиридин;
3-этил-4-(1-этилпропокси)-6-метил-2-(2,4,6-триметилфенокси)пиридин;
2-(2,6-диметил-4-пропилфенокси)-4-(1-этилпропокси)-3,6-диметилпиридин;
4-(1-этилпропокси)-2-(4-метокси-2,6-диметилфенокси)-3,6-диметилпиридин;
2-(4-этокси-2,6-диметилфенокси)-4-(1-этилпропокси)-3,6-диметилпиридин;
2-(4-хлор-2,6-диметилфенокси)-4-(1-этилпропокси)-3,6-диметилпиридин;
4-(1-метоксиметилпропокси)-3,6-диметил-2-(2,4,6-триметилфенокси)пиридин;
[3,6-диметил-2-(2,4,6-триметилфенокси)пиридин-4-ил]диэтиламин;
[3,6-диметил-2-(2,4,6-триметилфенокси)пиридин-4-ил]этилпропиламин;
[2,5-диметил-6-(2,4,6-триметилфенокси)пиримидин-4-ил](1-этилпропил)амин;
бутил-[3,6-диметил-2-(2,4,6-триметилфенокси)пиридин-4-ил]этиламин;
4-(1-этилпропокси)-3,6-диметил-2-(2,4,6-триметилфенилсульфанил)пиридин;
бутил-[2-(4-хлор-2,6-диметилфенокси)-3,6-диметилпиридин-4-ил]этиламин;
сложный метиловый эфир 4-(1-этилпропиламино)-6-метил-2-(2,4,6-триметилфенокси)никотиновой кислоты;
[3,6-диметил[-2-(2,4,6-триметилфенилсульфанил)пиридин-4-ил]этилпропиламин;
4-(1-этилпропиламино)-6-метил-2-(2,4,6-триметилфенокси)пиридин-3-ил]метанол;
[2-(4-хлор-2,6-диметилфенокси)-3,6-диметилпиридин-4-ил]этилпропиламин;
1-(этилпропил)-[6-метил-3-нитро-2-(2,4,6-триметилфенокси)пиридин-4-ил]амин;
N4-(1-этилпропил)-6-метил-3-нитро-N2-(2,4,6-триметилфенил)пиридин-2,4диамин;
N4-(1-этилпропил)-6-метил-2-(2,4,6-триметилфенокси)пиридин-3,4-диамин;
3,6-диметил-2-(2,4,6-триметилфенокси)пиридин-4-ил]-этил-(2,2,2-трифторэтил)амин;
N4-(1-этилпропил)-6-метил-N2-(2,4,6-триметилфенил)пиридин-2,3,4-триамин;
[3-хлорметил-6-метил-2-(2,4,6-триметилфенокси)пиридин-4-ил]-(1-этил-пропил)амин;
[3,6-диметил-2-(2,4,6-триметилфенокси)пиридин-4-ил]-(1-этилпропил)амин;
(1-этилпропил)-[2-метил-5-нитро-6-(2,4,6-тримет]пиридин-3-илокси)-пиримидин-4-ил]амин;
(1-этилпропил)-[3-метоксиметил-6-метил-2-(2,4,6-триметилфенокси)-пиридин-4-ил]амин;
(N-(1-этилпропил)-2-метил-5-нитро-N'-(2,4,6-триметилпиридин-3-ил)-пиримидин-4,6-диамин;
[2-(4-хлор-2,6-диметилфенокси)-3,6-диметилпиридин-4-ил]диэтиламин;
4-(1-этилпропокси)-3,6-диметил-2-(2,4,6-триметилфенокси)пиридин;
N-бутил-[2,3-диметил-7-(2,4,6-триметилфенил)-6,7-дигидро-5Н-пирроло-[2,3-d]пиримидин-4-ил]этиламин;
4-(бутилэтиламино)-2,5-диметил-7-(2,4,6-триметилфенил)-5,7-дигидропирроло[2,3-е]пиримидин-6-он;
4-(1-этилпропокси)-2,5-диметил-6-(2,4,6-триметилфенокси)пиримидин;
N-бутил-N-этил-2,5-диметил-N'-(2,4,6-триметилфенил)пиримидин-4,6-диамин;
(1-этилпропил)-[5-метил-3-(2,4,6-триметилфенил)-3Н-имидазо[4,5-b]-пиридин-7-ил]амин;
[2,5-диметил-3-(2,4,6-триметилфенил)-3Н-имидазо[4,5-b]пиридин-7-ил]-(1-этилпропил)амин;
N4-(1-этилпропил)-6,N3-диметил-2-(2,4,6-триметилфенокси)пиридин-3,4-диамин;
N4-(1-этилпропил)-6,N3,N3-триметил-2-[2,4,6-триметилфенокси)пиридин-3,4-диамин;
6-(1-этилпропокси)-2-метил-N4-(2,4,6-триметилфенил)пиримидин-4,5-диамин;
[4-(1-этилпропокси)-3,6-диметилпиридин-2-ил]-(2,4,6-триметилфенил)амин;
6-(этилпропиламино)-2,7-диметил-9-(2,4,6-триметилфенил)-7,9-дигидропурин-8-он;
или фармацевтически приемлемая соль одного из вышеуказанных соединений.
12. Фармацевтическая композиция, предназначенная для лечения (а) болезней, излечиваемых путем воздействия на кортикотропин-рилизинг фактор, в том числе нарушений, вызываемых этим фактором, но не ограничиваясь ими, или (b) воспалительных заболеваний, таких как: ревматоидный артрит и остеоартрит, боли, астма, псориаз и аллергия; общее беспокойство, паническое состояние; навязчивый страх; навязчиво-компульсивные побуждения; послетравматические стрессы; нарушения сна, вызванные стрессом; болевые ощущения, такие как фибромиалгия; подавленное настроение, в частности депрессия, в том числе сильная степень депрессии, непродолжительная депрессия, повторяющаяся депрессия, депрессия у детей, вызванная плохим обращением, и послеродовая депрессия; дистимия; раздвоение личности; циклотимия; синдром хронической усталости; головные боли, вызванные стрессом; рак; слизистый колит; болезнь Крона; синдром раздраженной толстой кишки; инфекции, связанные с вирусом иммунодефицита человека (ВИЧ); нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона; заболевания желудочно-кишечного тракта; нарушения, связанные с приемом пищи, такие как анорексия или кинорексия; стресс при кровотечениях; зависимость от химических препаратов и алкоголя; симптомы выведения из организма наркотических средств и алкоголя; вызванный стрессом транзиторный психоз; эутиреоз; синдром недостаточности антидиуретического гормона; ожирение; бесплодие; травмы головы; травма спинного мозга; ишемическое поражение нервных клеток; нервно-токсическое поражение нервных клеток; эпилепсия; инсульт; дисфункции иммунной системы, в том числе нарушения, вызванные стрессом; мышечные спазмы; недержание мочи; старческое слабоумие типа болезни Альцгеймера; слабоумие вследствие нескольких инфарктов; боковой амиотрофический склероз; и гипогликемия у млекопитающих; которая включает соединение по п. 1, оказывающее эффективное действие при лечении такого заболевания, и фармацевтически приемлемый носитель.
13. Способ лечения (а) болезней, излечиваемых путем воздействия на кортикотропин-рилизинг фактор, в том числе нарушений, вызываемых этим фактором, но не ограничиваясь ими, или (b) воспалительных заболеваний, таких как ревматоидный артрит и остеоартрит, боли, астма, псориаз и аллергия; общее беспокойство; паническое состояние; навязчивый страх; навязчиво-компульсивные побуждения; послетравматические стрессы; нарушения сна, вызванные стрессом; болевые ощущения, такие как фибромиалгия; подавленное настроение, в частности депрессия, в том числе сильная степень депрессии, непродолжительная депрессия, повторяющаяся депрессия, депрессия у детей, вызванная плохим обращением, и послеродовая депрессия; дистимия; раздвоение личности; циклотимия; синдром хронической усталости; головные боли, вызванные стрессом; рак; слизистый колит; болезнь Крона; синдром раздраженной толстой кишки; инфекции, связанные с вирусом иммунодефицита человека (ВИЧ); нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона; заболевания желудочно-кишечного тракта; нарушения, связанные с приемом пищи, такие как анорексия или кинорексия; стресс при кровотечениях; вызванный стрессом транзиторный психоз; эутиреоз; синдром недостаточности антидиуретического гормона; ожирение; бесплодие; травмы головы; травма спинного мозга; ишемическое поражение нервных клеток; нервнотоксическое поражение нервных клеток; эпилепсия; инсульт; дисфункции иммунной системы, в том числе нарушения, вызванные стрессом; мышечные спазмы; недержание мочи; старческое слабоумие типа болезни Альцгеймера; слабоумие вследствие нескольких инфарктов; боковой амиотрофический склероз; зависимость от химических препаратов и алкоголя; симптомы выведения из организма наркотических средств и алкоголя; и гипогликемия у млекопитающих; который включает введение больному соединения по п. 1, оказывающего эффективное действие при лечении такого заболевания.
14. Соединение формулы IV:
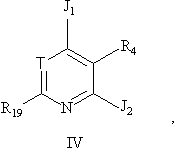
в которой
Т - А или CR7;
J1 - хлор, гидрокси или циано;
J2 - хлор или ZR5;
или когда Т - CR7 и J1 - хлор, тогда соединение присутствует в форме N-оксида;
R4 - водород, C1-C4алкил, фтор, хлор, бром, йод, C1-C4алкокси, трифторметокси, -СН2OСН3, -СН2OСН2СН3, -СН2СН2OСН3, -СН2СF3, СF3, амино, нитро, -NH(C1-C4алкил), -N(СН3)2, NНСОСН3, -NНСОNНСН3, -SOn(C1-C4алкил), где n означает 0, 1 или 2, циано, гидрокси, -СО(C1-C4алкил), -СНО, циано или -СОО(C1-C4алкил), где C1-C4алкил может необязательно иметь одну двойную или тройную связь и может быть замещен одним заместителем, выбираемым из группы, включающей гидрокси, амино, -NНСОСН3, -NH(C1-C2алкил), -N(C1-C2алкил)2, -COO(C1-C4алкил), -CO(C1-C4алкил), C1-C3алкокси, C1-C3тиоалкил, фтор, хлор, циано и нитро;
R5 - фенил или пиридил, замещенный одним-тремя заместителями, которые независимо друг от друга выбирают из фтора и хлора, C1-C6алкила и C1-C6алкоксила, или одним заместителем, выбираемым из группы, включающей гидрокси, йод, бром, формил, циано, нитро, трифторметил, амино, -(C1-C6алкил)О(C1-C6)алкил, -NНСН3, -N(СН3)2, -СООН, -СОО(C1-C4алкил), -СО(C1-C4алкил), -SO2NH(C1-C4алкил), -SO2N(C1-C4алкил)(C1-C2алкил), -SO2NH2, -NHSO2(C1-C4алкил), -S(C1-C6алкил) и -SO2(C1-C6алкил), где C1-C4алкильная и C1-C6алкильная части вышеуказанных групп R5 могут быть необязательно замещены одной или двумя фторогруппами или одним заместителем, выбираемым из гидрокси, амино, метиламино, диметиламино и ацетила;
R7 - водород, метил, фтор, хлор, бром, йод, циано, гидрокси, -О(C1-C4алкил), С(О)(C1-C4алкил), -С(О)О(C1-C4алкил), -ОСF3, СF3, -CH2OH, -CH2OCH3 или -CH2OCH2CH3;
R19 - метил или этил;
A - N, СН или ССН3;
при условии, что когда J1 - гидрокси или циано, то J2 - ZR5 и Т - А,
и что когда А - СН или ССН3, тогда Z – O или S,
и далее при условии, что исключаются соединения, в которых T – СR7, Z – O и заместителем в положении 4 фенильного кольца является хлор, гидрокси или циано, а также соединения, в которых J1 – хлор, R4 – Н, R19 – метил, а R5 выбран из группы, состоящей из 2-хлорфенила, 3-хлорфенила, 4-хлорфенила, 2,4-дихлорфенила, 2,4,6-трихлорфенила, 2-метилфенила и 3,5-диметилфенила.
15. Соединение по п. 14, в котором R4 - водород, C1-C4алкил, -O(C1-C4алкил), хлор или циано.
16. Соединение формулы ХІІ:
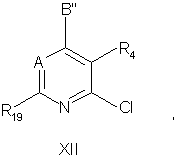
в которой
R4 - водород, C1-C4алкил, фтор, хлор, бром, йод, C1-C4алкокси, трифторметокси, -СН2OСН3, -СH2ОСН2СН3, -СH2СН2ОСН3, -СН2OСF3, СF3, амино, нитро, -NH(C1-C4алкил), -N(СН3)2, -NНСОСНз, -NHCONHCH3, -SOn(C1-C4алкил), где n означает 0, 1 или 2, циано, гидрокси, -CO(C1-C4алкил), где C1-C4алкил может необязательно иметь одну двойную или тройную связь и может быть замещен одним заместителем, выбираемым из группы, включающей гидрокси, амино, -NHCOCH3, -NH(C1-C2алкил), -N(C1-C2алкил)2, -СОО(C1-C4алкил), C1-C3алкокси, C1-C3тиоалкил, фтор, хлор, циано, нитро и СО(C1-C4алкил);
R19 - метил или этил;
В'' - -NR1R2, -CR1R2R11, -С(=CR2R12)R1, -NHCHR1R2, -OCHR1R2, -SCHR1R2, -CHR2OR12, -CHR2SR12, -C(S)R2 или -C(O)R2;
R1 - C1-C6алкил, который может быть необязательно замещен одним или двумя заместителями R8, независимо друг от друга выбираемыми из группы, включающей гидрокси, фтор, хлор, бром, йод, СF3, C1-C4алкокси, -O-СO-(C1-C4алкил), -O-CO-NH(C1-C4алкил), -O-CO-N(C1-C4алкил)(C1-C4алкил), -NH(C1-C4алкил), -N(C1-C4алкил)(C1-C4алкил), -S(C1-C4алкил), -N(C1-C4алкил)СО(C1-C4алкил), -NHCO(C1-C4алкил), -СОО(C1-C4алкил), -CONH(C1-C4алкил), -CON(C1-C4алкил)(C1-C2алкил), CN, NO2, -SO(C1-C4алкил) и -SO2(C1-C4алкил), где C1-C6алкил и (C1-C4)алкильные части вышеуказанных групп R1 могут необязательно иметь одну углерод-углеродную двойную или тройную связь;
R2 - C1-C12алкил, арил или -(C1-C4алкилен)арил, где арилом является фенил, нафтил, тиенил, бензотиенил, пиридил, хинолил, пиразинил, пиримидинил, имидазолил, фуранил, бензофуранил, бензотиазолил, изотиазолил, бензизотиазолил, бензизоксазолил, бензимидазолил, индолил или бензоксазол; 3-8-членный циклоалкил или -(C1-C6алкилен)циклоалкил, где один или два атома углерода в кольце циклоалкила, имеющего не менее 4 членов, и в циклоалкильной части -(C1-C6алкилен)циклоалкила, имеющего не менее 4 членов в кольце, могут быть необязательно замещены атомом кислорода, серы или N-R9, где R9 является водородом или C1-C4алкилом; где каждая из вышеуказанных групп R2 может быть необязательно замещена одним-тремя заместителями, которые независимо друг от друга выбирают из хлора, фтора и C1-C4алкила, или одним заместителем, выбираемым из группы, включающей бром, йод, C1-C6алкокси, -O-СО-(C1-C6алкил), -O-CO-N(C1-C4алкил)(C1-C2алкил), -S(C1-C6алкил), CN, NO2, -SO(C1-C4алкил) и -SO2(C1-C4алкил), и где C1-C12алкил и C1-C4алкиленовая часть (C1-C4алкилен)арила могут необязательно иметь одну углерод-углеродную двойную или тройную связь;
либо -NR1R2 или -CR1R2R11 могут образовывать насыщенное 5-8-членное карбоциклическое кольцо, которое может необязательно иметь одну или две углерод-углеродные двойные связи и в котором один или два атома углерода могут быть замещены атомом кислорода или серы;
R11 - водород, гидрокси, фтор или метокси;
R12 - водород или C1-C4алкил; и
A - N, СН или ССН3;
при условии, что, если А представляет собой СН или ССН3, то В'' означает -NR1R2, -NHR1R2, -OCHR1R2 или циано и R4 является электронодефицитной группой, такой как NO2, -COO(C1-C4алкил), -С(=O)СН3, -СООН или циано.
17. Соединение по пункту 16, где В'' представляет собой -NR1R2 или -NHCHR1R2 и А - СН или СН3.
18. Способ получения соединения формулы I:
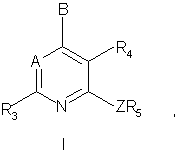
или его фармацевтически приемлемой соли, в которой
A - -CR7 или N;
В - -NR1R2, -NHCHR1R2, -OCHR1R2 или -SCHR1R2;
Z - NH, O, S, -N(C1-C2алкил) или -С(R13R14), где R13 и R14 независимо друг от друга могут представлять собой водород, трифторметил или метил, либо один из элементов R13 и R14 является цианогруппой, а другой - водородом или метилом;
R1 - C1-C6алкил, который может быть необязательно замещен одним или двумя заместителями R8, независимо друг от друга выбираемыми из группы, включающей гидрокси, фтор, хлор, бром, йод, СF3 и C1-C4алкокси, где C1-C6алкил и C1-C4алкильная часть C1-C4алкоксильной группы могут необязательно иметь одну углерод-углеродную двойную или тройную связь;
R2 - C1-C12алкил, арил или -(C1-C4алкилен)арил, где арилом является фенил, нафтил, тиенил, бензотиенил, пиридил, хинолил, пиразинил, пиримидил, имидазолил, фуранил, бензофуранил, бензотиазолил, изотиазолил, бензизотиазолил, бензизоксазолил, бензимидазолил, индолил или бензоксазолил; 3-8-членный циклоалкил или -(C1-C6алкилен) циклоалкил, где один или два атома углерода в кольце циклоалкила, имеющего не менее 4 членов, и в циклоалкильной части -(C1-C6алкилен)циклоалкила, имеющего не менее 4 членов в кольце, могут быть необязательно замещены атомом кислорода, серы или N-R9, где R9 является водородом или C1-C4алкилом; где каждая из вышеуказанных групп R2 может быть необязательно замещена одним-тремя заместителями, независимо друг от друга выбираемыми из хлора, фтора и C1-C4алкила, или одним заместителем, выбираемым из группы, включающей бром, йод, C1-C6алкокси, -O-СО-(C1-C6алкил), -O-CO-N(C1-C4алкил)(C1-C2алкил), -S(C1-C6алкил), CN, NO2, -SO(C1-C4алкил) и -SO2(C1-C4алкил), и где C1-C12алкил и C1-C4алкиленовая часть -(C1-C4алкилен)арила могут необязательно иметь одну углерод-углеродную двойную или тройную связь;
либо -NR1R2 может образовывать насыщенное 5-8-членное карбоциклическое кольцо, которое может необязательно иметь одну или две углерод-углеродные двойные связи и в котором один или два атома углерода могут быть замещены атомом кислорода или серы;
R3 - метил или этил;
R4 - водород, C1-C4алкил, фтор, хлор, бром, йод, C1-C4алкокси, трифторметокси, -СН2ОСН3, -СН2OСН2СН3, -СН2СН2OСН3, -СН2ОF3, СF3, амино, нитро, -NH(C1-C4алкил), -N(СН3)2, -NHCOCH3, -NHCONHCH3, -SOn(C1-C4алкил), где n означает 0, 1 или 2, циано, гидрокси, -СО(C1-C4алкил), -СНО, циано или -СОО(C1-C4алкил), где C1-C4алкил может необязательно иметь одну двойную или тройную связь и может быть замещен одним заместителем, выбираемым из группы, включающей гидрокси, амино, -NНСОСН3, -NH(C1-C2алкил), -N(C1-C2алкил)2, -COO(C1-C4алкил), -CO(C1-C4алкил), C1-C3алкокси, C1-C3тиоалкил, фтор, хлор, циано и нитро;
R5 - фенил или пиридил, замещенный одним-тремя заместителями, которые независимо друг от друга выбирают из фтора и хлора, C1-C6алкила и C1-C6алкоксила, или одним заместителем, выбираемым из группы, включающей гидрокси, йод, бром, формил, циано, нитро, трифторметил, амино, -(C1-C6алкил)О(C1-C6)алкил, -NНСН3, -N(СН3)2, -СООН, -СОО(C1-C4алкил), -СО(C1-C4алкил), -SO2NH(C1-C4алкил), -SO2N(C1-C4алкил)(C1-C2алкил), -SO2NH2, -NHSO2(C1-C4алкил), -S(C1-C6алкил) и -SO2(C1-C6алкил), где C1-C4алкильная и C1-C6алкильная части вышеуказанных групп R5 могут быть необязательно замещены одной или двумя фторогруппами или одним заместителем, выбираемым из гидрокси, амино, метиламино, диметиламино и ацетила; и
R7 - водород или метил;
или фармацевтически приемлемой соли такого соединения;
включающий взаимодействие в присутствии основания соединения формулы IV:
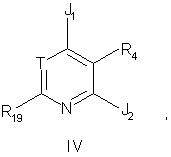
в которой
Т - CR7 или N;
J1 - хлор;
J2 - ZR5;
R19 – метил или этил;
R4, Z, R5, R7 определены выше;
с соединением формулы ВН, в которой В имеет указанные выше значения; и последующее необязательное превращение соединения формулы I, полученного в результате осуществления такой реакции, в его фармацевтически приемлемую соль.
19. Способ получения соединения формулы I:
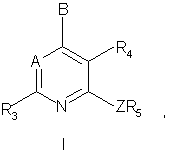
или его фармацевтически приемлемой соли, в которой
A - -CR7 или N;
В - -NR1R2, -CR1R2R11, -С(=CR2R12)R1, -NHCHR1R2, -OCHR1R2, -SCHR1R2, -CHR2OR12, -CHR2SR12, -C(S)R2 или -C(O)R2;
Z - NH, O, S, -N(C1-C2алкил) или -С(R13R14), где R13 и R14 независимо друг от друга представляют собой водород, трифторметил или метил либо один из элементов R13 и R14 является цианогруппой, а другой - водородом или метилом;
R1 - C1-C6алкил, который может быть необязательно замещен одним или двумя заместителями R8, независимо друг от друга выбираемыми из группы, включающей гидрокси, фтор, хлор, бром, йод, СF3 и C1-C4алкокси, где C1-C6алкил и C1-C4алкильная часть C1-C4алкоксильной группы могут необязательно иметь одну углерод-углеродную двойную или тройную связь;
R2 - C1-C12алкил, арил или -(C1-C4алкилен)арил, где арилом является фенил, нафтил, тиенил, бензотиенил, пиридил, хинолил, пиразинил, пиримидил, имидазолил, фуранил, бензофуранил, бензотиазолил, изотиазолил, бензизотиазолил, бензизоксазолил, бензимидазолил, индолил или бензоксазолил; 3-8-членный циклоалкил или -(C1-C6алкилен) циклоалкил, где один или два атома углерода в кольце циклоалкила, имеющего не менее 4 членов, и в циклоалкильной части -(C1-C6алкилен)циклоалкила, имеющего не менее 4 членов в кольце, могут быть необязательно замещены атомом кислорода, серы или N-R9, где R9 является водородом или C1-C4алкилом; где каждая из вышеуказанных групп R2 может быть необязательно замещена одним-тремя заместителями, независимо друг от друга выбираемыми из хлора, фтора и C1-C4алкила, или одним заместителем, выбираемым из группы, включающей бром, йод, C1-C6алкокси, -O-СО-(C1-C6алкил), -O-CO-N(C1-C4алкил)(C1-C2алкил), -S(C1-C6алкил), CN, NO2, -SO(C1-C4алкил) или -SO2(C1-C4алкил); и где C1-C12алкил и C1-C4алкиленовая часть -(C1-C4алкилен)арила могут необязательно иметь одну углерод-углеродную двойную или тройную связь;
либо -NR1R2 может образовывать насыщенное 5-8-членное карбоциклическое кольцо, которое может необязательно иметь одну или две углерод-углеродные двойные связи и в котором один или два атома углерода могут быть необязательно замещены атомом кислорода или серы;
R3 - метил, этил, фтор, хлор, бром, йод, циано, метокси, ОСF3, метилтио, метилсульфонил, СН2OН или СН2OСН3;
R4 - водород, C1-C4алкил, фтор, хлор, бром, йод, C1-C4алкокси, трифторметокси, -СН2OСН3, -СН2OСН2СН3, -СН2СН2OСН3, -СН2OF3, СF3, амино, нитро, -NH(C1-C4алкил), -N(СН3)2, -NНСОСН3, -NHCONHCH3, -SOn(C1-C4алкил), где n означает 0, 1 или 2, циано, гидрокси, -СО(C1-C4алкил), -СНО, циано или -СОО(C1-C4алкил), где C1-C4алкил может необязательно иметь одну двойную или тройную связь и может быть замещен одним заместителем, выбираемым из группы, включающей гидрокси, амино, -NНСОСН3, -NH(C1-C2алкил), -N(C1-C2алкил)2, -COO(C1-C4алкил), -СО(C1-C4алкил), C1-C3алкокси, C1-C4тиоалкил, фтор, хлор, циано и нитро;
R5 - фенил или пиридил, замещенный одним-тремя заместителями, которые независимо друг от друга выбирают из фтора, хлора, C1-C6алкила и C1-C6алкоксила, или одним заместителем, выбираемым из группы, включающей гидрокси, йод, бром, формил, циано, нитро, трифторметил, амино, -(C1-C6алкил)О(C1-C6)алкил, -NНСН3, -N(СН3)2, -СООН, -СОО(C1-C4алкил), -СО(C1-C4алкил), -SO2NH(C1-C4алкил), -SO2N(C1-C4алкила(C1-C2aлкил), -SO2NH2, -NHSO2(C1-C4алкил), -S(C1-C6алкил) и -SO2(C1-C6алкил), где C1-C4алкильная и C1-C6алкильная части вышеуказанных групп R5 могут быть необязательно замещены одной или двумя фторогруппами или одним заместителем, выбираемым из гидрокси, амино, метиламино, диметиламино и ацетила; и
R7 - водород или метил;
при условии, что, если А представляет собой СН или ССН3, то R4 является электронодефицитной группой, такой как NO2, -COO(C1-C4алкил), -С(=O)СН3, -СООН или CN; или фармацевтически приемлемой соли такого соединения;
включающий взаимодействие соединения формулы XII:

в которой R19 - метил или этил и A - N, СН или ССН3, причем если А является N, то В'' и R4 имеют значения, указанные выше для В и R4, а если А представляет собой СН или СН2, то В'' означает -NR1R2, -NHR1R2, -OCHR1R2 или циано и R4 является электронодефицитной группой, такой как NO2, -COO(C1-C4алкил), -С(=O)СН3, -СООН или CN;
с соединением формулы R5ZH, в которой R5 и Z имеют указанные выше значения; и последующее необязательное превращение соединения формулы I, получаемого в результате осуществления такой реакции, в его фармацевтически приемлемую соль.
20. Способ по п. 19, где R4 является нитрогруппой как в соединении формулы I, так и в соединении формулы IV.
21. Способ получения соединения формулы IV:
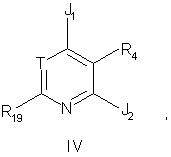
в которой
R19 - метил или этил;
J1 - хлор;
Т - -CR7;
J2 - ZR5;
Z - NH, O, S, -N(C1-C2алкил) или -С(R13R14), где R13 и R14 независимо друг от друга представляют собой водород, трифторметил или метил либо один из элементов R13 и R14 является цианогруппой, а другой - водородом или метилом;
R4 - водород, C1-C6алкил, фтор, хлор, бром, йод, C1-C4алкокси, трифторметокси, -СН2OСН3, -СН2ОСН2СН3, -СН2СН2OСН3, -СН2OF3, СF3, амино, нитро, -NH(C1-C4алкил), -N(СН3)2, -NHCOCH3, -NHCONHCH3, -SOn(C1-C4алкил), где n означает 0, 1 или 2, циано, гидрокси, -СО(C1-C4алкил), -СНО, циано или -СОО(C1-C4алкил), где C1-C4алкил может необязательно иметь одну двойную или тройную связь и может быть замещен одним заместителем, выбираемым из группы, включающей гидрокси, амино, -NHCOCH3, -NH(C1-C2алкил), -N(C1-C2алкил)2, -СОО(C1-C4алкил), -CO(C1-C4алкил), C1-C3алкокси, C1-C3тиоалкил, фтор, хлор, циано и нитро; и
R5 - фенил или пиридил, замещенный одним-тремя заместителями, выбираемыми независимо друг от друга из фтора, хлора, C1-C6алкила и C1-C6алкоксила, или одним заместителем, выбираемым из группы, включающей гидрокси, йод, бром, формил, циано, нитро, трифторметил, амино, -(C1-C6алкил)О(C1-C6)алкил, -NНСН3, -N(CH3)2, -СООН, -COO(C1-C4алкил), -СО(C1-C4алкил), -SO2NH(C1-C4алкил), -SO2N(C1-C4алкил)(C1-C4алкил), -SO2NH2, -NHSO2(C1-C4алкил), -S(C1-C6алкил) и -SO2(C1-C6алкил, где C1-C4алкильная и C1-C6алкильная части вышеуказанных групп R5 могут быть необязательно замещены одной или двумя фторогруппами или одним заместителем, выбираемым из гидрокси, амино, метиламино, диметиламино и ацетила;
R7 представляет собой водород, метил, фтор, хлор, бром, йод, циано, гидрокси, -O(C1-C4алкил), -С(О)(C1-C4алкил), -С(O)O(C1-C4алкил), -ОСF3, СF3, -СН2ОН, -СН2ОСН3 или -СН2OСН2СН3;
включающий взаимодействие с треххлористым фосфором соединения формулы Х:

в которой R19, R4, R5 и R7 имеют указанные выше значения.
22. Способ получения соединения формулы X:

в которой
R19 - метил или этил;
Z - О или S;
R4 - водород, C1-C4алкил, фтор, хлор, бром, йод, C1-C4алкокси, трифторметокси, -СН2OСН3, -СН2OСН2СН3, -СН2СН2OСН3, -СН2OF3, -СF3, амино, нитро, -NH(C1-C4алкил), -N(СН3)2, -NНСОNНСН3, NHCOCH3, SO(C1-C4алкил), где n означает 0, 1 или 2, циано, гидрокси, -СО(C1-C4алкил), -СНО, циано или -COO(C1-C4алкил), где C1-C4алкил может необязательно иметь одну двойную или тройную связь и может быть замещен одним заместителем, выбираемым из группы, включающей гидрокси, амино, -NНСОСН3, -NH(C1-C2алкил), -N(C1-C2алкил)2, -COO(C1-C4алкил), -CO(C1-C4алкил), C1-C3алкскси, C1-C3тиоалкил, фтор, хлор, циано и нитро; и
R5 - фенил или пиридил, замещенный одним-тремя заместителями, которые независимо друг от друга выбирают из фтора, хлора, C1-C6алкила и C1-C6алкоксила, или одним заместителем, выбираемым из группы, включающей гидрокси, йод, бром, формил, циано, нитро, трифторметил, амино, -(C1-C6алкил)О(C1-C6)алкил, -NНСН3, -N(СН3)2, -СООН, -СОО-(C1-C4алкил), -СО(C1-C4алкил), -SO2NH(C1-C4алкил), -SO2N(C1-C4алкил)(С1-С2алкил), -SO2NH2, -NHSO2(C1-C4алкил), -S(C1-С6алкил) и -SO2(С1-С6алкил), где C1-C4алкильная и C1-С6алкильная части вышеуказанных групп R5 могут быть необязательно замещены одной или двумя фторогруппами или одним заместителем, выбираемым из гидрокси, амино, метиламино, диметиламино и ацетила;
R7 представляет собой водород, метил, фтор, хлор, бром, йод, циано, гидрокси, -O(C1-C4алкил), -С(О)(C1-C4алкил), -С(O)O(C1-C4алкил), -ОСF3, СF3, -СН2ОН, -СН2ОСН3 или -СН2OСН2СН3;
включающий взаимодействие в присутствии основания соединения формулы XI:

в которой R4, R7 и R19 имеют указанные выше значения, с соединением формулы R5OH или R5SH, где R5 имеет указанные выше значения.
Текст
1. Соединение формулы I: B 2 (19) 1 3 71535 4 местителем, выбираемым из группы, включающей трифторметил, C1-C6алкил, который может быть гидрокси, амино, -NНСОСН3, -NH(C1-C2алкил), необязательно замещен одной гидроксильной, N(C1-C2алкил)2, -COO(C1-C4алкил), -CO(C1C1-C4алкоксильной или фторогруппой и может C4алкил), C1-C3алкокси, C1-C3тиоалкил, фтор, иметь одну углерод-углеродную двойную или хлор, циано и нитро; тройную связь, -(C1-C4алкилен)О(C1-C2алкил), R5 - фенил, нафтил, тиенил, бензотиенил, пириC1-C3гидроксиалкил, гидрокси, формил, -СОО(C1дил, хинолил, пиразинил, пиримидил, фуранил, C2алкил), -(C1-C2алкилен)амино и -С(О)(C1бензофуранил, бензотиазолил или индолил, где C4алкил). каждая из вышеуказанных групп R5 замещена од10. Соединение по п. 8, где указанные заместитеним-тремя заместителями, которые независимо ли выбирают независимо друг от др уга из группы, друг от др уга выбирают из фтора, хлора, C1включающей фтор, хлор, бром, йод, C1-C4алкокси, C6алкила и C1-C6алкоксила, или одним заместитетрифторметил, C1-C6алкил, который может быть лем, выбираемым из группы, включающей гидрокнеобязательно замещен одной гидроксильной, си, йод, бром, формил, циано, нитро, трифтормеC1-C4алкоксильной или фторогруппой и может тил, амино, -(C1-C6алкил)О(C1-C6)алкил, -NНСН3, иметь одну углерод-углеродную двойную или N(СН3)2, -СООН, -СОО(C1-C4алкил), -СО(C1тройную связь, -(C1-C4алкилен)О(C1-C2алкил), C4алкил), -SO2NH(C1-C4алкил), -SO2N(C1C1-C3гидроксиалкил, гидроксил, формил, -COO(C1C4алкил)(C1-C2алкил), -SO2NH2, -NHSO2(C1C2алкил), -(C1-C2алкилен)амино и -С(О)(C1C4алкил), -S(C1-C6алкил) и -SO2(C1-C6алкил), и где C4алкил). C1-C4алкильная и C1-C6алкильная части вышеука11. Соединение по п. 1, которым является: занных групп R5 могут быть необязательно заме4-(1-этилпропокси)-2,5-диметил-6-(2,4,6щены одной или двумя фторогруппами либо одтриметилбензил)пиримидин; ним заместителем, выбираемым из гидрокси, 2-(4-бром-2,6-диметилфенокси)-4-(1амино, метиламино, диметиламино и ацетила; этилпропокси)-3,6-диметилпиридин; R7 - водород, метил, фтор, хлор, бром, йод, циано, 2-(4-этил-2,6-диметилфенокси)-4-(1гидрокси, -О(C1-C4алкил), С(О)(C1-C4алкил), этилпропокси)-3,6-диметилпиридин; С(О)О(C1-C4алкил), -ОСF3, СF3, -CH2OH, 3-этил-4-(1-этилпропокси)-6-метил-2-(2,4,6CH2OCH3 или -CH 2OCH2CH3; триметилфенокси)пиридин; R11 - водород, гидрокси, фтор или метокси; 2-(2,6-диметил-4-пропилфенокси)-4-(1R12 - водород или C1-C4алкил; этилпропокси)-3,6-диметилпиридин; или фармацевтически приемлемая соль такого 4-(1-этилпропокси)-2-(4-метокси-2,6соединения. диметилфенокси)-3,6-диметилпиридин; 2. Соединение по п. 1, где В - -NR1R2, -NHCHR1R2, 2-(4-этокси-2,6-диметилфенокси)-4-(1-SCHR1R2 или -OCHR 1R2; этилпропокси)-3,6-диметилпиридин; R1 - C1-C6алкил, который может быть необязате2-(4-хлор-2,6-диметилфенокси)-4-(1льно замещен одним заместителем, выбираемым этилпропокси)-3,6-диметилпиридин; из гидроксила, фтора, СF3 или C1-C2алкоксильной 4-(1-метоксиметилпропокси)-3,6-диметил-2-(2,4,6группы, и может иметь одну двойную или тройную триметилфенокси)пиридин; связь; и R2 - бензил или C1-C6алкил, который мо[3,6-диметил-2-(2,4,6-триметилфенокси)пиридинжет необязательно иметь одну углерод4-ил]диэтиламин; углеродную двойную или тройную связь, где C1[3,6-диметил-2-(2,4,6-триметилфенокси)пиридинC6алкил или фенильная часть бензила могут быть 4-ил]этилпропиламин; замещены фтором, СF3, C1-C2алкилом или C1[2,5-диметил-6-(2,4,6C2алкоксилом. триметилфенокси)пиримидин-4-ил](13. Соединение по п. 1, где R1 - C1-C6алкил, котоэтилпропил)амин; рый может быть замещен фтором, СF3, гидрокси, бутил-[3,6-диметил-2-(2,4,6C1-C2алкилом или C1-C2алкоксилом и может иметь триметилфенокси)пиридин-4-ил]этиламин; одну углерод-углеродную двойную или тройную 4-(1-этилпропокси)-3,6-диметил-2-(2,4,6связь. триметилфенилсульфанил)пиридин; 4. Соединение по п. 1, где R2 - C1-C4алкил, котобутил-[2-(4-хлор-2,6-диметилфенокси)-3,6рый может быть необязательно замещен фтором, диметилпиридин-4-ил]этиламин; хлором, СF3, C1-C4алкилом или C1-C4алкоксилом. сложный метиловый эфир 4-(1-этилпропиламино)5. Соединение по п. 1, где R3 - метил, хлор или 6-метил-2-(2,4,6-триметилфенокси)никотиновой метокси. кислоты; 6. Соединение по п. 1, где R 4 - метил, -CH2OH, [3,6-диметил[-2-(2,4,6циано, трифторметокси, метокси, хлор, трифтортриметилфенилсульфанил)пиридин-4метил, -СООСН 3, -СН2OСН3, -CH2Cl, -CH2F, этил, ил]этилпропиламин; амино или нитро. 4-(1-этилпропиламино)-6-метил-2-(2,4,67. Соединение по п. 1, где R5 - фенил, замещентриметилфенокси)пиридин-3-ил]метанол; ный двумя или тремя заместителями. [2-(4-хлор-2,6-диметилфенокси)-3,68. Соединение по п. 1, где R5 - пиридил, замещендиметилпиридин-4-ил]этилпропиламин; ный двумя или тремя заместителями. 1-(этилпропил)-[6-метил-3-нитро-2-(2,4,69. Соединение по п. 7, где указанные заместители триметилфенокси)пиридин-4-ил]амин; выбирают независимо друг от др уга из группы, N4-(1-этилпропил)-6-метил-3-нитро-N2-(2,4,6включающей фтор, хлор, бром, йод, C1-C4алкокси, триметилфенил)пиридин-2,4диамин; 5 71535 6 N4-(1-этилпропил)-6-метил-2-(2,4,6рак; слизистый колит; болезнь Крона; синдром триметилфенокси)пиридин-3,4-диамин; раздраженной толстой кишки; инфекции, связан3,6-диметил-2-(2,4,6-триметилфенокси)пиридин-4ные с вирусом иммунодефицита человека (ВИЧ); ил]-этил-(2,2,2-трифторэтил)амин; нейродегенеративные заболевания, такие как боN4-(1-этилпропил)-6-метил-N2-(2,4,6лезнь Альцгеймера, болезнь Паркинсона и ботриметилфенил)пиридин-2,3,4-триамин; лезнь Хантингтона; заболевания желудочно[3-хлорметил-6-метил-2-(2,4,6кишечного тракта; нарушения, связанные с притриметилфенокси)пиридин-4-ил]-(1-этилемом пищи, такие как анорексия или кинорексия; пропил)амин; стресс при кровотечениях; зависимость от хими[3,6-диметил-2-(2,4,6-триметилфенокси)пиридинческих препаратов и алкоголя; симптомы выведе4-ил]-(1-этилпропил)амин; ния из организма наркотических средств и алкого(1-этилпропил)-[2-метил-5-нитро-6-(2,4,6ля; вызванный стрессом транзиторный психоз; тримет]пиридин-3-илокси)-пиримидин-4-ил]амин; эутиреоз; синдром недостаточности антидиурети(1-этилпропил)-[3-метоксиметил-6-метил-2-(2,4,6ческого гормона; ожирение; бесплодие; травмы триметилфенокси)-пиридин-4-ил]амин; головы; травма спинного мозга; ишемическое по(N-(1-этилпропил)-2-метил-5-нитро-N'-(2,4,6ражение нервных клеток; нервно-токсическое потриметилпиридин-3-ил)-пиримидин-4,6-диамин; ражение нервных клеток; эпилепсия; инсульт; ди[2-(4-хлор-2,6-диметилфенокси)-3,6сфункции иммунной системы, в том числе диметилпиридин-4-ил]диэтиламин; нарушения, вызванные стрессом; мышечные спа4-(1-этилпропокси)-3,6-диметил-2-(2,4,6змы; недержание мочи; старческое слабоумие триметилфенокси)пиридин; типа болезни Альцгеймера; слабоумие вследстN-бутил-[2,3-диметил-7-(2,4,6-триметилфенил)вие нескольких инфарктов; боковой амиотрофиче6,7-дигидро-5Н-пирроло-[2,3-d]пиримидин-4ский склероз; и гипогликемия у млекопитающих; ил]этиламин; которая включает соединение по п. 1, оказываю4-(бутилэтиламино)-2,5-диметил-7-(2,4,6щее эффективное действие при лечении такого триметилфенил)-5,7-дигидропирроло[2,3заболевания, и фармацевтически приемлемый е]пиримидин-6-он; носитель. 4-(1-этилпропокси)-2,5-диметил-6-(2,4,613. Способ лечения (а) болезней, излечиваемых триметилфенокси)пиримидин; путем воздействия на кортикотропин-рилизинг N-бутил-N-этил-2,5-диметил-N'-(2,4,6фактор, в том числе нарушений, вызываемых триметилфенил)пиримидин-4,6-диамин; этим фактором, но не ограничиваясь ими, или (b) (1-этилпропил)-[5-метил-3-(2,4,6-триметилфенил)воспалительных заболеваний, таких как ревмато3Н-имидазо[4,5-b]-пиридин-7-ил]амин; идный артрит и остеоартрит, боли, астма, псориаз [2,5-диметил-3-(2,4,6-триметилфенил)-3Ни аллергия; общее беспокойство; паническое сосимидазо[4,5-b]пиридин-7-ил]-(1-этилпропил)амин; тояние; навязчивый страх; навязчивоN4-(1-этилпропил)-6,N3-диметил-2-(2,4,6компульсивные побуждения; послетравматичестриметилфенокси)пиридин-3,4-диамин; кие стрессы; нарушения сна, вызванные стрессом; N4-(1-этилпропил)-6,N3,N3-триметил-2-[2,4,6болевые ощущения, такие как фибромиалгия; потриметилфенокси)пиридин-3,4-диамин; давленное настроение, в частности депрессия, в 6-(1-этилпропокси)-2-метил-N4-(2,4,6том числе сильная степень депрессии, непродолтриметилфенил)пиримидин-4,5-диамин; жительная депрессия, повторяющаяся депрессия, [4-(1-этилпропокси)-3,6-диметилпиридин-2-ил]депрессия у детей, вызванная плохим обращени(2,4,6-триметилфенил)амин; ем, и послеродовая депрессия; дистимия; раздво6-(этилпропиламино)-2,7-диметил-9-(2,4,6ение личности; циклотимия; синдром хронической триметилфенил)-7,9-дигидропурин-8-он; усталости; головные боли, вызванные стрессом; или фармацевтически приемлемая соль одного из рак; слизистый колит; болезнь Крона; синдром вышеуказанных соединений. раздраженной толстой кишки; инфекции, связан12. Фармацевтическая композиция, предназнаные с вирусом иммунодефицита человека (ВИЧ); ченная для лечения (а) болезней, излечиваемых нейродегенеративные заболевания, такие как бопутем воздействия на кортикотропин-рилизинг лезнь Альцгеймера, болезнь Паркинсона и бофактор, в том числе нарушений, вызываемых лезнь Хантингтона; заболевания желудочноэтим фактором, но не ограничиваясь ими, или (b) кишечного тракта; нарушения, связанные с привоспалительных заболеваний, таких как: ревматоемом пищи, такие как анорексия или кинорексия; идный артрит и остеоартрит, боли, астма, псориаз стресс при кровотечениях; вызванный стрессом и аллергия; общее беспокойство, паническое состранзиторный психоз; эутиреоз; синдром недостатояние; навязчивый страх; навязчивоточности антидиуретического гормона; ожирение; компульсивные побуждения; послетравматичесбесплодие; травмы головы; травма спинного мозкие стрессы; нарушения сна, вызванные стрессом; га; ишемическое поражение нервных клеток; нерболевые ощущения, такие как фибромиалгия; повнотоксическое поражение нервных клеток; эпидавленное настроение, в частности депрессия, в лепсия; инсульт; дисфункции иммунной системы, том числе сильная степень депрессии, непродолв том числе нарушения, вызванные стрессом; жительная депрессия, повторяющаяся депрессия, мышечные спазмы; недержание мочи; старческое депрессия у детей, вызванная плохим обращенислабоумие типа болезни Альцгеймера; слабоумие ем, и послеродовая депрессия; дистимия; раздвовследствие нескольких инфарктов; боковой амиоение личности; циклотимия; синдром хронической трофический склероз; зависимость от химических усталости; головные боли, вызванные стрессом; препаратов и алкоголя; симптомы выведения из 7 71535 8 организма наркотических средств и алкоголя; и 2,4,6-трихлорфенила, 2-метилфенила и 3,5гипогликемия у млекопитающих; который включадиметилфенила. ет введение больному соединения по п. 1, оказы15. Соединение по п. 14, в котором R4 - водород, вающего эффективное действие при лечении таC1-C4алкил, -O(C1-C4алкил), хлор или циано. кого заболевания. 16. Соединение формулы ХІІ: 14. Соединение формулы IV: B'' J1 T R19 N J2 R4 A R4 R19 , IV в которой Т - А или CR7; J1 - хлор, гидрокси или циано; J2 - хлор или ZR5; или когда Т - CR7 и J1 - хлор, тогда соединение присутствует в форме N-оксида; R4 - водород, C1-C4алкил, фтор, хлор, бром, йод, C1-C4алкокси, трифторметокси, -СН2OСН3, СН2OСН2СН3, -СН2СН2OСН3, -СН2СF3, СF3, амино, нитро, -NH(C1-C4алкил), -N(СН3)2, NНСОСН3, NНСОNНСН3, -SOn(C1-C4алкил), где n означает 0, 1 или 2, циано, гидрокси, -СО(C1-C4алкил), -СНО, циано или -СОО(C1-C4алкил), где C1-C4алкил может необязательно иметь одну двойную или тройную связь и может быть замещен одним заместителем, выбираемым из группы, включающей гидрокси, амино, -NНСОСН3, -NH(C1-C2алкил), N(C1-C2алкил)2, -COO(C1-C4алкил), -CO(C1C4алкил), C1-C3алкокси, C1-C3тиоалкил, фтор, хлор, циано и нитро; R5 - фенил или пиридил, замещенный однимтремя заместителями, которые независимо друг от друга выбирают из фтора и хлора, C1-C6алкила и C1-C6алкоксила, или одним заместителем, выбираемым из группы, включающей гидрокси, йод, бром, формил, циано, нитро, трифторметил, амино, -(C1-C6алкил)О(C1-C6)алкил, -NНСН3, -N(СН3)2, -СООН, -СОО(C1-C4алкил), -СО(C1-C4алкил), SO2NH(C1-C4алкил), -SO2N(C1-C4алкил) (C1-C2алкил), -SO2NH2, -NHSO2(C1-C4алкил), -S(C1C6алкил) и -SO2(C1-C6алкил), где C1-C4алкильная и C1-C6алкильная части вышеуказанных групп R5 могут быть необязательно замещены одной или двумя фторогр уппами или одним заместителем, выбираемым из гидрокси, амино, метиламино, диметиламино и ацетила; R7 - водород, метил, фтор, хлор, бром, йод, циано, гидрокси, -О(C1-C4алкил), С(О)(C1-C4алкил), С(О)О(C1-C4алкил), -ОСF3, СF3, -CH2OH, CH2OCH3 или -CH 2OCH2CH3; R19 - метил или этил; A - N, СН или ССН 3; при условии, что когда J1 - гидрокси или циано, то J2 - ZR5 и Т - А, и что когда А - СН или ССН 3, тогда Z – O или S, и далее при условии, что исключаются соединения, в которых T – СR7, Z – O и заместителем в положении 4 фенильного кольца является хлор, гидрокси или циано, а также соединения, в которых J1 – хлор, R4 – Н, R19 – метил, а R5 выбран из группы, состоящей из 2-хлорфенила, 3хлорфенила, 4-хлорфенила, 2,4-дихлорфенила, N Cl , XII в которой R4 - водород, C1-C4алкил, фтор, хлор, бром, йод, C1-C4алкокси, трифторметокси, -СН2OСН3, СH2ОСН2СН3, -СH2СН2ОСН3, -СН2OСF3, СF3, амино, нитро, -NH(C1-C4алкил), -N(СН3)2, -NНСОСНз, NHCONHCH3, -SOn(C1-C4алкил), где n означает 0, 1 или 2, циано, гидрокси, -CO(C1-C4алкил), где C1C4алкил может необязательно иметь одну двойную или тройную связь и может быть замещен одним заместителем, выбираемым из группы, включающей гидрокси, амино, -NHCOCH3, -NH(C1C2алкил), -N(C1-C2алкил)2, -СОО(C1-C4алкил), C1C3алкокси, C1-C3тиоалкил, фтор, хлор, циано, нитро и СО(C1-C4алкил); R19 - метил или этил; В'' - -NR1R2 , -CR 1R2R11 , -С(=CR2R12)R1 , -NHCHR1R2, -OCHR1R2, -SCHR1R2, -CHR2OR12, -CHR2SR12, C(S)R2 или -C(O)R2; R1 - C1-C6алкил, который может быть необязательно замещен одним или двумя заместителями R8, независимо друг от друга выбираемыми из группы, включающей гидрокси, фтор, хлор, бром, йод, СF3, C1-C4алкокси, -O-СO-(C1-C4алкил), -OCO-NH(C1-C4алкил), -O-CO-N(C1-C4алкил) (C1-C4алкил), -NH(C1-C4алкил), -N(C1-C4алкил) (C1-C4алкил), -S(C1-C4алкил), -N(C1C4алкил)СО(C1-C4алкил), -NHCO(C1-C4алкил), СОО(C1-C4алкил), -CONH(C1-C4алкил), -CON(C1C4алкил)(C1-C2алкил), CN, NO2, -SO(C1-C 4алкил) и -SO2(C1-C4алкил), где C1-C6алкил и (C1-C4)алкильные части вышеуказанных групп R1 могут необязательно иметь одну углеродуглеродную двойную или тройную связь; R2 - C1-C12алкил, арил или -(C1-C4алкилен)арил, где арилом является фенил, нафтил, тиенил, бензотиенил, пиридил, хинолил, пиразинил, пиримидинил, имидазолил, фуранил, бензофуранил, бензотиазолил, изотиазолил, бензизотиазолил, бензизоксазолил, бензимидазолил, индолил или бензоксазол; 3-8-членный циклоалкил или -(C1-C6алкилен)циклоалкил, где один или два атома углерода в кольце циклоалкила, имеющего не менее 4 членов, и в циклоалкильной части -(C1-C6алкилен)циклоалкила, имеющего не менее 4 членов в кольце, могут быть необязательно замещены атомом кислорода, серы или N-R9, где R9 является водородом или C1-C4алкилом; где каждая из вышеуказанных групп R2 может быть необязательно замещена одним-тремя заместителями, которые независимо друг от друга выбирают из хлора, фтора и C1-C4алкила, или одним заместителем, выбираемым из группы, включающей бром, 9 71535 10 йод, C1-C6алкокси, -O-СО-(C1-C6алкил), -O-COвыбираемым из группы, включающей бром, йод, N(C1-C4алкил)(C1-C2алкил), -S(C1-C6алкил), CN, C1-C6алкокси, -O-СО-(C1-C6алкил), -O-CO-N(C1NO2, -SO(C 1-C4алкил) и -SO2(C1-C4алкил), и где C4алкил)(C1-C2алкил), -S(C1-C6алкил), CN, NO2, C1-C12алкил и C1-C4алкиленовая часть SO(C1-C4алкил) и -SO2(C1-C4алкил), и где (C1-C4алкилен)арила могут необязательно иметь C1-C12алкил и C1-C4алкиленовая часть одну углерод-углеродную двойную или тройную -(C1-C4алкилен)арила могут необязательно иметь связь; либо -NR1R2 или -CR1R2R11 могут образоодну углерод-углеродную двойную или тройную вывать насыщенное 5-8-членное карбоцикличессвязь; либо -NR1R2 может образовывать насыкое кольцо, которое может необязательно иметь щенное 5-8-членное карбоциклическое кольцо, одну или две углерод-углеродные двойные связи которое может необязательно иметь одну или две и в котором один или два атома углерода могут углерод-углеродные двойные связи и в котором быть замещены атомом кислорода или серы; один или два атома углерода могут быть замещеR11 - водород, гидрокси, фтор или метокси; ны атомом кислорода или серы; R12 - водород или C1-C4алкил; и R3 - метил или этил; A - N, СН или ССН 3; R4 - водород, C1-C4алкил, фтор, хлор, бром, йод, при условии, что, если А представляет собой СН C1-C4алкокси, трифторметокси, -СН2ОСН3, или ССН 3, то В'' означает -NR1R2, -NHR1R2, СН2OСН2СН3, -СН2СН2OСН3, -СН2ОF3, СF3, амино, OCHR1R2 или циано и R4 является электроноденитро, -NH(C1-C4алкил), -N(СН3)2, -NHCOCH3, фицитной группой, такой как NO2, -COO(C 1NHCONHCH3, -SOn(C1-C4алкил), где n означает C4алкил), -С(=O)СН3, -СООН или циано. 0, 1 или 2, циано, гидрокси, -СО(C1-C4алкил), 17. Соединение по пункту 16, где В'' представляет СНО, циано или -СОО(C1-C4алкил), где C1-C4алкил собой -NR1R2 или -NHCHR1R2 и А - СН или СН 3. может необязательно иметь одну двойную или 18. Способ получения соединения формулы I: тройную связь и может быть замещен одним заB местителем, выбираемым из группы, включающей гидрокси, амино, -NНСОСН3, -NH(C1-C2алкил), R4 N(C1-C2алкил)2, -COO(C 1-C4алкил), A -CO(C1-C4алкил), C1-C3алкокси, C1-C3тиоалкил, фтор, хлор, циано и нитро; N ZR5 R3 , R5 - фенил или пиридил, замещенный однимтремя заместителями, которые независимо друг I от друга выбирают из фтора и хлора, C1-C6алкила или его фармацевтически приемлемой соли, в и C1-C6алкоксила, или одним заместителем, выкоторой бираемым из группы, включающей гидрокси, йод, A - -CR 7 или N; бром, формил, циано, нитро, трифторметил, амиВ - -NR1R2, -NHCHR1R2, -OCHR 1R2 или -SCHR1R2; но, -(C1-C6алкил)О(C1-C6)алкил, -NНСН3, -N(СН3)2, Z - NH, O, S, -N(C1-C2алкил) или -С(R13R14), где R13 -СООН, -СОО(C1-C4алкил), -СО(C1-C4алкил), и R14 независимо друг от др уга могут представлять SO2NH(C1-C4алкил), -SO2N(C1-C4алкил)(C1собой водород, трифторметил или метил, либо C2алкил), -SO2NH2, -NHSO2(C1-C4алкил), -S(C1один из элементов R13 и R14 является цианогрупC6алкил) и -SO2(C1-C6алкил), где C1-C4алкильная и пой, а другой - водородом или метилом; C1-C6алкильная части вышеуказанных групп R5 R1 - C1-C6алкил, который может быть необязатемогут быть необязательно замещены одной или льно замещен одним или двумя заместителями двумя фторогр уппами или одним заместителем, R8, независимо друг от друга выбираемыми из выбираемым из гидрокси, амино, метиламино, группы, включающей гидрокси, фтор, хлор, бром, диметиламино и ацетила; и йод, СF3 и C1-C4алкокси, где C1-C6алкил и C1R7 - водород или метил; C4алкильная часть C1-C4алкоксильной группы моили фармацевтически приемлемой соли такого гут необязательно иметь одну углеродсоединения; углеродную двойную или тройную связь; включающий взаимодействие в присутствии осноR2 - C1-C12алкил, арил или -(C1-C4алкилен)арил, вания соединения формулы IV: где арилом является фенил, нафтил, тиенил, бенJ1 зотиенил, пиридил, хинолил, пиразинил, пиримидил, имидазолил, фуранил, бензофуранил, бензоR4 Т тиазолил, изотиазолил, бензизотиазолил, бензизоксазолил, бензимидазолил, индолил или бензоксазолил; 3-8-членный циклоалкил или -(C1N J2 R19 , C6алкилен) циклоалкил, где один или два атома IV углерода в кольце циклоалкила, имеющего не мев которой нее 4 членов, и в циклоалкильной части -(C1Т - CR 7 или N; C6алкилен)циклоалкила, имеющего не менее 4 J1 - хлор; членов в кольце, могут быть необязательно заJ2 - ZR 5; мещены атомом кислорода, серы или N-R9, где R9 R19 – метил или этил; является водородом или C1-C4алкилом; где кажR4, Z, R5, R7 определены выше; дая из вышеуказанных групп R2 может быть необс соединением формулы ВН, в которой В имеет язательно замещена одним-тремя заместителями, указанные выше значения; и последующее необнезависимо друг от др уга выбираемыми из хлора, язательное превращение соединения формулы I, фтора и C1-C4алкила, или одним заместителем, полученного в результате осуществления такой 11 71535 12 реакции, в его фармацевтически приемлемую R4 - водород, C1-C4алкил, фтор, хлор, бром, йод, соль. C1-C4алкокси, трифторметокси, -СН2OСН3, 19. Способ получения соединения формулы I: СН2OСН2СН3, -СН2СН2OСН3, -СН2OF3, СF3, амино, B нитро, -NH(C1-C4алкил), -N(СН3)2, -NНСОСН3, NHCONHCH3, -SOn(C1-C4алкил), где n означает R4 0, 1 или 2, циано, гидрокси, -СО(C1-C4алкил), A СНО, циано или -СОО(C1-C4алкил), где C1-C4алкил может необязательно иметь одну двойную или N ZR5 , R3 тройную связь и может быть замещен одним заместителем, выбираемым из группы, включающей I гидрокси, амино, -NНСОСН3, -NH(C1-C2алкил), или его фармацевтически приемлемой соли, в N(C1-C2алкил)2, -COO(C1-C4алкил), -СО(C1которой C4алкил), C1-C3алкокси, C1-C4тиоалкил, фтор, A - -CR 7 или N; хлор, циано и нитро; В - -NR1R2, -CR1R2R11, -С(=CR2R12)R1 , -NHCHR1R2, R5 - фенил или пиридил, замещенный одним-OCHR1R2, -SCHR1R2, -CHR2OR12, -CHR2SR12, тремя заместителями, которые независимо друг C(S)R2 или -C(O)R2; от друга выбирают из фтора, хлора, C1-C6алкила и Z - NH, O, S, -N(C1-C2алкил) или -С(R13R14), где R13 C1-C6алкоксила, или одним заместителем, выбии R14 независимо друг от друга представляют сораемым из группы, включающей гидрокси, йод, бой водород, трифторметил или метил либо один бром, формил, циано, нитро, трифторметил, амииз элементов R13 и R14 является цианогруппой, а но, -(C1-C6алкил)О(C1-C6)алкил, -NНСН3, -N(СН3)2, другой - водородом или метилом; -СООН, -СОО(C1-C4алкил), -СО(C1-C4алкил), R1 - C1-C6алкил, который может быть необязатеSO2NH(C1-C4алкил), -SO2N(C1-C4алкила льно замещен одним или двумя заместителями (C1-C2aлкил), -SO2NH2, -NHSO2(C1-C4алкил), -S(C1R8, независимо друг от друга выбираемыми из C6алкил) и -SO2(C1-C6алкил), где C1-C4алкильная и группы, включающей гидрокси, фтор, хлор, бром, C1-C6алкильная части вышеуказанных групп R5 йод, СF3 и C1-C4алкокси, где C1-C6алкил и C1могут быть необязательно замещены одной или C4алкильная часть C1-C4алкоксильной группы модвумя фторогр уппами или одним заместителем, гут необязательно иметь одну углеродвыбираемым из гидрокси, амино, метиламино, углеродную двойную или тройную связь; диметиламино и ацетила; и R2 - C1-C12алкил, арил или -(C1-C4алкилен)арил, R7 - водород или метил; где арилом является фенил, нафтил, тиенил, бенпри условии, что, если А представляет собой СН зотиенил, пиридил, хинолил, пиразинил, пиримиили ССН3, то R4 является электронодефицитной дил, имидазолил, фуранил, бензофуранил, бензогруппой, такой как NO2, -COO(C 1-C4алкил), тиазолил, изотиазолил, бензизотиазолил, С(=O)СН3, -СООН или CN; или фармацевтически бензизоксазолил, бензимидазолил, индолил или приемлемой соли такого соединения; бензоксазолил; 3-8-членный циклоалкил или -(C1включающий взаимодействие соединения формуC6алкилен) циклоалкил, где один или два атома лы XII: углерода в кольце циклоалкила, имеющего не меB'' нее 4 членов, и в циклоалкильной части -(C1C6алкилен)циклоалкила, имеющего не менее 4 R4 членов в кольце, могут быть необязательно заA мещены атомом кислорода, серы или N-R9, где R9 является водородом или C1-C4алкилом; где кажN Cl , R19 дая из вышеуказанных групп R2 может быть необязательно замещена одним-тремя заместителями, XII независимо друг от др уга выбираемыми из хлора, в которой R19 - метил или этил и A - N, СН или фтора и C1-C4алкила, или одним заместителем, ССН3, причем если А является N, то В'' и R4 имеют выбираемым из группы, включающей бром, йод, значения, указанные выше для В и R4, а если А C1-C6алкокси, -O-СО-(C1-C6алкил), -O-CO-N(C1представляет собой СН или СН 2, то В'' означает C4алкил)(C1-C2алкил), -S(C1-C6алкил), CN, NO2, NR1R2, -NHR1R2, -OCHR1R2 или циано и R4 являеSO(C1-C4алкил) или -SO2(C1-C4алкил); и где C1тся электронодефицитной группой, такой как NO2, C12алкил и C1-C4алкиленовая часть -(C1-COO(C1-C4алкил), -С(=O)СН3, -СООН или CN; C4алкилен)арила могут необязательно иметь одну с соединением формулы R5ZH, в которой R5 и Z углерод-углеродную двойную или тройную связь; имеют указанные выше значения; и последующее либо -NR1R2 может образовывать насыщенное 5необязательное превращение соединения фор8-членное карбоциклическое кольцо, которое момулы I, получаемого в результате осуществления жет необязательно иметь одну или две углеродтакой реакции, в его фармацевтически приемлеуглеродные двойные связи и в котором один или мую соль. два атома углерода могут быть необязательно 20. Способ по п. 19, где R4 является нитрогруппой замещены атомом кислорода или серы; как в соединении формулы I, так и в соединении R3 - метил, этил, фтор, хлор, бром, йод, циано, формулы IV. метокси, ОСF3, метилтио, метилсульфонил, 21. Способ получения соединения формулы IV: СН2OН или СН 2OСН3; 13 J1 R4 Т R19 71535 14 в которой R19, R4, R5 и R7 имеют указанные выше значения. 22. Способ получения соединения формулы X: Cl N J2 , R7 R4 IV в которой R19 - метил или этил; J1 - хлор; Т - -CR7; J2 - ZR 5; Z - NH, O, S, -N(C1-C2алкил) или -С(R13R14), где R13 и R14 независимо друг от друга представляют собой водород, трифторметил или метил либо один из элементов R13 и R14 является цианогруппой, а другой - водородом или метилом; R4 - водород, C1-C6алкил, фтор, хлор, бром, йод, C1-C4алкокси, трифторметокси, -СН2OСН3, СН2ОСН2СН3, -СН2СН2OСН3, -СН2OF3, СF3, амино, нитро, -NH(C1-C4алкил), -N(СН3)2, -NHCOCH3, NHCONHCH3, -SOn(C1-C4алкил), где n означает 0, 1 или 2, циано, гидрокси, -СО(C1-C4алкил), -СНО, циано или -СОО(C1-C4алкил), где C1-C4алкил может необязательно иметь одну двойную или тройную связь и может быть замещен одним заместителем, выбираемым из группы, включающей гидрокси, амино, -NHCOCH3, -NH(C1-C2алкил), N(C1-C2алкил)2, -СОО(C1-C4алкил), -CO (C1-C4алкил), C1-C3алкокси, C1-C3тиоалкил, фтор, хлор, циано и нитро; и R5 - фенил или пиридил, замещенный однимтремя заместителями, выбираемыми независимо друг о т др уга из фтора, хлора, C1-C6алкила и C1-C6алкоксила, или одним заместителем, выбираемым из группы, включающей гидрокси, йод, бром, формил, циано, нитро, трифторметил, амино, -(C1-C6алкил)О(C1-C6)алкил, -NНСН3, -N(CH3)2, -СООН, -COO(C 1-C4алкил), -СО(C1-C4алкил), SO2NH(C1-C4алкил), -SO2N(C1-C4алкил)(C1C4алкил), -SO2NH2, -NHSO2(C1-C4алкил), -S(C1C6алкил) и -SO2(C1-C6алкил, где C1-C4алкильная и C1-C6алкильная части вышеуказанных групп R5 могут быть необязательно замещены одной или двумя фторогр уппами или одним заместителем, выбираемым из гидрокси, амино, метиламино, диметиламино и ацетила; R7 представляет собой водород, метил, фтор, хлор, бром, йод, циано, гидрокси, -O(C 1-C4алкил), С(О)(C1-C4алкил), -С(O)O(C1-C4алкил), -ОСF3, СF3, -СН2ОН, -СН2ОСН3 или -СН2OСН2СН3; включающий взаимодействие с треххлористым фосфором соединения формулы Х: R19 N+ O R4 X Cl R7 R4 R19 N+ O R19 N+ OX ZR5 , , в которой R19 - метил или этил; Z - О или S; R4 - водород, C1-C4алкил, фтор, хлор, бром, йод, C1-C4алкокси, трифторметокси, -СН2OСН3, СН2OСН2СН3, -СН2СН2OСН3, -СН2OF3, -СF3 , амино, нитро, -NH(C1-C4алкил), -N(СН3)2, NНСОNНСН3, NHCOCH3, SO(C1-C4алкил), где n означает 0, 1 или 2, циано, гидрокси, -СО (C1-C4алкил), -СНО, циано или -COO(C1-C4алкил), где C1-C4алкил может необязательно иметь одну двойную или тройную связь и может быть замещен одним заместителем, выбираемым из группы, включающей гидрокси, амино, -NНСОСН3, -NH(C1C2алкил), -N(C1-C2алкил)2, -COO (C1-C4алкил), -CO(C1-C4алкил), C1-C3алкскси, C1-C3тиоалкил, фтор, хлор, циано и нитро; и R5 - фенил или пиридил, замещенный однимтремя заместителями, которые независимо друг от друга выбирают из фтора, хлора, C1-C6алкила и C1-C6алкоксила, или одним заместителем, выбираемым из группы, включающей гидрокси, йод, бром, формил, циано, нитро, трифторметил, амино, -(C1-C6алкил)О(C1-C6)алкил, -NНСН3, -N(СН3)2, -СООН, -СОО-(C 1-C4алкил), -СО(C1-C4алкил), SO2NH(C1-C4алкил), -SO2N(C1-C4алкил) (С1-С2алкил), -SO2NH2, -NHSO2(C1-C4алкил), -S(C1С6алкил) и -SO2(С1-С6алкил), где C1-C4алкильная и C1-С6алкильная части вышеуказанных групп R5 могут быть необязательно замещены одной или двумя фторогр уппами или одним заместителем, выбираемым из гидрокси, амино, метиламино, диметиламино и ацетила; R7 представляет собой водород, метил, фтор, хлор, бром, йод, циано, гидрокси, -O(C 1-C4алкил), С(О)(C1-C4алкил), -С(O)O(C1-C4алкил), -ОСF3, СF3, -СН2ОН, -СН2ОСН3 или -СН2OСН2СН3; включающий взаимодействие в присутствии основания соединения формулы XI: Cl R7 ZR5 Cl , XI в которой R4, R7 и R19 имеют указанные выше значения, с соединением формулы R5OH или R5SH, где R5 имеет указанные выше значения. 15 71535 Известный уровень техники Предметом настоящего изобретения являются пиридины, пиримидины, пуриноны, пирролопиримидиноны и пирролопиридиноны, способы получения таких соединений, содержащие их фармацевтические композиции и способы их применения для лечения заболеваний центральной нервной системы и других нарушений. Антагонисты кортикотропин-рилизинг фактора описываются в патентах США №4605642 и 5063245, которые соответственно относятся к пептидам и пиразолинонам. В научной литературе уделяется большое внимание антагонистам кортикотропин-рилизинг фактора, например, их рассмотрению посвящен патент США №5063245, который включен в это описание изобретения в качестве противопоставленного материала. Различные виды активности, присущие антагонистам кортикотропин-рилизинг фактору, описываются в работе М. Дж. Овенса и др., Pharm. Rev., т.43, стр.425-473 (1991), которая также включена в качестве противопоставленного материала. На основании исследований, описанных в эти х и других противопоставленных материалах, можно сделать вывод о том, что антагонисты кортикотропинрилизинг фактора являются весьма эффективными при лечении целого ряда заболеваний, связанных с нервно-психическим напряжением, таких как депрессия, беспокойство, головная боль, слизистый колит, воспалительные заболевания, супрессия иммунного ответа, болезнь Альцгеймера, заболевания желудочно-кишечного тракта, анорексия на нервной почве, стресс при кровотечениях, симптомы выведения из организма наркотических средств и алкоголя, привыкание к наркотическим средствам, бесплодие, травмы головы, инсульт и инфекции, вызванные стрессом, у людей и животных. Краткое изложение существа изобретения Предметом настоящего изобретения является соединение формулы: 16 или его фармацевтически приемлемая соль, в которой пунктирными линиями обозначены необязательные двойные связи А - -CR 7 или N; В - -NR1R2, -CR1R2R11, -C(=CR 2R12)R1, NHCHR1R2, -OCHR1R2, -SCHR1R2, -CHR2OR12, CHR2SR12, -C(S)R2 или -C(O)R2; G - кислород, сера, NH, NCH3, водород, метокси, этокси, трифтор-метокси, метил, этил, тиометокси, NH2, NHCH3, N(CH3)2 или трифтор-метил; Υ - -СН или Ν; Ζ - NH, О, S, -N(C 1C2 алкил) или -C(R13R14), где R13 и R14 независимо друг от друга представляют собой водород, трифторметил или метил, либо один из элементов R13 и R14 является цианогруппой, а другой - водородом или метилом; R1 – C1-С6 алкил, который может быть необязательно замещен одним или двумя заместителями R8, которые независимо друг от друга выбирают из группы, включающей гидрокси, фтор, хлор, бром, иод, CF3, C1-C4 алкокси, -О-СО-(С1С4 алкил), -O-CO-NH-(C1C4 алкил), -O-CO-N(C1C4 алкил)(С1-С2 алкил), -NH(C1-C4 алкил), -N(C1-C2 алкил)(С1С4 алкил), -S(C1-C4 алкил), -N(C1-C4 алкил)СО(С 1-С4 алкил), -NHCO(C1-C4 алкил), СОО(С 1-С4 алкил), -CONH(С1-C4 алкил), -CON(C1C4 алкил)(С1С2 алкил), CN, NO2, -SO(C1-C4 алкил) и -SO2(С1-C4 алкил), где С 1-С6 алкил и (С1С4)алкильные части в группах R1 могут необязательно иметь одну углерод-углеродную двойную или тройную связь; R2 - С1-С12 алкил, арил или -(С1С4 алкилен)арил, где арилом является фенил, нафтил, тиенил, бензотиенил, пиридил, хинолил, пиразинил, пиримидил, имидазолил, фуранил, бензофуранил, бензотиазолил, изотиа-золил, бензизотиазолил, бензизоксазолил, бензимидазолил, 17 71535 18 индолил или бензоксазолил; 3-8-членный циклоаR7 - водород, метил, фтор, хлор, бром, иод, лкил или -(C1-C6 алкилен)циклоалкил, в котором циано, гидрокси, -О(С1-С4 алкил), -С(О)(С1-С4 алодин или два атома углерода в кольце циклоалкикил), -С(О)О(С1-С4 алкил), -OCF3, CF3, -CH2OH, ла, имеющем не менее 4 членов, и в циклоалкиСН2ОСН3 или -СН2ОСН2СН3; льной части -(С1-С6 алкилен)циклоал-кила, имеюR11 - водород, гидрокси, фтор или метокси; щего не менее 4 членов в кольце, могут быть R12 - водород или C1-C4 алкил; и необязательно замещены атомом кислорода, сеR16 и R17 независимо друг от друга представры или N-R9, где R9 является водородом или C1-C4 ляют собой водород, гидрокси, метил, этил, метоалкилом; при этом каждая из групп R2 может быть кси или этокси за исключением того, что R16 и R17 необязательно замещена одним-тремя заместине могут одновременно быть метокси или этокси; телями, которые независимо друг от друга выбилибо R16 и R17 вместе образуют окрают из хлора, фтора и С 1-С4 алкила, или одним со(=O)группу; заместителем, выбираемым из группы, включаюпри условии, что если G представляет собой щей бром, иод, С1-С6 алкокси, -О-СО(С1-С6 алкил), атом кислорода, серы, NH или NCH3, он должен -O-CO-N(C1-C4 алкил)(С1-С2 алкил), -S(C1-C6 албыть присоединен посредством двойной связи к пятичленному кольцу формулы III, а также при кил), CN, NO2, -SO(C1-C4 алкил)(*), а C1-С2 алкил и условии, что элемент R6 отсутствует, когда атом С1-С4 алкиленовая часть -(С1-С4 алкилен)арила могут необязательно иметь одну углеродазота, к которому он присоединен, связан двойной связью со смежным атомом углерода в кольце. углеродную двойную или тройную связь; (* -SO2 Типичные варианты осуществления настоя(С1-С4алкил),) щего изобретения включают соединения формул либо -NR1R2 или CR1R2R11 могут образовыI, II или III, в которых: (а) В - -NR1R2, NHCHR1R2, вать насыщенное 5-8-членное карбоциклическое кольцо, которое может необязательно включать SCHR1R2 или –OCHR1R2; R1 – C1-С6 алкил, который может быть необязательно замещен одной одну или две углерод-углеродные двойные связи гидроксильной группой, фтором, CF3 или C1-C2 и в котором один или два атома углерода могут алкоксильной группой и может иметь одну двобыть замещены атомом кислорода или серы; йную или тройную связь; и R2 - бензил или C1-C6 R3 - метил, этил, фтор, хлор, бром, иод, циано, метокси, OCF3, метилтио, метилсульфонил, алкил, который может необязательно иметь одну углерод-углеродную двойную или тройную связь, СН2ОН или СН 2ОСН3; причем С 1-С6 алкил или фенильная часть бензила R4 - водород, С1-С4 алкил, фтор, хлор, бром, могут быть необязательно замещены фтором, иод, С1-C4 алкокси, трифторметокси, -СН2ОСН3, CF3, C1-C2 алкилом или С1-С2 алкоксилом; или (b) СН2ОСН2СН3, -CH2CH2OCH3, -CH2OF3, CF3, амино, нитро, -NH(C1-C4 алкил), -N(CH3)2, -NHCOCH3,В - -CR1R2R11, где R1 С1-С6 алкил, который может быть необязательно замещен одной С 1-С2 алкокNHCONHCH3, -SOn(C1-C4 алкил), где n означает 0, сильной группой, CF3, фтором или гидроксильной 1 или 2, циано, гидрокси, -CO(C1-C4 алкил), -СНО, группой; R2 -бензил или С1-С6 алкил, где С1-С6 циано или -COO(C1-C4 алкил), где C1-C4 алкил алкил или фенильная часть бензила могут быть может необязательно иметь одну двойную или тройную связь и может быть замещен одним занеобязательно замещены одной С 1-С6 алкильной группой, CF3, C1-С6 алкоксильной группой, фторо-, местителем, выбираемым из группы, включающей хлоро- или бромогруппой; и R11 -водород или гидрокси, амино, -NHСОСН3, -NH(C1-C2 алкил), фтор. N(C1-C2 алкил)2, -СОО(С 1-С4 алкил), -СО(С1-С4 Другие варианты осуществления настоящего алкил), С1-С3 алкокси, С1-С3 тиоалкил, фтор, хлор, циано и нитро; изобретения включают соединения формул I, II или III, в которых R1 представляет собой C1-C6 R5 - фенил, нафтил, тиенил, бензотиенил, пиалкил, который может быть необязательно замеридил, хинолил, пирази-нил, пиримидил, фуранил, щен фтором, CF3, гидро-ксилом, С1-С2 алкилом бензофуранил, бензотиазолил или индолил, где или C1-C2 алкоксилом и может иметь одну углекаждая из групп R6 может быть замещена однимтремя заместителями, которые независимо друг род-углеродную двойную или тройную связь, и R2 - С1-С4 алкил, который может быть необязательно от друга выбирают из фтора, хлора, C1-С6 алкила замещен фтором, хлором, CF3, С1-С4 алкилом или и С1-С6 алкоксила, или одним заместителем, выС1-С4 алкоксилом. бираемым из группы, включающей гидрокси, иод, Другие варианты осуществления настоящего бром, формил, циано, нитро, трифторметил, амино, -(С1-С6 алкил)О(С 1-С6)алкил, -NHCH3, -N(CH3)2, изобретения включают соединения формул I, II или II, в которых R3 представляет собой метил, -СООН, -СОО-(С1-С4 алкил), -СО(С1-С4 алкил), хлор или метокси, R4 - метил, -СН2ОН, циано, SO2NH(C1-C4 алкил), -SO2N(C1-C4 алкил)(С1-С2 трифторметокси, метокси, трифторметил, хлор, алкил), -SO2NH2, -NHSO2(C1-C4 алкил), -S(C1-C6 СООСН3, -СН2ОСН3, -СН2СI, -CH2F, амино или алкил) и -SO2(C1-C6 алкил), и где С1-С4 алкильная и С1-С6 алкильная части групп R5 могут быть ненитро; R6 - водород, метил или этил и R5 - фенил или пиридил, где фенил или пиридил замещены обязательно замещены одной или двумя фторогдвумя или тремя заместителями, которые незавируппами или одним заместителем, выбираемым симо друг от др уга выбирают из фтора, хлора, из гидрокси, амино, метиламино, диметиламино и брома и иода, С1-С4 алко-кси, трифторметила, C1ацетила; R6 - водород или C1-С6 алкил, где C1-Сб алкил С6 алкила, который может быть необязательно замещен одной гидроксильной, С1-С2 алкоксильможет быть необязательно замещен одной гидроной или фторогруппой и может иметь одну углексильной, метоксильной, этоксильной или фторогрод-углеродную двойную или тройную связь, руппой; 19 71535 20 -(C1-С4 алкилен)О(С 1-С2 алкил), C1-С3 гидрок(2,4,6-триметилфенокси)-пиридин-4-ил]амин; сиалкил, гидрокси, формил, -COO(C1-C2 алкил), (N-(1-этилпропил)-2-метил-5-нитро-N'-(2,4,6(С1-C2 алкилен)амино и -(С(О)(С1-С4 алкил). триметилпиридин-3-ил)-пиримидин-4,6-диамин; Примерами предпочтительных соединений по [2-(4-хлор-2,6-диметилфенокси)-3,6настоящему изобретению являются: диметилпиридин-4-ил]диэтиламин; 4-(1-этилпропокси)-2,5-диметил-6-(2,4,64-(1-этилпропокси)-3,6-диметил-2-(2,4,6триметилбензил)пиримидин; триметилфенокси)пиридин; 2-(4-бром-2,6-диметилфенокси)-4-(1бутил-[2,5-диметил-7-(2,4,6-триметилфенил)этилпропокси)-3,6-диметилпиридин; 6,7-дигидро-5Н-пирроло[2,3-d]пиримидин-42-(4-этил-2,6-диметилфенокси)-4-(1ил]этиламин; этилпропокси)-3,6-диметилпиридин; 4-(бутилэтиламино)-2,5-диметил-7-(2,4,63-этил-4-(1-этилпропокси)-6-метил-2-(2,4,6триметилфенил)-5,7-дигидро-пирроло[2,3триметилфенокси)пиридин; d]пиримидин-6-он; 2-(2,6-диметил-4-пропилфенокси)-4-(14-(1-этилпропокси)-2,5-диметил-6-(2,4,6этилпропокси)-3,6-диметилпиридин; триметилфенокси)пиримидин; 4-(1-этилпропокси)-2-(4-метокси-2,6N-бутил-N-этил-2,5-диметил-N'-(2,4,6диметилфенокси)-3,6-диметилпиридин; триметилфенил)пиримидин-4,6-диамин; 2-(4-этокси-2,6-диметилфенокси)-4-(1(1-этилпропил)-[5-метил-3-(2,4,6этилпропокси)-3,6-диметилпиридин; триметилфенил)-3Н-имвдазо[4,5-b]-пиридин-72-(4-хлор-2,6-диметилфенокси)-4-(1ил]амин; этилпропокси)-3,6-диметилпиридин; [2,5-диметил-3-(2,4,6-триметилфенил)-3Н4-(1-метоксиметилпропокси)-3,6-диметил-2имидазо[4,5-b]пиридин-7-ил]-(1-этил-пропил)амин; (2,4,6-триметилфенокси)-пиридин; N4-(1-этилпропил)-6,N3-диметил-2-(2,4,6[3,6-диметил-2-(2,4,6-триметилфенокси)триметилфенокси)пиридин-3,4-диамин; пиридин-4-ил]диэтиламин; N4-(1-этилпропил)-6,N3,N3-триметил-2-(2,4,6[3,6-диметил-2-(2,4,6триметилфенокси)-пиридин-3,4-диамин; триметилфенокси)пиридин-4-ил]-этилпропиламин; 6-(1-этилпропокси-2-метил-N4-(2,4,6[2,5-диметил-6-(2,4,6триметилфенил)пиримидин-4,5-диамин; триметилфенокси)пиримидин-4-ил](1-этилпропил)[4-(1-этилпропокси)-3,6-диметилпирвдин-2-ил]амин; (2,4,6-триметилфенил)-амин; и бутил-[3,6-диметил-2-(2,4,66-(этилпропиламино)-2,7-диметил-9-(2,4,6триметилфенокси)пиридин-4-ил]этиламин; триметилфенил)-7,9-дигидро-пурин-8-он. 4-(1-этилпропокси)-3,6-диметил-2-(2,4,6Предметом настоящего изобретения является триметилфенилсульфанил)-пиридин; также фармацевтическая композиция, предназнабутил-[2-(4-хлор-2,6-диметилфенокси)-3,6ченная для лечения (а) болезней, излечиваемых диметилпирвдин-4-ил]этиламин; путем воздействия на кортикотропин-рилизинг сложный метиловый эфир 4-(1фактор, в том числе нарушений, вызываемых этилпропионил)-6-метил-2-(2,4,6-триметилэтим фактором, но не ограничиваясь ими, или (b) фенокси)никотиновой кислоты; воспалительных заболеваний, таких как ревмато[3,6-диметил-[2-(2,4,6идный артрит и остеоарт-рит, боли, астма, псоритриметилфенилсульфанил)пиридин-4-ил]этилаз и аллергия; общее беспокойство, паническое пропиламин; состояние; навязчивый страх; навязчиво4-(1-этилпропиламино)-6-метил-2-(2,4,6компульсивные побуждения; послетриметилфенокси)пиридин-3-ил]-метанол; травматические стрессы; нарушения сна, вызван[2-(4-хлор-2,6-диметилфенокси)-3,6ные стрессом; болевые ощущения, такие как фибдиметилпиридин-4-ил]-этилпропил-амин; ромиалгия; подавление настроение, в частности 1-(этилпропил)-[6-метил-3-нитро-2-(2,4,6депрессия, в том числе сильная степень депрестриметилфенокси)пиридин-4-ил]-амин; сии, непродолжительная депрессия, повторяющаN4-(1-этилпропил)-6-метил-3-нитро-N2-(2,4,6яся депрессия, депрессия у детей, вызванная триметилфенил)пиридин-2,4-диамин; плохим обращением, и послеродовая депрессия; N4-(1-этилпропил)-6-метил-2-(2,4,6дистимия; раздвоение личности; циклотимия; синтриметилфенокси)пирвдин-3,4диамин; дром хронической усталости; головные боли, выз[3,6-диметил-2-(2,4,6ванные стрессом; рак; слизистый колит; болезнь триметилфенокси)пиридин-4-ил]этил-(2,2,2Крона; синдром раздраженной толстой кишки; интрифтор-этил)амин; фекции, связанные с вирусом иммунодефицита N4-(1-этилпропил)-6-метил-N2-(2,4,6человека (ВИЧ); нейродегенеративные заболеватриметилфенил)пиридин-2,3,4-триамин; ния, такие как болезнь Альцгеймера, болезнь Пар[3-хлорметил-6-метил-2-(2,4,6кинсона и болезнь Хантингтона; заболевания жетриметилфенокси)пиридин-4-ил]-(1-этиллудочно-кишечного тракта; нарушения, связанные пропил)амин; с приемом пищи, такие как анорексия или киноре[3,6-диметил-2-(2,4,6ксия; стресс при кровотечениях; зависимость от триметилфенокси)пирицин-4-ил]-(1-этилпропил)химических препаратов и алкоголя (например, амин; зависимость от алкоголя, кокаина, героина, бен(1-этилпропил)-[2-метил-5-нитро-6-(2,4,6зодиазепинов и други х наркотических средств); триметилпиридин-3-илокси)-пиримидин-4-ил]амин; симптомы выведения из организма наркотических (1-этилпропил)-[3-метоксиметил-6-метил-2средств и алкоголя; вызванный стрессом транзи 21 71535 22 торный психоз; эутиреоз; сивдром недостаточносми с человеком); мышечные спазмы; недержание ти антидиуретического гормона; ожирение; беспмочи; старческое слабоумие типа болезни Альцлодие; травма головы; травма спинного мозга; геймера; слабоумие вследствие нескольких инфаишемическое поражение нервных клеток (наприрктов; боковой амиотрофический склероз; зависимер, церебральная ишемия, такая как церебральмость от химических препаратов и алкоголя ная ишемия гаппо-кампа); нервнотоксическое по(например, зависимоть от алкоголя, кокаина, геражение нервных клеток; эпилепсия; инсульт; роина, бензодиазепинов и других наркотических дисфункции иммунной системы, в том числе насредств); симптомы выведения из организма наррушения, вызванные стрессом (например, нервнокотических средств и алкоголя; и гипогликемия у психический синдром у свиней, лихорадка у крупмлекопитающих, в том числе и у человека, котоного рогатого скота при перевозке, судороги у лорый включает введение больному соединения шадей и дисфункции, вызванные тесным содерформул I, II или III либо его фармацевтически жанием цыплят, стресс у овец во время стрижки приемлемой соли, оказывающих эффективное или стресс у собак, вызванный взаимоотношениядействие при лечении такого заболевания. ми с человеком); мышечные спазмы; недержание Это изобретение далее включает промежутомочи; старческое слабоумие типа болезни Альцчные соединения формул : геймера; слабоумие вследствие нескольких инфарктов; боковой амиотрофический склероз и гипогликемия у млекопитающих, в том числе и у человека, которая включает соединение формул I, II или III либо его фармацевтически приемлемую соль, оказывающие эффективное действие при лечении такого заболевания, и фармацевтически приемлемый носитель. Настоящим изобретением далее предусматривается способ лечения (а) болезней, излечиваемых путем воздействия на кортикотропинршшзинг фактор, в том числе нарушений, вызываемых этим фактором, но не ограничиваясь ими, или (b) воспалительных заболеваний, таких как ревматоидный артрит и остеоартрит, боли, астма, псориаз и аллергия; общее беспокойство; паническое состояние; навязчивый страх; навязчивокомпульсивные побуждения; послетравматические стрессы; нарушения сна, вызванные стрессом; болевые ощущения, такие как фибромиалгия; подавленное настроение, в частности депрессия, в в которых R4 и R7 имеют значения, указанные том числе сильная степень депрессии, непродолвыше для формулы I; D -хлор, гидрокси или циажительная депрессия, повторяющаяся депрессия, но; R19 - метил или этил; R5 - фенил или пиридил и депрессия у детей, вызванная плохим обращениR5 замещен двумя или тремя заместителями, коем, и послеродовая депрессия; дистимия; раздвоторые независимо друг от друга выбирают из С 1ение личности; циклотимия; синдром хронической С4 алкила, хлора и брома, за исключением того, усталости; головные боли, вызванные стрессом; что только один такой заместитель может быть рак; слизистый колит; болезнь Крона; синдром бромом; А - N, СН или ССН 3; и Ζ - О, NH, N(CH 3), S раздраженной толстой кишки; инфекции, связанили СН 2 при условии, что, если А представляет ные с вирусом иммунодефицита человека (ВИЧ); собой СН или ССН3, то Ζ должен быть О или S. нейродегенеративные заболевания, такие как боТипичные варианты осуществления настоялезнь Альцгеймера, болезнь Паркинсона и бощего изобретения включают соединения формул лезнь Хантингтона; заболевания желудочноX или XI, в которых R7 - водород или метил. кишечного тракта; нарушения, связанные с приЭто изобретение далее включает промежутоемом пищи, такие как анорексия или кинорексия; чные соединения формулы; стресс при кровотечениях; вызванный стрессом транзиторный психоз; эутиреоз; синдром недостаточности антидиуретического гормона; ожирение; бесплодие; травмы головы; травма спинного мозга; ишемическое поражение нервных клеток (например, церебральная ишемия, такая как церебральная ишемия гиппокампа); нервнотоксическое поражение нервных клеток; эпилепсия; инсульт; дисфункции иммунной системы, в том числе нарушения, вызванные стрессом (например, нервнов которой R19 - метил или этил; А - N, СН или психический синдром у свиней, лихорадка у крупССН3, причем если А представляет собой N, то В" ного рогатого скота при перевозке, судорога у лои R4 имеют значения, указанные для В и R4 в фошадей и дисфункции, вызванные тесным содеррмуле I, а если А представляет собой СН или СН 3, жанием цыплят, стресс у овец во время стрижки то В" является -NR1R2, -NHR1R2, -OCHR1R2 или или стресс у собак, вызванный взаимоотношения 23 71535 24 циано, a R4 - электронодефицитной группой, такой или -NR1R2 может образовывать насыщенное как NO2, -COO(C 1-C4 алкил), -С(=О)СН3, -СООН 5-8-членное карбоциклическое кольцо, которое или CN. может необязательно иметь одну или две углеДругой вариант осуществления настоящего род-углеродные двойные связи и в котором один изобретения относится к соединениям формулы или два атома углерода в кольце могут быть заXII, в которой В" представляет собой –NR1R2 или – мещены атомом кислорода или серы; NHCHR1R2, а А означает СН или СН 3. R3 - метил или этил; Предметом настоящего изобретения является R4 - водород, С1-С4 алкил, фтор, хлор, бром, также способ получения соединения формулы; иод, С1-С4 алкокси, трифторметокси, -СН2ОСН3, СН2ОСН2СН3, -CH2CH2OCH3, -CH2OF3, CF3, амино, нитро, -NH(C1-C4 алкил), -N(CH3)2, -NHCOCH3, NHCONHCH3, -SOn(C1-C4 алкил), где n означает 0, 1 или 2, циано, гидрокси, -CO(C1-C4 алкил), -СНО, циано или -СОО(С1-С4 алкил), где С 1-С4 алкил может необязательно иметь одну двойную или тройную связь и может быть замещен одним заместителем, выбираемым из группы, включающей гидрокси, амино, -NHСОСН3, -NH(C1-C2 алкил), N(C1-C2 алкил)2, -СОО(С 1-С4 алкил), -CO(C1-C4 или его фармацевтически приемлемой соли, в алкил), C1-С3 алкокси, С1-С3 тиоалкил, фтор, хлор, которой циано и нитро; A - -CR 7 или Ν; R5 - фенил или пиридил и замещен однимВ - -NR1R2, -NHCHR1R2. –OCHR1R2 или – тремя заместителями, которые независимо друг SCHR1R2; от друга выбирают из фтора, хлора, C1-С6 алкила Ζ - NH, О, S, -N(C1-C2 алкил) или -C(R13R14), и C1-С6 алкоксила, или одним заместителем, выгде R13 и R14 независимо друг от друга представбираемым из группы, включающей гидрокси, иод, ляют собой водород, трифторметил или метил, бром, формил, циано, нитро, трифторметил, амилибо один из элементов R13 и R14 является цианоно, -(С1-С6 алкил)О(С 1-С6)алкил, -NHCH3, -N(CH3)2, группой, а другой - водородом или метилом; -СООН, -СОО-(С1-С4 алкил), -CO(C1-C4 алкил), R1 – С1-С6 алкил, который может быть необSO2NH(C1-C4 алкил), -SO2N(C1-C4 алкил)(С1-С2 язательно замещен одним или двумя заместитеалкил), -SO2NH2, -NHSO2(C1-C4 алкил), -S(C1-C6 лями R8, независимо друг от друга выбираемыми алкил) и -SO2(C1-C6 алкил), где С 1-С4 алкильная и из группы, включающей гидрокси, фтор, хлор, С1-С6 алкильная части групп R5 могут быть необбром, иод, CF3 и С1-С4 алко-кси, при этом С1-С6 язательно замещены одной или двумя фторогрупалкил и (С1-С4)алкильная часть С1-C4 алкоксильпами либо одним заместителем, выбираемым из ной группы могут необязательно иметь одну углегидрокси, амино, метиламино, ди-метиламино и род-углеродную двойную или тройную связь; ацетила; и R2 - С1-С12 алкил, арил или -(С1-С4 алкиR7 - водород или метил; лен)арил, в котором арил представляет собой или фармацевтически приемлемой соли такофенил, нафтил, тиенил, бензотиенил, пиридил, го соединения; включающий взаимодействие в хино-лил, пиразинил, пиримидил, имидазолил, присутствии основания соединения формулы: фуранил, бензофуранил, бензо-тиазолил, изотиазолил, бензизотиазолил, бензизоксазолил, бензимидазо-лил, индолил или бензоксазолил; 3-8членный циклоалкил или -(С1-С6 алкилен)циклоалкил, где один или два атома углерода в кольце цикло-алкила, имеющего по крайней мере 4 члена, и в циклоалкильной части -(С1С6 алкилен)циклоалкила, имеющего по крайней мере 4 члена в кольце, могут быть необязательно замещены атомом кислорода, серы или N-R9, где R9 является водородом или С1-С4 алкилом; любая из групп R2 может быть необязательно замещена в которой R19 представляет собой метил или одним-тремя заместителями, которые независимо этил, D - хлор, a A, Z, R4 и R5 имеют указанные друг о т др уга выбирают из хлора, фтора и С 1-С4 выше значения, с соединением формулы ВН, в алкила, или одним заместителем, выбираемым из которой В имеет указанные выше значения, с прогруппы, включающей бром, иод, С1-С6 алкокси, -Oследующим необязательным превращением соеCO-(C1-C6 алкил), -O-CO-N(C1-C4 алкил)(С1-С2 алдинения формулы I, полученного в результате кил), -S(C1-C6 алкил), CN, NО2, -SO(C1-C 4 алкил) и такого взаимодействия, в его фармацевтически -SO2(C1-C4 алкил), а С1-С12 алкил и С1-С4 алкилеприемлемую соль. новая часть -(С1-С4 алкилен)арила может необПредметом настоящего изобретения является язательно иметь одну углерод-углеродную двотакже способ получения соединения формулы; йную или тройную связь; 25 71535 или его фармацевтически приемлемой соли, в которой A - -CR 7 или Ν; В - -NR1R2, -CR 1R2R11, -C(=CR 2R12)R1, NHCHR1R2, -OCHR1R2, -SCHR1R2, -CHR2OR12, CHR2SR12, -C(S)R2 или -C(O)R2; Ζ - NH, O, S, -N(C1-C2 алкил) или -C(R13R14), где R13 и R14 независимо друг от друга представляют собой водород, трифторметил или метил, либо один из элементов R13 и R14 является цианогруппой, а другой - водородом или метилом; R1 – С1-С6 алкил, который может быть необязательно замещен одним или двумя заместителями R8, независимо друг от друга выбираемыми из группы, включающей гидрокси, фтор, хлор, бром, иод, CF3 и С 1-C4 алкокси, где C1-С6 алкил и (С1-C4) алкильная часть С1-C4 алкоксильной группы могут необязательно иметь одну углеродуглеродную двойную или тройную связь; R2 - С1-С12 алкил, арил или -(С1-С4 алкилен)арил, где арилом является фенил, нафтил, тиенил, бензотиенил, пиридил, хинолил, пиразинил, пиримидил, имидазолил, фуранил, бензофуранил, бензотиазолил, изотиа-золил, бензизотиазолил, бензизоксазолил, бензимидазолил, индолил или бензоксазолил; 3-8-членный циклоалкил или -(С1-С4 алкилен)циклоалкил, причем один или два атома углерода в кольце циклоалкила, имеющего не менее 4 членов, и в циклоалкильной части -(С1-С6 алкилен)циклоалкила, имеющего не менее 4 членов в кольце, могут быть необязательно замещены атомом кислорода, серы или NR9, где R9 представляет собой водород или C1-C4 алкил; любая из групп R2 может быть необязательно замещена одним-тремя заместителями, независимо друг от друга выбираемыми из хлора, фтора и С 1-C4 алкила, или одним заместителем, выбираемым из группы, включающей бром, иод, С1-С6 алкокси, -О-СО-(С1-С6 алкил), -ОCO-N(C1-C4 алкил)(С1-С2 алкил), -S(C1-C6 алкил), CN, NО2, -SO(C1-C4 алкил) и -SO2(C1-C4 алкил), а С1-С12 алкил и С1-С4 алкиленовая часть (С1-С4 алкилен)арила могут необязательно иметь одну углерод-углеродную двойную или тройную связь; либо -NR1R2 может образовывать насыщенное 5-8-членное карбо-циклическое кольцо, которое может необязательно иметь одну или две углерод-углеродных двойных связей и в котором один или два атома углерода в кольце могут быть замещены атомом кислорода или серы; R3 - метил, этил, фтор, хлор, бром, иод, циано, метокси, OCF3, метилтио, метилсульфонил, СН2ОН или СН 2ОСН3; 26 R4 - водород, С1-С4 алкил, фтор, хлор, бром, иод, С1-С4 алкокси, трифторметокси, -СН2ОСН3(*)СН2СН2ОСН3, -CH2OF3, CF3 , амино, нитро, -NH(C1C4 алкил), -N(CH3)2, -NHCOCH3, -NHCONHCH3, SOn(CrC4 алкил), где η означает 0, 1 или 2, циано, гидрокси, -CO(C1-C4 алкил), -СНО, циано или СОО(С 1-С4 алкил), где С1-С4 алкил может необязательно иметь одну двойную или тройную связь и может быть замещен одним заместителем, выбираемым из группы, включающей гидрокси, амино, NHСОСН3, -NH(C1-C2 алкил), -N(C1-C2 алкил)2, -СОО(С1-С4 алкил), -CO(C1-C4 алкил), C1-C3 алкокси, С1-С3 тиоалкил, фтор, хлор, циано и нитро; ((*)-CH2ОСН2СН3,) R5 - фенил или пиридил и замещен однимтремя заместителями, независимо друг от друга выбираемыми из фтора, хлора, C1-С6 алкила и C1С6 алкоксила, или одним заместителем, выбираемым из группы, включающей гидрокси, иод, бром, формил, циано, нитро, трифторметил, амино, -(С1С6 алкил)О(С 1-С6)алкил, -NHCH3, -N(CH3)2, -COOH, -COO(C1-C4 алкил), -CO(C1-C4 алкил), -SO2NH(C1C4 алкил), -SO2N(C1-C4 алкил)(С1-C2 алкил), SO2NH2, -NHSO2(C1-C4 алкил), -S(C1-C6 алкил) и SO2(C1-C6 алкил), где C1-C4 алкильная и C1-C6 алкильная части групп R5 могут быть необязательно замещены одной или двумя фторогруппами или одним заместителем, выбираемым из гидрокси, амино, метиламино, диметиламино и ацетила; и R7 - водород или метил; при условии, что если А представляет собой СН или ССН 2, R4 является электронодефицитной группой, такой как NO2, -СОО(С 1-С4)алкил, С(=О)СН3, -СООН или CN; или фармацевтически приемлемой соли такого соединения; который включает взаимодействие соединения формулы: в которой R19 представляет собой метил или этил и А - N, СН или ССН3, причем если А означает N, то В" и R4 имеют значения, указанные для В и R4 в пункте 1 формулы изобретения, а если А СН или СН 3, то В" является –NR1R2, -NHR 1R2,OCHR1R2, или СN, R4 – a элeктpoнoдeфицитнoй группой, такой как NO2, -COO(C 1-C4 алкил), С(=О)СН3, -СООН или CN; с соединением формулы R5ZH, в которой R5 и Ζ имеют указанные выше значения, с последующим необязательным превращением соединения формулы I, полученного в результате такого взаимодействия, в его фармацевтически приемлемую соль. Это изобретение относится также к способу получения соединения формулы: 27 71535 28 СН2ОСН2СН3, с тре ххлористым фосфором. Это изобретение относится также к способу получения соединения формулы: в которой R19 - метил или этил; D - хлор; А - -CR 7 или N; Ζ - ΝΗ, О, S, -N(C1-C2 алкил), или -C(R13R14), где R13 и R14 независимо друг от друга представляют собой водород, трифторметил или метил либо один из элементов R13 и R14 является цианогруппой, а другой - водородом или метилом; R4 - водород, С1-С4 алкил, фтор, хлор, бром, иод, С1-С4 алкокси, трифторметокси, -СН2ОСН3, СН2ОСН2СН3, -CH2CH2OCH3, -CH2OF3, CF3, амино, нитро, -NH(C1-C4 алкил), -N(CH3)2, -NHCOCH3, NHCONHCH3, -SOn(C1-C4 алкил), где n означает 0, 1 или 2, циано, гидрокси, -CO(C1-C4 алкил), -СНО, циано или -COO(C1-C4 алкил), где C1-C4 алкил может необязательно иметь одну двойную или тройную связь и может быть замещен одним заместителем, выбираемым из группы, включающей гидрокси, амино, -NHCOCH3, -NH(C1-C2 алкил), (С1-С2 алкил)2, -СОО(С 1-С4 алкил), -CO(C1-C4 алкил), С1-С3 алкокси, С1-С3 тиоалкил, фтор, хлор, циано и нитро; и R5 - фенил или пиридил и замещен однимтремя заместителями, которые независимо друг от друга выбирают из фтора и хлора, C1-С 6 алкила и C1-С6 алкоксила, или одним заместителем, выбираемым из группы, включающей гидрокси, иод, бром, формил, циано, нитро, трифторметил, амино, -(С1-С6 алкил)О(С 1-С6)алкил, -NHCH3, -N(CH3)2, -СООН, -СОО-(С1-С4 алкил), -CO(C1-C4 алкил), SO2NH(C1-C4 алкил), -SO2N(C1-C4 алкил)(С1-С2 алкил), -SO2NH2, -NHSO2(C1-C4 алкил), -S(C1-C6 алкил) и -SO2(C1-C6 алкил), где C1-C4 алкильная и C1-С6 алкильная части групп R5 могут быть необязательно замещены одной или двумя фторогруппами или одним заместителем, выбираемым из гидрокси, амино, метиламино, диметиламино и ацетила; включающий взаимодействие соединения формулы: в которой R19, R4 и R5 имеют указанные выше значения, a R7 представляет собой водород, метил, фтор, хлор, бром, иод, циано, гидрокси, -O(C 1С4 алкил), -С(О)(С1-С4 алкил), -С(О)О(С1-С4 алкил), -OCF3, CF3, -CH2OH, -СН2ОСН3 или в которой R19 - метил или этил; А - -CR 7 или N; Ζ - О, S, -C(R13R14), где R13 и R14 независимо друг от друга представляют cобой водород, трифторметил или метил либо один из элементов R13 и R14 является цианогруппой, а другой - атомом водорода или метилом; R4 - водород, C1-C4 алкил, фтор, хлор, бром, иод, C1-C4 алкокси, трифторметокси, -СН2ОСН3, СH2ОСН2СН3, -СН2СН2ОСН3, -CH2OF3, CF3, амино, нитро, -NH(C1-C4 алкил), -N(CH3)2, -NHCOCH3, NHCONHCH3, -SOn(C1-C4 алкил), где n означает 0, 1 или 2, циано, гидрокси, -CO(C1-C4 алкил), -СНО, циано или -СОО(С1-С4алкил), где С 1-С4 алкил может необязательно иметь одну двойную или тройную связь и может быть замещен одним заместителем, выбираемым из группы, включающей, гидрокси, амино, -NHСОСН3, -NH(C1-C2 алкил), -(С1-С2 алкил)2, -СОО(С 1-С4 алкил), -СО(С1С4 алкил), C1-С3 алкокси, C1-С3 тиоалкил, фтор, хлор, циано и нитро; и R5 - фенил или пиридил и замещен однимтремя заместителями, которые независимо друг от друга выбирают из фтора, хлора, C1-С6 алкила и C1-С6 алкоксила, или одним заместителем, выбираемым из группы, включающей гидрокси, иод, бром, формил, циано, нитро, трифторметил, амино, -(С1-С6 алкил)О(С 1-С6)алкші, -NHCH3, -N(CH3)2, -СООН, -СОО-(С1-С4 алкил), -СО(С1-С4 алкил), SO2NH(C1-C4 алкил), -SO2N(C1-C4 алкил)(С1-С2 алкил), -SO2NH2, -NHSO2(C1-C4 алкил), -S(C1-C6 алкил) и -SO2(C1-C6 алкил), где C1-C4 алкильная и C1-C6 алкильная части групп R5 могут быть необязательно замещены одной или двумя фторогруппами или одним заместителем, выбираемым из гидрокси, амино, метиламино, диме-тиламино и ацетила; включающий взаимодействие в присутствии основания соединения формулы; в которой R4, R7 и R19 имеют указанные выше 29 71535 30 значения, с соединением формулы R5OH или хметиленхлорид, позволяет получить соответстR5ОH, где R5 имеет указанные выше значения. вующее соединение формулы І, в которой В предПодробное описание изобретения ставляет собой -NR1R2. Альтернативно, путем Ниже описываются способы получения соедигидроаминирования соединения формулы І, в конений и композиций по настоящему изобретению. торой В является –NHR1 или -NH2, например поВ приводимом ниже описании и на схемах реакций средством ацюгарования, с последующим восстаэлементы с R1 по R9, R11, R12, R16, R17 , R19, A, B, G, новлением борогидридом (например пунктирные линии и структурные формулы I, II, II, борогидридом натрия), можно получить соответсX, XI, XII и IV при отсутствии специальных указатвующее соединение формулы І, в которой В явний имеют приведенные выше значения. ляется -NHR1R2 или NHCHR1R2. С1-С6 алкил означает алкил с прямой или разЕсли В является –NR1R2 или –NHCHR 1R2, изветвленной цепью, включающий от одного до шебыточное количество ВН можно использовать в сти атомов углерода, такой как метил, этил, изопкачестве как реагента, так и основания. Кроме ропил, трет-бутил или гексил. того, можно применять другие основания, в частЕсли R2 или R5 является гетероциклической ности карбонат калия, три-(С1-С6)алкиламин или группой, то такая группа присоединяется с помогидрид натрия. Эту реакцию выполняют при темщью атома углерода. пературе от 75°С до 230°С. Если реакция осущесЕсли в определениях R1, R2 и R3 указывается, твляется в присутствии основания, такого как гидчто С1-C4 алкил или С1-С6 алкил "может иметь рид натрия, С1-С4 алкоксид калия или лиодну двойную или тройную связь", это значит, что тийорганическое соединение, в частности налкил содержит не менее двух атомов углерода бутиллитий, используется молярный эквивалент для одной двойной или тройной связи. амина. Галогенами, используемыми в этом изобретеЕсли В является –OCHR 1R2 или –SCHR1R2, нии при отсутствии специального указания, являможно использовать основание, способное депроются фтор, хлор, бром или иод. тонировать ВН, например, гидрид щелочного меСоединения формулы І, в которой В предстаталла, в частности гидрид натрия или калия, или вляет собой -NR1R2, -NHCHR1R2, -OCHR1R2 или металлорганическое основание, такое как диизопSCHR1R2, a R3 -метил, этил или хлор (далее R19), ропиламид натрия, бис(триметилсилил)амид наможно получить путем взаимодействия соединетрия, диизопропиламид лития, ния формулы IV, в которой D означает Cl, a A, R4, бис(триметилсилил)амид лития, C1-C4 алкоксид R5 и Ζ имеют значения, приведенные для формунатрия или калия или н-бутиллитий. В качестве лы I, с соединением формулы ВН, в которой В растворителя можно использовать тетрагидрофуимеет указанные выше значения. Эта реакция ран, ацетонитрил, диметилсульфоксид, ацетон, осуществляется в растворителе в присутствии метиленхлорид, толуол, С2-С5 спирт, хлороформ, основания при температуре от 0°С до 230°С. Прибензол, ксилол или 1-метил-2-пирролидинон, при емлемыми растворителями являются такие оргаэтом температура реакции может находиться в нические растворители, как тетрагидрофуран, интервале от 0°С до 180°С, предпочтительно от ацетонитрил, диметилсульфоксид, ацетон, С2-С15 50°С до 80°С. алкиловый спирт, хлороформ (СНСІ3), бензол, Соединения формул I, II и III, в которых В и R3 ксилол, толуол, сульфолан, пиридин, хинолин, имеют значения, указанные для формул I, II и III, 2,4,6-триметилпиридин, ацетамид, ди-(С1за исключением того, что R3 не является метилом С2)алкилацетамид или 1-метил-2-пирролидинон. или этилом (далее определяется как R20, который Предпочтительным способом получения соеимеет те же значения, что и R3, за исключением динений формулы I, в которой А - -CR7, а В - того, что он не может быть метилом или этилом), NR1R2 или -NHCHR1R2, является двухстадийная можно получить путем взаимодействия соединепроцедура, описываемая ниже. Сначала соединений формул I, II или III, в которых R3 является хлоние формулы IV подвергают взаимодействию с ром, с нуклеофилом формулы R20H в присутствии избытком R1NH2 или NH3 или равноценным предорганического или неорганического основания или шественником NH3 (например, NaN3, nBu4N+N3без него. Приемлемые основания включают наили NH 2OH) при температуре от 75°С до 250°С и трий и гидрид натрия, если R20H является алканодавлении от 0 до 21 ат в указанном выше растволом или алкантиолом; или в присутствии более рителе, в результате чего образуется соединение слабых оснований, таких как карбонат калия или формулы І, в которой В является –NHR1, -NH2, триэтиламин, если R20H является амином. СоедиNH2OH или -N3. Соединения формулы І, в которой нения формулы І, в которой R20 является фтором, В означает -N3 или -NH2OH, можно превратить в можно получить из соответствующи х соединений, соответствующие соединения формулы І, в котов которых R20 означает хлор, в результате взаирой В представляет собой -NH2, с помощью хоромодействия с фторидом тетрабутиламмония. шо известных методов, таких как гидрогенизация Приемлемые растворители включают диметилсуили восстановление. Алкилирование соединения льфоксид, тетрагидрофуран или метиленхлорид, формулы І, в которой В является –NHR1 или -NH2, предпочтительно тетрагидрофуран. алкилгалогенидом в присутствии такого основаСоединения формулы I, в которой В - ния, как бистриметилсилиламид лития или натрия, CR1R2R11, -C(C=CR2R12)R1-CHR2OR12, -CHR2SR12 диизопропиламид лития или натрия, н-бутиллитий или -C(O)R2, a R2 представляет собой указанный или трет-бутоксид калия, в приемлемом растворивыше элемент R19, можно получить так, как покателе, таком как тетрагидрофуран, диоксан или зано в схеме реакций 1. 31 71535 32 модействия соединения формулы IB с трехфтористой диэтиламиносерой или смесью трифенилфосфина и четы-реххлористого углерода, получают соединение формулы ІС, в которой В' соответственно является -CR1R2F или -CR1R2CІ. Восстановление соединения формулы IA борогидридом натрия делает возможным получение соединения формулы I, в которой В является -CHR2OH. Алкилирование группы -CHR2OH посредством алкютгалогенида, например алкилиодида, в присутствии такого основания, как гидрид натрия, при комнатной температуре, позволяет получить соединение формулы І, в которой В является -CHR2OR12. Соединения формулы II, в которой элемент R3 аналогичен R19, можно получить из соединений формулы IV, в которой R19, R4, R5 и А имеют указанные выше значения, D является хлором, a YR21 представляет собой NH или -CHR21, где R21 - циано или -СОО(С1-С4 алкил), которые далее выражаются формулой IVB, как это показано на схеме реакций 2. Соединения формулы IV, в которой D является цианогруппой, а А, R4, R5 и R19 имеют значения, указанные для формулы IVA (не приведена), были получены в результате взаимодействия соответствующего соединения, в котором D - хлор, с цианидом калия или цианидом меди в диметилсульфоксиде, 1-метил-2-пирролидиноне, Ν,Νдиметилформамиде или ацетамиде, подвергают взаимодействию с реактивом Гриньяра, содержащим указанную выше гр уппу R2, с целью получения соединений формулы IA. Дальнейшее взаимодействие соединения формулы IA с реактивом Гриньяра, имеющим указанную выше группу R1, позволяет получить соединение формулы IB. Соответствующие соединения формулы ІС, в которой В' является -CR1R2R11 или -C(=CR 2R12)R1, можно получить известными методами. Так, в результате взаимодействия соединения формулы IB с кислотой, такой как концентрированная серная кислота в уксусной кислоте, или внутренней солью Бургесса, такой как сложный метиловый эфир гидроксида (карбоксисульфамоил)триэтиламмония, образуется соединение формулы ІС, в которой В' является -C(=CR 2R12)R1. Гидрогенизация соединения, в котором В' является -C(=CR 2R12)R1 с использованием катализатора, представляющего собой палладированный уголь или диоксид платины, позволяет получить соединение формулы ІС, в которой В' является CHR1R2. В результате взаи Соединения формулы VII, в которой каждый из элементов R4 и R6 представляет собой водород, a Y является Ν, можно получить путем нагре 33 71535 34 ва соединений формулы IVB с кислотным каталине являются водородом. Алкилирование соединезатором в приемлемом растворителе, таком как ния, в котором R17 является гидроксильной груптолуол, бензол, трет-бутанол, ацетонитрил и ацепой, посредством C1-C4алкилиодида в присутсттон, предпочтительно толуол. Кислотным каталивии гидрида натрия позволяет получить затором может быть серная кислота, хлористовосоответствующее соединение, в котором R17 явдородная кислота, паратолуолсульфокислота или ляется О(С 1-С4 алкилом). Восстановление соедиметилсульфокислота, предпочтительно паратолунений формулы VII металлорганическим соединеолсульфокислота. нием, таким как ди(С 1-С6 алкил)цинк, С1-С6 Если Υ в формуле IVB является СН или Ν, для алкиллитий или бромид C1-С6 алкилмагния, деладепротонирования соединения IVB можно испольет возможным получение соединений формулы зовать основание. Приемлемыми растворителями VII, в которой один из элементов R16 и R17 являетмогут быть тетрагидрофуран, толуол и метиленся С 1-С6 алкилом, а другом - гидроксилом. хлорид, температура реакции находится в интерПревращение соединений формулы VIII в соовале от -78°С до 100°С, предпочтительно от -78°С тветствующие соединения формулы IIА выполнядо 50°С, и пригодные основания включают гидрид ют с помощью описанных выше методов с целью натрия, гидрид калия, трет-бутоксид калия, получения соединений формулы I. бис(триметилсилил)амид лития и диизопроСоединения формулы III, в которой G являетпиламид лития или натрия. ся кислородом или серой, a R6 - водородом, можСоединения формулы VII, в которых каждый но получить путем взаимодействия соединений из элементов R4 и R6 является водородом, можно формулы I, в которой R4 представляет амино, а Ζ депротонировать с помощью такого основания, ΝΗ, с фосгеном, дифосгеном, трифосгеном или как гидрид натрия, или металлорганического соетиофосгеном. Эту реакцию осуществляют в придинения, такого как бис(триметилсилил)амид лисутствии основания, такого как три(С 1-С4 алтия, с последующим прекращением реакции холокил)амин, в приемлемом растворителе, предпочдным электрофильным соединением, тительно тетрагадрофуране, при температуре от содержащим группу R4, в частности R 4L, где L яв78°С до 50°С, предпочтительно от 0°С до комнатляется отщепляемой группой, такой как иод, бром, ной температуры. Обычное алкилирование этих ме-зилат, тозилат, или с паратолил-N-фтор-N-С1соединений, в которых R6 является водородом, С6 алкилсульфонамидом, иодином, паранитробеприемлемым основанием, например гидридом нзолом, диметилформамидом, ди(С1-С4 алнатрия, в таком растворителе, как сухой тетрагидкил)кетоном, формальдегидом, (С1-С4 алрофуран, позволяет получить соединения формукил)альдегидом или бромом, в результате чего лы II, в которых R6 является C1-C4 алкилом. получают соединение формулы VII, в которой R4 Соединения формулы III, в которой G являетфтор, хлор, бром, иод, гидрокси, С1-С4 алкил, ся алкилом, можно получить путем взаимодейстS(C1-C4 алкил), СНО, CH(OH)(C1-C4 алкил), вия соединения формулы І, в которой R4 предстаС(ОН)(ди-С1-С4 алкил) или СН2ОН. Дальнейшее вляет собой амино, а Ζ - ΝΗ, с соединением алкилирование гидроксильной группы или окислеформулы GC(OC 1-C2 алкил)3 в присутствии такой ние тиоалкильной группы позволяет получить сокислоты, как паратолуолсульфокислота (р-TsOH), единения формулы VII, в которой R4 представляет метансульфокислота (MsOH), газообразный хлоС1-С4 алко-кси и SOn(C1-C4 алкил), где n означает роводород (HCLg ) или концентрированная серная соответственно 1 или 2. Окисление соединений кислота (H2SO4), в таком растворителе, как толуформулы VII, в которой R4 - гидрокси, a R6 - водоол, ксилол, бензол, диоксан или тетрагидрофуран, род, делает возможным получение соответствуюпри температуре от комнатной до 140°С, предпочщи х соединений, в которых CR4R6 является С=О, тительно до 50°С до температуры кипения с обракоторые в результате гидроаминирования посредтным холодильником. Альтернативно, соединение ством соответствующего амина превращаются в формулы I, в которой R4 является аминогруппой, а соответствующие соединения, в которых R4 являΖ - ΝΗ, можно подвергнуть взаимодействию с соеется аминогруппой. Соединения формулы VII, в динением [G(C=O)]2O, G(C=O)CI или G(C=O)F в которых R4 является нитро- или аминогруппой, присутствии такого основания, как пиридин, проиможно получить путем взаимодействия соединезводное пиридина или три(С 1-С4)алкиламин, в ний формулы VII, в которой оба элемента R4 и R6 приемлемом растворителе, например СН2СI2, являются водородом, с алкилнитритом, в резульСНСІ3, тетрагадрофуране, диоксане, толуоле или тате чего образуются соединения, в которых бензоле, при температуре от 0°С до температуры CR4R6 является C=NOH, а окисление или восстакипения реакционной смеси с обратным холодиновление позволяет получить соединения формульником, предпочтительно от 0°С до комнатной лы VII, в которой R4 является соответственно ниттемпературы, с последующей циклизацией в кисрогруппой или амином. лотных условиях (например, с использованием Соединения формулы VII, в которой один из pTSOH, MSOH, HClg , газообразного бромоводороэлементов R4 и R6 является водородом, можно да (HBrg ) или концентрированной H2SO4). Циклипревратить в соответствующие соединения, в козацию можно выполнять в таком растворителе, торых оба элемента R16 и R17 являются водорокак С1-С5 спирт, толуол, ксилол, бензол, диоксан дом, путем восстановления с помощью такого или тетрагидрофуран. Эту реакцию можно осущевосстановителя, как алюмогидрид лития в тетраствлять в интервале температур от комнатной до гидрофуране. Путем аналогичного восстановле140°С. Температура реакции предпочтительно ния получают соединения, в которых R16 - водонаходится в интервале от 50°С до температуры род, a R17 - гидрокси, когда оба элемента R 4 и R6 кипения с обратным холо-дильником. 35 71535 36 Соединения формулы III, в которой G являетобратным холодильником. ся -O-(C1-C2 алкилом) или -OCF3, можно получить путем взаимодействия соединения формулы III, в которой G является кислородом, a R6 - водородом, с соединением формулы GOSO2CF 3 в присутствии основания, такого как три(С 1-С4 алкил)амин, или с бистриметилсилиламидом лития в гексаметилфосфорами-де или Ν,Νдиметилформамиде, с последующим прекращением реакции холодным соединением формулы Соединения формулы X можно получить из GOSO2 OG или G-X, где X является бромом, хлосоединений приведенной выше формулы XI, в ром или SO3CF3. которой R4 имеет значения, указанные для форСоединения формулы IV, в которой D являетмулы I, и R19 имеет приведенные выше значения ся хлором, a ZR5 -NHR5, можно получить из сое(то есть метил или этил), путем взаимодействия с динений формулы V: соединением формулы: R OH, R SH или R CHR . 5 в которой А и R4 имеют значения, указанные для формулы I, и R19 имеет приведенные выше значения, путем взаимодействия с R5NH2. Эту реакцию осуществляют в тетрагидрофуране или диметилсульфоксиде при температуре от 0°С до 150°С, предпочтительно от 50°С до 130°С. Соединения формулы IV, в которой D является хлором, a Z - О, S, CHR21 , где R21 является электронодефицитной группой, такой как циано, C(=O)R, COOR, в которой R - С1-С4 алкил, бензоил или аллил, или SOn-фенил, где n = 0, 1 или 2, можно получить путем взаимодействия соединений формулы V с соединениями R5OH, R5SH, R5NH2 или R5CHR21. Эта реакция протекает в присутствии основания, способного депротонировать R5ZH, таком как гидрид натрия, гидрид калия, карбонат калия, бис(триметилсилил)амид лития или натрия, диалкиламид лития или натрия, (C1-C4 алкоксид) натрия или калия или н-бутиллитий, с использованием других металлорга-нических галогенидов, таких как бромид, иодид или хлорид меди (I), оксид меди (II), оксид меди (I), металлическая медь и хлорид триалкилолова. Примерами приемлемых растворителей являются тетрагидрофуран, диметилсульфоксид, ацетонитрил, метиленхлорид, 1метил-2-пирролидинон, пиридин, хинолин, Ν,Νдиалкилацетамиды, 2,4,6-триметилпиридин, Ν,Νдиалкилформамиды, например Ν,Νдиметилформамид, гексаметилфосфо-рамид и толуол. Температура реакции может находиться в интервале от 0°С до 180°С, предпочтительно от 0°С до 150°С. Соединения формулы IV, в которой А является CR7, D - хлором, a Z - О, S, CHR21, можно получить путем восстановления рассматриваемых ниже соединений формулы X, в которых R7 и Ζ имеют указанные выше значения, с помощью такого восстановителя, как треххлористый фосфор, в приемлемом растворителе, например метиленхлориде или хлороформе, при температуре от 0°С до 100°С, предпочтительно от комнатной температуры до температуры кипения растворителя с 5 5 21 Эта реакция протекает в присутствии основания, которое способно де-протонировать R5ZH, например, гидрида натрия, гидрида калия, бис(триметилсилил)амида лития, натрия или калия, диалкиламида лития, натрия или калия, С1-С4 алкоксида натрия или калия или н-бутиллития. Приемлемыми растворителями являются тетрагидрофуран, диоксан, диметил-сульфоксид, 1-метил-2-пирролидинон, пиридин, N,N-ди-(C1-C4 алкил)-ацетамиды, ацетамид, N,N-(C1-C4 алкил)формамиды, ацетонитрил, метиленхлорид, толуол и ксилол. Температура реакции может находиться в интервале от -78°С до 150°С, предпочтительно от -40°С до 150°С. Соединения формулы XI можно получить путем взаимодействия соединений формулы V, в которой А представляет собой -CR7, a R4 и R19 имеют указанные выше значения, с таким оксидантом, как метахлорпер-бензойная кислота, перуксусная кислота и пертрифторуксусная кислота, в растворителе, которым может быт метиленхлорид, хлороформ, уксусная кислота, диметилформамид, метанол или смесь нескольких указанных выше растворителей, при температуре от 0°С до 100°С, предпочтительно от комнатной температуры до 60°С. Если R4 является электроноакцепторной группой, такой как NO2, -COO(C 1-C4 алкил), -СООН, CN или -СО(С1-С4)алкил, можно изменить порядок реакций сочетания, с помощью которых группы В и ZR5 вводятся в процесс синтеза соединений формулы I. Группу В можно ввести до стадии сочетания ZR5 с использованием методов, которые аналогичны рассмотренным выше. Например, соединения формулы І, в которой R4 является электронодефицитной группой, можно получить путем взаимодействия соединения формулы XII с соединением формулы HZR5. Соединения формулы XII можно получить путем взаимодействия соединения формулы V, в которой А является CR7, a R19 и R4 имеют указанные выше значения, с соединением формулы В"Н в присутствии осно-вания. Соединения формулы IV, в которой D является хлором, a Z - -N(C1-С4 алкилом), можно получить путем взаимодействия соответствующи х соединений, в которых Ζ означает ΝΗ, с основанием при температуре от -78°С до 100°С, предпочтительно от 0°С до комнатной температуры, с последующим прекращением реакции холодным С 1-С4 алкилиодидом или бромидом. Приемлемыми основаниями являются, например, гидрид натрия, 37 71535 38 бис(триметилсилил)амид лития или натрия, диалR4CH(COO-(Ci-C2 алкила))2 и 2 эквивалентов такиламид лития или натрия и н-бутиллитий. Подхокого основания, как ал-коксид натрия, например дящие растворители включают, в частности, тетметоксид натрия, в смеси спирта (например, мерагидрофуран, диметилсульфоксид, толуол, танола) и ацетона при температуре от 50°С до бензол или метиленхлорид. 200°С, предпочтительно при температуре кипения Соединения формулы IV, в которой D предс обратным холодильником. ставляет собой хлор, гид-рокси или ОР, где Ρ является обычной защитной группой для гидроксила, а Ζ - -CR13R14, можно получить путем алкилирования с использованием содержащего R13 алкилирующего агента, такого как R13I, соединений формулы IV, в которой Ζ является -CHR21, в присутствии основания, которое способно депротонировать группу Ζ, как указывалось выше, с последующим прекращением реакции содержащим R14 алкилирующим агентом, таким как R14I. В результате нагрева соединений формулы IV, в которой D представляет собой хлор или водород, а Ζ -CH(CN), в 85% фосфорной кислоте при температуре кипения с обратным холодильником образуются соответствующие соединения формулы IV, в которой D - гидрокси, a Z –СН2. Путем депротонирования соединений формулы IV, в которой Ζ явЕсли соединения по настоящему изобретению ляется СН2, с помощью такого же основания, косодержат один или несколько хиральных центров, торое использовалось для депротонирования то в объем этого изобретения входят рацемичесR5ZH, с последующим прекращением реакции кие смеси, а также отдельные энантиомеры и диаприемлемым электрофилом, таким как (С1-С6 алстереомеры таких соединений и их смеси. кил)иодид, иод, бром, ацетил-хлорид, формальдеСоли присоединения кислоты соединений фогид, ацетон, паратолил-N-фтор-N-(С1-С6 алрмулы I, II и III (активные соединения по настоякил)суль-фонамид, нитробензол, C1-С6 щему изобретению) можно получить обычным алкилнитрит, этиленоксид или дигалоген-этан, образом путем обработки раствора или суспензии можно получить соответствующие соединения соответствующего свободного основания одним формулы IV, в которой Ζ - -CHR13, -СН(ОН), цикхимическим эквивалентом фармацевтически прилопропил или -C(NOH). Дальнейшее алкилироваемлемой кислоты. Для выделения солей можно ние соединений, в которых Ζ является –CHR13, использовать обычные методы концентрирования например, так, как описывалось выше, с помощью или кристаллизации. Примерами приемлемых алкилирующего агента формулы R14 I, приводит к кислот являются уксусная, молочная, янтарная, образованию соответствующи х соединений, в комалеиновая, винная, лимонная, глюконовая, аскоторых Ζ представляет собой -C(R13R14). рбиновая, бензойная, коричная, фумаровая, сер-C(R5)NOH или -CH(OH)R5 можно превратить в ная, фосфорная, хлористоводородая, бромистоC(O)R5 с помощью известных методов. Путем гидводородая, иодистоводородая, сульфамиловая, рогенизации или восстановления соединений, в сульфоновые кислоты, такие как метансульфокикоторых Ζ является -C=NOH, можно получить соеслота, бензолсульфокислота, паратолуоласульдинения, в которых Ζ представляет собой -CHNH2. фокислота и другие подобные кислоты. В процессе получения некоторых промежуточных Активные соединения по настоящему изобресоединений может потребоваться ввод или удатению можно вводить отдельно или в смеси с фаление защитной группы с целью достижения реакрмацевтически приемлемыми носителями в виде ционной избирательности путем применения стаодной или нескольких доз. Приемлемыми фармандартных процедур органической химии. цевтическими носитєлями являются инертные Соединения формулы V, в которой А является твердые разбавители или наполнители, стерильN (далее определяются как соединения формулы ные водные растворы и различные органические VB) или CR7 (то есть соединения формулы VA), a растворители. Фармацевтические композиции, R4 и R19 имеют значения, указанные для формулы полученные путем соединения новых соединений I, можно получить путем взаимодействия соответформул I, II и III с фармацевтически приемлемыми ствующих соединений формулы VIB и VIA с 1 экносителями, можно вводить в виде различных вивалентом или избытком РОСІ3 при температуре дозированных форм, таких как таблетки, порошки, от комнатной до 180°С, предпочтительно при темлепешки, сиропы, растворы для инъекций и подопературе кипения с обратным холодильником, с бные формы. Эти фармацевтические композиции растворителем или без него. Соединения формумогут, при желании, содержать дополнительные лы VIA можно получить с помощью методов, анаингредиенты, в частности ароматизаторы, связулогичных тем, которые описаны в литературе и ющие вещества, наполнители и другие. Так, в хорошо известны специалистам в этой области. случае перорального введения таблетки, содер(См. Helv Chimica Acta., 25, стр.1306-1313 (1942)). жащие различные наполнители, такие как цитрат Соединения формулы VIB можно получить пунатрия, карбонат кальция и фосфат кальция, мотем взаимодействия 1 эквивалента хлористоводогут также включать различные дезинтегранты, родной соли R19C(=NH)(NH2), 1 эквивалента 39 71535 40 например, крахмал, метилцеллюлозу, альгановую ядерного магнитного резонанса (С13 ЯМР) измекислоту и определенные комплексные силикаты ряли для растворов в дейтеро-хлороформе вместе со связующими веществами, такими как (CDCI3), при этом положения пиков выражены в поли-винилпирролидон, сахароза, желатин и арачастях на миллион нисходящего потока из тетравийская камедь. Кроме того, в процессе таблетиметилсилана (TMS). Формы пиков обозначены рования часто используются смазывающие вещеследующим образом: с, синглет: д, дублет; т, триства, такие как стеарат магния, лаурилсульфат плет; к. квартет; м, мультиплет. натрия и тальк. Твердые композиции аналогичного В этих примерах используются следующие типа можно также использовать в качестве наполаббревиатуры: Ph = фенил; iPr = изопропил; нителей для мягких и жестких желатиновых капHRMS = масс-спектр с высоким разрешением. сул. Веществами, предпочтительно используемыПример 1 ми для этой цели, являются лактоза или A. Бутил-(6-хлор-2,5-диметилпиримвдин-4молочный сахар и высокомолекулярные полиэтиил)этиламин ленгликоли. Если для перорального введения исСмесь 2,5-диметил-4,6-дихлорпиримидина пользуются водные суспензии или эликсиры, ос(0,999г, 5,64ммоля) в 5мл ацетонитрила обрабановной активный ингредиент может быть смешан тывали триэтиламином (0,571г, 5,65ммоля) и Nс различными подслащивающими или ароматизибутилэтиламином (0,570г, 5,65ммоля) и в течение рующими веществами, красителями или пигменночи нагревали с обратным холодильником. Эту тами и, при желании, эмульгирующими или сусмесь охлаждали, разбавляли водой и разбавленспендирующими агентами, используемыми вместе ным хлороводородом, а затем экстрагировали с такими разбавителями, как вода, этанол, пропиэтилацетатом. Органический слой нейтрализоваленгликоль, глицерин и их сочетания. ли насыщенным раствором карбоната калия, проВ случае парентерального введения можно мывали рассолом, сушили и концентрировали с использовать растворы, содержащие активное образованием 0,877г (64%) указанного в заголовке соединение по этому изобретению или его фарсоединения в виде желтого масла. мацевтически приемлемую соль в кунжутном или Спектр 1Н ЯМР (CDCI3) δ 0,90 (т, 3Н), 1,15 (т, арахисовом масле, водном растворе пропиленг3Н), 1,22-1,36 (м, 2Н), 1,5-1,6 (м, 2Н), 2,20 (с, 3Н), ликоля или в стерильном водном растворе. Такие 2,45 (с, 3Н), 3,25-3,48 (м, 4Н) частей на миллион. водные растворы должны, при необходимости, B. N-Бутил-N-2,5-диметил-N'-(2,4,6содержать приемлемый буферный раствор и жидтриметилфенил)-пиримидин-4,6-диамин кий изотонический разбавитель с достаточным Смесь бутил-(6-хлор-2,5-диметилпиримидинсодержанием соли или глюкозы. Такие водные 4-ил)этиламина (398мг, 1,65ммоля), 2,4,6растворы особенно подходят для внутривенного, триметиланилина (4,04г, 30ммолей) и диизопровнутримышечного, подкожного и интраперитонеапил-этиламина (200мг, 1,55ммоля) нагревали в льного введения. Стерильные водные среды можтечение ночи при температуре от 210°С до 230°С. но легко получить с помощью стандартных метоЭту смесь резко охлаждали водой, разбавляли дов, применяемых в этой области. хлороводородом и экстрагировали этилацетатом. Эффективные дозы соединений формул I, II Органический слой нейтрализовали насыщенным или III и и х солей зависят от предполагаемого раствором карбоната калия, промывали рассолом, способа введения и таких факторов, как возраст и сушили и концентрировали с образованием темвес больного, и хорошо известны любому терапеного масла. Это масло перегоняли, что позволило вту. Величина дозы зависит также от заболевания, получить 579мг темного масла, которое затем подлежащего лечению. Например, суточная доза очищали посредством хроматографии на колонках для лечения болезней, вызванных стрессом, восиз силикагеля с использованием в качестве элюепалительных заболеваний, болезни Альцгеймера, нта смеси гексана и хлороформа с соотношением заболеваний желудочно-кишечного тракта, аноре1:1, в результате чего было получено 327мг укаксии на нервной почве, стресса при кровотечениях занного в заголовке соединения в виде желтого и симптомов выведения из организма наркотичествердого вещества. ких средств и алкоголя, обычно составляет от 0,1 Спектр 1Н ЯМР (CDCІ3) δ 0,92 (т, 3Н), 1,14 (т, до 50мг/кг веса тела больного. 3Н), 1,2-1,4 (м, 2Н), 1,45-1,60 (м, 2Н), 1,85 (с, 3Н), Методы, которые можно использовать для 2,16 (с, 6Н), 2,30 (с, 3Н), 2,33 (с, 3Н), 3,2-3,4 (м, определения антагонистической активности сое4Н), 5,8 (широкий синглет, 1Н), 6,90 (с, 2Н) частей динений по настоящему изобретению и их фармана миллион. цевтически приемлемых солей в отношении корПример 2 тикотропин-рилизинг фактора, описываются в A. Бутил-(6-хлор-2-метилпиримидин-4журналах Endocrinology, 116, 1653-1659 (1985) и ил)этиламин Peptides, 10, 179-188 (1985). Связывающая активСмесь 2-метил-4,6-дихлорпиримидина (1,63г, ность соединений формул I, II и III, выражаемая в 10ммолей) в 5мл ацетонитрила обрабатывали Nвиде значений IC50, обычно составляет от 0,5 набутилэтиламином (2,000г, 20ммолей) и нагревали номоля до 10 микромолей. с обратным холодильником в течение 0,5 часа. Настоящее изобретение иллюстрируется ниЭту смесь охлаждали, разбавляли водой и экстражеследующими примерами. Однако вполне понягировали этилацетатом. Органический слой протно, что данное изобретение не ограничивается мывали рассолом, сушили и концентрировали с этими примерами. Температуры плавления не образованием 2,271г (100% 0 указанного в заголоскорректированы. Спектры протонного ядерного вке соединения в виде светло-коричневого магнитного резонанса (1Н ЯМР) и спектры С 13 масла. 41 71535 42 Спектр 1Н ЯМР (CDCІ3) δ 0,93 (т, 3Н), 1,13 (т, 2-Метил-5-нитро-N,N'-бис-(2,4,63Н), 1,22-1,36 (м, 2Н), 1,45-1,6 (м, 2Н), 2,43 (с, 3Н), триметилфенил)пиримидин-4,6-диамин (с, 3Н), 3,25-3,60 (м, 4Н), 6,15 (с, 1Н) частей на Смесь 2-метил-5-нитро-4,6-дихлорпиримидина миллион. (0,513г, 2,47ммоля) в 6мл ацетонитрила обрабаB. N-Бyтил-N-этил-2-мeтил-N'-(2,4,6тывали 2,4,6-триметиланилином (0,333г, тpимeтилфeнил)пиpимидин-4,6-диамин 2,46ммоля) и триэтиламином (1мл) и перемешиСмесь бутил-(6-хлор-2-метилпиримидин-4вали при комнатной температуре в течение 4 чаил)этиламина (1,006г, 4,42ммоля) и 2,4,6сов. Эту смесь резко охлаждали водой и экстрагитриметиланилина (3мл) нагревали в течение ночи ровали этилацетатом. Органический слой с обратным холодильником. Эту смесь резко охпромывали рассолом, сушили и концентрировали лаждали водой и экстрагировали этилацетатом. с образованием 0,622г ярко-желтого твердого веОрганический слой сушили и концентрировали с щества. Это вещество очищали посредством хрообразованием 2,862 коричневого масла. Это масматографии на колонках из силикагеля, что позволо очищали посредством хроматографии на кололило получить (6-хлор-2-метил-5нках из силикагеля, что позволило получить 981мг нитропиримидин-4-ил)-(2,4,6(68%) указанного в заголовке соединения в виде триметилфенил)амин и указанное в заголовке желтого масла. соединение. Спектр 1Н ЯМР (CDCІ3) δ 0,80 (т, 3Н), 1,1-1,3 Спектр 1Н ЯМР (CDCI3) для 6-(хлор-2-метил-5(м, 2Н), 1,3-1,5 (м, 2Н), 2,17 (с, 6Н), 2,27 (с, 3Н), нитропиримидин-4-ил)-(2,4,62,41 (с, 3Н), 3,2 (м, 2Н), 3,36 (м, 2Н), 4,66 (с, 1Н), триметилфенил)амина: δ 2,16 (с, 6Н), 2,33 (с, 3Н), 6,90 (с, 2Н) частей на миллион. 2,43 (с, 3Н), 6,95 (с, 2Н), 8,79 (с, 1H) частей на Пример 3 миллион. A. Бутил-(6-хлор-2-метил-5-этилпиримидин-4Спектр 1Н ЯМР (CDC13) для 2-метил-5-нитроил)этиламин N,N'-бис-(2,4,6-три-метилфенил)пиримидин-4,6Смесь 2-метил-5-этил-4,6-дихлорпиримидина диамина: δ 2,11 (с, 3Н), 2,22 (с, 12Н), 2,33 (с, 3Н), (1,009г, 5,28ммоля) в 5мл ацетонитрила обраба6,96 (с, 4Н), 10,44 (с, 2Н) частей на миллион. тывали триэтиламином (0,571г, 5,65ммоля) и NПример 5 бутилэтиламином (0,540г, 5,31ммоля), а затем N-Бyтил-N-этил-2-мeтил-5-нитpo-N'-(2,4,6нагревали в течение ночи с обратным холодильтpимeтилфeнил)-пиримидин-4,6-диамин ником. Эту смесь разбавляли водой и разбавленСмесь 6-(хлор-2-метил-5-нитропиримвдин-4ных хлороводородом и экстрагировали этилацетаил)-(2,4,6-триметил-фенил)амина (838мг, том. Органичесакий слой нейтрализовали 2,10ммоля) и N-метил-н-бутиламина (555мг, насыщенным раствором карбоната калия, промы5,48ммоля) в 15мл ацетонитрила нагревали с обвали рассолом, сушили и концентрировали с обратным холодильником в течение 2 часов. Эту разованием 1,193г желтого масла, которое очисмесь резко охлаждали водой и экстрагировали щали посредством хроматографии на колонках из этил-ацетатом. Органический слой промывали силикагеля, что позволило получить 1,157г (86%) рассолом, сушили и концентрировали с образовауказанного в заголовке соединения в виде желтого нием 0,837г желтого масла. Твердое вещество масла. очищали посредством хроматографии на колонках Спектр 1Н ЯМР (CDCІ3) δ 0,90 (т, 3Н), 1,13 (т, из силикагеля с использованием в качестве элюе3Н), 1,18 (т, 3Н), 1,1-1,33 (м, 2Н), 1,4-1,6 (м, 2Н), нта смеси гексана и хлороформа с соотношением 2,41 (с, 3Н), 2,62 (к, 2Н), 3,25-3,48 (м, 4Н) частей 1:1, в результате чего было получено 753мг укана миллион. занного в заголовке соединения в виде жетого B. N-Бутил-N-этил-2-метил-5-этил-N'-(2,4,6масла. триметилфенил)-пиримидин-4,6-диамин Спектр 1Н ЯМР (CDCІ3) δ 0,95 (т, 3Н), 1.26 (т, Смесь бутил-(6-хлор-2-метил-53Н), 1,2-1,4 (м, 2Н), 1,55-1,75 (м, 2Н), 2,17 (с, 6Н), этилпиримидин-4-ил)этиламина (200мг, 2,23 (с, 3Н), 2,31 (с, 3Н), 3,4-3,6 (м, 4Н), 6,93 (с, 0,78ммоля) и 2,4,6-триметиланилина (0,963г, 2Н), 9,43 (с, 1Н) частей на миллион. 7,1ммоля) нагревали с обратным холодильником в Пример 6 течение 4 часов. Эту смесь резко охлаждали воСледующие соединения были получены в содой и экстрагировали этилацетатом. Органичесответствии со способом по примерам 3 или 5 при кий слой промывали насыщенным раствором кариспользовании в качестве исходных веществ сообоната калия и рассолом, сушили и тветствующего амина и (6-хлор-2-метил-5концентрировали с образованием темного масла. замещенный-пиримидин-4-ил)-(2,4,6Это масло перегоняли, в результате чего было триметилфенил)амина. получено 579мг темного масла, которое затем Ν-Πропил-Ν-этил-2-метил-5-нитро-Н'-(2,4,6очищали посредством хроматографии на колонках триметилфенил)-пиримидин-4,6-диамин из силикагеля с использованием хлороформа в Спектр 1Н ЯМР (CDCI3) δ 0,93 (т, 3Н), 1,26 (т, качестве элюента, что позволило получить ука3Н), 1,6-1,8 (м, 2Н), 2,17 (с, 6Н), 2,23 (с, 3Н), 2,31 занное в заголовке соединение в виде коричнего (с, 3Н), 3,4-3,55 (м, 4Н), 6,93 (с, 2Н), 9,41 (с, 1Н) масла. частей на миллион. Спектр 1Н ЯМР (CDCІ3) δ 0,93 (т, 3Н), 1,14 (т, N-Бутил-5-этил-2-метил-Н'-(2,4,63Н), 1,1-1,4 (м, 4Н), 1,45-1,60 (м, 2Н), 2,17 (с, 6Н), триметилфенил)пиримидин-4,6-диамин 2,30 (с, 3Н), 2,33 (с, 3Н), 3,2-3,4 (м, 4Н), 6,90 (с, 2Н) Спектр 1H ЯМР (CDC13) δ 0,98 (т, 3Н), 1,12 (т, частей на миллион. 3Н), 1,3-1,5 (м, 2Н), 1,5-1,7 (м, 2Н), 2,17 (с, 3Н), Пример 4 2,30 (с, 3Н), 3,4-3,5 (м, 2Н). 4,30 (широкий синглет, 43 71535 44 1Н), 5,65(ш.с.1Н), 6,91 (с,2Н) ч.млн. гидрофурана обрабатывали гидридом натрия 5,N-Диэтил-2-метил-N'-(2,4,6(9мг, 0,23ммоля, 60% суспензия в масле) при комтриметилфенил)пиримидин-4,6-диамин натной температуре, после чего в эту смесь добаСпектр 1Н ЯМР (CDCІ3) δ 1,09 (т, 3Н), 1,25 (т, вляли 0,02мл метилиодида и перемешивали в 3Н), 2,17 (с, 3Н), 2,30 (с, 3Н), 2,31 (с, 3Н), 3,4-3,6 течение ночи при комнатной температуре. Полу(м, 2Н), 4,35 (широкий синглет, 1Н), 6,90 (с, 2Н) ченную смесь резко охлаждали водой и экстрагичастей на миллион. ровали этилацетатом. Органический слой сушили Пример 7 и концентрировали с образованием 60мг коричнеN-Бутил-N-этил-2-метил-N'-(2,4,6вого масла. Это масло очищали посредством триметилфенил)пиримидин-4,5,6-триамин хроматографии на колонках из силикагеля с испоСмесь N-бутил-N-этил-2-метил-5-нитро-N'льзованием хлороформа в качестве элюента, что (2,4,6-триметилфенил)-пиримидин-4,6-диамина позволило получить 56мг указанного в заголовке (242мг, 0,65ммоля) и оксида платины (35мг) в соединения в виде желтого масла, которое крис50мл этанола гадрогенизировали при давлении таллизовалось после выстаивания. 2,8ат в течение 24 часов. Эту смесь фильтровали Спектр 1Н ЯМР (CDCІ3) δ 0,92 (т, 3Н), 1,17 (т, через целит и концентрировали до сухого состоя3Н), 1,63 (м, 2Н), 2,06 (с, 6Н). 2,33 ((с, 3Н), 2,46 (с, ния с образованием 217мг желтого масла. Масло 3Н), 3,32 (двойной дублет, 2Н), 3,40 (к, 2Н), 3,63 (с, очищали посредством хроматографии на колонках 3Н), 7,00 (с, 2Н) частей да миллион. из силикагеля, что позволило получить 135мг Пример 11 (61%) указанного в заголовке соединения. Следующие соединения были получены в соСпектр 1Н ЯМР (CDCІ3) δ 0,91 (т, 3Н), 1,09 (т, ответствии со способом по примеру 10 путем вза3Н), 1,2-1,4 (м, 2Н), 1,4-1,6 (м, 2Н), 2,18 (с, 6Н), имодействия соединения, указанного в заголовке2,30 (с, 3Н), 2,34 (с, 3Н), 3,0 (широкий синглет, 2Н), примера 9, с соответствующим алкил-иодидом. 3,1-3,3 (м, 4Н), 5,89 (с, 1Н), 6,92 (с, 2Н) частей на 7-Этил-6-(этилпропиламино)-2-метил-9-(2,4,6миллион. триметилфенил)-7,9-дигидропурин-8-он Пример 8 Спектр 1Н ЯМР (CDCІ3) δ 0,92 (т, 3Н), 1,14 (т, Следующие соединения были получены в со3Н). 1,23 (м, 3Н), 1,58 (м, 2Н), 2,04 (с, 6Н), 2,31 (с, ответствии со способом по примеру 7 путем гид3Н), 2,45 (с, 3Н), 3,32(дв. дублет, 2Н), 3,36 (к, 2Н), рогенизации соответствующи х 54,08 (к, 2Н), 7,00 (с, 2Н) частей на миллион. нитропроизводных. 6-(Этилпропиламино)-2-метил-7-пропил-9N-Пропил-N-этил-2-метил-(2,4,6(2,4,6-триметилфенил)-7,9-дигидропурин-8-он триметилфенил)пиримидин-4,5,6-триамин Спектр 1H ЯМР (CDCІ3) δ 0,87 (т, 3Н), 0,90 (т, 1 Спектр Н ЯМР (CDCІ3) δ 0,89 (т, 3Н), 1,09 (т, 3Н), 1,15 (т, 3Н), 1,5-12,8 (м, 4Н), 2,05 (с, 6Н), 2,33 3Н), 1,45-1,60 (м, 2Н), 2,18 (с, 6Н), 2,30 (с, 3Н), 2,34 (с, 3Н), 2,47 (с, 3Н), 3,32 (двойной дублет, 2Н), (с, 3Н), 3,80 (широкий синглет, 2Н), 3,1-3,30 (м, 3,38 (к, 2Н), 4,01 (к, 2Н), 7,00 (с, 2Н) частей на 4Н), 5,95 (широкий синглет, 1Н), 6,92 (с, 2Н) часмиллион. тей на миллион. Пример 12 2-Meтил-N,N'-биc-(2,4,6Сложный этиловый эфир [4-хлор-2-метил-6тpимeтилфeнил)пиpимидин-4,5,6-тpиaмин (2,4,6-триметилфенил-амино)пиримидин-5Спектр 1Н ЯМР (CDCІ3) δ 2,04 (широкий сингил]уксусной кислоты лет, 2Н), 2,21 (с, 12Н), 2,22 (с, 3Н), 2,30 (с, 6Н), Смесь сложного этилового эфира (2-метил6,30 (с, 2Н), 6,92 (с, 4Н) частей на миллион. 4,6-дихлорпиримидин-5-ил)уксусной кислоты Пример 9 (1,470г, 5,9ммоля) и 2,4,6-триметиланилина 6-(Этилпропиламино)-2-метил-9-(2,4,6(2,56мл, 17,7ммоля) в 15мл диметилсульфоксида триметилфенил)-7,9-дигидро-пурин-8-он нагревали в течение ночи при температуре 120°С Смесь N-пропил-N-этил-2-метил-N'-(2,4,6и 5 часов при температуре 138°С. Эту смесь резко триметилфенил)-пирими-дин-4,5,6-триамина охлаждали водой и экстрагировали этилацетатом. (120мг, 0,35ммоля) и триэтиламина (87мг, Органический слой промывали рассолом, сушили 0,86ммоля) в 5мл сухого тетрагидрофурана обраи концентрировали с образованием коричневого батывали трифосгеном (41мг, 0,14ммоля) при темасла. Это масло очищали посредством хроматомпературе 0°С. После практически мгновенного графии на колонках из силикагеля, что позволило образования осадка реакционную смесь нагреваполучить 1,070г (52%) указанного в заголовке соели до комнатной температуры. Вслед за перемединения в виде желтовано-коричневого твердого шиванием в течение 30 минут эту смесь фильтровещества . вали. Фильтрат концентрировали до сухого Спектр 1Н ЯМР (CDCІ3) δ 1,30 (т, 3Н), 2,14 состояния с образованием 125мг (100%) указанно(с, 6Н), 2,32 (с, 3Н), 2,37 (с, 3Н), 3,79 (с, 2Н), 4,23 го в заголовке соединения зеленоватого цвета. (к, 2Н), 7,00 (с, 2Н), 7,02 (с, 1Н) частей на миллиСпектр 1Н ЯМР (CDCІ3) δ 0,90 (т, 3Н), 1,21 он. (т, 3Н), 1,65 (м, 2Н), 2,10 (с, 6Н), 2,34 (с, 3Н), 2,39 Пример 13 (с, 3Н), 3,48 (двойной дублет, 2Н), 3,58 (к, 2Н), 6,99 A. 4-Хлор-2-метил-7-(2,4,6(с, 2Н), 9,63 (с, 1Н) частей на миллион. триметилфениламино)-5,7-дигидро-пирроло[2,3Пример 10 d]пиримидин-6-он 6-(Этилпропиламино)-2,7-диметил-9-(2,4,6Смесь соединения, указанного в заголовке триметилфенил)-7,9-дигидропурин-8-он примера 12 (960мг, 2,76ммоля) и паратолуолсуСмесь соединения, указанного в заголовке льфокислоты (105мг, 0,55ммоля) в 10мл толуола в примера 9 (54мг, 0,15ммоля), в 3мл сухого тетратечение 8 часов нагревали с обратным холодиль 45 71535 46 ником в конденсационном горшке Дина-Старка. Спектр 1Н ЯМР (CDCІ3) (4-хлор-2,5,5Эту смесь резко охлаждали водой и экстрагироватриметил-7-(2,4,6-триметил-фениламино)-5,7ли этилацетатом. Органический слой промывали дигадропирроло[2,3-d]пиримидин-6-он) δ 1,61 рассолом, сушили и концентрировали с образова(с, 6Н), 2,03 (с, 6Н), 2,32 (с, 3Н), 2,53 (с, 3Н), 7,00 нием 800мг коричневой массы, которую очищали (с, 2Н) частей на миллион. посредством хроматографии на колонках из силиСпектр 1Н ЯМР (CDCІ3) (4-хлор-2,5-диметил-7кагеля, что позволило получить 348мг (42%) ука(2,4,6-триметил-фениламино)-5,7занного в заголовке соединения в виде желтого дигидропирроло[2,3-d]пиримидин-6-он) δ 1,65 порошка. (д, 2Н), Спектр 1Н ЯМР (CDCІ3) δ 2,06 (с, 6Н), 2,34 (с, 2.03 (с, 3Н), 2,06 (с, 3Н), 2,34 (с, 3Н), 2,56 (с, 3Н), 2,56 (с, 3Н), 3,75 (с, 2Н), 7,02 (с, 2Н) частей на 3Н), 3,72 (к, 1Н), 7,00 (с, 2Н) частей на миллион. миллион. В. 4-(1-Гидроксиметилпропиламино)-2,5,5B. 4-(1-Гидроксиметилпропиламино)-2-метилтриметил-7-(2,4,6-триметилфенил)-5,77-(2,4,6-триметил-фенил)-5,7-дигидропирроло[2,3дигадропирроло[2,3-d]пиримидин-6-он d]пиримидин-6-он Указанное в заголовке соединение было полуСмесь соединения, полученного в соответстчено в соответствии со способом по примеру 13В вии с пунктом А (168мг, 0,557ммоля), и (S)-2при использовании в качестве исходных ве ществ аминобутанола (0,27мл, 2,78ммоля) в 5мл диме4-хлор-2,5,5-триметил-7-(2,4,6тилсульфоксида нагревали в течение 5 часов при триметилфениламино)-5,7-дигидро-пирроло[2,3температуре 145°С. Эту смесь резко охлаждали d]пиримидин-6-она и (S)-2-аминобутанола в димеводой и экстрагировали этилацетатом. Органичестилсульф-оксиде при температуре 140°С. кий слой промывали рассолом, сушили и концентСпектр 1H ЯМР (CDCІ3) δ 1,02 (т, 3Н), 1,53 (с, рировали с образованием масла. Это масло очи6Н), 1,5-1,8 (м, 2Н), щали посредством хроматографии на колонках из 2,04 (с, 6Н), 2,32 (с, 3Н), 2,38 (с, 3Н), 3,6-3,9 (м, силикагеля, после чего перекристаллизовывали 2Н), 4,0 (м, 1Н), 4,5 (д, 1Н), 5,25 (широкий синглет, простым диэтиловым эфиром, в результате чего 1Н), 7,00 (с, 2Н) частей на миллион. было получено 166мг указанного в заголовке соеПример 16 динения в виде серого твердого вещества. 5-Гидрокси-4-(1-гидроксиметилпропиламино)1 Спектр НЯМР (CDCІ3) δ 1,25 (т, 6Н), 1,5-1,8 2,5-диметил-7-(2,4,6-триметилфенил)-5,7(м, 2Н), 2,07 (с, 6Н), 2,31 (с, 3Н), 2,37 (с, 3Н), 3,50 дигидропирроло[2,3-а]пиримидин-6-он (с, 2Н), 3,4-3,9 (м, 2Н), 4,0 (м, 1Н), 4,8 (д, 1Н), 7,00 Указанное в заголовке соединение было полу(с, 2Н) частей на миллион. чено в соответствии со способом по примеру 13В Пример 14 при использовании в качестве исходных ве ществ 4-Диэтиламино-2-метил-7-(2,4,64-хлор-2,5-диметил-7-(2,4,6триметилфенил)-5,7-дигидро-пирроло[2,3триметилфениламино)-5,7-дигидро-пирроло[2,3d]пиримвдин-6-он d]пиримидин-6-она и (S)-2-аминобутанола в димеУказанное в заголовке соединение было полутилсульфоксиде при температуре 140°С. Было чено в соответствии со способом по примеру 13В получено два диастереоизомера. Ниже приведены при использовани диэтиламина вместо (S)-2спектры для каждого из них. аминобутанола. Первый изомер: спектр 1Н ЯМР (CDCІ3) δ 1,03 1 Спектр Н ЯМР (CDCІ3) δ 1,02 (т, 3Н), 2,08 (с, (т, 3Н), 1,55-1,75 (м, 2Н). 1,77 (с, 3Н), 2,05 (с, 3Н), 6Н), 2,31 (с, 3Н), 2,37 (с, 3Н), 3,55 (к, 4Н), 3,85 (с, 2,07 (с, 3Н), 2,32 (с, 3Н), 2,37 (с, 3Н), 3,55-3,85 2Н), 6,95 (с, 2Н) частей на миллион. (м, 2Н), 4,0 (м, 1Н), 5,1 (д, 1Н), 5,3 (широкий сингПример 15 лет, 1Н), 7,00 (с, 2Н) частей на миллион. А. 4-Хлор-2,5,5-триметил-7-(2,4,6Второй изомер: спектр 1Н ЯМР (CDC13) δ 1,03 триметилфениламино)-5,7-дигидро-пирроло[2,3(т, 3Н), 1,55-1,75 (м, 2Н), 1,73 (с, 3Н), 2,02 (с, 3Н), d]пиримидин-6-он и 4-хлор-2,5-диметил-7-(2,4,62,05 (с, 3Н), 2,32 (с, 3Н), 2,36 (с, 3Н), 3,58 (двойной триме-тилфенил)-5,7-дигидропирроло[2,3дублет, 1Н), 3,77 (двойной дублет, 1Н), 4,1 (м, 1Н), d]пиримидин-6-он 5,03 (д, 1Н), 7,00 (с, 2Н) частей на миллион. Смесь 4-хлор-2-метил-7-(2,4,6Пример 17 триметилфениламино)-5,7-дигидро-пирроло[2,35-Метокси-4-(бутилэтиламино)-2,5-диметил-7d]пиримвдин-6-она (93мг, 0,31ммоля) и гидрида (2,4,6-триметилфенил)-5,7-дигидро-пирроло[2,3натрия (14мг, 0,34ммоля, 60% в масле) в тетрагиd]пиримидин-6-он дрофуране перемешивали в течение 5 минут, по5-Гидрокси-4-(бутилэтиламино)-2,5-диметил-7сле чего обрабатывали избытком метилиодида и (2,4,6-триметилфенил)-5,7-дигидропирроло[2,3перемешивали еще 1 час. Эту смесь резко охлажd]пиримидин-6-он получали в соответствии со дали водой и экстрагировали этилацетатом. Оргаспособом по примеру 16, используя в качестве нический слой промывали рассолом, сушили и исходных веществ 4-хлор-2,5-диметил-7-(2,4,6концентрировали с образованием масла. Это матриметилфениламино)-5,7-дигидропирроло[2,3сло очищали посредством хроматографии на коd]пиримидин-6-он и N-бутилэтиламин в диметиллонках из силикагеля, что позволило получить сульфоксиде при температуре 140°С, Указанное в 32мг 4-хлор-2,5,5-триметил-7-(2,4,6заголовке соединение было получено в результатриметилфениламино)-5,7-дигидропдирроло[2,3те метилирования 5-гидрокси-4-(бутилэтиламино)(3]пиримидин-6-она и 64мг 4-хлор-2,5-диметил-72,5-диметил-7-(2,4,6-триметилфенил)-5,7-дигидро(2,4,6-триметилфениламино)-5,7пирроло[2,3-d]пиримидин-6-она гидридом натрия и дигидропирроло[2,3-d]пиримидин-6-она. метилиодидом в соответствии со способом по 47 71535 48 примеру 10. Бутил-[2,5-диметил-7-(2,4,6-триметилфенил)Спектр 1H ЯМР (CDCІ3) δ 6,97 (д, 2Н), 3,5-4,0 6,7-дигадро-5Н-пирроло[2,3-d]пиримидин-4-ил](м, 4Н), 3,23 (с, 3Н), 2,34 (с, 3Н), 2,32 (с, 3Н), 2,12 этиламин (с, 3Н), 2,03 (с, 3Н), 1,69 (с, 3Н), 1,6-1,8 (м, 2Н), Раствор (4-бутилэтиламино)-2,5-диметил-71,3-1,5 (м, 2Н), 1,24 (т, 3Н), 0,99 (т, 3Н) частей на (2,4,6-триметилфенил)-5,7-дигадропирроло[2,3миллион. d]пиримидин-6-она (111мг, 0,292ммоля) в сухом Пример 18 тетрагидрофуране обрабатывали алюмогидридом 4-(Бутилэтиламино)-2-метил-7-(2,4,6лития при комнатной температуре. Полученную триметилфенил)-5,7-дигидро-пирроло[2,3смесь нагревали с обратным холодильником в d]пиримидин-6-он течение 5 часов. В результате выполнения обычУказанное в заголовке соединение было полуной процедуры было получено 97 мг неочищенночено в соответствии со способом по примеру 13(В) го вещества в виде масла. Это масло очищали в при использовании в качестве исходных ве ществ хроматроне с использованием в качестве элюента 4-хлор-2-метил-7-(2,4,6-триметилфениламино)10% раствора этилаце-тата в гексане, что позво5,7-дигидропирроло-[2,3-d]пиримидин-6-она и Nлило получить бутил-[2,5-диметил-7-(2,4,6-трибутилэтиламина в диметилсульфоксиде, в резульметилфенил)-6,7-дигидро-5Н-пирроло[2,3тате взаимодействия которых в течение 2,5 часов d]пиримидин-4-ил]этиламин в виде прозрачного при температуре 135°С образовалось масло. бледно-желтого масла. Спектр 1Н ЯМР (CDCІ3) δ 7,00 (с, 2Н), 3,85 Спектр 1Н ЯМР (CDCІ3) δ 6,91 (д, 2Н), 3,7-3,9 (с, 2Н), 3,62 (к, 2Н), 3,53 (т, 2Н), 2,35 (с, 3Н), 2,32 (м, 2Н), 3,2-3,4 (м, 4Н), 2,5 (к, 1Н), 2,28 (с, 6Н), 2,22 (с, 3Н), 2,10 (с, 3Н), 1,55-1,70 (м, 2Н), 1,35-1,50 (м, (с, 3Н), 2,05 (с, 3Н), 1,5-1,7 (м, 2Н), 1,3-1,5 (м, 5Н), 2Н), 1,25 (т, 3Н), 1,00 (т, 3Н) частей на миллион. 1,17 (т, 3Н), 0,97 (т, 3Н) частей на миллион. Пример 19 Масс-спектр с высоким разрешением 4-(Бутилэтиламино)-2,5-диметил-7-(2,4,6(C23H34N4): высчитано 366,2776, обнаружено триметилфенил)-5,7-дигидро-пирроло[2,3366,27622. d]пиримидин-6-он Пример 21 Раствор 4-(бутилэтиламино)-2-метил-7-(2,4,64-(Бутилэтиламино)-2,5,5-триметил-7-(2,4,6триметилфенил)-5,7-дигидропирроло[2,3триметилфенил)-6,7-дигидро-5Н-пирроло[2,3d]пиримидин-6-она (285мг, 0,78ммоля) в 5мл сухоd]пиримидин-6-ол го тетрагидрофурана обрабатывали Указанное в заголовке соединение было полубис(триметилсилил)амидом лития (1,05ммоля) чено в соответствии со способом по примеру 20 при температуре -78°С и перемешивали в течение при использовании в качестве исходного вещест5 минут и резко охлаждали метилиодидом ва (4-(бутил-этиламино)-2,5,5-триметил-7-(2,4,6(0,054мл, 0,858ммоля) при той же температуре. триметилфенил)-5,7-ди-гидропирроло-[2,3После перемешивания в течение 10 минут эту d]пиримидин-6-он); полученный продукт представсмесь нагревали до 0°С и 20 минут перемешивали лял собой бледно-желтое твердое вещество, темпри этой температуре. Смесь резко охлаждали пература плавления 142-145°С. насыщенным раствором хлорида аммония и экстСпектр 1H ЯМP (CDCІ3) δ 6,95 (д, 2Н), 4,90 рагировали этилацетатом. Органический слой (с, 1H), 3,1-3,4 (м, 4Н), 2,4 (широкий синглет, 1H), промывали рассолом, сушили и концентрировали 2,33 (с, 3Н), 2,31 (с, 3Н), 2,21 (с, 3Н), 2,17 (с, 3Н), с образованием массы пурпурного цвета. Эту мас1,50 (с, 3Н), 1,45 (с, 3Н), 1,25-1,60 (м, 4Н), 1,11 (т, су очи щали посредством хрогматографии на ко3Н), 0,93 (т, 3Н) частей на миллион. лонках из силикагеля, что позволило получить 4Пример 22 (бутилэтиламино)-2,5-диметил-7-(2,4,6Бутилэтил-[6-метокси-2,5,5-триметил-7-(2,4,6триметилфенил)-5,7-дигидро-пирроло[2,3триметилфенил)-6,7-дигидро-5Н-пирроло[2,3d]пиримидин-6-он (120мг) в виде пурпурного стекd]пиримидин-4-ил]-амин ла, 4-(бутилэтиламино)-2,5,5-триметил-7-(2,4,6К раствору 4-(бутилэтиламино)-2,5,5триметилфенил)-5,7-дигидро-пирроло[2,3триметил-7-(2,4,6-триметил-фенил)-6,7-дигидросі]пиримидин-б-он (35 мг) в виде пурпурного стек5Н-пирроло[2,3-d]пиримидин-6-ола (20мг, ла и 98 мг смеси двух компонентов также в виде 0,05ммоля) в 1мл сухого тетрагидрофурана добапурпурного стекла. вляли при комнатной температуре сначала гидрид Спектр 1Н ЯМР (CDCI3) (4-(бутилэтиламино)натрия (60% суспензия в масле, 4мг, 0,1ммоля), а 2,5-диметил-7-(2,4,6-триметилфенил)-5,7затем метилиодид (0,3мл). После перемешивания дигидропирроло[2,3-d]пиримидин-6-он) δ 6,96 (с, при комнатной температуре в течение 2,5 часов 2Н), 3,7-3,9 (м, 2Н), 3,51 (к, 1H), 3,15-3,4 (м, 2Н), эту смесь резко охлаждали насыщенным раство2,34 (с, 3Н), 2,30 (с, 3Н), ром хлорида аммония и экстрагировали этилаце2,08 (с, 3Н), 2,05 (с, 3Н), 1,53 (д, 3Н), 1,5-1,65 татом. Органический слой промывали рассолом, (м, 2Н), 1,3-1,4 (м, 2Н), 1,17 (т, 3Н), 0,95 (т, 3Н) сушили и концентрировали с образованием 26мг частей на миллион. неочищенного вещества. После очистки посредстСпектр 1H ЯМР (CDCI3) (4-(бутилэтиламино)вом хроматографии на колонке из силикагеля с 2,5,5-триметил-7-(2,4,6-триметилфенил)-5,7использованием 10% раствора этилацетата в гекдигидропирроло[2,3-d]пиримидин-6-он) δ 6,98 сане было получено 19мг бесцветного масла, ко(с, 2Н), 3,45 (к, 2Н), 3,34 (т, 2Н), 2,34 (с, 3Н), 2,33 торое представляло собой указанное в заголовке (с, 3Н), 2,06 (с, 6Н), 1,55-1,7 (м, 2Н), 1,3-1,45 (м, соединение. 2Н), 1,23 (т, 3Н), 0,99 (т, 3Н) частей на миллион. Спектр 1Н ЯМР (CDCІ3) δ 6,92 (с, 1Н), 6,89 Пример 20 (с, 1Н 4,48 (с, 1Н),*. 3,11 (с, 3Н), 2,32 (с, 3Н), 2,28 49 71535 50 (с, 3Н), 2,20 (с, 3Н), 2,19 (с. 3Н), 1,45 (с, 3Н), 1,44 Спектр 1Н ЯМР (CDCІ3) δ 6,89 (с, 2Н), 5,60 (с, 3Н), 1,4-1,52 (м, 2Н), 1,2-1,4 (м, 2Н), 1,10 (т, 3Н), (широкий синглет, 2Н), 3,8-4,0 (м, 4Н), 2,27 (с, 6Н), 0,90 (т, 3Н) частей на миллион. 2,13 (с, 6Н), 2,1-2,25 (м, 2Н), 1,93 (с, 3Н) частей на *3,1-3,3 (Μ, 4Η), миллион. Пример 23 Пример 26 4-(Бутилэтиламино)-2-метил-7-(2,4,62-(S)-[2,5-Диметил-6-(2,4,6-триметилфенокси)триметилфенил)-7Н-пирроло-[2,3-d]пиримидинпиримидин-4-ил-амино]-бутан-ол 5,6-дион Смесь 4-хлор-2,5-диметил-6-(2,4,6Раствор 4-(бутилэтиламино)-2-метил-7-(2,4,6триметилфенилокси)пиримидина (30мг) и 2-(S)триметилфенил)-5,7-дигадровдирроло[2,3амино-1-бутанола (0,5мл) в 0,5мл диметилсульd]пиримидин-6-она (76мг, 0,207ммоля), РОСІ3 фоксида нагревали при температуре 130°С в те(0,039мл, 0,415ммоля), триэтиламина (0,059мл) и чение 4 часов, после чего ее резко охлаждали диметиламина (1мл) в 2мл ацетонитрила нагреваводой и экстрагировали этилацетатом. Органичесли в обратным холодильником в течение 1 часа. кий слой отделяли, сушили и концентрировали с Полученную смесь резко охлаждали водой и экстобразованием неочищенного вещества. Остаток рагировали этилацетатом. Органический слой очищали посредством хроматографии на колонках сушили и концентрировали с образованием корииз силикагеля, что позволило получить 24 мг укачневой массы (105мг). После выполнения хромазанного в заголовке соединения в виде белых критографии на колонках из силикагеля отделяли сталлов. указанное в заголовке соединение в виде желтого Масс-спектр с высоким разрешением стекла (10мг). (C19H27N3 O2): высчитано 329,2103, обнаружено Спектр 1H ЯМР (CDCI3) δ 7,00 (с, 2Н), 3,95-4,15 329,21249. (м, 2Н), 3,65-3,85 (м, 2Н), 2,38 (с, 3Н), 2,32 (с, 3Н), Инфракрасный спектр (КВr): 3400, 2940, 2,10 (с, 6Н), 1,55-1,75 (м, 2Н), 1,35-1,55 (м, 2Н), 1580см -1. 1,25 (т, 3Н), 1,00 (т, 3Н) частей на миллион. Спектр 1Н ЯМР (CDCІ3) δ 6,841 (с, 2Н), 5,72 Пример 24 (широкий синглет, 1Н), 4,45 (д, 1H), 3,82-3,96 (м, Н-Бутил-N-этил-2,5-N'-триметил-N'-(2,4,61H), 3,72-3,9 (м, 1Н), 3,5-3,6 (м, 1H), 2,27 (с, 3Н), триметилфенил)-пиримидин-4,6-диамин 2,21 (с, 3Н), 2,08 (с, 3Н), 2,02 (с, 6Н), 1,4-1,7 (м, Смесь (6-хлор-2,5-диметилпиримидин-4-ил)2Н), 1,03 (т, 3Н) частей на миллион. метил-(2,4,6-триметил-фенил)амина и NПример 27 бутилэтиламина (0,3мл) в 1мл диметилсульфок4-(1-Этилпропокси)-2,5-диметил-6-(2,4,6сида нагревали в масляной бане при температуре триметилфенокси)-пиримидин 160°С в течение 15 часов, после чего ее резко Смесь 3-пентанола (0,3мл) и гидрида натрия охлаждали водой и экстрагировали этилацетатом. (60% суспензия в масле, 32мг, 0,81ммоля) в димеОрганический слой отделяли, сушили и конценттилсульфоксиде перемешивали при комнатной рировали, в результате чего было получено нетемпературе в течение 5 минут и добавляли 4очищенное вещество. После очистки посредством хлор-2,5-диметил-6-(2,4,6хроматографии на колонках из силикагеля с испотриметилфенилокси)пиримидин (150мг, льзованием хлороформа в качестве элюента было 0,54ммоля). Полученную смесь нагревали при получено указанное в заголовке соединение в температуре 150°С в течение 5 часов, после чего виде масла. ее резко охлаждали водой и экстрагировали этиСпектр 1Н ЯМР (CDCІ3) δ 6,83 (с, 2Н), 3,22 (с, лацетатом. Органический слой отделяли, сушили 3Н), 3,12 (м, 4Н), 2,44 (с, 3Н), 2,26 (с, 3Н), 2,01 (с, и концентрировали с образованием твердого ве6Н), 1,35-1,42 (м, 2Н), 1,1-1,25 (м, 2Н), 1,00 (т, 3Н), щества бежевого цвета. Это вещество очищали 0,90 (т, 3Н) частей на миллион. посредством хроматографии на колонках из силиПример 25 кагеля с использованием в качестве элюента 20% [2,5-Диметил-6-(тетрапідрофуран-3-илокси)раствора хлороформа в гексане, что позволило пиримидин-4-ил]-(2,4,6-триметилфенил)амин получить указанное в заголовке соединение в виСмесь 3-гидрокситетрагидрофурана (0,5мл) и де белых кристаллов, температура плавления щцрвда натрии (60% суспензия в масле, 53мг, 93,5-95,5°С. 1,33ммоля) в сухом тетрагидрофуране перемешиСпектр 1H ЯМР (CDCІ3) δ 6,85 (с, 2Н), 5,11 (т, вали при комнатной температуре в течение 5 ми1H), 2,27 (с, 3Н), 2,26 (с, 3Н), 2,11 (с, 3Н), 2,03 (с, нут и добавляли (6-хлор-2,5-диметилпиримидин-46Н), 1,68 (т, 4Η), 0,92 (т, 6Η) частей на миллион. ил)-(2,4,6-триметилфенил)амин (107мг, Пример 28 0,388ммоля). Полученную смесь нагревали с обСложный этиловый эфир [[6-(Бутил-Nратным холодильником в течение 15 часов, после этиламино)-2-метил-пиримидин-4-ил]-(2,4,6чего ее резко охлаждали водой и экстрагировали триметилфенил)амино]уксусной кислоты этилацетатом. Органический слой отделяли, суСмесь сложного этилового эфира [(6-хлор-2шили и концентрировали с образованием желтого метилпиримидин-4-ил)-(2,4,6масла. Масло очищали посредством хроматогратриметилфенил)амино]уксусной кислоты (85мг, фии на колонках из силикагеля с использованием 0,244ммоля) и N-бутилэтиламина (0,17 мл, 1,1 в качестве элюента 20% раствора этилацетата в ммоля) в 4 мл диметилсульфоксида нагревали гексане, что позволило получить 48мг указанного при температуре 135°С в течение 15 часов, после в заголовке соединения в виде кристаллов белого чего добавляли 1мл N-бутилэтиламина и нагревацвета с желтоватым оттенком, температура плавли реакционную смесь при той же температуре ления 126-128°С. еще 15 часов (тонкослойная хроматография пока 51 71535 52 зала отсутствие исходного вещества). Эту смесь Спектр 1Н ЯМР (CDCІ3) δ 6,83 (с, 2Н), 5,49 (с, 1 резко охлаждали водой и экстрагировали этилН), 3,2-3,4 (м, 2Н), 3,0-3,2 (м, 2Н), 2,51 (с, 3Н), ацетатом. Органический слой отделяли, сушили и 2,24 (с, 3Н), 2,21 (с, 6Н), 1,66 (с, 3Н), 1,35-1,50 концентрировали с образованием 123мг светло(м, 2Н), 1,1-1,3 (м, 2Н), 1,05 (т, 3Н), 0,84 (т, 3Н) желтого масла. Это масло очищали посредством частей на миллион. хроматографии на колонках из силикагеля с испоПример 31 льзованием в качестве элюента 5% раствора эти2-[6-(1-Этилпропокси)-2,5-диметилпиримидинлацетата в гексане, что позволило получить 92мг 4-ил]-2-(2,4,6-три(91%) указанного в заголовке соединения в виде метилфенил)пропионитрил белого стекла. К раствору 3-пентанола (140мг, 1,59ммоля) в Спектр 1H ЯМР (CDCІ3) δ 6,94 (с, 2Н), 4,69 2мл сухого тетрагад-рофурана добавляли гидрид (с, 1H), 4,23 (с, 2Н), 4,22 (к, 2Н), 3,35 (к, 2Н), 3,15 натрия (60% суспензия в масле, 38мг) и переме(т, 2Η), 2,36 (с, 3Н), 2,31 (с, 3Н), 2,21 (с, 6Н), 1,3шивали эту смесь при комнатной температуре в 1,5 (м, 2Н), 1,34 (т, 3Н), 1,1-1,3 (м, 2Н), 1,01 (т, 3Н), течение 5 минут. К реакционной смеси добавляли 0,80 (т, 3Н) частей на миллион. 2-(6-хлор-2,5-диметилпиримидин-4-ил)-2-(2,4,6Пример 29 триметилфенил)пропионитрил (100мг, 4-(1-Этилпропокси)-3,6-диметил-2-(2,4,60,319ммоля) и полученную смесь нагревали с обтриметилфенокси)пиридин ратным холодильником в течение 4 часов. Эту К раствору 3-пентанола (0,2мл, 0,5205моля) в смесь резко охлаждали водой и экстрагировали диметилсульфоксиде (1мл) порциями добавляли этилацетатом. Органический слой отделяли, су60% суспензию гидрида натрия в масле (30мг). шили и концентрировали с образованием коричПосле перемешивания при комнатной температуневого масла (170мг). Остаток очищали в хроматре в течение 5 минут добавляли раствор 4-хлорроне с использованием в качестве элюента 20% 2,5-диметил-6-(2,4,6-триметилфенокси)пиридина раствора этилацетата в гексане, в результате чего (98мг) в 0,5мл сухого те трагидрофурана и полубыла получена смесь двух изомеров в виде стекченную смесь нагревали при температуре 130°С в ловидной массы желтого цвета, каждый из кототечение 5 часов. Затем ее резко охлаждали водой рых имел значение М+, равное 365, на основании и экстрагировали этилацетатом. Органический данных газовой хроматографии и массслой отделяли, сушили и концентрировали с обспектрометрии. разованием желтого твердого вещества. Это веСпектр 1Н ЯМР (CDCІ3) δ 6,8 и 6,76 (с, 2Н), щество очищали посредством хроматографии на 4,08 и 3,96 (м, 1Н), 3,25 и 3,22 (с, 3Н), 2,36 и 2,30 колонках из силикагеля с использованием в качес(с, 3Н), 2,21, 2,20 и 2,06 (с, всего 9Н), 1,5-1,7 тве элюента 20% раствора хлороформа в гексане, (м, 4Н), 1,04 (с, 3Н), 0,96 и 0,90 (т, 3Н) частей на что позволило получить 7мг указанного в заголовмиллион. ке соединения в виде белых кристаллов, темпераПример 32 тура плавления 72,5-74°С. 4-(1-Этилпропокси)-2,5-диметил-6-(2,4,6Спектр 1Н ЯМР (CDCІ3) δ 6,84 (с, 2Н), 6,26 триметилбензил)пиримидин (с, 1Н), 4,16 (м, 1Н), 2,27 (с, 3Н), 2,17 (с, 6Н), 2,04 Указанное в заголовке соединение было полу(с, 6Н), 1,69 (м, 4Н), 0,95 (т, 6Η) частей на милличено в соответствии со способом по примеру 32 он. при использовании в качестве исходных ве ществ Мезилатную соль 4-(1-этилпропокси)-3,54-хлор-2,5-диметил-6-(2,4,6диметил-2-(2,4,6-триметил-фенокси)пиридина потриметилбензил)пиримидина и 3-пентанола. Белучали путем добавления 1 эквивалента метансулые кристаллы, температура плавления 82-84°С льфокислоты в этилацетате. Белые кристаллы Соединения, указанные в заголовках примевыкристаллизовывали из этил-ацетата. Темпераров 33-39, были получены в соответствии со спотура плавления 117-119°С. собом по примеру 27 при использовании в качестПример 30 ве исходных ве ществ 4-хлор-2-метил-5[6-(Бутилэтиламино)-2,5-диметилпиримидин-4замещенного-6-замещенногоил]-(2,4,6-триметил-фенил)ацетонитрил фенокси)пиримидина и 3-пентанола. К раствору мезитилацетонитрила (66мг, Пример 33 0,41ммоля) в 1мл диметилсульфоксида добавля4-(2,4-Диметилфенокси)-6-(1-этилпропокси)ли NaH (60% суспензия в масле, 20мг, 0,50ммоля) 2,5-диметилпиримидин и перемешивали при комнатной температуре в Спектр 1Н ЯМР (CDCІ3) δ 6,8-7,0 (м, 3Н), 5,13 течение 20 минут, затем добавляли бутил-(6-хлор(м, 1Н), 2,30 (с, 6Н), 2,10 (с, 3Н), 2,09 (с, 3Н), 1,68 2,5-диметюширимидин-4-ил)этиламин (100мг, (м, 4Н), 0,92 (т, 6Η) частей на миллион. 0,414ммоля) и полученную смесь нагревали при Пример 34 температуре 130°С в течение 15 часов. Эту смесь 4-(2,6-Диметилфенокси)-6-(1-этилпропокси)резко охлаждали водой и экстрагировали этила2,5-диметилпиримидин цетатом. Органический слой отделяли, сушили и Спектр 1Н ЯМР (CDCІ3) δ 7,04 (м, 3Н), 5,12 (м, концентрировали с образованием 160мг коричне1Н), 2,25 (с, 3Н), 2,13 (с, 3Н), 2,07 (с, 6Н), 1,66 (м, вого масла. Это масло очищали посредством 4Н), 0,92 (т, 6Η) частей на миллион. хроматографии на колонках из силикагеля с испоПример 35 льзованием в качестве элюента 5% раствора эти4-(1-Этилпропокси)-2-метил-6-(2,4,6лацетата в гексане, что позволило получить укатриметилфенокси)пиримидин-5-карбонитрил занное в заголовке соединение в виде Температура плавления 128-130°С. коричневого масла. Спектр 1Н ЯМР (CDCІ3) δ 6,8 (с, 2Н), 5,18 (м, 53 71535 54 1Н), 2,30 (с, 3Н), 2,21 (с, 3Н), 2,00 (с, 6Н), 1,4-1,58 1Н), 4,20 (м, 1Н), 2,20 (с, 6Н), 2,08 (с, 6Н), 1,73 (м, 4Н), 0,90 (т, 6Η) частей на миллион. (м, 4Н), 0,99 (т, 6Η) частей на миллион. Пример 36 Пример 44 6-трет-Бутил-4-(1-этилпропокси)-2-метил-63-Этил-4-(1-этилпропокси)-6-метил-2-(2,4,6(2,4,6-триметил-(фенокси)пиримидин триметилфенокси)-пиридин Спектр 1Н ЯМР (CDCІ3) δ 6,85 (с, 2Н), 5,25 (м, Спектр 1Н ЯМР (CDC13) δ 6,85 (с, 2Н), 6,26 (с, 1Н), 2,29 (с, 3Н), 2,20 (с, 3Н), 2,03 (с, 6Н), 1,65-1,80 Ш), 4,18 (м, 1Н), 2,73 (к, 2Н), 2,28 (с, ЗН), 2,17 (с, (м, 4Н), 1,52 (с, 9Н), 0,90 (т, 6Η) частей на ЗН), 2,05 (с, 6Н), (м, 4Н), 1,18 (т, ЗН), 0,96 (τ, 6Η) миллион. частей на миллион. Пример 37 Пример 45 4-(1-Этилпропокси)-5-изопропил-2-метил-64-(1-Этилпропенилокси)-3,6-диметил-2-(2,4,6(2,4,6-триметил-фенокси)пиримидин триметилфенокси)-пиридин (смесь цис- и трансСпектр 1Н ЯМР (CDCІ3) δ 6,85 (с, 2Н), 5,17 (м, изомеров) 1Н), 3,50 (м, 1Н), 2,27 (с, 3Н), 2,23 (с, 3Н), 2,03 (с, Спектр 1Н ЯМР (CDCІ3) δ 6,85 (с, 2Н), 6,30 6Н), 1,69 (м, 4Н), 1,33 (с, 3Н), 1,31 (с, 3Н), 0,92 (т, (с, 0,3Н), 6,21 (с, 0,7Н), 5,10 (м, 0,7H), 4,95 (м, 6Η) частей на миллион. 0,3Н), 2,27 (с, 3Н), 2,24 (с, 2,1Н), 2,19 (с, 0,9Н), Пример 38 2,14 (с, 3Н), 2,05 (с, 6Н), 1,65 (д, 0,9Н), 1,50 (д, 5-Бром-4-(1-этилпропокси)-2-метил-6-(2,4,62,1Н), 1,08 (т, 1,8Н), 1,05 (т, 4,2Н) частей на милтриметилфенокси)-пиримидин лион. Спектр 1Η ЯМР (CDCІ3) δ 6,86 (с, 2Η), 5,16 Пример 46 (м, 1Н), 2,29 (с, 3Н), 2,28 (с, 3Н), 2,06 (с, 6Н), 1,65Соль метансульфокислоты 4-(11,80 (м, 4Н), 1,52 (с, 9Н), 0,95 (т, 6Η) частей на этилпропокси)-2,3,5-триметил-6-(2,4,6миллион. триметилфенокси)-пиридина Пример 39 Температура плавления 58-60°С. 5-Хлор-4-(1-этилпропокси)-2-метил-6-(2,4,6Спектр 1Н ЯМР (CDCІ3) δ 6,90 (с, 2Н), 4,20 триметилфенокси)-пиримидин (м, 1Н), 2,70 (с, 3Н), 2,61 (с, 3Н), 2,28 (с, 3Н), 2,16 Спектр 1Н ЯМР (CDCІ3) δ 6,86 (с, 2Н), 5,16 (м, (с, 3Н), 2,08 (с, 6Н), 1,5-1,8 (м, 4Н), 0,96 (т, 6Η) ча1Н), 2,28 (с, 3Н), 2,27 (с, 3Н), 2,06 (с, 6Н), 1,65-1,80 стей на миллион. (м, 4Н), 1,52 (с, 9Н), 0,94 (т, 6Η) частей на Пример 47 миллион. Сложный метиловый эфир 4-(1-этилпропокси)Соединения, указанные в заголовках приме6-метил-2-(2,4,6-триметилфенокси)никотиновой ров 40-41, были получены в соответствии со спокислоты собом по примеру 24 при использовании в качестСпектр 1Н ЯМР (CDCІ3) δ 6,84 (с, 2Н), 6,39 ве исходных веществ 4-хлор-2,5-диметил-6-(2,4,6(с, 1Н), 5,04 (м, 1Н), 3,85 (с, 3Н), 2,27 (с, 3Н), 2,23 триметилфенокси)пиримидина и соответствующе(с, 3Н), 2,05 (с, 6Н), 1,5-1,7 (м, 4Н), 0,95 (с, 6Н) го амина. частей на миллион. Пример 40 Пример 48 [2,5-Диметил-6-(2,4,64-(1-Этилпропокси)-2-метил-6-(2,4,6триметилфенокси)пиримидин-4-ил](1-этилтриметилфенокси)пиридин пропил)амин Спектр 1Н ЯМР (CDCІ3) δ 6,90 (с, 2Н), 6,34 (д, 1 Спектр Н ЯМР (CDCІ3) δ 6,84 (с, 2Н), 4,10 (м, J=2Гц, 1Н), 5,70 (д, J=2Гц, 1Н), 4,05 (м, 1Н), 2,40 2Н, ΝΗ и СН), 2,27 (с, 3Н), 2,21 (с, 3Н), 2,04 (с, 9Н), (с, 3Н), 2,30 (с, 3Н), 2,11 (с, 6Н), 1,62 (м, 4Н), 0,89 1,3-1,6 (м, 4Н), 0,91 (т, 6Η) частей на миллион. (т, 6Η) частей на миллион. Пример 41 Пример 49 Бутил-[2,5-диметил-6-(2,4,63,6-Диметил-4-(тетрагидрофуран-3-илокси)-2триметилфенокси)пиримидин-4-ил]-этиламин (2,4,6-триметил-фенокси)пиридин Спектр 1Н ЯМР (CDCІ3) δ 6,87 (с, 2Н), 3,76 (м, Спектр 1НЯМР (CDCІ3) δ 6,88 (с, 2Н), 6,25 (с, 2Н), 3,68 (т, 2Η), 2,73 (с, 3Н), 2,28 (с, 6Н), 1,99 (с, 1Н), 4,99 (м, 1Н), 3,9-4,1 (м, 4Н), 2,31 (с, 3Н), 2,23 6Н), 1,5-1,7 (м, 4Н), 1,27 (т, 3Н), 0,94 (т, 3Н) частей (с, 3Н), 2,20 (с, 3Н), 2,1-2,3 (м, 2Н), 2,07 (с, 6Н) на миллион. частей на миллион. Соединения, указанные в заголовках примеПример 50 ров 42-54, были получены в соответствии со спо4-(1-Метоксиметилпропокси)-3,6-диметил-2собом по примеру 29 при использовании в качест(2,4,6-триметил-фенокси)пиридин ве исходных ве ществ 4-хлор-2-метил-6Спектр 1Н ЯМР (CDCІ3) δ 6,88 (с, 2Н), 6,38 (с, (замещенного фенокси или тиофен-окси)пиридина 1Н), 4,42 (м, 1Н), 3,5-3,7 (м, 2Н), 3,42 (с, 3Н), 2,31 и соответствующего спирта. (с, 3Н), 2,21 (с, 6Н), 2,07 (с, 6Н), 1,7-1,85 (м, 2Н), Пример 42 1,02 (т, 3Н) частей на миллион. 2-(4-Бром-2,6-диметилфенокси)-4-(1Пример 51 этилпропокси)-3,6-диметил-пиридин 3-[3,6-Диметил-2,4,6Спектр 1Н ЯМР (CDCІ3) δ 7,18 (с, 2Н), 6,30 (с, триметилфенокси)пиридин-4-илокси]-пентан-2-ол 1Н), 4,22 (м, 1Н), 2,20 (с, 6Н), 2,05 (с, 6Н), 1,73 (м, Спектр 1Н ЯМР (CDCІ3) δ 6,88 (с, 2Н), 6,34 (с, 4Н), 1,00 (т, 6Η) частей на миллион. 1Н), 4,25-4,45 (м, 1Н), 3,6-3,8 (м, 1Н), 2,30 (м, 3Н), Пример 43 2,21 (с, 3Н), 2,20 (с, 3Н), 2,06 (с, 6Н), 1,2-1,4 (м, 2-(4-Хлор-2,6-диметилфенокси)-4-(15Н), 1,07 (т, 3Н) частей на миллион. этилпропокси)-3,6-диметил-пиридин Пример 52 Спектр 1Н ЯМР (CDCІ3) δ 7,05 (с, 2Н), 6,31 (с, 4-фтор-Бутокси-3,6-диметил-2-(2,4,6 55 71535 56 триметилфенокси)пиридин 3Н), 2,20 (с, 3Н), 2,09 (с, 6Н), 1,6-1,8 (м, 6Н), 0,9Спектр 1Н ЯМР (CDCІ3) δ 6,88 (с, 2Н), 6,31 1,1 (м, 9Н) частей на миллион. (с, 1Н), 4,35 (м, 1н), 2,30 (с, 3Н), 2,21 (с, 3Н), 2,19 Пример 58 (с, 3Н), 2,07 (с, 6Н), 1,7-1,9 (м, 2Н), 1,34 (д, 3Н), 2-(2,6-Диметилфенокси)-4-(1-этилпропокси)1,01 (т, 3Н) частей на миллион. 3,6-диметилпиридин Пример 53 Спектр 1Н ЯМР (CDCІ3) δ 7,06 (м, 3Н), 6,30 2-(2,4-Диметилфенилсульфанил)-4-(1(с, 1Н), 4,20 (м, 1Н), 2,21 (с, 6Н), 2,11 (с, 6Н), 1,73 этилпропокси)-3,6-диметил-пиридин (м, 4Н), 0,99 (т, 6Η) частей на миллион. Золотистое масло. Пример 59 Спектр 1Н ЯМР (CDCІ3) δ 7,19 (д, J=8Гц, 1Н), 2{4-[4-(1-Этилпропокси)-3,6-диметилпиридин7,06 (с, 1Н), 6,94 (д, J=8Гц, 1Н), 6,42 (с, 1Н), 4,19 2-илокси]-3,5-диметилфенил}пропан-2-ол (м, 1Н), 2,34 (с, 3Н), 2,33 (с, 3Н), 2,32 (с, 3Н), 2,18 Спектр 1Н ЯМР (CDCІ3) δ 7,15 (с, 2Н), 6,25 (с, 3Н), 1,69 (м, 4Н), 0,95 (т, 6Η) частей на (с, 1Н), 4,20 (м, 1Н), 2,20 (с, 3Н), 2,19 (с, 3Н), 2,10 миллион. (с, 6Н), 1,85 (широкий синглет, 1Н), 1,70 (м, 4Н), Пример 54 1,60 (с, 6Н), 0,95 (т, 6Η) частей на миллион. 4-(1-Этилпропокси)-3,6-диметил-2-(2,4,6Пример 60 триметилфенилсульфанил)-пиридин 4-(1-Этилпропокси)-2-(4-иод-2,6Спектр 1НЯМР (CDCІ3) δ 6,97 (с, 2Н), 6,30 диметилфенокси)-3,6-диметил-пиридин (с, 1Н), 4,15 (м, 1Н), 2,35 (с, 6Н), 2,30 (с, 3Н), 2,23 Спектр 1Н ЯМР (CDCІ3) δ 7,39 (с, 2Н), 6,30 (с, 3Н), 2,20 (с, 3Н), 1,68 (м, 4Н), 0,95 (т, 6Н) частей (с, 1Н), 4,19 (м, 1Н), 2,20 (с, 3Н), 2,18 (с, 3Н), 2,05 на миллион. (с, 6Н), 1,72 (м, 4Н), 0,98 (т, 6Η) частей на миллиПример 55 он. 2-(4-Этил-2,6-диметилфенокси)-4-(1Пример 61 этилпропокси)-3,6-диметил-пиридин 4-[4-(-Этилпропокси)-3,6-диметилпиридин-2К раствору 2,5 н. раствора н-бутиллития в гекилокси]-3,5-диметил-фенол сане (0,47мл, 1,18ммоля) в 5мл сухого тетрагадСпектр 1Н ЯМР (CDC13) δ 7,85 (широкий сингрофурана при температуре -78°С добавляли растлет, 1Н), 6,36 (с, 1Н), 6,24 (с, 2Н), 4,24 (м, 1Н), 2,39 вор 2-(4-бром-2,6-диметилфенокси)-4-(1(с, 3Н), 2,20 (с, 3Н), 2,02 (с, 6Н), 1,74 (м, 4Н), 1,00 этилпропокси)-3,6-диметил-пиридина (465мг, (т, 6Η) частей на миллион. 1,18ммоля) в 5мл сухого тетрагадрофурана. ПоПример 62 сле перемешивания в течение 5 минут при этой 1-{4-[4-(1-Этилпропокси)-3,6-диметилпиридинтемпературе добавляли избыток этилиодида 2-илокси]-3,5-диметилфенил}пирролидин-2-он (0,4мл) и продолжали перемешивать полученную Спектр 1Н ЯМР (CDC13) δ 7,30 (с, 2Н), 6,30 смесь при температуре -78°С в течение 30 минут, (с, 1Н), 4,20 (м, 1Н), 3,88 (т, 2Η), 2,61 (т, 2Η) частей а затем при 0°С еще 15 минут. Эту смесь резко на миллион. охлаждали насыщенным раствором хлорида амПример 63 мония и экстрагировали этилацетатом. Органиче{4-[4-(1-Этилпропокси)-3,6-диметилпиридин-2ский слой сушили и концентрировали с образоваилокси]-3,5-диметил-фенил}метанол нием светло-коричневого масла. Это масло Смесь 4-[4-(1-этшшропокси)-3,6очищали посредством хроматографии на колонках диметилпирвдин-2-илокси]-3,5-дииз силикагеля с использованием хлороформа в метилбензальдегада (114мг, 0,41ммоля) и борогикачестве элюента, что позволило получить 260мг дрида натрия (63мг, 1,6ммоля) в 3мл метанола указанного в заголовке соединения в виде белого перемешивали при комнатной температуре в тетвердого вещества. чение 2 часов. Реакционную смесь резко охлажСпектр 1Н ЯМР (CDCІ3) δ 6,90 (с, 2Н), 6,38 дали водой и экстрагировали этилацетатом. Орга(с, 1Н), 4,20 (м, 1Н), 2,61 (к, 2Н), 2,24 (с, 3Н), 2,21 нический слой сушили и концентрировали с (с, 3Н), 2,10 (с, 6Н), 1,70 (м, 4Н), 1,30 (т, 3Н), 0,98 образованием желтого масла. Это масло очищали (т, 6Η) частей на миллион. посредством хроматографии на колонках из силиСоединения, указанные в заголовках примекагеля с использованием хлороформа в качестве ров 56-62, получали в соответствии со способом элюента, что позволило получить 70мг указанного по примеру 55 при использовании в качестве исв заголовке соединения в виде бесцветного ходных ве ществ н-бутиллития и 2-(4-бром-2,6масла. диметилфенокси)-4-(1-этил-пропокси)-3,6Спектр 1Н ЯМР (CDCІ3) δ 7,04 (с, 2Н), 6,32 диметилпиридина с последующим прекращением (с, 1Н), 4,55 (с, 2Н), 4,21 (м, 1Н), 2,30 (широкий реакции холодным электрофилом. синглет, 1Н), 2,22 (с, 3Н), 2,21 (с, 3Н), 2,12 (с, 6Н), Пример 56 1,73 (м, 4Н), 0,91 (т, 6Η) частей на миллион. 4-[4-(Этилпропокси)-3,6-диметилпиридин-2Пример 64 илокси]-3,5-диметил-бензальдегид 4-(1-Этилпропокси)-2-(4-метокси-2,6Спектр 1Н ЯМР (CDCІ3) δ 9,94 (с, 1Н), 7,61 диметилфенокси)-3,6-диметил-пиридин (с, 2Н), 6,32 (с, 1Н), 4,20 (м, 1Н), 2,21 (с, 3Н), 2,16 К раствору 4-[4-(1-этилпропокси)-3,6(с, 9Н), 1,70 (м, 4Н), 0,98 (т, 6Η) частей на миллион. диметилпиридин-2-илокси]-3,5-диметилфенола Пример 57 (40мг, 0,12ммоля) в 3мл сухого тетрагидрофурана 2-(2,6-Диметил-4-пропилфенокси)-4-(1при комнатной температуре добавляли 1мг 60% этилпропокси)-3,6-диметил-пиридин суспензии гидрида натрия в масле. После переСпектр 'Η ЯМР (CDC13) δ 6,88 (с, 2Η), 6,30 (с, мешивания в течение 5 минут добавляли 0,3мл 1Н), 4,20 (м, Ш), 2,54 (двойной дублет, 2Н), 2,22 (с, метил-иодида и полученную смесь в течение ночи 57 71535 58 перемешивали при комнатной температуре. Эту триметилфенокси)пиридин-4-ил]этиламин смесь резко охлаждали водой и экстрагировали Смесь 4-хлор-3,6-диметил-2-(2,4,6этилацетатом. Органический слой сушили и контриметилфенокси)пиридин-4-ил]-этиламина центрировали с образованием желтого твердого (1,330г, 4,822ммоля) и 20мл этиламина в 13мл 1вещества . Это ве щество очищали посредством метил-2-пирролидинона нагревали в течение ночи хроматографии на колонках из силикагеля с испопри температуре 150°С и давлении 17,5ат в аппальзованием с качестве элюента смеси хлорофоррате высокого давления. Реакционную смесь прома и гексана с соотношением 1:1, в результате должали нагревать еще в течение 24 часов при чего было получено 20мг указанного в заголовке температуре 175°С и давлении 21ат, после чего соединения в виде желтого твердого вещества. ее охлаждали до комнатной температуры, разбаСпектр 1Н ЯМР (CDCІ3) δ 6,66 (с, 2Н), 6,28 вляли водой и экстрагировали этилацетатом. Ор(с, 1Н), 4,20 (м, 1Н), 3,79 (с, 3Н), 2,20 (с, 3Н), 2,19 ганический слой сушили и концентрировали с об(с, 3Н), 2,08 (с, 6Н), 1,71 (м, 4Н), 0,97 (т, 6Н) частей разованием коричневого масла. Масляный на миллион. остаток очищали посредством хроматографии на Пример 65колонках из силикагеля с использованием в качес4-(1-Этилпрпокси)-2-(4-изопропокси-2,6тве элюента 2% раствора метанола в хлорофордиметилфенокси)-3,6-диметилпиридин ме, что позволило получить 0,820г (60%) указанК раствору 4-{4-(1-этилпропокси)-3,6ного в заголовке соединения в виде белого диметилпиридин-2-илокси]-3,5-диметилфенола твердого вещества, температура плавления (58мг, 0,176ммоля) в 3мл сухого тетрагидрофура115-116°С. на добавляли трифенилфосфин (70мг, Спектр 1Н ЯМР (CDCI3) δ 6,87 (с, 2Н), 6,11 0,264ммоля) и изопропанол (60мг, 0,22ммоля). (с, 1Н), 3,85 (т, 1Н), 3,24 (м, 2Н), 2,30 (с, 3Н), 2,17 Полученную смесь перемешивали при комнатной (с, 3Н), 2,13 (с, 3Н), 2,08 (с, 6Н), 1,32 (т, 3Н) частей температуре в течение 5 минут и добавляли диэна миллион. тилазодикарбоксилат (46мг, 0,264ммоля), после Соединения, указанные в заголовках примечего ее продолжали перемешивать в течение ночи ров 69-71, были получены в соответствии со спопри комнатной температуре. Добавляли еще 20мг собом по примеру 68 при использовании в качестдиэтилазодикарбоксилата и перемешивали смесь ве исходных веществ 4-хлор-2-замещенногов течение 4 часов, после чего ее резко охлаждали феноксипиридина и соответствующего амина. водой и экстрагировали метиленхлоридом. ОргаПример 69 нический слой сушили и концентрировали с обра[3,6-Диметил-2-(2,4,6зованием масла. Масляный остаток очищали потриметилфенилсульфанил)пирвдин-4-ил]-(1средством хроматографии на колонках из этилпропил)амин силикагеля с использованием в качестве элюента Температура плавления 108-110°С. смесь гексана и хлороформа с соотношением от Спектр 1Н ЯМР (CDCI3) δ 6,95 (с, 2Н), 6,09 1:1 до 1:2, что позволило получить 38мг (58%) (с, 1н), 3,63 (д, 1н), 3,28 (м, 1н), 2,36 (с, 6Н), 2,30 указанного в заголовке соединения в виде бесцве(с, 3Н), 2,17 (с, 3Н), 2,11 (с, 3Н), 1,4-1,75 (м, 4Н), тного масла. 0,93 (т, 6Η) частей на миллион. Спектр 1Н ЯМР (CDCІ3) δ 6,60 (с, 2Н), 6,28 Хлористоводородная соль, температура пла(с, 1Н), 4,50 (м, 1Н), 4,18 (м, 1Н), 2,20 (с, 3Н), 2,19 вления 148-150°С. (с, 3Н), 2,07 (с, 6Н), 1,71 (м, 4Н), 1,34 (д, 6Н), 0,98 Спектр 1Н ЯМР (CDCI3) δ 6,95 (с, 2Н), 6,30 (т, 6Η) частей на миллион. (с, 1Н), 5,75 (д, 1Н)(*), 2,69 (с, 3Н), 2,33 (с, 6Н), 2,28 Соединения, указанные в заголовках приме(с, 3Н), 2,02 (с, 3Н), 1,72 (м, 4Н), 0,93 (т, 6Η) частей ров 66-67, были получены в соответствии со спона миллион. собом по примеру 64 при использовании в качест((*)3,38(м,1Н),) ве исходных веществ пиридин-3,5-диметилфенола Пример 70 или пиридин-3,5-диметил-фенилметанола и осно2-(4-Хлор-2,6-диметилфенокси)-3,6вания с последующим прекращением реакции диметилпиридин-4-ил]этиламин холодным алкилгалогенидом. Белое твердое вещество. Пример 66 Спектр 1Н ЯМР (CDCІ3) δ 7,04 (с, 2Н), 6,13 (с, 2-(4-Этокси-2,6-диметилфенокси)-4-(11Н), 3,88 (т, 1Н), 3,24 (м, 2Н), 2,17 (с, 3Н), 2,17 (с, этилпропокси)-3,6-диметил-пиридин 3Н), 2,08 (с, 6Н), 1,32 (т, 3Н) частей на миллион. Спектр 1Н ЯМР (CDCI3) δ 6,60 (с, 2Н), 6,28 Пример 71 (с, 1Н), 4,19 (м, 1Н), 3,99 (к, 2Н), 2,19 (с, 3Н), 2,18 [3,6-Диметил-2-(2,4,6(с, 3Н), 2,07 (с, 6Н), 1,74 (м, 4Н), 1,40 (т, 3Н), 0,97 триметилфенилсульфанил)пиридин-4-ил](т, 6Η) частей на миллион. этиламин Пример 67 Желтовато-коричневые кристаллы, темпера4-(1-Этилпропокси)-2-(4-метоксиметил-2,6туры плавления 114-116°С. диметилфенокси)-3,6-диметилпиридин Спектр 1Н ЯМР (CDCІ3) δ 6,94 (с, 2Н), 6,12 Температура плавления 58-60°С. (с, 1Н), 3,76 (т, 1Н), 3,21 (м, 2Н), 2,35 (с, 6Н), 2,30 Спектр 1Н ЯМР (CDCI3) δ 7,05 (с, 2Н), 6,30 (с, 3Н), 2,19 (с, 3Н), 2,10 (с, 3Н), 1,29 (т, 3Н) частей (с, 1Н), 4,41 (с, 2Н), 4,19 (м, 1Н), 3,42 (с, 3Н), 2,21 на миллион. (с, 3Н), 2,18 (с, 3Н), 2,11 (с, 6Н), 1,72 (м, 4Н), 0,98 Пример 72 (с, 6Н) частей на миллион. [3,6-Диметил-2-(2,4,6Пример 68 триметилфенокси)пиридин-4-ил]этил-пропиламин [3,6-Диметил-2-(2,4,6К раствору [3,6-диметил-2-(2,4,6 59 71535 60 триметилфенокси)пиридин-4-ил]-этиламина (7,00г, Спектр 1Η ЯМР (CDCІ3) δ 6,88 (с, 2Η), 6,41 (с, 24,6ммоля) в 100мл сухого тетрагидрофурана при 1Н), 3,0-3,3 (м, 4Н), 2,31 (с, 3Н), 2,25 (с, 3Н), 2,19 температуре -78°С добавляли 1,0Μ раствор (с, 3Н), 2,08 (с, 6Н), 1,3-1,6 (м, 4Н), 1,09 (т, 3Н), бис(триметилсилил)амида лития в гексане (32мл, 0,93 (т, 3Н) частей на миллион. 32ммоля). После перемешивания при этой темпеПример 76 ратуре в течение 10 минут реакционную смесь Бутил-[2-(4-хлор-2,6-диметилфенокси)-3,6обрабатывали иодпропаном (13мл, 125ммоля) при диметилпирвдин-4-ил]-этиламин температуре -70°С. Смесь продолжали перемеСпектр 1Н ЯМР (CDCІ3) δ 7,03 (с, 2Н), 6,39 шивать при этой температуре в течение 20 минут, (с, 1Н), 3,09 (к, 2Н), 3,01 (двойной дублет, 2Н), 2,21 после чего баню с сухим льдом удаляли и пере(с, 3Н), 2,16 (с, 3Н), 2,05 (с, 6Н), 1, 4-1,6 (м, 2Н), мешивали реакционную смесь при комнатной те1,25-1,40 (м, 2Н), 1,06 (т, 3Н), 0,87 (т, 3Н) частей мпературе еще 3 часа. Реакционную смесь резко на миллион. охлаждали водой и экстрагировали этилацетатом. Хлористоводородная соль, температура плаОрганический слой сушили и концентрировали с вления 177-178°С. образованием масла. Масляный остаток очищали Спектр 1Н ЯМР (CDCІ3) δ 7,20 (с, 2Н), 6,74 посредством хроматографии на колонках из сили(с, 1Н), 3,1-3,4 (м, 4Н), 2,24 (с, 3Н), 2,17 (с, 3Н), кагеля, используя в качестве элюента сначала 2,00 (с, 6Н), 1,4-1,6 (м, 2Н), 1,25-1,40 (м, 2Н), 1,05 смесь хлороформа и гексана с соотношением 1:1, (т, 3Н), 0,86 (т, 3Н) частей на миллион. а затем хлороформ, в результате чего было полуПример 77 чено 5.04г (62,5%) [3,6-диметил-2-(2,4,6-три[2-(4-Хлор-2,6-диметилфенокси)-3,6метилфенокси)пиридин-4-ил]этилпропиламина в диметилпиридин-4-ил]этил-пропиламин виде желтого твердого вещества. Спектр 1Н ЯМР (CDCІ3) δ 7,04 (с, 2Н), 6,41 1 Спектр Н ЯМР (CDCІ3) δ 6,88 (с, 2Н), 6,41 (с, 1Н), 3,11 (к, 2Н), 3,00 (м, 2Н), 2,24 (с, 3Н), 2,17 (с, 1Н), 3,11 (к, 2Н), 3,03 (двойной дублет, 2Н), 2.30 (с, 3Н), 2,07 (с, 6Н), 1,54 (м, 2Н), 1,08 (т, 3Н), 0,90 (с, 3Н), 2,25(с, 3Н), 2,19 (с, 3Н), 2,07 (с, 6Н), 1,55 (т, 3Н) частей на миллион. (м, 2Н), 1,08 (т, 3Н), 0,90 (т, 3Н) частей на миллиХлористоводородная соль, белые кристаллы, он. температура плавления 74-76°С. Соответствующая хлористоводородная соль, Спектр 1Н ЯМР (CDCІ3) δ 7,23 (с, 2Н), 6,81 белые кристаллы; температура плавления (с, 1Н), 3,58 (к, 2Н), 3,46 (м, 2Н), 2,38 (с, 3Н), 2,31 167-169°С. (с, 3Н), 2,13 (с, 6Н), 1,6-1,8 (м, 2Н), 1,26 (т, 3Н), Спектр 1Н ЯМР (CDCІ3) δ 7,00 (с, 2Н), 6,75 0,96 (т, 3Н) частей на миллион. (с, 1Н), 3,54 (к, 2H), 3,43 (т, 2Н), 2,35 (с, 3Н), 2,31 Пример 78 (с, 3Н), 2,27 (с, 3Н), 2,08 (с, 6Н), 1,69 (м, 2Н), 1,25 [2-(4-Хлор-2,6-диметилфенокси)-3,6(т, 3Н), 0,94 (т, 3Н) частей на миллион. диметилпиридин-4-ил]-диэтиламин Соединения, указанные в заголовках примеСпектр 1Н ЯМР (CDCІ3) δ 7,05 (с, 2Н), 6,41 ров 73-79, были получены в соответствии со спо(с, 1Н), 3,11 (к, 4Н), 2,24 (с, 3Н), 2,18 (с, 3Н), 2,07 собом по примеру 72 при использовании в качест(с, 6Н), 1,09 (т, 6Η) частей на миллион. ве исходных веществ 2-(замещенный фенокси или Хлористоводородная соль, белые кристаллы, тиофенокси)пиридин-4-ил-этиламина и основания температура плавления 184-185°С. (бис(триметилсилил)амида лития или диизопропиСпектр 1Н ЯМР (CDCІ3) δ 7,23 (с, 2Н), 6,81 ламида лития) с последующим прекращением (с, 1Н), 3,56 (к, 4Н), 2,37 (с, 3Н), 2,33 (с, 3Н), 2,12 реакции холодным алкилга-логенидом. (с, 6Н), 1,26 (т, 6Η) частей на миллион. Пример 73 Пример 79 [3,6-Диметил-2-(2,4,6[3,6-Диметил-[2-(2,4,6триметилфенокси)пиридин-4-ил]диэтиламин триметилфенилсульфанил)пиридин-4-ил]Спектр 1Н ЯМР (CDCІ3) δ 6,87 (с, 2Н), 6,40 этилпропиламин (с, 1Н), 3,10 (к, 4Н), 2,30 (с, 3Н), 2,24 (с, 3Н), 2,19 Спектр 1Н ЯМР (CDCІ3) δ 6,95 (с, 2Н), 6,45 (с, 3Н), 2,06 (с, 6Н), 1,08 (т, 6Η) частей на милли(с, 1Н), 3,02 (к, 2Н), 2,97 (двойной дублет, 2Н), 2,35 он. (с, 6Н), 2,31 (с, 3Н), 2,21 (с, 3Н), 2,20 (с, 3Н), 1,49 Хлористоводородная соль, белые кристаллы, (м, 2Н), 1,02 (т, 3Н), 0,86 (т, 3Н) частей на миллитемпература плавления 180-181°С. он. Спектр 1Н ЯМР (CDCІ3) δ 7,01 (с, 2Н), 6,78 Хлористоводородная соль, белые кристаллы, (с, 1Н), 3, 58 (к, 4Н), 2, 38 (с, 3Н), 2,32 (с, 6Н),2,10 температура плавления 110-112°С. (с, 6Н), 1,28 (т, 6Η) частей на миллион. Спектр 1Н ЯМР (CDCІ3) δ 6,92 (с, 2Н), 6,51 Пример 74 (с, 1Н), 3,27 (к, 2Н), 3,19 (двойной дублет, 2Н), 2,84 [3,6-Диметил-2-(2,4,6(с, 3Н), 2,32 (с, 6Н), 2,28 (с, 3Н), 1,82 (с, 3Н), 1,52 триметилфенокси)пиридин-4-ил]этил-метиламин (м, 2Н), 1,15 (т, 3Н), 0,84 (т, 3Н) частей на миллиСпектр 1Н ЯМР (CDCІ3) δ 6,86 (с, 2Н), 6,38 он. (с, 1Н), 3,05 (к, 2Н), 2,75 (с, 3Н), 2,29 (с, 3Н), 2,25 Пример 80 (с, 3Н), 2,18 (с, 3Н), 2,06 (с, 6Н), 1, 18 (т, 3Н) часN-[3,6-Диметил-2-(2,4,6тей на миллион. триметилфенокси)пиридин-4-ил]N-этил-2,2,2Хлористоводородная соль, температура платрифторацетамид вления 173-174°С. К раствору [3,6-диметил-2-(2,4,6Пример 75 триметилфенокси)пиридин-4-ил]-этиламина Бутил-[3,6-диметил-2-(2,4,6(200мг, 0,7ммоля) в сухом метиленхлориде добатриметилфенокси)пиридин-4-ил]-этиламин вляли три-этиламин (0,1мл, 0,73ммоля) и трифто
ДивитисяДодаткова інформація
Назва патенту англійськоюCorticotropine-releasing antagonists factor, methods for the preparation thereof, pharmaceuitical composition and a method for the treatment
Назва патенту російськоюАнтагонисты кортикотропин-рилизинг фактора, способы их получения, фармацевтическая композиция и способ лечения
Автори російськоюChen Yuhpyng L.
МПК / Мітки
МПК: C07D 487/04, A61P 3/00, A61P 37/08, A61K 31/00, C07D 401/04, C07D 239/42, A61P 37/00, A61K 31/44, C07D 473/22, C07D 239/50, C07D 473/32, A61P 25/28, C07D 473/40, A61K 31/4418, A61K 31/4353, C07D 239/34, A61P 25/04, A61P 25/24, A61P 17/00, A61P 25/08, A61K 31/52, A61K 31/437, A61K 31/435, C07D 213/69, A61P 31/12, A61P 11/06, A61P 25/26, A61P 5/38, C07D 213/89, A61P 35/00, A61P 25/20, A61P 1/00, C07D 213/80, C07D 473/34, A61P 29/00, A61K 31/505, A61P 25/00, A61P 3/10, C07D 401/12, A61P 39/02, A61P 25/16, A61P 31/00, A61P 11/00, C07D 239/38, C07D 473/28, C07D 239/48, C07D 213/74, C07D 213/71, C07D 471/04, C07D 239/26, A61P 3/04, C07D 239/52, A61P 25/18, A61K 31/522, A61K 31/4427, A61P 3/08, A61P 1/14, C07D 405/12, A61P 1/12, A61P 39/00, A61K 31/443
Мітки: лікування, композиція, способи, фармацевтична, фактора, спосіб, антагоністи, одержанння, кортикотропін-рилізинг
Код посилання
<a href="https://ua.patents.su/40-71535-antagonisti-kortikotropin-rilizing-faktora-sposobi-kh-oderzhannnya-farmacevtichna-kompoziciya-ta-sposib-likuvannya.html" target="_blank" rel="follow" title="База патентів України">Антагоністи кортикотропін-рилізинг фактора, способи їх одержанння, фармацевтична композиція та спосіб лікування</a>
Попередній патент: Довгастий штемпельний пристрій
Наступний патент: 2,4,4-тризаміщені похідні 1,3-діоксолану як антифунгіциди, спосіб їх отримання та фармацевтична композиція на їх основі (варіанти)
Випадковий патент: Спіральний трубчатий теплообмінник












