(полі)аміноалкіламіноалкіламідні, алкілсечовинні або алкілсульфонамідні похідні епіподофілотоксину, спосіб їх одержання та їх застосування в терапії як протиракових засобів
Номер патенту: 106876
Опубліковано: 27.10.2014
Автори: Гумінскі Ів, Барре Жан-Марк, Крюзінскі Анна, Імбер Тьєррі
Формула / Реферат
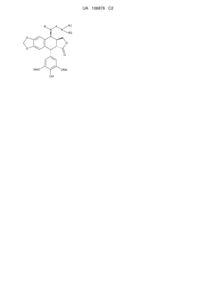
1. Сполука загальної формули 1:
 ,
,
Формула 1
де:
- R позначає водень,
- A позначає CO(CH2)n або CONH(CH2)n, де n дорівнює 2, 3, 4 або 5,
- R1 позначає H або C1-4алкіл,
- R2 позначає H, C1-4алкіл або (CH2)m-NR3R4, де m дорівнює 2, 3, 4 або 5,
- R3 позначає H або C1-4алкіл,
- R4 позначає H, C1-4алкіл або (CH2)p-NR5R6, де p дорівнює 2, 3, 4 або 5,
- R5 позначає H або C1-4алкіл, і
- R6 позначає H, C1-4алкіл або (CH2)q-NH2, де q дорівнює 2, 3, 4 або 5,
або її фармацевтично прийнятна сіль,
за винятком сполуки, де A позначає CO(CH2)2, де обидва R1 і R2 позначають H.
2. Сполука загальної формули 1 за п. 1, у якій R1 і R2 одночасно не позначають H, коли R позначає H, і A позначає CO(CH2)n, де n дорівнює 2, 3 або 4.
3. Сполука загальної формули 1 за будь-яким з пп. 1, 2, у якій m дорівнює 3 або 4, p дорівнює 3 або 4, і q дорівнює 3.
4. Сполука загальної формули 1 за будь-яким з пп. 1-3, вибрана з групи, що складається з:
3-[(2-диметиламіноетил)метиламіно]-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]пропіонаміду,
3-диметиламіно-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]пропіонаміду,
4-диметиламіно-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]бутираміду,
5-диметиламінопентанової кислоти N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]аміду,
4-{3-[4-(3-амінопропіламіно)бутиламіно]пропіламіно}-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]бутираміду,
1-{3-[4-(3-амінопропіламіно)бутиламіно]пропіл}-3-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]сечовини,
1-[3-{3-[4-(3-амінопропіламіно)бутиламіно]пропіламіно}пропіл]-3-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3‑d][1,3]діоксол-5-іл]сечовини,
5-[(2-диметиламіноетил)метиламіно]пентанової кислоти N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]аміду,
4-аміно-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]бутираміду,
або її адитивна сіль, утворена неорганічною чи органічною кислотою.
5. Сполука загальної формули 1 за п. 4, вибрана з групи, що складається з:
4-{3-[4-(3-амінопропіламіно)бутиламіно]пропіламіно}-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]бутираміду,
1-{3-[4-(3-амінопропіламіно)бутиламіно]пропіл}-3-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]сечовини,
1-[3-{3-[4-(3-амінопропіламіно)бутиламіно]пропіламіно}пропіл]-3-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]сечовини,
або її адитивна сіль, утворена неорганічною чи органічною кислотою.
6. Сполука формули 1 за будь-яким з пп. 1-5 для застосування як лікарського засобу.
7. Сполука формули 1 за п. 6 для застосування як лікарського засобу, призначеного для лікування раку та, зокрема, для протиракової терапії несолідних ("рідких") пухлин і солідних пухлин, таких як меланома, колоректальний рак, рак легенів, рак передміхурової залози, рак сечового міхура, рак молочної залози, рак матки, рак стравоходу, рак шлунка, рак підшлункової залози, рак печінки, рак яєчників, лейкоз, зокрема лімфоми та мієломи, рак вуха-горла-носа та рак головного мозку.
8. Застосування сполуки формули 1 за будь-яким з пп. 1-5 для виготовлення лікарського засобу, призначеного для протиракової терапії несолідних ("рідких") пухлин і солідних пухлин, таких як меланома, колоректальний рак, рак легенів, рак передміхурової залози, рак сечового міхура, рак молочної залози, рак матки, рак стравоходу, рак шлунка, рак підшлункової залози, рак печінки, рак яєчників, лейкоз, зокрема лімфоми та мієломи, рак вуха-горла-носа та рак головного мозку.
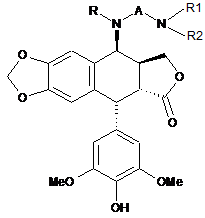
9. Спосіб одержання сполуки формули 1 за будь-яким з пп. 1-5, де A позначає CO(CH2)n, і R позначає H, де n такий, як визначено в п. 1, в якому здійснюють нижчеперелічені послідовні стадії, згідно з якими:
(a) проводять реакцію Ріттера між сполукою наведеної нижче формули 3:

Формула 3
і нітрилом формули Ra-CN, де Ra позначає -(CH2)n-x або -CH=CH2, n дорівнює 3, 4 або 5, і X позначає атом галогену, такий як атом хлору, з одержанням сполуки наведеної нижче формули 4:
 ,
,
Формула 4
(b) проводять реакцію алкілування між аміном у захищеній формі формули HNR1R2a, де:
- R1 такий, як визначено в п. 1,
- R2a позначає C1-4алкіл, захисну групу для аміну або (CH2)m-NR3aR4a, де m такий, як визначено в п. 1,
- R3a позначає C1-4алкіл або захисну групу для аміну,
- R4a позначає C1-4алкіл, захисну групу для аміну або (CH2)p-NR5aR6a, де p такий, як визначено в п. 1,
- R5a позначає C1-4алкіл або захисну групу для аміну,
- R6a позначає C1-4алкіл, захисну групу для аміну або (CH2)q-NR7aR8a, де q такий, як визначено в п. 1,
- R7a позначає H або захисну групу для аміну, і
- R8a позначає захисну групу для аміну,
і сполукою формули 4, отриманою на попередній стадії, з одержанням сполуки наведеної нижче формули 5:
 ,
,
Формула 5
де R2a такий, як визначено вище, і R1 та n такі, як визначено в п. 1,
(c) необов’язково видаляють захист з функціональних аміногруп, захищених захисними групами для аміну, з одержанням сполуки наведеної нижче формули 5a:
 ,
,
Формула 5а
де R1, R2 і n такі, як визначено в п. 1, і
(d) виділяють сполуку, отриману на попередній стадії, з реакційної суміші.
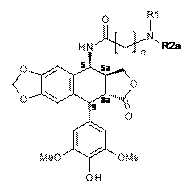
10. Спосіб одержання сполуки формули 1 за будь-яким з пп. 1-5, де A позначає CONH(CH2)n, де n такий, як визначено в п. 1, в якому здійснюють нижчеперелічені послідовні стадії, згідно з якими:
(a) проводять взаємодію сполуки наведеної нижче формули 8:
 ,
,
Формула 8
де R такий, як визначено в п. 1, і Y позначає захисну групу для гідроксилу, таку як бензилоксикарбоніл,
з ізоціанатом формули O=C=N-(CH2)n-X, де n такий, як визначено в п. 1, і X позначає атом галогену, такий як атом хлору,
з одержанням сполуки наведеної нижче формули 9:
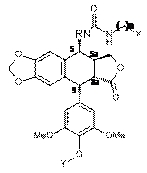 ,
,
Формула 9
(b) проводять реакцію алкілування між аміном у захищеній формі формули HNR1R2a, як визначено в п. 9,
і сполукою формули 9, отриманою на попередній стадії, з одержанням сполуки наведеної нижче формули 10a:
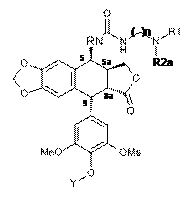 ,
,
Формула 10а
де Y такий, як визначено вище, R2a такий, як визначено в п. 12, і R1 та n такі, як визначено в п. 1,
(c) видаляють захист з функціональної фенольної групи і, необов’язково, видаляють захист з функціональних аміногруп, захищених захисними групами для аміну в сполуці формули 10a, отриманій на попередній стадії, з одержанням сполуки наведеної нижче формули 10b:
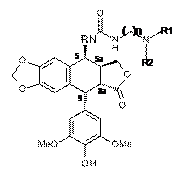 ,
,
Формула 10b
де R, R1, R2 і n такі, як визначено в п. 1, і
(d) виділяють сполуку, отриману на попередній стадії, з реакційної суміші.
11. Спосіб одержання сполуки формули 1 за будь-яким з пп. 1-5, де A позначає CONH(CH2)n, де n такий, як визначено в п. 1, в якому здійснюють нижчеперелічені послідовні стадії, згідно з якими:
(a) проводять взаємодію сполуки формули 8, як визначено в п. 10, з фосгеном або трифосгеном з одержанням проміжної активованої карбонільованої сполуки,
(b) проводять реакцію алкілування між аміном у захищеній формі формули H2N-(CH2)n-NR1aR2a, де R1a позначає атом водню, C1-4алкіл або захисну групу для аміну, і R2a такий, як визначено в п. 9, за умови, що R1a не позначає H, коли R2a позначає C1-4алкіл або (CH2)m-NR3aR4a,
і проміжною активованою карбонілованою сполукою, отриманою на попередній стадії, з одержанням сполуки наведеної нижче формули 10c:
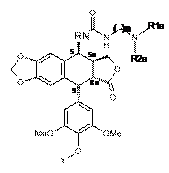 ,
,
Формула 10с
де R і n такі, як визначено в п. 1, Y такий, як визначено в п. 10, і R1a та R2a такі, як визначено вище,
(c) видаляють захист з функціональної фенольної групи та, необов’язково, видаляють захист з функціональних аміногруп, захищених захисними групами для аміну в сполуці формули 10c, отриманій на попередній стадії, з одержанням сполуки формули 10b, як визначено в п. 10, і
(d) виділяють сполуку, отриману на попередній стадії, з реакційної суміші.
12. Спосіб одержання сполуки формули 1 за будь-яким з пп. 1-5, де A позначає CO(CH2)n, де n такий, як визначено в п. 1, в якому здійснюють нижчеперелічені послідовні стадії, згідно з якими:
(a) проводять пептидне сполучення між сполукою наведеної нижче формули 6:
 ,
,
Формула 6
де R такий, як визначено в п. 1,
і кислотою наведеної нижче формули 12:
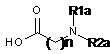 ,
,
Формула 12
де R1a такий, як визначено в п. 11, і R2a такий, як визначено в п. 9, за умови, що R1a не позначає H, коли R2a позначає C1-4алкіл або (CH2)m-NR3aR4a, і n такий, як визначено в п. 1,
з одержанням сполуки наведеної нижче формули 7b:
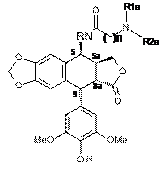 ,
,
Формула 7b
де R1a і R2a такі, як визначено вище, і R та n такі, як визначено в п. 1,
(b) необов’язково, видаляють захист з функціональних аміногруп, захищених захисними групами для аміну, з одержанням сполуки наведеної нижче формули 7:
 ,
,
Формула 7
де R, R1, R2 і n такі, як визначено в п. 1, і
(c) виділяють сполуку, отриману на попередній стадії, з реакційної суміші.
Текст
Реферат: Даний винахід стосується нових похідних епіподофілотоксину, заміщеного по положенню 4 можливо заміщеним ланцюгом (полі)аміноалкіламіноалкіламіду або алкілсечовини, або алкілсульфонаміду, способу їх одержання та їх застосування як лікарського засобу, зокрема як протиракового засобу. Формула 1, де: R позначає атом водню або С1-4алкіл, А позначає СО(СН2)n або CONH(CH2)n, де n = 2, 3, 4 або 5, R1 та R2 такі, як вони описані в даному винаході. UA 106876 C2 (12) UA 106876 C2 R N A R1 N R2 O O O O MeO OMe OH UA 106876 C2 5 10 15 20 25 30 35 40 Даний винахід стосується нових похідних подофілотоксину, заміщеного в положенні 4 можливо заміщеним ланцюгом (полі)аміноалкіламіноалкіламіду, або алкілсульфонаміду, або алкілсечовини, способу їх одержання та їх застосування як лікарського засобу, зокрема, як протиракових засобів. Сполуки за даним винаходом є похідними подофілотоксину, природного лігнану, відомого як терапевтичний засіб в лікуванні раку. Інші синтетичні похідні, такі як етопозид або тенипозид, є частиною терапевтичного арсеналу для лікування, зокрема, дрібноклітинного раку легені. Ці різні сполуки діють шляхом інгібування каталітичної активності топоізомерази II. Таким чином, алкіламінний заступник у положенні 4 4’-деметилподофілотоксинового скелета є спермін- або спермідиналкіламіднюю одиницею або, в більш загальному випадку, (полі)аміноалкіламіноалкіламідною одиницею. Крім того, цей заступник є спермін- або спермідиналкілсульфонамідною одиницею або, в більш загальному випадку, (полі)аміноалкіламіноалкілсульфонамідною одиницею. Крім усього іншого, цей заступник є спермін- або спермідиналкілсечовинною одиницею або, в більш загальному випадку, одиницею (полі)аміноалкіламіноалкілсечовини. Похідні 4’-деметилепіподофілотоксину відомі як інгібітори 2-топоізомерази. Їх цитотоксична та протипухлинна активності були виявлені та показані, зокрема, для етопозиду, TOP 53 (Drugs of the Future 1996, 21, 1136), GL 331 (Medicinal Research Reviews, 1997, 17, 367) і NK 611 (Cancer Chemother. Pharmacol. 1996, 38, 217 and 541). Описані сполуки, що мають амінні ланцюги бензиламінного типу, прямо приєднані по положенню 4 подофілотоксину (J. Med. Chem. 1991, 34, 3346). У заявці на патент FR 2810321 описуються похідні подофілотоксину карбаматного або тіокарбаматного типу, корисні в лікуванні раку. Також описані сполуки з амідом у положенні 4 (US 6566393; Acta Pharmaceutica Sinica (Yaoxue Xuebao), 1993, 28, 422; Acta Chem. Scand. 1993, 47, 1190; Anti-Cancer Drug Design 2001, 16, 305). Описані сполуки із сечовиною в положенні 4 (Heterocycles 1994, 39, (1), 361; J. Med. Chem. 2002, 45, 2294). У патенті EP 0876374 описується спосіб деметилування подофілотоксину та нескладного одержання 4’-деметилепіподофілотоксину, який є синтетичною проміжною сполукою при одержанні етопозиду та тенипозиду. У міжнародній заявці WO 03/082876 описуються 4-4’’-[{2’’-бензоїл-заміщені}аніліно]похідні подофілотоксину, що виявляють протиракову активність. Необхідність у забезпеченні більш ефективними видами терапії спонукає до пошуку нових молекул, що мають різні механізми дії, спрямованих при цьому на види пухлин, які погано піддаються або не піддаються лікуванню зараз, а також діючих в обхід проблем резистентності. Наявність цих нових продуктів також дозволяє розробляти протоколи, що включають спільне застосування терапій, більш активних по відношенню до деяких пухлин. Нові сполуки за даним винаходом забезпечують шлях подолання цієї проблеми. Сполуки, описані в заявці на патент WO 2005/100363, мають ацетамідний фрагмент в положенні 4 подофілотоксинової одиниці, причому зазначений фрагмент пов'язаний з амінним або поліамінним ланцюгом. Автори синтезували інші похідні, що мають алкіламідний, сечовинний або сульфонамідний фрагмент та документально підтвердили їх цитотоксичну та протиракову активність. Даний винахід стосується сполук загальної формули 1: R N A R1 N R2 O O O O MeO OMe OH Формула 1 45 50 Formula 1 де: R позначає водень або C1-4алкіл, A позначає CO(CH2)n, де n дорівнює 2, 3, 4 або 5, або A позначає CONH(CH2)n, де n має ті ж значення, що описані вище, або A позначає SO2(CH2)n, де n має ті ж значення, що описані вище, R1 позначає H або C1-4алкіл, R2 позначає H або C1-4алкіл, або 1 UA 106876 C2 5 10 15 20 25 30 35 40 45 50 55 60 R2 також може позначати (CH2)m-NR3R4, де R3 позначає H або C1- 4алкіл, і m дорівнює 2, 3, 4 або 5, R4 позначає H або C1-4алкіл, або R4 також може позначати (CH2)p-NR5R6, де R5 позначає H або C1- 4алкіл, і p дорівнює 2, 3, 4 або 5, і R6 позначає H або C1-4алкіл, або R6 також може позначати (CH2)q-NH2, де q дорівнює 2, 3, 4 або 5, за винятком сполуки, де A позначає CO(CH2)2, де обидва R1 і R2 позначають H. Мається на увазі, що термін “C1-4алкіл”, як він визначений в даному винаході, стосується насиченого лінійного або розгалуженого вуглеводневого ланцюга, який включає 1-4 атоми вуглецю. Приклад включає групи метил, етил, пропіл, ізопропіл, бутил, ізобутил, втор-бутил і трет-бутил. Таким чином, у цьому описі під C3- і C4-алкільними групами розуміються як лінійні, так і розгалужені групи. Даний винахід також стосується їхніх солей, зокрема, їх фармацевтично прийнятних водорозчинних солей, особливо, їх солей приєднання неорганічних чи органічних кислот, а також фармацевтичних композицій, що їх містять, та їх застосування як лікарського засобу, зокрема, призначеного для лікування раку. Сечовинні, амідні, карбаматні або сульфонамідні похідні подофілотоксину описані в літературі та патентах (Zhongguo Yaoke Daxue Xuebao 1993, 24, 134; WO 2004/000859; US 2004/0106676; J. Med. Chem. 2004, 47, 2365; Org. Biomol. Chem. 2005, 3, 1074; WO 2004/073375; Bioorg. Med. Chem. 2003, 11, 5135). Їхня активність вказує на інгібуючу дія по відношенню до 2топоізомерази та на їхню корисність як сполук, що виявляють протипухлинну активність. Однак низька розчинність у воді цих сполук ускладнює їхнє застосування. Хоча наявність у даній молекулі основного атома азоту дає можливість одержання розчинної солі, не завжди очевидно, яким образом можна одержати активну сполуку, що виявляє необхідні протипухлинні властивості. У літературі, за винятком заявки на патент WO 2005/100363, немає опису будь-якої сполуки, що має поліамінний ланцюг, ”пришитий” через спейсер в 4-положенні 4’-деметил-4дезоксиподофілотоксину. Відповідно, в даному винаході дається опис нових поліамінних похідних подофілотоксину. Сполуки за даним винаходом мають структуру епіподофілотоксину, заміщеного в положенні 4 сечовинною одиницею, з'єднаною з поліамінним ланцюгом, таким як, зокрема, у путресцину, сперміну або спермідину, а також у інших поліамінів. У подібний спосіб, це положення 4 може бути з'єднане з амідною групою, незалежно від того, з'єднана чи ні остання з лінійним спейсером, що містить від 2 до 5 атомів вуглецю, і далі з поліаміном, таким як путресцин, спермін чи спермідин або інші поліаміни. Крім того, положення 4 може бути заміщене сульфамідоетильною одиницею, з'єднаною у свою чергу з поліамінним ланцюгом, таким як ланцюг путресцину, сперміну або спермідину. Системи транспорту поліамінів вже були використані для цільової доставки цитотоксичних поліамінних аналогів (Annu. Rev. Pharmacol. Toxicol. 1995, 35, 55; Medicine/Sciences 1996, 12, 745), але схоже, без особливого успіху. Описані сполуки, що мають поліамінний ланцюг, “пришитий” до інтеркалюючої ДНК одиниці акридинового (J. Org. Chem. 2000, 65, 5590; J. Med. Chem. 2002, 45, 5098) або інденізохінолінового (J. Med. Chem. 2003, 46, 5712) типу. Особливість сполук за даним винаходом полягає в тому, що вони є ДНК-спрямованими агентами та успішно індукують ушкодження в зазначеній ДНК, як якісно, так кількісно відмінні від інших відомих протиракових сполук, таких як етопозид. Наявність поліамінного ланцюга, такого як, наприклад, ланцюг путресцину, сперміну або спермідину, має ту перевагу, що він розпізнається системою транспорту природних поліамінів, використовуваних раковою кліткою для проліферації (J. Cell. Physiol. 1993, 155, 399; Annu. Rev. Biochem. 1984, 53, 749). Це надає перевагу сполукам за даним винаходом у вигляді кращого шляху проходження до ракової клітини у порівнянні з іншими клітинами. Таким чином, сполуки за даним винаходом виявляють цитотоксичні властивості in vitro та протипухлинні властивості in vivo. Крім того, важливою перевагою цих сполук є наявність функціональних аміногруп, які забезпечують гарну розчинність у воді, що робить ці сполуки придатними з погляду технології виготовлення лікарських засобів, введення, здатності до розподілу та біодоступності в організмі. Через це, фармакокінетичні параметри є поліпшеними. Кращі сполуки за винаходом вибрані з наведених далі сполук: амідного ряду: 2 UA 106876 C2 сполуки 1: 3-(2-диметиламіноетиламіно)-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]пропіонаміду O N N H HN O O O O MeO 5 OMe OH , сполуки 2: 4-(2-диметиламіноетиламіно)-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]-бутираміду O H N HN N O O O O MeO OMe OH , сполуки 3: 3-[(2-диметиламіноетил)метиламіно]-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]пропіонаміду O N N HN O O O O MeO 10 OMe OH , сполуки 4: 4-[(2-диметиламіноетил)метиламіно]-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]бутираміду O N HN N O O O O MeO OMe OH , сполуки 5: 3-диметиламіно-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]пропіонаміду 3 UA 106876 C2 O N HN O O O OMeO OMe OH , сполуки 6: 4-диметиламіно-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]бутираміду O N HN O O O O MeO 5 OMe OH , сполуки 7: 5-диметиламінопентанової кислоти N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]аміду O N HN O O O O MeO OMe OH , сполуки 8: 3-(2-діетиламіноетиламіно)-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]пропіонаміду O N H HN N O O O O MeO 10 OMe OH , сполуки 9: 4-(2-діетиламіноетиламіно)-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]бутираміду 4 UA 106876 C2 O H N HN N O O O O MeO OMe OH , сполуки 10: 3-(2-діетиламінопропіламіно)-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]пропіонаміду O N H HN N O O O O MeO OMe OH 5 , сполуки 11: 4-(2-діетиламінопропіламіно)-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]бутираміду O H N HN N O O O O MeO OMe OH , сполуки 12: 3-(2-аміноетиламіно)-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]пропіонаміду O N H HN NH2 O O O O MeO 10 OMe OH , сполуки 13: 3-(3-амінопропіламіно)-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]пропіонаміду 5 UA 106876 C2 O N H HN NH2 O O O O MeO OMe OH , сполуки 14: 3-(4-амінобутиламіно)-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]пропіонаміду O NH2 N H HN O O O O MeO OMe OH 5 , сполуки 15: 4-(3-амінопропіламіно)-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]бутираміду O H N HN NH2 O O O O MeO OMe OH , сполуки 16: 4-(4-амінобутиламіно)-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]бутираміду O H N HN NH2 O O O O MeO 10 OMe OH , сполуки 17: 5-(4-амінобутиламіно)пентанової кислоти N-[9-(4-гідрокси-3,5-диметоксифеніл)8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]аміду 6 UA 106876 C2 O NH2 N H HN O O O O MeO OMe OH , сполуки 18: 3-{3-[4-(3-амінопропіламіно)бутиламіно]пропіламіно}-N-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]пропіонаміду O N H HN H N N H NH2 O O O O MeO 5 OMe OH , сполуки 19: 3-{3-[3-(3-амінопропіламіно)пропіламіно]пропіламіно}-N-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]пропіонаміду O N H HN N H NH2 N H O O O O MeO OMe OH 10 , сполуки 20: 3-{4-[4-(4-амінобутиламіно)бутиламіно]бутиламіно}-N-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]пропіонаміду O N H HN H N NH2 N H O O O O MeO OMe OH 15 , сполуки 21: 4-{3-[4-(3-амінопропіламіно)бутиламіно]пропіламіно}-N-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]бутираміду 7 UA 106876 C2 O H N HN H N NH2 N H O O O O MeO OMe OH , сполуки 22: 4-{3-[3-(3-амінопропіламіно)пропіламіно]пропіламіно}-N-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]бутираміду O H N HN H N H N NH2 O O O O MeO 5 OMe OH , сполуки 23: 4-{4-[4-(4-амінобутиламіно)бутиламіно]бутиламіно}-N-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]бутираміду O H N HN H N N H NH2 O O O O MeO OMe OH 10 , сполуки 24: 5-{3-[4-(3-амінопропіламіно)бутиламіно]пропіламіно}пентанової кислоти N-[9-(4гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3d][1,3]діоксол-5-іл]аміду O N H HN N H H N NH2 O O O O MeO OMe OH 15 , сполуки 25: 5-{3-[3-(3-амінопропіламіно)пропіламіно]пропіламіно}пентанової кислоти N-[9-(4гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3d][1,3]діоксол-5-іл]аміду 8 UA 106876 C2 O NH2 N H N H N H HN O O O O MeO OMe OH , сполуки 26: 5-{4-[4-(4-амінобутиламіно)бутиламіно]бутиламіно}пентанової кислоти N-[9-(4гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3d][1,3]діоксол-5-іл]аміду O H N N H HN N H NH2 O O O O MeO 5 OMe OH , сполуки 27: 3-[3-(4-амінобутиламіно)пропіламіно]-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]пропіонаміду O N H HN NH2 N H O O O O MeO 10 OMe OH , сполуки 28: 3-[4-(3-амінопропіламіно)бутиламіно]-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]пропіонаміду O H N N H HN NH2 O O O O MeO OMe OH , сполуки 29: 3-[3-(3-амінопропіламіно)пропіламіно]-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]пропіонаміду O N H HN N H NH2 O O O O MeO OMe OH 15 сполуки 30: , 3-[4-(4-амінобутиламіно)бутиламіно]-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8 9 UA 106876 C2 оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]пропіонаміду O H N N H HN NH2O O O O MeO OMe OH , сполуки 31: 4-[3-(4-амінобутиламіно)пропіламіно]-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]бутираміду O H N HN H N NH2 O O O O MeO 5 OMe OH , сполуки 32: 4-[4-(3-амінопропіламіно)бутиламіно]-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]бутираміду O H N HN NH2 N H O O O O MeO OMe OH 10 , сполуки 33: 4-[3-(3-амінопропіламіно)пропіламіно]-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]бутираміду O H N HN H N NH2 O O O O MeO OMe OH , сполуки 34: 4-[4-(4-амінобутиламіно)бутиламіно]-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]бутираміду 10 UA 106876 C2 O H N HN NH2 N H O O O O MeO OMe OH , сполуки 35: 5-[3-(4-амінобутиламіно)пропіламіно]пентанової кислоти N-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]аміду O NH2 N H N H HN O O O O MeO OMe OH 5 , сполуки 36: 5-[4-(3-амінопропіламіно)бутиламіно]пентанової кислоти N-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]аміду O H N N H HN NH2 O O O O MeO OMe OH , сполуки 37: 5-[3-(3-амінопропіламіно)пропіламіно]пентанової кислоти N-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]аміду O N H HN N H NH2 O O O O MeO 10 OMe OH , сполуки 38: 5-[4-(4-амінобутиламіно)бутиламіно]пентанової кислоти N-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]аміду 11 UA 106876 C2 O H N N H HN NH2 O O O O MeO OMe OH , сполуки 55: 5-[(2-диметиламіноетил)метиламіно]пентанової кислоти N-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]аміду O HN N N O O O O O O OH 5 , сполуки 56: 4-аміно-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]бутираміду O NH2 HN O O O O O O OH , сполуки 57: 5-амінопентанової кислоти N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]аміду O HN NH2 O O O O O O 10 OH , сполуки 58: 3-(5-амінопентиламіно)-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]пропіонаміду 12 UA 106876 C2 O HN NH2 N H O O O O O O OH ; ряду сечовини: сполуки 39: 1-(4-амінобутил)-3-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]сечовини O NH2 N H HN O O O O MeO 5 OMe OH , сполуки 40: 1-[4-(3-амінопропіламіно)бутил]-3-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]сечовини O H N N H HN NH2 O O O O MeO OMe OH 10 , сполуки 41: 1-[3-(4-амінобутиламіно)пропіл]-3-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]сечовини O HN N H N H NH2 O O O O MeO OMe OH , сполуки 42: 1-[3-(3-амінопропіламіно)пропіл]-3-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]сечовини 13 UA 106876 C2 O NH2 N H N H HN O O O O MeO OMe OH , сполуки 43: 1-[4-(4-амінобутиламіно)бутил]-3-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]сечовини O H N N H HN NH2 O O O O MeO OMe OH 5 , сполуки 44: 1-{2-[3-(4-амінобутиламіно)пропіламіно]етил}-3-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]сечовини O H N N H HN H N NH2 O O O O MeO OMe OH 10 , сполуки 45: 1-{2-[4-(3-амінопропіламіно)бутиламіно]етил}-3-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]сечовини O HN H N N H N H NH2 O O O O MeO OMe OH 15 , сполуки 46: 1-{4-[4-(4-амінобутиламіно)бутиламіно]бутил}-3-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]сечовини 14 UA 106876 C2 O H N N H HN NH2 N H O O O O MeO OMe OH , сполуки 47: 1-{3-[3-(3-амінопропіламіно)пропіламіно]пропіл}-3-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]сечовини O NH2 N H N H N H HN O O O O MeO 5 OMe OH , сполуки 48: 1-{3-[4-(3-амінопропіламіно)бутиламіно]пропіл}-3-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]сечовини O H N N H N H HN NH2 O O O O MeO OMe OH 10 , сполуки 49: 1-[2-{3-[4-(3-амінопропіламіно)бутиламіно]пропіламіно}етил]-3-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]сечовини O HN H N N H H N N H NH2 O O O O MeO 15 OMe OH , сполуки 50: 1-[3-{3-[4-(3-амінопропіламіно)бутиламіно]пропіламіно}пропіл]-3-[9-(4-гідрокси3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]сечовини 15 UA 106876 C2 O H N N H N H N H HN NH2 O O O O MeO OMe OH , сполуки 64: 1-[4-{3-[4-(3-амінопропіламіно)бутиламіно]пропіламіно}бутил]-3-[9-(4-гідрокси3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]сечовини O H N N H HN H N N H NH2 O O O O MeO 5 OMe OH , сполуки 65: 1-(5-{3-[4-(3-амінопропіламіно)бутиламіно]пропіламіно}пентил)-3-[9-(4-гідрокси3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]сечовини O H N N H N H N H HN NH2 O O O O MeO OMe OH 10 , сполуки 66: 1-{3-[3-(4-амінобутиламіно)пропіламіно]пропіл}-3-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]сечовини O HN N H N H NH2 N H O O O O MeO OMe OH 15 , сполуки 67: 1-{4-[3-(4-амінобутиламіно)пропіламіно]бутил}-3-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]сечовини 16 UA 106876 C2 O H N H N N H HN NH2 O O O O MeO OMe OH , сполуки 68: 1-{4-[4-(3-амінопропіламіно)бутиламіно]бутил}-3-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]сечовини O H N N H HN NH2 N H O O O O MeO 5 OMe OH ; сульфамідного ряду: сполуки 61: 2-(4-амінопентиламіно)етансульфонової кислоти N-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро-[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]аміду O O S HN NH2 N H O O O O MeO 10 OMe OH , сполуки 62: 2-[4-(4-амінобутиламіно)бутиламіно]етансульфонової кислоти N-[9-(4-гідрокси3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]аміду O O S N H HN H N NH2 O O O O MeO 15 OMe OH , сполуки 63: 2-[3-(3-амінопропіламіно)пропіламіно]етансульфонової кислоти N-[9-(4-гідрокси3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]аміду 17 UA 106876 C2 O O S N H HN NH2 N H O O O O MeO OMe OH , сполуки 51: 2-(4-амінобутиламіно)етансульфонової кислоти N-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]аміду O HN O S NH2 N H O O O O MeO OMe OH 5 , сполуки 52: 2-[3-(4-амінобутиламіно)пропіламіно]етансульфонової кислоти N-[9-(4-гідрокси3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]аміду O O S N H HN NH2 N H O O O O MeO OMe OH 10 , сполуки 53: 2-[4-(3-амінопропіламіно)бутиламіно]етансульфонової кислоти N-[9-(4-гідрокси3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]аміду O O S N H HN H N NH2 O O O O MeO 15 OMe OH , сполуки 54: 2-{3-[4-(3-амінопропіламіно)бутиламіно]пропіламіно}етансульфонової кислоти 3[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3d][1,3]діоксол-5-іл]аміду 18 UA 106876 C2 O O S H N N H N H HN NH2 O O O O MeO OMe OH , сполуки 59: 2-{3-[3-(3-амінопропіламіно)пропіламіно]пропіламіно}етансульфонової кислоти 3-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3d][1,3]діоксол-5-іл]аміду O O S NH2 N H N H N H HN O O O O MeO 5 OMe OH , сполуки 60: 2-{4-[4-(4-амінобутиламіно)бутиламіно]бутиламіно}етансульфонової кислоти 3[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3d][1,3]діоксол-5-іл]аміду O O S N H HN H N N H NH2 O O O O MeO 10 15 20 25 30 OMe OH , та їх солей приєднання неорганічних чи органічних кислот. Сполуки за винаходом є, наприклад, сполуками загальної формули 1, де: R позначає атом водню або C1-4алкіл, A позначає CO(CH2)n, CONH(CH2)n або SO2(CH2)n, де n дорівнює 2, 3, 4 або 5, R1 позначає атом водню або C1-4алкіл, R2 позначає атом водню або C1-4алкіл, або також може позначати (CH2)m-NR3R4, де m дорівнює 2, 3, 4 або 5, R3 позначає атом водню або C1-4алкіл, R4 позначає атом водню або C1-4алкіл або також може позначати (CH 2)p-NR5R6, де p дорівнює 2, 3, 4 або 5, R5 позначає атом водню або C1-4алкіл, і R6 позначає атом водню або C1-4алкіл або також може позначати (CH2)q-NH2, де q дорівнює 2, 3, 4 або 5, за винятком сполук, де A позначає CO(CH2)2 або A позначає SO2(CH2)3, і обидва R1 і R2 позначають H. Краще, R1 позначає H, R3 позначає H, і R5 позначає H. R також краще може позначати атом водню. Сполуками за винаходом є, наприклад, сполуки загальної формули 1, де A позначає CO(CH2)n або CONH(CH2)n, де n дорівнює 2, 3, 4 або 5, за винятком сполук, де A позначає CO(CH2)2, і обидва R1 і R2 позначають H. Сполуками за винаходом є, наприклад, такі сполуки загальної формули 1, які визначені вище, де R позначає H. 19 UA 106876 C2 5 10 15 20 25 30 35 40 45 50 55 Сполуками за винаходом є, наприклад, такі сполуки загальної формули 1, які визначені вище, де R1 і R2 одночасно не позначають H, коли R позначає H, і A позначає O(CH 2)n, де n дорівнює 2, 3 або 4. Одне конкретне втілення винаходу стосується таких сполук загальної формули 1, які визначені вище, де R2 позначає (CH2)m-NR3R4, краще, R4 позначає (CH2)p-NR5R6 і, зокрема, m дорівнює 3 або 4, і p дорівнює 3 або 4, наприклад, сполукам загальної формули 1, де R6 позначає H, C1-4алкіл або також (CH2)q-NH2, де q дорівнює 3. Даний винахід стосується, зокрема, сполук формули 1, вибраних із групи, що складається зі сполук 1-50, 55-58 і 64-68, описаних вище, та їх солей приєднання неорганічних чи органічних кислот. Більш конкретно, сполуки за винаходом можуть бути вибрані з групи, що складається зі сполук 14-50 і 64-68, які визначені вище, та їх солей приєднання неорганічних чи органічних кислот. Наприклад, сполуки за винаходом можуть бути вибрані з групи, що складається зі сполук 14, 16-18, 21-24, 27, 28, 31-36, 39-41, 44-50, 54, 64-68, які визначені вище, та їх солей приєднання неорганічних чи органічних кислот. Ізомерні сполуки за винаходом включені до обсягу винаходу. В даному винаході термін “фармацевтично прийнятний”, як він використовується в даному описі, має на увазі те, що є корисним у виготовленні фармацевтичної композиції, яка звичайно є нешкідливою, нетоксичною, та не є біологічно або інакше небажаною, і є придатною для фармацевтичного застосування як у ветеринарії, так і для людини. Як використано в даному описі, термін “фармацевтично прийнятні солі” сполуки означає солі, що є фармацевтично прийнятними, як визначено в даному описі, і які мають бажану фармакологічну активність вихідної сполуки. В рамках даного винаходу цей термін більш конкретно означає солі приєднання фармацевтично прийнятних неорганічних чи органічних кислот. Фармацевтично прийнятні кислоти включають соляну, бромистоводневу, сірчану, фосфорну, оцтову, трифтороцтову, молочну, піровиноградну, малонову, бурштинову, глутарову, фумарову, винну, малеїнову, лимонну, аскорбінову, щавлеву, метансульфонову, камфорну та сульфамову кислоти, але цим не обмежуються. Сполуки за винаходом характеризуються тим, що вони є розчинними у воді завдяки утворенню неорганічних чи органічних солей разом з оснóвними атомами азоту бічного ланцюга в положенні 4. Ще однією задачею даного винаходу є використання сполук формули 1 для протиракової терапії несолідних (“рідких”) пухлин і солідних пухлин, таких як меланоми, колоректальний рак, рак легенів, рак передміхурової залози, рак сечового міхура, рак молочної залози, рак матки, рак стравоходу, рак шлунка, рак підшлункової залози, рак печінки, рак яєчників, лейкози, зокрема, лімфоми та мієломи, рак вуха-горла-носа (ENT (ear, nose and throat) cancer) і рак головного мозку. Ці сполуки можуть бути використані в комбінації з іншими протираковими засобами лікування, які можуть бути цитотоксичними або цитостатичними, такими як похідні платини, таксани, вінкаалкалоїди, 5-FU (5-фторурацил), для посилення їх терапевтичної ефективності з метою лікування пухлин, резистентних до звичайних видів терапії. Іншою задачею даного винаходу є спосіб одержання цих сполук. Цей спосіб включає застосування подофілотоксину формули 2 як вихідної речовини. Зокрема, у відповідності зі способом, описаним у французькому патенті FR 2742439, використовують реакцію деметилування подофілотоксину під дією пари реагентів - метіоніну (або диметилсульфіду) та метансульфонової кислоти - у присутності або трифтороцтової кислоти, або ацетону та води з одержанням 4’-деметилепіподофілотоксину (4’-DMEP) формули 3. Ця сполука може бути піддана реакції Ріттера в присутності сірчаної кислоти або іншої сильної кислоти з органічним нітрилом формули Ra-CN, де Ra є -(CH2)n-X або -CH=CH2, де n дорівнює 3, 4 або 5, і X позначає атом галогену, такий як атом хлору, з одержанням сполуки формули 4. Органічним нітрилом може бути, зокрема, хлорацетонітрил або, в більш загальному випадку, галогеноалкілонітрил формули NC-(CH2)n-X. У такий спосіб може бути утворена проміжна сполука, амід формули 4a, де n дорівнює 3-5. Коли замість галогеноалкілонітрилів у взаємодію приводять акрилонітрил, одержують проміжний вініламід формули 4b. 20 UA 106876 C2 OH OH O 3 4 O O 5 R 5a O 2 O O O MeO 1 9 NH 6 8a 5 O 7 O 8 O O O MeO OMe MeO OMe OH OH Подофілотоксин Формула 3 формули2 Формула 6 O O O X HN HN Ra 5 5a 5 O 9 OMe OH Формула 4 5 10 15 20 25 30 5a O 9 O 8a 9 MeO OMe 8a O O O MeO 5 O 5a O O 8a HN n O O 8a 9 OMe OMe O 5a MeO OMe OH OH Формула 4a Формула 4b Проміжний амід формули 4a, де n дорівнює 1, і X позначає Cl, який є відомою проміжною сполукою, обробляють тіосечовиною при кип'ятінні зі зворотним холодильником в оцтовій кислоті з одержанням із чудовим виходом 4-аміно-4-дезокси-4’-деметилподофілотоксину, сполуки формули 6, де R позначає H, у відповідності зі способом, описаним у заявці на патент WO 2007/010007. Амідні сполуки формули 1, де A позначає (CH 2)n-X, і R позначає H, одержують у такий спосіб. Проміжні сполуки формули 4 (4a або 4b) можуть бути піддані алкілуванню аміном (моноаміном, діаміном або поліаміном), зокрема путресцином, спермідином або сперміном, у захищеній формі. Поліаміни містять кілька функціональних аміногруп, тому вони повинні бути захищені захисними групами із залишенням вільного положення первинної аміногрупи для гарної вибірковості взаємодії. Фахівцю в даній області відомий вибір захисних груп, таких як бензилоксикарбонільна або трет-бутилоксикарбонільна групи, для захисту тих функціональних аміногруп, які не повинні вступати у взаємодію. Наприклад, описаний спермін, захищений бензилоксикарбонільною (Z) або третбутилоксикарбонільною (BOC) групами. Також описаний спермідин, захищений групами Z або BOC. Таким чином, реакція алкілування буде здійснюватися між сполукою формули 4 і аміном формули HNR1R2a у захищеній формі, де: - R1 такий, як визначено вище, - R2a позначає C1-4алкіл, захисну групу для аміну або (CH2)m-NR3aR4a, де m такий, як визначено вище, - R3a позначає C1-4алкіл або захисну групу для аміну, - R4a позначає C1-4алкіл, захисну групу для аміну або (CH2)p-NR5aR6a, де p такий, як визначено вище, - R5a позначає C1-4алкіл або захисну групу для аміну, - R6a позначає C1-4алкіл, захисну групу для аміну або (CH2)q-NR7aR8a, де q такий, як визначено вище, - R7a позначає H або захисну групу для аміну, і - R8a є захисну групу для аміну. 21 UA 106876 C2 5 10 Застосування захищених функціональних аміногруп є придатним для запобігання синтезу небажаних побічних продуктів у процесі реакції сполучення, оскільки в цьому випадку є тільки один реакційноздатний сайт. Одержання різних амінів із захисними групами викладене в таких публікаціях: Protective Groups in Organic Synthesis (Th.W. Greene, 2-е вид., John Wiley and Sons, 1991) або в Synthesis 2002, 15, 2195; Bull. Chem. Soc. Jpn. 1998, 71, 699; Tet. Let. 1998, 39, 439 and 443; Tet. Let. 2001, 42, 2709; OPPI 1994, 26, 599; Synthesis 1994, 37; J. Org. Chem. 1998, 63, 9723; Tet. Let. 1994, 35, 2057 і 2061, J. Med. Chem. 2004, 47, 6055; J. Med. Chem. 2003, 46, 5712; Tet. Let. 1995, 36, 9401; Tet. 2000, 56, 2449. Захисними групами для аміну можуть, зокрема, бути Z або BOC. Краще, коли всі захисні групи на захищеному аміні будуть однаковими. В результаті реакції алкілування між захищеним аміном і сполукою формули 4 одержують сполуку формули 5, потім, після видалення захисту з функціональних аміногруп, захищених захисними групами для аміну (якщо такі групи є), сполуку формули 7a. R1 O N HN n 5 O R1 O N R2a 5a RN n 5 O O 9 O MeO 20 25 30 5 O n OMe MeO R2 5a O O 8a 9 O 8a O OMe OH 15 HN O O 8a 9 N R2 5a O R1 O MeO OMe OH OH Формула 5 Формула 7 Формула 7a Таким чином, з використанням набору вибірних захистів за допомогою захисних груп для аміну, наприклад BOC або Z, фахівці в даній області можуть одержати сполуки формули 7a. Можливою останньою стадією способу за винаходом є видалення захисту з функціональних аміногруп, захищених відповідними групами. Отримані сполуки потім будуть виділені з реакційної суміші згідно з методами, добре відомими фахівцям в даній області техніки. Сполуки за даним винаходом містять хіральні центри природного подофілотоксину. У сполуці формули 2 (4’-DMEP) атоми водню в положеннях 5, 5a, 8a і 9 характеризуються такою стехіометрією: H5, H5a, H8a, H9. У сполуці формули 3 конфігурація асиметричних атомів вуглецю краще є такою: 5S, 5aS, 8aR, 9R. Сполуки сечовини формули 10 одержують з 4-хлорацетамідо-4’-деметилподофілотоксину формули 4a (n дорівнює 1, X позначає Cl), у якому 4’-фенол захищений захисною групою для гідроксилу Y, такою як бензилоксикарбонільна група. В результаті обробки тіосечовиною утворюється аміносполука формули 8, де R позначає H, у якій група в положенні 4’ захищена захисною групою Y, такою як група Z (бензилоксикарбоніл), при цьому сполуки формули 8, де R не є H, можуть бути отримані у відповідності зі способом, викладеним в US 7378419. O R 5 O ( )n NH RN 5a 5 O 9 9 O MeO OMe O O OMe O R1 N O 8a O MeO A O O O 8a N R2 5a O O R X N H O Y OMe OH Y Формула 8 MeO Формула 9 Формула 11 22 UA 106876 C2 O O ( )n RN 5 O N N H R1 R2a 5a RN 5 O OMe O MeO OMe 15 N N H R1a R2a 5a O 9 8a O MeO OMe OH O Y Формула 10a 10 5 O O Y 5 RN O 8a 9 O MeO R2 5a ( )n R1 O O 8a 9 N N H O O O ( )n Формула 10b Формула 10c Цю сполуку формули 8 (зокрема, де R позначає H) далі приводять у взаємодію з ізоціанатами, такими як галогеноалкілізоціанати формули O=C=N-(CH2)n-X, де X є галогеном, і n позначає ланцюг, що містить від 2 до 5 CH2, з одержанням сполуки формули 9 (відповідно до методики, викладеної в Heterocycles 1994, 39, 361). Цю проміжну сполуку формули 9 приводять у взаємодію із захищеними моно-, ди-, три- або тетраамінами (формули HNR1R2a), як згадано вище, в традиційних умовах алкілування, тобто, зокрема, при кімнатній температурі в DMF у присутності триетиламіну та KI з одержанням сполук формули 10a, потім, після видалення захисту в 4’-положенні подофілотоксинового скелета та із захищених функціональних аміногруп, з одержанням сполук формули 10b. Отримані сполуки потім будуть виділені з реакційної суміші згідно з методами, добре відомими фахівцям в даній області. Сечовини можна одержати, використовуючи сполуку формули 8 (зокрема, де R позначає H) і фосген або трифосген, з одержанням без виділення активованої карбонілованої проміжної сполуки. Ці проміжні сполуки відповідають наведеній далі формулі: O RN5 O Cl 5a O O 9 8a O MeO OMe O Y 20 25 30 35 . Цю проміжну сполуку далі приводять у взаємодію безпосередньо із захищеним аміном, діаміном або поліаміном формули H2N-(CH2)n-NR1aR2a, де R1a позначає H, C1-4алкіл або захисну групу для аміну, і де R2a та n є такими, як визначено вище (де R1a не позначає H, коли R2a позначає C1-4алкіл або (CH2)m-NR3aR4a), з одержанням сполуки формули 10c, при цьому решту стадій синтезу виконують, як описано вище (видалення захисту з функціональних аміногруп і фенолу). Остання стадія видалення захисту, проведена або в кислотному середовищі у випадку групи BOC, або за допомогою каталітичного гідрування у випадку групи Z, приводить до одержання вільної поліамінної сполуки загальної формули 1, де A позначає CONH(CH2)n. Однак, алкілування поліамінів, проведене на подофілотоксин-галогеноалкіламідах, не є однозначною реакцією. Однією з умов проведення процесу цього класично використовуваного алкілування є лужне середовище. Важливо проводити реакцію в слабко лужному середовищі, наприклад, у присутності триетиламіну. Основність середовища може приводити разом з даним процесом до одержання побічного продукту, який утворюється в результаті епімеризації протона в положенні 2, що приводить до одержання цис-лактонового похідного формули 11, тобто ізомеру формули 1. Однак, за допомогою прецизійної хроматографії можливе виділення бажаного транс-лактонового похідного. У наведених далі прикладах показаний альтернативний спосіб попередження такої можливої епімеризації. Він полягає в утворенні ланцюга алканової кислоти на захищеному поліаміні (сполука формули 12, де R1a такий, як визначено вище), а 23 UA 106876 C2 потім сполученні отриманого продукту шляхом пептидного сполучення з 4-аміно-4-дезокси-4’деметилподофілотоксином формули 6 (зокрема, де R позначає H) відповідно до наведеної нижче реакційної схеми: O R NH HO 5 O R2a 5 O O O 9 O O 9 O OMe MeO 15 20 OMe OH Формула 7b Формула 6 10 8a O OH 5 R2a 5a Формула 12 8a MeO N ( )n RN N ( )n R1a O R1a Це пептидне сполучення проводять, краще, в присутності TBTU, краще, з поліаміном, який захищений бензилоксикарбонільними групами та містить фрагмент пропіонової, масляної або пентанової кислот. Проміжні кислоти, що містять фрагмент з 2-ма атомами вуглецю (формула 12, n = 2), одержують шляхом сполучення з метилакрилатом аналогічно одержанню продуктів, описаних в Tet. 2006, 62, 8332. Проміжні кислоти формули 12, де n дорівнює 3-5, одержують загальноприйнятим алкілуванням аміну, захищеного галогеноалкіловим складним ефіром, який далі омиляють до карбонової кислоти. Надалі одержують сполуки формули 7b, щоб після видалення захисту із захищених функціональних аміногруп одержати сполуки формули 7. Отримані сполуки потім будуть виділені з реакційної суміші згідно з методами, добре відомими фахівцям в даній області. Сульфонамідні сполуки одержують у такий спосіб. Сполуку формули 8 (зокрема, де R позначає H) приводять у взаємодію із хлоретилсульфонілхлоридом з одержанням вінілсульфонамідної проміжної сполуки, на противагу одержанню різних захищених поліамінів. Видалення захисту проводять шляхом традиційного гідрування в присутності палладію на вугіллі у випадку захисної групи Z або в кислотному середовищі у випадку захисної групи BOC. У наведених далі необмежуючих прикладах проілюстровані використовувані методики даного способу. 1. Одержання проміжних сполук Проміжна сполука I: 4-Аміно-4’-деметил-4-дезоксиподофілотоксин (формула 6, де R = H) NH2 O O O O O O 25 30 35 40 OH Цю сполуку одержують, як описано в заявці на патент WO 2007/010007. Стадія 1: Реакція Ріттера: одержання 4-хлорацетамідо-4’-деметил-4дезоксиподофілотоксину формули 4a (де n = 1, і X = Cl) До суспензії 30 г (0,075 моль) 4’-деметилепіподофілотоксину формули 3 в 47,5 мл (0,75 моль) хлорацетонітрилу при кімнатній температурі по краплях додають 0,5 мл концентрованої сірчаної кислоти. Суміш залишають перемішуватися при цій температурі протягом 1 години, протягом цього періоду часу спостерігається розчинення з наступним повторним утворенням осаду. Додають 300 мл 2-пропанолу. Осад відфільтровують, промивають 200 мл 2-пропанолу та водою до pH = 7. Отриману білу тверду речовину сушать під вакуумом при 40 °C з одержанням 32,9 г хлорацетамідвмісної сполуки формули 4a (n = 1, X = Cl), тобто з виходом 93%. Т.пл. = 240 °C. Стадія 2: Одержання 4-аміно-4’-деметил-4-дезоксиподофілотоксину (формула 6, де R = H) Суспензію 17 г (0,0358 моль) 4-хлорацетамідо-4’-деметил-4-дезоксиподофілотоксину, отриманого вище, в 75 мл льодяної оцтової кислоти нагрівають до 80 °C з перемішуванням. Додають однією порцією 4,2 г (0,0537 моль) тіосечовини. Суміш залишають перемішуватися при 24 UA 106876 C2 5 цій температурі протягом 1 год. 30 хв., протягом цього періоду часу спостерігається розчинення з наступним повторним утворенням осаду. Реакційну суміш фільтрують у гарячому стані, промивають 75 мл льодяної оцтової кислоти та діізопропіловим ефіром. Отриману білу тверду речовину сушать під вакуумом при 40 °C з одержанням 14,6 г сполуки формули 6 у формі 1 гідрохлориду, що відповідає молярному виходу 93%. Т.пл. >260 °C. H-ЯМР (DMSO) 8.63 (m, 2H), 8,32 (m, 1H), 7.23 (s, 1H, H5), 6.60 (s, 1H, H8), 6.18 (s, 2H, H2’, H6’), 6.05 (d, 2H, J = 2.1 Гц, OCH2O), 4.73 (d, 1H, J = 4.5 Гц, H4), 4.56 (d, 1H, J = 5.2 Гц, H1), 4,34 (m, 2H, H11a і H11b), 3.65 (dd, 1H, J = 5.2 Гц, H2), 3.62 (s, 6H, 2OCH3), 3.06 (m, 1H, H3). Проміжна сполука II: Одержання 4 -акриламідо-4’-деметил-4-дезоксиподофілотоксину O HN O O O O O 10 15 20 O OH Формула 5 До суспензії 3 г (0,0075 моль) 4’-деметилепіподофілотоксину формули 3 в 10 мл акрилонітрилу при кімнатній температурі додають декілька краплин концентрованої сірчаної кислоти. Суміш залишають перемішуватися при цій температурі протягом 3 годин, протягом цього періоду часу спостерігається розчинення з наступним повторним утворенням осаду. Додають 50 мл 2-пропанолу. Осад відфільтровують, промивають 2-пропанолом і водою до pH = 7. Отриману білу тверду речовину сушать під вакуумом при 40 °C з одержанням 2,64 г акриламідної сполуки. Т.пл. = 180 °C. TLC SiO2 (30:70 гептан:AcOEt): Rf = 0,25. Анал. C24H23NO3, H2O (MW = 471,464): розраховано C% 61,14, H% 5,63, N% 2,66; знайдено: C% 60,84, H% 5,34, N% 2,97. Проміжна сполука III: Одержання 4-хлорбутирамідо-4’-деметил-4-дезоксиподофілотоксину O Cl HN O O O O O O OH 25 30 35 Стадія 1: Одержання 4-хлорбутирамідо-4-дезоксиподофілотоксину Цю сполуку одержують із подофілотоксину та 4-хлорбутиронітрилу відповідно до методики, описаної на стадії 1 одержання проміжної сполуки I для взаємодії хлорацетонітрилу з 4’деметилепіподофілотоксином. TLC SiO2 (9:1 CH2Cl2:ацетон): Rf = 0,38; вихід = 71%. Стадія 2: Одержання 4-хлорбутирамідо-4’-деметил-4-дезоксиподофілотоксину (формула 4a, де n = 3 і X = Cl) 4,46 г сполуки, отриманої на стадії 1 вище, суспендують з перемішуванням в 21,16 мл метансульфонової кислоти. Потім додають 1,93 г D,L-метіоніну та перемішування продовжують протягом 2 год. Реакційну суміш виливають із перемішуванням у воду, і утворюється осад. В результаті фільтрування та промивання водою до нейтрального значення pH одержують після сушіння та видалення води 2,26 г (вихід = 52%) продукту деметилування. TLC SiO 2 (9:1 CH2Cl2:ацетон): Rf = 0,20. Продукт використовують безпосередньо без очищення на наступних стадіях алкілування. Проміжна сполука IV: Одержання 4-бромпентанамідо-4’-деметил-4дезоксиподофілотоксину 25 UA 106876 C2 O HN Br O O O O O O OH 5 10 15 20 25 30 35 40 45 50 Цю сполуку одержують аналогічно одержанню 4-хлорацетамідо-4’-деметил-4дезоксиподофілотоксину, стадія 1 для проміжної сполуки I, але з використанням відповідного реагенту, а саме 5-бромбутиронітрилу. 4-Бромпентанамідо-4’-деметил-4дезоксиподофілотоксин одержують із виходом 57%. TLC SiO2 (95:5 CH2Cl2:MeOH): Rf = 0,28. 1 Характерні сигнали спектра H-ЯМР (DMSO) 5.39 (t, 2H, J = 6.4 Гц, CH2Br), 2.17 (t, 2H, J = 7.2 Гц, CH2CO), 1.79 (m, 2H, CH2), 1.66 (m, 2H, CH2). 2. Одержання сполук за винаходом Приклад 1: Одержання 3-диметиламіно-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]пропіонаміду або (4диметиламінопропіонамідо)-4’-деметил-4-дезоксиподофілотоксину) (Сполука 5) 500 мг 4-аміно-4’-деметил-4-дезоксиподофілотоксину формули 6 і 146 мг 3диметиламінопропіонової кислоти розчиняють із перемішуванням в 50 мл ацетонітрилу разом з 0,21 мл триетиламіну. Додають 400 мг TBTU і перемішування продовжують протягом 6 год. при кімнатній температурі. Реакційну суміш виливають у воду (300 мл) і екстрагують етилацетатом (3100 мл). Органічні фази сушать над Na2SO4, фільтрують і упарюють. Залишок піддають флеш-хроматографії на SiO2 (елюювання сумішшю 78:20:2 CH2Cl2:MeOH:NH4OH). Після упарювання залишок ще раз піддають хроматографії на препаративній HPLC-колонці (X Bridge, OBD, C18, 30250 мм, 10 мкм), градієнт елюювання CH3CN/5 мМ HCl (від 10/90 до 80/20). Фракції екстрагують етилацетатом (2100 мл), сушать і упарюють. Залишок переводять у сіль, використовуючи суміш HCl в ізопропанолі та етилового ефіру, відфільтровують і сушать із одержанням 246 мг гідрохлориду у вигляді білого порошку. Вихід = 37%. TLC SiO 2 (90:9:1 1 CH2Cl2:MeOH:NH4OH): Rf = 0,38. ЯМР основи: H-ЯМР (DMSO) 8.36 (d, 1H, NH), 8.28 (s, 1H, OH), 6.76 (s, 1H, H5), 6.53 (s, 1H, H8), 6.24 (s, 2H, H2’, H6’), 5.99 (d, 2H, J = 8.4 Гц, OCH2O), 5.16 (dd, 1H, H4), 4.50 (d, 1H, J = 5 Гц, H1), 4.25 (t, 1H, H11a), 3,87 (t, 1H, H11b), 3.62 (s, 6H, OMe), 3.11 (dd, 1H, H2), 2,93 (m, 1H, H3), 2.42-2.55 (m, 2H, CH2N), 2.24-2.33 (m, 2H, CH2N), 2.12 (s, 6H, NMe2). Мас-спектр (APCI), m/z = 499, M-H+. Приклад 2: Одержання 4-диметиламіно-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо5,5a,6,8,8a,9-гексагідрофуро-[3’,4’:6,7]-нафто[2,3-d][1,3]діоксол-5-іл]бутираміду або (4диметиламінобутирамідо)-4’-деметил-4-дезоксиподофілотоксину) (Сполука 6) Розчин 570 мг проміжної сполуки III, отриманої вище, перемішують протягом 12 год. в 25 мл ацетонітрилу разом з 0,28 мл (5 екв.) диметиламіну. Потім реакційну суміш виливають на лід і додають 1 н. розчин HCl до pH = 4. Екстракцію проводять, використовуючи метиленхлорид, і потім водну фазу підлуговують розчином NaHCO 3 до pH = 8. Цю фазу повторно екстрагують CH2Cl2, сушать над Na2SO4, фільтрують і упарюють, одержуючи 100 мг оранжевої піни. Гідрохлорид утворюють у метилетилацетоні, додаючи розчин HCl в ізопропанолі (3 н.). Потім гідрохлорид відфільтровують, промивають метилетилкетоном, потім етиловим ефіром. Після сушіння отримані кристали є 90 мг білуватого порошку. TLC SiO 2 (90:10:1 CH2Cl2:MeOH:NH4OH): 1 Rf = 0,47. Т.пл. = 169 °C. H-ЯМР (DMSO) 8.35 (d, 1H, NH), 6.75 (s, 1H, H 5), 6.51 (s, 1H, H8), 6.20 (s, 2H, H2’, H6’), 5.96 (d, 2H, J = 6.36 Гц, OCH2O), 5.15 (dd, 1H, H4), 4.47 (d, 1H, J = 5 Гц, H1), 4.26 (t, 1H, H11a), 3.68 (t, 1H, H11b), 3.59 (s, 6H, OMe), 3,34 (m, 2H, CH2N), 3.08 (dd, 1H, H2), 2,93 (m, 1H, H3), 2.72 (s, 6H, NMe2), 2.22 (m, 2H, CH2CO), 1,86 (m, 2H, CH2). Анал. C27H33ClN2O8, розраховано C% 55,43; H% 6,37; N% 6,06; знайдено C% 55,74, H% 6,01, N% 4,68. Приклад 3: Одержання 3-[(2-диметиламіноетил)метиламіно]-N-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5іл]пропіонаміду або (4-[3-[2-(N-метил-N,N-диметиламіно-2-етил)]пропіонамід)]-4’-деметил-4дезоксиподофілотоксину) (Сполука 3) 200 мг проміжної сполуки II розчиняють в 20 мл THF і в реакційну суміш по краплях вносять 1,15 мл N,N,N'-триметилетилендіаміну. Суміш перемішують протягом 12 год. при кімнатній температурі і потім упарюють досуха. На цій стадії одержують суміш 2 епімерів по положенню 2 26 UA 106876 C2 5 10 15 20 25 30 35 40 45 50 55 60 (цис-лактон і транс-лактон).Флеш-хроматографія (елюювання сумішшю CH2Cl2:MeOH:NH4OH 90:10:0.5) дозволяє одержати 70 мг епімерного похідного по положенню 2 (цис-лактону). Т.пл. = 1 178 °C. H-ЯМР (DMSO) 8.41 (d, 1H, J = 8.96 Гц, CONH), 8.29 (m, 1H, OH), 6.95 (s, 1H, H8), 6,89 (s, 1H, H5), 6.42 (s, 2H, H2’, H6’), 6.01 (d, 2H, J = 4.04 Гц, OCH2O), 5.08 (dd, 1H, J = 6.6 Гц, H4), 4,37 (s, 1H, H1), 4.28 (t, 1H, J = 9.2 Гц, H11a), 4.01 (dd, 1H, J = 4 Гц, J’ = 9.6, H11b), 3.79 (dd, 1H, J = 1.6 Гц, J’ = 10.8, H2), 3.69 (s, 6H, OMe), 3,32 (m, 3H, H3, COCH2), 2.63-2.27 (m, 6H, CH2N), 2.194 (s, 3H, NMe), 2.101 (s, 6H, NMe2). Приклад 4: Одержання 5-диметиламінопентанової кислоти N-[9-(4-гідрокси-3,5диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]аміду або (4-диметиламінопентанамідо-4’-деметил-4-дезокси-подофілотоксину) (Сполука 7) 700 мг бромованої проміжної сполуки IV, отриманої вище, перемішують в 3,3 мл 2М розчину диметиламіну в THF протягом 4 діб в атмосфері азоту. Розчин виливають на лід і додають розчин HCl (0,1 н.) до pH = 7. Розчин екстрагують етилацетатом, одержуючи після сушіння над Na2SO4, фільтрування та упарювання 341 мг масла, яке потім очищають флеш-хроматографією на SiO2 (97:7:0,7 CH2Cl2:MeOH:NH4OH) з одержанням 200 мг чистого масла. Гідрохлорид утворюють, додаючи до основи, розчиненої в ізопропанолі, розчин солянокислого етанолу до кислого значення pH. TLC SiO2 (90:10:1 CH2Cl2:MeOH:NH4OH): Rf = 0,23. Т.пл. (клейка речовина) 1 = 224 °C. H-ЯМР (DMSO) 8,38 (d, 1H, J = 8.56 Гц, NH), 6.77 (s, 1H, H5), 6.53 (s, 1H, H8), 6.23 (s, 2H, H2’, H6’), 5.99 (d, 2H, J = 12.4 Гц, OCH2O), 5.18 (dd, 1H, J = 8.16 Гц, J’ = 4.76 Гц, H 4), 4.49 (d, 1H, J = 5.12 Гц, H1), 4.29 (t, 1H, J = 8 Гц, H11a), 3.73 (t, 1H, J = 10.34 Гц, H11b), 3.63 (s, 6H, OMe), 3.22 (dd, 1H, J = 5.16 Гц, J’ = 14.3Гц, H2), 3,3 (t, 2H, J = 7.08 Гц, CH 2N), 2.93 (m, 1H, H3), 2.71(s, 6H, NMe2), 2.20 (t, 2H, J = 6.88 Гц, CH2CO), 1.59 (m, 4H, CH2). Приклад 5: Одержання 5-[(2-диметиламіноетил)метиламіно]пентанової кислоти N-[9-(4гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3d][1,3]діоксол-5-іл]аміду або 4-[5-[2-(N-метил-N-диметиламіно-2-етил)]пентанамід)]-4’-деметил4-дезоксиподофілотоксину (Сполука 55) Цю сполуку одержують аналогічно одержанню сполуки із Прикладу 2, але використовуючи бромовану проміжну сполука IV і N,N,N'-триметилетилендіамін. Одержують 4[5-[2-(N-метил-Nдиметиламіно-2-етил)]пентанамід)]-4’-деметил-4-дезоксиподофілотоксин з домішкою його 8aепімеру. Флеш-хроматографія (елюювання сумішшю CH2Cl2:MeOH:NH4OH, 95:5:0,5, потім 90:10:0,6) дозволяє виділити вказану в заголовку сполуку. Дигідрохлорид кристалізують із ізопропанолу, додаючи солянокислий етанол. HPLC (C8 Symmetry; елюювання сумішшю буфера на основі KH2PO4 (3,4 г/л), доведеного до pH = 4 додаванням H3PO4, і CH3CN (80/20)). 1 Час утримання (RT): 4,95 хв. H-ЯМР (DMSO) 8,38 (d, 1H, J = 8.56 Гц, NH), 6.78 (s, 1H, H 5), 6.53 (s, 1H, H8), 6.24 (s, 2H, H2’, H6’), 6.00 (d, 2H, J = 11.3 Гц, OCH2O), 5.19 (dd, 1H, J = 8.15 Гц, J’ = 4.6 Гц, H4), 4.50 (d, 1H, J = 4.8 Гц, H1), 4.29 (t, 1H, J = 8 Гц, H11a), 3.72 (dd, 1H, H11b), 3.63 (s, 6H, OMe), 3.53 (m, 2H, CH2N), 3.08-3.24 (m, 5H, CH2N, H2), 2.93 (m, 1H, H3), 2.84 (s, 6H, NMe2), 2.79 (s, 3H, NMe), 2.20 (t, 2H, J = 6.88 Гц, CH2CO), 1.69 (t, 2H,CH2), 1.57 (m, 2H, CH2). Приклад 6: Одержання аміно-N-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]бутираміду або (4-амінобутанамідо-4’деметил-4-дезоксиподофілотоксину) (Сполука 56) Стадія 1: До розчину 1 г 4-аміно-4’-деметил-4-дезоксиподофілотоксину формули 6 в 50 мл ацетонітрилу при перемішуванні додають 510 мг 4-трет-бутоксикарбоніламіномасляної кислоти (Bioorg. Med. Chem. Lett. 2005, 15, 1969) разом з 0,40 мл триетиламіну. Потім додають 800 мг TBTU і перемішування продовжують при кімнатній температурі протягом 5 год. Реакційну суміш виливають у воду та екстрагують етилацетатом. Після випарювання розчинника залишок очищають флеш-хроматографією на SiO2 (градієнт елюювання від чистого CH2Cl2 до суміші 90:9:1 CH2Cl2:MeOH:NH4OH). Препаративна хроматографія на X Bridge C18, OBD, 30250 мм, 10 мкм, елюент: градієнт від 10:90 CH3CN/H2O до 90:10 CH3CN/H2O, дозволила одержати після упарювання фракцій, що містять чисту сполуку, 460 мг безбарвного масла. Вихід = 31%. TLC 1 SiO2 (90:9:1 CH2Cl2:MeOH:NH4OH): Rf = 0,20, H-ЯМР (DMSO) 8.25 (s, 1H, OH), 8.22 (d, 1H, J = 8 Гц, NH аміду), 6.79 (m, 1H, NH карбамату), 6.76 (s, 1H, H 5), 6.52 (s, 1H, H8), 6.24 (s, 2H, H2’, H6’), 6.00 (d, 2H, J = 13.2 Гц, OCH2O), 5.17 (dd, 1H, J = 8 Гц, J’ = 4.4 Гц, H 4), 4.49 (d, 1H, J = 4.8 Гц, H1), 4.27 (t, 1H, J = 8 Гц, H11a), 3.74 (t, 1H, J = 9.6 Гц, H11b), 3.62 (s, 6H, OMe), 3.15 (dd, 1H, J = 14.4 Гц і J’ = 5.2 Гц, H2), 2.89-2.96 (m, 3H, H3 і CH2N), 2.13 (t, 2H, J = 7.2 Гц, CH2CO), 1.62 (m, 2H, CH2), 1.36 (s, 9H, t-bu). Стадія 2: Проміжний карбамат, отриманий на стадії 1 вище, перемішують при кімнатній температурі протягом 4 год. в 25 мл CH2Cl2 у присутності 25 мл HCl в ізопропанолі (3,3 M). Після упарювання одержують білий осад, який потім фільтрують, промивають етиловим ефіром і сушать, одержуючи 275 мг гідрохлориду у вигляді білого порошку. Вихід 67%. Т.пл. = 284 °C. 27 UA 106876 C2 TLC SiO2 (90:9:1 CH2Cl2:MeOH:NH4OH): Rf = 0,18; MS (ESI+) m/z = 485 (M-H+). H-ЯМР (DMSO) 8.44 (d, 1H, J = 7.6 Гц, NH аміду), 8.27 (m, 1H, OH), 7.91 (m, 2H, NH 2 і HCl), 6.77 (s, 1H, H5), 6.53 (s, 1H, H8), 6.24 (s, 2H, H2’, H6’), 6.00 (d, 2H, J = 11.6 Гц, OCH2O), 5.19 (d, 1H, J = 4.4 Гц, H4), 4.52 (d, 1H, J = 5.2 Гц, H1), 4,31 (t, 1H, J = 8 Гц, H11a), 3.74 (m, 1H, H11b), 3.63 (s, 6H, OMe), 3.17 (dd, 1H, J = 14 Гц і J’ = 4.8 Гц, H2), 2.95 (m, 1H, H3), 2.81 (t, 2H, J = 7.6 Гц, CH2N), 2.27 (t, 2H, J = 7.2 Гц, CH2CO), 1.83 (m, 2H, CH2). Приклад 7: Одержання 5-амінопентанової кислоти N-[9-(4-гідрокси-3,5-диметоксифеніл)-8оксо-5,5a,6,8,8a,9-гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]аміду або (4амінопентанамідо-4’-деметил-4-дезоксиподофілотоксину) (Сполука 57) Цю сполуку одержують аналогічно одержанню сполуки із Прикладу 6 вище, але використовуючи 5-трет-бутоксикарбоніламінопентанову кислоту. Приклад 8: У такий саме спосіб, як і в Прикладі 6, але з використанням замість 4-третбутоксикарбоніламіномасляної кислоти відповідних захищених діаміно-, триаміно- або тетрааміновмісних кислот із пропіоновим ланцюгом (які одержують із використанням метилакрилату аналогічно способу в публікації Tetrahedron 2006, 62, 8335), синтезовані сполуки 8, 10, 12, 13, 14, 29, 30, 27, 28, 58, 19, 20 і 18 формули 1 (де A = CO(CH 2)n, n = 2). Приклад 9: Одержання 2-{3-[4-(3-амінопропіламіно)бутиламіно]пропіламіно}етансульфонової кислоти 3-[9-(4-гідрокси-3,5-диметоксифеніл)-8-оксо-5,5a,6,8,8a,9гексагідрофуро[3’,4’:6,7]нафто[2,3-d][1,3]діоксол-5-іл]аміду або (4--2-{3-[4-(3амінопропіламіно)бутиламіно]пропіламіно}етансульфонамідо-4’-деметил-4дезоксиподофілотоксину) (Сполука 54) Стадія 1: Одержання 4--вінілсульфоніламіно-4’-бензилоксикарбоніл-4’-деметил-4дезоксиподофілотоксину 500 мг 4-аміно-4-дезокси-4’-бензилоксикарбоніл-4’-деметилепіподофілотоксину формули 8 розчиняють в 20 мл CH2Cl2 разом з 0,4 мл триетиламіну. По краплях з перемішуванням додають 0,1 мл хлоретансульфонілхлориду в 5 мл CH2Cl2 при -15 °C. Перемішування продовжують протягом 15 хв., потім суміш залишають нагріватися до температури навколишнього середовища і перемішування продовжують протягом 4 год. Потім реакційну суміш виливають у воду та екстрагують CH2Cl2. Органічні фази поєднують, сушать над Na2SO4, фільтрують та упарюють. Залишок очищають флеш-хроматографією, елююють градієнтом від чистого гептану до чистого AcOEt. Отримані фракції, що містять чисту сполуку, упарюють, одержуючи 220 мг 1 піни. Вихід = 55%. TLC SiO2 (90:9:1 CH2Cl2:MeOH:NH4OH): Rf = 0,7; H-ЯМР (DMSO) 8.03 (d, 1H, J = 8.56 Гц, NH), 7.40 (m, 5H, Ar), 7.02 (dd, 1H, J = 16.36 Гц, J’ = 9.8 Гц, HC=), 6.91 (s, 1H, H5), 6.53 (s, 1H, H8), 6,33 (s, 2H, H2’, H6’), 6.15 (d, 1H, J = 16.4 Гц, HC=), 6.09 (d, 1H, J = 9.8 Гц, HC=), 6.01 (d, 2H, J = 11.3 Гц, OCH2O), 5.23 (s, 2H, CH2Ph), 4.67 (dd, 1H, J = 8.24 Гц, J’ = 4.4 Гц, H4), 4.59 (d, 1H, J = 5.4 Гц, H1), 4,31 (t, 1H, J = 8.04 Гц, H11a), 4.13 (t, 1H, H11b), 3.63 (s, 6H, OMe), 3.28 (dd, 1H, J = 5.36 Гц і J’ = 18.48 Гц, H2), 2.97 (m, 1H, H3). Стадія 2: Додавання N1,N2,N3-трибензилоксикарбонілсперміну 220 мг вінільного похідного, отриманого на наведеній вище стадії, розчиняють в 10 мл метанолу. До реакційної суміші додають 220 мг N1,N2,N3-трибензилоксикарбонілсперміну та перемішування продовжують протягом 5 діб при кімнатній температурі. Після упарювання під вакуумом додають воду та суміш екстрагують етилацетатом. Після сушіння органічної фази, фільтрування та упарювання проводять очищення флеш-хроматографією (градієнт елюювання від чистого гептану до чистого AcOEt і потім до суміші 90:9:1 AcOEt:MeOH:NH 4OH). Одержують 70 мг тетразаміщеної сполуки, отриманої в результаті приєднання, тобто з виходом 16% (транслактонової сполуки). Також одержують іншу епімерну по положенню 2 сполуку (цис-лактонова сполука). Аналіз транс-лактонової сполуки: TLC SiO2 (90:9:1 CH2Cl2:MeOH:NH4OH): Rf = 0,6. Аналітична HPLC: X Bridge C8, 4,6250 мм, 5 мкм, елюент: 80:20 CH3CN:H2O-KH2PO4 6,8 г/л, pH = 4, швидкість потоку 1 мл/хв, RRT = 3,55 хв. MS (ESI+) m/z = 1094. Стадія 3: Гідрогенолиз захисних груп 70 мг отриманого вище транс-лактонового похідного поміщають в атмосфері водню в суміш 10 мл метанолу та 5 мл CH2Cl2. Також додають 0,25 мл HCl в ізопропанолі разом з 50 мг 10%-го палладію на вугіллі. Енергійне перемішування продовжують протягом 5 год. Каталізатор відфільтровують, промивають метанолом, залишок упарюють під вакуумом і переносять в етиловий ефір для кристалізації гідрохлориду, який відфільтровують і сушать під вакуумом. Одержують 30 мг кристалів у вигляді гідрохлориду (вихід 63%). Т.пл. = 191 °C. Аналітична HPLC: X Bridge C8, 4,6250 мм, 5 мкм, елюент: 15:85 CH3CN:H2O-KH2PO4 6,8 г/л, pH = 4, швидкість потоку 1 мл/хв, RRT = 14,08 хв. MS (ESI+) m/z = 692 (M-H+). Приклад 10: Сполуки 51, 52, 53, 59, 60, 61, 62 і 63 можуть бути синтезовані в такий саме 1 5 10 15 20 25 30 35 40 45 50 55 60 28
ДивитисяДодаткова інформація
Назва патенту англійськоюNew (poly)aminoalkylaminoalkylamide, alkyl-urea, or alkyl-sulfonamide derivatives of epipodophyllotoxin, a process for preparing them, and application thereof in therapy as anticancer agents
Автори російськоюImbert, Thierry, Guminski, Yves, Barret, Jean-Marc, Kruczynski, Anna
МПК / Мітки
МПК: C07D 493/04, A61P 35/00, A61K 31/36
Мітки: алкілсечовинні, терапії, епіподофілотоксину, засобів, полі)аміноалкіламіноалкіламідні, одержання, застосування, протиракових, спосіб, алкілсульфонамідні, похідні
Код посилання
<a href="https://ua.patents.su/43-106876-poliaminoalkilaminoalkilamidni-alkilsechovinni-abo-alkilsulfonamidni-pokhidni-epipodofilotoksinu-sposib-kh-oderzhannya-ta-kh-zastosuvannya-v-terapi-yak-protirakovikh-zasobiv.html" target="_blank" rel="follow" title="База патентів України">(полі)аміноалкіламіноалкіламідні, алкілсечовинні або алкілсульфонамідні похідні епіподофілотоксину, спосіб їх одержання та їх застосування в терапії як протиракових засобів</a>
Попередній патент: Тіадіазолілоксифеніламідини та їх застосування як фунгіцидів
Наступний патент: Фармацевтична композиція ентакапону або його солей пролонгованого вивільнення
Випадковий патент: Похідні мигдалевої кислоти та їх застосування як інгібіторів тромбіну, фармацевтична композиція на їх основі