Сполуки і спосіб інгібування реплікації вірусу гепатиту с
Номер патенту: 93990
Опубліковано: 25.03.2011
Автори: Сейверт Скотт Д., Хаас Джулія, Блетт Лоренс М., Ендрюс Стівен, Бейгелман Леонід
Формула / Реферат
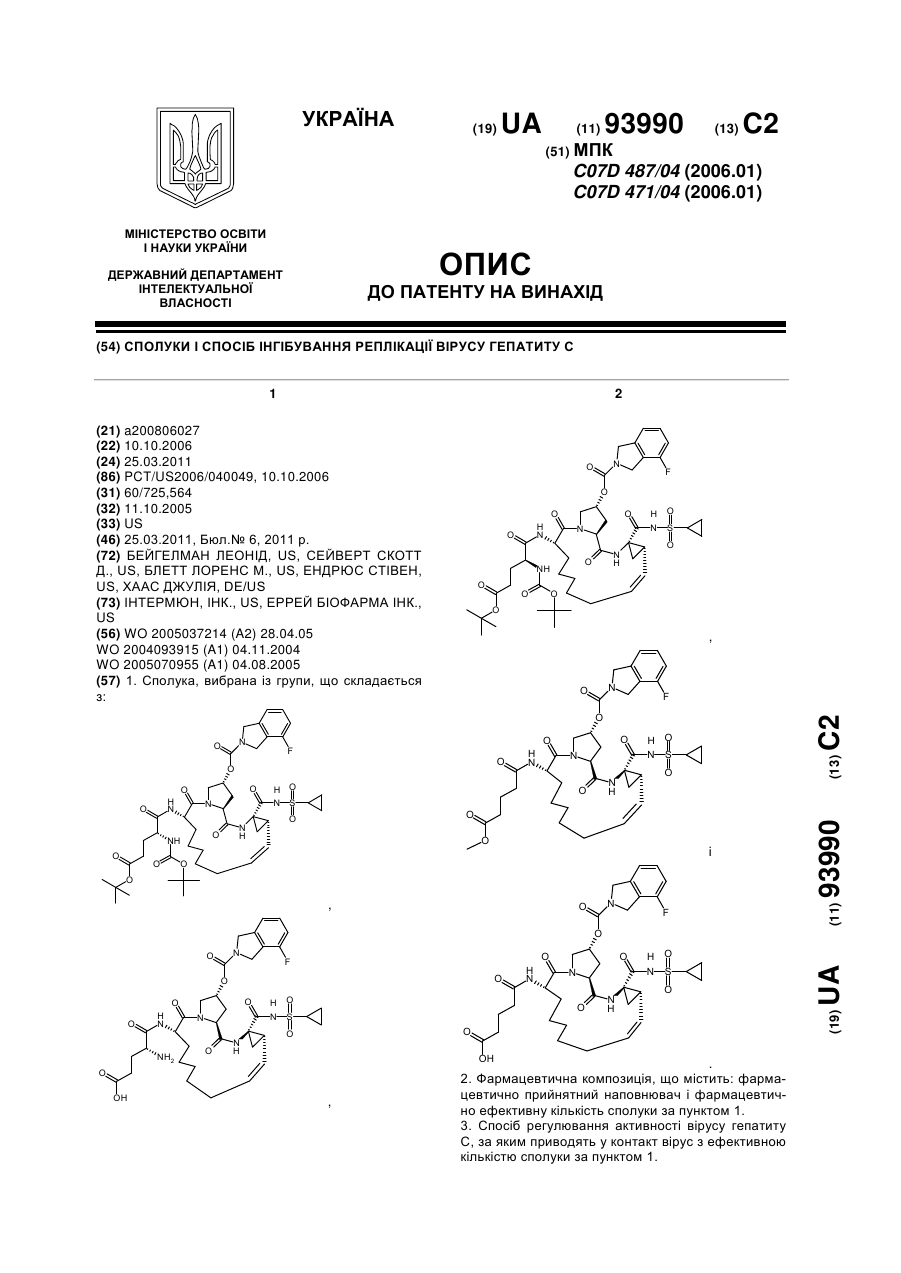
1. Сполука, вибрана із групи, що складається з:
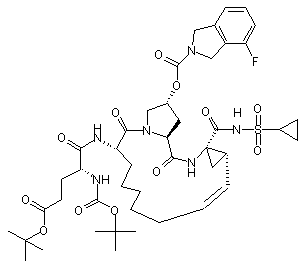 ,
, 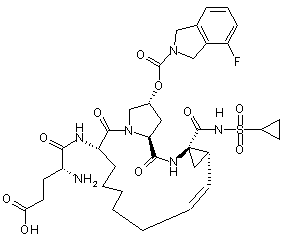 ,
, 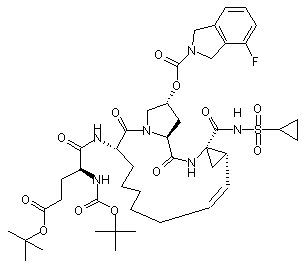 ,
, 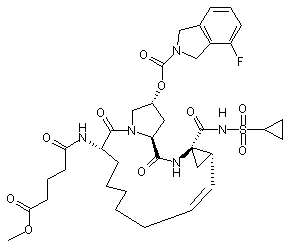 і
і 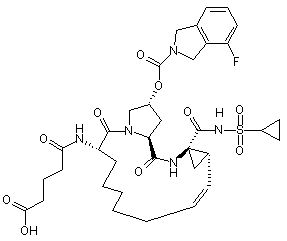 .
.
2. Фармацевтична композиція, що містить: фармацевтично прийнятний наповнювач і фармацевтично ефективну кількість сполуки за пунктом 1.
3. Спосіб регулювання активності вірусу гепатиту С, за яким приводять у контакт вірус з ефективною кількістю сполуки за пунктом 1.
4. Спосіб за пунктом 3, за яким сполукою модулюють NS3 протеазу.
5. Спосіб за пунктом 4, за яким сполукою інгібують NS3 протеазу.
6. Спосіб за пунктом 3, за яким сполукою модулюють NS3 геліказу.
7. Спосіб за пунктом 6, за яким сполукою інгібують NS3 геліказу.
8. Спосіб за пунктом 3, за яким сполукою модулюють NS3 протеазу і NS3 геліказу.
9. Спосіб за пунктом 8, за яким сполукою інгібують NS3 протеазу і NS3 геліказу.
10. Спосіб регулювання активності вірусу гепатиту С, заяким приводять у контакт вірус з ефективною кількістю фармацевтичної композиції за пунктом 2.
11. Спосіб за пунктом 10, за яким фармацевтичною композицією модулюють NS3 протеазу.
12. Спосіб за пунктом 11, за яким фармацевтичною композицією інгібують NS3 протеазу.
13. Спосіб за пунктом 10, за яким фармацевтичною композицією модулюють NS3 геліказу.
14. Спосіб за пунктом 13, за яким фармацевтичною композицією інгібують NS3 геліказу.
15. Спосіб за пунктом 10, за яким фармацевтичною композицією модулюють NS3 протеазу і NS3 геліказу.
16. Спосіб за пунктом 15, за яким фармацевтичною композицією інгібують NS3 протеазу і NS3 геліказу.
17. Спосіб лікування ссавця, за яким виявляють ссавця, зараженого вірусом гепатиту С, і вводять цьому ссавцю ефективну кількість сполуки за пунктом 1.
18. Спосіб за пунктом 17, який включає виявлення сполуки як інгібітора і протеази NS3, і гелікази NS3.
19. Спосіб лікування ссавця, за яким виявляють ссавця, зараженого вірусом гепатиту С, і вводять цьому ссавцю ефективну кількість фармацевтичної композиції за пунктом 2.
20. Спосіб за пунктом 19, який включає виявлення сполуки у фармацевтичній композиції як інгібітора і протеази NS3, і гелікази NS3.
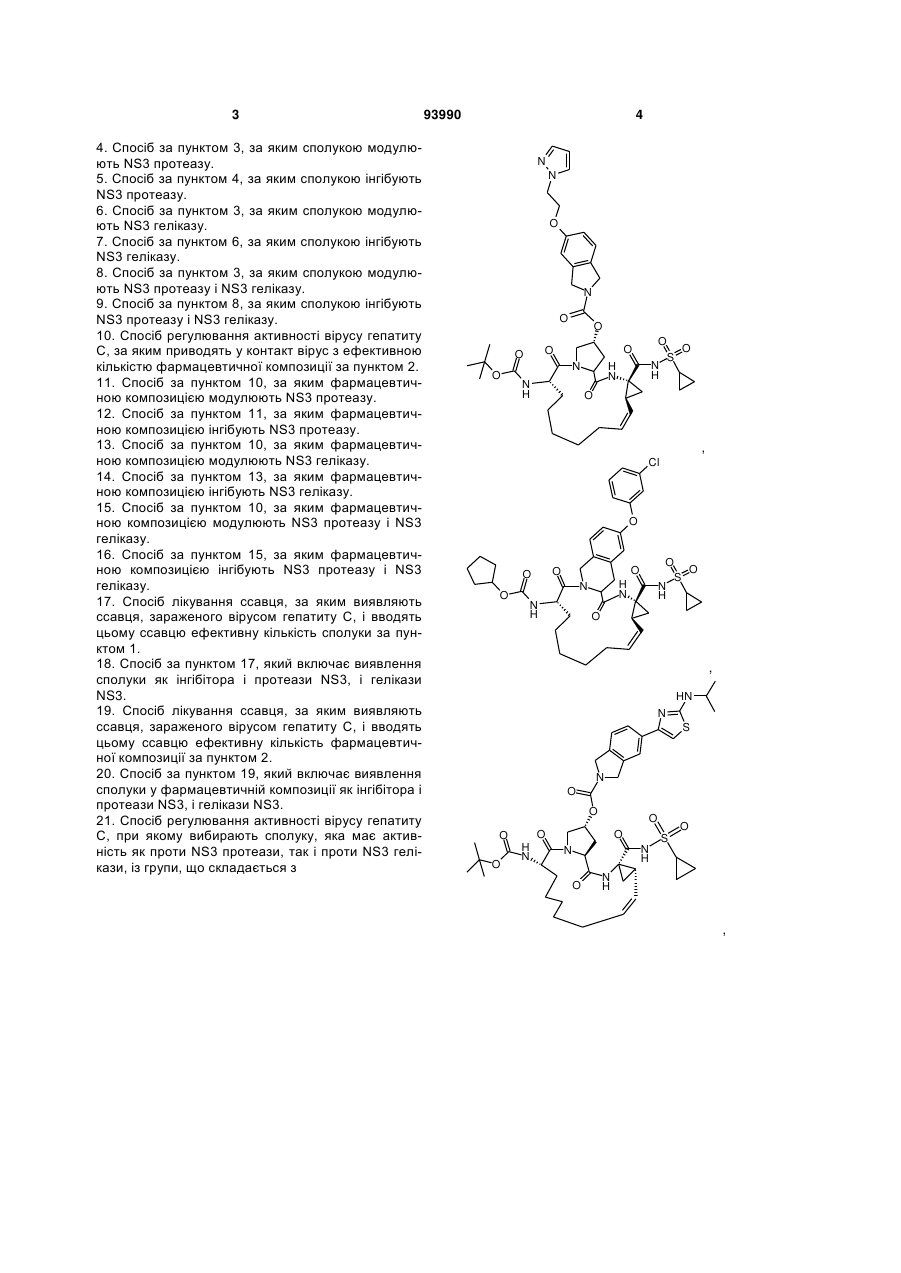
21. Спосіб регулювання активності вірусу гепатиту С, при якому вибирають сполуку, яка має активність як проти NS3 протеази, так і проти NS3 гелікази, із групи, що складається з
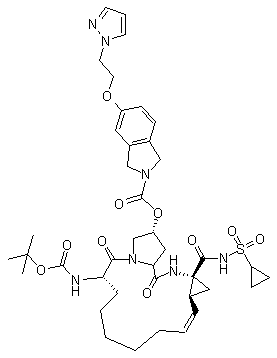 ,
, 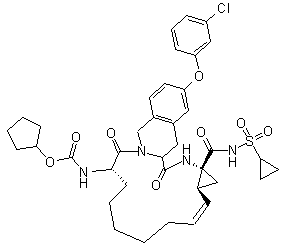 ,
, 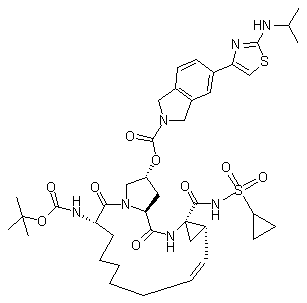 ,
, 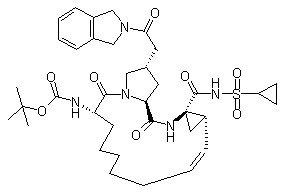 і
і 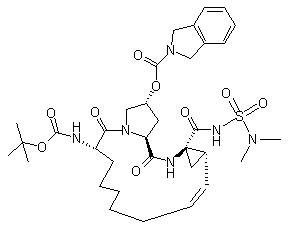 ;
;
і вірус гепатиту С приводять у контакт із сполукою у кількості, ефективній для регулювання як активності NS3 протеази, так і активності NS3 гелікази.
22. Спосіб за пунктом 21, за яким кількість сполуки вибирають ефективною як для інгібування активності NS3 протеази, так і для інгібування активності NS3 гелікази.
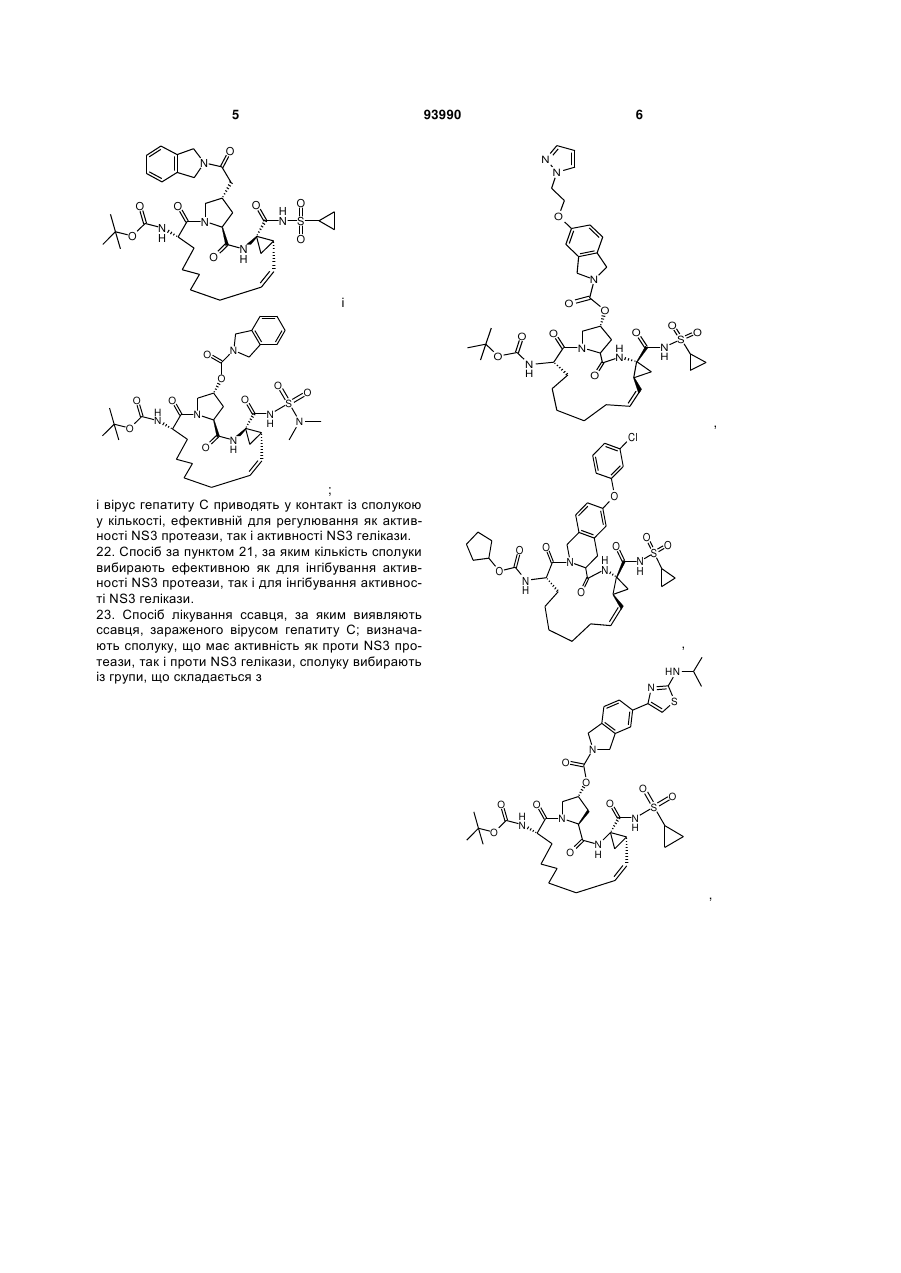
23. Спосіб лікування ссавця, за яким виявляють ссавця, зараженого вірусом гепатиту С; визначають сполуку, що має активність як проти NS3 протеази, так і проти NS3 гелікази, сполуку вибирають із групи, що складається з
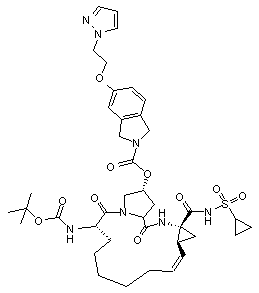 ,
, 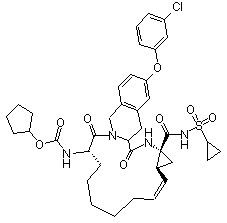 ,
,  ,
,  і
і  ;
;
і вводять ефективну кількість цієї сполуки ссавцеві.
24. Спосіб за пунктом 23, за яким кількість сполуки вибирають ефективною як для інгібування активності NS3 протеази, так і для інгібування активності NS3 гелікази.
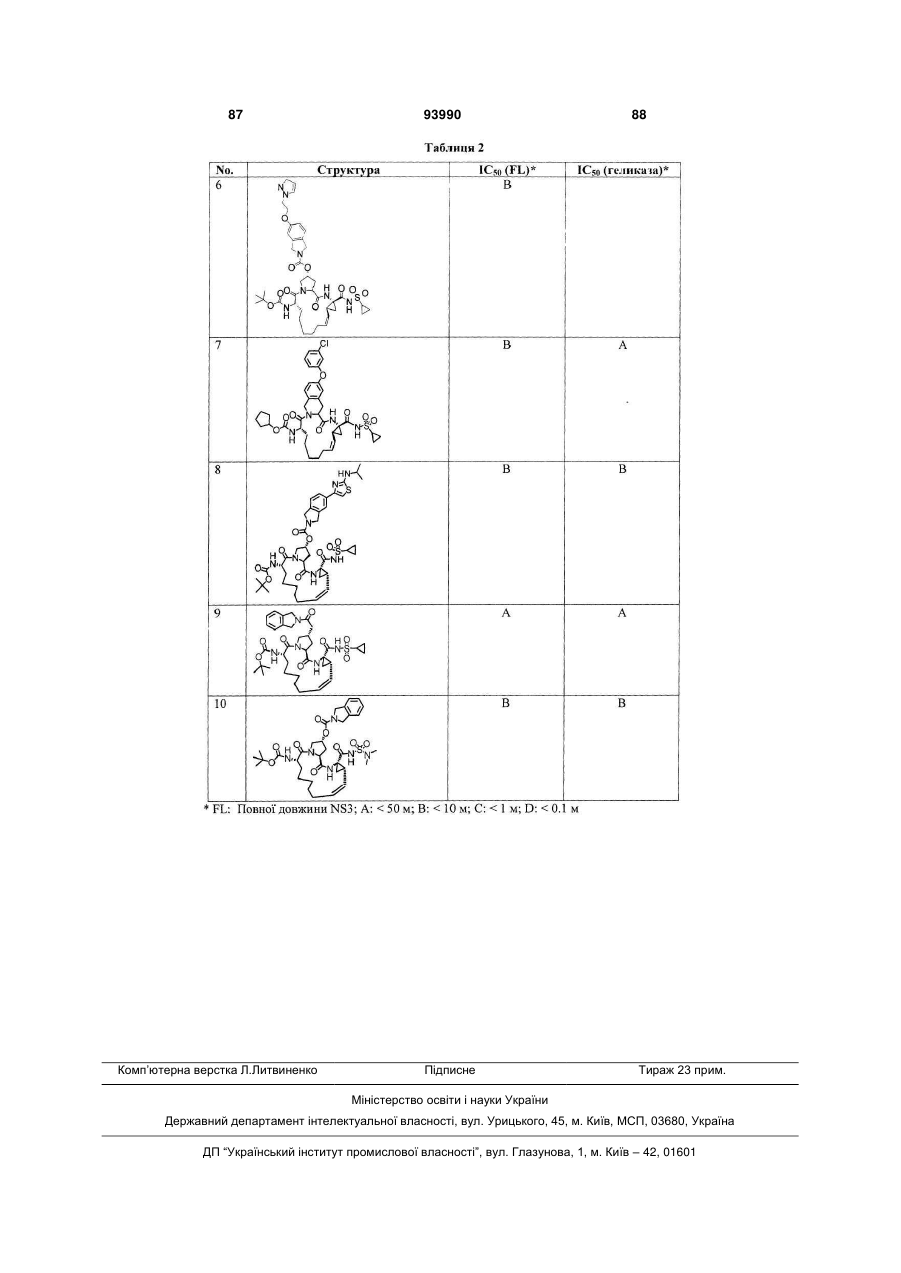
Текст
1. Сполука, вибрана із групи, що складається з: N O F O O O H N O N NH O O N H O H O N S O O O , N F O H N O N NH O O N H O H N N H O N S O N H O H O N S (13) O O O O O F O O O і O O , N O F 93990 N O C2 O (11) O O O O H N NH2 N O N H H O N S N O N H H O N S O O O OH O OH H N , . 2. Фармацевтична композиція, що містить: фармацевтично прийнятний наповнювач і фармацевтично ефективну кількість сполуки за пунктом 1. 3. Спосіб регулювання активності вірусу гепатиту С, за яким приводять у контакт вірус з ефективною кількістю сполуки за пунктом 1. (19) F O O O O UA O N O 3 4. Спосіб за пунктом 3, за яким сполукою модулюють NS3 протеазу. 5. Спосіб за пунктом 4, за яким сполукою інгібують NS3 протеазу. 6. Спосіб за пунктом 3, за яким сполукою модулюють NS3 геліказу. 7. Спосіб за пунктом 6, за яким сполукою інгібують NS3 геліказу. 8. Спосіб за пунктом 3, за яким сполукою модулюють NS3 протеазу і NS3 геліказу. 9. Спосіб за пунктом 8, за яким сполукою інгібують NS3 протеазу і NS3 геліказу. 10. Спосіб регулювання активності вірусу гепатиту С, за яким приводять у контакт вірус з ефективною кількістю фармацевтичної композиції за пунктом 2. 11. Спосіб за пунктом 10, за яким фармацевтичною композицією модулюють NS3 протеазу. 12. Спосіб за пунктом 11, за яким фармацевтичною композицією інгібують NS3 протеазу. 13. Спосіб за пунктом 10, за яким фармацевтичною композицією модулюють NS3 геліказу. 14. Спосіб за пунктом 13, за яким фармацевтичною композицією інгібують NS3 геліказу. 15. Спосіб за пунктом 10, за яким фармацевтичною композицією модулюють NS3 протеазу і NS3 геліказу. 16. Спосіб за пунктом 15, за яким фармацевтичною композицією інгібують NS3 протеазу і NS3 геліказу. 17. Спосіб лікування ссавця, за яким виявляють ссавця, зараженого вірусом гепатиту С, і вводять цьому ссавцю ефективну кількість сполуки за пунктом 1. 18. Спосіб за пунктом 17, який включає виявлення сполуки як інгібітора і протеази NS3, і гелікази NS3. 19. Спосіб лікування ссавця, за яким виявляють ссавця, зараженого вірусом гепатиту С, і вводять цьому ссавцю ефективну кількість фармацевтичної композиції за пунктом 2. 20. Спосіб за пунктом 19, який включає виявлення сполуки у фармацевтичній композиції як інгібітора і протеази NS3, і гелікази NS3. 21. Спосіб регулювання активності вірусу гепатиту С, при якому вибирають сполуку, яка має активність як проти NS3 протеази, так і проти NS3 гелікази, із групи, що складається з 93990 4 N N O N O O O S N H O O O O O N N H H N O , Cl O O O O S N H O O O H N N N H O , HN N S N O O O O O O O H N O S N H N O N H , 5 93990 6 O N N O H N S O O O O N N N H O N H O O N і O O N O O O O O O H N O N H H N O O S N H N O O S N H O N O O O O , N Cl N H ; і вірус гепатиту С приводять у контакт із сполукою у кількості, ефективній для регулювання як активності NS3 протеази, так і активності NS3 гелікази. 22. Спосіб за пунктом 21, за яким кількість сполуки вибирають ефективною як для інгібування активності NS3 протеази, так і для інгібування активності NS3 гелікази. 23. Спосіб лікування ссавця, за яким виявляють ссавця, зараженого вірусом гепатиту С; визначають сполуку, що має активність як проти NS3 протеази, так і проти NS3 гелікази, сполуку вибирають із групи, що складається з O O O O O H N N N H O O S N H O , HN N S N O O O O O O O H N O S N H N O N H , 7 93990 8 O N N O O O O O N H N O N H O H N S O O O O O O O H N N H N O O S N N H і ; і вводять ефективну кількість цієї сполуки ссавцеві. 24. Спосіб за пунктом 23, за яким кількість сполуки вибирають ефективною як для інгібування активності NS3 протеази, так і для інгібування активності NS3 гелікази. Споріднена заявка. [0001] Ця заявка має пріоритет за Попередньою заявкою на патент США № 60/725,564, поданою 11 жовтня 2005 р., що наводиться тут для посилання у всій її цілісності. Область застосування винаходу. Область техніки, до якої відноситься винахід. [0002] Даний винахід відноситься до сполук, способів їхнього синтезу, композицій і способів лікування інфекції вірусу гепатиту С (ВГС). Опис рівня техніки. [0003] Вірус гепатиту С (ВГС) є найпоширенішою у США хронічною інфекцією, що передається через кров. Хоча число нових заражень знизилося, кількість хронічних хворих є значною, і за даними Центрів з контролю й профілактики захворювань у США нараховується приблизно 3.9 мільйонів (1.8%) заражених людей. Хронічне захворювання печінки є десятим в списку лідируючих причин смертності серед дорослих у США і нараховує приблизно 25000 смертей щорічно, або приблизно, 1% від всіх смертей. Дослідження показують, що 40% хронічних захворювань печінки пов'язані з вірусом гепатиту С, в результаті виходить приблизно 8000-10000 смертей щороку. Пов'язана з вірусом гепатиту С кінцева стадія захворювання печінки є найчастішою причиною пересадження печінки серед дорослих. [0004] Антивірусна терапія хронічного гепатиту С динамічно розвивалася за останню декаду зі значними поліпшеннями, які спостерігалися в ефективності лікування. Проте, навіть при комбінованому лікуванні, використовуючи пегільований IFN- (інтерферон-) плюс рибавірин, у 40% - 50% пацієнтів лікування не вдавалося, тобто пацієнти демонстрували або відсутність лікувального ефекту або рецидив захворювання. Звичайно для таких пацієнтів була відсутня ефективна альтернатива лікування. Зокрема, пацієнти із запущеним фіброзом або цирозом печінки, що виявляється при біопсії, мають значний ризик розвитку ускладнень запущених захворювань печінки, включаючи ас цит, жовтяницю, варикозну кровотечу, енцефалопатію і прогресуюче порушення роботи печінки, також помітно зростає ризик гепатоцелюлярної карціноми. [0005] Широка поширеність хронічної форми вірусної інфекції гепатиту С несе серйозні наслідки для суспільної охорони здоров'я, у вигляді тягаря хронічних захворювань печінки в США. Дані, отримані від Національної Дослідницької Служби по Здоров'ю й Харчуванню (NHANES III) вказують, що значне збільшення числа заражень припало на кінець 60-х - початок 80 років, особливо серед людей у віці від 20 до 40 років. Приблизно підраховано, що кількість людей із затяжною формою ГС вірусної інфекції 20 років і більше може збільшитися в чотири рази за проміжок часу з 1990 по 2015 роки з 750,000 до понад 3 мільйонів. Пропорційне збільшення числа людей, заражених протягом 30 або 40 років, могло бути навіть більше. Оскільки ризик хронічних захворювань печінки, пов'язаних із ВГС, має відношення до тривалості зараження, ризик цирозу поступово збільшується для людей, заражених більш ніж 20 років, це приведе в результаті до значного збільшення захворювань, пов'язаних із цирозом і смертності серед пацієнтів, заражених між 1965-1985 роками. [0006] ВГС являє собою вірус сімейства флавівірусів з лінійною молекулою РНК позитивної полярності. Геном ВГС представлений однонитковою молекулою РНК довжиною близько 9500 нуклеотидів і містить єдину відкриту рамку зчитування (ORF), що несе інформацію про єдиний великий вірусспецифічний поліпротеїн, розміром близько 3000 амінокислотних залишків. В заражених клітинах, цей поліпротеїн розщеплюється на численні ділянки клітинними й вірусними протеазами з одержанням структурних і неструктурних (NS) протеїнів вірусу. У випадку ВГС утворення зрілих неструктурних протеїнів (NS2, NS3, NS4, NS4A, NS4B, NS5A і NS5B) здійснюється двома вірусними протеазами. Перша вірусна протеаза розщеплює зв'язок NS2-NS3 поліпротеїнів. Друга вірусна протеаза 9 це серинова протеаза, що містить N-кінцеву ділянку NS3 (далі поіменована як "NS3 протеаза"). NS3 протеаза є медіатором всіх наступних розщеплень на ділянках нижче положення NS3 у поліпротеїні (тобто, ділянках, розташованих між С-закінченням NS3 і С-закінченням поліпротеїну). NS3 протеаза проявляє активність як у цис положенні при розщепленні ділянки NS3-NS4, так і в транс для інших NS4A-NS4B, NS4B-NS5A, і NS5A-NS5B ділянок. Вважається, що білок NS4A, є багатофункціональним поліпротеїном і сприяє активності NS3 протеази і можливо бере участь у мембранній локалізації NS3 і інших вірусних репліказних компонентів. Очевидно, утворення комплексу між NS3 і NS4A необхідно для процесів, які медіірує NS3, і поліпшує протеолітичну ефективність на всіх ділянках, які розпізнає NS3. Протеаза NS3 також проявляє нуклеозид трифосфатазну і РНК геліказну активність. NS5B являє собою РНК-залежну РНК полімеразу, залучену в реплікацію РНК ВГС. Література [0007] METAVIR (1994) Hepatology 20: 15-20; Brunt (2000) Hepatol. 31:241-246; Alpini (1997) J. Hepatol. 27:371-380; Baroni et al. (1996) Hepatol. 23:1189-1199; Czaja et al. (1989) Hepatol. 10: 795800; Grossmanetal. (1998) J. Gastroenterol Hepatol. 13:1058-1060; Rockey and Chung (1994) J. Invest. Med. 42: 660-670; Sakaida et al. (1998) J. Hepatol. 28:471-479; Shi et al. (1997) Proc. Natl. Acad. Sci. USA 94: 10663-10668; Baroni et al. (1999) Liver 19 : 212-219; Lortat-Jacob et al. (1997) J. Hepatol. 26: 894-903; Llorent et al. (1996) J. Hepatol. 24: 555-563; U. S. Patent No. 5,082, 659; Європейська Патентна Заявка ЄР 294,160; Патент США № 4,806, 347; Balish et al. (1992) J. Infect. Diseases 166: 14011403; Katayama et al. (2001) J. Viral Hepatitis 8: 180185; Патент США № 5,082, 659; Патент США № 5,190, 751; Патент США № 4,806, 347; Wandl et al. (1992) Br. J. Haematol. 81:516-519; Європейська Патентна Заявка № 294,160; Патент Канади № 1,321, 348; Європейська Патентна Заявка № 276,120; Wandl et al. (1992) Sem. Oncol. 19: 88-94; Balish et al. (1992) J. Infectious Diseases 166: 1401 93990 10 1403; Van Dijk et al. (1994) Int. J. Cancer 56: 262268; Sundmacher et al. (1987) Current Eye Res. 6: 273-276; Патенти США № 6,172,046; 6,245,740; 5,824,784; 5,372,808; 5,980,884; опубліковані міжнародні патентні заявки WO 96/21468; WO 96/11953; WO 00/59929; WO 00/66623; W02003/064416; W02003/064455; W02003/064456; WO 97/06804; WO 98/17679; WO 98/22496; WO 97/43310; WO 98/46597; WO 98/46630; WO 99/07733 ; WO 99/07734, WO 00/09543; WO 00/09558; WO 99/38888; WO 99/64442; WO 99/50230; WO 95/33764; Torre et al. (2001) J. Med. Virol. 64: 455-459; Bekkering et al. (2001) J. Hepatol. 34: 435-440; Zeuzem et al. (2001) Gastroenterol. 120:1438-1447; Zeuzem (1999) R. Hepatol. 31: 6164; Keeffe і Hollinger (1997) Hepatol. 26: 101S-107S; Wills (1990) Clin. Pharmacokinet. 19: 390-399; Heathcote et al. (2000) New Engl. J Med. 343: 16731680; Husa і Husova (2001) Bratisl. Let Listy 102: 248-252; Glue et al. (2000) Clin. Pharmacol 68:556567; Bailon et al. (2001) Bioconj. Chem. 12: 195-202; і Neumann et al. (2001) Science 282:103; Zalipsky (1995) Adv. Drug Delivery Reviews S. 16,157-182; Mann et al. (2001) Lancet 358: 958-965; Zeuzem et al. (2000) New Engl. R Med. 343: 1666-1672; Патенти США № 5,633,388; 5,866,684; 6,018,020; 5,869,253; 6,608,027; 5,985, 265; 5,908, 121; 6,177,074; 5,985,263; 5,711,944; 5,382,657; і 5,908,121; Osborn et al. (2002) J. Pharmacol. Exp. Therap. 303: 540-548; Sheppard et al. (2003) Nat. Immunol. 4: 63-68; Chang et al. (1999) Nat. Biotechnol. 17: 793-797; Adolf (1995) Multiple Sclerosis 1 Suppl. 1: S44-S47; Chu et al., Tet Lett. (1996), 7229-7232; Дев'ята Конференція з Антивірусних Досліджень (Ninth Conference on Antiviral Research), Урабандай, Фукішіма, Японія (1996) (Antiviral Research, (1996), 30:1, A23 (реферат 19)); Steinkuhler et al., Biochem., 37: 8899-8905; Ingallinella et al., Biochem., 37: 8906-8914. Короткий опис винаходу. [0008] Перший варіант здійснення винаходу забезпечує сполуку, обрану із групи, яка складається з: 11 93990 12 [0009] Другий варіант здійснення винаходу забезпечує фармацевтичну композицію, що містить фармацевтично прийнятний носій; і фармацевтично ефективну кількість сполуки, зазначеної в першому варіанті здійснення винаходу. [0010] Третій варіант здійснення винаходу забезпечує спосіб регулювання активності вірусу гепатиту С, що включає контактування цього вірусу з ефективною кількістю сполуки по першому варіанту здійснення винаходу або фармацевтичною композицією по другому варіанту здійснення винаходу. [0011] Четвертий варіант здійснення винаходу забезпечує спосіб лікування ссавця, що включає виявлення ссавця, зараженого вірусом гепатиту С; і введення цьому ссавцеві ефективної кількості сполуки по першому варіанту здійснення винаходу або фармацевтичної композиції по другому варіанту здійснення винаходу. [0012] П'ятий варіант здійснення винаходу забезпечує спосіб регулювання активності вірусу гепатиту С, що включає [0013] вибір сполуки, що володіє активністю як проти NS3 протеази, так і проти NS3 гелікази, де сполуки вибирають із групи, що складається з: [0014] контактування сполуки з вірусом гепатиту С у кількості, ефективній для регулювання активності як NS3 протеази, так і NS3 гелікази. [0015] Шостий варіант здійснення винаходу забезпечує спосіб лікування ссавця, що включає: [0016] виявлення ссавця, зараженого вірусом гепатиту С; [0017] визначення сполуки, що володіє активністю як проти NS3 протеази, так і проти NS3 гелікази, де сполуки вибирають із групи, що складається з: 13 [0018] введення ссавцеві ефективної кількості цієї сполуки. [0019] Ці й інші варіанти здійснення винаходу, як описано в деталях нижче. Детальний опис кращих варіантів здійснення винаходу. Визначення. [0020] Термін «печіночний фіброз», який використовується тут, застосований по черзі з терміном «фіброз печінки», відноситься до росту рубцевої тканини в печінці, що відбувається при хронічній формі вірусної інфекції гепатиту. [0021] Терміни «індивід», «організм-носій вірусу», «суб'єкт» і «пацієнт» є взаємозамінними і відносяться до ссавців, включаючи, але, не обмежуючись приматами, включаючи мавп і людину. [0022] Термін «функція печінки», який використовується тут, відноситься до нормальної функції печінки, включаючи, але, не обмежуючись, синтетичною функцією, включаючи, але, не обмежуючись, синтезом протеїнів, таких як сироваткові протеїни (наприклад, альбумін, фактори згортання крові, лужна фосфатаза, амінотрансферази (наприклад, аланінова трансаміназа, аспартамова трансаміназа), 5'-нуклеозидаза, -глютамінілтранспептидаза і так далі), синтез білірубіна, синтез холестерину і синтез жовчних кислот; метаболічна функція печінки, включаючи, але, не обмежуючись, метаболізмом вуглеводів, метаболізмом амінокислот і аміаку, гормональним метаболізмом і ліпідним метаболізмом; детоксифікація екзогенних лікарських засобів; гемодинамічна функція, включаючи внутрішньостну і портальну динаміку кровообігу; тощо. [0023] Термін «тривала вірусна відповідь» (SVR; також іменований як «тривала відповідь» або «довга відповідь»), який використовується тут, відноситься до відповіді пацієнта на програму лікування вірусної інфекції гепатиту С, виходячи з титру ВГС у сироватці. Як правило, «тривала вірусна відповідь» відноситься до відсутності (не виявленню) РНК ВГС (наприклад, менше, ніж 500, 93990 14 менше ніж 200 або менше, ніж 100 геномних копій на мілілітр сироватки) у сироватці пацієнта за період, протягом, принаймні, одного місяця, принаймні, двох місяців, принаймні, трьох місяців, принаймні, чотирьох місяців, принаймні, п'яти місяців, принаймні, шести місяців слідом за припиненням лікування. [0024] Термін "пацієнти, що не піддаються лікуванню", який використовується тут, відноситься звичайно до пацієнтів, заражених ВГС, у яких відсутній лікувальний ефект після попередньої терапії ВГС (поіменовані як «пацієнти з відсутністю лікувального ефекту») або які спочатку відповідали на проведене лікування, але в яких лікувальний ефект не зберігається (поіменовані як «пацієнти з рецидивом захворювання»). Звичайно попередня терапія може включати монотерапію IFN- або комбіновану терапію IFN- і яким-небудь антивірусним агентом, наприклад IFN- і рибавірином. [0025] Терміни «лікування» і «терапія», які використовуються тут, відносяться до одержання бажаного фармакологічного і/або фізіологічного ефекту. Ефект може бути профілактичним, виходячи з повністю або частково відверненого захворювання або його симптомів, і/або може бути терапевтичним, виходячи із часткового або повного рятування від захворювання, і/або несприятливого ушкодження, властивого даному захворюванню. «Лікування», яке використовуються тут, охоплює будь-яке лікування захворювання у ссавця, а саме у людини, і включає (а) запобігання захворюванню пацієнта, що може бути схильний до захворювання, але при діагностиці виявлено, що захворювання відсутнє; (b) придушення захворювання, тобто зупинка його розвитку; і (с) звільнення від захворювання, тобто регресія захворювання. [0026] Терміни «індивід», «організм-носій вірусу», «суб'єкт» і «пацієнт» є взаємозамінними і відносяться до ссавців, включаючи, але, не обмежуючись мишами, мавпами, людиною, ссавцями тваринами фермерських і мисливських господарств і домашніми ссавцевими тваринами. 15 [0027] «Агоніст рецептора інтерферону І типу», який використовується тут, відноситься до будьякого ліганду людського рецептора інтерферону І типу природного походження або не природного походження, що зв'язує й викликає сигнальну трансдукцію через рецептор. Агоністи рецепторів інтерферону І типу включають інтерферони, що охоплюють інтерферони природного походження, модифіковані інтерферони, синтетичні інтерферони, гетерологічні інтерферони, змішані інтерферони; антитіла, специфічні до інтерферонових рецепторів; непептидні хімічні агоністи; тощо. [0028] Термін «агоніст рецептора інтерферону II типу», який використовується тут, відноситься до будь-якого ліганду людського рецептора інтерферону II типу природного походження або не природного походження, що зв'язує й викликає сигнальну трансдукцію через рецептор. Агоністи рецепторів інтерферону II типу включають природний людський інтерферон-, представників рекомбінантного IFN-, представників глікозилірованого IFN-, представників IFN-, пегільованого з модифікованими або зміненими представниками IFN-, гібридні білки, агоністи антитіл, специфічних до рецепторів, непептидні агоністи, тощо. [0029] Термін «агоніст рецептора інтерферону III типу», який використовується тут, відноситься до будь-якого ліганду людського IL-28 рецептора («IL-28R») природного походження або не природного походження, амінокислотна послідовність якого описана в Sheppard і ін., вище, і який зв'язує й викликає сигнальну трансдукцію через рецептор. [0030] Термін «агоністи рецепторів інтерферону», який використовується тут, відноситься до кожного з агоністів рецептора інтерферону І типу, агоністів рецептора інтерферону II типу або агоністів рецептора інтерферону III типу. [0031] Термін «дозоване введення», який використовується тут, відноситься до введення антивірусного агенту пацієнтові, який потребує цього, де введення може включати одну або більше доз антивірусного агенту із пристрою введення лікарських засобів. Таким чином, термін «дозоване введення», включає, але не обмежується, установкою тривалої системи введення (наприклад, насос або інший керований пристрій для ін'єкцій); однократну підшкірну ін'єкцію слідом за установкою системи для тривалого введення. [0032] «Безперервна доставка», яка використовується тут, (наприклад, у наступному контексті «безперервна доставка сполуки до тканини») означає просування лікарського засобу до місця доставки, наприклад, до тканини деяким способом, що забезпечить доставку бажаної кількості речовини до тканини за обраний проміжок часу, де приблизно ту ж саму кількість лікарського засобу одержує пацієнт щохвилини протягом обраного проміжку часу. [0033] «Контрольоване вивільнення», яке використовується тут, (наприклад, у наступному контексті «контрольоване вивільнення лікарського засобу») включає вивільнення сполуки (наприклад, агоністу рецептора інтерферону І типу або II типу, наприклад IFN-) з обраною або іншим способом контрольованою швидкістю, інтервалом 93990 16 і/або кількістю, на яку в значній мірі не впливають умови застосування. «Контрольоване вивільнення» таким чином, охоплює, але не обов'язково обмежується в основному безперервною доставкою і систематичною доставкою (наприклад, переривчастою доставкою за період часу, що порушується регулярними або нерегулярними тимчасовими інтервалами). [0034] «Систематична» або «тимчасова» доставка, яка використовується в контексті доставки лікарських засобів, означає доставку лікарського засобу систематично, особливо за регулярною схемою, за попередньо обраний відрізок часу (наприклад, інший, ніж період, пов'язаний з ін'єкцією ударної дози речовини). «Систематична» або «тимчасова» доставка лікарського засобу включає доставку лікарського засобу при зростаючій, зменшуваній, постійній або пульсуючій швидкості або діапазоні швидкостей (наприклад, кількість лікарського засобу за одиницю часу або обсяг лікарської форми за одиницю часу) і також включає доставку, що є безперервною або в значній мірі безперервною або постійною. [0035] Термін «пристрій для контрольованої доставки лікарського засобу» охоплює будь-який пристрій, де вивільнення (наприклад, швидкість, час вивільнення) лікарського засобу або іншої бажаної субстанції, що втримується в ньому, контролюється за допомогою або визначається самим пристроєм, і не піддається впливу навколишніх умов використання або де вивільнення відбувається при швидкості, що є відтвореною в навколишніх умовах використання. [0036] «Постійний у значній мірі», використовується тут у наступному контексті: «постійне в значній мірі вливання» або «постійна в значній мірі доставка» відноситься до доставки ліків способом, що не переривається протягом попередньо обраного тимчасового інтервалу, де кількість ліків, отриманих пацієнтом протягом будь-якого 8 годинного інтервалу в попередньо обраному періоді дії, ніколи не впаде до нуля. Більше того, «постійна в значній мірі» доставка може також охоплювати доставку ліків при постійній, попередньо обраній швидкості, або діапазоні швидкостей (наприклад, кількість ліків за одиницю часу або обсяг лікарської форми за одиницю часу), що не порушується протягом попередньо обраного періоду доставки ліків. [0037] «Стан, стійкий в значній мірі», який використовується тут, у контексті якого-небудь біологічного параметру, що може змінюватися, як функція від часу, означає, що цей біологічний параметр має постійне значення протягом проміжку часу, такого, що область під кривою, обумовлена значеннями біологічного параметру як функції від часу протягом будь-якого 8 годинного інтервалу в період дії (АUС8год.), не більше ніж на 20% більше або на 20% менше або переважно не більше ніж на 15% більше або на 15% менше і більш переважно не більше ніж на 10% більше або на 10% менше середньої області під кривою біологічного параметру за 8 годинний проміжок протягом періоду дії (АUС8год. середня). АUС8год. середня визначається як частка (q) від області під кривою 17 біологічного параметру за повний час дії (AUC загальна) розділена на кількість 8 годинних інтервалів за період дії (число/3дні), тобто, q = (AUC загальна)/ (число/3дні). Наприклад, концентрація в сироватці лікарського засобу зберігається в стійкому стані, протягом періоду дії ліків, коли область під кривою концентрації лікарського засобу в сироватці протягом будь-якого 8 годинного інтервалу за час дії (АUС8год.) не більше ніж на 20% більше або на 20% менше середньої області під кривою концентрації лікарського засобу в сироватці за будь-який 8 годинний інтервал під час дії (АUС8год. середня), тобто АUС8год. не більше ніж на 20% більше або на 20% менше АUС8год. середньої для концентрації лікарського засобу в сироватці за час дії ліків. [0038] Термін «алкіл», який використовується тут, відноситься до одновалентного радикалу із прямим або розгалуженим ланцюгом, що містить від одного до двадцяти атомів вуглецю, включаючи, але, не обмежуючись, метилом, етилом, nпропілом, ізопропілом, n-бутилом, ізобутилом, трет-бутилом, n-гексилом тощо. [0039] Термін «галоген», який використовується тут, відноситься до фтору, хлору, брому або йоду. [0040] Термін «алкокси», який використовується тут, відноситься до алкільного радикалу із прямим або розгалуженим ланцюгом, ковалентно пов'язаному з основною молекулою через -Озв'язок. Приклади алкокси включають, але не обмежуються, метокси, етокси, пропокси, ізопропокси, бутокси, n-бутокси, sec-бутокси, t-бутокси тощо. [0041] Термін «алкеніл», який використовується тут, відноситься до одновалентного радикалу із прямим або розгалуженим ланцюгом, що містить від двох до двадцяти атомів вуглецю і подвійний вуглецевий зв'язок, включаючи, але, не обмежуючись, 1-пропеніл, 2-пропеніл, 2-метил-1-пропеніл, 1-бутеніл, 2-бутеніл тощо. [0042] Термін «алкініл», який використовується тут, відноситься до одновалентного радикалу із прямим або розгалуженим ланцюгом, що містить від двох до двадцяти атомів вуглецю і потрійний вуглецевий зв'язок, включаючи, але, не обмежуючись, 1-пропеніл, 1-бутиніл, 2-бутиніл тощо. [0043] Термін «арил», який використовується тут, відноситься до гомоциклічного ароматичного радикалу, що є конденсованим або не конденсованим. Приклади арильних груп включають, але не обмежуються, фенілом, нафтилом, біфенілом, фенантренілом, нафтаценілом тощо. [0044] Термін «циклоалкил», який використовується тут, відноситься до насиченого аліфатичного кільця, що містить від трьох до двадцяти атомів вуглецю, включаючи, але, не обмежуючись, циклопропілом, циклопентилом, циклогексилом, циклогептилом тощо. [0045] Термін «циклоалкеніл», який використовується тут, відноситься до радикалу аліфатичної кільцевої системи, що містить від трьох до двадцяти атомів вуглецю, що має, принаймні, один подвійний вуглець-вуглецевий зв'язок у кільці. Приклади циклоалкенільних груп включають, але, 93990 18 не обмежуються, циклопропенілом, циклопентенілом, циклогексенілом, циклогептенілом тощо. [0046] Термін «поліциклоалкіл», який використовується тут. відноситься до радикалу насиченої аліфатичної кільцевої системи, що має, принаймні, два кільця, які є конденсованими з або без місточкових вуглеців. Приклади поліциклоалкіл груп включають, але не обмежуються, біцикло[4.4.0]деканіл, біцикло[2.2.1]гептаніл, адамантил, норборніл тощо. [0047] Термін «поліциклоалкеніл», який використовується тут, відноситься до радикалу аліфатичної кільцевої системи, що має, принаймні, два кільця, які є конденсованими з або без місточкових вуглеців, у яких, принаймні, одне кільце містить подвійний вуглець-вуглецевий зв'язок. Приклади поліциклоалкенільних груп включають, але не обмежуються, норборніленілом, 1,1'біциклопентенілом тощо. [0048] Термін «поліциклічний вуглеводень», який використовується тут, відноситься до радикалу кільцевої системи, де всі з членів кільця є атомами вуглецю. Поліциклічні вуглеводні можуть бути ароматичними або можуть містити менше, ніж максимальну кількість некумулятивних подвійних зв'язків. Приклади поліциклічних вуглеводнів включають, але не обмежуються, нафтолом, дигідронафтилом, інденілом, флуоренілом тощо. [0049] Термін «гетероциклічний» або «гетероцикліл», який використовується тут, відноситься до радикалу циклічної кільцевої системи, що має, принаймні, одну кільцеву систему, де один або більше атомів кільця не є вуглецями, а являють собою гетероатоми. Гетероцикли можуть бути ароматичними або неароматичними. Приклади гетероциклічних груп включають, але не обмежуються, морфолінілом, тетрагідрофуранілом, діоксоланілом, піролідинілом, оксазолілом, пиранілом, піридилом, пиримідилом, піролілом тощо. [0050] Термін «гетероарил», який використовується тут, відноситься до гетероциклічної групи або з одного або більше кілець, звичайно походить від арена заміною однієї або більше метинів і/або вініленових груп тривалентним або двовалентним гетероатомом, відповідно, способом, що зберігає ароматичні властивості в одному або більше кільці. Приклади гетероарильних груп включають, але не обмежуються, піридилом, піролілом, оксазолілом, індолілом тощо. [0051] Термін «арилалкіл», який використовується тут, відноситься до однієї або більше арильної групи, приєднаної до алкільного радикалу. Приклади арилалкільних груп включають, але не обмежуються, бензилом, фенетилом, фенпропілом, фенбутилом тощо. [0052] Термін «циклоалкілалкіл», який використовується тут, відноситься до однієї або більше циклоалкільної групи, приєднаної до алкільного радикалу. Приклади циклоалкілалкілів включають, але не обмежуються, циклогексилметилом, циклогексилетилом, циклопентилметилом, циклопентилетилом тощо. [0053] Термін «гетероарилалкіл», який використовується тут, відноситься до однієї або більше гетероарильних груп, приєднаних до алкільного 19 радикалу. Приклади гетероарилалкілів включають, але не обмежуються, піридилметилом, фуранілметилом, тіофенілетилом тощо. [0054] Термін «гетероциклілалкіл», який використовується тут, відноситься до однієї або більше гетероциклільної групи, приєднаної до алкільного радикалу. Приклади гетероциклілалкілу включають, але не обмежуються, морфолінілметилом, морфолінілетилом, морфолінілпропилом, тетрагідрофуранілметилом, пірролідинілпропілом тощо. [0055] Термін «арилокси», який використовується тут, відноситься до арильного радикалу, ковалентно пов'язаного з основною молекулою через -О- зв'язок. [0056] Термін «алкілтіо», який використовується тут, відноситься до алкільного радикалу прямого або розгалуженого ланцюга, ковалентно пов'язаного з основною молекулою через -S- зв'язок. [0057] Термін «арилтіо», який використовується тут, відноситься до арильного радикалу, ковалентно пов'язаного з основною молекулою через S- зв'язок. [0058] Термін «алкіламіно», який використовується тут, відноситься до азотного радикалу з однієї або більше алкільними групами, приєднаними до нього. Так, моноалкіламіно відноситься до азотного радикалу з однією алкильною групою, приєднаною до нього, і діалкіламіно відноситься до азотного радикалу із двома алкільними групами, приєднаними до нього. [0059] Термін «ціаноаміно», який використовується тут, відноситься до азотного радикалу з нітрильною групою, приєднаною до нього. [0060] Термін «карбаміл», який використовується тут, відноситься до RNHCOO-. [0061] Термін «кето» і «карбоніл», який використовується тут, відноситься до С=О. [0062] Термін «карбокси», який використовується тут, відноситься до -СООН. [0063] Термін «сульфаміл», який використовується тут, відноситься до -SO2NH2. [0064] Термін «сульфоніл». який використовується тут, відноситься до -SO2-. [0065] Термін «сульфініл», який використовується тут, відноситься до -SO-. [0066] Термін «тіокарбоніл», який використовується тут, відноситься до C=S. [0067] Термін «тіокарбокси», який використовується тут, відноситься до CSOH. [0068] Радикал, який використовується тут, означає вид молекули з одним, неспареним електроном так, що вид молекули, що містить радикал може бути ковалентно пов'язаний з іншим видом. Отже, у цьому контексті, радикал не обов'язково є вільним. До деякої міри, радикал вказує на особливу частину більшої молекули. Термін «радикал» може бути використаний взаємозамінно з терміном «група». [0069] Заміщена група, яка використовується тут, походить від незаміщеної основної структури, де один або більше атомів водню може бути замінений на інший атом або групу. При заміщенні, група (групи) заступник є однією або більше групою індивідуально і незалежно обраною з C1-С6 алкілу, C1-С6 алкенілу, C1-С6алкінилу, С3-С6 цикло 93990 20 алкілу, С3-С6 гетероциклоалкілу (наприклад, тетрагідрофурилу), арилу, гетероарилу, галогену (наприклад, хлор, бром, йод і фтор), ціано, гідрокси, C1-С6 алкокси, арилокси, сульфгідрил (меркапто), C1-С6 алкілтіо, арилтіо, моно- і ди-( C1-С6)алкіл аміно, четвертинні амонієві солі, аміно(C1С6)алкокси, гідрокси(C1-С6)алкіламіно, аміно(C1С6)алкілтіо, ціаноаміно, нітро, карбаміл, кето (окси), карбоніл, карбокси, гліколіл, гліцил, гідразино, гуаніл, сульфаміл, сульфоніл, сульфініл, тіокарбоніл, тіокарбокси і їхні комбінації. Захисні групи, які можуть утворювати захисні похідні перерахованих вище заступників, відомі фахівцям в області техніки й можуть бути виявлені в літературі, такій як Greene and Wuts Protective Groups in Organic Synthesis; (Захисні Групи в Органічному Синтезі) John Wiley and Sons: New York, 1999. Коли заступник описаний як «необов'язково заміщений» це значить, що заступник може бути заміщений вищевказаними заступниками. [0070] Асиметричні атоми вуглецю можуть бути присутні в описуваних сполуках. Всі такі ізомери, включаючи діастереомери і енантіомери, а також їхні суміші, включені в обсяг домагань зазначених сполук. Всі таутомерні форми також включені в цей обсяг домагань. Подібним чином, коли сполуки містять алкенільну або алкеніленову групу, існує можливість утворення цис- і трансізомерних форм сполук. Розглядаються як цис-, так і транс-ізомери, також суміші цис- і трансізомерів. Таким чином, посилання на сполуки, включає всі з вищевказаних ізомерних форм, щонайменше, якщо в контексті чітко не прописане інше. [0071] Різні форми включені у варіанти здійснення винаходу, включаючи поліморфи, сольвати, гідрати, конформери, солі та пролікарські похідні. Поліморф являє собою композицію, що має таку ж хімічну формулу, але структуру відмінну від структури даної хімічної сполуки. Сольват являє собою композицію, утворену при сольватації (комбінація молекул розчинника з молекулами або іонами сольвату). Гідрат являє собою сполуку, утворену включенням води. Конформер являє собою структуру, що є конформаційним ізомером. Конформаційний изомеризм являє собою феномен молекул з тією же самою структурною формулою, але різними конформаціями (конформерами) атомів при обертанні зв'язку. Солі сполук можуть бути отримані способами, відомими фахівцям з рівня техніки. Наприклад, солі сполук можуть бути отримані взаємодією відповідної основи або кислоти зі стехіометричним еквівалентом сполуки. Проліки являють собою сполуки, що випробовують біотрансформацію (хімічне перетворення) перед проявом фармакологічного ефекту. Наприклад, проліки можуть бути розглянуті і як ліки, що містять специфічні захисні групи, які використовують у короткостроковому способі змінити або усунути небажані властивості в основній молекулі. Таким чином, посилання на сполуки, включає всі з вищевказаних форм, щонайменше, якщо в контексті чітко не прописане інше. [0072] Там, де представлений діапазон значень, зрозуміло, що кожне проміжне значення, до 21 одного знаку після коми в одиницях нижнього граничного значення, щонайменше, якщо не зазначено інше, між верхнім і нижнім граничним значенням цього діапазону й будь-якого іншого діапазону, що заявляється, або проміжне значення в цьому заявленому діапазоні охоплюється цим винаходом. Верхні й нижні граничні значення цих більш маленьких діапазонів також можуть незалежно бути включені в ці більш маленькі діапазони і також охоплюються даним винаходом, за умови виключення будь-якого граничного значення в заявленому діапазоні. Там, де заявлений діапазон включає один або обидва граничних значення, діапазони, що виключають або один або обоє граничних значення, також включені в обсяг домагань даного винаходу. [0073] Щонайменше, якщо не зазначене інше, всі технічні або наукові терміни, використовувані тут, мають те ж саме значення, яке звичайно розуміється фахівцем у даній області техніки, до якої винахід належить. Хоча будь-які методи й матеріали, подібні або еквівалентні тим, що описані тут, можуть також бути використані в практичній частині або дослідженнях даного винаходу, кращі способи й матеріали все-таки описуються тут. Всі публікації, використані тут, приводяться для посилання з метою опису й розкриття способів і/або матеріалів у зв'язку, з якими публікації цитуються. [0074] Повинно бути відзначено, що форми однини, які використовуються тут і в формулі винаходу, включають множину, принаймні, якщо не зазначене інше. Таким чином, наприклад відсилання до будь-якого «способу» включає безліч таких способів і відсилання до «будь-якої дози» включає відсилання до однієї або більше дози і їхнім еквівалентам, відомим фахівцеві в області техніки, і так далі. [0075] Термін «приблизно» використовується тут у значенні біля, у діапазоні або орієнтовно. Коли термін «приблизно» використовується разом з діапазоном чисел, термін змінює цей діапазон розширенням його границь вище й нижче встановлених числових значень. У загальному значенні термін «приблизно» використовується тут для зміни числових значень вище й нижче встановлених відхилень на 10%. [0076] Терміни «включає(ю)ть» і «який включає», які використовуються в цьому описі, або в проміжній фразі або в тексті пункту формули винаходу, розглядаються як такі, що володіють значенням відкритих границь. Тобто терміни розглядаються синонімічно фразам «що має, принаймні» або «який включає у себе, принаймні». При використанні в контексті процесу (способу), термін «який включає» означає, що процес складається, принаймні, з перерахованих стадій, але може містити в собі й додаткові стадії. При використанні в контексті сполуки, композиції або пристрою, термін «який включає» означає, що сполуки, композиція або пристрій володіють, принаймні, перерахованими ознаками, але також можуть мати додаткові ознаки або містити додаткові компоненти. [0077] У цьому описі є відсилання на детальний виклад конкретних варіантів здійснення винаходу. Незважаючи на те, що винахід буде описано 93990 22 у зв'язку із цими конкретними варіантами здійснення винаходу, зрозуміло, що це не обмежує винахід цими конкретними варіантами здійснення. Навпаки, це виконано з наміром охопити альтернативи, модифікації та еквіваленти, які можуть бути включені в сутність і обсяг винаходу. В описі, представленому тут, численні конкретні деталі визначені для того, щоб забезпечити повне розуміння даного винаходу. Даний винахід не може бути практично здійснений без розуміння цих всіх або деяких специфічних деталей. В інших випадках, добре відомі операції способу не описуються детально для того, щоб не переобтяжувати даний винахід. [0078] Дані варіанти здійснення винаходу забезпечують Сполуки 1 -10, як описано нижче, також фармацевтичні композиції і форми, що містять кожну із Сполук 1-10. Сполуки 1-10 можуть мати тут різні найменування, що включають «цільові сполуки», «NS3 інгібітор», «сполуки NS3 інгібітор», «інгібітор протеази», «інгібітор гелікази» і інші подібні терміни, які легко розуміються фахівцями в області техніки. Цільові сполуки корисні для регулювання (тобто інгібування) активності NS3 протеази і/або гелікази, in vivo і/або ex vivo. Наприклад, цільові сполуки є корисними для лікування інфекції ВГС і інших захворювань, як подається нижче. Композиції. [0079] Дані варіанти здійснення забезпечують Сполуки 1-10, що мають хімічні структури, показані в Таблицях 1 і 2 нижче. У кращих варіантах здійснення винаходу розкритий спосіб лікування пацієнта з вірусною інфекцією гепатиту С, що включає введення пацієнтові ефективної кількості композиції, що містить кращу сполуку, наприклад, якоїнебудь композиції, що містить, принаймні, одну із Сполук 1-10. [0080] У кращих варіантах здійснення винаходу розкритий спосіб лікування фіброзу печінки у пацієнта, що включає введення пацієнтові ефективної кількості композиції, що містить кращу сполуку. [0081] У кращих варіантах здійснення винаходу розкритий спосіб збільшення функції печінки у пацієнта з вірусною інфекцією гепатиту С, що включає введення пацієнтові ефективної кількості композиції, що містить кращу сполуку. [0082] Даний винахід також розкриває композиції, що включають фармацевтичні композиції, які містять Сполуки 1-10 і їхні солі, ефіри або інші похідні. Описувана тут фармацевтична композиція включає цільові сполуки (сполуки за винаходом) і фармацевтично прийнятний наповнювач. Велика розмаїтість фармацевтично прийнятних наповнювачів (ексципієнтів) добре відома з рівня техніки і не має потреби в детальному обговоренні тут. Фармацевтично прийнятні наповнювачі (ексципієнти) описані в безлічі публікацій, включаючи, наприклад, A. Gennaro (2000) "Remington: The Science and Practice of Pharmacy", 20th edition, Lippincott, Williams, & Wilkins; Pharmaceutical Dosage Forms and Drug Delivery Systems (1999) H. С Ansel et al., eds., 7th ed., Lippincott, Williams, & Willcins; and Handbook of Pharmaceutical Excipients (2000) A. H. 23 Kibbe et al., eds., 3d ed. Amer. Pharmaceutical Assoc. [0083] Фармацевтично прийнятні ексципієнти, такі як розріджувачі, ад'юванти, носії або розчинники легко доступні для суспільного використання. Більше того, фармацевтично прийнятні допоміжні речовини, такі як регулюючі pH, буферні агенти, агенти, які регулюють концентрацію, стабілізатори, зволожувачі тощо, легко доступні для суспільного використання. [0084] У більшості варіантів здійснення винаходу, сполука за винаходом інгібує ензиматичну активність протеази NS3 вірусу гепатиту С (ВГС). Чи інгібує сполука NS3 ВГС, може бути легко визначено відомими методами. Звичайні методи охоплюють визначення, чи розщеплюється поліпротеїн ВГС або інший поліпептид, що включає ділянку розпізнавання NS3, протеазою NS3 у присутності агенту. У більшості варіантів здійснення винаходу описувана сполука інгібує NS3 ензиматичну активність, принаймні, на приблизно 10%, принаймні, на приблизно 15%, принаймні, на приблизно 20%, принаймні, на приблизно 25%, принаймні, на приблизно 30%, принаймні, на приблизно 40%, принаймні, на приблизно 50%, принаймні, на приблизно 60%, принаймні, на приблизно 70%, принаймні, на приблизно 80%, принаймні, на приблизно 90%, або більше в порівнянні з ензиматичною активністю NS3 під час відсутності сполуки. [0085] У багатьох варіантах здійснення винаходу, сполука за винаходом інгібує ензиматичну активність NS3 протеази ВГС із ІС50 менше, ніж 50 μΜ, наприклад, сполука за винаходом інгібує ензиматичну активність NS3 протеази ВГС із ІС50 менше, ніж 40 μΜ, менше, ніж 25 μΜ, менше, ніж 10 μΜ, менше, ніж 1 μΜ, менше, ніж 100 nМ менше, ніж 80 nМ, менше, ніж 60 nМ, менше, ніж 50 nМ, менше, ніж 25 nМ, менше, ніж 10 nМ, або менше, ніж 1 nМ або менше. [0086] У багатьох варіантах здійснення винаходу, цільова сполука інгібує ензиматичну активність NS3 гелікази віруси гепатиту С (ВГС). Чи інгібує сполука NS3 геліказу ВГС, може бути визначено використанням будь-якого з відомих способів. У багатьох варіантах здійснення винаходу, цільова сполука інгібує NS3 ензиматичну активність, принаймні, приблизно на 10%, принаймні, приблизно на 15%, принаймні, приблизно на 20%, принаймні, приблизно на 25%, принаймні, приблизно на 30%, принаймні, приблизно на 40%, принаймні, приблизно на 50%, принаймні, приблизно на 60%, принаймні, приблизно на 70%, принаймні, приблизно на 80%, принаймні, приблизно на 90%, або більше в порівнянні з ензиматичною активністю NS3 під час відсутності сполуки. [0087] У багатьох варіантах здійснення винаходу, описувана тут сполука інгібує реплікацію ВГС. Наприклад, сполука за винаходом інгібує реплікацію ВГС, принаймні, приблизно на 10%, принаймні, приблизно на 15%, принаймні, приблизно на 20%, принаймні, приблизно на 25%, принаймні, приблизно на 30%, принаймні, приблизно на 40%, принаймні, приблизно на 50%, принаймні, приблизно на 60%, принаймні, приблизно на 70%, 93990 24 принаймні, приблизно на 80%, принаймні, приблизно на 90%, або більше в порівнянні з реплікацією ВГС під час відсутності сполуки. Чи інгібує сполука реплікацію ВГС, може бути визначено методами, відомими з рівня техніки, включаючи дослідження на реплікацію вірусу in vitro. [0088] У багатьох варіантах здійснення винаходу, цільова сполука інгібує ензиматичну активність як NS3 протеази ВГС, так і NS3 гелікази вірусу гепатиту С (ВГС). Чи інгібує сполука як NS3 протеазу ВГС, так і NS3 геліказу ВГС, може бути визначено використанням будь-якого з відомих способів. У багатьох варіантах здійснення винаходу, цільова сполука інгібує ензиматичну активність як NS3 протеази ВГС, так і NS3 гелікази, принаймні, приблизно на 10%, принаймні, приблизно на 15%, принаймні, приблизно на 20%, принаймні, приблизно на 25%, принаймні, приблизно на 30%, принаймні, приблизно на 40%, принаймні, приблизно на 50%, принаймні, приблизно на 60%, принаймні, приблизно на 70%, принаймні, приблизно на 80%, принаймні, приблизно на 90%, або більше, у порівнянні з ензиматичною активністю NS3 протеази й NS3 гелікази ВГС під час відсутності цієї сполуки. Лікування вірусної інфекції гепатиту. [0089] Способи і композиції, описані тут, звичайно використовуються для лікування вірусної інфекції гепатиту С. [0090] Чи є спосіб за винаходом ефективним при лікуванні вірусної інфекції гепатиту С, може бути визначено зниженням вірусного навантаження, зниженням часу сероконверсії (вірус не виявляється в сироватці пацієнта), збільшенням швидкості тривалої вірусної відповіді на лікування, зниженням захворюваності або смертності в клінічних випадках, або іншим індикатором відповіді на захворювання. [0091] Звичайно ефективна кількість сполуки, описаної тут, наприклад кожної із Сполук 1-10, і необов'язково один або більше додаткових антивірусних агентів, являє собою кількість, що є ефективною для зниження вірусного навантаження або поліпшує тривалу вірусну відповідь на терапію. [0092] Чи є спосіб за винаходом ефективним при лікуванні вірусної інфекції гепатиту С, може бути визначено виміром вірусного навантаження або виміром параметрів, пов'язаних з інфекцією ВГС, включаючи, але не обмежуючись, фіброз печінки, збільшення концентрації трансамінази в сироватці та некровозапалювальної активності в печінці. Індикатори фіброзу печінки обговорюються в деталях нижче. [0093] Спосіб охоплює введення ефективної кількості сполуки, описаної тут, наприклад кожної із Сполук 1-10, необов'язково в комбінації з ефективною кількістю одного або більше додаткових антивірусних агентів. У деяких варіантах здійснення винаходу ефективна кількість сполуки, описаної тут, і необов'язково одного або більше додаткових антивірусних агентів представляє кількість, ефективну для зниження титру вірусу до рівня, що не виявляє, наприклад, приблизно від 1000 до 5000, від 500 до 1000 або від 100 до 500 геномних копій/мол сироватки. У деяких варіантах здійснення 25 винаходу ефективна кількість сполуки, описаної тут, і необов'язково одного або більше додаткових антивірусних агентів представляє кількість, ефективну для зниження вірусного навантаження до рівня, нижче, 100 геномних копій/мол сироватки. [0094] У деяких варіантах здійснення винаходу ефективна кількість сполуки, описаної тут, і необов'язково одного або більше додаткових антивірусних агентів представляє кількість, ефективну для досягнення зниження 1.5-log, 2-log, 2.5-log, 3-log, 3.5-log, 4-log, 4.5-log, або 5-log титру вірусу в сироватці пацієнта. [0095] У багатьох варіантах здійснення винаходу ефективна кількість сполуки, описаної тут, і необов'язково одного або більше додаткових антивірусних агентів представляє кількість, ефективну для поліпшення тривалої вірусної відповіді, наприклад відсутність (не виявлення) РНК ВГС (наприклад, менше, ніж 500, менше, ніж 400, менше ніж 200 або менше, ніж 100 геномних копій на мілілітр сироватки) у сироватці пацієнта за період протягом, принаймні, одного місяця, принаймні, двох місяців, принаймні, трьох місяців, принаймні, чотирьох місяців, принаймні, п'яти місяців, принаймні, шести місяців слідом за припиненням лікування. [0096] Як відзначено вище, чи є спосіб за винаходом ефективним при лікуванні вірусної інфекції гепатиту С, може бути визначено, як відзначено вище, виміром параметрів, пов'язаних з інфекцією ВГС, таких як фіброз печінки. Способи визначення ступеня фіброзу печінки обговорюються в деталях нижче. В деяких варіантах здійснення винаходу концентрація маркерів фіброзу печінки в сироватці вказує на його ступінь. [0097] У якості одного, не обмежуючого обсяг домагань, прикладу вимірюють концентрацію аланін амінотрансферази (ALT) у сироватці, використовуючи стандартні дослідження. Звичайно, концентрація ALT менше, ніж приблизно 45 міжнародних одиниць, вважається нормальною. У деяких варіантах здійснення винаходу ефективна кількість сполуки формули І і необов'язково одного або більше додаткових антивірусних агентів представляє кількість, ефективну для зниження концентрації ALT нижче, ніж 45 IU/ml сироватки. [0098] Терапевтично ефективну кількість сполуки, описаної тут, і необов'язково одного або більше додаткових антивірусних агентів представляє кількість, ефективна для зниження концентрації маркерів фіброзу печінки в сироватці, принаймні, приблизно на 10%, принаймні, приблизно на 15%, принаймні, приблизно на 20%, принаймні, приблизно на 25%, принаймні, приблизно на 30%, принаймні, приблизно на 40%, принаймні, приблизно на 50%, принаймні, приблизно на 60%, принаймні, приблизно на 70%, принаймні, приблизно на 80%, принаймні, приблизно на 90%, або більше, у порівнянні з концентрацією маркерів у пацієнта без проведення лікування або пацієнта, що одержував плацебо. Способи виміру маркерів у сироватці включають імунологічні методи, наприклад імуноферментний твердофазний аналіз (ELISA), радіоімуноаналіз тощо, використовуючи 93990 26 антитіла, специфічні для даного маркера в сироватці. [0099] У багатьох варіантах здійснення винаходу ефективна кількість сполуки, описаної тут, і необов'язково одного або більше додаткових антивірусних агентів представляє синергічну кількість. «Синергічна комбінація» або «синергічна кількість» описаної тут сполуки і додаткового антивірусного агенту, які використовуються тут, являє собою комбіновану дозу, що є більш ефективною в терапевтичному або профілактичному лікуванні вірусної інфекції ГС, ніж поступове поліпшення в результаті лікування, що передбачається або очікується тільки від додаткової комбінації (і) терапевтичної або профілактичної користі сполуки, описаної тут, коли вона вводиться в тій же самій дозі у вигляді монотерапії і (іі) терапевтичної або профілактичної користі додаткового антивірусного агенту, коли він вводиться в тій же самій дозі у вигляді монотерапії. [0100] У деяких варіантах здійснення винаходу обрана кількість сполуки, описаної тут, і обрана кількість додаткового антивірусного агенту є ефективною, коли використовується в комбінованій терапії для лікування захворювання, але обрана кількість сполуки, описаної тут, і/або обрана кількість додаткового антивірусного агенту є неефективною, коли використовується в монотерапії для лікування захворювання. Таким чином, винахід охоплює (1) режими, при яких обрана кількість додаткового антивірусного агенту поліпшує терапевтичну користь обраної кількості сполуки, описаної тут, коли вони використовуються в комбінованій терапії для лікування захворювання, причому обрана кількість антивірусного агенту не приносить терапевтичну користь, коли вона використовується в монотерапії для лікування захворювання (2) режими, при яких обрана кількість сполуки, описаної тут, поліпшує терапевтичну користь обраної кількості додаткового антивірусного агенту, коли вони використовуються в комбінованій терапії для лікування захворювання, причому обрана кількість сполуки, описаної тут, не приносить терапевтичну користь, коли вона використовується в монотерапії для лікування захворювання (3) режими, при яких обрана кількість сполуки, описаної тут, і обрана кількість додаткового антивірусного агенту забезпечують терапевтичну користь, коли вони використовуються в комбінованій терапії для лікування захворювання, причому кожна з обраних кількостей сполуки, описаної тут, і додаткового антивірусного агенту відповідно не приносить терапевтичну користь, коли вони використовуються в монотерапії для лікування захворювання. Що використовується тут «синергетично ефективна кількість» сполуки, описаної тут і додаткового антивірусного агенту і їхніх граматичних еквівалентів, варто вважати включеними в будьякий режим, охоплений режимами (1)-(3), перерахованими вище. Фіброз. [0101] Даний винахід забезпечує способи лікування фіброзу печінки (включаючи форми фіброзу печінки, що є наслідком або пов'язані з вірусною інфекцією гепатиту С), які звичайно включають 27 введення терапевтичної кількості сполуки, описаної тут, і необов'язково одного або більше додаткових антивірусних агентів, а також режими дозування, які обговорюються нижче. Ефективна кількість кожної із Сполук 1-10 з одним або більше додатковим антивірусним агентом або без них, а також режими дозування обговорюються нижче. [0102] Чи є лікування сполукою, описаною тут, і необов'язково одним або більше додатковим антивірусним агентом ефективним для зниження фіброзу печінки визначається кожною із числа добре відомих технік для виміру фіброзу печінки і функції печінки. Зниження фіброзу печінки визначається при аналізі зразка печіночної тканини, отриманої при біопсії. Аналіз біопсії печінки включає оцінку двох головних характеристик: некрозапального процесу, оцінюваних за «ступенем» виміру серйозності захворювання і поточної активності захворювання, ураження фіброзом і паренхімними або судинними змінами для оцінки «стадії» як відбиття тривалого розвитку хвороби. Див. наприклад, Brunt (2000) Hepatol. 31: 241-246; і METAVIR (1994) Hepatology 20: 15-20. На підставі аналізу біопсії печінки встановлюються індекси. Існують різні стандартні системи градації, які забезпечують кількісну оцінку ступеня і серйозності фіброзу. Вони включають METAVIR, Knodell, Scheuer, Ludwig, i Ishalc системи градації. [0103] Система градації METAVIR ґрунтується на аналізі різних ознак біопсії печінки, включаючи фіброз (портальний фіброз, центродолевий фіброз і цироз); некроз (частковий і лобулярний некроз, ацидофільна ретракція і балонуюча дистрофія); запалення (запалення портальних трактів, портальне лімфоідне скупчення і поширення портального запалення); зміни жовчних проток; індекс Кноделя (Knodell) (стадія перипортального некрозу, лобулярного некрозу, портального запалення, фіброзу і повного ступеню активності захворювання). Визначення кожної стадії в системі METAVIR є наступним: стадія: 0, немає фіброзу; стадія: 1, стелатне розростання портального тракту, але без утворення септ; стадія: 2, подовження портального тракту з невеликим утворенням септ; стадія: 3, численні септи без цирозу; і стадія: 4, цироз. [0104] Система градації Кноделя, також названа як Індекс Гістологічної Активності, класифікує ступінь активності захворювання, ґрунтуючись на стадіях по чотирьох категоріях гістологічних ознак: І, перипортальний і/або мосточковидний некроз; II, інтралобулярна дегенерація і фокальний некроз; III, портальне запалення; і IV, фіброз. У системі градації Кноделя, стадії є наступними: стадія: 0, немає фіброзу; стадія: 1, слабовиражений фіброз (поширення портального фіброзу); стадія: 2, помірний фіброз; стадія: 3, виражений фіброз (мосточковидний фіброз); і стадія: 4, цироз. Чим вище стадія захворювання, тим більше серйозно ушкоджена тканина печінки. Knodell (1981) Hepatol. 1:431. [0105] У системі градації Scheuer стадії є наступними: стадія: 0, немає фіброзу; стадія: 1, подовжені фіброзно-змінені портальні тракти; стадія: 2, перипортальні або портопортальні септи, але недоторкана архітектоніка; стадія: 3, фіброз із по 93990 28 рушенням архітектоніки, але відсутність очевидного цирозу; стадія: 4, імовірний або певний цироз. Scheuer (1991) J. Hepatol 13: 372. [0106] Система градації Ісхака (Ishak) описана в Ishak (1995) J. Hepatol. 22: 696-699. Стадія 0, немає фіброзу; стадія 1, фіброз деяких портальних трактів з короткими фіброзними септами або без них; стадія 2, фіброз більшості портальних трактів з короткими фіброзними септами або без них; стадія 3, фіброз більшості портальних трактів з рідкими портопортальними септами (мосточковидний фіброз); стадія 4, фіброз портальних трактів з вираженим мосточковидним фіброзом (портопортальні або портоцентральні септи); стадія 5, виражений мосточковидний фіброз (портопортальні або портоцентральні септи) з одиничними вузлами (ранній цироз); стадія 6, Цироз, імовірний або обумовлений цироз. [0107] Позитивні ефекти лікування фіброзу можуть бути також обмірювані і оцінені з використанням системи критеріїв Чайлда-П'ю (Child-Pugh), що включає багатокомпонентну систему критеріїв, які ґрунтуються на порушеннях концентрації в сироватці білірубіну, альбуміну, протромбінового часу, наявність і серйозність асциту, наявність і серйозність енцефалопатії. На підставі виявлення і серйозності порушення цих критеріїв, пацієнти можуть бути віднесені до однієї із трьох категорій за зростанням серйозності захворювання: А, В або С. [0108] У деяких варіантах здійснення винаходу терапевтично ефективна кількість сполуки формули І і необов'язково одного або більше додаткових антивірусних агентів являє собою кількість, що здійснює зміну однієї одиниці або більше в стадії фіброзу, ґрунтуючись на попередній і після лікування біопсії печінки. У конкретнихваріантах здійснення винаходу, терапевтично ефективна кількість сполуки формули І і необов'язково одного або більше додаткових антивірусних агентів знижує фіброз печінки, принаймні, на одну одиницю в системах градації METAVIR, Knodell, Scheuer, Ludwig, або Ishak. [0109] Вторинні або непрямі індекси функції печінки також можуть бути використані для оцінки ефективності лікування сполукою формул І-ХІХ. Морфометрична комп'ютеризована напівавтоматична оцінка фіброзу печінки, що заснована на специфічному фарбуванні колагеном і/або сироватковими маркерами фіброзу печінки, також може бути обмірювана як показник ефективності описуваного способу лікування. Вторинні індекси функції печінки включають, але не обмежуються рівнем трансамінази в сироватці, протромбіновим часом, білірубіном, підрахунком тромбоцитів, портальним тиском, рівнем альбуміну і оцінкою критеріїв Чайлда-П'ю (Child-Pugh). [0110] Терапевтично ефективна кількість сполуки, описаної тут, і необов'язково одного або більше додаткових антивірусних агентів представляє кількість, ефективну для збільшення індексу функції печінки, принаймні, приблизно на 10%, принаймні, приблизно на 20%, принаймні, приблизно на 25%, принаймні, приблизно на 30%, принаймні, приблизно на 35%, принаймні, приблизно 29 на 40%, принаймні, приблизно на 45%, принаймні, приблизно на 50%, принаймні, приблизно на 55%, принаймні, приблизно на 60%, принаймні, приблизно на 65%, принаймні, приблизно на 70%, принаймні, приблизно на 75%, принаймні, приблизно на 80%, принаймні, приблизно на 80%, або більше, у порівнянні з індексом функції печінки у пацієнта без проведення лікування або пацієнта, що одержував плацебо. Фахівець у даній області техніки може легко виміряти такі індекси функції печінки, використовуючи стандартні дослідницькі методи, багато з яких є комерційно доступними і які використовуються звичайно в клінічних умовах. [0111] Сироваткові маркери фіброзу печінки можуть бути також обмірювані як показник ефективності описуваного способу лікування. Сироваткові маркери включають, але не обмежуються, гіалуронат, N-термінальний проколлаген III пептид, 7S домен типу IV колагену, С-термінальний проколаген І пептид і ламінін. Додаткові біохімічні маркери фіброзу печінки включають -2макроглобулін, гаптоглобулін, гама глобулін, аполіпопротеїн А і гама глютаміл транспептидази. [0112] Терапевтично ефективна кількість сполуки, описаної тут, і необов'язково одного або більше додаткових антивірусних агентів представляє кількість, ефективну для зниження концентрації маркерів фіброзу печінки в сироватці, принаймні, приблизно на 10%, принаймні, приблизно на 15%, принаймні, приблизно на 20%, принаймні, приблизно на 25%, принаймні, приблизно на 30%, принаймні, приблизно на 40%, принаймні, приблизно на 50%, принаймні, приблизно на 60%, принаймні, приблизно на 70%, принаймні, приблизно на 80%, принаймні, приблизно на 90%, або більше, у порівнянні з концентрацією маркерів у пацієнта без проведення лікування або пацієнта, що одержував плацебо. Фахівець у даній області техніки може легко виміряти такі сироваткові маркери фіброзу печінки, використовуючи стандартні дослідницькі методи, багато з яких є комерційно доступними і які використовуються звичайно в клінічних умовах. Способи виміру маркерів у сироватці включають імунологічні методи, наприклад імуноферментний твердофазний аналіз (ELISA), радіоімуноаналіз тощо, використовуючи антитіла, специфічні для даного маркера в сироватці. [0113] Кількісні тести функціональних резервів печінки також можуть бути використані для оцінки ефективності лікування агоністами рецепторів інтерферону і пірфенідону (або аналогів пірфенідону). Вони включають: виведення індоціаніна зеленого (ICG), здатність видалення галактози (GEC), амінопіриновий дихальний тест (АВТ), виведення антипірину, виведення моноетилгліцин-ксилідиду (MEG-X) і виведення кофеїну. [0114] «Ускладнення, пов'язане із цирозом печінки», яке використовується тут, відноситься до захворювань, які являють собою наслідок декомпенсаційних захворювань печінки, тобто, або відбуваються слідом за або є результатом розвитку фіброзу печінки і включає, але не обмежується, розвиток асцитів, варикозної кровотечі, портальної гіпертензії, жовтяниці, прогресуючої печіночної недостатності, енцефалопатії, гепатоцелюлярної 93990 30 карциноми, відсутності функціонування печінки, що вимагає її пересадження, і летальний результат, зв'язаний с захворюваннями печінки. [0115] Терапевтично ефективна кількість сполуки, описаної тут, і необов'язково одного або більше додаткових антивірусних агентів представляє кількість, ефективну для зниження ступеня (наприклад, імовірності, що у пацієнта буде розвиватися захворювання) порушень, пов'язаних із цирозом печінки, принаймні, приблизно на 10%, принаймні, приблизно на 20%, принаймні, приблизно на 25%, принаймні, приблизно на 30%, принаймні, приблизно на 35%, принаймні, приблизно на 40%, принаймні, приблизно на 45%, принаймні, приблизно на 50%, принаймні, приблизно на 55%, принаймні, приблизно на 60%, принаймні, приблизно на 65%, принаймні, приблизно на 70%, принаймні, приблизно на 80 % або більше, у порівнянні з пацієнтами без проведення лікування або пацієнтами, що одержували плацебо. [0116] Чи є лікування сполукою, описаною тут, і необов'язково одним або більше антивірусним агентом ефективним у зниженні ступеня порушень, пов'язаних із цирозом печінки, може бути легко визначено фахівцями в області техніки. [0117] Зниження фіброзу печінки збільшує функцію печінки. Причому, винахід забезпечує методи збільшення функції печінки, що звичайно включають введення терапевтично ефективної кількості сполуки, описаної тут, і необов'язково одного або більше додаткових антивірусних агентів. Функції печінки включають, але не обмежуються, синтетичу функцію, включаючи, але не обмежуючись, синтез протеїнів, таких як сироваткові протеїни (наприклад, альбумін, фактори згортання крові, лужна фосфатаза, амінотрансфераза (наприклад, аланінова трансаміназа, аспартамова трансаміназа), 5'-нуклеозидаза, глютамінілтранспептидаза і так далі), синтез білірубіну, синтез холестерину і синтез жовчних кислот; метаболічну функцію печінки, включаючи, але, не обмежуючись, метаболізмом вуглеводів, метаболізмом амінокислот і аміаку, гормональним метаболізмом і ліпідним метаболізмом; детоксифікацію екзогенних лікарських засобів; гемодинамічну функцію, включаючи внутрішню і портальну динаміку кровообігу; тощо. [0118] Чи збільшується функція печінки, легко встановлюється фахівцями в області техніки, використовуючи добре перевірені тести по функціям печінки. Причому синтез маркерів функцій печінки, таких як альбумін, лужна фосфатаза, аланінова трансаміназа, аспартамова трансаміназа, білірубін тощо, може бути визначений виміром рівня маркерів у сироватці, використовуючи стандартні імунологічні і ензиматичні дослідження. Внутрішньостна циркуляція і портальна гемодинаміка можуть бути обмірювані шляхом портального тиску, і/або опору, що заклинює, використовуючи стандартні методи. Метаболічні функції можуть бути обмірювані визначенням рівня аміаку в сироватці. [0119] Чи попадають значення концентрації сироваткових протеїнів, що звичайно виділяє печінка, у нормальний діапазон значень може бути визначено виміром рівня таких протеїнів, викорис 31 товуючи стандартні імунологічні і ензиматичні дослідження. Фахівцеві в даній області відомі нормальні діапазони для таких сироваткових протеїнів. Далі приводяться не обмежуючі обсяг домагань приклади. Звичайна концентрація аланінової трансамінази становить близько 45 IU на мілілітр сироватки. Звичайна концентрація аспартамової трансамінази становить від 5 до 40 одиниць на мілілітр сироватки. Білірубін виміряється стандартними дослідженнями. Нормальний рівень білірубіна звичайно менше ніж 1.2 mg/dL. Концентрація сироваткового альбуміну виміряється, використовуючи стандартні дослідження. Звичайний рівень сироваткового альбуміну перебуває в діапазоні від 35 до 55 g/L. Тривалість протромбінового часу виміряється, також використовуючи стандартні дослідження. Звичайно протромбіновий час триває менше 4 секунд, у порівнянні з контролем. [0120] Терапевтично ефективна кількість сполуки, описаної тут, і необов'язково одного або більше додаткових антивірусних агентів представляє кількість, ефективну для збільшення функції печінки, принаймні, приблизно на 10%, принаймні, приблизно на 20%, принаймні, приблизно на 30%, принаймні, приблизно на 40%, принаймні, приблизно на 50%, принаймні, приблизно на 60%, принаймні, приблизно на 70%, принаймні, приблизно на 80% або більше. Наприклад, терапевтично ефективна кількість сполуки, описаної тут, і необов'язково одного або більше додаткових антивірусних агентів представляє кількість, ефективну для зниження підвищеної концентрації сироваткових маркерів функції печінки, принаймні, приблизно на 10%, принаймні, приблизно на 20%, принаймні, приблизно на 30%, принаймні, приблизно на 40%, принаймні, приблизно на 50%, принаймні, приблизно на 60%, принаймні, приблизно на 70%, принаймні, приблизно на 80% або більше, або зниження концентрації сироваткових маркерів функції печінки до нормального діапазону. Терапевтично ефективна кількість сполуки, описаної тут, і необов'язково одного або більше додаткових антивірусних агентів представляє кількість, ефективну для збільшення зниженої концентрації сироваткових маркерів функції печінки, принаймні, приблизно на 10%, принаймні, приблизно на 20%, принаймні, приблизно на 30%, принаймні, приблизно на 40%, принаймні, приблизно на 50%, принаймні, приблизно на 60%, принаймні, приблизно на 70%, принаймні, приблизно на 80% або більше, або збільшення концентрації сироваткових маркерів функції печінки до нормального діапазону. Дози, лікарські форми і шляхи введення. [0121] У способі за винаходом, активний агент (агенти) (наприклад, сполуки або сполуки, описані тут, і необов'язково один або більше додаткових антивірусних агентів) можуть бути введені пацієнтові, використовуючи будь-який відповідний засіб, здатні давати бажаний терапевтичний ефект. Причому агент може бути включений у різні лікарські форми для терапевтичного введення. Більш конкретно, агенти за даним винаходом можуть бути введені до складу фармацевтичної композиції в комбінації з відповідними фармацевтично прийнятними носіями або розріджувачами і можуть бути 93990 32 введені до складу твердих, напівтвердих рідких або газоподібних форм, таких як таблетки, капсули, порошок, гранули, мазі, розчини, супозиторії, ін'єкції, інгалятори і аерозолі. Лікарські форми [0122] Обговорюваний вище активний агент (агенти) (наприклад, Сполуки 1-10, визначені в Таблицях 1-2 нижче) може бути введений до складу, використовуючи добре відомі реагенти і способи. Композиції представлені в комбінації з фармацевтично прийнятними ексципієнтами. Широка розмаїтість фармацевтично прийнятних ексципієнтів відома з рівня техніки і не має потреби в детальному обговоренні тут. Фармацевтично прийнятні ексципієнти широко описані в безлічі публікацій, наприклад, A. Gennaro (2000) «Remington: The Science and Practice of Pharmacy» 20e видання, Lippincott, Williams, & Wilkins; Pharmaceutical Dosage Forms and Drug Delivery Systems (1999) H. C. Ansel і ін., eds., 7e вид., Lippincott, Williams & Wilkins; і Handbook of Pharmaceutical Excipients (2000) A. H. Kibbe і ін., eds., 3е вид. Amer. Pharmaceutical Assoc. [0123] Фармацевтично прийнятні ексципієнти, такі як наповнювачі, носії або розріджувачі легко доступні для суспільного застосування. Більше того, фармацевтично прийнятні допоміжні речовини, такі як pH регулюючі і буферні агенти, агенти що регулюють концентрацію, стабілізатори, зволожувачі тощо, легко доступні для суспільного застосування. [0124] У деяких варіантах здійснення винаходу, агент вводиться до складу водного буферу. Підходящі водні буфери включають, але не обмежуються, ацетатами, сукцинатами, цитратами і фосфатними буферами, що змінюються за інтенсивністю від 5mМ до 100mМ. У деяких варіантах здійснення винаходу водний буфер включає реагенти, які забезпечують ізотонічність розчину. Такі реагенти включають, але не обмежуються, хлоридом натрію; і цукрами, такими як манітол, декстроза, сахароза тощо. У деяких варіантах здійснення винаходу водний буфер також включає неіонні поверхнево-активні речовини (ПАР), такі як полісорбат 20 або 80. Необов'язково лікарські форми можуть також включати консерванти. Підходящі консерванти включають, але не обмежуються, бензиловий спирт, фенол, хлорбутанол, бензаалконіум хлорид тощо. У багатьох випадках форми зберігаються при температурі близько 4°С. Форми можуть бути також ліофілізовані, у такому випадку вони звичайно включають кріозахисні речовини, такі як сахароза, трегалоза, лактоза, мальтоза, манітол тощо. Ліофілізовані форми можуть зберігатися протягом тривалого періоду часу, навіть при кімнатній температурі. [0125] По суті, введення агентів може бути поліпшено різними способами, включаючи пероральний, трансбукальний, ректальний, парентеральний, інтраперитонеальний, інтрадермальний, підшкірний, внутрішньом'язовий, трансдермальний, внутрішньотрахеальний і так далі способи введення. У багатьох варіантах здійснення винаходу, введення здійснюється болісною ін'єкцією, 33 наприклад підшкірною болісною ін'єкцією, внутрішньом'язовою болісною ін'єкцією тощо. [0126] Фармацевтичні композиції за винаходом можуть бути введені перорально, парентерально або через вживлену ємність. Пероральне введення або введення через ін'єкцію переважне. [0127] Підшкірне введення фармацевтичної композиції здійснюється, використовуючи стандартні методи і пристрої, наприклад голку і шприц або систему портальної доставки підшкірної ін'єкції тощо, див., наприклад, патенти США № 3,547,119; 4,755,173; 4,531,937; 4,311,137; і 6,017,328. Комбінація порту для підшкірної ін'єкції і пристрою для введення фармацевтичної композиції за винаходом пацієнтові через зазначений порт іменується тут як «система портальної доставки підшкірної ін'єкції». У багатьох варіантах здійснення винаходу, підшкірне введення поліпшується болісною доставкою за допомогою голки і шприца. [0128] У фармацевтично дозованих формах агенти можуть бути введені у формі їх фармацевтично прийнятної солі або вони можуть також бути використані по одному або у відповідній комбінації з іншими фармацевтично активними сполуками. Наступні способи і ексципієнти є ілюстративними і не обмежують обсяг домагань. [0129] Для пероральних форм агенти можуть бути використані індивідуально або в комбінації з відповідними добавками для одержання таблеток, порошків, гранул або капсул, наприклад, зі звичайними добавками, такими як лактоза, манітол, кукурудзяний крохмаль; зі зв'язувальними речовинами, такими як кристалічна целюлоза, похідні целюлози, гуміарабік, кукурудзяний крохмаль або желатин; з дезінтеграторами (розривателями), такими як кукурудзяний крохмаль, картопляний крохмаль або натрій карбоксиметилцелюлоза; з лубрикантами, такими як тальк або стеарат магнію; або якщо бажано з розріджувачами, буферними агентами, зволожувачами, консервантами і ароматизаторами. [0130] Агенти можуть бути введені до складу для ін'єкції за допомогою розчинення, суспендування або емульсифікування їх у водному або неводному розчиннику, такому як рослинне або інші подібні масла, синтетичні гліцериди аліфатичних кислот, ефіри вищих аліфатичних кислот або пропіленгліколю, і якщо бажано зі звичайними добавками, такими як солюбілізатори, ізотонічні агенти, суспендуючі агенти, емульсифікуючі агенти, стабілізатори і консерванти. [0131] Більше того, агенти можуть бути введені в супозиторії змішуванням основи, такої як емульсифікуюча основа або водорозчинна основа. Сполуки за винаходом можуть бути введені ректально через супозиторій. Супозиторій може включати наповнювачі, такі як масло какао, парафін і поліетиленгліколі, які плавляться при температурі тіла, і залишаються у твердому виді при кімнатній температурі. [0132] Одиничні дозовані форми для перорального або ректального введення, такі як сиропи, еліксири і суспензії можуть бути надані, де кожна дозована одиниця, наприклад чайна ложка, столова ложка, таблетка або супозиторій містить певну 93990 34 кількість композиції, яка містить один або більше інгібіторів. Подібним чином, одиничні дозовані форми для ін'єкцій або внутрішньовенного введення можуть включати інгібітор (інгібітори) в композиції у вигляді розчину в стерильній воді, нормальному сольовому розчині або іншому фармацевтично прийнятному носії. [0133] Термін «одинична дозована форма», який використовується тут, відноситься до фізично ізольованої одиниці, що підходить як одинична доза для людини або тварини, кожна одиниця містить певну кількість сполуки за даним винаходом, розрахована в кількості достатній для одержання бажаного ефекту в з'єднанні з фармацевтично прийнятним розріджувачем, носієм або наповнювачем. Технічні вимоги для нових одиничних дозованих форм за винаходом залежать від конкретної застосовуваної сполуки і ефекту, який може бути поліпшений, і фармакодинаміки, пов'язаної з кожною сполукою у пацієнта. [0134] Фармацевтично прийнятні ексципієнти, такі як наповнювачі, носії або розріджувачі легко доступні для суспільного застосування. Більше того, фармацевтично прийнятні допоміжні речовини, такі як pH регулюючі й буферні агенти, агенти що регулюють концентрацію, стабілізатори, зволожувачі тощо, легко доступні для суспільного застосування. Інші антивірусні або антифібротичні агенти. [0135] Як обговорювалося вище, спосіб за винаходом здійснювався введенням NS3 інгібітору, такого як сполука, описана тут, і необов'язково одного або більше додаткового антивірусного агенту (агентів). [0136] У деяких варіантах здійснення винаходу спосіб також включає введення одного або більше агоністів рецептора інтерферону. Агоністи рецептора інтерферону описані вище. [0137] В інших варіантах здійснення винаходу спосіб включає введення пірфенідона або пірфенідонових аналогів. Пірфенідон і його аналоги описувалися вище. [0138] Додаткові антивірусні агенти, які підходять для використання в комбінованій терапії включають, але не обмежуються, нуклеотидними і нуклеозидними аналогами. Приклади, що не обмежують обсяг домагань, включають азидотимідин (AZT) (зидовудин), його аналоги і похідні; 2',3'дидеоксиинозин (DDI) (диданозин), і його аналоги і похідні; 2',3'-дидеоксицитидин (DDC) (дидеоксицитидин), його аналоги і похідні; (2',3'дидеокситимідин (D4T) (ставудин), його аналоги і похідні; комбівір; абакавір; адефовір; дипоксил; цидофовір; рибавірин; його аналоги; тощо. [0139] У деяких варіантах здійснення винаходу спосіб включає введення рибавірину. Рибавірин, 1--D-рибофуранозил-1Н-1,2,4-тріазол-3карбоксамід, являє собою нуклеозидний аналог, доступний від ICN Pharmaceuticals, Inc., Costa Mesa, Calif., і описуваний у каталозі Merck, сполука № 8199. Одинадцяте видання. Його виробництво і лікарські форми описані в патенті США № 4,211,771. Винахід також розглядає використання похідних рибавірину (див. наприклад, патент США № 6,277,830). Рибавірин може бути введений пе 35 рорально у вигляді капсули або таблетки. Звичайно, розглядаються інші типи введення рибавірину, наскільки вони є доступними, такі як назальні спреї, трансдермальне введення, супозиторії, лікарська форма тривалої дії і так далі. Будь-яка форма введення буде працювати так довго, поки самі лікарські форми доставляються без руйнування активного інгредієнту. [0140] В деяких варіантах здійснення винаходу додатковий антивірусний агент вводиться протягом усього курсу лікування NS3 інгібуючими сполуками. В інших варіантах здійснення винаходу додатковий антивірусний агент вводиться протягом періоду часу, що перекривається згодом лікуванням NS3 інгібуючими сполуками, наприклад, лікування додатковим антивірусним агентом може починатися до початку лікування NS3 інгібуючими сполуками і закінчуватися раніше закінчення лікування NS3 інгібуючими сполуками; лікування додатковим антивірусним агентом може починатися після початку лікування NS3 інгібуючими сполуками і закінчуватися після закінчення лікування NS3 інгібуючими сполуками; лікування додатковим антивірусним агентом може починатися після початку лікування NS3 інгібуючими сполуками і закінчуватися раніше закінчення лікування NS3 інгібуючими сполуками; або лікування додатковим антивірусним агентом може починатися до початку лікування NS3 інгібуючими сполуками і закінчуватися після закінчення лікування NS3 інгібуючими сполуками. Способи лікування. Монотерапії [0141] Сполука за винаходом інгібітор NS3 може бути використана для лікування гострої або хронічної форми ВГС. У багатьох варіантах здійснення винаходу сполука інгібітор NS3 вводиться протягом періоду від приблизно 1 дня до приблизно 7 днів, або близько 1 тижня до приблизно 2 тижнів, або близько 2 тижнів до приблизно 3 тижнів, або близько 3 тижнів до приблизно 4 тижнів або близько 1 місяця до приблизно 2 місяців або близько 2 місяців до приблизно 3 місяців, близько 4 місяців до приблизно 6 місяців або близько 6 місяців до приблизно 8 місяців або близько 8 місяців до приблизно 12 місяців або, принаймні, протягом одного року і може бути введена в більш довгий проміжок часу. Сполука інгібітор NS3 може бути введена 5 разів у день, 4 рази в день, три рази в день, два рази в день, щодня, через день, два рази в тиждень, три рази в тиждень, один раз у тиждень, через тиждень, три рази на місяць або один раз на місяць. В інших варіантах здійснення винаходу сполука інгібітор NS3 вводиться безперервним вливанням. [0142] У багатьох варіантах здійснення винаходу сполука інгібітор NS3 за винаходом вводиться перорально. [0143] У зв'язку з вищеописаними способами введення для лікування вірусної інфекції ГС у пацієнта, сполука інгібітор NS3 за винаходом може бути введена пацієнтові в дозуванні від 0.01 мг до приблизно 100 мг/кг ваги пацієнта в день, розділеної від 1 до 5 доз у день. У деяких варіантах здійснення винаходу сполука інгібітор NS3 вводиться в 93990 36 дозуванні від приблизно 0.5 мг до приблизно 75 мг/кг ваги тіла людини в день, розділеної від 1 до 5 доз у день. [0144] Кількість активного інгредієнта, що може бути з'єднана з носієм для одержання дозованої форми може варіюватися залежно від пацієнта, якому призначають лікування і конкретного способу введення. Звичайна фармацевтична форма містить приблизно від 5% до приблизно 95% активного інгредієнту (по вазі). В інших варіантах здійснення винаходу, фармацевтична форма може містити приблизно від 20% до приблизно 80% активного інгредієнта. [0145] Фахівець у даній області легко визначить, що концентрація дози може змінюватися як функція від специфічної сполуки інгібітору NS3, серйозності симптомів, сприйнятливості пацієнта до побічних ефектів. Кращі дозування для даної сполуки інгібітору NS3 легко визначаються фахівцем у даній області техніки за допомогою безлічі засобів. Кращими засобами є ті, які визначають біологічну активність даного агоністу рецептора інтерферону. [0146] У багатьох варіантах здійснення винаходу вводяться множинні дози сполуки інгібітору NS3. Наприклад, сполука інгібітор NS3 вводиться один раз на місяць, два рази на місяць, три рази на місяць, через тиждень, один раз у тиждень, два рази в тиждень, три рази в тиждень, чотири рази в тиждень, п'ять разів у тиждень, шість разів у тиждень, через день, щодня, два рази в день, три рази в день, за період часу, що змінюється в діапазоні від одного дня до одного тижня, або від 2 тижнів до приблизно 4 тижнів, від 1 місяця до приблизно 2 місяців або від 2 місяців до приблизно 4 місяців, від 4 місяців до приблизно 6 місяців або від 6 місяців до приблизно 8 місяців або від 8 місяців до приблизно 12 місяців або від одного року до двох років або від двох років до чотирьох років або більше. Комбінована терапія з рибавірином. [0147] У деяких варіантах здійснення винаходу способи забезпечують комбіновану терапію, що включає введення сполуки інгібітора NS3, як описано вище, і ефективної кількості рибавірину. Рибавірин може бути введений у дозах приблизно 400 мг, приблизно 800 мг, близько 1000 мг, або близько 1200 мг у день. [0148] В одному варіанті здійснення, винахід забезпечує кожний з вищеописаних способів модифікованих для включення спільного введення пацієнтові терапевтично ефективної кількості рибавірину протягом бажаного курсу лікування сполукою інгібітором NS3. (0149] В іншому варіанті здійснення, винахід забезпечує кожний з вищеописаних способів модифікованих для включення спільного введення пацієнтові від 800 мг до приблизно 1200 мг рибавірину перорально в день протягом бажаного курсу лікування сполукою інгібітором NS3. В іншому варіанті здійснення, винахід забезпечує кожний з вищеописаних способів, модифікованих для включення спільного введення пацієнтові (а) 1000 мг рибавірину, введеного перорально в день, якщо вага тіла пацієнта менше 75 кг або (b) 1200 мг ри 37 бавірину перорально в день, якщо вага тіла пацієнта більше або дорівнює 75 кг, де щоденна доза рибавірину необов'язково ділиться на дві дози протягом бажаного курсу лікування сполукою інгібітором NS3. Комбінована терапія з левовірином. [0150] У деяких варіантах здійснення винаходу, способи розкривають комбіновану терапію, що включає введення сполуки інгібітору NS3, як описано вище, і ефективної кількості левовірину. Левовірин може бути введений у дозах приблизно від 30 до 60 мг, від 60 до 125 мг, від 125 мг до 200 мг, від 200 мг до 300 мг, від 300 мг до 400 мг, від 400 мг до 1200 мг, від 600 мг до 1000 мг, від 700 мг до 900 мг у день, або близько 10 мг/кг ваги тіла в день. У деяких варіантах здійснення винаходу, левовірин може бути введений у дозах приблизно 400 мг, приблизно 800 мг, близько 1000 мг, або близько 1200 мг у день протягом бажаного курсу лікування сполукою інгібітором NS3. Комбінована терапія з вірамідином. [0151] У деяких варіантах здійснення винаходу, способи розкривають комбіновану терапію, що включає введення сполуки інгібітору NS3, як описано вище, і ефективної кількості вірамідину. Вірамідин може бути введений у дозах приблизно від 30 до 60 мг, від 60 до 125 мг, від 125 мг до 200 мг, від 200 мг до 300 мг, від 300 мг до 400 мг, від 400 мг до 1200 мг, від 600 мг до 1000 мг, від 700 мг до 900 мг у день, або близько 10 мг/кг ваги тіла в день. У деяких варіантах здійснення винаходу, вірамідин може бути введений у дозах приблизно 800 мг, близько 1000 мг, або близько 1200 мг у день протягом бажаного курсу лікування сполукою інгібітором NS3. Комбіновані терапії з інгібіторами альфаглюкозидази. [0152] Підходящі інгібітори -глюкозидази включають кожний з описаних вище іміно-цукрів, що включають похідні іміно цукрів з довгим алкильним ланцюгом, як описано в публікації патенту США № 2004/0110795; інгібітори ендоплазмічних, пов'язаних з ретикулою -глюкозидаз; інгібітори мембран-зв'язаних -глюкозидаз; міглітол (Glyset®) його активні похідні і аналоги; акарбозу (Precose®), її активні похідні і аналоги. [0153] У багатьох варіантах здійснення винаходу, способи передбачають комбіновану терапію, що включає введення сполуки інгібітору NS3, як описано вище, і ефективної кількості інгібітору глюкозидази, що вводять протягом періоду приблизно від 1 дня до 7 днів або приблизно від 1 тижня до 2 тижнів, або приблизно від 2 тижнів до 3 тижнів, або приблизно від 3 до 4 тижнів, або приблизно від 1 місяця до 2 місяців або приблизно від 3 до 4 місяців, або приблизно від 4 до 6 місяців, або приблизно від 6 до 8 місяців або приблизно від 8 до 12 місяців або, принаймні, рік і може бути введена за більш тривалий часовий інтервал. [0154] Інгібітор -глюкозидази може бути введений 5 разів у день, 4 рази в день, три рази в день, два рази в день, один раз у день, через день, три рази в тиждень, два рази в тиждень, один раз у тиждень, через тиждень, три рази на місяць, або один раз на місяць. В інших варіантах 93990 38 здійснення винаходу, інгібітор -глюкозидази вводиться у вигляді тривалого вливання. [0155] У багатьох варіантах здійснення, інгібітор -глюкозидази вводиться перорально. [0156] У зв'язку з вищеописаними способами для лікування флавівірусної інфекції, лікування вірусу гепатиту С і лікування фіброзу печінки, що відбувається в результаті інфекції ВГС, способи забезпечують комбіновану терапію, що включає введення сполуки інгібітору NS3, як описано вище, і ефективної кількості інгібітору -глюкозидази, що вводять пацієнтові в дозах приблизно від 10 до 600 мг у день розділеними дозами, наприклад, приблизно від 10 мг до 30 мг у день, приблизно від 30 до 60 мг у день, приблизно від 60 до 75 мг у день, приблизно від 75 до 90 мг у день, приблизно від 90 до 120 мг у день, приблизно від 120 до 150 мг у день, приблизно від 150 до 180 мг у день, приблизно від 180 до 210 мг у день, приблизно від 210 до 240 мг у день, приблизно від 240 до 270 мг у день, приблизно від 270 до 300 мг у день, приблизно від 300 до 360 мг у день, приблизно від 360 до 420 мг у день, приблизно від 420 мг до 480 мг у день або приблизно від 480 до 600 мг у день. [0157] У деяких варіантах здійснення винаходу, способи передбачають комбіновану терапію, що включає введення сполука інгібітору NS3, як описано вище і ефективної кількості інгібітору глюкозидази, що вводять у дозі приблизно 10 мг три рази в день. У деяких варіантах здійснення винаходу, інгібітор-глюкозидази, вводять у дозі приблизно 15 мг три рази в день. У деяких варіантах здійснення винаходу, інгібітор -глюкозидази, вводять у дозі приблизно 20 мг три рази в день. У деяких варіантах здійснення винаходу, інгібітор глюкозидази, вводять у дозі приблизно 25 мг три рази в день. У деяких варіантах здійснення винаходу, інгібітор -глюкозидази, вводять у дозі приблизно 30 мг три рази в день. У деяких варіантах здійснення винаходу, інгібітор -глюкозидази, вводять у дозі приблизно 40 мг три рази в день. У деяких варіантах здійснення винаходу, інгібітор глюкозидази, вводять у дозі приблизно 50 мг три рази в день. У деяких варіантах здійснення винаходу, інгібітор -глюкозидази, вводять у дозі приблизно 100 мг три рази в день. У деяких варіантах здійснення винаходу, інгібітор -глюкозидази, вводять у дозі приблизно від 75 мг до 150 мг у день двома або трьома розділеними дозами, коли вага пацієнта становить 60 кг або менше. У деяких варіантах здійснення винаходу, інгібітор глюкозидази, вводять у дозі приблизно від 75 мг до 300 мг у день двома або трьома розділеними дозами, коли вага пацієнта становить 60 кг або більше. [0158] Кількість активного інгредієнту (наприклад, інгібітору -глюкозидази), що може бути об'єднана з матеріалом носієм для одержання лікарської форми може змінюватися залежно від пацієнта і конкретного способу введення. Звичайна фармацевтична форма може містити приблизно від 5% до 95% активного інгредієнту (по вазі). В інших варіантах здійснення винаходу, фармацев 39 тична форма може містити приблизно від 20% до 80% активного інгредієнту. [0159] Фахівець у даній області легко оцінить, що рівень доз може змінюватися як функція від специфічного інгібітору -глюкозидази, серйозності симптомів і чутливості об'єкта до побічних дій. Кращі дози для даного інгібітору -глюкозидази легко визначаються фахівцем в області техніки за допомогою різних засобів. Звичайні засоби - це вимір фізіологічної активності даного активного агента. [0160] У багатьох варіантах здійснення винаходу вводяться множинні дози інгібітору глюкозидази. Наприклад, способи передбачають комбіновану терапію, що включає введення сполуки інгібітору NS3, як описано вище і ефективної кількості інгібітору -глюкозидази, один раз на місяць, два рази на місяць, три рази на місяць, через тиждень, один раз у тиждень, два рази в тиждень, три рази в тиждень, чотири рази в тиждень, п'ять разів у тиждень, шість разів у тиждень, через день, щодня, два рази в день, три рази в день, за період часу, що змінюється в діапазоні від одного дня до одного тижня, або від 2 тижнів до приблизно 4 тижнів, від 1 місяця до приблизно 2 місяців або від 2 місяців до приблизно 4 місяців, від 4 місяців до приблизно 6 місяців або від 6 місяців до приблизно 8 місяців або від 8 місяців до приблизно 12 місяців або від одного року до двох років або від двох років до чотирьох років або більше. Комбінована терапія з тимозином-. [0161] У деяких варіантах здійснення винаходу, способи забезпечують комбіновану терапію, що включає введення сполуки інгібітору NS3, як описано вище, і ефективної кількості тимозину-. Тимозин- (Zadaxin™) звичайно вводиться підшкірною ін'єкцією. Тимозин- може бути введений три рази в день, два рази в день, щодня, через день, два рази в тиждень, три рази в тиждень, один раз у тиждень, через тиждень, три рази на місяць або один раз на місяць, необов'язково безупинно або безупинно протягом бажаного курсу лікування сполукою інгібітором NS3. У багатьох варіантах здійснення винаходу тимозин- вводиться два рази в тиждень протягом бажаного курсу лікування сполукою інгібітором NS3. Ефективні дозування тимозину- змінюються в діапазоні від 0.5 мг до приблизно 5 мг, наприклад, приблизно від 0.5 мг до 1.0 мг, від 1.0 мг до 1.5 мг, від 1.5 мг до 2.0 мг, від 2.0 мг до 2.5 мг, від 2.5 мг до 3.0 мг, від 3.0 мг до 3.5 мг, від 3.5 мг до 4.0 мг, від 4.0 мг до 4.5 мг, або від 4.5 мг до приблизно 5.0 мг. У конкретних варіантах здійснення винаходу тимозин- вводиться в дозуваннях, що містять кількість 1.0 мг або 1.6 мг. [0162] Тимозин- вводиться протягом інтервалу часу, що змінюється від одного дня до одного тижня, або від 2 тижнів до приблизно 4 тижнів, від близько 1 місяця до приблизно 2 місяців або від близько 2 місяців до приблизно 4 місяців, від близько 4 місяців до приблизно 6 місяців або від близько 6 місяців до приблизно 8 місяців або від близько 8 місяців до приблизно 12 місяців або від одного року до двох років або від двох років до 93990 40 чотирьох років або більше. В одному варіанті здійснення винаходу, тимозин- вводиться протягом усього бажаного курсу лікування сполукою інгібітором NS3. Комбіновані терапії з інтерфероном (інтерферонами) [0163] У багатьох варіантах здійснення винаходу, способи забезпечують комбіновану терапію, що включає введення сполуки інгібітору NS3, як описано вище, і ефективної кількості агоністу рецептора інтерферону. У деяких варіантах здійснення винаходу сполука, описана тут, і агоністи рецепторів інтерферону Типу І або III вводяться спільно в способах лікування за винаходом. Агоністи рецепторів інтерферону І типу, що підходять для використання тут, включають будь-який інтерферон- (IFN-). У деяких варіантах здійснення винаходу, інтерферон- являє собою ПЕГільований (PEGylated) інтерферон-. У деяких варіантах здійснення винаходу, інтерферон- являє собою консенсусний інтерферон, такий як INFERGEN® інтерферон альфакон-1. У ще деяких інших варіантах здійснення винаходу, інтерферон- являє собою монопегільований (лінійний, 30 kD) консенсусний інтерферон. [0164] Ефективні дози IFN- змінюються від приблизно 3 μg (μг мкг) до 27 μΓ, від 4 MO (MU) до 10 МО, від приблизно 90 μг до 180 μг або від близько 18 μг до приблизно 90 μг. Ефективні дозування Infergen® консенсусного IFN- включають приблизно 3 μг приблизно 6 μг, приблизно 9 μг, приблизно 12 μг, приблизно 15 μг, приблизно 18 μг, приблизно 21 μг, приблизно 24 μг, приблизно 27 μг, приблизно 30 μг ліків на дозу. Ефективні дозування IFN-2a і IFN-2b змінюються від 3 мільйонних одиниць (МО) до 10 МО на дозу. Ефективні дозування PEGASYS® ПЕГільованого IFN2a, містять лікарський засіб у кількості приблизно від 90 μг до 270 μг або приблизно 180 μг на дозу. Ефективні дозування ΠΕΓ-INTRON® ПЕГільваного IFN-2b, містять кількість приблизно від 0.5 μг до 3.0 μг ліків на кг ваги тіла на дозу. Ефективні дозування ПЕГільованого консенсусного інтерферону (PEG CIFN) містять приблизно від 18 μг до 90 μг або від 27 μг до 60 μг або приблизно 45 μг амінокислоти на кг ваги на дозу PEG CIFN. Ефективні дозування монопегільованого (30 kD, лінійного) CIFN містять кількість приблизно від 45 μг до приблизно 270 μг, або приблизно від 60 μг до 180 μг або приблизно від 90 μг до 120 μг або від 90 μг до 120 μг лікарського засобу на дозу. IFN- може бути введений щодня, через день, один раз у тиждень, три рази в тиждень, через тиждень, три рази на місяць, один раз на місяць, в основному безупинно або безупинно. [0165] У багатьох варіантах здійснення винаходу, агоністи рецепторів інтерферону типу І або типу III і/або типу II вводяться протягом періоду від приблизно 1 дня до приблизно 7 днів, або близько 1 тижня до приблизно 2 тижнів, або близько 2 тижнів до приблизно 3 тижнів, або близько 3 тижнів до приблизно 4 тижнів або близько 1 місяця до приблизно 2 місяців або близько 2 місяців до приблизно 3 місяців, близько 4 місяців до приблизно 6 мі 41 сяців або близько 6 місяців до приблизно 8 місяців або близько 8 місяців до приблизно 12 місяців або, принаймні, протягом одного року і можуть бути введені в більш довгий проміжок часу. Режими дозування можуть включати введення три рази в день, два рази в день, щодня, через день, два рази в тиждень, три рази в тиждень, один раз у тиждень, через тиждень, три рази на місяць або один раз на місяць. У деяких варіантах здійснення винаходу, винахід розкриває будь-який з вищеописаних способів, в яких бажана кількість IFN- вводиться підшкірно пацієнтові болісною ін'єкцією щодня, через день, два рази в тиждень, три рази в тиждень, один раз у тиждень, через тиждень, три рази на місяць або один раз на місяць або вводиться пацієнтові підшкірно в день необов'язково безперервною або безперервною доставкою протягом бажаного лікування. В інших варіантах здійснення винаходу, винахід розкриває будь-який з вищеописаних способів в яких бажана кількість ПЕГільованого IFN- (PEG-IFN-) вводиться підшкірно пацієнтові болісною доставкою один раз у тиждень, через тиждень, три рази на місяць або один раз на місяць протягом бажаного лікування. [0166] В інших варіантах здійснення винаходу, сполука інгібітор NS3 і агоніст рецепторів інтерферону тип II вводиться спільно в способах лікування за винаходом. Агоніст рецепторів інтерферону тип II, що підходить для використання тут, також включає інтерферон- (IFN-). [0167] Ефективні дозування IFN- можуть змі2 2 нюватися від приблизно 0.5 μг/м до 500 μг/м , 2 2 звичайно від 1.5 μг/м до 200 μг/м , залежно від ваги пацієнта. Ця активність ґрунтується на 106 міжнародних одиниць (О) на 50 μг протеїну. IFN- може бути введений щодня, через день, три рази в тиждень або в основному безупинно або безупинно. [0168] У специфічних варіантах здійснення винаходу, що представляють інтерес, IFN- вводиться пацієнтові в одиничній дозованій формі від приблизно 25 μг до приблизно 500 μг, від приблизно 50 μг до 400 μг або від 100 μг до 300 μг. У конкретних варіантах здійснення винаходу, що представляють інтерес, доза введення становить 200 μг IFN-. У багатьох варіантах здійснення винаходу, що представляють інтерес, вводиться IFN-1b. [0169] Де дозування становить 200 μг на дозу, кількість IFN- на вагу тіла (якщо вага тіла становить від 45 до 135 кг) перебуває в межах від 4.4 μг IFN- на кг ваги тіла до приблизно 1.48 μг IFN- на кг ваги тіла. [0170] Поверхня тіла розглянутих пацієнтів звичайно змінюється від 1.33 м2 до приблизно 2.50 м2. Таким чином, у багатьох варіантах здійснення винаходу, дозування IFN- міняється від 150 μг/м2 до приблизно 20 μг/м2. Наприклад, дозування IFN змінюється від приблизно 20 μг/м2 до 30 μг/м2, від 30 μг/м2 до 40 μг/м2, від 40 μг/м2 до 50 μг/м2, від 50 μг/м2до 60 μг/м2, від 60 μг/м2 до 70 μг/м2, від 70 μг/м2 до 80 μг/м2, від 80 μг/м2 до 90 μг/м2, від 90 μг/м2 до 100 μг/м2, від 100 μг/м2 до 110 μг/м2, від 110 μг/м2 до 120 μг/м2, від 120 μг/м2 до 130 μг/м2, від 130 μг/м2 до 140 μг/м2, від 140 μг/м2 до 150 93990 42 μг/м2. У деяких варіантах здійснення винаходу дозувальна група змінюється від 25 μг/м2 до приблизно 100 μг/м2. В інших варіантах здійснення винаходу дозувальна група змінюється від 25 μг/м2 2 до приблизно 50 μг/м . [0171] У деяких варіантах здійснення винаходу агоніст рецепторів інтерферону тип І або тип III вводиться в першому режимі дозування, за яким має бути другий режим дозування. Перший режим дозування введення агоністів рецепторів інтерферону типу І або типу III (також поіменований як «режим введення») звичайно включає введення більш високої дози агоністу рецепторів інтерферону типу II або типу III. Наприклад, у випадку Infergen® консенсусного IFN- (CIFN), перший режим дозування включає введення CIFN приблизно 9 μг, 15 μг, 18 μг, 27 μг. Перший режим дозування може включати одну дозовану подію або, принаймні, дві або більше дозованих події. Перший режим дозування введення агоністів рецепторів інтерферону типу І або типу III може бути здійснений щодня, через день, три рази в тиждень, через тиждень, три рази на місяць, один раз на місяць, в основному безупинно або безупинно. [0172] Перший режим дозування введення агоністів рецепторів інтерферону типу І або типу III протягом першого періоду часу, де період часу може тривати 4 тижня, принаймні, 8 тижнів або, принаймні, приблизно 12 тижнів. [0173] Другий режим дозування введення агоністів рецепторів інтерферону типу II або типу III (також поіменований як «режим підтримки») звичайно включає введення більш низької дози агоніста рецепторів інтерферону типу II або типу III. Наприклад, у випадку CIFN, другий режим дозування включає введення CIFN, принаймні, приблизно 3 μг, 9 μг, 15 μг, 18 μг. Другий режим дозування може включати одну дозовану подію або, принаймні, дві або більше дозованих події. [0174] Другий режим дозування введення агоністів рецепторів інтерферону типу І або типу III може бути здійснений щодня, через день, три рази в тиждень, через тиждень, три рази на місяць, один раз на місяць, в основному безупинно або безупинно. [0175] У деяких варіантах здійснення винаходу, де здійснюється режим «введення/підтримки» агоністів рецепторів інтерферону типу І або типу III, «ініціююча» доза агоністів рецепторів інтерферону типу II (наприклад, IFN-) включається. У цих варіантах здійснення винаходу ІФН- вводиться протягом періоду часу від 1 до 14 днів або приблизно від 2 до 10 днів або від 3 до 7 днів перед початком лікування агоністами рецепторів інтерферону типу І або типу llІ. Цей період часу іменується як «ініціююча фаза». [0176] У деяких із цих варіантів здійснення винаходу лікування агоністами рецепторів інтерферону типу II триває протягом усього курсу лікування агоністами рецепторів інтерферону типу І або типу III. В інших варіантах здійснення винаходу, лікування агоністами рецепторів інтерферону типу II припиняється перед кінцем лікування агоністами рецепторів інтерферону типу І або типу III. У цих варіантах здійснення винаходу загальний час ліку 43 вання агоністами рецепторів інтерферону типу II (включаючи «ініціюючу фазу») становить приблизно від 2 днів до 30 днів, від 8 днів до 20 днів, від 10 днів до 18 днів або від 12 днів до 16 днів. У ще інших варіантах здійснення винаходу, лікування агоністами рецепторів інтерферону типу II припиняється, як тільки починається лікування агоністами рецепторів інтерферону типу І або типу III. [0177] В інших варіантах здійснення винаходу, агоністи рецепторів інтерферону типу І або типу III вводяться в індивідуальному режимі дозування. Наприклад, у випадку CIFN, доза CIFN звичайно змінюється від приблизно 3 μг до 15 μг, від приблизно 9 μг до 15 μг. Доза агоністів рецепторів інтерферону типу І або типу III звичайно вводиться щодня, через день, три рази в тиждень, через тиждень, три рази на місяць, один раз на місяць, в основному безупинно або безупинно. Доза агоністів рецепторів інтерферону типу І або типу III звичайно вводиться протягом деякого періоду часу, де період часу може бути, наприклад, від, принаймні, приблизно 24 тижнів до 48 тижнів або довше. [0178] У деяких варіантах здійснення винаходу, де індивідуальний режим введення агоністів рецепторів інтерферону типу І або типу III здійснюється, звичайно вводиться «ініціююча доза» агоністу рецептора інтерферону типу II (наприклад, IFN-). У цих варіантах здійснення винаходу IFN- вводиться протягом періоду часу від 1 до 14 днів або приблизно від 2 до 10 днів або від 3 до 7 днів перед початком лікування агоністами рецепторів інтерферону типу І або типу III. Цей період часу іменується як «ініціююча фаза». У деяких із цих варіантів здійснення винаходу лікування агоністами рецепторів інтерферону типу II триває протягом усього курсу лікування агоністами рецепторів інтерферону типу І або типу III. В інших варіантах здійснення винаходу, лікування агоністами рецепторів інтерферону типу II припиняється перед кінцем лікування агоністами рецепторів інтерферону типу І або типу III. У цих варіантах здійснення винаходу загальний час лікування агоністами рецепторів інтерферону типу II (включаючи «ініціюючу фазу») становить приблизно від 2 днів до 30 днів, від 8 днів до 20 днів, від 10 днів до 18 днів або від 12 днів до 16 днів. У ще інших варіантах здійснення винаходу, лікування агоністами рецепторів інтерферону типу II припиняється, як тільки починається лікування агоністами рецепторів інтерферону типу І або типу III. [0179] У додаткових варіантах здійснення винаходу сполука інгібітор NS3, агоністи рецепторів інтерферону типу І або типу III, агоністи рецепторів інтерферону типу II вводяться спільно протягом бажаного часу лікування у відповідності зі способами за винаходом. У деяких варіантах здійснення винаходу, сполука інгібітор NS3, інтерферон- і який-небудь інтерферон- вводяться спільно протягом бажаного часу лікування у відповідності зі способами за винаходом. [0180] У деяких варіантах здійснення, винахід розкриває способи, використовуючи кількість агоністів рецепторів інтерферону типу І або типу III, агоністів рецепторів інтерферону типу II і сполуки інгібітору NS3, ефективну для лікування вірусної 93990 44 інфекції ГС у пацієнта. У деяких варіантах здійснення, винахід розкриває способи з використанням ефективної кількості IFN-, IFN- і сполуки інгібітору NS3 для лікування вірусної інфекції ГС у пацієнта. В одному з варіантів здійснення, винахід розкриває спосіб з використанням ефективної кількості консенсусного IFN-, IFN- і сполуки інгібітору NS3 для лікування вірусної інфекції ГС у пацієнта. [0181] Звичайно, ефективна кількість консенсусного інтерферону (CIFN) і IFN-, що підходить для використання в способах за винаходом, забезпечується за допомогою співвідношення 1 μг CIFN: 10 μг IFN-, де обоє CIFN і IFN- є неПЕГільованими і неглікозильованими видами. [0182] В одному з варіантів здійснення, винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості INFERGEN® консенсусного IFN- і IFN- при лікуванні вірусної інфекції ГС у пацієнта, що включає введення пацієнтові дози INFERGEN®, що містить у кількості від 1 μг до 30 μг ліків на дозу INFERGEN®, підшкірно щодня, через день, три рази в тиждень, через тиждень, три рази на місяць, один раз на місяць, в основному безупинно або безупинно в комбінації з дозою IFN- утримуючу кількість від приблизно 10 μг до 300 μг ліків на дозу IFN-, підшкірно щодня, через день, три рази в тиждень, через тиждень, три рази на місяць, один раз на місяць, в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0183] В іншому варіанті здійснення, винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості INFERGEN® консенсусного IFN- і IFN- при лікуванні вірусної інфекції у пацієнта, що включає введення пацієнтові дози INFERGEN®, що містить у кількості від 1 μг до 9 μг ліків на дозу INFERGEN®, підшкірно щодня, через день, три рази в тиждень, через тиждень, три рази на місяць, один раз на місяць або за день в основному безупинно або безупинно в комбінації з дозою IFN утримуючу кількість від приблизно 10 μг до 100 μг ліків на дозу IFN-, підшкірно щодня, через день, три рази в тиждень, через тиждень, три рази на місяць, один раз на місяць, в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0184] В іншому варіанті здійснення, винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості INFERGEN® консенсусного IFN- і IFN- при лікуванні вірусної інфекції у пацієнта, що включає введення пацієнтові дози INFERGEN®, що містить 1 μг ліків на дозу INFERGEN®, підшкірно щодня, через день, три рази в тиждень, через тиждень, три рази на місяць, один раз на місяць або на день в основному безупинно або безупинно в комбінації з дозою IFN- утримуючу кількість від приблизно 10 μг до 50 μг ліків на дозу IFN-, підшкірно щодня, через день, три рази в тиждень, через тиждень, три рази на місяць, один раз на місяць, в основно 45 му безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0185] В іншому варіанті здійснення, винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості INFERGEN® консенсусного IFN- і IFN- при лікуванні вірусної інфекції в пацієнта, що включає введення пацієнтові дози INFERGEN®, що містить у кількості приблизно 9 μг ліків на дозу INFERGEN®, підшкірно щодня, через день, три рази в тиждень, через тиждень, три рази на місяць, один раз на місяць або за день в основному безупинно або безупинно в комбінації з дозою IFN утримуючу кількість від приблизно 90 μг до 100 μг ліків на дозу IFN-, підшкірно щодня, через день, три рази в тиждень, через тиждень, три рази на місяць, один раз на місяць, в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0186] В іншому варіанті здійснення, винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості INFERGEN® консенсусного IFN- і IFN- при лікуванні вірусної інфекції в пацієнта, що включає введення пацієнтові дози INFERGEN®, що містить у кількості приблизно 30 μг ліків на дозу INFERGEN®, підшкірно щодня, через день, три рази в тиждень, через тиждень, три рази на місяць, один раз на місяць або за день в основному безупинно або безупинно в комбінації з дозою IFN утримуючу кількість від приблизно 200 μг до 300 μг ліків на дозу IFN-, підшкірно щодня, через день, три рази в тиждень, через тиждень, три рази на місяць, один раз на місяць, в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0187] В іншому варіанті здійснення, винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості ПЕГільованого консенсусного IFN-, і IFN- при лікуванні вірусної інфекції у пацієнта, що включає введення пацієнтові дози ПЕГільованого консенсусного IFN-, (PEG-CIFN) що містить у кількості від 4 μг до 60 μг CIFN амінокислотної ваги на дозу PEG-CIFN підшкірно щотижня, через тиждень, три рази на місяць, один раз на місяць або за день в основному безупинно або безупинно в комбінації із загальною щотижневою дозою IFN- утримуючу кількість від приблизно 30 μг до 1000 μг ліки за тиждень поділеного на дози, що вводять підшкірно щодня, через день, три рази в тиждень, через тиждень, три рази на місяць, один раз на місяць, в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0188] В іншому варіанті здійснення, винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості ПЕГільованого консенсусного IFN- і IFN- при лікуванні вірусної інфекції у пацієнта, що включає введення пацієнтові дози ПЕГільованого консенсусного IFN- (PEG-CIFN), що містить у кількості від 18 μг до 24 μг ваги амінокислоти CIFN на дозу PEG-CIFN підшкірно щотижня, через тиж 93990 46 день, три рази на місяць, один раз на місяць або за день в основному безупинно або безупинно в комбінації із загальною щотижневою дозою IFN- утримуючу кількість від приблизно 100 μг до 300 μг ліків за тиждень поділеного на дози, що вводять підшкірно щодня, через день, три рази в тиждень, через тиждень, три рази на місяць, один раз на місяць, в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0189] Звичайно, ефективна кількість IFN-2a або 2b або 2с і IFN-, що підходять для використання в способах за винаходом, забезпечується за допомогою співвідношення доз 1 мільйонна одиниця (MO) IFN-2a або 2b або 2с : 30 μг IFN-, які не є ПЕГільованими або глікозованими видами. [0190] В іншому варіанті здійснення, винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості IFN-2a або 2b або 2с і IFN- при лікуванні вірусної інфекції в пацієнта, що включає введення пацієнтові дози IFN-2a або 2b або 2с, що містить у кількості приблизно від 1 МО до 20 МО ліків на дозу IFN-2a або 2b або 2с підшкірно щодня, через день, два рази в тиждень, три рази в тиждень або за день в основному безупинно або безупинно в комбінації з дозою IFN-, що містить кількість від приблизно 30 μг до 600 μг ліків на дозу IFN-, підшкірно щодня, через день, три рази в тиждень, через тиждень, три рази на місяць, один раз на місяць, в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0191] В іншому варіанті здійснення, винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості IFN-2a або 2b або 2с і IFN- при лікуванні вірусної інфекції в пацієнта, що включає введення пацієнтові дози IFN-2a або 2b або 2с, що містить у кількості приблизно 3 МО ліків на дозу IFN-2a або 2b або 2с підшкірно щодня, через день, два рази в тиждень, три рази в тиждень або на день в основному безупинно або безупинно в комбінації з дозою IFN-, що містить кількість приблизно 100 μг ліків на дозу IFN-, підшкірно щодня, через день, три рази в тиждень, через тиждень, три рази на місяць, один раз на місяць, в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0192] В іншому варіанті здійснення, винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості IFN-2a або 2b або 2с і IFN- при лікуванні вірусної інфекції в пацієнта, що включає введення пацієнтові дози IFN-2a або 2b або 2с, що містить у кількості приблизно 10 МО ліків на дозу IFN-2a або 2b або 2с підшкірно щодня, через день, два рази в тиждень, три рази в тиждень або за день в основному безупинно або безупинно в комбінації з дозою IFN-, що містить кількість приблизно 300 μг ліків на дозу IFN-, підшкірно щодня, через день, три рази в тиждень, через тиждень, три рази на місяць, один раз на місяць, в основному безупинно 47 або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0193] В іншому варіанті здійснення, винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості PEGASYS® ПЕГільованого IFN-2a і IFN- при лікуванні вірусної інфекції у пацієнта, що включає введення пацієнтові дози PEGASYS®, що містить у кількості приблизно від 90 μг до 360 μг ліків на дозу PEGASYS® підшкірно раз у тиждень, через тиждень, три рази на місяць або щомісяця в комбінації із загальною щотижневою дозою IFN- утримуючу кількість від приблизно 30 μг до 1000 μг ліків на тиждень поділеної на дози, що вводять підшкірно щодня, через день, два рази в тиждень, три рази в тиждень, що вводять в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0194] В іншому варіанті здійснення, винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості PEGASYS® ПЕГільованого IFN-2a і IFN- при лікуванні вірусної інфекції у пацієнта, що включає введення пацієнтові дози PEGASYS®, що містить у кількості приблизно 180 μг ліків на дозу PEGASYS® підшкірно раз у тиждень, через тиждень, три рази на місяць або щомісяця в комбінації із загальною щотижневою дозою IFN- утримуючу кількість від приблизно 100 μг до 300 μг ліків за тиждень поділеної на дози, що вводять підшкірно щодня, через день, два рази в тиждень, три рази в тиждень, що вводять в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0195] В іншому варіанті здійснення, винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості PEG INTRON® ПЕГільованого IFN-2b і IFN- при лікуванні вірусної інфекції у пацієнта, що включає введення пацієнтові дози PEG INTRON®, що містить у кількості приблизно від 0.75 μг до 3.0 μг ліків на кг ваги тіла на дозу PEG INTRON® підшкірно раз у тиждень, через тиждень, три рази на місяць або щомісяця в комбінації із загальною щотижневою дозою IFN- утримуючу кількість від приблизно 30 μг до 1000 μг ліків на тиждень поділеної на дози, що вводять підшкірно щодня, через день, два рази в тиждень, три рази в тиждень, що вводять в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0196] В іншому варіанті здійснення, винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості PEG INTRON® ПЕГільованого IFN-2b і IFN- при лікуванні вірусної інфекції у пацієнта, що включає введення пацієнтові дози PEG INTRON®, що містить у кількості приблизно 1.5 μг ліків на кг ваги тіла на дозу PEG INTRON® підшкірно раз у тиждень, через тиждень, три рази на місяць або щомісяця в комбінації із загальною щотижневою дозою IFN- утримуючу кількість від приблизно 100 μг до 300 μг ліків за тиждень поділеної на дози, що вводять підшкірно щодня, через день, два рази в тиждень, три рази в тиждень, що вводять в основ 93990 48 ному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0197] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і будь-який режим 9 μг INFERGEN® консенсусного IFN-, що вводять підшкірно щодня або два рази в тиждень і рибавірин, що вводять перорально щодня, де тривалість терапії становить 48 тижнів. У цьому варіанті рибавірин вводиться в кількості 1000 мг для пацієнтів, що важать менше 75 кг і 1200 мг для пацієнтів, що важать 75 кг і більше. [0198] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і будь-який режим 9 μг INFERGEN® консенсусного IFN-, що вводять підшкірно щодня або два рази в тиждень; 50 μг Actimmune® людського IFN-1b, що вводять підшкірно два рази в тиждень; і рибавірин, що вводять перорально щодня, де тривалість терапії становить 48 тижнів. У цьому варіанті рибавірин вводиться в кількості 1000 мг для пацієнтів, що важать менше 75 кг і 1200 мг для пацієнтів, що важать 75 кг і більше. [0199] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і будь-який режим 9 μг INFERGEN® консенсусного IFN-, що вводять підшкірно щодня або два рази в тиждень; 100 μг Actimmune® людського IFN-1b, що вводять підшкірно два рази в тиждень; і рибавірин, що вводять перорально щодня, де тривалість терапії становить 48 тижнів. У цьому варіанті рибавірин вводиться в кількості 1000 мг для пацієнтів, що важать менше 75 кг і 1200 мг для пацієнтів, що важать 75 кг і більше. [0200] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і будь-який режим 9 μг INFERGEN® консенсусного IFN-, що вводять підшкірно щодня або два рази в тиждень; і 50 μг Actimmune® людського IFN-1b, що вводять підшкірно два рази в тиждень, де тривалість терапії становить 48 тижнів. [0201] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і який-небудь режим 9 μг INFERGEN® консенсусного IFN-, що вводять підшкірно щодня або два рази в тиждень; і 100 μг Actimmune® людського IFN-1b, що вводять підшкірно два рази в тиждень; де тривалість терапії становить 48 тижнів. [0202] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і будь-який режим 9 μг INFERGEN® консенсусного IFN-, що вводять підшкірно щодня або два рази в тиждень; 25 μг Actimmune® людського IFN-1b, що 49 вводять підшкірно два рази в тиждень; і рибавірин, що вводять перорально щодня, де тривалість терапії становить 48 тижнів. У цьому варіанті рибавірин вводиться в кількості 1000 мг для пацієнтів, що важать менше 75 кг і 1200 мг для пацієнтів, що важать 75 кг і більше. [0203] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і будь-який режим 9 μг INFERGEN® консенсусного IFN-, що вводять підшкірно щодня або два рази в тиждень; 200 μг Actimmune® людського IFN-1b, що вводять підшкірно два рази в тиждень; і рибавірин, що вводять перорально щодня, де тривалість терапії становить 48 тижнів. У цьому варіанті рибавірин вводиться в кількості 1000 мг для пацієнтів, що важать менше 75 кг і 1200 мг для пацієнтів, що важать 75 кг і більше. [0204] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і будь-який режим 9 μг INFERGEN® консенсусного IFN-, що вводять підшкірно щодня або два рази в тиждень; і 25 μг Actimmune® людського IFN-1b, що вводять підшкірно два рази в тиждень, де тривалість терапії становить 48 тижнів. [0205] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і будь-який режим 9 μг INFERGEN® консенсусного IFN-, що вводять підшкірно щодня або два рази в тиждень; і 200 μг Actimmune® людського IFN-1b, що вводять підшкірно два рази в тиждень; де тривалість терапії становить 48 тижнів. [0206] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і який-небудь режим 100 μг моноПЕПльованого (30 kD, лінійного) консенсусного IFN-, що вводять підшкірно кожні десять днів або один раз у тиждень; і рибавірин, що вводять перорально щодня, де тривалість терапії становить 48 тижнів. У цьому варіанті рибавірин вводиться в кількості 1000 мг для пацієнтів, що важать менше 75 кг і 1200 мг для пацієнтів, що важать 75 кг і більше. [0207] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і будь-який режим 100 μг моноПЕГільованого (30 kD, лінійного) консенсусного IFN-, що вводять підшкірно кожні десять днів або один раз у тиждень; і 50 μг Actimmune® людського IFN-1b, що вводять підшкірно два рази в тиждень; і рибавірин, що вводять перорально щодня, де тривалість терапії становить 48 тижнів. У цьому варіанті рибавірин вводиться в кількості 1000 мг для пацієнтів, що важать менше 75 кг і 1200 мг для пацієнтів, що важать 75 кг і більше. [0208] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних спо 93990 50 собів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і будь-який режим 100 μг моноПЕГільованого (30 kD, лінійного) консенсусного IFN-, що вводять підшкірно кожні десять днів або один раз у тиждень; і 100 μг Actimmune® людського IFN-1b, що вводять підшкірно два рази в тиждень; і рибавірин, що вводять перорально щодня, де тривалість терапії становить 48 тижнів. У цьому варіанті рибавірин вводиться в кількості 1000 мг для пацієнтів, що важать менше 75 кг і 1200 мг для пацієнтів, що важать 75 кг і більше. [0209] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і будь-який режим 100 μг моноПЕГільованого (30 kD, лінійного) консенсусного IFN-, що вводять підшкірно кожні десять днів або один раз у тиждень; і 50 μг Actimmune® людського IFN-1b, що вводять підшкірно два рази в тиждень, де тривалість терапії становить 48 тижнів. [0210] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і будь-який режим 100 μг моноПЕГільованого (30 kD, лінійного) консенсусного IFN-, що вводять підшкірно кожні десять днів або один раз у тиждень; і 100 μг Actimmune® людського IFN-1b, що вводять підшкірно два рази в тиждень; де тривалість терапії становить 48 тижнів. [0211] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і будь-який режим 150 μг моноПЕГільованого (30 kD, лінійного) консенсусного IFN-, що вводять підшкірно кожні десять днів або один раз у тиждень; і рибавірин, що вводять перорально щодня, де тривалість терапії становить 48 тижнів. У цьому варіанті рибавірин вводиться в кількості 1000 мг для пацієнтів, що важать менше 75 кг і 1200 мг для пацієнтів, що важать 75 кг і більше. [0212] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і будь-який режим 150 μг моноПЕГільованого (30 kD, лінійного) консенсусного IFN-, що вводять підшкірно кожні десять днів або один раз у тиждень; і 50 μг Actimmune® людського IFN-1b, що вводять підшкірно два рази в тиждень; і рибавірин, що вводять перорально щодня, де тривалість терапії становить 48 тижнів. У цьому варіанті рибавірин вводиться в кількості 1000 мг для пацієнтів, що важать менше 75 кг і 1200 мг для пацієнтів, що важать 75 кг і більше. [0213] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і будь-який режим 150 μг моноПЕГільованого (30 kD, лінійного) консенсусного IFN-, що вводять 51 підшкірно кожні десять днів або один раз у тиждень; і 100 μг Actimmune® людського IFN-1b, що вводять підшкірно два рази в тиждень; і рибавірин, що вводять перорально щодня, де тривалість терапії становить 48 тижнів. У цьому варіанті рибавірин вводиться в кількості 1000 мг для пацієнтів, що важать менше 75 кг і 1200 мг для пацієнтів, що важать 75 кг і більше. [0214] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і будь-який режим 150 μг моноПЕГільованого (30 kD, лінійного) консенсусного IFN-, що вводять підшкірно кожні десять днів або один раз у тиждень; і 50 μг Actimmune® людського IFN-1b, що вводять підшкірно два рази в тиждень, де тривалість терапії становить 48 тижнів. [0215] В одному з варіантів здійснення, даний винахід розкриває будь-який з вищеописаних способів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і будь-який режим 150 μг моноПЕГільованого (30 kD, лінійного) консенсусного IFN-, що вводять підшкірно кожні десять днів або один раз у тиждень; і 100 μг Actimmune® людського IFN-1b, що вводять підшкірно два рази в тиждень, де тривалість терапії становить 48 тижнів. [0216] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і будь-який режим 200 μг моноПЕГільованого (30 kD, лінійного) консенсусного IFN-, що вводять підшкірно кожні десять днів або один раз у тиждень; і рибавірину, що вводять перорально щодня, де тривалість терапії становить 48 тижнів. У цьому варіанті рибавірин вводиться в кількості 1000 мг для пацієнтів, що важать менше 75 кг і 1200 мг для пацієнтів, що важать 75 кг і більше. [0217] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і будь-який режим 200 μг моноПЕГільованого (30 kD, лінійного) консенсусного IFN-, що вводять підшкірно кожні десять днів або один раз у тиждень; і 50 μг Actimmune® людського IFN-1b, що вводять підшкірно два рази в тиждень; і рибавірину, що вводять перорально щодня, де тривалість терапії становить 48 тижнів. У цьому варіанті рибавірин вводиться в кількості 1000 мг для пацієнтів, що важать менше 75 кг і 1200 мг для пацієнтів, що важать 75 кг і більше. [0218] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і будь-який режим 200 μг моноПЕГільованого (30 kD, лінійного) консенсусного IFN-, що вводять підшкірно кожні десять днів або один раз у тиждень; і 100 μг Actimmune® людського IFN-1b, що вводять підшкірно два рази в тиждень; і рибавірину, що вводять перорально щодня, де тривалість 93990 52 терапії становить 48 тижнів. У цьому варіанті рибавірин вводиться в кількості 1000 мг для пацієнтів, що важать менше 75 кг і 1200 мг для пацієнтів, що важать 75 кг і більше. [0219] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і будь-який режим 200 μг моноПЕГільованого (30 kD, лінійного) консенсусного IFN-, що вводять підшкірно кожні десять днів або один раз у тиждень; і 50 μг Actimmune® людського IFN-1b, що вводять підшкірно два рази в тиждень, де тривалість терапії становить 48 тижнів. [0220] В одному з варіантів здійснення, даний винахід розкриває будь-який з вищеописаних способів, що включає введення пацієнтові з вірусною інфекцією ГС ефективної кількості інгібітору NS3; і будь-який режим 200 μг моноПЕГільованого (30 kD, лінійного) консенсусного IFN-, що вводять підшкірно кожні десять днів або один раз у тиждень; і 100 μг Actimmune® людського IFN-1b, що вводять підшкірно два рази в тиждень, де тривалість терапії становить 48 тижнів. [0221] Будь-який з вищеописаних способів включає введення інгібітору NS3, агоністу рецептора інтерферону типу І (наприклад, який-небудь IFN-), і агоністу рецептора інтерферону типу II (наприклад, який-небудь IFN-), і може бути посилений введенням ефективної кількості антагоніста TNF- (наприклад, який-небудь антагоніст TNF-, відмінний від пірфенідону і його аналогів). Для прикладу, що не обмежує обсяг домагань, антагоністи TNF-, які підходять для використання в таких комбінованих терапіях, включають ENBREL®, REMICADE® і HUMIRA™. [0222] В одному з варіантів здійснення даний винахід розкриває спосіб використання ефективної кількості ENBREL®; ефективної кількості IFN-; ефективної кількості IFN-; і ефективної кількості інгібітору NS3 для лікування вірусної інфекції ГС у пацієнта, що включає введення пацієнтові дози ENBREL®, що містить кількість приблизно від 0.1 μг до 23 мг на дозу, приблизно від 0.1 μг до 1 μг, приблизно від 1 μг до 10 μг, приблизно від 10 μг до 100 μг, приблизно від 100 μг до 1 мг, приблизно від 1 мг до 5 мг, приблизно від 5 мг до 10 мг, приблизно від 10 мг до 15 мг, приблизно від 15 мг до 20 мг, або приблизно від 20 мг до 23 мг ENBREL®, підшкірно щодня, через день, два рази в тиждень, три рази в тиждень, один раз у тиждень, щотижня, три рази на місяць, один раз на місяць або кожний місяць або день в основному безупинно або безупинно протягом бажаного періоду лікування. [0223] В одному з варіантів здійснення даний винахід розкриває спосіб використання ефективної кількості REMICADE®; ефективної кількості IFN-; ефективної кількості IFN-; і ефективної кількості інгібітору NS3 для лікування вірусної інфекції ГС у пацієнта, що включає введення пацієнтові дози REMICADE®, що містить кількість приблизно від 0.1 мг/кг до 4.5 мг/кг, приблизно від 0.1 мг/кг до 0,5 мг/кг, приблизно від 0.5 мг/кг до 1.0 мг/кг, приблизно від 1.0 мг/кг до 1.5 мг/кг, приблизно від 1.5 мг/кг 53 до 2.0 мг/кг, приблизно від 2.0 мг/кг до 2.5 мг/кг, приблизно від 2.5 мг/кг до 3.0 мг/кг, приблизно від 3.0 мг/кг до 3.5 мг/кг, приблизно від 3.5 мг/кг до 4.0 мг/кг, приблизно від 4.0 мг/кг до 4.5 мг/кг на дозу REMICADE®, внутрішньовенно щодня, через день, два рази в тиждень, три рази в тиждень, один раз у тиждень, щотижня, три рази на місяць один раз на місяць або щомісяця або на день в основному безупинно або безупинно протягом бажаного періоду лікування. [0224] В одному з варіантів здійснення даний винахід розкриває спосіб використання ефективної кількості HUMIRA™; ефективної кількості IFN-; ефективної кількості IFN-; і ефективної кількості інгібітору NS3 для лікування вірусної інфекції ГС у пацієнта, що включає введення пацієнтові дози HUMIRA™, що містить кількість приблизно від 0.1 μг до 35 мг на дозу, приблизно від 0.1 μг до 1 μг, приблизно від 1 μг до 10 μг, приблизно від 10 μг до 100 μг, приблизно від 100 μг до 1 мг, приблизно від 1 мг до 5 мг, приблизно від 5 мг до 10 мг, приблизно від 10 мг до 15 мг, приблизно від 15 мг до 20 мг, або приблизно від 20 мг до 25 мг, приблизно від 25 мг до 30 мг, приблизно від 30 мг до 35 мг на дозу HUMIRA™, підшкірно щодня, через день, два рази в тиждень, три рази в тиждень, один раз у тиждень, щотижня, три рази на місяць один раз на місяць або щомісяця або на день в основному безупинно або безупинно протягом бажаного періоду лікування. Комбіновані терапії з пірфенідоном. [0225] У багатьох варіантах здійснення винаходу, способи розкривають комбіновану терапію, що включає введення сполуки інгібітору NS3 як описано вище і ефективної кількості пірфенідону або його аналогу. У деяких варіантах здійснення винаходу сполука інгібітор NS3, один або більше агоністів рецептору інтерферона і пірфенідон або його аналоги вводяться спільно в способах лікування за винаходом. У деяких варіантах здійснення винаходу сполука інгібітор NS3, який-небудь агоніст рецептора інтерферону типу І і пірфенідон (або який-небудь) його аналог вводяться спільно. В інших варіантах здійснення винаходу сполука інгібітор NS3, який-небудь агоніст рецептора інтерферону типу І, який-небудь агоніст рецептору інтерферона типу II і пірфенідон (або його аналоги) вводяться спільно. Агоністи рецептору інтерферона типу І, що підходять для використання тут, включають IFN-, такий як інтерферон альфа-2а, інтерферон альфа-2b, інтерферон альфакон-1, і ПЕГільований IFN-, такі як пегінтерферон альфа2а, пегінтерферон альфа-2b, і консенсусні ПЕГільовані інтерферони, такі як моноПЕГпегільований (30 kD, лінійний) консенсусний інтерферон. Агоністи рецептору інтерферона типу II, що підходять для використання тут, включають інтерферон-. [0226] Пірфенідон або який-небудь його аналог може бути введений один раз на місяць, два рази на місяць, один раз у тиждень, два рази в тиждень, три рази в тиждень, чотири рази в тиждень, п'ять разів у тиждень, шість разів у тиждень, або поділений на щоденні дози, які приймають від одного до п'яти разів у день за період часу, що змінюється приблизно від одного дня до одного 93990 54 тижня, або від 2 тижнів до приблизно 4 тижнів, від близько 1 місяця до приблизно 2 місяців або від близько 2 місяців до приблизно 4 місяців, від близько 4 місяців до приблизно 6 місяців або від близько 6 місяців до приблизно 8 місяців або від близько 8 місяців до приблизно 12 місяців або від одного року до двох років або від двох років до чотирьох років або більше. [0227] Ефективні дозування пірфенідону або специфічних аналогів пірфенідону включають залежну від ваги пацієнта дозу, що змінюється приблизно від 5мг/кг/день до 125 мг/кг/день, або фіксовану дозу від 400 мг до 3600 мг у день, або приблизно 1800 мг у день, або приблизно від 1200 до 1600 мг у день, що вводять перорально, розділені від одного до п'яти прийомів в день. Інші дози і форми пірфенідону і специфічних аналогів пірфенідону, що підходять для використання при лікуванні фібротичних захворювань, описуються в Патентах США № 5,310, 562; 5,518, 729; 5,716, 632; і 6,090, 822. [0228] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів, що включає спільне введення пацієнтові терапевтично ефективної кількості пірфенідону або його аналогів протягом бажаного курсу лікування сполукою інгібітором NS3. Комбіновані терапії з антагоністами TNF-. [0229] У багатьох варіантах здійснення винаходу, способи розкривають комбіновану терапію, що включає введення сполуки інгібітору NS3 як описано вище і ефективної кількості антагоністів TNF-, у комбінованій терапії для лікування вірусної інфекції ГС. [0230] Ефективні дози антагоністів TNF- змінюються від 0.1 μг до 40 мг на дозу, наприклад приблизно від 0.1 μг до 0.5 μг на дозу, приблизно від 0.5 μг до 1.0 μг на дозу, приблизно від 1.0 μг до 5.0 μг на дозу, приблизно від 5.0 μг до 10 μг на дозу, приблизно від 10 μг до 20 μг на дозу, приблизно від 20 μг до 30 μг на дозу, приблизно від 30 μг до 40 μг на дозу, приблизно від 40 μг до 50 μг на дозу, приблизно від 50 μг до 60 μг на дозу, приблизно від 60 μг до 70 μг на дозу, приблизно від 70 μг до 80 μг на дозу, приблизно від 80 μг до 90 μг на дозу, приблизно від 90 μг до 100 μг на дозу, приблизно від 100 μг до 150 μг на дозу, приблизно від 150 μг до 200 μг на дозу, приблизно від 200 μг до 250 μг на дозу, приблизно від 250 μг до 300 μг на дозу, приблизно від 300 μг до 400 μг на дозу, приблизно від 400 μг до 500 μг на дозу, приблизно від 500 μг до 600 μг на дозу, приблизно від 600 μг до 700 μг на дозу, приблизно від 700 μг до 800 μг на дозу, приблизно від 800 μг до 900 μг на дозу, приблизно від 900 μг до 1000 μг на дозу, приблизно від 1 мг до 10 мг на дозу, приблизно від 10 мг до 15 мг на дозу, приблизно від 15 мг до 20 мг на дозу, приблизно від 20 мг до 25 мг на дозу, приблизно від 25 мг до 30 мг на дозу, приблизно від 30 мг до 35 мг на дозу, приблизно від 35 мг до 40 мг на дозу. [0231] У деяких варіантах здійснення винаходу, ефективні дозування антагоністів TNF- позначаються як мг/кг ваги тіла. У цих варіантах здійснення, ефективні дозування антагоністів TNF- 55 змінюються від приблизно 0.1 мг/кг ваги тіла до 10 мг/кг ваги тіла, наприклад від приблизно від 0.1 мг/кг до 0.5 мг/кг ваги тіла, приблизно від 0.5 мг/кг до 1.0 мг/кг ваги тіла, приблизно від 1.0 мг/кг до 2.5 мг/кг ваги тіла, приблизно від 2.5 мг/кг до 5.0 мг/кг ваги тіла, приблизно від 5.0 мг/кг до 7.5 мг/кг ваги тіла, приблизно від 7.5 мг/кг до 10 мг/кг ваги тіла. [0232] У багатьох варіантах здійснення винаходу, антагоніст TNF- вводиться протягом періоду від одного дня до одного тижня, або від 2 тижнів до приблизно 3 тижнів, від 3 тижнів до приблизно 4 тижнів, від близько 1 місяця до приблизно 2 місяців, від близько 2 місяці до приблизно 3 місяців або від близько 3 місяців до приблизно 4 місяців, від близько 4 місяців до приблизно 6 місяців або від близько 6 місяців до приблизно 8 місяців або від близько 8 місяців до приблизно 12 місяців або, принаймні, одного року і може бути введений за більший інтервал часу. Антагоніст TNF- може бути введений три рази в день, два рази в день, щодня, через день, два рази в тиждень, три рази в тиждень, один раз у тиждень, щотижня, три рази на місяць, один раз на місяць, в основному безупинно або безупинно. [0233] У багатьох варіантах здійснення винаходу вводяться множинні дози антагоністів TNF-. Наприклад, антагоніст TNF- вводиться один раз на місяць, два рази на місяць, три рази на місяць, щотижня, один раз у тиждень, два рази у тиждень, три рази у тиждень, чотири рази у тиждень, п'ять разів у тиждень, шість разів у тиждень, через день, щодня, два рази на день, три рази на день, в основному безупинно або безупинно за період часу, що змінюється приблизно від одного дня до одного тижня, або від 2 тижнів до приблизно 4 тижнів, від близько 1 місяця до приблизно 2 місяців або від близько 2 місяців до приблизно 4 місяців, від близько 4 місяців до приблизно 6 місяців або від близько 6 місяців до приблизно 8 місяців або від близько 8 місяців до приблизно 12 місяців або від одного року до двох років або від двох років до чотирьох років або більше. [0234] Антагоніст TNF- і сполука інгібітор NS3A звичайно вводяться в окремих лікарських формах. Антагоніст TNF- і сполука інгібітор NS3A можуть бути введені в основному одночасно, або через приблизно 30 хвилин, 1 годину, 2 години, 4 години, 8 годин, 16 годин, 24 години, 36 годин, 72 години, 4 дні, 7 днів, або приблизно 2 тижня. [0235] В одному з варіантів здійснення винаходу, винахід розкриває спосіб, використовуючи ефективну кількість антагоністу TNF-, ефективну кількість сполуки інгібітора NS3, лікування вірусної інфекції ГС у пацієнта, що включає введення пацієнтові дози антагоніста TNF-, що містить приблизно від 0.1 μг до 40 мг на дозу антагоніста TNF-, підшкірно щодня, через день, два рази в тиждень, три рази в тиждень; або в день в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0236] В одному з варіантів здійснення даний винахід розкриває спосіб використання ефективної кількості ENBREL® і ефективної кількості інгібітору NS3 для лікування вірусної інфекції ГС у пацієнта, що включає введення пацієнту дози ENBREL®, що 93990 56 містить кількість приблизно від 0.1 μг до 23 мг на дозу, приблизно від 0.1 μг до 1 μг, приблизно від 1 μг до 10 μг, приблизно від 10 μг до 100 μг, приблизно від 100 μг до 1 мг, приблизно від 1 мг до 5 мг, приблизно від 5 мг до 10 мг, приблизно від 10 мг до 15 мг, приблизно від 15 мг до 20 мг, або приблизно від 20 мг до 23 мг ENBREL®, підшкірно щодня, через день, два рази в тиждень, три рази в тиждень, один раз у тиждень, щотижня, три рази на місяць, один раз на місяць або кожний місяць; або в день в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0237] В одному з варіантів здійснення даний винахід розкриває спосіб використання ефективної кількості REMICADE® і ефективної кількості інгібітору NS3 для лікування вірусної інфекції ГС у пацієнта, що включає введення пацієнтові дози REMICADE®, що містить кількість приблизно від 0.1 мг/кг до 4.5 мг/кг, приблизно від 0.1 мг/кг до 0,5 мг/кг, приблизно від 0.5 мг/кг до 1.0 мг/кг, приблизно від 1.0 мг/кг до 1.5 мг/кг, приблизно від 1.5 мг/кг до 2.0 мг/кг, приблизно від 2.0 мг/кг до 2.5 мг/кг, приблизно від 2.5 мг/кг до 3.0 мг/кг, приблизно від 3.0 мг/кг до 3.5 мг/кг, приблизно від 3.5 мг/кг до 4.0 мг/кг, приблизно від 4.0 мг/кг до 4.5 мг/кг на дозу REMICADE®, внутрішньовенно щодня, через день, два рази в тиждень, три рази в тиждень, один раз у тиждень, щотижня, три рази на місяць, один раз на місяць або щомісяця; або в день в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0238] В одному з варіантів здійснення даний винахід розкриває спосіб використання ефективної кількості HUMIRA™ і ефективної кількості інгібітору NS3 для лікування вірусної інфекції ГС у пацієнта, що включає введення пацієнтові дози HUMIRA™, що містить кількість приблизно від 0.1 μг до 35 мг на дозу, приблизно від 0.1 μг до 1 μг, приблизно від 1 μг до 10 μг, приблизно від 10 μг до 100 μг, приблизно від 100 μг до 1 мг, приблизно від 1 мг до 5 мг, приблизно від 5 мг до 10 мг, приблизно від 10 мг до 15 мг, приблизно від 15 мг до 20 мг, або приблизно від 20 мг до 25 мг, приблизно від 25 мг до 30 мг, приблизно від 30 мг до 35 мг на дозу HUMIRA™, підшкірно щодня, через день, два рази в тиждень, три рази в тиждень, один раз у тиждень, щотижня, три рази на місяць, один раз на місяць або щомісяця або за день в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. Комбіновані терапії з тирозином- [0239] У багатьох варіантах здійснення винаходу способи розкривають комбіновані терапії, що включають введення ефективної кількості сполуки інгібітору NS3 як описано вище, і ефективної кількості тимозину- у комбінованій терапії для лікування вірусної інфекції ГС. [0240] Ефективні дозування тимозину- змінюються приблизно від 0.5 мг до 5 мг, наприклад, приблизно від 0.5 мг до 1.0 мг, приблизно від 1.0 мг до 1.5 мг, приблизно від 1.5 мг до 2.0 мг, приблизно від 2.0 мг до 2.5 мг, або приблизно від 2.5 мг до 3.0 мг, приблизно від 3.0 мг до 3.5 мг, приблизно від 3.5 мг до 4.0 мг, приблизно від 4.0 мг до 4.5 57 мг, приблизно від 4.5 мг до 5 мг. У конкретних варіантах здійснення винаходу, тимозин- вводиться в дозах, що містять 1.0 мг або 1.6 мг речовини. [0241] В одному з варіантів здійснення винахід розкриває спосіб, що використовує ефективну кількість ZADAXIN™ тимозину- і ефективну кількість сполуки інгібітору NS3 для лікування вірусної інфекції ГС у пацієнта, що включає введення пацієнтові дози ZADAXIN™, що містить кількість приблизно від 1.0 мг до 1.6 мг на дозу, підшкірно два рази в тиждень протягом бажаного періоду лікування сполукою інгібітором NS3. Комбіновані терапії з антагоністами TNF- і інтерфероном. [0242] У деяких варіантах здійснення даний винахід розкриває спосіб лікування вірусної інфекції ГС у пацієнта з вірусною інфекцією ГС. Спосіб включає введення ефективної кількості інгібітору NS3, ефективної кількості антагоністів TNF- і ефективної кількості одного або більше інтерферонів. [0243] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості IFN- і ефективної кількості антагоністу TNF- при лікуванні вірусної інфекції ГС у пацієнта, що включає введення пацієнтові дози IFN-, що містить кількість приблизно від 10 μг до 300 μг лікарського засобу на дозу IFN-, що вводять підшкірно щодня, через день, два рази в тиждень, три рази в тиждень, щотижня, через тиждень, три рази на місяць, один раз на місяць; або в день в основному безупинно або безупинно, у комбінації з дозою антагоністу TNF-, що містить кількість приблизно від 0.1 μг до 40 мг антагоністу TNF- на дозу, що вводять підшкірно щодня, через день, два рази на тиждень або три рази на тиждень; або на день в основному безупинно або безупинно; протягом бажаного періоду лікування сполукою інгібітором NS3. [0244] В одному з варіантів здійснення даний винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості IFN- і ефективної кількості антагоністу TNF- при лікуванні вірусної інфекції ГС у пацієнта, що включає введення пацієнтові дози IFN-, що містить кількість приблизно від 10 μг до 100 μг лікарського засобу на дозу IFN-, що вводять підшкірно щодня, через день, два рази в тиждень, три рази в тиждень, щотижня, через тиждень, три рази на місяць, один раз на місяць; або в день в основному безупинно або безупинно, у комбінації з дозою антагоністу TNF-, що містить кількість приблизно від 0.1 μг до 40 мг антагоністу TNF- на дозу, що вводять підшкірно щодня, через день, два рази в тиждень або три рази в тиждень; або в день в основному безупинно або безупинно; протягом бажаного періоду лікування сполукою інгібітором NS3. [0245] В іншому варіанті здійснення даний винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості IFN- і ефективної кількості антагоністу TNF- при лікуванні вірусної інфекції ГС у пацієн 93990 58 та, що включає введення пацієнтові загальної тижневої дози IFN-, що містить кількість приблизно від 30 μг до 1000 μг лікарського засобу в тиждень, поділеного на дози, що вводять підшкірно щодня, через день, два рази в тиждень, три рази в тиждень або вводять в основному безупинно або безупинно, у комбінації з дозою антагоністу TNF-, що містить кількість приблизно від 0.1 μг до 40 мг антагоністу TNF- на дозу, що вводять підшкірно щодня, через день, два рази в тиждень або три рази в тиждень; або в день в основному безупинно або безупинно; протягом бажаного періоду лікування сполукою інгібітором NS3. [0246] В іншому варіанті здійснення даний винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості IFN- і ефективної кількості антагоністу TNF- при лікуванні вірусної інфекції ГС у пацієнта, що включає введення пацієнтові загальної тижневої дози IFN-, що містить кількість приблизно від 100 μг до 300 μг лікарського засобу в тиждень, поділеного на дози, що вводять підшкірно щодня, через день, два рази в тиждень, три рази в тиждень або вводять в основному безупинно або безупинно, у комбінації з дозою антагоністу TNF-, що містить кількість приблизно від 0.1 μг до 40 мг антагоністу TNF- на дозу, що вводять підшкірно щодня, через день, два рази в тиждень або три рази в тиждень; або в день в основному безупинно або безупинно; протягом бажаного періоду лікування сполукою інгібітором NS3. [0247] В одному з варіантів здійснення винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості INFERGEN® консенсусного IFN- і антагоністу TNF- при лікуванні вірусної інфекції ГС у пацієнта, що включає введення пацієнтові дози INFERGEN®, що містить у кількості приблизно від 1 μг до 30 μг ліків на дозу INFERGEN®, підшкірно щодня, через день, два рази в тиждень, три рази в тиждень, щотижня, через тиждень, три рази на місяць, один раз на місяць; або в день в основному безупинно або безупинно в комбінації з дозою антагоністу TNF-, що містить у кількості приблизно від 0.1 μг до 40 мг антагоністу TNF- на дозу, підшкірно щодня, через день, два рази в тиждень, три рази в тиждень, або в день, в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0248] В одному з варіантів здійснення винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості INFERGEN® консенсусного IFN- і антагоністу TNF- при лікуванні вірусної інфекції ГС у пацієнта, що включає введення пацієнтові дози INFERGEN®, що містить у кількості приблизно від 1 μг до 9 μг ліків на дозу INFERGEN®, підшкірно щодня, через день, два рази в тиждень, три рази в тиждень, щотижня, через тиждень, три рази на місяць, один раз на місяць; або в день в основному безупинно або безупинно в комбінації з дозою антагоністу TNF-, що містить у кількості приблизно від 0.1 μг до 40 мг антагоністу TNF- на дозу, підшкірно щодня, через день, два рази в тиждень, 59 три рази в тиждень, або в день, в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0249] В іншому варіанті здійснення даний винахід розкриває будь-який з вищеописаних способів, модифікованих для використання ефективної кількості ПЕГільованого консенсусного IFN- і антагоністу TNF- при лікуванні вірусної інфекції в пацієнта, що включає введення пацієнтові дози ПЕГільованого консенсусного IFN- (PEG CIFN), що містить у кількості приблизно від 4 μг до 60 μг CIFN амінокислотної ваги на дозу PEG CIFN, підшкірно щотижня, через тиждень, три рази на місяць, один раз на місяць; у комбінації з дозою антагоністу TNF-, що містить у кількості приблизно від 0.1 μг до 40 мг антагоністу TNF- на дозу, підшкірно щодня, через день, два рази в тиждень, три рази в тиждень, або в день, в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0250] В іншому варіанті здійснення даний винахід розкриває будь-який з вищеописаних способів, модифікованих для використання ефективної кількості ПЕГільованого консенсусного IFN- і антагоністу TNF- при лікуванні вірусної інфекції у пацієнта, що включає введення пацієнтові дози ПЕГільованого консенсусного IFN- (PEG CIFN), що містить у кількості приблизно від 18 μг до 24 μг CIFN амінокислотної ваги на дозу PEG CIFN, підшкірно щотижня, через тиждень, три рази на місяць, один раз на місяць; у комбінації з дозою антагоністу TNF-, що містить у кількості приблизно від 0.1 μг до 40 мг антагоністу TNF- на дозу, підшкірно щодня, через день, два рази в тиждень, три рази в тиждень, або в день, в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0251] В іншому варіанті здійснення, винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості IFN-2a або 2b або 2с і ефективну кількості антагоністу TNF- при лікуванні вірусної інфекції в пацієнта, що включає введення пацієнтові дози IFN-2a або 2b або 2с, що містить у кількості приблизно від 1 МО до 20 МО ліків на дозу IFN-2a або 2b або 2с підшкірно щодня, через день, два рази в тиждень, три рази в тиждень; або в день в основному безупинно або безупинно; у комбінації з дозою антагоністу TNF-, що містить у кількості приблизно від 0.1 μг до 40 мг антагоністу TNF- на дозу, підшкірно щодня, через день, два рази в тиждень, три рази в тиждень, або в день, в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0252] В іншому варіанті здійснення, винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості IFN-2a або 2b або 2с і ефективної кількості антагоніста TNF- при лікуванні вірусної інфекції в пацієнта, що включає введення пацієнтові дози IFN-2a або 2b або 2с, що містить у кількості приблизно від 3 МО ліків на дозу IFN-2a або 2b або 2с підшкірно щодня, через день, два рази в тиждень, три рази в тиждень; або в день в основному 93990 60 безупинно або безупинно; у комбінації з дозою антагоністу TNF-, що містить у кількості приблизно від 0.1 μг до 40 мг антагоністу TNF- на дозу, підшкірно щодня, через день, два рази в тиждень, три рази в тиждень, або в день, в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0253] В іншому варіанті здійснення, винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості IFN-2a або 2b або 2с і ефективної кількості антагоністу TNF- при лікуванні вірусної інфекції в пацієнта, що включає введення пацієнтові дози IFN-2a або 2b або 2с, що містить у кількості приблизно від 10 МО ліків на дозу IFN-2a або 2b або 2с підшкірно щодня, через день, два рази в тиждень, три рази в тиждень; або в день в основному безупинно або безупинно; у комбінації з дозою антагоністу TNF-, що містить у кількості приблизно від 0.1 μг до 40 мг антагоністу TNF- на дозу, підшкірно щодня, через день, два рази в тиждень, три рази в тиждень, або в день, в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0254] В іншому варіанті здійснення, винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості PEGASYS® ПЕГільованого IFN-2a, і ефективної кількості антагоністу TNF- при лікуванні вірусної інфекції в пацієнта, що включає введення пацієнтові дози PEGASYS®, що містить у кількості приблизно від 90 μг до 360 μг ліки на дозу PEGASYS® підшкірно раз у тиждень, через тиждень, три рази на місяць або щомісяця в комбінації з дозою антагоністу TNF-, що містить у кількості приблизно від 0.1 μг до 40 мг антагоністу TNF- на дозу, підшкірно щодня, через день, два рази в тиждень, три рази в тиждень, або в день, в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0255] В іншому варіанті здійснення, винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості PEGASYS® ПЕГільованого IFN-2a, і ефективної кількості антагоністу TNF- при лікуванні вірусної інфекції у пацієнта, що включає введення пацієнтові дози PEGASYS®, що містить у кількості приблизно 180 μг ліків на дозу PEGASYS® підшкірно раз у тиждень, через тиждень, три рази на місяць або щомісяця в комбінації з дозою антагоністу TNF-, що містить у кількості приблизно від 0.1 μг до 40 мг антагоністу TNF- на дозу, підшкірно щодня, через день, два рази в тиждень, три рази в тиждень, або в день, в основному безупинно або безупинно протягом бажаного періоду лікування сполукою інгібітором NS3. [0256] В іншому варіанті здійснення, винахід розкриває будь-який з вищеописаних способів модифікованих для використання ефективної кількості PEG INTRON® ПЕГільованого IFN-2b, і ефективної кількості антагоністу TNF- при лікуванні вірусної інфекції у пацієнта, що включає введення пацієнтові дози PEG INTRON®, що містить у кількості приблизно від 0.75 μг до 3.0 μг ліків
ДивитисяДодаткова інформація
Назва патенту англійськоюCompounds and methods for inhibiting hepatitis c viral replication
Автори англійськоюBeigelman Leonid, Seiwert Scott D., Blatt Lawrence M., Andrews Steven, Haas Julia
Назва патенту російськоюСоединения и способ ингибирования репликации вируса гепатита c
Автори російськоюБейгелман Леонид, Сейверт Скотт Д., Блетт Лоренс М., Эндрюс Стивен, Xaac Джулия
МПК / Мітки
МПК: C07D 487/04, C07D 471/04
Мітки: сполуки, реплікації, інгібування, гепатиту, спосіб, вірусу
Код посилання
<a href="https://ua.patents.su/44-93990-spoluki-i-sposib-ingibuvannya-replikaci-virusu-gepatitu-s.html" target="_blank" rel="follow" title="База патентів України">Сполуки і спосіб інгібування реплікації вірусу гепатиту с</a>
Попередній патент: Спосіб прогнозування відповіді на лікування
Наступний патент: Спосіб вилуговування металу з руди
Випадковий патент: Система для перевантажування рідкого хімічного продукту