Стриголактамові похідні та їх застосування як регуляторів росту рослин
Номер патенту: 109167
Опубліковано: 27.07.2015
Автори: Вольф Ханно Крістіан, Лашья Матільд Деніз, де Месмекер Ален, Юнг П'єр Жозеф Марсель
Формула / Реферат
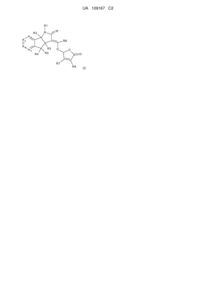
1. Сполука формули (І)
 , (I)
, (I)
де
W являє собою О або S;
R2 і R3 незалежно являють собою водень або С1-С3алкіл;
R4 і R5 незалежно являють собою водень, галоген, нітро, ціано, С1-С3алкіл, С1-С3галогеналкіл, С1-С3алкокси, гідроксил, -OC(O)R9, амін, N-С1-С3алкіламін або N,N-ді-С1-С3алкіламін;
R9 являє собою водень, С1-С6алкіл, С1-С6алкокси або С1-С6галогеналкіл;
R6 і R7 незалежно являють собою водень, С1-С3алкіл, гідроксил або С1-С3алкокси;
R8 являє собою водень, нітро, ціано, С1-С6алкіл або С1-С6галогеналкіл;
R1 являє собою водень, С1-С6алкокси, гідроксил, амін, N-С1-С6алкіламін, N,N-ді-С1-С6алкіламін, С1-С6алкіл, заміщений або незаміщений одним-п'ятьма R10, С1-С8алкілкарбоніл, С1-С8алкоксикарбоніл, арил, арил, заміщений одним-п'ятьма R10, гетероарил, гетероарил, заміщений одним-п'ятьма R10, гетероцикліл, гетероцикліл, заміщений одним-п'ятьма R10, бензил або бензил, заміщений одним-п'ятьма R10;
R10 являє собою водень, ціано, нітро, галоген, С1-С6алкіл, С1-С6алкокси, С1-С6галогеналкіл, С2-С6алкеніл або С2-С6алкініл;
кожний А1 А2, А3 і А4 незалежно являє собою С-Х або азот, де кожний X може бути однаковим або різним, і за умови, що не більше двох з А1 А2, А3 і А4 являють собою азот; і
X являє собою водень, галоген, ціано, С1-С3гідроксіалкіл, -OC(O)R9, С1-С6алкокси, С1-С6алкіл або С1-С6галогеналкіл, нітро, амін, N-С1-С6алкіламін, N,N-ді-С1-С6алкіламін або NHC(O)R9;
або її солі, або N-оксиди.
2. Сполука за п. 1, де W являє собою О.
3. Сполука за п. 2, де
R2 і R3 незалежно являють собою водень, метил або етил;
R4 і R5 незалежно являють собою водень, гідроксил, метил або етил;
R6, R7 і R8 незалежно являють собою водень, метил або етил;
R1 являє собою водень, С1-С6алкокси, С1-С6алкіл, заміщений або не заміщений одним-п'ятьма R10, С1-С8алкілкарбоніл, С1-С8алкоксикарбоніл, арил, арил, заміщений одним-п'ятьма R10, гетероарил, гетероарил, заміщений одним-п'ятьма R10, гетероцикліл, гетероцикліл, заміщений одним-п'ятьма R10, бензил або бензил, заміщений одним-п'ятьма R10;
R10 незалежно являє собою водень, ціано, нітро, галоген, С1-С6алкіл, С1-С6алкокси або С1-С6галогеналкіл;
кожний А1, А2, А3 і А4 незалежно являє собою С-Х; і
X являє собою водень, гідроксил, галоген, ціано, метил, етил, н-пропіл, гідроксиметил, трифторметил або метокси.
4. Композиція для регуляції росту рослин або стимуляції проростання насіння, що містить сполуку за будь-яким з попередніх пунктів і сільськогосподарсько прийнятний допоміжний засіб для складання.
5. Спосіб регуляції росту рослин на місці зростання, що передбачає нанесення на місце зростання регулюючої ріст рослин кількості композиції за п. 4.
6. Спосіб стимуляції проростання насіння, що передбачає нанесення на насіння або на місце зростання насіння стимулюючої проростання насіння кількості композиції за п. 4.
7. Спосіб боротьби з бур'янистими рослинами, що передбачає нанесення на місце зростання насіння бур'янистої рослини стимулюючої проростання насіння кількості композиції за п. 4, що забезпечує проростання насіння, а потім нанесення на місце зростання післясходового гербіциду.
8. Спосіб одержання сполуки формули (І)
 , (I)
, (I)
що передбачає етапи:
а) обробки сполуки формули (VI)
 (VI)
(VI)
амінним похідним з наступним відновленням з одержанням сполуки формули (III);
b) обробки сполуки формули (III)
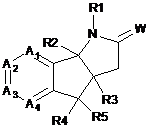 (III)
(III)
похідним складного ефіру мурашиної кислоти в основних умовах з утворенням сполуки формули (II); і
с) обробки сполуки формули (II)
 (II)
(II)
5Н-фураноновим похідним
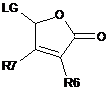
в основних умовах;
де W являє собою О або S;
R2 і R3 незалежно являють собою водень або С1-С3алкіл;
R4 і R5 незалежно являють собою водень, галоген, нітро, ціано, С1-С3алкіл, С1-С3галогеналкіл, С1-С3алкокси, гідроксил, -OC(O)R9, амін, N-С1-С3алкіламін або N,N-ді-С1-С3алкіламін;
R9 являє собою водень, С1-С6алкіл, С1-С6алкокси або С1-С6галогеналкіл;
R6 і R7 незалежно являють собою водень, С1-С3алкіл, гідроксил або С1-С3алкокси;
R8 являє собою водень, нітро, ціано, С1-С6алкіл або С1-С6галогеналкіл;
R1 являє собою водень, С1-С6алкокси, гідроксил, амін, N-С1-С6алкіламін, N,N-ді-С1-С6алкіламін, С1-С6алкіл, заміщений або не заміщений одним-п'ятьма R10, С1-С8алкілкарбоніл, С1-С8алкоксикарбоніл, арил, арил, заміщений одним-п'ятьма R10, гетероарил, гетероарил, заміщений одним-п'ятьма R10, гетероцикліл, гетероцикліл, заміщений одним-п'ятьма R10, бензил або бензил, заміщений одним-п'ятьма R10;
R10 являє собою водень, ціано, нітро, галоген, С1-С6алкіл, С1-С6алкокси, С1-С6галогеналкіл, С2-С6алкеніл або С2-С6алкініл; кожний А1, А2, А3 і А4 незалежно являє собою С-Х або азот, де кожний X може бути однаковим або різним, і за умови, що не більше двох з А1, А2, А3 і А4 являють собою азот; і X являє собою водень, галоген, ціано, С1-С3гідроксіалкіл, -OC(O)R9, С1-С6алкокси, С1-С6алкіл або С1-С6галогеналкіл, нітро, амін, N- С1-С6алкіламін, N,N-ді-С1-С6алкіламін або NHC(O)R9.
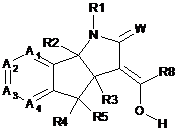
9. Сполука формули (II)
 , (II)
, (II)
де
W являє собою О або S;
R2 і R3 незалежно являють собою водень або С1-С3алкіл;
R4 і R5 незалежно являють собою водень, галоген, нітро, ціано, С1-С3алкіл, С1-С3галогеналкіл, С1-С3алкокси, гідроксил, -OC(O)R9, амін, N-С1-С3алкіламін або N,N-ді-С1-С3алкіламін;
R9 являє собою водень, С1-С6алкіл, С1-С6алкокси або С1-С6галогеналкіл;
R8 являє собою водень, нітро, ціано, С1-С6алкіл або С1-С6галогеналкіл;
R1 являє собою водень, С1-С6алкокси, гідроксил, амін, N-С1-С6алкіламін, N,N-ді-С1-С6алкіламін, С1-С6алкіл, заміщений або незаміщений одним-п'ятьма R10, С1-С8алкілкарбоніл, С1-С8алкоксикарбоніл, арил, арил, заміщений одним-п'ятьма R10, гетероарил, гетероарил, заміщений одним-п'ятьма R10, гетероцикліл, гетероцикліл, заміщений одним-п'ятьма R10, бензил або бензил, заміщений одним-п'ятьма R10;
R10 являє собою водень, ціано, нітро, галоген, С1-С6алкіл, С1-С6алкокси, С1-С6галогеналкіл, С2-С6алкеніл або С2-С6алкініл;
кожний А1, А2, А3 і А4 незалежно являють собою С-Х або азот, де кожний X може бути однаковим або різним, і за умови, що не більше двох з А1, А2, А3 і А4 являють собою азот; і
X являє собою водень, галоген, ціано, С1-С3гідроксіалкіл, -OC(O)R9, С1-С6алкокси, С1-С6алкіл або С1-С6галогеналкіл, нітро, амін, N-С1-С6алкіламін, N,N-ді-С1-С6алкіламін або NHC(O)R9; або її солі або N-оксиди.
10. Застосування сполуки формули (І) за п. 1 як регулятора росту рослин або стимулятора проростання насіння.
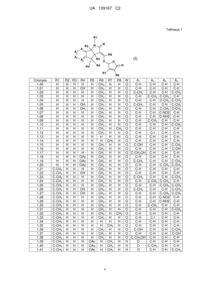
Текст
Реферат: Винахід належить до стриголактамних похідних формули (І), до способів і проміжних сполук для їх одержання, до композицій для регуляції росту рослин, що містять їх, і до способів їх застосування для контролю росту рослин і/або забезпечення проростання насіння. UA 109167 C2 (12) UA 109167 C2 R1 R2 A2 A3 N W A1 R8 A4 R4 R3 R5 O O O R7 R6 (I) UA 109167 C2 5 10 Даний винахід відноситься до нових стриголактамових похідних, до способів і проміжних сполук для їхнього одержання, до регулюючих ріст рослини композицій, що містять їх, а також до способів їх застосування для контролю росту рослин і/або забезпечення проростання насінь. Стриголактонові похідні є фітогормонами із властивостями регулювання росту рослин і проростання насінь; вони описані, наприклад, в WO2009/138655, WO2010/125065, WO05/077177, WO06/098626 і в Annual Review of Phytopathology (2010), 48 p.93-117. Відомо, що стриголактонові похідні, подібно синтетичному аналогу GR24, діють на проростання паразитичних бур'янистих рослин, таких як види Orobanche. У рівні техніки добре відомо, що тестування на проростання насінь Orobanche є тестом, застосовним для ідентифікації стриголактонових аналогів (див., наприклад, Plant and Cell Physiology (2010), 51(7) p.1095; і Organic & Biomolecular Chemistry (2009), 7(17), p.3413). Було виявлено, що певні стриголактамові похідні мають властивості аналогічні стриголактону. Відповідно до даного винаходу представлена сполука формули (I), R1 R2 A2 A3 W N A1 R8 R3 A4 R4 O O R5 R7 15 20 25 30 35 40 45 50 (I) O R6 , де W являє собою O або S; R2 і R3 незалежно являють собою водень або C1-C3алкіл; R4 і R5 незалежно являють собою водень, галоген, нітро, ціано, C1-C3алкіл, C1C3галогеналкіл, C1-C3алкокси, гідроксил, -OC(O)R9, амін, N-C1-C3алкіламін або N, N-ди-C1C3алкіламін; R9 являє собою водень, C1-C6алкіл, C1-C6алкокси або C1-C6галогеналкіл; R6 і R7 незалежно являють собою водень, C1-C3алкіл, гідроксил або C1-C3алкокси; R8 являє собою водень, нітро, ціано, C1-C6алкіл або C1-C6галогеналкіл; R1 являє собою водень, C1-C6алкокси, гідроксил, амін, N-C1-C6алкіламін, N, N-ди-C1C6алкіламін, C1-C6алкіл, необов'язково заміщений одним - п'ятьма R10, C1-C8алкілкарбоніл, C1-C8алкоксикарбоніл, арил, арил, заміщений одним - п'ятьма R10, гетероарил, гетероарил, заміщений одним - п'ятьма R10, гетероцикліл, гетероцикліл, заміщений одним - п'ятьма R10, бензил або бензил, заміщений одним - п'ятьма R10; R10 являє собою водень, ціано, нітро, галоген, C1-C6алкіл, C1-C6алкокси, C1C6галогеналкіл, C2-C6алкеніл або C2-C6алкініл; кожний з A1, A2, A3 і A4 незалежно являє собою C-X або азот, де кожний X може бути однаковим або різним, і за умови, що не більше двох з A1, A2, A3 і A4 являють собою азот; а X являє собою водень, галоген, ціано, гідроксил, -OC(O)R9, C1-C6алкокси, C1-C6алкіл, C1C6галогеналкіл, C1-C3гідроксіалкіл, нітро, амін, N-C1-C6алкіламін, N, N-ди-C1-C6алкіламін або NHC(O)R9. Сполуки формули (I) можуть існувати у вигляді різних геометричних або оптичних ізомерів (діастереоізомерів та енантіомерів) або таутомерних форм. Даний винахід охоплює всі такі ізомери і таутомери та їх суміші у всіх пропорціях, а також ізотопні форми, такі як дейтеровані сполуки. Даний винахід також охоплює всі солі, N-оксиди та металоїдні комплекси сполук формули (I). Кожний алкільний фрагмент або окремо, або як частина більшої групи (такий як алкокси, алкоксикарбоніл, алкілкарбоніл, алкіламінокарбоніл, діалкіламінокарбоніл) характеризується прямим або розгалуженим ланцюгом і являє собою, наприклад, метил, етил, н-пропіл, н-бутил, н-пентил, н-гексил, ізо-пропіл, н-бутил, втор-бутил, ізо-бутил, трет-бутил або нео-пентил. Алкільними групами переважно є C1-C6алкільні групи, більш переважно C1-C4 і найбільш переважно C1-C3алкільні групи. Галогеном є фтор, хлор, бром або йод. Галогеналкільними групами (або окремо, або як частина більшої групи, такої як галогеналкокси або галогеналкілтіо) є алкільні групи, які заміщені однією або кількома 1 UA 109167 C2 5 10 15 20 25 30 35 40 45 50 55 60 однаковими або різними атомами галогену і являють собою, наприклад, -CF3, -CF2Cl, -CH2CF3 або -CH2CHF2. Гідроксіалкільними групами є алкільні групи, які заміщені однією або кількома гідроксильними групами і являють собою, наприклад, -CH2OH, -CH2CH2OH або -CH(OH)CH3. У контексті даного винаходу термін "арил" відноситься до кільцевої системи, яка може бути моно-, бі- або трицикличною. Приклади таких кілець включають феніл, нафталеніл, антраценіл, інденіл або фенантреніл. Переважною арильною групою є феніл. Якщо не зазначено інше, алкеніл і алкініл, самі по собі або як частина іншого замісника, можуть бути із прямим або розгалуженим ланцюгом і переважно можуть містити 2-6 атомів вуглецю, переважно 2-4, більш переважно 2-3, і якщо буде потреба, може бути або в (E)-, або в (Z)-конфігурації. Приклади включають вініл, аліл та пропаргіл. Термін "гетероарил" відноситься до ароматичної кільцевої системи, що містить щонайменше один гетероатом та або окреме кільце, або два або більше злитих кілець. Переважно окремі кільця будуть містити до трьох, а біциклічні системи до чотирьох гетероатомів, які переважно будуть обрані з азоту, кисню та сірки. Приклади таких груп включають піридил, піридазиніл, піримідиніл, піразиніл, фураніл, тіофеніл, оксазоліл, ізоксазоліл, оксадіазоліл, тіазоліл, ізотіазоліл, тіадіазоліл, піроліл, піразоліл, імідазоліл, тріазоліл і тетразоліл. Переважною гетероарильною групою є піридин. Термін "гетероцикліл" визначається як такий, що включає гетероарил і на додаток його ненасичені або частково ненасичені аналоги, такі як 4,5,6,7-тетрагідро-бензотіофеніл, 9Hфтореніл, 3,4-дигідро-2H-бензо-1,4-діоксепініл, 2,3-дигідро-бензофураніл, піперидиніл, 1,3діоксоланіл, 1,3-діоксаніл, 4,5-дигідро-ізоксазоліл, тетрагідрофураніл і морфолініл. Переважні значення W, R2, R3, R4, R5, R9, R8, R1, R10, A1, A2, A3, A4 і X, у будь-якій комбінації, викладені нижче. W переважно являє собою кисень. R2 переважно являє собою водень, метил або етил; найбільш переважно R2 являє собою водень. R3 переважно являє собою водень, метил або етил; найбільш переважно R3 являє собою водень. R4 переважно являє собою водень, гідроксил, метил або етил; найбільш переважно R4 являє собою водень або гідроксил. R5 переважно являє собою водень, гідроксил, метил або етил; найбільш переважно R5 являє собою водень або гідроксил. R6 переважно являє собою водень, метил або етил; найбільш переважно R6 являє собою метил. R7 переважно являє собою водень, метил або етил; найбільш переважно R7 являє собою водень. R8 переважно являє собою водень, метил або етил; найбільш переважно R8 являє собою водень. R1 переважно являє собою водень, C1-C6алкокси, C1-C6алкіл, заміщений або не заміщений одним - п'ятьма R10, C1-C8алкілкарбоніл, C1-C8алкоксикарбоніл, арил, арил, заміщений одним - п'ятьма R10, гетероарил, гетероарил, заміщений одним - п'ятьма R10, гетероцикліл, гетероцикліл, заміщений одним - п'ятьма R10, бензил або бензил, заміщений одним - п'ятьма R10; більш переважно R1 являє собою водень, C1-C6алкокси, C1-C6алкіл, заміщений або не заміщений одним - п'ятьма R10, C1-C8алкілкарбоніл, C1-C8алкоксикарбоніл, бензил або бензил, заміщений одним - п'ятьма R10; найбільш переважно R1 являє собою водень, метил, етил, феніл, бензил, ацетат, або метоксикарбоніл. R10 незалежно являє собою водень, ціано, нітро, галоген, C1-C6алкіл, C1-C6алкокси, C1C6галогеналкіл; найбільш переважно R10 являє собою водень, ціано, нітро, хлорид, бромід, фтор, метил, метокси та трифторметил. Переважно A1 являє собою C-X. Переважно A2 являє собою C-X. Переважно A3 являє собою C-X. Переважно A4 являє собою C-X. Переважно, X являє собою водень, гідроксил, галоген, ціано, метил, етил, н-пропіл, гідроксиметил, трифторметил або метокси. Більш переважно, X являє собою водень, гідроксил, метил, трифторметил або метокси. Ще більш переважно, X являє собою водень, метил, гідроксил або метокси. Найбільш переважно, X являє собою водень, метил, гідроксил або метокси. У кращому варіанті здійснення забезпечена сполука формули (I), де 2 UA 109167 C2 5 10 15 W являє собою O; R2 і R3 незалежно являють собою водень, метил або етил; R4 і R5 незалежно являють собою водень, гідроксил, метил або етил; R6, R7 і R8 незалежно являють собою водень, метил або етил; R1 являє собою водень, C1-C6алкокси, C1-C6алкіл, заміщений або не заміщений одним п'ятьма R10, C1-C8алкілкарбоніл, C1-C8алкоксикарбоніл, арил, арил, заміщений одним п'ятьма R10, гетероарил, гетероарил, заміщений одним - п'ятьма R10, гетероцикліл, гетероцикліл, заміщений одним - п'ятьма R10, бензил або бензил, заміщений одним - п'ятьма R10; R10 незалежно являє собою водень, ціано, нітро, галоген, C1-C6алкіл, C1-C6алкокси або C1-C6галогеналкіл; кожний A1, A2, A3 і A4 незалежно являє собою C-X; і X являє собою водень, гідроксил, галоген, ціано, метил, етил, н-пропіл, гідроксиметил, трифторметил або метокси. У переважному варіанті здійснення забезпечена сполука формули (II), R1 R2 A2 A3 R8 R3 A4 R4 20 25 30 35 40 W N A1 R5 O H (II) , де W являє собою O або S; R2 і R3 незалежно являють собою водень або C1-C3алкіл; R4 і R5 незалежно являють собою водень, галоген, нітро, ціано, C1-C3алкіл, C1C3галогеналкіл, C1-C3алкокси, гідроксил, -OC(O)R9, амін, N-C1-C3алкіламін або N, N-ди-C1C3алкіламін; R8 являє собою водень, нітро, ціано, C1-C6алкіл або C1-C6галогеналкіл; R1 являє собою водень, C1-C6алкокси, гідроксил, амін, N-C1-C6алкіламін, N, N-ди-C1C6алкіламін, C1-C6алкіл, необов'язково заміщений одним - п'ятьма R10, C1-C8алкілкарбоніл, C1-C8алкоксикарбоніл, арил, арил, заміщений одним - п'ятьма R10, гетероарил, гетероарил, заміщений одним - п'ятьма R10, гетероцикліл, гетероцикліл, заміщений одним - п'ятьма R10, бензил або бензил, заміщений одним - п'ятьма R10; R10 являє собою водень, ціано, нітро, галоген, C1-C6алкіл, C1-C6алкокси, C1C6галогеналкіл, C2-C6алкеніл або C2-C6алкініл; кожний A1, A2, A3 і A4 незалежно являє собою C-X або азот, де кожний X може бути однаковим або різним, і за умови, що не більше двох з A1, A2, A3 і A4 являють собою азот; а X являє собою водень, галоген, ціано, гідроксил, -OC(O)R9, C1-C6алкокси, C1-C6алкіл, C1C6галогеналкіл, C1-C3гідроксіалкіл, нітро, амін, N-C1-C6алкіламін, N, N-ди-C1-C6алкіламін або NHC(O)R9; або її солі або N-оксиди. Переваги для A1, A2, A3, A4, R1, R2, R3, R4, R5, R8 і W є такими ж, як і переваги, викладені для відповідних замісників сполук формули (I). Сполука формули (II) є проміжною сполукою в синтезі сполуки формули (I). Таблиці 1 і 2 нижче представляють приклади сполук даного винаходу. 3 UA 109167 C2 Таблиця 1 R1 R2 A2 A3 W N A1 R8 R3 A4 R4 O O R5 R7 Сполука 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 1.11 1.12 1.13 1.14 1.15 1.16 1.17 1.18 1.19 1.20 1.21 1.22 1.23 1.24 1.25 1.26 1.27 1.28 1.29 1.30 1.31 1.32 1.33 1.34 1.35 1.36 1.37 1.38 1.39 1.40 1.41 R1 R2 R3 R4 R5 H H H H H H H H OH H H H H H H H H H H H H H H H H H H H OH H H H H OH H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H OAc H H H H OAc H H H H OAc H C-CH3 H H H H C-CH3 H H OH H C-CH3 H H H H C-CH3 H H H H C-CH3 H H H H C-CH3 H H OH H C-CH3 H H OH H C-CH3 H H H H C-CH3 H H H H C-CH3 H H H H C-CH3 H H H H C-CH3 H H H H C-CH3 H H H H C-CH3 H H H H C-CH3 H H H H C-CH3 H H H H C-CH3 H H H H C-CH3 H H H H C-CH3 H H H OAc C-CH3 H H H OAc C-CH3 H H H OAc (I) O R6 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 H H CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 H H CH3 CH3 CH3 H H H 4 R6 R7 R8 H H H H H H H H H H H H H H H H H H H H H H H CH3 H H H H CH3 H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H CH3 H H H H CH3 H H H H H H H CH3 H CH3 H CH3 H W A1 A2 O C-H C-H O C-H C-H O C-CH3 C-H O C-H C-CH3 O C-H C-H O C-CH3 C-H O C-H C-H O C-H C-H O C-H C-H O C-H C-CH3 O C-H C-H O C-H C-H O C-H C-I O C-H C-H O C-H C-H O C-OH C-H O C-H C-H O C-CH2OH C-H O C-H C-H O C-CH3 C-H O C-H C-H O C-H C-H O C-H C-H O C-CH3 C-H O C-H C-CH3 O C-H C-H O C-CH3 C-H O C-H C-H O C-H C-H O C-H C-H O C-H C-CH3 O C-H C-H O C-H C-H O C-H C-I O C-H C-H O C-H C-H O C-OH C-H O C-H C-H O C-CH2OH C-H H O C-H H O C-CH3 H O C-H A3 C-H C-H C-H C-CH3 C-CH3 C-H C-CH3 C-NO2 C-NH2 C-H C-H C-H C-H C-H C-H C-H C-H C-H C-H C-H C-CH3 C-H C-H C-H C-CH3 C-CH3 C-H C-CH3 C-NO2 C-NH2 C-H C-H C-H C-H C-H C-H C-H C-H C-H C-H C-H C-H A4 C-H C-H C-CH3 C-H C-CH3 C-CH3 C-CH3 C-H C-H C-H C-CH3 C-H C-H C-H C-H C-CH3 C-OH C-H C-H C-CH3 C-CH3 C-H C-H C-CH3 C-H C-CH3 C-CH3 C-CH3 C-H C-H C-H C-CH3 C-H C-H C-H C-H C-CH3 C-OH C-H C-H C-H C-CH3 UA 109167 C2 Таблиця 2 R1 A2 A3 A1 R2 W N R8 R3 A4 R4 Сполука 2.00 2.01 2.02 2.03 2.04 2.05 2.06 2.07 2.08 2.09 2.10 2.11 2.12 2.13 2.14 2.15 2.16 2.17 2.18 2.19 2.20 2.21 2.22 2.23 2.24 2.25 2.26 2.27 2.28 2.29 2.30 2.31 2.32 2.33 2.34 2.35 2.36 2.37 2.38 2.39 2.40 2.41 5 R1 H H H H H H H H H H H H H H H H H H H H H C-CH3 C-CH3 C-CH3 C-CH3 C-CH3 C-CH3 C-CH3 C-CH3 C-CH3 C-CH3 C-CH3 C-CH3 C-CH3 C-CH3 C-CH3 C-CH3 C-CH3 C-CH3 C-CH3 C-CH3 C-CH3 R2 H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H R3 H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H R5 R4 H OH H H H OH OH H H H H H H H H H H H OAc OAc OAc H OH H H H OH OH H H H H H H H H H H H H H H R5 H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H OAc OAc OAc O (II) H R8 H H H H H H H H H H H CH3 H H H H CH3 H CH3 CH3 CH3 H H H H H H H H H H H CH3 H H H H H CH3 H H H W O O O O O O O O O O O O O O O O H O H H H O O O O O O O O O O O O O O O O O H CH3 CH3 CH3 A1 C-H C-H C-CH3 C-H C-H C-CH3 C-H C-H C-H C-H C-H C-H C-H C-H C-H C-OH H C-H H H H C-H C-H C-CH3 C-H C-H C-CH3 C-H C-H C-H C-H C-H C-H C-H C-H C-H C-OH C-H H H H H A2 C-H C-H C-H C-CH3 C-H C-H C-H C-H C-H C-CH3 C-H C-H C-I C-H C-H C-H O C-H O O O C-H C-H C-H C-CH3 C-H C-H C-H C-H C-H C-CH3 C-H C-H C-I C-H C-H C-H C-H O H H H A3 C-H C-H C-H C-CH3 C-CH3 C-H C-CH3 C-NO2 C-NH2 C-H C-H C-H C-H C-H C-H C-H C-CH2OH C-H C-H C-CH3 C-H C-H C-H C-H C-CH3 C-CH3 C-H C-CH3 C-NO2 C-NH2 C-H C-H C-H C-H C-H C-H C-H C-H C-CH2OH O O O A4 C-H C-H C-CH3 C-H C-CH3 C-CH3 C-CH3 C-H C-H C-H C-CH3 C-H C-H C-H C-H C-CH3 C-H C-OH C-H C-H C-H C-H C-H C-CH3 C-H C-CH3 C-CH3 C-CH3 C-H C-H C-H C-CH3 C-H C-H C-H C-H C-CH3 C-OH C-H C-H C-CH3 C-H Сполуки формули (I) відповідно до даного винаходу самі по собі можуть бути використані в якості регуляторів росту рослин або стимуляторів проростання насіння, але, як правило, їх складають у композиції для регулювання росту рослин або стимулювання проростання насіння із використанням допоміжних засобів для складання, таких як носії, розчинники та поверхневоактивні речовини (SFA). Таким чином, даний винахід, крім того, відноситься до композиції для 5 UA 109167 C2 5 10 15 20 25 30 35 40 45 50 55 60 регулювання росту рослин, що містить регулюючу ріст рослин сполуку формули (I) і сільськогосподарсько прийнятний допоміжний засіб для складання. Даний винахід, крім того, відноситься до композиції для регулювання росту рослин, що містить в основному регулюючу ріст рослин сполуку формули (I) і сільськогосподарсько прийнятний допоміжний засіб для складання. Даний винахід, крім того, відноситься до композиції для регулювання росту рослин, що містить регулюючу ріст рослин сполуку формули (I) і сільськогосподарсько прийнятний допоміжний засіб для складання. Даний винахід, крім того, відноситься до композиції для стимуляції проростання насіння, що містить стимулюючу проростання насіння сполуку формули (I) і сільськогосподарсько прийнятний допоміжний засіб для складання. Даний винахід, крім того, відноситься до композиції для стимулювання проростання насіння, що містить в основному стимулюючу проростання насіння сполуку формули (I) і сільськогосподарсько прийнятний допоміжний засіб для складання. Даний винахід, крім того, відноситься до композиції для стимулювання проростання насіння, що містить стимулюючу проростання насіння сполуку формули (I) і сільськогосподарсько прийнятний допоміжний засіб для складання. Композиція може мати форму концентратів, які розчиняються перед застосуванням, хоча також можуть бути отримані готові до застосування композиції. Кінцеве розведення, як правило, здійснюється водою, але замість води або на додаток до води може бути виконане, наприклад, з рідкими добривами, мікроелементами, біологічними організмами, маслом або розчинниками. Композиції, як правило, містять від 0,1 до 99 ваг. %, особливо від 0,1 до 95 ваг. %, сполук формули I і від 1 до 99,9 ваг. % допоміжного засобу для складання, яке переважно включає від 0 до 25 ваг. % поверхнево-активної речовини. Композиції можуть бути обрані з ряду типів складів, багато з яких відомі з Manual on Development and Use of FAO Specifications for Plant Protection Products, 5th Edition, 1999. Вони включають Розпорошуванні порошки (DP), розчинні порошки (SP), розчинні у воді гранули (SG), гранули, що диспергуються у воді, (WG) зволожувані порошки (WP), гранули (GR) (що вивільняються повільно або швидко), розчинні концентрати (SL), змішувані з маслом рідини (OL), рідини наднизького об'єму (UL), емульговані концентрати (EC), концентрати, що диспергуються (DC), емульсії (і масло-у-воді (EW), і вода-в-маслі (EO)), мікроемульсії (ME), суспензійні концентрати (SC), аерозолі, капсульні суспензії (CS) та склади для обробки насіння. Вибір типу складу в кожному разі буде залежати від конкретної мети, що передбачається, і від фізичних, хімічних і біологічних властивостей сполуки формули (I). Розпорошуванні порошки (DP) можуть бути отримані змішуванням сполуки формули (I) з одним або кількома твердими розріджувачами (наприклад, природними глинами, каоліном, пірофілітом, бентонітом, глиноземом, монтморилонітом, кізельгуром, крейдою, діатомовою землею, фосфатами кальцію, карбонатами кальцію та магнію, сіркою, вапном, тонкодисперсними матеріалами, тальком та іншими органічними та неорганічними твердими носіями) і механічним здрібнюванням суміші до дрібного порошку. Розчинні порошки (SP) можуть бути отримані змішуванням сполуки формули (I) з однієї або кількома розчинними у воді неорганічними солями (такими як бікарбонат натрію, карбонат натрію або сульфат магнію) або з одним або кількома розчинними у воді органічними твердими речовинами (такими як полісахарид) і необов'язково з одним або кількома зволожуючими засобами, з одним або кількома диспергувальними засобами або із сумішшю зазначених засобів для поліпшеної диспергованості/розчинності у воді. Потім суміш подрібнюють до дрібного порошку. Подібні композиції також можуть бути гранульовані з утворенням розчинних у воді гранул (SG). Зволожувані порошки (WP) можуть бути отримані змішуванням сполуки формули (I) з одним або кількома твердими розріджувачами або носіями, з одним або кількома зволожуючими засобами та, переважно, з одним або кількома диспергувальними засобами та необов'язково з одним або кількома суспендуючими засобами для полегшення дисперсії в рідинах. Потім суміш подрібнюють до дрібного порошку. Подібні композиції також можуть бути гранульовані з утворенням гранул, що диспергуються у воді (WG). Гранули (GR) можуть бути отримані або гранулюванням суміші сполуки формули (I) та одного або кількох порошкових твердих розріджувачів або носіїв, або шляхом абсорбування сполуки формули (I) (або її розчину, у прийнятному засобі) у пористий гранулярний матеріал попередньо отриманих порожніх гранул (такий як пемза, атапульгітові глини, фулерова земля, кізельгур, діатомові землі або здрібнені кукурудзяні качани), або адсорбуванням сполуки формули (I) (або її розчину, у прийнятному засобі) на матеріал твердого ядра (такий як піски, силікати, мінеральні карбонати, сульфати або фосфати) і сушінням за необхідності. Засоби, які традиційно використовуються для абсорбції або адсорбції включають розчинники (такі як аліфатичні та ароматичні нафтові розчинники, спирти, ефіри, кетони та складні ефіри) і 6 UA 109167 C2 5 10 15 20 25 30 35 40 45 50 55 60 прилипачі (такі як полівінілацетати, полівінілові спирти, декстрини, цукри та рослинні олії). Одна або кілька інших добавок також можуть бути включені в гранули (наприклад, емульгуючий засіб, зволожуючий засіб або диспергувальний засіб). Концентрати, що диспергуються, (DC) можуть бути отримані розчиненням сполуки формули (I) у воді або в органічному розчиннику, такому як кетон, спирт або гліколевий ефір. Ці розчини можуть містити поверхнево-активний засіб (наприклад, для поліпшення розчинності у воді або попередження кристалізації в резервуарі обприскувача). Емульговані концентрати (EC) або емульсії масло-у-воді (EW) можуть бути отримані розчиненням сполуки формули (I) в органічному розчиннику (що необов'язково містить один або кілька зволожуючих засобів, один або кілька емульгуючих засобів або суміш зазначених засобів). Прийнятні органічні розчинники для застосування в EC включають ароматичні вуглеводні (такі як алкілбензоли або алкілнафталіни, представлені SOLVESSO 100, SOLVESSO 150 і SOLVESSO 200; SOLVESSO є зареєстрованою торгівельною маркою), кетони (такі як циклогексанон або метилциклогексанон) і спирти (такі як бензиловий спирт, фурфуриловий спирт або бутанол), N-алкілпіролідони (такі як N-метилпіролідон або N-октилпіролідон), диметиламіди жирних кислот (такі як диметиламід C 8-C10 жирної кислоти) і хлоровані вуглеводні. Продукт EC може мимовільно емульгуватися при додаванні у воду з одержанням емульсії, досить стабільної для забезпечення нанесення розпиленням за допомогою відповідного обладнання. Одержання EW передбачає одержання сполуки формули (I) або у вигляді рідини (якщо вона не є рідкою при кімнатній температурі, її можна розплавити при прийнятній температурі, як правило, нижче 70 °C), або в розчині (шляхом розчинення її у відповідному розчиннику), а потім емульгування отриманої в результаті рідини або розчину у воді, котра містить одну або кілька SFA, при високому зусиллі зрушення з одержанням емульсії. Прийнятні розчинники для застосування в EW включають рослинні олії, хлоровані вуглеводні (такі як хлорбензоли), ароматичні розчинники (такі як алкілбензоли або алкілнафталіни) та інші відповідні органічні розчинники, які характеризуються низькою розчинністю у воді. Мікроемульсії (ME) можуть бути отримані змішуванням води із сумішшю одного або кількох розчинників з одним або кількома SFA із спонтанним одержанням термодинамічно стабільного ізотропного рідкого складу. Сполука формули (I) спочатку знаходиться або у воді, або в суміші розчинника та SFA. Прийнятні розчинники для застосування в ME включають описані вище для застосування в EC або в EW. ME може бути системою або масло-у-воді, або вода-в-маслі (присутність якої може бути визначена вимірами провідності) і може бути прийнятною для змішування розчинних у воді та розчинних у маслі пестицидів у тому самому складі. ME є прийнятною для розведення у воді, причому або залишається у вигляді мікроемульсії, або утворює традиційну емульсію масло-у-воді. Суспензійні концентрати (SC) можуть включати водні або неводні суспензії тонко здрібнених нерозчинних твердих часток сполуки формули (I). SC можуть бути отримані за допомогою здрібнення у кульовому або бісерному млині твердої сполуки формули (I) у прийнятному середовищі, необов'язково з одним або декількома диспергуючими засобами з одержанням суспензії дрібних часток сполуки. Один або кілька зволожуючих засобів можуть бути включені в композицію, і може бути включений суспендуючий засіб для зниження швидкості осідання часток. В якості альтернативи, сполука формули (I) може бути помелена сухою і додана у воду, що містить описані вище засоби, з одержанням бажаного кінцевого продукту. Аерозольні склади включають сполуки формули (I) і прийнятний пропелент (наприклад, нбутан). Сполука формули (I) також може бути розчинена або диспергована в прийнятному середовищі (наприклад, у воді або у змішуваній з водою рідині, такій як н-пропанол) з одержанням композицій для застосування в ненагнітальних насосах для обприскування, які приводяться в дію руками. Капсульні суспензії (CS) можуть бути отримані способом, подібним одержанню складів EW, але з додатковим етапом полімеризації, так що виходить водна дисперсія масляних крапель, в якій кожна масляна крапля інкапсулюється в полімерну оболонку та містить сполуку формули (I) і необов'язково носій або її розріджувач. Полімерна оболонка може бути отримана або реакцією межфазної поліконденсації, або способом коацервації. Композиції можуть забезпечувати регульоване вивільнення сполуки формули (I), та їх можна використовувати для обробки насіння. Сполука формули (I) також може бути складена в біорозкладній полімерній матриці із забезпеченням повільного, регульованого вивільнення сполуки. Композиція може включати одну або кілька добавок для поліпшення біологічних характеристик композиції, наприклад, шляхом поліпшення зволоження, утримання або розподілу на поверхнях; стійкості до дощу на оброблених поверхнях; або поглинання або 7 UA 109167 C2 5 10 15 20 25 30 35 40 45 50 55 60 рухливості сполуки формули (I). Такі добавки включають поверхнево-активні засоби (SFA), добавки для розпилення на основі масел, наприклад, визначених мінеральних масел або природних рослинних олій (таких як соєва та рапсова олії), і суміші їх з іншими біопосилюючими допоміжними засобами (інгредієнтами, які можуть сприяти дії або модифікувати дію сполуки формули (I)). Зволожуючими засобами, диспергуючими засобами та емульгуючими засобами можуть бути SFA катіонного, аніонного, амфотерного або неіонного типу. Прийнятні SFA катіонного типу включають сполуки четвертинного амонію (наприклад, бромід цетилтриметиламонію), імідазоліни та амінні солі. Прийнятні аніонні SFA включають солі лужних металів і жирних кислот, солі аліфатичних складних моноефірів сірчаної кислоти (наприклад, лаурилсульфат натрію), солі сульфонованих ароматичних сполук (наприклад, додецилбензолсульфонат натрію, додецилбензолсульфонат кальцію, бутилнафталінсульфонат і суміші натрію ди-ізопропіл- і три-ізопропілнафталінсульфонатів), ефір сульфати, спиртові ефір сульфати (наприклад, лаурет-3-сульфат натрію), ефір карбоксилати (наприклад, лаурет-3-карбоксилат натрію), складні ефіри фосфатів (продукти реакції між одним або декількома жирними спиртами і фосфорною кислотою (переважно складні моноефіри) або пентоксид фосфору (переважно складні діефіри), наприклад, реакції між лауриловим спиртом і тетрафосфорною кислотою; додатково ці продукти можуть бути етоксильовані), сульфосукцинамати, парафін- або олефінсульфонати, таурати та лігносульфонати. Прийнятні SFA амфотерного типу включають бетаїни, пропіонати та гліцинати. Прийнятні SFA неіонного типу включають продукти конденсації алкіленоксидів, таких як етиленоксид, пропіленоксид, бутиленоксид або їх суміші, з жирними спиртами (такими як олеїловий спирт або цетиловий спирт) або з алкілфенолами (такими як октилфенол, нонілфенол або октилкрезол); частковими складними ефірами, що походять із довголанцюжкових жирних кислот або ангідриди гекситів; продукти конденсації зазначених часткових складних ефірів з етиленоксидом; блок-полімери (що містять етиленоксид і пропіленоксид); алканоламіди; прості складні ефіри (наприклад, складні ефіри жирних кислот і поліетиленгліколю); аміноксиди (наприклад, лаурилдиметиламіноксид) і лецитини. Прийнятні суспензійні засоби включають гідрофільні колоїди (такі як полісахариди, полівінілпіролідон або карбоксиметилцелюлоза натрію), розбухаючі глини (такі як бентоніт або атапульгіт). Даний винахід, крім того, відноситься до способу регулювання росту рослин на місці зростання, що передбачає застосування до місця зростання регулюючу ріст рослин кількість композиції відповідно до даного винаходу. Даний винахід також відноситься до способу забезпечення проростання насіння, що передбачає нанесення на насіння або застосування до місця зростання, що містить насіння, кількість композиції відповідно до даного винаходу, яка стимулює проростання насіння. Нанесення зазвичай здійснюються шляхом розпилення композиції, як правило, за допомогою змонтованого на тракторі розпилювача для великих площ, а також можуть використовуватися інші способи, такі як опудрювання (для порошків), краплинне зрошення або дощування. В якості альтернативи, композиція може бути внесена в борозну або нанесена безпосередньо на насіння до або під час висівання. Сполука формули (I) або композиція даного винаходу може бути нанесена на рослину, частину рослини, орган рослини, матеріал для розмноження рослин або навколишню їхню зону. В одному варіанті здійснення даний винахід відноситься до способу обробки матеріалу для розмноження рослин, що передбачає нанесення на матеріал для розмноження рослин композиції даного винаходу в кількості, ефективній для забезпечення проростання та/або регулювання росту рослин. Даний винахід також відноситься до матеріалу для розмноження рослин, обробленому сполукою формули (I) або композицією даного винаходу. Переважно, матеріалом для розмноження рослин є насіння. Термін "матеріал для розмноження рослин" означає всі генеративні частини рослини, такі як насіння, які можуть бути використані для розмноження останнього, і вегетативні рослинні матеріали, такі як черешки та бульби. Зокрема, можуть бути згадані насіння, коріння, плоди, бульби, цибулини та кореневища. Способи нанесення активних інгредієнтів на матеріал для розмноження рослин, особливо на насіння, відомі в рівні техніки та включають способи нанесення на матеріал для розмноження шляхом протравляння, покриття, дражирування та змочування. Обробка може бути застосована до насіння в будь-який час від збору насіння до висівання насіння або під час процесу висівання. Насіння також може бути піддане первинній обробці або до, або після 8 UA 109167 C2 5 10 15 20 25 30 35 40 45 50 55 60 обробки. Сполука формули (I) необов'язково може бути нанесене в комбінації з покриттям або технологією контрольованого вивільнення так, що сполука вивільняється із часом. Композиція даного винаходу може бути нанесена як досходова або післясходова. Відповідно, якщо композиція використовується для регулювання росту культурних рослин, вона може бути нанесена до або після появи сходів, але переважно після появи сходів сільськогосподарської культури. Якщо композиція використовується для забезпечення проростання насіння, вона може бути нанесена як досходова. Норми нанесення сполук формули I можуть варіювати в широких межах і залежати від природи ґрунту, способу нанесення (до або після появи сходів; протравляння насіння; внесення в борозну для насіння; неоране внесення та т.п.), культурної рослини, переважаючих кліматичних умов та інших факторів, регульованих способом нанесення, часом нанесення та цільовою сільськогосподарською культурою. Для листяного нанесення або дощування сполуки формули I відповідно до даного винаходу, як правило, застосовуються при нормі від 1 до 2000 г/га, особливо від 5 до 1000 г/га. Для обробки насіння норма нанесення, як правило, складає від 0,0005 до 150 г на 100 кг насіння. Рослини, для яких може бути використана композиція відповідно до даного винаходу, включають сільськогосподарські культури, такі як зернові (наприклад, пшеницю, ячмінь, жито, овес); буряк (наприклад, цукровий буряк або кормовий буряк); плодові (наприклад, зерняткові, кісточкові або ягідні, такі як яблуні, груші, сливи, персики, мигдаль, вишні, полуниця, малина або ожина); бобові рослини (наприклад, боби, сочевиця, горох або соя); олійні рослини (наприклад, рапс, гірчиця, мак, оливи, соняшник, кокосова пальма, рицина, боби какао або арахіс); огіркові рослини (наприклад, кабачки, огірки або дині); волокнисті рослини (наприклад, бавовник, льон, коноплі або джут); цитрусові (наприклад, апельсини, лимони, грейпфрут або мандарини); овочеві культури (наприклад, шпинат, латук, спаржу, капусти, моркву, лук, томати, картоплю, гарбузові або паприку); лаврові (наприклад, авокадо, коричне дерево або камфорне дерево); маїс; рис; тютюн; горіхи; каву; цукровий очерет; чай; виноград; хміль; дуріан; банан; каучуконосні рослини; газонні або декоративні (наприклад, квіти, чагарники, широколисті дерева або вічнозелені, такі як хвойні). Це перелік не має на увазі яке-небудь обмеження. Даний винахід також може бути використаний для регуляції росту або для забезпечення проростання насіння рослин, що не є сільськогосподарськими культурами, наприклад, для полегшення боротьби з бур'янистими рослинами шляхом синхронізації проростання. Слід розуміти, що сільськогосподарські культури також включають такі сільськогосподарські культури, які модифіковані традиційними способами селекції або генетично модифіковані. Наприклад, даний винахід може бути використаний відносно сільськогосподарських культур, яким надана витривалість до гербіцидів або класів гербіцидів (наприклад, ALS-, GS-, EPSPS-, PPO-, ACCаза- і HPPD-інгібітори). Прикладом сільськогосподарської культури, якій надана витривалість до імідазолінонів, наприклад, до імазамоксу, традиційними способами селекції, є яровий рапс Clearfield® (канола). Приклади сільськогосподарських культур, яким надана витривалість до гербіцидів способами генетичної модифікації, включають, наприклад, стійкі до гліфосату та гліфозинату сорти маїсу, комерційно доступні під торгівельною маркою Roundupready® і Libertylink®. Способи надання сільськогосподарським рослинам витривалості до HPPD-інгібіторів відомі, наприклад, з WO0246387; наприклад, сільськогосподарська рослина є трансгенною у відношенні полінуклеотиду, що містить послідовність ДНК, яка кодує стійкий до HPPD-інгібітору фермент HPPD, одержаний з бактерії, більш конкретно, з Pseudomonas fluorescens або Shewanella colwelliana, або з рослини, більш конкретно, одержаний з однодольної рослини, або ще більш конкретно, з видів ячменю, маїсу, пшениці, рису, Brachiaria, Chenchrus, Lolium, Festuca, Setaria, Eleusine, Sorghum або Avena. Сільськогосподарські культури також слід вважати такими, яким надана стійкість до шкідливих комах способами генної інженерії, наприклад, Bt-маїс (стійкий до кукурудзяного метелика), Bt-бавовник (стійкий до бавовняного довгоносика), а також Bt-картопля (стійкий до колорадського жука). Прикладами Bt-маїсу є гібриди маїсу Bt 176 NK® (Syngenta Seeds). Btтоксин являє собою білок, який утворюється в природі ґрунтовою бактерією Bacillus thuringiensis. Приклади токсинів або трансгенних рослин, здатних синтезувати такі токсини описані в EP-A-451878, EP-A-374753, WO 93/07278, WO 95/34656, WO 03/052073 і EP-A-427529. Прикладами трансгенних рослин, що мають один або кілька генів, які кодують стійкість до інсектицидів і експресують один або кілька токсинів, є KnockOut (маїс), Yield Gard (маїс), NuCOTIN33B (бавовник), Bollgard (бавовник), NewLeaf (картопля), NatureGard і Protexcta. Рослинні культури або їх насінний матеріал можуть бути в той же час стійкими до гербіцидів і стійкими до поїдання комахами ("stacked" трансгенні події). Наприклад, насіння може мати здатність до експресії інсектицидного білка Cry3 і в той же час, будучи стійким до 9 UA 109167 C2 5 гліфосату. Слід розуміти, що сільськогосподарські культури також включають такі, що отримані традиційними способами селекції або генної інженерії та мають так звані виробничі ознаки (наприклад, поліпшену стійкість при зберіганні, більш високу поживну цінність та поліпшений смак). Сполуки даного винаходу можуть бути отримані такими способами. СХЕМА 1 – варіант A W O A2 A3 A1 X R ZC(R4R5) C(R3)CH2 (XIII) OH O A2 A4 W R W A3 (XIV) A1 A2 A3 A4 R4 R5 (XV) A1 A4 R4 R5 10 15 i) Сполуки формули (XIV), де R являє собою C1-C6алкіл, можуть бути отримані обробкою сполук формули (XIII), де X являє собою Br або I, а R являє собою C1-C6алкіл, алільним похідним формули ZC(R4R5)C(R3)CH2, де Z являє собою похідні бору або олова, у присутності прийнятної системи каталізатор/ліганд, часто комплексу паладію(0). Сполука формули (XIII), де X являє собою Br або I, і R являє собою C1-C6алкіл, є відомою сполукою або може бути отримана способами, відомими фахівцеві в даній галузі. ii) Сполуки формули (XV) можуть бути отримані обробкою сполук формули (XIV), де R являє собою C1-C6алкіл, за допомогою гідролізу складноефірної групи з основою, такою як гідроксид натрію або гідроксид літію. 20 СХЕМА 1 – варіант B 25 30 35 40 i) Сполуки формули (XII), де X являє собою Br або I, можуть бути отримані обробкою сполук формули (XIII), де R являє собою H, C1-C6алкокси, Cl, F або Br, аміном формули HNR’2, де R" не є хіральним, таким як ізопропіл, або R’2 є хіральним, таким як (R, R)-2, 5-диметилпіролідин. Якщо R являє собою H, такі реакції можуть бути здійснені в присутності зв'язувального реагенту, такого як DCC (N, N'-дициклогексилкарбодіімід), EDC (1-етил-3-[3-диметиламінопропіл]карбодіімиду гідрохлорид) або BOP-Cl (біс(2-оксо-3-оксазолідиніл)фосфоновий хлорид), у присутності основи, такої як піридин, тріетиламін, 4-(диметиламіно)піридин або діізопропілетиламін, і необов'язково в присутності нуклеофільного каталізатора, такого як гідроксибензотріазол або 1-гідрокси-7-азабензотріазол. Якщо R являє собою Cl, такі реакції можуть бути здійснені в основних умовах, наприклад, у присутності піридину, тріетиламіну, 4(диметиламіно)піридину або діізопропілетиламіну та необов'язково в присутності нуклеофільного каталізатора. В якості альтернативи, реакція може бути проведена у двофазній системі, яка містить органічний розчинник, переважно етилацетат, і у водному розчиннику, переважно в розчині бікарбонату натрію. Якщо R являє собою C1-C6алкокси, складний ефір може бути безпосередньо перетворений в амід шляхом нагрівання складного ефіру та аміну ’ разом термічним способом. Сполуки формули (XIII) та аміни формули R 2NH або є відомими сполуками, або можуть бути отримані способами, відомими фахівцеві в даній галузі. ii) Сполуки формули (XI), де R" не є хіральним, таким як ізопропіл, або R’2 є хіральним, таким як (R, R)-2,5-диметилпіролідин, можуть бути отримані обробкою сполук формули (XII), де X являє собою Br або I, алільним похідним формули ZC(R4R5)C(R3)CH2, де Z являє собою бор або похідні олова, у присутності прийнятної системи каталізатор/ліганд, часто комплексу 10 UA 109167 C2 паладію(0). iii) В якості альтернативи, сполуки формули (XI) можуть бути отримані зі сполуки формули (XIV), де R являє собою H (сполука формули (XV)), C1-C6алкокси, Cl, F або Br, як описано в i). СХЕМА 2 – варіант A 5 W OH A2 A3 W R2 A1 A1 A2 A3 A4 R3 A4 R5 R4 R4 R5 (X) (XV) 10 Сполуки формули (X) можуть бути отримані обробкою сполук формули (XV) реагентом, застосовуваним для синтезу ацилхлориду, таким як (1-хлор-2-метил-пропеніл)-диметил-амін, з подальшою реакцією з основою, такою як тріетиламін. Утворення ацилхлориду дуже добре відомо фахівцеві в даній галузі та може бути виконано з багатьма іншими реагентами, такими як тіонілхлорид, оксалоїлхлорид або трихлорид фосфору. Друга реакція відома фахівцеві в даній галузі як обробка шляхом внутрішньомолекулярного кетенового циклоприєднання. СХЕМА 2 – варіант B 15 R W N A2 A3 A1 W R2 R A2 A3 A4 A1 R5 R4 R3 A4 R4 (XI) 20 R5 (X) Сполуки формули (X) можуть бути отримані обробкою сполук формули (XI) дегідратуючим засобом, таким як трифторметансульфоновий ангідрид, у присутності основи, такої як колідин, з одержанням кетенової проміжної сполуки імінію шляхом внутрішньомолекулярного циклоприєднання з подальшим гідролізом з водою. Застосування сполук формули (XI), де R’ 2 є хіральним, дає хіральні сполуки формули (X), (IX), (VIII), (VII), (VI), (IV), (III), (II), (I). СХЕМА 3 W R2 R2 A2 A3 A1 A2 R4 R3 A4 R4 R5 R5 (IX) (X) 25 30 A3 R3 A4 W O A1 Сполуки формули (IX) можуть бути отримані обробкою сполук формули (X) пероксидним похідним, таким як пероксид водню. Ця реакція дуже добре відома фахівцям у даній галузі за назвою окиснення Байера-Віллігера для перетворення карбонільних сполук у лактони або складні ефіри. СХЕМА 4 11 UA 109167 C2 A2 A3 R2 A2 A3 10 15 O A1 O O O R3 A4 R4 (VIII) A3 R3 A4 R5 O O R5 A2 R4 5 W A1 R2 A1 O O H A3 R3 A4 R4 (IX) A2 R5 A1 O R R3 A4 R4 (VII) W R5 (VI) i) Сполуки формули (VII), де W являє собою кисень, можуть бути отримані зі сполук формули (IX) через сполуку формули (VIII), де R2 являє собою водень, і W являє собою кисень, за допомогою гідролізу до кислот з обробкою гідроксидом лужного металу, таким як гідроксид натрію, у розчиннику, такому як вода, з подальшим окисненням in situ шляхом обробки оксидантом, таким як хлорид рутенію в присутності метаперіодату натрію. Сполуки формули (IX), такі як 2-інданоцтова кислота, 1-гідрокси-γ-лактон, комерційно доступні або одержують, як описано вище в 4). ii) Сполуки формули (VI), де R являє собою C1-C6алкіл, і W являє собою кисень, можуть бути отримані зі сполук формули (VII) шляхом утворення складного ефіру за допомогою обробки спиртом у присутності кислоти, наприклад, сірчаної кислоти в метанолі або етанолі. В якості альтернативи, сполуки формули (VI) можуть бути отримані з комерційного вихідного матеріалу, такого як інданонові похідні, як описано в літературі (див., наприклад, Bioorganic & Medicinal Chemistry (2008), 16(8), 4438, Journal of the Chemical Society, Perkin Transactions 1: Organic and Bio-Organic Chemistry (1999), (18), 2617, WO2005097093, Monatshefte fuer Chemie (1986), 117(5), 621). СХЕМА 5 20 25 30 35 i) Сполуки формули (III) можуть бути отримані зі сполуки формули (VI), де R не є воднем, наприклад, R являє собою метил або етил, шляхом відновного амінування реакцією заміщеного аміну, такого як метиламін та відновлювального засобу, такого як ціаноборгідрид натрію, з подальшою in situ внутрішньомолекулярною циклізацією. ii) В якості альтернативи, сполуки формули (IIIa) можуть бути отримані зі сполуки формули (VI), де R являє собою H, шляхом відновного амінування реакцією аміну, такого як ацетат амонію та відновлювального засобу, такого як ціаноборгідрид натрію, з подальшою in situ внутрішньомолекулярною циклізацією. iii) В якості альтернативи, сполуки формули (IIIa) можуть бути отримані зі сполуки формули (VI) шляхом утворення оксиму з використанням солі гідроксиламіну та основи, такої як ацетат натрію або піридин, з подальшим відновленням проміжного оксиму з використанням гідрогенування за допомогою H2 та каталізатора, такого як Pd/C або ренеєвського нікелевого каталізатора, або іншими відомими способами, такими як цинк в оцтовій кислоті. Сполуки формули (III), де R1 не є воднем, можуть бути отримані зі сполуки формули (IIIa) (де R1 є H) шляхом алкілування реакцією аміду з алкілуючим засобом, таким як алкілгалід, у присутності основи, такої як гідрид натрію. 12 UA 109167 C2 5 10 15 20 25 30 35 40 45 50 Сполуки формули (III), де R1 являє собою ароматичну або гетероароматичну групу, можуть бути отримані зі сполуки формули (IIIa) (де R1 являє собою H) шляхом реакції аміду з ароматичною або гетероароматичною сполукою формули Arx, X є галогеном, у присутності основи, такої як фосфат калію, та із прийнятним каталізатором, часто сіллю міді (I) та лігандом, таким як диметилетан-1,2-діамін. Сполуки формули (III), де R1 являє собою карбонільне похідне, можуть бути отримані шляхом ацилювання сполуки формули (IIIa) зі сполукою формули (V), де R являє собою OH, у присутності зв'язувального реагенту, такого як DCC (N, N'-дициклогексилкарбодіімід), EDC (1етил-3-[3-диметиламіно-пропіл]карбодііміду гідрохлорид) або BOP-Cl (біс(2-оксо-3оксазолідиніл)фосфоновий хлорид), у присутності основи, такої як піридин, тріетиламін, 4(диметиламіно)піридин або діізопропілетиламін, і необов'язково в присутності нуклеофільного каталізатора, такого як гідроксибензотріазол. Необов'язково, якщо R являє собою Cl або OC(O)C1-C6алкокси, реакція ацилювання може бути здійснена в основних умовах (наприклад, у присутності піридину, тріетиламіну, 4-(диметиламіно)піридину або діізопропілетиламіну). необов'язково в присутності нуклеофільного каталізатора. В якості альтернативи, реакція може бути проведена у двофазній системі, що містить органічний розчинник, переважно етилацетат, і водний розчинник, переважно розчин бікарбонату натрію. Необов'язково, якщо R являє собою C1-C6алкокси, амід може бути отриманий шляхом нагрівання складного ефіру (V) та аміду (IIIa) разом. R" може бути алкілом або алкоксигрупою. Крім того, сполуки формули (III) можуть бути отримані в рацемічній формі, як описано в Journal of Pharmaceutical Sciences 1973 Vol. 62, No. 8, p 1363, Journal of Organic Chemistry (1994), 59(2), 284, Russian Journal of Organic Chemistry, Vol. 41, No. 3, 2005, pp. 361 або в WO84/00962. Сполуки формули (III), де A1, A2, A3 і A4 незалежно являють собою C-CN, можуть бути отримані зі сполук формули (III), де A1, A2, A3 і A4 незалежно являють собою C-X (X є галогеном), з використанням паладієвого каталізатора, такого як паладію трифенілфосфін тетракіс, і ціанідної солі, такої як ціанід цинку. Сполуки формули (III), де A1, A2, A3 і A4 незалежно являють собою C-NO2, можуть бути отримані зі сполук формули (III), де A1, A2, A3 і A4 незалежно являють собою C-H, шляхом нітрування з використанням, наприклад, азотної кислоти, у присутності сірчаної кислоти. Сполуки формули (III), де A1, A2, A3 і A4 незалежно являють собою C-аліл або заміщений Cаліл, можуть бути отримані реакцією сполук формули (III), де A 1, A2, A3 і A4 незалежно являють собою C-X (X є заміщуваною групою, такою як галоген), з похідним алілбору або алілолову в присутності прийнятної системи каталізатор/ліганд, часто комплексу паладію (0). Ці реакції відомі фахівцям у даній галузі як приєднання Стілла та приєднання Сузукі, відповідно, див., наприклад, Strategic Applications of Named Reactions in Organic Synthesis Kurti, Laszlo; Czako, Barbara; Editors. USA. (2005), Publisher: Elsevier Academic Press, Burlington, Mass. Page 448 (приєднання Сузукі) і p 438 (приєднання Стілла) і цитовані посилання. Сполуки формули (III), де A1, A2, A3 і A4 описані для сполуки формули (I), можуть бути отримані гідрогенізацією сполуки формули (III), де A1, A2, A3 і A4 незалежно являють собою Cалільне похідне, з використанням стандартного каталізатора гідрогенізації, такого як паладій на вугіллі. Сполуки формули (III), де R4 або R5 не є воднем, можуть бути отримані зі сполуки формули (IIIa) (де R4 і R5 являють собою H) шляхом бензильного окиснення з використанням оксиданту, такого як перманганат калію або оксид хрому, з одержанням кетону (R4=R5=O). Сполука (III), де R4=OH і R5=H, може бути отримана з відповідного кетону шляхом відновлення кетону із відновлювальним засобом, таким як боргідрид натрію. В якості альтернативи, сполука формули (III), де R4=OAc, і R5=H, може бути отримана безпосереднім окисненням з (діацетоксийод)бензолом у присутності п-толуолсульфонаміду та йоду. Сполука (III), де R4=F і R5=H, може бути отримана зі сполуки (III), де R4=OH і R5=H, реакцією із фторуючим засобом, TM таким як діетиламіносірки трифторид або Deoxo-Fluor . СХЕМА 6 13 UA 109167 C2 R1 A2 A3 A1 R2 R1 W N R2 A2 A3 R3 A4 R4 R5 W N A1 R8 R3 A4 (III) R4 R5 O H (II) R1 A2 A3 A1 R2 R3 A4 R4 5 10 15 20 W N N R R5 R Сполуки формули (II) можуть бути отримані зі сполуки формули (III) шляхом реакції з похідним складного ефіру мурашиної кислоти, таким як метилформіат, у присутності основи, такої як діізопропіламід літію або трет-бутилат калію. В якості альтернативи, сполуки формули (II) можуть бути отримані зі сполуки формули (IV) шляхом гідролізу з кислотою, такою як хлороводень. Сполуки формули (IV) можуть бути отримані зі сполук формули (III) шляхом реакції з реагентом Бредерека (t-бутоксибіс(диметиламіно)метан), де R являє собою метил або аналог. Сполуки формули (II), де A1, A2, A3 і A4 описані для сполуки формули (I), можуть бути отримані гідрогенізацією сполуки формули (II), де A1, A2, A3 і A4 незалежно являють собою Cалільне похідне, з використанням стандартного каталізатора гідрогенізації, такого як паладій на вугіллі. Сполуки формули (II), де R1 являє собою карбоніл, можуть бути отримані зі сполуки формули (II), де R1 являє собою H, ацилюванням з подальшим селективним гідролізом діацильованого продукту. Ацилювання може бути виконане реакцією сполуки (II) зі сполукою формули R1X, де X являє собою галоген або OH, або (R1) 2O в основних умовах (наприклад, у присутності піридину, тріетиламіну, 4-(диметиламіно)піридину або діізопропілетиламіну), необов'язково в присутності нуклеофільного каталізатора, такого як 4-(диметиламіно)піридин. Гідроліз може бути виконаний у спиртовому розчиннику в присутності основи, такої як карбонат калію. O OR R2 A2 A3 H R2 N W N A1 R8 R3 A4 R5 R4 O H A2 A3 W A1 R8 R3 A4 R4 (IIa) 25 (IV) O R5 H (IIb) Сполуки формули (IIb) можуть бути отримані зі сполуки формули (IIa), де R являє собою алкільну групу, таку як трет-бутил, шляхом обробки кислотою, такою як трифтороцтова кислота або HCl. СХЕМА 7 14 UA 109167 C2 R1 R1 R2 A2 A3 R2 W N A2 A1 A3 R8 R3 A4 O H R5 R4 LG (II) 5 R7 R8 R3 A4 R4 O A3 A1 R2 30 35 40 R6 (I) R6 R1 W N R3 A4 A2 O A3 O A1 R6 R2 W N R8 R3 A4 O R5 R7 25 O R7 R8 R4 20 O Сполуки формули (I) можуть бути отримані зі сполук формули (II) шляхом нуклеофільного заміщення 5H-фуранонового похідного, що містить заміщувану групу (LG), і LG є заміщуваною групою, такою як бромід, у положенні 5 у присутності основи, такої як, наприклад, трет-бутилат калію або основа Хуніга. A2 15 O R5 O H 10 W N A1 R4 O O R7 (Ia) 1 O R5 R6 (I) В якості альтернативи, сполуки формули (I), де R являє собою алкільні похідні або 1 бензильні похідні, можуть бути отримані зі сполуки формули (Ia), де R являє собою H, шляхом алкілування реакцією аміну з алкілуючим засобом, таким як алкілгалогенід, бензилгалогенід, необов'язково в присутності основи, такої як гідрид натрію. В якості альтернативи, сполуки формули (I), де карбонільне похідне, може бути отримане зі 1 сполуки формули (Ia), де R являє собою H, шляхом ацилювання сполукою формули (V), де R являє собою OH, у присутності зв'язувального реагенту, такого як DCC (N, N'дициклогексилкарбодіімід), EDC (1-етил-3-[3-диметиламіно-пропіл]карбодііміду гідрохлорид) або BOP-Cl (біс(2-оксо-3-оксазолідиніл)фосфоновий хлорид), у присутності основи, такої як піридин, тріетиламін, 4-(диметиламіно)піридин або діізопропілетиламін, і необов'язково в присутності нуклеофільного каталізатора, такого як гідроксибензотріазол. Необов'язково, якщо R являє собою Cl або OC(O)C1-C6алкокси, реакція ацилювання може бути виконана в основних умовах (наприклад, у присутності піридину, тріетиламіну, 4-(диметиламіно)піридину або діізопропілетиламіну), необов'язково в присутності нуклеофільного каталізатора. В якості альтернативи, реакція може бути проведена у двофазній системі, що містить органічний розчинник, переважно етилацетат, і водний розчинник, переважно розчин бікарбонату натрію. Необов'язково, якщо R являє собою C1-C6алкокси, амід може бути отриманий нагріванням складного ефіру (V) та аміду (Ia) разом. R' може бути алкілом або алкоксигрупою. Сполуки формули (I), де W являє собою сірку, можуть бути отримані зі сполуки формули (I), де W являє собою кисень, шляхом нагрівання з передавальним тіогрупу реагентом, таким як реагент Лавесона або пентасульфіду фосфор. Приклади Для аналізу сполук застосовували наступні способи HPLC-MS. Спосіб A: Спектр реєстрували на мас-спектрометрі ZQ (Waters Corp. Milford, MA, USA), оснащеному джерелом електророзпилення (ESI; температура джерела 100 °C; температура десольватації 250 °C; напруга на конусі 30 В; потік газу на конусі 50 л/година, потік газу десольватації 400 л/година, діапазон мас: 100-900 Да) та Agilent 1100 LC (колонка: Gemini C18, розмір частинок 3 мкм, 110 Ангстрем, 30 × 3 мм (Phenomenex, Torrance, CA, USA); температура колонки: 60 °C; швидкість потоку 1,7 мл/хв.; елюент A: H2O/HCOOH 100:0,05; елюент B: MeCN/MeOH/HCO2H 80:20:0,04; градієнт: 0 хв. 5 % B; 2-2,8 хв. 100 % B; 2,9-3 хв. 5 % B; УФдетектування: 200-500 нм, розділення 2 нм. Потік ділили після колонки перед аналізом MS. 15 UA 109167 C2 5 10 15 20 25 30 35 Спосіб B: Спектр реєстрували на мас-спектрометрі ZMD (Micromass, Manchester UK), оснащеному джерелом електророзпилення (ESI; температура джерела 80 °C; температура десольватації 200 °C; напруга на конусі 30 В; потік газу десольватації 600 л/година, діапазон мас: 100-900 Да), і Agilent 1100 LC (колонка: Gemini C18, розмір частинок 3 мкм, 110 Ангстрем, 30 × 3 мм (Phenomenex, Torrance, CA, USA); температура колонки: 60 °C; швидкість потоку 1,7 мл/хв.; елюент A: H2O/HCO2H 100:0,05; елюент B: MeCN/MeOH/HCO2H 80:20:0,04; градієнт: 0 хв. 5 % B; 2-2,8 хв. 100 % B; 2,9-3 хв. 5 % B; УФ-детектування: 200-500 нм, розділення 2 нм. Потік ділили після колонки перед аналізом MS. Спосіб C: Спектр реєстрували на мас-спектрометрі API2000/Q-TRAP (Applied Biosystems), оснащеному джерелом електророзпилення (ESI; температура джерела 200 °C; капіляр 5,5 кВ, (потенціал декластеризації 50 В), (фокусуючий потенціал 400 В, вхідний потенціал 10 В), ("газова завіса" 30 фунтів на квадратний дюйм, GS1 40 фунтів на квадратний дюйм, GS2 50 фунтів на квадратний дюйм), діапазон мас: 100-800 Да) та Shimadzu SIL HTC/UFLC (колонка: див. таблицю H); температура колонки: 25 °C; швидкість потоку 1,2 мл/хв.; елюент A: 10 мм NH4OAc в H2O; елюент B: MeCN; градієнт: 0,01 хв. 10 % B; 1,5 хв. 30 % B; 3-4 хв. 90 %B; 5 хв. 10 % B; УФ-детектування: 220 і 260 нм. Потік ділили після колонки перед аналізом MS. Спосіб D: Спектр реєстрували на мас-спектрометрі Agilent G1956A, оснащеному джерелом електророзпилення (ESI; температура джерела 100 °C; температура десольватації 350 °C; капіляр 4 кВ; потік газу десольватації 10 л/година, діапазон мас: 100-1000 Да), і Agilent 1100 LC (колонка: Discovery HS-C18, розмір частинок 3 мкм, 110 Ангстрем, 50 × 4,6 мм, Supelco 569250U); температура колонки: немає даних; швидкість потоку 2,20 мл/хв.; елюент A: MeCN/TFA 100:0,05; елюент B: H2O/TFA 100:0,05; градієнт: 0 хв. 10 % A, 5 хв. 90 % A, 6 хв. 99 % A; УФдетектування: 190-400 нм, розділення 2 нм. Спосіб E: Спектр реєстрували на мас-спектрометрі SQD (Waters Corp. Milford, MA, USA), оснащеному джерелом електророзпилення (ESI; температура джерела 150 °C; температура десольватації 250 °C; напруга на конусі 45 В; потік газу десольватації 650 л/година, діапазон мас: 100-900 Да), і Agilent UP LC (колонка: Gemini C18, 3 мкм, 30 × 2 мм (Phenomenex, Torrance, CA, USA); LC (колонка: Gemini C18, розмір частинок 3 мкм, 110 Ангстрем, 30 × 3 мм (Phenomenex, Torrance, CA, USA); температура колонки: 60 °C; швидкість потоку 0,85 мл/хв.; елюент A: H2O/MeOH/HCO2H 100:5:0,05; елюент B: MeCN/HCOOH 100:0,05; градієнт: 0 хв. 0 % B; 0-1,2 хв. 100 % B; 1,2-1,50 хв. 100 % B; УФ-детектування: 210-500 нм, розділення 2 нм. Потік ділили після колонки перед аналізом MS. У всьому цьому розділі використовуються наступні абревіатури: s = синглет; bs = широкий синглет; d = дублет; dd = подвійний дублет; dt = подвійний триплет; t = триплет, tt = потрійний триплет, q = квартет, m = мультиплет; Me = метил; Et = етил; Pr = пропіл; Bu = бутил; M.p. = + температура кипіння; RT = час утримання, MH = молекулярний катіон (тобто виміряна молекулярна маса). Приклад I1: (N, N)-Діізопропіл-2-алілфенілацетамід Етап 1: (N, N)-діізопропіл-2-йодфенілацетамід 40 O OH I 45 50 HN O N I До розчину 2-йодфенілоцтової кислоти (11,0 г, 42,0 ммоль, комерційно доступної) у дихлорметані (85 мл) додавали оксалілхлорид (7,11 мл, 84 ммоль), а потім 2 краплі диметилформаміду. Розчин перемішували при кімнатній температурі протягом 2 годин і розчинники видаляли in vacuo. Залишок поглинався дихлорметаном (100 мл) і охолоджувався при 0 °C. Потім додавали діізопропіламін (17,6 мл, 126 ммоль) і розчин нагрівали до кімнатної температури. Розчинники видаляли in vacuum. Залишок ділили між етилацетатом і водою та екстрагували етилацетатом. Об'єднані органічні шари промивали хлороводнем (1N), сольовим розчином, сушили та концентрували з одержанням 14,3 г (N, N)-діізопропіл-2йодфенілацетаміду (біла тверда речовина, 99 %). C14H20INO, MW: 345,23; LCMS (спосіб A) RT + + -1 1 1,90 хв.; маса 346 (100 %, MH ), 268 (10 %, MNa ); IR: 2965, 1634, 1438, 1369, 1337 см ; H NMR (400 МГц, CdCl3) δ 7,84 (d, 1 H), 7,22-7,35 (m, 3 H), 6,84-6,97 (m, 1 H), 3,91 (m, 1 H), 3,76 (s, 2 H), 3,43 (m, 1 H), 1,46 (d, 3 H), 1,15 (d, 6 H) ppm. 16 UA 109167 C2 Етап 2: (N, N)-Діізопропіл-2-алілфенілацетамід O SnBu3 N 10 15 20 25 N "Pd" I 5 O До дегазованого розчину (N, N)-діізопропіл-2-йодфенілацетаміду (етап 1, 0,235 г, 0,681 ммоль) у толуолі (17 мл) додавали тетракіс(трифенілфосфін)паладій (84 мг, 0,072 ммоль). Отриманий у результаті розчин нагрівали до 110 °C протягом 20 годин, а потім охолоджували. Розчинники видаляли in vacuo, жовте масло розділяли між ацетонітрилом (30 мл) і гексаном (30 мл) і ацетонітрильний шар промивали гексаном (2*30 мл). Ацетонітрил видаляли in vacuo і залишок очищали флеш-хроматографією з елююванням циклогексаном та етилацетатом (9/14/1) з одержанням (N, N)-діізопропіл-2-алілфенілацетаміду (безбарвне масло, 250 мг, 67 %). + C17H25NO; MW: 259,39; LCMS (спосіб A) RT 1,97 хв.; ES: 260 (100 %, MH ); IR 2965, 1634, 1466, -1 1 1439, 1369, 1335 см ; H NMR (400 МГц, CdCl3) δ 7,09-7,23 (4 H, m), 5,95 (1 H, m), 5,07 (1 H, dd), 4,99 (1 H, dd), 3,85 (1 H, m), 3,66 (2 H, s), 3,38-3,50 (1 H, m), 3,36 (2 H, d), 1,45 (7 H, d), 1,08 (6 H, d) ppm. Альтернатива етапу 2 До дегазованого розчину (N, N)-діізопропіл-2-йодфенілацетаміду (етап 1, 0,50 г, 1,44 ммоль) у тетрагідрофурані (10 мл) додавали тетракіс(трифенілфосфін)паладій (39 мг, 0,034 ммоль), фторид цезію (0,207 мг, 1,40 ммоль) і пінакол алілборонат (0,229 мг, 1,361 ммоль). Отриманий у результаті розчин нагрівали до кипіння протягом 4 годин і додавали воду (20 мл). Водний шар екстрагували діетиловим ефіром і об'єднані органічні шари промивали сольовим розчином, сушили та концентрували. Залишок очищали флеш-хроматографією з елююванням циклогексаном і етилацетатом (9/1-4/1) з одержанням (N, N)-діізопропіл-2-алілфенілацетаміду (безбарвне масло, 135 мг, 76 %). Аналітичні дані були ідентичні попередній процедурі приєднання. Приклад I2: 2-(2-аліл-феніл)-1-((2R, 5R)-2,5-диметил-піролідин-1-іл)-етанон Етап 1: Метил-2-алілфенілацетат Sn(Bu)3 O O I O O Pd(PPh3)4 30 35 40 До розчину метил-2-йодфенілацетату (1,00 г, 3,62 ммоль, отриманому з відповідної кислоти згідно з літературним джерелом Tetrahedron 63, 2007, 9979) у толуолі (45 мл) додавали тетракіс(трифенілфосфін)паладій (209 мг, 0,181 ммоль) і алілтрибутилстанан (1,35 мл, 4,34 ммоль). Отриманий у результаті розчин нагрівали до 110 °C протягом 20 годин, а потім охолоджували. Розчинники видаляли in vacuo. Жовте масло розділяли між ацетонітрилом (30 мл) і гексаном (30 мл) і ацетонітрильний шар промивали гексаном (2*30 мл). Ацетонітрил видаляли in vacuo і залишок очищали флеш-хроматографією з елююванням циклогексаном і етилацетатом (15/1) з одержанням метил-2-алілфенілацетату (безбарвне масло, 446 мг, 65 %). + -1 1 C12H14O2; MW: 190,24; LCMS (спосіб A) RT 1,74 хв.; ES: 191 (100 %, MH ); IR 2951, 1734 см ; H NMR (400 МГц, CdCl3) δ 7,14-7,41 (4 H, m), 5,99 (1 H, m), 5,12 (1 H, m), 5,03 (1 H, m), 3,73 (3 H, s), 3,72 (2 H, s), 3,47 (2 H, dt) ppm. Етап 2: 2-алілфенілоцтова кислота O O LiOH OH O 45 До розчину метил-2-алілфенілацетату (етап 1, 0,400 мг, 2,10 ммоль) у тетрагідрофурані (10 мл) додавали гідроксид літію (0,097 г, 2,31 ммоль) у воді (10 мл). Розчин перемішували при 17 UA 109167 C2 5 кімнатній температурі протягом 3 годин і концентрували in vacuo. Додавали воду (40 мл) і доводили pH до 1. Розчин екстрагували дихлорметаном і об'єднані органічні шари сушили та концентрували з одержанням 2-алілфенілоцтової кислоти (жовте масло, 363 мг, 98 %); C11H12O2; -1 1 MW: 176,22; ES-175; IR 1702 см ; H NMR (400 МГц, CdCl3) δ 7,16-7,38 (4 H, m), 5,99 (1 H, m), 5,11 (1 H, m), 5,04 (1 H, m), 3,73 (2 H, s), 3,47 (2 H, dt) ppm. Приклад I3: 2-(2-аліл-феніл)-1-((2R, 5R)-2,5-диметил-піролідин-1-іл)-етанон O OH O EDCI, HOAt, Et3N, DMF N HN 10 15 20 До розчину 2-алілфенілоцтової кислоти (0,050 мг, 0,284 ммоль) у диметилформаміді (5 мл) додавали 3-[3-(диметиламіно)пропіл]-1-етилкарбодііміду гідрохлорид (EDCI, 0,075 ммоль, 0,397 ммоль), 1-гідроксі-7-азабензотріазол (HOAt, 0,054 мг, 0,397 ммоль), (2R, 5R)-диметилпіролідин (0,034 мл, 0,298 ммоль), а потім тріетиламін (0,118 мл, 0,851 ммоль). Розчин перемішували протягом 18 годин і додавали воду (20 мл). Водний шар екстрагували діетиловим ефіром, і об'єднані органічні шари промивали сольовим розчином, сушили та концентрували. Залишок очищали флеш-хроматографією з елююванням циклогексаном і етилацетатом (9/1-4/1) з одержанням 2-(2-аліл-феніл)-1-((2R, 5R)-2,5-диметил-піролідин-1-іл)-етанону (безбарвне масло, + 73 мг, 99 %). C17H23NO; MW: 257,38; LCMS (спосіб A) RT 1,84 хв.; ES 258 (100 %, MH ), 280 + 1 (10 %, MNa ); H NMR (400 МГц, CdCl3) δ 7,08-7,24 (4 H, m), 5,97 (1 H, m), 5,07 (1 H, m), 4,99 (1 H, m), 4,29 (1 H, q), 4,01 (1 H, q), 3,76 (1 H, d), 3,58 (1 H, d), 3,39 (2 H, m), 2,08-2,26 (2 H, m), 1,521,63 (2 H, m), 1,23 (3 H, d), 1,21 (3 H, d) ppm. Приклад I4:1,2a, 7,7 a-тетрагідро-2H-Циклобут[a]інден-2-он Спосіб A (шляхом утворення кетеімінію) 25 30 35 До розчину (N, N)-діізопропіл-2-алілфенілацетаміду (приклад I1, 0,100 г, 0,386 ммоль) у дихлорметані (10 мл) додавали колідин (0,061 мл, 0,463 ммоль), а потім трифторметансульфоновий ангідрид (0,072 мл, 0,424 ммоль). Розчин перемішували при кімнатній температурі протягом 24 годин. Розчинники видаляли in vacuo, залишок поглинався тетрахлоридом вуглецю (4 мл) і водою (4 мл), а двофазну суміш перемішували при 70 °C протягом 6 годин. Водний шар екстрагували дихлорметаном і об'єднані органічні шари сушили та концентрували. Залишок очищали флеш-хроматографією з елююванням циклогексаном і етилацетатом (20/1) з одержанням 1,2a, 7,7a-тетрагідро-2H-циклобут[a]інден-2-ону (безбарвне + масло, 48 мг, 74 %); MW: 158,22; LCMS (спосіб A) RT 1,51 хв.; ES: 159 (20 %, MH ), 143 (100 %); -1 1 IR: 2921 1777 см ; H NMR (400 МГц, CdCl3) δ 7,29-7,36 (2 H, m), 7,23-7,29 (2 H, m), 4,65-4,80 (1 H, m), 3,46 (1 H, dd), 3,36 (1 H), 3,11-3,19 (1 H, m) 3,08 (1 H, d), 2,88 (1 H, m) ppm. *Спосіб B (шляхом утворення кетену) 40 18 UA 109167 C2 5 10 15 20 До розчину 2-алілфенілоцтової кислоти (приклад I2, етап 2, 0,095 г, 0,539 ммоль) у дихлорметані (25 мл) при 0 °C додавали хлор-N, N,2-триметил-1-пропеніламін (0,078 мл, 0,593 ммоль). Розчин перемішували протягом 1 години, а потім нагрівали до кип'ятіння. Потім розчин тріетиламіну (0,082 мл, 0,593 ммоль) у дихлорметані (4 мл) повільно за дві години додавали до розчину соляної кислоти при нагріванні та до кип'ятіння. Реакційну суміш перемішували ще 2 години, а потім охолоджували. Розчинники видаляли in vacuo і залишок очищали флешхроматографією з елююванням циклогексаном і етилацетатом (20/1) з одержанням 1,2a, 7,7aтетрагідро-2H-циклобут[a]інден-2-ону (безбарвне масло, 56 мг, 66 %). Аналітичні дані були ідентичні продукту, отриманому способом A. Приклад I5: Похідне тетрагідроіндено[1,2-b]фуран-2-ону Приклад 1: рац-тетрагідроіндено[1,2-b]фуран-2-он H2O2 O O AcOH O Розчин 1,2a, 7,7a-тетрагідро-2H-циклобут[a]інден-2-ону (приклад I4, 0,377 мг, 2,383 ммоль) в оцтовій кислоті (5 мл) і воді (0,5 мл) охолоджували при 0 °C і додавали пероксид водню (30 % у воді, 0,810 мл, 7,14 ммоль). Розчин перемішували протягом 3 годин при 0 °C і реакційну суміш виливали в насичений розчин гідрокарбонату натрію. Розчин екстрагували етилацетатом і об'єднані органічні шари промивали сольовим розчином, сушили та концентрували. Залишок очищали флеш-хроматографією з елююванням циклогексаном і етилацетатом (4/1) з одержанням рац-тетрагідроіндено[1,2-b]фуран-2-ону (безбарвне масло, 383 мг, 92 %), яке твердло при охолодженні (дані збігаються з літературними даними, CAS 4471-33-4). C11H10O2; + -1 1 MW: 174,20; LCMS (спосіб A) RT 1,32 хв.; ES: 175 (60 %, MH ), 129 (100 %); IR: 1769 см ; H NMR (400 МГц, CdCl3) δ 7,50 (1 H, d), 7,25-7,39 (4 H, m), 5,91 (1 H, d), 3,28-3,45 (2 H, m), 2,86-2,97 (2 H, m), 2,41 (1 H, dd) ppm. Приклад 2: 3a(R), 8b(S)тетрагідроіндено[1,2-b]фуран-2-он O 25 30 35 N Хіральний лактон одержували з 2-(2-аліл-феніл)-1-((2R, 5R)-2,5-диметил-піролідин-1-іл)етанону (приклад I3) із застосуванням способу A (приклад I4) для утворення циклобутанону та окиснення Байера-Віллігера, як описано вище. Енантіомерний надлишок визначали аналізом хіральної HPLC з використанням колонки CHIRALPAK® IC (целюлоза трис(3,5дихлорфенілкарбамат), фіксована на 5 мкм силікагелю, 0,46 см x 25 см, DAD довжина хвилі (нм): 270); градієнт розчинника: гептан/ 2-пропанол/0,1 % DEA 97/03/0,1; швидкість потоку 1 мл/хв.; час утримання енантіомеру 1:32 хв. (96 %), енантіомеру 2:38 хв. (4 %); ee=92 %; [α]D= 107°(літературне джерело: J. Agric. Food Chem. 1997, 2278-2283). Приклад I6: Похідні метилового складного ефіру (1-оксо-індан-2-іл)-оцтової кислоти - Приклад I6(a): Метиловий складний ефір (1-оксо-індан-2-іл)-оцтової кислоти (H1) Етап 1: (1-оксо-індан-2-іл)-оцтова кислота O 40 45 O O O OO OH До суспензії тетрагідроіндено[1,2-b]фуран-2-ону (приклад I5 або комерційно доступного, 0,200 г, 1,15 ммоль) у воді (20 мл) додавали гідроксид натрію (0,051 г, 1,26 ммоль) і розчин нагрівали до 100 °C протягом однієї години. Розчин охолоджували до кімнатної температури, і по краплях додавали гідрат хлориду рутенію(III) (0,048 г, 0,230 ммоль) з подальшим перйодатом натрію (0,368 мг, 1,72 ммоль) у воді (5 мл). Розчин перемішували при кімнатній температурі протягом 1 години та додавали ізопропанол (0,2 мл). pH окиснювали до 1 із застосуванням 2M HCl і реакцію фільтрували. Фільтрат екстрагували дихлорметаном (3*30 мл) і об'єднані органічні шари промивали водою (30 мл), висушували та концентрували з одержанням (1-оксо-індан-2іл)-оцтової кислоти (блідо-жовта тверда речовина, 170 мг, 78 %). C11H10O3; MW: 190,2. LCMS 19 UA 109167 C2 + 1 (спосіб A) RT 1,16 хв.; ES-189 (35 %, MH ), 175 (70 %), 145 (100 %), 127 (90 %). H NMR (400 МГц, CD3OD) δ 7,71 (1 H, d), 7,65 (1 H, t), 7,54 (1 H, d), 7,41 (1 H, t), 3,39-3,51 (1 H, m), 2,83-3,02 (3 H, m), 2,70 (1 H, m) ppm. Етап 2: Метиловий складний ефір (1-оксо-індан-2-іл)-оцтової кислоти (H1) OO 5 10 15 20 25 30 OO OH O До розчину (1-оксо-індан-2-іл)-оцтової кислоти (Етап 1, 2,00 г) у метанолі (10 мл) при 0 °C додавали сірчану кислоту (2 мл). Розчин перемішували протягом 2 годин і потім розбавляли водою (50 мл) і екстрагували етилацетатом. Об'єднані органічні шари промивали насиченим гідрокарбонатом натрію, висушували та концентрували з одержанням метилового складного ефіру (1-оксо-індан-2-іл)-оцтової кислоти (блідо-жовте масло, 2,15 г, згідно з кількісним + аналізом). C12H12O3; MW: 204,23; LCMS (спосіб A) RT 1,40 хв.; ES 227 (25 %, MNa ), 205 (25 %, + -1 1 MH ), 173 (100 %); IR: 2952, 1734, 1710, 1608, 1436 см ; H NMR (400 МГц, CdCl3) 7,78 (1 H, d), 7,61 (1 H, t), 7,47 (1 H, d), 7,39 (1 H, t), 3,70 (3 H, s), 3,47 (1 H, dd), 2,95-3,08 (2 H, m), 2,89 (1 H, dd), 2,63 (1 H, dt) ppm. Сполуку застосовували без подальшого очищення на наступному етапі. - Приклад I6(b): метил-2-(5-фтор-1-оксо-індан-2-іл)ацетат (H2) Сполуки в даному прикладі синтезували відомим способом, описаним в Journal of Agricultural and Food Chemistry (1997), 45(6), 2278-2283 та Journal of Agricultural and Food Chemistry (1992), 40(7), 1230-5. Етап 1: 5-фтор-1-оксо-індан-2-карбоксилат O O O O F F Гідрид натрію (800 мг, 19,9 ммоль, 60 % у мінеральному маслі) промивали гексаном кваліфікації "для HPLC" (двічі). Додавали сухий бензол (4,2 мл) і діетилкарбонат (1,57 г, 1,6 мл, 13,3 ммоль) і отриманий у результаті розчин нагрівали в колбі зі зворотним холодильником протягом однієї години (реакційна суміш стала зеленою). До розчину, який кип'ятили в колбі зі зворотним холодильником, повільно протягом 45 хв. додавали 5-фтор-індан-1-он (1,0 г, 6,66 ммоль) у бензолі (2,7 мл). Отриману в результаті реакційну суміш кип'ятили в колбі зі зворотним холодильником протягом додаткової однієї години. Після закінчення реакції додавали оцтову кислоту / воду (50/50, приблизно 20 мл) доти, поки вся тверда речовина не розчинилася (pH-5). Водний шар екстрагували три рази бензолом. Об'єднану органічну частину промивали водою, насиченим сольовим розчином, висушували над сульфатом натрію та випарювали до сухості. Неочищений продукт очищали колонковою хроматографією з використанням етилацетату / гексану (5 %) з виходом необхідного продукту (1,3 г, 94 %). Етап 2: етил-2-(2-етоксі-2-оксо-етил)-5-фтор-1-оксо-індан-2-карбоксилат O O O O O O F 35 40 O F O Суміш етил-5-фтор-1-оксо-індан-2-карбоксилату (1,4 г, 6,3 ммоль), гідриду натрію (278 мг, 6,9 ммоль, 60 % у мінеральному маслі) і DMF (сухий, 2,5 мл) нагрівали до 65 °C протягом однієї години. Додавали розчин складного брометилового ефіру (1,15 г, 0,8 мл, 6,9 ммоль) у сухому DMF (4,0 мл) при такій же температурі та нагрівання продовжували протягом додаткових 3 годин. Після закінчення реакції реакційну масу випарювали до сухості, додавали 5 мл води та суспензію екстрагували етилацетатом (25 мл x 3). Об'єднаний органічний шар промивали сольовим розчином, висушували над сульфатом натрію, випарювали та піддавали колонковій хроматографії із застосуванням етилацетату/гексану (15 %) з виходом необхідного продукту (1,3 г, 72 %). 20 UA 109167 C2 Етап 3: (5-фтор-1-оксо-індан-2-іл)-оцтова кислота O O 10 15 20 OO OH O F O Етил-2-(2-етоксі-2-оксо-етил)-5-фтор-1-оксо-індан-2-карбоксилат (500 мг, 1,6 ммоль) суспендували в 1,4 мл суміші 6 N HCl: оцтової кислоти (1:1) і нагрівали до кипіння протягом 3 годин. Реакцію контролювали за допомогою TLC. Реакційну масу випарювали до сухості, додавали 10 мл води та екстрагували етилацетатом (40 мл x 3). Органічний шар промивали насиченим сольовим розчином, висушували над сульфатом натрію. Неочищений продукт промивали гексаном з одержанням необхідного продукту (280 мг, 82 %). Етап 4: метил-2-(5-фтор-1-оксо-індан-2-іл)ацетат H2 OO OO O O F 5 O F F (5-фтор-1-оксо-індан-2-іл)-оцтову кислоту (280 мг, 1,3 ммоль) брали в 10 мл метанолу (кваліфікації "для HPLC"), охолоджували до 0 °C, і по краплях у розчин додавали 0,5 мл концентрованої сірчаної кислоти, і нагрівали до кипіння протягом 5 годин. Реакцію контролювали за допомогою TLC. Після закінчення реакційну масу випарювали, додавали 10 мл води та екстрагували етилацетатом (25 мл x 3). Етилацетну частину промивали насиченим водним бікарбонатом натрію, сольовим розчином, висушували (сульфат натрію) і концентрували при зниженому тиску. Неочищений продукт очищали колонковою хроматографією із застосуванням ацетону / гексану (8 %) з виходом необхідного продукту H2 (230 мг, 77 %). Даний спосіб застосовували для одержання сполуки з H2 по H8 (таблиця H). - Приклад I6(c): метиловий складний ефір (1-оксо-4-бром-індан-2-іл)-оцтової кислоти H9 O OO O Br 25 30 Br До розчину 4-бромінданону (15,8 г, 75 ммоль) при -78 °C додавали Lihmds (1 M в THF, 90 мл). Злегка коричневому розчину дозволяли нагрітися до 0 °C і знову охолоджували до -75 °C та додавали по краплях етил-2-бромацетат (9,1 мл, 82 ммоль). Суміші дозволяли нагрітися протягом ночі (з -75 °C до -20 °C протягом 12 годин). Суміш гасили насиченим хлоридом амонію та екстрагували етилацетатом. Флеш-хроматографія дає 19,5 г титульної сполуки в суміші з початковим інданон-этил-2-[4-бром-2-(2-етоксі-2-оксо-етил)-1-оксо-індан-2-іл]ацетатом H9 і який застосовували без подальшого очищення на наступному етапі (чистота, 60 % необхідного продукту). Даний спосіб застосовували для одержання сполук H9 і H10 (таблиця H). Приклад I7:3,3a, 4,8b-тетрагідро-1H-індено[1,2-b]пірол-2-он - Приклад I7(a): 3,3a, 4,8b-тетрагідро-1H-індено[1,2-b]пірол-2-он G1 OO 35 OMe H N O Спосіб A Розчин ацетату амонію (3,77 г, 48,9 ммоль) одночасно випарювали в безводному метанолі. Потім метиловий складний ефір (1-оксо-індан-2-іл)-оцтової кислоти H1 (1,00 г, 4,89 ммоль) у метанолі (40 мл) додавали з подальшими молекулярними ситами (4,9 г). Розчин перемішували 21 UA 109167 C2 5 протягом 30 хв. і додавали ціаноборгідрид натрію (0,92 г, 14,9 ммоль). Суспензію кип'ятили в колбі зі зворотним холодильником протягом 40 годин. Розчин фільтрували через целіт. Додавали насичений розчин гідрокарбонату натрію та розчин екстрагували етилацетатом (3*50 мл). Об'єднані органічні шари промивали хлороводнем (1N), сольовим розчином, висушували та концентрували. Залишок очищали флеш-хроматографією з елююванням етилацетатом і потім етилацетатом/метанолом (95/5) з одержанням 3,3a, 4,8b-тетрагідро-1H-індено[1,2-b]пірол-2-он, G1 (біла тверда речовина, 300 мг, 35 %). LCMS (спосіб A) RT 1,17; ES 196, 174; IR 3233, 1689 -1 1 см ; Mp: 150-153 °C; H NMR (400 МГц, CD3OD) δ 7,34 (1 H, d), 7,12-7,27 (3 H, m), 5,04 (1 H, d), 3,22-3,37 (2 H, m), 2,83 (1 H, d), 2,70 (1 H, dd), 2,15 (1 H, dd) ppm. 10 Спосіб B HO OO 15 20 25 30 35 OMe OMe H N O До розчину метилового складного ефіру 1-оксо-індан-2-іл-оцтової кислоти H1 (8,55 г, 41,89 ммоль) у метанолі (100 мл) додавали ацетат натрію (5,15 г, 62,8 ммоль) і гідрохлорид гідроксиламіну (4,36 г, 62,8 ммоль). Розчин нагрівали до 65 °C протягом 12 годин, розбавляли водою, екстрагували етилацетатом, промивали сольовим розчином, висушували та концентрували з одержанням відповідного оксиму (8,00 г, 87 %). Залишок поглинався оцтовою кислотою (70 мл) і нагрівався до 60 °C. Потім, цинковий пил (23,8 г, 364 ммоль) додавали порціями, підтримуючи температуру нижче 80 °C. Розчин перемішували протягом 30 хв. при 60 °C і потім фільтрували. Воду додавали до фільтрату, і розчин нейтралізували твердим карбонатом калію, поки pH не досягло 7. Розчин екстрагували дихлорметаном, промивали водною HCl (1 N), висушували та концентрували з одержанням лактаму G1 (3,9 г, 61 %) у вигляді білої твердої речовини. Дані тотожні способу A. Даний спосіб застосовували для одержання сполук з G1 по G10 (таблиця G). - Приклад I7(b): 7-нітро-3,3a, 4,8b-тетрагідро-1H-індено[1,2-b]пірол-2-он H H O O N N NO2 Сірчану кислоту (72 мол) додавали до охолодженої суміші азотної кислоти (63,5 ммоль, 4,4 мл) і води (11,3 мл) і суміш додавали по краплях до холодної (2-8 °C) суспензії 3,3a, 4,8bтетрагідро-1H-індено[1,2-b]пірол-2-ону (10 г, 57,7 ммоль) у нітрометані (100 мл). Суміш перемішували 1,5 години при 2-8 °C після завершення додавання і виливали в суміш льоду та води (1 л). Білу суспензію перемішували протягом однієї години, фільтрували та промивали водою. Білу тверду речовину суспендували в 1 л етилацетату, висушували та концентрували під вакуумом. Одержували 7-нітро-3,3a, 4,8b-тетрагідро-1H-індено[1,2-b]пірол-2-он (9,2 г, 73 %). 1H NMR (400 МГц, CD3OD) δ 8,16-8,08 (2 H, m), 7,39 (1 H, d), 6,89 (1 H, brs), 5,09 (1 H, d), 3,493,37 (2 H, m), 2,93 (1 H, d), 2,78 (1 H, dd), 2,26 (1 H, dd) ppm. Приклад I8: похідні 2-оксо-3,3a, 4,8b-тетрагідро-2H-індено[1,2-b]піролу - Приклад I8(a): 2-оксо-3,3a, 4,8b-тетрагідро-2H-індено[1,2-b]пірол-1-карбонової кислоти трет-бутиловий складний ефір F1 O H N 40 NO O O N O До суспензії 3,3a, 4,8b-тетрагідро-1H-індено[1,2-b]пірол-2-ону G1 (0,100 г, 0,578 ммоль) у безводному ацетонітрилі (10 мл) додавали диметиламінопіридин (0,007 мг, 0,057 ммоль), тріетиламін (0,161 мл, 1,15 ммоль) і ди-t-бутил бікарбонат (245 ммоль, 1,15 ммоль в 1 мл дихлорметану). Розчин перемішували при кімнатній температурі протягом 6 годин. Розчин розбавляли етилацетатом і промивали хлороводнем (1M) і сольовим розчином. Об'єднані 22 UA 109167 C2 5 органічні шари висушували та концентрували. Залишок очищали флеш-хроматографією з елююванням етилацетатом і циклогексаном (7/3) з одержанням масла з більшим змістом смолистих речовин F1 (160 мг, згідно з кількісним аналізом). C16H19NO3; MW: 273,33; LCMS + + -1 1 (спосіб B) RT 1,74 хв.; ES: 296 (MNa ), 174 (MH -Boc), 129; IR: 2978, 1782, 1747, 1709 см ; H NMR (400 МГц, CdCl3) δ 7,57 (1 H, d), 7,19-7,34 (3 H, m), 5,62 (1 H, d), 3,08-3,26 (2 H, m), 2,84 (1 H, d), 2,78 (1 H, dd), 2,29 (1 H, dd), 1,63 (9 H, s) ppm. Даний спосіб застосовували для одержання сполук з F1 по F10 (таблиця F). - Приклад I8(b): Трет-бутил-5-ціано-2-оксо-3,3a, 4,8b-тетрагідроіндено[1,2-b]пірол-1карбоксилат F11 O O N O O O O N Br 10 15 20 25 N До розчину трет-бутил-5-бром-2-оксо-3,3a, 4,8b-тетрагідроіндено[1,2-b]пірол-1-карбоксилату F9 (1,5 г, 4,25 ммоль) в DMF (30 мл) додавали Pd(Pph3)4 (751 мг, 0,63 ммоль) та Zn(CN)2 (1,00 г, 8,51 ммоль). Розчин перемішували при 100 °C протягом 16 годин. Після охолодження додавали воду і розчин екстрагували етилацетатом. Органічний шар промивали сольовим розчином три рази, висушували та концентрували. Неочищену сировину розчиняли в 50 мл ацетонітрилу, в який додавали Boc2O (5,5 г, 25,2 ммоль), Net3 (6 мл) і DMAP (520 мг, 4,26 ммоль). Отриману в результаті суміш перемішували протягом 16 годин. Темно-коричневий розчин концентрували під вакуумом і залишок розчиняли в етилацетаті. Органічний шар промивали двічі HCl (1N), сольовий розчин, висушували та концентрували під вакуумом. Залишок очищали флешхроматографією з елююванням етилацетатом і циклогексаном (з 10/90 до 30/70 протягом 30 хв.) з одержанням 880 мг необхідної сполуки F11 у вигляді бежевої смоли (69 %). LCMS (спосіб E): 0,87 хв.; ES+: 619 [2M+Na]. Даний спосіб застосовували для одержання сполук F12 з F10 і F11 з F9 (таблиця F). - Приклад I8(c): Трет-бутил-8-аліл-2-оксо-3,3a, 4,8 b-тетрагідроіндено[1,2-b] пірол-1карбоксилат F14 O Br 30 35 O N O O O N O Розчин трет-бутил-8-бром-2-оксо-3,3a, 4,8b-тетрагідроіндено[1,2-b]пірол-1-карбоксилату (приклад F10, 700 мг), Pd(PPh3)4 (280 мг, 0,12 еквівалента), алілтрибутилстанат (1,65 г, 2,5 еквівалента) у толуолі (17 мл) дегазували та перемішували при кип'ятінні зі зворотним холодильником протягом ночі. Розчинник видаляли під вакуумом. Залишок поглинався ацетонітрилом (40 мл) і промивався двічі n-гексаном. Ацетонітрил видаляли під вакуумом і залишок очищали флеш-хроматографією з елююванням етилацетатом і циклогексаном (з 1 % до 25 %) з одержанням 350 мг необхідних продуктів (суміш алілу та ізомеру) F14: LCMS (спосіб E), RT: 1,06 хв., [ES+ [377, M+CH3CN+Na]. Даний спосіб застосовували для одержання сполук F13 з F9 і F14 з F10 (таблиця F) - Приклад I8(d): Трет-бутил-8-пропіл-2-оксо-3,3a, 4,8b-тетрагідроіндено[1,2-b]пірол-1карбоксилат F15 23 UA 109167 C2 O O N 5 10 15 20 25 30 O O O N O Колбу, промиту аргоном, наповнювали 2-оксо-3,3a, 4,8b-тетрагідро-2Н-4-аліл-індено[1,2b]пірол-1-карбонової кислоти трет-бутиловим складним ефіром F14 і ізомером (200 мг, 0,63 ммоль), етилацетатом (4 мл) і Pd/C (10 %, 30 мг). Чорну суспензію перемішували в атмосфері H2 при кімнатній температурі протягом 72 годин. Суспензію потім фільтрували на целітовій подушці і фільтрат концентрували під вакуумом, очищували флеш-хроматографією із градієнтом етилацетату у циклогексані від 1 % до 10 %, з одержанням необхідної сполуки F15 у + вигляді безбарвного масла (120 мг, 60 %). LCMS (спосіб E): 1,14 хв.; ES+: 338 (M+Na ). - Приклад I8(e): 1-(4-хлорoфеніл)-3,3a, 4,8b-тетрагідроіндено[1,2-b]пірол-2-он F16 До розчину тетрагідро-1H-індено[1,2-b]пірол-2-ону (1,00 г, 5,77 ммоль) у воді (3 мл) додавали оксид міді (I) (167 мг), p-хлорйодбензол (1,38 г, 5,77 ммоль), тетрабутиламонію бромід (0,372 г, 1,15 ммоль) і фосфат калію (2,45 г, 11,5 ммоль). Суспензію енергійно перемішували при 130 °C протягом ночі. Суміш охолоджували та розбавляли дихлорметаном. Тверду речовину відфільтровували та органічний шар висушували та концентрували. Залишок очищали флеш-хроматографією із градієнтом етилацетату в циклогексані від 1 % до 60 %, з + одержанням необхідного продукту F16 (600 мг, 39 %). LCMS (спосіб A) 1,72 хв.; ES+: 284 (M+H ). Даний спосіб застосовували для одержання сполуки F16-F19. - Приклад I8(f): 6-(2-оксо-3,3a, 4,8b-тетрагідроіндено[1,2-b]пірол-1-іл)піридин-3-карбонітрил F20 До суспензії 3,3a, 4,8b-тетрагідро-1H-індено[1,2-b]пірол-2-ону (1 г, 5,77 ммоль) у толуолі (15 мл) додавали гідрид натрію (0,254 г, 6,35 ммоль) при 0 °C. Порцію нагрівали до кімнатної температури та додавали 2-хлор-5-ціанопіридин (0,824 г, 5,77 ммоль). Порцію перемішували при 95 °C протягом 2 годин. Після охолодження порцію додавали до крижаної води та екстрагували етилацетатом (2x). Об'єднані органічні фази концентрували та залишок очищали колонковою хроматографією (гексан / етилацетат 7/3) з одержанням 6-(2-оксо-3,3a, 4,8bтетрагідроіндено[1,2-b]пірол-1-іл)піридин-3-карбонітрилу F20 (1,00 г, 63 %). LCMS (спосіб A) 1,68 + хв.; ES+: 276 (M+H ). - Приклад I8(g): ((3aR, 8bS)-1-тіазол-2-іл-3,3a, 4,8b-тетрагідроіндено[1,2-b]пірол-2-он F21 24 UA 109167 C2 5 10 15 20 25 30 35 До розчину (3aR, 8bS)-3,3a, 4,8b-тетрагідро-1H-індено[1,2-b]пірол-2-ону (0,500 г, 2,89 ммоль) у діоксані (6 мл) додавали фосфат калію (1,26 г, 5,77 ммоль), йодид міді (0,055 г, 0,289 ммоль), 2-бромтоазол (0,473 г, 2,89 ммоль) і N, N'-диметилетан-1,2-діамін (0,0254 г, 0,288 ммоль). Жовтий розчин нагрівали до кипіння протягом ночі. Суспензію потім розбавляли етилацетатом і фільтрували. Розчинники видаляли під вакуумом і залишок очищали флеш-хроматографією з елююванням циклогексаном і етилацетатом (0 % - 50 %) з одержанням титульної сполуки у вигляді безбарвного масла, ((3aR, 8bS)-1-тіазол-2-іл-3,3a, 4,8b-тетрагідроіндено[1,2-b]пірол-2+ ону F21 (0,390 г, 1,52 ммоль, 52,7 % вихід). LCMS (спосіб A) 1,66 хв.; ES+: 257 (M+H ). - Приклад I8(h): (3aR, 8bS)-1-аліл-3,3a, 4,8b-тетрагідроіндено[1,2-b]пірол-2-он F22 До розчину (3aR, 8bS)-3,3a, 4,8b-тетрагідро-1H-індено[1,2-b]пірол-2-ону (1,00 г, 5,77 ммоль) в DMF (10 мл) додавали при 0 °C гідрид натрію (60 % у мінеральному маслі, 0,254 г, 6,35 ммоль). Розчин перемішували протягом 1 години при 0 °C і додавали алілбромід (1,41 г, 2 еквівалента, 1,01 мл, 11,5 ммоль). Розчин перемішували протягом 18 годин при кімнатній температурі та додавали воду. Суміш екстрагували етилацетатом і промивали водою та сольовим розчином. Розчинники видаляли під вакуумом і залишок очищали флешхроматографією з елююванням циклогексаном і етилацетатом (50:50) з одержанням (3aR, 8bS)1-аліл-3,3a, 4,8b-тетрагідроіндено[1,2-b]пірол-2-ону F22 (0,910 г, 0,910 г, 4,27 ммоль, вихід + 73,9 %) у вигляді безбарвного масла. LCMS (спосіб A) 1,51 хв.; ES+: 214 (M+H ). Сполуки з F23 по F25 одержували згідно із даним способом з використанням 4фторбензилхлориду, 2-бромацетонітрилу, етилхлорформіату в якості алкілуючого реагенту. - Приклад I8(i): трет-бутил-(3aR, 8bS)-2,4-діоксо-3a, 8b-дигідро-3H-індено[1,2-b]пірол-1карбоксилат F26 До розчину 2-оксо-3,3a, 4,8b-тетрагідро-2H-індено[1,2-b]пірол-1-карбонової кислоти третбутилового складного ефіру F1 (5,00 г, 18,2 ммоль) в ацетоні (90 мл) і воді (20 мл) додавали KMnO4 (14,7 г, 93 ммоль). Розчин перемішували протягом 48 годин при кімнатній температурі та фільтрували. Розчин концентрували до половини об'єму та додавали розчин тіосульфату натрію (2 %, 50 мл). Розчин екстрагували етилацетатом, промивали сольовим розчином, висушували та концентрували. Залишок очищали флеш-хроматографією з елююванням циклогексаном і етилацетатом (7/3) з одержанням необхідного продукту F26 (1,6 г, 30 %). LCMS + (спосіб E): 0,81 хв.; ES+: 597 (2M+Na ). - Приклад I8(j): трет-бутил-(3aR, 4R, 8bS)-4-гідроксі-2-оксо-3,3a, 4,8 b-тетрагідроіндено[1,2b]пірол-1-карбоксилат F27 25 UA 109167 C2 5 10 15 20 25 30 До розчину трет-бутил-(3aR, 8bS)-2,4-діоксо-3a, 8b-дигідро-3H-індено[1,2-b]пірол-1карбоксилат F 26 (1,60 г, 5,56 ммоль) в етанолі (20 мл) і THF (20 мл) додавали при 0 °C NaBH4 (0,316 г, 8,15 ммоль). Розчин перемішували протягом 2 годин при 0 °C. 1M HCl обережно додавали та розчин концентрували під вакуумом. Залишок розділяли між етилацетатом і водою та екстрагували етилацетатом. Об'єднані органічні шари промивали сольовим розчином, висушували та концентрували. Залишок очищали флеш-хроматографією (2/1 циклогексану/етилацетату) з одержанням трет-бутил-(3aR, 4R, 8bS)-4-гідроксі-2-оксо-3,3a, 4,8bтетрагідроіндено[1,2-b]пірол-1-карбоксилату F27 (800 мг, 50 %). LCMS (спосіб E): 0,78 хв.; ES+: + 601 (2M+Na ). - Приклад I8(k): трет-бутил-(3aR, 4S, 8bS)-4-фтор-2-оксо-3,3a, 4,8b-тетрагідроіндено[1,2b]пірол-1-карбоксилат F28 До розчину трет-бутил-(3aR, 4R, 8bS)-4-гідроксі-2оксо-3,3a, 4,8 b-тетрагідроіндено[1,2b]пірол-1-карбоксилату (0,200 г, 0,691 ммоль) у дихлорметані (1 еквівалент, 3 мл, 0,69 ммоль) додавали при 0 °C трифторид діетиламіносірки (0,913 мл, 6,91 ммоль). Розчин перемішували при 0 °C протягом 30 хв. Реакційну суміш обережно гасили насиченим NaHCO 3 і екстрагували дихлорметаном. Органічний шар висушували та концентрували. Залишок очищали флешхроматографією (0 % - 80 % етилацетату в циклогексані) з одержанням необхідного продукту, + F28 (0,150 г, 74 %). LCMS (спосіб A): 1,65 хв.; ES+: 605 (2M+Na ). - Приклад I8(l): трет-бутил-4-ацетоксі-2-оксо-3,3a, 4,8b-тетрагідроіндено[1,2-b]пірол-1карбоксилат F29 До розчину 2-оксо-3,3a, 4,8b-тетрагідроіндено[1,2-b]пірол-1-карбоксилату (1,28 г, 4,68 ммоль) у дихлорметані (9 мл) додавали p-толуолсульфонамід (0,164 г, 0,937 ммоль), (діацетоксийод)бензол (3,85 г, 11,7 ммоль) та йод (0,238 г, 0,937 ммоль). Розчин нагрівали при 60 °C в аргоні протягом 2 годин. Розчин охолоджували до кімнатної температури та додавали насичений сульфат натрію (2 мл). Додавали воду та розчин екстрагували дихлорметаном (3*50 мл), висушували та концентрували. Залишок очищали флеш-хроматографією (від 10 % до 90 % етилацетату в циклогексані) з одержанням трет-бутил-4-ацетоксі-2-оксо-3,3a, 4,8bтетрагідроіндено[1,2-b]пірол-1-карбоксилату F29 (0,900 г, 58 %) у вигляді суміші діастереоізомерів (2:1 на користь "транс"). Ізомери могли не розділяти. LCMS (спосіб E): 0,90 + хв.; ES+: 685 (2M+Na ). Приклад I9: Синтез 3-[1-диметиламіно-мет-(Z)-іліден]-2-оксо-3,3a, 4,8b-тетрагідро-2H 26 UA 109167 C2 індено[1,2-b]пірол-1-карбонової кислоти трет-бутилового складного ефіру E1 5 10 15 20 25 30 Розчин 2-оксо-3,3a, 4,8b-тетрагідро-2H-індено[1,2-b]пірол-1-карбонової кислоти третбутилового складного ефіру F1 (160 мг, 0,586 ммоль) у трет-бутоксибіс(диметиламіно)метані нагрівали при 75 °C протягом 4 годин. Розчин розбавляли етилацетатом і промивали водою, сольовим розчином, висушували та концентрували з одержанням 3-[1-диметиламіно-мет-(Z)іліден]-2-оксо-3,3a, 4,8b-тетрагідро-2H-індено[1,2-b]пірол-1-карбонової кислоти трет-бутилового складного ефіру, E1 (безбарвна тверда речовина, 190 мг, 98 %). C19H24N2O3; MW: 328,41; LCMS + 1 (спосіб A) RT 1,78 хв.; ES: 329 (MH ), 273; H NMR (400 МГц, CdCl3) δ 7,74 (1 H, d), 7,15-7,26 (4 H, m), 5,61 (1 H, d), 3,99 (1 H, td), 3,37 (1 H, dd), 3,10 (6 H, s), 3,06 (1 H, dd), 1,60 (9 H, s) ppm. Даний спосіб застосовували для одержання сполук з E1 по E15 (таблиця E) Приклад I10: Синтез похідних 3-[1-гідрокси-мет-(Z)-іліден]-2-оксо-3,3a, 4,8b-тетрагідро-2Hіндено[1,2-b]піролу - Приклад I10(a): 3-[1-гідрокси-мет-(Z)-іліден]-2-оксо-3,3a, 4,8b-тетрагідро-2H-індено[1,2b]пірол-1-карбонової кислоти трет-бутиловий складний ефір D1 До розчину 3-[1-диметиламіно-мет-(Z)-іліден]-2-оксо-3,3a, 4,8b-тетрагідро-2H-індено[1,2b]пірол-1-карбонової кислоти трет-бутилового складного ефіру E1 (190 мг, 0,579 ммоль) у тетрагідрофурані (2 мл) додавали хлороводень (1M, 0,87 мл). Розчин перемішували при кімнатній температурі протягом 3 годин. Розчин розбавляли етилацетатом і промивали водою, сольовим розчином, висушували та концентрували. Залишок розтирали в порошок з етилацетатом з одержанням 3-[1-гідрокси-мет-(Z)-іліден]-2-оксо-3,3a, 4,8b-тетрагідро-2Hіндено[1,2-b]пірол-1-карбонової кислоти трет-бутилового складного ефіру D1 (білий порошок, + 1 140 мг, 80 %). C17H19NO4; MW: 301,35; LCMS (спосіб A) RT 1,72 хв.; ES: 302 (MH ), 246; H NMR (400 МГц, DMSO-d6) δ 11,04 (1 H, s), 7,54 (1 H, d), 7,42 (1 H, d), 7,13-7,31 (3 H, m), 5,59 (1 H, d), 3,70 (1 H, m), 3,22 (1 H, dd), 3,15 (1 H, dd), 1,53 (10 H, s) ppm. Даний спосіб застосовували для одержання сполук з D1 по D10 і D25 (таблиця D). - Приклад I10(b): Синтез трет-бутил-(3Z)-5-пропіл-3-(диметиламінометилен)-2-оксо-4,8bдигідро-3aH-індено[1,2-b]пірол-1-карбоксилату D11 Колбу, промиту аргоном, наповнили трет-бутил-(3Z)-5-аліл-3-(диметиламінометилен)-2-оксо4,8b-дигідро-3aH-індено[1,2-b]пірол-1-карбоксилатом D10 (98 мг, 0,29 ммоль) і Pd/C (10 %, 40 мг), і етилацетатом (6 мл). Чорну суспензію перемішували в атмосфері H 2 при кімнатній 27 UA 109167 C2 5 10 15 температурі протягом 24 годин. Суспензію фільтрували на целітовій подушці і жовтий фільтрат концентрували під вакуумом з одержанням титульної сполуки D11 у вигляді коричневої смоли (47 мг, 47 %). LCMS (спосіб E): RT: 1,06 хв.; ES-342 [M-H]. - Приклад I10(c): Синтез етил-(3E)-3-(гідроксиметилен)-2-оксо-4,8b-дигідро-3aH-індено[1,2b]пірол-1-карбоксилату D12 Этил-2-оксо-3,3a, 4,8b-тетрагідроіндено[1,2-b]пірол-1-карбоксилат (200 мг, 0,81 ммоль) розчиняли в тетрагідрофурані (8 мл), охолоджували до -78 °C. Потім додавали біс(триметилсиліл)амід літію (1 моль/л в THF, 1,22 мл, 1,22 ммоль). Після 1 години при -78 °C додавали етилформіат (0,198 мл, 2,446 ммоль). Суміш перемішували протягом ще 30 хв. і потім дозволяли нагрітися до кімнатної температури. Ще після 30 хв. додавали воду. Суміш екстрагували діетиловим ефіром, pH водного шару доводили до 1 і розчин екстрагували EtOAc (2*20 мл), висушували (Na2SO4) і концентрували з одержанням безбарвного масла, етил-(3E)-3(гідроксиметилен)-2-оксо-4,8b-дигідро-3aH-індено[1,2-b]пірол-1-карбоксилату D12 (120 мг, 54 %), яке використовували без подальшого очищення на наступному етапі. LCMS (спосіб A): RT: 1,53 хв.; ES-272 [M-H]. Наступні сполуки одержували згідно із даним способом, D12-D21, D23 і D24. - Приклад D22: Синтез (3E)-1-ацетил-3-(гідроксиметилен)-4,8b-дигідро-3aH-індено[1,2b]пірол-2-ону D22 20 25 30 35 40 До розчину (3E)-3-(гідроксиметилен)-1,3a, 4,8b-тетрагідроіндено[1,2-b]пірол-2-ону (100 мг, 0,497 ммоль) у дихлорметані (5 мл, 0,497 ммоль) додавали N, N-диметилпіридин-2-амін (6 мг, 0,05 ммоль), N, N-діетилетанамін (0,20 мл, 1,49 ммоль), ангідрид оцтової кислоти (0,152 г, 1,49 ммоль). Розчин перемішували протягом 24 годин при кімнатній температурі. Суміш розбавляли дихлорметаном і промивали 1N HCl. Органічний шар висушували та концентрували, і залишок очищали флеш-хроматографією (0 % - 100 % EtOAc в CyH) з одержанням [(E)-(1-ацетил-2-оксо4,8b-дигідро-3aH-індено[1,2-b]пірол-3-іліден)метил]-ацетату (45 мг, 31 %) (LCMS (спосіб A): RT: + 1,69 хв.; ES+286 (M+H ). До розчину попередньої сировини (40 мг, 0,14 ммоль) у метанолі (1 мл) додавали карбонат калію (0,019 г, 0,14 ммоль). Розчин перемішували протягом 30 хв. і додавали 1N HCl (2 краплі). Додавали воду (20 мл) і розчин екстрагували з EtOAc (2*20 мл), висушували та концентрували з одержанням білої твердої речовини (35 мг, кількісно оцінюваного), яку використовували без подальшого очищення на наступному етапі. LCMS (спосіб A): RT: 1,53 хв.; ES-272 [M-H]. Приклад I11: Синтез 3-[1-гідрокси-мет-(Z)-іліден]-3,3a, 4,8b-тетрагідро-1H-індено[1,2-b]пірол2-ону (C1) Спосіб A: До розчину 3-[1-гідрокси-мет-(Z)-іліден]-2-оксо-3,3a, 4,8b-тетрагідро-2H-індено[1,2-b]пірол-1карбонової кислоти трет-бутилового складного ефіру D1 (0,400 г, 1,32 ммоль) у дихлорметані (20 мл) додавали трифтороцтову кислоту (2 мол) при 0 °C. Розчин перемішували протягом 1 28
ДивитисяДодаткова інформація
Назва патенту англійськоюStrigolactam derivatives and their use as plant growth regulators
Автори англійськоюLachia, Mathilde, Denise, de Mesmaeker, Alain, Wolf, Hanno, Christian, Jung, Pierre, Joseph, Marcel
Автори російськоюЛашья Матильд Дэниз, дэ Месмекер Ален, Вольф Ханно Кристиан, Юнг Пьер Жозеф Марсель
МПК / Мітки
МПК: C07D 417/04, C07D 417/14, A01P 21/00, A01N 43/38, C07D 209/70, C07D 405/12, C07D 401/04, C07D 405/14
Мітки: застосування, рослин, росту, стриголактамові, похідні, регуляторів
Код посилання
<a href="https://ua.patents.su/45-109167-strigolaktamovi-pokhidni-ta-kh-zastosuvannya-yak-regulyatoriv-rostu-roslin.html" target="_blank" rel="follow" title="База патентів України">Стриголактамові похідні та їх застосування як регуляторів росту рослин</a>
Попередній патент: Спосіб отримання холестерину
Наступний патент: Розплав для борсульфідування стальних виробів
Випадковий патент: Метантенк