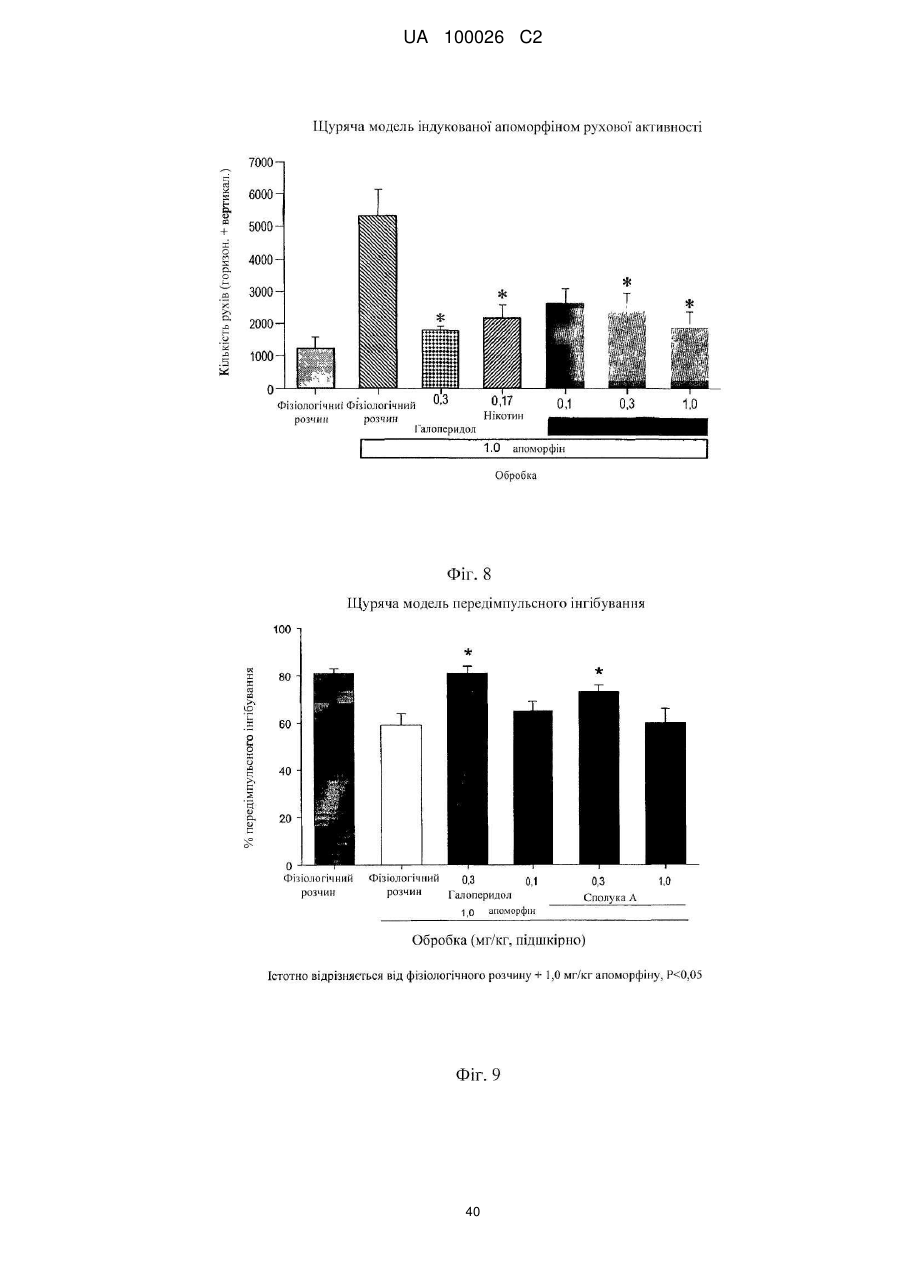
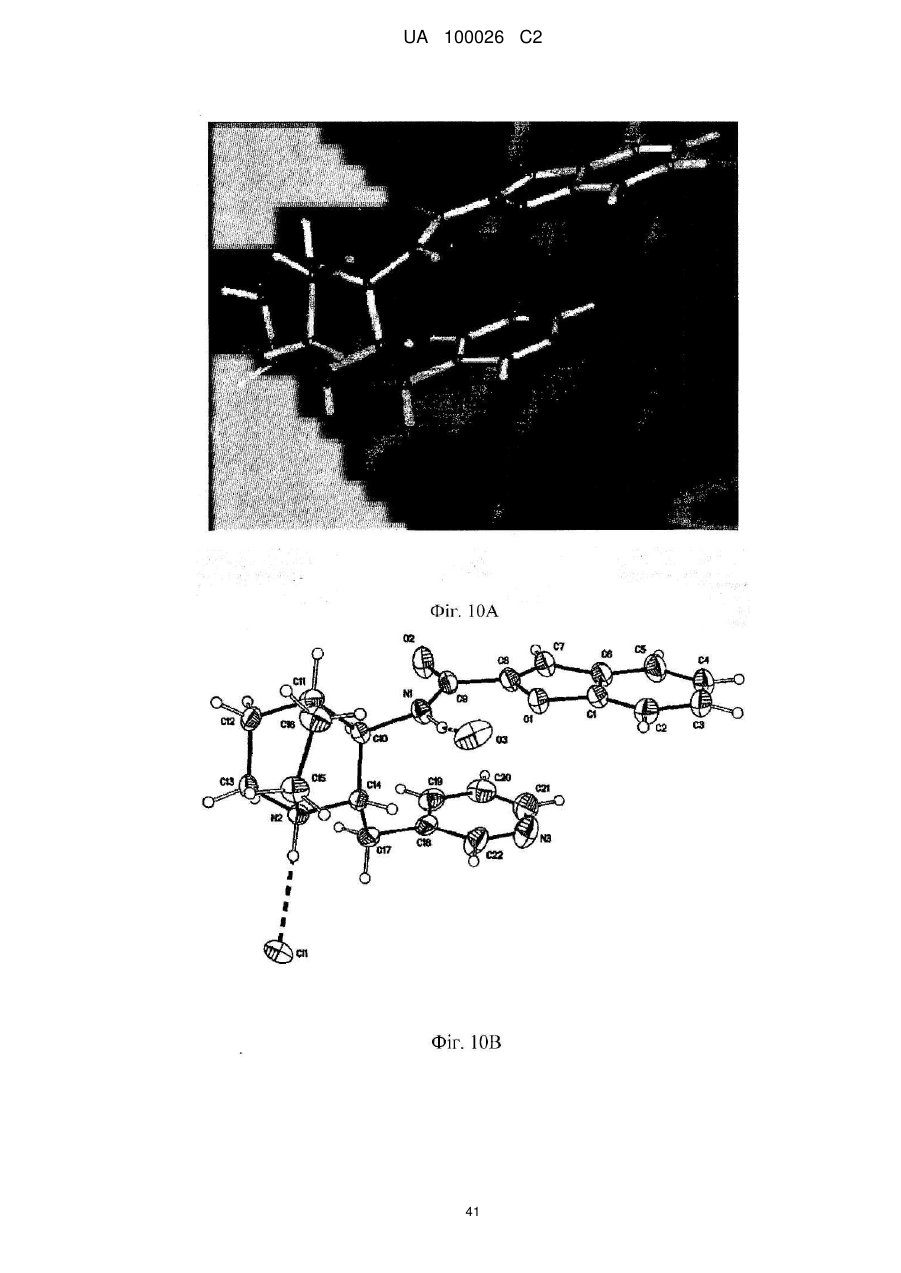
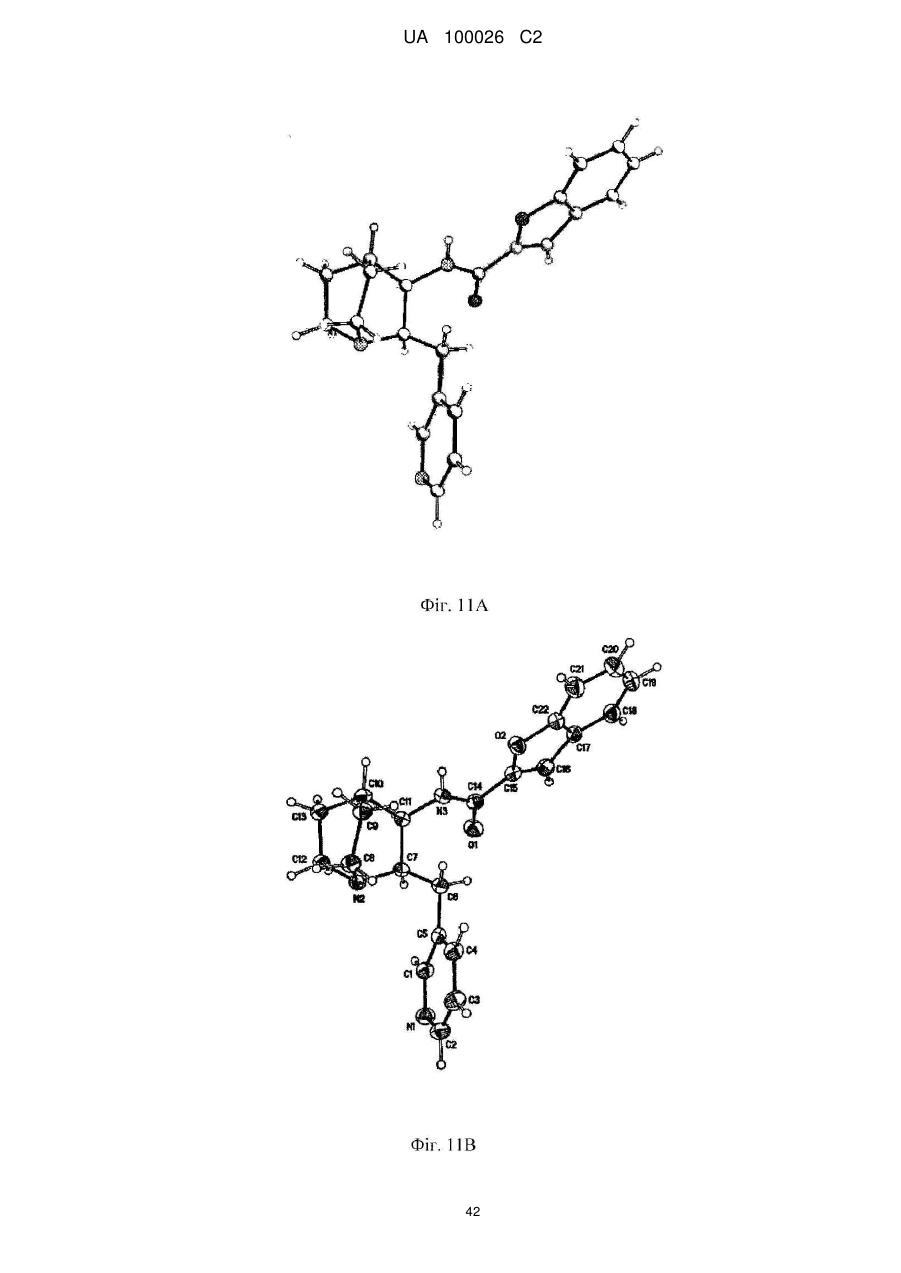
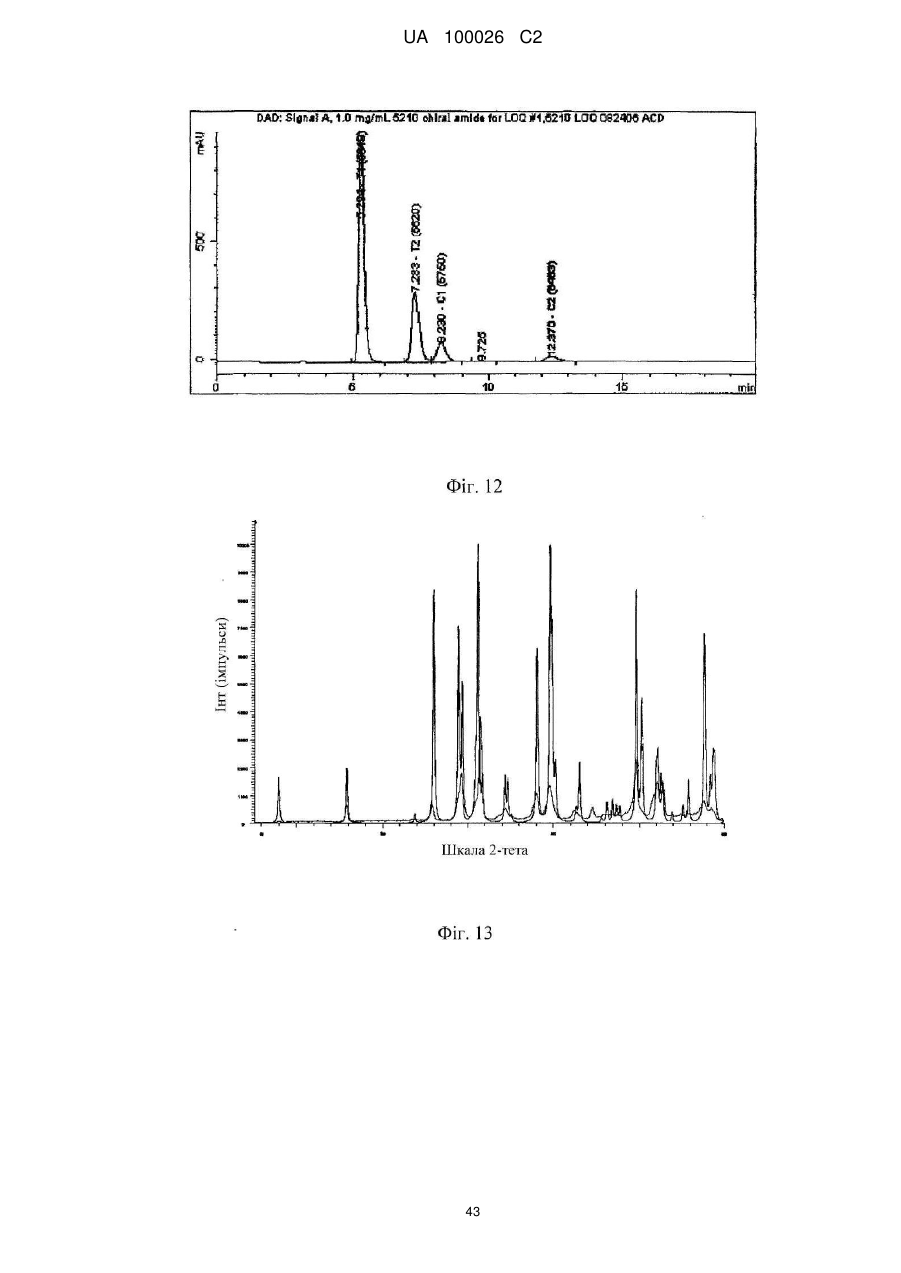
(2s,3r)-n-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксамід та його сольові форми
Номер патенту: 100026
Опубліковано: 12.11.2012
Автори: Беншеріф Меруан, Федоров Ніколай, Пфайффер Сондра, Філліпс Тереза І., Дженус Джон, Гатто Грегорі Дж., Метью Джейкоб, Далл Гарі Моріс, Мазуров Анатолій А., Джордан Крістен Г., Мяо Лань, Пфайффер Ініго, Бенсон Лайза, Муньос Хуліо А.
Формула / Реферат
1. Сіль кислоти і (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду, по суті вільна від (2S,3S)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду, (2R,3S)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду і (2R,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду,
де кислоту вибирають із хлористоводневої кислоти, сірчаної кислоти, фосфорної кислоти, малеїнової кислоти, толуолсульфонової кислоти, галактарової (слизової) кислоти, D-мигдальної кислоти, D-винної кислоти, метансульфонової кислоти, R- і S-10-камфорсульфонової кислоти, кетоглутарової кислоти або гіпурової кислоти.
2. Сполука за п. 1, де стехіометричне співвідношення (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду до кислоти становить 2:1, 1:1 або 1:2.
3. Сполука за п. 2, де стехіометричне співвідношення становить 1:1.
4. Гідрохлорид (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду, по суті вільний від гідрохлориду (2S,3S)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду, гідрохлориду (2R,3S)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду і гідрохлориду (2R,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду.
5. Моногідрохлорид (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду або його гідрат або сольват, по суті вільний від моногідрохлориду (2S,3S)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду, моногідрохлориду (2R,3S)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду і моногідрохлориду (2R,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду.
Текст
Реферат: UA 100026 C2 (12) UA 100026 C2 Даний винахід стосується (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксаміду, його нових сольових форм, способів їхнього одержання, нових проміжних сполук і способів лікування великої кількості станів порушень, включаючи ті, які пов'язані з дисфункцією центральної і вегетативної нервової системи. UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 60 ПЕРЕХРЕСНИЙ ЗВ’ЯЗОК ІЗ ПРІОРИТЕТНИМИ ЗАЯВКАМИ За даним винаходом вимагається пріоритет на підставі попередніх заявок на патент США № 60/971654, поданої 12 вересня 2007 року; 60/953610, поданої 2 серпня 2007 року; 60/953613, поданої 2 серпня 2007 року, і 60/953614, поданої 2 серпня 2007 року, кожна з яких включена в даний винахід шляхом посилання у всій своїй повноті. ГАЛУЗЬ ВИНАХОДУ Даний винахід стосується (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксаміду, його нових сольових форм, способів їхнього одержання, нових проміжних сполук і способів лікування великої кількості станів і порушень, включаючи ті, які пов’язані з дисфункцією центральної і вегетативної нервової системи. ПЕРЕДУМОВИ СТВОРЕННЯ ВИНАХОДУ Було показано, що нейронні нікотинові рецептори (NNR), характерні для центральної нервової системи (ЦНС), існують у вигляді декількох підтипів, найбільш звичайними серед яких є підтипи 42 і 7. Див., наприклад, Schmitt, Current Med. Chem. 7:749 (2000), включену в даний опис шляхом посилання. Передбачалося, що ліганди, які взаємодіють із підтипом 7 NNR, можуть використовуватися при лікуванні безлічі хворобливих станів і порушень. Основне уявлення щодо підтипу 7 нейронного нікотинового рецептора розкрите в публікації Mazurov et al., Curr. Med. Chem. 13: 1567-1584 (2006) і процитованих там посиланнях, включених у даний опис шляхом посилання. Відомими аналогами таких станів і порушень є порушення свідомості, шизофренія, запалення, ангіогенез, невротичний біль і фіброміалгія. Під час посмертних досліджень у тканині мозку пацієнтів із шизофренією виявлена знижена кількість NNR гіпокампа. Також існує поліпшений психологічний ефект у пацієнтів із шизофренією, що курять, у порівнянні з тими, що не курять. Нікотин поліпшує дефіцит сенсорного відбору у тварин і шизофреників. Блокада підтипу 7 NNR індукує дефіцит відбору, аналогічний до спостережуваного при шизофренії. Див., наприклад, Leonard et al., Schizophrenia Bulletin 22(3): 431 (1996), включену в даний опис шляхом посилання. Біохімічні, молекулярні і генетичні дослідження сенсорного процесингу в пацієнтів з Р50 викликаним слухом потенційним дефіцитом відбору дають підставу припустити, що підтип 7 NNR може функціонувати у ролі інгібуючого нейронного шляху. Див., наприклад, Freedman et al., Biological Psychiatry 38(1): 22 (1995), включену в даний опис шляхом посилання. Пізніше було припущено, що 7 NNR є медіаторами ангіогенезу, як описано в публікації Heeschen et al., J. Clin. Invest., 100:527 (2002), включеної шляхом посилання. У даних дослідженнях було показано, що інгібування підтипу 7 зменшує запальний ангіогенез. Рецептори 7 NNR також були запропоновані як мішені контрольованого нейрогенезу і росту пухлини (Utsugisawa et al., Molecular Brain Research 106(1-2): 88 (2002) і патентна заявка США 2002/0016371, кожна з яких включена в даний винахід шляхом посилання). Нарешті, недавно була виявлена роль підтипу 7 у когнітивній здатності (Levin and Rezvani, Current Drug Targets: CNS and Neurological Disorders 1(4): 423 (2002)), нейропротекції (O’Neill et al., Current Drug Targets: CNS and Neurological Disorders 1(4): 399 (2002) і Jeyarasasingam et al., Neuroscience 109(2): 275 (2002)) і невропатичного болю (Xiao et al., Proc. Nat. Acad. Sci. (US) 99(12): 8360 (2002)), кожне цитування включене в даний опис шляхом посилання. Повідомлялося, що різні сполуки взаємодіють із рецепторами 7 NNR і на даній підставі вони були запропоновані як лікування. Див., наприклад, РСТ WO 99/62505, PCT WO 99/03859, PCT WO 97/30998, PCT WO 01/36417, PCT WO 02/15662, PCT WO 02/16355, PCT WO 02/16356, PCT WO 02/16357, PCT WO 02/16358, PCT WO 02/17358, Stevens et al., Psychopharm. 136: 320 (1998), Dolle et al., J. Labelled Comp. Radiopharm. 44: 785 (2001) і Macor et al., Bioorg. Med. Chem. Lett. 11:319 (2001) і процитовані там посилання, дані посилання включені в даний опис шляхом посилання відносно попередніх зазначень із приводу 7 NNR і пропонованого лікування. Серед даних сполук загальним структурним мотивом є заміщений третинний біциклічний амін (наприклад, хінуклідин). Також повідомлялося, що аналогічні заміщені хінуклідинові сполуки зв’язуються з мускариновими рецепторами. Див., наприклад, патенти США № 5712270, Sabb, і РСТ WO 02/00652 і WO 02/051841, кожен з яких включений у даний опис шляхом посилання щодо таких сполук. Обмеження деяких нікотинових сполук полягає у тому, що вони пов’язані з різними небажаними побічними діями, наприклад, зі стимулюванням м’язових і гангліонарних рецепторів. Це призводить до продовжної необхідності в сполуках, композиціях і способах попередження або лікування різних станів або порушень, таких як порушення ЦНС, включаючи полегшення протікання симптомів даних порушень, де сполуки виявляють характерну для нікотинових сполук фармакологічну дію разом зі сприятливим ефектом, а саме на функціонування ЦНС, але без значних пов’язаних із цим побічних дій. Існує необхідність у 1 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 сполуках, композиціях і способах, які впливають на функцію ЦНС без істотного зачіпання тих підтипів нікотинових рецепторів, які здатні викликати небажані побічні дії, такі як помітна активність у серцево-судинних сайтах і сайтах скелетної мускулатури. У даному винаході розроблені такі сполуки, композиції і способи. СТИСЛИЙ ВИКЛАД СУТІ ВИНАХОДУ В одному аспекті даний винахід стосується (2S,3R)-N-(2-((3-піридиніл)метил)-1азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду або його фармацевтично прийнятної солі. Інший аспект стосується (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксаміду по суті в чистому вигляді або його фармацевтично прийнятної солі. Наступний аспект стосується (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксаміду, що по суті не містить (2S,3S), (2R,3S) або (2R,3R) ізомерів, або його фармацевтично прийнятної солі. Додатково, інший аспект стосується стереохімічно збагаченого (2S,3R)-N-(2-((3піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду або його фармацевтично прийнятної солі. В одному варіанті здійснення енантіомерний і/або діастереомерний надлишок становить 90% або більше. В одному варіанті здійснення енантіомерний і/або діастереомерний надлишок становить 95% або більше. В одному варіанті здійснення енантіомерний і/або діастереомерний надлишок становить 98% або більше. В одному варіанті здійснення енантіомерний і/або діастереомерний надлишок становить 99% або більше. В одному варіанті здійснення енантіомерний і/або діастереомерний надлишок становить 99,5% або більше. Інший аспект даного винаходу стосується солі (2S,3R)-N-(2-((3-піридиніл)метил)-1азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду з кислотою, де кислоту вибирають із хлористоводневої кислоти, сірчаної кислоти, фосфорної кислоти, малеїнової кислоти, птолуолсульфонової кислоти, галактарової (слизової) кислоти, D-мигдальної кислоти, D-винної кислоти, метансульфонової кислоти, R- і S-10-камфорсульфонової кислоти, кетоглутарової кислоти або гіпурової кислоти. В одному варіанті здійснення стехіометричне співвідношення (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду до кислоти становить 2:1, 1:1 або 1:2. В одному варіанті здійснення стехіометричне співвідношення становить 1:1. Один варіант здійснення даного винаходу являє собою гідрохлорид (2S,3R)-N-(2((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду або його гідрат або сольват, включаючи часткові гідрати або сольвати. Наступний варіант здійснення являє собою моногідрохлорид (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2карбоксаміду або його гідрат або сольват, включаючи часткові гідрати або сольвати. Даний винахід також стосується масштабованих синтезів (2S,3R)-N-(2-((3-піридиніл)метил)1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду і нових проміжних сполук. Обсяг даного винаходу включає всі комбінації аспектів, варіантів здійснення та описаних у даному винаході переваг. СТИСЛИЙ ОПИС ФІГУР На фіг.1А1-1А4 проілюстровані реакції у відповідь рецепторів 7 щура, експресованих у клітинах GH4C1 ссавців, на (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксамід; рацемат, тобто суміш (2S,3R), (2R,3S), (2R,3R) і (2S,3S); індивідуальні стереоізомери та ацетилхолін (AСh). На фіг.1В проілюстроване порівняння функціональних реакцій у відповідь рецепторів 7 щура, експресованих у клітинах GH4C1 ссавців, на (2S,3R)-N-(2-((3-піридиніл)метил)-1азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксамід; рацемат, тобто суміш (2S,3R), (2R,3S), (2R,3R) і (2S,3S); та індивідуальні стереоізомери в рамках ефективного діапазону концентрацій у плазмі крові. На фіг.2А проілюстровані реакції у відповідь рецепторів 7 людини, експресованих в ооцитах Xenopus, на (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран2-карбоксамід. На фіг.2В проілюстровані контрольні реакції у відповідь рецепторів 7 людини після застосування сполуки в зазначених концентраціях. Дані були нормалізовані до підсумкового заряду контрольних реакцій у відповідь на 300 мкМ AСh, одержаних за 5 хвилин перед експериментальними реакціями у відповідь, викликаними агоністом. Кожна точка являє собою середнє значення статистична похибка (SEM) нормалізованої відповіді принаймні для 4 ооцитів. На фіг.3 проілюстрована оцінка пізнавальної здатності в парадигмі об’єкта розпізнавання (ОR), яка демонструє, що (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3 2 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 60 ил)бензофуран-2-карбоксамід чинить позитивну дію при дозі 0,3 і 1 мг/кг, введеній i.p. (внутрішньочеревинно), p*0,5. На фіг.4 проілюстрована оцінка пізнавальної здатності в парадигмі ОR, яка демонструє, що (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксамід, введений перорально, чинить позитивну дію в широкому діапазоні концентрацій (0,3-10 мг/кг), p*0,5. На фіг.5 проілюстрована дія (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксаміду, введеного внутрішньочеревинно, на запобігання когнітивного дефіциту, викликаного МК-801, також відомого як дизоцилпін, комерційно доступний неконкурентний антагоніст рецептора NMDA, у завданні ОR. На фіг.6 проілюстровано, що середній час, проведений біля об’єкта А стосовно об’єкта В у завданні ОR у випробуванні для групи, обробленої носієм, через 30 хвилин, 6 годин або 24 години після кінцевого підгострого введення (перорально), істотно не відрізнявся (р=0,17, р=0,35 і р=0,12, відповідно). Альтернативно, через 30 хвилин, 2 години, 6 годин або 18 годин після кінцевого підгострого введення (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксаміду в дозі 0,3 мг/кг, суб’єкти проводили істотно більше часу (P0,05), досліджуючи об’єкт В (новий), ніж об’єкт А (знайомий). Більше того, у момент часу 2 години (75%) і 6 годин (71%) індекс розпізнавання був істотно кращим у тварин, оброблених (2S,3R)-N(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксамідом у дозі 0,3 мг/кг, у порівнянні з індексом розпізнавання (54%) у групи, обробленої носієм, через 30 хвилин після кінцевого введення. На фіг.7 проілюстрована оцінка пізнавальної здатності в парадигмі лабіринту з кутовим важелем (RAM). (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2карбоксамід (0,1, 0,3 і 1,0 мг/кг) вводили перорально за 30 хвилин перед денними заняттями. Поліпшення рішення завдання було очевидним у групі, що одержувала 0,3 мг/кг (2S,3R)-N-(2((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду під час другого тижня введення. На фіг.8 проілюстроване дослідження антипсихотичної дії, вимірюваної як гіперактивна поведінка, викликана допаміновою надстимуляцією, яка показує, що (2S,3R)-N-(2-((3піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксамід (0,3 і 1,0 мг/кг; підшкірно) зменшує локомоторну гіперактивність, викликану апоморфіном (1,0 мг/кг) після підшкірного введення щурам. На фіг.9 проілюстрована антипсихотична оцінка, передімпульсне інгібування, яка вказує, що викликаний апоморфіном дефіцит є оборотним при попередній обробці (2S,3R)-N-(2-((3піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксамідом після підшкірного введення. На фіг.10А проілюстровані результати рентгенодифракційного кристалографічного аналізу моногідрохлориду (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2карбоксаміду, що встановив абсолютну стереохімію речовини. Показана сполука являє собою частково гідратовану гідрохлоридну сіль, що показано за допомогою повністю розупорядкованого хлоридного аніона і часткового розміщення молекули води в асиметричній комірці. На фіг.10В проілюстровані результати рентгенодифракційного кристалографічного аналізу моногідрохлориду (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2карбоксаміду, що встановили абсолютну стереохімію речовини, зображені зі схемою нумерації атомів для посилання. Представлений вигляд вниз стосовно кристалографічної b-осі елементарної комірки. Міжмолекулярні водневі зв’язки показані пунктирними лініями. На фіг.11А проілюстровані результати рентгенодифракційного кристалографічного аналізу п-хлорбензоату (2R,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2карбоксаміду, що встановили абсолютну стереохімію речовини. На фіг.11В проілюстровані результати рентгенодифракційного кристалографічного аналізу п-хлорбензоату (2R,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2карбоксаміду, що встановили абсолютну стереохімію речовини, зображені зі схемою нумерації атомів для посилання. На фіг.12 проілюстрована повна хроматограма, що характеризує чотири стереоізомери N-(2((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду, де 2S,3R-ізомер демонструє пік із часом утримання 5,3 хвилини, 2R,3S-ізомер демонструє пік із часом утримання 7,3 хвилини, 2R,3R-ізомер демонструє пік із часом утримання 8,2 хвилини і 2S,3Sізомер демонструє пік із часом утримання 12,4 хвилини. Як описано в даному винаході, рухома фаза, необхідна в аналізі для забезпечення адекватного поділу, призводить до композиції 3 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 60 гексани:етанол: ди-н-бутиламін у співвідношенні 60:40:0,2, при швидкості потоку 1,0 мл/хв, при температурі колонки 20С і УФ-детектуванні при 270 нм. На фіг.13 наведена порошкова рентгенограма моногідрохлориду (2S,3R)-N-(2-((3піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду, що ілюструє як спостережувані (світліший), так і розраховані піки (темніші). В обох випадках характер розподілу піків узгоджується стосовно значень 2, а мінімальна відмінність в інтенсивності та ширині піків може бути пов’язана з розділенням приладів і переважними орієнтаційними ефектами. Як описано в даному винаході, додаткова мінімальна відмінність може бути пов’язана з температурним зсувом, оскільки спостережувані дані одержані при кімнатній температурі, а дані розрахунку одержані для структури при 120К. На фіг.14 наведена порошкова рентгенограма монотозилату (2S,3R)-N-(2-((3піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду. ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ Конкретна сполука, (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксамід, що має афінність (значення Ki1 нМ) і селективність відносно підтипу 7 NNR, проявляє ефективність на тваринних моделях свідомості (посилення свідомості) і психозу (антипсихотична дія). В одному аспекті даний винахід стосується (2S,3R)-N-(2-((3-піридиніл)метил)-1азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду або його фармацевтично прийнятної солі. Інший аспект стосується (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксаміду по суті в чистому вигляді або його фармацевтично прийнятної солі. Наступний аспект стосується (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксаміду, що по суті не містить (2S,3S), (2R,3S) або (2R,3R) ізомерів, або його фармацевтично прийнятної солі. Додатково, інший аспект стосується стереохімічно збагаченого (2S,3R)-N-(2-((3піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду або його фармацевтично прийнятної солі. В одному варіанті здійснення енантіомерний і/або діастереомерний надлишок становить 90% або більше. В одному варіанті здійснення енантіомерний і/або діастереомерний надлишок становить 95% або більше. В одному варіанті здійснення енантіомерний і/або діастереомерний надлишок становить 98% або більше. В одному варіанті здійснення енантіомерний і/або діастереомерний надлишок становить 99% або більше. В одному варіанті здійснення енантіомерний і/або діастереомерний надлишок становить 99,5% або більше. Інший аспект даного винаходу стосується солі (2S,3R)-N-(2-((3-піридиніл)метил)-1азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду з кислотою, де кислоту вибирають із хлористоводневої кислоти, сірчаної кислоти, фосфорної кислоти, малеїнової кислоти, птолуолсульфонової кислоти, галактарової (слизової) кислоти, D-мигдальної кислоти, D-винної кислоти, метансульфонової кислоти, R- і S-10-камфорсульфонової кислоти, кетоглутарової кислоти або гіпурової кислоти. В одному варіанті здійснення стехіометричне співвідношення (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду до кислоти становить 2:1, 1:1 або 1:2. В одному варіанті здійснення стехіометричне співвідношення становить 1:1. Один варіант здійснення даного винаходу являє собою гідрохлорид (2S,3R)-N-(2((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду або його гідрат або сольват, включаючи часткові гідрати або сольвати. Наступний варіант здійснення являє собою моногідрохлорид (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2карбоксаміду або його гідрат або сольват, включаючи часткові гідрати або сольвати. Інший аспект даного винаходу стосується (2S,3R)-N-(2-((3-піридиніл)метил)-1азабіцикло[2.2.2]октану. Інший аспект даного винаходу стосується фармацевтичної композиції, що включає сполуку за даним винаходом і один або декілька фармацевтично прийнятних носіїв. Інший аспект даного винаходу стосується способу лікування або попередження порушення центральної нервової системи, запалення, болю або неоваскуляризації, що включає введення сполуки за даним винаходом. В одному варіанті здійснення порушення центральної нервової системи характеризується зміною нормального вивільнення нейротрансмітера. В одному варіанті здійснення порушення центральної нервової системи вибирають зі слабкого когнітивного погіршення, пов’язаного з віком погіршення пам’яті, передстаречого слабоумства, раннього початку хвороби Альцгеймера, старечого слабоумства, слабоумства за типом Альцгеймера, хвороби Альцгеймера, деменції з тільцями Леві, слабоумства в результаті мікроінфаркту, пов’язаного зі СНІД слабоумства, ВІЛ-слабоумства, множинних церебральних інфарктів, паркінсонізму, хвороби Паркінсона, хвороби Піка, прогресуючого супрануклеарного 4 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 паралічу, хореї Хантінгтона, пізньої дискінезії, гіперкінезії, манії, порушення, пов’язаного з дефіцитом уваги, гіперактивності, пов’язаної з дефіцитом уваги, тривоги, депресії, дислексії, шизофренії, когнітивної дисфункції при шизофренії, депресії, обсесивно-компульсивних порушень або синдрому Туретта. В одному варіанті здійснення порушення центральної нервової системи вибирають із хвороби Альцгеймера, манії, порушення, пов’язаного з дефіцитом уваги, гіперактивності, пов’язаної з дефіцитом уваги, тривоги, дислексії, шизофренії, когнітивної дисфункції при шизофренії, депресії, обсесивно-компульсивних порушень або синдрому Туретта. Інший аспект даного винаходу включає застосування сполуки за даним винаходом для одержання лікарського засобу для лікування або попередження порушення центральної нервової системи, запалення, болю або неоваскуляризації. В одному варіанті здійснення порушення центральної нервової системи характеризується зміною нормального вивільнення нейротрансмітера. В одному варіанті здійснення порушення центральної нервової системи вибирають зі слабкого когнітивного погіршення, пов’язаного з віком погіршення пам’яті, передстаречого слабоумства, раннього початку хвороби Альцгеймера, старечого слабоумства, слабоумства за типом Альцгеймера, хвороби Альцгеймера, деменції з тільцями Леві, слабоумства в результаті мікроінфаркту, пов’язаного зі СНІД слабоумства, ВІЛ-слабоумства, множинних церебральних інфарктів, паркінсонізму, хвороби Паркінсона, хвороби Піка, прогресуючого супрануклеарного паралічу, хореї Хантінгтона, пізньої дискінезії, гіперкінезії, манії, порушення, пов’язаного з дефіцитом уваги, гіперактивності, пов’язаної з дефіцитом уваги, тривоги, депресії, дислексії, шизофренії, когнітивної дисфункції при шизофренії, депресії, обсесивно-компульсивних порушень або синдрому Туретта. В одному варіанті здійснення порушення центральної нервової системи вибирають із хвороби Альцгеймера, манії, порушення, пов’язаного з дефіцитом уваги, гіперактивності, пов’язаної з дефіцитом уваги, тривоги, дислексії, шизофренії, когнітивної дисфункції при шизофренії, депресії, обсесивнокомпульсивних порушень або синдрому Туретта. Інший аспект даного винаходу стосується сполуки за даним винаходом для застосування при лікуванні або попередження порушення центральної нервової системи, запалення, болю або неоваскуляризації. В одному варіанті здійснення порушення центральної нервової системи характеризується зміною нормального вивільнення нейротрансмітера. В одному варіанті здійснення порушення центральної нервової системи вибирають зі слабкого когнітивного погіршення, пов’язаного з віком погіршення пам’яті, передстаречого слабоумства, раннього початку хвороби Альцгеймера, старечого слабоумства, слабоумства за типом Альцгеймера, хвороби Альцгеймера, деменції з тільцями Леві, слабоумства в результаті мікроінфаркту, пов’язаного зі СНІД слабоумства, ВІЛ-слабоумства, множинних церебральних інфарктів, паркінсонізму, хвороби Паркінсона, хвороби Піка, прогресуючого супрануклеарного паралічу, хореї Хантінгтона, пізньої дискінезії, гіперкінезії, манії, порушення, пов’язаного з дефіцитом уваги, гіперактивності, пов’язаної з дефіцитом уваги, тривоги, депресії, дислексії, шизофренії, когнітивної дисфункції при шизофренії, депресії, обсесивно-компульсивних порушень або синдрому Туретта. В одному варіанті здійснення порушення центральної нервової системи вибирають із хвороби Альцгеймера, манії, порушення, пов’язаного з дефіцитом уваги, гіперактивності, пов’язаної з дефіцитом уваги, тривоги, дислексії, шизофренії, когнітивної дисфункції при шизофренії, депресії, обсесивно-компульсивних порушень або синдрому Туретта. У вищезазначених способах і застосуваннях в одному варіанті винаходу ефективні дози становлять між 1 мг і 10 мг протягом 24-годинного періоду. Інший аспект даного винаходу стосується способу одержання (2S,3R)-N-(2-((3піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду або його фармацевтично прийнятної солі шляхом послідовного динамічного оптичного поділу і стереоселективного відновного амінування (2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ону. Обсяг даного винаходу включає всі комбінації аспектів, варіантів здійснення та описаних у даному винаході переваг. Комерційна розробка потенційних лікарських засобів включає багато стадій, включаючи масштабування хімічного синтезу та очищення, виявлення оптимальних сольових форм тощо. У рецептурі лікарських композицій лікарська речовина переважно перебуває в такому вигляді, з яким зручно працювати та обробляти. Аналіз включає комерційну життєздатність, а також стійкість при одержанні. Крім того, при одержанні лікарських композицій важливо, щоб у плазмі крові забезпечувався надійний, відтворений і постійний профіль концентрації лікарського засобу після його введення пацієнтові. 5 UA 100026 C2 5 10 15 20 25 30 35 40 45 Хімічна стабільність, стабільність у твердому стані і тривалість зберігання активних інгредієнтів також є дуже важливими факторами. Лікарська речовина і композиція, що її містить, переважно повинні бути здатними ефективно зберігатися протягом істотного періоду часу без значної зміни фізико-хімічних характеристик активного компонента (наприклад, його хімічного складу, щільності, гігроскопічності і розчинності). Крім того, також важливо мати можливість одержання лікарського засобу у формі, яка є чистою, наскільки це можливо. Ці відмінні риси винаходу обговорюються нижче детальніше. I. Сполуки Сполука за даним винаходом являє собою (2S,3R)-N-(2-((3-піридиніл)метил)-1азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксамід, наведений нижче як сполука А, або фармацевтично прийнятні сольові форми сполуки А. Сполука А Рацемічна сполука – N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2карбоксамід, його синтез і застосування в медичних призначеннях описані в патенті США № 6953855, Мазурова та ін, включеному в даний опис шляхом посилання. Рацемічний N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксамід являє собою високоафінний ліганд для підтипу 7 нейронного нікотинового рецептора (NNR). Рацемічний N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксамід містить два асиметрично заміщених атоми вуглецю. Таким чином, рацемічний N-(2-((3піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксамід існує у вигляді чотирьох стереоізомерних форм, а саме, (S,S), (S,R), (R,R) і (R,S). Ізомер (S,R), а саме (2S,3R), являє собою сполуку А. Раніше припускали, що домінуючі стереоізомерні форми, одержувані в наданих синтезах, включаючи патент США № 6953855, характеризуються відносною цис-конфігурацією в 2 і 3 положеннях 1-азабіцикло[2.2.2]октанового (хінуклідинового) кільця. Інакше кажучи, існувала думка, що цис-діастереомер ((2R,3R) і (2S,3S), пара енантіомерів) є предомінуючими формами, які утворюються при одержанні наданими способами. Дане визначення про предомінування 1 цис-синтезу було обґрунтоване на (I) порівнянні констант Н спін-спінової взаємодії ядер водню в 2 і 3 положеннях хінуклідинового кільця і виділених діастереомерних (цис і транс) проміжних сполук із константами спін-спінової взаємодії, що повідомлялися в літературі; і на (II) очікуваному стереохімічному виході синтетичної хімії, використаної для одержання суміші сполук за аналогією з літературою, із посиланням на Warawa et al., J. Med. Chem. 18(6): 587-593 (1975) і Viti et al., Tetrahedron Lett., 35(32): 5939-5942 (1994), обидві з яких включені в даний опис шляхом посилання. Таким чином, очікувалося, що буде утворюватися цис-конфігурація. Як таке, біологічне тестування з використанням рацемату призводило до результатів, які приписувалися як властиві домінуючій цис-конфігурації. У цей момент було встановлено, за допомогою рентгенодифракційного аналізу кристалічних сольових форм і аналогів, що домінуючий діастереомер, який утворився в початковому синтезі, являв собою, насправді, транс-діастереомер. Крім того, було встановлено, що два енантіомери з відносною транс-стереохімією, а саме (2S,3R) і (2R,3S), істотно відрізняються один від одного за своєю здатністю взаємодіяти з підтипом 7 NNR. Сполука А з конфігурацією (2S,3R) має більшу активність. Із використанням додаткового аналізу було встановлено, що сполука А має фармакологічні властивості, які відрізняються від (i) властивостей кожного з інших трьох стереоізомерів, взятих 6 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 60 окремо; (ii) властивостей суміші всіх чотирьох стереоізомерів, а саме, рацемату; і (iii) властивостей інших лігандів рецептора NNR 7, про які повідомлялося в літературі. (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксамід (сполука А) являє собою високоселективний повний агоніст NNR рецептора 7 із надзвичайно низьким значенням ЕС50 (для активації) і хорошою різницею між ЕС50 м IC50 (для залишкового інгібування), забезпечуючи функціональний агонізм у широкому діапазоні терапевтично корисних концентрацій. II. Масштабований синтез (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксаміду Конкретні синтетичні стадії відрізняються за своєю здатністю піддаватися масштабуванню. Установлено, що реакції погано піддаються масштабуванню через безліч причин, включаючи розуміння безпеки, дорожнечу реагентів, важку обробку або очищення, енергетичні параметри реакції (термодинаміка або кінетика) і вихід реакції. Описаний у даному винаході синтез (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт3-ил)бензофуран-2-карбоксаміду був використаний для одержання кілограмових кількостей речовини, і реакції компонентів були проведені в багатокілограмовому масштабі з високим виходом. У масштабованому синтезі використаний як динамічний оптичний поділ рацемізованого кетону (2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]октан-3-ону), так і стереоселективне відновлення імінного похідного (R)--метилбензиламіну (відновне амінування) розділеного на ізомери кетону. Синтетична послідовність, яка тут описана, є легко масштабована і не включає хроматографічні стадії очищення. III. Одержання нових сольових форм (2S,3R)-N-(2-((3-піридиніл)метил)-1азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксамід у вигляді вільної основи являє собою аморфний порошок із дуже обмеженою розчинністю у воді. Вільна основа буде реагувати як з неорганічними, так і з органічними кислотами з одержанням певних кислотно-адитивних солей, які мають фізичні і хімічні властивості, які є виграшними для одержання фармацевтичних композицій, включаючи, але не обмежуючись зазначеним, кристалічність, розчинність у воді і стабільність. Стехіометрія солей за даним винаходом може змінюватися. Залежно від способу, із використанням якого утворюються описані в даному винаході солі, вони можуть мати кристалічну структуру, в якій оклюдовані розчинники, які присутні під час одержання солі. У такий спосіб солі можуть існувати у вигляді гідратів та інших сольватів зі змінною стехіометрією розчинника відносно (2S,3R)-N-(2-((3-піридиніл)метил)-1азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду. Спосіб одержання сольових форм може змінюватися. Одержання сольових форм (2S,3R)-N(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду звичайно включає (i) змішування вільної основи або розчину вільної основи, а саме (2S,3R)-N-(2-((3піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду, у придатному розчиннику з кислотою без розчинника або у вигляді розчину кислоти в придатному розчиннику; (iia) охолодження одержаного розчину солі, за необхідності, для того, щоб викликати утворення осаду; або (iib) додавання придатного “анти”-розчинника, для того, щоб викликати утворення осаду; або (iic) упарювання першого розчинника і додавання нового розчинника і повторення або стадії (iia), або стадії (iib); і (iii) фільтрування і збирання одержаної солі. В одному варіанті здійснення (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксамід є стереохімічно збагаченим. В одному варіанті здійснення енантіомерний і/або діастереомерний надлишок становить 90% або більше. В одному варіанті здійснення енантіомерний і/або діастереомерний надлишок становить 95% або більше. В одному варіанті здійснення енантіомерний і/або діастереомерний надлишок становить 98% або більше. В одному варіанті здійснення енантіомерний і/або діастереомерний надлишок становить 99% або більше. В одному варіанті здійснення енантіомерний і/або діастереомерний надлишок становить 99,5% або більше. Стехіометрія, суміш розчинників, концентрація розчиненої речовини і використовувана температура можуть змінюватися. Ілюстративні розчинники, які можна використовувати для одержання або перекристалізації сольових форм включають, без обмеження, етанол, метанол, ізопропіловий спирт, ацетон, етилацетат і ацетонітрил. 7 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 Приклади придатних фармацевтично прийнятних солей включають адитивні солі неорганічних кислот, такі як хлорид, бромід, сульфат, фосфат і нітрат; адитивні солі органічних кислот такі, як ацетат, галактарат, пропіонат, сукцинат, лактат, гліколят, малат, тартрат, цитрат, малеат, фумарат, метансульфонат, п-толуолсульфонат і аскорбат; і солі з амінокислотами, такі як аспартат і глутамат. Солі в деяких випадках можуть являти собою гідрати або сольвати з етанолом. Передбачені ілюстративні солі, як описано в патентах США № 5597919, Dull et al., 5616716, Dull et al., і 5663356, Ruecroft et al., кожен з яких включений у даний опис шляхом посилання. Скринінг солей вільної основи (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксаміду показав, що хоча можуть бути одержані багато солей із фармацевтично прийнятними кислотами, тільки деякі із цих солей мають прийнятні властивості для комерційного виробництва. Здатності передбачити характеристики, що ілюструють комерційно життєздатну сіль, відповідно, не існує. Кислоти, які давали солі, які були кристалічними, а саме солі, які виявляли деякий ступінь кристалічності залежно від способу, за допомогою якого їх одержують, включають хлористоводневу кислоту, сірчану кислоту, фосфорну кислоту, п-толуолсульфонову кислоту, галактарову (слизову) кислоту, D-мигдальну кислоту, D-винну кислоту, метансульфонову кислоту, R- і S-10-камфорсульфонову кислоту, малеїнову кислоту, кетоглутарову кислоту і гіпурову кислоту. Серед даних солей кожна із солей хлористоводневої кислоти, фосфорної кислоти, малеїнової кислоти і п-толуолсульфонової кислоти виявляла додаткові бажані властивості, включаючи високі температури плавлення, гарну розчинність у воді і низьку гігроскопічність. Такі характеристики для даних солей були несподіваними. IV. Фармацевтичні композиції Фармацевтичні композиції за даним винаходом включають описані тут солі, у чистому стані або у вигляді композиції, в якій сполуки об’єднані з будь-яким іншим фармацевтично сумісним продуктом, який може бути інертним або фізіологічно активним. Одержані фармацевтичні композиції можна використовувати для попередження стану або порушення в суб’єкта, схильного до такого стану або порушення, і/або для лікування суб’єкта, що страждає від даного стану або порушення. Описані тут фармацевтичні композиції включають сполуку за даним винаходом і/або її фармацевтично прийнятні солі. Спосіб, за допомогою якого вводять сполуки, може змінюватися. Композиції переважно вводять перорально (наприклад, у рідкому вигляді в розчиннику, такому як водна або неводна рідина, або у твердому носії). Переважні композиції для перорального введення включають пігулки, таблетки, капсули, каплети, сиропи і розчини, включаючи тверді желатинові капсули і капсули з вивільненням у часі. Стандартні ексципієнти включають зв’язувальні речовини, наповнювачі, барвники, солюбілізатори і таке інше. Рецептура композицій може бути складена у вигляді одиничної препаративної лікарської форми або у вигляді безлічі доз або підодиниць. Переважні композиції знаходяться у рідкому або напівтвердому вигляді. Можна використовувати композиції, що включають рідкий фармацевтично інертний носій, такий як вода або інші фармацевтично сумісні рідини, або напівтверді речовини. Застосування таких рідин і напівтвердих речовин добре відомо фахівцям у даній галузі. Композиції також можна вводити за допомогою ін’єкції, тобто внутрішньовенно, внутрішньом’язово, підшкірно, внутрішньочеревинно, внутрішньоартеріально, внутрішньотекально і внутрішньоцеребровентрикулярно. Внутрішньовенне введення є переважним способом ін’єкції. Придатні носії для ін’єкцій добре відомі фахівцям у даній галузі і включають 5% розчини декстрози, фізіологічний розчин і забуферений фосфатом фізіологічний розчин. Лікарський продукт також можна вводити у вигляді інфузії або ін’єкції (наприклад, у вигляді суспензії або у вигляді емульсії у фармацевтично прийнятній рідині або суміші рідин). Препарати також можна вводити з використанням інших засобів, наприклад, за допомогою ректального введення. Препарати, використовувані для ректального введення, такі як супозиторії, добре відомі фахівцеві в даній галузі. Лікарський продукт також можна вводити шляхом інгаляції (наприклад, у вигляді аерозолю або назально, або з використанням пристроїв для доставки такого типу, що зазначений у патенті США № 4922901, Brooks et al., опис якого включено в даний винахід у всій своїй повноті); зовнішньо (наприклад, у вигляді лосьйону); черезшкірно (наприклад, із використанням черезшкірного пластиру) або іонтофоретично; або шляхом сублінгвального або букального введення. Хоча є можливим введення сполуки у вигляді основної маси активної хімічної речовини, переважно, щоб лікарський продукт знаходився у вигляді фармацевтичної композиції або препарату для діючого та ефективного введення. 8 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ілюстративні способи введення сполук будуть очевидні кваліфікованому фахівцеві. Застосовність даних препаратів може залежати від конкретної використовуваної композиції і конкретного суб’єкта, що одержує лікування. Дані препарати можуть містити рідкий носій, що може бути олійним, водним, емульгованим або містити певні розчинники, придатні для даного способу введення. Композиції можна вводити шляхом дробного введення або з поступовою, безперервною, постійною або контрольованою швидкістю теплокровній тварині (наприклад, ссавцеві, такому як миша, щур, кіт, кролик, собака, свиня, корова або мавпа), але переважно їх уводять людині. Крім того, може змінюватися час протягом дня і кількість разів на день, коли вводять фармацевтичну композицію. Інші придатні методи введення сполук за даним винаходом описані в патенті США, 5604231 Smith et al., зміст якого включено в даний опис шляхом посилання. У варіанті здійснення даного винаходу і як буде прийнято до уваги фахівцями в даній галузі сполуку за даним винаходом можна вводити разом з іншими лікарськими сполуками. Наприклад, сполуку за даним винаходом можна використовувати разом з іншими лігандами NNR (такими як варениклін), антиоксидантами (такими як засоби, що вловлюють вільні радикали), протимікробними засобами (такими як антибіотики пеніцилінового ряду), противірусними засобами (такими як аналоги нуклеозидів зидовудину і ацикловіру), антикоагулянтами (такими як варфарин), протизапальними засобами (такими як НПЗП), жарознижуючими засобами, анальгетиками, анестетиками (такими як використовувані в хірургії), інгібіторами ацетилхолінестерази (такими як донепезил і галантамін), антипсихотичними препаратами (такими як галоперидол, клозапін, оланзапін і кветипін), імуносупресантами (такими як циклоспорин і метотрексат), нейропротекторними засобами, стероїдами (такими як стероїдні гормони), кортикостероїдами (такими як дексаметазон, предизон і гідрокортизон), вітамінами, мінералами, харчовими добавками, антидепресантами (такими як іміпрамін, флуоксетин, пароксетин, есциталопрам, сертралін, венлафаксин і дулоксетин), анксіолітичними засобами (такими як алпразолам і баспірон), антиконвульсантами (такими як фенітоїн і габапентин), судинорозширювальними засобами (такими як празозин і силденафіл), стабілізаторами настрою (такими як валпроат і арипіпразол), протираковими лікарськими засобами (такими як антипроліферативні засоби), антигіпертензивними засобами (такими як атенолол, клонідин, амлопідин, верапаміл і олмезартан), проносними засобами, препаратами для розрідження випорожнень, діуретиками (такими як фуросемід), антиспазмолітиками (такими як дицикломін), анти-дискінетичними засобами і противиразковими лікарськими засобами (такими як езомепразол). Сполуки за даним винаходом можна використовувати самі по собі або разом з іншими терапевтичними засобами. Таку комбінацію фармацевтично активних агентів можна вводити разом або окремо і, при введенні окремо, введення можна проводити одночасно або послідовно в будь-якому порядку. Кількості сполук або агентів і відносний розподіл введення за часом будуть вибиратися для досягнення бажаної терапевтичної дії. Введення в комбінації можна проводити як супутнє введення у вигляді (1) єдиної фармацевтичної композиції, що включає багато сполук; або (2) окремих фармацевтичних композицій, кожна з яких включає одну зі сполук. Альтернативно, комбінацію можна вводити окремо послідовно, де один лікарський агент уводять першим, а інший – другим або навпаки. Таке послідовне введення може бути близьким за часом або розділеним у часі. Сполуки за даним винаходом можна використовувати для лікування багатьох порушень і станів і, як такі, сполуки за даним винаходом можна використовувати разом із багатьма іншими придатними терапевтичними агентами, використовуваними для лікування або профілактики даних порушень або станів. Придатна доза сполуки являє собою кількість, ефективну для запобігання появи симптомів порушення або для лікування деяких симптомів порушення, від якого страждає пацієнт. Як відзначено, під термінами “ефективна кількість”, “терапевтична кількість” або “ефективна доза” мається на увазі, що кількість є достатньою для надання бажаної фармакологічної або терапевтичної дії, таким чином, призводять до ефективного попередження або лікування порушення. При лікуванні порушення ЦНС ефективна кількість сполуки являє собою кількість, достатню для проходження через гематоенцефалічний бар’єр суб’єкта для зв’язування з релевантними рецепторними сайтами в мозку суб’єкта і для модулювання активності релевантних підтипів NNR (наприклад, забезпечуючи секрецію нейротрансмітера, призводячи тим самим до ефективного попередження або лікування порушення). Приклад попередження порушення проявляється в тимчасовій відстрочці початку прояву симптомів захворювання. Приклад лікування порушення проявляється в зменшенні симптомів, пов’язаних із порушенням, або 9 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 60 полегшенні рецидиву симптомів порушення. Переважно, ефективна кількість є достатньою для одержання бажаного результату, але недостатньою для того, щоб викликати відчутні побічні дії. Ефективна доза може змінюватися залежно від таких факторів, як стан пацієнта, тяжкість симптомів захворювання і способу, за допомогою якого вводять фармацевтичну композицію. Для пацієнтів-людей ефективна доза типових сполук звичайно вимагає введення сполуки в кількості, достатній для модулювання активності релевантних NNR, але кількість повинна бути недостатньою для того, щоб викликати дію в скелетних м’язах або ганглії в будь-якому значимому ступені. Ефективна доза, звичайно, буде змінюватися від пацієнта до пацієнта, але, загалом, включає кількості, що починаються з моменту появи дії на ЦНС або інших бажаних терапевтичних дій, але нижче кількості, при яких спостерігаються м’язові ефекти. Описані тут сполуки при використанні в ефективних кількостях відповідно до описаних тут способів можуть забезпечувати певний ступінь запобігання прогресування або полегшення симптомів або полегшення, до деякої міри рецидиву порушень ЦНС або інших порушень. Ефективні кількості цих сполук звичайно знаходяться нижче порога концентрації, необхідного для того, щоб викликати будь-які відчутні побічні дії, наприклад, ті дії, які стосуються скелетних м’язів або ганглію. Сполуки можна вводити в терапевтичному вікні, в якому деякі порушення ЦНС та інші порушення піддаються лікуванню, а певні подібні дії виключені. Ідеально, ефективна доза описаних тут сполук є достатньою для забезпечення бажаної дії на порушення, але недостатньою (тобто перебуває не на такому досить високому рівні) для того, щоб викликати небажані побічні дії. Переважно, сполуки вводять у дозуванні, яке є ефективним для лікування порушень ЦНС або інших порушень, але меншим ніж, часто меншим 1/5, і часто меншим, ніж 1/10, кількості, необхідної для того, щоб викликати певні подібні дії в будь-якому істотному ступені. Найбільш переважно, ефективні дозування знаходяться у дуже низьких концентраціях, при яких відбуваються максимальна дія з мінімальними побічними діями. Звичайно ефективна доза таких сполук звичайно вимагає введення сполуки в кількості меншій, ніж 5 мг/кг маси пацієнта. Часто сполуки за даним винаходом вводять у кількості меншій, ніж приблизно 1 мг/кг маси пацієнта і звичайно меншій ніж приблизно 100 мкг/кг маси пацієнта, але частіше в діапазоні від приблизно 10 мкг до менше 100 мкг/кг маси пацієнта. Вищезазначені ефективні дози звичайно представляють кількість, що вводиться у вигляді однієї дози або у вигляді однієї або декількох доз, що вводяться протягом 24-годинного проміжку часу. Для пацієнтів-людей ефективна доза звичайних сполук звичайно вимагає введення сполуки в кількості принаймні приблизно 1, часто принаймні приблизно 10 і частіше принаймні приблизно 100 мг/24 години/пацієнта. Для пацієнтів-людей ефективна доза звичайних сполук звичайно вимагає введення сполуки в кількості, що звичайно не перевищує приблизно 500, часто не перевищує приблизно 400 і частіше не перевищує приблизно 300 мг/24 години/пацієнта. Додатково, композиції переважно вводять у такій ефективній дозі, що концентрація сполуки в плазмі крові пацієнта звичайно не перевищує 50 нг/мл, часто не перевищує 30 нг/мл, і частіше не перевищує 10 нг/мл. В одному варіанті здійснення даного винаходу ефективна доза становить між приблизно 1 і 10 мг протягом 24-годинного проміжку часу. V. СПОСІБ ЗАСТОСУВАННЯ ФАРМАЦЕВТИЧНИХ КОМПОЗИЦІЙ Як використано в даному описі, термін “агоніст” стосується речовини, яка стимулює свого партнера зв’язування, звичайно рецептор. Стимуляція визначається в контексті певного аналізу, або вона може бути очевидна з літератури, що обговорювалася тут, яка порівнює фактор або речовину, які прийняті у ролі “агоніста” або “антагоніста” певного партнера зв’язування за по суті аналогічних обставин, як це визнано фахівцями в даній галузі. Стимуляція може бути визначена за збільшенням певного ефекту або функції, які викликані взаємодією агоніста або часткового агоніста з партнером зв’язування і можуть включати алостеричні ефекти. Як використано в даному описі, термін “антагоніст” стосується речовини, яка інгібує свого партнера зв’язування, звичайно рецептор. Інгібування визначається в контексті певного аналізу, або воно може бути очевидним із літератури, що обговорювалася тут, яка порівнює фактор або речовину, які прийняті у ролі “агоніста” або “антагоніста” певного партнера зв’язування за по суті аналогічних обставин, як це визнано фахівцями в даній галузі. Інгібування може бути визначене за зменшенням певного ефекту або функції, які викликані взаємодією антагоніста з партнером зв’язування і можуть включати алостеричні ефекти. Як використано в даному описі, термін “частковий агоніст” або “частковий антагоніст” стосується речовини, яка забезпечує рівень стимуляції або інгібування, відповідно, свого партнера зв’язування, який не є повністю або зовсім агоністичним або антагоністичним, відповідно. Буде зрозуміло, що стимуляція і відповідно інгібування визначені по суті для будь 10 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 якої речовини або категорії речовин, які будуть визначатися як агоністи, антагоністи або часткові агоністи. Як використано в даному описі, термін “внутрішня активність” або “ефективність” стосується певної міри біологічної ефективності комплексу зв’язування партнерів. Щодо фармакології рецепторів, контекст, в якому внутрішню активність або ефективність будуть визначати, буде залежати від контексту комплексу зв’язування партнерів (наприклад, рецептор/ліганд) і розгляду активності, що стосується конкретного біологічного результату. Наприклад, при певних обставинах, внутрішня активність може змінюватися залежно від залученої системи вторинного месенджера. Див. Hoyer D and Boddeke H., Trends Pharmacol. Sci. 14(7): 270-5 (1993), включеної в даний опис шляхом посилання із приводу таких зазначень. Де такі контекстуально специфічні оцінки є значимими, і наскільки вони можуть бути значимими в контексті даного винаходу буде очевидно для звичайного фахівця в даній галузі. Як використано в даному описі, модулювання рецептора включає агонізм, частковий агонізм, антагонізм, частковий антагонізм або зворотний агонізм рецептора. Як використано в даному описі, нейротрансмітери, чиє вивільнення опосередковується описаними тут сполуками включають, але не обмежуються зазначеним, ацетилхолін, допамін, норепінефрин, серотонін і глутамат, і описані тут сполуки функціонують як модулятори підтипу 7 NNR ЦНС. Як використано в даному описі, термін “попередження” або “профілактика” включає будьякий ступінь зменшення прогресування або відстрочки початку захворювання, порушення або стану. Термін включає забезпечення захисної дії відносно конкретного захворювання, порушення або стану, а також ослаблення рецидиву захворювання, порушення або стану. Таким чином, в іншому аспекті винахід стосується способу лікування суб’єкта, підданого ризику розвитку або появи рецидиву порушення, опосередкованого NNR або nAChR. Сполуки і фармацевтичні композиції за винаходом можна використовувати для досягнення сприятливої терапевтичної або профілактичної дії, наприклад, у суб’єкта з дисфункцією ЦНС. Як відзначено вище, сполуки за даним винаходом у вигляді вільної основи і солі модулюють підтип 7 NNR, характерний для ЦНС, і можуть використовуватися для попередження або лікування різних станів або порушень, включаючи стани або порушення ЦНС, у суб’єктів, які мають або які піддані ризику появи таких станів або порушень, шляхом модулювання 7 NNR. Дані сполуки мають здатність селективно зв’язуватися з 7 NNR і проявляти нікотинову фармакологію, наприклад, діяти у ролі агоністів, часткових агоністів, антагоністів, як це описано. Наприклад, сполуки за даним винаходом при введенні в ефективних кількостях потребуючим цього пацієнтам забезпечують деякий ступінь попередження розвитку порушення ЦНС, а саме забезпечують протекторну дію, полегшення симптомів порушень ЦНС або ослаблення рецидиву порушення ЦНС або поєднання цих дій. Сполуки за даним винаходом можна використовувати для лікування або попередження тих типів станів і порушень, для яких інші типи нікотинових сполук були запропоновані або було показано, що їх можна використовувати як лікарські засоби. Див., наприклад, перераховані раніше в даному описі посилання, а також Williams et al., Drug News Perspec. 7(4): 205(1994), Arneric et al., CNS Drug Rev. 1(1): 1-26 (1995), Arneric et al., Exp. Opin. Invest. Drugs 5(1): 79-100 (1996); Bencherif et al., J. Pharmacol. Exp. Ther. 279:1413 (1996), Lippiello et al., J. Pharmacol. Exp. Ther. 279: 1422 (1996), Damaj et al., J. Pharmacol. Exp. Ther. 291: 390 (1999); Chiari et al., Anesthesiology 91: 1447 (1999), Lavand’homme and Eisenbach, Anesthesiology 91: 1455 (1999), Holladay et al., J. Med. Chem. 40(28): 4169-94 (1997), Bannon et al., Science 279: 77 (1998), PCT WO 94/08992, PCT WO 96/31475, PCT WO 96/40682 і патенти США № 5583140, Bencherif et al., 5597919, Dull et al., 5604231, Smith et al., і 5852041, Cosford et al., опис яких, що стосується таких терапевтичних зазначень, включений у даний винахід шляхом посилання. Сполуки та їхні фармацевтичні композиції можна використовувати для лікування або попередження багатьох порушень ЦНС, включаючи нейродегенеративні порушення, нейропсихіатричні порушення, неврологічні порушення і пагубні звички. Сполуки та їхні фармацевтичні композиції можна використовувати для лікування або попередження когнітивного дефіциту і дисфункцій, пов’язаних із віком та іншими факторами; порушень уваги і слабоумства, включаючи ті, які виникають під дією інфекційних агентів або метаболічних порушень; для забезпечення нейропротекції; для лікування конвульсій і множинних церебральних інфарктів; для лікування порушень настрою, маніакальних і пов’язаних зі шкідливими звичками поведінкових реакцій; для забезпечення знеболювання; для контролю запалення, такого як опосередковане цитокінами та ядерним фактором каппа В; для лікування запальних порушень; для забезпечення полегшення болю; для лікування метаболічних 11 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 60 порушень, таких як діабет або метаболічний синдром; і для лікування інфекцій у ролі протиінфекційних засобів для лікування бактеріальних, грибкових і вірусних інфекцій. Порушення ЦНС Числа порушень, захворювань і станів, для лікування або профілактики яких можна використовувати сполуки і фармацевтичні композиції за даним винаходом, стосуються пов’язане з віком погіршення пам’яті (AAMI), слабке когнітивне погіршення (MCI), пов’язане з віком когнітивне згасання (ARCD), передстарече слабоумство, ранній початок хвороби Альцгеймера, старече слабоумство, слабоумство за типом Альцгеймера, хвороба Альцгеймера, когнітивне погіршення без слабоумства (CIND), деменція з тільцями Леві (ДТЛ), ВІЛ-слабоумство, комплекс пов’язаного зі СНІД слабоумства, мультиінфарктна деменція, синдром Дауна, травма голови, травматичне ушкодження мозку (TBI), слабоумство в результаті травми, хвороба Крейцфельда-Якоба і пріонові хвороби, удар, ішемія, порушення дефіциту уваги, пов’язана з дефіцитом уваги гіперактивність, дислексія, шизофренія, порушення шизофренічної форми, шизофреноподібне порушення афективного типу, когнітивна дисфункція при шизофренії, когнітивний дефіцит при шизофренії, такий як дефіцит пам’яті, включаючи робочу пам’ять, функції організації, уваги, вігільність, обробки інформації і здатності навчатися, пов’язане із шизофренією слабоумство (будь-яке зі слабкого, середнього або важкого), паркінсонізм, включаючи хворобу Паркінсона, постенцефалічний паркінсонізм, паркінсонізмслабоумство Гаума, лобно-скроневе слабоумство паркінсонового типу (FTDP), хвороба Неймана-Піка (Niemann-Pick), хвороба Хантінгтона, хорея Хантінгтона, пізня дискінезія, гіперкінезія, прогресуючий супрануклеарний параліч, прогресуючий супрануклеарний парез, синдром втомлених ніг, розсіяний склероз, аміотрофічний латеральний склероз (ALS), захворювання рухових нейронів (MND), множинна системна атрофія (MSA), кортикобазальна дегенерація, синдром Гійома-Барре (GBS), хронічна запальна демієлінізуюча полінейропатія (CIDP), епілепсія, аутосомальна домінантна нічна лобно-скронева епілепсія, манія, тривожний стан, депресія, передменструальна дисфорія, панічні порушення, булімія, анорексія, нарколепсія, надлишкова сонливість у денний час, біполярні порушення, генералізований тривожний стан, обсесивно-компульсивне порушення, спалахи люті, порушення опозиційної непокори, синдром Туретта, аутизм, наркоманія і хронічний алкоголізм, схильність до паління, ожиріння, кахексія, псоріаз, вовчак, гострий ангіохоліт, афтозний стоматит, виразки, астма, виразковий коліт, запальне захворювання кишечника, хвороба Крона, післяопераційна кишкова непрохідність, спазматична дистонія, діарея, запор, резервуарний ілеїт, панкреатит, вірусна пневмонія, артрит, включаючи ревматоїдний артрит і остеоартрит, ендотоксемія, сепсис, атеросклероз, ідіопатичний фіброз легенів, гострий біль, хронічний біль, нейропатії, нетримання сечі, діабет і неоплазія. Когнітивні погіршення або дисфункції можуть бути пов’язані із психіатричними порушеннями або станами, такими як шизофренія та інші психотичні порушення, включаючи, але не обмежуючись зазначеним, психотичне порушення, шизофреноподібне порушення, шизоафективне порушення, маревне порушення, короткочасне психотичне порушення, гостре психотичне порушення і психотичні порушення внаслідок одного або більше загальних медичних станів, слабоумство різного виду та інші когнітивні порушення, включаючи, але не обмежуючись зазначеним, слабке когнітивне погіршення, передстарече слабоумство, хворобу Альцгеймера, старече слабоумство, слабоумство за типом Альцгеймера, пов’язане з віком погіршення пам’яті, деменцію з тільцями Леві (ДТЛ), судинне слабоумство, пов’язаний зі СНІД комплекс слабоумства, дислексію, паркінсонізм, включаючи хворобу Паркінсона, когнітивне погіршення і слабоумство при хворобі Паркінсона, когнітивне погіршення при розсіяному склерозі, когнітивне погіршення, викликане травматичним ушкодженням мозку, слабоумство внаслідок інших загальних медичних станів, тривожні стани, включаючи, але не обмежуючись зазначеним, панічний стан без агорафобії, панічний стан із супутньою агорафобією, агорафобію без історії панічного порушення, специфічні фобії, соціальну фобію, обсесивно-компульсивний синдром, посттравматичний стрес, гостре стресове порушення, генералізований тривожний стан і генералізований тривожний стан внаслідок загального медичного стану, порушення настрою, включаючи, але не обмежуючись зазначеним, глибоку депресію, психічну депресію, біполярну депресію, біполярну манію, біполярне порушення I типу, пов’язану з манією депресію, депресивні або змішані епізоди, біполярне порушення II типу, циклотимічне порушення і порушення настрою внаслідок загального медичного стану, порушення сну, включаючи, але не обмежуючись зазначеним, безсоння, первинне безсоння, первинну підвищену сонливість, нарколепсію, парасомнію, порушення, пов’язані з нічними кошмарами, порушення жаху перед сном і порушення, пов’язані з ходінням уві сні, ментальне згасання, порушення здатності до навчання, порушення рухових навичок, порушення спілкування, порушення, пов’язані з 12 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 60 розвитком росту, дефіцит уваги і порушення, пов’язані з руйнівною поведінкою, порушення, пов’язане з дефіцитом уваги, гіперактивність, пов’язана з порушенням уваги, порушення годування і харчування немовлят, дітей або дорослих, тики, елімінаційні порушення, порушення, пов’язані з речовинами, включаючи, але не обмежуючись зазначеним, зловживання наркотиками, інтоксикацію наркотиками, припинення прийому наркотиків, пов’язані з алкоголем порушення, пов’язані з амфетаміном або амфетаміноподібними сполуками порушення, пов’язані з кофеїном порушення, пов’язані з марихуаною порушення, пов’язані з кокаїном порушення, пов’язані з галюциногенами порушення, пов’язані з інгаляційними засобами порушення, пов’язані з нікотином порушення, пов’язані з опіоїдами порушення, пов’язані з фенциклідином або фенциклідиноподібними засобами порушення, і пов’язані із седативними, гіпнотичними або анксіолітичними засобами порушення, порушення особистості, включаючи, але не обмежуючись зазначеним, обсесивно-компульсивні порушення особистості та імпульсноконтрольні порушення. Симптоми шизофренії звичайно підрозділяють на три категорії: позитивні, негативні і когнітивні. Позитивні симптоми також можуть згадуватися як “психотичні” симптоми і включають манії і галюцинації. Позитивні симптоми згадуються як явні симптоми. Негативні симптоми включають емоційну пригніченість або недостатність вираження, нездатність почати і продовжувати активну діяльність, мову, яка є короткою і позбавленою змісту, недостатність задоволення та інтересу до активної діяльності. Негативні симптоми стосуються недостатності певних характеристик, які в протилежному випадку були присутні б у здорової людини. Когнітивні симптоми стосуються процесів мислення. Когнітивні симптоми включають недостатність пізнавальних здатностей, таких як пам’ять, включаючи робочу пам’ять, організуючу функцію, увагу, вігільність, обробку інформації і порушення здатності до навчання, із посиланням на публікацію Sharma et al., Cognitive Function in Scizophrenia: Deficits, Functional Consequences and Future Treatment, Psychiatr. Clin. N. Am. 26 (2003) 25-40, включену в даний опис шляхом посилання. Шизофренія також впливає на настрій. Хоча багато індивідуумів,хворих на шизофренію, піддані депресії, у деяких також є помітні коливання настрою і навіть біполярно-подібні стани. Вищезазначені стани і порушення обговорюються більш детально, наприклад, у довіднику “American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders”, четверте видання з редакцією, Вашингтон, DC, American Psychiatric Association, 2000; включеному в даний опис шляхом посилання для визначення таких станів і порушень. Даний довідник також можна згадати для більш детального опису симптомів і діагностичних особливостей, пов’язаних із застосуванням, зловживанням і залежністю від різних речовин. Переважно, лікування або попередження захворювань, порушень і станів відбуваються без відчутних побічних дій, включаючи, наприклад, значне підвищення тиску крові і серцевого ритму, істотний негативний вплив на шлунково-кишковий тракт і значний вплив на м’язи скелета. Переважно, що сполуки за даним винаходом при використанні в ефективних кількостях модулюють активність 7 NNR без помітної взаємодії з іншими підтипами нікотинових рецепторів, які характерні для ганглія людини, як продемонстровано недостатністю здатності викликати нікотинову функцію в адреналіновій хромафінній тканині або м’язі скелета, додатково продемонстровано недостатністю здатності викликати нікотинову функцію в препаратах клітин, що експресують нікотинові рецептори м’язового типу. Таким чином, можна думати, що дані сполуки здатні лікувати або запобігати захворюванню, порушенню і стану, не викликаючи помітних побічних дій, пов’язаних з активністю гангліонових і нейром’язових сайтів. Таким чином, передбачається, що введення сполук забезпечить терапевтичне вікно, що забезпечує лікування деяких захворювань, порушень і станів, при якому виключені деякі побічні дії. Тобто, вважають, що ефективна доза сполуки є достатньою для забезпечення бажаного впливу на захворювання, порушення або стан, але вона вважається недостатньою, а саме не такого високого рівня, щоб викликати небажані побічні впливи. Таким чином, даний винахід стосується застосування сполуки за даним винаходом або її фармацевтично прийнятної солі для застосування в терапії, такій як описана вище терапія. Ще в одному аспекті даний винахід стосується застосування сполуки за даним винаходом або її фармацевтично прийнятної солі для одержання лікарського засобу для використання при лікуванні порушення ЦНС, такого як описане вище порушення, захворювання або стан. Запалення Відомо, що нервова система, головним чином за допомогою блукаючого нерва, регулює величину властивої імунної відповіді шляхом інгібування вивільнення макрофагового фактора некрозу пухлини (TNF). Даний фізіологічний механізм відомий як “холінергічний протизапальний 13 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 60 шлях” (див., наприклад, Tracey, “The inflammatory reflex”, Nature 420:853-9 (2002), включену в даний опис шляхом посилання). Надлишкове запалення і синтез фактора некрозу пухлини викликають захворюваність і навіть смертність при багатьох захворюваннях. Дані захворювання включають, але не обмежуються зазначеним, ендотоксемію, ревматоїдний артрит, остеоартрит, псоріаз, астму, атеросклероз, ідіопатичний фіброз легенів і запальне захворювання кишечника. Запальні стани, які можна лікувати або для попередження яких можна використовувати введення описаних у даному винаході сполук, включають, але не обмежуються зазначеним, хронічне і гостре запалення, псоріаз, ендотоксемію, подагру, гостру псевдоподагру, гострий подагричний артрит, артрит, ревматоїдний артрит, остеоартрит, поліміозит, дерматоміозит, анкілозуючий спондиліт, хворобу Стілла, початок хвороби Стілла в дорослих, відторгнення алотрансплантата, хронічне відторгнення трансплантата, астму, атеросклероз, мононуклеарнофагоцитозалежне ушкодження легені, ідіопатичний фіброз легенів, атопічний дерматит, хронічне обструктивне захворювання легенів, респіраторний дистрес-синдром у дорослих, гострий легеневий синдром при хворобі серповидних клітин, запальне захворювання кишечника, хворобу Крона, виразковий коліт, гострий ангіохоліт, афтозний стоматит (пліснявку), резервуарний ілеїт, гломерулонефрит, люпус-нефрит, тромбоз і реакцію трансплантат-протихазяїна. Запальні реакції у відповідь, пов’язані з бактеріальною і/або вірусною інфекцією Багато бактеріальних і/або вірусних інфекцій (наприклад, менінгіт, гепатит і нефрит) пов’язані з побічними діями, що викликаються утворенням токсинів, і природною відповіддю організму на бактерії або віруси і/або токсини. Як обговорювалося вище, реакція організму у відповідь на інфекції часто включає утворення значної кількості TNF і/або інших цитокінів. Надекспресія таких цитокінів може завдати значної шкоди, такої як септичний шок (коли бактерія викликає сепсис), ендотоксичний шок, уросепсис і синдром токсичного шоку. Експресія цитокінів опосередковується NNR, і її можна інгібувати шляхом введення агоністів або часткових агоністів даних рецепторів. Ті сполуки, які описані в даному винаході, є агоністами або частковими агоністами даних рецепторів, і, отже, можуть використовуватися для зведення до мінімуму запальної відповіді, пов’язаної з бактеріальною інфекцією, а також вірусними і грибковими інфекціями. Приклади таких бактеріальних інфекцій включають карбункули, ботулізм і сепсис. Деякі з даних сполук також можуть мати антибактеріальні властивості. Дані сполуки також можна використовувати як допоміжну терапію разом з існуючими методами лікування бактеріальних, вірусних і грибкових інфекцій, такими як антибіотики, антивірусні препарати і протигрибкові препарати. Також можна використовувати антитоксини для зв’язування токсинів, продукованих агентами, що інфікують, і можливості проходити через організм у вигляді зв’язаних токсинів, не викликаючи запальної відповіді. Приклади антитоксинів описані, наприклад, у патенті США № 6310043, Bundle et al., включеному в даний опис шляхом посилання. Можуть бути ефективними інші агенти, ефективні проти бактерій та інших токсинів, і їхня терапевтична дія може бути доповнена введенням разом з описаними тут сполуками. Біль Сполуки можна застосовувати для лікування і/або попередження болю, включаючи гострий, неврологічний, запальний, невропатичний і хронічний біль. Аналгетична активність описаних тут сполук може бути продемонстрована на моделі постійного запального болю і невропатичного болю, здійсненій, як описано в опублікованій заявці на патент США № 20010056084 А1 (Allgeier et al.), включеній у даний винахід шляхом посилання, в якій продемонстрована гіпералгезія на щурячій моделі запального болю з повним ад’ювантом Фрейнда і механічна гіпералгезія невропатичного болю на мишачій моделі часткового лігування сідничного нерва. Аналгетична дія є придатною для лікування болю різного походження або етіології, зокрема для лікування запального болю і пов’язаної із цим гіпералгезії, невропатичного болю і пов’язаної із цим гіпералгезії, хронічного болю (наприклад, важкого хронічного болю, післяопераційного болю і болю, пов’язаного з різними станами, включаючи рак, стенокардію, ниркову або жовчну коліку, менструацію, мігрень і подагру). Запальний біль може мати різне походження, включаючи артрит і ревматоїдне захворювання, синовіт сухожильних піхв і васкуліт. Невропатичний біль включає тригемінальну або герпетичну невралгію, діабетичний невропатичний біль, пекучий біль, біль у нижній частині спини і синдроми деаферентації, такі як розрив плечового сплетення. Неоваскуляризація Рецептор 7 NNR пов’язаний із неоваскуляризацією. Інгібування неоваскуляризації, наприклад, шляхом введення антагоністів (або при деяких дозуваннях часткових агоністів) 7 NNR може лікувати або запобігати станам, що характеризують небажаною неоваскуляризацією 14 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 60 або ангіогенезом. Такі стани можуть включати ті, які характеризуються запальним ангіогенезом і/або викликаним ішемією ангіогенезом. Неоваскуляризацію, пов’язану з ростом пухлини, також можна інгібувати шляхом введення таких сполук, як описані в даному винаході, які функціонують як антагоністи або часткові агоністи 7 NNR. Специфічний антагонізм специфічної активності 7 NNR зменшує ангіогенну відповідь на запалення, ішемію і неоплазію. Вказівки, що стосуються придатних систем на моделі тварин для оцінки описаних тут сполук, можуть бути знайдені, наприклад, у публікації Heeschen C. et al., “A novel angiogenic pathway mediated by non-neuronal nicotinic acetylcholine receptors”, J. Clin. Invest. 110(4): 527-36 (2002), включеній у даний опис шляхом посилання для опису 7-специфічного інгібування ангіогенезу і клітинного (in vitro) і на моделі тварин моделювання ангіогенної активності, значимої для хвороби людини, особливо моделі пухлини Леві легені людини (in vivo, на мишах див., зокрема, сторінку 529 і 532-533). Ілюстративні типи пухлин, які можна лікувати з використанням описаних тут сполук, включають NSCLC (недрібноклітинна карцинома легенів), рак яєчника, рак підшлункової залози, карциному молочної залози, карциному товстої кишки, карциному прямої кишки, карциному легенів, карциному ротової частини глотки, карциному підглотівника, карциному стравоходу, карциному шлунка, карциному підшлункової залози, карциному печінки, карциному жовчного міхура, карциному жовчних проток, карциному тонкого кишечника, карциному сечовивідних шляхів, карциному нирки, карциному сечового міхура, уротеліальну карциному, карциному жіночих статевих шляхів, карциному шийки матки, карциному матки, карциному яєчника, трофобластичну пухлину, гестаційне (яке стосується вагітності) трофобластичне захворювання, карциному чоловічих статевих шляхів, карциному передміхурової залози, карциному сім’яних пухирців, карциному яєчок, пухлини ембріона, карциному ендокринної залози, карциному щитовидної залози, карциному надниркових залоз, карциному гіпофіза, карциному шкіри, гемангліоми, меланоми, саркоми, саркому кістки і м’якої тканини, саркому Капоші, пухлини мозку, пухлини нервів, пухлини очей, пухлини оболонок мозку, астроцитоми, гліоми, гліобластоми, ретинобластоми, нейроми, нейробластоми, шванноми, менінгіоми, щільні пухлини, що виникають із гематопоетичних злоякісних новоутворень (таких як лейкемії, хлорлейкемії, плазмацитоми і грибоподібні бляшки і пухлини слизової і лімфома/лейкемія шкірних Т-клітин), і щільні пухлини, що виникають із лімфоми. Сполуки також можна вводити разом з іншими формами протиракової терапії, включаючи спільне введення з антинеопластичними протипухлинними агентами, такими як цисплатин, адріаміцин, дауноміцин і таке інше і/або анти-VEGF (судинний ендотеліальний фактор росту) агентами, такими, як відомо в даній галузі. Сполуки можна вводити таким чином, що вони будуть націлені на місце пухлини. Наприклад, сполуки можна вводити в мікросферах, мікрочастинках або ліпосомах, кон’югованих із різними антитілами, які спрямовують частинки в пухлину. Крім того, сполуки можуть бути присутніми у мікросферах, мікрочастинках або ліпосомах, яким наданий придатний розмір для проходження через артерії і вени, але які застряють у капілярному ложі, що оточує пухлину, і вводити сполуки в пухлину локально. Такі пристрої для доставки лікарських засобів відомі в даній галузі. Інші порушення На додаток до лікування порушень ЦНС, запалення, неоваскуляризації і болю, сполуки за даним винаходом також можна використовувати для попередження або лікування деяких інших станів, захворювань і порушень, в яких відіграють роль NNR. Приклади включають автоімунні порушення, такі як вовчак, порушення, пов’язані з вивільненням цитокінів, вторинну кахексію після інфекції (наприклад, як спостерігається при СНІД, пов’язаному зі СНІД комплексі і неоплазії), метаболічні порушення, включаючи діабет типу I, діабет типу II, метаболічний синдром, ожиріння або гіперкальціємію, пемфігус, нетримання сечі, захворювання сітківки, інфекційні захворювання, міастенію, синдром Ітона-Ламберта, підвищений тиск крові, остеопороз, звуження кровоносних судин, дилатацію судин, серцеву аритмію, булімію, анорексію, а також показання, зазначені в опублікованій заявці РСТ WO 98/25619, включеній в даний опис шляхом посилання з питання, що стосується таких порушень. Сполуки за даним винаходом також можна застосовувати для лікування конвульсій, таких, які є симптоматичними при епілепсії, і для лікування станів, таких як сифіліс і хвороба Крейтцфельда-Якоба. Діагностичне застосування Сполуки можна використовувати в діагностичних композиціях, таких як зонди, особливо, якщо вони модифіковані таким чином, що включають придатні мітки. Зонди можна використовувати, наприклад, для визначення відносної кількості і/або функції певних рецепторів, особливо підтипу 7 рецепторів. Для цієї мети в сполуку за даним винаходом 11 18 76 123 125 переважно вводять мітку радіоактивного ізотопу, такого як С, F, Br, I або I. 15 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 60 Уведені сполуки можна виявляти з використанням відомих методів виявлення, придатних для використовуваної мітки. Приклади способів виявлення включають позитронну емісійну томографію (РЕТ) і однофотонну емісійну комп’ютерну томографію (SPECT). Описані вище 11 18 76 радіоактивні мітки можна використовувати при РЕТ (наприклад, С, F або Br) і SPECT 123 (наприклад, I) візуалізації зображення з періодами напіврозпаду, що становлять приблизно 11 18 123 20,4 хвилини для С, приблизно 109 хвилин для F, приблизно 13 годин для I, і приблизно 16 76 годин для Br. Для візуалізації вибраних підтипів рецепторів при концентраціях, що не досягають насичення, є бажаною висока специфічна активність. Дози, що вводяться, звичайно знаходяться нижче токсичного діапазону і забезпечують зображення з високою контрастністю. Очікується, що сполуки можна буде застосовувати при нетоксичних рівнях. Визначення дози проводять способом, відомим фахівцеві в галузі візуалізації із застосуванням радіоактивних міток. Див., із приводу введення таких сполук, наприклад, патент США № 5969144, London et al., включений у даний винахід шляхом посилання. Сполуки можна вводити з використанням відомих методів. Див, наприклад, патент США № 5969144, London et al., як відзначено, включений у даний винахід шляхом посилання з питань, що стосується такого введення. Сполуки можна вводити в рецептурних композиціях, які включають інші інгредієнти, такі як, наприклад, ті типи інгредієнтів, які використовують при складанні рецептури діагностичних композицій. Сполуки, використовувані відповідно до здійснення даного винаходу, найбільш переважно застосовують у формах із високим ступенем чистоти. Див, із приводу такого аналізу патент США № 5853696, Elmalch et al., включений у даний винахід шляхом посилання. Після введення сполук суб’єктові (наприклад, людині) присутність такої сполуки в організмі суб’єкта можна відобразити візуально та оцінити кількісно за допомогою придатних методів для виявлення присутності, кількості і функціональності вибраних підтипів NNR. Крім людей, сполуки також можна вводити тваринам, таким як миші, щури, собаки і мавпи. SPECT і РЕТ візуалізація може бути виконана з використанням будь-якого придатного методу і приладу. Для опису ілюстративних методів візуалізації див., Villemagne et al., в Arneric et al. (Eds.) Neuronal Nicotinic Receptors: Pharmacology and Therapeutic Opportunities, 235-250 (1998) і патент США № 5853696, Elmalch et al., кожен з яких включений у даний опис шляхом посилання. Радіоактивно мічені сполуки зв’язуються з високої афінністю із селективними підтипами NNR (наприклад, 7) і переважно проявляють нехтовно мале неспецифічне зв’язування відносно інших підтипів нікотинових холінергічних рецепторів (наприклад, ті підтипи рецепторів, які пов’язані з мускулатурою і нервовими вузлами (ганглії)). Як такі, сполуки можна використовувати як агенти для неінвазивної візуалізації підтипів нікотинових холінергічних рецепторів в організмі суб’єкта, зокрема в мозку, для діагностики, пов’язаної з безліччю захворювань і порушень ЦНС. В одному аспекті діагностичні композиції можна використовувати в способі діагностування захворювання в суб’єкта, такого як людина. Спосіб включає введення такому пацієнтові сполуки з виявленою міткою, як описано в даному винаході, і виявлення зв’язування такої сполуки з вибраними підтипами NNR (наприклад, підтип 7 рецептора). Фахівці в галузі використання діагностичних інструментів, таких як РЕТ і SPECT, можуть використовувати описані тут радіоактивно мічені сполуки для діагностики великої кількості станів і порушень, включаючи стани і порушення, пов’язані з дисфункцією центральної і вегетативної нервової системи. Такі порушення включають безліч захворювань і порушень ЦНС, включаючи хворобу Альцгеймера, хворобу Паркінсона і шизофренію. Можна провести оцінки цих та інших ілюстративних захворювань і порушень, включаючи ті, які зазначені в патенті США № 5952339, Bencherif et al., включеному в даний опис шляхом посилання. В іншому аспекті діагностичні композиції можна використовувати в способі контролю селективних підтипів нікотинових рецепторів у суб’єкта, такого як пацієнт-людина. Спосіб включає введення такому пацієнтові сполуки з міткою, що виявляється, як описано в даному винаході, і виявлення зв’язування такої сполуки з вибраними підтипами нікотинових рецепторів, а саме підтипу 7 рецептора. Зв’язування з рецепторами Сполуки за даним винаходом можна використовувати у ролі лігандів порівняння в аналізах зв’язування для сполук, які зв’язуються з підтипами NNR, зокрема з підтипом 7 рецептора. Із цією метою в сполуки за винаходом переважно вводять радіоактивну мітку з використанням 3 14 радіоактивного ізотопного фрагмента, таку як Н або С. VІ. Синтетичні приклади Наступні синтетичні приклади наведені для ілюстрації даного винаходу та їх не слід розглядати як обмежуючі обсяг винаходу. У даних експериментах всі частини і відсотки 16 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 60 наведені за масою, якщо не зазначено іншого. Всі розчини являють собою водні розчини, якщо не зазначено іншого. Приклад 1 Синтез у невеликому масштабі (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]октан-3іл)бензофуран-2-карбоксаміду (сполука А) і його енантіомеру (2R,3S)-N-(2-((3-піридиніл)метил)1-азабіцикло[2.2.2]октан-3-іл)бензофуран-2-карбоксаміду 2-((3-Піридиніл)метилен)-1-азабіцикло[2.2.2]октан-3-он Гідроксид калію (56 г, 0,54 моль) розчиняли в метанолі (420 мл). Додавали гідрохлорид 3хінуклідинону (75 г, 0,49 моль) і суміш перемішували протягом 30 хвилин при температурі навколишнього середовища. Додавали 3-піридинкарбоксальдегід (58 г, 0,54 моль) і суміш перемішували протягом 16 годин при температурі навколишнього середовища. За цей час реакційна суміш набувала жовтого кольору, і твердий осад утворювався на стінках колби. Тверді речовини зіскрібали зі стінок і великі шматки руйнували. При швидкому перемішуванні додавали воду (390 мл). Коли тверді речовини розчинялися, суміш охолоджували до 4С і витримували протягом ночі. Кристали збирали фільтруванням, промивали водою і сушили на повітрі, одержуючи 80 г жовтої твердої речовини. Другу порцію (8 г) одержували шляхом концентрування фільтрату до 10% його початкового об’єму і витримування при охолодженні до 4С протягом ночі. Обидві порції були досить чистими для подальшого перетворення (88 г, 82% вихід). 2-((3-Піридиніл)метил)-1-азабіцикло[2.2.2]октан-3-он 2-((3-Піридиніл)метилен)-1-азабіцикло[2.2.2]октан-3-он (20 г, 93 ммоль) суспендували в метанолі (200 мл) і обробляли 46 мл 6М соляної кислоти. Додавали 10% паладій-на-вугіллі (1,6 г) і суміш струшували при тиску водню 25 фт/кв.дюйм протягом 16 годин. Суміш фільтрували через діатомову землю і розчинник видаляли з фільтрату шляхом упарювання на роторному випарнику. Це давало неочищений гідрохлорид 2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]октан3-ону у вигляді білої смоли (20 г), що згодом обробляли 2М гідроксидом натрію (50 мл) і хлороформом (50 мл) і перемішували протягом години. Шар хлороформу відокремлювали і водну фазу обробляли 2М гідроксидом натрію (5 мл, достатньо до підвищення рН до 10) і насиченим водним розчином хлориду натрію (25 мл). Водну суміш екстрагували хлороформом (310 мл) і об’єднаний хлороформний екстракт сушили (безводний сульфат магнію) і концентрували шляхом упарювання на роторному випарнику. Залишок (18 г) розчиняли в теплому простому ефірі (320 мл) і охолоджували до 4С. Білу тверду речовину відфільтровували, промивали невеликою порцією холодного простого ефіру і сушили на повітрі. Концентрування фільтрату до 10% його початкового об’єму та охолодження до 4С давали другу порцію. Одержували об’єднаний вихід у 16 г (79%). 3-Аміно-2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]октан До перемішуваного розчину, 2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]октан-3-ону (3,00 г, 13,9 ммоль) у сухому метанолі (20 мл) в атмосфері азоту додавали 1М розчин хлориду цинку в простому ефірі (2,78 мл, 2,78 ммоль). Після перемішування при температурі навколишнього середовища протягом 30 хвилин дану суміш обробляли твердим форміатом амонію (10,4 г, 167 ммоль). Після перемішування протягом ще однієї години при температурі навколишнього середовища додавали порціями твердий ціаноборгідрид натрію (1,75 г, 27,8 ммоль). Реакційну суміш потім перемішували при температурі навколишнього середовища протягом ночі і припиняли реакцію шляхом додавання води (5 мл). Реакційну суміш після гасіння реакції розподіляли між 5М гідроксидом натрію (10 мл) і хлороформом (20 мл). Водний шар екстрагували хлороформом (20 мл) і об’єднані органічні шари сушили (сульфат натрію), фільтрували і концентрували. Це призводило в залишку до 2,97 г жовтої смоли. ГРХ-масспектрометричний (GCMS) аналіз показав, що продукт являв собою суміш цис- і транс-амінів у співвідношенні 1:9 поряд зі слідами відповідного спирту (98% виділення за загальною масою). (2R,3S) і (2S,3R)-3-аміно-2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]октан Ди-п-толуоїл-D-винну кислоту (5,33 г, 13,8 ммоль) додавали до перемішуваного розчину неочищеного 3-аміно-2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]октану (6,00 г, 27,6 ммоль цис/транс у співвідношенні 1:9) у метанолі (20 мл). Після завершення розчинення прозорий розчин потім концентрували до одержання твердої маси шляхом упарювання на роторному випарнику. Тверду речовину потім розчиняли в мінімальній кількості киплячого метанолу (5 мл). Розчин повільно охолоджували, спочатку до температури навколишнього середовища (1 г), потім витримували протягом (4 годин при 5С і, нарешті, при -5С протягом ночі. Сіль, що випала в осад, збирали фільтруванням із відсмоктуванням розчинника у вакуумі і перекристалізовували з 5 мл метанолу. Сушіння на повітрі давало 1,4 г білої твердої речовини, яку розподіляли між хлороформом (5 мл) і 2М гідроксидом натрію (5 мл). Хлороформний шар і 17 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 60 5 мл хлороформного екстракту водного шару поєднували, сушили (безводний сульфат натрію) і концентрували, одержуючи безбарвне масло (0,434 г). Енантіомерну чистоту для даної вільної основи визначали шляхом перетворення її частини у відповідний N-(трет-бутоксикарбоніл)-Lпролінамід, для якого потім аналізували діастереомерну чистоту (98%) із використанням РХМС. Маточний розчин після початкової кристалізації робили основним (рН 11) за допомогою 2М гідроксиду натрію і двічі екстрагували хлороформом (10 мл). Хлороформні екстракти сушили (безводний сульфат натрію) і концентрували, одержуючи масло. Даний амін (3,00 г, 13,8 ммоль) розчиняли в метанолі (10 мл) і обробляли толуоїл-L-винною кислотою (2,76 г, 6,90 ммоль). Суміш нагрівали для того, щоб сприяти розчиненню і потім повільно охолоджували до -5С, залишаючи при цій температурі на ніч. Осад збирали фільтруванням із відсмоктуванням розчинника у вакуумі, перекристалізовували з метанолу і сушили. Це давало в залишку 1,05 г білої твердої речовини. Дану сіль перетворювали у вільну основу (вихід = 0,364 г) і енантіомерну чистоту (97%) оцінювали з використанням пролінамідного способу, як описано вище для іншого енантіомеру. Транс-енантіомер А N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]октан-3-іл)бензофуран-2карбоксаміду Дифенілхлорфосфат (0,35 мл, 0,46 г, 1,7 ммоль) додавали по краплях до розчину бензофуран-2-карбонової кислоти (0,28 г, 1,7 ммоль) і триетиламіну (0,24 мл, 0,17 г, 1,7 ммоль) у сухому дихлорметані (5 мл). Після перемішування при температурі навколишнього середовища протягом 30 хвилин додавали розчин (2S,3R)-3-аміно-2-((3-піридиніл)метил)-1азабіцикло[2.2.2]октану (0,337 г, 1,55 ммоль) (який був одержаний із солі ди-п-толуоліл-D-винної кислоти) і триетиламіну (0,24 мл, 0,17 г, 1,7 ммоль) у сухому дихлорметані (5 мл). Реакційну суміш перемішували протягом ночі при температурі навколишнього середовища і потім обробляли 10% розчином гідроксиду натрію (1 мл). Двофазну суміш розділяли та органічний шар концентрували на центрифужному випарнику Genevac. Залишок розчиняли в метанолі (6 мл) і очищали за допомогою ВЕРХ на колонці С18 із силікагелем із використанням градієнта суміші ацетонітрил/вода, що містить 0,05% трифтороцтової кислоти, у ролі елюенту. Концентрування вибраних фракцій, розподіл одержаного залишку між хлороформом і насиченим водним розчином бікарбонату натрію та упарювання хлороформу давали 0,310 г 1 (42% вихід) білого порошку (95% чистота за даними ГРХ-мас-спектрометрії). Н ЯМР (300 МГц, CDCl3) 8,51 (д, 1H), 8,34 (дд, 1H), 7,66 (д, 1H), 7,58 (дт, 1H), 7,49 (д, 1H), 7,44 (с, 1H), 7,40 (дд, 1H), 7,29 (т, 1H), 7,13 (дд, 1H), 6,63 (д, 1H), 3,95 (т, 1H), 3,08 (м, 1H), 2,95 (м, 4H), 2,78 (м, 2H), 2,03 (м, 1H), 1,72 (м, 3H), 1,52 (м, 1H). Пізніше було визначено за допомогою хірального хроматографічного аналізу, що дана речовина (транс-енантіомер А) ідентична речовині, абсолютна конфігурація якої 2S,3R (визначена за допомогою рентгенодифракційного кристалографічного аналізу). Транс-енантіомер В N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]октан-3-іл)бензофуран-2карбоксаміду Дифенілхлорфосфат (96 мкл, 124 мг, 0,46 ммоль) додавали по краплях до розчину бензофуран-2-карбонової кислоти (75 мг, 0,46 ммоль) і триетиламіну (64 мкл, 46 мг, 0,46 ммоль) у сухому дихлорметані (1 мл). Після перемішування при температурі навколишнього середовища протягом 45 хвилин додавали розчин (2R,3S)-3-аміно-2-((3-піридиніл)метил)-1азабіцикло[2.2.2]октану (0,10 г, 0,46 ммоль) (який був одержаний із солі толуоліл-L-винної кислоти) і триетиламіну (64 мкл, 46 мг, 0,46 ммоль) у сухому дихлорметані (1 мл). Реакційну суміш перемішували протягом ночі при температурі навколишнього середовища і потім обробляли 10% розчином гідроксиду натрію (1 мл). Двофазну суміш розділяли та органічний шар і хлороформний екстракт (2 мл) водного шару концентрували за допомогою роторного випарника. Залишок розчиняли в метанолі та очищали за допомогою ВЕРХ на колонці С18 із силікагелем із використанням градієнта суміші ацетонітрил/вода, що містить 0,05% трифтороцтової кислоти, у ролі елюенту. Концентрування вибраних фракцій, розподіл одержаного залишку між хлороформом і насиченим водним розчином бікарбонату натрію та упарювання хлороформу давали 82,5 мг (50% вихід) білого порошку. Спектр ЯМР був ідентичний спектру, одержаному для 2S,3R-ізомеру. Оскільки безпосередній попередник даної речовини (транс-енантіомер В) є енантіомерним безпосередньому попередникові 2S,3Rсполуки (транс-енантіомер А), абсолютну конфігурацію транс-енантіомеру В припускали як таку, що являє собою 2R,3S. Приклад 2 Великомасштабний синтез (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]октан-3іл)бензофуран-2-карбоксаміду і п-толуолсульфонатної солі (2S,3R)-N-(2-((3-піридиніл)метил)-1азабіцикло[2.2.2]окт-3-ил)-1-бензофуран-2-карбоксаміду. 18 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 60 2-((3-Піридиніл)метилен)-1-азабіцикло[2.2.2]октан-3-он Гідрохлорид 3-хінуклідинону (8,25 кг, 51,0 моль) і метанол (49,5 л) додавали, в атмосфері азоту, у скляну реакційну колбу ємністю 100 л, обладнану механічною мішалкою, температурним датчиком і зворотним холодильником. Через лійку для порошку додавали гідроксид калію (5,55 кг, 99,0 моль) протягом приблизно 30 хвилин, що призводило до підвищення температури реакційної суміші від 50С до 56С. До реакційної суміші протягом приблизно 2 годин додавали 3-піридинкарбоксальдегід (4,80 кг, 44,9 моль). Одержану суміш перемішували при 20С5С протягом як мінімум 12 годин у міру контролю за ходом реакції за допомогою тонкошарової хроматографії (ТШХ). Після завершення реакції реакційну суміш фільтрували через фільтр із пористого скла й осад на фільтрі промивали метанолом (74,2 л). Фільтрат концентрували, переносили в реакційну колбу і додавали воду (66,0 л). Суспензію перемішували протягом як мінімум 30 хвилин, фільтрували й осад на фільтрі промивали водою (90 л) доти поки рН розчину після промивання не досягав 7-9. Тверду речовину сушили у вакуумі при 50С5С протягом як мінімум 12 годин, одержуючи 8,58 кг (89,3%) 2-((3піридиніл)метилен)-1-азабіцикло[2.2.2]октан-3-ону. ди-п-Толуоїл-D-тартратна сіль (2S)-2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]октан-3-ону 2-((3-Піридиніл)метилен)-1-азабіцикло[2.2.2]октан-3-он (5,40 кг, 25,2 моль) і метанол (40,5 л) уміщували у реакційну колбу ємністю 72 л з інертною атмосферою, обладнану механічною мішалкою, температурним датчиком, регулюючою системою низького тиску газу і приладом для вимірювання тиску. Простір над реакційною сумішшю заповнювали азотом і суміші перемішували до одержання прозорого жовтого розчину. У колбу додавали 10% паладій-навугіллі (50% вологий) (270 г). Атмосферу з реактора видаляли з використанням вакуумного насоса і простір над реакційною сумішшю заміняли на водень до тиску 10-20 дюймів водного стовпа. Видалення газової атмосфери з колби і подачу водню під тиском повторювали ще 2 рази, залишаючи реактор під тиском газоподібного водню в 20 дюймів водного стовпа після третьої подачі газу під тиском. Реакційну суміш перемішували при 20С5С протягом як мінімум 12 годин і контроль за ходом реакції проводили за допомогою ТШХ. Після завершення реакції суспензію фільтрували через шар Celite®545 (1,9 кг) на фільтрі з пористого скла й осад на фільтрі промивали метанолом (10,1 л). Фільтрат концентрували до одержання напівтвердої речовини, яку переносили, в атмосфері азоту, у реакційну колбу ємністю 100 л, обладнану механічною мішалкою, зворотним холодильником і температурним датчиком. Напівтверду речовину розчиняли в етанолі (57,2 л) і додавали ди-п-толуоїл-D-винну кислоту (DTTA) (9,74 кг, 25,2 моль). Перемішувану реакційну суміш нагрівали при кипінні зі зворотним холодильником протягом як мінімум 1 години і перемішували додатково протягом як мінімум 12 годин у міру охолодження реакційної суміші до температури між 15С і 30С. Суспензію фільтрували через настільний фільтр і осад на фільтрі промивали етанолом (11,4 л). Продукт сушили у вакуумі при температурі навколишнього середовища, одержуючи 11,6 кг (72% вихід, 59,5% факторизований за чистотою) ди-п-толуоїл-D-тартратної солі (2S)-2-((3-піридиніл)метил)-1азабіцикло[2.2.2]октан-3-ону. ди-п-Толуоїл-D-тартратна сіль (2S,3R)-3-аміно-2-((3-піридиніл)метил)-1азабіцикло[2.2.2]октану Воду (46,25 л) і бікарбонат натрію (4,35 кг, 51,8 моль) додавали в колбу ємністю 200 л. Після завершення розчинення додавали дихлорметан (69,4 л). Додавали ди-п-толуоїл-D-тартратну сіль (2S)-2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]октан-3-ону (11,56 кг, 19,19 моль) і реакційну суміш перемішували протягом від 2 хвилин до 10 хвилин. Шари залишали для відділення як мінімум на 2 хвилини (додавали додатково воду (20 л), якщо це було необхідно для розподілу шарів). Органічну фазу видаляли і сушили над безводним сульфатом натрію. До водної фази, що залишилася, додавали дихлорметан (34,7 л) і суспензію перемішували протягом від 2 хвилин до 10 хвилин. Шари залишали для відділення протягом від 2 хвилин до 10 хвилин. Знову органічну фазу видаляли і сушили над безводним сульфатом натрію. Екстракцію водної фази дихлорметаном (34,7 л) повторювали ще один раз, як описано вище. Зразки, одержані в кожній екстракції, аналізували за допомогою хірального ВЕРХ аналізу. Сульфат натрію видаляли шляхом фільтрування і фільтрати концентрували, одержуючи (2S)-2-((3-піридиніл)метил)-1азабіцикло[2.2.2]октан-3-он (4,0 кг) у вигляді твердої речовини. (2S)-2-((3-Піридиніл)метил)-1-азабіцикло[2.2.2]октан-3-он (3,8 кг) переносили в атмосфері азоту в чисту скляну реакційну колбу ємністю 100 л, обладнану механічною мішалкою і температурним датчиком. Додавали безводний тетрагідрофуран (7,24 л) і (+)-(R)-метилбензиламін (2,55 л, 20,1 моль). До переміщуваної реакційної суміші протягом 1 години додавали ізопропоксид титану(IV) (6,47 л, 21,8 моль). Реакційну суміш перемішували в атмосфері азоту протягом як мінімум 12 годин. До реакційної суміші додавали етанол (36,17 л). 19 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 Реакційну суміш охолоджували до температури нижче -5С і додавали порціями боргідрид натрію (1,53 кг, 40,5 моль), підтримуючи температуру реакційної суміші нижче 15С (таке додавання займало кілька годин). Реакційну суміш потім перемішували при 15С10С протягом мінімум 1 години. Контроль за ходом реакції проводили за допомогою ВЕРХ і після завершення реакції (на що показувала присутність менш 0,5% (2S)-2-((3-піридиніл)метил)-1азабіцикло[2.2.2]октан-3-ону, що залишився) додавали 2М гідроксид натрію (15,99 л) і суміш перемішували протягом як мінімум 10 хвилин. Реакційну суміш фільтрували через шар Celite®545 на настільній лійці. Осад на фільтрі промивали етанолом (15,23 л) і фільтрат концентрували, одержуючи масло. Концентрат переносили в чисту скляну реакційну колбу ємністю 100 л, обладнану механічною мішалкою і температурним датчиком, в інертній атмосфері. Додавали воду (1 л) і суміш охолоджували до 0С5С. До суміші додавали 2М соляну кислоту (24 л) для доведення рН суміші до рН 1. Потім суміш перемішували протягом як мінімум 10 хвилин і водну фазу екстрагували дихлорметаном (315,23 л). Органічні фази сушили над безводним сульфатом натрію (2,0 кг), фільтрували і концентрували, одержуючи (2S,3R)-N-((1R)-фенілетил)-3-аміно-2((3-піридиніл)метил)-1-азабіцикло[2.2.2]октан (4,80 кг, 84,7% вихід). (2S,3R)-N-((1R)-Фенілетил)-3-аміно-2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]октан переносили в скляну колбу ємністю 22 л, обладнану механічною мішалкою і температурним датчиком, в інертній атмосфері. Додавали воду (4,8 л) і перемішувану суміш, що, охолоджували до 5С5С. У реакційну колбу повільно додавали концентровану соляну кислоту (2,97 л), підтримуючи температуру суміші нижче 25С. Одержаний розчин переносили в реакційну колбу ємністю 72 л, що містить етанол (18 л), обладнану механічною мішалкою, температурним датчиком і зворотним холодильником, в інертній атмосфері. У колбу додавали 10% паладій-навугіллі (50% вологий) (311,1 г) і циклогексен (14,36 л). Реакційну суміш нагрівали при температурі, близькій до температури кипіння зі зворотним холодильником, протягом як мінімум 12 годин і хід реакції контролювали за допомогою ТШХ. Після завершення реакції реакційну суміш охолоджували до температури нижче 45С і фільтрували через шар Celite® 545 (1,2 кг) на лійці зі скляним пористим фільтром. Осад на фільтрі промивали етанолом (3 л) і фільтрат концентрували, одержуючи водну фазу. До концентрованого фільтрату додавали воду (500 мл) і об’єднаний водний шар промивали метил-трет-бутиловим ефіром (МТВЕ) (24,79 л). До водної фази додавали 2М гідроксид натрію (19,5 л) для доведення рН суміші до рН 14. Суміш потім перемішували протягом як мінімум 10 хвилин. Водну фазу екстрагували хлороформом (411,96 л) і об’єднані органічні фази сушили над безводним сульфатом натрію (2,34 кг). Фільтрат фільтрували і концентрували, одержуючи (2S,3R)-3-аміно-2-((3-піридиніл)метил)-1азабіцикло[2.2.2]октан (3,49 кг ніж кількісний вихід) у вигляді масла. (2S,3R)-3-Аміно-2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]октан переносили в чисту реакційну колбу ємністю 100 л, обладнану механічною мішалкою, зворотним холодильником і температурним датчиком, в інертній атмосфері. Додавали етанол (38,4 л) і ди-п-толуоїл-Dвинну кислоту (3,58 кг, 9,27 моль). Реакційну суміш нагрівали при несильному кипінні зі зворотним холодильником протягом як мінімум 1 години. Реакційну суміш потім перемішували протягом як мінімум 12 годин у міру її охолодження до температури між 15С і 30С. Одержану суспензію фільтрували й осад на фільтрі промивали етанолом (5,76 л). Осад на фільтрі переносили в чисту скляну реакційну колбу ємністю 100 л, обладнану механічною мішалкою, зворотним холодильником і температурним датчиком, в інертній атмосфері. Додавали розчин етанол/вода в співвідношенні 9:1 (30,7 л) і одержану суспензію нагрівали при несильному кипінні зі зворотним холодильником протягом як мінімум 1 години. Реакційну суміш потім перемішували протягом як мінімум 12 годин у міру її охолодження до температури між 15С і 30С. Суміш фільтрували, й осад на фільтрі промивали етанолом (5,76 л). Збирали продукт і сушили у вакуумі при 50С5С протягом як мінімум 12 годин, одержуючи 5,63 кг (58,1% вихід) ди-п-толуоїл-D-тартратної солі (2S,3R)-3-аміно-2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]октану. (2S,3R)-N-(2-((3-Піридиніл)метил)-1-азабіцикло[2.2.2]октан-3-іл)бензофуран-2-карбоксамід ди-п-Толуоїл-D-тартратну сіль (2S,3R)-3-аміно-2-((3-піридиніл)метил)-1азабіцикло[2.2.2]октану (3,64 кг, 5,96 моль) і 10% водний розчин хлориду натрію (14,4 л, 46,4 моль) додавали в скляну реакційну колбу ємністю 72 л, обладнану механічною мішалкою, в інертній атмосфері. До перемішуваної суміші додавали 5М гідроксид натрію (5,09 л) для доведення рН суміші до рН 14. Суміш потім перемішували протягом як мінімум 10 хвилин. Водний розчин екстрагували хлороформом (412,0 л) і об’єднані органічні шари сушили над безводним сульфатом натрію (1,72 кг). Об’єднані органічні шари фільтрували і фільтрат 20 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 концентрували, одержуючи (2S,3R)-3-аміно-2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]октан (1,27 кг) у вигляді масла. (2S,3R)-3-аміно-2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]октан переносили в скляну реакційну колбу ємністю 50 л, обладнану механічною мішалкою, в інертній атмосфері. До реакційної суміші додавали дихлорметан (16,5 л), триетиламін (847 мл, 6,08 моль), бензофуран2-карбонову кислоту (948 г, 5,85 моль) і гексафторфосфат О-(бензотриазол-1-іл)-N,N,N,1тетраметилуронію (HBTU) (2,17 кг, 5,85 моль). Суміш перемішували протягом як мінімум 4 годин при температурі навколишнього середовища і хід реакції контролювали за допомогою ВЕРХ. Після завершення реакції до реакційної суміші додавали 10% водний розчин карбонату калію (12,7 л, 17,1 моль) і суміш перемішували протягом як мінімум 5 хвилин. Шари відокремлювали та органічну фазу промивали 10% розчином повареної солі (12,7 л). Шари відокремлювали та органічну фазу охолоджували до 15С10С. До реакційної суміші повільно додавали 3М соляну кислоту (8,0 л) для доведення рН суміші до рН 1. Суміш потім перемішували протягом як мінімум 5 хвилин і шари залишали для розподілу як мінімум на 5 хвилин. Тверді речовини відфільтровували з використанням настільного фільтра. Шари фільтрату відокремлювали і водну фазу і тверді речовини з лійки переносили в реакційну колбу. У колбу повільно додавали порціями 3М гідроксид натрію (9,0 л) для доведення рН суміші до рН 14. Водну фазу екстрагували дихлорметаном (216,5 л). Об’єднані органічні фази сушили над безводним сульфатом натрію (1,71 кг). Суміш фільтрували і фільтрат концентрували, одержуючи (2S,3R)N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]октан-3-іл)бензофуран-2-карбоксамід (1,63 кг, 77,0% вихід) у вигляді жовтої твердої речовини. п-Толуолсульфонат (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксамід (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]октан-3-іл)бензофуран-2-карбоксамід (1,62 кг, 4,48 моль) і дихлорметан (8,60 кг) додавали в обплетену сулію. Відсотки маса/маса речовини в розчині визначали за допомогою ВЕРХ аналізу. Розчин концентрували до масла, додавали ацетон (4 л) і суміш концентрували, одержуючи маслянисту тверду речовину. Додатково додавали ацетон (12 л) до маслянистої речовини в колбі роторного випарника і одержану суспензію переносили в скляну реакційну колбу ємністю 50 л з механічною мішалкою, зворотним холодильником, температурним датчиком і зворотним холодильником в інертній атмосфері. Реакційну суміш нагрівали до 50С5С. До розчину додавали воду (80,7 г) і перемішували його протягом як мінімум 10 хвилин. До реакційної суміші порціями додавали птолуолсульфонову кислоту (853 г, 4,44 моль) протягом приблизно 15 хвилин. Реакційну суміш нагрівали до кипіння зі зворотним холодильником і витримували при даній температурі протягом як мінімум 30 хвилин для одержання розчину. Реакційну суміш охолоджували до 40С5С протягом приблизно 2 годин. Протягом приблизно 1,5 годин додавали ізопропілацетат (14,1 л). Реакційну суміш повільно охолоджували до температури навколишнього середовища протягом як мінімум 10 годин. Суміш фільтрували й осад на фільтрі промивали ізопропілацетатом (3,5 л). Виділений продукт сушили у вакуумі при 105С5С протягом від 2 до 9 годин, одержуючи 2,19 кг (88,5% вихід) п-толуолсульфонату (2S,3R)-N-(2-((3-піридиніл)метил)1 1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду, т.пл. 226-228С. Н ЯМР (500 МГц, D2O) 8,29 (с, 1H), 7,78 (м, J=5,1, 1H), 7,63 (д, J=7,9, 1H), 7,54 (д, J=7,8, 1H), 7,49 (д, J=8,1, 2H), 7,37 (м, J=8,3, 1H), 7,33 (м, J=8,3, 6,9, 1,0, 1H), 7,18 (м, J=7,8, 6,9, 1,0, 1H), 7,14 (д, J=8,1, 2H), 7,09 (с, 1H), 6,99 (дд, J=7,9, 5,1, 1H), 4,05 (м, J=7,7, 1H), 3,74 (м, 1H), 3,47 (м, 2H), 3,28 (м, 1H), 3,22 (м, 1H), 3,15 (дд, J=13,2, 4,7, 1H), 3,02 (дд, J=13,2, 11,5, 1H), 2,19 (с, 3H), 2,02 (м, 2H), 1,93 (м, 2H), 13 1,79 (м, 1H). C ЯМР (126 МГц, D2О) 157,2, 154,1, 150,1, 148,2, 146,4, 145,2, 138,0, 137,0, 130,9, 128,2 (2), 126,9, 126,8, 125,5 (2), 123,7, 123,3, 122,7, 111,7, 100,7, 61,3, 50,2, 48,0, 40,9, 33,1, 26,9, 21,5, 20,8, 17,0. Зразки даної речовини перетворювали у вільну основу сполуки А (для застосування в дослідженнях з вибору солі) шляхом обробки водним розчином гідроксиду натрію і екстракцією хлороформом. У міру упарювання хлороформу залишався не зовсім білий порошок, т.пл. 167170С, що має наступні спектральні характеристики: Електророзпилення в режимі позитивних + 1 іонів, мас-спектр [M+H] іон m/z=362. Н ЯМР (500 МГц, ДМСО-d6) 8,53 (д, J=7,6 Гц, 1H), 8,43 (д, J=1,7 Гц, 1H), 8,28 (дд, J=1,6, 4,7 Гц, 1H), 7,77 (д, J=7,7 Гц, 1H), 7,66 (д, J=8,5 Гц, 1H), 7,63 (дт, J=1,7, 7,7 Гц, 1H), 7,52 (с, 1H), 7,46 (м, J=8,5, 7,5 Гц, 1H), 7,33 (м, J=7,7, 7,5 Гц, 1H), 7,21 (дд, J=4,7, 7,7 Гц, 1H), 3,71 (м, J=7,6 Гц, 1H), 3,11 (м, 1H), 3,02 (м, 1H), 2,80 (м, 2H), 2,69 (м, 2H), 2,55 13 (м, 1H), 1,80 (м, 1H), 1,77 (м, 1H), 1,62 (м, 1H), 1,56 (м, 1H), 1,26 (м, 1H). C ЯМР (126 МГц, ДМСО-d6) 158,1, 154,1, 150,1, 149,1, 146,8, 136,4, 135,4, 127,1, 126,7, 123,6, 122,9, 122,6, 111,8, 109,3, 61,9, 53,4, 49,9, 40,3, 35,0, 28,1, 26,1, 19,6. 21 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 60 Моногідрохлоридну сіль сполуки А (див. приклад 5) піддавали рентгенодифракційному кристалографічному аналізу. Одержана кристалічна структура (показана на фіг.10А і 10В, відповідно) дозволяє встановити 2S,3R абсолютну конфігурацію сполуки А. Приклад 3 Синтез фосфатної солі (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксаміду У круглодонну колбу додавали (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксамід (8,18 г, 22,6 ммоль) і 2-пропанол (180 мл). Суміш перемішували і нагрівали при 65-70С доти, поки не розчиняли всі тверді речовини. Розчин інтенсивно перемішували при 65-70С і додавали по краплях за допомогою піпетки фосфорну кислоту (1,65 мл, 24,3 ммоль). Відразу ж утворювалася біла гранульована тверда речовина. Суміш перемішували при 65-70С протягом 30 хвилин, охолоджували до температури навколишнього середовища (23С) і додатково перемішували протягом 24 годин. Білу тверду речовину збирали фільтруванням із відсмоктуванням осаду у вакуумі й осад на фільтрі промивали 2-пропанолом (20 мл) і тверду речовину сушили на повітрі принаймні протягом 1 години. Тверду речовину додатково сушили у вакуумній печі при 75С протягом ночі (16 годин), одержуючи 10,7 г продукту ( кількісний вихід), т.пл. 265-273С із розкладанням, зі зміною кристалічності, 1 спостережуваним при 180С. Спектр Н ЯМР (ДМСО-d6) показував на присутність 2-пропанолу (міцний сольват), що може пояснити вихід, що перевищує кількісний. Аналіз методом хіральної РХ показував чистоту 97,1% (270 нм). Приклад 4 Синтез малеатної солі (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксаміду Малеїнову кислоту (0,067 г, 0,630 ммоль) додавали до гарячої суспензії (2S,3R)-N-(2-((3піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду (0,203 г, 0,560 ммоль) в ізопропілацетаті (2 мл), з осадженням дрібної білої твердої речовини разом зі смолоподібним осадом. Додатково додавали ізопропілацетат (3 мл) і малеїнову кислоту (0,006 г) і суміш нагрівали до кипіння зі зворотним холодильником. При кипінні зі зворотним холодильником додавали ізопропанол (5 мл). Одержану суміш білих твердих речовин охолоджували до температури навколишнього середовища, фільтрували і тверді речовини промивали ізопропілацетатом (2 мл). Продукт сушили у вакуумі при 60С протягом 18 годин одержуючи 1 0,228 г не зовсім білої пластівчастої твердої речовини (вихід 84,7%), т.пл.180-182С. Спектр Н ЯМР (ДМСО-d6) указував на стехіометричну сполуку моносолі. Обчислено для . С22Н23N3O2 C4H4O4: C, 65,40; H, 5,70; N, 8,80. Знайдено: С, 65,35, 65,29; H, 5,86, 5,68; N, 8,69, 8,78. Приклад 5 Синтез гідрохлоридних солей (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксаміду Моногідрохлорид: Одержували розчин соляної кислоти в ТГФ шляхом додавання по краплях концентрованої соляної кислоти (1,93 мл 12М розчину, 23,2 ммоль) до 8,5 мл охолодженого ТГФ. Розчин нагрівали до температури навколишнього середовища. У круглодонну колбу додавали (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2карбоксамід (8,49 г, 23,5 ммоль) і ацетон (85 мл). Суміш перемішували і нагрівали при 45-50С до одержання абсолютного розчину. Одержаний вихід розчин соляної кислоти в ТГФ додавали по краплях протягом 5 хвилин, використовуючи додаткову кількість ТГФ (1,5 мл) для переносу. Під час додавання розчину кислоти починало утворюватися гранульовану білу тверду речовину. Суміш охолоджували до температури навколишнього середовища і перемішували протягом ночі (16 годин). Тверду речовину збирали фільтруванням з відсмоктуванням осаду у вакуумі, осад на фільтрі промивали ацетоном (10 мл) і тверду речовину сушили на повітрі з відсмоктуванням у вакуумі протягом 30 хвилин. Тверду речовину додатково сушили у вакуумній печі при 75С протягом 2 годин, одержуючи 8,79 г дрібних білих кристалів (вихід 94%), т.пл. 255-262С. Аналіз 1 методом хіральної РХ давав чистоту в 98,8% (270 нм). Спектр Н ЯМР (ДМСО-d6) не показав 1 присутності залишкових розчинників і підтверджував моностехіометричну сполуку. Н ЯМР (300 МГц, ДМСО-d6) 10,7 (широкий с, 1Н – четвертиннийамоній), 8,80 (широкий с, 1Н – амідний Н), 8,54 (с, 1H), 8,23 (д, 1H), 7,78 (д, 1H), 7,74 (д, 1H), 7,60 (д, 1H), 7,47 (м, 2H), 7,33 (м, 1H), 7,19 (м, 1H), 4,19 (м, 1H), 4,08 (м, 1H), 3,05-3,55 (м, 6H), 2,00-2,10 (м, 3H), 1,90 (м, 1H), 1,70 (м, 1H). Рентгеноструктурний кристалографічний аналіз даної солі встановив стереохімічне віднесення і стехіометрію (див. фіг.10А і 10В). Дигідрохлорид: Газоподібний хлористий водень повільно барботували в охолоджуваний льодом розчин (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2 22 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 карбоксаміду (1,9 г, 5,3 ммоль) у безводному простому ефірі (25 мл). Леткі компоненти видаляли, спочатку в потоці азоту і потім у високому вакуумі (газопромивач із гідроксидом натрію вбудовували у високовакуумну лінію). Залишок розтирали кілька разів з невеликими порціями безводного простого ефіру (відкидали) і тверду речовину, що залишилася, сушили у високому вакуумі. Це давало 2,17 г (вихід 94%) не зовсім білого порошку, т.пл. 210-212З (гігроскопічно). Аналіз методом хіральної РХ давав чистоту 93,7% (270 нм). Мас-спектр методом + 1 електророзпилювання в режимі позитивних іонів давав іон [M+H] m/z=362. Н ЯМР (300 МГц, CD3OD) 9,15 (с, 1H), 8,84 (д, 1H), 8,63 (д, 1H), 7,97 (т, 1H), 7,75 (д, 1H), 7,61 (д, 1H), 7,52 (м, 2H), 7,35 (т, 1H), 4,50 (м, 1H), 4,32 (м, 1H), 3,40-3,85 (м, 6H), 1,95-2,40 (м, 5H). Приклад 6 Синтез гемігалактаратної солі (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксаміду Галактарову (слизову) кислоту (36,3 мг, 0,173 ммоль) додавали до розчину (2S,3R)-N-(2-((3піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду (125 мг, 0,346 ммоль) у гарячому етанолі (1 мл). Суміш нагрівали при кипінні зі зворотним холодильником після додавання води (8 крапель); потім гарячу суміш фільтрували через бавовняну пробку, яку згодом промивали етанолом (1 мл). Охолодження не призводило до утворення осаду. Леткі компоненти видаляли упарюванням із використанням роторного випарника і залишок (біла спінена речовина) розтирали з ізопропанолом (відкидали) і тверду речовину, що залишилася, розчиняли в киплячій суміші ацетон/вода (4 мл у співвідношенні 7:1). Повільне охолодження до 5С призводило до утворення білої твердої речовини, що відфільтровували, промивали ізопропанолом (31 мл) і сушили у високому вакуумі. У залишку одержували 118 мг (вихід 73%) 1 тонких білих пластин, т.пл. 134-139С. Н ЯМР (300 МГц, D2O) 8,29 (с, 1H), 7,78 (д, 1H), 7,62 (д, 1H), 7,54 (д, 1H), 7,35 (м, 2H), 7,18 (т, 1H), 7,10 (с, 1H), 6,98 (м, 1H), 4,08 (с, 1H, галактарова кислота), 3,98 (д, 1H), 3,77 (с, 1H, галактарова кислота), 3,66 (м, 1H), 3,35 (м, 1H), 2,95-3,30 (м, 4H), 1,65-2,05 (м, 5H). Приклад 7 Синтез D-тартратної солі (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксаміду Винну кислоту (25,6 мг, 0,173 ммоль) додавали (2S,3R)-N-(2-((3-піридиніл)метил)-1азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду (125 мг, 0,346 ммоль) у гарячому етанолі (1 мл). Одержаний розчин повільно охолоджували до температури навколишнього середовища. Тверда речовина не випадала в осад, тому розчин концентрували, одержуючи білу спінену речовину. Спроби кристалізації в ізопропанолі виявилися невдалими. Спінену речовину розчиняли в метанолі і додавали другу порцію половини еквівалента винної кислоти (25,6 мг, 0,173 ммоль). Суміш концентрували, одержуючи білу піну, яка не закристалізувалася із сумішей метанолу та ізопропанолу. Концентровану речовину (суміш твердої речовини і смолоподібної рідини) потім суспендували в етилацетаті (1 мл), одержуючи білу тверду речовину. Її виділяли фільтруванням (промивали етилацетатом) і сушили у вакуумній печі (18 годин при 40С), одержуючи 141 мг (вихід 79,7%) солі з моностехіометричною сполукою (ЯМР), т.пл. 136-140С. 1 Аналіз методом хіральної РХ давав чистоту 98,1% (270 нм). Н ЯМР (300 МГц, D2O) 8,50 (с, 1H), 8,01 (д, 1H), 7,86 (д, 1H), 7,75 (д, 1H), 7,56 (м, 2H), 7,38 (т, 1H), 7,32 (с, 1H), 7,21 (т, 1H), 4,34 (с, 2H, винна кислота), 4,26 (д, 1H), 3,95 (м, 1H), 3,64 (м, 2H), 3,15-3,55 (м, 4H), 1,90-2,30 (м, 5H). Приклад 8 Синтез метансульфонатної солі (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксаміду Метансульфонову кислоту (33,2 мг, 0,346 ммоль) додавали до розчину (2S,3R)-N-(2-((3піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду (125 мг, 0,346 ммоль) у гарячому етанолі (1 мл). Охолодження призводило до утворення осаду. Суміш нагрівали до кипіння зі зворотним холодильником і гарячу суміш фільтрували через бавовняну пробку, яку згодом промивали метанолом (1 мл). Леткі компоненти видаляли за допомогою роторного випарника і залишок (ясно-жовта піна) розчиняли в гарячому ізопропанолі (1 мл). Знову, охолодження призводило до утворення осаду. Ізопропанол упарювали і залишок суспендували в ацетоні (1 мл). Фільтрування і сушіння у вакуумній печі (18 годин при 50С) давали 146 мг 1 (вихід 92,5%) світло-бежевої твердої речовини, т.пл. 240-243С.Н ЯМР (300 МГц, D2O) 8,32 (с, 1H), 7,82 (д, 1H), 7,66 (д, 1H), 7,57 (д, 1H), 7,38 (м, 2H), 7,20 (м, 1H), 7,12 (с, 1H), 7,01 (м, 1H), 4,09 (д, 1H), 3,75 (м, 1H), 3,47 (м, 2H), 3,00-3,40 (м, 4H), 2,67 (с, 3H, метансульфонова кислота), 1,75-2,15 (м, 5H). Приклад 9 23 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 Синтез D-манделатної солі (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксаміду D-Мигдальну кислоту (52,6 мг, 0,346 ммоль) додавали до розчину (2S,3R)-N-(2-((3піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду (125 мг, 0,346 ммоль) у гарячому етанолі (1 мл). Розведення етилацетатом (4 мл) і охолодження не призводили до утворення осаду. Леткі компоненти видаляли упарюванням із використанням роторного випарника і залишок (біла піна) розчиняли в гарячому ізопропанолі (0,5 мл). Охолодження до 5С призводило до утворення білих кристалів, які збирали фільтруванням із відсмоктуванням у вакуумі. Сушіння у вакуумній печі (18 годин при 45С) давало 111 мг (вихід 62,4%) світло1 бежевої твердої речовини, т.пл. 188,5-193С. Н ЯМР (300 МГц, D2O) 8,33 (с, 1Н), 7,83 (с, 1Н), 7,67 (д, 1Н), 7,60 (д, 1Н), 7,27 (м, 8Н, включає мигдальну кислоту), 7,12 (с, 1Н), 7,01 (м, 1Н), 4,85 (с, 1Н, мигдальна кислота), 4,10 (д, 1Н), 3,75 (м, 1Н), 3,48 (м, 2Н), 3,00-3,40 (м, 4Н), 1,75-2,15 (м, 5Н). Приклад 10 Синтез R-камфорсульфонатної солі (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт3-ил)бензофуран-2-карбоксаміду R-10-Камфорсульфонову кислоту (80,3 мг, 0,346 ммоль) додавали до розчину (2S,3R)-N-(2((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду (125 мг, 0,346 ммоль) у гарячому етанолі (1 мл). Охолодження не призводило до осадження будь-якого осаду. Леткі компоненти видаляли упарюванням із використанням роторного випарника і залишок (білу піну) розчиняли в гарячому ізопропанолі (0,5 мл). Охолодження до 5С призводило до утворення окремих білих кристалів і молочної суспензії. При дряпанні стінок колби шпателем згодом призводило до перетворення суміші в густу масу дрібних білих кристалів. Додатково додавали 0,5 мл ізопропанолу і кристали збирали фільтруванням із відсмоктуванням осаду у вакуумі. Сушіння у вакуумній печі (5 годин при 70С, потім 2 години при 110С) давало 193 мг ос 1 (вихід 93,8%) білої твердої речовини, т.пл. 149,5-156 . Н ЯМР (300 МГц, D2O) 8,30 (с, 1Н), 7,79 (д, 1Н), 7,64 (д, 1Н), 7,55 (д, 1Н), 7,36 (м, 2Н), 7,18 (м, 1Н), 7,11 (с, 1Н), 6,99 (м, 1Н), 4,07 (д, 1Н), 3,73 (м, 1Н), 3,45 (м, 2Н), 3,95-3,35 (м, 5Н, включає камфорсульфонову кислоту), 2,64 (д, 1Н, камфорсульфонова кислота), 2,22 (м, 2Н), 1,70-2,10 (м, 8Н, включає камфорсульфонову кислоту), 1,45 (м, 1Н, камфорсульфонова кислота), 1,25 (м, 1Н, камфорсульфонова кислота), 0,85 (с, 3Н, камфорсульфонова кислота), 0,68 (с, 3Н, камфорсульфонова кислота). Приклад 11 Синтез S-камфорсульфонатної солі (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт3-ил)бензофуран-2-карбоксаміду S-10-камфорсульфонову кислоту (80,3 мг, 0,346 ммоль) додавали до розчину (2S,3R)-N-(2((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду (125 мг, 0,346 ммоль) у гарячому етанолі (1 мл). Розведення етилацетатом (4 мл) та охолодження не призводили до осадження будь-якого осаду. Леткі компоненти видаляли упарюванням із використанням роторного випарника і залишок (білу піну) розчиняли в гарячому ізопропанолі (1,5 мл). Охолодження до 5С призводило до утворення білих кристалів. Суміш концентрували до 0,5 мл і знову охолоджували до 5С. Потім тверду речовину збирали фільтруванням із відсмоктуванням осаду у вакуумі і сушили у вакуумі, спочатку 18 годин при 45С, але потім поступово при більш високій температурі (наприкінці при 110С) для видалення залишкового 1 ізопропанолу. Це давало 143 мг (вихід 69,7%) білої твердої речовини, т.пл. 153,5-157С. Н ЯМР (300 МГц, D2O) 8,29 (с, 1Н), 7,79 (д, 1Н), 7,63 (д, 1Н), 7,54 (д, 1Н), 7,34 (м, 2Н), 7,18 (м, 1Н), 7,10 (с, 1Н), 6,99 (м, 1Н), 4,05 (д, 1Н), 3,73 (м, 1Н), 3,44 (м, 2Н), 3,95-3,35 (м, 5Н, включає камфорсульфонову кислоту), 2,67 (д, 1Н, камфорсульфонова кислота), 2,23 (м, 2Н), 1,70-2,10 (м, 8Н, включає камфорсульфонову кислоту), 1,46 (м, 1Н, камфорсульфонова кислота), 1,25 (м, 1Н, камфорсульфонова кислота), 0,84 (с, 3Н, камфорсульфонова кислота), 0,64 (с, 3Н, камфорсульфонова кислота). Із використанням способів, аналогічних до описаних вище (приклади 3-11) було охарактеризовано кілька інших сольових форм. Результати одержання таких сполук наведені в прикладах 12-14. Приклад 12 Синтез сульфатної солі (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксаміду 1 Сульфатну сіль осаджували із суміші ізопропілацетату і води. Т.пл. 278С. Н ЯМР (400 МГц, ДМСО-d6) 9,28 (широкий с, 1Н, амід), 8,56 (дд, 1H), 8,24 (т, 1H), 7,77 (д, 1H), 7,74 (д, 1H), 7,60 24 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 (с, 1H), 7,40 (м, 2H), 7,35 (с, 1H), 7,21 (м, 1H), 4,21 (м, 1H), 3,93 (м, 2H), 3,10-3,60 (м, 5H), 2,05 (м, 3H), 1,92 (м, 1H), 1,73 (м, 1H). Приклад 13 Синтез кетоглутаратної солі (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксаміду 1 -Кетоглутаратну сіль осаджували з ізопропілацетату. Т.пл. 177С. Н ЯМР (400 МГц, ДМСОd6) 8,64 (с, 1Н, амід), 8,50 (д, 1H), 8,20 (д, 1H), 7,74 (д, 1H), 7,70 (д, 1H), 7,60 (м, 1H), 7,45 (м, 1H), 7,32 (м, 2H), 7,18 (м, 1H), 4,10 (м, 1H), 3,78 (м, 2H), 3,00-3,45 (м, 5H), 2,81 (м, 2H, кетоглутарова кислота), 2,41 (м, 2H, кетоглутарова кислота), 1,96 (м, 3H), 1,83 (м, 1H), 1,60 (м, 1H). Приклад 14 Синтез гіпуратної солі (2S,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксаміду Гіпуратну сіль осаджували з ацетону (занадто гігроскопічна для одержання температури 1 плавлення). Н ЯМР (400 МГц, ДМСО-d6) 8,79 (с, 1Н, амід), 8,56 (д, 1Н), 8,44 (с, 1Н, гіпурова кислота), 8,29 (м, 1Н), 7,87 (м, 2Н, гіпурова кислота), 7,76 (д, 1Н), 7,65 (м, 1Н), 7,54 (м, 1Н), 7,49 (м, 4Н, включає гіпурову кислоту), 7,34 (м, 2Н), 7,21 (м, 1Н), 3,91 (м, 1Н), 3,74 (м, 2Н), 3,00-3,50 (м, 5Н), 2,80 (м, 2Н, гіпурова кислота), 1,79 (м, 2Н), 1,60 (м, 2Н), 1,30 (м, 1Н). Приклад 15 Виділення (2R,3R)і (2S,3S)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксаміду і перетворення в солі галактарової кислоти Зразок надосадової рідини з досліду по виділенню п-толуолсульфонату (2S,3R)-N-(2-((3піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксаміду (приклад 2) концентрували шляхом упарювання на роторному випарнику, доводили до рН 10 за допомогою 10% водного гідроксиду натрію і екстрагували дихлорметаном. Дихлорметановий екстракт упарювали і залишок (1,8 г) розчиняли в абсолютному етанолі (55 мл), що містить 0,5% ди-нбутиламіну. Цей розчин впорскували порціями по 0,25 мл на 25 см 2,1 см колонку Chiralpak® AD хіральної ВЕРХ, елююючи сумішшю 60:40:0,2 гексан/етанол/ ди-н-бутиламін (швидкість потоку = 30 мл/хв), проводячи моніторинг при 270 нм. Виділення елюенту, елюйованого при 7,5 хвилини, і потім елюювання при 13,5 хвилини давало після упарювання розчинника 0,48 г (98% хіральна чистота) і 0,47 г (99% хіральна чистота) відповідно безбарвного масла. Два спектри 1 ЯМР були однаковими. Н ЯМР (300 МГц, CDCl3) 8,49 (с, 1H), 8,45 (д, 1H), 7,74 (д, 1H), 7,52 (м, 4H), 7,35 (т, 1H), 7,20 (дд, 1H), 7,05 (д, 1H), 4,55 (дт, 1H), 3,43 (м, 1H), 3,22 (м, 1H), 2,90 (м, 5H), 2,09 (м, 1H), 1,88 (м,4H). Теплий розчин кожного зі зразків вільної основи в абсолютному етанолі (10 мл) обробляли одним еквівалентом галактарової кислоти. Одержані суміші нагрівали при 75С протягом 5 хвилин і охолоджували при перемішуванні до температури навколишнього середовища. Одержані тверді речовини збирали фільтруванням із відсмоктуванням осаду у вакуумі і сушили у вакуумі, одержуючи 0,65 г (вихід 87%) і 0,62 г (вихід 85%) відповідно білої гранульованої 1 твердої речовини (т.пл. 200-205С у кожному випадку). Н ЯМР (300 МГц, D2O) 8,38 (с, 1H), 8,28 (д, 1H), 7,94 (д, 1H), 7,70 (д, 1H), 7,59 (д, 1H), 7,48 (т, 1H), 7,40 (м, 1H), 7,32 (м, 2H), 4,42 (м, 1H), 4,21 (с, 2H), 3,87 (с, 2H), 3,68 (м, 1H), 3,35 (м, 6H), 2,25 (м, 2H), 2,02 (м, 3H). Приклад 16 Синтез п-хлорбензоатної солі (2R,3R)-N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксаміду Тверду п-хлорбензойну кислоту (46,8 мг, 0,299 ммоль) додавали у вигляді однієї порції до розчину раніше виділеного ізомеру N-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3ил)бензофуран-2-карбоксаміду із прикладу 15 (108 мг, 0,299 ммоль) в ацетоні (10 мл). Цю суміш нагрівали майже при кипінні зі зворотним холодильником протягом 30 хвилин і охолоджували до температури навколишнього середовища. Осад не утворювався, тому розчин концентрували приблизно до 20% від його початкового об’єму (гаряча чашка), у цей момент починали утворюватися кристали. Суміш охолоджували і розводили ізопропанолом (2 мл). Дану суміш концентрували шляхом повільного упарювання розчинника при температурі навколишнього середовища і одержану тверду речовину збирали і сушили. Даний продукт, 145 мг (вихід 94%) 1 являв собою ясно-жовті кристали, т.пл. 150-152С. H ЯМР (300 МГц, CDCl3) 8,49 (с, 1H), 8,38 (д, 1H), 7,93 (д, 2H, п-хлорбензойна кислота), 7,67 (м, 2H), 7,57 (д, 1H), 7,45 (м, 1H), 7,36 (д, 2H, п-хлорбензойна кислота), 7,30 (м, 1H), 7,27 (с, 1H), 7,16 (м, 1H), 7,00 (д, 1H, амід), 6,90 (широкий с, четвертинний амоній), 4,62 (м, 1H), 3,85 (дд, 1H), 3,36 (м, 1H), 2,95-3,25 (м, 5H), 2,16 (с, 1H), 1,70-2,10 (м, 4H). 25 UA 100026 C2 5 10 15 20 25 30 35 40 45 50 55 60 За даними рентгенодифракційного дослідження даного зразка його абсолютна стереохімія 2R,3R (див. фіг.11A і 11B). Відповідно, шляхом виключення, останній елюйований ізомер у прикладі 15 має абсолютну конфігурацію 2S,3S. Приклад 17 Хіральний хроматографічний метод аналізу стереоізомерів Створення хірального хроматографічного способу відділення чотирьох стереоізомерів, одного від іншого, вважалося дуже багатообіцяючим. Початкові спроби (із використанням рухомої фази гексан/ізопропанол/триетиламін) призводило до перекривання піків і меншій ніж оптимальна формі піків. Перехід від ізопропанолу до етанолу і від триетиламіну до ди-нбутиламіну поліпшив поділ і форму піка і скоротив час проходу. Подробиці способу наступні: Аналітичний стовпчик: Chiralpak® AD (2504,6 мм, 5 напівтемних) Рухома фаза: 60:40:0,2 гексани/етанол/ ди-н-бутиламін Об’єм, що впорскується: 10 мкл Швидкість потоку: 1,0 мл у хвилину Температура: 20С Детектування: УФ при 270 нм Загальний час проходу: 25 хвилин Порядок елюювання (час утримання): 2S,3R (5,3 хв); 2R,3S (7,3 хв); 2R3R (8,3 хв); 2S,3S (12,1 хв) Ілюстративна хроматограма стереоізомерних аналогів показана на фіг.12. Приклад 18 Рентгенодифракційний аналіз порошку (XRPD) Рентгенодифракційний аналіз порошку (XRPD) був проведений для декількох зразків описаних тут солей. Наведено характер розподілу піків для гідрохлоридної (фіг.13) і тозилатної (фіг.14) солей. Рентгенодифракційний аналіз порошку (XRPD) Піки на рентгенодифрактограмі порошку одержані на кожному з або на обох із двох приладів. У ряді випадків рентгенограми були одержані на дифрактометрі Siemens D5000 із використанням CuK випромінювання (40 кВ, 40 мА), - гоніометр, V20 дивергенція і приймаючі щілини, графітовий вторинний монохроматор і сцинтиляційний лічильник. Роботу приладу перевіряли з використанням сертифікованого корундового стандарту (NIST 1976). Прохід зразків в умовах навколишнього середовища проводили на плоскій пластині для зразків із використанням порошків у тому вигляді, як вони були одержані. Приблизно 35 мг зразка обережно поміщали в порожнину, вирізану в полірованій силіконовій основі з нульовим фоном (510). Зразок обертали в його власній площині під час аналізу, скануючи від 2 до 42 із кроком з 0,05, із розрахунку 4 секунди на крок, з використанням CuK1 (=1,5406Å). У ряді випадків рентгенограми були одержані на дифрактометрі Bruker AXS C2 GADDS із використанням CuK випромінювання (40 кВ, 40 мА), автоматизована стадія XYZ, лазерний відеомікроскоп для автоподавання зразка і 2-мірні детектори площі HiStar. Оптика дифрактомера складається з одного багатошарового дзеркала Гебеля, з’єднаного з коліматором із точковою апертурою в 0,3 мм. Дивергенція променя (тобто ефективний розмір рентгенівського пучка на зразку) становила приблизно 4 мм. Використовували безперервний режим сканування - з відстанню зразок-детектор, що дорівнює 20 см, що давало ефективний діапазон 2 в 3,2-30,0. Звичайно зразок піддавали впливу рентгенівського променя протягом 120 секунд. Прохід зразків в умовах навколишнього середовища проводили на плоскій пластині для зразків із використанням порошків у тому вигляді, як вони були одержані без подрібнювання. Приблизно 1-2 мг зразка злегка спресовували на силіконовій основі для одержання плоскої поверхні. Зразки для проведення експерименту не в умовах навколишнього середовища встановлювали на силіконовій основі з використанням теплопровідної сполуки. Зразок потім нагрівали до придатної температури зі швидкістю приблизно 10С/хв і потім витримували в ізотермічних умовах протягом приблизно 5 хвилин перед початком збору даних. Диференціальна скануюча калориметрія (ДСК) Дані ДСК одержували на приладах TA Q1000, обладнаних автоматичним пристроєм для подачі зразка на 50 положень. Прилад був відкалібрований для калібрування енергії і температури з використанням сертифікованого індію. Звичайно 0,5-1,5 мг кожного зразка в алюмінієвій чашці з отворами під штифт нагрівали зі швидкістю 10С/хв від 25С до 175-200С. Над зразками підтримували струм азоту зі швидкістю 30 мл/хв. Термогравіметричний аналіз (ТГА) Дані ТГА одержували на приладі TA Q500 (TGA), обладнаному автоматичним пристроєм для подачі зразка на 16 положень. Прилад був температурно відкалібрований із використанням 26 UA 100026 C2 5 10 15 20 25 30 35 40 45 сертифікованого алюмелю. Звичайно 5-10 мг кожного зразка завантажували в попередньо зважені платиновий тигель і алюмінієву чашку для ДСК і нагрівали зі швидкістю 10С/хв від температури навколишнього середовища до 350С. Над зразками підтримували струм азоту зі швидкістю 60 мл/хв. Мікроскопія в поляризованому світлі (МПС) Зразки досліджували в поляризованому світлі на мікроскопі Leica LM/DM із цифровою відеокамерою для фіксації зображення. Невелику кількість кожного зразка поміщали на покривне скло в імерсійній олії і покривали покривним склом, окремі частинки відокремлювали один від одного наскільки це можливо. Зразки дивилися при придатному збільшенні в частково поляризованому світлі, з’єднаному з спектрозональним фільтром. Високотемпературна мікроскопія Високотемпературну мікроскопію проводили з використанням мікроскопа Leica LM/DM у поляризованому світлі, з’єднаному з гарячою пластиною Mettler-Toledo MTFP82HT і цифровою відеокамерою для фіксації зображення. Невелику кількість кожного зразка поміщали на покривне скло та окремі частинки відокремлювали один від одного наскільки це можливо. Зразки дивилися при придатному збільшенні в частково поляризованому світлі, з’єднаному з спектрозональним фільтром, у міру його нагрівання від температури навколишнього середовища зі швидкістю звичайно в 10С/хв. Гравіметрична сорбція пари (ГСП) Сорбційні ізотерми визначали на будь-якому із двох або на обох приладах. Ряд експериментів проводили з використанням аналізатора сорбції вологи VTI Corporation SGA-100, контрольованого програмним забезпеченням VTI FlowSystem 4. Температуру зразка підтримували при 25С за допомогою постійної термостатної бані Polyscience. Вологість контролювали шляхом змішування потоків сухого і вологого азоту. Зміни маси як функцію % відносної вологості (ВВ) контролювали з використанням цифрового записуючого пристрою Cahn Digital Recording Balance D200 з точністю +/- 0,0001 г. Звичайно зразки в 10-20 мг поміщали на врівноважену чашку ваг в умовах навколишнього середовища. Зразок сушили при 50С протягом 1 години. Стандартну ізотерму адсорбції одержували при 25С із 5% інтервалами ВВ у діапазоні 5-95% ВВ й ізотерму десорбції аналогічно одержували при 25С з 5% інтервалами ВВ у діапазоні 95-5% ВВ. Критерій зрівноважування зразка включав 0,0100% мас. протягом 5 хвилин при максимальному часі настання рівноваги в 180 хвилин для кожної точки % ВВ. Деякі сорбційні ізотерми одержані з використанням сорбційного аналізатора вологи Hiden IGASorp, контрольованого програмним забезпеченням CFRSorp. Температуру зразка підтримували при 25С з використанням рециркулюючої водяної бані Хубера. Вологість контролювали шляхом змішування потоків сухого і вологого азоту, при загальній швидкості потоку в 250 мл/хв. Відносну вологість вимірювали за допомогою каліброваного зонда Vaisala RH (динамічний діапазон 0-95% ВВ), розташованого поруч зі зразком. Зміни маси, (релаксацію маси) зразка як функцію % ВВ постійно контролювали за допомогою мікробалансу (точність (0,001 мг). Звичайно 10-20 мг зразка поміщали в урівноважений кошик із комірками з нержавіючої сталі в умовах навколишнього середовища. Зразок завантажували і вивантажували при 40% ВВ і 25С (типові умови навколишнього середовища). Ізотерму сорбції вологи одержували, як коротко описано нижче (2 скана давали 1 повний цикл). Стандартну ізотерму одержували при 25С з інтервалами в 10% ВВ у діапазоні 0-90% ВВ. Узагальнені параметри способу ГСП Параметри Адсорбція – скан 1 Десорбція/адсорбція – скан 2 Інтервали (% ВВ) Кількість сканів Швидкість потоку (мл/хв) Температура (С) Стабільність (С/хв) Мінімальний час сорбції (години) Максимальний час сорбції (години) Режим Точність (%) Значення 40-90 85 – сухий, сухий – 40 10 2 250 25 0,05 1 4 AF2 98 27 UA 100026 C2 5 10 15 20 У програмному забезпеченні використаний метод мінімізації найменших квадратів разом із моделлю релаксації маси. Вимірювана величина релаксації маси повинна бути в межах 5% від тієї, котра прогнозована з використанням програмного забезпечення, перед вибором наступного значення в % ВВ. Мінімальний час зрівноважування встановлювали в 1 годину, а максимальний – у 4 години. Звичайно зразки після завершення одержання ізотерми повторно аналізували методом рентгенодифракційного аналізу порошку (XRPD). Визначення води за Карлом Фішером Вміст води в кожному зразку вимірювали на кулонометрі Mettler Toledo DL39 із використанням реагенту Hydranal Coulomat AG і аргонового насоса. Зважені зразки твердої речовини вводили в посудину на платиновій чашці для ТГА, яку з’єднували з гумової септою для виключення доступу води. Використовували приблизно 10 мг зразки на титрування і проводили визначення у дворазовій повторності. Визначення термодинамічної водної розчинності методом ВЕРХ Водну розчинність визначали шляхом суспендування достатньої кількості сполуки в 0,25 мл води для одержання максимальної кінцевої концентрації 10 мг/мл вихідної вільної форми сполуки. Суспензію врівноважували при 25С протягом 24 годин і потім вимірювали рН. Суспензію фільтрували через скляний пористий фільтр С у 96-ямкові планшети. Фільтрат потім розводили з фактором 101. Кількісну оцінку проводили за допомогою ВЕРХ із посиланням на стандартний розчин із концентрацією приблизно 0,1 мг/мл у ДМСО. Проводили упорскування стандарту, розведеного і нерозбавленого розчину зразка. Розчинність розраховували з використанням площ піків, визначених шляхом інтегрування піка, виявленого при тому ж часі утримування, що і основний пік при упорскуванні стандарту. Якщо була достатня кількість твердої речовини на чашці фільтра, то одержували дані порошкової дифрактометрії (XRPD) Загальні подробиці способу для визначення термодинамічної водної розчинності 25 Тип способу Стовпчик Температура колонки (С): Упорскування (мкл): Детектування: Довжина хвилі, ширина смуги (нм): Швидкість потоку (мл/хв): Фаза А: Фаза В: Часова діаграма 30 Обернена фаза із градієнтним елююванням Phenomenex Luna, C18(2) 5 мкм, 504,6 мм 25 5, 8 і 50 260, 80 2 0,1% ТФОК у воді 0,085% ТФОК в ацетонітрилі Час (хв) % Фаза А % Фаза В 0,0 95 5 1,0 80 20 2,3 5 95 3,3 5 95 3,5 95 5 4,4 95 5 Визначення хімічної чистоти методом ВЕРХ Аналіз на чистоту проводили на системі серії Agilent HP1100, обладнаній детектором з діодною матрицею, і за допомогою програмного забезпечення ChemStation. Використовували один із двох способів, детально описаних нижче. Спосіб 1 Тип способу Колонка Температура колонки (С): Упорскування (мкл): Детектування: Довжина хвилі, ширина смуги (нм): Швидкість потоку (мл/хв): Фаза А: Обернена фаза із градієнтним елююванням Kromasil 5 мкм C18, 1504,6 мм 26 10 302, 8 1,0 0,0256 M KH2PO4 + 0,02 M Na сіль 1-гексансульфонової кислоти 28
ДивитисяДодаткова інформація
Назва патенту англійською(2s,3r)-n-(2-((3-pyridinyl)methyl)-1-azabicyclo[2.2.2]oct-3-yl)benzofuran-2-carboxamide and salt forms thereof
Автори англійськоюBencherif, Merouane, Benson, Lisa, Dull, Gary Maurice, Fedorov, Nikolai, Gatto Gregory J., Genus, John, Jordan, Kristen G., Mathew, Jacob, Mazurov, Anatoly A., Miao, Lan, Munoz, Julio A., Pfeiffer, Inigo, Pfeiffer, Sondra, Phillips, Teresa Y.
Назва патенту російською(2s,3r)-n-(2-((3-пиридинил)метил)-1-азабицикло[2.2.2]окт-3-ил)бензофуран-2-карбоксамид и его солевые формы
Автори російськоюБеншериф Меруан, Бенсон Лайза, Далл Гари Морис, Федоров Николай, Гатто Грегори Дж., Дженус Джон, Джордан Кристен Г., Метью Джейкоб, Мазуров Анатолий А., Мяо Лань, Муньос Хулио А., Пфайффер Иниго, Пфайффер Сондра, Филлипс Тереза И.
МПК / Мітки
МПК: A61P 25/00, A61P 29/00, A61P 25/22, A61P 25/28, A61P 35/00, A61P 25/14, A61P 25/16, A61P 25/24, A61P 25/02, A61K 31/4545, A61P 43/00, A61P 25/18
Мітки: 2s,3r)-n-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксамід, форми, сольові
Код посилання
<a href="https://ua.patents.su/46-100026-2s3r-n-2-3-piridinilmetil-1-azabiciklo222okt-3-ilbenzofuran-2-karboksamid-ta-jjogo-solovi-formi.html" target="_blank" rel="follow" title="База патентів України">(2s,3r)-n-(2-((3-піридиніл)метил)-1-азабіцикло[2.2.2]окт-3-ил)бензофуран-2-карбоксамід та його сольові форми</a>
Попередній патент: Спосіб виготовлення каталізатора синтезу вуглеводнів та використання його в процесі синтезу вуглеводнів
Наступний патент: Розподільний пристрій низької, середньої або високої напруги, який має короткозамикальну систему
Випадковий патент: Спосіб комбінованого удобрення ґрунту і деструкції рослинних решток