Похідні піролідиноксадіазолу та піролідинтіадіазолу, фармацевтична композиція на їх основі, спосіб їх одержання (варіанти)
Номер патенту: 75145
Опубліковано: 15.03.2006
Автори: Томас Рассел, Шварц Маттіас, Куаттропані Анна, Паж Патрік, Помель Венсан
Формула / Реферат
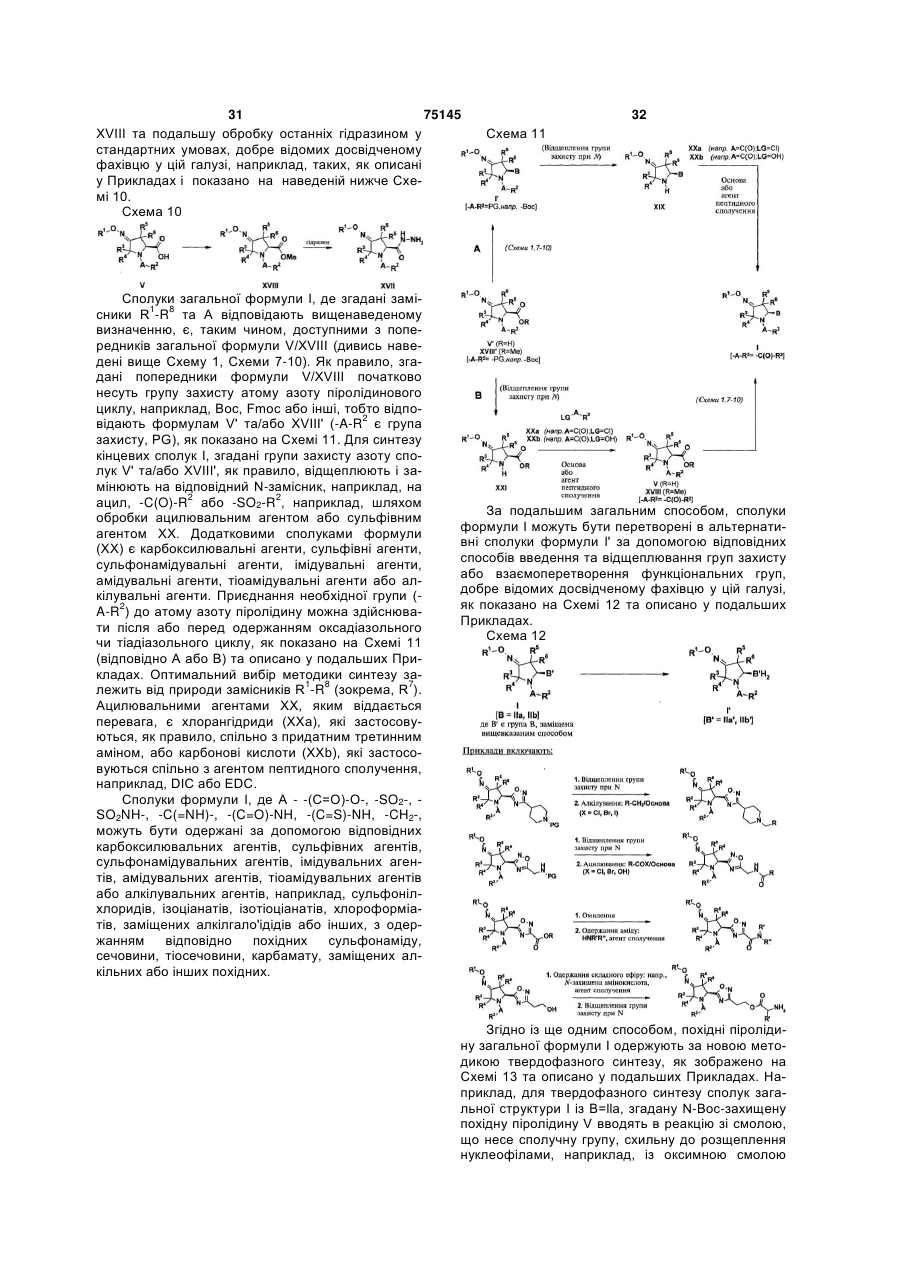
1. Сполуки формули I:
 ,
,
а також їх геометричні ізомери, оптично активні форми, наприклад енантіомери, діастереомери та рацемічні форми, а також їх фармацевтично прийнятні солі, де:
A вибраний з групи, яка складається з -(C=O)-, -(C=O)-O-, -SO2-, -SO2NH-, -CH2-;
B - оксадіазольний або тіадіазольний цикл;
R1 вибраний з групи, яка включає C1-C6-алкіл, C2-C6-алкеніл, C2-C6-алкініл, арил, гетероарил, C1-C6 алкіларил, C1-C6 алкілгетероарил, R1 може утворювати з атомом O, до якого він приєднаний, 3-8-членний насичений або ненасичений гетероцикл, який може містити 1-2 додаткових гетероатоми, вибрані з N, S та O, та який є факультативно конденсованим з арилом, гетероарилом або 3-8-членним насиченим або ненасиченим циклоалкілом;
R2 вибраний з групи, яка включає C1-C6-алкіл, C2-C6-алкеніл, C2-C6-алкініл, арил, гетероарил, гетероарилалкіл, 3-8-членний циклоалкіл, ацил, C1-C6-алкіларил, C1-C6-алкілгетероарил, де згадані циклоалкільні або арильні чи гетероарильні групи можуть бути конденсовані з 1-2 додатковими циклоалкільними або арильними чи гетероарильними групами;
R3, R4, R5 і R6 незалежно один від одного вибрані з групи, яка складається з водню, галоїду, C1-C6-алкілу або C1-C6-алкоксигрупи.
2. Сполука за п. 1, де R1 вибраний з групи, яка включає H або -C1-C6 алкіл, зокрема -CH3.
3. Сполука за п. 1 або п. 2, де A є -(C=O)-.
4. Сполука за будь-яким із попередніх пунктів, де R2 є арильна або гетероарильна група.
5. Сполука за п. 4, де R2 є фенільна група.
6. Сполука за п. 5, де згадана фенільна група заміщена фенільною групою.
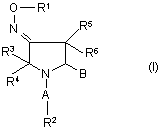
7. Сполука за будь-яким з попередніх пунктів, де B є оксадіазол формули IIa або IIb:
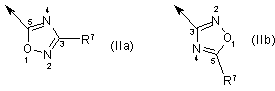 ,
,
де R7 вибраний з групи, яка включає водень, сульфоніл, аміногрупу, C1-C6-алкіл, C2-C6-алкеніл, C2-C6-алкініл, де згадані алкільний, алкенільний, алкінільний ланцюги можуть бути перервані гетероатомом, вибраним з N, O або S, арил, гетероарил, насичений або ненасичений 3-8-членний циклоалкіл, гетероциклоалкіл, де згадані циклоалкіл, гетероциклоалкіл, арильна чи гетероарильна групи можуть бути конденсовані з 1-2 додатковими циклоалкільними, гетероциклоалкільними, арильними або гетероарильними групами, ацильним фрагментом, C1-C6-алкіларилом, C1-C6-алкілгетероарилом, C1-C6-алкеніларилом, C1-C6-алкенілгетероарилом, C1-C6-алкініларилом, C1-C6-алкінілгетероарилом, C1-C6-алкілциклоалкілом, C1-C6-алкілгетероциклоалкілом, C1-C6-алкенілциклоалкілом, C1-C6-алкенілгетероциклоалкілом, C1-C6-алкінілциклоалкілом, C1-C6-алкінілгетероциклоалкілом, алкоксикарбонілом, амінокарбонілом, C1-C6-алкілкарбоксигрупою, C1-C6-алкілацильною групою, арилацильною групою, гетероарилацильною групою, C3-C8-(гетеро)циклоалкілацильною групою, C1-C6-алкілацилоксигрупою, C1-C6-алкілалкоксигрупою, C1-C6-алкілалкоксикарбонілом, C1-C6-алкіламінокарбонілом, C1-C6-алкілациламіногрупою, ациламіногрупою, C1-C6-алкілуреїдогрупою, C1-C6-алкілкарбаматом, C1-C6-алкіламіногрупою, C1-C6-алкіламонієм, C1-C6-алкілсульфонілоксигрупою, C1-C6-алкілсульфонілом, C1-C6-алкілсульфінілом, C1-C6-алкілсульфанілом, C1-C6-алкілсульфоніламіногрупою, C1-C6-алкіламіносульфонілом, гідроксильною групою або галоїдом.
8. Сполука за п. 7, де R7 вибраний з групи, яка включає сульфонільний чи амінний фрагмент або C1-C6-алкіл, C2-C6-алкеніл, C2-C6-алкініл, арил, гетероарил, 3-8-членний циклоалкіл, що факультативно містять щонайменше один гетероатом, вибраний з N, O, S, C1-C6-алкіларил, C1-C6-алкілгетероарил, C1-C6-алкеніларил, C1-C6-алкенілгетероарил, алкоксикарбоніл, амід карбонової кислоти, C1-C6-алкілкарбоніл, арилкарбоніл або гетероарилкарбоніл, C4-C8-циклоалкілкарбоніл, де згадані групи заміщені щонайменше однією сульфонільною або аміногрупою.
9. Сполука за п. 8, де R7 вибраний з групи, яка включає C1-C6-алкіламіногрупу, гетероциклоалкіл, C1-C6-алкілгетероциклоалкіл, амінокарбоніл, C1-C6-алкіламінокарбоніл, C1-C6-алкілациламіногрупу, C1-C6-алкілсульфоніл або C1-C6-алкіл.
10. Сполука за п. 9, де R7 вибраний з групи, яка включає диметиламінометил, 2-(диметиламіно)етил, 1-метил-3-піперидиніл або 4-(ацетил-1-піперазиніл)метил.
11. Сполука за будь-яким із пп. 1-10, де B є ізоксадіазол формули III чи IV:
 ,
,
де X є O або S;
R8 є водень, C1-C6-алкіл, C2-C6-алкеніл, C2-C6-алкініл, арил, гетероарил, насичений або ненасичений 3-8-членний циклоалкіл, який факультативно містить 1-3 гетероатоми, вибрані з N, O, S, ацил, C1-C6-алкіларил, C1-C6-алкілгетероарил, C1-C6-алкеніларил, C1-C6-алкенілгетероарил, алкоксикарбоніл, карбоксиламід, C1-C6-алкоксигрупа, арилоксигрупа, гетероарилоксигрупа, галоїд, ціан, C1-C6-алкілкарбоніл, арилкарбоніл або гетероарилкарбоніл, насичений або ненасичений C4-C8-циклоалкілкарбоніл, де згадані циклоалкіл або арил чи гетероарил можуть бути конденсовані з 1-2 додатковими циклоалкілами або арилами чи гетероарилами і де згаданий алкільний, алкенільний, алкінільний ланцюги можуть бути перервані гетероатомом, вибраним з N, O або S.
12. Сполука за будь-яким із попередніх пунктів, де кожний з R3, R4, R5 та R6 є H.
13. Сполука за будь-яким із попередніх пунктів, де A є -(C=O)-, R1 є метил, R2 є біфенільна група, кожний з R3, R4, R5 та R6 є H, і B є оксадіазольним циклом формули IIa, IIb, III чи IV.
14. Сполука за п. 13, де B є оксадіазольним циклом формули IIa чи IIb.
15. Сполука за будь-яким із попередніх пунктів, вибрана з поданого нижче переліку:
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону O-метилоксим;
(3EZ,5S)-1-(2'-метил[1,1'-біфеніл]-4-іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(1,3,4-оксадіазол-2-іл)-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(5-тіоксо-4,5-дигідро-1,3,4-оксадіазол-2-іл)-3-піролідинону О-метилоксим;
(3EZ,5S)-5-(3-бензил-1,2,4-оксадіазол-5-іл)-1-([1,1'-біфеніл]-4-ілкарбоніл)-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(3-{[(2-фурилметил)сульфаніл]метил}-1,2,4-оксадіазол-5-іл)-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3-[2-оксо-2-(1-піролідиніл)етил]-1,2,4-оксадіазол-5-іл}-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3-[(2-піридинілсульфаніл)метил]-1,2,4-оксадіазол-5-іл}-3-піролідинону О-метидоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл] -3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3-[(2-тієнілсульфаніл)метил]-1,2,4-оксадіазол-5-іл}-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3-[2-(3,5-диметил-1Н-піразол-1-іл)етил]-1,2,4-оксадіазол-5-іл}-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3-[(метилсульфоніл)метил]-1,2,4-оксадіазол-5-іл}-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(5-метил-3-ізоксазоліл)-1,2,4-оксадіазол-5-іл]-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(2-тієнілметил)-1,2,4-оксадіазол-5-іл]-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(3-феніл-1,2,4-оксадіазол-5-іл)-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(3-{[(2-фурилметил)сульфоніл]метил}-1,2,4-оксадіазол-5-іл)-3-піролідинону О-метилоксим;
(3EZ,5S)-5-[3-(амінометил)-1,2,4-оксадіазол-5-іл]-1-([1,1'-біфеніл]-4-ілкарбоніл)-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3-[(RS)-гідрокси(феніл)метил]-1,2,4-оксадіазол-5-іл}-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3-[(1RS)-1-гідроксипропіл]-1,2,4-оксадіазол-5-іл}-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(гідроксиметил)-1,2,4-оксадіазол-5-іл]-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3-[(1S,2R)-2-гідроксициклогексил]-1,2,4-оксадіазол-5-іл}-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(2-гідроксіетил)-1,2,4-оксадіазол-5-іл]-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(4-піперидиніл)-1,2,4-оксадіазол-5-іл]-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3-[(3RS)-піперидиніл]-1,2,4-оксадіазол-5-іл}-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3-[(2RS)-піперидиніл]-1,2,4-оксадіазол-5-іл}-3-піролідинону О-метилоксим;
(3EZ,5S)-1-[(2'-хлор[1,1'-біфеніл]-4-іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону О-метилоксим;
(3EZ,5S)-5-(3-метил-1,2,4-оксадіазол-5-іл)-1-{[2'-(трифторметил)[1,1'-біфеніл]-4-іл]карбоніл}-3-піролідинону О-метилоксим;
(3EZ,5S)-1-[(2'-фтор[1,1'-біфеніл]-4-іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону О-метилоксим;
(3EZ,5S)-1-[(4'-фтор[1,1'-біфеніл]-4-іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(1,2,4-оксадіазол-3-іл)-3-піролідинону О-метилоксим;
(3EZ,5S)-1-[(2'-фтор[1,1'-біфеніл]-4-іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону О-метилоксим;
(3EZ,5S)-1-[(2'-метил[1,1'-біфеніл]-4-іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону О-метилоксим;
(3EZ,5S)-1-[(2'-метил[1,1'-біфеніл]-4-іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(феноксиметил)-1,2,4-оксадіазол-3-іл] -3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(5-феніл-1,2,4-оксадіазол-3-іл)-3-піролідинону О-метилоксим;
N-({3-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4-оксадіазол-5-іл}метил)ацетамід;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[4-(гідроксиметил)феніл]-1,2,4-оксадіазол-3-іл}-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(2-гідроксіетил)-1,2,4-оксадіазол-3-іл]-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(2S)-2-гідрокси-2-фенілетил]-1,2,4-оксадіазол-3-іл}-3-піролідинону О-метилоксим;
{3-[2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4-оксадіазол-5-іл}метилформамід;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(метоксиметил)-1,2,4-оксадіазол-3-іл]-3-піролідинону О-метилоксим;
(3EZ,5S)-l-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(2-феноксіетил)-1,2,4-оксадіазол-3-іл]-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(2-метоксіетил)-1,2,4-оксадіазол-3-іл]-3-піролідинону О-метилоксим;
(3EZ,5S)-5-[5-(1-ацетил-4-піперидиніл)-1,2,4-оксадіазол-3-іл]-1-([1,1'-біфеніл]-4-ілкарбоніл)-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(2-піридиніл)-1,2,4-оксадіазол-3-іл]-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(3-тієніл)-1,2,4-оксадіазол-3-іл]-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(5-етил-1,2,4-оксадіазол-3-іл)-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(5-циклопентил-1,2,4-оксадіазол-3-іл)-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(5-метил-1,2,4-оксадіазол-3-іл)-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(RS)-гідрокси(феніл)метил]-1,2,4-оксадіазол-3-іл}-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(1RS)-1-гідрокси-2-фенілетил]-1,2,4-оксадіазол-3-іл}-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(1R)-1-(диметиламіно)-2-фенілетил]-1,2,4-оксадіазол-3-іл}-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(3-піридиніл)-1,2,4-оксадіазол-3-іл]-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(4-піридиніл)-1,2,4-оксадіазол-3-іл]-3-піролідинону О-метилоксим;
(3EZ,5S)-5-{5-[(4-ацетил-1-піперазиніл)метил]-1,2,4-оксадіазол-3-іл}-1-([1,1'-біфеніл]-4-ілкарбоніл)-3-піролідинону О-метилоксим;
(3EZ,5S)-5-[3-(1-ацетил-4-піперилиніл)-1,2,4-оксадіазол-5-іл]-1-([1,1'-біфеніл]-4-ілкарбоніл)-3-піролідинону О-метилоксим;
(3EZ,5S)-5-{5-[(4-ацетил-1-піперазиніл)метил]-1,2,4-оксадіазол-3-іл}-1-([1,1'-біфеніл]-4-ілкарбоніл)-3-піролідинону О-метилоксим;
N-({3-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4-оксадіазол-5-іл}метил)-3-(1-піперидиніл)пропанамід;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(3S)-1-метилпіперидиніл]-1,2,4-оксадіазол-3-іл}-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(3R)-1-метилпіперидиніл]-1,2,4-оксадіазол-3-іл}-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(6-гідрокси-3-піридиніл)-1,2,4-оксадіазол-3-іл]-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(диметиламіно)метил]-1,2,4-оксадіазол-3-іл}-3-піролідинону О-метилоксим;
(3EZ,5S)-5-{5-[(1S,2R)-1-аміно-2-гідроксипропіл]-1,2,4-оксадіазол-3-іл}-1-([1,1'-біфеніл]-4-ілкарбоніл)-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(3S)-піперидиніл]-1,2,4-оксадіазол-3-іл}-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(3R)-піперидиніл]-1,2,4-оксадіазол-3-іл}-3-піролідинону О-метилоксим;
(3EZ,5RS)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(1-метил-3-піперидиніл)-1,2,4-оксадіазол-3-іл]-3-піролідинону О-метилоксим;
трет-бутил-(3R)-3-{3-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4-(метоксііміно)-піролідиніл]-1,2,4-оксадіазол-5-іл}-1-піперидинкарбоксилат;
4-({3-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4-оксадіазол-5-іл}метил)-2,6-піперазиндіон;
(3Z,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(2-гідроксіетил)-1,2,4-оксадіазол-5-іл]-3-піролідинону О-метилоксим;
(3Z,5S)-1-[(2'-хлор-4'-фтор[1,1'-біфеніл]-4-іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(1-метил-4-піперидиніл)-1,2,4-оксадіазол-3-іл]-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(диметиламіно)метил]-1,2,4-оксадіазол-3-іл}-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(1-метил-4-піперидиніл)-1,2,4-оксадіазол-5-іл]-3-піролідинону О-метилоксим;
(3EZ,5S)-5-{5-[(1S)-1-аміно-2-гідроксіетил]-1,2,4-оксадіазол-3-іл}-1-([1,1'-біфеніл]-4-ілкарбоніл)-3-піролідинону О-метилоксим;
5-[(2S,4E)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4-(метоксііміно)піролідиніл]-H-[3-(диметиламіно)пропіл]-1,2,4-оксадіазол-3-карбоксамід;
(3E,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(диметиламіно)метил]-1,2,4-оксадіазол-3-іл}-3-піролідинону О-метилоксим;
трет-бутил-(3S)-3-{3-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4-оксадіазол-5-іл}-1-піперидинкарбоксилат;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(4-метил-1-піперазиніл)метил]-1,2,4-оксадіазол-3-іл}-3-піролідинону О-метилоксим;
(3Z,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(4-метил-1-піперазиніл)метил]-1,2,4-оксадіазол-3-іл}-3-піролідинону О-метилоксим;
етил-5-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4-оксадіазол-3-карбоксилат;
(3E,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(2-гідроксіетил)-1,2,4-оксадіазол-5-іл]-3-піролідинону О-метилоксим;
(3Z,5RS)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(2-гідроксіетил)-1,2,4-оксадіазол-5-іл]-3-піролідинону О-метилоксим;
N-({3-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4-оксадіазол-5-іл}метил)-3-(диметиламіно)пропанамід;
трет-бутил-4-(2-{3-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4-оксадіазол-5-іл}етил)-1-піперазинкарбоксилат;
(3EZ,5S)-1-[(2'-хлор-4'-фтор[1,1'-біфеніл]-4-іл)карбоніл]-5-[3-(2-гідроксіетил)-1,2,4-оксадіазол-5-іл]-3-піролідинону О-метилоксим;
(3EZ,5S)-1-[(4'-фтор-2'-метил[1,1'-біфеніл]-4-іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону О-метилоксим;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[2-(диметиламіно)етил]-1,2,4-оксадіазол-3-іл}-3-піролідинону О-метилоксим;
2-{5-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4-оксадіазол-3-іл}етил[(трет-бутоксикарбоніл)аміно]ацетат;
N-({3-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4-оксадіазол-5-іл}метил)-2-(диметиламіно)ацетамід;
(3EZ,5S)-1-[(2'-хлор-4'-фтор[1,1'-біфеніл]-4-іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону О-метилоксим;
(3EZ,5S)-5-{5-[(15)-1-аміно-2-трет-бутоксіетил]-1,2,4-оксадіазол-3-іл}-1-([1,1'-біфеніл]-4-ілкарбоніл)-3-піролідинону О-метилоксим;
трет-бутил-4-{5-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4-оксадіазол-3-іл}-1-піперидинкарбоксилат;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(1-піперазинілметил)-1,2,4-оксадіазол-3-іл]-3-піролідинону О-метилоксим;
трет-бутил-(4S)-4-{3-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4-(метоксііміно)-піролідиніл]-1,2,4-оксадіазол-5-іл}-4-[(трет-бутоксикарбоніл)аміно]бутаноат;
{[(2S,4EZ)-2-(5-{[(трет-бутоксикарбоніл)аміно]метил}-1,2,4-оксадіазол-3-іл)-4-(метоксііміно)піролідиніл]карбоніл}-1,1'-біфеніл;
трет-бутил-2-{3-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4-оксадіазол-5-іл}етилкарбамат;
2-{5-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4-оксадіазол-3-іл}етил аміноацетат;
(3E,5S)-1-[(2',4'-дифтор[1,1'-біфеніл]-4-іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону О-метилоксим;
(3EZ,5S)-1-[(2',4'-дифтор[1,1'-біфеніл]-4-іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону О-метилоксим;
4-{[(2S,4EZ)-2-(5-{(1S)-2-трет-бутокси-l-[(трет-бутоксикарбоніл)аміно]етил}-1,2,4-оксадіазол-3-іл)-4-(метоксііміно)піролідиніл]карбоніл}-1,1'-біфеніл;
(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(5-вініл-1,2,4-оксадіазол-3-іл)-3-піролідинону О-метилоксим;
4-{[(2S,4EZ)-2-(5-{(1S,2R)-2-трет-бутокси-1-[(трет-бутоксикарбоніл)аміно]пропіл}-1,2,4-оксадіазол-3-іл)-4-(метоксііміно)піролідиніл]карбоніл}-1,1'-біфеніл;
(3Z,5S)-1-[(2',4'-дифтор[1,1'-біфеніл]-4-іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону О-метилоксим;
трет-бутил-4-({3-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4-(метоксііміно)-піролідиніл]-1,2,4-оксадіазол-5-іл}метил)-1-піперазин-карбоксилат.
16. Сполука за будь-яким із пп. 1-15 для застосування як лікарського засобу.
17. Застосування сполуки за будь-яким із пп. 1-15 для одержання фармацевтичної композиції для лікування та/або профілактики передчасних пологів, передчасного народження життєздатного, але недоношеного плода, та дисменореї.
18. Застосування сполуки за будь-яким із пп. 1-15 для одержання фармацевтичної композиції для модулювання рецептора окситоцину.
19. Застосування за п. 18, де згадане модулювання полягає у блокуванні рецептора окситоцину або антагонізування зв’язування окситоцину з його рецептором.
20. Застосування за п. 19 для лікування або профілактики розладів, що опосередковуються рецептором окситоцину.
21. Застосування сполуки за будь-яким із пп. 1-15 для одержання фармацевтичної композиції для перорального введення.
22. Фармацевтична композиція, що містить щонайменше одну сполуку за будь-яким із пп. 1-15 та фармацевтично прийнятний носій, розріджувач або наповнювач.
23. Спосіб одержання сполуки піролідиноксадіазолу формули (I), де B – 1,2,4-оксадіазольна група формули (IIb), який включає таку стадію:
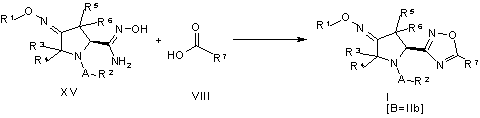 .
.
24. Спосіб одержання сполуки піролідиноксадіазолу формули (I), де B – 1,2,4-оксадіазольна група формули (IIа), який включає таку стадію:
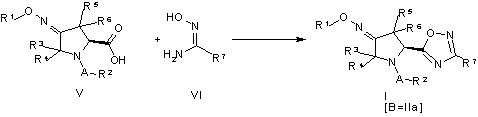 .
.
25. Спосіб одержання сполуки піролідиноксадіазолу формули (I), де B – 1,2,4-оксадіазольна група формули (III) або (IV), який включає будь-яку з таких стадій:
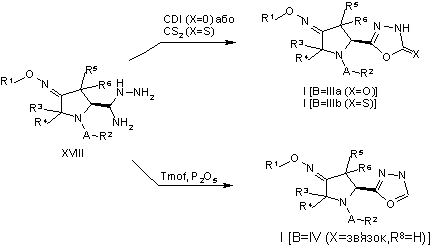 .
.
Текст
1. Сполуки формули I: C2 2 (13) 1 3 75145 4 алкінілциклоалкілом, C1-C612. Сполука за будь-яким із попередніх пунктів, де алкінілгетероциклоалкілом, алкоксикарбонілом, кожний з R3, R4, R5 та R6 є H. амінокарбонілом, C1-C6-алкілкарбоксигрупою, C113. Сполука за будь-яким із попередніх пунктів, де C6-алкілацильною групою, арилацильною групою, A є -(C=O)-, R1 є метил, R2 є біфенільна група, гетероарилацильною групою, C3-C8кожний з R3, R4, R5 та R6 є H, і B є оксадіазольним (гетеро)циклоалкілацильною групою, C1-C6циклом формули IIa, IIb, III чи IV. алкілацилоксигрупою, C1-C6-алкілалкоксигрупою, 14. Сполука за п. 13, де B є оксадіазольним цикC1-C6-алкілалкоксикарбонілом, C1-C6лом формули IIa чи IIb. алкіламінокарбонілом, C1-C615. Сполука за будь-яким із попередніх пунктів, алкілациламіногрупою, ациламіногрупою, C1-C6вибрана з поданого нижче переліку: алкілуреїдогрупою, C1-C6-алкілкарбаматом, C1-C6(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(3-метилалкіламіногрупою, C1-C6-алкіламонієм, C1-C61,2,4-оксадіазол-5-іл)-3-піролідинону Oалкілсульфонілоксигрупою, C1-C6метилоксим; алкілсульфонілом, C1-C6-алкілсульфінілом, C1-C6(3EZ,5S)-1-(2'-метил[1,1'-біфеніл]-4-іл)карбоніл]-5алкілсульфанілом, C1-C6(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону Оалкілсульфоніламіногрупою, C1-C6метилоксим; алкіламіносульфонілом, гідроксильною групою або (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(1,3,4галоїдом. оксадіазол-2-іл)-3-піролідинону О-метилоксим; 8. Сполука за п. 7, де R7 вибраний з групи, яка (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(3-метилвключає сульфонільний чи амінний фрагмент або 1,2,4-оксадіазол-5-іл)-3-піролідинону ОC1-C6-алкіл, C2-C6-алкеніл, C2-C6-алкініл, арил, метилоксим; гетероарил, 3-8-членний циклоалкіл, що факуль(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(5-тіоксотативно містять щонайменше один гетероатом, 4,5-дигідро-1,3,4-оксадіазол-2-іл)-3-піролідинону вибраний з N, O, S, C1-C6-алкіларил, C1-C6О-метилоксим; алкілгетероарил, C1-C6-алкеніларил, C1-C6(3EZ,5S)-5-(3-бензил-1,2,4-оксадіазол-5-іл)-1-([1,1'алкенілгетероарил, алкоксикарбоніл, амід карбобіфеніл]-4-ілкарбоніл)-3-піролідинону Онової кислоти, C1-C6-алкілкарбоніл, арилкарбоніл метилоксим; або гетероарилкарбоніл, C4-C8(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(3-{[(2циклоалкілкарбоніл, де згадані групи заміщені щофурилметил)сульфаніл]метил}-1,2,4-оксадіазол-5найменше однією сульфонільною або аміногруіл)-3-піролідинону О-метилоксим; пою. (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3-[29. Сполука за п. 8, де R7 вибраний з групи, яка оксо-2-(1-піролідиніл)етил]-1,2,4-оксадіазол-5-іл}-3включає C1-C6-алкіламіногрупу, гетероциклоалкіл, піролідинону О-метилоксим; C1-C6-алкілгетероциклоалкіл, амінокарбоніл, C1(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3-[(2C6-алкіламінокарбоніл, C1-C6-алкілациламіногрупу, піридинілсульфаніл)метил]-1,2,4-оксадіазол-5-іл}C1-C6-алкілсульфоніл або C1-C6-алкіл. 3-піролідинону О-метидоксим; 10. Сполука за п. 9, де R7 вибраний з групи, яка (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(4включає диметиламінометил, 2фторфеніл)-1,2,4-оксадіазол-5-іл] -3-піролідинону (диметиламіно)етил, 1-метил-3-піперидиніл або 4О-метилоксим; (ацетил-1-піперазиніл)метил. (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3-[(211. Сполука за будь-яким із пп. 1-10, де B є ізоксатієнілсульфаніл)метил]-1,2,4-оксадіазол-5-іл}-3діазол формули III чи IV: піролідинону О-метилоксим; HH (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3-[2-(3,53 3 диметил-1Н-піразол-1-іл)етил]-1,2,4-оксадіазол-5N N3 3 N N 4 4N 4 4 N (III) (III) N N іл}-3-піролідинону О-метилоксим; XX (IV(IV ) ) X X 2 2 2 2 5 5 5 5 (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{38 8 O O O O R R 1 1 1 1 [(метилсульфоніл)метил]-1,2,4-оксадіазол-5-іл}-3піролідинону О-метилоксим; (III) (IV) (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(5де X є O або S; метил-3-ізоксазоліл)-1,2,4-оксадіазол-5-іл]-3R8 є водень, C1-C6-алкіл, C2-C6-алкеніл, C2-C6піролідинону О-метилоксим; алкініл, арил, гетероарил, насичений або ненаси(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(2чений 3-8-членний циклоалкіл, який факультативтієнілметил)-1,2,4-оксадіазол-5-іл]-3-піролідинону но містить 1-3 гетероатоми, вибрані з N, O, S, О-метилоксим; ацил, C1-C6-алкіларил, C1-C6-алкілгетероарил, C1(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(3-фенілC6-алкеніларил, C1-C6-алкенілгетероарил, алкок1,2,4-оксадіазол-5-іл)-3-піролідинону Осикарбоніл, карбоксиламід, C1-C6-алкоксигрупа, метилоксим; арилоксигрупа, гетероарилоксигрупа, галоїд, ціан, (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(3-{[(2C1-C6-алкілкарбоніл, арилкарбоніл або гетероарифурилметил)сульфоніл]метил}-1,2,4-оксадіазол-5лкарбоніл, насичений або ненасичений C4-C8іл)-3-піролідинону О-метилоксим; циклоалкілкарбоніл, де згадані циклоалкіл або (3EZ,5S)-5-[3-(амінометил)-1,2,4-оксадіазол-5-іл]-1арил чи гетероарил можуть бути конденсовані з 1([1,1'-біфеніл]-4-ілкарбоніл)-3-піролідинону О2 додатковими циклоалкілами або арилами чи метилоксим; гетероарилами і де згаданий алкільний, алкеніль(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3-[(RS)ний, алкінільний ланцюги можуть бути перервані гідрокси(феніл)метил]-1,2,4-оксадіазол-5-іл}-3гетероатомом, вибраним з N, O або S. піролідинону О-метилоксим; 5 75145 6 (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3-[(1RS)(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[51-гідроксипропіл]-1,2,4-оксадіазол-5-іл}-3(метоксиметил)-1,2,4-оксадіазол-3-іл]-3піролідинону О-метилоксим; піролідинону О-метилоксим; (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3(3EZ,5S)-l-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(2(гідроксиметил)-1,2,4-оксадіазол-5-іл]-3феноксіетил)-1,2,4-оксадіазол-3-іл]-3-піролідинону піролідинону О-метилоксим; О-метилоксим; (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(2[(1S,2R)-2-гідроксициклогексил]-1,2,4-оксадіазол-5метоксіетил)-1,2,4-оксадіазол-3-іл]-3-піролідинону іл}-3-піролідинону О-метилоксим; О-метилоксим; (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(2(3EZ,5S)-5-[5-(1-ацетил-4-піперидиніл)-1,2,4гідроксіетил)-1,2,4-оксадіазол-5-іл]-3-піролідинону оксадіазол-3-іл]-1-([1,1'-біфеніл]-4-ілкарбоніл)-3О-метилоксим; піролідинону О-метилоксим; (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(4(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(2піперидиніл)-1,2,4-оксадіазол-5-іл]-3-піролідинону піридиніл)-1,2,4-оксадіазол-3-іл]-3-піролідинону ОО-метилоксим; метилоксим; (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3-[(3RS)(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(3піперидиніл]-1,2,4-оксадіазол-5-іл}-3-піролідинону тієніл)-1,2,4-оксадіазол-3-іл]-3-піролідинону ОО-метилоксим; метилоксим; (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3-[(2RS)(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(5-етилпіперидиніл]-1,2,4-оксадіазол-5-іл}-3-піролідинону 1,2,4-оксадіазол-3-іл)-3-піролідинону ОО-метилоксим; метилоксим; (3EZ,5S)-1-[(2'-хлор[1,1'-біфеніл]-4-іл)карбоніл]-5(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(5(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону Оциклопентил-1,2,4-оксадіазол-3-іл)-3-піролідинону метилоксим; О-метилоксим; (3EZ,5S)-5-(3-метил-1,2,4-оксадіазол-5-іл)-1-{[2'(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(5-метил(трифторметил)[1,1'-біфеніл]-4-іл]карбоніл}-31,2,4-оксадіазол-3-іл)-3-піролідинону Опіролідинону О-метилоксим; метилоксим; (3EZ,5S)-1-[(2'-фтор[1,1'-біфеніл]-4-іл)карбоніл]-5(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(RS)(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону Огідрокси(феніл)метил]-1,2,4-оксадіазол-3-іл}-3метилоксим; піролідинону О-метилоксим; (3EZ,5S)-1-[(4'-фтор[1,1'-біфеніл]-4-іл)карбоніл]-5(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(1RS)(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону О1-гідрокси-2-фенілетил]-1,2,4-оксадіазол-3-іл}-3метилоксим; піролідинону О-метилоксим; (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(1,2,4(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(1R)-1оксадіазол-3-іл)-3-піролідинону О-метилоксим; (диметиламіно)-2-фенілетил]-1,2,4-оксадіазол-3(3EZ,5S)-1-[(2'-фтор[1,1'-біфеніл]-4-іл)карбоніл]-5іл}-3-піролідинону О-метилоксим; (3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону О(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(3метилоксим; піридиніл)-1,2,4-оксадіазол-3-іл]-3-піролідинону О(3EZ,5S)-1-[(2'-метил[1,1'-біфеніл]-4-іл)карбоніл]-5метилоксим; (3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону О(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(4метилоксим; піридиніл)-1,2,4-оксадіазол-3-іл]-3-піролідинону О(3EZ,5S)-1-[(2'-метил[1,1'-біфеніл]-4-іл)карбоніл]-5метилоксим; (3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону О(3EZ,5S)-5-{5-[(4-ацетил-1-піперазиніл)метил]метилоксим; 1,2,4-оксадіазол-3-іл}-1-([1,1'-біфеніл]-4(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5ілкарбоніл)-3-піролідинону О-метилоксим; (феноксиметил)-1,2,4-оксадіазол-3-іл] -3(3EZ,5S)-5-[3-(1-ацетил-4-піперилиніл)-1,2,4піролідинону О-метилоксим; оксадіазол-5-іл]-1-([1,1'-біфеніл]-4-ілкарбоніл)-3(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(5-фенілпіролідинону О-метилоксим; 1,2,4-оксадіазол-3-іл)-3-піролідинону О(3EZ,5S)-5-{5-[(4-ацетил-1-піперазиніл)метил]метилоксим; 1,2,4-оксадіазол-3-іл}-1-([1,1'-біфеніл]-4N-({3-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4ілкарбоніл)-3-піролідинону О-метилоксим; (метоксііміно)піролідиніл]-1,2,4-оксадіазол-5N-({3-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4іл}метил)ацетамід; (метоксііміно)піролідиніл]-1,2,4-оксадіазол-5(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[4іл}метил)-3-(1-піперидиніл)пропанамід; (гідроксиметил)феніл]-1,2,4-оксадіазол-3-іл}-3(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(3S)-1піролідинону О-метилоксим; метилпіперидиніл]-1,2,4-оксадіазол-3-іл}-3(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(2піролідинону О-метилоксим; гідроксіетил)-1,2,4-оксадіазол-3-іл]-3-піролідинону (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(3R)-1О-метилоксим; метилпіперидиніл]-1,2,4-оксадіазол-3-іл}-3(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(2S)-2піролідинону О-метилоксим; гідрокси-2-фенілетил]-1,2,4-оксадіазол-3-іл}-3(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(6піролідинону О-метилоксим; гідрокси-3-піридиніл)-1,2,4-оксадіазол-3-іл]-3{3-[2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4піролідинону О-метилоксим; (метоксііміно)піролідиніл]-1,2,4-оксадіазол-5(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5іл}метилформамід; [(диметиламіно)метил]-1,2,4-оксадіазол-3-іл}-3піролідинону О-метилоксим; 7 75145 8 (3EZ,5S)-5-{5-[(1S,2R)-1-аміно-2-гідроксипропіл]трет-бутил-4-(2-{3-[(2S,4EZ)-1-([1,1'-біфеніл]-41,2,4-оксадіазол-3-іл}-1-([1,1'-біфеніл]-4ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4ілкарбоніл)-3-піролідинону О-метилоксим; оксадіазол-5-іл}етил)-1-піперазинкарбоксилат; (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(3S)(3EZ,5S)-1-[(2'-хлор-4'-фтор[1,1'-біфеніл]-4піперидиніл]-1,2,4-оксадіазол-3-іл}-3-піролідинону іл)карбоніл]-5-[3-(2-гідроксіетил)-1,2,4-оксадіазолО-метилоксим; 5-іл]-3-піролідинону О-метилоксим; (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(3R)(3EZ,5S)-1-[(4'-фтор-2'-метил[1,1'-біфеніл]-4піперидиніл]-1,2,4-оксадіазол-3-іл}-3-піролідинону іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3О-метилоксим; піролідинону О-метилоксим; (3EZ,5RS)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(1(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[2метил-3-піперидиніл)-1,2,4-оксадіазол-3-іл]-3(диметиламіно)етил]-1,2,4-оксадіазол-3-іл}-3піролідинону О-метилоксим; піролідинону О-метилоксим; трет-бутил-(3R)-3-{3-[(2S,4EZ)-1-([1,1'-біфеніл]-42-{5-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4ілкарбоніл)-4-(метоксііміно)-піролідиніл]-1,2,4(метоксііміно)піролідиніл]-1,2,4-оксадіазол-3оксадіазол-5-іл}-1-піперидинкарбоксилат; іл}етил[(трет-бутоксикарбоніл)аміно]ацетат; 4-({3-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4N-({3-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4(метоксііміно)піролідиніл]-1,2,4-оксадіазол-5(метоксііміно)піролідиніл]-1,2,4-оксадіазол-5іл}метил)-2,6-піперазиндіон; іл}метил)-2-(диметиламіно)ацетамід; (3Z,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(2(3EZ,5S)-1-[(2'-хлор-4'-фтор[1,1'-біфеніл]-4гідроксіетил)-1,2,4-оксадіазол-5-іл]-3-піролідинону іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3О-метилоксим; піролідинону О-метилоксим; (3Z,5S)-1-[(2'-хлор-4'-фтор[1,1'-біфеніл]-4(3EZ,5S)-5-{5-[(15)-1-аміно-2-трет-бутоксіетил]іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-31,2,4-оксадіазол-3-іл}-1-([1,1'-біфеніл]-4піролідинону О-метилоксим; ілкарбоніл)-3-піролідинону О-метилоксим; (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(1трет-бутил-4-{5-[(2S,4EZ)-1-([1,1'-біфеніл]-4метил-4-піперидиніл)-1,2,4-оксадіазол-3-іл]-3ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4піролідинону О-метилоксим; оксадіазол-3-іл}-1-піперидинкарбоксилат; (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(1[(диметиламіно)метил]-1,2,4-оксадіазол-3-іл}-3піперазинілметил)-1,2,4-оксадіазол-3-іл]-3піролідинону О-метилоксим; піролідинону О-метилоксим; (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(1трет-бутил-(4S)-4-{3-[(2S,4EZ)-1-([1,1'-біфеніл]-4метил-4-піперидиніл)-1,2,4-оксадіазол-5-іл]-3ілкарбоніл)-4-(метоксііміно)-піролідиніл]-1,2,4піролідинону О-метилоксим; оксадіазол-5-іл}-4-[(трет(3EZ,5S)-5-{5-[(1S)-1-аміно-2-гідроксіетил]-1,2,4бутоксикарбоніл)аміно]бутаноат; оксадіазол-3-іл}-1-([1,1'-біфеніл]-4-ілкарбоніл)-3{[(2S,4EZ)-2-(5-{[(третпіролідинону О-метилоксим; бутоксикарбоніл)аміно]метил}-1,2,4-оксадіазол-35-[(2S,4E)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4іл)-4-(метоксііміно)піролідиніл]карбоніл}-1,1'(метоксііміно)піролідиніл]-H-[3біфеніл; (диметиламіно)пропіл]-1,2,4-оксадіазол-3трет-бутил-2-{3-[(2S,4EZ)-1-([1,1'-біфеніл]-4карбоксамід; ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4(3E,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5оксадіазол-5-іл}етилкарбамат; [(диметиламіно)метил]-1,2,4-оксадіазол-3-іл}-32-{5-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4піролідинону О-метилоксим; (метоксііміно)піролідиніл]-1,2,4-оксадіазол-3трет-бутил-(3S)-3-{3-[(2S,4EZ)-1-([1,1'-біфеніл]-4іл}етил аміноацетат; ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4(3E,5S)-1-[(2',4'-дифтор[1,1'-біфеніл]-4-іл)карбоніл]оксадіазол-5-іл}-1-піперидинкарбоксилат; 5-(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону О(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(4метилоксим; метил-1-піперазиніл)метил]-1,2,4-оксадіазол-3-іл}(3EZ,5S)-1-[(2',4'-дифтор[1,1'-біфеніл]-43-піролідинону О-метилоксим; іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3(3Z,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(4піролідинону О-метилоксим; метил-1-піперазиніл)метил]-1,2,4-оксадіазол-3-іл}4-{[(2S,4EZ)-2-(5-{(1S)-2-трет-бутокси-l-[(трет3-піролідинону О-метилоксим; бутоксикарбоніл)аміно]етил}-1,2,4-оксадіазол-3-іл)етил-5-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-44-(метоксііміно)піролідиніл]карбоніл}-1,1'-біфеніл; (метоксііміно)піролідиніл]-1,2,4-оксадіазол-3(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(5-вінілкарбоксилат; 1,2,4-оксадіазол-3-іл)-3-піролідинону О(3E,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(2метилоксим; гідроксіетил)-1,2,4-оксадіазол-5-іл]-3-піролідинону 4-{[(2S,4EZ)-2-(5-{(1S,2R)-2-трет-бутокси-1-[(третО-метилоксим; бутоксикарбоніл)аміно]пропіл}-1,2,4-оксадіазол-3(3Z,5RS)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(2іл)-4-(метоксііміно)піролідиніл]карбоніл}-1,1'гідроксіетил)-1,2,4-оксадіазол-5-іл]-3-піролідинону біфеніл; О-метилоксим; (3Z,5S)-1-[(2',4'-дифтор[1,1'-біфеніл]-4-іл)карбоніл]N-({3-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-45-(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону О(метоксііміно)піролідиніл]-1,2,4-оксадіазол-5метилоксим; іл}метил)-3-(диметиламіно)пропанамід; трет-бутил-4-({3-[(2S,4EZ)-1-([1,1'-біфеніл]-4ілкарбоніл)-4-(метоксііміно)-піролідиніл]-1,2,4оксадіазол-5-іл}метил)-1-піперазин-карбоксилат. 9 75145 10 R O R 16. Сполука за будь-яким із пп. 1-15 для застосуO R N R R O N R N N OH O вання як лікарського засобу. + R R HO N R R NH 17. Застосування сполуки за будь-яким із пп. 1-15 N R N R A R A R для одержання фармацевтичної композиції для XV V III I [B = IIb] лікування та/або профілактики передчасних поло. гів, передчасного народження життєздатного, але 24. Спосіб одержання сполуки піролідиноксадіазонедоношеного плода, та дисменореї. лу формули (I), де B – 1,2,4-оксадіазольна група 18. Застосування сполуки за будь-яким із пп. 1-15 формули (IIа), який включає таку стадію: R для одержання фармацевтичної композиції для O R O HO R N R R N N R O O модулювання рецептора окситоцину. N + R R HN N R 19. Застосування за п. 18, де згадане модулюванR OH N R N R A R A R ня полягає у блокуванні рецептора окситоцину або V VI I антагонізування зв’язування окситоцину з його [B = IIa ] . рецептором. 25. Спосіб одержання сполуки піролідиноксадіазо20. Застосування за п. 19 для лікування або пролу формули (I), де B – 1,2,4-оксадіазольна група філактики розладів, що опосередковуються рецепформули (III) або (IV), який включає будь-яку з тором окситоцину. таких стадій: R 21. Застосування сполуки за будь-яким із пп. 1-15 O R CDI (X=0) або N R N NH для одержання фармацевтичної композиції для CS (X=S) R перорального введення. X N O R R 22. Фармацевтична композиція, що містить щоA R O R N R H I [B=IIIa (X=O)] N NH найменше одну сполуку за будь-яким із пп. 1-15 та I [B=IIIb (X=S)] R фармацевтично прийнятний носій, розріджувач N R NH A R або наповнювач. XVIII R 23. Спосіб одержання сполуки піролідиноксадіазоO R N R N N Tmof, P O лу формули (I), де B – 1,2,4-оксадіазольна група R формули (IIb), який включає таку стадію: N O R 5 1 5 6 1 6 3 3 7 4 7 4 2 2 2 5 1 5 6 1 6 3 4 3 7 2 7 4 2 2 5 1 6 2 3 4 5 1 2 6 2 3 4 2 2 5 1 2 6 5 3 4 A R2 I [B=IV (X=звязок,R8=H)] . ' Цей винахід стосується нових похідних піролідиноксадіазолу та піролідинтіадіазолу, зокрема, їх застосування як лікарських засобів, а також фармацевтичних композицій, що містять такі похідні піролідину. Згадані похідні піролідину є придатними для лікування та/або запобігання передчасних пологів, передчасного народження життєздатного, але недоношеного, плода та дисменореї. У варіантах, яким віддається перевага, згадані похідні піролідину виявляють модуляторну, а саме антагоністичну активність відносно рецептора окситоцину. У варіантах, яким віддається більша перевага, згадані сполуки є придатними для лікування та/або запобігання хворобливих станів, що опосередковуються окситоцином, у тому числі передчасних пологів, передчасного народження життєздатного, але недоношеного плода та дисменореї. Однією з найважливіших проблем у галузі акушерства є терапія передчасних пологів та передчасного народження життєздатного, але недоношеного плода, оскільки вони являють собою головну причину перинатальної захворюваності та смертності. Для лікування передчасних пологів було запропоновано застосування сульфату магнію та етанолу. Однак сульфат магнію у разі концентрації у плазмі, що перевищує терапевтичний діапазон 48мг/дл, може спричиняти пригнічення провідності серцевого м'яза та нервово-м'язового переносу збудження, пригнічення дихання та зупинку серця, що робить цей засіб непридатним, особливо в разі порушення функціонування нирок. Етанол є ефективним засобом запобігання передчасним пологам, однак він не викликає відповідного зменшення частоти виникнення дихальної недостатності плоду. Крім того, припускають, що етанол виявляє негативний вплив на плід. Два інших терапевтичних засоби входять до складу однієї з двох груп: a) 2-адренергічних агоністів або b) антагоністів окситоцину. 2-адренергічний рецептор, як правило, викликає пригнічувальну дію у межах клітин, у яких він експресується (м'язи, серце, матка тощо). 2адренергічні агоністи застосовуються для активації згаданої пригнічувальної дії цього рецептора. Таким чином, 2-адренергічні агоністи є симпатоміметичними засобами, які, разом з іншим, пригнічують скоротність матки. Відомими Р2адренергічними агоністами для лікування передчасних пологів є ритодрин (Ritodrine), тербуталін (Terbutaline) та альбутерол (Albuterol). Ритодрин (R*,S*)-4-гідрокси-альфа-[1-[[2-(4гідроксифеніл)етил]аміно]-етил]бензол-метанол; [дивись патент США №3,410,944 на ім'я Н.В. Філіпс (N.V. Philips)] є провідним 2-адренергічним агоністом, однак він викликає ряд серцевосудинних та метаболічних побічних ефектів у матері, у тому числі тахікардію, підвищену секрецію реніну, гіперглікемію (а також реагентну гіпоглікемію у немовляти). Тербуталін (5-[2-[(1,1-диметилетил)аміно]-1 11 75145 12 гідроксіетил]-1,3-бензолдіол, [патент США ситоцину. Еванс (Evans) та інші повідомляють у /. №3,937,838 на ім'я Драко (Draco)]) та альбутерол Med. Chem., 35, 3919 (1992) про інданілпіперидини та толілпіперазини як про антагоністи окситоцину, ( 1-[(1,1-диметилетил)аміно]метил]-4-гідрокси-1,3придатні до перорального вживання. бензолдиметанол; [патент СШA №3,644,353 на Авторами цього винаходу встановлено, що ім'я Аллен (Allen) та Ханберіс (Hanburys)]) є додатсполуки за цим винаходом є антагоністами оксиковими 2-адренергічними агоністами і викликають тоцину і зв'язуються з рецептором окситоцину. У побічні ефекти, схожі з побічними ефектами рітодразі, коли рецептор окситоцину зв'язується сполурину. ками за цим винаходом, окситоцин антагонізується Порівняно недавній варіант підходу до запобішляхом запобігання його зв'язуванню зі своїм регання передчасних пологів полягає у застосуванні цептором і позбавлення, таким чином, здатності антагоністів окситоцину. до проявлення його біологічних або фармакологіОкситоцин (ОТ) є пептидним гормоном і вичних ефектів. Сполуки за цим винаходом є, таким кликає скорочення матки ссавців під час пологів. чином, придатними для лікування та запобігання Відповідний рецептор окситоцину є подібним до передчасних пологів та передчасного народження рецепторів вазопресину V1a та V2 і виявляє свою життєздатного, але недоношеного плода. Згадані дію через сполучений з G-білком рецептор, пов'ясполуки є придатними також для припинення скозаний з активацією фосфоліпази С і підвищенням рочувальної діяльності матки перед розродженням вмісту ІР3, який вивільнює Са2+ із внутрішньоклішляхом кесаревого розтину. Зокрема, сполуки за тинних пулів. Наслідкове підвищення внутрішньокцим винаходом є придатними для лікування та літинних рівнів кальцію веде до посилення скорозапобігання пов'язаних з окситоцином розладів у чення гладких м'язів через активацію кінази тварин, у варіанті, якому віддається перевага, у легкого ланцюга міозину. Кількість рецепторів окссавців і, зокрема, у людей. Іншою метою цього ситоцину (ОТ) різко зростає під час вагітності. Бувинаходу є запропонувати спосіб антагонізування ло показано, що концентрація ОТ рецепторів кофункцій окситоцину при хворобливих станах у релює зі спонтанною активністю матки (М. Маггі ссавців. Метою цього винаходу є також розроб(М. Maggi) та інші, J.Clin. Endocrinol Metabol; 70; лення способу запобігання або лікування пов'яза1142, 1990). Протягом кількох останніх років були них з окситоцином розладів, наприклад, передчаснагромаджені дані, які дозволяють висунути приних пологів, шляхом протидії зв'язуванню пущення, що гормон окситоцин може бути фізіолоокситоцину з відповідним рецептором. гічним ініціатором пологів у кількох видів ссавців, у Сполуки за цим винаходом є придатними татому числі людей. Окрім того, гадають, що окситокож для лікування дисменореї, яка може визначацин виявляє свій вплив двома різними шляхами: тись як періодичні болі, пов'язані з менструацією, - шляхом безпосереднього скорочення міомепід час овуляторних циклів. Біль, як гадають, є трію матки та наслідком скорочень та ішемії матки, що, ймовір- шляхом посилення синтезу та, вивільнення но, опосередковується ефектом простагландинів, скоротних простагландинів з ендометрія/відпадної продукованих у секреторному ендометрії. Завдяки оболонки матки. Ці простагландини можуть, крім блокуванню як безпосередніх, так і опосередковатого, відігравати важливу роль у процесі досягненних ефектів окситоцину на матку, антагоніст оксиня повного розвитку шийки матки. тоцину є більш ефективним для лікування дисмеЗавдяки цим механізмам, процес пологів (вчанореї, аніж сучасні схеми лікарського лікування. сних та передчасних) ініціюється підвищеною чутУ подальших параграфах наведені визначення ливістю матки до окситоцину, що є, частково, рерізних хімічних фрагментів, з яких складаються зультатом збільшення кількості рецепторів сполуки за цим винаходом, що призначені для окситоцину у цій тканині. однакового застосування у рамках опису та пунктів Шляхом блокування окситоцину можна досягформули винаходу, якщо інше чітко сформульовати безпосередніх (скоротних) та опосередкованих не визначення не надає відповідному терміну ши(підвищений синтез простагландину) ефектів оксиршого обсягу. тоцину на матку. Таким чином, блокатор або антаТермін "C1-C6-алкіл" означає одновалентні алгоніст окситоцину вважається більш ефективним кільні групи, що містять 1-6 атомів вуглецю. Прикщодо лікування передчасних пологів, аніж сучасні ладами таких груп є метил, етил, н-пропіл, ізопросхеми лікарського лікування. піл, н-бутил, ізобутил, трет-бутил, н-гексил тощо. Атозібан (atosiban) (окситоцин, 1-(3Термін "арил" означає ненасичену ароматичну меркаптопропанова кислота)-2-(О-етил-Dкарбоциклічну групу із кількістю атомів вуглецю від тирозин)-4-L-треонін-8-L-орнітин) є циклічним пен6 до 14, що містить один цикл (наприклад, феніл) тапептидом, що є найкращим відомим антагонісабо кілька конденсованих циклів (наприклад, нафтом окситоцину [WO 9501368, Феррінг А.Б. (Ferring тил). До арилів, яким віддається перевага, налеA.B.); /. Reprod. Fertil, 101(2), 345-52 (English) 1994; жать феніл, нафтил, фенантрил тощо. Am. J. Obstet. Gynecol, 170(2), 474-8 (English) Термін "C1-C6-алкіларил" означає C1-C61994]. Принциповою перешкодою до застосування алкільні групи, що мають арильний замісник, в пептидних антагоністів типу атозибану є проблема тому числі бензил, фенетил тощо. низької оральної біодоступності внаслідок його Термін "гетероарил" означає моноциклічну або розкладу в кишечнику. З цієї причини їх слід ввоконденсовану біциклічну чи трициклічну гетероадити парентерально. роматичну групу. Окремими прикладами гетероа[У WO 96/22775 та патенті США №5,756,497 роматичних груп є факультативно заміщені піри(Merck)] також розкрито бензоксазинілпіперидини дил, піроліл, фурил, тієніл, імідазоліл, оксазоліл, або бензоксазинони як антагоністи рецептора ок 13 75145 14 ізоксазоліл, тіазоліл, ізотіазоліл, піразоліл, 1,2,3Термін "карбокси(л)" означає групу -С(О)ОН. триазоліл, 1,2,4-триазоліл, 1,2,3-оксадіазоліл, Термін "C1-C6-алкілкарбокси(л)" означає C1-C61,2,4-оксадіазоліл, 1,2,5-оксадіазоліл, 1,3,4алкільні групи, що мають карбоксильний замісник, оксадіазоліл, 1,3,4-триазиніл, 1,2,3-триазиніл, бенв тому числі 2-карбоксіетил тощо. зофурил, [2,3-дигідро]бензофурил, ізобензофурил, Термін "ацил" означає групу -C(O)R, де R є Η, бензотієніл, бензотриазоліл, ізобензотієніл, індо"C1-C6-алкіл", "С2-С6-алкеніл", "С2-С6-алкініл", "С3ліл, ізоіндоліл, 3Н-індоліл, бензимідазоліл, імідаС8-циклоалкіл", "гетероциклоалкіл", "арил", "гетезо[1,2-а]піридил, бензотіазоліл, бензоксазоліл, роарил", "C1-C6-алкіларил" або "C1-C6хінолізиніл, хіназолініл, фталазиніл, хіноксалініл, алкілгетероарил", "С2-С6-алкеніларил", "С2-С6цінолініл, нафтиридин, піридо[3,4-b]піридил, піриалкенілгетероарил", "С2-С6-алкініларил", "С2-С6до[3,2-b]піридил, піридо[4,3-b]піридил, хіноліл, ізоалкінілгетероарил", "C1-C6-алкілциклоалкіл", "C1хіноліл, тетразоліл, 5,6,7,8-тетрагідрохіноліл, C6-алкілгетероциклоалкіл". 5,6,7,8-тетрагідроізохіноліл, пуриніл, птеридиніл, Термін "C1-C6-алкілацил" означає C1-C6карбазоліл, ксантеніл або бензохіноліл. алкільні групи, що мають ацильний замісник, в Термін "C1-C6-алкілгетероарил" означає C1-C6тому числі 2-ацетилетил тощо. алкільні групи, що мають гетероарильний замісТермін "арилацил" означає арильні групи, що ник, в тому числі 2-фурилметил, 2-тієнілметил, 2мають ацильний замісник, в тому числі 2(1Н-індол-3-іл)етил тощо. ацетилфеніл тощо. Термін "C2-C6-алкеніл" означає алкенільні груТермін "гетероарилацил" означає гетероарипи, які переважно містять від 2 атомів до 6 атомів льні групи, що мають ацильний замісник, в тому вуглецю та мають щонайменше 1 ділянку чи 2 дічислі 2-ацетилпіридил тощо. лянки алкенільної ненасиченості. До алкенільних Термін "С3-С8-(гетеро)циклоалкілацил" ознагруп, яким віддається перевага, належать етеніл (чає 3-8-членні циклоалкільні або гетероциклоалкіСН=СН2), н-2-пропеніл (аліл, -СН2СН=СН2) тощо. льні групи, що мають ацильний замісник. Термін "C2-C6-алкеніларил" означає C2-C6Термін "ацилокси(група)" означає групу алкенільні групи, що мають арильний замісник, в OC(O)R, де R є Η, "C1-C6-алкіл", "C2-C6-алкеніл", тому числі 2-фенілвініл тощо. "C2-C6-алкініл", "С3-С8-циклоалкіл", "гетероциклоаТермін "C2-C6-алкенілгетероарил" означає C2лкіл", "арил", "гетероарил", "C1-C6-алкіларил" або C6-алкенільні групи, що мають гетероарильний "C1-C6-алкілгетероарил", "С2-С6-алкеніларил", "C2замісник, в тому числі 2-(3-піридиніл)вініл тощо. C6-алкенілгетероарил", "С2-С6-алкініларил", "C2-C6Термін "C2-C6-алкініл" означає алкінільні групи, алкінілгетероарил", "С1-С6-алкілциклоалкіл", "С1які містять переважно від 2 атомів до 6 атомів вугС6-алкілгетероциклоалкіл". лецю і мають щонайменше 1-2 ділянки алкінільної Термін "С1-С6-алкілацилокси(група)" означає ненасиченості. До алкінільних груп, яким віддаєтьС1-С6-алкільні групи, що мають замісну ацилоксигся перевага, належать етиніл (-С=СН), пропаргіл (рупу, в тому числі 2-(ацетилокси)етил тощо. СН2С=СН) тощо. Термін "алкокси(група)" означає групу -O-R, де Термін "C2-C6-алкініларил" означає C2-C6R охоплює "С1-С6-алкіл", "С2-С6-алкеніл", "С2-С6алкінільні групи, що мають арильний замісник, в алкініл", "С3-С8-циклоалкіл", "гетероциклоалкіл", тому числі фенілетиніл тощо. "арил", "гетероарил", "С1-С6-алкіларил" або "С1-С6Термін "C2-C6-алкінілгетероарил" означає C2алкілгетероарил", "С2-С6-алкеніларил", "С2-С6C6-алкінільні групи, що мають гетероарильний заалкенілгетероарил", "С2-С6-алкініларил", "С2-С6місник, в тому числі 2-тієнілетиніл тощо. алкінілгетероарил", "С1-С6-алкілциклоалкіл", "С1Термін "С3-С8-циклоалкіл" означає насичену С6-алкілгетероциклоалкіл". карбоциклічну групу із кількістю атомів вуглецю від Термін "С1-С6-алкілалкокси(група)" означає С13 до 8, що включає один цикл (наприклад, циклоС6-алкільні групи, що мають алкоксильні заміснигексил) або кілька конденсованих циклів (наприки, в тому числі 2-етоксіетил тощо. клад, норборніл). До циклоалкілів, яким віддається Термін "алкоксикарбоніл" означає групу перевага, належать циклопентил, циклогексил, C(O)OR, де R охоплює "С1-С6-алкіл", "С2-С6норборніл тощо. алкеніл", "С2-С6-алкініл", "С3-С8-циклоалкіл", "гетеТермін "C1-C6-алкілциклоалкіл" означає C1-C6роциклоалкіл", "арил", "гетероарил", "С1-С6алкільні групи, що мають циклоалкільний замісник, алкіларил" або "С1-С6-алкілгетероарил", "С2-С6в тому числі циклогексилметил, циклопентилпроалкеніларил", "С2-С6-алкенілгетероарил", "С2-С6піл тощо. алкініларил", "С2-С6-алкінілгетероарил", "С1-С6Термін "гетероциклоалкіл" означає С3-С8алкілциклоалкіл", "С1-С6-алкілгетероциклоалкіл". циклоалкільну групу, що відповідає визначенню, Термін "С1-С6-алкілалкоксикарбоніл" означає наведеному вище, в якій до 3 атомів вуглецю заС1-С6-алкільні групи, що мають алкоксикарбонільмінені на гетероатоми, вибрані з групи, яка вклюний замісник, в тому числі 2чає О, S, NR, де R визначається як водень або (бензилоксикарбоніл)етил тощо. метил. До гетероциклоалкілів, яким віддається Термін "амінокарбоніл" означає групу перевага, належать піролідин, піперидин, піпераC(O)NRR', де кожний R, R' охоплює незалежно зин, 1-метилпіперазин, морфолін тощо. водень, "С1-С6-алкіл", "С2-С6-алкеніл", "С2-С6Термін "C1-C6-алкілгетероциклоалкіл" означає алкініл", "С3-С8-циклоалкіл", "гетероциклоалкіл", C1-C6-алкільні групи, що мають гетероциклоалкі"арил", "гетероарил", "С1-С6-алкіларил" або "С1-С6льний замісник, в тому числі 2-(1-піролідиніл)етил, алкілгетероарил", "С2-С6-алкеніларил", "С2-С64-морфолінілметил, (1-метил-4-піперидиніл)метил алкенілгетероарил", "С2-С6-алкініларил", "С2-С6тощо. алкінілгетероарил", "С1-С6-алкілциклоалкіл", "С1 15 75145 16 С6-алкілгетероциклоалкіл". кільну групу. Термін "С1-С6-алкіламінокарбоніл" означає С1Термін "С1-С6-алкіламоній" означає С1-С6С6-алкільні групи, що мають амінокарбонільний алкільні групи, що мають як замісник амоній, в замісник, в тому числі 2тому числі 2-(1-піролідиніл)етил тощо. (диметиламінокарбоніл)етил тощо. Термін "група, що піддається іонізації" означає Термін "ациламіно" означає групу -NRC(O)R', групу, яка може бути перетворена в сіль, наприде кожний R, R' є незалежно від іншого водень, клад, шляхом протонування. Прикладами груп, що "С1-С6-алкіл", "С2-С6-алкеніл", "С2-С6-алкініл", "С3піддаються іонізації/протонуванню, є амінні або С8-циклоалкіл", "гетероциклоалкіл", "арил", "гетесульфонільні групи. роарил", "С1-С6-алкіларил" або "С1-С6Термін "галоїд" означає атоми фтору, хлору, алкілгетероарил", "С2-С6-алкеніларил", "С2-С6брому і йоду. алкенілгетероарил", "С2-С6-алкініларил", "С2-С6Термін "сульфонілокси(група)" означає групу алкінілгетероарил", "С1-С6-алкілциклоалкіл", "С1OSO2-R, де R вибраний з групи, яка включає Н, С6-алкілгетероциклоалкіл". "С1-С6-алкіл", "С1-С6-алкіл", заміщений галоїдами, Термін "С1-С6-алкілациламіно" означає С1-С6наприклад, групу -OSO2-CF3, "С2-С6-алкеніл", "С2алкільні групи, що мають як замісник ациламіногС6-алкініл", "С3-С8-циклоалкіл", "гетероциклоалкіл", рупу, в тому числі 2-(пропіоніламіно)етил тощо. "арил", "гетероарил", "С1-С6-алкіларил" або "С1-С6Термін "уреїдо" означає групу -NRC(O)NR'R", алкілгетероарил", "С2-С6-алкеніларил", "С2-С6де кожний з R, R', R" є незалежно від інших воалкенілгетероарил", "С2-С6-алкініларил", "С2-С6день, "С1-С6-алкіл", "С2-С6-алкеніл", "С2-С6-алкініл", алкінілгетероарил", "С1-С6-алкілциклоалкіл", "С1"С3-С8-циклоалкіл", "гетероциклоалкіл", "арил", С6-алкілгетероциклоалкіл". "гетероарил", "С1-С6-алкіларил" або "С1-С6Термін "С1-С6-алкілсульфонілокси(група)" алкілгетероарил", "С2-С6-алкеніларил", "С2-С6означає С1-С6-алкільні групи, що мають як замісалкенілгетероарил", "С2-С6-алкініларил", "С2-С6ник сульфонілоксигрупу, в тому числі 2алкінілгетероарил", "С1-С6-алкілциклоалкіл", "С1(метилсульфонілокси)етил тощо. С6-алкілгетероциклоалкіл", та де R і R" спільно з Термін "сульфоніл" означає групу "-SO2-R", де атомом азоту, до якого вони приєднані, можуть R вибраний з групи, яка включає Н, "арил", "гетефакультативно утворювати 3-8-членну гетероцикроарил", "С1-С6-алкіл", "С1-С6-алкіл", заміщений лоалкільну групу. галоїдами, наприклад, групу -SO2-CF3, "С2-С6Термін "С1-С6-алкілуреїдо" означає С1-С6алкеніл", "С2-С6-алкініл", "С3-С8-циклоалкіл", "гетеалкільні групи, що мають як замісник уреїдогрупу, роциклоалкіл", "арил", "гетероарил", "С1-С6в тому числі 2-(N'-метилуреїдо)етил тощо. алкіларил" або "С1-С6-алкілгетероарил", "С2-С6Термін "карбамат" означає групу -NRC(O)OR, алкеніларил", "С2-С6-алкенілгетероарил", "С2-С6де кожний з R, R' є незалежно від іншого водень, алкініларил", "С2-С6-алкінілгетероарил", "С1-С6"С1-С6-алкіл", "С2-С6-алкеніл", "С2-С6-алкініл", "С3алкіл циклоалкіл", "С1-С6-алкілгетероциклоалкіл". С8-циклоалкіл", "гетероциклоалкіл", "арил", "гетеТермін "С1-С6-алкілсульфоніл" означає С1-С6роарил", "С1-С6-алкіларил" або "С1-С6алкільні групи, що мають сульфонільний замісник, алкілгетероарил", "С2-С6-алкеніларил", "С2-С6в тому числі 2-(метилсульфоніл)етил тощо. алкенілгетероарил", "С2-С6-алкініларил", "С2-С6Термін "сульфініл" означає групу "-S(O)-R", де алкінілгетероарил", "С1-С6-алкілциклоалкіл", "С1R вибраний групи, яка включає в себе Н, "С1-С6С6-алкілгетероциклоалкіл". алкіл", "С1-С6-алкіл", заміщений галоїдами, наприТермін "аміно" означає групу -NRR, де кожний клад, групи -SO-CF3, "С2-С6-алкеніл", "С2-С6R, R' є незалежно від іншого водень, "С1-С6-алкіл", алкініл", "С3-С8-циклоалкіл", "гетероциклоалкіл", "С2-С6-алкеніл", "С2-С6-алкініл", "С3-C8-циклоалкіл", "арил", "гетероарил", "С1-С6-алкіларил" або "С1-С6"гетероциклоалкіл", "арил", "гетероарил", "С1-С6алкілгетероарил", "С2-С6-алкеніларил", "С2-С6алкіларил" або "С1-С6-алкілгетероарил", "С2-С6алкенілгетероарил", "С2-С6-алкініларил", "С2-С6алкеніларил", "С2-С6-алкенілгетероарил", "С2-С6алкінілгетероарил", "С1-С6-алкілциклоалкіл", "С1алкініларил", "С2-С6-алкінілгетероарил", "С1-С6С6-алкілгетероциклоалкіл". алкілциклоалкіл", "С1-С6-алкілгетероциклоалкіл", Термін "С1-С6-алкілсульфініл" означає С1-С6та де R і R' спільно з атомом азоту, до якого вони алкільні групи, що мають сульфінільний замісник, приєднані, можуть факультативно утворювати 3-8в тому числі 2-(метилсульфініл)етил тощо. членну гетероциклоалкільну групу. Термін "сульфаніл" означає групи -S-R, де R Термін "С1-С6-алкіламіно" означає С1-С6охоплює Н, "С1-С6-алкіл", "С1-С6-алкіл", заміщений алкільні групи, що мають як замісник аміногрупу, в галоїдами, наприклад, групу -SO-CF3, "С2-С6тому числі 2-(1-піролідиніл)етил тощо. алкеніл", "С2-С6-алкініл", "С3-С8-циклоалкіл", "гетеТермін "амоній" означає позитивно заряджену роциклоалкіл", "арил", "гетероарил", "С1-С6групу -N+RR'R", де кожний з R, R',R" є незалежно алкіларил" або "С1-С6-алкілгетероарил", "С2-С6від інших "С1-С6-алкіл", "С2-С6-алкеніл", "С2-С6алкеніларил", "С2-С6-алкенілгетероарил", "С2-С6алкініл", "С3-С8-циклоалкіл", "гетероциклоалкіл", алкініларил", "С2-С6-алкінілгетероарил", "С1-С6"С1-С6-алкіларил" або "С1-С6-алкілгетероарил", алкілциклоалкіл", "С1-С6-алкілгетероциклоалкіл". "С2-С6-алкеніларил", "С2-С6-алкенілгетероарил", До сульфанільних груп, яким віддається перевага, "С2-С6-алкініларил", "С2-С6-алкінілгетероарил", "С1належать метилсульфаніл, етилсульфаніл тощо. С6-алкілциклоалкіл", "С1-С6Термін "С1-С6-алкілсульфаніл" означає С1-С6алкілгетероциклоалкіл", та де R і R' спільно з атоалкільні групи, що мають сульфанільний замісник, мом азоту, до якого вони приєднані, можуть факув тому числі 2-(етилсульфаніл)етил тощо. льтативно утворювати 3-8-членну гетероциклоалТермін "сульфоніламіно" означає групу 17 75145 18 NRSO2-R', де кожний R, R' є незалежно водень, лоти, нафталінсульфонової кислоти, нафталінди"С1-С6-алкіл", "С2-С6-алкеніл", "С2-С6-алкініл", "С3сульфонової кислоти, метансульфонової кислоти С8-циклоалкіл", "гетероциклоалкіл", "арил", "гетета полігалактуронової кислоти. Згадані сполуки роарил", "С1-С6-алкіларил" або "С1-С6можна вживати також як фармацевтично прийняталкілгетероарил", "С2-С6-алкеніларил", "С2-С6ні солі четвертинної основи, відомі фахівцю у цій алкенілгетероарил", "С2-С6-алкініларил", "С2-С6галузі, до яких, зокрема, належить сіль четвертиналкінілгетероарил", "С1-С6-алкілциклоалкіл", "С1ного амонію формули -NR,R',R" + Ζ", де R, R', R", С6-алкілгетероциклоалкіл ". незалежно один від одного є водень, алкіл або Термін "С1-С6-алкілсульфоніламіно" означає бензил, С1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл, С1-С6-алкільні групи, що мають як замісник сульС1-С6-алкіларил, С1-С6-алкілгетероарил, циклоалфоніламіногрупу, в тому числі 2кіл, гетероциклоалкіл, a Z - протиіон, в тому числі (етилсульфоніламіно)етил тощо. хлорид, бромід, йодид, -О-алкіл, толуолсульфоТермін "аміносульфоніл" означає групу -SO2нат, метилсульфонат, сульфонат, фосфат або NRR', де кожний R, R' є незалежно від іншого вокарбоксилат (наприклад, бензоат, сукцинат, ацедень, "С1-С6-алкіл", "С2-С6-алкеніл", "С2-С6-алкініл", тат, гліколят, малеат, малат, фумарат, цитрат, "С3-С8-циклоалкіл", "гетероциклоалкіл", "арил", тартрат, аскорбат, циннамоат, манделоат та ди"гетероарил", "С1-С6-алкіларил" або "С1-С6фенілацетат). алкілгетероарил", "С2-С6-алкеніларил", "С2-С6Вираз "фармацевтично активна похідна" ознаалкенілгетероарил", "С2-С6-алкініларил", "С2-С6чає будь-яку сполуку, яка, після введення реципієалкінілгетероарил", "С1-С6-алкілциклоалкіл", "С1нту, здатна виявляти, безпосередньо або опосеС6-алкілгетероциклоалкіл". редковано, активність, що розкривається у цьому Термін "С1-С6-алкіламіносульфоніл" означає описі. С1-С6-алкільні групи, що мають аміносульфонільТермін "енантіомерний надлишок" (ее) стосуний замісник, в тому числі 2ється продуктів, які одержують шляхом асиметри(циклогексиламіносульфоніл)етил тощо. чного синтезу, тобто синтезу із застосуванням неТермін "заміщений або незаміщений": У разі рацемічних вихідних матеріалів та/або реагентів відсутності інших обмежень, що встановлюються або синтезу, який включає щонайменше одну енавизначенням окремого замісника, вищенаведені нтіоселективну стадію, завдяки чому одержують групи, а саме "алкільна", "алкенільна", "алкінільна", надлишок одного енантіомеру щонайменше приб"арильна" та "гетероарильна" і т.п. групи, можуть лизно 52%. За відсутності асиметричного синтезу, факультативно заміщуватись 1-5 замісниками, одержують, як правило, рацемічні продукти, які, вибраними з групи, яка включає "С1-С6-алкіл", "С2однак, також мають активність згідно з цим винаС6-алкеніл", "С2-С6-алкініл", "циклоалкіл", "гетероходом як антагоністи рецептора окситоцину. циклоалкіл", "С1-С6-алкіларил", "С1-С6Загальна формула (І) за цим винаходом охопалкілгетероарил", "С1-С6-алкілциклоалкіл", "С1-С6лює також таутомери, геометричні ізомери, оптичалкілгетероциклоалкіл", "аміногрупу", "амоній", но активні форми, наприклад, енантіомери, діас"ацил", "ацилоксигрупу", "ацил аміногрупу", "амінотереомери та рацемічні форми представлених карбоніл", "алкоксикарбоніл", "уреїдо", "карбамат", нею сполук, а також їхні фармацевтично прийнятні "арил", "гетероарил", "сульфініл", "сульфоніл", солі. Фармацевтично прийнятними солями форму"алкоксигрупу", "сульфаніл", "галоїд", "карбоксигли (І), яким віддається перевага, є солі з кислотарупу", тригалоїдметил, ціангрупу, гідроксигрупу, ми, які одержують із застосуванням фармацевтичмеркаптогрупу, нітрогрупу тощо. За альтернативно прийнятних кислот, наприклад, гідрохлорид, ним варіантом згадане заміщення може також гідробромід, сульфат або бісульфат, фосфат або включати ситуації, коли сусідні замісники були гідрофосфат, ацетат, бензоат, сукцинат, фумарат, піддані реакції замикання циклу із залученням сумалеат, лактат, цитрат, тартрат, глюконат, метансідніх функціональних груп, з одержанням, таким сульфонат, бензолсульфонат та паратолуолсульчином, наприклад, лактамів, лактонів, циклічних фонат. ангідридів, але також ацеталів, тіоацеталів, амінаОдним із аспектів цього винаходу є піролідилів, що утворюються при замиканні циклу, наприноксадіазоли та піролідинтіадіазоли формули (І). клад, із метою одержання групи захисту. Похідні піролідиноксадіазолу та піролідинтіаВираз "фармацевтично прийнятні солі або діазолу за формулою І є придатними для модулюкомплекси" означає солі або комплекси визначевання, зокрема, для пригнічення функції рецептоних нижче сполук вказаної формули, що зберігара окситоцину і, конкретніше, як антагоністи ють необхідну біологічну активність. Прикладами рецептора окситоцину. У разі, коли рецептор окситаких солей є (але ними не обмежуються) солі, тоцину зв'язується сполуками за формулою І, окодержані доданням кислоти (солі з кислотами), які ситоцин антагонізується шляхом запобігання його одержують із застосуванням неорганічних кислот зв'язуванню зі своїм рецептором і позбавлення, (наприклад, хлористоводневої кислоти, бромистотаким чином, здатності до виявлення його біологіводневої кислоти, сірчаної кислоти, фосфорної чних або фармакологічних ефектів. Сполуки за кислоти, азотної кислоти тощо), та солі, одержані цим винаходом є, таким чином, особливо придатдоданням органічних кислот, наприклад, оцтової ними для лікування та запобігання пов'язаних з кислоти, щавлевої кислоти, винної кислоти, буршокситоцином розладів у ссавців і, зокрема, у лютинової кислоти, яблучної кислоти, фумарової кидей. слоти, малеїнової кислоти, аскорбінової кислоти, Згаданими сполуками за цим винаходом є бензойної кислоти, дубильної кислоти, памової сполуки формули І. кислоти, альгінової кислоти, поліглутамінової кис 19 75145 20 вибрані з групи, яка включає Η або -С1-С6 алкіл, зокрема, -СН3, А - -(С=О)-, R2 - заміщений або незаміщений арил, заміщена або незаміщена гете(І) роарильна група, зокрема, біфенільна група. Відповідно до варіанта втілення, якому віддається перевага, замісник В - 1,2,4-оксадіазоловий Згадана формула охоплює також геометричні замісник, який може бути приєднаний до піролідиізомери, оптично активні форми, наприклад, енаннового циклу відповідно до наведених нижче фортіомери, діастереомери та рацемічні форми предмул (ІІа) або (ІІb): ставлених нею сполук, а також їхні фармацевтично прийнятні солі. Фармацевтично прийнятними солями сполук І, яким віддається перевага, є солі з (IIa) (IIb) кислотами, які одержують із застосуванням фармацевтично прийнятних кислот, наприклад, гідрохлорид, гідробромід, сульфат або бісульфат, фоУ згаданих формулах (llа) і (llb), R7 вибрані з сфат або гідрофосфат, ацетат, бензоат, сукцинат, групи, яка включає водень, сульфоніл, аміногрупу, фумарат, малеат, лактат, цитрат, тартрат, глюконезаміщений або заміщений С1-С6-алкіл, незамінат, метансульфонат (мезилат), бензол сульфощений або заміщений С2-С6-алкеніл, незаміщений нат та паратолуолсульфонат. або заміщений С2-С6-алкініл, де згадані алкільний, У згаданій формулі (І), А вибраний з групи, яка алкенільний, алкінільний ланцюги можуть бути включає -(С=О)-, -(С=О)-О-, -SO2-, -SO2NH-, перервані гетероатомом, вибраним з N, О або S, C(=NH)-, -(C=O)-NH-, -(C=S)-NH, -CH2-. У варіанті, незаміщений або заміщений арил, незаміщений якому віддається найбільша перевага, А - карбоніабо заміщений гетероарил, незаміщений або зальна група. міщений насичений або ненасичений 3-8-членний В - незаміщений або заміщений оксадіазольциклоалкіл, незаміщений або заміщений гетероциний або тіадіазольний цикл. клоалкіл, де згадані циклоалкіл, гетероциклоалкіл, R1 вибраний з групи, яка включає незаміщений арильна або гетероарильна групи можуть бути або заміщений С1-С6-алкіл, незаміщений або законденсованими з 1-2 додатковими циклоалкільміщений С2-С6-алкеніл, незаміщений або заміщеними, гетероциклоалкільними, арильними або гений С2-С6-алкініл, незаміщений або заміщений тероарильними групами, ацильним фрагментом, арил, незаміщений або заміщений гетероарил, незаміщеним або заміщеним С1-С6-алкіларилом, незаміщений або заміщений С1-С6-алкіларил, ненезаміщеним або заміщеним С1-С6заміщений або заміщений С1-С6-алкілгетероарил, 1 алкілгетероарилом, незаміщеним або заміщеним R може утворювати з атомом О, до якого він приС1-С6-алкеніларилом, незаміщеним або заміщеєднаний, 3-8-членний заміщений або незаміщеним С1-С6-алкенілгетероарилом, незаміщеним або ний, насичений або ненасичений гетероцикл, який заміщеним С1-С6-алкініларилом, незаміщеним або може містити 1-2 додаткових гетероатоми, вибрані заміщеним С1-С6-алкінілгетероарилом, незаміщез-посеред N, S та О та який є факультативно конним або заміщеним С1-С6-алкілциклоалкілом, неденсований з арилом, гетероарил ом або 3-8заміщеним або заміщеним С1-С6членним насиченим або ненасиченим циклоалкі1 алкілгетероциклоалкілом, незаміщеним або замілом. У варіанті, якому віддається перевага, R - Η щеним С1-С6-алкенілциклоалкілом, незаміщеним або С1-С3-алкіл, більша перевага віддається метаабо заміщеним С1-С6-алкенілгетероциклоалкілом, льній групі. незаміщеним або заміщеним С1-С6R2 вибраний з групи, яка включає в себе незаалкінілциклоалкілом, незаміщеним або заміщеним міщений або заміщений С1-С6-алкіл, незаміщений С1-С6-алкінілгетероциклоалкілом, заміщеним або або заміщений С2-С6-алкеніл, незаміщений або незаміщеним алкоксикарбонілом, заміщеним або заміщений С2-С6-алкініл, незаміщений або замінезаміщеним амінокарбонілом, заміщеною або щений арил, незаміщений або заміщений гетероанезаміщеною С1-С6-алкілкарбоксильною групою, рил, незаміщений або заміщений насичений або заміщеною або незаміщеною С1-С6-алкілацильною ненасичений 3-8-членний циклоалкіл, ацил, незагрупою, заміщеною або незаміщеною арилацильміщений або заміщений С1-С6-алкіларил, незаміною групою, заміщеною або незаміщеною гетерощений або заміщений С1-С6-алкілгетероарил, де арилацильною групою, заміщеною або незаміщезгадані циклоалкільні або арильні чи гетероарильною С3-С8-(гетеро)циклоалкілацильною групою, ні групи можуть бути конденсованими з 1-2 додатнезаміщеною або заміщеною С1-С6ковими циклоалкільними або арильними чи гетеалкілацилоксигрупою, незаміщеною або заміщероарильними групами. Більша перевага ною С1-С6-алкілалкоксильною групою, незаміщевіддається арильній, зокрема, фенільній групі, фаною або заміщеною С1-С6культативно заміщеній, наприклад додатковою алкілалкоксикарбонільною групою, незаміщеною фенільною групою (це забезпечує біфенільну або заміщеною С1-С6-алкіламінокарбонільною грускладову). пою, незаміщеною або заміщеною С1-С6R3, R4, R5 і R6 незалежно один від одного вибалкілациламіногрупою, ациламіногрупою, незамірані з групи, яка включає водень, галоїд, С1-С6щеною або заміщеною С1-С6-алкілуреїдогрупою, алкіл, С1-С6-алкоксигрупу. У варіанті, якому віддазаміщеним або незаміщеним С1-С6ється перевага, кожен із них є Н. алкілкарбаматом, незаміщеною або заміщеною Похідними піролідину, яким віддається переС1-С6-алкіламіногрупою, незаміщеним або замівага, є сполуки, що відповідають формулі І, де R1 щеним С1-С6-алкіламонієм, незаміщеною або за 21 75145 22 міщеною С1-С6-алкілсульфонілоксигрупою, незанасичений або ненасичений С4-С8міщеною або заміщеною С1-С6циклоалкілкарбоніл, де згадані циклоалкіл або алкілсульфонільною групою, незаміщеною або арил чи гетероарил можуть бути конденсованими заміщеною С1-С6-алкілсульфінільною групою, нез 1-2 додатковими циклоалкілом або арилом чи заміщеною або заміщеною С1-С6гетероарилом і де згадані алкільний, алкенільний, алкілсульфанільною групою, незаміщеною або алкінільний ланцюги можуть бути перервані гетезаміщеною С1-С6-алкілсульфоніламіногрупою, нероатомом, вибраним із Ν, Ο або S. заміщеною або заміщеною С1-С6Особлива перевага серед піролідинових похіалкіламіносульфонільною групою, гідроксигрупою, дних віддається сполукам, що відповідають форгалоїдом, ціаногрупою. мулі І, де А є -(С=О), R1 є С1-С6-алкільна група, R2 Відповідно до варіанта втілення, якому віддає арильна або гетероарильна група, кожний з R3, 7 ється перевага, R - замісник, що містить здатну R4, R5 та R6 є Η і В є оксадіазол відповідно до фоіонізуватися (зокрема, здатну протонуватися) грурмул llа, llb, III або IV. пу. Найбільша перевага серед піролідинових поЗокрема, R7 може бути вибраний з групи, що хідних віддається сполукам, що відповідають фовключає карбоксил та аміногрупу. рмулі І, де А є -(С=О), R1 є метальна група, R2 є 7 За альтернативним варіантом, R може бути (не)заміщена арильна група або (не)заміщена гевибраний з групи, що включає будь-які з вищезгатероарильна група, кожний з R3, R4, R5 та R6 є Η та даних замісників, які несуть щонайменше одну В є оксадіазол, що відповідає формулам llа, llb, III і карбоксильну або аміногрупу. Замісником, здатIV, особливо 1,2,4-оксадіазол формул llа або llb. ним іонізуватися (протонуватися), якому віддаєтьНайбільша перевага серед піролідинових пося перевага, є циклічний третинний амін (який явхідних віддається сполукам, що відповідають фоляє собою гетероциклоалкіл). рмулі І, де А є -(С=О), R1 є метальна група, R2 є Групами, яким віддається більша перевага, є біфенільна група, кожний з R3, R4, R5 та R6 є Η та С1-С6-алкіламіногрупа, гетероциклоалкіл, наприВ є оксадіазол, що відповідає формулам llа, llb, III клад, піперазини або піперидини, С1-С6та IV, особливо 1,2,4-оксадіазол формул llа або llb. алкілгетероциклоалкіл, амінокарбоніл, С1-С6Сполуки формули І можуть мати один або кіалкіламінокарбоніл, С1-С6-алкілациламіногрупа, лька асиметричних центрів і можуть, таким чином, С1-С6-алкілсульфоніл, С1-С6-алкілкарбоксигрупа. існувати у формі енантіомерів або діастереомерів. Групами, яким віддається найбільша перевага, є Слід розуміти, що цей винахід охоплює як суміші, диметиламінометил, 2-(диметиламіно)етил, 1так і окремі індивідуальні ізомери або енантіомери метил-3-піперидиніл, (4-ацетил-1-піперазиніл)згаданих сполук формули І. За варіантом втілення, метил. якому віддають особливу перевагу, похідні піроліВідповідно до іншого варіанта втілення, замісдину за формулою І одержують з енантіомерним ник В є 1,3,4-оксадіазолом формули (IV)або його надлишком щонайменше 52% ее, за варіантом, таутомером формули(III): якому віддається перевага, щонайменше 92-98% ее. Конкретними прикладами сполук формули І є (IIІ) (IV) сполуки, наведені нижче: (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(3метил-1,2,4-оксадіазол-5-іл)-3-піролідинону ОX у згаданих формулах (III) і (IV) є О або S, метилоксим отже, в випадку формули IV X може бути також (3EZ,5S)-1-[(2'-метил[1,1'-біфеніл]-4зв'язком. У випадку, коли X є О або S та R8 є воіл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3день, сполуки формули IV являють собою відповіпіролідинону О-метилоксим дні таутомери формули III. (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5R8 формули (IV) вибраний із групи, до якої (1,3,4-оксадіазол-2-іл)-3-піролідинону Овходять водень, незаміщений або заміщений С1метилоксим С6-алкіл, незаміщений або заміщений С2-С6(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(5алкеніл, незаміщений або заміщений С2-С6-алкініл, оксо-1,2,4-оксадіазол-5-іл)-3-піролідинону Онезаміщений або заміщений арил, незаміщений метилоксим або заміщений гетероарил, незаміщений або за(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(5міщений насичений або ненасичений 3-8-членний тіоксо-4,5-дигідро-1,3,4-оксадіазол-2-іл)-3циклоалкіл, який факультативно містить щонаймепіролідинону О-метилоксим нше один гетероатом (наприклад 1-3) вибраний з (3EZ,5S)-5-(3-бензил-1,2,4-оксадіазол-5-іл)-1N, О, S, ацил, незаміщений або заміщений С1-С6([1,1'-біфеніл]-4-ілкарбоніл)-3-піролідинону Оалкіларил, незаміщений або заміщений С1-С6метилоксим алкілгетероарил, незаміщений або заміщений С1(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(3С6-алкеніларил, незаміщений або заміщений С1{[(2-фурилметил)сульфаніл]метил}-1,2,4С6-алкенілгетероарил, заміщений або незаміщеоксадіазол-5-іл)-3-піролідинону О-метилоксим ний алкоксикарбоніл, карбоксиламід, заміщена або (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3-[2незаміщена С1-С6-алкоксильна група, заміщена оксо-2-(1-піролідиніл)етил]-1,2,4-оксадіазол-5-іл}-3або незаміщена арилоксигрупа, заміщена або непіролідинону О-метилоксим заміщена гетероарилоксигрупа, галоїд, ціан, замі(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3-[(2щений або незаміщений С1-С6-алкілкарбоніл, запіридинілсульфаніл)метил]-1,2,4-оксадіазол-5-іл}міщений або незаміщений арилкарбоніл або 3-піролідинону О-метилоксим гетероарилкарбоніл, заміщений або незаміщений 23 75145 24 (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(4(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5фторфеніл)-1,2,4-оксадіазол-5-іл]-3-піролідинону (1,2,4-оксадіазол-3-іл)-3-піролідинону ОО-метилоксим метилоксим (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3-[(2(3E,5S)-1-[(2'-фтор[1,1'-біфеніл]-4-іл)карбоніл]тієнілсульфаніл)метил]-1,2,4-оксадіазол-5-іл}-35-(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону Опіролідинону О-метилоксим метилоксим (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3-[2(3E,5S)-1-[(2'-метил[1,1'-біфеніл]-4(3,5-диметил-1Н-піразол-1-іл)етил]-1,2,4іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3оксадіазол-5-іл}-3-піролідинону О-метилоксим піролідинону О-метилоксим (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3(3E,5S)-1-[(2'-метил[1,1'-біфеніл]-4[(метилсульфоніл)метил]-1,2,4-оксадіазол-5-іл}-3іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3піролідинону О-метилоксим піролідинону О-метилоксим (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(5(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5метил-3-ізоксазоліл)-1,2,4-оксадіазол-5-іл]-3(феноксиметил)-1,2,4-оксадіазол-3-іл]-3піролідинону О-метилоксим піролідинону О-метилоксим (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(2(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(5тієнілметил)-1,2,4-оксадіазол-5-іл]-3-піролідинону феніл-1,2,4-оксадіазол-3-іл)-3-піролідинону ОО-метилоксим метилоксим (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(3H-({3-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)феніл-1,2,4-оксадіазол-5-іл)-3-піролідинону О4-(метоксііміно)піролідиніл]-1,2,4-оксадіазол-5метилоксим іл}метил)ацетамід (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(3(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[4{[(2-фурилметил)сульфоніл]метил}-1,2,4(гідроксиметил)феніл]-1,2,4-оксадіазол-3-іл}-3оксадіазол-5-іл)-3-піролідинону О-метилоксим піролідинону О-метилоксим (3EZ,5S)-5-[3-(амінометил)-1,2,4-оксадіазол-5(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(2іл]-1-([1,1'-біфеніл]-4-ілкарбоніл)-3-піролідинону Огідроксіетил)-1,2,4-оксадіазол-3-іл]-3-піролідинону метилоксим О-метилоксим (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5[(R,S)-гідрокси(феніл)метил]-1,2,4-оксадіазол-5-іл}[(2S)-2-гідрокси-2-фенілетил]-1,2,4-оксадіазол-33-піролідинону О-метилоксим іл}-3-піролідинону О-метилоксим (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3{3-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4[(1R,S)-1-гідроксипропіл]-1,2,4-оксадіазол-5-іл}-3(метоксііміно)піролідиніл]-1,2,4-оксадіазол-5піролідинону О-метилоксим іл}метилформамід (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5(гідроксиметил)-1,2,4-оксадіазол-5-іл]-3(метоксиметил)-1,2,4-оксадіазол-3-іл]-3піролідинону О-метилоксим піролідинону О-метилоксим (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(2[(1S,2R)-2-гідроксициклогексил]-1,2,4-оксадіазол-5феноксіетил)-1,2,4-оксадіазол-3-іл]-3-піролідинону іл}-3-піролідинону О-метилоксим О-метилоксим (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(2(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(2гідроксіетил)-1,2,4-оксадіазол-5-іл]-3-піролідинону метоксіутил)-1,2,4-оксадіазол-3-іл]-3-піролідинону О-метилоксим О-метилоксим (3Z,5RS)-1 -([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(2(3EZ,5S)-5-[5-(1-ацетил-4-піперидиніл)-1,2,4гідроксіетил)-1,2,4-оксадіазол-5-іл]-3-піролідинону оксадіазол-3-іл]-1-([1,1'-біфеніл]-4-ілкарбоніл)-3О-метилоксим піролідинону О-метилоксим (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(4(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(2піперидиніл)-1,2,4-оксадіазол-5-іл] -3-піролідинону піридиніл)-1,2,4-оксадіазол-3-іл]-3-піролідинону ОО-метилоксим метилоксим (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(3[(3RS)-піперидиніл]-1,2,4-оксадіазол-5-іл}-3тієніл)-1,2,4-оксадіазол-3-іл]-3-піролідинону Опіролідинону О-метилоксим метилоксим (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{3(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(5[(2RS)-піперидиніл]-1,2,4-оксадіазол-5-іл}-3етил-1,2,4-оксадіазол-3-іл)-3-піролідинону Опіролідинону О-метилоксим метилоксим (3EZ,5S)-1-[(2'-хлор[1,1'-біфеніл]-4(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(5іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3циклопентил-1,2,4-оксадіазол-3-іл)-3-піролідинону піролідинону О-метилоксим О-метилоксим (3EZ,5S)-5-(3-метил-1,2,4-оксадіазол-5-іл)-1(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(5{[2'-(трифторметил)[1,1'-біфеніл]-4-іл]карбоніл}-3метил-1,2,4-оксадіазол-3-іл)-3-піролідинону Опіролідинону О-метилоксим метилоксим (3Z,5S)-1-[(2'-фтор[1,1'-біфеніл]-4-іл)карбоніл](3EZ,5S)-1-([1,1'-біфеніл] -4-ілкарбоніл)-5-{55-(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону О[(RS)-гідрокси(феніл)метил]-1,2,4-оксадіазол-3-іл}метилоксим 3-піролідинону О-метилоксим (3EZ,5S)-1-[(4'-фтор[1,1'-біфеніл]-4(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3[(1RS)-1-гідрокси-2-фенілетил]-1,2,4-оксадіазол-3піролідинону О-метилоксим іл}-3-піролідинону О-метилоксим 25 75145 26 (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5піролідинону О-метилоксим [(1R)-1-(диметиламіно)-2-фенілетил]-1,2,4(3EZ,5S)-5-{5-[(1S)-1-аміно-2-гідроксіетил]оксадіазол-3-іл}-3-піролідинону О-метилоксим 1,2,4-оксадіазол-3-іл}-1-([1,1'-біфеніл]-4(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(3ілкарбоніл)-3-піролідинону О-метилоксим піридиніл)-1,2,4-оксадіазол-3-іл]-3-піролідинону О5-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4метилоксим (метоксііміно)піролідиніл]-Н-[3(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(4(диметиламіно)пропіл]-1,2,4-оксадіазол-3піридиніл)-1,2,4-оксадіазол-3-іл]-3-піролідинону Окарбоксамід метилоксим (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5(3Z,5S)-5-{5-[(4-ацетил-1-піперазиніл)метил][(диметиламіно)метил]-1,2,4-оксадіазол-3-іл}-31,2,4-оксадіазол-3-іл}-1-([1,1'-біфеніл]-4піролідинону О-метилоксим ілкарбоніл)-3-піролідинону О-метилоксим трет-бутил (3S)-3-{3-[(2S,4ЕZ)-1-([1,1'-біфеніл](3EZ,5S)-5-[3-(1-ацетил-4-піперидиніл)-1,2,44-ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4оксадіазол-5-іл]-1-([1,1'-біфеніл]-4-ілкарбоніл)-3оксадіазол-5-іл}-1-піперидинкарбоксилат піролідинону О-метилоксим (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(4(3EZ,5S)-5-{5-[(4-ацетил-1-піперазиніл)метил]метил-1-піперазиніл)метил]-1,2,4-оксадіазол-3-іл}1,2,4-оксадіазол-3-іл}-1-([1,1'-біфеніл]-43-піролідинону О-метилоксим ілкарбоніл)-3-піролідинону О-метилоксим (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[(4H-({3-[(2S,4ЕZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)метил-1-піперазиніл)метил]-1,2,4-оксадіазол-3-іл}4-(метоксііміно)-піролідиніл]-1,2,4-оксадіазол-53-піролідинону О-метилоксим іл}метил)-3-(1-піперидиніл)пропанамід етил 5-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{54-(метоксііміно)піролідиніл]-1,2,4-оксадіазол-3[(3S)-1-метилпіперидиніл]-1,2,4-оксадіазол-3-іл}-3карбоксилат піролідинону О-метилоксим (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(2(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5гідроксіетил)-1,2,4-оксадіазол-5-іл] -3-піролідинону [(3R)-1-метилпіперидиніл]-1,2,4-оксадіазол-3-іл}-3О-метилоксим піролідинону О-метилоксим H-({3-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(64-(метоксііміно)-піролідиніл]-1,2,4-оксадіазол-5гідрокси-3-піридиніл)-1,2,4-оксадіазол-3-іл]-3іл}метил)-3-(диметиламіно)пропанамід піролідинону О-метилоксим трет-бутил 4-(2-{3-[(2S,4EZ)-1-([1,1'-біфеніл]-4(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5ілкарбоніл)-4-(метоксііміно)-піролідиніл]-1,2,4[(диметиламіно)метил]-1,2,4-оксадіазол-3-іл}-3оксадіазол-5-іл}етил)-1-піперазинкарбоксилат піролідинону О-метилоксим (3EZ,5S)-1-[(2'-хлор-4'-фтор[1,1'-біфеніл]-4(3EZ,5S)-5-{5-[(1S,2R)-1-аміно-2іл)карбоніл]-5-[3-(2-гідроксіетил)-1,2,4-оксадіазолгідроксипропіл]-1,2,4-оксадіазол-3-іл}-1-([1,1'5-іл]-3-піролідинону О-метилоксим біфеніл]-4-ілкарбоніл)-3-піролідинону О(3EZ,5S)-1-[(4'-фтор-2'-метил[1,1'-біфеніл]-4метилоксим іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5піролідинону О-метилоксим [(3S)-піперидиніл]-1,2,4-оксадіазол-3-іл}-3(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5-[2піролідинону О-метилоксим (диметиламіно)етил]-1,2,4-оксадіазол-3-іл}-3(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5піролідинону О-метилоксим [(3R)-піперидиніл]-1,2,4-оксадіазол-3-іл}-32-{5-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4піролідинону О-метилоксим (метоксііміно)-піролідиніл]-1,2,4-оксадіазол-3(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(1іл}етил[(трет-бутоксикарбоніл)аміно]ацетат метил-3-піперидиніл)-1,2,4-оксадіазол-3-іл]-3Н-({3-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)піролідинону О-метилоксим 4-(метоксііміно)-піролідиніл]-1,2,4-оксадіазол-5трет-бутил (3R)-3-{3-[(2S,4ЕZ)-1-([1,1'-біфеніл]іл}метил)-2-(диметиламіно)ацетамід 4-ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4(3EZ,5S)-1-[(2'-хлор-4'-фтор[1,1'-біфеніл]-4оксадіазол-5-іл}-1-піперидинкарбоксилат іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-34-({3-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4піролідинону О-метилоксим (метоксііміно)піролідиніл]-1,2,4-оксадіазол-5(3EZ,5S)-5-{5-[(1S)-1-аміно-2-трет-бутоксіетил]іл}метил)-2,6-піперазиндіон 1,2,4-оксадіазол-3-іл}-1-([1,1'-біфеніл]-4(3Z,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(2ілкарбоніл)-3-піролідинону О-метилоксим гідроксіетил)-1,2,4-оксадіазол-5-іл]-3-піролідинону трет-бутил 4-{5-[(2S,4EZ)-1-([1,1'-біфеніл]-4О-метилоксим ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4(3Z,5S)-1-[(2'-хлор-4'-фтор[1,1'-біфеніл]-4оксадіазол-3-іл}-1-піперидинкарбоксилат іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(1піролідинону О-метилоксим піперазинілметил)-1,2,4-оксадіазол-3-іл]-3(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[5-(1піролідинону О-метилоксим метил-4-піперидиніл)-1,2,4-оксадіазол-3-іл]-3трет-бутил (4S)-4-{3-[(2S,4EZ)-1-([1,1'-біфеніл]піролідинону О-метилоксим 4-ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-{5оксадіазол-5-іл}-4-[(трет[(диметиламіно)метил]-1,2,4-оксадіазол-3-іл}-3бутоксикарбоніл)аміно]бутаноат піролідинону О-метилоксим 4-{[(2S,4ЕZ)-2-(5-{[(трет(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(1бутоксикарбоніл)аміно]метил}-1,2,4-оксадіазол-3метил-4-піперидиніл)-1,2,4-оксадіазол-5-іл]-3іл)-4-(метоксііміно)піролідиніл]карбоніл}-1,1' 27 75145 28 біфеніл умови. Оптимальні умови реакцій можуть змінюваТРЕТ-БУТИЛ 2-{3-[(2S,4EZ)-1-([1,1'-біфеніл]-4тись у залежності від конкретних застосованих ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4реагентів або розчинників, однак фахівці у цій гаоксадіазол-5-іл}етилкарбамат лузі можуть визначати такі умови шляхом станда2-{5-[(2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4ртних процедур оптимізації. (метоксііміно)піролідиніл]-1,2,4-оксадіазол-3Взагалі, похідні піролідину за загальною форіл}етил аміноацетат мулою І можна одержувати кількома способами із (3EZ,5S)-1-[(2',4'-дифтор[1,1'-біфеніл]-4застосуванням методик як рідкофазового, так і іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3твердофазного хімічного синтезу. піролідинону О-метилоксим За одним зі способів, похідні піролідину зага(3EZ,5S)-1-[(2',4'-дифтор[1,1'-біфеніл]-4льної формули І, де замісником В є 1,2,4іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3оксадіазол формули (IIа), одержують із відповідних піролідинону О-метилоксим карбонових кислот V та амідоксимів VI, де заміс4-{[(2S,4EZ)-2-(5-{(1S)-2-трет-бутокси-1-[(третники R1-R7 та А відповідають вищенаведеному бутоксикарбоніл)-аміно]етил}-1,2,4-оксадіазол-3визначенню, за допомогою добре відомих методик іл)-4-(метоксііміно)піролідиніл]карбоніл}-1,1'рідкофазового синтезу, наприклад, тих, що описані біфеніл у Прикладах та показані на наведеній нижче Схе(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(5мі 1. вініл-1,2,4-оксадіазол-3-іл)-3-піролідинону ОСхема 1 метилоксим 4-{[(2S,4ЕZ)-2-(5-{(1S,2R)-2-трет-бутокси-1[(трет-бутоксикарбоніл)-аміно]пропіл}-1,2,4оксадіазол-3-іл)-4(метоксііміно)піролідиніл]карбоніл}-1,1'-біфеніл (3Z,5S)-1-[(2',4'-дифтор[1,1'-біфеніл]-4Амідоксими VI одержують або з комерційних іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3джерел, або з відповідних нітрилів VII шляхом піролідинону О-метилоксим проведення реакції останніх із гідроксиламіном у трет-бутил 4-({3-[(2S,4EZ)-1-([1,1'-біфеніл]-4стандартних умовах, добре відомих фахівцям у цій ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4галузі, наприклад, в умовах, описаних у Прикладах оксадіазол-5-іл}метил)-1-піперазинкарбоксилат та показаних на поданій нижче Схемі 2. Ще один аспект цього винаходу стосується заСхема 2 стосування похідних піролідиноксадіазолу та піролідинтіадіазолу формули І як лікарських засобів, зокрема, для лікування та/або запобігання передчасних пологів, передчасного народження життєНітрили VII одержують або з комерційних джездатного, але недоношеного плода, для припирел, або з, наприклад, відповідних карбонових нення скорочувальної діяльності матки перед кислот VIII, як показано на Схемі 3, за допомогою розродженням шляхом кесаревого розтину та диспособів взаємоперетворення функціональних сменореї. За варіантом, якому віддається перевагруп, добре відомих фахівцю у цій галузі, що зага, згадані сполуки за формулою І є придатними стосовуються для перетворення карбонових кисдля модулювання функції окситоцину, і, таким чилот у відповідні нітрили. Приклади включають (і) ном, конкретно вони надають можливість лікуванвідновлення карбонової кислоти VIII до відповідноня та/або запобігання розладів, що опосередковуго альдегіду з подальшим перетворенням у відпоються рецептором окситоцину. Термін "лікування" відний оксим та дегідратацію останнього до відпоохоплює модуляцію, а саме пригнічення або антавідного нітрилу VII за допомогою, наприклад, N,N'гонізування, рецепторів окситоцину. карбонілдіімідазолу або подібних реагентів чи (іі) Більш конкретно, згадані сполуки за цим винаперетворення карбонової кислоти VIII у відповідходом є придатними для лікування передчасних ний первинний карбоксамід із подальшою дегідрапологів, дисменореї та для припинення скорочутацією до відповідного нітрилу VII із застосуванвальної діяльності матки перед розродженням ням стандартних умов, добре відомих фахівцю у шляхом кесаревого розтину. цій галузі, наприклад, таких, що описані у подальЩе однією подальшою метою цього винаходу ших Прикладах. є спосіб одержання похідних піролідину за формуСхема 3 лою І. Згадані похідні піролідину, приклади яких наведено у цьому винаході, можна одержувати з легкодоступних вихідних матеріалів із застосуванням описаних нижче загальних методів та процеПіролідин-2-карбонові кислоти V (дивись Схедур. Слід розуміти, що в разі, коли вказано типові му 1), де згадані замісники R1-R7 та А відповідають експериментальні умови або експериментальні вищенаведеному визначенню, можна одержувати умови, яким віддається перевага (тобто темперазі сполук загальної формули IX шляхом реакції із тури реакцій, тривалість реакцій, молярні співвідзаміщеними гідроксиламінами X із застосуванням ношення реагентів, розчинники тощо), якщо не стандартних методик синтезу, як описано далі у буде зроблено спеціального застереження можуть Прикладах і показано на Схемі 4. застосовуватись також інші експериментальні 29 Схема 4 Сполуки формули X одержують або з комерційних джерел, або з N-Boc-гідроксиламіну XI та алкілувальних агентів XII (Х=СІ, Вr, І) за допомогою стандартних методів синтезу, як показано на Схемі 5 та описано у подальших Прикладах. Схема 5 Кетосполуки загальної формули IX, де згадані замісники R1-R7 та А відповідають вищенаведеному визначенню, можна одержувати шляхом окиснення комерційно доступного, відповідним чином TV-захищеного 4-гідроксипроліну XIII із застосуванням стандартних методик синтезу, як описано далі у Прикладах і показано на Схемі 6. За альтернативним варіантом згадані сполуки загальної формули IX можуть, у свою чергу, бути одержані зі сполук формули V шляхом перетворення оксиму простого ефіру в кетон, наприклад, при гідролізі у м'яких умовах, як описано далі у Прикладах. Якщо, за цим сценарієм, кетосполуки IX у подальшому знов вводять у реакцію з різними гідроксиламінними компонентами X*, наприклад, як показано на Схемі 6, тоді загальне перетворення V IX V* буде відповідати взаємообміну R1 у межах оксимефірного фрагменту сполук загальної формули V. Аналогічне взаємоперетворення оксиму простого ефіру є можливим на рівні кінцевих сполук загальної формули І (I XIV I*), що також показано на Схемі 6. Схема 6 75145 30 Амідоксими XV одержують із відповідних нітрилів XVI, де замісники R1-R7 та А відповідають вищенаведеному визначенню, шляхом проведення реакції останніх із гідроксиламіном у стандартних умовах, добре відомих фахівцю у цій галузі, наприклад, таких, як описані у Прикладах і показано на наведеній нижче Схемі 8. Нітрили XVI, у свою чергу, одержують, наприклад, із відповідних карбонових кислот V, де згадані замісники R1-R7 та А відповідають вищенаведеному визначенню, за допомогою способів взаємоперетворення функціональних груп, добре відомих фахівцю у цій галузі техніки, що застосовуються для перетворення карбонової кислоти у відповідний нітрил. Приклади включають (і) відновлення карбонової кислоти V до відповідного альдегіду з подальшим перетворенням у відповідний оксим та дегідратацію останнього до відповідного нітрилу XVI за допомогою, наприклад, N,N'-карбонілдіімідазолу або подібних реагентів чи (іі) перетворення карбонової кислоти V у відповідний первинний карбоксамід із подальшою дегідратацією до відповідного нітрилу XVI із застосуванням стандартних умов, добре відомих фахівцю у цій галузі, наприклад, таких, як описані у подальших Прикладах. Схема 8 Похідні піролідину загальної формули І, де згаданим замісником В є 1,3,4-оксадіазол формул III та/або IV, можуть бути одержані з відповідних сполук гідразиду XVII, де згадані замісники R1-R7 та А відповідають вищенаведеному визначенню, із застосуванням методик хімії рідкої фази, добре відомих досвідченому фахівцю у цій галузі, наприклад, таких, як описані у Прикладах і показано на наведеній нижче Схемі 9. Наприклад, сполуки формули І, де згаданим замісником В є 1,3,4оксадіазол формули III, можуть бути одержані шляхом проведення реакції XVII із CDI або CS2 в основному середовищі з одержанням відповідних продуктів, де X - відповідно О або S. За альтернативним варіантом, проміжний гідразид XVII можна спочатку піддавати обробці TMOF, потім Р2О5 у киплячому толуолі, з одержанням сполук формули І, де В-IV. Схема 9 За іншим способом, похідні піролідину загальної формули І, де замісником В є 1,2,4-оксадіазол формули (llb), одержують із відповідних амідоксимів кислот XV, де замісники R1-R7 та А відповідають вищенаведеному визначенню, та карбонових кислот VIII із застосуванням добре відомих методик рідкофазового синтезу, наприклад, таких, як описані у Прикладах і показано на наведеній нижче Схемі 7. Схема 7 Гідразиди XVII одержують, наприклад, із відповідних карбонових кислот V, де згадані замісники R1-R7 та А відповідають вищенаведеному визначенню, через відповідні метилові складні ефіри 31 75145 XVIII та подальшу обробку останніх гідразином у стандартних умовах, добре відомих досвідченому фахівцю у цій галузі, наприклад, таких, як описані у Прикладах і показано на наведеній нижче Схемі 10. Схема 10 Сполуки загальної формули І, де згадані замісники R1-R8 та А відповідають вищенаведеному визначенню, є, таким чином, доступними з попередників загальної формули V/XVIII (дивись наведені вище Схему 1, Схеми 7-10). Як правило, згадані попередники формули V/XVIII початково несуть групу захисту атому азоту піролідинового циклу, наприклад, Вос, Fmoc або інші, тобто відповідають формулам V' та/або XVIII' (-A-R2 є група захисту, PG), як показано на Схемі 11. Для синтезу кінцевих сполук І, згадані групи захисту азоту сполук V' та/або XVIII', як правило, відщеплюють і замінюють на відповідний N-замісник, наприклад, на ацил, -C(O)-R2 або -SO2-R2, наприклад, шляхом обробки ацилювальним агентом або сульфівним агентом XX. Додатковими сполуками формули (XX) є карбоксилювальні агенти, сульфівні агенти, сульфонамідувальні агенти, імідувальні агенти, амідувальні агенти, тіоамідувальні агенти або алкілувальні агенти. Приєднання необхідної групи (A-R2) до атому азоту піролідину можна здійснювати після або перед одержанням оксадіазольного чи тіадіазольного циклу, як показано на Схемі 11 (відповідно А або В) та описано у подальших Прикладах. Оптимальний вибір методики синтезу залежить від природи замісників R1-R8 (зокрема, R7). Ацилювальними агентами XX, яким віддається перевага, є хлорангідриди (ХХа), які застосовуються, як правило, спільно з придатним третинним аміном, або карбонові кислоти (ХХb), які застосовуються спільно з агентом пептидного сполучення, наприклад, DIC або EDC. Сполуки формули І, де А - -(С=О)-О-, -SO2-, SO2NH-, -C(=NH)-, -(C=O)-NH, -(C=S)-NH, -CH2-, можуть бути одержані за допомогою відповідних карбоксилювальних агентів, сульфівних агентів, сульфонамідувальних агентів, імідувальних агентів, амідувальних агентів, тіоамідувальних агентів або алкілувальних агентів, наприклад, сульфонілхлоридів, ізоціанатів, ізотіоціанатів, хлороформіатів, заміщених алкілгало'ідідів або інших, з одержанням відповідно похідних сульфонаміду, сечовини, тіосечовини, карбамату, заміщених алкільних або інших похідних. 32 Схема 11 За подальшим загальним способом, сполуки формули І можуть бути перетворені в альтернативні сполуки формули l' за допомогою відповідних способів введення та відщеплювання груп захисту або взаємоперетворення функціональних груп, добре відомих досвідченому фахівцю у цій галузі, як показано на Схемі 12 та описано у подальших Прикладах. Схема 12 Згідно із ще одним способом, похідні піролідину загальної формули І одержують за новою методикою твердофазного синтезу, як зображено на Схемі 13 та описано у подальших Прикладах. Наприклад, для твердофазного синтезу сполук загальної структури І із В=llа, згадану N-Вос-захищену похідну піролідину V вводять в реакцію зі смолою, що несе сполучну групу, схильну до розщеплення нуклеофілами, наприклад, із оксимною смолою 33 75145 34 Кайзера, із застосуванням стандартних умов сподених Схемах, забезпечують одержання енантіолучення, опосередкованого карбодіімідом, добре мерно чистих сполук формули І, якщо використовідомих досвідченому фахівцю у цій галузі. Відщевуються енантіомерно чисті вихідні матеріали. плення захисної Вос-групи розбавленою TFA у Залежно від використання (R)- або (S)-форм комеDCM або BF3·OEt2 у розбавленій НОАс у DCM зарційно доступних сполук формул V-VIII, X та/або безпечує одержання сполук формули XXIV. XX як вихідних матеріалів, можуть бути одержані Останні сполуки можна піддавати обробці ацилю(R)-, а також (S)-енантіомери. вальними агентами загальної формули XX, де Однак послідовності реакцій, показані на визамісники А та R2 відповідають вищенаведеному щенаведених Схемах, як правило, забезпечують визначенню, a LG може бути відповідною відщеподержання сумішей (Ε)- та (Z)-ізомерів відносно люваною групою. Ацилювальними агентами XX, замісників при екзоциклічному подвійному зв'язку яким віддається перевага, є хлорангідриди (ХХа), згаданого піролідинового циклу. В усіх досліджещо застосовуються спільно з третинним аміном, них випадках, згадані (Ε)/(Ζ)-ізомери могли бути або карбонові кислоти (ХХb), що застосовуються розділені стандартними хроматографічними метоспільно з агентом пептидного сполучення, напридами, добре відомими досвідченому фахівцю у цій клад, DIC, EDC, TBTU, DECP або іншими, з одергалузі, наприклад, високоефективною рідинною жанням продуктів загальної формули XXIII. Сполухроматографією (HPLC) з оберненою фазою або ки формули І, де А відрізняється від карбонільної флеш-хроматографією (FC) на силікагелі. За альфункціональної групи, одержують шляхом заміни тернативним варіантом, будь-який зі згаданих сполук формули XX сполуками, що містять відпо(Ε)/(Ζ)-ізомерів можна успішно збагачувати шлявідні функціональні групи, наприклад, сульфонілххом селективної кристалізації з відповідних розлоридами, ізоціанатами, ізотіоціанатами, хлорочинників або сумішей розчинників. Визначення форміатами, заміщеними галоїдалкілами або абсолютної конфігурації екзоциклічного подвійного іншими, з одержанням відповідно похідних сульзв'язку здійснювали за допомогою методів ЯМР, фонаміду, сечовини, тіосечовини, карбамату, задетально описаних у літературі, а також відомих міщених алкільних похідних або інших. З метою досвідченому фахівцю у цій галузі (визначення одержання кінцевих сполук загальної формули І, конфігурації, наприклад, оксимних функціональних зв'язок зі згаданою смолою розривають шляхом груп дивись, [наприклад, у Е. Брейтмайєр (Е. тривалої обробки амідоксимами VI, з подальшим Breitmaier), В. Вельтер (W. Voelter), Carbon-13 нагріванням з, наприклад, піридином. Колами на NMR Spectroscopy, 3-є видання, VCH, 1987, схемі 13 позначено гранули смоли, з якими відпостор.240]). З метою збільшення загального виходу відні сполуки зв'язуються під час твердофазного ізомеру, якому віддається перевага (як правило, синтезу. Інші похідні формули І одержують із за(Z)-ізомеру), ізомер, якому віддається менша пестосуванням відомих модифікацій або варіантів ревага (як правило, (Е)-ізомер), можна повертати в послідовності реакцій Схеми 13. Для твердофазпроцес шляхом умисної повторної ізомеризації у ного синтезу сполук загальної формули І, окрім органічних розчинниках, що містять слідові концевищезгаданої оксимної смоли Кайзера, можуть нтрації кислоти, наприклад, НСI, із подальшим застосовуватись інші придатні реагенти, а саме повторним розділенням (E)/(Z) способами хромасмоли, відомі досвідченому фахівцю у цій галузі. тографування та/або кристалізації, як показано на Схема 13 Схемі 14. Схема 14 Послідовності реакцій, показані на вищенаве У разі, якщо вищенаведені способи синтезу виявляються непридатними для одержання сполук формули І та/або необхідних проміжних продуктів для синтезу сполук формули І, слід застосовувати придатні способи одержання, відомі досвідченому фахівцю у цій галузі. Взагалі, шляхи синтезу будьякої індивідуальної сполуки формули І будуть залежати від специфічних замісників у кожній молекулі та від легкодоступності необхідних проміжних продуктів; і в таких випадках ці фактори визначаються досвідченими фахівцями у цій галузі. Щодо способів введення та відщеплення груп захисту, дивись Філіпп Дж. Косінскі (Philip J. Kocienski), у монографії "Protecting Groups", Georg Thieme Verlag Stuttgart, New York, 1994 та Теодора В. Грін (Theodora W. Greene) і Пітер Г.М. Вутс (Peter G.M. Wuts) у монографії "Protective Groups in Organic Synthesis", Wiley-Interscience, 1991. Сполуки за цим винаходом можна виділяти в 35 75145 36 комбінації з молекулами розчинника шляхом кристично ефективній кількості. Фактично вживана кіталізації з випаровуванням відповідного розчиннилькість згаданої сполуки, як правило, визначається ка. Фармацевтично прийнятні солі сполук формули лікарем з урахуванням релевантних обставин, у І, які містять основну групу, з кислотами можна тому числі стану, що підлягає лікуванню, вибраноодержувати стандартним способом. Наприклад, го шляху введення, конкретної застосовуваної розчин вільної основи можна вводити в реакцію з сполуки, віку, маси та індивідуальної реакції пацієпридатною кислотою, чистою або у придатному нта, тяжкості симптомів у пацієнта тощо. розчині, і виділяти одержану сіль шляхом фільтруФармацевтичні композиції за цим винаходом вання або вакуумного випаровування реакційного можна вводити в організм різноманітними шляхарозчинника. Фармацевтично прийнятні солі з осми, у тому числі перорально, ректально,черезшкіновами можна одержувати аналогічним чином рно, підшкірно, внутрішньовенно, внутрішньом'яшляхом обробки розчину сполуки формули І призово та назально. Композиції для перорального датною основою. Солі обох типів можна одержувведення можуть мати форму нерозфасованого вати або взаємоперетворювати методами іонного лікарського засобу у вигляді рідких розчинів або обміну. суспензій або нерозфасованого лікарського засобу Кінцевий аспект цього винаходу стосується зау вигляді порошку ("ангро"). Частіше, однак, комстосування згаданих сполук формули І для лікупозиціям надають форму дозованих одиниць для вання передчасних пологів, передчасного нарополегшення точного дозування. Термін "дозована дження життєздатного, але недоношеного плода, одиниця" означає фізично дискретну одиницю, дисменореї (за варіантом, якому віддається перепридатну як разова доза для людей та інших ссаввага, згадані сполуки формули (І) є придатними ців, причому кожна одиниця містить попередньо для модулювання рецептора окситоцину), застовизначену кількість активного матеріалу, розрахосування згаданих сполук для одержання фармавану на досягнення необхідного терапевтичного цевтичних композицій для модулювання рецептоефекту, в комбінації з придатним фармацевтичним ра окситоцину, а також композицій, що містять наповнювачем. До типових дозованих одиниць активні сполуки за формулою І. Згадане модулюналежать ампули або шприци, попередньо наповвання рецептора окситоцину розглядається як нені визначеною кількістю рідких композицій, або придатний варіант підходу до лікування передчасдраже, таблетки, капсули тощо у разі твердих комних пологів, передчасного народження життєздатпозицій. У таких композиціях похідна піролідинокного, але недоношеного плода та дисменореї. Тасадіазолу становить, як правило, неосновний комким чином, фармацевтичні композиції, що містять понент (від приблизно 0,1%(мас.) до приблизно сполуку формули І та фармацевтично прийнятний 50%(мас.) або за варіантом, якому віддається пеносій, розріджувач або наповнювач, також входять ревага, від приблизно 1% (мас.) до приблизно 40% до обсягу цього винаходу. Досвідченому фахівцю у (мас.)), решту становлять різноманітні розчинники цій галузі відомі різноманітні носії, розріджувачі або носії та допоміжні речовини, які сприяють одеабо наповнювачі, придатні для одержання фармаржанню необхідної дозованої лікарської форми. цевтичних композицій. Крім того, цей винахід проРідкі форми, придатні для перорального вжипонує сполуки для застосування як лікарський завання, можуть включати придатний водний або сіб. неводний носій з буферами, суспендувальними Сполукам за цим винаходом, разом із традиагентами та диспергаторами, барвниками, коригеційно застосовуваним ад'ювантом, носієм, розрінтами тощо. Тверді форми можуть включати, наджувачем або наповнювачем, можна надавати приклад, будь-який з таких інгредієнів або сполук форму фармацевтичних композицій та дозованих подібної природи: в'яжучу речовину, наприклад, одиниць таких композицій, і в такій формі вони мікрокристалічну целюлозу, трагакант або желаможуть застосовуватись у вигляді твердих речотин; наповнювач, наприклад, крохмаль або лактовин, таких як таблетки або заповнені капсули, або зу, дезінтегратор, наприклад, альгінову кислоту, рідких речовин, таких як розчини, суспензії, емульпримогель або кукурудзяний крохмаль; змащувасії, еліксири або заповнені такими речовинами льний агент, наприклад, стеарат магнію; ковзну капсули, для перорального застосування, або у речовину, наприклад, колоїдний діоксид кремнію; формі стерильних розчинів для ін'єкцій для паренпідсолоджуючу речовину, наприклад, цукрозу або терального введення (у тому числі для підшкірного сахарин; або коригент, наприклад, м'яту перцеву, застосування). Такі фармацевтичні композиції та метилсаліцилат або апельсиновий ароматизатор. дозовані лікарські форми можуть містити інгредієОснову ін'єкційних композицій становить, як нти у звичайних співвідношеннях із додатковими правило, стерильний фізіологічний розчин для активними сполуками чи речовинами або без них, і ін'єкцій або фізіологічний розчин з фосфатним такі дозовані лікарські форми можуть містити будьбуфером чи інші ін'єкційні носії, відомі у цій галузі. яку придатну ефективну кількість активного інгреЯк вказано вище, похідні піролідину формули І у дієнта, пропорційну з діапазоном передбачуваної таких композиціях становлять, як правило, неосдобової дози застосування. новний компонент, часто у діапазоні від У разі застосування як фармацевтичні засоби, 0,05%(мас.) до 10%(мас), решту становить ін'єкпохідні піролідину за цим винаходом застосовуційний носій тощо. ються, як правило, у формі фармацевтичної комВищеописані компоненти для перорального позиції. Такі композиції можна одержувати спосовведення або ін'єкційні композиції є лише репребом, добре відомим у фармації, і містити зентативними прикладами. Додаткові матеріали, а щонайменше одну активну сполуку. Взагалі, спотакож технологічні методи тощо наведені у розділі луки за цим винаходом вживаються у фармацев8 довідникового видання Remington's 37 75145 38 Pharmaceutical Sciences, 17-е видання, 1985, 25°С. Після завершення додавання хромової кисMarck Publishing Company, Easton, Pennsylvania, лоти реакційну суміш додатково перемішували яке включено до цього опису посиланням. протягом 15хв. при підтримуванні оптимальної Сполуки за цим винаходом можуть також ввотемператури 25°С. Після цього реакцію гасили дитись у лікарських формах пролонгованої дії або шляхом додання метанолу (20мл). Нагрівання суза допомогою систем пролонгованої доставки ліміші за рахунок тепла реакції регулювали за допокарських засобів. Опис репрезентативних матеріамогою льодяної бані і, в разі потреби, безпосередлів пролонгованого виділення можна також знайти нім додаванням невеликої кількості подрібненого у матеріалах, включених до Remington's льоду до реакційної суміші. Реакційну суміш фільPharmaceutical Sciences. трували через шар целіту, після чого концентруДалі для ілюстрації цього винаходу будуть навали у вакуумі. Одержаний кислотний розчин ексведені деякі приклади, які не повинні розглядатись трагували етилацетатом (3 300мл), і об'єднані як такі, що обмежують обсяг винаходу. Дані висоорганічні шари промивали розсолом (2 100мл). коефективної рідинної хроматографії, ЯМР та масОрганічний розчин після цього сушили сульфатом спектрометрії, наведені у поданих нижче прикламагнію і концентрували у вакуумі. Неочищений дах, були одержані за вказаними відповідними продукт перекристалізовували з етилацетату з методиками. У поданих нижче прикладах застосоодержанням кристалічного продукту білого кольовуються такі скорочення: хв. - хвилини; год. - годиру, (2S)-1-(трет-бутоксикарбоніл)-4-оксо-2ни, г - грам,ммоль - мілімоль, т.пл. - температура піролідинкарбонової кислоти (22,55г, 76%). Енанплавлення, екв. - еквіваленти,мл - мілілітр, мкл тіоморфний проміжний хімічний продукт, (2R)-1мікролітри, л - літри, ACN - ацетонітрил, Вос - бу(трет-бутоксикарбоніл)-4-оксо-2токсикарбоніл, CDCI3 - дейтерований хлороформ, піролідинкарбонову кислоту, одержували за тією CDI - карбонілдіімідазол, сНех - циклогексан, DCM самою методикою, використовуючи як вихідну (ДХМ) - дихлорметан, DECP - діетилціанфосфосполуку продажну (2R,4S)-1-(третнат, DIC - діізопропілкарбодіімід, DMAP - 4бутоксикарбоніл)-4-гідрокси-2-піролідинкарбонову диметиламінопіридин, DMF (ДМФ) - диметилфоркислоту. мамід, DMSO (ДМСО) - (диметилсульфоксид), 1Н ЯМР (360МГц, CDCI3); 1,4 (m, 9H), 2,5-3,0 DMSO-d6 - дейтерований диметилсульфоксид, (m, 2H), 3,7-3,9 (m, 2H), 4,75 (dd, 1Н). EDC - 1-(3-диметиламінопропіл)-3-етилкарбодіімід, Проміжна сполука 2: (2S,4EZ)-1-(третEtOAc - етилацетат, Et2O - діетиловий ефір, Fmoc бутоксикарбоніл)-4-(метоксііміно)-29-фторфенілметоксикарбоніл, HOBt 1піролідинарбонова кислота (див. Схема 4, сполугідроксибензотриазол, HPLC (РХВЕ) - рідинна ка V) хроматографія високої ефективності, Kaiser oxime resin (оксимна смола Кайзера) 4нітробензофеноноксимна смола; K2СО3 - карбонат калію, NaH - гідрид натрію, NaHCO3 - бікарбонат натрію, nBuLi - н-бутиллітій, TBTU - тетрафторборат О-бензотриазоліл-N,N,N',N'-тетраметилуронію, Готували розчин, що містив (2S)-1-(третTEA - триетиламін, TFA - трифтороцтова кислота, бутоксикарбоніл)-4-оксо-2-піролідинкарбонову киTHF (ТГФ) - тетрагідрофуран, TMOF - триметилорслоту (Проміжна сполука 1, 5,0г, 21ммоль) та гідтоформіат, MgSO4 - сульфат магнію, PetEther рохлорид О-метилгідроксиламіну (2,7г, 32,8ммоль) петролейний ефір, rt - кімнатна температура. у хлороформі (100мл), що містив триетиламін Приклади (5,5г, 55ммоль). Після цього одержану реакційну Проміжна сполука 1: (2S)-1-(третсуміш перемішували при температурі навколишбутоксикарбоніл)-4-оксо-2-піролідинкарбонова нього середовища протягом ночі, а потім видаляли кислота (дивись Схема 6, сполука XIII) розчинник. Одержану неочищену реакційну суміш розчиняли в етилацетаті (150мл) і швидко промивали 1-н. розчином НСІ (40мл). Після цього кислотний шар екстрагували етилацетатом (3 20мл), об'єднані органічні шари промивали розсолом, сушили над сульфатом магнію, фільтрували та Куповану (2S,4R)-1-(трет-бутоксикарбоніл)-4видаляли розчинник у вакуумі. Цільовий продукт гідрокси-2-піролідинкарбонову кислоту (30г, (5,3г, 94%) виділяли у вигляді масла блідо-жовтого 0,1моль) розчиняли в ацетоні (1500мл). У колбу кольору. вставляли механічну мішалку і енергійно перемі1 Н ЯМР (400МГц, CDCI3); 1,45 (m, 9Н), 2,8-3,2 шували одержаний розчин. Свіжий 8N розчин хро(m, 2Н), 3,9 (s, 3Н), 4,2 (m, 2Н), 4,5-4,7 (m, 1Н). мової кислоти одержували шляхом розчинення Проміжна сполука 3: (2S,4EZ)-1-(треттриоксиду хрому (66,7г, 0,667моль) у воді (40мл), бутоксикарбоніл)-4-(етоксііміно)-2додання концентрованої сірчаної кислоти (53,3мл) піролідинкарбонова кислота (див. Схема 4, сполуі додання кількості води, достатньої для доведенка V) ня об'єму розчину до 115мл. Після цього одержаний 8N розчин хромової кислоти (115мл) додавали крапля за краплею протягом 30хв. при безперервному енергійному перемішуванні; шляхом відведенням тепла реакції за допомогою льодяної бані підтримували температуру на оптимальному рівні 39 75145 40 Готували розчин, що містив (2S)-1-(третПроміжна сполука 6: 1-[(аміноокси)метил]-4бутоксикарбоніл)-4-оксо-2-піролідинкарбонову киметоксибензол (див. Схема 5, сполука X) слоту (Проміжна сполука 1, 5,0г, 22ммоль) та гідрохлорид O-етилгідроксиламіну (6,4г, 65,5ммоль) у суміші (1:1) піридину та етанолу (100мл). РеакційГотували розчин N-Boc-гідроксиламіну (2,0г, ну суміш нагрівали зі зворотним холодильником 17,1ммоль) у сухому THF (60мл). Після цього допротягом 2,5год., після чого охолоджували, і видадавали гідрид натрію (1,1г 60% суспензії у парафіляли розчинник. Залишок розчиняли в етилацетаті новому маслі, 25,7ммоль), і суспензію перемішуі швидко промивали 1,3-н. розчином НСl (40мл). вали. Потім до реакційної суміші додавали Після цього кислотний шар екстрагували етилацекаталітичну кількість KІ, а потім обережно додавататом (3 20мл), і об'єднані органічні шари промили 4-метоксибензилхлорид (3,2г, 20,4ммоль). вали розсолом, сушили над сульфатом магнію, Одержану реакційну суміш перемішували протяфільтрували, і видаляли розчинник у вакуумі. Цігом ночі, після чого видаляли розчинник у вакуумі. льовий продукт (5,5г, 93%) виділяли у вигляді маОдержаний залишок розбавляли діетиловим ефісла блідо-жовтого кольору. ром (100мл) і протягом 20хв. барботували газопо1 H ЯМР (400МГц, DMSO); 1,3 (t, 3Н), 1,55 (m, дібним НСI, що викликало початок осадження 9Н), 2,9-2,7 (m, 1Н), 3,4-3,1 (m, 1H), 4,1-4,3 (m, 4H), продукту. Колбу закривали пробкою і залишали 4,6 (m, 1H), 12-13,5 (br, 1H). стояти протягом ночі. Після цього продукт відфільПроміжна сполука 4: (2S,4EZ)-4тровували у вигляді не зовсім білої воскоподібної [(алілокси)іміно]-1-(трет-бутоксикарбоніл)-2речовини (вихід у різних партіях 39-52%). 1 піролідинкарбонова кислота (див. Схема 4, сполуH ЯМР (400МГц, D2O); 3,8 (s, 3Н), 5 (s, 2H), ка V) 7,0 (d, 2H), 7,4 (d, 2H). Проміжна сполука 7: Амідоксими. яких немає у продажу Метод А: наприклад N'-гідроксіетанімідамід (ацетамідоксим) (див. Схема 2, сполука VI) Готували розчин, що містив (2S)-1-(третбутоксикарбоніл)-4-оксо-2-піролідинкарбонову кислоту (Проміжна сполука 1, 5,0г, 22ммоль) та моногідрат гідрохлориду О-алілгідроксиламіну (7,2г, 65,5ммоль) у суміші (1:1) піридину та етанолу (100мл). Реакційну суміш нагрівали зі зворотним холодильником протягом 2,5год., після чого охолоджували, і видаляли розчинник. Залишок розчиняли в етилацетаті і швидко промивали 1,3-н. розчином НСl (40мл). Після цього кислотний шар екстрагували етилацетатом (3 20мл), і об'єднані органічні шари промивали розсолом, сушили над сульфатом магнію, фільтрували, і видаляли розчинник у вакуумі. Цільовий продукт (5,9г, 94%) виділяли у вигляді масла блідо-жовтого кольору. 1 H ЯМР (400МГц, CDCI3); 1,5 (m, 9H), 2,8-3,2 (m, 2H), 4,2 (m, 2H), 4,5-4,7 (m, 3Н), 5,25 (m, 2Н), 5,9 (m, 1H), 11,1 (широкий s, 1Н). Проміжна сполука 5: (2S,4EZ)-1-(третбутоксикарбониі)-4-{[(4-метоксибензил)окси]іміно}2-піролідинкарбонова кислота (див. Схема 4, сполука V) За тією самою методикою, що була застосована для одержання Проміжної сполуки 2, однак використовуючи як вихідні сполуки (2S)-1-(третбутоксикарбоніл)-4-оксо-2-піролідинкарбонову кислоту (Проміжна сполука 1) та 1[(аміноокси)метил]-4-метоксибензол (Проміжна сполука 6), одержали цільову сполуку у вигляді смоли з виходом 85%. 1 H ЯМР (400МГц, DMSO); 1,5 (m, 9Н), 2,7-2,9 (m, 1Н) 3,9 (s, 3Н), 4,2 (m, 3Н), 4,6 (m, 1H), 5,15 (s, 2H), 7,1 (d, 2H), 7,45 (d, 2H). 45мл ацетонітрилу високої чистоти додавали до 90мл суміші 50% гідроксиламіну/50% води (у масовому відношенні) і перемішували за допомогою магнітної мішалки при температурі 25°С. Більшість часу відділявся кристалічний N'гідроксіетанімідамід. Суміш перемішували протягом 24год. при кімнатній температурі до завершення утворення кристалів і наступного дня відфільтровували. У разі, коли тверда речовина початково не відділялася, відбирали невелику кількість розчину, випаровували, і одержані кристали вносили як затравку в основний розчин. Одержаний продукт очищали таким чином: кристали відфільтровували, після чого розчиняли у неполярному розчиннику (перфторгексані) при нагріванні і охолоджували протягом ночі при температурі навколишнього середовища для перекристалізації. Після цього одержаний кристалічний матеріал відфільтровували і промивали перфторгексаном. Цільовий продукт, N'-гідроксіетанімідамід, мав температуру плавлення 136-138°С і вихід приблизно 56%. Метод В: наприклад, трет-бутил-2-аміно-2(гідроксііміно)етилкарбамат (Схема 2, сполука XI) Триетиламін (535мкл, 3,84ммоль) додавали до розчину трет-бутилціанметилкарбамату (500мг, 3,20ммоль) та гідрохлориду гідроксиламіну (227мг, 3,84ммоль) в етанолі (10мл). Після цього реакційну суміш нагрівали протягом ночі при температурі 80°С. Одержаний розчин випаровували у вакуумі. До одержаного залишку додавали етилацетат (10мл), і відфільтровували гідрохлорид триетиламіну. Одержаний розчин випаровували у вакуумі з 41 75145 42 одержанням неочищеного продукту. 1Н), 3,15 (m, 1H), 3,9 (s, 3H), 4,2 (m, 2H), 4,5 (m, 1 H ЯМР (360МГц, DMSO); 1,53 (s, 9Н), 3,621H), 7,2 (m, 1H), 7,65 (m, 1H). 3,63 (d, 2Н), 5,33-5,44 (s, 2Н) 7,10(t, 1Н), 8,94(s, Трет-бутил-(2S,4EZ)-2-(амінокарбоніл)-41H). (метоксііміно)-1-піролідин-карбоксилат (20г, Так само, застосовуючи Метод В та викорис77,7ммоль) завантажували у круглодонну колбу товуючи як вихідні продукти відповідні продажні місткістю 1л в інертній атмосфері. У колбу заванкарбонітрили та гідрохлорид гідроксиламіну, були тажували спочатку безводний дихлорметан одержані перелічені нижче аналогічні проміжні (140мл), потім TFA (60мл). Реакційну суміш переамідоксими: (2RS)-N',2-дигідроксибутанімідамід, мішували при кімнатній температурі протягом (1S,2R)-N',290хв., контролюючи зникнення вихідного матеріадигідроксициклогексанкарбоксимідамід, N',3лу методом хроматографії в тонкому шарі (елюент дигідроксипропанімідамід, N',210% МеОН у DCM). Після цього до реакційної судигідроксіетанімідамід, (2RS)-N',2-дигідрокси-2міші додавали толуол (200мл), і розчинники видафенілетанімідамід, трет-бутил-4ляли у вакуумі. Одержаний залишок повторно роз[аміно(гідроксііміно)метил]-1чиняли в DCM (200мл), охолоджували до піперидинкарбоксилат, трет-бутил-(3RS)-3температури -5°С, і додавали триетиламін (43мл, [аміно(гідроксііміно)метил]-1311ммоль) (реакція екзотермічна). До реакційної піперидинкарбоксилат, трет-бутил-(2RS)-2суміші додавали [1,1'-біфеніл]-4-карбонілхлорид [аміно(гідроксііміно)метил]-1(16,8г, 77,7ммоль) і перемішували при кімнатній піперидинкарбоксилат, етилтемпературі протягом 1,5год. На цьому етапі вноаміно(гідроксііміно)етаноат. сили додаткову кількість DCM (500мл) та 1М НСI Проміжна сполука 8: (2S,4EZ)-1-([1,1'-біфеніл](250мл). Одержану суміш енергійно перемішували, 4-ілкарбоніл)-N'-гідрокси-4-(метоксііміно)-2і осад відфільтровували. Шари фільтрату розділяпіролідинкарбоксимідамш (Схема 8, сполука XV) ли, органічний шар промивали 1М НСI (250мл) і насиченим розчином бікарбонату (250мл). Водний шар з основною реакцією піддавали зворотному промиванню DCM (250мл), об'єднані органічні фази сушили над сульфатом магнію, фільтрували, і фільтрат концентрували до об'єму приблизно 200мл. Одержану суспензію фільтрували з одер1-(трет-бутоксикарбоніл)-4-(метоксііміно)-2жанням цільового продукту, (2S,4EZ)-1-([1,1'піролідинкарбонову кислоту (Проміжна сполука 2, біфеніл]-4-ілкарбоніл)-4-(метоксііміно)-295,9г, 0,371моль) завантажували в колбу місткістю піролідинкарбоксаміду, у вигляді твердої речовини 3л з відбортованим горлом, обладнану підвісною не зовсім білого кольору (7,3г, 28%). Шляхом домішалкою, вхідним та вихідним патрубками для давання гексану (125мл) до фільтрату можна було подавання азоту та датчиком температури. У колодержати додаткову кількість матеріалу нижчого бу завантажували сухий THF (1,15л), і одержаний рівня чистоти (7,9г, 30%) розчин охолоджували до температури -20°С, після 1 Н ЯМР (400МГц, DMSO); 2,6 (m, 1H), 3,2 (m, чого додавали триетиламін (52мл, 0,371моль). 1Н), 3,8 (m, 3H), 4,1-4,5 (m, 2H), 4,9 (m, 1H), 7,2-8,0 Розчин перемішували протягом 10хв. До розчину (m, 11H). протягом 10хв. додавали етилхлорформіат (35мл, (2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-40,371моль), підтримуючи температуру на рівні (метоксііміно)-2-піролідин-карбоксамід (7,46г, приблизно -20°С. Після цього реакційну суміш до22,1ммоль) вносили у круглодонну колбу, і додадатково перемішували протягом 30хв. при згаданій вали піридин (400мл) та n-толуолсульфонілхлорид температурі. Готували насичений розчин аміаку в (4,21г, 22,1ммоль). Одержану суспензію нагрівали THF шляхом барботування аміаком 250мл сухого при температурі 80°С протягом 4год. Розчинник THF протягом 15хв. при температурі -78°С. Розчин видаляли у вакуумі, одержаний залишок розчиняаміаку через канюлю додавали до реакційної сули в DCM (400мл), розчин промивали 1М НСl міші протягом 10хв. при підтримуванні температу(2 75мл) і насиченим розчином бікарбонату ри суміші нижче -25°С для регулювання виділення (70мл), сушили над сульфатом натрію, фільтруватепла реакції. Одержаний розчин витримували ли, і видаляли розчинник у вакуумі. Після очищенпротягом 2год. до досягнення ним кімнатної темня шляхом хроматографування на силікагелі на ператури, після чого додатково перемішували прокоротких колонках з елююванням спочатку дихлотягом 1год. Розчинник із реакційної суміші видалярметаном для видалення менш полярного матеріли у вакуумі, і розподіляли одержаний залишок алу і потім 1% МЕОН у DCM, одержали цільову між дихлорметаном (500мл) та водою (500мл). сполуку, (2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4Після відділення органічний шар промивали водою (метоксііміно)-2-піролідинкарбонітрил, у вигляді не (3 250мл), об'єднані водні шари промивали зовсім білої твердої речовини (4,2г, 60%). (2 250мл) DCM, і цей DCM піддавали зворотному 1 H ЯМР (400МГц, DMSO); 3,0 (m, 1H), 3,2 (m, промиванню водою (100мл). Об'єднані органічні 1H), 3,7 (m, 3H), 4,2 (m, 1H), 4,5 (m, 1H), 5,4 (m, шари сушили над сульфатом натрію, фільтрували, 1H), 7,4-7,8 (m, 9H). і розчинник видаляли у вакуумі. Цільовий продукт, За загальною методикою, описаною вище для трет-бутил-(2S,4EZ)-2-(амінокарбоніл)-4синтезу Проміжної сполуки 8, триетиламін (1,94мл, (метоксііміно)-1-піролідинкарбоксилат, одержали у 13,94ммоль) повільно при перемішуванні додававигляді аморфної твердої речовини білого кольору ли до суспензії (2S,4EZ)-1-([1,1'-біфеніл]-4(85,8г, 90%). 1 ілкарбоніл)-4-(метоксііміно)-2H ЯМР (400МГц, DMSO); 1,5 (s, 9Н), 2,65 (m, 43 75145 44 піролідинкарбонітрилу (3,71г, 11,62ммоль) та гід0,15моль) та карбонату натрію (250г) у толуолі рохлориду гідроксиламіну (0,97г, 13,94ммоль) в (500мл) та воді (500мл) в атмосфері азоту додаетанолі (150мл). Одержану реакційну суміш перевали тетракіс-трифенілфосфін паладію (0) (9г, мішували при температурі 80°С протягом 16год., 0,0074моль). Одержану реакційну суміш нагрівали після чого охолоджували до температури навкозі зворотним холодильником протягом 10год. Післишнього середовища. Розчинник видаляли випаля цього до реакційної суміші додавали 100мл ровуванням, тверду речовину суспендували у воді 10% NaOH, водний шар відділяли і промивали (100мл), після чого відфільтровували. Тверду ретолуолом (2 200мл). При підкисленні водного шачовину промивали на спеченому фільтрі діетилору 3-н. розчином НСl одержали твердий продукт, вим ефіром (2 100мл), після чого сушили у вакууякий відфільтровували, промивали водою та сумі при температурі 40°С з одержанням цільового шили. Після цього неочищений продукт кристаліпродукту, (2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)зували з толуолу з одержанням 2'-метил[1,1'N'-гідрокси-4-(метоксііміно)-2біфеніл]-4-карбонової кислоти (20г, 62,5%). І, напіролідинкарбоксіімідаміду (3,35г, 82%). впаки, згаданий продукт можна також одержати з 1 H-ЯМР (400МГц, DMSO): 2,6-2,7 (m, 1H), 2,91-бром-2-метилбензолу та 43,1 (m, 1H), 3,6-3,75 (m, 3H), 4,0-4,2 (m, 1H), 4,2-4,4 карбоксибензолборної кислоти в аналогічних умо(m, 1H), 4,6 (m, 0,5H), 5,1 (m, 0,5H), 5,5 (m, 2H), вах. 1 7,4-7,8 (m, 9H), 9,2-9,4 (m, 1H). H ЯМР (300МГц, DMSO); 2,2 (s, 3Н), 7,2-7,4 Проміжна сполука 9: трет-бутил (2S,4EZ)-2(m, 4H), 7,43 (d, J=9Гц, 2Н), 7,99 (d, J=9Гц, 2Н), 13 (гідразинокарбоніл)-4-(метоксііміно)-1(b, 1Н). піролідинкарбоксилат (Схема 10, сполука XVII) Аналогічно, використовуючи відповідні продажні борні кислоти та арилброміди, одержали перелічені нижче споріднені проміжні похідні 1,1'біфенілу (12): 4'-метил[1,1'-біфеніл]-4-карбонову кислоту; 2',3-диметил[1,1'-біфеніл]-4-карбонову кислоту; 2',6'-диметил[1,1'-біфеніл]-4-карбонову кислоту; 2-метил[1,1'-біфеніл]-4-карбонову кислоГотували розчин, що містив, наприклад, (4ЕZ)ту; 3-метил[1,1'-біфеніл]-4-карбонову кислоту; 2,2'1-(трет-бутоксикарбоніл)-4-(метоксііміно)-2диметил[1,1'-біфеніл]-4-карбонову кислоту; 2'піролідинкарбонову кислоту (Проміжна сполука 2, метокси- [1,1'-біфеніл]-4-карбонову кислоту; 3'17,81ммоль; 4,6г) у суміші (1:1) метанолу та толуметокси [1,1'-біфеніл]-4-карбонову кислоту; 4'олу (250мл). Після цього до згаданого розчину, метокси[1,1'-біфеніл]-4-карбонову кислоту; 2'перемішуваного при кімнатній температурі в атмохлор[1,1'-біфеніл]-4-карбонову кислоту; 3'сфері азоту, крапля за краплею додавали тримехлор[1,1'-біфеніл]-4-карбонову кислоту; 4'тилсилілдіазометан (32,5мл 2М розчину в гексані, хлор[1,1'-біфеніл]-4-карбонову кислоту; 3',4'59ммоль). Після закінчення виділення газоподібдихлор[1,1'-біфеніл]-4-карбонову кислоту; 2'ного азоту, одержаний розчин жовтого кольору (трифторметил)[1,1'-біфеніл]-4-карбонову кислоту; випаровували у вакуумі, залишок повторно розчи3'-(трифторметил)[1,1'-біфеніл]-4-карбонову кисняли в DCM, промивали насиченим розчином лоту; 2'-ціан[1,1'-біфеніл]-4-карбонову кислоту; NH4CІ, 10% NaHCO3 і розсолом, сушили над 2',4'-дифтор[1,1'-біфеніл]-4-карбонову кислоту; 4Na2SO4 і випаровували у вакуумі з одержанням (2-піридиніл)бензойну кислоту; 4-(3цільової сполуки, 1-трет-бутил-2-метил-(2S,4EZ)-4піридиніл)бензойну кислоту; 4-(4(метоксііміно)-1,2-піролідин-дикарбоксилату, у випіридиніл)бензойну кислоту; 4-(5гляді масла жовтого кольору (4,0г, 83%). піримідиніл)бензойну кислоту та інші. 1-трет-бутил-2-метил-(2S,4EZ)-4Проміжна сполука 11: 4-(3-метил-2(метоксііміно)-1,2-піролідин-дикарбоксилат піридиніл)бензойна кислота (1,95ммоль; 530мг) розчиняли в 4мл МеОН, і доСуміш 2-бром-3-метилпіридину (22,5г, давали розчин (4мл) МеОН та 1,5мл (d=1.03; 0,1312моль), 4-(гідроксиметил)-фенілборної кис30,86ммоль) 80% гідразин-гідрату (кінцева конценлоти (25г; 0,164моль), Pd(PPh3)4 (9,5г, 0,0082моль) трація NH2NH2 13%). Реакційну суміш перемішута розчину карбонату натрію (200г у 500мл води) в вали протягом 2 днів. Розчинники випаровували у толуолі (750мл) нагрівали зі зворотним холодильвакуумі, одержаний залишок повторно розчиняли у ником в атмосфері азоту протягом 15год. ТолуоМеОН і випаровували (цю операцію повторювали льний шар відділяли і переганяли під зниженим тричі). Цільову сполуку, трет-бутил-(2S,4EZ)-2тиском, одержуючи залишок. Одержаний залишок (гідразинкарбоніл)-4-(метоксііміно)-1очищали хроматографією на колонці, і одержувапіролідинкарбоксилат, виділяли у вигляді масла ли [4-(3-метил-2-піридиніл)феніл]метанол (12г, жовтого кольору (500мг; 94%). 1 47%). H ЯМР (CDCI3): 1,47 (s, 9H, СН3), 2,8-3,2 (m, До розчину [4-(3-метил-22Н, СН2), 3,87 (s, 3Н, СН3-О), 3,95-4,3 (m, 2Н, піридиніл)феніл]метанолу (12г, 0,06моль) у безвоСН2), 4,52 (m, 1Н, CH-N), MS(APCI+): 273,0, +1 дному DMF (150мл) додавали дихромат піридинію 545,4(2M ). (91г, 0,24моль) і перемішували при кімнатній темПроміжна сполука 10: 2'-метил[1,1'-біфеніл]-4пературі протягом 3 днів. Одержану реакційну сукарбонова кислота міш виливали у воду і екстрагували етилацетатом (250мл). Органічний шар промивали водою, розсолом, сушили і концентрували. Неочищену речоДо суміші 4-бромбензойної кислоти (30г, вину очищали хроматографією на колонці із силі0,15моль), 2-метилфенілборної кислоти (24г, 45 75145 46 кагелем з одержанням 4-(3-метил-26,50г, 25,17ммоль) та ацетамідоксиму (Проміжна піридиніл)бензойної кислоти (3г, 25%) у вигляді сполука 7, 1,86г, 25,17ммоль) у DCM (55мл), і петвердої речовини білого кольору. ремішували протягом ночі при кімнатній темпера1 H ЯМР (300МГц, DMSO); 2,3 (s, 3Н), 7,33 (dd, турі (нерозчинні у DCM амідоксими попередньо J=7,5Гц, 5Гц, 1H), 7,67 (d, J=8Гц, 2Н), 7,75 (d, розчиняли в THF, до якого додавали розчин DIC та J=7,5Гц, 1Н), 8,01 (d, J=8Гц, 2Н), 8,50 (d, J=5Гц, Проміжної сполуки 2 у DCM). Після фільтрації із 1Н), 13 (b, 1H). застосуванням вакууму і випаровування у вакуумі Проміжна сполука 12: 4-(1-оксидо-3одержаний залишок розчиняли у піридині (60мл), піридиніл)бензойна кислота нагрівали зі зворотним холодильником протягом До суміші 4-толілборної кислоти (38г, 1год., потім охолоджували і відстоювали протягом 0,28моль), 3-бромпіридину (44г, 0,28моль), Na2CO3 ночі, після чого випаровували у вакуумі. Неочище(200г) в толуолі (500мл) та воді (500мл) додавали ний продукт розчиняли в DCM (50мл) і промивали Pd(PPh3)4 (16г, 0,014моль) і нагрівали зі зворотним спочатку насиченим водним розчином NaHCO3 холодильником протягом 16год. Одержану реак(2 50мл), потім 1М водним розчином НСl ційну суміш охолоджували, відділений органічний (2 50мл), сушили над сульфатом магнію і випарошар промивали водою і розсолом і сушили. Розвували у вакуумі (вихід неочищеного продукту чинник видаляли, одержуючи 4-(3-піридил)толуол 70%). Після хроматографування на силікагелі з (42г, 90%). елююванням 15% етилацетату в гексані одержали До суміші 4-(3-піридил)толуолу (35г, цільову сполуку, трет-бутил-(2S,4ЕZ)-40,207моль) у піридині (400мл) та воді (400мл) час(метоксііміно)-2-(3-метил-1,2,4-оксадіазол-5-іл)-1тинами додавали KМnО4 (16 г, 1,03моль) і нагрівапіролідинкарбоксилат (4,4г, 60% вихід). 1 ли зі зворотним холодильником протягом 12год. H ЯМР (360МГц, DMSO); 1,3-1,6 (d, 9Н), 2,4 Одержану реакційну суміш фільтрували через це(s, 3Н), 2,8-3,4 (m, 2H), 3,9 (s, 3Н), 4,3 (s, 2Н), 5,2літ і підкислювали концентрованою НСl. Продукт 5,4 (m, 1H). промивали водою і сушили з одержанням 4-(3b) Методика стадії відщеплення групи захисту піридил)бензойної кислоти (32г, 76%) у вигляді азоту твердої речовини білого кольору. До суміші 4-(3Готували розчин, що містив трет-бутилпіридил)бензойної кислоти (22г, 0,11моль) у THF (2S,4EZ)-4-(метоксііміно)-2-(3-метил-1,2,4(2,5л) додавали mСРВА (152г, 0,44моль, 50%), і оксадіазол-5-іл)-1-піролідинкарбоксилат (1,26г, перемішували при кімнатній температурі протягом 4,25ммоль) у безводному DCM (120мл). Реакційну 12год. Тверду речовину відділяли фільтруванням і суміш при температурі 0°С повільно барботували промивали THF з одержанням 4-(1-оксидо-3газоподібним НСl, попередньо висушеним у вловпіридиніл)бензойної кислоти (20г, 86%). лювачах із H2SO4 та активованим вугіллям, і від1 H ЯМР (300МГц, DMSO); 7,5-7,8 (m, 5Н), 7,9 щеплення захисної групи контролювали хроматог(d, J=8Гц, 2Н), 8,33 (d, J=5Гц, 2Н). рафією в тонкому шарі із застосуванням суміші Аналогічно, використовуючи як вихідний проциклогексану/етилацетату (1/1) та проявлення дукт 4-толілборну кислоту (45г, 0,33моль) та 2плям розчином Панкальді (Pancaldi). Через приббромпіридин (52г, 0,33моль), одержали споріднену лизно 45хв. хроматографія в тонкому шарі показапроміжну сполуку, 4-(1-оксидо-2ла відсутність вихідного матеріалу, після чого DCM піридиніл)бензойну кислоту. випаровували під вакуумом без нагрівання для Приклад 1: Загальна методика рідкофазового запобігання розкладу солі піролідину. Після цього синтезу похідних піролідиноксадіазолу загальної додавали DCM (20мл) і знову випаровували під формули І із В=ІІа (Схеми 1,11): (3EZ,5S)-1-([1,1'вакуумом для видалення залишкового активного біфеніл1-4-ілкарбоніл)-5-(3-метил-1,2,4НСl (2-3 рази). Цільовий продукт, хлористоводневу оксадіазол-5-іл)-3-піролідинону О-мєтилоксиму: сіль (3EZ,5S)-5-(3-метил-1,2,4-оксадіазол-5-іл)-3(3E,5S)-1-[(2'-метил[1,1'-біфеніл]-4-іл)карбоніл]-5піролідинону О-метилоксиму, виділяли у вигляді (3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону Отвердої речовини білого кольору і використовуваметилоксиму та (3Z,5S)-1-[(2'-метил[1,1'-біфеніл]ли без додаткового очищення та визначення влас4-іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3тивостей. піролідинону О-метилоксиму c) Методики стадії блокування азоту Метод А: До розчину хлористоводневої солі (3EZ,5S)-5-(3-метил-1,2,4-оксадіазол-5-іл)-3піролідинону О-метилоксиму (200мг, 0,86ммоль) у DCM (5мл) спочатку додавали [1,1'-біфеніл]-4карбонілхлорид (205мг, 0,95ммоль), потім діізопропілетиламін (314мкл, 1,81ммоль) і перемішували протягом ночі при кімнатній температурі. До реакційної суміші додавали амінометилполістирол (250мг) і перемішували протягом 1год., після чого фільтрували із застосуванням вакууму. Одержаний розчин промивали водним розчином лимонної а) Методика одержання оксадіазолового циклу кислоти (2 5мл), після чого сушили над MgSO4 та Діізопропілкарбодіімід (3,16г, 25,17ммоль) довипаровували у вакуумі. Одержаний продукт, давали до розчину (2S,4EZ)-1-(трет(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-(3-метилбутоксикарбоніл)-4-(метоксііміно)-21,2,4-оксадіазол-5-іл)-3-піролідинону Опіролідинкарбонової кислоти (Проміжна сполука 2, метилоксим, очищали хроматографією на силіка 47 75145 48 гелі з елююванням 20% етилацетату в гексані хроматографії як суміш E-/Z-ізомерів у вигляді ма(60мг, вихід 19%). сла з виходом 31% (чистота за даними РХВЕ Метод В: Готували розчин, що містив хлорис98,5%). товодневу сіль (3EZ,5S)-5-(3-метил-1,2,4Масло; 1H ЯМР (300МГц, CDCI3): 2,41 (s, 3Н, оксадіазол-5-іл)-3-піролідинону О-метилоксиму, 2'СН3), 2,96-3,31 (m, 2H, СН2), 3,87 (s, 3Н, NOCH3), метил-[1,1'-біфеніл]-4-карбонову кислоту (0,857г, 4,31-4,59 (m, 2Н, СН2), 6,03 (m, 1Н), 7,30 (s, 3Н, Η 4,04ммоль, 0,95екв.) та факультативно DMAP аром.), 7,50-7,64 (m, 5Н, Η аром.); MS(ESI+): 411,2; (1,03г, 8,50ммоль, 2,0екв.) у безводному DCM MS(ESI-): 408,9. (120мл). Реакційну суміш перемішували при кімнаПриклад 3: (3EZ,5S)-(3-метил-1,2,4-оксадіазолтній температурі протягом 10хв., потім охолоджу5-іл)-1-{[2'-(трифторметил)[1,1'-біфеніл]-4вали до 0°С. При температурі 0°С частинами проіл]карбоніл}-3-піролідинону О-метилоксим тягом 30хв. повільно додавали EDC та НСl (815мг, 4,25ммоль). Реакційну суміш перемішували при температурі 0°С протягом 2год. і обережно нагрівали до кімнатної температури протягом ночі. Після завершення реакції органічну фазу двічі промивали лимонною кислотою (10%) та карбонатом натрію (10%). Органічну фазу сушили і випаровуІз застосуванням загальної методики, описаної вали. Неочищений продукт очищали та розділяли в Прикладі 1 (Метод В), використовуючи як вихідні на (Е)- та (Z)-ізомери хроматографуванням на косполуки (2S,4EZ)-1-(трет-бутоксикарбоніл)-4лонці (система Biotage, колонка 40М, 90г SiO2, із (метоксііміно)-2-піролідин-карбонову кислоту застосуванням суміші циклогексану/етилацетату (Проміжна сполука 2), N'-гідроксіетанімідамід (1/1) як елюенту), і одержали (3E,5S)-1-[(2'(Проміжна сполука 7) та 2'-(трифторметил) [1,1'метил[1,1'-біфеніл]-4-іл)карбоніл]-5-(3-метил-1,2,4біфеніл]-4-карбонову кислоту (Проміжна сполука оксадіазол-5-іл)-3-піролідинону О-метилоксим 10), вказану в заголовку сполуку виділили після (770мг, 34%) у вигляді безбарвного масла, чистота флеш-хроматографії як суміш E-/Z-ізомерів у виза даними РХВЕ 97,5%) та (3Z,5S)-1-[(2'гляді масла з виходом 44% (чистота за даними метил[1,1'-біфеніл]-4-іл)карбоніл]-5-(3-метил-1,2,4РХВЕ 88,2%). оксадіазол-5-іл)-3-піролідинону О-метилоксим Масло; 1H ЯМР (300МГц, CDCI3): 2,40 (s, 3Н, (740мг, 33%) у вигляді безбарвного масла, чистота СН3), 2,88-3,31 (m, 2H, CH2), 3,87 (s, 3Н, NOCH3), за даними РХВЕ 98,3%). 4,27-4,53 (m, 2H, CH2), 6,03 (m, 1H), 7,27-7,70 (m, (3E,5S)-1-[(2'-метил[1,1'-біфеніл]-47H, Η аром.), 7,77 (m, 1H, Η аром.); MS(ESI+): іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3445,4; MS(ESI ): 443,1. піролідинону О-метилоксим: масло; 1H ЯМР Приклад 4: (3E,5S)-1-[(2'-фтор[1,1'-біфеніл1-4(300МГц, CDCI3): 2,28 (s, 3Н, ArCH3), 2,42 (s, 3H, іл)карбоніл1-5-(3-метил-1,2,4-оксадіазол-5-іл)-3CH3), 3,03-3,32 (m, 2Н), 3,88 (s, 3Н, NOCH3), 4,38піролідинону О-метилоксим та (3Ζ,5S)-1-[(2'4,59 (m, 2H), 6,03 (m, 1H), 7,22-7,29 (m, 5H, Η фтор[1,1'-біфеніл]-4-іл)карбоніл]-5-(3-метил-1,2,4аром.), 7,40-7,44 (m, 2H, Η аром.), 7,55 (m, 1H); оксадіазол-5-іл)-3-піролідинону О-метилоксим MS(APCI+): 391,5; MS(APCl-): 389,2. (3Z,5S)-1-[(2'-метил[1,1'-біфеніл]-4іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3піролідинону О-метилоксим: біла тверда речовина, т.пл. 146,5°С; ІЧ (чистий) 2936, 1645, 1583, 1408, 1323, 1047, 890 см-1; 1H ЯМР (300МГц, CDCI3): 2,28 Із застосуванням загальної методики, описаної (s, 3Н, ArCH3), 2,42 (s, 3Н, СН3), 3,03-3,32 (m, 2H), в Прикладі 1 (Метод В), використовуючи як вихідні 3,88 (s, 3Н, NOCH3), 4,38-4,59 (m, 2H), 6,03 (m, 1H), сполуки (2S,4EZ)-1-(трет-бутоксикарбоніл)-47,22-7,29 (m, 5H, Η аром.), 7,40-7,44 (m, 2H, Η (метоксііміно)-2-піролідин-карбонову кислоту аром.), 7,55 (m, 1H); MS(APCI+): 391,5; MS(APCI-): (Проміжна сполука 2), N'-гідроксіетанімідамід 389,2. (Проміжна сполука 7) та 2'-фтор[1,1'-біфеніл]-4Приклад 2: (3EZ,5S)-1-[(2'-хлор[1,1'-біфеніл1-4карбонову кислоту (Проміжна сполука 10), вказані іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3в заголовку сполуки одержали як суміші E-/Zпіролідинону О-метилоксим ізомерів із подальшим розділенням засобами флеш-хроматографії з одержанням (3E,5S)-1-[(2'фтор[1,1'-біфеніл]-4-іл)карбоніл]-5-(3-метил-1,2,4оксадіазол-5-іл)-3-піролідинону О-метилоксиму з виходом 11% (чистота за даними РХВЕ 95,0%) та (3Z,5S)-1-[(2'-фтор[1,1'-біфеніл]-4-іл)карбоніл]-5-(3метил-1,2,4-оксадіазол-5-іл)-3-піролідинону ОІз застосуванням загальної методики, описаної метилоксиму з виходом 11% (чистота за даними в Прикладі 1 (Метод В), використовуючи як вихідні РХВЕ 98,2%). продукти (2S,4EZ)-1-(трет-бутоксикарбоніл)-4(3E,5S)-1-[(2'-фтор[1,1'-біфеніл]-4-іл)карбоніл](метоксііміно)-2-піролідин-карбонової кислоти 5-(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону О(Проміжна сполука 2), N'-гідроксіетанімідаміду метилоксим: масло; 1H ЯМР (300МГц, CDCI3): 2,42 (Проміжна сполука 7) та 2'-хлор[1,1'-біфеніл]-4(s, 3Н, СН3), 3,07-3,25 (m, 2H, СН2), 3,87 (s, 3Н, карбонової кислоти (Проміжна сполука 10), вказаNOCH3), 4,42-4,52 (m, 2Н, СН2), 6,04 (m, 1H), 7,15ну в заголовку сполуку виділили після флеш 49 75145 50 7,29 (m, 2Н, Η аром.), 7,30-7,44 (m, 2Н, Η аром.), піролідинону О-метилоксим: масло; 1Н ЯМР 7,70 (m, 4Н); MS(ESI+): 395,0; MS(ESI-): 393,0. (300МГц, CDCI3): 2,31 (s, 3Н, СН3), 2,78-3,24 (m, (3Z,5S)-1-[(2'-фтор[1,1'-біфеніл]-4-іл)карбоніл]2Н, СН2), 3,77 (s, 3Н, NOCH3), 4,30-4,52 (m, 2Н, 5-(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону ОСН2), 5,93 (m, 1H), 6,88-7,60 (m, 7Н, Η аром.); метилоксим: масло; 1Н ЯМР (300МГц, CDCI3): 2,42 MS(ESI+): 429,20. (s, 3Н, СН3), 3,02 (m, 1H, СН), 3,25 (m, 1Н, CH), (3Z,5S)-1-[(2'-хлор-4'-фтор[1,1'-біфеніл]-43,87 (s, 3Н, NOCH3), 4,34-4,58 (m, 2H, CH2), 6,04 іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3(m, 1H), 7,15-7,29 (m, 2H, Η аром.), 7,30-7,44 (m, піролідинону О-метилоксим: масло; 1Н ЯМР + 2H, Η аром.), 7,70 (m, 4H); MS(ESI ): 395,0; MS(Esl (300МГц, CDCI3): 2,31 (s, 3Н, СН3), 2,78-3,24 (m, ): 393,0. 2Н, СН2), 3,77 (s, 3Н, NOCH3), 4,30-4,52 (m, 2Н, Приклад 5: (3EZ,5S)-1-[(4'-фтор[1,1'-біфеніл1СН2), 5,93 (m, 1H), 6,88-7,60 (m, 7Н, Η аром.); 4-іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3MS(ESI+): 429,20. піролідинону О-метилоксим Приклад 7: (3EZ,5S)-1-[(2',4'-дифтор[1,1'біфеніл]-4-іл)карбоніл]-5-(3-метил-1,2,4оксадіазол-5-іл)-3-піролідинону О-метилоксим; (3Z,5S)-1-[(2',4'-дифтор[1,1'-біфеніл]-4-іл)карбоніл]5-(3-метил-1,2,4-оксадіазол-5-іл)-3-піролідинону Ометилоксим; (3E,5S)-1-[(2',4'-дифтор[1,1'-біфеніл|4-іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3піролідинону О-метилоксим Із застосуванням загальної методики, описаної в Прикладі 1 (Метод В), використовуючи як вихідні сполуки (2S,4EZ)-)-1-(трет-бутоксикарбоніл)-4(метоксііміно)-2-піролідин-карбонову кислоту (Проміжна сполука 2), N'-гідроксіетанімідамід (Проміжна сполука 7) та 4'-фтор[1,1'-біфеніл]-4карбонову кислоту (Проміжна сполука 10), вказану Із застосуванням загальної методики, описаної в заголовку сполуку виділили після флешв Прикладі 1 (Метод В), використовуючи як вихідні хроматографії як суміш E-/Z-ізомерів у вигляді масполуки (2S,4EZ)-1-(трет-бутоксикарбоніл)-4сла з виходом 32% (чистота за даними РХВЕ (метоксііміно)-2-піролідин-карбонову кислоту 94,1%). (Проміжна сполука 2), N'-гідроксіетанімідамід Масло; 1H ЯМР (300МГц, CDCI3): 2,42 (s, 3Н, (Проміжна сполука 7) та 2',4'-дифтор [1,1'-біфеніл]СН3), 2,95-3,30 (m, 2H, СН2), 3,87 (s, 3Н, NOCH3), 4-карбонову кислоту (Проміжна сполука 10), вка4,27-4,55 (m, 2Н, СН2), 6,02 (m, 1Н), 7,12 (m, 2Н, Η зану в заголовку сполуку виділили після флешаром.), 7,27-7,61 (m, 6Н, Η аром.); MS(ESI+): 395,5; хроматографії як суміш E-/Z-ізомерів у вигляді маMS(ESI-): 393,4. сла із загальним виходом 37% (чистота за даними Приклад 6: (3EZ,5S)-1-[(2'-хлор-4'-фтор[1,1'РХВЕ 98,6%). Подальше флеш-хроматографічне біфеніл]-4-іл)карбоніл]-5-(3-метил-1,2,4розділення Е- та Z-ізомерів забезпечило одержаноксадіазол-5-іл)-3-піролідинону О-метилоксим; ня (3Z,5S)-1-[(2',4'-дифтор[1,1'-біфеніл]-4(3Z,5S)-1-[(2'-хлор-4'-фтор[1,1'-біфеніл]-4іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3піролідинону О-метилоксиму з виходом 15% (чиспіролідинону О-метилоксим тота за даними HPLC 98,5%) та (3E,5S)-1-[(2',4'дифтор[1,1'-біфеніл]-4-іл)карбоніл]-5-(3-метил1,2,4-оксадіазол-5-іл)-3-піролідинону Ометилоксиму з виходом 13% (чистота за даними РХВЕ 97,5%). (3EZ,5S)-1-[(2',4'-дифтор[1,1'-біфеніл]-4іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3Із застосуванням загальної методики, описаної піролідинону О-метилоксим: масло; 1Н ЯМР в Прикладі 1 (Метод В), використовуючи як вихідні (300МГц, CDCI3): 2,34 (s, 3Н, СН3), 2,86-3,25 (m, сполуки (2S,4EZ)-1-(трет-бутоксикарбоніл)-42H, СН2), 3,79 (s, 3H, NOCH3), 4,30-4,52 (m, 2Н, (метоксііміно)-2-піролідин-карбонову кислоту СН2), 5,96 (m, 1Н), 6,82-7,01 (m, 2Н, Η аром.), 7,32(Проміжна сполука 2), N'-гідроксіетанімідамід 7,66 (m, 5Н, Η аром.); MS(ESI+): 413,40 ; MS(ESl-): (Проміжна сполука 7) та 2'-хлор-4'-фтор-[1,1'411,20. біфеніл]-4-карбонову кислоту (Проміжна сполука (3Z,5S)-1-[(2',4'-дифтор[1,1'-біфеніл]-410), вказану в заголовку сполуку виділили після іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3флеш-хроматографії як суміш E-/Z-ізомерів у випіролідинону О-метилоксим: масло; 1H ЯМР гляді масла із загальним виходом 60% (чистота за (300МГц, CDCI3): 2,31 (s, 3Н, СН3), 2,78-3,24 (m, даними РХВЕ 95,20%). Подальше флеш2H, СН2), 3,77 (s, 3Н, NOCH3), 4,30-4,52 (m, 2Н, хроматографування забезпечило одержання СН2), 5,93 (m, 1Н), 6,88-7,60 (m, 7Н, Η аром.); (3Z,5S)-1-[(2'-хлор-4'-фтор[1,1'-біфеніл]-4MS(ESI+): 413,40; MS(ESI-): 411,20. іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3(3E,5S)-1-[(2',4'-дифтор[1,1'-біфеніл]-4піролідинону О-метилоксиму з виходом 30% (чисіл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-3тота за даними РХВЕ 97,5%). піролідинону О-метилоксим: масло; 1H ЯМР (3EZ,5S)-1-[(2'-хлор-4'-фтор[1,1'-біфеніл]-4(300МГц, CDCI3): 2,31 (s, 3Н, СН3), 2,78-3,24 (m, іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол-5-іл)-32Н, СН2), 3,77 (s, 3Н, NOCH3), 4,30-4,52 (m, 2Н, 51 75145 52 СН2), 5,93 (m, 1Н), 6,88-7,60 (m, 7Н, Η аром.); (3E,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(2MS(ESI+): 413,40; MS(ESI-): 411,20. гідроксіетил)-1,2,4-оксадіазол-5-іл]-3-піролідинону Приклад 8: (3EZ,5S)-1-[(4'-фтор-2'-метил[1,1'О-метилоксим: біла тверда речовина, т.пл. бензил]-4-іл)карбоніл]-5-(3-метил-1,2,4-оксадіазол140,5°С; 1H ЯМР (300МГц, CDCI3): 2,98-3,05 (m, 5-іл)-3-піролідинону О-метилоксим 3Н, СН2), 3,33 (m, 1Н, СН2), 3,86 (s, 3Н, ОСН3), 4,35-4,57 (m, 2H, СН2), 6,04 (m, 1H, СН), 7,38-7,51 (m, 3Н, Н-Ar,), 7,51-7,61 (m, 6Н, Н-Ar,); M+(ESI+): 407,31; M(ESI-): 405,13. (3Z,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(2гідроксіетил)-1,2,4-оксадіазол-5-іл]-3-піролідинону О-метилоксим: біла тверда речовина, т.пл. 141°С; Із застосуванням загальної методики, описаної 1 H ЯМР (300МГц, CDCI3): 2,98-3,05 (m, 3Н, СН2), в Прикладі 1 (Метод В), використовуючи як вихідні 3,33 (m, 1Н, СН2), 3,86 (s, 3Н, ОСН3), 4,35-4,57 (m, сполуки (2S,4EZ)-1-(трет-бутоксикарбоніл)-42H, СН2), 6,04 (m, 1H, СН), 7,38-7,51 (m, 3Н, Н-Ar,), (метоксііміно)-2-піролідин-карбонову кислоту 7,51-7,61 (m, 6Н, Н-Ar,); M+(ESI+): 407,31; M(Esl-): (Проміжна сполука 2), N'-гідроксіетанімідамід 405,13. (Проміжна сполука 7) та 4'-фтор-2'-метил[1,1'Приклад 10: 2-{5-[(2S,4EZ)-1-([1,1'-біфеніл]-4біфеніл]-4-карбонову кислоту (Проміжна сполука ілкарбоніл)-4-(метоксііміно) піролідиніл]-1,2,410), вказану в заголовку сполуку виділили після оксадіазол-3-іл}етил[(третфлеш-хроматографії як суміш E-/Z-ізомерів у вибутоксикарбоніл)аміно]ацетат; 2-{5-[(2S,4EZ)-1гляді масла із загальним виходом 14% (чистота за ([1,1'-біфеніл]-4-ілкарбоніл)-4даними РХВЕ 95,2%). (метоксііміно)піролідиніл]-1,2,4-оксадіазол-3Масло; 1H ЯМР (300МГц, CDCI3) : 2,17 (s, 3Н, іл}етиламіноацетат СН ), 2,34 (s, 3Н, СН ), 2,86-3,26 (m, 2Н, СН ), 3,80 3 3 2 (s, 3Н, NOCH3), 4,33-4,45 (m, 2Н, СН2), 5,97 (m, 1Н), 6,82-6,95 (m, 2Н, Η аром.), 7,10-7,66 (m, 5Н, Η аром.); MS(ESI+): 409,33; MS(ESI-): 407,11. Приклад 9: (3E,5S)-1-[(1,1'-біфеніл]-4ілкарбоніл]-5-[3-(2-гідроксіетил)-1,2,4-оксадіазол-5іл]-3-піролідинону О-метилоксим; (3Z,5S)-1-[(1,1'біфеніл]-4-ілкарбоніл]-5-[3-(2-гідроксіетил)-1,2,4оксадіазол-5-іл]-3-піролідинону О-метилоксим Із застосуванням загальної методики, описаної в Прикладі 1 (Метод В), використовуючи як вихідні сполуки (2S,4EZ)-1-(трет-бутоксикарбоніл)-4(метоксііміно)-2-піролідин-карбонову кислоту (Проміжна сполука 2), N',3дигідроксипропанімідамід (Проміжна сполука 7) та [1,1'-біфеніл]-4-карбонову кислоту (Проміжна сполука 10), цільову сполуку виділили після флешхроматографії як суміш E-/Z-ізомерів у вигляді масла із загальним виходом 64% (чистота за даними РХВЕ 90%). На цій стадії було здійснено очищення з видаленням домішок із застосуванням розчину препарату пол-трисаміну (роl-trisamine, продукт фірми Novabiochem) у DCM із метою видалення кислотних побічних продуктів, відділення яких засобами флеш-хроматографії на колонках виявилося утрудненим. На кінцевій стадії Е- та Zізомери були розділені способом флешхроматографії на колонці (система Biotage, колонка 40М, 90г SiO2, із застосуванням суміші циклогексану/етилацетату (2/8) як елюенту); одержали (3E,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(2гідроксіетил)-1,2,4-оксадіазол-5-іл]-3-піролідинону О-метилоксим із виходом 25% (чистота за даними РХВЕ 98,0%) та (3Z,5S)-1-([1,1'-біфеніл]-4ілкарбоніл)-5-[3-(2-гідроксіетил)-1,2,4-оксадіазол-5іл]-3-піролідинону О-метилоксим із виходом 25% (чистота за даними РХВЕ 99,5%). До розчину (3Z,5S)-1-([1,1'-біфеніл]-4ілкарбоніл)-5-[3-(2-гідроксіетил)-1,2,4-оксадіазол-5іл]-3-піролідинону О-метилоксиму (1,59ммоль, Приклад 9), диметиламінопіридину (185мг, 1,51ммоль) та [(трет-бутоксикарбоніл)аміно]оцтової кислоти (264мг, 1,51ммоль) в DCM (50мл) при 0°С додавали частинами (протягом 15хв.) при перемішуванні EDC (290мг, 1,51ммоль). Після перемішування протягом 1год. при температурі 0°С реакційній суміші давали нагрітися до кімнатної температури. Проходження реакції контролювали хроматографією в тонкому шарі та рідинною хроматографією з масспектрометричним детектуванням. Після додаткової години перемішування при кімнатній температурі реакційну суміш гідролізували водою, промивали спочатку 10% лимонною кислотою (2 10мл), потім водним розчином Na2CO3 (2 10мл), сушили над MgSO4 і випаровували у вакуумі з одержанням неочищеного продукту. Після хроматографування на силікагелі з елююванням 40% EtOAc у циклогексані одержали цільову сполуку, (2-{5-[(2S,4ЕZ)-1([1,1'-біфеніл]-4-ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4-оксадіазол-3-іл}етил[(тpетбутоксикарбоніл)аміно]ацетат), у вигляді суміші Ета Z-ізомерів з виходом 90% (чистота за даними РХВЕ: 93,6%). M+(ESI+): 564,61; M(ESI-): 562,60. 2-{5-[(2S,4ЕZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4(метоксііміно)-піролідиніл]-1,2,4-оксадіазол-3іл}етил[(тpет-бутоксикарбоніл)аміно]ацетат (100мг, 0,178ммоль) обробляли 25% розчином TFA в DCM при 0°С протягом 1год. Після цього за допомогою розчину карбонату натрію (10%) реакцію суміші при температурі 0°С повільно доводили до основної, і екстрагували реакційну суміш DCM. Органічні фази об'єднували і сушили над сульфатом магнію; після видалення розчинника одержали цільову 53 75145 54 сполуку, 2-{5-[(2S,4EZ)-1-([1,1'-біфеніл]-41,80ммоль) обробляли 25% розчином TFA в DCM ілкарбоніл)-4-(метоксііміно)-піролідиніл]-1,2,4при 0°С протягом 1год. Після цього за допомогою оксадіазол-3-іл}етиламіноацетат, у вигляді масла з розчину карбонату натрію (10%) реакцію суміші виходом 70% (чистота за даними РХВЕ 94,6%). доводили до основної, і реакційну суміш екстрагуM+(ESI+): 464,17; M(Esl-): 462,86. вали DCM. Органічні фази об'єднували і сушили Приклад 11: (3EZ,5S)-1-[(2'-хлор-4'-фтор[1,1'над сульфатом магнію; після видалення розчиннибіфеніл]-4-іл)карбоніл]-5-[3-(2-гідроксіетил)-1,2,4ка одержали залишок, який очищали флешоксадіазол-5-іл]-3-піролідинону О-метилоксим хроматографією із застосуванням суміші циклогексану з етилацетатом (2/8) як елюенту з одержанням (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(4піперидиніл)-1,2,4-оксадіазол-5-іл]-3-піролідинону О-метилоксиму у вигляді суміші Ε-/Ζ-ізомерів із виходом 80% (чистота за даними РХВЕ 96,1%). Масло; 1H ЯМР (300МГц, CDCI3): 1,80-2,20 (m, 4Н, СН2), 2,90-3,50 (m, 8Н, СН2), 3,87 (s, 3Н, Із застосуванням загальної методики, описаної NOCH3), 4,30-4,60 (m, 2Н, СН2), 6,04 (m, 1Н, СН), в Прикладі 1 (Метод В), використовуючи як вихідні 7,48-7,64 (m, 9Н, Η аром.); MS(ESI+): 446,4. сполуки (2S,4EZ)-1-(тpет-бутоксикарбоніл)-4Приклад 13: (3EZ,5S)-5-[3-(1-ацетил-4(метоксііміно)-2-піролідин-карбонову кислоту піперидиніл)-1,2,4-оксадіазол-5-іл]-1-([1,1'-біфеніл](Проміжна сполука 2), N',34-ілкарбоніл)-3-піролідинону О-метилоксим дигідроксипропанімідамід (Проміжна сполука 7) та 2'-хлор-4'-фтор [1,1'-біфеніл]-4-карбонову кислоту (Проміжна сполука 10), цільову сполуку виділили після флеш-хроматографії як суміш E-/Z-ізомерів у вигляді масла із загальним виходом 8% (чистота за даними РХВЕ 78,7%). Масло; 1H ЯМР (300МГц, CDCI3): 2,93 (m, 2Н, СН2), 3,10-3,25 (m, 2H, СН2), 3,80 (s, 3Н, NOCH3), 4,34-4,45 (m, 2Н, СН2), 5,98 (m, 1Н), 6,90-7,05 (m, 2Н, Η аром.), 7,20-7,66 (m, 5Н, Η аром.); MS(ESI+): (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(4459,12; MS(ESI-): 457,07. піперидиніл)-1,2,4-оксадіазол-5-іл]-3-піролідинону Приклад 12: трет-бутил-4-{5-[(2S,4EZ)-1-([1,1'О-метилоксим (Приклад 12) розчиняли у безводбіфеніл]-4-ілкарбоніл)-4-(метоксііміно)піролідиніл]ному DCM при температурі 0°С у присутності 1,2,4-оксадіазол-3-іл}-1-піперидинкарбоксилат: 1,5екв. триетиламіну, і додавали 1екв. ацетилхло(3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(4риду. Реакційну суміш перемішували при згаданій піперидиніл)-1,2,4-оксадіазол-5-іл]-3-піролідинону температурі протягом 30хв., після чого гідролізуО-метилоксим вали льодом. Після цього за допомогою розчину карбонату натрію (10%) реакцію суміші доводили до основної, і реакційну суміш екстрагували DCM. Екстракт сушили над сульфатом магнію, після видалення розчинника одержали залишок, який очищали флеш-хроматографією із застосуванням суміші циклогексану з етилацетатом (1/1) як елюенту, і одержали (3EZ,5S)-5-[3-(1-ацетил-4піперидиніл)-1,2,4-оксадіазол-5-іл]-1-([1,1'-біфеніл]4-ілкарбоніл)-3-піролідинону О-метилоксим у виІз застосуванням загальної методики, описаної гляді суміші E-/Z-ізомерів ізвиходом 95% (чистота в Прикладі 1 (Метод А), використовуючи як вихідні за даними РХВЕ 100%). сполуки (2S,4EZ)-1-(трет-бутоксикарбоніл)-4Масло; 1H ЯМР (300МГц, CDCI3): 1,70-2,20 (m, (метоксііміно)-2-піролідин-карбонову кислоту 8H, СН3СО, СН2), 2,89-3,40 (m, 6Н, СН2), 3,88 (s, (Проміжна сполука 2), трет-бутил-4-[аміно3Н, NOCH3), 4,40-4,60 (m, 2Н, СН2), 6,04 (m, 1H, (гідроксііміно)метил]-1-піперидинкарбоксилат СН), 7,48-7,64 (m, 9Н, Η аром.); MS(ESI+): 488,37; (Проміжна сполука 7) та [1,1'-біфеніл]-4MS(ESI-): 486,17. карбонілхлорид, необхідну сполуку, трет-бутил-4Приклад 14: (3EZ,5S)-1-([1,1'-біфеніл]-4{5-[(2S,4ЕZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-4ілкарбоніл)-5-[3-(1-метил-4-піперидиніл)-1,2,4(метоксііміно)піролідиніл]-1,2,4-оксадіазол-3-іл}-1оксадіазол-5-іл]-3-піролідинону О-метилоксим піперидинкарбоксилат, виділили після флешхроматографії (циклогексан/етилацетат 6/4) як суміш E-/Z-ізомерів із 60% виходом (97,9% чистота за даними РХВЕ). Масло; 1H ЯМР (300МГц, CDCI3): 1,47 (s, 9Н, СН3), 1,60-2,10 (m, 4H, СН2), 2,90-3,02 (m, 2Н, СЯ2), 3,30-3,40 (m, 1Н, СН), 3,86 (s, 3Н, NOCH3), 4,01-4,55 (m, 6Н, CH2N), 6,03 (m, 1Н), 7,48-7,64 (m, 9Н, Η аром.); MS(ESI+): 546,4; MS(ESI-): 544,2. (3EZ,5S)-1-([1,1'-біфеніл]-4-ілкарбоніл)-5-[3-(4Трет-бутил-4-{5-[(2S;4EZ)-1-([1,1'-біфеніл]-4піперидиніл)-1,2,4-оксадіазол-5-іл]-3-піролідинону ілкарбоніл)-4-(метоксііміно)піролідиніл]-1,2,4О-метилоксим (Приклад 12) розчиняли у безводоксадіазол-3-іл}-1-піперидинкарбоксилат (100мг, 55 75145 56 ному DCM при температурі 0°С у присутності 1,5екв. триетиламіну, і додавали 1екв. метилйодиду. Реакційну суміш перемішували при кімнатній температурі протягом 12год. Реакційну суміш гідролізували, після чого за допомогою розчину карбонату натрію (10%) реакцію суміші доводили до основної, і реакційну суміш екстрагували DCM. Екстракт сушили над сульфатом магнію, після виІз застосуванням загальної методики, далення розчинника одержали залишок, який описаної в Прикладі 15, використовуючи як вихідні очищали флеш-хроматографією із застосуванням сполуки (2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-N'суміші дихлорметану з метанолом (98/2) як елюегідрокси-4-(метоксііміно)-2нту, і одержували (3EZ,5S)-1-([1,1'-біфеніл]-4піролідинкарбоксимідамід (Проміжна сполука 8) та ілкарбоніл)-5-[3-(4-піперидиніл)-1,2,4-оксадіазол-5(форміламіно)оцтову кислоту, одержали вказану в іл]-3-піролідинону О-метилоксим як суміш E-/Zзаголовку сполуку (чистота за даними РХВЕ 72%). ізомерів із виходом 50% (чистота за даними РХВЕ 1 H-ЯМР (400МГц, CDCI3): 2,9-3,2 (m, 2Н), 3,8 96,8%). 1 (m, 3Н), 4,2-4,4 (m, 2H0, 4,6 (m, 2H), 5,9 (m, 1H), 7,0 Масло; H ЯМР (300МГц, CDCI3): 1,19 (m, 2Н, (m, 1H), 7,3-7,7 (m, 9H), 8,2 (s, 1H), MS(ESI+): СН2), 2,14-2,70 (m, 8H, СН3, СН2), 2,89-3,25 (m, 4H, m/z=420,1. СН2), 3,80 (s, 3Н, NOCH3), 4,20-4,55 (m, 2H, СН2), Приклад 17: (3EZ,5S)-1-(1,1'-біфеніл]-45,94 (m, 1Н, СН), 7,33-7,58 (m, 9Н, Η аром.); ілкарбоніл)-5-[5-(метоксиметил)-1,2,4-оксадіазолMS(ESI+): 460,43; MS(ESI-): 458,24. 3-іл]-3-піролідинону О-метилоксим Приклад 15: Загальна методика рідкофазового синтезу похідних піролідиноксадіазолу загальної формули І. де В - замісник формули llb (дивись Схему 7. Схему 11): (3EZ,5S)-1-([1,1'-біфеніл]-4ілкарбоніл)-5-[5-(феноксиметил)-1,2,4-оксадіазол3-іл]-3-піролідинону О-метилоксим До суспензії (2S,4EZ)-1-([1,1'-біфеніл]-4ілкарбоніл)-N'-гідрокси-4-(метоксііміно)-2піролідинкарбоксимідаміду (Проміжна сполука 8, 100мг, 0,28ммоль), DMAP (41мг, 0,34ммоль) та феноксіоцтової кислоти (48мг, 0,31ммоль) у суміші DCM/DMF (1:1, 10мл) додавали EDC (59мг, 0,31ммоль). Після перемішування протягом ночі при температурі навколишнього середовища розчинник випаровували у вакуумі. Одержаний залишок розчиняли в DCM (10мл) і промивали спочатку водним розчином лимонної кислоти (2 10мл), потім водним розчином бікарбонату натрію (2 10мл). Після випаровування у вакуумі додавали піридин (15мл), і розчин нагрівали зі зворотним холодильником протягом ночі. Піридин видаляли у вакуумі, одержаний залишок розчиняли у DCM (10мл), промивали водним розчином лимонної кислоти (2 10мл), сушили над сульфатом магнію і випаровували з одержанням вказаної в заголовку сполуки (чистота за даними РХВЕ 80%). MS(ESI+): m/z=469,2. Приклад 16: {3-[(2S,4ЕZ)-1-([1,1'-біфеніл]-4ілкарбоніл)-4-(метоксііміно)-піролідиніл]1,2,4оксадіазол-5-іл}метилформамід Із застосуванням загальної методики, описаної в Прикладі 15, використовуючи як вихідні сполуки (2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-N'-гідрокси4-(метоксііміно)-2-піролідинкарбоксимідамід (Проміжна сполука 8) та метоксиоцтову кислоту, одержали вказану в заголовку сполуку з чистотою за даними РХВЕ 91%. 1 H-ЯМР (400МГц, CDCI3): 2,9-3,2 (m, 2Н), 3,4 (s, 3Н), 3,75 (m, 3Н), 4,2-4,5 (m, 2Н), 4,6 (s, 2Н), 6,0 (m, 1Н), 7,4-7,6 (m, 9H), MS(ESI+): m/z=407,2. Приклад 18: (3EZ,5S)-1-([1,1'-біфеніл-4ілкарбоніл)-5-(5-феніл-1,2,4-оксадіазол-3-іл)-3піролідинону О-метилоксим Із застосуванням загальної методики, описаної в Прикладі 15, використовуючи як вихідні сполуки (2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-N'-гідрокси4-(метоксііміно)-2-піролідинкарбоксимідамід (Проміжна сполука 8) та бензойну кислоту, одержали вказану в заголовку сполуку з чистотою за даними РХВЕ 85%. MS(ESI+): m/z=439,2. Приклад 19: N-({3-[(2S,4EZ)-1-([1,1'-біфеніл]-4ілкарбоніл)-4-(метоксііміно)-піролідиніл]-1,2,4оксадіазол-5-іл}метил)ацетамід 57 Із застосуванням загальної методики, описаної в Прикладі 15, використовуючи як вихідні сполуки (2S,4ЕZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-N'-гідрокси4-(метоксііміно)-2-піролідинкарбоксимідамід (Проміжна сполука 8) та (ацетиламіно) оцтову кислоту, одержали вказану в заголовку сполуку з чистотою за даними РХВЕ 72%. MS(ESI+): m/z=434,2. Приклад 20: (3EZ,5S)-1-([1,1'-біфеніл]-4ілкарбоніл)-5-{5-[4-(гідроксиметил)феніл]-1,2,4оксадіазол-3-іл]-3-піролідинону О-метилоксим Із застосуванням загальної методики, описаної в Прикладі 15, використовуючи як вихідні сполуки (2S,4ЕZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-N'-гідрокси4-(метоксііміно)-2-піролідинкарбоксимідамід (Проміжна сполука 8) та 4-(гідроксиметил)-бензойну кислоту, одержали вказану в заголовку сполуку з чистотою за даними РХВЕ 54%. MS(ESI+): m/z=469,4. Приклад 21: (3EZ,5S)-1-([1,1'-біфеніл]-4ілкарбоніл)-5-[5-(2-гідроксіетил)-1,2,4-оксадіазол-3іл]-3-піролідинону О-метилоксим Із застосуванням загальної методики, описаної в Прикладі 15, використовуючи як вихідні сполуки (2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-N'-гідрокси4-(метоксііміно)-2-піролідинкарбоксимідамід (Проміжна сполука 8) та 3-гідроксипропіонову кислоту, одержали вказану в заголовку сполуку з чистотою за даними РХВЕ 61%. MS(ESI+): m/z=407,2. Приклад 22: (3EZ,5S)-1-([1,1'-біфеніл]-4ілкарбоніл)-5-{5-[(2S)-2-гідрокси-2-фенілетил]1,2,4-оксадіазол-3-іл}-3-піролідинону Ометилоксим 75145 58 Із застосуванням загальної методики, описаної в Прикладі 15, використовуючи як вихідні сполуки (2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-N'-гідрокси4-(метоксііміно)-2-піролідинкарбоксимідамід (Проміжна сполука 8) та (3S)-3-гідрокси-3фенілпропіонову кислоту, одержали вказану в заголовку сполуку з чистотою за даними РХВЕ 89%. MS(ESI+): m/z=483,3. Приклад 23: (3EZ,5S)-1-(1,1'-біфеніл]-4ілкарбоніл)-5-[5-(2-феноксіетил)-1,2,4-оксадіазол3-іл]-3-піролідинону О-метилоксим Із застосуванням загальної методики, описаної в Прикладі 15, використовуючи як вихідні сполуки (2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-N'-гідрокси4-(метоксііміно)-2-піролідинкарбоксимідамід (Проміжна сполука 8) та 3-феноксипропіонову кислоту, одержали вказану в заголовку сполуку з чистотою за даними РХВЕ 84%. MS(ESI+): m/z=483,3. Приклад 24: (3EZ,5S)-1-([1,1'-біфеніл]-4ілкарбоніл)-5-[5-(2-метоксіетил)-1,2,4-оксадіазол-3іл]-3-піролідинону О-метилоксим Із застосуванням загальної методики, описаної в Прикладі 15, використовуючи як вихідні сполуки (2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-N'-гідрокси4-(метоксііміно)-2-піролідинкарбоксимідамід (Проміжна сполука 8) та 3-метоксипропіонову кислоту, одержали вказану в заголовку сполуку з чистотою за даними РХВЕ 80%. MS(ESI+): m/z=421,1. Приклад 25: (3EZ,5S)-5-[5-(1-ацетил-4піперидиніл)-1,2,4-оксадіазол-3-іл]-1-([1,1'-біфеніл]4-ілкарбоніл)-3-піролідинону О-метилоксим Із застосуванням загальної методики, описаної в Прикладі 15, використовуючи як вихідні сполуки (2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-N'-гідрокси4-(метоксііміно)-2-піролідинкарбоксимідамід (Проміжна сполука 8) та 1-ацетил-4піперидинкарбонову кислоту, одержали вказану в заголовку сполуку з чистотою за даними РХВЕ 87%. MS(ESI+): m/z=488,4. Приклад 26: (3ЕZ,5S)-1-([1,1'-біфеніл]-4ілкарбоніл)-5-[5-(2-піридиніл)-1,2,4-оксадіазол-3 59 іл]-3-піролідинону О-метилоксим Із застосуванням загальної методики, описаної в Прикладі 15, використовуючи як вихідні сполуки з (2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-N'гідрокси-4-(метоксііміно)-2піролідинкарбоксимідамід (Проміжна сполука 8) та 2-піридинкарбонову кислоту, одержали вказану в заголовку сполуку з чистотою за даними РХВЕ 82%. MS(ESI+): m/z=440,2. Приклад 27: (3EZ,5S)-1-([1,1'-біфеніл]-4ілкарбоніл)-5-[5-(3-тієніл)-1,2,4-оксадіазол-3-іл]-3піролідинону О-метилоксим Із застосуванням загальної методики, описаної в Прикладі 15, використовуючи як вихідні сполуки (2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-N'-гідрокси4-(метоксііміно)-2-піролідинкарбоксимідамід (Проміжна сполука 8) та 3-тіофенкарбонову кислоту, одержали вказану в заголовку сполуку з чистотою за даними РХВЕ 64%. MS(ESI+): m/z=445,2. Приклад 28: (3EZ,5S)-1-([1,1'-біфеніл]-4ілкарбоніл)-5-(5-етил-1,2,4-оксадіазол-3-іл)-3піролідинону О-метилоксим Із застосуванням загальної методики, описаної в Прикладі 15, використовуючи як вихідні сполуки (2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-N'-гідрокси4-(метоксііміно)-2-піролідинкарбоксимідамід (Проміжна сполука 8) та пропіонову кислоту, одержали вказану в заголовку сполуку з чистотою за даними РХВЕ 47%. MS(ESI+): m/z=391,1. Приклад 29: (3EZ,5S)-1-(1,1'-біфеніл]-4ілкарбоніл)-5-(5-циклопентил-1,2,4-оксадіазол-3іл)-3-піролідинону О-метилоксим Із застосуванням загальної методики, описаної в Прикладі 15, використовуючи як вихідні сполуки (2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-N'-гідрокси 7514560 4-(метоксііміно)-2-піролідинкарбоксимідамід (Проміжна сполука 8) та циклопентанкарбонову кислоту, одержали вказану в заголовку сполуку з чистотою за даними РХВЕ 62%. MS(ESI+): m/z=431,1. Приклад 30: (3EZ,5S)-1-([1,1'-біфеніл]-4ілкарбоніл)-5-(5-метил-1,2,4-оксадіазол3-іл)-3піролідинону О-метилоксим Із застосуванням загальної методики, описаної в Прикладі 15, використовуючи як вихідні сполуки (2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-N'-гідрокси4-(метоксііміно)-2-піролідинкарбоксимідамід (Проміжна сполука 8) та оцтову кислоту, одержали вказану в заголовку сполуку з чистотою за даними РХВЕ 76%. MS(ESI+): m/z=377,0. Приклад 31: (3EZ,5S)-1-(1,1'-біфеніл]-4ілкарбоніл)-5-{5-[(RS)-гідрокси(феніл)-метил]-1,2,4оксадіазол-3-іл}-3-піролідинону О-метилоксим Із застосуванням загальної методики, описаної в Прикладі 15, використовуючи як вихідні сполуки (2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-N'-гідрокси4-(метоксііміно)-2-піролідинкарбоксимідамід (Проміжна сполука 8) та (2RS)-гідрокси(феніл)етанову кислоту, одержали вказану в заголовку сполуку з чистотою за даними РХВЕ 73%. MS(ESI+): m/z=469,3. Приклад 32: (3EZ,5S)-1-([1,1'-біфеніл]-4ілкарбоніл)-5-{5-[(1RS)-1-гідрокси-2-фенілетил]1,2,4-оксадіазол-3-іл}-3-піролідинону Ометилоксим Із застосуванням загальної методики, описаної в Прикладі 15, використовуючи як вихідні сполуки (2S,4EZ)-1-([1,1'-біфеніл]-4-ілкарбоніл)-N'-гідрокси4-(метоксііміно)-2-піролідинкарбоксимідамід (Проміжна сполука 8) та (2RS)-2-гідрокси-3фенілпропіонову кислоту, одержали вказану в заголовку сполуку з чистотою за даними РХВЕ 78%. MS(ESI+): m/z=483,3. Приклад 33: (3EZ,5S)-1-([1,1'-біфеніл]-4ілкарбоніл)-5-{5-[(1R)-1-(диметиламіно)-2фенілетил]-1,2,4-оксадіазол-3-іл}-3-піролідинону О-метилоксим
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrrolidine oxadiazole and thiadiazole derivatives, pharmaceutical composition based thereon, a method for producing thereof (variants)
Автори англійськоюSchwarz Matthias, Page Patrick, Pomel Vincent, Quattropani Anna
Назва патенту російськоюПроизводные пирролидиноксадиазола и пирролидинтиадиазола, фармацевтическая композиция на их основании, способ их получения (варианты)
Автори російськоюШварц Маттиас, Паж Патрик, Помель Венсан, Куаттропани Анна
МПК / Мітки
МПК: C07D 413/14, A61K 31/4245, C07D 413/04, A61P 15/06, A61K 31/454, A61K 31/4439, A61P 15/00, A61P 5/24, A61P 43/00, A61K 31/496
Мітки: одержання, фармацевтична, варіанти, похідні, спосіб, композиція, піролідиноксадіазолу, основі, піролідинтіадіазолу
Код посилання
<a href="https://ua.patents.su/46-75145-pokhidni-pirolidinoksadiazolu-ta-pirolidintiadiazolu-farmacevtichna-kompoziciya-na-kh-osnovi-sposib-kh-oderzhannya-varianti.html" target="_blank" rel="follow" title="База патентів України">Похідні піролідиноксадіазолу та піролідинтіадіазолу, фармацевтична композиція на їх основі, спосіб їх одержання (варіанти)</a>
Попередній патент: Модифікація поверхні
Наступний патент: Спосіб лікування хворих з пароксизмами фібриляції передсердь при ішемічній хворобі серця
Випадковий патент: Спосіб одержання морозива